Ссылка на родственные заявки
[01] По настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на патент США, серийный номер 62/419,947, поданной 9 ноября 2016 г., которая полностью включена в настоящий документ.
Перечень последовательностей
[02] Настоящая заявка содержит перечень последовательностей, который был подан в электронном виде в формате ASCII и настоящим полностью включен посредством ссылки. Указанная копия ASCII, созданная 31 октября 2017 г., называется 42363-711_601_SL.txt и ее размер составляет 242369 байт.
Предшествующий уровень техники настоящего изобретения
[03] Молекулы главного комплекса гистосовместимости (MHC) класса II, как правило, обнаруживаются на антигенпрезентирующих клетках, где они презентируют антиген для узнавания CD4+ T-клетками, помогая регулировать иммунные ответы. Молекулы МНС класса II образуются путем димеризации альфа- и бета-цепи и стабилизируются в присутствии полипептидного антигена, который связывается в связывающей полости, образованной альфа- и бета-цепью. Тем не менее, производство MHC класса II в сконструированных системах in vitro было проблематичным из-за внутренней нестабильности гетеродимеров белка, даже в присутствии полипептида.
Краткое раскрытие настоящего изобретения
[04] В настоящем документе раскрыты выделенные и очищенные гетеродимеры антиген-МНС и эффективные способы их получения. Гетеродимеры конструируют для облегчения производства и выделения. Используют несколько способов увеличения производства выделенных гетеродимеров. Во-первых, альфа- и бета-цепи по отдельности сливают с частью тяжелой цепи IgG, затем IgG конструируют с архитектурой выступ-во-впадину (с одной из альфа- или бета-цепи IgG, состоящей из выступа и противоположной альфа- или бета-цепью IgG, содержащей впадину). В некоторых случаях гетеродимер может быть дополнительно стабилизирован с помощью цистеиновой ловушки между антигеном и остатком связывающей полости МНС класса II. Чтобы использовать цистеиновую ловушку, антиген может содержать эндогенный или сконструированный цистеин, который образует дисульфидную связь со сконструированным цистеином на альфа- или бета-цепи молекулы МНС, которая находится в непосредственной близости от связывающей полости. Эта цистеиновая ловушка может дополнительно повысить стабильность пептидной молекулы МНС. Неожиданно было обнаружено, что архитектура выступ-во-впадину работает в отсутствие гетерологичных доменов димеризации, которые использовались ранее. Фактически, было обнаружено, что гетерологичный домен димеризации является вредным для образования гетеродимеров.
[05] В настоящем документе согласно одному аспекту предусмотрены выделенные гетеродимеры, содержащие по меньшей мере один первый полипептид и по меньшей мере один второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ который расположен в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II или их комбинацию, а второй полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию или (ii) первый полипептид содержит домен β1 МНС класса II, домен β2 МНС класса II или их комбинацию, а второй полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию. Согласно некоторым вариантам осуществления выступ содержит один или несколько не встречающихся в природе аминокислотных остатков. Согласно некоторым вариантам осуществления выступ содержит один или несколько встречающихся в природе аминокислотных остатков. Согласно некоторым вариантам осуществления выступ содержит одну или несколько аминокислот, выбранных из фенилаланина, аргинина, тирозина, триптофана и цистеина. Согласно некоторым вариантам осуществления выступ содержит остаток аргинина. Согласно некоторым вариантам осуществления выступ содержит остаток фенилаланина. Согласно некоторым вариантам осуществления выступ содержит остаток тирозина. Согласно некоторым вариантам осуществления выступ содержит остаток триптофана. Согласно некоторым вариантам осуществления выступ содержит остаток цистеина. Согласно некоторым вариантам осуществления выступ содержит остаток цистеина и остаток триптофана. Согласно некоторым вариантам осуществления полость содержит не встречающийся в природе аминокислотный остаток. Согласно некоторым вариантам осуществления полость содержит встречающийся в природе аминокислотный остаток. Согласно некоторым вариантам осуществления полость содержит одну или несколько аминокислот, выбранных из аланина, серина, треонина, валина и цистеина. Согласно некоторым вариантам осуществления полость содержит остаток аланина. Согласно некоторым вариантам осуществления полость содержит остаток серина. Согласно некоторым вариантам осуществления полость содержит остаток треонина.
[06] Согласно некоторым вариантам осуществления полость содержит остаток валина. Согласно некоторым вариантам осуществления полость содержит остаток цистеина. Согласно некоторым вариантам осуществления полость содержит остаток цистеина, остаток серина, остаток аланина и остаток валина. Согласно некоторым вариантам осуществления первый полипептид и второй полипептид взаимодействуют через домен CH3 антитела. Согласно некоторым вариантам осуществления домен CH3 происходит от IgG. Согласно некоторым вариантам осуществления IgG относится к подтипу IgG1. Согласно некоторым вариантам осуществления первый полипептид и/или второй полипептид дополнительно содержат C-концевой остаток цистеина. Согласно некоторым вариантам осуществления первый полипептид и/или второй полипептид дополнительно содержат сайт биотинилирования. Согласно некоторым вариантам осуществления первый полипептид и/или второй полипептид дополнительно содержат метку Strep. Согласно некоторым вариантам осуществления выделенный гетеродимер содержит по меньшей мере один полипептид, кодируемый SEQ ID NO: 1. Согласно некоторым вариантам осуществления выделенный гетеродимер содержит по меньшей мере один полипептид, кодируемый SEQ ID NO: 2. Согласно некоторым вариантам осуществления выделенный гетеродимер содержит по меньшей мере один полипептид, кодируемый SEQ ID NO: 3. Согласно некоторым вариантам осуществления выделенный гетеродимер содержит по меньшей мере один полипептид, кодируемый SEQ ID NO: 4. Согласно некоторым вариантам осуществления выделенный гетеродимер содержит по меньшей мере один полипептид, кодируемый любой из SEQ ID NO: 5-8. Согласно некоторым вариантам осуществления выделенный гетеродимер содержит по меньшей мере один полипептид, кодируемый последовательностью ДНК, содержащей любую из SEQ ID NO: 1-26, 64 или 65. Согласно некоторым вариантам осуществления выделенный гетеродимер содержит по меньшей мере один полипептид, содержащий аминокислотную последовательность любой из SEQ ID NO: 27-63 или ее фрагмент.
[07] В настоящем документе согласно другому аспекту предусмотрены мультимеры, содержащие два или более описанных в настоящем документе выделенных гетеродимеров. Согласно некоторым вариантам осуществления мультимер дополнительно содержит авидин.
[08] Согласно некоторым вариантам осуществления каждый из двух или более гетеродимеров связан с авидином. Согласно некоторым вариантам осуществления мультимер дополнительно содержит полимерную главную цепь, причем каждый из двух или более гетеродимеров соединен с полимерным остовом. Согласно некоторым вариантам осуществления полимерный остов представляет собой декстран или полиэтиленгликоль (ПЭГ).
[09] В настоящем документе согласно другому аспекту предусмотрены полипептиды, содержащие домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию и по меньшей мере один сконструированный выступ. Согласно некоторым вариантам осуществления по меньшей мере один сконструированный выступ не расположен в домене α1 MHC класса II или в домене α2 MHC класса II. Согласно некоторым вариантам осуществления сконструированный выступ расположен в домене СН3 антитела, слитого с полипептидом. Согласно некоторым вариантам осуществления полипептид необязательно содержит домен CH2 антитела, расположенный между доменом α2 MHC класса II и доменом CH3 со сконструированным выступом. Согласно некоторым вариантам осуществления полипептид содержит домен CH3 антитела, а домен CH3 антитела содержит по меньшей мере одну мутацию, выбранную из списка, состоящего из S354C, T366W и как S354C, так и T366W (нумерация EU).
[010] В настоящем документе согласно другому аспекту предусмотрены полипептиды, содержащие домен β1 МНС класса II, домен β2 МНС класса II или их комбинацию и по меньшей мере один сконструированный выступ. Согласно некоторым вариантам осуществления по меньшей мере один сконструированный выступ не расположен в домене β1 МНС класса II или в домене β2 МНС класса II. Согласно некоторым вариантам осуществления сконструированный выступ расположен в домене СН3 антитела, слитого с полипептидом. Согласно некоторым вариантам осуществления полипептид необязательно содержит домен CH2 антитела, расположенный между доменом β2 MHC класса II и доменом CH3 со сконструированным выступом. Согласно некоторым вариантам осуществления полипептид содержит домен CH3 антитела, а домен CH3 антитела содержит по меньшей мере одну мутацию, выбранную из списка, состоящего из S354C, T366W и как S354C, так и T366W (нумерация EU).
[011] Согласно некоторым вариантам осуществления выступ содержит один или несколько не встречающихся в природе аминокислотных остатков. Согласно некоторым вариантам осуществления выступ содержит один или несколько встречающихся в природе аминокислотных остатков. Согласно некоторым вариантам осуществления выступ содержит одну или несколько аминокислот, выбранных из фенилаланина, аргинина, тирозина, триптофана и цистеина. Согласно некоторым вариантам осуществления выступ содержит остаток аргинина. Согласно некоторым вариантам осуществления выступ содержит остаток фенилаланина. Согласно некоторым вариантам осуществления выступ содержит остаток тирозина. Согласно некоторым вариантам осуществления выступ содержит остаток триптофана. Согласно некоторым вариантам осуществления выступ содержит остаток цистеина. Согласно некоторым вариантам осуществления выступ содержит остаток цистеина и остаток триптофана.
[012] В настоящем документе согласно другому аспекту предусмотрены полипептиды, содержащие домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию и по меньшей мере одну сконструированную полость. Согласно некоторым вариантам осуществления по меньшей мере одна сконструированная полость не расположена в домене α1 МНС класса II или в домене α2 МНС класса II. Согласно некоторым вариантам осуществления сконструированная полость расположена в домене СН3 антитела, слитого с полипептидом. Согласно некоторым вариантам осуществления полипептид необязательно содержит домен CH2 антитела, расположенный между доменом α2 MHC класса II и доменом CH3 со сконструированной полостью. Согласно некоторым вариантам осуществления полипептид содержит домен CH3 антитела, а домен CH3 антитела содержит по меньшей мере одну мутацию, выбранную из списка, состоящего из Y349C, T366S, L368A, Y407V (нумерация EU) и их комбинаций.
[013] В настоящем документе согласно другому аспекту предусмотрены полипептиды, содержащие домен β1 МНС класса II, домен β2 МНС класса II или их комбинацию и по меньшей мере одну сконструированную полость. Согласно некоторым вариантам осуществления по меньшей мере одна сконструированная полость не расположена в домене β1 МНС класса II или в домене β2 МНС класса II. Согласно некоторым вариантам осуществления сконструированная полость расположена в домене СН3 антитела, слитого с полипептидом. Согласно некоторым вариантам осуществления полипептид необязательно содержит домен CH2 антитела, расположенный между доменом β2 MHC класса II и доменом CH3 со сконструированной полостью. Согласно некоторым вариантам осуществления полипептид содержит домен CH3 антитела, а домен CH3 антитела содержит по меньшей мере одну мутацию, выбранную из списка, состоящего из Y349C, T366S, L368A, Y407V (нумерация EU) и их комбинаций.
[014] Согласно некоторым вариантам осуществления полость содержит не встречающийся в природе аминокислотный остаток. Согласно некоторым вариантам осуществления полость содержит встречающийся в природе аминокислотный остаток. Согласно некоторым вариантам осуществления полость содержит одну или несколько аминокислот, выбранных из аланина, серина, треонина, валина и цистеина. Согласно некоторым вариантам осуществления полость содержит остаток аланина. Согласно некоторым вариантам осуществления полость содержит остаток серина. Согласно некоторым вариантам осуществления полость содержит остаток треонина. Согласно некоторым вариантам осуществления полость содержит остаток валина. Согласно некоторым вариантам осуществления полость содержит остаток цистеина. Согласно некоторым вариантам осуществления полость содержит остаток цистеина, остаток серина, остаток аланина и остаток валина.
[015] Согласно некоторым вариантам осуществления выступ расположен в константном домене СН3 антитела. Согласно некоторым вариантам осуществления полость расположена в константном домене СН3 антитела. Согласно некоторым вариантам осуществления полипептид дополнительно содержит C-концевой остаток цистеина.
[016] В настоящем документе согласно другому аспекту предусмотрены полипептиды, кодируемые последовательностью ДНК, содержащей любую из SEQ ID NO: 1-26, 64 или 65.
[017] В настоящем документе согласно другому аспекту предусмотрены полипептиды, содержащие аминокислотную последовательность любой из SEQ ID NO: 27-63 или ее фрагмент.
[018] В настоящем документе согласно другому аспекту предусмотрены конъюгаты гетеродимер-наночастица, содержащие по меньшей мере один описанный в настоящем документе гетеродимер и наночастицу, причем наночастица не является липосомальной и/или содержит твердое ядро. Согласно некоторым вариантам осуществления твердое ядро представляет собой ядро из золота или оксида железа. Согласно некоторым вариантам осуществления по меньшей мере один гетеродимер ковалентно или нековалентно связан с наночастицей. Согласно некоторым вариантам осуществления по меньшей мере один гетеродимер ковалентно связан с наночастицей через линкер. Согласно некоторым вариантам осуществления линкер содержит полиэтиленгликоль.
[019] В настоящем документе согласно другому аспекту предусмотрены способы получения гетеродимера, содержащего первый полипептид и второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который устанавливается в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II или их комбинацию, а второй полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию или (ii) первый полипептид содержит домен β1 МНС класса II, домен β2 МНС класса II или их комбинацию, а второй полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию; включающие следующие стадии: (а) культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую первый полипептид и второй полипептид, включая в себя их поверхности контакта, причем нуклеиновая кислота, кодирующая поверхность контакта первого полипептида, была изменена из нуклеиновой кислоты, кодирующей исходную поверхность контакта первого полипептида, для кодирования выступа, или нуклеиновая кислота, кодирующая поверхность контакта второго полипептида, была изменена из нуклеиновой кислоты, кодирующей исходную поверхность контакта второго полипептида, для кодирования полости, или и то и другое, и причем культивирование является таким, что первый полипептид и второй полипептид экспрессируется; и (b) извлечение гетеродимера из культуры клеток-хозяев.
[020] Согласно некоторым вариантам осуществления нуклеиновая кислота, кодирующая первый полипептид, была изменена из исходной нуклеиновой кислоты для кодирования выпуклости, а нуклеиновая кислота, кодирующая второй полипептид, была изменена из исходной нуклеиновой кислоты для кодирования полости.
[021] Согласно некоторым вариантам осуществления стадии (а) предшествует стадия, на которой каждая из одной или нескольких нуклеиновых кислот, кодирующих исходный аминокислотный остаток на поверхности контакта первого полипептида, заменяется нуклеиновой кислотой, кодирующей импортный аминокислотный остаток, причем выступ содержит один или несколько импортных остатков. Согласно некоторым вариантам осуществления импортный остаток выбирают из фенилаланина, аргинина, тирозина, триптофана и цистеина. Согласно некоторым вариантам осуществления импортный остаток представляет собой аргинин. Согласно некоторым вариантам осуществления импортный остаток представляет собой фенилаланин.
[022] Согласно некоторым вариантам осуществления импортный остаток представляет собой тирозин. Согласно некоторым вариантам осуществления импортный остаток представляет собой триптофан. Согласно некоторым вариантам осуществления импортный остаток представляет собой цистеин.
[023] Согласно некоторым вариантам осуществления стадии (а) предшествует стадия, на которой каждая из одной или нескольких нуклеиновых кислот, кодирующих исходный аминокислотный остаток на поверхности контакта второго полипептида, заменяется нуклеиновой кислотой, кодирующей импортный аминокислотный остаток, причем полость содержит один или несколько импортных остатков. Согласно некоторым вариантам осуществления импортный остаток выбирают из цистеина, аланина, серина, треонина или валина. Согласно некоторым вариантам осуществления импортный остаток представляет собой цистеин. Согласно некоторым вариантам осуществления импортный остаток представляет собой аланин. Согласно некоторым вариантам осуществления импортный остаток представляет собой серин. Согласно некоторым вариантам осуществления импортный остаток представляет собой треонин. Согласно некоторым вариантам осуществления импортный остаток представляет собой валин.
[024] Согласно некоторым вариантам осуществления каждый первый полипептид и второй полипептид содержат константный домен антитела. Согласно некоторым вариантам осуществления константный домен антитела представляет собой домен CH3. Согласно некоторым вариантам осуществления константный домен антитела происходит из IgG. Согласно некоторым вариантам осуществления IgG представляет собой человеческий IgG1. Согласно некоторым вариантам осуществления константный домен антитела представляет собой домен CH2 и CH3. Согласно некоторым вариантам осуществления CH3 дополнительно содержит сконструированный выступ или полость (впадину).
[025] В настоящем документе согласно другому аспекту предусмотрены способы получения конъюгата гетеродимер-наночастица, содержащего связывание по меньшей мере одного описанного в настоящем документе гетеродимера с наночастицей, причем наночастица не является липосомальной и/или содержит твердое ядро. Согласно некоторым вариантам осуществления твердое ядро представляет собой ядро из золота или оксида железа. Согласно некоторым вариантам осуществления стадия связывания включает ковалентное или нековалентное связывание по меньшей мере одного гетеродимера с наночастицей. Согласно некоторым вариантам осуществления стадия связывания включает ковалентное связывание по меньшей мере одного гетеродимера с наночастицей через линкер. Согласно некоторым вариантам осуществления линкер содержит полиэтиленгликоль.
[026] Согласно другому аспекту в настоящем документе предусмотрен выделенный гетеродимер, содержащий по меньшей мере один первый полипептид и по меньшей мере один второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ который расположен в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II или их комбинацию, а второй полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию; или (ii) первый полипептид содержит домен β1 МНС класса II, домен β2 МНС класса II или их комбинацию, а второй полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию. Согласно некоторым вариантам осуществления выступ содержит один или несколько не встречающихся в природе аминокислотных остатков. Согласно некоторым вариантам осуществления выступ содержит одну или несколько аминокислот, выбранных из фенилаланина, аргинина, тирозина, триптофана и цистеина. Согласно некоторым вариантам осуществления первый или второй полипептид выделенного гетеродимера содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотной последовательности, представленной в SEQ ID NO: 53. Согласно определенным вариантам осуществления первый или второй полипептид выделенного гетеродимера содержит аминокислотную последовательность, по меньшей мере на 80% идентичную последовательности SEQ ID NO: 54. Согласно некоторым вариантам осуществления первый или второй полипептид выделенного гетеродимера содержит домен СН3, а домен СН3 содержит по меньшей мере одну мутацию, выбранную из списка, состоящего из S354C, T366W и как S354C, так и T366W (нумерация EU). Согласно определенным вариантам осуществления полость содержит не встречающийся в природе аминокислотный остаток. Согласно определенным вариантам осуществления полость содержит одну или несколько аминокислот, выбранных из аланина, серина, треонина, валина и цистеина. Согласно некоторым вариантам осуществления первый или второй полипептид выделенного гетеродимера содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотной последовательности, представленной в SEQ ID NO: 51. Согласно определенным вариантам осуществления первый или второй полипептид выделенного гетеродимера содержит аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности, представленной в SEQ ID NO: 52. Согласно некоторым вариантам осуществления первый или второй полипептид выделенного гетеродимера содержит домен CH3, а домен CH3 содержит по меньшей мере одну мутацию выбранную из списка, состоящего из Y349C, T366S, L368A, Y407V (нумерация EU) и их комбинаций.
[027] Согласно определенным вариантам осуществления один или оба из первого полипептида или второго полипептида не содержат гетерологичный домен димеризации. Согласно определенным вариантам осуществления один или оба из первого полипептида или второго полипептида не содержат лейциновую молнию. Согласно определенным вариантам осуществления один или оба из первого полипептида или второго полипептида не содержат сайт-специфический сайт биотинилирования. Согласно некоторым вариантам осуществления выделенный гетеродимер дополнительно содержит относящийся к аутоиммунному заболеванию антиген. Согласно некоторым вариантам осуществления относящийся к заболеванию антиген содержит полипептид длиной по меньшей мере 11 аминокислот. Согласно некоторым вариантам осуществления относящийся к аутоиммунному заболеванию антиген соединен с доменом α1 МНС класса II или доменом β1 МНС класса II гибким линкером. Согласно некоторым вариантам осуществления антиген ковалентно связан с доменом α1 МНС класса II или доменом β1 МНС класса II дисульфидной связью, образованной между аминокислотой цистеином, связанной с антигенным пептидом, и аминокислотой цистеином домена α1 МНС класса II или домена β1 МНС класса II. Согласно некоторым вариантам осуществления аминокислота цистеин из домена α1 MHC класса II или домена β1 MHC класса II находится в пределах 10 аминокислот от остатка, который образует часть связывающей борозды MHC класса II. Согласно некоторым вариантам осуществления цистеиновый остаток домена α1 МНС класса II или β1 домена МНС класса II находится в пределах 3 аминокислот от остатка, который образует часть связывающей борозды МНС класса II. Согласно некоторым вариантам осуществления аминокислота цистеин из домена α1 MHC класса II или домена β1 MHC класса II была введена в природную последовательность домена α1 MHC класса II или домена β1 MHC класса II. Согласно определенным вариантам осуществления выделенный гетеродимер предназначен для применения при лечении индивидуума, у которого диагностировано или предположительно имеется аутоиммунное заболевание. Согласно определенным вариантам осуществления выделенный гетеродимер кодируется полинуклеотидом, кодирующим описанный в настоящем документе первый или второй полипептид. Согласно определенным вариантам осуществления клетка-хозяин содержит полинуклеотид. Согласно определенным вариантам осуществления полинуклеотид стабильно интегрирован в геном. Согласно некоторым вариантам осуществления по меньшей мере один гетеродимер конъюгирован с наночастицей с образованием конъюгата гетеродимер-наночастица, причем наночастица не является липосомальной и/или содержит твердое ядро. Согласно определенным вариантам осуществления твердое ядро представляет собой ядро из золота, железа или оксида железа. Согласно определенным вариантам осуществления твердое ядро составляет в диаметре менее 100 нанометров. Согласно определенным вариантам осуществления по меньшей мере один гетеродимер ковалентно связан с наночастицей. Согласно некоторым вариантам осуществления по меньшей мере один гетеродимер ковалентно связан с наночастицей через линкер, содержащий полиэтиленгликоль (ПЭГ). Согласно определенным вариантам осуществления полиэтиленгликоль функционализирован малеимидом. Согласно определенным вариантам осуществления полиэтиленгликоль составляет менее чем 5 кДа. Согласно некоторым вариантам осуществления фармацевтическая композиция, содержащая конъюгат гетеродимер-наночастица, образуется с фармацевтическим вспомогательным веществом, стабилизатором или разбавителем. Согласно определенным вариантам осуществления выделенный гетеродимер или фармацевтическая композиция предназначены для применения в способе лечения аутоиммунного заболевания или воспалительного состояния. Согласно некоторым вариантам осуществления способ лечения аутоиммунного заболевания или воспалительного состояния включает введение индивидууму выделенного конъюгата гетеродимер-наночастица или фармацевтической композиции.
[028] Согласно другому аспекту в настоящем документе описан способ получения гетеродимера, содержащего первый полипептид и второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который расположен в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II или их комбинацию, а второй полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию; или (ii) первый полипептид содержит домен β1 МНС класса II, домен β2 МНС класса II или их комбинацию, а второй полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию; включающий стадии: (а) культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую первый полипептид и второй полипептид, включая в себя их поверхности контакта, причем нуклеиновая кислота, кодирующая поверхность контакта первого полипептида, была изменена из нуклеиновой кислоты, кодирующей исходную поверхность контакта первого полипептида, для кодирования выступа, или нуклеиновая кислота, кодирующая поверхность контакта второго полипептида, была изменена из нуклеиновой кислоты, кодирующей исходную поверхность контакта второго полипептида, для кодирования полости, или и то и другое, и причем культивирование таково, что первый полипептид и второй полипептид экспрессируется; и (b) извлечение гетеродимера из культуры клеток-хозяев. Согласно определенным вариантам осуществления нуклеиновая кислота, кодирующая первый полипептид и второй полипептид, стабильно интегрируется в геном клетки-хозяина. Согласно определенным вариантам осуществления клетка-хозяин содержит клетку яичника китайского хомячка (СНО). Согласно некоторым вариантам осуществления извлечение гетеродимера из культуры клеток-хозяев или культур клеток-хозяев включает внесение жидкости, содержащей гетеродимер, в колонку для жидкостной хроматографии. Согласно некоторым вариантам осуществления колонка для жидкостной хроматографии содержит белок A, белок G, белок L или их комбинацию.
[029] Согласно другому аспекту в настоящем документе описан способ получения гетеродимера, содержащего первый полипептид и второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ который расположен в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II или их комбинацию, а второй полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию или (ii) первый полипептид содержит домен β1 МНС класса II, домен β2 МНС класса II или их комбинацию, а второй полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию; включающий стадии: (а) культивирование первой клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую первый полипептид; (b) культивирование второй клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую второй полипептид; (c) выделение полипептидов из культур клеток-хозяев и (d) образование гетеродимера путем инкубации первого и второго полипептидов вместе; причем нуклеиновая кислота, кодирующая поверхность контакта первого полипептида, была изменена из нуклеиновой кислоты, кодирующей исходную поверхность контакта первого полипептида, для кодирования выступа, или нуклеиновая кислота, кодирующая поверхность контакта второго полипептида, была изменена из нуклеиновой кислоты, кодирующей исходную поверхность контакта второго полипептида, для кодирования полости или и то и другое. Согласно определенным вариантам осуществления нуклеиновая кислота, кодирующая первый полипептид и второй полипептид, стабильно интегрируется в геном клетки-хозяина. Согласно определенным вариантам осуществления первая и вторая клетки-хозяева содержат клетки яичника китайского хомячка (СНО). Согласно некоторым вариантам осуществления способ дополнительно включает извлечение гетеродимера или полипептидов из культуры клеток-хозяев или культур клеток-хозяев и включает внесение жидкости, содержащей гетеродимер или полипептиды, в колонку для жидкостной хроматографии. Согласно некоторым вариантам осуществления колонка для жидкостной хроматографии содержит белок A, белок G, белок L или их комбинацию.
[030] В настоящем документе согласно одному аспекту предусмотрены выделенные гетеродимеры, содержащие по меньшей мере один первый полипептид и по меньшей мере один второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который расположен в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II, домен CH2 IgG и домен CH3 IgG, причем выступ образован мутациями в домене CH3 IgG, соответствующем S354C и T366W (нумерация EU); и (ii) второй полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II, домен CH2 IgG и домен CH3 IgG, причем полость образована мутациями в домене CH3 IgG, соответствующем Y349C, T366S, L368A и Y407V (нумерация EU).
[031] В настоящем документе согласно одному аспекту предусмотрены выделенные гетеродимеры, содержащие по меньшей мере один первый полипептид и по меньшей мере один второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который расположен в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II, домен CH2 IgG и домен CH3 IgG, причем выступ образован мутациями в домене CH3 IgG, соответствующем S354C и T366W (нумерация EU); и (ii) второй полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II, домен CH2 IgG и домен CH3 IgG, причем полость образована мутациями в домене CH3 IgG, соответствующем Y349C, T366S , L368A и Y407V (нумерация EU).
Краткое описание графических материалов
[032] На фиг. 1A-B показан лентивирусный вектор как в линеаризованной (A), так и в круговой форме (B).
[033] На фиг. 2 показан пример конструирования pMHC с использованием лейциновой молнии.
[034] На фиг. 3 схематично показаны дизайны pMHC выступ-во-впадину (с лейциновой молнией и без нее).
[035] Фиг. 4А-С. На фиг. 4А показан проточный цитометрический анализ экспрессии eGFP в клетках СНО, трансдуцированных лентивирусами, кодирующими pMHC BDC2.5mi/IAg7-выступ-во-впадину с лейциновой молнией (слева) или без нее (справа). На фиг. 4В и фиг. 4C показаны профили элюирования аффинной хроматографией с белком G культуральных супернатантов из клеток CHO, экспрессирующих pMHC на основе выступ-во-впадину без лейциновой молнии (фиг. 4B) и с лейциновой молнией (фиг. 4C).
[036] На фиг. 5 показана электрофоретическая подвижность pMHC на основе выступ-во-впадину без молнии посредством нативного (слева) и денатурирующего (справа) ДСН-ПААГ.
[037] На фиг. 6 показаны профили окрашивания FACS BDC2.5-CD4+ Т-клеток с использованием тетрамеров, изготовленных с использованием обычных мономеров pMHC (левая панель) или дизайна на основе выступ-во-впадину без молнии (средняя и правая панели).
[038] На фиг. 7 показаны неденатурирующие (слева) и денатурирующие (справа) изображения на геле ДСН-ПААГ для наночастиц PFM, конъюгированных с pMHC BDC2.5mi/IAg7 на основе выступ-во-впадину без молнии.
[039] На фиг. 8 показаны Т-клеточные ответы у мышей, обработанных наночастицами 2.5mi/IAg7 на основе выступ-во-впадину без молнии (слева) или обычными (не основанными на выступе-во-впадину) наночастицами 2.5mi/IAg7 с молниями (справа). Мышей обрабатывали 10 дозами (2 дозы в неделю в течение 5 недель), после чего выделяли Т-клетки селезенки, сортировали на 2.5mi/IAg7 тетрамер-положительные и отрицательные фракции и стимулировали гранулами, покрытыми моноклональными антителами к CD3/к CD28. мРНК анализировали на присутствие транскриптов, соответствующих клеткам TR1, из тетрамер-положительных и отрицательных фракций.
[040] На фиг. 9А-В показано высвобождение цитокинов из Т-клеток, выделенных у мышей, обработанных, как на фиг. 8. Мышей обрабатывали либо наночастицами на основе выступ-во-впадину 2.5mi/IAg7 без молнии (A), либо обычными наночастицами на основе выступ-во-впадину 2.5mi/IAg7 (B) с молнией (B).
[041] На фиг. 10 показан профиль очистки mono-Q белка BDC-PEG-биотин. Фракции с номерами от 19 до 38 собирали для скрининга биотина с помощью анализа ИФА и ДСН-ПААГ.
[042] На фиг. 11 показаны профили ДСН-ПААГ очищенных моно-Q фракций. Дорожки помечены номером каждой фракции FPLC. 20 мкл каждой фракции наносили на гель.
[043] На фиг. 12 показан анализ вестерн-блоттинг фракций 22-25 (дорожки 5-9), который показал присутствие биотина исключительно в альфа-цепи мономера pMHC по сравнению с мономером pMHC BDC2.5mi/IAg7, несущим последовательность биотинилирования в альфа-цепи и биотинилированным с использованием фермента BirA (дорожка 1). Фракции 25-29 объединяли и использовали для получения тетрамеров pMHC. Дорожки 11-17 показывают фракции 30-36.
[044] На фиг. 13 показан профиль проточной цитометрии BDC2.5-CD4+ Т-клеток, окрашенных тетрамерами, полученными с использованием BDC2,5mi/I-Ag7-малеимид-ПЭГ2-биотина.
[045] На фиг. 14А и фиг. 14B показаны профили элюирования FPLC, на фиг. 14C и фиг. 14D показан анализ ДСН-ПААГ элюированных фракций, указанных на фиг. 14А и фиг. 14В.
[046] На фиг. 15А-D показана проточная цитометрия меченых GFP клеток JURMA, экспрессирующих TCR, специфический для DR, в комплексе с полипептидом IGRP13-25. На фиг. 15А показана клеточная линия отдельно; на фиг. 15В показана клеточная линия, инкубированная с РЕ, меченым DR3 IGRP13-25, полученным по стандартной технологии димеризации лейциновой молнии; на фиг. 15C показана клеточная линия, инкубированная с PE-меченым DR3 IGRP13-25, изготовленным с использованием технологии димеризации выступ-во-впадину и цис-ловушки, без лейциновой молнии; на фиг. 15D показана клеточная линия, инкубированная с нерелевантными меченными РЕ гетеродимерами МНС класса II.
[047] На фиг. 16А и фиг. 16B показана стимуляция клеток JURMA, экспрессирующих TCR, специфический для DR, в комплексе с полипептидом IGRP13-25, конъюгированным с наночастицей.
Подробное описание настоящего изобретения
[048] Различные варианты осуществления описаны ниже. Следует отметить, что конкретные варианты осуществления не предназначены для исчерпывающего описания или для ограничения более широких аспектов, обсуждаемых в настоящем документе. Один аспект, описанный в связи с конкретным вариантом осуществления, не обязательно ограничен этим вариантом осуществления и может применяться на практике с любым другим вариантом (вариантами) осуществления.
[049] В настоящем документе согласно одному аспекту предусмотрены выделенные гетеродимеры, содержащие по меньшей мере один первый полипептид и по меньшей мере один второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ который расположен в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II или их комбинацию, а второй полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию или (ii) первый полипептид содержит домен β1 МНС класса II, домен β2 МНС класса II или их комбинацию, а второй полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию. Первый полипептид, второй полипептид или оба могут содержать домен антитела СН3, слитый с полипептидом. Необязательно, либо первый полипептид, либо второй полипептид, либо оба содержат домен CH2 антитела, расположенный между MHC (α- или β-цепью) и доменом CH3. Согласно некоторым вариантам осуществления первый полипептид содержит домен CH3 антитела, а домен CH3 антитела содержит по меньшей мере одну мутацию, выбранную из перечня, состоящего из S354C, T366W и как S354C, так и T366W (нумерация EU). Согласно некоторым вариантам осуществления второй полипептид содержит домен CH3 антитела, а домен CH3 антитела содержит по меньшей мере одну мутацию, выбранную из списка, состоящего из Y349C, T366S, L368A, Y407V (нумерация EU) и их комбинаций. Согласно другим вариантам осуществления выделенный гетеродимер содержит относящийся к аутоиммунному или воспалительному заболеванию пептид, необязательно ковалентно связанный с первым или вторым полипептидом. Необязательно, относящийся к аутоиммунному или воспалительному заболеванию пептид содержит остаток цистеина, который взаимодействует с остатком цистеина либо в первом, либо во втором полипептиде с образованием цистеиновой ловушки.
[050] Согласно одному аспекту один полипептид гетеродимера содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию и по меньшей мере один сконструированный выступ. Согласно некоторым вариантам осуществления по меньшей мере один сконструированный выступ не расположен в домене α1 MHC класса II или в домене α2 MHC класса II. Согласно некоторым вариантам осуществления сконструированный выступ расположен в домене СН3 антитела, слитого с полипептидом. Согласно некоторым вариантам осуществления полипептид необязательно содержит домен CH2 антитела, расположенный между доменом α2 MHC класса II и доменом CH3 со сконструированным выступом. Согласно некоторым вариантам осуществления полипептид содержит домен CH3 антитела, а домен CH3 антитела содержит по меньшей мере одну мутацию, выбранную из списка, состоящего из S354C, T366W и как S354C, так и T366W (нумерация EU). Согласно другим вариантам осуществления полипептид содержит относящийся к аутоиммунному или воспалительному заболеванию пептид. Необязательно, относящийся к аутоиммунному или воспалительному заболеванию пептид содержит остаток цистеина, который взаимодействует с остатком цистеина в домене α1 или β1 MHC с образованием цистеиновой ловушки.
[051] Согласно одному аспекту один полипептид гетеродимера содержит домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию и по меньшей мере один сконструированный выступ. Согласно некоторым вариантам осуществления по меньшей мере один сконструированный выступ не расположен в домене β1 МНС класса II или в домене β2 МНС класса II. Согласно некоторым вариантам осуществления сконструированный выступ расположен в домене СН3 антитела, слитого с полипептидом. Согласно некоторым вариантам осуществления полипептид необязательно содержит домен CH2 антитела, расположенный между доменом β2 MHC класса II и доменом CH3 со сконструированным выступом. Согласно некоторым вариантам осуществления полипептид содержит домен CH3 антитела, а домен CH3 антитела содержит по меньшей мере одну мутацию, выбранную из списка, состоящего из S354C, T366W и как S354C, так и T366W (нумерация EU). Согласно другим вариантам осуществления полипептид содержит относящийся к аутоиммунному или воспалительному заболеванию пептид. Необязательно, относящийся к аутоиммунному или воспалительному заболеванию пептид содержит остаток цистеина, который взаимодействует с остатком цистеина в домене α1 или β1 MHC с образованием цистеиновой ловушки.
[052] Согласно одному аспекту один полипептид гетеродимера содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию и по меньшей мере одну сконструированную полость. Согласно некоторым вариантам осуществления по меньшей мере одна сконструированная полость не расположена в домене α1 МНС класса II или в домене α2 МНС класса II. Согласно некоторым вариантам осуществления сконструированная полость расположена в домене СН3 антитела, слитого с полипептидом. Согласно некоторым вариантам осуществления полипептид необязательно содержит домен CH2 антитела, расположенный между доменом α2 MHC класса II и доменом CH3 со сконструированной полостью. Согласно некоторым вариантам осуществления полипептид содержит домен CH3 антитела, а домен CH3 антитела содержит по меньшей мере одну мутацию, выбранную из списка, состоящего из Y349C, T366S, L368A, Y407V (нумерация ЕU) и их комбинаций. Согласно другим вариантам осуществления полипептид содержит относящийся к аутоиммунному или воспалительному заболеванию пептид. Необязательно, относящийся к аутоиммунному или воспалительному заболеванию пептид содержит остаток цистеина, который взаимодействует с остатком цистеина в домене α1 или β1 MHC с образованием цистеиновой ловушки.
[053] Согласно одному аспекту один полипептид гетеродимера содержит домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию и по меньшей мере одну сконструированную полость. Согласно некоторым вариантам осуществления по меньшей мере одна сконструированная полость не расположена в домене β1 МНС класса II или в домене β2 МНС класса II. Согласно некоторым вариантам осуществления сконструированная полость расположена в домене СН3 антитела, слитого с полипептидом. Согласно некоторым вариантам осуществления полипептид необязательно содержит домен CH2 антитела, расположенный между доменом β2 MHC класса II и доменом CH3 со сконструированной полостью. Согласно некоторым вариантам осуществления полипептид содержит домен CH3 антитела, а домен CH3 антитела содержит по меньшей мере одну мутацию, выбранную из списка, состоящего из Y349C, T366S, L368A, Y407V (нумерация ЕU) и их комбинаций. Согласно другим вариантам осуществления полипептид содержит относящийся к аутоиммунному или воспалительному заболеванию пептид. Необязательно, относящийся к аутоиммунному или воспалительному заболеванию пептид содержит остаток цистеина, который взаимодействует с остатком цистеина в домене α1 или β1 MHC с образованием цистеиновой ловушки.
[054] Используемый в настоящем документе термин «приблизительно» будет понятен специалистам в настоящей области техники и будет варьировать до некоторой степени в зависимости от контекста, в котором он используется. Если есть употребления термина, которые не понятны специалистам в настоящей области техники, учитывая контекст, в котором они используются, «приблизительно» будет означать до плюс или минус 10% конкретного термина.
[055] Использование терминов в единственном и множественном числе и аналогичных ссылок в контексте описания элементов (особенно в контексте нижеследующей формулы изобретения) следует толковать как единственное, так и множественное число, если иное не указано в настоящем документе или явно не противоречит контексту. Перечисление диапазонов значений в настоящем документе просто предназначено для того, чтобы служить кратким способом индивидуальной ссылки на каждое отдельное значение, попадающее в этот диапазон, если в настоящем документе не указано иное, и каждое отдельное значение включается в описание, как если бы оно было отдельно указано в настоящем документе. Все описанные в настоящем документе способы могут быть выполнены в любом подходящем порядке, если иное не указано в настоящем документе или иное явно не противоречит контексту. Использование любых и всех примеров или иллюстративных формулировок (например, «таких как»), представленных в настоящем документе, предназначено просто для лучшего освещения вариантов осуществления и не налагает ограничения на объем формулы изобретения, если не указано иное. Ни одна формулировка в описании не должна быть истолкована как указывающая на необязательный элемент как существенный.
[056] Используемый в настоящем документе термин «гетеродимер» относится к молекуле, содержащей первый полипептид и второй полипептид, причем второй полипептид отличается по аминокислотной последовательности от первого полипептида по меньшей мере одним аминокислотным остатком. «Мультимер» относится к молекуле, содержащей два или более гетеродимеров или содержащей четыре или более полипептидов, раскрытых в настоящем документе.
[057] Используемый в настоящем документе «индивидуум» является синонимом «субъекта». У индивидуума может быть диагностировано заболевание. У индивидуума может подозреваться наличие определенного заболевания на основании проявления по меньшей мере одного симптома указанного заболевания, наличия семейного анамнеза указанного заболевания, наличия генотипа, соответствующего определению риска для указанного заболевания, или проведения одного из фенотипических «лабораторных тестов» с уровнем или приблизительным уровнем, который означал бы, что индивидуум характеризуется риском заболевания. Индивидуум может представлять собой млекопитающее, такое как лошадь, кошка, собака, свинья, корова, коза или овца. Индивидуум может в определенных случаях представлять собой человека.
[058] Используемый в настоящем документе термин «полипептид» в целом относится к пептидам и белкам, содержащим более десяти аминокислот.
[059] Используемый в настоящем документе термин «первый полипептид» представляет собой любой полипептид, который должен быть связан со вторым полипептидом. Первый и второй полипептид встречаются «поверхностями контакта» (определено ниже). В дополнение к поверхности контакта первый полипептид может содержать один или несколько дополнительных доменов, таких как «связывающие домены» (например, лиганд-связывающий домен) или константные домены антител (или их части), включая в себя домены CH2, CH1 и CL. Согласно некоторым вариантам осуществления первый полипептид содержит по меньшей мере один домен, который происходит от антитела. Согласно дополнительным вариантам осуществления домен, как правило, представляет собой константный домен, такой как домен СН3 антитела. Согласно еще другим вариантам осуществления домен образует поверхность контакта первого полипептида.
[060] Используемый в настоящем документе «второй полипептид» представляет собой любой полипептид, который должен быть связан с первым полипептидом через «поверхность контакта». В дополнение к поверхности контакта второй полипептид может содержать дополнительные домены, такие как «связывающий домен» (например, лиганд-связывающий домен) или константные домены антитела (или их части), включая в себя домены CH2, CH1 и CL. Согласно некоторым вариантам осуществления второй полипептид содержит по меньшей мере один домен, который происходит из антитела. Согласно другим вариантам осуществления домен, как правило, представляет собой константную область, такую как домен СН3 антитела. Согласно еще другим вариантам осуществления домен образует поверхность контакта второго полипептида.
[061] Используемый в настоящем документе термин «связывающий домен» включает в себя любую область полипептида, которая отвечает за селективное связывание с представляющей интерес молекулой (например, антигеном).
[062] Используемый в настоящем документе термин «связывающая борозда» относится к молекулярному карману или расщелине, которая существует в гетеродимере МНС класса II, образованном между доменом α1 МНС класса II и доменом β2 МНС класса II. Это часть гетеродимера MHC класса II, которая взаимодействует с антигенами. Антигены, как правило, представляют собой полипептидные антигены, но могут быть дополнительно модифицированы липидными фрагментами, гликолевыми фрагментами или гликолипидными фрагментами. Остатки, которые составляют связывающую борозду, проявляют полиморфизм и объясняют различия в связывании антигена между различными аллелями HLA. Важной особенностью связывающей борозды для молекул МНС класса II является то, что концы борозды открыты и позволяют антигену выходить за пределы одной или обеих сторон связывающей борозды.
[063] Используемый в настоящем документе термин «поверхность контакта» включает в себя те «контактные» аминокислотные остатки в первом полипептиде, которые взаимодействуют с одним или несколькими «контактными» аминокислотными остатками на поверхности контакта второго полипептида. Согласно некоторым вариантам осуществления поверхность контакта содержит домен СН3 иммуноглобулина. Согласно другим вариантам осуществления иммуноглобулин происходит из антитела IgG. Антитело IgG может характеризоваться изотипом IgG1, IgG2, IgG3 или IgG4. Согласно другим вариантам осуществления иммуноглобулин происходит из человеческого антитела IgG1.
[064] Используемый в настоящем документе термин «выступ» относится по меньшей мере к одной боковой цепи аминокислоты, которая выступает из поверхности контакта первого полипептида и, следовательно, может располагаться в компенсаторной полости в соседней поверхности контакта (т.е. поверхности контакта второго полипептида), чтобы стабилизировать гетеродимер и тем самым способствовать образованию гетеродимера, например, по отношению к образованию гомодимера. Выступ может существовать в исходной поверхности контакта или может быть введен синтетически (например, путем изменения нуклеиновой кислоты, кодирующей поверхность контакта). «Сконструированный выступ» вводят синтетически. Согласно некоторым вариантам осуществления нуклеиновую кислоту, кодирующую поверхность контакта первого полипептида, изменяют для кодирования выступа. Для достижения этой цели нуклеиновую кислоту, кодирующую по меньшей мере один «исходный» аминокислотный остаток на поверхности контакта первого полипептида, заменяют нуклеиновой кислотой, кодирующей по меньшей мере один «импортный» аминокислотный остаток, который характеризуется большим объемом боковой цепи, чем исходный аминокислотный остаток. Понятно, что может быть более одного исходного и соответствующего импортного остатка. Согласно некоторым вариантам осуществления верхний предел для числа замененных исходных остатков представляет собой общее количество остатков на поверхности контакта первого полипептида. Согласно некоторым вариантам осуществления импортными остатками для образования выступа, как правило, являются встречающиеся в природе аминокислотные остатки. Согласно некоторым вариантам осуществления импортные остатки выбирают из аргинина (R), цистеина (C), фенилаланина (F), тирозина (Y) и триптофана (W). Согласно некоторым вариантам осуществления импортные остатки выбирают из аргинина (R), фенилаланина (F), тирозина (Y) и триптофана (W). Согласно некоторым вариантам осуществления импортные остатки представляют собой триптофан и тирозин. Согласно некоторым вариантам осуществления импортные остатки представляют собой триптофан и цистеин. Согласно некоторым вариантам осуществления исходный остаток для образования выступа характеризуется небольшим объемом боковой цепи, например, аланин, аспарагин, аспарагиновая кислота, глицин, серин, треонин или валин. Согласно некоторым вариантам осуществления остаток серина заменяют цистеином, а остаток треонина заменяют триптофаном. Согласно некоторым вариантам осуществления серин в положении 354 заменяют другим аминокислотным остатком для образования части или всего выступа. Согласно некоторым вариантам осуществления треонин в положении 366 заменяют другим аминокислотным остатком для образования части или всего выступа. Согласно другим вариантам осуществления аминокислотные замены содержат S354C и T366W (нумерация EU). Вся нумерация соответствует Edelman, Gerald M. et al. PNAS 63(1) (1969): 78-85.
[065] Используемый в настоящем документе термин «полость» относится по меньшей мере к одной боковой цепи аминокислоты, которая углублена от поверхности контакта второго полипептида и, следовательно, вмещает соответствующий выступ в смежной поверхности контакта первого полипептида. Полость может существовать в исходной поверхности контакта или может быть введена синтетически (например, путем изменения нуклеиновой кислоты, кодирующей поверхность контакта). «Сконструированную полость» вводят синтетически. Согласно некоторым вариантам осуществления нуклеиновую кислоту, кодирующую поверхность контакта второго полипептида, изменяют для кодирования полости. Для достижения этого нуклеиновую кислоту, кодирующую по меньшей мере один «исходный» аминокислотный остаток на поверхности контакта второго полипептида, заменяют ДНК, кодирующей по меньшей мере один «импортный» аминокислотный остаток, который характеризуется меньшим объемом боковой цепи, чем исходный аминокислотный остаток. Понятно, что может быть более одного исходного и соответствующего импортного остатка. Верхний предел для количества заменяемых исходных остатков представляет собой общее количество остатков на поверхности контакта второго полипептида. Согласно некоторым вариантам осуществления импортными остатками для образования полости, как правило, являются встречающиеся в природе аминокислотные остатки. Согласно некоторым вариантам осуществления импортные остатки выбирают из аланина (A), цистеина (C), серина (S), треонина (T) и валина (V). Согласно некоторым вариантам осуществления импортные остатки выбирают из аланина (A), серина (S), треонина (T) и валина (V). Согласно некоторым вариантам осуществления импортные остатки выбирают из аланина (A), цистеина (C), серина (S) и валина (V). Согласно некоторым вариантам осуществления импортные остатки представляют собой серин, аланин или треонин. Согласно некоторым вариантам осуществления импортные остатки представляют собой аланин (A), цистеин (C), серин (S) и валин (V). Согласно некоторым вариантам осуществления тирозин в положении 349 заменяют другим аминокислотным остатком для образования части или всей полости. Согласно некоторым вариантам осуществления треонин в положении 366 заменяют другим аминокислотным остатком для образования части или всей полости. Согласно некоторым вариантам осуществления лейцин в положении 368 заменяют другим аминокислотным остатком для образования части или всей полости. Согласно некоторым вариантам осуществления тирозин в положении 407 заменяют другим аминокислотным остатком для образования части или всей полости. Согласно некоторым вариантам осуществления исходный остаток для образования полости характеризуется большим объемом боковой цепи, например, тирозин, аргинин, фенилаланин или триптофан. Согласно другим вариантам осуществления исходный остаток выбирают из тирозина, треонина и лейцина. Согласно некоторым вариантам осуществления один или несколько остатков тирозина заменяют на цистеин или валин, остаток треонина заменяют на серин, а остаток лейцина заменяют на аланин. Согласно другим вариантам осуществления аминокислотные замены содержат Y349C, T366S, L368A и Y407V (нумерация EU). Вся нумерация соответствует Edelman, Gerald M. et al. PNAS 63(1) (1969): 78-85.
[066] Используемый в настоящем документе термин «исходный» аминокислотный остаток представляет собой остаток, который заменен «импортным» остатком, который может характеризоваться меньшим или большим объемом боковой цепи, чем исходный остаток. Импортный аминокислотный остаток может представлять собой встречающийся в природе или не встречающийся в природе аминокислотный остаток, но предпочтительно является встречающимся. «Встречающиеся в природе» аминокислотные остатки представляют собой остатки, кодируемые генетическим кодом. Под «не встречающимся в природе» аминокислотным остатком подразумевается остаток, который не кодируется генетическим кодом, но который способен ковалентно связывать соседний аминокислотный остаток(остатки) в полипептидной цепи. Примерами не встречающихся в природе аминокислотных остатков являются норлейцин, орнитин, норвалин, гомосерин и другие аналоги аминокислотных остатков, такие как описанные в Ellman et al., Meth. Enzym. 202:301-336 (1991), например. Для получения таких не встречающихся в природе аминокислотных остатков, могут применяться процедуры Noren et al. Science 244: 182 (1989) и Ellman et al., смотрите выше. Вкратце, это включает в себя химическую активацию супрессорной тРНК не встречающимся в природе аминокислотным остатком с последующей транскрипцией in vitro и трансляцией РНК. Способ по настоящему изобретению включает замену по меньшей мере одного исходного аминокислотного остатка, но можно заменить более одного исходного остатка. Как правило, не более чем все остатки на поверхности контакта первого или второго полипептида будут содержать исходные аминокислотные остатки, которые заменяются. Предпочтительные исходные остатки для замены являются «погруженными». Под «погруженными» подразумевается, что остаток по существу недоступен для растворителя. Согласно некоторым вариантам осуществления импортный остаток не является цистеином для предотвращения возможного окисления или неправильного связывания дисульфидных связей.
[067] Выступ «устанавливается» в полости, что означает, что пространственное расположение выступа и полости на поверхности контакта первого полипептида и второго полипептида, соответственно, а также размеры выступа и полости таковы, что выступ может быть расположен в полости без значительного нарушения нормальной ассоциации первого и второго полипептидов на поверхности контакта. Поскольку выступы, содержащие одну из нескольких аминокислот, такие как, без ограничения, Cys, Tyr, Phe и Trp, как правило, не проходят перпендикулярно от оси поверхность контакта и характеризуются предпочтительными конформациями, выравнивание выступа с соответствующей полостью зависит от моделирования пары выступ/полость на основе трехмерной структуры, такой как структура, полученная с помощью рентгеновской кристаллографии или ядерного магнитного резонанса (ЯМР). Это может быть достигнуто с использованием общепринятых в технике способов.
[068] «Исходная нуклеиновая кислота» представляет собой нуклеиновую кислоту, кодирующую представляющий интерес полипептид, который может быть «изменен» (т.е. генетически модифицирован или мутирован) для кодирования выступа или полости. Исходная или стартовая нуклеиновая кислота может представлять собой встречающуюся в природе нуклеиновую кислоту или может содержать нуклеиновую кислоту, которая была подвергнута предварительному изменению (например, фрагмент гуманизированного антитела). Под «изменением» нуклеиновой кислоты подразумевается, что исходная нуклеиновая кислота мутирует путем вставки, делеции или замены по меньшей мере одного кодона, кодирующего представляющий интерес аминокислотный остаток. Как правило, кодон, кодирующий исходный остаток, заменяется кодоном, кодирующим импортный остаток. Способы генетической модификации ДНК таким образом были рассмотрены в публикации Mutagenesis: a Practical Approach, M. J. McPherson, Ed., (IRL Press, Oxford, UK. (1991) и включают сайт-направленный мутагенез, кассетный мутагенез и мутагенез полимеразной цепной реакцией (ПЦР), например.
[069] Выступ или полость могут быть «введены» в поверхность контакта первого или второго полипептида синтетическими средствами, например, с помощью рекомбинантных технологий, синтеза пептидов in vitro, тех способов введения не встречающихся в природе аминокислотных остатков, которые были описаны ранее, путем ферментативного или химического сочетания пептидов или некоторой комбинации этих способов. Соответственно, выступ или полость, которые «вводятся», являются «не встречающимися в природе» или «ненативными», что означает, что они не существуют в природе или в исходном полипептиде (например, гуманизированном моноклональном антителе).
[070] Предпочтительно импортный аминокислотный остаток для образования выступа содержит относительно небольшое количество «ротамеров» (например, приблизительно 3-6). «Ротамер» представляет собой энергетически выгодную конформацию боковой цепи аминокислоты. Количество ротамеров различных аминокислотных остатков приведено в Ponders and Richards, J. Mol. Biol. 193: 775-791 (1987).
[071] Используемый в настоящем документе термин «выступ-во-впадину» относится к архитектуре полипептида, требующей выступа на поверхности контакта первого полипептида и соответствующей полости (или «впадины») на поверхности контакта второго полипептида, так что выступ может быть расположена в полости, чтобы способствовать образованию гетеродимера. Выступы могут быть созданы путем замещения небольших аминокислотных боковых цепей на поверхности контакта первого полипептида более крупными боковыми цепями (например, фенилаланином или тирозином). Полости идентичного или сходного размера с выпуклостями могут быть созданы на поверхности контакта второго полипептида путем замещения больших боковых цепей аминокислот меньшими (например, аланином или треонином). Выступы и полости могут быть получены синтетическими способами, такими как изменение нуклеиновой кислоты, кодирующей полипептиды, или синтезом пептидов с использованием рутинных способов специалистом в настоящей области техники. Согласно некоторым вариантам осуществления поверхность контакта первого полипептида расположена в домене Fc в первом полипептиде, а поверхность контакта второго полипептида расположена в домене Fc во втором полипептиде. Гетеродимеры с «выступом-во-впадину» и способы их получения и применения описаны в патентах США №5731168; 5807706; 5821333; 7642228; 7695936; 8216805 и 8679785; и в публикации Merchant et al., Nature Biotechnology, 1998, 16: 677-681, все из которых полностью включены в настоящий документ посредством ссылки.
[072] Используемый в настоящем документе термин «выделенный» гетеродимер означает гетеродимер, который был идентифицирован и отделен и/или извлечен из компонента его естественной среды для культивирования клеток. Загрязняющие компоненты его естественной среды представляют собой материалы, которые будут мешать диагностическому или терапевтическому применению гетеродимера, и могут включать в себя ферменты, гормоны и другие белковые или небелковые растворы. Согласно предпочтительным вариантам осуществления гетеродимер будет очищен (1) до более чем 95 мас.% белка, как определено способом Лоури, и наиболее предпочтительно более чем 99 мас.%, (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающейся чашкой, или (3) до гомогенности с помощью ДСН-ПААГ в восстанавливающих или невосстанавливающих условиях с использованием окрашивания кумасси синим или серебром.
[073] Под «наносферой», «NP» или «наночастицей» в настоящем документе подразумевается небольшая дискретная частица, которую вводят индивидуально или множественно субъекту, образцу клетки или образцу ткани, в зависимости от ситуации. Согласно определенным вариантам осуществления используемый в настоящем документе термин «наночастица» включает в себя любые слои вокруг ядра наночастицы. Согласно определенным вариантам осуществления наночастицы характеризуются по существу сферической формой. Согласно определенным вариантам осуществления наночастица не является липосомой или вирусной частицей. Согласно другим вариантам осуществления наночастица состоит из любого подходящего материала, например, твердого вещества, твердого ядра, металла, дендримера, полимерной мицеллы, оксида металла или белка или фрагмента или их комбинаций. Используемый в настоящем документе термин «по существу сферический» означает, что форма частиц не отклоняется от сферы более чем на 10%. Различные известные антигенные или пептидные комплексы по настоящему изобретению могут быть применены к частицам. Наночастицы по настоящему изобретению характеризуются размером от приблизительно 1 нм до приблизительно 1 мкм, от приблизительно 1 нм до приблизительно 500 нм или, альтернативно, от приблизительно 1 нм до приблизительно 100 нм, или, альтернативно, от приблизительно 1 нм до приблизительно 50 нм, или, альтернативно, от приблизительно 5 нм до приблизительно 100 нм, и согласно некоторым аспектах относится к среднему или среднему диаметру множества наночастиц, когда предполагается множество наночастиц. Более мелкие наноразмерные частицы могут быть получены, например, с помощью процесса фракционирования, в результате чего более крупные частицы могут осесть в водном растворе. Верхнюю часть раствора затем извлекают способами, известными специалистам в настоящей области техники. Эта верхняя часть обогащена частицами меньшего размера. Процесс может повторяться до тех пор, пока не будет получен желаемый средний размер. Термин «наноструктура», как правило, используется для описания структур размером менее чем 1 мкм.
[074] Комплекс антиген-MHC-наночастица («NP-комплекс» или «комплекс» или pMHC-NP или «комплекс наночастиц») относится к презентации пептида, углевода, липида или другого антигенного сегмента, фрагмента или эпитопа антигенной молекулы или белка (т.е. аутопептид или аутоантиген) на поверхности, такой как ядро наночастицы.
[075] «Ядро наночастиц» представляет собой подложку наночастиц, которая включает в себя слои или покрытия или не включает в себя их. Комплекс наночастиц содержит ядро по меньшей мере с комплексом антиген-МНС, связанным с ядром.
[076] «Плотность», когда речь идет о pMHC на наночастицу, рассчитывается как площадь поверхности ядра наночастицы с внешними слоями или без них, которые также могут включать в себя линкеры. Площадь поверхности представляет собой общую доступную площадь поверхности используемой конструкции. Согласно одному аспекту, когда используют ПЭГ-линкер, это может увеличить общий диаметр ядра наночастицы приблизительно на 20 нм2 наночастицы, что увеличивает площадь поверхности соответственно общей доступной площади поверхности наночастицы. Другими словами, это конечная площадь поверхности наночастицы без добавления одного или нескольких из pMHC, костимулирующих молекул и/или цитокинов.
[077] «Антиген» в контексте настоящего документа относится ко всей части, фрагменту или сегменту молекулы, которая может индуцировать иммунный ответ у субъекта или экспансию иммунной клетки, предпочтительно Т- или В-клетки.
[078] Используемый в настоящем документе термин «относящийся к заболеванию» антиген относится к антигену или его фрагменту, выбранному для лечения выбранного заболевания и участвующему в процессе заболевания. Например, относящийся к сахарному диабету антиген представляет собой антиген или его фрагмент, который, когда он представлен, вызывает иммунный ответ, который служит для лечения сахарного диабета; таким образом, относящийся к сахарному диабету антиген, производящий такой эффект, выбирают для лечения сахарного диабета. Антиген, относящийся к рассеянному склерозу (MS), выбирают для лечения MS. Относящийся к сахарному диабету антиген не будет выбран для лечения MS. Аналогично, относящийся к аутоиммунитету антиген представляет собой антиген, который имеет отношение к аутоиммунному заболеванию и не может быть выбран для лечения нарушения или заболевания, отличного от аутоиммунитета, например, рака. Неограничивающие иллюстративные относящиеся к заболеванию антигены раскрыты в настоящем документе, и, кроме того, такие антигены могут быть определены для конкретного заболевания на основе техник, механизмов и способов, документированных в литературе.
Гетеродимеры MHC класса II и архитектура «выступ-во-впадине»
[079] Экспрессия молекул МНС класса II была затруднена, поскольку секретируемые α- и β-цепи МНС класса II, лишенные трансмембранного и цитоплазматического доменов, не образуют стабильных гетеродимеров даже в присутствии пептидного лиганда. Трансмембранные области α- и β-цепей MHC класса II способствуют правильной сборке гетеродимера αβ предположительно благодаря взаимодействию двух α-спиральных трансмембранных сегментов.
[080] В настоящее время уровень техники заключается в получении рекомбинантных молекул pMHC класса II для производства тетрамеров pMHC с использованием лейциновой молнии. Это также справедливо для предприятия по производству тетрамеров NIH и коммерческих поставщиков тетрамеров pMHC.
[081] Этот подход, однако, предлагает свои собственные ограничения в качестве платформы для построения мономеров pMHC класса II для производства относящихся к заболеванию соединений наночастиц pMHC класса II: 1) вероятность того, что последовательности jun/fos могут быть распознаны как «чужеродные» и, таким образом, являются иммуногенными для индивидуумов, подвергнутых лечению pMHC-наночастицами, которые могут потенциально ограничивать терапевтическую активность, особенно после многократного введения; 2) хроматографическое отделение комплексов pMHC от супернатантов эукариотической клеточной культуры (т.е. яичника китайского хомячка -CHO-) затруднено, если метки аффинного разделения не введены в комплекс pMHC; и 3) аффинные метки также являются проблематичными из-за антигенности аффинных меток, таких как FLAG или 6xHIS. Из-за возможности антигенности и их потенциального широкого применения при очистке различных белков эти метки не подходят для применения с человеческими терапевтическими средствами. К сожалению, добавление аффинных меток к этим белкам может вызвать производство антител к лекарственным средствам (ADA).
[082] В настоящем документе согласно одному аспекту предусмотрены выделенные гетеродимеры, содержащие по меньшей мере один первый полипептид и по меньшей мере один второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ который расположен в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II или их комбинацию, а второй полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию или (ii) первый полипептид содержит домен β1 МНС класса II, домен β2 МНС класса II или их комбинацию, а второй полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию.
[083] Согласно другому аспекту в настоящем документе предусмотрены выделенные гетеродимеры, содержащие первый полипептид и второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который может быть расположен в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II или их комбинацию, а второй полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию или (ii) первый полипептид содержит домен β1 МНС класса II, домен β2 МНС класса II или их комбинацию, а второй полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию.
[084] Согласно другому аспекту в настоящем документе предусмотрены выделенные гетеродимеры, содержащие первый полипептид и второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который расположен в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен α1 МНС класса II и домен α2 МНС класса II, а второй полипептид содержит домен β1 MHC класса II и домен β2 MHC класса II или (ii) первый полипептид содержит домен β1 МНС класса II и домен β2 МНС класса II, а второй полипептид содержит домен α1 МНС класса II и домен α2 МНС класса II.
[085] Согласно некоторым вариантам осуществления каждый первый полипептид и второй полипептид содержат домен СН3 антитела и взаимодействуют через домены СН3. Согласно некоторым вариантам осуществления первый полипептид и второй полипептид, каждый, содержат домен СН2 антитела и взаимодействуют через домены СН2. Согласно некоторым вариантам осуществления каждый первый полипептид и второй полипептид содержат домен СН2 и домен СН3 антитела и взаимодействуют через домены СН2, домены СН3 или их комбинацию. Согласно некоторым вариантам осуществления первый полипептид и второй полипептид, каждый, содержат домен CH2 и домен CH3 антитела и взаимодействуют через домены CH3. Согласно некоторым вариантам осуществления домен CH3 происходит от IgG. Согласно некоторым вариантам осуществления домен CH2 происходит от IgG. IgG может быть подтипа IgG1, IgG2, IgG3 или IgG4. Согласно некоторым вариантам осуществления IgG относится к подтипу IgG1.
[086] Согласно некоторым вариантам осуществления первый полипептид и/или второй полипептид дополнительно содержат C-концевой остаток цистеина. Согласно некоторым вариантам осуществления первый полипептид и второй полипептид дополнительно содержат C-концевой остаток цистеина. Согласно некоторым вариантам осуществления первый полипептид или второй полипептид дополнительно содержат C-концевой остаток цистеина. Согласно некоторым вариантам осуществления первый полипептид дополнительно содержит C-концевой остаток цистеина. Согласно некоторым вариантам осуществления второй полипептид дополнительно содержит C-концевой остаток цистеина.
[087] Биотинилирование pMHC через BirA представляет собой технику, как правило, используемую для получения биотинилированных мономеров pMHC, подходящих для тетрамеризации с использованием стрептавидина. Такие тетрамеры pMHC и их производные высшего порядка (пентамеры, декстрамеры или другие мультимеры) применимы в качестве реагентов, способных подсчитывать частоту антиген-специфических Т-клеток в биологических образцах. Согласно некоторым вариантам осуществления первый полипептид и/или второй полипептид дополнительно содержат сайт биотинилирования. Согласно некоторым вариантам осуществления первый полипептид и второй полипептид дополнительно содержат сайт биотинилирования. Согласно некоторым вариантам осуществления первый полипептид или второй полипептид дополнительно содержат сайт биотинилирования. Согласно некоторым вариантам осуществления первый полипептид дополнительно содержит сайт биотинилирования. Согласно некоторым вариантам осуществления второй полипептид дополнительно содержит сайт биотинилирования.
[088] Согласно некоторым вариантам осуществления первый полипептид и/или второй полипептид дополнительно содержат метку Strep. Согласно некоторым вариантам осуществления первый полипептид и второй полипептид дополнительно содержат метку Strep. Согласно некоторым вариантам осуществления первый полипептид или второй полипептид дополнительно содержат метку Strep. Согласно некоторым вариантам осуществления первый полипептид дополнительно содержит метку Strep. Согласно некоторым вариантам осуществления второй полипептид дополнительно содержит метку Strep.
[089] Согласно некоторым вариантам осуществления выделенный гетеродимер дополнительно содержит лейциновую молнию. Согласно некоторым вариантам осуществления первый полипептид содержит фрагмент C-Jun, а второй полипептид содержит фрагмент C-Fos. Согласно некоторым вариантам осуществления выделенный гетеродимер не содержит лейциновой молнии.
[090] Согласно некоторым вариантам осуществления выделенный гетеродимер лишен посторонних последовательностей белков, которые могут быть мишенью иммунореактивности, таких как последовательность биотинилирования, на которую нацеливается фермент BirA, чтобы присоединить молекулу биотина или метку эпитопа/аффинности/очистки (например, c-Myc, FLAG, V5, полигистидин, 6xHIS и т.д.). Часто димеры МНС получают с использованием гетерологичных доменов димеризации. Некоторые примеры включают в себя лейциновые молнии (димеры Fos/Jun, Acid-p1/Base-p1 или GCN4), димеры белка иммунитета к колицину E9/E9-ДНКазы или димеры домена T1 Kv1.2. Согласно некоторым вариантам осуществления выделенный гетеродимер лишен домена димеризации, отличного от архитектуры «выступ-во-впадину». Согласно некоторым вариантам осуществления выделенный гетеродимер лишен домена димеризации лейциновой молнии. Согласно некоторым вариантам осуществления выделенный гетеродимер лишен доменов димеризации c-FOS/c-JUN.
[091] Согласно некоторым вариантам осуществления домен α1 MHC класса II и домен α2 MHC класса II, и домен β1 MHC класса II, и домен β2 MHC класса II гетеродимера происходят от молекулы лейкоцитарного антигена (HLA), такой как HLA-DR, HLA-DQ или HLA-DP. Согласно некоторым вариантам осуществления домен α1 MHC класса II и домен α2 MHC класса II получены из DRA, DQA1 или DPA1. Согласно определенным вариантам осуществления домен α1 МНС класса II или домен α2 МНС класса II получены из DRA, DQA1 или DPA1. Согласно некоторым вариантам осуществления домен β1 MHC класса II и β2 MHC класса II получены из HLA-DRB1, HLA-DRB3, HLA-DRB4, HLA-DRB5, HLA-DQB1 или HLA-DPB1. Согласно некоторым вариантам осуществления домен β1 MHC класса II или β2 MHC класса II получены из HLA-DRB1, HLA-DRB3, HLA-DRB4, HLA-DRB5, HLA-DQB1 или HLA-DPB1.
[092] Согласно некоторым вариантам осуществления два или более гетеродимеров ковалентно связаны друг с другом через полимерный остов, образуя мультимер. Согласно некоторым вариантам осуществления полимерный остов представляет собой декстран или полиэтиленгликоль. Согласно некоторым вариантам осуществления каждый из полипептидов в гетеродимере присоединен к остову полимера. Согласно некоторым вариантам осуществления каждый из полипептидов в гетеродимере присоединен к полимерному остову через концевой остаток цистеина на каждом из полипептидов. Согласно некоторым вариантам осуществления каждый из полипептидов в гетеродимере присоединен к полимерному остову через сайт биотинилирования на каждом из полипептидов.
[093] Согласно некоторым вариантам осуществления два гетеродимера ковалентно связаны друг с другом через авидин с образованием мультимера.
Антигены
[094] Согласно определенным вариантам осуществления описанные в настоящем документе гетеродимеры дополнительно содержат антиген. Согласно определенным вариантам осуществления антиген представляет собой полипептидный антиген, который составляет по меньшей мере 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или более аминокислот в длину, и согласно некоторым вариантам осуществления длиной не более чем 50, 60, 70, 80, 90 или 100 аминокислот. Согласно определенным вариантам осуществления антиген представляет собой относящийся к заболеванию антиген. Согласно некоторым вариантам осуществления антиген представляет собой относящийся к аутоиммунному заболеванию антиген. Согласно определенным вариантам осуществления антиген представляет собой относящийся к воспалительному заболеванию антиген. Описанные в настоящем документе антигены соединены с N-концом полипептида MHC класса IIα или MHC класса IIβ. Согласно определенным вариантам осуществления антигены соединены гибким пептидным линкером. Линкер может, например, представлять собой полипептидный линкер и содержать глицин и серин.
[095] Согласно определенным вариантам осуществления антиген представляет собой относящийся к аутоиммунному заболеванию антиген. Согласно некоторым вариантам осуществления относящийся к аутоиммунному заболеванию антиген представляет собой относящийся к сахарному диабету I типа, рассеянному склерозу, глютеиновой болезни, первичному билиарному циррозу, аутоиммунному гепатиту, первичному склерозирующему холангиту, пузырчатке, пузырчатке листовидной, пузырчатке обыкновенной, нейромиелиту зрительного нерва со спектральным расстройством, артриту (включая в себя ревматоидный артрит), аллергической астме, воспалительным заболеваниям кишечника (включая в себя болезнь Крона и язвенный колит), системной красной волчанке, атеросклерозу, хронической обструктивной болезни легких, эмфиземе, псориазу, аутоиммунному гепатиту, увеиту, синдрому Шегрена, склеродермии, антифосфолипидному синдрому, ANCA-ассоциированному васкулиту или синдрому мышечной скованности антиген. Согласно дополнительному аспекту относящийся к заболеванию антиген представляет собой антиген, относящийся к опухоли или раку. Согласно некоторым вариантам осуществления относящийся к аутоиммунному заболеванию антиген представляет собой антиген, относящийся к сахарному диабету I типа. Согласно некоторым вариантам осуществления относящийся к аутоиммунному заболеванию антиген представляет собой антиген, относящийся к рассеянному склерозу. Согласно некоторым вариантам осуществления относящийся к аутоиммунному заболеванию антиген представляет собой антиген, относящийся к ревматоидному артриту. Согласно некоторым вариантам осуществления относящийся к аутоиммунному заболеванию антиген представляет собой антиген, относящийся к болезни Крона. Согласно некоторым вариантам осуществления относящийся к аутоиммунному заболеванию антиген представляет собой антиген, связанный с неспецифическим язвенным колитом. Согласно некоторым вариантам осуществления относящийся к аутоиммунному заболеванию антиген представляет собой антиген, относящийся к глютеиновой болезни. Согласно некоторым вариантам осуществления относящийся к аутоиммунному заболеванию антиген представляет собой антиген, относящийся к аутоиммунному заболеванию гепатобилиарной системы. Согласно некоторым вариантам осуществления антиген, относящийся к аутоиммунному заболеванию гепатобилиарной системы, представляет собой относящийся к первичному билиарному циррозу, аутоиммунному гепатиту или первичному склерозирующему холангиту антиген. Согласно определенным вариантам осуществления антиген получают из микроба желудочно-кишечного тракта. Согласно некоторым вариантам осуществления антиген, полученный из микроба желудочно-кишечного тракта, представляет собой флагеллин, Fla-2, Fla-X, неохарактеризованный белок E.coli (YIDX) или интегразу бактероидов. Согласно определенным вариантам осуществления антиген представляет собой пищевой антиген. Согласно определенным вариантам осуществления пищевой антиген представляет собой глиадин. Согласно определенным вариантам осуществления пищевой антиген представляет собой овальбумин. Согласно определенным вариантам осуществления пищевой антиген представляет собой полученный из арахиса антиген.
Цистеиновое улавливание
[096] Цистеиновая ловушка может быть использована для стабилизации описанного в настоящем документе гетеродимера. Цистеиновое улавливание включает образование ковалентно связанных полипептидных комплексов из несвязанных полипептидных партнеров. Согласно некоторым вариантам осуществления цистеиновое улавливание включает введение цистеина в стратегически выбранном положении в области взаимодействия полипептидных партнеров для образования стабилизированного полипептидного комплекса. Согласно некоторым вариантам осуществления цистеиновое улавливание может стабилизировать полипептидный комплекс, чтобы способствовать определенной конформации и предотвращать диссоциацию. Цистеиновое улавливание также называют дисульфидным улавливанием и дисульфидным сшиванием. Примеры способов и применений цистеинового улавливания рассмотрены в Kufareva, et al., Methods Enzymol. 570: 389-420 (2016). В контексте MHC цистеин встраивают в полипептид, который, как известно или предположительно, связывается в связывающей борозде димера MHC класса II. Цистеин затем вводят в связывающую борозду или недалеко от нее, так что когда полипептид связывается со связывающей бороздой, цистеин связывающей борозды может приближаться и образовывать дисульфидную связь с цистеином полипептида.
[097] Для применения цистеиновой ловушки требуется, чтобы два цистеина были встроены в полипептиды, которые составляют гетеродимеры. Первый цистеин представляет собой «цистеин связывающей борозды», который находится внутри или рядом с бороздой MHC класса II. Цистеин связывающей борозды может находиться в пределах 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот от связывающей борозды. Цистеин может быть расположен либо на альфа-, либо на бета-цепях, а также на N- или C-конце связывающей борозды. Второй цистеин представляет собой «цистеин полипептида», который находится внутри или вблизи антигенного полипептида, который связывается в связывающей борозде. Цистеин полипептида может находиться в пределах 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот антигенного полипептида. Цистеин полипептида может находиться на N- или C-конце антигенного полипептида. Как правило, антигенный полипептид присоединяется либо к альфа-цепи, либо к бета-цепи гибким линкером, и между линкером и антигенным полипептидом располагается цистеин. Согласно некоторым вариантам осуществления структура полипептидной цепи представляет собой антигенный полипептид-цистеин полипептида-линкер-домен α1 MHC класса II, домен α2 MHC класса II. Согласно некоторым вариантам осуществления структура полипептидной цепи представляет собой антигенный полипептид-цистеин полипептида-линкер-домен β1 MHC класса II, домен β2 MHC класса II. Согласно некоторым вариантам осуществления структура полипептидной цепи представляет собой цистеин полипептида-антигенный полипептид-линкер-домен α1 MHC класса II, домен α2 MHC класса II. Согласно некоторым вариантам осуществления структура полипептидной цепи представляет собой цистеин полипептида-антигенный полипептид-линкер-домен β1 MHC класса II, домен β2 MHC класса II. Эти полипептиды MHC класса II могут дополнительно содержать домен CH2 и CH3 со сконструированным выступом на одном полипептиде и домен CH2 и CH3 со сконструированной впадиной на другом полипептиде. В некоторых случаях антигенный полипептид может содержать встречающийся в природе цистеин, что исключает необходимость добавления остатка цистеина.
[098] Согласно некоторым вариантам осуществления полипептиды описанных в настоящем документе гетеродимеров содержат одну или несколько мутаций для введения цистеина. Согласно некоторым вариантам осуществления мутация может находиться в альфа-цепи МНС класса II. Согласно некоторым вариантам осуществления мутация может находиться в бета-цепи МНС класса II. Согласно некоторым вариантам осуществления мутация может находиться в домене α1 MHC класса II. Согласно некоторым вариантам осуществления мутация может находиться в домен β1 МНС класса II. Согласно некоторым вариантам осуществления мутация может находиться рядом со связывающей бороздой, которая образована между цепями α1 и β1 MHC класса II на одной или обеих цепях альфа и бета. Согласно некоторым вариантам осуществления мутация может быть в полипептидном антигене, который связан со связывающей бороздой. Согласно некоторым вариантам осуществления мутация может быть на N-конце антигенного полипептида, который связывается со связывающей бороздой. Согласно некоторым вариантам осуществления мутация может происходить на С-конце антигенного полипептида, который связывается со связывающей бороздой. Согласно некоторым вариантам осуществления цистеиновая ловушка может быть образована между остатком цистеина на N-конце антигенного пептида, который связывается в связывающей борозде MHC, и остатком на N-конце связывающей борозды, расположенной на альфа-цепи MHC класса II. Согласно некоторым вариантам осуществления цистеиновая ловушка может быть образована между остатком цистеина на N-конце антигенного пептида, который связывается в связывающей борозде MHC, и остатком на C-конце связывающей борозды, расположенной на альфа-цепи MHC класса II. Согласно некоторым вариантам осуществления цистеиновая ловушка может быть образована между остатком цистеина на С-конце антигенного пептида, который связывается в связывающей борозде MHC, и остатком на N-конце связывающей борозды, расположенной на альфа-цепи МНС класса II. Согласно некоторым вариантам осуществления цистеиновая ловушка может быть образована между остатком цистеина на С-конце антигенного пептида, который связывается в связывающей борозде МНС, и остатком на С-конце связывающей борозды, расположенной на альфа-цепи МНС класса II. Согласно некоторым вариантам осуществления цистеиновая ловушка может быть образована между остатком цистеина на N-конце антигенного пептида, который связывается в связывающей борозде MHC, и остатком на N-конце связывающей борозды, расположенной в бета-цепи MHC класса II. Согласно некоторым вариантам осуществления цистеиновая ловушка может быть образована между остатком цистеина на N-конце антигенного пептида, который связывается в связывающей борозде MHC, и остатком на C-конце связывающей борозды, расположенной на бета-цепи MHC класса II. Согласно некоторым вариантам осуществления цистеиновая ловушка может быть образована между остатком цистеина на С-конце антигенного пептида, который связывается в связывающей борозде MHC, и остатком на N-конце связывающей борозды, расположенной на бета-цепи MHC класса II. Согласно некоторым вариантам осуществления цистеиновая ловушка может быть образована между остатком цистеина на С-конце антигенного пептида, который связывается в связывающей борозде МНС, и остатком на С-конце связывающей борозды, расположенной на бета-цепи МНС класса II. Согласно некоторым вариантам осуществления мутация может находиться в полипептиде связывающего ядра. Согласно некоторым вариантам осуществления мутация включает замену аминокислотного остатка на цистеин. Согласно некоторым вариантам осуществления мутация включает добавление остатка цистеина в рамке с другими остатками.
[099] Неограничивающие примеры полипептидов, которые содержат цистеиновую ловушку, включают в себя, без ограничения, полипептиды, указанные в SEQ ID NO: 60 и 61. Согласно некоторым вариантам осуществления полипептиды для цистеинового улавливания содержат аминокислотную последовательность с идентичностью, составляющей по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к полипептидам, указанным в любой из SEQ ID NO: 60 и 61. Согласно некоторым вариантам осуществления мутация на цистеин может происходить в любом одном или нескольких остатках полипептидов, указанных в SEQ ID NO: 62 и 63. Согласно некоторым вариантам осуществления полипептиды для цистеинового улавливания содержит аминокислотную последовательность с идентичностью, составляющей по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к полипептидами, указанными в любой из SEQ ID NO: 62 и 63. Согласно некоторым вариантам осуществления мутация на цистеин может быть в любом одном или нескольких остатках полипептидов, указанных в SEQ ID NO: 62 и 63.
Конъюгаты гетеродимер-наночастица
[0100] Согласно другому аспекту в настоящем документе предусмотрены конъюгаты гетеродимер-наночастица, содержащие по меньшей мере один описанный в настоящем документе гетеродимер и наночастицу, причем наночастица не является липосомальной и/или содержит твердое ядро. Согласно определенным вариантам осуществления твердое ядро может представлять собой металл или оксид металла. Согласно определенным вариантам осуществления твердое ядро может представлять собой железо, оксид железа или золото. Твердое ядро может представлять собой ядро высокой плотности, так что плотность превышает приблизительно 2,0 г/см3, приблизительно 3,0 г/см3, приблизительно 4,0 г/см3, приблизительно 5,0 г/см3, приблизительно 6,0 г/см3 или приблизительно 7,0 г/см3. Согласно некоторым вариантам осуществления плотность твердого ядра составляет от приблизительно 4,0 г/см3 до приблизительно 8,0 г/см3. Согласно некоторым вариантам осуществления плотность твердого ядра составляет от приблизительно 5,0 г/см3 до приблизительно 8,0 г/см3. Согласно некоторым вариантам осуществления плотность твердого ядра составляет от приблизительно 5,0 г/см3 до приблизительно 7,0 г/см3. Согласно некоторым вариантам осуществления плотность твердого ядра составляет от приблизительно 5,0 г/см3 до приблизительно 6,0 г/см3.
[0101] Согласно другому аспекту в настоящем документе предусмотрены конъюгаты гетеродимер-наночастица, содержащие по меньшей мере один описанный в настоящем документе гетеродимер и наночастицу, причем наночастица не является липосомальной и содержит ядро из оксида железа.
[0102] Согласно другому аспекту в настоящем документе предусмотрены конъюгаты гетеродимер-наночастица, содержащие по меньшей мере один описанный в настоящем документе гетеродимер и наночастицу, причем наночастица не является липосомальной и содержит золотое ядро.
[0103] Согласно другому аспекту в настоящем документе предусмотрены конъюгаты гетеродимер-наночастица, содержащие по меньшей мере один описанный в настоящем документе гетеродимер и наночастицу, причем наночастица не является липосомальной и содержит ядро из оксида железа; и по меньшей мере один гетеродимер ковалентно связан с наночастицей через линкер.
[0104] Согласно другому аспекту в настоящем документе предусмотрены конъюгаты гетеродимер-наночастица, содержащие по меньшей мере один описанный в настоящем документе гетеродимер и наночастицу, причем наночастица не является липосомальной и содержит ядро из оксида железа; и по меньшей мере один гетеродимер ковалентно связан с наночастицей через линкер, содержащий полиэтиленгликоль. Согласно некоторым вариантам осуществления конъюгат гетеродимер-наночастица содержит по меньшей мере один описанный в настоящем документе гетеродимер и наночастицу, причем наночастица не является липосомальной и содержит ядро из оксида железа; и по меньшей мере один гетеродимер ковалентно связан с наночастицей через линкер, содержащий полиэтиленгликоль с молекулярной массой менее чем 500 дальтон. Согласно некоторым вариантам осуществления полиэтиленгликоль характеризуется молекулярной массой менее чем 1 кДа, 2 кДа, 3 кДа, 4 кДа, 5 кДа, 6 кДа, 7 кДа, 8 кДа, 9 кДа или 10 кДа. Согласно некоторым вариантам осуществления полиэтиленгликоль функционализирован малеимидом. Согласно некоторым вариантам осуществления полиэтиленгликоль характеризуется молекулярной массой от приблизительно 1 кДа до приблизительно 5 кДа, от приблизительно 2 кДа до приблизительно 5 кДа, от приблизительно 3 кДа до приблизительно 5 кДа. Согласно некоторым вариантам осуществления полиэтиленгликоль функционализирован малеимидом. Согласно некоторым вариантам осуществления конец линкера, который находится в контакте с твердым ядром, встроен в твердое ядро.
[0105] Согласно некоторым аспектам ядро наночастицы характеризуется диаметром, выбранным из группы от приблизительно 1 нм до приблизительно 100 нм; от приблизительно 1 нм до приблизительно 75 нм; от приблизительно 1 нм до приблизительно 50 нм; от приблизительно 1 нм до приблизительно 25 нм; от приблизительно 1 нм до приблизительно 25 нм; от приблизительно 5 нм до приблизительно 100 нм; от приблизительно 5 нм до приблизительно 50 нм; от приблизительно 5 нм до приблизительно 25 нм, от приблизительно 15 нм до приблизительно 25 нм или от приблизительно 5 нм до приблизительно 20 нм. Согласно некоторым вариантам осуществления ядро наночастиц характеризуется диаметром от приблизительно 25 нм до приблизительно 60 нм, от приблизительно 25 нм до приблизительно 50 нм, от приблизительно 20 нм до приблизительно 40 нм, от приблизительно 15 нм до приблизительно 50 нм, от приблизительно 15 нм до приблизительно 40 нм, от приблизительно 15 нм до приблизительно 35 нм, от приблизительно 15 нм до приблизительно 30 нм или от приблизительно 15 нм до приблизительно 25 нм, альтернативно, приблизительно 15 нм, приблизительно 20 нм, приблизительно 25 нм, приблизительно 30 нм приблизительно 35 нм или приблизительно 40 нм.
[0106] Согласно некоторым аспектам количество pMHC на ядро наночастицы (называемое в настоящем документе «валентностью» комплекса наночастиц) может варьировать от приблизительно 1 комплекса pMHC на 1 ядро наночастицы до приблизительно 6000 комплексов pMHC на 1 ядро наночастицы, альтернативно, от приблизительно 10:1 до приблизительно 6000:1, альтернативно, от приблизительно 11:1 до приблизительно 6000:1, альтернативно, от приблизительно 12:1 до приблизительно 6000:1, альтернативно, по меньшей мере 2:1, альтернативно, по меньшей мере 8:1, альтернативно, по меньшей мере 9:1, альтернативно, по меньшей мере 10:1, альтернативно, по меньшей мере 11:1 или, альтернативно, по меньшей мере 12:1. Согласно некоторым вариантам осуществления количество pMHC на ядро наночастицы составляет от приблизительно 10:1 до приблизительно 6000:1, от приблизительно 20:1 до приблизительно 5500:1, альтернативно, от приблизительно 10:1 до приблизительно 5000:1, альтернативно, от приблизительно 10:1 до 4000:1, альтернативно, от 10:1 до 3500:1, альтернативно, от 10:1 до 3000:1, альтернативно, от 10:1 до 2500:1, альтернативно, от 10:1 до приблизительно 2000:1, альтернативно, от приблизительно 10:1 до приблизительно 1500:1, альтернативно, от приблизительно 10:1 до 1000:1, альтернативно, от приблизительно 10:1 до приблизительно 500:1, альтернативно, от приблизительно 10:1 до приблизительно 100:1, альтернативно, от приблизительно 20:1 до приблизительно 50:1, альтернативно, от приблизительно 25:1 до приблизительно 60:1; альтернативно, от приблизительно 30:1 до приблизительно 50:1, альтернативно, от приблизительно 35:1 до приблизительно 45:1 или, альтернативно, приблизительно 40:1. Согласно некоторым вариантам осуществления количество pMHC на ядро наночастицы составляет от приблизительно 10:1 до приблизительно 100:1, от приблизительно 10:1 до приблизительно 110:1, от приблизительно 10:1 до приблизительно 120:1, от приблизительно 10:1 до приблизительно 130:1, от приблизительно 10:1 до приблизительно 140:1, от приблизительно 10:1 до приблизительно 150:1 или от приблизительно 10:1 до приблизительно 160:1. Согласно некоторым вариантам осуществления количество pMHC на ядро наночастицы составляет от приблизительно 30:1 до приблизительно 100:1, от приблизительно 30:1 до приблизительно 110:1, от приблизительно 30:1 до приблизительно 120:1, от приблизительно 30:1 до приблизительно 130:1, от приблизительно 30:1 до приблизительно 140:1, от приблизительно 30:1 до приблизительно 150:1 или от приблизительно 30:1 до приблизительно 160:1. Согласно некоторым вариантам осуществления количество pMHC на ядро наночастицы составляет от приблизительно 32:1 до приблизительно 100:1, от приблизительно 32:1 до приблизительно 110:1, от приблизительно 32:1 до приблизительно 120:1, от приблизительно 30:1 до приблизительно 130:1, от приблизительно 32:1 до приблизительно 140:1, от приблизительно 32:1 до приблизительно 150:1 или от приблизительно 32:1 до приблизительно 160:1.
[0107] В некоторых аспектах ядро из наночастиц характеризуется определенной валентностью на площадь поверхности ядра, также называемую в настоящем документе «плотностью». Согласно этим аспектам плотность pMHC на наночастицу составляет от приблизительно 0,025 pMHC/100 нм2 до приблизительно 100 pMHC/100 нм2 площади поверхности ядра наночастицы, альтернативно, от приблизительно 0,406 рМНС/100 нм2 до приблизительно 50 рМНС/100 нм2 или, альтернативно, от приблизительно 0,05 рМНС/100 нм2 до приблизительно 25 рМНС/100 нм2. Согласно определенным аспектам плотность pMHC на наночастицу составляет от приблизительно 0,4 рМНС/100 нм2 до приблизительно 25 рМНС/100 нм2, от приблизительно 0,4 рМНС/100 нм2 до приблизительно 20 рМНС/100 нм2, от приблизительно 0,4 рМНС/100 нм2 до приблизительно 15 pMHC/100 нм2, от приблизительно 0,4 pMHC/100 нм2 до приблизительно 14 pMHC/100 нм2, от приблизительно 0,4 pMHC/100 нм2 до приблизительно 13 pMHC/100 нм2, от приблизительно 0,4 pMHC/100 нм2 до приблизительно 12 pMHC/100 нм2, от приблизительно 0,4 рМНС/100 нм2 до приблизительно 11,6 рМНС/100 нм2, от приблизительно 0,4 рМНС/100 нм2 до приблизительно 11,5 рМНС/100 нм2, от приблизительно 0,4 рМНС/100 нм2 до приблизительно 11 рМНС/100 нм2, от приблизительно 0,4 рМНС/100 нм2 до 10 мкМ/100 нм2, от приблизительно 0,4 мкМ/100 нм2 до приблизительно 9 мкМ/100 нм2, от приблизительно 0,4 мкМ/100 нм2 до приблизительно 8 мкМ/100 нм2, от приблизительно 0,4 мкМ/100 нм2 до приблизительно 7 pMHC/100 нм2, от приблизительно 0,4 pMHC/100 нм2 до приблизительно 6 pMHC/100 нм2, от приблизительно 0,4 pMHC/100 нм2 до приблизительно 5 pMHC/100 нм2, от приблизительно 0,4 pMHC/100 нм2 до приблизительно 4 pMHC/100 нм2, от приблизительно 0,4 рМНС/100 нм2 до приблизительно 3 рМНС/100 нм2, от приблизительно 0,4 рМНС/100 нм2 до приблизительно 2,5 рМНС/100 нм2, от приблизительно 0,4 рМНС/100 нм2 до приблизительно 2 рМНС/100 нм2 или от приблизительно 0,4 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2.
[0108] Согласно другому аспекту наночастица может характеризоваться плотностью pMHC от приблизительно 0,22 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2, от приблизительно 0,22 рМНС/100 нм2 до приблизительно 9 рМНС/100 нм2, от приблизительно 0,22 рМНС/100 нм2 до приблизительно 8 рМНС/100 нм2, от приблизительно 0,22 рМНС/100 нм2 до приблизительно 7 рМНС/100 нм2, от приблизительно 0,22 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2, от приблизительно 0,22 рМНС/100 нм2 до приблизительно 5 pMHC/100 нм2, от приблизительно 0,22 pMHC/100 нм2 до приблизительно 4 pMHC/100 нм2, от приблизительно 0,22 pMHC/100 нм2 до приблизительно 3 pMHC/100 нм2, от приблизительно 0,22 pMHC/100 нм2 до приблизительно 2 pMHC/100 нм2 или от приблизительно 0,22 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2. Согласно некоторым аспектам наночастица характеризуется плотностью pMHC от приблизительно 0,22 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2, от приблизительно 0,24 рМНС/100 нм2 до приблизительно 9 рМНС/100 нм2, от приблизительно 0,26 рМНС/100 нм2 до приблизительно 8 рМНС/100 нм2, от приблизительно 0,28 рМНС/100 нм2 до приблизительно 7 рМНС/100 нм2, от приблизительно 0,24 рМНС/100 нм2 до приблизительно 4 рМНС/100 нм2, от приблизительно 0,5 рМНС/100 нм2 до приблизительно 3 рМНС/100 нм2 или от приблизительно 0,6 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2. Согласно дополнительному аспекту наночастица характеризуется плотностью pMHC от приблизительно 0,4 рМНС/100 нм2 до приблизительно 1,3 рМНС/100 нм2, альтернативно, от приблизительно 0,5 рМНС/100 нм2 до приблизительно 0,9 рМНС/100 нм2 или, альтернативно, от приблизительно 0,6 рМНС/100 нм2 до приблизительно 0,8 рМНС/100 нм2.
[0109] Согласно некоторым вариантам осуществления наночастица может характеризоваться плотностью pMHC приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9,0, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10,0, 10,1, 10,2, 10,3, 10,4, 10,5, 10,6, 10,7, 10,8, 10,9, 11,0, 11,1, 11,2, 11,3, 11,4, 11,5, 11,6, 11,7, 11,8, 11,9 или 12,0 рМНС/100 нм2. Согласно конкретным вариантам осуществления наночастица может характеризоваться плотностью pMHC от приблизительно 0,4 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2, от приблизительно 0,4 рМНС/100 нм2 до приблизительно 2,5 рМНС/100 нм2, от приблизительно 0,4 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2 или от приблизительно 0,4 рМНС/100 нм2 до приблизительно 12 рМНС/100 нм2.
[0110] Согласно еще одному аспекту наночастица характеризуется плотностью pMHC, как определено в настоящем документе, от приблизительно 0,4 рМНС/100 нм2 до приблизительно 1,3 рМНС/100 нм2, альтернативно, от приблизительно 0,5 рМНС/100 нм2 до приблизительно 0,9 рМНС/100 нм2 или, альтернативно, от приблизительно 0,6 рМНС/100 нм2 до приблизительно 0,8 рМНС/100 нм2 и, кроме того, при этом ядро наночастицы составляет в диаметре от приблизительно 25 нм до приблизительно 60 нм, от приблизительно 25 нм до приблизительно 50 нм, от приблизительно 20 нм до приблизительно 40 нм, от приблизительно 15 нм до приблизительно 50 нм, от приблизительно 15 нм до приблизительно 40 нм, от приблизительно 15 нм до приблизительно 35 нм, от приблизительно 15 нм до приблизительно 30 нм, от приблизительно 15 нм до приблизительно 25 нм, альтернативно, приблизительно 15 нм, приблизительно 20 нм, приблизительно 25 нм, приблизительно 30 нм, приблизительно 35 нм или приблизительно 40 нм, или приблизительно 50 нм.
Компоненты костимулирующей молекулы
[0111] Согласно определенным аспектам NP дополнительно содержат или, альтернативно, состоят по существу или кроме того состоят по меньшей мере из одной костимулирующей молекулы. Костимулирующие молекулы представляют собой молекулы, которые производят вторичный сигнал in vivo, который служит для активации наивных Т-клеток в антигенспецифические Т-клетки, способные вызывать иммунный ответ на клетки, обладающие указанным специфическим антигеном. Настоящее раскрытие не ограничено какой-либо конкретной костимулирующей молекулой. Различные костимулирующие молекулы хорошо известны в настоящей области техники. Некоторыми неограничивающими примерами костимулирующих молекул являются 4-IBBL, OX40L, CD40, IL-15/IL-15Ra, CD28, CD80, CD86, CD30L и ICOSL. Только одна конкретная костимулирующая молекула может быть связана с одной наночастицей или множество костимулирующих молекул может быть связано с одной и той же наночастицей. Согласно некоторым вариантам осуществления костимулирующая молекула представляет собой белок, такой как антитело, который способен выступать в роли агониста для костимулирующего рецептора на Т-клетке. В этом случае антитело способно индуцировать костимулирующий сигнал, который необходим для активации наивных Т-клеток и индукции иммунного ответа антигенспецифическим образом. Дополнительно или альтернативно, используемый в настоящем документе термин «костимулирующая молекула» может также относиться к средству, способному производить костимулирующий сигнал, оказывая агонистическое действие на нативную костимулирующую сигнальную молекулу, например, анти-CD28 или лиганд CD28, производящий костимулирующий ответ CD28.
[0112] Согласно конкретным вариантам осуществления костимулирующими молекулами по настоящему изобретению может быть любая одна или несколько из следующих молекул B7-1/CD80, BTLA, B7-2/CD86, CD28, B7-H1/PD-L1, CTLA-4, B7-H2, Gi24/VISTA/B7-H5, B7-H3, ICOS, B7-H4, PD-1, B7-H6, PD-L2/B7-DC, B7-H7, PDCD6, LILRA3/CD85e, LILRB2/CD85d/ILT4, LILRA4/CD85g/ILT7, LILRB3/CD85a/ILT5, LILRB1/CD85j/ILT2, LILRB4/CD85k/ILT3, 4-1BB/TNFRSF9/CD137, лиганд GITR/TNFSF18, лиганд 4-1BB/TNFSF9, HVEM/TNFRSF14, BAFF/BLyS/TNFSF13B, LIGHT/TNFSF14, BAFF R/TNFRSF13C, лимфотоксин-альфа/TNF-бета, CD27/TNFRSF7, OX40/TNFRSF4, лиганд CD27/TNFSF7, лиганд OX40/TNFSF4, CD30/TNFRSF8, RELT/TNFRSF19L, лиганд CD30/TNFSF8, TACI/TNFRSF13B, CD40/TNFRSF5, TL1A/TNFSF15, лиганд CD40/TNFSF5, TNF-альфа, DR3/TNFRSF25, TNF RII/TNFRSF1B, GITR/TNFRSF18, 2B4/CD244/SLAMF4, CD84/SLAMF5, BLAME/SLAMF8, CD229/SLAMF3, CD2, CRACC/SLAMF7, CD2F-10/SLAMF9, NTB-A/SLAMF6, CD48/SLAMF2, SLAM/CD150, CD58/LFA-3, CD7, DPPIV/CD26, CD96, EphB6, CD160, интегрин альфа 4 бета 1, CD200, интегрин альфа 4 бета 7/LPAM-1, CD300a/LMIR1, LAG-3, CRTAM, TIM-1/KIM-1/HAVCR, DAP12, TIM-4, дектин-1/CLEC7A, TSLP R, ICOSL и/или их биологические эквиваленты.
[0113] Костимулирующая молекула может быть связана с наночастицей таким же образом, как комплекс pMHC. Согласно одному варианту осуществления настоящего изобретения костимулирующая молекула и комплекс антиген/МНС отдельно присоединены к наночастице. Согласно другому варианту осуществления настоящего раскрытия костимулирующая молекула и комплекс pMHC сначала образуют комплекс вместе, а затем впоследствии образуют комплекс с наночастицей. Несколько костимулирующих молекул могут быть связаны с наночастицей; они могут быть кратны одной и той же костимулирующей молекуле или множеству разных костимулирующих молекул. Как правило, полипептидные комплексы добавляют к наночастицам с получением наночастиц с адсорбированными или связанными полипептидными комплексами, характеризующихся соотношением количества костимулирующих молекул к количеству наночастиц от приблизительно 1 до 6000 молекул на наночастицу или, альтернативно, по меньшей мере приблизительно или максимум приблизительно 0,1, 0,5, 1, 10, 100, 500, 1000, 2000, 3000, 4000, 5000, 6000 или более к 1, и колеблется, как правило, от приблизительно 0,1:1 до приблизительно 50:1. Согласно другому аспекту отношение костимулирующей молекулы к комплексу pMHC может составлять приблизительно от 0,1, 0,5, 1, 2, 5, 10, 50 или более к 1, предпочтительно получают соотношение 1:1, 1:2, 1:9, 1:10, 1:100, 2:1, 9:1, 10:1 или 100:1 комплекса костимулирующей молекулы к pMHC. Аналогично, плотность костимулирующих молекул по отношению к площади поверхности наночастиц может быть рассчитана по той же относительной формуле, что и комплексов pMHC. Согласно некоторым вариантам осуществления плотность костимулирующей молекулы на единицу площади поверхности наночастицы составляет от приблизительно 0,0022 костимулирующих молекул/100 нм2 до приблизительно 13,26 костимулирующих молекул/100 нм2. Согласно некоторым вариантам осуществления диапазон плотности костимулирующих молекул может быть таким же или отличаться от диапазона плотности для комплексов pMHC.
[0114] Согласно некоторым вариантам осуществления, при которых наночастица содержит одну или несколько костимулирующих молекул и не содержит комплекса pMHC, наночастица характеризуется костимулирующей плотностью от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 6,5 костимулирующих молекул/100 нм2, от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 6 костимулирующих молекул/100 нм2, от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 5,8 костимулирующих молекул/100 нм2, от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 5,75 костимулирующих молекул/100 нм2, от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 5,5 костимулирующих молекул/100 нм2, от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 5 костимулирующих молекул/100 нм2, от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 4,5 костимулирующих молекул/100 нм2, от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 4 костимулирующих молекул/100 нм2, от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 3,5 костимулирующих молекул/100 нм2, от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 3 костимулирующих молекул/100 нм2, от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 2,5 костимулирующих молекул/100 нм2, от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 2 костимулирующих молекул/100 нм2, от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 1,5 костимулирующих молекул/100 нм2, от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 1,25 костимулирующих молекул/100 нм2, от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 1 костимулирующей молекулы/100 нм2 или от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 0,75 костимулирующей молекулы/100 нм2.
[0115] Согласно другому аспекту наночастица может характеризоваться плотностью костимулирующих молекул от приблизительно 0,11 костимулирующей молекулы/100 нм2 до приблизительно 5 костимулирующих молекул/100 нм2, от приблизительно 0,11 костимулирующей молекулы/100 нм2 до приблизительно 4,5 костимулирующих молекул/100 нм2, от приблизительно 0,11 костимулирующей молекулы/100 нм2 до приблизительно 4 костимулирующих молекул/100 нм2, от приблизительно 0,11 костимулирующей молекулы/100 нм2 до приблизительно костимулирующих молекул/100 нм2, от приблизительно 0,11 костимулирующей молекулы/100 нм2 до приблизительно 3 костимулирующих молекул/100 нм2, от приблизительно 0,11 костимулирующей молекулы/100 нм2 до приблизительно 2,5 костимулирующих молекул/100 нм2, от приблизительно 0,11 костимулирующей молекулы/100 нм2 до приблизительно 2 костимулирующих молекул/100 нм2, от приблизительно 0,11 костимулирующей молекулы/100 нм2 до приблизительно 1,5 костимулирующих молекул/100 нм2, от приблизительно 0,11 костимулирующей молекулы/100 нм2 до приблизительно 1 рМНС/100 нм2 или от приблизительно 0,11 костимулирующей молекулы/100 нм2 до приблизительно 0,75 костимулирующей молекулы/100 нм2. Согласно некоторым аспектам ядро наночастиц характеризуется плотностью костимулирующих молекул от приблизительно 0,11 костимулирующей молекулы/100 нм2 до приблизительно 5 костимулирующих молекул/100 нм2, от приблизительно 0,12 костимулирующей молекулы/100 нм2 до приблизительно 4,5 костимулирующих молекул/100 нм2, от приблизительно 0,13 костимулирующей молекулы/100 нм2 до приблизительно 4 костимулирующих молекул/100 нм2, от приблизительно 0,14 костимулирующей молекулы/100 нм2 до приблизительно 3,5 костимулирующих молекул/100 нм2, от приблизительно 0,12 костимулирующей молекулы/100 нм2 до приблизительно 2 костимулирующих молекул/100 нм2, от приблизительно 0,25 костимулирующей молекулы/100 нм2 до приблизительно 1,5 костимулирующих молекул/100 нм2 или от приблизительно 0,3 костимулирующей молекулы/100 нм2 до приблизительно 0,75 костимулирующей молекулы/100 нм2. Согласно дополнительному аспекту ядро наночастиц характеризуется плотностью костимулирующих молекул от приблизительно 0,2 костимулирующей молекулы/100 нм2 до приблизительно 0,65 костимулирующей молекулы/100 нм2, альтернативно, от приблизительно 0,25 костимулирующей молекулы/100 нм2 до приблизительно 0,45 костимулирующей молекулы/100 нм2 или, альтернативно, от приблизительно 0,3 костимулирующей молекулы/100 нм2 до приблизительно 0,4 костимулирующей молекулы/100 нм2.
[0116] Согласно некоторым вариантам осуществления, при которых наночастица содержит комплекс pMHC и одну или несколько костимулирующих молекул, наночастица характеризуется плотностью костимулирующих молекул от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 13 костимулирующих молекул/100 нм2, от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 12 костимулирующих молекул/100 нм2, от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 11,6 костимулирующих молекул/100 нм2, от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 11,5 костимулирующих молекул/100 нм2, от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 11 костимулирующих молекул/100 нм2, от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 10 костимулирующих молекул/100 нм2, от приблизительно 0,4 костимулирующей молекулы/100 нм2 приблизительно 9 костимулирующих молекул/100 нм2, от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 8 костимулирующих молекул/100 нм2, от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 7 костимулирующих молекул/100 нм2, от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 6 костимулирующих молекул/100 нм2, от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 5 костимулирующих молекул/100 нм2, от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 4 костимулирующей молекулы/100 нм2, от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 3 костимулирующих молекул/100 нм2, от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 2,5 костимулирующих молекул/100 нм2, от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 2 костимулирующих молекул/100 нм2 или от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 1,5 костимулирующих молекул/100 нм2.
[0117] Согласно другому аспекту наночастица может характеризоваться плотностью костимулирующих молекул от приблизительно 0,22 костимулирующей молекулы/100 нм2 до приблизительно 10 костимулирующих молекул/100 нм2, от приблизительно 0,22 костимулирующей молекулы/100 нм2 до приблизительно 9 костимулирующих молекул/100 нм2, от приблизительно 0,22 костимулирующей молекулы/100 нм2 до приблизительно 8 костимулирующих молекул/100 нм2, от приблизительно 0,22 костимулирующей молекулы/100 нм2 до приблизительно 7 костимулирующих молекул/100 нм2, от приблизительно 0,22 костимулирующей молекулы/100 нм2 до приблизительно 6 костимулирующих молекул/100 нм2, от приблизительно 0,22 костимулирующей молекулы/100 нм2 до приблизительно 5 костимулирующих молекул/100 нм2, от приблизительно 0,22 костимулирующей молекулы/100 нм2 до приблизительно 4 костимулирующих молекул/100 нм2, от приблизительно 0,22 костимулирующей молекулы/100 нм2 до приблизительно 3 костимулирующих молекул/100 нм2, от приблизительно 0,22 костимулирующей молекулы/100 нм2 до приблизительно 2 костимулирующих молекул/100 нм2 или от приблизительно 0,22 костимулирующей молекулы/100 нм2 до приблизительно 1,5 костимулирующих молекул/100 нм2. Согласно некоторым аспектам ядро наночастиц характеризуется плотностью костимулирующих молекул от приблизительно 0,22 костимулирующей молекулы/100 нм2 до приблизительно 10 костимулирующих молекул/100 нм2, 0,24 костимулирующей молекулы/100 нм2 до приблизительно 9 костимулирующих молекул/100 нм2, от приблизительно 0,26 костимулирующей молекулы/100 нм2 до приблизительно 8 костимулирующих молекул/100 нм2, от приблизительно 0,28 костимулирующей молекулы/100 нм2 до приблизительно 7 костимулирующих молекул/100 нм2, от приблизительно 0,24 костимулирующей молекулы/100 нм2 до приблизительно 4 костимулирующих молекул/100 нм2, от приблизительно 0,5 костимулирующей молекулы/100 нм2 до приблизительно 3 костимулирующих молекул/100 нм2 или от приблизительно 0,6 костимулирующей молекулы/100 нм2 до приблизительно 1,5 костимулирующих молекул/100 нм2. Согласно дополнительному аспекту наночастица характеризуется плотностью костимулирующих молекул от приблизительно 0,4 костимулирующей молекулы/100 нм2 до приблизительно 1,3 костимулирующих молекул/100 нм2, альтернативно, от приблизительно 0,5 костимулирующей молекулы/100 нм2 до приблизительно 0,9 костимулирующей молекулы/100 нм2 или, альтернативно, от приблизительно 0,6 костимулирующей молекулы/100 нм2 до приблизительно 0,8 костимулирующей молекулы/100 нм2.
[0118] Согласно одному аспекту наночастица содержит костимулирующую молекулу и не содержит какого-либо компонента пептид-МНС. Согласно некоторым вариантам осуществления этот комплекс наночастиц костимулирующих молекул смешивают с комплексом наночастиц пептид-MHC с образованием композиции, которая содержит две разные популяции наночастиц, одна из которых содержит только костимулирующие молекулы, а другая содержит только пептид-MHC. Эти две популяции могут быть смешаны в любом подходящем соотношении, включая в себя 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8 или 1:9 содержащих костимулирующие молекулы наночастиц к содержащим пептид-MHC наночастицам или 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9 содержащих пептид-MHC наночастиц к содержащим костимулирующие молекулы наночастицам.
Цитокины
[0119] Согласно определенным аспектам NP дополнительно содержат или, альтернативно, состоят по существу или еще дополнительно состоят по меньшей мере из одной молекулы цитокина. Используемый в настоящем документе термин «цитокин» охватывает низкомолекулярные белки, секретируемые различными клетками иммунной системы, которые действуют как сигнальные молекулы для регуляции широкого спектра биологических процессов в организме на молекулярном и клеточном уровнях. «Цитокины» включают в себя отдельные иммуномодулирующие белки, которые относятся к классу лимфокинов, интерлейкинов или хемокинов.
[0120] Неограничивающие примеры раскрыты в настоящем документе: например, IL-1A и IL-1B представляют собой два различных представителя семейства интерлейкинов-1 (IL-1) человека. Зрелый IL-1A представляет собой белок 18 кДа, также известный как фактор, активирующий фибробласты (FAF), фактор, активирующий лимфоциты (LAF), фактор, активирующий В-клетки (BAF), эндогенный медиатор лейкоцитов (LEM) и т.д. IL-4 представляет собой цитокин, который индуцирует дифференцировку клеток Т-хелперов-2 (Th2) и тесно связан с IL-13 и выполняет схожие функции. IL-5 производится Th2-клетками и тучными клетками. Он стимулирует рост В-клеток и увеличивает секрецию иммуноглобулина. Он также участвует в активации эозинофилов. IL-6 представляет собой интерлейкин, который может действовать как провоспалительный или противовоспалительный цитокин. Он секретируется Т-клетками и макрофагами для стимуляции иммунного ответа на травму или другое повреждение ткани, приводящее к воспалению. IL-6 также вырабатывается мышцами в ответ на их сокращение. IL-8 представляет собой хемокин, производимый макрофагами и другими типами клеток, такими как эпителиальные клетки и эндотелиальные клетки, и действует как важный медиатор иммунной реакции в ответе врожденной иммунной системы. IL-12 участвует в дифференцировке наивных Т-клеток в Т-хелперные (Th1 или Th2) клетки. Как гетеродимерный цитокин, IL-12 образуется после того, как две субъединицы, кодируемые двумя отдельными генами, IL-12A (p35) и IL-12B (p40), димеризуются после синтеза белка. IL-12p70 указывает на этот гетеродимерный состав. IL-13, цитокин, секретируемый многими типами клеток, особенно клетками Th2, является важным медиатором аллергического воспаления и заболеваний. IL-17 представляет собой цитокин, производимый Т-хелперами, и индуцируется IL-23, что приводит к разрушительному повреждению тканей в реакциях замедленного типа. IL-17 функционирует как провоспалительный цитокин, который реагирует на вторжение внеклеточных патогенов в иммунную систему и вызывает разрушение клеточного матрикса патогена. IP-10 или индуцированный гамма-интерфероном белок 10 также известен как C-X-C мотив хемокина 10 (CXCL10) или цитокин B10 с малым индуцируемым действием. В качестве небольшого цитокина, принадлежащего к семейству хемокинов СХС, IP-10 секретируется несколькими типами клеток (включая в себя моноциты, эндотелиальные клетки и фибробласты) в ответ на IFN-γ. Воспалительные белки макрофагов (MIP) относятся к семейству хемокинов. Существуют две основные формы человеческого MIP, MIP-1α и MIP-1β, которые также известны как хемокиновый (C-C мотив) лиганд 3 (CCL3) и CCL4, соответственно. Оба производятся макрофагами после стимуляции бактериальными эндотоксинами. Гранулоцитарный колониестимулирующий фактор (G-CSF или GCSF), также известный как колониестимулирующий фактор 3 (CSF 3), представляет собой гормон колониестимулирующего фактора. G-CSF представляет собой гликопротеин, фактор роста и цитокин, производимый рядом различных тканей для стимуляции костного мозга с образованием гранулоцитов и стволовых клеток. G-CSF также стимулирует выживание, пролиферацию, дифференцировку и функцию предшественников нейтрофилов и зрелых нейтрофилов. Эпидермальный фактор роста или EGF представляет собой фактор роста, который играет важную роль в регуляции роста, пролиферации и дифференцировки клеток путем связывания с высокой аффинностью с его рецептором EGFR. Фактор роста эндотелия сосудов (VEGF) представляет собой семейство факторов роста, которые являются важными сигнальными белками, участвующими как в васкулогенезе (образование de novo эмбриональной системы кровообращения), так и в ангиогенезе (рост кровеносных сосудов из уже существующей сосудистой системы).
[0121] Цитокин или цитокины могут быть связаны с наночастицей таким же образом, как комплекс pMHC. Согласно одному варианту осуществления настоящего раскрытия цитокин или цитокины и комплекс pMHC отдельно прикреплены к наночастице. Согласно другому варианту осуществления настоящего раскрытия молекула цитокина или цитокинов и комплекс pMHC сначала образуют комплекс вместе, а затем впоследствии образуют комплекс с наночастицей. Множественные цитокины могут быть связаны с наночастицей; они могут представлять собой множество одних и тех же цитокинов или различных цитокинов.
[0122] Согласно некоторым вариантам осуществления цитокин образует комплекс с антителом к цитокину с образованием комплекса цитокин/антитело к цитокину, который впоследствии образует комплекс с наночастицей. Согласно некоторым вариантам осуществления комплекс цитокин/антитело к цитокину включает в себя, без ограничения, комплексы IL-2/анти-IL-2. Комплексы IL-2/анти-IL-2 могут характеризоваться агонистическими свойствами или антагонистические свойствами.
[0123] Согласно некоторым вариантам осуществления цитокин образует комплекс с рецептором цитокинов с образованием комплекса цитокин/рецептор цитокина, который впоследствии образует комплекс с наночастицей. Согласно некоторым вариантам осуществления комплекс цитокин/рецептор цитокина включает в себя, без ограничения, IL15/IL-15Ra и/или IL-1/IL-2Ra. Согласно некоторым вариантам осуществления комплекс IL15/IL-15Ra может функционировать в качестве костимулятора.
[0124] Как правило, полипептидные комплексы добавляют к наночастицам для получения наночастиц с адсорбированными или связанными полипептидными комплексами, характеризующимися отношением количества цитокинов к количеству наночастиц от приблизительно 1 до 5999 молекул на наночастицу или, альтернативно, по меньшей мере приблизительно или максимум приблизительно 0,1, 0,5, 1, 10, 100, 500, 1000, 2000, 3000, 4000, 5000, 6000 или более к 1 и варьировать в пределах, например, от приблизительно 0,1:1 до приблизительно 50:1. Согласно другим аспектам отношение цитокина к комплексу антиген/МНС может составлять приблизительно от 0,1, 0,5, 1, 2, 5, 10, 50 или более к 1, предпочтительно получают соотношение 1:1, 1:2, 1:9, 1:10, 1:100, 2:1, 9:1, 10:1 или 100:1 цитокина к комплексу антиген/МНС. Аналогично, плотность цитокинов относительно площади поверхности наночастиц может быть рассчитана по той же относительной формуле, что и комплексов антиген/МНС. Согласно некоторым вариантам осуществления плотность цитокинов на единицу площади поверхности наночастицы составляет от приблизительно 0,0022 цитокина/100 нм2 до приблизительно 13,26 цитокинов/100 нм2. Согласно некоторым вариантам осуществления диапазон плотности цитокинов может быть таким же как диапазон плотности для комплексов антиген/МНС или отличаться от него.
[0125] Согласно одному аспекту наночастица содержит молекулу цитокина и не содержит какого-либо компонента пептид-МНС. Согласно некоторым вариантам осуществления этот комплекс наночастиц с молекулой цитокина смешивают с комплексом наночастиц с пептид-МНС с образованием композиции, которая включает в себя две разные популяции наночастиц, одна из которых содержит только молекулы цитокинов, а другая содержит только пептид-МНС. Эти две популяции могут быть смешаны в любом подходящем соотношении, включая в себя 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9 содержащих молекулы цитокина наночастиц к содержащим пептид-MHC наночастицам или: 1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9 содержащих пептид-MHC наночастиц к содержащим молекулы цитокина наночастицам.
Синтез NP
[0126] Наночастицы могут быть образованы путем контактирования водной фазы, содержащей костимулирующую молекулу(ы), комплекс pMHC и/или цитокин, а также полимер, и неводной фазы с последующим испарением неводной фазы, чтобы вызвать слияние частиц из водной фазы, как описано в патенте США № 4589330 или 4818542. Определенными полимерами для таких препаратов являются природные или синтетические сополимеры или полимеры, которые включают в себя желатин, агар, крахмал, арабиногалактан, альбумин, коллаген, полигликолевую кислоту, полимолочную кислоту, гликолид-L(-), лактид, поли(эпсилон-капролактон), поли(эпсилон-капролактон-CO-молочную кислоту), поли(эпсилон-капролактон-CO-гликолевую кислоту), поли(β-гидрокси-масляную кислоту), поли(этиленоксид), полиэтилен, поли(алкил-2-цианоакрилат), поли(гидроксиэтилметакрилат) , полиамиды, поли(аминокислоты), поли(2-гидроксиэтил DL-аспартам), поли(сложный эфир мочевины), поли(L-фенилаланин/этиленгликоль/1,6-диизоцианатогексан) и поли(метилметакрилат). В частности, определенными полимерами являются сложные полиэфиры, такие как полигликолевая кислота, полимолочная кислота, гликолид-L(-), лактид, поли(эпсилон-капролактон), поли(эпсилон-капролактон-СО-молочная кислота) и поли(эпсилон-капролактон-СО-гликолевая кислота). Растворители, применимые для растворения полимера, включают в себя: воду, гексафторизопропанол, метиленхлорид, тетрагидрофуран, гексан, бензол или гексафторацетон сесквигидрат.
[0127] Наночастицы с золотом (GNP) синтезируют с использованием химического восстановления хлорида золота цитратом натрия, как описано (Perrault, S.D. et al. (2009) Nano Lett 9: 1909-1915). Вкратце, 2 мл 1% HAuCl4 (Sigma Aldrich) добавляют к 100 мл H2O при интенсивном перемешивании и раствор нагревают на масляной бане. Шесть (для 14 нм GNP) или два мл (для 40 нм GNP) 1% цитрата Na добавляют к кипящему раствору HAuCl4, который перемешивают в течение дополнительных 10 минут, а затем охлаждают до комнатной температуры. GNP стабилизируют добавлением 1 мкМ тиол-ПЭГ-линкеров (Nanocs, MA), функционализированных группами -COOH или -NH2 в качестве акцепторов МНС. Пегилированные GNP промывают водой для удаления свободного тиол-ПЭГ, концентрируют и хранят в воде для дальнейшего анализа. Плотность NP определяют с помощью спектрофотометрии и рассчитывают по закону Бера.
[0128] Серии SFP NP с оксидом железа (SFP IONP) также могут быть получены тепловым разложением ацетата железа в органических растворителях в присутствии поверхностно-активных веществ, а затем превращением растворителя в водные буферы путем пегилирования (Xie, J. et al. (2007) Adv Mater 19:3163; Xie, J. et al. (2006) Pure Appl. Chem. 78:1003-1014; Xu, C. et al. (2007) Polymer International 56:821-826). Вкратце, 2 мМ Fe(acac)3 (Sigma Aldrich, Oakville, ON) растворяют в смеси 10 мл бензилового эфира и олеиламина и нагревают до 100°С в течение 1 часа, затем при 300°С в течение 2 часов с обратным холодильником под защитой слоя азота. Синтезированные NP осаждают добавлением этанола и ресуспендируют в гексане. Для пегилирования IONP 100 мг различных линкеров DPA-PEG 3,5 кДа (JenKem Tech USA) растворяют в смеси CHCl3 и HCON(CH3)2 (диметилформамид (DMF)). Затем раствор NP (20 мг Fe) добавляют к раствору DPA-PEG и перемешивают в течение 4 часов при комнатной температуре. Пегилированные SFP NP осаждают в течение ночи путем добавления гексана и затем ресуспендируют в воде. Следовые количества агрегатов удаляют с помощью высокоскоростного центрифугирования (20000 мкг, 30 мин), и монодисперсные SFP NP хранят в воде для дальнейшей характеристики и конъюгации pMHC. Концентрацию железа в продуктах IONP определяют спектрофотометрией при A410 в 2 н. HCL. На основании молекулярной структуры и диаметра SFP NP (Fe3O4; диаметр 8 ± 1 нм) (Xie, J. et al. (2007) Adv Mater 19:3163; Xie, J. et al. (2006) Pure Appl. Chem. 78:1003-1014), по оценкам заявителя, растворы SFP, содержащие 1 мг железа, содержат 5 × 1014 NP.
[0129] Наночастицы также могут быть получены тепловым разложением или нагреванием предшественника наночастиц. Согласно одному варианту осуществления наночастица представляет собой наночастицу металла или оксида металла. Согласно одному варианту осуществления наночастица представляет собой наночастицу оксида железа. Согласно одному варианту осуществления наночастица представляет собой наночастицу золота. Согласно одному варианту осуществления в настоящем документе представлены наночастицы, полученные в соответствии с настоящей технологией. Согласно одному варианту осуществления в настоящем документе предложен способ получения наночастиц оксида железа, включающий реакцию теплового разложения ацетилацетоната железа. Согласно одному варианту осуществления полученная наночастица оксида железа является водорастворимой. Согласно одному аспекту наночастица оксида железа является подходящей для конъюгации белка. Согласно одному варианту осуществления способ включает одностадийную реакцию теплового разложения.
[0130] Согласно одному аспекту тепловое разложение происходит в присутствии функционализированных молекул ПЭГ.
[0131] Согласно одному аспекту тепловое разложение включает нагревание ацетилацетоната железа. Согласно одному варианту осуществления тепловое разложение включает нагревание ацетилацетоната железа в присутствии функционализированных молекул ПЭГ. Согласно одному варианту осуществления тепловое разложение включает нагревание ацетилацетоната железа в присутствии бензилового эфира и функционализированных молекул ПЭГ.
[0132] Без ограничения теорией согласно одному варианту осуществления функционализированные молекулы ПЭГ используются в качестве восстанавливающих реагентов и в качестве поверхностно-активных веществ. Предлагаемый в настоящем документе способ изготовления наночастиц упрощает и улучшает обычные способы, в которых используются поверхностно-активные вещества, которые трудно смещать или которые не смещаются до завершения молекулами ПЭГ, чтобы сделать частицы водорастворимыми. Как правило, поверхностно-активные вещества могут быть дорогими (например, фосфолипиды) или токсичными (например, олеиновая кислота или олеиламин). Согласно другому аспекту без ограничения теорией способ получения наночастиц устраняет необходимость применения обычных поверхностно-активных веществ, тем самым достигая высокой степени молекулярной чистоты и растворимости в воде.
[0133] Согласно одному варианту осуществления тепловое разложение включает ацетилацетонат железа и бензиловый эфир и в отсутствие обычных поверхностно-активных веществ, отличных от применяемых в настоящем документе.
[0134] Согласно одному варианту осуществления температура для теплового разложения составляет от приблизительно 80°С до приблизительно 300°С или от приблизительно 80°С до приблизительно 200°С, или от приблизительно 80°С до приблизительно 150°С, или от приблизительно 100°С до приблизительно 250°С, или от приблизительно 100°С до приблизительно 200°С, или от приблизительно 150°C до приблизительно 250°C, или от приблизительно 150°C до приблизительно 250°C. Согласно одному варианту осуществления тепловое разложение происходит в течение приблизительно от 1 до 2 часов.
[0135] Согласно одному варианту осуществления способ изготовления наночастиц оксида железа включает стадию очистки, например, с использованием магнитной колонки Miltenyi Biotec LS.
[0136] Согласно одному варианту осуществления наночастицы стабильны при температуре приблизительно 4°С в физиологическом растворе с фосфатным буфером (PBS) без какой-либо заметной деградации или агрегации. Согласно одному варианту осуществления наночастицы стабильны в течение по меньшей мере 6 месяцев.
[0137] Согласно одному аспекту в настоящем документе предложен способ получения комплексов наночастиц, включающий контактирование pMHC с наночастицами оксида железа, представленными в настоящем документе. Без ограничения теорией pMHC кодирует цистеин на своем карбокситерминальном конце, который может реагировать с малеимидной группой в функционализированном ПЭГ при температуре от приблизительно 6,2 до приблизительно 6,5 в течение от приблизительно 12 до приблизительно 14 часов.
[0138] Согласно одному аспекту способ получения комплексов наночастиц включает стадию очистки, например, с использованием магнитной колонки Miltenyi Biotec LS.
Относящиеся к заболеванию антигены
[0139] Комплекс pMHC в pMHC-NP выбирают для применения на основании подлежащего лечению заболевания. Например, относящийся к сахарному диабету антиген представляет собой антиген или его фрагмент, который экспрессируется в клетке, ткани или органе, на который нацеливаются при этом аутоиммунном заболевании и который подвергается воздействию иммунной системы при повреждении клетки, ткани или органа, вызванном аутоиммунным ответом, даже если антиген не является пусковым механизмом процесса заболевания или ключевым игроком в его патогенезе и, когда он присутствует, вызывает иммунный ответ, который служит для лечения сахарного диабета; таким образом, относящийся к сахарному диабету антиген, отвечающий этому определению, выбирают для лечения сахарного диабета. Относящийся к MS антиген выбирают для лечения MS. Относящийся к сахарному диабету антиген не будет выбран для лечения MS. Относящийся к раку или опухоли антиген будет лечить рак и/или опухоли. Неограничивающие иллюстративные относящиеся к заболеванию антигены раскрыты в настоящем документе, и, кроме того, такие антигены могут быть определены для конкретного заболевания на основе техник, механизмов и способов, хорошо документированных в литературе.
[0140] Согласно определенным аспектам относящийся к заболеванию антиген, содержащийся в комплексе антиген-МНС, выбирают из относящегося к аутоиммунному заболеванию антигена, относящегося к воспалению антигена или относящегося к аллергическому заболеванию антигена. Согласно дополнительным аспектам относящийся к иммунному воспалению антиген выбирают из следующей группы: относящийся к бронхиальной астме антиген, относящийся к сахарному диабету антиген, относящийся к преддиабету антиген, относящийся к рассеянному склерозу антиген, относящийся к аллергической астме антиген, относящийся к первичному билиарному циррозу антиген, относящийся к циррозу антиген, относящийся к нейромиелиту зрительного нерва со спектральным расстройством (болезнь Девика, NMO) антиген, относящийся к аутоиммунному энцефалиту антиген, относящийся к аутоантитело-опосредованным неврологическим синдромам антиген, относящийся к синдрому мышечной скованности антиген, относящийся к паранеопластическим заболеваниям антиген, относящийся к другим заболеваниям центральной и периферической нервной системы антиген, относящийся к обыкновенной пузырчатке антиген, относящийся к воспалительному заболеванию кишечника (IBD) антиген, относящийся к болезни Крона антиген, относящийся к язвенному колиту антиген, относящийся к артриту антиген, относящийся к ревматоидному артриту антиген, относящийся к системной красной волчанке (SLE) антиген, относящийся к глютеиновой болезни антиген, относящийся к псориазу антиген, относящийся к очаговой алопеции антиген, относящийся к приобретенной тромбоцитопенической пурпуре антиген, относящийся к аутоиммунной кардиомиопатии антиген, относящийся к идиопатической дилятационной кардиомиопатии (IDCM) антиген, относящийся к миастении гравис антиген, относящийся к увеиту антиген, относящийся к анкилозирующему спондилиту антиген, относящийся к болезни Грейвса антиген, относящийся к тиреоидиту Хашимото антиген, относящийся к опосредованным иммуннитетом миопатиям антиген, относящийся к антифосфолипидному синдрому (ANCA+) антиген, относящийся к атеросклерозу антиген, относящийся к склеродермии антиген, относящийся к аутоиммунному гепатиту антиген, относящийся к дерматомиозиту антиген, относящийся к хронической обструктивной болезни легких антиген, относящийся к травме спинного мозга антиген, относящийся к травматическому повреждению антиген, относящийся к индуцированному табаком разрушению легких антиген, относящийся к хронической обструктивной болезни легких (ХОБЛ) антиген, относящийся к эмфиземе легкого антиген, относящийся к склерозирующему холангиту антиген, относящийся к периферической невропатии антиген, относящийся к нарколепсии антиген, относящийся к синдромом Гудпасчера антиген, относящийся к болезни Кавасаки антиген, относящийся к аутоиммунному увеиту антиген, относящийся к колиту антиген, относящийся к эмфиземе антиген, относящийся к пузырчатке антиген, относящийся к пузырчатке листовидной антиген, относящийся к артриту антиген, относящийся к синдрому Шегрена антиген, относящийся к ANCA-ассоциированному васкулиту антиген, относящийся к первичному склерозирующему холангиту антиген, относящийся к воспалению жировая ткани/сахарному диабету типа II антиген или относящийся к связанному с ожирением воспалению жировой ткани/инсулинрезистентности антиген.
[0141] Согласно определенным аспектам относящийся к заболеванию антиген, получают из одного или нескольких из следующей группы: PPI, IGRP, GAD, периферин, aGlia, PDC-E2, инсулин, DG1EC2, DG3, AQP4, PLP, MOG, MBP, CII, DERP1, DERP2, OVA, BacInt, CBir, Fla-X, Fla-2, YIDX, AChR, тиреоидная пероксидаза, тиреоидный рецептор, фосфолипидный антиген, H4, H2B, H1, ДНК, ApoB, ApoE, NMDAR, потенциал-управляемый калиевый канал, эластин, аррестин, миоропероксидаза PERM_HUMAN, миелобластин PRTN3_HUMAN, цитохром CP4D6_HUMAN P450 2D6, SPCS_HUMAN O-фосфосерил-тРНК(Sec) селен-трансфераза, антимикробный пептид кателицидин CAMP_HUMAN, ДНК топоизомераза I, CENP-C, бета-2-гликопротеин 1 APOH_HUMAN, RO60_HUMAN 60 кДа SS-A/Ro рибонуклеопротеин, белок Lupus La LA_HUMAN, IRBP, миозин, CD1d-связывающие липидные антигены, Cap18, CP2D6, SPCS, RO60, RO52, LA, APOH, MPO, PRTN3 или HSP.
[0142] Согласно некоторым вариантам осуществления относящийся к заболеванию антиген представляет собой:
а) относящийся к сахарному диабету антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: препроинсулин (PPI), островок-специфическая глюкозо-6-фосфатаза (IGRP), глутамат декарбоксилаза (GAD), аутоантиген-2 островковых клеток (ICA2), инсулин, проинсулин или фрагмент или эквивалент каждого из них;
b) относящийся к рассеянному склерозу антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы миелиновый основной белок, миелин-ассоциированный гликопротеин, миелиновый олигодендроцитарный белок, протеолипидный белок, олигодендроцитный миелиновый олигопротеин, миелин-ассоциированный олигодендроцитарный основной белок, специфический к олигодендроциту белок, белки теплового шока, специфические к олигодендроцитам белки, NOGO A, гликопротеин Po, периферический миелиновый белок 22, 2'3'-циклический нуклеотид-3'-фосфодиэстераза или фрагмент или эквивалент каждого из них;
c) относящийся к глютеиновой болезни антиген и происходящий из глиадина или его фрагмента или его эквивалента;
d) относящийся к первичному билиарному циррозу антиген и происходящий из PDC-E2 или его фрагмента или его эквивалента;
e) относящийся к пузырчатке листовидной антиген и/или относящийся к пузырчатке обыкновенной антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: DG1, DG3 или фрагмента или эквивалента каждого из них;
f) относящийся к нейромиелиту зрительного нерва со спектральным расстройством антиген и происходящий из AQP4 или его фрагмента или его эквивалента;
g) относящийся к артриту антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: белки теплового шока, связывающий иммуноглобулин белок, гетерогенные ядерные RNP, аннексин V, кальпастатин, коллаген типа II, глюкозо-6-фосфат-изомераза, фактор элонгации хряща человека gp39, маннозосвязывающий лектин, цитруллинированный виментин, коллаген типа II, фибриноген, альфа-енолаза, анти-карбамилированный белок (анти-CarP), пептидиларгининдеминаза типа 4 (PAD4), BRAF, гамма-цепь фибриногена, тяжелая цепь H1 ингибитора интер-альфа-трипсина, альфа-1-антитрипсин, ингибитор C1 плазменной протеазы, гельсолин, альфа-1-B гликопротеин, церулоплазмин, тяжелая цепь H4 ингибитора интер-альфа-трипсина, фактор комплемента H, альфа-2-макроглобулин, сывороточный амилоид, C-реактивный белок, сывороточный альбумин, бета-цепь фиброгена, серотрансферин, альфа 2 HS гликопротеин, виментин, комплемент C3 или фрагмент или эквивалент каждого из них;
h) относящийся к аллергической астме антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: DERP1, DERP2 или фрагмента или эквивалента каждого из них;
i) относящийся к воспалительному заболеванию кишечника антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: флагелин, Fla-2, Fla-X, YIDX, интеграза бактероидов или фрагмент или эквивалент каждого из них;
j) относящийся к системной красной волчанке антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: двухцепочечная (дц)ДНК, рибонуклеопротеин (RNP), Smith (Sm), связанный с синдромом Шегрена антиген A (SS-A)/Ro, связанный с синдромом Шегрена антиген B (SS-B)/La, RO60, RO52, гистоны или фрагмент или эквивалент каждого из них;
k) относящийся к атеросклерозу антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: ApoB, ApoE или фрагмент или эквивалент каждого из них;
l) относящийся к ХОБЛ антиген и/или относящийся к эмфиземе антиген и происходящий из эластина или его фрагмента или его эквивалента;
m) относящийся к псориазу антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: Cap18, ADMTSL5, ATL5 или их фрагмент или эквивалент;
n) относящийся к аутоиммунному гепатиту антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: CYP2D6, SLA или фрагмент или эквивалент каждого из них;
o) относящийся к увеиту антиген и происходящий из аррестина или его фрагмента или его эквивалента;
p) относящийся к синдрому Шегрена антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: (SS-A)/Ro, (SS-B)/La, MR3, RO60, RO52 или фрагмент или эквивалент каждого из них;
q) относящийся к склеродермии антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: CENP-C, TOP 1, РНК-полимераза III или фрагмент или эквивалент каждого из них;
r) относящийся к антифосфолипидному синдрому антиген и происходящий из APOH или его фрагмента или его эквивалента;
s) относящийся к ANCA-ассоциированному васкулиту антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: MPO, PRTN3 или фрагмент или эквивалент каждого из них; или же
t) относящийся к синдрому мышечной скованности антиген и происходящий из GAD или его фрагмента или его эквивалента.
Относящиеся к сахарному диабету антигены
[0143] Относящиеся к сахарному диабету антигены включают в себя, без ограничения, антигены, происходящие из PPI, IGRP, GAD, аутоантигена-2 островковых клеток (ICA2) и/или инсулина. Аутореактивные, относящиеся к диабету антигенные пептиды включают в себя, без ограничения, те, которые перечислены в следующей таблице 1, в дополнение к пептидам и белкам, раскрытым в публикации США 2005/0202032, которая полностью включена в настоящий документ посредством ссылки, а также эквиваленты и/или комбинации каждого из них.
Относящиеся к MS антигены
[0144] Антигены настоящего раскрытия включают в себя антигены, связанные с рассеянным склерозом. Такие антигены включают в себя, например, антигены, раскрытые в публикации заявки на патент США № 2012/0077686, и антигены, происходящие из миелинового основного белка, миелин-ассоциированного гликопротеина, миелинового олигодендроцитарного белка, протеолипидного белка, олигодендроцитарного миелинового олигопротеина, миелин-ассоциированного олигодендроцитарного основного белка, специфического к олигодендроцитам белка, белков теплового шока, олигодендроцит-специфических белков NOGO A, гликопротеина Po, периферического миелинового белка 22 или 2'3'-циклической нуклеотид-3'-фосфодиэстеразы. Согласно некоторым вариантам осуществления антиген происходит из миелинового олигодендроцитарного гликопротеина (MOG).
[0145] Согласно дополнительным аспектам пептидные антигены для лечения MS и связанных с MS нарушений включают в себя, без ограничения, перечисленные в таблице 2, а также эквиваленты и/или комбинации каждого из них:
Относящиеся к глютеиновой болезни (CD) антигены
[0146] Относящиеся к глютеиновой болезни антигены включают в себя, без ограничения, антигены, происходящие из глиадина. Согласно некоторым вариантам осуществления неограничивающие типы глиадина включают в себя альфа/бета-глиадин, γ-глиадин или ω-глиадин. Другие неограничивающие иллюстративные относящиеся к глютеиновой болезни антигены включают в себя антигены, перечисленные в таблице 3, а также их эквиваленты и/или комбинации.
Относящиеся к первичному билиарному циррозу (PBC) антигены
[0147] Относящиеся к первичному билиарному циррозу антигены включают в себя, без ограничения, антигены, происходящие из PDC-E2. Неограничивающие примеры иллюстративных антигенов включают в себя те, которые перечислены в таблице 4, а также эквиваленты и/или комбинации каждого из них.
Относящиеся к пузырчатке листовидной (PF) и пузырчатке обыкновенной (PV) антигены
[0148] Относящиеся к PF и PV антигены включают в себя, без ограничения, антигены, происходящие из десмоглеина 3 (DG3) и/или десмоглеина 1 (DG1). Неограничивающие примеры включают в себя те, которые перечислены в таблице 5, а также эквиваленты и/или комбинации каждого из них.
Относящиеся к нейромиелиту зрительного нерва со спектральным расстройством (NMO) антигены
[0149] Относящиеся к NMO антигены включают в себя, без ограничения, антигены, происходящие из AQP4 или аквапорина 4. Неограничивающие примеры включают в себя те, которые перечислены в таблице 6, а также эквиваленты и/или комбинации каждого из них.
Относящиеся к артриту антигены
[0150] Относящиеся к артриту антигены включают в себя, без ограничения, антигены, происходящие из белков теплового шока, иммуноглобулин-связывающего белка, гетерогенных ядерных RNP, аннексина V, кальпастатина, коллагена типа II, глюкозо-6-фосфат-изомеразы, фактора элонгации человеческого хряща gp39, связывающего маннозу лектина, цитруллинированного виментина, коллагена типа II, фибриногена, альфа-енолазы, анти-карбамилированного белка (анти-CarP), пептидиларгининдеиминазы типа 4 (PAD4), BRAF, гамма-цепи фибриногена, тяжелой цепи интер-альфа-трипсина H1, альфа-1-антитрипсина, ингибитора C1 плазменной протеазы, гельзолина, альфа-1-B гликопротеина, церулоплазмина, тяжелой цепи H4 ингибитора альфа-трипсина, фактора комплемента H, альфа-2-макроглобулина, сывороточного амилоида, C-реактивного белка, сывороточного альбумина, бета-цепи фиброгена, серотрансферина, альфа 2 HS гликопротеина, виментина, комплемента C3 или фрагмента или эквивалента каждого из них.
Относящиеся к аллергической астме антигены
[0151] Относящиеся к аллергической астме антигены включают в себя, без ограничения, антигены, происходящие из DERP1 и DERP2. Неограничивающие примеры включают в себя те, которые перечислены в таблице 7, а также эквиваленты и/или комбинации каждого из них.
Относящиеся к воспалительному заболеванию кишечника антигены
[0152] Относящиеся к воспалительному заболеванию кишечника антигены включают в себя, без ограничения, относящиеся к болезни Крона антигены и относящиеся к язвенному колиту антигены. Согласно некоторым вариантам осуществления относящиеся к воспалительному заболеванию кишечника антигены включают в себя, без ограничения, антигены, происходящие из интегразы бактероидов, флагелина, флагеллина 2 (Fla-2/Fla-X) или неохарактеризованного белка E.coli (YIDX). Неограничивающие примеры включают в себя те, которые перечислены в таблице 8, а также эквиваленты и/или комбинации каждого из них.
Относящиеся к системной красной волчанке (SLE) антигены
[0153] Относящиеся к SLE антигены включают в себя, без ограничения, антигены, происходящие из H4, H2B, H1’, дцДНК, RNP, Smith (Sm), связанного с синдромом Шегрена антигена A (SS-A)/Ro, связанного с синдромом Шегрена антигена B (SS-B)/La и/или гистонов. Согласно некоторым вариантам осуществления SS-A включает в себя, без ограничения, RO60 и RO52. Согласно некоторым вариантам осуществления гистоны включают в себя, без ограничения, H4, H2B, H1’. Неограничивающие примеры включают в себя те, которые перечислены в таблице 9, а также эквиваленты и/или комбинации каждого из них.
Относящиеся к атеросклерозу антигены
[0154] Относящиеся к атеросклерозу антигены включают в себя, без ограничения, антигены, происходящие из аполипопротеина B (ApoB) или аполипопротеина E (ApoE). Неограничивающие примеры включают в себя те, которые перечислены в таблице 10, а также эквиваленты и/или комбинации каждого из них.
Относящиеся к хронической обструктивной болезни легких (ХОБЛ) и/или эмфиземе антигены
[0155] Относящиеся к ХОБЛ и/или эмфиземе антигены включают в себя, без ограничения, происходящие из эластина. Неограничивающие примеры включают в себя те, которые перечислены в таблице 11, а также эквиваленты и/или комбинации каждого из них.
Относящиеся к псориазу антигены
[0156] Относящиеся к псориазу антигены включают в себя, без ограничения, перечисленные в следующей таблице 12, а также их эквиваленты и/или комбинации. Другие неограничивающие иллюстративные относящиеся к псориазу антигены могут происходить из человеческого адамис-подобного белка 5 (ATL5), кателицидинового антимикробного пептида (CAP18) и/или ADAMTS-подобного белка 5 (ADMTSL5).
Относящиеся к аутоиммунному гепатиту антигены
[0157] Относящиеся к аутоиммунному гепатиту антигены включают в себя, без ограничения, антигены, раскрытые в приведенной ниже таблице 13, а также их эквиваленты и/или комбинации. Другие неограничивающие иллюстративные относящиеся к аутоиммунному гепатиту антигены могут происходить из микросомального цитохрома P450IID6 (CYP2D6) и/или растворимого печеночного антигена (SLA).
Относящиеся к увеиту антигены
[0158] Относящиеся к увеиту антигены включают в себя, без ограничения, антигены, раскрытые в приведенной ниже таблице 14, а также их эквиваленты и/или их комбинации. Другие неограничивающие иллюстративные относящиеся к увеиту антигены могут происходить из аррестина, S-антигена сетчатки человека и/или связывающего ретиноидный интерфорецептор белка, (IRBP).
Относящиеся к синдрому Шегрена антигены
[0159] Относящиеся к синдрому Шегрена антигены включают в себя, без ограничения, антигены, раскрытые в следующей таблице 15, а также их эквиваленты и/или комбинации. Другие неограничивающие иллюстративные относящиеся к синдрому Шегрена антигены могут происходить из (SS-A)/Ro, (SS-B)/La, RO60, RO52 и/или мускаринового рецептора 3 (MR3).
Относящиеся к склеродермии антигены
[0160] Относящиеся к склеродермии антигены включают в себя, без ограничения, антигены, раскрытые в приведенной ниже таблице 16, а также их эквиваленты и/или комбинации. Неограничивающие иллюстративные относящиеся к склеродермии антигены могут происходить из центромерного белка С центромерного аутоантигена (CENP-C), ДНК-топоизомеразы I (TOP1) и/или РНК-полимеразы III.
Относящиеся к антифосфолипидному синдрому антигены
[0161] Относящиеся к антифосфолипидному синдрому антигены включают в себя, без ограничения, антигены, раскрытые в приведенной ниже таблице 17, а также их эквиваленты и/или комбинации. Неограничивающие иллюстративные относящиеся к антифосфолипидному синдрому антигены могут происходить из бета-2-гликопротеина 1 (BG2P1 или APOH).
Относящиеся к ANCA-ассоциированному васкулиту антигены
[0162] Относящиеся к ANCA-ассоциированному васкулиту антигены включают в себя, без ограничения, антигены, раскрытые в приведенной ниже таблице 18, а также их эквиваленты и/или комбинации. Неограничивающие иллюстративные относящиеся к ANCA-ассоциированному васкулиту антигены могут происходить из миелопероксидазы (MPO), протеиназы (PRTN3) или фактора повышения проницаемости бактерий (BPI).
Относящиеся к синдрому мышечной скованности антигены
[0163] Относящиеся к синдрому мышечной скованности антигены включают в себя, без ограничения, антигены, раскрытые в следующей таблице 14, а также их эквиваленты и/или комбинации. Неограничивающие иллюстративные относящиеся к синдрому мышечной скованности антигены могут происходить из глутаматдекарбоксилазы (GAD). Согласно некоторым вариантам осуществления GAD включает в себя, без ограничения, GAD65.
[0164] Предполагается, что в композициях по настоящему раскрытию содержится от приблизительно 0,001 мг до приблизительно 10 мг общего белка на мл в композиции. Таким образом, концентрация белка в композиции может составлять приблизительно, по меньшей мере приблизительно или максимум приблизительно 0,001, 0,010, 0,050, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0, 50, 100 мкг/мл или мг/мл или более (или любой диапазон, полученный из него). Из этого приблизительно, по меньшей мере приблизительно или максимум приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 , 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94 95, 96, 97, 98, 99 или 100% могут представлять собой комплекс пептид/МНС/наночастицы.
[0165] Настоящее раскрытие включает введение комплекса пептид/MHC/наночастица для осуществления диагностики, лечения или профилактической терапии против развития заболевания или состояния, связанного с аутоиммунными реакциями или раком.
[0166] Кроме того, в патенте США № 4554101 (Hopp), который включен в настоящий документ посредством ссылки, описывается идентификация и получение эпитопов из первичных аминокислотных последовательностей на основе гидрофильности. Посредством способов, раскрытых в Hopp, специалист в настоящей области техники сможет идентифицировать потенциальные эпитопы из аминокислотной последовательности и подтвердить их иммуногенность. Многочисленные научные публикации были также посвящены предсказанию вторичной структуры и идентификации эпитопов из анализа аминокислотных последовательностей (Chou & Fasman, 1974a,b; 1978a,b; 1979). Любой из них может быть использован, если это желательно, в дополнение к идеям Hopp в патенте США № 4554101.
Другие антигенные компоненты
[0167] Молекулы, отличные от пептидов, могут быть использованы в качестве антигенов или антигенных фрагментов в комплексе с молекулами МНС. Такие молекулы включают в себя, без ограничения, углеводы, липиды, небольшие молекулы и т.п. Углеводы представляют собой основные компоненты внешней поверхности различных клеток. Определенные углеводы характерны для разных стадий дифференцировки, и очень часто эти углеводы распознаются специфическими антителами. Экспрессия отдельных углеводов может быть ограничена определенными типами клеток. Было показано, что ответы аутоантител на эндометриальные и сывороточные антигены являются общей чертой эндометриоза. Был описан ответ аутоантитела сыворотки при эндометриозе на ряд ранее идентифицированных антигенов, включая в себя гликопротеин 2-Гереманс-Шмида и карбоангидразу, которая специфична для углеводного эпитопа.
Неограничивающие иллюстративные комплексы антиген-MHC
[0168] Согласно определенным вариантам осуществления конкретные комбинации антигена и МНС могут быть оптимизированы для лечения конкретного заболевания. Неограничивающие примеры включают в себя, без ограничения, следующие примеры.
[0169] Для лечения сахарного диабета типа I антиген комплекса pMHC может быть получен из антигена группы: PPI76-90(K88S), IGRP13-25, GAD555-567, GAD555-567(557I), IGRP23-35, B24-C36, PPI76-90 или фрагмента или эквивалента каждого из них, а MHC комплекса pMHC содержит весь полипептид или часть полипептида группы: HLA-DRB1*0401/DRA, HLA-DRB1*0301/DRA или фрагмента или эквивалента каждого из них.
[0170] Согласно некоторым вариантам осуществления антиген комплекса pMHC содержит:
а) относящийся к сахарному диабету антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: препроинсулин (PPI), островок-специфическая глюкозо-6-фосфатаза (IGRP), глутамат декарбоксилаза (GAD), аутоантиген-2 островковых клеток (ICA2), инсулин, проинсулин или фрагмент или эквивалент каждого из них;
b) относящийся к рассеянному склерозу антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: миелиновый основной белок, миелин-ассоциированный гликопротеин, миелиновый олигодендроцитарный белок, протеолипидный белок, олигодендроцитный миелиновый олигопротеин, миелин-ассоциированный олигодендроцитарный основной белок, специфический к олигодендроциту белок, белки теплового шока, специфические к олигодендроцитам белки, NOGO A, гликопротеин Po, периферический миелиновый белок 22, 2'3'-циклический нуклеотид-3'-фосфодиэстераза или фрагмент или эквивалент каждого из них;
c) относящийся к глютеиновой болезни антиген и происходящий из глиадина или его фрагмента или его эквивалента;
d) первичный относящийся к билиарному циррозу антиген и происходящий из PDC-E2 или его фрагмента или его эквивалента;
e) относящийся к пузырчатке листовидной антиген и/или относящийся к пузырчатке обыкновенной антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: DG1, DG3 или фрагмента или эквивалента каждого из них;
f) относящийся к нейромиелиту зрительного нерва со спектральным расстройством антиген и происходящий из AQP4 или его фрагмента или его эквивалента;
g) относящийся к артриту антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: белки теплового шока, связывающий иммуноглобулин белок, гетерогенные ядерные RNP, аннексин V, кальпастатин, коллаген типа II, глюкозо-6-фосфат-изомераза, фактор элонгации хряща человека gp39, маннозосвязывающий лектин, цитруллинированный виментин, коллаген типа II, фибриноген, альфа-енолаза, анти-карбамилированный белок (анти-CarP), пептидиларгининдеминаза типа 4 (PAD4), BRAF, гамма-цепь фибриногена, тяжелая цепь H1 ингибитора интер-альфа-трипсина, альфа-1-антитрипсин, ингибитор C1 плазменной протеазы, гельсолин, альфа-1-B гликопротеин, церулоплазмин, тяжелая цепь H4 ингибитора интер-альфа-трипсина, фактор комплемента H, альфа-2-макроглобулин, сывороточный амилоид, C-реактивный белок, сывороточный альбумин, бета-цепь фиброгена, серотрансферин, альфа 2 HS гликопротеин, виментин, комплемент C3 или фрагмент или эквивалент каждого из них;
h) относящийся к аллергической астме антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: DERP1, DERP2 или фрагмента или эквивалента каждого из них;
i) относящийся к воспалительному заболеванию кишечника антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: флагелин, Fla-2, Fla-X, YIDX, интеграза бактероидов или фрагмент или эквивалент каждого из них;
j) относящийся к системной красной волчанке антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: двухцепочечная (дц)ДНК, рибонуклеопротеин (RNP), Smith (Sm), связанный с синдромом Шегрена антиген A (SS-A)/Ro, связанный с синдромом Шегрена антиген B (SS-B)/La, RO60, RO52, гистоны или фрагмент или эквивалент каждого из них;
k) относящийся к атеросклерозу антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: ApoB, ApoE или фрагмент или эквивалент каждого из них;
l) относящийся к ХОБЛ антиген и/или относящийся к эмфиземе антиген и происходящий из эластина или его фрагмента или его эквивалента;
m) относящийся к псориазу антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: Cap18, ADMTSL5, ATL5 или их фрагмент или эквивалент;
n) относящийся к аутоиммунному гепатиту антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: CYP2D6, SLA или фрагмент или эквивалент каждого из них;
o) относящийся к увеиту антиген и происходящий из аррестина или его фрагмента или его эквивалента;
p) относящийся к синдрому Шегрена антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: (SS-A)/Ro, (SS-B)/La, MR3, RO60, RO52 или фрагмент или эквивалент каждого из них;
q) относящийся к склеродермии антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: CENP-C, TOP 1, РНК-полимераза III или фрагмент или эквивалент каждого из них;
r) относящийся к антифосфолипидному синдрому антиген и происходящий из APOH или его фрагмента или его эквивалента;
s) относящийся к ANCA-ассоциированному васкулиту антиген и происходящий из антигена, выбранного из одного или нескольких из следующей группы: MPO, PRTN3 или фрагмент или эквивалент каждого из них; или же
t) относящийся к синдрому мышечной скованности антиген и происходящий из GAD или его фрагмента или его эквивалента.
[0171] Согласно некоторым вариантам осуществления белок MHC комплекса pMHC содержит весь или часть классического белка MHC класса I, неклассического белка MHC класса I, классического белка MHC класса II, неклассического белка MHC класса II, димеры MHC (Fc слияния), тетрамеры MHC или полимерные формы белка MHC, причем белок MHC необязательно содержит гетеродимер или мультимер MHC-альфа-Fc/MHC-бета-Fc на основе «выступа-во-впадину».
[0172] Согласно некоторым вариантам осуществления белок MHC комплекса pMHC содержит весь или часть полипептида группы: HLA DR, HLA DQ, HLA DP, HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-G, CD1d или фрагмент или эквивалент каждого из них.
[0173] Согласно некоторым вариантам осуществления белок MHC комплекса pMHC содержит весь или часть полипептида группы: HLA-DR, HLA-DQ, HLA-DP или фрагмент или эквивалент каждого из них.
[0174] Согласно некоторым вариантам осуществления белок MHC комплекса pMHC содержит весь или часть полипептида группы: HLA-DRB1/DRA, HLA-DRB3/DRA, HLA-DRB4/DRA, HLA-DRB5/DRA, HLA -DQA1/HLA-DQB1, HLA-DPB1/HLA-DPA1 или фрагмент или эквивалент каждого из них.
[0175] Согласно определенным аспектам комплекс pMHC содержит:
а) относящийся к сахарному диабету антиген, полученный из антигена, выбранного из одного или нескольких из группы: hInsB10-18, hIGRP228-236, hIGRP265-273, IGRP206-214, hIGRP206-214, NRP-A7, NRP-I4, NRP-V7, YAI/Db, INS B15–23, PPI76-90 (K88S), IGRP13-25, GAD555-567, GAD555-567(557I), IGRP23-35, B24-C36, PPI76-90, INS-I9, TUM, G6Pаза, проинсулинL2-10, проинсулинL3-11, проинсулинL6-14, проинсулинB5-14, проинсулинB10-18, проинсулинB14-22, проинсулинB15-24, проинсулинB17-25, проинсулинB18-27, проинсулинB20-27, проинсулинB21-29, проинсулинB25-C1, проинсулинB27-C5, проинсулинC20-28, проинсулинC25-33, проинсулинC29-A5, проинсулинA1-10, проинсулинA2-10, проинсулинA12-20 или фрагмент или эквивалент каждого из них;
b) относящийся к рассеянному склерозу антиген, полученный из антигена, выбранного из одного или нескольких группы: MOG35-55, MOG36-55, MAG287-295, MAG509-517, MAG556-564, MBP110-118, MOG114-122, MOG166-175, MOG172-180, MOG179-188, MOG188-196, MOG181-189, MOG205-214, PLP80-88, MAG287-295, MAG509-517, MAG556-564, MOG97-109 MOG97-109(E107S), MBP89-101, PLP175-192, PLP94-108, MBP86-98, PLP54-68, PLP249-263, MOG156-170, MOG201-215, MOG38-52, MOG203-217, PLP250-264, MPB13-32, MPB83-99, MPB111-129, MPB146-170, MOG223-237, MOG6-20, PLP88-102, PLP139-154 или фрагмент или эквивалент каждого из них;
c) относящийся к глютеиновой болезни антиген, полученный из антигена, выбранного из одного или нескольких из группы: aGlia57-68, aGlia62-72, aGlia217-229 или фрагмент или эквивалент каждого из них;
d) относящийся к первичному билиарному циррозу антиген, полученный из антигена, выбранного из одного или нескольких из группы: PDC-E2122-135, PDC-E2249-262, PDC-E2249-263, PDC-E2629-643, PDC-E272-86, PDC-E2353-367, PDC-E2422-436, PDC-E2629-643, PDC-E280-94, PDC-E2353-367, PDC-E2535-549 или фрагмент или эквивалент каждого из них;
e) относящийся к пузырчатке листовидной антиген и/или относящийся к пузырчатке обыкновенной антиген, каждый из которых получен из антигена, выбранного из одного или нескольких из группы: DG1216-229, DG397-111, DG3251-265, DG3441-455,DG3351-365, DG3453-467, DG3540-554, DG3280-294, DG3326-340, DG3367-381, DG313-27, DG3323-337, DG3438-452, DG148-62, DG1206-222, DG1363-377, DG13-17, DG1192-206, DG1326-340, DG11-15, DG135-49, DG1325-339 или фрагмент или эквивалент каждого из них;
f) относящийся к нейромиелиту зрительного нерва со спектральным расстройством антиген, полученный из антигена, выбранного из одного или нескольких из группы: AQP4129-143, AQP4284-298, AQP463-76, AQP4129-143, AQP439-53 или фрагмент или эквивалент каждого из них;
g) относящийся к аллергической астме антиген, полученный из антигена, выбранного из одного или нескольких из группы: DERP116-30, DERP1171-185, DERP1110-124, DERP-226-40, DERP-2 107-121 или фрагмент или эквивалент каждого из них;
h) относящийся к воспалительному заболеванию кишечника антиген, полученный из антигена, выбранного из одного или нескольких из группы: антиген интегразы бактериоидов183-197, антиген интегразы бактериоидов146-160, антиген интегразы бактериоидов175-189, антиген интегразы бактериоидов1-15, антиген интегразы бактериоидов183-197, антиген интегразы бактериоидов30-44, антиген интегразы бактериоидов70-84, антиген интегразы бактериоидов337-351, антиген интегразы бактериоидов171-185, антиген интегразы бактериоидов4-18, антиген интегразы бактериоидов256-270, Fla-2/Fla-X366-380, Fla-2/Fla-X164-178, Fla-2/Fla-X261-275, Fla-2/Fla-X1-15, Fla-2/Fla-X51-65, Fla-2/Fla-X269-283, Fla-2/Fla-X4-18, Fla-2/Fla-X271-285, YIDX78-92, YIDX93-107, YIDX98-112, YIDX23-37, YIDX78-92, YIDX195-209, YIDX22-36, YIDX80-94, YIDX101-115 или фрагмент или эквивалент каждого из них;
i) относящийся к системной красной волчанке антиген, полученный из антигена, выбранного из одного или нескольких из группы: H471-94, H474-88, H476-90, H475-89, H478-92, H480-94, H2B10-24, H2B16-30, H1´22-42, H1´27-41 или фрагмент или эквивалент каждого из них;
j) относящийся к атеросклерозу антиген, полученный из антигена, выбранного из одного или нескольких из группы: ApoB3501-3516, ApoB1952-1966, ApoB978-993, ApoB3498-3513, ApoB210A, ApoB210B, ApoB210C или фрагмент или эквивалент каждого из них;
k) относящийся к ХОБЛ антиген и/или относящийся к эмфиземе антиген, каждый из которых получен из антигена, выбранного из одного или нескольких из группы: эластин89-103, эластин698-712, эластин8-22, эластин94-108, эластин13-27, эластин695-709, эластин563-577, эластин558-572, эластин698-712, эластин566-580, эластин645-659 или фрагмент или эквивалент каждого из них;
l) относящийся к псориазу антиген, полученный из антигена, выбранного из одного или нескольких из группы: Cap1864-78, Cap1834-48, Cap1847-61, Cap18151-165, Cap18149-163, Cap18152-166, Cap18131-145, Cap1824-38, ADMTSL5245-259, ADMTSL5267-281, ADMTSL5372-386, ADMTSL5289-303, ADMTSL5396-410, ADMTSL5433-447, ADMTSL5142-156, ADMTSL5236-250, ADMTSL5301-315, ADMTSL5203-217, ADMTSL5404-418 или фрагмент или эквивалент каждого из них;
m) относящийся к аутоиммунному гепатиту антиген, полученный из антигена, выбранного из одного или нескольких из группы: (CYP2D6)193-207, CYP2D676-90, CYP2D6293-307, CYP2D6313-332, CYP2D6393-412, CYP2D6199-213, CYP2D6450-464, CYP2D6301-315, CYP2D6452-466, CYP2D659-73, CYP2D6130-144, CYP2D6193-212, CYP2D6305-324, CYP2D6131-145, CYP2D6216-230, CYP2D6238-252, CYP2D6199-213, CYP2D6235-252, CYP2D6293-307, CYP2D6381-395, CYP2D6429-443, SLA334-348, SLA196-210, SLA115-129, SLA373-386, SLA186-197, SLA317-331, SLA171-185, SLA417-431, SLA359-373, SLA215-229, SLA111-125, SLA110-124, SLA299-313, SLA342-356, SLA49-63, SLA119-133, SLA260-274, SLA26-40, SLA86-100, SLA331-345 или фрагмент или эквивалент каждого из них;
n) относящийся к увеиту антиген, полученный из антигена, выбранного из одного или нескольких из группы: аррестин199-213, аррестин77-91, аррестин250-264, аррестин172-186, аррестин354-368, аррестин239-253, аррестин102-116, аррестин59-73, аррестин280-294, аррестин291-306, аррестин195-209, аррестин200-214 или фрагмент или эквивалент каждого из них;
o) относящийся к синдрому Шегрена антиген, полученный из антигена, выбранного из одного или нескольких из группы: RO60127-141, RO60523-537, RO60243-257, RO60484-498, RO60347-361, RO60369-383, RO60426- 440, RO60267-281, RO60178-192, RO60358-372, RO60221-235, RO60318-332, RO60407-421, RO60459-473, RO6051-65, RO60312-326, LA241-255, LA101-115, LA153-167, LA178-192, LA19-33, LA37-51, LA133-147, LA50-64, LA32-46, LA153-167, LA83-97, LA136-150, LA297-311, LA59-73, LA151-165, LA86-100, LA154-168 или фрагмент или эквивалент каждого из них;
р) относящийся к склеродермии антиген, полученный из антигена, выбранного из одного или нескольких из группы: TOP1346-360, TOP1420-434, TOP1750-764, TOP1419-433, TOP1591-605, TOP1695-709, TOP1305-319, TOP1346-360, TOP1419-433, TOP1425-439, TOP1614-628, CENP-C297-311, CENP-C857-871, CENP-C887-901, CENP-C212-226, CENP-C643-657, CENP-C832-846, CENP-C167-181, CENP-C246-260, CENP-C846-860, CENP-C149-163, CENP-C833-847, CENP-C847-861 или фрагмент или эквивалент каждого из них;
q) относящийся к антифосфолипидному синдрому антиген, полученный из антигена, выбранного из одного или нескольких из группы: APOH235-249, APOH306-320, APOH237-251, APOH295-309, APOH28-42, APOH173-187, APOH264-278, APOH295-309, APOH49-63, APOH269-283, APOH295-309, APOH321-355, APOH322-336, APOH324-338 или фрагмент или эквивалент каждого из них;
r) относящийся к ANCA-ассоциированному васкулиту антиген, полученный из антигена, выбранного из одного или нескольких из группы: MPO506-520, MPO302-316, MPO7-21, MPO689-703, MPO248-262, MPO444-458, MPO513-527, MPO97-111, MPO616-630, MPO462-476, MPO617-631, MPO714-728, PRTN344-58, PRTN3234-248, PRTN359-73, PRTN3117-131, PRTN3164-178, PRTN371-85, PRTN3241-255, PRTN359-73, PRTN3183-197, PRTN362-76, PRTN3118-132, PRTN3239-253 или фрагмент или эквивалент каждого из них или
s) относящийся к синдрому мышечной скованности антиген, полученный из антигена, выбранного из одного или нескольких из группы: GAD212-226, GAD555-569, GAD297-311 или фрагмент или эквивалент каждого из них.
[0176] Согласно определенным аспектам комплекс pMHC содержит:
а) относящийся к сахарному диабету антиген, полученный из антигена, выбранного из одного или нескольких из группы: hInsB10-18, hIGRP228-236, hIGRP265-273, IGRP206-214, hIGRP206-214, NRP-A7, NRP-I4, NRP-V7, YAI/Db, INS B15–23, PPI76-90 (K88S), IGRP13-25, GAD555-567, GAD555-567(557I), IGRP23-35, B24-C36, PPI76-90, INS-I9, TUM, G6Pаза, проинсулинL2-10, проинсулинL3-11, проинсулинL6-14, проинсулинB5-14, проинсулинB10-18, проинсулинB14-22, проинсулинB15-24, проинсулинB17-25, проинсулинB18-27, проинсулинB20-27, проинсулинB21-29, проинсулинB25-C1, проинсулинB27-C5, проинсулинC20-28, проинсулинC25-33, проинсулинC29-A5, проинсулинA1-10, проинсулинA2-10, проинсулинA12-20 или фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит весь или часть HLA-DR или его фрагмент или эквивалент;
b) относящийся к рассеянному склерозу антиген, полученный из антигена, выбранного из одного или нескольких из группы: MOG35-55, MOG36-55, MAG287-295, MAG509-517, MAG556-564, MBP110-118, MOG114-122, MOG166-175, MOG172-180, MOG179-188, MOG188-196, MOG181-189, MOG205-214, PLP80-88, MAG287-295, MAG509-517, MAG556-564, MOG97-109 MOG97-109(E107S), MBP89-101, PLP175-192, PLP94-108, MBP86-98, PLP54-68, PLP249-263, MOG156-170, MOG201-215, MOG38-52, MOG203-217, PLP250-264, MPB13-32, MPB83-99, MPB111-129, MPB146-170, MOG223-237, MOG6-20, PLP88-102, PLP139-154 или фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит весь или часть HLA-DR или его фрагмент или эквивалент;
c) относящийся к глютеиновой болезни антиген, полученный из антигена, выбранного из одного или нескольких из группы: aGlia57-68, aGlia62-72, aGlia217-229 или их фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит весь или часть HLA-DR или его фрагмент или эквивалент;
d) относящийся к первичному билиарному циррозу антиген, полученный из антигена, выбранного из одного или нескольких из группы: PDC-E2122-135, PDC-E2249-262, PDC-E2249-263, PDC-E2629-643, PDC-E272-86, PDC-E2353-367, PDC-E2422-436, PDC-E2629-643, PDC-E280-94, PDC-E2353-367, PDC-E2535-549 или фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит весь или часть HLA-DR или его фрагмент или эквивалент;
e) относящийся к пузырчатке листовидной антиген и/или относящийся к пузырчатке обыкновенной антиген, каждый из которых получен из антигена, выбранного из одного или нескольких из группы: DG1216-229, DG397-111, DG3251-265, DG3441-455,DG3351-365, DG3453-467, DG3540-554, DG3280-294, DG3326-340, DG3367-381, DG313-27, DG3323-337, DG3438-452, DG148-62, DG1206-222, DG1363-377, DG13-17, DG1192-206, DG1326-340, DG11-15, DG135-49, DG1325-339 или фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит весь или часть HLA-DR или его фрагмент или эквивалент;
f) относящийся к нейромиелиту зрительного нерва со спектральным расстройством антиген, полученный из антигена, выбранного из одного или нескольких из группы: AQP4129-143, AQP4284-298, AQP463-76, AQP4129-143, AQP439-53 или фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит весь или часть HLA-DR или его фрагмент или эквивалент;
g) относящийся к аллергической астме антиген, полученный из антигена, выбранного из одного или нескольких из группы: DERP116-30, DERP1171-185, DERP1110-124, DERP-226-40, DERP-2 107-121 или фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит весь или часть полипептида группы: HLA-DR, HLA-DP или фрагмент или эквивалент каждого из них;
h) относящийся к воспалительному заболеванию кишечника антиген, полученный из антигена, выбранного из одного или нескольких из группы: антиген интегразы бактериоидов183-197, антиген интегразы бактериоидов146-160, антиген интегразы бактериоидов175-189, антиген интегразы бактериоидов1-15, антиген интегразы бактериоидов183-197, антиген интегразы бактериоидов30-44, антиген интегразы бактериоидов70-84, антиген интегразы бактериоидов337-351, антиген интегразы бактериоидов171-185, антиген интегразы бактериоидов4-18, антиген интегразы бактериоидов256-270, Fla-2/Fla-X366-380, Fla-2/Fla-X164-178, Fla-2/Fla-X261-275, Fla-2/Fla-X1-15, Fla-2/Fla-X51-65, Fla-2/Fla-X269-283, Fla-2/Fla-X4-18, Fla-2/Fla-X271-285, YIDX78-92, YIDX93-107, YIDX98-112, YIDX23-37, YIDX78-92, YIDX195-209, YIDX22-36, YIDX80-94, YIDX101-115 или фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит весь или часть HLA-DR или его фрагмент или эквивалент;
i) относящийся к системной красной волчанке антиген, полученный из антигена, выбранного из одного или нескольких из группы: H471-94, H474-88, H476-90, H475-89, H478-92, H480-94, H2B10-24, H2B16-30, H1´22-42, H1´27-41 или фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит весь или часть полипептида группы: I-Ad, HLA-DR или фрагмент или эквивалент каждого из них;
j) относящийся к атеросклерозу антиген, полученный из антигена, выбранного из одного или нескольких из группы: ApoB3501-3516, ApoB1952-1966, ApoB978-993, ApoB3498-3513, ApoB210A, ApoB210B, ApoB210C или фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит весь или часть I-Ab или его фрагмент или эквивалент;
k) относящийся к ХОБЛ антиген и/или относящийся к эмфиземе антиген, каждый из которых получен из антигена, выбранного из одного или нескольких из группы: эластин89-103, эластин698-712, эластин8-22, эластин94-108, эластин13-27, эластин695-709, эластин563-577, эластин558-572, эластин698-712, эластин566-580, эластин645-659 или фрагмент или эквивалент каждого из них, и белок МНС комплекса pMHC содержит весь или часть HLA-DR или его фрагмент или эквивалент;
l) относящийся к псориазу антиген, полученный из антигена, выбранного из одного или нескольких из группы: Cap1864-78, Cap1834-48, Cap1847-61, Cap18151-165, Cap18149-163, Cap18152-166, Cap18131-145, Cap1824-38, ADMTSL5245-259, ADMTSL5267-281, ADMTSL5372-386, ADMTSL5289-303, ADMTSL5396-410, ADMTSL5433-447, ADMTSL5142-156, ADMTSL5236-250, ADMTSL5301-315, ADMTSL5203-217, ADMTSL5404-418 или фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит весь или часть HLA-DR или его фрагмент или эквивалент;
m) относящийся к аутоиммунному гепатиту антиген, полученный из антигена, выбранного из одного или нескольких из группы: (CYP2D6)193-207, CYP2D676-90, CYP2D6293-307, CYP2D6313-332, CYP2D6393-412, CYP2D6199-213, CYP2D6450-464, CYP2D6301-315, CYP2D6452-466, CYP2D659-73, CYP2D6130-144, CYP2D6193-212, CYP2D6305-324, CYP2D6131-145, CYP2D6216-230, CYP2D6238-252, CYP2D6199-213, CYP2D6235-252, CYP2D6293-307, CYP2D6381-395, CYP2D6429-443, SLA334-348, SLA196-210, SLA115-129, SLA373-386, SLA186-197, SLA317-331, SLA171-185, SLA417-431, SLA359-373, SLA215-229, SLA111-125, SLA110-124, SLA299-313, SLA342-356, SLA49-63, SLA119-133, SLA260-274, SLA26-40, SLA86-100, SLA331-345 или фрагмент или эквивалент каждого из них, и белок MHC из комплекса pMHC содержит весь или часть HLA-DR или его фрагмент или эквивалент;
n) относящийся к увеиту антиген, полученный из антигена, выбранного из одного или нескольких из группы: аррестин199-213, аррестин77-91, аррестин250-264, аррестин172-186, аррестин354-368, аррестин239-253, аррестин102-116, аррестин59-73, аррестин280-294, аррестин291-306, аррестин195-209, аррестин200-214 или фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит весь или часть HLA-DR или его фрагмент или эквивалент;
o) относящийся к синдрому Шегрена антиген, полученный из антигена, выбранного из одного или нескольких из группы: RO60127-141, RO60523-537, RO60243-257, RO60484-498, RO60347-361, RO60369-383, RO60426- 440, RO60267-281, RO60178-192, RO60358-372, RO60221-235, RO60318-332, RO60407-421, RO60459-473, RO6051-65, RO60312-326, LA241-255, LA101-115, LA153-167, LA178-192, LA19-33, LA37-51, LA133-147, LA50-64, LA32-46, LA153-167, LA83-97, LA136-150, LA297-311, LA59-73, LA151-165, LA86-100, LA154-168 или фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит весь или часть полипептида группы: HLA-DR, HLA-DP или фрагмент или эквивалент каждого из них;
р) относящийся к склеродермии антиген, полученный из антигена, выбранного из одного или нескольких из группы: TOP1346-360, TOP1420-434, TOP1750-764, TOP1419-433, TOP1591-605, TOP1695-709, TOP1305-319, TOP1346-360, TOP1419-433, TOP1425-439, TOP1614-628, CENP-C297-311, CENP-C857-871, CENP-C887-901, CENP-C212-226, CENP-C643-657, CENP-C832-846, CENP-C167-181, CENP-C246-260, CENP-C846-860, CENP-C149-163, CENP-C833-847, CENP-C847-861 или фрагмент или эквивалент каждого из них, а также белок MHC комплекса pMHC содержит весь или часть HLA-DR или его фрагмент или эквивалент;
q) относящийся к антифосфолипидному синдрому антиген, полученный из антигена, выбранного из одного или нескольких из группы: APOH235-249, APOH306-320, APOH237-251, APOH295-309, APOH28-42, APOH173-187, APOH264-278, APOH295-309, APOH49-63, APOH269-283, APOH295-309, APOH321-355, APOH322-336, APOH324-338 или фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит все или часть HLA-DR или его фрагмент или эквивалент;
r) относящийся к ANCA-ассоциированному васкулиту антиген, полученный из антигена, выбранного из одного или нескольких из группы: MPO506-520, MPO302-316, MPO7-21, MPO689-703, MPO248-262, MPO444-458, MPO513-527, MPO97-111, MPO616-630, MPO462-476, MPO617-631, MPO714-728, PRTN344-58, PRTN3234-248, PRTN359-73, PRTN3117-131, PRTN3164-178, PRTN371-85, PRTN3241-255, PRTN359-73, PRTN3183-197, PRTN362-76, PRTN3118-132, PRTN3239-253 или фрагмент или эквивалент каждого из них, и белок MHC комплекса pMHC содержит весь или часть HLA-DR или его фрагмент или эквивалент или
s) относящийся к синдрому мышечной скованности антиген, полученный из антигена, выбранного из одного или нескольких из группы: GAD212-226, GAD555-569, GAD297-311, и белок MHC комплекса pMHC содержит весь или часть полипептида группы: HLA-DR, HLA-DQ или фрагмент или эквивалент каждого из них.
[0177] Согласно определенным аспектам комплекс pMHC предназначен для лечения:
а) сахарного диабета I типа, и комплекс pMHC выбирают из группы: PPI76-90(K88S)-HLA-DRB1*0401/DRA, IGRP13-25-HLA-DRB1*0301/DRA, GAD555-567-HLA-DRB1*0401/DRA, GAD555-567(557I)-HLA-DRB1*0401/DRA, IGRP23-35-HLA-DRB1*0401/DRA, B24-C36-HLA-DRB1*0301/DRA или PPI76-90-HLA-DRB1*0401/DRA;
b) рассеянного склероза, и комплекс pMHC выбирают из группы: MBP86-98-HLA-DRB1*1501/DRA, MBP89-101-HLA-DRB5*0101/DRA, MOG38-52-HLA-DRB4*0101/DRA, MOG97-109(E107S)-HLA-DRB1*0401/DRA, MOG203-217-HLA-DRB3*0101/DRA, PLP54-68-HLA-DRB3*0101/DRA, PLP94-108-HLA-DRB1*0301/DRA, PLP250-264-HLA-DRB4*0101/DRA, MPB13-32-HLA-DRB5*0101/DRA, MPB83-99-HLA-DRB5*0101/DRA, MPB111-129-HLA-DRB5*0101/DRA, MPB146-170-HLA-DRB5*0101/DRA, MOG223-237-HLA-DRB3*0202/DRA, MOG6-20-HLA-DRB5*0101/DRA, PLP88-102-HLA-DRB3*0202/DRA или PLP139-154-HLA-DRB5*0101/DRA;
c) глютеиновой болезни, и комплекс pMHC выбирают из группы: aGlia57-68- HLA-DQA1*0501/HLA-DQB1*0201, aGlia62-72- HLA-DQA1*0501/HLA-DQB1*0201, aGlia217-229- HLA-DQA1*0501/HLA-DQB1*0302 или aGlia217-229-HLA-DQA1*03/ HLA-DQB1*0302;
d) первичного билиарного цирроза, и комплекс pMHC выбирают из группы: PDC-E2122-135-HLA-DRB4*0101/DRA, PDC-E2249-262-HLA-DRB4*0101/DRA, PDC-E2249-263-HLA-DRB1*0801/DRA, PDC-E2629-643-HLA-DRB1*0801/DRA, PDC-E272-86-HLA-DRB3*0202/DRA, PDC-E2353-367-HLA-DRB3*0202/DRA, PDC-E2422-436-HLA-DRB3*0202/DRA, PDC-E2629-643-HLA-DRB4*0101/DRA, PDC-E280-94-HLA-DRB5*0101/DRA, PDC-E2353-367-HLA-DRB5*0101/DRA, or PDC-E2535-549-HLA-DRB5*0101/DRA, mPDC-E2166-181-I-Ag7 или mPDC-E282-96-I-Ag7;
e) пузырчатки листовидной и/или пузырчатки обыкновенной, и комплекс pMHC выбирают из группы: DG1216-229-HLA-DRB1*0101/DRA, DG1216-229-HLA-DRB1*0102/DRA, DG397-111-HLA-DRB1*0402/DRA, DG3251-265-HLA-DRB1*0402/DRA, DG3251-265-HLA-DRB1*0401/DRA, DG3441-455-HLA-DRB1*0402/DRA, DG3351-365-HLA-DRB3*0202/DRA, DG3453-467-HLA-DRB3*0202/DRA, DG3540-554-HLA-DRB3*0202/DRA, DG3280-294-HLA-DRB4*0101/DRA, DG3326-340-HLA-DRB4*0101/DRA, DG3367-381-HLA-DRB4*0101/DRA, DG313-27-HLA-DRB5*0101/DRA, DG3323-337-HLA-DRB5*0101/DRA, DG3438-452-HLA-DRB5*0101/DRA, DG148-62-HLA-DRB3*0202/DRA, DG1206-222-HLA-DRB3*0202/DRA, DG1363-377-HLA-DRB3*0202/DRA, DG13-17-HLA-DRB4*0101/DRA, DG1192-206-HLA-DRB4*0101/DRA, DG1326-340-HLA-DRB4*0101/DRA, DG11-15-HLA-DRB5*0101/DRA, DG135-49-HLA-DRB5*0101/DRA или DG1325-339-HLA-DRB5*0101/DRA;
f) нейромиелита зрительного нерва со спектральным расстройством, и комплекс pMHC выбирают из группы: AQP4129-143-HLA-DRB1*0101/DRA, AQP4284-298-HLA-DRB1*0301/DRA, AQP463-76-HLA-DRB1*0301/DRA, AQP4129-143-HLA-DRB1*0401/DRA или AQP439-53-HLA-DRB1*1501/DRA;
g) аллергической астмы, и комплекс pMHC выбирают из группы: DERP-116-30-HLA-DRB1*0101/DRA, DERP-116-30 -HLA-DRB1*1501/DRA, DERP1171-185 - HLA-DRB1*1501/DRA, DERP-1110-124 -HLA-DPB1*0401/DRA, DERP-226-40 -HLA-DRB1*0101/DRA; DERP-226-40-HLA-DRB1*1501/DRA или DERP-2107-121-HLA-DRB1*0301/DRA;
h) воспалительного заболевания кишечника, и комплекс pMHC выбирают из группы: антиген интегразы бактероидов183-197 - HLA-DRB3*0101/DRA, антиген интегразы бактероидов146-160- HLA-DRB3*0101/DRA, антиген интегразы бактероидов175-189- HLA-DRB3*0101/DRA, антиген интегразы бактероидов1-15 - HLA-DRB5*0101/DRA, антиген интегразы бактероидов183-197- HLA-DRB5*0101/DRA, антиген интегразы бактероидов183-197-HLA-DRB3*0101/DRA, антиген интегразы бактероидов30-44- HLA-DRB5*0101/DRA, антиген интегразы бактероидов70-84- HLA-DRB4*0101/DRA, антиген интегразы бактероидов337-351- HLA-DRB4*0101/DRA, антиген интегразы бактероидов171-185- HLA-DRB4*0101/DRA, антиген интегразы бактероидов4-18-HLA-DRB3*0202/DRA, антиген интегразы бактероидов171-185-HLA-DRB3*0202/DRA, антиген интегразы бактероидов256-270-HLA-DRB3*0202/DRA, Fla-2/Fla-X366-380- HLA-DRB3*0101/DRA, Fla-2/Fla-X164-178- HLA-DRB3*0101/DRA, Fla-2/Fla-X261-275- HLA-DRB5*0101/DRA, Fla-2/Fla-X1-15- HLA-DRB5*0101/DRA, Fla-2/Fla-X51-65- HLA-DRB4*0101/DRA, Fla-2/Fla-X269-283- HLA-DRB4*0101/DRA, Fla-2/Fla-X4-18-HLA-DRB3*0202/DRA, Fla-2/Fla-X261-275-HLA-DRB3*0202/DRA, Fla-2/Fla-X271-285-HLA-DRB3*0202/DRA, YIDX78-92– HLA-DRB3*0101/DRA, YIDX78-92- HLA-DRB4*0101/DRA, YIDX93-107- HLA-DRB3*0101/DRA, YIDX98-112- HLA-DRB5*0101/DRA, YIDX23-37- HLA-DRB5*0101/DRA, YIDX78-92- HLA-DRB4*0101/DRA, YIDX195-209- HLA-DRB4*0101/DRA, YIDX22-36-HLA-DRB3*0202/DRA, YIDX80-94-HLA-DRB3*0202/DRA или YIDX101-115-HLA-DRB3*0202/DRA;
i) ХОБЛ и/или эмфиземы, и комплекс pMHC выбирают из группы: эластин89-103-HLA-DRB3*0101/DRA, эластин698-712-HLA-DRB5*0101/DRA, эластин8-22-HLA-DRB5*0101/DRA, эластин94-108-HLA-DRB5*0101/DRA, эластин13-27-HLA-DRB4*0101/DRA, эластин695-709-HLA-DRB4*0101/DRA, эластин563-577-HLA-DRB4*0101/DRA, эластин558-572-HLA-DRB4*0101/DRA, эластин698-712-HLA-DRB5*0101/DRA, эластин566-580-HLA-DRB3*0202/DRA или эластин645-659-HLA-DRB3*0202/DRA;
j) псориаза, и комплекс pMHC выбирают из группы: Cap1864-78-HLA-DRB3*0101/DRA, Cap1834-48-HLA-DRB3*0101/DRA, Cap1847-61-HLA-DRB3*0101/DRA, Cap18151-165-HLA -DRB4*0101/DRA, Cap18149-163-HLA-DRB5*0101/DRA, Cap18152-166-HLA-DRB5*0101/DRA, Cap18131-145-HLA-DRB5*0101/DRA, Cap1824-38-HLA-DRB3*0202/DRA, ADMTSL5245-259-HLA-DRB3*0101/DRA, ADMTSL5267-281-HLA-DRB3*0101/DRA, ADMTSL5372-386-HLA-DRB3*0101/DRA, ADMTSL5289-303-HLA-DRB4*0101/DRA, ADMTSL5396-410-HLA-DRB4*0101/DRA, ADMTSL5433-447-HLA-DRB4*0101/DRA, ADMTSL5142-156-HLA-DRB5*0101/DRA, ADMTSL5236-250-HLA-DRB5*0101/DRA, ADMTSL5301-315-HLA-DRB5*0101/DRA, ADMTSL5203-217-HLA-DRB3*0202/DRA, ADMTSL5404-418-HLA-DRB3*0202/DRA или ADMTSL5433-447-HLA-DRB3*0202/DRA;
k) аутоиммунного гепатита, и комплекс pMHC выбирают из группы: CYP2D6193-207-HLA-DRB1*0301/DRA, CYP2D676-90-HLA-DRB1*0301/DRA, CYP2D6293-307-HLA-DRB1*0301/DRA, CYP2D6313-332-HLA-DRB1*0301/DRA, CYP2D6393-412-HLA-DRB1*0301/DRA, CYP2D6199-213-HLA-DRB1*0401/DRA, CYP2D6450-464-HLA-DRB1*0401/DRA, CYP2D6301-315-HLA-DRB1*0401/DRA, CYP2D6452-466-HLA-DRB1*0701/DRA, CYP2D659-73-HLA-DRB1*0701/DRA, CYP2D6130-144-HLA-DRB1*0701/DRA, CYP2D6193-212-HLA-DRB1*0701/DRA, CYP2D6305-324-HLA-DRB1*0701/DRA, CYP2D6131-145-HLA-DRB3*0202/DRA, CYP2D6216-230-HLA-DRB3*0202/DRA, CYP2D6238-252-HLA-DRB3*0202/DRA, CYP2D6199-213-HLA-DRB4*0101/DRA, CYP2D6235-252-HLA-DRB4*0101/DRA, CYP2D6293-307-HLA-DRB4*0101/DRA, CYP2D6238-252-HLA-DRB5*0101/DRA, CYP2D6381-395-HLA-DRB5*0101/DRA, CYP2D6429-443-HLA-DRB5*0101/DRA, SLA334-348-HLA-DRB1*0301/DRA, SLA196-210-HLA-DRB1*0301/DRA, SLA115-129-HLA-DRB1*0301/DRA, SLA373-386-HLA-DRB1*0301/DRA, SLA186-197-HLA-DRB1*0301/DRA, SLA317-331-HLA-DRB1*0401/DRA, SLA171-185-HLA-DRB1*0401/DRA, SLA417-431-HLA-DRB1*0401/DRA, SLA359-373-HLA-DRB1*0701/DRA, SLA215-229-HLA-DRB1*0701/DRA, SLA111-125-HLA-DRB1*0701/DRA, SLA110-124-HLA-DRB3*0202/DRA, SLA299-313-HLA-DRB3*0202/DRA, SLA342-356-HLA-DRB3*0202/DRA, SLA49-63-HLA-DRB4*0101/DRA, SLA119-133-HLA-DRB4*0101/DRA, SLA260-274-HLA-DRB4*0101/DRA, SLA26-40-HLA-DRB5*0101/DRA, SLA86-100-HLA-DRB5*0101/DRA или SLA331-345-HLA-DRB5*0101/DRA;
l) увеита, и комплекс pMHC выбирают из группы: аррестин199-213-HLA-DRB3*0101/DRA, аррестин77-91-HLA-DRB3*0101/DRA, аррестин250-264-HLA-DRB3*0101/DRA, аррестин172-186-HLA-DRB4*0101/DRA, аррестин354-368-HLA-DRB4*0101/DRA, аррестин239-253-HLA-DRB4*0101/DRA, аррестин102-116-HLA-DRB5*0101/DRA, аррестин59-73-HLA-DRB5*0101, аррестин280-294-HLA-DRB5*0101, аррестин291-306-HLA-DRB1*0301/DRA, аррестин195-209-HLA-DRB3*0202/DRA, аррестин199-213-HLA-DRB3*0202/DRA или аррестин200-214-HLA-DRB3*0202/DRA;
m) синдрома Шегрена, и комплекс pMHC выбран из группы: RO60127-141-HLA-DRB1*0301/DRA, RO60523-537-HLA-DRB1*0301/DRA, RO60243-257-HLA-DRB1*0301/DRA, RO60484-498-HLA-DRB3*0101/DRA, RO60347-361-HLA-DRB3*0101/DRA, RO60369-383-HLA-DRB3*0101/DRA, RO60426-440-HLA-DRB4*0101/DRA, RO60267-281-HLA-DRB4*0101/DRA, RO60178-192-HLA-DRB4*0101/DRA, RO60358-372-HLA-DRB5*0101/DRA, RO60358-372-HLA-DRB4*0101/DRA, RO60221-235-HLA-DRB5*0101/DRA, RO60221-235-HLA-DRB4*0101/DRA, RO60318-332-HLA-DRB5*0101/DRA, RO60318-332-HLA-DRB4*0101/DRA, RO60407-421-HLA-DRB4*0101/DRA, RO60407-421-HLA-DQA1*0501/HLA-DQB1*0201, RO60459-473-HLA-DRB4*0101/DRA, RO60459-473-HLA-DQA1*0501/HLA-DQB1*0201, RO60318-332-HLA-DQA1*0501/HLA-DQB1*0201, RO6051-65-HLA-DRB3*0202/DRA, RO60312-326-HLA-DRB3*0202/DRA, RO60347-361-HLA-DRB3*0202/DRA, LA241-255-HLA-DRB1*0301/DRA, LA101-115-HLA-DRB1*0301/DRA, LA153-167-HLA-DRB1*0301/DRA, LA178-192-HLA-DRB3*0101/DRA, LA19-33-HLA-DRB3*0101/DRA, LA37-51-HLA-DRB3*0101/DRA, LA133-147-HLA-DRB4*0101/DRA, LA50-64-HLA-DRB4*0101/DRA, LA32-46-HLA-DRB4*0101/DRA, LA153-167-HLA-DRB5*0101/DRA, LA83-97-HLA-DRB5*0101/DRA, LA136-150-HLA-DRB5*0101/DRA, LA297-311-HLA-DQA1*0501/HLA-DQB1*0201, LA59-73-HLA-DQA1*0501/HLA-DQB1*0201, LA59-73-HLA-DRB4*0101/DRA, LA151-165-HLA-DQA1*0501/HLA-DQB1*0201, LA151-165-HLA-DRB4*0101/DRA, LA297-311-HLA-DRB4*0101/DRA, LA50-64-HLA-DRB3*0202/DRA, LA86-100-HLA-DRB3*0202/DRA или LA154-168-HLA-DRB3*0202/DRA;
n) склеродермии, и комплекс pMHC выбирают из группы: TOP1346-360-HLA-DRB3*0101/DRA, TOP1420-434-HLA-DRB3*0101/DRA, TOP1750-764-HLA-DRB3*0101/DRA, TOP1419-433-HLA-DRB4*0101/DRA, TOP1591-605-HLA-DRB4*0101/DRA, TOP1695-709-HLA-DRB4*0101/DRA, TOP1305-319-HLA-DRB5*0101/DRA, TOP1346-360-HLA-DRB5*0101/DRA, TOP1419-433-HLA-DRB5*0101/DRA, TOP1420-434-HLA-DRB3*0202/DRA, TOP1425-439-HLA-DRB3*0202/DRA, TOP1614-628-HLA-DRB3*0202/DRA, CENP-C297-311-HLA-DRB3*0101/DRA, CENP-C857-871-HLA-DRB3*0101/DRA, CENP-C887-901-HLA-DRB3*0101/DRA, CENP-C212-226-HLA-DRB4*0101/DRA, CENP-C643-657-HLA-DRB4*0101/DRA, CENP-C832-846-HLA-DRB4*0101/DRA, CENP-C167-181-HLA-DRB5*0101/DRA, CENP-C246-260-HLA-DRB5*0101/DRA, CENP-C846-860-HLA-DRB5*0101/DRA, CENP-C149-163-HLA-DRB3*0202/DRA, CENP-C833-847-HLA-DRB3*0202/DRA или CENP-C847-861-HLA-DRB3*0202/DRA;
o) антифосфолипидного синдрома, и комплекс pMHC выбирают из группы: APOH235-249-HLA-DRB3*0101/DRA, APOH306-320-HLA-DRB3*0101/DRA, APOH237-251-HLA-DRB3*0101/DRA, APOH295-309-HLA-DRB3*0101/DRA, APOH28-42-HLA-DRB4*0101/DRA, APOH173-187-HLA-DRB4*0101/DRA, APOH264-278-HLA-DRB4*0101/DRA, APOH295-309-HLA-DRB4*0101/DRA, APOH49-63-HLA-DRB5*0101/DRA, APOH269-283-HLA-DRB5*0101/DRA, APOH295-309-HLA-DRB5*0101/DRA, APOH321-355-HLA-DRB3*0202/DRA, APOH322-336-HLA-DRB3*0202/DRA или APOH324-338-HLA-DRB3*0202/DRA;
p) ANCA-ассоциированного васкулита, и комплекс pMHC выбирают из группы: MPO506-520-HLA-DRB3*0101/DRA, MPO302-316-HLA-DRB3*0101/DRA, MPO7-21-HLA-DRB3*0101/DRA, MPO689-703-HLA-DRB4*0101/DRA, MPO248-262-HLA-DRB4*0101/DRA, MPO444-458-HLA-DRB4*0101/DRA, MPO513-527-HLA-DRB5*0101/DRA, MPO97-111-HLA-DRB5*0101/DRA, MPO616-630-HLA-DRB5*0101/DRA, MPO462-476-HLA-DRB3*0202/DRA, MPO617-631-HLA-DRB3*0202/DRA, MPO714-728-HLA-DRB3*0202/DRA, PRTN344-58-HLA-DRB3*0101/DRA, PRTN3234-248-HLA-DRB3*0101/DRA, PRTN359-73-HLA DRB3*0101/DRA, PRTN359-73-HLA-DRB5*0101/DRA, PRTN3117-131-HLA-DRB4*0101/DRA, PRTN3164-178-HLA-DRB4*0101/DRA, PRTN371-85-HLA-DRB4*0101/DRA, PRTN3241-255-HLA-DRB5*0101/DRA, PRTN3183-197-HLA-DRB5*0101/DRA, PRTN362-76-HLA-DRB3*0202/DRA, PRTN3118-132-HLA-DRB3*0202/DRA или PRTN3239-253-HLA-DRB3*0202/DRA, или
q) синдрома мышечной скованности, и комплекс pMHC выбирают из группы: GAD212-226-HLA-DRB1*0801/DRA, GAD555-569-HLA-DRB1*0801/DRA или GAD297-311-HLA-DRB1*0301/DRA.
[0178] Согласно некоторым аспектам комплекс pMHC предназначен для лечения:
а) сахарного диабета I типа, и комплекс pMHC выбирают из группы: PPI76-90(K88S)-HLA-DRB1*0401/DRA, IGRP13-25-HLA-DRB1*0301/DRA, GAD555-567-HLA-DRB1*0401/DRA, GAD555-567(557I)-HLA-DRB1*0401/DRA, IGRP23-35-HLA-DRB1*0401/DRA или PPI76-90-HLA-DRB1*0401/DRA;
b) рассеянного склероза, и комплекс pMHC выбирают из группы: MBP86-98-HLA-DRB1*1501/DRA, MBP89-101-HLA-DRB5*0101/DRA, MOG38-52-HLA-DRB4*0101/DRA, MOG97-109(E107S)-HLA-DRB1*0401/DRA, MOG203-217-HLA-DRB3*0101/DRA, PLP54-68-HLA-DRB3*0101/DRA, PLP94-108-HLA-DRB1*0301/DRA, PLP250-264-HLA-DRB4*0101/DRA, MPB13-32-HLA-DRB5*0101/DRA, MPB83-99-HLA-DRB5*0101/DRA, MPB111-129-HLA-DRB5*0101/DRA, MPB146-170-HLA-DRB5*0101/DRA, MOG223-237-HLA-DRB3*0202/DRA, MOG6-20-HLA-DRB5*0101/DRA, PLP88-102-HLA-DRB3*0202/DRA или PLP139-154-HLA-DRB5*0101/DRA;
c) глютеиновой болезни, и комплекс pMHC выбирают из группы: aGlia57-68- HLA-DQA1*0501/HLA-DQB1*0201, aGlia62-72- HLA-DQA1*0501/HLA-DQB1*0201 или aGlia217-229- HLA-DQA1*0501/HLA-DQB1*0302;
d) первичного билиарного цирроза, и комплекс pMHC выбирают из группы: PDC-E2122-135-HLA-DRB4*0101/DRA, PDC-E2249-262-HLA-DRB4*0101/DRA, PDC-E2249-263-HLA-DRB1*0801/DRA, PDC-E2629-643-HLA-DRB1*0801/DRA, PDC-E272-86-HLA-DRB3*0202/DRA, PDC-E2353-367-HLA-DRB3*0202/DRA, PDC-E2422-436-HLA-DRB3*0202/DRA, PDC-E2629-643-HLA-DRB4*0101/DRA, PDC-E280-94-HLA-DRB5*0101/DRA, PDC-E2353-367-HLA-DRB5*0101/DRA или PDC-E2535-549-HLA-DRB5*0101/DRA;
e) пузырчатки листовидной и/или пузырчатки обыкновенной, и комплекс pMHC выбирают из группы: DG1216-229-HLA-DRB1*0101/DRA, DG397-111-HLA-DRB1*0402/DRA, DG3251-265-HLA-DRB1*0401/DRA, DG3441-455-HLA-DRB1*0402/DRA, DG3351-365-HLA-DRB3*0202/DRA, DG3453-467-HLA-DRB3*0202/DRA, DG3540-554-HLA-DRB3*0202/DRA, DG3280-294-HLA-DRB4*0101/DRA, DG3326-340-HLA-DRB4*0101/DRA, DG3367-381-HLA-DRB4*0101/DRA, DG313-27-HLA-DRB5*0101/DRA, DG3323-337-HLA-DRB5*0101/DRA, DG3438-452-HLA-DRB5*0101/DRA, DG148-62-HLA-DRB3*0202/DRA, DG1206-222-HLA-DRB3*0202/DRA, DG1363-377-HLA-DRB3*0202/DRA, DG13-17-HLA-DRB4*0101/DRA, DG1192-206-HLA-DRB4*0101/DRA, DG1326-340-HLA-DRB4*0101/DRA, DG11-15-HLA-DRB5*0101/DRA, DG135-49-HLA-DRB5*0101/DRA или DG1325-339-HLA-DRB5*0101/DRA;
f) нейромиелита зрительного нерва со спектральным расстройством, и комплекс pMHC выбирают из группы: AQP4284-298-HLA-DRB1*0301/DRA, AQP463-76-HLA-DRB1*0301/DRA, AQP4129-143-HLA-DRB1*0401/DRA или AQP439-53-HLA-DRB1*1501/DRA;
g) аллергической астмы, и комплекс pMHC выбирают из группы: DERP-116-30-HLA-DRB1*0101/DRA, DERP-116-30 -HLA-DRB1*1501/DRA, DERP1171-185 - HLA-DRB1*1501/DRA, DERP-1110-124 -HLA-DPB1*0401/DRA, DERP-226-40 -HLA-DRB1*0101/DRA; DERP-226-40-HLA-DRB1*1501/DRA или DERP-2107-121-HLA-DRB1*0301/DRA;
h) воспалительного заболевания кишечника, и комплекс pMHC выбирают из группы: антиген интегразы бактероидов1-15 - HLA-DRB5*0101/DRA, антиген интегразы бактероидов183-197-HLA-DRB3*0101/DRA, антиген интегразы бактероидов70-84- HLA-DRB4*0101/DRA, антиген интегразы бактероидов4-18-HLA-DRB3*0202/DRA, антиген интегразы бактероидов171-185-HLA-DRB3*0202/DRA, антиген интегразы бактероидов256-270-HLA-DRB3*0202/DRA, Fla-2/Fla-X366-380- HLA-DRB3*0101/DRA, Fla-2/Fla-X261-275- HLA-DRB5*0101/DRA, Fla-2/Fla-X51-65- HLA-DRB4*0101/DRA, Fla-2/Fla-X4-18-HLA-DRB3*0202/DRA, Fla-2/Fla-X261-275-HLA-DRB3*0202/DRA, Fla-2/Fla-X271-285-HLA-DRB3*0202/DRA, YIDX78-92-HLA-DRB3*0101/DRA, YIDX78-92- HLA-DRB4*0101/DRA, YIDX98-112- HLA-DRB5*0101/DRA, YIDX22-36-HLA-DRB3*0202/DRA, YIDX80-94-HLA-DRB3*0202/DRA или YIDX101-115-HLA-DRB3*0202/DRA;
i) эмфиземы, и комплекс pMHC выбирают из группы: эластин89-103-HLA-DRB3*0101/DRA, эластин698-712-HLA-DRB5*0101/DRA, эластин558-572-HLA-DRB4*0101/DRA, эластин566-580-HLA-DRB3*0202/DRA или эластин645-659-HLA-DRB3*0202/DRA;
j) псориаза, и комплекс pMHC выбирают из группы: Cap1864-78-HLA-DRB3*0101/DRA, Cap1834-48-HLA-DRB3*0101/DRA, Cap1847-61-HLA-DRB3*0101/DRA, Cap18151-165-HLA -DRB4*0101/DRA, Cap18149-163-HLA-DRB5*0101/DRA, Cap18152-166-HLA-DRB5*0101/DRA, Cap18131-145-HLA-DRB5*0101/DRA, Cap1824-38-HLA-DRB3*0202/DRA, ADMTSL5245-259-HLA-DRB3*0101/DRA, ADMTSL5267-281-HLA-DRB3*0101/DRA, ADMTSL5372-386-HLA-DRB3*0101/DRA, ADMTSL5289-303-HLA-DRB4*0101/DRA, ADMTSL5396-410-HLA-DRB4*0101/DRA, ADMTSL5433-447-HLA-DRB4*0101/DRA, ADMTSL5142-156-HLA-DRB5*0101/DRA, ADMTSL5236-250-HLA-DRB5*0101/DRA, ADMTSL5301-315-HLA-DRB5*0101/DRA, ADMTSL5203-217-HLA-DRB3*0202/DRA, ADMTSL5404-418-HLA-DRB3*0202/DRA или ADMTSL5433-447-HLA-DRB3*0202/DRA;
k) аутоиммунного гепатита, и комплекс pMHC выбирают из группы: CYP2D6193-207-HLA-DRB1*0301/DRA, CYP2D676-90-HLA-DRB1*0301/DRA, CYP2D6293-307-HLA-DRB1*0301/DRA, CYP2D6313-332-HLA-DRB1*0301/DRA, CYP2D6393-412-HLA-DRB1*0301/DRA, CYP2D6199-213-HLA-DRB1*0401/DRA, CYP2D6450-464-HLA-DRB1*0401/DRA, CYP2D6301-315-HLA-DRB1*0401/DRA, CYP2D6452-466-HLA-DRB1*0701/DRA, CYP2D659-73-HLA-DRB1*0701/DRA, CYP2D6130-144-HLA-DRB1*0701/DRA, CYP2D6193-212-HLA-DRB1*0701/DRA, CYP2D6305-324-HLA-DRB1*0701/DRA, CYP2D6131-145-HLA-DRB3*0202/DRA, CYP2D6216-230-HLA-DRB3*0202/DRA, CYP2D6238-252-HLA-DRB3*0202/DRA, CYP2D6199-213-HLA-DRB4*0101/DRA, CYP2D6235-252-HLA-DRB4*0101/DRA, CYP2D6293-307-HLA-DRB4*0101/DRA, CYP2D6238-252-HLA-DRB5*0101/DRA, CYP2D6381-395-HLA-DRB5*0101/DRA, CYP2D6429-443-HLA-DRB5*0101/DRA, SLA334-348-HLA-DRB1*0301/DRA, SLA196-210-HLA-DRB1*0301/DRA, SLA115-129-HLA-DRB1*0301/DRA, SLA373-386-HLA-DRB1*0301/DRA, SLA186-197-HLA-DRB1*0301/DRA, SLA317-331-HLA-DRB1*0401/DRA, SLA171-185-HLA-DRB1*0401/DRA, SLA417-431-HLA-DRB1*0401/DRA, SLA359-373-HLA-DRB1*0701/DRA, SLA215-229-HLA-DRB1*0701/DRA, SLA111-125-HLA-DRB1*0701/DRA, SLA110-124-HLA-DRB3*0202/DRA, SLA299-313-HLA-DRB3*0202/DRA, SLA342-356-HLA-DRB3*0202/DRA, SLA49-63-HLA-DRB4*0101/DRA, SLA119-133-HLA-DRB4*0101/DRA, SLA260-274-HLA-DRB4*0101/DRA, SLA26-40-HLA-DRB5*0101/DRA, SLA86-100-HLA-DRB5*0101/DRA или SLA331-345-HLA-DRB5*0101/DRA;
l) увеита, и комплекс pMHC выбирают из группы: аррестин199-213-HLA-DRB3*0101/DRA, аррестин77-91-HLA-DRB3*0101/DRA, аррестин250-264-HLA-DRB3*0101/DRA, аррестин172-186-HLA-DRB4*0101/DRA, аррестин354-368-HLA-DRB4*0101/DRA, аррестин239-253-HLA-DRB4*0101/DRA, аррестин102-116-HLA-DRB5*0101/DRA, аррестин59-73-HLA-DRB5*0101, аррестин280-294-HLA-DRB5*0101, аррестин291-306-HLA-DRB1*0301/DRA, аррестин195-209-HLA-DRB3*0202/DRA, аррестин199-213-HLA-DRB3*0202/DRA или аррестин200-214-HLA-DRB3*0202/DRA;
m) синдрома Шегрена, и комплекс pMHC выбирают из группы: RO60127-141-HLA-DRB1*0301/DRA, RO60523-537-HLA-DRB1*0301/DRA, RO60243-257-HLA-DRB1*0301/DRA, RO60484-498-HLA-DRB3*0101/DRA, RO60347-361-HLA-DRB3*0101/DRA, RO60369-383-HLA-DRB3*0101/DRA, RO60426-440-HLA-DRB4*0101/DRA, RO60267-281-HLA-DRB4*0101/DRA, RO60178-192-HLA-DRB4*0101/DRA, RO60358-372-HLA-DRB5*0101/DRA, RO60221-235-HLA-DRB5*0101/DRA, RO60318-332-HLA-DRB5*0101/DRA, RO6051-65-HLA-DRB3*0202/DRA, RO60312-326-HLA-DRB3*0202/DRA, RO60347-361-HLA-DRB3*0202/DRA, LA241-255-HLA-DRB1*0301/DRA, LA101-115-HLA-DRB1*0301/DRA, LA153-167-HLA-DRB1*0301/DRA, LA178-192-HLA-DRB3*0101/DRA, LA19-33-HLA-DRB3*0101/DRA, LA37-51-HLA-DRB3*0101/DRA, LA133-147-HLA-DRB4*0101/DRA, LA50-64-HLA-DRB4*0101/DRA, LA32-46-HLA-DRB4*0101/DRA, LA153-167-HLA-DRB5*0101/DRA, LA83-97-HLA-DRB5*0101/DRA, LA136-150-HLA-DRB5*0101/DRA, LA50-64-HLA-DRB3*0202/DRA, LA86-100-HLA-DRB3*0202/DRA или LA154-168-HLA-DRB3*0202/DRA;
n) склеродермии, и комплекс pMHC выбирают из группы: TOP1346-360-HLA-DRB3*0101/DRA, TOP1420-434-HLA-DRB3*0101/DRA, TOP1750-764-HLA-DRB3*0101/DRA, TOP1419-433-HLA-DRB4*0101/DRA, TOP1591-605-HLA-DRB4*0101/DRA, TOP1695-709-HLA-DRB4*0101/DRA, TOP1305-319-HLA-DRB5*0101/DRA, TOP1346-360-HLA-DRB5*0101/DRA, TOP1419-433-HLA-DRB5*0101/DRA, TOP1420-434-HLA-DRB3*0202/DRA, TOP1425-439-HLA-DRB3*0202/DRA, TOP1614-628-HLA-DRB3*0202/DRA, CENP-C297-311-HLA-DRB3*0101/DRA, CENP-C857-871-HLA-DRB3*0101, CENP-C887-901-HLA-DRB3*0101, CENP-C212-226-HLA-DRB4*0101/DRA, CENP-C643-657-HLA-DRB4*0101/DRA, CENP-C832-846-HLA-DRB4*0101/DRA, CENP-C167-181-HLA-DRB5*0101/DRA, CENP-C246-260-HLA-DRB5*0101/DRA, CENP-C846-860-HLA-DRB5*0101/DRA, CENP-C149-163-HLA-DRB3*0202/DRA, CENP-C833-847-HLA-DRB3*0202/DRA или CENP-C847-861-HLA-DRB3*0202/DRA;
o) антифосфолипидного синдрома, и комплекс pMHC выбирают из группы: APOH235-249-HLA-DRB3*0101/DRA, APOH306-320-HLA-DRB3*0101/DRA, APOH237-251-HLA-DRB3*0101/DRA, APOH295-309-HLA-DRB3*0101/DRA, APOH28-42-HLA-DRB4*0101/DRA, APOH173-187-HLA-DRB4*0101/DRA, APOH264-278-HLA-DRB4*0101/DRA, APOH295-309-HLA-DRB4*0101/DRA, APOH49-63-HLA-DRB5*0101/DRA, APOH269-283-HLA-DRB5*0101/DRA, APOH295-309-HLA-DRB5*0101/DRA, APOH321-355-HLA-DRB3*0202/DRA, APOH322-336-HLA-DRB3*0202/DRA или APOH324-338-HLA-DRB3*0202/DRA;
p) ANCA-ассоциированного васкулита, и комплекс pMHC выбирают из группы: MPO506-520-HLA-DRB3*0101/DRA, MPO302-316-HLA-DRB3*0101/DRA, MPO7-21-HLA-DRB3*0101/DRA, MPO689-703-HLA-DRB4*0101/DRA, MPO248-262-HLA-DRB4*0101/DRA, MPO444-458-HLA-DRB4*0101/DRA, MPO513-527-HLA-DRB5*0101/DRA, MPO97-111-HLA-DRB5*0101/DRA, MPO616-630-HLA-DRB5*0101/DRA, MPO462-476-HLA-DRB3*0202/DRA, MPO617-631-HLA-DRB3*0202/DRA, MPO714-728-HLA-DRB3*0202/DRA, PRTN344-58-HLA-DRB3*0101/DRA, PRTN3234-248-HLA-DRB3*0101/DRA, PRTN359-73-HLA DRB3*0101/DRA, PRTN359-73-HLA-DRB5*0101/DRA, PRTN3117-131-HLA-DRB4*0101/DRA, PRTN3164-178-HLA-DRB4*0101/DRA, PRTN371-85-HLA-DRB4*0101/DRA, PRTN3241-255-HLA-DRB5*0101/DRA, PRTN3183-197-HLA-DRB5*0101/DRA, PRTN362-76-HLA-DRB3*0202/DRA, PRTN3118-132-HLA-DRB3*0202/DRA или PRTN3239-253-HLA-DRB3*0202/DRA или
q) синдрома мышечной скованности, и комплекс pMHC выбирают из группы: GAD212-226-HLA-DRB1*0801/DRA, GAD555-569-HLA-DRB1*0801/DRA, or GAD297-311-HLA-DRB1*0301/DRA.
[0179] Выбор костимулирующей молекулы или молекул, которые должны быть связаны с комплексом pMHC/NP, также может быть оптимизирован аналогичным образом и будет в значительной степени зависеть от природы популяции иммунных клеток, нуждающихся в дифференцировке или увеличении количества. Например, если целью является увеличение количества или дифференциация популяций Т-регуляторных клеток, соответствующие комбинации могут включать в себя, без ограничения, костимулирующие молекулы и цитокины, такие как IL15-IL15Ra, IL-2, IL-10, IL-35, ICOS-L, комплекс IL2/моноклональное антитело к IL2, TGF-бета, IL-21, ITE или ICOSL. Напротив, согласно определенным вариантам осуществления, таких как при определенных типах рака, увеличение количества и/или дифференцировка T-регуляторного фенотипа может не быть желаемой реакцией. Таким образом, альтернативные костимулирующие молекулы и цитокины будут оптимизированы для конкретного лечения.
Полипептиды
[0180] Согласно другому аспекту в настоящем документе предусмотрены полипептиды, содержащие домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию и по меньшей мере один сконструированный выступ. Согласно некоторым вариантам осуществления домен α1 МНС класса II и домен α2 МНС класса II получены из молекулы лейкоцитарного антигена (HLA), такой как HLA-DR, HLA-DQ или HLA-DP. Согласно некоторым вариантам осуществления домен α1 MHC класса II и домен α2 MHC класса II получены из DRA, DQA1 или DPA1. Согласно некоторым вариантам осуществления домен α1 MHC класса II или домен α2 MHC класса II получены из DRA, DQA1 или DPA1.
[0181] Согласно другому аспекту в настоящем документе предусмотрены полипептиды, содержащие домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию и по меньшей мере один сконструированный выступ. Согласно некоторым вариантам осуществления домен β1 МНС класса II и домен β2 МНС класса II получены из молекулы лейкоцитарного антигена (HLA), такой как HLA-DR, HLA-DQ или HLA-DP. Согласно некоторым вариантам осуществления домен β1 MHC класса II и β2 MHC класса II получены из HLA-DRB1, HLA-DRB3, HLA-DRB4, HLA-DRB5, HLA-DQB1 или HLA-DPB1. Согласно некоторым вариантам осуществления домен β1 MHC класса II или β2 MHC класса II получены из HLA-DRB1, HLA-DRB3, HLA-DRB4, HLA-DRB5, HLA-DQB1 или HLA-DPB1.
[0182] Согласно другому аспекту в настоящем документе предусмотрены полипептиды, содержащие домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию и по меньшей мере одну сконструированную полость.
[0183] Согласно другому аспекту в настоящем документе предусмотрены полипептиды, содержащие домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию и по меньшей мере одну сконструированную полость.
[0184] Согласно другому аспекту в настоящем документе предусмотрены полипептиды, содержащие домен α1 МНС класса II и домен α2 МНС класса II и по меньшей мере один сконструированный выступ.
[0185] Согласно другому аспекту в настоящем документе предусмотрены полипептиды, содержащие домен β1 МНС класса II и домен β2 МНС класса II и по меньшей мере один сконструированный выступ.
[0186] Согласно другому аспекту в настоящем документе предусмотрены полипептиды, содержащие домен α1 МНС класса II и домен α2 МНС класса II и по меньшей мере одну сконструированную полость.
[0187] Согласно другому аспекту в настоящем документе предусмотрены полипептиды, содержащие домен β1 МНС класса II и домен β2 МНС класса II и по меньшей мере одну сконструированную полость.
[0188] Согласно некоторым вариантам осуществления полипептид дополнительно содержит C-концевой остаток цистеина. Согласно некоторым вариантам осуществления полипептид дополнительно содержит сайт биотинилирования. Согласно некоторым вариантам осуществления полипептид дополнительно содержит метку Strep.
[0189] Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид кодируется последовательностью ДНК, содержащей любую из SEQ ID NO: 1-26, 64 или 65. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей SEQ ID NO: 1. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей SEQ ID NO: 2. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей SEQ ID NO: 3. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей SEQ ID NO: 4. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей SEQ ID NO: 25. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей SEQ ID NO: 26.
[0190] Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид кодируется любой из SEQ ID NO: 1-8. Согласно некоторым вариантам осуществления полипептид кодируется SEQ ID NO: 1. Согласно некоторым вариантам осуществления полипептид кодируется SEQ ID NO: 2. Согласно некоторым вариантам осуществления полипептид кодируется SEQ ID NO: 3. Согласно некоторым вариантам осуществления полипептид кодируется SEQ ID NO: 4. Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид кодируется любой из SEQ ID NOS: 5-6. Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид кодируется любой из SEQ ID NO: 5-8.
[0191] Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 80% по отношению к любой из SEQ ID NO: 1-26, 64 или 65. Это включает идентичность по меньшей мере 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к любой из SEQ ID NO: 1-8. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к любой из SEQ ID NO: 1-26, 64 или 65. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к SEQ ID NO: 1. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к SEQ ID NO: 2. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к SEQ ID NO: 3. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к SEQ ID NO: 4. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к любой из SEQ ID NO: 5-6. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к любой из SEQ ID NO: 5-8.
[0192] Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 85% по отношению к любой из SEQ ID NO: 1-26, 64 или 65. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 85% по отношению к SEQ ID NO: 1. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 85% по отношению к SEQ ID NO: 2. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 85% по отношению к SEQ ID NO: 3. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 85% по отношению к SEQ ID NO: 4. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 85% по отношению к любой из SEQ ID NO: 5-6. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 85% по отношению к любой из SEQ ID NO: 5-8.
[0193] Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 90% по отношению к любой из SEQ ID NO: 1-26, 64 или 65. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 90% по отношению к SEQ ID NO: 1. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 90% по отношению к SEQ ID NO: 2. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 90% по отношению к SEQ ID NO: 3. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 90% по отношению к SEQ ID NO: 4. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 90% по отношению к любой из SEQ ID NO: 5-6. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 90% по отношению к любой из SEQ ID NO: 5-8.
[0194] Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 95% по отношению к любой из SEQ ID NO: 1-26, 64 или 65. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 95% по отношению к SEQ ID NO: 1. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 95% по отношению к SEQ ID NO: 2. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 95% по отношению к SEQ ID NO: 3. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 95% по отношению к SEQ ID NO: 4. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 95% по отношению к любой из SEQ ID NO: 5-6. Согласно некоторым вариантам осуществления полипептид кодируется последовательностью ДНК, содержащей последовательность ДНК с идентичностью по меньшей мере 95% по отношению к любой из SEQ ID NO: 5-8.
[0195] Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид представляет собой полипептид, содержащий аминокислотную последовательность любой из SEQ ID NO: 27-63 или ее фрагмент. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность SEQ ID NO: 35-50 или ее фрагмент. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность SEQ ID NO: 51 или ее фрагмент. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность SEQ ID NO: 52 или ее фрагмент. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность SEQ ID NO: 53 или ее фрагмент. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность SEQ ID NO: 54 или ее фрагмент. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность SEQ ID NO: 55-59 или ее фрагмент. Используемый в настоящем документе «фрагмент» аминокислотной последовательности или полипептида содержит по меньшей мере 5 аминокислот. Согласно некоторым вариантам осуществления фрагмент содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию. Согласно некоторым вариантам осуществления фрагмент содержит домен α1 MHC класса II, домен α2 MHC класса II, описанный в настоящем документе сконструированный выступ или любую их комбинацию. Согласно некоторым вариантам осуществления фрагмент содержит домен α1 MHC класса II, домен α2 MHC класса II, описанную в настоящем документе сконструированную полость или любую их комбинацию. Согласно некоторым вариантам осуществления фрагмент содержит домен β1 MHC класса II, домен β2 MHC класса II, описанный в настоящем документе сконструированный выступ или любую их комбинацию. Согласно некоторым вариантам осуществления фрагмент содержит домен β1 MHC класса II, домен β2 MHC класса II, описанную в настоящем документе сконструированную полость или любую их комбинацию.
[0196] Согласно некоторым вариантам осуществления фрагмент содержит домен α1 MHC класса II, домен α2 MHC класса II и описанный в настоящем документе сконструированный выступ. Согласно некоторым вариантам осуществления фрагмент содержит домен α1 MHC класса II, домен α2 MHC класса II и описанную в настоящем документе сконструированную полость. Согласно некоторым вариантам осуществления фрагмент содержит домен β1 MHC класса II, домен β2 MHC класса II и описанный в настоящем документе сконструированный выступ. Согласно некоторым вариантам осуществления фрагмент содержит домен β1 МНС класса II, домен β2 МНС класса II и описанную в настоящем документе сконструированную полость.
[0197] Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 80% по отношению к аминокислотной последовательности любой из SEQ ID NO: 27-63 или ее фрагменту. Это включает в себя идентичность по меньшей мере 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к любой из SEQ ID NO: 27-63. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к аминокислотной последовательности любой из SEQ ID NO: 35-50 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к аминокислотной последовательности SEQ ID NO: 51 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к аминокислотной последовательности SEQ ID NO: 52 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к аминокислотной последовательности SEQ ID NO: 53 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к аминокислотной последовательности SEQ ID NO: 54 или ее фрагменту. Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к аминокислотной последовательности любой из SEQ ID NO: 55-59 или ее фрагменту.
[0198]Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 85% по отношению к аминокислотной последовательности любой из SEQ ID NO: 27-63 или ее фрагменту. Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 85% по отношению к аминокислотной последовательности любой из SEQ ID NO: 35-50 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 85% по отношению к аминокислотной последовательности SEQ ID NO: 51 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 85% по отношению к аминокислотной последовательности SEQ ID NO: 52 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 85% по отношению к аминокислотной последовательности SEQ ID NO: 53 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 85% по отношению к аминокислотной последовательности SEQ ID NO: 54 или ее фрагменту. Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 85% по отношению к аминокислотной последовательности любой из SEQ ID NO: 55-59 или ее фрагменту.
[0199] Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 90% по отношению к аминокислотной последовательности любой из SEQ ID NO: 27-63 или ее фрагменту. Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 90% по отношению к аминокислотной последовательности любой из SEQ ID NO: 35-50 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 90% по отношению к аминокислотной последовательностью SEQ ID NO: 51 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 90% по отношению к аминокислотной последовательности SEQ ID NO: 52 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 90% по отношению к аминокислотной последовательности SEQ ID NO: 53 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 90% по отношению к аминокислотной последовательности SEQ ID NO: 54 или ее фрагменту. Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 90% по отношению к аминокислотной последовательности любой из SEQ ID NO: 55-59 или ее фрагменту.
[0200] Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 95% по отношению к аминокислотной последовательности любой из SEQ ID NO: 27-63 или ее фрагменту. Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 95% по отношению к аминокислотной последовательности любой из SEQ ID NO: 35-50 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 95% по отношению к аминокислотной последовательности SEQ ID NO: 51 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с по идентичностью меньшей мере 95% по отношению к аминокислотной последовательности SEQ ID NO: 52 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 95% по отношению к аминокислотной последовательности SEQ ID NO: 53 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 95% по отношению к аминокислотной последовательности SEQ ID NO: 54 или ее фрагменту. Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 95% по отношению к аминокислотной последовательности любой из SEQ ID NO: 55-59 или ее фрагменту.
[0201] Согласно некоторым вариантам осуществления предусмотренный в настоящем документе полипептид представляет собой полипептид, содержащий аминокислотную последовательность любой из SEQ ID NO: 60-61 или ее фрагменту. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность с идентичностью по меньшей мере 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к аминокислотной последовательности любой из SEQ ID NO: 60-61 или ее фрагменту.
[0202] Согласно некоторым вариантам осуществления четыре или более описанных в настоящем документе полипептидов ковалентно присоединены к остову полимера с образованием мультимера. Согласно некоторым вариантам осуществления полимерный остов представляет собой декстран или полиэтиленгликоль. Согласно некоторым вариантам осуществления каждый из полипептидов присоединен к полимерному остову через концевой остаток цистеина на каждом из полипептидов. Согласно некоторым вариантам осуществления каждый из полипептидов присоединен к полимерному остову через сайт биотинилирования на каждом из полипептидов.
[0203] Согласно некоторым вариантам осуществления четыре или более полипептидов ковалентно присоединены к авидину с образованием мультимера.
Выступ и/или полость
[0204] Согласно некоторым вариантам осуществления полипептид содержит сконструированный выступ. Согласно некоторым вариантам осуществления выступ содержит один или несколько не встречающихся в природе аминокислотных остатков. Согласно некоторым вариантам осуществления выступ содержит один или несколько встречающихся в природе аминокислотных остатков. Согласно некоторым вариантам осуществления выступ содержит одну или несколько аминокислот, выбранных из фенилаланина, аргинина, тирозина, триптофана и цистеина. Согласно некоторым вариантам осуществления выступ содержит остаток фенилаланина. Согласно некоторым вариантам осуществления выступ содержит остаток аргинина. Согласно некоторым вариантам осуществления выступ содержит остаток тирозина. Согласно некоторым вариантам осуществления выступ содержит остаток триптофана. Согласно некоторым вариантам осуществления выступ содержит остаток цистеина. Согласно некоторым вариантам осуществления выступ содержит остаток цистеина и остаток триптофана.
[0205] Согласно некоторым вариантам осуществления полипептид содержит сконструированную полость. Согласно некоторым вариантам осуществления полость содержит один или несколько не встречающихся в природе аминокислотных остатков. Согласно некоторым вариантам осуществления полость содержит один или несколько встречающихся в природе аминокислотных остатков. Согласно некоторым вариантам осуществления полость содержит одну или несколько аминокислот, выбранных из аланина, серина, треонина, валина и цистеина. Согласно некоторым вариантам осуществления полость содержит остаток аланина. Согласно некоторым вариантам осуществления полость содержит остаток серина. Согласно некоторым вариантам осуществления полость содержит остаток треонина. Согласно некоторым вариантам осуществления полость содержит остаток валина. Согласно некоторым вариантам осуществления полость содержит остаток цистеина. Согласно некоторым вариантам осуществления полость содержит остаток цистеина, остаток серина, остаток аланина и остаток валина.
[0206] Согласно некоторым вариантам осуществления выступ или полость не расположены в домене МНС класса II на полипептиде. Согласно некоторым вариантам осуществления выступ или полость расположены в константном домене СН3 антитела на полипептиде. Согласно некоторым вариантам осуществления выступ расположен в константном домене СН3 антитела на полипептиде. Согласно некоторым вариантам осуществления полость расположена в константном домене СН3 антитела на полипептиде.
[0207] Согласно некоторым вариантам осуществления полость содержит нуклеотидную последовательность с идентичностью по меньшей мере 80% по отношению к нуклеотидной последовательности, представленной в SEQ ID NO: 25. Согласно некоторым вариантам осуществления полость содержит нуклеотидную последовательность с идентичностью по меньшей мере 85% по отношению к нуклеотидной последовательности, представленной в SEQ ID NO: 25. Согласно некоторым вариантам осуществления полость содержит нуклеотидную последовательность с идентичностью по меньшей мере 90% по отношению к нуклеотидной последовательности, представленной в SEQ ID NO: 25. Согласно некоторым вариантам осуществления полость содержит нуклеотидную последовательность с идентичностью по меньшей мере 95% по отношению к нуклеотидной последовательности, представленной в SEQ ID NO: 25. Согласно некоторым вариантам осуществления полость содержит нуклеотидную последовательность с идентичностью по меньшей мере 98% по отношению к нуклеотидной последовательности, представленной в SEQ ID NO: 25. Согласно некоторым вариантам осуществления полость содержит нуклеотидную последовательность, представленную в SEQ ID NO: 25. Согласно некоторым вариантам осуществления полость содержит нуклеотидную последовательность с идентичностью по меньшей мере 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к нуклеотидной последовательностью, представленной в SEQ ID NO: 25.
[0208] Согласно определенным вариантам осуществления полость содержит аминокислотную последовательность с идентичностью по меньшей мере 80% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 51. Согласно определенным вариантам осуществления полость содержит аминокислотную последовательность с идентичностью по меньшей мере 85% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 51. Согласно определенным вариантам осуществления полость содержит аминокислотную последовательность с идентичностью по меньшей мере 90% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 51. Согласно определенным вариантам осуществления полость содержит аминокислотную последовательность с идентичностью по меньшей мере 95% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 51. Согласно определенным вариантам осуществления полость содержит аминокислотную последовательность с идентичностью по меньшей мере 98% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 51. Согласно определенным вариантам осуществления полость содержит аминокислотную последовательность, представленную в SEQ ID NO: 51. Согласно некоторым вариантам осуществления эта полость содержит нуклеотидную последовательность с идентичностью по меньшей мере 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 51.
[0209] Согласно определенным вариантам осуществления полость встроена в домен СН2 или СН3 молекулы иммуноглобулина. Согласно определенным вариантам осуществления полость встроена в домен СН3 молекулы иммуноглобулина. Согласно определенным вариантам осуществления полость встроена в домен СН3 молекулы иммуноглобулина и содержит аминокислотную последовательность с идентичностью аминокислотной последовательности по меньшей мере 80% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 52. Согласно определенным вариантам осуществления полость встроена в домен СН3 молекулы иммуноглобулина и содержит аминокислотную последовательность с идентичностью по меньшей мере 90% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 52. Согласно определенным вариантам осуществления полость встроена в домен СН3 молекулы иммуноглобулина и содержит аминокислотную последовательность с идентичностью по меньшей мере 95% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 52. Согласно определенным вариантам осуществления полость встроена в домен СН3 молекулы иммуноглобулина и содержит аминокислотную последовательность с идентичностью по меньшей мере 98% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 52. Согласно определенным вариантам осуществления полость встроена в домен CH3 молекулы иммуноглобулина и содержит аминокислотную последовательность, представленную в SEQ ID NO: 52. Согласно некоторым вариантам осуществления полость встроена в домен СН3 молекулы иммуноглобулина и содержит аминокислотную последовательность с идентичностью по меньшей мере 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 52.
[0210] Согласно определенным вариантам осуществления выступ содержит нуклеотидную последовательность с идентичностью по меньшей мере 80% по отношению к нуклеотидной последовательностью, представленной в SEQ ID NO: 26. Согласно определенным вариантам осуществления выступ содержит нуклеотидную последовательность с идентичностью по меньшей мере 80% по отношению к нуклеотидной последовательности, представленной в SEQ ID NO: 26. Согласно определенным вариантам осуществления выступ содержит нуклеотидную последовательность с идентичностью по меньшей мере 90% по отношению к нуклеотидной последовательности, представленной в SEQ ID NO: 26. Согласно определенным вариантам осуществления выступ содержит нуклеотидную последовательность с идентичностью по меньшей мере 95% по отношению к нуклеотидной последовательности, представленной в SEQ ID NO: 26. Согласно некоторым вариантам осуществления выступ содержит нуклеотидную последовательность с идентичностью по меньшей мере 98% по отношению к нуклеотидной последовательности, представленной в SEQ ID NO: 26. Согласно определенным вариантам осуществления выступ содержит нуклеотидную последовательность, представленную в SEQ ID NO: 26. Согласно некоторым вариантам осуществления выступ содержит нуклеотидную последовательность с идентичностью по меньшей мере 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к нуклеотидной последовательности, представленной в SEQ ID NO: 26.
[0211] Согласно определенным вариантам осуществления выступ содержит аминокислотную последовательность с идентичностью по меньшей мере 80% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 53. Согласно определенным вариантам осуществления выступ содержит аминокислотную последовательность с идентичностью по меньшей мере 80% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 53. Согласно определенным вариантам осуществления выступ содержит аминокислотную последовательность с идентичностью по меньшей мере 90% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 53. Согласно определенным вариантам осуществления выступ содержит аминокислотную последовательность с идентичностью по меньшей мере 95% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 53. Согласно определенным вариантам осуществления выступ содержит аминокислотную последовательность с идентичностью по меньшей мере 98% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 53. Согласно определенным вариантам осуществления выступ содержит аминокислотную последовательность, представленную в SEQ ID NO: 53. Согласно некоторым вариантам осуществления выступ содержит аминокислотную последовательность с идентичностью по меньшей мере 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 53.
[0212] Согласно определенным вариантам осуществления выступ встроен в домен СН2 или СН3 молекулы иммуноглобулина. Согласно определенным вариантам осуществления выступ встроен в домен СН3 молекулы иммуноглобулина. Согласно определенным вариантам осуществления выступ встроен в домен CH3 молекулы иммуноглобулина и содержит аминокислотную последовательность с идентичностью по меньшей мере 80% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 54. Согласно определенным вариантам осуществления выступ встроен в домен СН3 молекулы иммуноглобулина и содержит аминокислотную последовательность с идентичностью по меньшей мере 90% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 54. Согласно определенным вариантам осуществления выступ встроен в домен СН3 молекулы иммуноглобулина и содержит аминокислотную последовательность с идентичностью по меньшей мере 95% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 54. Согласно определенным вариантам осуществления выступ встроен в домен СН3 молекулы иммуноглобулина и содержит аминокислотную последовательность с идентичностью по меньшей мере 98% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 54. Согласно определенным вариантам осуществления выступ встроен в домен CH3 молекулы иммуноглобулина и содержит аминокислотную последовательность, представленную в SEQ ID NO: 54. Согласно некоторым вариантам осуществления выступ встроен в домен СН3 молекулы иммуноглобулина и содержит аминокислотную последовательность с идентичностью по меньшей мере 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% по отношению к аминокислотной последовательности, представленной в SEQ ID NO: 54.
[0213] Выступ и полость могут быть сконструированы путем специфической мутации в домене CH3 IgG1, слитого с альфа или бета доменом MHC класса II. Согласно определенным вариантам осуществления выступ содержит мутацию S354C (схема нумерации антител ЕU) в области CH3 молекулы IgG1. Согласно определенным вариантам осуществления выступ содержит мутацию T366W (схема нумерации антител ЕU) в области CH3 молекулы IgG1. Согласно определенным вариантам осуществления выступ содержит мутации S354C и T366W (схема нумерации антител ЕU) в области CH3 молекулы IgG1. Согласно определенным вариантам осуществления выступ содержит мутации S354C и T366W (схема нумерации антител ЕU) в области CH3 молекулы IgG1. Согласно определенным вариантам осуществления выступ состоит из мутации S354C и T366W (схема нумерации антител ЕU) в области CH3 молекулы IgG1. Согласно определенным вариантам осуществления полость содержит мутацию Y349C (схема нумерации антител ЕU) в области CH3 молекулы IgG1. Согласно определенным вариантам осуществления полость содержит мутацию T366S (схема нумерации антител ЕU) в области CH3 молекулы IgG1. Согласно определенным вариантам осуществления полость содержит мутацию L368A (схема нумерации антител ЕU) в области CH3 молекулы IgG1. Согласно определенным вариантам осуществления полость содержит мутацию Y407V (схема нумерации антител ЕU) в области CH3 молекулы IgG1. Согласно определенным вариантам осуществления полость содержит мутации Y349C, T366S, L368A и Y407V (схема нумерации антител ЕU) в области CH3 молекулы IgG1. Согласно определенным вариантам осуществления полость состоит из мутации Y349C, T366S, L368A и Y407V (схема нумерации антител ЕU) в области CH3 молекулы IgG1.
[0214] Согласно одному варианту осуществления выделенные гетеродимеры содержат по меньшей мере один первый полипептид и по меньшей мере один второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который устанавливается в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II, домен CH2 IgG и домен CH3 IgG, причем выступ образован мутациями в домене CH3 IgG, и (ii) второй полипептид содержит домен β1 МНС класса II, домен β2 МНС класса II, домен СН2 IgG и домен СН3 IgG, причем полость образована мутациями в домене СН3 IgG.
[0215] Согласно одному варианту осуществления выделенные гетеродимеры содержат по меньшей мере один первый полипептид и по меньшей мере один второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который устанавливается в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II, домен CH2 IgG и домен CH3 IgG, причем выступ образован мутациями в домене CH3 IgG; и (ii) второй полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II, домен CH2 IgG и домен CH3 IgG, причем полость образована мутациями в домене CH3 IgG.
[0216] Согласно одному варианту осуществления выделенные гетеродимеры содержат по меньшей мере один первый полипептид и по меньшей мере один второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который устанавливается в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II, домен CH2 IgG и домен CH3 IgG, причем выступ образован мутациями в домене CH3 IgG, соответствующими S354C и T366W (нумерация EU); и (ii) второй полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II, домен CH2 IgG и домен CH3 IgG, причем полость образована мутациями в домене CH3 IgG, соответствующими Y349C, T366S, L368A и Y407V (нумерация EU).
[0217] Согласно одному варианту осуществления выделенные гетеродимеры содержат по меньшей мере один первый полипептид и по меньшей мере один второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который устанавливается в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II, домен CH2 IgG и домен CH3 IgG, причем выступ образован мутациями в домене CH3 IgG, соответствующими S354C и T366W (нумерация EU); и (ii) второй полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II, домен CH2 IgG и домен CH3 IgG, причем полость образована мутациями в домене CH3 IgG, соответствующими Y349C, T366S, L368A и Y407V (нумерация EU).
[0218] Согласно одному варианту осуществления выделенные гетеродимеры содержат по меньшей мере один первый полипептид и по меньшей мере один второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который устанавливается в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид состоит из домена α1 MHC класса II, домена α2 MHC класса II, домена CH2 IgG и домена CH3 IgG, причем выступ образован мутациями в домене CH3 IgG, и (ii) второй полипептид состоит из домена β1 MHC класса II, домена β2 MHC класса II, домена CH2 IgG и домена CH3 IgG, причем полость образована мутациями в домене CH3 IgG.
[0219] Согласно одному варианту осуществления выделенные гетеродимеры содержат по меньшей мере один первый полипептид и по меньшей мере один второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который устанавливается в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид состоит из домена β1 MHC класса II, домена β2 MHC класса II, домена CH2 IgG и домена CH3 IgG, причем выступ образован мутациями в домене CH3 IgG; и (ii) второй полипептид состоит из домена α1 MHC класса II, домена α2 MHC класса II, домена CH2 IgG и домена CH3 IgG, причем полость образована мутациями в домене CH3 IgG.
[0220] Согласно одному варианту осуществления выделенные гетеродимеры содержат по меньшей мере один первый полипептид и по меньшей мере один второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который устанавливается в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид состоит из домена α1 MHC класса II, домена α2 MHC класса II, домена CH2 IgG и домена CH3 IgG, причем выступ образован мутациями в домене CH3 IgG, соответствующими S354C и T366W (нумерация EU); и (ii) второй полипептид состоит из домена β1 MHC класса II, домена β2 MHC класса II, домена CH2 IgG и домена CH3 IgG, причем полость образована мутациями в домене CH3 IgG, соответствующими Y349C, T366S, L368A и Y407V (нумерация EU).
[0221] Согласно одному варианту осуществления выделенные гетеродимеры содержат по меньшей мере один первый полипептид и по меньшей мере один второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который устанавливается в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид состоит из домена β1 MHC класса II, домена β2 MHC класса II, домене CH2 IgG и домене CH3 IgG, причем выступ образован мутациями в домене CH3 IgG, соответствующими S354C и T366W (нумерация EU); и (ii) второй полипептид состоит из домена α1 MHC класса II, домена α2 MHC класса II, домена CH2 IgG и домена CH3 IgG, причем полость образована мутациями в домене CH3 IgG, соответствующими Y349C, T366S, L368A и Y407V (нумерация EU).
Способы получения
[0222] Согласно другому аспекту в настоящем документе представлены способы получения описанного в настоящем документе гетеродимера. В настоящем раскрытии рассматриваются способы получения гетеродимеров, при которых гетеродимеры содержат первый полипептид, содержащий домен α1 MHC класса II и домен α2 MHC класса II, и второй полипептид, содержащий домен β1 MHC класса II и домен β2 MHC класса II. Согласно некоторым вариантам осуществления каждый полипептид дополнительно содержит домен CH2 и CH3. Согласно некоторым вариантам осуществления домен CH3 дополнительно содержит либо сконструированный выступ, либо сконструированную впадину (полость). Если выступ связан с полипептидом, содержащим домен α1 и α2 MHC класса II, то впадина связана с полипептидом, содержащим домен β1 и β2 MHC класса II. Конфигурация может быть переключена с выступом, связанным с полипептидом, содержащим домен β1 и β2 MHC класса II, и с впадиной, связанной с полипептидом, содержащим домен α1 и α2 MHC класса II. Гетеродимер также содержит иммунологически релевантный полипептид, связанный в связывающей борозде, которая образуется между альфа- и бета-цепями МНС класса II. Полипептид может представлять собой часть любой из первой или второй полипептидной цепи, связанной с ним гибким аминокислотным линкером.
[0223] Согласно некоторым вариантам осуществления полипептиды гетеродимеров кодируются полинуклеотидами, которые вводят в эукариотическую клеточную линию. Согласно некоторым вариантам осуществления эукариотическая клеточная линия представляет собой клеточную линию млекопитающих. Согласно некоторым вариантам осуществления эукариотическая клеточная линия представляет собой клеточную линию CHO (яичник китайского хомячка). Полинуклеотид может быть введен способами, известными в настоящей области техники, такими как вирусная трансдукция (ретровирусная или лентивирусная) или путем получения стабильной клеточной линии, которая содержит копию полинуклеотида, интегрированного в геном. После экспрессии гетеродимеры собираются в клетке и секретируются в культуральную среду. На этой стадии культуральную среду подвергают по меньшей мере одной дополнительной стадии очистки. Согласно определенным вариантам осуществления эта стадия очистки включает любое одно или несколько из центрифугирования, ультрацентрифугирования, диализа, фильтрации, хроматографии или колоночной хроматографии. Согласно определенным вариантам осуществления, поскольку полипептиды содержат домен CH2 и CH3 иммуноглобулина человека, то стадия хроматографии включает аффинную хроматографию с использованием белка A, белка G, белка L или любой их комбинации. Согласно определенным вариантам осуществления стадия хроматографии включает аффинную хроматографию с использованием белка А. Согласно определенным вариантам осуществления стадия хроматографии включает аффинную хроматографию с использованием белка G. Согласно определенным вариантам осуществления стадия хроматографии включает аффинную хроматографию с использованием белка A/G. Согласно определенным вариантам осуществления стадия хроматографии состоит из аффинной хроматографии с использованием белка A. Согласно определенным вариантам осуществления стадия хроматографии состоит из аффинной хроматографии с использованием белка G. Согласно определенным вариантам осуществления стадия хроматографии состоит из аффинной хроматографии с использованием белка A/G. Согласно определенным вариантам осуществления на стадии хроматографии не используют аффинный реагент, отличный от белка А, белка G, белка L или их комбинации (это не включает в себя стадии хроматографии на основе неаффинности, такие как обессоливание или эксклюзионная хроматография).
[0224] Согласно некоторым вариантам осуществления представлены способы получения гетеродимера, содержащего первый полипептид и второй полипептид, причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который может быть расположен в сконструированной полости на поверхности контакта второго полипептида; и (i) первый полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II или их комбинацию и второй полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию или (ii) первый полипептид содержит домен β1 МНС класса II, домен β2 МНС класса II или их комбинацию и второй полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию; включающие стадии: (а) культивирования клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую первый полипептид и второй полипептид, включая в себя их поверхности контакта, причем нуклеиновая кислота, кодирующая поверхность контакта первого полипептида, была изменена из нуклеиновой кислоты, кодирующей исходную поверхность контакта первого полипептида, чтобы кодировать выступ, или нуклеиновая кислота, кодирующая поверхность контакта второго полипептида, был изменена из нуклеиновой кислоты, кодирующей исходную поверхность контакта второго полипептида, чтобы кодировать полость, или и то, и другое, и причем культивирование таково, что экспрессируется первый полипептид и второй полипептид; и (b) извлечение гетеродимера из культуры клеток-хозяев. Согласно некоторым вариантам осуществления нуклеиновая кислота, кодирующая первый полипептид, была изменена из исходной нуклеиновой кислоты для кодирования выступа, а нуклеиновая кислота, кодирующая второй полипептид, была изменена из исходной нуклеиновой кислоты для кодирования полости. Согласно некоторым вариантам осуществления стадии (а) предшествует стадия, на которой каждая из одной или нескольких нуклеиновых кислот, кодирующих исходный аминокислотный остаток с поверхности контакта первого полипептида, заменяется нуклеиновой кислотой, кодирующей импортный аминокислотный остаток, причем выступ содержит один или несколько импортных остатков. Согласно дополнительным вариантам осуществления один или несколько импортных остатков характеризуются большим объемом боковой цепи, чем исходный аминокислотный остаток. Согласно некоторым вариантам осуществления стадии (а) предшествует стадия, на которой каждая из одной или нескольких нуклеиновых кислот, кодирующих исходный аминокислотный остаток на поверхности контакта второго полипептида, заменяется нуклеиновой кислотой, кодирующей импортный аминокислотный остаток, причем полость содержит один или несколько импортных остатков. Согласно дополнительным вариантам осуществления один или несколько импортных остатков характеризуются меньшим объемом боковой цепи, чем исходный аминокислотный остаток.
[0225] Согласно некоторым вариантам осуществления импортный остаток выбирают из фенилаланина, аргинина, тирозина, триптофана, аланина, серина, треонина, валина и цистеина. Согласно некоторым вариантам осуществления импортный остаток представляет собой аргинин. Согласно некоторым вариантам осуществления импортный остаток представляет собой фенилаланин. Согласно некоторым вариантам осуществления импортным остаток представляет собой тирозин. Согласно некоторым вариантам осуществления импортный остаток представляет собой триптофан. Согласно некоторым вариантам осуществления импортный остаток представляет собой аланин. Согласно некоторым вариантам осуществления импортный остаток представляет собой серин. Согласно некоторым вариантам осуществления импортный остаток представляет собой треонин. Согласно некоторым вариантам осуществления импортный остаток представляет собой валин. Согласно некоторым вариантам осуществления импортный остаток не представляет собой цистеин. Согласно некоторым вариантам осуществления импортный остаток представляет собой цистеин. Согласно некоторым вариантам осуществления импортные остатки представляют собой цистеин и триптофан. Согласно некоторым вариантам осуществления импортные остатки представляет собой цистеин, серин, аланин и валин.
[0226] Согласно другому аспекту в настоящем документе представлены способы получения описанного в настоящем документе конъюгата гетеродимер-наночастица. Согласно некоторым вариантам осуществления способы включают связывание по меньшей мере одного описанного в настоящем документе гетеродимера с наночастицей, причем наночастица не является липосомальной и/или содержит твердое ядро. Согласно некоторым вариантам осуществления способы включают связывание по меньшей мере одного описанного в настоящем документе гетеродимера с наночастицей, причем наночастица не является липосомальной и содержит твердое ядро. Согласно некоторым вариантам осуществления способы включают связывание по меньшей мере одного описанного в настоящем документе гетеродимера с наночастицей, причем наночастица не является липосомальной или содержит твердое ядро. Согласно некоторым вариантам осуществления способы включают связывание по меньшей мере одного описанного в настоящем документе гетеродимера с наночастицей, причем наночастица не является липосомальной и содержит твердое золотое ядро. Согласно некоторым вариантам осуществления способы включают связывание по меньшей мере одного описанного в настоящем документе гетеродимера с наночастицей, причем наночастица не является липосомальной и включают твердое ядро из оксида железа. Согласно некоторым вариантам осуществления способы включают связывание по меньшей мере одного описанного в настоящем документе гетеродимера с наночастицей, причем наночастица не является липосомальной и содержит ядро из оксида железа; и стадия связывания включает ковалентное связывание по меньшей мере одного гетеродимера с наночастицей через линкер.
Способы лечения заболеваний
[0227] Согласно другому аспекту в настоящем документе представлены способы лечения заболевания с использованием композиций, содержащих, состоящих из или состоящих по существу из раскрытых в настоящем документе гетеродимеров и/или раскрытых в настоящем документе конъюгатов гетеродимер-наночастица. Согласно некоторым вариантам осуществления заболевание представляет собой аутоиммунное заболевание или нарушение.
[0228] Выделенные гетеродимеры или выделенные комплексы гетеродимер-наночастица по настоящему изобретению применимы для перепрограммирования/дифференциации аутореактивных Т-клеток в Т-регуляторные или TR1-клетки. Согласно определенным вариантам осуществления TR1-клетки экспрессируют IL-10. Согласно определенным вариантам осуществления TR1-клетки секретируют IL-10. Согласно определенным вариантам осуществления TR1-клетки экспрессируют CD49b. Согласно определенным вариантам осуществления TR1-клетки экспрессируют LAG-3. Т-клетки, которые имеют эти фенотипические характеристики, применимы для лечения воспалительных или аутоиммунных состояний индивидуумов.
[0229] «Аутоиммунное заболевание или нарушение» включает в себя заболевания или нарушения, возникающие и направленные против собственных тканей или органов человека, или их проявления или состояния, возникающие в результате этого. Согласно одному варианту осуществления оно относится к состоянию, которое является результатом или усугубляется производством Т-клеток, которые реагируют с нормальными тканями организма и антигенами. Примеры аутоиммунных заболеваний или нарушений включают в себя, без ограничения, артрит (такой ревматоидный артрит, как острый артрит, хронический ревматоидный артрит, подагра или подагрический артрит, острый подагрический артрит, острый иммунологический артрит, хронический воспалительный артрит, дегенеративный артрит, индуцированный коллагеном II типа артрит, инфекционный артрит, артрит Лайма, пролиферативный артрит, псориатический артрит, болезнь Стилла, артрит позвоночника и ювенильный ревматоидный артрит, остеоартрит, хронический прогрессирующий артрит, деформирующий артрит, первичный хронический полиартрит, реактивный артрит и анкилозирующий спондилоартрит), воспалительные гиперпролиферативные заболевания кожи, псориаз (такой как бляшечный псориаз, каплевидный псориаз, пустулезный псориаз и псориаз ногтей), атопию (включая в себя такие атопические заболевания, как сенная лихорадка и синдром Иова), дерматит (включая в себя контактный дерматит, хронический контактный дерматит, эксфолиативный дерматит, аллергический дерматит, аллергический контактный дерматит, герпетиформный дерматит, нуммулярный дерматит, себорейный дерматит, неспецифический дерматит, первичный раздражающий контактный дерматит и атопический дерматит), Х-связанный гипер-IgM синдром, аллергические внутриглазные воспалительные заболевания, крапивницу (такую как хроническая аллергическая крапивница и хроническая идиопатическая крапивница, включая в себя хроническую аутоиммунную крапивницу), миозит, полимиозит/дерматомиозит, ювенильный дерматомиозит, токсический эпидермальный некролиз, склеродермию (включая в себя системную склеродермию), склероз (такой как системный склероз; рассеянный склероз (MS), такой как спинооптический MS, первичный прогрессирующий MS (PPMS) и возвратно-ремиттирующий MS (RRMS); прогрессирующий системный склероз, атеросклероз, артериосклероз, рассеянный склероз и атаксический склероз), нейромиелит зрительного нерва со спектральным расстройством (NMO, также известный как болезнь Девика или синдром Девика), воспалительное заболевание кишечника (IBD) (например, болезнь Крона; аутоиммунные медико-кишечные заболевания, такие как язвенный колит, микроскопический колит, коллагеновый колит, полипозный колит, некротический энтероколит и трансмуральный колит и опосредованное аутоиммунным ответом воспалительное заболевание кишечника), воспаление кишечника, гангренозную пиодермию, нодозную эритему, первичный склерозирующий холангит, синдром острой дыхательной недостаточности (включая в себя взрослый или острый синдром дыхательной недостаточности (ARDS)), менингит, воспаление всей или части сосудистой оболочки глаза, ирит, хориоидит, аутоиммунное гематологическое нарушение, ревматоидный спондилит, ревматоидный синовит, наследственный ангионевротический отек, повреждение черепного нерва, как при менингите, гестационный герпес, пемфигоид беременных, прурит scroti, аутоиммунную преждевременную овариальную недостаточность, внезапную потерю слуха вследствие аутоиммунного состояния, такие IgE-опосредованные заболевания, как анафилаксия и аллергический и атопический ринит, такой энцефалит, как энцефалит Расмуссена и лимбический и/или стволовой энцефалит, увеит (такой как передний увеит, острый передний увеит, гранулематозный увеит, негранулематозный увеит, факоантигенный увеит, задний увеит или аутоиммунный увеит), гломерулонефрит (GN) с нефротическим синдромом и без него (такой как хронический или острый гломерулонефрит, такой как первичный GN, иммунно-опосредованный GN, мембранозный GN (мембранозная нефропатия), идиопатический мембранозный GN или идиопатическая мембранозная нефропатия, мембрано- или мембранозный пролиферативный GN (MPGN), включая в себя типы I и II, и быстро прогрессирующий GN или пролиферативный нефрит), аутоиммунную полигландулярную эндокринную недостаточность, баланит, включая в себя плазмоцеллюлярный баланит, баланопостит, эритему центробежную кольцевидную, стойкую дисхромическую эритему, мультиформную эритему, анулярную гранулему, лишай блестящий, склероатрофический лишай, простой хронический лишай, спинулезный лишай, красный плоский лишай, ламеллярный ихтиоз, эпидермолитический ихтиоз, предраковый злокачественный кератоз, гангренозную пиодермию, аллергические состояния и реакции, аллергическую реакцию, экзему (в том числе аллергическую или атопическую экзему, астеатозную экзему, дисгидротическую экзему и везикулярную ладонно-подошвенную экзему), астму (такую как бронхиальная астма, аутоиммунная астма), состояния, включающие в себя инфильтрацию Т-клеток и хронические воспалительные реакции, иммунные реакции против чужеродных антигенов, таких как группы крови плода АВО во время беременности, хроническое воспалительное заболевание легких, аутоиммунный миокардит, дефицит адгезии лейкоцитов, волчанку (включая в себя волчаночный нефрит, энцефалит при системной красной волчанке, детскую волчанку, неченочную волчанку, экстраренальную волчанку, дискоидную волчанку и дискоидную красную волчанку, алопецию, системную красную волчанку (SLE), такую как кожная SLE или подострая кожная SLE, синдром неонатальной волчанки (NLE) и диссеминированная красная волчанка), сахарный диабет типа I, сахарный диабет типа II и латентный аутоиммунный сахарный диабет у взрослых (или сахарный диабет типа 1,5). Также рассматриваются иммунные реакции, связанные с острой и отсроченной гиперчувствительностью, опосредованной цитокинами и Т-лимфоцитами, саркоидоз, гранулематоз (включая в себя лимфоматоидный гранулематоз, гранулематоз Вегенера или агранулоцитоз), васкулиты (включая в себя васкулит, васкулит с поражением сосудов крупного диаметра (включая в себя ревматическую полимиалгию и полиаскулярные сосудистые заболевания и гигантоклеточный неспецифический аортоартериит (Такаясу)), васкулит с поражением сосудов среднего диаметра (включая в себя болезнь Кавасаки и нодозный полиартериит/нодозный панартерии), микроскопический полиартериит, иммуноваскулит, васкулит ЦНС, кожный васкулит, гиперчувствительный васкулит, некротический васкулит, такой как системный некротический васкулит, а также ANCA-ассоциированные васкулиты (такой как васкулит или синдром Чарга-Стросса (CSS) и ANCA-ассоциированные васкулиты мелких сосудов), височный артериит, апластическая анемия, аутоиммунная апластическая анемия, анемия с положительным тестом Кумбса, анемия Даймонда-Блэкфана, гемолитическая анемия, иммунная гемолитическая анемия, включая в себя аутоиммунную гемолию (AIHA), болезнь Аддисона, аутоиммунная нейтропения, панцитопения, лейкопения, заболевания, связанные с диапедезом лейкоцитов, воспалительные заболевания ЦНС, болезнь Альцгеймера, болезнь Паркинсона, синдром множественного поражения органов (например, вторичные по отношению к сепсису, травме или кровоизлиянию), опосредованные комплексом антиген-антитело заболевания, заболевание с образованием антител к базальной мембране клубочков, антифосфолипидный синдром, аллергический неврит, болезнь/синдром Бехчета, синдром Каслмана, синдром Гудпасчера, синдром Рейно, синдром Шегрена, синдром Стивенса-Джонсона, пемфигоид, такой как буллезный пемфигоид и кожный пемфигоид, пузырчатка (включая в себя пузырчатку обыкновенную, пузырчатку листовидную, слизисто-мембранную пузырчатку и эритематозную пузырчатку), аутоиммунные полиэндокринопатии, болезнь или синдром Рейтера, тепловое повреждение, преэклампсия, болезнь иммунных комплексов, такая как индуцированный иммунными комплексами нефрит, опосредованный антителами нефрит, полиневропатии, хроническая невропатия, такая как полиневропатия IgM или опосредованная IgM невропатия, аутоиммунная или иммуноопосредованная тромбоцитопения, такая как идиопатическая тромбоцитопеническая пурпура (ITP), включая в себя хроническую или острую ITP, приобретенная тромбоцитопеническая пурпура, склерит, такой как идиопатический цератоиммунный склерит, эписклерит, аутоиммунное заболевание семенников и яичников, включая в себя аутоиммунный орхит и оофорит, первичный гипотиреоз, гипопаратиреоз, аутоиммунные эндокринные заболевания (включая в себя тиреоидит (такой как аутоиммунный тиреоидит, болезнь Хашимото, хронический тиреоидит (тиреоидит Хашимото) или подострый тиреоидит), аутоиммунное заболевание щитовидной железы, идиопатический гипотиреоз или заболевание Грейвса), такие полигландулярные синдромы, как аутоиммунные полигландулярные синдромы (или синдромы полигландулярные эндокринопатии), паранеопластические синдромы, включая в себя неврологические паранеопластические синдромы, такие как миастенический синдром Ламберта-Итона или синдром Итона-Ламберта, синдром мышечной скованности или синдром скованного человека, такой энцефаломиелит, как аллергический энцефаломиелит или экспериментальный аллергический энцефаломиелит (EAE), такая миастения гравис, как связанная с тимомой миастения гравис, дегенерация мозжечка, нейромиотония, опсоклонус или опсо-миоклональный синдром (OMS), сенсорная невропатия, мультифокальная двигательная невропатия, синдром Шихана, аутоиммунный гепатит, хронический гепатит, волчаночный гепатит, врожденный гигантоклеточный гепатит, хронический активный гепатит, аутоиммунный хронический активный гепатит, лимфоидный интерстициальный пневмонит (LIP), облитерирующий бронхиолит (не трансплант.) против NSIP, синдром Гийена-Барре, болезнь Бергера (IgA-нефропатия), идиопатическая IgA-нефропатия, линейный IgA-дерматоз, острый фебрильный нейтрофильный дерматоз, субкорнеальный пустулезный дерматоз, переходный акантолитический дерматоз, такой цирроз, как первичный билиарный цирроз и пневмоноцирроз, синдром аутоиммунной энтеропатии, целиакия или глютеновая болезнь, целиакия-спру (глютеновая энтеропатия), рефрактерная спру, идиопатическая спру, криоглобулинемия, амилотрофический латеральный склероз (ALS; болезнь Лу Герига), ишемическая болезнь сердца, такое аутоиммунное заболевание уха, как аутоиммунное заболевание внутреннего уха (AIED), аутоиммунная потеря слуха, такой полихондрит, как рефрактерный или рецидивирующий полихондрит, легочный альвеолярный протеиноз, синдром Когана/несифилитический интерстициальный кератит, паралич Белла, болезнь/синдром Свита, аутоиммунная розацеа, связанная с опоясывающим лишаем боль, амилоидоз, незлокачественный лимфоцитоз, первичный лимфоцитоз, который включает в себя моноклональный В-клеточный лимфоцитоз (например, доброкачественная моноклональная гаммопатия и моноклональная гаммопатия неопределенного значения, MGUS), периферическая нейропатия, паранеопластический синдром, такие каналопатии, как эпилепсия, мигрень, аритмия, мышечные нарушения, глухота, слепота, периодический паралич, каналопатии ЦНС, аутизм, воспалительная миопатия, фокальный или сегментарный или фокально-сегментарный гломерулосклероз (FSGS), эндокринная офтальмопатия, увеоретинит, хориоретинит, аутоиммунное гепатологическое заболевание, фибромиалгия, полиэндокринная недостаточность, синдром Шмидта, воспаление надпочечников, атрофия желудка, пресенильная деменция, такие демиелинизирующие заболевания, как аутоиммунные демиелинизирующие заболевания и хроническая воспалительная демиелинизирующая полиневропатия, синдром Дресслера, очаговая алопеция, тотальная алопеция, синдром CREST (кальциноз, феномен Рейно, пищеводная дискинезия, склеродактилия и телеангиэктазия), мужское и женское аутоиммунное бесплодие (например, из-за антисперматозоидных антител), смешанное заболевание соединительной ткани, болезнь Шагаса, ревматическая лихорадка, рецидивирующий аборт, легкое фермера, мультиформная эритема, посткардиотомический синдром, синдром Кушинга, легочная аллергия птицеводов, аллергический гранулематозный ангиит, доброкачественный лимфоцитарный ангиит, синдром Альпорта, такой альвеолит, как аллергический альвеолит и фиброзирующий альвеолит, интерстициальное заболевание легких, трансфузионная реакция, проказа, малярия, такие паразитарные заболевания, как лейшманиоз, трипанозомоз, шистосомоз, аскаридоз, аспергиллез, синдром Самптера, синдром Каплана, денге, эндокардит, эндомиокардиальный фиброз, диффузный интерстициальный легочный фиброз, интерстициальный фиброз легких, фиброз легких, идиопатический легочный фиброз, муковисцидоз, эндофтальмит, стойкая возвышающаяся эритема, эритробластоз плода, эозинофильный фасциит, синдром Шульмана, синдром Фелти, фляриаз, такой циклит, как хронический циклит, гетерохронический циклит, иридоциклит (острый или хронический) или циклит Фукса, пурпура Геноха-Шонлейна, инфекция вирусом иммунодефицита человека (HIV), SCID, синдром приобретенного иммунодефицита (AIDS), эховирусная инфекция, сепсис, эндотоксемия, панкреатит, тиреоксикоз, парвовирусная инфекция, вирусная инфекция краснухи, поствакцинальные синдромы, вирусная инфекция Эпштейна-Барра, эпидемический паротит, синдром Эвана, аутоиммунная гонадная недостаточность, хорея Сиденхема, постстрептококковый нефрит, облитерирующий тромбоангиит, тиреотоксикоз, сухотка спинного мозга, хориоидит, гигантоклеточная полимиалгия, хронический аллергический пневмонит, сухой кератоконъюнктивит, эпидемический кератоконъюнктивит, идиопатический нефротический синдром, минимальное изменение нефропатии, доброкачественное семейное и ишемическое-реперфузионное повреждение, трансплантации органов реперфузии, ретинальный аутоиммунитет, воспаление суставов, бронхит, хроническое обструктивное заболевание дыхательных путей/легких, силикоз, афты, афтозный стоматит, артериосклеротические нарушения, асперниогенез, аутоиммунный гемолиз, болезнь Бека, криоглобулинемия, контрактура Дюпюитрена, эндофтальмит phacoanaphylactica, аллергический энтерит, узловатая лепрозная эритема, идиопатический паралич лицевого нерва, синдром хронической усталости, ревматическая лихорадка, болезнь Хаммена-Рича, сенсоневральная тугоухость, пароксизмальная гемоглобинурия, гипогонадизм, илеит региональный, лейкопения, инфекционный мононуклеоз, поперечный миелит, первичная идиопатическая микседема, нефроз, симпатическая офтальмия, гранулематозный орхит, панкреатит, острый полирадикулит, гангренозная пиодермия, тиреоидит Кервена, приобретенная атрофия селезенки, незлокачественная тимома, витилиго, синдром токсического шока, пищевое отравление, состояния, включающие в себя инфильтрацию Т-клеток, нарушение адгезии лейкоцитов, иммунные реакции, связанные с острой и отсроченной гиперчувствительностью, опосредованной цитокинами и Т-лимфоцитами, заболевания, связанные с диапедезом лейкоцитов, синдром множественного поражения органов, заболевания, опосредованные комплексом антиген-антитело, болезнь антигломерулярной базальной мембраны, аллергический неврит, аутоиммунные полиэндокринопатии, оофорит, первичная микседема, аутоиммунный атрофический гастрит, симпатическая офтальмия, ревматические заболевания, смешанные заболевания соединительной ткани, нефротический синдром, инсулит, полиэндокринная недостаточность, аутоиммунный полигландулярный синдром I типа, приобретенный идиопатический гипопаратиреоз (AOIH), такая кардиопатия, как дилятационная кардиомиопатия, гипофизопатия, приобретенный буллезный эпидермолиз (EBA), гемохроматоз, миокардит, нефротический синдром, первичный склерозирующий холангит, гнойный или негнойный синусит, острый или хронический синусит, этмоидит, фронтит, гайморит или сфиноидальный синусит, связанные с эозинофилами нарушения, такие как эозинофилия, эозинофильный инфильтрат легкого, синдром эозинофилии-миалгии, синдром Леффлера, хроническая эозинофильная пневмония, тропическая легочная эозинофилия, бронхопневмонический аспергиллез, аспергиллема или гранулемы, содержащие эозинофилы, анафилаксия, серонегативные спондилоартриты, полиэндокринное аутоиммунное заболевание, склерозирующий холангит, склера, эписклера, хронический слизисто-кожный кандидоз, синдром Брутона, преходящая гипогаммаглобулинемия детей, синдром Вискотта-Олдрича, синдром атаксии-телеангиэктазии, ангиэктазия, аутоиммунные расстройства, связанные с коллагеновой болезнью, ревматизм, неврологическое заболевание, лимфаденит, снижение артериального давления, сосудистая дисфункция, повреждение тканей, сердечно-сосудистая ишемия, гипералгезия, почечная ишемия, церебральная ишемия и заболевание, сопровождающее васкуляризацию, аллергическая реакция, гломерулонефрит, реперфузионное повреждение, ишемическое реперфузионное нарушение, реперфузионное повреждение миокарда или других тканей, лимфоматозный трахеобронхит, воспалительный дерматит, дерматоз с острыми воспалительными компонентами, полиорганная недостаточность, буллезные заболевания, некроз почечной коры, острый гнойный менингит или другие воспалительные заболевания центральной нервной системы, глазные и орбитальные воспалительные заболевания, синдромы, связанные с переливанием гранулоцитов, цитокин-индуцированная токсичность, нарколепсия, острое серьезное воспаление, хроническое трудноизлечимое воспаление, пиелит, эндартериальная гиперплазия, язвенная болезнь желудка, вальвулит, эмфизема, очаговая алопеция, воспаление жировой ткани/сахарный диабет II типа, ожирение, связанное с воспалением жировой ткани/резистентность к инсулину и эндометриоз.
[0230] Согласно некоторым вариантам осуществления аутоиммунное нарушение или заболевание может включать в себя, без ограничения, сахарный диабет I и II типа, предиабет, отторжение трансплантата, рассеянный склероз, связанное с рассеянным склерозом нарушение, преждевременную недостаточность яичников, склеродермию, болезнь/синдром Шегрена, волчанку, витилиго, алопецию (облысение), полигландулярную недостаточность, болезнь Грейвса, гипотиреоз, полимиозитит, пузырчатку, болезнь Крона, колит, аутоиммунный гепатит, гипопитуитаризм, миокардит, болезнь Аддисона, аутоиммунные заболевания кожи, увеит, пернициозную анемию, гипопаратиреоз и/или ревматоидный артрит. Другие представляющие интерес показания включают в себя, без ограничения, бронхиальную астму, аллергическую астму, первичный билиарный цирроз, цирроз печени, нейромиелит зрительного нерва со спектральным расстройством (болезнь Девика, оптико-спинальный рассеянный склероз (OSMS)), пузырчатку обыкновенную, воспалительное заболевание кишечника (IBD), артрит, ревматоидный артрит, системную красную волчанку (SLE), глютеиновую болезнь, псориаз, аутоиммунную кардиомиопатию, идиопатическую дилятационную кардиомиопатию (IDCM), миастению гравис, увеит, анкилозирующий спондилит, опосредованные иммунной системой миопатии, рак простаты, антифосфолипидный синдром (ANCA+), атеросклероз, дерматомиозит, хроническую обструктивную болезнь легких (COPD), эмфизему, повреждение спинного мозга, травматическое повреждение, вызванное табаком разрушение легких, ANCA-ассоциированный васкулит, псориаз, склерозирующий холангит, первичный склерозирующий холангит и заболевания центральной и периферической нервной системы.
[0231] Согласно некоторым вариантам осуществления аутоиммунное нарушение или заболевание может включать в себя, без ограничения, сахарный диабет I типа, рассеянный склероз, глютеиновую болезнь, первичный билиарный цирроз, пузырчатку, пузырчатку листовидную, пузырчатку обыкновенную, нейромиелит зрительного нерва со спектральным расстройством, артрит (включая в себя ревматоидный артрит), аллергическую астму, воспалительное заболевание кишечника (включая в себя болезнь Крона и язвенный колит), системную красную волчанку, атеросклероз, хроническую обструктивную болезнь легких, эмфизему, псориаз, аутоиммунный гепатит, увеит, синдром Шегрена, склеродермию, антифосфолипидный синдром, ANCA-ассоциированный васкулит и синдром мышечной скованности. Согласно дополнительному аспекту относящийся к заболеванию антиген представляет собой антиген, относящийся к опухоли или раку.
[0232] Согласно определенным вариантам осуществления выделенные гетеродимеры или выделенные комплексы гетеродимер-наночастица по настоящему изобретению включены в фармацевтическую композицию, содержащую один или несколько фармацевтически приемлемых вспомогательных веществ, носителей и разбавителей. Согласно определенным вариантам осуществления выделенные гетеродимеры или выделенные комплексы гетеродимер-наночастица по настоящему изобретению вводят суспендированными в стерильном растворе. Согласно определенным вариантам осуществления раствор содержит 0,9% NaCl. Согласно определенным вариантам осуществления раствор дополнительно содержит один или несколько из: буферов, например, ацетатного, цитратного, гистидинового, сукцинатного, фосфатного, бикарбонатного и гидроксиметиламинометанового (трис); поверхностно-активные вещества, например, полисорбат 80 (Твин 80), полисорбат 20 (Твин 20) и полоксамер 188; полиол/дисахарид/полисахариды, например, глюкоза, декстроза, манноза, маннит, сорбит, сахароза, трегалоза и декстран 40; аминокислоты, например, глицин или аргинин; антиоксиданты, например, аскорбиновая кислота, метионин; или хелатирующие средства, например, EGTA или EGTA. Согласно определенным вариантам осуществления выделенные гетеродимеры или выделенные комплексы гетеродимер-наночастица по настоящему изобретению поставляются/хранятся лиофилизированными и восстанавливаются перед введением. Согласно определенным вариантам осуществления лиофилизированные выделенные гетеродимеры или выделенные составы комплексов гетеродимер-наночастицы содержат наполнитель, такой как маннит, сорбит, сахароза, трегалоза или декстран 40. Лиофилизированный состав может содержаться в ампуле, состоящей из стекла. Выделенные гетеродимеры или выделенные комплексы гетеродимер-наночастицы, когда они составлены, независимо от того, были ли они восстановлены или нет, могут быть забуферены при определенном рН, как правило, менее чем 7,0. Согласно некоторым вариантам осуществления pH может составлять от 4,5 до 6,5, от 4,5 до 6,0, от 4,5 до 5,5, от 4,5 до 5,0 или от 5,0 до 6,0. Согласно определенным вариантам осуществления для внутривенного введения могут быть составлены выделенные гетеродимеры или выделенные комплексы гетеродимер-наночастицы. Согласно определенным вариантам осуществления выделенные гетеродимеры или выделенные комплексы гетеродимер-наночастица могут быть составлены для перорального приема. Согласно определенным вариантам осуществления выделенные гетеродимеры или выделенные комплексы гетеродимер-наночастица могут быть составлены для парентерального, внутримышечного или внутрикожного введения. Согласно определенным вариантам осуществления выделенные гетеродимеры или выделенные комплексы гетеродимер-наночастица могут быть составлены и/или введены без какого-либо иммунологического адъюванта или другого соединения или полипептида, предназначенного для увеличения или уменьшения иммунного ответа.
[0233] Согласно другому аспекту в настоящем документе представлены способы обнаружения и/или мониторинга популяции иммунных клеток, предпочтительно Т-клеток, включающие введение меченого комплекса антиген-МНС, причем субъект получил раскрытые в настоящем документе гетеродимеры и/или раскрытые в настоящем документе конъюгаты гетеродимер-наночастица.
[0234] Согласно определенным аспектам в настоящем документе представлены способы обнаружения популяции TR1-клеток и/или эффекторных Т-клеток антигенспецифическим образом у субъекта, который получил раскрытые в настоящем документе гетеродимеры и/или раскрытые в настоящем документе конъюгаты гетеродимер-наночастица. Способ включает, альтернативно, состоит или, кроме того, дополнительно состоит по существу из контакта образца, предположительно содержащего TR1-клетки, с эффективным количеством меченого комплекса pMHC для образования мультимерного комплекса и обнаружения любого мультимерного комплекса, таким образом обнаруживая популяцию TR1-клеток. Согласно некоторым вариантам осуществления способ дополнительно включает, альтернативно, дополнительно состоит из или, кроме того, дополнительно состоит по существу из окрашивания любой популяции Т-клеток с использованием меченого мультимерного комплекса. Согласно некоторым вариантам осуществления стадия обнаружения популяции TR1-клеток включает проточную цитометрию для обнаружения любого мультимерного комплекса. Согласно некоторым вариантам осуществления способ дополнительно включает или, альтернативно, состоит из или, кроме того, состоит по существу из введения комплекса или композиции субъекту.
[0235] Согласно определенным аспектам в настоящем документе представлены способы обнаружения популяции TR1-клеток и/или эффекторных Т-клеток антиген-специфическим образом у субъекта, который получил раскрытые в настоящем документе гетеродимеры и/или раскрытые в настоящем документе конъюгаты гетеродимер-наночастица. Способ включает, альтернативно, состоит из или, кроме того, состоит по существу из любого из следующих анализов: анализ ELISPOT на цитокины, направленный на мультимеры анализ эпитопов или анализ с соосаждением мультимера. Согласно некоторым вариантам осуществления способ дополнительно включает, альтернативно, дополнительно состоит или, кроме того, дополнительно состоит по существу из введения раскрытых в настоящем документе гетеродимеров и/или раскрытых в настоящем документе конъюгатов гетеродимер-наночастица.
[0236] Согласно другим аспектам в настоящем документе представлены способы мониторинга увеличения количества популяции антиген-специфических TR1 и/или эффекторных Т-клеток у субъекта. Способ включает, альтернативно, состоит из или, кроме того, состоит по существу из: а) введения субъекту эффективного количества раскрытых в настоящем документе гетеродимеров и/или раскрытых в настоящем документе конъюгатов гетеродимер-наночастица, причем относящийся к заболеванию антиген комплекса pMHC выбирают для увеличения количества антиген-специфических TR1 и/или эффекторных T-клеток; b) выделения подходящего образца из субъекта, предположительно содержащего популяцию; c) контактирования образца с эффективным количеством меченого комплекса pMHC с образованием мультимерного комплекса и обнаружения любого мультимерного комплекса и d) количественного определения количества антигенспецифических TR1 и/или эффекторных Т-клеток в популяции. Согласно некоторым вариантам осуществления способ дополнительно включает, альтернативно, дополнительно состоит из или, кроме того, состоит по существу из окрашивания любого мультимерного комплекса. Согласно некоторым вариантам осуществления стадия количественного определения числа антигенспецифических TR1 и/или эффекторных T-клеток включает проточную цитометрию и/или ИФА. Согласно некоторым вариантам осуществления способ дополнительно включает, альтернативно, дополнительно состоит или, кроме того, дополнительно состоит по существу из введения раскрытых в настоящем документе гетеродимеров и/или раскрытых в настоящем документе конъюгатов гетеродимер-наночастица.
[0237] Существует много типов иммуноанализов, которые могут быть реализованы. Иммуноанализы, охватываемые настоящим раскрытием, включают в себя, без ограничения, описанные в патенте США 4367110 (сэндвич-анализ с двойным моноклональным антителом) и патенте США 4452901 (вестерн-блоттинг). Другие анализы включают в себя иммунопреципитацию меченых лигандов и иммуноцитохимию как in vitro, так и in vivo.
[0238] Одним из способов количественного определения числа циркулирующих антигенспецифических иммунных клеток является анализ с использованием тетрамеров. В этом анализе специфический эпитоп связан с синтетическими мультимерными формами флуоресцентно меченых молекул МНС. Поскольку иммунные клетки распознают антигены в форме коротких пептидов, связанных с молекулами МНС, клетки с соответствующим рецептором Т-клеток будут связываться с мечеными тетрамерами и могут быть количественно определены с помощью проточной цитометрии. Хотя этот способ занимает меньше времени, чем анализ ELISPOT, мультимерный анализ измеряет только связывание, а не функцию. Не все клетки, которые связывают определенный антиген, обязательно становятся активированными. Однако была продемонстрирована корреляция между ELISPOT, мультимерным и цитотоксическим анализами.
[0239] Иммуноанализы, как правило, представляют собой анализы связывания. В настоящей области техники известны некоторые иммуноанализы, включая в себя различные типы ферментных иммуносорбентных анализов (ИФА), радиоиммуноанализы (RIA) или бинарные анализы, такие как технология Luminex®. Иммуногистохимическое обнаружение с использованием срезов тканей также применимо.
[0240] В одном примере ИФА антитела или антигены иммобилизуют на выбранной поверхности, такой как лунка в полистирольном планшете для микротитрования, щуп или опора для колонки. Затем в лунки добавляют исследуемую композицию, предположительно содержащую нужный антиген или антитело, например, клинический образец. После связывания и отмывания для удаления неспецифически связанных иммунных комплексов можно обнаружить связанный антиген или антитело. Обнаружение, как правило, достигается путем добавления другого антитела, специфического к желаемому антигену или антителу, которое связано с обнаруживаемой меткой. Этот тип ИФА известен как «сэндвич-ИФА». Обнаружение также может быть достигнуто путем добавления второго антитела, специфического к желаемому антигену, с последующим добавлением третьего антитела, которое характеризуется аффинностью связывания со вторым антителом, причем третье антитело связано с обнаруживаемой меткой. Вариации способов ИФА известны специалистам в настоящей области техники.
[0241] Также возможны конкурентные ИФА, в которых исследуемые образцы конкурируют за связывание с известными количествами меченых антигенов или антител. Количество реакционноспособных частиц в неизвестном образце определяют путем смешивания образца с известными мечеными частицами до инкубации или во время нее с покрытыми лунками. Присутствие реакционноспособных частиц в образце снижает количество меченых частиц, доступных для связывания с лункой, и, таким образом, снижает предельный сигнал.
[0242] Независимо от используемого формата, ИФА характеризуются некоторыми общими чертами, такими как покрытие, инкубация или связывание, промывание для удаления неспецифически связанных частиц и обнаружение связанных иммунных комплексов.
[0243] Антиген или антитела также могут быть связаны с твердой подложкой, такой как в форме планшета, гранул, щупа, мембраны или матрикса колонки, и анализируемый образец наносят на иммобилизованный антиген или антитело. При покрытии планшета антигеном или антителом, как правило, инкубируют лунки планшета с раствором антигена или антитела либо в течение ночи, либо в течение определенного периода. Затем лунки планшета промывают для удаления не полностью адсорбированного материала. Любые оставшиеся доступными поверхности лунок затем «покрывают» неспецифическим белком, который является антигенно нейтральным по отношению к исследуемой антисыворотке. К ним относятся бычий сывороточный альбумин (БСА), казеин и растворы сухого молока. Покрытие позволяет блокировать сайты неспецифической адсорбции на иммобилизирующей поверхности и, таким образом, уменьшать фон, вызванный неспецифическим связыванием антисыворотки на поверхности.
[0244] В ИФА более обычно используют вторичные или третичные средства обнаружения, а не прямую процедуру. Таким образом, после связывания антигена или антитела с лункой, покрытой нереакционноспособным материалом для уменьшения фона и промывания для удаления несвязанного материала, иммобилизирующую поверхность подвергают контакту с клиническим или подлежащим исследованию биологическим образцом в условиях, эффективных для образования иммунного комплекса (антиген/антитело). Затем для обнаружения иммунного комплекса требуется меченый вторичный связывающий лиганд или антитело или вторичный связывающий лиганд или антитело в сочетании с меченым третичным антителом или третьим связывающим лигандом.
[0245] Кроме того, проточная цитометрия может применяться для обнаружения и количественного определения конкретных подтипов клеток в соответствии с маркерами клеточной поверхности. Обычные способы обнаружения и количественного определения с помощью проточной цитометрии включают применение флуоресцентно меченных гранул, которые связываются с маркерами клеточной поверхности, специфическими для каждого подтипа иммунных клеток, например, CD 4-специфические гранулы, для отбора CD 4+ Т-клеток и т.д.
[0246] Описанные в настоящем документе композиции могут, как правило, вводиться парентерально, путем инъекции, например, внутривенно, подкожно или внутримышечно. Композиции для внутривенного введения могут включать в себя стабилизаторы, вспомогательные вещества и консерванты. Композиции pMHC-наночастиц могут быть суспендированы в стерильном физиологическом растворе, забуференном физиологическом растворе или забуференном фосфатом физиологическом растворе. Кроме того, согласно определенным вариантам осуществления составы для внутривенного введения содержат декстрозу, глюкозу, маннит, рН-буферы или бикарбонат натрия. Дополнительные составы, которые подходят для других способов введения, включают в себя составы для перорального применения. Составы для перорального применения включают в себя такие, как правило, используемые вспомогательные вещества, как, например, маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния и т.п. фармацевтической степени чистоты. Эти композиции принимают форму растворов, суспензий, таблеток, пилюль, капсул, составов с замедленным высвобождением или порошков и содержат от приблизительно 10% до приблизительно 95% активного ингредиента, предпочтительно от приблизительно 25% до приблизительно 70%. Приготовление водной композиции, которая содержит комплекс антиген-МНС-наночастицы, который модифицирует иммунное состояние субъекта, будет известно специалистам в настоящей области техники в свете настоящего раскрытия. Согласно определенным вариантам осуществления композицию можно вводить в виде ингаляции (например, патент США № 6651655, который специально полностью включен посредством ссылки). Согласно одному варианту осуществления комплекс антиген-гетеродимер-наночастица (т.е. комплекс антиген-pMHC-NP) вводят системно. Согласно конкретным вариантам осуществления описанный в настоящем документе комплекс pMHC-NP или композиции, содержащие множество описанных в настоящем документе комплексов pMHC-NP, вводят внутривенно.
ПРИМЕРЫ
Пример 1. Экспрессия комплексов пептид-MHC (pMHC) с лейциновой молнией.
[0247] Для экспрессии комплексов pMHC в клетках CHO-S фрагменты ДНК, кодирующие комплекс pMHC (в разных конфигурациях, смотрите фиг. 2), клонируют в лентивирусный вектор экспрессии pLV/CMV-GW (фиг. 1A и 1B). Обе альфа- и бета-цепи комплекса pMHC кодируются одной ORF, либо в виде двух отдельных цепей, разделенных последовательностью ухода с рибосомы P2A (фиг. 2, вверху), либо в виде двух отдельных цепей, клонированных в двух разных векторах (фиг. 2, внизу). Фрагмент, кодирующий pMHC, клонируют перед кассетой IRES-EGFP. Экспрессированный продукт бета-цепи состоит из лидерной последовательности, последовательности эпитопа, GS-линкера, за которым следует внеклеточный домен бета-цепи и фрагмент C-Jun (40 аминокислот). Экспрессированная альфа-цепь содержит лидерную последовательность, внеклеточный домен альфа-цепи, фрагмент C-fos (40 аминокислот), сайт биотинилирования BirA (14 аминокислот) и метки 6X-гистидин и/или Strep с C-концевым цистеином. Предпочтительный дизайн вектора (фиг. 2, снизу) кодирует обе цепи на отдельных плазмидах.
Пример 2. Гетеродимеризация pMHC на основе «выступ-во-впадину».
[0248] Следующие эксперименты описывают попытки разработки гетеродимеров pMHC, которые предназначены для клинического применения у людей, обладающие улучшенными характеристиками безопасности, эффективности и регуляции; и поддаются очистке в больших количествах, необходимых для таких клинических применений. Современные биологические лекарственные средства, которые включают в себя стандартные метки эпитопа (например, FLAG, 6xHIS), не подходят с клинической точки зрения, потому что метка эпитопа может запускать выработку антител к лекарственному средству. Это особенно актуально, когда разные лекарственные средства несут одну и ту же метку или одно и то же лекарственное средство требует последующего введения. Например, инъекция пациенту с лекарственным средством A, очищенным с использованием метки эпитопа X, может привести к иммунному ответу против метки эпитопа X, так что любое последующее введение того же лекарственного средства или другого лекарственного средства с той же меткой эпитопа будет нейтрализовано ответом антител, который был получен при первом введении лекарственного средства А. Очистка без метки эпитопа создает проблему для выделения in vitro растворимых α-β гетеродимеров MHC класса II. Это связано с тем, что способы хроматографического разделения полипептидов МНС не позволяют очищать большие количества белка высокой чистоты.
[0249] Поэтому была предпринята попытка разработать рекомбинантные молекулы МНС класса II, которые облегчают очистку рекомбинантных pMHC: а) с повышенной секрецией из клеток СНО; b) без необходимости применять метки очистки и c) обеспечивая возможности биотинилирования мономеров для получения тетрамера без необходимости введения меток биотинилирования в последовательность. Первоначально была предпринята попытка получения стабильных гетеродимеров MHC класса II, несущих гетеродимеризующую лейциновую молнию, но слитых с версией «выступ-по-впадину» человеческого белка IgG1, в результате чего рекомбинантные гетеродимеры pMHC поддаются очистке от супернатантов культуры с использованием аффинной хроматографии с белком А или белком G. В качестве контроля получали версию, лишенную лейциновой молнии (фиг. 3, показано справа), и ожидалось, что она будет производить нестабильные гетеродимеры pMHC. Описанные в примере 1 выше конструкции (фиг. 1А, 1В и 2) выбирали для экспрессии, в которой альфа- и бета-цепи комплекса МНС кодируются одной ORF, кодирующей две отдельные цепи, разделенные последовательностью ухода с рибосомы Р2А. Также включали сайт биотинилирования BirA (14 аминокислот) (для обычного биотинилирования на основе ферментов), метки 6X гистидина и стрептококка (для дальнейшего повышения чистоты препаратов, если возникла такая необходимость) и C-концевой цистеин (для обеспечения конъюгации с функционализированными малеимидом наночастицами). Однако следует отметить, что наличие сайта биотинилирования, меток 6X-гистидина и стрептавидина является необязательным и может быть опущено, чтобы позволить очищать гетеродимеры с использованием белка A/G/L.
[0250] Вкратце, мышиные BDC2.5mi/IAg7 или человеческие IGRP13-25/DRB1*0301 альфа-цепи pMHC класса II с лейциновой молнией и без нее связывали с Fc-областью человеческого IgG1, модифицированного так, чтобы он содержал полипептидный «выступ». Аналогичным образом, конструкцию пептид-бета-цепь MHC (с лейциновой молнией и без нее) связывали с областью Fc человеческого IgG1, модифицированной так, чтобы она содержала полипептидную «впадину». В SEQ ID NO: 1-8 и 27-34 представлены последовательности ДНК и аминокислот соответствующих кодирующих pMHC кассет, соответственно.
[0251] Для экспрессии этих конструкций pMHC плазмиды, содержащие гены pMHC, сначала трансфицировали в клетки 293T вместе с плазмидами, кодирующими вирусное ядро HIV и белки оболочки для вирусной упаковки. Упакованные вирусные частицы затем использовали для трансдукции клеток CHO-S. Трансдуцированные клетки CHO-S, экспрессирующие самые высокие уровни eGFP, затем отбирали путем сортировки клеток посредством FACS. Дополнительно увеличивали количество клеток с высоким EGFP, хранили и затем использовали в качестве производственной клеточной линии pMHC.
[0252] Усилия были сосредоточены на кодирующей BDC2.5mi/IAg7 мышиной конструкции с лейциновой молнией C-Jun/C-Fos или без лейциновой молнии C-Jun/C-Fos. Обе клеточные линии СНО, трансдуцированные этими конструкциями, экспрессировали трансгенную РНК, что подтверждается экспрессией высоких уровней eGFP (измеренных способом проточной цитометрии) в соответствующих клеточных линиях. На фиг. 4А показаны клетки СНО, трансдуцированные кодирующими BDC2.5mi/IAg7 конструкциями с лейциновой молнией C-Jun/C-Fos 402 или без лейциновой молнии C-Jun/C-Fos 404 по сравнению с клетками СНО отрицательного контроля 401 и 403, соответственно. Супернатанты из клеток CHO-S концентрировали и очищали с использованием диализа. рMHC в концентрированной среде подвергали аффинной хроматографии на основе белка G и элюировали при кислотном pH. На фиг. 4С показано, что неожиданно, несмотря на экспрессию информационной РНК, клеточная линия СНО, экспрессирующая содержащие лейциновую молнию pMHC с «выступом-во-впадину», производила чрезвычайно низкие уровни pMHC. Смотрите пик 406 из профиля элюирования белка G (фиг. 4C). Наиболее неожиданным, как показано на фиг. 4B, было то, что клеточная линия, экспрессирующая pMHC с «выступом-во-впадину» без лейциновой молнии, экспрессировала обильные количества связывающего белок G материала. Смотрите пик 405 из профиля элюирования белка G (фиг. 4B).
[0253] Материал pMHC без молнии, собранный аффинной хроматографией с белком G, количественно оценивали и анализировали на его чистоту с помощью электрофореза как на нативном, так и на денатурирующем ДСН-ПААГ. На фиг. 5 показано, что материал pMHC без молнии, собранный аффинной хроматографией с белком G, прогонялся как одна полоса в невосстанавливающих условиях (слева от маркера), и что, как и ожидалось, эти молекулярные частицы прогонялись как три отдельные полосы в денатурирующем ДСН-ПААГ, паттерн удивительно похожий на тот, который наблюдается с pMHC, экспрессируемыми с использованием обычных конструкций на основе лейциновой молнии C-Jun/C-Fos. Смотрите 501 и 502 для одиночных полос в невосстанавливающих условиях и 503 для трех полос в денатурирующих условиях (фиг. 5).
Пример 3. Связывание комплексов pMHC с когнатными Т-клетками.
[0254] Чтобы проверить способность очищенного комплекса pMHC без молнии специфически связываться с когнатными Т-клетками, очищенный комплекс биотинилировали in vitro, а затем очищали с помощью анионообменной хроматографии. Биотинилированные фракции объединяли, диализовали и использовали для получения тетрамеров pMHC с использованием фторхром-конъюгированного стрептавидина. Эти реагенты затем проверяли на их способность специфически связываться с когнатными Т-клетками in vitro. Использовали CD4+ T-клетки селезенки от трансгенной мыши, экспрессирующей BDC2.5mi-специфический T-клеточный рецептор, в котором большинство CD4+ T-клеток обладают одинаковой антигенной специфичностью (в отличие от высокополиклонального антигенного репертуара TCR). В качестве положительного контроля использовали тетрамер, полученный с использованием мономеров pMHC, экспрессированных с использованием конструкций на основе лейциновой молнии C-Jun/C-Fos, описанных на фиг. 2. Как показано на фиг. 6, тетрамер на основе pMHC с «выступом-во-впадину» без молнии, выполненный по существу аналогично своему аналогу с молнией без Fc-слияния, демонстрировал осуществимость этого нового подхода.
Пример 4. Связывание pMHC без молнии с функционализированными малеимидом наночастицами.
[0255] Чтобы выяснить, может ли эта версия pMHC без молнии продуктивно соединяться с наночастицами, функционализированными малеимидом, с помощью C-концевого свободного цистеина, наночастицы PF-Mal инкубировали с очищенным белком и затем очищали для удаления конъюгатов из свободного pMHC с использованием магнитных колонок Miltenyi-Biotec. На левой панели на фиг. 7 показано изображение нативного геля свободного pMHC (дорожка N1: 2.5mi-выступ-во-впадину в количестве 6 мкг) в сравнении с конъюгированными с pMHC наночастицами (дорожка N2: 2.5mi-выступ-во-впадину-PFM-031716 в количестве 6,4 мкл и дорожка N3: 2.5mi-выступ-во-впадину-PFM-031716 в количестве 3,2 мкл). На фигуре показано, что большая часть pMHC в препаратах связана с наночастицами, которые не попадают в гель. На правой панели на фиг. 7 показано изображение геля ДСН-ПААГ, в котором те же препараты прогоняли в денатурирующих условиях (10% ДСН-ПААГ), которые отделяют pMHC от поверхности наночастиц. Дорожка 1 содержала набор маркерных белков, а дорожка 2 содержала 2.5mi-выступ-во-впадину в количестве 6 мкг. Дорожка 3 содержала 2.5mi-выступ-во-впадину-PFM-031716 в количестве 6,4 мкл, а дорожка 4 содержала 2.5mi-выступ-во-впадину-PFM-031716 в количестве 3,2 мкл. Изображение ясно показывает, что обе цепи pMHC без молнии продуктивно связаны с поверхностью наночастиц. Количественная оценка валентности pMHC показала, что на каждой наночастице было 42 pMHC, валентность, сравнимая с валентностью, полученной с обычными мономерами pMHC без молнии.
Пример 5. Увеличение количества ауторегуляторных Т-клеток с использованием наночастиц pMHC без молнии.
[0256] Была установлена способность наночастиц, покрытых pMHC без молнии, запускать образование и увеличение количества когнатных ауторегуляторных CD4+ T-клеток (T-регуляторных типа 1, TR1) in vivo, как в случае с их обычными аналогами pMHC (не выступ-во-впадину) с молнией. Как показано на фиг. 8, когнатные (тетрамер+) CD4+ Т-клетки увеличивают количество in vivo в ответ на обработку этим соединением, экспрессируют TR1-релевантные маркеры мРНК по сравнению с их некогнатными (тетрамер-негативными) аналогами, что определяется количественной ПЦР в реальном времени. На фиг. 9А и фиг. 9В показано, что в соответствии с этим, (тетрамер+) CD4+ Т-клетки увеличивают количество in vivo, в отличие от их тетрамер-негативных аналогов, секретируют TR1-релевантные цитокины при стимуляции моноклональными антителами к CD3 и к CD28 ex vivo. Таким образом, эти гетеродимеры pMHC на основе «выступ-во-впадину» без молнии обладают сходной биологической активностью по сравнению с активностью обычного pMHC с молнией.
Пример 6. Сайт-направленное биотинилирование гетеродимеров pMHC без молнии, лишенных метки биотинилирования (BirA).
[0257] В pMHC, полученных для терапевтических целей, должны отсутствовать посторонние белковые последовательности, которые могут быть мишенью иммунореактивности, такие как последовательность биотинилирования, на которую нацеливается фермент BirA, чтобы присоединить молекулу биотина. Биотинилирование pMHC через BirA представляет собой технику, как правило, используемую для получения биотинилированных мономеров pMHC, подходящих для тетрамеризации с использованием стрептавидина. Такие тетрамеры pMHC и их производные более высокого порядка (пентамеры, декстрамеры и т.д., совместно определенные как «мультимеры») применимы в качестве реагентов, способных подсчитывать частоту антигенспецифических Т-клеток в биологических образцах. В настоящем документе ниже описан способ, который позволяет получать мультимеры pMHC из мономеров pMHC без меток биотинилирования, таким образом, позволяя применять мономеры pMHC, полученные в терапевтических целях (например, для доставки через наночастицы), для получения их диагностических производных.
[0258] Это было достигнуто путем присоединения одной молекулы биотина к карбокси-концевому цистеину мономеров BDC2.5mi/IAg7 через соединенный с биотином спейсер полиэтиленгликоля (ПЭГ), который функционализирован малеимидом. Вкратце, pMHC и биотин-ПЭГ-малеимидные линкеры различной длины инкубировали в течение ночи и затем подвергали обширному диализу через мембраны с отсечкой молекулярной массы 12-14 кДа для удаления свободного биотин-PEG-малеимида. Полученную смесь подвергали анионообменной хроматографии на колонках monoQ (фиг. 10), чтобы идентифицировать элюированные фракции, содержащие биотинилированные молекулы pMHC, посредством ИФА. Смотрите пиковое поглощение УФ-излучения в 1001 на фиг. 10. Положительные фракции затем анализировали на денатурирующих гелях ДСН-ПААГ. Как показано на фиг. 11, фракции 25, 27, 28, 29, 30, 31, 32, 33 и 34 содержали самую высокую концентрацию биотинилированного pMHC. Как показано на фиг. 12, вестерн-блоттинг для альфа-цепи МНС подтвердил, что фракции 25, 27, 28, 29, 30, 31, 32, 33 и 34 содержали биотинилированный гетеродимер МНС. Молекулы pMHC, содержащиеся в этих фракциях, затем заменяли буфером и использовали для получения тетрамеров pMHC, используя фторхром-конъюгированный стрептавидин. Такие тетрамеры pMHC затем исследовали на их способность связываться с трансгенными CD4+ T-клетками рецептора Т-клеток BDC2.5 с использованием проточной цитометрии (фиг. 13).
[0259] Первоначальные эксперименты с ПЭГ различной длины были безуспешными. Удивительно, но эксперименты с использованием низкомолекулярного биотин-ПЭГ-малеимида, содержащего только две единицы ПЭГ, дали успешные результаты, предполагая, что присутствие даже небольших количеств свободных неконъюгированных молекул биотин-ПЭГ-малеимида достаточно для того, чтобы препятствовать образованию тетрамера.
Пример 7. Синтез пегилированных наночастиц Fe (НР) способом теплового разложения (PFM).
[0260] Материалы для синтеза включали в себя ацетилацетонат железа (III) {Fe(acac)3, Fe(C5H7O2)3}, М.м. 353,17, (Sigma-Aldrich, № в каталоге 517003-50G); бензиловый эфир {(C6H5CH2)2O}, М.м. 198,26 (Sigma-Aldrich, № в каталоге 108014-1KG); гексан, CH3(CH2)4CH3, М.м. 86,18 (Sigma-Aldrich, № в каталоге 34859-1L); FeCl3.6H2O, М.м. 270,3 (Sigma-Aldrich, № в каталоге 44944-50G); мПЭГ2000-малеимид, (JenKem Tech USA, № в каталоге A3214-10);
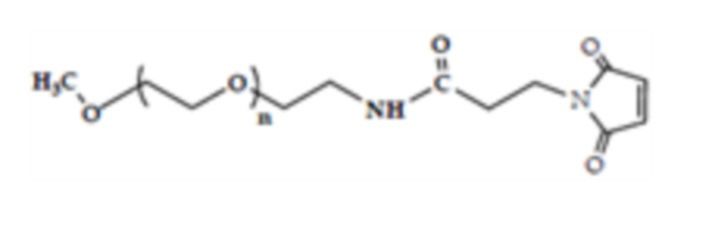
Нагревательный кожух из полусферической ткани, 50 мл (Safety Emporium, лаборатория и расходные материалы, № изделия: 20310); управление питанием DigiTril II, (Safety Emporium, лаборатория и расходные материалы, № изделия: 20010); круглодонная варочная колба объемом 50 мл (VWR, № в каталоге 89091-464, соединение 24/40); спиральный конденсатор (VWR, № в каталоге 89053-932, соединение 24/40); настольная центрифуга с поворотным ротором, (Beckman Coulter, центрифуга Allegra 25R); высокоскоростная центрифуга (Sorvall RC-6 Plus, Thermo Scientific) с ротором SS5; стеклянные центрифужные пробирки объемом 30 мл (Corex, № 8445) с переходниками для ротора SS5; колонки LS и магниты (Miltenyi Biotech, № в каталоге 130-042-041); трансмиссионный электронный микроскоп (H7650, Hitachi); THERMOMIXER®, (Eppendorf, 24-луночный); спектрофотометр (UV-2550, SHIMADZU) и микрокювета для спектрофотометрии (100 мкл).
Протокол реакции:
[0261] Кипящую колбу объемом 50 мл помещают на нагревательный кожух на мешалке. Нагревательный кожух соединяют с регулятором мощности DigiTril II. ПЭГ2000-малеимид (1,5 г) добавляют в кипящую колбу. Температуру устанавливают равной 80°C, нагревая материал ПЭГ до полного расплавления материала ПЭГ. При перемешивании в кипящую колбу добавляют бензиловый эфир (3,5 мл) и Fe(acac)3 (353 мг). Смесь обезвоживают при температуре 110°С в течение 1 часа. Спиральный конденсатор прикрепляют к кипящей колбе. Смесь нагревают до температуры 260°С. Цвет смеси превращается из черного в темно-коричневый. Температуру смеси поддерживают при 260°С в течение 2 ч с обратным холодильником, после чего смесь постепенно охлаждают до комнатной температуры. К смеси добавляют воду, не содержащую эндотоксинов (20 мл). Смесь переносят в одну коническую пробирку объемом 50 мл и интенсивно встряхивают в течение 2 мин. Смесь центрифугируют при 4000 об/мин в течение 20 минут с использованием настольной центрифуги. Гранулы выбрасывают. К смеси добавляют гексан (15 мл) и смесь интенсивно встряхивают в течение 2 минут. Смесь центрифугируют при 4000 об/мин в течение 10 минут с использованием настольной центрифуги. Черную водную фракцию (низкая фракция) из каждой пробирки собирают и переносят в коническую пробирку объемом 50 мл. Промывку гексаном повторяют три раза. Черный раствор переносят в две стеклянные центрифужные пробирки объемом 30 мл. Каждую пробирку центрифугируют при 20000 об/мин в течение 20 минут с использованием высокоскоростной центрифуги. Черный раствор переносят в коническую пробирку объемом 50 мл, а гранулы выбрасывают. Черный раствор очищают с использованием колонки LS (например, черный раствор (2-3 мл) загружают для очистки, раствор сливают через колонку и колонку промывают 3 раза 5 мл воды). Очищенные NP PFM собирают путем проталкивания NP, удерживаемых в колонке LS, в чистую коническую пробирку объемом 50 мл. Раствор NP PFM стерилизуют, пропуская через серию шприцевых фильтрующих устройств с размерами пор 0,45 мкм, 0,2 мкм и 0,1 мкм.
Характеристика продукта:
1. Размер частиц и монодисперсность:
1a. Размер ядра из оксида железа отдельных наночастиц PFM: анализ с помощью трансмиссионной электронной микроскопии (ТЕМ).
[0262] Подготовка образца для анализа ТЕМ: раствор NP PFM (20 мкл) разводят в воде (40 мкл), и разведенный раствор NP PFM (10 мкл) капают на поверхность медной сетки, покрытой поливинилформаваром (Electron Microscopy Sciences, № в каталоге FF300-Cu) или углеродной пленкой (Electron Microscopy Sciences, № в каталоге CF300-Cu). Остаточный раствор удаляют с помощью фильтровальной бумаги.
[0263] TEM-анализ проводят с использованием H7650 (Hitachi) при увеличении от 10000 до 40000 X. Размер 30-50 NP PFM измеряют для получения среднего размера (средний размер ядер NP PFM ожидается в диапазоне 18-20 нм).
1b. Гидродинамический размер NP PFM:
Анализ динамического рассеяния света (DLS).
[0264] Раствор NP PFM (20 мкл) разводят в 1 мл воды в кювете DLS и исследуют с использованием устройства Zeta NanoSizer (Мелверн, Великобритания) для определения размера DLS NP PFM в растворе. Ожидается одиночный пик при ~ 45-50 нм.
2. Концентрация железа (спектрофотометрический анализ):
2а. Стандарт концентрации Fe:
[0265] Стандартный раствор 2 мг Fe/мл готовят растворением FeCl3.6H2O (48,3 мг) в деионизированной H2O (5 мл). Стандартный раствор (20 мкл) добавляют к 6 н. HCl (400 мкл) в микропробирке 1. Разбавленный стандартный раствор (200 мкл) из микропробирки 1 переносят в микропробирку 2, содержащую 200 мкл 6 н. HCl. Разбавленный стандартный раствор (200 мкл) из микропробирки 2 переносят в микропробирку 3, содержащую 6 н. HCl (200 мкл). Разбавления повторяют еще 4 раза.
2b. Раствор образца:
[0266] Раствор NP PFM (20 мкл) добавляют к 6 н. HCl (400 мкл) в микропробирке S1 и перемешивают. Разведенный раствор NP PFM (200 мкл) из микропробирки S1 переносят в микропробирку S2, содержащую 6 н. HCl (200 мкл). Разведенный раствор NP PFM (200 мкл) из микропробирки S2 переносят в микропробирку S3, содержащую 6 н. HCl (200 мкл). Разведение раствора NP PFM повторяют еще 3 раза.
2с. Нагревание образца:
[0267] Микропробирки, содержащие серийно разведенные стандартные растворы Fe и NP PFM, нагревают до температуры 60°C в течение 30 минут, а затем охлаждают до комнатной температуры.
2d. Спектрофотометрия:
[0268] Поглощение растворов стандарта Fe и NP PFM при A410 (λ=410 нм) измеряют с использованием спектрофотометра с микрокюветой (100 мкл).
2е. Расчеты:
[0269] Строят стандартную кривую. Рассчитывают концентрацию железа в растворе NP PFM.
3. Поверхностный заряд и химия
3a. Поверхностный заряд NP PFM: измерение дзета-потенциала.
[0270] Раствор NP PFM (100 мкл) разводят деионизированной водой (1 мл) в капиллярной ячейке. Дзета-потенциал NP PFM определяют с использованием устройства Zeta NanoSizer (Мелверн, Великобритания).
3b. Анализ поверхностных экспонирующих функциональных групп: инфракрасный спектроскопический анализ с преобразованием Фурье (FT-IR).
[0271] Контрольные образцы: образцы mPEG-Mal помещают на планшет ATR (аттенюированное полное отражение).
[0272] Образцы NP PFM: раствор NP PFM (10 мкл) помещают на планшет ATR и сушат на воздухе.
[0273] FT-IR анализ: спектры FT-IR контрольного ПЭГ и ПЭГ, закрепленного на поверхности PFM-NP, производятся спектрофотометром Nicolet FT-IR в режиме ATR (аттенюированное полное отражение). Каждый из спектров записывается как среднее из 256 сканирований при спектральном разрешении 4 см-1.
Пример 8. Приготовление конъюгатов pMHC-наночастицы (pMHC-PFM).
[0274] Материалы для синтеза включали в себя фосфатный буферный раствор (PBS), pH 7,2-7,4; 200 мМ фосфатный буфер, рН 6,2; белок pMHC-Cys в PBS (1-6 мг/мл, один остаток цистеина добавляют к C-концу альфа-цепи pMHC посредством молекулярного конструирования); 1 М раствор хлорида натрия; 0,5 М раствор ЭДТА, рН 8,0; раствор NP PFM (1-3 мг Fe/мл); колонки и магниты LS (Miltenyi Biotech, № в каталоге 130-042-041); трансмиссионный электронный микроскоп (H7650, Hitachi); THERMOMIXER®, (Eppendorf, 24-луночный); спектрофотометр (UV-2550, SHIMADZU) и микрокювету для спектрофотометрии (100 мкл).
Протокол реакции конъюгации:
[0275] Белок pMHC-cys (М.м. ~ 55 кДа) и NP PFM (18-20 нм, приблизительно 1×1014 NP/мг Fe) смешивают при молярном соотношении 100:1 в 40 мМ фосфатном буфере, pH 6,2, содержащем 150 мМ NaCl и 2 мМ ЭДТА. Общий объем реакционного раствора (содержит NP PFM, эквивалентный 1-5 мг Fe) составляет 10 мл. Ожидается, что степень восстановления будет составлять 40-50% как для белка pMHC, так и для PFM-NP. Фосфатный буфер, рН 6,2 (2,0 мл), добавляют в коническую пробирку объемом 15 мл. Добавляют 0,5 М раствор ЭДТА (0,04 мл) и 1 М раствор хлорида натрия для доведения конечной концентрации до 150 мМ. Воду добавляют для доведения конечного реакционного объема до 10 мл, включая в себя объем растворов белка и NP PFM. Добавляют белок pMHC (3 мг). Реакционную смесь инкубируют в течение ночи при комнатной температуре при осторожном встряхивании. Реакционный раствор переносят в коническую пробирку объемом 50 мл и добавляют PBS (30 мл). Реакционный раствор инкубируют в течение 30 минут при комнатной температуре в условиях осторожного встряхивания. Реакционный раствор очищают с использованием колонки LS (например, реакционный раствор (5 мл) загружают для очистки, раствор сливают через колонку и колонку промывают 3 раза 5 мл PBS). Очищенные NP PFM собирают путем проталкивания NP, удерживаемых в колонке LS, в коническую пробирку объемом 15 мл. Очищенный раствор pMHC-PFM NP стерилизуют путем пропускания через шприцевое фильтрующее устройство с размером пор 0,45 мкм. Раствор pMHC-PFM NP хранят при температуре 4°C.
Продукт:
[0276] pMHC-PFM NP с валентностью pMHC ~ 50 pMHC/NP в PBS, pH 7,4.
Пример 9. Биотинилирование мономеров pMHC с помощью биотин-ПЭГ-малеимида.
Реакция биотинилирования
[0277] Белок (pMHC класса II, содержащий свободный цистеин в хвосте) (5,0 мг) растворяют в 40 мМ фосфатном буфере с рН 6,2 (2,0 мл) с 2 мМ ЭДТА. PBS (190 мкл) добавляют к малеимид-ПЭГ2-биотину EZ-link (2,0 мг) с получением 20 мМ исходного раствора. (Thermo Scientific: № в каталоге 21902BID, описание: EZ-Link®, малеимид-ПЭГ2-биотин, формат No-Weigh™, 8×2 мг) (каждый раз готовится свежим). Исходный раствор (78,12 мкл) быстро добавляли к раствору белка (это дает 20-кратный молярный избыток малеимид-ПЭГ2-биотина по отношению к белку). Реакционную пробирку накрывают алюминиевой фольгой для защиты от света и выдерживают в течение ночи при комнатной температуре в условиях осторожного встряхивания. Избыток малеимид-ПЭГ2-биотина удаляют, выполняя замену буфера на 20 мМ Трис, рН 8,0, используя ультрацентробежное устройство 10KD amicon (Millipore: № в каталоге UFC801024) по меньшей мере 5 раз. Чтобы обеспечить удаление избытка малеимид-ПЭГ2-биотина, раствор белка диализируют с использованием отсечной мембраны 12-14 кДа (Spectra/Por®: № в каталоге 132678) в 20 мМ Трис, рН 8,0 в течение ночи. (Загрязнение избытка малеимид-ПЭГ2-биотина может помешать очистке и биотин-специфическому скринингу ИФА.) Образец белка собирают для очистки mono-Q.
Очистка - ионообменная хроматография Mono-Q
[0278] Линию A помещают в буфер A [20 мМ Трис, рН 8,0], а линию B помещают в буфер B [20 мМ Трис + 400 мМ NaCl]. ddH2O (10-20 мл) впрыскивают в пробоотборную петлю, и все, кроме ~ 0,5 мл, вводятся вручную для промывки пробоотборной петли. Колонку Mono-Q и адаптер ограничителя потока (FR902) присоединяют к FPLC. Колонку уравновешивают буфером А. Объем реакционной смеси для биотинилирования белка увеличивают с помощью 20 мМ Трис, рН от 8,0 до 5-10 мл. Смесь впрыскивают шприцем в супер-петлю (INV-900). Образец вводят для связывания с колонкой, несвязанный белок вымывают, а связанный белок элюируют градиентом буфера B. Все фракции элюирования, связанные с пиками хроматограммы, собирают. Колонку промывают после каждого прогона в соответствии с протоколом производителя, при промывании со скоростью 0,5 мл/мин минимум: 2 мл 2 М NaCl, 4 мл 1 М NaOH и 2 мл 2 М NaCl снова. Колонку промывают водой до тех пор, пока базовая линия не станет стабильной (минимум 2 мл). Колонку переворачивают для очистки по мере необходимости. Линии A и B помещают в 20%-ный этанол, после чего выполняют PumpWash, а затем промывание, чтобы промыть колонку для хранения. Затем колонку и ограничитель потока удаляют, а пробоотборную петлю очищают от любого остаточного белка.
ИФА для идентификации биотинилированного мономера
[0279] Планшет для ИФА покрывают 2-20 мкл (в зависимости от интенсивности пика) каждой фракции элюирования, собранной в общей сложности до 100 мкл с PBS на лунку, в двух экземплярах. Планшет инкубируют при температуре 37°С в течение 1-2 ч. Положительным контролем является разведение 1:200 анти-мышиного Kd-биотина. Отрицательный контроль представляет собой PBS. Планшеты промывают 3 раза 150 мкл 0,05% Твин-20 в PBS. 100 мкл HRP-экстравидин (Sigma: № в каталоге E2886-1ML), разведение 1:2000 в блокирующем буфере (1% БСА, 0,02% NaN3 в PBS), добавляют на лунку и планшет инкубируют при комнатной температуре в течение 30 мин. Планшет промывают 3 раза 150 мкл 0,05% Твин-20 в PBS. Предварительно нагретый субстрат TMB (100 мкл) добавляют на лунку, и планшет инкубируют 15-30 минут (в зависимости от изменения цвета) при комнатной температуре в темноте. 2 н. H2SO4 (50 мкл) добавляют на лунку, чтобы остановить реакцию. Планшеты оценивают при OD450-570нм. Отрицательный контроль должен характеризоваться OD450-570нм ~ 0,005. Положительный контроль должен характеризоваться OD450-570нм ~ 3. Хороший положительный образец характеризуется прочтением OD450-570нм от 2 до 3.
ДСН-ПААГ и вестерн-блоттинг для идентификации биотинилированного мономера
[0280] ДСН-ПААГ запускают для каждой фракции очистки моно-Q (10-20 мкл/лунку, в зависимости от интенсивности пика), чтобы идентифицировать фракции белка с желаемым профилем полос. Для вестерн-блоттинга: проводят еще один ДСН-ПААГ с 2 мкг каждой фракции на лунку. Гель инкубируют в буфере для переноса в течение 15 минут (буфер для переноса: 25 мМ Трис, 190 мМ глицин, 20% метанол, рН 8,3). Собирают сэндвич переноса и переносят при постоянном напряжении 18 В течение 15 минут. Мембрану инкубируют с блокирующим буфером в течение от 1 часа до ночи (блокирующий буфер: 3% БСА в 20 мМ трис-буфере с 150 мМ хлорида натрия рН 7,5). Мембрану инкубируют в HRP-экстравидин (1:2000, разведенном в блокирующем буфере) в течение 1 часа при комнатной температуре. Мембрану промывают TBST 5 раз (TBST: 20 мМ Трис, 150 мМ NaCl, 0,1% Твин 20, рН 7,5). Изображение получают путем добавления хемилюминесцентного субстрата (Thermo Scientific: № в каталоге 34087) (ожидается наличие одной полосы в положении альфа-цепи).
Сбор биотинилированного мономера:
[0281] В зависимости от анализа ИФА, ДСН-ПААГ и вестерн-блоттинга желаемые фракции объединяют, и замену буфера на PBS осуществляют с использованием ультрацентробежного устройства amicon 10KD. Концентрацию биотинилированного мономера измеряют по методу Брэдфорда и аликвотируют в несколько пробирок с четкой меткой.
[0282] Тетрамер pMHC получают с использованием стрептавидина-РЕ для окрашивания когнатных CD4+ Т-клеток, по-видимому, потому что свободные неконъюгированные молекулы биотин-ПЭГ-малеимида, которые были в избытке, не могут быть надлежащим образом удалены и, таким образом, препятствуют образованию тетрамера. Материал хранится при температуре -80°С.
Пример 10. Гетеродимеры pMHC с «выступом-во-впадину» без лейциновой молнии с цис-ловушкой стабилизируют гетеродимеры pMHC.
[0283] Для некоторых пептидных гетеродимеров MHC класса II достаточно архитектуры типа «выступ-во-впадину». Однако некоторые гетеродимеры требуют дополнительной стабилизации. Гетеродимеры HLA DR3 в комплексе с полипептидом IGRP13-25 не могли экспрессироваться, когда были сконструированы с «выступом-во-впадину» и у них отсутствовала лейциновая молния, как показано отсутствием пика элюирования в профиле FPLC 1401 на фиг. 14А и геле ДСН-ПААГ элюированной фракции, показанной на фиг. 14С. Когда вводили цистеин на С-конце IGRP13-25 между спейсером, который соединяет полипептид IGRP с доменом впадины-бета (SEQ ID NO: 61) и экспрессируется с помощью домена выступ-альфа (SEQ ID NO: 60), были способны образовываться стабильные гетеродимеры. Смотрите пики элюирования 1402 на фиг. 14B и ДСН-ПААГ на фиг. 14D.
Пример 11. Гетеродимеры IGRP13-25/DR3 pMHC связываются с клеточными линиями, экспрессирующими когнатный TCR
[0284] Затем исследовали способность гетеродимеров IGRP13-25 pMHC-DR3 с «выступом-во-впадину» без молнии с цис-ловушкой связываться с рецептором Т-клеток. Для этого использовали репортерную клеточную линию, экспрессирующую альфа- и бета-цепь человеческого рецептора Т-клеток, специфического для IGRP13-25 pMHC-DR3.
Протокол трансдукции клеточной линии JURMA-hCD4 с ретровирусом, кодирующим IGRP-TCR
[0285] Создание линии упаковочных клеток GP+EnvAM12. Авторы настоящего изобретения трансфицировали клетки 293T ретровирусом, экспрессирующим IGRP-TCR, и репортером GFP, а также упаковочными конструкциями gag/pol и VSV. Через три дня VSV-псевдотипированные обогащенные супернатанты собирали, делили на аликвоты и замораживали. Эти аликвоты использовали для трансдукции амфотрофной упаковочной клеточной линии GP+envAm12 (ATCC CRL-9641) путем инфицирования центрифугированием (2700 об/мин, 1 ч). После 5 инфицирований центрифугированием трансдуцированный GP+envAm12 сортировали для экспрессии GFP, если это необходимо.
Трансдукция клеточной линии JURMA-hCD4 ретровирусом, кодирующим IGRP-TCR
[0286] Три миллиона трансдуцированных и отсортированных GP+envAm12 высевали на лунку 6-луночного планшета в конечном объеме 3 мл. На следующий день 100000 JURMA-hCD4 совместно культивировали с предварительно нанесенными трансдуцированными GP+envAm12 в конечном объеме 3 мл с добавлением 8 мкг/мл полибрена. Эту совместную культуру поддерживали в течение двух недель, меняя среду каждые 2 или 3 дня. После совместного культивирования клетки JURMA-hCD4 собирали, анализировали проточной цитометрией и сортировали для высокой экспрессии трансгена. Затем клетки окрашивали РЕ меченными гетеродимерами. На фиг. 15А изображены неокрашенные клетки в качестве отрицательного контроля, на фиг. 15D изображены клетки, окрашенные нерелевантным тетрамером, на фиг. 15В изображено окрашивание тетрамерами, полученными из гетеродимеров, экспрессированных с использованием технологии цис-ловушки и лейциновой молнии, на фиг. 15С изображены тетрамеры, изготовленные из гетеродимеров, экспрессированных с использованием технологии цис-ловушки и «выступ-во-впадину», без лейциновой молнии. Окрашивание между гетеродимерами, полученными с использованием любой технологии, было устойчивым. Эти данные демонстрируют, что гетеродимеры, изготовленные с использованием технологии без молнии с цис-ловушкой могут связывать рецептор Т-клеток.
Пример 12. Гетеродимеры pMHC IGRP13-25/DR3 с «выступом-во-впадину» стимулируют репортерные клеточные линии in vitro.
[0287] Способность стабилизированных гетеродимеров с цис-ловушкой и «выступом-во-впадину» при присоединении к наночастицам оксида железа, стимулировать передачу сигналов Т-клетками исследовали с использованием клеток Jurma, экспрессирующих TCR IGRP13-25 человека и люциферазу под контролем промотора NFAT. Эти результаты, показанные на фиг. 16А и фиг. 16B показывают, что стабилизированные гетеродимеры с цис-ловушкой и «выступом-во-впадину», когда они присоединены к наночастицам оксида железа, способны индуцировать передачу сигналов Т-клетками.
[0288] Хотя некоторые варианты осуществления были проиллюстрированы и описаны, следует понимать, что в них могут быть внесены изменения и модификации в соответствии с обычными навыками в настоящей области техники без отхода от технологии в ее более широких аспектах, как определено в следующей формуле изобретения.
[0289] Варианты осуществления, иллюстративно описанные в настоящем документе, могут подходящим образом применяться на практике в отсутствие какого-либо элемента или элементов, ограничения или ограничений, конкретно не раскрытых в настоящем документе. Таким образом, например, термины «содержащий», «включающий в себя», «состоящий» и т.д. следует читать в широком смысле и без ограничений. Кроме того, используемые в настоящем документе термины и выражения использовались в качестве терминов описания, а не ограничения, и при использовании таких терминов и выражений нет намерения исключать какие-либо эквиваленты показанных и описанных признаков или их частей, но признается, что возможны различные модификации в пределах объема заявленной технологии. Кроме того, фраза «состоящий по существу из» будет пониматься как включающая в себя те элементы, которые конкретно указаны, и те дополнительные элементы, которые не оказывают существенного влияния на основные и новые характеристики заявленной технологии. Фраза «состоящий из» исключает любой не указанный элемент.
[0290] Настоящее раскрытие не должно быть ограничено терминами конкретных вариантов осуществления, описанных в настоящей заявке. Многие модификации и изменения могут быть сделаны без отклонения от его сущности и объема, как будет очевидно специалистам в настоящей области техники. Функционально эквивалентные способы и композиции в пределах объема настоящего раскрытия, в дополнение к тем, которые перечислены в настоящем документе, будут очевидны для специалистов в настоящей области техники из предшествующего описания. Такие модификации и вариации предназначены для попадания под охват прилагаемой формулы изобретения. Настоящее раскрытие должно быть ограничено только терминами прилагаемой формулы изобретения, а также полным объемом эквивалентов, на которые имеют право такие формулы. Также следует понимать, что используемая в настоящем документе терминология предназначена только для описания конкретных вариантов осуществления и не предназначена для ограничения.
[0291] Кроме того, когда признаки или аспекты настоящего раскрытия описаны в терминах групп Маркуша, специалисты в настоящей области техники поймут, что раскрытие также таким образом описано в терминах любого отдельного представителя или подгруппы представителей группы Маркуша.
[0292] Как будет понятно специалисту в настоящей области техники, для любых и всех целей, особенно с точки зрения предоставления письменного описания, все раскрытые в настоящем документе диапазоны также охватывают любые и все возможные поддиапазоны и комбинации их поддиапазонов. Любой из перечисленных диапазонов может быть легко распознан как в достаточной степени описывающий и позволяющий разбить один и тот же диапазон по меньшей мере на равные половины, трети, четверти, пятые, десятые и т.д. В качестве неограничивающего примера каждый обсуждаемый в настоящем документе диапазон можно легко разбить на нижнюю треть, среднюю треть и верхнюю треть и т.д. Как будет понятно специалисту в настоящей области техники, все выражения, такие как «до», «по меньшей мере», «более чем», «менее чем» и подобные включают в себя приведенное число и относятся к диапазонам, которые могут быть впоследствии разбиты на поддиапазоны, как обсуждалось выше. Наконец, как будет понятно специалисту в настоящей области техники, диапазон включает в себя каждого отдельного представителя.
[0293] Все публикации, заявки на патенты, выданные патенты и другие документы, указанные в настоящем описании, включены в настоящий документ посредством ссылки, как если бы каждая отдельная публикация, заявка на патент, выданный патент или другой документ были специально и индивидуально указаны для полного включения посредством ссылки. Определения, которые содержатся в тексте, включенном посредством ссылки, исключаются в той степени, в которой они противоречат определениям в настоящем раскрытии.
[0294] Другие варианты осуществления изложены в следующей формуле изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЮТиАй ЛИМИТЕД ПАРТНЕРШИП
<120> РЕКОМБИНАНТНЫЕ МОЛЕКУЛЫ PMHC КЛАССА II
<130> 42363-711.601
<140>
<141>
<150> 62/419,947
<151> 2016-11-09
<160> 65
<170> PatentIn версия 3.5
<210> 1
<211> 3171
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 1
atgggttctc tgcaaccgct ggccaccttg tacctgctgg gtatgctggt cgctagcagc 60
ctcggacagc acctgcagaa ggactacaga gcctactaca ccttcggagg tggaggcggc 120
tcaggaggtg gaagcggcgg ctctggggac acccgaccac gtttcttgga gtactctacg 180
tctgagtgtc atttcttcaa tgggacggag cgggtgcggt acctggacag atacttccat 240
aaccaggagg agaacgtgcg cttcgacagc gacgtggggg agttccgggc ggtgacggag 300
ctggggcggc ctgatgccga gtactggaac agccagaagg acctcctgga gcagaagcgg 360
ggccgggtgg acaactactg cagacacaac tacggggttg tggagagctt cacagtgcag 420
cggcgagtcc atcctaaggt gactgtgtat ccttcaaaga cccagcccct gcagcaccat 480
aacctcctgg tctgttctgt gagtggtttc tatccaggca gcattgaagt caggtggttc 540
cggaatggcc aggaagagaa gactggggtg gtgtccacag gcctgatcca caatggagac 600
tggaccttcc agaccctggt gatgctggaa acagttcctc ggagtggaga ggtttacacc 660
tgccaagtgg agcacccaag cgtgacaagc cctctcacag tggaatggag agcacggtct 720
gaatctgcac agagcaagtc cggaggcgga ggcggacgga tcgctcggct agaggaaaaa 780
gtgaaaacct tgaaagcgca aaactccgag ctggcgtcca cggccaacat gctcagggaa 840
caggtggcac agcttaagca gaaagtcatg aaccacgaca aaactcacac atgcccaccg 900
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 960
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 1020
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 1080
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 1140
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 1200
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 1260
tgcaccctgc ccccatcccg ggatgagctg accaagaacc aggtcagcct gagctgcgcg 1320
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 1380
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctcgtcagc 1440
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 1500
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc cggcggctcc 1560
ggagccacga acttctctct gttaaagcaa gcaggagacg tggaagaaaa ccccggtccc 1620
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcatcaa agaagaacat 1680
gtgatcatcc aggccgagtt ctatctgaat cctgaccaat caggcgagtt tatgtttgac 1740
tttgatggtg atgagatttt ccatgtggat atggcaaaga aggagacggt ctggcggctt 1800
gaagaatttg gacgatttgc cagctttgag gctcaaggtg cattggccaa catagctgtg 1860
gacaaagcca acctggaaat catgacaaag cgctccaact atactccgat caccaatgta 1920
cctccagagg taactgtgct cacaaacagc cctgtggaac tgagagagcc caacgtcctc 1980
atctgtttca tagacaagtt caccccacca gtggtcaatg tcacgtggct tcgaaatgga 2040
aaacctgtca ccacaggagt gtcagagaca gtcttcctgc ccagggaaga ccaccttttc 2100
cgcaagttcc actatctccc cttcctgccc tcaactgagg acgtttacga ctgcagggtg 2160
gagcactggg gcttggatga gcctcttctc aagcactggg agtttgatgc tccaagccct 2220
ctcccagaga ctacagagtc cggaggcgga ggcggactga cagatacact ccaagcggag 2280
acagatcaac ttgaagacga gaagtctgcg ttgcagaccg agattgccaa tctactgaaa 2340
gagaaggaaa aactggagtt tattttggca gcccacgaca aaactcacac atgcccaccg 2400
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 2460
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 2520
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 2580
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 2640
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 2700
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 2760
tacaccctgc ccccatgccg ggatgagctg accaagaacc aggtcagcct gtggtgcctg 2820
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 2880
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctctacagc 2940
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 3000
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc gggcggtagt 3060
ggtagtggta gtggatctct gggtggtatc ttcgaggcta tgaagatgga gctgcgcgat 3120
caccatcacc atcaccataa ctggagccac cctcagttcg agaagtgttg a 3171
<210> 2
<211> 2931
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид "
<400> 2
atgggttctc tgcaaccgct ggccaccttg tacctgctgg gtatgctggt cgctagcagc 60
ctcggacagc acctgcagaa ggactacaga gcctactaca ccttcggagg tggaggcggc 120
tcaggaggtg gaagcggcgg ctctggggac acccgaccac gtttcttgga gtactctacg 180
tctgagtgtc atttcttcaa tgggacggag cgggtgcggt acctggacag atacttccat 240
aaccaggagg agaacgtgcg cttcgacagc gacgtggggg agttccgggc ggtgacggag 300
ctggggcggc ctgatgccga gtactggaac agccagaagg acctcctgga gcagaagcgg 360
ggccgggtgg acaactactg cagacacaac tacggggttg tggagagctt cacagtgcag 420
cggcgagtcc atcctaaggt gactgtgtat ccttcaaaga cccagcccct gcagcaccat 480
aacctcctgg tctgttctgt gagtggtttc tatccaggca gcattgaagt caggtggttc 540
cggaatggcc aggaagagaa gactggggtg gtgtccacag gcctgatcca caatggagac 600
tggaccttcc agaccctggt gatgctggaa acagttcctc ggagtggaga ggtttacacc 660
tgccaagtgg agcacccaag cgtgacaagc cctctcacag tggaatggag agcacggtct 720
gaatctgcac agagcaagtc cggaggcgga ggcggagaca aaactcacac atgcccaccg 780
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 840
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 900
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 960
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 1020
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 1080
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 1140
tgcaccctgc ccccatcccg ggatgagctg accaagaacc aggtcagcct gagctgcgcg 1200
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 1260
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctcgtcagc 1320
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 1380
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc cggcggctcc 1440
ggagccacga acttctctct gttaaagcaa gcaggagacg tggaagaaaa ccccggtccc 1500
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcatcaa agaagaacat 1560
gtgatcatcc aggccgagtt ctatctgaat cctgaccaat caggcgagtt tatgtttgac 1620
tttgatggtg atgagatttt ccatgtggat atggcaaaga aggagacggt ctggcggctt 1680
gaagaatttg gacgatttgc cagctttgag gctcaaggtg cattggccaa catagctgtg 1740
gacaaagcca acctggaaat catgacaaag cgctccaact atactccgat caccaatgta 1800
cctccagagg taactgtgct cacaaacagc cctgtggaac tgagagagcc caacgtcctc 1860
atctgtttca tagacaagtt caccccacca gtggtcaatg tcacgtggct tcgaaatgga 1920
aaacctgtca ccacaggagt gtcagagaca gtcttcctgc ccagggaaga ccaccttttc 1980
cgcaagttcc actatctccc cttcctgccc tcaactgagg acgtttacga ctgcagggtg 2040
gagcactggg gcttggatga gcctcttctc aagcactggg agtttgatgc tccaagccct 2100
ctcccagaga ctacagagtc cggaggcgga ggcggagaca aaactcacac atgcccaccg 2160
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 2220
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 2280
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 2340
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 2400
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 2460
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 2520
tacaccctgc ccccatgccg ggatgagctg accaagaacc aggtcagcct gtggtgcctg 2580
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 2640
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctctacagc 2700
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 2760
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc gggcggtagt 2820
ggtagtggta gtggatctct gggtggtatc ttcgaggcta tgaagatgga gctgcgcgat 2880
caccatcacc atcaccataa ctggagccac cctcagttcg agaagtgttg a 2931
<210> 3
<211> 3168
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 3
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcagatc tgcccaccat 60
cccatctggg cccgaatgga cgccggaggt ggaggctcac tagtgccccg aggctctgga 120
ggtggaggct ctggagactc cgaaaggcat ttcgtgcacc agttcaaggg cgagtgctac 180
ttcaccaacg ggacgcagcg catacggctc gtgaccagat acatctacaa ccgggaggag 240
tacctgcgct tcgacagcga cgtgggcgag taccgcgcgg tgaccgagct ggggcggcac 300
tcagccgagt actacaataa gcagtacctg gagcgaacgc gggccgagct ggacacggcg 360
tgcagacaca actacgagga gacggaggtc cccacctccc tgcggcggct tgaacagccc 420
aatgtcgcca tctccctgtc caggacagag gccctcaacc accacaacac tctggtctgt 480
tcggtgacag atttctaccc agccaagatc aaagtgcgct ggttcaggaa tggccaggag 540
gagacagtgg gggtctcatc cacacagctt attaggaatg gggactggac cttccaggtc 600
ctggtcatgc tggagatgac ccctcatcag ggagaggtct atacctgcca tgtggagcat 660
cccagcctga agagccccat cactgtggag tggagggcac agtccgagtc tgcccggagc 720
aagtccggag gcggaggcgg acggatcgct cggctagagg aaaaagtgaa aaccttgaaa 780
gcgcaaaact ccgagctggc gtccacggcc aacatgctca gggaacaggt ggcacagctt 840
aagcagaaag tcatgaacca cgacaaaact cacacatgcc caccgtgccc agcacctgaa 900
ctcctggggg gaccgtcagt cttcctcttc cccccaaaac ccaaggacac cctcatgatc 960
tcccggaccc ctgaggtcac atgcgtggtg gtggacgtga gccacgaaga ccctgaggtc 1020
aagttcaact ggtacgtgga cggcgtggag gtgcataatg ccaagacaaa gccgcgggag 1080
gagcagtaca acagcacgta ccgtgtggtc agcgtcctca ccgtcctgca ccaggactgg 1140
ctgaatggca aggagtacaa gtgcaaggtc tccaacaaag ccctcccagc ccccatcgag 1200
aaaaccatct ccaaagccaa agggcagccc cgagaaccac aggtgtgcac cctgccccca 1260
tcccgggatg agctgaccaa gaaccaggtc agcctgagct gcgcggtcaa aggcttctat 1320
cccagcgaca tcgccgtgga gtgggagagc aatgggcagc cggagaacaa ctacaagacc 1380
acgcctcccg tgctggactc cgacggctcc ttcttcctcg tcagcaagct caccgtggac 1440
aagagtaggt ggcagcaggg gaacgtcttc tcatgctccg tgatgcatga ggctctgcac 1500
aaccactaca cacagaagag cctctccctg tctcccggcg gctccggagc cacgaacttc 1560
tctctgttaa agcaagcagg agacgtggaa gaaaaccccg gtcccatggc tatcatctac 1620
ctcatcctcc tgttcaccgc tgtgcggggc gaagacgaca ttgaggccga ccacgtaggc 1680
ttctatggta caactgttta tcagtctcct ggagacattg gccagtacac acatgaattt 1740
gatggtgatg agttgttcta tgtggacttg gataagaaga aaactgtctg gaggcttcct 1800
gagtttggcc aattgatact ctttgagccc caaggtggac tgcaaaacat agctgcagaa 1860
aaacacaact tgggaatctt gactaagagg tcaaatttca ccccagctac caatgaggct 1920
cctcaagcga ctgtgttccc caagtcccct gtgctgctgg gtcagcccaa cacccttatc 1980
tgctttgtgg acaacatctt cccacctgtg atcaacatca catggctcag aaatagcaag 2040
tcagtcacag acggcgttta tgagaccagc ttcctcgtca accgtgacca ttccttccac 2100
aagctgtctt atctcacctt catcccttct gatgatgaca tttatgactg caaggtggag 2160
cactggggcc tggaggagcc ggttctgaaa cactgggaac ctgagattcc agcccccatg 2220
tcagagctga cagagtccgg aggcggaggc ggactgacag atacactcca agcggagaca 2280
gatcaacttg aagacgagaa gtctgcgttg cagaccgaga ttgccaatct actgaaagag 2340
aaggaaaaac tggagtttat tttggcagcc cacgacaaaa ctcacacatg cccaccgtgc 2400
ccagcacctg aactcctggg gggaccgtca gtcttcctct tccccccaaa acccaaggac 2460
accctcatga tctcccggac ccctgaggtc acatgcgtgg tggtggacgt gagccacgaa 2520
gaccctgagg tcaagttcaa ctggtacgtg gacggcgtgg aggtgcataa tgccaagaca 2580
aagccgcggg aggagcagta caacagcacg taccgtgtgg tcagcgtcct caccgtcctg 2640
caccaggact ggctgaatgg caaggagtac aagtgcaagg tctccaacaa agccctccca 2700
gcccccatcg agaaaaccat ctccaaagcc aaagggcagc cccgagaacc acaggtgtac 2760
accctgcccc catgccggga tgagctgacc aagaaccagg tcagcctgtg gtgcctggtc 2820
aaaggcttct atcccagcga catcgccgtg gagtgggaga gcaatgggca gccggagaac 2880
aactacaaga ccacgcctcc cgtgctggac tccgacggct ccttcttcct ctacagcaag 2940
ctcaccgtgg acaagagtag gtggcagcag gggaacgtct tctcatgctc cgtgatgcat 3000
gaggctctgc acaaccacta cacacagaag agcctctccc tgtctccggg cggtagtggt 3060
agtggtagtg gatctctggg tggtatcttc gaggctatga agatggagct gcgcgatcac 3120
catcaccatc accataactg gagccaccct cagttcgaga agtgttga 3168
<210> 4
<211> 2928
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 4
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcagatc tgcccaccat 60
cccatctggg cccgaatgga cgccggaggt ggaggctcac tagtgccccg aggctctgga 120
ggtggaggct ctggagactc cgaaaggcat ttcgtgcacc agttcaaggg cgagtgctac 180
ttcaccaacg ggacgcagcg catacggctc gtgaccagat acatctacaa ccgggaggag 240
tacctgcgct tcgacagcga cgtgggcgag taccgcgcgg tgaccgagct ggggcggcac 300
tcagccgagt actacaataa gcagtacctg gagcgaacgc gggccgagct ggacacggcg 360
tgcagacaca actacgagga gacggaggtc cccacctccc tgcggcggct tgaacagccc 420
aatgtcgcca tctccctgtc caggacagag gccctcaacc accacaacac tctggtctgt 480
tcggtgacag atttctaccc agccaagatc aaagtgcgct ggttcaggaa tggccaggag 540
gagacagtgg gggtctcatc cacacagctt attaggaatg gggactggac cttccaggtc 600
ctggtcatgc tggagatgac ccctcatcag ggagaggtct atacctgcca tgtggagcat 660
cccagcctga agagccccat cactgtggag tggagggcac agtccgagtc tgcccggagc 720
aagtccggag gcggaggcgg agacaaaact cacacatgcc caccgtgccc agcacctgaa 780
ctcctggggg gaccgtcagt cttcctcttc cccccaaaac ccaaggacac cctcatgatc 840
tcccggaccc ctgaggtcac atgcgtggtg gtggacgtga gccacgaaga ccctgaggtc 900
aagttcaact ggtacgtgga cggcgtggag gtgcataatg ccaagacaaa gccgcgggag 960
gagcagtaca acagcacgta ccgtgtggtc agcgtcctca ccgtcctgca ccaggactgg 1020
ctgaatggca aggagtacaa gtgcaaggtc tccaacaaag ccctcccagc ccccatcgag 1080
aaaaccatct ccaaagccaa agggcagccc cgagaaccac aggtgtgcac cctgccccca 1140
tcccgggatg agctgaccaa gaaccaggtc agcctgagct gcgcggtcaa aggcttctat 1200
cccagcgaca tcgccgtgga gtgggagagc aatgggcagc cggagaacaa ctacaagacc 1260
acgcctcccg tgctggactc cgacggctcc ttcttcctcg tcagcaagct caccgtggac 1320
aagagtaggt ggcagcaggg gaacgtcttc tcatgctccg tgatgcatga ggctctgcac 1380
aaccactaca cacagaagag cctctccctg tctcccggcg gctccggagc cacgaacttc 1440
tctctgttaa agcaagcagg agacgtggaa gaaaaccccg gtcccatggc tatcatctac 1500
ctcatcctcc tgttcaccgc tgtgcggggc gaagacgaca ttgaggccga ccacgtaggc 1560
ttctatggta caactgttta tcagtctcct ggagacattg gccagtacac acatgaattt 1620
gatggtgatg agttgttcta tgtggacttg gataagaaga aaactgtctg gaggcttcct 1680
gagtttggcc aattgatact ctttgagccc caaggtggac tgcaaaacat agctgcagaa 1740
aaacacaact tgggaatctt gactaagagg tcaaatttca ccccagctac caatgaggct 1800
cctcaagcga ctgtgttccc caagtcccct gtgctgctgg gtcagcccaa cacccttatc 1860
tgctttgtgg acaacatctt cccacctgtg atcaacatca catggctcag aaatagcaag 1920
tcagtcacag acggcgttta tgagaccagc ttcctcgtca accgtgacca ttccttccac 1980
aagctgtctt atctcacctt catcccttct gatgatgaca tttatgactg caaggtggag 2040
cactggggcc tggaggagcc ggttctgaaa cactgggaac ctgagattcc agcccccatg 2100
tcagagctga cagagtccgg aggcggaggc ggagacaaaa ctcacacatg cccaccgtgc 2160
ccagcacctg aactcctggg gggaccgtca gtcttcctct tccccccaaa acccaaggac 2220
accctcatga tctcccggac ccctgaggtc acatgcgtgg tggtggacgt gagccacgaa 2280
gaccctgagg tcaagttcaa ctggtacgtg gacggcgtgg aggtgcataa tgccaagaca 2340
aagccgcggg aggagcagta caacagcacg taccgtgtgg tcagcgtcct caccgtcctg 2400
caccaggact ggctgaatgg caaggagtac aagtgcaagg tctccaacaa agccctccca 2460
gcccccatcg agaaaaccat ctccaaagcc aaagggcagc cccgagaacc acaggtgtac 2520
accctgcccc catgccggga tgagctgacc aagaaccagg tcagcctgtg gtgcctggtc 2580
aaaggcttct atcccagcga catcgccgtg gagtgggaga gcaatgggca gccggagaac 2640
aactacaaga ccacgcctcc cgtgctggac tccgacggct ccttcttcct ctacagcaag 2700
ctcaccgtgg acaagagtag gtggcagcag gggaacgtct tctcatgctc cgtgatgcat 2760
gaggctctgc acaaccacta cacacagaag agcctctccc tgtctccggg cggtagtggt 2820
agtggtagtg gatctctggg tggtatcttc gaggctatga agatggagct gcgcgatcac 2880
catcaccatc accataactg gagccaccct cagttcgaga agtgttga 2928
<210> 5
<211> 3168
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 5
atgggttctc tgcaaccgct ggccaccttg tacctgctgg gtatgctggt cgctagcagc 60
ctcggacagc acctgcagaa ggactacaga gcctactaca ccttcggagg tggaggcggc 120
tcaggaggtg gaagcggcgg ctctggggac acccgaccac gtttcttgga gtactctacg 180
tctgagtgtc atttcttcaa tgggacggag cgggtgcggt acctggacag atacttccat 240
aaccaggagg agaacgtgcg cttcgacagc gacgtggggg agttccgggc ggtgacggag 300
ctggggcggc ctgatgccga gtactggaac agccagaagg acctcctgga gcagaagcgg 360
ggccgggtgg acaactactg cagacacaac tacggggttg tggagagctt cacagtgcag 420
cggcgagtcc atcctaaggt gactgtgtat ccttcaaaga cccagcccct gcagcaccat 480
aacctcctgg tctgttctgt gagtggtttc tatccaggca gcattgaagt caggtggttc 540
cggaatggcc aggaagagaa gactggggtg gtgtccacag gcctgatcca caatggagac 600
tggaccttcc agaccctggt gatgctggaa acagttcctc ggagtggaga ggtttacacc 660
tgccaagtgg agcacccaag cgtgacaagc cctctcacag tggaatggag agcacggtct 720
gaatctgcac agagcaagtc cggaggcgga ggcggacgga tcgctcggct agaggaaaaa 780
gtgaaaacct tgaaagcgca aaactccgag ctggcgtcca cggccaacat gctcagggaa 840
caggtggcac agcttaagca gaaagtcatg aaccacgaca aaactcacac atgcccaccg 900
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 960
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 1020
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 1080
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 1140
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 1200
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 1260
tacaccctgc ccccatgccg ggatgagctg accaagaacc aggtcagcct gtggtgcctg 1320
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 1380
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctctacagc 1440
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 1500
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc gggcggctcc 1560
ggagccacga acttctctct gttaaagcaa gcaggagacg tggaagaaaa ccccggtccc 1620
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcatcaa agaagaacat 1680
gtgatcatcc aggccgagtt ctatctgaat cctgaccaat caggcgagtt tatgtttgac 1740
tttgatggtg atgagatttt ccatgtggat atggcaaaga aggagacggt ctggcggctt 1800
gaagaatttg gacgatttgc cagctttgag gctcaaggtg cattggccaa catagctgtg 1860
gacaaagcca acctggaaat catgacaaag cgctccaact atactccgat caccaatgta 1920
cctccagagg taactgtgct cacaaacagc cctgtggaac tgagagagcc caacgtcctc 1980
atctgtttca tagacaagtt caccccacca gtggtcaatg tcacgtggct tcgaaatgga 2040
aaacctgtca ccacaggagt gtcagagaca gtcttcctgc ccagggaaga ccaccttttc 2100
cgcaagttcc actatctccc cttcctgccc tcaactgagg acgtttacga ctgcagggtg 2160
gagcactggg gcttggatga gcctcttctc aagcactggg agtttgatgc tccaagccct 2220
ctcccagaga ctacagagtc cggaggcgga ggcggactga cagatacact ccaagcggag 2280
acagatcaac ttgaagacga gaagtctgcg ttgcagaccg agattgccaa tctactgaaa 2340
gagaaggaaa aactggagtt tattttggca gcccacgaca aaactcacac atgcccaccg 2400
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 2460
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 2520
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 2580
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 2640
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 2700
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 2760
tgcaccctgc ccccatcccg ggatgagctg accaagaacc aggtcagcct gagctgcgcg 2820
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 2880
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctcgtcagc 2940
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 3000
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc cggcggtagt 3060
ggtagtggta gtggatctct gggtggtatc ttcgaggcta tgaagatgga gctgcgcgat 3120
caccatcacc atcaccataa ctggagccac cctcagttcg agaagtgt 3168
<210> 6
<211> 2928
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 6
atgggttctc tgcaaccgct ggccaccttg tacctgctgg gtatgctggt cgctagcagc 60
ctcggacagc acctgcagaa ggactacaga gcctactaca ccttcggagg tggaggcggc 120
tcaggaggtg gaagcggcgg ctctggggac acccgaccac gtttcttgga gtactctacg 180
tctgagtgtc atttcttcaa tgggacggag cgggtgcggt acctggacag atacttccat 240
aaccaggagg agaacgtgcg cttcgacagc gacgtggggg agttccgggc ggtgacggag 300
ctggggcggc ctgatgccga gtactggaac agccagaagg acctcctgga gcagaagcgg 360
ggccgggtgg acaactactg cagacacaac tacggggttg tggagagctt cacagtgcag 420
cggcgagtcc atcctaaggt gactgtgtat ccttcaaaga cccagcccct gcagcaccat 480
aacctcctgg tctgttctgt gagtggtttc tatccaggca gcattgaagt caggtggttc 540
cggaatggcc aggaagagaa gactggggtg gtgtccacag gcctgatcca caatggagac 600
tggaccttcc agaccctggt gatgctggaa acagttcctc ggagtggaga ggtttacacc 660
tgccaagtgg agcacccaag cgtgacaagc cctctcacag tggaatggag agcacggtct 720
gaatctgcac agagcaagtc cggaggcgga ggcggagaca aaactcacac atgcccaccg 780
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 840
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 900
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 960
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 1020
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 1080
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 1140
tacaccctgc ccccatgccg ggatgagctg accaagaacc aggtcagcct gtggtgcctg 1200
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 1260
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctctacagc 1320
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 1380
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc gggcggctcc 1440
ggagccacga acttctctct gttaaagcaa gcaggagacg tggaagaaaa ccccggtccc 1500
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcatcaa agaagaacat 1560
gtgatcatcc aggccgagtt ctatctgaat cctgaccaat caggcgagtt tatgtttgac 1620
tttgatggtg atgagatttt ccatgtggat atggcaaaga aggagacggt ctggcggctt 1680
gaagaatttg gacgatttgc cagctttgag gctcaaggtg cattggccaa catagctgtg 1740
gacaaagcca acctggaaat catgacaaag cgctccaact atactccgat caccaatgta 1800
cctccagagg taactgtgct cacaaacagc cctgtggaac tgagagagcc caacgtcctc 1860
atctgtttca tagacaagtt caccccacca gtggtcaatg tcacgtggct tcgaaatgga 1920
aaacctgtca ccacaggagt gtcagagaca gtcttcctgc ccagggaaga ccaccttttc 1980
cgcaagttcc actatctccc cttcctgccc tcaactgagg acgtttacga ctgcagggtg 2040
gagcactggg gcttggatga gcctcttctc aagcactggg agtttgatgc tccaagccct 2100
ctcccagaga ctacagagtc cggaggcgga ggcggagaca aaactcacac atgcccaccg 2160
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 2220
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 2280
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 2340
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 2400
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 2460
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 2520
tgcaccctgc ccccatcccg ggatgagctg accaagaacc aggtcagcct gagctgcgcg 2580
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 2640
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctcgtcagc 2700
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 2760
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc cggcggtagt 2820
ggtagtggta gtggatctct gggtggtatc ttcgaggcta tgaagatgga gctgcgcgat 2880
caccatcacc atcaccataa ctggagccac cctcagttcg agaagtgt 2928
<210> 7
<211> 3165
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 7
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcagatc tgcccaccat 60
cccatctggg cccgaatgga cgccggaggt ggaggctcac tagtgccccg aggctctgga 120
ggtggaggct ctggagactc cgaaaggcat ttcgtgcacc agttcaaggg cgagtgctac 180
ttcaccaacg ggacgcagcg catacggctc gtgaccagat acatctacaa ccgggaggag 240
tacctgcgct tcgacagcga cgtgggcgag taccgcgcgg tgaccgagct ggggcggcac 300
tcagccgagt actacaataa gcagtacctg gagcgaacgc gggccgagct ggacacggcg 360
tgcagacaca actacgagga gacggaggtc cccacctccc tgcggcggct tgaacagccc 420
aatgtcgcca tctccctgtc caggacagag gccctcaacc accacaacac tctggtctgt 480
tcggtgacag atttctaccc agccaagatc aaagtgcgct ggttcaggaa tggccaggag 540
gagacagtgg gggtctcatc cacacagctt attaggaatg gggactggac cttccaggtc 600
ctggtcatgc tggagatgac ccctcatcag ggagaggtct atacctgcca tgtggagcat 660
cccagcctga agagccccat cactgtggag tggagggcac agtccgagtc tgcccggagc 720
aagtccggag gcggaggcgg acggatcgct cggctagagg aaaaagtgaa aaccttgaaa 780
gcgcaaaact ccgagctggc gtccacggcc aacatgctca gggaacaggt ggcacagctt 840
aagcagaaag tcatgaacca cgacaaaact cacacatgcc caccgtgccc agcacctgaa 900
ctcctggggg gaccgtcagt cttcctcttc cccccaaaac ccaaggacac cctcatgatc 960
tcccggaccc ctgaggtcac atgcgtggtg gtggacgtga gccacgaaga ccctgaggtc 1020
aagttcaact ggtacgtgga cggcgtggag gtgcataatg ccaagacaaa gccgcgggag 1080
gagcagtaca acagcacgta ccgtgtggtc agcgtcctca ccgtcctgca ccaggactgg 1140
ctgaatggca aggagtacaa gtgcaaggtc tccaacaaag ccctcccagc ccccatcgag 1200
aaaaccatct ccaaagccaa agggcagccc cgagaaccac aggtgtacac cctgccccca 1260
tgccgggatg agctgaccaa gaaccaggtc agcctgtggt gcctggtcaa aggcttctat 1320
cccagcgaca tcgccgtgga gtgggagagc aatgggcagc cggagaacaa ctacaagacc 1380
acgcctcccg tgctggactc cgacggctcc ttcttcctct acagcaagct caccgtggac 1440
aagagtaggt ggcagcaggg gaacgtcttc tcatgctccg tgatgcatga ggctctgcac 1500
aaccactaca cacagaagag cctctccctg tctccgggcg gctccggagc cacgaacttc 1560
tctctgttaa agcaagcagg agacgtggaa gaaaaccccg gtcccatggc tatcatctac 1620
ctcatcctcc tgttcaccgc tgtgcggggc gaagacgaca ttgaggccga ccacgtaggc 1680
ttctatggta caactgttta tcagtctcct ggagacattg gccagtacac acatgaattt 1740
gatggtgatg agttgttcta tgtggacttg gataagaaga aaactgtctg gaggcttcct 1800
gagtttggcc aattgatact ctttgagccc caaggtggac tgcaaaacat agctgcagaa 1860
aaacacaact tgggaatctt gactaagagg tcaaatttca ccccagctac caatgaggct 1920
cctcaagcga ctgtgttccc caagtcccct gtgctgctgg gtcagcccaa cacccttatc 1980
tgctttgtgg acaacatctt cccacctgtg atcaacatca catggctcag aaatagcaag 2040
tcagtcacag acggcgttta tgagaccagc ttcctcgtca accgtgacca ttccttccac 2100
aagctgtctt atctcacctt catcccttct gatgatgaca tttatgactg caaggtggag 2160
cactggggcc tggaggagcc ggttctgaaa cactgggaac ctgagattcc agcccccatg 2220
tcagagctga cagagtccgg aggcggaggc ggactgacag atacactcca agcggagaca 2280
gatcaacttg aagacgagaa gtctgcgttg cagaccgaga ttgccaatct actgaaagag 2340
aaggaaaaac tggagtttat tttggcagcc cacgacaaaa ctcacacatg cccaccgtgc 2400
ccagcacctg aactcctggg gggaccgtca gtcttcctct tccccccaaa acccaaggac 2460
accctcatga tctcccggac ccctgaggtc acatgcgtgg tggtggacgt gagccacgaa 2520
gaccctgagg tcaagttcaa ctggtacgtg gacggcgtgg aggtgcataa tgccaagaca 2580
aagccgcggg aggagcagta caacagcacg taccgtgtgg tcagcgtcct caccgtcctg 2640
caccaggact ggctgaatgg caaggagtac aagtgcaagg tctccaacaa agccctccca 2700
gcccccatcg agaaaaccat ctccaaagcc aaagggcagc cccgagaacc acaggtgtgc 2760
accctgcccc catcccggga tgagctgacc aagaaccagg tcagcctgag ctgcgcggtc 2820
aaaggcttct atcccagcga catcgccgtg gagtgggaga gcaatgggca gccggagaac 2880
aactacaaga ccacgcctcc cgtgctggac tccgacggct ccttcttcct cgtcagcaag 2940
ctcaccgtgg acaagagtag gtggcagcag gggaacgtct tctcatgctc cgtgatgcat 3000
gaggctctgc acaaccacta cacacagaag agcctctccc tgtctcccgg cggtagtggt 3060
agtggtagtg gatctctggg tggtatcttc gaggctatga agatggagct gcgcgatcac 3120
catcaccatc accataactg gagccaccct cagttcgaga agtgt 3165
<210> 8
<211> 2925
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 8
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcagatc tgcccaccat 60
cccatctggg cccgaatgga cgccggaggt ggaggctcac tagtgccccg aggctctgga 120
ggtggaggct ctggagactc cgaaaggcat ttcgtgcacc agttcaaggg cgagtgctac 180
ttcaccaacg ggacgcagcg catacggctc gtgaccagat acatctacaa ccgggaggag 240
tacctgcgct tcgacagcga cgtgggcgag taccgcgcgg tgaccgagct ggggcggcac 300
tcagccgagt actacaataa gcagtacctg gagcgaacgc gggccgagct ggacacggcg 360
tgcagacaca actacgagga gacggaggtc cccacctccc tgcggcggct tgaacagccc 420
aatgtcgcca tctccctgtc caggacagag gccctcaacc accacaacac tctggtctgt 480
tcggtgacag atttctaccc agccaagatc aaagtgcgct ggttcaggaa tggccaggag 540
gagacagtgg gggtctcatc cacacagctt attaggaatg gggactggac cttccaggtc 600
ctggtcatgc tggagatgac ccctcatcag ggagaggtct atacctgcca tgtggagcat 660
cccagcctga agagccccat cactgtggag tggagggcac agtccgagtc tgcccggagc 720
aagtccggag gcggaggcgg agacaaaact cacacatgcc caccgtgccc agcacctgaa 780
ctcctggggg gaccgtcagt cttcctcttc cccccaaaac ccaaggacac cctcatgatc 840
tcccggaccc ctgaggtcac atgcgtggtg gtggacgtga gccacgaaga ccctgaggtc 900
aagttcaact ggtacgtgga cggcgtggag gtgcataatg ccaagacaaa gccgcgggag 960
gagcagtaca acagcacgta ccgtgtggtc agcgtcctca ccgtcctgca ccaggactgg 1020
ctgaatggca aggagtacaa gtgcaaggtc tccaacaaag ccctcccagc ccccatcgag 1080
aaaaccatct ccaaagccaa agggcagccc cgagaaccac aggtgtacac cctgccccca 1140
tgccgggatg agctgaccaa gaaccaggtc agcctgtggt gcctggtcaa aggcttctat 1200
cccagcgaca tcgccgtgga gtgggagagc aatgggcagc cggagaacaa ctacaagacc 1260
acgcctcccg tgctggactc cgacggctcc ttcttcctct acagcaagct caccgtggac 1320
aagagtaggt ggcagcaggg gaacgtcttc tcatgctccg tgatgcatga ggctctgcac 1380
aaccactaca cacagaagag cctctccctg tctccgggcg gctccggagc cacgaacttc 1440
tctctgttaa agcaagcagg agacgtggaa gaaaaccccg gtcccatggc tatcatctac 1500
ctcatcctcc tgttcaccgc tgtgcggggc gaagacgaca ttgaggccga ccacgtaggc 1560
ttctatggta caactgttta tcagtctcct ggagacattg gccagtacac acatgaattt 1620
gatggtgatg agttgttcta tgtggacttg gataagaaga aaactgtctg gaggcttcct 1680
gagtttggcc aattgatact ctttgagccc caaggtggac tgcaaaacat agctgcagaa 1740
aaacacaact tgggaatctt gactaagagg tcaaatttca ccccagctac caatgaggct 1800
cctcaagcga ctgtgttccc caagtcccct gtgctgctgg gtcagcccaa cacccttatc 1860
tgctttgtgg acaacatctt cccacctgtg atcaacatca catggctcag aaatagcaag 1920
tcagtcacag acggcgttta tgagaccagc ttcctcgtca accgtgacca ttccttccac 1980
aagctgtctt atctcacctt catcccttct gatgatgaca tttatgactg caaggtggag 2040
cactggggcc tggaggagcc ggttctgaaa cactgggaac ctgagattcc agcccccatg 2100
tcagagctga cagagtccgg aggcggaggc ggagacaaaa ctcacacatg cccaccgtgc 2160
ccagcacctg aactcctggg gggaccgtca gtcttcctct tccccccaaa acccaaggac 2220
accctcatga tctcccggac ccctgaggtc acatgcgtgg tggtggacgt gagccacgaa 2280
gaccctgagg tcaagttcaa ctggtacgtg gacggcgtgg aggtgcataa tgccaagaca 2340
aagccgcggg aggagcagta caacagcacg taccgtgtgg tcagcgtcct caccgtcctg 2400
caccaggact ggctgaatgg caaggagtac aagtgcaagg tctccaacaa agccctccca 2460
gcccccatcg agaaaaccat ctccaaagcc aaagggcagc cccgagaacc acaggtgtgc 2520
accctgcccc catcccggga tgagctgacc aagaaccagg tcagcctgag ctgcgcggtc 2580
aaaggcttct atcccagcga catcgccgtg gagtgggaga gcaatgggca gccggagaac 2640
aactacaaga ccacgcctcc cgtgctggac tccgacggct ccttcttcct cgtcagcaag 2700
ctcaccgtgg acaagagtag gtggcagcag gggaacgtct tctcatgctc cgtgatgcat 2760
gaggctctgc acaaccacta cacacagaag agcctctccc tgtctcccgg cggtagtggt 2820
agtggtagtg gatctctggg tggtatcttc gaggctatga agatggagct gcgcgatcac 2880
catcaccatc accataactg gagccaccct cagttcgaga agtgt 2925
<210> 9
<211> 1554
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 9
atgggttctc tgcaaccgct ggccaccttg tacctgctgg gtatgctggt cgctagcagc 60
ctcggacagc acctgcagaa ggactacaga gcctactaca ccttcggagg tggaggcggc 120
tcaggaggtg gaagcggcgg ctctggggac acccgaccac gtttcttgga gtactctacg 180
tctgagtgtc atttcttcaa tgggacggag cgggtgcggt acctggacag atacttccat 240
aaccaggagg agaacgtgcg cttcgacagc gacgtggggg agttccgggc ggtgacggag 300
ctggggcggc ctgatgccga gtactggaac agccagaagg acctcctgga gcagaagcgg 360
ggccgggtgg acaactactg cagacacaac tacggggttg tggagagctt cacagtgcag 420
cggcgagtcc atcctaaggt gactgtgtat ccttcaaaga cccagcccct gcagcaccat 480
aacctcctgg tctgttctgt gagtggtttc tatccaggca gcattgaagt caggtggttc 540
cggaatggcc aggaagagaa gactggggtg gtgtccacag gcctgatcca caatggagac 600
tggaccttcc agaccctggt gatgctggaa acagttcctc ggagtggaga ggtttacacc 660
tgccaagtgg agcacccaag cgtgacaagc cctctcacag tggaatggag agcacggtct 720
gaatctgcac agagcaagtc cggaggcgga ggcggacgga tcgctcggct agaggaaaaa 780
gtgaaaacct tgaaagcgca aaactccgag ctggcgtcca cggccaacat gctcagggaa 840
caggtggcac agcttaagca gaaagtcatg aaccacgaca aaactcacac atgcccaccg 900
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 960
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 1020
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 1080
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 1140
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 1200
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 1260
tgcaccctgc ccccatcccg ggatgagctg accaagaacc aggtcagcct gagctgcgcg 1320
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 1380
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctcgtcagc 1440
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 1500
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc cggc 1554
<210> 10
<211> 1554
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 10
atgggttctc tgcaaccgct ggccaccttg tacctgctgg gtatgctggt cgctagcagc 60
ctcggacagc acctgcagaa ggactacaga gcctactaca ccttcggagg tggaggcggc 120
tcaggaggtg gaagcggcgg ctctggggac acccgaccac gtttcttgga gtactctacg 180
tctgagtgtc atttcttcaa tgggacggag cgggtgcggt acctggacag atacttccat 240
aaccaggagg agaacgtgcg cttcgacagc gacgtggggg agttccgggc ggtgacggag 300
ctggggcggc ctgatgccga gtactggaac agccagaagg acctcctgga gcagaagcgg 360
ggccgggtgg acaactactg cagacacaac tacggggttg tggagagctt cacagtgcag 420
cggcgagtcc atcctaaggt gactgtgtat ccttcaaaga cccagcccct gcagcaccat 480
aacctcctgg tctgttctgt gagtggtttc tatccaggca gcattgaagt caggtggttc 540
cggaatggcc aggaagagaa gactggggtg gtgtccacag gcctgatcca caatggagac 600
tggaccttcc agaccctggt gatgctggaa acagttcctc ggagtggaga ggtttacacc 660
tgccaagtgg agcacccaag cgtgacaagc cctctcacag tggaatggag agcacggtct 720
gaatctgcac agagcaagtc cggaggcgga ggcggacgga tcgctcggct agaggaaaaa 780
gtgaaaacct tgaaagcgca aaactccgag ctggcgtcca cggccaacat gctcagggaa 840
caggtggcac agcttaagca gaaagtcatg aaccacgaca aaactcacac atgcccaccg 900
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 960
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 1020
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 1080
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 1140
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 1200
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 1260
tacaccctgc ccccatgccg ggatgagctg accaagaacc aggtcagcct gtggtgcctg 1320
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 1380
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctctacagc 1440
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 1500
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc gggc 1554
<210> 11
<211> 1434
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 11
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcatcaa agaagaacat 60
gtgatcatcc aggccgagtt ctatctgaat cctgaccaat caggcgagtt tatgtttgac 120
tttgatggtg atgagatttt ccatgtggat atggcaaaga aggagacggt ctggcggctt 180
gaagaatttg gacgatttgc cagctttgag gctcaaggtg cattggccaa catagctgtg 240
gacaaagcca acctggaaat catgacaaag cgctccaact atactccgat caccaatgta 300
cctccagagg taactgtgct cacaaacagc cctgtggaac tgagagagcc caacgtcctc 360
atctgtttca tagacaagtt caccccacca gtggtcaatg tcacgtggct tcgaaatgga 420
aaacctgtca ccacaggagt gtcagagaca gtcttcctgc ccagggaaga ccaccttttc 480
cgcaagttcc actatctccc cttcctgccc tcaactgagg acgtttacga ctgcagggtg 540
gagcactggg gcttggatga gcctcttctc aagcactggg agtttgatgc tccaagccct 600
ctcccagaga ctacagagtc cggaggcgga ggcggactga cagatacact ccaagcggag 660
acagatcaac ttgaagacga gaagtctgcg ttgcagaccg agattgccaa tctactgaaa 720
gagaaggaaa aactggagtt tattttggca gcccacgaca aaactcacac atgcccaccg 780
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 840
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 900
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 960
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 1020
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 1080
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 1140
tacaccctgc ccccatgccg ggatgagctg accaagaacc aggtcagcct gtggtgcctg 1200
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 1260
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctctacagc 1320
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 1380
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc gggc 1434
<210> 12
<211> 1434
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 12
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcatcaa agaagaacat 60
gtgatcatcc aggccgagtt ctatctgaat cctgaccaat caggcgagtt tatgtttgac 120
tttgatggtg atgagatttt ccatgtggat atggcaaaga aggagacggt ctggcggctt 180
gaagaatttg gacgatttgc cagctttgag gctcaaggtg cattggccaa catagctgtg 240
gacaaagcca acctggaaat catgacaaag cgctccaact atactccgat caccaatgta 300
cctccagagg taactgtgct cacaaacagc cctgtggaac tgagagagcc caacgtcctc 360
atctgtttca tagacaagtt caccccacca gtggtcaatg tcacgtggct tcgaaatgga 420
aaacctgtca ccacaggagt gtcagagaca gtcttcctgc ccagggaaga ccaccttttc 480
cgcaagttcc actatctccc cttcctgccc tcaactgagg acgtttacga ctgcagggtg 540
gagcactggg gcttggatga gcctcttctc aagcactggg agtttgatgc tccaagccct 600
ctcccagaga ctacagagtc cggaggcgga ggcggactga cagatacact ccaagcggag 660
acagatcaac ttgaagacga gaagtctgcg ttgcagaccg agattgccaa tctactgaaa 720
gagaaggaaa aactggagtt tattttggca gcccacgaca aaactcacac atgcccaccg 780
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 840
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 900
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 960
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 1020
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 1080
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 1140
tgcaccctgc ccccatcccg ggatgagctg accaagaacc aggtcagcct gagctgcgcg 1200
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 1260
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctcgtcagc 1320
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 1380
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc cggc 1434
<210> 13
<211> 1434
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 13
atgggttctc tgcaaccgct ggccaccttg tacctgctgg gtatgctggt cgctagcagc 60
ctcggacagc acctgcagaa ggactacaga gcctactaca ccttcggagg tggaggcggc 120
tcaggaggtg gaagcggcgg ctctggggac acccgaccac gtttcttgga gtactctacg 180
tctgagtgtc atttcttcaa tgggacggag cgggtgcggt acctggacag atacttccat 240
aaccaggagg agaacgtgcg cttcgacagc gacgtggggg agttccgggc ggtgacggag 300
ctggggcggc ctgatgccga gtactggaac agccagaagg acctcctgga gcagaagcgg 360
ggccgggtgg acaactactg cagacacaac tacggggttg tggagagctt cacagtgcag 420
cggcgagtcc atcctaaggt gactgtgtat ccttcaaaga cccagcccct gcagcaccat 480
aacctcctgg tctgttctgt gagtggtttc tatccaggca gcattgaagt caggtggttc 540
cggaatggcc aggaagagaa gactggggtg gtgtccacag gcctgatcca caatggagac 600
tggaccttcc agaccctggt gatgctggaa acagttcctc ggagtggaga ggtttacacc 660
tgccaagtgg agcacccaag cgtgacaagc cctctcacag tggaatggag agcacggtct 720
gaatctgcac agagcaagtc cggaggcgga ggcggagaca aaactcacac atgcccaccg 780
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 840
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 900
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 960
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 1020
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 1080
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 1140
tgcaccctgc ccccatcccg ggatgagctg accaagaacc aggtcagcct gagctgcgcg 1200
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 1260
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctcgtcagc 1320
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 1380
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc cggc 1434
<210> 14
<211> 1434
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 14
atgggttctc tgcaaccgct ggccaccttg tacctgctgg gtatgctggt cgctagcagc 60
ctcggacagc acctgcagaa ggactacaga gcctactaca ccttcggagg tggaggcggc 120
tcaggaggtg gaagcggcgg ctctggggac acccgaccac gtttcttgga gtactctacg 180
tctgagtgtc atttcttcaa tgggacggag cgggtgcggt acctggacag atacttccat 240
aaccaggagg agaacgtgcg cttcgacagc gacgtggggg agttccgggc ggtgacggag 300
ctggggcggc ctgatgccga gtactggaac agccagaagg acctcctgga gcagaagcgg 360
ggccgggtgg acaactactg cagacacaac tacggggttg tggagagctt cacagtgcag 420
cggcgagtcc atcctaaggt gactgtgtat ccttcaaaga cccagcccct gcagcaccat 480
aacctcctgg tctgttctgt gagtggtttc tatccaggca gcattgaagt caggtggttc 540
cggaatggcc aggaagagaa gactggggtg gtgtccacag gcctgatcca caatggagac 600
tggaccttcc agaccctggt gatgctggaa acagttcctc ggagtggaga ggtttacacc 660
tgccaagtgg agcacccaag cgtgacaagc cctctcacag tggaatggag agcacggtct 720
gaatctgcac agagcaagtc cggaggcgga ggcggagaca aaactcacac atgcccaccg 780
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 840
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 900
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 960
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 1020
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 1080
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 1140
tacaccctgc ccccatgccg ggatgagctg accaagaacc aggtcagcct gtggtgcctg 1200
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 1260
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctctacagc 1320
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 1380
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc gggc 1434
<210> 15
<211> 1314
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 15
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcatcaa agaagaacat 60
gtgatcatcc aggccgagtt ctatctgaat cctgaccaat caggcgagtt tatgtttgac 120
tttgatggtg atgagatttt ccatgtggat atggcaaaga aggagacggt ctggcggctt 180
gaagaatttg gacgatttgc cagctttgag gctcaaggtg cattggccaa catagctgtg 240
gacaaagcca acctggaaat catgacaaag cgctccaact atactccgat caccaatgta 300
cctccagagg taactgtgct cacaaacagc cctgtggaac tgagagagcc caacgtcctc 360
atctgtttca tagacaagtt caccccacca gtggtcaatg tcacgtggct tcgaaatgga 420
aaacctgtca ccacaggagt gtcagagaca gtcttcctgc ccagggaaga ccaccttttc 480
cgcaagttcc actatctccc cttcctgccc tcaactgagg acgtttacga ctgcagggtg 540
gagcactggg gcttggatga gcctcttctc aagcactggg agtttgatgc tccaagccct 600
ctcccagaga ctacagagtc cggaggcgga ggcggagaca aaactcacac atgcccaccg 660
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 720
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 780
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 840
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 900
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 960
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 1020
tacaccctgc ccccatgccg ggatgagctg accaagaacc aggtcagcct gtggtgcctg 1080
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 1140
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctctacagc 1200
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 1260
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc gggc 1314
<210> 16
<211> 1314
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 16
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcatcaa agaagaacat 60
gtgatcatcc aggccgagtt ctatctgaat cctgaccaat caggcgagtt tatgtttgac 120
tttgatggtg atgagatttt ccatgtggat atggcaaaga aggagacggt ctggcggctt 180
gaagaatttg gacgatttgc cagctttgag gctcaaggtg cattggccaa catagctgtg 240
gacaaagcca acctggaaat catgacaaag cgctccaact atactccgat caccaatgta 300
cctccagagg taactgtgct cacaaacagc cctgtggaac tgagagagcc caacgtcctc 360
atctgtttca tagacaagtt caccccacca gtggtcaatg tcacgtggct tcgaaatgga 420
aaacctgtca ccacaggagt gtcagagaca gtcttcctgc ccagggaaga ccaccttttc 480
cgcaagttcc actatctccc cttcctgccc tcaactgagg acgtttacga ctgcagggtg 540
gagcactggg gcttggatga gcctcttctc aagcactggg agtttgatgc tccaagccct 600
ctcccagaga ctacagagtc cggaggcgga ggcggagaca aaactcacac atgcccaccg 660
tgcccagcac ctgaactcct ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 720
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 780
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 840
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 900
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 960
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 1020
tgcaccctgc ccccatcccg ggatgagctg accaagaacc aggtcagcct gagctgcgcg 1080
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 1140
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctcgtcagc 1200
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 1260
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc cggc 1314
<210> 17
<211> 1539
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 17
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcagatc tgcccaccat 60
cccatctggg cccgaatgga cgccggaggt ggaggctcac tagtgccccg aggctctgga 120
ggtggaggct ctggagactc cgaaaggcat ttcgtgcacc agttcaaggg cgagtgctac 180
ttcaccaacg ggacgcagcg catacggctc gtgaccagat acatctacaa ccgggaggag 240
tacctgcgct tcgacagcga cgtgggcgag taccgcgcgg tgaccgagct ggggcggcac 300
tcagccgagt actacaataa gcagtacctg gagcgaacgc gggccgagct ggacacggcg 360
tgcagacaca actacgagga gacggaggtc cccacctccc tgcggcggct tgaacagccc 420
aatgtcgcca tctccctgtc caggacagag gccctcaacc accacaacac tctggtctgt 480
tcggtgacag atttctaccc agccaagatc aaagtgcgct ggttcaggaa tggccaggag 540
gagacagtgg gggtctcatc cacacagctt attaggaatg gggactggac cttccaggtc 600
ctggtcatgc tggagatgac ccctcatcag ggagaggtct atacctgcca tgtggagcat 660
cccagcctga agagccccat cactgtggag tggagggcac agtccgagtc tgcccggagc 720
aagtccggag gcggaggcgg acggatcgct cggctagagg aaaaagtgaa aaccttgaaa 780
gcgcaaaact ccgagctggc gtccacggcc aacatgctca gggaacaggt ggcacagctt 840
aagcagaaag tcatgaacca cgacaaaact cacacatgcc caccgtgccc agcacctgaa 900
ctcctggggg gaccgtcagt cttcctcttc cccccaaaac ccaaggacac cctcatgatc 960
tcccggaccc ctgaggtcac atgcgtggtg gtggacgtga gccacgaaga ccctgaggtc 1020
aagttcaact ggtacgtgga cggcgtggag gtgcataatg ccaagacaaa gccgcgggag 1080
gagcagtaca acagcacgta ccgtgtggtc agcgtcctca ccgtcctgca ccaggactgg 1140
ctgaatggca aggagtacaa gtgcaaggtc tccaacaaag ccctcccagc ccccatcgag 1200
aaaaccatct ccaaagccaa agggcagccc cgagaaccac aggtgtgcac cctgccccca 1260
tcccgggatg agctgaccaa gaaccaggtc agcctgagct gcgcggtcaa aggcttctat 1320
cccagcgaca tcgccgtgga gtgggagagc aatgggcagc cggagaacaa ctacaagacc 1380
acgcctcccg tgctggactc cgacggctcc ttcttcctcg tcagcaagct caccgtggac 1440
aagagtaggt ggcagcaggg gaacgtcttc tcatgctccg tgatgcatga ggctctgcac 1500
aaccactaca cacagaagag cctctccctg tctcccggc 1539
<210> 18
<211> 1539
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 18
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcagatc tgcccaccat 60
cccatctggg cccgaatgga cgccggaggt ggaggctcac tagtgccccg aggctctgga 120
ggtggaggct ctggagactc cgaaaggcat ttcgtgcacc agttcaaggg cgagtgctac 180
ttcaccaacg ggacgcagcg catacggctc gtgaccagat acatctacaa ccgggaggag 240
tacctgcgct tcgacagcga cgtgggcgag taccgcgcgg tgaccgagct ggggcggcac 300
tcagccgagt actacaataa gcagtacctg gagcgaacgc gggccgagct ggacacggcg 360
tgcagacaca actacgagga gacggaggtc cccacctccc tgcggcggct tgaacagccc 420
aatgtcgcca tctccctgtc caggacagag gccctcaacc accacaacac tctggtctgt 480
tcggtgacag atttctaccc agccaagatc aaagtgcgct ggttcaggaa tggccaggag 540
gagacagtgg gggtctcatc cacacagctt attaggaatg gggactggac cttccaggtc 600
ctggtcatgc tggagatgac ccctcatcag ggagaggtct atacctgcca tgtggagcat 660
cccagcctga agagccccat cactgtggag tggagggcac agtccgagtc tgcccggagc 720
aagtccggag gcggaggcgg acggatcgct cggctagagg aaaaagtgaa aaccttgaaa 780
gcgcaaaact ccgagctggc gtccacggcc aacatgctca gggaacaggt ggcacagctt 840
aagcagaaag tcatgaacca cgacaaaact cacacatgcc caccgtgccc agcacctgaa 900
ctcctggggg gaccgtcagt cttcctcttc cccccaaaac ccaaggacac cctcatgatc 960
tcccggaccc ctgaggtcac atgcgtggtg gtggacgtga gccacgaaga ccctgaggtc 1020
aagttcaact ggtacgtgga cggcgtggag gtgcataatg ccaagacaaa gccgcgggag 1080
gagcagtaca acagcacgta ccgtgtggtc agcgtcctca ccgtcctgca ccaggactgg 1140
ctgaatggca aggagtacaa gtgcaaggtc tccaacaaag ccctcccagc ccccatcgag 1200
aaaaccatct ccaaagccaa agggcagccc cgagaaccac aggtgtacac cctgccccca 1260
tgccgggatg agctgaccaa gaaccaggtc agcctgtggt gcctggtcaa aggcttctat 1320
cccagcgaca tcgccgtgga gtgggagagc aatgggcagc cggagaacaa ctacaagacc 1380
acgcctcccg tgctggactc cgacggctcc ttcttcctct acagcaagct caccgtggac 1440
aagagtaggt ggcagcaggg gaacgtcttc tcatgctccg tgatgcatga ggctctgcac 1500
aaccactaca cacagaagag cctctccctg tctccgggc 1539
<210> 19
<211> 1446
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 19
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcgaaga cgacattgag 60
gccgaccacg taggcttcta tggtacaact gtttatcagt ctcctggaga cattggccag 120
tacacacatg aatttgatgg tgatgagttg ttctatgtgg acttggataa gaagaaaact 180
gtctggaggc ttcctgagtt tggccaattg atactctttg agccccaagg tggactgcaa 240
aacatagctg cagaaaaaca caacttggga atcttgacta agaggtcaaa tttcacccca 300
gctaccaatg aggctcctca agcgactgtg ttccccaagt cccctgtgct gctgggtcag 360
cccaacaccc ttatctgctt tgtggacaac atcttcccac ctgtgatcaa catcacatgg 420
ctcagaaata gcaagtcagt cacagacggc gtttatgaga ccagcttcct cgtcaaccgt 480
gaccattcct tccacaagct gtcttatctc accttcatcc cttctgatga tgacatttat 540
gactgcaagg tggagcactg gggcctggag gagccggttc tgaaacactg ggaacctgag 600
attccagccc ccatgtcaga gctgacagag tccggaggcg gaggcggact gacagataca 660
ctccaagcgg agacagatca acttgaagac gagaagtctg cgttgcagac cgagattgcc 720
aatctactga aagagaagga aaaactggag tttattttgg cagcccacga caaaactcac 780
acatgcccac cgtgcccagc acctgaactc ctggggggac cgtcagtctt cctcttcccc 840
ccaaaaccca aggacaccct catgatctcc cggacccctg aggtcacatg cgtggtggtg 900
gacgtgagcc acgaagaccc tgaggtcaag ttcaactggt acgtggacgg cgtggaggtg 960
cataatgcca agacaaagcc gcgggaggag cagtacaaca gcacgtaccg tgtggtcagc 1020
gtcctcaccg tcctgcacca ggactggctg aatggcaagg agtacaagtg caaggtctcc 1080
aacaaagccc tcccagcccc catcgagaaa accatctcca aagccaaagg gcagccccga 1140
gaaccacagg tgtacaccct gcccccatgc cgggatgagc tgaccaagaa ccaggtcagc 1200
ctgtggtgcc tggtcaaagg cttctatccc agcgacatcg ccgtggagtg ggagagcaat 1260
gggcagccgg agaacaacta caagaccacg cctcccgtgc tggactccga cggctccttc 1320
ttcctctaca gcaagctcac cgtggacaag agtaggtggc agcaggggaa cgtcttctca 1380
tgctccgtga tgcatgaggc tctgcacaac cactacacac agaagagcct ctccctgtct 1440
ccgggc 1446
<210> 20
<211> 1446
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 20
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcgaaga cgacattgag 60
gccgaccacg taggcttcta tggtacaact gtttatcagt ctcctggaga cattggccag 120
tacacacatg aatttgatgg tgatgagttg ttctatgtgg acttggataa gaagaaaact 180
gtctggaggc ttcctgagtt tggccaattg atactctttg agccccaagg tggactgcaa 240
aacatagctg cagaaaaaca caacttggga atcttgacta agaggtcaaa tttcacccca 300
gctaccaatg aggctcctca agcgactgtg ttccccaagt cccctgtgct gctgggtcag 360
cccaacaccc ttatctgctt tgtggacaac atcttcccac ctgtgatcaa catcacatgg 420
ctcagaaata gcaagtcagt cacagacggc gtttatgaga ccagcttcct cgtcaaccgt 480
gaccattcct tccacaagct gtcttatctc accttcatcc cttctgatga tgacatttat 540
gactgcaagg tggagcactg gggcctggag gagccggttc tgaaacactg ggaacctgag 600
attccagccc ccatgtcaga gctgacagag tccggaggcg gaggcggact gacagataca 660
ctccaagcgg agacagatca acttgaagac gagaagtctg cgttgcagac cgagattgcc 720
aatctactga aagagaagga aaaactggag tttattttgg cagcccacga caaaactcac 780
acatgcccac cgtgcccagc acctgaactc ctggggggac cgtcagtctt cctcttcccc 840
ccaaaaccca aggacaccct catgatctcc cggacccctg aggtcacatg cgtggtggtg 900
gacgtgagcc acgaagaccc tgaggtcaag ttcaactggt acgtggacgg cgtggaggtg 960
cataatgcca agacaaagcc gcgggaggag cagtacaaca gcacgtaccg tgtggtcagc 1020
gtcctcaccg tcctgcacca ggactggctg aatggcaagg agtacaagtg caaggtctcc 1080
aacaaagccc tcccagcccc catcgagaaa accatctcca aagccaaagg gcagccccga 1140
gaaccacagg tgtgcaccct gcccccatcc cgggatgagc tgaccaagaa ccaggtcagc 1200
ctgagctgcg cggtcaaagg cttctatccc agcgacatcg ccgtggagtg ggagagcaat 1260
gggcagccgg agaacaacta caagaccacg cctcccgtgc tggactccga cggctccttc 1320
ttcctcgtca gcaagctcac cgtggacaag agtaggtggc agcaggggaa cgtcttctca 1380
tgctccgtga tgcatgaggc tctgcacaac cactacacac agaagagcct ctccctgtct 1440
cccggc 1446
<210> 21
<211> 1419
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 21
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcagatc tgcccaccat 60
cccatctggg cccgaatgga cgccggaggt ggaggctcac tagtgccccg aggctctgga 120
ggtggaggct ctggagactc cgaaaggcat ttcgtgcacc agttcaaggg cgagtgctac 180
ttcaccaacg ggacgcagcg catacggctc gtgaccagat acatctacaa ccgggaggag 240
tacctgcgct tcgacagcga cgtgggcgag taccgcgcgg tgaccgagct ggggcggcac 300
tcagccgagt actacaataa gcagtacctg gagcgaacgc gggccgagct ggacacggcg 360
tgcagacaca actacgagga gacggaggtc cccacctccc tgcggcggct tgaacagccc 420
aatgtcgcca tctccctgtc caggacagag gccctcaacc accacaacac tctggtctgt 480
tcggtgacag atttctaccc agccaagatc aaagtgcgct ggttcaggaa tggccaggag 540
gagacagtgg gggtctcatc cacacagctt attaggaatg gggactggac cttccaggtc 600
ctggtcatgc tggagatgac ccctcatcag ggagaggtct atacctgcca tgtggagcat 660
cccagcctga agagccccat cactgtggag tggagggcac agtccgagtc tgcccggagc 720
aagtccggag gcggaggcgg agacaaaact cacacatgcc caccgtgccc agcacctgaa 780
ctcctggggg gaccgtcagt cttcctcttc cccccaaaac ccaaggacac cctcatgatc 840
tcccggaccc ctgaggtcac atgcgtggtg gtggacgtga gccacgaaga ccctgaggtc 900
aagttcaact ggtacgtgga cggcgtggag gtgcataatg ccaagacaaa gccgcgggag 960
gagcagtaca acagcacgta ccgtgtggtc agcgtcctca ccgtcctgca ccaggactgg 1020
ctgaatggca aggagtacaa gtgcaaggtc tccaacaaag ccctcccagc ccccatcgag 1080
aaaaccatct ccaaagccaa agggcagccc cgagaaccac aggtgtgcac cctgccccca 1140
tcccgggatg agctgaccaa gaaccaggtc agcctgagct gcgcggtcaa aggcttctat 1200
cccagcgaca tcgccgtgga gtgggagagc aatgggcagc cggagaacaa ctacaagacc 1260
acgcctcccg tgctggactc cgacggctcc ttcttcctcg tcagcaagct caccgtggac 1320
aagagtaggt ggcagcaggg gaacgtcttc tcatgctccg tgatgcatga ggctctgcac 1380
aaccactaca cacagaagag cctctccctg tctcccggc 1419
<210> 22
<211> 1419
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 22
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcagatc tgcccaccat 60
cccatctggg cccgaatgga cgccggaggt ggaggctcac tagtgccccg aggctctgga 120
ggtggaggct ctggagactc cgaaaggcat ttcgtgcacc agttcaaggg cgagtgctac 180
ttcaccaacg ggacgcagcg catacggctc gtgaccagat acatctacaa ccgggaggag 240
tacctgcgct tcgacagcga cgtgggcgag taccgcgcgg tgaccgagct ggggcggcac 300
tcagccgagt actacaataa gcagtacctg gagcgaacgc gggccgagct ggacacggcg 360
tgcagacaca actacgagga gacggaggtc cccacctccc tgcggcggct tgaacagccc 420
aatgtcgcca tctccctgtc caggacagag gccctcaacc accacaacac tctggtctgt 480
tcggtgacag atttctaccc agccaagatc aaagtgcgct ggttcaggaa tggccaggag 540
gagacagtgg gggtctcatc cacacagctt attaggaatg gggactggac cttccaggtc 600
ctggtcatgc tggagatgac ccctcatcag ggagaggtct atacctgcca tgtggagcat 660
cccagcctga agagccccat cactgtggag tggagggcac agtccgagtc tgcccggagc 720
aagtccggag gcggaggcgg agacaaaact cacacatgcc caccgtgccc agcacctgaa 780
ctcctggggg gaccgtcagt cttcctcttc cccccaaaac ccaaggacac cctcatgatc 840
tcccggaccc ctgaggtcac atgcgtggtg gtggacgtga gccacgaaga ccctgaggtc 900
aagttcaact ggtacgtgga cggcgtggag gtgcataatg ccaagacaaa gccgcgggag 960
gagcagtaca acagcacgta ccgtgtggtc agcgtcctca ccgtcctgca ccaggactgg 1020
ctgaatggca aggagtacaa gtgcaaggtc tccaacaaag ccctcccagc ccccatcgag 1080
aaaaccatct ccaaagccaa agggcagccc cgagaaccac aggtgtacac cctgccccca 1140
tgccgggatg agctgaccaa gaaccaggtc agcctgtggt gcctggtcaa aggcttctat 1200
cccagcgaca tcgccgtgga gtgggagagc aatgggcagc cggagaacaa ctacaagacc 1260
acgcctcccg tgctggactc cgacggctcc ttcttcctct acagcaagct caccgtggac 1320
aagagtaggt ggcagcaggg gaacgtcttc tcatgctccg tgatgcatga ggctctgcac 1380
aaccactaca cacagaagag cctctccctg tctccgggc 1419
<210> 23
<211> 1326
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 23
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcgaaga cgacattgag 60
gccgaccacg taggcttcta tggtacaact gtttatcagt ctcctggaga cattggccag 120
tacacacatg aatttgatgg tgatgagttg ttctatgtgg acttggataa gaagaaaact 180
gtctggaggc ttcctgagtt tggccaattg atactctttg agccccaagg tggactgcaa 240
aacatagctg cagaaaaaca caacttggga atcttgacta agaggtcaaa tttcacccca 300
gctaccaatg aggctcctca agcgactgtg ttccccaagt cccctgtgct gctgggtcag 360
cccaacaccc ttatctgctt tgtggacaac atcttcccac ctgtgatcaa catcacatgg 420
ctcagaaata gcaagtcagt cacagacggc gtttatgaga ccagcttcct cgtcaaccgt 480
gaccattcct tccacaagct gtcttatctc accttcatcc cttctgatga tgacatttat 540
gactgcaagg tggagcactg gggcctggag gagccggttc tgaaacactg ggaacctgag 600
attccagccc ccatgtcaga gctgacagag tccggaggcg gaggcggaga caaaactcac 660
acatgcccac cgtgcccagc acctgaactc ctggggggac cgtcagtctt cctcttcccc 720
ccaaaaccca aggacaccct catgatctcc cggacccctg aggtcacatg cgtggtggtg 780
gacgtgagcc acgaagaccc tgaggtcaag ttcaactggt acgtggacgg cgtggaggtg 840
cataatgcca agacaaagcc gcgggaggag cagtacaaca gcacgtaccg tgtggtcagc 900
gtcctcaccg tcctgcacca ggactggctg aatggcaagg agtacaagtg caaggtctcc 960
aacaaagccc tcccagcccc catcgagaaa accatctcca aagccaaagg gcagccccga 1020
gaaccacagg tgtacaccct gcccccatgc cgggatgagc tgaccaagaa ccaggtcagc 1080
ctgtggtgcc tggtcaaagg cttctatccc agcgacatcg ccgtggagtg ggagagcaat 1140
gggcagccgg agaacaacta caagaccacg cctcccgtgc tggactccga cggctccttc 1200
ttcctctaca gcaagctcac cgtggacaag agtaggtggc agcaggggaa cgtcttctca 1260
tgctccgtga tgcatgaggc tctgcacaac cactacacac agaagagcct ctccctgtct 1320
ccgggc 1326
<210> 24
<211> 1326
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 24
atggctatca tctacctcat cctcctgttc accgctgtgc ggggcgaaga cgacattgag 60
gccgaccacg taggcttcta tggtacaact gtttatcagt ctcctggaga cattggccag 120
tacacacatg aatttgatgg tgatgagttg ttctatgtgg acttggataa gaagaaaact 180
gtctggaggc ttcctgagtt tggccaattg atactctttg agccccaagg tggactgcaa 240
aacatagctg cagaaaaaca caacttggga atcttgacta agaggtcaaa tttcacccca 300
gctaccaatg aggctcctca agcgactgtg ttccccaagt cccctgtgct gctgggtcag 360
cccaacaccc ttatctgctt tgtggacaac atcttcccac ctgtgatcaa catcacatgg 420
ctcagaaata gcaagtcagt cacagacggc gtttatgaga ccagcttcct cgtcaaccgt 480
gaccattcct tccacaagct gtcttatctc accttcatcc cttctgatga tgacatttat 540
gactgcaagg tggagcactg gggcctggag gagccggttc tgaaacactg ggaacctgag 600
attccagccc ccatgtcaga gctgacagag tccggaggcg gaggcggaga caaaactcac 660
acatgcccac cgtgcccagc acctgaactc ctggggggac cgtcagtctt cctcttcccc 720
ccaaaaccca aggacaccct catgatctcc cggacccctg aggtcacatg cgtggtggtg 780
gacgtgagcc acgaagaccc tgaggtcaag ttcaactggt acgtggacgg cgtggaggtg 840
cataatgcca agacaaagcc gcgggaggag cagtacaaca gcacgtaccg tgtggtcagc 900
gtcctcaccg tcctgcacca ggactggctg aatggcaagg agtacaagtg caaggtctcc 960
aacaaagccc tcccagcccc catcgagaaa accatctcca aagccaaagg gcagccccga 1020
gaaccacagg tgtgcaccct gcccccatcc cgggatgagc tgaccaagaa ccaggtcagc 1080
ctgagctgcg cggtcaaagg cttctatccc agcgacatcg ccgtggagtg ggagagcaat 1140
gggcagccgg agaacaacta caagaccacg cctcccgtgc tggactccga cggctccttc 1200
ttcctcgtca gcaagctcac cgtggacaag agtaggtggc agcaggggaa cgtcttctca 1260
tgctccgtga tgcatgaggc tctgcacaac cactacacac agaagagcct ctccctgtct 1320
cccggc 1326
<210> 25
<211> 678
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 25
gacaaaactc acacatgccc accgtgccca gcacctgaac tcctgggggg accgtcagtc 60
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca 120
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac 180
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac 240
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag 300
tgcaaagtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa 360
gggcagcccc gagaaccaca ggtgtgcacc ctgcccccat cccgggatga gctgaccaag 420
aaccaggtca gcctgagctg cgcggtcaaa ggcttctatc ccagcgacat cgccgtggag 480
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 540
gacggctcct tcttcctcgt cagcaagctc accgtggaca agagcaggtg gcagcagggg 600
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac acagaagagc 660
ctctccctgt ctcccggc 678
<210> 26
<211> 678
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 26
gacaaaactc acacatgccc accgtgccca gcacctgaac tcctgggggg accgtcagtc 60
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca 120
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac 180
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac 240
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag 300
tgcaaagtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa 360
gggcagcccc gagaaccaca ggtgtacacc ctgcccccat gccgggatga gctgaccaag 420
aaccaggtca gcctgtggtg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag 480
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 540
gacggctcct tcttcctcta cagcaagctc accgtggaca agagcaggtg gcagcagggg 600
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac acagaagagc 660
ctctccctgt ctccgggc 678
<210> 27
<211> 1056
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 27
Met Gly Ser Leu Gln Pro Leu Ala Thr Leu Tyr Leu Leu Gly Met Leu
1 5 10 15
Val Ala Ser Ser Leu Gly Gln His Leu Gln Lys Asp Tyr Arg Ala Tyr
20 25 30
Tyr Thr Phe Gly Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser
35 40 45
Gly Asp Thr Arg Pro Arg Phe Leu Glu Tyr Ser Thr Ser Glu Cys His
50 55 60
Phe Phe Asn Gly Thr Glu Arg Val Arg Tyr Leu Asp Arg Tyr Phe His
65 70 75 80
Asn Gln Glu Glu Asn Val Arg Phe Asp Ser Asp Val Gly Glu Phe Arg
85 90 95
Ala Val Thr Glu Leu Gly Arg Pro Asp Ala Glu Tyr Trp Asn Ser Gln
100 105 110
Lys Asp Leu Leu Glu Gln Lys Arg Gly Arg Val Asp Asn Tyr Cys Arg
115 120 125
His Asn Tyr Gly Val Val Glu Ser Phe Thr Val Gln Arg Arg Val His
130 135 140
Pro Lys Val Thr Val Tyr Pro Ser Lys Thr Gln Pro Leu Gln His His
145 150 155 160
Asn Leu Leu Val Cys Ser Val Ser Gly Phe Tyr Pro Gly Ser Ile Glu
165 170 175
Val Arg Trp Phe Arg Asn Gly Gln Glu Glu Lys Thr Gly Val Val Ser
180 185 190
Thr Gly Leu Ile His Asn Gly Asp Trp Thr Phe Gln Thr Leu Val Met
195 200 205
Leu Glu Thr Val Pro Arg Ser Gly Glu Val Tyr Thr Cys Gln Val Glu
210 215 220
His Pro Ser Val Thr Ser Pro Leu Thr Val Glu Trp Arg Ala Arg Ser
225 230 235 240
Glu Ser Ala Gln Ser Lys Ser Gly Gly Gly Gly Gly Arg Ile Ala Arg
245 250 255
Leu Glu Glu Lys Val Lys Thr Leu Lys Ala Gln Asn Ser Glu Leu Ala
260 265 270
Ser Thr Ala Asn Met Leu Arg Glu Gln Val Ala Gln Leu Lys Gln Lys
275 280 285
Val Met Asn His Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
290 295 300
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
305 310 315 320
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
325 330 335
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
340 345 350
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
355 360 365
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
370 375 380
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
385 390 395 400
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
405 410 415
Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
420 425 430
Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp
435 440 445
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
450 455 460
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser
465 470 475 480
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
485 490 495
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
500 505 510
Leu Ser Leu Ser Pro Gly Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu
515 520 525
Lys Gln Ala Gly Asp Val Glu Glu Asn Pro Gly Pro Met Ala Ile Ile
530 535 540
Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Ile Lys Glu Glu His
545 550 555 560
Val Ile Ile Gln Ala Glu Phe Tyr Leu Asn Pro Asp Gln Ser Gly Glu
565 570 575
Phe Met Phe Asp Phe Asp Gly Asp Glu Ile Phe His Val Asp Met Ala
580 585 590
Lys Lys Glu Thr Val Trp Arg Leu Glu Glu Phe Gly Arg Phe Ala Ser
595 600 605
Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val Asp Lys Ala Asn
610 615 620
Leu Glu Ile Met Thr Lys Arg Ser Asn Tyr Thr Pro Ile Thr Asn Val
625 630 635 640
Pro Pro Glu Val Thr Val Leu Thr Asn Ser Pro Val Glu Leu Arg Glu
645 650 655
Pro Asn Val Leu Ile Cys Phe Ile Asp Lys Phe Thr Pro Pro Val Val
660 665 670
Asn Val Thr Trp Leu Arg Asn Gly Lys Pro Val Thr Thr Gly Val Ser
675 680 685
Glu Thr Val Phe Leu Pro Arg Glu Asp His Leu Phe Arg Lys Phe His
690 695 700
Tyr Leu Pro Phe Leu Pro Ser Thr Glu Asp Val Tyr Asp Cys Arg Val
705 710 715 720
Glu His Trp Gly Leu Asp Glu Pro Leu Leu Lys His Trp Glu Phe Asp
725 730 735
Ala Pro Ser Pro Leu Pro Glu Thr Thr Glu Ser Gly Gly Gly Gly Gly
740 745 750
Leu Thr Asp Thr Leu Gln Ala Glu Thr Asp Gln Leu Glu Asp Glu Lys
755 760 765
Ser Ala Leu Gln Thr Glu Ile Ala Asn Leu Leu Lys Glu Lys Glu Lys
770 775 780
Leu Glu Phe Ile Leu Ala Ala His Asp Lys Thr His Thr Cys Pro Pro
785 790 795 800
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
805 810 815
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
820 825 830
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
835 840 845
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
850 855 860
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
865 870 875 880
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
885 890 895
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
900 905 910
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp
915 920 925
Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe
930 935 940
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
945 950 955 960
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
965 970 975
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
980 985 990
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
995 1000 1005
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Ser Gly Ser Gly
1010 1015 1020
Ser Gly Ser Leu Gly Gly Ile Phe Glu Ala Met Lys Met Glu Leu
1025 1030 1035
Arg Asp His His His His His His Asn Trp Ser His Pro Gln Phe
1040 1045 1050
Glu Lys Cys
1055
<210> 28
<211> 976
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 28
Met Gly Ser Leu Gln Pro Leu Ala Thr Leu Tyr Leu Leu Gly Met Leu
1 5 10 15
Val Ala Ser Ser Leu Gly Gln His Leu Gln Lys Asp Tyr Arg Ala Tyr
20 25 30
Tyr Thr Phe Gly Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser
35 40 45
Gly Asp Thr Arg Pro Arg Phe Leu Glu Tyr Ser Thr Ser Glu Cys His
50 55 60
Phe Phe Asn Gly Thr Glu Arg Val Arg Tyr Leu Asp Arg Tyr Phe His
65 70 75 80
Asn Gln Glu Glu Asn Val Arg Phe Asp Ser Asp Val Gly Glu Phe Arg
85 90 95
Ala Val Thr Glu Leu Gly Arg Pro Asp Ala Glu Tyr Trp Asn Ser Gln
100 105 110
Lys Asp Leu Leu Glu Gln Lys Arg Gly Arg Val Asp Asn Tyr Cys Arg
115 120 125
His Asn Tyr Gly Val Val Glu Ser Phe Thr Val Gln Arg Arg Val His
130 135 140
Pro Lys Val Thr Val Tyr Pro Ser Lys Thr Gln Pro Leu Gln His His
145 150 155 160
Asn Leu Leu Val Cys Ser Val Ser Gly Phe Tyr Pro Gly Ser Ile Glu
165 170 175
Val Arg Trp Phe Arg Asn Gly Gln Glu Glu Lys Thr Gly Val Val Ser
180 185 190
Thr Gly Leu Ile His Asn Gly Asp Trp Thr Phe Gln Thr Leu Val Met
195 200 205
Leu Glu Thr Val Pro Arg Ser Gly Glu Val Tyr Thr Cys Gln Val Glu
210 215 220
His Pro Ser Val Thr Ser Pro Leu Thr Val Glu Trp Arg Ala Arg Ser
225 230 235 240
Glu Ser Ala Gln Ser Lys Ser Gly Gly Gly Gly Gly Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Ser
465 470 475 480
Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val Glu Glu
485 490 495
Asn Pro Gly Pro Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala
500 505 510
Val Arg Gly Ile Lys Glu Glu His Val Ile Ile Gln Ala Glu Phe Tyr
515 520 525
Leu Asn Pro Asp Gln Ser Gly Glu Phe Met Phe Asp Phe Asp Gly Asp
530 535 540
Glu Ile Phe His Val Asp Met Ala Lys Lys Glu Thr Val Trp Arg Leu
545 550 555 560
Glu Glu Phe Gly Arg Phe Ala Ser Phe Glu Ala Gln Gly Ala Leu Ala
565 570 575
Asn Ile Ala Val Asp Lys Ala Asn Leu Glu Ile Met Thr Lys Arg Ser
580 585 590
Asn Tyr Thr Pro Ile Thr Asn Val Pro Pro Glu Val Thr Val Leu Thr
595 600 605
Asn Ser Pro Val Glu Leu Arg Glu Pro Asn Val Leu Ile Cys Phe Ile
610 615 620
Asp Lys Phe Thr Pro Pro Val Val Asn Val Thr Trp Leu Arg Asn Gly
625 630 635 640
Lys Pro Val Thr Thr Gly Val Ser Glu Thr Val Phe Leu Pro Arg Glu
645 650 655
Asp His Leu Phe Arg Lys Phe His Tyr Leu Pro Phe Leu Pro Ser Thr
660 665 670
Glu Asp Val Tyr Asp Cys Arg Val Glu His Trp Gly Leu Asp Glu Pro
675 680 685
Leu Leu Lys His Trp Glu Phe Asp Ala Pro Ser Pro Leu Pro Glu Thr
690 695 700
Thr Glu Ser Gly Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro
705 710 715 720
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
725 730 735
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
740 745 750
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
755 760 765
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
770 775 780
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
785 790 795 800
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
805 810 815
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
820 825 830
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp
835 840 845
Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe
850 855 860
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
865 870 875 880
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
885 890 895
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
900 905 910
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
915 920 925
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Ser Gly Ser Gly Ser
930 935 940
Gly Ser Leu Gly Gly Ile Phe Glu Ala Met Lys Met Glu Leu Arg Asp
945 950 955 960
His His His His His His Asn Trp Ser His Pro Gln Phe Glu Lys Cys
965 970 975
<210> 29
<211> 1055
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 29
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Arg
1 5 10 15
Ser Ala His His Pro Ile Trp Ala Arg Met Asp Ala Gly Gly Gly Gly
20 25 30
Ser Leu Val Pro Arg Gly Ser Gly Gly Gly Gly Ser Gly Asp Ser Glu
35 40 45
Arg His Phe Val His Gln Phe Lys Gly Glu Cys Tyr Phe Thr Asn Gly
50 55 60
Thr Gln Arg Ile Arg Leu Val Thr Arg Tyr Ile Tyr Asn Arg Glu Glu
65 70 75 80
Tyr Leu Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg Ala Val Thr Glu
85 90 95
Leu Gly Arg His Ser Ala Glu Tyr Tyr Asn Lys Gln Tyr Leu Glu Arg
100 105 110
Thr Arg Ala Glu Leu Asp Thr Ala Cys Arg His Asn Tyr Glu Glu Thr
115 120 125
Glu Val Pro Thr Ser Leu Arg Arg Leu Glu Gln Pro Asn Val Ala Ile
130 135 140
Ser Leu Ser Arg Thr Glu Ala Leu Asn His His Asn Thr Leu Val Cys
145 150 155 160
Ser Val Thr Asp Phe Tyr Pro Ala Lys Ile Lys Val Arg Trp Phe Arg
165 170 175
Asn Gly Gln Glu Glu Thr Val Gly Val Ser Ser Thr Gln Leu Ile Arg
180 185 190
Asn Gly Asp Trp Thr Phe Gln Val Leu Val Met Leu Glu Met Thr Pro
195 200 205
His Gln Gly Glu Val Tyr Thr Cys His Val Glu His Pro Ser Leu Lys
210 215 220
Ser Pro Ile Thr Val Glu Trp Arg Ala Gln Ser Glu Ser Ala Arg Ser
225 230 235 240
Lys Ser Gly Gly Gly Gly Gly Arg Ile Ala Arg Leu Glu Glu Lys Val
245 250 255
Lys Thr Leu Lys Ala Gln Asn Ser Glu Leu Ala Ser Thr Ala Asn Met
260 265 270
Leu Arg Glu Gln Val Ala Gln Leu Lys Gln Lys Val Met Asn His Asp
275 280 285
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
290 295 300
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
305 310 315 320
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
325 330 335
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
340 345 350
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
355 360 365
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
370 375 380
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
385 390 395 400
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys
405 410 415
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
420 425 430
Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
435 440 445
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
450 455 460
Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp
465 470 475 480
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
485 490 495
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
500 505 510
Gly Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp
515 520 525
Val Glu Glu Asn Pro Gly Pro Met Ala Ile Ile Tyr Leu Ile Leu Leu
530 535 540
Phe Thr Ala Val Arg Gly Glu Asp Asp Ile Glu Ala Asp His Val Gly
545 550 555 560
Phe Tyr Gly Thr Thr Val Tyr Gln Ser Pro Gly Asp Ile Gly Gln Tyr
565 570 575
Thr His Glu Phe Asp Gly Asp Glu Leu Phe Tyr Val Asp Leu Asp Lys
580 585 590
Lys Lys Thr Val Trp Arg Leu Pro Glu Phe Gly Gln Leu Ile Leu Phe
595 600 605
Glu Pro Gln Gly Gly Leu Gln Asn Ile Ala Ala Glu Lys His Asn Leu
610 615 620
Gly Ile Leu Thr Lys Arg Ser Asn Phe Thr Pro Ala Thr Asn Glu Ala
625 630 635 640
Pro Gln Ala Thr Val Phe Pro Lys Ser Pro Val Leu Leu Gly Gln Pro
645 650 655
Asn Thr Leu Ile Cys Phe Val Asp Asn Ile Phe Pro Pro Val Ile Asn
660 665 670
Ile Thr Trp Leu Arg Asn Ser Lys Ser Val Thr Asp Gly Val Tyr Glu
675 680 685
Thr Ser Phe Leu Val Asn Arg Asp His Ser Phe His Lys Leu Ser Tyr
690 695 700
Leu Thr Phe Ile Pro Ser Asp Asp Asp Ile Tyr Asp Cys Lys Val Glu
705 710 715 720
His Trp Gly Leu Glu Glu Pro Val Leu Lys His Trp Glu Pro Glu Ile
725 730 735
Pro Ala Pro Met Ser Glu Leu Thr Glu Ser Gly Gly Gly Gly Gly Leu
740 745 750
Thr Asp Thr Leu Gln Ala Glu Thr Asp Gln Leu Glu Asp Glu Lys Ser
755 760 765
Ala Leu Gln Thr Glu Ile Ala Asn Leu Leu Lys Glu Lys Glu Lys Leu
770 775 780
Glu Phe Ile Leu Ala Ala His Asp Lys Thr His Thr Cys Pro Pro Cys
785 790 795 800
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
805 810 815
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
820 825 830
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
835 840 845
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
850 855 860
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
865 870 875 880
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
885 890 895
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
900 905 910
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu
915 920 925
Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr
930 935 940
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
945 950 955 960
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
965 970 975
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
980 985 990
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
995 1000 1005
Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Ser Gly Ser Gly Ser
1010 1015 1020
Gly Ser Leu Gly Gly Ile Phe Glu Ala Met Lys Met Glu Leu Arg
1025 1030 1035
Asp His His His His His His Asn Trp Ser His Pro Gln Phe Glu
1040 1045 1050
Lys Cys
1055
<210> 30
<211> 975
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 30
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Arg
1 5 10 15
Ser Ala His His Pro Ile Trp Ala Arg Met Asp Ala Gly Gly Gly Gly
20 25 30
Ser Leu Val Pro Arg Gly Ser Gly Gly Gly Gly Ser Gly Asp Ser Glu
35 40 45
Arg His Phe Val His Gln Phe Lys Gly Glu Cys Tyr Phe Thr Asn Gly
50 55 60
Thr Gln Arg Ile Arg Leu Val Thr Arg Tyr Ile Tyr Asn Arg Glu Glu
65 70 75 80
Tyr Leu Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg Ala Val Thr Glu
85 90 95
Leu Gly Arg His Ser Ala Glu Tyr Tyr Asn Lys Gln Tyr Leu Glu Arg
100 105 110
Thr Arg Ala Glu Leu Asp Thr Ala Cys Arg His Asn Tyr Glu Glu Thr
115 120 125
Glu Val Pro Thr Ser Leu Arg Arg Leu Glu Gln Pro Asn Val Ala Ile
130 135 140
Ser Leu Ser Arg Thr Glu Ala Leu Asn His His Asn Thr Leu Val Cys
145 150 155 160
Ser Val Thr Asp Phe Tyr Pro Ala Lys Ile Lys Val Arg Trp Phe Arg
165 170 175
Asn Gly Gln Glu Glu Thr Val Gly Val Ser Ser Thr Gln Leu Ile Arg
180 185 190
Asn Gly Asp Trp Thr Phe Gln Val Leu Val Met Leu Glu Met Thr Pro
195 200 205
His Gln Gly Glu Val Tyr Thr Cys His Val Glu His Pro Ser Leu Lys
210 215 220
Ser Pro Ile Thr Val Glu Trp Arg Ala Gln Ser Glu Ser Ala Arg Ser
225 230 235 240
Lys Ser Gly Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys
245 250 255
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
260 265 270
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
275 280 285
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
290 295 300
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
305 310 315 320
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
325 330 335
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
340 345 350
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
355 360 365
Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Arg Asp Glu
370 375 380
Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr
385 390 395 400
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
405 410 415
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
420 425 430
Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
435 440 445
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
450 455 460
Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Ser Gly Ala Thr Asn Phe
465 470 475 480
Ser Leu Leu Lys Gln Ala Gly Asp Val Glu Glu Asn Pro Gly Pro Met
485 490 495
Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Glu Asp
500 505 510
Asp Ile Glu Ala Asp His Val Gly Phe Tyr Gly Thr Thr Val Tyr Gln
515 520 525
Ser Pro Gly Asp Ile Gly Gln Tyr Thr His Glu Phe Asp Gly Asp Glu
530 535 540
Leu Phe Tyr Val Asp Leu Asp Lys Lys Lys Thr Val Trp Arg Leu Pro
545 550 555 560
Glu Phe Gly Gln Leu Ile Leu Phe Glu Pro Gln Gly Gly Leu Gln Asn
565 570 575
Ile Ala Ala Glu Lys His Asn Leu Gly Ile Leu Thr Lys Arg Ser Asn
580 585 590
Phe Thr Pro Ala Thr Asn Glu Ala Pro Gln Ala Thr Val Phe Pro Lys
595 600 605
Ser Pro Val Leu Leu Gly Gln Pro Asn Thr Leu Ile Cys Phe Val Asp
610 615 620
Asn Ile Phe Pro Pro Val Ile Asn Ile Thr Trp Leu Arg Asn Ser Lys
625 630 635 640
Ser Val Thr Asp Gly Val Tyr Glu Thr Ser Phe Leu Val Asn Arg Asp
645 650 655
His Ser Phe His Lys Leu Ser Tyr Leu Thr Phe Ile Pro Ser Asp Asp
660 665 670
Asp Ile Tyr Asp Cys Lys Val Glu His Trp Gly Leu Glu Glu Pro Val
675 680 685
Leu Lys His Trp Glu Pro Glu Ile Pro Ala Pro Met Ser Glu Leu Thr
690 695 700
Glu Ser Gly Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys
705 710 715 720
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
725 730 735
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
740 745 750
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
755 760 765
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
770 775 780
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
785 790 795 800
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
805 810 815
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
820 825 830
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu
835 840 845
Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr
850 855 860
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
865 870 875 880
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
885 890 895
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
900 905 910
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
915 920 925
Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Ser Gly Ser Gly Ser Gly
930 935 940
Ser Leu Gly Gly Ile Phe Glu Ala Met Lys Met Glu Leu Arg Asp His
945 950 955 960
His His His His His Asn Trp Ser His Pro Gln Phe Glu Lys Cys
965 970 975
<210> 31
<211> 1056
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 31
Met Gly Ser Leu Gln Pro Leu Ala Thr Leu Tyr Leu Leu Gly Met Leu
1 5 10 15
Val Ala Ser Ser Leu Gly Gln His Leu Gln Lys Asp Tyr Arg Ala Tyr
20 25 30
Tyr Thr Phe Gly Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser
35 40 45
Gly Asp Thr Arg Pro Arg Phe Leu Glu Tyr Ser Thr Ser Glu Cys His
50 55 60
Phe Phe Asn Gly Thr Glu Arg Val Arg Tyr Leu Asp Arg Tyr Phe His
65 70 75 80
Asn Gln Glu Glu Asn Val Arg Phe Asp Ser Asp Val Gly Glu Phe Arg
85 90 95
Ala Val Thr Glu Leu Gly Arg Pro Asp Ala Glu Tyr Trp Asn Ser Gln
100 105 110
Lys Asp Leu Leu Glu Gln Lys Arg Gly Arg Val Asp Asn Tyr Cys Arg
115 120 125
His Asn Tyr Gly Val Val Glu Ser Phe Thr Val Gln Arg Arg Val His
130 135 140
Pro Lys Val Thr Val Tyr Pro Ser Lys Thr Gln Pro Leu Gln His His
145 150 155 160
Asn Leu Leu Val Cys Ser Val Ser Gly Phe Tyr Pro Gly Ser Ile Glu
165 170 175
Val Arg Trp Phe Arg Asn Gly Gln Glu Glu Lys Thr Gly Val Val Ser
180 185 190
Thr Gly Leu Ile His Asn Gly Asp Trp Thr Phe Gln Thr Leu Val Met
195 200 205
Leu Glu Thr Val Pro Arg Ser Gly Glu Val Tyr Thr Cys Gln Val Glu
210 215 220
His Pro Ser Val Thr Ser Pro Leu Thr Val Glu Trp Arg Ala Arg Ser
225 230 235 240
Glu Ser Ala Gln Ser Lys Ser Gly Gly Gly Gly Gly Arg Ile Ala Arg
245 250 255
Leu Glu Glu Lys Val Lys Thr Leu Lys Ala Gln Asn Ser Glu Leu Ala
260 265 270
Ser Thr Ala Asn Met Leu Arg Glu Gln Val Ala Gln Leu Lys Gln Lys
275 280 285
Val Met Asn His Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
290 295 300
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
305 310 315 320
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
325 330 335
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
340 345 350
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
355 360 365
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
370 375 380
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
385 390 395 400
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
405 410 415
Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys
420 425 430
Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
435 440 445
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
450 455 460
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
465 470 475 480
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
485 490 495
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
500 505 510
Leu Ser Leu Ser Pro Gly Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu
515 520 525
Lys Gln Ala Gly Asp Val Glu Glu Asn Pro Gly Pro Met Ala Ile Ile
530 535 540
Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Ile Lys Glu Glu His
545 550 555 560
Val Ile Ile Gln Ala Glu Phe Tyr Leu Asn Pro Asp Gln Ser Gly Glu
565 570 575
Phe Met Phe Asp Phe Asp Gly Asp Glu Ile Phe His Val Asp Met Ala
580 585 590
Lys Lys Glu Thr Val Trp Arg Leu Glu Glu Phe Gly Arg Phe Ala Ser
595 600 605
Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val Asp Lys Ala Asn
610 615 620
Leu Glu Ile Met Thr Lys Arg Ser Asn Tyr Thr Pro Ile Thr Asn Val
625 630 635 640
Pro Pro Glu Val Thr Val Leu Thr Asn Ser Pro Val Glu Leu Arg Glu
645 650 655
Pro Asn Val Leu Ile Cys Phe Ile Asp Lys Phe Thr Pro Pro Val Val
660 665 670
Asn Val Thr Trp Leu Arg Asn Gly Lys Pro Val Thr Thr Gly Val Ser
675 680 685
Glu Thr Val Phe Leu Pro Arg Glu Asp His Leu Phe Arg Lys Phe His
690 695 700
Tyr Leu Pro Phe Leu Pro Ser Thr Glu Asp Val Tyr Asp Cys Arg Val
705 710 715 720
Glu His Trp Gly Leu Asp Glu Pro Leu Leu Lys His Trp Glu Phe Asp
725 730 735
Ala Pro Ser Pro Leu Pro Glu Thr Thr Glu Ser Gly Gly Gly Gly Gly
740 745 750
Leu Thr Asp Thr Leu Gln Ala Glu Thr Asp Gln Leu Glu Asp Glu Lys
755 760 765
Ser Ala Leu Gln Thr Glu Ile Ala Asn Leu Leu Lys Glu Lys Glu Lys
770 775 780
Leu Glu Phe Ile Leu Ala Ala His Asp Lys Thr His Thr Cys Pro Pro
785 790 795 800
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
805 810 815
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
820 825 830
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
835 840 845
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
850 855 860
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
865 870 875 880
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
885 890 895
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
900 905 910
Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Arg Asp
915 920 925
Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe
930 935 940
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
945 950 955 960
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
965 970 975
Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
980 985 990
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
995 1000 1005
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Ser Gly Ser Gly
1010 1015 1020
Ser Gly Ser Leu Gly Gly Ile Phe Glu Ala Met Lys Met Glu Leu
1025 1030 1035
Arg Asp His His His His His His Asn Trp Ser His Pro Gln Phe
1040 1045 1050
Glu Lys Cys
1055
<210> 32
<211> 976
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 32
Met Gly Ser Leu Gln Pro Leu Ala Thr Leu Tyr Leu Leu Gly Met Leu
1 5 10 15
Val Ala Ser Ser Leu Gly Gln His Leu Gln Lys Asp Tyr Arg Ala Tyr
20 25 30
Tyr Thr Phe Gly Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser
35 40 45
Gly Asp Thr Arg Pro Arg Phe Leu Glu Tyr Ser Thr Ser Glu Cys His
50 55 60
Phe Phe Asn Gly Thr Glu Arg Val Arg Tyr Leu Asp Arg Tyr Phe His
65 70 75 80
Asn Gln Glu Glu Asn Val Arg Phe Asp Ser Asp Val Gly Glu Phe Arg
85 90 95
Ala Val Thr Glu Leu Gly Arg Pro Asp Ala Glu Tyr Trp Asn Ser Gln
100 105 110
Lys Asp Leu Leu Glu Gln Lys Arg Gly Arg Val Asp Asn Tyr Cys Arg
115 120 125
His Asn Tyr Gly Val Val Glu Ser Phe Thr Val Gln Arg Arg Val His
130 135 140
Pro Lys Val Thr Val Tyr Pro Ser Lys Thr Gln Pro Leu Gln His His
145 150 155 160
Asn Leu Leu Val Cys Ser Val Ser Gly Phe Tyr Pro Gly Ser Ile Glu
165 170 175
Val Arg Trp Phe Arg Asn Gly Gln Glu Glu Lys Thr Gly Val Val Ser
180 185 190
Thr Gly Leu Ile His Asn Gly Asp Trp Thr Phe Gln Thr Leu Val Met
195 200 205
Leu Glu Thr Val Pro Arg Ser Gly Glu Val Tyr Thr Cys Gln Val Glu
210 215 220
His Pro Ser Val Thr Ser Pro Leu Thr Val Glu Trp Arg Ala Arg Ser
225 230 235 240
Glu Ser Ala Gln Ser Lys Ser Gly Gly Gly Gly Gly Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Ser
465 470 475 480
Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val Glu Glu
485 490 495
Asn Pro Gly Pro Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala
500 505 510
Val Arg Gly Ile Lys Glu Glu His Val Ile Ile Gln Ala Glu Phe Tyr
515 520 525
Leu Asn Pro Asp Gln Ser Gly Glu Phe Met Phe Asp Phe Asp Gly Asp
530 535 540
Glu Ile Phe His Val Asp Met Ala Lys Lys Glu Thr Val Trp Arg Leu
545 550 555 560
Glu Glu Phe Gly Arg Phe Ala Ser Phe Glu Ala Gln Gly Ala Leu Ala
565 570 575
Asn Ile Ala Val Asp Lys Ala Asn Leu Glu Ile Met Thr Lys Arg Ser
580 585 590
Asn Tyr Thr Pro Ile Thr Asn Val Pro Pro Glu Val Thr Val Leu Thr
595 600 605
Asn Ser Pro Val Glu Leu Arg Glu Pro Asn Val Leu Ile Cys Phe Ile
610 615 620
Asp Lys Phe Thr Pro Pro Val Val Asn Val Thr Trp Leu Arg Asn Gly
625 630 635 640
Lys Pro Val Thr Thr Gly Val Ser Glu Thr Val Phe Leu Pro Arg Glu
645 650 655
Asp His Leu Phe Arg Lys Phe His Tyr Leu Pro Phe Leu Pro Ser Thr
660 665 670
Glu Asp Val Tyr Asp Cys Arg Val Glu His Trp Gly Leu Asp Glu Pro
675 680 685
Leu Leu Lys His Trp Glu Phe Asp Ala Pro Ser Pro Leu Pro Glu Thr
690 695 700
Thr Glu Ser Gly Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro
705 710 715 720
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
725 730 735
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
740 745 750
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
755 760 765
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
770 775 780
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
785 790 795 800
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
805 810 815
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
820 825 830
Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Arg Asp
835 840 845
Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe
850 855 860
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
865 870 875 880
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
885 890 895
Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
900 905 910
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
915 920 925
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Ser Gly Ser Gly Ser
930 935 940
Gly Ser Leu Gly Gly Ile Phe Glu Ala Met Lys Met Glu Leu Arg Asp
945 950 955 960
His His His His His His Asn Trp Ser His Pro Gln Phe Glu Lys Cys
965 970 975
<210> 33
<211> 1055
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 33
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Arg
1 5 10 15
Ser Ala His His Pro Ile Trp Ala Arg Met Asp Ala Gly Gly Gly Gly
20 25 30
Ser Leu Val Pro Arg Gly Ser Gly Gly Gly Gly Ser Gly Asp Ser Glu
35 40 45
Arg His Phe Val His Gln Phe Lys Gly Glu Cys Tyr Phe Thr Asn Gly
50 55 60
Thr Gln Arg Ile Arg Leu Val Thr Arg Tyr Ile Tyr Asn Arg Glu Glu
65 70 75 80
Tyr Leu Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg Ala Val Thr Glu
85 90 95
Leu Gly Arg His Ser Ala Glu Tyr Tyr Asn Lys Gln Tyr Leu Glu Arg
100 105 110
Thr Arg Ala Glu Leu Asp Thr Ala Cys Arg His Asn Tyr Glu Glu Thr
115 120 125
Glu Val Pro Thr Ser Leu Arg Arg Leu Glu Gln Pro Asn Val Ala Ile
130 135 140
Ser Leu Ser Arg Thr Glu Ala Leu Asn His His Asn Thr Leu Val Cys
145 150 155 160
Ser Val Thr Asp Phe Tyr Pro Ala Lys Ile Lys Val Arg Trp Phe Arg
165 170 175
Asn Gly Gln Glu Glu Thr Val Gly Val Ser Ser Thr Gln Leu Ile Arg
180 185 190
Asn Gly Asp Trp Thr Phe Gln Val Leu Val Met Leu Glu Met Thr Pro
195 200 205
His Gln Gly Glu Val Tyr Thr Cys His Val Glu His Pro Ser Leu Lys
210 215 220
Ser Pro Ile Thr Val Glu Trp Arg Ala Gln Ser Glu Ser Ala Arg Ser
225 230 235 240
Lys Ser Gly Gly Gly Gly Gly Arg Ile Ala Arg Leu Glu Glu Lys Val
245 250 255
Lys Thr Leu Lys Ala Gln Asn Ser Glu Leu Ala Ser Thr Ala Asn Met
260 265 270
Leu Arg Glu Gln Val Ala Gln Leu Lys Gln Lys Val Met Asn His Asp
275 280 285
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
290 295 300
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
305 310 315 320
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
325 330 335
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
340 345 350
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
355 360 365
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
370 375 380
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
385 390 395 400
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
405 410 415
Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
420 425 430
Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
435 440 445
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
450 455 460
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
465 470 475 480
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
485 490 495
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
500 505 510
Gly Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp
515 520 525
Val Glu Glu Asn Pro Gly Pro Met Ala Ile Ile Tyr Leu Ile Leu Leu
530 535 540
Phe Thr Ala Val Arg Gly Glu Asp Asp Ile Glu Ala Asp His Val Gly
545 550 555 560
Phe Tyr Gly Thr Thr Val Tyr Gln Ser Pro Gly Asp Ile Gly Gln Tyr
565 570 575
Thr His Glu Phe Asp Gly Asp Glu Leu Phe Tyr Val Asp Leu Asp Lys
580 585 590
Lys Lys Thr Val Trp Arg Leu Pro Glu Phe Gly Gln Leu Ile Leu Phe
595 600 605
Glu Pro Gln Gly Gly Leu Gln Asn Ile Ala Ala Glu Lys His Asn Leu
610 615 620
Gly Ile Leu Thr Lys Arg Ser Asn Phe Thr Pro Ala Thr Asn Glu Ala
625 630 635 640
Pro Gln Ala Thr Val Phe Pro Lys Ser Pro Val Leu Leu Gly Gln Pro
645 650 655
Asn Thr Leu Ile Cys Phe Val Asp Asn Ile Phe Pro Pro Val Ile Asn
660 665 670
Ile Thr Trp Leu Arg Asn Ser Lys Ser Val Thr Asp Gly Val Tyr Glu
675 680 685
Thr Ser Phe Leu Val Asn Arg Asp His Ser Phe His Lys Leu Ser Tyr
690 695 700
Leu Thr Phe Ile Pro Ser Asp Asp Asp Ile Tyr Asp Cys Lys Val Glu
705 710 715 720
His Trp Gly Leu Glu Glu Pro Val Leu Lys His Trp Glu Pro Glu Ile
725 730 735
Pro Ala Pro Met Ser Glu Leu Thr Glu Ser Gly Gly Gly Gly Gly Leu
740 745 750
Thr Asp Thr Leu Gln Ala Glu Thr Asp Gln Leu Glu Asp Glu Lys Ser
755 760 765
Ala Leu Gln Thr Glu Ile Ala Asn Leu Leu Lys Glu Lys Glu Lys Leu
770 775 780
Glu Phe Ile Leu Ala Ala His Asp Lys Thr His Thr Cys Pro Pro Cys
785 790 795 800
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
805 810 815
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
820 825 830
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
835 840 845
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
850 855 860
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
865 870 875 880
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
885 890 895
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
900 905 910
Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Arg Asp Glu
915 920 925
Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr
930 935 940
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
945 950 955 960
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
965 970 975
Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
980 985 990
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
995 1000 1005
Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Ser Gly Ser Gly Ser
1010 1015 1020
Gly Ser Leu Gly Gly Ile Phe Glu Ala Met Lys Met Glu Leu Arg
1025 1030 1035
Asp His His His His His His Asn Trp Ser His Pro Gln Phe Glu
1040 1045 1050
Lys Cys
1055
<210> 34
<211> 975
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 34
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Arg
1 5 10 15
Ser Ala His His Pro Ile Trp Ala Arg Met Asp Ala Gly Gly Gly Gly
20 25 30
Ser Leu Val Pro Arg Gly Ser Gly Gly Gly Gly Ser Gly Asp Ser Glu
35 40 45
Arg His Phe Val His Gln Phe Lys Gly Glu Cys Tyr Phe Thr Asn Gly
50 55 60
Thr Gln Arg Ile Arg Leu Val Thr Arg Tyr Ile Tyr Asn Arg Glu Glu
65 70 75 80
Tyr Leu Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg Ala Val Thr Glu
85 90 95
Leu Gly Arg His Ser Ala Glu Tyr Tyr Asn Lys Gln Tyr Leu Glu Arg
100 105 110
Thr Arg Ala Glu Leu Asp Thr Ala Cys Arg His Asn Tyr Glu Glu Thr
115 120 125
Glu Val Pro Thr Ser Leu Arg Arg Leu Glu Gln Pro Asn Val Ala Ile
130 135 140
Ser Leu Ser Arg Thr Glu Ala Leu Asn His His Asn Thr Leu Val Cys
145 150 155 160
Ser Val Thr Asp Phe Tyr Pro Ala Lys Ile Lys Val Arg Trp Phe Arg
165 170 175
Asn Gly Gln Glu Glu Thr Val Gly Val Ser Ser Thr Gln Leu Ile Arg
180 185 190
Asn Gly Asp Trp Thr Phe Gln Val Leu Val Met Leu Glu Met Thr Pro
195 200 205
His Gln Gly Glu Val Tyr Thr Cys His Val Glu His Pro Ser Leu Lys
210 215 220
Ser Pro Ile Thr Val Glu Trp Arg Ala Gln Ser Glu Ser Ala Arg Ser
225 230 235 240
Lys Ser Gly Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys
245 250 255
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
260 265 270
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
275 280 285
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
290 295 300
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
305 310 315 320
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
325 330 335
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
340 345 350
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
355 360 365
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu
370 375 380
Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr
385 390 395 400
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
405 410 415
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
420 425 430
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
435 440 445
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
450 455 460
Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Ser Gly Ala Thr Asn Phe
465 470 475 480
Ser Leu Leu Lys Gln Ala Gly Asp Val Glu Glu Asn Pro Gly Pro Met
485 490 495
Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Glu Asp
500 505 510
Asp Ile Glu Ala Asp His Val Gly Phe Tyr Gly Thr Thr Val Tyr Gln
515 520 525
Ser Pro Gly Asp Ile Gly Gln Tyr Thr His Glu Phe Asp Gly Asp Glu
530 535 540
Leu Phe Tyr Val Asp Leu Asp Lys Lys Lys Thr Val Trp Arg Leu Pro
545 550 555 560
Glu Phe Gly Gln Leu Ile Leu Phe Glu Pro Gln Gly Gly Leu Gln Asn
565 570 575
Ile Ala Ala Glu Lys His Asn Leu Gly Ile Leu Thr Lys Arg Ser Asn
580 585 590
Phe Thr Pro Ala Thr Asn Glu Ala Pro Gln Ala Thr Val Phe Pro Lys
595 600 605
Ser Pro Val Leu Leu Gly Gln Pro Asn Thr Leu Ile Cys Phe Val Asp
610 615 620
Asn Ile Phe Pro Pro Val Ile Asn Ile Thr Trp Leu Arg Asn Ser Lys
625 630 635 640
Ser Val Thr Asp Gly Val Tyr Glu Thr Ser Phe Leu Val Asn Arg Asp
645 650 655
His Ser Phe His Lys Leu Ser Tyr Leu Thr Phe Ile Pro Ser Asp Asp
660 665 670
Asp Ile Tyr Asp Cys Lys Val Glu His Trp Gly Leu Glu Glu Pro Val
675 680 685
Leu Lys His Trp Glu Pro Glu Ile Pro Ala Pro Met Ser Glu Leu Thr
690 695 700
Glu Ser Gly Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys
705 710 715 720
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
725 730 735
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
740 745 750
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
755 760 765
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
770 775 780
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
785 790 795 800
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
805 810 815
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
820 825 830
Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Arg Asp Glu
835 840 845
Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr
850 855 860
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
865 870 875 880
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
885 890 895
Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
900 905 910
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
915 920 925
Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Ser Gly Ser Gly Ser Gly
930 935 940
Ser Leu Gly Gly Ile Phe Glu Ala Met Lys Met Glu Leu Arg Asp His
945 950 955 960
His His His His His Asn Trp Ser His Pro Gln Phe Glu Lys Cys
965 970 975
<210> 35
<211> 518
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 35
Met Gly Ser Leu Gln Pro Leu Ala Thr Leu Tyr Leu Leu Gly Met Leu
1 5 10 15
Val Ala Ser Ser Leu Gly Gln His Leu Gln Lys Asp Tyr Arg Ala Tyr
20 25 30
Tyr Thr Phe Gly Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser
35 40 45
Gly Asp Thr Arg Pro Arg Phe Leu Glu Tyr Ser Thr Ser Glu Cys His
50 55 60
Phe Phe Asn Gly Thr Glu Arg Val Arg Tyr Leu Asp Arg Tyr Phe His
65 70 75 80
Asn Gln Glu Glu Asn Val Arg Phe Asp Ser Asp Val Gly Glu Phe Arg
85 90 95
Ala Val Thr Glu Leu Gly Arg Pro Asp Ala Glu Tyr Trp Asn Ser Gln
100 105 110
Lys Asp Leu Leu Glu Gln Lys Arg Gly Arg Val Asp Asn Tyr Cys Arg
115 120 125
His Asn Tyr Gly Val Val Glu Ser Phe Thr Val Gln Arg Arg Val His
130 135 140
Pro Lys Val Thr Val Tyr Pro Ser Lys Thr Gln Pro Leu Gln His His
145 150 155 160
Asn Leu Leu Val Cys Ser Val Ser Gly Phe Tyr Pro Gly Ser Ile Glu
165 170 175
Val Arg Trp Phe Arg Asn Gly Gln Glu Glu Lys Thr Gly Val Val Ser
180 185 190
Thr Gly Leu Ile His Asn Gly Asp Trp Thr Phe Gln Thr Leu Val Met
195 200 205
Leu Glu Thr Val Pro Arg Ser Gly Glu Val Tyr Thr Cys Gln Val Glu
210 215 220
His Pro Ser Val Thr Ser Pro Leu Thr Val Glu Trp Arg Ala Arg Ser
225 230 235 240
Glu Ser Ala Gln Ser Lys Ser Gly Gly Gly Gly Gly Arg Ile Ala Arg
245 250 255
Leu Glu Glu Lys Val Lys Thr Leu Lys Ala Gln Asn Ser Glu Leu Ala
260 265 270
Ser Thr Ala Asn Met Leu Arg Glu Gln Val Ala Gln Leu Lys Gln Lys
275 280 285
Val Met Asn His Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
290 295 300
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
305 310 315 320
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
325 330 335
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
340 345 350
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
355 360 365
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
370 375 380
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
385 390 395 400
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
405 410 415
Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
420 425 430
Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp
435 440 445
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
450 455 460
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser
465 470 475 480
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
485 490 495
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
500 505 510
Leu Ser Leu Ser Pro Gly
515
<210> 36
<211> 518
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 36
Met Gly Ser Leu Gln Pro Leu Ala Thr Leu Tyr Leu Leu Gly Met Leu
1 5 10 15
Val Ala Ser Ser Leu Gly Gln His Leu Gln Lys Asp Tyr Arg Ala Tyr
20 25 30
Tyr Thr Phe Gly Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser
35 40 45
Gly Asp Thr Arg Pro Arg Phe Leu Glu Tyr Ser Thr Ser Glu Cys His
50 55 60
Phe Phe Asn Gly Thr Glu Arg Val Arg Tyr Leu Asp Arg Tyr Phe His
65 70 75 80
Asn Gln Glu Glu Asn Val Arg Phe Asp Ser Asp Val Gly Glu Phe Arg
85 90 95
Ala Val Thr Glu Leu Gly Arg Pro Asp Ala Glu Tyr Trp Asn Ser Gln
100 105 110
Lys Asp Leu Leu Glu Gln Lys Arg Gly Arg Val Asp Asn Tyr Cys Arg
115 120 125
His Asn Tyr Gly Val Val Glu Ser Phe Thr Val Gln Arg Arg Val His
130 135 140
Pro Lys Val Thr Val Tyr Pro Ser Lys Thr Gln Pro Leu Gln His His
145 150 155 160
Asn Leu Leu Val Cys Ser Val Ser Gly Phe Tyr Pro Gly Ser Ile Glu
165 170 175
Val Arg Trp Phe Arg Asn Gly Gln Glu Glu Lys Thr Gly Val Val Ser
180 185 190
Thr Gly Leu Ile His Asn Gly Asp Trp Thr Phe Gln Thr Leu Val Met
195 200 205
Leu Glu Thr Val Pro Arg Ser Gly Glu Val Tyr Thr Cys Gln Val Glu
210 215 220
His Pro Ser Val Thr Ser Pro Leu Thr Val Glu Trp Arg Ala Arg Ser
225 230 235 240
Glu Ser Ala Gln Ser Lys Ser Gly Gly Gly Gly Gly Arg Ile Ala Arg
245 250 255
Leu Glu Glu Lys Val Lys Thr Leu Lys Ala Gln Asn Ser Glu Leu Ala
260 265 270
Ser Thr Ala Asn Met Leu Arg Glu Gln Val Ala Gln Leu Lys Gln Lys
275 280 285
Val Met Asn His Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
290 295 300
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
305 310 315 320
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
325 330 335
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
340 345 350
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
355 360 365
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
370 375 380
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
385 390 395 400
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
405 410 415
Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys
420 425 430
Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
435 440 445
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
450 455 460
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
465 470 475 480
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
485 490 495
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
500 505 510
Leu Ser Leu Ser Pro Gly
515
<210> 37
<211> 478
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 37
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Ile
1 5 10 15
Lys Glu Glu His Val Ile Ile Gln Ala Glu Phe Tyr Leu Asn Pro Asp
20 25 30
Gln Ser Gly Glu Phe Met Phe Asp Phe Asp Gly Asp Glu Ile Phe His
35 40 45
Val Asp Met Ala Lys Lys Glu Thr Val Trp Arg Leu Glu Glu Phe Gly
50 55 60
Arg Phe Ala Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val
65 70 75 80
Asp Lys Ala Asn Leu Glu Ile Met Thr Lys Arg Ser Asn Tyr Thr Pro
85 90 95
Ile Thr Asn Val Pro Pro Glu Val Thr Val Leu Thr Asn Ser Pro Val
100 105 110
Glu Leu Arg Glu Pro Asn Val Leu Ile Cys Phe Ile Asp Lys Phe Thr
115 120 125
Pro Pro Val Val Asn Val Thr Trp Leu Arg Asn Gly Lys Pro Val Thr
130 135 140
Thr Gly Val Ser Glu Thr Val Phe Leu Pro Arg Glu Asp His Leu Phe
145 150 155 160
Arg Lys Phe His Tyr Leu Pro Phe Leu Pro Ser Thr Glu Asp Val Tyr
165 170 175
Asp Cys Arg Val Glu His Trp Gly Leu Asp Glu Pro Leu Leu Lys His
180 185 190
Trp Glu Phe Asp Ala Pro Ser Pro Leu Pro Glu Thr Thr Glu Ser Gly
195 200 205
Gly Gly Gly Gly Leu Thr Asp Thr Leu Gln Ala Glu Thr Asp Gln Leu
210 215 220
Glu Asp Glu Lys Ser Ala Leu Gln Thr Glu Ile Ala Asn Leu Leu Lys
225 230 235 240
Glu Lys Glu Lys Leu Glu Phe Ile Leu Ala Ala His Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
465 470 475
<210> 38
<211> 478
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 38
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Ile
1 5 10 15
Lys Glu Glu His Val Ile Ile Gln Ala Glu Phe Tyr Leu Asn Pro Asp
20 25 30
Gln Ser Gly Glu Phe Met Phe Asp Phe Asp Gly Asp Glu Ile Phe His
35 40 45
Val Asp Met Ala Lys Lys Glu Thr Val Trp Arg Leu Glu Glu Phe Gly
50 55 60
Arg Phe Ala Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val
65 70 75 80
Asp Lys Ala Asn Leu Glu Ile Met Thr Lys Arg Ser Asn Tyr Thr Pro
85 90 95
Ile Thr Asn Val Pro Pro Glu Val Thr Val Leu Thr Asn Ser Pro Val
100 105 110
Glu Leu Arg Glu Pro Asn Val Leu Ile Cys Phe Ile Asp Lys Phe Thr
115 120 125
Pro Pro Val Val Asn Val Thr Trp Leu Arg Asn Gly Lys Pro Val Thr
130 135 140
Thr Gly Val Ser Glu Thr Val Phe Leu Pro Arg Glu Asp His Leu Phe
145 150 155 160
Arg Lys Phe His Tyr Leu Pro Phe Leu Pro Ser Thr Glu Asp Val Tyr
165 170 175
Asp Cys Arg Val Glu His Trp Gly Leu Asp Glu Pro Leu Leu Lys His
180 185 190
Trp Glu Phe Asp Ala Pro Ser Pro Leu Pro Glu Thr Thr Glu Ser Gly
195 200 205
Gly Gly Gly Gly Leu Thr Asp Thr Leu Gln Ala Glu Thr Asp Gln Leu
210 215 220
Glu Asp Glu Lys Ser Ala Leu Gln Thr Glu Ile Ala Asn Leu Leu Lys
225 230 235 240
Glu Lys Glu Lys Leu Glu Phe Ile Leu Ala Ala His Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
465 470 475
<210> 39
<211> 478
<212> PRT
<<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 39
Met Gly Ser Leu Gln Pro Leu Ala Thr Leu Tyr Leu Leu Gly Met Leu
1 5 10 15
Val Ala Ser Ser Leu Gly Gln His Leu Gln Lys Asp Tyr Arg Ala Tyr
20 25 30
Tyr Thr Phe Gly Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser
35 40 45
Gly Asp Thr Arg Pro Arg Phe Leu Glu Tyr Ser Thr Ser Glu Cys His
50 55 60
Phe Phe Asn Gly Thr Glu Arg Val Arg Tyr Leu Asp Arg Tyr Phe His
65 70 75 80
Asn Gln Glu Glu Asn Val Arg Phe Asp Ser Asp Val Gly Glu Phe Arg
85 90 95
Ala Val Thr Glu Leu Gly Arg Pro Asp Ala Glu Tyr Trp Asn Ser Gln
100 105 110
Lys Asp Leu Leu Glu Gln Lys Arg Gly Arg Val Asp Asn Tyr Cys Arg
115 120 125
His Asn Tyr Gly Val Val Glu Ser Phe Thr Val Gln Arg Arg Val His
130 135 140
Pro Lys Val Thr Val Tyr Pro Ser Lys Thr Gln Pro Leu Gln His His
145 150 155 160
Asn Leu Leu Val Cys Ser Val Ser Gly Phe Tyr Pro Gly Ser Ile Glu
165 170 175
Val Arg Trp Phe Arg Asn Gly Gln Glu Glu Lys Thr Gly Val Val Ser
180 185 190
Thr Gly Leu Ile His Asn Gly Asp Trp Thr Phe Gln Thr Leu Val Met
195 200 205
Leu Glu Thr Val Pro Arg Ser Gly Glu Val Tyr Thr Cys Gln Val Glu
210 215 220
His Pro Ser Val Thr Ser Pro Leu Thr Val Glu Trp Arg Ala Arg Ser
225 230 235 240
Glu Ser Ala Gln Ser Lys Ser Gly Gly Gly Gly Gly Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
465 470 475
<210> 40
<211> 478
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 40
Met Gly Ser Leu Gln Pro Leu Ala Thr Leu Tyr Leu Leu Gly Met Leu
1 5 10 15
Val Ala Ser Ser Leu Gly Gln His Leu Gln Lys Asp Tyr Arg Ala Tyr
20 25 30
Tyr Thr Phe Gly Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser
35 40 45
Gly Asp Thr Arg Pro Arg Phe Leu Glu Tyr Ser Thr Ser Glu Cys His
50 55 60
Phe Phe Asn Gly Thr Glu Arg Val Arg Tyr Leu Asp Arg Tyr Phe His
65 70 75 80
Asn Gln Glu Glu Asn Val Arg Phe Asp Ser Asp Val Gly Glu Phe Arg
85 90 95
Ala Val Thr Glu Leu Gly Arg Pro Asp Ala Glu Tyr Trp Asn Ser Gln
100 105 110
Lys Asp Leu Leu Glu Gln Lys Arg Gly Arg Val Asp Asn Tyr Cys Arg
115 120 125
His Asn Tyr Gly Val Val Glu Ser Phe Thr Val Gln Arg Arg Val His
130 135 140
Pro Lys Val Thr Val Tyr Pro Ser Lys Thr Gln Pro Leu Gln His His
145 150 155 160
Asn Leu Leu Val Cys Ser Val Ser Gly Phe Tyr Pro Gly Ser Ile Glu
165 170 175
Val Arg Trp Phe Arg Asn Gly Gln Glu Glu Lys Thr Gly Val Val Ser
180 185 190
Thr Gly Leu Ile His Asn Gly Asp Trp Thr Phe Gln Thr Leu Val Met
195 200 205
Leu Glu Thr Val Pro Arg Ser Gly Glu Val Tyr Thr Cys Gln Val Glu
210 215 220
His Pro Ser Val Thr Ser Pro Leu Thr Val Glu Trp Arg Ala Arg Ser
225 230 235 240
Glu Ser Ala Gln Ser Lys Ser Gly Gly Gly Gly Gly Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
465 470 475
<210> 41
<211> 438
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 41
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Ile
1 5 10 15
Lys Glu Glu His Val Ile Ile Gln Ala Glu Phe Tyr Leu Asn Pro Asp
20 25 30
Gln Ser Gly Glu Phe Met Phe Asp Phe Asp Gly Asp Glu Ile Phe His
35 40 45
Val Asp Met Ala Lys Lys Glu Thr Val Trp Arg Leu Glu Glu Phe Gly
50 55 60
Arg Phe Ala Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val
65 70 75 80
Asp Lys Ala Asn Leu Glu Ile Met Thr Lys Arg Ser Asn Tyr Thr Pro
85 90 95
Ile Thr Asn Val Pro Pro Glu Val Thr Val Leu Thr Asn Ser Pro Val
100 105 110
Glu Leu Arg Glu Pro Asn Val Leu Ile Cys Phe Ile Asp Lys Phe Thr
115 120 125
Pro Pro Val Val Asn Val Thr Trp Leu Arg Asn Gly Lys Pro Val Thr
130 135 140
Thr Gly Val Ser Glu Thr Val Phe Leu Pro Arg Glu Asp His Leu Phe
145 150 155 160
Arg Lys Phe His Tyr Leu Pro Phe Leu Pro Ser Thr Glu Asp Val Tyr
165 170 175
Asp Cys Arg Val Glu His Trp Gly Leu Asp Glu Pro Leu Leu Lys His
180 185 190
Trp Glu Phe Asp Ala Pro Ser Pro Leu Pro Glu Thr Thr Glu Ser Gly
195 200 205
Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
210 215 220
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
225 230 235 240
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
245 250 255
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
260 265 270
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
275 280 285
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
290 295 300
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
305 310 315 320
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
325 330 335
Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys
340 345 350
Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
355 360 365
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
370 375 380
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
385 390 395 400
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
405 410 415
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
420 425 430
Leu Ser Leu Ser Pro Gly
435
<210> 42
<211> 438
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 42
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Ile
1 5 10 15
Lys Glu Glu His Val Ile Ile Gln Ala Glu Phe Tyr Leu Asn Pro Asp
20 25 30
Gln Ser Gly Glu Phe Met Phe Asp Phe Asp Gly Asp Glu Ile Phe His
35 40 45
Val Asp Met Ala Lys Lys Glu Thr Val Trp Arg Leu Glu Glu Phe Gly
50 55 60
Arg Phe Ala Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val
65 70 75 80
Asp Lys Ala Asn Leu Glu Ile Met Thr Lys Arg Ser Asn Tyr Thr Pro
85 90 95
Ile Thr Asn Val Pro Pro Glu Val Thr Val Leu Thr Asn Ser Pro Val
100 105 110
Glu Leu Arg Glu Pro Asn Val Leu Ile Cys Phe Ile Asp Lys Phe Thr
115 120 125
Pro Pro Val Val Asn Val Thr Trp Leu Arg Asn Gly Lys Pro Val Thr
130 135 140
Thr Gly Val Ser Glu Thr Val Phe Leu Pro Arg Glu Asp His Leu Phe
145 150 155 160
Arg Lys Phe His Tyr Leu Pro Phe Leu Pro Ser Thr Glu Asp Val Tyr
165 170 175
Asp Cys Arg Val Glu His Trp Gly Leu Asp Glu Pro Leu Leu Lys His
180 185 190
Trp Glu Phe Asp Ala Pro Ser Pro Leu Pro Glu Thr Thr Glu Ser Gly
195 200 205
Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
210 215 220
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
225 230 235 240
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
245 250 255
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
260 265 270
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
275 280 285
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
290 295 300
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
305 310 315 320
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
325 330 335
Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
340 345 350
Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp
355 360 365
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
370 375 380
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser
385 390 395 400
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
405 410 415
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
420 425 430
Leu Ser Leu Ser Pro Gly
435
<210> 43
<211> 513
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 43
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Arg
1 5 10 15
Ser Ala His His Pro Ile Trp Ala Arg Met Asp Ala Gly Gly Gly Gly
20 25 30
Ser Leu Val Pro Arg Gly Ser Gly Gly Gly Gly Ser Gly Asp Ser Glu
35 40 45
Arg His Phe Val His Gln Phe Lys Gly Glu Cys Tyr Phe Thr Asn Gly
50 55 60
Thr Gln Arg Ile Arg Leu Val Thr Arg Tyr Ile Tyr Asn Arg Glu Glu
65 70 75 80
Tyr Leu Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg Ala Val Thr Glu
85 90 95
Leu Gly Arg His Ser Ala Glu Tyr Tyr Asn Lys Gln Tyr Leu Glu Arg
100 105 110
Thr Arg Ala Glu Leu Asp Thr Ala Cys Arg His Asn Tyr Glu Glu Thr
115 120 125
Glu Val Pro Thr Ser Leu Arg Arg Leu Glu Gln Pro Asn Val Ala Ile
130 135 140
Ser Leu Ser Arg Thr Glu Ala Leu Asn His His Asn Thr Leu Val Cys
145 150 155 160
Ser Val Thr Asp Phe Tyr Pro Ala Lys Ile Lys Val Arg Trp Phe Arg
165 170 175
Asn Gly Gln Glu Glu Thr Val Gly Val Ser Ser Thr Gln Leu Ile Arg
180 185 190
Asn Gly Asp Trp Thr Phe Gln Val Leu Val Met Leu Glu Met Thr Pro
195 200 205
His Gln Gly Glu Val Tyr Thr Cys His Val Glu His Pro Ser Leu Lys
210 215 220
Ser Pro Ile Thr Val Glu Trp Arg Ala Gln Ser Glu Ser Ala Arg Ser
225 230 235 240
Lys Ser Gly Gly Gly Gly Gly Arg Ile Ala Arg Leu Glu Glu Lys Val
245 250 255
Lys Thr Leu Lys Ala Gln Asn Ser Glu Leu Ala Ser Thr Ala Asn Met
260 265 270
Leu Arg Glu Gln Val Ala Gln Leu Lys Gln Lys Val Met Asn His Asp
275 280 285
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
290 295 300
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
305 310 315 320
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
325 330 335
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
340 345 350
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
355 360 365
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
370 375 380
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
385 390 395 400
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys
405 410 415
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
420 425 430
Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
435 440 445
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
450 455 460
Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp
465 470 475 480
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
485 490 495
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
500 505 510
Gly
<210> 44
<211> 513
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 44
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Arg
1 5 10 15
Ser Ala His His Pro Ile Trp Ala Arg Met Asp Ala Gly Gly Gly Gly
20 25 30
Ser Leu Val Pro Arg Gly Ser Gly Gly Gly Gly Ser Gly Asp Ser Glu
35 40 45
Arg His Phe Val His Gln Phe Lys Gly Glu Cys Tyr Phe Thr Asn Gly
50 55 60
Thr Gln Arg Ile Arg Leu Val Thr Arg Tyr Ile Tyr Asn Arg Glu Glu
65 70 75 80
Tyr Leu Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg Ala Val Thr Glu
85 90 95
Leu Gly Arg His Ser Ala Glu Tyr Tyr Asn Lys Gln Tyr Leu Glu Arg
100 105 110
Thr Arg Ala Glu Leu Asp Thr Ala Cys Arg His Asn Tyr Glu Glu Thr
115 120 125
Glu Val Pro Thr Ser Leu Arg Arg Leu Glu Gln Pro Asn Val Ala Ile
130 135 140
Ser Leu Ser Arg Thr Glu Ala Leu Asn His His Asn Thr Leu Val Cys
145 150 155 160
Ser Val Thr Asp Phe Tyr Pro Ala Lys Ile Lys Val Arg Trp Phe Arg
165 170 175
Asn Gly Gln Glu Glu Thr Val Gly Val Ser Ser Thr Gln Leu Ile Arg
180 185 190
Asn Gly Asp Trp Thr Phe Gln Val Leu Val Met Leu Glu Met Thr Pro
195 200 205
His Gln Gly Glu Val Tyr Thr Cys His Val Glu His Pro Ser Leu Lys
210 215 220
Ser Pro Ile Thr Val Glu Trp Arg Ala Gln Ser Glu Ser Ala Arg Ser
225 230 235 240
Lys Ser Gly Gly Gly Gly Gly Arg Ile Ala Arg Leu Glu Glu Lys Val
245 250 255
Lys Thr Leu Lys Ala Gln Asn Ser Glu Leu Ala Ser Thr Ala Asn Met
260 265 270
Leu Arg Glu Gln Val Ala Gln Leu Lys Gln Lys Val Met Asn His Asp
275 280 285
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
290 295 300
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
305 310 315 320
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
325 330 335
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
340 345 350
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
355 360 365
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
370 375 380
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
385 390 395 400
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
405 410 415
Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
420 425 430
Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
435 440 445
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
450 455 460
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
465 470 475 480
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
485 490 495
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
500 505 510
Gly
<210> 45
<211> 482
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 45
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Glu
1 5 10 15
Asp Asp Ile Glu Ala Asp His Val Gly Phe Tyr Gly Thr Thr Val Tyr
20 25 30
Gln Ser Pro Gly Asp Ile Gly Gln Tyr Thr His Glu Phe Asp Gly Asp
35 40 45
Glu Leu Phe Tyr Val Asp Leu Asp Lys Lys Lys Thr Val Trp Arg Leu
50 55 60
Pro Glu Phe Gly Gln Leu Ile Leu Phe Glu Pro Gln Gly Gly Leu Gln
65 70 75 80
Asn Ile Ala Ala Glu Lys His Asn Leu Gly Ile Leu Thr Lys Arg Ser
85 90 95
Asn Phe Thr Pro Ala Thr Asn Glu Ala Pro Gln Ala Thr Val Phe Pro
100 105 110
Lys Ser Pro Val Leu Leu Gly Gln Pro Asn Thr Leu Ile Cys Phe Val
115 120 125
Asp Asn Ile Phe Pro Pro Val Ile Asn Ile Thr Trp Leu Arg Asn Ser
130 135 140
Lys Ser Val Thr Asp Gly Val Tyr Glu Thr Ser Phe Leu Val Asn Arg
145 150 155 160
Asp His Ser Phe His Lys Leu Ser Tyr Leu Thr Phe Ile Pro Ser Asp
165 170 175
Asp Asp Ile Tyr Asp Cys Lys Val Glu His Trp Gly Leu Glu Glu Pro
180 185 190
Val Leu Lys His Trp Glu Pro Glu Ile Pro Ala Pro Met Ser Glu Leu
195 200 205
Thr Glu Ser Gly Gly Gly Gly Gly Leu Thr Asp Thr Leu Gln Ala Glu
210 215 220
Thr Asp Gln Leu Glu Asp Glu Lys Ser Ala Leu Gln Thr Glu Ile Ala
225 230 235 240
Asn Leu Leu Lys Glu Lys Glu Lys Leu Glu Phe Ile Leu Ala Ala His
245 250 255
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
260 265 270
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
275 280 285
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
290 295 300
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
305 310 315 320
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
325 330 335
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
340 345 350
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
355 360 365
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
370 375 380
Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
385 390 395 400
Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
405 410 415
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
420 425 430
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
435 440 445
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
450 455 460
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
465 470 475 480
Pro Gly
<210> 46
<211> 482
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 46
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Glu
1 5 10 15
Asp Asp Ile Glu Ala Asp His Val Gly Phe Tyr Gly Thr Thr Val Tyr
20 25 30
Gln Ser Pro Gly Asp Ile Gly Gln Tyr Thr His Glu Phe Asp Gly Asp
35 40 45
Glu Leu Phe Tyr Val Asp Leu Asp Lys Lys Lys Thr Val Trp Arg Leu
50 55 60
Pro Glu Phe Gly Gln Leu Ile Leu Phe Glu Pro Gln Gly Gly Leu Gln
65 70 75 80
Asn Ile Ala Ala Glu Lys His Asn Leu Gly Ile Leu Thr Lys Arg Ser
85 90 95
Asn Phe Thr Pro Ala Thr Asn Glu Ala Pro Gln Ala Thr Val Phe Pro
100 105 110
Lys Ser Pro Val Leu Leu Gly Gln Pro Asn Thr Leu Ile Cys Phe Val
115 120 125
Asp Asn Ile Phe Pro Pro Val Ile Asn Ile Thr Trp Leu Arg Asn Ser
130 135 140
Lys Ser Val Thr Asp Gly Val Tyr Glu Thr Ser Phe Leu Val Asn Arg
145 150 155 160
Asp His Ser Phe His Lys Leu Ser Tyr Leu Thr Phe Ile Pro Ser Asp
165 170 175
Asp Asp Ile Tyr Asp Cys Lys Val Glu His Trp Gly Leu Glu Glu Pro
180 185 190
Val Leu Lys His Trp Glu Pro Glu Ile Pro Ala Pro Met Ser Glu Leu
195 200 205
Thr Glu Ser Gly Gly Gly Gly Gly Leu Thr Asp Thr Leu Gln Ala Glu
210 215 220
Thr Asp Gln Leu Glu Asp Glu Lys Ser Ala Leu Gln Thr Glu Ile Ala
225 230 235 240
Asn Leu Leu Lys Glu Lys Glu Lys Leu Glu Phe Ile Leu Ala Ala His
245 250 255
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
260 265 270
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
275 280 285
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
290 295 300
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
305 310 315 320
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
325 330 335
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
340 345 350
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
355 360 365
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
370 375 380
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
385 390 395 400
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
405 410 415
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
420 425 430
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
435 440 445
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
450 455 460
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
465 470 475 480
Pro Gly
<210> 47
<211> 473
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 47
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Arg
1 5 10 15
Ser Ala His His Pro Ile Trp Ala Arg Met Asp Ala Gly Gly Gly Gly
20 25 30
Ser Leu Val Pro Arg Gly Ser Gly Gly Gly Gly Ser Gly Asp Ser Glu
35 40 45
Arg His Phe Val His Gln Phe Lys Gly Glu Cys Tyr Phe Thr Asn Gly
50 55 60
Thr Gln Arg Ile Arg Leu Val Thr Arg Tyr Ile Tyr Asn Arg Glu Glu
65 70 75 80
Tyr Leu Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg Ala Val Thr Glu
85 90 95
Leu Gly Arg His Ser Ala Glu Tyr Tyr Asn Lys Gln Tyr Leu Glu Arg
100 105 110
Thr Arg Ala Glu Leu Asp Thr Ala Cys Arg His Asn Tyr Glu Glu Thr
115 120 125
Glu Val Pro Thr Ser Leu Arg Arg Leu Glu Gln Pro Asn Val Ala Ile
130 135 140
Ser Leu Ser Arg Thr Glu Ala Leu Asn His His Asn Thr Leu Val Cys
145 150 155 160
Ser Val Thr Asp Phe Tyr Pro Ala Lys Ile Lys Val Arg Trp Phe Arg
165 170 175
Asn Gly Gln Glu Glu Thr Val Gly Val Ser Ser Thr Gln Leu Ile Arg
180 185 190
Asn Gly Asp Trp Thr Phe Gln Val Leu Val Met Leu Glu Met Thr Pro
195 200 205
His Gln Gly Glu Val Tyr Thr Cys His Val Glu His Pro Ser Leu Lys
210 215 220
Ser Pro Ile Thr Val Glu Trp Arg Ala Gln Ser Glu Ser Ala Arg Ser
225 230 235 240
Lys Ser Gly Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys
245 250 255
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
260 265 270
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
275 280 285
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
290 295 300
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
305 310 315 320
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
325 330 335
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
340 345 350
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
355 360 365
Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Arg Asp Glu
370 375 380
Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr
385 390 395 400
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
405 410 415
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
420 425 430
Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
435 440 445
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
450 455 460
Gln Lys Ser Leu Ser Leu Ser Pro Gly
465 470
<210> 48
<211> 473
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 48
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Arg
1 5 10 15
Ser Ala His His Pro Ile Trp Ala Arg Met Asp Ala Gly Gly Gly Gly
20 25 30
Ser Leu Val Pro Arg Gly Ser Gly Gly Gly Gly Ser Gly Asp Ser Glu
35 40 45
Arg His Phe Val His Gln Phe Lys Gly Glu Cys Tyr Phe Thr Asn Gly
50 55 60
Thr Gln Arg Ile Arg Leu Val Thr Arg Tyr Ile Tyr Asn Arg Glu Glu
65 70 75 80
Tyr Leu Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg Ala Val Thr Glu
85 90 95
Leu Gly Arg His Ser Ala Glu Tyr Tyr Asn Lys Gln Tyr Leu Glu Arg
100 105 110
Thr Arg Ala Glu Leu Asp Thr Ala Cys Arg His Asn Tyr Glu Glu Thr
115 120 125
Glu Val Pro Thr Ser Leu Arg Arg Leu Glu Gln Pro Asn Val Ala Ile
130 135 140
Ser Leu Ser Arg Thr Glu Ala Leu Asn His His Asn Thr Leu Val Cys
145 150 155 160
Ser Val Thr Asp Phe Tyr Pro Ala Lys Ile Lys Val Arg Trp Phe Arg
165 170 175
Asn Gly Gln Glu Glu Thr Val Gly Val Ser Ser Thr Gln Leu Ile Arg
180 185 190
Asn Gly Asp Trp Thr Phe Gln Val Leu Val Met Leu Glu Met Thr Pro
195 200 205
His Gln Gly Glu Val Tyr Thr Cys His Val Glu His Pro Ser Leu Lys
210 215 220
Ser Pro Ile Thr Val Glu Trp Arg Ala Gln Ser Glu Ser Ala Arg Ser
225 230 235 240
Lys Ser Gly Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys
245 250 255
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
260 265 270
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
275 280 285
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
290 295 300
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
305 310 315 320
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
325 330 335
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
340 345 350
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
355 360 365
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu
370 375 380
Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr
385 390 395 400
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
405 410 415
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
420 425 430
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
435 440 445
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
450 455 460
Gln Lys Ser Leu Ser Leu Ser Pro Gly
465 470
<210> 49
<211> 442
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 49
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Glu
1 5 10 15
Asp Asp Ile Glu Ala Asp His Val Gly Phe Tyr Gly Thr Thr Val Tyr
20 25 30
Gln Ser Pro Gly Asp Ile Gly Gln Tyr Thr His Glu Phe Asp Gly Asp
35 40 45
Glu Leu Phe Tyr Val Asp Leu Asp Lys Lys Lys Thr Val Trp Arg Leu
50 55 60
Pro Glu Phe Gly Gln Leu Ile Leu Phe Glu Pro Gln Gly Gly Leu Gln
65 70 75 80
Asn Ile Ala Ala Glu Lys His Asn Leu Gly Ile Leu Thr Lys Arg Ser
85 90 95
Asn Phe Thr Pro Ala Thr Asn Glu Ala Pro Gln Ala Thr Val Phe Pro
100 105 110
Lys Ser Pro Val Leu Leu Gly Gln Pro Asn Thr Leu Ile Cys Phe Val
115 120 125
Asp Asn Ile Phe Pro Pro Val Ile Asn Ile Thr Trp Leu Arg Asn Ser
130 135 140
Lys Ser Val Thr Asp Gly Val Tyr Glu Thr Ser Phe Leu Val Asn Arg
145 150 155 160
Asp His Ser Phe His Lys Leu Ser Tyr Leu Thr Phe Ile Pro Ser Asp
165 170 175
Asp Asp Ile Tyr Asp Cys Lys Val Glu His Trp Gly Leu Glu Glu Pro
180 185 190
Val Leu Lys His Trp Glu Pro Glu Ile Pro Ala Pro Met Ser Glu Leu
195 200 205
Thr Glu Ser Gly Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro
210 215 220
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
290 295 300
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp
340 345 350
Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 50
<211> 442
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 50
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Glu
1 5 10 15
Asp Asp Ile Glu Ala Asp His Val Gly Phe Tyr Gly Thr Thr Val Tyr
20 25 30
Gln Ser Pro Gly Asp Ile Gly Gln Tyr Thr His Glu Phe Asp Gly Asp
35 40 45
Glu Leu Phe Tyr Val Asp Leu Asp Lys Lys Lys Thr Val Trp Arg Leu
50 55 60
Pro Glu Phe Gly Gln Leu Ile Leu Phe Glu Pro Gln Gly Gly Leu Gln
65 70 75 80
Asn Ile Ala Ala Glu Lys His Asn Leu Gly Ile Leu Thr Lys Arg Ser
85 90 95
Asn Phe Thr Pro Ala Thr Asn Glu Ala Pro Gln Ala Thr Val Phe Pro
100 105 110
Lys Ser Pro Val Leu Leu Gly Gln Pro Asn Thr Leu Ile Cys Phe Val
115 120 125
Asp Asn Ile Phe Pro Pro Val Ile Asn Ile Thr Trp Leu Arg Asn Ser
130 135 140
Lys Ser Val Thr Asp Gly Val Tyr Glu Thr Ser Phe Leu Val Asn Arg
145 150 155 160
Asp His Ser Phe His Lys Leu Ser Tyr Leu Thr Phe Ile Pro Ser Asp
165 170 175
Asp Asp Ile Tyr Asp Cys Lys Val Glu His Trp Gly Leu Glu Glu Pro
180 185 190
Val Leu Lys His Trp Glu Pro Glu Ile Pro Ala Pro Met Ser Glu Leu
195 200 205
Thr Glu Ser Gly Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro
210 215 220
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
290 295 300
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Arg Asp
340 345 350
Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 51
<211> 226
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 51
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly
225
<210> 52
<211> 106
<212> PRT
<213> Homo sapiens
<400> 52
Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Arg Asp
1 5 10 15
Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe
20 25 30
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
35 40 45
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
50 55 60
Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
65 70 75 80
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
85 90 95
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
100 105
<210> 53
<211> 226
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 53
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly
225
<210> 54
<211> 106
<212> PRT
<213> Homo sapiens
<400> 54
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp
1 5 10 15
Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe
20 25 30
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
35 40 45
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
50 55 60
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
65 70 75 80
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
85 90 95
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
100 105
<210> 55
<211> 113
<212> PRT
<213> Homo sapiens
<400> 55
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
1 5 10 15
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
20 25 30
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
35 40 45
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
50 55 60
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
65 70 75 80
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
85 90 95
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
100 105 110
Lys
<210> 56
<211> 224
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 56
Gln His Leu Gln Lys Asp Tyr Arg Ala Tyr Tyr Thr Phe Gly Gly Gly
1 5 10 15
Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser Gly Asp Thr Arg Pro Arg
20 25 30
Phe Leu Glu Tyr Ser Thr Ser Glu Cys His Phe Phe Asn Gly Thr Glu
35 40 45
Arg Val Arg Tyr Leu Asp Arg Tyr Phe His Asn Gln Glu Glu Asn Val
50 55 60
Arg Phe Asp Ser Asp Val Gly Glu Phe Arg Ala Val Thr Glu Leu Gly
65 70 75 80
Arg Pro Asp Ala Glu Tyr Trp Asn Ser Gln Lys Asp Leu Leu Glu Gln
85 90 95
Lys Arg Gly Arg Val Asp Asn Tyr Cys Arg His Asn Tyr Gly Val Val
100 105 110
Glu Ser Phe Thr Val Gln Arg Arg Val His Pro Lys Val Thr Val Tyr
115 120 125
Pro Ser Lys Thr Gln Pro Leu Gln His His Asn Leu Leu Val Cys Ser
130 135 140
Val Ser Gly Phe Tyr Pro Gly Ser Ile Glu Val Arg Trp Phe Arg Asn
145 150 155 160
Gly Gln Glu Glu Lys Thr Gly Val Val Ser Thr Gly Leu Ile His Asn
165 170 175
Gly Asp Trp Thr Phe Gln Thr Leu Val Met Leu Glu Thr Val Pro Arg
180 185 190
Ser Gly Glu Val Tyr Thr Cys Gln Val Glu His Pro Ser Val Thr Ser
195 200 205
Pro Leu Thr Val Glu Trp Arg Ala Arg Ser Glu Ser Ala Gln Ser Lys
210 215 220
<210> 57
<211> 191
<212> PRT
<213> Homo sapiens
<400> 57
Ile Lys Glu Glu His Val Ile Ile Gln Ala Glu Phe Tyr Leu Asn Pro
1 5 10 15
Asp Gln Ser Gly Glu Phe Met Phe Asp Phe Asp Gly Asp Glu Ile Phe
20 25 30
His Val Asp Met Ala Lys Lys Glu Thr Val Trp Arg Leu Glu Glu Phe
35 40 45
Gly Arg Phe Ala Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala
50 55 60
Val Asp Lys Ala Asn Leu Glu Ile Met Thr Lys Arg Ser Asn Tyr Thr
65 70 75 80
Pro Ile Thr Asn Val Pro Pro Glu Val Thr Val Leu Thr Asn Ser Pro
85 90 95
Val Glu Leu Arg Glu Pro Asn Val Leu Ile Cys Phe Ile Asp Lys Phe
100 105 110
Thr Pro Pro Val Val Asn Val Thr Trp Leu Arg Asn Gly Lys Pro Val
115 120 125
Thr Thr Gly Val Ser Glu Thr Val Phe Leu Pro Arg Glu Asp His Leu
130 135 140
Phe Arg Lys Phe His Tyr Leu Pro Phe Leu Pro Ser Thr Glu Asp Val
145 150 155 160
Tyr Asp Cys Arg Val Glu His Trp Gly Leu Asp Glu Pro Leu Leu Lys
165 170 175
His Trp Glu Phe Asp Ala Pro Ser Pro Leu Pro Glu Thr Thr Glu
180 185 190
<210> 58
<211> 198
<212> PRT
<213> Mus musculus
<400> 58
Gly Asp Ser Glu Arg His Phe Val His Gln Phe Lys Gly Glu Cys Tyr
1 5 10 15
Phe Thr Asn Gly Thr Gln Arg Ile Arg Leu Val Thr Arg Tyr Ile Tyr
20 25 30
Asn Arg Glu Glu Tyr Leu Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg
35 40 45
Ala Val Thr Glu Leu Gly Arg His Ser Ala Glu Tyr Tyr Asn Lys Gln
50 55 60
Tyr Leu Glu Arg Thr Arg Ala Glu Leu Asp Thr Ala Cys Arg His Asn
65 70 75 80
Tyr Glu Glu Thr Glu Val Pro Thr Ser Leu Arg Arg Leu Glu Gln Pro
85 90 95
Asn Val Ala Ile Ser Leu Ser Arg Thr Glu Ala Leu Asn His His Asn
100 105 110
Thr Leu Val Cys Ser Val Thr Asp Phe Tyr Pro Ala Lys Ile Lys Val
115 120 125
Arg Trp Phe Arg Asn Gly Gln Glu Glu Thr Val Gly Val Ser Ser Thr
130 135 140
Gln Leu Ile Arg Asn Gly Asp Trp Thr Phe Gln Val Leu Val Met Leu
145 150 155 160
Glu Met Thr Pro His Gln Gly Glu Val Tyr Thr Cys His Val Glu His
165 170 175
Pro Ser Leu Lys Ser Pro Ile Thr Val Glu Trp Arg Ala Gln Ser Glu
180 185 190
Ser Ala Arg Ser Lys Ser
195
<210> 59
<211> 196
<212> PRT
<213> Mus musculus
<400> 59
Glu Asp Asp Ile Glu Ala Asp His Val Gly Phe Tyr Gly Thr Thr Val
1 5 10 15
Tyr Gln Ser Pro Gly Asp Ile Gly Gln Tyr Thr His Glu Phe Asp Gly
20 25 30
Asp Glu Leu Phe Tyr Val Asp Leu Asp Lys Lys Lys Thr Val Trp Arg
35 40 45
Leu Pro Glu Phe Gly Gln Leu Ile Leu Phe Glu Pro Gln Gly Gly Leu
50 55 60
Gln Asn Ile Ala Ala Glu Lys His Asn Leu Gly Ile Leu Thr Lys Arg
65 70 75 80
Ser Asn Phe Thr Pro Ala Thr Asn Glu Ala Pro Gln Ala Thr Val Phe
85 90 95
Pro Lys Ser Pro Val Leu Leu Gly Gln Pro Asn Thr Leu Ile Cys Phe
100 105 110
Val Asp Asn Ile Phe Pro Pro Val Ile Asn Ile Thr Trp Leu Arg Asn
115 120 125
Ser Lys Ser Val Thr Asp Gly Val Tyr Glu Thr Ser Phe Leu Val Asn
130 135 140
Arg Asp His Ser Phe His Lys Leu Ser Tyr Leu Thr Phe Ile Pro Ser
145 150 155 160
Asp Asp Asp Ile Tyr Asp Cys Lys Val Glu His Trp Gly Leu Glu Glu
165 170 175
Pro Val Leu Lys His Trp Glu Pro Glu Ile Pro Ala Pro Met Ser Glu
180 185 190
Leu Thr Glu Ser
195
<210> 60
<211> 476
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 60
Met Ala Ile Ile Tyr Leu Ile Leu Leu Phe Thr Ala Val Arg Gly Ile
1 5 10 15
Lys Glu Glu His Val Ile Ile Gln Ala Glu Phe Tyr Leu Asn Pro Asp
20 25 30
Gln Ser Gly Glu Phe Met Phe Asp Phe Asp Gly Asp Glu Ile Phe His
35 40 45
Val Asp Met Ala Lys Lys Glu Thr Val Trp Arg Leu Glu Glu Phe Gly
50 55 60
Arg Phe Ala Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val
65 70 75 80
Asp Lys Ala Asn Leu Glu Cys Met Thr Lys Arg Ser Asn Tyr Thr Pro
85 90 95
Ile Thr Asn Val Pro Pro Glu Val Thr Val Leu Thr Asn Ser Pro Val
100 105 110
Glu Leu Arg Glu Pro Asn Val Leu Ile Cys Phe Ile Asp Lys Phe Thr
115 120 125
Pro Pro Val Val Asn Val Thr Trp Leu Arg Asn Gly Lys Pro Val Thr
130 135 140
Thr Gly Val Ser Glu Thr Val Phe Leu Pro Arg Glu Asp His Leu Phe
145 150 155 160
Arg Lys Phe His Tyr Leu Pro Phe Leu Pro Ser Thr Glu Asp Val Tyr
165 170 175
Asp Cys Arg Val Glu His Trp Gly Leu Asp Glu Pro Leu Leu Lys His
180 185 190
Trp Glu Phe Asp Ala Pro Ser Pro Leu Pro Glu Thr Thr Glu Ser Gly
195 200 205
Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
210 215 220
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
225 230 235 240
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
245 250 255
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
260 265 270
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
275 280 285
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
290 295 300
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
305 310 315 320
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
325 330 335
Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys
340 345 350
Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
355 360 365
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
370 375 380
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
385 390 395 400
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
405 410 415
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
420 425 430
Leu Ser Leu Ser Pro Gly Gly Ser Gly Ser Gly Ser Gly Ser Leu Gly
435 440 445
Gly Ile Phe Glu Ala Met Lys Met Glu Leu Arg Asp His His His His
450 455 460
His His Asn Trp Ser His Pro Gln Phe Glu Lys Cys
465 470 475
<210> 61
<211> 478
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 61
Met Gly Ser Leu Gln Pro Leu Ala Thr Leu Tyr Leu Leu Gly Met Leu
1 5 10 15
Val Ala Ser Ser Leu Gly Gln His Leu Gln Lys Asp Tyr Arg Ala Tyr
20 25 30
Tyr Thr Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser
35 40 45
Gly Asp Thr Arg Pro Arg Phe Leu Glu Tyr Ser Thr Ser Glu Cys His
50 55 60
Phe Phe Asn Gly Thr Glu Arg Val Arg Tyr Leu Asp Arg Tyr Phe His
65 70 75 80
Asn Gln Glu Glu Asn Val Arg Phe Asp Ser Asp Val Gly Glu Phe Arg
85 90 95
Ala Val Thr Glu Leu Gly Arg Pro Asp Ala Glu Tyr Trp Asn Ser Gln
100 105 110
Lys Asp Leu Leu Glu Gln Lys Arg Gly Arg Val Asp Asn Tyr Cys Arg
115 120 125
His Asn Tyr Gly Val Val Glu Ser Phe Thr Val Gln Arg Arg Val His
130 135 140
Pro Lys Val Thr Val Tyr Pro Ser Lys Thr Gln Pro Leu Gln His His
145 150 155 160
Asn Leu Leu Val Cys Ser Val Ser Gly Phe Tyr Pro Gly Ser Ile Glu
165 170 175
Val Arg Trp Phe Arg Asn Gly Gln Glu Glu Lys Thr Gly Val Val Ser
180 185 190
Thr Gly Leu Ile His Asn Gly Asp Trp Thr Phe Gln Thr Leu Val Met
195 200 205
Leu Glu Thr Val Pro Arg Ser Gly Glu Val Tyr Thr Cys Gln Val Glu
210 215 220
His Pro Ser Val Thr Ser Pro Leu Thr Val Glu Trp Arg Ala Arg Ser
225 230 235 240
Glu Ser Ala Gln Ser Lys Ser Gly Gly Gly Gly Gly Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
465 470 475
<210> 62
<211> 443
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 62
Met Met Ser Phe Val Ser Leu Leu Leu Val Gly Ile Leu Phe His Ala
1 5 10 15
Thr Gln Ala Ile Lys Glu Glu His Val Ile Ile Gln Ala Glu Phe Tyr
20 25 30
Leu Asn Pro Asp Gln Ser Gly Glu Phe Met Phe Asp Phe Asp Gly Asp
35 40 45
Glu Ile Phe His Val Asp Met Ala Lys Lys Glu Thr Val Trp Arg Leu
50 55 60
Glu Glu Phe Gly Arg Phe Ala Ser Phe Glu Ala Gln Gly Ala Leu Ala
65 70 75 80
Asn Ile Ala Val Asp Lys Ala Asn Leu Glu Met Thr Lys Arg Ser Asn
85 90 95
Tyr Thr Pro Ile Thr Asn Val Pro Pro Glu Val Thr Val Leu Thr Asn
100 105 110
Ser Val Glu Leu Arg Glu Pro Asn Val Leu Ile Cys Phe Ile Asp Lys
115 120 125
Phe Thr Pro Val Val Asn Val Thr Trp Leu Arg Asn Gly Lys Pro Val
130 135 140
Thr Thr Gly Val Ser Glu Thr Val Phe Leu Pro Arg Glu Asp His Leu
145 150 155 160
Phe Arg Lys Phe His Tyr Leu Pro Phe Leu Pro Ser Thr Glu Asp Val
165 170 175
Tyr Asp Cys Arg Val Glu His Trp Gly Leu Asp Glu Pro Leu Leu Lys
180 185 190
His Trp Glu Phe Asp Ala Pro Ser Pro Leu Pro Glu Thr Thr Glu Ser
195 200 205
Gly Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro Cys Pro Ala Pro
210 215 220
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
225 230 235 240
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
245 250 255
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
260 265 270
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
275 280 285
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
290 295 300
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
305 310 315 320
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
325 330 335
Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys
340 345 350
Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
355 360 365
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
370 375 380
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
385 390 395 400
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
405 410 415
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
420 425 430
Leu Ser Leu Ser Pro Gly Gly Ser Gly Ser Cys
435 440
<210> 63
<211> 478
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 63
Met Gly Ser Leu Gln Pro Leu Ala Thr Leu Tyr Leu Leu Gly Met Leu
1 5 10 15
Val Ala Ser Ser Leu Gly Gln His Leu Gln Lys Asp Tyr Arg Ala Tyr
20 25 30
Tyr Thr Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser
35 40 45
Gly Asp Thr Arg Pro Arg Phe Leu Glu Tyr Ser Thr Ser Glu Cys His
50 55 60
Phe Phe Asn Gly Thr Glu Arg Val Arg Tyr Leu Asp Arg Tyr Phe His
65 70 75 80
Asn Gln Glu Glu Asn Val Arg Phe Asp Ser Asp Val Gly Glu Phe Arg
85 90 95
Ala Val Thr Glu Leu Gly Arg Pro Asp Ala Glu Tyr Trp Asn Ser Gln
100 105 110
Lys Asp Leu Leu Glu Gln Lys Arg Gly Arg Val Asp Asn Tyr Cys Arg
115 120 125
His Asn Tyr Gly Val Val Glu Ser Phe Thr Val Gln Arg Arg Val His
130 135 140
Pro Lys Val Thr Val Tyr Pro Ser Lys Thr Gln Pro Leu Gln His His
145 150 155 160
Asn Leu Leu Val Cys Ser Val Ser Gly Phe Tyr Pro Gly Ser Ile Glu
165 170 175
Val Arg Trp Phe Arg Asn Gly Gln Glu Glu Lys Thr Gly Val Val Ser
180 185 190
Thr Gly Leu Ile His Asn Gly Asp Trp Thr Phe Gln Thr Leu Val Met
195 200 205
Leu Glu Thr Val Pro Arg Ser Gly Glu Val Tyr Thr Cys Gln Val Glu
210 215 220
His Pro Ser Val Thr Ser Pro Leu Thr Val Glu Trp Arg Ala Arg Ser
225 230 235 240
Glu Ser Ala Gln Ser Lys Ser Gly Gly Gly Gly Gly Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
465 470 475
<210> 64
<211> 1344
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 64
atgatgagct tcgtgagcct gctgctggtg ggcatcctgt tccacgccac ccaggccatc 60
aaagaagaac atgtgatcat ccaggccgag ttctatctga atcctgacca atcaggcgag 120
tttatgtttg actttgatgg tgatgagatt ttccatgtgg atatggcaaa gaaggagacg 180
gtctggcggc ttgaagaatt tggacgattt gccagctttg aggctcaagg tgcattggcc 240
aacatagctg tggacaaagc caacctggaa tgcatgacaa agcgctccaa ctatactccg 300
atcaccaatg tacctccaga ggtaactgtg ctcacaaaca gccctgtgga actgagagag 360
cccaacgtcc tcatctgttt catagacaag ttcaccccac cagtggtcaa tgtcacgtgg 420
cttcgaaatg gaaaacctgt caccacagga gtgtcagaga cagtcttcct gcccagggaa 480
gaccaccttt tccgcaagtt ccactatctc cccttcctgc cctcaactga ggacgtttac 540
gactgcaggg tggagcactg gggcttggat gagcctcttc tcaagcactg ggagtttgat 600
gctccaagcc ctctcccaga gactacagag tccggaggcg gaggcggaga caaaactcac 660
acatgcccac cgtgcccagc acctgaagcc gcggggggac cgtcagtctt cctcttcccc 720
ccaaaaccca aggacaccct catgatctcc cggacccctg aggtcacatg cgtggtggtg 780
gacgtgagcc acgaagaccc tgaggtcaag ttcaactggt acgtggacgg cgtggaggtg 840
cataatgcca agacaaagcc gcgggaggag cagtacaaca gcacgtaccg tgtggtcagc 900
gtcctcaccg tcctgcacca ggactggctg aatggcaagg agtacaagtg caaggtctcc 960
aacaaagccc tcccagcccc catcgagaaa accatctcca aagccaaagg gcagccccga 1020
gaaccacagg tgtacaccct gcccccatgc cgggatgagc tgaccaagaa ccaggtcagc 1080
ctgtggtgcc tggtcaaagg cttctatccc agcgacatcg ccgtggagtg ggagagcaat 1140
gggcagccgg agaacaacta caagaccacg cctcccgtgc tggactccga cggctccttc 1200
ttcctctaca gcaagctcac cgtggacaag agtaggtggc agcaggggaa cgtcttctca 1260
tgctccgtga tgcatgaggc tctgcacaac cactacacac agaagagcct ctccctgtct 1320
ccgggcggta gtggtagttg ttga 1344
<210> 65
<211> 1437
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 65
atgggttctc tgcaaccgct ggccaccttg tacctgctgg gtatgctggt cgctagcagc 60
ctcggacagc acctgcagaa ggactacaga gcctactaca cctgtggagg tggaggcggc 120
tcaggaggtg gaagcggcgg ctctggggac acccgaccac gtttcttgga gtactctacg 180
tctgagtgtc atttcttcaa tgggacggag cgggtgcggt acctggacag atacttccat 240
aaccaggagg agaacgtgcg cttcgacagc gacgtggggg agttccgggc ggtgacggag 300
ctggggcggc ctgatgccga gtactggaac agccagaagg acctcctgga gcagaagcgg 360
ggccgggtgg acaactactg cagacacaac tacggggttg tggagagctt cacagtgcag 420
cggcgagtcc atcctaaggt gactgtgtat ccttcaaaga cccagcccct gcagcaccat 480
aacctcctgg tctgttctgt gagtggtttc tatccaggca gcattgaagt caggtggttc 540
cggaatggcc aggaagagaa gactggggtg gtgtccacag gcctgatcca caatggagac 600
tggaccttcc agaccctggt gatgctggaa acagttcctc ggagtggaga ggtttacacc 660
tgccaagtgg agcacccaag cgtgacaagc cctctcacag tggaatggag agcacggtct 720
gaatctgcac agagcaagtc cggaggcgga ggcggagaca aaactcacac atgcccaccg 780
tgcccagcac ctgaagccgc ggggggaccg tcagtcttcc tcttcccccc aaaacccaag 840
gacaccctca tgatctcccg gacccctgag gtcacatgcg tggtggtgga cgtgagccac 900
gaagaccctg aggtcaagtt caactggtac gtggacggcg tggaggtgca taatgccaag 960
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 1020
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aagtctccaa caaagccctc 1080
ccagccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 1140
tgcaccctgc ccccatcccg ggatgagctg accaagaacc aggtcagcct gagctgcgcg 1200
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 1260
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctcgtcagc 1320
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 1380
catgaggctc tgcacaacca ctacacacag aagagcctct ccctgtctcc cggctga 1437
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МОЛЕКУЛЫ IMMTAC, СВЯЗЫВАЮЩИЕ РЕСТРИКТИРОВАННЫЙ ПО HLA-A*02 ПЕПТИД, С УВЕЛИЧЕННЫМ ПЕРИОДОМ ПОЛУВЫВЕДЕНИЯ | 2020 |
|
RU2833530C2 |
| ВЫСОКОАФФИННЫЙ Т-КЛЕТОЧНЫЙ РЕЦЕПТОР ДЛЯ РАСПОЗНАВАНИЯ АНТИГЕНА AFP | 2019 |
|
RU2836365C2 |
| ИСКУССТВЕННЫЕ АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2763798C1 |
| T-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ, РАСПОЗНАЮЩИЕ МУТАЦИЮ R175H ИЛИ Y220C В P53 | 2020 |
|
RU2830061C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО | 2021 |
|
RU2840407C1 |
| Композиции и библиотеки, содержащие рекомбинантные полинуклеотиды, кодирующие Т-клеточные рецепторы, и способы применения рекомбинантных Т-клеточных рецепторов | 2017 |
|
RU2752528C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ T-КЛЕТОК И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2835034C2 |
| ИММУНОИНДУЦИРУЮЩЕЕ СРЕДСТВО | 2016 |
|
RU2744843C2 |
| КОНСТРУКТЫ Т-КЛЕТОЧНОГО РЕЦЕПТОРА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2785954C2 |
| НОВЫЕ КОНСТРУКЦИИ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА, СОДЕРЖАЩИЕ ДОМЕНЫ TNFR2 | 2019 |
|
RU2808254C2 |
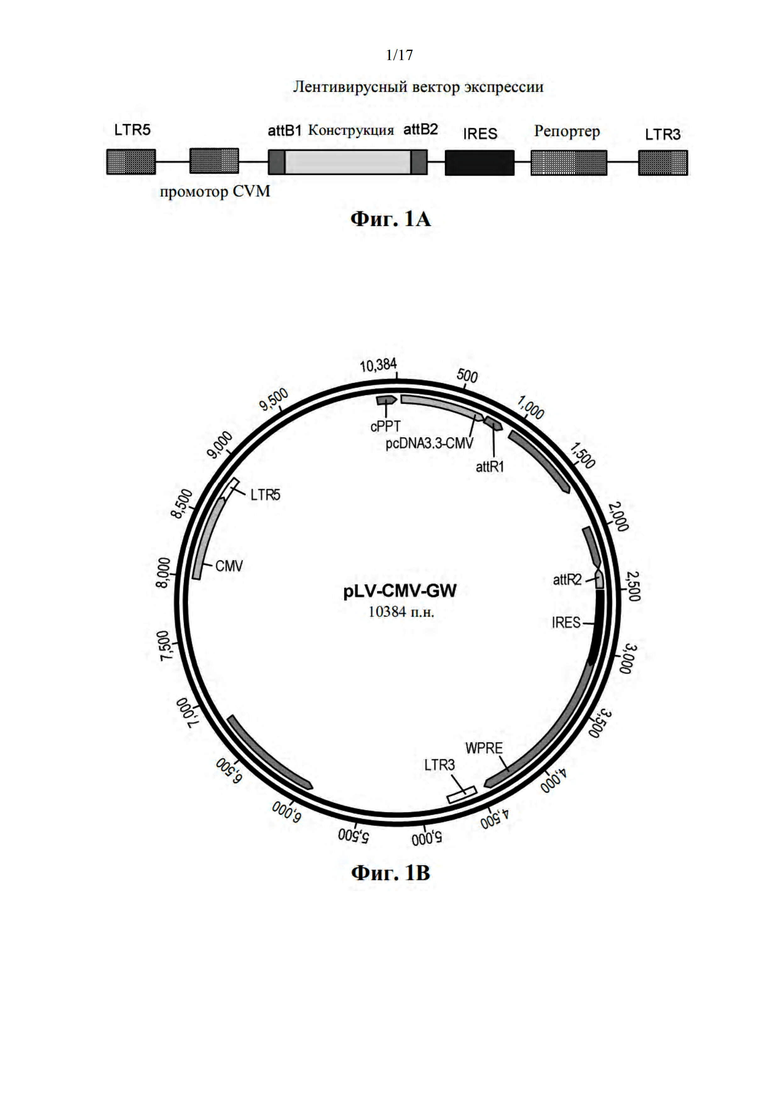
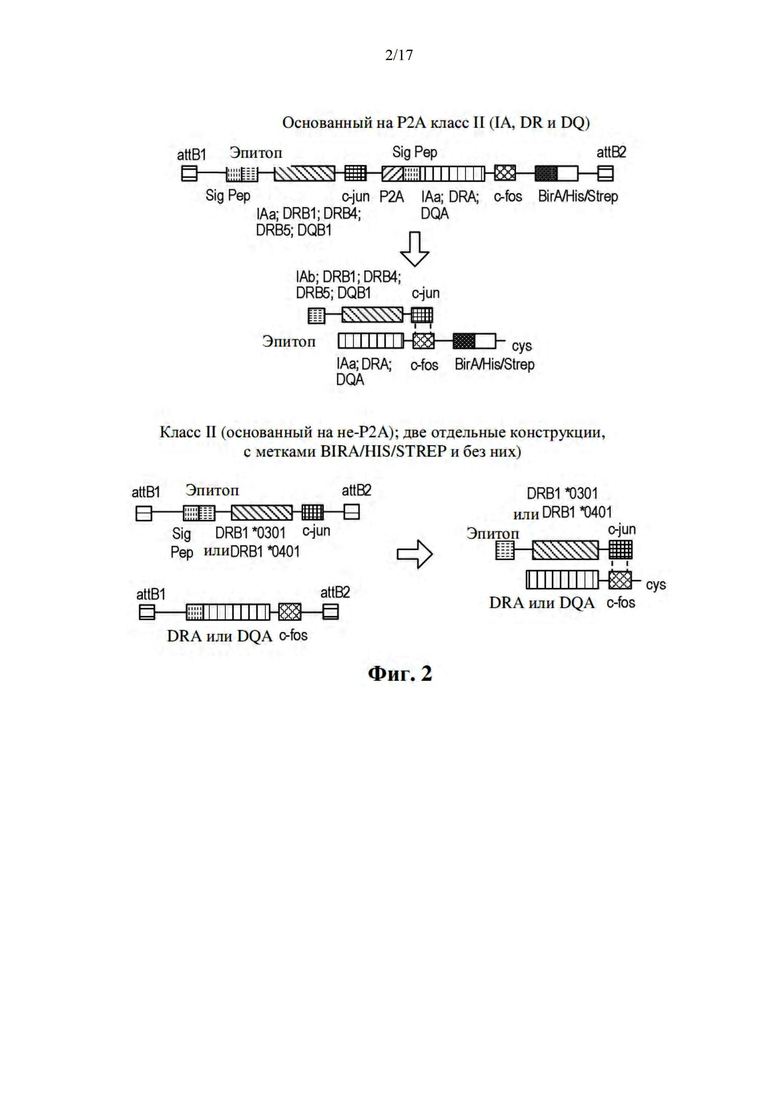



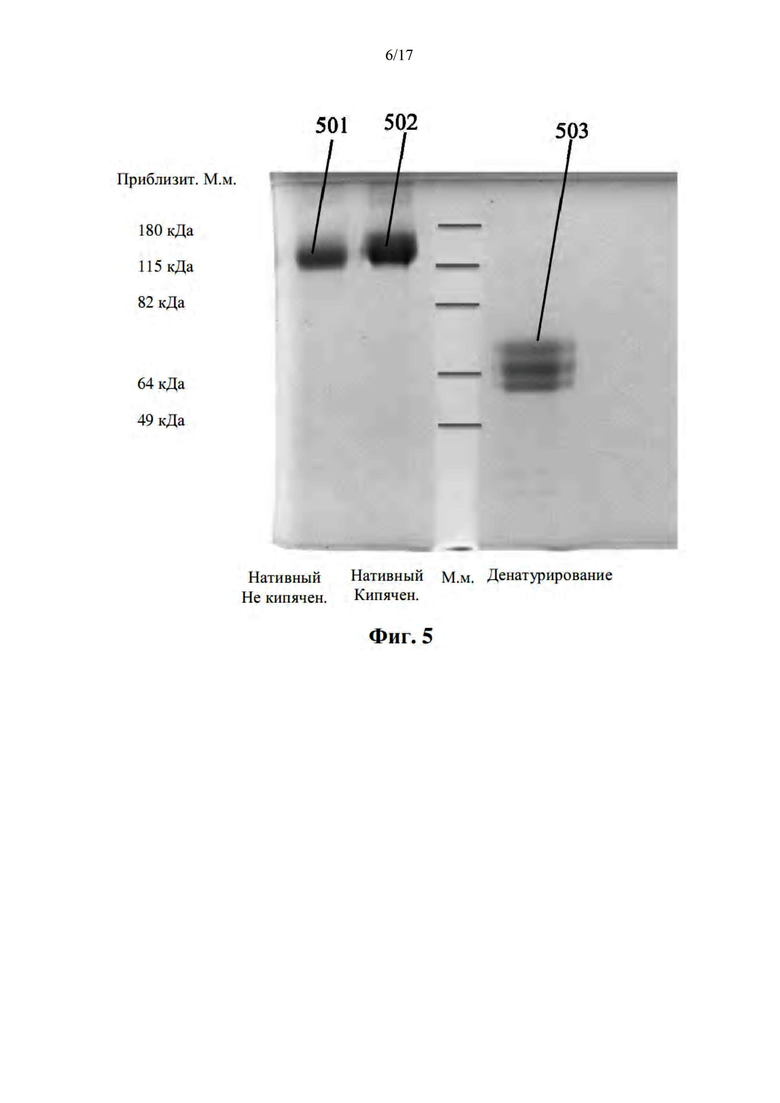
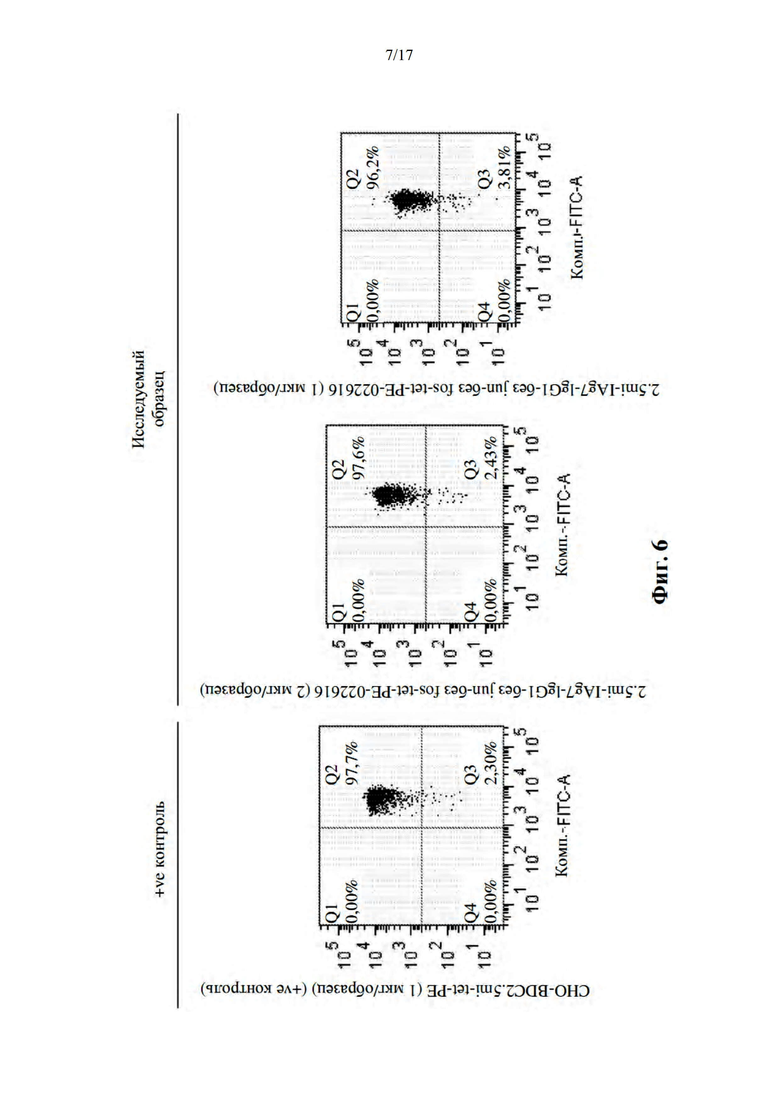
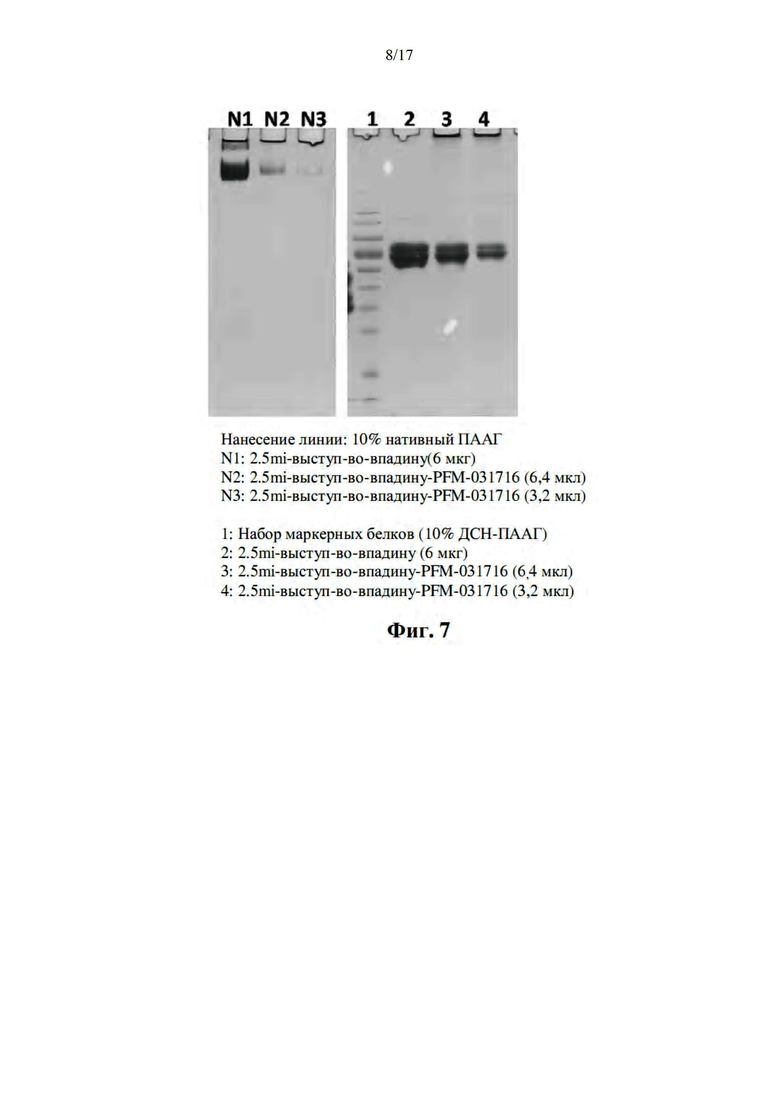
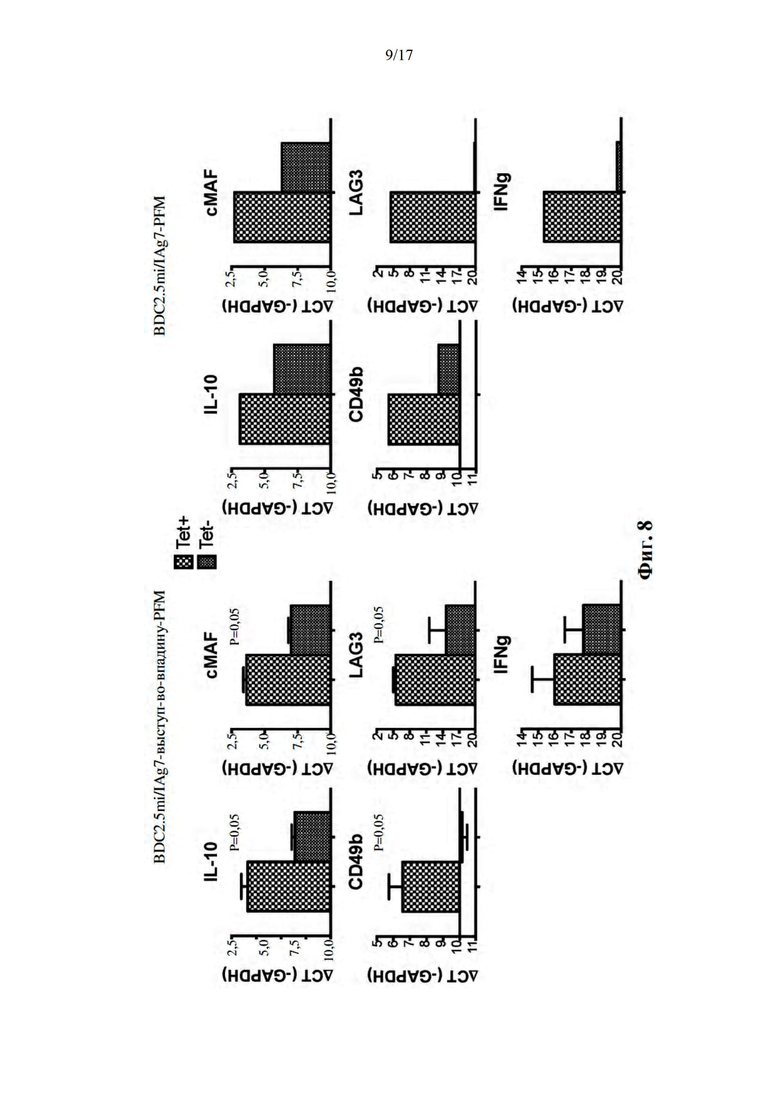
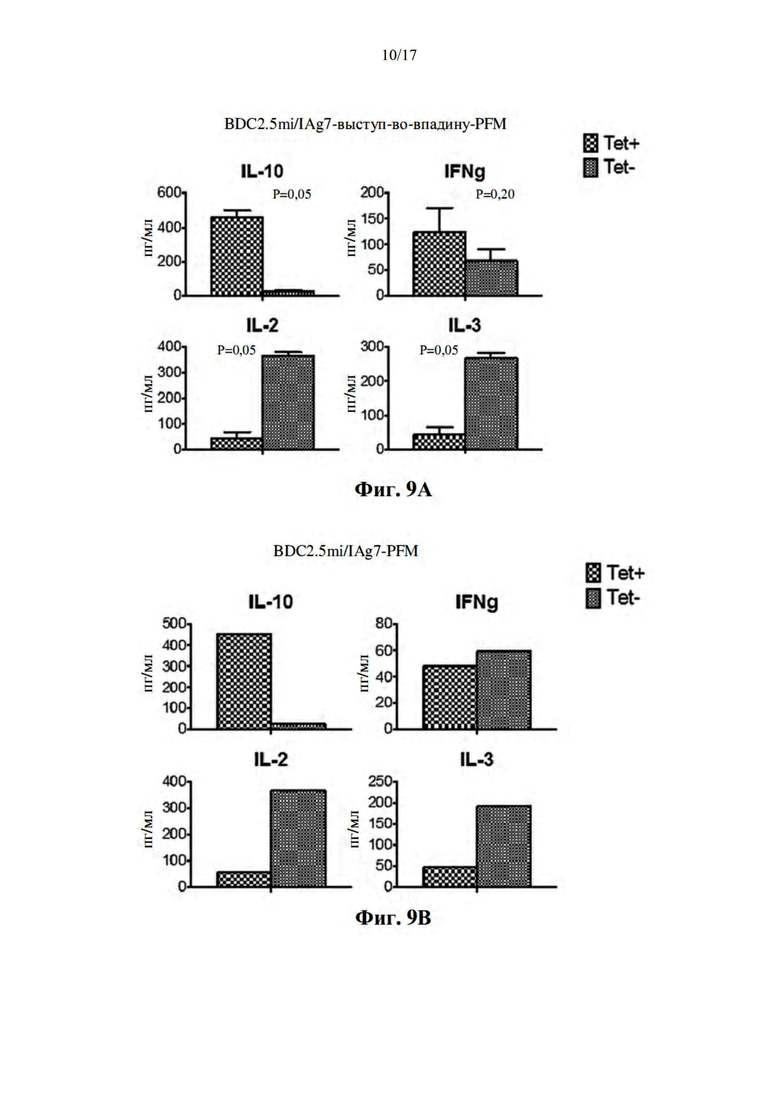
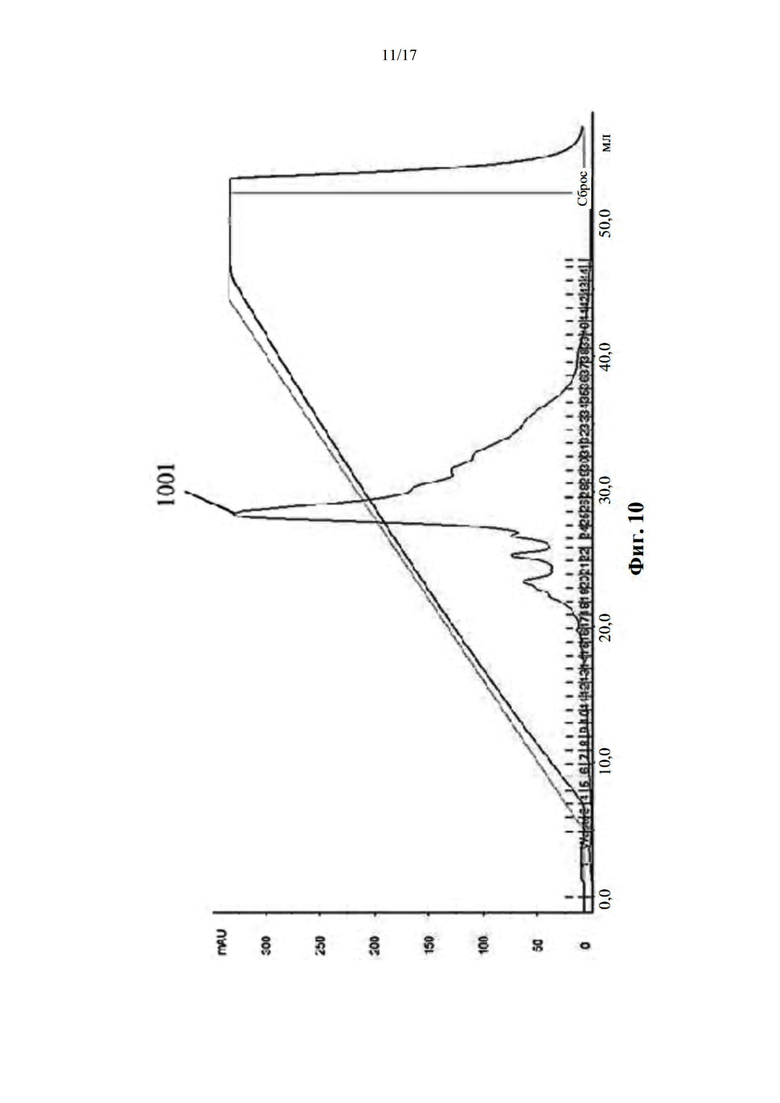
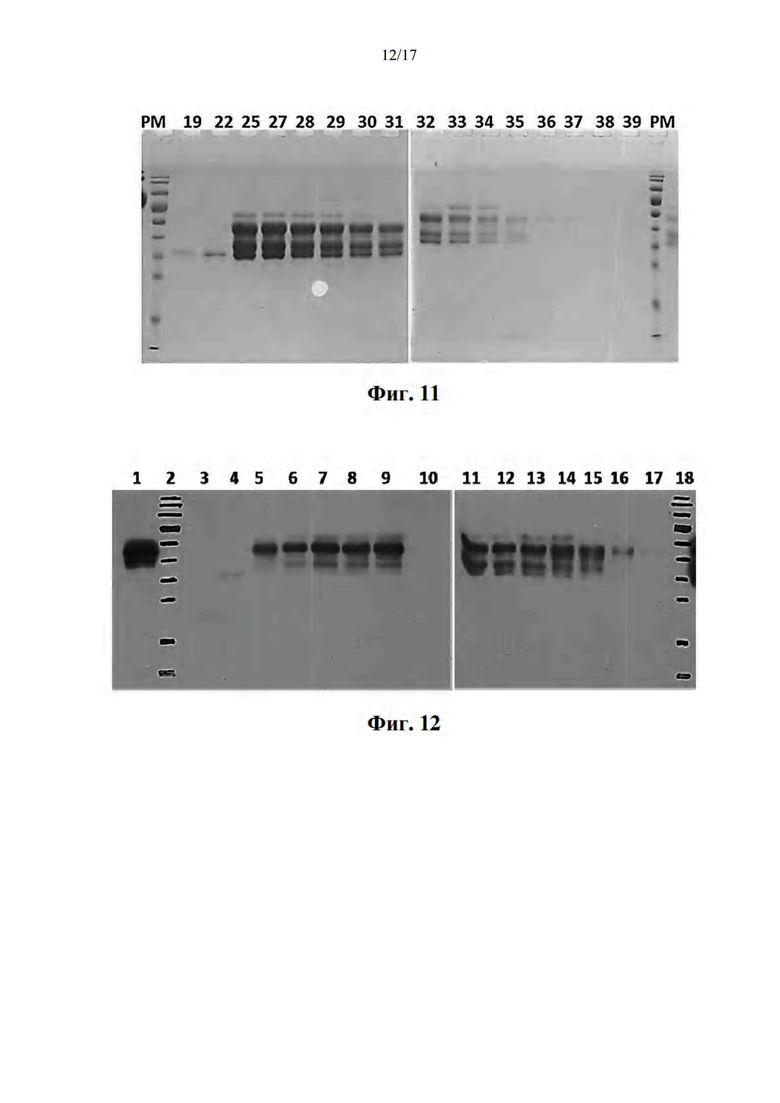
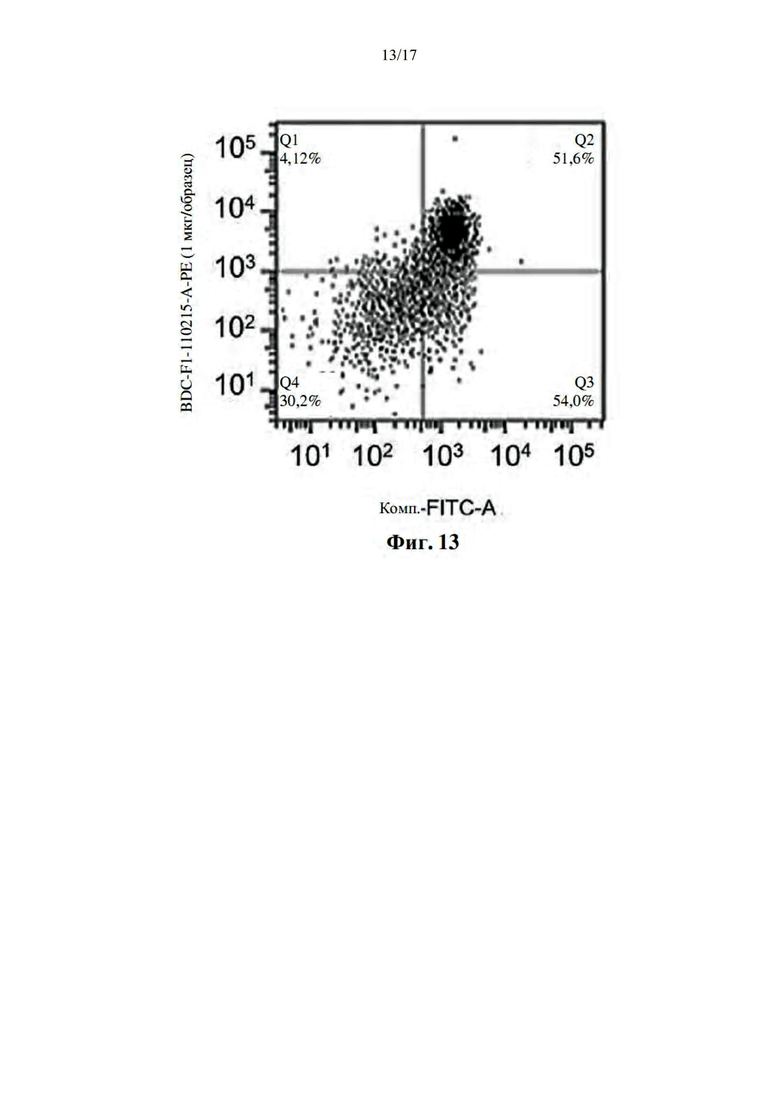
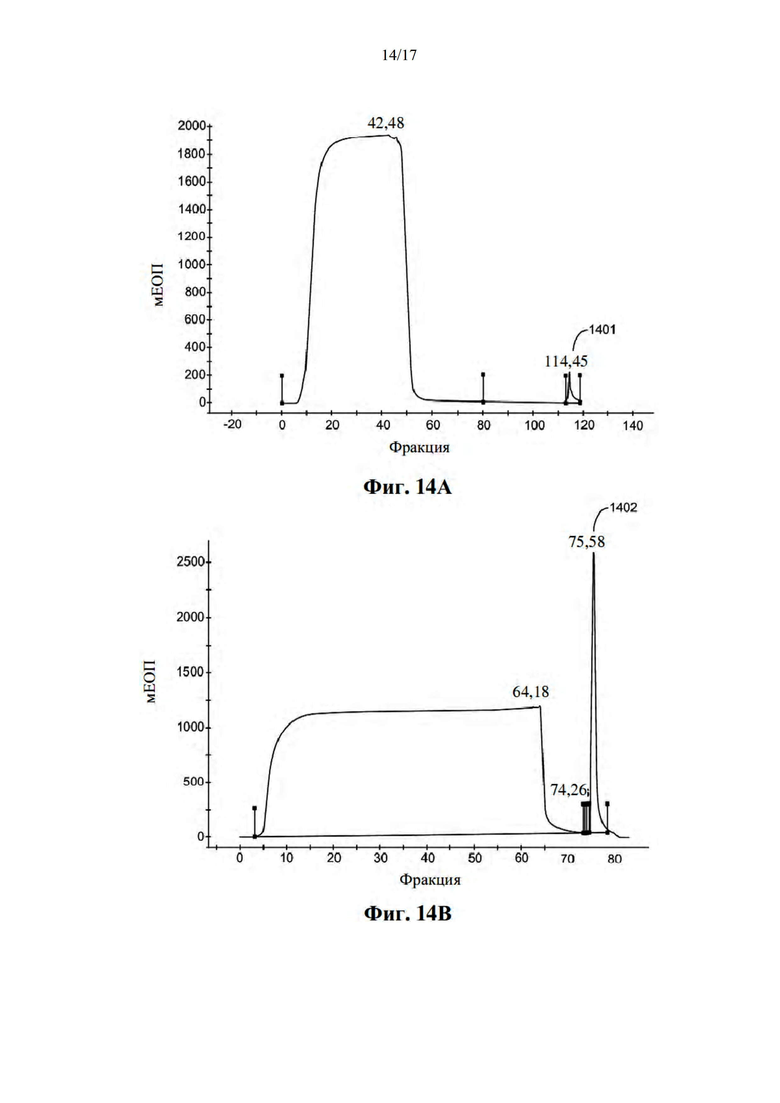


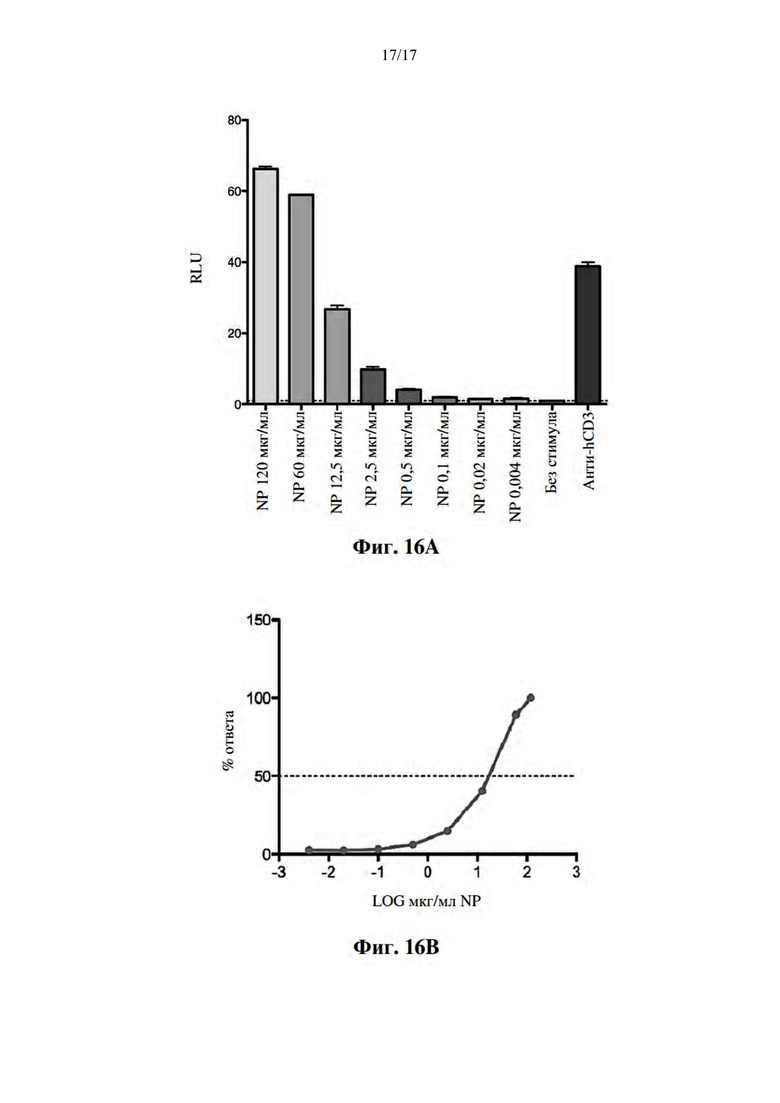
Изобретение относится к области биотехнологии, конкретно к выделенному гетеродимеру, содержащему первый полипептид с SEQ ID NO: 53 или 54 и второй полипептид с SEQ ID NO: 51 или 52, и может быть использовано в медицине. Полученный гетеродимер, где один из первого и второго полипептидов гетеродимера содержит α-домен МНС класса II, а другой из первого и второго полипептидов содержит β-домен МНС класса II, может быть конъюгирован с наночастицей с образованием конъюгата гетеродимер-наночастица и может быть использован для регуляции иммунного ответа и эффективного лечения аутоиммунного заболевания. 13 н. и 30 з.п. ф-лы, 16 ил., 19 табл., 12 пр.
1. Выделенный гетеродимер для регуляции иммунного ответа, содержащий:
по меньшей мере один первый полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, выбранной из SEQ ID NO: 53 и SEQ ID NO: 54, и
по меньшей мере один второй полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, выбранной из SEQ ID NO: 51 и SEQ ID NO: 52,
причем первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который расположен в сконструированной полости на поверхности контакта второго полипептида; и
причем один из первого и второго полипептидов гетеродимера содержит α-домен МНС класса II, а другой из первого и второго полипептидов содержит β-домен МНС класса II, так что или
(i) первый полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию и второй полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию, или
(ii) первый полипептид содержит домен β1 МНС класса II, домен β2 МНС класса II или их комбинацию и второй полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию.
2. Выделенный гетеродимер по п. 1, в котором выступ содержит один или несколько не встречающихся в природе аминокислотных остатков.
3. Выделенный гетеродимер по п. 1 или 2, в котором выступ содержит одну или несколько аминокислот, выбранных из фенилаланина, аргинина, тирозина, триптофана и цистеина.
4. Выделенный гетеродимер по любому из пп. 1, 2, причем первый или второй полипептид выделенного гетеродимера содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, представленной в SEQ ID NO: 53.
5. Выделенный гетеродимер по п. 4, причем первый или второй полипептид выделенного гетеродимера содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, представленной в SEQ ID NO: 54.
6. Выделенный гетеродимер по п. 1, причем первый полипептид выделенного гетеродимера содержит сконструированный выступ, содержащий домен β1 MHC класса II, домен β2 MHC класса II, домен CH2 IgG и домен CH3 IgG, причем выступ образован мутациями в домене CH3, соответствующими S354C и T366W (нумерация EU), и второй полипептид содержит домен α1 MHC класса II, домен α2 MHC класса II, домен CH2 IgG и домен CH3 IgG, причем полость образована мутациями в домене CH3 IgG, соответствующими Y349C, T366S, L368A и Y407V (нумерация EU).
7. Выделенный гетеродимер по п. 1, в котором полость содержит не встречающийся в природе аминокислотный остаток.
8. Выделенный гетеродимер по п. 1 или 7, в котором полость содержит одну или несколько аминокислот, выбранных из аланина, серина, треонина, валина и цистеина.
9. Выделенный гетеродимер п. 1, причем первый или второй полипептид выделенного гетеродимера содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, представленной в SEQ ID NO: 51.
10. Выделенный гетеродимер по п. 9, в котором первый или второй полипептид выделенного гетеродимера содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, представленной в SEQ ID NO: 52.
11. Выделенный гетеродимер по любому из пп. 1-10, в котором один или оба из первого полипептида или второго полипептида не содержат гетерологичный домен димеризации.
12. Выделенный гетеродимер по любому из пп. 1-11, в котором один или оба из первого полипептида или второго полипептида не содержат лейциновую молнию.
13. Выделенный гетеродимер по любому из пп. 1-12, в котором один или оба из первого полипептида или второго полипептида не содержат сайт-специфического сайта биотинилирования.
14. Выделенный гетеродимер по любому из пп. 1-13, дополнительно содержащий относящийся к аутоиммунному заболеванию антиген.
15. Выделенный гетеродимер по п. 14, в котором относящийся к заболеванию антиген содержит полипептид длиной по меньшей мере 11 аминокислот.
16. Выделенный гетеродимер по п. 15, в котором относящийся к аутоиммунному заболеванию антиген связан с доменом α1 МНС класса II или доменом β1 МНС класса II гибким линкером.
17. Выделенный гетеродимер по п. 14, в котором антиген ковалентно связан с доменом α1 MHC класса II или доменом β1 MHC класса II посредством дисульфидной связи, образованной между аминокислотой цистеином, связанной с антигенным пептидом, и аминокислотой цистеином домена α1 МНС класса II или домена β1 МНС класса II.
18. Выделенный гетеродимер по п. 17, в котором аминокислота цистеин домена α1 МНС класса II или домена β1 МНС класса II находится в пределах 10 аминокислот от остатка, который образует часть связывающей борозды МНС класса II.
19. Выделенный гетеродимер по п. 18, в котором остаток цистеина домена α1 МНС класса II или домена β1 МНС класса II находится в пределах 3 аминокислот от остатка, который образует часть связывающей борозды МНС класса II.
20. Выделенный гетеродимер по любому из пп. 17-19, в котором аминокислота цистеин домена α1 MHC класса II или домена β1 MHC класса II введена во встречающуюся в природе последовательность домена α1 MHC класса II или домена β1 МНС класса II.
21. Применение выделенного гетеродимера по любому из пп. 1-20 для лечения индивидуума, у которого диагностировано аутоиммунное заболевание.
22. Полинуклеотид, кодирующий первый полипептид по любому из пп. 1-20.
23. Клетка-хозяин, представляющая собой клетку яичника китайского хомячка (CHO), для получения полипептида по одному из пп. 1-20, содержащая экспрессионный вектор, содержащий полинуклеотид по п. 22 или 41.
24. Клетка-хозяин по п. 23, в которой экспрессионный вектор стабильно интегрирован в геном.
25. Конъюгат гетеродимер-наночастица для лечения аутоиммунного заболевания, содержащий выделенный гетеродимер по любому из пп. 1-20, причем по меньшей мере один гетеродимер конъюгирован с наночастицей с образованием конъюгата гетеродимер-наночастица, причем наночастица содержит твердое ядро из золота, железа или оксида железа.
26. Конъюгат гетеродимер-наночастица по п. 25, в котором твердое ядро составляет в диаметре менее чем 100 нанометров.
27. Конъюгат гетеродимер-наночастица по любому из пп. 25, 26, в котором по меньшей мере один гетеродимер ковалентно связан с наночастицей.
28. Конъюгат гетеродимер-наночастица по п. 27, в котором по меньшей мере один гетеродимер ковалентно связан с наночастицей через линкер, содержащий полиэтиленгликоль (ПЭГ).
29. Конъюгат гетеродимер-наночастица по п. 28, в котором полиэтиленгликоль функционализирован малеимидом.
30. Конъюгат гетеродимер-наночастица по п. 29, в котором полиэтиленгликоль составляет менее чем 5 кДа.
31. Фармацевтическая композиция для лечения аутоиммунного заболевания, содержащая эффективное количество конъюгата гетеродимер-наночастица по любому из пп. 25-30 и фармацевтическое вспомогательное вещество, стабилизатор или разбавитель.
32. Применение конъюгата гетеродимер-наночастица по любому из пп. 25-30 или фармацевтической композиции по п. 31 для лечения аутоиммунного заболевания.
33. Способ лечения аутоиммунного заболевания, включающий введение индивидууму конъюгата гетеродимер-наночастица по любому из пп. 25-30 или фармацевтической композиции по п. 31.
34. Способ получения гетеродимера, содержащего первый полипептид и второй полипептид:
по меньшей мере один первый полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, выбранной из SEQ ID NO: 51 и SEQ ID NO: 52, и
по меньшей мере один второй полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, выбранной из SEQ ID NO: 53 и SEQ ID NO: 54, причем
первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который расположен в сконструированной полости на поверхности контакта второго полипептида; и
причем один из первого и второго полипептидов гетеродимера содержит α-домен МНС класса II, а другой из первого и второго полипептидов содержит β-домен МНС класса II, так что или
(i) первый полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию, а второй полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию, или
(ii) первый полипептид содержит домен β1 МНС класса II, домен β2 МНС класса II или их комбинацию, а второй полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию;
включающий стадии:
(i) культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую первый полипептид и второй полипептид, включая в себя их поверхности контакта, причем нуклеиновая кислота, кодирующая поверхность контакта первого полипептида, была изменена из нуклеиновой кислоты, кодирующей исходную поверхность контакта первого полипептида, для кодирования выступа, нуклеиновая кислота, кодирующая поверхность контакта второго полипептида, была изменена из нуклеиновой кислоты, кодирующей исходную поверхность контакта второго полипептида, для кодирования полости, или и то и другое, и причем культивирование является таким, что экспрессируются первый полипептид и второй полипептид; и
(ii) извлечение и очистка гетеродимера из культуры клеток-хозяев.
35. Способ получения гетеродимера, содержащего первый полипептид и второй полипептид, причем
первый полипептид и второй полипептид встречаются на поверхности контакта, причем поверхность контакта первого полипептида содержит сконструированный выступ, который расположен в сконструированной полости на поверхности контакта второго полипептида; и
(i) первый полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию, а второй полипептид содержит домен β1 MHC класса II, домен β2 MHC класса II или их комбинацию, или
(ii) первый полипептид содержит домен β1 МНС класса II, домен β2 МНС класса II или их комбинацию, а второй полипептид содержит домен α1 МНС класса II, домен α2 МНС класса II или их комбинацию;
включающий стадии:
(i) культивирование первой клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую первый полипептид;
(ii) культивирование второй клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую второй полипептид;
(iii) выделение первого и второго полипептидов из культур клеток-хозяев; а также
(iv) образование гетеродимера путем инкубации первого и второго полипептидов вместе;
причем нуклеиновая кислота, кодирующая поверхность контакта первого полипептида, была изменена из нуклеиновой кислоты, кодирующей исходную поверхность контакта первого полипептида, для кодирования выступа, а нуклеиновая кислота, кодирующая поверхность контакта второго полипептида, была изменена из нуклеиновой кислоты, кодирующей исходную поверхность контакта второго полипептида, для кодирования полости, или и то и другое.
36. Способ по п. 34 или 35, в котором нуклеиновая кислота, кодирующая первый полипептид и второй полипептид, стабильно интегрирована в геном клетки-хозяина.
37. Способ по п. 34, в котором клетка-хозяин содержит клетку яичника китайского хомячка (СНО).
38. Способ по п. 35, в котором первая и вторая клетки-хозяева содержат клетку яичника китайского хомячка (СНО).
39. Способ по любому из пп. 34-38, в котором извлечение полипептидов из культуры клеток-хозяев или культур клеток-хозяев включает внесение жидкости, содержащей гетеродимер, в колонку для жидкостной хроматографии.
40. Способ по п. 39, в котором колонка для жидкостной хроматографии содержит белок А, белок G, белок L или любую их комбинацию.
41. Полинуклеотид, кодирующий второй полипептид по любому из пп.1-20.
42. Применение конъюгата гетеродимер-наночастица по любому из пп. 25-30 или фармацевтической композиции по п. 31 для лечения воспалительного состояния.
43. Способ лечения воспалительного состояния, включающий введение индивидууму конъюгата гетеродимер-наночастица по любому из пп. 25-30 или фармацевтической композиции по п. 31.
| MARRACK P | |||
| et al | |||
| Evolutionarily conserved amino acids that control TCR-MHC interaction, Annual Review of Immunology, 2008, V | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| GASSER B | |||
| et al | |||
| Antibody production with yeasts and filamentous fungi: on the road to large scale? Biotechnology letters, 2007, V | |||
| Солесос | 1922 |
|
SU29A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| LAI X | |||
| et al | |||
| General synthesis and gas‐sensing | |||
Авторы
Даты
2022-08-01—Публикация
2017-11-08—Подача