родственные заявки
По настоящей заявке испрашиваются преимущества приоритета Предварительной патентной заявки США серийный номер 62/341360, поданной 25 мая 2016 г., Предварительной патентной заявки США серийный номер 62/359326, поданной 7 июля 2016, и Предварительной патентной заявки США серийный номер 62/487814, поданной 20 апреля 2017, полное содержание каждой из которых приведено в настоящем описании в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ
Аутоиммунные заболевания, такие как рассеянный склероз (MS) и системное аутоиммунное заболевание (SAD), и воспалительное заболевание кишечника (IBD), представляют собой патологии, возникающие из-за аномального иммунного ответа против собственных тканей организма. MS характеризуется деградацией миелина, защитной липидной оболочки, окружающей нервные волокна, посредством собственных иммуноцитов организма. SAD представляют собой группу заболеваний соединительных тканей с разнообразными симптомами, включающую ревматоидный артрит (RA), системную красную волчанку (SLE) и синдром Шегрена (SS). IBD представляют собой группу воспалительных состояний толстого и тонкого кишечника, включающую болезнь Крона, глютенчувствительную целиакию и язвенный колит.
Вирус Эпштейна-Барр (EBV), также известный как вирус герпеса 4 человека, представляет собой повсеместно распространенный вирус герпеса. Недавно показано, что воздействие EBV может вызывать предрасположенность или иным образом играть роль в патогенезе аутоиммунных заболеваний, включая MS, SAD и IBD. Например, недавние исследования показали, что для индивидуумов с диагнозом MS показаны более высокие уровни родственных EBV белков в B-клетках, накапливающихся в нервной ткани, чем у здоровых индивидуумов. Выдвинута гипотеза, что увеличение количества инфицированных EBV B-клеток и/или дефектное уничтожение таких клеток может вызывать предрасположенность индивидуумов к таким аутоиммунным заболеваниям.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам лечения аутоиммунных заболеваний (например, MS, SAD и/или IBD), включающим введение субъекту аллогенных цитотоксических T-клеток (CTL), экспрессирующих T-клеточный рецептор, который специфически связывается с пептидом EBV, представленным на MHC класса I. В некоторых вариантах осуществления, MHC класса I, по которому рестрицирован TCR, кодирован аллелем HLA, который присутствует у субъекта. В некоторых вариантах осуществления, способ включает отбор аллогенных CTL из банка клеток. В некоторых вариантах осуществления, пептид EBV содержит пептид LMP1 или его фрагмент, пептид LMP2A или его фрагмент, и/или пептид EBNA1 или его фрагмент. В некоторых вариантах осуществления, пептид EBV содержит последовательность, перечисленную в таблице 1.
В конкретных аспектах, изобретение относится к способам лечения аутоиммунного заболевания (например, MS, SAD и/или IBD), включающим получение аллогенных CTL, экспрессирующих T-клеточный рецептор, которые специфически связываются с пептидом EBV, представленным на MHC класса I, и затем введение аллогенных CTL субъекту. В некоторых вариантах осуществления, аллогенные CTL сохраняют в банке клеток до введения субъекту. В некоторых вариантах осуществления, MHC класса I, по которому рестрицирован TCR, кодирован аллелем HLA, который присутствует у субъекта. В некоторых вариантах осуществления, аллогенные CTL получают посредством инкубации образца, содержащего аллогенные CTL (например, образца PBMC), с антигенпредставляющими клетками (APC), представляющими пептид EBV на MHC класса I (например, MHC класса I, кодированном аллелем HLA, который присутствует у субъекта), таким образом, индукции пролиферации специфических для пептида CTL в образце. В некоторых вариантах осуществления, APC вынуждают представлять пептид EBV посредством их инкубации с конструкцией нуклеиновой кислоты (например, AdE1-LMPpoly) кодирующей пептид EBV, таким образом, индукции представления посредством APC пептида EBV. В некоторых вариантах осуществления, APC могут представлять собой B-клетки, антигенпредставляющие T-клетки, дендритные клетки или искусственные антигенпредставляющие клетки (например, линию клеток, экспрессирующих CD80, CD83, 41BB-L и/или CD86, таких как клетки aK562). В некоторых вариантах осуществления, пептид EBV содержит пептид LMP1 или его фрагмент, пептид LMP2A или его фрагмент, и/или пептид EBNA1 или его фрагмент. В некоторых вариантах осуществления, пептид EBV содержит последовательность, перечисленную в таблице 1.
В некоторых вариантах осуществления, CTL отбирают (например, отбирают из банка клеток) по совместимости с субъектом до введения субъекту. В некоторых вариантах осуществления, CTL отбирают, если они рестрицированы по аллелю HLA, общему с субъектом (т.е., TCR CLT рестрицированы по белку MHC класса I, кодируемому аллелем HLA, который присутствует у субъекта). В некоторых вариантах осуществления, CTL отбирают, если CTL и субъект разделяют по меньшей мере 2 (например, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6) аллелей HLA, и CTL рестрицированы по общему аллелю HLA. В некоторых вариантах осуществления, CTL, вводимые субъекту, отобраны из банка клеток (например, банка CTL).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
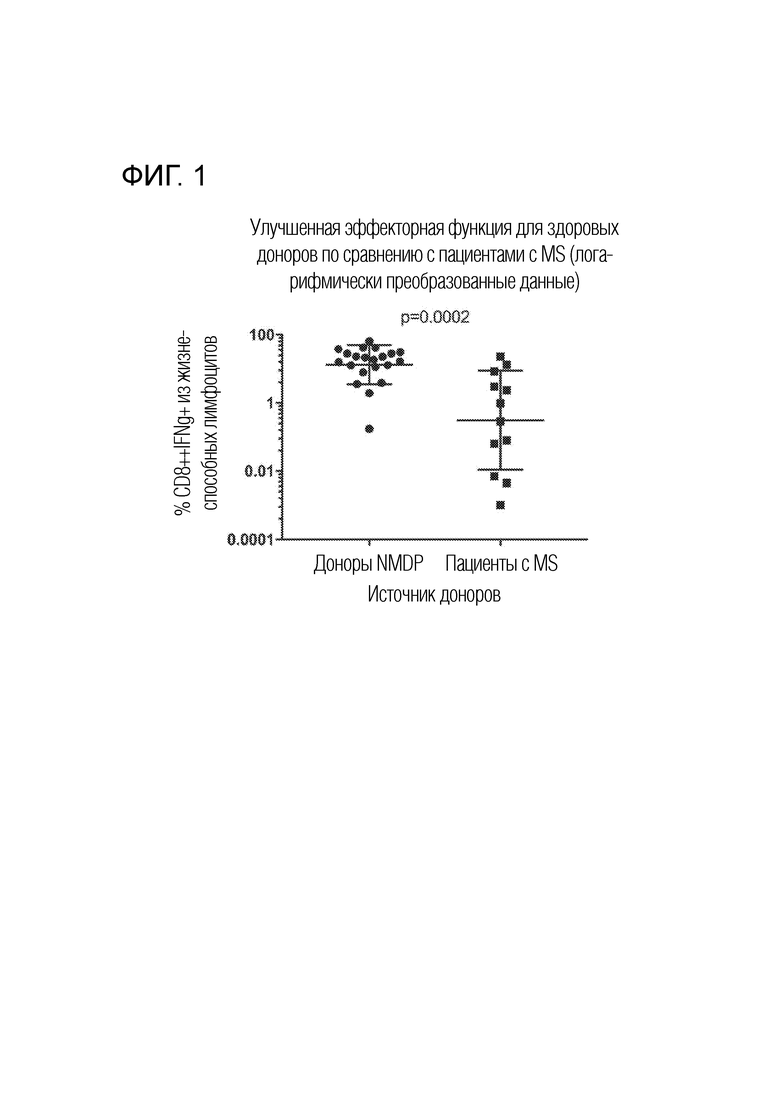
На фигуре 1 показана улучшенная эффекторная функция продукта CTL, полученного от здоровых (NMDP) доноров, по сравнению с продуктом CTL, полученным от пациентов с MS, как измерено по доле жизнеспособных лимфоцитов, являющихся CD8+ и IFNg+ после стимуляции (значение p=0,0002 по критерию Манна-Уитни).
ПОДРОБНОЕ ОПИСАНИЕ
Общие положения
Настоящее изобретение относится к способам лечения аутоиммунных нарушений (например, MS, SAD и/или IBD) у субъекта с использованием аллогенных CTL, узнающих один или несколько эпитопов EBV, описанных, например, в настоящем описании. В некоторых вариантах осуществления, способ дополнительно включает отбор аллогенных CTL из банка клеток. В некоторых вариантах осуществления, способ дополнительно включает получение аллогенных CTL.
Определения
Для удобства, конкретные термины, используемые в описании, примерах и прилагаемой формуле изобретения, собраны в этом разделе.
Формы единственного числа используют в настоящем описании для обозначения одного или более, чем одного (т.е., по меньшей мере одного) из грамматических объектов ссылки. В качестве примера, «элемент» означает один элемент или более одного элемента.
В рамках изобретения, термин «введение» обозначает предоставление лекарственное средство или композиции субъекту, и включает, но без ограничения, введение медицинским работником и самостоятельное введение. Такое средство, может содержать, например, пептид, описанный в настоящем описании, антигенпредставляющую клетку, представленную в настоящем описании, и/или CTL, представленный в настоящем описании.
Термин «аминокислота» предназначен для включения всех молекул, природных или синтетических, которые включают как функциональную аминогруппу, так и функциональную группу кислоты, и способны к включению в полимер из природных аминокислот. Иллюстративные аминокислоты включают природные аминокислоты; их аналоги, производные и родственные соединения; аналоги аминокислот, имеющие варианты боковых цепей; и все стереоизомеры любых из вышеуказанных.
Термин «связывание» или «взаимодействие» относится к ассоциации, которая может представлять собой стабильную ассоциацию между двумя молекулами, например, между TCR и пептидом/MHC, например, благодаря электростатическим, гидрофобным, ионным взаимодействиям и/или взаимодействиям водородных связей в физиологических условиях.
Каждый из терминов «биологический образец», «образец ткани» или просто «образец» относится к группе клеток, полученной из ткани субъекта. Источник образца ткани может представлять собой солидную ткань, например, из свежего, замороженного и/или консервированного органа, образца ткани, биопсии или аспирата; кровь или любые составляющие крови, сыворотку, кровь; физиологические жидкости, такие как спинномозговая жидкость, амниотическая жидкость, перитонеальная жидкость или интерстициальная жидкость, моча, слюна, кал, слезы; или клетки из любого периода времени в ходе беременности или развития субъекта.
В рамках изобретения, термин «цитокин» относится к любому секретированному полипептиду, который влияет на функции клеток и представляет собой молекулу, модулирующую взаимодействия между клетками при иммунном, воспалительном или гематопоэтическом ответе. Цитокин включает, но без ограничения, монокины и лимфокины, вне зависимости от того, какие клетки их продуцируют. Например, монокин, как правило, обозначают как продуцированный и секретированный мононуклеарной клеткой, такой как макрофаг и/или моноцит. Однако, многие другие клетки также продуцируют монокины, такие как клетки естественные киллеры, фибробласты, базофилы, нейтрофилы, эндотелиальные клетки, астроциты головного мозга, стромальные клетки костного мозга, эпидермальные кератиноциты и B-лимфоциты. Лимфокины, как правило, обозначают как продуцированные клетками лимфоцитами. Примеры цитокинов включают, но без ограничения, интерлейкин-1 (IL-1), интерлейкин-2 (IL-2), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8), фактор некроза опухоли-альфа (TNFα) и фактор некроза опухоли бета (TNFβ).
Термин «эпитоп» обозначает белковую детерминанту, способную к специфическому связыванию с антителом или TCR. Эпитопы обычно состоят из химически активных поверхностных группировок молекул, таких как боковые цепи аминокислот или сахаров. Определенные эпитопы можно определять по конкретной последовательности аминокислот, с которыми антитело способно связываться.
В рамках изобретения, фраза «фармацевтически приемлемый» относится к средствам, соединениям, материалам, композициям, и/или лекарственным формам, которые, в рамках обоснованного врачебного решения, являются пригодными для использования в контакте с тканями человека и животных без избыточной токсичности, раздражения, аллергического ответа или других проблем или осложнений, соразмерно с целесообразным соотношением польза/риск.
В рамках изобретения, фраза «фармацевтически приемлемый носитель» означает фармацевтически приемлемый материал, композицию или носитель, такой как жидкий или твердый инкапсулирующий материал наполнителя, разбавителя, расширителя или растворителя, вовлеченный в перенос или транспортировку средства от одного органа или части тела, к другому органу или части тела. Каждый носитель должен является «приемлемым» в том смысле, что является совместимым с другими ингредиентами состава и не является вредным для пациента. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; (4) порошокообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) наполнители, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) забуферивающие средства, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) растворы с забуферeнным pH; (21) полиэфиры, поликарбонаты и/или полиангидриды; и (22) другие нетоксичные совместимые вещества, используемые в фармацевтических составах.
Термины «полинуклеотид», и «нуклеиновая кислота» используют взаимозаменяемо. Они относятся к полимерной форме нуклеотидов любой длины, либо к дезоксирибонуклеотидам, либо к рибонуклеотидам, или их аналогам. Полинуклеотиды могут иметь любую трехмерную структуру, и могут осуществлять любую функцию. Ниже приведены неограничивающие примеры полинуклеотидов: кодирующие или некодирующие области гена или фрагмента гена, локусы (локус), определенные из анализа сцепления, экзоны, интроны, матричная РНК (мРНК), транспортная РНК, рибосомальная РНК, рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенная ДНК любой последовательности, выделенная РНК любой последовательности, зонды нуклеиновой кислоты и праймеры. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и аналоги нуклеотидов. Если они присутствуют, модификации структуры нуклеотида можно вносить до или после сборки полимера. Полинуклеотид можно дополнительно модифицировать, например, посредством конъюгации с метящим компонентом. Во всех последовательностях нуклеиновой кислоты, представленных в настоящем описании, нуклеотиды U являются взаимозаменяемыми с нуклеотидами T.
В рамках изобретения, лекарственное средство, которое «предотвращает» состояние, относится к соединению, которое, при введении в статистической выборке до начала нарушения или состояния, уменьшает частоту встречаемости нарушения или состояния в подвергнутой лечению выборке по сравнению с не подвергнутой лечению контрольной выборкой, или задерживает начало или уменьшает тяжесть одного или нескольких симптомов нарушения или состояния по сравнению с не подвергнутой лечению контрольной выборкой.
В рамках изобретения, «специфическое связывание» относится к способности TCR связываться с пептидом, представленным на MHC (например, MHC класса I или MHC класса II). Как правило, TCR специфически связывается со своим пептидом/MHC с аффинностью по меньшей мере с KD приблизительно 10-4 M или менее, и связывается с предопределенным антигеном/партнером по связыванию с аффинностью (как выражено по KD), по меньшей мере в 10 раз меньшей, по меньшей мере в 100 раз меньшей или по меньшей мере в 1000 раз меньшей, чем аффинность связывания с комплексом неспецифического и неродственного пептида/MHC (например, с комплексом, содержащим пептид BSA или пептид казеина).
В рамках изобретения, термин «субъект» обозначает человека или не относящегося к человеку животного, выбранного для лечения или терапии.
Фразы «терапевтически эффективное количество» и «эффективное количество», в рамках изобретения, обозначают количество средства, которое является эффективным для получения желательного терапевтического эффекта по меньшей мере в субпопуляции клеток у субъекта с целесообразным соотношением польза/риск, применимым для любой медицинской помощи.
В рамках изобретения, термин «лечение» заболевания у субъекта или «лечение» субъекта, имеющего или, как подозревают, имеющего заболевание, относится к подверганию субъекта фармацевтическому лечению, например, введению CTL, описанных в настоящем описании, так что по меньшей мере один симптом заболевания уменьшают или предотвращают его ухудшение.
Термин «вектор» относится к средствам, посредством которых нуклеиновую кислоту, можно размножать и/или переносить между организмами, клетками или клеточными компонентами. Векторы включают плазмиды, вирусы, бактериофаги, провирусы, фагмиды, транспозоны и искусственные хромосомы, и т.п., которые могут являться способными или могут не являться способными к автономной репликации или интеграции в хромосому клетки-хозяина.
Пептиды
В конкретных аспектах, изобретение относится к способам лечения аутоиммунных нарушений (например, MS, SAD и/или IBD) с использованием аллогенных CTL, экспрессирующих TCR, которые специфически связываются с пептидами, содержащими эпитопы EBV, представленными на MHC класса I. В некоторых вариантах осуществления, изобретение относится к способам получения таких аллогенных CTL, например, посредством инкубации образца, содержащего CTL (т.е., образца PBMC) с антигенпредставляющими клетками (APC), представляющими один или несколько эпитопов EBV, описанных в настоящем описании (например, APC, представляющими пептид, описанный в настоящем описании, содержащими комплекс эпитопа EBV на MHC класса I).
В некоторых вариантах осуществления, пептиды, представленные в настоящем описании, содержат последовательность любого вирусного белка EBV (например, последовательность из по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 непрерывных аминокислот из любого белка EBV). В некоторых вариантах осуществления, пептиды, представленные в настоящем описании, содержат не более 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11 или 10 непрерывных аминокислот вирусного белка EBV.
В некоторых вариантах осуществления, пептиды, представленные в настоящем описании, содержат последовательность LMP1 (например, последовательность из по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 непрерывных аминокислот из LMP1). В некоторых вариантах осуществления, пептиды, представленные в настоящем описании, содержат не более 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11 или 10 непрерывных аминокислот из LMP1. Иллюстративная аминокислотная последовательность LMP1 представлена ниже (SEQ ID NO: 1):
1 mdldlergpp gprrpprgpp lssyialall llllallfwl yiimsnwtgg allvlyafal
61 mlviiiliif ifrrdllcpl galcllllmi tlllialwnl hgqalylgiv lfifgcllvl
121 giwvyfleil wrlgatiwql lafflaffld illliialyl qqnwwtllvd llwlllflai
181 liwmyyhgqr hsdehhhdds lphpqqatdd ssnhsdsnsn egrhhllvsg agdapplcsq
241 nlgapgggpd ngpqdpdntd dngpqdpdnt ddngphdplp qdpdntddng pqdpdntddn
301 gphdplphnp sdsagndggp pnlteevenk ggdrgppsmt dggggdphlp tlllgtsgsg
361 gddddphgpv qlsyyd
В некоторых вариантах осуществления, пептиды, представленные в настоящем описании, содержат последовательность LMP2A (например, последовательность из по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 непрерывных аминокислот из LMP2A). В некоторых вариантах осуществления, пептиды, представленные в настоящем описании, содержат не более 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11 или 10 непрерывных аминокислот из LMP2A. Иллюстративная аминокислотная последовательность LMP2A представлена ниже (SEQ ID NO: 2):
1 mgslemvpmg agppspggdp dgddggnnsq ypsasgsdgn tptppndeer esneeppppy
61 edldwgngdr hsdyqplgnq dpslylglqh dgndglpppp ysprddssqh iyeeagrgsm
121 npvclpviva pylfwlaaia ascftasvst vvtatglals llllaavass yaaaqrkllt
181 pvtvltavvt ffaicltwri edppfnsllf allaaagglq giyvlvmlvl lilayrrrwr
241 rltvcggimf lacvlvlivd avlqlspllg avtvvsmtll llafvlwlss pgglgtlgaa
301 lltlaaalal laslilgtln lttmfllmll wtlvvllics scsscpltki llarlflyal
361 allllasali aggsilqtnf kslsstefip nlfcmllliv agilfilail tewgsgnrty
421 gpvfmclggl ltmvagavwl tvmtntllsa wiltagflif ligfalfgvi rccryccyyc
481 ltleseerpp tpyrntv
В некоторых вариантах осуществления, пептиды, представленные в настоящем описании, содержат последовательность EBNA1 (например, последовательность из по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 непрерывных аминокислот из EBNA1). В некоторых вариантах осуществления, пептиды, представленные в настоящем описании, содержат не более 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11 или 10 непрерывных аминокислот из EBNA1. Иллюстративная аминокислотная последовательность EBNA1 представлена ниже (SEQ ID NO: 3):
1 pffhpvgead yfeylqeggp dgepdvppga ieqgpaddpg egpstgprgq gdggrrkkgg
61 wfgkhrgqgg snpkfeniae glrvllarsh vertteegtw vagvfvyggs ktslynlrrg
121 talaipqcrl tplsrlpfgm apgpgpqpgp lresivcyfm vflqthifae vlkdaikdlv
181 mtkpaptcni kvtvcsfddg vdlppwfppm vegaaaegdd gddgdeggdg degeegqe
В некоторых вариантах осуществления, пептид содержит последовательность эпитопа, перечисленную в таблице 1.
Таблица 1: Иллюстративные эпитопы вирусного белка EBV
В некоторых вариантах осуществления, пептиды, представленные в настоящем описании, содержат два или более из эпитопов EBV. В некоторых вариантах осуществления, пептиды, представленные в настоящем описании, содержат по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 эпитопов EBV. Например, в некоторых вариантах осуществления, пептид, представленный в настоящем описании, содержит два или более эпитопов EBV, соединенных линкерами (например, полипептидными линкерами).
В некоторых вариантах осуществления, последовательность пептидов содержит последовательность вирусного белка EBV, за исключением 1 или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) консервативных модификаций последовательности. В рамках изобретения, термин «консервативные модификации последовательности» предназначен для обозначения аминокислотных модификаций, которые значительно не влияют на взаимодействие или не изменяют взаимодействия между TCR и пептидом, содержащим аминокислотную последовательность, представленную на MHC. Такие консервативные модификации включают замены, добавления (например, добавления аминокислоты к N- или C-концу пептида) и делеции (например, делеции аминокислоты с N- или C-конца пептида) аминокислот. Консервативные аминокислотные замены представляют собой замены, при которых аминокислотный остаток заменен на аминокислотный остаток, имеющий сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, определены в данной области. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или несколько аминокислотных остатков из пептидов, описанных в настоящем описании, можно заменять на другие аминокислотные остатки из того же семейства боковых цепей, и измененный пептид можно тестировать по сохранению связывания с TCR с использованием способов, известных в данной области. Модификации можно вводить в антитело стандартными способами, известными в данной области, такими как сайт-направленный мутагенез и опосредованный ПЦР мутагенез.
В некоторых вариантах осуществления, пептиды, представленные в настоящем описании, содержат последовательность, по меньшей мере на 80%, 85%, 90%, 95% или 100% идентичную последовательности вирусного белка EBV (например, последовательность фрагмента вирусного белка EBV). Для определения процента идентичности двух аминокислотных последовательностей, последовательности выравнивают для целей оптимального сравнения (например, можно вносить пропуски в одну или обе из первой и второй аминокислотной последовательности для оптимального выравнивания, и неидентичные последовательности можно не учитывать для целей сравнения). Затем сравнивают аминокислотные остатки в соответствующих положениях аминокислот. Когда положение в первой последовательности занято таким же аминокислотным остатком, как и в соответствующем положении во второй последовательности, тогда молекулы являются идентичными в этом положении. Процент идентичности между двумя последовательностями является функцией количества идентичных положений, разделяемых последовательностями, принимая во внимание количество пропусков и длину каждого пропуска, которые необходимо внести для оптимального выравнивания двух последовательностей.
В некоторых вариантах осуществления, пептид представляет собой химерный или слитый пептид. В рамках изобретения, «химерный пептид» или «слитый пептид» включает пептид, имеющий последовательность, представленную в настоящем описании, связанную с отличным пептидом, имеющим последовательность, с которой он не связан в природе. Например, отличный пептид можно сливать с N-концом или C-концом пептида, представленного в настоящем описании, либо напрямую, через пептидную связь, либо опосредованно, через химический линкер. В некоторых вариантах осуществления, пептид из представленных в настоящем описании связан в другим пептидом, содержащим отличные эпитопы EBV. В некоторых вариантах осуществления, пептид, представленный в настоящем описании, связан с пептидами, содержащими эпитопы из возбудителей других вирусных и/или инфекционных заболеваний.
Химерный или слитый пептид, представленный в настоящем описании, можно получать стандартными способами рекомбинантной ДНК. Например, фрагменты ДНК, кодирующие различные пептидные последовательности, лигируют вместе в одной рамке считывания в соответствии с общепринятыми способами, например, с использованием затупленных или выступающих концов для лигирования, расщепления ферментами рестрикции для получения подходящих концов, заполнения липких концов соответствующим образом, обработки щелочной фосфатазой для избегания нежелательного соединения и ферментативного лигирования. В другом варианте осуществления, слитый ген можно синтезировать общепринятыми способами, включая использование автоматических синтезаторов ДНК. Альтернативно, можно проводить амплификацию ПЦР фрагментов генов с использованием якорных праймеров, приводящих к образованию комплементарных выступающих концов между двумя последовательными фрагментами гена, которые затем можно гибридизовать и повторно амплифицировать для получения последовательности химерного гена (см., например, Current Protocols in Molecular Biology, Ausubel et al., eds., John Wiley & Sons: 1992). Более того, коммерчески доступно множество экспрессирующих векторов, которые уже кодируют слитую группу.
Пептиды, представленные в настоящем описании, можно выделять из источников - клеток или тканей посредством подходящей схемы очистки с использованием стандартных способов очистки белка, и можно получать способами рекомбинантной ДНК, и/или можно химически синтезировать с использованием стандартных способов синтеза пептидов. Пептиды, описанные в настоящем описании, можно продуцировать в прокариотических или эукариотических клетках-хозяевах посредством экспрессии нуклеотидов, кодирующих пептид(ы) по настоящему изобретению. Альтернативно, такие пептиды можно синтезировать посредством химических способов. Способы экспрессии гетерологичных пептидов в рекомбинантных хозяевах, химического синтеза пептидов и трансляции in vitro хорошо известны в данной области и дополнительно описаны в Maniatis et al., Molecular Cloning: A Laboratory Manual (1989), 2nd Ed., Cold Spring Harbor, N. Y.; Berger and Kimmel, Methods in Enzymology, Volume 152, Guide to Molecular Cloning Techniques (1987), Academic Press, Inc., San Diego, Calif.; Merrifield, J. (1969) J. Am. Chem. Soc. 91:501; Chaiken I. M. (1981) CRC Crit. Rev. Biochem. 11:255; Kaiser et al. (1989) Science 243:187; Merrifield, B. (1986) Science 232:342; Kent, S. B. H. (1988) Annu. Rev. Biochem. 57:957; и Offord, R. E. (1980) Semisynthetic Proteins, Wiley Publishing, содержание которых приведено в настоящем описании в качестве ссылки.
В конкретных аспектах, изобретение относится к молекулам нуклеиновой кислоты, кодирующим пептиды, описанные в настоящем описании. В некоторых вариантах осуществления, молекула нуклеиновой кислоты представляет собой вектор. В некоторых вариантах осуществления, молекула нуклеиновой кислоты представляет собой вирусный вектор, такой как экспрессирующий вектор на основе аденовируса, содержащий молекулы нуклеиновой кислоты, описанные в настоящем описании. В некоторых вариантах осуществления, вектор, представленный в настоящем описании, кодирует множество эпитопов, представленных в настоящем описании (например, в форме полиэпитопа). В некоторых вариантах осуществления, вектор, представленный в настоящем описании, кодирует по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 эпитопов, представленных в настоящем описании (например, эпитопов, представленных в таблице 1).
В некоторых вариантах осуществления, вектор представляет собой AdE1-LMPpoly. Вектор AdE1-LMPpoly кодирует полиэпитоп из определенных эпитопов CTL из LMP1 и LMP2, слитый с последовательностью EBNA1 с истощенным повтором Gly-Ala. Вектор AdE1-LMPpoly описан, например, в Smith et al., Cancer Research 72:1116 (2012); Duraiswamy et al., Cancer Research 64:1483-9 (2004); и Smith et al., J. Immunol 117:4897-906, содержание каждого из которых, таким образом, приведено в качестве ссылки.
В рамках изобретения, термин «вектор» относится к молекуле нуклеиновой кислоты, способной к транспортировке другой нуклеиновой кислоты, с которой она связана. Одним типом вектора является «плазмида», которая относится к кольцевой двухцепочечной петле ДНК, в которую можно лигировать дополнительные фрагменты ДНК. Другим типом вектора является вирусный вектор, где дополнительные фрагменты ДНК можно лигировать в вирусный геном. Конкретные векторы являются способными к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы, имеющие бактериальную точку начала репликации, эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) могут интегрироваться в геном клетки-хозяина при введении в клетку-хозяина, и таким образом, реплицироваться вместе с геномом хозяина. Более того, конкретные векторы являются способными управлять экспрессией генов. Такие векторы обозначены в настоящем описании как «рекомбинантные экспрессирующие векторы» (или просто, «экспрессирующие векторы»). В некоторых вариантах осуществления, настоящее изобретение относится к нуклеиновым кислотам, функционально связанным с одной или несколькими регуляторными последовательностями (например, промотором) в экспрессирующем векторе. В некоторых вариантах осуществления, клетка транскрибирует нуклеиновую кислоту, представленную в настоящем описании, и таким образом, экспрессирует пептид, описанный в настоящем описании. Молекула нуклеиновой кислоты может являться интегрированной в геном клетки, или она может являться внехромосомной.
В некоторых вариантах осуществления, настоящее изобретение относится к клеткам, содержащим нуклеиновую кислоту, описанную в настоящем описании (например, нуклеиновую кислоту, кодирующую пептид, описанный в настоящем описании). Клетка может представлять собой, например, прокариотическую, эукариотическую клетку, клетку млекопитающего, птичью, мышиную и/или человеческую клетку. В некоторых вариантах осуществления, клетка представляет собой клетку млекопитающего. В некоторых вариантах осуществления клетка представляет собой APC (например, антигенпредставляющую T-клетку, дендритную клетку, B-клетку или клетку aK562). В настоящих способах, нуклеиновую кислоту, описанную в настоящем описании, можно вводить, например, в форме нуклеиновой кислоты без носителя для доставки, в комбинации с реагентом для доставки. В некоторых вариантах осуществления, любой способ доставки нуклеиновой кислоты, известный в данной области, можно использовать в способах, описанных в настоящем описании. Пригодные реагенты для доставки включают, но без ограничения, например, липофильный реагент Mirus Transit TKO; липофектин; липофектамин; целфектин; поликатионы (например, полилизин), ателоколлаген, наноплексы и липосомы. В некоторых вариантах осуществления способов, описанных в настоящем описании, липосомы используют для доставки нуклеиновой кислоты в клетку или субъекту. Липосомы, пригодные для использования в способах, описанных в настоящем описании, можно формировать из стандартных формирующих везикулы липидов, которые в основном включают нейтральные или отрицательно заряженные фосфолипиды и стерол, такой как холестерин. Выбором липидов обычно руководствуются с учетом таких факторов, как желательный размер липосомы и время полужизни липосом в кровотоке. Множество способов известно для получения липосом, например, как описано в Szoka et al. (1980), Ann. Rev. Biophys. Bioeng. 9:467; и в Патентах США No. 4235871, 4501728, 4837028 и 5019369, полное содержание описания которых приведено в настоящем описании в качестве ссылки.
Аллогенные CTL
Настоящее изобретение относится к способам лечения аутоиммунных заболеваний (например, MS, SAD, IBD) посредством введения субъекту аллогенных CTL, экспрессирующих T-клеточный рецептор, который специфически связывается с пептидом EBV, представленным на MHC класса I. В некоторых вариантах осуществления, CTL происходят из банка клеток. В некоторых вариантах осуществления, MHC представляет собой MHC класса I. В некоторых вариантах осуществления, MHC класса II имеет полипептид α-цепи, представляющий собой HLA-DMA, HLA-DOA, HLA-DPA, HLA-DQA или HLA-DRA. В некоторых вариантах осуществления, MHC класса II имеет полипептид β-цепи, представляющий собой HLA-DMB, HLA-DOB, HLA-DPB, HLA-DQB или HLA-DRB. В некоторых вариантах осуществления, CTL хранят в библиотеке или банке клеток перед их введением субъекту.
В некоторых вариантах осуществления, настоящее изобретение относится к APC, представляющим пептид, описанный в настоящем описании (например, пептид, содержащий последовательность эпитопа LMP1, LMP2A или EBNA1). В некоторых вариантах осуществления APC представляют собой B-клетки, антигенпредставляющие T-клетки, дендритные клетки или искусственные антигенпредставляющие клетки (например, клетки aK562).
Дендритные клетки для использования в способе можно получать посредством отбора PBMC из образца от пациента и их адгезии на пластике. Как правило, популяция моноцитов прилипает, и все другие клетки можно отмыть. Затем адгерентную популяцию подвергают дифференцировке с использованием IL-4 и GM-CSF для получения происходящих из моноцитов дендритных клеток. Эти клетки можно подвергать созреванию посредством добавления IL-1β, IL-6, PGE-1 и TNF-α (которое осуществляет повышающую регуляцию важных костимулирующих молекул на поверхности дендритной клетки), и затем их трансдуцируют с использованием одного или нескольких из пептидов, представленных в настоящем описании.
В некоторых вариантах осуществления, APC представляет собой искусственную антигенпредставляющую клетку, такую как клетка aK562. В некоторых вариантах осуществления, искусственные антигенпредставляющие клетки конструируют для экспрессии CD80, CD83, 41BB-L и/или CD86. Иллюстративные искусственные антигенпредставляющие клетки, включая клетки aK562, описаны в публикации Патента США No. 2003/0147869, содержание которой, таким образом, приведено в качестве ссылки.
В конкретных аспектах, изобретение относится к способам получения APC, представляющих один или несколько эпитопов EBV, описанных в настоящем описании, включающим приведение APC в контакт с пептидом, содержащим эпитоп EBV, и/или с нуклеиновой кислотой, кодирующей эпитоп EBV. В некоторых вариантах осуществления, APC являются облученными. В некоторых вариантах осуществления, APC представляют пептид, описанный в настоящем описании (например, пептид, содержащий последовательность эпитопа LMP1, LMP2A или EBNA1). Клетку, представляющую пептид, описанный в настоящем описании, можно получать посредством стандартных способов, известных в данной области. Например, клетку можно подвергать сенсибилизации, чтобы способствовать поглощению пептидов. В некоторых вариантах осуществления, клетки трансфицируют с использованием нуклеиновой кислоты, кодирующей пептид, представленный в настоящем описании. Настоящее изобретение относится к способам получения антигенпредставляющих клеток (APC), включающим подвергание клеток сенсибилизации с использованием пептидов, описанных в настоящем описании. Иллюстративные примеры получения антигенпредставляющих клеток можно обнаружить в WO2013088114, полное содержание которой, таким образом, приведено в качестве ссылки.
В некоторых вариантах осуществления, настоящее изобретение относится к T-клеткам (например, CD4-T-клеткам и/или CD8-T-клеткам), экспрессирующим TCR (например, TCR αβ или TCR γδ), узнающий пептид, описанный в настоящем описании, представленный на MHC. В некоторых вариантах осуществления, T-клетка представляет собой CD8-T-клетку (CTL), экспрессирующую TCR, узнающий пептид, описанный в настоящем описании, представленный на MHC класса I. В некоторых вариантах осуществления, T-клетка представляет собой CD4-T-клетку (T-клетку-помощник), узнающую пептид, описанный в настоящем описании, представленный на MHC класса II.
В некоторых вариантах осуществления, изобретение относится к способам получения, активации и/или индукции пролиферации T-клеток (например, CTL), узнающих один или несколько из эпитопов EBV, описанных в настоящем описании. В некоторых вариантах осуществления, образец, содержащий CTL (т.е., образец PBMC) инкубируют в культуре с APC, представленной в настоящем описании (например, APC, представляющей пептид, содержащий комплекс эпитопа EBV на MHC класса I). В некоторых вариантах осуществления, APC являются аутологичными для субъекта, от которого получены T-клетки. В некоторых вариантах осуществления, APC не являются аутологичными для субъекта, от которого получены T-клетки. В некоторых вариантах осуществления, образец, содержащий T-клетки, инкубируют 2 или более раз с APC, представленными в настоящем описании. В некоторых вариантах осуществления, T-клетки инкубируют с APC в присутствии по меньшей мере одного цитокина. В некоторых вариантах осуществления, цитокин представляет собой IL-4, IL-7 и/или IL-15. Иллюстративные способы индукции пролиферации T-клеток с использованием APC представлены, например, в публикации Патента США No. 2015/0017723, содержание которой, таким образом, приведено в качестве ссылки.
В некоторых вариантах осуществления, настоящее изобретение относится к композициям (например, терапевтическим композициям), содержащим T-клетки и/или APC, представленные в настоящем описании, используемым для лечения и/или предотвращения аутоиммунного заболевания у субъекта посредством введения субъекту эффективного количества композиции. В некоторых аспектах, изобретение относится к способам лечения аутоиммунных нарушений с использованием композиции (например, фармацевтической композиции, такой как композиции, содержащие аллогенные CTL). В некоторых вариантах осуществления, композиция включает комбинацию множества (например, двух или более) CTL, представленных в настоящем описании.
Терапевтические способы
В некоторых вариантах осуществления, изобретение относится к способам лечения аутоиммунного нарушения у субъекта посредством введения субъекту аллогенных CTL, представленных в настоящем описании. В некоторых вариантах осуществления, аллогенные CTL отобраны из банка клеток (например, предварительно полученного сторонней организацией банка полученных от доноров эпитопспецифических CTL).
В некоторых вариантах осуществления, способы, представленные в настоящем описании, можно использовать для лечения любого аутоиммунного заболевания. Примеры аутоиммунных заболеваний включают, например, гломерулярный нефрит, артрит, подобное дилатационной кардиомиопатии заболевание, язвенный колит, синдром Шегрена, болезнь Крона, системный эритематоз, хронический ревматоидный артрит, ювенильный ревматоидный артрит, болезнь Стилла, рассеянный склероз, псориаз, аллергический контактный дерматит, полимиозит, пахидермию, нодозный панартериит, ревматическую атаку, витилиго обыкновенное, болезнь Бехчета, болезнь Хашимото, болезнь Аддисона, дерматомиозит, миастению, синдром Рейтера, болезнь Грэйвса, злокачественную анемию, бесплодие, пемфигус, аутоиммунную тромбоцитопеническую пурпуру, аутоиммунную гемолитическую анемию, активный хронический гепатит, болезнь Аддисона, антифосфолипидный синдром, атопическую аллергию, аутоиммунный атрофический гастрит, аутоиммунную ахлоргидрию, глютенчувствительную целиакию, синдром Кушинга, дерматомиозит, дискоидную красную волчанку, синдром Гудпасчера, тиреоидит Хашимото, идиопатическую атрофию надпочечников, идиопатическую тромбоцитопению, инсулинзависимый диабет, cиндром Ламберта-Итона, волчаночный гепатит, лимфопению, смешанное заболевание соединительной ткани, пемфигоид, обыкновенную пузырчатку, пернициозную анемию, факогенный увеит, узелковый полиартериит, полигландулярные аутоиммунные синдромы, первичный биллиарный цирроз, первичный склерозирующий холангит, синдром Рейно, рецидивирующий полихондрит, синдром Шмидта, ограниченную склеродермию (или синдром crest), симпатическую офтальмию, системную красную волчанку, артериит Такаясу, височный артериит, тиреотоксикоз, устойчивость к инсулину типа b, диабет типа I, язвенный колит и гранулематоз Вегенера.
В некоторых вариантах осуществления, способы, представленные в настоящем описании, используют для лечения MS. В некоторых вариантах осуществления, MS представляет собой рецидивирующе-ремиттирующий MS, вторично-прогрессирующий MS, первично-прогрессирующий MS или прогрессивно-рецидивирующий MS.
В некоторых вариантах осуществления, способы, представленные в настоящем описании, используют для лечения SAD. Например, в конкретных вариантах осуществления, способы, представленные в настоящем описании, используют для лечения ревматоидного артрита, системной красной волчанки и/или синдром Шегрена.
В некоторых вариантах осуществления, способы, представленные в настоящем описании, используют для лечения IBD. Например, в конкретных вариантах осуществления способы, представленные в настоящем описании, используют для лечения болезни Крона (регионарного заболевания кишечника, например, неактивных и активных форм), глютенчувствительной целиакии (например, неактивных и активных форм) и/или язвенного колита (например, неактивных и активных форм). В некоторых вариантах осуществления, способы, представленные в настоящем описании, используют для лечения синдрома раздраженной кишки, микроскопического колита, лимфоцитарно-плазмоцитарного энтерита, целиакии, коллагенозного колита, лимфоцитарного колита, эозинофильного энтероколита, неуточненного колита, инфекционного колита (вирусного, бактериального или протозойного, например, амебного колита) (например, вызванного clostridium dificile колита), псевдомембранозного колита (некротизирующего колита), ишемического воспалительного заболевания кишечника, болезни Бехчета, саркоидоза, склеродермии, ассоциированной с IBD, ассоциированных с дисплазией уплотнений или очагов, и/или первичного склерозирующего холангита.
Фактические уровни дозирования активных ингредиентов в фармацевтических композициях, представленных в настоящем описании, можно менять таким образом, чтобы получить количество активного ингредиента, которое является эффективным для достижения желательного терапевтического ответа для конкретных пациента, композиции и способа введения, не являясь токсичным для пациента.
Выбранный уровень дозирования может зависеть от множества факторов, включая активность конкретного используемого средства, способ введения, время введения, скорость выведения или метаболизма конкретного используемого соединения, длительность лечения, другие лекарственные средства, соединения и/или материалы, используемые в комбинации с конкретным используемым соединением, возраст, пол, массу, состояние, общее состояние здоровья и предшествующий анамнез пациента, подвергаемого лечению, и подобные факторы, хорошо известные в области медицины.
В некоторых вариантах осуществления, способ включает отбор аллогенных CTL из банка клеток (например, предварительно полученного сторонней организацией банка полученных от доноров эпитопспецифических CTL). В некоторых вариантах осуществления, CTL отбирают, поскольку они экспрессируют TCR, рестрицированный по MHC класса I, кодированному аллелем HLA, который присутствует у субъекта. В некоторых вариантах осуществления, CTL отбирают, если CTL и субъект разделяют по меньшей мере 2 (например, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6) аллелей HLA, и CTL рестрицированы посредством общего аллеля HLA. В некоторых вариантах осуществления, способ включает тестирование репертуара TCR предварительно полученных сторонней организацией полученных от доноров эпитопспецифических T-клеток (т.е., аллогенных T-клеток) с использованием проточной цитометрии. В некоторых вариантах осуществления, эпитопспецифические T-клетки детектируют с использованием анализа тетрамеров, анализа ELISA, анализа вестерн-блоттинга, анализа флуоресцентной микроскопии, анализа деградации по Эдману и/или анализа масс-спектрометрии (например, секвенирования белка). В некоторых вариантах осуществления, репертуар TCR анализируют с использованием зонда на основе нуклеиновой кислоты, анализа амплификации нуклеиновой кислоты и/или анализа секвенирования.
ПРИМЕРЫ
Пример 1: Получение сторонней организацией банка полученных от доноров эпитопспецифических CTL.
В сторонней организации банк полученных от доноров эпитопспецифических CTL получают посредством направленной идентификации материала донорских лимфоцитов для получения популяций CTL достаточного масштаба, широты возможности совпадения с HLA пациента и ограниченной мишенью активности. Идентификацию донорского материала облегчают посредством любой комбинации генетической аннотации донора/материала или характеристик качества полученного продукта, вытекающих из следующих материалов:
(a) Аллели HLA донора - специфическим аллелям HLA можно отдавать приоритет, и специфически собирать их в качестве исходного материала для получения CTL на основании способности наиболее широко охватывать намеченную популяцию пациентов и/или родственных эпитопов, содержащихся в стимулирующих пептидных последовательностях.
(b) Способность тестируемой аликвоты донорского материала усиливать и/или вызывать эффективную цитотоксическую активность при следовании протоколу стимуляции CTL.
(c) Эпитоп/HLA-рестрикция стимулированного донорского материала, как показано по исследованиям цитотоксичности, или посредством функциональной характеризации ответа, как показано по анализам дегрануляции, высвобождения цитокинов, передачи сигналов или других маркеров апоптоза в клетках-мишенях и/или эпитопспецифической стимуляции компартмента CTL.
(d) Полученный фенотипический профиль продукта CTL в тестируемой аликвоте, применительно к экспрессии костимулирующих молекул, маркеров истощения, маркеров дифференцировки и/или другим характеристикам полученного продукта.
После параллельной или последовательной стимуляции и получения содержащих CTL продуктов, каждую партию или лот CTL характеризуют и аннотируют по специфичности HLA-рестрикции и активности. Затем охарактеризованные лоты криоконсервируют в жизнеспособном состоянии, чтобы позволять их реанимацию в более поздний срок. Объединенная криоконсервация множества лотов, полученных из различного донорского материала с экспрессией различных аллелей HLA, приводит к широкому разнообразию рестрицированной по HLA активности в криоконсервированном «банке». Затем содержимое банка является готовым к отбору и проверке соответствия характеристикам пациента в будущем, так что конкретные лоты можно извлекать и реанимировать для целей обеспечения легко доступной терапии с характеристиками, приспособленными к характеристикам каждого пациента.
Пример 2: Отбор CTL из полученной сторонней организацией линии клеток донора, полученной из банка эпитопспецифических CTL.
Персонифицированное изъятие содержащихся в банке продуктов можно осуществлять посредством упорядоченного и выполненного в порядке приоритетов установления совместимости характеристик материала с генетическим фоном пациента или фоном заболевания. Такую иерархическую последовательность соображений можно осуществлять посредством использования алгоритма, разработанного для объединения этих входных данных и вывода совпадающего лота. Этот алгоритм может быть основан на HLA-рестрикции, или, при доступности множества лотов, на совпадении HLA-рестрикции в комбинации с наборами дополнительных входных данных, где каждое соответственным образом взвешено, и включении дополнительных специфических для лота и/или пациента характеристик и аннотаций для отбора наиболее эффективного специфического для пациента лота, или лота, который уменьшает потенциал неблагоприятных событий. Ниже представлен иллюстративный формат для такого алгоритма изъятия.
Аллогенные полученные сторонней организацией EBV-CTL отбирают для субъекта из библиотеки доступных линий клеток EBV-CTL. Следующие стадии описывают способ идентификации линии(линий) клеток, предназначенных для использования для субъекта:
1) Для совпадения линии клеток с пациентом, линия клеток и пациент должны разделять ≥2 локусов HLA при высоком разрешении, где по меньшей мере 1 локус HLA субъекта или, предпочтительно, компартмента EBV+ B-клеток субъекта, если он известен, совпадает с HLA-рестрикцией данной линии клеток CTL.
2) Для обеспечения наличия адекватной дозы клеток, присутствие достаточного количества клеток из отобранной линии клеток для введения при минимум X циклов при Y CTL/кг фактической массы тела на дозу (n доз на цикл (X), X циклов=nX доз суммарно; таким образом, минимальная доступная доза должна составлять по меньшей мере nXY x 106 CTL/кг фактической массы тела). Минимальную дозу можно менять в зависимости от характеристик пациента или заболевания.
3) Если только одна линия клеток идентифицирована в соответствии с обсуждаемыми ранее стандартами, тогда эту линию клеток следует использовать, и не выдвигают дополнительных критериев отбора. Однако, в некоторых случаях, может существовать более одной линии клеток в библиотеке CTL, удовлетворяющих совпадению по HLA (1) и требованиям минимальной дозы (2) для данного субъекта. Среди этих линий клеток CTL, некоторые могут иметь дополнительные характеристики аллелей HLA, либо рестрицирующих, либо определенных в генотипе донора материала, которые могут быть ассоциированы, либо клинически, либо с опосредованными уровнями обоснованности, с уменьшенной клинической эффективностью, как определено по уменьшенной эффективности или увеличенной ассоциации с неблагоприятными событиями. Если это имеет место, линии клеток можно отбирать по отсутствию этого дополнительного аллеля HLA.
Кроме того, линии клеток, которые ранее вводили пациентам и регистрировали полученные ответы. Эти данные ответа линии клеток используют для отбора среди линий клеток CTL вариантов, удовлетворяющих требованиям (1) и (2), следующим образом:
3a) Среди линий клеток, где предшествующие показатели частоты ответов были больше, чем указанный порог среди по меньшей мере 4 подвергнутых лечению пациентов, затем отбирают наибольшую существующую дозу клеток, доступную в библиотеке. Если исходный донорский материал использовали для последующей партии, и получена такая же HLA-рестрикция, как для первой партии, тогда показатели частоты ответов для последующих партий, разделяющих такую же HLA-рестрикцию, можно принимать как имеющие сходную эффективность.
3b) Если не присутствует линий клеток, удовлетворяющих критериям в (3a), тогда среди линий клеток, удовлетворяющих требованиям из (1) и (2), отбирают линию с наиболее высокой частотой ответов и по меньшей мере одним предшествующим ответом.
3c) Если не присутствует линий клеток с предшествующей частотой ответов, отбор среди линий клеток, для которых ранее показано, что их HLA-рестрикция вызывает ответы, с приоритетом для линии клеток по HLA-рестрикции, разделяемой с субъектом (или заболеванием субъекта), с наиболее высоким предшествующим ответом.
3d) Наконец, если предшествующим требованиям невозможно соответствовать, отбирают линии, избегая HLA-рестрикции с известным неадекватным ответом или с увеличенной распространенностью уменьшенной клинической эффективности или потенциальной ассоциацией с ней.
Любых пациентов с диагнозом первично-прогрессирующий MS (PPMS), вторично-прогрессирующий MS (SPMS) или рецидивирующе-ремиттирующий MS (RRMS) можно лечить с использованием EBV-CTL, при условии, что присутствует доступная линия клеток с HLA-рестрикцией, совпадающей с аллелем HLA пациента.
Пример 3: Лечение MS с использованием полученных сторонней организацией полученных от доноров CTL
Пациентов с рецидивирующе-ремиттирующим, первично-прогрессирующим и вторично-прогрессирующим MS лечат с использованием полученных сторонней организацией аллогенных нацеленных EBV-CTL, проявляющих цитотоксичность против B-клеток и плазматических клеток, представляющих антигены EBNA1, LMP1 и LMP2. Пациентов подвергают четырем введениям нацеленных EBV-CTL в дозе 2×10^7 клеток/м2, введенных внутривенно с Q2-недельными интервалами (т.е. на сутки 1, 15, 29 и 43). Пациентов оценивают по событиям рецидива, серийной усиленной гадолинием МРТ головного мозга, и серийной люмбальной пункции для измерения уровней IgG в спинномозговой жидкости и встречаемости олигоклональных полос. Расширенную шкалу оценки степени инвалидизации (EDSS) вводят для характеризации прогрессирования инвалидности. Информацию о сопутствующих лекарственных средствах и неблагоприятных событиях собирают для характеризации профиля безопасности лечения. Ниже приведены показатели эффективности лечения:
1) Значимое уменьшение количества новых усиленных гадолинием очагов, как наблюдают по визуализации МРТ при ежемесячных осмотрах пациентов с RRMS по сравнению с ретроспективным контролем в сходной популяции пациентов.
2) Значимое уменьшение годовой частоты клинических рецидивов при ежемесячных осмотрах по сравнению с ретроспективным контролем в сходной популяции пациентов.
3) Значимое уменьшение уровней IgG в CSF по сравнению с исходным у пациентов с первично-прогрессирующим MS (PPMS), вторично-прогрессирующим MS (SPMS) и рецидивирующе-ремиттирующим MS (RRMS).
4) У тридцати процентов пациентов с первично-прогрессирующим, вторично-прогрессирующим и рецидивирующе-ремиттирующим MS исчезают олигоклональные полосы, присутствовавшие исходно.
5) От слабого до умеренного улучшения показателей EDSS через 6 и 12 месяцев у пациентов с первично-прогрессирующим MS (PPMS), вторично-прогрессирующим MS (SPMS) и рецидивирующе-ремиттирующим MS (RRMS).
6) Значимое улучшение мышечной силы, возникающее у 50% пациентов с RRMS, 30% пациентов с PPMS и 25% пациентов с SPMS.
7) У 80% пациентов с RRMS не показано доказательств активности заболевания за 1 год по сравнению с ретроспективным контролем, для которого показано 65%.
Пример 4: Лечение MS с использованием полученных сторонней организацией полученных от доноров CTL (ATA188)
Пациентов с рецидивирующе-ремиттирующим, первично-прогрессирующим и вторично-прогрессирующим MS лечат с использованием адоптивного переноса полученных сторонней организацией полученных от доноров CTL. Аллогенные нацеленные на латентный белок-2 EBV цитотоксические T-лимфоциты (аллогенные L2 EBV CTL), или ATA188, представляют собой совпадающие по HLA, размноженные in vitro, антигенспецифические T-клетки, специфические для белковых антигенов EBV, включающих латентный мембранный белок 1 (LMP1), LMP2 и EBNA1. ATA188 получают из мононуклеарных клеток периферической крови (PBMC) здоровых сероположительных по EBV доноров. Часть этих донорских клеток становятся T-клетками для иммунотерапии, и часть представляют собой антигенпредставляющие клетки (APC), которые используют для стимуляции T-клеток. APC трансдуцируют с использованием нового, рекомбинантного, дефектного по репликации аденовируса, кодирующего трансген, экспрессирующий полипептидный белок и укороченный белок EBNA1 (AdE1-LMPpoly). Полиэпитопный белок включает множество рестрицированных по HLA класса I CD8+ T-клеточных эпитопов из LMP1 и LMP2 в форме «нитки бус». Укороченный белок EBNA1 исключает последовательность повтора глицин-аланин, которая мешает трансляции и эндогенному процессингу этого белка, и сохраняет CD8+ и CD4+ T-клеточные эпитопы. Доклинические и клинические исследования показали, что эти экспрессирующие LMP и EBNA1 APC являются высоко эффективными для индукции быстрого размножения антигенспецифических T-клеток от доноров-людей в присутствии интерлейкина-2 (IL-2). Полученный клеточный продукт, ATA188, криоконсервируют и подтверждают по HLA-рестрикции с цитотоксическим потенциалом и по отсутствию аденовирусной инфекционности.
Способ и дозирование
Пациентов подвергают 2 циклам лечения, где каждый цикл состоит из 15-суточного периода лечения (с 3 инфузиями, где каждую вводят приблизительно через 7 суток, на сутки 1, 8 [±2 суток] и 15 [±2 суток]). После третьей инфузии из цикла 1, субъекты входят в 20-суточный период наблюдения с приблизительно еженедельными осмотрами, и после третьей инфузии из цикла 2, субъекты входят в период отслеживания с 11 ежемесячными (каждые 28±5 суток) осмотрами. Суммарно, субъектов наблюдают в течение по меньшей мере 1 года после первой дозы ATA188.
Первую когорту лечат при дозе 5×106 клеток, с последующими дозами 1×107, 2,0×107 и 4,0×107 (в когортах 2, 3 и 4, соответственно). Внутри когорт 1-4, в лечении делают отсрочку для субъектов, с 8-суточной паузой между лечением первого и второго субъектов, и второго и третьего субъектов (например, лечение второго субъекта можно начинать через сутки после того, как первому субъекту ввели инфузию на сутки 8, если не наблюдают ограничивающей дозу токсичности. Ограничивающая дозу токсичность, или DLT, представляет собой токсичность, рассматриваемую как по меньшей мере возможно, связанную с введением ATA188. После регистрации третьего субъекта, регистрируют остальную когорту. Повышение дозы от одной когорты к следующей происходит, если не возникает DLT в течение первых 35 суток после первой дозы из цикла 1, суток 1 (т.е., в 35-суточном окне оценки DLT), для всех 6 субъектов в когорте. Если один субъект среди шести испытывает DLT в пределах 35-суточного окна оценки, дополнительных 3 субъектов регистрируют в когорту этой дозы. Если DLT не наблюдают (в пределах 35-суточного окна оценки) среди дополнительных 3 субъектов, продолжают повышение дозы до когорты следующей дозы. Если 2 или более из 9 субъектов внутри когорты испытывают DLT в пределах 35-суточного окна оценки, этот уровень дозирования можно рассматривать как максимально переносимую дозу (MTD). MTD представляет собой наивысшую исследованную дозу, при которой < 1 из 6 субъектов имеют DLT. Если все дозы имеют < 1 из 6, тогда MTD представляет собой наивысшую исследованную дозу. Кроме того, предшествующий уровень дозирования рассматривают как RP2D. RP2D представляет собой дозу ATA188, выбранную для фазы 2 на основании оценки всех данных по безопасности, эффективности и биомаркерам, собранных в ходе повышения дозы (т.е., в когортах 1-4), с встречаемостью субъектов с DLT < 16,6% в течение первых 35 суток дозирования, регистрирующими исследователями и назначенным спонсором медицинским наблюдателем. Если 2 или более из 9 субъектов в когорте самой низкой дозы (когорте 1) испытывают DLT в пределах 35-суточного окна оценки, можно исследовать более низкую дозу/более редкое расписание после консультации с назначенным спонсором медицинским наблюдателем и регистрирующими исследователями.
Повышение дозы может быть основано на оценке безопасности, включая неблагоприятные события, произошедшие после начала лечения (TEAE), клинические лабораторные данные, данные физического обследования, включая показатели жизненно важных функций, и электрокардиограммы (ЭКГ), после того, как для всех субъектов внутри когорты завершено 35-суточное окно оценки DLT.
Повышение дозы (т.е., в когорте 5) проводят при RP2D без отсрочки/остановки лечения между субъектами.
Пациентов оценивают по событиям рецидива и изменению по сравнению с фоном количества усиленных гадолинием (Gd) и новых или увеличенных очагов T2 на сканах магнитно-резонансной томографии (МРТ) головного мозга. ATA188 отбирают для каждого субъекта на основании соответствия по меньшей мере 2 аллелей человеческих лейкоцитарных антигенов (HLA) по меньшей мере с 1 HLA-рестрицирующим аллелем, общим между ATA188 и субъектом. Расширенную шкалу оценки степени инвалидизации (EDSS) вводят для характеризации прогрессирования заболевания и инвалидности. Информацию о сопутствующих лекарственных средствах и неблагоприятных событиях собирают для характеризации профиля безопасности лечения.
Показатели исхода/оценки исследования:
Ниже приведены показатели эффективности лечения:
1) Изменение по сравнению с фоном количества усиленных Gd и новых или увеличенных очагов T2 на сканах МРТ головного мозга.
2) Уменьшение годовой частоты клинических рецидивов.
3) От слабого до умеренного улучшения показателей EDSS у пациентов с первично-прогрессирующим MS (PPMS), вторично-прогрессирующим MS (SPMS) и рецидивирующе-ремиттирующим MS (RRMS).
Пациентов оценивают по частоте, персистенции и размножению циркулирующих специфических для EBV T-клеток и по корреляции клеточной кинетики с конечными точками эффективности и безопасности. Кроме того, любое количество конечных точек можно оценивать у участников исследования. Например, изменение дезоксирибонуклеиновой кислоты (ДНК) EBV, изменение уровня витамина D3, изменение нейрофиламентов, изменение отношения переноса намагниченности (MTR) при МРТ, изменение оценки клинического исхода (например, баллов по шкале влияния рассеянного склероза 29 (MSIS), баллов по шкале оценки утомляемости (FSS), баллов по шкале остроты зрения (VA) и баллов по шкале комплексной оценки функций при рассеянном склерозе (MSFC))) и изменение индекса иммуноглобулинов G (IgG) (включая количественную оценку IgG и анализ олигоклональных полос (OCB) в сыворотке и спинномозговой жидкости (CSF)) можно измерять посредством проведения первого измерения до введения T-клеток и проведения дополнительных измерений во время или после исследования.
Исследуемая популяция:
Вплоть до 42 субъектов с RRMS и 6 субъектов с SPMS с недавней активностью заболевания можно регистрировать в 6-10 центрах исследования. Если DLT не возникает в исследовании, можно регистрировать всего 36 субъектов (30 с RRMS и 6 с SPMS).
Ниже следуют критерии включения/исключения для пациентов, участвующих в исследовании. Субъекта можно считать подходящим для участия в этом исследовании, если он удовлетворяет всему из следующего:
1. MS в анамнезе, удовлетворяющий одному из следующих критериев:
- RRMS, как определено по пересмотренным критериям Мак-Дональда 2010 г. для диагностики MS
ИЛИ
- SPMS, диагностированный по меньшей мере за 1 год до регистрации, без рецидивов в течение года до предоставления информированного согласия
2. Положительный по EBV серологический анализ
3. Доступность подходящих частично совпадающих и рестрицированных по HLA ATA188
4. Мужчины и женщины в возрасте 18-45 лет
5. Балл по EDSS 3,0-6,5
6. Желание и возможность предоставить письменное информированное согласие
Субъект не является подходящим для участия в исследовании, если удовлетворяет любому из следующих критериев:
1. Сопутствующее серьезное неконтролируемое или неразрешенное медицинское состояние, такое как инфекция, ограничивающее соблюдение протокола или подвергающее субъекта неприемлемому риску
2. Положительное серологическое тестирование и/или тестирование нуклеиновой кислоты (NAT) по вирусу иммунодефицита человека (HIV)
3. Серологическое тестирование и/или NAT, показывающее активную инфекцию вирусом гепатита B (HBV), или статус носителя HBV (примечание: положительное серологическое тестирование по HBV, показывающее предшествующую, но устраненную инфекцию HBV, не является критерием исключения)
4. Серологическое тестирование и/или NAT, показывающее активную инфекцию вирусом гепатита C (HCV)
5. Положительное серологическое тестирование по сифилису или Т-лимфотропному вирусу человека I/II (HTLV)
6. Серьезное незлокачественное заболевание (например, тяжелая дисфункция сердца или дыхательных путей)
7. Неконтролируемый психоз, неконтролируемая депрессия или риск суицида, зависимость от химических веществ или любое другое психическое расстройство, которое может дискредитировать способность участвовать в этом исследовании
8. Клинически значимые аномалии общего клинического анализа крови, функции почек или функции печени:
a. Повышенные биохимические показатели функции печени, включая уровень общего билирубина (TBILI) > 1,5× верхнего предела нормы (ULN; если субъект не имеет документированной болезни Жильбера), аспартатаминотрансферазы (AST) или аланинаминотрансферазы (ALT) > 3,0×ULN.
b. Субъекты с уровнем креатинина > 1,5×ULN и расчетным выведением креатинина < 60 мл/мин (с использованием формулы Кокрофта-Голта)
c. Гемоглобин < 10 г/дл; тромбоциты < 100×109/л; абсолютное количество нейтрофилов < 1,5×109/л
9. Любое противопоказание для МРТ и/или Gd, такое как аллергия, или любой объект, который реагирует на сильные статические магнитные поля с импульсным градиентом, включая любые металлические фрагменты или инородные тела (например, клипсу(клипсы) для аневризмы, кардиостимуляторы, электронные имплантаты, шунты)
10. Предшествующие злокачественные опухоли, за исключением успешно излеченного немеланомного рака кожи или карциномы шейки матки in situ, с ≥ 5% шансом рецидива в пределах 12 месяцев
11. Иммуномодулирующая терапия (помимо коротких курсов кортикостероидов) следующим образом:
a. Любое предшествующее лечение с использованием истощающего B-клетки средства
b. Любое предшествующее лечение с использованием алемтузумаба
c. Лечение с использованием ацетата глатирамера или IFNβ в пределах 4 недель от предоставления информированного согласия
d. Лечение с использованием диметилфумарата в пределах 4 недель от предоставления информированного согласия
e. Лечение с использованием финголимода в пределах 2 месяцев от предоставления информированного согласия
f. Лечение с использованием натализумаба, метотрексата, азатиоприна или циклоспорина в пределах 6 месяцев от предоставления информированного согласия
g. Лечение с использованием терифлуномида в пределах 12 месяцев от предоставления информированного согласия, если для пациента не завершено ускоренное выведение с использованием холестирамина
h. Лечение с использованием митоксантрона, циклофосфамида, кладрибина, ритуксимаба или любого другого иммунодепрессанта или цитотоксического лекарственного средства (отличного от стероидов) в пределах 12 месяцев от предоставления информированного согласия, или определенное исследователем наличие остаточной иммуносупрессии в результате этих видов лечения
12. Терапия антитимоцитарным глобулином или подобным антителом против T-клеток за ≤ 4 недель до предоставления информированного согласия.
13. Женщина с детородным потенциалом, не желающая использовать высокоэффективный способ контрацепции (т.е., такой, который приводит к беременности менее, чем для 1% в год при постоянном и правильном использовании), например, имплантаты, инъецируемые средства, комбинированные пероральные контрацептивы, некоторые внутриматочные устройства контрацепции, половое воздержание или подвергнутый вазэктомии партнер, во время подвергания лечению с использованием ATA188 и в течение 3 месяцев после последней дозы.
ИЛИ
Мужчина, имеющий партнера - женщину с детородным потенциалом, не желающую использовать высокоэффективный способ контрацепции, и/или не желающий воздерживаться от донорства спермы во время подвергания лечению с использованием ATA188 и в течение 3 месяцев после последней дозы
14. Женщины, осуществляющие грудное вскармливание.
15. Беременность.
16. Невозможность следовать способам исследования.
17. Предшествующее лечение с использованием EBV-T-клеточной терапии.
Статистические способы, используемые в исследовании
Популяция для анализа
Всех субъектов, которые зарегистрированы в этом исследовании, и которым вводят любой исследуемый продукт, включают в популяции для оценки эффективности и безопасности. Популяция для оценки эффективности предназначена для первичных анализов эффективности и всех анализов распределения, демографии и исходных характеристик заболевания.
Чтобы считать субъекта подходящим для анализа DLT, субъект должен либо иметь DLT в пределах 35-суточного окна оценки, либо иметь завершенную 35-суточную оценку DLT.
Анализы эффективности
Описательную статистику предоставляют для конечных точек эффективности и, кроме того, конечные точки для длительной эффективности анализируют с использованием способов регрессии.
Анализы безопасности
Оценки безопасности включают все связанные и не связанные AE. Все AE обозначают с использованием Словаря по нормативно-правовой деятельности в области медицины и ранжируют в соответствии с CTCAE версии 4.03. AE обобщают по количеству и проценту субъектов, для которых зарегистрированы AE, как серьезные по сравнению с не серьезными, и по зарегистрированной исследователем взаимосвязи (не связанные, возможно связанные, связанные). Описательную статистику можно использовать для обобщения типов и частот AE.
Пример 5: CTL от здоровых доноров с улучшенной эффекторной функцией
Мононуклеарные клетки периферической крови (PBMC) получали от здоровых сероположительных по EBV доноров (доноров NMDP) или пациентов с MS. Часть каждого из этих образцов донорских клеток использовали в качестве источника размноженных CTL, и часть использовали в качестве источника антигенпредставляющих клеток (APC), которые использовали для стимуляции CTL. APC трансдуцировали с использованием рекомбинантного, дефектного по репликации аденовируса кодирующего трансген, экспрессирующий полипептидный белок и укороченный белок EBNA1 (AdE1-LMPpoly). Полиэпитопный белок включает множество рестрицированных по HLA класса I CD8+ T- клеточных эпитопов из LMP1 и LMP2 в форме «нитки бус». Укороченный белок EBNA1 исключает последовательность повтора глицин-аланин, которая мешает трансляции и эндогенному процессингу этого белка, и сохраняет CD8+ и CD4+ T- клеточные эпитопы. Часть CTL образца донорских клеток совместно культивировали с полученными APC для размножения и стимуляции CTL в образце, специфических для эпитопов EBV. После стимуляции и получения содержащих CTL продуктов, партии CTL тестировали по эффекторной функции посредством FACs. Как видно на фигуре 1, продукты CTL, полученные от здоровых доноров, имели значимо более высокий процент жизнеспособных лимфоцитов, которые являлись экспрессирующими интерферон γ (IFNg) и CD8+, по сравнению с продуктами CTL, полученными от пациентов с MS (значение p 0,0002 по критерию Манна-Уитни). Эти данные показывают, что более надежный продукт CTL с более высокой долей эффекторных CD8 T-клеток и функциональных IFNg+ CTL получают, когда здоровых доноров используют в качестве источника CTL для аллогенного переноса, по сравнению с тем, когда пациентов с MS используют в качестве источника CTL для аутологичного переноса.
Полное содержание всех публикаций, патентов, патентных заявок и номеров доступа последовательностей, упомянутых в настоящем описании, таким образом, приведено в качестве ссылки, как если бы было конкретно и индивидуально указано, что содержание каждой индивидуальной публикации, патента или патентной заявки приведено в качестве ссылки. В случае противоречия, настоящая заявка, включая любые определения в настоящем описании, имеет преимущество.
Специалисту в данной области известны или могут быть определены с использованием не более, чем общепринятых экспериментов, множество эквивалентов конкретных вариантов осуществления изобретения, описанных в настоящем описании. Такие эквиваленты предназначены для включения в следующую формулу изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА С ИСПОЛЬЗОВАНИЕМ АУТОЛОГИЧНЫХ Т-КЛЕТОК | 2018 |
|
RU2769474C2 |
| СПОСОБЫ ИММУНОТЕРАПИИ | 2017 |
|
RU2756276C2 |
| СПОСОБЫ ОТБОРА T-КЛЕТОЧНОЙ ЛИНИИ И ЕЕ ДОНОРА ДЛЯ АДОПТИВНОЙ КЛЕТОЧНОЙ ТЕРАПИИ | 2015 |
|
RU2734784C2 |
| СПОСОБЫ ЭКСПАНДИРОВАНИЯ АНТИГЕНСПЕЦИФИЧЕСКИХ CAR-T-КЛЕТОК, КОМПОЗИЦИИ И ПРИМЕНЕНИЯ, СВЯЗАННЫЕ С НИМИ | 2019 |
|
RU2800920C2 |
| СПОСОБЫ EX VIVO ЭКСПАНСИИ ЕСТЕСТВЕННЫХ КЛЕТОК-КИЛЛЕРОВ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2814083C2 |
| СПОСОБЫ ЛЕЧЕНИЯ МНОЖЕСТВЕННОЙ МИЕЛОМЫ И ПЛАЗМОКЛЕТОЧНОГО ЛЕЙКОЗА ПОСРЕДСТВОМ Т-КЛЕТОЧНОЙ ТЕРАПИИ | 2016 |
|
RU2743381C2 |
| ИММУНОТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ОСНОВЕ ДРОЖЖЕЙ С BRACHYURY | 2012 |
|
RU2690180C2 |
| СПОСОБ И СИСТЕМЫ ДЛЯ ПРОГНОЗИРОВАНИЯ СПЕЦИФИЧЕСКИХ ДЛЯ HLA КЛАССА II ЭПИТОПОВ И ОХАРАКТЕРИЗАЦИИ CD4+ T-КЛЕТОК | 2019 |
|
RU2826261C2 |
| ИММУНОТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ОСНОВЕ ДРОЖЖЕЙ С BRACHYURY | 2012 |
|
RU2619850C2 |
| ПЕПТИДЫ NEIL3 И ВКЛЮЧАЮЩИЕ ИХ ВАКЦИНЫ | 2010 |
|
RU2600888C2 |
Группа изобретений относится к способам лечения аутоиммунного заболевания с использованием аллогенных T-клеток. Способы основаны на введении субъекту аллогенных цитотоксических T-клеток (CTL), экспрессирующих T-клеточный рецептор, который специфически связывается с пептидом вируса Эпштейна-Барр (EBV), представленным на MHC класса I, где MHC класса I кодирован аллелем HLA, который присутствует у субъекта. Изобретения позволяют осуществлять лечение рассеянного склероза, в частности первично-прогрессирующего или вторично-прогрессирующего рассеянного склероза. 4 н. и 22 з.п. ф-лы, 1 ил., 1 табл., 5 пр.
1. Способ лечения или предотвращения рассеянного склероза (MS) у субъекта, включающий введение субъекту аллогенных цитотоксических T-клеток (CTL), экспрессирующих T-клеточный рецептор, который специфически связывается с пептидом вируса Эпштейна-Барр (EBV), представленным на MHC класса I, где MHC класса I кодирован аллелем HLA, который присутствует у субъекта.
2. Способ по п. 1, где аллогенные CTL получены из банка клеток.
3. Способ лечения или предотвращения рассеянного склероза (MS) у субъекта, включающий:
a) отбор из банка клеток аллогенных CTL, экспрессирующих T-клеточный рецептор, специфически связывающий пептид EBV, представленный на MHC класса I;
b) введение аллогенных CTL субъекту, где MHC класса I кодирован аллелем HLA, который присутствует у субъекта.
4. Способ лечения или предотвращения рассеянного склероза (MS) у субъекта, включающий:
a) инкубацию образца, содержащего аллогенные CTL, с антигенпредставляющими клетками (APC), представляющими пептид EBV, таким образом, индукцию пролиферации специфических для пептида EBV CTL, экспрессирующих Т-клеточный рецептор, который специфически связывается с пептидом EBV, представленным на MHC класса I, в образце;
b) введение специфических для пептида аллогенных CTL субъекту,
где MHC класса I кодирован аллелем HLA, который присутствует у субъекта.
5. Способ лечения или предотвращения рассеянного склероза (MS) у субъекта, включающий:
a) введение в антигенпредставляющие клетки (APC) конструкции нуклеиновой кислоты, кодирующей пептид EBV, таким образом, индукцию APC для представления пептида EBV на MHC класса I;
b) индукцию специфического для пептида EBV CTL посредством инкубации образца, содержащего аллогенные CTL, с антигенпредставляющими клетками (APC), таким образом, индукцию пролиферации CTL, экспрессирующих Т-клеточный рецептор, который специфически связывается с пептидом EBV, представленным на MHC класса I; и
c) введение специфических для пептида аллогенных CTL субъекту,
где MHC класса I кодирован аллелем HLA, который присутствует у субъекта.
6. Способ по п. 5, где конструкция нуклеиновой кислоты представляет собой вирусный вектор.
7. Способ по п. 6, где вирусный вектор представляет собой AdE1-LMPpoly.
8. Способ по любому из пп. 4-7, где аллогенные CTL сохраняют в банке клеток до введения субъекту.
9. Способ по любому из пп. 4-7, где образец инкубируют с одним или несколькими цитокинами на стадии (a).
10. Способ по любому из пп. 4-7, где APC включают B-клетки.
11. Способ по любому из пп. 4-7, где APC включают антигенпредставляющие T-клетки.
12. Способ по любому из пп. 4-7, где APC включают дендритные клетки.
13. Способ по любому из пп. 4-7, где APC включают искусственные антигенпредставляющие клетки.
14. Способ по п. 13, где APC представляют собой клетки aK562.
15. Способ по любому из пп. 4-7, где APC и аллогенные CTL получены от одного и того же донора.
16. Способ по любому из пп. 4-7, где образец включает мононуклеарные клетки периферической крови (PBMC).
17. Способ по любому из пп. 1-7, где пептид EBV включает пептид LMP1 или его фрагмент.
18. Способ по любому из пп. 1-7, где пептид EBV включает пептид LMP2A или его фрагмент.
19. Способ по любому из пп. 1-7, где пептид EBV включает пептид EBNA1 или его фрагмент.
20. Способ по любому из пп. 1-7, где аллогенные CTL, вводимые субъекту, имеют общие с субъектом по меньшей мере 2 аллеля HLA.
21. Способ по любому из пп. 1-7, где MS является первично-прогрессирующим MS или вторично-прогрессирующим MS.
22. Способ по любому из пп. 1-7, где указанная стадия введения включает по меньшей мере 3 отдельные инфузии указанных аллогенных CTL указанному субъекту.
23. Способ по п. 22, где указанные по меньшей мере 3 отдельные инфузии вводят указанному субъекту с интервалом приблизительно 7 суток.
24. Способ по п. 22, где каждая отдельная инфузия включает введение указанному субъекту по меньшей мере 2,0 × 107 указанных аллогенных CTL.
25. Способ по п. 22, где каждая отдельная инфузия включает введение указанному субъекту по меньшей мере 4,0 × 107 указанных аллогенных CTL.
26. Способ по любому из пп. 1-7, где указанная стадия введения включает введение указанному субъекту по меньшей мере 2 циклов из 3 отдельных инфузий на цикл указанных аллогенных CTL.
| PENDER M.P | |||
| et al., "Epstein-Barr virus-specific adoptive immunotherapy for progressive multiple sclerosis", Multiple Sclerosis Journal, 2014, Vol | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| ROSKROW M | |||
| A., et al., "Epstein-Barr Virus (EBV)-Specific Cytotoxic T Lymphocytes for the Treatment of Patients With EBV-Positive Relapsed Hodgkin's Disease", Blood, 1998, 91 | |||
Авторы
Даты
2022-06-14—Публикация
2017-05-25—Подача