Область техники
[0001] Настоящее изобретение относится, главным образом, к соединению, имеющему определенную химическую структуру, которое обладает противовоспалительным действием в центральной нервной системе, или к его фармакологически приемлемой соли, а также к его фармацевтическому применению. Кроме того, настоящее изобретение относится к механизму действия, фармацевтической композиции, получению фармацевтической композиции, способам предупреждения и/или лечения и т.п. с применением указанного соединения или его фармакологически приемлемой соли.
Уровень техники
[0002] Гризеофульвин являетсяантибиотиком, впервые выделенным из Penicillium griseofulvum, вида пенициллиновых плесневых грибов рода Aspergillus, учеными AE Oxford et al. в 1939 году (непатентная литература 1). Его вводят, главным образом, перорально, однако он является слаборастворимым и легко усваиваемым лекарственным соединением, а кинетика его пероральной абсорбции затруднена. Его используют в качестве противогрибкового агента против дерматофитов, таких как Microsporum (Microsporum), Trichophyton (Trichophyton) и Epidermophyton (Epidermophyton) (непатентная литература 2 и 3).
[0003] Гризеофульвин связывается с тубулином в клетках. Это приводит к остановке клеточного цикла на фазе G2/M, вызывает митотические патологии и подавляет рост различных клеток, таких как клетки грибков, растений и млекопитающих. Подавление роста грибковых клеток происходит при очень низких концентрациях, по сравнению с клетками млекопитающих, предположительно, вследствие более высокой связывающей аффинности с грибковым тубулином, по сравнению с тубулином млекопитающих. Кроме того, он также обладает эффектом подавления динамической нестабильности микротрубочек и стабилизации движения микротрубочек посредством связывания с белками, ассоциированными с микротрубочками (MAP) (непатентная литература 4).
[0004] Гризеофульвин оказывает эффект подавления роста раковых клеток человека и вызывает апоптоз, а также демонстрирует противоопухолевую активность в отношении опухолей, трансплантированных бестимусным голым мышам, при использовании в комбинации с нокодазолом. Таким образом, он также предположительно обладает действием противоракового агента (непатентная литература 5).
[0005] С другой стороны, давно известно, что он обладает противовоспалительным действием, помимо своего противогрибкового эффекта. Например, установлено, что он проявляет противовоспалительное действие в отношении формалинового отека и гранулемы вокруг ватного шарика, которые являются моделями воспаления у крыс (непатентная литература 6). В реальной клинической практике описано, что он демонстрирует фармакологический эффект в отношении красного плоского лишая (lichen planus) (непатентная литература 7), плазмацитарного хейлита (plasma cell cheilitis) (непатентная литература 8) и пигментированного пурпурозного дерматоза (pigmented purpuric dermatosis) (непатентная литература 9), которые представляют собой негрибковые воспалительные заболевания кожи.
[0006] Кроме того, описано, что он проявляет фармакологический эффект в отношении ливедоидного васкулита (livedoid vasculitis) (непатентная литература 9), полиартрита, такого как синдром «плечо-кисть» (shoulder-hand syndrome), и плечелопаточного периартрита (scapulo-humeral peryarthritis) (непатентная литература 6 и 10).
[0007] Обнаружено, что он оказывает действие на микротрубочки лейкоцитов и антагонистическое действие на гистамин, серотонин, простагландин и т.п., которые являются химическими медиаторами воспаления in vitro (непатентная литература 6), но подробности механизма действия гризеофульвина для противовоспалительного эффекта не ясны.
[0008] Как описано выше, гризеофульвин, обладающий многими физиологическими действиями, подвергали превращению с применением различных заместителей, и в настоящее время синтезированы его производные (непатентная литература 11).
[0009] В последние годы, с развитием исследовательской деятельности, установлена взаимосвязь между умственными расстройствами, нейродегенеративными заболеваниями и воспалением (непатентная литература 12 и 13).
Описано, что стресс усиливает выработку воспалительных цитокинов в микроглии, и что уровни цитокинов в крови (TNFα и т.п.) являются высокими у пациентов с психиатрическими расстройствами (депрессией, шизофренией и т.п.), а также сделано предположение об участии воспаления головного мозга в умственных заболеваниях. Кроме того, сделано предположение, что при нейродегенеративных заболеваниях, типичным примером которых является болезнь Альцгеймера, белки, которые предположительно являются их причиной, могут запускать воспаление головного мозга посредством активации микроглии.
Литературные источники из известного уровня техники
Непатентная литература
[0010] Непатентная литература 1: Oxford AE, Raistrick H, Simonart P. Studies in the biochemistry of micro-organisms: Griseofulvin, C(17)H(17)O(6)Cl, a metabolic product of Penicillium griseo-fulvum Dierckx. 1537917094409_0. 193 9 февраля ; 33(2): 240-248.
Непатентная литература 2: Gentles JC. Experimental ringworm in guinea pigs: oral treatment with griseofulvin. Nature. 16 августа, 1958; 182 (4633): 476-477.
Непатентная литература 3: Williams DI, Marten RH, Sarkany I. Oral treatment of ringworm with griseofulvin. Lancet. 6 декабря, 1958; 2 (7058): 1212-1213.
Непатентная литература 4: Wehland J, Herzog W, Weber K. Interaction of griseofulvin with microtubules, microtubule protein and tubulin. J MoI Biol. 15 апреля, 1977; 111 (3): 329-342.
Непатентная литература 5: Ho YS, Duh JS, Jeng JH, Wang YJ, Liang YC, Lin CH, Tseng CJ, Yu CF, Chen CF, Chen RJ, Lin JK. Griseofulvin potentiates antitumorigenicity effects of nocodazole through induction of apoptosis and G2/M cell cycle arrest in human colorectal cancer cells. Int J Cancer. 1 февраля, 2001; 91 (3): 393-401.
Непатентная литература 6: Sorrentino L, Capasso F, Di Rosa M. Anti-inflammatory properties of griseofulvin. Agents Actions. Март, 1977; 7 (1): 157-162.
Непатентная литература 7: Sehgal VN, Bikhchandani R, Koranne RV, Nayar M, Saxena HM. Histopatical evaluation of griseofulvin therapy in lichen planus. A double-blind controlled study. Dermatologica. 1980; 161 (1): 22-27.
Непатентная литература 8: Tamaki K, Osada A, Tsukamoto K, Ohtake N, Furue M. Treatment of plasma cell cheilitis with griseofulvin. J Am Acad Dermatol. Май, 1994; 30 (5 Pt 1): 789-790.
Непатентная литература 9: Tamaki K, Yasaka N, Osada A, Shibagaki N, Furue M. Successful treatment of pigmented purpuric dermatosis with griseofulvin. Br J Dermatol. Январь, 1995; 132 (1): 159-160.
Непатентная литература 10: Cohen A, Goldman J, Daniels R, Kanenson W. Treatment of shoulder-hand syndrome with griseofulvin. J Am Med Assoc. 4 июня, 1960; 173: 542-543.
Непатентная литература 11: Petersen AB, Ronnest MH, Larsen, TO, Clausen MH. The Chemistry of Griseofulvin. Chem. Rev. Декабрь, 2014; 114: 12088-12107.
Непатентная литература 12: Kadota A. Neuroinflammation Hypothesis of Psychiatric Disorders, Psychiatria et Neurologia Japonica (2012), том 114, № 2, 124-133.
Непатентная литература 13: Kadota A. Neurodegenerative Diseases, Neuroinflammation and Microglia, Clinical Neurology (2014) 54, 1119-1121.
Сущность изобретения
Проблема, решаемая в настоящем изобретении
[0011] В настоящем изобретении предложено соединение, имеющее определенную химическую структуру, которое обладает противовоспалительным действием в центральной нервной системе и которое пригодно в качестве активного ингредиента для предупреждения и лечения воспалительных заболеваний, его фармакологически приемлемая соль, его фармацевтическое применение и т.п., или новый способ его получения и его промежуточные соединения. Соединение, согласно настоящему изобретению, или его фармацевтически приемлемая соль обладают разными свойствами противовоспалительных агентов, существующих в настоящее время, поэтому его считают пригодным в качестве нового фармацевтического агента.
В частности, в настоящем изобретении предложено применение для предупреждения и лечения воспалительных заболеваний, связанных с центральной нервной системой, с применением гризеофульвина на основании установленного факта противовоспалительного эффекта гризеофульвина в центральной нервной системе. Кроме того, в настоящем изобретении, посредством оптимизации структуры гризеофульвина, обнаружено соединение, обладающее превосходным противовоспалительным эффектом в центральной нервной системе, и предложено его применение для предупреждения и лечения воспалительных заболеваний центральной нервной системы.
Способы решения проблемы
[0012] Авторами настоящего изобретения проведены масштабные исследования для разработки соединения, пригодного в качестве активного ингредиента для предупреждения и лечения воспалительного заболевания центральной нервной системы, его фармакологически приемлемой соли и т.п.; в результате разработано соединение, его фармакологически приемлемая соль, их фармацевтическое применение и т.п. согласно настоящему изобретению. Кроме того, обнаружено, что соединение и его фармакологически приемлемая соль согласно настоящему изобретению обладают превосходными свойствами в отношении противовоспалительной активности в центральной нервной системе, биодоступности, активности in vitro, активности in vivo, быстрого действия препарата, устойчивого лекарственного эффекта, физической стабильности, межлекарственного взаимодействия, токсичности и т.п., и являются пригодными в качестве фармацевтических препаратов.
Таким образом, настоящее изобретение является таким, как описано ниже.
[0013] [1]
Соединение общей формулы (1) или его фармакологически приемлемая соль:
[0014] [Химическая формула 1]
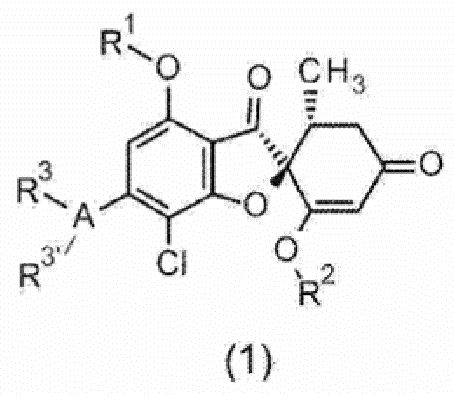
[0015] [Ниже приведено определение символов в формуле.
R1:
C1-C6 алкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C3-C6 циклоалкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, или
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X
R2:
C1-C6 алкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C3-C6 циклоалкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, или
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X.
A:
5-членное ароматическое гетероциклическое кольцо,
6-членное ароматическое гетероциклическое кольцо,
8-10-членное конденсированное ароматическое гетероциклическое кольцо,
5-7-членное ненасыщенное гетероциклическое кольцо,
4-7-членное насыщенное гетероциклическое кольцо,
бензольное кольцо, -CH= или циано-группа (если A представляет собой циано-группу, то R3 и R3’ не существуют)
R3, R3’:
R3 и R3’, каждый независимо, представляют собой атом водорода, атом галогена, циано-группу, гидрокси-группу, оксо-группу,
C1-C6 алкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C1-C6 алкокси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C2-C6 алкенильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C2-C6 алкинильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C3-C6 циклоалкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
аминогруппа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C1-C6 алкоксикарбонильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
карбамоильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
фенильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
5-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
6-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
5-7-членная ненасыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
8-10-членная конденсированная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, или
R3 и R3’ могут образовывать 5-7-членное ненасыщенное гетероциклическое кольцо, 4-7-членное насыщенное гетероциклическое кольцо или C3-C6 циклоалкильное кольцо в качестве кольца, которое связывается и конденсируется с A, и указанное кольцо необязательно замещено одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X.
Группа заместителя X:
атом галогена, циано-группа, гидрокси-группа, оксо-группа, C1-C6 алкильная группа, гидрокси-C1-C6 алкильная группа, C1-C6 алкокси-C1-C6 алкильная группа, C1-C6 галогеналкильная группа, C3-C6 циклоалкильная группа, C3-C6 галогенциклоалкильная группа,
фенильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
5-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
6-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
C1-C6 алкокси-группа, C1-C6 галогеналкокси-группа, C3-C6 циклоалкокси-группа, C3-C6 галогенциклоалкокси-группа,
фенокси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
5-членная ароматическая гетероциклическая окси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
6-членная ароматическая гетероциклическая окси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
4-7-членная насыщенная гетероциклическая окси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
C1-C6 алкоксикарбонильная группа, C3-C6 циклоалкоксикарбонильная группа, карбокси-группа, C1-C6 алкилкарбонильная группа, C3-C6 циклоалкилкарбонильная группа,
фенилкарбонильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
карбамоильная группа, моно(C1-C6 алкил)аминокарбонильная группа, ди(C1-C6 алкил)аминокарбонильная группа, моно(C1-C6 алкил)аминосульфонильная группа, ди(C1-C6 алкил)аминосульфонильная группа, аминогруппа, моно(C1-C6 алкил)аминогруппа, ди(C1-C6 алкил)аминогруппа, C1-C6 алкоксикарбониламино-группа, моно(C1-C6 алкил)аминокарбониламино-группа, ди(C1-C6 алкил)аминокарбониламино-группа, C1-C6 алкилкарбониламино-группа,
фенилкарбонамино-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
5-членная ароматическая гетероциклическая карбониламино-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
6-членная ароматическая гетероциклическая карбониламино-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y, или
C1-C6 алкилсульфониламино-группа.
Группа заместителя Y:
C1-C6 алкильная группа, C1-C6 алкокси-группа, атом галогена или гидрокси-группа.
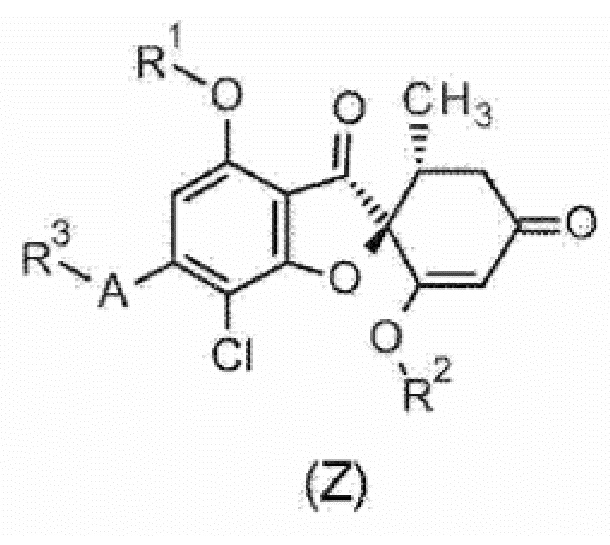
Однако в качестве соединения общей формулы (1) или его фармацевтически приемлемой соли исключено соединение или его фармацевтически приемлемая соль следующей общей формулы (Z).
[0016] [Химическая формула 2]
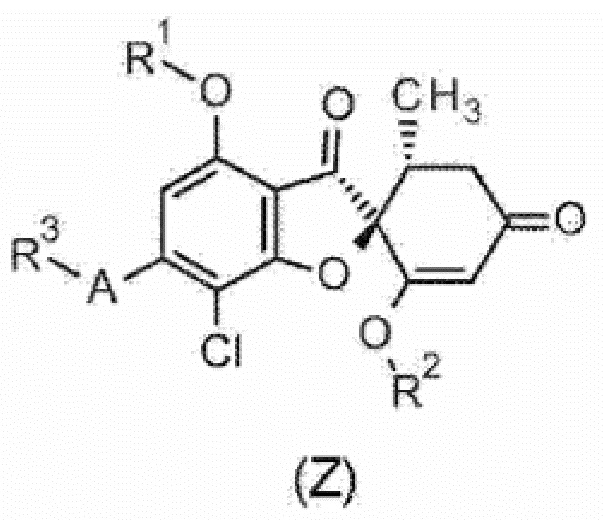
[0017] Следует отметить, что символы в формуле соединения общей формулы (Z) имеют следующее определение.
R1:
C1-C6 алкильная группа или гидрокси-C1-C6 алкильная группа.
R2:
C1-C6 алкильная группа.
A:
5-членное ароматическое гетероциклическое кольцо.
R3:
C1-C6 алкильная группа, гидрокси-C1-C6 алкильная группа или C1-C6 алкокси-C1-C6 алкильная группа].
[0018] [2]
Соединение или его фармакологически приемлемая соль по п. [1], отличающиеся тем, что 5-членное ароматическое гетероциклическое кольцо или 5-членная ароматическая гетероциклическая группа в A, R3 или R3’ представляет собой любую группу, выбранную из группы, представленной ниже.
[0019] [Химическая формула 3]

[0020] [3]
Соединение или его фармакологически приемлемая соль по п. [1] или [2], отличающиеся тем, что 6-членное ароматическое гетероциклическое кольцо или 6-членная ароматическая гетероциклическая группа в A, R3 или R3’ представляет собой любую группу, выбранную из группы, представленной ниже.
[0021] [Химическая формула 4]

[0022] [4]
Соединение или его фармакологически приемлемая соль по любому из пп. [1] - [3], отличающиеся тем, что 8-10-членное конденсированное ароматическое гетероциклическое кольцо или 8-10-членная конденсированная ароматическая гетероциклическая группа в A, R3 или R3’ представляет собой любую группу, выбранную из группы, представленной ниже.
[0023] [Химическая формула 5]
[0024] [5]
Соединение или его фармакологически приемлемая соль по любому из пп. [1] - [4], отличающиеся тем, что 5-7-членное ненасыщенное гетероциклическое кольцо или 5-7-членная ненасыщенная гетероциклическая группа в A, R3 или R3’ представляет собой любую группу, выбранную из группы, представленной ниже.
[0025] [Химическая формула 6]

[0026] [6]
Соединение или его фармакологически приемлемая соль по любому из пп. [1] - [5], отличающиеся тем, что 4-7-членное насыщенное гетероциклическое кольцо или 4-7-членная насыщенная гетероциклическая группа в A, R1, R2 или R3 представляет собой любую группу, выбранную из группы, представленной ниже.
[0027] [Химическая формула 7]
[0028] [7]
Соединение или его фармакологически приемлемая соль по п. [1], отличающиеся тем, что соединение общей формулы (1) представляет собой любое соединение, выбранное из следующей группы.
(2S,5’R)-7-хлор-6-(5-этил-1,3,4-оксадиазол-2-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-тетрагидропиран-4-ил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[5-(1-метил-4-пиперидил)-1,3,4-оксадиазол-2-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-[5-(4-фтор-1-метил-4-пиперидил)-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-[5-[(1S)-1-метоксиэтил]-1,3,4-оксадиазол-2-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-этокси-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-(дифторметокси)-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-[3-(1-метоксиэтил)-1,2,4-оксадиазол-5-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-[3-(1-гидрокси-1-метилэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(1H-пиразол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-[1-(2-метоксиэтил)пиразол-3-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-(1,8-диокса-2-азаспиро[4.5]дец-2-ен-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(8-метил-1-окса-2,8-диазаспиро[4.5]дец-2-ен-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-(2-метоксипиримидин-5-ил)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-(6-метокси-3-пиридил)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(3-пиридил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
[0029] [8]
Фармацевтическая композиция, содержащая соединение по любому из пп. [1] - [7] или его фармакологически приемлемую соль в качестве активного ингредиента.
[0030] [9]
Фармацевтическая композиция по п. [8] для предупреждения и/или лечения воспалительного заболевания центральной нервной системы.
[0031] [10]
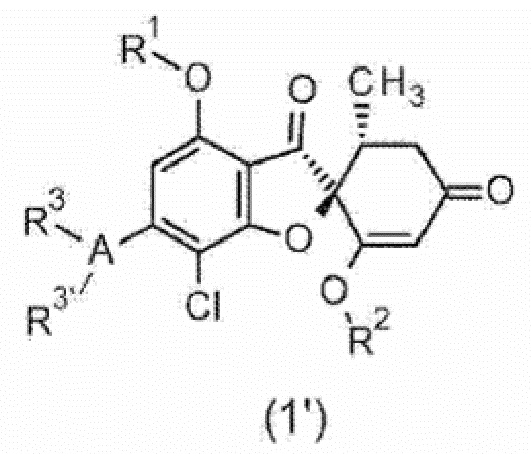
Фармацевтическая композиция для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, содержащая соединение общей формулы (1’) или его фармакологически приемлемую соль.
[0032]
[Химическая формула 8]

[0033] [Символы в формуле имеют следующие значения.
R1:
C1-C6 алкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C3-C6 циклоалкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, или
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X.
R2:
C1-C6 алкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C3-C6 циклоалкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, или
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X.
A:
5-членное ароматическое гетероциклическое кольцо,
6-членное ароматическое гетероциклическое кольцо,
8-10-членное конденсированное ароматическое гетероциклическое кольцо,
5-7-членное ненасыщенное гетероциклическое кольцо,
4-7-членное насыщенное гетероциклическое кольцо,
бензольное кольцо или одинарная связь (если одинарная связь, то один или другой из R3 и R3’ отсутствует).
R3, R3’:
R3 и R3’, каждый независимо, представляют собой атом водорода, атом галогена, циано-группу, гидрокси-группу,
C1-C6 алкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C1-C6 алкокси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C2-C6 алкенильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C2-C6 алкинильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C3-C6 циклоалкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
аминогруппа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C1-C6 алкоксикарбонильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
карбамоильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
фенильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
5-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
6-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
5-7-членная ненасыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
8-10-членная конденсированная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
или
R3 и R3’ могут образовывать 5-7-членное ненасыщенное гетероциклическое кольцо, 4-7-членное насыщенное гетероциклическое кольцо или C3-C6 циклоалкильное кольцо в качестве кольца, которое связывается и конденсируется с A, и указанное кольцо необязательно замещено одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X.
Группа заместителя X:
атом галогена, циано-группа, гидрокси-группа, оксо-группа, C1-C6 алкильная группа, гидрокси-C1-C6 алкильная группа, C1-C6 алкокси-C1-C6 алкильная группа, C1-C6 галогеналкильная группа, C3-C6 циклоалкильная группа, C3-C6 галогенциклоалкильная группа,
фенильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
5-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
6-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
C1-C6 алкокси-группа, C1-C6 галогеналкокси-группа, C3-C6 циклоалкокси-группа, C3-C6 галогенциклоалкокси-группа,
фенокси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
5-членная ароматическая гетероциклическая окси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
6-членная ароматическая гетероциклическая окси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
4-7-членная насыщенная гетероциклическая окси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
C1-C6 алкоксикарбонильная группа, C3-C6 циклоалкоксикарбонильная группа, карбокси-группа, C1-C6 алкилкарбонильная группа, C3-C6 циклоалкилкарбонильная группа,
фенилкарбонильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
карбамоильная группа, моно(C1-C6 алкил)аминокарбонильная группа, ди(C1-C6 алкил)аминокарбонильная группа, моно(C1-C6 алкил)аминосульфонильная группа, ди(C1-C6 алкил)аминосульфонильная группа, аминогруппа, моно(C1-C6 алкил)аминогруппа, ди(C1-C6 алкил)аминогруппа, C1-C6 алкоксикарбониламино-группа, моно(C1-C6 алкил)аминокарбониламино-группа, ди(C1-C6 алкил)аминокарбониламино-группа, C1-C6 алкилкарбониламино-группа,
фенилкарбонамино-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
5-членная ароматическая гетероциклическая карбониламино-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
6-членная ароматическая гетероциклическая карбониламино-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y, или
C1-C6 алкилсульфониламино-группа.
Группа заместителя Y:
C1-C6 алкильная группа, C1-C6 алкокси-группа, атом галогена или гидрокси-группа].
[0034] [11]
Фармацевтическая композиция по п. [10], отличающаяся тем, что R1 представляет собой метильную группу, этильную группу или гидроксиэтильную группу.
[0035] [12]
Фармацевтическая композиция по п. [10] или [11], отличающаяся тем, что R2 представляет собой метильную группу.
[0036] [13]
Фармацевтическая композиция по любому из пп. [10] - [12], отличающаяся тем, что 5-членное ароматическое гетероциклическое кольцо или 5-членная ароматическая гетероциклическая группа в A, R3 или R3’ представляет собой любую группу, выбранную из группы, представленной ниже.
[0037] [Химическая формула 9]
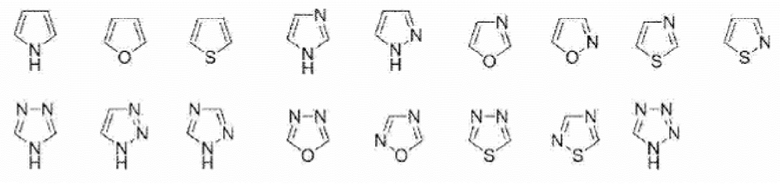
[0038] [14]
Фармацевтическая композиция по любому из пп. [10] - [13], отличающаяся тем, что 6-членное ароматическое гетероциклическое кольцо или 6-членная ароматическая гетероциклическая группа в A, R3 или R3’ представляет собой любую группу, выбранную из группы, представленной ниже.
[0039] [Химическая формула 10]

[0040] [15]
Фармацевтическая композиция по любому из пп. [10] - [14], отличающаяся тем, что 5-7-членное ненасыщенное гетероциклическое кольцо или 5-7-членная ненасыщенная гетероциклическая группа в A, R3 или R3’ представляет собой любую группу, выбранную из группы, представленной ниже.
[0041]
[Химическая формула 11]
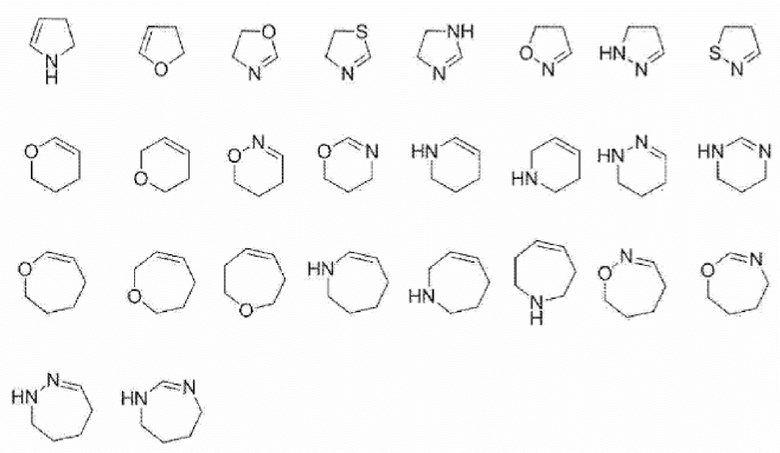
[0042] [16]
Фармацевтическая композиция по любому из пп. [10] - [15], отличающаяся тем, что 4-7-членное насыщенное гетероциклическое кольцо или 4-7-членная насыщенная гетероциклическая группа в A, R1, R2 или R3 представляет собой любую группу, выбранную из группы, представленной ниже.
[0043] [Химическая формула 12]

[0044] [17]
Фармацевтическая композиция по любому из пп. [10] - [12], отличающаяся тем, что A представляет собой 5-членное ароматическое гетероциклическое кольцо, R3 представляет собой метильную группу, этильную группу, гидрокси-C1-C3 алкильную группу или метокси-C1-C3 алкильную группу, и R3’ представляет собой атом водорода.
[0045] [18]
Фармацевтическая композиция по любому из пп. [10] - [12], отличающаяся тем, что A представляет собой любое кольцо, выбранное из следующей группы, а в случае двух связывающих групп R3’ отсутствует.
[0046] [Химическая формула 13]
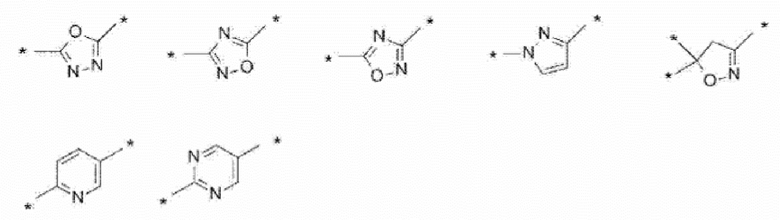
[0047] [* указывает связывающую группу].
[0048] [19]
Фармацевтическая композиция для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, содержащая соединение общей формулы (1’’) или его фармакологически приемлемую соль.
[0049] [Химическая формула 14]

[0050] [Символы в формуле имеют следующие значения.
R1: метильная группа или этильная группа.
R2: метильная группа.
A: Любое кольцо, выбранное из следующей группы
[0051] [Химическая формула 15]

[0052] [* указывает связывающую группу].
R3: метильная группа или этильная группа]
[0053] [20]
Фармацевтическая композиция по п. [10], отличающаяся тем, что соединение общей формулы (1’) представляет собой любое соединение, выбранное из следующей группы.
(2S,5’R)-7-хлор-6-(2-гидроксиэтокси)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-(2-метоксиэтокси)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(1-метилпиразол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-(1-этилпиразол-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(3-метил-1,2,4-оксадиазол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил)-1,2,4-оксадиазол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-[5-(1-гидрокси-1-метилэтил)-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-[5-[(1S)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-[5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-этокси-6-[5-(1-гидрокси-1-метилэтил)-1,3,4-оксадиазол-2-ил]-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-этокси-6-[5-[(1S)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-[3-(1-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(3-метил-1,2,4-оксадиазол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(5-метил-1,2,4-оксадиазол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-(5-этил-1,3,4-оксадиазол-2-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-тетрагидропиран-4-ил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[5-(1-метил-4-пиперидил)-1,3,4-оксадиазол-2-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-[5-(4-фтор-1-метил-4-пиперидил)-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’- метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-[5-[(1S)-1-метоксиэтил]-1,3,4-оксадиазол-2-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-этокси-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-(дифторметокси)-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-[3-(1-метоксиэтил)-1,2,4-оксадиазол-5-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-[3-(1-гидрокси-1-метилэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(1H-пиразол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-[1-(2-метоксиэтил)пиразол-3-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-(1,8-диокса-2-азаспиро[4.5]дец-2-ен-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(8-метил-1-окса-2,8-диазаспиро[4.5]дец-2-ен-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-(2-метоксипиримидин-5-ил)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-(6-метокси-3-пиридил)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(3-пиридил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4,6-триметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
[0054] [21]
Фармацевтическая композиция для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, содержащая соединение, описанное ниже, или его фармакологически приемлемую соль.
(2S,5’R)-7-хлор-6-(1-этилпиразол-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион.
[0055] [22]
Фармацевтическая композиция для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, содержащая соединение, описанное ниже, или его фармакологически приемлемую соль.
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион.
[0056] [23]
Фармацевтическая композиция для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, содержащая соединение, описанное ниже, или его фармакологически приемлемую соль.
(2S,5’R)-7-хлор-6-(5-этил-1,3,4-оксадиазол-2-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион.
[0057] [24]
Фармацевтическая композиция для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, содержащая соединение, описанное ниже, или его фармакологически приемлемую соль.
(2S,5’R)-7-хлор-6-[3-(1-гидрокси-1-метилэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион.
[0058] [25]
Фармацевтическая композиция для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, содержащая соединение, описанное ниже, или его фармакологически приемлемую соль.
(2S,5’R)-7-хлор-4-этокси-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион.
[0059] [26]
Фармацевтическая композиция по любому из пп. [9] - [25], отличающаяся тем, что воспалительное заболевание центральной нервной системы представляет собой любое заболевание, выбранное из группы, состоящей из
болезни Альцгеймера, болезни Паркинсона, деменции с тельцами Леви, множественной системной атрофии, болезни Пика, прогрессирующего надъядерного паралича, дегенерации коры головного мозга, дегенерации лобно-височной доли, болезни Хантингтона, амиотрофического бокового склероза, спинальной и бульбарной мышечной атрофии, спинальной мышечной атрофии, спиноцеребеллярной дегенерации, рассеянного склероза, болезни Крейтцфельдта-Якоба, фатальной семейной бессонницы, синдрома Герстманна-Штреусслера-Шейнкера, синдрома Дауна, болезни Ниманна-Пика, церебральной амилоидной ангиопатии, энцефлопатии на фоне ВИЧ, энцефалопатии на фоне гриппа, печеночной энцефалопатии, прогрессирующей многоочаговой лейкоэнцефалопатии, анти-NMDA-рецепторного энцефалита, церебро-сосудистых расстройств, травматических повреждений головного мозга, повреждений спинного мозга, гипоксической энцефалопатии, эпилепсии, неврита зрительного нерва, врожденных метаболических заболеваний головного мозга, энцефалопатии Вернике, расстройств аутического спектра, расстройств дефицита внимания/гиперактивности, тиковых расстройств, шизофрении, биполярных расстройств, больших депрессивных расстройств (устойчивой к лечению депрессии и послеродовой депрессии), устойчивых депрессивных расстройств (дистимического расстройства), предменструальных дистимических расстройств, тревожных расстройств, фокальной фобии, панических расстройств, обсессивно-компульсивных расстройств, расстройств, связанных с эмоциональной травмой и стрессом, пищевых расстройств, нарушений суточного ритма сна/бодрствования, нарколепсии, расстройств, связанных с употреблением психоактивных веществ (алкогольной зависимости и наркотической зависимости), расстройств контроля над побуждениями, бреда, расстройств личности и синдрома Ретта.
[0060] [27]
Фармацевтическая композиция по любому из пп. [9] - [25], отличающаяся тем, что воспалительное заболевание центральной нервной системы представляет собой любое заболевание, выбранное из группы, состоящей из
болезни Альцгеймера, болезни Паркинсона, деменции с тельцами Леви, множественной системной атрофии, болезни Пика, прогрессирующего надъядерного паралича, дегенерации коры головного мозга, дегенерации лобно-височной доли, болезни Хантингтона, амиотрофического бокового склероза, спинальной и бульбарной мышечной атрофии, спинальной мышечной атрофии, спиноцеребеллярной дегенерации, рассеянного склероза, болезни Крейтцфельдта-Якоба, шизофрении, биполярных расстройств, больших депрессивных расстройств (устойчивой к лечению депрессии и послеродовой депрессии), устойчивых депрессивных расстройств (дистимического расстройства), предменструальных дистимических расстройств, тревожных расстройств, фокальной фобии, панических расстройств, обсессивно-компульсивных расстройств, расстройств, связанных с эмоциональной травмой и стрессом, пищевых расстройств, нарушений суточного ритма сна/бодрствования, нарколепсии, расстройств, связанных с употреблением психоактивных веществ (алкогольной зависимости и наркотической зависимости), расстройств контроля над побуждениями, бреда, расстройств личности и синдрома Ретта.
[0061] [28]
Фармацевтическая композиция по любому из пп. [9] - [25], отличающаяся тем, что воспалительное заболевание центральной нервной системы представляет собой любое заболевание, выбранное из группы, состоящей из
шизофрении, биполярных расстройств, больших депрессивных расстройств (устойчивой к лечению депрессии и послеродовой депрессии), устойчивых депрессивных расстройств (дистимического расстройства), предменструальных дистимических расстройств, тревожных расстройств, фокальной фобии, панических расстройств и обсессивно-компульсивных расстройств.
[29]
Кристалл (2S,5’R)-7-хлор-6-(1-этилпиразол-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-диона (пример 4), имеющий пики при приблизительно 9,5, 10,7, 14,1, 16,4, 17,9, 23,3, 23,6, 23,9, 24,4 и 27,2, которые представляют собой углы дифракции (2θ (°)) на диаграмме рентгеновской порошковой дифракции.
[30]
Кристалл (2S,5’R)-7-хлор-6-(1-этилпиразол-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-диона (пример 4), имеющий диаграмму рентгеновской дифракции, представленную на фиг. 1.
[31]
Кристалл (2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-диона (пример 5), имеющий пики при приблизительно 10,0, 12,3, 15,6, 18,3, 19,1, 20,7, 22,3, 22,9, 24,2 и 29,3, которые представляют собой углы дифракции (2θ (°)) на диаграмме рентгеновской порошковой дифракции.
[32]
Кристалл (2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-диона (пример 5), имеющий диаграмму рентгеновской дифракции, представленную на фиг. 2.
[33]
Кристалл (2S,5’R)-7-хлор-6-(5-этил-1,3,4-оксадиазол-2-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-диона (пример 17), имеющий пики при приблизительно 6,4, 11,2, 11,6, 12,7, 14,7, 17,0, 19,6, 22,4, 24,1 и 26,0, которые представляют собой углы дифракции (2θ (°)) на диаграмме рентгеновской порошковой дифракции.
[34]
Кристалл (2S,5’R)-7-хлор-6-(5-этил-1,3,4-оксадиазол-2-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-диона (пример 17), имеющий диаграмму рентгеновской дифракции, представленную на фиг. 3.
[35]
Кристалл (2S,5’R)-7-хлор-6-[3-(1-гидрокси-1-метилэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-диона (пример 25), имеющий пики при приблизительно 8,1, 11,5, 13,2, 13,5, 14,0, 14,4, 20,8, 21,4, 22,3 и 25,3, которые представляют собой углы дифракции (2θ (°)) на диаграмме рентгеновской порошковой дифракции.
[36]
Кристалл (2S,5’R)-7-хлор-6-[3-(1-гидрокси-1-метилэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-диона (пример 25), имеющий диаграмму рентгеновской дифракции, представленную на фиг. 4.
Эффект изобретения
[0062] Соединение, имеющее определенную химическую структуру, которое обладает противовоспалительным действием в центральной нервной системе, или его фармакологически приемлемая соль согласно настоящему изобретению имеет некоторые свойства, отличные от существующих в настоящее время противовоспалительных агентов, поэтому оно предположительно пригодно в качестве нового фармацевтического средства.
Кроме того, соединение и его фармакологически приемлемая соль согласно настоящему изобретению обладают превосходными свойствами в отношении противовоспалительной активности, биодоступности, активности in vitro, активности in vivo, быстрого действия препарата, устойчивого лекарственного эффекта, физической стабильности, межлекарственного взаимодействия, токсичности и т.п., и являются пригодными в качестве фармацевтических препаратов.
Краткое описание графических материалов
[0063] На фиг. 1 представлена диаграмма рентгеновской порошковой дифракции соединения из примера 4. На оси ординат представлена интенсивность (отсчеты), а по оси абсцисс - угол дифракции (2θ (°)).
На фиг. 2 представлена диаграмма рентгеновской порошковой дифракции соединения из примера 5. На оси ординат представлена интенсивность (отсчеты), а по оси абсцисс - угол дифракции (2θ (°)).
На фиг. 3 представлена диаграмма рентгеновской порошковой дифракции соединения из примера 17. На оси ординат представлена интенсивность (отсчеты), а по оси абсцисс - угол дифракции (2θ (°)).
На фиг. 4 представлена диаграмма рентгеновской порошковой дифракции соединения из примера 25. На оси ординат представлена интенсивность (отсчеты), а по оси абсцисс - угол дифракции (2θ (°)).
Варианты воплощения изобретения
[0064] Ниже приведено подробное описание настоящего изобретения.
[0065] (Заместители, пояснение терминов и т.п.)
Один аспект настоящего изобретения включает соединение общей формулы (1) или его фармакологически приемлемую соль.
[0066]
[Химическая формула 16]
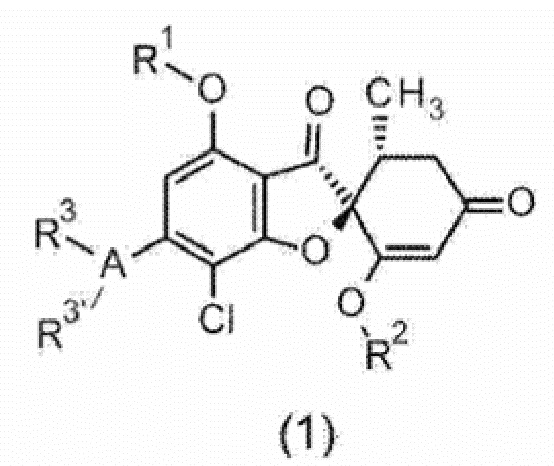
[0067] [Символы в формуле имеют следующие значения.
R1:
C1-C6 алкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C3-C6 циклоалкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, или
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X.
R2:
C1-C6 алкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C3-C6 циклоалкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, или
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X.
A:
5-членное ароматическое гетероциклическое кольцо,
6-членное ароматическое гетероциклическое кольцо,
8-10-членное конденсированное ароматическое гетероциклическое кольцо,
5-7-членное ненасыщенное гетероциклическое кольцо,
4-7-членное насыщенное гетероциклическое кольцо,
бензольное кольцо, -CH= или циано-группа (если A представляет собой циано-группу, то R3 и R3’ не существуют).
R3, R3’:
R3 и R3’, каждый независимо, представляют собой атом водорода, атом галогена, циано-группу, гидрокси-группу, оксо-группу,
C1-C6 алкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C1-C6 алкокси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C2-C6 алкенильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C2-C6 алкинильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C3-C6 циклоалкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
аминогруппа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C1-C6 алкоксикарбонильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
карбамоильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
фенильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
5-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
6-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
5-7-членная ненасыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
8-10-членная конденсированная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, или
R3 и R3’ могут образовывать 5-7-членное ненасыщенное гетероциклическое кольцо, 4-7-членное насыщенное гетероциклическое кольцо или C3-C6 циклоалкильное кольцо в качестве кольца, которое связывается и конденсируется с A, и указанное кольцо необязательно замещено одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X.
Следует отметить, что кольцо, образованное R3 и R3’, связанными друг с другом и конденсированными с A, включает спирокольцо.
Группа заместителя X:
атом галогена, циано-группа, гидрокси-группа, оксо-группа, C1-C6 алкильная группа, гидрокси-C1-C6 алкильная группа, C1-C6 алкокси-C1-C6 алкильная группа, C1-C6 галогеналкильная группа, C3-C6 циклоалкильная группа, C3-C6 галогенциклоалкильная группа,
фенильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
5-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
6-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
C1-C6 алкокси-группа, C1-C6 галогеналкокси-группа, C3-C6 циклоалкокси-группа, C3-C6 галогенциклоалкокси-группа,
фенокси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
5-членная ароматическая гетероциклическая окси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
6-членная ароматическая гетероциклическая окси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
4-7-членная насыщенная гетероциклическая окси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
C1-C6 алкоксикарбонильная группа, C3-C6 циклоалкоксикарбонильная группа, карбокси-группа, C1-C6 алкилкарбонильная группа, C3-C6 циклоалкилкарбонильная группа,
фенилкарбонильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
карбамоильная группа, моно(C1-C6 алкил)аминокарбонильная группа, ди(C1-C6 алкил)аминокарбонильная группа, моно(C1-C6 алкил)аминосульфонильная группа, ди(C1-C6 алкил)аминосульфонильная группа, аминогруппа, моно(C1-C6 алкил)аминогруппа, ди(C1-C6 алкил)аминогруппа, C1-C6 алкоксикарбониламино-группа, моно(C1-C6 алкил)аминокарбониламино-группа, ди(C1-C6 алкил)аминокарбониламино-группа, C1-C6 алкилкарбониламино-группа,
фенилкарбонамино-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
5-членная ароматическая гетероциклическая карбониламино-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
6-членная ароматическая гетероциклическая карбониламино-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y, или
C1-C6 алкилсульфониламино-группа.
Группа заместителя Y:
C1-C6 алкильная группа, C1-C6 алкокси-группа, атом галогена или гидрокси-группа.
Однако в качестве соединения общей формулы (1) или его фармацевтически приемлемой соли исключено соединение или его фармацевтически приемлемая соль следующей общей формулы (Z).
[0068]
[Химическая формула 17]
[0069] Следует отметить, что символы в формуле соединения общей формулы (Z) имеют следующее определение.
R1:
C1-C6 алкильная группа или гидрокси-C1-C6 алкильная группа.
R2:
C1-C6 алкильная группа.
A:
5-членное ароматическое гетероциклическое кольцо.
R3:
C1-C6 алкильная группа, гидрокси-C1-C6 алкильная группа или C1-C6 алкокси-C1-C6 алкильная группа].
[0070]
Кроме того, один аспект настоящего изобретения включает фармацевтическую композицию для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, которая содержит соединение общей формулы (1’) или его фармакологически приемлемую соль.
[0071] [Химическая формула 18]
[0072] [Символы в формуле имеют следующие значения.
R1:
C1-C6 алкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C3-C6 циклоалкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, или
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X.
R2:
C1-C6 алкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C3-C6 циклоалкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, или
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X.
A:
5-членное ароматическое гетероциклическое кольцо,
6-членное ароматическое гетероциклическое кольцо,
8-10-членное конденсированное ароматическое гетероциклическое кольцо,
5-7-членное ненасыщенное гетероциклическое кольцо,
4-7-членное насыщенное гетероциклическое кольцо,
бензольное кольцо или одинарная связь (если одинарная связь, то один или другой из R3 и R3’ отсутствует).
R3, R3’:
R3 и R3’, каждый независимо, представляют собой атом водорода, атом галогена, циано-группу, гидрокси-группу,
C1-C6 алкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C1-C6 алкокси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C2-C6 алкенильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C2-C6 алкинильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C3-C6 циклоалкильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
аминогруппа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C1-C6 алкоксикарбонильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
карбамоильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
фенильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
5-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
6-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
5-7-членная ненасыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
8-10-членная конденсированная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, или
R3 и R3’ могут образовывать 5-7-членное ненасыщенное гетероциклическое кольцо, 4-7-членное насыщенное гетероциклическое кольцо или C3-C6 циклоалкильное кольцо в качестве кольца, которое связывается и конденсируется с A, и указанное кольцо необязательно замещено одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X.
Следует отметить, что кольцо, образованное R3 и R3’, связанными друг с другом и конденсированными с A, включает спирокольцо.
Группа заместителя X:
атом галогена, циано-группа, гидрокси-группа, оксо-группа, C1-C6 алкильная группа, гидрокси-C1-C6 алкильная группа, C1-C6 алкокси-C1-C6 алкильная группа, C1-C6 галогеналкильная группа, C3-C6 циклоалкильная группа, C3-C6 галогенциклоалкильная группа,
фенильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
5-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
6-членная ароматическая гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
4-7-членная насыщенная гетероциклическая группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
C1-C6 алкокси-группа, C1-C6 галогеналкокси-группа, C3-C6 циклоалкокси-группа, C3-C6 галогенциклоалкокси-группа,
фенокси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
5-членная ароматическая гетероциклическая окси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
6-членная ароматическая гетероциклическая окси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
4-7-членная насыщенная гетероциклическая окси-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
C1-C6 алкоксикарбонильная группа, C3-C6 циклоалкоксикарбонильная группа, карбокси-группа, C1-C6 алкилкарбонильная группа, C3-C6 циклоалкилкарбонильная группа,
фенилкарбонильная группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
карбамоильная группа, моно(C1-C6 алкил)аминокарбонильная группа, ди(C1-C6 алкил)аминокарбонильная группа, моно(C1-C6 алкил)аминосульфонильная группа, ди(C1-C6 алкил)аминосульфонильная группа, аминогруппа, моно(C1-C6 алкил)аминогруппа, ди(C1-C6 алкил)аминогруппа, C1-C6 алкоксикарбониламино-группа, моно(C1-C6 алкил)аминокарбониламино-группа, ди(C1-C6 алкил)аминокарбониламино-группа, C1-C6 алкилкарбониламино-группа,
фенилкарбонамино-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
5-членная ароматическая гетероциклическая карбониламино-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y,
6-членная ароматическая гетероциклическая карбониламино-группа, необязательно замещенная одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя Y, или
C1-C6 алкилсульфониламино-группа.
Группа заместителя Y:
C1-C6 алкильная группа, C1-C6 алкокси-группа, атом галогена или гидрокси-группа].
[0073] Следующий аспект настоящего изобретения включает заместитель соединения общей формулы (1’) в фармацевтической композиции для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, причем указанная фармацевтическая композиция содержит соединение общей формулы (1’) или его фармакологически приемлемую соль и представляет собой случай, описанный ниже.
5-Членное ароматическое гетероциклическое кольцо для A является таким, как описано выше, но более предпочтительно представляет собой следующее 5-членное кольцо. (Следует отметить, что в данном случае R3’ отсутствует).
[0074] [Химическая формула 19]

[0075] [* указывает связывающую группу].
5-Членное ароматическое гетероциклическое кольцо образует следующее соединение в качестве соединения общей формулы (1’), в зависимости от связывающей группы.
[0076] [Химическая формула 20]
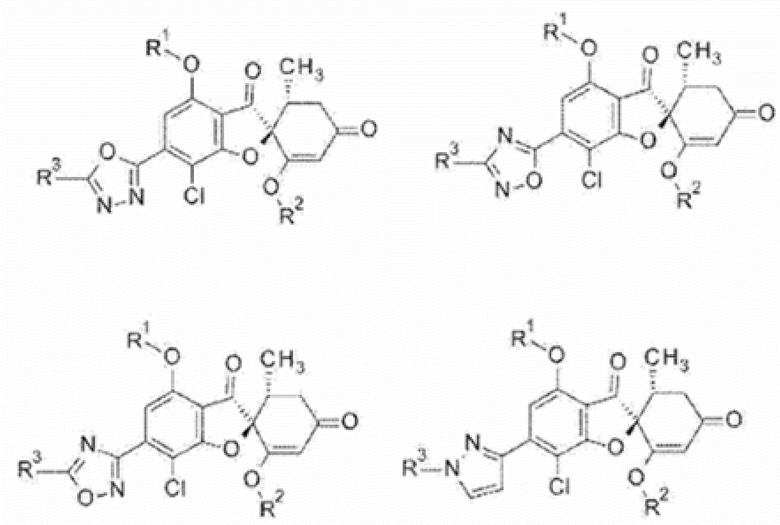
[0077] [В данной формуле R1, R2 и R3 имеют такое же значение, как в случае соединения описанной выше общей формулы (1’)].
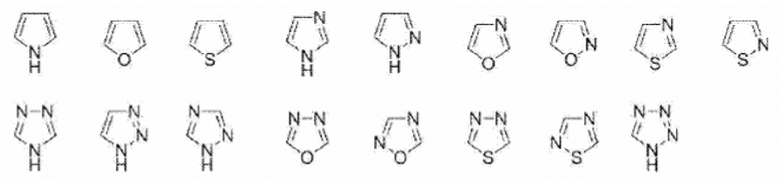
[0078] В данном контексте «5-членное ароматическое гетероциклическое кольцо» представляет собой моноциклическое 5-членное ароматическое гетероциклическое кольцо, содержащее от одного до четырех атомов, выбранных из группы, состоящей из атома азота, атома азота и атома серы. Например, включены такие кольца, как представлены ниже.
[0079] [Химическая формула 21]
[0080] В данном контексте «6-членное ароматическое гетероциклическое кольцо» представляет собой моноциклическое 6-членное ароматическое гетероциклическое кольцо, содержащее от одного до четырех атомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы. Например, включены такие кольца, как представлены ниже.
[0081] [Химическая формула 22]
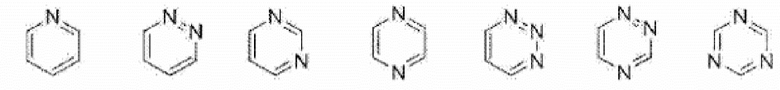
[0082] В данном контексте «8-10-членное конденсированное ароматическое гетероциклическое кольцо» представляет собой 8-10-членное конденсированное ароматическое гетероциклическое кольцо, содержащее от одного до четырех атомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы. Например, включены такие кольца, как представлены ниже.
[0083] [Химическая формула 23]
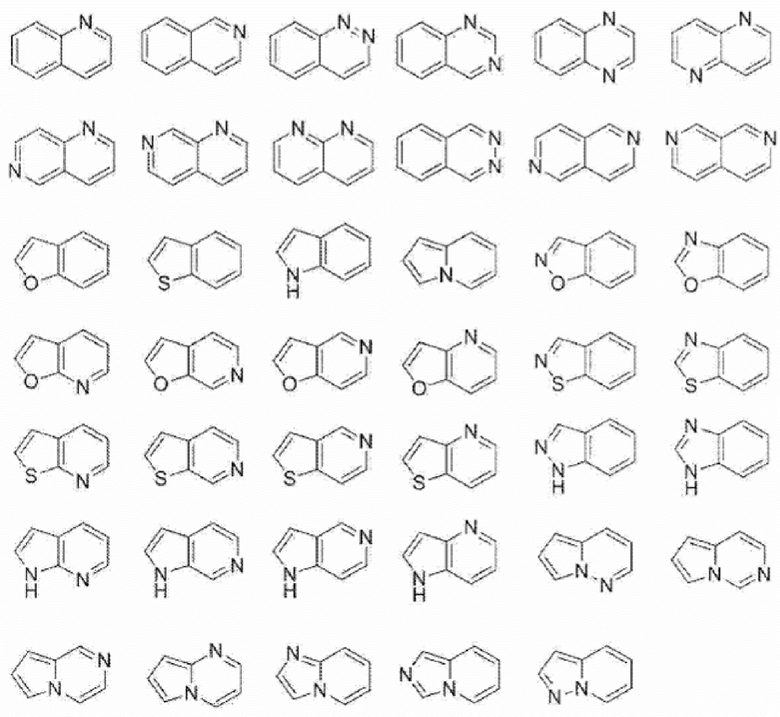
[0084] В данном контексте «5-7-членное ненасыщенное гетероциклическое кольцо» представляет собой кольцо, в котором моноциклическое 5-7-членное насыщенное гетероциклическое кольцо частично окислено, или кольцо, в котором ароматическое гетероциклическое кольцо частично восстановлено, и которое содержит от одного до четырех атомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы. Например, включены такие кольца, как представлены ниже.
[0085]
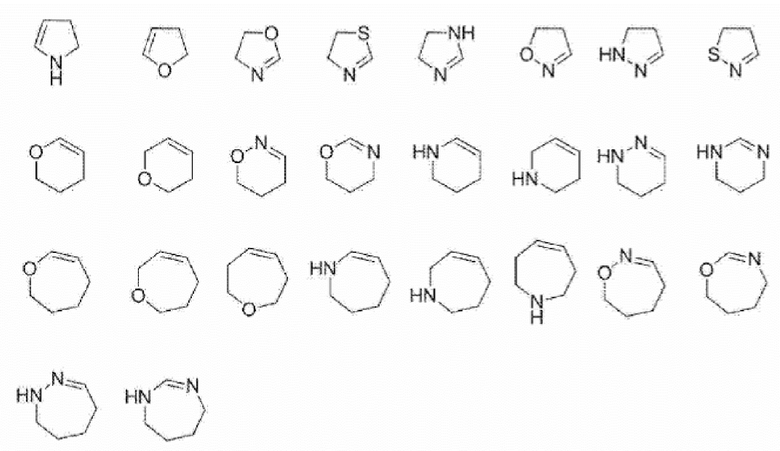
[Химическая формула 24]
[0086] В данном контексте «4-7-членное насыщенное гетероциклическое кольцо» представляет собой моноциклическое 4-7-членное насыщенное гетероциклическое кольцо, содержащее от одного до четырех атомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы. Например, такие кольца, как представлены ниже, включены в качестве моноциклических 4-7-членных насыщенных гетероциклических колец.
[0087] [Химическая формула 25]

[0088] «Атом галогена» в данном контексте представляет собой атом фтора, атом хлора, атом брома или атом йода и предпочтительно представляет собой атом фтора или атом хлора.
[0089] «C1-C6 алкильная группа» в данном контексте представляет собой линейную или разветвленную алкильную группу, содержащую от одного до шести атомов углерода. Ее примеры включают метильную группу, этильную группу, 1-пропильную группу, изопропильную группу, 1-бутильную группу, 2-бутильную группу, 2-метил-1-пропильную группу, 2-метил-2-пропильную группу, 1-пентильную группу, 2-пентильную группу, 3-пентильную группу, 2-метил-2-бутильную группу, 3-метил-2-бутильную группу, 1-гексильную группу, 2-гексильную группу, 3-гексильную группу, 2-метил-1-пентильную группу, 3-метил-1-пентильную группу, 2-этил-1-бутильную группу, 2,2-диметил-1-бутильную группу и 2,3-диметил-1-бутильную группу, и она предпочтительно представляет собой метильную группу или этильную группу.
[0090] «C2-C6 алкенильная группа» в данном контексте представляет собой линейную или разветвленную алкенильную группу, содержащую от двух до шести атомов углерода, и она может содержать одну или две, или более двойных углерод-углеродных связей. Например, она представляет собой винильную группу, 2-пропенильную (аллильную) группу, 2-бутенильную группу, 2-пентенильную группу, 3-метил-2-бутенильную группу, 2-гексенильную группу или 3-метил-2-пентенильную группу, и предпочтительно она представляет собой винильную группу или аллильную группу.
[0091] «C2-C6 алкинильная группа» в данном контексте представляет собой линейную или разветвленную алкинильную группу, содержащую от двух до шести атомов углерода, и она может содержать одну или две, или более тройных углерод-углеродных связей. Например, она представляет собой этинильную группу, 1-пропинильную группу, 2-пропинильную группу, 1-бутинильную группу, 2-бутинильную группу, 1-пентинильную группу, 2-пентинильную группу или 1-гексинильную группу, и она предпочтительно представляет собой этинильную группу или 1-пропинильную группу.
[0092] «C1-C6 алкокси-группа» в данном контексте представляет собой группу, в которой атом кислорода связан с C1-C6 алкильной группой. Ее примеры включают метокси-группу, этокси-группу, 1-пропокси-группу, 2-пропокси-группу, 1-бутокси-группу, 2-бутокси-группу, 2-метил-1-пропокси-группу, 2-метил-2-пропокси-группу, 1-пентилокси-группу, 2-пентилокси-группу, 3-пентилокси-группу, 2-метил-2-бутокси-группу, 3-метил-2-бутокси-группу, 1-гексилокси-группу, 2-гексилокси-группу, 3-гексилокси-группу, 2-метил-1-пентилокси-группу и 3-метил-1-пентилокси-группу. Предпочтительно, она представляет собой метокси-группу, этокси-группу, 1-пропокси-группу или 2-пропокси группу.
[0093] «C3-C6 циклоалкильная группа» в данном контексте представляет собой циклическую алкильную группу, содержащую от трех до шести атомов углерода, и она предпочтительно представляет собой циклопропильную группу, циклобутильную группу, циклопентильную группу или циклогексильную группу.
[0094] «Гидрокси-C1-C6 алкильная группа» в данном контексте представляет собой группу, в которой гидроксильная группа связана с C1-C6 алкильной группой. Например, она представляет собой гидроксиметильную группу или гидроксиэтильную группу.
«C1-C6 алкокси-C1-C6 алкильная группа» в данном контексте представляет собой группу, в которой C1-C6 алкокси связан с C1-C6 алкильной группой. Ее примеры включают метоксиметильную группу, метоксиэтильную группу, этоксиметильную группу и этоксиэтильную группу.
[0095] «C1-C6 галогеналкильная группа» в данном контексте представляет собой группу, в которой атом галогена связан с C1-C6 алкильной группой. Ее примеры включают фторметильную группу, дифторметильную группу, дихлорметильную группу, дибромметильную группу, трифторметильную группу, трихлорметильную группу, 2-фторэтильную группу, 2-бромэтильную группу, 2-хлорэтильную группу, 2-йодэтильную группу, 2,2-дифторэтильную группу, 2,2,2-трифторэтильную группу, трихлорэтильную группу, пентафторэтильную группу, 3-фторпропильную группу, 3-хлорпропильную группу и 4-фторбутильную группу. Предпочтительно, она представляет собой трифторметильную группу.
[0096] «C3-C6 галогенциклоалкильная группа» в данном контексте представляет собой группу, в которой атом галогена связан с C3-C6 циклоалкильной группой, и ее примеры включают фторциклопропильную группу, фторциклобутильную группу, фторциклопентильную группу и фторциклогексильную группу.
[0097] «C1-C6 галогеналкокси-группа» в данном контексте представляет собой группу, в которой атом галогена связан с C1-C6 алкокси-группой, и ее примеры включают фторметокси-группу, дифторметокси-группу, дихлорметокси-группу, дибромметокси-группу, трифторметокси-группу, трихлорметокси-группу, 2-фторэтокси-группу, 2-бромэтокси-группу, 2-хлорэтокси-группу, 2-йодэтокси-группу, 2,2-дифторэтокси-группу, 2,2,2-трифторэтокси-группу, трихлорэтокси-группу, пентафторэтокси-группу, 3-фторпропокси-группу, 3-хлорпропокси-группу и 4-фторбутокси-группу. Предпочтительно, она представляет собой трифторметокси-группу.
[0098] «C3-C6 циклоалкокси-группа» в данном контексте представляет собой группу, в которой C3-C6 циклоалкильная группа связана с атомом кислорода, и она предпочтительно представляет собой циклопропилокси-группу, циклобутилокси-группу, циклопентилокси-группу или циклогексилокси-группу.
[0099] «C3-C6 галогенциклоалкокси-группа» в данном контексте представляет собой группу, в которой C3-C6 галогенциклоалкильная группа связана с атомом кислорода, и ее примеры включают фторциклопропокси-группу, фторциклобутокси-группу, фторциклопентилокси-группу и фторциклогексилокси-группу.
[0100] «5-Членная ароматическая гетероциклическая окси-группа» в данном контексте представляет собой группу, в которой 5-членное ароматическое гетероциклическое кольцо связано с атомом кислорода.
[0101] «6-Членная ароматическая гетероциклическая окси-группа» в данном контексте представляет собой группу, в которой 6-членное ароматическое гетероциклическое кольцо связано с атомом кислорода.
[0102] «4-7-Членная насыщенная гетероциклическая окси-группа» в данном контексте представляет собой группу, в которой 4-7-членное насыщенное гетероциклическое кольцо связано с атомом кислорода.
[0103] «C1-C6 алкоксикарбонильная группа» в данном контексте представляет собой группу, в которой C1-C6 алкокси-группа связана с карбонильной группой, и ее примеры включают метоксикарбонильную группу, этоксикарбонильную группу и пропоксикарбонильную группу.
[0104] «C3-C6 циклоалкоксикарбонильная группа» в данном контексте представляет собой группу, в которой C3-C6 циклоалкокси-группа связана с карбонильной группой, и она предпочтительно представляет собой циклопропилоксикарбонильную группу, циклобутилоксикарбонильную группу, циклопентилоксикарбонильную группу или циклогексилоксикарбонильную группу.
[0105] «C1-C6 алкилкарбонильная группа» в данном контексте представляет собой группу, в которой C1-C6 алкильная группа связана с карбонильной группой, и ее примеры включают метилкарбонильную группу, этилкарбонильную группу или пропилкарбонильную группу.
[0106] «Моно(C1-C6 алкил)аминокарбонильная группа» в данном контексте представляет собой группу, в которой одна C1-C6 алкильная группа связана с аминогруппой аминокарбонильной группы, и она предпочтительно представляет собой метиламинокарбонильную группу, этиламинокарбонильную группу или пропиламинокарбонильную группу.
[0107] «Ди(C1-C6 алкил)аминокарбонильная группа» в данном контексте представляет собой группу, в которой две C1-C6 алкильные группы связаны с аминогруппой аминокарбонильной группы, и она предпочтительно представляет собой диметиламинокарбонильную группу, диэтиламинокарбонильную группу или дипропиламинокарбонильную группу.
[0108] «Моно(C1-C6 алкил)аминосульфонильная группа» в данном контексте представляет собой группу, в которой одна C1-C6 алкильная группа связана с аминогруппой аминосульфонильной группы, и она предпочтительно представляет собой метиламиносульфонильную группу, этиламиносульфонильную группу или пропиламиносульфонильную группу.
[0109] «Ди(C1-C6 алкил)аминосульфонильная группа» в данном контексте представляет собой группу, в которой две C1-C6 алкильные группы связаны с аминогруппой аминосульфонильной группы, и она предпочтительно представляет собой диметиламиносульфонильную группу, диэтиламиносульфонильную группу или дипропиламиносульфонильную группу.
[0110] «Моно(C1-C6 алкил)аминогруппа» в данном контексте представляет собой группу, в которой одна C1-C6 алкильная группа связана с аминогруппой, и она предпочтительно представляет собой метиламино-группу, этиламино-группу или пропиламино-группу.
[0111] «Ди(C1-C6 алкил)аминогруппа» в данном контексте представляет собой группу, в которой две C1-C6 алкильные группы связаны с аминогруппой, и она предпочтительно представляет собой диметиламино-группу, диэтиламино-группу или дипропиламино-группу.
[0112] «C1-C6 алкоксикарбониламино-группа» в данном контексте представляет собой группу, в которой C1-C6 алкоксикарбонильная группа связана с аминогруппой, и, например, представляет собой метоксикарбониламино-группу, этоксикарбониламино-группу или пропоксикарбониламино-группу.
[0113] «Моно(C1-C6 алкил)аминокарбониламино-группа» в данном контексте представляет собой группу, в которой моно(C1-C6 алкил)аминокарбонильная группа связана с аминогруппой, и она предпочтительно представляет собой метиламинокарбониламино-группу, этиламинокарбониламино-группу или пропиламинокарбониламино-группу.
[0114] «Ди(C1-C6 алкил)аминокарбониламино-группа» в данном контексте представляет собой группу, в которой ди(C1-C6 алкил)аминокарбонильная группа связана с аминогруппой, и она предпочтительно представляет собой диметиламинокарбониламино-группу, диэтиламинокарбониламино-группу или дипропиламинокарбониламино-группу.
[0115] «5-Членная ароматическая гетероциклическая карбониламино-группа» в данном контексте представляет собой группу, в которой 5-членная ароматическая гетероциклическая карбонильная группа связана с аминогруппой.
[0116] «6-Членная ароматическая гетероциклическая карбониламино-группа» в данном контексте представляет собой группу, в которой 6-членная ароматическая гетероциклическая карбонильная группа связана с аминогруппой.
[0117] «C1-C6 алкилсульфониламино-группа» в данном контексте представляет собой группу, в которой C1-C6 алкильная группа связана с сульфонильной группой сульфониламино-группы, и она предпочтительно представляет собой метилсульфониламино-группу, этилсульфониламино-группу или пропилсульфониламино-группу.
[0118] «Фармакологически приемлемая соль» означат соль, которую можно использовать в качестве фармацевтического агента. Если соединение имеет кислотную группу или основную группу, то его можно превращать в основную соль или в кислотную соль посредством взаимодействия с основанием или кислотой, и указанный термин означает его соль.
[0119] Фармакологически приемлемая «основная соль» соединения предпочтительно включает соль щелочного металла, такую как натриевая соль, калиевая соль и литиевая соль; соль щелочноземельного металла, такую как магниевая соль и кальциевая соль; соли органических оснований, такие как соль N-метилморфолина, соль триэтиламина, соль трибутиламина, соль диизопропилэтиламинa, соль дициклогексиламина, соль N-метилпиперидина, соль пиридина, соль 4-пирролидинопиридина и соль пиколина; и соль аминокислоты, такую как глициновая соль, лизиновая соль, аргининовая соль, орнитиновая соль, глутамат и аспартат, и она предпочтительно представляет собой соль щелочного металла.
[0120] Фармакологически приемлемая «кислотная соль» соединения предпочтительно включает соль неорганической кислоты, такую как гидрогалогенид, такой как гидрофторид, гидрохлорид, гидробромид и гидройодид, нитрат, перхлорат, сульфат и фосфат; органическую соль, такую как низший алкансульфонат, такой как метансульфонат, трифторметансульфонат и этансульфонат, арилсульфонат, такой как бензолсульфонаты и п-толуолсульфонат, ацетат, малат, фумарат, сукцинат, цитрат, аскорбат, тартрат, оксалат, малеат и т.п.; и соль аминокислоты, такую как соль глицина, соль лизина, соль аргинина, соль орнитина, глутамат и аспартат, и наиболее предпочтительно она представляет собой гидрогалогенид (в частности, гидрохлорид).
[0121] Соединение согласно настоящему изобретению или его фармакологически приемлемая соль может абсорбировать влагу, может присоединяться к адсорбированной воде или становиться гидратом, будучи оставлена на воздухе или при перекристаллизации. Настоящее изобретение также включает соединения таких различных гидратов, сольватов и кристаллических полиморфов.
[0122] Соединения согласно наcтоящему изобретению, их фармакологически приемлемые соли или сольваты, в зависимости от типа и комбинации заместителей, могут иметь различные изомеры, такие как геометрические изомеры, такие как цис-изомер и транс-изомер, таутомеры или оптические изомеры, такие как d-изомер и l-изомер, причем указанные соединения включают все изомеры, стереоизомеры и смеси указанных изомеров и стереоизомеров в любом соотношении, если не указано иное. Смеси таких изомеров можно разделять известными способами разделения.
[0123] Соединения согласно настоящему изобретению также включают метки, то есть соединение, в котором один или более атомов соединения заменены изотопом (например, 2H, 3H, 13C, 14C, 35S и т.п.).
[0124] Кроме того, настоящее изобретение также включает так называемые пролекарства. Пролекарство представляет собой соединение, содержащее группу, которая может быть превращена в аминогруппу, гидроксильную группу, карбоксильную группу или т.п. соединения посредством гидролиза или в физиологических условиях, и группы, образующие такие пролекарства, представляют собой группы, описанные в публикации Prog. Med., том 5, сс. 2157-2161 (1985) или т.п. Более конкретно, если в соединении есть аминогруппа, то в качестве пролекарства включено соединение, в котором аминогруппа ацилирована, алкилирована или фосфорилирована (например, оно представляет собой соединение, в котором аминогруппа эйкозаноилирована, аланилирована, пентиламинокарбонилирована, (5-метил-2-оксо-1,3-диоксолен-4-ил)метоксикарбонилирована, тетрагидрофуранилирована, пирролидинилметилирована, пивалоилоксиметилирована или трет-бутилирована или т.п.) и т.п., а если в соединении есть гидроксильная группа, то включено соединение, в котором гидроксильная группа ацилирована, алкилирована, фосфорилирована или борирована (например, оно представляет собой соединение, в котором гидроксильная группа ацетилирована, пальмитоилирована, пропаноилирована, пивалоилирована, сукцинилирована, фумарилирована, аланилирована или диметиламинометилкарбонилирована или т.п.) и т.п.
Кроме того, если в соединении есть карбокси-группа, то включено соединение, в котором карбокси-группа эстерифицирована или амидирована (например, оно представляет собой соединение, в котором карбокси-группа этил-эстерифицирована, фенил-эстерифицирована, карбоксиметил-эстерифицирована, диметиламинометил-эстерифицирована, пивалоилоксиметил-эстерифицирована, этоксикарбонилоксиэтил-эстерифицирована, амидирована или метиламидирована или т.п.) и т.п.
[0125] В данном контексте, если не указано иное, значения анализа порошковой рентгеновской дифракции представляют собой значения, полученные с использованием излучения Cu-Kα. При использовании рентгеновского излучения, отличного от излучения Cu-Kα, значения 2θ (°) изменяются в соответствии с уравнением 2d sin θ=nλ (d представляет собой расстояние между двумя поверхностями, n представляет собой произвольное целое число, λ представляет собой длину волны рентгеновского излучения), но они лишь дают представление о кристаллах согласно настоящему изобретению с помощью по существу эквивалентных альтернативных способов выражения, и включены в объем настоящего изобретения, который без труда понятен специалистам в области кристаллов. Кроме того, относительные интенсивности пиков, представленные на диаграммах, могут варьироваться, например, в зависимости от степени кристаллизации образца, способа получения или т.п. 2θ (°) существенно не изменяется, но может варьироваться в пределах диапазона погрешности (обычно в пределах диапазона ± 0,2°), как известно специалистам в области кристаллов. При описании характеристического пика порошковой рентгеновской дифракции, представленного углом 2θ, термин «около» означает ± 0,2°, и в другом варианте воплощения он означает ± 0,1°.
[0126] В связи с характером данных, значение анализа порошковой рентгеновской дифракции не следует интерпретировать строго ограниченно, поскольку важны расстояния в кристаллической решетке и общая картина при определении идентичности кристаллов, и поскольку относительная интенсивность может несколько варьироваться в зависимости от направления роста кристалла, размера частиц и условий измерения.
[0127] (Способ получения)
Способ получения описан ниже. Однако способ получения соединения или его соли никоим образом не ограничен следующим способом.
[0128] [Способ A]
Способ A представляет собой способ получения соединения (A-III) согласно настоящему изобретению
[0129]
[Химическая формула 26]
[0130] [В данной формуле R1, R2 и R3 имеют такое же значение, как в случае соединения описанной выше общей формулы (1) или (1’). X означает уходящую группу, такую как группа галогена].
[0131] (Стадия A1) Стадия деметилирования
Данная стадия представляет собой стадию получения соединения (A-II) из соединения (A-I) с применением галогенида металла в присутствии основания и краун-эфира.
Примеры основания включают триэтиламин, диизопропилэтиламин, пиридин и т.п.
Примеры краун-эфира включают 18-краун-6 и т.п.
Примеры галогенида металла включают йодид калия и т.п.
Растворитель может включать, например, N, N-диметилформамид или т.п., или нерастворитель, температура реакции обычно составляет от приблизительно 60 до 120 °С, и время реакции обычно составляет от приблизительно 1 до 24 часов.
[0132] (Стадия A2) Стадия алкилирования
(При использовании галогенированного алкила)
Данная стадия представляет собой стадию получения соединения (A-III) из соединения (A-II) с применением соответствующего алкилирующего реагента в присутствии основания.
Примеры алкилирующего реагента включают галогенированный алкил, такой как алкилйодид и алкилбромид, сульфонатный сложный эфир, такой как алкилтозилат и алкилмезилат, диэтил(бромдифторметил)фосфонат, хлордифторацетат натрия и т.п.
Примеры основания включают триэтиламин, диизопропилэтиламин, карбонат калия, гидроксид калия и т.п.
В качестве растворителя включен тетрагидрофуран, 1,4-диоксан, ацетонитрил, дихлорметан, N, N-диметилформамид и т.п., а также включена их смесь. Температура реакции обычно составляет от приблизительно 0 до 100 °С, и время реакции обычно составляет от приблизительно 0,5 до 24 часов.
[0133] (В случае использования реакции Мицунобу)
Данная стадия представляет собой стадию получения соединения (A-III) из соединения (A-II) с применением соответствующего спирта в присутствии фосфина и сложного эфира азодикарбоновой кислоты или диазодикарбоксамида.
Примеры фосфина включают трифенилфосфин, три-н-бутилфосфин и т.п.
Примеры азодикарбоксилата или диазодикарбоксамида включают диэтилазодикарбоксилат, ди-трет-бутилазодикарбоксилат, 1,1’-(азодикарбонил)дипиридин и т.п.
В качестве растворителя включены тетрагидрофуран, 1,4-диоксан, толуол и т.п., а также включена их смесь. Температура реакции обычно составляет от приблизительно 0 до 100 °С, и время реакции обычно составляет от приблизительно 0,5 до 24 часов.
[0134] [Способ B]
Способ B представляет собой способ получения соединения (B-III) (соединения, соответствующего соединению (A-I), использованному в способе A). Если R1 представляет собой метильную группу, то соединение (B-III) может быть получено без осуществления указанных стадий.
[0135]
[Химическая формула 27]
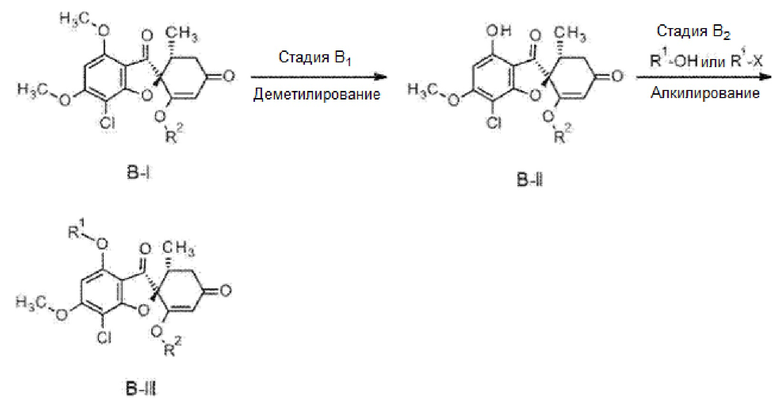
[0136] [В данной формуле R1 и R2 имеют такое же значение, как в случае соединения описанной выше общей формулы (1) или (1’), и X имеет такое же значение, как описано выше].
[0137] (Стадия B1) Стадия деметилирования
Данная стадия представляет собой стадию получения соединения (B-II) из соединения (B-I) с применением галогенида металла.
Примеры галогенида металла включают йодид магния и т.п.
Примеры растворителя включают толуол, тетрагидрофуран, 1,4-диоксан и т.п., или он может содержать их смесь.
Температура реакции обычно составляет от приблизительно 60 до 120 °С, и время реакции обычно составляет от приблизительно 0,5 до 24 часов.
[0138] (Стадия B2) Стадия алкилирования
Данная стадия представляет собой стадию получения соединения (B-III) из соединения (B-II). Ее можно осуществлять способом, подобным (стадии A2).
[0139] [Способ C]
Способ C представляет собой способ получения соединения (C-III) согласно настоящему изобретению из соединения (C-I) (соединения, соответствующего соединению (A-II), использованному в способе A).
[0140]
[Химическая формула 28]
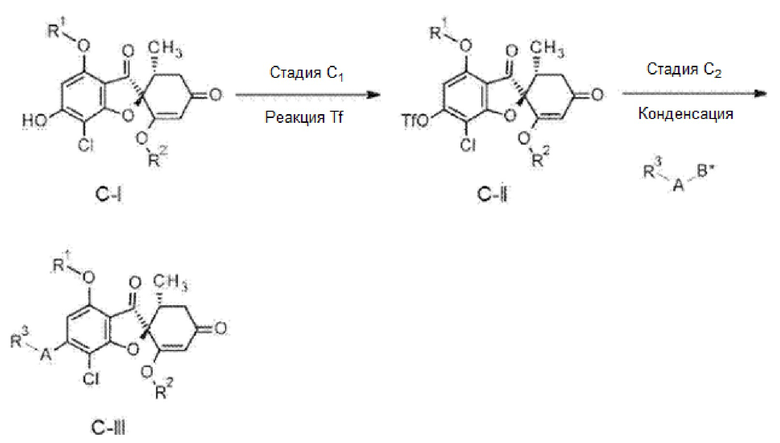
[0141] [В данной формуле R1, R2, R3 и A имеют такое же значение, как в случае соединения описанной выше общей формулы (1) или (1’). Tf означает трифторметансульфонильную группу, B* означает бороновую кислоту или пинаколовый эфир бороновой кислоты, или т.п.].
[0142] (Стадия C1) Стадия трифторметансульфонилирования
Данная стадия представляет собой стадию получения соединения (C-II) из соединения (C-I) в присутствии основания с применением трифторметансульфонилирующего реагента.
Примеры трифторметансульфонилирующего реагента включают ангидрид трифторметансульфоновой кислоты, хлорангидрид трифторметансульфоновой кислоты, N-фенилбис(трифторметансульфонимид) и т.п.
Примеры основания включают триэтиламин, диизопропилэтиламин и т.п.
Растворитель может включать, например, тетрагидрофуран, 1,4-диоксан, ацетонитрил, дихлорметан и т.п., и он может содержать их смесь.
Температура реакции обычно составляет от приблизительно минус 20 °С до комнатной температуры, и время реакции обычно составляет от приблизительно 0,5 до 24 часов.
[0143] (Стадия C2) Стадия осуществления реакции сочетания с применением катализатора на основе переходного металла
Данная стадия представляет собой стадию получения соединения (C-III) из соединения (C-II) с применением палладиевого катализатора и бороновой кислоты или пинаколового эфира бороновой кислоты R3-A в присутствии основания.
Примеры палладиевого катализатора включают тетракис(трифенилфосфин)палладий, [1,1’-бис(дифенилфосфино)ферроцен]дихлорпалладий, трис(дибензилиденацетон)дипалладий, ацетат палладия, ацетилацетонат палладия, бис(трифенилфосфин)палладия дихлорид и т.п.
Примеры основания включают триэтиламин, диизопропилэтиламин, 1,8-диазабицикло[5.4.0]-7-ундецен (DBU), 1,5-диазабицикло[4.3.0]-5-нонен (DBN), гидрокарбонат калия, бикарбонат натрия, карбонат калия, карбонат натрия, гидроксид калия, гидроксид натрия, фосфат калия, фосфат натрия и т.п.
В качестве примеров растворителя могут быть включены метанол, этанол, тетрагидрофуран, 1,4-диоксан, вода, N, N-диметилформамид, диметилсульфоксид, толуол и т.п. Может быть включена их смесь.
Температура реакции обычно составляет от приблизительно 60 до 120 °С, и время реакции обычно составляет от приблизительно 0,5 до 12 часов.
[0144] [Способ D]
Способ D представляет собой способ получения соединения (D-IV) согласно настоящему изобретению из соединения (D-I) (соединения, соответствующего соединению (C-II), использованному в способе C).
[0145]
[Химическая формула 29]
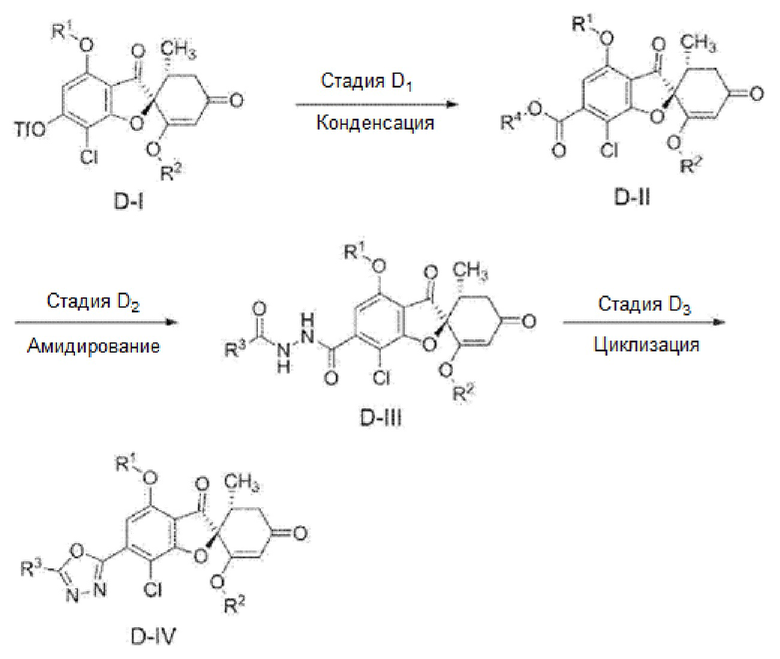
[0146] [В данной формуле R1, R2 и R3 имеют такое же значение, как в случае соединения описанной выше общей формулы (1) или (1’). Tf имеет такое же значение, как описано выше, и R4 означает фенильную группу, необязательно имеющую заместитель].
[0147] (Стадия D1) Стадия сочетания с формиатным эфиром
Данная стадия представляет собой стадию получения соединения (D-II) из соединения (D-I) с применением формиатного эфира в присутствии основания и палладиевого катализатора (с фосфиновым лигандом).
Примеры основания включают триэтиламин, диизопропилэтиламин, диметиламинопиридин, карбонат калия, карбонат натрия, гидроксид калия, гидроксид натрия и т.п.
Примеры формиатного эфира включают фенилформиат, (2,4,6-трихлорфенил)формиат и т.п.
Примеры палладиевого катализатора включают ацетат палладия, ацетилацетонат палладия, трифторацетат палладия, дихлорид палладия, трис(дибензилиденацетон)дипалладий, бис(трифенилфосфин)палладия дихлорид и т.п.
Примеры фосфинового лиганда для применения одновременно с палладиевым катализатором могут включать 4,5-бис(дифенилфосфино)-9,9-диметилксантен (xantphos), 1,l’-бис(дифенилфосфино)ферроцен (dppf), 2,2’-бис(дифенилфосфино)-1,1-бинафтил (BINAP), бис(дифенилфосфино)метан (DPPM), трифенилфосфин, 1,2-бис(дифенилфосфино)этан (DPPE) и т.п.
Примеры растворителя включают N, N-диметилформамид, толуол, тетрагидрофуран, ацетонитрил и т.п., и включена их смесь.
Температура реакции обычно составляет от приблизительно комнатной температуры до 120 °С, и время реакции обычно составляет от приблизительно одного до восьми часов.
[0148] (Стадия D2) Стадия осуществления амидирования с применением ацилгидразина
Данная стадия представляет собой стадию получения соединения (D-III) из соединения (D-II) с применением соответствующего ацилгидразина в присутствии основания.
Примеры основания включают триэтиламин, диизопропилэтиламин, диметиламинопиридин, карбонат калия, карбонат натрия, гидроксид калия, гидроксид натрия и т.п. В качестве добавки для облегчения реакции могут быть преимущественными N-гидроксисукцинимид (HOSu), 1-гидроксибензотриазол (HOBt), 1-гидрокси-7-азабензотриазол (HOAt) или т.п.
Примеры растворителя включают N, N-диметилформамид, дихлорметан, тетрагидрофуран, ацетонитрил и т.п., и включена их смесь.
Температура реакции обычно составляет от приблизительно 0 до 60 °С, и время реакции обычно составляет от приблизительно 1 до 12 часов.
[0149] (Стадия D3) Стадия образования кольца
Данная стадия представляет собой стадию получения соединения (D-IV) из соединения (D-III) с применением дегидратирующего агента.
Примеры дегидратирующего агента включают внутреннюю соль гидроксида (метоксикарбонилсульфамоил)триэтиламмония, фосфорилхлорид, полифосфорную кислоту, серную кислоту, трифенилфосфин/йод, янтарную кислоту, тозилат, тозилхлорид и т.п.
Примеры растворителя включают толуол, ацетонитрил, дихлорметан и т.п., а смешанный растворитель, как таковой, и нерастворитель включены.
Температура реакции обычно составляет от приблизительно 0 до 100 °С, и время реакции обычно составляет от приблизительно 0,5 до 24 часов.
[0150] [Способ E]
Способ E представляет собой способ получения соединения (E-III) согласно настоящему изобретению из соединения (E-I) (соединения, соответствующего соединению (D-II), использованному в способе D).
[0151] [Химическая формула 30]

[0152] [В данной формуле R1, R2 и R3 имеют такое же значение, как в случае соединения описанной выше общей формулы (1) или (1’), и R4 имеет такое же значение, как описано выше].
[0153] (Стадия E1) Стадия осуществления ацилирования с применением амидоксима
Данная стадия представляет собой стадию получения соединения (E-II) из соединения (E-I) с применением соответствующего амидоксима в присутствии основания.
Примеры основания включают триэтиламин, диизопропилэтиламин, диметиламинопиридин, карбонат калия, карбонат натрия, гидроксид калия, гидроксид натрия и т.п., и в качестве добавки для облегчения реакции преимущественным может быть N-гидроксисукцинимид (HOSu), 1-гидроксибензотриазол (HOBt), 1-гидрокси-7-азабензотриазол (HOAt) или т.п.
Примеры растворителя включают N, N-диметилформамид, дихлорметан, тетрагидрофуран, ацетонитрил и т.п., и включена их смесь.
Температура реакции обычно составляет от приблизительно комнатной температуры до 80 °С, и время реакции обычно составляет от приблизительно 1 до 12 часов.
[0154] (Стадия E2) Стадия образования кольца
Данная стадия представляет собой стадию получения соединения (E-III) посредством перемешивания соединения (E-II) в растворителе при комнатной температуре или при нагревании.
Примеры растворителя включают толуол, N, N-диметилформамид, дихлорметан, тетрагидрофуран, ацетонитрил и т.п., и включена их смесь.
Температура реакции обычно составляет от приблизительно комнатной температуры до 100 °С, и время реакции обычно составляет от приблизительно 0,5 до 24 часов.
[0155] [Способ F]
Способ F представляет собой способ получения соединения (F-V) согласно настоящему изобретению из соединения (F-I) (соединения, соответствующего соединению (C-II), использованному в способе C).
[0156]
[Химическая формула 31]
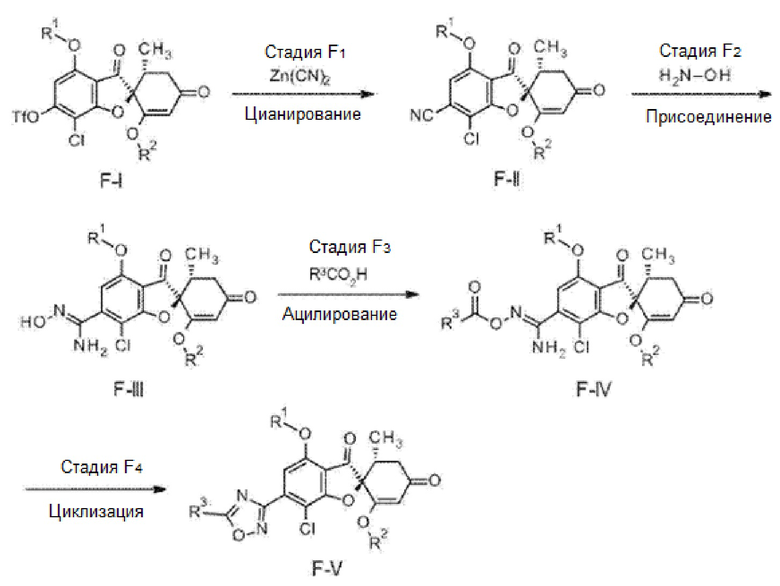
[0157] [В данной формуле R1, R2 и R3 имеют такое же значение, как в случае соединения описанной выше общей формулы (1) или (1’), и Tf имеет такое же значение, как описано выше].
[0158] (Стадия F1) Стадия осуществления цианирования с применением катализатора на основе переходного металла
Данная стадия представляет собой стадию получения соединения (F-II) из соединения (F-I) в присутствии или в отсутствие фосфина и в присутствии цианида цинка и палладиевого катализатора.
Примеры палладиевого катализатора включают трис(дибензилиденацетон)дипалладий, бис[три(трет-бутил)фосфин]палладий, тетракис(трифенилфосфин)палладий, бис(трифторацетокси)палладий и т.п.
Примеры фосфина включают трифенилфосфин, три(трет-бутил)фосфин, три-о-толуилфосфин, дифенилфосфиноферроцен, дифенилфосфинобутан и т.п. Примеры растворителя включают N-метил-2-пирролидон, N, N-диметилформамид и т.п., и включена их смесь.
Температура реакции обычно составляет от приблизительно 80 до 120 °С, и время реакции обычно составляет от приблизительно одного до восьми часов.
[0159] (Стадия F2) Стадия присоединения гидроксиламина
Данная стадия представляет собой стадию получения соединения (F-III) из соединения (F-II) с применением гидроксиламина.
Примеры растворителя включают метанол, этанол, диметилсульфоксид, воду и т.п., и включена смесь указанных растворителей.
Температура реакции обычно составляет от приблизительно комнатной температуры до 100 °С, и время реакции обычно составляет от приблизительно 0,5 до 24 часов.
[0160] (Стадия F3) Стадия ацилирования оксима
Данная стадия представляет собой стадию получения соединения (F-IV) из соединения (F-III) в присутствии конденсирующего агента и основания с применением соответствующей карбоновой кислоты.
Примеры конденсирующего агента включают O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония гексафторфосфат (HATU), 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолин (DMT-MM), 1-(3-диметиламинопропил)-3-этилкарбодиимид (WSC или EDCI) и т.п.
Примеры основания включают триэтиламин, диизопропилэтиламин, диметиламинопиридин и т.п.
В качестве добавки для облегчения реакции могут быть преимущественными N-гидроксисукцинимид (HOSu), 1-гидроксибензотриазол (HOBt), 1-гидрокси-7-азабензотриазол (HOAt) или т.п.
Примеры растворителя могут включать этанол, тетрагидрофуран, ацетонитрил, N, N-диметилформамид, дихлорметан, толуол и т.п., и может быть включена смесь указанных растворителей.
Температура реакции обычно составляет от приблизительно комнатной температуры до 60 °С, и время реакции обычно составляет от приблизительно 0,5 до 24 часов.
[0161] (Стадия F4) Стадия образования кольца
Данная стадия представляет собой стадию получения соединения (F-V) посредством перемешивания соединения (F-IV) в растворителе при комнатной температуре или при нагревании.
Примеры растворителя могут включать толуол, N, N-диметилформамид, дихлорметан, тетрагидрофуран, ацетонитрил и т.п., и включена их смесь.
Температура реакции обычно составляет от приблизительно 60 до 120 °С, и время реакции обычно составляет от приблизительно 0,5 до 24 часов.
[0162] [Способ G]
Способ G представляет собой способ получения соединения (G-III) согласно настоящему изобретению из соединения (G-I).
[0163] [Химическая формула 32]
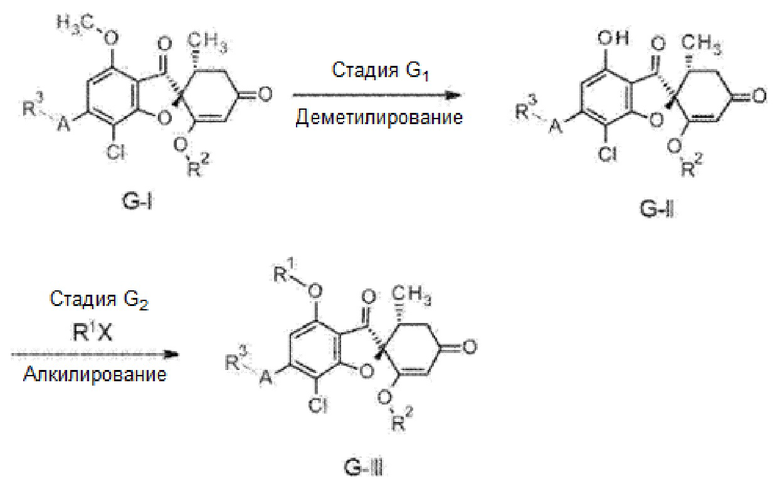
[0164] [В данной формуле R1, R2 и R3 имеют такое же значение, как в случае соединения описанной выше общей формулы (1) или (1’), и X имеет такое же значение, как описано выше].
[0165] (Стадия G1) Стадия деметилирования
Данная стадия представляет собой стадию получения соединения (G-II) из соединения (G-I). Ее можно осуществлять способом, подобным (стадии B1).
[0166] (Стадия G2) Стадия алкилирования
Данная стадия представляет собой стадию получения соединения (G-III) из соединения (G-II). Ее можно осуществлять способом, подобным (стадии A2).
[0167] [Способ H]
Способ H представляет собой способ получения соединения (H-II) согласно настоящему изобретению посредством снятия защитной группы, если R1 или R3 в соединении (H-I) содержит защитную группу.
[0168] [Химическая формула 33]

[0169] [В данной формуле R1, R2, R3 и A имеют такое же значение, как в случае соединения описанной выше общей формулы (1) или (1’), и R1’ и R3’ означают защищенные группы R1 и R3, соответственно].
[0170] (Стадия H1) Стадия снятия защиты
(В случае тетрагидропиранила (THP))
Данная стадия представляет собой стадию получения соединения (H-II) из соединения (H-I), содержащего гидрокси-группу, защищенную тетрагидропиранильной группой, с применением кислоты.
Примеры кислоты включают соляную кислоту, серную кислоту, смесь соляной кислоты и метанола, смесь соляной кислоты и 1,4-диоксана, смесь соляной кислоты и этилацетата, уксусную кислоту, п-толуолсульфоновую кислоту или п-толуолсульфонат пиридиния.
Примеры растворителя включают метанол, этанол, тетрагидрофуран, воду, их смесь и т.п.
Температура реакции обычно составляет от приблизительно 0 до 80 °С, и время реакции обычно составляет от приблизительно 0,5 до 24 часов.
[0171] (В случае силильной группы)
Данная стадия представляет собой стадию получения соединения (H-II) из соединения (H-I), содержащего гидрокси-группу, защищенную силильной группой, с применением десилилирующего реагента.
Примеры десилилирующего реагента включают кислоту или фторид тетрабутиламмония (TBAF), фтороводород, фтороводород-пиридин и т.п.
Примеры кислоты могут включать соляную кислоту, серную кислоту, смесь соляной кислоты и метанола, смесь соляной кислоты и 1,4-диоксана, смесь соляной кислоты и этилацетата, уксусную кислоту, п-толуолсульфоновую кислоту, трифторуксусную кислоту и т.п., и она также может реагировать в каталитическом количестве.
Примеры растворителя могут включать метанол, этанол, тетрагидрофуран, 1,2-диметоксиэтан, 1,4-диоксан, ацетонитрил, воду и т.п., и может быть включена их смесь.
Температура реакции обычно составляет от приблизительно 0 до 60 °С, и время реакции обычно составляет от приблизительно 0,5 до 24 часов.
[0172] [Способ I]
Способ I представляет собой способ получения соединения (I-IV) согласно настоящему изобретению из соединения (I-I) (соединения, соответствующего соединению (D-II), использованному в способе D).
[0173] [Химическая формула 34]
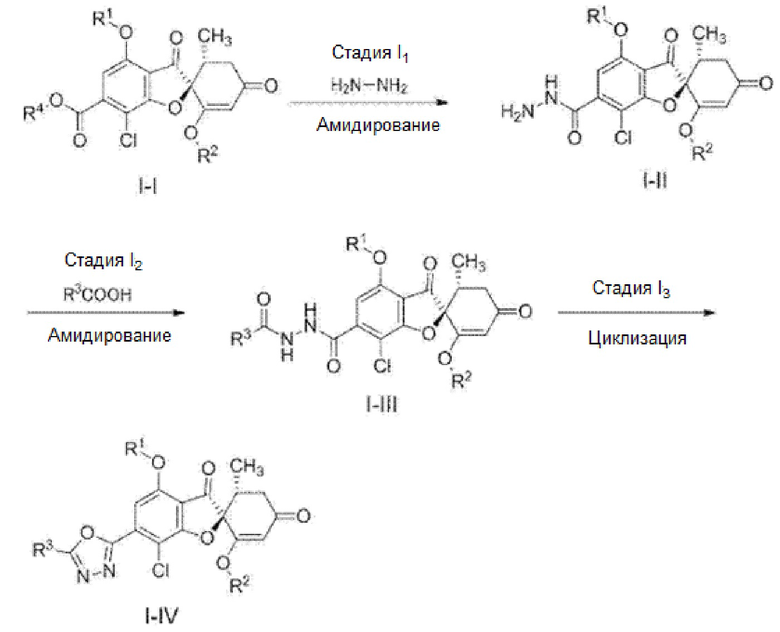
[0174] [В данной формуле R1, R2 и R3 имеют такое же значение, как в случае соединения описанной выше общей формулы (1) или (1’), и R4 имеет такое же значение, как описано выше].
[0175] (Стадия I1) Стадия осуществления амидирования с применением гидразина
Данная стадия представляет собой стадию получения соединения (I-II) из соединения (I-I) с применением гидразина в присутствии основания.
Примеры основания включают триэтиламин, диизопропилэтиламин, диметиламинопиридин, карбонат калия, карбонат натрия, гидроксид калия, гидроксид натрия и т.п. В качестве добавки для облегчения реакции могут быть преимущественными N-гидроксисукцинимид (HOSu), 1-гидроксибензотриазол (HOBt), 1-гидрокси-7-азабензотриазол (HOAt) или т.п.
Примеры растворителя могут включать N, N-диметилформамид, дихлорметан, тетрагидрофуран, ацетонитрил и т.п., и включена их смесь.
Температура реакции обычно составляет от приблизительно 0 до 30 °С, и время реакции обычно составляет от приблизительно 1 до 24 часов.
[0176] (Стадия I2) Стадия ацилирования ацилгидразина
Данная стадия представляет собой стадию получения соединения (I-III) из соединения (I-II) в присутствии конденсирующего агента и основания с применением соответствующей карбоновой кислоты.
Примеры конденсирующего агента включают O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония гексафторфосфат (HATU), 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолин (DMT-MM), 1-(3-диметиламинопропил)-3-этилкарбодиимид (WSC или EDCI) и т.п.
Примеры основания включают триэтиламин, диизопропилэтиламин, диметиламинопиридин и т.п.
В качестве добавки для облегчения реакции могут быть преимущественными N-гидроксисукцинимид (HOSu), 1-гидроксибензотриазол (HOBt), 1-гидрокси-7-азабензотриазол (HOAt) или т.п.
Примеры растворителя могут включать этанол, тетрагидрофуран, ацетонитрил, N, N-диметилформамид, дихлорметан, толуол и т.п., и может быть включена смесь указанных растворителей.
Температура реакции обычно составляет от приблизительно комнатной температуры до 60°С, и время реакции обычно составляет от приблизительно 0,5 до 24 часов.
[0177] (Стадия D3) Стадия образования кольца
Данная стадия представляет собой стадию получения соединения (I-IV) из соединения (I-III). Ее можно осуществлять способом, подобным (стадии D3).
[0178] [Способ J]
Способ J представляет собой способ получения соединения (J-V) согласно настоящему изобретению из соединения (J-I) (соединения, соответствующего соединению (C-II), использованному в способе C).
[0179] [Химическая формула 35]
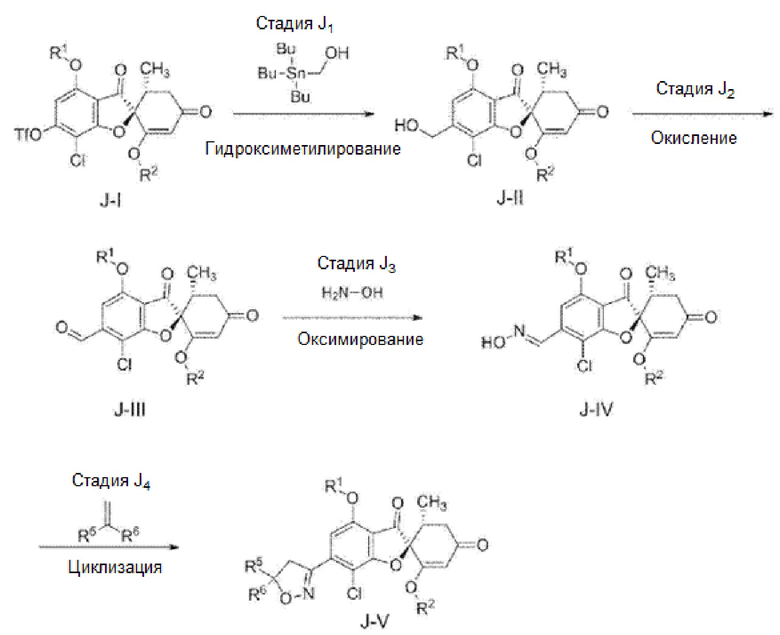
[0180] [В данной формуле R1 и R2 имеют такое же значение, как в случае соединения описанной выше общей формулы (1) или (1’), и R5 и R6, каждый независимо, означают водород, C1-C6 алкильную группу или 5-7-членное ненасыщенное гетероциклическое кольцо, 4-7-членное насыщенное гетероциклическое кольцо или C3-C6 циклоалкильное кольцо, в котором они оба связаны друг с другом].
[0181] (Стадия J1) Стадия осуществления гидроксиметилирования с применением катализатора на основе переходного металла
Данная стадия представляет собой стадию получения соединения (J-II) из соединения (J-I) с применением трибутилстаннилметанола в присутствии или в отсутствие фосфина и в присутствии палладиевого катализатора.
Примеры палладиевого катализатора включают тетракис(трифенилфосфин)палладий, дихлорид бис(трифенилфосфин)палладия (II) и т.п.
Примеры фосфина включают трифенилфосфин, три-о-толилфосфин и т.п.
Примеры растворителя могут включать 1,4-диоксан, этанол или N, N-диметилформамид и т.п., и включена их смесь.
Температура реакции обычно составляет от приблизительно 80 до 120 °С, и время реакции обычно составляет от приблизительно 1 до 24 часов.
[0182] (Стадия J2) Стадия окисления спирта
Данная стадия представляет собой стадию получения соединения (J-III) посредством взаимодействия соединения (J-II) с окислительным агентом.
Примеры окислительного агента включают периодинан Десс-Мартина, диметилсульфоксид, хромовую кислоту и т.п.
Примеры растворителя включают дихлорметан, ацетонитрил и т.п.
Температура реакции обычно составляет от приблизительно минус 20 °С до 40 °С, и время реакции обычно составляет от приблизительно 0,5 до 24 часов.
[0183] (Стадия J3) Стадия оксимирования
Данная стадия представляет собой стадию получения соединения (J-IV) из соединения (J-III) с применением гидроксиламина или его гидрохлорида в присутствии или в отсутствие основания.
Примеры основания включают ацетат натрия, гидроксид натрия, бикарбонат натрия, карбонат калия, пиридин и т.п.
Примеры растворителя включают метанол, этанол, воду и т.п., и включена их смесь.
Температура реакции обычно составляет от приблизительно комнатной температуры до 100°С, и время реакции обычно составляет от приблизительно 1 до 24 часов.
[0184] (Стадия J4) Стадия образования кольца
Данная стадия представляет собой стадию получения соединения (J-V) из соединения (J-IV) с применением хлорирующего реагента в присутствии или в отсутствие основания.
Примеры основания включают триэтиламин, диизопропилэтиламин, пиридин, 1,8-диазабицикло[5.4.0]-7-ундецен (DBU) и т.п.
Примеры хлорирующего реагента включают N-хлорсукцинимид (NCS), гипохлорит натрия, трет-бутилгипохлорит и т.п.
Примеры растворителя включают N, N-диметилформамид, дихлорметан, хлороформ, тетрагидрофуран, 1,4-диоксан, ацетонитрил, воду и т.п., и включена их смесь.
Температура реакции обычно составляет от приблизительно минус 20 до 40°С, и время реакции обычно составляет от приблизительно 1 до 24 часов.
[0185] [Способ K]
Способ K представляет собой способ получения соединения (K-II) согласно настоящему изобретению посредством алкилирования R1’ или R3’ в соединении (K-I).
[0186] [Химическая формула 36]
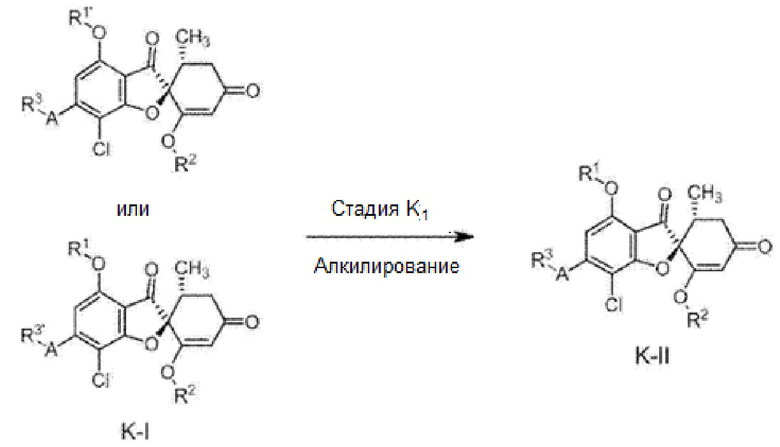
[0187] [В данной формуле R1, R2, R3 и A имеют такое же значение, как в случае соединения описанной выше общей формулы (1) или (1’), и R1’ и R3’, каждый независимо, означают C1-C6 алкильную группу, которая имеет заместитель, содержащий атом водорода или активный атом водорода, такой как гидроксильная группа или аминогруппа].
[0188] (Стадия K1) Стадия алкилирования
(При использовании галогенированного алкила)
Данная стадия представляет собой стадию получения соединения (K-II) из соединения (K-I). Ее можно осуществлять способом, подобным (стадии A2).
(При использовании реакции восстановительного аминирования)
Данная стадия представляет собой стадию получения соединения (K-II) посредством взаимодействия соединения (K-I) с соответствующим альдегидом в присутствии или в отсутствие кислоты с применением восстановительного агента.
Примеры восстановительного агента включают триацетоксиборгидрид натрия, цианоборгидрид натрия и т.п.
Примеры кислоты могут включать уксусную кислоту, тетраизопропилортотитанат, хлорид цинка и т.п.
Примеры растворителя включают метанол, ацетонитрил, воду, тетрагидрофуран, дихлорметан и т.п., и может быть включена их смесь. Температура реакции обычно составляет от приблизительно 0 до 80 °С, и время реакции обычно составляет от приблизительно 0,5 до 24 часов.
[0189] Соединения, полученные описанными выше способами, могут быть выделены и очищены известными способами, такими как экстракция, осаждение, перегонка, хроматография, фракционная перекристаллизация и перекристаллизация.
Кроме того, если соединение или промежуточное соединение синтеза содержит асимметричный атом углерода, то существуют оптические изомеры. Каждый из них может быть выделен и очищен обычным способом, таким как фракционная перекристаллизация (разделение солей), в ходе которой указанные оптические изомеры подвергают перекристаллизации посредством превращения в соответствующие соли и колоночной хроматографии. В качестве справочного документа, где описан способ выделения оптического изомера из рацематов, может быть включена публикация J. Jacques et al., “Enantiomers, Racemates and Resolution, John Wiley And Sons, Inc.”.
[0190] (Форма введения)
Введение можно осуществлять в любой форме перорального введения в виде таблетки, пилюли, капсулы, гранулы, порошка, раствора или т.п., или в любой форме парентерального введения в виде инъекции для внутрисуставного, внутривенного, внутримышечного или т.п. введения, в виде суппозиториев, глазных капель, глазной мази, трансдермального раствора, мази, трансдермального пластыря, трансмукозального раствора, трансмукозального пластыря, средства для ингаляции или т.п.
[0191] В качестве твердой композиции для перорального введения,
используют таблетку, порошок, гранулу и т.п. Такая твердая композиция состоит из одного или более активных ингредиентов и по меньшей мере одного инертного вспомогательного вещества, такого как лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, крахмал, поливинилпирролидон, метасиликат-алюминат магния и/или т.п. Твердая композиция может содержать, в соответствии с обычным способом, инертную добавку, такую как смазывающее вещество, такое как стеарат магния, разрыхлитель, такой как карбоксиметилкрахмал натрия, стабилизатор и солюбилизатор. Таблетка или пилюля при необходимости может быть покрыта сахарным покрытием или пленкой из вещества, растворимого в желудке или кишечнике.
[0192] В качестве жидкой композиции для перорального введения,
используют фармацевтически приемлемую эмульсию, раствор, суспензию, сироп, эликсир или т.п. К такой жидкой композиции можно добавлять традиционно используемый инертный разбавитель, такой как очищенная вода или этанол. Помимо инертного разбавителя, жидкая композиция может содержать солюбилизатор, адъювант, такой как смачивающий агент, подсластитель, вкусовой агент, ароматизатор и консервант.
[0193] В качестве инъекции для парентерального введения,
используют стерильный водный или неводный раствор, суспензию или эмульсию и т.п. Водный растворитель включает, например, дистиллированную воду для инъекций, физиологический солевой раствор и т.п. Неводные растворители включают, например, пропиленгликоль, полиэтиленгликоль и растительное масло, такое как оливковое масло, спирты, такие как этанол, полисорбат 80 и т.п. Такая композиция для инъекции может дополнительно содержать агент тоничности, консервант, смачивающий агент, эмульсию, диспергирующий агент, стабилизатор или солюбилизатор. Указанные композиции для инъекций можно стерилизовать, например, фильтрованием через фильтр, удерживающий бактерии, введением бактерицида или облучением. Кроме того, указанные композиции для инъекций можно использовать посредством получения стерильной твердой композиции и растворения или суспендирования в стерильной воде или в стерильном растворителе для инъекций перед применением.
[0194] В качестве препарата для наружного применения,
используют мазь, пластырь, крем, гель, горячий компресс, спрей, лосьон, глазные капли, глазную мазь и т.п. Такие препараты для наружного применения содержат традиционно используемые мазевые основы, основы для лосьонов, водные или неводные растворы, суспензии, эмульсии и т.п. Например, в качестве основы для мази или лосьона используют полиэтиленгликоль, пропиленгликоль, белый вазелин, белый пчелиный воск, полиоксиэтилен, гидрированное касторовое масло, моностеарат глицерина, стеариловый спирт, цетиловый спирт, лауромакрогол, сорбитансесквиолеат и т.п.
[0195] Трансмукозальный агент, такой как средство для ингаляции, и трансназальный агент используют в твердой, жидкой или полутвердой форме, и он может быть получен в соответствии с общеизвестным способом. Например, при необходимости можно добавлять известное вспомогательное вещество и, кроме того, регулятор рН, консервант, поверхностно-активное вещество, смазывающее вещество, стабилизатор, загуститель и т.п. Для таких трансмукозальных агентов в качестве способа введения можно использовать устройства, подходящие для ингаляции или инсуфляции. Например, предложенное соединение можно вводить отдельно или в виде порошковой или составленной в композицию смеси, или в виде раствора или суспензии в комбинации с фармацевтически приемлемым носителем, с применением известных устройств и небулайзеров, таких как устройства для ингаляции отмеренных доз. Также можно использовать устройство для ингаляции сухого порошка или т.п. для однократного или многократного введения, и сухой порошок или капсулу, содержащую порошок. Альтернативно, можно использовать подходящий эжектор. Например, он может быть в форме аэрозольного спрея под давлением или т.п., полученным с применением подходящего газа, такого как хлорфторалкан, гидрофторалкан или диоксид углерода.
[0196] (Схема введения доз)
В случае обычного перорального введения соответствующая суточная доза составляет от приблизительно 0,001 до 100 мг/кг, предпочтительно от 0,1 до 30 мг/кг, и более предпочтительно от 0,1 до 10 мг/кг массы тела. Ее вводят в одной дозе или делят на две или более доз. При внутривенном введении соответствующая суточная доза составляет от приблизительно 0,0001 до 10 мг/кг массы тела, которую вводят однократно или делят на несколько раз в сутки.
Кроме того, в качестве трансмукозального агента вводят от приблизительно 0,001 до 100 мг/кг массы тела однократно или делят на несколько раз в сутки. Дозу соответствующим образом определяют в зависимости от конкретного случая, с учетом симптомов, возраста, пола и т.п.
[0197] (Комбинированное применение)
Согласно настоящему изобретению, средство можно использовать в комбинациии с различными терапевтическими агентами или профилактическими агентами для лечения заболеваний, против которых они считаются эффективными. Комбинацию можно вводить одновременно, раздельно и непрерывно или с необходимыми интервалами времени. Совместно вводимые лекарственные формы могут быть смешаны или составлены по отдельности, даже если это агент для компаундирования.
[0198] (Пример лекарственной формы 1) Порошок
Порошок получали смешиванием 5 г соединения согласно настоящему изобретению или его соли, 895 г лактозы и 100 г кукурузного крахмала в смесителе.
(Пример лекарственной формы 2) Гранула
После смешивания 5 г соединения согласно настоящему изобретению или его соли, 865 г лактозы и 100 г гидроксипропилцеллюлозы с низкой степенью замещения, добавляли 300 г 10% водного раствора гидроксипропилцеллюлозы и вымешивали. Полученную смесь гранулировали с помощью экструзионного гранулятора и сушили с получением гранул.
(Пример лекарственной формы 3) Таблетка
После смешивания в смесителе 5 г соединения согласно настоящему изобретению или его соли, 90 г лактозы, 34 г кукурузного крахмала, 20 г кристаллической целлюлозы и 1 г стеарата магния, посредством таблетирования в таблетировочной машине получали таблетки.
[0199] Фармакологическую активность соединения согласно настоящему изобретению или его фармакологически приемлемой соли подтверждали следующим тестом.
[0200] (Пример теста) Тест принудительного плавания
Для испытания использовали самцов мышей ddY (возрастом 4 недели на момент оценки) в группах по 10 мышей. Мышей помещали в ванну с водой (внутренний диаметр 14,5 см, высота 20 см, температура воды приблизительно 24 °С) при высоте наполнения водой приблизительно 15 см, и проводили испытание плавания в течение 15 минут (тренировочное испытание). На следующий день мышам перорально вводили суспензию каждого соединения (10 мл/кг, растворитель: 0,5% водный раствор метилцеллюлозы), и спустя четыре часа их помещали в ванну с водой. Сразу после этого в течение шести минут измеряли время неподвижности (с) и рассчитывали отношение среднего времени неподвижности для каждой группы введения соединения к среднему времени неподвижности в контрольной группе (введение 10 мл/кг 0,5% водного раствора метилцеллюлозы без соединения).
[0201] [Таблица 1]
[0202] Результаты данного теста свидетельствуют о сокращении среднего времени неподвижности по сравнению с контрольной группой для каждой группы введения соединения, использованной в данном испытании, и данный тест может подтвердить эффект соединения согласно настоящему изобретению.
В соответствии с результатами теста, было показано, что соединение согласно настоящему изобретению или его фармакологически приемлемая соль эффективны для предупреждения и/или лечения воспалительных заболеваний центральной нервной системы, таких как болезнь Альцгеймера, болезнь Паркинсона, деменция с тельцами Леви, множественная системная атрофия, болезнь Пика, прогрессирующий надъядерный паралич, дегенерация коры головного мозга, дегенерация лобно-височной доли, болезнь Хантингтона, амиотрофический боковой склероз, спинальная и бульбарная мышечная атрофия, спинальная мышечная атрофия, спиноцеребеллярная дегенерация, рассеянный склероз, болезнь Крейтцфельдта-Якоба, фатальная семейная бессонница, синдром Герстманна-Штреусслера-Шейнкера, синдром Дауна, болезнь Ниманна-Пика, церебральная амилоидная ангиопатия, энцефлопатия на фоне ВИЧ, энцефалопатия на фоне гриппа, печеночная энцефалопатия, прогрессирующая многоочаговая лейкоэнцефалопатия, анти-NMDA-рецепторный энцефалит, церебро-сосудистые расстройства, травматические повреждения головного мозга, повреждения спинного мозга, гипоксическая энцефалопатия, эпилепсия, неврит зрительного нерва, врожденные метаболические заболевания головного мозга, энцефалопатия Вернике, расстройства аутического спектра, расстройства дефицита внимания/гиперактивности, тиковые расстройства, шизофрения, биполярные расстройства, большие депрессивные расстройства (устойчивая к лечению депрессия и послеродовая депрессия), устойчивые депрессивные расстройства (дистимическое расстройство), предменструальные дистимические расстройства, тревожные расстройства, фокальная фобия, панические расстройства, обсессивно-компульсивные расстройства, расстройства, связанные с эмоциональной травмой и стрессом, пищевые расстройства, нарушения суточного ритма сна/бодрствования, нарколепсия, расстройства, связанные с употреблением психоактивных веществ (алкогольная зависимость и наркотическая зависимость), расстройства контроля над побуждениями, бред, расстройства личности и синдром Ретта.
Примеры
[0203] Далее настоящее изобретение более подробно описано с помощью примеров, но объем настоящего изобретения не ограничен ими.
В следующих примерах спектры ядерного магнитного резонанса (далее 1H ЯМР) описаны с помощью значений δ (м.д.) в качестве значений химического сдвига с тетраметилсиланом в качестве стандартного вещества. Тип расщепления обозначен как с для синглета, д для дублета, т для триплета, к для квартета, м для мультиплета и ш для широкого сигнала.
[0204] (Пример 1)
(2S,5’R)-7-хлор-6-(2-гидроксиэтокси)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(1a)
(2S,5’R)-7-хлор-6-гидрокси-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-гидрокси-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(+)-Гризеофульвин ((2S,5’R)-7-хлор-3’,4,6-триметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион, CAS номер: 126-07-8, код продукта: G0384 (Tokyo Chemical Industry)) (50 г), йодид калия (23,5 г) и 18-краун-6-эфир (41,2 г) растворяли в пиридине (500 мл), смесь перемешивали при 120 °С в течение девяти часов и оставляли стоять при комнатной температуре в течение ночи.
Реакционную смесь концентрировали, добавляли 4% водный раствор бикарбоната натрия и дважды промывали смесь этилацетатом. Водный слой нейтрализовали 1 моль/л раствором соляной кислоты и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: дихлорметан/этанол=99/1 (об./об.)] с получением 19,4 г неочищенного продукта.
Затем добавляли этилацетат для получения твердого вещества и отфильтровывали с получением 15,2 г (выход: 32%) указанного в заголовке соединения в виде белого твердого вещества.
[0205] (1б)
(2S,5’R)-7-хлор-6-(2-гидроксиэтокси)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-(2-гидроксиэтокси)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-Хлор-6-гидрокси-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (0,1 г) из примера 1 (1a) растворяли в N, N-диметилформамиде (3 мл), добавляли 2-бромэтанол (0,0738 г) и карбонат калия (0,102 г) и перемешивали при 100°C в течение шести часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: этилацетат] с получением 38 мг (выход: 34%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
[0206] (Пример 2)
(2S,5’R)-7-хлор-3’,4-диметокси-6-(2-метоксиэтокси)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-(2-метоксиэтокси)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-гидрокси-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (30 мг) из примера 1 (1a) растворяли в N, N-диметилформамиде (1 мл), добавляли 2-бромэтилметиловый эфир (136 мг) и карбонат калия (135 мг) и перемешивали при 80 °С в течение шести часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия.
Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: этилацетат] с получением 20 мг (выход: 57%) указанного в заголовке соединения в виде белого твердого вещества.
[0207] (Пример 3)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(1-метилпиразол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(3a)
[(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-ил]трифторметансульфонат
[(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-ил]трифторметансульфонат
(2S,5’R)-7-хлор-6-гидрокси-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (20 г) из примера 1 (1a) растворяли в дихлорметане (300 мл), добавляли N-фенилбис(трифторметансульфонимид) (25,3 г) и триэтиламин (20,6 мл), и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционную смесь разбавляли дихлорметаном и промывали органический слой водой и насыщенным солевым раствором, и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=8/2-3/7 (об./об.)] с получением 23,5 г (выход: 85%) указанного в заголовке соединения в виде белого твердого вещества.
[0208] (3б)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(1-метилпиразол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(1-метилпиразол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
[(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-ил]трифторметансульфонат (76 мг) из примера 3 (3a) растворяли в N, N-диметилформамиде (1,6 мл) и добавляли 1-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (0,0403 г), карбонат калия (0,0669 г) и аддукт дихлорида [1,1’-бис(дифенилфосфино)ферроцен]палладия (II) с дихлорметаном (0,0131 г) при комнатной температуре и перемешивали при 80 °С в течение трех часов.
После снижения температуры реакции до комнатной температуры реакционную смесь разбавляли этилацетатом и отфильтровывали нерастворимые вещества. Фильтрат выливали в воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 27 мг (выход: 42%) указанного в заголовке соединения в виде белого твердого вещества.
[0209] (Пример 4)
(2S,5’R)-7-хлор-6-(1-этилпиразол-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-(1-этилпиразол-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
[(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-ил]трифторметансульфонат (0,5 г) из примера 3 (3a) растворяли в толуоле (10 мл) и добавляли 1-этил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (0,283 г), хлор(2-дициклогексилфосфино-2’,4’,6’-триизопропил-1,1’-бифенил)[2-(2’-амино-1,1’-бифенил)]палладий (II) (0,167 г) и насыщенный водный раствор бикарбоната натрия (5 мл) и перемешивали при 90 °С в течение двух часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 266 мг (выход: 60%) указанного в заголовке соединения в виде белого твердого вещества.
[0210] (Пример 5)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(5a)
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
[(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-ил]трифторметансульфонат (20 г) из примера 3 (3a) растворяли в толуоле (200 мл) и добавляли ацетат палладия (II) (0,477 г), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (2,46 г) и N, N-диизопропилэтиламин (14,8 мл) и нагревали до 80 °C. Тремя порциями добавляли 2,4,6-трихлорфенилформиат (12,5 г) каждые 30 минут.
После перемешивания при 80 °С в течение 30 минут, реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=7/3-3/7 (об./об.)] с получением 19,5 г (выход: 84%) указанного в заголовке соединения в виде белого твердого вещества.
[0211] (5б)
(2S,5’R)-N’-ацетил-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2S,5’R)-N’-ацетил-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (35 г) из примера 5 (5a) растворяли в дихлорметане (400 мл); добавляли 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (8,72 г), ацетогидразид (чистота: 90%, 7,12 г), 4-диметиламинопиридин (0,783 г) и триэтиламин (26,8 мл); и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционный раствор промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: метанол/этилацетат=0/10-1/9 (об./об.)] с получением 23,4 г (выход: 86%) указанного в заголовке соединения в виде белого твердого вещества.
[0212] (5в)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-N’-ацетил-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид (0,25 г) из примера 5 (5б) растворяли в толуоле (5 мл) и добавляли безводный 1,4-диоксан (5 мл), внутреннюю соль гидроксида (метоксикарбонилсульфамоил)триэтиламмония (0,169 г) и перемешивали смесь при 60 °С в течение одного часа.
К реакционной смеси добавляли воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 49 мг (выход: 20%) указанного в заголовке соединения в виде белого твердого вещества.
[0213] (Пример 6)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(3-метил-1,2,4-оксадиазол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(6a)
[(Z)-1-аминоэтилиденамино]-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
[(Z)-1-аминоэтилиденамино]-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
[0214] (2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (3 г) из примера 5 (5a) растворяли в дихлорметане (50 мл); добавляли N’-гидроксиэтанимидамид (0,488 г), 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (0,748 г), 4-диметиламинопиридин (0,0671 г) и триэтиламин (2,28 мл); и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционный раствор разбавляли этилацетатом и промывали органический слой водой и насыщенным солевым раствором, и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=80/20-0/100 (об./об.)] с получением 2,32 г (выход: количественный) указанного в заголовке соединения в виде белого твердого вещества.
[0215] (6б)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(3-метил-1,2,4-оксадиазол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(3-метил-1,2,4-оксадиазол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
[(Z)-1-аминоэтилиденамино]-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,95 г) из примера 6 (6a) растворяли в толуоле (20 мл) и перемешивали при 110°C в течение шести часов.
Остаток, полученный в результате концентрирования реакционного раствора, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=8/2-3/7 (об./об.)] и растирали с н-гексаном и этилацетатом с получением 756 мг (выход: 83%) указанного в заголовке соединения в виде белого твердого вещества.
[0216] (Пример 7)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил-1,2,4-оксадиазол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(7a)
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбонитрил
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбонитрил
[(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-ил]трифторметансульфонат (1 г) из примера 3 (3a) растворяли в N, N-диметилформамиде (10 мл), добавляли тетракис(трифенилфосфин)палладий (0) (0,245 г) и цианид цинка (0,499 г) и перемешивали смесь при 90 °С в течение пяти часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=8/2-3/7 (об./об.)] с получением 540 мг (выход: 73%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
[0217] (7б)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил-1,2,4-оксадиазол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил-1,2,4-оксадиазол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбонитрил (0,54 г) из примера 7 (7a) растворяли в этаноле (10 мл), добавляли 50% водный раствор гидроксиламина (0,19 мл) и перемешивали смесь при 90 °С в течение шести часов.
Реакционный раствор концентрировали и дважды подвергали азеотропной перегонке с толуолом. Остаток растворяли в дихлорметане (20 мл); добавляли уксусную кислоту (0,0891 мл), 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид (0,299 г), 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (0,0424 г) и триэтиламин (0,652 мл); и перемешивали смесь при комнатной температуре в течение пяти часов.
Реакционный раствор разбавляли дихлорметаном и промывали органический слой водой и насыщенным солевым раствором, и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, подвергали грубой очистке колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)]. Полученный неочищенный продукт суспендировали в толуоле (5 мл) и перемешивали при 100°С в течение семи часов.
К реакционной смеси добавляли воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=7/3-2/8 (об./об.)] с получением 34 мг (выход: 5,4%, три стадии) указанного в заголовке соединения в виде белого твердого вещества.
[0218] (Пример 8)
(2S,5’R)-7-хлор-6-[5-(1-гидрокси-1-метилэтил)-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(8a)
(2S,5’R)-7-хлор-N’-(2-гидрокси-2-метилпропаноил)-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2S,5’R)-7-хлор-N’-(2-гидрокси-2-метилпропаноил)-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2, 6’-циклогексен]-6-карбогидразид
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,5 г) из примера 5 (5a) растворяли в дихлорметане (10 мл); добавляли 2-гидрокси-2-метилпропаногидразид (0,162 г), 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (0,125 г), 4-диметиламинопиридин (0,0224 г) и триэтиламин (0,639 мл); и оставляли смесь стоять при комнатной температуре в течение ночи.
Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: метанол/этилацетат=0/10-1/9 (об./об.)] с получением 415 мг (выход: 97%) указанного в заголовке соединения в виде белого твердого вещества.
[0219] (8б)
(2S,5’R)-7-хлор-6-[5-(1-гидрокси-1-метилэтил)-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-[5-(1-гидрокси-1-метилэтил)-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-N’-(2-гидрокси-2-метилпропаноил)-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид (0,415 г) из примера 8 (8a) растворяли в дихлорметане (5 мл), добавляли триэтиламин (0,62 мл) и п-толуолсульфонилхлорид (0,254 г) и перемешивали смесь при комнатной температуре в течение двух часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: метанол/этилацетат=0/10-1/9 (об./об.)] с получением 141 мг (выход: 35%) указанного в заголовке соединения в виде белого твердого вещества.
[0220] (Пример 9)
(2S,5’R)-7-хлор-6-[5-[(1S)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(9a)
(2S)-2-тетрагидропиран-2-илоксипропангидразид
(2S)-2-тетрагидропиран-2-илоксипропангидразид
Метил-(2S)-2-тетрагидропиран-2-илоксипропаноат (регистрационный номер CAS: 153829-63-1, J. Org. Chem. 1991, 56, 1088-1093) (2,2 г) растворяли в этаноле (8 мл), добавляли моногидрат гидразина (1,8 г) и оставляли смесь стоять в течение ночи при комнатной температуре. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: метанол/этилацетат=0/10-1/9 (об./об.)] с получением 1,6 г (выход: 73%) указанного в заголовке соединения в виде белого твердого вещества.
[0221] (9б)
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксо-N’-[(2S)-2-тетрагидропиран-2-илоксипропаноил]спиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксо-N’-[(2S)-2-тетрагидропиран-2-илоксипропаноил]спиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2,4,6-тихлорфенил)-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,5 г) из примера 5 (5a) растворяли в дихлорметане (10 мл); добавляли (2S)-2-тетрагидропиран-2-илоксипропангидразид (0,258 г) из примера 9 (9a), 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (0,125 г), 4-диметиламинопиридин (0,0112 г) и N, N-диизопропилэтиламин (0,478 мл); и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционную смесь выливали в воду и нейтрализовали 1 моль/л раствором соляной кислоты, и экстрагировали реакционную смесь этилацетатом.
Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 490 мг (выход: количественный) указанного в заголовке соединения в виде белого твердого вещества.
[0222] (9в)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[5-[(1S)-1-тетрагидропиран-2-илоксиэтил]-1,3,4-оксадиазол-2-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[5-[(1S)-1-тетрагидропиран-2-илоксиэтил]-1,3,4-оксадиазол-2-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксо-N’-[(2S)-2-тетрагидропиран-2-илоксипропаноил]спиро[бензофуран-2,6’-циклогексен]-6-карбогидразид (0,49 г) из примера 9 (9б) растворяли в дихлорметане (5 мл), добавляли триэтиламин (0,637 мл) и п-толуолсульфонилхлорид (0,209 г) и перемешивали смесь при комнатной температуре в течение трех часов.
Реакционную смесь выливали в воду и нейтрализовали 1 моль/л раствором соляной кислоты, и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 452 мг (выход: 95%) указанного в заголовке соединения в виде белого твердого вещества.
[0223] (9г)
(2S,5’R)-7-хлор-6-[5-[(1S)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-[5-[(1S)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[5-[(1S)-1-тетрагидропиран-2-илоксиэтил]-1,3,4-оксадиазол-2-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (0,452 г) из примера 9 (9в) растворяли в этаноле (4 мл), добавляли воду (1 мл) и моногидрат п-толуолсульфоновой кислоты (0,0828 г) и перемешивали смесь при 50 °С в течение одного часа.
Реакционную смесь выливали в воду, добавляли 1 моль/л раствор соляной кислоты и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: метанол/этилацетат=0/1-1/19 (об./об.)] с получением 119 мг (выход: 31%) указанного в заголовке соединения в виде белого твердого вещества.
[0224] (Пример 10)
(2S,5’R)-7-хлор-6-[5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(10a)
(2R)-2-тетрагидропиран-2-илоксипропангидразид
(2R)-2-тетрагидропиран-2-илоксипропангидразид
Метил-(2R)-2-тетрагидропиран-2-илоксипропаноат (регистрационный номер CAS: 124508-74-3, Tetrahedron, 2012, 68, 2068-2073.) (1,6 г) растворяли в этаноле (8 мл), добавляли моногидрат гидразина (1,2 мл) и перемешивали смесь при 90 °С в течение четырех часов.
После стояния при комнатной температуре в течение ночи, смесь перемешивали при 90 °С в течение 10 часов. Затем смесь оставляли стоять при комнатной температуре в течение ночи, и затем перемешивали при 90 °С в течение 10 часов. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: метанол/этилацетат=0/1-1/9 (об./об.)] с получением 1 г (выход: 62%) указанного в заголовке соединения в виде белого твердого вещества.
[0225] (10б)
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксо-N’-[(2R)-2-тетрагидропиран-2-илоксипропаноил]спиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксо-N’-[(2R)-2-тетрагидропиран-2-илоксипропаноил]спиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,5 г) из примера 5 (5a) растворяли в дихлорметане (10 мл); добавляли (2R)-2-тетрагидропиран-2-илоксипропангидразид (0,19 г) из примера 10 (10a), 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (0,124 г), 4-диметиламинопиридин (0,0112 г) и N, N-диизопропилэтиламин (0,478 мл); и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционную смесь выливали в воду и нейтрализовали 1 моль/л раствором соляной кислоты, и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: метанол/этилацетат=0/10-1/9 (об./об.)] с получением 460 мг (выход: 94%) указанного в заголовке соединения в виде белого твердого вещества.
[0226] (10в)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[5-[(1R)-1-тетрагидропиран-2-илоксиэтил]-1,3,4-оксадиазол-2-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[5-[(1R)-1-тетрагидропиран-2-илоксиэтил]-1,3,4-оксадиазол-2-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксо-N’-[(2R)-2-тетрагидропиран-2-илоксипропаноил]спиро[бензофуран-2,6’-циклогексен]-6-карбогидразид (0,46 г) из примера 10 (10б) растворяли в дихлорметане (5 мл), добавляли триэтиламин (0,598 мл) и п-толуолсульфонилхлорид (0,196 г) и перемешивали смесь при комнатной температуре в течение двух часов.
Реакционную смесь выливали в воду и нейтрализовали 1 моль/л раствором соляной кислоты, и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 315 мг (выход: 71%) указанного в заголовке соединения в виде белого твердого вещества.
[0227] (10г)
(2S,5’R)-7-хлор-6-[5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-[5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-Хлор-3’,4-диметокси-5’-метил-6-[5-[(1R)-1-тетрагидропиран-2-илоксиэтил]-1,3,4-оксадиазол-2-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (0,315 г) из примера 10 (10в) растворяли в этаноле (4 мл) добавляли воду (1 мл) и моногидрат п-толуолсульфоновой кислоты (0,0577 г) и перемешивали смесь при 50 °С в течение одного часа.
Реакционную смесь выливали в воду, добавляли 1 моль/л раствор соляной кислоты и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: метанол/этилацетат=0/10-1/19 (об./об.)] с получением 112 мг (выход: 42%) указанного в заголовке соединения в виде белого твердого вещества.
[0228] (Пример 11)
(2S,5’R)-7-хлор-4-этокси-6-[5-(1-гидрокси-1-метилэтил)-1,3,4-оксадиазол-2-ил]-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(11a)
(2S,5’R)-7-хлор-4-гидрокси-6-[5-(1-гидрокси-1-метилэтил)-1,3,4-оксадиазол-2-ил]-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-гидрокси-6-[5-(1-гидрокси-1-метилэтил)-1,3,4-оксадиазол-2-ил]-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
Магний в форме стружек (0,41 г) добавляли в диэтиловый эфир (60 мл), и тремя порциями добавляли йод (3,9 г) каждые 20 минут. После перемешивания при комнатной температуре в течение одного часа, добавляли (2S,5’R)-7-хлор-6-[5-(1-гидрокси-1-метилэтил)-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (6,3 г) из примера 8 (8б) и толуол (150 мл), и перемешивали смесь при 90 °С в течение семи часов.
В реакционную смесь добавляли воду, и после нейтрализации с помощью 1 моль/л раствора солярной кислоты смесь делали слабощелочной, используя насыщенный водный раствор бикарбоната натрия, и экстрагировали реакционную смесь этилацетатом. Органический слой промывали 1 моль/л раствором соляной кислоты и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 2,7 г (выход: 44%) указанного в заголовке соединения в виде белого твердого вещества.
[0229] (11б)
(2S,5’R)-7-хлор-4-этокси-6-[5-(1-гидрокси-1-метилэтил)-1,3,4-оксадиазол-2-ил]-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-этокси-6-[5-(1-гидрокси-1-метилэтил)-1,3,4-оксадиазол-2-ил]-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-гидрокси-6-[5-(1-гидрокси-1-метилэтил)-1,3,4-оксадиазол-2-ил]-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (0,3 г) из примера 11 (11a) растворяли в N, N-диметилформамиде (4 мл); добавляли карбонат калия (0,191 г) и йодэтан (0,0827 мл); и перемешивали смесь при 80 °С в течение двух часов.
Реакционную смесь выливали в воду и нейтрализовали 1 моль/л раствором соляной кислоты, и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=6/4-1/9 (об./об.)] с получением 42 мг (выход: 13%) указанного в заголовке соединения в виде белого твердого вещества.
[0230] (Пример 12)
(2S,5’R)-7-хлор-4-этокси-6-[5-[(1S)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-этокси-6-[5-[(1S)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
Магний в форме стружек (0,073 г) добавляли в диэтиловый эфир (20 мл), добавляли небольшое количество йода (0,70 г) и перемешивали смесь при комнатной температуре в течение 10 минут. Затем тремя порциями добавляли йод (0,70 г) каждые 20 минут. После перемешивания при комнатной температуре в течение 30 минут, добавляли толуол (50 мл), (2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[5-[(1S)-1-тетрагидропиран-2-илоксиэтил]-1,3,4-оксадиазол-2-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (1,3 г) из примера 9 (9в) и перемешивали при 80 °С в течение восьми часов.
К реакционной смеси добавляли воду, реакционную смесь нейтрализовали 1 моль/л раствором соляной кислоты и экстрагировали реакционную смесь этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, растворяли в N, N-диметилформамиде (10 мл), добавляли карбонат калия (1,36 г) и йодэтан (0,485 мл) и перемешивали смесь при 80 °С в течение одного часа. Реакционную смесь выливали в воду и нейтрализовали 1 моль/л раствором соляной кислоты, и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=7/3-2/8 (об./об.)], и полученное твердое вещество растирали с н-гексаном и этилацетатом с получением 122 мг (выход: 13%) указанного в заголовке соединения в виде белого твердого вещества.
[0231] (Пример 13)
(2S,5’R)-7-хлор-6-[3-(1-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(13a)
2-тетрагидропиран-2-илоксипропаннитрил
2-тетрагидропиран-2-илоксипропаннитрил
2-гидроксипропаннитрил (5,0 г) растворяли в дихлорметане (150 мл), добавляли 3,4-дигидро-2H-пиран (7,7 г) и моногидрат п-толуолсульфоновой кислоты (1,3 г) и перемешивали смесь при комнатной температуре в течение 14 часов. После добавления в реакционный раствор триэтиламина, растворитель отгоняли при пониженном давлении, полученный остаток очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=97/3-7/3 (об./об.)] и получали указанное в заголовке соединение в виде двух типов диастереомеров, составивших 5,7 г (низкая полярность, выход: 52%) и 2,5 г (высокая полярность, выход: 23%), соответственно. Они представляли собой бледно-желтые твердые вещества.
[0232] (13б)
N’-гидрокси-2-тетрагидропиран-2-илоксипропанамидин
N’-гидрокси-2-тетрагидропиран-2-илоксипропанамидин
Диастереомер низкой полярности, 2-тетрагидропиран-2-илоксипропаннитрил (5,6 г), полученный в примере 13 (13a) растворяли в этаноле (36 мл), добавляли 50% водный раствор гидроксиламина (4,3 мл) и нагревали смесь до 80 °С, и перемешивали в течение пяти часов. После возврата к комнатной температуре отгоняли растворитель при пониженном давлении и очищали полученный остаток колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=10/1-0/1 (об./об.)] с получением 5,0 г (выход: 74%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
[0233] (13в)
[(Z)-(1-амино-2-тетрагидропиран-2-илоксипропилиден)амино]-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
[(Z)-(1-амино-2-тетрагидропиран-2-илоксипропилиден)амино]-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,5 г) из примера 5 (5a) растворяли в дихлорметане (10 мл); добавляли N’-гидрокси-2-тетрагидропиран-2-илоксипропанамидин (0,207 г) из примера 13 (13б), 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (0,125 г), 4-диметиламинопиридин (0,0112 г) и N, N-диизопропилэтиламин (0,478 мл); и перемешивали смесь при комнатной температуре в течение пяти часов.
Реакционную смесь выливали в воду и нейтрализовали 1 моль/л раствором соляной кислоты, и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 410 мг (выход: 83%) указанного в заголовке соединения в виде белого твердого вещества.
[0234] (13г)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[3-(1-тетрагидропиран-2-илоксиэтил)-1,2,4-оксадиазол-5-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[3-(1-тетрагидропиран-2-илоксиэтил)-1,2,4-оксадиазол-5-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
[(Z)-(1-амино-2-тетрагидропиран-2-илоксипропилиден)амино]-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,41 г) из примера 13 (13в) растворяли в толуоле (5 мл) и перемешивали при 110°C в течение семи часов.
Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-1/9 (об./об.)] с получением 375 мг (выход: 95%) указанного в заголовке соединения в виде белого твердого вещества.
[0235] (13д)
(2S,5’R)-7-хлор-6-[3-(1-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-[3-(1-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[3-(1-тетрагидропиран-2-илоксиэтил)-1,2,4-оксадиазол-5-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (0,375 г) из примера 13 (13г) растворяли в этаноле (4 мл), добавляли моногидрат п-толуолсульфоновой кислоты (0,0687 г) и воду (1 мл) и перемешивали смесь при комнатной температуре в течение восьми часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 195 мг (выход: 62%) указанного в заголовке соединения в виде белого твердого вещества.
[0236] (Пример 14)
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(14a)
(2S,5’R)-7-хлор-4-гидрокси-3’,6-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-гидрокси-3’,6-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
Магний в форме стружек (1,03 г) добавляли в диэтиловый эфир (50 мл), небольшими порциями добавляли йод (8,63 г) в течение одного часа. После перемешивания при комнатной температуре в течение 30 минут, добавляли толуол (100 мл) и (+)-гризеофульвин (10 г) и перемешивали смесь при 80 °С в течение трех часов.
К реакционной смеси добавляли воду, смесь нейтрализовали 1 моль/л раствором соляной кислоты и экстрагировали реакционную смесь этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 7,8 г (выход: 81%) указанного в заголовке соединения в виде белого твердого вещества.
[0237] (14б)
(2S,5’R)-7-хлор-3’,6-диметокси-5’-метил-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,6-диметокси-5’-метил-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-гидрокси-3’,6-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (5,1 г) из примера 14 (14a) растворяли в N, N-диметилформамиде (60 мл), добавляли 2-(2-бромэтокси)тетрагидро-2H-пиран (3,8 г) и карбонат калия (6,2 г) и перемешивали смесь при 80 °С в течение семи часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=8/2-3/7 (об./об.)] с получением 6,9 г (выход: 98%) указанного в заголовке соединения в виде белого твердого вещества.
[0238] (14в)
(2S,5’R)-7-хлор-6-гидрокси-3’-метокси-5’-метил-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-гидрокси-3’-метокси-5’-метил-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,6-диметокси-5’-метил-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (6,9 г) из примера 14 (14б) растворяли в пиридине (70 мл), добавляли 18-краун-6-эфир (4,3 г) и йодид калия (2,5 г) и перемешивали смесь при 120 °С в течение восьми часов.
Реакционный раствор концентрировали и выливали реакционную смесь в воду, и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 3,8 г (выход: 57%) указанного в заголовке соединения в виде белого твердого вещества.
[0239] (14г)
[(2S,5’R)-7-хлор-1’-метокси-5’-метил-3,3’-диоксо-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран- 2,6’-циклогексен]-6-ил] трифторметансульфонат
[(2S,5’R)-7-хлор-1’-метокси-5’-метил-3,3’-диоксо-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,6’-циклогексен]-6-ил] трифторметансульфонат
(2S,5’R)-7-хлор-6-гидрокси-3’-метокси-5’-метил-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (3,8 г) из примера 14 (14в) растворяли в дихлорметане (40 мл), добавляли триэтиламин (2,9 мл) и N-фенилбис(трифторметансульфонимид) (3,6 г) и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционный раствор разбавляли дихлорметаном и промывали органический слой водой и насыщенным солевым раствором, и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=8/2-4/6 (об./об.)] с получением 3,2 г (выход: 65%) указанного в заголовке соединения в виде белого твердого вещества.
[0240] (14д)
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’-метокси-5’-метил-3,3’-диоксо-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’-метокси-5’-метил-3,3’-диоксо-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
[(2S,5’R)-7-хлор-1’-метокси-5’-метил-3,3’-диоксо-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,6’-циклогексен]-6-ил]трифторметансульфонат (1 г) из примера 14 (14г) растворяли в толуоле (200 мл); добавляли ацетат палладия (II) (0,0192 г), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,0989 г) и N, N-диизопропилэтиламин (0,596 мл); и нагревали смесь до 80°C.
Тремя порциями добавляли 2,4,6-трихлорфенилформиат (0,501 г) каждые 10 минут. После перемешивания при 80 °С в течение 30 минут, реакционную смесь охлаждали до комнатной температуры, выливали в воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=8/2-4/6 (об./об.)] с получением 850 мг (выход: 75%) указанного в заголовке соединения в виде белого твердого вещества.
[0241] (14е)
(2S,5’R)-N’-ацетил-7-хлор-1’-метокси-5’-метил-3,3’-диоксо-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2S,5’R)-N’-ацетил-7-хлор-1’-метокси-5’-метил-3,3’-диоксо-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’-метокси-5’-метил-3,3’-диоксо-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,4 г) из примера 14 (14д) растворяли в дихлорметане (20 мл); добавляли ацетогидразин (чистота: 90%, 0,0673 г), 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (0,0824 г), 4-диметиламинопиридин (0,0148 г) и триэтиламин (0.254 мл); и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционную смесь выливали в воду и нейтрализовали 1 моль/л раствором соляной кислоты, и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: метанол/этилацетат=0/10-1/9 (об./об.)] с получением 280 мг (выход: 86%) указанного в заголовке соединения в виде белого твердого вещества.
[0242] (14ж)
(2S,5’R)-7-хлор-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-N’-ацетил-7-хлор-1’-метокси-5’-метил-3,3’-диоксо-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,6’-циклогексен]-6-карбогидразид (0,28 г) из примера 14 (14е) растворяли в дихлорметане (5 мл), добавляли п-толуолсульфонилхлорид (0,149 г) и триэтиламин (0,364 мл) и перемешивали при комнатной температуре в течение трех часов.
Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 202 мг (выход: 75%) указанного в заголовке соединения в виде белого твердого вещества.
[0243] (14з)
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (0,202 г) из примера 14 (14ж) растворяли в этаноле (2 мл), добавляли моногидрат п-толуолсульфоновой кислоты (0,037 г) и воду (5 мл) и перемешивали смесь при 50 °С в течение двух часов.
Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: метанол/этилацетат=0/10-1/9 (об./об.)] с получением 39 мг (выход: 23%) указанного в заголовке соединения в виде белого твердого вещества.
[0244] (Пример 15)
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(3-метил-1,2,4-оксадиазол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(15a)
[(Z)-1-аминоэтилиденамино]-(2S,5’R)-7-хлор-1’-метокси-5’-метил-3,3’-диоксо-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
[(Z)-1-аминоэтилиденамино]-(2S,5’R)-7-хлор-1’-метокси-5’-метил-3,3’-диоксо-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’-метокси-5’-метил-3,3’-диоксо-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,45 г) из примера 14 (14д) растворяли в дихлорметане (10 мл); добавляли N’-гидроксиэтанимидамид (0,0758 г), 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (0,0928 г), 4-диметиламинопиридин (0,00833 г) и триэтиламин (0,285 мл); и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: метанол/этилацетат=0/10-1/9 (об./об.)] с получением 345 мг (выход: 94%) указанного в заголовке соединения в виде белого твердого вещества.
[0245] (15б)
(2S,5’R)-7-хлор-3’-метокси-5’-метил-6-(3-метил-1,2,4-оксадиазол-5-ил)-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’-метокси-5’-метил-6-(3-метил-1,2,4-оксадиазол-5-ил)-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
[(Z)-1-аминоэтилиденамино]-(2S,5’R)-7-хлор-1’-метокси-5’-метил-3,3’-диоксо-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,345 г) из примера 15 (15a) суспендировали в толуоле (5 мл) и перемешивали при 100°C в течение пяти часов. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 283 мг (выход: 85%) указанного в заголовке соединения в виде белого твердого вещества.
[0246] (15в)
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(3-метил-1,2,4-оксадиазол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(3-метил-1,2,4-оксадиазол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’-метокси-5’-метил-6-(3-метил-1,2,4-оксадиазол-5-ил)-4-(2-тетрагидропиран-2-илоксиэтокси)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (0,283 г) из примера 15 (15б) растворяли в этаноле (2 мл), добавляли моногидрат п-толуолсульфоновой кислоты (0,0518 г) и воду (5 мл) и перемешивали при 50 °С в течение трех часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: метанол/этилацетат=0/10-1/9 (об./об.)] с получением 128 мг (выход: 54%) указанного в заголовке соединения в виде белого твердого вещества.
[0247] (Пример 16)
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(5-метил-1,2,4-оксадиазол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(16a)
(2S,5’R)-7-хлор-4-гидрокси-3’-метокси-5’-метил-6-(5-метил-1,2,4-оксадиазол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-гидрокси-3’-метокси-5’-метил-6-(5-метил-1,2,4-оксадиазол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил-1,2,4-оксадиазол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (2,3 г) из примера 7 (7б) растворяли в смешанном растворителе из толуола (20 мл) и эфира (40 мл), добавляли йодид магния (1,52 г) и перемешивали смесь при 80 °С в течение пяти часов.
К реакционной смеси добавляли воду и после нейтрализации 4 н. раствором соляной кислоты экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: петролейный эфир/этилацетат=1/1 (об./об.)] с получением 1,7 г (выход: 64%) указанного в заголовке соединения в виде желтого твердого вещества.
[0248] (16б)
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(5-метил-1,2,4-оксадиазол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(5-метил-1,2,4-оксадиазол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
Хлорид палладия (0,45 мг) растворяли в воде (2 мл) и добавляли бромид тетрабутиламмония (10,3 мг) и карбонат калия (4,42 мг). После перемешивания при 60 °С в течение 15 минут, добавляли (2S,5’R)-7-хлор-4-гидрокси-3’-метокси-5’-метил-6-(5-метил-1,2,4-оксадиазол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (50 мг) из примера 16 (16a) и оксиран (28,1 мг) и перемешивали смесь при 60 °С в течение 12 часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали тонкослойной хроматографией [проявляющий растворитель: этилацетат] с получением 16 мг (выход: 29%) указанного в заголовке соединения в виде желтого твердого вещества.
[0249] (Пример 17)
(2S,5’R)-7-хлор-6-(5-этил-1,3,4-оксадиазол-2-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(17a)
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксо-N’-пропаноилспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксо-N’-пропаноилспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,50 г) из примера 5 (5a) растворяли в дихлорметане (20 мл), добавляли 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (0,12 г), пропионогидразид (чистота: 90%, 0,097 г), 4-диметиламинопиридин (0,011 г) и триэтиламин (0,39 мл) и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционный раствор промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении с получением 0,75 г неочищенного указанного в заголовке соединения в виде бледно-желтого твердого вещества.
[0250] (17б)
(2S,5’R)-7-хлор-6-(5-этил-1,3,4-оксадиазол-2-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-(5-этил-1,3,4-оксадиазол-2-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксо-N’-пропаноилспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид (0,75 г) из примера 17 (17a) растворяли в тетрагидрофуране (10 мл), добавляли внутреннюю соль гидроксида (метоксикарбонилсульфамоил)триэтиламмония (0,614 г) и перемешивали смесь при комнатной температуре в течение трех часов.
К реакционной смеси добавляли воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 201 мг (выход: 28%, две стадии) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
[0251] (Пример 18)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-тетрагидропиран-4-ил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(18a)
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксо-N’-(тетрагидропиран-4-карбонил)спиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксо-N’-(тетрагидропиран-4-карбонил)спиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,50 г) из примера 5 (5a) растворяли в дихлорметане (20 мл), добавляли тетрагидропиран-4-карбогидразид (0,20 г), 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (0,125 г), 4-диметиламинопиридин (0,011 г) и триэтиламин (0,38 мл) и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционный раствор промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: метанол/этилацетат=0/10-1/9 (об./об.)] с получением 405 мг (выход: 90%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
[0252] (18б)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-тетрагидропиран-4-ил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-тетрагидропиран-4-ил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксо-N’-(тетрагидропиран-4-карбонил)спиро[бензофуран-2,6’-циклогексен]-6-карбогидразид (0,405 г) из примера 18 (18a) растворяли в тетрагидрофуране (10 мл), добавляли внутреннюю соль гидроксида (метоксикарбонилсульфамоил)триэтиламмония (0,392 г) и перемешивали смесь при 50 °С в течение пяти часов.
К реакционной смеси добавляли воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 51 мг (выход: 13%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
[0253] (Пример 19)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[5-(1-метил-4-пиперидил)-1,3,4-оксадиазол-2-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(19a)
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (20,0 г) из примера 5 (5a) растворяли в дихлорметане (300 мл) и добавляли 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (5,98 г), N, N-диизопропилэтиламин (31,9 мл) и 4-диметиламинопиридин (0,447 г). После перемешивания смеси при комнатной температуре в течение четырех часов, добавляли моногидрат гидразина (1,78 мл) и перемешивали смесь при комнатной температуре в течение одного часа.
После концентрирования реакционного раствора остаток, полученный двукратной азеотропной перегонкой с этанолом, растирали с этанолом с получением 13,2 г (выход: 95%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
[0254] (19б)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[5-(1-метил-4-пиперидил)-1,3,4-оксадиазол-2-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[5-(1-метил-4-пиперидил)-1,3,4-оксадиазол-2-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид (0,50 г) из примера 19 (19a) растворяли в тетрагидрофуране (10 мл) и добавляли этанол (10 мл), 1-метилпиперидин-4-карбоновую кислоту (0,225 г), 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолина гидрохлорида (0,436 г) и 4-метилморфолин (0,361 мл) и оставляли смесь стоять при комнатной температуре в течение двух дней.
Затем добавляли 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолина гидрохлорид (0,436 г) и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении.
Полученный остаток растворяли в дихлорметане (10 мл), добавляли триэтиламин (1,45 мл) и п-толуолсульфонилхлорид (0,475 г) и перемешивали смесь при комнатной температуре в течение трех часов.
Реакционную смесь выливали в воду, смесь делали слабощелочной с помощью насыщенного водного раствора бикарбоната натрия и экстрагировали реакционную смесь дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле NH [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)], и полученное твердое вещество растирали с н-гексаном и этилацетатом с получением 298 мг (выход: 29%, две стадии) указанного в заголовке соединения в виде белого твердого вещества.
[0255] (Пример 20)
(2S,5’R)-7-хлор-6-[5-(4-фтор-1-метил-4-пиперидил)-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-[5-(4-фтор-1-метил-4-пиперидил)-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид (0,50 г) из примера 19 (19a) растворяли в тетрагидрофуране (10 мл), добавляли 4-фтор-1-метилпиперидин-4-карбоновой кислоты гидрохлорид (0,254 г), 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолина гидрохлорид (0,436 г) и 4-метилморфолин (0,361 мл) и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении.
Полученный остаток растворяли в дихлорметане (10 мл), добавляли триэтиламин (1,33 мл) и п-толуолсульфонилхлорид (0,437 г) и перемешивали смесь при комнатной температуре в течение двух часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: этилацетат/метанол=10/0-85/15 (об./об.)], и полученное твердое вещество растирали с н-гексаном и этилацетатом с получением 235 мг (выход: 24%, две стадии) указанного в заголовке соединения в виде белого твердого вещества.
[0256] (Пример 21)
(2S,5’R)-7-хлор-3’,4-диметокси-6-[5-[(1S)-1-метоксиэтил]-1,3,4-оксадиазол-2-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(21a)
(2S,5’R)-7-хлор-1’,4-диметокси-N’-[(2S)-2-метоксипропаноил]-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2S,5’R)-7-хлор-1’,4-диметокси-N’-[(2S)-2-метоксипропаноил]-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид (0,50 г) из примера 19 (19a) растворяли в тетрагидрофуране (10 мл), добавляли (S)-(-)-2-метоксипропионовую кислоту (0,164 г) и 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолина гидрохлорид (0,545 г) и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: этилацетат/метанол=1/0-19/1 (об./об.)] с получением 410 мг (выход: 67%) указанного в заголовке соединения в виде белого твердого вещества.
[0257] (21б)
(2S,5’R)-7-хлор-3’,4-диметокси-6-[5-[(1S)-1-метоксиэтил]-1,3,4-оксадиазол-2-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-[5-[(1S)-1-метоксиэтил]-1,3,4-оксадиазол-2-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-1’,4-диметокси-N’-[(2S)-2-метоксипропаноил]-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид (0,410 г) из примера 21 (21a) растворяли в дихлорметане (5 мл), добавляли триэтиламин (0,613 мл) и п-толуолсульфонилхлорид (0,200 г) и перемешивали смесь при комнатной температуре в течение двух часов.
Реакционную смесь выливали в воду, и после нейтрализации 1 моль/л раствором соляной кислоты реакционную смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)], и полученное твердое вещество растирали с н-гексаном и этилацетатом с получением 235 мг (выход: 60%) указанного в заголовке соединения в виде белого твердого вещества.
[0258] (Пример 22)
(2S,5’R)-7-хлор-4-этокси-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(22a)
(2S,5’R)-7-хлор-4-гидрокси-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-гидрокси-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
Магний в форме стружек (0,36 г) добавляли в диэтиловый эфир (50 мл) и тремя порциями добавляли йод (3,5 г) каждые 15 минут. После перемешивания при комнатной температуре в течение 30 минут, добавляли (2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (5,0 г) из примера 5 (5в) и толуол (100 мл) и перемешивали смесь при 100 °С в течение шести часов.
К реакционной смеси добавляли воду и после нейтрализации 1 моль/л раствором соляной кислоты экстрагировали смесь этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия, и отгоняли растворитель при пониженном давлении с получением 2,5 г (выход: 52%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
[0259] (22б)
(2S,5’R)-7-хлор-4-этокси-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-этокси-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-гидрокси-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (200 мг) из примера 22 (22a) растворяли в N, N-диметилформамиде (3,0 мл), добавляли карбонат калия (283 мг) и йодэтан (0,082 мл) и перемешивали смесь при 90 °С в течение пяти часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=7/3-0/10 (об./об.)] с получением 146 мг (выход: 68%) указанного в заголовке соединения в виде белого твердого вещества.
[0260] (Пример 23)
(2S,5’R)-7-хлор-4-(дифторметокси)-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(23a)
(2S,5’R)-7-хлор-4-(дифторметокси)-3’,6-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-(дифторметокси)-3’,6-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-гидрокси-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (3,5 г) из примера 1 (1a) растворяли в ацетонитриле (70 мл), добавляли воду (30 мл) и гидроксид калия (12 г) при минус 20°C и перемешивали смесь при минус 20°C в течение 10 минут. Медленно добавляли диэтил(бромдифторметил)фосфонат (5,5 мл) при минус 20°C и медленно повышали температуру до 0 °С в течение одного часа.
К реакционной смеси добавляли воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=8/2-2/8 (об./об.)] с получением 2,5 г (выход: 62%) указанного в заголовке соединения в виде белого твердого вещества.
[0261] (23б)
(2S,5’R)-7-хлор-4-(дифторметокси)-6-гидрокси-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-(дифторметокси)-6-гидрокси-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-(дифторметокси)-3’,6-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (2,5 г) из примера 23 (23a) растворяли в пиридине (500 мл), добавляли 18-краун-6 (1,9 г) и йодид калия (1,1 г) и перемешивали смесь при 120 °С в течение восьми часов.
Реакционный раствор концентрировали, к реакционной смеси добавляли воду и после нейтрализации 1 моль/л раствором соляной кислоты экстрагировали реакционную смесь этилацетатом.
Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 1,7 г (выход: 71%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
[0262] (23в)
[(2S,5’R)-7-хлор-4-(дифторметокси)-1’-метокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-ил]трифторметансульфонат
[(2S,5’R)-7-хлор-4-(дифторметокси)-1’-метокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-ил]трифторметансульфонат
(2S,5’R)-7-хлор-4-(дифторметокси)-6-гидрокси-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (1,7 г) из примера 23 (23б) растворяли в дихлорметане (200 мл), добавляли N-фенилбис(трифторметансульфонимид) (1,9 г) и триэтиламин (1,6 мл) и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционный раствор разбавляли дихлорметаном и промывали органический слой водой и насыщенным солевым раствором, и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=10/0-6/4 (об./об.)] с получением 950 мг (выход: 41%) указанного в заголовке соединения в виде белого твердого вещества.
[0263] (23г)
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-4-(дифторметокси)-1’-метокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-4-(дифторметокси)-1’-метокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
[(2S,5’R)-7-хлор-4-(дифторметокси)-1’-метокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-ил]трифторметансульфонат (0,40 г) из примера 23 (23в) растворяли в толуоле (5 мл); добавляли ацетат палладия (II) (0,018 г), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,091 г) и N, N-диизопропилэтиламин (0,275 мл); и нагревали смесь до 80 °C. Тремя порциями добавляли 2,4,6-трихлорфенилформиат (0,231 г) каждые 30 минут.
После перемешивания при 80 °С в течение 30 минут, реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=10/0-6/4 (об./об.)] с получением 182 мг (выход: 40%) указанного в заголовке соединения в виде белого твердого вещества.
[0264] (23д)
(2S,5’R)-N’-ацетил-7-хлор-4-(дифторметокси)-1’-метокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2S,5’R)-N’-ацетил-7-хлор-4-(дифторметокси)-1’-метокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид
(2,4,6-Трихлорфенил)-(2S,5’R)-7-хлор-4-(дифторметокси)-1’-метокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,182 г) из примера 23 (23г) растворяли в дихлорметане (20 мл); добавляли ацетогидразид (чистота: 90%, 0,035 г), 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (0,043 г), 4-диметиламинопиридин (0,0038 г) и триэтиламин (0,131 мл); и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционную смесь добавляли в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=10/0-7/3 (об./об.)] с получением 141 мг (выход: 98%) указанного в заголовке соединения в виде белого твердого вещества.
[0265] (23е)
(2S,5’R)-7-хлор-4-(дифторметокси)-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-4-(дифторметокси)-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-N’-ацетил-7-хлор-4-(дифторметокси)-1’-метокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбогидразид (0,141 г) из примера 23 (23д) растворяли в 1,4-диоксане (5,0 мл), добавляли внутреннюю соль гидроксида (метоксикарбонилсульфамоил)триэтиламмония (0,146 г) и перемешивали смесь при комнатной температуре в течение двух часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=10/0-4/6 (об./об.)] с получением 70 мг (выход: 52%) указанного в заголовке соединения в виде белого твердого вещества.
[0266] (Пример 24)
(2S,5’R)-7-хлор-3’,4-диметокси-6-[3-(1-метоксиэтил)-1,2,4-оксадиазол-5-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(24a)
[(Z)-(1-амино-2-метоксипропилиден)амино]-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
[(Z)-(1-амино-2-метоксипропилиден)амино]-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,5 г) из примера 5 (5a) растворяли в дихлорметане (10 мл); добавляли N’-гидрокси-2-метоксипропанимидамид (0,130 г), 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (0,125 г), 4-диметиламинопиридин (0,011 г) и N, N-диизопропилэтиламин (0,478 мл); и перемешивали смесь при комнатной температуре в течение трех часов.
Реакционную смесь выливали в воду, и после нейтрализации 1 мол/л раствором соляной кислоты реакционную смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 375 мг (выход: 88%) указанного в заголовке соединения в виде белого твердого вещества.
[0267] (24б)
(2S,5’R)-7-хлор-3’,4-диметокси-6-[3-(1-метоксиэтил)-1,2,4-оксадиазол-5-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-[3-(1-метоксиэтил)-1,2,4-оксадиазол-5-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
[(Z)-(1-aмино-2-метоксипропилиден)амино]-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,375 г) из примера 24 (24a) растворяли в толуоле (10 мл) и перемешивали смесь при 120°C в течение 12 часов.
Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=10/0-7/3 (об./об.)] и растирали с н-гексаном и этилацетатом с получением 265 мг (выход: 74%) указанного в заголовке соединения в виде белого твердого вещества.
[0268] (Пример 25)
(2S,5’R)-7-хлор-6-[3-(1-гидрокси-1-метилэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(25a)
[(Z)-(1-амино-2-гидрокси-2-метилпропилиден)амино]-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
[(Z)-(1-амино-2-гидрокси-2-метилпропилиден)амино]-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат
(2,4,6-трихлорфенил)-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (1,0 г) из примера 5 (5a) растворяли в дихлорметане (20 мл); добавляли 2,N-дигидрокси-2-метилпропионамизин (0,238 г), 3H-1,2,3-триазоло[4,5-b]пиридин-3-ол (0,249 г), 4-диметиламинопиридин (0,022 г) и N, N-диизопропилэтиламин (0,957 мл); и оставляли смесь стоять при комнатной температуре в течение ночи.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: этилацетат/метанол=10/0-9/1 (об./об.)] с получением 765 мг (выход: 89%) указанного в заголовке соединения в виде белого твердого вещества.
[0269] (25б)
(2S,5’R)-7-хлор-6-[3-(1-гидрокси-1-метилэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-[3-(1-гидрокси-1-метилэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
[(Z)-(1-амино-2-гидрокси-2-метилпропилиден)амино]-(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбоксилат (0,765 г) из примера 25 (25a) растворяли в толуоле (10 мл) и перемешивали смесь при 110°C в течение семи часов.
Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] и растирали с н-гексаном и этилацетатом с получением 512 мг (выход: 70%) указанного в заголовке соединения в виде белого твердого вещества.
[0270] (Пример 26)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(1H-пиразол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(26a)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(2-тетрагидропиран-2-илпиразол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(2-тетрагидропиран-2-илпиразол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
[(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-ил] трифторметансульфонат (2,0 г) из примера 3 (3a) растворяли в 1,4-диоксане (30 мл) и воде (2 мл); добавляли 1-тетрагидропиран-2-ил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиразол (1,54 г), карбонат калия (1,76 г) и дихлорид [1,1’-бис(дифенилфосфино)ферроцен]палладия (II) (0,155 г) при комнатной температуре; и перемешивали смесь при 90 °С в течение трех часов.
После снижения температуры реакции до комнатной температуры отфильтровывали нерастворимые вещества. Фильтрат выливали в воду и экстрагировали дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: петролейный эфир/этилацетат=10/1-2/1 (об./об.)] с получением 1,8 г (выход: 90%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
[0271] (26б)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(1H-пиразол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(1H-пиразол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(2-тетрагидропиран-2-илпиразол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (1,8 г) из примера 26 (26a) растворяли в дихлорметане (5 мл), добавляли трифторуксусную кислоту (5 мл) и перемешивали смесь при комнатной температуре в течение 20 минут.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали высокоэффективной жидкостной хроматографией [растворитель для элюирования: 0,05% соляная кислота/ацетонитрил=70/30-45/55 (об./об.)] с получением 1,1 г (выход: 74%) указанного в заголовке соединения в виде желтого твердого вещества.
[0272] (Пример 27)
(2S,5’R)-7-хлор-3’,4-диметокси-6-[1-(2-метоксиэтил)пиразол-3-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-[1-(2-метоксиэтил)пиразол-3-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(1H-пиразол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион (250 мг) из примера 26 (26б) растворяли в N, N-диметилформамиде (5 мл), добавляли 2-бромэтилметиловый эфир (179 мг) и карбонат калия (267 мг) и перемешивали смесь при 80 °С в течение трех часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали высокоэффективной жидкостной хроматографией [растворитель для элюирования: 10 мМ водный раствор гидрокарбоната аммония/ацетонитрил=67/33-37/63 (об./об.)] с получением 81 мг (выход: 28%) указанного в заголовке соединения в виде белого твердого вещества.
[0273] (Пример 28)
(2S,5’R)-7-хлор-6-(1,8-диокса-2-азаспиро[4.5]дец-2-ен-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(28a)
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбальдегид
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбальдегид
[(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-ил]трифторметансульфонат (4,5 г) из примера 3 (3a) растворяли в 1,4-диоксане (120 мл), добавляли трибутилстаннилметанол (регистрационный номер CAS: 27490-33-1) (8,29 г) и тетракис(трифенилфосфин)палладий (1,66 г) при комнатной температуре и перемешивали смесь при 60 °С в течение 15 часов.
Остаток, который получали отгонкой растворителя при пониженном давлении, подвергали грубой очистке колоночной хроматографией на силикагеле [растворитель для элюирования: петролейный эфир/этилацетат=25/1-1/1 (об./об.)].
Полученный неочищенный продукт растворяли в дихлорметане (20 мл), добавляли периодинан Десс-Мартина (3,61 г) и перемешивали смесь при комнатной температуре в течение двух часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: петролейный эфир/этилацетат=1/1 (об./об.)] с получением 1,25 г (выход: 37%, две стадии) указанного в заголовке соединения в виде желтого твердого вещества.
[0274] (28б)
(2S,5’R)-7-хлор-6-(1,8-диокса-2-азаспиро[4.5]дец-2-ен-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-6-(1,8-диокса-2-азаспиро[4.5]дец-2-ен-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбальдегид (1,0 г) из примера 28 (28a) растворяли в метаноле (10 мл), добавляли гидрохлорид гидроксиламина (158 мг) и ацетат натрия (585 мг) и перемешивали смесь при комнатной температуре в течение одного часа.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, подвергали грубой очистке колоночной хроматографией на силикагеле [растворитель для элюирования: петролейный эфир/этилацетат=50/1-10/1 (об./об.)] и получали неочищенный продукт (730 мг), содержащий (2S,5’R,6E)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбальдегидоксим в качестве основного компонента, в виде желтого твердого вещества.
Полученный неочищенный продукт (300 мг) растворяли в дихлорметане (6 мл); добавляли 4-метилентетрагидропиран (регистрационный номер CAS: 36838-71-8) (322 мг), пиридин (0,041 мл) и гипохлорит натрия (20 мл) при минус 10 °C, и перемешивали смесь при комнатной температуре в течение трех часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали высокоэффективной жидкостной хроматографией [растворитель для элюирования: 0,225% водный раствор муравьиной кислоты/ацетонитрил=55/45-45/55 (об./об.)] с получением 92 мг (выход: 17%, две стадии) указанного в заголовке соединения в виде белого твердого вещества.
[0275] (Пример 29)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(8-метил-1-окса-2,8-диазаспиро[4.5]дец-2-ен-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(8-метил-1-окса-2,8-диазаспиро[4.5]дец-2-ен-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
Неочищенный продукт (92 мг), содержащий (2S,5’R,6E)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-карбальдегидоксим, который получали как промежуточное соединение в примере 28 (28б) в качестве основного компонента, растворяли в дихлорметане (3,0 мл); добавляли трет-бутил-4-метиленпиперидин-1-карбоксилат (регистрационный номер CAS: 159635-49-1) (162 мг), пиридин (0,013 мл) и гипохлорит натрия (7,0 мл) при минус 10 °C; и перемешивали смесь при минус 10°C в течение трех часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, подвергали грубой очистке колоночной хроматографией на силикагеле [растворитель для элюирования: петролейный эфир/этилацетат=1/1 (об./об.)].
Полученный неочищенный продукт растворяли в дихлорметане (4,0 мл) и добавляли раствор хлороводорода в 1,4-диоксане (4 М, 50 мл). После перемешивания при комнатной температуре в течение двух часов отгоняли растворитель при пониженном давлении.
Полученный остаток растворяли в метаноле (1,0 мл); добавляли формальдегид (70 мг), триэтиламин (0,078 мл), уксусную кислоту (0,065 мл) и цианоборгидрид натрия (55 мг); и перемешивали смесь при комнатной температуре в течение трех часов.
Остаток, который получали отгонкой растворителя при пониженном давлении, очищали высокоэффективной жидкостной хроматографией [растворитель для элюирования: 0,05% водный раствор аммиака/ацетонитрил=67/33-37/63 (об./об.)] с получением 41 мг (выход: 32%, три стадии) указанного в заголовке соединения в виде белого твердого вещества.
[0276] (Пример 30)
(2S,5’R)-7-хлор-3’,4-диметокси-6-(2-метоксипиримидин-5-ил)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-(2-метоксипиримидин-5-ил)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
[(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-ил]трифторметансульфонат (0,50 г) из примера 3 (3a) растворяли в толуоле (10 мл); добавляли 2-метокси-5-пиримидилбороновую кислоту (0,245 г), насыщенный водный раствор бикарбоната натрия (5,0 мл) и хлор(2-дициклогексилфосфино-2’,4’,6’-триизопропил-1,1’-бифенил)[2-(2’-амино-1,1’-бифенил)]палладий (II) (0,167 г) при комнатной температуре; и перемешивали смесь при 90 °С в течение двух часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=7/3-1/9 (об./об.)] с получением 58 мг (выход: 12%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
[0277] (Пример 31)
(2S,5’R)-7-хлор-3’,4-диметокси-6-(6-метокси-3-пиридил)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-6-(6-метокси-3-пиридил)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
[(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-ил]трифторметансульфонат (0,50 г) из примера 3 (3a) растворяли в толуоле (10 мл); добавляли 2-метоксипиридин-5-бороновую кислоту (0,244 г), насыщенный водный раствор бикарбоната натрия (5,0 мл), и хлор(2-дициклогексилфосфино-2’,4’,6’-триизопропил-1,1’-бифенил)[2-(2’-амино-1,1’-бифенил)]палладий (II) (0,167 г) при комнатной температуре; и перемешивали смесь при 90 °С в течение двух часов.
Реакционную смесь выливали в воду и экстрагировали реакционную смесь этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 128 мг (выход: 28%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
[0278] (Пример 32)
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(3-пиридил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(3-пиридил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион
[(2S,5’R)-7-хлор-1’,4-диметокси-5’-метил-3,3’-диоксоспиро[бензофуран-2,6’-циклогексен]-6-ил]трифторметансульфонат (0,50 г) из примера 3 (3a) растворяли в N, N-диметилформамиде (5,0 мл); добавляли 3-пиридилбороновую кислоту (0,196 г), дихлорид [1,1’-бис(дифенилфосфино)ферроцен]палладия (II) (0,347 г) и бикарбонат натрия (0,268 г); и перемешивали смесь при 70 °С в течение трех часов.
Реакционную смесь выливали в воду, реакционную смесь экстрагировали этилацетатом и удаляли нерастворимые вещества фильтрованием через целит. Органический слой промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток, который получали отгонкой растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [растворитель для элюирования: н-гексан/этилацетат=1/1-0/1 (об./об.)] с получением 65 мг (выход: 15%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
[0279] Результаты анализа соединений из представленных примеров с помощью рентгеновской порошковой дифракции представлены ниже.
Условия анализа:
Модель: Rigaku Rint TTR-III
Держатель образца: Неотражающий держатель образца
Образец: Соответствующее количество
Условия генерации рентгеновского излучения: 50 кВ, 300 мА
Длина волны: 1,54 Å (Ka-излучение меди)
Скорость сканирования: 20°/мин.
Диапазон сканирования: от 2 до 40°
Ширина дискретизации: 0,02°
Выполнение анализа: Несколько мг экспериментального вещества собирали шпателем, помещали на неотражающий держатель образца и сплющивали кусочком бумаги для взвешивания. Затем анализировали расположение пиков в условиях, описанных выше.
[0280] (Пример 4)
Принимая максимальную интенсивность пика за 100 на фиг. 1 дифракционной диаграммы рентгеновской порошковой дифракции (CuKα, λ=1,54 Å, скорость сканирования=20°/мин.), в таблице 2 представлены пики с относительной интенсивностью 4 или более.
[0281]
[Таблица 2]
[0282] (Пример 5)
Принимая максимальную интенсивность пика за 100 на фиг. 2 дифракционной диаграммы рентгеновской порошковой дифракции (CuKα, λ=1,54 Å, скорость сканирования=20°/мин.), в таблице 3 представлены пики с относительной интенсивностью 4 или более.
[0283] [Таблица 3]
[0284] (Пример 17)
Принимая максимальную интенсивность пика за 100 на фиг. 3 дифракционной диаграммы рентгеновской порошковой дифракции (CuKα, λ=1,54 Å, скорость сканирования=20°/мин.), в таблице 4 представлены пики с относительной интенсивностью 4 или более.
[0285] [Таблица 4]
[0286] (Пример 25)
Принимая максимальную интенсивность пика за 100 на фиг. 4 дифракционной диаграммы рентгеновской порошковой дифракции (CuKα, λ=1,54 Å, скорость сканирования=20°/мин.), в таблице 5 представлены пики с относительной интенсивностью 4 или более.
[0287] [Таблица 5]
[0288] Ниже представлены структурные формулы соединений, описанных в примерах, и их физико-химические данные.
[0289]

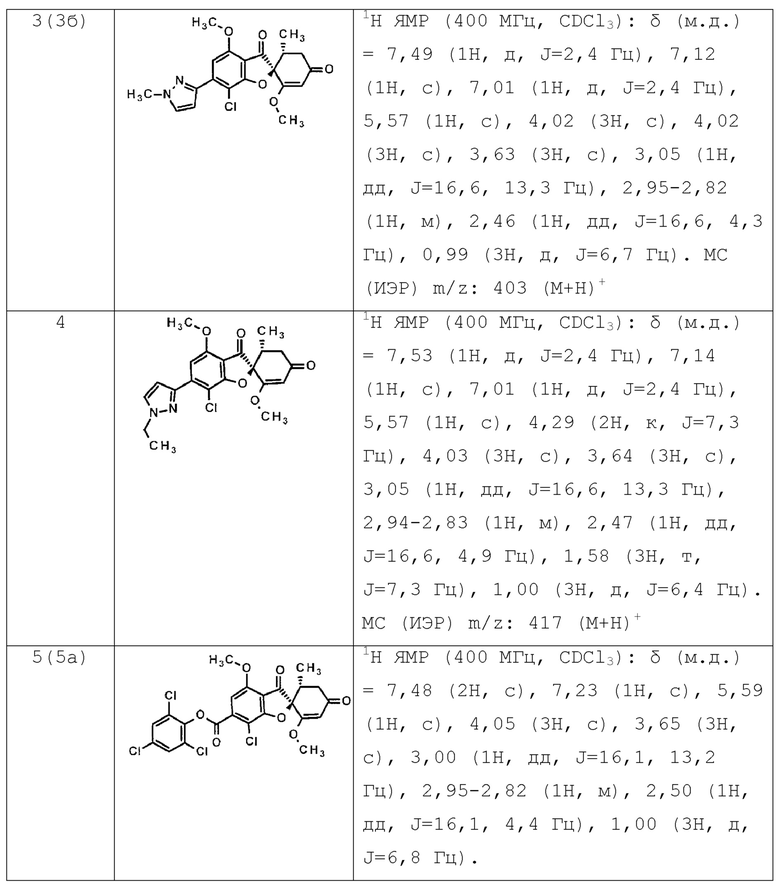
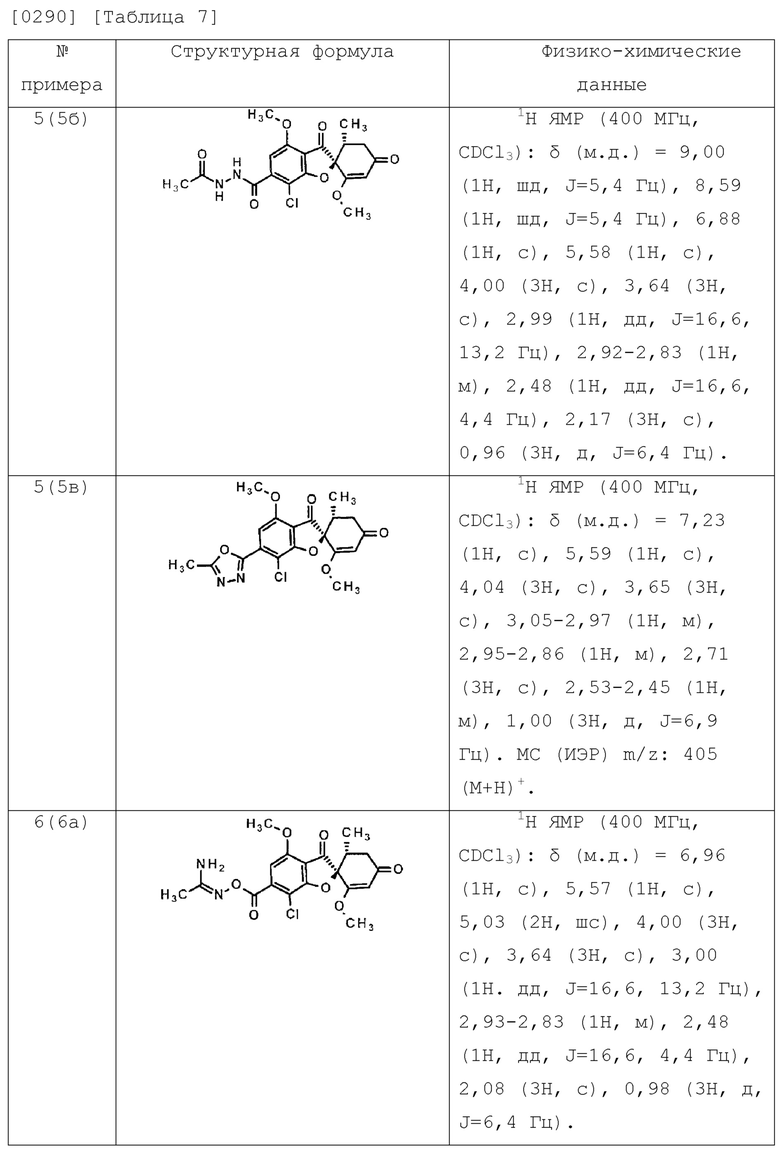

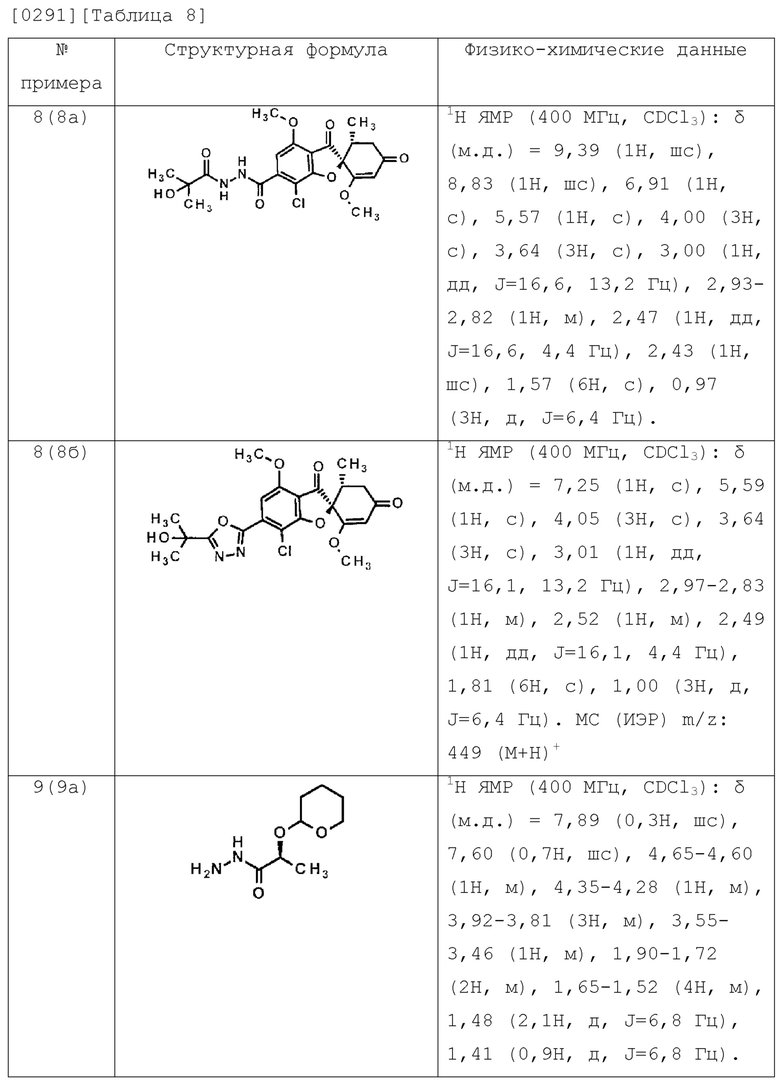
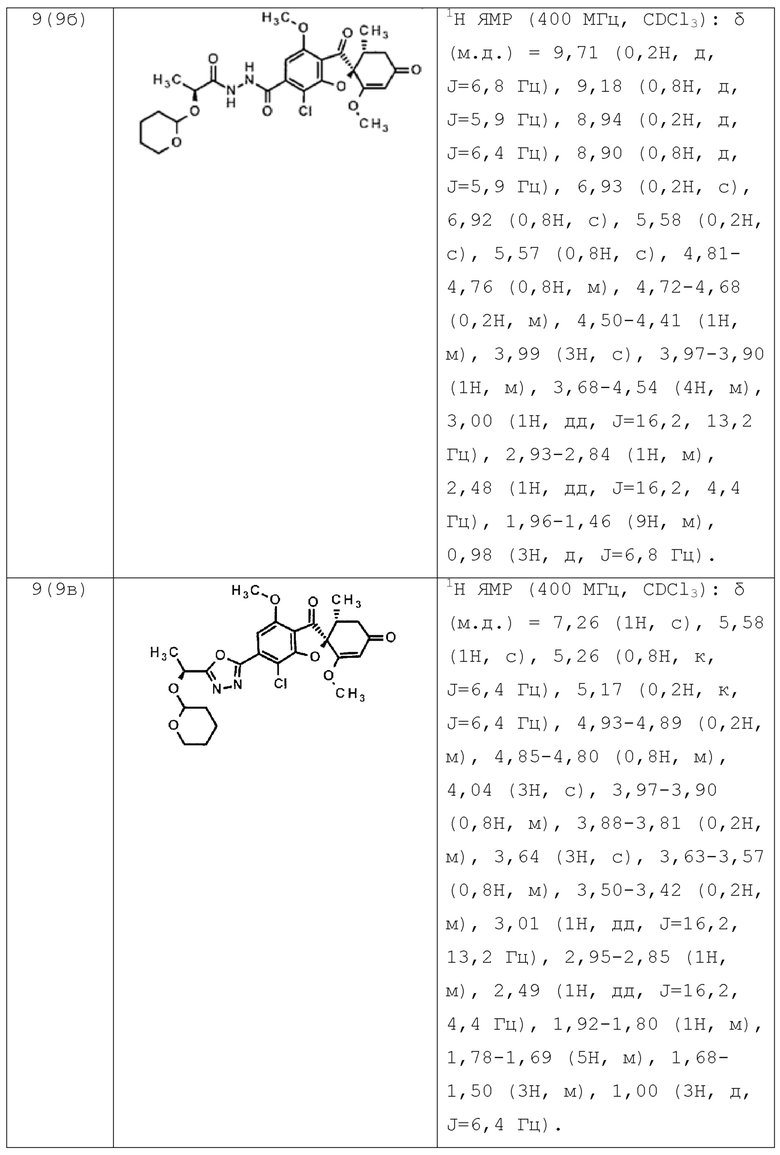
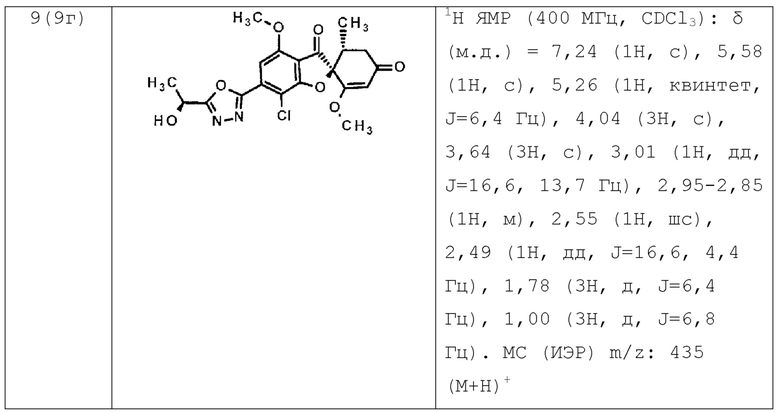
[0292]

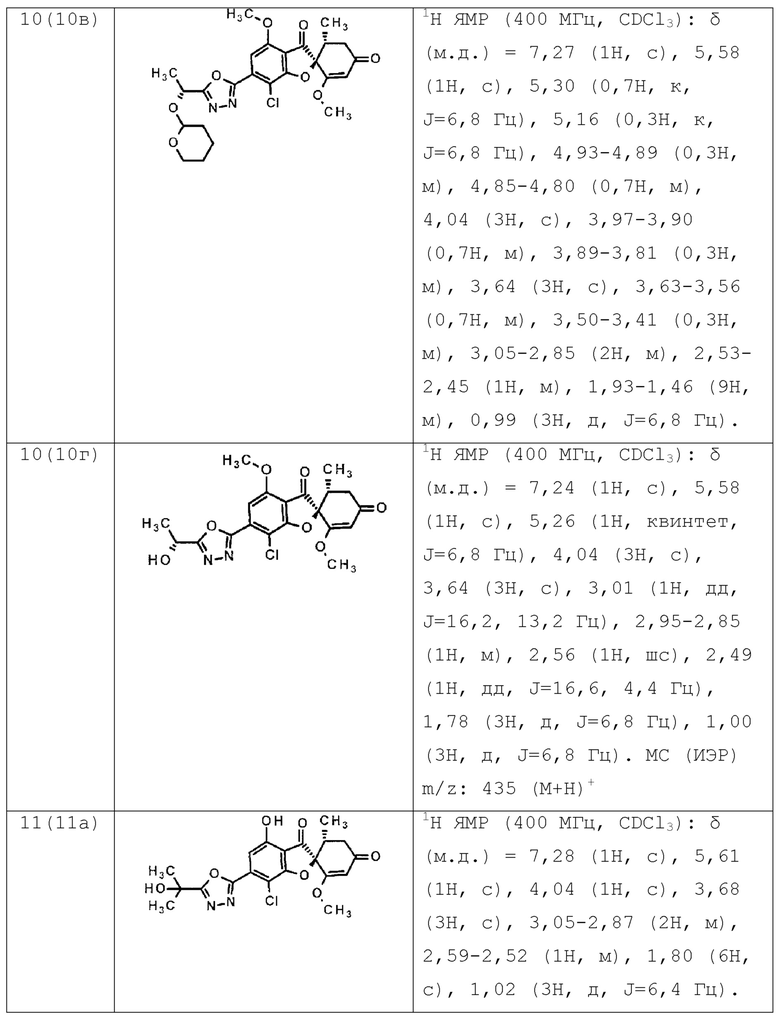
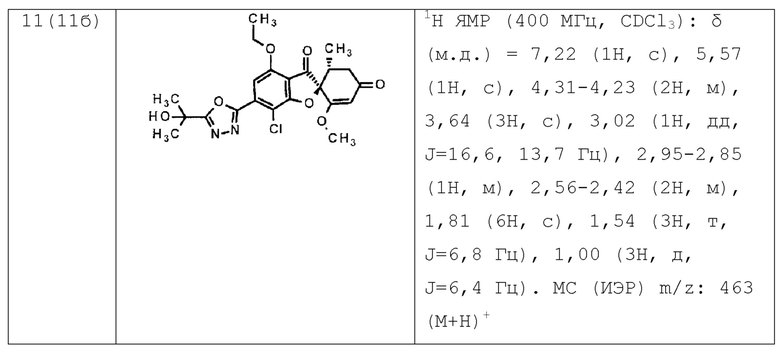 [0293]
[0293]
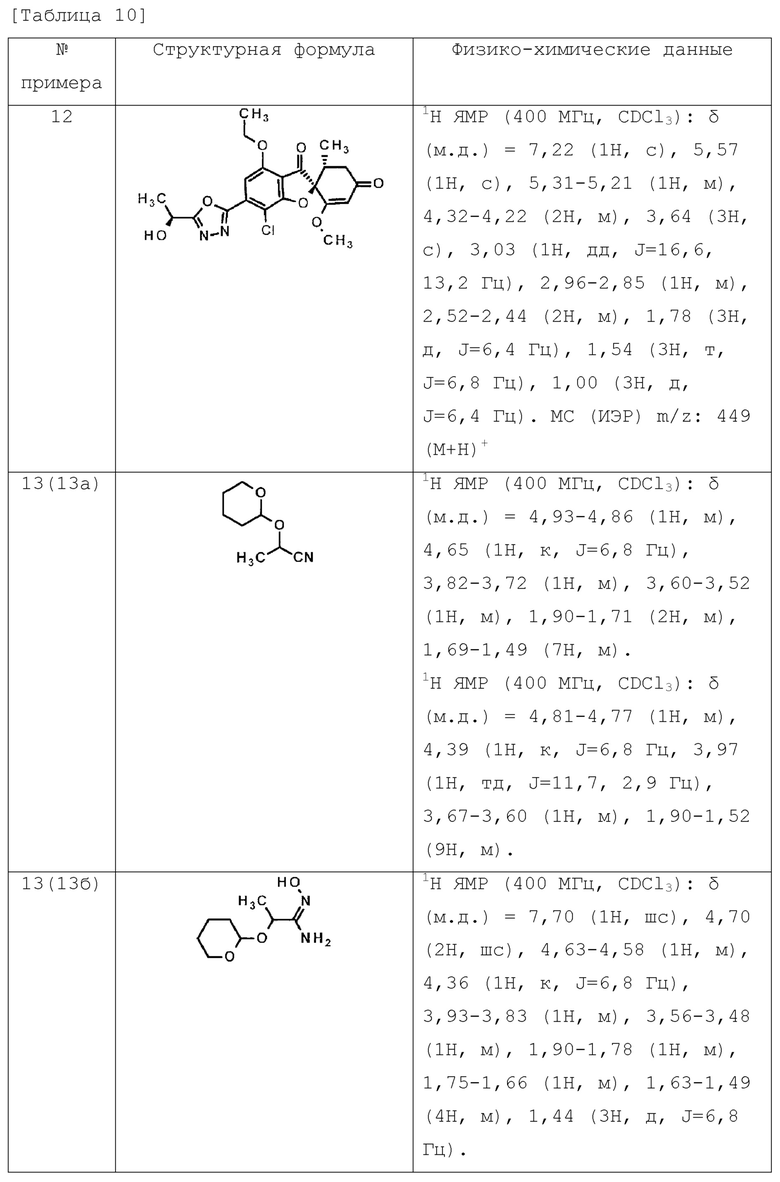
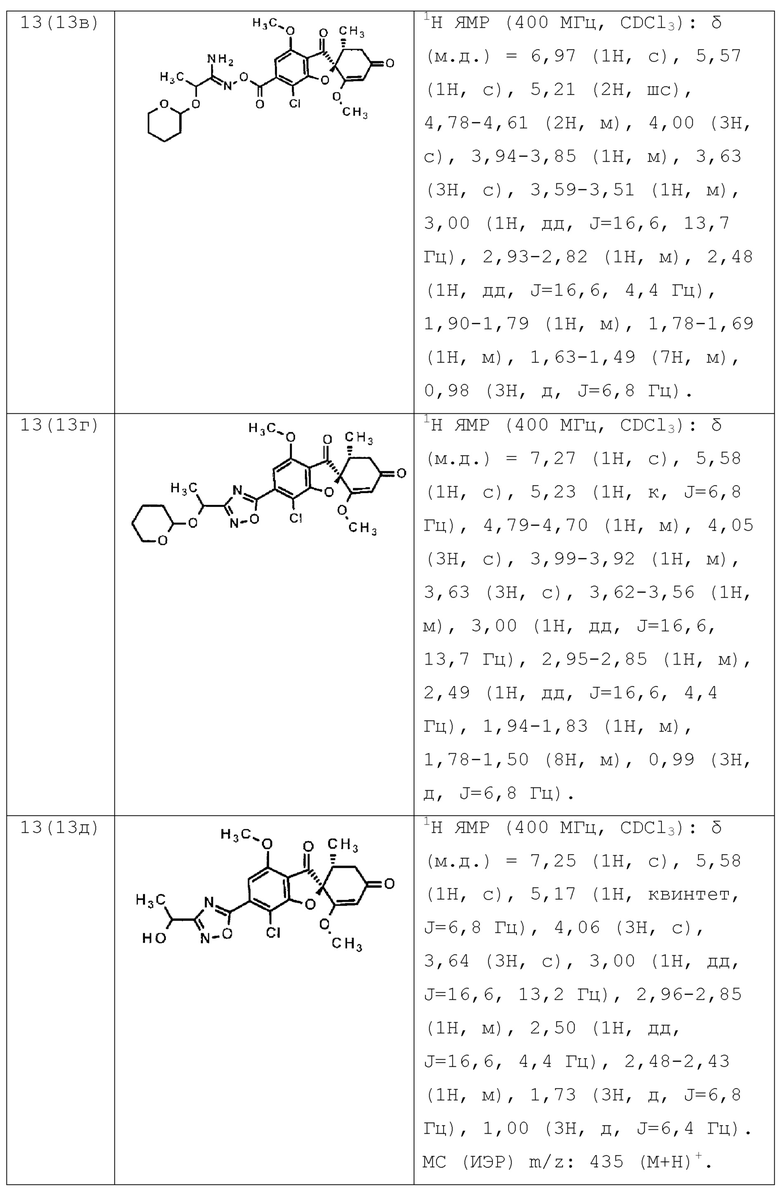
[0294]


[0295]

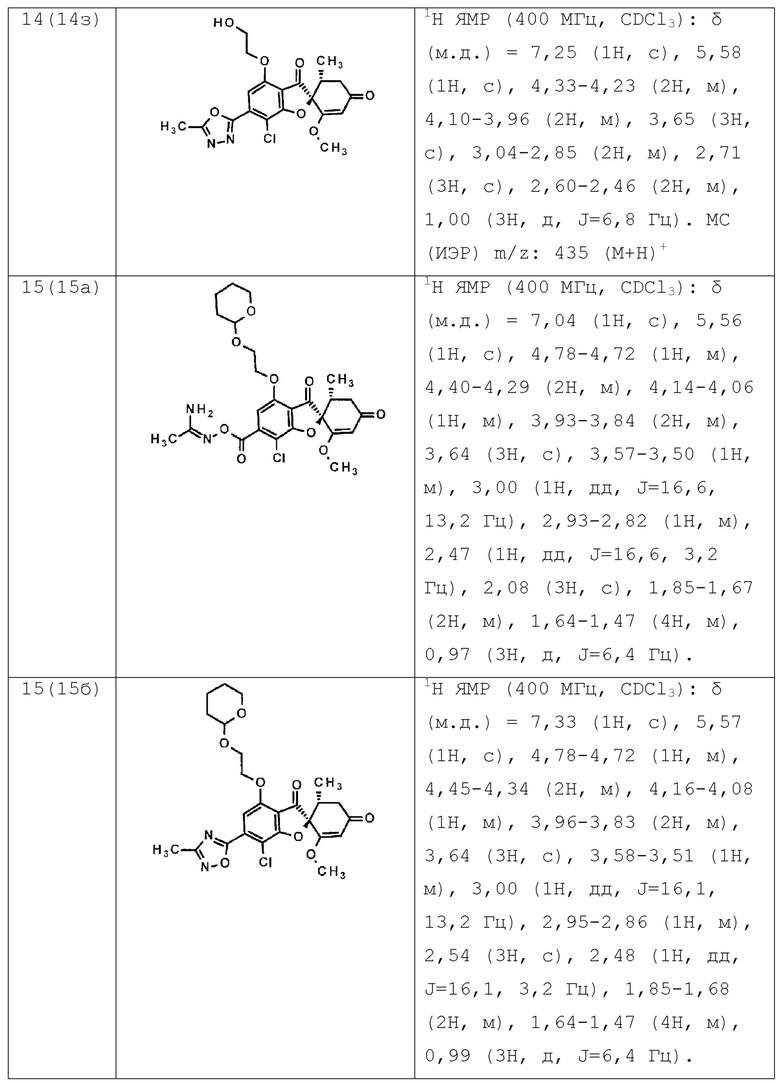
[0296]
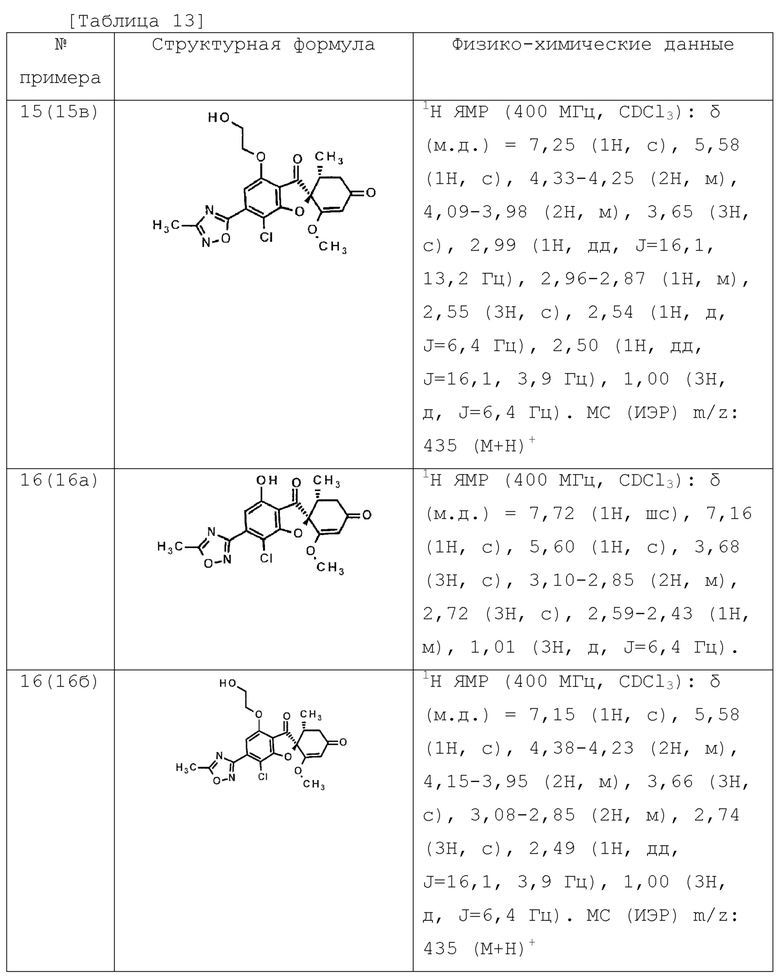


[0297]
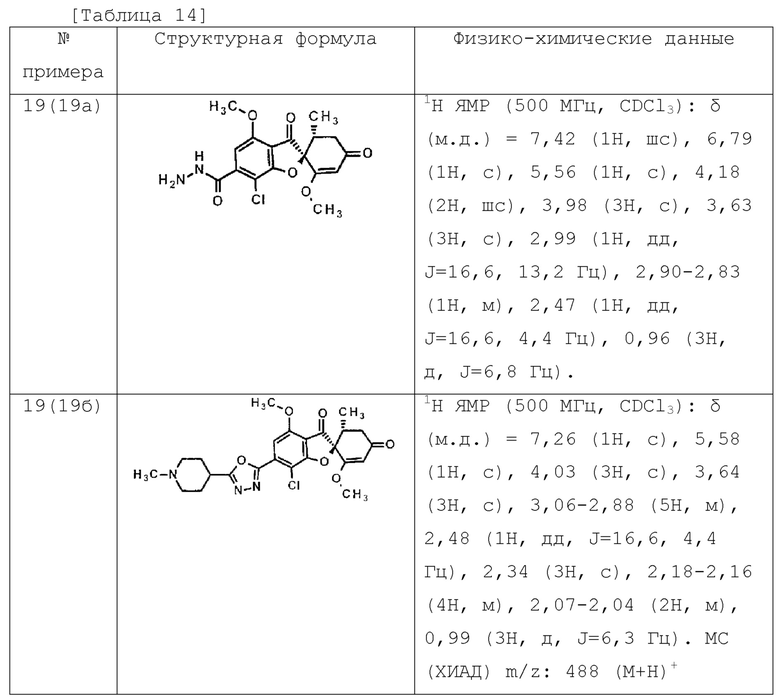
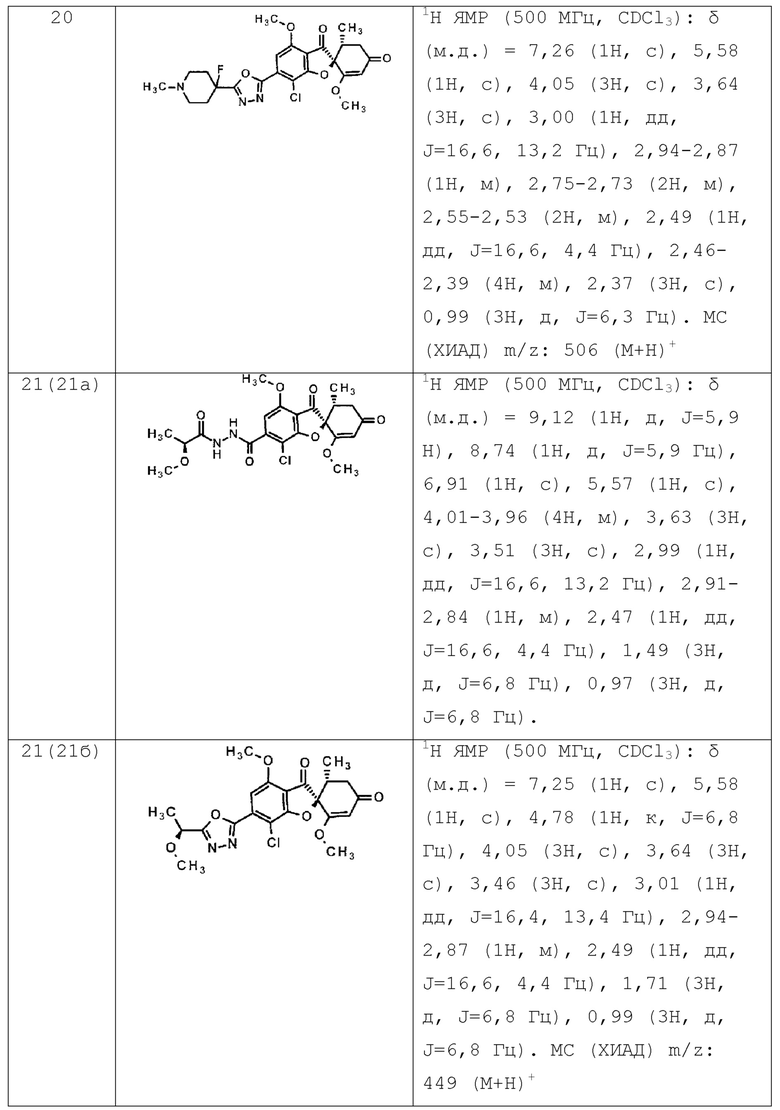
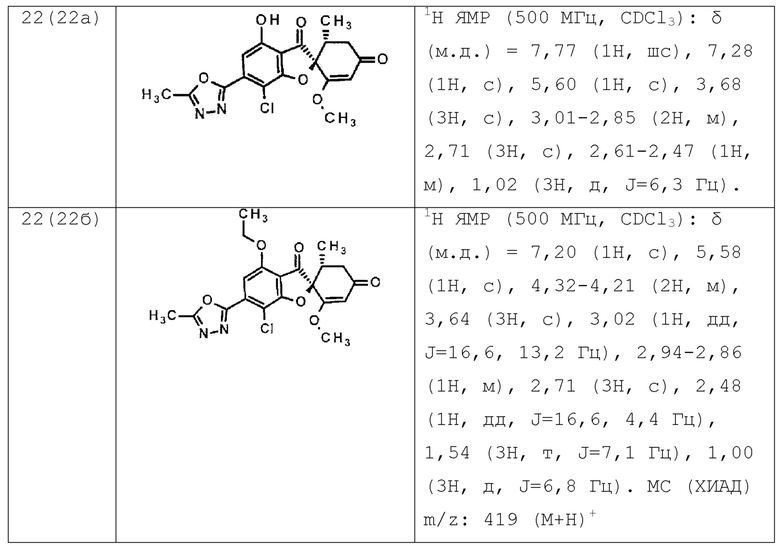
[0298]
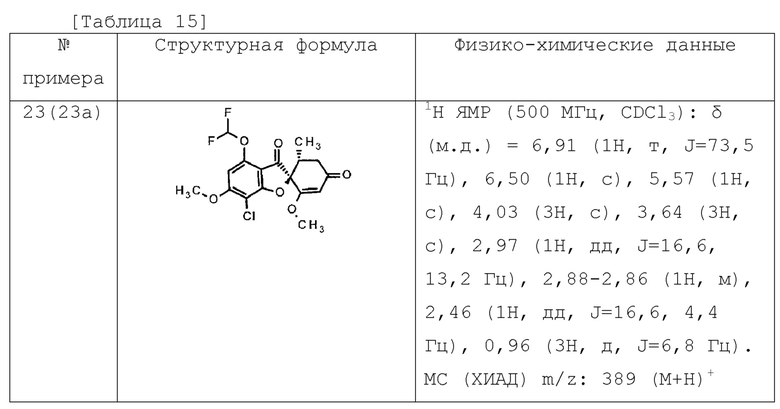
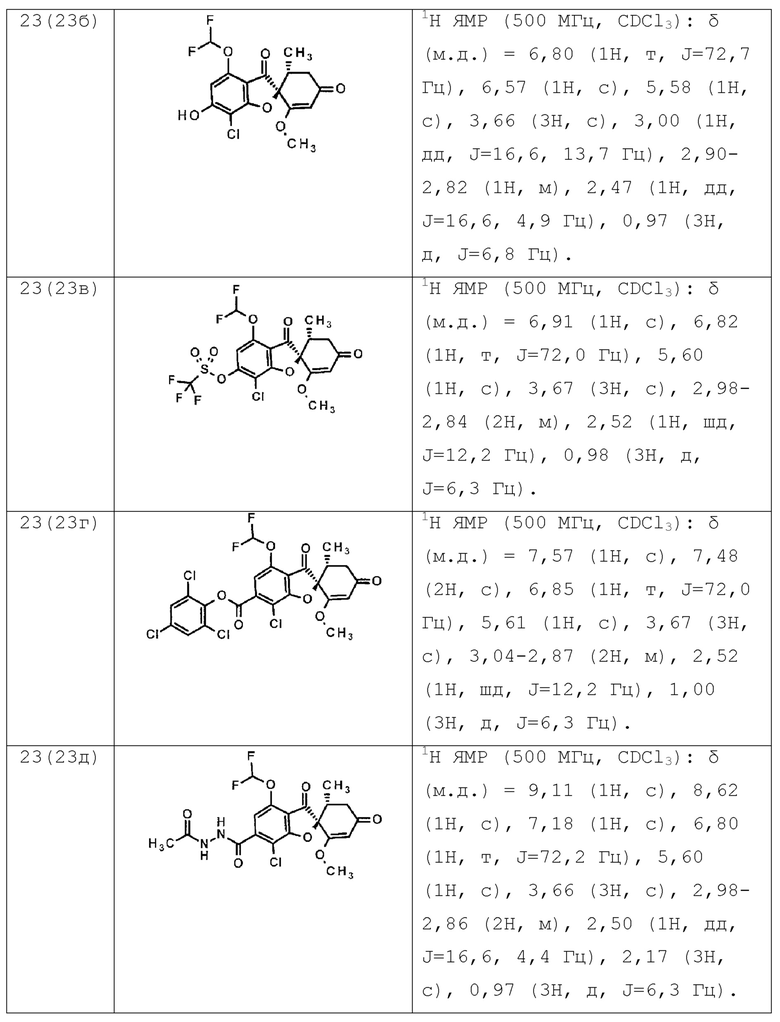
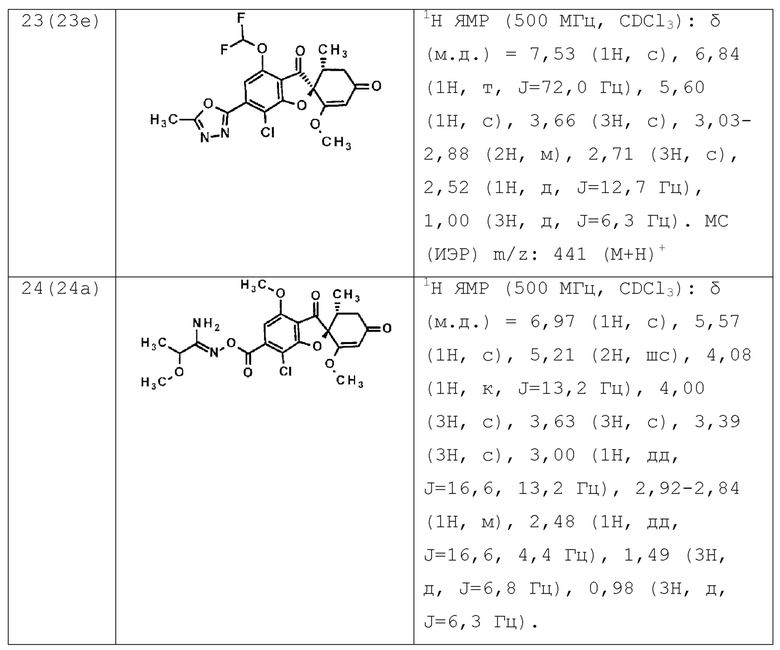
[0299]
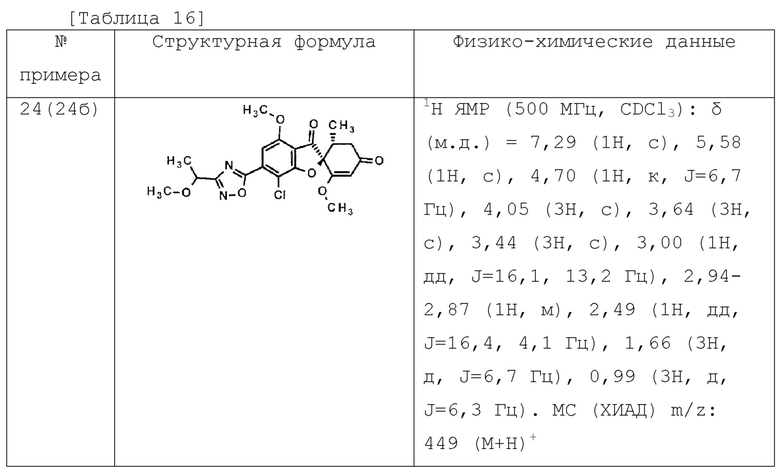

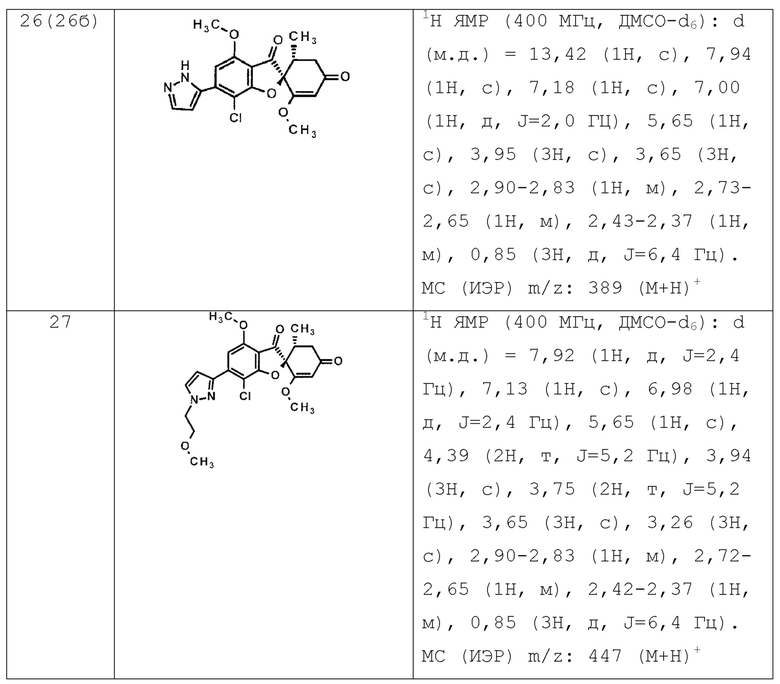
[0300]


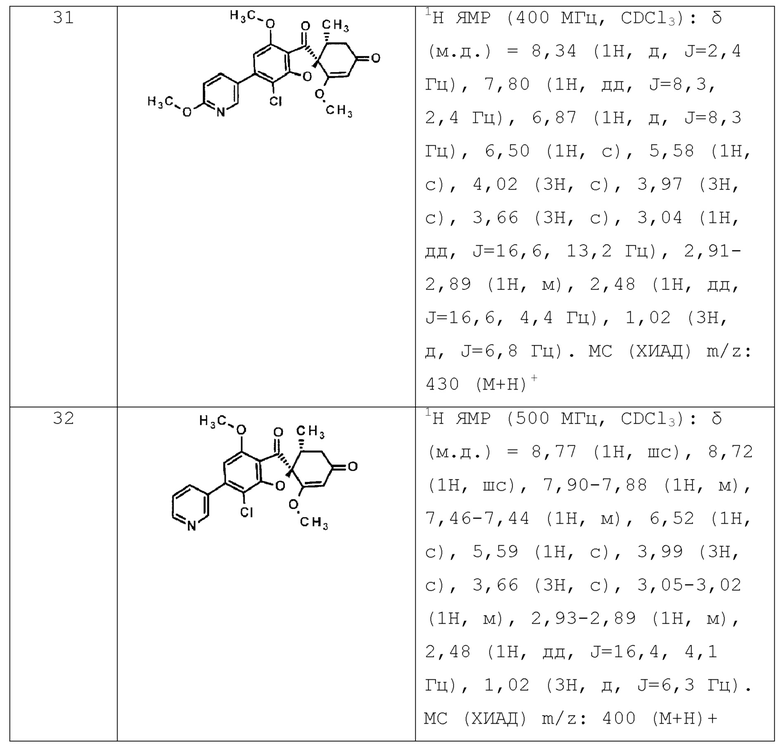
| название | год | авторы | номер документа |
|---|---|---|---|
| ГРИЗЕОФУЛЬВИНОВОЕ СОЕДИНЕНИЕ | 2017 |
|
RU2736208C2 |
| ЦИКЛИЧЕСКИЕ ДИОНЫ В КАЧЕСТВЕ ГЕРБИЦИДНЫХ СОЕДИНЕНИЙ | 2020 |
|
RU2822391C2 |
| СУЛЬФОНАМИДНОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ | 2017 |
|
RU2732572C2 |
| ОРТОЗАМЕЩЕННЫЕ АМИДЫ 2-МЕТОКСИИМИНОФЕНИЛУКСУСНОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СРЕДСТВО ДЛЯ БОРЬБЫ С ВРЕДОНОСНЫМИ ГРИБАМИ И ИНСЕКТОАКАРИЦИДНОЕ СРЕДСТВО | 1994 |
|
RU2130924C1 |
| ПРОТИВООПУХОЛЕВЫЙ АГЕНТ | 2018 |
|
RU2770824C2 |
| АЗАИНДОЛЬНОЕ ПРОИЗВОДНОЕ | 2015 |
|
RU2649575C1 |
| ПРОИЗВОДНЫЕ ЦИКЛИЧЕСКОГО ЦИАНОЕНОНА КАК МОДУЛЯТОРЫ KEAP1 | 2021 |
|
RU2822828C1 |
| КОНДЕНСИРОВАННОЕ ХИНОЛИНОВОЕ ПРОИЗВОДНОЕ И ЕГО ПРИМЕНЕНИЕ | 2005 |
|
RU2384571C2 |
| ГЕТЕРОАРОМАТИЧЕСКИЕ МОДУЛЯТОРЫ РЕТИНОЛ-СВЯЗАННОГО ОРФАННОГО РЕЦЕПТОРА ГАММА | 2017 |
|
RU2771280C2 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ НЕВРОПАТИИ | 2003 |
|
RU2337682C2 |


Изобретение относится к производным гризеофульвина, фармацевтической композиции на их основе, а также к применению фармацевтической композиции для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, где композиция содержит соединение общей формулы (1’) или его фармакологически приемлемую соль, где R1 представляет собой C1-C6 алкильую группу, необязательно замещенную одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, R2 представляет собой C1-C6 алкильную группу, A представляет собой 5-членное ароматическое гетероциклическое кольцо, выбранное из пиразолила и оксадиазолила, 6-членное ароматическое гетероциклическое кольцо, выбранное из пиридинила и пиримидинила, или одинарную связь (если одинарная связь, то один или другой из R3 и R3’ отсутствует); R3 и R3’, каждый независимо, представляют собой атом водорода, гидроксигруппу, C1-C6 алкильную группу, необязательно замещенную одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, C1-C6 алкоксигруппу, необязательно замещенную одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, 6-членную ароматическую гетероциклическую группу, выбранную из пиперидинила и тетрагидропиранила, необязательно замещенную одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, или R3 и R3’ могут образовывать 6-членное ненасыщенное гетероциклическое кольцо в качестве кольца, которое связывается и конденсируется с A, и указанное кольцо необязательно замещено одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, группа заместителя X представляет собой атом галогена, гидроксигруппу, C1-C6 алкильную группу, C1-C6 алкоксигруппу. Технический результат: получены новые соединения, а также фармацевтическая композиция на их основе, которые могут найти применение в медицине для лечения воспалительного заболевания центральной нервной системы. 10 н. и 7 з.п. ф-лы, 4 ил., 17 табл., 25 пр.
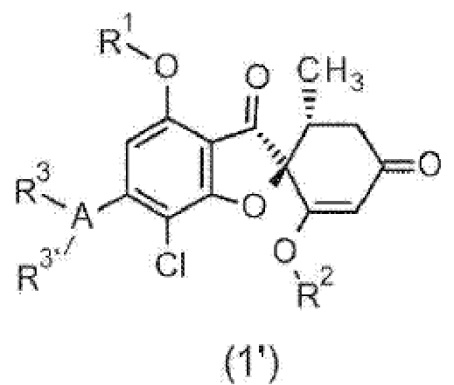
1. Соединение или его фармакологически приемлемая соль, где соединение представляет собой любое соединение, выбранное из следующей группы:
(2S,5’R)-7-хлор-6-(5-этил-1,3,4-оксадиазол-2-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-тетрагидропиран-4-ил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[5-(1-метил-4-пиперидил)-1,3,4-оксадиазол-2-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-6-[5-(4-фтор-1-метил-4-пиперидил)-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-6-[5-[(1S)-1-метоксиэтил]-1,3,4-оксадиазол-2-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-4-этокси-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-4-(дифторметокси)-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-6-[3-(1-метоксиэтил)-1,2,4-оксадиазол-5-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-6-[3-(1-гидрокси-1-метилэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(1H-пиразол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-6-[1-(2-метоксиэтил)пиразол-3-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-6-(1,8-диокса-2-азаспиро[4.5]дец-2-ен-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(8-метил-1-окса-2,8-диазаспиро[4.5]дец-2-ен-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-6-(2-метоксипиримидин-5-ил)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-6-(6-метокси-3-пиридил)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(3-пиридил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион.
2. Фармацевтическая композиция для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, содержащая соединение по п. 1 или его фармакологически приемлемую соль в качестве активного ингредиента.
3. Применение фармацевтической композиции по п. 2 для предупреждения и/или лечения воспалительного заболевания центральной нервной системы.
4. Применение фармацевтической композиции для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, где композиция содержит соединение общей формулы (1’) или его фармакологически приемлемую соль:
[Химическая формула 8]
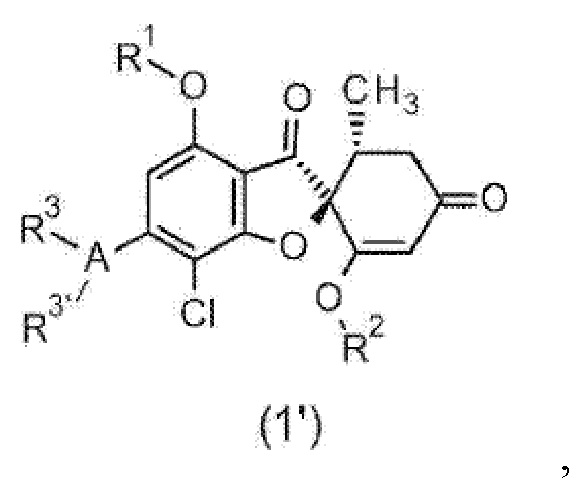
где R1 представляет собой
C1-C6 алкильную группу, необязательно замещенную одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
R2 представляет собой
C1-C6 алкильную группу,
A представляет собой:
5-членное ароматическое гетероциклическое кольцо, выбранное из пиразолила и оксадиазолила,
6-членное ароматическое гетероциклическое кольцо, выбранное из пиридинила и пиримидинила,
или одинарную связь (если одинарная связь, то один или другой из R3 и R3’ отсутствует),
R3 и R3’, каждый независимо, представляют собой атом водорода, гидроксигруппу,
C1-C6 алкильную группу, необязательно замещенную одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
C1-C6 алкоксигруппу, необязательно замещенную одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
6-членную ароматическую гетероциклическую группу, выбранную из пиперидинила и тетрагидропиранила, необязательно замещенную одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X, или
R3 и R3’ могут образовывать 6-членное ненасыщенное гетероциклическое кольцо в качестве кольца, которое связывается и конденсируется с A, и указанное кольцо необязательно замещено одинаковыми или различными одним-двумя заместителями, выбранными из группы заместителя X,
группа заместителя X представляет собой
атом галогена, гидроксигруппу, C1-C6 алкильную группу, C1-C6 алкоксигруппу.
5. Применение по п. 4, отличающееся тем, что R1 представляет собой метильную группу, этильную группу или гидроксиэтильную группу.
6. Применение по п. 4 или 5, отличающееся тем, что R2 представляет собой метильную группу.
7. Применение по любому из пп. 4-6, отличающееся тем, что A представляет собой 5-членное ароматическое гетероциклическое кольцо, R3 представляет собой метильную группу, этильную группу, гидрокси-C1-C3 алкильную группу или метокси-C1-C3 алкильную группу и R3’ представляет собой атом водорода.
8. Применение фармацевтической композиции для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, где композиция содержит соединение общей формулы (1’’) или его фармакологически приемлемую соль:
[Химическая формула 14]

где R1 представляет собой метильную группу или этильную группу,
R2 представляет собой метильную группу,
A представляет собой любое кольцо, выбранное из следующей группы:
[Химическая формула 15]

[* указывает связывающую группу],
R3 представляет собой метильную группу или этильную группу.
9. Применение по п. 4, отличающееся тем, что соединение общей формулы (1’) представляет собой любое соединение, выбранное из следующей группы:
(2S,5’R)-7-хлор-6-(2-гидроксиэтокси)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-6-(2-метоксиэтокси)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(1-метилпиразол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-6-(1-этилпиразол-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(3-метил-1,2,4-оксадиазол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил)-1,2,4-оксадиазол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-6-[5-(1-гидрокси-1-метилэтил)-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-6-[5-[(1S)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-6-[5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-4-этокси-6-[5-(1-гидрокси-1-метилэтил)-1,3,4-оксадиазол-2-ил]-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-4-этокси-6-[5-[(1S)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]-3’-метокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-6-[3-(1-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(3-метил-1,2,4-оксадиазол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-4-(2-гидроксиэтокси)-3’-метокси-5’-метил-6-(5-метил-1,2,4-оксадиазол-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-6-(5-этил-1,3,4-оксадиазол-2-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-тетрагидропиран-4-ил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-[5-(1-метил-4-пиперидил)-1,3,4-оксадиазол-2-ил]спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-6-[5-(4-фтор-1-метил-4-пиперидил)-1,3,4-оксадиазол-2-ил]-3’,4-диметокси-5’- метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-6-[5-[(1S)-1-метоксиэтил]-1,3,4-оксадиазол-2-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-4-этокси-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-4-(дифторметокси)-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-6-[3-(1-метоксиэтил)-1,2,4-оксадиазол-5-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-6-[3-(1-гидрокси-1-метилэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(1H-пиразол-5-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-6-[1-(2-метоксиэтил)пиразол-3-ил]-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-6-(1,8-диокса-2-азаспиро[4.5]дец-2-ен-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(8-метил-1-окса-2,8-диазаспиро[4.5]дец-2-ен-3-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-6-(2-метоксипиримидин-5-ил)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-6-(6-метокси-3-пиридил)-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(3-пиридил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион,
(2S,5’R)-7-хлор-3’,4,6-триметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион.
10. Применение фармацевтической композиции для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, где композиция содержит (2S,5’R)-7-хлор-6-(1-этилпиразол-3-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион или его фармакологически приемлемую соль.
11. Применение фармацевтической композиции для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, где композиция содержит (2S,5’R)-7-хлор-3’,4-диметокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион или его фармакологически приемлемую соль.
12. Применение фармацевтической композиции для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, где композиция содержит (2S,5’R)-7-хлор-6-(5-этил-1,3,4-оксадиазол-2-ил)-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион или его фармакологически приемлемую соль.
13. Применение фармацевтической композиции для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, где композиция содержит (2S,5’R)-7-хлор-6-[3-(1-гидрокси-1-метилэтил)-1,2,4-оксадиазол-5-ил]-3’,4-диметокси-5’-метилспиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион или его фармакологически приемлемую соль.
14. Применение фармацевтической композиции для предупреждения и/или лечения воспалительного заболевания центральной нервной системы, где композиция содержит (2S,5’R)-7-хлор-4-этокси-3’-метокси-5’-метил-6-(5-метил-1,3,4-оксадиазол-2-ил)спиро[бензофуран-2,4’-циклогекс-2-ен]-1’,3-дион или его фармакологически приемлемую соль.
15. Применение по любому из пп. 3-14, отличающееся тем, что воспалительное заболевание центральной нервной системы представляет собой любое заболевание, выбранное из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, деменции с тельцами Леви, множественной системной атрофии, болезни Пика, прогрессирующего надъядерного паралича, дегенерации коры головного мозга, дегенерации лобно-височной доли, болезни Хантингтона, амиотрофического бокового склероза, спинальной и бульбарной мышечной атрофии, спинальной мышечной атрофии, спиноцеребеллярной дегенерации, рассеянного склероза, болезни Крейтцфельдта-Якоба, фатальной семейной бессонницы, синдрома Герстманна-Штреусслера-Шейнкера, синдрома Дауна, болезни Ниманна-Пика, церебральной амилоидной ангиопатии, энцефлопатии на фоне ВИЧ, энцефалопатии на фоне гриппа, печеночной энцефалопатии, прогрессирующей многоочаговой лейкоэнцефалопатии, анти-NMDA-рецепторного энцефалита, церебро-сосудистых расстройств, травматических повреждений головного мозга, повреждений спинного мозга, гипоксической энцефалопатии, эпилепсии, неврита зрительного нерва, врожденных метаболических заболеваний головного мозга, энцефалопатии Вернике, расстройств аутического спектра, расстройств дефицита внимания/гиперактивности, тиковых расстройств, шизофрении, биполярных расстройств, больших депрессивных расстройств (устойчивой к лечению депрессии и послеродовой депрессии), устойчивых депрессивных расстройств (дистимического расстройства), предменструальных дистимических расстройств, тревожных расстройств, фокальной фобии, панических расстройств, обсессивно-компульсивных расстройств, расстройств, связанных с эмоциональной травмой и стрессом, пищевых расстройств, нарушений суточного ритма сна/бодрствования, нарколепсии, расстройств, связанных с употреблением психоактивных веществ (алкогольной зависимости и наркотической зависимости), расстройств контроля над побуждениями, бреда, расстройств личности и синдрома Ретта.
16. Применение по любому из пп. 3-14, отличающееся тем, что воспалительное заболевание центральной нервной системы представляет собой любое заболевание, выбранное из группы, состоящей из
болезни Альцгеймера, болезни Паркинсона, деменции с тельцами Леви, множественной системной атрофии, болезни Пика, прогрессирующего надъядерного паралича, дегенерации коры головного мозга, дегенерации лобно-височной доли, болезни Хантингтона, амиотрофического бокового склероза, спинальной и бульбарной мышечной атрофии, спинальной мышечной атрофии, спиноцеребеллярной дегенерации, рассеянного склероза, болезни Крейтцфельдта-Якоба, шизофрении, биполярных расстройств, больших депрессивных расстройств (устойчивой к лечению депрессии и послеродовой депрессии), устойчивых депрессивных расстройств (дистимического расстройства), предменструальных дистимических расстройств, тревожных расстройств, фокальной фобии, панических расстройств, обсессивно-компульсивных расстройств, расстройств, связанных с эмоциональной травмой и стрессом, пищевых расстройств, нарушений суточного ритма сна/бодрствования, нарколепсии, расстройств, связанных с употреблением психоактивных веществ (алкогольной зависимости и наркотической зависимости), расстройств контроля над побуждениями, бреда, расстройств личности и синдрома Ретта.
17. Применение по любому из пп. 3-14, отличающееся тем, что воспалительное заболевание центральной нервной системы представляет собой любое заболевание, выбранное из группы, состоящей из
шизофрении, биполярных расстройств, больших депрессивных расстройств (устойчивой к лечению депрессии и послеродовой депрессии), устойчивых депрессивных расстройств (дистимического расстройства), предменструальных дистимических расстройств, тревожных расстройств, фокальной фобии, панических расстройств и обсессивно-компульсивных расстройств.
| GREEN G | |||
| F | |||
| H | |||
| ET AL, Journal of the Chemical Society, 1964, pp | |||
| Аппарат для электрической передачи изображений без проводов | 1920 |
|
SU144A1 |
| WO 2010124695 A1, 04.11.2010 | |||
| VINCET A.M | |||
| ET AL, Amyotrophic Lateral Sclerosis and Other Motor Neuron Disorders, 6 (1), 2005, pp | |||
| Солесос | 1922 |
|
SU29A1 |
| WO 2010072770 A3, 01.07.2010 | |||
| SORRENTINO ET AL, Agents and Actions, Birkhaeuser Verlag, Basel, vol | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Соломорезка | 1918 |
|
SU157A1 |
| ГУСЕНИЧНЫЙ ТРАКТОР | 1922 |
|
SU6964A1 |
Авторы
Даты
2022-06-21—Публикация
2018-09-28—Подача