Область техники
[0001]
Настоящее изобретение относится к противоопухолевому агенту и, в частности, относится к комбинированному препарату, содержащему в комбинации сульфонамидное соединение или его соль и другой противоопухолевый агент(ы), а также агент для усиления противоопухолевого эффекта другого противоопухолевого агента(ов).
Предпосылки изобретения
[0002]
Рибонуклеотидредуктаза (далее также называемая RNR) состоит из гетероолигомера большой субъединицы M1 и малой субъединицы M2, и для проявления ферментативной активности необходима экспрессия их обеих. RNR распознает рибонуклеозид-5'-дифосфат (в дальнейшем также называемый NDP) в качестве субстрата и катализирует реакцию восстановления до 2'-дезоксирибонуклеозид-5'-дифосфата (далее также называемого dNDP). Поскольку RNR является ограничивающим скорость ферментом в пути синтеза dNTP de novo, RNR играет существенную роль в синтезе и восстановлении ДНК (непатентный документ 1).
Ферментативная активность RNR тесно связана с пролиферацией клеток, и имеется сообщение, что ферментативная активность особенно высока при злокачественном новообразовании (непатентный документ 2). Действительно, при различных типах солидных опухолей и рака крови сообщалось о многочисленных корреляциях с избыточной экспрессией M2, субъединицы RNR, и ее прогнозом (непатентные документы 3 и 4). Кроме того, ингибирование роста клеток путем ингибирования RNR и противоопухолевого эффекта in vivo было зарегистрировано в клеточных линиях, полученных из нескольких видов злокачественных новообразований, и на неклинических моделях (непатентные документы 5 и 6), поэтому было настоятельно рекомендовано, чтобы RNR была одной из важных молекул-мишеней при лечения злокачественного новообразования.
[0003]
Традиционно в качестве соединений, обладающих активностью ингибирования RNR, известны гидроксимочевина (далее также называемая HU) и тиосемикарбазон 3-аминопиридин-2-карбоксальдегид (далее также называемый 3-АР). Эти соединения отличаются по структуре от сульфонамидных соединений по настоящему изобретению. Хотя HU использовалась клинически в течение более 30 лет, ее ингибирующая RNR активность очень слабая и ее действие ограничено (непатентный документ 7). Кроме того, переносимость при использовании HU также считается проблемой (непатентный документ 8). Между тем, 3-АР имеет структуру, обладающую способностью образовывать хелаты с ионами металлов, и было известно, что 3-АР образует хелаты главным образом с ионами железа, тем самым ингибируя RNR (непатентный документ 9). Однако предполагалось, что 3-АР оказывает нецелевое воздействие на различные другие белки, для образования которых необходимы ионы железа, и известно, что в клинических случаях возникали побочные эффекты, такие как гипоксия, одышка, метгемоглобинемия и тому подобное (непатентный документ 10).
Поэтому было весьма желательным разработать ингибитор RNR, который обладает улучшенной ингибирующей RNR активностью и структурой, которая не образует хелаты с ионами металлов, и может быть использован для лечения заболеваний, связанных с RNR, таких как опухоли.
[0004]
Сообщалось о некоторых комбинационных эффектах, вызванных комбинациями ингибиторов RNR и дополнительных противоопухолевых агентов. Например, сообщалось об усилении эффекта ингибирования пролиферации клеток в клеточной линии немелкоклеточной рака легкого путем комбинации ингибитора RNR 3-АР и антиметаболита цитарабина или гемцитабина (непатентный документ 11). Кроме того, сообщалось об усилении in vivo эффекта продления жизни за счет комбинации 3-АР и ингибирующего топоизомеразу препарата этопозида или препарата платины цисплатина и т.д. с использованием моделей лейкоза мыши (непатентный документ 12).
Список цитирования
Непатентная литература
[0005]
Непатентный документ 1: Annu. Rev. Biochem. 67, 71-98. (1998)
Непатентный документ 2: J. Biol. Chem. 245, 5228-5233. (1970)
Непатентный документ 3: Nat. Commun. 5, 3128 doi: 10,1038 / ncomms 4128 (2014)
Непатентный документ 4: Clin. Sci. 124, 567-578. (2013)
Непатентный документ 5: Expert. Opin. Ther. Targets 17, 1423-1437 (2013)
Непатентный документ 6: Biochem. Pharmacol. 59, 983-991 (2000)
Непатентный документ 7: Biochem. Pharmacol. 78, 1178-11 85 (2009)
Непатентный документ 8: Cancer Res. 54, 3686-3691 (1994)
Непатентный документ 9: Pharmacol. Rev. 57, 547-583 (2005)
Непатентный документ 10: Future Oncol. 8, 145-150 (2012)
Непатентный документ 11: Biochem. Pharmacol. 73, 1548-1557 (2007)
Непатентный документ 12: Biochem. Pharmacol. 59, 983-991 (2000)
Сущность изобретения
Техническая задача
[0006]
Задачей настоящего изобретения является создание способа усиления противоопухолевого эффекта с помощью соединения, сильно ингибирующего RNR.
Решение задачи
[0007]
В результате обширных исследований, направленных на решение вышеупомянутых проблем, авторы настоящего изобретения обнаружили, что группа соединений, имеющих сульфонамидную структуру, представленную следующей формулой (I), обладает превосходной активностью, усиливающей противоопухолевый эффект при совместном использовании с другим соединением(ями), обладающим противоопухолевым эффектом (другой противоопухолевый агент(ы)), и разработали настоящее изобретение. В настоящем изобретение предложено следующее: [1]-[15].
[0008]
[1]
Комбинированный состав для лечения и/или предотвращения опухоли, содержащий сульфонамидное соединение, представленное следующей формулой (I):
[Формула 1]
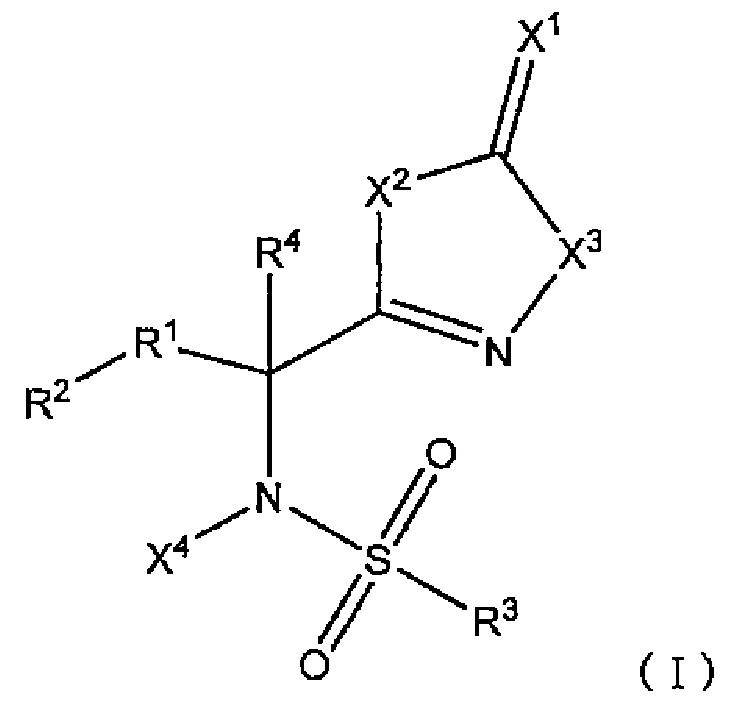
[В формуле
X1 представляет собой атом кислорода или атом серы;
X2 представляет собой атом кислорода или -NH-;
X3 представляет собой -NH- или атом кислорода;
X4 представляет собой атом водорода или C1-C6 алкильную группу;
R1 представляет собой -C(R11)(R12)- или -C(=CH2)-;
R11 и R12 являются одинаковыми или различными и представляют собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу, альтернативно, могут быть взяты вместе с атомами углерода, к которым R11 и R12 присоединены, образуют насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода;
R2 представляет собой C6-C14 ароматическую углеводородную группу или 9 или 10-членную полностью ненасыщенную гетероциклическую группу,
где R2 может иметь заместители, и, когда R2 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители;
R3 представляет собой ароматическую углеводородную группу C6-C14 или 5-10-членную полностью ненасыщенную гетероциклическую группу,
где R3 может иметь заместители, и, когда R3 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители; и
R4 представляет собой атом водорода или C1-C6 алкильную группу;
(при условии, что X1 является атомом кислорода, когда X2 представляет собой атом кислорода, X3 представляет собой -NH-, X4 представляет собой атом водорода, R1 представляет собой -CH2-, R2 представляет собой фенильную группу, R3 представляет собой 4-метилфенильную группу, и R4 представляет собой атом водорода)]
или его соль и другой противоопухолевый агент(ы).
[0009]
[2]
Комбинированный состав в соответствии с [1], где в формуле (I):
X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12)-;
R11 и R12 являются одинаковыми или различными и представляют собой атом водорода или C1-C6 алкильную группу;
R2 представляет собой C6-C14 ароматическую углеводородную группу, где R2 может содержать R21 в качестве заместителя;
R21 представляет собой атом галогена или C1-C6 алкильную группу (когда присутствуют два или более из R21, R21 являются одинаковыми или отличаются друг от друга);
R3 представляет собой C6-C14 ароматическую углеводородную группу, которая может содержать R31 в качестве заместителя или может быть конденсирована с 4-8-членным насыщенным гетероциклическим кольцом (где насыщенное гетероциклическое кольцо может содержать Rc в качестве заместителя);
R31 представляет собой атом галогена или аминокарбонильную группу (когда присутствуют два или более из R31, R31 являются одинаковыми или отличаются друг от друга);
Rc представляет собой атом галогена, гидрокси группу или C1-C6 алкильную группу (когда присутствуют два или более из Rc, Rc являются одинаковыми или отличаются друг от друга); и
R4 представляет собой атом водорода.
[0010]
[3]
Комбинированный состав в соответствии с [1] или [2], где в формуле (I),
X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12)-;
один из R11 и R12 представляет собой атом водорода, и другой представляет собой C1-C6 алкильную группу;
R2 представляет собой фенильную группу, где R2 может содержать R21 в качестве заместителя;
R21 представляет собой атом галогена или C1-C6 алкильную группу (когда присутствуют два или более из R21, R21 являются одинаковыми или отличаются друг от друга);
R3 представляет собой фенильную группу, которая может содержать R31 в качестве заместителя или может быть конденсирована с моноциклическим 6-членным насыщенным гетероциклическим кольцом, имеющим один атом кислорода (где насыщенное гетероциклическое кольцо может содержать Rc в качестве заместителя);
R31 представляет собой атом галогена или аминокарбонильную группу (когда присутствуют два или более из R31, R31 являются одинаковыми или отличаются друг от друга);
Rc представляет собой атом галогена, гидрокси группу или C1-C6 алкильную группу (когда присутствуют два или более из Rc, Rc являются одинаковыми или отличаются друг от друга); и
R4 представляет собой атом водорода.
[0011]
[4]
Комбинированный состав в соответствии с любым одним из [1]-[3], где в формуле (I),
X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12)-;
один из R11 и R12 представляет собой атом водорода, и другой представляет собой метильную группу;
R2 представляет собой фенильную группу, содержащую R21 в качестве заместителя;
R21 представляет собой атом галогена или C1-C6 алкильную группу (когда присутствуют два или более из R21, R21 являются одинаковыми или отличаются друг от друга);
R3 представляет собой фенильную группу, содержащую R31 в качестве заместителя или хроманильную группу, содержащую Rc в качестве заместителя;
R31 представляет собой атом галогена или аминокарбонильную группу (когда присутствуют два или более из R31, R31 являются одинаковыми или отличаются друг от друга);
Rc представляет собой атом галогена, гидрокси группу или C1-C6 алкильную группу (когда присутствуют два или более из Rc, Rc являются одинаковыми или отличаются друг от друга); и
R4 представляет собой атом водорода.
[0012]
[5]
Комбинированный состав в соответствии с любым одним из [1]-[4], где сульфонамидное соединение выбрано из следующих соединений (1)-(5):
(1) 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(2) 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(3) 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(4) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамид; и
(5) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид.
[0013]
[6]
Комбинированный состав в соответствии с любым одним из [1]-[5], где сульфонамидное соединение, представленное формулой (I), или его соль и другой противоопухолевый агент(ы) вводятся одновременно, последовательно или в шахматном порядке.
[0014]
[7]
Комбинированный состав в соответствии с любым одним из [1]-[6], где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата.
[0015]
[8]
Комбинированный состав в соответствии с любым одним из [1]-[7], где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из 5-фторурацила (5-FU), трифлуридина, флударабина (или активного метаболита флударабина нуклеозида), цитарабина, гемцитабина, децитабина, гуадецитабина, азацитидина, цисплатина, оксалиплатина, карбоплатина, этопозида, AZD6738, прексасертиба, SCH900776, люминеспиба, олапариба, талазопариба, лапатиниба, сунитиниба, кабозантиниба и мидостаурина.
[0016]
[9]
Агент для усиления противоопухолевого эффекта другого противоопухолевого агента(ов), содержащий сульфонамидное соединение, представленное следующей формулой (I):
[Формула 2]

[В формуле
X1 представляет собой атом кислорода или атом серы;
X2 представляет собой атом кислорода или -NH-;
X3 представляет собой -NH- или атом кислорода;
X4 представляет собой атом водорода или C1-C6 алкильную группу;
R1 представляет собой -C(R11)(R12)- или -C(=CH2)-;
R11 и R12 являются одинаковыми или различными и представляют собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу, альтернативно, могут быть взяты вместе с атомами углерода, к которым R11 и R12 присоединены, образуют насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода;
R2 представляет собой C6-C14 ароматическую углеводородную группу или 9 или 10-членную полностью ненасыщенную гетероциклическую группу,
где R2 может иметь заместители, и, когда R2 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители;
R3 представляет собой ароматическую углеводородную группу C6-C14 или 5-10-членную полностью ненасыщенную гетероциклическую группу,
где R3 может иметь заместители, и, когда R3 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители; и
R4 представляет собой атом водорода или C1-C6 алкильную группу;
(при условии, что X1 является атомом кислорода, когда X2 представляет собой атом кислорода, X3 представляет собой -NH-, X4 представляет собой атом водорода, R1 представляет собой -CH2-, R2 представляет собой фенильную группу, R3 представляет собой 4-метилфенильную группу, и R4 представляет собой атом водорода)]
или его соль в качестве активного ингредиента.
[0017]
[10]
Противоопухолевый агент, содержащий сульфонамидное соединение или его соль, для лечения больного злокачественным новообразованием, получающего другой противоопухолевый агент(ы), где сульфонамидным соединением является соединение, представленное следующей формулой (I):
[Формула 3]

[В формуле
X1 представляет собой атом кислорода или атом серы;
X2 представляет собой атом кислорода или -NH-;
X3 представляет собой -NH- или атом кислорода;
X4 представляет собой атом водорода или C1-C6 алкильную группу;
R1 представляет собой -C(R11)(R12)- или -C(=CH2)-;
R11 и R12 являются одинаковыми или различными и представляют собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу, альтернативно, могут быть взяты вместе с атомами углерода, к которым R11 и R12 присоединены, образуют насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода;
R2 представляет собой C6-C14 ароматическую углеводородную группу или 9 или 10-членную полностью ненасыщенную гетероциклическую группу,
где R2 может иметь заместители, и, когда R2 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители;
R3 представляет собой ароматическую углеводородную группу C6-C14 или 5-10-членную полностью ненасыщенную гетероциклическую группу,
где R3 может иметь заместители, и, когда R3 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители; и
R4 представляет собой атом водорода или C1-C6 алкильную группу;
(при условии, что X1 является атомом кислорода, когда X2 представляет собой атом кислорода, X3 представляет собой -NH-, X4 представляет собой атом водорода, R1 представляет собой -CH2-, R2 представляет собой фенильную группу, R3 представляет собой 4-метилфенильную группу, и R4 представляет собой атом водорода)].
[0018]
[11]
Фармацевтическая композиция, содержащая сульфонамидное соединение или его соль и другой противоопухолевый агент(ы), где сульфонамидным соединением является соединение, представленное следующей формулой (I):
[Формула 4]

[В формуле
X1 представляет собой атом кислорода или атом серы;
X2 представляет собой атом кислорода или -NH-;
X3 представляет собой -NH- или атом кислорода;
X4 представляет собой атом водорода или C1-C6 алкильную группу;
R1 представляет собой -C(R11)(R12)- или -C(=CH2)-;
R11 и R12 являются одинаковыми или различными и представляют собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу, альтернативно, могут быть взяты вместе с атомами углерода, к которым R11 и R12 присоединены, образуют насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода;
R2 представляет собой C6-C14 ароматическую углеводородную группу или 9 или 10-членную полностью ненасыщенную гетероциклическую группу,
где R2 может иметь заместители, и, когда R2 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители;
R3 представляет собой ароматическую углеводородную группу C6-C14 или 5-10-членную полностью ненасыщенную гетероциклическую группу,
где R3 может иметь заместители, и, когда R3 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители; и
R4 представляет собой атом водорода или C1-C6 алкильную группу;
(при условии, что X1 является атомом кислорода, когда X2 представляет собой атом кислорода, X3 представляет собой -NH-, X4 представляет собой атом водорода, R1 представляет собой -CH2-, R2 представляет собой фенильную группу, R3 представляет собой 4-метилфенильную группу, и R4 представляет собой атом водорода)].
[0019]
[12]
Сульфонамидное соединение, представленное следующей формулой (I):
[Формула 5]

[В формуле
X1 представляет собой атом кислорода или атом серы;
X2 представляет собой атом кислорода или -NH-;
X3 представляет собой -NH- или атом кислорода;
X4 представляет собой атом водорода или C1-C6 алкильную группу;
R1 представляет собой -C(R11)(R12)- или -C(=CH2)-;
R11 и R12 являются одинаковыми или различными и представляют собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу, альтернативно, могут быть взяты вместе с атомами углерода, к которым R11 и R12 присоединены, образуют насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода;
R2 представляет собой C6-C14 ароматическую углеводородную группу или 9 или 10-членную полностью ненасыщенную гетероциклическую группу,
где R2 может иметь заместители, и, когда R2 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители;
R3 представляет собой ароматическую углеводородную группу C6-C14 или 5-10-членную полностью ненасыщенную гетероциклическую группу,
где R3 может иметь заместители, и, когда R3 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители; и
R4 представляет собой атом водорода или C1-C6 алкильную группу;
(при условии, что X1 является атомом кислорода, когда X2 представляет собой атом кислорода, X3 представляет собой -NH-, X4 представляет собой атом водорода, R1 представляет собой -CH2-, R2 представляет собой фенильную группу, R3 представляет собой 4-метилфенильную группу, и R4 представляет собой атом водорода)]
или его соль для применения при лечении и/или предотвращении опухоли путем введения сульфонамидного соединения или его соли и другого противоопухолевого агента(ов) одновременно, последовательно или в шахматном порядке.
[0020]
[13]
Продукт, содержащий сульфонамидное соединение, представленное следующей формулой (I):
[Формула 6]

[В формуле
X1 представляет собой атом кислорода или атом серы;
X2 представляет собой атом кислорода или -NH-;
X3 представляет собой -NH- или атом кислорода;
X4 представляет собой атом водорода или C1-C6 алкильную группу;
R1 представляет собой -C(R11)(R12)- или -C(=CH2)-;
R11 и R12 являются одинаковыми или различными и представляют собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу, альтернативно, могут быть взяты вместе с атомами углерода, к которым R11 и R12 присоединены, образуют насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода;
R2 представляет собой C6-C14 ароматическую углеводородную группу или 9 или 10-членную полностью ненасыщенную гетероциклическую группу,
где R2 может иметь заместители, и, когда R2 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители;
R3 представляет собой ароматическую углеводородную группу C6-C14 или 5-10-членную полностью ненасыщенную гетероциклическую группу,
где R3 может иметь заместители, и, когда R3 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители; и
R4 представляет собой атом водорода или C1-C6 алкильную группу;
(при условии, что X1 является атомом кислорода, когда X2 представляет собой атом кислорода, X3 представляет собой -NH-, X4 представляет собой атом водорода, R1 представляет собой -CH2-, R2 представляет собой фенильную группу, R3 представляет собой 4-метилфенильную группу, и R4 представляет собой атом водорода)]
или его соль для применения при лечении и/или предотвращении опухоли путем введения сульфонамидного соединения или его соли и другого противоопухолевого агента(ов) одновременно, последовательно или в шахматном порядке,
и другой противоопухолевый агент(ы), в виде комбинированного состава.
[0021]
[14]
Способ лечения и/или предотвращения опухоли, включающий введение сульфонамидного соединения, представленного следующей формулой (I):
[Формула 7]

[В формуле
X1 представляет собой атом кислорода или атом серы;
X2 представляет собой атом кислорода или -NH-;
X3 представляет собой -NH- или атом кислорода;
X4 представляет собой атом водорода или C1-C6 алкильную группу;
R1 представляет собой -C(R11)(R12)- или -C(=CH2)-;
R11 и R12 являются одинаковыми или различными и представляют собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу, альтернативно, могут быть взяты вместе с атомами углерода, к которым R11 и R12 присоединены, образуют насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода;
R2 представляет собой C6-C14 ароматическую углеводородную группу или 9 или 10-членную полностью ненасыщенную гетероциклическую группу,
где R2 может иметь заместители, и, когда R2 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители;
R3 представляет собой ароматическую углеводородную группу C6-C14 или 5-10-членную полностью ненасыщенную гетероциклическую группу,
где R3 может иметь заместители, и, когда R3 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители; и
R4 представляет собой атом водорода или C1-C6 алкильную группу;
(при условии, что X1 является атомом кислорода, когда X2 представляет собой атом кислорода, X3 представляет собой -NH-, X4 представляет собой атом водорода, R1 представляет собой -CH2-, R2 представляет собой фенильную группу, R3 представляет собой 4-метилфенильную группу, и R4 представляет собой атом водорода)]
или его соли и другого противоопухолевого агента(ов) одновременно, последовательно или в шахматном порядке.
[0022]
[15]
Способ лечения и/или предотвращения опухоли, включающий введение сульфонамидного соединения, представленного следующей формулой (I):
[Формула 8]

[В формуле
X1 представляет собой атом кислорода или атом серы;
X2 представляет собой атом кислорода или -NH-;
X3 представляет собой -NH- или атом кислорода;
X4 представляет собой атом водорода или C1-C6 алкильную группу;
R1 представляет собой -C(R11)(R12)- или -C(=CH2)-;
R11 и R12 являются одинаковыми или различными и представляют собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу, альтернативно, могут быть взяты вместе с атомами углерода, к которым R11 и R12 присоединены, образуют насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода;
R2 представляет собой C6-C14 ароматическую углеводородную группу или 9 или 10-членную полностью ненасыщенную гетероциклическую группу,
где R2 может иметь заместители, и, когда R2 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители;
R3 представляет собой ароматическую углеводородную группу C6-C14 или 5-10-членную полностью ненасыщенную гетероциклическую группу,
где R3 может иметь заместители, и, когда R3 имеет два заместителя на атомах углерода, которые находятся рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомами углерода, к которым заместители присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, каждое из которых может иметь заместители; и
R4 представляет собой атом водорода или C1-C6 алкильную группу;
(при условии, что X1 является атомом кислорода, когда X2 представляет собой атом кислорода, X3 представляет собой -NH-, X4 представляет собой атом водорода, R1 представляет собой -CH2-, R2 представляет собой фенильную группу, R3 представляет собой 4-метилфенильную группу, и R4 представляет собой атом водорода)]
или его соли больному злокачественным новообразованием, получающему другой противоопухолевый агент(ы).
[0023]
Настоящее изобретение относится также к следующим аспектам:
Фармацевтическая композиция для предотвращения и/или лечения опухоли, содержащая вышеуказанное сульфонамидное соединение, представленное формулой (I), или его соль и другой противоопухолевый агент(ы).
Сульфонамидное соединение, представленное приведенной выше формулой (I) или его соль для усиления противоопухолевого эффекта другого противоопухолевого агента(ов).
Применение сульфонамидного соединения, представленного приведенной выше формулой (I), или его соли для усиления противоопухолевого эффекта другого противоопухолевого агента(ов).
Применение сульфонамидного соединения, представленного приведенной выше формулой (I), или его соли при изготовлении средства для усиления противоопухолевого эффекта другого противоопухолевого агента(ов).
Способ предотвращения и/или лечения опухоли, включающий стадию введения пациенту профилактически и/или терапевтически эффективного количества сульфонамидного соединения, представленного приведенной выше формулой (I), или его соли и другого противоопухолевого агента(ов) в комбинации.
Способ предотвращения и/или лечения опухоли, включающий стадию введения больному злокачественным новообразованием, получающему другой противоопухолевый агент(ы), профилактически и/или терапевтически эффективного количества сульфонамидного соединения, представленного приведенной выше формулой (I), или его соли.
Способ усиления противоопухолевого эффекта, включающий стадию введения больному злокачественным новообразованием, получающему другой противоопухолевый агент(ы), терапевтически и/или профилактически эффективного количества сульфонамидного соединения, представленного вышеуказанной формулой (I), или его соли.
Продукт, содержащий сульфонамидное соединение, представленное приведенной выше формулой (I), или его соль и другой противоопухолевый агент(ы) в виде комбинированного состава, используемого одновременно, последовательно или в шахматном порядке для предотвращения и/или лечения опухоли .
[0024]
Настоящее описание охватывает содержание, раскрытое в заявке на патент Японии № 2017-229681, на которой основан приоритет настоящей заявки.
Полезные эффекты изобретения
[0025]
В соответствии с настоящим изобретением может быть проведено лечение злокачественного новообразования с превосходным противоопухолевым эффектом, при этом предотвращены побочные эффекты.
Краткое описание чертежей
[0026]
[Фигура 1] Представляет собой диаграмму, иллюстрирующую противоопухолевый эффект при пероральном введении соединений примеров 5 и 11 мышам с подкожной трансплантацией линии клеток рака крови человека с точки зрения суточного изменения относительного объема опухоли (далее также называемого «RTV»).
[Фигура 2] Представляет собой диаграмму, иллюстрирующую противоопухолевый эффект при пероральном введении соединений примеров 1 и 14 мышам с подкожной трансплантацией линии клеток рака крови человека с точки зрения суточного изменения RTV.
[Фигура 3] Представляет собой диаграмму, иллюстрирующую противоопухолевый эффект при пероральном введении соединений примеров 209A, 222A и 235A мышам с подкожной трансплантацией линии клеток рака крови человека с точки зрения суточного изменения RTV.
[Фигура 4] Представляет собой диаграмму, иллюстрирующую противоопухолевый эффект при пероральном введении соединений примеров 200A и 228A мышам с подкожной трансплантацией линии клеток рака крови человека с точки зрения суточного изменения RTV.
Подробное описание изобретения
[0027]
В настоящем изобретении ингибиторы RNR, которые обеспечивают превосходный синергетический эффект с другими противоопухолевыми агентами, представляют собой сульфонамидные соединения, представленные приведенной выше формулой (I), или их соли.
[0028]
«CA-CB», используемый в настоящем документе для описания групп, относится к группе, имеющей A-B число атомов углерода. Например, «C1-C6 алкильная группа» представляет собой алкильную группу, имеющую от 1 до 6 атомов углерода. Термин «A-B-членный» указывает, что число атомов, составляющих кольцо (члены кольца), составляет A-B. Например, «5-10-членная ненасыщенная гетероциклическая группа» означает ненасыщенную гетероциклическую группу, в которой число членов кольца равно 5-10.
[0029]
«Заместитель», как используется в настоящем документе, относится к атому галогена, гидрокси группе, амино группе, оксо группе, циано группе, нитро группе, карбоксильной группе, аминокарбонильной группе, тиоамидной группе, C1-C6-алкильной группе, C2-C6-алкинильной группе, C3-C6-циклоалкильной группе, C1-C6-алкокси группе, C1-C6-алкокси-C1-C6-алкокси группе, галоген-C1-C6-алкильной группе, галоген-C1-C6-алкокси группе, C6-C14 ароматической углеводородной группе, ненасыщенной гетероциклической группе, насыщенной гетероциклической группе, азотсодержащей насыщенной гетероциклической группе, азотсодержащей насыщенной гетероциклической карбонильной группе, C1-C14 ацильной группе, C1-C14 ациламино группе, C2-C7 алкоксикарбонильной группе, C1-C14 ацилокси группе, C7-C13 аралкилокси группе и тому подобное.
[0030]
«Атом галогена», как используется в настоящем документе, относится к атому фтора, атому хлора, атому брома и атому йода.
[0031]
«C1-C6 алкильная группа», как используется в настоящем документе, относится к прямой или разветвленной насыщенной углеводородной группе, имеющей от 1 до 6 атомов углерода, такой как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, трет-бутильная группа, н-пентильная группа, изопентильная группа, гексильная группа и тому подобное.
[0032]
«С2-С6-алкинильная группа», как используется в настоящем документе, относится к ненасыщенной углеводородной группе с прямой или разветвленной цепью, имеющей от 2 до 6 атомов углерода и, по меньшей мере, одну тройную связь, например, этинильная, 1- или 2-пропинильная группа, 1-, 2- или 3-бутинильная группа, 1-метил-2-пропинильная группа и тому подобное.
[0033]
«C3-C6 циклоалкильная группа», как используется в настоящем документе, относится к насыщенной циклической углеводородной группе, имеющей от 3 до 6 атомов углерода, например, циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа и тому подобное.
[0034]
«C1-C6 алкокси группа», как используется в настоящем документе, относится к окси группе, с которой связана насыщенная углеводородная группа с прямой или разветвленной цепью, имеющая от 1 до 6 атомов углерода, например, метокси группа, этоксигруппа, пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, трет-бутоксигруппа, пентилоксигруппа, изопентилоксигруппа, гексилоксигруппа и тому подобное.
[0035]
«C1-C6 алкокси-C1-C6 алкокси группа», как используется в настоящем документе, относится к C1-C6 алкокси группе, в которой один из атомов водорода C1-C6 алкокси группы заменен C1-C6 алкокси группой, например, метоксиметокси группа, метоксиэтоксигруппа, метоксипропоксигруппа, этоксиметокси группа, этоксиэтоксигруппа, пропоксиметокси группа и тому подобное.
[0036]
«Галоген-С1-С6-алкильная группа», как используется в настоящем документе, относится к C1-C6 алкильной группе, в которой один или несколько атомов водорода заменены атомом галогена, например, фторметильная группа, дифторметильная группа, трифторметильная группа, трихлорметильная группа, фторэтильная группа, 1,1,1-трифторэтильная группа, монофтор-н-пропильная группа, перфтор-н-пропильная группа, перфторизопропильная группа и тому подобное.
[0037]
«C6-C14 ароматическая углеводородная группа», как используется в настоящем документе, относится к моноциклической или полициклической ароматической углеводородной группе, имеющей от 6 до 14 атомов углерода, например, фенильная группа, нафтильная группа, антраценильная группа, фенантрильная группа, флуоренильная группа и тому подобное.
[0038]
«Ненасыщенная гетероциклическая группа», как используется в настоящем документе, относится к моноциклической или полициклической ненасыщенной гетероциклической группе, имеющей по меньшей мере один гетероатом, выбранный из атома азота, атома серы и атома кислорода (предпочтительно, от 1 до 4, более предпочтительно, от 1 до 3). Ненасыщенная гетероциклическая группа включает полностью ненасыщенную гетероциклическую группу (полностью ненасыщенная гетероциклическая группа) и частично ненасыщенную гетероциклическую группу (частично ненасыщенная гетероциклическая группа).
[0039]
Полностью ненасыщенная гетероциклическая группа включает, например, пирролильную группу, имидазолильную группу, пиразолильную группу, триазолильную группу, тетразолил, фуранил (фурильную группу), оксазолильную группу, изоксазолильную группу, оксадиазолильную группу, тиофенильную группу (тиенильная группа), тиазолильную группу, изотиазолильную группу, тиадиазолильную группу, пиридинильную группу (пиридильная группа), пиримидинильную группу (пиримидильная группа), пиразинильную группу (пиразильная группа), пиридазинильную группу, индолильную группу, изоиндолильную группу, индазолильную группу (бензпиразольная группа), бензимидазолильную группу, бензотриазолильную группу, азаиндолильную группу, пирролопиридинильную группу, имидазопиридинильную группу, пиразолопиридинильную группу, триазолопиридинильную группу, пирролопиримидинильную группу, имидазопиримидинильную группу, пиразолопиримидинильную группу, бензофуранильную группу, (бензофурильная группа), хинолильную группу, изохинолильную группу, хиназолинильную группу, хиноксалильную группу и тому подобное.
[0040]
Частично ненасыщенная гетероциклическая группа включает, например, дигидропиранильную группу, дигидротриазолильную группу, дигидрофуранильную группу, дигидрооксадиазолильную группу, дигидрохинолильную группу, дигидрохиназолинильную группу, индолинильную группу, дигидрохиназолинильную группу, индолинильную группу, тетрагидроизохинолильную группу, метилендиоксифенильную группу, этилендиоксифенильную группу, дигидробензофуранильную группу, дигидробензоксазолильную группу, дигидропиридооксазинильную группу и тому подобное.
[0041]
«Насыщенная гетероциклическая группа», как используется в настоящем документе, относится к моно- или полициклической полностью насыщенной гетероциклической группе, имеющей, по меньшей мере, один гетероатом, выбранный из атома азота, атома серы и атома кислорода (предпочтительно от 1 до 4, более предпочтительно от 1 до 3), и включает, например, азетидинильную группу, пирролидинильную группу, пиперидинильную группу, пиперазинильную группу, гексаметилениминогруппу, морфолино группу, тиоморфолино группу, гомопиперазинильную группу, тетрагидрофуранильную группу, тетрагидропиранильную группу, тетрагидротиофенильную группу, тиазолидинильную группу, оксазолидинильную группу и тому подобное.
[0042]
«Азотсодержащая насыщенная гетероциклическая группа», как используется в настоящем документе, относится к насыщенной гетероциклической группе, имеющей один или несколько атомов азота, которая необязательно включает гетероатом, отличный от атома азота, и включает, например, морфолино группу.
[0043]
«Азотсодержащая насыщенная гетероциклическая карбонильная группа», как используется в настоящем документе, относится к карбонильной группе, с которой связана азотсодержащая насыщенная гетероциклическая группа, и включает, например, морфолинокарбонильную группу.
[0044]
«C1-C14-ацильная группа», как используется в настоящем документе, относится к карбонильной группе, к которой присоединен атом водорода, C1-C6 алкильная группа, C6-C14 ароматическая углеводородная группа или ненасыщенная гетероциклическая группа, и включает, например: формильную группу; (С1-С6-алкил) карбонильную группу, такую как ацетильная группа, пропаноильная группа, бутаноильная группа; (C3-C6 циклоалкил) карбонильную группу, такую как циклопропаноильная группа, циклобутаноильная группа; или (С6-С13) арилкарбонильную группу, такую как бензоильная группа, нафтилкарбонильная группа, флуоренилкарбонильная группа.
[0045]
«C1-C14 ациламиногруппа», как используется в настоящем документе, относится к аминогруппе, в которой один или два атома водорода замещены C1-C14 ацильной группой, и включает, например, ацетиламиногруппу, пропаноиламиногруппу, бутаноиламиногруппу, циклопропаноиламиногруппу.
[0046]
«C2-C7 алкоксикарбонильная группа», как используется в настоящем документе, относится к карбонильной группе, к которой присоединена C1-C6 алкокси группа, и включает, например, метоксикарбонильную группу, этоксикарбонильную группу, н-пропоксикарбонильную группу, изопропоксикарбонильную группу, н-бутоксикарбонильную группу, трет-бутоксикарбонильную группу и тому подобное.
[0047]
«C1-C14 ацилокси группа», как используется в настоящем документе, относится, например, к формилоксигруппе; (C1-C6 алкил) карбонилоксигруппе, такой как метилкарбонилоксигруппа, этилкарбонилоксигруппа, н-пропилкарбонилоксигруппа, изопропилкарбонилоксигруппа, н-бутилкарбонилоксигруппа, изо-бутилкарбонилоксигруппа, трет-бутилкарбонилоксигруппа, н-пентилкарбонилоксигруппа, изопентилкарбонилоксигруппа, гексилкарбонилоксигруппа и тому подобное; (C3-C6 циклоалкил) карбонилоксигруппе, такой как циклопропаноилоксигруппа, циклобутаноилоксигруппа и тому подобное; (C6-C13 арил) карбонилоксигруппе, такой как фенилкарбонилоксигруппа, нафтилкарбонилоксигруппа, флуоренилкарбонилоксигруппа и тому подобное.
[0048]
«C7-C13 аралкилоксигруппа», как используется в настоящем документе, относится к алкилоксигруппе, в которой один атом водорода заменен арильной группой, и включает, например, бензилоксигруппу, фенетилоксигруппу, нафтилметилоксигруппу, флуоренилметилоксигруппу и тому подобное.
[0049]
«Насыщенное или частично ненасыщенное углеводородное кольцо», как используется в настоящем документе, относится к моноциклическому или полициклическому насыщенному или частично ненасыщенному углеводородному кольцу и включает, например, циклопропановое кольцо, циклобутановое кольцо, циклопентановое кольцо, циклогексановое кольцо, циклогептановое кольцо, циклооктановое кольцо, циклобутеновое кольцо, циклопентеновое кольцо, циклогексеновое кольцо, циклогептеновое кольцо, циклооктадиеновое кольцо и тому подобное.
[0050]
«Насыщенное или частично ненасыщенное гетероциклическое кольцо», как используется в настоящем документе, относится к моноциклическому или полициклическому насыщенному или частично ненасыщенному гетероциклическому кольцу, имеющему гетероатом, выбранный из атомов азота, атома серы и атома кислорода, и включает, например, оксирановое кольцо, азетидиновое кольцо, пирролидиновое кольцо, имидазолидиновое кольцо, пиперидиновое кольцо, пиперазиновое кольцо, морфолиновое кольцо, тетрагидрофурановое кольцо, тетрагидропирановое кольцо, диоксановое кольцо, тетрагидротиофеновое кольцо, дигидропирановое кольцо, дигидрофуран и тому подобное.
[0051]
«Спиро гетероциклическая группа», как используется в настоящем документе, относится к насыщенной или ненасыщенной спиро гетероциклической группе, имеющей спиро атом углерода и гетероатом, выбранный из атома азота, атома серы и атома кислорода, и включает, например, 2-окса-6-азаспиро[3,4]октанильную группу, 2-окса-7-азаспиро[3,5] нонанильную группу и тому подобное.
[0052]
«Мостиковая гетероциклическая группа», как используется в настоящем документе, относится к мостиковой гетероциклической группе, имеющей более одного кольца, которая имеет два мостиковых атома углерода и гетероатом, выбранный из атома азота, атома серы и атома кислорода, и включает, например, 3-окса-8-азабицикло[3,2,1]октанильную группу, 8-окса-3-азабицикло[3,2,1]октанильную группу и тому подобное.
[0053]
В соединениях, представленных формулой (I) по настоящему описанию, X1 представляет собой атом кислорода или атом серы. X1 предпочтительно представляет собой атом кислорода.
[0054]
В соединениях, представленных формулой (I) по настоящему описанию, X2 представляет собой атом кислорода или -NH-. X2 предпочтительно представляет собой атом кислорода.
[0055]
В соединениях, представленных формулой (I) по настоящему описанию, X3 представляет собой -NH- или атом кислорода. X3 предпочтительно представляет собой -NH-.
[0056]
В соединениях формулы (I) X4 представляет собой атом водорода или C1-C6 алкильную группу.
«C1-C6 алкильная группа», представленная X4, предпочтительно, представляет собой C1-C3 алкильную группу, более предпочтительно, метильную группу.
X4, предпочтительно, представляет собой атом водорода или метильную группу, более предпочтительно, атом водорода.
[0057]
В соединениях формулы (I) R1 представляет собой -C(R11)(R12)- или -C(=CH2)-.
В -C(R11)(R12)-, R11 и R12 являются одинаковыми или различными и представляют собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу, альтернативно, взятые вместе с атомами углерода, к которым они присоединены, образуют насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода.
«Атом галогена», представленный R11 и R12, предпочтительно, представляет собой атом фтора, атом хлора, атом брома, более предпочтительно, атом фтора.
«C1-C6 алкильная группа», указанная в R11 и R12, предпочтительно, представляет собой C1-C3 алкильную группу, более предпочтительно, метильную группу или этильную группу, более предпочтительно, метильную группу.
[0058]
«Насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода», которое образуется путем объединения R11 и R12 вместе с атомами углерода, к которым они присоединены, предпочтительно, представляет собой моноциклическое насыщенное углеводородное кольцо с 3-6 атомами углерода и, более предпочтительно, циклопропановое кольцо.
Предпочтительно, R11 представляет собой атом галогена, гидрокси группу или C1-C6 алкильную группу, и R12 представляет собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу, альтернативно, R11 и R12 взяты вместе с атомами углерода, к которым они присоединены, образуют насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода. Более предпочтительно, R11 представляет собой C1-C6 алкильную группу, и R12 представляет собой атом водорода, и более предпочтительно, R11 представляет собой метильную группу, и R12 представляет собой атом водорода.
[0059]
R1, предпочтительно, представляет собой -C(R11) (R12)-, R11 представляет собой атом галогена, гидрокси группу или C1-C6 алкильную группу, и R12 представляет собой атом водорода, атом галогена, гидрокси группу или C1-C6 алкильную группу, альтернативно, R11 и R12, взятые вместе с атомами углерода, к которым они присоединены, образуют насыщенное углеводородное кольцо, имеющее от 3 до 8 атомов углерода. Более предпочтительно, -C(R11)(R12)- и R11 представляют собой C1-C6 алкильную группу, R12 представляет собой атом водорода. Еще более предпочтительно, он представляет собой -CH(CH3)-.
[0060]
В соединениях формулы (I) R2 представляет собой C6-C14 ароматическую углеводородную группу или 9-10-членную полностью ненасыщенную гетероциклическую группу.
«C6-C14 ароматическая углеводородная группа», представленная R2, предпочтительно, представляет собой C6-C10 ароматическую углеводородную группу, более предпочтительно, фенильную группу или нафтильную группу, еще более предпочтительно, фенильную группу.
Более того, «полностью ненасыщенная гетероциклическая группа, имеющая 9-10-членов», представленная R2, предпочтительно, представляет собой бициклическую 9-10-членную полностью ненасыщенную гетероциклическую группу, имеющую 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, бициклическую 9-10-членную полностью ненасыщенную гетероциклическую группу, имеющую 1-2 гетероатома, выбранных из атома азота и атома серы, еще более предпочтительно, бензотиофенильную группу, бензотиазолильную группу, хинолильную группу.
[0061]
В соединениях формулы (I) R2 может быть незамещенным или может иметь заместитель. Кроме того, когда R2 имеет два заместителя у атомов углерода, расположенных рядом друг с другом в ароматическом углеводородном кольце, R2 может образовывать 4-8-членное насыщенное или частично ненасыщенное углеводородное кольцо или гетероциклическое кольцо, имеющее заместитель(и), где заместители конденсированы с образованием кольца вместе с атомом углерода, к которому они присоединены.
Когда R2 имеет заместитель, положение заместителя особо не ограничивается, но, например, предпочтительным является 2, 3, 5 или 6-положение, когда R2 представляет собой фенильную группу. Кроме того, число заместителей особо не ограничивается, но, предпочтительно, равно нулю, то есть нет замещения, или составляет 1-4, и, более предпочтительно, 1-4 или 1-3. Когда число заместителей равно двум или более, виды заместителя могут быть одинаковыми или различными.
[0062]
В соединениях формулы (I), предпочтительно, R2 может быть замещен «заместителем», более предпочтительно, R2 может быть замещен R21. Также, предпочтительно, когда R2 имеет два заместителя на атомах углерода, расположенных рядом друг с другом в ароматическом углеводородном кольце, заместители могут быть конденсированы вместе с атомом углерода, к которому они присоединены, с образованием насыщенного или частично ненасыщенного 4-8-членного углеводородного кольца или гетероциклического кольца, необязательно замещенного Rz.
[0063]
R21, который может быть заместителем в R2, представляет собой атом галогена, аминокарбонильную группу, циано группу, C1-C6 алкильную группу, которая может быть замещена Rx, C3-C6 циклоалкильную группу, которая может быть замещена Rx, C2-C6 алкинильную группу, которая может быть замещена Rx, C6-C14 ароматическую углеводородную группу, которая может быть замещена Ry, или ненасыщенное 5-10-членное гетероциклическое кольцо, которое может быть замещено Rz.
Положение, в котором R21 является заместителем, особо не ограничивается, но представляет собой, например, предпочтительно, 2, 3, 5 или 6-положение, когда R2 представляет собой фенильную группу. Кроме того, число заместителей R21 особо не ограничивается, но, предпочтительно, равно нулю, то есть нет замещения, или составляет 1-4, более предпочтительно, 1-4 или 1-3. Когда число заместителей R21 равно двум или более, виды заместителя могут быть одинаковыми или различными.
[0064]
«Атом галогена», указанный в R21, предпочтительно, представляет собой атом фтора, атом хлора или атом брома.
[0065]
«C1-C6 алкильная группа» в «C1-C6 алкильной группе, которая может быть замещена Rx», указанной в R21, предпочтительно, представляет собой C1-C3 алкильную группу, более предпочтительно, метильную группу или этильную группу.
Заместитель Rx в «C1-C6 алкильной группе, которая может быть замещена Rx», указанной в R21, представляет собой атом галогена или C6-C14 ароматическую углеводородную группу. Заместитель Rx, предпочтительно, представляет собой атом галогена, более предпочтительно, атом фтора. Число Rx, которые являются заместителями в С1-С6 алкильной группе, особо не ограничивается, но, предпочтительно, равно нулю, то есть нет замещения, или составляет 1-3. Когда число заместителей Rx составляет 2 или более, виды заместителя могут быть одинаковыми или различными.
[0066]
«C3-C6 циклоалкильная группа» в «C3-C6 циклоалкильной группе, которая может быть замещена Rx», указанной в R21, предпочтительно, представляет собой циклопропильную группу.
Rx в «C3-C6 циклоалкильной группе, которая может быть замещена Rx», указанной в R21, представляет собой атом галогена, как указано выше, или C6-C14 ароматическую углеводородную группу, предпочтительно, атом галогена, более предпочтительно, атом фтора. Число заместителей Rx в C3-C6 циклоалкильной группе особо не ограничивается, но. Предпочтительно, равно нулю, то есть нет замещения, или составляет 1, более предпочтительно 0. Когда число заместителей Rx составляет 2 или более, виды заместителя могут быть таким же или другим.
[0067]
«C2-C6-алкинильная группа» в «C2-C6-алкинильной группе, которая может быть замещена Rx», указанной в R21, предпочтительно, представляет собой C2-C4-алкинильную группу, более предпочтительно, этинильную группу.
Заместитель Rx в «C2-C6-алкинильной группе может быть замещен Rx», указанной в R21, представляет собой атом галогена, как указано выше, или C6-C14-ароматическую углеводородную группу, предпочтительно, C6-C14-ароматическую углеводородную группу, более предпочтительно, C6-C10 ароматическую углеводородную группу, более предпочтительно, фенильную группу.
Число заместителей Rx в C2-C6 алкинильной группе особо не ограничивается, но, предпочтительно, равно нулю, то есть нет замещения, или составляет 1, более предпочтительно, 1. Когда число заместителей Rx составляет 2 или более, виды заместителя могут быть одинаковым или разным.
[0068]
«C6-C14 ароматическая углеводородная группа» в «C6-C14 ароматической углеводородной группе, которая может быть замещена Ry», указанной в R21, предпочтительно, представляет собой C6-C10 ароматическую углеводородную группу, более предпочтительно, фенильную группу.
Заместитель Ry в указанной в R21, представляет собой атом галогена или C1-C6 алкокси группу.
Атом галогена, указанный в Ry, предпочтительно, представляет собой атом фтора или атом хлора. Кроме того, C1-C6 алкокси группа, указанная в Ry, предпочтительно, представляет собой C1-C3 алкокси группу, более предпочтительно, метокси группу. Заместитель Ry в «C6-C14 ароматической углеводородной группе, которая может быть замещена Ry», указанной в R21, предпочтительно, представляет собой атом фтора, атом хлора или C1-C3 алкокси группу, более предпочтительно, атом фтора, атом хлора или метокси группу. Число заместителей Ry в C6-C14 ароматической углеводородной группе особо не ограничивается, но, предпочтительно, равно нулю, то есть нет замещения, или оно составляет 1 или 2. Когда число заместителей Ry составляет 2 или более, виды заместителя могут быть одинаковые или разные.
[0069]
«5-10-членная ненасыщенная гетероциклическая группа» в «5-10-членной ненасыщенной гетероциклической группе, необязательно замещенной Rz», указанной в R21, предпочтительно, представляет собой полностью или частично ненасыщенную моноциклическую или бициклическую 5-10-членную гетероциклическую группу, имеющую 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы или атома кислорода, более предпочтительно, моноциклическую 5-6-членную ненасыщенную гетероциклическую группу, имеющую 1-3 атома азота или атом кислорода. Предпочтительно, она представляет собой пирролильную группу, имидазолильную группу, пиразолильную группу, пиридильную группу, пиримидильную группу, оксазолильную группу, дигидропиридооксазинильную группу, более предпочтительно, пиразолильную группу, пиридильную группу, пиримидильную группу, оксазолильную группу, дигидропиридооксазинильную группу, более предпочтительно, пиразолильную группу.
[0070]
Заместитель Rz в «5-10-членной ненасыщенной гетероциклической группе, необязательно замещенной Rz», указанной в R21, представляет собой атом галогена, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C3-C6 циклоалкильную группу, C1-C6 алкокси группу, C6-C14 ароматическую углеводородную группу, азотсодержащую насыщенную гетероциклическую группу или азотсодержащую насыщенную гетероциклическую карбонильную группу.
«Атом галогена», указанный в Rz, предпочтительно, представляет собой атом фтора или атом хлора.
«C1-C6 алкильная группа», указанная в Rz, предпочтительно, представляет собой C1-C3 алкильную группу, более предпочтительно, метильную группу или этильную группу.
«Галоген-C1-C6-алкильная группа», указанная в Rz, предпочтительно, представляет собой галоген-C1-C3-алкильную группу, более предпочтительно, дифторметильную группу или трифторметильную группу. «C3-C6 циклоалкильная группа», указанная в Rz, предпочтительно, представляет собой циклопропильную группу или циклобутильную группу.
«C1-C6 алкокси группа», указанная в Rz, предпочтительно, представляет собой C1-C3 алкокси группу, более предпочтительно, метокси группу.
«C6-C14 ароматическая углеводородная группа», указанная в Rz, предпочтительно, представляет собой фенильную группу.
«Азотсодержащая насыщенная гетероциклическая группа», представленная Rz, предпочтительно, представляет собой морфолино группу или пиперидинильную группу.
«Азотсодержащая насыщенная гетероциклическая карбонильная группа», указанная в Rz, предпочтительно, представляет собой морфолинокарбонильную группу.
[0071]
Заместитель Rz в «5-10-членной ненасыщенной гетероциклической группе, необязательно замещенной Rz», предпочтительно, представляет собой атом галогена, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C3-C6 циклоалкильную группу, C1-C6 алкокси группу, фенильную группу, морфолино группу, пиперидинильную группу или морфолинокарбонильную группу, более предпочтительно, C1-C6 алкильную группу, более предпочтительно, метильную группу. Число Rz, который является заместителем в 5-10-членной ненасыщенной гетероциклической группы, особо не ограничивается, но, предпочтительно, равно нулю, то есть нет замещения, или, предпочтительно, составляет 1 или 2. Когда число заместителей Rz составляет 2 или более, вид заместителя может быть одинаковым или различным.
[0072]
R21, который может быть заместителем в R2, предпочтительно, представляет собой атом галогена, аминокарбонильную группу, циано группу, C1-C6 алкильную группу (необязательно замещенную атомом галогена), C3-C6 циклоалкильную группу, C2-C6 алкинильную группу (необязательно замещенную C6-C14 ароматической углеводородной группой), C6-C14 ароматическую углеводородную группу (необязательно замещенную группой, выбранной из атома галогена и C1-C6 алкокси группы) или моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода (необязательно замещенную группой, выбранной из атома галогена, C1-C6 алкильной группы, галоген C1-C6 алкильной группы, C3-C6 циклоалкильной группы, C1-C6 алкокси группы, C6-C14 ароматической углеводородной группы, азотсодержащей насыщенной гетероциклической группы и азотсодержащей насыщенной гетероциклической карбонильной группы).
[0073]
Более предпочтительно, представляет собой атом галогена, циано группу, C1-C6 алкильную группу (необязательно замещенную атомом галогена), C3-C6 циклоалкильную группу, фенильную группу (необязательно замещенную группой, выбранной из группы, состоящей из атома галогена или C1-C6 алкокси группы) или моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода (необязательно замещенную группой, выбранной из атома галогена, С1-С6-алкильной группы, галоген-С1-С6-алкильной группы, С3-С6-циклоалкильной группы, С1-С6-алкокси группы, морфолино группы, пиперидинильной группы и морфолинокарбонильной группы).
Более предпочтительно, представляет собой атом галогена, C1-C6 алкильную группу или моноциклическую 5 или 6-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 3 атомов (атомов азота) (необязательно замещенную C1-C6 алкильной группой).
Более предпочтительно, представляет собой атом галогена или C1-C6 алкильную группу.
[0074]
В соединениях формулы (I) когда число заместителей в R2 составляет 2 или более и имеются два заместителя у атомов углерода, расположенных рядом друг с другом в ароматическом углеводородном кольце, «4-8-членное насыщенное или частично ненасыщенное углеводородное кольцо или гетероциклическое кольцо, которое может иметь заместитель(и)», которое образовано путем объединения заместителей и атома углерода, к которому они присоединены, представляет собой кольцо, например, кольцо, конденсированное с бензольным кольцом. «Насыщенное или частично ненасыщенное 4-8-членное углеводородное кольцо или гетероциклическое кольцо» в «4-8-членном насыщенном или частично ненасыщенном углеводородном кольце или гетероциклическом кольце, которое может иметь заместитель(и)», предпочтительно, представляет собой моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо или моноциклическое 4-8-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атомов кислорода, более предпочтительно, насыщенное или частично ненасыщенное углеводородное кольцо, имеющее от 4 до 8 атомов углерода, более предпочтительно, моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее от 4 до 6 атомов углерода, или моноциклическое 4-6-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, и, еще более предпочтительно, моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 5 или 6 атомов углерода, более предпочтительно, насыщенное углеводородное кольцо, имеющее 5 атомов углерода.
[0075]
Заместитель Rz в «4-8-членном насыщенном или частично ненасыщенном углеводородном кольце или гетероциклическом кольце, необязательно замещенном Rz», как указано выше, представляет собой атом галогена, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C3-C6 циклоалкильную группу, C1-C6 алкокси группу, C6-C14 ароматическую углеводородную группу, азотсодержащую насыщенную гетероциклическую группу или азотсодержащую насыщенную гетероциклическую карбонильную группу, предпочтительно, C1-C6 алкильную группу и, более предпочтительно, C1-C3 алкильную группу и, еще более предпочтительно, метильную группу. Число Rz, которые являются заместителями в насыщенном или частично ненасыщенном углеводородном кольце или гетероциклическом кольце, особо не ограничивается, но, предпочтительно, равно нулю, то есть нет замещения, или равно единице, более предпочтительно, оно равно нулю, то есть нет замещения. Когда число заместителей Rz составляет 2 или более, тип заместителя может быть одинаковым или различным.
[0076]
«Насыщенное или частично ненасыщенное 4-8-членное углеводородное кольцо или гетероциклическое кольцо, необязательно замещенное Rz», предпочтительно, представляет собой моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 4-8 атомов углерода, которое необязательно замещено Rz, или моноциклическое 4-8-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 4-8 атомов углерода (которое может быть замещено С1-С6 алкильной группой), или моноциклическое насыщенное или частично ненасыщенное 4-8-членное гетероциклическое кольцо, имеющее 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода (необязательно замещенное С1-С6 алкильной группой), более предпочтительно, насыщенное или частично ненасыщенное моноциклическое углеводородное кольцо, имеющее от 4 до 8 атомов углерода (необязательно замещенное С1-С6 алкильной группой), более предпочтительно, моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 5 или 6 атомов углерода (необязательно замещенное C1-C6 алкильной группой).
[0077]
В соединениях, представленных формулой (I), конденсированное кольцо, которое образуется, когда соединение имеет два заместителя у атомов углерода, расположенных рядом друг с другом в ароматическом углеводородном кольце, R2 представляет собой, например, дигидроинденовое кольцо, тетрагидронафталиновое кольцо, дигидробензофурановое кольцо.
[0078]
В соединениях, представленных формулой (I), R2, предпочтительно, представляет собой C6-C14 ароматическую углеводородную группу или бициклическую полностью ненасыщенную 9-10-членную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атомов кислорода, и R2 может быть замещен R21, и, когда R2 имеет два заместителя на атоме углерода, расположенных рядом друг с другом в ароматическом углеводородном кольце, R2 может быть моноциклическим насыщенным или частично ненасыщенным углеводородным кольцом, имеющим 4-8 атомов углерода (необязательно замещенным C1-C6 алкильной группой), где заместители конденсированы вместе с атомом углерода, к которому присоединен каждый из заместителей, или моноциклическим 4-8-членным насыщенным или частично ненасыщенным гетероциклическим кольцом, имеющим 1-3 гетероатома, выбранных из атома азота, атома серы и атомов кислорода (необязательно замещенным C1-C6 алкильной группой); и
[0079]
R21 представляет собой атом галогена, аминокарбонильную группу, циано группу, C1-C6 алкильную группу (необязательно замещенную атомом галогена), C3-C6 циклоалкильную группу, C2-C6 алкинильную группу (необязательно замещенную C6-C14 ароматической углеводородной группой), C6-C14 ароматическую углеводородную группу (необязательно замещенную группой, выбранной из группы, состоящей из атома галогена и C1-C6 алкокси группы) или моноциклическое или бициклическое 5-10-членное ненасыщенное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода (необязательно замещенное группой, выбранной из группы, состоящей из атома галогена, C1-C6-алкильной группы, галоген-C1-C6-алкильной группы, C3-C6-циклоалкильной группы, C1-C6-алкокси группы, C6-C14-ароматической углеводородной группы, азотсодержащей насыщенной гетероциклической группы и азотсодержащей насыщенной гетероциклической карбонильной группы).
[0080]
В соединениях, представленных формулой (I), R2, более предпочтительно, представляет собой C6-C14 ароматическую углеводородную группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атоме углерода, расположенных рядом друг с другом в ароматическом углеводородном кольце, R2 может образовывать моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее от 4 до 8 атомов углерода (необязательно замещенное С1-С6-алкильной группой), где заместители конденсированы вместе с атомом углерода, к которому присоединен каждый из заместителей;
[0081]
R21 представляет собой атом галогена, циано группу, С1-С6-алкильную группу (необязательно замещенную атомом галогена), С3-С6-циклоалкильную группу, фенильную группу (необязательно замещенную группой, выбранной из группы, состоящей из атома галогена, С1-С6 алкокси группы) или моноциклическое или бициклическое 5-10-членное ненасыщенное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода (необязательно замещенное группой, выбранной из группы, состоящей из атома галогена, C1-C6-алкильной группы, галоген-C1-C6-алкильной группы, C3-C6-циклоалкильной группы, C1-C6-алкокси группы, морфолино-группы, пиперидинильной группы и морфолинокарбонильной группы).
[0082]
Также, в соединениях, представленных формулой (I), R2, более предпочтительно, представляет собой C6-C10 ароматическую углеводородную группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атоме углерода, расположенных рядом друг с другом в ароматическом углеводородном кольце, R2 может образовывать моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 5 или 6 атомов углерода (необязательно замещенное C1-C6 алкильной группой), где заместители конденсированы вместе с атомом углерода, к которому присоединен каждый из заместителей; и
R21 представляет собой атом галогена, C1-C6 алкильную группу или моноциклическое 5- или 6-членное ненасыщенное гетероциклическое кольцо, имеющее 1-3 атома азота (необязательно замещенное C1-C6 алкильной группой).
[0083]
Также, в соединениях, представленных формулой (I), R2 особенно предпочтительно представляет собой фенильную группу или нафтильную группу (необязательно замещенную группой, выбранной из группы, состоящей из атома галогена и C1-C6 алкильной группы); инданильную группу (2,3-дигидро-1Н-инденильную группу); или тетрагидронафтильную группу.
[0084]
В соединениях, представленных формулой (I), R3 представляет собой C6-C14 ароматическую углеводородную группу или 5-10-членную полностью ненасыщенную гетероциклическую группу.
«C6-C14 ароматическая углеводородная группа», указанная в R3, предпочтительно, представляет собой C6-C10 ароматическую углеводородную группу, более предпочтительно, фенильную группу или нафтильную группу, особенно предпочтительно, фенильную группу.
[0085]
«5-10-членная полностью ненасыщенная гетероциклическая группа», указанная в R3, представляет собой моноциклическую или бициклическую 5-10-членную полностью ненасыщенную гетероциклическую группу, имеющую 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, моноциклическую или бициклическую 5-7-членную полностью ненасыщенную гетероциклическую группу, имеющую 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, особенно предпочтительно, моноциклическое 5-6-членное полностью ненасыщенное гетероциклическое кольцо, имеющее 1-3 гетероатома, выбранных из атома азота, атома серы и атомов кислорода. Предпочтительно, представляет собой имидазолильную группу, пиридильную группу, тиофенильную группу, индолильную группу, индазолильную группу, бензопиранильную группу, бензотриазолильную группу, бензотиадиазолильную группу, изоксазолильную группу, хинолильную группу, более предпочтительно, имидазолильную группу, пиридильную группу, тиофенильную группу, индолильную группу, индазолильную группу, бензопиранильную группу, бензотриазолильную группу, бензотиадиазолильную группу, хинолильную группу, более предпочтительно, пиридильную группу, тиофенильную группу, индолильную группу, индазолильную группу, бензопиранильную группу, бензотриазолильную группу, хинолильную группу, более предпочтительно, пиридильную группу.
[0086]
В соединениях, представленных формулой (I), R3 может быть незамещенным или может иметь заместитель. Также, когда R3 имеет два заместителя на атомах углерода, расположенных рядом друг с другом в ароматическом углеводородном кольце, R3 может образовывать 4-8-членное насыщенное или частично ненасыщенное углеводородное кольцо или гетероциклическое кольцо, которое может быть замещено, где заместители конденсированы вместе с атомом углерода, к которому присоединен каждый из заместителей; и,
когда R3 имеет заместитель, положение заместителя особо не ограничивается. Хотя число заместителей не ограничено, оно особенно предпочтительно равно 0, то есть нет замещения. Альтернативно, число заместителей составляет от 1 до 4, более предпочтительно, от 1 до 3. Когда число заместителей равно двум или более, виды заместителя могут быть одинаковыми или различными.
В соединениях, представленных формулой (I), предпочтительно, R3 может быть замещен «заместителем», более предпочтительно, R3 может быть замещен R31. Также, предпочтительно, когда R3 имеет два заместителя на атомах углерода, расположенных рядом друг с другом в ароматическом углеводородном кольце, R3 может образовывать 4-8-членное насыщенное или частично ненасыщенное углеводородное кольцо или гетероциклическое кольцо, которое может быть замещено Rc, где заместители конденсированы вместе с атомом углерода, к которому присоединен каждый из заместителей.
[0087]
R31, который может быть заместителем в R3, представляет собой атом галогена, циано группу, нитрогруппу, карбоксильную группу, тиоамидную группу, C1-C6 алкильную группу, которая может быть замещена Ra, аминогруппу, которая может быть замещена Ra, C3-C6 циклоалкильную группу, которая может быть замещена Rb, C1-C6 алкокси группу, которая может быть замещена Rb, C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу, которая может быть замещена Rb, C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу, которая может быть замещена Rb, C6-C14 ароматическое углеводородное кольцо, которое может быть замещено Rb, 5-10-членное ненасыщенное гетероциклическое кольцо, которое может быть замещено Rc, аминокарбонильную группу, которая может быть замещена Rd и Re, или -S(=O)2Rf.
Хотя число заместителей не ограничено, оно особенно предпочтительно равно 0, то есть нет замещения. Альтернативно, число заместителей составляет от 1 до 4, более предпочтительно от 1 до 3. Когда число заместителей равно двум или более, виды заместителя могут быть одинаковыми или различными.
[0088]
«Атом галогена», указанный в R31, предпочтительно, представляет собой атом фтора, атом хлора или атом брома, более предпочтительно, атом хлора или атом брома.
[0089]
«C1-C6 алкильная группа» в «C1-C6 алкильной группе, которая может быть замещена Ra», указанная в R31, предпочтительно, представляет собой C1-C3 алкильную группу, более предпочтительно, метильную группу.
Заместитель Ra в «C1-C6 алкильной группе, которая может быть замещена Ra», указанной в R31, представляет собой атом галогена, гидрокси группу, C1-C14 ацильную группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу или C1-C6 алкокси-C1-C6 алкокси группу.
«Атом галогена», указанный в Ra, предпочтительно, представляет собой атом фтора.
«C1-C14 ацильная группа», указанная в Ra, предпочтительно, представляет собой ацетильную группу.
«C1-C14 ацилокси группа», указанная в Ra, предпочтительно, представляет собой ацетилокси группу.
«C2-C6-алкинильная группа», указанная в Ra, предпочтительно, представляет собой этинильную группу, 1-пропинильную группу.
«C1-C6 алкокси-C1-C6 алкокси группа», указанная в Ra, предпочтительно, представляет собой метоксиметокси группу.
[0090]
Заместитель Ra в «C1-C6 алкильной группе, которая может быть замещена Ra», указанной в R31, предпочтительно, представляет собой атом галогена, гидрокси группу, C1-C6 ацилокси группу, C2-C6 алкинильную группу или C1-C6 алкокси C1-C6 алкокси группу, более предпочтительно, атом галогена или гидрокси группу. Хотя число Ra, который является заместителем Ra, особо не ограничивается, предпочтительно, оно равно 0, то есть замещение отсутствует, или составляет один или более. Когда число заместителей Ra составляет 2 или более, виды заместителя могут быть одинаковыми или различными.
[0091]
Ra в «амино группе, необязательно замещенной Ra», указанной в R31, представляет собой атом галогена, гидрокси группу, C1-C14 ацильную группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу или C1-C6 алкокси C1-C6 алкокси группу, предпочтительно, C1-C14 ацильную группу, более предпочтительно, ацетильную группу.
Число Ra заместителей амино группы особо не ограничивается, предпочтительно, оно равно 0, то есть замещение отсутствует, или составляет 1, более предпочтительно, 0.
[0092]
«C3-C6 циклоалкильная группа» в «C3-C6 циклоалкильной группе, необязательно замещенной Rb», указанной в R31, предпочтительно, представляет собой циклопропильную группу.
Rb в «C3-C6 циклоалкильной группе, необязательно замещенной Rb», указанной в R31, представляет собой атом галогена, амино группу или C1-C6 алкокси группу.
[0093]
«Атом галогена», указанный в Rb предпочтительно, представляет собой атом фтора.
"C1-C6 алкокси группа», указанная в Rb предпочтительно, представляет собой C1-C3 алкокси группа, более предпочтительно метокси группа.
«Атом галогена», указанный в Rb, предпочтительно, представляет собой атом фтора.
«C1-C6 алкокси группа», указанная в Rb, предпочтительно, представляет собой C1-C3 алкокси группу, более предпочтительно, метокси группу.
Rb в «C3-C6 циклоалкильной группе, необязательно замещенной Rb», указанной в R31, предпочтительно, представляет собой амино группу. Число Rb заместителей в C3-C6 циклоалкильной группе особо не ограничивается, предпочтительно, оно равно 0, то есть замещение отсутствует, или составляет 1, более предпочтительно, нулю. Когда число заместителей Rb составляет два или более, виды заместителя могут быть одинаковыми или различными.
[0094]
«C1-C6 алкокси группа» в «C1-C6 алкокси группе, необязательно замещенной Rb», указанной в R31, предпочтительно, представляет собой C1-C3 алкокси группу, более предпочтительно, метокси группу.
Rb в «C1-C6 алкокси группе, необязательно замещенной Rb», указанной в R31, представляет собой, как указано выше, атом галогена, амино группу или C1-C6 алкокси группу, предпочтительно, атом галогена, более предпочтительно, атом фтора. Хотя число Rb заместителей в C1-C6 алкокси группе не ограничивается, оно равно 0, то есть замещение отсутствует, или составляет один или два. Когда число заместителей Rb составляет два или более, виды заместителя могут быть одинаковыми или различными.
[0095]
«C2-C7 алкоксикарбонильная группа», указанная в R31, предпочтительно, представляет собой C2-C4 алкоксикарбонильную группу, более предпочтительно, метоксикарбонильную группу.
[0096]
«C1-C14 ацильная группа» в «C1-C14 ацильной группе, необязательно замещенной Rb», указанной в R31, предпочтительно, представляет собой ацетильную группу.
Rb в «C1-C14 ацильной группе, необязательно замещенной Rb», указанной в R31, представляет собой, как указано выше, атом галогена, амино группу или C1-C6 алкокси группу, предпочтительно, атом галогена, более предпочтительно, атом фтора. Хотя число Rb заместителей в C1-C14 ацильной группе не ограничивается, оно может быть равно нулю, то есть замещение отсутствует, или составлять от одного до трех. Когда число заместителей Rb составляет два или более, виды заместителя могут быть одинаковыми или различными.
[0097]
«Тиоамидная группа», указанная в R31, предпочтительно, представляет собой -C(= S)-NH2.
[0098]
«C6-C14 ароматическая углеводородная группа» в «C6-C14 ароматической углеводородной группе, необязательно замещенной Rb», указанной в R31, предпочтительно, представляет собой C6-C10 ароматическую углеводородную группу, и, более предпочтительно, фенильную группу.
Заместитель Rb в «C6-C14 ароматической углеводородной группе, необязательно замещенной Rb», указанной в R31, представляет собой, как указано выше, атом галогена, амино группу или C1-C6 алкокси группу, и, предпочтительно, атом галогена или C1-C3 алкокси группу, и, более предпочтительно, атом галогена, и, более предпочтительно, атом фтора. Хотя число Rb заместителей в C6-C14 ароматической углеводородной группе особо не ограничивается, предпочтительно, равно нулю, то есть замещение отсутствует, или равно одному. Когда число заместителей Rb составляет 2 или более, виды групп могут быть одинаковыми или различными.
[0099]
«5-10-членная ненасыщенная гетероциклическая группа» в «5-10-членной ненасыщенной гетероциклической группе, необязательно замещенной Rc», указанной в R31, предпочтительно, представляет собой моноциклическую или бициклическую 5-10 членную полностью или частично ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, моноциклическую 5-6-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода. Предпочтительно, представляет собой пирролильную группу, имидазолильную группу, пиразолильную группу, тетразолильную группу, изоксазолильную группу, оксадиазолильную группу, дигидрооксадиазолильную группу, предпочтительно, пиразолильную группу, 1,3,4-оксадиазолильную группу, 2,3-дигидро-1,3,4-оксазолильную группу.
[0100]
Заместитель Rc в «5-10 членной ненасыщенной гетероциклической группе, необязательно замещенной одним или более Rc», указанной в R31, представляет собой атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой, галоген C1-C6 алкильную группу, C1-C14 ацил, или C1-C14 ациламино группу, C1-C14 ацилокси группу или C7-C13 аралкилокси группу.
«Атом галогена», указанный в Rc, предпочтительно, представляет собой атом фтора.
«C1-C6 алкильные группы, необязательно замещенные гидрокси группой», указанные в Rc, предпочтительно, представляют собой C1-C3 алкильную группу, необязательно замещенную гидрокси группой, и, более предпочтительно, метильную группу или гидроксиэтильную группу.
«Галоген C1-C6 алкильная группа», представленная Rc, предпочтительно, представляет собой галоген C1-C3 алкильную группу, более предпочтительно, трифторметильную группу, дифторэтильную группу.
«C1-C14 ацильная группа», указанная в Rc, предпочтительно, представляет собой ацетильную группу или циклопропаноильную группу.
«C1-C14 ациламино группа», указанная в Rc, предпочтительно, представляет собой ацетиламино группу.
«C1-C14 ацилокси группа», указанная в Rc, предпочтительно, представляет собой ацетилокси группу.
«C7-C13 аралкилокси группа», указанная в Rc, предпочтительно, представляет собой бензилокси группу.
[0101]
Rc в «5-10-членной ненасыщенной гетероциклической группе, необязательно замещенной Rc», указанной в R31, предпочтительно, представляет собой атом галогена, C1-C6 алкильную группу или оксо группу, более предпочтительно, C1-C6 алкильную группу или оксо группу, более предпочтительно, C1-C6 алкильную группу. Хотя число Rc заместителей в 5-10-членной ненасыщенной гетероциклической группе особо не ограничивается, предпочтительно, оно равно нулю, то есть замещение отсутствует, или, предпочтительно, составляет один или более 2, более предпочтительно, равно нулю. Когда число заместителей Rc составляет 2 или более, виды групп могут быть одинаковыми или различными.
[0102]
«Аминокарбонильная группа, необязательно замещенная Rd и Re», указанная в R31, конкретно представлена следующей группой (II).
[0103]
[Формула 9]
[0104]
Rd и Re являются одинаковыми или различными и представляют собой: атом водорода; гидрокси группу; C7-C13 аралкилокси группу или C1-C6 алкильную группу, необязательно замещенную гидроксильными группами; альтернативно, взятые вместе с атомом азота, который является соседним по отношению к Rd и Re, образуют насыщенную или ненасыщенную 4-10-членную гетероциклическую кольцевую группу, необязательно замещенную амино группой, спиро гетероциклическую кольцевую группу или мостиковую гетероциклическую кольцевую группу.
«C7-C13 аралкилокси группа», указанная в Rd или Re, предпочтительно, представляет собой бензилокси группу.
«C1-C6 алкильная группа, необязательно замещенная гидрокси группами», указанная в Rd или Re, предпочтительно, представляет собой C1-C3 алкильную группу, необязательно замещенную гидрокси группой, более предпочтительно, метильную группу или гидроксиэтильную группу.
[0105]
«Насыщенная гетероциклическая группа» в «4-10-членной насыщенной гетероциклической группе, необязательно замещенной амино группой», в Rd или Re, предпочтительно, представляет собой моноциклическую или бициклическую 4-10-членную насыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, предпочтительно, 5-6-членную моноциклическую насыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, азетидинильную группу, пирролидинильную группу, пиперидино группу, пиперазинильную группу, морфолино группу.
«Ненасыщенная гетероциклическая группа» в «4-10-членной насыщенной или ненасыщенной гетероциклической группе, необязательно замещенной амино группой», которая образуется вместе с Rd или Re и соседними атомами азота, предпочтительно, представляет собой моноциклическую или бициклическую или 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы, атома кислорода, более предпочтительно, моноциклическую 5-6-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы, атома кислорода, особенно предпочтительно, пирролильную группу.
[0106]
«Спиро гетероциклическая группа», образованная вместе с Rd или Re и соседним атомом азота, предпочтительно, представляет собой моноспиро гетероциклическую группу, более предпочтительно, оксоазаспиро нонанилкарбамоильную группу или азаспиро октанилкарбамоильную группу.
«Мостиковая гетероциклическая группа», образованная вместе с указанными Rd или Re и соседним атома азота, предпочтительно, представляет собой бициклическую мостиковую гетероциклическую группу, более предпочтительно, оксоазабициклооктанил карбамоильную группу.
[0107]
Заместители Rd и Re в «аминокарбонильной группе, необязательно замещенной Rd и Re», указанной в R31, являются, предпочтительно, одинаковыми или различными и представляют собой гидрокси группу или C1-C6 алкильную группу, альтернативно, взятые вместе с соседним атомом азота, образуют моноциклическую 5-6-членную насыщенную гетероциклическую группу, которая может быть замещена амино группой, имеющей от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, моноспиро гетероциклическую группу или бициклическую мостиковую гетероциклическую группу.
[0108]
«Аминокарбонильная группа, необязательно замещенная Rd и Re», указанная в R31, предпочтительно, представляет собой -CONH2 группу, (моно или ди-C1-C6 алкил)аминокарбонильную группу, гидроксиамино группу, (C7-C13 аралкил)оксиаминокарбонильную группу или циклическую аминокарбонильную группу, более предпочтительно, -CONH2 группу, (моно или ди-C1-C3 алкил)аминокарбонильную группу, гидроксиаминокарбонильную группу, бензилоксикарбонильную группу, пирролидин-1-илкарбонильную группу, пиперидин-1-илкарбонильную группу, пиперазин-1-илкарбонильную группу, морфолин-4-илкарбонильную группу, азетидин-1-илкарбонильную группу, оксо азабициклооктанилкарбонильную группу, оксо азаспиро нонанилкарбонильную группу, азаспиро октанилкарбонильную группу, более предпочтительно, -CONH2 группу, диметиламинокарбонильную группу или пирролидин-1-илкарбонильную группу.
[0109]
Rf в «-S(=O)2Rf», указанный в R31, представляет собой амино группу, C1-C6 алкильную группу или 4-10-членную насыщенную гетероциклическую группу.
C1-C6 алкильная группа, указанная в Rf, предпочтительно, представляет собой C1-C3 алкильную группу, более предпочтительно, метильную группу.
4-10-членная насыщенная гетероциклическая группа, указанная в Rf, предпочтительно, представляет собой моноциклическую или бициклическую 4-10-членную насыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, моноциклическую 5-6-членную насыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, более предпочтительно, пирролидинильную группу, пиперидино группу или пиперазинильную группу.
«-S(=O)2Rf», указанный в R31, предпочтительно, представляет собой аминосульфонильную группу, метилсульфонильную группу или пиперидиносульфонильную группу.
[0110]
R31, который может быть замещен R3, предпочтительно, представляет собой атом галогена, циано группу, нитро группу, карбоксильную группу, тиоамидную группу, C1-C6 алкильную группу (которая может быть замещена группой, выбранной из группы, включающей атом галогена, гидрокси группу, C1-C14 ацильную группу, C1-C14 ацилокси группу, C2-C6 алкинил и C1-C6 алкокси C1-C6 алкокси группу), амино группу (которая может быть замещена C1-C14 ацильной группой), C3-C6 циклоалкильную группу (которая может быть замещена амино группой), C1-C6 алкокси группу (которая может быть замещена атомами галогена), C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу (которая может быть замещена атомами галогена), C6-C14 ароматическую углеводородную группу (которая может быть замещена группой, выбранной из группы, включающей атом галогена, амино группу и C1-C6 алкокси группу), моноциклическое или бициклическое 5-10 членное ненасыщенное гетероциклическое кольцо, имеющее от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которое может быть замещено группой, включающей атом галогена, оксо группу и C1-C6 алкильную группу), аминокарбонильную группу, необязательно замещенную Rd и Re (где Rd и Re являются одинаковыми или различными и представляют собой атом водорода, гидрокси группу, C7-C13 аралкилокси группу или C1-C6 алкильную группу, которая может быть замещена гидроксильной группой, альтернативно, взятые вместе с соседним атомом азота образуют моноциклическую или бициклическую 4-10 членную насыщенного или ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, спиро гетероциклическую группу или мостиковую гетероциклическую группу) или -S(=O)2Rf (где Rf представляет собой амино группу, C1-C6 алкильную группу или 4-10 членную насыщенную гетероциклическую группу).
[0111]
Более предпочтительно, он представляет собой атом галогена, циано группу, нитро группу, карбоксильную группу, тиоамидную группу, C1-C6 алкильную группу (которая может быть замещена группой, выбранной из группы, включающей атом галогена, гидрокси группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу и C1-C6 алкокси C1-C6 алкокси группу), амино группу, C3-C6 циклоалкильную группу (которая может быть замещена амино группой), C1-C6 алкокси группу (которая может быть замещена атомом галогена), C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу (которая может быть замещена атомом галогена), C6-C10 ароматическую углеводородную группу (которая может быть замещена атомом галогена), моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которая может быть замещена группой, выбранной из группы, включающей C1-C6 алкильную группу и оксо группу), -CONH2 группу, (моно- или ди-C1-C6 алкил)аминокарбонильную группу, гидроксиаминокарбонильную группу, (C7-C13 аралкил)оксиаминокарбонильную группу, циклическую аминокарбонильную группу, аминосульфонильную группу, C1-C6 алкилсульфонильную группу или пиперидиносульфонильную группу.
[0112]
Более предпочтительно, он представляет собой атом галогена, амино группу, C1-C6 алкильную группу (которая может быть замещена группой, выбранной из группы, включающей атом галогена и гидрокси группу), C1-C6 алкокси группу (которая может быть замещена атомами галогена), моноциклическую 5 или 6-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, -CONH2 группу, (моно или ди C1-C6 алкил)аминокарбонильную группу или гидроксиамино группу.
Более предпочтительно, он представляет собой атом галогена, амино группу, C1-C6 алкокси группу или -CONH2 группу.
[0113]
Когда соединение формулы (I) имеет два или более заместителей на R3 и два заместителя на атомах углерода, соседних по отношению друг к другу в ароматическом углеводородном кольце R3, «4-8-членное насыщенное или частично ненасыщенное углеводородное кольцо или гетероциклическое кольцо, которое может быть замещено», образованное с атомами углерода, к которым они присоединены, представляет собой кольцо, например, кольцо, конденсированное с бензольным кольцом. «4-8-членное насыщенное или частично ненасыщенное углеводородное кольцо или гетероциклическое кольцо» в «4-8-членном насыщенном или частично ненасыщенном углеводородном кольце или гетероциклическом кольце, которое может быть замещено», предпочтительно, представляет собой моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 4-8 атомов углерода, или 4-8-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее от 1 до 4 гетероатомов, выбранных из группы, включающей атом азота, атом серы и атом кислорода, более предпочтительно, моноциклическое от 4 до 6-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из группы, включающей атом азота, атом серы и атом кислорода, более предпочтительно, моноциклическое 6-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее один или два атома кислорода.
[0114]
Заместитель Rc в «4-8-членном насыщенном или частично ненасыщенном углеводородном кольце или гетероциклическом кольце, которое необязательно замещено Rc», представляет собой атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, которая необязательно замещена гидрокси группой, галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ациламино группу, C1-C14 ацилокси группу или C7-C13 аралкилокси группу, предпочтительно, гидрокси группу, амино группу, оксо группу или C1-C6 алкильную группу, которая необязательно замещена гидрокси группой, галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ацилокси группу, более предпочтительно, гидрокси группу или C1-C6 алкильную группу. Число заместителей Rc в насыщенном или частично ненасыщенном углеводородном кольце или гетероциклическом кольце особо не ограничивается, но предпочтительно составляет от 1 до 3. Когда число заместителей Rc равно 2 или более, виды групп могут быть одинаковыми или различными.
[0115]
«4-8-членное насыщенное или частично ненасыщенное углеводородное кольцо или гетероциклическое кольцо, которое необязательно замещено Rc», предпочтительно, представляет собой моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо (которое необязательно замещено группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой, галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ациламино группу, C1-C14 ацилокси группу и C7-C13 аралкилокси группу), моноциклическое 4-8-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которое необязательно замещено группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой, галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ациламино группу, C1-C14 ацилокси группу и C7-C13 аралкилокси группу).
[0116]
Более предпочтительно, моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, имеющее 4-8 атомов углерода, (которое необязательно замещено группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу и C1-C6 алкильную группу, необязательно замещенную гидрокси группой, галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ациламино группу и C1-C14 ацилокси группу), или моноциклическое 4-8-членное насыщенное или частично ненасыщенное гетероциклического кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которое необязательно замещено группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой, галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ациламино группу и C1-C14 ацилокси группу).
[0117]
Более предпочтительно, моноциклическое 4-6-членное гетероциклическое кольцо, имеющее от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которое необязательно замещено группой, выбранной из группы, включающей гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C1-C14 ациламино группу и C1-C14 ацилокси группу).
Более предпочтительно, моноциклическое 6-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, имеющее 1 или два атома кислорода, (которое необязательно замещено группой, выбранной из группы, включающей гидроксильную группу и C1-C6 алкильную группу).
В соединениях, представленных формулой (I), конденсированное кольцо, которое образуется, когда имеются два заместителя на атомах углерода, соседних по отношению друг к другу в ароматическом углеводородном кольце R3, например, представляет собой хромановое кольцо, дигидробензоксазиновое кольцо, дигидроинденовое кольцо, индолиновое кольцо, тетрагидрохиноксалиновое кольцо, дигидробензодиоксановое кольцо, тетрагидронафталиновое кольцо, тетрагидрохинолиновое кольцо, тетрагидроизохинолиновое кольцо, дигидробензотиофеновое кольцо, изоиндолиновое кольцо, дигидроизобензофурановое кольцо, дигидробензоимидазольное кольцо и тому подобное.
[0119]
В соединениях, представленных формулой (I), R3, предпочтительно, представляет собой C6-C14 ароматическую углеводородную группу или моноциклическую или бициклическую 5-10-членную полностью ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, где R3 может быть замещен R31, или, когда R3 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического насыщенного или частично ненасыщенного углеводородного кольца, имеющего 4-8 атомов углерода, (которое необязательно замещено группой, включающей группу, выбранную из атома галогена, гидрокси группы, амино группы, оксо группы, C1-C6 алкильной группы, необязательно замещенной гидрокси группой, галоген C1-C6 алкильной группы, C1-C14 ацильной группы, C1-C14 ациламино группы, C1-C14 ацилокси группы и C7-C13 аралкилокси группы) или моноциклического 4-8-членного насыщенного или частично ненасыщенного гетероциклического кольца, имеющего от 1 до 4 гетероатомов, выбранных из атома азота, атома серы или атома кислорода, (необязательно замещенного группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой, галоген C1-C6 алкильные группы, C1-C14 ацильную группу, C1-C14 ациламино группу, C1-C14 ацилокси группу, C7-C13 аралкилокси группу);
[0120]
R31 представляет собой атом галогена, циано группу, нитро группу, карбоксильную группу, тиоамидную группу, C1-C6 алкильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена, гидрокси группу, C1-C14 ацильную группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу и C1-C6 алкокси C1-C6 алкокси группу), амино группу (необязательно замещенную C1-C14 ацильной группой), C3-C6 циклоалкильную группу (необязательно замещенную амино группой), C1-C6 алкокси группу (необязательно замещенную атомами галогена), C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу (необязательно замещенную атомом галогена), C6-C14 ароматическую углеводородную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена, амино группу и C1-C6 алкокси группу), моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенную группой, выбранной из группы, включающей атом галогена, оксо группу и C1-C6 алкильную группу), аминокарбонильную группу, необязательно замещенную Rd и Re (где Rd и Re являются одинаковыми или различными и представляют собой атом водорода, гидрокси группу, C7-C13 аралкилокси группу, C1-C6 алкильную группу, которая необязательно замещена гидроксильной группой, альтернативно, взятые вместе с соседним атомом азота образуют моноциклическую или бициклическую 4-10-членную насыщенную или ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атомов азота, серы и кислорода, которая может быть замещена амино группой, спиро гетероциклическую группу или мостиковую гетероциклическую группу) или -S(=O)2Rf (где Rf представляет собой амино группу, C1-C6 алкильную группу или 4-10-членную насыщенную гетероциклическую группу).
[0121]
В соединениях, представленных формулой (I), R3, более предпочтительно, представляет собой C6-C10 ароматическую углеводородную группу или моноциклическую или бициклическую 5-10-членную полностью ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, где R3 необязательно замещен R31, и, когда он имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического насыщенного или частично ненасыщенного углеводородное кольца, имеющего 4-8 атомов углерода, (которое необязательно замещено группой, состоящей из группы, выбранной из атома галогена, гидрокси группы, амино группы, оксо группы, C1-C6 алкильной группы, необязательно замещенной гидрокси группой, галоген C1-C6 алкильной группы, C1-C14 ацильной группы, C1-C14 ациламино группы и C1-C14 ацилокси группы), или моноциклического 4-8-членного насыщенного или частично ненасыщенного гетероциклического кольца, имеющего от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенного группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой; галоген C1-C6 алкильные группы; C1-C14 ацильную группу; C1-C14 ациламино группу; C1-C14 ацилокси группу);
[0122]
R31 представляет собой атом галогена, циано группу, нитро группу, карбоксильную группу, тиоамидную группу, C1-C6 алкильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена, гидрокси группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу и C1-C6 алкокси C1-C6 алкокси группу), амино группу, C3-C6 циклоалкильную группу (необязательно замещенную амино группой), C1-C6 алкокси группу (необязательно замещенную атомом галогена), C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу (необязательно замещенную атомом галогена), C6-C10 ароматическую углеводородную группу (которая может быть замещена атомом галогена), моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенную группой, выбранной из группы, включающей C1-C6 алкильную группу или оксо группу), -CONH2 группу, (моно- или ди-C1-C6 алкил)аминокарбонильную группу, гидроксиамино группу, (C7-C13 аралкил) окси аминокарбонильную группу, циклическую амино карбонильную группу, аминосульфонильную группу, C1-C6 алкилсульфонильную группу или пиперидиносульфонильную группу.
[0123]
В соединениях, представленных формулой (I), R3, более предпочтительно, представляет собой C6-C10 ароматическую углеводородную группу (где C6-C10 ароматическая углеводородная группа необязательно замещена R31, и, когда C6-C10 ароматическая углеводородная группа имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического 4-6-членного насыщенного или частично ненасыщенного гетерокольца, имеющего от 1 до 3 гетероатомов, (которое необязательно замещено группой, состоящей из гидрокси группы, амино группы, оксо группы, C1-C6 алкильной группы, галоген C1-C6 алкильной группы, C1-C14 ациламино группы и C1-C14 ацилокси группы) или моноциклической 5-6-членной полностью ненасыщенной гетероциклической группы, имеющей от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которая необязательно замещена группой, выбранной из группы, включающей атом галогена, C1-C6 алкильную группу, необязательно замещенную гидроксильной группой, C1-C6 алкокси группу, C2-C7 алкоксикарбонильную группу, -CONH2 группу (моно- или ди-C1-C6 алкил)аминокарбонильную группу, пирролидин-1-илкарбонильную группу, морфолин-4-илкарбонильную группу, 2-окса-7-азаспиро[3,5]нонанильную группу, 3-окса-8-азабицикло[3,2,1]октанильную группу и 8-окса-3-азабицикло[3,2,1]октанильную группу);
[0124]
R31 представляет собой атом галогена, амино группу, C1-C6 алкильную группу (которая необязательно замещена группой, выбранной из группы, включающей атом галогена и гидрокси группу), C1-C6 алкокси группу (которая необязательно замещена атомом галогена), 5 или 6-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, -CONH2 группу, (моно или ди-C1-C6 алкил)аминокарбонильную группу или гидроксиамино группу.
[0125]
Также в соединениях, представленных формулой (I), R3 представляет собой, особенно предпочтительно, фенильную группу (где фенильная группа может быть замещена R31, и, когда фенильная группа имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу на бензольном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического 6-членного насыщенного или частично ненасыщенного гетерокольца, имеющего один или два атома кислорода, (которое необязательно замещенного группой, выбранной из группы, включающей гидрокси группу и C1-C6 алкильную группу)) или пиридильную группу (которая необязательно замещена -CONH2 группой, (моно или ди C1-C6 алкил)аминокарбонильной группой или пирролидин-1-илкарбонильной группой);
R31 представляет собой атом галогена, амино группу, C1-C6 алкокси группу или -CONH2 группу.
[0126]
В соединениях, представленных формулой (I), R4 представляет собой атом водорода или C1-C6 алкильную группу.
«C1-C6 алкильная группа», указанная в R4, предпочтительно, представляет собой C1-C3 алкильную группу, более предпочтительно, метильную группу.
R4, предпочтительно, представляет собой атом водорода или метильную группу, более предпочтительно, атом водорода.
[0127]
Среди соединений формулы (I) по настоящему изобретению предпочтительные соединения включают следующие.
В формуле (I),
X1 представляет собой атом кислорода или атом серы;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода или метильную группу;
R1 представляет собой -C(R11)(R12) (где R11 и R12 являются одинаковыми или различными и представляют собой атом водорода или C1-C6 алкильную группу);
R2 представляет собой C6-C14 ароматическую углеводородную группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического насыщенного или частично ненасыщенного углеводородного кольца, имеющего 4-8 атомов углерода, (которое необязательно замещено C1-C6 алкильной группой);
R21 представляет собой атом галогена, циано группу, C1-C6 алкильную группу (которая необязательно замещена атомом галогена), C3-C6 циклоалкильную группу, фенильную группу (которая необязательно замещена группой, выбранной из группы, включающей атом галогена и C1-C6 алкокси группу) или моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которая необязательно замещена группой, выбранной из группы, включающей атом галогена, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C3-C6 циклоалкильную группу, C1-C6 алкокси группу, морфолино группу, пиперидинильную группу и морфолинокарбонильную группу);
R3 представляет собой C6-C10 ароматическую углеводородную группу или моноциклическую или бициклическую 5-10-членную полностью ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, где R3 необязательно замещен R31, и, когда R3 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического насыщенного или частично ненасыщенного углеводородного кольца, имеющего 4-8 атомов углерода, (которое необязательно замещено группой, состоящей из группы, выбранной из атома галогена, гидрокси группы, амино группы, оксо группы, C1-C6 алкильной группы, необязательно замещенной гидрокси группой, галоген C1-C6 алкильной группы, C1-C14 ацильной группы, C1-C14 ациламино группы и C1-C14 ацилокси группы) или моноциклического 4-8-членного насыщенного или частично ненасыщенного гетероциклического кольца, имеющего от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенного группой, выбранной из группы, включающей атом галогена, гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, необязательно замещенную гидрокси группой; галоген C1-C6 алкильную группу; C1-C14 ацильную группу; C1-C14 ациламино группу и C1-C14 ацилокси группу);
R31 представляет собой атом галогена, циано группу, нитро группу, карбоксильную группу, тиоамидную группу, C1-C6 алкильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена, гидрокси группу, C1-C14 ацилокси группу, C2-C6 алкинильную группу и C1-C6 алкокси C1-C6 алкокси группу), амино группу, C3-C6 циклоалкильную группу (необязательно замещенную амино группой), C1-C6 алкокси группу (необязательно замещенную атомом галогена), C2-C7 алкоксикарбонильную группу, C1-C14 ацильную группу (необязательно замещенную атомом галогена), C6-C10 ароматическое углеводородное кольцо (необязательно замещенное атомом галогена), моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенную группой, выбранной из группы, включающей C1-C6 алкильную группу и оксо группу), -CONH2 группу, (моно- или ди-C1-C6 алкил)аминокарбонильную группу, гидроксиаминокарбонильную группу, (C7-C13 аралкилокси)оксиамино карбонильную группу, циклическую аминокарбонильную группу, аминосульфонильную группу, C1-C6 алкилсульфонильную группу или пиперидиносульфонильную группу; и
R4 представляет собой атом водорода;
(при условии, что X1 является атомом кислорода, когда X2 представляет собой атом кислорода, X3 представляет собой -NH-, X4 представляет собой атом водорода, R1 представляет собой -CH2-, R2 представляет собой фенильную группу, R3 представляет собой 4-метилфенильную группу, и R4 представляет собой атом водорода)
или его соль.
[0128]
Более того, среди соединений формулы (I) по настоящему изобретению более предпочтительные соединения включают следующие.
В формуле (I),
X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12) (где R11 представляет собой C1-C6 алкильную группу, и R12 представляет собой атом водорода);
R2 представляет собой C6-C10 ароматическую углеводородную группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического насыщенного или частично ненасыщенного углеводородного кольца, имеющего 5 или 6 атомов углерода, (которое необязательно замещено C1-C6 алкильной группой);
R21 представляет собой атом галогена, C1-C6 алкильную группу или моноциклическую 5-6-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 3 атомов азота, (которая необязательно замещена C1-C6 алкильной группой);
R3 представляет собой C6-C10 ароматическую углеводородную группу (где C6-C10 ароматическая углеводородная группа необязательно замещена R31, и, когда C6-C10 ароматическая углеводородная группа имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического 4-6-членного насыщенного или частично ненасыщенного гетероциклического кольца, имеющего от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (необязательно замещенного группой, выбранной из группы, включающей гидрокси группу, амино группу, оксо группу, C1-C6 алкильную группу, галоген C1-C6 алкильную группу, C1-C14 ацильную группу, C1-C14 ациламино группу и C1-C14 ацилокси группу) или моноциклическую 5-6-членную полностью ненасыщенную гетероциклическую группу, имеющую от 1 до 3 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, (которая необязательно замещена группой, выбранной из группы, включающей атом галогена, C1-C6 алкильную группу, необязательно замещенную гидроксильной группой, C1-C6 алкокси группу, C2-C7 алкоксикарбонильную группу, -CONH2 группу, (моно- или ди-C1-C6 алкил)аминокарбонильную группу, пирролидин-1-илкарбонильную группу, морфолин-4-илкарбонильную группу, 2-окса-7-азаспиро[3,5]нонанильную группу, 3-окса-8-азабицикло[3,2,1]октанильную группу и 8-окса-3-азабицикло[3,2,1]октанильную группу);
R31 представляет собой атом галогена, амино группу, C1-C6 алкильную группу (необязательно замещенную группой, выбранной из группы, включающей атом галогена и гидрокси группу), C1-C6 алкокси группу (необязательно замещенную атомом галогена), моноциклическую 5-6-членную ненасыщенную гетероциклическую группу, имеющую от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, -CONH2 группу, (моно- или ди-C1-C6 алкил)аминокарбонильную группу, гидроксиамино карбонильную группу; и
R4 представляет собой атом водорода;
или его соль.
[0129]
Среди соединений формулы (I) по настоящему изобретению более предпочтительные соединения включают следующие.
В формуле (I),
X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12) (где R11 представляет собой метильную группу, и R12 представляет собой атом водорода);
R2 представляет собой фенильную группу или нафтильную группу, где R2 может быть замещен R21, и, когда R2 имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу в ароматическом углеводородном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического насыщенного или частично ненасыщенного углеводородного кольца, имеющего 5 или 6 атомов углерода, (которое необязательно замещено C1-C6 алкильной группой);
R21 представляет собой атом галогена или C1-C6 алкильная группа;
R3 представляет собой фенильную группу (где фенильная группа необязательно замещена R31, и, когда фенильная группа имеет два заместителя на атомах углерода, являющихся соседними по отношению друг к другу на бензольном кольце, заместители могут быть связаны с атомами углерода, к которым присоединены заместители, с образованием моноциклического 6-членного насыщенного или частично ненасыщенного гетероциклического кольца, имеющего 1 или 2 атома кислорода, (необязательно замещенного группой, выбранной из группы, включающей гидроксильную группу и C1-C6 алкильную группу) или пиридильную группу (которая необязательно замещена -CONH2 группой, (моно- или ди-C1-C6 алкил)аминокарбонильной группой, пирролидин-1-илкарбонильной группой);
R31 представляет собой атом галогена, амино группу, C1-C6 алкокси группу, -CONH2 группу; и
R4 представляет собой атом водорода;
или его соль.
[0130]
Особенно предпочтительные сульфонамидные соединения включают следующие:
(1) 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(2) 5-хлор-2-(N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(3) 5-бром-2-(N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(4) 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(5) 5-хлор-2-(N-((1S,2R)-2-(2-фторнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(6) 5-хлор-2-(N-((1S,2R)-2-(3-этил-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(7) 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(8) 5-бром-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(9) 2-(N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-5-хлор-бензамид;
(10) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-6-(пирролидин-1-карбонил)пиридин-2-сульфонамид;
(11) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид;
(12) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-хроман-8-сульфонамид;
(13) N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-гидрокси-4-метил-хроман-8-сульфонамид;
(14) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид;
(15) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид;
(16) 3-хлор-6-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-N,N-диметилпиколинамид;
(17) 4-амино-2-метокси-N-((1S,2R)-2-(8-метилнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид;
(18) 4-амино-N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метоксибензолсульфонамид; и
(19) 5-хлор-2-[[(1S,2R)-3,3,3-тридейтерио-2-(6-фтор-2,3-диметилфенил)-1-(2-оксо-3H-1,3,4-оксадиазол-5-ил)пропил]сульфамоил]бензамид.
[0131]
Способ получения сульфонамидного соединения в соответствии с настоящим изобретением описан в представленных примерах. Соединения формулы (I) по настоящему изобретению, например, могут быть получены следующим способом получения. Однако, настоящее изобретение не ограничивается этим способом.
[0132]
[Формула 10]
[Стадия A]
[где L1 представляет собой удаляемую группу. Символы имеют те же значения, что определены выше.]
[0133]
[A-1]
В этом способе соединение, представленное общей формулой (4), может быть получено путем взаимодействия соединения, представленного общей формулой (1), с металлоорганическим реагентом (3), таким как реактив Гриньяра, представленный формулой R11MgHal.
Hal представляет собой атом галогена.
Количество реагента Гриньяра (3) составляет от 0,8 до 20 эквивалентов относительно соединения (1), предпочтительно, от 1,0 до 10 эквивалентов. Температура реакции составляет от -80°C до 100°C, предпочтительно, от -78°C до 50°C. Время реакции составляет от 0,1 до 24 часов, предпочтительно, от 0,1 до 3 часов.
[0134]
На этой стадии соединение, представленное общей формулой (4), где R11 представляет собой H, может быть получено путем взаимодействия соединения, представленного формулой (1), с хорошо известным восстановителем вместо реактива Гриньяра (3).
Восстановители, которые должны использоваться, включают, например, боргидрид натрия, боргидрид лития, литий алюминий гидрид, диэтокси алюминий литий гидрид, триэтокси литий алюминий гидрид, три-трет-бутокси литий алюминий гидрид, алюминий магний гидрид, алюминий гидрид магний хлорид, натрий алюминий гидрид, натрий триэтоксиалюминий гидрид, бис(2-метоксиэтокси) алюминий натрий гидрид, диизобутил алюминий гидрид (далее DIBAL-H) и тому подобное, и, предпочтительно, боргидрид натрия.
Реакционный растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, включает простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и тому подобное), спирты (метанол, этанол и тому подобное) и воду, и предпочтительным является метанол.
Количество используемого восстановителя составляет от 0,8 до 10 эквивалентов относительно соединения (1), предпочтительно, от 1 до 5 эквивалентов.
Температура реакции составляет от 0°C до температуры точки кипения растворителя, предпочтительно, от 0 до 40°C. Время реакции составляет от 0,05 до 24 часов, предпочтительно, 0,2-2 часа. При этом соединение, представленное общей формулой (4), полученное вышеуказанным способом, может быть подвергнуто следующей стадии, с выделением или без выделения, и очистке с помощью хорошо известных путей выделения, описанных далее.
[0135]
[A-2]
На этой стадии соединение, представленное общей формулой (4), может быть получено путем взаимодействия соединения, представленного общей формулой (2), с хорошо известными восстановителями.
Восстановители, которые должны быть использованы, включают боргидрид натрия.
Реакционные растворители, которые должны быть использованы, особо не ограничиваются, пока это не оказывает негативного влияния на реакцию, и представляют собой, например, простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), спирты (метанол, этанол, 2-пропанол, трет-бутанол, этиленгликоль и т.д.), воду и тому подобное, предпочтительно, метанол или этанол.
Количество восстановителя составляет от 0,8 до 10 эквивалентов относительно соединения (2), предпочтительно, от 1 до 5 эквивалентов.
Температура реакции составляет между 0°C и температурой точки кипения растворителя, предпочтительно, от 0 до 40°C. Время реакции составляет от 0,5 до 24 часов, предпочтительно, 0,2-2 часа. При этом полученное соединение, представленное общей формулой (4), может быть подвергнуто следующей стадии с выделением или без выделения, и очистке с помощью хорошо известных путей выделения, описанных далее.
[0136]
[A-3]
В этом способе соединение, представленное общей формулой (5), может быть получено путем взаимодействия соединения, представленного общей формулой (4), с галогенирующим агентом или сульфонилгалогенид углеводородами.
Удаляемые группы, представленные L1, представляют собой, например, атом галогена, такой как атом хлора, атом брома или атом йода, метилсульфонилокси группу, трифторметилсульфонилокси группу, органическую сульфонилокси группу, такую как п-толилсульфонилокси группу.
Реакционные растворители, которые должны быть использованы, особо не ограничиваются, пока это не оказывает негативного влияния на реакцию, например, представляют собой простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода и т.д.), ароматические углеводороды (бензол, толуол, ксилол, пиридин и т.д.), и предпочтительными являются простые эфиры.
Галогенирующие агенты, которые должны быть использованы, представляют собой, например, тионилхлорид, оксалилхлорид, пентахлорид фосфора, трихлорид фосфора, тионилбромид, трибромид фосфора и тому подобное. Предпочтительно, представляют собой тионилхлорид или трибромид фосфора. Сульфонил галогенид углеводороды представляют собой, например, метансульфонилхлорид, этансульфонилхлорид, п-толуолсульфонилхлорид или фенилсульфонилхлорид и тому подобное.
Реакционные растворители, которые должны быть использованы, особо не ограничиваются, пока это не оказывает негативного влияния на реакцию, и представляют собой, например, простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол, и т.д.), и предпочтительным является дихлорметан.
Количество галогенирующего агента или сульфонил галогенид углеводородов составляет от 0,3 эквивалентов до 20 эквивалентов относительно соединения (4), предпочтительно, от 0,3 до 4 эквивалентов.
Температура реакции составляет от -20°C до 100°C, предпочтительно, от 0°C до 100°C. Время реакции составляет обычно от 0,01 до 200 часов, предпочтительно, от 0,5 часа до 24 часов. Таким образом, полученное соединение, представленное общей формулой (5), может быть подвергнуто следующей стадии с выделением или без выделения, и очистке с помощью хорошо известных путей выделения, описанных далее.
[0137]
[Формула 11]
[Стадия B]
[Символы в формуле определены выше.]
[0138]
[B-1]
В этом способе никелевый комплекс, представленный общей формулой (7), получают путем взаимодействия соединения, представленного общей формулой (1) или (5), с легко доступным соединением, представленным формулой (6).
Реакционные растворители, которые должны быть использованы, особо не ограничиваются, пока это не оказывает негативного влияния на реакцию, и представляют собой, например, органические растворители или их смеси, такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, пропионитрил и т.д.), амиды (N,N-диметилформамид (указываемый далее как ДМФ), N,N-диметилацетамид, N-метилпирролидинон, и предпочтительным является ДМФ.
Основания, которые должны быть использованы, представляют собой, например: органические амины, такие как триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, лутидин или коллидин; соли щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия, фосфат натрия, фосфат калия, гидроксид натрия, гидроксид калия; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид натрия, трет-бутоксид калия; сильноосновной амид лития, такой как литий диизопропиламид; сильноосновной гексаметилдисилазан, такой как гексаметилдисилазан лития, гексаметилдисилазан натрия, гексаметилдисилазан калия; и, предпочтительно, гидроксид натрия, гидроксид калия, трет-бутоксид калия и тому подобное.
Количество основания, которое должно быть использовано, обычно составляет от 0,1 до 100 эквивалентов относительно соединения (6), предпочтительно, от 1 до 20 эквивалентов.
Количество соединения (1) или (5) составляет 0,5-10 эквивалентов относительно соединения (6), предпочтительно, от 1 до 5 эквивалентов.
Температура реакции составляет от -80 до 50°C, предпочтительно, от -60 до 40°C. Время реакции составляет 0,2-24 часов, предпочтительно, от 0,5 до 6 часов. Давление, используемое в вышеуказанном способе получения, не может быть особо ограничено, и его примеры включают, примерно от 0,1 до 10 атм. Никелевый комплекс, представленный общей формулой (7), который получат в этом способе, может быть подвергнут следующей стадии с выделением или без выделения, и очистке с помощью хорошо известных путей выделения, описанных далее.
[0139]
[B-2]
На этой стадии аминокислота, представленная общей формулой (8), может быть получена путем взаимодействия никелевого комплекса или его соли с кислотой, представленной общей формулой (7).
Кислоты, которые должны быть использованы, особо не ограничиваются, но включают общеизвестные кислоты. Кислоты могут представлять собой неорганические кислоты или органические кислоты. Неорганические кислоты включают, например, соляную кислоту, азотную кислоту, серную кислоту и перхлорную кислоту. Органические кислоты включают, например, уксусную кислоту, трифторуксусную кислоту, метансульфоновую кислоту, трифторметансульфоновую кислоту, щавелевую кислоту, пропионовую кислоту, масляную кислоту, валериановую кислоту и тому подобное. Предпочтительно, кислота представляет собой соляную кислоту, серную кислоту, трифторуксусную кислоту или метансульфоновую кислоту, более предпочтительно, соляную кислоту или метансульфоновую кислоту.
Количество кислоты особо не ограничивается, и обычно составляет от 0,1 до 50 эквивалентов относительно никелевого комплекса, представленного общей формулой (7), и, предпочтительно, от 0,3 до 10 эквивалентов.
Растворитель, который должен быть использован, предпочтительно, представляет собой спирт, более предпочтительно, метанол или этанол.
Температура реакции составляет обычно от 0°C до 100°C, и, предпочтительно, от 40 до 80°C. Время реакции составляет обычно от 0,1 до 72 часов, и, предпочтительно, от 0,1 до 10 часов. Давление, используемое в вышеуказанном способе получения, особо не ограничивается, и его примеры включают, от 0,1 до 10 атм. Аминокислота, представленная общей формулой (8), полученная в настоящем способе, может быть подвергнута следующей стадии способа с выделением или без выделения, и очистке с помощью хорошо известных путей выделения и очистки, описанных далее, или трансформации между введением защиты и удалением защиты.
[0140]
[Формула 12]
[Стадия C]
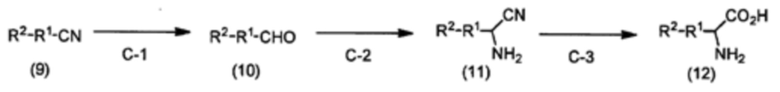
[Символы в формуле определены выше.]
[0141]
[C-1]
На этой стадии соединение, представленное общей формулой (10), может быть получено путем взаимодействия соединения, представленного общей формулой (9), с хорошо известным восстановителем.
Восстановителем является три(этокси) литий алюминий гидрид, три(втор-бутил)боргидрид лития или DIBAL-H, и тому подобное, и предпочтительным является DIBAL-H.
Количество восстановителя обычно составляет от 1 до 10 эквивалентов относительно соединения (9), предпочтительно, от 2,0 до 10 эквивалентов.
Растворитель, которые должен быть использован, представляет собой любой вид растворителей (тетрагидрофуран, 1,4-диоксан и т.д.), апротонные полярные растворители (N,N-диметилформамид, диметилсульфоксид, ацетонитрил и т.д.), галогеновые растворители (дихлорметан, хлороформ и т.д.), ароматические углеводородные растворители (толуол, ксилол и т.д.) или смешанный растворитель и тому подобное, и, предпочтительно, дихлорметан.
Температура реакции составляет от -100°C до 50°C, предпочтительно, от -100 до 10°C. Время реакции составляет от 0,1 до 24 часов, предпочтительно, 0,2-5 часов.
Давление, используемое в вышеуказанном способе получения, не может быть особо ограничено, и его примеры включают, примерно от 0,1 до 10 атм.
Соединение, представленное общей формулой (10), которое получают по этому способу, может быть подвергнуто следующей стадии с выделением или без выделения, и очистке с помощью хорошо известных путей выделения, описанных далее.
Соединение, представленное общей формулой (9), может быть получено способами, описанными в ссылочной литературе (международная публикация № WO2011/071565), или, если необходимо, объединяя способы, описанные в ссылочных примерах и примерах.
[0142]
[C-2]
На этой стадии соединение, представленное общей формулой (11), получают путем взаимодействия с соединением, представленным общей формулой (10), с цианидным агентом и аммиаком.
Цианидный агент, который должен быть использован, представляет собой, например, гидроцианид, цианиды металлов, соединения циангидрина, ацил цианиды, галоген цианиды и тому подобное. Цианиды металлов представляют собой, например, цианиды щелочных металлов, такие как цианиды натрия, цианиды калия; цианиды щелочноземельных металлов, такие как цианид кальция; цианиды переходных металлов, такие как цианид меди. Предпочтительным является цианид калия.
Аммиак, используемый на данной стадии, может представлять собой газообразный аммиак, жидкий амммиак, или водный раствор аммиака, и водный раствор аммиака является желательным с точки зрения того, что он не требует сложного реакционного устройства.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, и он включает простые эфиры (тетрагидрофуран, 1,4-диоксан и т.д.), апротонные полярные растворители (N,N-диметилформамид, диметил сульфоксиды, ацетонитрил и т.д.), галогеновые растворители (дихлорметан, хлороформ и т.д.), ароматические углеводородные растворители, такие как толуол, спиртовые растворители (метанол, этанол и т.д.), воду и смешанные растворители, и, предпочтительно, воду и смешанный растворитель с метанолом.
Количество цианидного агента, которое должно быть использовано, обычно составляет от 1 до 10 эквивалентов относительно соединения (10), предпочтительно, от 2,0 до 5,0 эквивалентов. Количество аммиака, используемого в реакции, предпочтительно, составляет 1,5-10 эквивалентов относительно соединения (10) и, более предпочтительно, от 1,8 до 2,5 эквивалентов. При необходимости добавляют хлорид аммония. Его количество составляет обычно 0,2-2,0 эквивалента относительно соединения (10), предпочтительно, от 0,1 до 0,5 эквивалента.
Температура реакции составляет от -100°C до 100°C, предпочтительно, от 0 до 60°C. Время реакции составляет от 0,1 до 24 часов, предпочтительно, 0,2-5 часов. Давление, используемое в вышеуказанном способе получения, не может быть особо ограничено, и его примеры включают примерно от 0,1 до 10 атм. Соединение, представленное общей формулой (11), может быть подвергнуто следующей стадии с выделением или без выделения и очистке хорошо известными путями выделения и очистки, как описано далее.
[0143]
[C-3]
В этом способе соединение, представленное общей формулой (12), получают таким же образом, как в [B-2], описанном выше, используя соединение, представленное общей формулой (11). Соединение, представленное общей формулой (12), может быть подвергнуто следующей стадии с выделением или без выделения и очистке хорошо известными путями выделения и очистки, как описано далее. Дальнейшее осуществление способа для соединений, представленных общими формулами (8) и (12), описано в качестве примера.
Более того, в настоящем способе R1 и R2 могут быть преобразованы в структуры, соответствующие группам с введенной защитой/удаленной защитой по настоящему изобретению.
[0144]
[Формула 13]
[Стадия D]
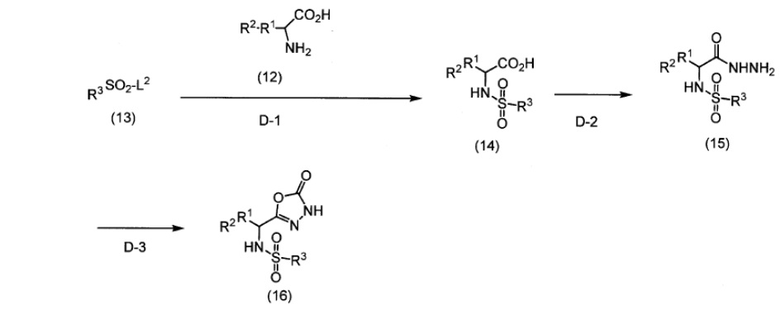
[В формуле L2 представляет собой удаляемую группу. Символы имеют те же значения, что определены выше.]
[0145]
[D-1]
На этой стадии карбоновая кислота, представленная общей формулой (14), может быть получена путем взаимодействия аминокислоты, представленной общей формулой (12), с галогенангидридом сульфоновой кислоты, представленным общей формулой (13), в присутствии основания.
Основания, которые должны быть использованы, представляют собой соли щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия, фосфат натрия, фосфат калия, гидроксид натрия, или органические амины, такие как триметиламин или гидроксид калия, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, лутидин и коллидин, в качестве примера, и, предпочтительно, триэтиламин.
Реакционный растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, и он представляет собой органические растворители или воду и т.д., такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и тому подобное. Эти растворители могут быть использованы в смеси при соответствующем соотношении.
Число эквивалентов основания и амина составляет 0,5-10 эквивалентов, соответственно, предпочтительно, от 1,0 до 5,0 эквивалентов.
Количество галогенангидрида сульфоновой кислоты устанавливают подходящим в соответствии с соединениями, представленными общей формулой (12), но не ограничивается, и обычно составляет от 1,0 до 5,0 эквивалентов по отношению к соединению, представленному общей формулой (12), более предпочтительно, от 1,0 до 2,5 эквивалентов.
Температуру реакции устанавливают в соответствии с соединениями, представленными общей формулой (12), но не ограничивают, и она составляет, например, от -20 до 70°C, предпочтительно, от 0 до 40°C. Время реакции составляет обычно от 0,1 до 24 часов, предпочтительно, 0,2-6,0 часов. Соединение, представленное общей формулой (14), может быть подвергнуто следующей стадии с выделением или без выделения и очистке с помощью хорошо известных путей выделения и очистки, описанных далее.
Соединение, представленное общей формулой (13), может быть получено способами, описанными в ссылочной литературе (Tetrahedron Lett. 51,418-421 (2010)), или, если необходимо, объединяя способы, описанные в ссылочных примерах и примерах.
[0146]
[D-2]
На этой стадии соединение, представленное общей формулой (15), может быть получено путем взаимодействия карбоновой кислоты, представленной общей формулой (14), с конденсирующим агентом и гидразином. Альтернативно, оно может быть получено путем взаимодействия производного гидразина, имеющего соответствующую защитную группу, с карбоновой кислотой, представленной общей формулой (14), таким же образом, и затем осуществляя реакцию удаления защитной группы.
Конденсирующим агентом является, например, 1,1'-карбонилдиимидазол (далее, CDI), дициклогексилкарбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид и тому подобное, предпочтительно, CDI.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органические растворители, такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.) и амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон), и они могут быть использованы отдельно или в комбинации.
Количество конденсирующего агента по отношению к соединению, представленному формулой (14), составляет обычно от 1 до 50 эквивалентов, предпочтительно, примерно от 1 до 5. Количество гидразина относительно соединения, представленного общей формулой (14), составляет обычно от 1 до 100 эквивалентов, предпочтительно, 1-5 эквивалентов. Основание представляет собой органическое основание, такое как триэтиламин, пиридин, 4-диметиламинопиридин, диазабициклоундецен и тому подобное.
Температура реакции составляет от -20 до 80°C, предпочтительно, от 0 до 40°C. Время реакции составляет обычно от 0,05 до 24 часов, более предпочтительно, от 0,05 до 6 часов. Соединение, представленное общей формулой (15), может быть подвергнуто следующей стадии с выделением или без выделения и очистке с помощью хорошо известных путей выделения и очистки, описанных далее.
[0147]
[D-3]
На этой стадии соединение, представленное общей формулой (16), по настоящему изобретению, может быть получено путем циклизации соединения, представленного общей формулой (15), с ацилирующим агентом.
Ацилирующий агент представляет собой, например, изобутил хлорформиат, CDI, фосген, трифосген и тому подобное, предпочтительно, CDI. Основание представляет собой органическое основание, такое как триэтиламин, N,N-диизопропилэтиламин, пиридин, 4-диметиламинопиридин, и такое как диазабициклоундецен и тому подобное.
Количество ацилирующего агента по отношению к соединению, представленному формулой (15), обычно представляет собой, предпочтительно, от 1 до 50 эквивалентов и, более предпочтительно, от 1 до 5 эквивалентов.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органические растворители, такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и т.д.) и тому подобное, и они могут использоваться отдельно или в виде смеси.
Температура реакции составляет от -20 до 80°C, предпочтительно, от 0 до 50°C. Время реакции составляет обычно от 0,5 до 24 часов, предпочтительно, от 0,5 до 8 часов. Соединение, представленное общей формулой (16), может быть подвергнуто следующей стадии с выделением или без выделения и очистке с помощью хорошо известных путей выделения и очистки, описанных далее.
Соединение, представленное общей формулой (16) по настоящему изобретению, может быть синтезировано 1) путем защиты аминогруппы аминокислоты соединения, представленного выше общей формулы (12), хорошо известной подходящей защитной группой, 2) преобразованием группы карбоновой кислоты в оксадиазолоновое кольцо таким же способом как и в [D-2], 3) удалением защитной группы хорошо известным способом, 4) сульфонамидированием таким же образом как и в [D-1].
[0148]
[Формула 14]
[Стадия E]
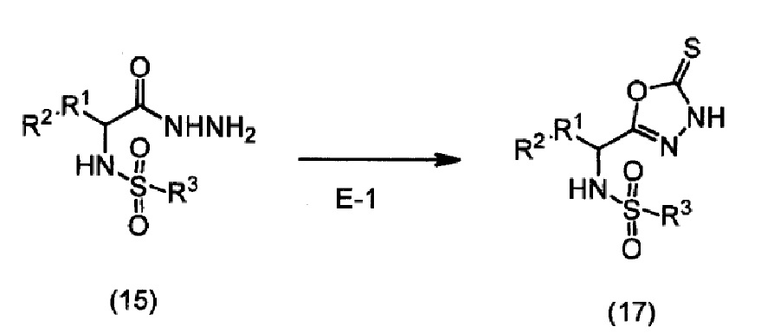
[В формуле символы имеют те же значения, что определены выше.]
[0149]
[E-1]
На этой стадии соединение, представленное общей формулой (17) по настоящему изобретению, может быть получено путем взаимодействия соединения, представленного общей формулой (15), с дисульфидом углерода.
Основания, используемое в данной реакции, представляют собой, например, соли щелочных металлов, такие как гидроксид натрия, гидроксид калия, органические амины, такие как триэтиламин, алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид натрия, трет-бутоксид калия, амиды металлов, такие как диизопропиламид лития, и, предпочтительно, гидроксид калия.
Количество основания, которое должно быть использовано, по отношению к соединению, представленному формулой (15), составляет обычно от 1 до 20 эквивалентов, предпочтительно, от 1 до 5 эквивалентов. Количество дисульфида углерода по отношению к соединению, представленному формулой (15), составляет обычно от 1 до 20 эквивалентов, предпочтительно, от 1 до 5 эквивалентов.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органические растворители, воду, например, спирты (метанол, этанол, пропанол), простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и тому подобное), и они могут быть использованы отдельно или в виде смеси.
Температура реакции составляет от 0 до 150°C, предпочтительно, между 20 и 100°C. Время реакции составляет обычно от 0,5 до 24 часов, предпочтительно, от 1,0 до 12 часов. Соединение, представленное общей формулой (17) по настоящему изобретению, может быть выделено и очищено хорошо известными путями выделения и очистки.
[0150]
[Формула 15]
[Стадия F]
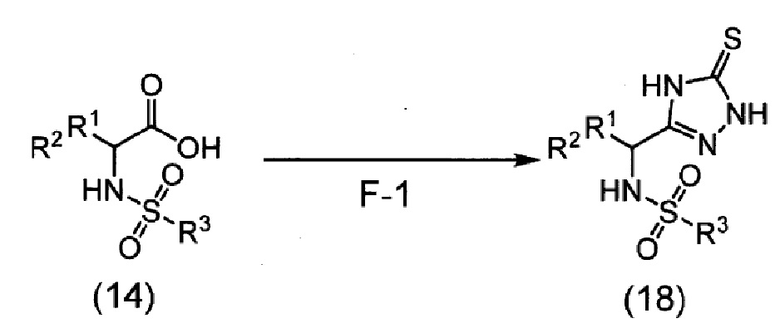
[В формуле символы имеют те же значения, что определены выше.]
[0151]
[F-1]
На этой стадии соединение общей формулы (18) может быть получено путем конденсации и одновременной циклизации соединения, представленного общей формулой (14), и тиосемикарбазида.
Конденсирующий агент представляет собой, например, CDI, дициклогексилкарбодиимид, 1-этил-3-(3-диметиламинопропил)-карбодиимид гидрохлорид и тому подобное, предпочтительно, 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органические растворители, такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и тому подобное). Они могут использоваться отдельно или в виде смеси.
Количество конденсирующего агента относительно соединения, представленного общей формулой (14), составляет от 1,0 до 50 эквивалентов, предпочтительно, от 1 до 5 эквивалентов. Количество тиосемикарбазида относительно соединения, представленного общей формулой (14), составляет обычно от 1 до 100 эквивалентов, предпочтительно, от 1,0 до 5,0 эквивалентов. Основание представляет собой органические основания, такие как триэтиламин, N,N-диизопропилэтиламин, пиридин, 4-диметиламинопиридин, диазабициклоундецен и тому подобное.
Температура реакции составляет от -20 до 180°C, предпочтительно, от 0 до 100°C. Время реакции составляет обычно от 0,05 до 24 часов, предпочтительно, от 0,05 до 6 часов. Соединение, представленные формулой (18) по настоящему изобретению, может быть выделено и очищено хорошо известными путями выделения и очистки, как описано далее.
[0152]
[Формула 16]
[Стадия G]
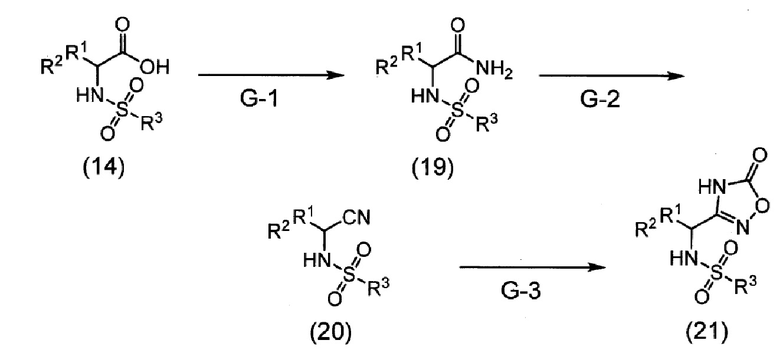
[В формуле символы имеют те же значения, что определены выше.]
[0153]
[G-1]
На этой стадии соединение, представленное общей формулой (19), может быть получено путем взаимодействия карбоновой кислоты, представленной общей формулой (14), с конденсирующим агентом и аммиаком.
Конденсирующий агент представляет собой, например, 1,1'-карбонилдиимидазол (далее, CDI), дициклогексилкарбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид и тому подобное, предпочтительно, CDI.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органические растворители, такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и тому подобное). Они могут использоваться отдельно или в виде смеси.
Количество конденсирующего агента относительно соединения, представленного общей формулой (14), составляет обычно от 1 до 50 эквивалентов, предпочтительно, от 1 до 5 эквивалентов. Аммиак используется в виде водного раствора или соли соляной кислоты, и его количество относительно соединения, представленного общей формулой (14), составляет обычно от 1 до 100 эквивалентов, предпочтительно, от 1,0 до 5,0 эквивалентов. Основания включают, например, органические основания, такие как триэтиламин, пиридин, 4-диметиламинопиридин, диазабициклоундецен и тому подобное.
Температура реакции составляет от -20 до 80°C, предпочтительно, от 0 до 40°C. Время реакции составляет обычно от 0,05 до 24 часов, предпочтительно, от 0,05 до 6 часов. Соединение, представленное общей формулой (19), может быть подвергнуто следующей стадии с выделением или без выделения и очистке с помощью хорошо известных путей выделения и очистки, описанных далее.
[0154]
[G-2]
На этой стадии нитрил, представленный общей формулой (20), может быть получен исходя из соединения амида, представленного общей формулой (19).
Дегидратирующие агенты включают, например, оксалилхлорид, тионилхлорид, хлорангидрид циануровой кислоты и тому подобное, предпочтительным является хлорангидрид циануровой кислоты.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органические растворители, такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, пропионитрил и т.д.), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и тому подобное). Они могут использоваться отдельно или в виде смеси.
Количество дегидратирующего агента относительно соединения, представленного общей формулой (19), составляет обычно от 1 до 50 эквивалентов.
Температура реакции составляет от -20 до 80°C, предпочтительно, между от 0 до 40°C. Время реакции составляет обычно от 0,05 до 24 часов, предпочтительно, от 0,5 до 3 часов. Соединение, представленное общей формулой (20), может быть подвергнуто следующей стадии с выделением или без выделения и очистке с помощью хорошо известных путей выделения и очистки, описанных далее.
[0155]
[G-3]
На этой стадии производное амидоксима получают из производного нитрила, представленного общей формулой (20), путем добавления гидроксиламина и далее взаимодействия с ацилирующим агентом с последующей циклизацией при нагревании и получением соединения, представленного общей формулой (21).
Количество гидроксиламина, которое должно быть использовано для получения амидоксима, составляет в реакции обычно от 1 до 50 эквивалентов по отношению к соединению, представленному общей формулой (20).
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органический растворитель, такой как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и тому подобное). Они могут использоваться отдельно или в виде смеси.
Температура реакции составляет от -20 до 100°C, предпочтительно, от 0 до 60°C. Время реакции составляет обычно от 0,5 до 3 дней, предпочтительно, от 0,05 до 12 часов. Полученное производное амидоксима, представленное общей формулой (20), может быть подвергнуто следующей стадии с выделением или без выделения и очистке с помощью хорошо известных путей выделения и очистки, описанных далее.
Ацилирующий агент, используемый для амидоксима, представляет собой, например, хлорформиат, 2-этилгексил, CDI, фосген, трифосген и тому подобное, предпочтительно, хлорформиат, 2-этилгексил. Основание, которое должно быть использовано, включает органические основания, такие как триэтиламин, N,N-диизопропилэтиламин, пиридин, 4-диметиламинопиридин, диазабициклоундецен и тому подобное.
Количество ацилирующего агента составляет обычно от 1 до 50 эквивалентов относительно производного амидоксима, и, более предпочтительно, примерно от 1 до 3 эквивалентов.
Растворитель, который должен быть использован, особо не ограничивается, пока это не оказывает негативного влияния на реакцию, например, представляет собой органические растворители, такие как простые эфиры (диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и т.д.), галогенированные углеводороды (дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода), ароматические углеводороды (бензол, толуол, ксилол и т.д.), алифатические углеводороды (гексан, пентан, циклогексан и т.д.), нитрилы (ацетонитрил, проптонитрил и т.д.), амиды (ДМФ, N,N-диметилацетамид, N-метилпирролидинон и т.д.) и тому подобное, и они могут быть использованы отдельно или в виде смеси, и в процессе реакции они могут быть заменены на другие растворители.
Температура взаимодействия с ацилирующим агентом составляет от -20 до 80°C, предпочтительно, от 0 до 40°C. Время реакции составляет обычно от 0,5 до 24 часов, предпочтительно, от 0,5 до 3 часов. Температура реакции, используемая при реакции циклизации полученного ацилированного соединения, составляет от 0 до 150°C, предпочтительно, от 0 до 120°C. Время реакции составляет обычно от 0,5 до 24 часов, предпочтительно, от 0,5 до 12 часов. Полученное соединение, представленное общей формулой (21), может быть подвергнуто следующей стадии с выделением или без выделения и очистке с помощью хорошо известных путей выделения и очистки, описанных далее.
[0156]
Соединение, представленное формулой (I) по настоящему изобретению, и его промежуточные продукты могут быть выделены и очищены хорошо известными путями выделения и очистки, такими как перекристаллизация, кристаллизация, дистилляция или колоночная хроматография. Соединение по настоящему изобретению и его синтетические промежуточные продукты обычно могут образовывать фармакологически приемлемую соль хорошо известным способом, и также могут быть преобразованы друг в друга.
[0157]
Когда в соединении по настоящему изобретению присутствуют оптические изомеры, стереоизомеры, таутомеры или поворотные изомеры, соединение по настоящему изобретению охватывает эти изомеры или их смесь. Например, когда в соединении по настоящему изобретению присутствует оптический изомер, если не указано иное, соединением по настоящему изобретению также охватываются рацемат и оптический изомер, выделенный из рацемата. Эти изомеры могут быть получены хорошо известным синтетическим способом, методами разделения (концентрирование, экстракция растворителем, колоночная хроматография, перекристаллизация и тому подобное), соответственно, с одним соединением. В соединении по настоящему изобретению, например, когда X1=атом кислорода, X2=атом кислорода, X3=NH, имеются таутомеры, показанные далее, все изомеры также включены в настоящее изобретение.
[0158]
[Формула 17]
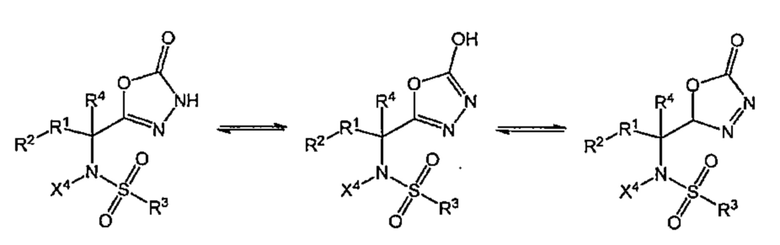
[0159]
Сульфонамидное соединение, представленное формулой (I), или его соль могут быть в аморфной (аморфное) или кристаллической форме, и кристаллическая форма может быть в виде монокристаллической формы или полиморфической смеси, охватываемыми сульфонамидным соединением, представленным формулой (I), или его солью. Кристаллы могут быть получены путем применения хорошо известного способа кристаллизации.
Более того, сульфонамидное соединение, представленное формулой (I), или его соль могут представлять собой сольват (например, гидрат и т.д.) или не быть сольватом, они оба охватываются сульфонамидным соединением, представленным формулой (I), или его солью. Соединения, меченные изотопами (например, дейтерием, 3H, 14C, 35S, 125I и т.д.) и тому подобное, также охватываются сульфонамидным соединением, представленным формулой (I), или его солью.
[0160]
Хотя пролекарства сульфонамидного соединения, представленного формулой (I), или его соль также включены в настоящее изобретение, пролекарства относятся к соединениям, которые преобразуются в сульфонамидное соединение, представленное формулой (I), или его соль путем взаимодействия с ферментом или желудочной кислотой в физиологическом состоянии в живом организме, то есть, соединения, которые преобразуются в сульфонамидное соединение, представленное формулой (I), или его соль путем ферментативного окисления, восстановления или гидролиза и тому подобное, или соединения, которые преобразуются в сульфонамидное соединение, представленное формулой (I), или его соль с помощью желудочной кислоты. Более того, пролекарство сульфонамидного соединения, представленного формулой (I), или его соль может представлять собой соединения, которые преобразуются в сульфонамидное соединение, представленное формулой (I), или его соль в физиологических условиях, как описано в работе Hirokawa Shoten 1990 annual «Development of Pharmaceuticals» Volume 7 Molecular Design pages 163-198.
[0161]
Соль сульфонамидного соединения, представленного формулой (I) подразумевает соль, которая является фармацевтически приемлемой.
[0162]
Сульфонамидное соединение, представленное формулой (I), или его соль обладают ингибирующей активностью против RNR. Сульфонамидное соединение, представленное формулой (I), или его соль могут быть использованы в качестве лекарственного средства для профилактики или лечения заболеваний, связанных с RNR, без проявления побочных эффектов, основанных на побочном действии белков, для образования которых требуются ионы железа, благодаря его превосходной ингибирующей RNR активности и его структуре, которая не образует хелаты с ионами металлов.
[0163]
Применение сульфонамидного соединения, представленного формулой (I), или его соли и другого противоопухолевого агента(ов) в комбинации усиливает противоопухолевый эффект. Комбинированный препарат сульфонамидного соединения, представленного формулой (I), или его соли и другого противоопухолевого агента(ов) может быть в виде одной формы препарата (то есть смешиваемый агент) или может быть комбинированным введением в двух или более отдельных формах препарата.
[0164]
В настоящем изобретении противоопухолевый эффект можно оценивать, например, на основании уменьшения объема опухоли, замедленного роста опухоли или продления периодов выживания.
[0165]
В одном варианте осуществления предложен противоопухолевый агент, содержащий сульфонамидное соединение, представленное формулой (I), или его соль и другой противоопухолевый агент(ы). Кроме того, в другом варианте осуществления предложен агент для усиления противоопухолевого эффекта другого противоопухолевого агента(ов), включающий сульфонамидное соединение, представленное формулой (I), или его соль в качестве активного ингредиента.
[0166]
Другой противоопухолевый агент(ы) конкретно не ограничен, но включает антиметаболиты, препараты платины, препараты на основе растительных алкалоидов и молекулярно-таргетные препараты.
[0167]
Антиметаболиты включают 5-фторурацил (5-FU), 5-фтор-2'-дезоксиуридин (FdUrd), тегафур, тегафур-урацил (например, UFT), тегафур-гимерацил-отерацил (например, TS-1), пеметрексед, трифлуридин, трифлуридин-типирацил гидрохлорид (например, Lonsurf), флударабин (или активный метаболит флударабин нуклеозид), цитарабин, гемцитабин, капецитабин, неларабин, клофарабин и ингибиторы метилирования ДНК (децитабин, гвадецитабин, азацитидин и т.д.). 5-Фторурацил (5-FU), трифлуридин, флударабин (или активный метаболит флударабина нуклеозид), цитарабин, гемцитабин, или ингибиторы метилирования ДНК (децитабин, гвадецитабин, азацитидин и т.д.) являются предпочтительными, и 5-фторурацил (5-FU), трифлуридин, флударабин (или активный метаболит флударабина нуклеозид), цитарабин, гемцитабин, децитабин, гуадецитабин или азацитидин являются предпочтительными.
[0168]
Препараты платины включают цисплатин, оксалиплатин, карбоплатин и недаплатин и предпочтительно представляют собой цисплатин, оксалиплатин, или карбоплатин.
[0169]
Препараты на основе растительных алкалоидов включают лекарственные средства, ингибирующие микротрубочки, такие как паклитаксел, доцетаксел, винбластин, винкристин, виндезин, винорелбин и эрибулин, и лекарственные средства, ингибирующие топоизомеразу, такие как иринотекан (или активный метаболит SN-38), ногитекан и этопозид. Препарат, ингибирующий топоизомеразу, такой как иринотекан (или активный метаболит SN-38), ногитекан и этопозид, является предпочтительным, препарат, ингибирующий топоизомеразу II, такой как этопозид, является более предпочтительным, и этопозид является еще более предпочтительным.
[0170]
Молекулярно-таргетные препараты включают ингибиторы ATR (атаксия-телеангиэктазия и Rad3-родственный белок), ингибиторы Chk1 (контрольная киназа 1), ингибиторы HSP (белок теплового шока) 90, ингибиторы PARP (поли-АДФ-рибозная полимераза), ингибиторы EGFR (рецептор эпидермального фактора роста), ингибиторы Her2, ингибиторы VEGFR (рецептор фактора роста эндотелия сосудов), ингибиторы PDGFR (рецептор фактора роста тромбоцитов), ингибиторы MET, ингибиторы AXL, ингибиторы RET, FLT3 (ингибиторы тирозинкиназы 3), KIT ингибиторы, ингибиторы CSF1R (рецептор колониестимулирующего фактора 1), ингибиторы TIE2 (рецепторная протеинтирозинкиназа, расположенная на поверхности эндотелиальных клеток) и ингибиторы TRKB.
[0171]
Ингибиторы ATR включают AZD6738, берзосертиб, BAY1895344 и VX-803. AZD6738 является предпочтительным.
[0172]
Ингибиторы Chk1 включают прексасертиб, SCH900776, GDC-0575 и CCT245737. Прексасертиб или SCH900776 являются предпочтительными.
[0173]
Ингибиторы HSP90 включают люминспиб, ганетеспиб, оналеспиб и 3-этил-4-{3-изопропил-4-(4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)-1H-пиразоло[3,4-b]пиридин-1-ил}бензамид. Люминеспиб является предпочтительным.
[0174]
Ингибиторы PARP включают олапариб, рукапариб, нирапариб, велипариб и талазопариб. Олапариб или талазопариб являются предпочтительными.
[0175]
Ингибиторы EGFR включают низкомолекулярные ингибиторы, такие как лапатиниб, гефитиниб, эрлотиниб, афатиниб и вандетаниб, и антитела против EGFR, такие как цетуксимаб и панитумумаб. Низкомолекулярный ингибитор, такой как лапатиниб и вандетаниб, является предпочтительным, и лапатиниб является более предпочтительным. Кроме того, подходящими являются также ингибиторы мультикиназы.
[0176]
Ингибиторы Her2 включают низкомолекулярные ингибиторы, такие как лапатиниб, и антитела против Her2, такие как трастузумаб, пертузумаб и трастузумаб эмтанзин. Низкомолекулярный ингибитор, такой как лапатиниб, является предпочтительным, и лапатиниб является более предпочтительным. Кроме того, подходящими являются также ингибиторы мультикиназы.
[0177]
Ингибиторы VEGFR представляют собой ингибиторы по меньшей мере одного из VEGFR1, VEGFR2 и VEGFR3 и включают низкомолекулярные ингибиторы, такие как сунитиниб, кабозантиниб, мидостаурин, сорафениб, вандетаниб, пазопаниб, ленватиниб и акситиниб, и антитела против VEGFR, такие как антитела против VEGFR. Сунитиниб, кабозантиниб или мидостаурин являются предпочтительными. Кроме того, подходящими являются также ингибиторы мультикиназы.
[0178]
Ингибиторы PDGFR являются ингибиторами PDGFRα и/или PDGFRβ и включают сунитиниб, мидостаурин, пазопаниб, ленватиниб и сорафениб. Сунитиниб или мидостаурин являются предпочтительными. Кроме того, подходящими являются также ингибиторы мультикиназы.
[0179]
Ингибиторы МЕТ включают кабозантиниб, кризотиниб и тепотиниб. Кабозантиниб является предпочтительным. Кроме того, подходящими являются также ингибиторы мультикиназы.
[0180]
Ингибиторы AXL включают кабозантиниб и гилтеритиниб. Кабозантиниб является предпочтительным. Кроме того, подходящими являются также ингибиторы мультикиназы.
[0181]
Ингибиторы RET включают сунитиниб, кабозантиниб, сорафениб, ленватиниб и вандетаниб. Сунитиниб или кабозантиниб являются предпочтительными. Кроме того, подходящими являются также ингибиторы мультикиназы.
[0182]
Ингибиторы FLT3 включают сунитиниб, кабозантиниб, мидостаурин, гилтеритиниб и сорафениб. Сунитиниб, кабозантиниб или мидостаурин являются предпочтительными. Кроме того, подходящими являются также ингибиторы мультикиназы.
[0183]
Ингибиторы KIT включают сунитиниб, мидостаурин, пазопаниб, ленватиниб и сорафениб. Сунитиниб или мидостаурин являются предпочтительными. Кроме того, подходящими являются также ингибиторы мультикиназы.
[0184]
Ингибиторы CSF1R включают сунитиниб, BLZ-945 и ARRY-382. Сунитиниб является предпочтительным. Кроме того, подходящими являются также ингибиторы мультикиназы.
[0185]
Ингибиторы TIE2 включают кабозантиниб. Кабозантиниб является предпочтительным. Кроме того, подходящими являются также ингибиторы мультикиназы.
[0186]
Ингибиторы TRKB включают кабозантиниб и энтректиниб. Кабозантиниб является предпочтительным. Кроме того, подходящими являются также ингибиторы мультикиназы.
[0187]
«Ингибитор мультикиназы» в настоящем документе представляет собой соединение, обладающее ингибирующей активностью в отношении двух или более киназ, например, лапатиниб, обладающий ингибирующей активностью в отношении EGFR и ингибирующей активностью в отношении HER2.
[0188]
Другой противоопухолевый агент(ы), предпочтительно, представляет собой антиметаболит, препарат платины, препарат на основе растительных алкалоидов или молекулярно-таргетный препарат, более предпочтительно, антиметаболит, препарат платины, препарат, ингибирующий активность топоизомеразы II или молекулярно-таргетный препарат, еще более предпочтительно, антиметаболит, препарат платины, препарат, ингибирующий активность топоизомеразы II, ингибитор ATR, ингибитор Chk1, ингибитор HSP90, ингибитор PARP, ингибитор EGFR, ингибитор Her2, ингибитор VEGFR, ингибитор PDGFR, ингибитор MET, ингибитор AXL, ингибитор RET, ингибитор FLT3, или ингибиторы KIT, еще более предпочтительно, антиметаболит, препарат платины, этопозид, ингибитор ATR, ингибитор Chk1, люминеспиб, олапариб, талазопариб, лапатиниб, сунитиниб, кабозантиниб или мидостаурин, еще более предпочтительно, антиметаболит, препарат платины, этопозид, AZD6738, прексасертиб, SCH900776, люминеспиб, олапариб, талазопариб, лапатиниб, сунитиниб, кабозантиниб или мидостаурин, еще более предпочтительно, антиметаболит, цисплатин, оксалиплатин, карбоплатин, этопозид, AZD6738, прексасертиб, SCH900776, люминеспиб, олапариб, талазопариб, лапатиниб, сунитиниб, кабозантиниб или мидостаурин, еще более предпочтительно, 5-фторурацил (5-FU), трифлуридин, флударабин, цитарабин, гемцитабин, ингибитор метилирования ДНК, цисплатин, оксалиплатин, карбоплатин, этопозид, AZD6738, прексасертиб, SCH900776, люминеспиб, олапариб, талазопариб, лапатиниб, сунитиниб, кабозантиниб или мидостаурин, еще более предпочтительно, 5-фторурацил (5-FU), трифлуридин, флударабин, цитарабин, гемцитабин, децитабин, гуадецитабин, азацитидин, цисплатин, оксалиплатин, карбоплатин, этопозид, AZD6738, прексасертиб, SCH900776, люминеспиб, олапариб, талазопариб, лапатиниб, сунитиниб, кабозантиниб или мидостаурин.
[0189]
Опухоли, представляющие интерес по настоящему изобретению, конкретно не ограничены, если проявляется эффект усиления противоопухолевого эффекта. Опухоль, на которую сульфонамидное соединение, представленное формулой (I), или его соль оказывает противоопухолевое действие, является предпочтительной, и связанная с RNR злокачественная опухоль является более предпочтительной.
[0190]
«Связанное с RNR заболевание» включает злокачественные опухоли, возникновение которых может быть снижено, или симптомы которых находятся в состоянии ремиссии, или они могут быть облегчены и/или полностью излечены путем выключения или подавления и/или ингибирования функций RNR. Представляющие интерес злокачественные опухоли особо не ограничиваются, представляют собой рак головы и шеи, рак желудочно-кишечного тракта (рак пищевода, рак желудка, дуоденальный рак, рак печени, рак желчных путей (рак желчного пузыря, рак желчных протоков и т.д.), рак поджелудочной железы, колоректальный рак (рак толстой кишки, рак прямой кишки и т.д.), рак легких (немелкоклеточный рак легкого, мелкоклеточный рак легкого, мезотелиома и т.д.), рак молочной железы, рак половых органов (рак яичников, рак матки (рак шейки матки, рак эндометрия и т.д.) и т.д.), рак мочевой системы (рак почки, рак мочевого пузыря, рак предстательной железы, опухоль яичек и т.д.), гемопоэтические опухоли (лейкемия, злокачественная лимфома, множественная миелома и т.д.), опухоли костных и мягких тканей, рак кожи, опухоль головного мозга и тому подобное. Предпочтительными являются рак желудочно-кишечного тракта (рак пищевода, рак желудка, дуоденальный рак, рак печени, рак желчных путей (рак желчного пузыря, рак желчных протоков и т.д.), рак поджелудочной железы, колоректальный рак (рак толстой кишки, рак прямой кишки и т.д.), рак легких (немелкоклеточный рак легкого, мелкоклеточный рак легкого, мезотелиома и т.д.) или гемопоэтические опухоли (лейкемия, злокачественная лимфома, множественная миелома и т.д.), более предпочтительными являются рак толстой кишки, рак поджелудочной железы, рак легких (немелкоклеточный рак легких, мелкоклеточный рак легких, мезотелиома и т.д.) или гематопоэтические опухоли (лейкоз, злокачественная лимфома, множественная миелома и т.д.), и еще более предпочтительными являются рак толстой кишки, рак поджелудочной железы, рак легких (немелкоклеточный рак легких, мелкоклеточный рак легких, мезотелиома и т.д.) или лейкемия.
[0191]
В настоящем документе «RNR» включает RNR человека или не человека, предпочтительно, RNR человека.
[0192]
При использовании сульфонамидного соединения, представленного формулой (I), или его соли в качестве фармацевтического средства их, необязательно, можно составить вместе с фармацевтически приемлемым носителем, и в зависимости от профилактических или терапевтических целей могут быть подходящими различные лекарственные формы, и в качестве лекарственных форм могут быть, например, любые пероральные средства, инъекции, суппозитории, мази и накладки. Поскольку сульфонамидное соединение, представленное формулой (I), или его соль обладают превосходной способностью к всасыванию в полости рта, предпочтительными являются пероральные средства. Эти лекарственные формы могут быть получены способами получения, широко известными для специалиста в данной области.
Что касается фармацевтически приемлемых носителей, то в качестве фармацевтических материалов используются общеизвестные различные органические или неорганические вещества-носители, и они входят в состав как: нейтральные вспомогательные вещества, связующие вещества, разрыхляющие агенты, смазывающие вещества, красители для твердых препаратов; и растворители, солюбилизирующие агенты, суспендирующие агенты, изотонические агенты, буферы, успокаивающее средство для жидких препаратов и тому подобное. Кроме того, при необходимости также могут быть использованы фармацевтические добавки, которые включают, например, консерванты, антиоксиданты, красители, подслащивающие агенты, ароматизаторы, стабилизирующие агенты.
[0193]
Что касается фармацевтически приемлемых носителей и фармацевтических добавок, обычно они включают, например, в качестве нейтрального вспомогательного вещества лактозу, сахарозу, хлорид натрия, глюкозу, крахмал, карбонат кальция, каолин, микрокристаллическую целлюлозу, кремниевую кислоту и тому подобное; в качестве связующих воду, этанол, пропанол, сахарный сироп, раствор глюкозы, раствор крахмала, раствор желатина, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропил крахмал, метилцеллюлозу, этилцеллюлозу, шеллак, фосфат кальция, поливинилпирролидон и тому подобное; в качестве разрыхлителей сухой крахмал, альгинат натрия, порошок агара, гидрокарбонат натрия, карбонат кальция, лаурилсульфат натрия, моноглицерид стеариновой кислоты, лактозу и тому подобное; в качестве лубрикантов очищенный стеарат талька, буру, полиэтиленгликоль и тому подобное; в качестве красителя оксид титана, оксид железа и тому подобное; в качестве ароматизирующих агентов сахарозу, апельсиновую цедру, лимонную кислоту, виноградную кислоту и тому подобное.
[0194]
При составлении перорального твердого препарата он может быть изготовлен добавлением нейтрального вспомогательного вещества к сульфонамидному соединению, представленному формулой (I) или другому противоопухолевому агенту(ам), и при необходимости, добавлением, кроме того, связующих веществ, разрыхлителей, смазывающих веществ, красителей или ароматизаторов и тому подобное с последующим формованием в виде таблеток, покрытых оболочкой таблеток, гранул, порошков, капсул и тому подобное.
При составлении инъецируемых форм они могут быть подготовлены добавлением агентов, регулирующих рН, буферов, стабилизаторов, изотонических агентов, местных анестетиков и тому подобное, к сульфонамидному соединению, представленному формулой (I) или другому противоопухолевому агенту(ам) с последующим изготовлением далее в виде подкожных, внутримышечных и внутривенных инъекций обычным способом.
[0195]
Препарат другого противоопухолевого агента(ов) также включает его DDS составы (система доставки лекарственного средства). Например, «паклитаксел» включает связанный с альбумином паклитаксел (например, абраксан) и мицеллу паклитаксела (например, NK105) и тому подобное, и «цисплатин» включает мицеллу цисплатина (например, NC-6004) и тому подобное.
[0196]
Количество сульфонамидного соединения, представленного формулой (I), которое должно быть включено в состав каждой из единичных дозированных форм, описанных выше, на единичную дозированную форму, как правило, может составлять от 0,05 до 1000 мг для пероральной дозы, от 0,01 до 500 мг для инъекций, от 1 до 1000 мг для суппозиториев, при условии, что они могут быть изменены в зависимости от симптомов у пациентов, которые принимают их или их дозированные формы.
[0197]
Кроме того, суточная доза лекарственного средства в лекарственной форме относительно сульфонамидного соединения, представленного формулой (I), составляет от 0,05 до 5000 мг, предпочтительно, от 0,1 до 2000 мг в день для взрослых (масса тела 50 кг) и, предпочтительно, вышеуказанное количество вводится один раз или 2-3 раза в день, при условии, что оно может быть изменено в зависимости от симптомов у пациентов, веса, возраста или пола и тому подобного.
[0198]
Схема введения сульфонамидного соединения, представленного общей формулой (I), или его соли и другого противоопухолевого агента(ов) подходящим образом выбрана в пределах диапазона, в котором каждый активный ингредиент оказывает противоопухолевое действие, и активные ингредиенты вводятся одновременно или отдельно в шахматном порядке. При раздельном введении любой из активных ингредиентов может быть введен первым.
[0199]
Сульфонамидное соединение, представленное общей формулой (I), или его соль и другой противоопухолевый агент(ы) могут быть составлены в виде двух или более лекарственных форм каждого активного ингредиента или могут быть составлены вместе в виде одной лекарственной формы, основываясь на лекарственной форме или схеме введения каждого активного ингредиента. Кроме того, препараты могут быть изготовлены и распределены в одной упаковке, подходящей для комбинированного использования, или могут изготавливаться и продаваться в отдельных упаковках.
Примеры
[0200]
Настоящее изобретение описано далее более подробно с предоставлением примеров и примеров исследований, но настоящее изобретение не ограничивается этими примерами.
Различные реагенты, используемые в примерах, являются коммерчески доступными продуктами, если не указано иное. Для колоночной хроматографии на силикагеле использовали заполненную силикагелем колонку Biotage Ltd. SNAP-ULTRA (зарегистрированный товарный знак), или для обращенно-фазовой колоночной хроматографии на силикагеле использовали изготовленную Biotage заполненную силикагелем колонку SNAP KP-C18-HS (зарегистрированная торговая марка). ВЭЖХ, очищенная препаративной хроматографией с обращенной фазой, проводилась при следующих условиях. Объем и градиент впрыска выполнялись соответствующим образом.
Колонка: YMC-Actus Triart C18, 30×50 мм, 5 мкМ
УФ детекция: 254 нм
Скорость потока колонки: 40 мл/мин
Подвижная фаза: вода/ацетонитрил (0,1% муравьиная кислота)
Объем впрыска: 1,0 мл
Градиент: вода/ацетонитрил (от 10% до 90%)
[0201]
Для получения ЯМР спектра использовали AL400 (400 МГц; JEOL (JEOL)) и Mercury400 (400 МГц; Agilent Technologies), и в качестве внутреннего стандарта использовали тетраметилсилан, при условии, что тетраметилсилан был в составе слаболетучего растворителя, в противном случае измерение проводили с использованием растворителя для ЯМР в качестве внутреннего стандарта, выражая все значение δ в м.д. Кроме того, ЖХМС спектры получали в следующих условиях, используя ACQUITY SQD изготовленный Waters (квадрупольный).
Колонка: изготовленная Waters ACQUITY UPLC (зарегистрированная торговая марка) BEH C18, 2,1×50 мм, 1,7 мкМ
МС детекция: ESI отрицательный
УФ детекция: 254 и 280 нм
Скорость потока колонки : 0,5 мл/мин
Подвижная фаза: вода/ацетонитрил (0,1 % муравьиная кислота)
Объем впрыска: 1 мкл
Градиент (таблица 1)
0,1
2,1
3,0
95
5
СТОП
5
95
[0202]
Значения сокращений показаны далее.
с: синглет
д: дублет
т: триплет
кв: квартет
дд: двойной дублет
дт: двойной триплет
тд: триплет дублет
тт: триплет
ддд: двойной дублет
ддт: двойной триплет
дтд: двойной триплет дублет
тдд: триплет-двойной дублет
м: мультиплет
шир.: широкий
шир. с: широкий синглет
ДМСО-d6: дейтерированный диметилсульфоксид
CDCl3: дейтерированный хлороформ
CD3OD: дейтерированный метанол
CDI: 1,1'-карбоксиметил сульфонил диимидазол
DAST: трифторид N,N-диэтиламиносеры
DIBAL-H: диизобутилалюминийгидрид
ДМФ: диметилформамид
ДМСО: диметилсульфоксид
ТГФ: Тетрагидрофуран
WSC=EDCI=1-этил-3-(3-диметиламинопропил)карбодиимид
HOBt=1-гидроксибензотриазол
[0203]
[Ссылочный пример A1. Синтез 2-(1-бромэтил)-1-фтор-3,4-диметилбензола]
[0204]
[Формула 18]
[0205]
(Стадия 1) 1-(6-фтор-2,3-диметилфенил)этанол
После добавления по каплям при температуре 0°C раствора метилмагнийбромида в диэтиловом эфире (3,0М, 70 мл) к 6-фтор-2,3-диметилбензальдегиду (22,0 г) в растворе ТГФ (300 мл) реакционную смесь перемешивали при комнатной температуре в течение 1 часа. На ледяной бане по каплям добавляли насыщенный водный раствор хлорида аммония (150 мл) и добавляли этилацетат (200 мл), и полученный продукт разделяли на слои. Органический слой последовательно промывали HCl (1М, 200 мл), водой (200 мл) и насыщенным солевым раствором (200 мл), затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 1-(6-фтор-2,3-диметилфенил)этанола (23,7 г).
[0206]
(Стадия 2)
К раствору в хлороформе (120 мл) 1-(6-фтор-2,3-диметилфенил)этанола (23,7 г), полученного на вышеуказанной стадии 1, при температуре 0°C добавляли по каплям трибромид фосфора (26,5 мл), и реакционный раствор перемешивали в течение 30 минут при температуре 0°C. Реакционную смесь добавляли к охлажденному на льду насыщенному водному раствору бикарбоната натрия (1 л). После добавления к смеси хлороформа (500 мл) полученный продукт разделяли на слои и органический слой последовательно промывали водой (200 мл) и насыщенным солевым раствором (200 мл). Органический слой сушили над безводным сульфатом магния, получая указанное в заголовке соединение (29,5 г) при концентрировании при пониженном давлении.
[0207]
[Ссылочные примеры A2-A41]
Альдегид и метилмагнийбромид в качестве исходных продуктов подвергали взаимодействию друг с другом таким же образом, как в ссылочном примере A1, стадии 1 и стадии 2, и затем полученный продукт подвергали взаимодействию с трибромидом фосфора с получением соединений ссылочных примеров A2-A41. При этом соединения ссылочных примеров A40 и A41 получали по той же методике, но используя вместо метилмагнийбромида этилмагнийбромид и метилйодид-d3-магний, соответственно.
[0208]
[Таблица 1]



[0209]
[Ссылочный пример B1. Синтез 2-(1-бромэтил)-4-этил-1-фтор-3-метилбензола]
[0210]
[Формула 19]
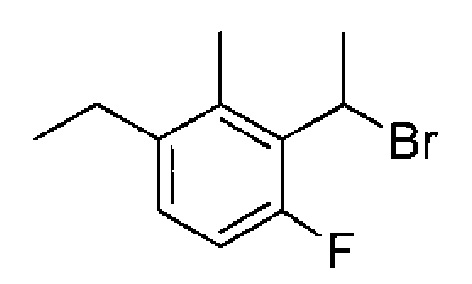
[0211]
(Стадия 1) 2-бром-3-этил-6-фторбензальдегид
К раствору 2-бром-1-этил-4-фторбензола (14,4 г) в ТГФ (150 мл) при температуре -78°C добавляли по каплям раствор диизопропиламида лития (1,5M, 54 мл). После перемешивания реакционного раствора в течение 30 минут добавляли ДМФА (6,5 мл) и смесь дополнительно перемешивали в течение 20 минут. К реакционному раствору последовательно добавляли по каплям воду (50 мл) и соляную кислоту (6M, 50 мл) и смесь дважды экстрагировали гексаном (100 мл). Объединенный органический слой два раза промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия, концентрировали при пониженном давлении и получали 2-бром-3-этил-6-фторбензальдегид (14,5 г).
[0212]
(Стадия 2) 3-этил-6-фтор-2-метилбензальдегид
К раствору 2-бром-3-этил-6-фторбензальдегида, полученного на описанной выше стадии 1 (14,5 г), в 1,4-диоксане (200 мл) добавляли воду (90 мл), трикалийфосфат (32,0 г), метилбороновую кислоту (6,4 г) и аддукт [бис(дифенилфосфино)ферроцен]палладий (II) дихлорид дихлорметан (1,75 г), и реакционный раствор нагревали с обратным холодильником при температуре 110°C в течение 2 часов. Реакционному раствору давали остыть до комнатной температуры, и смесь дополнительно перемешивали в течение 2 часов, после чего добавляли гексан (90 мл). Реакционный раствор фильтровали через CELITE, остаток промывали гексаном и затем отделяли фильтрат. Органический слой дважды промывали насыщенным солевым раствором (100 мл) и после высушивания над безводным сульфатом натрия концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) и получали 3-этил-6-фтор-2-метилбензальдегид (8,4 г).
[0213]
(Стадия 3)
В соответствии со способами, описанными в ссылочном примере A1, стадии 1 и 2, используя 3-этил-6-фтор-2-метилбензальдегид (8,4 г), полученный на вышеуказанной стадии 2, осуществляли такую же операцию с получением указанного в заголовке соединения.
[0214]
[Ссылочные примеры B2-B6]
В соответствии со способами, описанными в ссылочном примере B1, стадии 1 и 2, и в ссылочном примере A1, стадии 1 и 2, были синтезированы следующие соединения ссылочных примеров B2-B5. Также в соответствии со способами, описанными в ссылочном примере B1, стадия 1, и в ссылочном примере A1, стадии 1 и 2, было синтезировано соединение ссылочного примера B6.
[0215]
[Таблица 2]
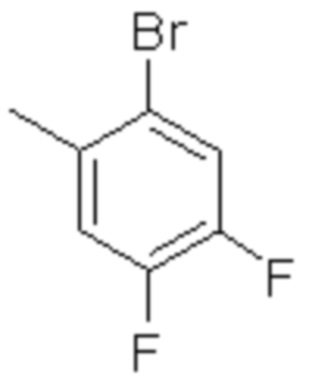
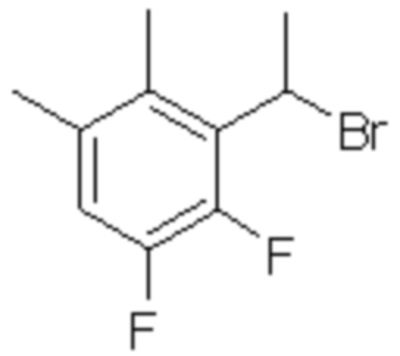

[0216]
[Ссылочный пример C1. Синтез 7-(1-хлорэтил)-1-метил-2,3-дигидро-1H-индена]
[0217]
[Формула 20]
[0218]
К раствору (5,0 мл) 1-(3-метил-2,3-дигидро-1H-инден-4-ил)этанона (1,0 г) в метаноле добавляли боргидрид натрия (261 мг) и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор добавляли в воду (10 мл) и затем два раза экстрагировали этилацетатом (20 мл). Объединенный органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток растворяли в дихлорметане (5,0 мл), при комнатной температуре добавляли тионилхлорид (2,0 мл) и реакционный раствор перемешивали при температуре 50°C в течение 30 минут. В реакционный раствор добавляли воду и смесь два раза экстрагировали этилацетатом (20 мл). Объединенный органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,1 г).
[0219]
[Ссылочные примеры C2-C4]
В соответствии со способом ссылочного примера C1 были синтезированы следующие соединения ссылочных примеров C2-C4.
[0220]
[Таблица 3]
[0221]
[Ссылочный пример D1. Синтез (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановой кислоты]
[0222]
[Формула 21]
[0223]
Раствор в ДМФ (50 мл) 2-(1-бромэтил)-1-фтор-3,4-диметилбензола (14,0 г), полученного в ссылочном примере A1, добавляли по каплям к раствору в ДМФ (50 мл) (S)-2-[о-[(N-бензилпролил)амино]фенил]бензилиденаминоацетата (2-)-N,N,N-никеля (II) (14,5 г) и гидроксида калия (16,3 г), и смесь перемешивали при той же температуре в течение 1 часа. В реакционный раствор добавляли насыщенный раствор хлорида аммония (50 мл) и этилацетат (50 мл), слои разделяли и водный слой два раза экстрагировали этилацетатом (50 мл). Объединенные органические слои промывали последовательно водой (50 мл) и насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: этил ацетат/гексан). Полученное соединение растворяли в метаноле (120 мл), добавляли соляную кислоту (3M, 90 мл) и смесь перемешивали при температуре 80°C в течение 45 минут. Метанол отгоняли при пониженном давлении и к остатку добавляли хлороформ (50 мл) и воду (50 мл). Водный слой промывали хлороформом (50 мл) и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией с обращенной фазой на силикагеле (метанол/вода) с получением указанного в заголовке соединения (2,0 г). 1H ЯМР (CD3OD) δ: 7,03 (дд, J=8,2, 5,7 Гц, 1H), 6,79 (дд, J=11,7, 8,4 Гц, 1H), 3,74-3,87 (м, 2H), 2,29 (с, 3H), 2,25 (с, 3H), 1,40 (дд, J=6,8, 2,4 Гц, 3H)
[0224]
[Ссылочные примеры D2-D58]
После взаимодействия алкилирующего агента, полученного в ссылочных примерах A2-A41, ссылочных примерах B1-B6 и в ссылочных примерах C1-C4, и (S)-2-[о-[(N-бензилпролил)амино]фенил]бензилиденаминоацетата (2-)-N,N,N-никеля (II), кислотным гидролизом были получены соединения ссылочных примеров D2-D58, показанные далее. При этом в случае соединения ссылочного примера D56 в качестве исходного вещества использовали 6-фтор-2,3-диметилбензальдегид, и соединения ссылочных примеров D57 и 58 были получены тем же способом, используя вместо (S)-2-[о-[(N-бензилпролил)амино]фенил]-бензилиденамино-ацетата (2-)-N,N,N-никеля (II) (R)-2-[о-[(N-бензилпролил)амино]фенил]-бензилиденаминоацетат (2-)-N,N,N-никеля (II).
[0225]
[Таблица 4]
(Номер ссылочного примера или структурная формула)
(Номер ссылочного примера или структурная формула)
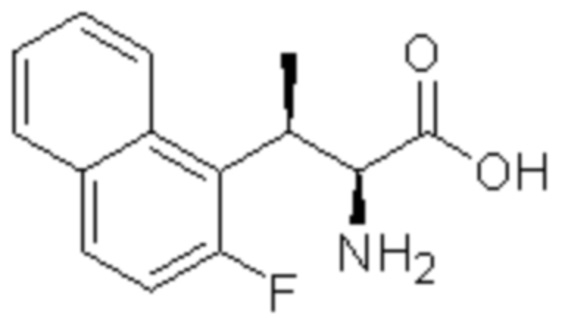
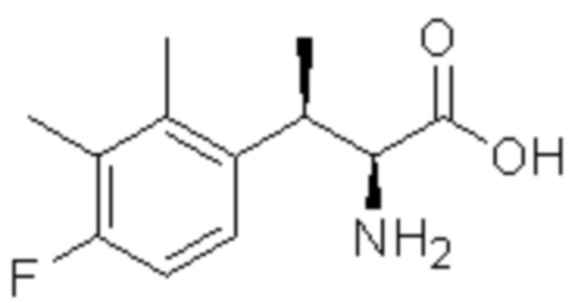
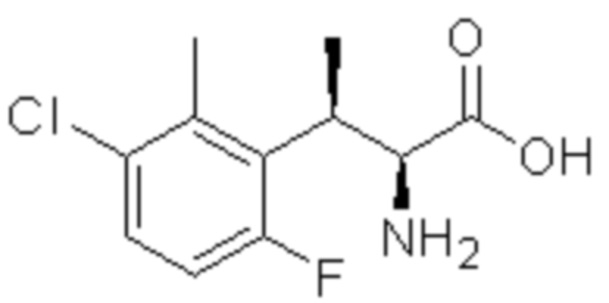
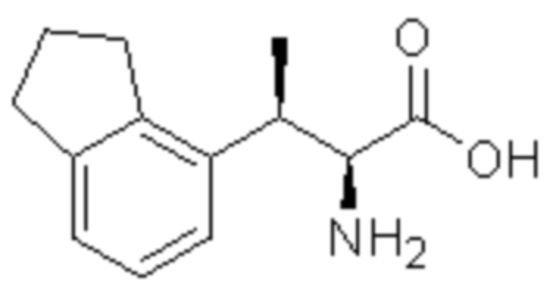
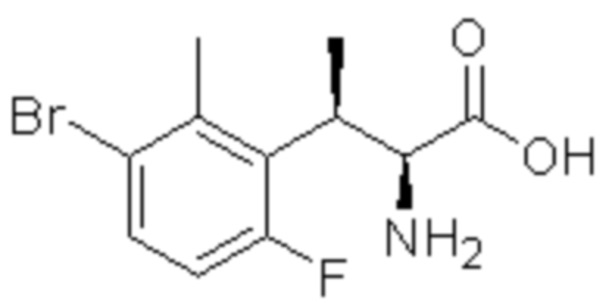
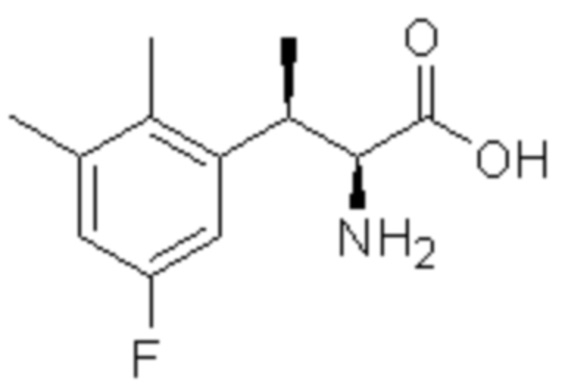
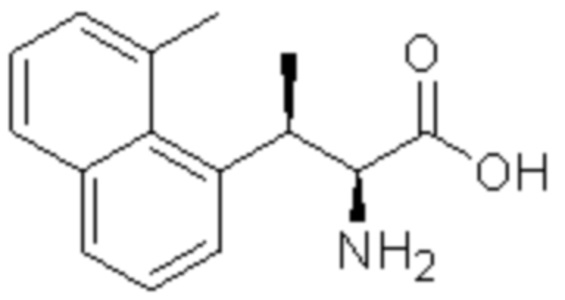
[0225]
[Таблица 4]
(Номер ссылочного примера или структурная формула)
(Номер ссылочного примера или структурная формула)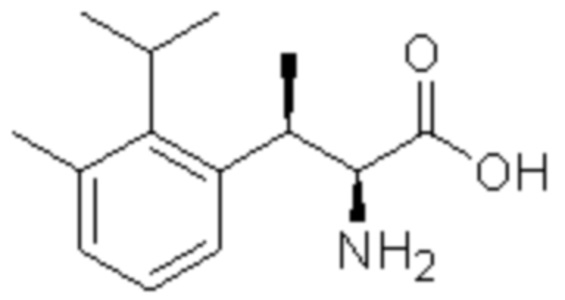
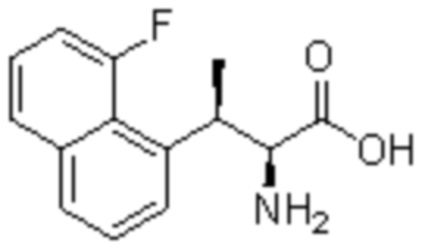
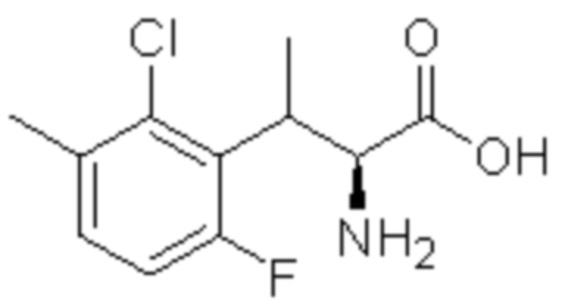
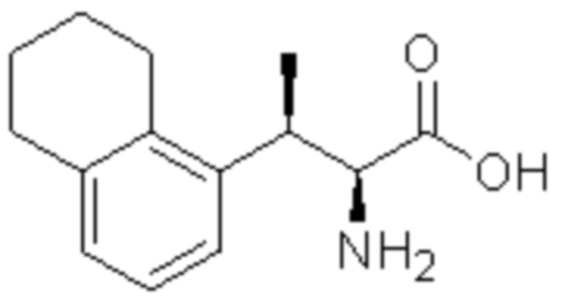
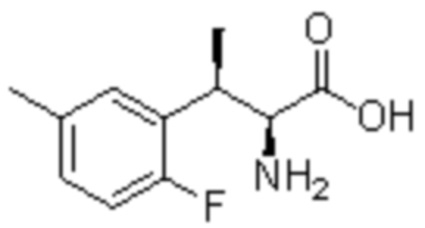
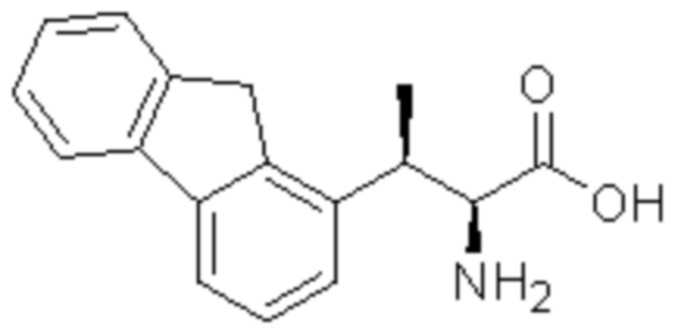
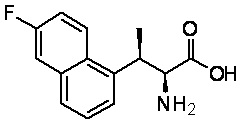
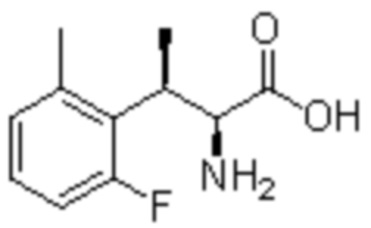
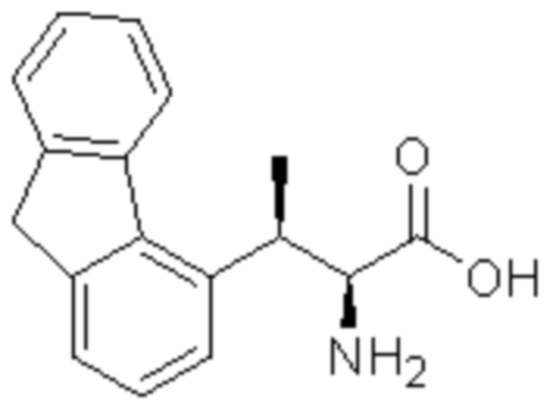
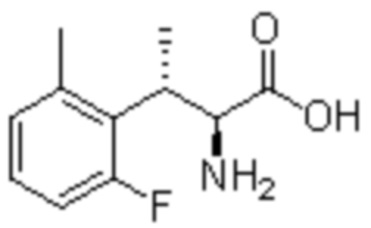
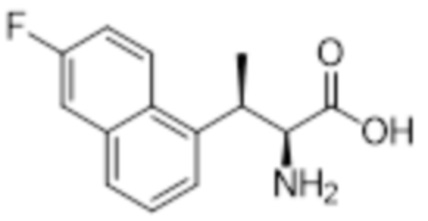
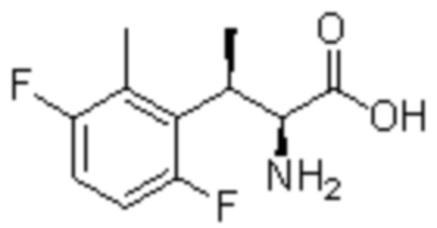
(Номер ссылочного примера или структурная формула)
(Номер ссылочного примера или структурная формула)
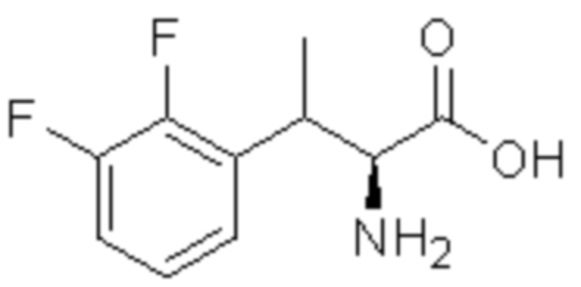
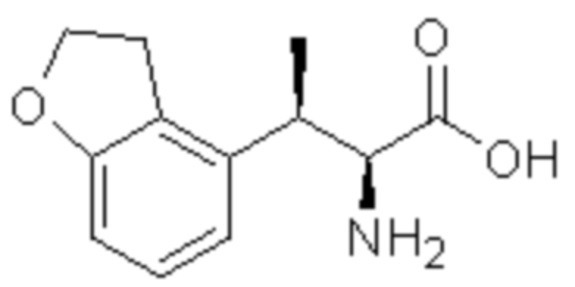
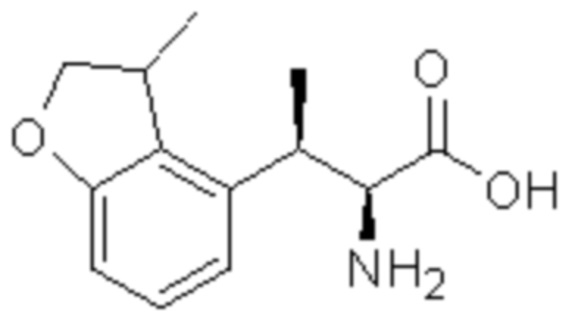
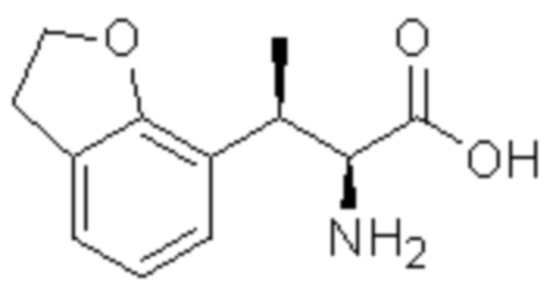
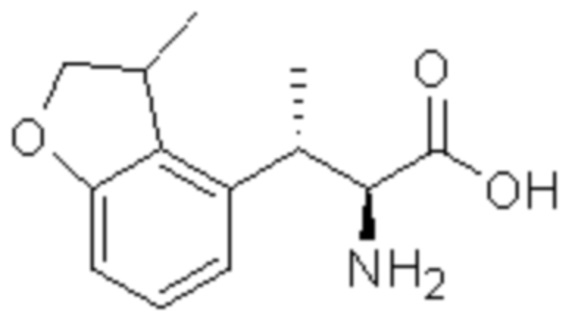
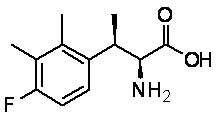
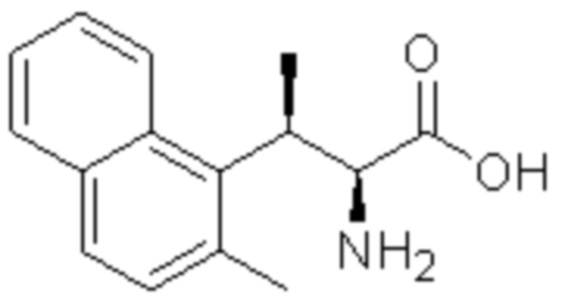
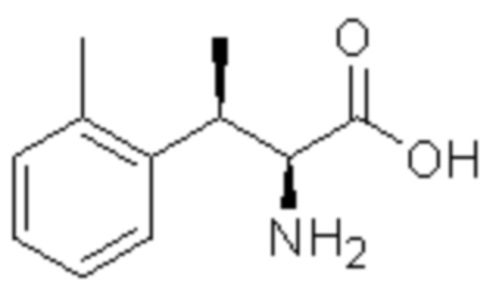
(Номер ссылочного примера или структурная формула)
(Номер ссылочного примера или структурная формула)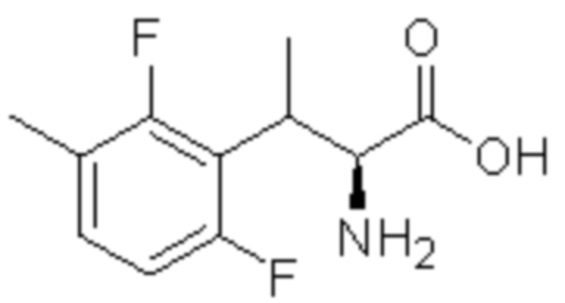
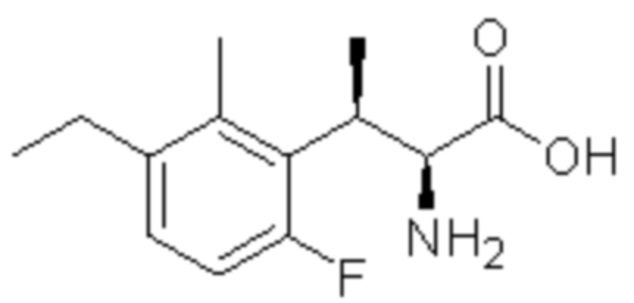
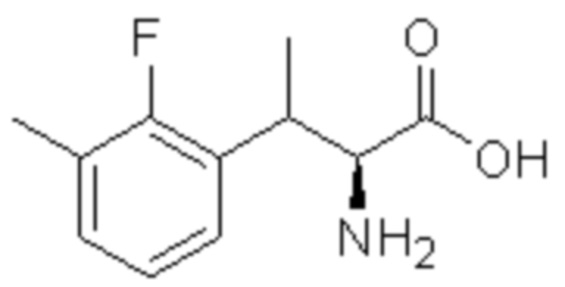
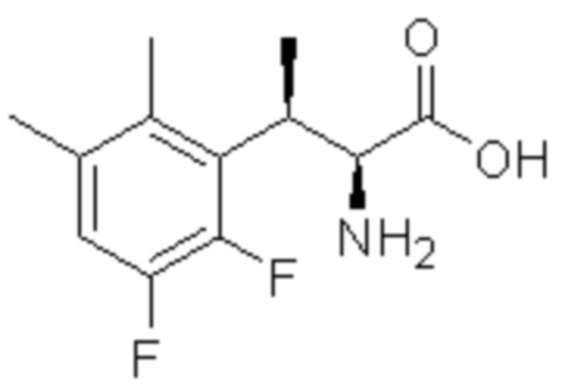
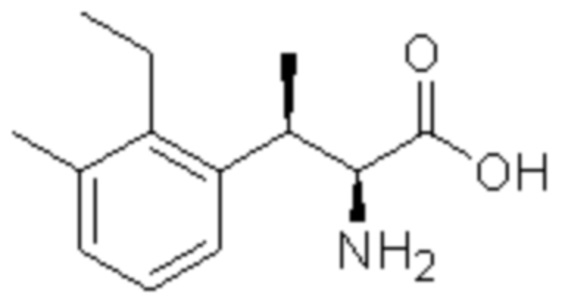
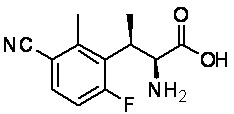
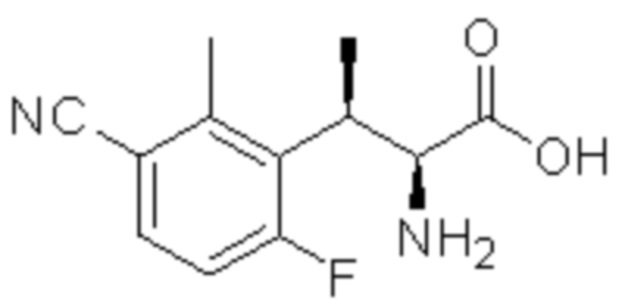
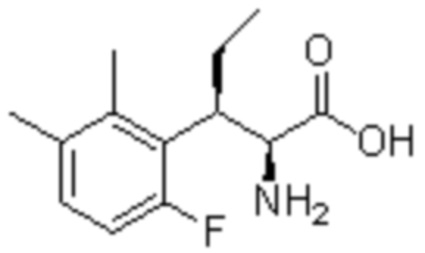
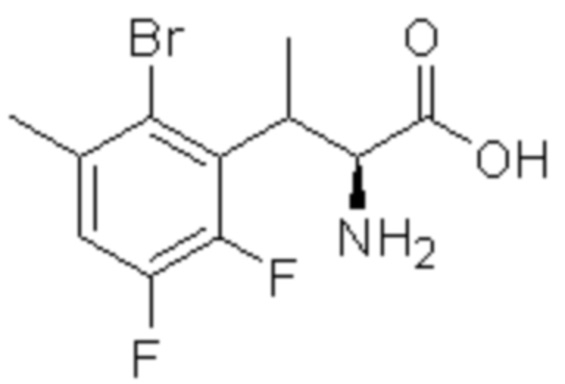
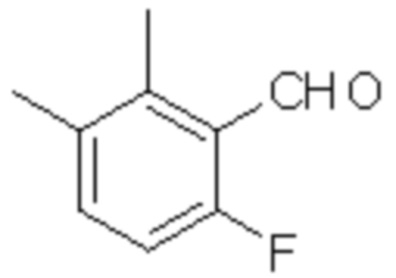
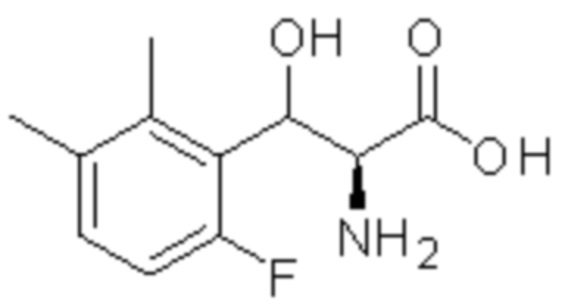
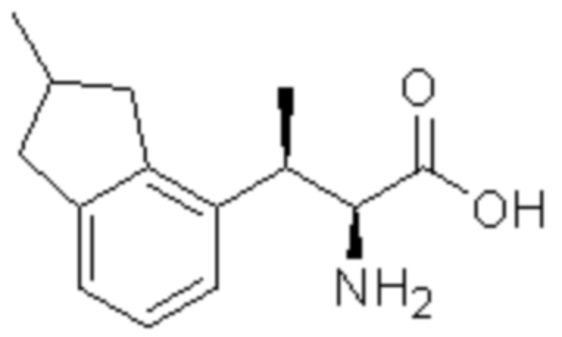
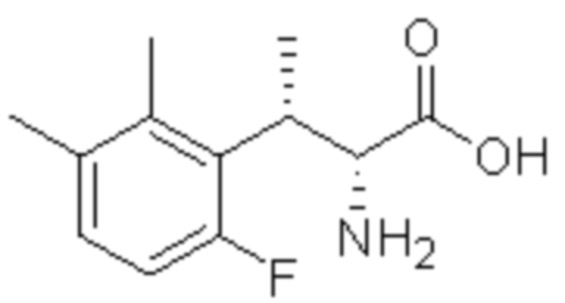
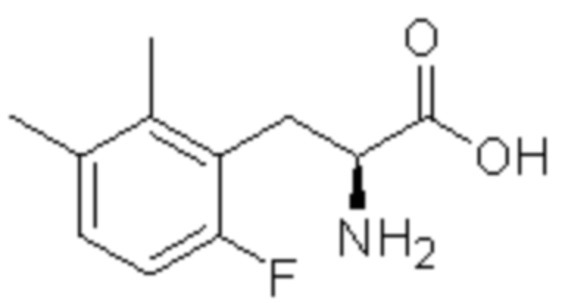
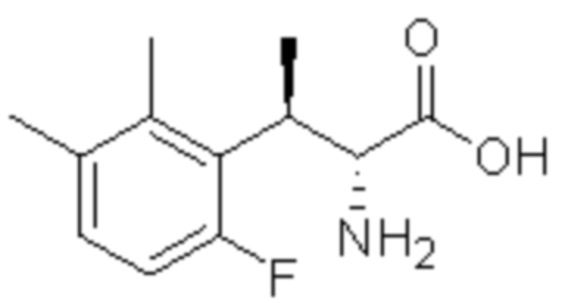
[0226]
[Ссылочный пример D59. Синтез моногидрохлорида 2-амино-3-(6-фтор-2,3-диметилфенил)-3-метилбутановой кислоты]
[0227]
[Формула 22]
[0228]
(Стадия 1) 2-(6-фтор-2,3-диметилфенил)-2-метилпропаналь
2-(6-Фтор-2,3-диметилфенил)-2-метилпропаннитрил (700 мг) растворяли в дихлорметане (35 мл) и охлаждали до температуры -78°C. Добавляли раствор диизобутилалюминийгидрида в толуоле (1,0М, 10 мл) и реакционный раствор перемешивали в течение 1 часа при той же температуре. Последовательно добавляли метанол (5,0 мл) и CELITE (20 г) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор фильтровали через CELITE, промывали смесью гексан/этилацетат=1/1 (30 мл) и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 2-(6-фтор-2,3-диметилфенил)-2-метилпропаналя (400 мг).
[0229]
(Стадия 2) 2-амино-3-(6-фтор-2,3-диметилфенил)-3-метилбутаннитрил
2-(6-Фтор-2,3-диметилфенил)-2-метилпропаналь (400 мг), полученный на вышеуказанной стадии 1, растворяли в метаноле (7,0 мл) и добавляли воду (10 мл), 28% водный раствор аммиака (280 мкл), цианид калия (130 мг) и хлорид аммония (110 мг), и реакционный раствор перемешивали в течение 12 часов при температуре 70°C. В реакционный раствор добавляли насыщенный водный раствор гидрокарбоната натрия (5,0 мл) и смесь экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 2-амино-3-(6-фтор-2,3-диметилфенил)-3-метилбутаннитрила (380 мг).
[0230]
(Стадия 3)
2-Амино-3-(6-фтор-2,3-диметилфенил)-3-метилбутаннитрил (380 мг), полученный на вышеописанной стадии 2, растворяли в соляной кислоте (12М, 5,0 мл) и реакционный раствор перемешивали в течение 12 часов при температуре 100°C. Реакционный раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением указанного в заголовке соединения (300 мг).
[0231]
[Ссылочный пример D60. Синтез моногидрохлорида 2-амино-2-(1-(6-фтор-2,3-диметилфенил)циклопропил)уксусной кислоты]
[0232]
[Формула 23]
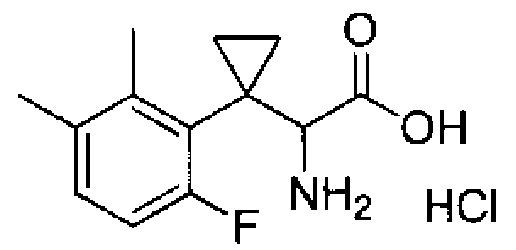
[0233]
Указанное в заголовке соединения было синтезировано в соответствии со способом ссылочного примера D59, используя вместо 2-(6-фтор-2,3-диметилфенил)-2-метилпропаннитрила 1-(6-фтор-2,3-диметилфенил)циклопропанкарбонитрил.
[0234]
[Ссылочный пример D61. Синтез моногидрохлорида 2-амино-3-(6-фтор-2,3-диметилфенил)-3-бутеновой кислоты]
[0235]
[Формула 24]
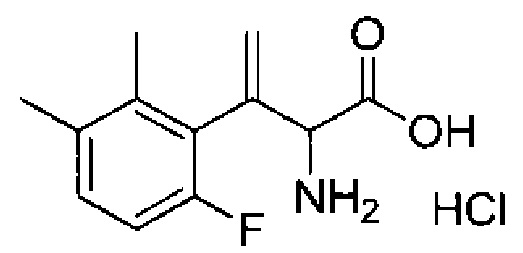
[0236]
(Стадия 1) 2-(6-фтор-2,3-диметил)-2-гидрокси-пропаннитрил
В раствор (20 мл) 1-(6-фтор-2,3-диметилфенил)этанона (1,3 г) дихлорметане добавляли йодид цинка (480 мг) и триметилсилил цианид (2,0 мл) , и реакционную смесь перемешивали в течение 12 часов при комнатной температуре. В реакционный раствор добавляли водный раствор гидроксида натрия (2 М, 10 мл) и смесь экстрагировали смесью этилацетат/гексан=1/1 (20 мл). Органический слой промывали соляной кислотой (2М, 20 мл) и насыщенным солевым раствором (20 мл), в этом порядке, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 2-(6-фтор-2,3-диметил)-2-гидрокси-пропаннитрила (1,4 г).
[0237]
(Стадия 2) 2-фтор-2-(6-фтор-2,3-диметилфенил)пропаннитрил
К раствору в дихлорметане (5,0 мл) 2-(6-фтор-2,3-диметил)-2-гидрокси-пропаннитрила (170 мг) , полученного на вышеописанной стадии 1, добавляли DAST (150 мкл) и реакционный раствор перемешивали при комнатной температуре в течение 12 часов. В реакционный раствор добавляли насыщенный водный раствор гидрокарбоната натрия (10 мл) и смесь экстрагировали смесью этилацетат/гексан=1/1 (20 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 2-фтор-2-(6-фтор-2,3-диметилфенил)пропаннитрила (100 мг).
[0238]
(Стадия 3) 2-амино-3-фтор-3-(6-фтор-2,3-диметилфенил)-бутаннитрил
Исходя из 2-фтор-2-(6-фтор-2,3-диметилфенил)пропаннитрила, полученного на вышеуказанной стадии 2, в соответствии со способом ссылочного примера D59, стадии 1-2, получали 2-амино-3-фтор-3-(6-фтор-2,3-диметилфенил)-бутаннитрил.
(Стадия 4) моногидрохлорид 2-амино-3-(6-фтор-2,3-диметилфенил)-3-бутеновой кислоты
[0239]
2-Амино-3-фтор-3-(6-фтор-2,3-диметилфенил)бутаннитрил (460 мг), полученный на вышеуказанной стадии 3, растворяли в соляной кислоте (12M, 3,0 мл), и смесь перемешивали в течение 12 часов при температуре 100°C. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением указанного в заголовке соединения.
[0240]
[Ссылочный пример E1. Синтез 5-хлор-8-(хлорсульфонил)-4-метил-d3-хроман-4-ил ацетата]
[0241]
[Формула 25]

[0242]
(Стадия 1) 8-бром-5-хлор-4-метилхроман-4-ол
К раствору в диэтиловом эфире (1,0М, 63 мл) метил йодид-d3-магния добавляли ТГФ (50 мл), и при комнатной температуре по каплям добавляли раствор в ТГФ (50 мл) 8-бром-5-хлорхроман-4-она (7,5 г). Реакционный раствор перемешивали в течение 10 минут при той же температуре, на ледяной бане медленно добавляли по каплям соляную кислоту (1M, 50 мл), и для разделения слоев добавляли этилацетат (50 мл). Водный слой экстрагировали этилацетатом (50 мл) и объединенный органический слой промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 8-бром-5-хлор-4-метилхроман-4-ола (7,7 г).
[0243]
(Стадия 2) 8-бром-5-хлор-4-метил-d3-хроман-4-ил ацетат
В раствор в безводной уксусной кислоте (100 мл) 8-бром-5-хлор-4-метилхроман-4-ола (7,7 г), полученного на вышеуказанной стадии 1, при температуре -40°C добавляли по каплям раствор в ацетонитриле (12 мл) трифторметансульфонат скандия (III) (340 мг), и реакционный раствор перемешивали в течение 30 минут при той же температуре. В реакционный раствор последовательно добавляли насыщенный водный раствор гидрокарбоната натрия (100 мл) и этилацетат (100 мл) и слои разделяли. Водный слой экстрагировали этилацетатом (100 мл) и объединенные органические слои промывали два раза насыщенным водным раствором гидрокарбоната натрия (100 мл) и один раз насыщенным солевым раствором (100 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 8-бром-5-хлор-4-метил-d3-хроман-4-ил ацетата (8,9 г).
[0244]
(Стадия 3) 8-(бензилтио)-5-хлор-4-метил-d3-хроман-4-ил ацетат
К раствору в 1,4-диоксане (70 мл) 8-бром-5-хлор-4-метил-d3-хроман-4-ил ацетата (6,7 г), полученного на вышеуказанной стадии 2, добавляли 4,5-бис(дифенилфосфино)-9,9-диметилксантен (600 мг), трис(дибензилиденацетон) дипалладий (0) (480 мг), N,N-диизопропилэтиламин (7,2 мл) и бензилмеркаптан (2,8 мл), и реакционный раствор перемешивали в течение 2 часов при температуре 90°C. Реакционному раствору давали остыть до комнатной температуры и фильтровали через CELITE. После промывки остатка гексаном (50 мл), для разделения слоев к фильтрату добавляли воду (50 мл). Органический слой промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Реакционный раствор концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 8-(бензилтио)-5-хлор-4-метил-d3-хроман-4-ил ацетата (6,3 г).
[0245]
(Стадия 4)
К раствору в ацетонитриле (100 мл) 8-(бензилтио)-5-хлор-4-метил-d3-хроман-4-ил ацетата (6,3 г), полученного на вышеуказанной стадии 3, добавляли воду (3 мл), уксусную кислоту (4,3 мл) и 1,3-дихлор-5,5-диметилгиданотоин (7,2 г) и реакционный раствор перемешивали в течение 30 минут при той же температуре. В реакционный раствор добавляли насыщенный водный раствор гидрокарбоната натрия (70 мл) и этилацетат (70 мл) и слои разделяли. Водный слой экстрагировали этилацетатом (70 мл). Объединенный органический слой промывали насыщенным солевым раствором (70 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения (5,3 г).
[0246]
[Ссылочный пример E5. Синтез 5-хлор-8-(хлорсульфонил)-4-(трифторметил)хроман-4-ил ацетата]
[0247]
[Формула 26]
[0248]
(Стадия 1) 8-бром-5-хлор-4-(трифторметил)хроман-4-ol
К раствору в ТГФ (4 мл) 8-бром-5-хлор-хроманон-4-она (398,2 мг) при комнатной температуре добавляли фторид цезия (340,2 мг) и трифторметилтриметилсилан (0,68 мл) и реакционный раствор перемешивали в течение 4 часов. В реакционный раствор добавляли водный раствор хлорида аммония (5 мл) и смесь экстрагировали смесью этилацетат/гексан=1/1 (15 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (элюент: гексан/этилацетат) с получением 8-бром-5-хлор-4-(трифторметил)хроманон-4-ола (139,2 мг).
(Стадия 2)
Исходя из 8-бром-5-хлор-4-(трифторметил)хроман-4-ола, полученного на вышеописанной стадии 1, получали указанное в заголовке соединение в соответствии со способом ссылочного примера E1, стадия 2-4.
[0249]
[Ссылочный пример E6. Синтез 8-(хлорсульфонил)-4-(трифторметил)хроман-4-ил ацетата]
Соединение ссылочного примера E6 было синтезировано в соответствии со способом ссылочного примера E5, стадии 1 и 2, используя 8-бром-хроманон-4-он в качестве исходного вещества.
[0250]
[Ссылочные примеры E2-E4 и E7-E34]
В соответствии со способом ссылочного примера E1, стадии 1-4, были синтезированы соединения ссылочных примеров E2-E4. В соответствии со способом ссылочных примеров E1, стадии 3 и 4, были синтезированы соединения ссылочных примеров E7-E32. В соответствии со способом ссылочного примера E1, стадии 2-4, были синтезированы соединения ссылочных примеров E33 и E34. Соединения ссылочных примеров E2-E4 и E7-E34 и исходные вещества перечислены в следующей таблице.
[0251]
[Таблица 5]
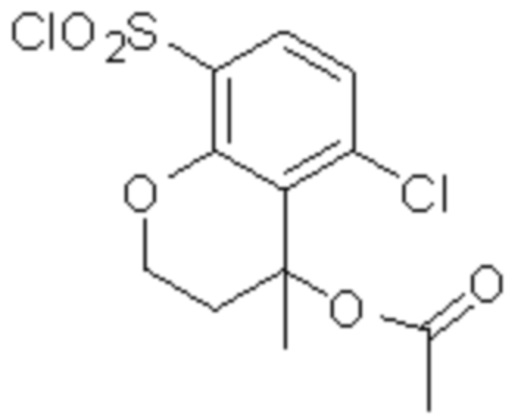
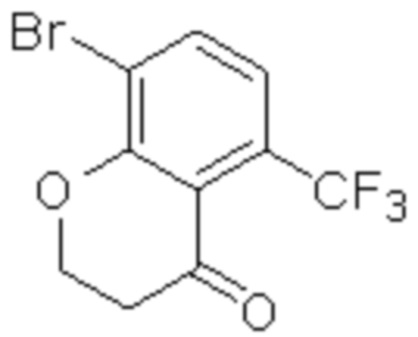
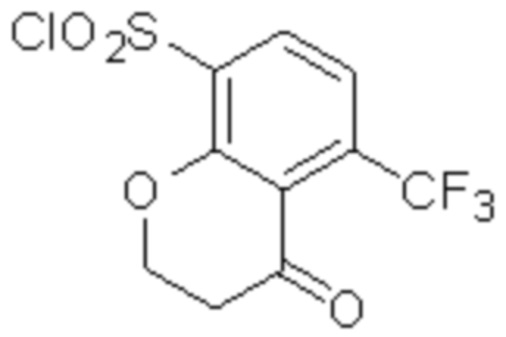
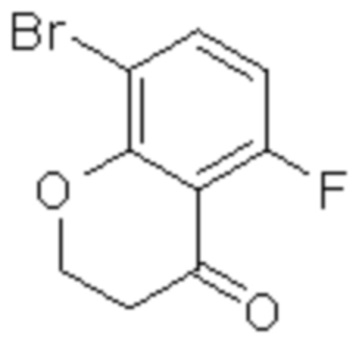
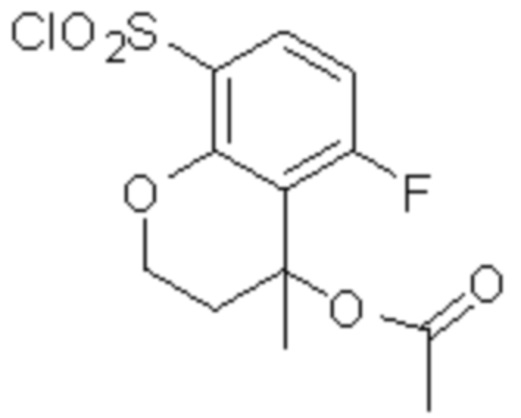

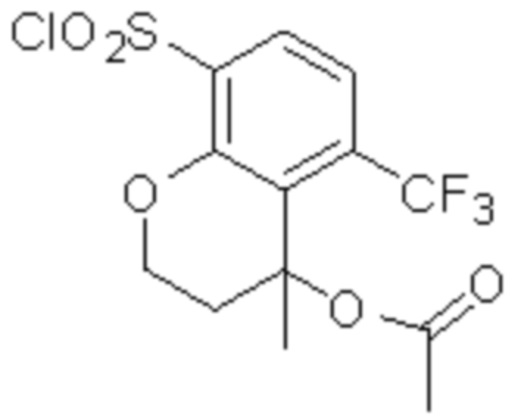
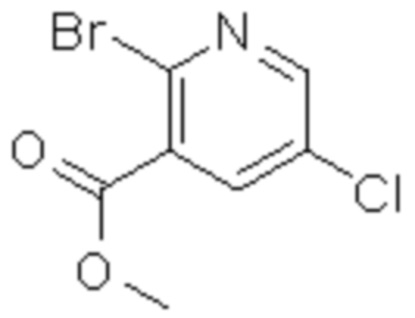
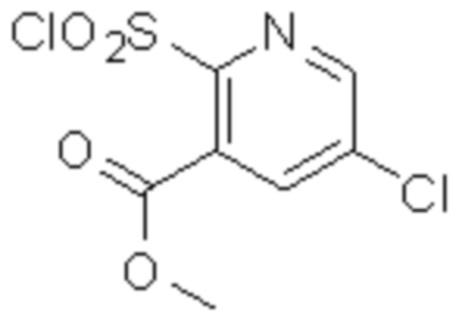


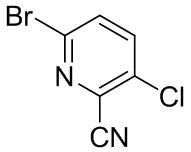
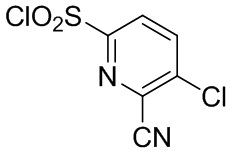
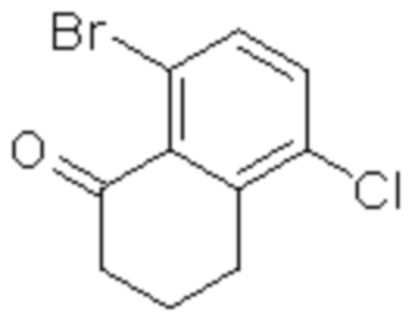
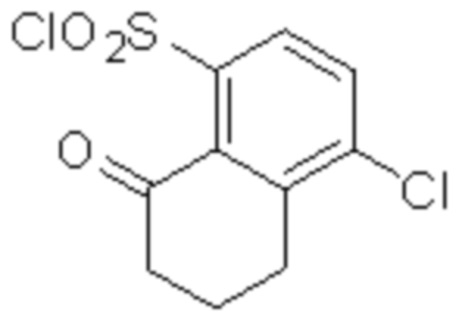
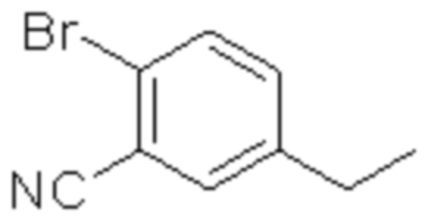
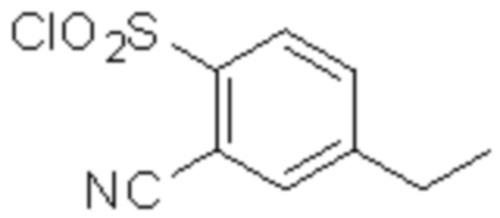
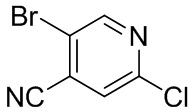
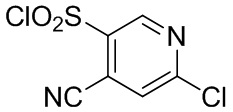
[0252]
Ссылочный пример E35. Синтез 5-хлор-6-(пирролидин-1-карбонил)пиридин-2-сульфонилхлорида]
[0253]
[Формула 27]
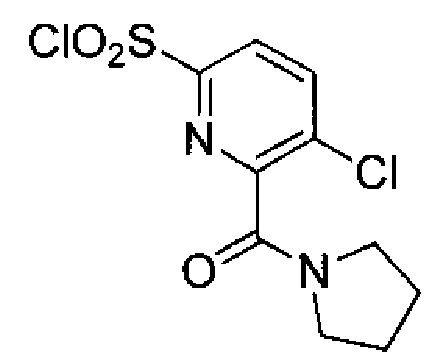
[0254]
(Стадия 1) метил 6-(бензилтио)-3-хлорпиколинат
В соответствии со способом ссылочного примера E1, стадия 3, из метил 6-бром-3-хлорпиколината получали метил 6-(бензилтио)-3-хлорпиколинат.
[0255]
(Стадия 2) 6-(бензилтио)-3-хлорпиколиновая кислота
Метил 6-(бензилтио)-3-хлорпиколинат (1,0 г), полученный на вышеуказанной стадии 1, растворяли в ТГФ (5,0 мл) и добавляли воду (1,0 мл), гидроксид лития (165 мг), и реакционный раствор перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор добавляли к соляной кислоте (1М, 10 мл) и два раза экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 6-(бензилтио)-3-хлорпиколиновой кислоты (920 мг).
[0256]
(Стадия 3) (6-(бензилтио)-3-хлорпиридин-2-ил)(пирролидин-1-ил)метанон
6-(Бензилтио)-3-хлор-пиколиновую кислоту (100 мг), полученную на вышеуказанной стадии 2, растворяли в ДМФ (2,5 мл), добавляли CDI (116 мг), реакционный раствор перемешивали при комнатной температуре в течение 10 минут, и затем добавляли триэтиламин (150 мкл) и пирролидин (60 мкл), и реакционный раствор перемешивали в течение 12 часов при температуре 50°C. Реакционный раствор добавляли в воду (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением (6-(бензилтио)-3-хлорпиридин-2-ил)(пирролидин-1-ил)метанона (105 мг).
[0257]
(Стадия 4)
Получали указанное в заголовке соединение из (6-(бензилтио)-3-хлорпиридин-2-ил)(пирролидин-1-ил)метанона, полученного на вышеуказанной стадии 3 в соответствии со способом ссылочного примера E1, стадия 4.
[0258]
[Ссылочные примеры E36-E43]
В соответствии со способом ссылочных примеров E35, стадия 3, и E1, стадия 4, из 6-(бензилтио)-3-хлорпиколиновой кислоты, полученной в ссылочном примере E35, стадия 2, были синтезированы соединения ссылочных примеров E36-E43, показанные далее.
[0259]
[Таблица 6]
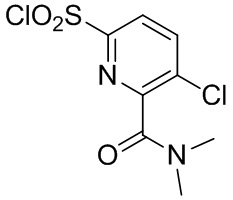
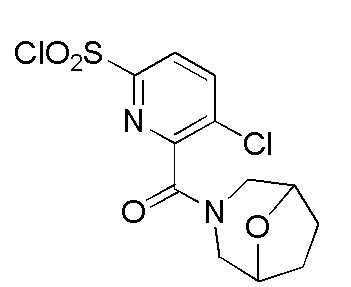
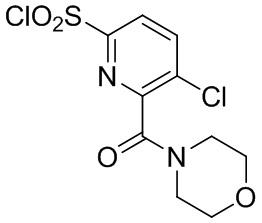
[0260]
[Ссылочный пример E44. Синтез 1-(6-хлор-3-(хлорсульфонил)-2-метоксифенил)этилацетата]
[0261]
[Формула 28]
[0262]
(Стадия 1) 3-бром-6-хлор-2-метоксибензальдегид
В соответствии со способом ссылочного примера B1, стадия 1, из 1-бром-4-хлор-2-метоксибензола получали 3-бром-6-хлор-2-метоксибензальдегид.
[0263]
(Стадия 2) 1-(3-бром-6-хлор-2-метоксифенил)этанол
Исходя из 3-бром-6-хлор-2-метоксибензальдегида, полученного на вышеуказанной стадии 1, в соответствии со способом ссылочного примера A1, стадия 1, получали 1-(3-бром-6-хлор-2-метоксифенил)этанол.
[0264]
(Стадия 3) 1-(3-бром-6-хлор-2-метоксифенил)этилацетат
1-(3-Бром-6-хлор-2-метоксифенил)этанол (1,9 г), полученный на вышеуказанной стадии 2, растворяли в дихлорметане (20 мл), последовательно добавляли триэтиламин (2,0 мл), N,N-диметил-4-аминопиридин (100 мг) и уксусный ангидрид (1,2 мл), и реакционный раствор перемешивали в течение 30 минут при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 1-(3-бром-6-хлор-2-метоксифенил)этилацетата)(2,2 г).
[0265]
(Стадия 4)
Исходя из 1-(3-бром-6-хлор-2-метоксифенил)этилацетата, полученного на вышеуказанной стадии 3, получали указанное в заголовке соединение в соответствии со способом ссылочного примера E1, стадии 3 и 4.
[0266]
[Ссылочный пример E45. Синтез 1-(5-хлор-2-(хлорсульфонил)-3-метоксипиридин-4-ил)этилацетата]
[0267]
[Формула 29]
[0268]
В соответствии с каждым из способов ссылочного примера B1, стадия 1, ссылочного примера A1, стадия 1, ссылочного примера E44, стадия 3, и ссылочного примера E1, стадии 3 и 4, получали указанное в заголовке соединение, используя вместо 1-бром-4-хлор-2-метоксибензола 2-бром-5-хлор-3-метоксипиридин.
[0269]
[Ссылочный пример E46. Синтез 2-(6-хлор-3-(хлорсульфонил)-2-метоксифенил)пропан-2-ил ацетата]
[0270]
[Формула 30]
[0271]
(Стадия 1) 1-(3-бром-6-хлор-2-метоксифенил)этанон
К раствору в дихлорметане (30 мл) 1-(3-бром-6-хлор-2-метоксифенил)этанола (2,8 г), полученного в ссылочном примере E44, стадия 2, добавляли 1,1,1-триацетокси-1,1-дигидро-1,2-бензйодоксол-3-(1H)-он (5,4 г), и реакционный раствор перемешивали в течение 20 минут при комнатной температуре. Реакционный раствор добавляли по каплям в перемешиваемый раствор насыщенного водного раствора гидрокарбоната натрия/раствор гидросульфита натрия=1/1 (50 мл) на ледяной бане, и слои разделяли. Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 1-(3-бром-6-хлор-2-метоксифенил)этанона (2,7 г).
[0272]
(Стадия 2) 1-(3-бром-6-хлор-2-метоксифенил)этилацетат
Исходя из 1-(3-бром-6-хлор-2-метоксифенил)этанона, полученного на вышеуказанной стадии 1, в соответствии со способом ссылочного примера E1, стадии 1 и 2, получали 1-(3-бром-6-хлор-2-метоксифенил)этилацетат.
[0273]
(Стадия 3)
Исходя из 1-(3-бром-6-хлор-2-метоксифенил)этилацетата (500 мг), полученного на вышеуказанной стадии 2, получали указанное в заголовке соединение в соответствии со способом ссылочных примеров E1, стадии 3 и 4.
[0274]
[Ссылочный пример E47. Синтез 4-хлор-2-(2,2-дифторэтокси)бензол-1-сульфонилхлорида]
[0275]
[Формула 31]

[0276]
(Стадия 1) 1-бром-4-хлор-2-(2,2-дифторэтокси)бензол
К раствору в ДМФ (5 мл) 2-бром-5-хлорфенола (244 мг) добавляли карбонат калия (325 мг) и 2,2-дифторэтил 4-метилбензолсульфонат (320 мг), и реакционный раствор перемешивали в течение 3 часов при температуре 95°C. Реакционный раствор добавляли в водный раствор гидроксида натрия (1 М, 20 мл) и экстрагировали смесью толуол/этилацетат=1/1 (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 1-бром-4-хлор-2-(2,2-дифторэтокси)бензола (315 мг).
[0277]
(Стадия 2)
Указанное в заголовке соединения было синтезировано из 1-бром-4-хлор-2-(2,2-дифторэтокси)бензола, полученного на вышеуказанной стадии 1, в соответствии со способом ссылочных примеров E1, стадии 3 и 4.
[0278]
[Ссылочные примеры E48 и E49]
В соответствии со способами, описанными в ссылочном примере E47, стадия 1, и в ссылочном примере E1, стадии 3 и 4, были синтезированы соединения ссылочных примеров E48 и 49, показанные далее. Однако, что касается ссылочного примера 48, вместо 2,2-дифторэтил 4-метилбензолсульфоната использовали хлордифторацетат натрия.
[0279]
[Таблица 7]
[0280]
[Ссылочный пример E50. Синтез 4-хлор-2-(изоксазол-5-ил)бензол-1-сульфонилхлорида]
[0281]
[Формула 32]
[0282]
(Стадия 1) 5-(2-бром-5-хлорфенил)изоксазол
Раствор 1-(2-бром-5-хлорфенил)этанона (400 мг) в N,N-диметилформамиддиметилацетале (6,0 мл) перемешивали в течение 16 часов при температуре 140°C. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат). Полученное соединение растворяли в метаноле (4,0 мл), добавляли гидроксиламин гидрохлорид (175 мг), и реакционный раствор перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор добавляли в водный раствор бикарбоната натрия (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле t до чистого (элюент: гексан/этилацетат) с получением 5-(2-бром-5-хлорфенил)изоксазоле (430 мг).
[0283]
(Стадия 2)
Исходя из 5-(2-бром-5-хлорфенил)изоксазола, полученного на вышеуказанной стадии 1, получали указанное в заголовке соединение в соответствии со способом ссылочного примера E1, стадии 3,4.
[0284]
[Ссылочный пример E51. Синтез трет-бутил бензилокси(5-хлор-2-(хлорсульфонил)бензоил)карбамата]
[0285]
[Формула 33]
[0286]
(Стадия 1) N-(бензилокси)-2-(бензилтио)-5-хлорбензамид
В соответствии со способом ссылочного примера E1, стадия 3, их N-(бензилокси)-2-бром-5-хлорбензамида был синтезирован N-(бензилокси)-2-(бензилтио)-5-хлорбензамид.
[0287]
(Стадия 2) трет-бутил бензилокси (2-(бензилтио)-5-хлор-бензоил)карбамат
К раствору в дихлорметане (10 мл) N-(бензилокси)-2-(бензилтио)-5-хлорбензамида (433 мг), полученного в ссылочном примере 1, добавляли N,N-диметил-4-аминопиридин (280 мг) и ди-трет-бутил дикарбонат (740 мг), и реакционный раствор перемешивали в течение 16 часов при температуре 55°C. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением трет-бутилбензилокси (2-(бензилтио)-5-хлорбензоил)карбамата (549 мг).
[0288]
(Стадия 3)
Исходя из трет-бутилбензилокси (2-(бензилтио)-5-хлорбензоил)карбамата, полученного на вышеуказанной стадии 2, получали указанное в заголовке соединение в соответствии со способом ссылочного примера E1, стадия 4.
[0289]
[Ссылочный пример E52. Синтез трет-бутил (5-хлор-2-(хлорсульфонил)бензоил)(метил)карбамата]
[0290]
[Формула 34]
[0291]
(Стадия 1) 2-бром-5-хлор-N-метилбензамид
Исходя из 2-бром-5-хлорбензойной кислоты и метиламина в соответствии со способом ссылочного примера E35, стадия 3, получали 2-бром-5-хлор-N-метилбензамид.
[0292]
(Стадия 2) трет-бутил (2-бром-5-хлорбензоил)(метил)карбамат
(2-Бром-5-хлорбензоил)(метил)карбамат получали из 2-бром-5-хлор-N-метилбензамида, полученного на вышеуказанной стадии 1, в соответствии со способом ссылочного примера E51, стадия 2.
[0293]
(Стадия 3)
Исходя из трет-бутил (2-бром-5-хлорбензоил)(метил)карбамата, полученного на вышеуказанной стадии 2, получали указанное в заголовке соединение в соответствии со способом ссылочных примеров E1, стадии 3 и 4.
[0294]
[Ссылочный пример E53. Синтез метил 5-хлор-2-(хлорсульфонил)-4-нитробензоат]
[0295]
[Формула 35]
[0296]
(Стадия 1) метил 2-бром-5-хлор-4-нитробензоат
К раствору в 2-метил-2-пропаноле (5 мл) 1-бром-4-хлор-2-метил-5-нитробензола (1,0 г добавляли воду (5 мл), анизол (2,5 мл) и перманганат калия (1,6 г), и реакционный раствор перемешивали при температуре 100°C в течение 20 часов. Реакционный раствор охлаждали до комнатной температуры, фильтровали через CELITE, и промывали водой (10 мл) и этилацетатом (10 мл). Объединенные фильтраты добавляли к соляной кислоте (1М, 20 мл) и слои разделяли. Водный слой экстрагировали три раза этилацетатом (20 мл). Объединенный органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток растворяли в метаноле (5,0 мл), добавляли дихлорметан (10 мл) и раствор в гексане триметилсилилдиазометана (0,6М, 6,0 мл), и реакционный раствор перемешивали при комнатной температуре в течение 20 минут. Реакционный раствор концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением метил 2-бром-5-хлор-4-нитробензоата (529 мг).
[0297]
(Стадия 2)
Исходя из метил 2-бром-5-хлор-4-нитробензоата, полученного на вышеуказанной стадии 1, в соответствии со способом по ссылочному примеру E1, стадии 3 и 4, получали указанное в заголовке соединение.
[0298]
[Ссылочный пример E54. Синтез 4-хлор-2-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)бензол-1-сульфонилхлорида]
[0299]
[Формула 36]
[0300]
(Стадия 1) 5-(2-бром-5-хлорфенил)-1,3,4-оксадиазол-2(3H)-он
К суспензии в ТГФ (6,0 мл) 2-бром-5-хлорбензойной кислоты (300 мг) добавляли CDI (310 мг), и реакционный раствор перемешивали при комнатной температуре в течение 20 минут. Реакционный раствор охлаждали на льду, добавляли гидразин моногидрат (160 мкл), и реакционный раствор перемешивали при той же температуре в течение 20 минут. Реакционный раствор добавляли в воду (15 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток растворяли в 1,4-диоксан (6,0 мл), добавляли CDI (310 мг) и реакционный раствор перемешивали при температуре 45°C в течение 2 часов. Реакционный раствор добавляли в воду (15 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 5-(2-бром-5-хлорфенил)-1,3,4-оксадиазол-2(3H)-она (300 мг).
[0301]
(Стадия 2)
Исходя из 5-(2-бром-5-хлорфенил)-1,3,4-оксадиазол-2(3H)-она, полученного на вышеуказанной стадии 1, указанного в заголовке соединения получали в соответствии со способом стадий 3 и 4 ссылочного примера E1.
[0302]
[Ссылочный пример E55. Синтез трет-бутил N-трет-бутоксикарбонил-N-(1-(5-хлор-2-хлорсульфонилфенил)-циклопропил]карбамата]
[0303]
[Формула 37]
[0304]
(Стадия 1) 1-(2-бензилсульфанил-5-хлорфенил)циклопропанамин
К суспензии в ТГФ (10 мл) 2-(бензилтио)-5-хлорбензонитрила (1,0 г) и тетраизопропоксида титана (1,3 мл) при температуре -78°C добавляли по каплям раствор в диэтиловом эфире (3,0М, 3,0 мл) метилмагнийбромида, и реакционный раствор перемешивали при той же температуре в течение 10 минут. В реакционный раствор добавляли комплекс трифторид бора-диэтиловый эфир (1,1 мл), и смесь дополнительно перемешивали при комнатной температуре в течение 1 часа, и затем для разделения слоев добавляли воду (5 мл) и водный раствор гидроксида натрия (1М, 5 мл), водный слой экстрагировали диэтиловым эфиром (20 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 1-(2-бензилсульфанил-5-хлор-фенил)циклопропанамина (490 мг).
[0305]
(Стадия 2) трет-бутил N-[1-(2-бензилсульфанил-5-хлор-фенил)-циклопропил]-N-трет-бутоксикарбонил-карбамат
К раствору в 1,2-дихлорэтане (10 мл) 1-(2-бензилсульфанил-5-хлор-фенил)циклопропанамина (490 мг), полученного на вышеуказанной стадии 1, добавляли N,N-диметил-4-аминопиридин (210 мг) и ди-трет-бутил дикарбонат (1,8 г), и реакционный раствор перемешивали при температуре 50°C в течение 16 часов. Реакционный раствор добавляли к соляной кислоте (1М, 10 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан) с получением трет-бутил N-[1-(2-бензилсульфанил-5-хлор-фенил)циклопропил]-N-трет-бутоксикарбонилкарбамата (502 мг).
[0306]
(Стадия 3)
Исходя из трет-бутил N-[1-(2-бензилсульфанил-5-хлор-фенил)циклопропил]-N-трет-бутоксикарбонил-карбамата, полученного на вышеуказанной стадии 2, в соответствии со способом ссылочного примера E1, стадия 4, получали указанное в заголовке соединения.
[0307]
[Ссылочный пример E56. Синтез метил 6-(бис(трет-бутоксикарбонил)амино)-3-хлорсульфонил-2-метокси-бензоата]
[0308]
[Формула 38]
[0309]
(Стадия 1) метил 6-(бис(трет-бутоксикарбонил)амино)-3-бром-2-метоксибензоат
Исходя из метил 6-амино-3-бром-2-метоксибензоата в соответствии со способом ссылочного примера E55, стадия 2, получали метил 6-(бис(трет-бутоксикарбонил)амино)-3-бром-2-метоксибензоат.
[0310]
(Стадия 2)
Указанное в заголовке соединение получали из метил 6-(бис(трет-бутоксикарбонил)амино)-3-бром-2-метоксибензоата, полученного на вышеуказанной стадии 1, в соответствии со способом ссылочного примера E1, стадии 3 и 4.
[0311]
[Ссылочный пример E57. Синтез 5-хлор-4,4-дифторхроман-8-сульфонилхлорида]
[0312]
[Формула 39]
[0313]
(Стадия 1) 8-(бензилтио)-5-хлорхроман-4-он
Исходя из 8-бром-5-хлорхроман-4-она в соответствии со способом ссылочного примера E1, стадия 3, получали 8-(бензилтио)-5-хлорхроман-4-он.
[0314]
(Стадия 2) 8-(бензилтио)-5-хлор-4,4-дифторхроман
Исходя из 8-(бензилтио)-5-хлорхроман-4-она (125 мг), полученного на вышеуказанной стадии 1, в соответствии со способом ссылочного примера D61, стадия 2, получали 8-(бензилтио)-5-хлор-4,4-дифторхроман.
[0315]
(Стадия 3)
Исходя из 8-(бензилтио)-5-хлор-4,4-дифторхромана, полученного на вышеуказанной стадии 2, получали указанное в заголовке соединение в соответствии со способом ссылочного примера E1, стадия 4.
[0316]
[Ссылочный пример E58. Синтез трет-бутил 5-хлор-8-(хлорсульфонил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилата]
[0317]
[Формула 40]
[0318]
(Стадия 1) 8-бром-5-хлор-3,4-дигидро-2H-бензоксазин
К раствору в ДМФ (6 мл) 2-амино-6-бром-3-хлорфенола (1,3 г) добавляли 1,2-дибромэтан (500 мкл) и карбонат калия (3,0 г), и реакционный раствор перемешивали в течение 12 часов при температуре 100°C. Реакционному раствору давали остыть до комнатной температуры, в реакционный раствор добавляли насыщенный водный раствор хлорида аммония (10 мл) и этилацетат (10 мл), слои разделяли, и водный слой экстрагировали этилацетатом (20 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 8-бром-5-хлор-3,4-дигидро-2H-бензоксазина (400 мг).
[0319]
(Стадия 2) трет-бутил 8-бром-5-хлор-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилат
К раствору в диоксане (5 мл) 8-бром-5-хлор-3,4-дигидро-2H-1,4-бензоксазина (223 мг), при комнатной температуре добавляли 4-диметиламинопиридин (44 мг), триэтиламин (0,25 мл) и ди-трет-бутил дикарбамат (458 мг), и реакционный раствор перемешивали в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией (элюент: гексан/этилацетат) с получением трет-бутил 8-бром-5-хлор-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилата (140 мг).
[0320]
(Стадия 3)
Исходя из трет-бутил 8-бром-5-хлор-2H-бензо [b][1,4]оксазин-4(3H)-карбоксилата, полученного на вышеуказанной стадии 2, в соответствии со способами стадий 3 и 4 ссылочного примера E1 получали указанное в заголовке соединение.
[0321]
[Ссылочный пример E59. Синтез трет-бутил 8-(хлорсульфонил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилатаа]
[0322]
[Формула 41]
[0323]
(Стадия 1) трет-бутил 8-бром-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилат
Исходя из 8-бром-3,4-дигидро-2H-бензо[b][1,4]оксазина в соответствии со способом ссылочного примера E58, стадия 2, получали трет-бутил 8-бром-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилат.
[0324]
(Стадия 2)
Исходя из трет-бутил 8-бром-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилата, полученного на вышеуказанной стадии 1, в соответствии со ссылочным примером E1, стадии 3 и 4, получали указанное в заголовке соединение.
[0325]
[Ссылочный пример E60. Синтез трет-бутил 4-(хлорсульфонил)-1H-индол-1-карбоксилата]
[0326]
[Формула 42]
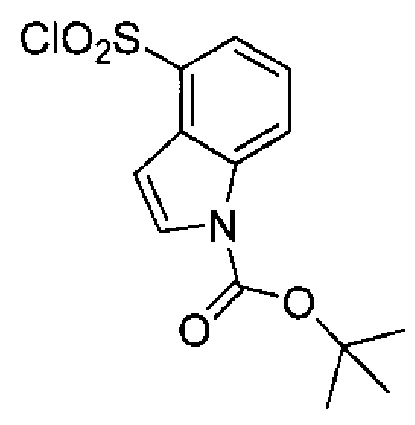
[0327]
Исходя из коммерчески доступного трет-бутил 4-бром-1H-индол-1-карбоксилата (Ark Pharm, Inc.) в соответствии со способом ссылочного примера E1, стадии 3 и 4, получали указанное в заголовке соединение.
[0328]
[Ссылочный пример E61. Синтез 5-хлор-4-этил-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонилхлорида]
[0329]
[Формула 43]
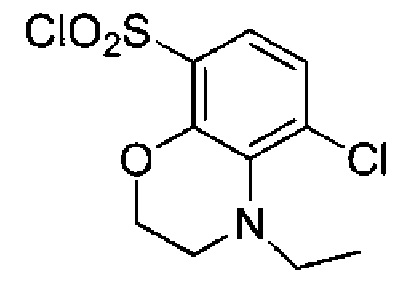
[0330]
(Стадия 1) 8-бром-5-хлор-4-этил-2,3-дигидро-1,4-бензоксазин
К раствору в ДМСО (2,0 мл) 8-бром-5-хлор-3,4-дигидро-2H-бензоксазина (380 мг), полученного в ссылочном примере E58, стадия 1, добавляли гидроксид калия (120 мг) и этил йодид (100 мкл), и реакционный раствор перемешивали при температуре 100°C в течение 2 часов. Реакционному раствору давали остыть до комнатной температуры, для разделения слоев добавляли насыщенный водный раствор хлорида аммония (10 мл) и этилацетат (10 мл), и водный слой экстрагировали этилацетатом (10 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Реакционный раствор концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 8-бром-5-хлор-4-этил-2,3-дигидро-1,4-бензоксазина (105 мг).
[0331]
(Стадия 2)
Исходя из 8-бром-5-хлор-4-этил-2,3-дигидро-1,4-бензоксазина, полученного на вышеуказанной стадии 1, в соответствии со способом ссылочных примеров E1, стадии 3 и 4, получали указанное в заголовке соединение.
[0332]
[Ссылочный пример E62. Синтез 4-(циклопропанкарбонил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонилхлорида]
[0333]
[Формула 44]
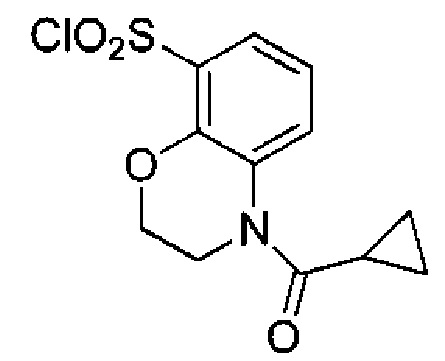
[0334]
(Стадия 1) (8-бром-2H-бензо[b][1,4]оксазин-4(3H)-ил)(циклопропил)метанон
К раствору в ТГФ (2,0 мл) 8-бром-3,4-дигидро-2H-бензо[b][1,4]оксазина (62 мг) при температуре 0°C добавляли гидрид натрия (18 мг) и реакционный раствор перемешивали в течение 30 минут. В реакционный раствор добавляли циклопропанкарбонилхлорид (170 мкл) и смесь дополнительно перемешивали при комнатной температуре в течение 2 часов. В реакционный раствор для разделения слоев последовательно добавляли насыщенный водный раствор хлорида аммония (10 мл) и этилацетат (10 мл), и водный слой экстрагировали этилацетатом (10 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением (8-бром-2H-бензо[b][1,4]оксазин-4(3H)-ил)(циклопропил)метанона (87 мг).
[0335]
(Стадия 2)
Исходя из (8-бром-2H-бензо[b][1,4]оксазин-4(3H)-ил)(циклопропил)метанона, полученного на вышеуказанной стадии 1 в соответствии со способом стадий 3 и 4 ссылочного примера E1 получали указанное в заголовке соединение.
[0336]
[Ссылочный пример E63. Синтез 5-хлор-4-(2,2-дифторэтил)-3-оксо-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонилхлорида]
[0337]
[Формула 45]
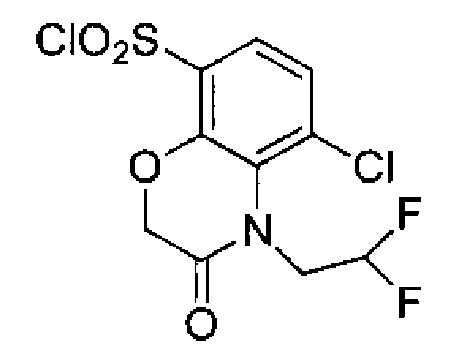
[338]
(Стадия 1) 8-бром-5-хлор-2H-бензо[b][1,4]оксазин-3(4H)-он
2-Амино-6-бром-3-хлорфенол (140 мг) растворяли в ТГФ (2,0 мл), добавляли хлорацетилхлорид (100 мкл) и гидрокарбонат натрия (240 мг) и реакционный раствор перемешивали при комнатной температуре в течение 3 часов. В реакционный раствор добавляли карбонат калия (440 мг), и смесь дополнительно перемешивали при температуре 80°C в течение 5 часов. Реакционному раствору давали остыть до комнатной температуры и для разделения слоев добавляли насыщенный водный раствор хлорида аммония (10 мл) и этилацетат (10 мл), и водный слой экстрагировали этилацетатом (20 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 8-бром-5-хлор-2H-бензо[b][1,4]оксазин-3(4H)-она (160 мг).
[0339]
(Стадия 2) 8-бром-5-хлор-4-(2,2-дифторэтил)-2H-бензо[b][1,4]оксазин-3(4H)-он
К раствору в ДМФ (2,5 мл) 8-бром-5-хлор-2H-бензо[b][1,4]оксазин-3(4H)-она (69 мг), полученного на вышеуказанной стадии 1, последовательно добавляли карбонат калия (420 мг) и 2,2-дифторэтил пара-толуолсульфонат (500 мг), и реакционный раствор перемешивали при температуре 100°C в течение 3 часов. Реакционному раствору давали остыть до комнатной температуры и для разделения слоев добавляли насыщенный водный раствор хлорида аммония (10 мл) и этилацетат (10 мл), и водный слой экстрагировали этилацетатом (10 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 8-бром-5-хлор-4-(2,2-дифторэтил)-2H-бензо[b][1,4]оксазин-3(4H)-она (85 мг).
[0340]
(Стадия 3) 8-(бензилтио)-5-хлор-4-(2,2-дифторэтил)-2H-бензо[b][1,4]оксазин-3(4H)-он
Исходя из 8-бром-5-хлор-4-(2,2-дифторэтил)-2H-бензо[b][1,4]оксазин-3(4H)-она, полученного на вышеуказанной стадии 2, в соответствии со способом ссылочного примера E1, стадия 3, получали 8-(бензилтио)-5-хлор-4-(2,2-дифторэтил)-2H-бензо[b][1,4]оксазин-3(4H)-он.
[0341]
(Стадия 4)
Исходя из 8-(бензилтио)-5-хлор-4-(2,2-дифторэтил)-2H-бензо[b][1,4]оксазин-3(4H)-она в соответствии со способом ссылочного примера E1, стадия 4, получали соединение, указанное в заголовке вышеуказанной стадии 3.
[0342]
[Ссылочный пример E64 и E65]
Исходя из 8-бром-5-хлор-2H-бензо[b][1,4]оксазин-3(4H)-она, полученного в ссылочном примере E63, стадия 1, в соответствии со способом ссылочного примера E63, стадия 2, и в ссылочном примере E1, стадии 3 и 4, были синтезированы следующие соединения ссылочных примеров E64 и E65.
[0343]
[Таблица 8]
[0344]
[Ссылочный пример E66. Синтез 5-хлор-4-(2,2-дифторэтил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонилхлорида]
[0345]
[Формула 46]
[0346]
(Стадия 1) 8-(бензилтио)-5-хлор-4-(2,2-дифторэтил)-3,4-дигидро-2H-бензо[b][1,4]оксазин
К раствору в ТГФ (5 мл) 8-(бензилтио)-5-хлор-4-(2,2-дифторэтил)-2H-бензо[b][1,4]оксазин-3(4H)-она (270 мг), полученного в ссылочном примере 63, стадия 3, добавляли диметилсульфид боран (1,0 мл), и реакционный раствор перемешивали при температуре 70°C в течение 4 часов. Реакционному раствору давали остыть до комнатной температуры, для разделения слоев добавляли по порядку метанол (5 мл), этилацетат (10 мл) и воду (10 мл), и водный слой экстрагировали этилацетатом (10 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 8-(бензилтио)-5-хлор-4-(2,2-дифторэтил)-3,4-дигидро-2H-бензо[b][1,4]оксазина (154 мг).
[0347]
(Стадия 2)
Исходя из 8-(бензилтио)-5-хлор-4-(2,2-дифторэтил)-3,4-дигидро-2H-бензо[b][1,4]оксазина, полученного на вышеуказанной стадии 1, в соответствии со способом ссылочного примера E1, стадия 4, получали указанное в заголовке соединение.
[0348]
[Ссылочный пример E67. Синтез 2-циано-5-(морфолин-4-карбонил)бензол-1-сульфонилхлорида]
[0349]
[Формула 47]
[0350]
(Стадия 1) этил 3-(бензилтио)-4-цианобензоат
Этил 3-(бензилтио)-4-цианобензоат получали из этил 3-бром-4-цианобензоата в соответствии со способом ссылочного примера E1, стадия 3.
[0351]
(Стадия 2) 6-(бензилтио)-4-циано-бензойная кислота
К раствору в ТГФ (4,0 мл) этил 3-(бензилтио)-4-цианобензоата (344 мг), полученного на вышеуказанной стадии 1, добавляли водный раствор гидроксида натрия (3М, 4,0 мл) и реакционный раствор перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор добавляли к соляной кислоте (1М, 15 мл) и два раза экстрагировали этилацетатом (20 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 6-(бензилтио)-4-цианобензойная кислоты (210 мг).
[0352]
(Стадия 3) 2-(бензилтио)-4-(морфолин-4-карбонил)бензонитрил
Используя 6-(бензилтио)-4-циано-бензойную кислоту, полученную на вышеописанной стадии 2, и морфолин, в соответствии со ссылочным примером E35, стадия 3, получали 2-(бензилтио)-4-(морфолин-4-карбонил)бензонитрил.
(Стадия 4)
Исходя из 2-(бензилтио)-4-(морфолин-4-карбонил)бензонитрила, полученного на вышеуказанной стадии 3, в соответствии со способом ссылочного примера E1, стадия 4, получали указанное в заголовке соединение.
[0353]
[Ссылочный пример E68. Синтез 2-циано-5-(диметилкарбамоил)бензол-1-сульфонилхлорида]
[0354]
[Формула 48]
[0355]
(Стадия 1) 2-(бензилтио)-4-циано-N,N-диметилбензамид
В соответствии со способом ссылочного примера E35, стадия 3, из 6-(бензилтио)-4-цианобензойной кислоты, полученной в ссылочном примере E67, стадия 2, и диметиламина получали 2-(бензилтио)-4-циано-N,N-диметилбензамид.
[0356]
(Стадия 2)
Исходя из 2-(бензилтио)-4-циано-N,N-диметилбензамида, полученного на вышеуказанной стадии 1, в соответствии со способом ссылочного примера E1, стадия 4, получали указанное в заголовке соединение.
[0357]
[Ссылочный пример E69. Синтез 4-хлор-2-циано-5-(диметилкарбамоил)бензол-1-сульфонилхлорид]
[0358]
[Формула 49]
[0359]
Указанное в заголовке соединения было синтезировано из метил 5-бром-2-хлор-4-цианобензоата в соответствии с каждым из способов ссылочного примера E1, стадия 3, ссылочного примера E67, стадия 2, ссылочного примера E35, стадия 3, и ссылочного примера E1, стадия 4.
[0360]
[Ссылочный пример E70. Синтез трет-бутил (5-хлор-8-(хлорсульфонил)хроман-4-ил)карбамат]
[0361]
[Формула 50]
[0362]
(Стадия 1) 8-бензил-сульфанил-5-хлорхроман-4-он
Исходя из 8-бром-5-хлорхроман-4-она в соответствии со способом ссылочного примера E1, стадия 3, получали 8-бензилсульфанил-5-хлорхроман-4-он.
[0363]
(Стадия 2) 8-бензил-сульфанил-5-хлорхроман-4-амин
8-Бензилсульфанил-5-хлорхроман-4-он (460 мг), полученный на вышеуказанной стадии 1, растворяли в метаноле (3,0 мл), добавляли хлорид аммония (1,2 г) и реакционный раствор перемешивали при комнатной температуре в течение 2 часов. В реакционный раствор добавляли цианоборгидрид натрия (670 мг), и смесь дополнительно перемешивали при температуре 80°C в течение 14 часов. В реакционный раствор для разделения слоев последовательно добавляли насыщенный водный раствор гидрокарбоната натрия (10 мл), an водный раствор гидроксида натрия (5 М, 10 мл) и хлороформ (20 мл), и водный слой два раза экстрагировали хлороформом (20 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (этилацетат) с получением 8-бензилсульфанил-5-хлорхроман-4-амина (216 мг).
[0364]
(Стадия 3) трет-бутил (8-(бензилтио)-5-хлорхроман-4-ил)карбамат
Исходя из 8-бензилсульфанил-5-хлор-хроман-4-амина (216 мг), полученного на вышеуказанной стадии 2, в соответствии с Ссылочный пример E58, стадия 2, получали трет-бутил (8-(бензилтио)-5-хлорхроман-4-ил)карбамат.
[0365]
(Стадия 4)
Исходя из трет-бутил (8-(бензилтио)-5-хлорхроман-4-ил)карбамата, полученного на вышеуказанной стадии 3, в соответствии со способом ссылочного примера E1, стадия 4, получали указанное в заголовке соединение.
[0366]
[Ссылочный пример E71. Синтез 4-ацетамидо-5-хлорхроман-8-сульфонилхлорида]
[0367]
[Формула 51]
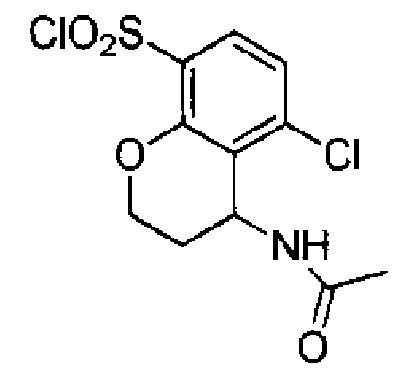
[0368]
(Стадия 1) N-(8-бром-5-хлорхроманон-4-ил)ацетамид
8-Бром-5-хлорхроманон-4-амин (250 мг) растворяли в ДМФ (2,0 мл) и ТГФ (7,0 мл), последовательно добавляли N,N-диметил-4-аминопиридин (45 мг), триэтиламин (400 мкл) и уксусный ангидрид (200 мкл) и смесь перемешивали при комнатной температуре в течение 2 часов. В реакционный раствор добавляли воду (10 мл) и смесь экстрагировали этилацетатом (10 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением N-(8-бром-5-хлорхроманон-4-ил)ацетамида (260 мг).
[0369]
(Стадия 2)
Исходя из N-(8-бром-5-хлорхроманон-4-ил)ацетамида, полученного на вышеуказанной стадии 1, в соответствии со способом ссылочных примеров E1, стадии 3 и 4, получали указанное в заголовке соединение.
[0370]
[Ссылочный пример E72. Синтез 1-(3-хлор-6-(хлорсульфонил)пиридин-2-ил)-2,2,2-трифторэтилацетат]
[0371]
[Формула 52]
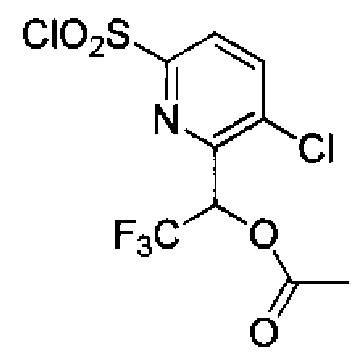
[0372]
(Стадия 1) 1-(6-бром-3-хлорпиридин-2-ил)-2,2,2-трифторэтанол
К раствору в ТГФ (10 мл) 6-бром-3-хлорпиколинальдегида (770 мг) добавляли фторид цезия (700 мг) и (трифторметил)триметилсилан (700 мкл) и реакционный раствор перемешивали при комнатной температуре в течение 4 часов. В реакционный раствор добавляли насыщенный водный раствор гидрокарбоната натрия (10 мл), и смесь экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 1-(6-бром-3-хлорпиридин-2-ил)-2,2,2-трифторэтанола (600 мг).
[0373]
(Стадия 2)
Исходя из 1-(6-бром-3-хлорпиридин-2-ил)-2,2,2-трифторэтанола, полученного на вышеуказанной стадии 1, в соответствии со способом ссылочных примеров E44, стадия 3, и E1, стадии 3-4, получали указанное в заголовке соединение.
[0374]
[Ссылочный пример E73. Синтез метил 5-бром-2-(хлорсульфонил)никотинат]
[0375]
[Формула 53]
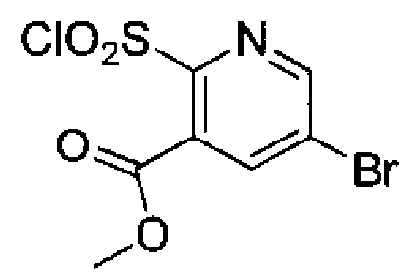
[0376]
(Стадия 1) метил 2-(бензилтио)-5-бром-никотинат
К раствору в ТГФ (5,0 мл) бензилмеркаптана (700 мкл) при температуре 0°C добавляли гидрид натрия (285 мг) и реакционный раствор перемешивали при комнатной температуре в течение 15 мин. В реакционный раствор добавляли по каплям раствор в ТГФ (3,0 мл) метил 2,5-дибромникотината (1,59 г), и смесь перемешивали при температуре 0°C в течение 20 минут. Реакционный раствор добавляли в воду (10 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением метил 2-(бензилтио)-5-бромникотината (1,5 г).
[0377]
(Стадия 2)
Исходя из метил 2-(бензилтио)-5-бромникотината, полученного на вышеуказанной стадии 1, в соответствии со способом ссылочного примера E1, стадия 4, получали указанное в заголовке соединение.
[0378]
[Ссылочный пример F1. Синтез моногидрохлорида 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2(3H)-она]
[0379]
[Формула 54]
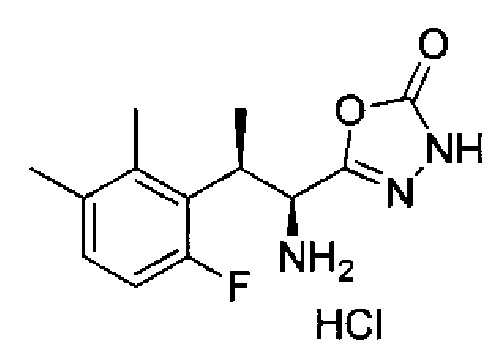
[0380]
(Стадия 1) (2S,3R)-2-((трет-бутоксикарбонил)амино)-3-(6-фтор-2,3-диметилфенил)бутановая кислота
К (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановой кислоте (515 мг), полученной в ссылочном примере D1, последовательно добавляли воду (9 мл), 1,4-диоксан (9 мл) и триэтиламин (955 мкл) и смесь охлаждали до температуры 0°C. В реакционный раствор при той же температуре добавляли ди-трет-бутил дикарбонат (650 мг), и смесь перемешивали в течение 45 минут. Реакционный раствор добавляли к соляной кислоте (1М, 20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат/2% уксусная кислота) с получением (2S,3R)-2-((трет-бутоксикарбонил)амино)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (745 мг).
[0381]
(Стадия 2) трет-бутил ((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)карбамат
К раствору в ТГФ (14,0 мл) (2S,3R)-2-(трет-бутоксикарбониламино)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (440 мг), полученной на вышеуказанной стадии 1, добавляли CDI (302 мг), и реакционный раствор перемешивали при комнатной температуре в течение 20 минут. Реакционный раствор охлаждали до температуры 0°C, добавляли гидразин моногидрат (200 мкл), и смесь перемешивали при той же температуре в течение 30 минут. Реакционный раствор добавляли в воду (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. К раствору в 1,4-диоксане (14 мл) полученного остатка добавляли CDI (560 мг) и реакционный раствор перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор добавляли в воду (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением трет-бутил ((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)карбамата (356 мг).
[0382]
(Стадия 3)
трет-Бутил ((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)карбамат (550 мг), полученный на вышеуказанной стадии 2, растворяли в соляной кислоте-1,4-диоксан (4М, 5,0 мл), и реакционный раствор перемешивали при комнатной температуре в течение 1,5 часов. Реакционный раствор концентрировали при пониженном давлении с получением указанного в заголовке соединения.
[0383]
[Ссылочные примеры F2-F10]
В соответствии со способом ссылочного примера F1, стадии 1-3, были синтезированы следующие соединения ссылочных примеров F2-F10.
[0384]
[Таблица 9]
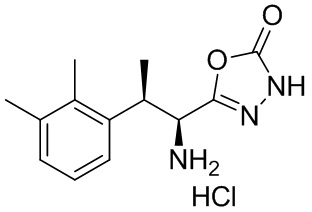
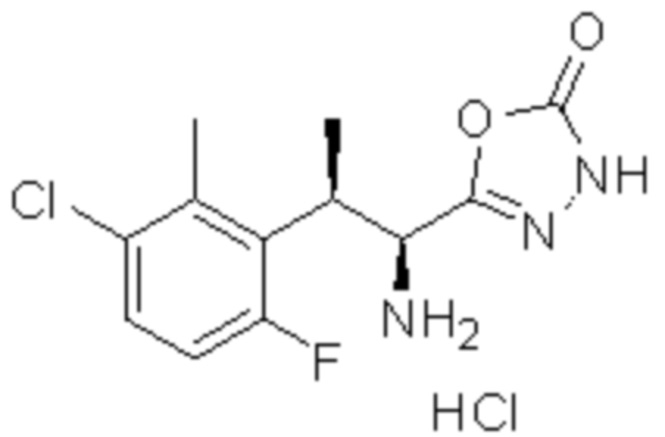
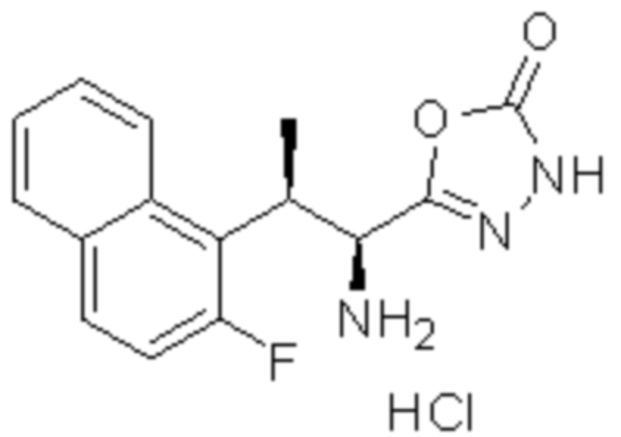
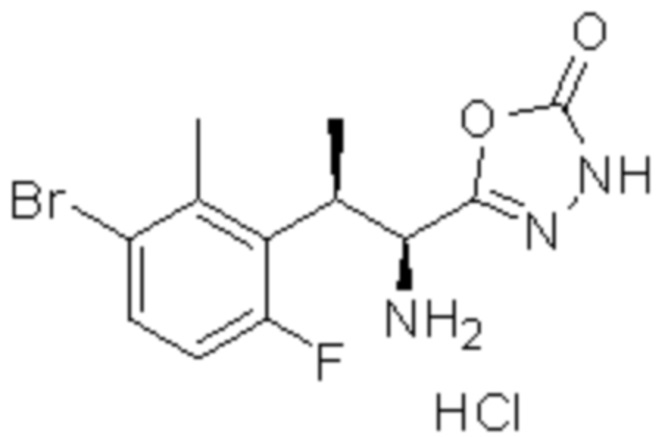
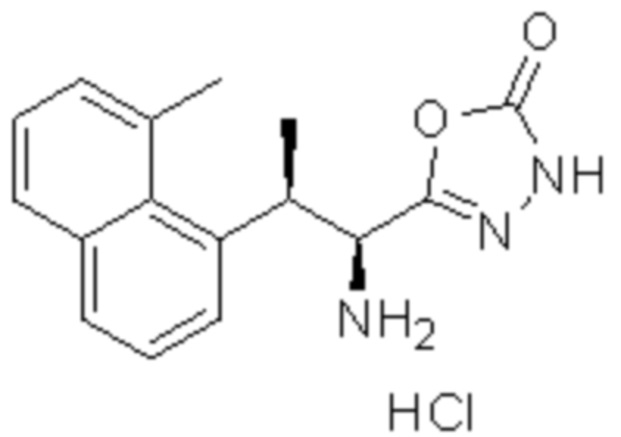
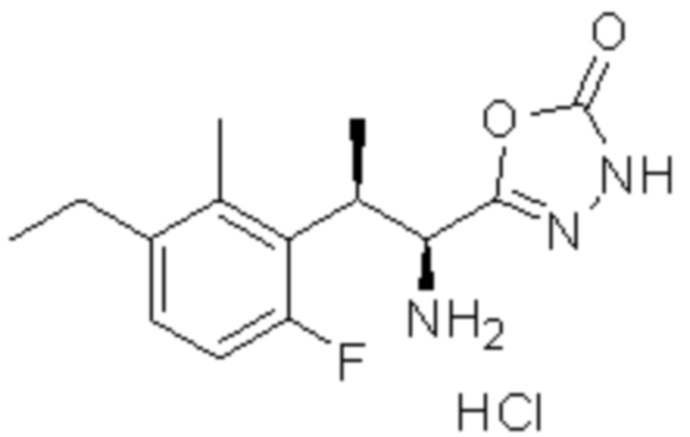
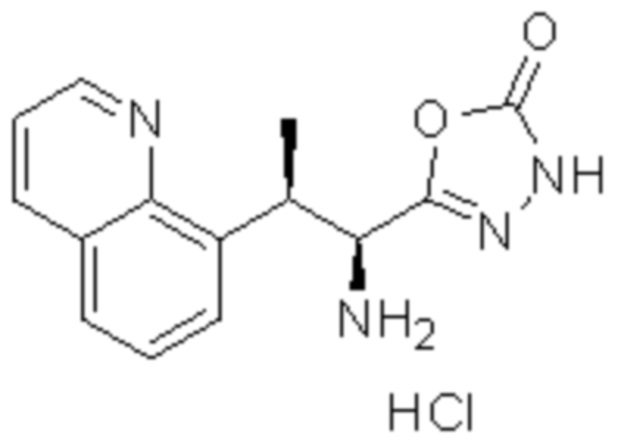
[0385]
[Пример 1]
Синтез 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-бензамида
[0386]
(Стадия 1)
К раствору в 1,4-диоксане (5,0 мл) и воде (5,0 мл) (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (300 мг), полученной в ссылочном примере D1, добавляли триэтиламин (570 мкл) и затем охлаждали до температуры 0°C. В реакционный раствор добавляли 4-бром-2-цианобензол-1-сульфонилхлорид (362 мг) и смесь перемешивали при той же температуре в течение 45 минут. Реакционный раствор добавляли к соляной кислоте (1М, 15 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат/2% уксусная кислота) с получением (2S,3R)-2-(4-бром-2-цианофенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (465 мг).
[0387]
(Стадия 2)
К раствору в ТГФ (5,0 мл) (2S,3R)-2-(4-бром-2-цианофенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (465 мг), полученный на вышеуказанной стадии 1, добавляли CDI (210 мг) и реакционный раствор перемешивали при комнатной температуре в течение 20 минут. Реакционный раствор охлаждали до температуры 0°C, добавляли гидразин моногидрат (200 мкл) и смесь перемешивали при той же температуре в течение 20 минут. Реакционный раствор добавляли в воду (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении.
К раствору в 1,4-диоксане (4,0 мл) полученного остатка добавляли CDI (211 мг) и реакционный раствор перемешивали при температуре 45°C в течение 1 часа. Реакционный раствор добавляли в воду (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 4-бром-2-циано-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамида (386 мг).
[0388]
(Стадия 3)
К раствору в ДМСО (5,0 мл) 4-бром-2-циано-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамида (386 мг), полученного на вышеуказанной стадии 2, на ледяной бане последовательно добавляли водный раствор перекиси водорода (1,0 мл) и карбонат калия (420 мг) и реакционный раствор перемешивали при температуре 60°C в течение 2,5 часов. Реакционный раствор медленно добавляли к соляной кислоте (1М, 15 мл) на ледяной бане и затем экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0389]
[Примеры 2-128]
Соединения примеров 2-43 были синтезированы в соответствии со способом примера 1, стадии 1-3. Соединения примеров 44-128 были синтезированы в соответствии со способом примера 1, стадии 1 и 2. Необходимые исходные продукты перечислены в следующей таблице. «ArSO2Cl» в последующих таблицах относится к производному арилсульфонилхлорида, используемого в реакции с исходным веществом в каждом примере.
[0390]
[Таблица 10]


























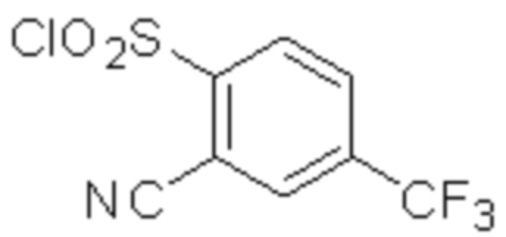





































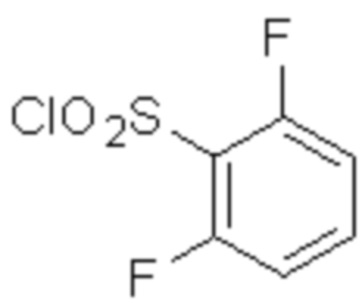
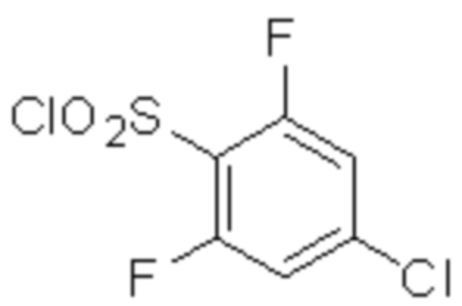




[0391]
[Пример 129]
Синтез 5-Хлор-8-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-4-метил-d3-хроман-4-ил ацетат
[0392]
К раствору в пиридине (1,5 мл) моногидрохлорида 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2(3H)-она (45 мг), полученного в ссылочном примере F1, 5-хлор-8-(хлорсульфонил)-4-метил-d3-хроман-4-илацетат (80 мг), полученного в ссылочном примере E1 добавляли, и реакционный раствор перемешивали при комнатной температуре в течение 12 часов. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения (59 мг) в виде смеси 1:1 диастереомеров.
[0393]
[Примеры 130-185]
В соответствии со способом примера 129 были синтезированы следующие соединения примеров 130-185 и примеров 338-343. Необходимые исходные продукты перечислены в следующей таблице.
[0394]
[Таблица 11]

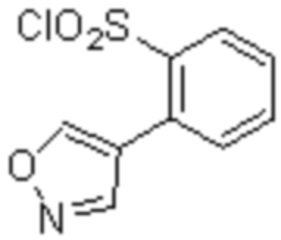
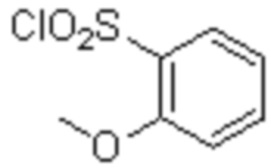
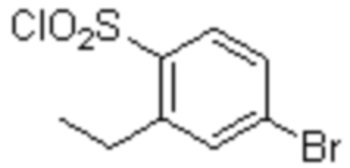
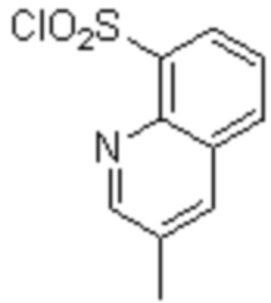


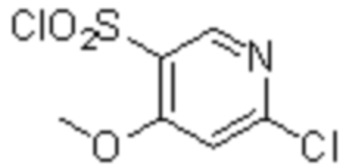
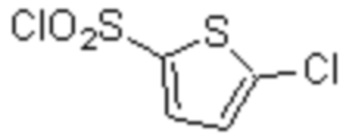
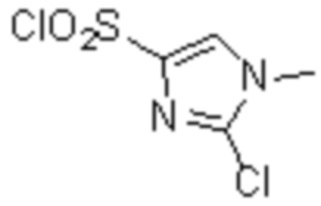
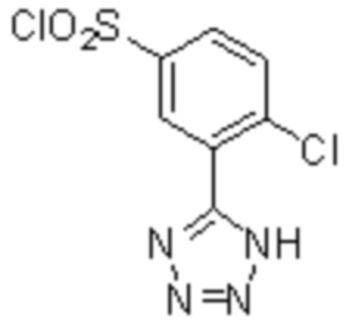
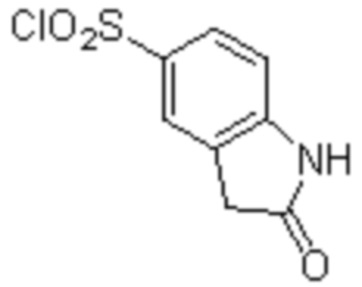
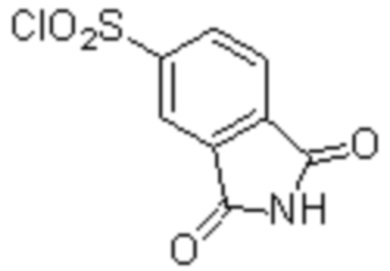
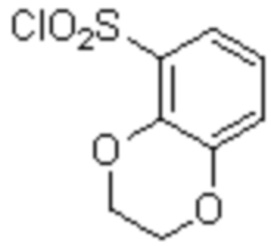
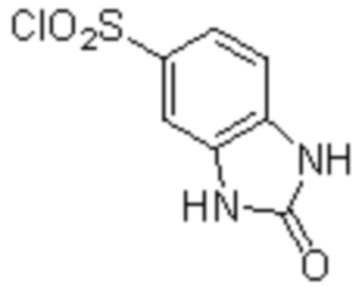

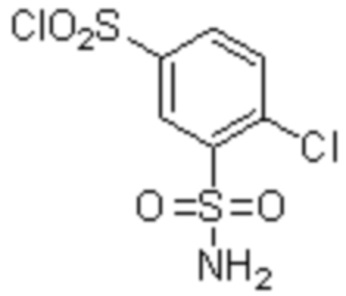
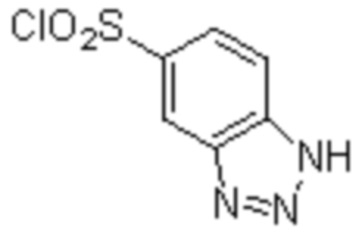
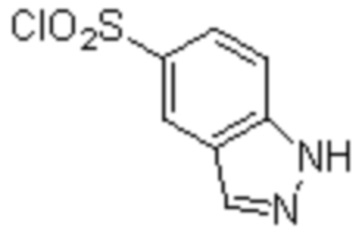
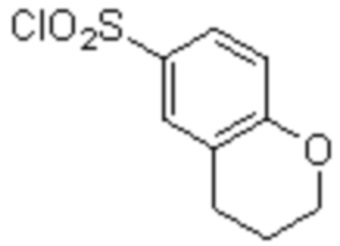
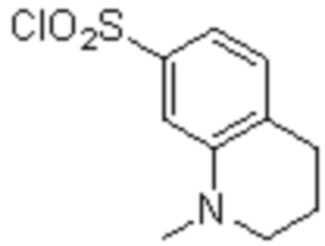
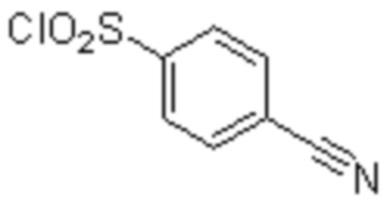
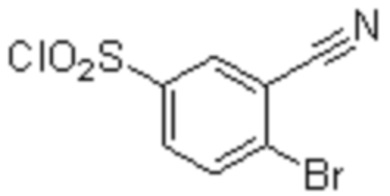
[0395]
[Пример 186]
Синтез 2,4-дифтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3-(2-гидроксипропан-2-ил)бензолсульфонамида
[0396]
(Стадия 1)
Метил 3-(хлорсульфонил)-2,6-дифторбензоат (33 мг) добавляли к раствору в пиридине (1,0 мл) моногидрохлорида 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2(3H)-она (20 мг), полученного в ссылочном примере F1, и реакционный раствор перемешивали в течение 12 часов при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением метил 2,6-дифтор-3-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоата (12,5 мг).
[0397]
(Стадия 2)
К раствору в ТГФ (2,0 мл) метил 2,6-дифтор-3-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоата (12,5 мг), полученного на вышеописанной стадии 1, при температуре 0°C добавляли по каплям раствор в диэтиловом эфире (3,0М, 84 мкл) метилмагнийбромида и реакционный раствор перемешивали в течение 1 часа при комнатной температуре. На ледяной бане добавляли по каплям насыщенный водный раствор хлорида аммония (10 мл), добавляли этилацетат (10 мл) и слои разделяли. Органический слой промывали последовательно соляной кислотой (1М, 10 мл), водой (10 мл) и насыщенный насыщенным солевым раствором (10 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0398]
[Примеры 187-195]
В соответствии со способом примера 186 были синтезированы следующие соединения примеров 187-195. Необходимые исходные продукты перечислены в следующей таблице.
[0399]
[Таблица 12]

[0400]
[Пример 196]
Синтез 5-фтор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-4-(2-гидроксипропан-2-ил)бензамида
[0401]
(Стадия 1)
Исходя из моногидрохлорида 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2(3H)-она (60 мг), полученного в ссылочном примере F1, и метил 2-фтор-5-(хлорсульфонил)-4-цианобензоата (94 мг), полученного в ссылочном примере E15, в соответствии со способом примера 129 получали метил 4-(циано-2-фтор-5(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоат (49 мг).
[0402]
(Стадия 2)
Исходя из метил 4-циано-2-фтор-5-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоата (49 мг), полученного на вышеописанной стадии 1, в соответствии со способом примера 186, стадия 2, получали 2-циано-4-фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-(2-гидроксипропан-2-ил)бензолсульфонамид (27,5 мг).
[0403]
(Стадия 3)
Исходя из 2-циано-4-фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-(2-гидроксипропан-2-ил)бензолсульфонамида (27,5 мг), полученного на вышеописанной стадии 2, в соответствии со способом примера 1, стадия 3, получали указанное в заголовке соединение.
[0404]
[Примеры 197-199]
В соответствии со способами примера 129, примера 186, стадия 2, примера 1, стадия 3, были синтезированы следующие соединения примеров 197-199. Необходимые исходные продукты перечислены в следующей таблице. Однако, в случае примера 199 синтез осуществляли, используя вместо метилмагнийбромида 1-пропинилмагнийбромид.
[0405]
[Таблица 13]
[0406]
[Пример 200]
Синтез 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамида, изомер A и изомер B
[0407]
Смесь диастереомеров 1:1 5-хлор-8-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-4-метил-d3-хроман-4-илацетата (59 мг), полученную в пример 129, растворяли в метаноле (2,0 мл) и воде (1,0 мл), добавляли гидроксид лития (5 мг) и реакционный раствор перемешивали при температуре 55°C в течение 1 часа. После концентрирования реакционного раствора к остатку добавляли соляную кислоту (1М, 10 мл) и этилацетат (10 мл) и слои разделяли. Водный слой экстрагировали этилацетатом (10 мл) и объединенные органические слои промывали насыщенным солевым раствором (10 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил), и фракции концентрировали с получением каждого из двух диастереомерных продуктов. Вещество, элюированное первым, обозначали как соединение A, и Вещество, элюированное позже, обозначали как соединение B.
[0408]
[Примеры 201-229]
В соответствии со способом примера 200 были синтезированы следующие соединения примеров 201-229. В случае разделения диастереомеров ранее элюированное соединение обозначали как A, а позднее элюированное соединение как B-2. В случае разделения диастереомеров ранее элюированное соединение обозначали как A, а позднее элюированное соединение как B-2. Необходимые исходные продукты перечислены в следующей таблице.
[0409]
[Таблица 14]
207B
208B
209B
220B
222B
224B
226B
227B
228B
229B
[0410]
[Пример 230]
Синтез 5-фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамида, изомер A и изомер B
[0411]
(Стадия 1)
Используя моногидрохлорид 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2(3H)-она (40 мг), полученный в ссылочном примере F1, и 5-фтор-4-оксохроман-8-сульфонилхлорид (60 мг), полученный в ссылочном примере E8, в соответствии со способом примера 129 получали 5-фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-оксохроман-8-сульфонамид (44 мг).
[0412]
(Стадия 2)
К раствору в этаноле (2,0 мл) 5-фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-оксохроман-8-сульфонамида (44 мг), полученного на вышеописанной стадии 1, добавляли боргидрид натрия (13,5 мг) и реакционный раствор перемешивали при комнатной температуре в течение 30 минут. После концентрирования реакционного раствора при пониженном давлении к остатку добавляли воду (10 мл) и этилацетат (10 мл), разделяли, и водный слой экстрагировали этилацетатом (10 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил), и фракции концентрировали с получением каждого из двух диастереомерных продуктов. Вещество, элюированное первым, обозначали как соединение A, и вещество, элюированное позже, обозначали как соединение B.
[0413]
[Примеры 231-244]
В соответствии со способом примера 129 и примера 230, стадия 2, были синтезированы соединения примеров 231-244, показанные далее. В случае разделения диастереомеров первое элюированное соединение было обозначено как A, а позднее элюированное соединение как B. Соотношение диастереомеров в смеси составляет 1:1, если не указано иное. Необходимые исходные продукты перечислены в следующей таблице.
[0414]
[Таблица 15]
235B
243B
244B
[0415]
[Пример 245]
Синтез 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-никотинамида
[0416]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)-бутановую кислоту (100 мг), полученную в ссылочном примере D1, и метил 5-хлор-2-(хлорсульфонил)никотинат (140 мг), полученный в ссылочном примере E11, в соответствии со способом примера 1, стадии 1, 2, получали метил 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)никотинат (174 мг).
[0417]
(Стадия 2)
Метил 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)никотинат (174 мг), полученный на вышеописанной стадии 1, растворяли в ТГФ (2,5 мл) и воде (2,5 мл), добавляли гидроксид лития (30 мг) и реакционный раствор перемешивали при температуре 50°C в течение 16 часов. Реакционный раствор добавляли к соляной кислоте (1М, 15 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат/2% уксусная кислота) с получением 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)никотиновой кислоты (145 мг).
[0418]
(Стадия 3)
К раствору в толуоле (1,2 мл) 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)никотиновой кислоты (10 мг), полученной на вышеописанной стадии 2, последовательно добавляли ДМФ (30 мкл) и тионилхлорид (60 мкл), и реакционный раствор перемешивали при температуре 95°C в течение 40 минут. Реакционному раствору давали остыть до комнатной температуры и затем концентрировали при пониженном давлении. К раствору в ТГФ (2,0 мл) остатка при температуре -10°C медленно добавляли по каплям 28% водный раствор аммиака (1,0 мл) и реакционный раствор перемешивали при комнатной температуре в течение 30 мин. Реакционный раствор добавляли к соляной кислоте (1М, 10 мл) и экстрагировали этилацетатом (10 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0419]
[Примеры 246-264]
Соединения примеров 246-264, показанные далее, были синтезированы в соответствии со способами примера 1, стадии 1 и 2, и примера 245, стадия 2 и 3. Необходимые исходные продукты перечислены в следующей таблице.
[0420]
[Таблица 16]


[0421]
[Пример 265]
Синтез 4-амино-N-((1S,2R)-2-(2-фторнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метоксибензолсульфонамида
[0422]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(2-фторнафталин-1-ил)бутановую кислоту (45 мг), полученную в ссылочном примере D3, и 2-метокси-4-нитробензол-1-сульфонилхлорид (60 мг), в соответствии со способом примера 1, стадии 1 и 2, получали N-((1S,2R)-2-(2-фторнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метокси-4-нитробензолсульфонамид (32 мг).
[0423]
(Стадия 2)
N-((1S,2R)-2-(2-Фторнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метокси-4-нитробензолсульфонамид (32 мг), полученный на вышеописанной стадии 1, растворяли в этаноле (2,0 мл) и воде (1,0 мл), последовательно добавляли железо (30 мг) и хлорид аммония (20mg), и реакционный раствор перемешивали при температуре 80°C в течение 1 часа. Реакционный раствор фильтровали через CELITE и остаток промывали этилацетатом (10 мл). Объединенные фильтраты концентрировали и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0424]
[Примеры 266-272]
Соединения примеров 266-272, показанные далее, были синтезированы в соответствии со способом примера 1, стадии 1 и 2, и примера 265, стадия 2. Необходимые исходные продукты перечислены в следующей таблице.
[0425]
[Таблица 17]

[0426]
[Пример 273]
Синтез 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-(2-гидроксиэтил)-3-оксо-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида
[0427]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (50 мг), полученную в ссылочном примере D1, и 4-(2-(бензилокси)этил)-5-хлор-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонилхлорид (142 мг), полученный в ссылочном примере E65, в соответствии со способом примера 1, стадии 1 и 2, получали 4-(2-(бензилокси)этил)-5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3-оксо-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамид (22 мг).
[0428]
(Стадия 2)
К раствору в ТГФ (1,5 мл) 4-(2-(бензилокси)этил)-5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3-оксо-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида (20 мг), полученного на вышеописанной стадии 1, добавляли 20 мас% гидроксид палладия (30 мг), и реакционную смесь перемешивали при комнатной температуре в течение 30 минут в атмосфере водорода. Реакционный раствор фильтровали через CELITE и остаток промывали смесью гексан/этилацетат=1/1 (10 мл), и объединенный фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0429]
[Пример 274]
Синтез N-(5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)фенил)ацетамид
[0430]
К раствору в дихлорметане (1,0 мл) 2-амино-4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамида (5,0 мг), полученного в примере 271, последовательно добавляли пиридин (5,0 мкл) и уксусный ангидрид (4,0 мкл), и реакционный раствор перемешивали при комнатной температуре for 3 часов. Реакционный раствор добавляли к соляной кислоте (1М, 5,0 мл) и экстрагировали этилацетатом (10 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0431]
[Пример 275]
Синтез 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида
[0432]
(Стадия 1)
Исходя из моногидрохлорида 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2(3H)-она (14,3 мг), полученного в ссылочном примере F1, и трет-бутил 5-хлор-8-(хлорсульфонил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилата (25,3 мг), полученного в ссылочном примере E58, в соответствии со способом примера 129 получали трет-бутил 5-хлор-8-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилат (30,4 мг).
[0433]
(Стадия 2)
К трет-бутил 5-хлор-8-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилату (30,4 мг), полученному на вышеописанной стадии 1, добавляли хлористоводородную кислоту-1,4-диоксан (4М, 5,0 мл), и реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения.
[0434]
[Примеры 276-283]
Соединения примеров 276-283, показанные далее, были синтезированы в соответствии со способом примера 129 и примера 275, стадия 2. Необходимые исходные продукты перечислены в следующей таблице.
[0435]
[Таблица 18]
[0436]
[Пример 284]
Синтез 4-ацетил-5-хлор-N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида
[0437]
К раствору в дихлорметане (1,0 мл) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида (31,5 мг), полученного в примере 275, последовательно добавляли триэтиламин (40 мкл) и уксусный ангидрид (20 мкл), и реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения.
[0438]
[Пример 285]
Синтез 2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-N-гидроксибензамида
[0439]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (125 мг), полученную в ссылочном примере D1, и в качестве исходного вещества трет-бутилбензилокси (5-хлор-2-(хлорсульфонил)бензоил)карбамат (280 мг), полученный в ссылочном примере E51, в соответствии со способом примера 1, стадия 1, была синтезирована (2S,3R)-2-(2-((бензилокси)(трет-бутоксикарбонил)карбамоил)-4-хлорфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановая кислота (250 мг).
[0440]
(Стадия 2)
(2S,3R)-2-(2-((Бензилокси)(трет-бутоксикарбонил)карбамоил)-4-хлорфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (250 мг), полученную на вышеуказанной стадии 1, растворяли в растворе соляная кислота-1,4-диоксан (4М, 4 мл) и реакционный раствор перемешивали при температуре 45°C в течение 2,5 часов. Реакционный раствор концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат/2% уксусная кислота) с получением (2S,3R)-2-(2-((бензилокси)карбамоил)-4-хлорфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (215 мг).
[0441]
(Стадия 3)
Исходя из (2S,3R)-2-(2-((бензилокси)карбамоил)-4-хлорфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (215 мг), полученной на вышеописанной стадии 2, в соответствии со способом примера 1, стадия 2, получали N-(бензилокси)-5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид (75 мг).
[0442]
(Стадия 4)
К раствору в метаноле (4,0 мл) N-(бензилокси)-5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида (75 мг), полученного на вышеописанной стадии 3, добавляли 10% палладий-углерод (55 мг) и реакционный раствор перемешивали в атмосфере водорода в течение 1,5 часов. Нерастворимое вещество удаляли фильтрованием через CELITE и остаток промывали метанолом (10 мл). Объединенный фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0443]
[Пример 286]
Синтез 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-N-гидроксибензамида
[0444]
К раствору в дихлорметане (3,0 мл) N-(бензилокси)-5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида (66 мг), полученного в примере 285, стадия 3, при температуре -60°C добавляли трибромид бора (1,0М, 170 мкл), и реакционный раствор перемешивали при температуре 0°C в течение 1 часа. В реакционный раствор добавляли метанол (1,0 мл) и смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат/2% уксусная кислота) с получением указанного в заголовке соединения.
[0445]
[Пример 287]
Синтез 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензотиоамида
[0446]
К раствору в толуоле (500 мкл) 5-хлор-2-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(2-оксо-3H-1,3,4-оксадиазол-5-ил)пропил)сульфамоил)бензамида (15 мг), полученного в примере 5, при комнатной температуре добавляли реагент Лавессона (20 мг) и реакционный раствор перемешивали при температуре 100°C в течение 12 часов. После чего давали остыть до комнатной температуры и концентрировали при пониженном давлении, полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0447]
[Пример 288]
Синтез 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-метил-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида
[0448]
К раствору в метаноле (1,0 мл) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида (48 мг), полученного в примере 275, последовательно добавляли уксусную кислоту (20 мкл) и 37%-ный водный раствор формальдегида (30 мкл), и реакционный раствор перемешивали при комнатной температуре в течение 30 минут. В реакционный раствор добавляли боргидрид натрия (12 мг) и смесь дополнительно перемешивали в течение 20 минут. В реакционный раствор добавляли воду (15 мл) и смесь экстрагировали смесью этилацетат/гексан=1/1 (15 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения.
[0449]
[Пример 289]
Синтез 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-метил-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида
[0450]
(Стадия 1)
Исходя из моногидрохлорида 5-((1S,2R)-1-амино-2-(3-хлор-6-фтор-2-метилфенил)пропил)-1,3,4-оксадиазол-2(3H)-она (10,3 мг), полученного в ссылочном примере F7, и трет-бутил 5-хлор-8-(хлорсульфонил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилата (25,3 мг), полученного в ссылочном примере E58, в соответствии со способом примера 129 получали трет-бутил 5-хлор-8-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилат (25,4 мг).
[0451]
(Стадия 2)
К трет-бутил 5-хлор-8-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-2H-бензо[b][1,4]оксазин-4(3H)-карбоксилату (25,4 мг), полученному на вышеописанной стадии 1, добавляли раствор хлористоводородная кислота-1,4-диоксан (4М, 5,0 мл) и реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида (15,2 мг).
[0452]
(Стадия 3)
Исходя из 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-8-сульфонамида (15,2 мг), полученного на вышеописанной стадии 2, в соответствии со способом примера 288 было синтезировано указанное в заголовке соединения.
[0453]
[Пример 290]
Синтез 4-хлор-N-((1S)-2-(6-фтор-2,3-диметилфенил)-2-гидрокси-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)этил)-2-метоксибензолсульфонамида
[0454]
(Стадия 1)
Используя (2S)-2-амино-3-(6-фтор-2,3-диметилфенил)-3-гидроксипропионовую кислоту (139 мг), полученную в ссылочном примере D56, и 4-хлор-2-метоксибензолсульфонилхлорид (175 мг), в соответствии со способом примера 1, стадия 1, была синтезирована (2S)-2-(4-хлор-2-метоксифенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)-3-гидроксипропионовая кислота (163 мг).
[0455]
(Стадия 2)
К раствору в ДМФ (10 мл) (2S)-2-(4-хлор-2-метоксифенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)-3-гидроксипропионовой кислоты (163 мг), полученной на вышеописанной стадии 1, последовательно добавляли имидазол (753 мг) и трет-бутилдиметилхлорсилан (563 мг) и реакционный раствор перемешивали при температуре 60°C в течение 12 часов. Реакционный раствор добавляли в воду (20 мл) и экстрагировали смесью этилацетат/гексан=1/1 (30 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток растворяли в метаноле (10 мл) и ТГФ (2,0 мл), добавляли карбонат калия (1,0 г) и воду (2,0 мл) и реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор добавляли к соляной кислоте (1М, 20 мл) и экстрагировали смесью этилацетат/гексан=1/1 (30 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением (2S)-3-((трет-бутилдиметилсилил)окси)-2-(4-хлор-2-метоксифенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)пропионовой кислоты (175 мг).
[0456]
(Стадия 3)
Исходя из (2S)-3-((трет-бутилдиметилсилил)окси)-2-(4-хлор-2-метоксифенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)пропионовой кислоты (175 мг), полученной на вышеописанной стадии 2, в соответствии со способом примера 1, стадия 2, получали N-((1S)-2-((трет-бутилдиметилсилил)окси)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)этил)-4-хлор-2-метоксибензолсульфонамид (126 мг).
[0457]
(Стадия 4)
К раствору в ТГФ (6,0 мл) N-((1S)-2-((трет-бутилдиметилсилил)окси)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)этил)-4-хлор-2-метоксибензолсульфонамида (126 мг), полученного на вышеуказанной стадии 3, последовательно добавляли уксусную кислоту (600 мкл) и тетра-н-бутиламмоний фторид (6,0 мл), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор добавляли в воду (20 мл) и экстрагировали смесью этилацетат/гексан=1/1 (30 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения в виде смеси диастереомеров.
[0458]
[Пример 291]
Синтез 4-хлор-N-((1R)-2-фтор-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)этил)-2-метоксибензолсульфонамида
[0459]
К раствору в дихлорметане (200 мкл) 4-хлор-N-((1S)-2-(6-фтор-2,3-диметилфенил)-2-гидрокси-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)этил)-2-метоксибензолсульфонамида (5,6 мг), полученного в примере 290, добавляли DAST (10 мкл) и смесь перемешивали при комнатной температуре в течение 2 часов. В реакционный раствор добавляли насыщенный водный раствор гидрокарбоната натрия (5,0 мл) и смесь экстрагировали смесью этилацетат/гексан=1/1 (10 мл). Органический слой промывали насыщенным солевым раствором (5,0 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения в виде смеси диастереомеров.
[0460]
[Пример 292]
Синтез 5-хлор-4-фтор-N-((1S,2R)-2-(2-фторнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)хроман-8-сульфонамида
[0461]
Исходя из 5-хлор-N-((1S,2R)-2-(2-фторнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамида (13 мг), полученного в примере 233, в соответствии со способом примера 291 получали указанное в заголовке соединение в виде смеси диастереомеров 1:1.
[0462]
[Пример 293]
Синтез 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-6-(2,2,2-трифторацетил)пиридин-2-сульфонамида
[0463]
Исходя из 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-6-(2,2,2-трифтор-1-гидроксиэтил)пиридин-2-сульфонамида (15,6 мг), полученного в примере 221, в соответствии со способом ссылочного примера E46, стадия 1, получали указанное в заголовке соединение.
[0464]
[Пример 294]
Синтез 3-ацетил-4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метоксибензолсульфонамида
[0465]
Исходя из 4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3-(1-гидроксиэтил)-2-метоксибензолсульфонамида, полученного в примере 204, в соответствии со способом ссылочного примера E46, стадия 1, получали указанное в заголовке соединение.
[0466]
[Пример 295]
Синтез 5-хлор-N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2H-хромен-8-сульфонамида
[0467]
(Стадия 1)
Исходя из (2S,3R)-2-амино-3-(2,3-диметилфенил)бутановой кислоты (58 мг), полученной в ссылочном примере D6, и 5-хлор-4-оксохроман-8-сульфонилхлорида (88 мг), полученного в ссылочном примере E7, в соответствии со способом примера, стадии 1 и 2, получали 5-хлор-N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-оксохроман-8-сульфонамид (63,4 мг).
[0468]
(Стадия 2)
Исходя из 5-хлор-N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-оксохроман-8-сульфонамида (63,4 мг), полученного на стадия 1 выше, в соответствии со способом примера 230, стадия 2, получали 5-хлор-N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид (48 мг) в виде смеси диастереомеров.
[0469]
(Стадия 3)
К раствору в толуоле (2,0 мл 5-хлор-N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамида (10 мг), полученного на вышеописанной стадии 2, добавляли моногидрат п-толуолсульфоновой кислоты (2,0 мг) и реакционный раствор перемешивали при температуре 110°C в течение 30 минут. Реакционный раствор добавляли в воду (5 мл) и экстрагировали этилацетатом (10 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0470]
[Пример 296]
Синтез 4-хлор-N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-(гидроксиметил)бензолсульфонамида
[0471]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(2,3-дигидро-1H-инден-4-ил)бутановую кислоту (50 мг), полученную в ссылочном примере D10, и метил 5-хлор-2-(хлорсульфонил)бензоат (71 мг), в соответствии со способом стадий 1 и 2 примера 1 получали метил 5-хлор-2-(N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоат (43 мг).
[0472]
(Стадия 2)
К раствору в ТГФ (2,0 мл) метил 5-хлор-2-(N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоата (15 мг), полученного на вышеуказанной стадии 1, добавляли раствор в ТГФ боргидрида лития (2М, 100 мкл) и реакционный раствор перемешивали при температуре 60°C в течение 1 часа. Реакционный раствор добавляли в воду (10 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0473]
[Пример 297]
Синтез 4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метокси-3-(1-(метоксиметокси)этил)бензолсульфонамида
[0474]
К раствору в толуоле (1,5 мл) 4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3-(1-гидроксиэтил)-2-метоксибензолсульфонамида (10 мг), полученного в примере 204, последовательно добавляли N,N-диизопропилэтиламин (25 мкл) и хлорметилметиловый эфир (10 мкл) и реакционный раствор перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0475]
[Пример 298]
Синтез 4-хлор-N-((1S,2R)-2-(4-фтор-4'-метокси-2-метил-[1,1'-бифенил]-3-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метоксибензолсульфонамида
[0476]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(3-бром-6-фтор-2-метилфенил)бутановую кислоту (200 мг), полученную в ссылочном примере D5, и 4-хлор-2-метоксибензолсульфонилхлорид (280 мг), в соответствии со способом стадий 1 и 2 примера 1, был синтезирован N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-хлор-2-метоксибензолсульфонамид (262 мг).
[0477]
(Стадия 2)
К раствору в 1,4-диоксане (1,0 мл) N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-хлор-2-метоксибензолсульфонамида (11 мг), при комнатной температуре последовательно добавляли 4-метоксифенилбороновую кислоту (5,0 мг), аддукт дихлорида [1,1ʼ-бис (дифенилфосфино)ферроцен]палладия (II) с дихлорметаном (4,0 мг и водный раствор карбоната натрия (2М, 100 мкл) и реакционный раствор перемешивали при температуре 100°C в течение 1 часа. Реакционному раствору давали остыть до комнатной температуры, нерастворимое вещество удаляли фильтрованием через CELITE и остаток промывали гексаном/этилацетат=1/1 (10 мл). Объединенный фильтрат концентрировали при пониженном давлении и полученный остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения.
[0478]
[Примеры 299-324]
Используя N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-хлор-2-метоксибензолсульфонамид, полученного в примере 298, стадия 1, в соответствии со способом примера 298, стадия 2, были синтезированы соединения примеров 299-324, показанные далее. Используемые бороновые кислоты или эфиры бороновых кислот перечислены в следующей таблице.
[0479]
[Таблица 19]
[0480]
[Пример 325]
Синтез 4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3-(1-метил-1H-пиразол-4-ил)бензолсульфонамида
[0481]
(Стадия 1)
Исходя из (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (200 мг), полученной в ссылочном примере D1, и 3-бром-4-хлорбензолсульфонилхлорида (306 мг) в соответствии со способом стадий 1 и 2 примера 1 был синтезирован 3-бром-4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид (274 мг).
[0482]
(Стадия 2)
К раствору в 1,4-диоксане (0,7 мл) 3-бром-4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамида (5,6 мг), полученного на вышеописанной стадии 1, при комнатной температуре последовательно добавляли (1-метил-1H-пиразол-4-ил)бороновую кислоту (6,2 мг), аддукт дихлорида [1,1'-бис(дифенилфосфино)ферроцен]палладия (II) с дихлорметаном (5,0 мг), водный раствор карбоната натрия (2М, 100 мкл) и реакционный раствор перемешивали в течение 4 часов при температуре 100°C. Реакционному раствору давали остыть до комнатной температуры, нерастворимое вещество удаляли фильтрованием через CELITE и остаток промывали смесью гексан/этилацетат=1/1 (10 мл). Объединенный фильтрат концентрировали при пониженном давлении, и полученный остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения.
[0483]
[Пример 326]
Синтез 6-хлор-2'-фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-[1,1'-бифенил]-3-сульфонамида
[0484]
Используя 3-бром-4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид, полученный в примере 325, стадия 1, и (2-фторфенил)бороновую кислоту, в соответствии со способом примера 325, стадия 2, было синтезировано указанное в заголовке соединения.
[0485]
[Пример 327]
Синтез 4-хлор-N-((1S,2R)-2-(6-фтор-2-метил-3-(фенилэтинил)фенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метоксибензолсульфонамида
[0486]
К раствору в ДМФ (1,0 мл) N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-хлор-2-метоксибензолсульфонамида (10,9 мг), полученного в примере 298, стадия 1, при комнатной температуре последовательно добавляли дихлорбис(трифенилфосфин)палладий (II) (1,5 мг), йодид меди (I) (1,5 мг), триэтиламин (30 мкл) и этинилбензол (20 мкл), реакционный раствор нагревали до температуры 100°C и смесь перемешивали в течение 4 часов. Реакционному раствору давали остыть до комнатной температуры, и нерастворимое вещество удаляли фильтрованием через CELITE и остаток промывали смесью гексан/этилацетат=1/1 (10 мл). Объединенный фильтрат концентрировали при пониженном давлении и полученный остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения.
[0487]
[Пример 328]
Синтез 4-амино-5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-метилхроман-8-сульфонамида
[0488]
К раствору в бензоле (1,5мл) 5-хлор-N-((1S,2R)-2-(3- хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамида (17 мг), полученного в примере 209A, последовательно добавляли триметилсилилазид (50 мкл), комплекс трифторид бора-диметиловый эфир (100 мкл) и реакционный раствор перемешивали в течение 1 часа при комнатной температуре. В реакционный раствор добавляли насыщенный водный раствор бикарбоната натрия (10 мл) и смесь экстрагировали смесью этилацетат/гексан=1/1 (10 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток растворяли в ТГФ (1,5 мл) и воде (50 мкл). К остатку добавляли трифенилфосфин (15 мг) и реакционный раствор перемешивали в течение 2 часов при комнатной температуре. Нерастворимое вещество удаляли фильтрованием через CELITE и остаток промывали этилацетатом/гексан=1/1 (10 мл). Объединенный фильтрат концентрировали при пониженном давлении и полученный остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения в виде смеси диастереомеров 1:1.
[0489]
[Пример 329]
Синтез 4-амино-N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-метил-хроман-8-сульфонамида
[0490]
Указанное в заголовке соединения получали в соответствии со способом примера 328, используя N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-гидрокси-4-метилхроман-8-сульфонамид, полученный в примере 222A.
[0491]
[Пример 330]
Синтез 4-амино-5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-метилхроман-8-сульфонамида, изомер A и изомер B
[0492]
К раствору в 1,4-диоксане (1,0 мл) диастереомерной смеси 4-амино-5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-метилхроман-8-сульфонамида (6,4 мг), полученного в примере 328, при комнатной температуре добавляли триэтиламин (100 мкл) и ди-трет-бутил дикарбонат (54 мг) и реакционный раствор перемешивали в течение 4 часов. Реакционный раствор концентрировали при пониженном давлении, полученный остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил) и фракции концентрировали с получением каждого из двух диастереомерных продуктов. Вещество, элюированное первым, обозначали как соединение A, и вещество, элюированное позже, обозначали как соединение B. Полученные соединения A и B, каждое, растворяли в растворе хлористоводородная кислота-диоксан (4М, 2,0 мл) и реакционный раствор перемешивали при температуре 70°C в течение 4 часов. Реакционному раствору давали остыть до комнатной температуры и концентрировали при пониженном давлении. Вещество, полученное из соединения A, обозначили как соединение 330A, и вещество, полученное из соединения B как соединение 330B.
[0493]
[Пример 331]
Синтез 2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-4-(1,3,4-оксадиазол-2-ил)бензамид
[0494]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (80 мг), полученную в ссылочном примере D1, и этил 3-(хлорсульфонил)-4-цианобензоат (146 мг), полученный в ссылочном примере E13, в соответствии со способом стадий 1 и 2 примера 1, получали этил 4-циано-3-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоат (40 мг).
[0495]
(Стадия 2)
К раствору в ДМСО (1 мл) этил 4-циано-3-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензоата (40 мг), полученного на вышеописанной стадии 1, добавляли 30%-ую водную перекись водорода (0,5 мл) и карбонат калия (20 мг) и реакционный раствор перемешивали при температуре 70°C в течение 1 часа. В реакционный раствор добавляли 1M соляную кислоту и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, концентрировали при пониженном давлении и полученный остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением 4-карбамоил-3-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензойной кислоты (8,9 мг).
[0496]
(Стадия 3)
К раствору в дихлорметане (1,5 мл) 4-карбамоил-3-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензойной кислоты (16 мг), полученной на вышеописанной стадии 2, добавляли (изоцианоимино)трифенилфосфоран (36 мг) и реакционный раствор перемешивали при комнатной температуре в течение 72 часов. Реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил) с получением указанного в заголовке соединения (1,1 мг).
[0497]
[Пример 332]
Синтез 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-тиоксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-бензамида
[0498]
(Стадия 1)
(2S,3R)-2-Амино-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (300 мг), полученную в ссылочном примере D1, растворяли в воде (5,0 мл) и 1,4-диоксане (5,0 мл), добавляли триэтиламин (570 мкл) и охлаждали до температуры 0°C. В реакционный раствор добавляли 4-бром-2-цианобензол-1-сульфонилхлорид (362 мг) и смесь перемешивали при той же температуре в течение 45 минут. Реакционный раствор добавляли к соляной кислоте (1М, 15 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат/2% уксусная кислота) с получением (2S,3R)-2-(4-бром-2-цианофенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (465 мг).
[0499]
(Стадия 2)
К раствору в ТГФ (1,5 мл) (2S,3R)-2-(4-бром-2-цианофенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (22 мг), полученной на вышеописанной стадии 1, добавляли CDI (13 мг), реакционный раствор перемешивали при комнатной температуре в течение 30 минут, затем добавляли гидразин моногидрат (12 мкл) и смесь перемешивали в течение 20 минут. Реакционный раствор концентрировали при пониженном давлении и полученный остаток растворяли в этаноле (1,2 мл), последовательно добавляли дисульфид углерода (10 мкл) и гидроксид калия (10 мг) и реакционный раствор перемешивали при температуре 90°C в течение 12 часов. Реакционный раствор добавляли к соляной кислоте (1М, 10 мл) и экстрагировали этилацетатом (10 мл). Органический слой промывали насыщенным солевым раствором(10 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0500]
[Примеры 333-335]
В соответствии со способом примера 332, стадии 1 и 2, были синтезированы соединения примеров 333-335, показанные далее. Исходные вещества перечислены в следующей таблице.
[0501]
[Таблица 20]
[0502]
[Пример 336]
Синтез 4-хлор-N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-тиоксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-3-(2-гидроксипропан-2-ил)бензолсульфонамида
[0503]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(2,3-дигидро-1H-инден-4-ил)бутановой кислоты (20 мг) и 3-ацетил-4-хлорбензол-1-сульфонилхлорид (20 мг), полученный в ссылочном примере D10, в соответствии со способом примера 332, стадии 1 и 2, получали 3-ацетил-4-хлор-N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-тиоксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид (12 мг).
[0504]
(Стадия 2)
Исходя из 3-ацетил-4-хлор-N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-тиоксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамида (12 мг), полученного на вышеописанной стадии 1, получали указанное в заголовке соединение в соответствии со способом примера 186, стадия 2.
[0505]
[Пример 337]
Синтез 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-N-метилсульфамоил)бензамида
[0506]
(Стадия 1)
Используя (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (530 мг), полученную в ссылочном примере D1, и 4-хлор-2-цианобензол-1-сульфонилхлорид (660 мг), в соответствии со способом примера 1, стадия 1, получали (2S,3R)-2-(4-хлор-2-цианофенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (777 мг).
[0507]
(Стадия 2)
К раствору в ТГФ (500 мкл) (2S,3R)-2-(4-хлор-2-цианофенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (11 мг), полученной на вышеописанной стадии 1, добавляли CDI (15 мг) и реакционный раствор перемешивали в течение 1 часа при комнатной температуре. В реакционный раствор добавляли метанол (1,0 мл) и смесь дополнительно перемешивали в течение 16 часов. Реакционный раствор добавляли в воду (10 мл) и экстрагировали диэтиловым эфиром (15 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением метил (2S,3R)-2-(4-хлор-2-цианофенил)-3-(6-фтор-2,3-диметилфенил)бутаноата (12 мг).
[0508]
(Стадия 3)
К метил (2S,3R)-2-(4-хлор-2-цианофенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутаноату (100 мг), полученному на вышеописанной стадии 2, последовательно добавляли метанол (2 мл), дихлорметан (2 мл) и раствор в гексане триметилсилилдиазометана (0,6М, 800 мкл) и реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Путем концентрирования реакционного раствора при пониженном давлении получали метил (2S,3R)-2-(4-хлор-2-циано-N-метилфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутаноат (101 мг).
[0509]
(Стадия 4)
Метил (2S,3R)-2-(4-хлор-2-циано-N-метилфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутаноат (101 мг), полученный на стадии 3 выше, в соответствии со способом примера 245, стадия 2, получали (2S,3R)-2-(4-хлор-2-циано-N-метилфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (8,5 мг).
[0510]
(Стадия 5)
К (2S,3R)-2-(4-хлор-2-циано-N-метилфенилсульфонамид)-3-(6-фтор-2,3-диметилфенил)бутановой кислоте (8,5 мг), полученной на вышеописанной стадии 4, в соответствии со способом примера 1, стадия 2, получали 4-хлор-2-циано-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-N-метилбензолсульфонамид (6,0 мг).
[0511]
(Стадия 6)
Исходя из 4-хлор-2-циано-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-N-метилбензолсульфонамида (6,0 мг), полученного на вышеописанной стадии 5, в соответствии со способом примера 1, стадия 3, получали указанное в заголовке соединение.
[0512]
[Пример 344]
Синтез 6-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4'-метокси-[1,1'-бифенил]-3-сульфонамид
Используя 3-бром-4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид и (4-метоксифенил)бороновую кислоту, полученную в примере 325, стадия 1, было синтезировано указанное в заголовке соединения в соответствии со способом примера 325, стадия 2.
[0513]
[Пример 345]
Синтез 3-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-2'-метокси-[1,1'-бифенил]-4-карбоксамида
(Стадия 1)
Исходя из (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановой кислоты, полученной в ссылочном примере D1, и 5-бром-2-цианобензолсульфонилхлорида, в соответствии со способом стадий 1 и 2 примера 1, был синтезирован 5-бром-2-циано-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид.
(Стадия 2)
Используя 5-бром-2-циано-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид, полученный на вышеописанной стадии 1, и 2-метоксифенилбороновую кислоту, в соответствии со способом примера 325, стадия 2, и примера, стадия 3, получали указанное в заголовке соединение.
[0514]
[Пример 346]
Синтез 4-(N-((1S,2R)-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-3-метоксибензамида
Исходя из 4-циано-N-((1S,2R)-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метоксибензолсульфонамида, полученного в примере 342, получали указанное в заголовке соединение в соответствии со способом примера 1, стадия 3.
[0515]
[Пример 347]
Синтез 4-(N-((1S,2R)-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида
Исходя из 4-циано-N-((1S,2R)-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамида, полученного в примере 341, в соответствии со способом примера 1, стадия 3, получали указанное в заголовке соединение.
[0516]
[Пример 348]
Синтез 4-бром-N-((1S,2R)-2-(нафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)пропил)бензолсульфонамида
(Стадия 1)
Используя (2S,3R)-2-амино-3-(нафталин-1-ил)бутановую кислоту, полученную в ссылочном примере D11, и 4-бромбензолсульфонилхлорид, в соответствии со способом стадии 1 примера 1 получали (2S,3R)-2-((4-бромфенил)сульфонамидо)-3-(нафталин-1-ил)бутановую кислоту.
(Стадия 2)
К раствору в ДМФ (2,5 мл) (2S,3R)-2-((4-бромфенил)сульфонамидо)-3-(нафталин-1-ил)бутановой кислоты (283 мг), полученной на вышеописанной стадии 1, добавляли хлорид аммония (41 мг), HOBt (103 мг), триэтиламин (0,264 мл) и WSC (146 мг) и реакционный раствор перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор добавляли в воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением (2S,3R)-2-((4-бромфенил)сульфонамидо)-3-(нафталин-1-ил)бутанамид в виде сырого продукта.
(Стадия 3)
К раствору в ДМФ (2 мл) (2S,3R)-2-((4-бромфенил)сульфонамидо)-3-(нафталин-1-ил)бутанамида, полученного на вышеописанной стадии 2, при температуре 0°C добавляли хлорангидрид циануровой кислоты (59 мг) и реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор добавляли в воду и экстрагировали смешанным растворителем этилацетат/толуол. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 4-бром-N-((1S,2R)-1-циано-2-(нафталин-1-ил)пропил)бензол сульфонамида (137 мг).
(Стадия 4)
К раствору в этаноле (2 мл) 4-бром-N-((1S,2R)-1-циано-2-(нафталин-1-ил)пропил)бензолсульфонамида (137 мг), полученного на вышеописанной стадии 3, добавляли воду (0,66 мл) и 50% водный раствор гидроксиламина (0,060 мл) и реакционный раствор перемешивали при комнатной температуре в течение ночи. Реакционный раствор концентрировали при пониженном давлении, добавляли в воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением (2S,3R)-2-((4-бромфенил)сульфонамидо)-N-гидрокси-(3-нафталин-1-ил)бутанамида (130 мг) в виде сырого продукта.
(Стадия 5)
К раствору в ДМФ (1,0 мл) (2S,3R)-2-((4-бромфенил)сульфонамидо)-N-гидрокси-3-(нафталин-1-ил)бутанамида (20 мг), полученного на вышеописанной стадии 4, добавляли пиридин (0,004 мл) и 2-этилгексил хлорформиат (0,009 мл) и реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Затем добавляли ксилол и реакционный раствор перемешивали в течение ночи при температуре 100°C. В реакционный раствор добавляли воду и смесь экстрагировали смешанным растворителем этилацетат/гексан. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения (37 мг).
[0517]
[Пример 349]
Синтез 4-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)пропил)-2-метоксибензолсульфонамида
(Стадия 1)
Используя (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановую кислоту, полученную в ссылочном примере D1, и 4-хлор-2-метоксибензолсульфонилхлорид, в соответствии со способом примера 1, стадия 1, получали (2S,3R)-2-((4-хлор-2-метоксифенил)сульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановую кислоту.
(Стадия 2)
Исходя из (2S,3R)-2-((4-хлор-2-метоксифенил)сульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты, полученной на вышеописанной стадии 1, в соответствии со способом примера 348, стадия 2-стадия 5, получали указанное в заголовке соединение.
[0518]
[Пример 350]
(2S,3R)-2-((4-хлор-2-метоксифенил)сульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановую кислоту (142 мг), полученную в примере 348, стадия 1, растворяли в ДМФ (3,3 мл) и последовательно добавляли WSC (130 мг), HOBt (100 мг), N,N-диизопропилэтиламин (200 мкл) и тиосемикарбазид (70 мг) и реакционный раствор перемешивали при температуре 80°C в течение 4 часов. Реакционный раствор добавляли к насыщенному водному раствору хлорида аммония (15 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (15 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат). Полученный остаток растворяли в этаноле (1,5 мл), добавляли 20% водный раствор гидроксида натрия (2,0 мл) и реакционный раствор перемешивали при температуре 80°C в течение 12 часов. Реакционный раствор добавляли к соляной кислоте (1М, 5,0 мл) и экстрагировали этилацетатом (10 мл). Органический слой промывали насыщенным солевым раствором (5,0 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[0519]
Далее показаны структурные формулы и физические характеристики соединений примеров 1-350.
[0520]
[Таблица 21]
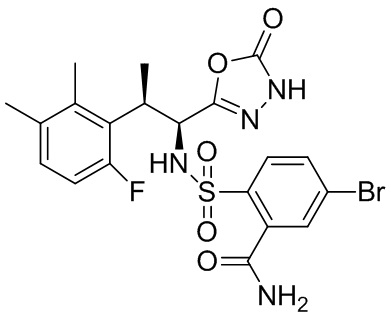
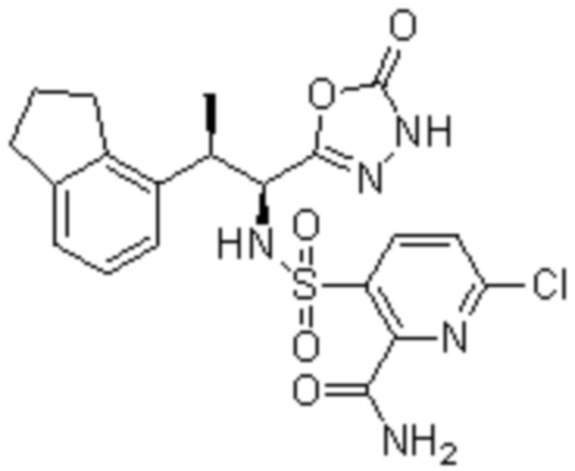
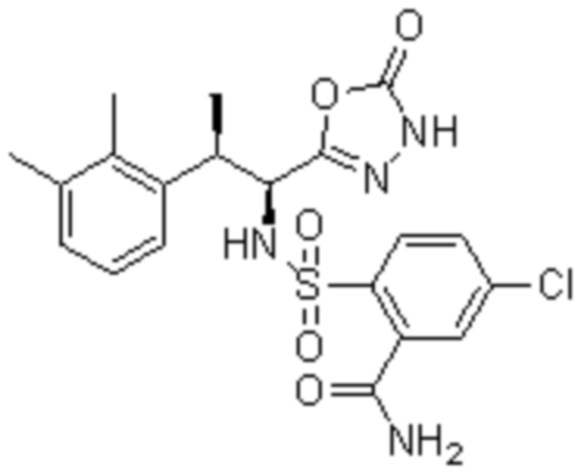
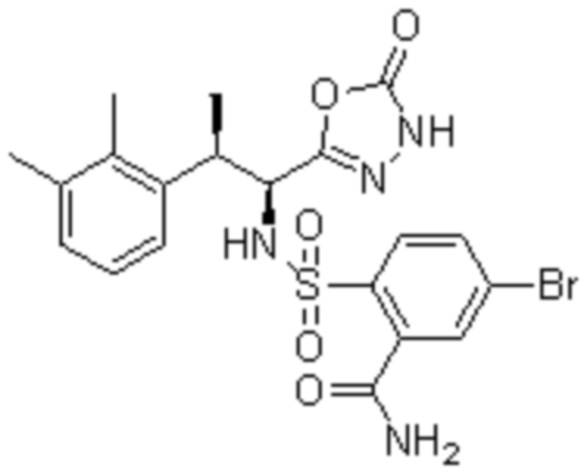
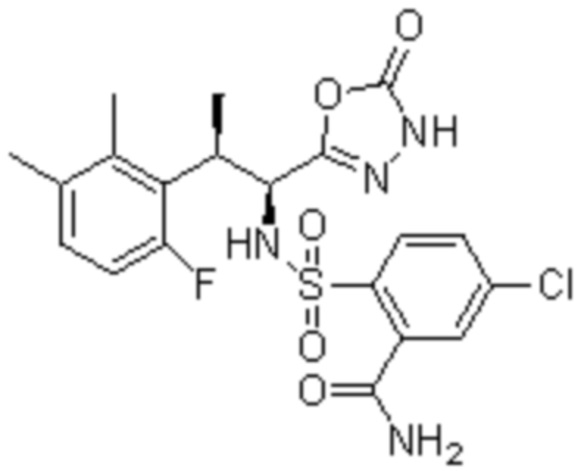
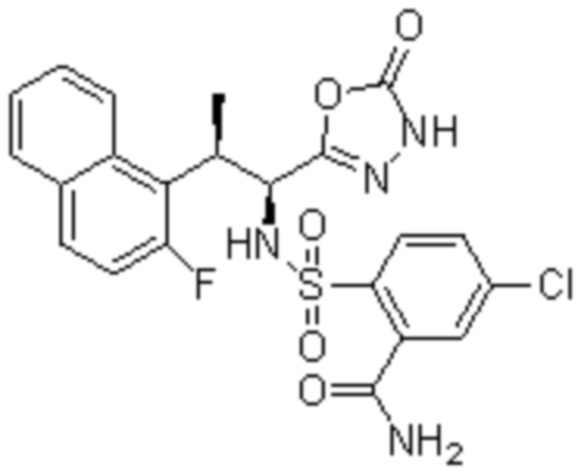
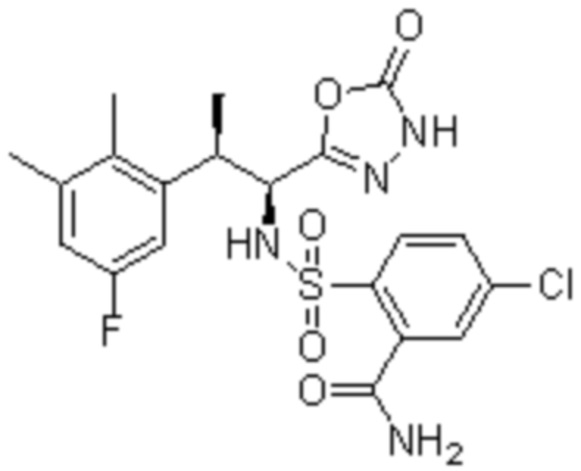
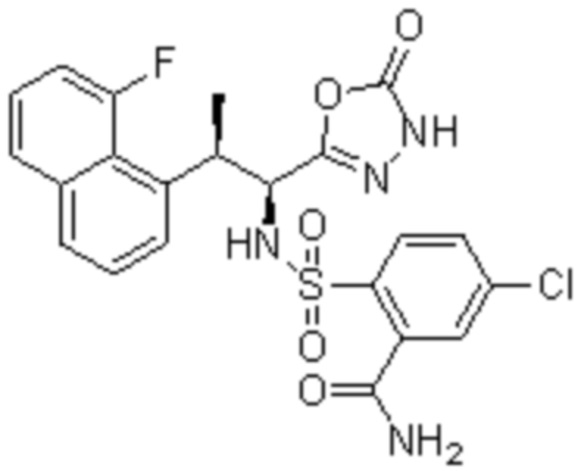
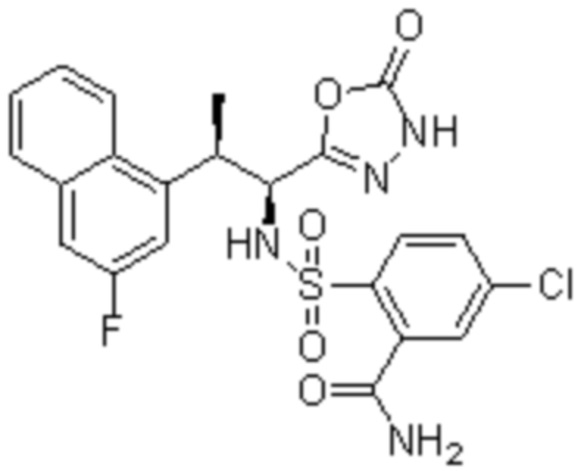
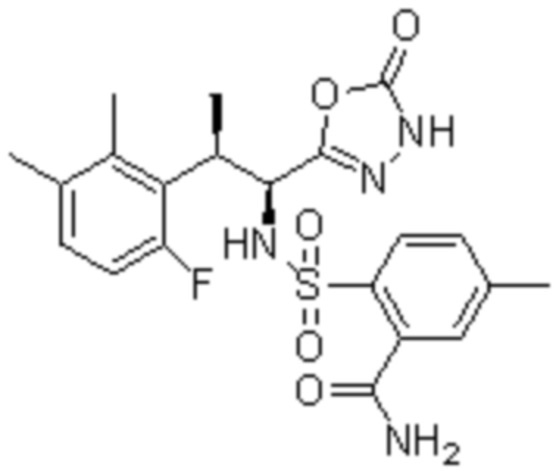
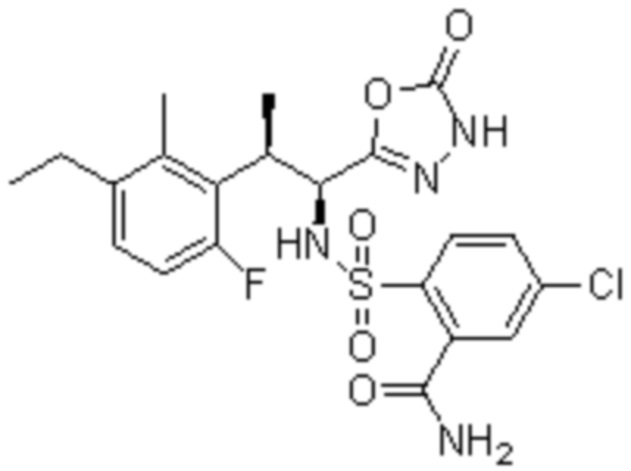
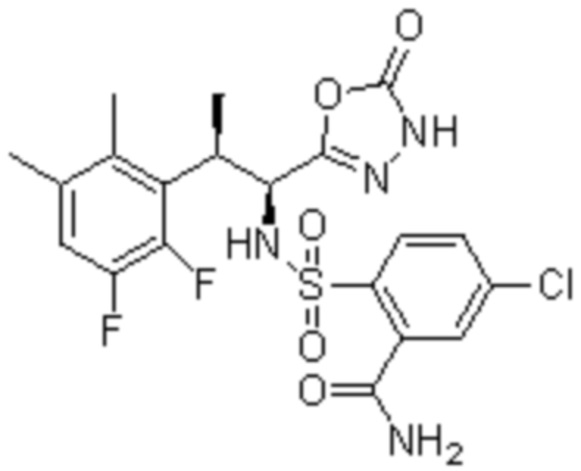
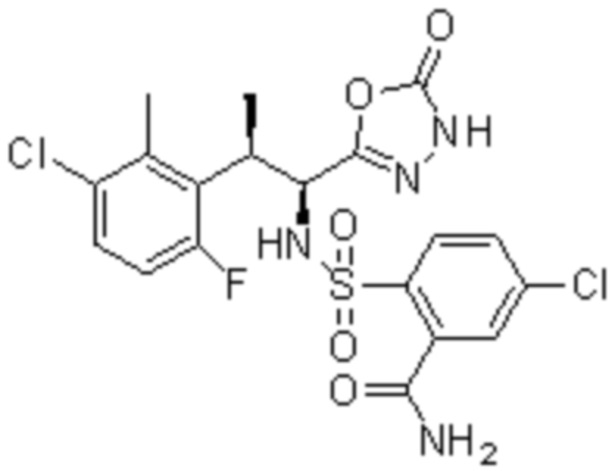
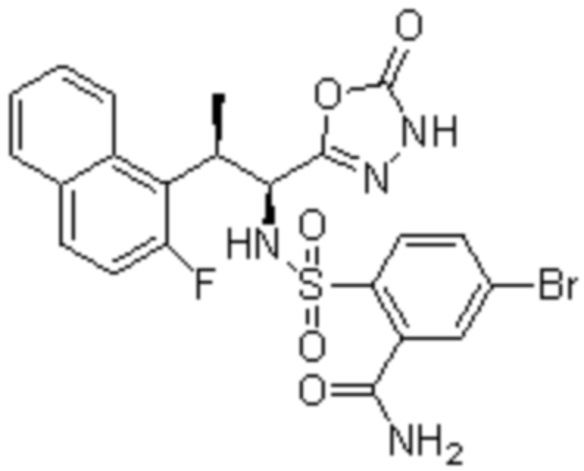
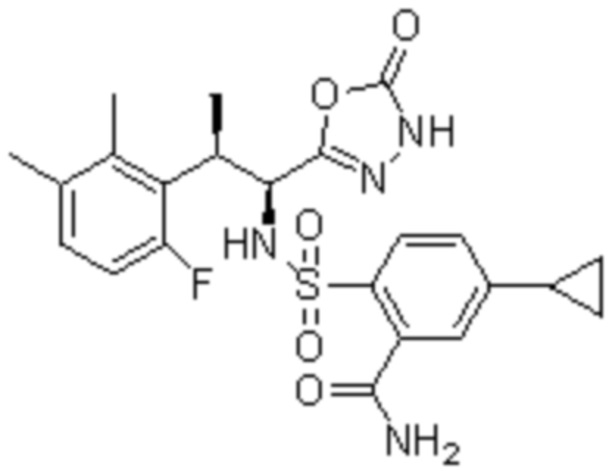
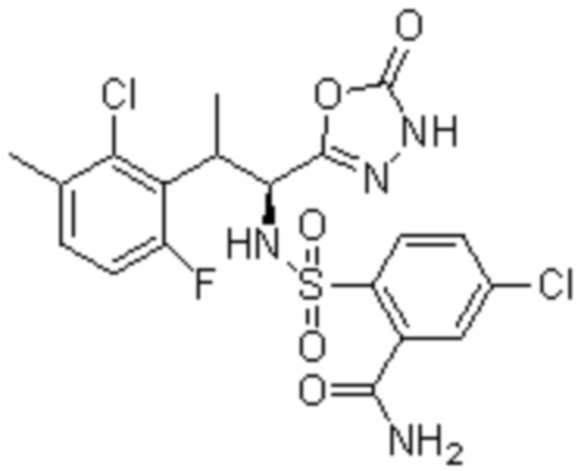
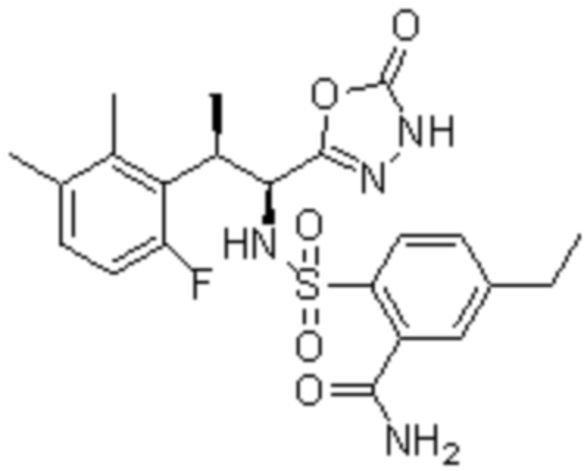
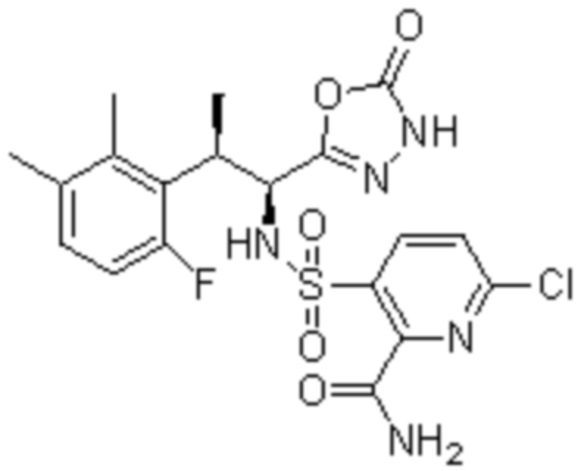
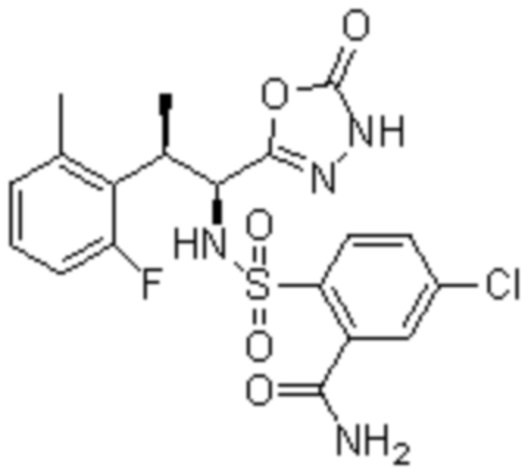
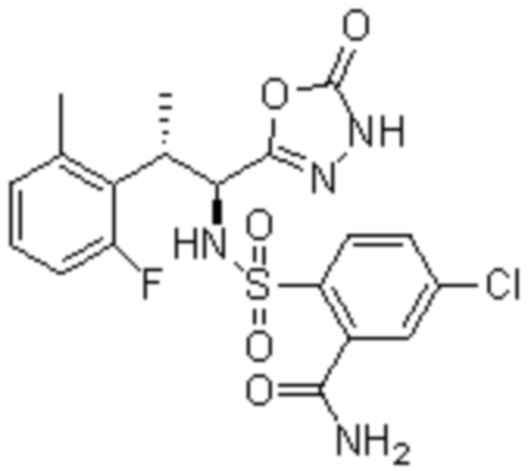
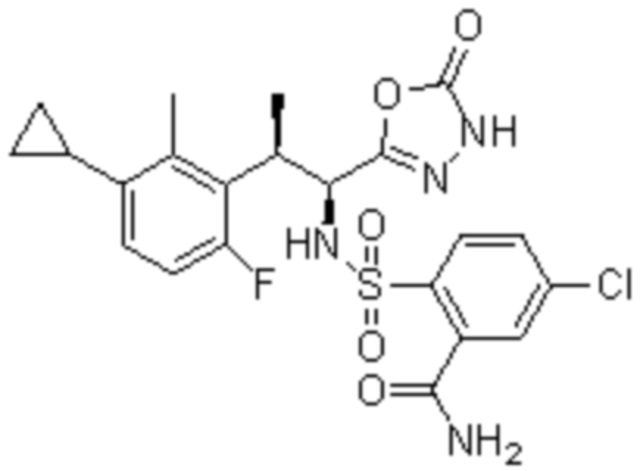
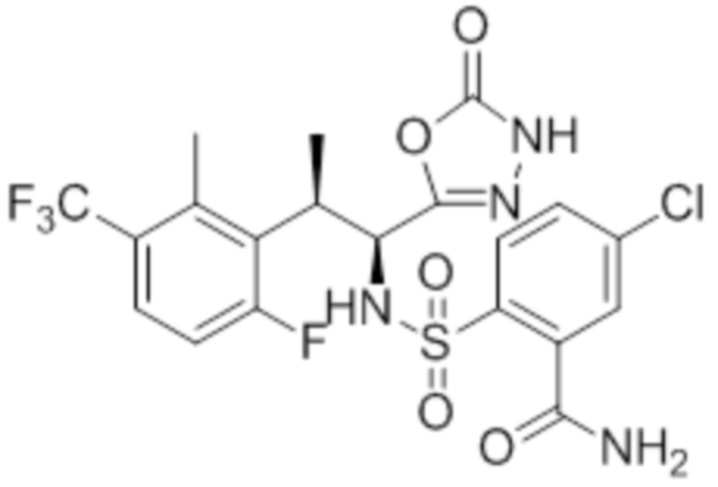
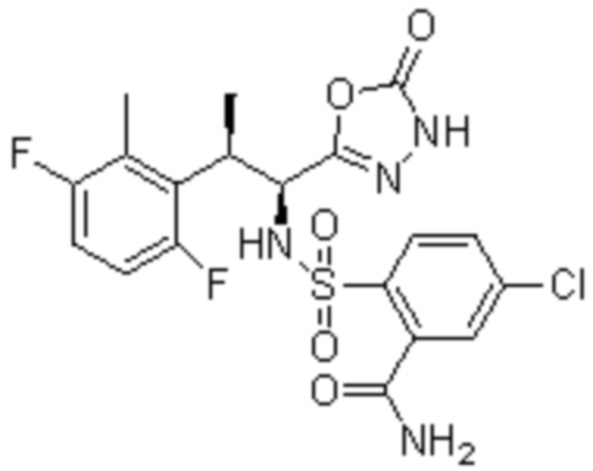
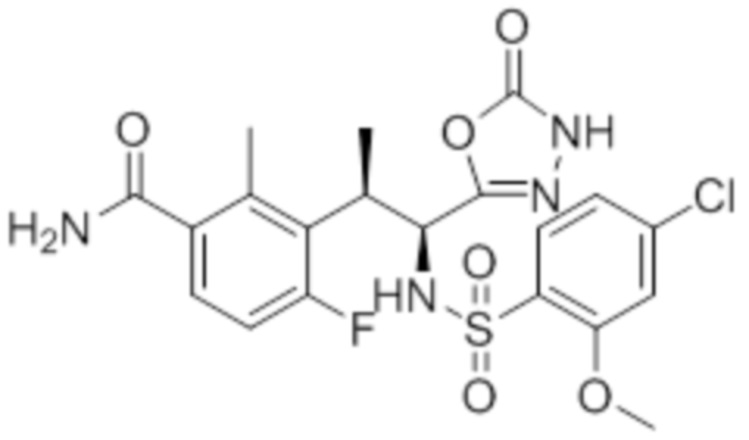
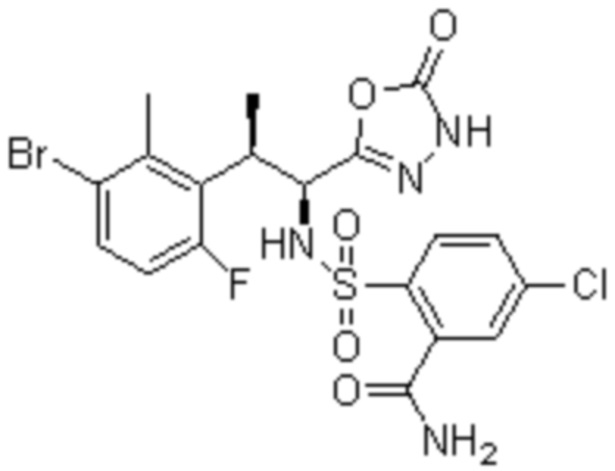
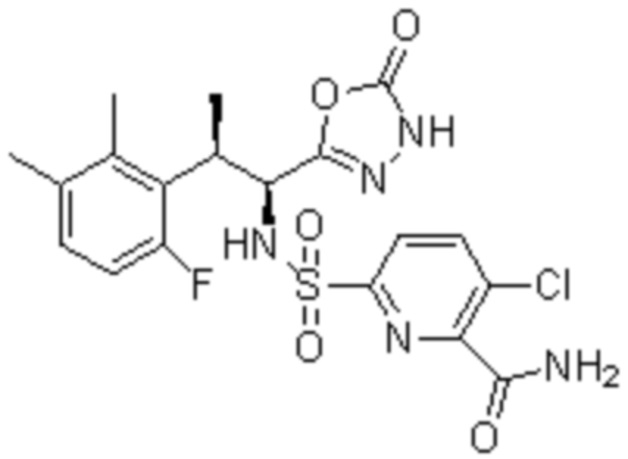
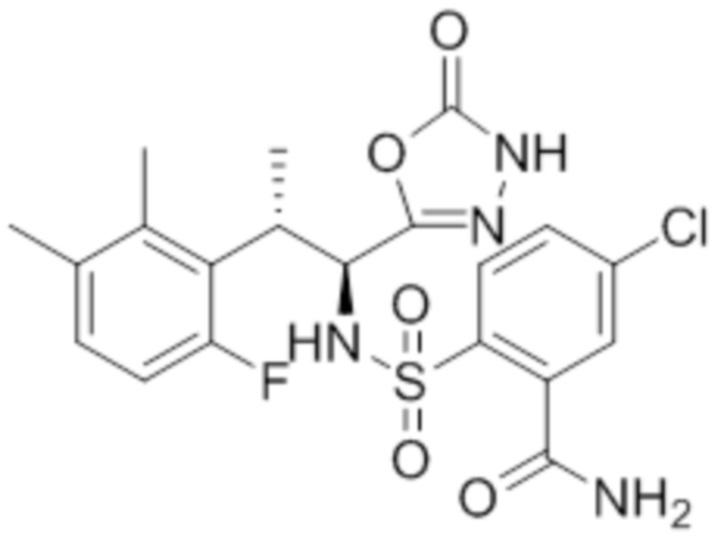
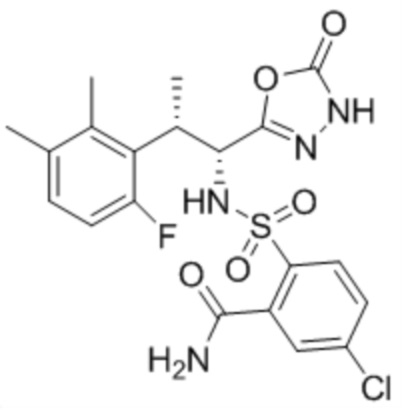
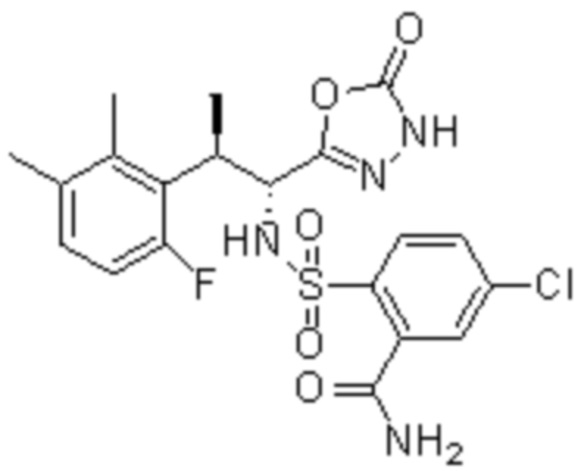

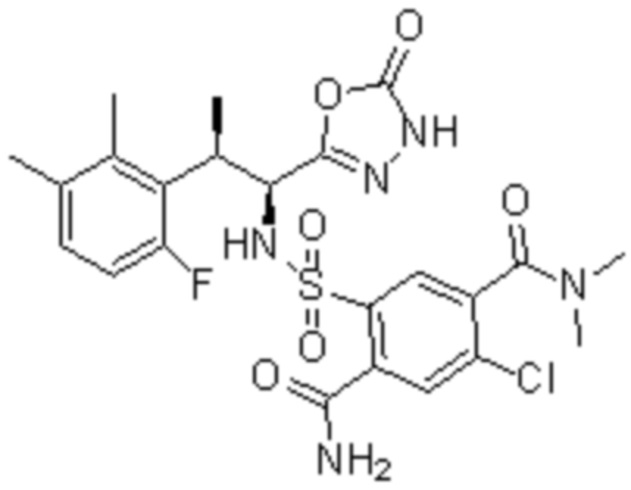
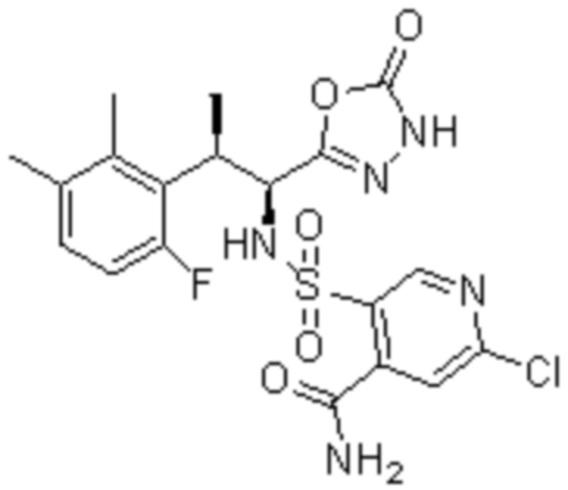
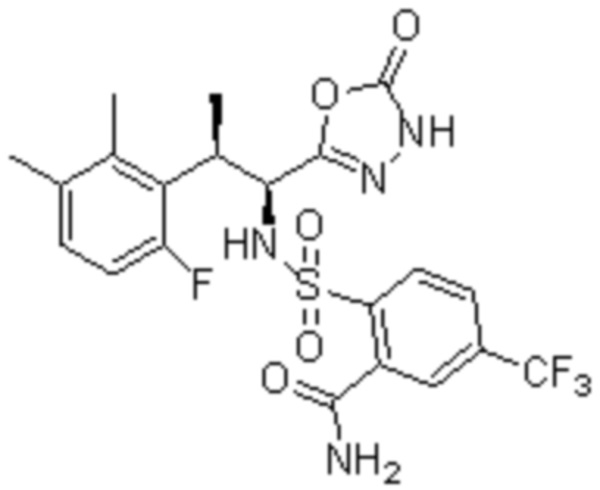
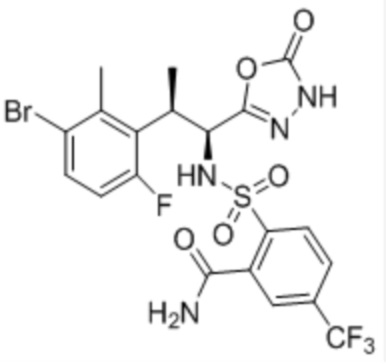
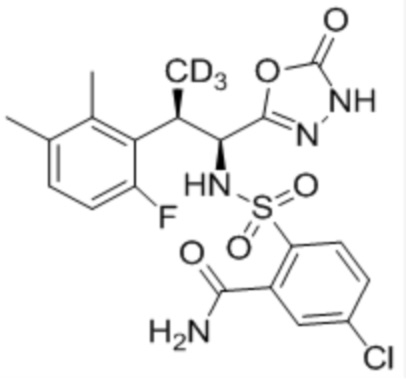

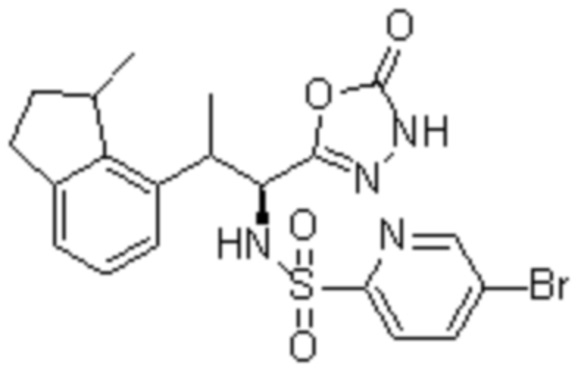
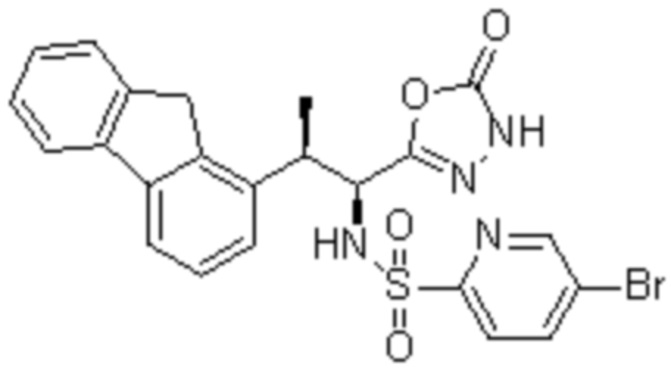
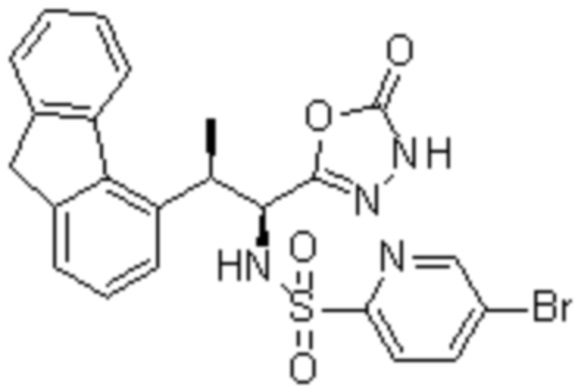
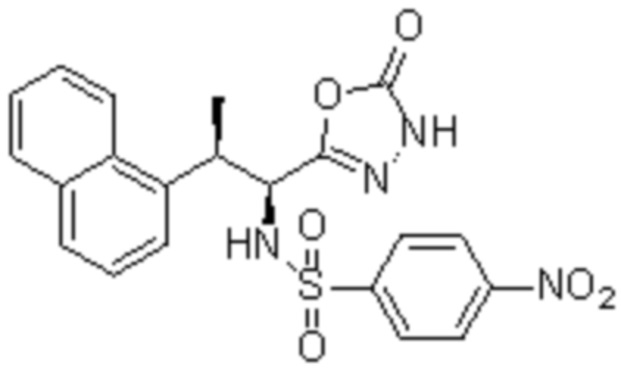
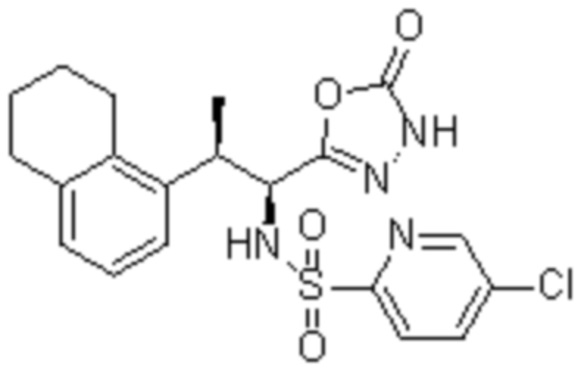
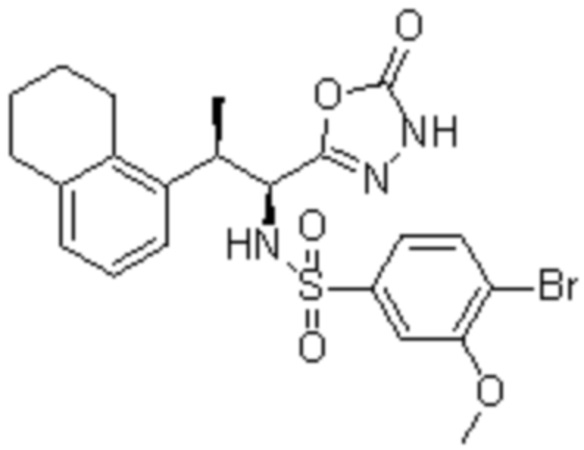
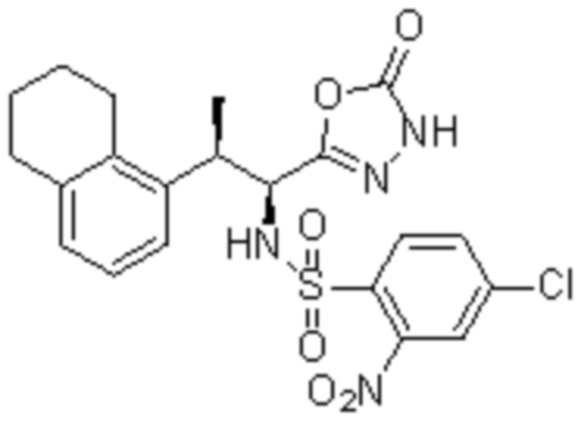
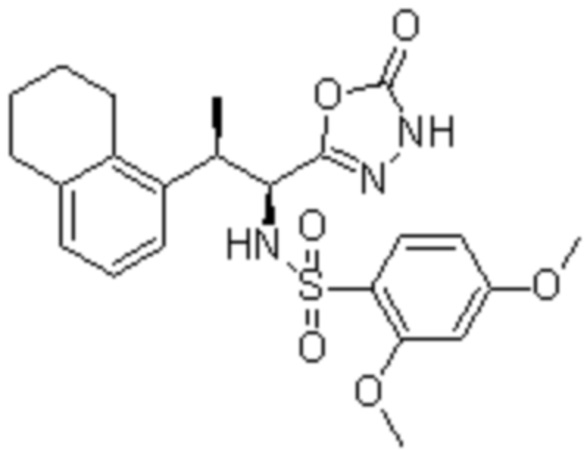
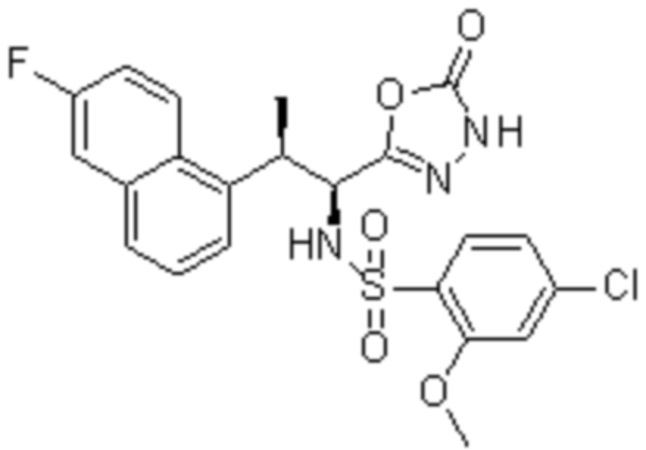
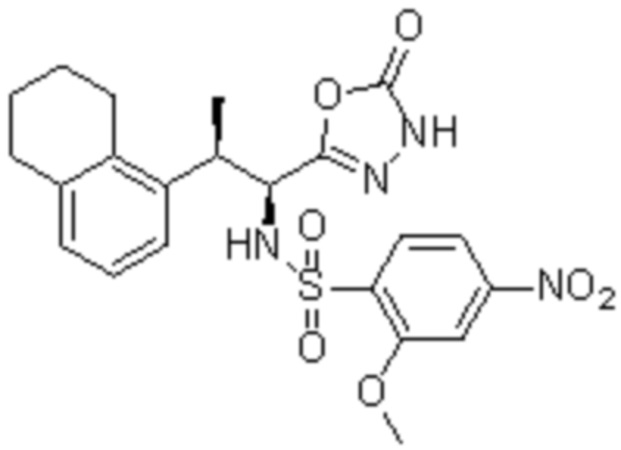
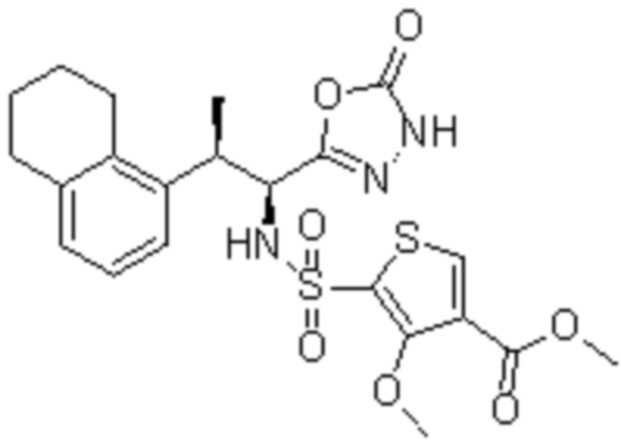
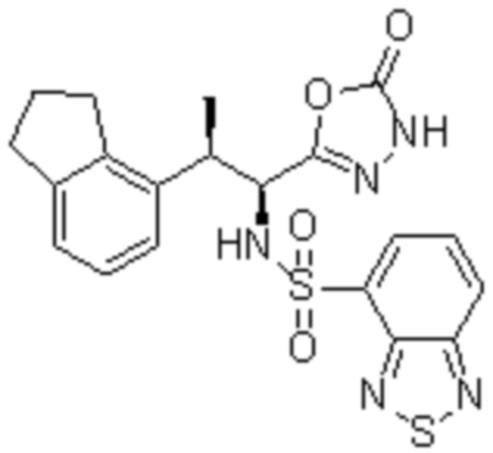
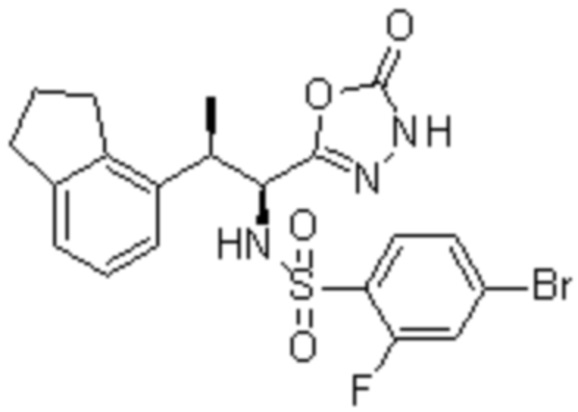
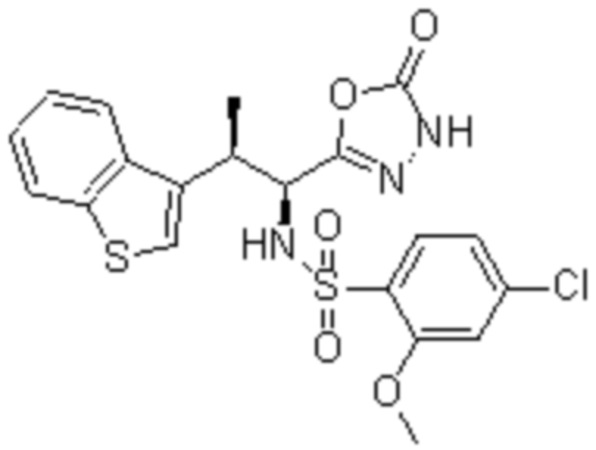

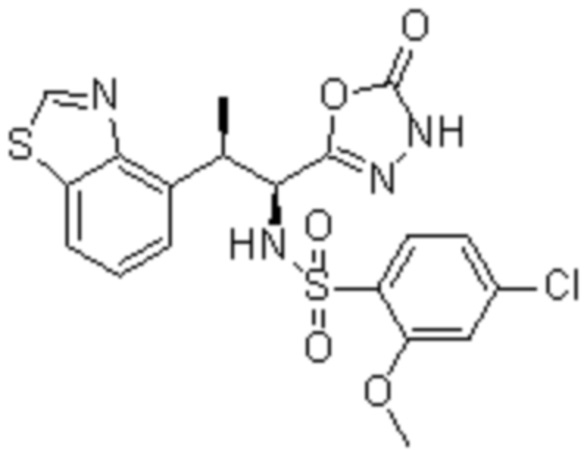
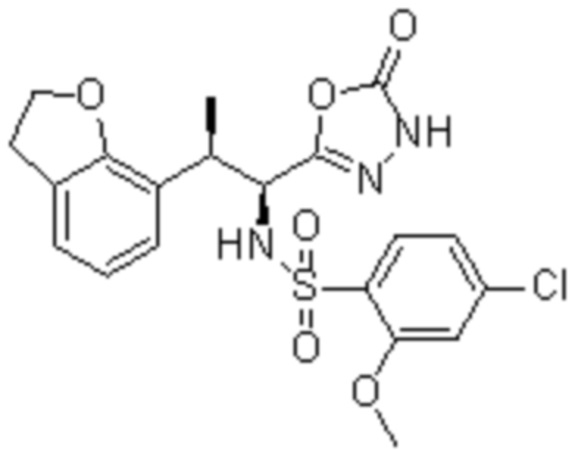
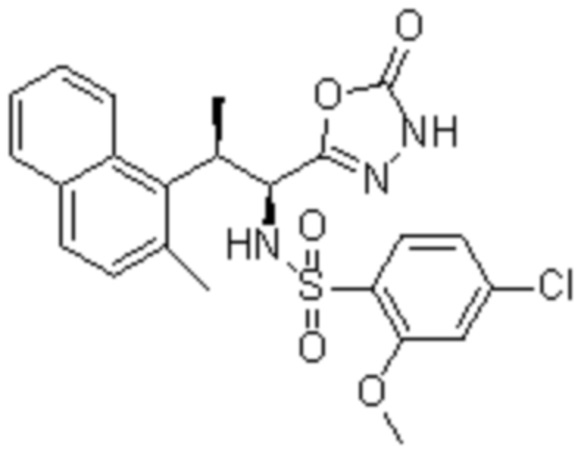
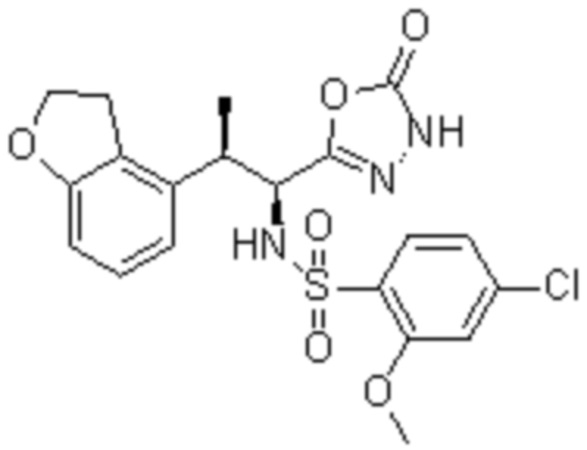
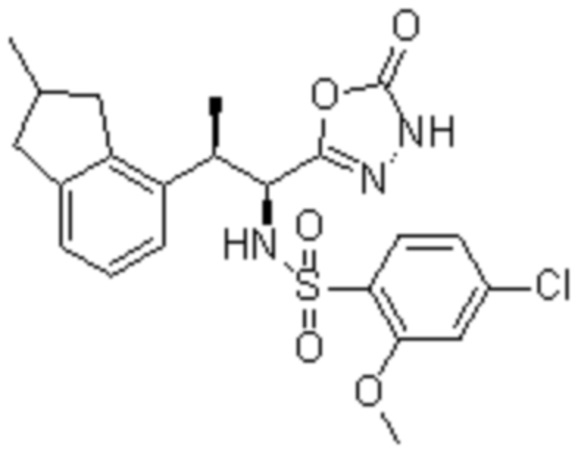
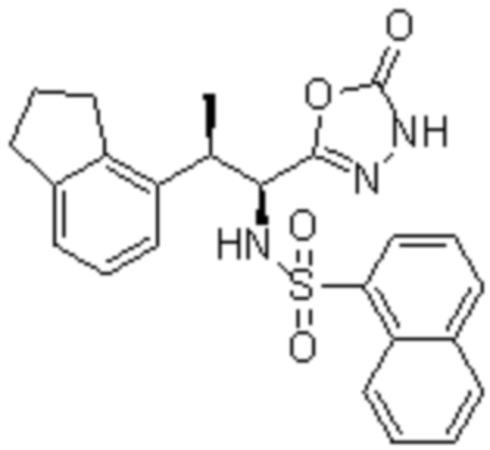
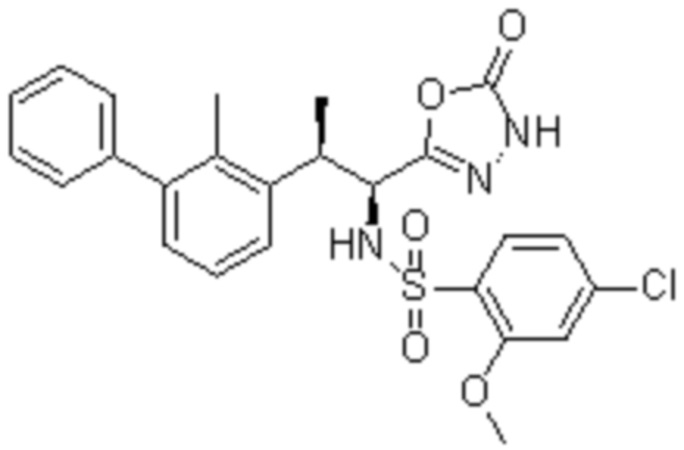

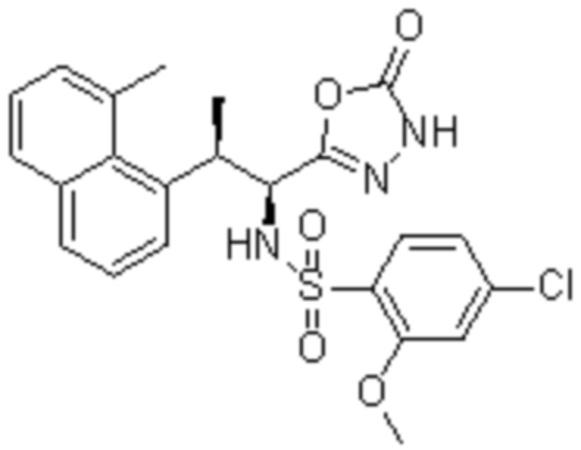
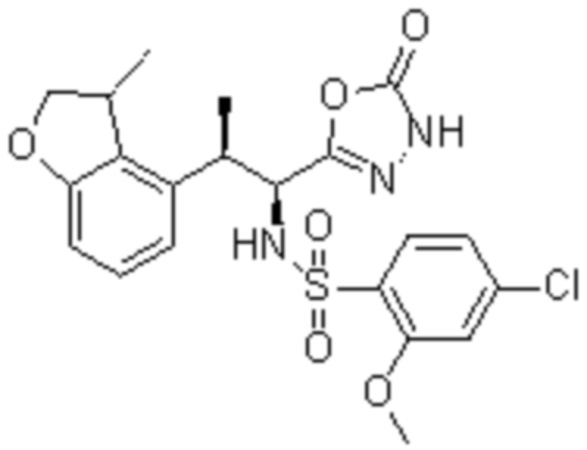
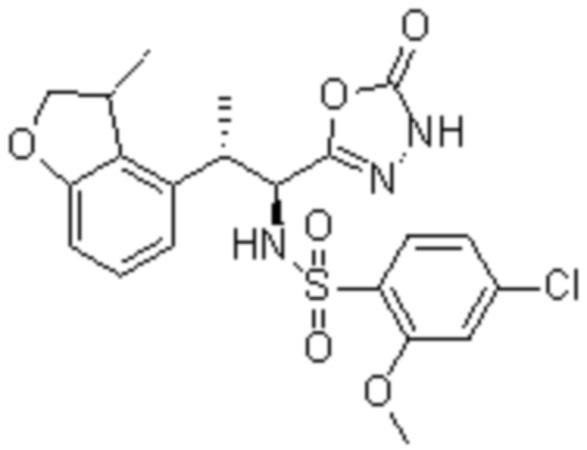
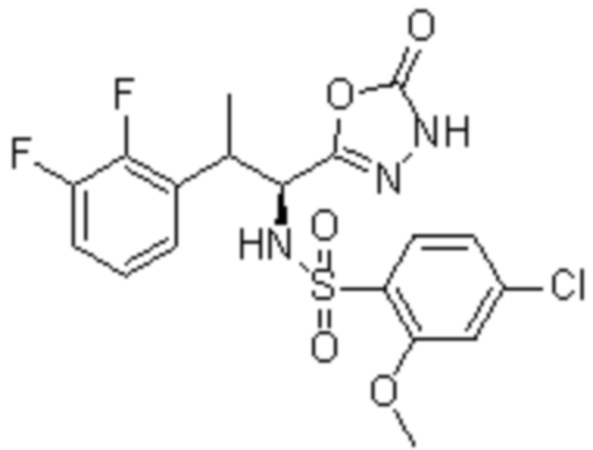
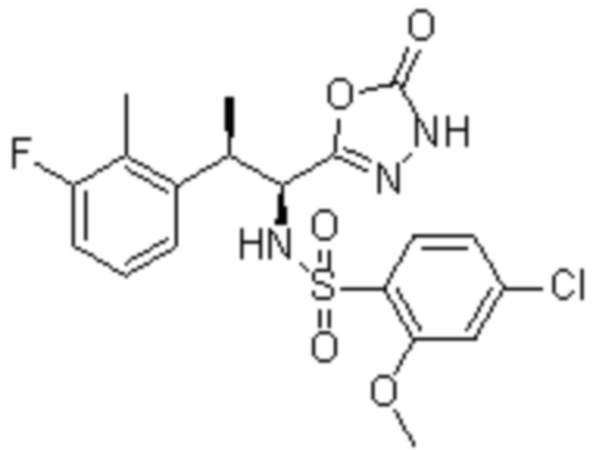
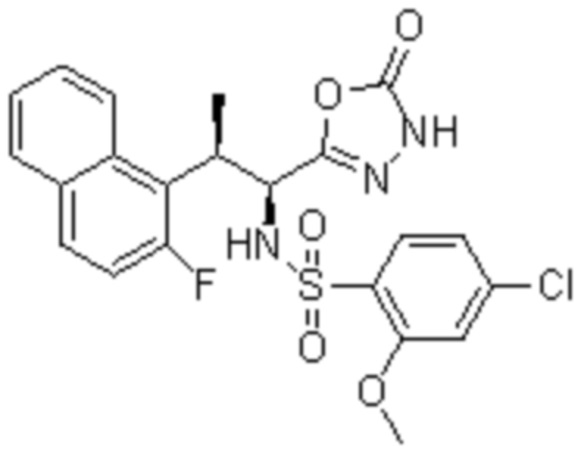
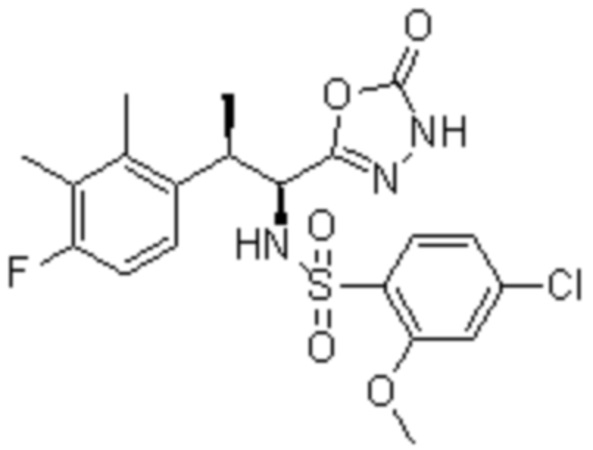
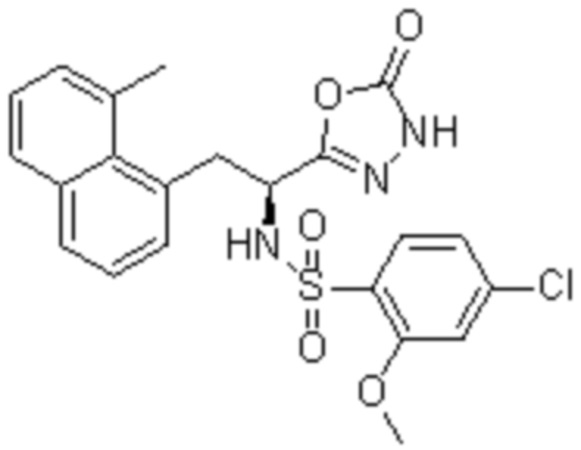
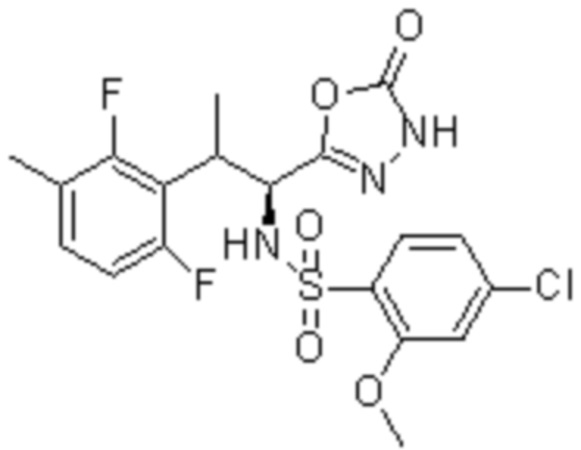
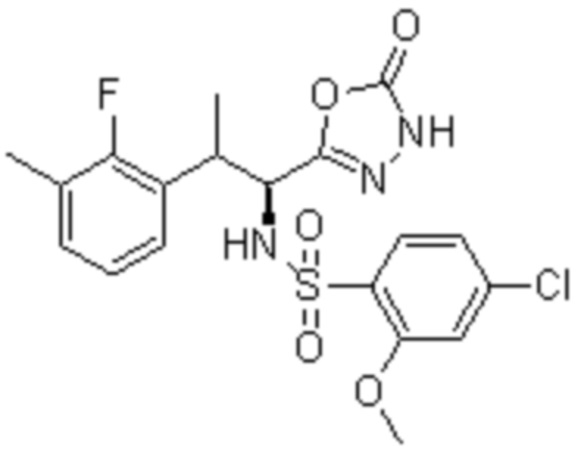
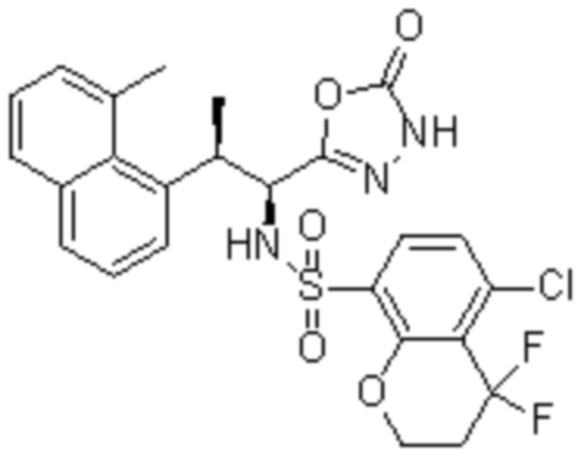
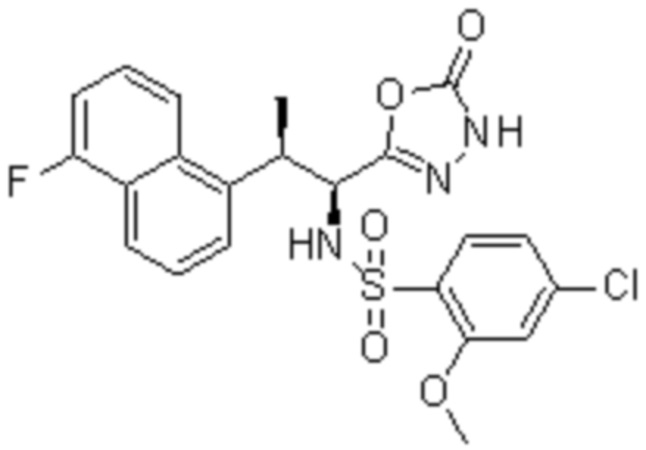
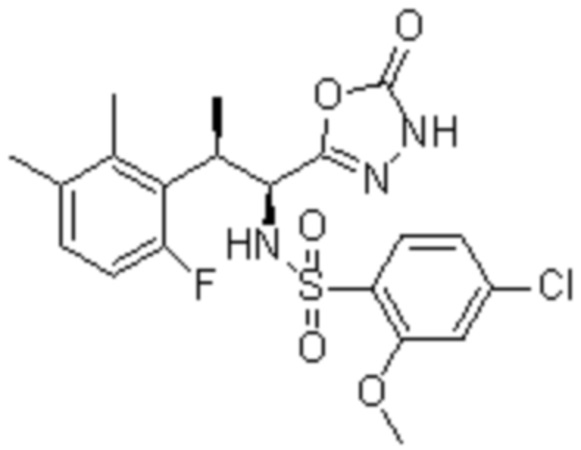
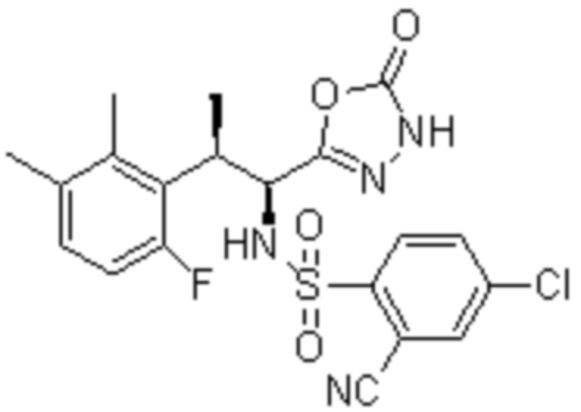
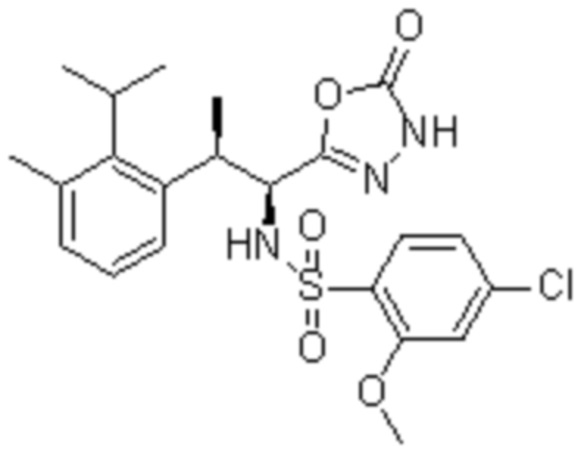
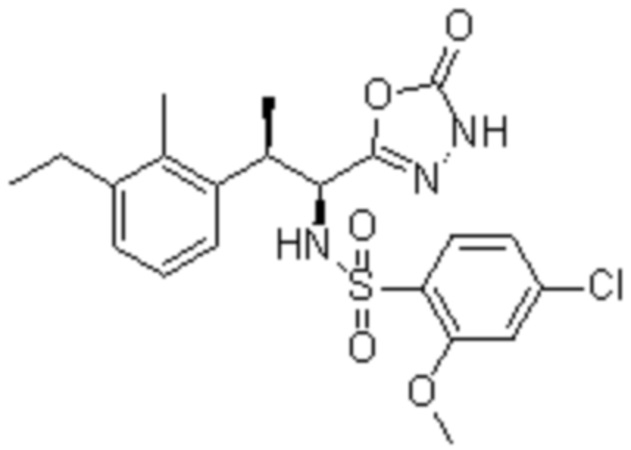
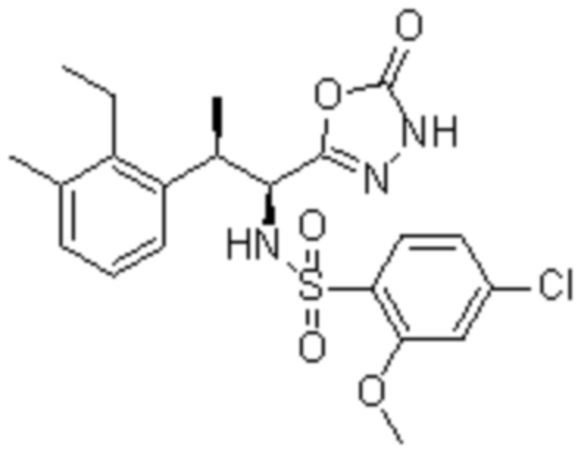

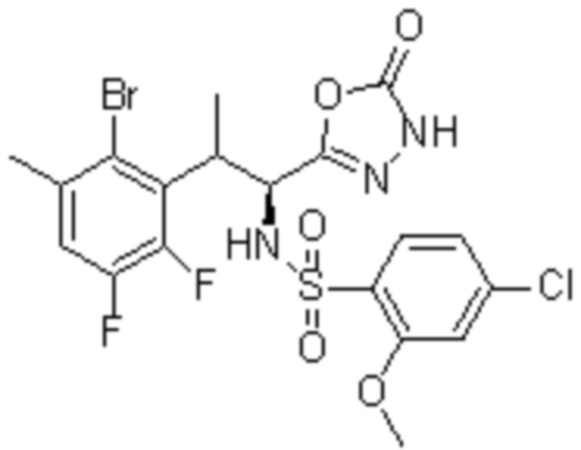
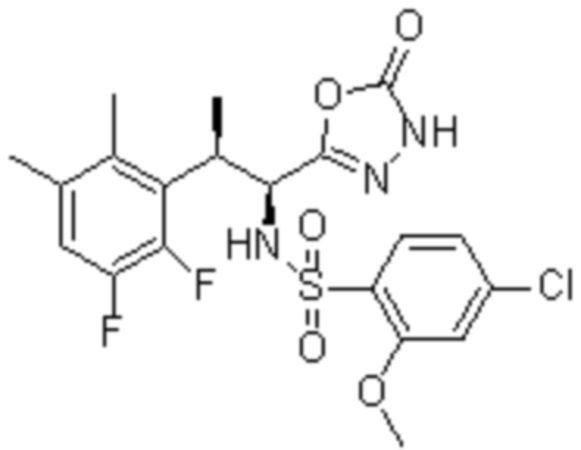
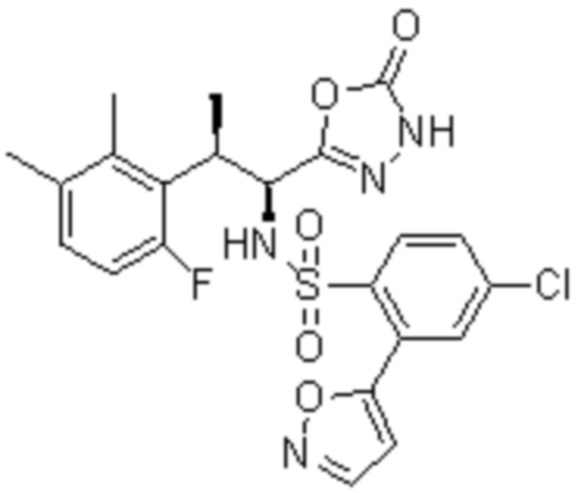
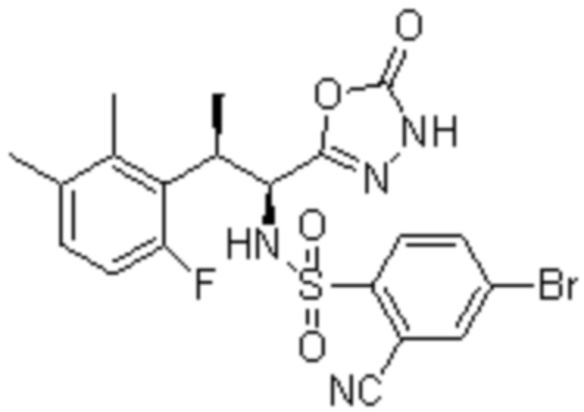
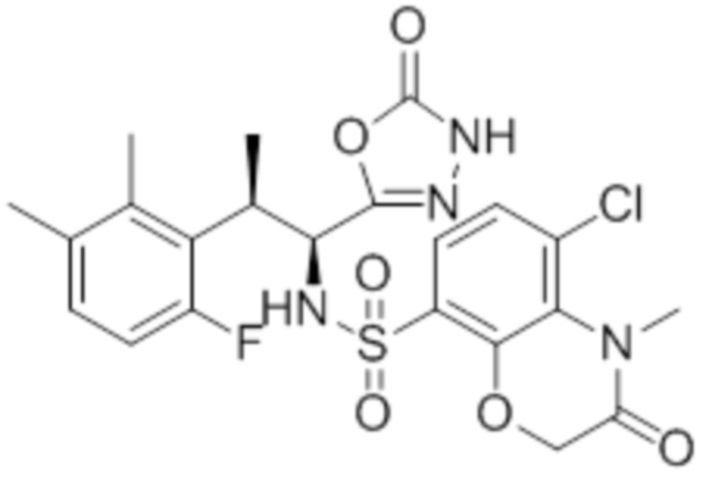
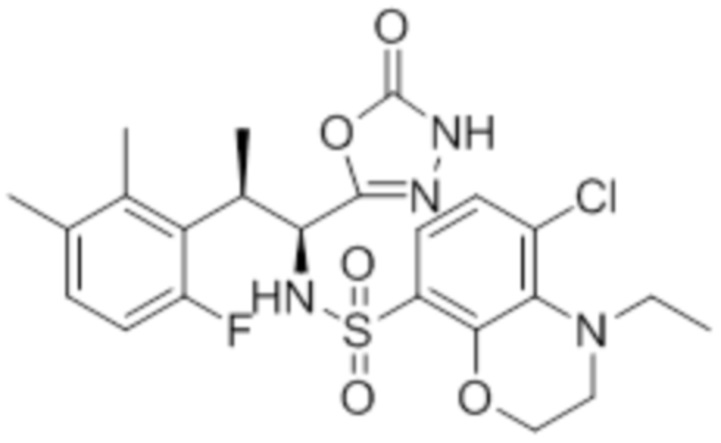
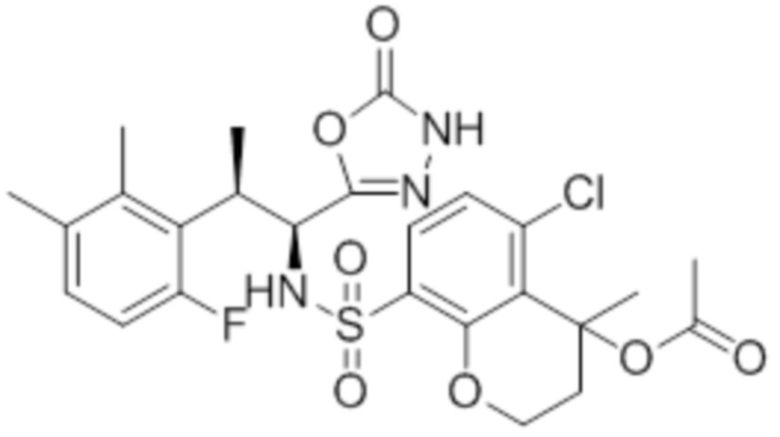
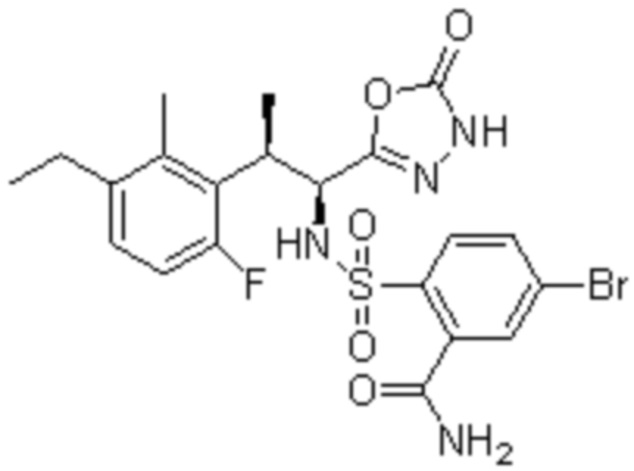
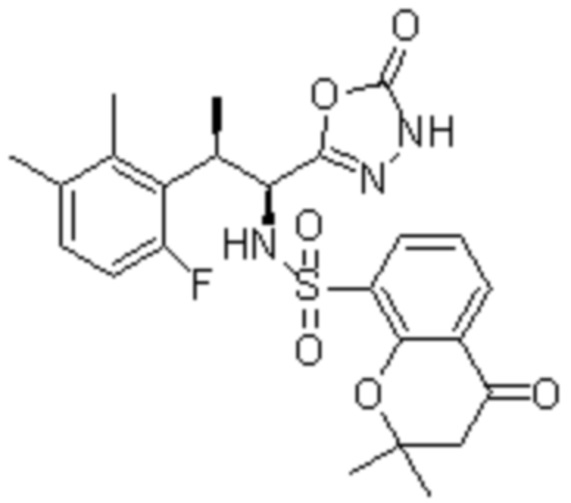
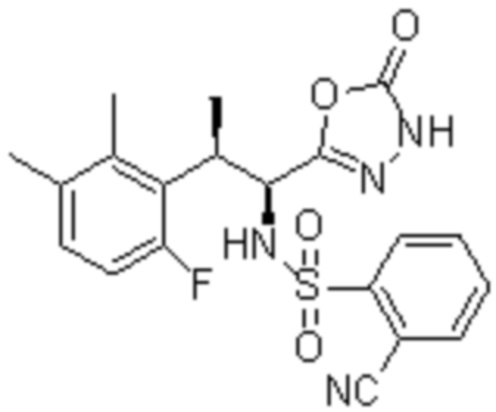
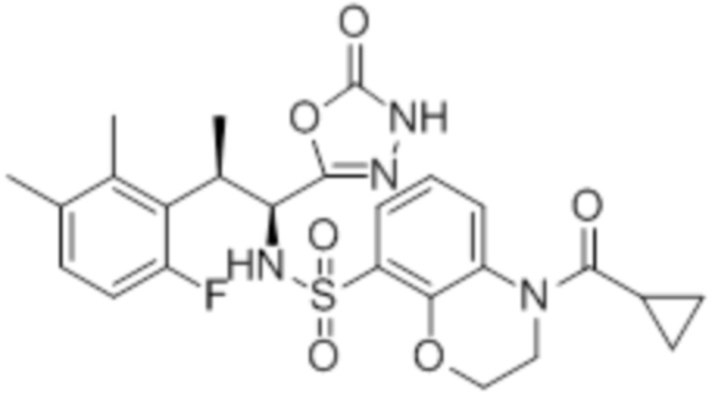
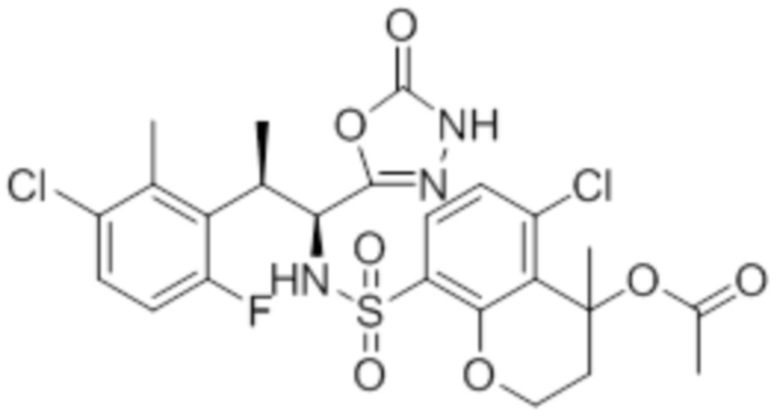
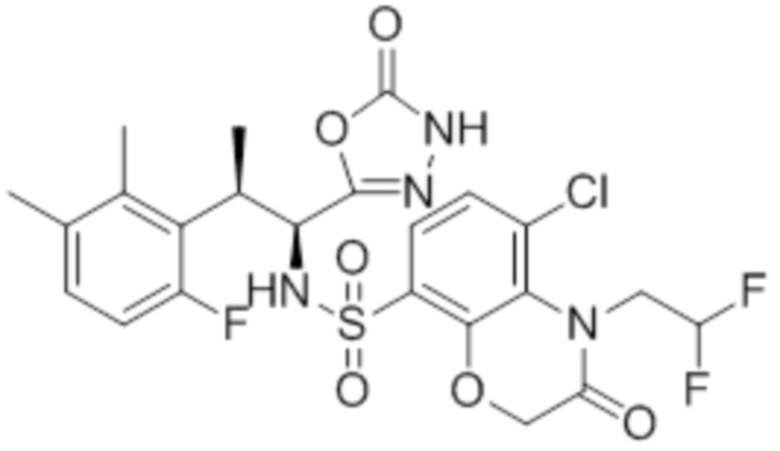
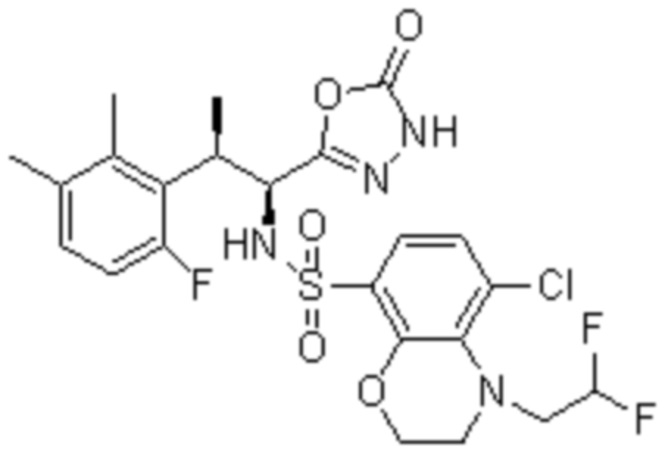
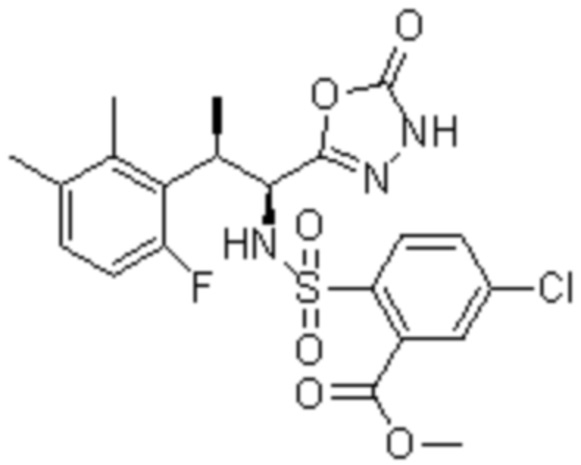
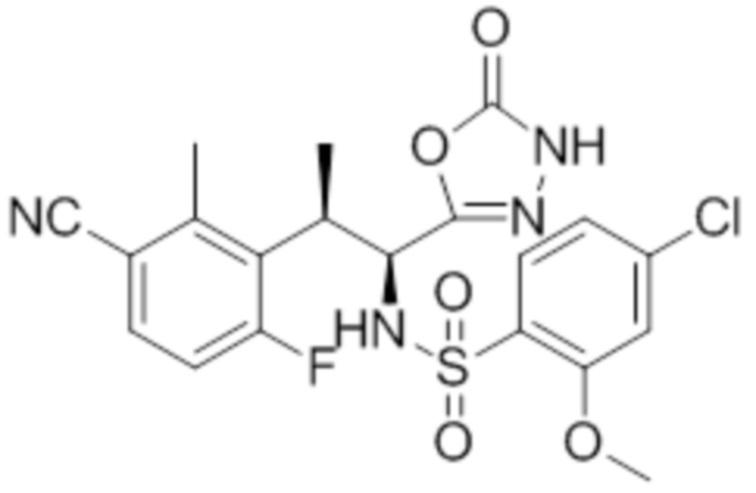
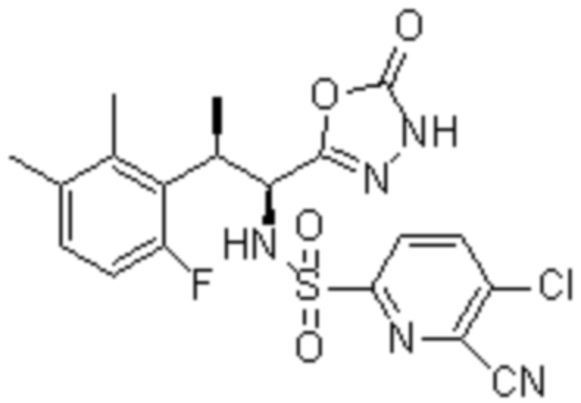
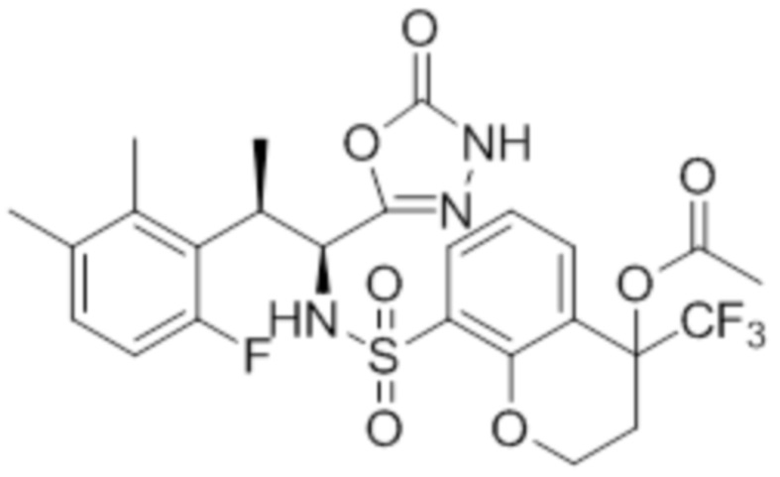
1,85 мин, m/z [M-H]- 586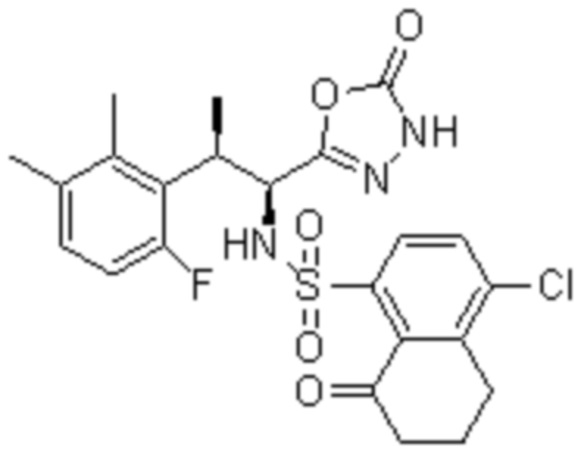
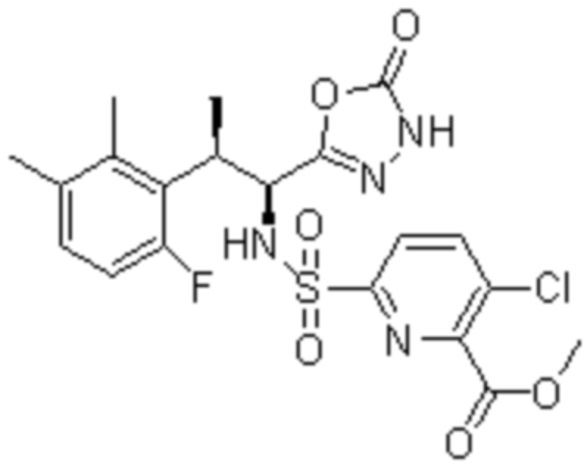

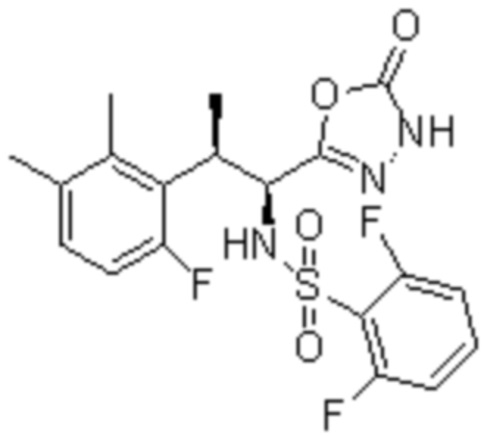
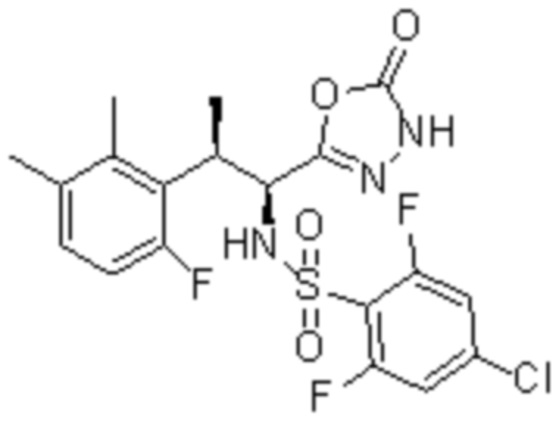
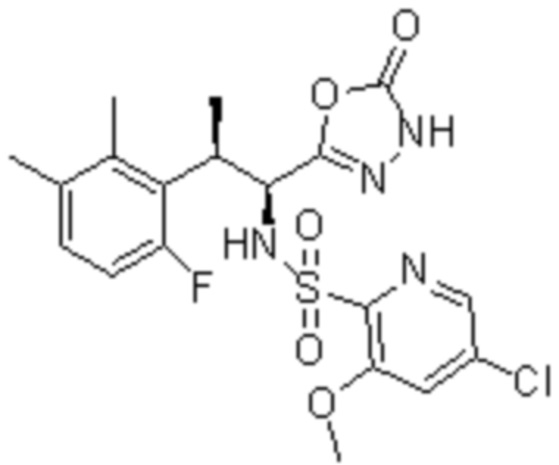
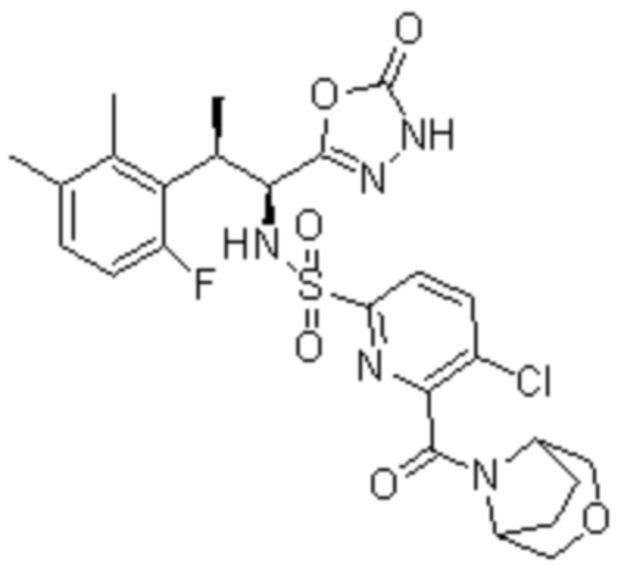
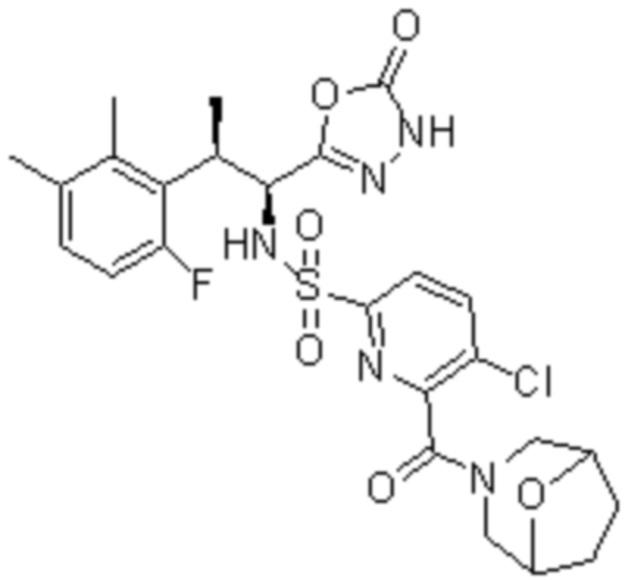
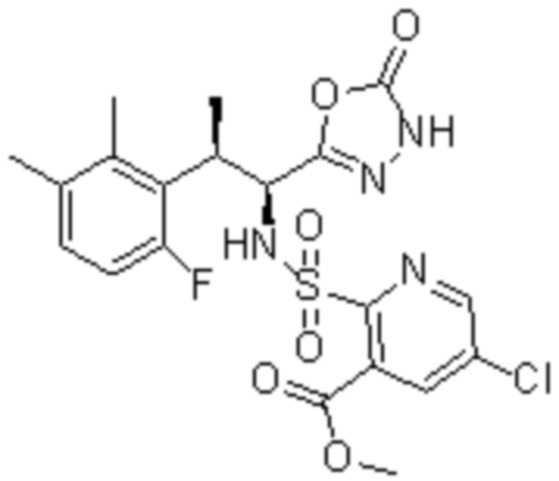
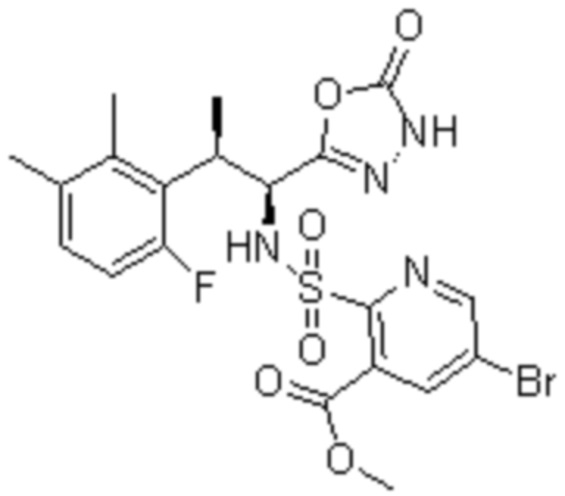
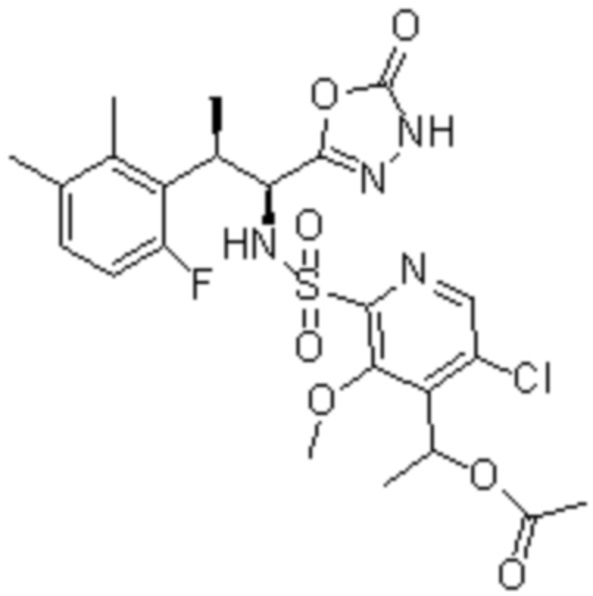
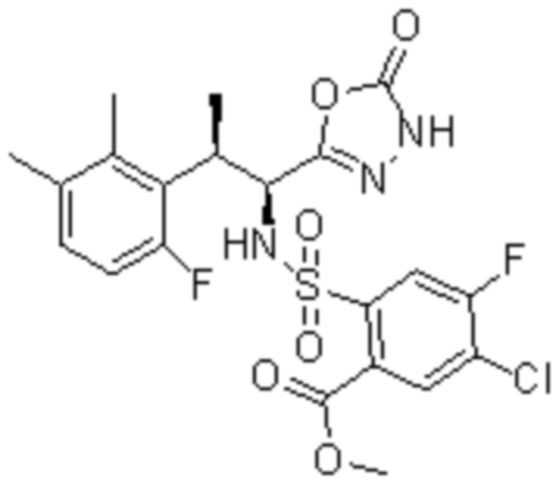
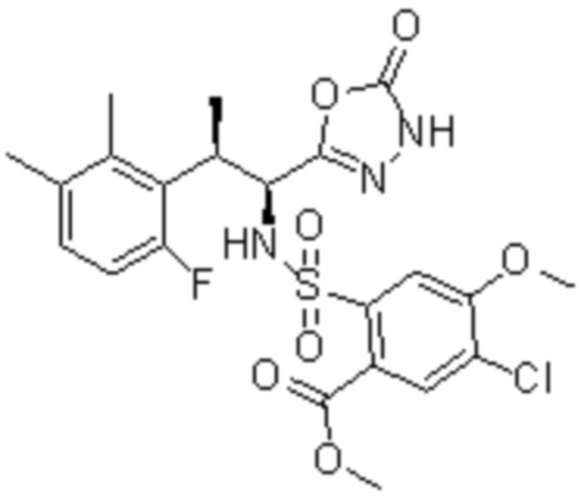
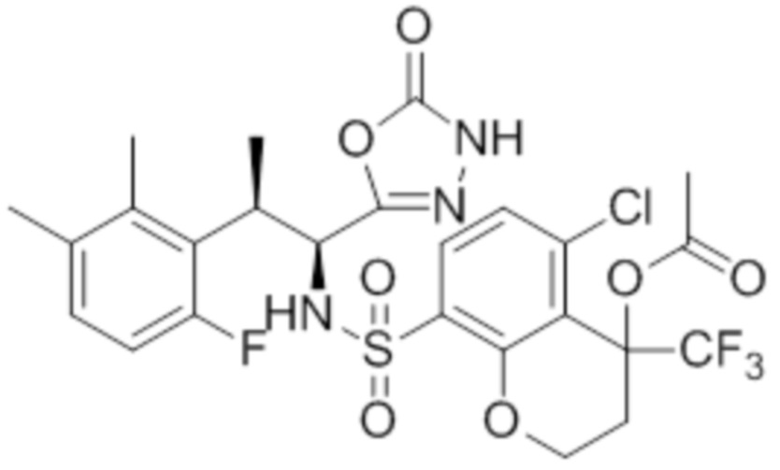
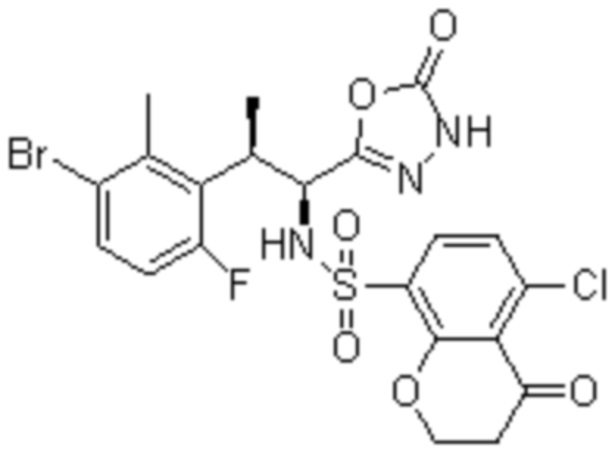
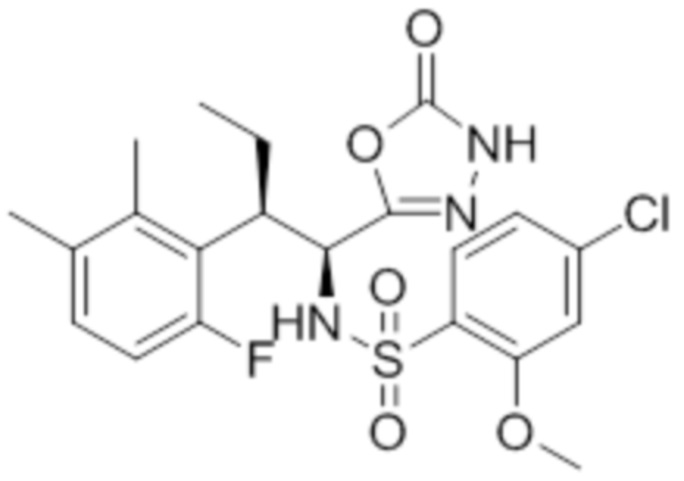
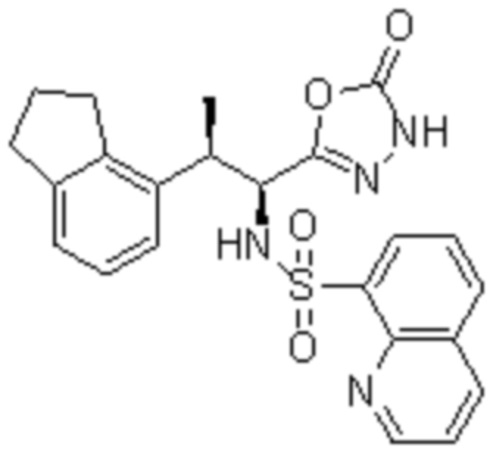
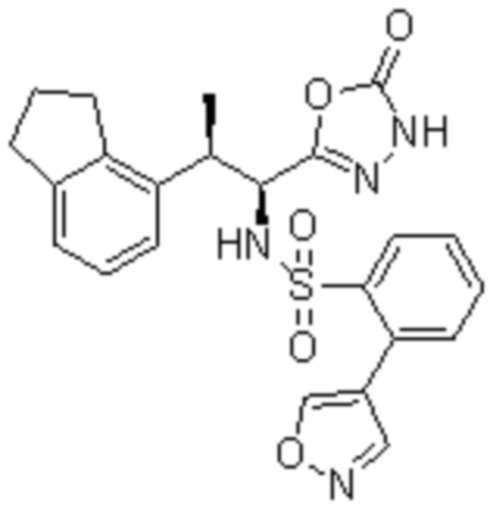
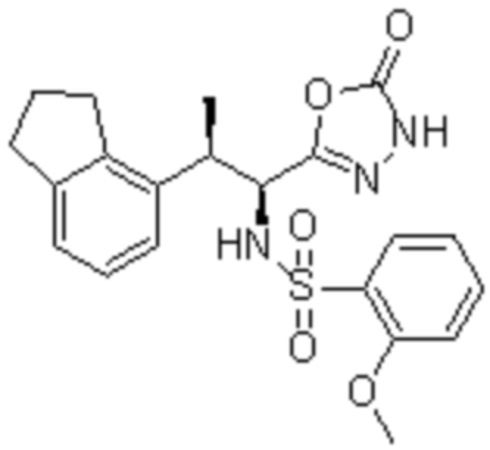
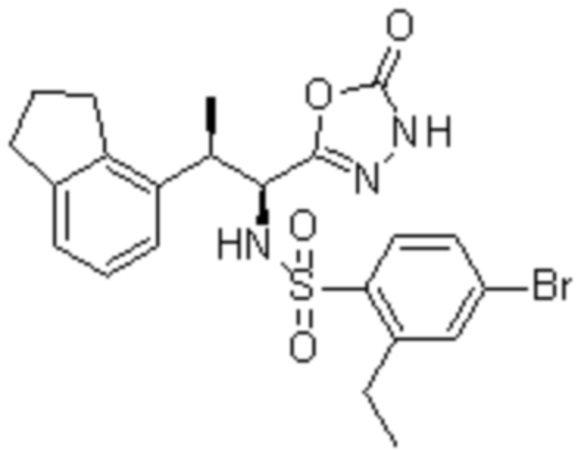
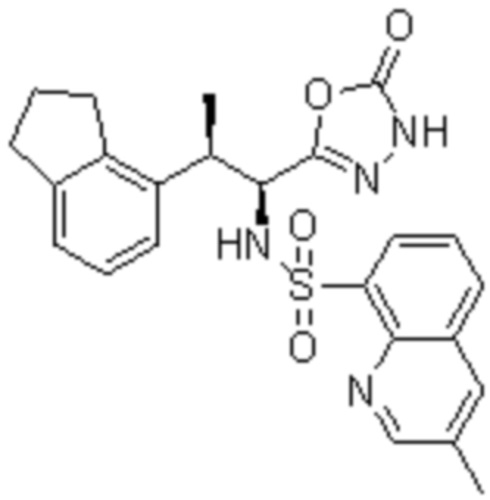
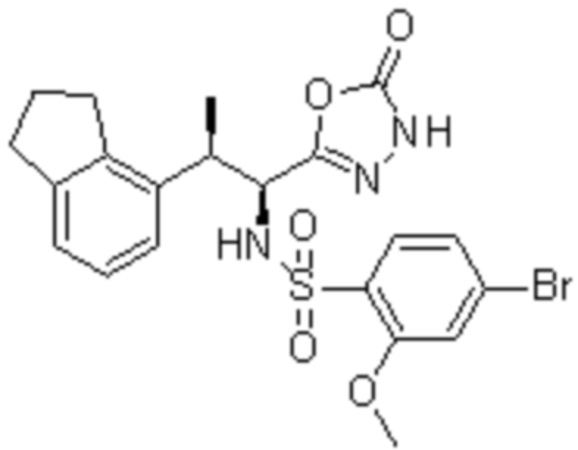
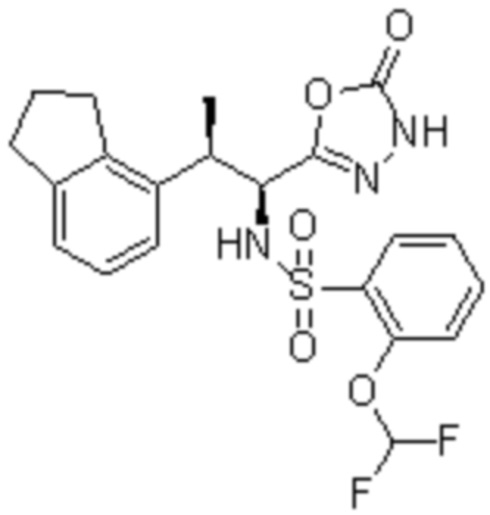
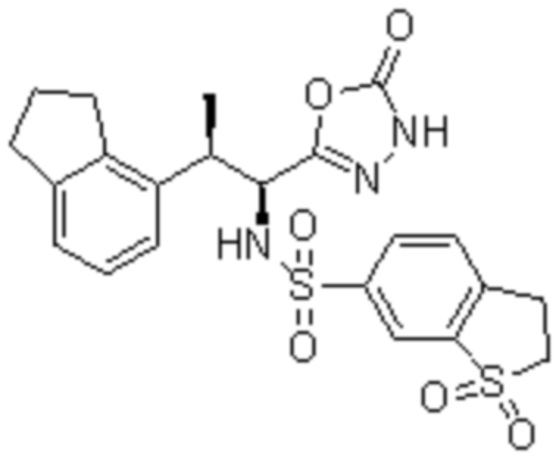
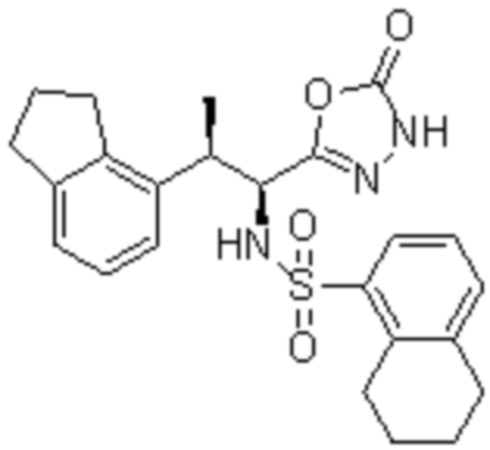
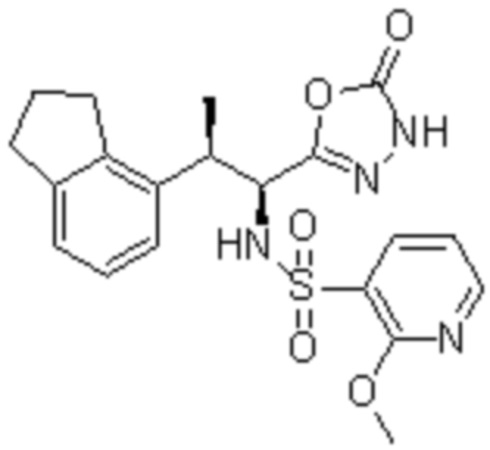
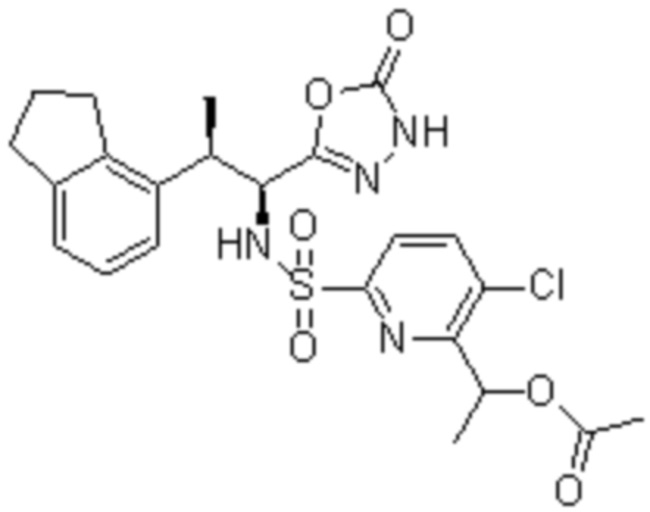
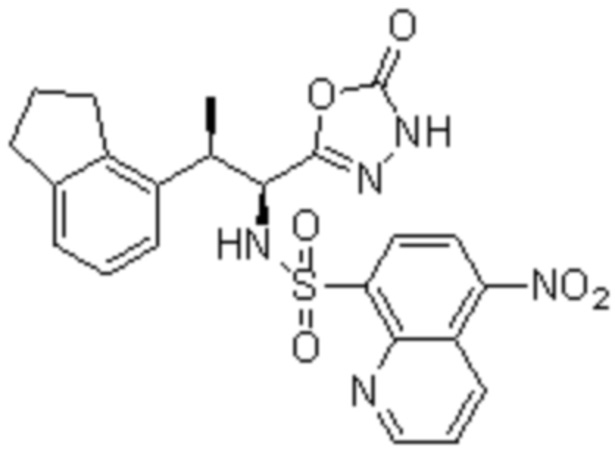
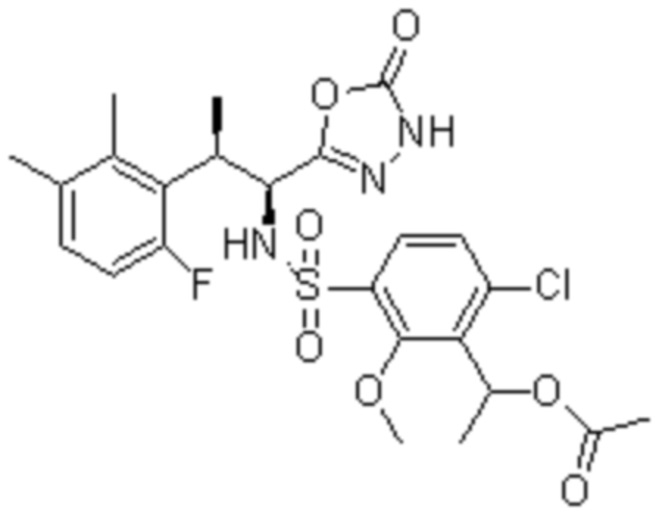
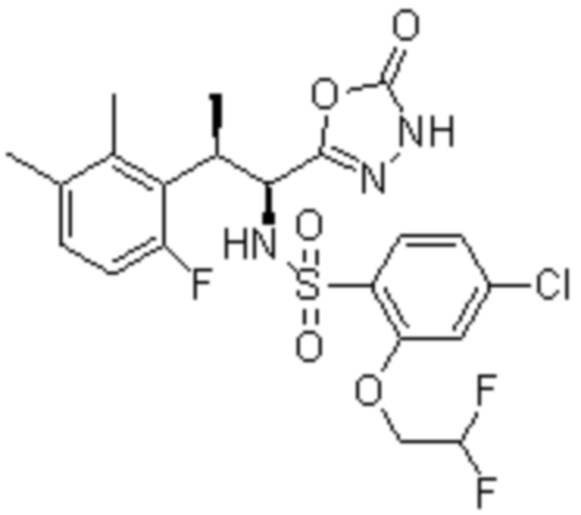
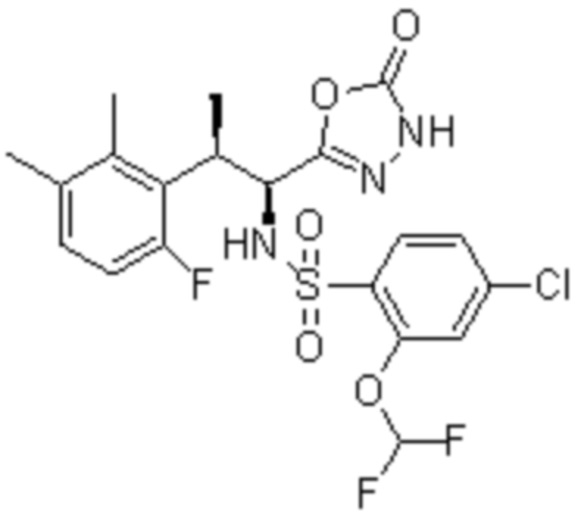
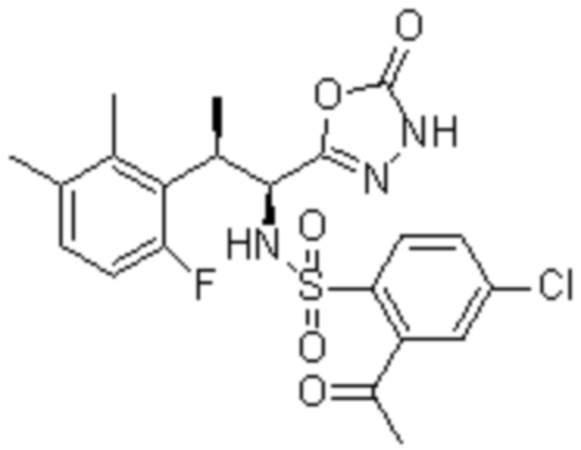
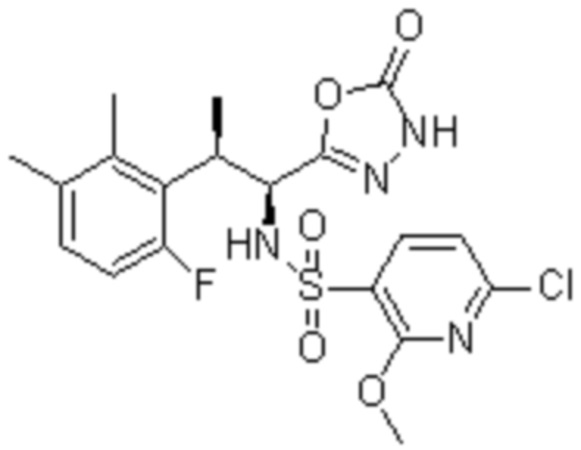

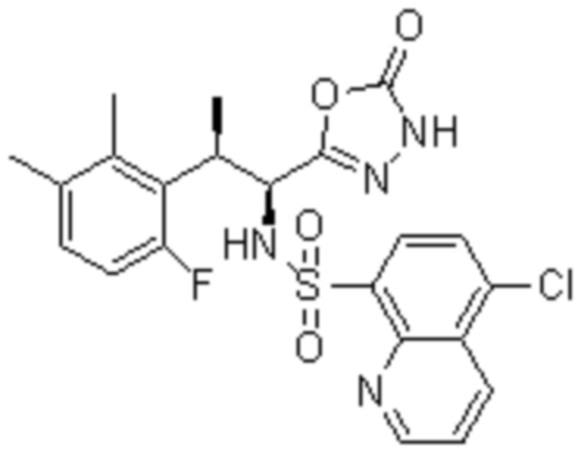
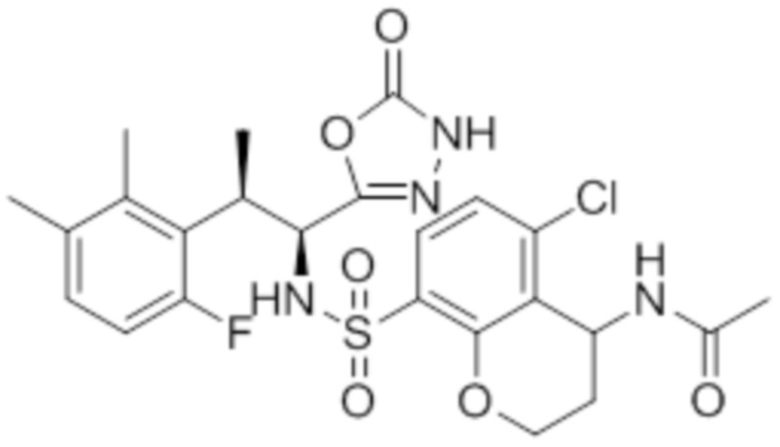
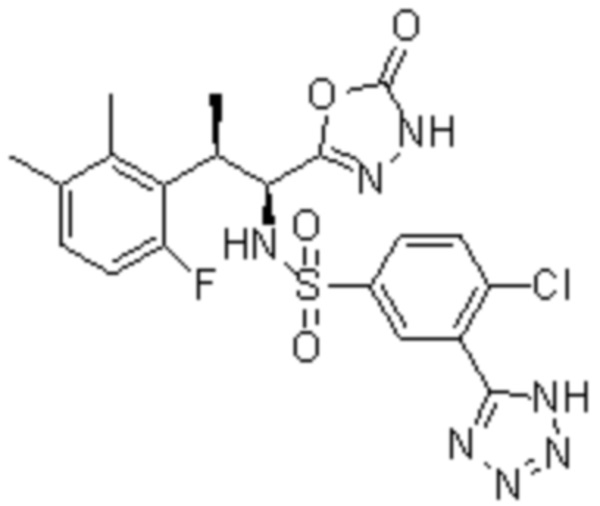
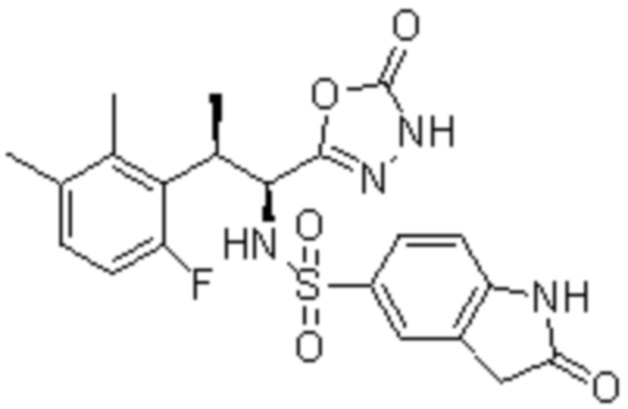
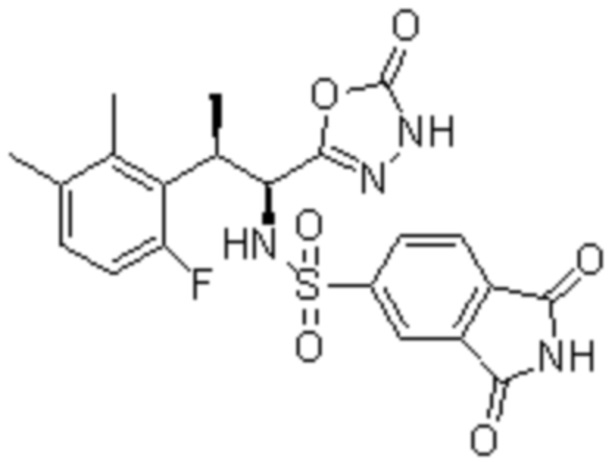
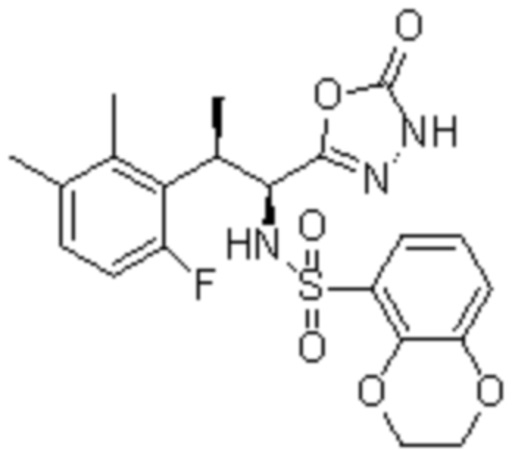
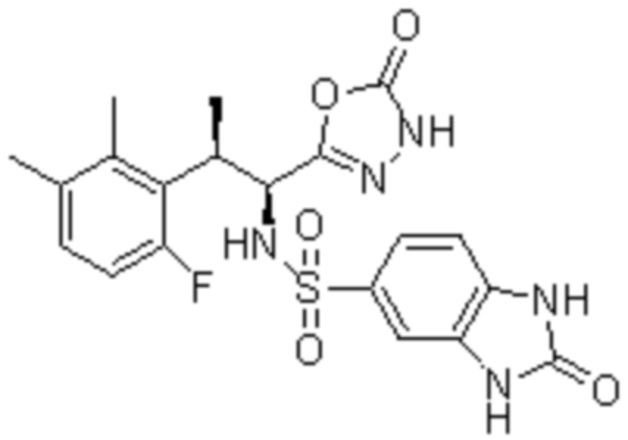
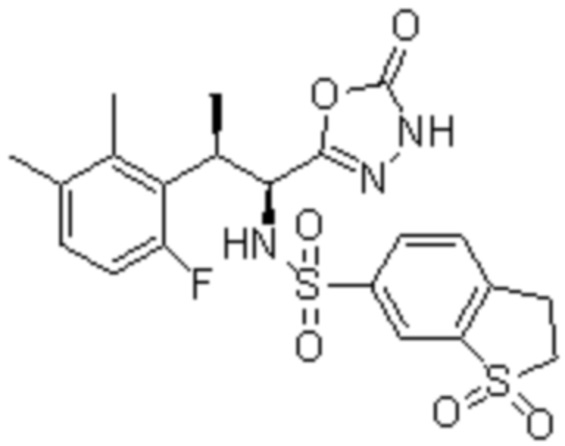
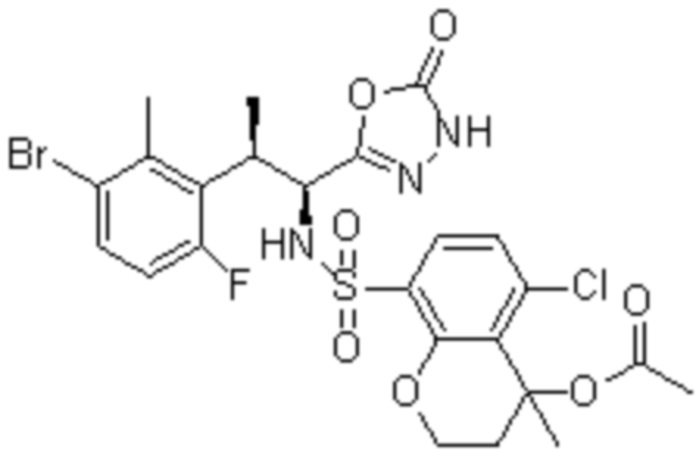
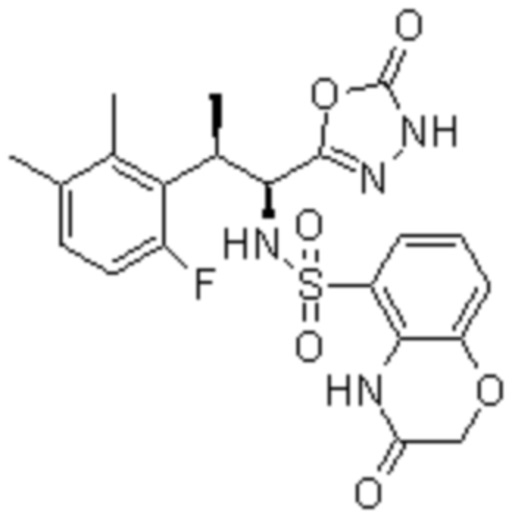
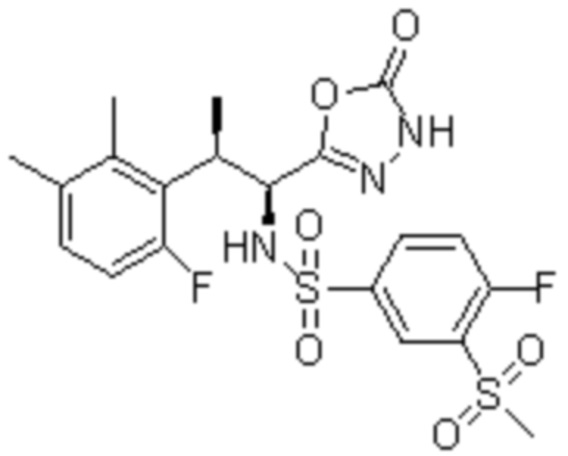

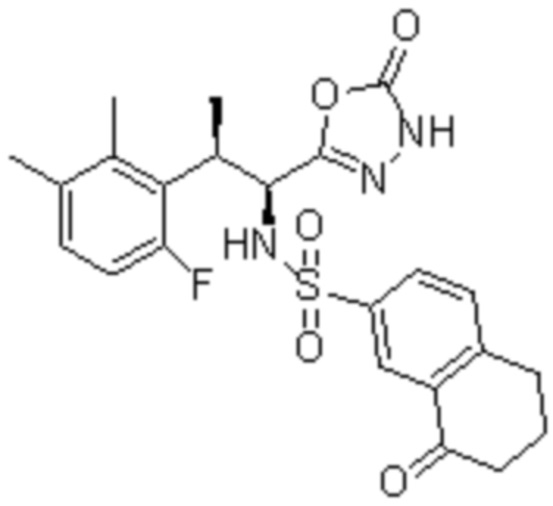
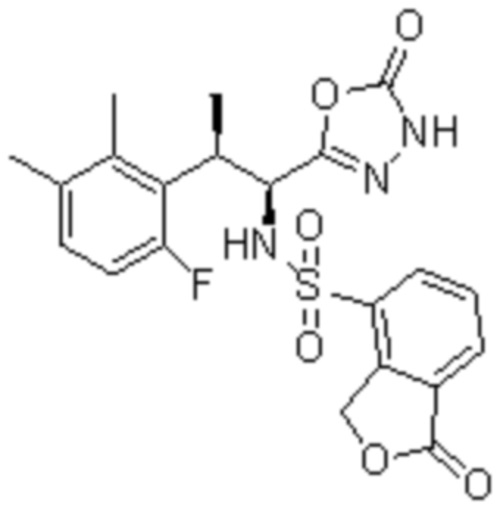
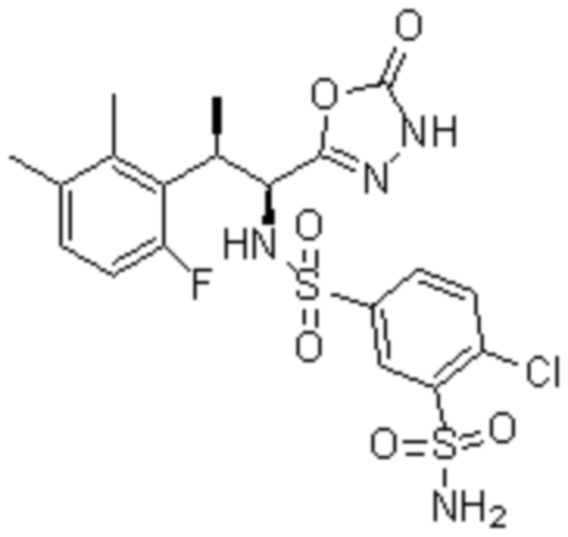
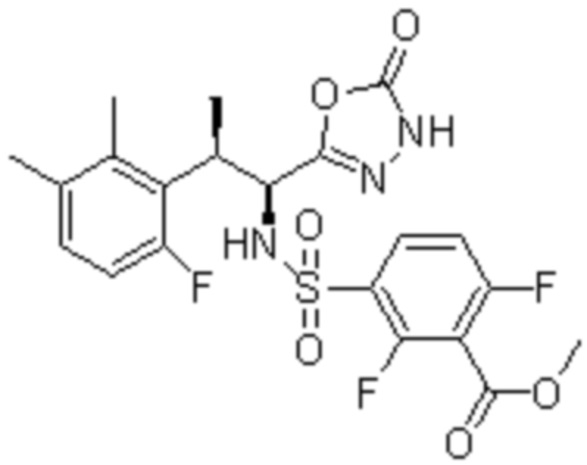
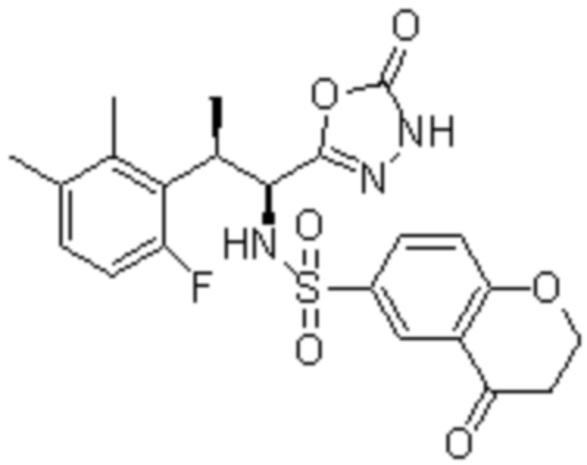
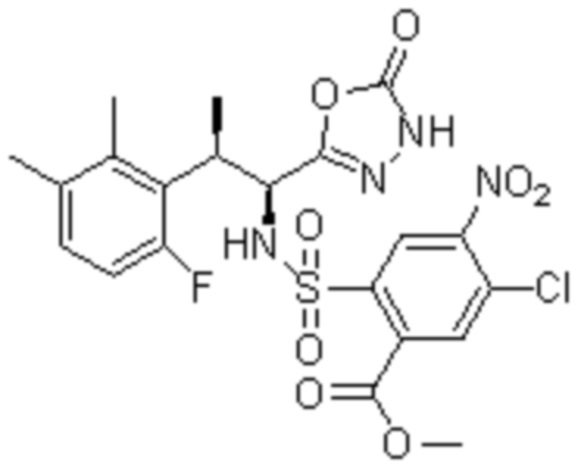
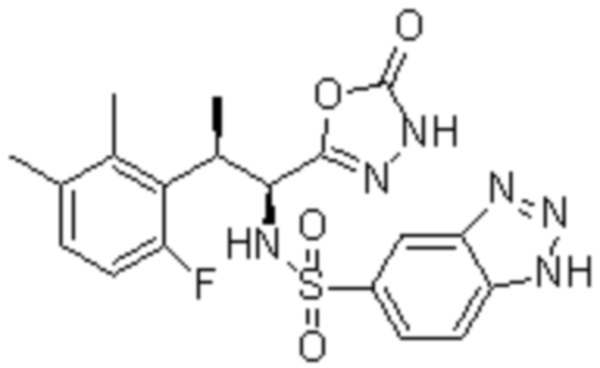
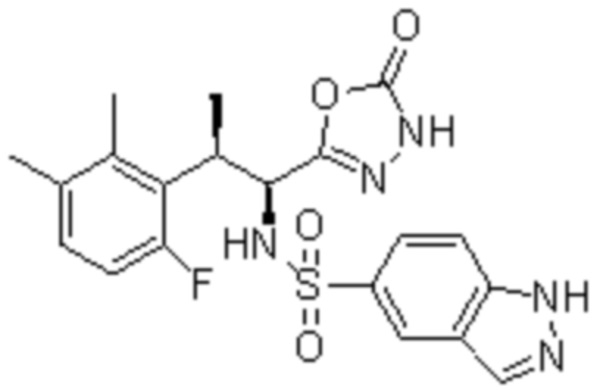
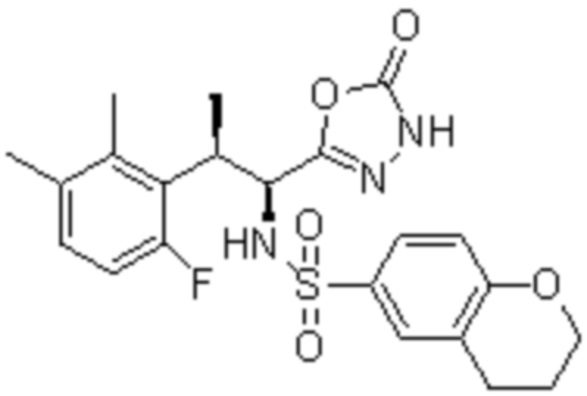
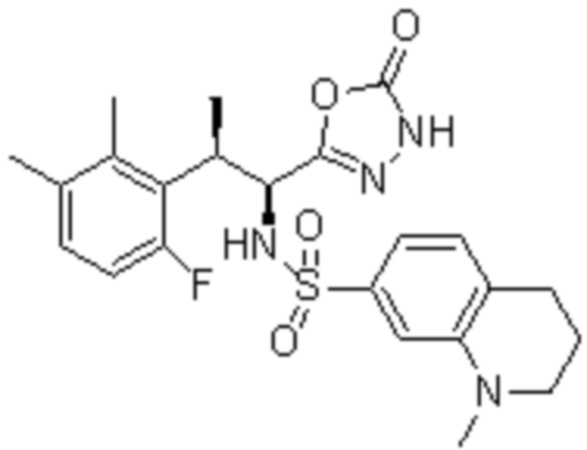
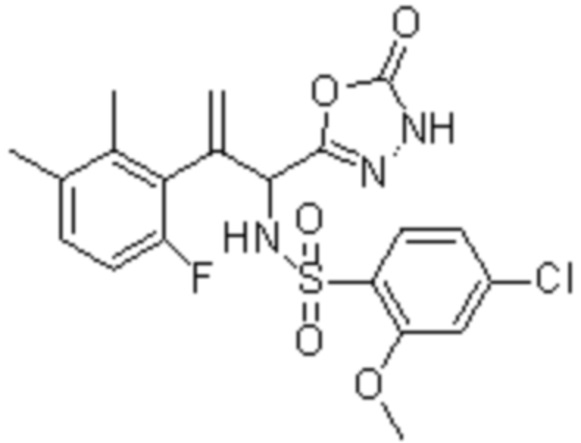
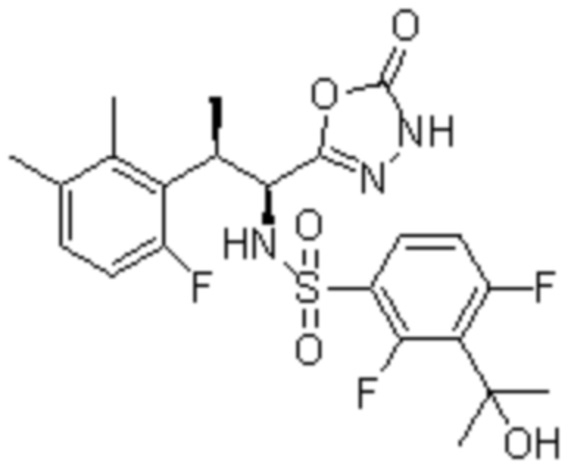
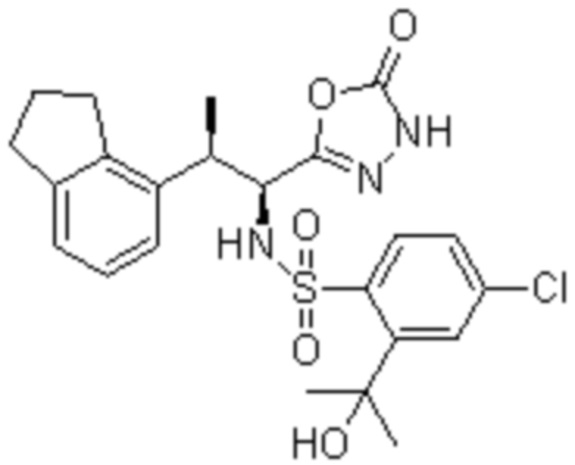
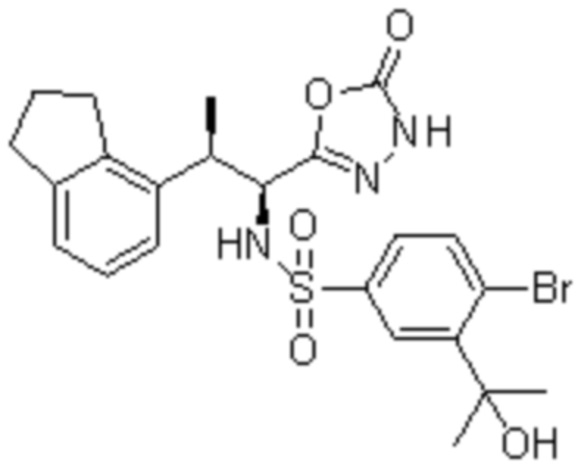
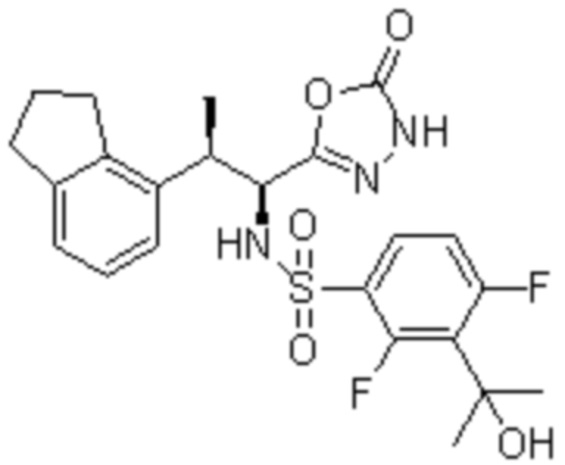
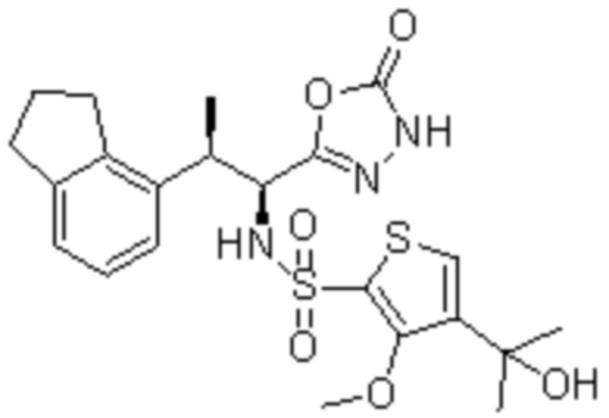
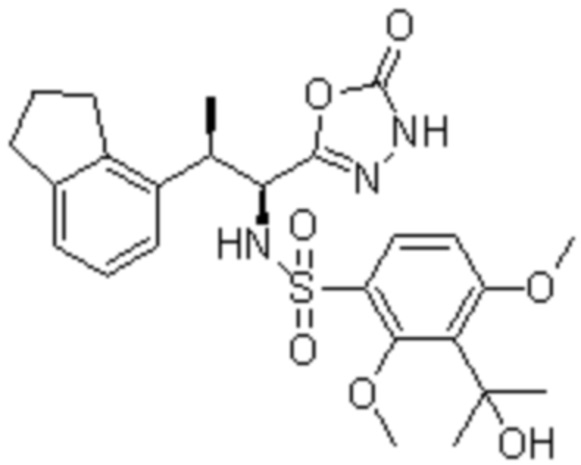
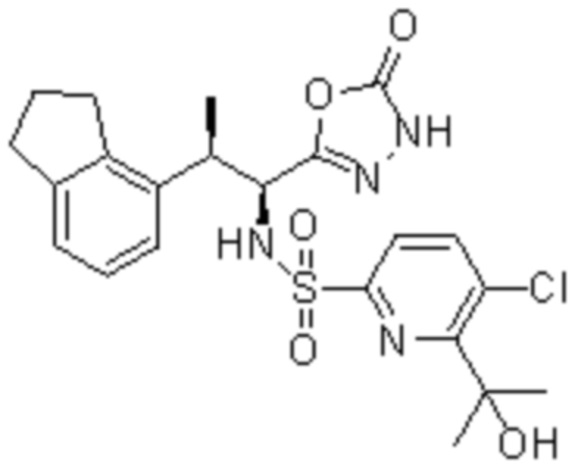
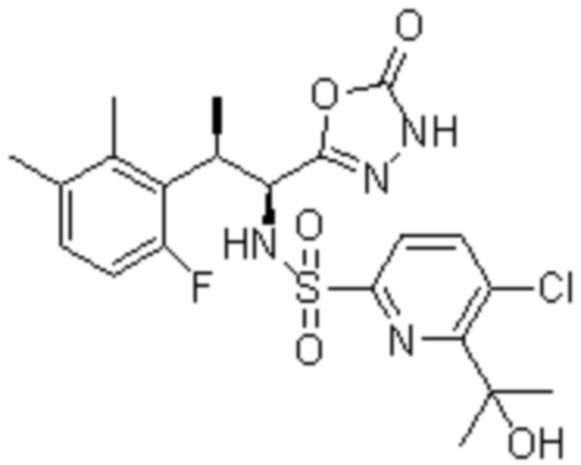
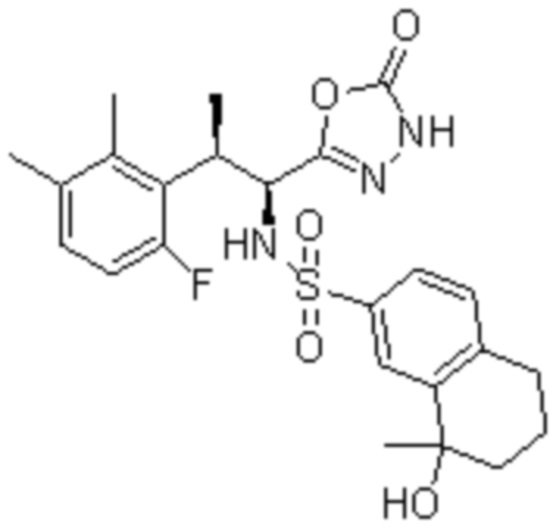
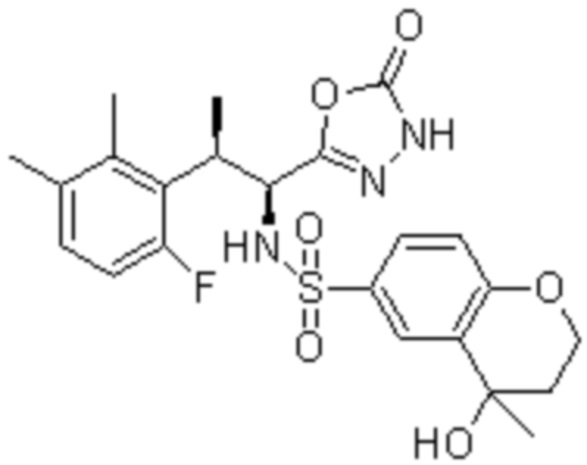
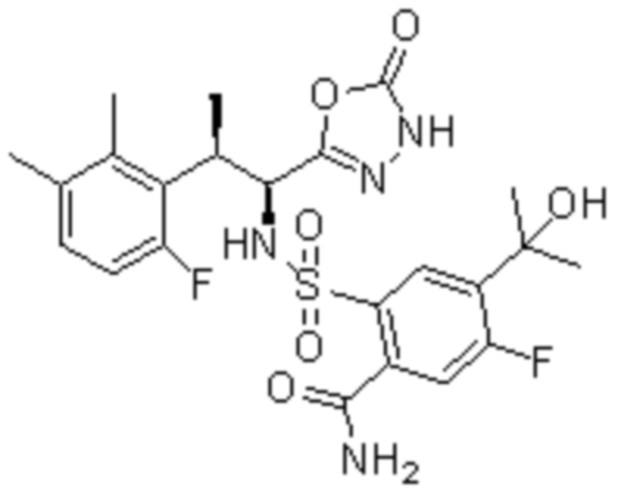

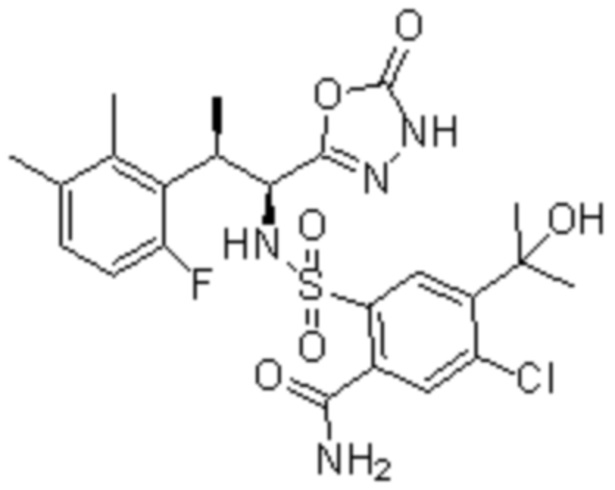
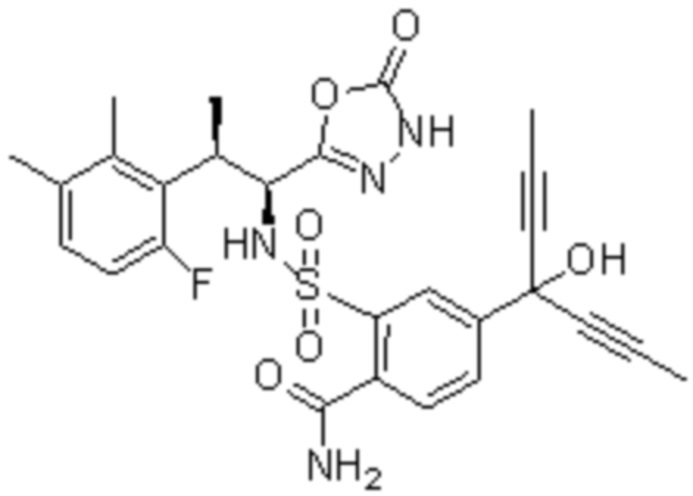
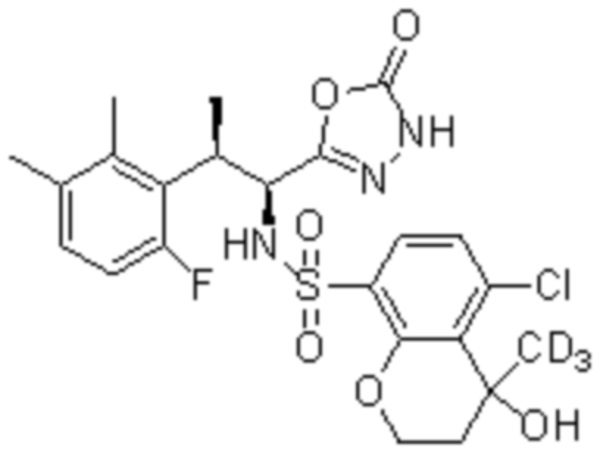

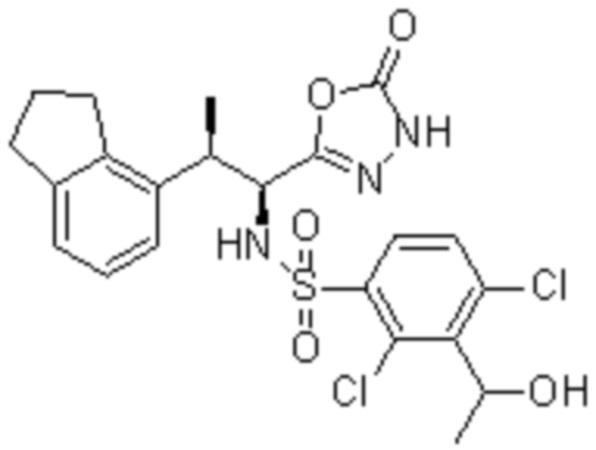
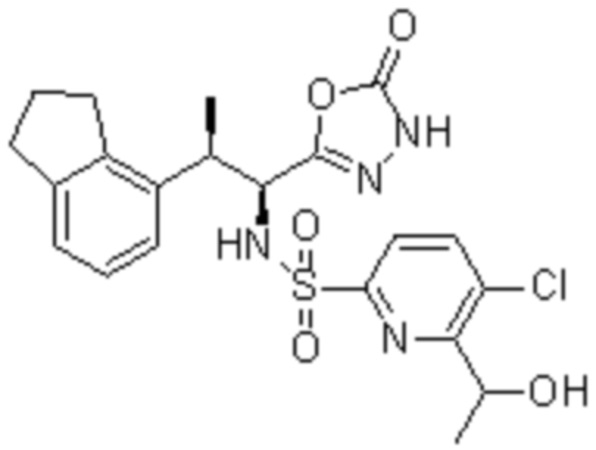
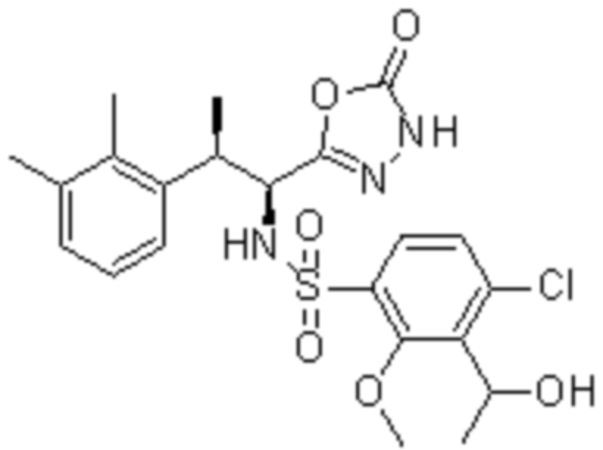
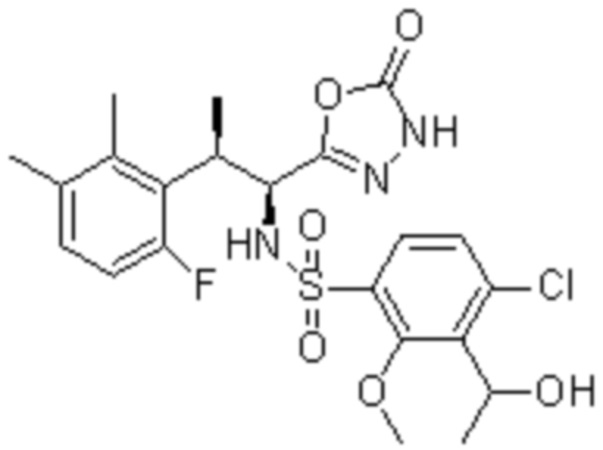
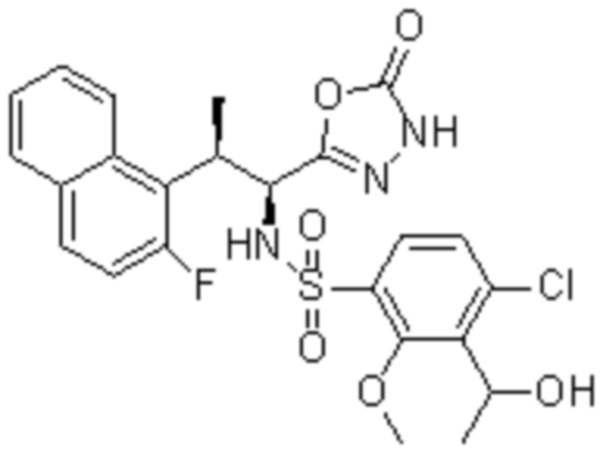
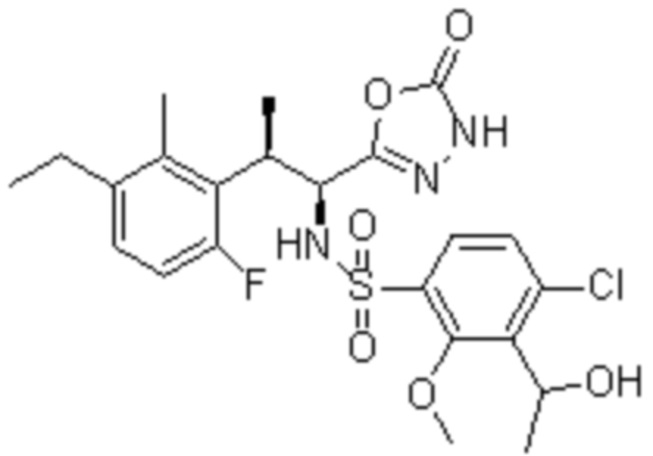
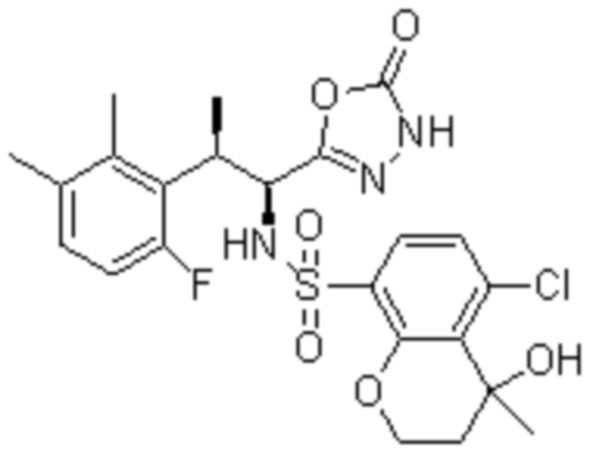


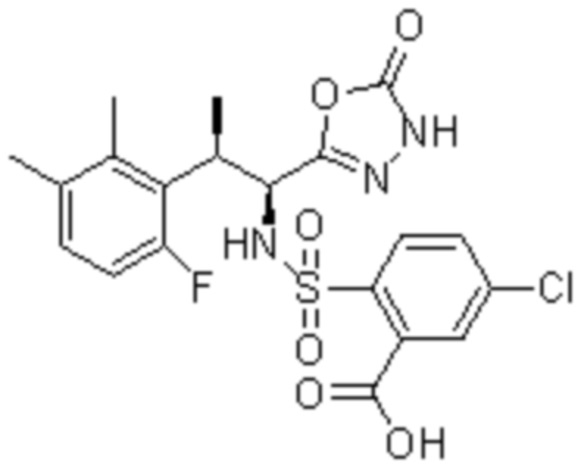
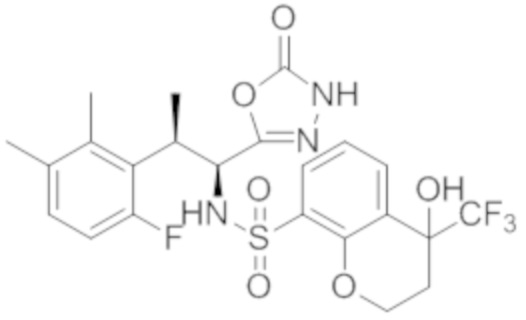
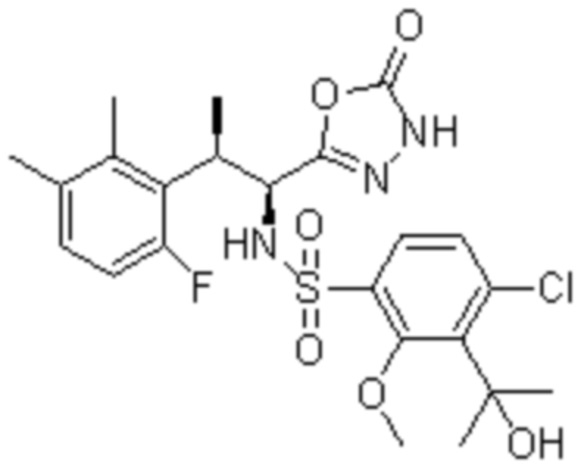
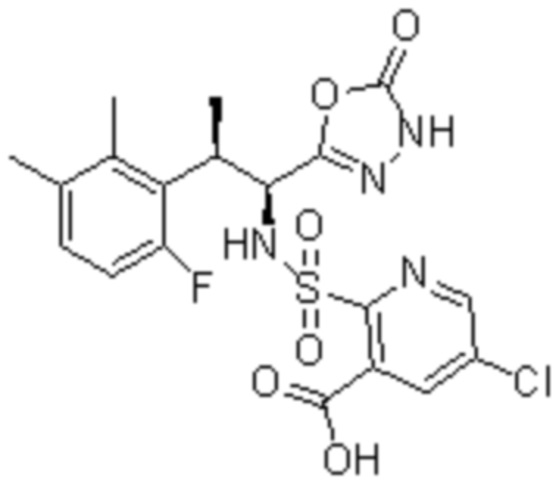
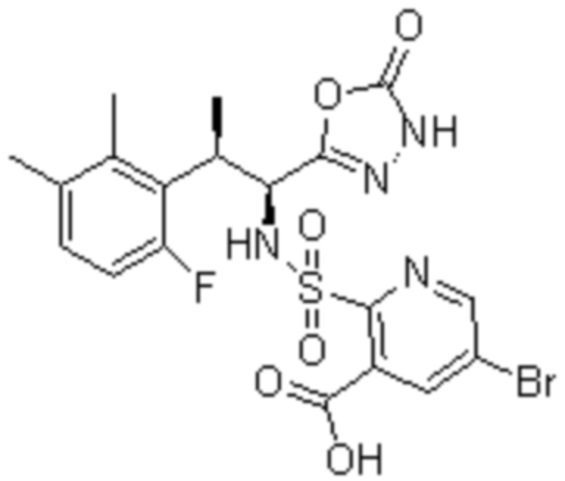
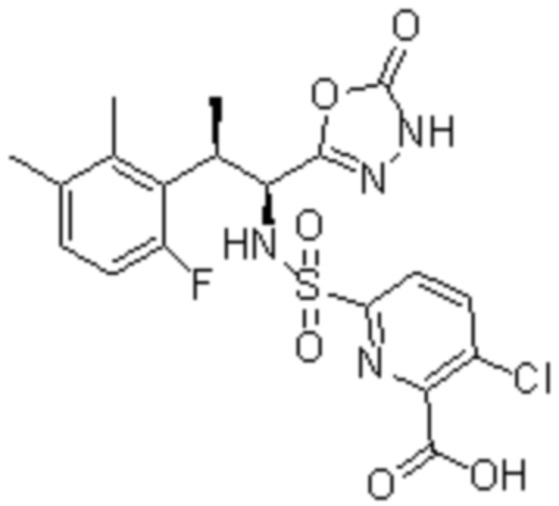
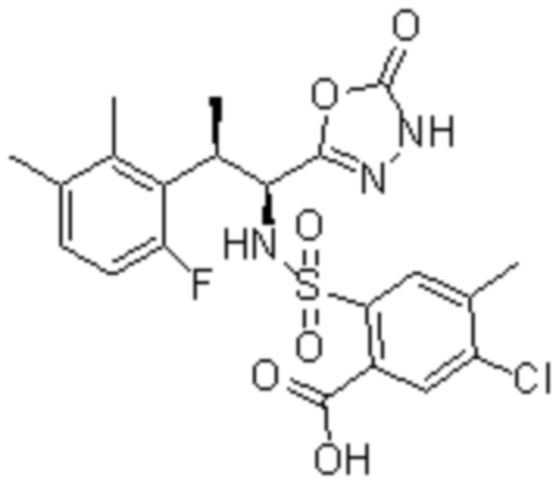
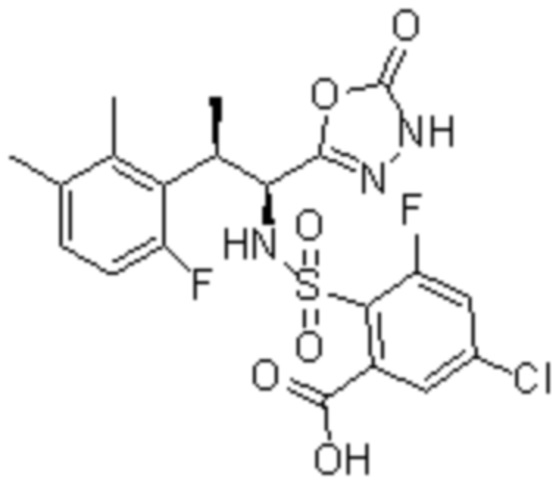
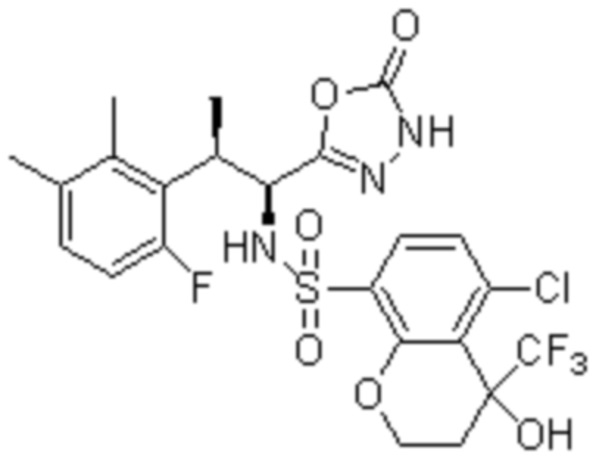

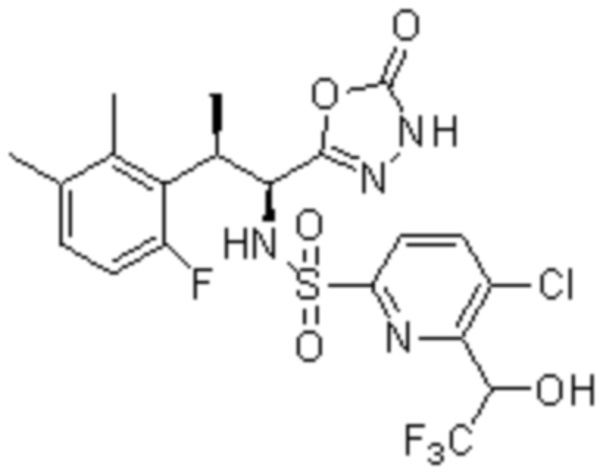
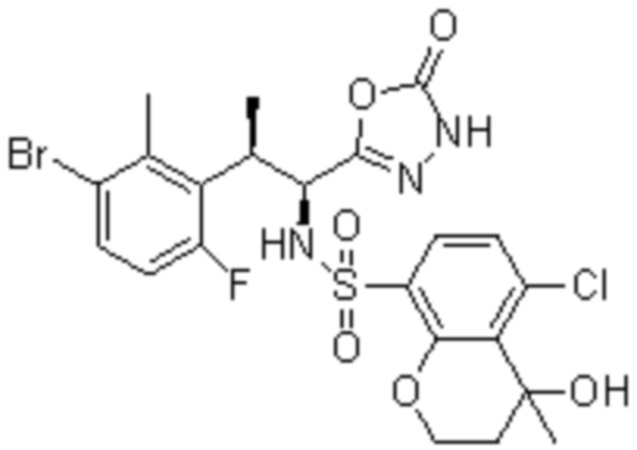


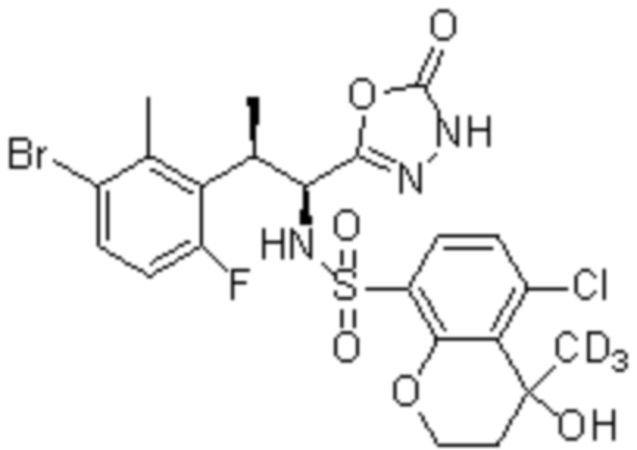

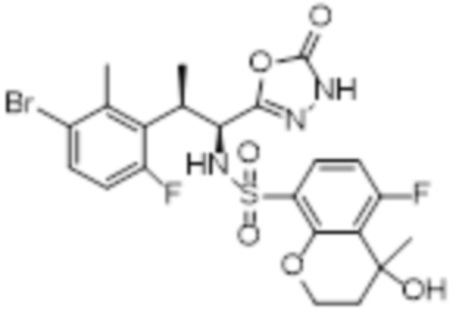
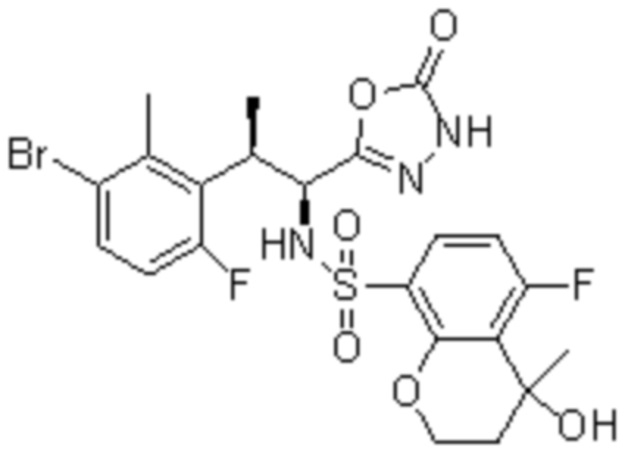
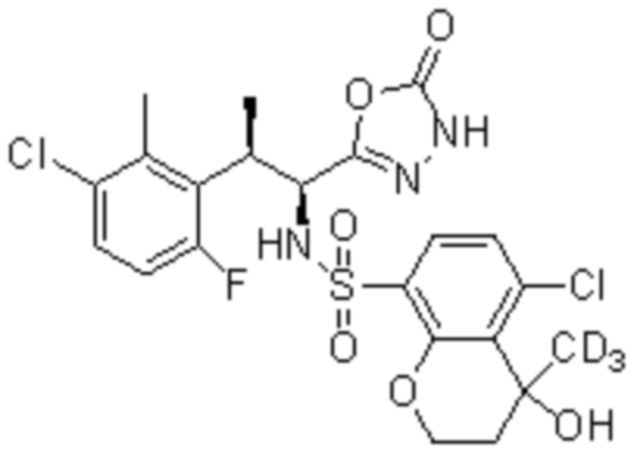

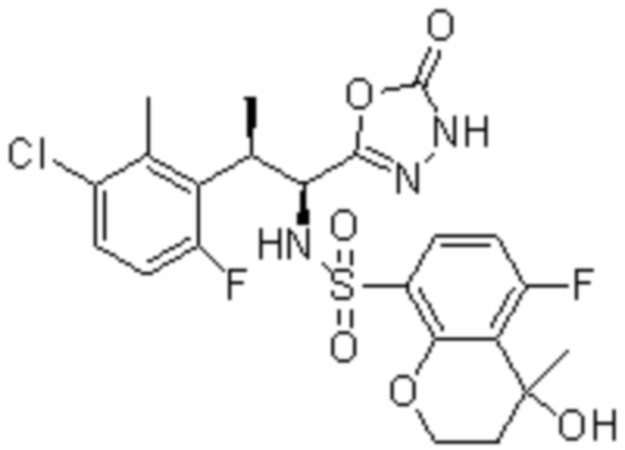

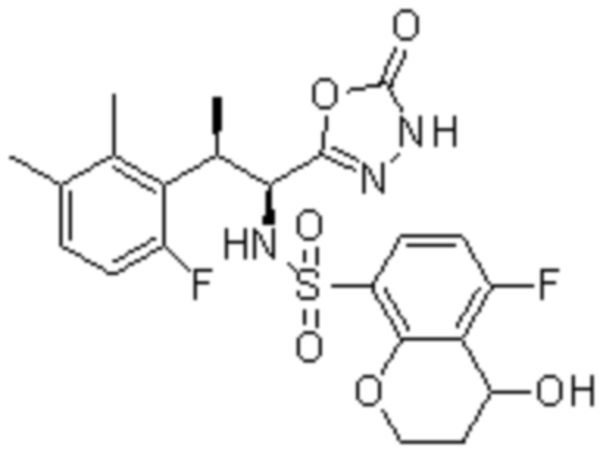

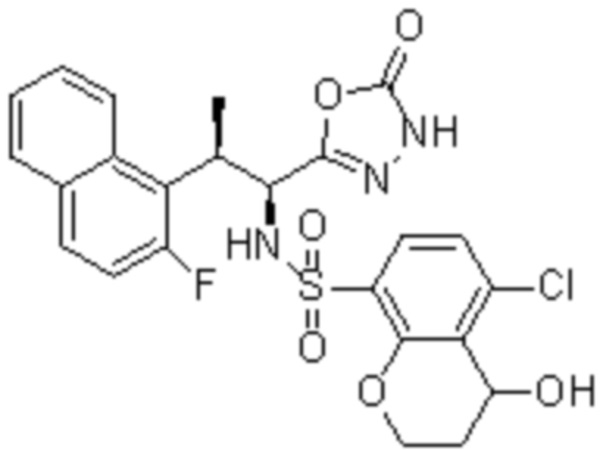
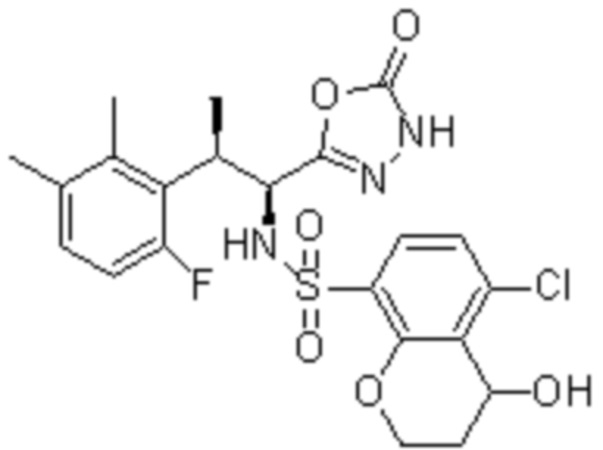

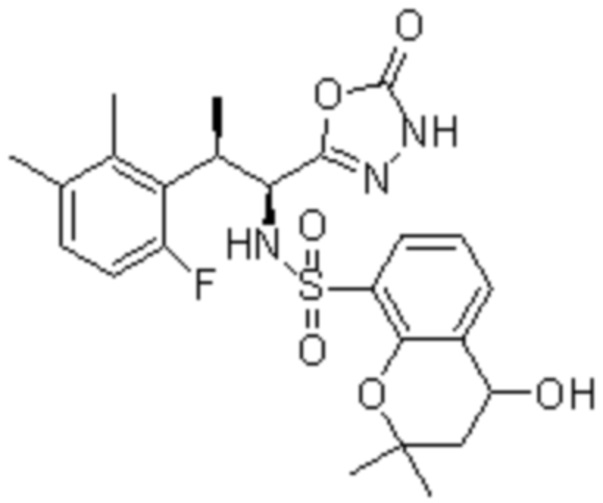
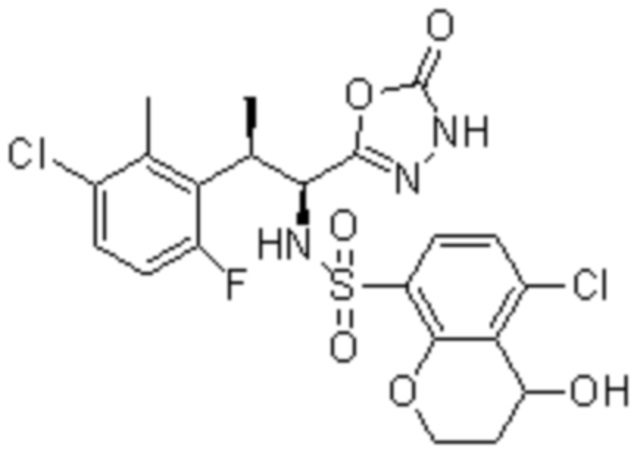
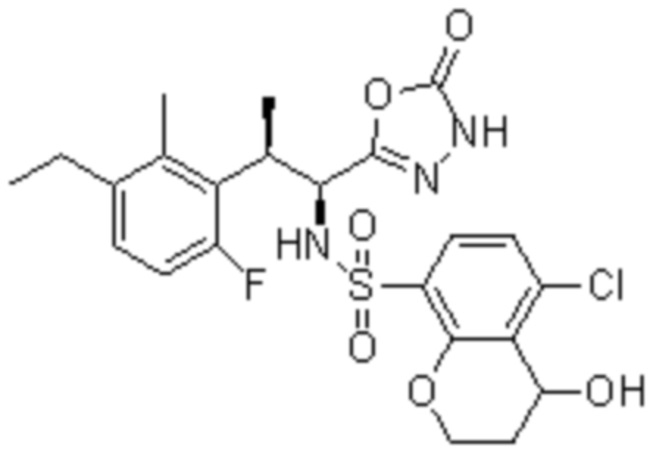
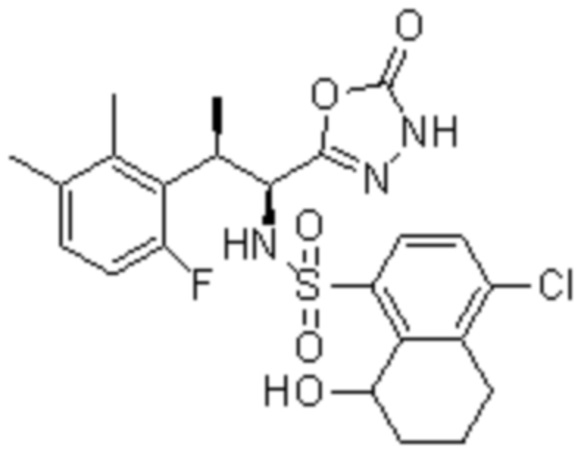

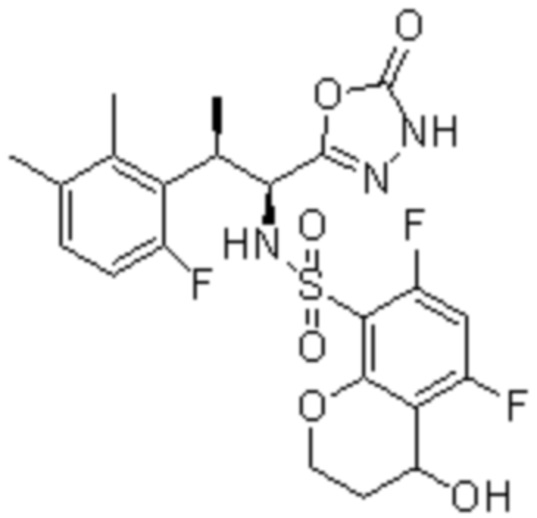
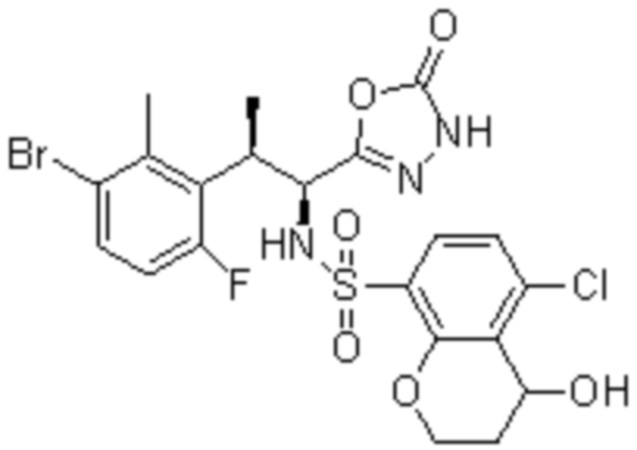

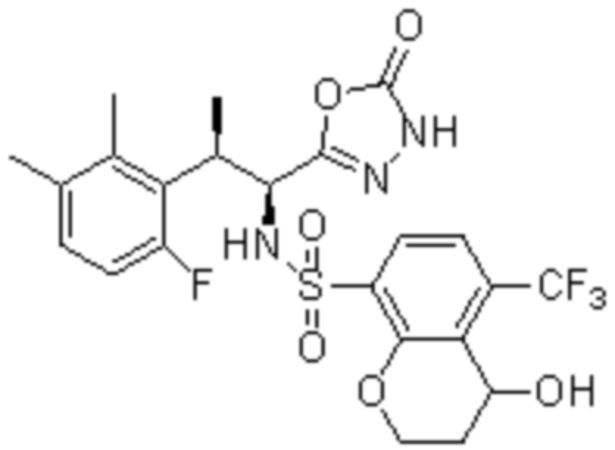

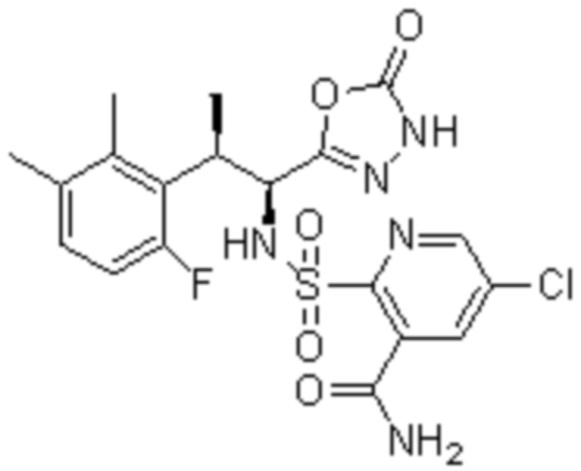
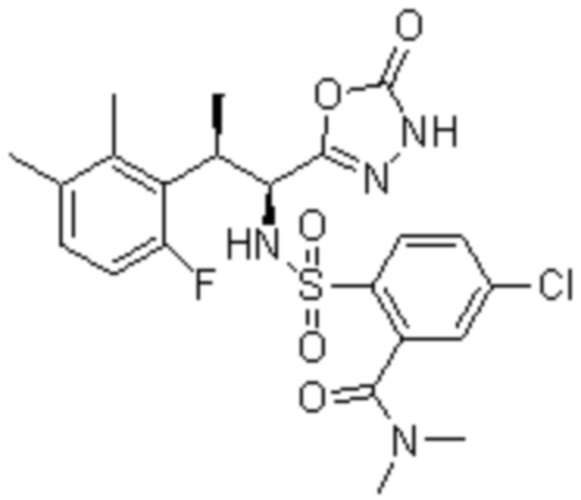
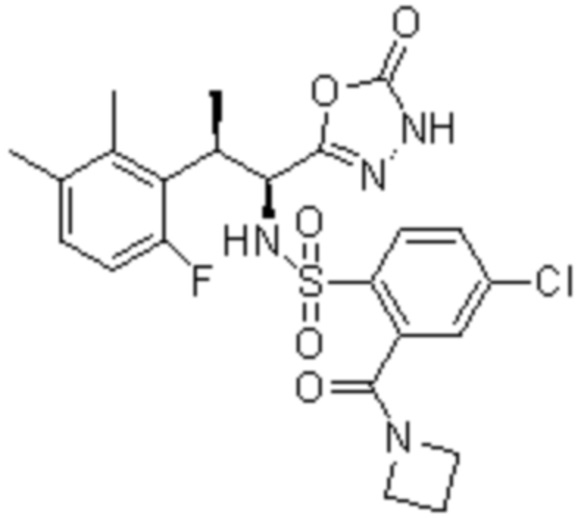
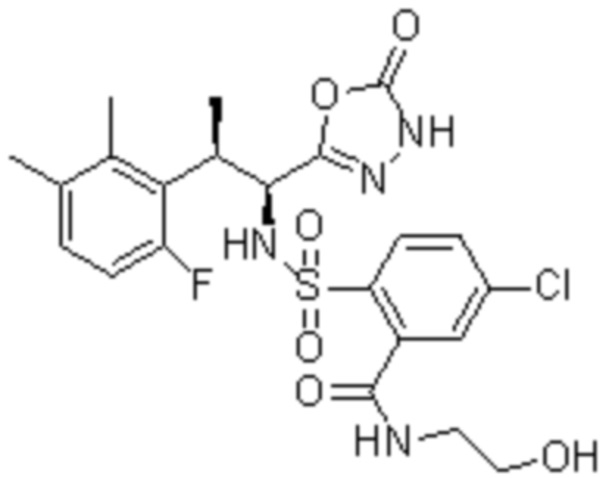
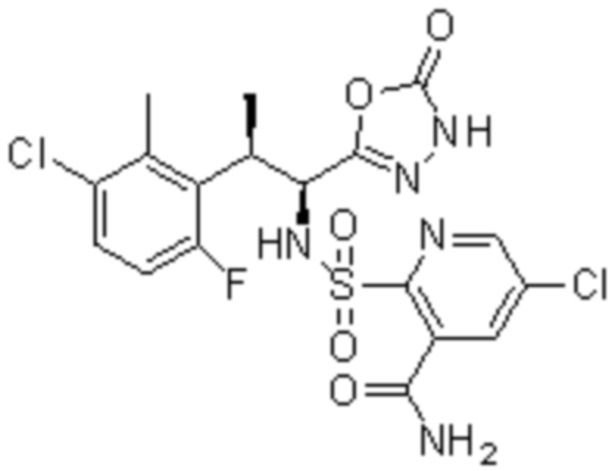
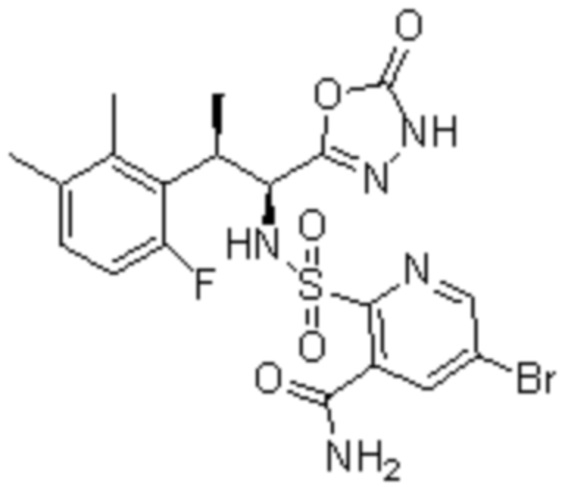
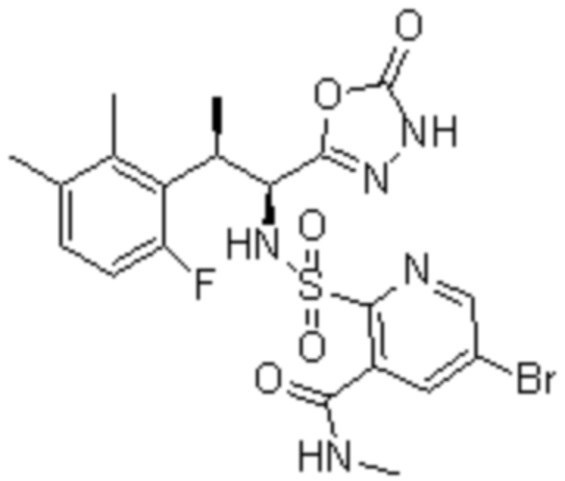
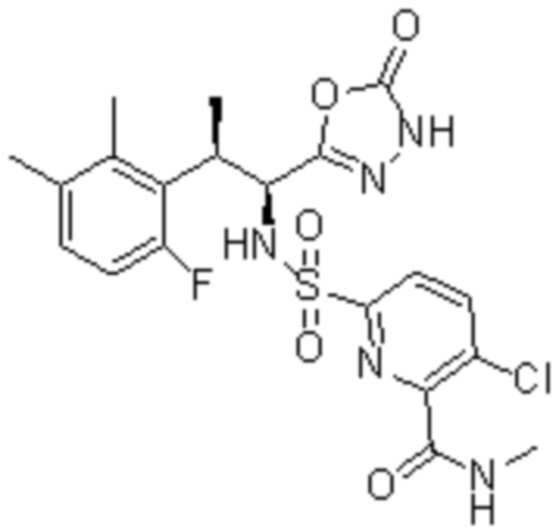
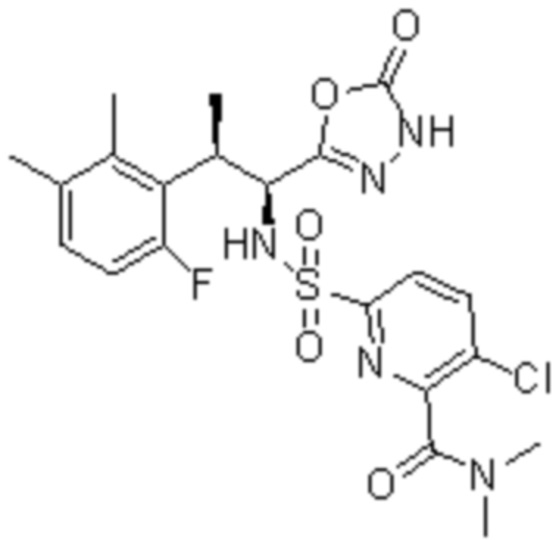
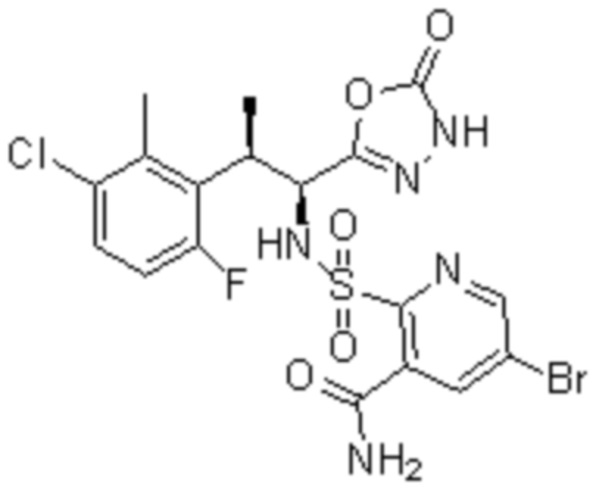
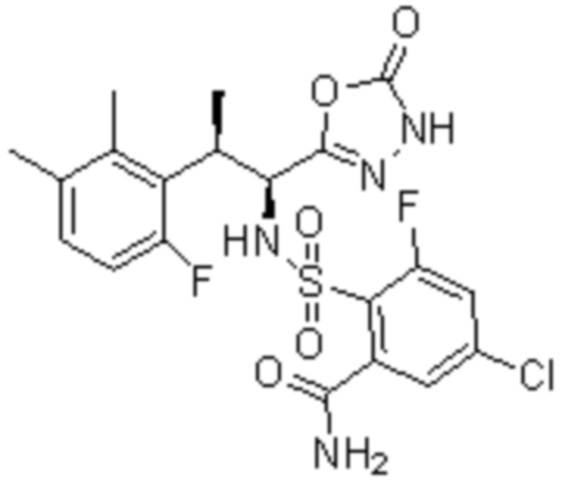
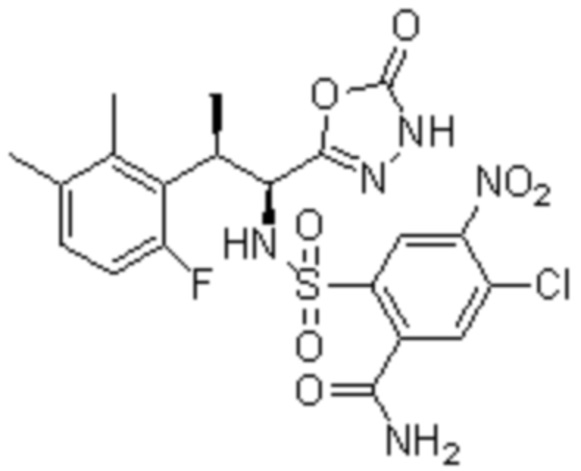
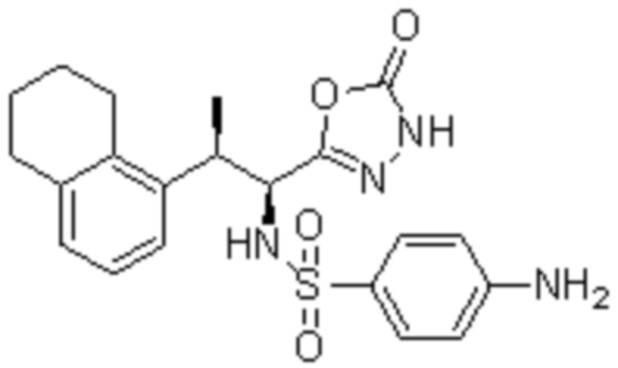
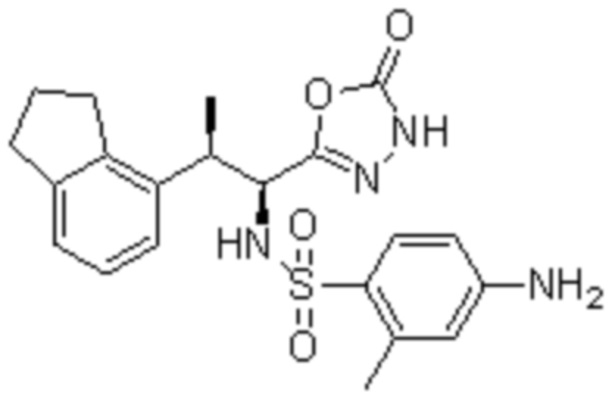
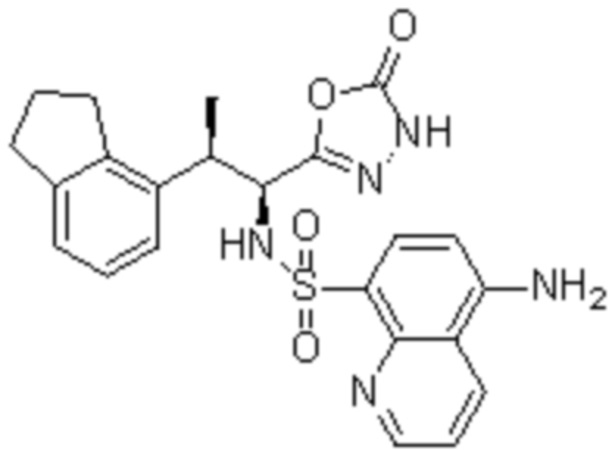
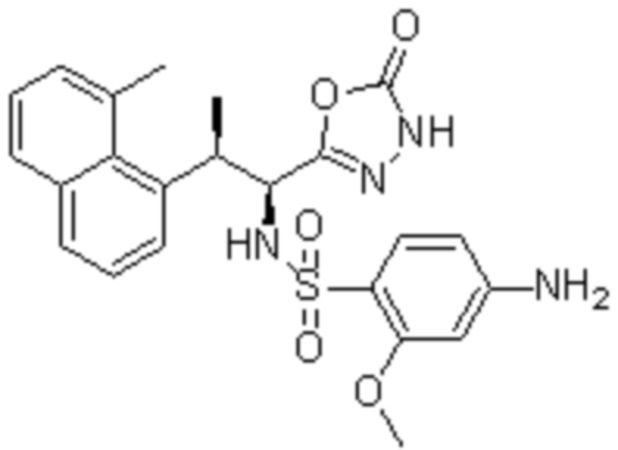
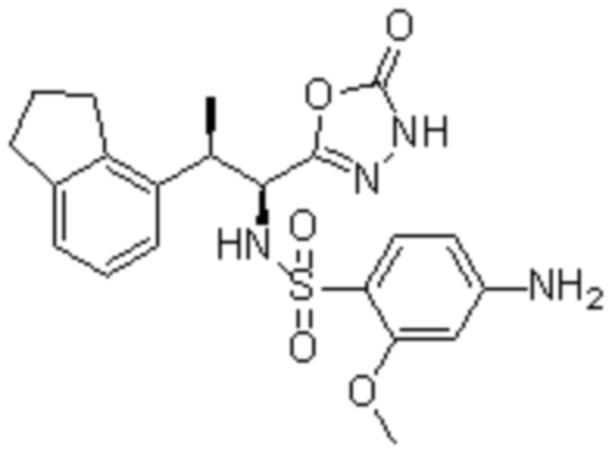
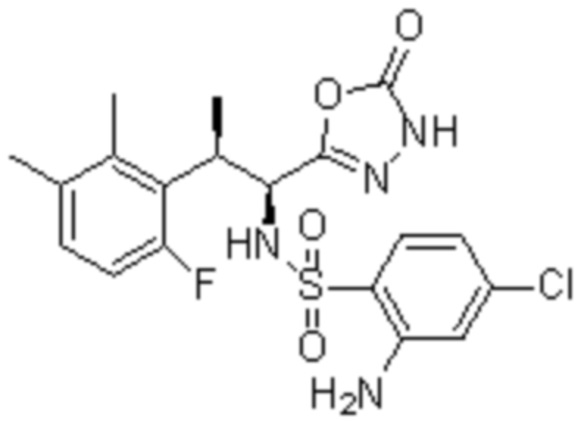
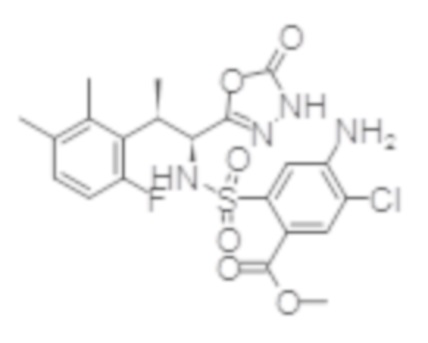
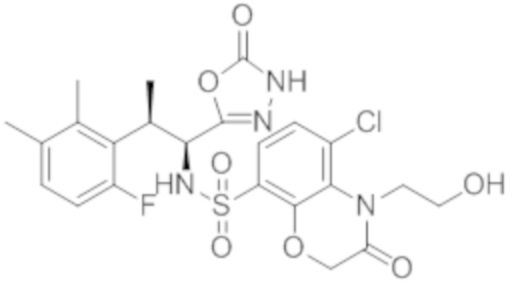
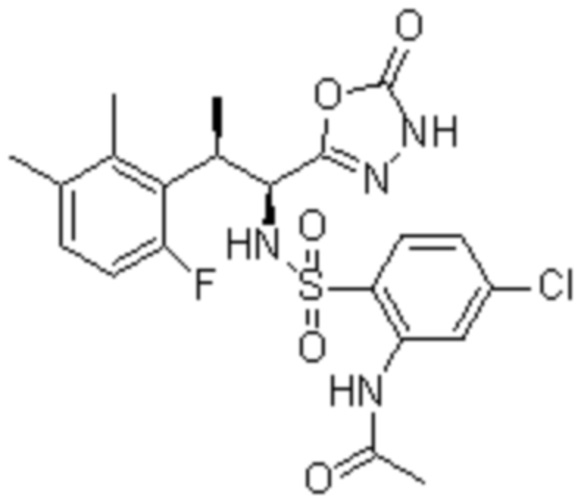
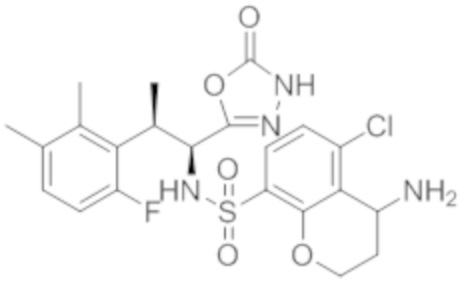
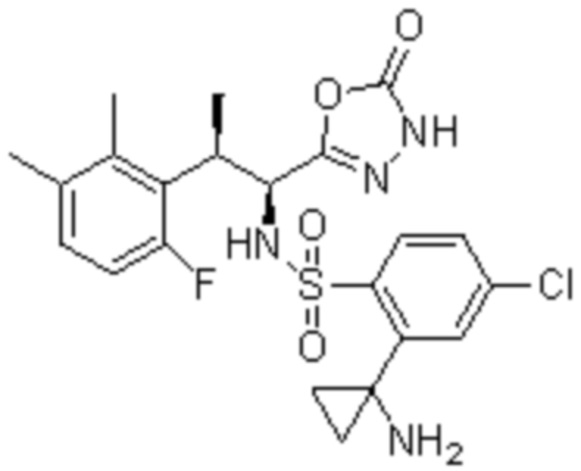
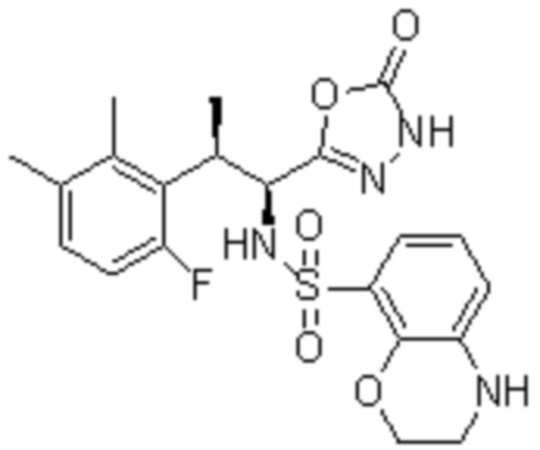
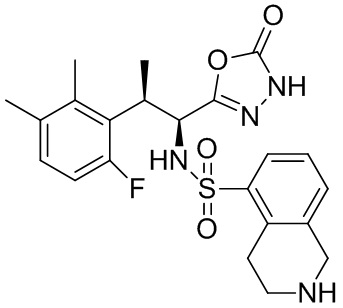
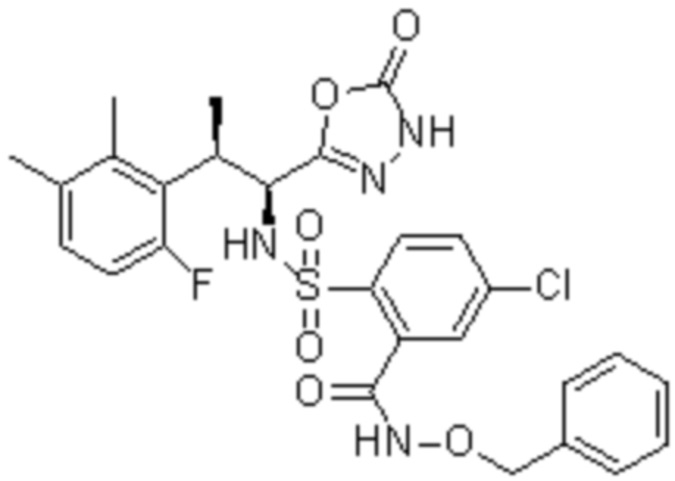
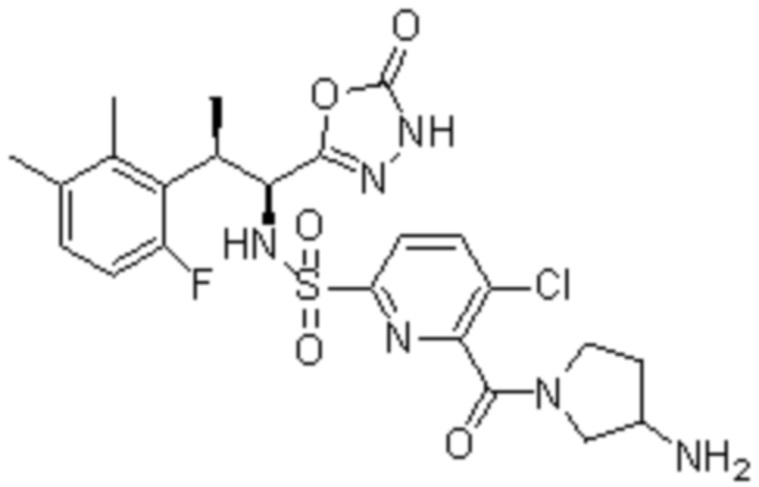
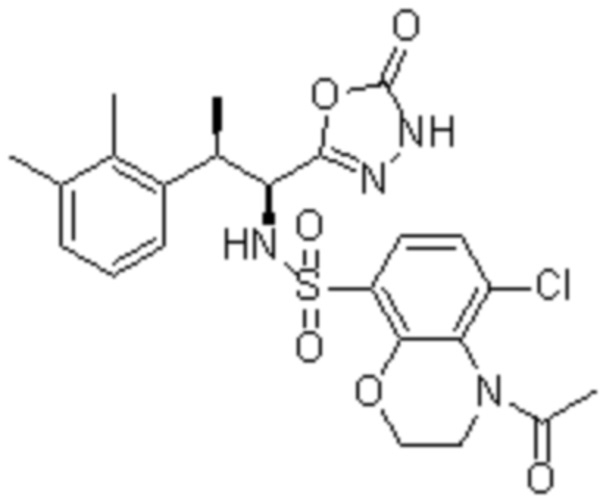
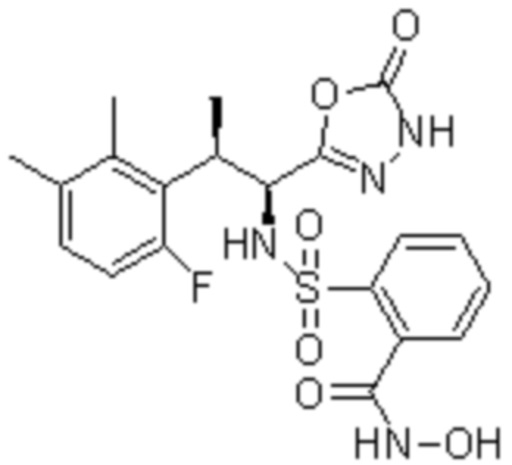
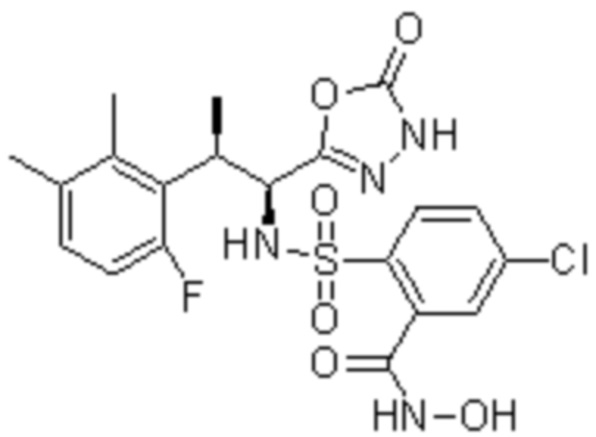
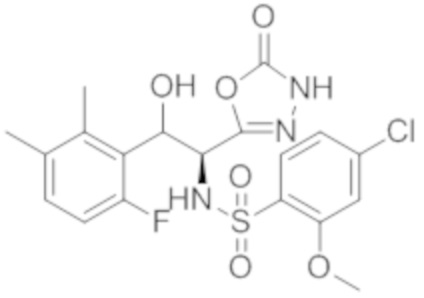
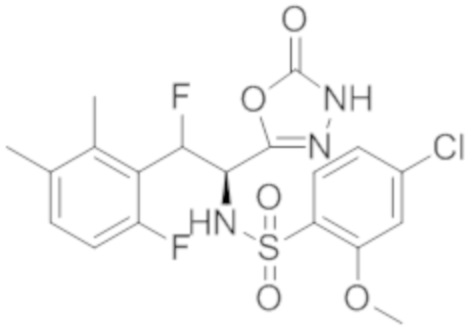
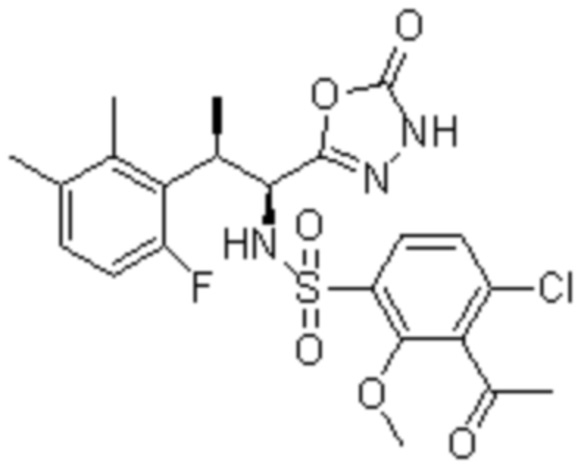
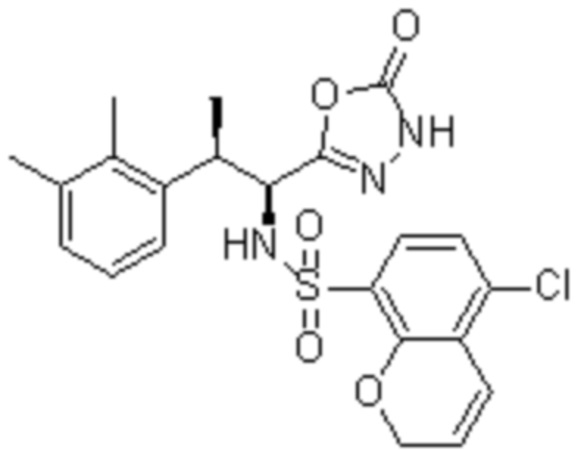
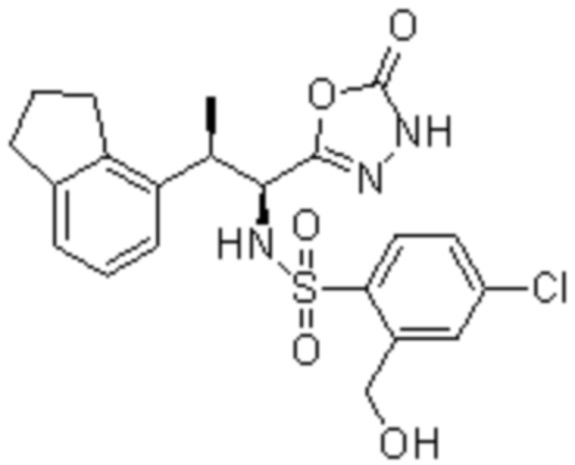
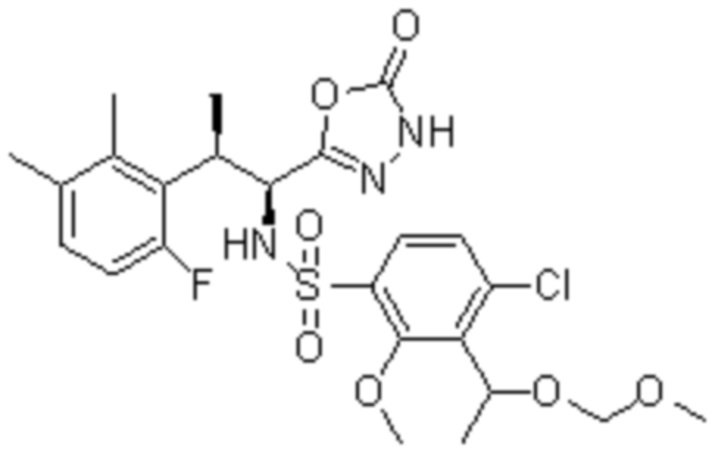
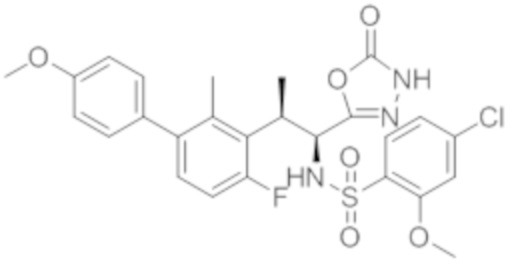
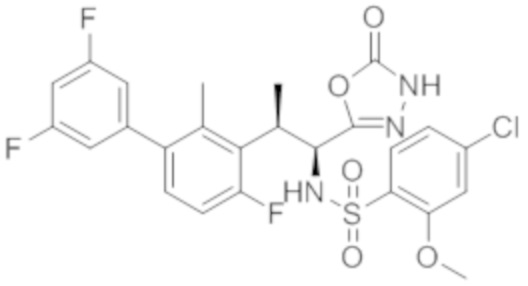
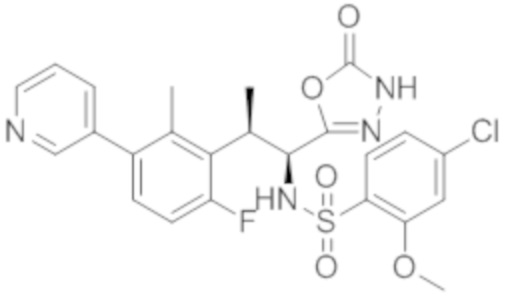
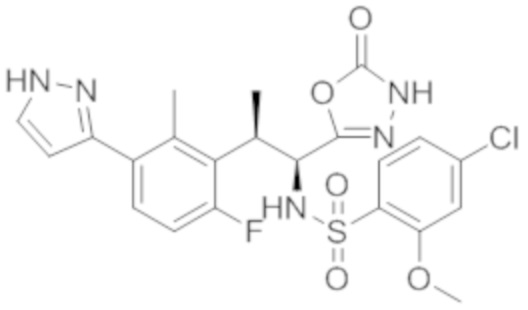
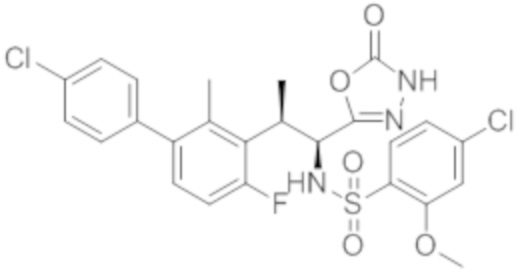
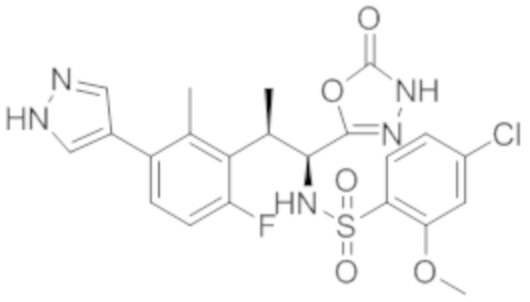
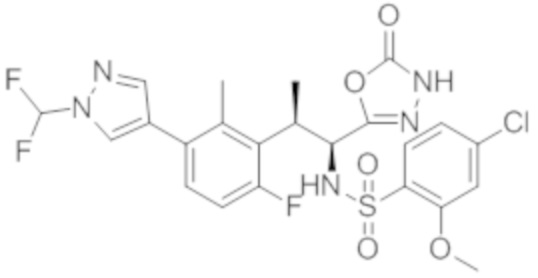
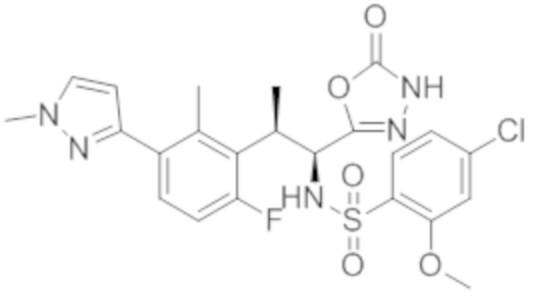
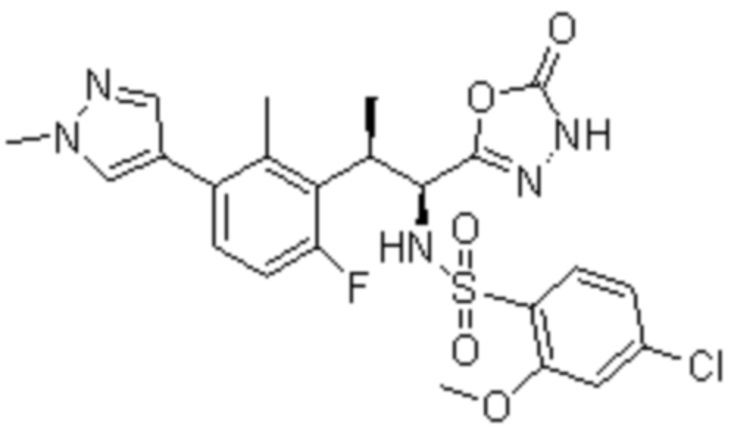
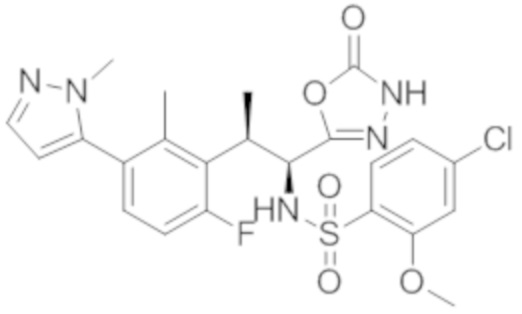
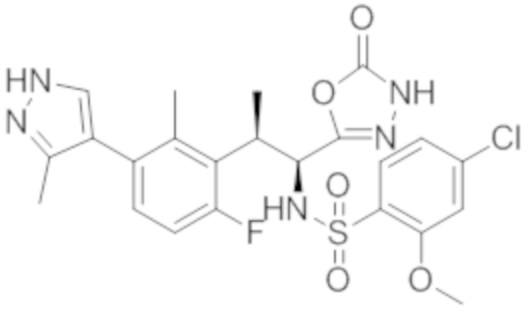
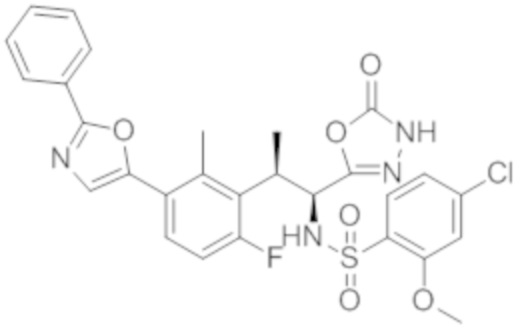
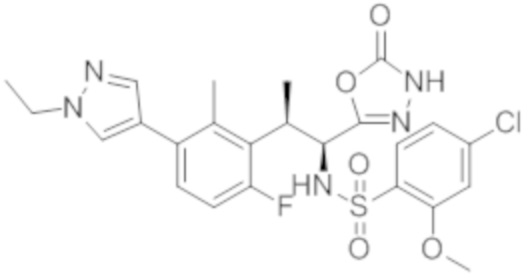
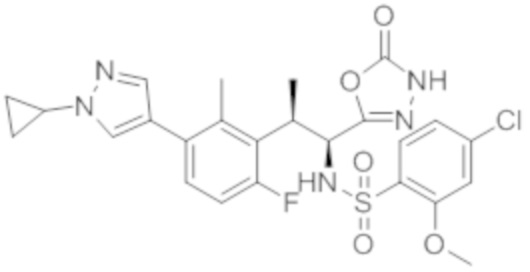
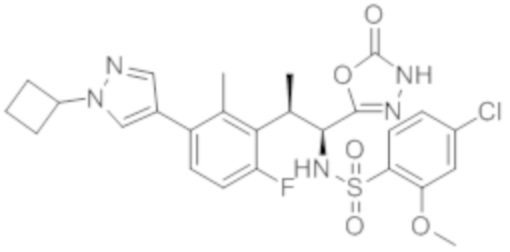
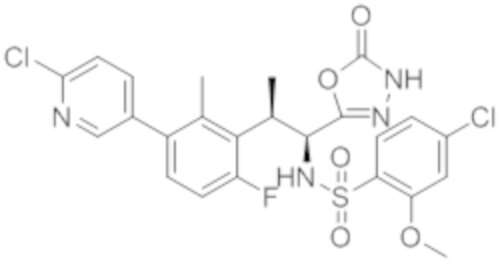
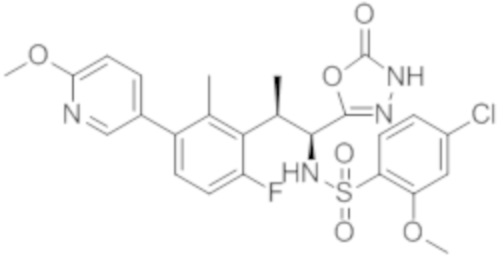
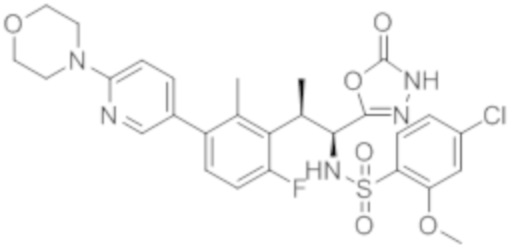
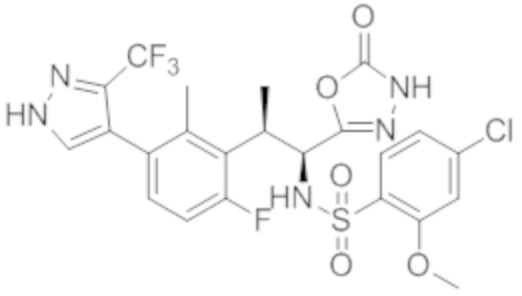
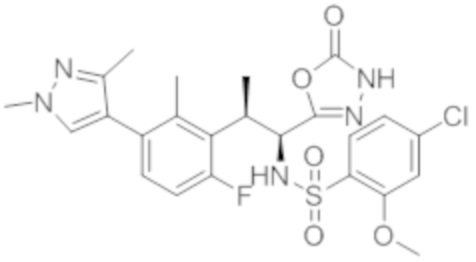
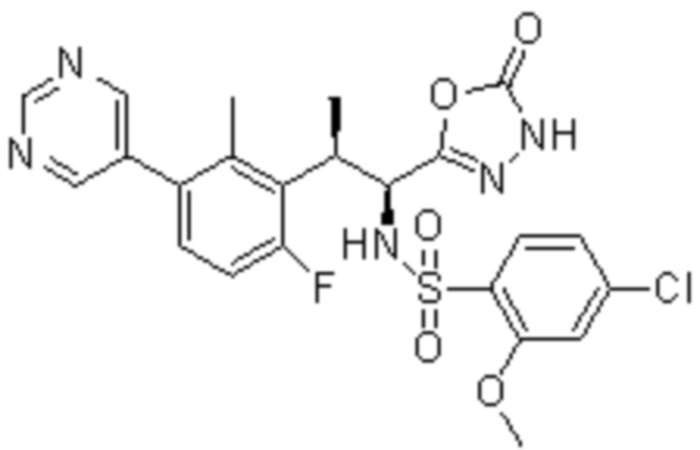
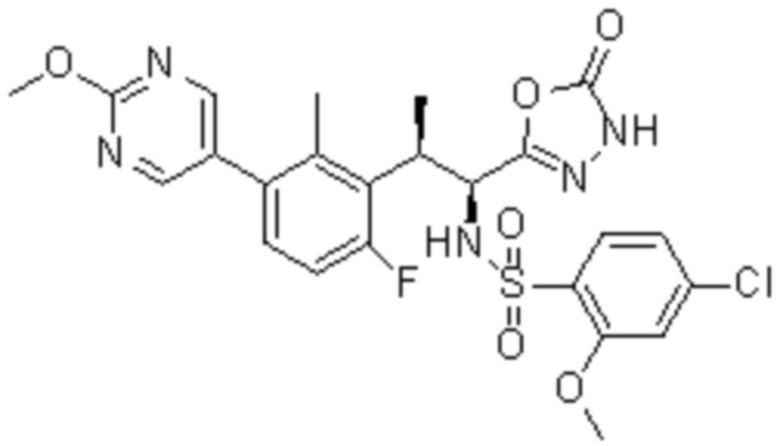
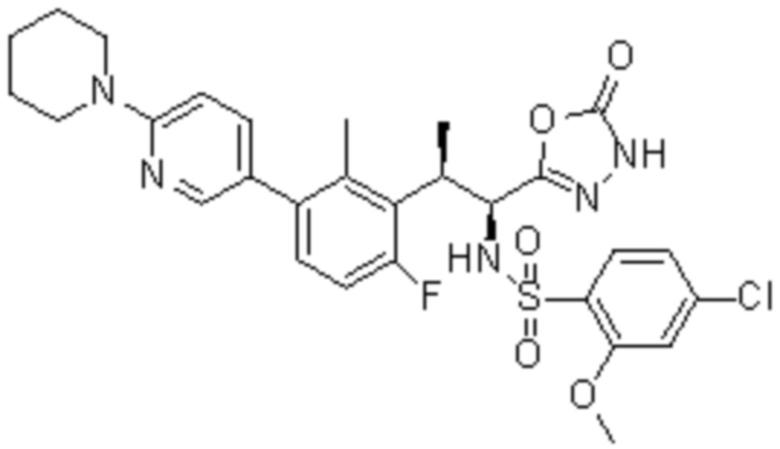
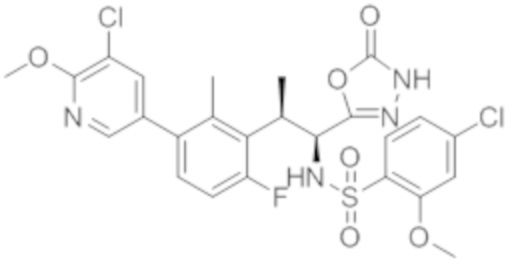
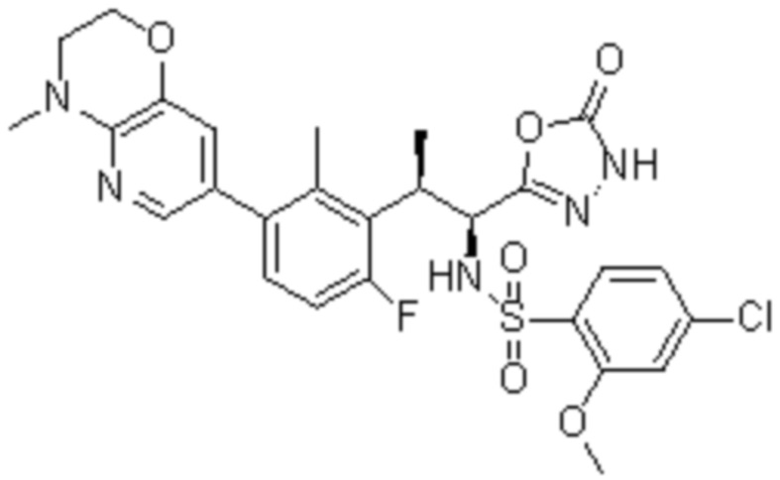
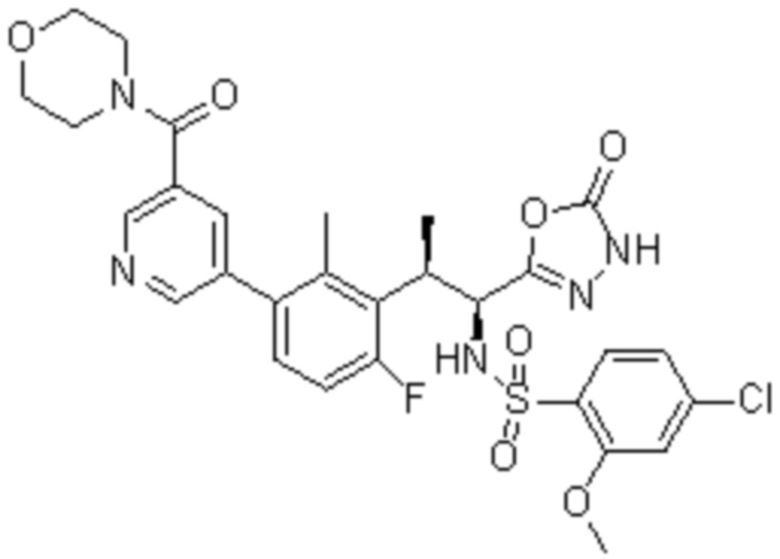
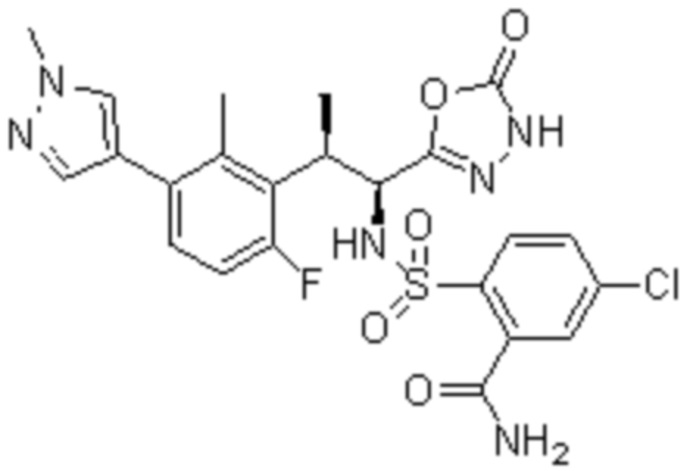
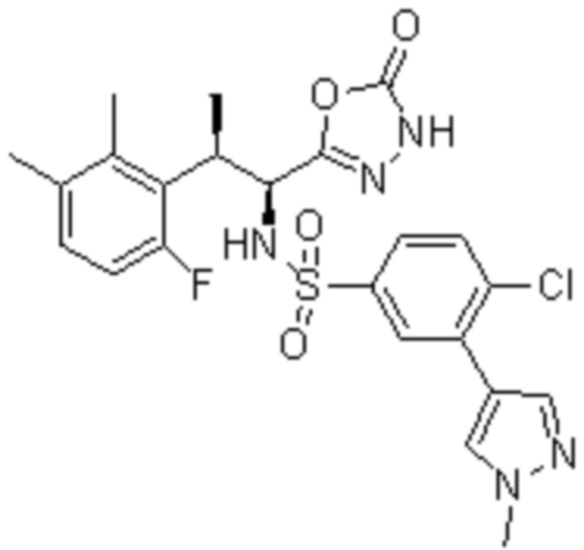
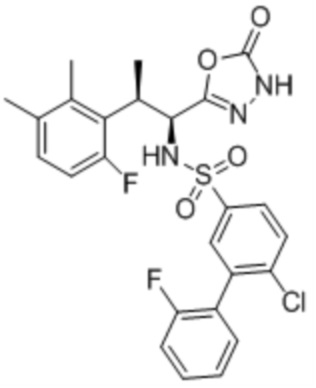
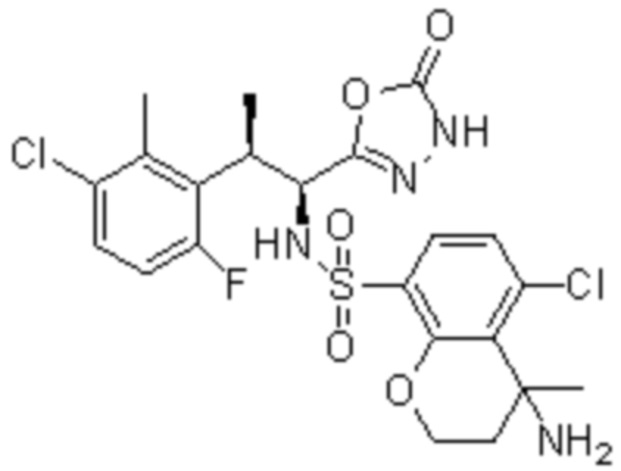

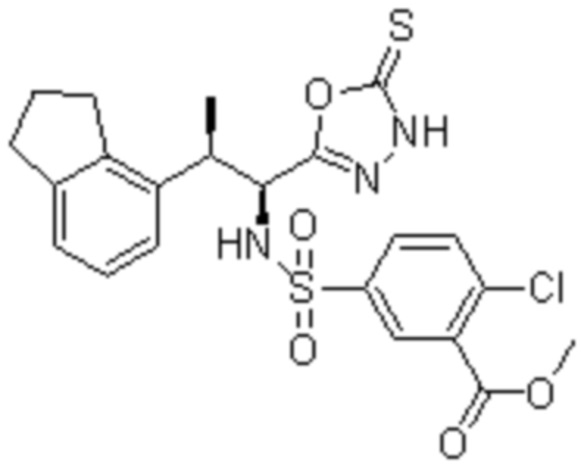
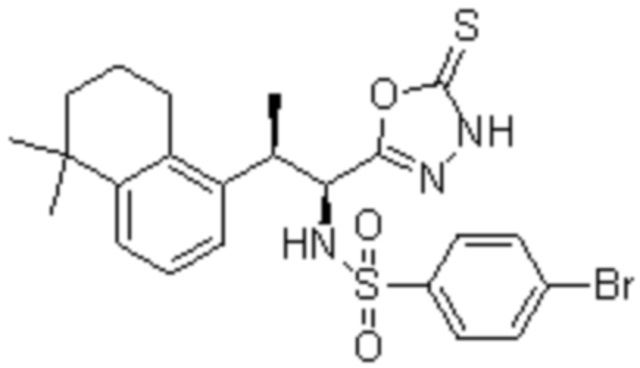
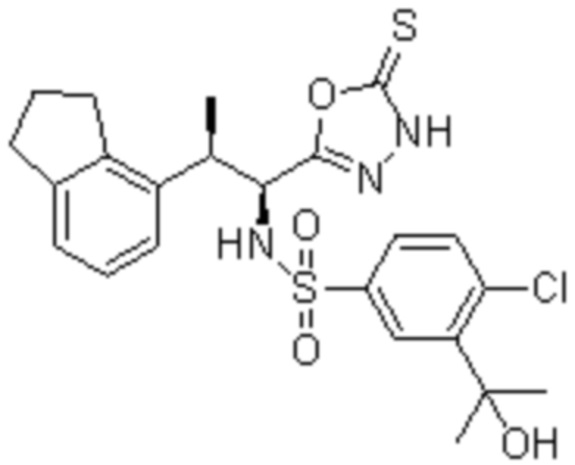
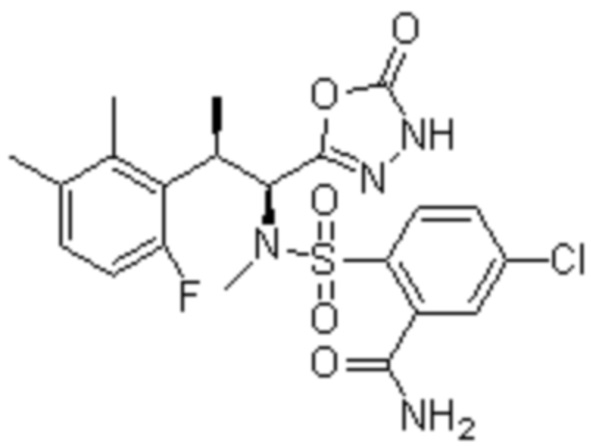
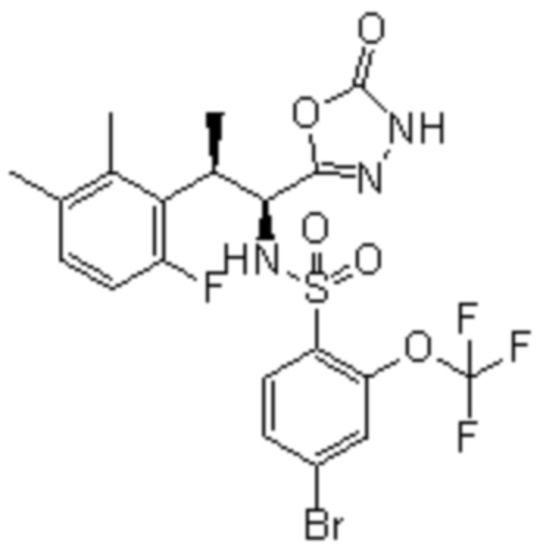
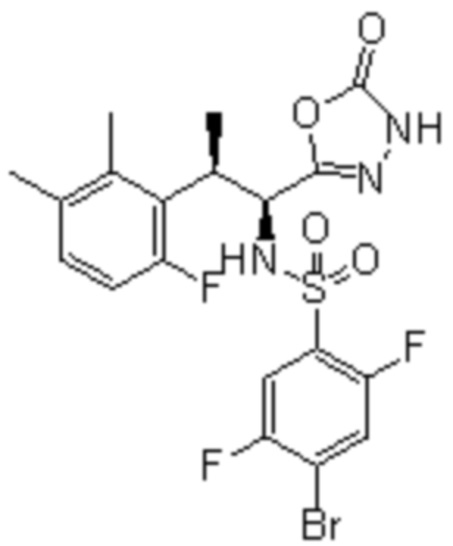
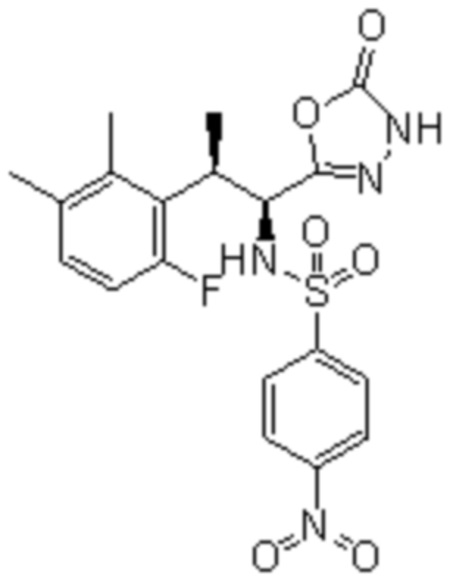
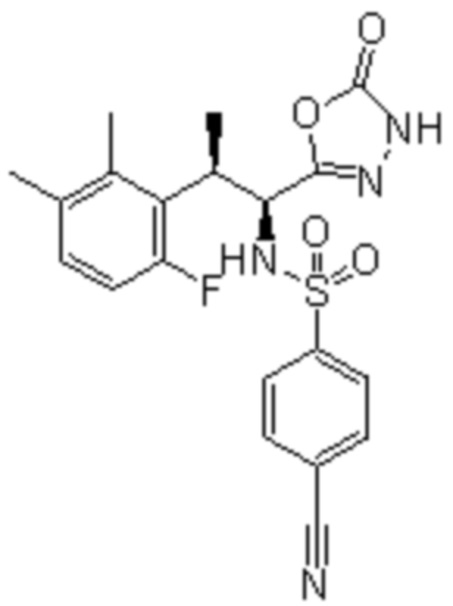
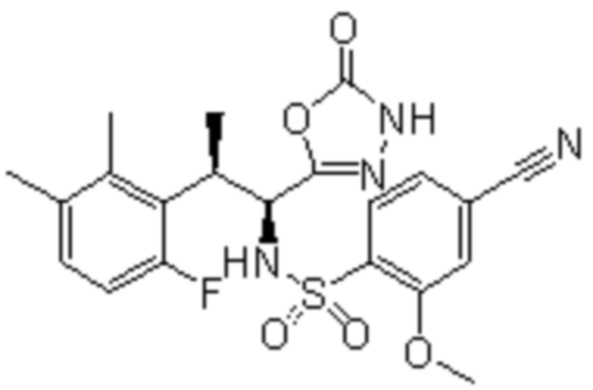
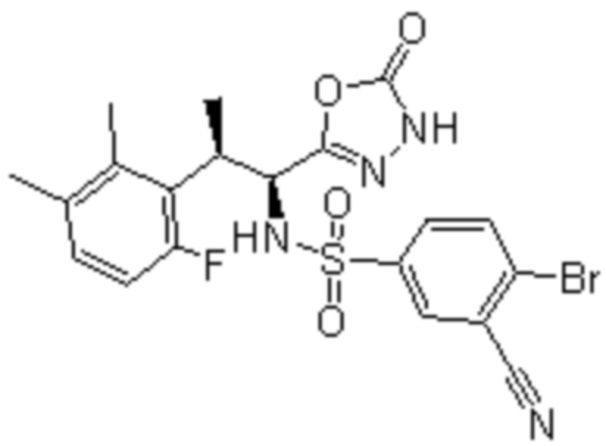
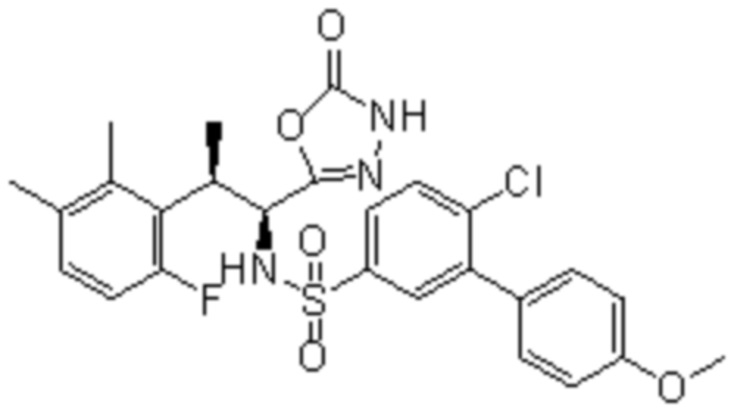
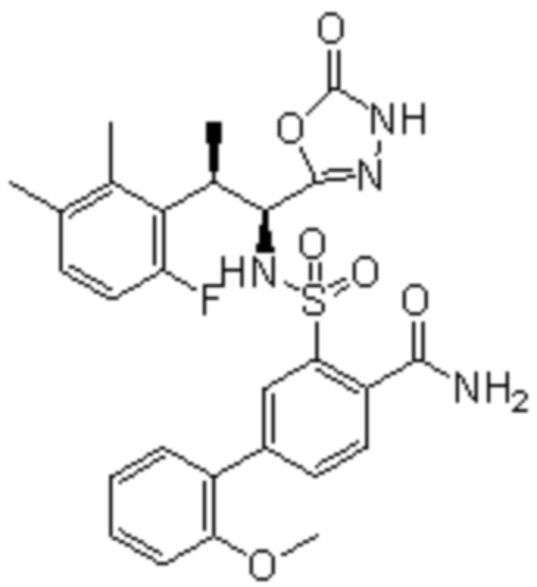
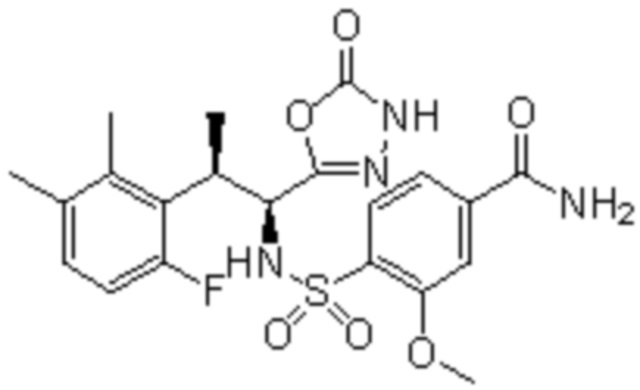
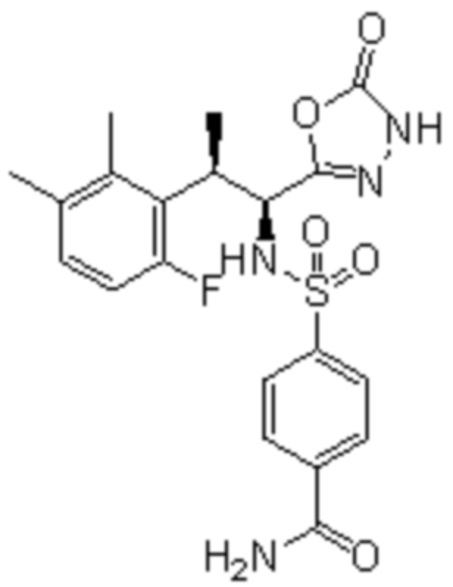
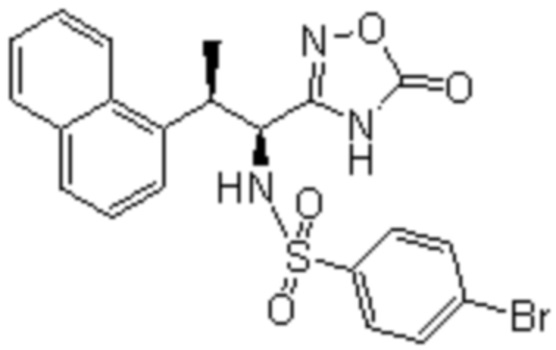
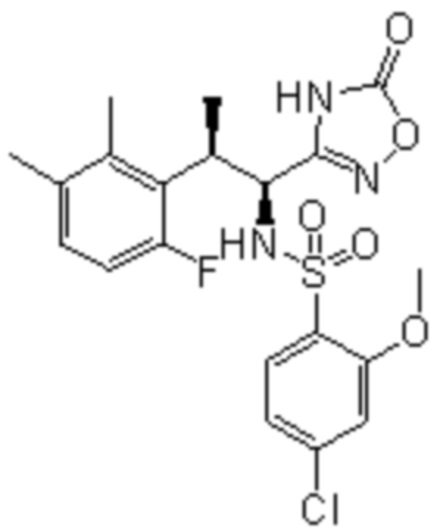
[0521]
Пример исследования
Соединение в соответствии с настоящим изобретением оценивали с использованием следующего метода исследований.
[0522]
[Пример исследования 1. Ингибирующее RNR человека действие]
Ингибирующую активность в отношении реакции восстановления рибонуклеотида (далее называемая реакцией RNR) соединение примера определяли путем определения образования деоксицитидиндифосфата (далее называемого dCDP) из цитидиндифосфата (далее называемого CDP) следующим способом.
Субъединицу M1 человека (изоформа 1, регистрационный номер GenBank: NM_001033), с которой слит гистидин на аминоконце, и субъединицу M2 человека (мутант, лишенный аминоконцевых 59 аминокислот изоформы 2, регистрационный номер GenBank: NM_001034), с которой слит гистидин, сверхэкспрессировали в Escherichia coli и солюбилизировали после сбора, и меченные гистидином белки M1 и M2 человека очищали на никель-хелатной колонке. Смесь меченных гистидином белков M1 и M2 человека использовали в качестве RNR в реакции восстановления рибонуклеотида.
[to]
Для определения ингибирующей активности соединения примера в отношении реакции восстановления рибонуклеотида был указан метод, описанный в документе [CANCER RESEARCH 64, 1-6, 2004].
Сначала соединение примеров серийно разбавляли ДМСО. Затем белок M1 человека и белок M2 человека добавляли к 0,02%-ному водному раствору альбумина, полученному из фетальной бычьей сыворотки, добавляли раствор в ДМСО соединения примера или контрольный раствор ДМСО (конечная концентрация ДМСО составляла 1%), и смесь оставляли стоять в течение 20 минут. После этого добавляли реакционный буфер [50 мМ буфера HEPES (рН 7,2) при конечной концентрации, 4 мМ ацетата магния при конечной концентрации, 100 мМ хлорида калия при конечной концентрации, 6 мМ дитиотреитола при конечной концентрации, 2 мМ аденозинтрифосфата при конечной концентрации, 0,24 мМ никотинамидадениндинуклеотидфосфата при конечной концентрации] и 10 мкМ CDP при конечной концентрации и инкубировали при 37°С в течение 30 минут для проведения реакции восстановления рибонуклеотида. Сразу же после взаимодействия реакцию останавливали нагреванием при 100°С в течение 15 минут с последующим центрифугированием при 10000 об/мин в течение 10 минут. После центрифугирования часть (5 мкл) полученного супернатанта анализировали с помощью высокоэффективной жидкостной хроматографии (Shimadzu Corporation, Prominence) с использованием Shim-pack XR-ODS (производства Shimadzu GLC Co., 3,0×100 мм). Элюирование осуществляли с измерением на длине волны 265 нм со скоростью потока 0,5 мл/мин с помощью 9-минутного градиента концентрации от смеси 12:13 подвижной фазы А (10 мМ дигидрофосфата калия (рН 6,7), 10 мМ тетрабутиламмония, 0,25% метанола) и подвижной фазы В (50 мМ дигидрофосфата калия (рН 6,7), 5,6 мМ тетрабутиламмония, 30% метанола) до той же смеси 2:3 для измерения субстрата CDP (RT 5,9 мин) и продукта реакции dCDP (RT 6,2 мин).
[0524]
Ингибирующую активность соединения примера was определяли согласно следующему уравнению, и концентрации исследуемых соединений, ингибирующих реакцию RNR на 50%, показаны как IC50 мкМ) в таблице 22.
[0525]
[Математическая формула 1]
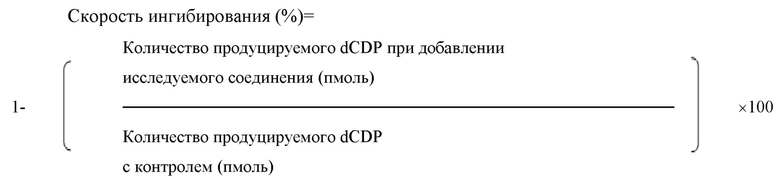
[0526]
В результате из следующей таблицы видно, что сульфонамидное соединение, представленное формулой (I) обладает превосходным ингибирующим RNR действием.
[0527]
[Таблица 22]
ингибирующая активность IC50 (мкМ)
ингибирующая активность IC50 (мкМ)
ингибирующая активность IC50 (мкМ)
ингибирующая активность IC50 (мкМ)
ингибирующая активность IC50 (мкМ)
ингибирующая активность IC50 (мкМ)
ингибирующая активность IC50 (мкМ)
ингибирующая активность IC50 (мкМ)
ингибирующая активность IC50 (мкМ)
ингибирующая активность IC50 (мкМ)
[0528]
[Пример исследования 2. Ингибирующее клеточную пролиферацию действие на линию клеток рака молочной железы]
Клетки клеточной линии HCC 1806 рака молочной железы человека (American Type Culture Collection, ATCC) ежедневно пассировали при плотности клеток, не превышающей 80% в среде ATCC, рекомендованной Roswell Park Memorial Institute (RPMI-1640), содержащей 10% фетальной бычьей сыворотки (FBS). Для того, чтобы начать исследование ингибирующей пролиферацию клеток активности, клетки HCC 1806 суспендировали в вышеуказанной среде, распределяя при 180 мкл в каждой лунке 96-луночного планшета с плоским дном, так что количество клеток на лунку составляло 2000, клетки культивировали при 37°С в течение 1 дня в инкубаторе, содержащем 5% газообразного диоксида углерода.
[0529]
На следующий день соединение примера растворяли и в каждую лунку культурального планшета для клеток добавляли по 20 мкл раствора с добавкой лекарственного средства, разбавленного последовательно дистиллированной водой в 10 раз конечной концентрации, и клетки культивировали при температуре 37°С в течение 72 часов в инкубаторе, содержащем 5% углекислого газа. После культивирования в течение 72 часов в каждую лунку добавляли 20 мкл глутаральдегида и оставляли на 30 минут, затем планшет промывали 10 раз водой и сушили. В каждую лунку добавляли 100 мкл раствора красителя (0,05% кристаллического фиолетового в 20% метанольном растворе) и оставляли на 30 минут, затем планшет промывали 10 раз водой и сушили. В каждую лунку добавляли 100 мкл экстрагирующего раствора (0,1н NaH2 PO4:100% этанол=1:1) и перемешивали, и смесь измеряли на длине волны 540 нм с использованием планшетного ридера (MTP-450 производства Corona Electric Co., Ltd.).
[0530]
Скорость ингибирования роста рассчитывали по следующей формуле и определяли концентрацию (IC50 (мкМ)) исследуемого соединения, ингибирующую на 50%. Результаты представлены в таблице 23.
Скорость ингибирования роста (%)={(CB)-(TB)}/(CB)×100
T: поглощение лунки, в которую добавляли соединение примера
C: поглощение лунок, в которые не было добавлено соединение примера
B: поглощение лунок, в которым не добавляли клеточную суспензию
В результате, как видно из следующей таблицы 23, было обнаружено, что все сульфонамидные соединения, представленные формулой(I), обладают ингибирующей рост активностью в отношении клеток рака молочной железы человека.
[0531]
[Таблица 23]
[0532]
[Пример исследования 3. Ингибирующее пролиферацию клеток действие на раковые клеточные линии рака человека]
В соответствии со способом примера исследования 2, оценивали ингибирующее пролиферацию клеток действие на различных линиях раковых клеток, как представлено в таблице 24. Клетки NCI-H460, CFPAC-1, MSTO-211H, DU145, ACHN, HCT116, NCI-H2228 и NCI-H2170 были приобретены у компании ATCC, клетки A2780 и RPMI7932 были приобретены у компании European Collection of Cell Cultures, клетки GB-1 и HLE были приобретены у компании JCRB Cell Bank, клетки A673 были приобретены у компании DS Pharma Biomedical Co., Ltd., и клетки NUGC-3 были приобретены у компании Health Science Research Resources Bank.
В результате, как видно из следующей таблицы, было обнаружено, что сульфонамидные соединения, представленные формулой (I) обладают ингибирующей рост активностью в отношении различных видов раковых клеток человека.
[0533]
[Таблица 24]
[0534]
[Пример исследования 4. Оценка противоопухолевого эффекта с использованием клеточной линии рака крови человека (MV-4-11) Модель подкожной трансплантации (in vivo)]
Клеточную линию рака крови человека MV-4-11 трансплантировали подкожно голой мыши (BALB/cA Jcl-nu/nu, CLEA Japan, Inc.), и в то время, когда объем опухоли у голой мыши, которой привита опухоль, достигал от 100 до 300 мм3, случайным образом распределяли в группы по четыре мыши, так что средние объемы опухолей в каждой группе были равномерными (день 0), и ежедневно со скоростью 100 мг/кг/день перорально вводили соединение примера один раз в день в течение 14 дней. Дозирующие растворы соединения примера были получены с использованием 0,5% HPMC.
[0535]
Для определения массы использовали электрические весы для животных. Скорость изменения массы тела в день n (BWCn) от массы тела в день n (BWn) рассчитывали в соответствии со следующим уравнением.
Скорость изменения массы тела BWCn (%)=(BWn-BW0)/BW0×100
[0536]
Объем опухоли (TV) рассчитывали по следующему уравнению послойно и измеряя большую ось и малую оси с помощью цифрового штангенциркуля.
Объем опухоли (мм3) = Большая ось (мм)×Малая ось (мм)×Малая ось (мм)/2
Чтобы сравнить хронологическую трансформацию пролиферации опухоли при введении каждого соединения, относительный объем опухоли (RTV), устанавливающий объем опухоли на момент распределения как 1, скорость пролиферации опухоли рассчитывали в соответствии со следующей формулой, и трансформация среднего значения RTV каждого индивидуума показан на фигурах от 1 до 4.
RTV= объем опухоли в день измерения объема опухоли)/(объем опухоли на момент распределения)
[0537]
Когда среднее значение RTV для группы, которой вводили соединение по настоящему изобретению, в день окончательной оценки меньше среднего значения RTV для контрольной группы, и когда показана статистически значимая разница (тест Стьюдента-t), то соединение примера определяется как являющееся значительно эффективным, и статически значимая разница отмечена на фигуре значком * (*: p <0,05).
В результате было обнаружено, что все сульфонамидные соединения, представленные формулой (I), демонстрирует значительный противоопухолевый эффект.
[0538]
[Пример исследования 5. Демонстрация эффекта комбинации сульфонамидного соединения и другого противоопухолевого агента]
Дистрибьюторы реагентов, дистрибьюторы линий опухолевых клеток, сред и ряда клеток, подлежащих посеву, используемых в этом примере исследования, показаны в следующих таблицах 25 и 26.
[0539]
[Таблица 25]
[0540]
[Таблица 26]
[0541]
Каждую клеточную линию высевали при 90 мкл/лунку в 96-луночный культуральный планшет (Thermo Fisher Scientific, Inc.) в соответствии с приведенными выше таблицами Планшет с посевными клетками культивировали в инкубаторе с температурой 37°C и 5% CO2. На следующий день после посева к клеткам добавляли различные концентрации сульфонамидного соединения и другого противоопухолевого агента. В частности, было приготовлено десять серийных разведений (включая 0 нМ) в отношении сульфонамидного соединения (соединения примеров 1, 5, 14, 209А и 235А) и другого противоопухолевого агента с использованием дистиллированной воды Otsuka (Otsuka Pharmaceutical Factory; далее именуемой как DW). Последовательные разведения каждого соединения или DW добавляли при 5 мкл/лунку в планшет так, чтобы каждое соединение и DW, или сульфонамидное соединение и другой противоопухолевый агент были объединены. Общее соотношение концентраций составляло 1,5 для всех лекарственных средств, и самая высокая концентрация (указанная конечной концентрацией) каждого соединения, добавленного к каждой клеточной линии, показана в следующих таблицах 27-30. Планшет после добавления культивировали при 37°C в течение 3 дней в условиях5% CO2.
Три дня спустя добавляли реагент CellTiter-Glo® (Promega Corporation) при 100 мкл/лунку и измеряли величину люминесценции с использованием планшет-ридера EnSpire(R) Multimode Plate Reader (PerkinElmer Co., Ltd.).
[0542]
[Таблица 27]
[Таблица 28]
[Таблица 29]
[Таблица 30]
[[0543]
Усиление эффекта при комбинированном использовании лекарственных средств оценивали в соответствии со способом, описанным в известных документах (Trends Pharmacol. Sci. 4, 450-454, 1983; и Pharmacol. Rev. 58 (3), 621-681, 2006).
На основании полученных данных рассчитывали среднее значение для 3 лунок для каждого состояния лекарственного средства и рассчитывали выживаемость клеток, нормализованную по отношению к контрольным лункам, заполненным несущей средой (DW). A Fa (fractional inhibition) value was calculated by subtracting the cell survival rate from 1. Значение Fa (дробного ингибирования) рассчитывали путем вычитания коэффициента выживаемости клеток из 1. Значение Fa концентрации, при которой сохранялось 0,01 <Fa <0,999, и линейный коэффициент корреляции r графика медианного эффекта был больше 0,92, вводили в программу анализа эффекта введения лекарственного средства CalcuSyn Version 2.0 (Biosoft) на основе метода медианного эффекта для расчета значения индекса комбинации (CI) (Synergy 1,3-21,2014).
Комбинаторный эффект определяли в соответствии со следующей таблицей31 (Pharmacol. Rev. 58 (3), 621-681, 2006).
[0544]
[Таблица 31]
[0545]
Результаты показаны в следующих таблицах 32-51.
[0546]
[Таблица 32]
[0547]
[Таблица 33]
[0548]
[Таблица 34]
[0549]
[Таблица 35]
[0550]
[Таблица 36]
[0551]
[Таблица 37]
[0552]
[Таблица 38]
[0553]
[Таблица 39]
[0554]
[Таблица 40]
[0555]
[Таблица 41]
[0556]
[Таблица 42]
[0557]
[Таблица 43]
[0558]
[Таблица 44]
[0559]
[Таблица 45]
[0560]
[Таблица 46]
[0561]
[Таблица 47]
[0562]
[Таблица 48]
[0563]
[Таблица 49]
[0564]
[Таблица 50]
[0565]
[Таблица 51]
[0566]
Из этих результатов очевидно, что все сульфонамидные соединения, представленные формулой (I), синергически ингибируют рост линии клеток рака легкого человека, линии клеток рака крови человека, линии клеток рака поджелудочной железы человека и линии клеток рака толстой кишки человека при использовании в сочетании с любым из различных противоопухолевых агентов, включая антиметаболит, препарат платины, препарат на основе растительных алкалоидов, и молекулярно-таргетный препарат.
[0567]
Кроме того, в последний день оценки группы комбинированного введения сульфонамидного соединения, представленного формулой (I), и другого противоопухолевого агента в тесте in vivo с использованием голых мышей (BALB/cA Jcl-nu/nu), которым трансплантировали опухолевые клетки человека, показали статистически значимое противоопухолевый эффект по сравнению с группами, получавшими отдельное введение каждого лекарственного средства. Кроме того, скорость изменения массы тела в группах с комбинированным введением составляла менее 20% от массы тела до введения (в день 0) и изменялась в приемлемом диапазоне.
[0568]
Все публикации, патенты и патентные заявки, процитированные в настоящем документе, включены в настоящий документ посредством ссылки во всей их полноте.
| название | год | авторы | номер документа |
|---|---|---|---|
| СУЛЬФОНАМИДНОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ | 2017 |
|
RU2732572C2 |
| СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2781383C2 |
| ГЕТЕРОАРОМАТИЧЕСКИЕ МОДУЛЯТОРЫ РЕТИНОЛ-СВЯЗАННОГО ОРФАННОГО РЕЦЕПТОРА ГАММА | 2017 |
|
RU2771280C2 |
| НОВОЕ ПРОИЗВОДНОЕ ФЕНИЛПИРРОЛА | 2009 |
|
RU2470917C2 |
| КОНДЕНСИРОВАННОЕ ХИНОЛИНОВОЕ ПРОИЗВОДНОЕ И ЕГО ПРИМЕНЕНИЕ | 2005 |
|
RU2384571C2 |
| СОЕДИНЕНИЯ 2, 4-ПИРИМИДИНДИАМИНА, ОБЛАДАЮЩИЕ ВОЗДЕЙСТВИЕМ ПРИ АУТОИММУННЫХ РАССТРОЙСТВАХ | 2004 |
|
RU2356901C2 |
| ДИАМИНОВЫЕ ПРОИЗВОДНЫЕ | 2003 |
|
RU2333203C2 |
| ПРОИЗВОДНЫЕ ГИДРОКСАМОВОЙ ИЛИ КАРБОНОВОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ ИЛИ ВЕТЕРИНАРНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2136657C1 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ С ПОМОЩЬЮ СОЕДИНЕНИЙ 2,4-ПИРИМИДИНДИАМИНА | 2013 |
|
RU2659777C2 |
| ЦИКЛОАЛКАНОВОЕ ПРОИЗВОДНОЕ | 2013 |
|
RU2635354C2 |
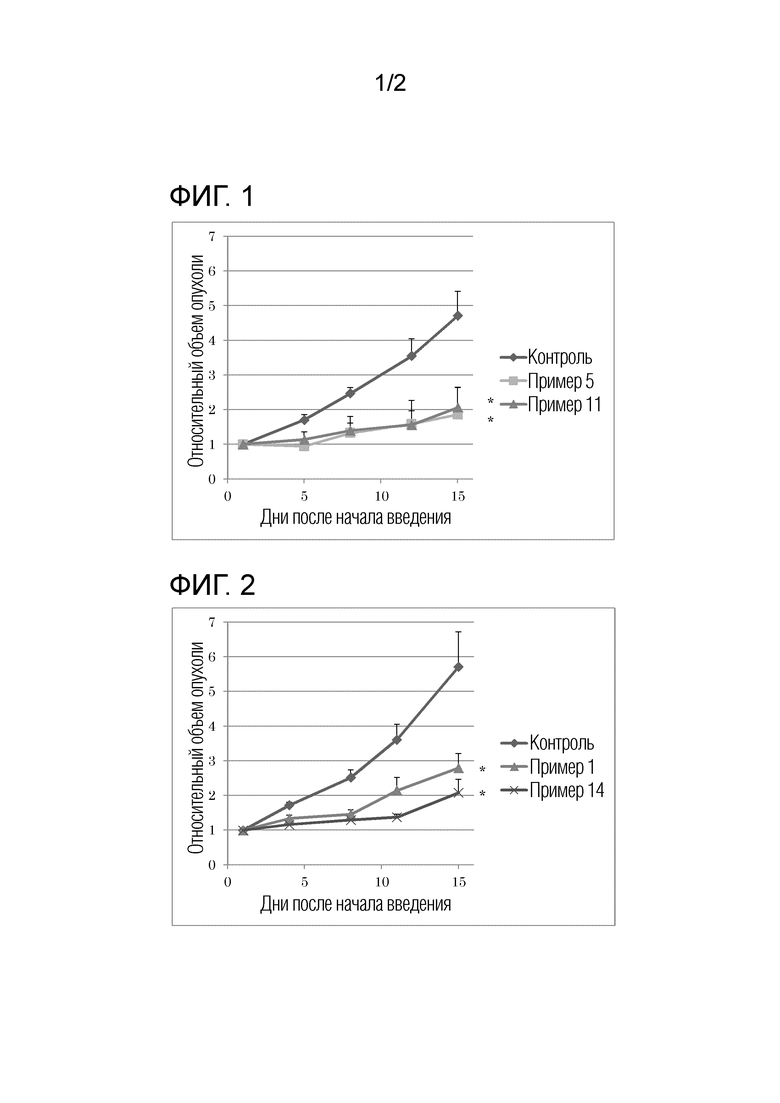
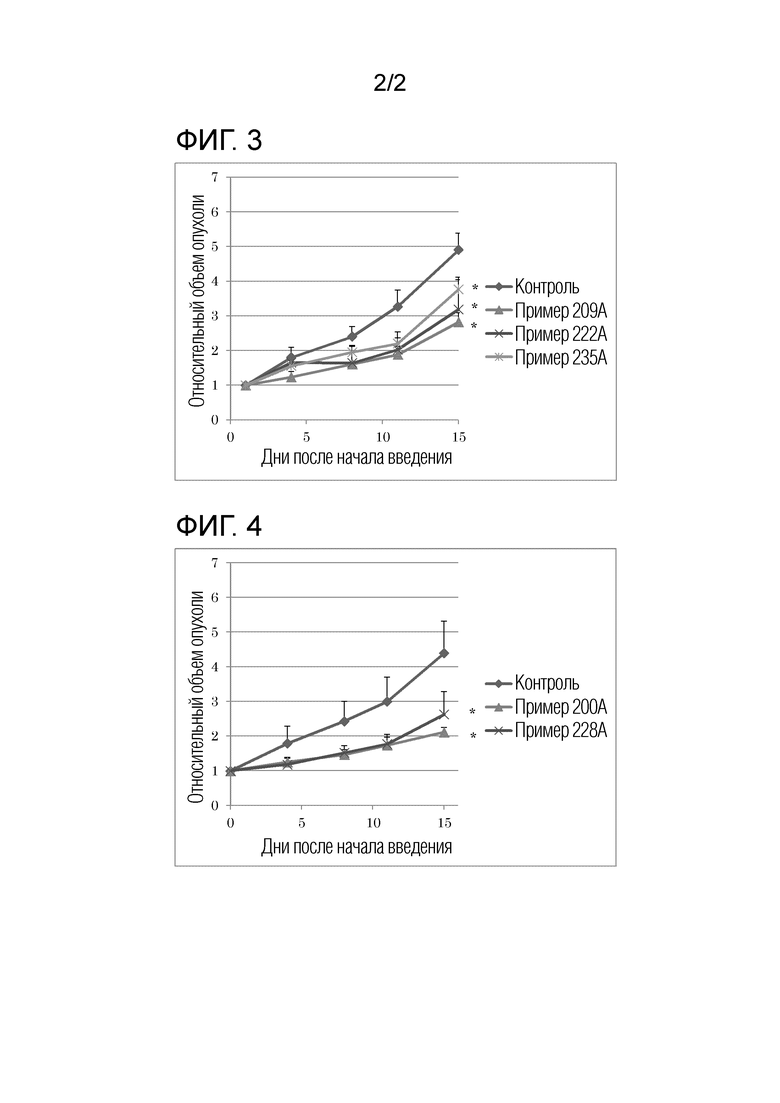
Группа изобретений относится к области медицины и фармацевтики и касается сульфонамидных соединений для лечения и/или предотвращения опухоли. Для этого разработана фармацевтическая композиция, содержащая эффективное количество сульфонамидного соединения, представленного формулой (I), где X1 представляет собой атом кислорода; X2 представляет собой атом кислорода; X3 представляет собой -NH-; X4 представляет собой атом водорода; R1 представляет собой -C(R11)(R12)-; один из R11 и R12 представляет собой атом водорода, а другой представляет собой метильную группу; R2 представляет собой фенильную группу, имеющую R21 в качестве заместителя; R21 представляет собой атом галогена или C1-C6 алкильную группу (когда присутствуют два или более из R21, R21 являются одинаковыми или отличаются друг от друга); R3 представляет фенильную группу, имеющую R31 в качестве заместителя, или хроманильную группу, имеющую Rc в качестве заместителя; R31 представляет собой атом галогена или аминокарбонильную группу (когда присутствуют два или более из R31, R31 являются одинаковыми или отличаются друг от друга); Rc представляет собой атом галогена, гидроксигруппу или C1-C6 алкильную группу (когда присутствуют два или более из Rc, Rc являются одинаковыми или отличаются друг от друга) и R4 представляет собой атом водорода; или его фармацевтически приемлемую соль и по меньшей мере другой противоопухолевый агент. Также раскрыты агент для усиления противоопухолевого эффекта другого противоопухолевого агента, противоопухолевый агент для лечения больного раком, получающего другой противоопухолевый агент, сульфонамидное соединение и способы лечения и/или предотвращения рака. Полученные соединения обладают активностью ингибирования рибонуклеотидредуктазы (RNR) и усиливают противоопухолевый эффект при совместном использовании с другим соединением, обладающим противоопухолевым эффектом. 16 н. и 20 з.п. ф-лы, 4 ил., 51 табл., 355 пр.
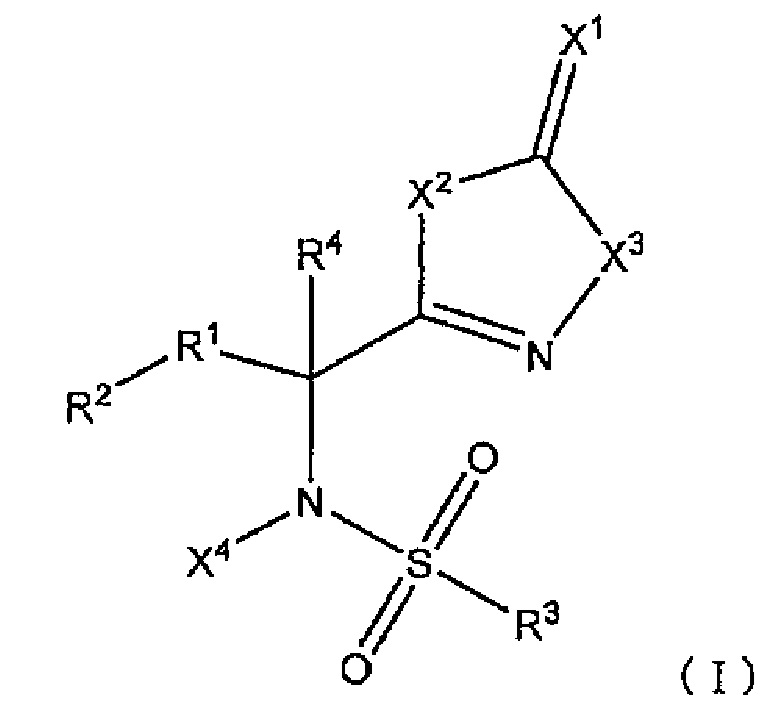
1. Фармацевтическая композиция для применения при лечении и/или предотвращении опухоли путем введения с другим противоопухолевым агентом(ами), содержащая эффективное количество сульфонамидного соединения, представленного следующей формулой (I):
[Формула 1]
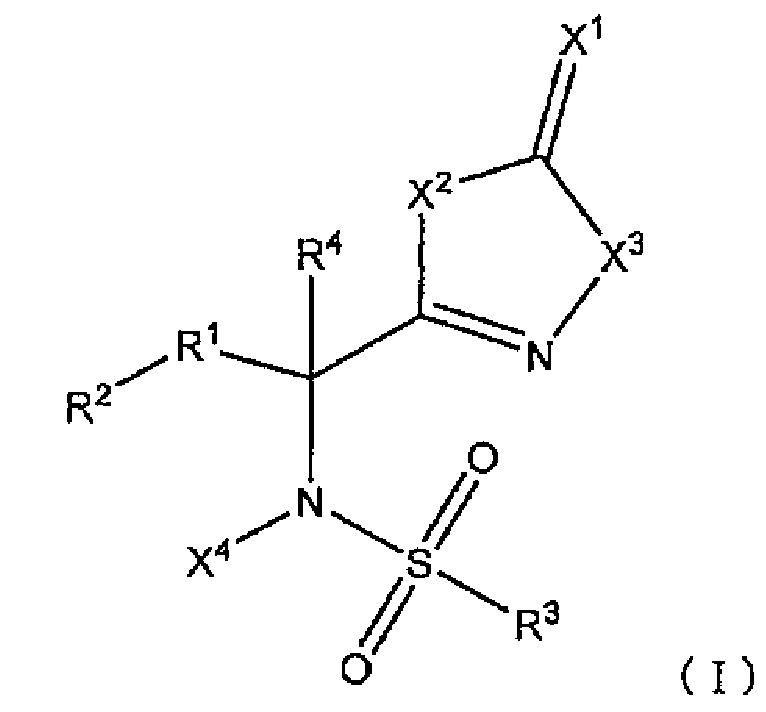
где X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12)-;
один из R11 и R12 представляет собой атом водорода, а другой представляет собой метильную группу;
R2 представляет собой фенильную группу, имеющую R21 в качестве заместителя;
R21 представляет собой атом галогена или C1-C6 алкильную группу (когда присутствуют два или более из R21, R21 являются одинаковыми или отличаются друг от друга);
R3 представляет фенильную группу, имеющую R31 в качестве заместителя, или хроманильную группу, имеющую Rc в качестве заместителя;
R31 представляет собой атом галогена или аминокарбонильную группу (когда присутствуют два или более из R31, R31 являются одинаковыми или отличаются друг от друга);
Rc представляет собой атом галогена, гидроксигруппу или C1-C6 алкильную группу (когда присутствуют два или более из Rc, Rc являются одинаковыми или отличаются друг от друга); и
R4 представляет собой атом водорода;
или его фармацевтически приемлемой соли,
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
2. Фармацевтическая композиция по п. 1, содержащая другой противоопухолевый агент(ы).
3. Фармацевтическая композиция по п. 1 или 2, где сульфонамидное соединение выбрано из следующих соединений (1)-(5):
(1) 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(2) 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(3) 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(4) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамид; и
(5) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид.
4. Фармацевтическая композиция по любому из пп. 1-3, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводятся одновременно, последовательно или в шахматном порядке.
5. Фармацевтическая композиция по любому из пп. 1-4, где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из 5-фторурацила (5-FU), трифлуридина, флударабина (или активного метаболита флударабина нуклеозида), цитарабина, гемцитабина, децитабина, гуадецитабина, азацитидина, цисплатина, оксалиплатина, карбоплатина, этопозида, AZD6738, прексасертиба, SCH900776, люминеспиба, олапариба, талазопариба, лапатиниба, сунитиниба, кабозантиниба и мидостаурина.
6. Агент для усиления противоопухолевого эффекта другого противоопухолевого агента(ов), содержащий сульфонамидное соединение, представленное следующей формулой (I):
[Формула 3]

где X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12)-;
один из R11 и R12 представляет собой атом водорода, а другой представляет собой метильную группу;
R2 представляет собой фенильную группу, имеющую R21 в качестве заместителя,
R4 представляет собой атом водорода;
R21 представляет собой атом галогена или C1-C6 алкильную группу (когда присутствуют два или более из R21, R21 являются одинаковыми или отличаются друг от друга);
R3 представляет фенильную группу, имеющую R31 в качестве заместителя, или хроманильную группу, имеющую Rc в качестве заместителя;
R31 представляет собой атом галогена или аминокарбонильную группу (когда присутствуют два или более из R31, R31 являются одинаковыми или отличаются друг от друга);
Rc представляет собой атом галогена, гидроксигруппу или C1-C6 алкильную группу (когда присутствуют два или более из Rc, Rc являются одинаковыми или отличаются друг от друга),
или его фармацевтически приемлемую соль в качестве активного ингредиента,
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
7. Противоопухолевый агент для лечения больного раком, получающего другой противоопухолевый агент(ы), содержащий сульфонамидное соединение или его фармацевтически приемлемую соль, где сульфонамидным соединением является соединение, представленное следующей формулой (I):
[Формула 4]

где X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12)-;
один из R11 и R12 представляет собой атом водорода, а другой представляет собой метильную группу;
R2 представляет собой фенильную группу, имеющую R21 в качестве заместителя,
R21 представляет собой атом галогена или C1-C6 алкильную группу (когда присутствуют два или более из R21, R21 являются одинаковыми или отличаются друг от друга);
R3 представляет фенильную группу, имеющую R31 в качестве заместителя, или хроманильную группу, имеющую Rc в качестве заместителя;
R31 представляет собой атом галогена или аминокарбонильную группу (когда присутствуют два или более из R31, R31 являются одинаковыми или отличаются друг от друга);
Rc представляет собой атом галогена, гидроксигруппу или C1-C6 алкильную группу (когда присутствуют два или более из Rc, Rc являются одинаковыми или отличаются друг от друга),
R4 представляет собой атом водорода;
и где пациенту, которому вводят другой противоопухолевый агент(ы),
i) вводят дозу с другим противоопухолевым агентом(ами) одновременно с сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью; или
ii) вводят дозу с другим противоопухолевым агентом(ами) перед сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью; или
iii) вводят дозу с другим противоопухолевым агентом(ами) после сульфонамидного соединения, представленного формулой (I), или его фармацевтически приемлемой соли,
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
8. Сульфонамидное соединение, представленное следующей формулой (I):
[Формула 6]

где X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12)-;
один из R11 и R12 представляет собой атом водорода, а другой представляет собой метильную группу;
R2 представляет собой фенильную группу, имеющую R21 в качестве заместителя,
R21 представляет собой атом галогена или C1-C6 алкильную группу (когда присутствуют два или более из R21, R21 являются одинаковыми или отличаются друг от друга);
R3 представляет фенильную группу, имеющую R31 в качестве заместителя, или хроманильную группу, имеющую Rc в качестве заместителя;
R31 представляет собой атом галогена или аминокарбонильную группу (когда присутствуют два или более из R31, R31 являются одинаковыми или отличаются друг от друга);
Rc представляет собой атом галогена, гидроксигруппу или C1-C6 алкильную группу (когда присутствуют два или более из Rc, Rc являются одинаковыми или отличаются друг от друга),
R4 представляет собой атом водорода;
или его фармацевтически приемлемая соль для применения при лечении и/или предотвращении опухоли путем введения сульфонамидного соединения или его фармацевтически приемлемой соли и другого противоопухолевого агента(ов) одновременно, последовательно или в шахматном порядке,
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
9. Способ лечения и/или предотвращения опухоли, включающий введение сульфонамидного соединения, представленного следующей формулой (I):
[Формула 8]

где X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12)-;
один из R11 и R12 представляет собой атом водорода, а другой представляет собой метильную группу;
R2 представляет собой фенильную группу, имеющую R21 в качестве заместителя,
R21 представляет собой атом галогена или C1-C6 алкильную группу (когда присутствуют два или более из R21, R21 являются одинаковыми или отличаются друг от друга);
R3 представляет фенильную группу, имеющую R31 в качестве заместителя, или хроманильную группу, имеющую Rc в качестве заместителя;
R31 представляет собой атом галогена или аминокарбонильную группу (когда присутствуют два или более из R31, R31 являются одинаковыми или отличаются друг от друга);
Rc представляет собой атом галогена, гидроксигруппу или C1-C6 алкильную группу (когда присутствуют два или более из Rc, Rc являются одинаковыми или отличаются друг от друга),
R4 представляет собой атом водорода;
или его фармацевтически приемлемой соли и другого противоопухолевого агента(ов) одновременно, последовательно или в шахматном порядке,
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
10. Способ по п. 9, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят последовательно или в шахматном порядке с другим противоопухолевым агентом(ами), вводимым перед сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью.
11. Способ по п. 9, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят последовательно или в шахматном порядке с другим противоопухолевым агентом(ами), вводимым после сульфонамидного соединения, представленного формулой (I), или его фармацевтически приемлемой соли.
12. Способ лечения и/или предотвращения опухоли, включающий введение сульфонамидного соединения, представленного следующей формулой (I):
[Формула 9]

где X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12)-;
один из R11 и R12 представляет собой атом водорода, а другой представляет собой метильную группу;
R2 представляет собой фенильную группу, имеющую R21 в качестве заместителя,
R21 представляет собой атом галогена или C1-C6 алкильную группу (когда присутствуют два или более из R21, R21 являются одинаковыми или отличаются друг от друга);
R3 представляет фенильную группу, имеющую R31 в качестве заместителя, или хроманильную группу, имеющую Rc в качестве заместителя;
R31 представляет собой атом галогена или аминокарбонильную группу (когда присутствуют два или более из R31, R31 являются одинаковыми или отличаются друг от друга);
Rc представляет собой атом галогена, гидроксигруппу или C1-C6 алкильную группу (когда присутствуют два или более из Rc, Rc являются одинаковыми или отличаются друг от друга),
R4 представляет собой атом водорода;
или его фармацевтически приемлемой соли больному злокачественным новообразованием, получающему другой противоопухолевый агент(ы); и
и где пациенту, которому вводят другой противоопухолевый агент(ы),
i) вводят дозу с другим противоопухолевым агентом(ами) одновременно с сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью; или
ii) вводят дозу с другим противоопухолевым агентом(ами) перед сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью; или
iii) вводят дозу с другим противоопухолевым агентом(ами) после сульфонамидного соединения, представленного формулой (I), или его фармацевтически приемлемой соли,
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
13. Применение сульфонамидного соединения, представленного следующей формулой (I):

где X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12)-;
один из R11 и R12 представляет собой атом водорода, а другой представляет собой метильную группу;
R2 представляет собой фенильную группу, имеющую R21 в качестве заместителя,
R21 представляет собой атом галогена или C1-C6 алкильную группу (когда присутствуют два или более из R21, R21 являются одинаковыми или отличаются друг от друга);
R3 представляет фенильную группу, имеющую R31 в качестве заместителя, или хроманильную группу, имеющую Rc в качестве заместителя;
R31 представляет собой атом галогена или аминокарбонильную группу (когда присутствуют два или более из R31, R31 являются одинаковыми или отличаются друг от друга);
Rc представляет собой атом галогена, гидроксигруппу или C1-C6 алкильную группу (когда присутствуют два или более из Rc, Rc являются одинаковыми или отличаются друг от друга),
R4 представляет собой атом водорода;
или его фармацевтически приемлемой соли для получения лекарственного средства для лечения и/или предотвращения опухоли у пациента, которому вводят другой противоопухолевый агент(ы); и
где пациенту, которому вводят другой противоопухолевый агент(ы),
i) вводят дозу с другим противоопухолевым агентом(ами) одновременно с сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью; или
ii) вводят дозу с другим противоопухолевым агентом(ами) перед сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью; или
iii) вводят дозу с другим противоопухолевым агентом(ами) после сульфонамидного соединения, представленного формулой (I), или его фармацевтически приемлемой соли,
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
14. Применение сульфонамидного соединения, представленного следующей формулой (I):

где X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12)-;
один из R11 и R12 представляет собой атом водорода, а другой представляет собой метильную группу;
R2 представляет собой фенильную группу, имеющую R21 в качестве заместителя,
R21 представляет собой атом галогена или C1-C6 алкильную группу (когда присутствуют два или более из R21, R21 являются одинаковыми или отличаются друг от друга);
R3 представляет фенильную группу, имеющую R31 в качестве заместителя, или хроманильную группу, имеющую Rc в качестве заместителя;
R31 представляет собой атом галогена или аминокарбонильную группу (когда присутствуют два или более из R31, R31 являются одинаковыми или отличаются друг от друга);
Rc представляет собой атом галогена, гидроксигруппу или C1-C6 алкильную группу (когда присутствуют два или более из Rc, Rc являются одинаковыми или отличаются друг от друга),
R4 представляет собой атом водорода;
или его фармацевтически приемлемой соли для получения лекарственного средства для лечения и/или предотвращения опухоли путем введения с другим противоопухолевым агентом(ами);
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
15. Применение по п. 14, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят одновременно, последовательно или в шахматном порядке.
16. Применение по п. 15, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят последовательно или в шахматном порядке с другим противоопухолевым агентом(ами), вводимым перед сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью.
17. Применение по п. 15, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят последовательно или в шахматном порядке с другим противоопухолевым агентом(ами), вводимым после сульфонамидного соединения, представленного формулой (I), или его фармацевтически приемлемой соли.
18. Применение сульфонамидного соединения, представленного следующей формулой (I):

где X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12)-;
один из R11 и R12 представляет собой атом водорода, а другой представляет собой метильную группу;
R2 представляет собой фенильную группу, имеющую R21 в качестве заместителя,
R21 представляет собой атом галогена или C1-C6 алкильную группу (когда присутствуют два или более из R21, R21 являются одинаковыми или отличаются друг от друга);
R3 представляет фенильную группу, имеющую R31 в качестве заместителя, или хроманильную группу, имеющую Rc в качестве заместителя;
R31 представляет собой атом галогена или аминокарбонильную группу (когда присутствуют два или более из R31, R31 являются одинаковыми или отличаются друг от друга);
Rc представляет собой атом галогена, гидроксигруппу или C1-C6 алкильную группу (когда присутствуют два или более из Rc, Rc являются одинаковыми или отличаются друг от друга),
R4 представляет собой атом водорода;
или его фармацевтически приемлемой соли для лечения и/или предотвращения опухоли у онкологического пациента, которому вводят дозу другого противоопухолевого агента(ов); и
где пациенту, которому вводят другой противоопухолевый агент(ы),
i) вводят дозу с другим противоопухолевым агентом(ами) одновременно с сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью; или
ii) вводят дозу с другим противоопухолевым агентом(ами) перед сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью; или
iii) вводят дозу с другим противоопухолевым агентом(ами) после сульфонамидного соединения, представленного формулой (I), или его фармацевтически приемлемой соли,
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
19. Применение сульфонамидного соединения, представленного следующей формулой (I):

где X1 представляет собой атом кислорода;
X2 представляет собой атом кислорода;
X3 представляет собой -NH-;
X4 представляет собой атом водорода;
R1 представляет собой -C(R11)(R12)-;
один из R11 и R12 представляет собой атом водорода, а другой представляет собой метильную группу;
R2 представляет собой фенильную группу, имеющую R21 в качестве заместителя,
R21 представляет собой атом галогена или C1-C6 алкильную группу (когда присутствуют два или более из R21, R21 являются одинаковыми или отличаются друг от друга);
R3 представляет фенильную группу, имеющую R31 в качестве заместителя, или хроманильную группу, имеющую Rc в качестве заместителя;
R31 представляет собой атом галогена или аминокарбонильную группу (когда присутствуют два или более из R31, R31 являются одинаковыми или отличаются друг от друга);
Rc представляет собой атом галогена, гидроксигруппу или C1-C6 алкильную группу (когда присутствуют два или более из Rc, Rc являются одинаковыми или отличаются друг от друга),
R4 представляет собой атом водорода;
или его фармацевтически приемлемой соли для лечения и/или предотвращения опухоли путем введения с другим противоопухолевым агентом(ами);
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
20. Применение по п. 19, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят одновременно, последовательно или в шахматном порядке.
21. Применение по п. 20, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят последовательно или в шахматном порядке с другим противоопухолевым агентом(ами), вводимым перед сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью.
22. Применение по п. 20, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят последовательно или в шахматном порядке с другим противоопухолевым агентом(ами), вводимым после сульфонамидного соединения, представленного формулой (I), или его фармацевтически приемлемой соли.
23. Способ лечения и/или профилактики опухоли, включающий введение сульфонамидного соединения или его фармацевтически приемлемой соли и другого противоопухолевого агента(ов) одновременно, последовательно или в шахматном порядке,
где сульфонамидное соединение выбрано из следующих соединений (1)-(5):
(1) 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(2) 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(3) 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(4) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамид; и
(5) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид,
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
24. Способ по п. 23, где сульфонамидное соединение или его фармацевтически приемлемую соль и другой противоопухолевый агент(ы) вводят последовательно или в шахматном порядке с другим противоопухолевым агентом(ами), вводимым перед сульфонамидным соединением или его фармацевтически приемлемой солью.
25. Способ по п. 23, где сульфонамидное соединение или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят последовательно или в шахматном порядке с другим противоопухолевым агентом(ами), вводимым после сульфонамидного соединения или его фармацевтически приемлемой соли.
26. Способ лечения и/или профилактики опухоли, включающий введение сульфонамидного соединения или его фармацевтически приемлемой соли, у онкологического пациента, которому вводят дозу другого противоопухолевого агента(ов),
где сульфонамидное соединение выбрано из следующих соединений (1)-(5):
(1) 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(2) 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(3) 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(4) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамид; и
(5) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид,
где пациенту, которому вводят другой противоопухолевый агент(ы),
i) вводят дозу с другим противоопухолевым агентом(ами) одновременно с сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью; или
ii) вводят дозу с другим противоопухолевым агентом(ами) перед сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью; или
iii) вводят дозу с другим противоопухолевым агентом(ами) после сульфонамидного соединения, представленного формулой (I), или его фармацевтически приемлемой соли,
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
27. Применение сульфонамидного соединения или его фармацевтически приемлемой соли для получения лекарственного средства для лечения и/или профилактики опухоли у пациента, которому вводят дозу другого противоопухолевого агента(ов),
где сульфонамидное соединение выбрано из следующих соединений (1)-(5):
(1) 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(2) 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(3) 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(4) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамид; и
(5) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид,
где пациенту, которому вводят другой противоопухолевый агент(ы),
i) вводят дозу с другим противоопухолевым агентом(ами) одновременно с сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью; или
ii) вводят дозу с другим противоопухолевым агентом(ами) перед сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью; или
iii) вводят дозу с другим противоопухолевым агентом(ами) после сульфонамидного соединения, представленного формулой (I), или его фармацевтически приемлемой соли,
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
28. Применение сульфонамидного соединения или его фармацевтически приемлемой соли для получения лекарственного средства для лечения и/или профилактики опухоли путем введения с другим противоопухолевым агентом(ами),
где сульфонамидное соединение выбрано из следующих соединений (1)-(5):
(1) 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(2) 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(3) 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(4) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамид; и
(5) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид,
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
29. Применение по п. 28, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят одновременно, последовательно или в шахматном порядке.
30. Применение по п. 29, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят последовательно или в шахматном порядке с другим противоопухолевым агентом(ами), вводимым перед сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью.
31. Применение по п. 29, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят последовательно или в шахматном порядке с другим противоопухолевым агентом(ами), вводимым после сульфонамидного соединения, представленного формулой (I), или его фармацевтически приемлемой соли.
32. Применение сульфонамидного соединения или его фармацевтически приемлемой соли для лечения и/или профилактики опухоли у пациента, которому вводят дозу другого противоопухолевого агента(ов),
где сульфонамидное соединение выбрано из следующих соединений (1)-(5):
(1) 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(2) 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(3) 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(4) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамид; и
(5) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид,
где пациенту, которому вводят другой противоопухолевый агент(ы),
i) вводят дозу с другим противоопухолевым агентом(ами) одновременно с сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью; или
ii) вводят дозу с другим противоопухолевым агентом(ами) перед сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью; или
iii) вводят дозу с другим противоопухолевым агентом(ами) после сульфонамидного соединения, представленного формулой (I), или его фармацевтически приемлемой соли,
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
33. Применение сульфонамидного соединения или его фармацевтически приемлемой соли для лечения и/или профилактики опухоли путем введения с другим противоопухолевым агентом(ами),
где сульфонамидное соединение выбрано из следующих соединений (1)-(5):
(1) 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(2) 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(3) 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
(4) 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамид; и
(5) 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид,
где другой противоопухолевый агент(ы), по меньшей мере один или несколько, выбран из антиметаболита, препарата платины, лекарственного средства на основе растительного алкалоида и молекулярно-таргетного препарата,
где опухоль представляет собой рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак молочной железы, рак половых органов, рак мочевой системы, гемопоэтические опухоли, опухоли костных и мягких тканей, рак кожи, опухоль головного мозга.
34. Применение по п. 33, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят одновременно, последовательно или в шахматном порядке.
35. Применение по п. 34, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят последовательно или в шахматном порядке с другим противоопухолевым агентом(ами), вводимым перед сульфонамидным соединением, представленным формулой (I), или его фармацевтически приемлемой солью.
36. Применение по п. 34, где сульфонамидное соединение, представленное формулой (I), или его фармацевтически приемлемая соль и другой противоопухолевый агент(ы) вводят последовательно или в шахматном порядке с другим противоопухолевым агентом(ами), вводимым после сульфонамидного соединения, представленного формулой (I), или его фармацевтически приемлемой соли.
| WO 2017150725 A1, 08.09.2017 | |||
| WO 2017111074 A1, 29.06.2017 | |||
| WO 2004014300 A2, 19.02.2004 | |||
| ПРОИЗВОДНЫЕ ТРИАЗОЛА | 2007 |
|
RU2409570C2 |
| НОВЫЙ ПИРИМИДИНОВЫЙ НУКЛЕОЗИД ИЛИ ЕГО СОЛЬ | 2006 |
|
RU2395517C2 |
Авторы
Даты
2022-04-22—Публикация
2018-11-28—Подача