ОБЛАСТЬ ТЕХНИКИ
[001] Настоящие изобретение относится к медицинским устройствам, предназначенным для лечения сосудистых заболеваний, в частности, к имплантируемым стентам, содержащим лекарственное покрытие. Более конкретно, настоящее изобретение относится к устройствам для локального введения терапевтических агентов для профилактики и лечения сосудистых заболеваний, и к способам поддержания терапевтических агентов на имплантируемых медицинских устройствах, а также к способам предупреждения повреждений таких медицинских устройств.
УРОВЕНЬ ТЕХНИКИ
[002] Большое число людей страдает от болезней органов кровообращения, вызванных прогрессирующей блокадой кровеносных сосудов. Чрескожная транслюминальная ангиопластика (ЧТА) представляет собой медицинскую процедуру, при которой в пораженный участок кровеносного сосуда имплантируют стент, обеспечивающий структурную поддержку при жестком поддержании каркаса стенки сосуда. Эта поддержка помогает поддерживать проходимость просветов сосудов. При этом стент может быть саморасширяющимся или расширяемым с помощью баллона. Стент доставляется к месту имплантации через сосуды пациента с помощью системы доставки, включающей тонкий катетер. В случае применения баллоно-расширяемого стента, например, коронарного стента, на конце катетера располагается баллон с закрепленным на нем стентом. При имплантации стент расширяют, и это приводит к его плотному контакту со стенкой кровеносного сосуда. После этого систему доставки извлекают из тела пациента, в то время как стент остается в сосуде пациента в месте имплантации.
[003] При всей популярности ЧТА у этой процедуры есть свои ограничения. Имплантация стента может вызывать отторжение, воспалительные процессы, тромбообразование, а также рестеноз, инициируемый повреждением сосудов во время имплантации. В процесс рестеноза вносят вклад множество процессов, включающих тромбоз, воспаление, высвобождение фактора роста и цитокинов, пролиферацию клеток, миграцию клеток и синтез внеклеточного матрикса.
[004] Под давлением, создаваемым стентом при имплантации, гладкомышечные клетки и эндотелиальные клетки в сосудистой стенке подвергаются повреждению и инициируют тромботический и воспалительный ответ. Выделяемые из клеток факторы роста провоцируют пролиферативный ответ и миграцию гладкомышечных клеток в сосудистой стенке. Пролиферация/миграция обычно начинается в течение одного-двух дней после поражения и достигает пика через несколько дней [Campbell и Campbell, 1987; Clowes и Schwartz, 1985: цит. по Acton, 2013, стр. 37].
[005] Одновременно с локальной пролиферацией и миграцией воспалительные клетки прилипают к месту сосудистого повреждения. В течение трех-семи дней после повреждения воспалительные клетки мигрируют в более глубокие слои сосудистой стенки. На животных моделях с использованием баллонного повреждения или повреждения, вызванного имплантацией стента, воспалительные клетки могут присутствовать в месте сосудистого повреждения в течение, по меньшей мере, тридцати дней, определяя развитие острой и хронической фаз рестеноза [Tanaka et al. 1993; Edelman and Rogers, 1998].
[006] Использование стентов с лекарственным покрытием позволяет значительно снизить рестеноз за счет локального введения терапевтических агентов. Было предложено множество вариантов лекарственного покрытия для стентов для предупреждения и лечения повреждений, вызывающих разрастание интимы. Указанные покрытия могут сами снижать те стимулы, которые создает стент в отношении поврежденных стенок сосудов, что снижает тенденцию к тромбозу или рестенозу. Альтернативно, лекарственное покрытие может доставлять терапевтический агент в просвет сосудов, снижая пролиферацию гладкомышечной ткани или рестеноз. Механизм доставки агента связан с диффузией агента через объемный полимер или через поры, созданные в полимерной структуре, либо за счет эрозии биодеградируемого покрытия.
[007] Лекарственные покрытия для стентов в основном представляют собой полимерные покрытия, в которые либо инкапсулируется терапевтический агент, либо они связывают такой агент с поверхностью.
[008] В зависимости от степени биодеградации полимеры делятся на биодеградируемые и биостабильные [Штильман, 2006; Malmsten, 2002]. Наибольшее применение в медицине среди биодеградируемых полимеров получили полилактиды: полигликолевая кислота (PGA), полимолочная кислота (PLA), поли(ε-капролактон) и др. [Edlund and Albertsson, 2002]. Перспективными являются полимерные соединения, молекулы которых содержат несколько типов мономерных звеньев или так называемые сополимеры [Park, 1995]. Одним из наиболее удобных биодеградируемых сополимеров является полилактид-ко-гликолид (PLGA), который используется для контролируемого высвобождения различных терапевтических агентов.
[009] В качестве биостабильных полимеров для создания лекарственных покрытий долгое время использовались политетрафторэтиленовые (ПТФЭ) гомополимеры. Указанные полимеры нерастворимы ни в одном из растворителей при реальных температурах и в этой связи их трудно наносить на небольшие медицинские устройства с поддержанием важных характеристик таких устройств.
[0010] В качестве альтернативы были предложены лекарственные покрытия на основе поливинилиденфторидных сополимеров.
[0011] Важно отметить, что для эффективной доставки терапевтического агента к месту лечения крайне важен способ, посредством которого конкретные терапевтические агенты или их сочетания наносятся на стент. Так, например, способы и материалы, используемые для фиксирования терапевтического агента на стенте, не должны мешать действию терапевтического агента или сочетания терапевтических агентов. Дополнительно, используемые способы и материалы должны быть биосовместимыми и поддерживать терапевтический агент на стенте в процессе доставки и в течение заданного периода времени. Так, например, удаление терапевтического агента со стента в ходе доставки к месту лечения может привести к непригодности стента. Кроме того, для загрузки стента в систему доставки к стенту прикладывают значительную радиально сжимающую силу, а также могут подвергать воздействию повышенной температуры. Важно, чтобы во время процедуры загрузки стента лекарственное покрытие не теряло свою целостность, не растрескивалось, не удалялось со стента частично или полностью.
[0012] Соответственно, имеется потребность в разработке лекарственного покрытия такого состава, который, с одной стороны, позволял бы доставлять терапевтический агент к месту лечения и контролировать скорость его высвобождения, а с другой стороны позволял бы наносить лекарственное покрытие на стент доступным способом и гарантировал бы целостность и функциональность лекарственного покрытия во время всех манипуляций, производимых со стентом до имплантации в сосуде.
ТЕРМИНЫ И СОКРАЩЕНИЯ
[0013] BHT — butylhydroxytoluene, бутилгидрокситолуол (ионол, дибунол, агидол-1).
[0014] PDLLA — полилактид, мономерами которого являются D-форма и L-форма молочной кислоты.
[0015] PLA (ПЛА) — полилактид, биоразлагаемый, биосовместимый, термопластичный, полимер, мономером которого является молочная кислота.
[0016] PLGA (ПЛГА) — полилактид-ко-гликолид, сополимер, состоящий из остатков молочной и гликолевой кислот.
[0017] PLLA — полилактид, мономером которого является L-форма молочной кислоты.
[0018] PBMA — поли-н-бутилметакрилат, poly-n-butyl methacrylate.
[0019] PVDF-HFP — поли(винилидин фторид-ко-гексафторпропилен), poly(vinylidenefluoride-co-hexafluoropropylene)), фторполимер, полукристаллический сополимер.
[0020] ПЭГ — полиэтиленгликоль, polyethylene glycol, polyoxyethylene, poly(ethylene oxide), полиэфир.
[0021] Сиролимус (рапамицин) — терапевтический агент, оказывает супрессивное действие на иммунную систему, блокируя активацию Т- и В-лимфоцитов. То есть организм не защищается от стентов как от чужеродных элементов. Также останавливается пролиферация — разрастание ткани, ведущее к рестенозу. Схожими свойствами обладают такие производные сиролимуса, как эверолимус, биолимус и зотаролимус.
[0022] Паклитаксел – терапевтический агент, обладающий цитостатическим действием. Ингибирует митоз клеток и препятствует формированию неоинтимы.
[0023] ЧТА — чрескожная транслюминальная ангиопластика.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0024] Задачей настоящего изобретения является создание стента с лекарственным покрытием, подходящим для чрескожной транслюминальной ангиопластики.
[0025] Данная задача решается заявляемым изобретением за счет достижения такого технического результата, как создание стента с биоразлагаемым или биостабильным лекарственным покрытием, надежно связанным со стентом, обладающим равномерностью толщины, обеспечивающим эффективную скорость высвобождения терапевтического агента в физиологических условиях. Также важной частью технического результата является доступность способа формирования указанного лекарственного покрытия на поверхности стента.
[0026] Заявленный технический результат достигается за счет того, что лекарственное покрытие на поверхности стента включает по меньшей мере один полимер и по меньшей мере один терапевтический агент.
[0027] При этом полимер или несколько полимеров формируют полимерную матрицу, в которую инкапсулированы один или несколько терапевтических агентов. В качестве терапевтических агентов могут выступать различные вещества, обладающие свойствами, соответствующими конкретной врачебной задаче. Так как стенты чаще всего используются для лечения заболеваний кровеносных сосудов, в предпочтительном варианте реализации терапевтический агент может представлять собой сиролимус, однако возможен выбор и любого другого терапевтического агента, удовлетворяющего критериям, например, эверолимуса, биолимуса, зотаролимуса и паклитаксела.
[0028] От того, какие именно полимеры формируют полимерную матрицу лекарственного покрытия, зависит стабильность лекарственного покрытия после имплантации стента. Так, биоразлагаемое лекарственное покрытие может быть получено на основе поли-L-лактида или сочетания поли-L-лактида с полилактид-ко-гликолидом. Биостабильное лекарственное покрытие может быть получено на основе фторполимера, например, поли(винилидин фторид-ко-гексафторпропилена).
[0029] При этом молекулярная масса полимеров влияет как на скорость высвобождения терапевтического агента, так и на возможность формирования прочного, равномерного лекарственного покрытия на поверхности стента. Так, для получения биоразлагаемого лекарственного покрытия могут быть использованы поли-L-лактид и полилактид-ко-гликолид с молекулярной массой от приблизительно 50 кДа до приблизительно 100 кДа. Для получения биостабильного лекарственного покрытия предпочтительно может быть использован поли(винилидин фторид-ко-гексафторпропилен) с молекулярной массой от приблизительно 150 кДа до приблизительно 350 кДа.
[0030] Указанные характеристики полимеров позволяют сформировать лекарственное покрытие, высвобождающее терапевтический агент, с терапевтически эффективной скоростью. Например, для сиролимуса такая скорость составляет от приблизительно 30% мас. до приблизительно 70% мас. за первые 3-7 суток в физиологических условиях in vitro. Именно эта скорость позволяет эффективно предотвратить отторжение стента, воспаление и рестеноз в месте лечения сосуда.
[0031] Возможность формирования лекарственного покрытия на поверхности стента обеспечивается тем, что компоненты лекарственного покрытия растворяют в органическом растворителе с образованием жидкой композиции. Затем из этой жидкой композиции формируют аэрозоль, который путем распыления в виде микродисперсных капель наносят на поверхность стента.
[0032] Размер частиц аэрозоля в сильной степени определяет возможность равномерного нанесения материала лекарственного покрытия на поверхность стента. Размер частиц аэрозоля, в свою очередь, зависит от вязкости жидкой композиции. А вязкость жидкой композиции в основном определяется молекулярной массой полимеров, входящих в состав лекарственного покрытия. Указанные молекулярные массы полимеров позволяют сздавать жидкую композицию с кинематической вязкостью от приблизительно 0,5 сСт до приблизительно 1,5 сСт.
[0033] Равномерность толщины лекарственного покрытия также обеспечивается тем, что во время разбрызгивания аэрозоля стент непрерывно вращается вокруг продольной оси, а также совершает поступательные движения в продольном направлении. Причем для обеспечения равномерности лекарственного покрытия вдоль стента, варьируют скорость вращения и поступательных движений при нанесении аэрозоля на центральную область и на периферические области стента.
[0034] Затем нанесенный аэрозоль высушивают при повышенной температуре для удаления органического растворителя. Температура сушки зависит от особенностей полимера и определяется температурй перехода конкретного полимера в высокотекучее состояние. Так, лекарственное покрытие, включающее поли-L-лактид или сочетание поли-L-лактида с полилактид-ко-гликолидом, высушивают при температуре не более 60ºС. Лекарственное покрытие, включающее поли(винилидин фторид-ко-гексафторпропилен), высушивают при температурене более 80ºС.
[0035] Для повышения функциональности в лекарственное покрытие дополнительно включают протекторы терапевтических агентов. Протекторы – это вещества, защищающие терапевтические агенты от возможных химических модификаций, нарушающих терапевтическую активность агентов. Такие модификации могут возникать под воздействием окружающей среды во время подготовки стента к имплантации, в процессе транспортирования и хранения, а также со стороны организма пациента после имплантации. Так как чаще всего терапевтические агенты подвергаются окислению, в качестве протектора терапевтического агента используют антиоксиданты. В предпочтительном варианте реализации используют бутилгидрокситолуол как биосовместимый антиоксидант с известными характеристиками.
[0036] Еще одной важной характеристикой лекарственного покрытия является его эластичность. Дело в том, что во время подготовки к имплантации и во время имплантации стент претерпевает значительные механические деформации. Так, во время загрузки стента в систему доставки он подвергается радиальному сжатию, а во время имплантации — радиальному расширению. При этом стент представляет собой трубчатую конструкцию, состоящую состоит из множества соединенных между собой корон. Короны состоят из множества колен и ребер. Во время сжатия и расширения стента угол колена значительно меняется, и лекарственное покрытие в области колена испытывает значительное натяжение. Соответственно, лекарственное покрытие должно обладать определенной эластичностью, чтобы оно не трескалось и не отваливалось от стента во время загрузки стента в систему доставки, во время продвижения стента по сосудистому руслу пациента и во время имплантации.
[0037] Поли(винилидин фторид-ко-гексафторпропилен) сам по себе обесепечивает необходимую эластичность биостабильному лекарственному покрытию.
[0038] В состав биоразлагаемого лекарственного покрытия на основе поли-L-лактида или сочетание поли-L-лактида с полилактид-ко-гликолидом дополнительно включают пластификатор для обеспечения необходимой эластичности. В предпочтительном варианте реализации в качестве пластификатора используют полиэтиленгликоль с молекулярной массой от приблизительно 200 Да до приблизительно 800 Да. Полиэтиленгликоль с указанной молекулярной массой удобен в использовании, не токсичен и при попадании в организм человека беспрепятственно выводится почками, не причиняя вреда здоровью.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0039] На Фиг. 1 представлено схематичное изображение стента.
[0040] На Фиг. 2 схематично показан процесс нанесения материала лекарственного покрытия на поверхность стента.
[0041] На Фиг. 3А-Ж показаны поверхности стентов с лекарственным покрытием на основе различных полимеров.
[0042] На Фиг. 4А-Д показаны поверхности стентов с лекарственным покрытием на основе различных полимеров после стерилизации.
[0043] На Фиг. 5 представлены результаты исследования кинетики высвобождения сиролимуса из лекарственных покрытий на основе различных полимеров в эксперименте in vitro.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0044] В приведенном ниже подробном описании реализации изобретения приведены многочисленные детали реализации, призванные обеспечить отчетливое понимание настоящего изобретения. Однако, квалифицированному в предметной области специалисту, очевидно, каким образом можно использовать настоящее изобретение, как с данными деталями реализации, так и без них. В других случаях хорошо известные методы, процедуры и компоненты не описаны подробно, чтобы не затруднять излишне понимание особенностей настоящего изобретения.
[0045] Кроме того, из приведенного изложения ясно, что изобретение не ограничивается приведенной реализацией. Многочисленные возможные модификации, изменения, вариации и замены, сохраняющие суть и форму настоящего изобретения, очевидны для квалифицированных в предметной области специалистов.
[0046] Стент 1 представляет собой трубчатую конструкцию и имеет продольную ось, а также первый конец 2 и второй конец 3 (Фиг. 1). Вдоль продольной оси а стент условно делится на центральную область 14 и периферические области 15. Стент 1 состоит из множества корон 4. Короны 4 состоят из множества колен 5 и ребер 6. Каждая из множества корон 4 соединена с соседней короной 4 посредством перемычек 7.
[0047] В одном варианте реализации стент 1 является периферическим саморасширяющимся стентом, выполненным из материала с памятью формы, например, из нитинола. В другом варианте реализации стент 1 является баллоно-расширяемым стентом, выполненным, например, из нержавеющей стали марки L306 или L316, или сплава кобальт-хром. При этом в обоих вариантах реализации стент 1 может быть изготовлен единой конструкцией методом лазерной резки из металлической трубки.
[0048] Стент 1 выполнен с возможностью радиального сжатия и радиального расширения. Стент 1 может подвергаться радиальному сжатию при загрузке в систему доставки. При этом стент 1 переходит в сжатую конфигурацию. Стент 1 по кровеносному руслу доставляется в зону имплантации. Во время имплантации стент 1 может быть расширен за счет выведения за пределы катетера или путем раздувания баллона, находящегося внутри стента 1. При этом каждое колено 5 стента 1 испытывает пластические невозвратные деформации, и стент 1 переходит в расширенную конфигурацию. В расширенной конфигурации наружный диаметр D стента 1 может составлять от приблизительно 2 до приблизительно 7 мм, а длина L стента 1 может составлять от приблизительно 6 мм до приблизительно 38 мм.
[0049] Стент 1 имеет лекарственное покрытие, отвечающее следующим требованиям:
• покрытие обеспечивает высвобождение лекарственного агента с определенной скоростью;
• покрытие поддерживает функциональность лекарственного агента в течение определенного времени хранения, в процессе подготовки стента 1 к имплантации, а также некоторое время после имплантации;
• покрытие выполнено с возможностью нанесения на поверхность стента 1;
• покрытие сохраняет целостность и функциональность во время всех манипуляций со стентом 1, предшествующих имплантации, включая стерилизацию стента 1, загрузку стента 1 в систему доставки, продвижение стента 1 по сосудистому руслу пациента;
• в случае биодеградируемого покрытия, оно обладает определенной скоростью биодеградации в организме пациента.
[0050] Лекарственное покрытие может включать один или несколько биосовместимых полимеров, один или несколько терапевтических агентов, а также один или несколько протекторов, защищающих функциональность одного или нескольких терапевтических агентов в покрытии. Кроме того, лекарственное покрытие может дополнительно включать пластификатор.
[0051] Полимер или комбинация полимеров образуют полимерную матрицу, в которую инкапсулирован один или несколько терапевтических агентов. Полимерная матрица позволяет терапевтическому агенту удерживаться на поверхности стента 1 во время всех манипуляций, проводимых со стентом 1. Кроме того, полимерная матрица определяет скорость высвобождения терапевтического агента в организме пациента. Полимер или комбинация полимеров может составлять от приблизительно 60% мас. до приблизительно 70% мас. от массы покрытия, высушенного после нанесения на стент 1. Количество полимера или комбинации полимеров в покрытии определяет прочность лекарственного покрытия и скорость высвобождения терапевтического агента.
[0052] В некоторых вариантах реализации лекарственное покрытие может включать несколько слоев полимерной матрицы, из которых все слои, часть слоев или только один содержит терапевтический агент или комбинацию нескольких терапевтических агентов. Также в некоторых вариантах реализации разные слои полимерной матрицы могут содержать разные терапевтические агенты.
[0053] В некоторых вариантах реализации полимерная матрица может быть биоразлагаемой. Для создания такой матрицы может быть использован полимер или комбинация полимеров, биоразлагаемых из-за их лабильной природы, например, такой как лабильная природа сложноэфирных групп. В некоторых вариантах осуществления могут быть выбраны такие полимеры, которые расщепляются, абсорбируются, резорбируются и выводятся организмом млекопитающих. В качестве биоразлагаемых полимеров могут использоваться полимеры, включающие остатки молочной кислоты, например, полилактиды (PLA) и полилактид-ко-гликолиды (PLGA). В предпочтительном варианте реализации используется смесь PLA и PLGA. При этом соотношение PLLA и PLGA подбирается с учетом требований к прочности лекарственного покрытия и к скорости биодеградации. Можно отметить, что полимерные покрытия на основе PLLA более прочные, устойчивые к температурному воздействию и имеют более ровную поверхность, однако такие покрытия медленно деградируют. В некоторых случаях, быстрая скорость деградации лекарственного покрытия является более предпочтительной, так как снижает вероятность развития воспалительной реакции на присутствие полимерной матрицы в организме пациента. PLGA образует быстроразлагающуюся полимерную матрицу. Однако покрытие на основе одного PLGA менее прочное и устойчивое, в частности, к воздействию повышенной температуры, что может приводить к занчительной потере качества лекарственного покрытия при стерилизации стентов. Оптимальное соотношение полимеров PLLA:PLGA лежит в приблизительном диапазоне от 50:50 до 85:15.
[0054] При этом PLA может содержать остатки L-формы (PLLA). Одной из причин использования только PLLA является физиологичность: L-форма встречается в природе, а D-форму получают синтетическим путем [Штильман, 2006]. Форма молочной кислоты, а также присутствие одной или двух форм молочной кислоты в полилактиде влияет на скорость деградации полимера в организме человека, а также на структуру и свойства полимерной матрицы, определяющие скорость высвобождения терапевтического агента. Так, около 50% мас. PLLA разлагается приблизительно в течение 7 месяцев в физиологических условиях. Кроме того, при формировании полимерной матрицы PLLA формирует более упорядоченную кристаллическую структуру, чем, например, поли-D,L-лактид (PDLLA). Также PLLA формирует более гидрофильное покрытие, чем PDLLA. Это значительно влияет на скорость высвобождения терапевтического агента.
[0055] PLGA является очень удобным сополимером для создания лекарственного покрытия с контролируемым высвобождением одного или нескольких терапевтических агентов. В качестве мономеров PLGA содержит остатки молочной и гликолевой кислоты. При этом молочная кислота также может быть в виде L-формы, D-формы молочной кислоты или их смеси. В предпочтительном варианте реализации PLGA включает только L-форму молочной кислоты. Физико-химические свойства PLGA определяются молярным соотношением и последовательным расположением молочной и гликолевых кислот. Чем больше соотношения лактида к гликолиду, тем гидрофобнее будет вещество и тем хуже его растворимость в воде [Vergera et al., 1998; Park, 1995]. Чем гидрофобнее полимерная матрица, тем медленнее высвобождается инкапсулированный в нее терапевтический агент. При создании полимерной матрицы покрытия может использоваться PLGA с соотношением лактиды/гликолиды от 50/50 до 75/25.
[0056] Важной характеристикой полимеров, использующихся при создании биоразлагаемой полимерной матрицы, является их молекулярная масса, так как она влияет на скорость биодеградации полимера: чем меньше молекулярная масса, тем ниже скорость биодеградации. Для создания биоразлагаемой полимерной матрицы могут быть использованы полимеры, имеющие молекулярную массу от приблизительно 50 кДа до приблизительно 100 кДа. Такая молекулярная масса полимеров обеспечивает их биодеградацию в течение нескольких месяцев. Так, 50% PLGA разлагается в течение приблизительно 1 месяца, а 50% PLLA разлагается в течение приблизительно 7 месяцев после имплантации. Кроме того, молекулярная масса полимеров влияет на скорость высвобождения терапевтического агента.
[0057] Однако не всегда можно точно определить молекулярную массу полимера, так как он может представлять собой смесь молекул, состоящих из разного количества мономеров. Поэтому в отношении полимеров удобно пользоваться таким параметром, как характеристическая вязкость. Характеристическая вязкость является мерой вклада макромолекул в вязкость раствора полимера. Для создания биоразлагаемой полимерной матрицы могут быть использованы полимеры с характеристической вязкостью от приблизительно 0,2 дл/г до приблизительно 1,2 дл/г. Указанные параметры полимеров обеспечивают возможность формирования качественного лекарственного покрытия на поверхности стента.
[0058] Как уже отмечалось выше, лекарственное покрытие должно выдерживать все манипуляции, производимые со стентом от создания до имплантации. Одной из таких манипуляций, является стерилизация стента перед введением в организм пациента. Стандартная процедура стерилизации включает обработку стента 1 этиленоксидом при высокой относительной влажности и температуре около 50°С. При этом этиленоксид и водяной пар могут проявлять свойства пластификаторов, что в сочетании с воздействием вытокой температуры может приводить к размягчению биоразлагаемого лекарственного покрытия. В результате могут появляться грубые дефекты лекарственного покрытия, — наслоения, потеки, капли, оголение материала стента. Все эти дефекты могут приводить к нарушению скорости высвобождения терапевтического агента и/или снижению прочности связывания лекарственного покрытия со стентом. В результате лекарственное покрытие может отваливаться от стента 1 во время продвижения стента по сосудистому руслу пациента во время доставки, а также после имплантации.
[0059] Экспериментальные данные показывают, что биоразлагаемое лекарственное покрытие на основе указанных полимеров выдерживает процедуру стерилизации без ухудшения качества покрытия. В то же время биоразлагаемое лекарственное покрытие на основе только PLGA или PDLLA после стерилизации имеет описанные грубые дефекты. Дело в том, что PLGA и PDLLA являются аморфными полимерами, и температура их перехода в высокоэластичное и далее в высокотекучее состояние находится в диапазоне 40-60°С [Д.А. Белов, Л.П. Круль, А.П. Поликарпов, И.А. Климовцова. Термомеханические свойства полилактидов. Вестник БГУ, 2007, сер. 2, № 3, с. 40-46]. Дополнительное воздействие водяного пара и этиленоксида, выступающих в качестве со-пластификаторов, приводит к размягчению лекарственного покрытия и стекания его со стента 1 под воздействием силы тяжести.
[0060] В некоторых вариантах реализации полимер или комбинация полимеров, формирующие полимерную матрицу, могут быть биостабильными. В качестве полимеров для формирования биостабильной матрицы, в которую инкапсулирован терапевтический агент, могут быть использованы биосовместимые фторполимеры. В предпочтительном варианте реализации в этом качестве используют поли(винилидин фторид-ко-гексафторпропилен) (PVDF-HFP). Это один из немногих биосовместимых эластичных фторполимеров. При высыхании на поверхности стента 1, PVDF-HFP образует пленку, которая способна растягиваться и выдерживать значительные механические деформации без разрушения. Это свойства крайне важно при формировании лекарственного покрытия стента 1, т.к. при сжатии стента 1 во время загрузки в систему доставки и при расширении стента 1 во время имплантации, лекарственное покрытие всегда испытывает деформации. Если покрытие не будет обладать достаточной эластичностью оно может трескаться и отшелушиваться во время описанных деформаций стента 1.
[0061] Однако фторполимеры, в частности PVDF-HFP, могут иметь недостаточно высокую адгезию к металлической поверхности стента 1. Недостаточная адгезия полимерной матрицы может приводить к частичной или полной потере лекарственного покрытия при сжатии стента 1 при загрузке в систему доставки или при продвижении стента 1 по сосудистому руслу пациента. Кроме того, отваливающиеся фрагменты покрытия могут оказаться достаточно большими, чтобы, попадая в кровоток, закупоривать мелкие сосуды по ходу тока крови. Кроме того, из-за потери части покрытия недостаточное количество терапевтического агента будет высвобождено в месте лечения. Соответственно, может быть не получен необходимый терапевтический эффект.
[0062] Для улучшения адгезии лекарственного покрытия к металлической поверхности стента 1 могут быть использованы любые биосовместимые праймеры, например, клеи или биосовместимые полимеры, образующие грунтовочный слой, который обеспечивает адгезию полимерной матрицы, содержащей один или несколько терапевтических агентов. При этом грунтовочный слой непосредственно контактирует с металлической поверхностью стента 1, а полимерная матрица, содержащая один или несколько терапевтических агентов, располагается поверх грунтовочного слоя. В качестве таких биосовместимых полимеров могут использоваться различные полиакрилаты. В предпочтительном варианте реализации может быть использован поли-н-бутилметакрилат (PBMA).
[0063] Полимеры, используемые для формирования грунтовочного слоя и полимерной матрицы, содержащей один или несколько терапевтических агентов, могут иметь молекулярную массу от приблизительно 100 кДа до приблизительно 350 кДа. В частности, PVDF-HFP может иметь молекулярную массу от приблизительно 150 кДа до приблизительно 350 кДа. Молекулярная масса полимеров влияет на скорость высвобождения терапевтического агента. Кроме того, заявленный диапазон молекулярной массы полимеров обусловлен возможностью их растворения в органических растворителях, что обеспечивает возможность создания жидкой композиции, используемой для формирования лекарственного покрытия на поверхности стента. Также заявленная молекулярная масса полимеров обеспечивает определенную вязкость указанной жидкой композиции, необходимую для формирования качественного лекарственного покрытия. При этом диапазон характеристической вязкости PVDF-HFP, пригодного для формирования лекарственного покрытия, составляет приблизительно 0,6-1,2 дл/г. Более высокая вязкость растворов PVDF-HFP неудобна и даже неприемлема с технологической точки зрения, и не оправдана с точки зрения улучшения рецептуры лекарственного покрытия.
[0064] Терапевтические агенты, которые могут входить в состав полимерного покрытия, включают, но не ограничиваются этим: антипролиферативные, противоопухолевые, противовоспалительные, противоаллергические агенты, иммунодепрессанты, антибиотики, анестетики, антикоагулянты, и их комбинации. Терапевтический агент или комбинация терапевтических агентов может составлять от приблизительно 20% мас. до приблизительно 40% мас. от массы высушенного покрытия. Антипролиферативные агенты предотвращают неоинтимальную гиперплазию и, соответственно, рестеноз после имплантации стента. При этом антипролиферативные агенты могут быть выбраны из группы: сиролимус, эверолимус, биолимус, зотаролимус и паклитаксел. В предпочтительном варианте реализации терапевтический агент представляет собой сиролимус (рапамицин).
[0065] В качестве протекторов, защищающих функциональность одного или нескольких терапевтических агентов в покрытии, могут быть использованы антиоксиданты. Один или несколько антиоксидантов защищают терапевтический агент или несколько терапевтических агентов от потери функциональности вследствие окисления. Антиоксиданты могут представлять собой, например, бутилгидрокситолуол (ВНТ, ионол, дибунол, агидол-1), токоферол или 6-пальмитат аскорбиновой кислоты. В предпочтительном варианте реализации лекарственное покрытие включает в себя только ВНТ, содержание которого составляет от приблизительно 0,05% мас. до приблизительно 1% мас. от массы высушенного покрытия. ВНТ — липофильное органическое вещество, подавляющее автокаталитические процессы радикального окисления. ВНТ является донором атома водорода, превращая пероксидные радикалы в гидропероксиды. Каждая молекула ионола деактивирует две молекулы пероксидных радикалов [Burton and Ingold, 1981].
[0066] В некоторых вариантах реализации покрытие содержит пластификатор. Пластификатор делает высушенное на стенте покрытие более пластичным. Это позволяет избежать появления трещин в покрытии и отслоения при загрузке стента в систему доставки (например, при обжатии стента на баллоне) и при расширении стента во время имплантации. Трещины в покрытии могут приводить к частичной или полной потере лекарственного покрытия. Пластификатор должен быть совместим с полимерами, образующими лекарственное покрытие. В качестве пластификатора может быть использованы, например, мономеры молочной или гликолевой кислот, линейные или циклические олигомерами молочной или гликолевой кислот. В предпочтительном варианте воплощения пластификатор представляет собой полиэтиленгликоль (ПЭГ), имеющий молекулярную массу от приблизительно 200 Да до приблизительно 800 Да. ПЭГ с указанной молекулярной массой является жидким веществом, и именно в таком виде работает как пластификатор. Также в указанном диапазоне молекулярной массы ПЭГ имеет превосходную биосовместимость, не токсичен, легко выводится из организма, не имеет выраженного запаха, вкуса, бесцветен, нелетуч и доступен на рынке. В еще более предпочтительном варианте реализации в качестве пластификатора используют ПЭГ с молекулярной массой 400 Да. При этом содержание ПЭГ может составлять от приблизительно 1% мас. до приблизительно 5% мас. от массы высушенного покрытия. В количестве менее 1% мас. ПЭГ не обеспечивает необходимую степень скольжения между макромолекулами полимера, соответственно, не обеспечивает нужную эластичность лекарственного покрытия. При содержании ПЭГ более 1% мас. лекарственное покрытие будет слишком мягким и утратит необходимую прочность и адгезию с поверхностью стента.
[0067] Для формирования лекарственного покрытия создают жидкую композицию, содержащую один или несколько биосовместимых полимеров, один или несколько терапевтических агентов, один или несколько протекторов терапевтических агентов и один или несколько органических растворителей, например, изопропанол или хлороформ. В некоторых вариантах реализации композиция также включает пластификатор.
[0068] Покрытие формируется при нанесении на стент 1 аэрозоля, полученного из указанной жидкой композиции. При этом размер частиц аэрозоля может составлять от приблизительно 3 мкм до приблизительно 50 мкм. Размер частиц аэрозоля существенно влияет на равномерность нанесения и качество лекарственного покрытия. Размер частиц аэрозоля зависит от вязкости жидкой композиции — чем выше вязкость, тем труднее сформировать аэрозоль с частицами нужного размера и тем труднее качественно нанести лекарственное покрытие. Указанные выше параметры полимеров позволяют создавать жидкую композицию с кинематической вязкостью в диапазоне приблизительно 0,7-1,5 сСт. Использование более вязкой жидкой композиции (>1,5 сСт) приводит к трудностям при формировании покрытия заявленным способом. Использование жидкой композиции со слишком низкой вязкостью (<0,7 сСт) значительно и неоправданно увеличивает время, затрачиваемое на нанесение аэрозоля для получения необходимой толщины лекарственного покрытия. Таким образом, указанный диапазон кинематической вязкости жидкой композиции является оптимальным, так как при этом сохраняется и качество поверхности лекарственного покрытия, и минимизируется время, затрачиваемое на формирование лекарственного покрытия.
[0069] Для формирования лекарственного покрытия стент 1 закрепляют на держателе 9 так, что первый конец 2 стента 1 расположен ближе к первому концу 10 камеры для нанесения покрытия 11, а второй конец 3 стента 1 расположен ближе ко второму концу 12 камеры для нанесения покрытия 11 (Фиг. 2). При этом с держателем 9 соприкасается примерно половина стента1. Температура в камере для нанесения покрытия 11 может составлять от приблизительно 22ºС до приблизительно 40ºС.
[0070] Описанный выше аэрозоль подается приблизительно под прямым углом к поверхности стента 1 из форсунки 13, расположенной в верхней части камеры для нанесения покрытия 11, приблизительно посередине между проксимальным концом 12 и дистальным концом 10 камеры для нанесения покрытия 11. Скорость подачи аэрозоля может составлять от приблизительно 0,025 мл/мин до приблизительно 0,3 мл/мин.
[0071] Во время нанесения аэрозоля благодаря перемещению держателя 9 стент 1 непрерывно вращается вокруг продольной оси а. Направление вращения стента условно показано стрелкой 16, однако стоит отметить, что вращение стента может происходить как по часовой стрелке, так и против часовой стрелки. Кроме того, во время нанесения аэрозоля стент 1 совершает повторяющиеся поступательные движения вдоль продольной оси а. Как схематично показывает стрелка 17, движение в направлении первого конца 10 камеры для нанесения покрытия 11 чередуется с движением в направлении второго конца 12 камеры для нанесения покрытия 11. При этом каждый раз держатель 9 со стентом 1 перемещается вдоль продольной оси на расстояние, равное приблизительно половине длины L стента 1.Это обусловлено тем, что держатель 9, соприкасающийся с половиной стента 1, не позволяет должным образом нанести аэрозоль на на внутреннюю часть половины стента 1, закрепленной на держателе 9. Соответственно, для формирования качественного лекарственного покрытия на всей поверхности стента 1, аэрозоль сначала наносят на одну половину стента 1, а затем на вторую, как будет описано ниже.
[0072] После нанесения аэрозоля на первую половину стента 1 держатель 9 с закрепленным стентом 1 извлекают из камеры для нанесения покрытия 11 и помещают в сушильный шкаф. Стент 1 сушат при температуре от приблизительно 40°С до приблизительно 80°С в течение от 30 минут до 48 часов. С одной стороны, чем ниже температура сушки, тем безопаснее сушка для терапевтических агентов, которые могут входить в состав лекарственного покрытия. С другой стороны, температура сушки ниже 40°С значительно увеличивает время сушки, что неоправданно затягивает производственный процесс. Время сушки зависит от температуры сушки, размера стента и состава покрытия. Сушка происходит при пониженном давлении, которое не превышает 400 мм рт. ст. Пониженное давление позволяет быстрее высушить нанесенное на стент 1 покрытие, не повышая температуры.
[0073] После сушки стент 1 снимают с держателя 9, а затем вновь закрепляют на держателе 9, развернув на 180°. В результате второй конец 3 стента 1 оказывается расположен ближе к первому концу 10 камеры для нанесения покрытия 11, а первый конец 2 стента 1 — ближе ко второму концу 12 камеры для нанесения покрытия 11. Далее проводят разбрызгивание аэрозоля так, как описано выше.
[0074] Как было сказано ранее, на каждом этапе аэрозоль попадает приблизительно на половину стента 1. Однако после разворачивания стента 1 и нанесения аэрозоля на вторую половину стента 1, в центральной области 14 стента 1 возникает зона перекрытия нанесения аэрозоля. Это вызвано отчасти тем, что максимальное продольное перемещение стента 1 может несколько превышать половину длины стента 1. Кроме того, аэрозоль попадает на стент 1 не только строго под форсункой, но и по бокам от линии расположения форсунки 13. Направление разбрызгивания аэрозоля схематично показано стрелками 8. Таким образом, в зоне перекрытия в центральной области 14 стента 1 толщина лекарственного покрытия может быть больше, чем на периферических областях 15 стента 1.
[0075] Для обеспечения равномерности толщины лекарственного покрытия в зоне перекрытия в центральной области 14 стента 1 при разбрызгивании аэрозоля варьируют скорости вращения и поступательного движения стента 1в зависимости от того, какая область стента 1 располагается под форсункой 13 в данный момент. Когда под форсункой 13 находится центральная область 14 стента 1, скорость вращения стента 1 составляет приблизительно 300-400 оборотов в минуту. Когда под форсункой 13 находятся периферические области 15 стента 1, скорость вращения стента 1 составляет приблизительно 150-300 оборотов в минуту. Когда под форсункой 13 находится центральная область 14 стента 1, скорость поступательного движения стента 1 составляет приблизительно 0,4-0,8 см/сек. Когда под форсункой 13 находятся периферические области 15 стента 1, скорость поступательного движения стента 1составляет приблизительно 0,25-0,4 см/сек. Варьирование скоростей вращения и поступательного движения стента 1 во время разбрызгивания аэрозоля позволяет добиться плавного уменьшения количества нанесенного покрытия в зоне перекрытия. Таким образом, после нанесения аэрозоля на обе половины стента 1, толщина лекарственного покрытия в центральной области 14 стента 1 становится близкой к толщине лекарственного покрытия в периферических областях 15 стента 1. Равномерность толщины лекарственного покрытия позволяет проводить дальнейшие манипуляции со стентом (например, сжатие при загрузке в систему доставки) с меньшим риском повреждения целостности покрытия.
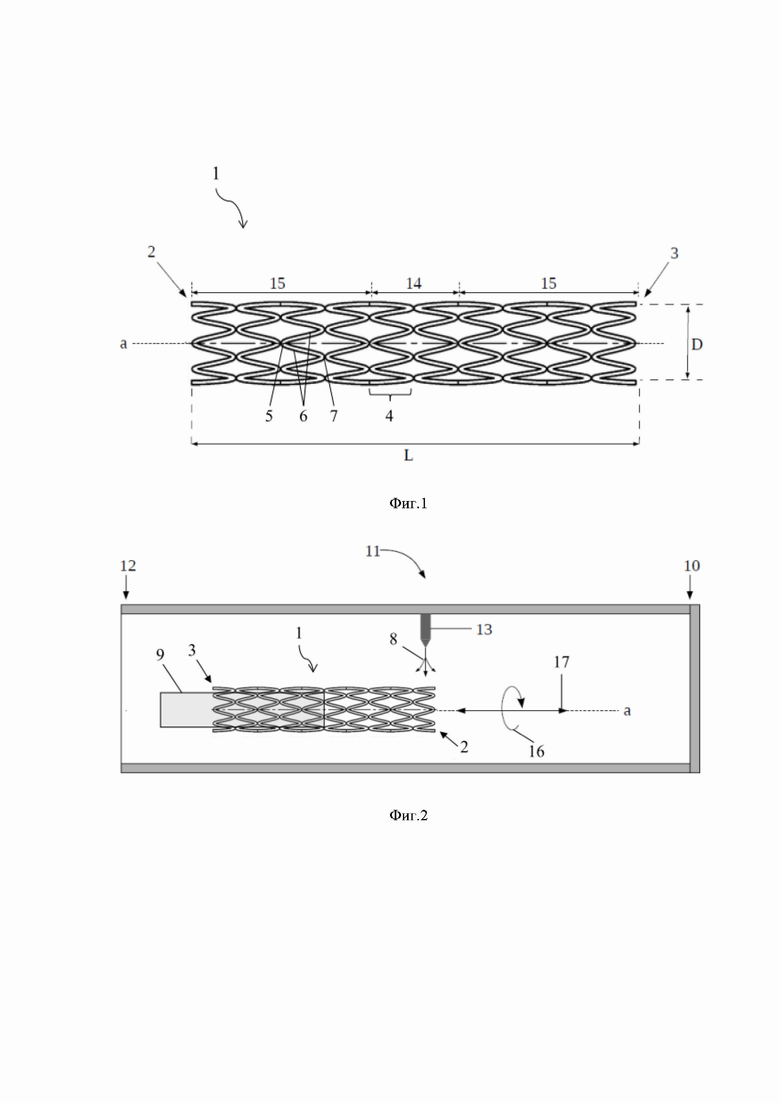
[0076] После нанесения аэрозоля на обе половины стента 1 следует финальная сушка лекарственного покрытия, которую проводят при тех же параметрах, что и первую сушку. Во время сушки органический растворитель или несколько органических растворителей, содержащихся в жидкой композиции, практически полностью испаряются так, что их суммарное содержание в высушенном покрытии не превышает 1% мас. После завершения финальной сушки покрытие образует на поверхности стента 1 сплошную пленку толщиной от приблизительно 3 мкм до приблизительно 8 мкм.
[0077] Биоразлагаемое полимерное лекарственное покрытие на поверхности стента 1 формируют путем разбрызгивания аэрозоля, полученного из жидкой композиции, содержащей один или несколько биосовместимых полимеров, один или несколько терапевтических агентов, антиоксидант, пластификатор и один или несколько органических растворителей. Биоразлагаемое полимерное лекарственное покрытие формируют в два этапа, каждый из которых заключается в нанесении аэрозоля на одну половину стента, как описано выше. Этапы разделены между собой сушкой и разворотом стента относительно держателя на 180º. Затем следует финальная сушка. При этом первую и финальную сушки при формировании биоразлагаемого лекарственного покрытия проводят при температуре при температуре от приблизительно 40°С до приблизительно 60°С. Температура выше 60°С может приводить к стеклованию полимеров, формирующих биоразлагаемую полимерную матрицу.
[0078] При формировании биостабильного полимерного лекарственного покрытия на поверхности стента 1 количество этапов увеличивается до четырех. Это связано с тем, что каждый из двух слоев биостабильного полимерного лекарственного покрытия формируется в два этапа. Так, на первых двух этапах на поверхность стента наносят аэрозоль, полученный из первой жидкой композиции, содержащей биосовместимый праймер и один или несколько органических растворителей. Параметры нанесения аэрозоля аналогичны тем, что описаны выше для биоразлагаемого покрытия. Между первым и вторым этапами проводят сушку покрытия и разворот стента 1 на держателе 9.
[0079] На третьем и четвертом этапах формирования биостабильного лекарственного покрытия на поверхность стента 1 наносят аэрозоль, полученный из второй жидкой композиции, содержащей фторполимер, один или несколько терапевтических агентов, антиоксидант и один или несколько органических растворителей. Параметры нанесения аэрозоля аналогичны тем, что описаны выше для биоразлагаемого покрытия. Между третьим и четвертым этапами проводят сушку покрытия и разворот стента на держателе. После четвертого этапа проводят финальную сушку покрытия.
[0080] При этом все сушки проводят при тех же параметрах, которые описаны для биоразлагаемого покрытия за тем исключением, что верхний предел температуры сушки может достигать 80°С. Это связано с тем, что биостабильные полимеры обладают более высокой температурой стеклования.
[0081] При формировании обоих типов полимерного лекарственного покрытия после финальной сушки проводят контроль качества полученного лекарственного покрытия. Под микроскопом визуально оценивают качество сформированного покрытия и выбирают такие стенты 1, лекарственное покрытие которых обладает гладкой поверхностью без трещин, эрозий, наплывов, капель, сгустков материала покрытия.
ОПИСАНИЕ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
[0082] Пример 1. Качество лекарственных покрытий на основе различных полимеров.
[0083] Для формирования лекарственного покрытия заявленным способом получали жидкую композицию путем растворения сиролимуса, ПЭГ-400, BHT и полимера в хлороформе. При этом использовали различные полимеры с разной характеристической вязкостью (Таблица 1). В результате получали варианты жидкой композиции с кинематической вязкостью в диапазоне 0,7-1,5 сСт.
[0084] Таблица 1. Характеристики полимеров в составе разных вариантов лекарственного покрытия.
PLGA (50/50)
0,15-0,25
PLGA (65/35)
0,55-0,75
PLGA (75/25)
0,55-0,75
[0085] Указанные полимеры и их сочетания использовали для формирования вариантов лекарственного покрытия на поверхности стентов согласно заявленному способу. В случае использования сочетания PLLA + PLGA полимеры входили в покрытие в приблизительно равном соотношении. В случае использования PVDF-HFP на поверхности стента предварительно формировали грунтовочный слой из PMBA, как описано выше. Качество готового высушенного лекарственного покрытия оценивали визуально с помощью микроскопа со встроенной цифровой фотокамерой.
[0086] В случае вариантов №1, №2, №4, №5, №6 и №7 лекарственное покрытие образует гладкую поверхность без видимых дефектов (Фиг. 3А, 3Б, 3Г, 3Д, 3Е и 3Ж, соответственно). В случае варианта №3 покрытие неравномерное, похожее на паутину (Фиг. 3В). Вероятнее всего, дефектное покрытие возникло из-за высокой кинематической вязкости жидкой композиции, обусловленной высокой характеристической вязкостью полимера. Высокая вязкость жидкой композиции приводит к технологическим трудностям при нанесении покрытия. Из представленных данных видно, что для формирования лекарственного покрытия согласно заявленному способу может быть использована жидкая композиция на основе полимеров с характеристической вязкостью 0,2-1,2 дл/г.
[0087] Пример 2. Качество лекарственного покрытия после стерилизации стента.
[0088] Как уже говорилось выше, стерилизация является одним из важных этапов подготовки стента к имплантации. При этом стандартная стерилизация этиленоксидом при высокой относительной влажности и температуре около 50°С может значительно ухудшать качество лекарственного покрытия: появляются потеки, неровности, шероховатости и т.п.
[0089] В данном эксперименте стерилизацию стентов проводили после закрепления стента на системе доставки путем обжатия стента на баллоне. Нумерация вариантов лекарственных покрытий в данном эксперименте соответствует нумерации вариантов из Таблицы 1. Стерилизацию стентов с биоразлагаемым лекарственным покрытием №1, №2, №4 и №5 проводили при относительной влажности 87% и температуре 52°С.
[0090] После стерилизации обнаружилось, что лекарственные покрытия №1 и №2 на основе PLLA не имели потеков, вид поверхности покрытия существенно не изменился (Фиг. 4А и 4Б, соответственно). Лекарственные покрытия №4 и №5 на основе сочетания PLLA и PLGA сохранили необходимое качество после стерилизации (Фиг. 4В и 4Г).
[0091] Стерилизацию стента с биостабильным лекарственным покрытием №7 на основе PVDF-HFP проводили при относительной влажности 87% и температуре 52°С. Покрытие №7 также не имело существенных дефектов после стерилизации (Фиг. 4Д).
[0092] Из представленных данных можно сделать вывод, что указанные биоразлагаемые лекарственные покрытия на основе PLLA и сочетания PLLA c PLGA, а также биостабильное лекарственное покрытие на основе PVDF-HFP, способны выдерживать стандартную процедуру стерилизации этиленоксидом.
[0093] Пример 3. Исследование кинетики высвобождения сиролимуса из лекарственных покрытий на основе различных полимеров.
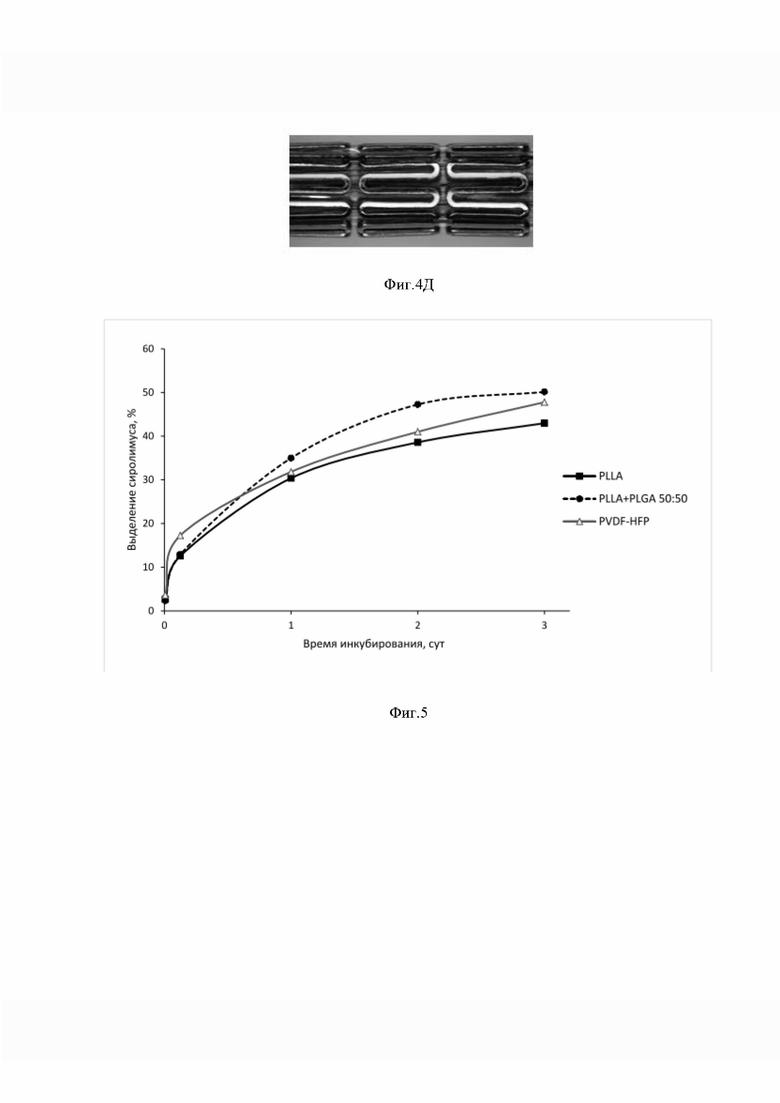
[0094] В данном исследовании использовали стерилизованные этиленоксидом стенты с лекарственными покрытиями на основе PLLA (№2), сочетания PLLA + PLGA (№4) и на основе PVDF-HFP (№7) (Таблица 2). Нумерация вариантов лекарственных покрытий в данном эксперименте соответствует нумерации вариантов из Таблицы 1. При этом все стенты содержали сиролимуса около 40% мас. от массы сухого покрытия. В данном эксперименте имитировали физиологические условия, в которые попадает стент после имплантации. Стенты инкубировали в воде 37°С в течение 2 мин, затем раскрывали индефлятором. Скорость высвобождения сиролимуса исследовали in vitro, инкубируя стенты с лекарственным покрытием в буферном растворе при 37°С, и определяли количество сиролимуса, выделившегося в определенные интервалы времени.
[0095] Таблица 2. Характеристики различных вариантов лекарственных покрытий.
PLGA (0,15-0,25)
[0096] Кинетика выделения сиролимуса из указанных лекарственных покрытий показана на Фиг. 5. По оси абсцисс отмечено время инкубации стентов в физиологическом растворе, за единицу измерения взяты сутки. По оси ординат отмечена доля сиролимуса, выделившаяся за определенный промежуток времени, в процентах от исходной массы сиролимуса в лекарственном покрытии Видно, что все варианты лекарственного покрытия продемонстрировали терапевтически эффективную скорость высвобождения сиролимуса — около 50% мас. за первые 3 суток эксперимента.
[0097] В настоящих материалах заявки представлено предпочтительное раскрытие осуществления заявленного технического решения, которое не должно использоваться как ограничивающее иные, частные воплощения его реализации, которые не выходят за рамки испрашиваемого объема правовой охраны и являются очевидными для специалистов в соответствующей области техники.
ЛИТЕРАТУРА
1) Acton QA Vascular Diseases: New Insights for the Healthcare Professional // Scholary Editions. 2013.
2) Burton GW, Ingold K. U. Autoxidation of biological molecules. 1. Antioxidant activity of vitamin E and related chain-breaking phenolic antioxidants in vitro // J. Am. Chem. Soc. 1981. Vol. 103 (21): p. 6472—6477.
3) Edlund U, Albertsson AC. Degradable polymer microspheres for controlled drug delivery // Advances in Polymer Science. 2002. Vol. 157: p. 67-112.
4) Edelman ER, Rogers C. Pathobiologic responses to stenting // The American journal of cardiology. 1998; 81(7A): 4E–6E.
5) Malmsten M. Surfactants and Polymers in drug Delivery // Institute for Surface Chemistry and Royal Institute of Technology, Stockholm, Sweden. 2002.
6) Park TG. Degradation of Poly(lactic-co-glycolide acid) microspheres: effect of copolymer composition // Biomaterils. 1995. Vol.16: p.1123-1130.
7) Tanaka H, Sukhova GK, Swanson SJ, Clinton SK, Ganz P, Cybulsky MI, Libby P. Sustained activation of vascular cells and leukocytes in the rabbit aorta after balloon injury // Circulation. 1993; 88: p. 1788–1803.
8) Vergerа ML, Fluckigera L, Kimb Y, Hoffmana M, Maincent P. Preparation and characterization of nanoparticles containing an antihypertensive agents // Eup. J. Pharm. Biopharm.1998. Vol.46: p.137-143.
9) Штильман М. И. Полимеры медико-биологического назначения // М.: Академкнига, 2006.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТЕНТ, ВЫДЕЛЯЮЩИЙ ДВА ЛЕКАРСТВЕННЫХ ВЕЩЕСТВА | 2010 |
|
RU2552086C2 |
| СТЕНТ, ВЫДЕЛЯЮЩИЙ РАПАМИЦИН | 2010 |
|
RU2563429C2 |
| СТЕНТ ИЗ ОГОЛЕННОГО МЕТАЛЛА С РЕЗЕРВУАРАМИ, ВЫДЕЛЯЮЩИМИ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ | 2011 |
|
RU2573107C2 |
| Способ получения биодеградируемого полимерного покрытия на основе полилактида на проволоке TiNbTaZr | 2018 |
|
RU2686747C1 |
| СТЕНТ С ТОНКИМИ КАРКАСНЫМИ ЭЛЕМЕНТАМИ ИЗ БИОРАССАСЫВАЮЩЕГОСЯ ПОЛИМЕРА С ВЫСОКОЙ УСТАЛОСТНОЙ И РАДИАЛЬНОЙ ПРОЧНОСТЬЮ И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2014 |
|
RU2667649C2 |
| СПОСОБЫ И КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КЛОНИДИН, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЛЕЧЕНИЯ ПОСЛЕОПЕРАЦИОННОЙ БОЛИ | 2009 |
|
RU2510263C2 |
| СТИМУЛИРУЮЩАЯ АДГЕЗИЮ ВРЕМЕННАЯ МАСКА ДЛЯ ПОКРЫТЫХ ПОВЕРХНОСТЕЙ | 2009 |
|
RU2526885C2 |
| СОСТАВЫ, СОДЕРЖАЩИЕ КЛОНИДИН В РАЗЛАГАЕМОМ ПОЛИМЕРЕ | 2009 |
|
RU2494731C2 |
| СТЕНТ | 2007 |
|
RU2432183C9 |
| УСТРОЙСТВО ДЛЯ ЛОКАЛЬНОЙ И/ИЛИ РЕГИОНАРНОЙ ДОСТАВКИ С ПРИМЕНЕНИЕМ ЖИДКИХ СОСТАВОВ ТЕРАПЕВТИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ | 2009 |
|
RU2596092C2 |


Группа изобретений относится к области медицины, а именно к имплантируемым стентам, содержащим лекарственное покрытие и к способу его получения. Стент включает полимер, выбранный для биостабильного либо биоразлагаемого лекарственного покрытия и представляющий собой полилактид или фторполимер, и терапевтический агент, сохраняющий терапевтическую активность в сочетании с выбранным полимером, сформированного путем нанесения на поверхность стента аэрозоля, сформированного из жидкой композиции, имеющей кинематическую вязкость от 0,5 сСт до 1,5 сСт, и последующего высушивания нанесенного на поверхность стента аэрозоля. Заявленный стент получен оригинальным способом. Группа изобретений позволяет доставить терапевтический агент к месту лечения и контролировать скорость его высвобождения, при этом сохранить целостность и функциональность во время всех манипуляций, производимых со стентом до имплантации в сосуде. 2 н. и 19 з.п. ф-лы, 5 ил., 2 табл., 3 пр.
1. Стент, имеющий продольную ось, центральную область и периферические области, содержащий на поверхности лекарственное покрытие, включающее, по меньшей мере, один полимер, выбранный для биостабильного либо биоразлагаемого лекарственного покрытия и представляющий собой полилактид или фторполимер, а также терапевтический агент, сохраняющий терапевтическую активность в сочетании с выбранным полимером, сформированное путем нанесения на поверхность стента аэрозоля, сформированного из жидкой композиции, имеющей кинематическую вязкость от 0,5 сСт до 1,5 сСт, и последующего высушивания нанесенного на поверхность стента аэрозоля.
2. Стент по п. 1, где терапевтический агент может быть выбран из ряда, включающего сиролимус, эверолимус, биолимус, зотаролимус или паклитаксел.
3. Стент по п. 2, в котором полимер выбран таким образом, что покрытие обеспечивает высвобождение от 30% мас. до 70% мас. терапевтического агента за первые 3 суток в физиологических условиях in vitro.
4. Стент по п. 1, где лекарственное покрытие дополнительно включает вещество, защищающее терапевтическую активность терапевтического агента.
5. Стент по п. 4, где вещество, защищающее терапевтическую активность терапевтического агента, представляет собой бутилгидрокситолуол.
6. Стент по п. 1, где полилактид представляет собой поли-L-лактид или сочетание поли-L-лактида с полилактид-ко-гликолидом и имеет молекулярную массу от 50 кДа до 100 кДа.
7. Стент по п. 6, где лекарственное покрытие дополнительно включает пластификатор.
8. Стент по п. 7, где пластификатор представляет собой полиэтиленгликоль с молекулярной массой от 200 Да до 800 Да.
9. Стент по п. 1, где фторполимер представляет собой поли(винилидин фторид-ко-гексафторпропилен) с молекулярной массой от 150 кДа до 350 кДа.
10. Способ формирования стента, содержащего на поверхности лекарственное покрытие, включающий следующие этапы:
формируют стент, имеющий продольную ось, центральную область и периферические области;
наносят на поверхность стента аэрозоль, сформированный из жидкой композиции, имеющей кинематическую вязкость от 0,5 сСт до 1,5 сСт,
и включающей, по меньшей мере, один полимер, выбранный для биостабильного либо биоразлагаемого лекарственного покрытия и представляющий собой полилактид или фторполимер,
терапевтический агент, сохраняющий терапевтическую активность в сочетании с выбранным полимером,
и органический растворитель, способный растворять выбранный полимер;
при этом нанесение аэрозоля производят при непрерывном вращении стента вокруг продольной оси и непрерывном поступательном движении стента вдоль продольной оси,
высушивают нанесенный на поверхность стента аэрозоль.
11. Способ по п. 10, где терапевтический агент выбирают из ряда, включающего сиролимус, эверолимус, биолимус, зотаролимус или паклитаксел.
12. Способ по п. 10, где аэрозоль формируют из жидкой композиции, дополнительно включающей вещество, защищающее терапевтическую активность терапевтического агента.
13. Способ по п. 12, где в качестве вещества, защищающего терапевтическую активность терапевтического агента, используют бутилгидрокситолуол.
14. Способ по п. 10, где в качестве полилактида используют поли-L-лактид или сочетание поли-L-лактида с полилактид-ко-гликолидом, причем полимер имеет молекулярную массу от 50 кДа до 100 кДа.
15. Способ по п. 14, в котором нанесенный на поверхность стента аэрозоль высушивают при температуре не более 60ºС.
16. Способ по п. 14, в котором аэрозоль формируют из жидкой композиции, дополнительно включающей пластификатор.
17. Способ по п. 16, где в качестве пластификатора используют полиэтиленгликоль с молекулярной массой от 200 Да до 800 Да.
18. Способ по п. 10, где в качестве фторполимера используют поли(винилидин фторид-ко-гексафторпропилен) с молекулярной массой от 150 кДа до 350 кДа.
19. Способ по п. 18, в котором нанесенный на поверхность стента аэрозоль высушивают при температуре 20-80ºС.
20. Способ по п. 10, в котором в процессе нанесения аэрозоля на поверхность центральной области стента увеличивают скорость вращения стента вокруг продольной оси и скорость поступательного движения стента вдоль продольной оси.
21. Способ по п. 10, в котором нанесенный на поверхность стента аэрозоль высушивают при давлении, не превышающем 400 мм рт. ст.
| СПОСОБ НАНЕСЕНИЯ СПЛОШНОГО ПОКРЫТИЯ НА СТЕНТ И СТЕНТ, ПОЛУЧЕННЫЙ НАЗВАННЫМ СПОСОБОМ | 2006 |
|
RU2458708C2 |
| US 20130317599 B2, 21.07.2015 | |||
| WO 2004032804 A1, 22.04.2004 | |||
| КУДРЯШОВ А.Н | |||
| и др | |||
| Современное поколение стентов с лекарственным покрытием: фокус на сиролимус-покрытый стент "Калипсо" | |||
| Патология кровообращения и кардиохирургия | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
Авторы
Даты
2022-06-30—Публикация
2021-02-26—Подача