[0001] Настоящее изобретение относится к модифицированному белку, который представляет собой комбинацию (i) L-аспарагиназы и (ii) одного или нескольких (поли)пептидов, где (поли)пептид состоит исключительно из аминокислотных остатков пролина и аланина. Модифицированный белок может быть образован несколькими способами, включая химическое конъюгирование между L-аспарагиназой и (поли)пептидами или путем экспрессии модифицированного белка в виде гибридного белка. В данном документе также представлены нуклеиновые кислоты, кодирующие модифицированный белок, векторы и/или клетки-хозяева, содержащие их, а также способы их получения. Раскрыты композиции, содержащие модифицированный белок, и их применение в медицине, особенно при лечении рака. В другом аспекте изобретения L-аспарагиназа может быть получена из бактерий рода Erwinia и/или она имеет по меньшей мере 85% идентичность аминокислотной последовательности SEQ ID NO: 1.
[0002] Белки с активностью L-аспарагин-аминогидролазы, широко известные как L-аспарагиназы, успешно используются для лечения острого лимфобластного лейкоза (ОЛЛ) у детей в течение многих лет. ОЛЛ является наиболее распространенным злокачественным раком у детей (Avramis (2005) Clin. Pharmacokinet. 44, 367-393).
[0003] L-аспарагиназа также используется для лечения болезни Ходжкина, острого миелолейкоза, острого миеломоноцитарного лейкоза, хронического лимфоцитарного лейкоза, лимфосаркомы, ретикулосаркомы и меланосаркомы (Kotzia (2007) J. Biotechnol. 127, 657-669). Считается, что противоопухолевая активность L-аспарагиназы обусловлена неспособностью или сниженной способностью некоторых злокачественных клеток синтезировать L-аспарагин (Id). Эти злокачественные клетки полагаются на внеклеточный запас L-аспарагина. Однако фермент L-аспарагиназа катализирует гидролиз L-аспарагина до аспарагиновой кислоты и аммиака, тем самым истощая циркулирующие пулы L-аспарагина и убивая опухолевые клетки, которые не могут осуществлять синтез белка без L-аспарагина (Id).
[0004] L-аспарагиназа E.coli была первым ферментным препаратом, использованным в терапии ОЛЛ, и продавалась под торговым названием Elspar® в Соединенных Штатах или как Kidrolase® и L-аспарагиназа Medac® в Европе. L-аспарагиназы также были выделены из других микроорганизмов, например, белка L-аспарагиназы из Erwinia chrysanthemi, названного кризантаспаза, который продавался под торговым названием Erwinase® (Wriston (1985) M eth. Enzymol. 113, 608-618; Goward (1992) Bioseparation 2, 335-341). Также были идентифицированы L-аспарагиназы из других видов Erwinia, включая, например, Erwinia chrysanthemi 3937 (номер доступа в Genbank AAS67028), Erwinia chrysanthemi NCPPB 1125 (номер доступа в Genbank CAA31239), Erwinia carotovora (номер доступа в Genbank AAP92666) и Erwinia carotovora subsp. artroseptica (номер доступа в Genbank AAS67027). Эти L-аспарагиназы Erwinia chrysanthemi имеют идентичность аминокислотной последовательности между собой примерно 91-98%, в то время как L-аспарагиназы Erwinia carotovora имеют примерно 75-77% идентичность аминокислотной последовательности с L-аспарагиназами Erwinia chrysanthemi (Kotzia (2007) J. Biotechnol. 127, 657-669).
[0005] L-аспарагиназы бактериального происхождения обладают высоким иммуногенным и антигенным потенциалом и часто провоцируют неблагоприятные реакции, начиная от легкой аллергической реакции и заканчивая анафилактическим шоком у сенсибилизированных пациентов (Wang (2003) Leukemia 17, 1583-1588). L-аспарагиназа E. coli является особенно иммуногенной в соответствии с полученными данными о наличии анти-аспарагиназных антител к L-аспарагиназе E. coli после внутривенного или внутримышечного введения, достигающими 78% у взрослых и 70% у детей (Id).
[0006] L-аспарагиназы Escherichia Coli и Erwinia chrysanthemi различаются по своим фармакокинетическим свойствам и, соответственно, имеют различные иммуногенные профили (Klug Albertsen (2001), Brit. J. Haematol. 115, 983-990). Кроме того, было показано, что антитела, которые вырабатывались после обработки L-аспарагиназой Е.coli, не реагируют перекрестно с L-аспарагиназой Erwinia (Wang (2003) Leukemia 17, 1583-1588). Таким образом, L-аспарагиназа Erwinia (крисантаспаза) использовалась в качестве терапии ОЛЛ второй линии у пациентов, показавших реакцию на L-аспарагиназу E. coli (Duval (2002) Blood 15, 2734-2739; Avramis (2005) Clin. Pharmacokinet. 44, 367-393).
[0007] В другой попытке снизить иммуногенность, связанную с введением микробных L-аспарагиназ, была разработана L-аспарагиназа E.coli, модифицированная метоксиполиэтиленгликолем (mPEG). Эта так называемая mPEG-L-аспарагиназа или пегаспаргаза, продаваемая под торговым названием Oncaspar® (Enzon Inc.) была впервые одобрена в США для терапии ОЛЛ второй линии в 1994 году, а с 2006 года - для терапии ОЛЛ первой линии у детей и взрослых.
[0008] Oncaspar® представляет собой L-аспарагиназу E.coli, которая была модифицирована по нескольким остаткам лизина с использованием mPEG-сукцинимидилсукцината 5 кДа (SS-PEG) (патент США № 4,179,337). SS-PEG представляет собой PEG-реагент первого поколения, который содержит нестабильную сложноэфирную связь, которая чувствительна к гидролизу ферментами или при слабощелочных значениях pH (патент США № 4,670,417). Эти свойства снижают стабильность in vitro и in vivo и могут снизить безопасность лекарств.
[0009] Кроме того, было продемонстрировано, что антитела, разработанные против L-аспарагиназы из E.coli, будут перекрестно реагировать с Oncaspar® (Wang (2003) Leukemia 17, 1583-1588). Несмотря на то, что эти антитела не были нейтрализующими, данное открытие ясно продемонстрировало высокий потенциал перекрестной гиперчувствительности или перекрестной инактивации in vivo. Действительно, в одном сообщении были представлены данные о том, что 30-41% детей, получавших пегаспаргазу, имели аллергическую реакцию (Id).
[00010] В дополнение к внешним аллергическим реакциям недавно сообщалось о проблеме «скрытой гиперчувствительности», когда пациенты вырабатывают антитела к аспарагиназе без проявления каких-либо клинических признаков реакции гиперчувствительности (Wang (2003) Leukemia 17, 1583-1588). Эта реакция может привести к образованию нейтрализующих антител к L-аспарагиназе и пегаспаргазе E. coli; однако этих пациентов не переводят на L-аспарагиназу Erwinia из-за отсутствия внешних признаков гиперчувствительности, и поэтому они получают более короткую продолжительность эффективного лечения (Holcenberg (2004) J. Pediatr. Hematol. Oncol. 26, 273-274).
[00011] Лечение L-аспарагиназой Erwinia chrysanthemi часто используется в случае повышенной чувствительности к L-аспарагиназам, полученным из E. coli-. Однако было отмечено, что до 30-50% пациентов, получающих L-аспарагиназу Erwinia, являются антителоположительными (Avramis (2005), Clin. Pharmacokinet. 44, 367-393). Более того, поскольку L-аспарагиназа Erwinia chrysanthemi имеет более короткий период полувыведения, чем L-аспарагиназы E. coli, ее следует вводить чаще (Id). В исследовании Avramis et. al, аспарагиназа Erwinia была связана с низкими фармакокинетическими профилями (Avramis (2007), J. Pediatr. Hematol. Oncol. 29, 239-247). Следовательно, L-аспарагиназа и пегаспаргаза E. coli, являются предпочтительными препаратами терапии ОЛЛ первой линии по сравнению с L-аспарагиназой Erwinia.
[00012] Многочисленные биофармацевтические препараты успешно пегилированы и продаются на протяжении многих лет. Однако во многих случаях пегилированные биофармацевтические препараты проявляют значительно сниженную активность по сравнению с немодифицированным биофармацевтическим препаратом. В случае L-аспарагиназы Erwinia carotovora было отмечено, что пегилирование снижало ее активность in vitro примерно до 57% (Kuchumova (2007) Biochemistry (Moscow) Supplement Series B: Biomedical Chemistry, 1, 230-232). L-аспарагиназа Erwinia carotovora имеет только примерно 75% гомологии с L-аспарагиназой Erwinia chrysanthemi (крисантаспаза). Для Oncaspar® также известно, что его активность in vitro составляет примерно 50% по сравнению с немодифицированной L-аспарагиназой E.coli.
[00013] Таким образом, технической проблемой, лежащей в основе настоящего изобретения, является обеспечение средств и способов лечения рака, такого как лейкоз или неходжкинская лимфома, которые позволяют избежать ограничений и недостатков способов лечения предшествующего уровня техники, особенно некоторых пегилированных аспарагиназ.
[00014] Техническая проблема решается путем предоставления вариантов осуществления, охарактеризованных в формуле изобретения.
[00015] В одном аспекте настоящее изобретение относится к модифицированному белку, содержащему (i) L-аспарагиназу и (ii) один или несколько (поли)пептидов, где (поли)пептид состоит исключительно из аминокислотных остатков пролина и аланина. В предпочтительном аспекте изобретение относится к модифицированному белку, содержащему (i) L-аспарагиназу, имеющую по меньшей мере 85% идентичность аминокислотной последовательности SEQ ID NO: 1 и (ii) один или несколько (поли)пептидов, где (поли)пептиды состоят исключительно из аминокислотных остатков пролина и аланина.
Настоящее изобретение относится, в частности, к следующим пунктам:
1. Модифицированный белок, содержащий (i) L-аспарагиназу и (ii) один или несколько (поли)пептидов, где (поли)пептид состоит исключительно из аминокислотных остатков пролина и аланина.
2. Модифицированный белок по п. 1, в котором указанная L-аспарагиназа имеет по меньшей мере 85% идентичность аминокислотной последовательности SEQ ID NO: 1
3. Модифицированный белок по п. 1 или 2, в котором указанная L-аспарагиназа имеет аминокислотную последовательность SEQ ID NO: 1.
4. Модифицированный белок по любому из пп. 1-3, в котором модифицированный белок имеет активность аспарагиназы или глутаминазы выше, чем у немодифицированной L-аспарагиназы.
5. Модифицированный белок по любому из пп. 1-4, в котором указанный модифицированный белок обладает активностью истощения L-аспарагина, которая по меньшей мере примерно на 20% превышает таковую у немодифицированной L-аспарагиназы.
6. Модифицированный белок по любому из пп. 1-5, в котором указанная L-аспарагиназа представляет собой тетрамер.
7. Модифицированный белок по любому из пп. 1-6, который представляет собой модифицированный белок указанной L-аспарагиназы и полипептида, где полипептид состоит исключительно из аминокислотных остатков пролина и аланина.
8. Модифицированный белок по п. 7, где указанный полипептид состоит из примерно 100-600 аминокислотных остатков пролина и аланина, в частности примерно 200-400 аминокислотных остатков пролина и аланина.
9. Модифицированный белок по п. 7 или 8, где указанный полипептид состоит в общей сложности из примерно 200 аминокислотных остатков пролина и аланина или в общей сложности примерно из 400 аминокислотных остатков пролина и аланина.
10. Модифицированный белок по любому из пп. 7-9, где указанные пролиновые остатки составляют более чем примерно 10% и менее чем примерно 70% полипептида.
11. Модифицированный белок по любому из пп. 7-10, где указанный полипептид содержит множество аминокислотных повторов, где указанный повтор состоит из остатков пролина и аланина и где не более 6 последовательных аминокислотных остатков являются идентичными.
12. Модифицированный белок по любому из пп. 7-11, где указанный полипептид содержит или состоит из аминокислотной последовательности AAPAAPAPAAPAAPAPAAPA (SEQ ID NO: 5) или циклически переставленных версий или (а) мультимера(ов) последовательностей в целом или частей последовательности.
13. Модифицированный белок по любому из пп. 7-12,
(а) в котором указанный полипептид содержит или состоит из аминокислотной последовательности в соответствии с представленной в SEQ ID NO: 7 или 9;
(b) где указанный полипептид содержит или состоит из аминокислотной последовательности, кодируемой нуклеиновой кислотой, имеющей нуклеотидную последовательность в соответствии с представленной в SEQ ID NO: 8 или 10.
14. Модифицированный белок по любому из пп. 7-13,
(а) в котором указанный модифицированный белок содержит или состоит из аминокислотной последовательности в соответствии с представленной в SEQ ID NO: 11 или 13;
(b) в котором указанный модифицированный белок содержит или состоит из аминокислотной последовательности, кодируемой нуклеиновой кислотой, имеющей нуклеотидную последовательность в соответствии с представленной в SEQ ID NO:12 или 14.
15. Модифицированный белок по любому из пп. 7-14, в котором указанный полипептид представляет собой полипептид с конформацией статистического клубка.
16. Модифицированный белок по любому из пп. 7-15, в котором модифицированный белок представляет собой гибридный белок L-аспарагиназы и полипептида.
17. Модифицированный белок по любому из п. 1-6, который представляет собой модифицированный белок L-аспарагиназы и одного или нескольких пептидов, где каждый независимо представляет собой пептид RN-(P/A)-RC,
где (P/A) представляет собой аминокислотную последовательность, состоящую исключительно из аминокислотных остатков пролина и аланина, где RN представляет собой защитную группу, присоединенную к N-концевой аминогруппе аминокислотной последовательности, и
где RC представляет собой аминокислотный остаток, связанный посредством своей аминогруппы с C-концевой карбоксигруппой аминокислотной последовательности,
где каждый пептид конъюгирован с L-аспарагиназой посредством амидной связи, образованной из карбоксигруппы C-концевого аминокислотного остатка RC пептида и свободной аминогруппы L-аспарагиназы, и
где по меньшей мере одна из свободных аминогрупп, с которыми конъюгированы пептиды, не является N-концевой α-аминогруппой L-аспарагиназы.
18. Модифицированный белок по п. 17, где указанная аминокислотная последовательность состоит из в общей сложности от 15 до 45 аминокислотных остатков пролина и аланина.
19. Модифицированный белок по п. 17 или 18, в котором указанная аминокислотная последовательность состоит из 20 аминокислотных остатков пролина и аланина.
20. Модифицированный белок по п. 17 или 18, в котором указанная аминокислотная последовательность состоит из 40 аминокислотных остатков пролина и аланина.
21. Модифицированный белок по любому из пп. 17-20, где указанные пролиновые остатки составляют более чем примерно 10% и менее чем примерно 70% аминокислотной последовательности.
22. Модифицированный белок по любому из пп. 17-21, в котором указанная аминокислотная последовательность представляет собой
AAPAAPAPAAPAAPAPAAPA (SEQ ID NO: 5) или
AAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPA (SEQ ID NO: 15).
23. Модифицированный белок по любому из пп. 17-22,
где RN представляет собой пироглутамоил или ацетил, и/или
где RC представляет собой ε-аминогексановую кислоту.
24. Модифицированный белок по любому из пп. 17-23, в котором пептиды, содержащиеся в указанном модифицированном белке, принимают конформацию статистического клубка.
25. Модифицированный белок по любому из пп. 17-24, в котором все пептиды, содержащиеся в указанном модифицированном белке, являются одинаковыми.
26. Модифицированный белок по любому из пп. 17-25, в котором по меньшей мере одна из свободных аминогрупп, с которыми конъюгированы пептиды, представляет собой ε-аминогруппу лизинового остатка L-аспарагиназы.
27. Модифицированный белок по любому из пп. 17-26, в котором свободные аминогруппы, с которыми конъюгированы пептиды, выбраны из группы, включающей ε-аминогруппу(ы) любых лизиновых остатков L-аспарагиназы и N-концевую(ые) α-аминогруппу(ы) L-аспарагиназы.
28. Модифицированный белок по любому из пп. 17-27, в котором L-аспарагиназа состоит из четырех субъединиц, и где 9-13 пептидов в соответствии с определением по любому из пп. 15-24 конъюгированы с каждой субъединицей L-аспарагиназы.
29. Модифицированный белок по любому из пп. 1-28, где указанный полипептид или пептид опосредует сниженную иммуногенность указанного модифицированного белка.
30. Нуклеиновая кислота, кодирующая модифицированный белок по любому из пп. 1-16.
31. Нуклеиновая кислота по п. 30, отличающаяся тем, что указанная нуклеиновая кислота выбрана из группы, состоящей из:
(a) нуклеиновой кислоты, содержащей нуклеотидную последовательность SEQ ID NO:12 или 14;
(b) нуклеиновой кислоты, содержащей нуклеотидную последовательность, имеющую по меньшей мере 85% идентичность нуклеотидной последовательности, определенной в (а); и
(c) нуклеиновой кислоты, которая является вырожденной, из-за генетического кода, в нуклеотидной последовательности, в соответствии с определением в (a) или (b).
32. Вектор, содержащий нуклеиновую кислоту по п. 30 или 31.
33. Клетка-хозяин, содержащая нуклеиновую кислоту по п. 30 или 31 или вектор по п. 32.
34. Клетка-хозяин по п. 33, отличающаяся тем, что указанная клетка-хозяин выбрана из группы, состоящей из Pseudomonas fluorescens и Corynebacterium glutamicum.
35. Способ получения модифицированного белка по любому из пп. 1-16, 29 или нуклеиновой кислоты по п. 30 или 31.
36. Способ по п. 35, включающий культивирование клетки-хозяина по п. 33 или 34 и выделение указанного модифицированного белка из культуры или из указанной клетки.
37. Способ получения модифицированного белка в соответствии с определением в любом из пп. 17-29, причем процесс включает:
(а) сочетание активированного пептида формулы RN-(P/A)-RC-act, где RC-act представляет собой карбокси-активированную форму RC, где RC и (P/A) имеют значения, определенные для модифицированного белка, который необходимо получить, и где RN представляет собой защитную группу, которая присоединена к N-концевой аминогруппе (P/A), с L-аспарагиназой для получения модифицированного белка L-аспарагиназы и пептидов, в котором RN представляет собой защитную группу.
38. Способ по п. 37, отличающийся тем, что активированная карбоксигруппа аминокислотного остатка RC-act в активированном пептиде является активной сложноэфирной группой.
39. Композиция, содержащая модифицированный белок по любому из пп. 1-29 или модифицированный белок, полученный способом по любому из пп. 35-38.
40. Композиция по п. 39, которая представляет собой фармацевтическую композицию, необязательно дополнительно содержащую (а) фармацевтически приемлемый(е) носитель(и) или наполнитель(и).
41. Модифицированный белок по любому из пп. 1-29 или модифицированный белок, полученный способом по любому из пп. 35-38, или композиция по п. 39 или 40 для применения в качестве лекарственного средства.
42. Модифицированный белок по любому из п. 1-29, модифицированный белок, полученный способом по любому из пп. 35-38, или композиция по п. 39 или 40 для применения при лечении заболевания, например, заболевания, поддающегося лечению истощением L-аспарагина у пациента.
43. Способ лечения заболевания, поддающегося лечению истощением L-аспарагина у пациента, причем указанный способ включает введение указанному пациенту эффективного количества модифицированного белка по любому из пп. 1-29, модифицированного белка, полученного способом в соответствии с любым из пп. 35-38, или композиция по пп. 39 или 40.
44. Модифицированный белок для применения в соответствии с п. 42 или композиция для применения в соответствии с п. 42, или способ в соответствии с п. 43, где указанное заболевание, поддающееся лечению истощением L-аспарагина, представляет собой рак.
45. Модифицированный белок по любому из пп. 1-29, модифицированный белок, полученный способом по любому из пп. 35-38, или композиция по п. 39 или 40 для применения при лечении рака.
46. Способ лечения рака, включающий введение субъекту модифицированного белка по любому из пп. 1-29 или модифицированного белка, полученного способом по любому из пп. 35-38, или композиции по п. 39 или 40.
47. Модифицированный белок для применения в соответствии с п. 44 или 45 или композиция для применения в соответствии с п. 44 или 45, где указанный рак представляет собой не солидный рак; или способ по п. 44 или 46, в котором указанный рак представляет собой не солидный рак.
48. Модифицированный белок для применения в соответствии с п. 47 или композиция для применения в соответствии с п. 47, где указанным не солидным раком является лейкоз или неходжкинская лимфома; или способ по п. 47, в котором указанный не солидный рак представляет собой лейкоз или неходжкинскую лимфому.
49. Модифицированный белок для применения в соответствии с п. 48 или композиция для применения в соответствии с п. 48, где указанный лейкоз представляет собой острый лимфобластный лейкоз (ОЛЛ) или острый миелоидный лейкоз (ОМЛ); или способ по п. 48, в котором указанный лейкоз представляет собой острый лимфобластный лейкоз (ОЛЛ) или острый миелоидный лейкоз (ОМЛ).
50. Модифицированный белок для применения по любому из пп. 42, 44, 45 и 47-49 или композиция для применения по любому из пп. 42, 44, 45 и 47-49 или способ по любому из пп. 43, 44 и 46-49, в котором указанный модифицированный белок вызывает более низкий иммуногенный ответ у указанного пациента по сравнению с немодифицированной L-аспарагиназой.
51. Модифицированный белок для применения по любому из пп. 42, 44, 45 и 47-50 или композиция для применения по любому из пп. 42, 44, 45 и 47-50 или способ по любому 43, 44 и 46-50, в котором указанный модифицированный белок имеет более длительный период полувыведения из кровотока in vivo после однократной дозы по сравнению с немодифицированной L-аспарагиназой.
52. Модифицированный белок для применения по любому из пп. 42, 44, 45 и 47-51 или композиция для применения по любому из пп. 42, 44, 45 и 47-51, или способ по любому из пп. 43, 44 и 46-51, в котором указанный модифицированный белок имеет большее значение AUC после однократной дозы по сравнению с немодифицированной L-аспарагиназой.
53. Модифицированный белок для применения по любому из пп. 42, 44, 45 и 47-52 или композиция для применения по любому из пп. 42, 44, 45 и 47-52 или способ по любому из пп. 43, 44 и 46-52, в котором указанный пациент ранее имел гиперчувствительность к L-аспарагиназе E. coli или ее пегилированной форме.
54. Модифицированный белок для применения по любому из пп. 42, 44, 45 и 47-53 или композиция для применения по любому из пп. 42, 44, 45 и 47-53 или способ по любому из пп. 43, 44 и 46-53, в котором указанный пациент ранее имел гиперчувствительность к L-аспарагиназе Erwinia.
55. Модифицированный белок для применения по любому из пп. 42, 44, 45 и 47-54 или композиция для применения по любому из пп. 42, 44, 45 и 47-54 или способ по любому из пп. 43, 44 и 46-54, в котором лечение включает внутривенное введение указанного модифицированного белка.
[00016] В одном аспекте настоящее изобретение относится к модифицированному белку, содержащему (i) рекомбинантную L-аспарагиназу, имеющую по меньшей мере 85% идентичность аминокислотной последовательности SEQ ID NO:1 и (ii) один или несколько (поли)пептидов, где (поли)пептид состоит исключительно из аминокислотных остатков пролина и аланина. Приведенные в данном документе пояснения и определения в отношении терминов «модифицированный белок», «L-аспарагиназа», «(поли)пептиды» и тому подобное, приведенные в данном документе, применяются mutatis mutandis (с учетом внесения необходимых изменений в толкование). Используемый в данном документе термин «рекомбинантная L-аспарагиназа» относится к рекомбинантной форме L-аспарагиназы, имеющей по меньшей мере 85% идентичность аминокислотной последовательности нативной L-аспарагиназы Erwinia. Термин «рекомбинантный» может относиться к рекомбинантно продуцируемой L-аспарагиназе, например, L-аспарагиназе, продуцируемой в клетке-хозяине, содержащей нуклеиновую кислоту, кодирующую L-аспарагиназу.
[00017] Модифицированные белки, кроме того, показывают увеличенный период полувыведения из плазмы и, следовательно, более длительную продолжительность действия по сравнению с соответствующей неконъюгированной L-аспарагиназой. Это позволяет снизить частоту приема и, следовательно, нагрузку побочными эффектами. Изобретение также относится к способам получения модифицированных белков в соответствии с описанным в данном документе.
[00018] В определенных аспектах изобретение относится к модифицированному белку, содержащему (i) L-аспарагиназу, имеющую по меньшей мере 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентичность аминокислотной последовательности SEQ ID NO: 1 и (ii) один или несколько (поли)пептидов, где (поли)пептиды состоят только из аминокислотных остатков пролина и аланина. Понятно, что термин «состоящий исключительно из аминокислотных остатков пролина и аланина» означает присутствие по меньшей мере одного остатка пролина и по меньшей мере одного остатка аланина, т. е. должны присутствовать как по меньшей мере один остаток пролина, так и по меньшей мере один остаток аланина. В предпочтительном аспекте изобретение относится к модифицированному белку, содержащему (i) рекомбинантную L-аспарагиназу, имеющую аминокислотную последовательность SEQ ID NO: 1 и (ii) один или несколько (поли)пептидов, в которых (поли)пептиды состоят исключительно из аминокислотных остатков пролина и аланина. В одном аспекте L-аспарагиназа представляет собой тетрамер (т. е., L-аспарагиназу, состоящую из четырех субъединиц или мономеров). Одна примерная субъединица или мономер имеет аминокислотную последовательность SEQ ID NO: 1.
[00019] В одном аспекте (поли)пептид (т. е., полипептид или пептид) опосредует пониженную иммуногенность модифицированного белка, описанного в данном документе, например, пониженную иммуногенность модифицированного белка по сравнению с неконъюгированной L-аспарагиназой.
[00020] Как показано в прилагаемых примерах, белок PA#1(200)-крисантаспаза имел 109%, а белок PA#1(400)-крисантаспаза имел 118% ферментативной активности по сравнению с немодифицированной крисантаспазой; см. пример 5. Это демонстрирует, что конденсирование аспарагиназ, соответствующих описанным в данном документе, с полипептидами не влияет на ферментативную активность. Удивительно, но активность даже увеличивалась с длиной PA-полипептида.
[00021] В более общем смысле, представленные в данном документе модифицированные белки имеют такую же или по существу такую же (ферментативную) активность по сравнению с немодифицированной аспарагиназой. (Ферментативная) активность может быть оценена посредством анализа Несслера. Подробности анализа Несслера представлены в прилагаемых примерах и/или раскрыты в предшествующем уровне техники, например, Mashburn (1963) Biochem. Biophys. Res. Commun. 12, 50 (полностью включен в настоящее описание в качестве ссылки). Соответственно, в одном аспекте предложенные в данном документе модифицированные белки имеют такую же или по существу одинаковую (ферментативную) активность по сравнению с немодифицированной аспарагиназой в соответствии с оценкой посредством анализа Несслера. Используемый в данном документе термин «немодифицированная аспарагиназа» относится к нативной аспарагиназе, то есть к аспарагиназе, которая не модифицирована конденсированием /конъюгацией с (поли)пептидами в соответствии с определением в данном документе.
[00022] Например, «немодифицированная аспарагиназа» представляет собой L-аспарагиназу, имеющую по меньшей мере 85% идентичность аминокислотной последовательности SEQ ID NO: 1. В предпочтительном аспекте «немодифицированная аспарагиназа» представляет собой L-аспарагиназу, имеющую аминокислотную последовательность SEQ ID NO: 1.
[00023] В некоторых аспектах предлагаемые в данном документе модифицированные белки имеют (ферментативную) активность выше, чем у немодифицированной L-аспарагиназы. (Ферментативная) активность может быть оценена, например, посредством анализа Несслера. Подробности анализа Несслера представлены в прилагаемых примерах и/или раскрыты в предшествующем уровне техники, например, Mashburn (1963) Biochem. Biophys. Res. Commun. 12, 50 (полностью включен в настоящее описание в качестве ссылки). Соответственно, в одном аспекте представленные в данном документе модифицированные белки имеют (ферментативную) активность выше, чем у немодифицированной L-аспарагиназы, что оценивается посредством анализа Несслера. Используемый в данном документе термин «немодифицированная аспарагиназа» относится к нативной аспарагиназе, то есть к аспарагиназе, которая не модифицирована конденсированием /конъюгацией с (поли)пептидами в соответствии с определением в данном документе. Например, «немодифицированная аспарагиназа» представляет собой L-аспарагиназу, имеющую по меньшей мере 85% идентичность аминокислотной последовательности SEQ ID NO:1. В предпочтительном аспекте «немодифицированная аспарагиназа» представляет собой L-аспарагиназу, имеющую аминокислотную последовательность SEQ ID NO: 1. Например, модифицированные белки обладают (ферментативной) активностью, которая может быть по меньшей мере на 5% и/или до 30% (например, по меньшей мере на 10%, 15%, 20%, 25% или более) выше чем таковая у L-аспарагиназы, особенно выше чем у немодифицированной L-аспарагиназы, особенно в соответствии с оценкой посредством анализа Несслера. Приведенные выше пояснения применимы, в частности, к представленным в данном документе гибридным белкам (например, модифицированному белку L-аспарагиназы и полипептида, где полипептид состоит исключительно из аминокислотных остатков пролина и аланина), но не ограничиваются ими.
[00024] В некоторых аспектах модифицированные белки имеют активность аспарагиназы или активность глутаминазы выше, чем у немодифицированной L-аспарагиназы. Например, модифицированные белки могут обладать активностью аспарагиназы или активностью глутаминазы по меньшей мере на 5% и/или до 30% (например, по меньшей мере на 10%, 15%, 20%, 25% (или более) выше чем таковая у L-аспарагиназы, особенно выше чем у немодифицированной L-аспарагиназы, особенно в соответствии с оценкой посредством анализа Несслера. В некоторых вариантах осуществления активность аспарагиназы или активность глутаминазы можно измерять посредством анализа Несслера. Скорость гидролиза аспарагина может быть определена путем измерения высвобожденного аммиака, а количество высвобожденного аммиака при использовании раскрытых в данном документе модифицированных белков можно сравнить с количеством, полученным при использовании L-аспарагиназы или немодифицированной L-аспарагиназы. В дополнительных аспектах указанные модифицированные белки имеют активность истощения L-аспарагина выше, чем у немодифицированной L-аспарагиназы. Например, модифицированные белки имеют активность истощения L-аспарагина по меньшей мере на 5% и/или до 30% (например, по меньшей мере на 10%, 15%, 20%, 25% или более) выше чем таковая у L-аспарагиназы, особенно выше чем у немодифицированной L-аспарагиназы, особенно в соответствии с оценкой посредством анализа Несслера. Изобретение также относится к фармацевтической композиции, содержащей модифицированный белок и модифицированный белок или фармацевтическую композицию для применения в терапии, или для применения в качестве лекарственного средства, или для применения в медицине.
[00025] Обычно модифицированный белок может быть получен путем химического cочетания или генетического конденсирования (в случае конъюгации с другим белком или пептидом). Используемый в данном документе термин «гибридный белок» относится главным образом к модифицированному белку, содержащему (i) L-аспарагиназу и (ii) один или несколько полипептидов, где полипептид состоит исключительно из аминокислотных остатков пролина и аланина. В данном контексте полипептид может состоять из примерно 200-400 пролиновых и аланиновых аминокислотных остатков. Примерная аминокислотная последовательность таких полипептидов показана в SEQ ID NO: 7 или 9.
[00026] Если модифицированный белок получают путем химического сочетания, он включает (i) L-аспарагиназу и (ii) один или несколько пептидов, где пептид состоит исключительно из аминокислотных остатков пролина и аланина. В данном контексте пептид может содержать в общей сложности от 10 до 100 аминокислотных остатков пролина и аланина, от примерно 15 до примерно 60 аминокислотных остатков пролина и аланина, от примерно 15 до 45 аминокислотных остатков пролина и аланина, например, от примерно 20 до примерно 40, например, 20 аминокислотных остатков пролина и аланина или 40 аминокислотных остатков пролина и аланина. Типичными аминокислотными последовательностями таких пептидов являются AAPAAPAPAAPAAPAPAAPA (SEQ ID NO: 5) или AAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPA (SEQ ID NO: 15).
[00027] Используемый в данном документе термин «модифицированный белок» можно использовать взаимозаменяемо с термином «конъюгат», в частности, если термин «модифицированный белок» относится к модифицированному белку, полученному путем химического сочетания или в виде гибридного белка, то есть, прежде всего, если он включает (i) L-аспарагиназу и (ii) один или несколько (поли)пептидов, где (поли)пептиды состоят исключительно из аминокислотных остатков пролина и аланина. Аналогично, термины «немодифицированный» и «неконъюгированный» могут использоваться в данном документе взаимозаменяемо.
[00028] Изобретение также относится к способу получения модифицированного белка, включающему (а) сочетание активированного пептида формулы RN-(P/A)-RC-act, где RC-act представляет собой карбокси-активированную форму RC, где RC и (P/A) имеют значения, определенные для модифицированного белка, который необходимо получить, и где RN представляет собой защитную группу, которая присоединена к N-концевой аминогруппе (P/A), с L-аспарагиназой для получения модифицированного белка L-аспарагиназы и пептидов, в котором RN представляет собой защитную группу.
[00029] В прилагаемых примерах (см. пример 1, таблицу 1) было продемонстрировано, что модифицированный белок может быть получен с использованием различных массовых соотношений активированного пептида и аспарагиназы. Например, могут быть использованы массовые соотношения 10:1 (активированный пептид: аспарагиназа), 7,5:1, 5:1 или 3,5:1. Наблюдалось, что (ферментативная) активность модифицированного белка была наивысшей при использовании соотношения 5:1 или ниже (см. пример 1, таблицу 2). Таким образом при применении способа, описанного выше в данном документе, может быть выгодно использовать массовое соотношение активированный пептид: аспарагиназа 5:1 или ниже, например 5:1, 4:1, 3,5:1 или 3:1. Используемый в данном документе термин «массовое соотношение» относится к отношению молекулярной массы активированного пептида в соответствии с определением в данном документе и аспарагиназы в соответствии с определением в данном документе (например, аспарагиназа, как показано в SEQ ID NO: 1 и белки с по меньшей мере 85% идентичностью с SEQ ID NO: 1). «Молекулярная масса» обычно указывается в данном документе с использованием научной единицы измерения «дальтон» (Да). Хорошо известно, что единица молекулярной массы аспарагиназы или пептида, указанная в данном документе в дальтонах (Да), является альтернативным названием для унифицированной единицы атомной массы (а. е. м.). Молекулярная масса, например, 500 Да, таким образом, эквивалентна 500 г/моль. Термин «кДа» (килодальтон) относится к 1000 Да.
[00030] Молекулярная масса аспарагиназы или пептида может быть определена с использованием способов, известных в данной области техники, таких как, например, масс-спектрометрия (например, масс-спектрометрия с электрораспылительной ионизацией, ESI-MS или масс-спектрометрия с лазерной десорбцией/ионизацией с помощью матрицы, MALDI-MS), гель-электрофорез (например, электрофорез в полиакриламидном геле с использованием додецилсульфата натрия, ДСН-ПААГ-электрофорез (SDS-PAGE)), гидродинамические методы (например, гель-фильтрация/эксклюзионная хроматография, SEC или градиентная седиментация) или динамическое (DLS) или статическое рассеяние света (например, многоугловое рассеяние света, MALS), или молекулярная масса аспарагиназы или пептида может быть рассчитана по известной аминокислотной последовательности (и известным посттрансляционным модификациям, если они присутствуют) аспарагиназы или пептида. Предпочтительно молекулярную массу аспарагиназы или пептида определяют с помощью масс-спектрометрии.
[00031] Изобретение также относится к способу получения модифицированного белка или нуклеиновой кислоты, кодирующей модифицированный белок. В некоторых аспектах способ включает выработку L-аспарагиназы в хозяине, выбранном из группы, включающей дрожжи, такие как Saccharomyces cerevisiae и Pichia Pistoris, а также бактерии, актиномицеты, грибы, водоросли и другие микроорганизмы, включая Escherichia coli, Bacillus sp., Pseudomonas fluorescens, Corynebacterium glutamicum и бактериальные хозяева следующих родов: Serratia, Proteus, Acinetobacter и Alcaligenes. Специалистам в данной области техники известны другие хозяева, включая Nocardiopsis alba, который экспрессирует вариант аспарагиназы, не обладающий глутаминазной активностью (Meena et al. (2014) Bioprocess Biosyst. Eng, статья за октябрь 2014 г., которая полностью включена в настоящее описание посредством ссылки) и статьи, раскрытые в Savitri et al. (2003) Indian Journal of Biotechnology, 2, 184-194, которые полностью включены в настоящее описание посредством ссылки.
[00032] Модифицированный белок может представлять собой гибридный белок, содержащий (i) L-аспарагиназу, имеющую по меньшей мере 85% идентичность аминокислотной последовательности SEQ ID NO: 1, и (ii) один или несколько полипептидов, где полипептид состоит исключительно из аминокислотных остатков пролина и аланина.
[00033] Остатки пролина в полипептиде, состоящем исключительно из аминокислотных остатков пролина и аланина, могут составлять более примерно 10% и менее примерно 70% полипептида. Соответственно, предпочтительно, чтобы от 10% до 70% от общего числа аминокислотных остатков в полипептиде составляли пролиновые остатки; более предпочтительно от 20% до 50% от общего числа аминокислотных остатков, содержащихся в полипептиде, составляли пролиновые остатки; и еще более предпочтительно от 30% до 40% (например, 30%, 35% или 40%) от общего числа аминокислотных остатков, содержащихся в полипептиде, представляли собой пролиновые остатки.
[00034] Полипептид может содержать множество аминокислотных повторов, где указанный повтор состоит из остатков пролина и аланина и где не более 6 последовательных аминокислотных остатков являются идентичными. В частности, полипептид может содержать или состоять из аминокислотной последовательности AAPAAPAPAAPAAPAPAAPA (SEQ ID NO: 5) или циклически переставленных версий или (а) мультимера(ов) последовательностей в целом или частей последовательности.
[00035] Предпочтительно полипептид содержит или состоит из аминокислотной последовательности в соответствии с представленной в SEQ ID NO: 7 или 9, или полипептид содержит или состоит из аминокислотной последовательности, кодируемой нуклеиновой кислотой, имеющей нуклеотидную последовательность, представленной SEQ ID NO: 8 или 10. Предпочтительно, чтобы модифицированный белок (а) содержал или состоял из аминокислотной последовательности, представленной в SEQ ID NO: 11 или 13; или (b) содержал или состоял из аминокислотной последовательности, кодируемой нуклеиновой кислотой, имеющей нуклеотидную последовательность представленную в SEQ ID NO: 12 или 14. В одном аспекте полипептид представляет собой полипептид с конформацией статистического клубка.
[00036] В некоторых аспектах модифицированный белок, например, гибридный белок, обладает активностью аспарагиназы или глутаминазы, которая выше активности неконъюгированной L-аспарагиназы. Например, модифицированные белки могут иметь активность аспарагиназы или глутаминазы по меньшей мере на 5% и/или до 30% (например, по меньшей мере на 10%, 15%, 20%, 25% (или более) выше, чем таковая у немодифицированной L-аспарагиназы, особенно в соответствии с оценкой посредством анализа Несслера. В дополнительных аспектах L-аспарагиназа в модифицированном белке, например, в гибридном белке, ковалентно связана с концевым остатком полипептида непосредственно посредством аминной связи, и/или гибридный белок получен рекомбинантным способом. В предпочтительных аспектах модифицированный белок, например, гибридный белок, содержит линкер между L-аспарагиназой и полипептидом. Типичным линкером может быть аминокислотный остаток аланина. Изобретение также относится к фармацевтической композиции, содержащей модифицированный белок, например, гибридный белок, или ее применению в терапии, или для применения в качестве лекарственного средства, или для применения в медицине.
[00037] Изобретение также относится к нуклеиновой кислоте, кодирующей модифицированный белок, в частности, гибридный белок в соответствии с определением в данном документе. Предпочтительно нуклеиновая кислота выбрана из группы, состоящей из: (а) молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность SEQ ID NO: 12 или 14; (b) молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность, имеющую по меньшей мере 85% идентичность нуклеотидной последовательности, определенной в (а); и (c) молекулы нуклеиновой кислоты, которая является вырожденной, из-за генетического кода, в нуклеотидной последовательности, в соответствии с определением в (a).
[00038] Один аспект изобретения дополнительно относится к способу получения модифицированного белка в соответствии с определением в данном документе, или нуклеиновой кислоты в соответствии с определением в данном документе. Способ может включать культивирование клетки-хозяина в соответствии с определением в данном документе, и выделение указанного модифицированного белка из культуры или из указанной клетки. Способ получения модифицированного белка в соответствии с определением в данном документе, в частности гибридного белка, может включать культивирование клетки-хозяина, трансформированной или содержащей вектор, содержащий нуклеиновую кислоту, кодирующую модифицированный белок, в частности, гибридный белок, в условиях, вызывающих экспрессию модифицированного белка, особенно гибридного белка. В некоторых аспектах клетка-хозяин выбрана из группы, указанной выше.
[00039] Изобретение, кроме того, относится к способу лечения заболевания, поддающегося лечению истощением L-аспарагина у пациента, при этом указанный способ включает введение указанному пациенту эффективного количества модифицированного белка в соответствии с определением в данном документе, например, гибридного белка. Заболевание, излечимое истощением L-аспарагина, может представлять собой рак. Модифицированный белок в соответствии с определением в данном документе, может вызывать более низкий иммуногенный ответ у пациента по сравнению с неконъюгированной L-аспарагиназой, может иметь более длительный период полувыведения из кровотока in vivo после однократного введения по сравнению с неконъюгированной L-аспарагиназой и/или может иметь большее значение AUC после однократной дозы по сравнению с L-аспарагиназой (особенно неконъюгированной L-аспарагиназой).
[00040] Задача, решаемая данным изобретением может рассматриваться как получение препарата L-аспарагиназы с высокой биологической активностью in vitro; стабильной связью белка с модификатором; длительным периодом полувыведения in vivo; значительно сниженной иммуногенностью, о чем свидетельствует, например, уменьшение или устранение ответа антител к препарату L-аспарагиназы после повторных введений; и/или полезность в качестве терапии второй линии для пациентов, у которых развилась чувствительность к терапии первой линии с использованием, например, L-аспарагиназ, полученных не из E.coli.
[00041] Данная задача решается в соответствии с настоящим изобретением посредством вариантов осуществления, охарактеризованных в формуле изобретения, в частности, путем предоставления модифицированного белка, содержащего L-аспарагиназу и модификатор, то есть (ii) один или несколько (поли)пептидов, где (поли)пептид состоит исключительно из аминокислотных остатков пролина и аланина, а также обеспечения способов его получения и использования.
[00042] В одном аспекте в данном документе описана модифицированная L-аспарагиназа с улучшенными фармакологическими свойствами по сравнению с немодифицированным белком L-аспарагиназы.
[00043] Используемый в данном документе термин «модифицированная L-аспарагиназа» относится к «модифицированному белку, содержащему (i) L-аспарагиназу и (ii) один или несколько (поли)пептидов, в которых (поли)пептид состоит исключительно из аминокислотных остатков пролина и аланина в соответствии с определением и описанием в данном документе. В одном аспекте изобретения L-аспарагиназа получена из Erwinia, имеющая по меньшей мере 85% идентичность аминокислоте SEQ ID NO: 1.
[00044] Описанная в данном документе модифицированная L-аспарагиназа, например, L-аспарагиназа, конъюгированная или конденсированная с одним или несколькими (поли)пептидами, где (поли)пептид состоит исключительно из аминокислотных остатков пролина и аланина, служит терапевтическим средством, особенно для использования у пациентов, которые показывают гиперчувствительность (например, аллергическую реакцию или скрытую гиперчувствительность) к лечению L-аспарагиназой или пегилированной L-аспарагиназой Erwinia и/или E.coli или немодифицированной L-аспарагиназой Erwinia. Модифицированная L-аспарагиназа, описанная в данном документе, также полезна в качестве терапевтического агента для применения у пациентов, у которых наблюдался рецидив заболевания, например рецидив ОЛЛ, и которые ранее получали лечение другой формой аспарагиназы.
[00045] Erwinia chrysanthemi (также известная как Pectobacterium chrysanthemi) была переименована в Dickeya chrysanthemi. Таким образом, термины Erwinia chrysanthemi, Pectobacterium chrysanthemi и Dickeya chrysanthemi используются в данном документе взаимозаменяемо.
[00046] Если явно не указано иное, термины, используемые в данном документе, будут поняты в соответствии с их обычным значением в данной области техники.
[00047] Используемый в данном документе термин «включающий» означает «включающий без ограничения», и термины, используемые в единственном числе, должны включать множественное число и наоборот, если контекст не требует иного.
[00048] Используемые в данном документе термины «содержащий», «включающий», «имеющий» или их грамматические варианты следует понимать как определяющие заявленные признаки, целые числа, стадии или компоненты, но не исключающие добавления одного или нескольких дополнительных признаков, целых чисел, стадий, компонентов или групп. Термины «содержащий»/«включающий»/«имеющий» охватывают термины «состоящий из» и «состоящий по существу из». Таким образом, всякий раз, когда в данном документе используются термины «содержащий»/«включающий»/«имеющий», они могут быть заменены на «состоящий по существу из» или предпочтительно «состоящий из».
[00049] Термины «содержащий»/«включающий»/«имеющий» означают, что может присутствовать любой дополнительный компонент (или также признаки, целые числа, стадии и тому подобное).
[00050] Термин «состоящий из» означает отсутствие любых дополнительных компонентов (или аналогичных признаков, целых чисел, стадий и тому подобное.
[00051] Термин «состоящий по существу из» или его грамматические варианты при использовании в данном документе следует понимать как указывающий на заявленные признаки, целые числа, стадии или компоненты, но не исключающий добавления одного или нескольких дополнительных признаков, целых чисел, стадий, компонентов или их групп, но только в том случае, если дополнительные признаки, целые числа, стадии, компоненты или их группы существенно не изменяют основные и новые характеристики заявленного продукта, композиции, устройства или способа и т. п.
[00052] Таким образом, термин «состоящий по существу из» означает, что могут присутствовать конкретные дополнительные компоненты (или аналогичные признаки, целые числа, стадии и тому подобное), а именно, те, которые не оказывают существенного влияния на основные характеристики продукта, композиции, устройства или способа. Другими словами, термин «по существу состоящий из» (который может использоваться здесь взаимозаменяемо с термином «по существу содержащий»), допускает присутствие других компонентов в продукте, композиции, устройстве или способе в дополнение к обязательным компонентам (или, аналогично, признакам, целым числам, стадиям и т. п.), при условии, что наличие других компонентов не оказывает существенного влияния на существенные характеристики продукта, композиции, устройства или способа.
[00053] Используемый в данном документе термин «примерно» относится к ± 10%, если в данном документе не указано иное.
[00054] При использовании в данном документе единственное число может включать в себя множественное.
[00055] Используемый в данном документе термин «заболевание, поддающееся лечению истощением аспарагина» относится к патологическому состоянию или расстройству, при котором клетки, участвующие или ответственные за состояние или расстройство, либо лишены, либо обладают пониженной способностью синтезировать L-аспарагин. Истощение или лишение L-аспарагина может быть частичным или практически полным (например, до уровней, которые невозможно обнаружить с использованием способов и устройств, известных в данной области техники).
[00056] Используемый в данном документе термин «терапевтически эффективное количество» относится к количеству белка (например, аспарагиназы или ее модифицированного белка), необходимого для получения желаемого терапевтического эффекта.
[00057] Используемый в данном документе термин «L-аспарагиназа» представляет собой фермент с активностью L-аспарагин-аминогидролазы. Ферментативная активность L-аспарагиназы может включать не только дезамидирование аспарагина до аспарагиновой кислоты и аммиака, но также дезамидирование глютамина до глутаминовой кислоты и аммиака. Аспарагиназы обычно состоят из четырех мономеров (хотя сообщалось о некоторых с пятью или шестью). Каждый мономер может иметь массу от примерно 32 000 до примерно 36 000 дальтон.
[00058] Многие белки L-аспарагиназы были идентифицированы в данной области техники и выделены известными способами из микроорганизмов. (См., например, Savitri and Azmi, Indian J. Biotechnol 2 (2003) 184-194, полностью включенный в данный документ посредством ссылки). Наиболее широко используемые и коммерчески доступные L-аспарагиназы получены из E.coli или из Erwinia chrysanthemi, которые имеют структурную гомологию 50% или менее.
[00059] Нижеследующее относится к «L-аспарагиназе», используемой в соответствии с изобретением. В пределах видов Erwinia, как правило, сообщалось о 75-77% идентичности последовательностей между ферментами, полученными из Erwinia chrysanthemi и Erwinia carotovora, и примерно 90% идентичности последовательностей было обнаружено между различными подвидами Erwinia chrysanthemi (Kotzia (2007), Journal of Biotechnology 127, 657-669, полностью включенная в данный документ посредством ссылки). Некоторые репрезентативные L-аспарагиназы Erwinia включают, например, те, которые приведены в Таблице 1 ниже, в которой раскрывается процент идентичности последовательности с Erwinia Chrysanthemi NCPPB 1066:
[00060] Последовательности L-аспарагиназ Erwinia и записи GenBank Таблицы 1 включены в данный документ посредством ссылки. Примерами L-аспарагиназ, используемых в терапии, являются L-аспарагиназа, выделенная из E.coli и из Erwinia, в частности, Erwinia chrysanthemi.
[00061] L-аспарагиназы могут быть нативными ферментами, выделенными из микроорганизмов. Они также могут быть получены с помощью технологий рекомбинантных ферментов при получении микроорганизмов, таких как E. coli. В качестве примеров, белок, используемый в модифицированном белке по изобретению, может представлять собой рекомбинантный белок, продуцируемый в штамме E.coli, предпочтительно белок из вида Erwinia, в частности, Erwinia chrysanthemi, продуцируемый в рекомбинантном штамме E.coli.
[00062] Ферменты могут быть идентифицированы по их конкретной активности. Таким образом, данное определение включает в себя все полипептиды, которые обладают определенной специфической активностью, также присутствующей в других организмах, более конкретно - в других микроорганизмах. Часто ферменты с подобной активностью могут быть идентифицированы по их группированию в определенные семейства, определенные как PFAM или COG. PFAM (база данных выравниваний и скрытых марковских моделей белковых семейств; pfam.sanfferac.ukl) представляет большую коллекцию выравниваний последовательностей белков. Каждая PFAM позволяет визуализировать множественные выравнивания, видеть домены белка, оценивать распределение среди организмов, получать доступ к другим базам данных и визуализировать известные структуры белка. COG (кластеры ортологичных групп белков; vv-ww.nebi.nlm.nih.gov/COG/) получают путем сравнения белковых последовательностей из 43 полностью секвенированных геномов, представляющих 30 основных филогенетических линий. Каждый COG определяется на основании по меньшей мере трех строк, что позволяет идентифицировать бывшие консервативные домены.
[00063] Средства идентификации процентной идентичности последовательности хорошо известны специалистам в данной области техники и включают, в частности, программы BLAST, которые можно использовать на веб-сайте blast.ncbi.olo.nih.gov/Blast.cgi с указанными параметрами по умолчанию, указанными.а этом сайте. Полученные последовательности можно затем использовать (например, выровнять), используя, например, программу CLUSTALW (ebi.ac.uk/Tools/clustalw2/index.html) с параметрами по умолчанию. Используя ссылки на GenBank для известных генов, специалисты в данной области техники способны определить эквивалентные гены в других организмах, бактериальных штаммах, дрожжах, грибах, млекопитающих, растениях и т. д. Эта рутинная работа преимущественно выполняется с использованием согласованных последовательностей, которые могут быть определенным путем проведения выравнивания последовательностей с генами, происходящими из других микроорганизмов, и разработки вырожденных зондов для клонирования соответствующего гена в другом организме.
[00064] Специалист в данной области техники поймет, как выбирать и конструировать белки, в значительной степени сохраняющие свою активность L-аспарагиназы. Одним из подходов к измерению активности L-аспарагиназы является анализ Несслера, описанный Mashburn (1963) Biochem. Biophys. Res. Commun. 12, 50 (полностью включен в настоящее описание в качестве ссылки).
[00065] В конкретном аспекте модифицированного белка по изобретению L-аспарагиназа имеет по меньшей мере примерно 85% гомологии или идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 1, более конкретно по меньшей мере примерно 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% гомологии или идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 1, как указано в прилагаемом перечне последовательностей. Термины «гомология» и «идентичность последовательности» используются в данном документе взаимозаменяемо.
[00066] Термин «содержащий последовательность SEQ ID NO: 1» (например, если L-аспарагиназа имеет 100% гомологию или идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 1) означает, что аминокислотная последовательность аспарагиназы не может быть строго ограничена SEQ ID NO:1, но может содержать одну, две, три, четыре, пять, шесть, семь, восемь, девять, десять или более дополнительных аминокислот. Другими словами, если L-аспарагиназа для применения в данном документе имеет 100% гомологию или идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 1, L-аспарагиназа может содержать или состоять из аминокислотной последовательности SEQ ID NO: 1. Термин «содержащий» в данном контексте означает, что аминокислотная последовательность L-аспарагиназы SEQ ID NO: 1 может содержать одну, две, три, четыре, пять, шесть, семь, восемь, девять, десять или более дополнительных аминокислот.
В конкретном аспекте белок представляет собой L-аспарагиназу Erwinia chrysantherni, содержащую или состоящую из последовательности SEQ ID NO: 1. В другом аспекте L-аспарагиназа взята из Erwinia chrysanthemi NCPPB 1066 (номер доступа в Genbank CAA32884, полностью включенный в настоящее описание посредством ссылки), и она либо содержит сигнальные пептиды и/или лидерные последовательности, или нет.
Фрагменты L-аспарагиназы, предпочтительно L-аспарагиназы по SEQ ID NO:1, также включены в определение L-аспарагиназы, используемой в модифицированном белке по изобретению. Термин «фрагмент аспарагиназы» (например, фрагмент аспарагиназы SEQ ID NO: 1) означает, что последовательность аспарагиназы может содержать меньше аминокислот, чем в приведенных в данном документе в качестве примера аспарагиназах (например, аспарагиназе SEQ ID NO: 1) но все же достаточно аминокислот для придания активности L-аминогидролазы. Например, «фрагмент аспарагиназы» представляет собой фрагмент, который представляет собой/состоит из по меньшей мере примерно 150 или 200 смежных аминокислот одной из аспарагиназ, представленных в качестве примера в данном документе (например, аспарагиназы SEQ ID NO: 1) (например, примерно 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 321, 322, 323, 324, 325, 326 смежных аминокислот) и/или где указанный фрагмент имеет до 50 аминокислот, удаленных с N-конца указанной аспарагиназы, приведенной в качестве примера в данном документе (например, аспарагиназы SEQ ID NO: 1) (например, до 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45 или 50) и/или имеет до 75 или 100 аминокислот, удаленных с С-конца указанной аспарагиназы, приведенной в качестве примера в данном документе (например, аспарагиназы SEQ ID NO:1) (например, до 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 70, 75, 80, 85, 90, 95 или 100) и/или имеет удаленные аминокислоты как на N-конце, так и на C-конце указанной аспарагиназы, приведенной в качестве примера в данном документе (например, аспарагиназы SEQ ID NO: 1), где общее количество удаленных аминокислот может составлять до 125 или 150 аминокислот.
[00067] В данной области техники хорошо известно, что полипептид может быть модифицирован путем замены, вставки, делеции и/или добавления одной или нескольких аминокислот с сохранением его ферментативной активности. Термин «одна или несколько аминокислот» в данном контексте может относиться к одной, двум, трем, четырем, пяти, шести, семи, восьми, девяти, десяти или более аминокислотам. Например, замена одной аминокислоты в данном положении химически эквивалентной аминокислотой, которая не влияет на функциональные свойства белка, является обычной практикой. Замены могут быть определены как обмены в одной из следующих групп:
Небольшие алифатические, неполярные или слегка полярные остатки: Ala, Ser, Thr, Pro, Gly
Полярные отрицательно заряженные остатки и их амиды: Asp, Asn, Glu, Gln
Полярные положительно заряженные остатки: His, Arg, Lys
Большие алифатические, неполярные остатки: Met, Leu, Ile, Val, Cys
Большие ароматические остатки: Phe, Tyr, Trp.
[00068] Таким образом можно ожидать, что изменения, которые приводят к замене одного отрицательно заряженного остатка на другой (такой как замена глутаминовой кислоты на аспарагиновую кислоту) или одного положительно заряженного остатка на другой (такой как замена лизина на аргинин), приведут к получению функционально эквивалентного продукта.
[00069] Положения, в которых аминокислоты модифицированы, и количество аминокислот, подлежащих модификации в аминокислотной последовательности, конкретно не ограничены. Специалист в данной области техники способен распознавать модификации, которые можно вводить, не влияя на активность белка. Например, можно ожидать, что модификации в N- или C-концевой части белка не изменят активность белка при определенных обстоятельствах. В частности, были широко охарактеризованы определенные аспарагиназы, особенно в отношении последовательностей, структур и остатков, образующих активный каталитический сайт. Такая характеризация обеспечивает руководство в отношении остатков, которые могут быть модифицированы без влияния на активность фермента. Все известные L-аспарагиназы из бактериальных источников имеют общие структурные особенности. Все они являются гомотетрамерами с четырьмя активными центрами между N- и C-концевыми доменами двух соседних мономеров (AghaipouR(2001) Biochemistry 40, 5655-5664, полностью включенная в данный документ в качестве ссылки). Все они имеют высокую степень сходства в своих третичных и четвертичных структурах (Papageorgiou (2008) FEBS J. 275, 4306-4316, полностью включенная в данный документ посредством ссылки). Последовательности каталитических сайтов L-аспарагиназ высоко консервативны между Erwinia chrysanthemi, Erwinia carotovora и L-аспарагиназой II E. coli (Id). Гибкая петля активного сайта содержит аминокислотные остатки 14-33, и структурный анализ показывает, что Thr15, Thr95, Ser62, G1u63, Asp96 и A1a120 связываются с лигандом (Id). Aghaipour et al. провели детальный анализ четырех активных сайтов L-аспарагиназы Erwinia chrysanthemi, изучив кристаллические структуры фермента с высоким разрешением, образующего комплекс с его субстратами (Aghaipour (2001) Biochemistry 40, 5655-5664). Kotzia et al. обеспечили последовательности для L-аспарагиназ из нескольких видов и подвидов Erwinia и хотя белки имеют только примерно 75-77% идентичность между Erwinia chrysanthemi и Erwinia carotovora, каждый из них все еще обладает активностью L-аспарагиназы (Kotzia (2007) J. Biotechnol. 127, 657-669). Moola et al выполнили исследования по картированию эпитопов L-аспарагиназы Erwinia chrysanthemi 3937 и смогли сохранить активность фермента даже после мутации различных антигенных последовательностей в попытке снизить иммуногенность аспарагиназы (Moola (1994) Biochem. J. 302, 921-927). Поскольку L-аспарагиназы были широко охарактеризованы, специалист в данной области техники может определить, как производить фрагменты и/или замены последовательности, при этом сохраняя активность фермента.
[00070] Используемый в данном документе термин «примерно» изменяет, например, размеры, объемы, количество ингредиента в композиции, концентрации, температуру процесса, время процесса, выходы, скорости потока, давления и подобные значения и их диапазоны, и относится к изменению числового количества, которое может иметь место, например, в результате типичных процедур измерения и обработки, используемых для изготовления соединений, композиций, концентратов или составов для использования; из-за непреднамеренной ошибки в этих процедурах; из-за различий в изготовлении, источнике или чистоте исходных материалов или ингредиентов, используемых для осуществления способов; а также прочим факторам, которые необходимо учесть. Термин «примерно» также охватывает количества, которые различаются из-за старения, например, композиции, препарата или клеточной культуры с конкретной начальной концентрацией или смеси, и количества, которые отличаются из-за смешивания или обработки композиции или препарата с конкретной начальной концентраций или смеси. Измененные термином «примерно» пункты формулы изобретения, приложенные к данному документу, включают эквиваленты этих количеств. Термин «примерно» далее может относиться к диапазону значений, которые аналогичны заявленному эталонному значению. В некоторых вариантах осуществления термин «примерно» относится к диапазону значений, которые находятся в пределах 10, 9, 8,7, 6, 5,4, 3, 2, 1 процента или менее от заявленного эталонного значения.
[00071] В контексте настоящего изобретения неожиданно было обнаружено, что химическое конъюгирование одного или нескольких пептидов, состоящих исключительно из аминокислотных остатков пролина и аланина, через специфический С-концевой аминокислотный остаток (RC) с L-аспарагиназой позволяет получить модифицированный белок L-аспарагиназы, имеющий особенно высокое соотношение сочетания указанных пептидов на молекулу аспарагиназы и, таким образом, значительно сниженную иммуногенность и увеличенный период полувыведения из плазмы. Кроме того, было обнаружено, что данная новая методика также может применяться к L-аспарагиназе без ухудшения ее каталитической активности, что значительно повышает терапевтическую ценность соответствующих модифицированных белков, описанных в данном документе.
[00072] В одном аспекте в данном документе описан модифицированный белок, содержащий (i) L-аспарагиназу, имеющую по меньшей мере 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентичность аминокислотой последовательность SEQ ID NO:1 и (ii) один или несколько пептидов, где пептид состоит исключительно из аминокислотных остатков пролина и аланина.
[00073] В предпочтительном аспекте модифицированный белок представляет собой модифицированный белок L-аспарагиназы и один или несколько пептидов, где каждый независимо представляет собой пептид RN-(P/A)-RC, где (P/A) представляет собой аминокислотную последовательность, состоящую исключительно из аминокислотных остатков пролина и аланина, где RN представляет собой защитную группу, присоединенную к N-концевой аминогруппе аминокислотной последовательности, и где RC представляет собой аминокислотный остаток, связанный через свою аминогруппу с C-концевой карбоксильной группой аминокислотной последовательности, где каждый пептид конъюгирован с L-аспарагиназой через амидную связь, образованную карбоксильной группой С-концевого аминокислотного остатка RC пептида и свободной аминогруппой L-аспарагиназы, и где по меньшей мере одна из свободных аминогрупп, с которыми конъюгированы пептиды, не является N-концевой α-аминогруппой L-аспарагиназы.
[00074] В некотором аспекте мономер модифицированного белка имеет от примерно 350, 400, 450, 500 аминокислот до примерно 550, 600, 650, 700 или 750 аминокислот после модификации. В дополнительных аспектах модифицированный белок содержит от примерно 350 до примерно 750 аминокислот или от примерно 500 до примерно 750 аминокислот.
[00075] Каждый пептид, который содержится в модифицированном белке в соответствии с описанием в данном документе, независимо представляет собой пептид RN-(P/A)-RC. Соответственно, для каждого из пептидов, содержащихся в модифицированном белке, описанном в данном документе, каждый из N-концевой защитной группы RN, аминокислотной последовательности (P/A) и C-концевого аминокислотного остатка RC независимо выбран из их соответствующих значений. Таким образом, два или более пептидов, содержащихся в модифицированном белке, могут быть одинаковыми или отличаться друг от друга. В одном аспекте все пептиды, содержащиеся в модифицированном белке, являются одинаковыми.
[00076] Кроме того, пептиды, содержащиеся в модифицированном белке, предпочтительно принимают конформацию статистического клубка, особенно когда модифицированный белок присутствует в водной среде (например, водном растворе или водном буфере). Наличие конформации статистического клубка может быть определено с использованием методов, известных в данной области техники, в частности с помощью спектроскопических методов, таких как спектроскопия с круговым дихроизмом (CD).
[00077] Фрагмент (P/A) в химически конъюгированном модифицированном белке, который содержится в пептиде RN-(P/A)-RC, представляет собой аминокислотную последовательность, которая может состоять из в общей сложности от 10 до 100 аминокислотных остатков пролина и аланина, в общей сложности от 15 до 60 аминокислотных остатков пролина и аланина, в общей сложности от 15 до 45 аминокислотных остатков пролина и аланина, например, в общей сложности от 20 до примерно 40 аминокислотных остатков пролина и аланина, например, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 или 45 аминокислотных остатков пролина и аланина. В предпочтительном аспекте указанная аминокислотная последовательность состоит из 20 аминокислотных остатков пролина и аланина. В другом предпочтительном аспекте указанная аминокислотная последовательность состоит из 40 аминокислотных остатков пролина и аланина. В пептиде RN-(P/A)-RC отношение числа пролиновых остатков, содержащихся во фрагменте (P/A), к общему количеству аминокислотных остатков, содержащихся в (P/A), предпочтительно составляет ≥ 10% и ≤70%, более предпочтительно ≥20% и ≤50%, и еще более предпочтительно ≥25% и ≤40%. Соответственно, предпочтительно, чтобы от 10% до 70% от общего числа аминокислотных остатков в (P/A) представляли собой пролиновые остатки; более предпочтительно от 20% до 50% от общего числа аминокислотных остатков, включенных в (P/A), представляли собой пролиновые остатки; и еще более предпочтительно, от 25% до 40% (например, 25%, 30%, 35% или 40%) от общего числа аминокислотных остатков, содержащихся в (P/A), представляли собой пролиновые остатки. Более того, предпочтительно, чтобы (P/A) не содержал каких-либо последовательных пролиновых остатков (т. е., чтобы он не содержал частичную последовательность PP). В предпочтительном аспекте (P/A) представляет собой аминокислотную последовательность AAPAAPAPAAPAAPAPAAPA (SEQ ID NO: 5). В другом предпочтительном аспекте (P/A) представляет собой аминокислотную последовательность AAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPA (SEQ ID NO: 15).
[00078] Группа RN в пептиде RN-(P/A)-RC может представлять собой защитную группу, которая присоединена к N-концевой аминогруппе, в частности к N-концевой α-аминогруппе аминокислотной последовательности (P/A). Предпочтительно, чтобы RN представлял собой пироглутамоил или ацетил.
[00079] Группа RC в пептиде RN-(P/A)-RC представляет собой аминокислотный остаток, который через свою аминогруппу связан с C-концевой карбоксигруппой (P/A) и который содержит по меньшей мере два атома углерода между своей аминогруппой и своей карбоксигруппой. Будет понятно, что по меньшей мере два атома углерода между аминогруппой и карбоксигруппой RC могут обеспечивать расстояние по меньшей мере двух атомов углерода между аминогруппой и карбоксигруппой RC (что имеет место, если например, RC представляет собой ω-амино-C3-15 алкановую кислоту, такую как ε-аминогексановая кислота). Предпочтительно, чтобы RC представлял собой ε-аминогексановую кислоту.
[00080] В одном варианте осуществления пептид представляет собой Pga-AAPAAPAPAAPAAPAPAAPA-Ahx-COOH (SEQ ID NO: 16) или Pga-AAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPA-Ahx-COOH (SEQ ID NO:17). Термин «Pga» является аббревиатурой от «пироглутамоил» или «пироглутаминовая кислота». Термин «Ahx» является аббревиатурой от «ε-аминогексановая кислота».
[00081] Как также продемонстрировано в прилагаемых примерах, неожиданно было обнаружено, что использование С-концевого аминокислотного остатка RC в соответствии с определением в настоящем документе, включая, в частности, ε-аминогексановую кислоту, позволяет получать модифицированные белки с преимущественно высоким соотношением сочетания пептидов, состоящие исключительно из аминокислотных остатков пролина и аланина на молекулу аспарагиназы, и, таким образом, преимущественно снижает иммуногенность и преимущественно увеличивает период полувыведения из плазмы.
[00082] В описанных в данном документе модифицированных белках каждый пептид RN-(P/A)-RC может быть конъюгирован с L-аспарагиназой через амидную связь, образованную из карбоксигруппы C-концевого аминокислотного остатка RC пептида и свободной аминогруппы L-аспарагиназы. Свободной аминогруппой L-аспарагиназы может быть, например, N-концевая α-аминогруппа или аминогруппа боковой цепи L-аспарагиназы (например, ε-аминогруппа остатка лизина, содержащегося в L-аспарагиназе). Если L-аспарагиназа состоит из нескольких субъединиц, например, если L-аспарагиназа является тетрамером, может присутствовать несколько N-концевых α-аминогрупп (т. е., по одной на каждую субъединицу). В одном аспекте от 9 до 13 пептидов в соответствии с определением в данном документе (например, 9, 11, 12 или 13 пептидов) могут быть химически конъюгированы с L-аспарагиназой (например, с каждой субъединицей/мономером L-аспарагиназы).
[00083] В соответствии с вышеизложенным, в одном аспекте, по меньшей мере одна из свободных аминогрупп, с которыми пептиды химически конъюгированы, не является (т. е., отличается от) N-концевой α-аминогруппой L-аспарагиназы. Соответственно, предпочтительно, чтобы по меньшей мере одна из свободных аминогрупп, с которой конъюгированы пептиды, представляла собой аминогруппу боковой цепи L-аспарагиназы, и особенно предпочтительно, чтобы по меньшей мере одна из свободных аминогрупп, с которой конъюгированы пептиды, представляет собой ε-аминогруппу лизинового остатка L-аспарагиназы.
[00084] Кроме того, предпочтительно, чтобы свободные аминогруппы, с которыми конъюгированы пептиды, были выбраны из ε-аминогрупп любых лизиновых остатков L-аспарагиназы, N-концевых α-аминогрупп L-аспарагиназы или любых субъединиц L-аспарагиназы и любой их комбинации. Особенно предпочтительно, чтобы одна из свободных аминогрупп, с которыми конъюгированы пептиды, представляла собой N-концевую α-аминогруппу, в то время как другие из свободных аминогрупп, с которыми конъюгированы пептиды, представляют собой ε-аминогруппы лизинового остатка L-аспарагиназы. Альтернативно, предпочтительно, чтобы каждая из свободных аминогрупп, с которыми конъюгированы пептиды, представляла собой ε-аминогруппу лизинового остатка L-аспарагиназы.
[00085] Модифицированные белки в соответствии с описанным в данном документе состоят из L-аспарагиназы и одного или нескольких пептидов в соответствии с определением в данном документе. Соответствующий модифицированный белок может, например, состоять из одной L-аспарагиназы и одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, 15, 20, 25, 30, 35, 40, 45, 50, 55 (или более) пептидов, каждый из которых конъюгирован с L-аспарагиназой. L-аспарагиназа может представлять собой, например, мономерный белок или белок, состоящий из множества субъединиц, например, тетрамер. Если L-аспарагиназа представляет собой мономерный белок, соответствующий модифицированный белок может, например, состоять из одной мономерной L-аспарагиназы и от девяти до тринадцати (или более) (например, 9, 10, 11, 12 или 13) пептидов каждый из которых конъюгирован с мономерной L-аспарагиназой. Примерная аминокислотная последовательность мономерной L-аспарагиназы показана в SEQ ID NO. 1. Если L-аспарагиназа представляет собой белок, состоящий из множества субъединиц, например, из четырех субъединиц (т. е., если указанная L-аспарагиназа представляет собой тетрамер), соответствующий модифицированный белок может, например, состоять из четырех субъединиц L-аспарагиназы и от девяти до тринадцати (или более) (например, 9, 10, 11, 12 или 13) пептидов в соответствии с определением в данном документе, каждый из которых конъюгирован с каждой субъединицей L-аспарагиназы. Примерная аминокислотная последовательность субъединицы L-аспарагиназы показана в SEQ ID NO. 1. Аналогично, если L-аспарагиназа представляет собой белок, состоящий из множества субъединиц, например, из четырех субъединиц (т. е., если указанная L-аспарагиназа представляет собой тетрамер), соответствующий модифицированный белок может, например, состоять из четырех субъединиц L-аспарагиназы и 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55 (или более) пептидов, каждый из которых конъюгирован с тетрамером L-аспарагиназы. В одном аспекте изобретение относится к модифицированному белку, имеющему L-аспарагиназу и множество химически связанных пептидных последовательностей. В дополнительном аспекте длина пептидных последовательностей составляет от примерно 10 до примерно 100, от примерно 15 до примерно 60 или от примерно 20 до примерно 40.
[00086] Пептид, состоящий исключительно из аминокислотных остатков пролина и аланина, может быть ковалентно связан с одной или несколькими аминокислотами указанной L-аспарагиназы, такими как лизиновые остатки и/или N-концевой остаток, и/или пептидом, состоящим исключительно из пролина и аланина, и аминокислотные остатки могут быть ковалентно связаны с по меньшей мере от примерно 40, 50, 60, 70, 80 или 90% до примерно 60, 70, 80, 90 или 100% доступных аминогрупп, включая аминогруппы лизиновых остатков и/или N-концевой остаток на поверхности L-аспарагиназы. Например, на L-аспарагиназу может быть доступно примерно 11-12 лизиновых остатков, и примерно 9-12 лизинов будет конъюгировано с пептидом, состоящим исключительно из аминокислотных остатков пролина и аланина. В дополнительных аспектах пептид, состоящий исключительно из аминокислотных остатков пролина и аланина, ковалентно связан с от примерно 20, 30, 40, 50 или 60% до примерно 30, 40, 50, 60, 70, 80 или 90% от общего количества лизиновых остатков указанной L-аспарагиназы. В других вариантах осуществления пептид, состоящий исключительно из аминокислотных остатков пролина и аланина, ковалентно связан с L-аспарагиназой через линкер. Типичные линкеры включают линкеры, раскрытые в публикации заявки на патент США № 2015/0037359, которая полностью включена в настоящее описание посредством ссылки.
[00087] Кроме того, указанный модифицированный белок может иметь период полувыведения по меньшей мере примерно 5, 10, 12, 15, 24, 36, 48, 60, 72, 84 или 96 часов в дозе примерно 25 мкг белка/кг, и/или более длительный период полувыведения in vivo по сравнению с немодифицированной L-аспарагиназой. Кроме того, указанный модифицированный белок может иметь большую площадь под кривой зависимости концентрации лекарственного средства в плазме от времени (AUC) по сравнению с L-аспарагиназой.
[00088] Модифицированный белок по настоящему изобретению может быть получен с использованием способов, известных в данной области техники. В частности, его можно изготовить с использованием описанного ниже способа и/или в соответствии с процедурами, описанными в примерах, или по аналогии с ними.
[00089] Изобретение, кроме того, относится к способу получения модифицированного белка в соответствии с определением в данном документе, причем способ включает: (а) сочетание активированного пептида формулы RN-(P/A)-RC-act, где RC-act представляет собой карбокси-активированную форму RC, где RC и (P/A) имеют значения, определенные для модифицированного белка, который необходимо получить, и где RN представляет собой защитную группу, которая присоединена к N-концевой аминогруппе (P/A), с L-аспарагиназой для получения модифицированного белка L-аспарагиназы и пептидов, в котором RN представляет собой защитную группу.
[00090] Карбокси-активированный С-концевой аминокислотный остаток RC-act, который содержится в активированном пептиде, может быть любым аминокислотным остатком RC в соответствии с описанием и определением в данном документе в отношении пептида, где карбоксигруппа RC находится в форме активированной карбоксигруппы. Предпочтительно, активированная карбоксигруппа аминокислотного остатка RC-act в активированном пептиде является активной сложно эфирной группой.
[00091] Если активированная карбоксигруппа RC-act является активной сложноэфирной группой, она предпочтительно выбрана из любой из следующих активных сложноэфирных групп:
[00092]

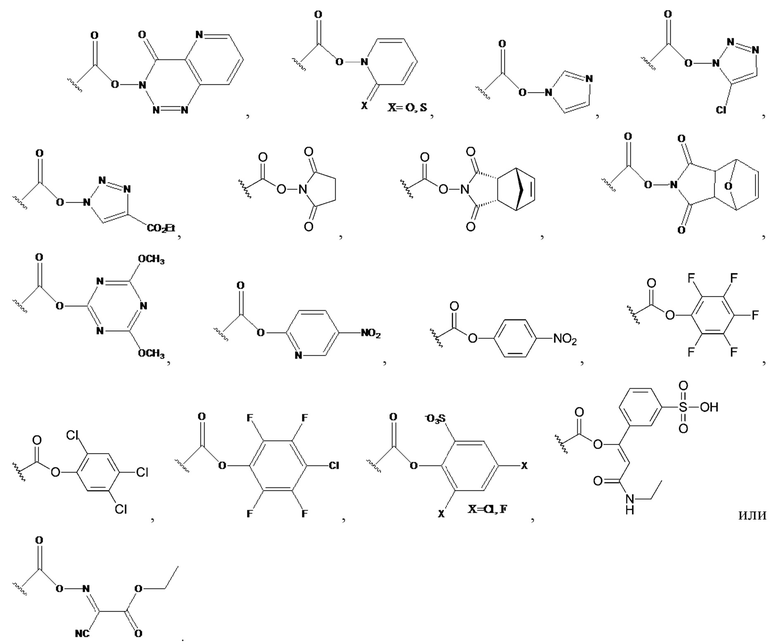
[00093] Особенно предпочтительной активной сложноэфирной группой является активная сложноэфирная группа 1-гидроксибензотриазол (HOBt). Соответственно, особенно предпочтительно, чтобы активированная карбоксигруппа RC-act представляла собой группу со следующей формулой:
[00094] 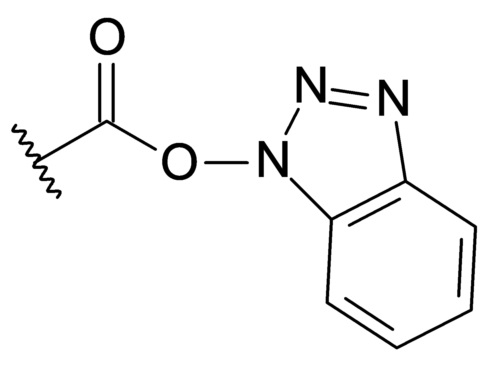
[00095] (активная сложноэфирная группа HOBt)
[00096] Способ может дополнительно включать перед стадией (а) дополнительную стадию превращения пептида формулы RN-(P/A)-RC, где RC и (P/A) имеют значения, определенные для модифицированного белка, который нужно приготовить, и где RN представляет собой защитную группу, которая присоединена к N- концевой аминогруппе (P/A), в активированный P/A пептид.
[00097] Например, чтобы получить активированный пептид, имеющий 1- гидроксибензотриазоловую активную сложноэфирную группу в качестве активированной карбоксигруппы RC-act, стадия превращения пептида в активированный пептид может проводиться путем взаимодействия пептида с солью фосфониевого, урониевого или иммониевого сложного эфира 1-гидроксибензотриазола (HOBt) в присутствии основания. Соль фосфониевого, урониевого или аммониевого производного HOBt предпочтительно представляет собой тетрафторборат O-(бензотриазол-1-ил)-1,1,3,3-тетраметилурония (TBTU).
[00098] Стадия сочетания (а) и предыдущая необязательная стадия превращения пептида в активированный пептид могут быть проведены, например, с использованием любого из способов сочетания пептида или образования амидной связи, описанных в литературе, например, в любой из: El-Faham et al., 2011 Chem Rev. 111(11), 6557-6602; Montalbetti et al., 2005 Tetrahedron, 61(46), 10827-10852; Klose et al., 1999 Chem. Commun. 18, 1847-1848; Valeur et al., 2007; Carpino et al., 1995 J. Am. Chem. Soc. 117(19), 5401-5402);; Valeur et al., 2009 Chem. Soc. Rev., 38(2), 606-631; or Hermanson, 2013 Bioconjugate techniques. Third edition. Academic press. Подходящие реагенты и условия реакции для таких процедур дополнительно описаны в вышеупомянутой литературе и в приведенных в ней дополнительных ссылках. Дополнительные описания приведены в патентах США № 8,563,521; 9,260,494; и 9,221,882, каждый из которых включен в настоящее описание в качестве ссылки в полном объеме.
[00099] Способы удаления защитных групп RN, как это требуется на необязательной стадии (b), хорошо известны в данной области техники и описаны, например, в Wuts et al., 2012 Greene's Protective Groups in Organic Synthesis. Fourth Edition. John Wiley & Sons and/or in Isidro-Llobet et al., 2009 Chem. Rev. 109(6), 2455-2504. Таким образом, необязательная стадия (b) может проводиться, например, в соответствии с описанием для соответствующей защитной группы RN в любой из вышеупомянутых ссылок.
[000100] В некоторых аспектах изобретение относится к модифицированному белку, содержащему (i) L-аспарагиназу, имеющую по меньшей мере 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентичности аминокислотной последовательности SEQ ID NO:1 и (ii) и полипептид, где полипептид состоит исключительно из аминокислотных остатков пролина и аланина. В одном аспекте модифицированный белок представляет собой гибридный белок. Полипептид, состоящий исключительно из аминокислотных остатков пролина и аланина, может иметь длину от примерно 200 до примерно 400 аминокислотных остатков пролина и аланина. Другими словами, полипептид может состоять из примерно 200-400 пролиновых и аланиновых аминокислотных остатков. В предпочтительном аспекте полипептид состоит из примерно 200 (например, 201) аминокислотных остатков пролина и аланина (т. е., имеет длину примерно 200 (например, 201) аминокислотных остатков пролина и аланина), или полипептид состоит из всего примерно 400 (например, 401) аминокислотных остатков пролина и аланина (т. е., имеет длину примерно 400 (например, 401) аминокислотных остатков пролина и аланина). В некоторых предпочтительных вариантах осуществления полипептид содержит или состоит из аминокислотной последовательности, представленной в SEQ ID NO: 7 или 9; или полипептид содержит или состоит из аминокислотной последовательности, кодируемой нуклеиновой кислотой, имеющей нуклеотидную последовательность, представленную в SEQ ID NO: 8 или 10. В некоторых аспектах модифицированный белок, предпочтительно где модифицированный белок представляет собой гибридный белок, и каждый мономер имеет от примерно 350, 400, 450, 500 аминокислот до примерно 550, 600, 650, 700, 750 или 1000 аминокислот, включает мономер и аминокислотную последовательность P/A. В дополнительных аспектах модифицированный белок содержит от примерно 350 до примерно 800 аминокислот или от примерно 500 до примерно 750 аминокислот.
[000101] Например, полипептид включает пептиды, полученные в патенте США № 9,221,882.
[000102] В предпочтительном аспекте модифицированный белок содержит или состоит из аминокислотной последовательности в соответствии с представленной в SEQ ID NO: 11 или 13; или (b) содержит или состоит из аминокислотной последовательности, кодируемой нуклеиновой кислотой, имеющей нуклеотидную последовательность, представленную в SEQ ID NO: 12 или 14. В данном документе предполагается, что модифицированный белок включает (а) белок, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 11 или 13; (b) белок в соответствии с определением в (а), в котором в аспарагиназе удалены, вставлены, добавлены или замещены от одной до 65 аминокислот; (c) белок, кодируемый нуклеиновой кислотой, имеющей нуклеотидную последовательность, представленную в SEQ ID NO: 12 или 14; (d) белок, имеющий аминокислотную последовательность, кодируемую нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты в соответствии с определением в (c); (е) белок, имеющий по меньшей мере 85% идентичность белку по любому из пп. (а)-(d); и (f) белок, имеющий аминокислотную последовательность, кодируемую нуклеиновой кислотой, которая является вырожденной, из-за генетического кода, в нуклеотидной последовательности нуклеиновой кислоты, в соответствии с определением в (c) или (d).
[000103] Модифицированный белок в соответствии с определением в данном документе может состоять из четырех субъединиц, где субъединицы выбраны из группы, состоящей из (а) белка, имеющего аминокислотную последовательность, представленную в SEQ ID NO: 1; (b) белка в соответствии с определением в (а), в котором в аспарагиназе удалены, вставлены, добавлены или замещены от одной до 65 аминокислот; (c) белка, кодируемого молекулой нуклеиновой кислоты, имеющей нуклеотидную последовательность, представленную в SEQ ID NO: 2; (d) белка, имеющего аминокислотную последовательность, кодируемую нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты в соответствии с определением в (с); (е) белка, имеющего по меньшей мере 85% идентичность белку по любому из пп. (а)-(d); и (f) белка, имеющего аминокислотную последовательность, кодируемую нуклеиновой кислотой, которая является вырожденной, из-за генетического кода, в нуклеотидной последовательности нуклеиновой кислоты, в соответствии с определением в (с) или (d).
[000104] Изобретение относится к нуклеиновой кислоте, кодирующей модифицированный белок в соответствии с определением в данном документе, в частности, если модифицированный белок представляет собой модифицированный белок L-аспарагиназы и полипептида, где полипептид состоит исключительно из аминокислотных остатков пролина и аланина. В предпочтительном аспекте модифицированный белок представляет собой гибридный белок. В предпочтительном аспекте нуклеиновая кислота выбрана из группы, состоящей из: (а) нуклеиновой кислоты, содержащей нуклеотидную последовательность SEQ ID NO: 12 или 14; (b) нуклеиновой кислоты, содержащей нуклеотидную последовательность, имеющую по меньшей мере 85% идентичность нуклеотидной последовательности, определенной в (а); и (c) нуклеиновой кислоты, которая является вырожденной, из-за генетического кода, в нуклеотидной последовательности, в соответствии с определением в (a).
[000105] В дополнительном аспекте изобретение относится к нуклеотидной последовательности, кодирующей гибридный белок, включая нуклеотидную последовательность, имеющую по меньшей мере 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентичности нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 12 или 14. В то время как кодируемый полипептид содержит повторяющуюся аминокислотную последовательность, которая может образовывать статистический клубок, кодирующая нуклеиновая кислота предпочтительно содержит последовательности с низким повторением нуклеотидов. Другими словами, нуклеиновая кислота может содержать нуклеотидную последовательность, кодирующую полипептид с высоким содержанием PA, где указанная кодирующая нуклеотидная последовательность содержит нуклеотидные повторы, имеющие максимальную длину 14, 15, 16, 17, примерно 20, примерно 25, примерно 30, примерно 35, примерно 40, примерно 45, примерно 50 или примерно 55 нуклеотидов. Низкоповторная нуклеиновая кислота, раскрытая в данном описании, может быть выгодной по сравнению с высокоповторными молекулами нуклеиновой кислоты. В частности, может быть улучшена генетическая стабильность низкоповторных молекул нуклеиновой кислоты, которые будут использоваться в данном раскрытии.
[000106] В некоторых аспектах нуклеотидная последовательность представляет собой последовательность, кодирующую любой из модифицированных белков, включающих L-аспарагиназу и полипептид, где полипептид состоит исключительно из аминокислотных остатков пролина и аланина, предпочтительно где модифицированный белок представляет собой гибридный белок, описанный в данном документе, за исключением того, что одну или несколько аминокислот добавляют, удаляют, вставляют или заменяют при условии, что гибридный белок, имеющий эту аминокислотную последовательность, обладает L-аспарагиназной активностью.
[000107] В дополнительных аспектах изобретение относится к (рекомбинантному) вектору, содержащему нуклеотидную последовательность, кодирующую модифицированный белок, содержащий L-аспарагиназу и полипептид, где полипептид состоит исключительно из аминокислотных остатков пролина и аланина, предпочтительно где модифицированный белок представляет собой гибридный белок в соответствии с описанным в данном документе, где вектор может экспрессировать модифицированный белок (например, гибридный белок). В дополнительных аспектах изобретение также относится к хозяину, содержащему (рекомбинантный) вектор, описанный в данном документе. Хозяином могут быть дрожжи, такие как Saccharomyces cerevisiae и Pichia Pistoris, а также бактерии, актиномицеты, грибы, водоросли и другие микроорганизмы, включая Escherichia coli, Bacillus sp., Pseudomonas fluorescens, Corynebacterium glutamicum и бактериальные хозяева следующих родов: Serratia, Proteus, Acinetobacter и Alcaligenes. Специалистам в данной области техники известны другие хозяева, включая Nocardiopsis alba, которая экспрессирует вариант аспарагиназы, не обладающий глутаминазной активностью (Meena et al. (2014) Bioprocess Biosyst. Eng, статья за октябрь 2014 г., которая полностью включена в настоящее описание посредством ссылки) и статьи, раскрытые в Savitri et al. (2003) Indian Journal of Biotechnology, 2, 184-194, которые полностью включены в настоящее описание посредством ссылки.
[000108] Настоящее изобретение относится к вектору, содержащему нуклеиновую кислоту в соответствии с описанным в данном документе выше, то есть, нуклеиновую кислоту, кодирующую модифицированный белок в соответствии с определением в данном документе, в частности, модифицированный белок L-аспарагиназы и полипептида, где полипептид состоит исключительно из аминокислотных остатков пролина и аланина, такой как гибридный белок. В предпочтительном аспекте нуклеиновая кислота выбрана из группы, состоящей из: (а) нуклеиновой кислоты, содержащей нуклеотидную последовательность SEQ ID NO: 12 или 14; (b) нуклеиновой кислоты, содержащей нуклеотидную последовательность, имеющую по меньшей мере 85% идентичность нуклеотидной последовательности, определенной в (а); и (c) нуклеиновой кислоты, которая является вырожденной, из-за генетического кода, в нуклеотидной последовательности, в соответствии с определением в (a).
[000109] Изобретение относится к клетке-хозяину, содержащей нуклеиновую кислоту в соответствии с определением в данном документе, или содержащей вектор в соответствии с определением в данном документе. Примеры хозяев перечислены выше.
[000110] Изобретение, кроме того, относится к способу получения модифицированного белка в соответствии с описанным в данном документе, предпочтительно гибридного белка или кодирующей его нуклеиновой кислоты. Способ может включать культивирование клетки-хозяина в соответствии с определением в данном документе, и выделение указанного модифицированного белка из культуры или из указанной клетки. Способ может включать культивирование клетки-хозяина (например, клетки-хозяина, трансформированной нуклеиновой кислотой, или клетки-хозяина, содержащей нуклеиновую кислоту и/или вектор, содержащий нуклеотидную последовательность, кодирующую модифицированный белок (предпочтительно гибридный белок), в условиях, вызывающих экспрессию модифицированного белка (предпочтительно гибридного белка). Примеры хозяев перечислены выше.
[000111] Многие подходящие векторы известны специалистам в области молекулярной биологии. Выбор подходящего вектора зависит от желаемой функции, включая плазмиды, космиды, вирусы, бактериофаги и другие векторы, обычно используемые в генной инженерии.
[000112] Для конструирования различных плазмид могут быть использованы способы, которые хорошо известны специалистам в данной области техники, см., например, методы, описанные в Sambrook (2012) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press. Типичные плазмидные векторы включают, например, pQE-12, серию плазмид pUCseries, pBluescript (Stratagene), серию векторов экспрессии pET (Novagen) или pCRTOPO (Invitrogen), lambda gt11, pJOE, серию pBBR1-MCS, pJB861, pBSMuL, pBC2, pUCPKS, pTACT1. Типичные векторы, совместимые с экспрессией в клетках млекопитающих, включают в себя векторную систему Е-027 pCAG Козак - Шерри (L45a), pREP (Invitrogen), pCEP4 (Invitrogen), pMC1neo (Stratagene), pXT1 (Stratagene), pSG5 (Stratagene), EBO-pSV2neo, pBPV-1, pdBPVMMTneo, pRSVgpt, pRSVneo, pSV2-dhfr, pIZD35, вектор экспрессии кДНК Окаяма - Берг pcDV1 (Pharmacia), pRc/CMV, pcDNA1, pcDNA3 (Invitrogen), pcDNA3.1, pSPORT1 (GIBCO BRL), pGEMHE (Promega), pLXIN, pSIR (Clontech), pIRES-EGFP (Clontech), pEAK-10 (Edge Biosystems) pTriEx-Hygro (Novagen) и pCINeo (Promega). Неограничивающие примеры плазмидных векторов, подходящих для Pichia pastoris, включают, например, плазмиды pAO815, pPIC9K и pPIC3.5K (все Invitrogen).
[000113] Обычно векторы могут содержать одну или несколько точек начала репликации (ori) и систем наследования для клонирования или экспрессии, один или несколько маркеров для отбора у хозяина, например, устойчивость к антибиотику, и одну или несколько кассет экспрессии. Примеры подходящих точек начала репликации включают, например, полноразмерный ColE1, его укороченные версии, такие как присутствующие в плазмидах pUC, вирусный SV40 и точка начала репликации фага M13. Неограничивающие примеры селектируемых маркеров включают ампициллин, хлорамфеникол, тетрациклин, канамицин, dhfr, gpt, неомицин, гигромицин, бластицидин или генетицин. Кроме того, указанный вектор содержит регуляторную последовательность, которая функционально связана с указанной нуклеотидной последовательностью или молекулой нуклеиновой кислоты, определенной в данном документе.
[000114] Кодирующие последовательности, например, указанные нуклеотидные последовательность, кодирующие полипептид, содержащийся в векторе, могут быть связаны с (а) транскрипционными регуляторными элементами и/или с другими аминокислотными кодирующими последовательностями с использованием установленных способов. Такие регуляторные последовательности хорошо известны специалистам в данной области техники и включают, без ограничения, регуляторные последовательности, обеспечивающие инициацию транскрипции, внутренние сайты связывания рибосом(IRES) и, необязательно, регуляторные элементы, обеспечивающие терминацию транскрипции и стабилизацию транскрипта. Неограничивающие примеры таких регуляторных последовательностей, обеспечивающих инициацию транскрипции, включают промоторы, кодон инициации трансляции, энхансеры, инсуляторы и/или регуляторные элементы, обеспечивающие терминацию транскрипции. Дополнительные примеры включают последовательности Козак и интроны, фланкированные донорными и акцепторными сайтами для сплайсинга РНК, последовательности нуклеиновых кислот, кодирующие сигналы секреции или, в зависимости от используемой системы экспрессии, сигнальные последовательности, способные направлять экспрессированный белок в клеточный компартмент или в культуральную среду.
[000115] Примеры подходящих промоторов включают, без ограничения, промотор цитомегаловируса (CMV), промотор SV40, промотор RSV (вирус саркомы Рауса), промотор lacZ, промотор β-актина птиц, промотор CAG-(комбинация промотора β-актина птиц и немедленно-раннего энхансера цитомегаловируса), промотор гена человеческого фактора элонгации-1α, промотор AOX1, промотор GAL1, промотор CaM-киназы, промотор lac, trp или tac, промотор lacUV5, промотор T7 или T5, промотор гена полиэдрина вируса ядерного полиэдроза Autographa californica (AcMNPV) или интрон глобина у млекопитающих, а также другие животные клетки. Одним примером энхансера является, например, энхансер SV40. Неограничивающие дополнительные примеры регуляторных элементов/последовательностей, обеспечивающих терминацию транскрипции, включают в себя поли-А-сайт SV40, поли-А-сайт tk или сигналы полиаденилирования гена полиэдрина AcMNPV.
[000116] Кроме того, в зависимости от системы экспрессии, к представленной в данном документе кодирующей последовательности нуклеиновой кислоты могут быть добавлены лидерные последовательности, способные направлять полипептид в клеточный компартмент или секретировать его в среду. Лидерные последовательности собираются в рамке с последовательностями трансляции, инициации и терминации, и, предпочтительно, лидерная последовательность способна направлять секрецию транслированного белка или его части в периплазматическое пространство или во внеклеточную среду. Подходящими лидерными последовательностями являются, например, сигнальные последовательности BAP (бактериальная щелочная фосфатаза), CTB (субъединица B-холерного токсина), DsbA, ENX, OmpA, PhoA, stII, OmpT, PelB, Tat (транслокация двойного аргинина) в E. coli и сигнальные последовательности бычьего гормона роста, человеческого химотрипсиногена, человеческого фактора VIII, человеческого Ig-каппа, человеческого инсулина, человеческого интерлейкина-2, люциферазы из Metrida или Vargula,, человеческого трипсиногена-2, инулиназы из Kluyveromyces marxianus, фактор спаривания альфа-1 из Saccharomyces cerevisiae, меллитин, человеческий азуроцидин и тому подобное в эукариотических клетках.
[000117] Векторы могут также содержать дополнительную экспрессируемую последовательность нуклеиновой кислоты, кодирующую один или несколько шаперонов для облегчения надлежащего сворачивания белка.
[000118] В некоторых аспектах вектор по настоящему изобретению представляет собой вектор экспрессии. Вектор экспрессии способен направлять репликацию и экспрессию молекулы нуклеиновой кислоты по изобретению, например, нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую полипептид, и нуклеотидную последовательность, кодирующую аспарагиназу.
[000119] Молекулы нуклеиновой кислоты и/или векторы в соответствии с описанным в данном документе выше могут быть предназначены для введения в клетки, например, нехимическими способами (электропорация, сонопорация, оптическая трансфекция, электроперенос гена, гидродинамическая доставка или естественная трансформация при контакте клеток с молекулой нуклеиновой кислотой в соответствии с изобретением), химическими способами (фосфат кальция, ДМСО, ПЭГ, липосомы, DEAE-декстран, полиэтиленимин, нуклеофекция и т.д.), способами на основе частиц (генная пушка, магнитофекция, импалфекция), способами, основанными на фаговом или фагемидном векторе, и вирусными способами. Например, векторы экспрессии, полученные из вирусов, таких как ретровирусы, вирус коровьей оспы, аденоассоциированный вирус, вирусы герпеса, вирус леса Семлики или вирус папилломы крупного рогатого скота, могут быть использованы для доставки молекул нуклеиновой кислоты в целевую клеточную популяцию.
[000120] Настоящее изобретение также относится к клетке-хозяину или хозяину, не являющемуся человеком, трансформированным вектором или нуклеиновой кислотой, описанными в данном документе. Понятно, что термин «клетка-хозяин или хозяин, не являющийся человеком, трансформированный вектором» относится к клетке-хозяину или хозяину, не являющемуся человеком, который содержит вектор или нуклеиновую кислоту в соответствии с описанным в данном документе. Клетки-хозяева для экспрессии полипептидов хорошо известны в данной области техники и включают прокариотические клетки и эукариотические клетки. Подходящие культуральные среды и условия для вышеописанных клеток-хозяев известны в данной области техники.
[000121] «Культивирование хозяина или клетки-хозяина» включает экспрессию модифицированного белка, в том числе в виде гибридного белка в соответствии с определением в данном документе, и/или полипептида в соответствии с определением в данном документе, и/или аспарагиназы в хозяине или клетке-хозяине.
[000122] Способы выделения модифицированного белка и/или полипептида в соответствии с определением в данном документе и/или аспарагиназы включают, без ограничения, стадии очистки, такие как очистка посредством аффинной хроматографии (предпочтительно с использованием метки слияния, такой как Strep-метка II или His 6-метка), гель-фильтрации (эксклюзионная хроматография), анионообменной хроматографии, катионообменной хроматографии, хроматографии гидрофобного взаимодействия, жидкостной хроматографии высокого давления (ВЭЖХ), обращенно-фазовой ВЭЖХ, осаждения сульфатом аммония или иммунопреципитации. Эти способы хорошо известны в данной области техники и в целом описаны, например, в Scopes (1994) Protein Purification - Principles and Practice, Springer. Такие способы дают по существу очищенные полипептиды. Указанные чистые полипептиды имеют гомогенность предпочтительно по меньшей мере примерно от 90 до 95% (на уровне белка), более предпочтительно по меньшей мере примерно от 98 до 99%. Наиболее предпочтительно такие чистые полипептиды подходят для фармацевтического применения.
[000123] В данном документе предусматривается, что модифицированный белок, содержащий L-аспарагиназу и полипептид, может быть получен путем экспрессии молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую полипептид, и последовательность нуклеиновой кислоты, кодирующую аспарагиназу. Может быть выделен экспрессированный модифицированный белок. Альтернативно, модифицированный белок может быть получен путем культивирования/выращивания хозяина, содержащего нуклеотидную последовательность или молекулу нуклеиновой кислоты, кодирующую указанный полипептид, состоящий исключительно из пролина и аланина. Таким образом, нуклеиновая кислота экспрессируется в хозяине. Может быть выделен полученный полипептид. Полученный полипептид может быть конъюгирован с аспарагиназой, например, через пептидную связь или непептидную связь.
[000124] Модифицированные белки, описанные в данном документе, могут быть использованы для лечения заболевания, которое можно лечить истощением аспарагина. Заболевание, излечимое истощением аспарагина, предпочтительно представляет собой рак, такой как не солидный рак. Предпочтительно не солидный рак представляет собой лейкоз или неходжкинскую лимфому. Лейкоз предпочтительно представляет собой острый лимфобластный лейкоз (ОЛЛ) или острый миелоидный лейкоз (ОМЛ). Например, модифицированные белки полезны при лечении или производстве лекарственного средства для применения при лечении острого лимфобластного лейкоза (ОЛЛ) как у взрослых, так и у детей, или острого миелоидного лейкоза (ОМЛ) как у взрослых, так и у детей. Предполагается, что использование модифицированных белков, описанных в данном документе, для лечения других патологических состояний, при которых ожидается благоприятный эффект истощения аспарагина. Такие патологические состояния включают, но не ограничиваются следующим: злокачественные новообразования или раковые заболевания, включая, но не ограничиваясь этим, злокачественные новообразования в кровеносной системе, NK-клеточную лимфому, рак поджелудочной железы, болезнь Ходжкина, острый миелоцитарный лейкоз, острый миеломоноцитарный лейкоз, хронический лимфоцитарный лейкоз, лимфосаркому, ретикулоклеточную саркому, меланосаркому и диффузную B-клеточную крупноклеточную лимфому (DLBCL). Рак может представлять собой солидный рак, например, рак легких или рак молочной железы. Типичные незлокачественные заболевания крови, отвечающие на истощение аспарагина, включают заболевания крови, опосредованные иммунной системой, например, инфекционные заболевания, такие как те, которые вызваны ВИЧ-инфекцией (т.е., СПИД). Заболевания, отличные от заболеваний кровеносной системы, связанные с аспарагиновой зависимостью, включают аутоиммунные заболевания, например, ревматоидный артрит, системную красную волчанку, аутоиммунные, коллагенозы сосудов и т.д. Прочие аутоиммунные заболевания включают остеоартрит, синдром Иссака, псориаз, инсулинозависимый сахарный диабет, рассеянный склероз, склерозирующий панэнцефалит, системную красную волчанку, ревматическую лихорадку, воспалительное заболевание кишечника (например, язвенный колит и болезнь Крона), первичный биллиарный цирроз, хронический активный гепатит, гломерулонефрит, миастению, пузырчатку обыкновенную и болезнь Грейвса. Клетки, предположительно вызывающие заболевание, могут быть проверены на зависимость от аспарагина с использованием любого подходящего анализа in vitro или in vivo, например, с использованием анализа in vitro при условии, что в среде для выращивания отсутствует аспарагин.
[000125] Изобретение, кроме того, относится к способу лечения заболевания, поддающегося лечению истощением L-аспарагина у пациента, причем указанный способ включает введение указанному пациенту эффективного количества модифицированного белка. В некоторых предпочтительных аспектах указанное заболевание, излечимое истощением L-аспарагина, представляет собой острый лимфобластный лейкоз (ОЛЛ), острый миелоидный лейкоз (ОМЛ) или неходжкинскую лимфому. В некоторых аспектах указанное заболевание, поддающееся лечению истощением L-аспарагина, представляет собой рак, включая, но не ограничиваясь этим, NK-клеточную лимфому и рак поджелудочной железы. В дополнительных вариантах осуществления модифицированный белок, описанный в данном документе, вызывает более низкий иммуногенный ответ у указанного пациента по сравнению с L-аспарагиназой указанного модифицированного белка.
[000126] В некоторых аспектах модифицированный белок, описанный выше, имеет более длительный период полувыведения из кровотока in vivo после однократной дозы по сравнению с немодифицированной L-аспарагиназой указанного модифицированного белка. Описанный в данном документе модифицированный белок может снижать уровни L-аспарагина в плазме в течение периода времени по меньшей мере примерно 12, 24, 48, 72, 96 или 120 часов при введении в дозе 5 Ед/кг массы тела (по массе) или 10 мкг/кг (на основе содержания белка). Описанный в данном документе модифицированный белок может снижать уровни L-аспарагина в плазме до неопределяемых уровней в течение периода времени по меньшей мере примерно 12, 24, 48, 72, 96, 120 или 144 часов при введении в дозе 25 Ед/кг массы тела или 50 мкг/кг (на основе содержания белка). Описанный в данном документе модифицированный белок может снижать уровни L-аспарагина в плазме в течение периода времени по меньшей мере примерно 12, 24, 48, 72, 96, 120, 144, 168, 192, 216 или 240 часов при введении в дозе 50 Ед/кг массы тела или 100 мкг/кг (на основе содержания белка). Описанный в данном документе модифицированный белок может снижать уровни L-аспарагина в плазме до неопределяемых уровней в течение периода времени по меньшей мере примерно 12, 24, 48, 72, 96, 120, 144, 168, 192, 216 или 240 часов при введении в доза в диапазоне от примерно 10 000 до примерно 15 000 МЕ/м2 (примерно 20-30 мг белка/м2).
[000127] Описанный в данном документе модифицированный белок может приводить к сходному уровню истощения L-аспарагина в течение определенного периода времени (например, 24, 48 или 72 часа) после однократной дозы.
[000128] Описанный в данном документе модифицированный белок может иметь более длительное время t1/2, по сравнению с немодифицированной L-аспарагиназой, вводимой в эквивалентной дозе белка. Описанный выше модифицированный белок может иметь большее значение AUC (например, по меньшей мере в 1,5, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз) после однократной дозы по сравнению с L-аспарагиназой указанного немодифицированного белка.
[000129] В некоторых аспектах модифицированный белок, описанный в данном документе, не вызывает какого-либо значительного ответа антител в течение определенного периода времени после введения однократной дозы, например, более чем примерно 1 недели, 2 недель, 3 недель, 4, недель, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель и т. д. Например, модифицированный белок не вызывает какого-либо значительного ответа антител в течение по меньшей мере 8 недель. В одном примере выражение «не вызывает какого-либо значительного ответа антител» означает, что субъект, получающий модифицированный белок, идентифицирован в пределах общепризнанных параметров как отрицательный по антителам. Уровни антител могут быть определены способами, известными в данной области техники, например, ИФА или анализом поверхностного плазмонного резонанса (Zalewska-Szewczyk (2009) Clin. Exp. Med. 9, 113-116; Avramis (2009) Anticancer Research 29, 299-302, каждая из которых включена в настоящий документ посредством ссылки во всей своей полноте). Модифицированный белок может иметь любую комбинацию таких свойств.
[000130] В некоторых аспектах лечение модифицированным белком, описанным в данном документе, будет проводиться в качестве терапии первой линии. В другом аспекте лечение модифицированным белком будет назначаться в качестве терапии второй линии у пациентов, особенно у пациентов с ОЛЛ, у которых развивались объективные признаки аллергии или гиперчувствительности, включая «скрытую гиперчувствительность», к другим препаратам аспарагиназы, в частности, нативной L-аспарагиназе, полученной из Escherichia coli, или ее пегилированному варианту (пегаспаргазе). Неограничивающие примеры объективных признаков аллергии или гиперчувствительности включают тестирование «положительной реакции на антитело» на фермент аспарагиназу. В конкретном аспекте модифицированный белок используется в терапии второй линии после лечения пегапаргазой. Пациент, возможно, имел предшествующую гиперчувствительность к L-аспарагиназе E. coli и/или мог иметь предшествующую гиперчувствительность к L-аспарагиназе Erwinia. Гиперчувствительность может быть выбрана из группы, состоящей из аллергической реакции, анафилактического шока и скрытой гиперчувствительности.
[000131] Частота рецидивов у пациентов с ОЛЛ после лечения L-аспарагиназой остается высокой: примерно у 10-25% пациентов с ОЛЛ у детей наблюдается ранний рецидив (например, у некоторых во время поддерживающей фазы через 30-36 месяцев после индукции) (Avramis (2005) Clin. Pharmacokinet. 44, 367-393). Если у пациента, получающего L-аспарагиназу, полученную из E. coli, возникает рецидив, последующее лечение препаратами E. coli может привести к эффекту «вакцинации», в результате чего препарат E. coli обладает повышенной иммуногенностью во время последующих приемов. Описанный в данном документе модифицированный белок можно использовать в способе лечения пациентов с рецидивирующим ОЛЛ, которых ранее лечили другими препаратами аспарагиназы, в частности, тех, которых ранее лечили аспарагиназами, полученными из E.coli. Рецидив заболевания может возникать после лечения L-аспарагиназой E.coli или ее пегилированной формой.
[000132] В другом аспекте изобретение относится к способу лечения острого лимфобластного лейкоза, включающему введение пациенту, нуждающемуся в лечении, терапевтически эффективного количества модифицированного белка, описанного выше. В конкретном аспекте лечение будет вводиться в дозе от примерно 1500 МЕ/м2 до примерно 15 000 МЕ/м2, обычно от примерно 10 000 до примерно 15 000 МЕ/м2 (примерно 20-30 мг белка/м2), по графику от примерно двух раз в неделю до примерно одного раза в месяц, обычно один раз в неделю или один раз в две недели. Описанный выше модифицированный белок можно вводить в виде одного агента (например, монотерапии) или в составе комбинации химиотерапевтических препаратов, включая, но не ограничиваясь этим, глюкокортикоиды, кортикостероиды, противораковые соединения или другие агенты, включая, но не ограничиваясь ими, метотрексат, дексаметазон, преднизон, преднизолон, винкристин, циклофосфамид и антрациклин. В качестве примера, пациентам с ОЛЛ будет вводиться модифицированный белок, описанный выше, в качестве компонента многоагентной химиотерапии в течение 3 фаз химиотерапии, включая индукцию, консолидацию или интенсификацию и поддержание. В конкретном примере модифицированный белок, описанный выше, не вводят с ингибитором аспарагинсинтетазы (например, таким, как изложено в WO 2007/103290, которая включена в настоящее описание в качестве ссылки во всей своей полноте). В другом конкретном примере модифицированный белок, описанный выше, не вводят с ингибитором аспарагинсинтетазы, а вводят с другими химиотерапевтическими препаратами. Модифицированный белок, описанный выше, можно вводить до, после или одновременно с другими соединениями в составе схемы химиотерапии с несколькими агентами.
[000133] В конкретном варианте осуществления способ включает введение модифицированного белка, описанного выше, в количестве от примерно 1 Ед/кг до примерно 25 Ед/кг (например, примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 ед/кг) или их эквивалентное количество 20 (например, на основе содержания белка). Количество модифицированного белка, подлежащего доставке, будет зависеть от многих факторов, например, IC50, EC50, биологического периода полувыведения соединения, возраста, размера, веса и физического состояния пациента, а также болезни или расстройства, подлежащего лечению. Важность этих и других факторов, которые следует учитывать, хорошо известна специалистам в данной области техники. В некоторых вариантах осуществления количество модифицированного белка для введения может варьироваться от примерно 10 международных единиц на квадратный метр площади поверхности тела пациента (МЕ/м2) до 50 000 МЕ/м2. В дополнительных аспектах модифицированный белок вводят в количестве, выбранном из группы, состоящей из примерно 5, примерно 10 и примерно 25 ед/кг. В другом конкретном аспекте модифицированный белок вводят в дозе от примерно 1000 МЕ/м2 до примерно 20 000 МЕ/м2 (например, 1000 МЕ/м2, 2000 МЕ/м2, 3000 МЕ/м2, 4000 МЕ/м2, 5000 МЕ/м2, 6000 МЕ/м2, 7000 МЕ/м2, 8000 МЕ/м2, 9000 МЕ/м2, 10 000 МЕ/м2, 11 000 МЕ/м2, 25 12 000 МЕ/м2, 13 000 МЕ/м2, 14 000 МЕ/м2, 15 000 МЕ/м2, 16 000 МЕ/м2, 17 000 МЕ/м2, 18 000 МЕ/м2, 19 000 МЕ/м2 или 20 000 МЕ/м2). В другом конкретном аспекте модифицированный белок, описанный выше, вводят в дозе, которая истощает L-аспарагин до неопределяемых уровней с использованием способов и устройств, известных в данной области техники, в течение периода от примерно 3 дней до примерно 10 дней (например, 3, 4, 5, 6, 7, 8, 9 или 10 дней) для однократной дозы.
[000134] Модифицированный белок можно вводить в дозе, которая истощает L-аспарагин до неопределяемых уровней в течение периода от 3 дней до 10 дней, от 5 дней до 20 дней, от 1 дня до 15 дней или от 2 дней до 30 дней. Модифицированный белок можно вводить в дозе, которая истощает L-аспарагин до неопределяемых уровней в течение периода от 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней до 5, 6, 7., 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней. Модифицированный белок можно вводить внутривенно или внутримышечно. В дополнительных вариантах указанный модифицированный белок можно вводить один или два раза в неделю, менее одного раза в неделю или в виде монотерапии.
[000135] Настоящее изобретение относится к композиции, содержащей модифицированный белок в соответствии с определением в данном документе, или модифицированный белок, полученный способом в соответствии с описанным в данном документе. Композиция может представлять собой фармацевтическую композицию, необязательно дополнительно включающую (а) фармацевтически приемлемые носители или наполнители.
[000136] Изобретение также относится к фармацевтической композиции, содержащей модифицированный белок, описанный выше. В конкретном аспекте фармацевтическая композиция содержится во флаконе в виде лиофилизированного порошка, который должен быть восстановлен растворителем, таким как доступные в настоящее время нативные L-аспарагиназы, независимо от бактериального источника, используемого для их производства (например, Kidrolase®, Elspar®, Erwinase ®). В другом аспекте фармацевтическая композиция представляет собой «готовый к использованию» раствор, такой как пегаспаргаза (Oncaspar®), позволяющий, в дополнение к соответствующей обработке, вводить его, например, внутримышечно, внутривенно (инфузия и/или болюс), интрацеребровентрикулярно (icv) и подкожно.
[000137] Модифицированный белок, включая содержащие его композиции (например, фармацевтическую композицию), можно вводить пациенту с использованием стандартных методик. Способы и составы обычно можно найти в Remington's Pharmaceutical Sciences, 22nd ed., Pharmaceutical Press, (2012). Подходящие лекарственные формы отчасти зависят от применения или пути введения, например, перорального, трансдермального, трансмукозального или инъекционного (парентерального). Такие лекарственные формы должны позволять терапевтическому агенту достигать клетки-мишени или иным образом оказывать желаемый терапевтический эффект. Например, фармацевтические композиции, вводимые в кровоток, предпочтительно являются растворимыми. Фармацевтические композиции по изобретению могут быть составлены в виде фармацевтически приемлемых солей и их комплексов. Фармацевтически приемлемые соли представляют собой нетоксичные соли, присутствующие в количествах и концентрациях, при которых они вводятся. Получение таких солей может облегчить фармацевтическое использование путем изменения физических характеристик соединения, не препятствуя его физиологическому действию. Полезные изменения физических свойств включают снижение температуры плавления для облегчения введения через слизистую оболочку и повышение растворимости для облегчения введения более высоких концентраций лекарственного средства. Фармацевтически приемлемая соль модифицированного белка в соответствии с описанием в данном документе может присутствовать в виде комплекса, как будет понятно специалистам в данной области техники. Фармацевтически приемлемые соли включают соли присоединения кислоты, такие как соли, содержащие сульфат, гидрохлорид, фумарат, малеат, фосфат, сульфамат, ацетат, цитрат, лактат, тартрат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, циклогексилсульфамат и хинат. Фармацевтически приемлемые соли могут быть получены из кислот, включая соляную кислоту, малеиновую кислоту, серную кислоту, фосфорную кислоту, сульфаминовую кислоту, уксусную кислоту, лимонную кислоту, молочную кислоту, винную кислоту, малоновую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, бензолсульфоновую кислоту, п-толуолсульфокислоту, циклогексилсульфаминовую кислоту, фумаровую кислоту и хинную кислоту. Фармацевтически приемлемые соли также включают соли присоединения оснований, такие как соли, содержащие бензатин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглюмин, прокаин, алюминий, кальций, литий, магний, калий, натрий, аммоний, алкиламин и цинк, в присутствии кислотных функциональных групп, таких как карбоновая кислота или фенол. Например, см. Remington's Pharmaceutical Sciences выше. Такие соли могут быть получены с использованием подходящих соответствующих оснований. Фармацевтически приемлемые носители и/или наполнители также могут быть включены в фармацевтическую композицию по изобретению для облегчения введения конкретной аспарагиназы. Примеры носителей, подходящих для использования в практике изобретения, включают карбонат кальция, фосфат кальция, различные сахара, такие как лактоза, глюкоза или сахароза, или типы крахмала, производные целлюлозы, желатин, растительные масла, полиэтиленгликоли и физиологически совместимые растворители. Примеры физиологически совместимых растворителей включают стерильные растворы воды для инъекций (WFI - англ.: water for injection), физиологический раствор и декстрозу. Фармацевтические композиции по изобретению могут вводиться различными путями, включая внутривенное, внутрибрюшинное, подкожное, внутримышечное, пероральное, местное (трансдермальное) или трансмукозальное введение. Для системного введения пероральное введение является предпочтительным. Например, для перорального введения соединения могут быть составлены в виде обычных пероральных лекарственных форм, таких как капсулы, таблетки, и жидких препаратов, таких как сиропы, эликсиры и концентрированные капли. Альтернативно, можно использовать инъекцию (парентеральное введение), например, внутримышечную, внутривенную, внутрибрюшинную и подкожную инъекцию. Для инъекций фармацевтические композиции готовят в виде жидких растворов, предпочтительно в физиологически совместимых буферах или растворах, таких как физиологический раствор, раствор Хенкса или раствор Рингера. Кроме того, соединения могут быть составлены в твердой форме и повторно растворены или суспендированы непосредственно перед применением. Например, могут быть получены лиофилизированные формы модифицированного белка. В конкретном аспекте модифицированный белок вводят внутримышечно. В предпочтительном конкретном аспекте модифицированный белок вводят внутривенно.
[000138] Системное введение также может осуществляться трансмукозальным или трансдермальным путем. Для трансмукозального или трансдермального введения в составе используются обеспечивающее проникновение вещества, подходящие для проникновения через барьер. Такие обеспечивающее проникновение вещества хорошо известны в данной области техники и включают, например, для трансмукозального введения, соли желчных кислот и производные фузидиевой кислоты. Кроме того, для облегчения проникновения могут быть использованы детергенты. Например, трансмукозальное введение может осуществляться с использованием назальных спреев, ингаляторов (для доставки в легкие), ректальных суппозиториев или вагинальных суппозиториев. Для местного применения соединения могут быть приготовлены в виде мазей, гелей или кремов, как хорошо известно в данной области техники.
[000139] В одном аспекте изобретение также относится к применению в терапии модифицированного белка в соответствии с описанным в данном документе. Применение может относится к лечению заболевания, поддающегося лечению истощением L-аспарагина, описанного выше, в виде способа лечения заболевания, поддающегося лечению истощением L-аспарагина. В одном аспекте изобретение относится к модифицированному белку в соответствии с описанным в данном документе, или к модифицированному белку, полученному способом в соответствии с описанным в данном документе, или к композиции, содержащей модифицированный белок в соответствии с описанным в данном документе, для применения в качестве лекарственного средства/для применения в терапии/для применения в медицине.
[000140] В одном аспекте изобретение относится к модифицированному белку в соответствии с описанным в данном документе, или к модифицированному белку, полученному способом в соответствии с описанным в данном документе, или к композиции, содержащей модифицированный белок в соответствии с описанным в данном документе, для применения при лечении заболевания, поддающегося лечению истощением L-аспарагина у пациента. Настоящее изобретение также относится к применению модифицированного белка, как описано в данном документе, или модифицированного белка, полученного способом, как описано в данном документе, или композиции, включающей модифицированный белок, как описано в данном документе, при приготовлении лекарственного средства для лечения заболевания. поддающегося излечению посредством истощения L-аспарагина у пациента. Настоящее изобретение также относится к способу лечения заболевания, поддающегося лечению истощением L-аспарагина у пациента, причем указанный способ включает введение указанному пациенту эффективного количества модифицированного белка в соответствии с описанным в данном документе, модифицированного белка, полученного способом в соответствии с описанным в данном документе, или композиции в соответствии с описанным в данном документе. Предпочтительно заболевание, излечимое истощением L-аспарагина, представляет собой рак.
[000141] В предпочтительном аспекте изобретение относится к модифицированному белку в соответствии с описанным в данном документе, или к модифицированному белку, полученному способом в соответствии с описанным в данном документе, или к композиции, содержащей модифицированный белок в соответствии с описанным в данном документе, для применения при лечении рака. Настоящее изобретение также относится к применению модифицированного белка в соответствии с описанным в данном документе, или модифицированного белка, полученного способом в соответствии с описанным в данном документе, или композиции, содержащей модифицированный белок в соответствии с описанным в данном документе, при приготовлении лекарственного средства для лечения рака. Настоящее изобретение также относится к способу лечения рака, включающему введение модифицированного белка, описанного в данном документе, модифицированного белка, полученного способом, описанным в данном документе, или композиции, описанной в данном документе, субъекту.
[000142] В данном раскрытии предпочтительно, чтобы подлежащий лечению субъект представлял собой млекопитающее, в частности человека.
[000143] Рак может быть не солидным раком, например лейкозом или неходжкинской лимфомой. Предпочтительно лейкоз представляет собой острый лимфобластный лейкоз (ОЛЛ) или острый миелоидный лейкоз (ОМЛ).
[000144] Модифицированный белок может вызывать более низкий иммуногенный ответ у пациента по сравнению с неконъюгированной L-аспарагиназой. Модифицированный белок может иметь более длительный период полувыведения in vivo после однократной дозы по сравнению с неконъюгированной L-аспарагиназой. Модифицированный белок может иметь большее значение AUC после однократной дозы по сравнению с неконъюгированной L-аспарагиназой. Пациент может иметь повышенную чувствительность к L-аспарагиназе E. coli или ее пегилированной форме.
[000145] Настоящее изобретение далее иллюстрируется посредством ссылки на следующие неограничивающие фигуры и примеры.
[000146] Описание фигур.
[000147] Фигура 1. Химия конъюгации крисантаспазы с N-концевыми защищенными P/A-пептидами через аминогруппы
(A) и (B) изображают химические структуры P/A пептидов (SEQ ID NO: 16 и 17, аминокислотную последовательность, показанную в SEQ ID NO: 5 и 15), содержащую 20 или 40 остатков Pro/Ala (соответственно), которые были получены твердофазным синтезом пептидов. Для избежания полимеризации пептидов при химической активации С-конца, N-конец был защищен пироглутамильным (Pga) остатком. Аминогексановая кислота (Ahx) была включена в C-конец пептидов, чтобы служить линкером. (C) В присутствии ненуклеофильного основания N, N-диизопропилэтиламин (DIPEA, основание Хюнига) и с ДМСО в качестве растворителя, P/A-пептид, защищенный с N-конца, активируется на своем С-конце производным бензотриазола O-(бензотриазол-1-ил)-N, тетрафторборатом N, N,N',N'-тетраметилурония (TBTU). Активный сложный гидроксибензотриазоловый (HOBt) эфир пептида впоследствии используется для дериватизации аминогрупп (ε-аминогруппы лизиновых остатков или N-концевой α-аминогруппы) крисантаспазы с P/A пептидом посредством образования пептидных или изопептидных связей, при этом высвобождается свободный HOBt. Эта стадия сочетания выполняется в водном растворе (например, буфере ФСБ) с содержанием органического растворителя ≤ 30%. Белок, модифицированный P/A-крисантаспазой, может быть очищен от остаточного P/A-пептида/реагента сочетания с помощью диализа и/или хроматографии (например, ионообменной хроматографии).
[000148] Фигура 2. Оптимизация соотношения сочетания крисантаспазы/Pga-P/A(20)-Ahx
Рекомбинантная крисантаспаза, продуцируемая в E.coli, была конъюгирована с пептидом Pga-P/A#1(20)-Ahx (фиг. 1A) (SEQ ID NO: 16, аминокислотная последовательность показана в SEQ ID NO: 5) как описано в Примере 1. Соотношение пептида к белку варьировало от 3,5 до 10 мг P/A-пептида на 1 мг крисантаспазы. В гель загружали 7 мкг кризантаспазы из каждой реакции сочетания. Кроме того, в качестве стандарта размера («стандарт») использовали смесь реакций сочетания с соотношениями от 0,3 до 10 мг пептида на мг белка. Количество связанных P/A-пептидов можно определить путем подсчета полос на данном результате анализа, начиная с неконъюгированной крисантаспазы, как отмечено справа. Полоса «кДа»: неокрашенный белковый маркер молекулярной массы Pierce™ (Thermo Fisher Scientific).
[000149] Фигура 3. Очистка продукта сочетания пептида крисантаспазы/ Pga-P/A(40)-Ahx с помощью анионообменной хроматографии
Рекомбинантная кризантаспаза, продуцируемая в E.coli, была конъюгирована с пептидом Pga-P/A (40)-Ahx (фиг. 1B) (SEQ ID NO: 17, аминокислотная последовательность показана в SEQ ID NO: 15) как описано в Примере 2. После диализа с использованием рабочего буфера AIX (25 мМ борной кислоты/NaOH, рН 9,0, 1 мМ ЭДТК) проводили анионообменную хроматографию на колонке Source™ 15Q(A) 85 мл. При применении градиента концентрации NaCl модифицированный ферментный белок элюировался в виде единого острого пика, что было обнаружено по ультрафиолетовому следу при 280 нм. Отделение оставшегося несвязанного пептида и других небелковых побочных продуктов химического конъюгирования, не поглощающего УФ-излучение при 280 нм, контролировали с помощью УФ-отслеживания при длине волны 225 нм. (B) анализ SDS-PAGE модифицированного белка крисантаспазы/Pga-P/A(40)-Ahx, после очистки анионообменной хроматографией (полоса 1). Полоса 2 отображает данные смеси реакций сочетания с соотношениями от 0,3 до 10 мг пептида на мг белка, что позволяет определить количество связанных P/A-пептидов на мономер крисантаспазы. Предварительно окрашенный маркер PageRuleR™ Plus (Thermo FisheRScientific) был нанесен на полосу «М».
[000150] Фигура 4. Очистка продукта сочетания пептида крисантаспазы/ Pga-P/A(20)-Ahx с помощью анионообменной хроматографии
Рекомбинантная крисантаспаза, вырабатываемая в E.coli, была конъюгирована с пептидом Pga-P/A(20)-Ahx (фиг. 1A) (SEQ ID NO: 16, аминокислотная последовательность показана в SEQ ID NO: 5) как описано в Примере 3. После диализа с использованием рабочего буфера AIX (25 мМ борной кислоты/NaOH, рН 9,0, 1 мМ ЭДТК) проводили анионообменную хроматографию на колонке Source™ 15Q(A) 85 мл. При применении градиента концентрации NaCl модифицированный ферментный белок элюировался в виде единого острого пика, что было обнаружено по ультрафиолетовому следу при 280 нм. Отделение оставшегося несвязанного пептида и других небелковых побочных продуктов химического конъюгирования, не поглощающего УФ-излучение при 280 нм, проявлялось при УФ-отслеживании при длине волны 225 нм. (B) анализ SDS-PAGE модифицированного белка крисантаспазы/Pga-P/A(20)-Ahx, после очистки анионообменной хроматографией (полоса 1). Полоса 2 отображает данные смеси реакций сочетания с соотношениями от 0,3 до 10 мг пептида на мг белка, что позволяет определить количество связанных P/A-пептидов на мономер крисантаспазы. Предварительно окрашенный маркер PageRuleR™ Plus (Thermo FisheRScientific) был нанесен на полосу «М».
[000151] Фигура 5. Клонирование экспрессионных векторов для выработки PASилированной крисантаспазы в E.coli
(A) Плазмидная карта pASK75-SapI-крисантаспазы (SEQ ID NO: 4) и (B) ее производного pASK75-PA400-крисантаспазы (SEQ ID NO: 14) после бесшовного введения генной кассеты PA#1c/1b(400) (SEQ ID NO: 10) через два обратно ориентированных сайта рестрикции SapI. Структурный ген для биологически/фармакологически активной (пре)белковой PA#1(400)-крисантаспазы (SEQ ID NO: 13), содержащий низкоповторную нуклеотидную последовательность, кодирующую полипептид PA#1 с 401 аминокислотным остатком, и структурный ген для крисантаспазы, а также кодирующая область для бактериальной сигнальной последовательности Enx (SPEnx) клонируются под транскрипционным контролем tet-промотора/оператора (tetp/o). Плазмидный каркас вне экспрессионной кассеты, фланкированный сайтами рестрикции Xba I и Hin dIII, идентичен основной цепи экспрессирующего вектора pASK75 (Skerra (1994) Gene 151:131-135). Плазмиду для экспрессии крисантаспазы, конденсированной с PA#1(200) (SEQ ID NO: 11), аналогичным образом клонировали с использованием генной кассеты PA#1b(200) (SEQ ID NO: 12).
[000152] Фигура 6. SDS-PGE анализ рекомбинантной кризантаспазы, генетически конденсированной с PA200 или PA400
(A) Анализ гибридного белка зрелой PA#1(400)-крисантаспазы (SEQ ID 13) после периплазматической экстракции (PPE), осаждения сульфатом аммония (ASP) и анионообменной хроматографии (AEX) с помощью 10% SDS-PAGE. (B) В геле показаны 5 мкг образцов очищенной зрелой PA#1(200)-крисантаспазы (полоса 1) (SEQ ID NO: 11) или PA#1(400)-крисантаспазы (полоса 2) (SEQ ID NO: 13). Размеры маркерных белков (М) указаны слева. Гибридный белок PA#1(200)-крисантаспаза и PA#1(400)-крисантаспаза проявляется в виде отдельных гомогенных полос с кажущимся молекулярным размером примерно 105 кДа (полоса 1) или 200 кДа (полоса 2) соответственно. Из-за плохого связывания SDS гибридные белки PA обычно демонстрируют значительно большие размеры (Schlapschy (2013) Protein Eng Des Sel. 26: 489-501), чем, например, расчетная масса 51 кДа для мономера PA#1(200)-крисантаспазы или 67 кДа для мономера PA#1(400)-крисантаспазы.
[000153] Фигура 7. Эксклюзионная хроматография PASилированных вариантов крисантаспазы
(A) Наложение профилей элюирования для немодифицированной крисантаспазы, а также для крисантаспазы, химически конъюгированной с пептидами Pga-P/A(20)-Ahx или Pga-P/A(40)-Ahx (описано в примерах 3 и 2 соответственно) и рекомбинантной кризантаспазы, генетически конденсированной с полипептидами либо PA#1(200) (SEQ ID NO: 7), либо PA#1(400) (SEQ ID NO: 9) (описано в примере 5). 150 мкл очищенного белка в концентрации 1 мг/мл наносили на колонку Superdex™ S200 10/300 GL, уравновешенную ФСБ. Контролировали поглощение при 280 нм и пик каждого цикла хроматографии нормализовали к 100%.
(B) Калибровочная кривая для хроматограмм из (A) с использованием колонки Superdex S200 10/300 GL. Логарифм молекулярной массы маркерных белков (овальбумин, 43,0 кДа; бычий сывороточный альбумин, 66,3 кДа; алкогольдегидрогеназа, 150 кДа, β-амилаза, 200 кДа, апоферритин, 440 кДа) наносили на график в зависимости от объема элюирования (черные кружки) и выравнивали по прямой линии. По наблюдаемым объемам элюции тетрамерной крисантантаспазы, ее модифицированных пептидом PA # 1 белков и рекомбинантных гибридных белков PA#1(черные квадраты), их видимые молекулярные размеры были определены следующим образом. Крисантаспаза, 105 кДа (истинная масса 140 кДа); модифицированный белок крисантаспазы/Pga-P/A(20)-Ahx, 531 кДа (истинная масса 228 кДа); модифицированный белок крисантаспазы/Pga-P/A(40)-Ahx, 820 кДа (истинная масса 284 кДа); PA200-крисантаспаза, 595 кДа (истинная масса 205 кДа); PA400-крисантаспаза, 1087 кДа (истинная масса 269 кДа). Эти данные показывают, что химически конъюгированные P/A-пептиды и генетическое конденсирование с полипептидом PA#1 обеспечивают значительно увеличенный гидродинамический объем.
[000154] Фигура 8. ESI-MS анализ вариантов PASилированной кризантаспазы
(A) Полученный с помощью электрораспылительной ионизационной масс-спектрометрии (ESI-MS) необработанный m/z-спектр очищенного модифицированного белка крисантаспазы/Pga-P/A(20)-Ahx, полученного в соответствии с описанием в примере 3, был подвергнут деконволюции с получением масс-спектра (b). Наблюдаемые массовые виды могут быть однозначно отнесены к крисантаспазе, конъюгированной с 9-14 пептидами (см. Таблицу 3). Основные пики, однако, наблюдались только для видов белков с 10-13 пептидами, что соответствует определению отношения сочетания пептидов с помощью SDS-PAGE (см. фиг. 4B). (C) и (E) показывают необработанные m/z-спектры конденсированных белков PA200-крисантаспазы и PA400-крисантаспазы, полученных в Примере 5. Масс-спектры (D) и (F) после деконволюции выявили массы 51 164,75 Да и 671 99,17 Да соответственно, что почти полностью соответствует расчетным массам 51 163,58 Да.
Фигура 9. Средние (± ст. откл.) профили концентрации в плазме в зависимости от времени после однократной внутривенной болюсной дозы у самцов мышей линии CD-1
На фигурах показана плазменная аспарагиназная активность конъюгатов PA-крисантаспазы после однократной внутривенной болюсной дозы у самцов мышей.
[000155] Следующие примеры иллюстрируют изобретение.
[000156] Пример 1. Оптимизация отношения сочетания для получения пироглутамоил-P/A(20)-аминогексаноил-крисантаспазы
[000157] 4,38 мг пептида Pga-P/A#1(20)-Ahx (фиг. 1А; соль TFA, чистота 98%; PSL Peptide Specialty Laboratories, Heidelberg, Германия) (SEQ ID NO: 16, аминокислотная последовательность показана в SEQ ID NO: 5) растворяли в 66,3 мкл ДМСО. Химическая активация P/A-пептида через его концевую карбоксилатную группу начиналась добавлением 23,7 мкл раствора 500 мМ TBTU (CAS № 125700-67-6; Iris Biotech, Marktredwitz, Германия) в ДМСО и 2,7 мкл DIPEA в раствор пептида и встряхивания (см. фиг. 1C). При таких количествах концентрация пептида составляла 25,8 мМ, а молярное соотношение между DIPEA, TBTU и Pga-P/A#1(20)-Ahx составляло 5: 5:1. После 10 мин инкубации при 25°С смесь разводили в пробирках Эппендорфа в соответствии с таблицей 1.
[000158] Раствор L-аспарагиназы Dickeya chrysanthemi (крисантаспаза, SEQ ID NO: 1, рекомбинантной, выработанной в E.coli (партия RE-LAP-P57D) с концентрацией 2 мг/мл, готовили в фосфатно-солевом буфере (ФСБ: 115 мМ NaCl, 4 мМ KH2PO4 и 16 мМ Na2HPO4, pH 7,4) и пипеткой вносили в каждую пробирку Эппендорфа в соответствии с объемами, указанными в таблице 1. После смешивания путем повторного пипетирования и встряхивания реакции сочетания позволяли протекать при 25°С в течение 30 минут. Реакцию гасили добавлением глицина (pH доводили трис-основанием до 8,0) до конечной концентрации 250 мМ.
[000159] Таблица 1. Серия разведений активированного P/A-пептида для сочетания с аспарагиназой
[000160] SDS-PAGE анализ модифицированных белков показан на фиг. 2. Отдельные полосы соответствуют белкам, модифицированным белками, отличающими друг от друга на один связанный P/A-пептид. Дополнительное применение смеси реакций сочетания с соотношениями пептида от 0,3 до 10 мг на мг белка позволило подсчитать полосы в последовательном анализе, начиная с неконъюгированного белка, и, таким образом, можно было точно определить количество связанных Р/А-пептидов. Интенсивности полос количественно определяли денситометрически с использованием программного обеспечения Quant v12.2 (TotalLab, Newcastle upon Tyne, Великобритания) и рассчитывали средние арифметические значения числа связанных пептидов на мономер крисантаспазы, взвешенные по интенсивностям соответствующих полос (см. таблицу 2). 3,5 мг P/A-пептида на мг крисантаспазы привели к соотношению сочетания в диапазоне от 9 до 12 P/A-пептидов на мономер крисантаспазы (среднее значение: 10,4). Увеличение применяемого массового отношения до 10 мг P/A-пептида на мг крисантаспазы привело только к незначительному увеличению результирующего соотношения сочетания от 10 до 13 P/A-пептидов на крисантаспазу (среднее значение 12,0), что указывает на насыщение доступных аминогрупп.
[000161] Модифицированные белки очищали с помощью анионообменной хроматографии (AEX) на колонке MonoQ HR5/5 (GE Healthcare), используя 25 мМ Na-бората с pH 9,0, 1 мМ ЭДТК в качестве рабочего буфера с градиентом концентрации NaCl от 0 до 1 М для элюирования белков. Активность L-аспарагиназной аминогидролазы каждого модифицированного белка крисантаспазы определяли по реакции аммиака, который высвобождается из-за ферментативной активности L-аспарагина с реагентом Несслера. Вкратце, 50 мкл раствора фермента смешивали с 20 мМ L-аспарагина в 100 мМ буферном растворе бората натрия, рН 8,6, содержащем 0,015% (мас./об.) бычьего сывороточного альбумина, и инкубировали в течение 15 мин при 37°С. Реакцию останавливали добавлением 200 мкл реагента Несслера (Sigma-Aldrich). Поглощение данного раствора измеряли при 450 нм. Активность рассчитывали по калибровочной кривой, которая была получена с использованием сульфата аммония в качестве эталона. Результаты приведены в таблице 2.
[000162] Таблица 2. Ферментативные активности кризантаспазы, конъюгированной с пептидом Pga-P/A(20)-Ahx при разных количествах
[000163] Пример 2. Получение пироглутамоил-P/A(40)-аминогексаноил-крисантаспазы
[000164] 28 мг пептида пироглутамоил-P/A#1(40)-Ahx (SEQ ID NO. 17, аминокислотная последовательность показана в SEQ ID NO: 15), фиг. 1B, соль TFA, чистота 98%; Almac Group, Craigavon, Великобритания) растворяли в 1324 мкл безводного ДМСО (99,9%; Sigma-Aldrich, Taufkirchen, Германия). Для достижения химической активации P/A-пептида через его концевую карбоксилатную группу добавляли 162 мкл раствора 500 мМ TBTU (CAS # 125700-67-6; Iris Biotech, Marktredwitz, Германия) в ДМСО и, после смешивания, 14 мкл DIPEA (99,5%, биотех. степени чистоты, Sigma-Aldrich). Всю смесь кратковременно встряхивали и инкубировали в течение 20 мин при 25°С (см. фиг. 1C). При таких количествах концентрация пептида составляла 5,41 мМ, а молярное соотношение между DIPEA, TBTU и Pga-P/A#1(40)-Ahx составляло 10:10:1.
[000165] 3,5 мл ледяного раствора крисантаспазы (SEQ ID NO: 1) (2 мг/мл в ФСБ) смешивали с раствором активированного пептида (1,5 мл) с получением массового соотношения между Pga-P/A#1(40)-Ahx и крисантаспазой 5:1, и инкубировали при комнатной температуре в течение 30 минут для обеспечения связывания. Используя диализную трубку с регенерированной целлюлозной мембраной (Номинальное Отсечение по Молекулярной Массе (MWCO) 50 кДа, Spectrum Laboratories, Los Angeles, CA), раствор диализовали с использованием 5 л рабочего буфера AEX (25 мМ Na-борат pH 9,0, 1 мМ ЭДТК) и подвергали анионообменной хроматографии на колонке HiScale™ 16/40, заполненной смолой Source™ 15Q (GE Healthcare). Колонку уравновешивали рабочим буфером AEX и белок, модифицированный белком, элюировали, используя сегментированный градиент концентрации NaCl от 0 до 150 мМ в объеме 1 колонки и от 150 до 1000 мМ в объемах 0,25 колонки (фиг. 3А).
[000166] Нанесение элюата на SDS-PAGE вместе с результатами анализа, полученными при объединении реакций сочетания с соотношениями 0,3-10 мг пептида на мг белка, позволило определить коэффициент связывания 9-11 пептидов PA на мономер крисантаспазы (среднее значение: 10,0) (фиг. 3В). Ферментативная активность модифицированного белка крисантаспазы/PA(40), определенная с использованием анализа Несслера, описанного в примере 1, составила 78,2% от активности аналогичным образом проанализированной немодифицированной крисантаспазы.
[000167] Пример 3. Получение пироглутамоил-P/A(20)-аминогексаноил-крисантаспазы
[000168] 21 мг пептида пироглутамоил-P/A#1(20)-Ahx (SEQ ID NO. 5, фиг. 1А; соль TFA, чистота 98%; PSL Peptide Specialty Laboratories, Heidelberg, Германия) растворяли в 1376 мкл безводного ДМСО (99,9%; Sigma-Aldrich, Taufkirchen, Германия). Для достижения химической активации P/A-пептида через его концевую карбоксилатную группу добавляли 114 мкл раствора 500 мМ TBTU (CAS № 125700-67-6; приобретенного у компании Iris Biotech, Marktredwitz, Германия) в ДМСО и, после смешивания, 10 мкл DIPEA (99,5%, биотех. степени чистоты, Sigma-Aldrich). Всю смесь кратковременно встряхивали и инкубировали в течение 20 мин при 25°С (фиг. 1C). При таких количествах концентрация пептида составляла 7,58 мМ, а молярное соотношение между DIPEA, TBTU и Pga-P/A#1(20)-Ahx составляло 5: 5:1.
[000169] 3,5 мл ледяного раствора крисантаспазы (SEQ ID NO: 1) (2 мг/мл в ФСБ) смешивали с раствором активированного пептида (1,5 мл) с получением массового соотношения между Pga-P/A#1(40)-Ahx и крисантаспазой 5:1, и инкубировали при комнатной температуре в течение 30 минут для обеспечения сочетания. Используя диализную трубку с регенерированной целлюлозной мембраной (MWCO 50 кДа, Spectrum Laboratories, Los Angeles, CA), раствор диализовали с использованием 5 л рабочего буфера AEX (25 мМ Na-борат pH 9,0, 1 мМ ЭДТК) и подвергали анионообменной хроматографии на колонке HiScale™ 16/40, заполненной смолой Source™ 15Q (GE Healthcare). Колонку уравновешивали рабочим буфером AEX и белок, модифицированный белком, элюировали, используя сегментированный градиент концентрации NaCl от 0 до 150 мМ в объеме 1 колонки и от 150 до 1000 мМ в объемах 0,25 колонки (фиг. 4А).
[000170] Нанесение элюата на SDS-PAGE вместе с результатами анализа, полученными при объединении реакций сочетания с соотношениями 0,3-10 мг пептида на мг белка, позволило определить соотношение сочетания 10-13 пептидов PA на мономер крисантаспазы (среднее значение: 11,9) (фиг. 4B). Ферментативная активность модифицированного белка крисантаспазы/PA(20), определенная с использованием анализа Несслера, описанного в примере 1, составила 91,2% от активности аналогичным образом проанализированной немодифицированной крисантаспазы.
[000171] Пример 4. Клонирование экспрессионных плазмид для периплазматического продуцирования крисантаспазы конденсированной на N-конце с P/A последовательностями различной длины
[000172] Фрагмент синтетической ДНК, кодирующий зрелую аминокислотную последовательность L-аспарагиназы Dickeya chrysanthemi (UniProt ID P06608), был получен от поставщика синтеза генов (Thermo FisheRScientific, Regensburg, Германия). Этот фрагмент гена (SEQ ID NO: 4) содержит сайт рестрикции Xba I, за которым следует сайт связывания рибосомы, нуклеотидная последовательность, кодирующая сигнальный пептид Enx, за которым следует кодон аланина GCC, первая последовательность распознавания SapI GCTCTTC на некодирующей цепи, 11-нуклеотидный спейсер и вторая рестрикционная последовательность SapI в обратной комплементарной ориентации с последовательностью распознавания GCTCTTC на кодирующей цепи, за которой следует кодон аланина GCC, непосредственно связанный с кодирующей последовательностью зрелой L-аспарагиназы, за которой наконец следует сайт рестрикции HindIII.
[000173] Данный фрагмент гена был клонирован в pASk75 через фланкирующие сайты рестрикции XbaI и HindIII в соответствии со стандартными процедурами (Sambrook (2012) MoleculaRCloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press). Полученную плазмиду (фиг. 5А) расщепляли SapI, что приводило к высвобождению небольшой (30 п. н.) ДНК-вставки, содержащей сайты распознавания SapI и расщепленный векторный каркас с совместимыми липкими концами 5'-GCC/5'-GGC в положении непосредственно перед закодированным зрелым N-концом L-аспарагиназы, который идеально подходит для вставки низкоповторной молекулы нуклеиновой кислоты, кодирующей последовательность с повторяющимися аминокислотами с большим количеством пролина/аланина. После выделения фрагмента вектора с использованием набора для гель-экстракции Promega Wizard (Promega, Mannheim, Германия) и дефосфорилирования с использованием термочувствительной щелочной фосфатазы FastAP (Thermo FisheRScientific, Waltham, MA) в соответствии с инструкциями производителя, его лигировали с генной кассетой PA#1b(200), вырезанной из pXL2-PA#1b(200) (SEQ ID NO: 8) или генной кассетой PA#1c/1b(400), вырезанной из pXL2-PA#1c/1b(400) (SEQ ID NO: 10) через фрагмент рестрикции EarI. Полученные плазмиды (SEQ ID NO: 12 и SEQ ID NO: 14) (фиг. 5b) обеспечивают бактериальную экспрессию гибридных белков (SEQ ID NO: 11 и SEQ ID NO: 13), состоящих из богатой пролином/аланином аминокислотной повторяющейся последовательности, конденсированной с биологически активным белком крисантаспазой (после процессинга in vivo сигнального пептида Enx при периплазматической секреции в E.coli).
[000174] Пример 5. Бактериальная продукция и очистка гибридных белков между последовательностью PA#1(200) или PA#1(400) и крисантаспазой
[000175] Оба гибридных белка PA#1(200)-крисантаспаза и PA#1(400)-крисантаспаза (расчетная масса: 51 кДа и 67 кДа соответственно) были получены при 25°С в E.coli W3110, содержащей экспрессирующую плазмиду pASK75-PA200-крисантаспазы или pASK75-PA400-крисантаспазы (фиг. 5B) из примера 4, с использованием настольного ферментера объемом 8 л с синтетической минеральной глюкозной средой с добавлением 100 мг/л ампициллина в соответствии с опубликованной методикой (Schiweck (1995) Proteins 23: 561-565). Экспрессию рекомбинантного гена индуцировали добавлением 500 мкг/л ангидротетрациклина (Skerra (1994) loc. cit.), как только культура достигла OD550=40. После индукционного периода 2,5 ч клетки собирали центрифугированием и ресуспендировали в течение 10 мин в ледяном буфере для периплазматического фракционирования (500 мМ сахарозы, 1 мМ ЭДТК, 200 мМ борной кислоты/NaOH, рН 8,0; 2 мл на л и OD550). После добавления 15 мМ ЭДТК и 250 мкг/мл лизоцима клеточную суспензию инкубировали в течение 20 минут на льду, несколько раз центрифугировали и извлекали очищенный супернатант, содержащий рекомбинантный белок.
[000176] Периплазматические экстракты дважды диализировали при 4°С с использованием 15 л ФСБ, содержащего 1 мМ ЭДТК, по меньшей мере, в течение 6 часов соответственно, фильтровали с использованием мембраны из нитрата целлюлозы 0,2 мкм (GE Healthcare) и осаждали добавлением сульфата аммония (степень чистоты по ЕФ; Applichem, Darmstadt, Германия) до насыщения 25% при 25°С. После центрифугирования супернатант удаляли и осадок ресуспендировали в рабочем буфере AEX (25 мМ Na-борат pH 9,0, 1 мМ ЭДТК) и диализировали при 4°С с использованием 5 л рабочего буфера AEX в течение по меньшей мере 6 часов. Раствор диализированного белка очищали от оставшихся нерастворимых веществ центрифугированием и подвергали субтрактивной анионообменной хроматографии с использованием колонки HiScale™ объемом 85 мл (GE Healthcare, Freibur, Германия), заполненной смолой Source15Q, соединенной с системой очистки Äkta™ (GE Healthcare, Freibur, Германия), уравновешенный в рабочем буфере AEX. Проточная колонка, содержащая чистый белок (см. фиг. 6А и 6В), была дважды подвергнута диализу с использованием 5 л ФСБ.
[000177] Гомогенные белковые препараты без признаков агрегации были получены с конечным выходом 128 мг для PA#1(200)-крисантаспазы и 48 мг для PA#1(400)-крисантаспазы из одного 8-литрового ферментера, соответственно. Концентрации белка определяли путем измерения поглощения при 280 нм с использованием рассчитанного коэффициента экстинкции (Gill (1989) Anal. Biochem. 182: 319-326) из 19370 M-1 cm-1. Ферментативные активности гибридных белков определяли с использованием анализа Несслера, описанного в примере 1. В этой установке гибридный белок PA#1(200)-крисантаспаза показал 109%, а PA#1(400)-крисантаспаза показал 118% ферментативной активности по сравнению с аналогичным образом проанализированной немодифицированной крисантаспазой. Это демонстрирует, что слияние N-конца крисантаспазы с полипептидами P/A длиной до по меньшей мере 401 аминокислоту не влияет на ферментативную активность.
[000178] Пример 6. Измерение гидродинамического объема генетически PASилированной и химически PASилированной крисантаспазы с помощью аналитической гель-фильтрации
[000179] Эксклюзионную хроматографию (SEC) проводили на колонке Superdex™ S200 с увеличением 10/300 GL (GE Healthcare Europe, Freiburg, Германия) при скорости потока 0,5 мл/мин с использованием системы Äkta™ Purifier 10 (GE Healthcare) с ФСБ (115 мМ NaCl, 4 мМ KH2PO4, 16 мМ Na2HPO4; pH 7,4) в качестве рабочего буфера. С использованием одноразовых ультрафильтрационных устройств из регенерированной целлюлозы (MWCO 10 кДа; Merck-Millipore, Darmstadt, Германия) рекомбинантную кризантаспазу, генетически конденсированную с полипептидами PA#1(200) или PA#1(400) (описанными в примере 5) и крисантаспазу, химически конъюгированную с пептидом Pga-P/A(40)-Ahx (описанным в примере 2) или пептидом Pga-P/A(20)-Ahx (описанным в примере 3), доводили до концентрации 1 мг/мл в ФСБ. 150 мкл образцов концентрированных PASилированных ферментов и неPASилированной крисантаспазы наносили на колонку индивидуально и следы хроматографии накладывали (фиг. 7A). Все пять белков элюируются в единичных гомогенных пиках.
[000180] Для калибровки колонки (фиг. 7B) 150 мкл соответствующей смеси следующих глобулярных белков (Sigma, Deisenhofen, Германия) наносили в ФСБ при концентрациях белка от 0,5 мг/мл до 1,0 мг/мл: цитохром с, 12,4 кДа; овальбумин, 43,0 кДа; бычий сывороточный альбумин, 66,3 кДа; алкогольдегидрогеназа, 150 кДа; β-амилаза, 200 кДа; апоферритин, 440 кДа; тиреоглобулин, 660 кДа.
[000181] В результате рекомбинантные слитые белки РА и химически конъюгированные ферментные препараты демонстрировали значительно больший размер, чем соответствующие глобулярные белки с той же молекулярной массой. С увеличением размера P/A (поли)пептидного фрагмента такая диспропорция мол. массы/гидродинамического объема еще больше увеличивалась. Кажущееся увеличение размера PA (200)-крисантаспазы составляло 5,1 раза по сравнению с негибридной крисантаспазой, тогда как истинная масса была больше только в 1,5 раза. Кажущееся увеличение размера PA (400)-крисантаспазы по сравнению с негибридной крисантаспазой составляло 10,4 раза, тогда как истинная масса была больше только в 1,9 раза. Это наблюдение ясно указывает на значительно увеличенный гидродинамический объем, придаваемый биологически активному ферменту крисантаспазе полипептидным сегментом Pro/Ala согласно данному изобретению.
[000182] Пример 7. ESI-MS анализ химически или генетически PASилированной крисантаспазой
[000183] 250 мкл очищенного химически модифицированного белка крисантаспазы с Pga-P/A(20)-Ahx из примера 3 и рекомбинантных гибридных белков PA200 и PA400 из примера 5, все в концентрации 1 мг/мл, наносили на колонку Resource ™ RPC объемом 1 мл (GE Healthcare, Freiburg, Германия), соединенную с системой очистки Äkta™ с использованием в качестве рабочего буфера 2% по объему ацетонитрила и 1% по объему муравьиной кислоты. Белки элюировали с использованием градиента ацетонитрила от 2% по объему ацетонитрила, 1% по объему муравьиной кислоты до 80% по объему ацетонитрила, 0,1% по объему муравьиной кислоты в 20 объемах колонки. Элюированные белки непосредственно анализировали с помощью масс-спектрометрии ESI на приборе maXis ™ micrOTOF (BrukeRDaltonik, Bremen, Германия) с использованием режима определения положительных ионов. Необработанный m/z-спектр химически модифицированного белка крисантаспазы/Pga-P/A(20)-Ahx показан на фиг. 8A. Массы, выявленные в результате деконволюции масс-спектра (фиг. 8В), приведены в таблице 3. Распределение масс соответствует соотношениям сочетания, определенным анализом SDS-PAGE, описанным в примере 2.
[000184] Необработанный m/z-спектр рекомбинантного гибридного белка PA#1(200)-крисантаспазы (SEQ ID NO: 11) показан на фиг. 8C. Масс-спектр после деконволюции выявил массу 51 164,75 Да (фиг. 8D), которая по существу совпадает с рассчитанной массой этого белка (51 163,58 Да). Необработанный m/z-спектр рекомбинантного гибридного белка PA#1(400)-крисантаспазы (SEQ ID NO: 13) показан на фиг. 8E. Спектр после деконволюции (фиг. 8F) выявил массу 67199,17 Да, которая по существу совпадает с расчетной массой этого белка (67 201,99 Да). Это ясно демонстрирует, что интактный фермент крисантаспаза, генетически конденсированный с PA200 или PA400, может продуцироваться в E.coli в высокогомогенной форме.
[000185] Таблица 3. Сравнение расчетных и измеренных масс, обнаруженных в препарате химически модифицированного белка крисантаспазы/Pga-P/A(20)-Ahx
Пример 8. Аспарагиназная активность
[000186] Ферментативную активность PASилированной L-аспарагиназы определяли катализом превращения L-аспарагина в L-аспарагиновую кислоту. Эта реакция высвобождает один моль аммиака на моль превращенного L-аспарагина. Высвобожденный аммиак обнаруживается с помощью реагента Несслера. В присутствии реагента Несслера аммиак будет образовывать водорастворимый комплекс желтого цвета, который можно определить количественно путем измерения поглощения при 450 нм (Mashburn et al. (1963) Biochem. Biophys. Res. Commun. 12, 50). Одна единица ферментативной активности L-аспарагиназы (международная единица или МЕ) определяется как количество фермента, которое катализирует превращение одного мкмоля L-аспарагина в минуту. Удельную активность образцов (МЕ/мг) определяют путем деления значения активности L-аспарагиназы, выраженной в МЕ/мл, на концентрацию белка, выраженную в мг/мл. Измеряли массу белкового мономера с PASилированной последовательностью.
[000187] Измерение активности L-аспарагиназы основано на анализе конечной точки, в котором образец разводят до серии конечных концентраций фермента, которые затем инкубируют при 37°С при насыщенной концентрации L-аспарагина в течение 15 минут. Реакцию останавливают добавлением реагента Несслера, и количество аммиака, полученного в результате реакции, экстраполируют из калибровочной кривой, построенной на основании известных количеств сульфата аммония, используемых в качестве стандарта. Затем для каждого образца создается график зависимости концентрации фермента от аммиака, а угловой коэффициент кривой делится на время реакции для получения удельной активности в МЕ/мг. Удельная активность указывается в МЕ/мг и округляется до ближайшего целого числа.
[000188] Первоначальные результаты тестирования приведены в таблице ниже для каждого из модифицированных белков или гибридных белков.
Пример 9. Фармакокинетика
[000189] Фармакокинетический профиль E.coli, экспрессирующей рекомбинантную кризазаспазу в виде PASилированного гибридного белка (PA-200) или химически конъюгированную с PA-пептидами (PA-20), был охарактеризован после введения однократной внутривенной болюсной дозы мышам CD-1. Мыши CD-1 представляют собой модель здоровой мыши.
[000190]
[000191] Все животные получали один болюс внутривенно (в/в) через латеральную хвостовую вену (10 мл/кг) в зависимости от массы тела, измеренной до введения дозы. Индивидуальные дозы были рассчитаны на основе самых последних индивидуальных измерений массы тела для обеспечения правильной дозы. Первый день введения дозы основывался на массе тела в день исследования 0. У всех животных отслеживали смертность, отклонения от нормы и признаки боли и патологий два раза в день, один раз утром и один раз днем.
[000192] PASилированную аспарагиназу вводили мышам в виде однократной внутривенной дозы 25 МЕ/кг массы тела. Группам мышей вводили дозу 25 МЕ/кг массы тела, и образцы плазмы отбирали в назначенное время в течение до 10 дней (240 ч) после введения дозы. Активность аспарагиназы в плазме мыши измеряли с использованием квалифицированного биохимического анализа, как описано в предыдущих примерах. Средняя плазменная активность аспарагиназы (n=4) в зависимости от времени была нанесена на график (Фиг. 1) и был проведен фармакокинетический анализ.
[000193] Образцы крови брали до введения дозы и примерно через 6, 24 (день 1), 48 (день 2), 51 (день 2), 54 (день 2), 60 (день 2), 96 (день 4), 168 (день 7) и 240 (день 10) часов после введения дозы. Использовали процедуру забора крови из хвостовой части (отрезали конец хвоста). Для первого сбора крови отрезали приблизительно 1-2 мм дистального конца хвоста, все последовательные сборы крови собирали с одного и того же участка путем удаления струпа и облегчения кровотока путем поглаживания хвоста. Приблизительно 100 мкл крови в каждый момент времени собирали в охлажденные пробирки K3 ЭДТК (Minivette). Кровь переносили в пробирки, подходящие для центрифугирования. Для выделения плазмы все образцы центрифугировали в течение примерно 20 минут после отбора проб при 3000 g в центрифуге с охлаждением, установленной для поддержания примерно 4°С в течение примерно 10 минут. После центрифугирования извлекали максимальное количество плазмы (нацеливание на 30 мкл) и помещали в пластиковые флаконы. До проведения испытаний пластиковые флаконы хранили при температуре от -65 до -85°С.
[000194] Активность аспарагиназы измеряли как концентрацию аспарагиназы в образцах плазмы в соответствии с описанным ранее (Allas et al. (2009) Blood, 114, 2033). Параметры, зависящие от достаточной характеристики конечной фазы профиля концентрации в зависимости от времени (t½, CL и Vss), сообщались только в том случае, если R2 (квадрат коэффициента корреляции для линейной регрессии, использованный для оценки постоянной скорости терминальной элиминации, λz) был больше 0,8. Фармакокинетические данные были импортированы в Phoenix WinNonlin v6.4 (Certara/Pharsight) для анализа. Данные об активности аспарагиназы в плазме в зависимости от времени анализировали с использованием некомпартментальных методов с выборочным взятием образцов в модели введения болюса внутривенно. Значения активности ниже предела количественного определения анализа (10 ЕД/л) при расчете групповых средних значений были установлены равными нулю. Для расчетов использовались номинальные уровни дозы и время сбора образцов. Расчетные значения t½ составляли 50,2 ч для кристантаспазы PA-20 и 17,9 ч для кристантаспазы PA-200.
[000195] Настоящее изобретение относится к следующим нуклеотидным и аминокислотным последовательностям:
[000196] Некоторые последовательности, представленные в данном документе, доступны в базе данных NCBI и могут быть получены на сайте www.ncbi.nlm.nih.gov/sites/entrez?db=gene; эти последовательности также относятся к аннотированным и модифицированным последовательностям. Настоящее изобретение также предоставляет методики и способы, в которых используются гомологичные последовательности и варианты кратких последовательностей, представленных в данном документе. Предпочтительно такие «варианты» представляют собой генетические варианты.
SEQ ID No. 1:
Аминокислотная последовательность L-аспарагиназы Dickeya chrysanthemi.
ADKLPNIVILATGGTIAGSAATGTQTTGYKAGALGVDTLINAVPEVKKLANVKGEQFSNMASENMTGDVVLKLSQRVNELLARDDVDGVVITHGTDTVEESAYFLHLTVKSDKPVVFVAAMRPATAISADGPMNLLEAVRVAGDKQSRGRGVMVVLNDRIGSARYITKTNASTLDTFKANEEGYLGVIIGNRIYYQNRIDKLHTTRSVFDVRGLTSLPKVDILYGYQDDPEYLYDAAIQHGVKGIVYAGMGAGSVSVRGIAGMRKAMEKGVVVIRSTRTGNGIVPPDEELPGLVSDSLNPAHARILLMLALTRTSDPKVIQEYFHTY
SEQ ID No. 2:
Нуклеотидная последовательность, кодирующая L-аспарагиназу Dickeya chrysanthemi
GCAGATAAACTGCCGAATATTGTTATTCTGGCAACCGGTGGCACCATTGCAGGTAGCGCAGCAACCGGCACCCAAACCACAGGTTATAAAGCCGGTGCACTGGGTGTTGATACCCTGATTAATGCAGTTCCGGAAGTTAAAAAACTGGCCAATGTGAAAGGTGAACAGTTTAGCAATATGGCCAGCGAAAATATGACCGGTGATGTTGTTCTGAAACTGAGCCAGCGTGTTAATGAACTGCTGGCACGTGATGATGTTGATGGTGTGGTTATTACCCATGGCACCGATACCGTTGAAGAAAGCGCCTATTTTCTGCATCTGACCGTGAAAAGCGATAAACCGGTTGTTTTTGTTGCAGCAATGCGTCCGGCAACCGCAATTAGCGCAGATGGTCCGATGAATCTGCTGGAAGCAGTTCGTGTTGCCGGTGATAAACAGAGCCGTGGTCGTGGTGTTATGGTTGTTCTGAATGATCGTATTGGTAGCGCACGCTATATTACCAAAACCAATGCAAGCACCCTGGATACCTTTAAAGCCAATGAAGAAGGTTATCTGGGCGTTATTATTGGCAATCGCATTTATTATCAGAATCGCATTGATAAACTGCATACCACCCGTAGCGTTTTTGATGTTCGTGGTCTGACCAGCCTGCCGAAAGTTGATATTCTGTATGGCTATCAGGATGATCCGGAATATCTGTATGATGCAGCCATTCAGCATGGTGTTAAAGGTATTGTGTATGCAGGTATGGGTGCAGGTAGCGTTAGCGTTCGTGGTATTGCAGGTATGCGTAAAGCAATGGAAAAAGGCGTTGTTGTTATTCGTAGCACCCGTACCGGTAATGGTATTGTTCCGCCGGATGAAGAACTGCCGGGTCTGGTTAGCGATAGCCTGAATCCGGCACATGCACGTATTCTGCTGATGCTGGCACTGACCCGTACCAGCGATCCGAAAGTGATTCAGGAATATTTTCATACCTAT
SEQ ID No. 3:
Аминокислотная последовательность L-аспарагиназы Dickeya chrysanthemi
Сигнальный пептид: 1-28; удаляется при клонировании: аспарагиназа, 29-39; 40-366
MFKFKKNFLVGLSAALMSISLFSATASA ARRAIVGRSSAADKLPNIVILATGGTIAGSAATGTQTTGYKAGALGVDTLINAVPEVKKLANVKGEQFSNMASENMTGDVVLKLSQRVNELLARDDVDGVVITHGTDTVEESAYFLHLTVKSDKPVVFVAAMRPATAISADGPMNLLEAVRVAGDKQSRGRGVMVVLNDRIGSARYITKTNASTLDTFKANEEGYLGVIIGNRIYYQNRIDKLHTTRSVFDVRGLTSLPKVDILYGYQDDPEYLYDAAIQHGVKGIVYAGMGAGSVSVRGIAGMRKAMEKGVVVIRSTRTGNGIVPPDEELPGLVSDSLNPAHARILLMLALTRTSDPKVIQEYFHTY
SEQ ID No. 4
Нуклеотидная последовательность (синтетическая), кодирующая L-аспарагиназу Dickeya chrysanthemi
зрелая аспарагиназа кодируется основаниями 160-1140 (жирные буквы). Таким образом, нуклеотидная последовательность, кодирующая L-аспарагиназу, варьируется от нуклеотидов в положении 160 до 1140.
TCTAGAAATAATTTTGTTTAACTTTAAGAAGGAGATATACATATGTTCAAATTCAAAAAAAACTTCCTGGTGGGTCTGAGCGCAGCACTGATGAGCATTAGCCTGTTTAGCGCAACCGCAAGCGCAGCCAGAAGAGCGATTGTAGGACGCTCTTCTGCCGCAGATAAACTGCCGAATATTGTTATTCTGGCAACCGGTGGCACCATTGCAGGTAGCGCAGCAACCGGCACCCAGACCACCGGTTATAAAGCCGGTGCACTGGGTGTTGATACCCTGATTAATGCAGTTCCGGAAGTTAAAAAACTGGCCAATGTTAAAGGTGAGCAGTTTAGCAATATGGCCAGCGAAAATATGACCGGTGATGTTGTTCTGAAACTGAGCCAGCGTGTTAATGAACTGCTGGCACGTGATGATGTTGATGGTGTTGTTATTACCCATGGCACCGATACCGTTGAAGAAAGCGCATATTTTCTGCATCTGACCGTGAAAAGCGATAAACCGGTTGTTTTTGTTGCAGCAATGCGTCCGGCAACCGCCATTAGCGCAGATGGTCCGATGAATCTGCTGGAAGCAGTTCGTGTTGCCGGTGATAAACAGAGCCGTGGTCGTGGTGTTATGGTTGTGCTGAATGATCGTATTGGTAGCGCACGTTATATTACCAAAACCAATGCAAGCACCCTGGATACCTTTAAAGCAAATGAAGAAGGTTATCTGGGCGTCATTATTGGCAATCGTATCTATTATCAGAACCGCATCGACAAACTGCATACCACCCGTAGCGTTTTTGATGTTCGTGGTCTGACCAGCCTGCCGAAAGTGGATATTCTGTATGGTTATCAGGATGATCCGGAATATCTGTATGATGCAGCAATTCAGCATGGTGTGAAAGGTATTGTTTATGCAGGTATGGGTGCGGGTAGCGTTAGCGTTCGTGGTATTGCCGGTATGCGTAAAGCAATGGAAAAAGGTGTTGTTGTGATTCGTAGCACCCGTACCGGTAATGGTATTGTTCCGCCTGATGAAGAACTGCCTGGTCTGGTTAGCGATAGCCTGAATCCGGCACATGCACGTATTCTGCTGATGCTGGCACTGACCCGTACCAGCGATCCGAAAGTTATTCAAGAATATTTTCATACCTATTAAGCTT
SEQ ID No. 5:
Аминокислотная последовательность пептида PA(20)
AAPAAPAPAAPAAPAPAAPA
SEQ ID No. 6:
Нуклеотидная последовательность, кодирующая пептид PA(20)
GCCGCGCCAGCGGCCCCGGCCCCTGCCGCGCCCGCTGCTCCCGCCCCTGCTGCCCCAGCC
SEQ ID No. 7:
Аминокислотная последовательность полипептида PA (200)
AAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAA
SEQ ID No. 8:
Нуклеотидная последовательность, кодирующая полипептид PA(200)
GCCGCGCCAGCGGCCCCGGCCCCTGCCGCGCCCGCTGCTCCCGCCCCTGCTGCCCCAGCCGCCGCTCCTGCGGCACCTGCGCCCGCCGCGCCGGCAGCGCCGGCACCGGCAGCTCCGGCGGCCGCGCCTGCAGCTCCTGCACCGGCGGCTCCAGCAGCCCCGGCGCCGGCCGCACCTGCGGCGGCGCCCGCGGCGCCTGCACCCGCAGCGCCTGCGGCACCGGCCCCAGCAGCCCCTGCCGCCGCACCGGCTGCGCCTGCCCCAGCGGCCCCCGCTGCCCCGGCCCCGGCGGCTCCAGCCGCAGCGCCTGCCGCCCCAGCGCCCGCAGCACCGGCGGCACCAGCTCCGGCGGCGCCGGCGGCGGCTCCGGCAGCTCCGGCCCCTGCTGCGCCGGCTGCGCCGGCTCCGGCGGCCCCTGCGGCGGCTCCGGCCGCACCTGCACCTGCCGCGCCGGCTGCTCCGGCCCCGGCTGCCCCAGCAGCGGCACCAGCAGCGCCTGCTCCTGCGGCGCCTGCAGCTCCGGCGCCGGCAGCCCCGGCCGCCGCACCCGCGGCTCCAGCCCCCGCCGCTCCAGCAGCCCCCGCGCCAGCTGCACCTGCTGCC
SEQ ID No. 9:
Аминокислотная последовательность полипептида PA(400)
AAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAA
SEQ ID No. 10:
Нуклеотидная последовательность, кодирующая полипептид PA(400)
GCCGCGCCAGCGGCCCCGGCCCCTGCCGCGCCCGCTGCTCCCGCCCCTGCTGCCCCAGCCGCCGCTCCTGCGGCACCTGCGCCCGCCGCGCCGGCAGCGCCGGCACCGGCAGCTCCGGCGGCCGCGCCTGCAGCTCCTGCACCGGCGGCTCCAGCAGCCCCGGCGCCGGCCGCACCTGCGGCGGCGCCCGCGGCGCCTGCACCCGCAGCGCCTGCGGCACCGGCCCCAGCAGCCCCTGCCGCCGCACCGGCTGCGCCTGCCCCAGCGGCCCCCGCTGCCCCGGCCCCGGCGGCTCCAGCCGCAGCGCCTGCCGCCCCAGCGCCCGCAGCACCGGCGGCACCAGCTCCGGCGGCGCCGGCGGCGGCTCCGGCAGCTCCGGCCCCTGCTGCGCCGGCTGCGCCGGCTCCGGCGGCCCCTGCGGCGGCTCCGGCCGCACCTGCACCTGCCGCGCCGGCTGCTCCGGCCCCGGCTGCCCCAGCAGCGGCACCAGCAGCGCCTGCTCCTGCGGCGCCTGCAGCTCCGGCGCCGGCAGCCCCGGCCGCCGCACCCGCGGCTCCAGCCCCCGCCGCTCCAGCAGCCCCCGCGCCAGCTGCACCTGCTGCCGCTCCTGCTGCCCCTGCTCCCGCTGCCCCCGCCGCCCCCGCCCCAGCTGCCCCCGCTGCCGCACCTGCTGCCCCAGCTCCCGCTGCCCCAGCCGCGCCGGCCCCCGCAGCTCCAGCCGCGGCACCAGCTGCCCCAGCTCCAGCGGCGCCTGCTGCCCCGGCCCCCGCGGCACCGGCTGCCGCGCCCGCAGCTCCAGCGCCTGCTGCACCGGCTGCTCCGGCACCCGCCGCGCCAGCAGCTGCCCCTGCGGCACCAGCTCCTGCTGCCCCCGCGGCACCTGCACCCGCTGCCCCGGCGGCAGCTCCCGCCGCGCCAGCCCCTGCAGCTCCTGCTGCACCTGCTCCTGCCGCCCCTGCTGCTGCCCCTGCTGCTCCAGCCCCTGCAGCACCGGCCGCTCCAGCTCCTGCCGCTCCTGCCGCTGCGCCCGCTGCTCCAGCCCCAGCTGCGCCAGCAGCTCCTGCACCTGCTGCCCCTGCCGCCGCCCCTGCGGCTCCAGCACCTGCTGCACCGGCCGCCCCGGCGCCCGCTGCCCCCGCAGCAGCCCCAGCCGCACCCGCTCCAGCAGCTCCCGCAGCCCCAGCACCCGCAGCACCAGCCGCC
SEQ ID No. 11:
Аминокислотная последовательность гибридного белка аспарагиназы-PA(200)
AAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAADKLPNIVILATGGTIAGSAATGTQTTGYKAGALGVDTLINAVPEVKKLANVKGEQFSNMASENMTGDVVLKLSQRVNELLARDDVDGVVITHGTDTVEESAYFLHLTVKSDKPVVFVAAMRPATAISADGPMNLLEAVRVAGDKQSRGRGVMVVLNDRIGSARYITKTNASTLDTFKANEEGYLGVIIGNRIYYQNRIDKLHTTRSVFDVRGLTSLPKVDILYGYQDDPEYLYDAAIQHGVKGIVYAGMGAGSVSVRGIAGMRKAMEKGVVVIRSTRTGNGIVPPDEELPGLVSDSLNPAHARILLMLALTRTSDPKVIQEYFHTY
SEQ ID No. 12:
Нуклеотидная последовательность, кодирующая гибридный белок аспарагиназа-PA(200) (XbaI/HindIII)
Зрелый гибридный белок (SEQ ID NO 11), кодируемый основаниями 127-1710 (жирные буквы). Таким образом, нуклеотидная последовательность, кодирующая гибридный белок, может варьироваться от нуклеотидов в положении 127 до 1710 SEQ ID NO: 12. Соответственно, термин «модифицированный белок, содержащий или состоящий из аминокислотной последовательности, кодируемой нуклеиновой кислотой, имеющей нуклеотидную последовательность, представленную в SEQ ID NO: 12» при использовании в данном документе может быть более узко определен как «модифицированный белок, содержащий или состоящий из аминокислотной последовательности, кодируемой нуклеиновой кислотой, имеющей нуклеотидную последовательность, представленную в положениях с 127 по 1710 SEQ ID NO: 12».
TCTAGAAATAATTTTGTTTAACTTTAAGAAGGAGATATACATATGTTCAAATTCAAAAAAAACTTCCTGGTGGGTCTGAGCGCAGCACTGATGAGCATTAGCCTGTTTAGCGCAACCGCAAGCGCAGCCGCGCCAGCGGCCCCGGCCCCTGCCGCGCCCGCTGCTCCCGCCCCTGCTGCCCCAGCCGCCGCTCCTGCGGCACCTGCGCCCGCCGCGCCGGCAGCGCCGGCACCGGCAGCTCCGGCGGCCGCGCCTGCAGCTCCTGCACCGGCGGCTCCAGCAGCCCCGGCGCCGGCCGCACCTGCGGCGGCGCCCGCGGCGCCTGCACCCGCAGCGCCTGCGGCACCGGCCCCAGCAGCCCCTGCCGCCGCACCGGCTGCGCCTGCCCCAGCGGCCCCCGCTGCCCCGGCCCCGGCGGCTCCAGCCGCAGCGCCTGCCGCCCCAGCGCCCGCAGCACCGGCGGCACCAGCTCCGGCGGCGCCGGCGGCGGCTCCGGCAGCTCCGGCCCCTGCTGCGCCGGCTGCGCCGGCTCCGGCGGCCCCTGCGGCGGCTCCGGCCGCACCTGCACCTGCCGCGCCGGCTGCTCCGGCCCCGGCTGCCCCAGCAGCGGCACCAGCAGCGCCTGCTCCTGCGGCGCCTGCAGCTCCGGCGCCGGCAGCCCCGGCCGCCGCACCCGCGGCTCCAGCCCCCGCCGCTCCAGCAGCCCCCGCGCCAGCTGCACCTGCTGCCGCAGATAAACTGCCGAATATTGTTATTCTGGCAACCGGTGGCACCATTGCAGGTAGCGCAGCAACCGGCACCCAGACCACCGGTTATAAAGCCGGTGCACTGGGTGTTGATACCCTGATTAATGCAGTTCCGGAAGTTAAAAAACTGGCCAATGTTAAAGGTGAGCAGTTTAGCAATATGGCCAGCGAAAATATGACCGGTGATGTTGTTCTGAAACTGAGCCAGCGTGTTAATGAACTGCTGGCACGTGATGATGTTGATGGTGTTGTTATTACCCATGGCACCGATACCGTTGAAGAAAGCGCATATTTTCTGCATCTGACCGTGAAAAGCGATAAACCGGTTGTTTTTGTTGCAGCAATGCGTCCGGCAACCGCCATTAGCGCAGATGGTCCGATGAATCTGCTGGAAGCAGTTCGTGTTGCCGGTGATAAACAGAGCCGTGGTCGTGGTGTTATGGTTGTGCTGAATGATCGTATTGGTAGCGCACGTTATATTACCAAAACCAATGCAAGCACCCTGGATACCTTTAAAGCAAATGAAGAAGGTTATCTGGGCGTCATTATTGGCAATCGTATCTATTATCAGAACCGCATCGACAAACTGCATACCACCCGTAGCGTTTTTGATGTTCGTGGTCTGACCAGCCTGCCGAAAGTGGATATTCTGTATGGTTATCAGGATGATCCGGAATATCTGTATGATGCAGCAATTCAGCATGGTGTGAAAGGTATTGTTTATGCAGGTATGGGTGCGGGTAGCGTTAGCGTTCGTGGTATTGCCGGTATGCGTAAAGCAATGGAAAAAGGTGTTGTTGTGATTCGTAGCACCCGTACCGGTAATGGTATTGTTCCGCCTGATGAAGAACTGCCTGGTCTGGTTAGCGATAGCCTGAATCCGGCACATGCACGTATTCTGCTGATGCTGGCACTGACCCGTACCAGCGATCCGAAAGTTATTCAAGAATATTTTCATACCTATTAAGCTT
SEQ ID No. 13:
Аминокислотная последовательность гибридного белка аспарагиназа-PA(400) AAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPAAADKLPNIVILATGGTIAGSAATGTQTTGYKAGALGVDTLINAVPEVKKLANVKGEQFSNMASENMTGDVVLKLSQRVNELLARDDVDGVVITHGTDTVEESAYFLHLTVKSDKPVVFVAAMRPATAISADGPMNLLEAVRVAGDKQSRGRGVMVVLNDRIGSARYITKTNASTLDTFKANEEGYLGVIIGNRIYYQNRIDKLHTTRSVFDVRGLTSLPKVDILYGYQDDPEYLYDAAIQHGVKGIVYAGMGAGSVSVRGIAGMRKAMEKGVVVIRSTRTGNGIVPPDEELPGLVSDSLNPAHARILLMLALTRTSDPKVIQEYFHTY
SEQ ID No. 14:
Нуклеотидная последовательность, кодирующая гибридный белок аспарагиназа-PA(400)
(XbaI/HindIII)
Зрелый гибридный белок (SEQ ID NO 13), кодируемый основаниями 127-2184 (жирные буквы). Таким образом, нуклеотидная последовательность, кодирующая гибридный белок, может варьироваться от нуклеотидов в положении 127 до 2184 SEQ ID NO: 14. Соответственно, термин «модифицированный белок, содержащий или состоящий из аминокислотной последовательности, кодируемой нуклеиновой кислотой, имеющей нуклеотидную последовательность, представленную в SEQ ID NO: 14» при использовании в данном документе может быть более узко определен как «модифицированный белок, содержащий или состоящий из аминокислотной последовательности, кодируемой нуклеиновой кислотой, имеющей нуклеотидную последовательность, представленную в положениях с 127 по 2184 SEQ ID NO: 14».
TCTAGAAATAATTTTGTTTAACTTTAAGAAGGAGATATACATATGTTCAAATTCAAAAAAAACTTCCTGGTGGGTCTGAGCGCAGCACTGATGAGCATTAGCCTGTTTAGCGCAACCGCAAGCGCAGCCGCGCCAGCGGCCCCGGCCCCTGCCGCGCCCGCTGCTCCCGCCCCTGCTGCCCCAGCCGCCGCTCCTGCGGCACCTGCGCCCGCCGCGCCGGCAGCGCCGGCACCGGCAGCTCCGGCGGCCGCGCCTGCAGCTCCTGCACCGGCGGCTCCAGCAGCCCCGGCGCCGGCCGCACCTGCGGCGGCGCCCGCGGCGCCTGCACCCGCAGCGCCTGCGGCACCGGCCCCAGCAGCCCCTGCCGCCGCACCGGCTGCGCCTGCCCCAGCGGCCCCCGCTGCCCCGGCCCCGGCGGCTCCAGCCGCAGCGCCTGCCGCCCCAGCGCCCGCAGCACCGGCGGCACCAGCTCCGGCGGCGCCGGCGGCGGCTCCGGCAGCTCCGGCCCCTGCTGCGCCGGCTGCGCCGGCTCCGGCGGCCCCTGCGGCGGCTCCGGCCGCACCTGCACCTGCCGCGCCGGCTGCTCCGGCCCCGGCTGCCCCAGCAGCGGCACCAGCAGCGCCTGCTCCTGCGGCGCCTGCAGCTCCGGCGCCGGCAGCCCCGGCCGCCGCACCCGCGGCTCCAGCCCCCGCCGCTCCAGCAGCCCCCGCGCCAGCTGCACCTGCTGCCGCTCCTGCTGCCCCTGCTCCCGCTGCCCCCGCCGCCCCCGCCCCAGCTGCCCCCGCTGCCGCACCTGCTGCCCCAGCTCCCGCTGCCCCAGCCGCGCCGGCCCCCGCAGCTCCAGCCGCGGCACCAGCTGCCCCAGCTCCAGCGGCGCCTGCTGCCCCGGCCCCCGCGGCACCGGCTGCCGCGCCCGCAGCTCCAGCGCCTGCTGCACCGGCTGCTCCGGCACCCGCCGCGCCAGCAGCTGCCCCTGCGGCACCAGCTCCTGCTGCCCCCGCGGCACCTGCACCCGCTGCCCCGGCGGCAGCTCCCGCCGCGCCAGCCCCTGCAGCTCCTGCTGCACCTGCTCCTGCCGCCCCTGCTGCTGCCCCTGCTGCTCCAGCCCCTGCAGCACCGGCCGCTCCAGCTCCTGCCGCTCCTGCCGCTGCGCCCGCTGCTCCAGCCCCAGCTGCGCCAGCAGCTCCTGCACCTGCTGCCCCTGCCGCCGCCCCTGCGGCTCCAGCACCTGCTGCACCGGCCGCCCCGGCGCCCGCTGCCCCCGCAGCAGCCCCAGCCGCACCCGCTCCAGCAGCTCCCGCAGCCCCAGCACCCGCAGCACCAGCCGCCGCAGATAAACTGCCGAATATTGTTATTCTGGCAACCGGTGGCACCATTGCAGGTAGCGCAGCAACCGGCACCCAGACCACCGGTTATAAAGCCGGTGCACTGGGTGTTGATACCCTGATTAATGCAGTTCCGGAAGTTAAAAAACTGGCCAATGTTAAAGGTGAGCAGTTTAGCAATATGGCCAGCGAAAATATGACCGGTGATGTTGTTCTGAAACTGAGCCAGCGTGTTAATGAACTGCTGGCACGTGATGATGTTGATGGTGTTGTTATTACCCATGGCACCGATACCGTTGAAGAAAGCGCATATTTTCTGCATCTGACCGTGAAAAGCGATAAACCGGTTGTTTTTGTTGCAGCAATGCGTCCGGCAACCGCCATTAGCGCAGATGGTCCGATGAATCTGCTGGAAGCAGTTCGTGTTGCCGGTGATAAACAGAGCCGTGGTCGTGGTGTTATGGTTGTGCTGAATGATCGTATTGGTAGCGCACGTTATATTACCAAAACCAATGCAAGCACCCTGGATACCTTTAAAGCAAATGAAGAAGGTTATCTGGGCGTCATTATTGGCAATCGTATCTATTATCAGAACCGCATCGACAAACTGCATACCACCCGTAGCGTTTTTGATGTTCGTGGTCTGACCAGCCTGCCGAAAGTGGATATTCTGTATGGTTATCAGGATGATCCGGAATATCTGTATGATGCAGCAATTCAGCATGGTGTGAAAGGTATTGTTTATGCAGGTATGGGTGCGGGTAGCGTTAGCGTTCGTGGTATTGCCGGTATGCGTAAAGCAATGGAAAAAGGTGTTGTTGTGATTCGTAGCACCCGTACCGGTAATGGTATTGTTCCGCCTGATGAAGAACTGCCTGGTCTGGTTAGCGATAGCCTGAATCCGGCACATGCACGTATTCTGCTGATGCTGGCACTGACCCGTACCAGCGATCCGAAAGTTATTCAAGAATATTTTCATACCTATTAAGCTT
SEQ ID NO 15: Аминокислотная последовательность пептида PA(40)
AAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPA
SEQ ID NO 16: Модифицированный пептид PA(20)
Pga-AAPAAPAPAAPAAPAPAAPA-Ahx-COOH
SEQ ID NO 17: Модифицированный пептид PA(40)
Pga-AAPAAPAPAAPAAPAPAAPAAAPAAPAPAAPAAPAPAAPA-Ahx-COOH
[000197] Все ссылки, цитируемые в данном документе, полностью включены в качестве ссылки. После полного описания изобретения специалисту в данной области техники будет понятно, что изобретение может быть осуществлено на практике в широком и эквивалентном диапазоне условий, параметров и тому подобного, без влияния на сущность или объем изобретения или любого варианта его осуществления.
Список ссылок
Carpino & El-Faham, 1995
Carpino, L.A. & El-Faham, A. (1995) Tetramethylfluoroformamidinium hexafluorophosphate: a rapid-acting peptide coupling reagent for solution and solid phase peptide synthesis. J. Am. Chem. Soc. 117(19), 5401-5402.
El-Faham et al., 2011
El-Faham, A. & Albericio, F. (2011) Peptide coupling reagents, more than a letter soup. Chem Rev. 111(11), 6557-6602.
Hermanson, 2013
Hermanson, G.T. (2013) Bioconjugate techniques. Third edition. Academic press.
Isidro-Llobet, 2009
Isidro-Llobet, A., Alvarez, M. & Albericio, F. (2009) Amino acid-protecting groups. Chem. Rev. 109(6), 2455-2504.
Klose et al., 1999
Klose, J., Bienert, M., Mollenkopf, C., Wehle, D., Zhang, C.-W., Carpino, L.A. & Henklein P. (1999) 2-Propanephosphonic acid anhydride (T3P)-mediated segment coupling and head-to-tail cyclization of sterically hindered peptides. Chem. Commun. 18, 1847-1848.
Montalbetti et al., 2005
Montalbetti, C.A. & Falque, V. (2005) Amide bond formation and peptide coupling. Tetrahedron, 61(46), 10827-10852.
Valeur et al., 2007
Valeur, E. & Bradley, M. (2009) Amide bond formation: beyond the myth of coupling reagents. Chem. Soc. Rev., 38(2), 606-631.
Valeur et al., 2009
Valeur, E. & Bradley, M. (2009) Amide bond formation: beyond the myth of coupling reagents. Chem. Soc. Rev., 38(2), 606-631.
Wuts, 2012
Wuts, P.G. & Greene, T.W. (2012) Greene's Protective Groups in Organic Synthesis. Fourth Edition. John Wiley & Sons.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> XL-protein GmbH
Jazz Pharmaceuticals Ireland Limited
<120> Модифицированная L-аспарагиназа
<130> AA2000 PCT S3
<150> EP 17 17 7237.9
<151> 21.06.2017
<150> US 62/523,061
<151> 21.06.2017
<150> US 15/671,086
<151> 07.08.2017
<160> 17
<170> BiSSAP 1.3
<210> 1
<211> 327
<212> Белок
<213> Dickeya chrysanthemi
<220>
<223> L-аспарагиназа
<400> 1
Ala Asp Lys Leu Pro Asn Ile Val Ile Leu Ala Thr Gly Gly Thr Ile
1 5 10 15
Ala Gly Ser Ala Ala Thr Gly Thr Gln Thr Thr Gly Tyr Lys Ala Gly
20 25 30
Ala Leu Gly Val Asp Thr Leu Ile Asn Ala Val Pro Glu Val Lys Lys
35 40 45
Leu Ala Asn Val Lys Gly Glu Gln Phe Ser Asn Met Ala Ser Glu Asn
50 55 60
Met Thr Gly Asp Val Val Leu Lys Leu Ser Gln Arg Val Asn Glu Leu
65 70 75 80
Leu Ala Arg Asp Asp Val Asp Gly Val Val Ile Thr His Gly Thr Asp
85 90 95
Thr Val Glu Glu Ser Ala Tyr Phe Leu His Leu Thr Val Lys Ser Asp
100 105 110
Lys Pro Val Val Phe Val Ala Ala Met Arg Pro Ala Thr Ala Ile Ser
115 120 125
Ala Asp Gly Pro Met Asn Leu Leu Glu Ala Val Arg Val Ala Gly Asp
130 135 140
Lys Gln Ser Arg Gly Arg Gly Val Met Val Val Leu Asn Asp Arg Ile
145 150 155 160
Gly Ser Ala Arg Tyr Ile Thr Lys Thr Asn Ala Ser Thr Leu Asp Thr
165 170 175
Phe Lys Ala Asn Glu Glu Gly Tyr Leu Gly Val Ile Ile Gly Asn Arg
180 185 190
Ile Tyr Tyr Gln Asn Arg Ile Asp Lys Leu His Thr Thr Arg Ser Val
195 200 205
Phe Asp Val Arg Gly Leu Thr Ser Leu Pro Lys Val Asp Ile Leu Tyr
210 215 220
Gly Tyr Gln Asp Asp Pro Glu Tyr Leu Tyr Asp Ala Ala Ile Gln His
225 230 235 240
Gly Val Lys Gly Ile Val Tyr Ala Gly Met Gly Ala Gly Ser Val Ser
245 250 255
Val Arg Gly Ile Ala Gly Met Arg Lys Ala Met Glu Lys Gly Val Val
260 265 270
Val Ile Arg Ser Thr Arg Thr Gly Asn Gly Ile Val Pro Pro Asp Glu
275 280 285
Glu Leu Pro Gly Leu Val Ser Asp Ser Leu Asn Pro Ala His Ala Arg
290 295 300
Ile Leu Leu Met Leu Ala Leu Thr Arg Thr Ser Asp Pro Lys Val Ile
305 310 315 320
Gln Glu Tyr Phe His Thr Tyr
325
<210> 2
<211> 981
<212> ДНК
<213> Dickeya chrysanthemi
<220>
<223> L-аспарагиназа
<400> 2
gcagataaac tgccgaatat tgttattctg gcaaccggtg gcaccattgc aggtagcgca 60
gcaaccggca cccaaaccac aggttataaa gccggtgcac tgggtgttga taccctgatt 120
aatgcagttc cggaagttaa aaaactggcc aatgtgaaag gtgaacagtt tagcaatatg 180
gccagcgaaa atatgaccgg tgatgttgtt ctgaaactga gccagcgtgt taatgaactg 240
ctggcacgtg atgatgttga tggtgtggtt attacccatg gcaccgatac cgttgaagaa 300
agcgcctatt ttctgcatct gaccgtgaaa agcgataaac cggttgtttt tgttgcagca 360
atgcgtccgg caaccgcaat tagcgcagat ggtccgatga atctgctgga agcagttcgt 420
gttgccggtg ataaacagag ccgtggtcgt ggtgttatgg ttgttctgaa tgatcgtatt 480
ggtagcgcac gctatattac caaaaccaat gcaagcaccc tggatacctt taaagccaat 540
gaagaaggtt atctgggcgt tattattggc aatcgcattt attatcagaa tcgcattgat 600
aaactgcata ccacccgtag cgtttttgat gttcgtggtc tgaccagcct gccgaaagtt 660
gatattctgt atggctatca ggatgatccg gaatatctgt atgatgcagc cattcagcat 720
ggtgttaaag gtattgtgta tgcaggtatg ggtgcaggta gcgttagcgt tcgtggtatt 780
gcaggtatgc gtaaagcaat ggaaaaaggc gttgttgtta ttcgtagcac ccgtaccggt 840
aatggtattg ttccgccgga tgaagaactg ccgggtctgg ttagcgatag cctgaatccg 900
gcacatgcac gtattctgct gatgctggca ctgacccgta ccagcgatcc gaaagtgatt 960
caggaatatt ttcataccta t 981
<210> 3
<211> 366
<212> Белок
<213> Dickeya chrysanthemi
<220>
<223> L-аспарагиназа с сигнальным пептидом
<400> 3
Met Phe Lys Phe Lys Lys Asn Phe Leu Val Gly Leu Ser Ala Ala Leu
1 5 10 15
Met Ser Ile Ser Leu Phe Ser Ala Thr Ala Ser Ala Ala Arg Arg Ala
20 25 30
Ile Val Gly Arg Ser Ser Ala Ala Asp Lys Leu Pro Asn Ile Val Ile
35 40 45
Leu Ala Thr Gly Gly Thr Ile Ala Gly Ser Ala Ala Thr Gly Thr Gln
50 55 60
Thr Thr Gly Tyr Lys Ala Gly Ala Leu Gly Val Asp Thr Leu Ile Asn
65 70 75 80
Ala Val Pro Glu Val Lys Lys Leu Ala Asn Val Lys Gly Glu Gln Phe
85 90 95
Ser Asn Met Ala Ser Glu Asn Met Thr Gly Asp Val Val Leu Lys Leu
100 105 110
Ser Gln Arg Val Asn Glu Leu Leu Ala Arg Asp Asp Val Asp Gly Val
115 120 125
Val Ile Thr His Gly Thr Asp Thr Val Glu Glu Ser Ala Tyr Phe Leu
130 135 140
His Leu Thr Val Lys Ser Asp Lys Pro Val Val Phe Val Ala Ala Met
145 150 155 160
Arg Pro Ala Thr Ala Ile Ser Ala Asp Gly Pro Met Asn Leu Leu Glu
165 170 175
Ala Val Arg Val Ala Gly Asp Lys Gln Ser Arg Gly Arg Gly Val Met
180 185 190
Val Val Leu Asn Asp Arg Ile Gly Ser Ala Arg Tyr Ile Thr Lys Thr
195 200 205
Asn Ala Ser Thr Leu Asp Thr Phe Lys Ala Asn Glu Glu Gly Tyr Leu
210 215 220
Gly Val Ile Ile Gly Asn Arg Ile Tyr Tyr Gln Asn Arg Ile Asp Lys
225 230 235 240
Leu His Thr Thr Arg Ser Val Phe Asp Val Arg Gly Leu Thr Ser Leu
245 250 255
Pro Lys Val Asp Ile Leu Tyr Gly Tyr Gln Asp Asp Pro Glu Tyr Leu
260 265 270
Tyr Asp Ala Ala Ile Gln His Gly Val Lys Gly Ile Val Tyr Ala Gly
275 280 285
Met Gly Ala Gly Ser Val Ser Val Arg Gly Ile Ala Gly Met Arg Lys
290 295 300
Ala Met Glu Lys Gly Val Val Val Ile Arg Ser Thr Arg Thr Gly Asn
305 310 315 320
Gly Ile Val Pro Pro Asp Glu Glu Leu Pro Gly Leu Val Ser Asp Ser
325 330 335
Leu Asn Pro Ala His Ala Arg Ile Leu Leu Met Leu Ala Leu Thr Arg
340 345 350
Thr Ser Asp Pro Lys Val Ile Gln Glu Tyr Phe His Thr Tyr
355 360 365
<210> 4
<211> 1147
<212> ДНК
<213> Dickeya chrysanthemi
<220>
<223> L-аспарагиназа
<400> 4
tctagaaata attttgttta actttaagaa ggagatatac atatgttcaa attcaaaaaa 60
aacttcctgg tgggtctgag cgcagcactg atgagcatta gcctgtttag cgcaaccgca 120
agcgcagcca gaagagcgat tgtaggacgc tcttctgccg cagataaact gccgaatatt 180
gttattctgg caaccggtgg caccattgca ggtagcgcag caaccggcac ccagaccacc 240
ggttataaag ccggtgcact gggtgttgat accctgatta atgcagttcc ggaagttaaa 300
aaactggcca atgttaaagg tgagcagttt agcaatatgg ccagcgaaaa tatgaccggt 360
gatgttgttc tgaaactgag ccagcgtgtt aatgaactgc tggcacgtga tgatgttgat 420
ggtgttgtta ttacccatgg caccgatacc gttgaagaaa gcgcatattt tctgcatctg 480
accgtgaaaa gcgataaacc ggttgttttt gttgcagcaa tgcgtccggc aaccgccatt 540
agcgcagatg gtccgatgaa tctgctggaa gcagttcgtg ttgccggtga taaacagagc 600
cgtggtcgtg gtgttatggt tgtgctgaat gatcgtattg gtagcgcacg ttatattacc 660
aaaaccaatg caagcaccct ggataccttt aaagcaaatg aagaaggtta tctgggcgtc 720
attattggca atcgtatcta ttatcagaac cgcatcgaca aactgcatac cacccgtagc 780
gtttttgatg ttcgtggtct gaccagcctg ccgaaagtgg atattctgta tggttatcag 840
gatgatccgg aatatctgta tgatgcagca attcagcatg gtgtgaaagg tattgtttat 900
gcaggtatgg gtgcgggtag cgttagcgtt cgtggtattg ccggtatgcg taaagcaatg 960
gaaaaaggtg ttgttgtgat tcgtagcacc cgtaccggta atggtattgt tccgcctgat 1020
gaagaactgc ctggtctggt tagcgatagc ctgaatccgg cacatgcacg tattctgctg 1080
atgctggcac tgacccgtac cagcgatccg aaagttattc aagaatattt tcatacctat 1140
taagctt 1147
<210> 5
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептид PA(20)
<400> 5
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
1 5 10 15
Ala Ala Pro Ala
20
<210> 6
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Пептид PA(20)
<400> 6
gccgcgccag cggccccggc ccctgccgcg cccgctgctc ccgcccctgc tgccccagcc 60
<210> 7
<211> 201
<212> Белок
<213> Искусственная последовательность
<220>
<223> Полипептид PA(200).
<400> 7
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
1 5 10 15
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
20 25 30
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro
35 40 45
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala
50 55 60
Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
65 70 75 80
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
85 90 95
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
100 105 110
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro
115 120 125
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala
130 135 140
Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
145 150 155 160
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
165 170 175
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
180 185 190
Ala Pro Ala Pro Ala Ala Pro Ala Ala
195 200
<210> 8
<211> 603
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Полипептид PA(200).
<400> 8
gccgcgccag cggccccggc ccctgccgcg cccgctgctc ccgcccctgc tgccccagcc 60
gccgctcctg cggcacctgc gcccgccgcg ccggcagcgc cggcaccggc agctccggcg 120
gccgcgcctg cagctcctgc accggcggct ccagcagccc cggcgccggc cgcacctgcg 180
gcggcgcccg cggcgcctgc acccgcagcg cctgcggcac cggccccagc agcccctgcc 240
gccgcaccgg ctgcgcctgc cccagcggcc cccgctgccc cggccccggc ggctccagcc 300
gcagcgcctg ccgccccagc gcccgcagca ccggcggcac cagctccggc ggcgccggcg 360
gcggctccgg cagctccggc ccctgctgcg ccggctgcgc cggctccggc ggcccctgcg 420
gcggctccgg ccgcacctgc acctgccgcg ccggctgctc cggccccggc tgccccagca 480
gcggcaccag cagcgcctgc tcctgcggcg cctgcagctc cggcgccggc agccccggcc 540
gccgcacccg cggctccagc ccccgccgct ccagcagccc ccgcgccagc tgcacctgct 600
gcc 603
<210> 9
<211> 401
<212> Белок
<213> Искусственная последовательность
<220>
<223> Полипептид PA(400).
<400> 9
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
1 5 10 15
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
20 25 30
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro
35 40 45
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala
50 55 60
Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
65 70 75 80
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
85 90 95
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
100 105 110
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro
115 120 125
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala
130 135 140
Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
145 150 155 160
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
165 170 175
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
180 185 190
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro
195 200 205
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala
210 215 220
Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
225 230 235 240
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
245 250 255
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
260 265 270
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro
275 280 285
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala
290 295 300
Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
305 310 315 320
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
325 330 335
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
340 345 350
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro
355 360 365
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala
370 375 380
Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
385 390 395 400
Ala
<210> 10
<211> 1203
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Полипептид PA(400).
<400> 10
gccgcgccag cggccccggc ccctgccgcg cccgctgctc ccgcccctgc tgccccagcc 60
gccgctcctg cggcacctgc gcccgccgcg ccggcagcgc cggcaccggc agctccggcg 120
gccgcgcctg cagctcctgc accggcggct ccagcagccc cggcgccggc cgcacctgcg 180
gcggcgcccg cggcgcctgc acccgcagcg cctgcggcac cggccccagc agcccctgcc 240
gccgcaccgg ctgcgcctgc cccagcggcc cccgctgccc cggccccggc ggctccagcc 300
gcagcgcctg ccgccccagc gcccgcagca ccggcggcac cagctccggc ggcgccggcg 360
gcggctccgg cagctccggc ccctgctgcg ccggctgcgc cggctccggc ggcccctgcg 420
gcggctccgg ccgcacctgc acctgccgcg ccggctgctc cggccccggc tgccccagca 480
gcggcaccag cagcgcctgc tcctgcggcg cctgcagctc cggcgccggc agccccggcc 540
gccgcacccg cggctccagc ccccgccgct ccagcagccc ccgcgccagc tgcacctgct 600
gccgctcctg ctgcccctgc tcccgctgcc cccgccgccc ccgccccagc tgcccccgct 660
gccgcacctg ctgccccagc tcccgctgcc ccagccgcgc cggcccccgc agctccagcc 720
gcggcaccag ctgccccagc tccagcggcg cctgctgccc cggcccccgc ggcaccggct 780
gccgcgcccg cagctccagc gcctgctgca ccggctgctc cggcacccgc cgcgccagca 840
gctgcccctg cggcaccagc tcctgctgcc cccgcggcac ctgcacccgc tgccccggcg 900
gcagctcccg ccgcgccagc ccctgcagct cctgctgcac ctgctcctgc cgcccctgct 960
gctgcccctg ctgctccagc ccctgcagca ccggccgctc cagctcctgc cgctcctgcc 1020
gctgcgcccg ctgctccagc cccagctgcg ccagcagctc ctgcacctgc tgcccctgcc 1080
gccgcccctg cggctccagc acctgctgca ccggccgccc cggcgcccgc tgcccccgca 1140
gcagccccag ccgcacccgc tccagcagct cccgcagccc cagcacccgc agcaccagcc 1200
gcc 1203
<210> 11
<211> 528
<212> Белок
<213> Искусственная последовательность
<220>
<223> Гибридный белок аспарагиназа-PA(200)
<400> 11
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
1 5 10 15
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
20 25 30
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro
35 40 45
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala
50 55 60
Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
65 70 75 80
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
85 90 95
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
100 105 110
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro
115 120 125
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala
130 135 140
Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
145 150 155 160
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
165 170 175
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
180 185 190
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Asp Lys Leu Pro Asn Ile
195 200 205
Val Ile Leu Ala Thr Gly Gly Thr Ile Ala Gly Ser Ala Ala Thr Gly
210 215 220
Thr Gln Thr Thr Gly Tyr Lys Ala Gly Ala Leu Gly Val Asp Thr Leu
225 230 235 240
Ile Asn Ala Val Pro Glu Val Lys Lys Leu Ala Asn Val Lys Gly Glu
245 250 255
Gln Phe Ser Asn Met Ala Ser Glu Asn Met Thr Gly Asp Val Val Leu
260 265 270
Lys Leu Ser Gln Arg Val Asn Glu Leu Leu Ala Arg Asp Asp Val Asp
275 280 285
Gly Val Val Ile Thr His Gly Thr Asp Thr Val Glu Glu Ser Ala Tyr
290 295 300
Phe Leu His Leu Thr Val Lys Ser Asp Lys Pro Val Val Phe Val Ala
305 310 315 320
Ala Met Arg Pro Ala Thr Ala Ile Ser Ala Asp Gly Pro Met Asn Leu
325 330 335
Leu Glu Ala Val Arg Val Ala Gly Asp Lys Gln Ser Arg Gly Arg Gly
340 345 350
Val Met Val Val Leu Asn Asp Arg Ile Gly Ser Ala Arg Tyr Ile Thr
355 360 365
Lys Thr Asn Ala Ser Thr Leu Asp Thr Phe Lys Ala Asn Glu Glu Gly
370 375 380
Tyr Leu Gly Val Ile Ile Gly Asn Arg Ile Tyr Tyr Gln Asn Arg Ile
385 390 395 400
Asp Lys Leu His Thr Thr Arg Ser Val Phe Asp Val Arg Gly Leu Thr
405 410 415
Ser Leu Pro Lys Val Asp Ile Leu Tyr Gly Tyr Gln Asp Asp Pro Glu
420 425 430
Tyr Leu Tyr Asp Ala Ala Ile Gln His Gly Val Lys Gly Ile Val Tyr
435 440 445
Ala Gly Met Gly Ala Gly Ser Val Ser Val Arg Gly Ile Ala Gly Met
450 455 460
Arg Lys Ala Met Glu Lys Gly Val Val Val Ile Arg Ser Thr Arg Thr
465 470 475 480
Gly Asn Gly Ile Val Pro Pro Asp Glu Glu Leu Pro Gly Leu Val Ser
485 490 495
Asp Ser Leu Asn Pro Ala His Ala Arg Ile Leu Leu Met Leu Ala Leu
500 505 510
Thr Arg Thr Ser Asp Pro Lys Val Ile Gln Glu Tyr Phe His Thr Tyr
515 520 525
<210> 12
<211> 1717
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Гибридный белок аспарагиназа-PA(200)
<400> 12
tctagaaata attttgttta actttaagaa ggagatatac atatgttcaa attcaaaaaa 60
aacttcctgg tgggtctgag cgcagcactg atgagcatta gcctgtttag cgcaaccgca 120
agcgcagccg cgccagcggc cccggcccct gccgcgcccg ctgctcccgc ccctgctgcc 180
ccagccgccg ctcctgcggc acctgcgccc gccgcgccgg cagcgccggc accggcagct 240
ccggcggccg cgcctgcagc tcctgcaccg gcggctccag cagccccggc gccggccgca 300
cctgcggcgg cgcccgcggc gcctgcaccc gcagcgcctg cggcaccggc cccagcagcc 360
cctgccgccg caccggctgc gcctgcccca gcggcccccg ctgccccggc cccggcggct 420
ccagccgcag cgcctgccgc cccagcgccc gcagcaccgg cggcaccagc tccggcggcg 480
ccggcggcgg ctccggcagc tccggcccct gctgcgccgg ctgcgccggc tccggcggcc 540
cctgcggcgg ctccggccgc acctgcacct gccgcgccgg ctgctccggc cccggctgcc 600
ccagcagcgg caccagcagc gcctgctcct gcggcgcctg cagctccggc gccggcagcc 660
ccggccgccg cacccgcggc tccagccccc gccgctccag cagcccccgc gccagctgca 720
cctgctgccg cagataaact gccgaatatt gttattctgg caaccggtgg caccattgca 780
ggtagcgcag caaccggcac ccagaccacc ggttataaag ccggtgcact gggtgttgat 840
accctgatta atgcagttcc ggaagttaaa aaactggcca atgttaaagg tgagcagttt 900
agcaatatgg ccagcgaaaa tatgaccggt gatgttgttc tgaaactgag ccagcgtgtt 960
aatgaactgc tggcacgtga tgatgttgat ggtgttgtta ttacccatgg caccgatacc 1020
gttgaagaaa gcgcatattt tctgcatctg accgtgaaaa gcgataaacc ggttgttttt 1080
gttgcagcaa tgcgtccggc aaccgccatt agcgcagatg gtccgatgaa tctgctggaa 1140
gcagttcgtg ttgccggtga taaacagagc cgtggtcgtg gtgttatggt tgtgctgaat 1200
gatcgtattg gtagcgcacg ttatattacc aaaaccaatg caagcaccct ggataccttt 1260
aaagcaaatg aagaaggtta tctgggcgtc attattggca atcgtatcta ttatcagaac 1320
cgcatcgaca aactgcatac cacccgtagc gtttttgatg ttcgtggtct gaccagcctg 1380
ccgaaagtgg atattctgta tggttatcag gatgatccgg aatatctgta tgatgcagca 1440
attcagcatg gtgtgaaagg tattgtttat gcaggtatgg gtgcgggtag cgttagcgtt 1500
cgtggtattg ccggtatgcg taaagcaatg gaaaaaggtg ttgttgtgat tcgtagcacc 1560
cgtaccggta atggtattgt tccgcctgat gaagaactgc ctggtctggt tagcgatagc 1620
ctgaatccgg cacatgcacg tattctgctg atgctggcac tgacccgtac cagcgatccg 1680
aaagttattc aagaatattt tcatacctat taagctt 1717
<210> 13
<211> 728
<212> Белок
<213> Искусственная последовательность
<220>
<223> Гибридный белок аспарагиназа-PA-(400)
<400> 13
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
1 5 10 15
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
20 25 30
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro
35 40 45
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala
50 55 60
Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
65 70 75 80
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
85 90 95
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
100 105 110
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro
115 120 125
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala
130 135 140
Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
145 150 155 160
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
165 170 175
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
180 185 190
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro
195 200 205
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala
210 215 220
Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
225 230 235 240
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
245 250 255
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
260 265 270
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro
275 280 285
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala
290 295 300
Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
305 310 315 320
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
325 330 335
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
340 345 350
Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro
355 360 365
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Ala Pro Ala
370 375 380
Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
385 390 395 400
Ala Ala Asp Lys Leu Pro Asn Ile Val Ile Leu Ala Thr Gly Gly Thr
405 410 415
Ile Ala Gly Ser Ala Ala Thr Gly Thr Gln Thr Thr Gly Tyr Lys Ala
420 425 430
Gly Ala Leu Gly Val Asp Thr Leu Ile Asn Ala Val Pro Glu Val Lys
435 440 445
Lys Leu Ala Asn Val Lys Gly Glu Gln Phe Ser Asn Met Ala Ser Glu
450 455 460
Asn Met Thr Gly Asp Val Val Leu Lys Leu Ser Gln Arg Val Asn Glu
465 470 475 480
Leu Leu Ala Arg Asp Asp Val Asp Gly Val Val Ile Thr His Gly Thr
485 490 495
Asp Thr Val Glu Glu Ser Ala Tyr Phe Leu His Leu Thr Val Lys Ser
500 505 510
Asp Lys Pro Val Val Phe Val Ala Ala Met Arg Pro Ala Thr Ala Ile
515 520 525
Ser Ala Asp Gly Pro Met Asn Leu Leu Glu Ala Val Arg Val Ala Gly
530 535 540
Asp Lys Gln Ser Arg Gly Arg Gly Val Met Val Val Leu Asn Asp Arg
545 550 555 560
Ile Gly Ser Ala Arg Tyr Ile Thr Lys Thr Asn Ala Ser Thr Leu Asp
565 570 575
Thr Phe Lys Ala Asn Glu Glu Gly Tyr Leu Gly Val Ile Ile Gly Asn
580 585 590
Arg Ile Tyr Tyr Gln Asn Arg Ile Asp Lys Leu His Thr Thr Arg Ser
595 600 605
Val Phe Asp Val Arg Gly Leu Thr Ser Leu Pro Lys Val Asp Ile Leu
610 615 620
Tyr Gly Tyr Gln Asp Asp Pro Glu Tyr Leu Tyr Asp Ala Ala Ile Gln
625 630 635 640
His Gly Val Lys Gly Ile Val Tyr Ala Gly Met Gly Ala Gly Ser Val
645 650 655
Ser Val Arg Gly Ile Ala Gly Met Arg Lys Ala Met Glu Lys Gly Val
660 665 670
Val Val Ile Arg Ser Thr Arg Thr Gly Asn Gly Ile Val Pro Pro Asp
675 680 685
Glu Glu Leu Pro Gly Leu Val Ser Asp Ser Leu Asn Pro Ala His Ala
690 695 700
Arg Ile Leu Leu Met Leu Ala Leu Thr Arg Thr Ser Asp Pro Lys Val
705 710 715 720
Ile Gln Glu Tyr Phe His Thr Tyr
725
<210> 14
<211> 2317
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Гибридный белок аспарагиназа-PA(400)
<400> 14
tctagaaata attttgttta actttaagaa ggagatatac atatgttcaa attcaaaaaa 60
aacttcctgg tgggtctgag cgcagcactg atgagcatta gcctgtttag cgcaaccgca 120
agcgcagccg cgccagcggc cccggcccct gccgcgcccg ctgctcccgc ccctgctgcc 180
ccagccgccg ctcctgcggc acctgcgccc gccgcgccgg cagcgccggc accggcagct 240
ccggcggccg cgcctgcagc tcctgcaccg gcggctccag cagccccggc gccggccgca 300
cctgcggcgg cgcccgcggc gcctgcaccc gcagcgcctg cggcaccggc cccagcagcc 360
cctgccgccg caccggctgc gcctgcccca gcggcccccg ctgccccggc cccggcggct 420
ccagccgcag cgcctgccgc cccagcgccc gcagcaccgg cggcaccagc tccggcggcg 480
ccggcggcgg ctccggcagc tccggcccct gctgcgccgg ctgcgccggc tccggcggcc 540
cctgcggcgg ctccggccgc acctgcacct gccgcgccgg ctgctccggc cccggctgcc 600
ccagcagcgg caccagcagc gcctgctcct gcggcgcctg cagctccggc gccggcagcc 660
ccggccgccg cacccgcggc tccagccccc gccgctccag cagcccccgc gccagctgca 720
cctgctgccg ctcctgctgc ccctgctccc gctgcccccg ccgcccccgc cccagctgcc 780
cccgctgccg cacctgctgc cccagctccc gctgccccag ccgcgccggc ccccgcagct 840
ccagccgcgg caccagctgc cccagctcca gcggcgcctg ctgccccggc ccccgcggca 900
ccggctgccg cgcccgcagc tccagcgcct gctgcaccgg ctgctccggc acccgccgcg 960
ccagcagctg cccctgcggc accagctcct gctgcccccg cggcacctgc acccgctgcc 1020
ccggcggcag ctcccgccgc gccagcccct gcagctcctg ctgcacctgc tcctgccgcc 1080
cctgctgctg cccctgctgc tccagcccct gcagcaccgg ccgctccagc tcctgccgct 1140
cctgccgctg cgcccgctgc tccagcccca gctgcgccag cagctcctgc acctgctgcc 1200
cctgccgccg cccctgcggc tccagcacct gctgcaccgg ccgccccggc gcccgctgcc 1260
cccgcagcag ccccagccgc acccgctcca gcagctcccg cagccccagc acccgcagca 1320
ccagccgccg cagataaact gccgaatatt gttattctgg caaccggtgg caccattgca 1380
ggtagcgcag caaccggcac ccagaccacc ggttataaag ccggtgcact gggtgttgat 1440
accctgatta atgcagttcc ggaagttaaa aaactggcca atgttaaagg tgagcagttt 1500
agcaatatgg ccagcgaaaa tatgaccggt gatgttgttc tgaaactgag ccagcgtgtt 1560
aatgaactgc tggcacgtga tgatgttgat ggtgttgtta ttacccatgg caccgatacc 1620
gttgaagaaa gcgcatattt tctgcatctg accgtgaaaa gcgataaacc ggttgttttt 1680
gttgcagcaa tgcgtccggc aaccgccatt agcgcagatg gtccgatgaa tctgctggaa 1740
gcagttcgtg ttgccggtga taaacagagc cgtggtcgtg gtgttatggt tgtgctgaat 1800
gatcgtattg gtagcgcacg ttatattacc aaaaccaatg caagcaccct ggataccttt 1860
aaagcaaatg aagaaggtta tctgggcgtc attattggca atcgtatcta ttatcagaac 1920
cgcatcgaca aactgcatac cacccgtagc gtttttgatg ttcgtggtct gaccagcctg 1980
ccgaaagtgg atattctgta tggttatcag gatgatccgg aatatctgta tgatgcagca 2040
attcagcatg gtgtgaaagg tattgtttat gcaggtatgg gtgcgggtag cgttagcgtt 2100
cgtggtattg ccggtatgcg taaagcaatg gaaaaaggtg ttgttgtgat tcgtagcacc 2160
cgtaccggta atggtattgt tccgcctgat gaagaactgc ctggtctggt tagcgatagc 2220
ctgaatccgg cacatgcacg tattctgctg atgctggcac tgacccgtac cagcgatccg 2280
aaagttattc aagaatattt tcatacctat taagctt 2317
<210> 15
<211> 40
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептид PA(40)
<400> 15
Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala Pro
1 5 10 15
Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala
20 25 30
Ala Pro Ala Pro Ala Ala Pro Ala
35 40
<210> 16
<211> 22
<212> Белок
<213> Искусственная последовательность
<220>
<223> Модифицированный пептид PA(20)
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = Pga (пироглутаминовая кислота)
<220>
<221> ВАРИАНТ
<222> 22
<223> Xaa = Ahx (6-аминогексановая кислота)
<400> 16
Xaa Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala
1 5 10 15
Pro Ala Ala Pro Ala Xaa
20
<210> 17
<211> 42
<212> Белок
<213> Искусственная последовательность
<220>
<223> модифицированный пептид PA(40)
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = Pga (пироглутаминовая кислота)
<220>
<221> ВАРИАНТ
<222> 42
<223> Xaa = Ahx (6-аминогексановая кислота)
<400> 17
Xaa Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro Ala Ala Pro Ala
1 5 10 15
Pro Ala Ala Pro Ala Ala Ala Pro Ala Ala Pro Ala Pro Ala Ala Pro
20 25 30
Ala Ala Pro Ala Pro Ala Ala Pro Ala Xaa
35 40
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Связывающие молекулы, специфичные в отношении CD73, и пути их применения | 2015 |
|
RU2730665C2 |
| СУБЪЕДИНИЧНАЯ ВАКЦИНА ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2020 |
|
RU2811991C2 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2795973C1 |
| СПОСОБЫ ОБНАРУЖЕНИЯ ФОЛАТНОГО РЕЦЕПТОРА 1 В ОБРАЗЦЕ ПАЦИЕНТА | 2018 |
|
RU2759410C2 |
| ЭКСПРЕССИЯ ПОЛИПЕПТИДОВ НИТРОГЕНАЗЫ В РАСТИТЕЛЬНЫХ КЛЕТКАХ | 2018 |
|
RU2809244C2 |
| СЛИТЫЙ БЕЛОК НА ОСНОВЕ АНТИТЕЛА К ЕТА И TGF-β TRAP, СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2832190C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ВАРИАНТЫ ПЕПТИДОВ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2729161C2 |
| МОДИФИЦИРОВАННЫЙ БЕЛОК, СВЯЗЫВАЮЩИЙ ФАКТОР Н | 2017 |
|
RU2773464C1 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2788949C1 |
| БЕЛКИ НА ОСНОВЕ АНТИТЕЛА С ПРИВИТЫМ ЦИТОКИНОМ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ПРИ ИММУННЫХ НАРУШЕНИЯХ | 2018 |
|
RU2786730C2 |
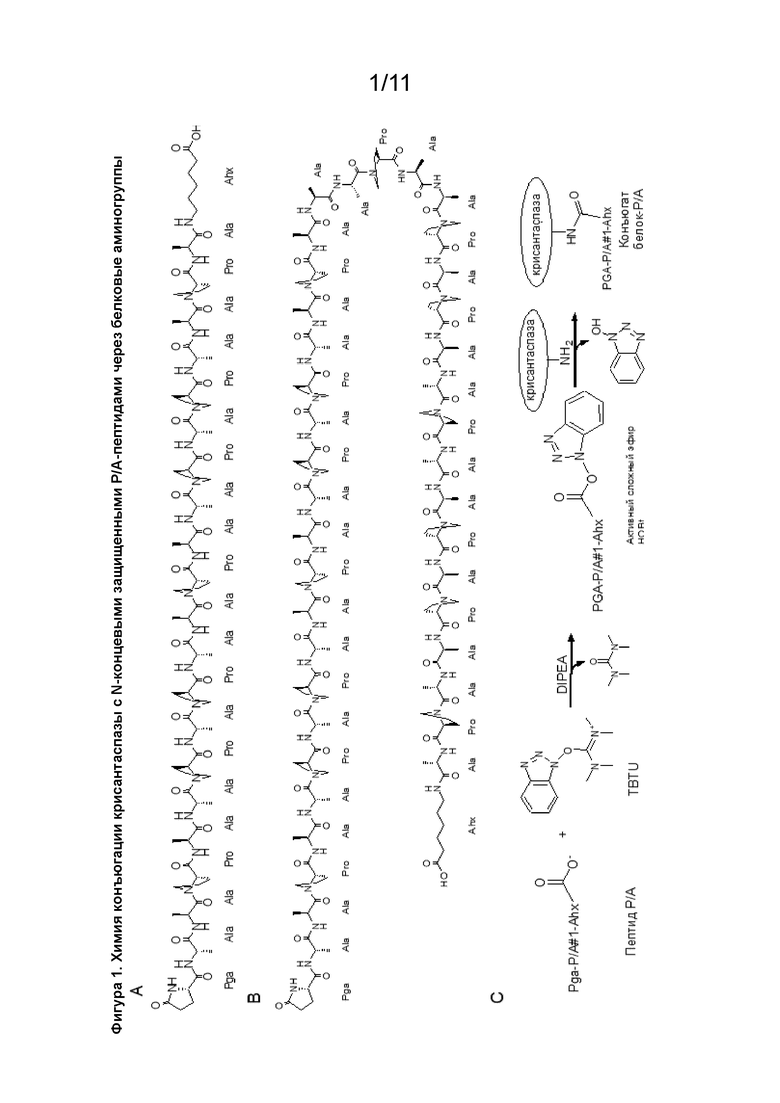
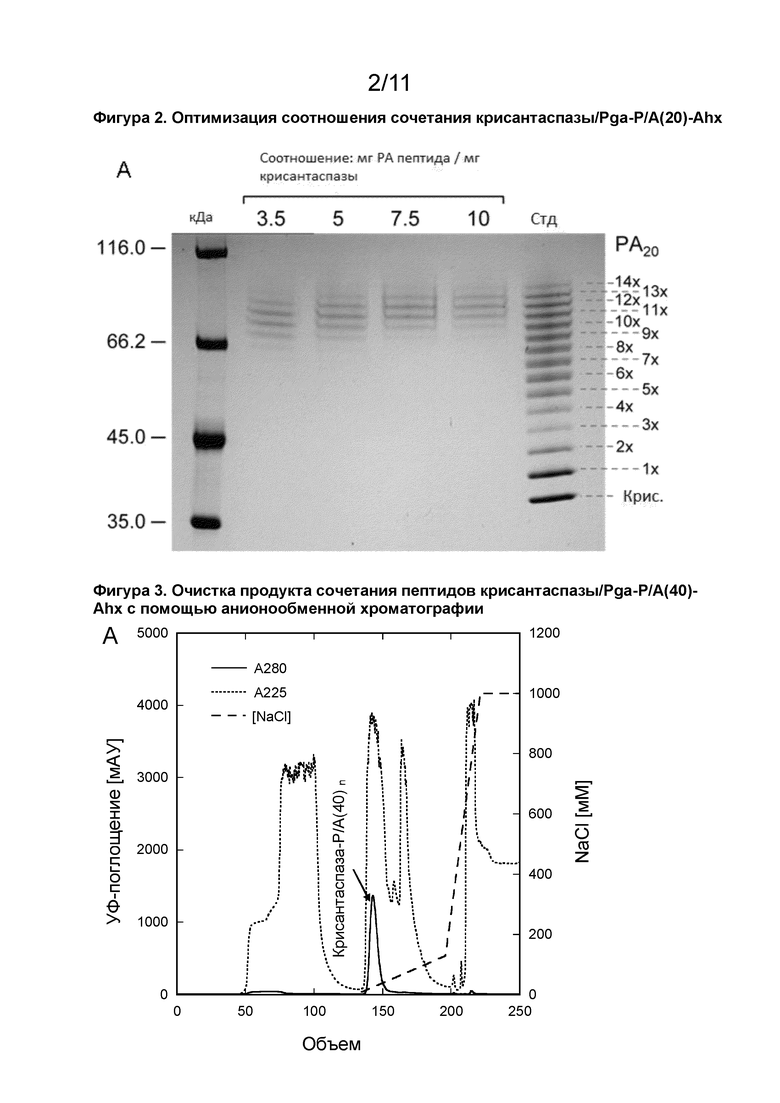
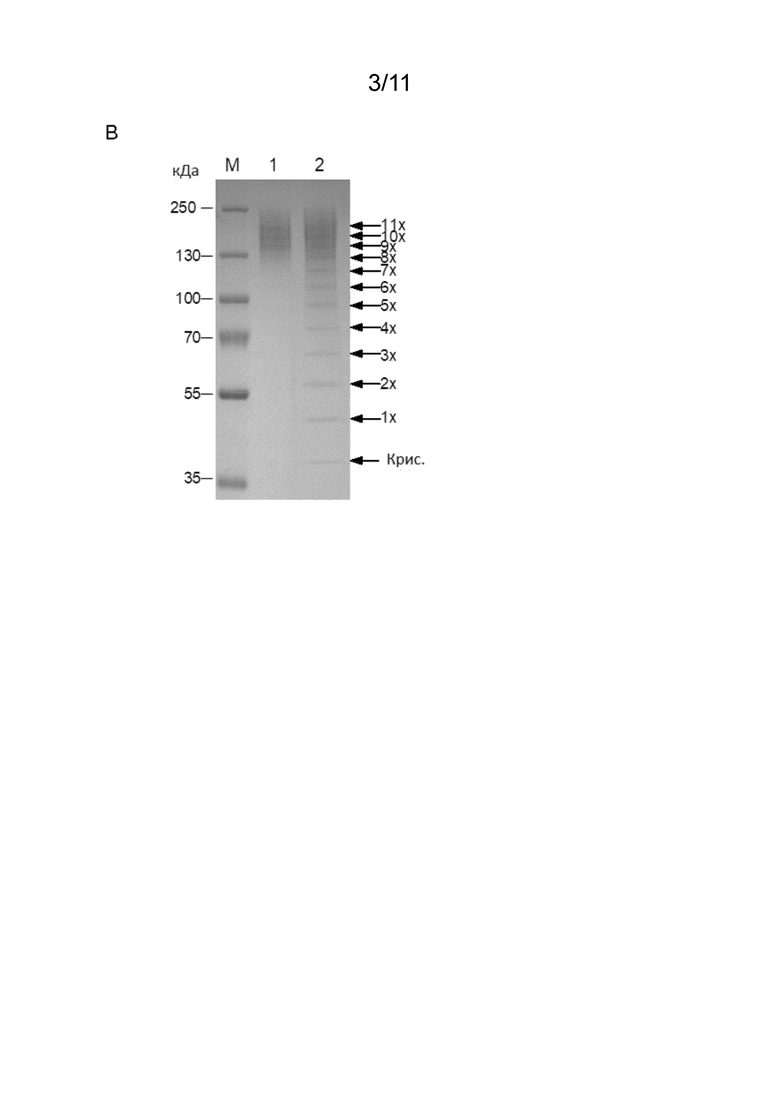
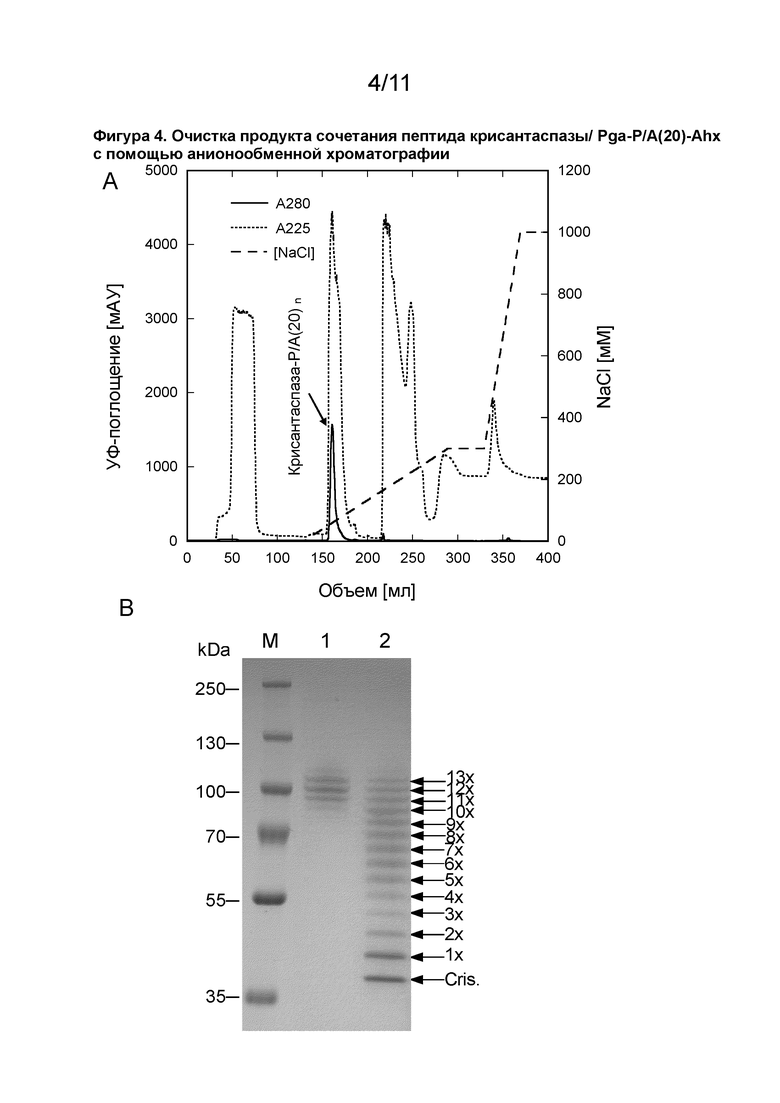
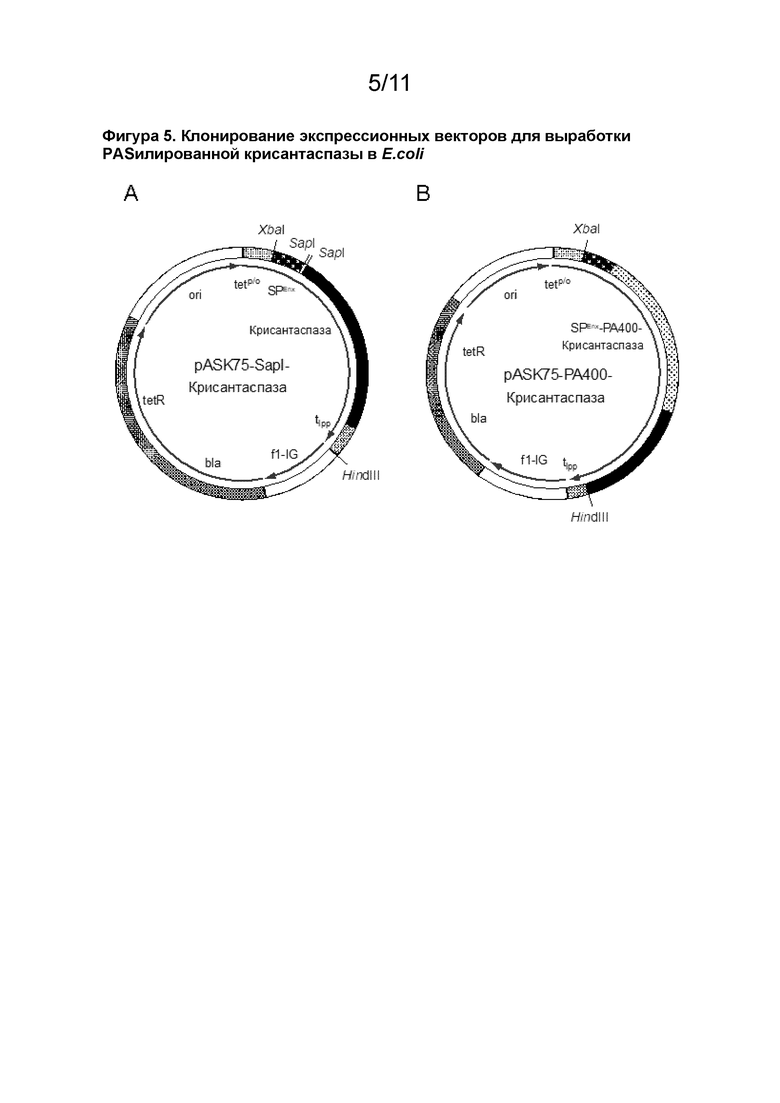
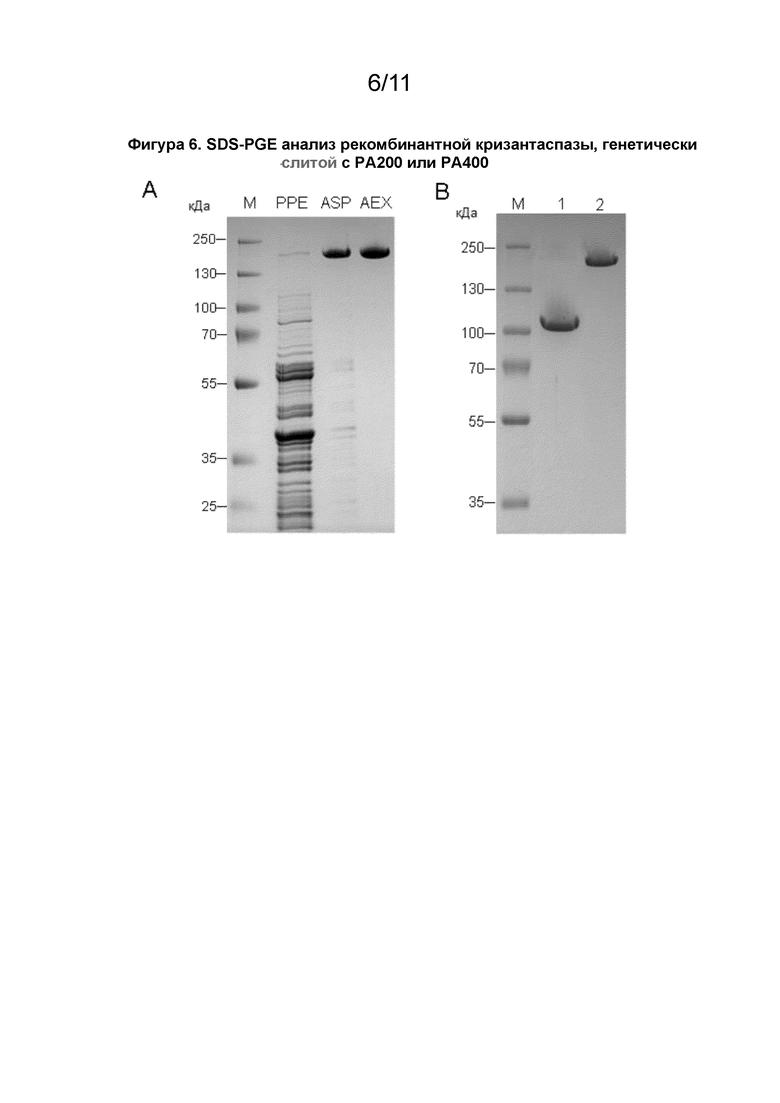
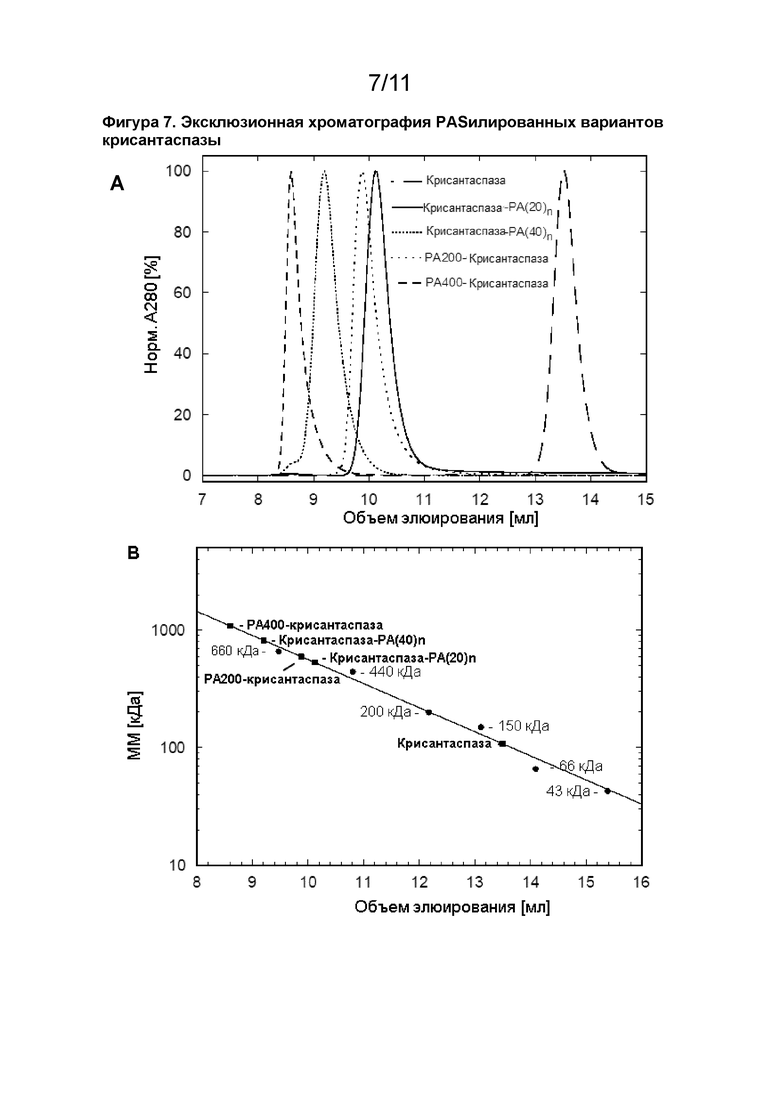
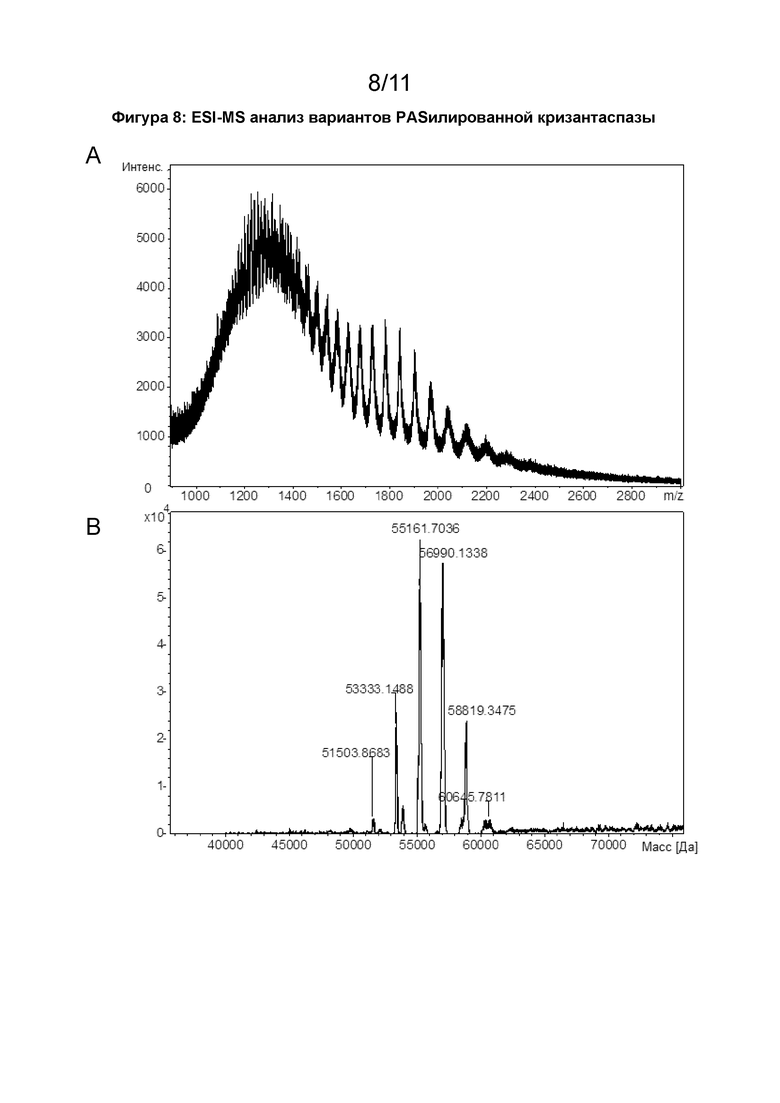
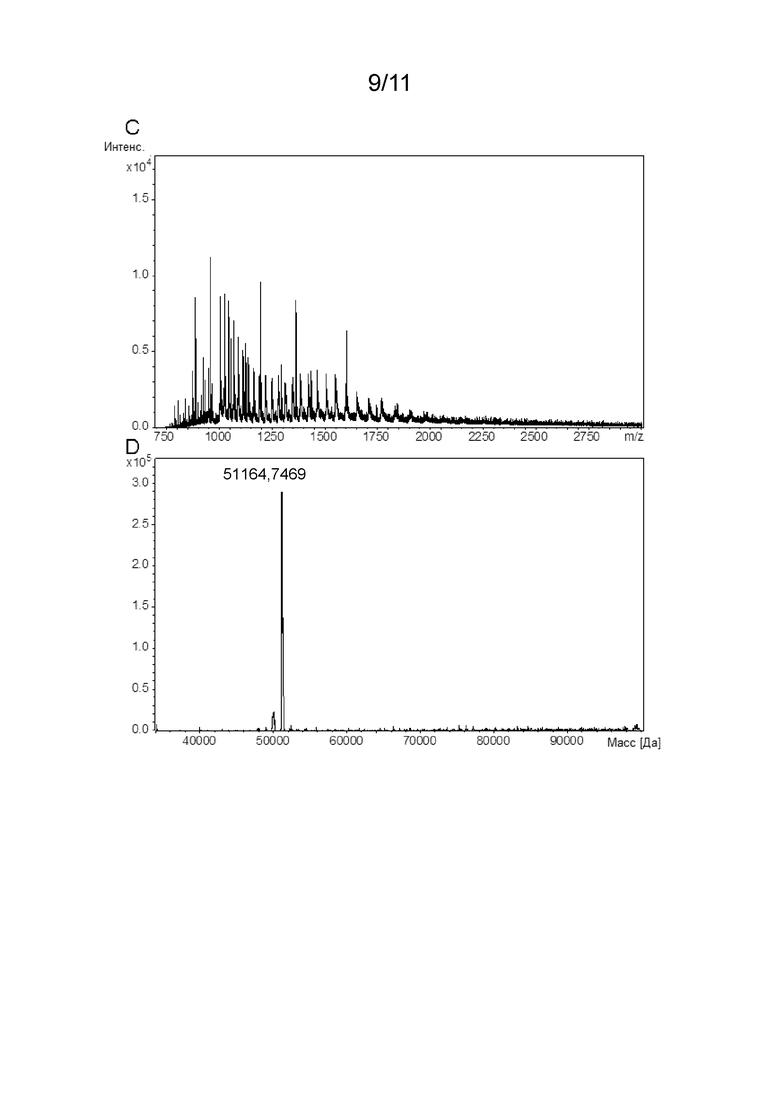
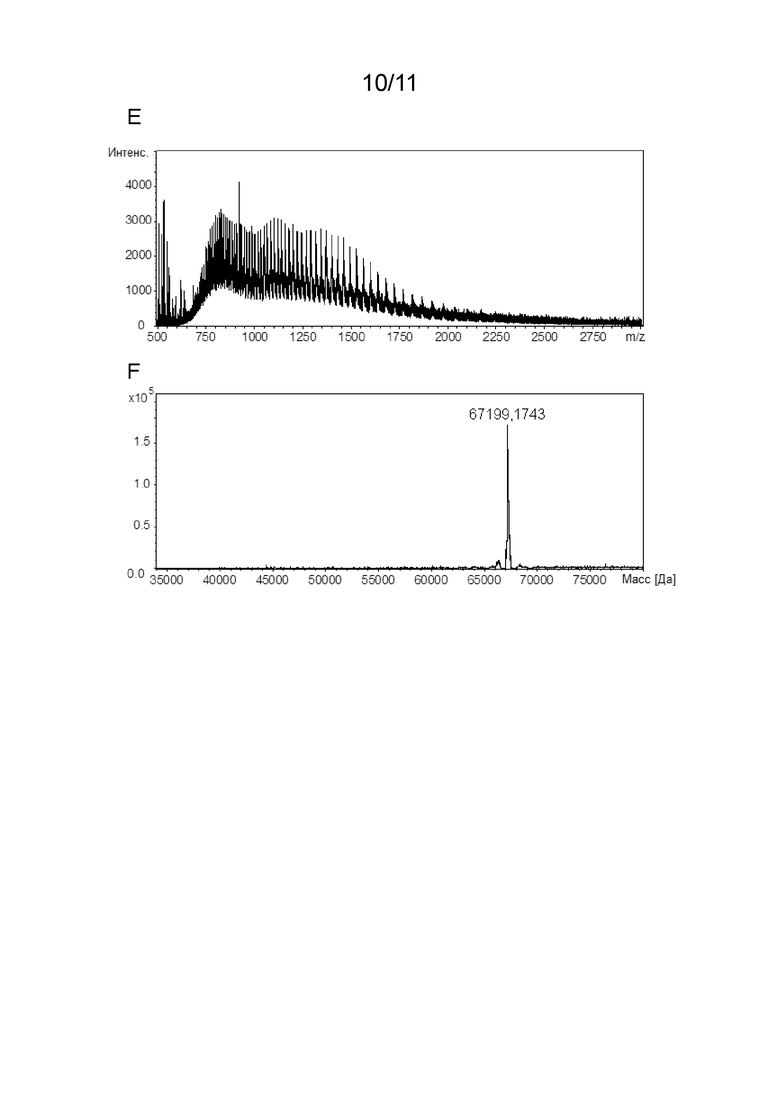
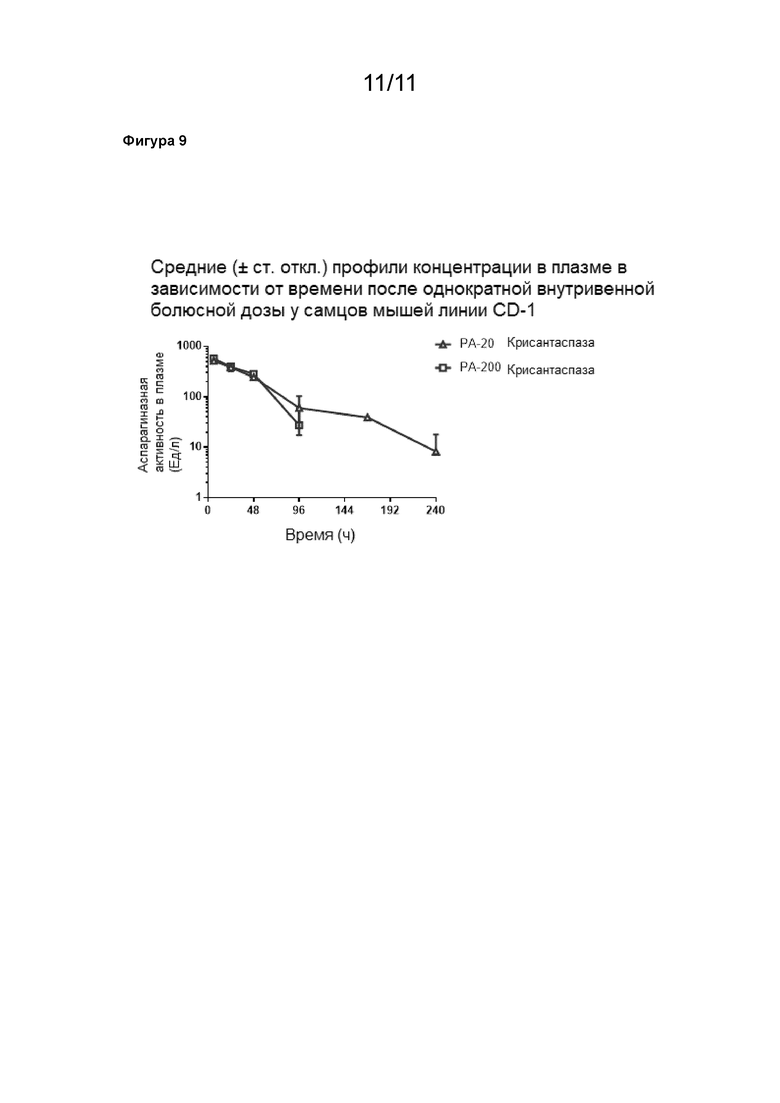
Изобретение относится к биотехнологии и представляет собой модифицированный белок для лечения заболевания, поддающегося лечению истощением аспарагина, где указанный модифицированный белок представляет собой тетрамер, и каждый мономер указанного тетрамера содержит: (i) L-аспарагиназу, имеющую по меньшей мере 95% идентичности аминокислотной последовательности SEQ ID NO: 1, и (ii) один или более (поли)пептидов, где (поли)пептид состоит из 20-600 аминокислотных остатков пролина и аланина. Изобретение позволяет эффективно лечить заболевания, поддающиеся лечению истощением аспарагина. 17 з.п. ф-лы, 9 ил., 5 табл., 9 пр.
1. Модифицированный белок для лечения заболевания, поддающегося лечению истощением аспарагина, где указанный модифицированный белок представляет собой тетрамер, и каждый мономер указанного тетрамера содержит: (i) L-аспарагиназу, имеющую по меньшей мере 95% идентичности аминокислотной последовательности SEQ ID NO: 1, и (ii) один или более (поли)пептидов, где (поли)пептид состоит из 20-600 аминокислотных остатков пролина и аланина.
2. Модифицированный белок по п.1, где субъединица L-аспарагиназы имеет аминокислотную последовательность, содержащую SEQ ID NO: 1.
3. Модифицированный белок по п.1, где субъединица L-аспарагиназы имеет аминокислотную последовательность, состоящую из SEQ ID NO: 1.
4. Модифицированный белок по п.3, где полипептид состоит из 100-600 аминокислотных остатков пролина и аланина.
5. Модифицированный белок по п.3, где аминокислотные остатки пролина составляют более 10% и менее 70% полипептида.
6. Модифицированный белок по п.3, где полипептид имеет аминокислотную последовательность, содержащую SEQ ID NO: 5.
7. Модифицированный белок по п.3, где полипептид имеет аминокислотную последовательность, содержащую SEQ ID NO: 7.
8. Модифицированный белок по п.3, где полипептид имеет аминокислотную последовательность, содержащую SEQ ID NO: 9.
9. Модифицированный белок по п.3, где мономер имеет аминокислотную последовательность, содержащую SEQ ID NO: 11.
10. Модифицированный белок по п.3, где мономер имеет аминокислотную последовательность, содержащую SEQ ID NO: 13.
11. Модифицированный белок по п.1, где заболевание, поддающееся лечению истощением аспарагина, представляет собой рак.
12. Модифицированный белок по п.11, где рак представляет собой лейкоз или неходжкинскую лимфому.
13. Модифицированный белок по п.1, где полипептид слит на N-конце субъединицы L-аспарагиназы.
14. Модифицированный белок по п.1, где рак представляет собой рак поджелудочной железы.
15. Модифицированный белок по п.4, где не более 6 последовательных аминокислотных остатков в полипептиде идентичны.
16. Модифицированный белок по п.12, где рак представляет собой лейкоз.
17. Модифицированный белок по п.16, где лейкоз представляет собой острый лимфобластный лейкоз (ОЛЛ).
18. Модифицированный белок по п.16, где лейкоз представляет собой острый миелоидный лейкоз (ОМЛ).
| WO 2011003633 A1, 13.01.2011 | |||
| WO 2011144756 A1, 24.11.2011 | |||
| СПОСОБ ПОЛУЧЕНИЯ СУБСТАНЦИИ РЕКОМБИНАНТНОЙ L-АСПАРАГИНАЗЫ ERWINIA CAROTOVORA | 2010 |
|
RU2441914C1 |
Авторы
Даты
2022-07-06—Публикация
2018-06-21—Подача