Область техники, к которой относится изобретение
Настоящее изобретение относится к способу разложения фосфогипса (ФГ), являющегося побочным продуктом производства фосфорной кислоты, до оксида кальция и диоксида серы.
Предшествующий уровень техники
Фосфогипс CaSO4⋅2H2O представляет собой побочный продукт производства фосфорной кислоты мокрым способом (который является наиболее распространенным способом):
Ca5(PO4)3F + 5H2SO4 + 10H2O → 3H3PO4 + 5CaSO4⋅2H2O + HF (1)
После этого сульфат кальция отделяют от фосфорной кислоты фильтрованием.
Из уравнения реакции (1) видно, что на 3 моля полученной фосфорной кислоты образуется 5 моль побочного продукта (ФГ), то есть для производства больших количеств фосфорной кислоты придется утилизировать в окружающую среду тонны ФГ.
Однако ФГ содержит серу, которая необходима для получения диоксида серы, используемого при производстве серной кислоты. Следует отметить, что в 2008 г. стоимость серы возросла от 35 долларов США за тонну до 840 долларов США за тонну.
Кроме того, цементным заводам необходим CаО, который обычно получают разложением CaCO3 при очень высокой температуре. В данном способе расходуется большое количество энергии в результате масштабных выбросов СО2, вследствие чего цементные заводы были бы весьма заинтересованы в покупке второго продукта разложения ФГ, т.е. СаО.
Разложение CaSO4 на воздухе обычно протекает преимущественно при высокой температуре, примерно при 1400°C, что является весьма высокозатратным, согласно следующему уравнению реакции:
CaSO4 → CaO +SO2 + 1/2 O2…T=1560°C (2)
Однако его разложение можно провести в восстановительной атмосфере, например, в атмосфере СО, при более низкой температуре (cм. документ [1]):
CaSO4 + СО → CaO +SO2 + СO2…T=1100°C (3)
Данный способ также потребляет значительные количества энергии, приводя к образованию другого нежелательного побочного продукта (сульфида кальция CaS) в восстановительной атмосфере:
CaSO4 + 4СО → CaS + СO2…T=1100°C (4)
Однако известен способ разложения ФГ действием чистого СО (см. [1, 2]) или при помощи твердофазных реакций С-ФГ (см. документ [3]). Значительное энергозатраты все еще являются препятствием, делающим данный способ экономически нереализуемым.
В последующем описании разложение фосфогипса ФГ относится, в частности, к разложению CaSO4.
Раскрытие изобретения
Цель настоящего изобретения заключается в создании экологически безопасного способа, при использовании которого разложение фосфогипса протекает с высокой конверсией ФГ, приводя к образованию CaO и SO2 при низком выходе CaS и, в то же время, обеспечивает достаточное количество энергии для протекания реакции.
Соответственно, изобретение относится к способу разложения сульфата кальция (CaSO4), присутствующего в фосфогипсе (ФГ), включающему следующие стадии:
а) обеспечение наличия реактора, содержащего фосфогипс (ФГ) и твердый источник углерода (С),
b) введение потока кислорода (O2) во взаимодействие с источником углерода (C) для получения оксида углерода (CO),
c) введение во взаимодействие оксида углерода (CO), полученного на стадии а), с сульфатом кальция (CaSO4) из фосфогипса с получением оксида кальция (CaO) и диоксида серы (SO2) согласно следующему уравнению:
CaSO4 + CO → CaO + SO2 + CO2
где массовое отношение С/ФГ составляет от 0,2 до 0,4, а массовое отношение O2/ФГ составляет от 0,5 до 1,5.
Согласно другим необязательным признакам данного способа:
- массовое отношение C/ФГ составляет от 0,15 до 0,45, предпочтительно, приблизительно равно 0,3;
- массовое отношение O2/ФГ составляет от 0,2 до 1, предпочтительно, приблизительно равно 1;
- массовое отношение O2/C составляет от 1 до 3, предпочтительно, приблизительно равно 2;
- стадии b) и c) предпочтительно осуществляют в реакторе с псевдоожиженным слоем;
- стадия b) состоит во введении кислорода (O2) в реактор с псевдоожиженным слоем таким образом, чтобы поток кислорода (O2) контактировал с массой фосфогипса и источника углерода в указанном реакторе с псевдоожиженным слоем;
- стадию c) осуществляют при температуре 1100°C или ниже;
- конверсия сульфата кальция (CaSO4) составляет 80% или больше, предпочтительно 85% или больше, тогда как выход побочного продукта (CaS) составляет 20% или меньше, предпочтительно 15% или меньше.
Краткое описание чертежей
Следующие признаки и преимущества изобретения будут очевидны из последующего подробного описания, основанного на прилагаемых чертежах, в которых:
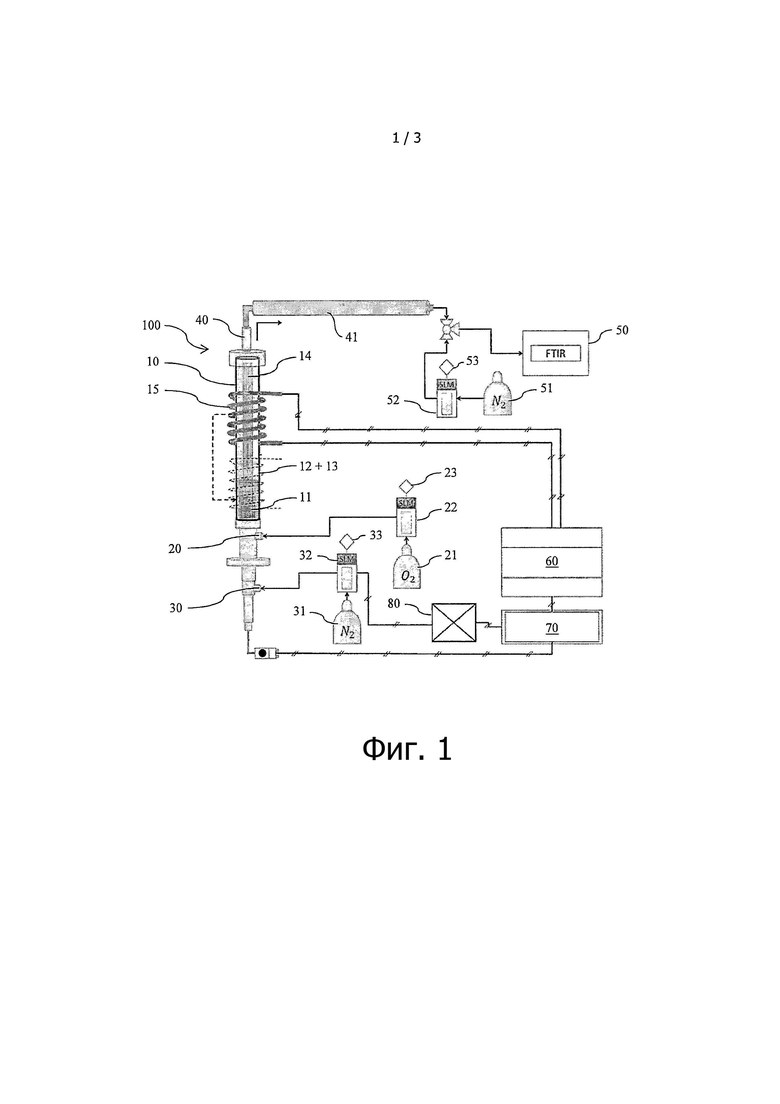
на фиг. 1 представлена схема реактора с псевдоожиженным слоем и индукционным нагревом для проведения экспериментов по разложения гипса при помощи окисления углерода;
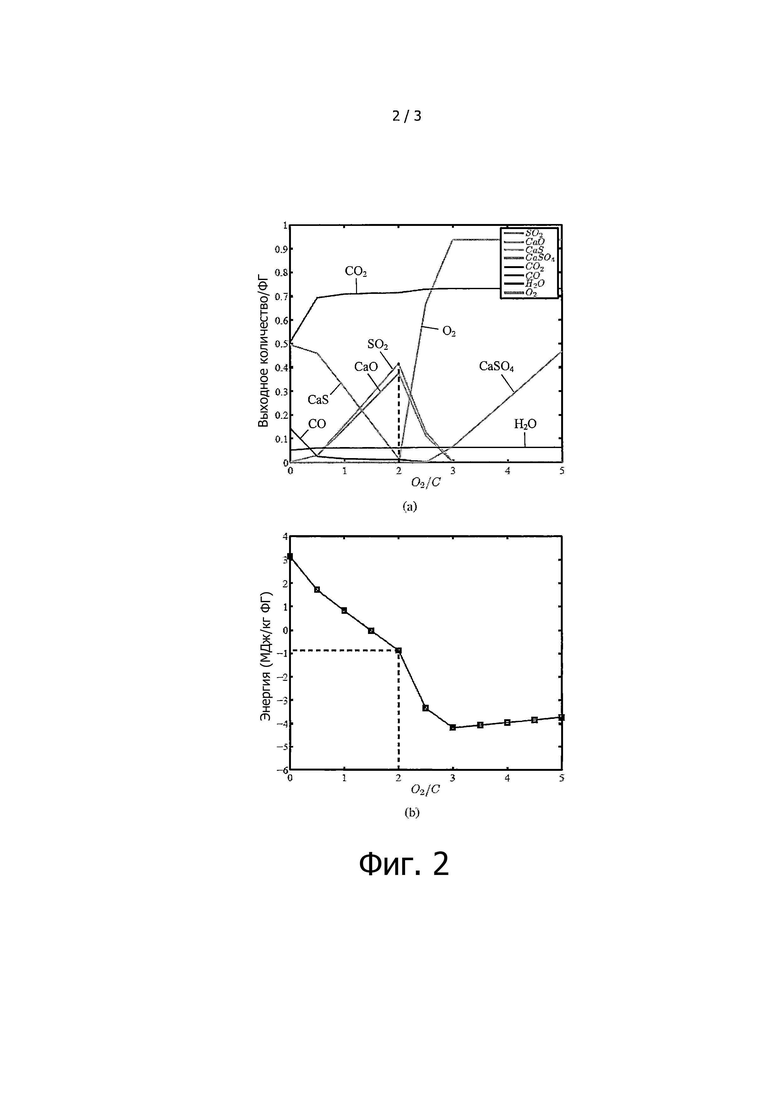
на фиг. 2 приведены результаты моделирования процесса разложения ФГ при помощи окисления углерода (C/ФГ ≈ 0,2) at 1100°C с использованием FactSage™: (a) выходные количества, масштабированные относительно ввода ФГ - вертикальная пунктирная линия соответствует отношению O2/C ≈ 2, где SO2 и CaO имеют максимальные значения; (b) ΔH - вертикальная пунктирная линия аналогична (a) и соответствует отношению O2/C ≈ 2, а горизонтальная пунктирная линия представляет потребность ФГ в энергии ΔH ≈ -0.87 МДж/кг для исчерпывающего разложения ФГ до SO2 и CaO при отношении O2/C ≈ 2;
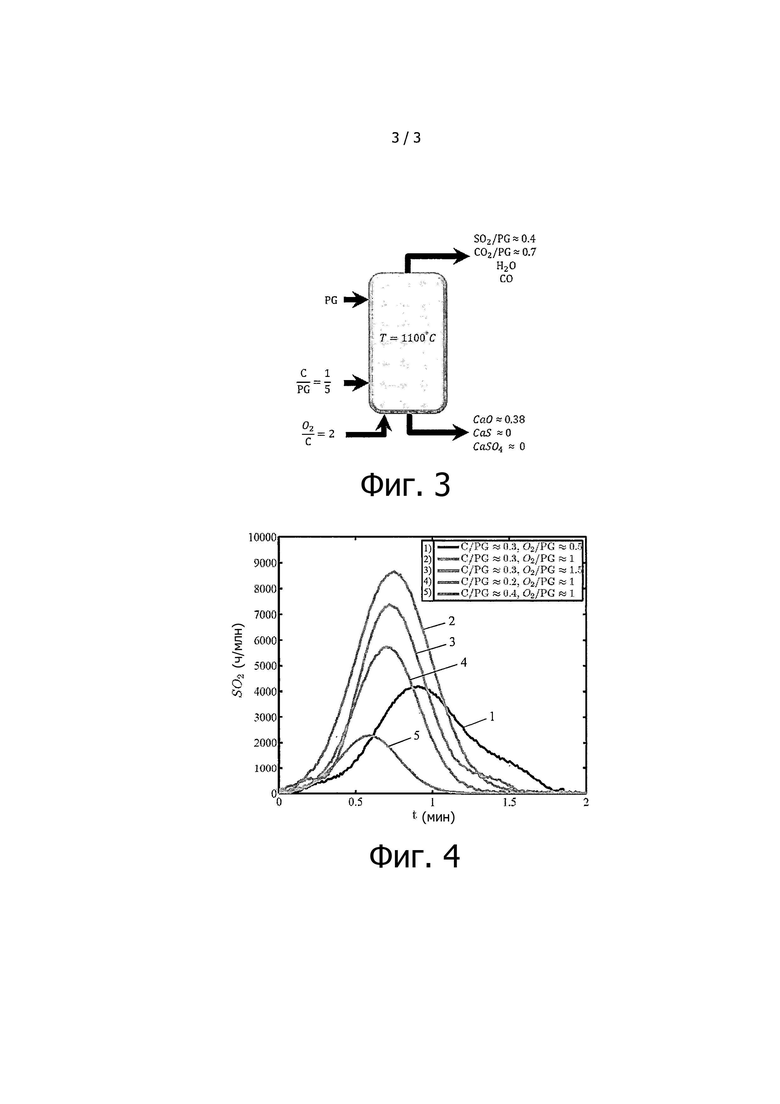
на фиг. 3 представлен вариант осуществления данного способа для разложения ФГ и обработки выходящего твердого вещества путем окисления углерода, полученный в результате ≈500 циклов моделирования с использованием метода FactSage™ (все отношения являются массовыми);
на фиг. 4 показано получение SO2 в результате разложения ФГ путем окисления углерода в реакторе с псевдоожиженным слоем и индукционным нагревом при температуре 1100°C при общем количестве образца 6 г при различных отношениях C/ФГ и O2/ФГ.
Осуществление изобретения
Для разложения ФГ до CaO и SO2 предлагаемый способ включает объединение ФГ с углеродом (например, каменным углем, коксом, древесным углем или любым другим источником углерода) при одновременном введении кислорода в реактор с псевдоожиженным слоем для окисления углерода (O2 используют в стехиометрическом количестве). Предпочтительно, поток кислорода O2 контактирует с массой фосфогипса и твердого источника углерода С.
Процесс окисления не только приводит к получению требуемого количества СО для разложения гипса при 1100°C, но и обеспечивает необходимое количество энергии.
Однако количество образовавшегося СО существенно зависит от отношения O2/C.
В результате было найдено, что значение отношения O2/C является крайне важным для получения оптимального количества необходимого СО.
С другой стороны, для разложения всего объема ФГ отношение С/ФГ нужно увеличить, чтобы теплообразование соответствовало количеству энергии, необходимому для процесса разложения.
Авторами изобретения найдены отношения O2/C и C/ФГ, соответствующие наиболее эффективному разложению ФГ до CaO и SO2 при образовании, в то же время, минимального количества CaS. Однако образовавшийся CaS также можно превратить либо в обычные продукты (CaO и SO2), либо в CaSO4, подвергающийся стандартному разложению до CaO и SO2.
Разложение сульфида кальция можно осуществить в окислительной среде при 1100°C, как описано уравнениями реакций (5) и (6):
CaS + 1,5O2 → CaO + SO2 (5)
CaS + 2O2 → CaSO4 (6)
Образовавшийся CaSO4 затем подвергнется процессу разложения за счет восстановления СО. Поэтому в условиях предложенного способа могут одновременно протекать как окислительные, так и восстановительные реакции, без каких-либо требований к проведению двух различных окислительно-восстановительных стадий, предложенных в документе [4].
Углерод в качестве источника энергии в условиях окисления участвует в двух следующих реакциях:
С +0,5О2 → СО (9)
С +О2 → СО2 (10)
которые являются экзотермическими.
Сульфид кальция непосредственно не взаимодействует с углеродом. Однако CaS можно превратить в CaO и SO2 по реакции
CaS + 3CO2 → CaO + SO2 + 3СО (11)
Из продуктов реакции (11) CaO и CO не взаимодействуют с CaS, тогда как SO2 способен реагировать с CaS с образованием CaSO4:
CaS + 2SO2 → CaSO4 + 2S (12)
После этого между CaS и CaSO4 могут происходить различные взаимодействия, приводящие в результате к желательным твердым и газообразными продуктам:
3 CaSO4 + CaS → 4 СаО + 4 SO2 (13)
CaSO4 + 3 CaS → 4 СаО + 4 S (14)
CaS + 3 CaSO4 + 4 СO2 → 4 СаСO3 + 4 SO2 (15)
CaS + 3 SO3 → СаO + 4 SO2 (16)
При достаточном количестве углерода и регулируемых объемах кислорода, углерод способен привести к выработке необходимого количества энергии и в то же время необходимого объема СО для инициирования процесса разложения CaSО4. Поэтому в непрерывных потоках CaSО4 и углерода при введении кислорода все реакции протекают за счет теплоты, образующейся при сгорании углерода.
Далее настоящее изобретение объяснено более подробно при помощи неограничивающих примеров и вариантов осуществления.
Фосфогипс (диаметр частиц 20<dρ<60 мкм, плотность ≈2,3 г/см3) предоставлен компанией OCP CO., Марокко, и был проанализирован тремя методами: методом NAA (нейтронно-активационного анализа) и рентгеновской фотоэлектронной спектроскопии (РФЭС), результаты которых представлены далее в таблицах (5), (6) и (7) соответственно.
Каменный уголь (диаметр частиц 20<dρ<60 мкм, в качестве источника углерода) предоставлен компанией Recommunity Inc., Канада, и имеет теплоту сгорания 28280 кДж/кг и охарактеризован данными CHNS-элементного анализа (определение массовых долей углерода (С), водорода (Н), азота (N) и серы (S)) и NAA (нейтронно-активационного анализа), которые представлены в таблицах (8) и (9) соответственно.
Эксперименты по разложению фосфогипса и CaS при помощи окисления углерода проводили в новом реакторе с псевдоожиженным слоем и индукционным нагревом, который способен выдерживать нагревание до 1100°С при скорости 200°C/с. Схема устройства 100 для проведения реакции, включающая данный реактор 10, показана на фиг. 1.
Реактор 10 включает в себя ввод 20 газа, через который кислород О2 (реагирующий газ) подают в реактор. Источник кислорода 21, который связан с цифровым регулятором 22 расхода, питаемым источником 23 питания, позволяет регулировать поток кислорода О2, вводимый в реактор 10.
Аналогичным образом, реактор 10 включает в себя ввод 30 газа, через который азот N2 (газ-носитель) подают в реактор. Источник азота 31, который связан с цифровым регулятором 32 расхода, питаемым источником 33 питания, позволяет регулировать поток азота, вводимый в реактор 10.
Указанные газы покидают реактор через выходное отверстие 40, снабженное термо- и/или электроизоляцией 41.
Анализатор 50, такой как ИК-Фурье спектрометр (инфракрасная спектроскопия с Фурье-преобразованием) можно использовать для анализа газов, выходящих из реактора, для сбора данных, на основании которых получают, например, инфракрасные спектры, спектры испускания или спектры поглощения. Для этой цели предусмотрен источник азота 51, который связан с цифровым регулятором 52 расхода, питаемым источником 53 питания.
Реактор 10 состоит из трубы, предпочтительной изготовленной из алюминия, в которую перед проведением реакции помещают песок 11, фосфогипс 12 и уголь 13. Внутри реактора 10 вертикальные стержни 14 из нержавеющей стали прикреплены к пластине. Металлическая спираль 15, предпочтительно, медная спираль, обмотана вокруг трубы реактора 10 и к ней подают энергию при помощи источника 60 питания для индукционного нагрева. Температуру реактора регулируют при помощи регулятора 70 температуры. Устройство 100 для проведения реакции предпочтительно снабжено системой сбора данных 80 (DAS или DAQ) для отбора сигналов различных экспериментальных параметров и их преобразования в значения, подходящие для компьютерной обработки.
Потоки азота N2 и кислорода O2 с заранее определенными скоростями приводят в псевдоожиженное состояние материал, находящийся внутри трубы, таким образом, чтобы он обеспечивал минимальные условия псевдоожижения, что достигается за счет синхронизации скоростей потока и температуры внутри реактора 10, которую измеряют при помощи термопар. Однако отношение азота N2 и кислорода O2 поддерживают постоянным при помощи цифрового регулятора 22 потока.
Протекание электрического тока (изменяющего свое направление с очень высокой частотой) в металлической спирали 15 приводит к возникновению магнитного поля, так что направление указанного магнитного поля также изменяется с очень высокой частотой. Стержни 14 из нержавеющей стали являются проводниками, в которых электрический ток индуцируется магнитным полем. Вследствие этого за счет эффекта Джоуля внутри трубы реактора 10, окруженной металлической спиралью 15, выделяется теплота.
Пример 1. Оптимальное отношение углерода и O2 для разложения ФГ до SO2 и CaO
При сгорании углерода образуется CO, вступающий во взаимодействие с ФГ при температуре 1100°С согласно уравнению реакции:
CaSO4 + СО → CaO +SO2 + СO2…T=1100°C (3)
Однако при 1100°С протекают также следующие нежелательные реакции, что свидетельствует о необходимости оптимизировать концентрацию СО:
CaSO4 + 4СО → CaS + СO2…T=1100°C (4)
Разложение фосфогипса в атмосфере СО имеет заметные преимущества, заключающиеся в снижении рабочей температуры от 1560 до 1100°C и, таким образом, уменьшении энергозатрат для поддержания реактора при данной температуре.
Однако поддержание температуры реактора при 1100°C требует большого количества энергии, что делает этот способ экономически нецелесообразным.
Как правило, СО можно получить из различных источников, таких как паровой риформинг (из природного газа) или окислением угля/биомассы. В последнем случае окисление угля продуванием O2 (в количестве ниже стехиометрического) в реактор, в котором находятся и ФГ, и гипс, может привести к получению СО, СО2 и Н2О, где количество полученного СО можно регулировать за счет подаваемого в реактор количества О2. С другой стороны, газификация угля способна дать огромное количество энергии, обеспечивая, таким образом, необходимую теплоту для разложения ФГ в атмосфере СО. Однако для получения достаточного количества СО требуется оптимальное количество O2, в противном случае разложение ФГ в атмосфере СО приведет к получению CaS вместо SO2 и CaO согласно уравнению реакции (4).
Чтобы определить оптимальные количества углерода и O2, необходимые для разложения ФГ до SO2 и CaO, нужно учитывать два лимитирующих фактора: (i) количества SO2 и CaO должны быть максимизированы, и (ii) ΔН<0. При ΔН<0 энергия, выделяющаяся в результате окисления углерода и экзотермических реакций, уравновешивается энергетическими требованиями эндотермической реакции и, таким образом, в этой точке стационарного состояния для поддержания процесса разложения при 1100°C не требуется энергии. Данную оптимизацию проводят в два этапа: (i) определение отношения C/ФГ для максимизации количеств SO2 и CaO в выходящем потоке, и (ii) определение необходимого количества O2 для достижения ΔН<0.
На фиг. 2 и 3 обобщены результаты, полученные при использовании программы FactSage в условиях равновесия для определения оптимальных количеств углерода C и O2, необходимых для обеспечения достаточного количества СО и теплоты за счет окисления углерода. На основании полученных данных были определены отношения O2/C ≈ 2 и C/PG ≈ 0,2.
Для обеспечения необходимых количеств углерода и O2, были выбраны отношения C/ФГ ≈ 0,2, 0,3 и 0,4, чтобы оптимизировать получение SO2 и CaO, тогда как отношение O2/ФГ изменяли от 0,5 до 1 и 1,5. Начальные условия экспериментов в псевдоожиженном слое представлены в таблице 1. В ходе следующих двух стадий отношения C/ФГ и O2/ФГ оптимизировали для максимизации получения SO2 и CaO. Следует отметить, что во всех экспериментах в качестве источника углерода использовали каменный уголь.
Следует отметить, что при моделировании в расчетах учитывали только содержание углерода в каменном угле.
Анализ оставшегося в результате процесса разложения твердого вещества проводили методом РФЭС и полученные результаты представлены в таблице 2. Молярные доли компонентов из результатов анализа методом РФЭС приведены также в таблицах 3 и 4.
Для объяснения результатов эксперимента нужно рассмотреть три серии реакций:
1 - C-ФГ (твердая фаза-твердая фаза)
2CaSO4 + C → 2CaO + 2SO2 + CO2 (17)
CaSO4 + 4C → CaS + 4CO (18)
2 -C-O2 (твердая фаза-газ)
С + 0,5О2 → СО (19)
С + СО2 → 2СО (20)
С + О2 → СО2 (21)
3 - ФГ-СО (твердая фаза-газ)
CaSO4 + CО → CaO + SO2 + CO2 (3)
CaSO4 + 4CО → CaS + CO2 (4)
Значение отношения C/ФГ изменяется при постоянном отношении O2/ФГ (≈1) (таблица 3): При C/PG ≈ 0,2, отношение О2/ФГ ≈ 1 приводит к получению СО (реакция (20), а не реакция (19)) в количестве, которое меньше оптимального необходимого значения, поскольку оптимальное отношение О2/ФГ (≈ 1) достигается только при С/ФГ ≈ 0,3. Поэтому преобладает реакция (17) и выход СаО был бы больше, чем выход CaS, однако конверсия ФГ неполная из-за недостаточной выработки СО. Кроме того, CaS образуется в результате реакций (17) и (18). Следует отметить, что отношение С/ФГ ≈ 0,2 достаточно велико для того, чтобы реакция (18) преобладала над реакцией (17). Однако в результате по реакции (4) CaS не образуется в достаточном количестве, он образуется по реакции (18).
При C/ФГ ≈ 0,3 отношение О2/ФГ ≈ 1 обеспечивает количество О2, достаточное для оптимального получения СО по реакциям C-O2. Поэтому реакция (21) преобладает по сравнению с реакцией (22), и приводит к преимущественному образованию CaO. Однако по реакции (21) CaS не образуется в большом количестве, он образуется в результате реакции (18), поскольку отношение C/ФГ ≈ 0,3 обеспечивает достаточное количество углерода для содействия реакции (18). В итоге при C/ФГ ≈ 0,3 CaS образуется в большем количестве, чем при C/ФГ. Поскольку для обоих условий преобладающей является реакция (3), а не (4), в большем количестве CaS образуется по реакции (18) благодаря более высокому содержанию углерода. Следует отметить, что CaS также образуется в небольшом количестве по реакции (4) в обоих условиях, при этом количество больше при отношении C/ФГ ≈ 0,3, поскольку О2/ФГ ≈ 1, тогда как образование CaS крайне чувствительно к оптимальному отношению О2/ФГ, то есть небольшие отклонения от данного отношения повлияют на выход CaS. Поэтому при С/ФГ ≈ 0,2 отношение О2/ФГ ≈ 1 приводит к получению СО в количестве, которое выходит за пределы данного критического значения.
Наконец, при C/ФГ ≈ 0,4 отношение О2/ФГ ≈ 1 СО образуется в количестве больше оптимального по реакции (19), что приводит к получению CaS по преобладающей реакции (4). Однако CaS также образуется в значительном количестве по реакции (18) благодаря очень высокому содержанию углерода.
Отношение О2/ФГ изменяется при постоянном отношении C/ФГ ≈ 0,3 (таблица (4)): Предполагают, что при C/PG ≈ 0,3, в результате твердофазных реакций CaS образуется в таком же объеме. При О2/ФГ ≈ 0,5, 1 и 1,5 СО получают в высоком, оптимальном и малом количестве, для оптимизации производства СаО, не допуская при этом образования CaS. Поэтому при О2/ФГ ≈ 1,5 CaS присутствует в твердом продукте в ничтожно малом количестве, тогда как отношение О2/ФГ ≈ 0,5 приводит к максимальному образованию CaS по уравнению (4).
Количество CaS в ряде экспериментов является минимальным либо при большом отношении О2/ФГ, либо при малом отношении С/ФГ, потому что в таких условиях удается в достаточной степени избежать протекания реакций (18) и (4). С другой стороны, такая минимизация сопровождается более низкой конверсией ФГ. Таким образом, для получения максимальной конверсии ФГ и высокого выхода СаО, авторы пришли к отношению C/PG ≈ 0,3 при О2/ФГ ≈ 1. Следует отметить, что в данных условиях выход CaS все еще значителен. Поэтому необходим отдельный способ для удаления CaS.
Закономерности образования SO2 во всех проведенных опытах в реакторе с псевдоожиженным слоем представлены на фиг. 4.
Очевидно, что SO2 образуется в максимальном количестве при O2/ФГ ≈1 и С/ФГ ≈ 0,3. Более высокие количества либо углерода, либо кислорода препятствуют образованию SO2 (за счет образования CaS), в то время как меньшие количества приводят к частичной конверсии CaSО4 и, таким образом, к меньшему количеству желательных газообразных продуктов.
Следовательно, исходя из результатов моделирования и предварительных экспериментальных данных, разложение ФГ до SO2 и CaO при помощи окисления углерода практически осуществимо. В результате окисления углерода образуется СО, обеспечивая при этом достаточное количество энергии для проведения процесса разложения. Кроме того, образующийся побочный продукт, CaS, можно также удалить в ходе процесса разложения ФГ за счет газификации углерода в другом реакторе с псевдоожиженным слоем, что будет рассмотрено в следующей работе. По аналогии с процессом разложения ФГ, выходящее твердое вещество, включающее в себя CaSO4, CaO, и CaS, можно превратить лишь в CaO путем оптимизации количества углерода и O2 во втором реакторе. В зависимости от требуемой чистоты, после второго реактора можно установить третий реактор.
Литература
[1] Патент США 3087790.
[2] Патент США 6024932.
[3] Патент США 4503018.
[4] Патент США 5433939.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ РАЗЛОЖЕНИЯ СУЛЬФИДА КАЛЬЦИЯ | 2018 |
|
RU2776054C2 |
| СПОСОБ НЕПРЕРЫВНОЙ ПЕРЕРАБОТКИ СМЕШАННОГО МЕДЬСОДЕРЖАЩЕГО СЫРЬЯ | 1995 |
|
RU2081195C1 |
| СПОСОБ КОНВЕРСИИ УГЛЯ С ПОЛУЧЕНИЕМ КАЧЕСТВЕННОГО ВОДОРОДА ДЛЯ ТОПЛИВНЫХ СМЕСЕЙ И ДИОКСИДА УГЛЕРОДА, ГОТОВОГО К УТИЛИЗАЦИИ, И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2002 |
|
RU2290428C2 |
| Способ получения двуокиси серы и извести | 1980 |
|
SU941282A1 |
| Способ переработки фосфогипса | 1982 |
|
SU1074817A1 |
| УСТАНОВКА ДЛЯ ПОЛУЧЕНИЯ НАГРЕТЫХ ГАЗОВ ИЗ УГЛЕРОДСОДЕРЖАЩЕГО МАТЕРИАЛА | 2015 |
|
RU2615690C1 |
| ЭНЕРГОСБЕРЕГАЮЩИЙ СПОСОБ УТИЛИЗАЦИИ СУЛЬФАТОВ КАЛЬЦИЯ - ФОСФОГИПСА И ОСАДКОВ ОЧИСТНЫХ СООРУЖЕНИЙ С ПОЛУЧЕНИЕМ ЦЕМЕНТНОГО КЛИНКЕРА И СЕРНИСТОГО ГАЗА ДЛЯ ПРОИЗВОДСТВА СЕРНОЙ КИСЛОТЫ | 2005 |
|
RU2296723C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ КАЛЬЦИЕВОГО СУЛЬФИДИЗАТОРА ДЛЯ ОСАЖДЕНИЯ ТЯЖЕЛЫХ ЦВЕТНЫХ МЕТАЛЛОВ ИЗ КИСЛЫХ СУЛЬФАТНЫХ РАСТВОРОВ И ЖИДКОЙ ФАЗЫ ГИДРАТНЫХ ЖЕЛЕЗИСТЫХ ПУЛЬП | 1997 |
|
RU2120484C1 |
| СПОСОБ ПЕРЕРАБОТКИ ФОСФОГИПСА В НЕОРГАНИЧЕСКИЕ ПРОДУКТЫ | 2024 |
|
RU2836153C1 |
| СПОСОБ ОЧИСТКИ ГАЗОВЫХ ПОТОКОВ ОТ СЕРОВОДОРОДА | 2012 |
|
RU2535041C2 |
Изобретение относится к способу разложения сульфата кальция (CaSO4), находящегося в фосфогипсе (ФГ). Способ включает обеспечение наличия реактора, в котором содержится фосфогипс (ФГ) и твердый источник углерода (С), введение потока кислорода (O2) во взаимодействие с источником углерода (С) для генерирования оксида углерода (СО). Далее вводят во взаимодействие полученный оксид углерода (СО), с сульфатом кальция (CaSO4) фосфогипса, с получением оксида кальция (CaO) и диоксида серы (SO2) согласно реакции CaSO4 + CO → CaO + SO2 + CO2. При этом массовое отношение C/ФГ составляет от 0,2 до 0,4, а массовое отношение O2/ФГ составляет от 0,5 до 1,5. Обеспечивается увеличение степени конверсии фосфогипса при выработке достаточного количества энергии для протекания реакции разложения сульфата кальция. 7 з.п. ф-лы, 9 табл., 1 пр., 4 ил.
1. Способ разложения сульфата кальция (CaSO4), присутствующего в фосфогипсе (ФГ), отличающийся тем, что он включает следующие стадии:
a) обеспечение наличия реактора, в котором содержится фосфогипс (ФГ) и твердый источник углерода (С),
b) введение потока кислорода (O2) во взаимодействие с источником углерода (С) для генерирования оксида углерода (СО),
c) введение во взаимодействие оксида углерода (СО), полученного на стадии а), с сульфатом кальция (CaSO4) фосфогипса, с получением оксида кальция (CaO) и диоксида серы (SO2) согласно следующей реакции:
CaSO4 + CO → CaO + SO2 + CO2
где массовое отношение C/ФГ составляет от 0,2 до 0,4, а массовое отношение O2/ФГ составляет от 0,5 до 1,5.
2. Способ по п. 1, в котором массовое отношение C/ФГ приблизительно равно 0,3.
3. Способ по п. 1 или 2, в котором массовое отношение O2/ФГ составляет от 0,5 до 1, предпочтительно, приблизительно равно 1.
4. Способ по любому из пп. 1-3, в котором массовое отношение O2/С составляет от 1,25 до 3, предпочтительно, приблизительно равно 2.
5. Способ по любому из пп. 1-4, в котором стадии b) и c) осуществляют в реакторе с псевдоожиженным слоем.
6. Способ по п. 5, в котором стадия b) состоит из введения кислорода (O2) в реактор с псевдоожиженным слоем таким образом, чтобы поток кислорода (O2) контактировал с массой фосфогипса и источника углерода в указанном реакторе с псевдоожиженным слоем.
7. Способ по любому из пп. 1-6, в котором стадию c) осуществляют при температуре 1100°C или ниже.
8. Способ по любому из пп. 1-7, в котором конверсия сульфата кальция (CaSO4) составляет 80% или выше, предпочтительно 85% или выше, в то время как выход побочного продукта (CaS) составляет 20% или ниже, предпочтительно 15% или ниже.
| US 4102989 A, 25.07.1978 | |||
| US 4503018 A, 05.03.1985 | |||
| US 3729551 A, 24.04.1973 | |||
| US 3607045 A, 21.09.1971 | |||
| Способ получения сернистого газа и портландцементного клинкера | 1987 |
|
SU1604730A1 |
Авторы
Даты
2022-07-12—Публикация
2018-11-22—Подача