Предлагаемое изобретение относится к области медицины, в т.ч. ветеринарной медицины, в частности к серологической диагностике инфекционных болезней общих для человека и животных, к ним относится и COVID 19.
Существенную роль в этиологии вирусных заболеваний респираторной системы у животных и человека играют коронавирусы, герпесвирусы, реже выделяют пикорна- и реовирусы. Серологическая диагностика является наиболее распространенной как в аспекте ретроспективного отслеживания возможных вспышек заболевания, так и оценки эффективности его специфической профилактики.
SARS-CoV-2 представляет собой вирус, содержащий одноцепочеч-ную РНК (семейство Coronaviridae, род бетакоронавирусы) (Zhou Р. А pneumonia outbreak associated with a new coronavirus of probable bat origin // Nature, 2020. - Vol. 579, N 7798. - P. 270-273). Геном этих патогенов кодирует четыре основных структурных белка: спайк-белок (S-белок), оболочечный белок (Е), мембранный белок (М) и нуклеокапсид (N), а также приблизительно 16 неструктурных белков (nsp1-16) и 5-8 вспомогательных белков. Среди них белок S играет важную роль в прикреплении вируса к клетке хозяина, слиянии с клеточной мембраной, проникновении в клетку. S-белок состоит из двух компонентов, он содержит субъединицу S1, ответственную за связывание вируса с рецептором, и субъединицу S2, ответственную за слияние вируса и клеточной мембраной (Du L. The spike protein of SARS-CoV - a target for vaccine and therapeuticdevelopment //Nat Rev Microbiol,2009. Vol.7, N 3. - P. 226-236.; Du L. MERS-CoV spike protein: a key target for antivirals // Expert Opin TherTargets, 2017. - Vol.21, N 2. - P. 131-143.). Субъединица S1 имеет V-образную структуру, в ее составе выделяют N-концевой домен (NTD) и С-концевой домен, каждый из которых может быть рецептор-связывающим доменом (RBD) в зависимости от разновидности коронавируса и поражаемых им клеток того или иного хозяина (Ou X., Liu Y., Lei X., Li P., Mi D., Ren L., Guo L., Guo R., Chen Т., Hu J., Xiang Z., Mu Z., Chen X., Chen J., Hu K., Jin Q., Wang J., Qian Z. Characterization of spike glycoprotein of SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV //Nat Commun, 2020. - Vol. 11. - P. 1620). Во время инфекционного процесса коронавирус сначала взаимодействует через S1-RBD с рецептором клетки хозяина, вызывая конформационные изменения в субъединице S2, которые приводят к слиянию вируса и проникновению в клетку-мишень (Du L. The spike protein of SARS-CoV - a target for vaccine and therapeuticdevelopment //Nat Rev Microbiol,2009. Vol. 7, N 3. - P. 226-236.; Du L. MERS-CoV spike protein: a key target for antivirals // Expert Opin TherTargets, 2017. - Vol. 21, N 2. - P. 131-143).
Различные коронавирусы используют различные домены внутри субъединицы S1 для распознавания рецепторов клетки-мишени. SARS-CoV-2 и SARS-CoV связывают ангиотензинпревращающий фермент 2 (АСЕ2), экспрессируемый пневмоцитами и энтероцитами, в то время как MERS-CoV связывает дипептидилпептидазу 4 (DPP4) клеток печени или легких (Du L. The spike protein of SARS-CoV - a target for vaccine and therapeuticdevelopment //Nat Rev Microbiol, 2009. Vol. 7, N 3. - P. 226-236.; Du L. MERS-CoV spike protein: a key target for antivirals // Expert Opin TherTargets, 2017. - Vol. 21, N 2. - P. 131-143; Zhou Y., Yang Y., Huang J., Jiang S., Du L. Advances in MERS-CoV vaccines and therapeutics based on the receptor-binding domain // Viruses, 2019. - Vol.11, N 1. - Pii:E60).
Серологические исследования имеют важное значение для определения уровня протективного иммунитета среди животных и людей, определения диагноза. Чувствительная и специфичная идентификация антител к коронавирусу SARS-Cov-2 может способствовать скринингу широких групп населения, а также массовому исследованию животных при подозрении на заболевания, вызванные коронавирусными инфекциями. Общее число населения, для которого потребуются серологические исследования в России может исчисляться тысячами и даже миллионами людей, а количество животных может быть гораздо выше. Помимо актуальности использования в социально-эпидемиологическом плане, серологические методы имеют и клиническое значение. Они позволяют детально характеризовать иммунный ответ на SARS-CoV-2 как качественным, так и количественным образом, прогнозировать тяжесть течения COVID-19, быть одним из критериев выздоровления (Kohmer N., Westhaus S.,  С., Cieseka S., Rabenau H.F. Brief clinical evaluation of six high-throughput SARS-CoV-2 IgG antibody assays // J Clin Virol, 2020. - Vol.129. - P. 104480).
С., Cieseka S., Rabenau H.F. Brief clinical evaluation of six high-throughput SARS-CoV-2 IgG antibody assays // J Clin Virol, 2020. - Vol.129. - P. 104480).
Исходя из вышеуказанного, проблема диагностики и борьбы с данными инфекциями является актуальной. Известны различные способы выявления коронавирусных инфекций.
Реакция нейтрализации (РН), основанная на введении комплекса антиген - антитело животным или в чувствительные тест-объекты. При отсутствии у животных и тест-объектов повреждающего действия микроорганизмов или их антигенов, токсинов говорят о нейтрализующем действии иммунной сыворотки и о специфичности взаимодействия комплекса антиген - антитело. РН не характеризует общее иммунное состояние животного, т.к. в ней участвует только гуморальный иммунитет. Как и в других реакциях, активность клеточной иммунной системы здесь не имеет значения. РН имеет преимущество перед реакцией защиты - она не оказывает отрицательного действия на здоровье подопытного животного и может повторяться неоднократно (Воронин Е.С. Ветеринарная микробиология и иммунология. Электронный дидактический комплекс (ЭДК) / Е.С. Воронин, В.Н. Кисленко, Н.М. Колычев, В.И. Плешакова // Электронный ресурс: https://nsau.edu.ru/images/vetfac/images/ebooks/microbiology/index.htm (дата обращения 19.01.2021).
В настоящее время уже разработана тест-система ПЦР диагностики COVID-19 у животных ФГБУ «ВНИИЗЖ» (В РФ создали первую тест-систему диагностики возбудителя COVID-19 у животных / Электронный ресурс: https://www.interfax.ru/russia/703968. (дата обращения 25.04.2021)), а также уже существует тест-система и способ для выявления РНК коронави-руса SARS-COV-2, вируса-возбудителя коронавирусного заболевания 2019 COVID-19, методом полимеразной цепной реакции в режиме реального времени (Патент РФ №2 731 390 от 12.04.2020). Метод обратной транскрипции-полимеразной цепной реакции обладает наиболее высокими показателями чувствительности и специфичности, за счет выявления уникальных для организмов участков генетического материала. Например, у кошек обнаружение вируса в фекалиях считается вирусоносительством, а в крови показателем инфекционного перитонита. Обнаружение вируса в крови не является диагностическим и прогностическим параметром, т.к. были случаи обнаружения вируса в крови у серопозитивных кошек без дальнейшего развития инфекции. Кроме того, отсутствие вируса в крови не гарантирует, что у кошки не будет развиваться инфекционный перитонит.
ОТ-ПЦР метод используют для выявления возбудителя, но результат может быть как ложноотрицательным, так и ложноположительным (Зотов И.Е. Коронавирусная инфекция кошек / Электронный ресурс: https://www.svoydoctor.ru/vladeltsam/poleznoe/stati/koronavirusnaya-infektsiya-koshek/ (дата обращения 19.01.2021)). В слуае с ПЦР диагностикой COVID 19 у людей, существет проблема невозможности отбора проб на исследования в органах и тканях, повреждения которых и вызывают развитие патологии (легкие, тонкий отдел кишечника). Нет гарантии, что в момент появления симптомов SARS CoV2 сохранится в носоглотке, откуда берут мазки или концентрация геномной РНК будет не менее 1×104 копий на 1 мл биологических жидкостей. Учитывая, что вирусная инфекция обязательно имеет этапы, когда концентрация вирусного агента ниже порога чувствительности ПЦР, а распределение вирусного агента неравномерно в организме, то имеют диагностическое значение только положительные результаты ПЦР.
Для решения проблемы диагностики наиболее подходящим является высокочувствительный метод иммуноферментного анализа (ИФА). Так как продолжительность хронических форм COVID 19 составляет до 12 недель (Sudre, С.Н., Murray, В., Varsavsky, Т. et al. Attributes and predictors of long COVID. Nat Med 27, 626-631 (2021). https://doi.org/10.1038/s41591-021-01292-y), а инкубационный период может достигать 14 дней (Noel George, Naresh K. Tyagi, Jang Bahadur Prasad, COVID-19 pandemic and its average recovery time in Indian states, Clinical Epidemiology and Global Health, Volume 11, 2021, 100740, https://doi.org/10.1016/j.cegh.2021.100740.), то серологическая диагностика может иметь и самостоятельное клиническое значение, а не только быть средством ретроспективной диагностики.
Иммуноферментный анализ является высокоспецифичным, чувствительным и универсальным методом. ИФА включает последовательные иммунохимические взаимодействия. Основные составляющие анализа иммобилизованы на твердой фазе, что позволяет удалять использованные реагенты, вводить новые и накапливать детектируемые продукты в реакционных объемах растворов (EngvallE: 1977. Med Biol., 55 (4): 193-200, Kohl Т.О., Ascoli С.A: 2017(7). Cold Spring HarbProtoc, doi: 10.1101/pdb.prot093757, Kohl Т.О., Ascoli C.A: 2017(6). ColdSpringHarbProtoc, doi:10.1101/pdb.prot093724).
Известен способ серологической диагностики вирусных желудочно-кишечных инфекций крупного рогатого скота методом иммуноферментного анализа, преимущественно рота-, коронавирусного энтеритов, вирусной диареи крупного рогатого скота, включающий взаимодействие антигенов с антителами, с антивидовыми антителами, меченными пероксидазой хрена, добавление субстратной смеси и учет результатов по интенсивности окраски образовавшегося комплекса, характеризующийся тем, что в реакции используют планшеты с предварительно сорбированными на них антигенами (Патент РФ №2472162 от 04.05.2011). Недостатком данного способа является отсутствие возможности использование его для диагностики энтеритов у свиней и кур, необходимость разведения проб фекалий и использование специальных индикаторных тест-полосок, что является экономически невыгодным в условиях масштабных предприятий.
Прототипом является способ использования рекомбинантных белков Sars-CoV-2 в составе тест-системы для иммуноферментного анализа с определением уровней антител классов IgM, IgG, IgA в сыворотке/плазме крови больных Covid - 19 (Патент РФ №2730897 от 26.08.2020). Минусом данного способа является недостаточная чувствительность и специфичность реакции, обусловленная снижением чувствительности, при уменьшении размеров рекомбинантных антигенов или снижением специфичности, при увеличении размеров молекулы рекомбинантного антигена. Также существенный вклад в неоптимальную диагностику может вносить наличие стерических эффектов при иммобилизации антигена, что также может влиять на эффективность и специфичность связывания антител.
К недостаткам современных способов серологической диагностики COVID 19 у людей и животных относятся следующие факторы: 1. У людей переболевших COVID 19 или зараженных SARS CoV2 бессимптомно могут не обнаруживаться антитела к SARS CoV2 класса М и G по причине наличия другого изотипа антител (класса А), формирования клеточного иммунитета и иммуносупрессии.
2. Использование антигенов на основе S белка SARS COV 2, как правило, не позволяет отличать поствакцинальные антитела и антитела к полевому штамму вируса SARS CoV2 (при использовании РНК вакцин и рекомбинантных вакцин на основе аденовирусного вектора).
3. Низкие уровни антител к SARS CoV2 сопоставимые с фоновыми значениями.
Техническая задача - повысить чувствительность способа серологической диагностики COVID 19/инфицированности SARS CoV2 на ранних этапах развития болезни у животных и человека и создать диагностический набора.
Сущность изобретения состоит в использовании диагностического набора, включающего все необходимые компоненты для проведения иммуноферментного анализа, позволяющего выявлять антиген SARS CoV2 в образцах испытуемого материала от людей и кошек на ранней стадии развития болезни с высокой специфичностью и чувствительностью. Принцип способа заключается в следующем: специфические иммуноглобулины, иммобилизованные на поверхности лунок полистиролового микропланшета, связываются с гомологичными антигенами, присутствующими в исследуемом материале, образуя комплекс антиген-антитело. Полученный иммунный комплекс выявляется путем взаимодействия с иммуноферментным конъюгатом, фермент которого, после добавления субстрата, вызывает разложение субстрат-индикаторного раствора и образование окрашенного продукта. Интенсивность окраски в лунке микропланшета считывают с помощью ИФА-ридера. Интенсивность пропорциональна содержанию специфического антигена в испытуемом образце, результаты учитывают по общепринятой формуле.
Для повышения специфичности и аналитической чувствительности способа серологической диагностики используем фрагмент гена белка N, который включает в себя аминокислотную последовательность MGSSHHHHHHSSGLVPRGSHMgkedlkfprgqgvpintnsspddqigyyrratrrirggdgkmkdlsprwyfyylgtgpeaglpygankdgiivwategalntpkdhi gsqassrsssrsmssmstpgssrgtsparmagng.
Способ отличается тем, что для повышения специфичности, в качестве антигена, используем уникальную для SARS CoV-2 последовательность белка N, метод сорбции антигена на поверхность полистиролового микропланшета подразумевает связывание антигена с наночастицами серебра иммоби-лизированными на полистироловом микропланшете, критерием выявления антител является факт прироста антител в динамике, в т.ч. во взаимосвязи с появлением клинических признаков. Для повышения клинической чувствительности способа серологической диагностики COVID 19 у вирусоносите-лей с пониженным уровнем антител используются ряд диагностических алгоритмов таких как:
A) положительным считается диагноз COVID 19 в случае прироста концентрации антител в 2 и более раза, в течение 1.5 месяца с момента первого исследования.
Б) человек, не имеющий антител к SARS CoV2, но у которого появились антитела класса М к антигенам данного вируса, не входящих в вакцинный препарат, через 10-14 дней после вакцинации считается зараженным SARS CoV2 на момент вакцинации.
B) в отсутствии антител к SARS CoV2 человек считается контактирующим с данным вирусом, в случае обнаружения антител у животного (кошка), контактирующем только со своим владельцем.
Г) человек, не имеющий антител к SARS CoV2, считается заболевшим, если прирост антител зафиксирован у синхронно болеющих с ним контактных лиц.
Поставленная задача решается следующим образом - для выявления антител к вирусу SARS CoV-2 необходимо подготовить микропланшет по следующей методике:
1. В 96-луночный полистироловый микропланшет вносят 0,6% раствор бычьего сывороточного альбумина в карбонат-бикарбонатном буфере.
2. Инкубируют 12 часов при t=+5°C.
3. Удаляют раствор из микропланшета.
4. Высушивают микропланшеты при t=+20-25°C.
5. Вносят в каждую лунку 6 ng наночастиц серебра в объеме 60 мкл.
6. Инкубируют 30 минут при t=+20-25°C.
7. Дважды промывают деионизированной водой лунки микропланшета.
8. Вносят 1-3 мкг антигена РА1 в объеме 70 мкл.
9. Инкубируют 30 минут при t=+20-25°C.
10. Вносят 140 мкл 3% раствора бычьего сывороточного альбумина.
11. Инкубируют 3 часа при t=+20-25°C.
12. Тщательно удаляют содержимое из лунок микропланшета.
13. Дважды промывают деионизированной водой.
14. Высушивают при t=+20-25°C.
15. Хранят при t=+5°C.
Диагностический набор для выявления возбудителя COVID-19 содержит: планшет полистироловый 96-луночный, сенсибилизированный реком-бинантным антигеном с уникальной последовательностью белка N; положительный контрольный образец, инактивированный (K+); отрицательный контрольный образец, инактивированный (K-); конъюгат, представляющий собой антитела IgM и IgG; буферный раствор - концентрат фосфатно-солевого буферного раствора 0,01М рН 7,2-7,4 с 0,05% твином-20 (ФСБ-Т); субстрат - раствор тетраметилбензидина - 0,005%, 0,006% перекиси водорода, 0,01М ацетата натрия рН3,3 (ТМБ); стоп-реагент (серная кислота 0,5М); ванночка для реагентов. Компоненты набора расфасованы в пластиковые флаконы разного объема с завинчивающимися крышками и упакованы в коробки. Способ проведения реакции и интерпретации результатов:
1. В подготовленный планшет добавляют буфер ФСБ-Т по 100 мкл на 30 минут.
2. Разводят сыворотку крови в титр-трубках - для тестирования на наличие IgM добавляют 5 мкл сывороки к 250 мкл ФСБ-Т, для тестирования на наличие IgG добавляют 5 мкл сыворотки в 500 мкл ФСБ-Т.
3. Удаляют остатки буфера из микропланшета постукиванием по сложенной в несколько слоев фильтровальной бумаге.
4. Добавляют по 70 мкл полученных растворов (п. 3) в лунки планшета.
5. Заклеивают плашку полимерной пленкой.
6. Инкубируют 40 минут при t=+20-25°C.
7. Добавляют по 300 мкл ФСБ-Т в лунки, инкубируют 3 минуты, жидкость окончательно удаляют, и планшет подсушивают постукиванием по сложенной в несколько слоев фильтровальной бумаге. Проделывают 3 раза.
8. Добавляют конъюгаты по 70 мкл в лунки.
9. Инкубируют 40 минут при t=+20-25°C.
10. Добавляют по 300 мкл ФСБ-Т в лунки, инкубировуют 3 минуты, жидкость окончательно удаляют, и планшет подсушивают постукиванием по сложенной в несколько слоев фильтровальной бумаге. Проделывают 4 раза.
11. Добавляют субстрат ТМБ по 100 мкл в лунки.
12. Инкубируют 10-15 минут при t=+20-25°C.
13. Реакцию останавливают добавлением в каждую используемую лунку по 100 мкл стоп-раствора.
14. Учет результатов ИФА проводят после остановки реакции, используют спектрофотометр (ридер) с вертикальным лучом света при длине волны 492 нм.
15. Оценивают показатель S/P по формуле - (OD492 пробы - OD 492 отрицательного контрольного образца) деленное на (OD 492 положительного контрольного образца минус OD 492 отрицательного контрольного образца) в качестве положительного контроля берут разведение положительной сыворотки, характеризующееся оптической плотностью в ИФА превышающей оптическую плотность отрицательного контрольного образца в 1,2-1,5 раза.
Факт контакта человека с SARS CoV2 считается подтвержденным, если зафиксирован прирост S/P в интервале времени от 2-х недель до 1.5 месяцев у обследуемого человека или наличие антител у животного (кошки) единственным источником заражения SARS CoV 2 для которого, является его владелец.
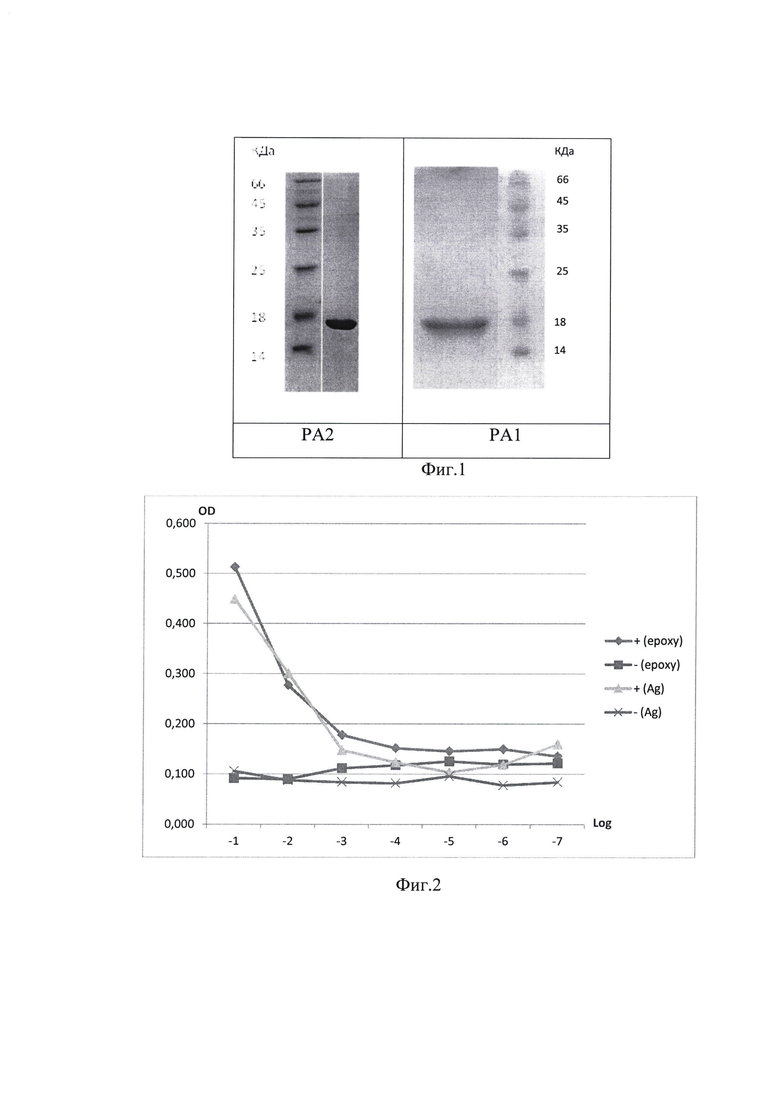
Пример 1. Для сравнения эффективности иммобилизации антигенов были использованы 2 разных вещества - наночастицы серебра и эпоксидная смола, и соответственно разные антигены РА1 и РА2.
Аминокислотная последовательность РА1: MGSSHHHHHHSSGLVPRGSHMgkedlkprgqgvpintnsspdgkmkdlsprwyfyylgtgpeaglpygankdgiiwvvlqlpqgttlpkgfyaegsrggsqassrsssrsmssmstpgssrgtsparmagng
Аминокислотная последовательность РА2: MGSSHHHHHHSSGLVPRGSHMigmevtpsgtwltytgaiklddkdpnfkdqvillnkhidayktfpptepkkdkkkkadetqalpqrqkkqqtvtllpaadlddfskqlqqsmssadstqa
Хроматографический анализ проводили на колонке VDSpher PUR 100 С18-Е 250×4,6 mm в градиенте концентрации 80% AcCN в 0,1% ТФУ от 30 до 70% со скоростью 1 мл/мин (табл.1).

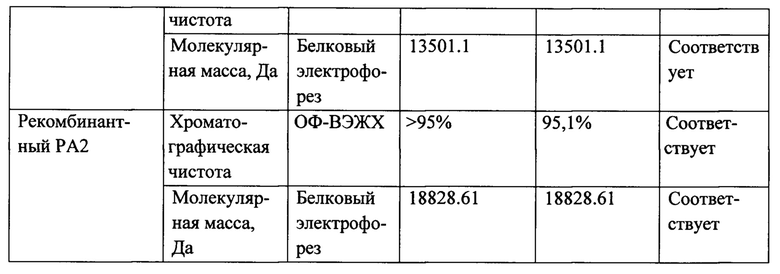
Результаты электрофоретического анализ РА1 и РА2 в 15% ПААГ в денатурирующих условиях представлены на фиг.1.
Иммобилизацию антигена, осуществляли следующим образом - в 96-луночный полистироловый микропланшет вносили 0,6% раствор бычьего сывороточного альбумина в карбонат-бикарбонатном буфере, инкубировали 12 часов при +5°С. Удаляли раствор, высушивали микропланшеты при +21°С. Вносили в каждую лунку 6 ng наночастиц серебра в объеме 60 мкл и инкубировали 30 минут. Дважды промывали деионизированной водой лунки микропланшета. Вносили 1-3 мкг антигена РА1 в объеме 70 мкл и инкубировали 30 минут при +21°С. Вносили 140 мкл 3% раствора бычьего сывороточного альбумина и инкубировали 3 часа. Тщательно удаляли содержимое из лунок. Дважды промывали деионизированной водой и высушивали при +21°С. Хранили при +5°С.
Для иммобилизации антигена РА2 в 96-луночный полистироловый микропланшет вносили 0,6% раствор бычьего сывороточного альбумина в карбонат-бикарбонатном буфере, инкубировали 12 часов при +5°С. Удаляли раствор, высушивали микропланшеты при +21°С. Вносили 0,01% раствор эпоксидной смолы в изопропаноле, в объеме 60 мкл и высушивали. Наносили антиген РА2 в объеме 60 мкл и инкубировали 30 минут. Добавляли 120 мкл 3% бычьего сывороточного альбумина и инкубировали 3 часа. Промывали дважды деионизированной водой и высушивали.
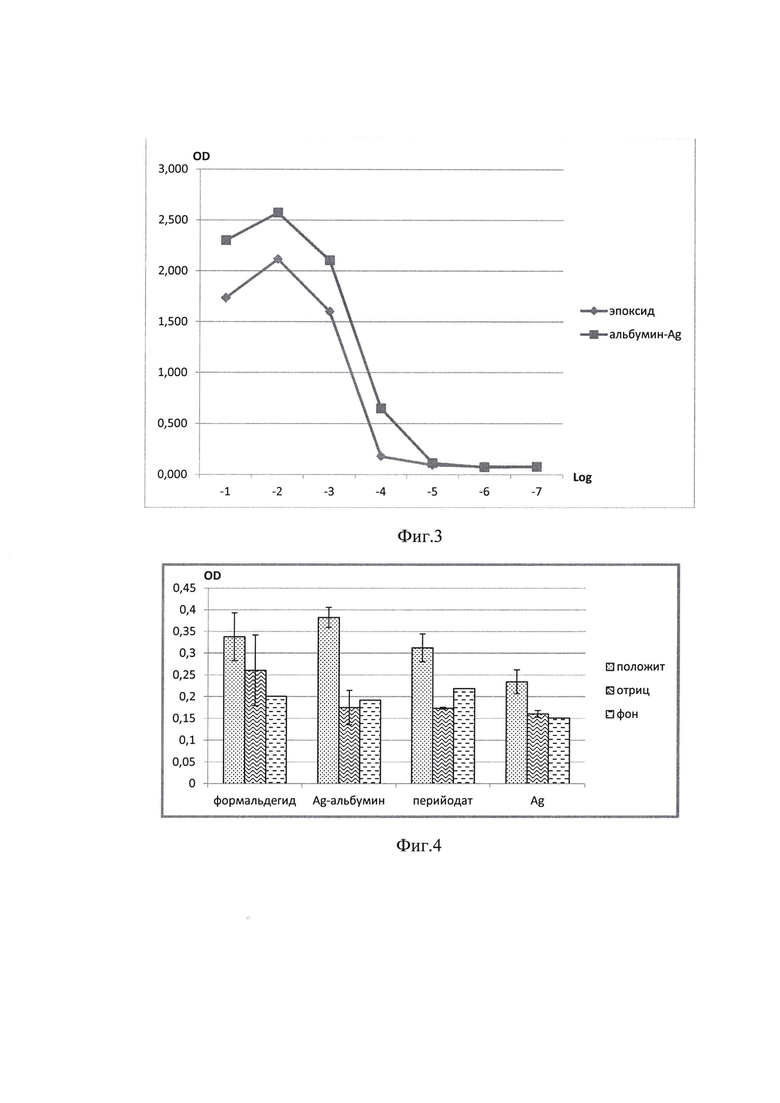
По результатам иммуноферментного анализа (ИФА) с антителами к фрагменту белка N, было установлено более эффективное связывание фрагмента рекомбинантного белка N с наночастицами серебра в сравнении с эпоксидной смолой (фиг. 2). Наилучшими характеристиками обладал набор включающий в себя микропланшет с наночастицами серебра и иммобилизированным на них антигеном.
Пример 2. Сравнительный анализ чувствительности предлагаемого способа и набора для его осуществления позволили показано связывание иммуноглобулинов класса G эпоксидными группами и наночастицами серебра на фиг. 3. Использование наночастиц серебра позволяет добиться большей чувствительности реакции ИФА и большей чувствительности в сравнении с иммобилизацией антигенов на эпоксидные группы.
Предварительные сравнительные испытания методов иммобилизации показали большую эффективность использования наночастиц в составе комплекса с альбумином.
Пример 3. Для анализа специфичности предложенного способа и набора для выявления заражения людей и животных SARS CoV2 взяли заведомо положительные и заведомо отрицательные (на наличие антител к SARS CoV2) сыворотки и сравнили специфичность предложенного способа и способа иммобилизации антигенов на эпоксидные группы. На фиг 4. показаны результаты ИФА на РА1 с заведомо положительными и отрицательными сыворотками при разных методах иммобилизации антигена, OD 405 (M±SD). Наилучший результат показал способ с иммобилизацией наночастицами серебра с альбуминами (фиг. 4)
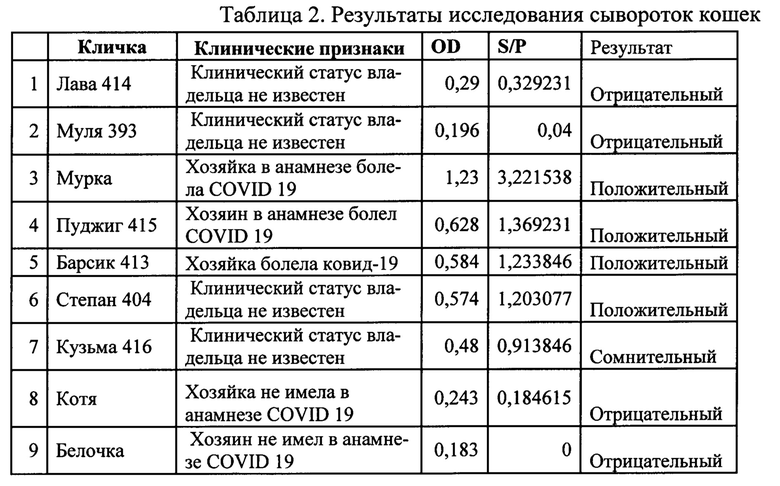
Пример 4. Иммуноферментный анализ для сывороток кошек.
В 96-луночный планшет, уже иммобилизированный наночастицами серебра, вносили по 70 мкл разведенной в 100 раз в фосфатно-солевом буферном растворе с твином (ФСБ-Т) сыворотки. Инкубировали 30 минут при +21°С, закрыв микропланшеты пленкой. Промывали трехкратно ФСБ-Т (250 мкл), инкубируя по 3 минуты между промывками. Разводили конъюгат до рабочей концентрации и вносили в объеме 70 мкл на лунку. Инкубировали 30 минут при +21°С, закрыв микропланшеты пленкой. Удаляли раствор из лунок. Затем промывали трехкратно ФСБ-Т, инкубируя по 3 минуты между промывками. Вносили субстрат ТМБ по 100 мкл. Инкубирвали при +21°С до хорошо выраженной разницы между положительными и отрицательными контрольными лунками. Останавливают реакцию стоп-раствором (0,5М раствором серной кислоты). Считывали результаты ИФА ридером при длине волны 492 нм.
Полученные результаты исследования сывороток кошек имеют прямую зависимость от заболеваемости хозяев (табл. 2).
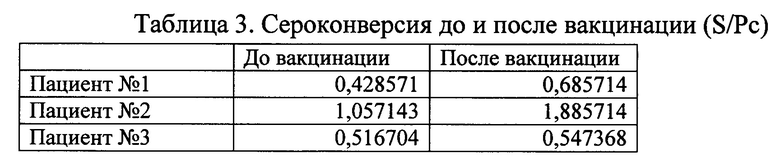
Пример 5. Изучение сероконверсии у людей с клиническими признаками SARS CoV2.
При исследовании сыворотки крови у людей, не имеющих антител до применения вакцины ГамКовидВак, через 14 дней после вакцинации был зафиксирован прирост показателя S/Pc антител класса М (табл. 3).
Человек, не имеющий антител к SARS CoV2,но у которого появились антитела класса М к антигенам данного вируса, не входящих в вакцинный препарат, через 10-14 дней после вакцинации считается зараженным SARS CoV 2 на момент вакцинации.
Таких образом, с помощью уменьшения размера антигена, на основе фрагмента белка N SARS CoV2, за счет исключения неспецифических для SARS CoV2 участков, удается повысить специфичность данной серологической реакции. Снижение чувствительности реакции удалось скомпенсировать благодаря иммобилизации антигена с использованием наночастиц серебра, что в свою очередь, повысило оптическую плотность. Использование, в качестве диагностического критерия, сероконверсии (прироста показателя отражающего концентрацию специфических антител) позволяет уменьшить влияние фоновых значений оптической плотности на снижение чувствительности диагностического теста, в т.ч. условиях иммуносупрессии, вызываемой SARS CoV2. Использование предложенных диагностических алгоритмов имеет значение для оценки эпидемических рисков (удельная доля бессимптомных носителей в популяции), рисков обострения латентной инфекции при вакцинации, в т.ч. ревакцинации.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИСПОЛЬЗОВАНИЯ РЕКОМБИНАНТНЫХ БЕЛКОВ SARS-COV-2 В СОСТАВЕ ТЕСТ-СИСТЕМЫ ДЛЯ ИММУНОФЕРМЕНТНОГО АНАЛИЗА С ОПРЕДЕЛЕНИЕМ УРОВНЕЙ АНТИТЕЛ КЛАССОВ IgM, IgG, IgA В СЫВОРОТКЕ/ПЛАЗМЕ КРОВИ БОЛЬНЫХ COVID-19 | 2020 |
|
RU2730897C1 |
| Способ проведения иммуноферментного анализа для выявления антител в биологическом образце человека, специфичных к коронавирусу человека SARS-COV2, тест-система | 2021 |
|
RU2759149C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ НЕЙТРАЛИЗУЮЩИХ АНТИТЕЛ К SARS-CoV-2 В СЫВОРОТКЕ ИЛИ ПЛАЗМЕ КРОВИ ЛЮДЕЙ, ПЕРЕНЕСШИХ COVID-19 ИЛИ ПРИВИТЫХ ВАКЦИНАМИ ДЛЯ ПРОФИЛАКТИКИ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИИ COVID-19, С ИСПОЛЬЗОВАНИЕМ НАБОРА РЕАГЕНТОВ ДЛЯ ИММУНОФЕРМЕНТНОГО АНАЛИЗА, СОДЕРЖАЩЕГО РЕКОМБИНАНТНЫЙ РЕЦЕПТОР-СВЯЗЫВАЮЩИЙ ДОМЕН (RBD) ПОВЕРХНОСТНОГО ГЛИКОПРОТЕИНА S КОРОНАВИРУСА SARS-COV-2 И РЕКОМБИНАНТНЫЙ ЧЕЛОВЕЧЕСКИЙ РЕЦЕПТОР АСЕ2 | 2021 |
|
RU2784655C1 |
| ПОЛИПЕПТИДНЫЙ МОДУЛЬ ДЛЯ СВЯЗЫВАНИЯ КОНСЕРВАТИВНОГО ЭПИТОПА РЕЦЕПТОР-СВЯЗЫВАЮЩЕГО ДОМЕНА БЕЛКА SPIKE КОРОНАВИРУСА SARS-COV-2 | 2022 |
|
RU2809183C1 |
| Штамм гибридных клеток животных Mus musculus 2E1B5 - продуцент моноклонального антитела к рецептор-связывающему домену белка S вируса SARS-CoV-2 | 2021 |
|
RU2771288C1 |
| Штамм гибридных клеток животных Mus musculus 1F1 - продуцент моноклонального антитела к нуклеокапсидному белку N вируса SARS-CoV-2 | 2021 |
|
RU2769817C1 |
| Моноклональное антитело к RBD фрагменту в составе S белка вируса SARS-CoV-2 | 2020 |
|
RU2744274C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ S-АНТИГЕНА В ЦЕЛЬНОВИРИОННЫХ ИНАКТИВИРОВАННЫХ АДСОРБИРОВАННЫХ НА ГИДРООКИСИ АЛЮМИНИЯ, СУБЪЕДИНИЧНЫХ НА ОСНОВЕ S-БЕЛКА, РЕКОМБИНАНТНЫХ ИЛИ ПОЛИПЕПТИДНЫХ, СОДЕРЖАЩИХ ДОМЕН RBD SPIKE-БЕЛКА ВИРУСА SARS-COV ВАКЦИНАХ ДЛЯ ПРОФИЛАКТИКИ КОРОНАВИРУСНОЙ ИНФЕКЦИИ COVID-19 И/ИЛИ ДРУГИХ КОРОНАВИРУСНЫХ ИНФЕКЦИЙ | 2023 |
|
RU2825291C1 |
| Тест-система и способ дифференцированного выявления антител к SARS-CoV-2 | 2021 |
|
RU2754340C1 |
| Способ иммуноферментного определения уровня антигенраспознающих рецепторов В-лимфоцитов, представленных мембранными, специфическими к RBD PROTEIN SARS-CoV-2, IgG антителами | 2021 |
|
RU2760438C1 |
Группа изобретений относится к области медицины, в т.ч. ветеринарной медицины, в частности к серологической диагностике инфекционных болезней общих для человека и животных (к ним относится и COVID 19). Сущность группы изобретений состоит в использовании диагностического набора, включающего все необходимые компоненты для проведения иммуноферментного анализа, позволяющего выявлять вирус SARS-CoV-2 в образцах сыворотки крови на ранней стадии развития болезни с высокой специфичностью и чувствительностью за счет фрагмента белка N SARS CoV 2, иммобилизованного на поверхности лунок микропланшета, покрытых альбумином посредством наночастиц серебра. Группа изобретений относится также к способу выявления заражения людей и животных SARS CoV2, подразумевающему исследование сывороток крови человека и животных на наличие антител к антигенам SARS CoV2, иммобилизированным на поверхности ИФА микропланшета, при отсутствии антител к SARS CoV2 человек считается контактирующим с данным вирусом, в случае обнаружения антител у животного (кошка) - контактирующим только со своим владельцем. Группа изобретений обеспечивает чувствительную и эффективную серодиагностику COVID-19 на ранних этапах развития болезни. 2 н. и 2 з.п. ф-лы, 4 ил., 3 табл., 4 пр.
1. Диагностический набор для осуществления способа выявления заражения людей и животных SARS CoV2, включающий 96-луночный полистироловый микропланшет с иммобилизированными наночастицами серебра, сенсибилизированный рекомбинантным антигеном с уникальной аминокислотной последовательностью белка N
MGSSYYYYYYSSGLVPRGSHMgkedlkfprgqgvpintnsspddqigyyrratrrirggdgkmkdlsprwyfyylgtgpeaglpygankdgiiwvategalntpkdhigtrnpannaaivlqlpqgttlpkgfyaegsrggsqassrsssrsrnssrnstpgssrgtsparmagng (РА1); положительный контрольный образец, инактивированный (K+); отрицательный контрольный образец, инактивированный (K-); конъюгат, представляющий собой антитела класса М (IgM) и антитела класса G (IgG); концентрат фосфатно-солевого буферного раствора 0,01 М рН 7,2-7,4 с 0,05% твином-20 (ФСБ-Т) для разведения антител и отмывки; субстрат - раствор 3,3',5,5'-тетраметилбензидина (ТМБ); стоп-реагент - 0,5% SDS или серная кислота 0,5М; ванночка для реагентов.
2. Диагностический набор по п. 1, отличающийся тем, что фрагмент белка N SARS CoV2 иммобилизован на поверхности лунок 96-луночного полистиролового микропланшета, покрытых наночастицами серебра в составе комплекса с альбумином.
3. Способ выявления заражения людей и животных SARS CoV2, характеризующийся исследованием сывороток крови человека и животных на наличие антител к антигенам SARS CoV2 с использованием набора по пп. 1, 2, при этом разводят сыворотку крови в титротрубках по 5 мкл для тестирования на наличие антител класса G (IgG) и белка А в 500 мкл фосфатно-солевого буферного раствора с твином-80 (ФСБ-Т), для антител класса М (IgM) в 250 мкл ФСБ-Т, переносят из титротрубок в лунки диагностического 96-луночного полистиролового микропланшета по 70 мкл полученных растворов, инкубируют 40 минут, отмывают не связавшиеся антитела ФСБ-Т, добавляют ФСБ-Т по 300 мкл во все лунки, инкубируют 3 минуты, повторяют трижды, вносят конъюгаты по 70 мкл, инкубируют 40 минут, отмывают ФСБ-Т, добавляют ФСБ-Т по 300 мкл во все лунки, инкубируют 3 минуты, повторяют 4 раза, вносят 3,3',5,5'-тетраметилбензидин (ТМБ) по 100 мкл, инкубируют 10-15 минут, останавливают реакцию стоп-раствором 0,5% SDS или серной кислотой 0,5 М по 100 мкл и проводят учет реакции по изменению оптической плотности субстрата на спектрофотометре с вертикальным лучом света при длине волны 405 нм, оценивают показатель S/Pc по формуле - (OD405 пробы - OD 405 отрицательного контрольного образца), деленное на (OD 405 положительного контрольного образца минус OD 405 отрицательного контрольного образца), при этом положительный считается диагноз COVID-19 в случае прироста антител в 2 и более раза, в течение 1,5 месяцев с момента исследования, а также когда антитела класса М обнаружены у человека, не имеющего антител к антигенам SARS CoV2, не входящих в вакцинный препарат, через 10-14 дней после вакцинации считается зараженным SARS CoV2 на момент вакцинации; в отсутствие антител к SARS CoV2 человек считается контактирующим с данным вирусом, в случае обнаружения антител у животного - контактирующим только со своим владельцем.
4. Способ по п. 3, где животное представляет собой кошку.
| СПОСОБ ИСПОЛЬЗОВАНИЯ РЕКОМБИНАНТНЫХ БЕЛКОВ SARS-COV-2 В СОСТАВЕ ТЕСТ-СИСТЕМЫ ДЛЯ ИММУНОФЕРМЕНТНОГО АНАЛИЗА С ОПРЕДЕЛЕНИЕМ УРОВНЕЙ АНТИТЕЛ КЛАССОВ IgM, IgG, IgA В СЫВОРОТКЕ/ПЛАЗМЕ КРОВИ БОЛЬНЫХ COVID-19 | 2020 |
|
RU2730897C1 |
| Штамм hCoV-19/Russia/Omsk-202118-1707/2020 коронавируса SARS-CoV-2, иммуносорбент, содержащий цельновирионный очищенный антиген, полученный на основе указанного штамма и тест-система ИФА для выявления антител классов M, G и A к коронавирусу SARS-CoV-2 с использованием указанного иммуносорбента | 2021 |
|
RU2752862C1 |
| CN 111398597 A, 10.07.2020 | |||
| CN 111187354 A, 22.05.2020. | |||
Авторы
Даты
2022-07-18—Публикация
2021-09-03—Подача