Изобретение относится к методикам проведения лабораторных биологических исследований и может быть использовано для проведения гистологических и иммуногистохимических исследований, а также биоинженерии.
Охлаждение образцов перед нарезкой на микротоме является необходимым этапом при получении гистологических срезов, исключающим нарушение целостности срезов. Однако использование микротома требует дегидратации образца в спиртах и использования специальной фиксации биологического образца в парафине. В настоящее время существуют криотомы, которые позволяют получать гистологические срезы без необходимости предварительной фиксации образца, однако являются дорогостоящим оборудованием, требующим сложного обслуживания.
Использование жидкого азота в свободном состоянии в условиях комнатной температуры приводит к образованию сферообразных капель, движение которых по поверхности не позволяет зафиксировать их на образце. Использование фильтровальной бумаги позволяет нанести на поверхность образца жидкий азот (0,808 г/см³) удельной массой 0,0008 грамм на 1 мм2, испарение которого в течение 2-5 секунд приводит к отводу тепла в 0,32 Дж/мм2 (при условии теплоты парообразования азота 400 Дж/грамм). Для биологических тканей средней удельной теплоемкостью около 3,35 Дж/(грамм·град) и плотностью около 1,6 кг/л данный эффект позволяет теоретически снизить температуру эффективного слоя охлаждения (толщиной ~1 мм) на температуру t=-0,32 Дж/(3,35*0,0016 грамм)=-59,7°C.
Известен способ изготовления слайзов пантов северного оленя (RU 2325173 C2), в котором резка пантов на слайзы производится при помощи механических ручных или электромеханических гильотин, а также циркулярных ножей и прочего режущего оборудования. Толщина нарезаемых пластин в зависимости от их использования в дальнейшем составляет от 0,5 мм - до 10 мм (в сыром состоянии). В случае чрезмерной рыхлости ткани панта необходимо произвести нормализацию: погрузить панты вертикально верхушкой вниз в сосуд с водой (панты должны быть полностью в воде) на срок 2-36 часов. Затем разместить в холоде (в морозильной камере, на натуральном морозе или в прочих охлаждающих и замораживающих устройствах) до полной заморозки 1-36 часов в зависимости от диаметра панта при температуре от -3°С до -60°С. В этом случае резка слайзов производится на замороженных пантах. Оптимальный срок нахождения панта в воде составляет 12 часов, температура в морозильной камере - 18°С, время выдержки - 10-12 часов. При более высокой температуре увеличивается время выдержки: а) при - -10°С время заморозки 20-24 часа; б) при -25°С время заморозки 5-8 часов.
Недостатком данного способа является их вымачивание в воде и дальнейшее замораживание образцов в течение продолжительного времени (от 5 до 24 часов), что влияет на структурную организацию получаемых слайзов ткани.
Известно устройство для охлаждения парафиновых блоков с гистологическими или биологическими образцами (RU 135093, 27.11.2013). Устройство для охлаждения парафиновых блоков с гистологическими или биологическими образцами включает холодильник, внешний блок охлаждения в виде охлаждающей платформы со встроенным внутрь змеевиком для пропускания жидкого хладоносителя от холодильника и систему охлаждения держателя образца микротома. Змеевик охлаждающей платформы соединен непосредственно с системой охлаждения держателя образца, выполненной в форме канала внутри держателя образца, трубками, размещенными внутри микротома. Устройство применяют при изготовлении тонких срезов гистологических или биологических образцов для последующего микроскопического исследования, и может найти применение в медицинских и биологических лабораториях, специализирующихся на гистологических и цитологических исследованиях.
Известен способ косвенного охлаждения режущего инструмента (RU 2539272, 20.01.2015), в котором содержится режущий элемент в виде вставной режущей пластины, охлаждаемой косвенно с помощью теплообменника с микроканалами, который установлен у задней поверхности вставной режущей пластины. Теплообменник выполнен с внутренней камерой, в которую подают охлаждающую жидкость, такую как криогенная жидкость. Камера может содержать ребра для улучшения отвода тепла криогенной жидкостью от вставной режущей пластины. С внутренним пространством теплообменника соединены подающая и отводящая трубки для охлаждающей жидкости. Техническим результатом является снижение расхода криогенной жидкости.
Известно автономное устройство для локального охлаждения биологической ткани (RU 138847, 27.03.2014). Устройство включает теплоизолированный цилиндрический герметичный корпус, содержащий герметичную металлическую колбу и теплоизолирующую оболочку из пенополиуретана, затвор, магистраль подвода криоагента и рабочий наконечник, герметичная металлическая колба выполнена с выпуклым дном, теплоизолирующая оболочка из пенополиуретана имеет углубление в центральной части дна корпуса, толщина пенополиуретана между углублением и центром дна герметичной металлической колбы составляет 0,2-0,5 толщины пенополиуретановой теплоизоляции в цилиндрической части корпуса. Углубление в центральной части дна корпуса имеет вид усеченного конуса с диаметром большого основания в пределах 60-70 мм и плоским или выпуклым малым основанием. Толщина пенополиуретана между углублением и центром дна герметичной металлической колбы лежит в пределах 2-5 мм. Устройство снабжено подставкой в виде плоского диска с выступом из пенополиуретана, входящим в углубление теплоизолирующей оболочки из пенополиуретана в центральной части дна корпуса. Подставка может быть укреплена на плоском диске из материала с высокой плотностью, например, металла Устройство обладает улучшенными эксплуатационными и эргономическими характеристиками за счет оптимального распределения теплопритоков по поверхности устройства, обеспечивающего снижение теплопритоков в режиме ожидания на вспомогательном столике для инструментария (при подготовке криопроцедуры) и их повышения при проведении процедуры.
Известно устройство для локального охлаждения ткани (SU 532976, 05.11.1978), в котором передача холода от канюли предлагаемого криоэкстрактора к биологической ткани осуществляется практически в точке, т.е. отсутствует регулирование зоны криовоздействия, что ограничивает область применения криоэкстрактора, для этого корпус снабжен телескопически выдвижным теплоизолированным кожухом, охватывающим канюлю по скользящей посадке. Температуру рабочего конца канюли в процессе операции постоянно контролируют и корректируют с помощью средств автоматизации и регулирования, предусмотренных конструкцией криокоагулятора, в комплект которого входит описанный инструмент или с помощью других известных приборов.
Известно устройство для локального охлаждения биологической ткани (RU 118856, 10.08.2012). Устройство для криовоздействия на ткани человека, включает теплоизолированный корпус, содержащий внутри магистраль подвода криоагента, и сменный рабочий наконечник с хладопроводом из материала с высокой теплопроводностью при температуре кипения жидкого азота, имеющим сплошной рабочий и полый присоединительный концы, и присоединительным узлом для герметичного подсоединения хладопровода к корпусу устройства, хладопровод выполнен в форме тонкостенного стакана из лейкосапфира, выращенного методом некапиллярного формообразования. Устройство обладает улучшенными функциональными и эксплуатационными характеристиками за счет достижения оптимальных свойств хладопроводов сменных рабочих наконечников, обеспечивающих одновременно необходимую теплопроводность, высокую формоустойчивость и хорошую стерилизуемость, а также позволяет увеличить глубину криовоздействия.
Известен микротом с охлаждающим устройством (US 7673546 B2, 09.03.2010 “Microtome having a cooling device”). Микротом содержит охлаждаемый держатель образца для приема образца, причем держатель образца подключен к контуру охлаждающей жидкости. Кроме того, с держателем образца связана охлаждаемая пластина теплопроводности. Образец охлаждают с использованием хладагента до температур от -10°C до -50°C.
Известен микротом криостата с закрывающим устройством (DE4434937 C1, 02.11.1995 “Kryostat-Mikrotom mit einer Abdeckeinrichtung”). Микротом включает отдельную камеру, расположенную в криостате. В стенке камеры имеется удлиненная прорезь, через которую проходит держатель объекта с линейными колебаниями.
Наиболее близким (прототипом) является способ изготовления срезов из свежезамороженной ткани лимфатических узлов (RU 2432575 C2, 27.10.2011). Данный способ предполагает получение срезов путем замораживания биопсийного материала в форме пластинки в n-гексане, охлажденном до температуры -95°С, и далее изготавливают на криостате срезы толщиной не более 7 мкм.
Однако, в известном способе необходимо предварительно охладить образец в морозильной камере, что приводит к образованию трещин на поверхности образца, не позволяя использовать его для получения тканевых срезов. Из экспериментальных данных известно, что требуемой для получения срезов биологических тканей является глубокое охлаждение ее поверхностного слоя до -20°C, что в известных способах достигается опосредованным охлаждением образца путем добавления жидкого азота к теплообменнику.
Техническим результатом заявляемого способа является охлаждение гистологического образца без растрескивания поверхности образца.
Технический результат решается тем, что при изготовлении гистологических срезов образцы предварительно охлаждают при минусовой температуре от -1°C до -15°C, либо погружают в жидкий азот на 2 мин, после чего биоматериал фиксируют в тисках микротома с зажимами и на образец, при помощи пинцета, помещают волокнистый материал в виде фильтровальной бумаги разной плотностью и воздействуют на волокнистый материал жидким азотом 0,808 г/см³, удельной массой 0,0008 грамм на 1 мм2, после чего микротом отрезают слайз необходимой толщины биоматериала. Причем плотность и размер пор волокнистого материала выбирают исходя из требуемого уменьшения температуры поверхности образца.
Изобретение поясняется подробным описанием, таблицей, примерами выполнения и иллюстрациями, на которых изображено:
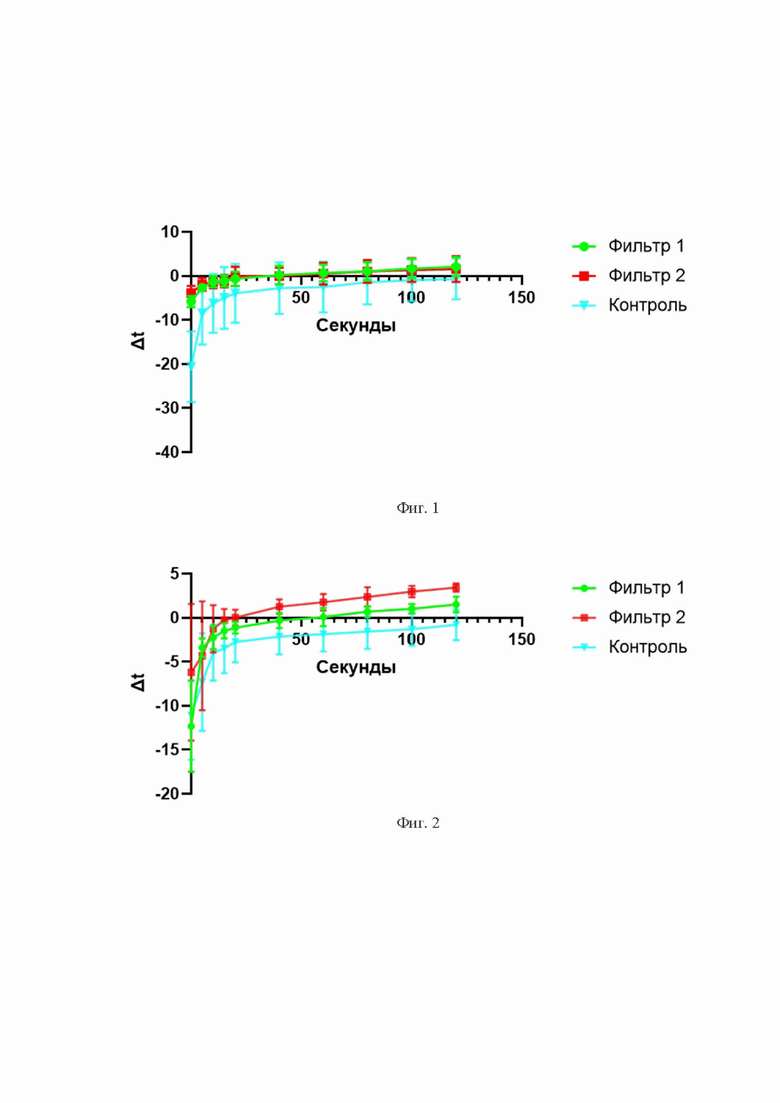
Фиг. 1 - диаграмма примера 1: кривые роста температуры при смачивании жидким азотом в зависимости от типа используемой фильтровальной бумаги: фильтр 1 - зеленый цвет; фильтр 2 - красный; контроль - голубой (отсутствие фильтровальной бумаги).
Фиг. 2 - диаграмма примера 2: кривые роста температуры при смачивании жидким азотом в зависимости от типа используемой фильтровальной бумаги: фильтр 1 - зеленый цвет; фильтр 2 - красный; контроль - голубой (отсутствие фильтровальной бумаги).
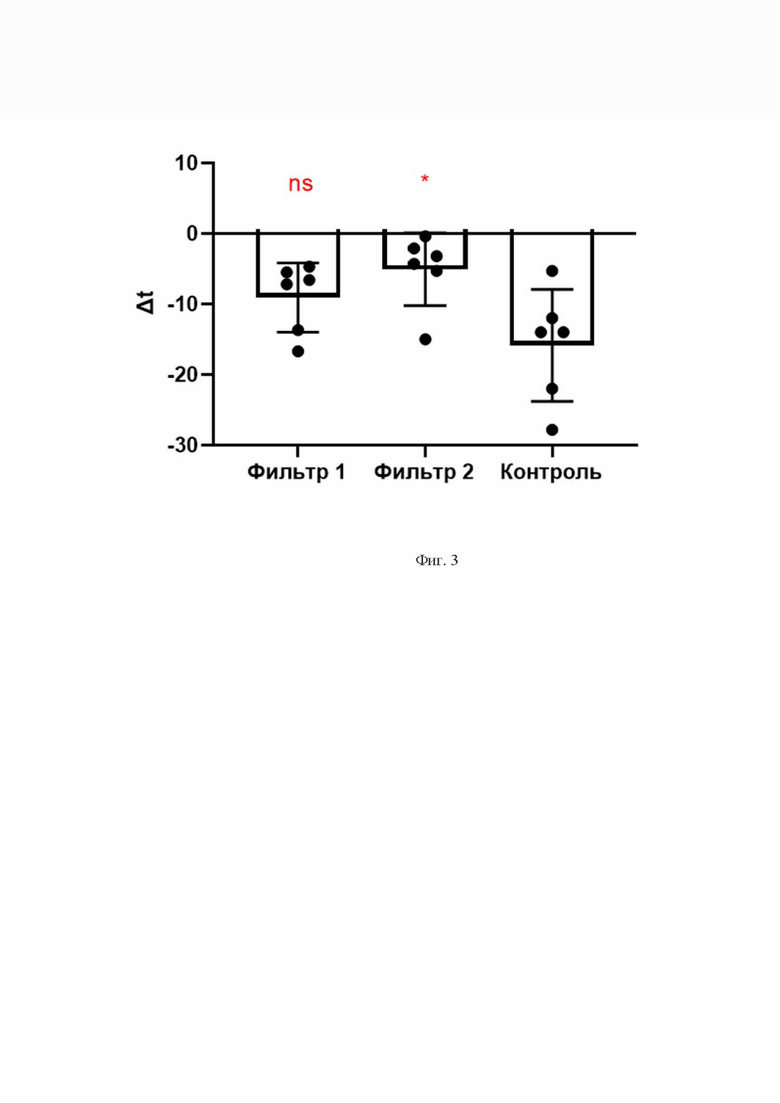
Фиг. 3 - Снижение первоначальной температуры поверхности образца при его смачивании жидким азотом в присутствии фильтровальной бумаги, а также без использования фильтра (Контроль).
Способ осуществляют следующим образом.
При изготовлении гистологических срезов образцы предварительно охлаждают при минусовой температуре (от -1°C до -15°C). После чего биоматериал фиксируют в тисках микротома с зажимами и на образец, при помощи пинцета, помещают волокнистый материал в виде фильтровальной бумаги разной плотностью. Далее на волокнистый материал воздействуют жидким азотом 0,808 г/см³, удельной массой 0,0008 грамм на 1 мм2. Плотность и размер пор волокнистого материала выбирают исходя из требуемого уменьшения температуры поверхности образца, чем ниже необходима конечная температура образца, тем менее плотным должен являться материал фильтровальной бумаги. Так как пористый волокнистый материал задерживает жидкий азот в течение 2-5 секунд, то поверхность биологического материала равномерно охлаждается. Далее на микротоме отрезается слайз необходимой толщины биоматериала, толщина слайза зависит от конечных целей.
Способ иллюстрируется следующими примерами.
Пример 1.
Для приповерхностной заморозки поверхности образцов мышечной ткани, размерами 3,5см*2,5см*2см (Образец-1) и 2см*2см*2см (Образец-2) использовались два образца фильтровальной бумаги со следующими характеристиками:
- фильтр-1: диаметр пор 2-3 мкм, плотность 1,125 г/м2, зольность 0.00048-0.00054 г;
- фильтр-2: диаметр пор 5-8 мкм, плотность 2,75 г/м2, зольность 0.00016-0.00020 г).
Температуру образцов измеряли, используя специальный пирометр IR-T1 Condtrol (3-16-024).
При охлаждении в кипящем слое температура образцов (предварительно охлажденных до температуры от -1°C до -15°C) первоначально снижалась от -5°C (фильтр-2) до -15°C (контрольный образец, без фильтра). При этом отсутствие фильтра приводило к растрескиванию поверхности и порче образца вследствие быстрого охлаждения и расширения водного содержимого образца. При использовании фильтровальной бумаги, напротив, образцы не разрушались, а температура стабильно снижалась вне зависимости от первоначальной температуры в диапазоне от -1°C до -15°C (Фиг. 1).
Пример 2.
Для приповерхностной заморозки поверхности образцов мышечной ткани различного объема, размерами 3,5см*2,5см*2см (Образец-1) и 2см*2см*2см (Образец-2) использовались два образца фильтровальной бумаги со следующими характеристиками: Фильтр-1 (диаметр пор 2-3 мкм, плотность 1,125 г/м2, зольность 0.00048-0.00054 г) и Фильтр-2 (диаметр пор 5-8 мкм, плотность 2,75 г/м2, зольность 0.00016-0.00020 г).
При смачивании фильтровальной бумаги жидким азотом наблюдалось снижение температуры в зависимости от свойств фильтровальной бумаги. Температуру образцов измеряли, используя специальный пирометр IR-T1 Condtrol (3-16-024).
При охлаждении в кипящем слое температура образцов (предварительно охлажденных до температуры от -1°C до -15°C) первоначально снижали от -5°C (фильтр-2) до -15°C (контрольный образец, без фильтра). При этом отсутствие фильтра приводило к растрескиванию поверхности и порче образца вследствие быстрого охлаждения и расширения водного содержимого образца.
При использовании фильтровальной бумаги, напротив, образцы не разрушались, а температура стабильно снижалась вне зависимости от первоначальной температуры в диапазоне от -1°C до -15°C (Фиг. 2).
Данные по образцам 1 и 2 объединены на Фиг. 3 и в таблице 1 (среднее, стандартное отклонение, границы 95% доверительного интервала).
Таблица 1.
Параметры глубины охлаждения при различных условиях
Из таблицы видно, что использование волокнистого материала приводит к снижению температуры поверхности образцов на -9°C и -5°C, в зависимости от свойств материала (пористости и плотности), без повреждения поверхности препарата из-за растрескивания вследствие смачивания жидким азотом.
Использование предложенного способа не требует пробоподготовки образцов тканей перед нарезкой, тем самым сохраняется поверхность образцов достаточно жесткой для получения гистологических срезов, что значительно сокращает время подготовки образцов при гистологическом исследовании.
Предложенный способ позволяет:
- получить гистологические срезы для образцов без предварительной фиксации, основанный на предварительном замораживании образца и его локальным охлаждением перед стадией нарезания;
- предотвратить растрескивание образцов при прямом воздействии жидкого азота.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗГОТОВЛЕНИЯ СЛАЙЗОВ ПАНТОВ СЕВЕРНОГО ОЛЕНЯ | 2006 |
|
RU2325173C2 |
| Способ приготовления гистологических препаратов для выявления внутриклеточных липидных включений в тканях человека и животных | 2019 |
|
RU2705594C1 |
| СПОСОБ ПОДГОТОВКИ ОБРАЗЦОВ КОСТНОЙ ТКАНИ С ИМПЛАНТИРОВАННЫМ МЕТАЛЛОМ ДЛЯ ГИСТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ | 2022 |
|
RU2797125C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАЗАЛЬНЫХ ХОНДРОЦИТОВ НОВОРОЖДЕННЫХ КРЫСЯТ | 2024 |
|
RU2825897C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ГИСТОЛОГИЧЕСКИХ ПРЕПАРАТОВ | 2010 |
|
RU2420299C1 |
| Способ приготовления гистологических препаратов роговицы глаза | 2019 |
|
RU2697475C1 |
| СПОСОБ ВИТРИФИКАЦИИ ОВАРИАЛЬНОЙ ТКАНИ | 2018 |
|
RU2678106C2 |
| Ротационный микротом с вибрирующим режущим устройством для получения срезов живых растительных тканей | 2021 |
|
RU2760452C1 |
| КАССЕТА ДЛЯ ПОДГОТОВКИ ОБРАЗЦОВ БИОЛОГИЧЕСКИХ ТКАНЕЙ К ГИСТОЛОГИЧЕСКОМУ ИССЛЕДОВАНИЮ | 1992 |
|
RU2080579C1 |
| Способ посмертной диагностики аспирации грудного молока или молочной смеси у детей первого года жизни | 2022 |
|
RU2800235C1 |
Изобретение относится к области медицины, а именно к методам лабораторной диагностики. Проводят криоохлаждение поверхности образца для гистологических и иммуногистохимических исследований в жидком азоте. Для чего образец предварительно охлаждают при минусовой температуре от -1 до -15°C, затем фиксируют в тисках микротома с зажимами. На образец, при помощи пинцета, помещают волокнистый материал в виде фильтровальной бумаги. Воздействуют на волокнистый материал жидким азотом 0,808 г/см3, удельной массой 0,0008 г на 1 мм2. Далее микротомом отрезают срез необходимой толщины биоматериала. Способ позволяет получить гистологические срезы с образцов без предварительной их фиксации, что сокращает время подготовки образцов для исследования, а также позволяет предотвратить растрескивание образцов за счет исключения прямого воздействия жидкого азота на образец. 3 ил., 1 табл., 2 пр.
Способ криоохлаждения поверхности образца гистологических и иммуногистохимических исследований, включающий охлаждение образца в жидком азоте, отличающийся тем, что при изготовлении гистологических срезов образцы предварительно охлаждают при минусовой температуре от -1 до -15°C, после чего биоматериал фиксируют в тисках микротома с зажимами и на образец, при помощи пинцета, помещают волокнистый материал в виде фильтровальной бумаги и воздействуют на волокнистый материал жидким азотом 0,808 г/см3, удельной массой 0,0008 г на 1 мм2, после чего микротомом отрезают слайс необходимой толщины биоматериала.
| Yizhong Huang et al | |||
| A Multi-hole Cryovial Eliminates Freezing Artifacts when Muscle Tissues are Directly Immersed in Liquid Nitrogen, J Vis Exp | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ СРЕЗОВ ИЗ СВЕЖЕЗАМОРОЖЕННОЙ ТКАНИ ЛИМФАТИЧЕСКИХ УЗЛОВ | 2009 |
|
RU2432575C2 |
| СПОСОБ ОЦЕНКИ ТИПОВ МЫШЕЧНЫХ ВОЛОКОН | 2015 |
|
RU2628810C2 |
| Способ выявления опухолеспецифичных мишеней в гистологических срезах тканей больных раком легкого человека | 2015 |
|
RU2639238C2 |
| Сычева А.М | |||
| и др | |||
| Оптимизация преаналитического этапа обработки материала для проведения | |||
Авторы
Даты
2022-07-22—Публикация
2021-09-14—Подача