Изобретение относится к регенеративной медицине, в частности к тканевой инженерии, может быть использовано при изготовлении тканеинженерных конструкций, в том числе с применением 3D-биопечати.
Структура и функции хрящевой ткани, например, в суставах, могут быть легко нарушены вследствие травмы, старения или заболевания, что приводит к значительному снижению качества жизни. Из-за своей аваскулярной природы хрящ плохо подвергается регенерации. Достижения регенеративной медицины и тканевой инженерии позволяют решить задачу восстановления хрящевой ткани с помощью имплантации аутологичных хондроцитов и/или тканеинженерных конструкций, содержащих эти же клетки.
Для реализации этих подходов в клинических условиях необходимо получать большие количества жизнеспособных хондроцитов. В то же время хрящ не является самой клеточной тканью, только 2-10% его объема составляют хондроциты [A.O. Oseni, P.E. Butler, A.M. Seifalian Optimization of chondrocyte isolation and characterization for large-scale cartilage tissue engineering. J Surg Res.2013; 181(1):41-8. doi: 10.1016/j.jss.2012.05.087.; S.A. Muhammad, N. Nordin, P. Hussin et al. Optimization of Protocol for Isolation of Chondrocytes from Human Articular Cartilage. Cartilage.2021; 13(2_suppl):872S-884S. doi: 10.1177/1947603519876333.; R. A. Somoza, J. F. Welter Isolation of Chondrocytes from Human Cartilage and Cultures in Monolayer and 3D. Methods Mol Biol. 2021:2245:1-12. doi: 10.1007/978-1-0716-1119-7_1]. Они представляют собой высокоспециализированные клетки, локализованные внутри плотного внеклеточного матрикса (ВКМ) хряща в полостях, известных как лакуны [E.B. Hunziker, T.M. Quinn, H-J Häuselmann Quantitative structural organization of normal adult human articular cartilage. Osteoarthritis Cartilage. 2002;10(7):564-72. doi: 10.1053/joca.2002.0814]. Во время разрушения плотного ВКМ при извлечении хондроцитов они часто подвергаются воздействию агрессивных ферментов в течение продолжительных периодов времени. Это снижает не только конечное количество клеток, но также их жизнеспособность, пролиферативную активность [A.O. Oseni, P. E. Butler, A. M. Seifalian Optimization of chondrocyte isolation and characterization for large-scale cartilage tissue engineering. J Surg Res. 2013; 181(1):41-8. doi: 10.1016/j.jss.2012.05.087] и способность формировать матрикс после изоляции [S.A. Muhammad, N. Nordin, P. Hussin et al. Optimization of Protocol for Isolation of Chondrocytes from Human Articular Cartilage. Cartilage.2021; 13(2_suppl):872S-884S. doi: 10.1177/1947603519876333]. Увеличение количества клеток путем пассирования не решает проблему, так как хондроциты склонны к дедифференцировке в фибробласты при повторных пассажах [Marlovits S., Hombauer M., Truppe M., et al. Changes in the ratio of type-I and type-II collagen expression during monolayer culture of human chondrocytes. J Bone Joint Surg Br. 2004; 86(2):286-95. doi: 10.1302/0301-620x.86b2.14918.; Schlegel W., Nürnberger S., Hombauer M., et al. Scaffold-dependent differentiation of human articular chondrocytes, Int. J. Mol. Med 2008; 22:691-699. doi: 10.3892/ijmm_00000074]. Несмотря на то, что за последние 50 с лишним лет [R. A. Somoza, J. F. Welter Isolation of Chondrocytes from Human Cartilage and Cultures in Monolayer and 3D. Methods Mol Biol. 2021: 2245:1-12. doi: 10.1007/978-1-0716-1119-7_1] протоколы изоляции, размножения и поддержания этих клеток были значительно улучшены, разработка протокола, оптимально подходящего для выделения хондроцитов из ткани, все еще является актуальной задачей. А интенсивное развитие тканевой инженерии и регенеративной медицины требует совершенствования методов выделения клеток мелких лабораторных животных для проведения экспериментальных исследований.
Источником гиалинового хряща в организме человека и животных может быть реберный хрящ или хрящ носовой перегородки. Хондроциты, полученные из хряща носовой перегородки, обладают большим потенциалом в качестве клинически ценного источника клеток для регенерации хрящевой ткани [M.H. Lim, J.H. Jeun, D.H. Kim, et al. Evaluation of Collagen Gel-Associated Human Nasal Septum-Derived Chondrocytes As a Clinically Applicable Injectable Therapeutic Agent for Cartilage Repair. Tissue Eng Regen Med. 2020; 17(3):387-399. doi: 10.1007/s13770-020-00261-9].
Кроме получения назальных хондроцитов из хрящевой ткани человека [B.E. Pippenger, M. Ventura, K. Pelttari, et al. Bone-forming capacity of adult human nasal chondrocytes. J Cell Mol Med. 2015; 19(6):1390-1399. doi: 10.1111/jcmm.12526; G.G. Lehoczky, R.E.Trofin, Q. Vallmajo-Martin, et al. In Vitro and Ectopic In Vivo Studies toward the Utilization of Rapidly Isolated Human Nasal Chondrocytes for Single-Stage Arthroscopic Cartilage Regeneration Therapy. Int J Mol Sci. 2022; 23(13):6900. doi: 10.3390/ijms23136900.; J.H. Jeon, B.G. Yun, M.J. Lim, et al. Rapid Cartilage Regeneration of Spheroids Composed of Human Nasal Septum-Derived Chondrocyte in Rat Osteochondral Defect Model. Tissue Eng Regen Med. 2020; 17(1):81-90. doi: 10.1007/s13770-019-00231-w.; M. Mumme, A. Barbero, S. Miot, et al. Nasal chondrocyte-based engineered autologous cartilage tissue for repair of articular cartilage defects: an observational first-in-human trial. Observational Study Lancet. 2016; 388(10055):1985-1994. doi: 10.1016/S0140-6736(16)31658-0.; M. H. Lim, J.H. Jeun, D.H. Kim, et al. Evaluation of Collagen Gel-Associated Human Nasal Septum-Derived Chondrocytes As a Clinically Applicable Injectable Therapeutic Agent for Cartilage Repair. Tissue Eng Regen Med. 2020; 17(3):387-399. doi: 10.1007/s13770-020-00261-9] описано использование для этих целей таких животных, как крысы [K. Bardsley, A. Kwarciak, C. Freeman, et al. Repair of bone defects in vivo using tissue engineered hypertrophic cartilage grafts produced from nasal chondrocytes. Biomaterials. 2017: 112:313-323. doi: 10.1016/j.biomaterials.2016.10.014.; C. Bermueller, S. Schwarz, A.F. Elsaesser, et al. Marine collagen scaffolds for nasal cartilage repair: prevention of nasal septal perforations in a new orthotopic rat model using tissue engineering techniques Tissue Eng Part A. 2013; 19(19-20):2201-14. doi: 10.1089/ten.TEA.2012.0650], кролики [W. Chen, C. Li, M. Peng, et al. Autologous nasal chondrocytes delivered by injectable hydrogel for in vivo articular cartilage regeneration. Cell Tissue Bank. 2018; 19(1):35-46. doi: 10.1007/s10561-017-9649-y.; Y. Yan, R. Fu, C. Liu, et al. Sequential Enzymatic Digestion of Different Cartilage Tissues: A Rapid and High-Efficiency Protocol for Chondrocyte Isolation, and Its Application in Cartilage Tissue Engineering. Cartilage. 2021; 13(2_suppl):1064S-1076S. doi: 10.1177/19476035211057242], овцы [A.O. Oseni, P. E. Butler, A. M. Seifalian Optimization of chondrocyte isolation and characterization for large-scale cartilage tissue engineering. J Surg Res. 2013; 181(1):41-8. doi: 10.1016/j.jss.2012.05.087] и крупный рогатый скот [W. Kafienah, M. Jakob, O. Démarteau, et al. Three-dimensional tissue engineering of hyaline cartilage: comparison of adult nasal and articular chondrocytes. Comparative Study Tissue Eng. 2002; 8(5):817-26. doi: 10.1089/10763270260424178.; M.B Pabbruwe, E. Esfandiari, W. Kafienah, et al. Induction of cartilage integration by a chondrocyte/collagen-scaffold implant. Biomaterials. 2009; 30(26):4277-86. doi: 10.1016/j.biomaterials. 2009.02.052]. От способа получения фрагментов хрящевой ткани зависит продолжительность ферментативного воздействия на них, что оказывает непосредственное влияние на жизнеспособность изолированных клеток. У человека материал получают или при биопсии с помощью перфоратора, или во время пластических операций на носовой перегородке. Обычно авторы не описывают подробно эти процедуры. Только в одной работе приводится способ извлечения фрагментов хряща диаметром 6 мм из носовой перегородки под местной анестезией через разрез Киллиана (около 10 мм краниальнее каудальной границы перегородки и примерно 5 мм дорсально от переходной зоны к верхней челюсти) с использованием инструмента для пункционной биопсии. После того, как образец хряща был отделен от надхрящницы, разрезан на небольшие кусочки и обработан ферментативно, изолированные назальные хондроциты культивировали в течение 2 недель до применения [M. Mumme, A. Barbero, S. Miot, et al. Nasal chondrocyte-based engineered autologous cartilage tissue for repair of articular cartilage defects: an observational first-in-human trial. Observational Study Lancet. 2016; 388(10055):1985-1994. doi: 10.1016/S0140-6736(16)31658-0].
Способы получения фрагментов носовой перегородки у животных различаются в зависимости от вида животного.
Известен способ прижизненного получения фрагментов носовой перегородки диаметром 2 мм при биопсии у новозеландского кролика под общей анестезией [W. Chen, C. Li, M. Peng, et al. Autologous nasal chondrocytes delivered by injectable hydrogel for in vivo articular cartilage regeneration. Cell Tissue Bank. 2018; 19(1):35-46. doi: 10.1007/s10561-017-9649-y]. У таких животных, как овцы и крупный рогатый скот, образцы хряща отбирали в течение нескольких часов после убоя [A.O. Oseni, P. E. Butler, A. M. Seifalian Optimization of chondrocyte isolation and characterization for large-scale cartilage tissue engineering. J Surg Res. 2013; 181(1):41-8. doi: 10.1016/j.jss.2012.05.087.; W. Kafienah, M. Jakob, et al. Three-dimensional tissue engineering of hyaline cartilage: comparison of adult nasal and articular chondrocytes. Comparative Study Tissue Eng. 2002; 8(5):817-26. doi: 10.1089/10763270260424178.; M.B Pabbruwe, E. Esfandiari, W. Kafienah, et al. Induction of cartilage integration by a chondrocyte/collagen-scaffold implant. Biomaterials. 2009; 30(26):4277-86. doi: 10.1016/j.biomaterials.2009.02.052]. В работе M.B. Pabbruwe et al. (2009) для этого использовали перфоратор для биопсии кожи, извлекая фрагменты цилиндрической формы диаметром 8 мм и толщиной 4,0 мм.
В двух работах для получения хрящевой ткани носовой перегородки использовали взрослых крыс [C.C. Bermueller, S. Schwarz, A.F. Elsaesser, et al. Marine collagen scaffolds for nasal cartilage repair: prevention of nasal septal perforations in a new orthotopic rat model using tissue engineering techniques Tissue Eng Part A. 2013; 19(19-20):2201-14. doi: 10.1089/ten.TEA.2012.0650.; K. Bardsley, A. Kwarciak, C. Freeman, et al. Repair of bone defects in vivo using tissue engineered hypertrophic cartilage grafts produced from nasal chondrocytes. Biomaterials. 2017: 112:313-323. doi: 10.1016/j.biomaterials.2016.10.014]. Способы извлечения хряща не описаны.
Во всех представленных случаях фрагменты хряща после измельчения подвергают ферментативной обработке в течение определенного времени, которое отличается у разных авторов. Используют различные комбинации ферментов, но чаще всего коллагеназу II типа, концентрация которой составляет от 0,15% до 0,3% в разных исследовательских группах. После определения жизнеспособности изолированные клетки высевают в хондрогенную или обычную среду и культивируют или замораживают после одного пассажа в зависимости от задач исследования.
Во всех приведенных работах фрагменты хряща для получения хондроцитов отбирали у взрослых животных, что является существенным недостатком. Известно, что количество и жизнеспособность хондроцитов, изолированных из хрящевой ткани, кроме других факторов, коррелирует с возрастом донора [A. Barbero, S. Grogan, D. Schäfer, et al. Age related changes in human articular chondrocyte yield, proliferation and post-expansion chondrogenic capacity. Osteoarthritis and Cartilage, 2004; 12: 476-484. doi:10.1016/j.joca.2004.02.010]. Поэтому предпочтительней отбирать хрящи у молодых животных или даже эмбрионов.
За прототип взят способ получения фрагментов хряща носовой перегородки с последующей изоляцией хондроцитов у 21-дневных эмбрионов крысы [J.M. Sautier, J.R. Nefussi, N. Forest. In vitro differentiation and mineralization of cartilaginous nodules from enzymatically released rat nasal cartilage cells. Biol Cell. 1993; 78(3):181-9. doi: 10.1016/0248-4900(93)90128-2]. Этот же способ был использован и в более поздних работах [R. Nadra, P. Menuelle, S. Chevallier, A. Berdal. Regulation by glucocorticoids of cell differentiation and insulin-like growth factor binding protein production in cultured fetal rat nasal chondrocytes. J Cell Biochem. 2003; 88(5):911-22. doi: 10.1002/jcb.10396] и [А. Asselin, S. Hattar, M. Oboeuf, D. et al. The modulation of tissue-specific gene expression in rat nasal chondrocyte cultures by bioactive glasses. Biomaterials. 2004; 25(25):5621-30. doi: 10.1016/j.biomaterials.2004.01.016]. Авторы отбирали ткани 21-дневных эмбрионов крысы Sprague-Dawley. Извлекали матку с плодами и сразу же помещали в холодный фосфатно-буферный раствор (PBS). В среднем было получено 13 плодов от одной беременной крысы. Отдельные эмбрионы были обезглавлены и у них снимали кожу до переднего края носовой кости. Под препаровальным микроскопом рассекали лобно-носовые швы, центральную часть межносовых швов и хрящи носовой перегородки, очищали от надкостницы и соединительной ткани. Фрагменты ткани перед диссоциацией объединяли и инкубировали на магнитной мешалке в течение 2 ч при 37°С в ферментной смеси коллагеназы (0,25%) и гиалуронидазы (0,1%). По истечении периода инкубации клетки механически диссоциировали путем отсасывания фрагментов ткани через стеклянную пипетку объемом 10 мл. Полученную клеточную суспензию фильтровали через 13-мм металлический фильтр Swinney для удаления остатков тканей. Суспензию центрифугировали при 1600 об/мин в течение 5 мин, трижды промывали в PBS, подсчитывали и ресуспендировали в среде DMEM с добавлением 10% фетальной телячьей сыворотки (Biosis), 10 мМ/3-глицерофосфата (Sigma), 50 мкг/мл аскорбиновой кислоты и антибиотиков (50 ЕД /мл пенициллина, 50 мкг/мл стрептомицина). Затем клетки высевали в количестве 2×105 клеток/см2 в чашки для культивирования диаметром 50 мм (Falcon) или на покровные стекла для иммуногистохимических исследований. Клетки инкубировали во влажном инкубаторе в атмосфере из 5% СО2 и воздуха, а среду для культивирования меняли каждые 48 ч в течение 12 суток, чтобы проследить морфологические изменения в культурах.
Однако иссечение фрагментов хряща под микроскопом трудоемко и требует высокой квалификации сотрудников, а механическая диссоциация клеток может повреждать их в не меньшей степени, чем ферментативная обработка.
Техническим решением является разработка способа получения изолированных назальных хондроцитов новорожденных крысят, обладающих высокой адгезионной способностью и пролиферативной активностью.
Технический результат решается тем, что так же, как и в известном способе, получают фрагменты хряща, а затем изолируют из них хондроциты ферментативным путем.
Особенностью заявляемого способа является то, что фрагменты носового хряща получают у 4-8-дневных крысят на полуавтоматическом микротоме с вибрирующим лезвием, промывают их в стерильном фосфатно-солевом буферном растворе, измельчают и подвергают однократной обработке 0,15% раствором коллагеназы I типа в течение 20 часов при 37°С, после чего клетки отмывают от фермента центрифугированием в питательной среде с добавлением сыворотки крови животных, определяют их жизнеспособность на проточном цитометре, культивируют во флаконах до образования монослоя, снимают с пластика, типируют и замораживают.
Изобретение поясняется подробным описанием, примерами использования и иллюстрациями, на которых изображено:
Фиг. 1 - Микротом с вибрирующим лезвием Leica VT1200 (Германия), общий вид: слева направо: панель управления; блок питания; базовый прибор.
Фиг. 2 - фотоиллюстрация: голова 8-дневного крысенка, зафиксированная на диске для образцов с помощью цианакрилатного клея в буферном поддоне до начала резки.
Фиг. 3 - фотоиллюстрация: срез головы животного, выполненный с помощью вибрирующего микротома.
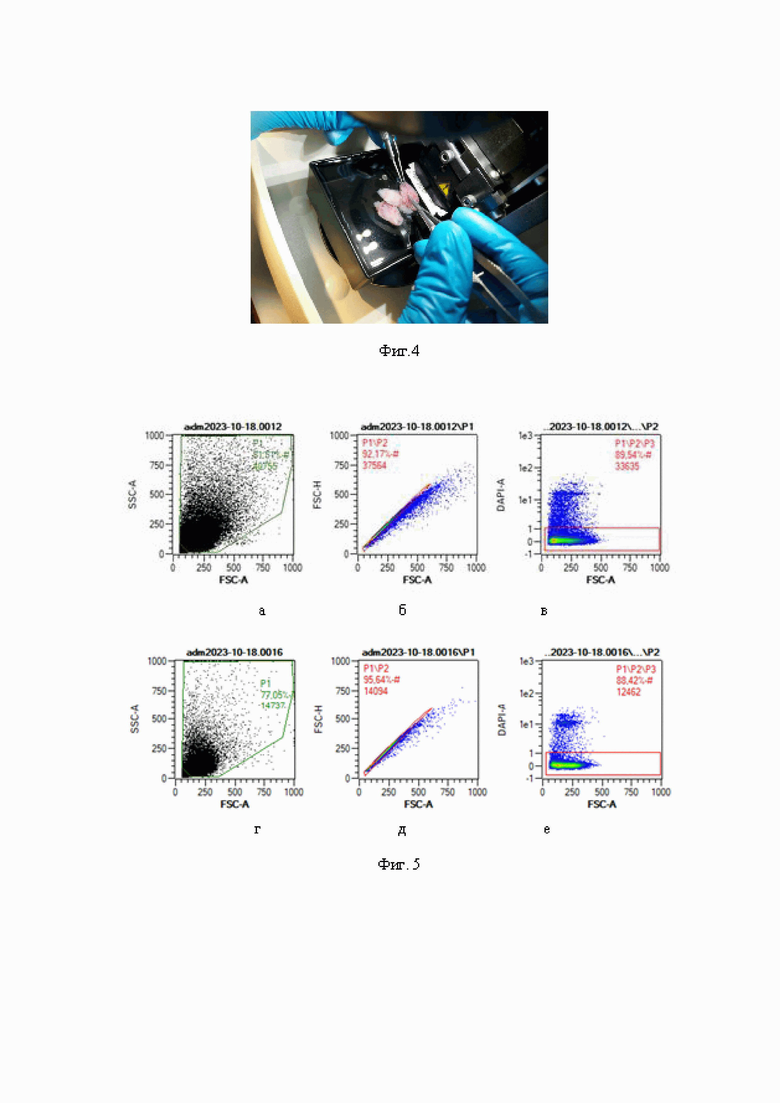
Фиг. 4 - фотоиллюстрация извлечения носовой перегородки и носовых раковин хирургическими инструментами.
Фиг. 5 - Сравнительная схема проведения анализа проточной цитометрии: а, б, в) анализ проточной цитометрии - хондроциты получены по предложенному способу; г, д, е) анализ проточной цитометрии - клетки получены по стандартной методике. N=4.
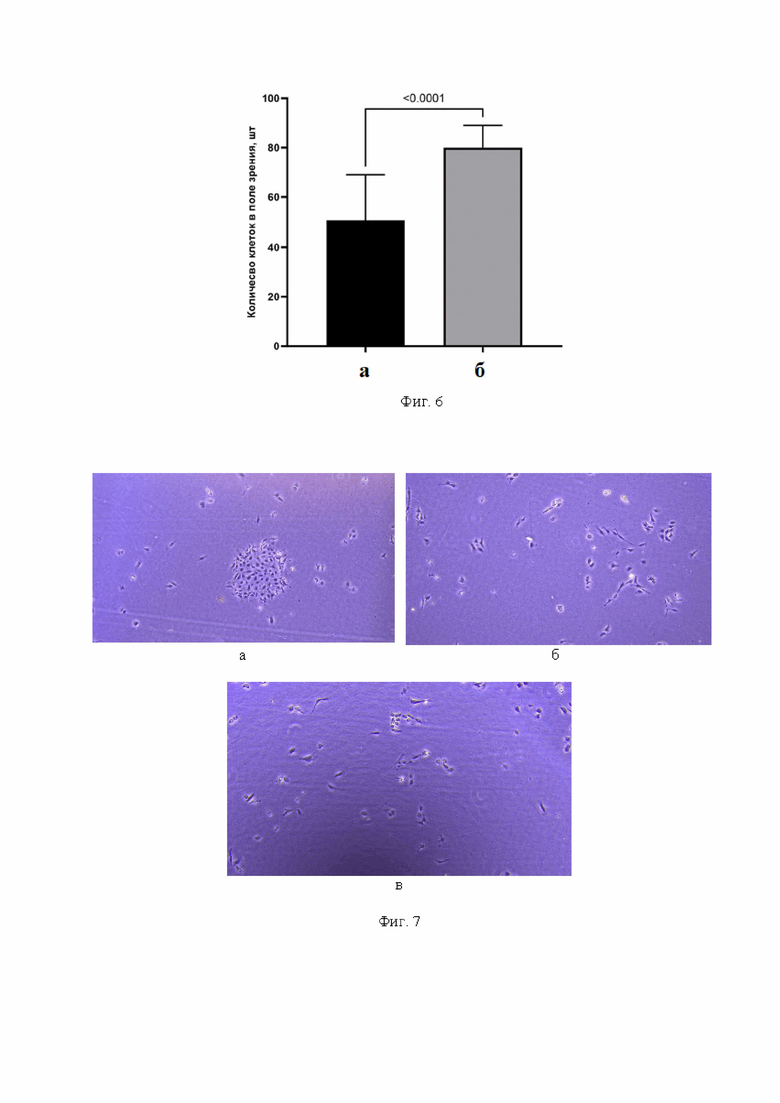
Фиг. 6 - Диаграмма распределения количества клеток в поле зрения: а) стандартный способ получения хондроцитов и б) предлагаемый нами способ получения хондроцитов, (N=24).
Фиг. 7 - фотоиллюстрация назальных хондроцитов, изолированных с помощью микротома, на 2-е сутки после посева: а) колония (> 50 клеток); б, в) отдельные клетки.
Об. × 5 фазовый контраст.
Фиг. 8 - Фотоиллюстрация назальных хондроцитов, изолированных по стандартной методике: а, б) отдельные клетки и колонии (< 50 клеток) на 2-е сутки после посева.
Об. × 5 фазовый контраст.
Фиг. 9 - Фотоиллюстрация: монослой во флаконе с назальными хондроцитами, изолированными с применением микротома, 6-й день. Об. × 5 фазовый контраст.
Фиг. 10 - Фотоиллюстрация: монослой во флаконе с назальными хондроцитами, изолированными по стандартной методике, 7-й день. Об. × 5 фазовый контраст.
Способ осуществляют следующим образом.
Вначале подготавливают к работе микротом с вибрирующим лезвием (Leica VT1200, Германия) (Фиг. 1). На базовый прибор устанавливают поддон для льда, в него помещают буферный поддон, в котором, в свою очередь, закрепляют диск для образцов. Предварительно поддоны и диск стерилизуют в 70%-ном этиловом спирте. Буферный поддон заполняют холодным стерильным фосфатно-солевым буферным раствором рН - 7,4 («ЭКО-Сервис», Россия). Закрепляют стерильное лезвие в держателе. На панели управления настраивают вручную скорость резания, толщину срезов и амплитуду вибрации.
Для получения фрагментов хряща из носовой перегородки используют новорожденных крысят (возраст от 4 до 8 дней).
Производят декапитацию животного на уровне 1-2 шейного позвонка. Голову животного фиксируют горизонтально на диске для образцов с помощью цианакрилатного клея, погружают в фосфатный буфер и устанавливают лезвие микротома на уровне носовых проходов под углом 45-50° к поверхности кожи (Фиг. 2). С помощью микротома выполняют автоматический срез головы животного на указанном уровне в горизонтальной проекции (Фиг. 3). На полученном препарате отчетливо визуализируется перпендикулярная пластинка носовой перегородки и носовые раковины. При помощи глазных ножниц двумя разрезами по направлению сверху вниз рассекают перпендикулярную пластинку носовой перегородки в области переднего септального угла и перпендикулярной пластинки решетчатой кости. При помощи пинцета (например, офтальмологического или микрохирургического пинцета с шириной кончиков не более 1 мм) захватывают носовую перегородку в области переднего септального узла. Непрерывной вертикальной тракцией единым блоком извлекают препарат носовой перегородки и носовых раковин (Фиг. 4). Удаляют соединительную ткань и надхрящницу, измельчают на фрагменты толщиной 3-4 мм.
Далее фрагменты дважды промывают стерильным фосфатно-солевым буфером рН - 7,4 («ЭКО-Сервис», Россия) с добавлением антибиотиков: 50 ЕД /мл пенициллина, 50 мкг/мл стрептомицина и помещают в 0,15%-ный раствор коллагеназы I типа (Gibco, США) в среде DMEM с содержанием глюкозы 4,5 г/л (ПанЭко, Россия), инкубируют при +37°C и 5% CO2 в течение ~20 ч в CO2-инкубаторе (SCO5W, Shellab, США). После инкубации для окончательного разделения клеток раствор перемешивают 30 мин при 100 об/мин на магнитной мешалке (Biosan, Латвия). Нерасщепленные фрагменты ткани удаляют фильтрованием (100 нм, нейлон; SPL Lifesciences, Южная Корея). Затем клетки осаждают в течение 5 мин при 400 g (центрифуга Hermle Z446K, Германия). Для отмывания от фермента клеточный осадок ресуспендируют в среде DMEM с содержанием глюкозы 4,5 г/л (ПанЭко, Россия), содержащей 10% эмбриональной телячьей сыворотки (Biosera, Бразилия) и центрифугируют в том же режиме. Процедуру повторяют дважды. После этого клетки ресуспендируют в среде DMEM с сывороткой, подсчитывают в камере Горяева, часть клеток отбирают для проточной цитометрии. Оставшуюся клеточную суспензию переносят в культуральные флаконы Corning (США) из расчета не менее 10 000 на см2 поверхности, добавляют среду DMEM (содержание глюкозы 4,5 г/л), содержащую 10% эмбриональной телячьей сыворотки, пенициллин-стрептомицин (по 50 ЕД/мкг/мл), глютамин (649 мкг/мл) и помещают в СО2-инкубатор для прикрепления. Через 24 ч производят замену среды на свежую. Культивируют до образования монослоя, после чего снимают с пластика. На этом этапе клетки типируют, затем используют в экспериментах или замораживают.
Способ подтверждается экспериментальными данными.
Пример 1
В день эксперимента получали назальные хондроциты у 8-дневных беспородных крысят. Всего было взято 8 животных, разделенных на две группы по 4. У крысят первой группы хондроциты получали предлагаемым способом. У крысят второй группы использовали способ изоляции хондроцитов со стандартной ферментативной обработкой, описание которого приводится ниже.
Производили декапитацию животного на уровне 1-2 шейного позвонка. Голову помещали в чашку Петри в стерильный фосфатно-солевой буферный раствор. Снимали кожу и ножницами производили поперечный разрез на уровне глаз, отделяя верхнюю челюсть. Затем строго по центру вдоль спинки носа в сагиттальном направлении выполняли рассечение тканей. На полученном препарате четко визуализируется носовая перегородка. Иссекали носовую перегородку с окружающими тканями и промывали ее в фосфатно-солевом буферном растворе с добавлением антибиотиков. Для удаления всех мягких тканей хрящи помещали в стакан с 0,25% раствором трипсина и 0,2% раствором коллагеназы I типа в питательной среде DMEM (ПанЭко, Россия) в соотношении 1:1. Перемешивали при 100 об/мин на магнитной мешалке (Biosan, Латвия) 30 минут при +37°С. Процедуру повторяли еще раз со свежими растворами. Затем два раза перемешивали по 30 минут только в 0,25% растворе трипсина, меняя раствор. Центрифугировали при 100 G 2 мин (центрифуга Hermle Z446K, Германия). Супернатант выбрасывали, хрящи помещали в новый стакан с 0,15% раствором коллагеназы I типа в питательной среде DMEM и оставляли на ночь при +37°С в СО2 в инкубаторе SCO5W, Shellab (США). На следующий день после ~20 часовой инкубации для окончательного разделения клеток раствор один раз перемешивали в течение 30 минут на магнитной мешалке при 100 об/мин, непереваренные фрагменты удаляли фильтрованием через сито для клеток с размером пор 100 нм (нейлон; SPL Lifesciences, Южная Корея). Для отмывания от фермента фильтрат центрифугировали при 400 G 5 минут, к осадку добавляли питательную среду DMEM с 10% сыворотки, операцию повторяли еще раз. После последнего центрифугирования клеточный осадок ресуспендировали в питательной среде DMEM, часть клеток отбирали для проточной цитометрии. Оставшуюся клеточную суспензию переносили в культуральные флаконы Corning (США) из расчета не менее 10000 на см2 поверхности, добавляли среду DMEM (содержание глюкозы 4,5 г/л), содержащую 10% эмбриональной телячьей сыворотки (Biosera, Бразилия), пенициллин-стрептомицин (по 50 ЕД/мкг/мл), глютамин (649 мкг/мл) и помещали в СО2-инкубатор для прикрепления. Через 24 ч производили замену среды на свежую. Культивировали до образования монослоя, после чего снимали с пластика, типировали и замораживали.
Способы сравнивали между собой по нескольким показателям:
1) количество живых клеток непосредственно после изоляции из хряща;
2) количество клеток в пересчете на одно животное;
3) способность клеток к адгезии и их пролиферативная активность;
4) время образования монослоя.
Изолированные из хрящевой ткани клетки подсчитывали в камере Горяева каждый образец не менее, чем в двух полях зрения под микроскопом Leica DMi1 (Leica Microsystem, Germany).
Живые и мертвые клетки детектировали после окрашивания флуоресцентным красителем DAPI (1 мкг/мл, D1306, Invitrogen, США) с помощью проточной цитометрии. Проточную цитометрию проводили на MACSQuant Analyzer 16 (Miltenyi Biotec, Германия).
Приводим принципиальную схему проведения анализа проточной цитометрии клеток, полученных по предложенному нами способу (Фиг. 5 а, б, в) и схему проточной цитометрии клеток, полученных по стандартной методике (Фиг. 5 г, д, е).
Для измерения флуоресценции DAPI использовали канал V1 c фильтром 450/50 нм. Общий объем пробы составлял 400 мкл, для анализа отбиралось 50 мкл. В образцах (N=4) количество записываемых событий составляло 50000 для предлагаемой методики и от 19127 до 35525 для стандартной. Разное количество событий связано с разным количеством изолированных клеток. Стратегия гейтирования проточной цитометрии заключалась в отсечении дебриса, построении региона P1 по FSC-A против SSC-A. Для отсечения клеточных дуплетов строился регион P2 по гейту 1 на диаграмме FSC-A против FSC-H. Далее из гейта 2 выбирались события с низкой интенсивностью флуоресценции DAPI и задавался регион P3.
Для исследования способности к адгезии и пролиферативной активности клеток их подсчитывали через 2-е суток после посева во флаконах, не снимая с пластика, и на 5-е сутки, - снимая. Через 2 суток после посева считали количество распластанных клеток в поле зрения. Для этого фотографировали клетки в каждом флаконе в 12 полях зрения по всему периметру флакона с помощью микроскопа Leica DMi1 (Leica Microsystem, Germany; Flexacam C1 camera, Leica Microsystem, Germany) с объективом ×5. Подсчет клеток на фотографиях проводили в программе ImageJ 1.52a. Каждая группа состояла из 2-х флаконов с площадью поверхности 25 см2. На 5-е сутки клетки снимали с пластика раствором трипсина-ЭДТА (ПанЭко, Россия), ресуспендировали и подсчитывали в камере Горяева в двух полях зрения каждый образец. % конфлюэнтности определяли визуально под микроскопом Leica DMi1c объективом ×5, осматривая флаконы ежедневно.
Статистическая обработка
Статистическую обработку проводили с использованием однофакторного дисперсионного анализа one-way ANOVA. Данные сравнивали по U-критерию Манна - Уитни, P < 0,05 считали статистически значимым. Графики строили в программе GraphPad Prism 10.
Результаты
Количество живых клеток, изолированных из фрагментов хряща, полученных с помощью вибрирующего микротома, по данным проточной цитометрии составило 89,78 ± 0,20%, в то время как при использовании стандартного протокола - 88,59 ± 0,14%. Между группами есть достоверное различие (P < 0,05) по U-критерию Манна-Уитни. Это говорит о том, что жизнеспособность клеток, полученных предлагаемым способом, сразу после изоляции из хряща отличалась в лучшую сторону от жизнеспособности клеток, изолированных по стандартному протоколу. Количество клеток в пересчете на одно животное по предлагаемому методу составляло 747500 ± 38891 и 306667 ± 9428 по стандартному, отличаясь в 2,4 раза.
Подсчет клеток на вторые сутки после посева показал, что медиана количества клеток в поле зрения для стандартного метода составляет 51 (Фиг. 6 а), в то время как для предлагаемого - 80 (Фиг. 6 б). Между группами есть достоверные различия по U-критерию Манна-Уитни (P < 0.00001). Во флаконах с клетками, изолированными с применением микротома, на этом сроке мы наблюдали присутствие мелких и более крупных (> 50 клеток) колоний (Фиг. 7 а) и делящиеся клетки (Фиг. 7 б, в). Во флаконах с клетками, изолированными по стандартной методике, делящиеся клетки встречались реже, колонии чаще содержали менее 50 клеток (Фиг. 8 а, б). На 5-е сутки общее количество клеток в первом случае составляло 1 550 000 ± 14142/флакон, во втором - 750 000 ± 42426/флакон, т.е. различалось в 2 раза. Поскольку количество посеянных клеток было одинаковым (232 000 ± 3535/флакон) в обоих случаях, из этого следует, что в группе предлагаемого метода число клеток увеличилось в 6,6 раза, в группе стандартного метода - только в 3,2 раза. Клетки первой группы на 6-е сутки сформировали 100% монослой (Фиг. 9), в то время как во второй группе монослой был сформирован на сутки позже, и на 7-е сутки встречались отдельные «окна», не заполненные клетками (Фиг. 10).
Выводы
Предлагаемый способ изоляции назальных хондроцитов с применением вибрирующего микротома позволяет получить большее количество жизнеспособных клеток, в том числе в пересчете на одно животное. Клетки обладают лучшей адгезионной способностью, более короткой лаг-фазой и более высокой скоростью пролиферации (по сравнению с клетками, изолированными по стандартной методике с длительной ферментативной обработкой), и может быть использован при изготовлении тканеинженерных конструкций, в том числе с применением 3D-биопечати.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ХРЯЩЕПОДОБНЫХ СТРУКТУР ИЗ СТВОЛОВЫХ КЛЕТОК С ИНДУЦИРОВАННОЙ ПЛЮРИПОТЕНТНОСТЬЮ И СТРУКТУРЫ, ПОЛУЧЕННЫЕ УКАЗАННЫМ СПОСОБОМ | 2023 |
|
RU2814248C1 |
| Способ биофабрикации трансплантата в виде клеточных сфероидов для регенеративных технологий восстановления хряща субъекта на основе надхрящницы собственного реберного хряща субъекта и мультипотентных мезенхимальных стромальных клеток костного мозга этого же субъекта | 2022 |
|
RU2800991C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРЕХМЕРНОГО ХОНДРОТРАНСПЛАНТАТА | 2008 |
|
RU2392973C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДОНОРСКИХ ХОНДРОБЛАСТОВ | 2004 |
|
RU2285039C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ГИАЛИНОВОГО ХРЯЩА ПРИ ЛЕЧЕНИИ ВНУТРИСУСТАВНЫХ ПЕРЕЛОМОВ | 2008 |
|
RU2364360C1 |
| Трансплантат - тканеинженерная надхрящница для восстановления хряща субъекта | 2023 |
|
RU2822238C1 |
| СПОСОБ ПРОИЗВОДСТВА КЛЕТОЧНЫХ СФЕРОИДОВ ДЛЯ ВОССТАНОВЛЕНИЯ ХРЯЩЕЙ | 2019 |
|
RU2731314C1 |
| Способ создания тканеинженерных конструкций методом биопечати биочернилами для регенерации хрящевой ткани в условиях организма | 2021 |
|
RU2770558C2 |
| Способ оценки эффективности применения клеточно-инженерной конструкции на основе полимерного носителя и клеточной культуры в эксперименте при замещении дефектов гиалинового хряща | 2022 |
|
RU2805231C1 |
| СПОСОБ РЕГЕНЕРАЦИИ ХРЯЩЕВОЙ ГИАЛИНОВОЙ ТКАНИ СУСТАВОВ НА НАЧАЛЬНЫХ СТАДИЯХ ДЕСТРУКТИВНЫХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2452527C1 |


Изобретение относится к области биотехнологии, в частности к способу получения назальных хондроцитов новорожденных крысят. Указанный способ включает получение фрагментов хряща с последующим изолированием из них хондроцитов ферментативным путем, причем фрагменты носового хряща получают у 4-8-дневных крысят на полуавтоматическом микротоме с вибрирующим лезвием. Изобретение обеспечивает получение большего количества жизнеспособных клеток, в том числе в пересчете на одно животное, причем указанные клетки обладают лучшей адгезионной способностью, более короткой лаг-фазой и более высокой скоростью пролиферации. 10 ил., 1 пр.
Способ получения назальных хондроцитов новорожденных крысят, включающий получение фрагментов хряща с последующим изолированием из них хондроцитов ферментативным путем, отличающийся тем, что фрагменты носового хряща получают у 4-8-дневных крысят на полуавтоматическом микротоме с вибрирующим лезвием, промывают их в стерильном фосфатно-солевом буферном растворе, измельчают и подвергают однократной обработке 0,15%-ным раствором коллагеназы I типа в течение 20 часов при 37°С, после чего клетки отмывают от фермента центрифугированием в питательной среде с добавлением сыворотки крови животных, определяют их жизнеспособность на проточном цитометре, культивируют во флаконах до образования монослоя, снимают с пластика, типируют и замораживают.
| СПОСОБ ПОЛУЧЕНИЯ ДОНОРСКИХ ХОНДРОЦИТОВ | 2009 |
|
RU2409662C2 |
| Способ выделения хондроцитов | 2017 |
|
RU2677688C1 |
| ISAEVA E.V | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| Катодная лампа с внешним подогревом | 1923 |
|
SU493A1 |
| ЛЫЗО Т.С | |||
| и др | |||
| Морфофункциональная характеристика пролиферации хондроцитов при экспериментальном остеоартрозе у крыс, | |||
Авторы
Даты
2024-09-02—Публикация
2024-02-15—Подача