Изобретение относится к области медицины и биологии, а именно к гистологии и к гистологической технике и может быть использовано в практике патоморфологических лабораторий лечебных учреждений и морфологических кафедр высших учебных заведений медицинского и биологического профиля.
В морфофункциональном отношении кость является одной из наиболее сложных и биологически активных тканей. По многим показателям она превосходит другие системы организма и является наиболее массивной, многофункциональной, обладает высокой метаболической и репаративной активностью. Костная ткань в разных участках на 20-25% состоит из органического матрикса. Большей частью любой кости в организме человека является неорганическая составляющая, которая в основном представлена гидроксиапатитом кальция (Внутрикостные блокады. Клинические наблюдения: монография / Л.Е. Корнилова, Л.Е. Соков, О.П. Артюков. - Москва: Издательский Дом Академии Естествознания, 2014. - 173 с.) [1]. Такое соотношение органического и неорганического компонентов костной ткани требует особого подхода к подготовке материала для гистологического исследования.
Особый интерес для врачей, работающих с костной тканью, представляет остеоинтеграция имплантируемого материала, а конкретно - степень минерализации кости вокруг него. В стоматологической практике чаще всего исследуют ткани на границе кость/металл. В качестве металла выступают различные сплавы титана, из которых изготавливают дентальные имплантаты (титан марки ВТ-100, Grade 4, Grade 5) или остеопластические материалы (например, пористый титан «Natix»).
Процесс приготовления костной ткани для гистологического исследования достаточно трудоемкий, но, как правило, именно на этапе получения срезов костной ткани с имплантируемым материалом случается больше всего ошибок, приводящих к затруднению визуализации костных структур.
Из уровня техники известны следующие способы получения гистологических препаратов костной ткани.
Один из основополагающих способов получения гистологических препаратов костной ткани был известен еще с середины XX века, он предусматривает фиксацию костной ткани 10%-ным раствором формалина с промывкой водой, обезжиривание спиртом и декальцинацией в 5-10%-ном растворе азотной кислоты с последующим приготовлением срезов на микротоме и их окрашивание (Волкова О.В., Елецкий Ю.К. Основы гистологии с гистологической техникой. - М.: Медицина, 1982, с. 258-268) [2]. Недостатком известного способа является невозможность получить высококачественный гистологический препарат костной ткани с имплантируемым материалом, например, металлом. При декальцинации происходит размягчение костной ткани, а вживленный в нее имплантируемый материал остается с неизменной плотностью.
В современной гистологической практике, как правило, после взятия материала, фиксации, обезвоживания и декальцинации костного блока проводят заливку в парафин. Окончательная заливка в парафин производится при помощи диспенсера, в котором парафин поддерживается нагретым до температуры +56-58°С, снабженный нагревательной и охлаждающей платформами. Для изготовления срезов парафиновых блоков используют ротационные и санные микротомы. Толщина стандартного среза составляет 4-6 мкм. Заливку в целлоидин, желатин, водорастворимые пластмассы и синтетические смолы используют крайне редко. Так заливка в целлоидин может быть необходима для обработки трудно режущихся, содержащих полости и лакуны, хрупких тканей (глазное яблоко, кости и окружающие их ткани), объектов больших размеров, например, эмбрионов), а также во избежание воздействия высоких температур на ткань.
Несмотря на то, что заливка в парафин предпочтительнее, приготовление парафиновых срезов имеет существенные недостатки:
1. материал плохо режется из-за недостаточного обезвоживания ткани;
2. нож «подскакивает», не срезая ткань или на срезах образуются поперечные борозды вследствие переуплотнения или пересушивания материала при фиксации или обезвоживании;
3. срезы покрыты полосами и легко раскрываются, для предотвращения чего следует правильно декальцинировать материал, либо использовать специальный нож для более плотных тканей (Краткий курс гистологической техники: учебно-методическое пособие / М.О. Мавликеев [и др.]. - Казань: Казан, ун-т, 2020. - 107 с.) [3].
К недостаткам метода следует отнести значительное сжатие исследуемого материала (до 20%), вызываемое воздействием высокой температуры в процессе пропитывания парафином. Известное неудобство представляет необходимость удаления парафина из срезов перед их окраской. Парафин при комнатной температуре - твердое гомогенное вещество. Существует несколько сортов парафина: мягкие (точка плавления 45-54°С) и твердые (точка плавления 58-60°С). В большинстве случаев для заливки применяют парафин с точкой плавления 54-56°С (Основы гистологической техники: учебное пособие / В.А. Корьяк, Л.А. Николаева; ФГБОУ ВО ИГМУ Минздрава России, Институт сестринского образования. - Иркутск: ИГМУ, 2020. - 85 с.) [4].
Известен иной способ приготовления препаратов для исследования микроскопической структуры костной ткани, разработанный в 1997 году Бабичевым В.В., который, как заявляет автор, позволяет быстро, просто и надежно определить уровень минерализации костных структур. Отличительной особенностью способа является прокаливание на разогретой металлической поверхности костного блока или фрагмента кости до коричневого или красного цвета. Механизм «проявления» контуров микроскопических структур костной ткани связан с тем, что при прокаливании органический компонент кости, сгорая и уплотняясь под воздействием концентрических сил сжатия, изменяет свой цвет и оптические свойства (прозрачность). В стадии коричневого каления кости создаются условия для определения степени минерального насыщения остеонных структур. Молодые, маломинерализованные формы остеонов выглядят на общем фоне более темными, остеоны большой степени плотности имеют одинаковый с фоном цвет, а остеоны средней степени плотности занимают между ними промежуточное положение. Определить степень минерального насыщения можно и при сером калении кости. При этом эталоном оптической плотности могут быть высокоминерализованные вставочные системы костной ткани (Способ приготовления препаратов для исследования микроскопической структуры костной ткани: пат. 2113701 Рос. Федерация МПК G01N 1/28 / В.И. Бабичев, В.Г. Донцов; заявитель и патентообладатель В.И. Донцов. - №97103458/14; заявл. 04.03.97; опубл. 20.06.98) [5]. Недостатком данной методики считается воздействие высоких температур, разрушающих органический компонент костной ткани, что не позволяет изучать участки костной ткани, которые важны в отслеживании степени и стадии регенеративных изменений.
Наиболее близким по технической сущности и выбранным в качестве прототипа предлагаемого способа подготовки образцов костной ткани с имплантированным металлом для гистологического исследования является методика получения гистологических препаратов костной ткани с имплантируемым материалом, разработанная в 1997 году коллективом авторов (Способ получения гистологических препаратов костной ткани с имплантируемым материалом: пат. 2099705 Рос. Федерация МПК G01N 33/48 / М.А. Звигинцев, С.И. Старосветский, В.М. Семенюк, А.А. Левенец, А.И. Поздеев, Т.В. Фурцев, Е.В. Бабушкин, И.Ю. Владимирова; заявитель и патентообладатель: товарищество с ограниченной ответственностью "Медицинский лечебно-профилактический центр по проблеме сахарного диабета" - №96100685/14; заявл. 10.01.96; опубл. 20.12.97) [6].
Методика прототипа включает фиксацию образцов, промывку и приготовление шлифов. Отличительной особенностью является то, что приготовление шлифов проводят жидким азотом. Замораживание костной ткани с имплантируемым материалом придает мягким тканям плотность, близкую к твердым структурам. Это позволяет проводить равномерное сошлифовывание всех тканевых структур с имплантируемым материалом. Полученный гистологический препарат предлагаемым способом позволяет глубоко изучить процессы остеоинтеграции в пористой и плотной структурах имплантируемых материалов.
Однако время выдерживания образцов в жидком азоте до момента получения шлифа авторами не указано, что не дает возможность точно выполнить методику и получить качественный срез. Избыточное время нахождения препарата костной ткани с имплантируемым материалом в жидком азоте однозначно повлияет на костную ткань или имплантируемый материал, нарушив их структуру.
Толщина шлифов, получаемых таким образом, составляет 15-30 мкм, что усложняет процесс окраски и фиксацию на предметном стекле. Для улучшения качества окрашивания и фиксации необходимо получить шлиф толщиной не более 10 мкм. Кроме этого, после извлечения шлифов из азота, авторы предлагают доводить образцы до комнатной температуры, обрабатывать в 96%-ном спирте и окрашивать. Как известно, размораживание всегда приводит к образованию излишней влаги на поверхности образца, особенно если в нем содержится достаточное количество жидкости. В то же время, если образцы после извлечения из жидкого азота сразу подвергать окрашиванию, кристаллическая структура замороженных костных структур не позволит добиться равномерной и качественной прокраски.
Одним из основных недостатков метода прототипа является недостаточно четкое разделение границы материал-кость в уже готовом препарате из-за размазывания частиц имплантированного материала по срезу ножом (лезвием) микротома. В связи с этим невозможно оценить степень остеоинтеграции металла и кости на этапах лечения.
Задача заявляемого технического решения - получение высококачественных образцов костной ткани с имплантированным металлом для гистологического исследования, позволяющих оценить степень остеоинтеграции на границе металл-кость.
Поставленная задача достигается путем нагрева в термостате и быстрого замораживания в жидком азоте образца костной ткани с имплантированным металлом, а также приготовлением срезов в микротоме-криостате с использованием специальных одноразовых лезвий и размораживания в условиях вакуума и комнатной температуры.
Способ осуществляют следующим образом.
Подготовленные блоки образцов костной ткани с имплантированным металлом размером от 0,5 до 1 см3 помещают в 10 об.%-ный раствор формалина на 24-48 часов для фиксации. После химической фиксации костные блоки промывают под холодной проточной водой в течение двух часов для удаления остатков формалина и более равномерной окраски срезов. Промытые образцы подвергают обезвоживанию в спиртах восходящей концентрации и декальцинации. Декальцинацию осуществляют как бескислотным способом, например, в 5-10% водном растворе ЭДТА (этилендиаминтетрауксусный ацетат), рН которого доведен с помощью гидроксида натрия до 6,0-7,0, так и с помощью кислот, например, трихлоруксусной или азотной.
Перед приготовлением срезов образец препарата костной ткани с имплантированным металлом помещают в термостат, нагревают до 37°С и выдерживают 15 минут. Затем образец помещают в емкость с жидким азотом на 5 минут, после чего изготавливают шлифы в микротоме-криостате толщиной от 5 до 10 мкм, размещают их на предметное стекло и размораживают в лабораторной вакуумной сушилке при давлении 75 кПа температуре 24°С в течение 10 минут.
Окрашивание производят гематоксилином и эозином.
Характеристика этапов подготовки образца костной ткани с имплантированным металлом.
С целью облегчения приготовления срезов из биоптата костной ткани с имплантированным металлом предложен способ заморозки в емкости с жидким азотом. Однако в процессе отработки методики замораживания в жидком азоте и дальнейшей нарезке шлифов установлено, что на границе металл-кость остается много металлических включений, усложняющих визуализацию наиболее значимой зоны остеоинтеграции. Решено провести предварительный нагрев образца в термостате до температуры 37°С, так как именно эта температура не вызывает денатурацию белковых структур костной ткани и одновременно позволяет быстро (15 минут) и равномерно прогреть металл, уменьшая его прилипание к лезвию в микротоме-криостате после заморозки в жидком азоте. Таким образом, на шлифе до окрашивания не видно металлической стружки, а после окрашивания костные и соединительнотканные структуры выглядят более контрастными и четкими.
Для получения качественного замороженного среза необходимым условием является быстрое замораживание ткани, при котором вода, оставшаяся в образце, не кристаллизуется, а переходит в состояние аморфного льда. В связи с этим предварительно нагретый до 37°С образец костной ткани с имплантированным металлом необходимо сразу же подвергнуть заморозке.
Скорость замораживания, в первую очередь, ограничивается скоростью теплопереноса. Образец костной ткани с имплантируемым металлом обладает различной теплопроводностью. Костная ткань имеет низкую теплопроводность в отличие от имплантируемого металла, поэтому быстро и равномерно охладить образец большого объема без повреждений очень сложно. Для обеспечения максимальной скорости охлаждения исследуемый образец следует замораживать в жидкой среде. Эта жидкость (хладагент) должна иметь точку плавления ниже температуры инициации кристаллизации воды - 70°С. Этому требованию удовлетворяет жидкий азот.
Для резки замороженного материала используют специальные приборы - криостаты, или микротомы-криостаты.
Достоинства замораживающей методики микротомирования:
1) отсутствие необходимости в заливке;
2) быстрота и простота изготовления срезов.
Для микротома-криостата можно использовать одноразовые микротомные лезвия, например, «Соло» (Беларусь) или «Feather» (Япония) типа С35 с углом заточки 35°. Они имеют эпоксидное покрытие и платиновое напыление, что облегчает их скольжение по образцу, позволяет уменьшить прилипание частиц имплантированного металла к лезвию.
В определенных условиях сочетание вакуума, давления и температуры создают условия, позволяющие добиться удаления газовых включений или газов, растворенных в твердых телах. Так, опытным путем установлено, что в случае размораживания образца костной ткани с имплантируемым металлом в лабораторной вакуумной сушилке происходит дегидратация и дегазация исследуемого объекта, что способствует лучшему прокрашиванию структур по любой из выбранных методик. Кроме этого, в условиях вакуума поверхность шлифа подсушивается без образования влаги, деформирующей структуры костной ткани.
Предварительный нагрев образца костной ткани с имплантированным металлом до 37°С и выдержка в течение 15 минут в термостате с последующим замораживанием в жидком азоте в течение 5 минут, а также приготовление срезов в микротоме-криостате толщиной от 5 до 10 мкм с использованием специальных одноразовых лезвий и размораживание в лабораторной вакуумной сушилке при давлении 75 кПа, температуре 24°С в течение 10 минут, обеспечивает получение эффекта, ранее не изученного - получение высококачественных образцов костной ткани с имплантируемым металлом для гистологического исследования, позволяющих оценить степень остеоинтеграции на границе металл-кость.
Сопоставительный анализ признаков заявленного решения с признаками прототипа и ближайших аналогов свидетельствует о соответствии заявленного решения критериям «новизна» и «промышленная применимость».
Результаты поиска показали, что заявляемое изобретение не вытекает для специалиста явным образом из известного уровня техники, поскольку не выявлено влияние предусматриваемых существенными признаками заявленного технического решения, что обеспечивает решение поставленной технической задачи.
Заявляемые параметры подготовки образца костной ткани с имплантированным металлом определены опытным путем.
С целью подбора оптимальных параметров, позволяющих получить высококачественный образец костной ткани с имплантированным металлом для гистологического исследования, проведен эксперимент в 4 сериях. Подготовку челюстных костей барана с имплантированным пористым титаном осуществляют по описанному выше способу.
В 1-й серии эксперимента образцы после фиксации, промывки, проводки в банках спиртов восходящей концентрации и декальцинации нагревают в термостате до 60°С и выдерживают в течение 5 минут, затем помещают в емкость с жидким азотом на 1 минуту. Во 2-й серии эксперимента образцы костной ткани с имплантированным пористым титаном нагревают в термостате до 50°С и выдерживают в течение 5 минут, затем образец кости помещают в емкость с жидким азотом на 3 минуты, в 3-й серии - максимальная температура в термостате составляет 37°С, время выдержки 15 минут, затем образец кости помещают в емкость с жидким азотом на 5 минут. Все исследуемые образцы костной ткани во всех 3 сериях эксперимента размораживают в лабораторной вакуумной сушилке при давлении 75 кПа, температуре 24°С в течение 10 минут. Данные параметры размораживания установлены опытным путем, являются оптимальными для поставленной задачи.
Качество подготовленного образца костной ткани с имплантированным металлом оценивают по четкости окрашивания границы металл-кость и наличию металлических включений в этой зоне.
В результате проведенных испытаний установлена оптимальная температура и время выдержки образца в термостате. Так, увеличение температуры в термостате до 60°С и уменьшение времени погружения в жидкий азот до 1 минуты вызывало денатурацию белковых структур, что ухудшало качество окрашенного среза, но граница металл-кость выглядела четкой, без металлических включений. При температуре 50°С в течение 5 минут и погружение в жидкий азот на 3 минуты на срезе оставались металлические включения. По всей видимости это происходило из-за недостаточного прогрева металла перед заморозкой. Уменьшение температуры в термостате до 37°С, но увеличение времени выдержки до 15 минут, а также погружение в емкость с жидким азотом на 5 минут, позволяют достигнуть желаемого качественного среза, на котором четко прокрашивается граница металл-кость и отсутствуют частицы металла в костной ткани.
Пример практического использования заявляемого способа подготовки препаратов костной ткани с имплантированным материалом для гистологического исследования.
Подготовленные блоки образцов костной ткани барана размером 0,5 см3 с имплантированным пористым титаном «Natix» помещают в 10 об.%-ный раствор формалина на 48 часов для фиксации. После фиксации костные блоки промывают под холодной проточной водой в течение двух часов для удаления остатков формалина и более равномерной окраски срезов. Промытые образцы проводят в спиртах восходящей концентрации и подвергают декальцинации в 5-10% водном растворе ЭДТА (этилендиаминтетрауксусный ацетат), рН которого был доведен с помощью гидроксида натрия до 6,0-7,0 в течение 36 часов.
Для приготовления среза образец костной ткани с имплантируемым металлом сначала помещают в термостат (электрический суховоздушный ТС-1/20 СПУ), разогревают до 37°С и выдерживают 15 минут. Сразу после извлечения образца из термостата его с помощью пинцета опускают на 5 минут в емкость объемом 50 мл с жидким азотом в количестве 30 мл, затем в этой же емкости образец переносят в камеру микротома-криостата, которую предварительно охлаждают до -20°С. Замороженный образец достают из емкости и помещают на фильтровальную бумагу в рабочей зоне камеры криостата для удаления излишков жидкого азота. Шлифы изготавливают с помощью одноразовых микротомных лезвий для криостата фирмы «Feather» (Япония) типа С35 с углом заточки 35°, имеющих эпоксидное покрытие и платиновое напыление. Толщина полученного шлифа составляет 10 мкм. Полученные срезы снимают на предметные стекла комнатной температуры, помещают в лабораторную вакуумную сушилку В-класса фирмы «Woson» (Китай) на режим вакуум-теста (параметры режима: температура 24°С, при давлении 75 кПа, в течение 10 минут). После извлечения предметного стекла с образцом производят окрашивание гематоксилином и эозином (фиг. 1, фиг. 2).
На Фиг. 1 изображены гранулы пористого титана «Natix» (1) в толще костной ткани (2), в стадии организации соединительной тканью (3). Окраска гематоксилином и эозином. Ок. 10, об. 20
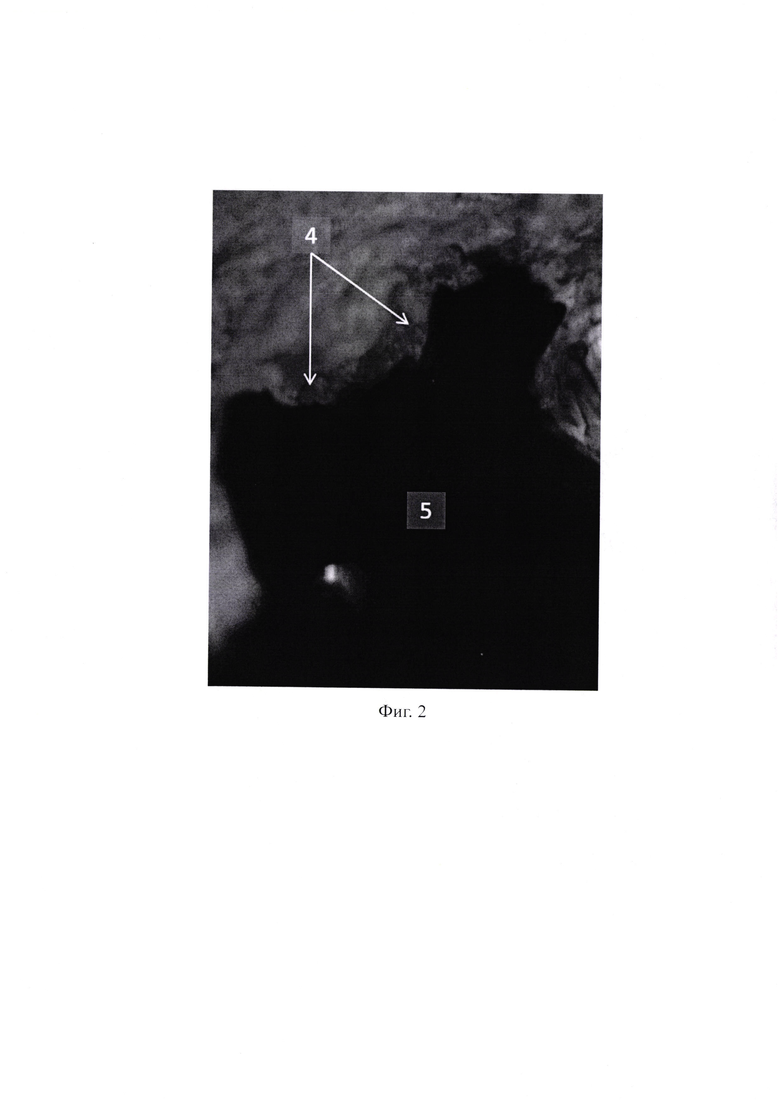
На Фиг. 2 изображен процесс фагоцитоза макрофагами (4) гранулы пористого титана «Natix» (5). Окраска гематоксилином и эозином. Ок. 10, об. 100.
Таким образом, проведенные исследования показали, что разработанный способ подготовки образцов костной ткани с имплантированным металлом для гистологического исследования позволяет получить высококачественный образец костной ткани с имплантированным металлом, имеющий оптимальные характеристики по четкости окрашивания границы металл-кость, позволяющие наиболее объективно оценить степень и полноту остеоинтеграции.
ИСТОЧНИКИ ИНФОРМАЦИИ:
1. Внутрикостные блокады. Клинические наблюдения: монография / Л.Е. Корнилова, Л.Е. Соков, О.П. Артюков. - Москва: Издательский Дом Академии Естествознания, 2014. - 173 с.
2. Волкова О.В., Елецкий Ю.К. Основы гистологии с гистологической техникой. - М.: Медицина, 1982, - С. 258-268.
3. Краткий курс гистологической техники: учебно-методическое пособие / М.О. Мавликеев [и др.]. - Казань: Казан, ун-т, 2020. - 107 с.
4. Основы гистологической техники: учебное пособие / В.А. Корьяк, Л.А. Николаева; ФГБОУ ВО ИГМУ Минздрава России, Институт сестринского образования. - Иркутск: ИГМУ, 2020. - 85 с.
5. Способ приготовления препаратов для исследования микроскопической структуры костной ткани: пат. 2113701 Рос. Федерация МПК G01N 1/28 / В.И. Бабичев, В.Г. Донцов; заявитель и патентообладатель В.И. Донцов. - №97103458/14; заявл. 04.03.97; опубл. 20.06.98.
6. Способ получения гистологических препаратов костной ткани с имплантируемым материалом: пат. 2099705 Рос. Федерация МПК G01N 33/48 / М.А. Звигинцев, С.И. Старосветский, В.М. Семенюк, А.А. Левенец, А.И. Поздеев, Т.В. Фурцев, Е.В. Бабушкин, И.Ю. Владимирова; заявитель и патентообладатель: товарищество с ограниченной ответственностью "Медицинский лечебно-профилактический центр по проблеме сахарного диабета" - №96100685/14; заявл. 10.01.96; опубл. 20.12.97.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ БЕСКИСЛОТНОЙ ДЕКАЛЬЦИНАЦИИ ОБРАЗЦА КОСТНОЙ ТКАНИ ПЕРЕД ГИСТОХИМИЧЕСКИМ ИССЛЕДОВАНИЕМ | 2022 |
|
RU2797130C1 |
| СПОСОБ ЛЕЧЕНИЯ ПАРОДОНТИТА И ПЕРИИМПЛАНТИТА | 2023 |
|
RU2830655C1 |
| ОЗОНИРОВАННЫЙ РАСТВОР КОЛЛОИДНОГО СЕРЕБРА ДЛЯ ЛЕЧЕНИЯ ПАРОДОНТИТА И ПЕРИИМПЛАНТИТА | 2023 |
|
RU2830653C1 |
| СПОСОБ СУБАНТРАЛЬНОЙ АУГМЕНТАЦИИ КОСТИ ДЛЯ УСТАНОВКИ ДЕНТАЛЬНЫХ ИМПЛАНТАТОВ ПРИ АТРОФИИ АЛЬВЕОЛЯРНОГО ОТРОСТКА ВЕРХНЕЙ ЧЕЛЮСТИ | 2011 |
|
RU2469675C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИСТОЛОГИЧЕСКИХ ПРЕПАРАТОВ КОСТНОЙ ТКАНИ С ИМПЛАНТИРУЕМЫМ МАТЕРИАЛОМ | 1996 |
|
RU2099705C1 |
| ПАСТА ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ПЕРИИМПЛАНТИТА | 2022 |
|
RU2786136C1 |
| ОСТЕОПЛАСТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ РЕМОДЕЛИРОВАНИЯ ПЕРИИМПЛАНТНОЙ ЗОНЫ ЧЕЛЮСТНОЙ КОСТИ | 2020 |
|
RU2765850C1 |
| ОСТЕОПЛАСТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ СУБАНТРАЛЬНОЙ АУГМЕНТАЦИИ | 2019 |
|
RU2729651C1 |
| СПОСОБ ОПТИМИЗАЦИИ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА | 2020 |
|
RU2738406C1 |
| СПОСОБ НЕПОСРЕДСТВЕННОЙ ДЕНТАЛЬНОЙ ИМПЛАНТАЦИИ У ПАЦИЕНТОВ С ВКЛЮЧЕННЫМИ ДЕФЕКТАМИ ЗУБНЫХ РЯДОВ | 2010 |
|
RU2447859C1 |

Изобретение относится к гистологии и к гистологической технике и может быть использовано в практике патоморфологических лабораторий. Способ подготовки препарата костной ткани с имплантированным металлом для гистологического исследования включает его фиксацию в 10 об.%-ном растворе формалина, промывание под проточной водой, проводку в спиртах восходящей концентрации, декальцинацию, приготовление шлифов с погружением в жидкий азот и окрашивание, отличается тем, что образец костной ткани с имплантированным металлом размером от 0,5 до 1 см3 после декальцинации сначала помещают в термостат и нагревают до 37°С в течение 15 минут, а затем погружают в емкость с жидким азотом на 5 минут, после чего изготавливают в микротоме-криостате шлифы толщиной от 5 до 10 мкм, которые размораживают в лабораторной вакуумной сушилке при давлении 75 кПа, температуре 24°С в течение 10 минут и окрашивают гематоксилином и эозином. Изобретение обеспечивает получение высококачественных образцов костной ткани с имплантированным металлом, позволяющих оценить степень остеоинтеграции на границе металл-кость. 2 ил.
Способ подготовки препарата костной ткани с имплантированным металлом для гистологического исследования, включающий его фиксацию в 10 об.%-ном растворе формалина, промывание под проточной водой, проводку в спиртах восходящей концентрации, декальцинацию, приготовление шлифов с погружением в жидкий азот и окрашивание, отличающийся тем, что образец костной ткани с имплантированным металлом размером от 0,5 до 1 см3 после декальцинации сначала помещают в термостат и нагревают до 37°С в течение 15 минут, а затем погружают в емкость с жидким азотом на 5 минут, после чего изготавливают в микротоме-криостате шлифы толщиной от 5 до 10 мкм, которые размораживают в лабораторной вакуумной сушилке при давлении 75 кПа, температуре 24°С в течение 10 минут и окрашивают гематоксилином и эозином.
| RU 96100685 A, 10.05.1998 | |||
| Способ подготовки образцов костной ткани человека для исследования методом растровой электронной микроскопии | 2018 |
|
RU2688944C1 |
| Способ подготовки крупных образцов регенерирующей кости для сканирующей электронной микроскопии | 2020 |
|
RU2747640C1 |
| СПОСОБ ГИСТОЛОГИЧЕСКОГО ОКРАШИВАНИЯ ВНУТРИСТЕНОЧНЫХ ВЕН ПОЛЫХ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ЧЕЛОВЕКА | 2020 |
|
RU2756252C1 |
| Способ изготовления гистологических препаратов | 2015 |
|
RU2613175C1 |
| СПОСОБ ПОДГОТОВКИ ОБРАЗЦОВ БИОЛОГИЧЕСКИХ ТКАНЕЙ К ГИСТОЛОГИЧЕСКИМ ИССЛЕДОВАНИЯМ | 2011 |
|
RU2499242C2 |
Авторы
Даты
2023-05-31—Публикация
2022-04-06—Подача