Изобретение относится к области медицины, в частности к фармакологии, а именно к средствам, обладающим нейропротекторным действием и антиоксидантной активностью, общей структурной формулы 3-(N-pyrrolyl)propanoyl-L-histidine.
Пиррол - ароматический пятичленный азотистый гетероцикл. Высокая реакционноспособность и биологическая активность производных пиррола лежат в основе многих природных продуктов и фармацевтических композиций [R.A. Jones, Pyrroles: The synthesis and the physical and chemical aspects of the pyrrole ring // Wiley-Interscience, 1990]. Так, пиррольный гетероцикл включен в структуру порфириновых колец, играющих ключевую роль в функции хлорофилла, гема, желчных пигментов, витамина В12 [Paul R. Ortiz de Montellano. "Hemes in Biology". Wiley Encyclopedia of Chemical Biology. John Wiley & Sons. (2008) doi:10.1002/9780470048672.wecb221]. Пирролсодержащие аналоги рассматриваются как потенциальный источник биологически активных соединений, которые обладают значительным набором полезных свойств [V. Bhardwaj, D. Gumber, V. Abbot, S. Dhimana, P. Sharmaa. Pyrrole: a resourceful small molecule in key medicinal hetero-aromatics // RSC Adv., 2015, 5, 15233-15266].
Комбинация различных фармакофоров в системе пиррольных колец приводит к образованию более активных соединений. Из-за разнообразия профиля терапевтического действия аналогов пиррола поиск новых фармацевтически значимых производных пиррола активно ведется и в настоящее время. Пиррольный гетероцикл находит широкое применение при синтезе терапевтически активных соединений, включая фунгициды, антибиотики [Н. Nakano, S. Umio, К. Kariyone, K. Tanaka, Т. Kishimoto, Н. Noguchi, I. Ueda, H. Nakamura and Т. Morimoto. Total synthesis of pyrrolnitrin, a new antibiotic // Tetrahedron Lett., 1966, 7: 737-740], противовоспалительные препараты [W.W. Wilkerson, R.A. Copeland, M. Covington and J.M. Trzaskos Antiinflammatory 4,5-diarylpyrroles. 2. Activity as a function of cyclooxygenase-2 inhibition. // J. Med. Chem., 1995, 38(20): 3895-3901]; препараты, снижающие уровень холестерина [S.P. Adams, M. Tsang, J.M. Wright. Lipid-lowering efficacy of atorvastatin // Cochrane Database Syst Rev. 2015; 2015(3): CD008226. doi: 10.1002/14651858.CD008226.pub3]; противоопухолевые средства [https://clinicaltrials.gov/search/intervention=Obatoclax] и многие другие.
Некоторые из препаратов, содержащих пиррольный компонент, уже доступны на фармацевтическом рынке, другие проходят клинические испытания [V. Bhardwaj, D. Gumber, V. Abbot, S. Dhimana, P. Sharmaa. Pyrrole: a resourceful small molecule in key medicinal hetero-aromatics // RSC Adv., 2015, 5, 15233-15266].
Так в стадии предварительных испытаний находится изамолтан. Препарат изамолтан действует как антагонист β-адренергических рецепторов, а также 5-НТ1А и 5-НТ1В рецепторов серотонина. Показано его анксиолитическое действие на грызунах.
Значительный интерес представляет амтолметин гуацил (торговое название: Найзилат). Амтолметин гуацил является эффективным нестероидным противовоспалительным препаратом (НПВП). Будучи неселективным ингибитором циклооксигеназ (ЦОГ-1 и ЦОГ-2), он оказывает противовоспалительное, анальгезирующее, жаропонижающее, десенсибилизирующее действие, обладает гастропротекторным эффектом; подавляет провоспалительные факторы, снижает агрегацию тромбоцитов; регулирует метаболизм арахидоновой кислоты, уменьшает образование простагландинов (в т.ч. в очаге воспаления), подавляет экссудативную и пролиферативную фазы воспаления. Способность амтолметин гуацила влиять на таламические центры болевой чувствительности, снижать концентрацию биогенных аминов, обладающих раздражающими свойствами, повышать порог болевой чувствительности рецепторного аппарата, устранять или уменьшать интенсивность болевого синдрома позволяет использовать его при болевом синдроме слабой и средней интенсивности по ряду показаний. По своим фармакологическим свойствам амтолметин гуацил близок к аспирину, но отличается комплексом гастропротективных свойств, главным из которых является повышение концентрации оксида азота в слизистой оболочке желудочно-кишечного тракта [А.Е. Каратеев На пути к созданию новой генерации нестероидных противовоспалительных препаратов: амтолметин гуацил. // Современная ревматология. 2014; 8(2): 83-89]
В перечень жизненно необходимых и важнейших лекарственных средств Минздрава РФ входит Кеторолак - нестероидный противовоспалительный препарат (НПВС), ингибитор биосинтеза простагландинов. Является наиболее сильным по анальгезирующему действию среди наиболее часто используемых НПВС. [А.В. Матвеев, А.Е. Крашенинников, Е.А. Егорова. Современный взгляд на эффективность и безопасность кеторолака. РМЖ. Медицинское обозрение. 2018; 2(4): 34-39. https://www.rmj.ru/articles/klinicheskaya_farmakologiya].
В последнее время была разработана новая серия аналогов пиррола на основе пиррол-2,5 диона, все полученные соединения тестировали на антиоксидантные свойства, причем большинство из них продемонстрировали значительную антиоксидантную активность. [G.M. Reddy, A. Camilo, R. Garcia, J. Pyrrole-2,5-dione analogs as a promising antioxidant agents: microwave-assisted synthesis, bio-evaluation, SAR analysis and DFT studies/interpretation. // Bioorganic Chemistry, (2021). 106, [104465]. https://doi.org/10.1016/j.bioorg.2020.104465].
Был синтезирован ряд новых гидразонов N-пирролилгидразида. Первоначальный скрининг безопасности in vitro на цитотоксичность (на клетках HepG2) и гемосовместимость (анализ гемолиза) показал высокую безопасность новых соединений. Их прямая антиоксидантная активность была определена в ABTS- и DPPH-тестах. На клеточных моделях индукции окислительного стресса in vitro был определен антиоксидантный защитный эффект этих соединений, позволивший выявить перспективные соединения с антиоксидантными свойствами и отсутствием токсичности [D. Tzankova, S. Vladimirova, D. Aluani, Y. Yordanov, L. Peikova, M. Georgieva. Synthesis, in vitro safety and antioxidant activity of new pyrrole hydrazones. // Acta Pharm. 2020. 70(3): 303-324. doi: 10.2478/acph-2020-0026. PMID: 32074071].
Близкими по химической структуре к производным пиррола являются относящийся к группе фенилпиперазина лорпипразол (торговая марка Normarex) и производное пирролидона пирацетам.
Фармакологическая активность Normarex осуществляется путем подавления 5-НТ2А и 5-НТ2С серотонинергических рецепторов, а также альфа1 и альфа2 адренергических рецепторов, H1 гистаминергических рецепторов и, в высоких дозах, ингибирования транспортера серотонина SERT.2. Normarex является антипсихотическим и анксиолитическим средством, и широко используется на фармакологическом рынке [https://go.drugbank.com/drugs/DB09195].
Пирацетам по состоянию на 2019 год входит в перечень жизненно необходимых и важнейших лекарственных препаратов РФ. В России препарат применяется в неврологической, психиатрической и наркологической практике. Пирацетам влияет на текучесть клеточных мембран, стимулирует окислительно-восстановительные процессы, усиливает утилизацию глюкозы, улучшает регионарный кровоток в ишемизированных участках мозга, его активное участие в нейрометаболических процессах обусловливает, как следствие, нейротропные и нейропротективные эффекты. В мультицентровых исследованиях было показано, что у больных с различными цереброваскулярными заболеваниями, сопровождающимися когнитивными и двигательными расстройствами, применение пирацетама приводило к улучшению координации движений, эмоционально-волевой, психической сферы, когнитивных функций [М.А. Пирадов, М.М. Танашян, М.А. Домашенко, Д.В. Сергеев, М.Ю. Максимова. Нейропротекция при цереброваскулярных заболеваниях: поиск жизни на Марсе или перспективное направление лечения? Часть 1. Острые нарушения мозгового кровообращения // Анналы клинической и экспериментальной неврологии 2015; 9(1): 41-50].
Таким образом, благодаря имеющимся данным о противовоспалительной и антиоксидантной активности, вовлеченности в регуляцию активности серотонинергических, адренергических и гистаминергических рецепторов, пирролсодержащие соединения можно рассматривать в качестве потенциальной основы для разработки биологически активных препаратов. Подобными свойствами обладает природный дипептид карнозин (β-аланил-L-гистидин) [А.А. Болдырев Карнозин: новые концепции для функций давно известной молекулы // Биохимия, 2012; 77(4):403-418; А.А. Boldyrev, G. Aldini, W. Derave, Physiology and pathophysiology of carnosine. // Physiol.Rev. 2013; 93: 1803-1845; D.S. Berezhnoy, S.L. Stvolinsky, A.V. Lopachev, A.A. Devyatov, O.M. Lopacheva, O.I. Kulikova, D.A. Abaimov, T.N. Fedorova. Carnosine as an effective neuroprotector in brain pathology and potential neuromodulator in normal conditions. // Amino Acids. 2019; 51(1): 139-150. DOI: 10.1007/s00726-018-2667-7].
Однако, несмотря на многочисленные результаты исследований нейропротекторного действия карнозина и его аналогов как на in vitro, так и in vivo моделях заболеваний центральной нервной системы, карнозин не получил выхода в практическую медицину в виде лекарственной формы, хотя добавление карнозина и других гистидинсодержащих дипептидов, таких как анзерин и N-ацетилкарнозин, а также их компонентов (например, β-аланина) были предложены в качестве потенциальных стратегий профилактики ряда хронических заболеваний [K. Menon, A. Mousa, В. de Courten. Effects of supplementation with carnosine and other histidine-containing dipeptides on chronic disease risk factors and outcomes: protocol for a systematic review of randomized controlled trials. // BMJ Open. 2018; 8: e020623. doi:10.1136/bmjopen-2017-020623]. Ведущим ограничением для применения карнозина в клинической практике является его быстрый гидролиз в кровяном русле под действием специфического фермента - сывороточной карнозиназы, что приводит к необходимости использования высоких суточных доз препарата.
Сочетание пиррола и карнозина в одном соединении представляется чрезвычайно перспективным для создания нового нейропротекторного соединения, характеризующегося высокой антиоксидантной активностью с высокой устойчивостью к гидролизу сывороточной карнозиназой.
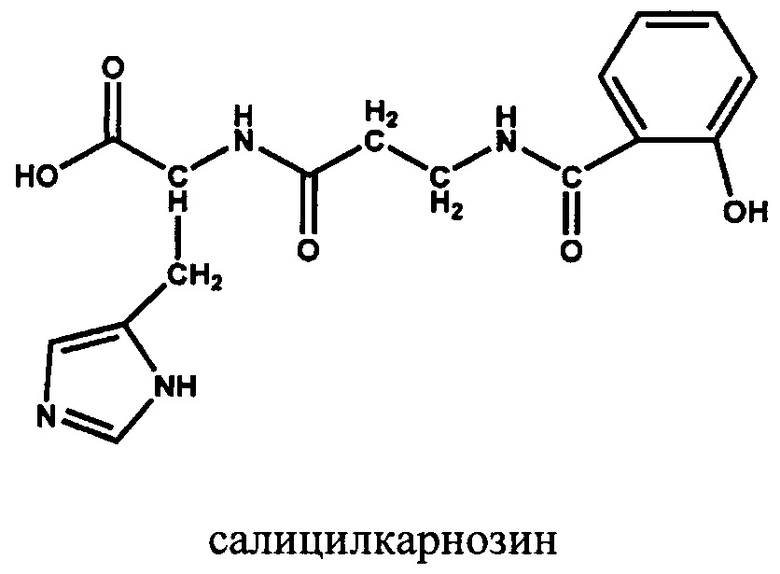
Наиболее близким техническим решением к заявленному является средство общей структурной формулы (1): 2-[3-(2-гидрокси-бензоиламино)-пропиониламино]-3-(1Н-имидазол-4-ил)-пропионовая кислота (салицилкарнозин), обладающее антиагрегантной, супероксид-перехватывающей, антиоксидантной и цитопротекторной активностью [RU 2694061, 09.07.2019].
Задача изобретения: создание нового средства на основе пиррола и карнозина, обладающего нейропротекторным действием и антиоксидантной активностью.
Технический результат заключается в расширении арсенала средств, обладающих высокой антиоксидантной и нейропротекторной активностью активностью и высокой устойчивостью к гидролизу сывороточной карнозиназой.
Технический результат достигается тем, что создано средство общей структурной формулы (I): 3-(N-pyrrolyl)propanoyl-L-histidin (пирролилкарнозин),
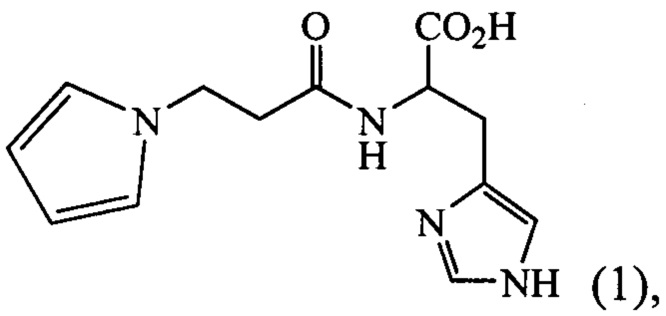 обладающее антиоксидантной и нейропротекторной активностью.
обладающее антиоксидантной и нейропротекторной активностью.
Ниже приведены примеры, иллюстрирующие изобретение.
Пример 1. Синтез и идентификация средства
Для синтеза средства общей структурной формулы (I): 3-(N-pyrrolyl)propanoyl-L-histidin (пирролилкарнозин),

использовали следующие реактивы: L-карнозин, чистота >98% (Swedlight АВ, Швеция); 2,5-диметокситетрагидрофуран, чистота 99%, смесь цис- и трансизомеров (Acros Organics), метанол, этанол, уксусная кислота (Химмед, Россия), деионизированная вода.
L-карнозин (10 г, 44.2 ммоль), 2,5-диметокситетрагидрофуран (1.1 экв., 6.4 г, 48.7 ммоль) и уксусную кислоту (2.5 экв., 6.6 г, 110.5 ммоль) растворяли в 60 мл деионизированной воды, помещали в плотно закрытую колбу и в нагретую до 102-103°С баню и перемешивали в течение 3 часов при этой температуре. Гомогенный темно-коричневый раствор упаривали до коричневой карамели, которую последовательно растворяли в воде (два раза по 120 мл) и упаривали после каждого растворения. Твердый остаток растворяли в 60 мл кипящего метанола, и полученный горячий раствор равномерно наносили на силикагель для флэш-хроматографии. Хроматографию проводили в метаноле (Rf=0.62). Фракции, содержащие продукт, объединяли и упаривали. Полученный светло-желтый порошок (10 г) в течение 2 часов подвергали кипячению в 25 мл этанола, после чего суспензию охлаждали до комнатной температуры (12 часов). Белый кристаллический осадок на фильтре промывали охлажденным этанолом. Выход продукта синтеза составил 9.5 г (78%). По данным ЯМР содержание целевого соединения в осадке составило 99%, единственной следовой примесью являлся метанол.
Масс-спектрометрия по полному ионному току.
Определение содержания пирролилкарнозина в пробах проводили методом тандемной ВЭЖХ масс-спектрометрии с помощью хроматографа Surveyor LC Pump Plus в сочетании с масс-спектрометрическим детектором LCQ Fleet (Thermo Scientific, США); аналитической колонки - Ultrasphere ODS (250×4.6 мм; С18, 100А, 5 мкм; Hichrom Ltd, Великобритания). Данные обрабатывали с помощью программы Xcalibur 2.1 Foundation 1.0.1. Для количественного измерения концентрации анализируемых соединений применяли метод внешнего стандарта. При градуировке измеряли соотношение площади хроматографического пика аналита в зависимости от концентрации. Для хроматографирования применяли градиентный насос Surveyor LC Pump (Waters, США), скорость потока подвижной фазы составляла 0,7 мл/мин, режим элюирования - изократический, продолжительность анализа - 10 минут. В качестве подвижной фазы использовалась комбинация растворов 10 мМ ацетатного буфера, рН 3,7 (раствор А) и ацетонитрила (с добавлением 10 мМ ацетата аммония (90:10)) (раствор Б), взятых в соотношении 90%А:10%Б. В указанных условиях, время удерживания пирролилкарнозина (tR) составляло 8,24±0,1 минут (см. фиг. 1). На фиг. 1 представлена масс-хроматограмма раствора пирролилкарнозина по полному ионному току. Для количественного анализа оценивали площадь хроматографического пика аналита по полному ионному току дочерних ионов, образующихся при фрагментации квазимолекулярного иона пирролилкарнозина с m/z 277.29 с нормализованной энергией соударений 35 эВ. Для детектирования пирролилкарнозина был подобран оптимальный режим мониторинга выбранных ионов с положительной электрорасыплительной ионизацией, создаваемый напряжением в 5 кВ (см. фиг. 2). На фиг. 2 представлен масс-спектр второго порядка (MS2) для пирролилкарнозина. Как видно из фиг. 2, в масс-спектре второго порядка, образующемся при соударительной фрагментации квазимолекулярного иона пирролилкарнозина, основным пиком является пик фрагмент-иона с отношением массы к заряду m/z 231.15. Вторым наиболее устойчивым ионом, образующимся при фрагментации, является ион-продукт с m/z 259.05. Пик с m/z 259.05 образуется при дегидроксилировании квазимолекулярного иона [М-ОН]=259 г/моль, а пик с m/z 231.15, образуется при его дегидроксилировании с последующим декарбоксилированием [М-CO2H]=231 г/моль. Таким образом, два указанных пика соответствуют наиболее устойчивым ионам, образующимся при фрагментации (дегидроксилирование с последующим декарбоксилированием) пирролилкарнозина, с молекулярной массой 276 г/моль.
Препаративная очистка.
Препаративная очистка не требовалась. Полученное в результате флэш-хроматографии вещество с последующим кипячением в этаноле обладало чистотой 99% (ЯМР). Для хроматографии использовался стандартный лабораторный силикагель (0.060-0.200 mm, 60  ) (Acros Organics).
) (Acros Organics).
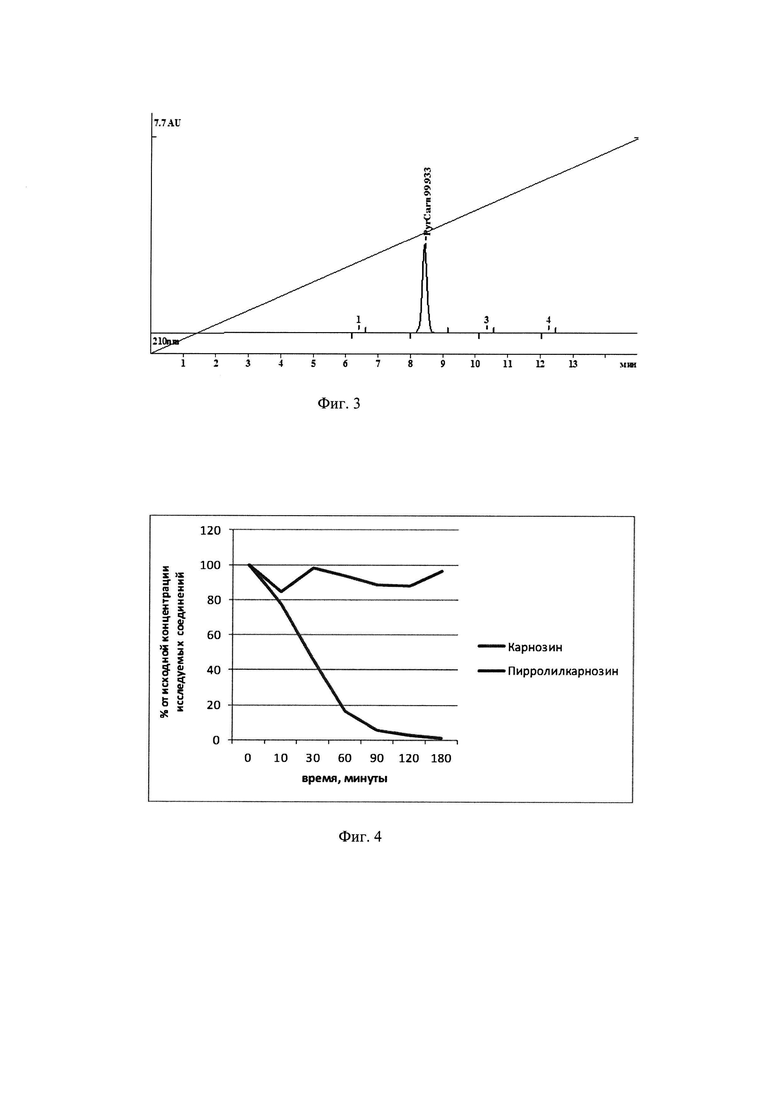
Дополнительно чистоту полученного вещества определяли методом ВЭЖХ с использованием колонки Prontosil 120C18aq. Для нанесения на колонку полученное вещество растворяли в воде в концентрации 1,0 мг/мл, на колонку наносили 2,0 мкл. Элюцию образца с колонки вели в градиентном режиме: элюент A=200 mM LiClO4+5 mM HClO4 - раствор в воде; элюент В - метанол. Градиент 0% В до 20% В за 15 мин. Скорость подачи составляла 0.15 мл/мин, температура: 35.0°С, давление: 3.1 МРа. На фиг. 3 показано, что полученный препарат пирролилкарнозина представляет собой гомогенное соединение, практически не содержащее иных компонентов. Данные о чистоте полученного соединения приведены в таблице 1 и на фиг. 3.
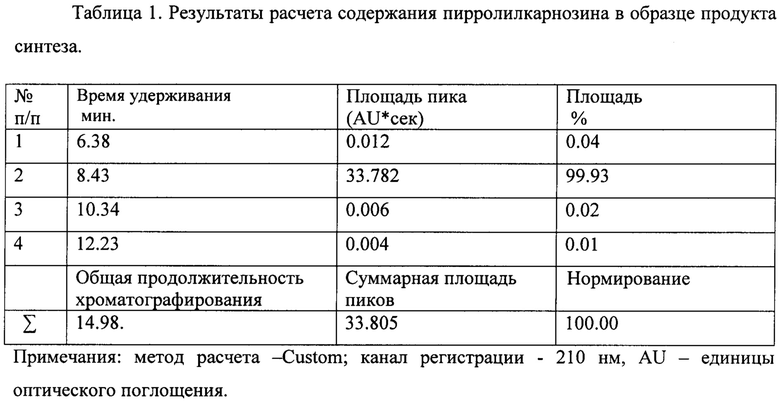
Исходя из данных таблицы 1 по данным ВЭЖХ подтвержденная чистота полученного пирролилкарнозина >99%.
Температура плавления пирролилкарнозина составила 242-246°С.
Подтверждение молекулярной структуры полученного соединения
Молекулярная структура пирролилкарнозина была подтверждена данными исследования продукта реакции методами ЯМР-спектроскопии и масс-спектрометрии высокого разрешения (МСВР).
1Н и 13C ЯМР спектры были получены в D2O на оборудовании «BrukerAvance 500» («Bruker Daltonics Inc.», США) на частоте 500 МГц для 1Н и частоте 125 МГц для 13С.
1H NMR (500 MHz, D2O) δ 2.58-2.68 (m, 2H), 2.86 (dd, 1H, J=15.5 Hz, J=8.9 Hz), 3.06 (dd, 1H, J=15.5 Hz, J=4.6 Hz), 4.01-4.12 (m, 2H), 4.33 (dd, 1H, J=8.9 Hz, J=4.6 Hz), 6.00 (t, 2H, J=1.9 Hz), 6.59 (t, 2H, J=1.9 Hz), 6.85 (s, 1H), 8.42 (d, 1H, J=1.0 Hz)
13C NMR (125 MHz, D2O) δ 27.3, 37.7, 45.1, 54.0, 107.9, 116.6, 121.3, 129.5, 133.1, 173.2, 176.5
Масс-спектры высокого разрешения (MCBP) измеряли на приборе Bruker micrOTOF II с использованием электро-распылительной ионизации (ЭРИ). В образце методом МСВР при позитивной ионизации для целевого соединения было установлено отношение массы к заряду m/z [М+Н]=277.1287 г/моль, что соответствует 3-(N-пирролил)пропаноил-L-гистидину (пирролилкарнозину) (С13 H16 N4 О3) в протонированной форме с [М+Н]=277.1295 г/моль. Таким образом, молекулярная масса пирролилкарнозина, определенная методом масс-спектрометрии высокого разрешения, составила 276 г/моль.
По исследованным физико-химическим характеристикам полученное нами соединение 3-(N-пирролил)пропаноил-L-гистидин (пирролилкарнозин) описывается следующей структурной формулой:
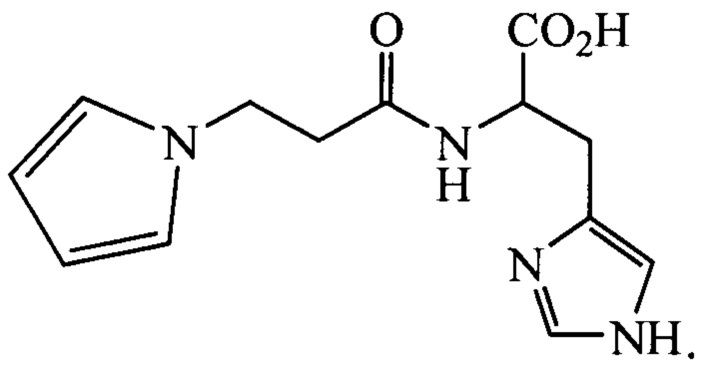
Пример 2. Устойчивость пирролилкарнозина к гидролизу карнозиназой.
Для определения устойчивости пирролилкарнозина и свободного карнозина к сывороточной карнозиназе был использован метод, предложенный Пеговой А. с соавт. [А. Pegova, Н. Abe, A. Boldyrev. Hydrolysis of carnosine and related compounds by mammalian carnosinases // Сотр. Biochem. Physiol, part В Biochem. Mol. Biol. 2000; 127: 443-446], в основу которого положена оценка степени гидролиза исследуемых соединений в присутствии сывороточной карнозиназы крови доноров. В исследовании использовали смесь образцов сыворотки, полученных от нескольких доноров. Сывороточную карнозиназу активировали путем инкубации с 5 мМ CdCl2 при 37°С в течение 30 минут. Затем вносили в пробы карнозин или пирролилкарнозина, в конечной концентрации 2 мМ. Пробы инкубировали в течение 0-30-60-120-180 минут при 37°С смешивали их с охлажденной 20% ТХУ в пропорции 1:1, денатурированные белки осаждали центрифугированием при 16000 g в течение 30 минут при +4°С, супернатант использовали для анализа. Белки осаждали 20% ТХУ, осадок удаляли центрифугированием, супернатант использовали для анализа. В качестве контроля были взяты пробы, которые инкубировали без добавления сыворотки.
Определение содержания пирролилкарнозина и карнозина в пробах проводили методом ВЭЖХ-масс-спектрометрии. Пирролилкарнозин определяли по методике, приведенной выше, а для анализа карнозина использовали оригинальный авторский способ определения [А.В. Лопачев, Е.В. Коновалова, Е.Ю. Пантюхова., Р.Д. Сейфулла, Т.Н. Федорова., А.К. Сариев., С.Л. Стволинский, Д.А. Абаимов. Патент РФ №2585115 от 05.03.2015. «Способ определения карнозина в биологических материалах»].
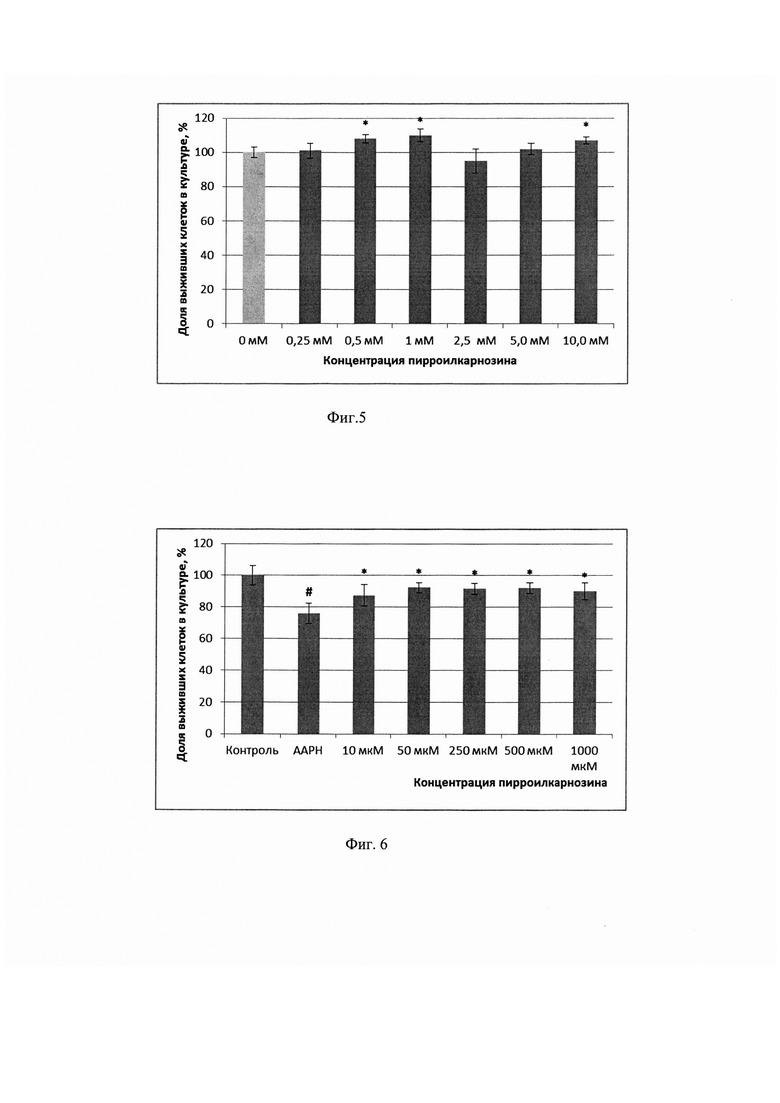
На фиг. 4 показано, что карнозин гидролизовался сывороточной карнозиназой на 86% за 1 час и полностью на 100% - за 3 часа, тогда как пирролилкарнозин в течение 3 часов практически не подвергался гидролизу сывороточной карнозиназой. Данные представлены в % от исходной концентрации (2 мМ) исследуемых соединений.
Пример 3. Определение антиоксидантной активности пирролилкарнозина методом железо-индуцированной хемилюминесценции.
Для оценки антиоксидантной активности пирролилкарнозина in vitro использовали модель перекисного окисления липидов (ПОЛ), инициируемого ионами Fe2+ в липопротеинах низкой и очень низкой плотности (ЛП), выделенных из сыворотки крови пациентов с сосудистыми заболеваниями головного мозга. Метод основан на измерении параметров хемилюминесценции (ХЛ) в условиях окисления суспензии ЛП ионами двухвалентного железа. Регистрировали следующие кинетические параметры ХЛ: быструю вспышку ХЛ (h, мВ), отражающую стационарный уровень липидных гидроперекисей и длительность латентного периода ХЛ (лаг-период, τ, с), характеризующего резистентность ЛП к окислению, которая зависит от их эндогенной антиоксидантной активности.
Антиоксидантное действие пирролилкарнозина сравнивали с действием карнозина. Растворы этих соединений вносили в реакционную пробу объемом 1 мл в диапазоне концентраций 1 мМ - 0,5 мМ - 0,25 мМ - 0,05 мМ. Через 30 секунд к пробам добавляли раствор двухвалентного железа (FeSO4×7H2O) в концентрации - 2,5 мМ. Измерение ХЛ проводили на приборе Luminometer-1251 (LKB, Швеция) при 37°С и непрерывном перемешивании в 2 параллельных пробах для каждого образца, используя в анализе среднюю величину. Изменение изучаемых параметров кривой ХЛ выражали в процентах по отношению к контрольным значениям для проб, не содержащих исследуемые соединения [Т.Н. Федорова Применение хемилюминесцентного анализа для сравнительной оценки некоторых фармакологических веществ // Эксперим. клин, фармакология. 2003. Т. 66(5). 56-58].
Данные изменения параметров железо-индуцированной ХЛ под влиянием исследуемых соединений отражены в таблицах 2 и 3. Пирролилкарнозин начинает действовать с минимальной концентрации 0,05 мМ, снижая уровень липидных гидроперекисей на 26% (относительно контроля, принятого за 100%); в концентрации 0,25 мМ - на 40%; в концентрации 0,5 мМ - на 45%, в концентрации 1 мМ - на 50%, пропорционально своей концентрации в пробе (см. табл. 2). Карнозин начинает проявлять свое действие в более высокой концентрации - 0,25 мМ, снижая уровень липидных гидроперекисей на 29%, в концентрации 0,5 мМ - на 37%, в концентрации 1 мМ - на 48% (см. табл. 3).
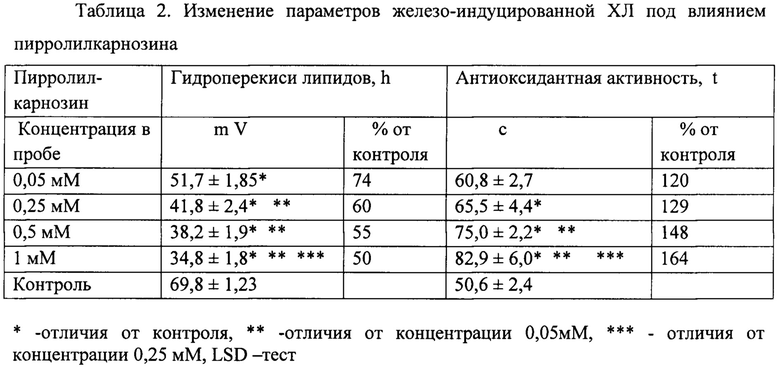
Пирролилкарнозин и карнозин увеличивали длительность латентного периода ХЛ, характеризующего эндогенный антиоксидантный потенциал, пропорционально их концентрации в пробе, в концентрации 0,05 мМ- на 20% и 10%, 0,25 мМ - на 29% и 35%, в концентрации 0,5 мМ - на 48% и 50%, в концентрации 1 мМ - на 64% и 62%, соответственно.

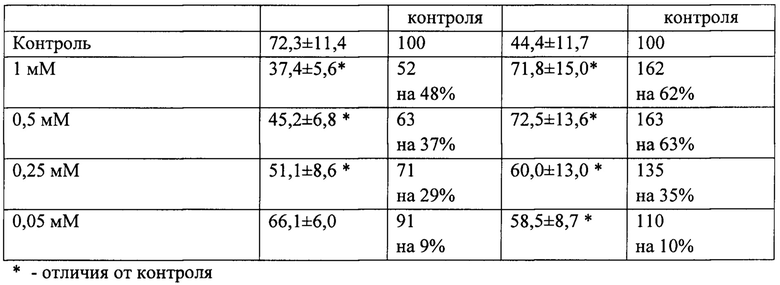
В целом, антиоксидантная активность пирролилкарнозина, характеризующаяся способностью снижать уровень липидных гидроперекисей и повышать андогенный антиоксидантный потенциал, оказалась сопоставимой с действием карнозина, а в ряде случаев - выше действия карнозина. Полученные данные свидетельствуют о высокой антиоксидантной активности нового соединения.
Пример 4. Влияние пирролилкарнозина на выживаемость клеток нейробластомы, дифференцированных по дофаминергическому типу.
Оценка собственной цитотоксичности пирролилкарнозина в диапазоне концентраций от 0,25 мМ до 10 мМ была проведена по его влиянию на жизнеспособность клеток в культуре нейробластомы человека SH-SY5Y, дифференцированной по дофаминергическому типу, с помощью МТТ-теста.
В группы лунок 96-луночного планшета, содержащих дифференцированные клетки нейробластомы, добавляли пирролилкарнозин до конечных концентраций от 0,25 мМ до 10,0 мМ (минимум по 8 лунок на каждую группу). В контрольные лунки пирролилкарнозин не добавляли.
Инкубацию с пирролилкарнозином проводили в течение 24 часов. Жизнеспособность клеток оценивали с помощью МТТ-теста. Для этого в лунки приливали МТТ-реагент и продолжали инкубацию в течение 3 часов, после чего из лунок осторожно удаляли среду, не затрагивая образовавшиеся кристаллы формазана. В каждой лунке сухой остаток формазана растворяли в 100 мкл ДМСО, с получением раствора фиолетового цвета. Превращение желтой соли тетразолия в продукт его конъюгации с формазаном фиолетового цвета является показателем митохондриальной активности жизнеспособных клеток. Планшеты помещали в спектрофотометр для микропланшетов Synergy Н4 (BioTek), в котором раствор в лунках перемешивался в течение 6 минут, и проводилось измерение оптической плотности при длинах волн λ=570 нм и λ=660 нм. Из показаний оптической плотности при λ=570 нм вычитали показания при λ=660 нм [Е.Е. Akkuratov, О.М Lopacheva, М. Kruusmagi, A.V Lopachev, Z.A Shah, A.A Boldyrev, Lijun Liu Functional Interaction Between Na/K-ATPase and NMDA Receptor in Cerebellar Neurons // Mol. Neurobiol. 2015; 52(3): 1726-1734]. Данные представлены в процентах от величины оптической плотности раствора в контрольных лунках, жизнеспособность клеток в которых принимали за 100%. Обработку результатов проводили в программе Microsoft Exel.
Пирролилкарнозин не проявлял собственной токсичности при инкубации культуры в широком диапазоне его концентрации в пробе (0,1 мМ - 0,5 мМ - 1 мМ - 2,5 мМ - 5 мМ - 10 мМ) (см. фиг. 5).
Пример 5. Оценка нейропротекторного действия пирролилкарнозина в модели общего окислительного стресса.
На культуре клеток нейробластомы человека SH-SY5Y, дифференцированной по дофаминергическому типу, оценивали нейропротекторное действие пирролилкарнозина в условиях окислительного стресса, индуцированного 2,2'-азобис(2-метилпропионамидин) дигидрохлоридом (ААРН) [R, Lakshminarayana, G. Aruna, U.V. Sathish, M.D. Shylaja, V. Baskaran. Structural elucidation of possible lutein oxidation products mediated through peroxyl radical inducer 2,2'-Azobis (2 methylpropionamidine) dihydrochloride: antioxidant and cytotoxic influence of oxidized lutein in HeLa cells. // Chem Biol Interact, 2013; 203: 448-455], который напрямую генерирует АФК с последующим развитием ОС как в водной фазе внутри клеток, так и во внеклеточной среде.
Клетки рассаживали в 96-луночные планшеты из расчета 40 тысяч клеток на лунку и дифференцировали по нейрональному типу в течение 6 дней по описанному выше методу. На 7-й день к клеткам добавляли индуктор ОС (ААРН) и исследуемое соединение (пирролилкарнозин) в соответствующих концентрациях, минимум по 8 лунок на каждую группу. Затем клетки инкубировали в течение 24 часов одновременно с исследуемым препаратом. К контрольным клеткам ААРН и пирролилкарнозин не добавляли.
Жизнеспособность клеток определяли с помощью МТТ-теста, как описано выше.
Из полученных результатов следует, что инкубация культуры клеток в присутствии 2 мМ ААРН в течение 24 часов приводила к снижению жизнеспособности клеток (р<0,001), в среднем на 24% относительно интактных клеток, жизнеспособность которых принята за 100% (р<0,001).
На фиг. 6 показано влияние пирролилкарнозина в диапазоне концентраций 10 мкМ - 1000 мкМ в культуральной среде на жизнеспособность клеток нейробластомы в условиях индукции окислительного стресса 2 мМ ААРН при инкубации в течение 24 часов; данные представлены в процентах от среднего уровня сигнала в лунках с контрольными клетками (М± SEM, (#) - р<0,01 по отношению к контрольным клеткам); (*) - р<0,01 по отношению к клеткам, не получавшим пироллилкарнозин (группа ААРН)
Внесение в культуральную среду пироллилкарнозина (в концентрации 10 мкМ - 50 мкМ - 250 мкМ - 500 мкМ - 1000 мкМ), начиная с концентрации 10 мкМ, увеличивало жизнеспособность клеток на 10%-15% (см. фиг. 6).
Пример 6. Влияние пирролилкарнозина на жизнеспособность первичной культуры клеток коры больших полушарий мозга крыс в условиях глюкозо-кислородной депривации.
Для моделирования острой ишемии головного мозга с последующей реперфузией in vitro была использована модель глюкозо-кислородной депривации (ГКД) - помещение нейрональной клеточной культуры в среду, не содержащую глюкозы и лишенную доступа кислорода.
Работа проводилась на первичной культуре коры больших полушарий головного мозга 18-дневных эмбрионов крыс линии Вистар. Культуру выращивали в 6-луночных («SPL», США) и 96-луночных («Nunc», США) планшетах в среде Neurobasal Medium (NBM) («Gibco», США) с 2% бессывороточной добавкой В-27 Serum-Free Supplement («Gibco», США), 100 Ед/мл пенициллин-стрептомицина, 1% GlutaMAX («Gibco», США). Каждые двое суток производили замену половины объема среды на более свежую.
Через 10 дней после посадки культуру помещали в условия глюкозо-кислородной депривации (ГКД) на 4 часа, контрольная группа оставалась в условиях нормоксии, и уровень глюкозы в среде не менялся. Культуры экспериментальных групп инкубировали в искусственной цереброспинальной жидкости (ИЦСЖ, 125 мМ NaCl, 26 мМ NaHCO3, 4 мМ KCl, 1,25 мМ NaH2PO4, 1,2 мМ MgCl2, 2 мМ CaCl2, 25 мМ глюкоза) без антиоксидантов, либо с добавлением исследуемого вещества пироллилкарнозина в концентрации 0,1 мМ, 0,2 мМ, 0,5 мМ или 1 мМ. После ГКД клетки помещали в условия нормоксии и меняли среду на NBM, содержащую 0,1 мМ, 0,2 мМ, 0,5 мМ или 1 мМ вещество пироллилкарнозин. Контрольную группу на время эксперимента помещали в NBM без антиоксидантов. Спустя 24 часа после начала реоксигенации проводили МТТ-тест для оценки выживаемости клеток и измеряли активность лактатдегидрогеназы, увеличение активности в среде, которая свидетельствует о гибели клеток.
6.1. Влияние пирролилкарнозина на жизнеспособность первичной культуры клеток коры больших полушарий мозга крыс в условиях глюкозо-кислородной депривации (МТТ-тест).
Для определения действующей концентрации, а также для исключения токсического действия пироллилкарнозина был поставлен эксперимент с инкубацией культуры нейронов с пироллилкарнозином в разных концентрациях (0,1 мМ, 0,2 мМ, 0,5 мМ и 1 мМ) в условиях нормоксии, во время 4 часов ГКД и 24 часов реоксигенации или только во время 24 часов реоксигенации.
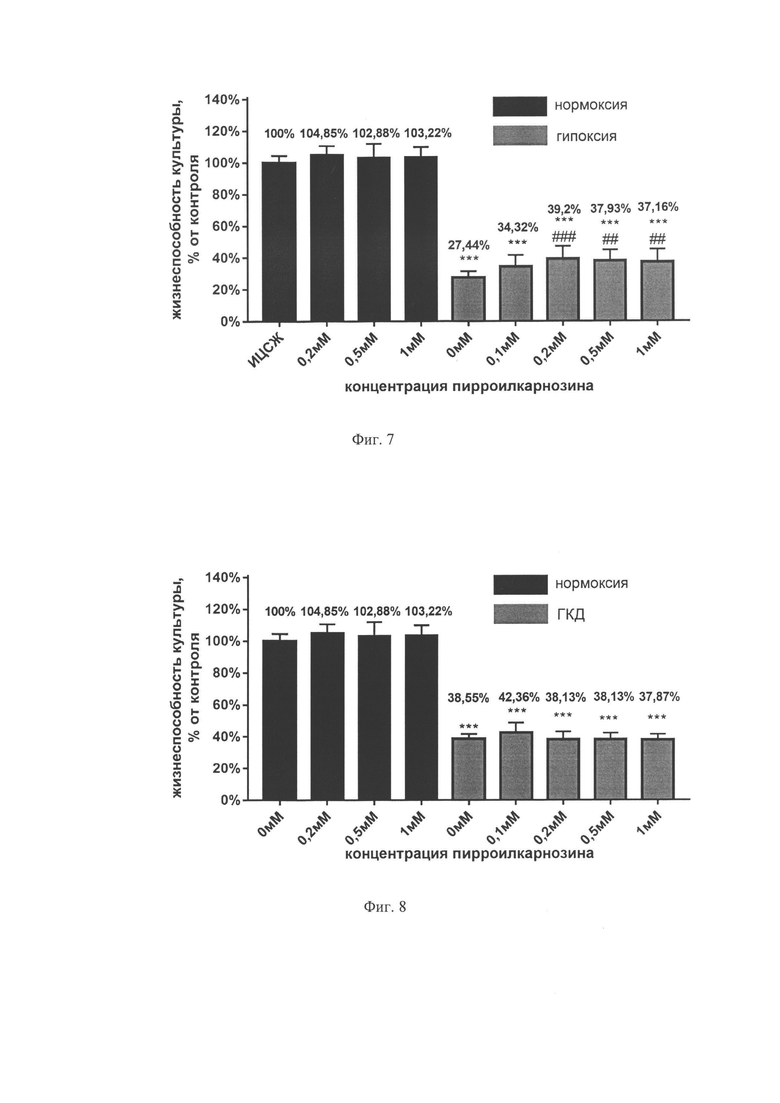
На фиг. 7 показана жизнеспособность нейронов после ГКД согласно МТТ-тесту. Культуры инкубировали в ИЦСЖ в условиях нормоксии («нормоксия») или в ИЦСЖ без глюкозы в условиях гипоксии («ГКД») с пироллилкарнозином во время 4 часов ГКД и 24 часов реоксигенации в указанных концентрациях. На графике представлено среднее±стандартное отклонение, n=12; * отличие от 0 мМ, нормоксия: *** р<0,001; # отличие от 0 мМ, ГКД: ## р<0,01; ### р<0,001
На фиг. 8 показана жизнеспособность нейронов после ГКД согласно МТТ-тесту. Культуры инкубировали в ИЦСЖ в условиях нормоксии («нормоксия») или в ИЦСЖ без глюкозы в условиях гипоксии («ГКД») с пироллилкарнозином только во время 24 часов реоксигенации в указанных концентрациях. На графике представлено среднее±стандартное отклонение, n=12; * отличие от 0 мМ, нормоксия: *** р<0,001.
При инкубации в условиях нормоксии жизнеспособность культур не менялась, то есть пироллилкарнозин не оказывает токсического действия в исследуемых концентрациях (0,2 мМ, 0,5 мМ и 1 мМ) (см. фиг. 7, 8). Жизнеспособность культур, перенесших ГКД, статистически значимо (р<0,001) снижалась относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии, независимо от концентрации пироллилкарнозина (см. фиг. 7, 8). Жизнеспособность культур значимо увеличивалась относительно культуры, подвергшейся ГКД без добавления пироллилкарнозина, при инкубации с ним во время 4 часов ГКД и 24 часов реоксигенации, в концентрациях 0,2 мМ (на 11,76%), 0,5 мМ (на 10,49%) и 1 мМ (на 9,72% (см. фиг. 7). При инкубации с пироллилкарнозином только во время 24 часов реоксигенации статистически значимых отличий от культуры, подвергавшейся ГКД без вещества, обнаружено не было (см. фиг. 8).
Таким образом, пироллилкарнозин не оказывает токсического действия на первичную культуру нейронов и, согласно МТТ-тесту, оказывает нейропротекторный эффект в концентрациях 0,2 мМ, 0,5 мМ и 1 мМ при инкубации с ним культуры во время 4 часов ГКД и 24 часов реоксигенации.
6.2. Влияние пироллилкарнозина на жизнеспособность первичной культуры клеток коры больших полушарий мозга крыс в условиях глюкозо-кислородной депривации (ЛДГ-тест).
Для подтверждения данных о положительном влиянии пирролилкарнозина на жизнеспособность нейронов по результатам МТТ-теста оценили его влияние на гибель нейронов, регистрируемую по активности ЛДГ в среде после инкубации культуры с ним во время 4 часов ГКД и 24 часов реоксигенации или только во время 24 часов реоксигенации.
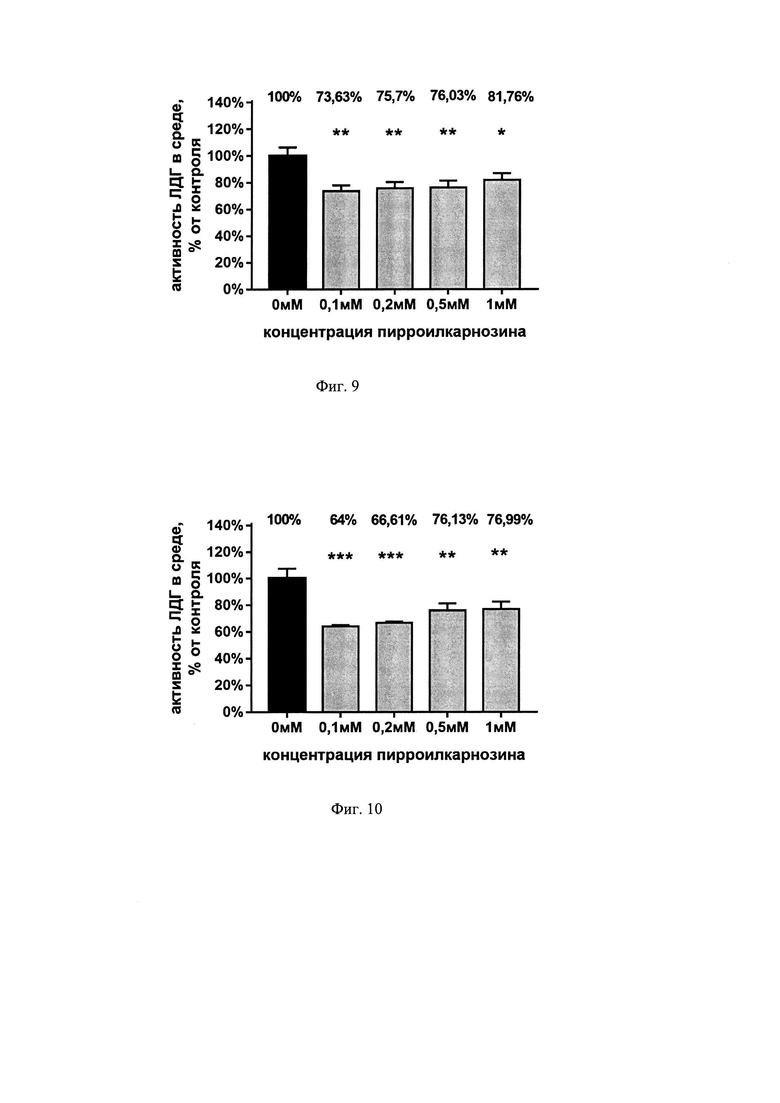
Пирролилкарнозин снижает активность ЛДГ в концентрациях 0,1 мМ (на 26,4%), 0,2 мМ (на 24,3%), 0,5 мМ (на 24%), 1 мМ (на 18,2%) при инкубации с ним культуры во время 4 часов ГКД и 24 часов реоксигенации (см. фиг. 9), а также снижает активность ЛДГ в концентрациях 0,1 мМ (на 36%), 0,2 мМ (на 33,4%), 0,5 мМ (на 23,9%), 1 мМ (на 23%) при инкубации с ним культуры во время 24 часов реоксигенации после 4 часов ГКД (см. фиг. 10) относительно активности ЛДГ в среде без пирролилкарнозина.
На фиг. 9 показана активность фермента ЛДГ в среде при инкубации с пирролилкарнозином во время 4 часов ГКД и 24 часов реоксигенации. Культуры инкубировали с ИЦСЖ без глюкозы в условиях гипоксии в течение 4 часов с последующим добавлением пирролилкарнозина в указанных концентрациях. На графике представлено среднее ± стандартное отклонение, n=8. * - р<0,05, ** - р<0,01.
На фиг. 10 показана активность фермента ЛДГ в среде при инкубации с пирролилкарнозином только во время 24 часов реоксигенации. Культуры инкубировали в ИЦСЖ без глюкозы в условиях гипоксии в течение 4 часов с последующим добавлением пирролилкарнозина в указанных концентрациях. На графике представлено среднее±стандартное отклонение, n=8. ** - р<0,01, *** - р<0,001.
Согласно данным, полученным при измерении активности ЛДГ, пирролилкарнозин препятствует гибели нейронов в концентрациях 0,1 мМ, 0,2 мМ, 0,5 мМ, 1 мМ как при инкубации с ним культуры во время 4 часов ГКД и 24 часов реоксигенации, так и только во время 24 часов реоксигенации после 4 часов ГКД (см. фиг. 9, 10).
Таким образом, пирролилкарнозин не оказывает токсическое действие и проявляет нейропротекторный эффект в условиях глюкозо-кислородной депривации. Согласно данным МТТ и ЛДГ тестов наиболее эффективная минимальная концентрация пироллилкарнозина при моделировании острой ишемии головного мозга с последующей реперфузией составила 0,2 мМ.
Пример 7. Влияние пирролилкарнозина на жизнеспособность и гибель первичной культуры клеток коры больших полушарий мозга крыс в условиях эксайтотоксичности, индуцированной N-метил-D-аспартатом (NMDA).
Для моделирования условий эксайтотоксичности, характерной для патохимического каскада при инсульте, использовали метод NMDA-индуцированной эксайтотоксичности, предложенный [Н. Wan Ko, K. Park, Н. Kim., P. Han, Y. Kim, В. Gwag, Е. Choi Са2+ -Mediated Activation of c-Jun N-Terminal Kinase and Nuclear Factor KB by NMDA in Cortical Cell Cultures // J. Neurochem. 1998; 71(4): 1390-5. doi: 10.1046/j.1471-4159.1998.71041390.x].
Культуру клеток коры больших полушарий мозга крыс готовили, как описано выше. Через 10 дней после посадки к культуре добавляли 100 мкМ агониста глутаматных NMDA-рецепторов N-метил-D-аспартата (NMDA), растворенный в ИЦСЖ без ионов магния, так как они способны закрывать ионный канал глутаматных NMDA-рецепторов, и инкубировали в течение 15 минут при температуре 37°С, относительной влажности 80% и содержании СО2 5%. После чего в культуре меняли среду на содержащую исследуемое вещество (пироллилкарнозин) в концентрации 0,2 мМ, 0,5 мМ или 1 мМ. Через 24 часа проводили МТТ-тест и измеряли активность лактатдегидрогеназы в среде.
7.1. Влияние пирролилкарнозина на жизнеспособность первичной культуры клеток коры больших полушарий мозга крыс в условиях NMDA-индуцированной эксайтотоксичности (МТТ-тест).
Первичную культуру нейронов коры больших полушарий 18-дневных эмбрионов крыс инкубировали в ИЦСЖ, не содержащей ионы магния, со 100 мкМ NMDA в течение 15 минут для моделирования условий эксайтотоксичности. После этого культурам заменили среду на не содержащую антиоксиданты нейробазальную среду с добавлением пирролилкарнозина в концентрациях 0,2 мМ, 0,5 мМ или 1 мМ. В интактной культуре заменили среду на не содержащую антиоксиданты нейробазальную среду, без инкубации с NMDA. Через 24 часа после окончания ГКД оценивали гибель клеток в культуре с помощью МТТ-теста.
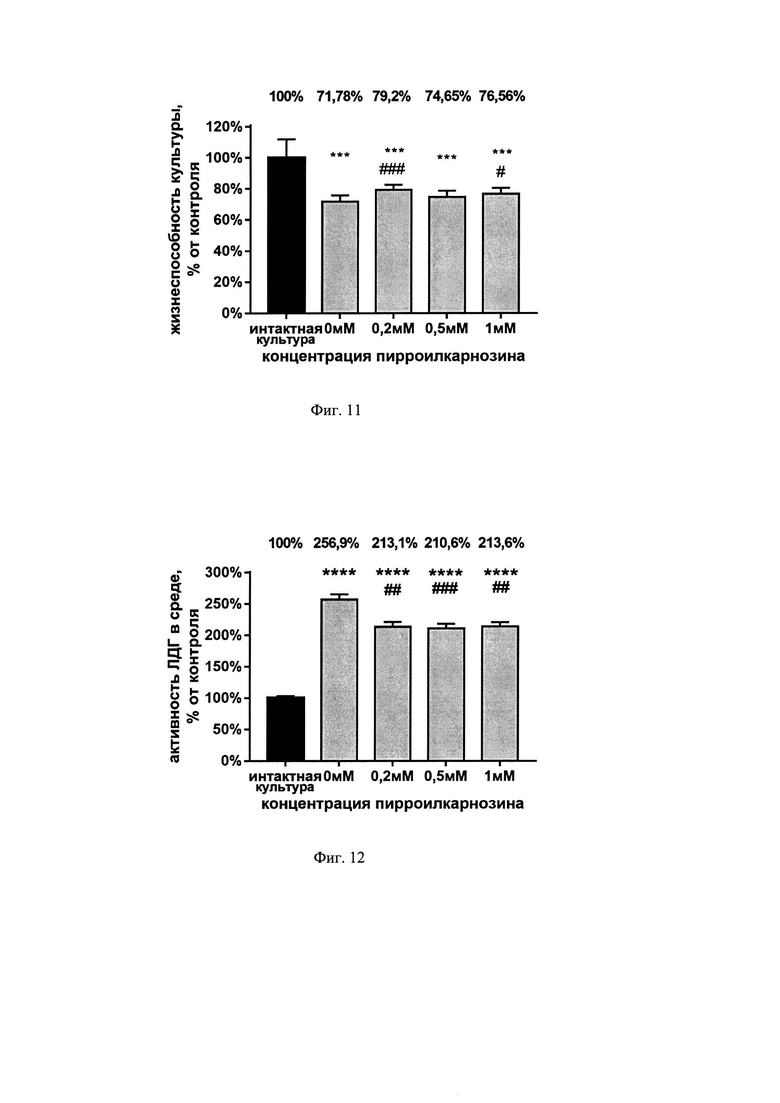
На фиг. 11 показана жизнеспособность нейронов при инкубации культуры с пирролилкарнозином после моделирования эксайтотоксичности согласно МТТ-тесту. Культуры инкубировали в ИЦСЖ с 100 мкМ NMDA в течение 15 минут с последующим добавлением пироллилкарнозина в указанных концентрациях. На графике представлено среднее±стандартное отклонение, n=12; * отличие от интактной культуры: *** р<0,001; # отличие от 0 мМ: # р<0,05, ### р<0,001.
Инкубация культуры нейронов со 100 мкМ NMDA в течение 15 минут снизила их жизнеспособность на 28,22% согласно МТТ-тесту. Жизнеспособность культур, инкубированных с пирролилкарнозином в концентрациях 0,2 мМ и 1 мМ увеличилась относительно культуры, инкубированной только со 100 мкМ NMDA на 7,42% и 4,78% соответственно (см. фиг. 11).
7.2. Влияние пирролилкарнозина на гибель первичной культуры клеток коры больших полушарий мозга крыс в условиях эксайтотоксического эффекта 100 мкМ (ЛДГ-тест).
Первичную культуру нейронов коры больших полушарий 18-дневных эмбрионов крыс инкубировали в ИЦСЖ, не содержащей ионы магния, со 100 мкМ NMDA в течение 15 минут для моделирования условий эксайтотоксичности. После этого культурам заменили среду на не содержащую антиоксиданты нейробазальную среду с добавлением пирролилкарнозина в концентрациях 0,2 мМ, 0,5 мМ или 1 мМ. В интактной культуре заменили среду на не содержащую антиоксиданты нейробазальную среду, без инкубации с NMDA. Через 24 часа после окончания ГКД в культуральной среде измеряли активность лактатдегидрогеназы (ЛДГ).
На фиг. 12 показана активность фермента ЛДГ в среде при инкубации культуры с пирролилкарнозином после моделирования эксайтотоксичности. Культуры инкубировали в ИЦСЖ с 100 мкМ NMDA в течение 15 минут с последующим добавлением пироллилкарнозина в указанных концентрациях. На графике представлено среднее ± стандартное отклонение, n=8; * отличие от интактной культуры: *** - р<0,001; # отличия от 0 мМ: ## р<0,01, ### р<0,001.
Инкубация культуры нейронов со 100 мкМ NMDA в течение 15 минут привела к повышению активности ЛДГ в среде на 156,9% относительно интактной культуры без последующего добавления пирролилкарнозина, и на 113,1%, 110,6% и 113,6% при последующем добавлении пирролилкарнозина в концентрациях 0,2 мМ, 0,5 мМ и 1 мМ соответственно. Активность ЛДК в среде культур, инкубированных с пирролилкарнозином в концентрациях 0,2 мМ, 0,5 мМ и 1 мМ, уменьшилась относительно культуры, инкубированной только с NMDA на 43,8%, 46,3% и 43,3% соответственно (см. фиг. 12).
Согласно данным, полученным при измерении активности ЛДГ, пирролилкарнозин снижает гибель нейронов культуры в концентрациях 0,2 мМ, 0,5 мМ, 1 мМ в условиях NMDA-индуцированной эксайтотоксичности.
По данным МТТ и ЛДГ тестов минимальная концентрация пирролилкарнозина, обладающая нейропротекторным эффектом в условиях эксайтотоксического воздействия NMDA на культуру нейронов, составила 0,2 мМ.
Таким образом, полученное средство обладает высокой антиоксидантной и нейропротекторной активностью и высокой устойчивостью к гидролизу сывороточной карнозиназой.
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство, обладающее нейропротекторной противоишемической активностью | 2022 |
|
RU2780112C1 |
| Мицелярный комплекс липоевой кислоты с карнозином для защиты млекопитающих от окислительного стресса | 2016 |
|
RU2647435C2 |
| НЕЙРОПРОТЕКТОРНОЕ СРЕДСТВО | 2016 |
|
RU2614697C1 |
| Средство, обладающее антиагрегантной, цитопротекторной и антиоксидантной активностью | 2018 |
|
RU2694061C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2009 |
|
RU2540470C9 |
| Способ получения глиальных производных индуцированных плюрипотентных стволовых клеток с повышенной экспрессией BDNF для терапии ишемического инсульта | 2023 |
|
RU2829361C1 |
| СПОСОБ ОЦЕНКИ КОМПЛЕКСНОЙ ЗАЩИТЫ КЛЕТОК ПРИ НЕЙРОВОСПАЛЕНИИ НА МОДЕЛИ IN VITRO ПРИ ВОЗДЕЙСТВИИ АГОНИСТОМ ПАР1 | 2022 |
|
RU2796524C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ИШЕМИЧЕСКИХ ПОРАЖЕНИЙ МОЗГА | 2004 |
|
RU2288714C2 |
| ПРИМЕНЕНИЕ L-КАРНОЗИНА ДЛЯ ПРИГОТОВЛЕНИЯ НАНОПРЕПАРАТА, ОБЛАДАЮЩЕГО АНТИГИПОКСИЧЕСКОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2482867C1 |
| СПОСОБ ПРОФИЛАКТИКИ И КОРРЕКЦИИ МЕТАБОЛИЧЕСКИХ И ФУНКЦИОНАЛЬНЫХ НАРУШЕНИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ В УСЛОВИЯХ СТРЕССА | 2019 |
|
RU2717107C1 |

Изобретение относится к области медицины, в частности к фармакологии, а именно к средству 3-(N-пирролил)пропаноил-L-гистидин общей структурной формулы (1). Предложенное средство обладает антиоксидантной и нейропротекторной активностью. Технический результат заключается в расширении арсенала средств, обладающих высокой антиоксидантной и нейропротекторной активностью. 12 ил., 3 табл., 7 пр.

Средство общей структурной формулы (1): 3-(N-пирролил)пропаноил-L-гистидин

обладающее антиоксидантной и нейропротекторной активностью.
| Средство, обладающее антиагрегантной, цитопротекторной и антиоксидантной активностью | 2018 |
|
RU2694061C1 |
| MENON K | |||
| et al | |||
| Effects of supplementation with carnosine and other histidine-containing dipeptides on chronic disease risk factors and outcomes: protocol for a systematic review of randomized controlled trials, BMJ Open, 2018, v | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| БОЛДЫРЕВ А.А | |||
| Карнозин: новые концепции для | |||
Авторы
Даты
2022-08-03—Публикация
2021-11-17—Подача