Изобретение относится к области медицины, в частности к фармакологии, а именно к средствам, обладающим антиагрегантной, цитопротекторной, антиоксидантной и супероксид-перехватывающей активностью, общей структурной формулы X-бета-аланил-L-гистидин (X-карнозин), где X - салицил (СЦ) или ацетилсалицил (АСЦ).
Салициловая кислота (СК) и ее производные долгое время используются в медицине в качестве нестероидных противовоспалительных препаратов (НПВП). Наиболее известный салицилат представляет собой ацетилсалициловую кислоту (АСК, аспирин). АСК, благодаря ее способности препятствовать агрегации тромбоцитов, применяется для лечения и профилактики сердечно-сосудистых заболеваний (Домашенко М.А., Танашян М.М.. Ацетилсалициловая кислота в лечении и профилактике ишемических нарушений мозгового кровообращения. // РМЖ Неврология Психиатрия. 2011. Т. 19(9). С. 562-573; Танашян М.М., Раскуражев А.А., Кузнецова П.И. Аспирин: легенда продолжается // Профилактическая медицина. 2018. Т. 21(5). С. 124-129). Кроме того, АСК обладает противовоспалительным, жаропонижающим и анальгетическим действием (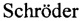 Н,
Н,  K. Clinical pharmacology of acetylsalicylic acid. // Z. Kardiol. 1992. V. 81 (Suppl 4). P. 171-175).
K. Clinical pharmacology of acetylsalicylic acid. // Z. Kardiol. 1992. V. 81 (Suppl 4). P. 171-175).
Антитромботическое действие АСК обусловлено наличием ацетильной группы, которая посредством реакции ацетилирования приводит к необратимому ингибированию циклооксигеназы 1 (СОХ-1) и, как следствие, к подавлению образования тромбоксана А2. (Awtry Е.Н., Loscalzo J. Aspirin. // Circulation, 2000. V. 101(10). P. 1206-1218). Аспирин остается основным средством как первичной, так и вторичной профилактики ишемического инсульта (Пирадов М.А., Танашян М.М., Максимова М.Ю. Инсульт: современные технологии диагностики и лечения. МЕДпресс-информ Москва, 2018. 360 с). Клиническая эффективность аспирина показана в ряде международных исследований. Так по данным метаанализа, проведенного в 2009 году, прием аспирина снижает риск атеротромботических событий на 14% при первичной профилактике и на 22% при вторичной профилактике (Сергеев Д.В., Танашян М.М., Пирадов М.А. Антиагрегантная терапия при ишемическом инсульте: проблемы и перспективы // РМЖ Неврология Психиатрия. 2012, №31, С. 1536-1540). В настоящее время аспирин является единственным антиагрегантным препаратом, эффективность которого при назначении в острый период ишемического инсульта подкреплена данными доказательной медицины.
Как и другие НПВП, АСК может оказывать как местное (за счет раздражения слизистой оболочки), так и системное (за счет уменьшения синтеза простагландинов) повреждающее воздействие на слизистую оболочку желудочно-кишечного тракта (ЖКТ) при пероральном приеме, в том числе с возникновением эрозий и язв, развитием желудочно-кишечных кровотечений. (Рафальский В.В., Крикова А.В., Багликова А.Н. Особенности клинической фармакологии ацетилсалициловой кислоты как антитромботического препарата // Кардиоваскулярная терапия и профилактика. 2009. V. 8(7). Р. 102-107). Кроме того, высокие дозы аспирина могут вызывать проагрегантное воздействие на тромбоциты, а также повышение артериального давления (АД), нарушение функций печени и почек, аллергические проявления. Частота этих осложнений напрямую зависит от высокой (>1000 мг/сут.) суточной дозы препарата. Использование малых суточных доз аспирина (1 мг/кг массы тела) в лечении больных с цереброваскулярными заболеваниями (ЦВЗ) впервые в мировой клинической практике в НИИ неврологии РАМН (Суслина З.А., Высоцкая В.Г., Антиагрегантное действие и клинический эффект малых доз аспирина при лечении больных артериальной гипертензией и цереброваскулярными нарушениями. // Клиническая медицина, 1983, №9, С. 51-58), позволило минимизировать побочные эффекты аспирина, но не устранило полностью его способность индуцировать повреждения ЖКТ.
Наличие побочных эффектов обусловливает целесообразность модификации салицилатов, с сохранением их основных терапевтических эффектов. Одним из способов решения данной задачи может быть создание синтетических производных на основе салицилатов и природного антиоксиданта карнозина (бета-аланил-L-гистидин), который показал противоязвенную активность при моделировании язвенных повреждений слизистой оболочки желудка у крыс, что выражалось в уменьшении размеров очага язвенного повреждения и ускорении его заживления (Трубицына И.Е., Шабанова М.Е., Чикунова Б.З., Шаврацкий В.Х., Формазюк В.Е., Сергиенко В.И., Стволинский С.Л., Болдырев А.А. Характеристика противоязвенной эффективности карнозина. // Пат. физиол. и эксперим, терапия, 1997. №4. С. 17-20).
Карнозин обладает свойствами прямого антиоксиданта - перехватчика радикалов, а также индуктора антиоксидантных систем в условиях окислительного стресса (ОС), антигликирующего агента, хелатора ионов металлов и молекулярного шаперона (Болдырев А.А., Карнозин: новые концепции для функций давно известной молекулы. // Биохимия, 2012. Т. 77(4). С. 403-418). Антиоксидантное и нейропротекторное действие карнозина охарактеризовано на различных моделях в экспериментах in vitro и in vivo (Boldyrev A.A., Aldini G., Derave W., Physiology and pathophysiology of carnosine. // Physiol. Rev. 2013. V. 93. P. 1803-1845).
Ключевым молекулярным механизмом, лежащим в основе гибели нервной ткани при ишемии мозга является ОС. На моделях фокальной ишемии мозга в бассейне средней мозговой артерии исследована эффективность карнозина и ключевые механизмы его нейропротекторного действия. Впервые выявлен эффект низких доз карнозина как при его курсовом профилактическом применении, так и в постишемическом периоде, который выражался в уменьшении площади очага ишемии и неврологического дефицита на фоне повышения антиоксидантной активности и нормализации уровня белков-регуляторов апоптоза в приочаговой зоне мозга (Стволинский С.Л., Федорова Т.Н, Девятое А.А., Медведев О.С., Белоусова М.А., Рыжков И.Н., Тутельян В.А. Нейропротективное действие карнозина в условиях экспериментальной фокальной ишемии-реперфузии головного мозга. // Журнал неврологии и психиатрии им. С.С. Корсакова 2017. Т. 117. №12-2, С. 60-64; Федорова Т.Н., Гаврилова С.А., Морозова М.П., Девятое А.А., Бережной Д.С., Стволинский С.Л. Нейропротекторное действие карнозина в условиях фокальной ишемии мозга. // Вопр. биол. мед. фарм. химии. 2017. Т. 20(4). С. 25-31).
В пилотном исследовании было показано, что карнозин повышает эффективность базисной терапии у пациентов с дисциркуляторной энцефалопатией, улучшая неврологическую симптоматику и восстанавливая уровень эндогенной антиоксидантной защиты в плазме крови (Федорова Т.Н., Беляев М.С., Трунова О.А., Гнездицкий В.В., Максимова М.Ю., Болдырев А.А. Нейропептид карнозин увеличивает устойчивость липопротеинов и эритроцитов крови и эффективность иммунокомпетентной системы у пациентов с хронической дисциркуляторной энцефалопатией // Биол. мембраны. 2008. Т. 25. С. 479-483). Однако его эффективность в организме ограничена низкой липофильностью, а также гидролизом под действием специфических ферментов - тканевой и сывороточной карнозиназ (Wolos A., Piekarska K., Carnosinase in the kidney and liver. // Intern. J. Biochem. 1975. V. 6. P. 723-726). Можно предположить, что новые соединения карнозина с салицилатами защищенные от гидролиза карнозиназой будут обладать нейропротекторным действием, антиагрегантной и антиоксидантной активностью, а также позволят предотвратить побочные эффекты на ЖКТ.
Из уровня техники известно совместное использование карнозина и АСК только в форме биорезорбируемой гидрогелевой полимерной композиции в виде пленки, применяемой в сердечно-сосудистой хирургии. При этом для получения композиции желатина с биологически активными веществами, в том числе и АСК, готовят 5-10 мас. % раствор желатина с молекулярной массой 60-80 кДа в дистиллированной воде. Раствор нагревают до температуры 40°С до полного растворения желатина, затем выливают на подложку из полипропилена, полиэтилена. Высушивание композиции осуществляют при температуре не выше 30°С в течение 3-5 дней. Для перевода в водонерастворимое состояние полимерные композиции обрабатывают 0,05-0,1 мас. % растворами сшивающих агентов - глутарового альдегида или генипина при комнатной температуре. Полимерную композицию промывают дистиллированной водой для удаления непрореагировавших остатков сшивающего агента (контроль промывных вод - спектрофотометрический). Введение в полимерную композицию биологически активных веществ (БАВ) - ацетилсалициловой кислоты, гепарина, дипиридамола, L-карнозина, ципрофлоксацина, метронидазола осуществляют путем хемосорбции. Полимерные композиции погружают в раствор БАВ с концентрацией 0,05-1,0 мас. %. Для пластифицирования полимерных композиций их погружают в растворы пластификатора с концентрацией - 7-10 мас. %. Композиции получают в виде пленок (RU 2519103, 10.06.2014). Однако данная композиция используется только в качестве пленки для покрытий имплантируемых изделий и устройств, предназначенных для контакта с кровью (манжеты для искусственных клапанов сердца, кардиохирургические заплаты, протезы кровеносных сосудов и др.); для использования в качестве биофизического барьера для профилактики спаечных процессов после хирургических вмешательств; и для создания систем с контролируемым высвобождением биологически активных и лекарственных веществ.
Наиболее близким к описываемому по технической сущности и достигаемому результату является антиоксидантный комплекс, представляющий собой комплекс карнозина с α-липоевой кислотой, полученный путем смешивания α-липоевой кислоты с водным раствором карнозина в эквимолярном соотношении (RU 2647435, 15.03.2018). Данный комплекс проявляет высокую антиоксидантную активность, устойчивость к гидролизу сывороточной карнозиназой, нейропротекторную активность в условиях воздействия нейротоксина- 6-гидроксидофамина на культуру клеток нейробластомы человека SH-SY5Y. В условиях острой гипобарической гипоксии у крыс данный комплекс защищает экспериментальных животных от гибели и способствует сохранению когнитивных функций мозга.
Задача изобретения: создание нового средства на основе салицилатов и карнозина, обладающего нейропротекторным действием, антиагрегантной и антиоксидантной активностью.
Технический результат заключается в расширении арсенала средств, обладающих антиагрегантной, антиоксидантной и цитопротекторной активностью и обеспечивающих существенное снижение побочных эффектов на ЖКТ, присущих НПВП.
Технический результат достигается тем, что создано средство общей структурной формулы (I): Х-бета-аланил-L-гистидин или Х-карнозин (Х-К), где X - салицил (СЦ) -,
обладающее супероксид-перехватывающей, антиоксидантной, нейропротекторной и антиагрегантной активностью.
Ниже приведены примеры, иллюстрирующие изобретение.
Пример. 1.
Синтез и идентификация средства
Для синтеза средства общей структурной формулы (I): Х-бета-аланил-L-гистидин или Х-карнозин (Х-К), где X - салицил (СЦ)-,

использовали следующие реактивы: ацетилсалициловая кислота (Хэбэй Цзихэн Труп Фармасьютикал Ко. Лтд, Китай), карнозин (Hamari Chemicals, Япония); триэтиламин, пивалоил хлорид (Fluka, Германия); ацетонитрил, диэтиловый эфир (Химмед, Россия). Все растворители абсолютировали соответствующим образом по общепринятым методикам. Синтез проводили в растворе классическими методами синтеза.
В первой колбе 2.0 г (11.1 ммоль) АСК растворяли в 40 мл ацетонитрила, охлаждали до температуры -5°С, к раствору прибавляли 1.76 мл (12.2 ммоль) триэтиламина (ТЭА), охлаждали до температуры -30°С, перемешивая на магнитной мешалке. К охлажденному раствору прибавляли 1.5 мл (12.2 ммоль) пивалоил хлорида (PivCl), перемешивали на магнитной мешалке 20 минут при температуре -10°С, охлаждали до температуры -30°С.
Карнозин 2.5 г (11.1 ммоль) растворяли в 7 мл воды и 14 мл ацетонитрила, прибавляли 1.55 мл (11.1 ммоль) ТЭА, охлаждали до температуры -20°С и через 20 минут прибавляли к содержимому первой колбы. Реакционную смесь выдерживали 1 час при температуре -10°С и 12 часов при температуре 18-20°С перемешивая на магнитной мешалке. Реакционную смесь упаривали на роторном испарителе досуха. Остаток растворяли в абсолютном метаноле и высаживали этилацетатом. Полученный продукт дважды переосаждали из абсолютного метанола сухим эфиром. Продукт отфильтровывали, многократно промывая его на фильтре сухим эфиром.
Полученное вещество высушивали под вакуумом в эксикаторе, в качестве осушителей использовали КОН, Р2О5 и парафин, осушители в эксикаторе меняли несколько раз. Выход продукта синтеза составил 2.8 г. По данным ВЭЖХ содержание целевого соединения в осадке составило 22.3%.
Масс-спектрометрия по полному ионному току.
В образце методом масс-спектрометрии для целевого соединения было установлено отношением массы к заряду m/z [М-Н] = 345 г/моль, что соответствует веществу салицил-карнозин (салицил-β-аланил-L-гистидин, СЦК) с молекулярной массой 346 г/моль. Кроме СЦК были установлены примеси ацетилкарнозина, диацетилкарнозина и СК (величины m/z в виде отрицательных ионов [М-Н] равны 267.1, 309.1 и 137.0, соответственно).
Препаративная очистка
Для последующей очистки 2.5 г полученного образца хроматографировали на колонке LiChroprep RP-18, используя в качестве подвижной фазы градиент этанола (0 - 30%). В отобранных фракциях (объем 1,0 мл) с помощью тонкослойной хроматографии (ТСХ) определяли наличие СЦК, используя АСК, СК и карнозин в качестве стандартов.
В таблице 1 приведены хроматографические подвижности (Rf) салицил-карнозина и стандартов: карнозина, АСК и СК в использованных системах растворителей при ТСХ.

Фракции, содержащие СЦК, объединяли, упаривали досуха на роторном испарителе, растворяли в абсолютном метаноле и осаждали сухим эфиром. Полученный осадок сушили в вакууме. Выход продукта составил 680 мг, содержание СЦК - 86%.
Получение высокоочищенного салицил-карнозина.
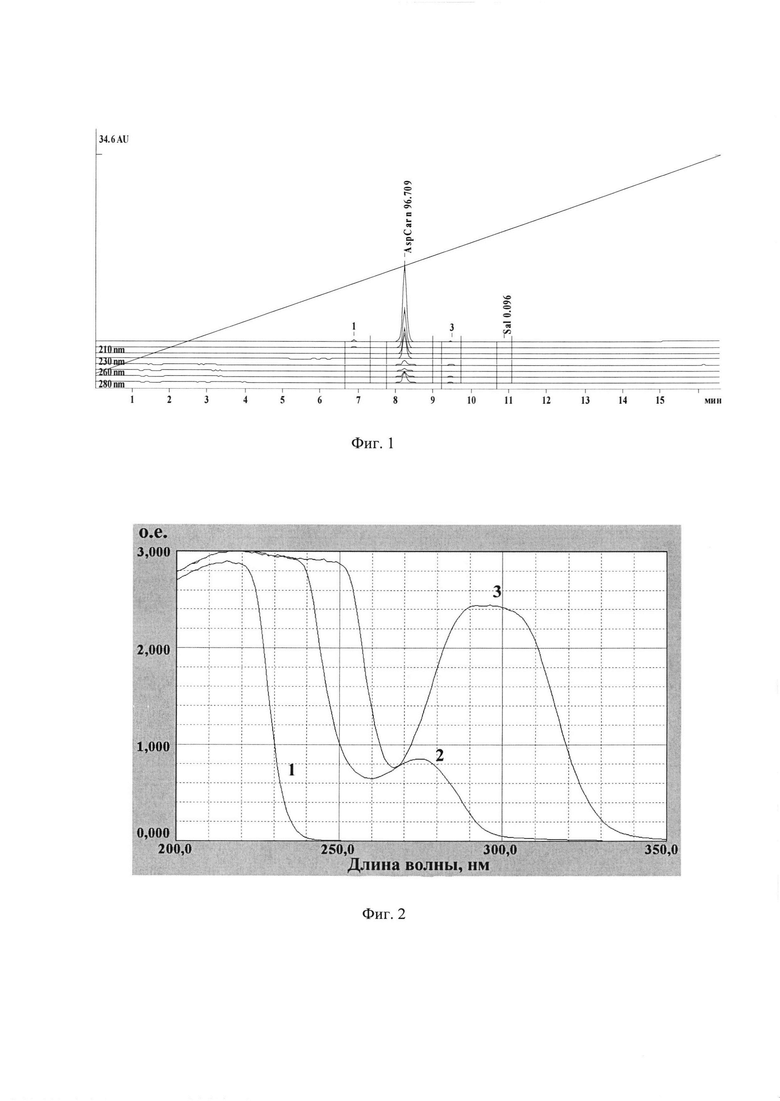
На следующем этапе была проведена очистка средства СЦК методом ВЭЖХ с использованием колонки Reprosilpur C18aq на хроматографе Милихром-А02. Для нанесения на колонку 250 мг неочищенного СЦК растворили в смеси 500 мкл метанола +500 мкл воды + 50 мкл уксусной кислоты. Выход регистрировали спектрофотометрически при λ=226 нм. Время удерживания составило 3.2 мин, выход 44.5 мг. Чистота полученного вещества составила 96,9% (см. фиг. 1). На фиг. 1 показан анализ чистоты синтезированного средства для исследований молекулярной структуры салицил-карнозина, полученного методом ВЭЖХ с обращенной фазой (по оси ординат - величина оптического поглощения при приведенных на графике длинах волн, в условных единицах - AU).
Элементный анализ.
Было проведено определение элементного состава СЦК на элементном анализаторе «Carlo-Erba Strumentazione» модель 1106 (Италия). Полученные данные представлены в таблице 2.

Полученные результаты элементного анализа удовлетворительно совпали с теоретическими данными для СЦК.
Спектральная характеристика.
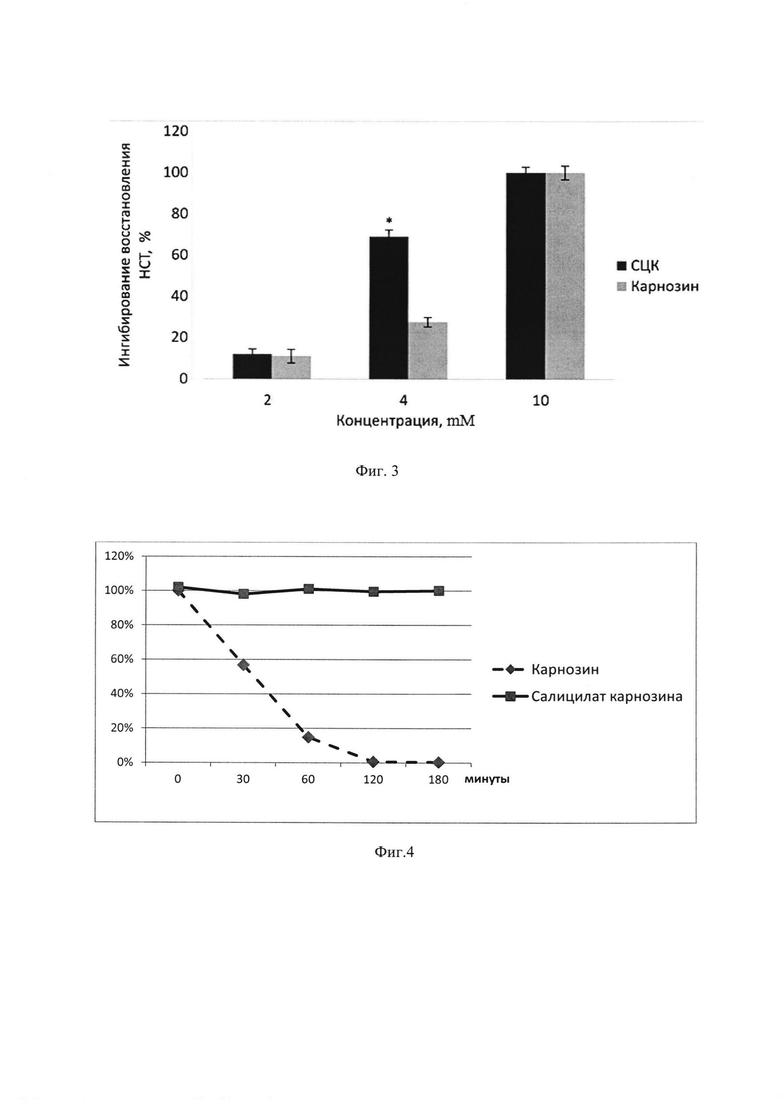
Оптическую плотность растворов СК, СЦК и карнозина измеряли при длинах волн 200-350 нм (рис. 2). Максимум поглощения для СЦК составил λмах=298±1 нм; при pH=5.89 (c=40 мг/мл). На фиг. 2 показаны спектры поглощения для карнозина (1), салициловой кислоты (2) и салицил-карнозина (3) в концентрациях 40 мг/мл.
Температура плавления.
Температура плавления СЦК составила 167-169°С.
Подтверждение молекулярной структуры полученного соединения.
Молекулярная структура СЦК была подтверждена данными исследования высокоочищенного препарата методами ЯМР-спектроскопии и масс-спектрометрии высокого разрешения (МСВР). ЯМР-1Н-спектры были получены на оборудовании «BrukerAvance 300» («Bruker DaltonicsInc.», США) на частоте 300 МГц; 13C-ЯМР-спектры были получены на оборудовании Bruker Avance 600 на частоте 150 МГц. Масс-спектры высокого разрешения (МСВР) измеряли на приборе Bruker micrOTOF II с использованием электро-распылительной ионизации (ЭРИ).
- 1Н - ЯМР - (300 MHz, D2O) δ 2.49-2.64 (m, 2Н), 2.95-3.03 (m, 1Н), 3.13-3.20 (m, 1H, J=4.3 Hz), 3.51-3.63 (m, 2H), 4.48 (dd, 1H, J=4.5 Hz), 6.90-6.97 (m, 2H), 7.06 (s, 1H), 7.41 (t, 1H, J=7.7 Hz), 7.56 (d, 1H, J=7.7 Hz), 8.19 (s, 1H);
- 13C - ЯМР (150 MHz, D2O) δ 28.0, 36.1, 36.7, 54.4, 116.9, 117.9, 120.8, 129.1, 130.5, 133.7, 134.9, 158.0, 158.3, 170.2, 174.2, 177.1;
- MCBP (m/z) [M+H] - расчетное значение для C16H18N4O5: 347.1358; полученное при исследовании 347.1350.
Таким образом, молекулярная масса СЦК, определенная методом масс-спектрометрии высокого разрешения, составила 346 г/моль.
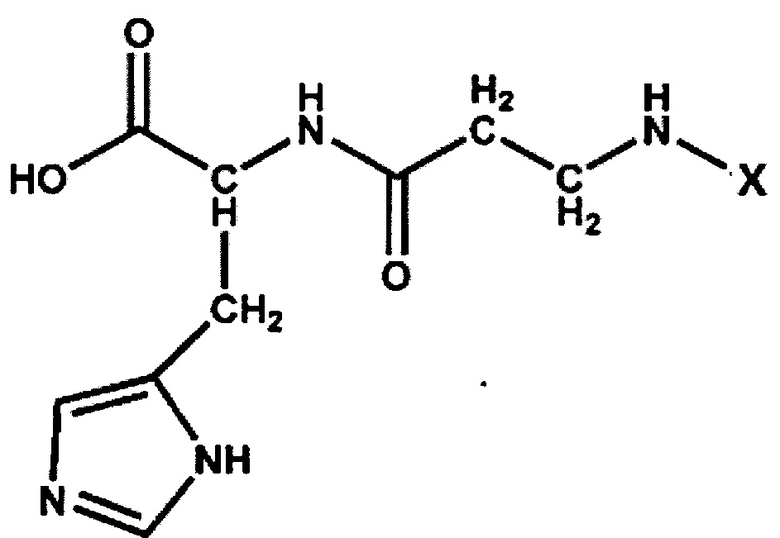
По исследованным физико-химическим характеристикам полученное нами соединение салицил-β-аланил-L-гистидин (СЦК) описывается следующей структурной формулой:
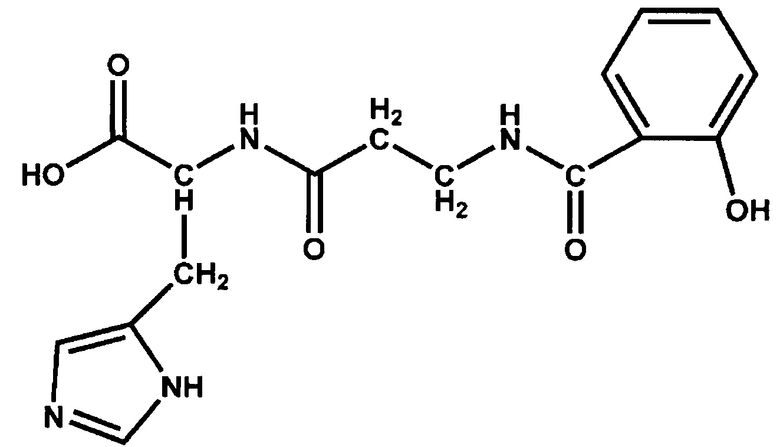
Пример 2.
Супероксид-перехватывающая активность салицилкарнозина.
Известно, что в активном центре Cu/Zn-зависимой супероксиддисмутазы медь и цинк связаны координационными связями с остатками гистидина. Было показано, что комплексы карнозина с цинком и медью обладают эффективной супероксид-перехватывающей способностью (Гуляева Н.В. Супероксид-перехватывающая активность карнозина в присутствии ионов меди и цинка // Биохимия. 1987. Т. 52. №7. С. 1216-1220).
Супероксид-перехватывающую активность карнозина и СЦК определяли спектрофотометрически путем оценки степени торможения супероксиддисмутазой реакции восстановления нитросинего тетразолия (НСТ) в формазан супероксидными радикалами, генерируемыми системой ферментативного окисления ксантина в присутствии ксантиноксидазы.
В кинетическом режиме измеряли подавление нарастания оптической плотности при длине волны поглощения 560 нм, обусловленное ингибированием восстановления НСТ.
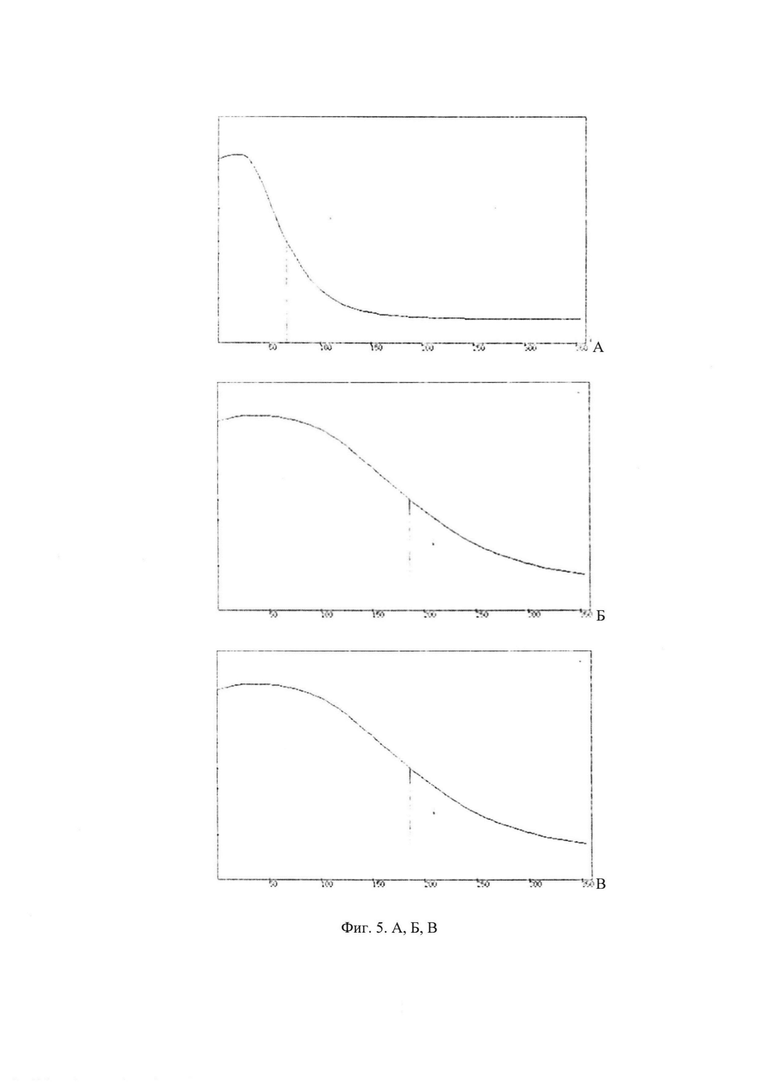
Определение скорости генерации супероксида проводили в контрольных образцах, не содержащих карнозин и СЦК, и при добавлении их комплексов с медью и цинком. Для получения комплексов с медью и цинком образцы карнозина и СЦК предварительно инкубировали 10 мин при комнатной температуре с эквимолярной концентрацией CUSO4 и ZnSO4. Супероксид-перехватывающую активность комплексов Cu/Zn - карнозина и Cu/Zn - СЦК в концентрациях 2, 4 и 10 мМ оценивали в % к контрольным образцам, не содержащим комплексов карнозина и СЦК.
Была выявлена концентрационная зависимость супероксид-перехватывающей активности комплексов карнозина и СЦК с CuSO4 и ZnSO4 (фиг. 3). В концентрации 10 мМ оба комплекса практически полностью ингибировали восстановление НСТ. При концентрации 4 мМ СЦК-комплекс ингибировал восстановление НСТ на 67%, комплекс с карнозином - на 24%»; т.е. СЦК оказался в 2,8 раза эффективнее, чем карнозин. При низкой концентрации (2 мМ) супероксид-перехватывающая активность обоих комплексов снижалась и не превышала 12%. Полученные результаты свидетельствуют о высокой супероксид перехватывающей активности СЦК (* - p<0,001 по отношению к карнозину).
Пример 3.
Устойчивость салицил-карнозина к гидролизу карнозиназой.
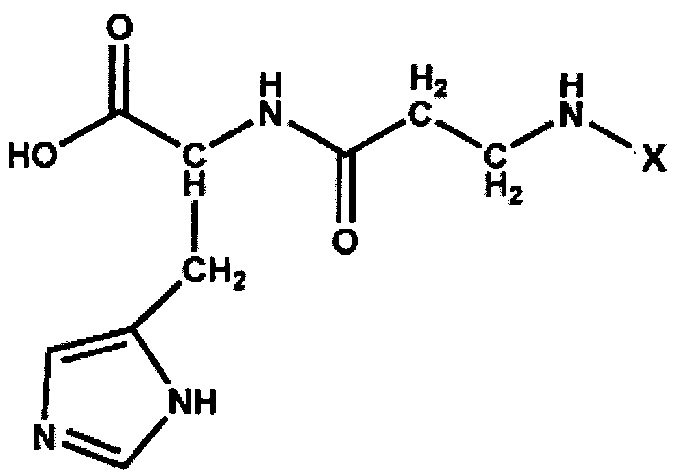
Для определения устойчивости к сывороточной карнозиназе ЛипК и свободного карнозина был использован метод, предложенный Пеговой и соавт. (Pegova A., Abe Н., Boldyrev A. Hydrolysis of carnosine and related compounds by mammalian carnosinases // Comp. Biochem. Physiol, part В Biochem. Mol. Biol. 2000. V. 127. P. 443-446). В исследовании использовали смесь образцов сыворотки, полученных от нескольких доноров. Сывороточную карнозиназу активировали путем инкубации с 5 мМ CdCl2 при 37°С в течение 30 мин. Карнозин или СЦК вносили в пробы в концентрации 2 мМ. Пробы инкубировали в течение 0-30-60-120-180 мин при 37°С. Белки осаждали ТХУ, осадок удаляли центрифугированием, супернатант использовали для анализа. В качестве контроля были взяты пробы, которые инкубировали без добавления сыворотки. Определение содержания СЦК и карнозина в пробах проводили методом ВЭЖХ-масс-спектрометрии, как описано выше. Отклик прибора в условных единицах интегрирования от стартовых образцов (0 мин), содержащих карнозин и СЦК в концентрации 2 мМ, принимали за 100%, остальные образцы нормировали на площадь пика стартового образца.
Карнозин гидролизовался препаратом фермента на 86% за 1 ч и полностью - за 2 ч, тогда как СЦК в течение 3 ч практически не подвергался гидролизу (см. фиг. 4). На фиг. 4 показано определение устойчивости СЦК к гидролизу сывороточной карнозиназой.
Пример 4.
Определение антиоксидантной активности салицил-карнозина методом железо-индуцированной хемилюминесценции.
Для оценки антиоксидантной активности СЦК in vitro использовали модель перекисного окисления липидов (ПОЛ), инициируемого ионами Fe2+ в липопротеинах низкой и очень низкой плотности (ЛП), выделенных из сыворотки крови пациентов с сосудистыми заболеваниями головного мозга.
Метод основан на измерении параметров хемилюминесценции (ХЛ) в условиях окисления суспензии ЛП ионами двухвалентного железа. Регистрировали следующие кинетические параметры ХЛ: быструю вспышку ХЛ (h, мВ), отражающую стационарный уровень липидных гидроперекисей; длительность латентного периода возгорания ХЛ (лаг-период, τ, c), характеризующего резистентность ЛП к окислению, которая зависит от их эндогенной антиоксидантной активности; максимальную величину хемилюминесценции (Н), которая характеризует общую способность субстрата (ЛП) к окислению.
Антиоксидантное действие СЦК сравнивали с действием карнозина, АСК, и тролокса. Растворы этих соединений вносили в реакционную пробу объемом 1 мл в концентрации 500 мкМ.
Через 30 секунд к пробам добавляли раствор двухвалентного железа (FeSO4*7H2O) в концентрации 2,5 мМ. Измерение ХЛ проводили на приборе Luminometer-1251 (LKB, Швеция) при 37°С и непрерывном перемешивании в 2 параллельных пробах для каждого образца, используя в анализе среднюю величину. Изменение изучаемых параметров кривой ХЛ выражали в процентах по отношению к контрольным значениям для проб, не содержащих исследуемые соединения (Федорова Т.Н. Применение хемилюминесцентного анализа для сравнительной оценки некоторых фармакологических веществ // Эксперим. клин, фармакология. 2003. Т. 66(5). 56-58). Данные изменения параметров железоиндуцированной хемилюминесценции под влиянием исследуемых соединений (конечная концентрация - 500 мкМ) отражены в таблице 3.
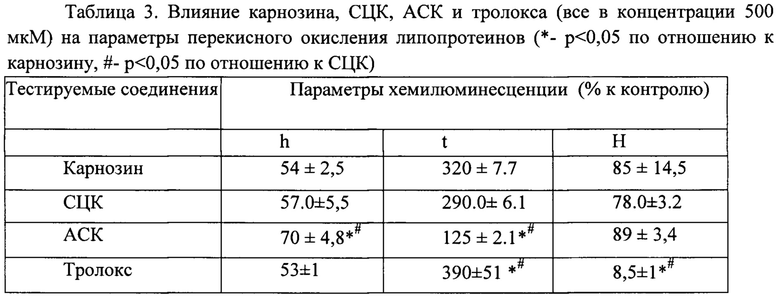
Результаты эксперимента показывают, что карнозин и СЦК с равной эффективностью изменяют кинетические параметры ХЛ: снижая на 46% и 43% интенсивность быстрой вспышки и увеличивая на 220% и 190% (по отношению к контролю, принятому за 100%) длительность латентного периода; при этом максимальная величина хемилюминесценции изменялась незначительно. Способность этих соединений ингибировать развитие быстрой вспышки ХЛ свидетельствует об их взаимодействии с предобразованными липидными гидроперекисями, а увеличение длительности латентного периода ХЛ характеризует их прямое антиоксидантное действие. По эффективности предотвращения роста липидных гидроперекисей и повышению антиоксидантной активности карнозин и СЦК сопоставимы с тролоксом, принятым в качестве «золотого стандарта» при исследовании активности природных антиоксидантов. Максимальная интенсивность перекисного окисления липопротеинов на 90% блокировалась тролоксом, при этом карнозин и СЦК не оказывали существенного влияния на этот параметр. АСК характеризуется низкой антиоксидантной активностью по сравнению с карнозином, СЦК и тролоксом.
Пример 5.
Цитопротекторное действие салицил-карнозина в условиях индукции окислительного гемолиза эритроцитов.
В качестве источника эритроцитов была использована кровь здоровых доноров, стабилизированная гепарином (20 ед/мл), которую разводили в 10 раз физиологическим раствором (145 мМ NaCl) и хранили при 37°С не более 4 часов. Устойчивость суспензии эритроцитов к окислительному воздействию определяли, регистрируя кинетику их гемолиза по изменению оптической плотности проб при длине волны 630 нм. Измерения проводили при 37°С и непрерывном перемешивании. Для измерения гемолиза в кювету, содержащую пирофосфатный буфер (10 мМ, pH=8,4), приготовленный на физиологическом растворе, вносили суспензию эритроцитов до концентрации (5±0.3)*106 клеток/мл. Подсчет количества клеток проводили в камере Горяева. Окислительную атаку индуцировали добавлением гипохлорита натрия (NaOCl) до конечной концентрации 200 мкМ в пробе. Процедуру проводили до достижения максимального уровня гемолиза.
Влияние карнозина, СЦК, АСК, тролокса и тиклопидина (высокоэффективного антиагреганта, не относящегося к классу НПВП, угнетающего агрегацию эритроцитов и повышающего их способность к деформации) на окислительный гемолиз эритроцитов оценивали:
а) по снижению скорости (V) гемолиза, определяемой по tg угла наклона кривой на линейном участке;
б) по увеличению времени, за которое гемолитическому разрушению подвергалась половина эритроцитов по сравнению с контролем (t1/2).
При измерении кинетики гемолиза перед добавлением индуктора окисления - NaOCl в кювету вносили исследуемые соединения до конечной концентрации 100 мкМ. Измеряемые параметры выражали в % по отношению к контрольным образцам, не содержащим исследуемые соединения.
По окончанию измерения гемолиза эритроцитов, вызванного NaOCl, во всех пробах проводили контрольное определение pH реакционной смеси. Необходимость контроля pH реакционной среды (8,3-8,4) была вызвана тем, что эффективность действия NaOCl снижается в кислой среде.
При исследовании антигемолитической активности СЦК в качестве препарата сравнения использовали карнозин. В предварительном опыте было показано, что 50%-ингибирование гемолиза обеспечивается концентрацией карнозина 25 мкМ. Далее в этой концентрации оценивали антигемолитическое действие СЦК, АСК, тиклопидина и тролокса. Результаты антигемолитического действия исследуемых соединений представлены в таблице 4.

На фиг. 5 приведены примеры кинетики гемолиза эритроцитов: А - контроль; Б и В - в присутствии 100 мкМ салицил-карнозина и карнозина, соответственно; вертикальной чертой отмечено время гемолиза половины эритроцитов.
Из приведенных данных можно заключить, что в условиях индукции гемолиза гипохлоритом натрия СЦК и карнозин в концентрации 25 мкМ проявили сильное ингибирующее действие на скорость гемолиза и время разрушения половины эритроцитов (52% и 227%, и 50% и 223%, соответственно; см. фиг. 5Б и 5В). Тиклопидин был сопоставим по антигемолитическому действию с карнозином и СЦК, тогда как АСК и тролокс в этих условиях не оказывали влияния на измеряемые параметры.
Пример 6.
Антиагрегантная активность салицил-карнозина.
Антиагрегантную активность СЦК сравнивали с действием АСК, тиклопидина, карнозина и тролокса.
Тромбоциты получали из донорской крови в соответствии со стандартной процедурой. Агрегацию инициировали добавлением раствора аденозиндифосфата в концентрации 10 мкМ. Процесс агрегации тромбоцитов регистрировали турбидиметрическим методом по изменению оптической плотности с использованием лазерного агрегометра BIOLA Ltd. Коэффициент агрегации тромбоцитов рассчитывали в % к контрольным образцам, не содержащим исследуемые соединения. В качестве препарата сравнения использовали АСК, являющуюся широко применяемым высокоэффективным антиагрегантным препаратом. В предварительном эксперименте было показано, что 50% подавление агрегации тромбоцитов достигается при концентрации АСК, равной 85 мкМ.
В эксперименте исследуемые соединения использовали в такой же концентрации. Результаты антиагрегантной активности исследуемых соединений показаны в таблице 5.

СЦК подавлял агрегацию тромбоцитов на 42%, АСК - на 46%, тиклопидин - на 43%. Под действием карнозина агрегация тромбоцитов снижалась на 22%, тролокс не проявлял антиагрегантной активности. Антиагрегантная активность карнозина была в 2 раза ниже, чем у СЦК, АСК и тиклопидина. Таким образом по эффективности действия СЦК был сопоставим с АСК и тиклопидином, применяемыми в клинике в качестве антиагрегантов (см. табл. 5).
Пример 7.
Влияние карнозина и салицил-карнозина на устойчивость крыс к острой гипобарической гипоксии.
Защитный эффект СЦК in vivo был исследован в модели острой гипобарической гипоксии (ОГГ). В эксперименте использовали самцов крыс линии Вистар весом 180-220 г. Условия ОГГ были созданы в барометрической камере путем снижения атмосферного давления до 145 мм рт. ст., приводящего к 100% гибели животных в течение 15-30 минут. Животные были разделены на 3 группы по 8 животных: 1 - контроль, гипоксия с введением физиологического раствора; 2 - гипоксия с введением карнозина; 3 - гипоксия с введением СЦК. Изучаемые соединения вводили внутрибрюшинно в дозе 100 мг/кг массы тела за 1 час до помещения в барокамеру. Крыс по одной сажали в барокамеру и в течение 1 минуты снижали давление до указанного выше значения. Животных содержали в камере до полной остановки дыхания, после чего в течение 1 мин восстанавливали давление до нормального. Регистрировали время реабилитации (RT, сек), которое является периодом от момента перевода животного в условия нормального атмосферного давления до восстановления активной позы. Влияние карнозина и СЦК на время реабилитации крыс, перенесших воздействие острой гипобарической гипоксии, показано в таблице 6.

Из данных, представленных в таблице 6, следует, что введение карнозина способствует значительному снижению (в 5 раз) времени восстановления активной позы крыс после воздействия ОГГ по сравнению с контрольными животными, получавшими физиологический раствор. СЦК также способствует значительному снижению (в 2,5 раза) времени восстановления активной позы крыс после воздействия ОГГ по сравнению с контрольными животными. Смертность в группе животных, получавших карнозин, была в 1,7 раза ниже, чем в группе, получавших физиологический раствор. Введение животным СЦК полностью предотвращало их гибель, обусловленную действием ОГГ. АСК с наименьшей эффективностью (в 1,6 раза) сокращала время восстановления позы и не защищала животных от гибели. Полученные результаты свидетельствуют о высокой эффективности СЦК как антигипоксанта.
Пример 8.
Влияние карнозина, ацетилсалициловой кислоты и салицил-карнозина на формирование язвенного повреждения слизистой оболочки желудка.
Влияние карнозина, АСК и СЦК на формирование язвенного повреждения слизистой оболочки желудка было исследовано на модели ацетатной язвы по Окабе (Okabe S., Roth J., Pfeiffer С.A method for experimental, penetrating gastric and duodenal ulcers in rats. Observations on normal healing // An. J. Dig. Diseases. 1971. V. 16. P. 277-282). Данная модель по своим патоморфологическим признакам, закономерностям развития и заживления, а также реакции на лекарственные препараты имеет сходные элементы с язвенной болезнью у человека. Развитие язвы в модели Окабе характеризуется определенной стадийностью: фаза альтерации - некроз и некробиоз тканей (1-3 сутки); отторжение некротических масс (3-5 сутки); фаза регенерации - разрастание соединительной ткани в дне язвы (5-13 сутки); редукция соединительной ткани в дне язвы, завершение эпителизации и формирование новой слизистой на месте язвы (13-40 сутки); при этом после 20-40 суток заживления периодически выявляются обострения хронической язвы.
Эксперименты проводили на крысах линии Wistar массой 180-220 г. Перед оперативным вмешательством крыс не кормили 18 часов, предоставляя свободный доступ к воде. Язвенное повреждение моделировали, помещая после вскрытия брюшной полости на внешнюю стенку желудка кольцо с 0,03 мл ледяной уксусной кислоты на 30 с. Далее кислоту удаляли, брюшную полость зашивали. После операции животных содержали в обычных условиях. Препараты вводили через зонд по 3 схемам: в интервале 1-5, 1-10 и 5-10 сутки. Вскрытие проводили соответственно на 5- или 10-е сутки. На слизистой оболочке желудка определяли площадь очага повреждения - «язвенный индекс».
На фиг. 6 представлены данные измерений язвенного индекса в группах животных, которым вводили исследуемые препараты (ось X - сроки введения: 1-5, 1-10, 5-10 сутки; ось У - ЯИ, см2; колонки слева направо - контроль, карнозин 50 мг/кг, 100 мг/кг, СЦК 50 мг/кг, АСК 50 мг/кг). Наиболее значимые отличия наблюдаются для срока введения с 1 по 5 сутки. В группах животных, получавших карнозин в дозах 50 и 100 мг/кг массы тела, площадь очага уменьшалась на 17% и 29% по сравнению с контрольной группой, получавшей физиологический раствор. В группе животных, получавших СЦК в дозе 50 мг/кг массы тела, размер очага уменьшался на 39% по сравнению с контролем.
Таким образом, СЦК оказался эффективнее карнозина в дозе 50 и 100 мг/кг массы тела, на 24% и 12%, соответственно. У животных, получавших АСК, площадь очага повреждения увеличивалась на 26% относительно контрольной группы, получавшей физиологический раствор, что свидетельствует о токсичности АСК.
На 2-ой стадии язвенного процесса - отторжения некротических масс в язвенном очаге (5-10 сутки), при введении карнозина в суточной дозе 50 мг/кг массы тела площадь очага не отличалась от контрольной группы (0,05 см2), а при введении в дозе 100 мг/кг массы тела карнозин снижал площадь язвенного очага на 27%. СЦК в дозе 50 мг/кг снижал площадь язвенного очага на 28%. Таким образом, эффективность противоязвенного действия СЦК на 2-ой стадии язвенного процесса в 2 раза превышает действие карнозина.
В третьей группе животных, получавших исследуемые препараты с 1 по 10-е сутки, эффективность эпителизации язвенного повреждения у крыс, оцениваемая по площади язвенного очага, показала следующие результаты. По сравнению с контрольной группой у крыс, получавших карнозин в дозе 50 мг/кг массы тела, к 10 суткам площадь очага была ниже на 8%, а в дозе 100 мг/кг - на 31%. У крыс, получавших СЦК в дозе 50 мг/кг, к 10 суткам площадь очага была на 57% ниже, чем в контроле. Полученные результаты свидетельствуют о том, что на стадии эпителизации язвенного повреждения эффективность СЦК в дозе 50 мг/кг в 1,6 раза выше, чем у карнозина в дозе 100 мг/кг.
Введение АСК в период с 5 по 10 сутки и с 1 по 10 сутки препятствовало заживлению язвенного очага, площадь которого в 5-6 раз превышала площадь очага как у контрольных крыс, так и у крыс, получавших карнозин и СЦК (фиг. 6).
Таким образом, СЦК был эффективнее карнозина на всех этапах формирования и заживления язвенного дефекта слизистой оболочки желудка крыс. АСК в использованной модели не только не препятствовала развитию язвенного поражения желудка, но и усиливала патологический процесс и препятствовала процессу заживления.
Полученные результаты указывают на перспективы применения СЦК в качестве антиагрегантного препарата при сердечно-сосудистых и цереброваскулярных заболеваниях, а также противовоспалительного средства, позволяющего избежать побочных эффектов, связанных с повреждениями желудочно-кишечного тракта, присущих аспирину и другим НПВП.
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство, обладающее нейропротекторной противоишемической активностью | 2022 |
|
RU2780112C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИГИПОКСИЧЕСКОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ | 2001 |
|
RU2191592C1 |
| Мицелярный комплекс липоевой кислоты с карнозином для защиты млекопитающих от окислительного стресса | 2016 |
|
RU2647435C2 |
| Средство, обладающее антиоксидантной и нейропротекторной активностью | 2021 |
|
RU2777391C1 |
| КОМБИНИРОВАННОЕ АНТИАГРЕГАНТНОЕ И АНТИОКСИДАНТНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2010 |
|
RU2430728C1 |
| ПРИМЕНЕНИЕ L-КАРНОЗИНА ДЛЯ ПРИГОТОВЛЕНИЯ НАНОПРЕПАРАТА, ОБЛАДАЮЩЕГО АНТИГИПОКСИЧЕСКОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2482867C1 |
| КОМБИНАЦИЯ, ОБЛАДАЮЩАЯ АНТИАГРЕГАНТНОЙ, ЛИПИДРЕГУЛИРУЮЩЕЙ И ГАСТРОПРОТЕКТОРНОЙ АКТИВНОСТЯМИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2010 |
|
RU2453314C1 |
| СПОСОБ ОЦЕНКИ АНТИОКСИДАНТНОЙ АКТИВНОСТИ ПРИРОДНЫХ СОЕДИНЕНИЙ | 2023 |
|
RU2821319C1 |
| Композит для ускоренного заживления ран различной этиологии, применение композита в качестве косметического средства и в качестве лечебного средства в ветеринарии, средство для регенерации кожных покровов на основе композита | 2017 |
|
RU2693228C2 |
| ДИГИДРОБРОМИД 2-(3,4-ДИГИДРОКСИФЕНИЛ)-9-ДИЭТИЛАМИНОЭТИЛИМИДАЗО[1,2-a] БЕНЗИМИДАЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2008 |
|
RU2391979C2 |

Изобретение относится к средству общей структурной формулы (1): Х-бета-аланил-L-гистидин или X-карнозин (Х-К), где X - салицил (СЦ), обладающему антиагрегантной, супероксид-перехватывающей, антиоксидантной и цитопротекторной активностью. Технический результат: создание нового средства на основе производного салициловой кислоты с карнозином, обладающего высокой антиагрегантной, супероксид-перехватывающей, антиоксидантной и цитопротекторной активностью и способного обеспечивать защиту слизистой оболочки желудочно-кишечного тракта от побочных повреждающих эффектов, присущих нестероидным противовоспалительным препаратам. 6 ил., 6 табл., 8 пр.
 (1)
(1)
Средство общей структурной формулы (1): Х-бета-аланил-L-гистидин или X-карнозин (Х-К), где X - салицил (СЦ),
 (1)
(1)
обладающее антиагрегантной, супероксид-перехватывающей, антиоксидантной и цитопротекторной активностью.
| WO 2006074114 A2, 13.07.2006 | |||
| Froemming K.H | |||
| "Synthesis of some peptide-like derivatives of salicylic acid" Archiv der Pharmazie und Berichte der Deutschen Pharmazeutischen Gesellschaft, 299(2), 1966, 179-88 | |||
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИГИПОКСИЧЕСКОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ | 2001 |
|
RU2191592C1 |
| БИОЛОГИЧЕСКИ АКТИВНЫЙ КАРНОЗИН-АНЗЕРИНСОДЕРЖАЩИЙ КОМПЛЕКС И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2003 |
|
RU2255758C2 |
| Мицелярный комплекс липоевой кислоты с карнозином для защиты млекопитающих от окислительного стресса | 2016 |
|
RU2647435C2 |
Авторы
Даты
2019-07-09—Публикация
2018-12-25—Подача