Изобретение относится к области медицины, в частности к фармакологии, а именно к средствам, обладающим нейропротекторной противоишемической активностью.
В качестве средства, обладающего нейропротекторной противоишемической активностью, предлагается рассматривать средство общей структурной формулы (1): 1.
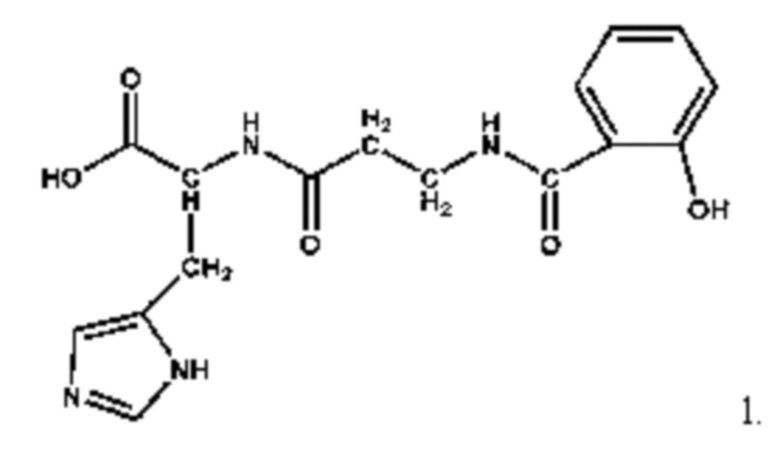
которое ранее было описано как салицил-бета-аланил L-гистидин (салицил-карнозин), имеющий антиагрегантную, супероксид-перехватывающую, антиоксидантную и цитопротекторную активность с низким повреждающим действием (патент RU 2694061 от 09.07.2019). Салицил-карнозин (СК) обладает антиоксидантной активностью, сравнимой с антиоксидантной активностью карнозина при измерении СОД-подобной активности, Fe2+-индуцированной хемилюминесценции, BaSO4-индуцированного дыхательного взрыва и при оценке стабилизации структуры эритроцитов при окислительном повреждении, вызванном гипохлоритом натрия, но в отличие от карнозина, СК не расщепляется тканевыми и сывороточными карнозиназами. Показано, что антиагрегантная активность СК в крови здоровых людей сопоставима с антиагрегантной активностью аспирина или превышает ее, но в отличие от аспирина, СК защищает слизистую оболочку желудка от образования язв и способствует их эпителизации. Таким образом, СК сохраняет фармакологически значимые свойства аспирина и карнозина, проявляя в то же время противоязвенную активность и устойчивость к гидролизу карнозиназами. [Трубицына И.Е., Стволинский С.Л., Куликова О.И., Федорова Т.Н., Тарасова Т.В., Ефремов Л.И., Михайлова З.Ф., Варванина Г.Г. Защитное действие нового соединения - салицил-карнозин - на процесс формирования хронической ацетатной язвы желудка у крыс. // Эксп. клин. гастроэнтерология, 2019, т.163, N3, с.58-64].
Исследование нейропротекторных свойств соединения СК при острых нарушениях мозгового кровообращения в известном уровне техники не выявлено.
Известны средства, обладающие нейропротекторной противоишемической активностью, в частности нейропротекторную активность соединения исследовали на тотальной транзиторной ишемии головного мозга (ТТИГМ) у крыс с помощью О-(((4-гидрокси-3,5-ди(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)бензил)окси)этил)-О-(2-гидроксиэтил)-(1→4)-α-D-глюкана с содержанием фрагментов 2,6-диизоборнил-4-метиленфенола от 0,5 до 6,0 мас.% (Д-ГЭК). Двукратное внутривенное введение Д-ГЭК приводило к достоверному увеличению числа выживших животных по сравнению с контрольной группой. Количество выживших животных в группе Д-ГЭК составило 78% (RU 2701739, 01.10.2019). В данной работе не описано токсическое свойство гибридного макромолекулярного соединения Д-ГЭК.
Известно применение 5α-андростан-3β,5,6β-триола для изготовления нейропротекторных лекарственных средств. Соединение обладает значительным защитным действием против повреждений нейронов, вызванных ишемией головного мозга, ишемией спинного мозга или гипоксией, и не имеет заметных токсических реакций в пределах своей эффективной дозы (RU 2541093, 10.02.2015). Данное средство рассмотрено в качестве ближайшего аналога.
Технический результат заключается в расширении арсенала средств, обладающих нейропротекторной противоишемической активностью за счет установления нейропротекторного действия на in vitro моделях ишемического и эксайтотоксического повреждения головного мозга.
Технический результат достигается тем, что применяют салицил-бета-аланил L-гистидин в качестве нейропротекторного противоишемического средства.
Изобретение иллюстрируется следующими примерами.
Пример 1. Влияние салицил-бета-аланил-L-гистидина (салицил-карнозина), салициловой кислоты и ацетилсалициловой кислоты на жизнеспособность первичной культуры клеток коры больших полушарий мозга крыс в условиях глюкозо-кислородной депривации (ГКД).
Для моделирования острой ишемии головного мозга с последующей реперфузией in vitro была использована модель глюкозо-кислородной депривации - замена стандартной среды для выращивания клеточной культуры на среду, не содержащую глюкозы, с последующим ограничением доступа кислорода до концентрации 1%.
Работа проводилась на первичной культуре коры больших полушарий головного мозга 18-дневных эмбрионов крыс линии Вистар. Для получения первичной культуры нейронов коры больших полушарий беременных самок крыс подвергали эвтаназии с помощью СО2, затем в стерильных условиях извлекали 18-дневные эмбрионы. Из эмбрионов извлекали головной мозг и отделяли большие полушария. Полученный биологический материал промывали в растворе Хэнкса, не содержащем ионы Са2+ и Mg2+ («ПанЭко»,Россия), очищали от сосудов и инкубировали в растворе трипсина-ЭДТА («ПанЭко», Россия») в течение 20 минут при 37°С. Затем трипсин инактивировали 10% эмбриональной телячьей сывороткой крови (FBS), («ПанЭко», Россия) на растворе Хэнкса. Препарат дважды промывали раствором Хэнкса и суспендировали в среде МЕМ («ПанЭко», Россия) с 10% FBS и 100 Ед/мл пенициллина-стрептомицина («ПанЭко, Россия»). Полученную суспензию клеток центрифугировали в течение 2 минут при 400 g, ресуспендировали в среде МЕМ с перечисленными выше добавками и распределяли по планшетам с плотностью 1,2×105 клеток на см2.
За 24 часа до посадки первичной культуры нейронов коры больших полушарий головного мозга 18-дневных эмбрионов крыс в лунки 96-луночных планшетов вносили по 100 мкл стерилизованного поли-L-орнитина («Sigma», США) в концентрации 0,1 мг/мл и в лунки 6-луночных планшетов - по 2 мл. В день посадки планшеты промывали стерилизованной дистиллированной водой.
Культуру содержали в СО2-инкубаторе («SHEL LAB», США) при 37°С, 80% влажности, 5% СО2 в течение суток, затем среду заменяли на NBM («Gibco», США) с 2% бессывороточной добавкой В-27 Serum-Free Supplement («Gibco», США), 100 Ед/мл пенициллин-стрептомицина, 1% GlutaMAX («Gibco», США). Далее замену среды проводили каждые двое суток.
Через 10 дней после посадки культуры, включенные в экспериментальные группы, инкубировали в течение 4 часов при содержании кислорода 1% в искусственной цереброспинальной жидкости (ИЦСЖ) (125 мМ NaCl, 26 мМ NaHCO3, 4 мМ KCl, 1,25 мМ NaH2PO4, 1,2 мМ MgCl2, 2 мМ CaCl2, 25 мМ глюкоза) без антиоксидантов, либо с добавлением исследуемого вещества: салицил-карнозина (СК), салициловой кислоты (Сал) или ацетилсалициловой кислоты (АСК) в концентрации 0,5 мМ или 1 мМ. После ГКД клетки помещали в условия нормоксии и меняли среду на NBM без антиоксидантов, содержащую 0,5 мМ или 1 мМ исследуемых веществ: СК, Сал или АСК. Контрольную группу на время эксперимента помещали в NBM без антиоксидантов. Спустя 24 часа после начала реоксигенации проводили МТТ-тест для оценки жизнеспособности культуры клеток и измеряли активность ЛДГ в среде для оценки гибели нейронов.
Были выделены следующие группы культивируемых клеток:
1. Культура клеток, которую после замены среды на искусственную цереброспинальную жидкость (ИЦСЖ) инкубировали в условиях нормоксии в течение 4 часов при температуре 37°С, относительной влажности 80% и содержании СО2 5% с последующей заменой среды на NBM без антиоксидантов.
2. Культура клеток, которую после замены среды на ИЦСЖ без глюкозы инкубировали в условиях гипоксии (5% СО2, 1% О2, 94% N2) в течение 4 часов с последующей реоксигенацией (24 часа) и с заменой среды на NBM без антиоксидантов.
3. Культура клеток, которую после замены среды на ИЦСЖ без глюкозы с исследуемыми веществами: СК, Сал или АСК (1 мМ) инкубировали в условиях гипоксии (5% СО2, 1% О2, 94% N2) в течение 4 часов, с последующей реоксигенацией (24 часа) и с заменой среды на NBM без антиоксидантов, содержащую 1 мМ исследуемых веществ: СК, Сал или АСК.
4. Культура клеток, которую после замены среды на ИЦСЖ без глюкозы инкубировали в условиях гипоксии (5% СО2, 1% О2, 94% N2) в течение 4 часов, с последующей реоксигенацией (24 часа) и с заменой среды на NBM без антиоксидантов, содержащую 1 мМ исследуемых веществ: СК, Сал или АСК.
1.1. Оценка жизнеспособности нейронов первичной культуры клеток коры больших полушарий мозга крыс в условиях глюкозо-кислородной депривации
Для оценки жизнеспособности клеток использовали МТТ-тест. Живые клетки способны восстанавливать тетразолиевый краситель 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромид (МТТ) до пурпурного формазана, оптическую плотность которого можно измерить. Таким образом, количество живых клеток определяют, проинкубировав их с МТТ.
МТТ растворяют в растворе Хэнкса. Из лунок 96-луночных планшетов отбирают среду и добавляют раствор 0,5 мг/мл МТТ и инкубируют в течение двух часов при температуре 37°С, относительной влажности 80% и содержании СО2 5%. После инкубации полностью отбирают жидкое содержимое лунок. Далее добавляют по 100 мкл ДМСО в лунки для растворения формазана, перемешивают и измеряют оптическую плотность при длине волны 570 нм (максимум поглощения формазана), и 660 нм (фон) на планшетном ридере Synergy H1 (BioTek). Из значений, полученных при 570 нм, вычитают значения, полученные при 660 нм [Scudiere D., Shoemaker R., Paul K., Monks A., Tierney S., Nofziger T., Currens M., Seniff D., Boyd M. Evaluation of a Soluble Tetrazolium/Formazan Assay for Cell Growth and Drug Sensitivity in Culture Using Human and Other Tumor Cell Lines // Cancer Research. 1988. 48. P. 4827-4833]. Результаты представляют в виде процентов относительно разницы оптической плотности при 570 нм и при 660 нм в лунках с контрольными клетками, инкубированными в ИЦСЖ.
Для оценки нейропротекторного действия салицил-карнозина (СК) относительно салициловой кислоты (Сал) и ацетилсалициловой кислоты (АСК) провели эксперимент с ГКД и инкубацией культур клеток с веществами во время ГКД и реоксигенации (24 часа) или только во время реоксигенации. По окончании реоксигенации ставили МТТ-тест, как описано выше.
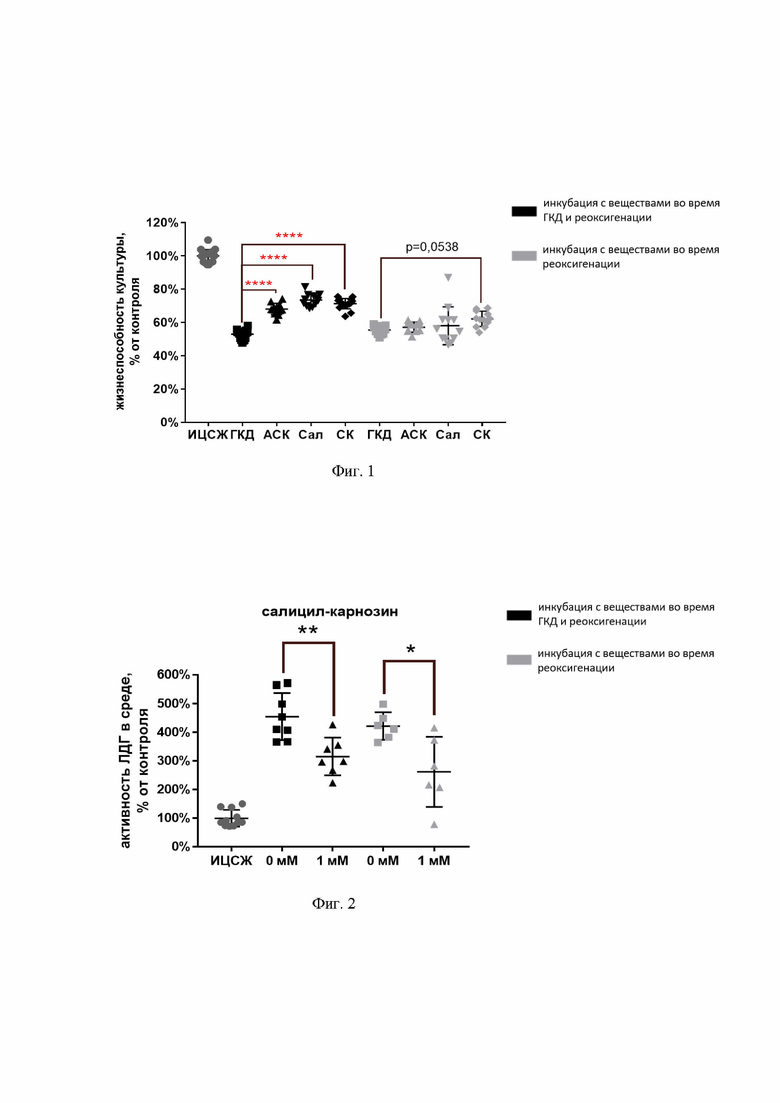
На фиг. 1 показана жизнеспособность нейронов после ГКД согласно МТТ-тесту в среде при инкубации с салицил-карнозином во время ГКД и последующей реоксигенации или только во время реоксигенации. Культуры инкубировали в ИЦСЖ в условиях нормоксии или в ИЦСЖ без глюкозы в условиях гипоксии в течение 4 часов с добавлением 0,5 мМ СК, АСК или Сал во время ГКД и последующей реоксигенации (24 часа) или только во время реоксигенации.
ИЦСЖ - искусственная цереброспинальная жидкость, ГКД - глюкозо-кислородная депривация, АСК - ацетилсалициловая кислота, Сал - салициловая кислота, СК - салицил-карнозин. Исследуемые вещества добавляли в концентрации 0,5 мМ. Для проверки нормальности распределений использовали тест Шапиро-Уилка. Для определения достоверности различий использовали однофакторный дисперсионный анализ. На графике представлено среднее ± стандартное отклонение, n=10-18. * - p<0,05, ** - p<0,01, *** - p<0,001, **** - p<0,0001.
ГКД приводила к снижению жизнеспособности культуры на 44,5% и 46,96% относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии, при этом жизнеспособность культур, перенесших ГКД, статистически значимо (p<0,0001) снижалась относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии, независимо от добавления исследуемых веществ (см. фиг.1).
Инкубация культуры с 0,5 мМ СК во время ГКД и реоксигенации приводила к увеличению жизнеспособности культуры относительно группы без добавления веществ на 18,33% (р<0,0001), инкубация с 0,5 мМ ацетилсалициловой кислотой - на 15,1% (р<0,0001), с 0,5 мМ салициловой кислотой - на 20,53% (р<0,0001) относительно культуры, инкубированной в условиях ГКД и во время реоксигенации без веществ, в то время как при инкубации с веществами только при реоксигенации статистически значимых отличий относительно культуры, инкубированной без веществ, не было обнаружено. Однако стоит отметить, что жизнеспособность культуры, инкубированной с 0,5 мМ СК при реоксигенации, увеличилась относительно культуры без веществ на 6,7% на уровне значимости р=0,0538 (см. фиг.1).
Таким образом, как следует из данных МТТ-теста, в условиях глюкозо-кислородной депривации салицил-карнозин обеспечивал более эффективное, по сравнению с ацетилсалициловой и салициловой кислотами, повышение жизнеспособности культуры нейрональных клеток.
1.2. Оценка гибели нейронов первичной культуры клеток коры больших полушарий мозга крыс в условиях глюкозо-кислородной депривации.
Для подтверждения данных о положительном влиянии СК на жизнеспособность нейронов по результатам МТТ-теста оценили его влияние на гибель нейронов по активности лактатдегидрогеназы (ЛДГ) в среде после инкубации нейронов с 1 мМ СК во время ГКД и реоксигенации или только во время реоксигенации.
ЛДГ - фермент, катализирующий реакцию взаимного превращения пирувата и лактата. При повреждении клетки выделяют ЛДГ [Farhana A., Lappin S.L.Biochemistry, Lactate Dehydrogenase // In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan. 2021 May 7. http://www.ncbi.nlm.nih.gov/books/nbk557536/]. Таким образом, высокая активность ЛДГ в среде указывает на высокий уровень повреждения клеток. Активность ЛДГ измеряют в соответствии с протоколом Lactate Dehydrogenase Activity Assay Kit («Sigma-Aldrich», https://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/Bulletin/1/mak066bul.pdf). В качестве калибровки используют пробы, содержащие НАДН стандарт, растворенный в LDH Assay Buffer в количестве 0, 2,5, 5, 7,5, 10 и 12,5 нмоль в лунке. Результаты представляют в виде процентов относительно уровня активности ЛДГ в среде с контрольными клетками, инкубированными в ИЦСЖ.
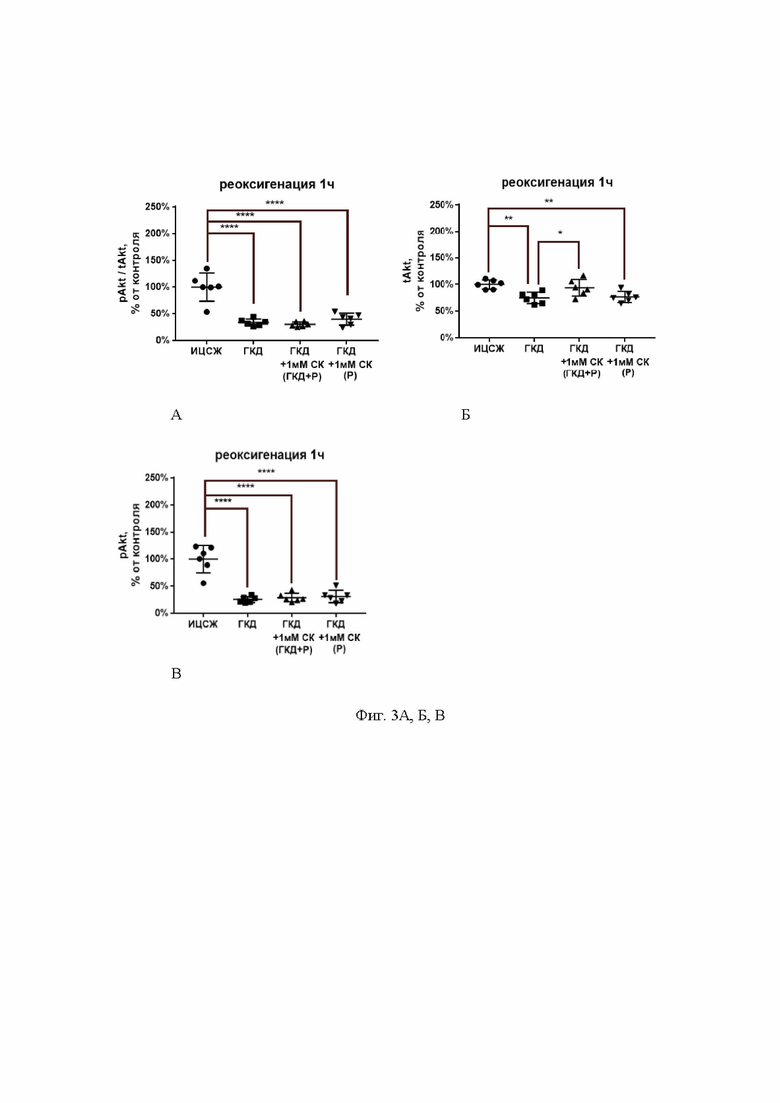
На фиг. 2 показана активность фермента ЛДГ в среде при инкубации с салицил-карнозином во время ГКД и реоксигенации или только во время реоксигенации. Культуры инкубировали в ИЦСЖ в условиях нормоксии или в ИЦСЖ без глюкозы в условиях гипоксии в течение 4 часов с добавлением салицил-карнозина во время ГКД и последующей реоксигенации (24 часа) или только во время реоксигенации в концентрации 1 мМ или без него («0 мМ», «1 мМ»). По окончании реоксигенации проводили определение активности ЛДГ, как указано выше.
Для проверки нормальности распределений использовали тест Шапиро-Уилка. Для определения достоверности различий использовали t-критерий Стьюдента. На графиках представлено среднее ± стандартное отклонение, n=6-11. * - p<0,05, ** - p<0,01.
ГКД приводила к увеличению активности ЛДГ в среде на 355,3% (p<0,0001) и 322% (p=0,0002) относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии. Инкубация с 1мМ СК в условиях ГКД приводила к уменьшению активности ЛДГ в среде как при инкубации с ним во время ГКД и реоксигенации на 139,6% (р=0,0037), так и при инкубации с ним только во время реоксигенации на 159,2% (р=0,026) относительно культуры, инкубированной в условиях ГКД и во время реоксигенации без веществ, что свидетельствует об уменьшении количества погибших нейронов в культуре в условиях ГКД под действием СК.
Таким образом, как следует из данных ЛДГ-теста, в условиях глюкозо-кислородной депривации салицил-карнозин более эффективно, чем ацетилсалициловая и салициловая кислоты, препятствовал гибели культуры нейрональных клеток.
Пример 2. Молекулярные механизмы нейропротекторного действия салицил-карнозина. Влияние 1 мМ салицил-карнозина на киназы Akt и ERK1/2
Чтобы оценить влияние салицил-карнозина на активацию киназ Akt, ERK1/2, JNK, РКС в первичной культуре клеток коры больших полушарий мозга крыс в условиях ГКД с реоксигенацией была проведена 4-часовая ГКД с 1-часовой реоксигенацией для выявления кратковременных эффектов СК, а также ГКД с 6-часовой реоксигенацией - для выявления долговременных эффектов СК.
Были выделены следующие группы культивируемых клеток:
1. Культура клеток, которую после замены среды на ИЦСЖ инкубировали в условиях нормоксии в течение 4 часов при температуре 37°С, относительной влажности 80% и содержании СО2 5% с последующей заменой среды на NBM без антиоксидантов.
2. Культура клеток, которую после замены среды на ИЦСЖ без глюкозы инкубировали в условиях гипоксии (5% СО2, 1% О2, 94% N2) в течение 4 часов с последующей реоксигенацией (1 час, 6 часов) и с заменой среды на NBM без антиоксидантов.
3. Культура клеток, которую после замены среды на ИЦСЖ без глюкозы с 1 мМ салицил-карнозина инкубировали в условиях гипоксии (5% СО2, 1% О2, 94% N2) в течение 4 часов, с последующей реоксигенацией (1 час, 6 часов) и с заменой среды на NBM без антиоксидантов, содержащую 1 мМ салицил-карнозина
4. Культура клеток, которую после замены среды на ИЦСЖ без глюкозы инкубировали в условиях гипоксии (5% СО2, 1% О2, 94% N2) в течение 4 часов, с последующей реоксигенацией (1 час, 6 часов) и с заменой среды на NBM без антиоксидантов, содержащую 1 мМ салицил-карнозина.
Анализ проводили при помощи вестерн-блоттинга [Лопачев А.В., Лопачева О.М., Никифорова К.А., Филимонов И.С., Федорова Т.Н., Аккуратов Е.Е. Сравнительное действие кардиотонических стероидов на внутриклеточные процессы в нейронах коры головного мозга крысы // Биохимия, 2018. Т 83, № 2, с. 238-250]. Активацию киназ Akt, ERK1/2, JNK, РКС рассчитывали по соотношению интенсивности люминесценции полос, соответствующих их фосфорилированной форме, к интенсивности люминесценции полос, соответствующих их общему количеству в пробе, нормированных на общее количество белка в соответствующих дорожках на мембране.
Киназа Akt участвует в антиапоптотическом сигнальном каскаде PI3K/Akt, способствуя выживанию клеток. Для изучения влияния ГКД и СК на активацию, общее количество и количество фосфорилированной формы киназы Akt проводили 4-часовую ГКД с 1- или 6-часовой реоксигенацией. При помощи вестерн-блоттинга анализировали общее количество киназы Akt и ее фосфорилированной формы, а также общее количество белка на мембране для нормировки. tAkt - общее количество киназы Akt, нормированное на общее количество белка в соответствующей дорожке на мембране, pAkt - количество фосфорилированной формы киназы Akt, нормированное на общее количество белка в соответствующей дорожке на мембране, pAkt/tAkt - активация киназы Akt.
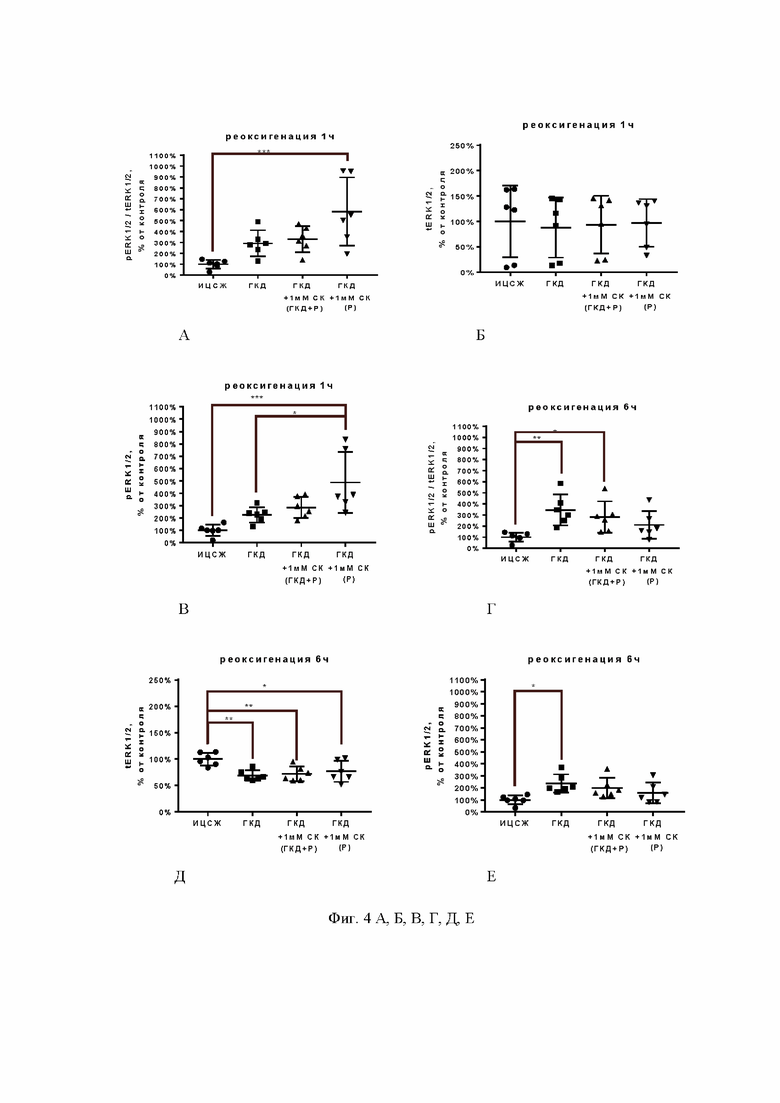
На фиг. 3 А, Б, В показана активность киназы Akt нейронов (pAkt/tAkt), общее количество киназы Akt (tAkt) и количество ее фосфорилированной формы (pAkt) после ГКД и 1-часовой реоксигенации в культурах, инкубированных с 1 мМ СК в условиях ГКД и реоксигенации или только в условиях ГКД.
ИЦСЖ - искусственная цереброспинальная жидкость, ГКД - глюкозо-кислородная депривация, Р - реоксигенация, СК - салицил-карнозин. Для определения достоверности различий использовали однофакторный дисперсионный анализ. Среднее ± стандартное отклонение, n=6. * - p<0,05, ** - p<0,01, *** - p<0,001, **** - p<0,0001.
В культурах, инкубированных в условиях ГКД с последующей 1-часовой реоксигенацией, выявили снижение pAkt/tAkt на 66,17% (р<0,0001) (фиг. 3 А), снижение tAkt на 25,17% (р=0,0036) (фиг. 3 Б) и снижение pAkt на 74,62% (р<0,0001) (фиг. 3 В) по сравнению с культурой, инкубированной в ИЦСЖ в условиях нормоксии. 1 мМ СК при инкубации с ним культуры во время ГКД и 1-часовой реоксигенации приводил к увеличению tAkt относительно культуры, инкубированной в условиях ГКД и во время 1-часовой реоксигенации без вещества, на 19,17% (р=0,0339) и была сопоставима с культурой, инкубированной в ИЦСЖ в условиях нормоксии по этому параметру ( см. фиг. 3, Б). На другие показатели (pAkt/tAkt и pAkt ) СК влияния не оказал (см. фиг. 3 А, В).
Таким образом, на основании полученных данных можно сделать вывод о том, что нейропротекторное действие салицил-карнозина в концентрации 1 мМ при инкубации с ним культуры во время ГКД и 1-часовой реоксигенации может быть связано с увеличением общего количества киназы Akt, которая участвует в антиапоптотическом сигнальном каскаде PI3K/Akt, способствуя выживанию клеток.
В регуляции жизнеспособности нейронов также участвует киназа ERK1/2 [M. Kristiansen, J. Ham. Programmed cell death during neuronal development: the sympathetic neuron model // Cell Death and Differentiation. 2014. V.21, p.1025-1035; doi:10.1038/cdd.2014.47]. Для изучения влияния ГКД и салицил-карнозина на активацию, общее количество и количество фосфорилированной формы киназы ERK1/2 проводили 4-часовую ГКД с 1- или 6-часовой реоксигенацией. При помощи вестерн-блоттинга анализировали общее количество киназы ERK1/2 и ее фосфорилированной формы, а также общее количество белка на мембране для нормировки. tERK1/2 - общее количество киназы ERK1/2, нормированное на общее количество белка в соответствующей дорожке на мембране, pERK1/2 - количество фосфорилированной формы киназы ERK1/2, нормированное на общее количество белка в соответствующей дорожке на мембране, pERK1/2/tERK1/2 - активация киназы ERK1/2.
На фиг. 4 А, Б, В, Г, Д, Е показана активность киназы ERK1/2 нейронов (pERK1/2 / tERK1/2), общее количество киназы ERK1/2 (tERK1/2) и количество ее фосфорилированной формы (pERK1/2) после ГКД и 1-часовой или 6-часовой реоксигенации в культурах, инкубированных с 1 мМ СК в условиях ГКД и реоксигенации или только в условиях ГКД.
ИЦСЖ - искусственная цереброспинальная жидкость, ГКД - глюкозо-кислородная депривация, Р - реоксигенация, СК - салицил-карнозин .Для проверки нормальности распределений использовали тест Шапиро-Уилка. Для определения достоверности различий использовали однофакторный дисперсионный анализ. На графиках представлено среднее ± стандартное отклонение, n=6. * - p<0,05, ** - p<0,01, *** - p<0,001, **** - p<0,0001.
В культурах, инкубированных в условиях ГКД с последующей 1-часовой реоксигенацией без вещества, а также в культуре, инкубированной с 1 мМ СК во время ГКД и 1-часовой реоксигенации, не было выявлено отличий от культуры, инкубированной в ИЦСЖ в условиях нормоксии по таким параметрам, как tERK1/2, pERK1/2 и pERK1/2 / tERK1/2 (см. фиг. 4 А, Б, В).
1 мМ СК при инкубации с ним культуры только во время 1-часовой реоксигенации вызывал увеличение pERK1/2 / tERK1/2 на 483,4% (р=0,0004) по сравнению с культурой, инкубированной в ИЦСЖ в условиях нормоксии (см. фиг. 4 А), а также вызывал увеличение pERK1/2 на 387,4% (р=0,0002) относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии, и на 261,8% (р=0,0206) относительно культуры, инкубированной в условиях ГКД без вещества (см. фиг. 4 В), но не повлиял на tERK1/2 (см. фиг. 4 Б).
При инкубации культуры в условиях ГКД с последующей 6-часовой реоксигенацией было выявлено увеличение pERK1/2 / tERK1/2 на 245,4% (р=0,006) и увеличение pERK1/2 на 136,7% (р=0,0133), а также снижение tERK1/2 на 31,07% (р=0,004) относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии (см. фиг. 4 Г, Д, Е)
1 мМ СК при инкубации с ним культуры во время ГКД и 6-часовой реоксигенации вызывал увеличение pERK1/2 / tERK1/2 на 180,9% (р=0,0327) и снижение tERK1/2 на 27,84% (р=0,0065) относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии, в то время как количество pERK1/2 не менялось (см. фиг. 4 Г, Д, Е).
1 мМ СК при инкубации с ним культуры только во время 6-часовой реоксигенации вызывал снижение tERK1/2 на 23,1% (р=0,0117), в то время как pERK1/2 / tERK1/2 и pERK1/2 не менялись относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии (см. фиг. 4 Г, Д, Е).
Таким образом, добавление 1 мМ салицил-карнозина при 1-часовой реоксигенации может оказывать нейропротекторное действие за счет активации киназы ERK1/2 (увеличения количества её фосфорилированной формы), а при 6-часовой реоксигенации - за счет того, что вызывает уменьшение её активации при ишемии.
Согласно полученным данным нейропротекторный эффект салицил-карнозина в условиях ГКД с последующей реоксигенацией связан с уменьшением деградации Akt, а также с увеличением активации ERK1/2 относительно контроля после 1-часовой реоксигенации и уменьшением активации ERK1/2 после 6-часовой рекосигенации относительно культуры, инкубированной в условиях ГКД и реоксигенации без СК. В использованной модели ишемии гибель нейронов не была связана с динамикой активности киназ JNK и PKC.
Пример 3. Влияние салицил-карнозина и его предшественников - ацетилсалициловой кислоты и карнозина на жизнеспособность первичной культуры клеток коры больших полушарий мозга крыс в модели NMDA-индуцированной эксайтотоксичности.
Для моделирования NMDA-индуцированной эксайтотоксичности первичную культуру клеток коры больших полушарий головного мозга 18-дневных эмбрионов крыс инкубировали в течение 15 минут при температуре 37°С, относительной влажности 80% и содержании СО2 5% со 100 мкМ агонистом глутаматных NMDA-рецепторов N-метил-D-аспартатом, растворенным в ИЦСЖ без ионов магния, так как ионы магния закрывают ионный канал глутаматных NMDA-рецепторов [Wan Ko H., Park K., Kim H., Han P., Kim Y., Gwag B., Choi E. Ca2+ -Mediated Activation of c-Jun N-Terminal Kinase and Nuclear Factor KB by NMDA in Cortical Cell Cultures // Journal of Neurochemistry. 1998. V.71, N4, p.1390-1395. doi: 10.1046/j.1471-4159.1998.71041390.x.]. Далее в культуре меняли среду на NBM, содержащую исследуемые вещества в концентрации 0,2 мМ, 0,5 мМ или 1 мМ (салицил-карнозин, ацетилсалициловую кислоту или карнозин).
Через 24 часа после моделирования NMDA-индуцированной эксайтотоксичности проводили МТТ-тест для оценки жизнеспособности культуры клеток и измеряли активность ЛДГ в среде для оценки гибели нейронов.
Культуры клеток, содержащиеся в 96-луночных планшетах, были разделены на следующие группы:
1. Культура клеток, которую после замены среды на ИЦСЖ инкубировали в течение 15 минут при температуре 37°С, относительной влажности 80% и содержании СО2 5% с последующей заменой среды на NBM без антиоксидантов;
2. Культура клеток, которую после замены среды на ИЦСЖ, содержащую 100 мкМ NMDA и не содержащую ионы магния, инкубировали в течение 15 минут при температуре 37°С, относительной влажности 80% и содержании СО2 5%, с последующей заменой среды на NBM без антиоксидантов;
3. Культура клеток, которую после замены среды на ИЦСЖ, содержащую 100 мкМ NMDA и не содержащую ионы магния, инкубировали в течение 15 минут при температуре 37°С, относительной влажности 80% и содержании СО2 5%, с последующей заменой среды на NBM без антиоксидантов, содержащую 0,2 мМ, 0,5 мМ или 1 мМ салицил-карнозин, ацетилсалициловую кислоту или карнозин.
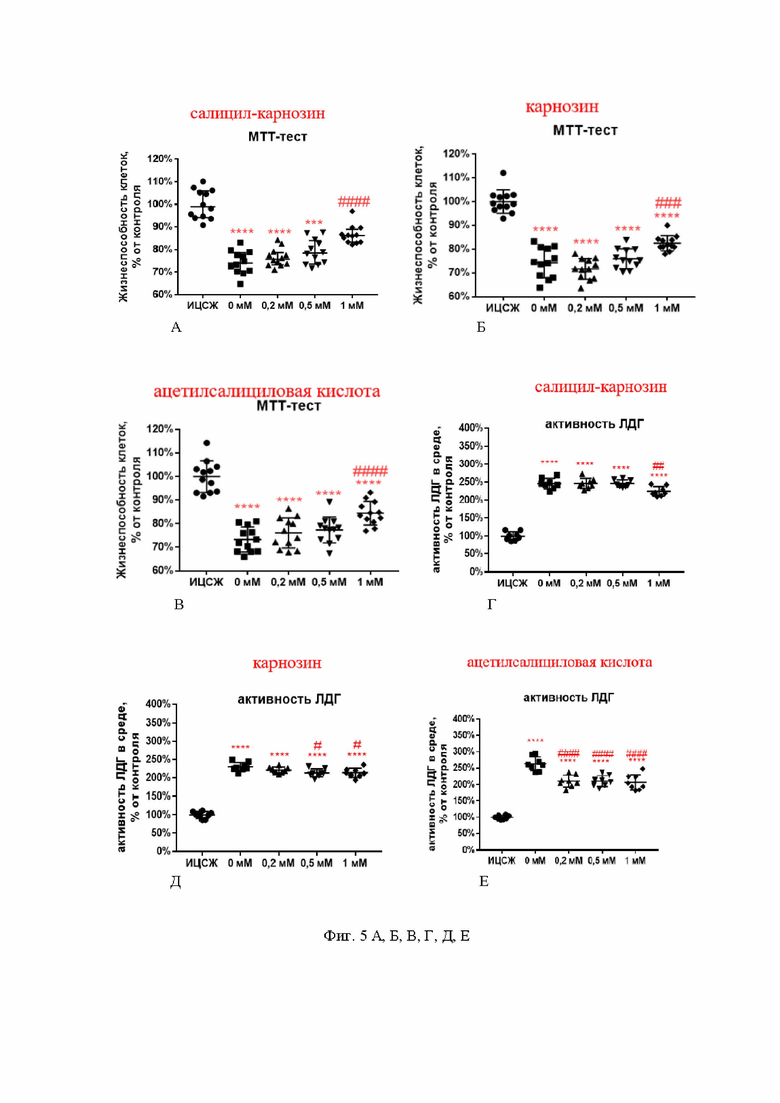
На фиг. 5 А, Б, В, Г, Д, Е показана жизнеспособность нейронов после моделирования NMDA-индуцированной эксайтотоксичности при инкубации с 1 мМ салицил-карнозина, определенная на основании МТТ-теста (фиг. 5 А, Б, В) и активности фермента ЛДГ (фиг. 5 Г, Д, Е).
ИЦСЖ - искусственная цереброспинальная жидкость. Для определения достоверности различий использовали однофакторный дисперсионный анализ. Среднее ± стандартное отклонение, n=8. * - отличие от культуры, инкубированной в ИЦСЖ, # - отличие от культуры, инкубированной в ИЦСЖ со 100 мкМ NMDA. # - p<0,05, ## - p<0,01, *** или ### - p<0,001, **** или #### - p<0,0001.
По данным МТТ-теста жизнеспособность культуры в пробах, инкубированных со 100 мкМ NMDA, уменьшалась на 25,68%, 25,71% и 26,66% (p<0,0001) относительно культуры, инкубированной в ИЦСЖ, содержащей ионы магния и не содержащей NMDA по сравнению с культурой, инкубированной в ИЦСЖ (см. фиг. 5 А, Б, В). Добавление исследуемых веществ в культуральную среду оказывало нейропротекторное действие на культуры нейронов, инкубированных в течение 15 минут со 100 мкМ NMDA, в концентрации 1 мМ (р<0,0001 для салицил-карнозина (см. фиг. 5 А) и ацетилсалициловой кислоты (см. фиг. 5 В) и р=0,0003 для карнозина (см. фиг. 5 Б).
По данным измерения активности ЛДГ гибель нейронов в культурах, инкубированных со 100 мкМ NMDA, увеличивалась на 146%, 130%, 163,5% (р<0,0001) по сравнению с культурой, инкубированной в ИЦСЖ (фиг. 5 Г, Д, Е). Добавление исследуемых веществ в культуральную среду предотвращало гибель нейронов по данным оценки активности ЛДГ: салицил-карнозин оказывал нейропротекторное действие на культуры нейронов, инкубированных в течение 15 минут со 100 мкМ NMDA, в концентрации 1 мМ (р=0,0086) (см. фиг. 5 Г), карнозин - в концентрации 0,5 мМ (р=0,015) и 1мМ (р=0,0187) (см. фиг. 5 Д), ацетилсалициловая кислота - в концентрации 0,2 мМ, 0,5 мМ и 1 мМ (р<0,0001) (см. фиг. 5 Е).
Из полученных результатов следует, что в условиях NMDA - индуцированной эксайтотоксичности салицил-карнозин в концентрации 1 мМ по данным МТТ-теста и ЛДГ-теста проявляет нейропротекторную активность, соизмеримую с таковой для ацетилсалициловой и салициловой кислот.
Таким образом, при оценке нейропротекторного и противоишемического действия салицил-карнозина в моделях ишемии, вызванной ГКД и NMDA-индуцированной эксайтотоксичности на первичной культуре клеток коры больших полушарий головного мозга 18-дневных эмбрионов крыс, были получены следующие результаты:
- в модели ишемии, вызванной ГКД, салицил-карнозин проявил большую нейропротекторную эффективность, чем ацетилсалициловая и салициловая кислоты, что подтверждено результатами, полученными при проведении МТТ-теста и при измерении активности фермента ЛДГ в культуральной среде.
- согласно полученным данным нейропротекторное противоишемическое действие салицил-карнозина в условиях ГКД и 1-часовой реоксигенации связано с увеличением общего количества киназы Akt и с активацией киназы ERK1/2, а в условиях ГКД и 6-часовой реоксигенации связано, в свою очередь, с инактивацией киназы ERK1/2.
- в модели NMDA-индуцированной эксайтотоксичности салицил-карнозин в концентрации 1 мМ проявил нейропротекторную эффективность в условиях NMDA-индуцированной эксайтотоксичности, так же как и ацетилсалициловая кислота и карнозин.
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство, обладающее антиоксидантной и нейропротекторной активностью | 2021 |
|
RU2777391C1 |
| Средство, обладающее антиагрегантной, цитопротекторной и антиоксидантной активностью | 2018 |
|
RU2694061C1 |
| Способ оценки биологической активности тетрадекапептида | 2017 |
|
RU2667120C1 |
| СПОСОБ ОБЕСПЕЧЕНИЯ ТРЕБУЕМЫХ УРОВНЕЙ ФАКТОРА 2 РОСТА ГЛИИ В ПЛАЗМЕ | 2014 |
|
RU2687097C2 |
| 3R, 4S -3-[4-(4-ФТОРФЕНИЛ-4-ГИДРОКСИПИПЕРИДИН-1-ИЛ] ХРОМАН- 4,7-ДИОЛ, ЕГО ОПТИЧЕСКИЕ ИЗОМЕРЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ И СПОСОБЫ ЛЕЧЕНИЯ | 1994 |
|
RU2126404C1 |
| СПОСОБ ОБЕСПЕЧЕНИЯ ТРЕБУЕМЫХ УРОВНЕЙ ФАКТОРА 2 РОСТА ГЛИИ В ПЛАЗМЕ | 2009 |
|
RU2530650C2 |
| ПРИМЕНЕНИЕ КАРДИОТРОФИНА ПРИ ЗАБОЛЕВАНИЯХ ПЕЧЕНИ | 2002 |
|
RU2279289C2 |
| СПОСОБ ПРОФИЛАКТИКИ И КОРРЕКЦИИ МЕТАБОЛИЧЕСКИХ И ФУНКЦИОНАЛЬНЫХ НАРУШЕНИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ В УСЛОВИЯХ СТРЕССА | 2019 |
|
RU2717107C1 |
| НЕЙРОПРОТЕКТОРНОЕ СРЕДСТВО | 2016 |
|
RU2614697C1 |
| ТЕРАПЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ СНИЖЕНИЯ УСТОЙЧИВОСТИ К ИНГИБИТОРАМ ТИРОЗИНКИНАЗЫ | 2016 |
|
RU2735493C2 |
Изобретение относится к применению салицил-бета-аланил-L-гистидина (салицил-карнозина) в качестве нейропротекторного противоишемического средства в виде жизнеспособности нейронов первичной культуры клеток коры больших полушарий мозга крыс в условиях глюкозо-кислородной депривации и в модели NMDA-индуцированной эксайтотоксичности. 5 ил., 3 пр.
Применение салицил-бета-аланил-L-гистидина (салицил-карнозина) в качестве нейропротекторного противоишемического средства в виде жизнеспособности нейронов первичной культуры клеток коры больших полушарий мозга крыс в условиях глюкозо-кислородной депривации и в модели NMDA-индуцированной эксайтотоксичности.
| Средство, обладающее антиагрегантной, цитопротекторной и антиоксидантной активностью | 2018 |
|
RU2694061C1 |
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| интернет-источник | |||
Авторы
Даты
2022-09-19—Публикация
2022-02-18—Подача