Изобретение относится к молекулярной биологии и генной инженерии и может быть использовано в медицинской диагностике для обнаружения вируса гепатита С в биологических жидкостях.
В современной клинической практике вирус гепатита С (ВГС) диагностируется с помощью иммуноферментных (ИФА) тест-систем 2-го и 3-го поколения. Этот метод основан на специфическом взаимодействии антител к вирусу гепатита С из сыворотки с рекомбинантными белками вируса гепатита С, которые затем связываются с вторичными антителами против иммуноглобулинов классов G и М (IgG или IgM), меченными ферментами, катализирующими развитие цветной реакции. В тест системах 2-го поколения используются антитела против эпитопов, полученных из core (С-22), NS3 (С-33) и NS4 (С-100) регионов вируса гепатита С [Pawlotsky J. Diagnostic testing in hepatitis С virus infection: viral kinetics and genomics // Semin. Liver. Dis. 2003. Vol.23. P. 3-11.].
Недостатком данного метода является продолжительный период, необходимый для появления специфических антител после инфицирования вирусом гепатита С (10 недель). Для того, чтобы сократить диагностическое окно используются иммуноферментные тест-системы 3-го поколения, сконструированные на основе антигена NS5 и высокоиммуногенного эпитопа NS3 регионов. Данное усовершенствование позволяет обнаруживать антитела к антигенам вируса гепатита С на 4-6-й неделе после инфицирования [Colin С., Lanoir D., Touzet S., Meyaud-Kraemer L., Bailly F., Trepo C. Sensitivity and specificity of third-generation hepatitis С virus antibody detection assays: an analysis of the literature // J. Viral. Hepat. 2001. Vol.8. P. 87-95.].
Однако при использовании упомянутых тест-систем достаточно часто встречаются ложноположительные результаты определения антител к антигенам вируса гепатита С у пациентов с наличием ревматоидного фактора в крови, среди беременных, у пациентов с аутоиммунными заболеваниями и др. Ложноотрицательные результаты выявления антител к антигенам вируса гепатита С могут наблюдаться у пациентов, находящихся на гемодиализе или у лиц с тяжелой иммуносуппрессией, например у ВИЧ-инфицированных или больных с гематологическими злокачественными новообразованиями. Также существует множество генотипов и субтипов вируса гепатита С, которые не определяются с помощью ИФА. Приблизительно у 15% пациентов с хроническим заболеванием печени вирусной этиологии в крови не определяются серологические маркеры [Соринсои С.Н. Вирусные гепатиты. СПб.: Медицина, 1998, с. 128-133].
Наличие антител к антигенам вируса гепатита С не позволяет отдифференцировать начальную стадию заболевания от последующих. Часто определяются общие антитела к вирусу гепатита С, по которым нельзя сказать, острый или хронический гепатит мы наблюдаем в настоящее время. В латентную фазу и фазу клинической активности спектр антител идентичен. [С.В. Губкин, А.Л. Сычев, В.М. Мицура. Преимущества метода ПЦР в сравнении с обнаружением антител к вирусу гепатита С при лабораторной диагностике вирусного гепатита С // Медицинский журнал. 2009. №2. С. 153-154.]
Кроме того, для обнаружения виремии используется определение маркера вируса гепатита С - кор-антигена при помощи хемилюминесцентной детекции [Park Y., Lee B.S., Kim B.S. et al. New automated hepatitis С virus (HCV) core antigen assay as an alternative to real-time PCR for HCV RNA quantification // Clin. Microbiol. 2010. T. 48. C. 2253-2256]. Кор-антиген обнаруживается в плазме крови в период виремии при гепатите С, но на ранних стадиях заболевания антигены вируса гепатита С циркулируют в чрезвычайно низких концентрациях, что делает данный метод не эффективным для ранней диагностики вируса гепатита С. Кроме того, кор-антиген вируса гепатита С изменчив и может «ускользнуть» от антител, что повышает вероятность появления ложноотрицательных результатов. Так же к недостаткам данного метода относится высокая стоимость оборудования, необходимого для проведения данного анализа.
Преодолеть недостатки данных тест-систем позволяют методы молекулярной биологии для выявления нуклеиновых кислот вирусов, которые наиболее адекватно отражают активность вирусной репликации.
Обычно в практике осуществляют анализ на РНК вируса гепатита С методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) [Takenobu Kamada, Norio Hayashi, Eiji Mita, Keiji Ueda. Patent Ep 0469348 A2 09.07.91]. Из исследуемого материала (сыворотка или плазма крови, печеночный биоптат) выделяют РНК вируса гепатита С. Учитывая, что нуклеиновая кислота вируса гепатита С представлена РНК, а для амплификации необходима молекула кДНК, при помощи фермента - обратной транскриптазы, происходит образование однонитевых молекул кДНК вируса гепатита С. На следующем этапе к определенному участку каждой из цепей кДНК вируса гепатита присоединяются праймеры - короткие олигонуклеотиды, комплементарные известным нуклеотидным последовательностям.
Сравнение первичной структуры 5'-нетранслируемой области генома различных изолятов вируса гепатита С выявило их незначительную изменчивость (между генотипами, гомология нуклеотидов - 92-98%, а внутри генотипа 98-99%). Это сделало предпочтительным выбор праймеров из этой зоны РНК вируса гепатита С и их применение в диагностических тест-системах, выпускаемых в России и за рубежом.
Далее, при помощи фермента ДНК-зависимой ДНК полимеразы происходит синтез новых участков ДНК. В настоящее время в качестве источника этого фермента чаще всего используют бактерии Thermophilus termus (Tth-полимераза) или Thermophilus aquaticus (Taq-полимераза). Многократное повторение циклов ПЦР приводит к накоплению фрагментов кДНК вируса гепатита С, которые возможно зарегистрировать при помощи электрофореза в полиакриламидном геле с последующей визуальной детекцией или же с применением гибридизации с олигонуклеотидными зондами [М.И. Михайлов. Лабораторная диагностика гепатита С // Вирусные гепатиты: Достижения и перспективы. 2001. №2(12). С. 56-57]
В настоящее время для количественной детекции вирусной РНК используется ПЦР в реальном времени (real-time ПЦР). Недостатком методов, основанных на реакции обратной транскрипции и ПЦР фрагментов РНК вируса гепатита С, является их низкая чувствительность, требующая на момент проведения диагностики наличия в крови человека большого числа вирионов гепатита С.
Прототипом нашего изобретения является патент [Abrignani Sergio, Grandi Guido. Patent US 2012/0066779 A1 15.03.2012]. В нем речь идет об использовании белка CD81 для лечения и диагностики гепатита С. Описываются фармацевтические композиции, животные модели и диагностические наборы для этих применений. В основном, в патенте описаны возможные пути лечения вирусного гепатита С при помощи CD81, а также модели (клеточные, животные, in vitro модели) для поиска веществ, нарушающих взаимодействие вируса гепатита С с рецептором CD81 человека и некоторых животных, в том числе трансгенных животных. Некоторые аспекты патента относятся к диагностике вирусного гепатита С при помощи белка CD81. Предлагается использовать CD81 в иммуноферментном анализе (ИФА, ELISA) и в радиоиммунологическом анализе (RIA). Предлагается использовать анти- CD81-антитела в качестве антиидиотипических антител против вируса гепатита С. Предлагаются различные варианты использования антител и/или меченного белка Е2 для детекции взаимодействия вируса гепатита С с CD81. Перечисленные выше диагностические методики, предложенные в патенте [Abrignani Sergio, Grandi Guido. Patent US 2012/0066779 A1 15.03.2012], не применяются в нашем изобретении.
Разработанный нами способ включает создание белка слияния стрептавидина с большой экстраклеточной петлей CD81 и использование полученного белка для повышения чувствительности ПЦР-диагностики вируса гепатита С.
Стрептавидин - белок массой 60 кДа, впервые был выделен из бактерии Streptomyces avidinii и является аналогом авидина, выделенного из желтка куриного яйца. Стрептавидин, как и авидин, обладает высоким сродством к биотину (известному как витамин В7) и имеет гомотетрамерную структуру. Константа диссоциации комплекса витамина В7 и стрептавидина составляет примерно 10-17 моль/м3, что характеризует их связь как одно из самых сильных нековалентных взаимодействий в природе. Вторичная структура стрептавидинового мономера состоит из восьми антипараллельных β-нитей, которые сворачиваются в третичную бочкообразную структуру. Участок, отвечающий за связывание биотина, расположен на конце данной структуры. Четыре одинаковых стрептавидиновых мономера соединяясь, образуют четвертичную структуру. Биотинсвязывающий сайт находится внутри данной бочкообразной структуры и включает в себя несколько остатков, в том числе Trp120 из соседней субъединицы.
Предлагаемый способ включает создание плазмиды, обеспечивающей синтез белка слияния стрептавидина с большой экстраклеточной петлей CD81, трансформацию полученной плазмидой клеток E.coli, выращивание трансформированных E.coli с последующим их разрушением, выделение и очистку белка слияния стрептавидина с большой экстраклеточной петлей CD81.
Нами используется лишь сама молекула рецептора CD81 человека, а точнее ее небольшой фрагмент, называемый большой экстраклеточной петлей рецептора CD81 человека.
CD81 - мембранный белок из надсемейства тетраспанинов, продукт гена человека TSPAN28. В перечне последовательностей под номером SEQ ID No: 1 приведена аминокислотная последовательность белка CD81 человека. Аминокислотные остатки (а.к.о.) с 113 по 201 соответствуют большой экстраклеточной петле.
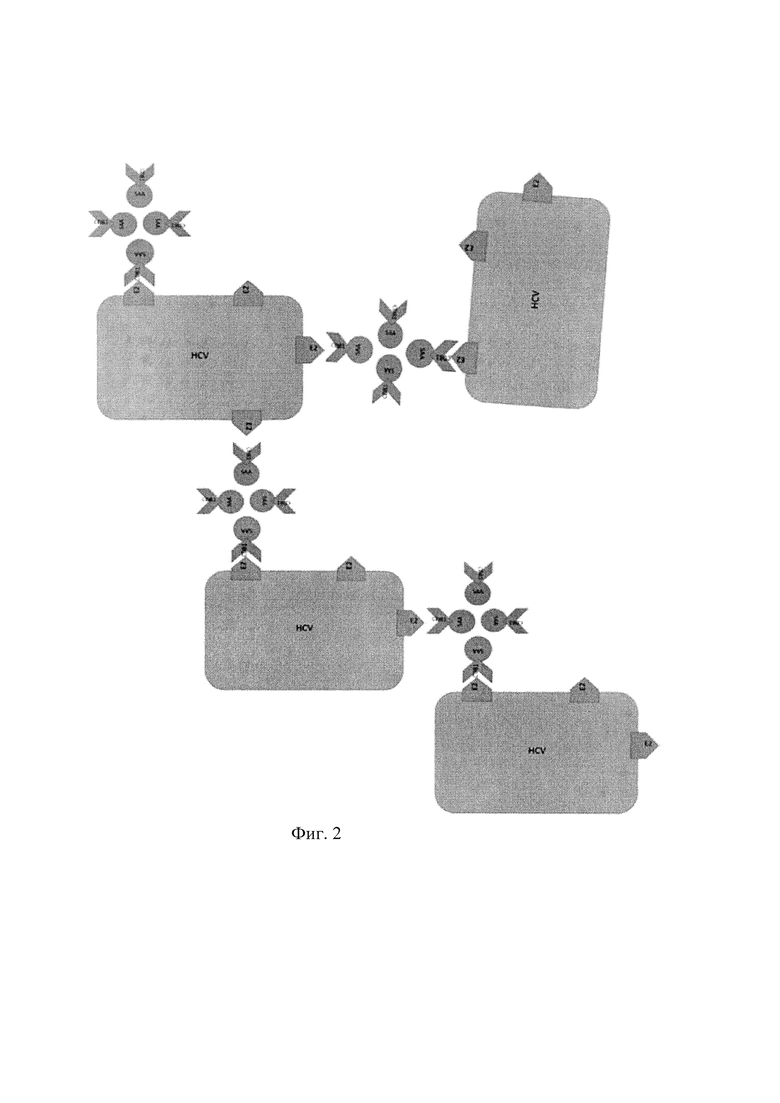
Основным преимуществом нашего изобретения является возможность концентрирования вирионов вируса гепатита С за счет тетрамерности созданной нами молекулы (фиг. 1, 2). На фиг. 1 изображен самособирающийся тетрамер химерного рекомбинантного белка слияния CD81 и стрептавидина (SAA - стрептавидин, CD81 - большая экстраклеточная петля человеческого рецептора CD81). На фиг. 2 изображены агрегаты вирионов, образованные за счет добавления в раствор CD81-SAA, HCV - вирион вируса гепатита С.Это позволяет увеличивать чувствительность существующих методов детекции ВГС за счет увеличения числа вирионов в объеме пробы для постановки реакции обоатной транскрипции с последующей ПЦР. В патенте [Abrignani Sergio, Grandi Guido. Patent US 2012/0066779 A1 15.03.2012] никак не затрагивается проблема повышения чувствительности каких-либо методик детекции ВГС, концентрирование вирионов не описано, рецептор CD81 или его фрагмент не синтезируется в форме какого-либо олигомера, в том числе в форме тетрамера.
В настоящее время основным источником стрептавидина является продуцент S. avidinii АТСС 27419, обладающий высокой природной устойчивостью к антибиотикам и требующий длительное время культивирования. Кроме того, при выделении стрептавидина из S. Avidinii, целевой белок часто загрязнен биотином [Proc. Natl. Acad. Sci. 1980. V. 77. P. 4666-4668; Biochem. Biophys. Methods. 1986. V. 13. P. 103-112; J. Immunol. Methods. 1988. V. 113. P. 83-91].
В связи с этим коммерческий стрептавидин в настоящее время, в основном, является рекомбинантным и получается в E.coli.
В международной заявке [PCT/US2006/016480 от 13.08.2009], предлагается способ экспрессии стрептавидина в питательную среду. Известен способ получения конструкции экспрессионной плазмиды для наработки стрептавидина в параплазматическом пространстве (pSAV27) [Вейко В.П., Гулько Л.Б., Дебабов В.Г., Дьяков Н.А., Окорокова Н.А., Соколов А.К., патент RU 2153535, опуб. 27.07.2000]. Получение плазмиды включает: выделение из S. avidinii M170791 нуклеотидной последовательности, кодирующей лидерный пептид стрептавидина и зрелый белок (прострептавидин) с введением сайтов рестрикции; конструирование высококопийной pSAV27 плазмиды с ампицилиновым маркером; трансформация штамма E.coli JM110 полученной конструкцией; выращивание штамма-продуцента на LB-среде; лизирование полученной биомассы для выделения периплазматической фракции; определение биологической активности стрептавидина путем разделения в ПААГ продуктов связывания стрептавидина с синтетическим биотинилированным олигонуклеотидом. По сравнению с вышеприведенным методом выделения белка из телец включения, данный метод обладает значительным преимуществом. Плазмида pSAV27, несущая последовательность лидерного пептида вместе с нуклеотидной последовательностью гомотетрамерного стрептавидина, селективно экспрессирует белок в периплазматическое пространство, где он локализируется в биологически активном состоянии.
Указанные выше патенты и публикации описывают получение не химерного стрептавидина, то есть стрептавидина, не связанного с какими-либо другими белками или пептидами. Предлагаемым нами изобретением является рекомбинантный химерный стрептавидин, включающий в себя как аминокислотную последовательность стрептавидина, так и последовательность фрагмента другого белка, а именно CD81 человека. С точки зрения химерного стрептавидина, аналогом заявляемого изобретения является способ получения рекомбинантного химерного белка стрептавидина и меланома-адресующего олигопептида [Рубцов М.А., Сыркина М.С., Вейко В.П., Окорокова Н.А., Замятнин А.А., Патент RU 2577138, опуб. 10.03.2016]. В описанном способе предлагается культивирование E.coli, трансформированных плазмидой, кодирующей белок слияния стрептавидина и меланома-адресующего олигопептида. Авторы описывают выделение целевого белка из периплазмы E.coli. Получаемый таким образом белок может быть использован для диагностики меланомы. Заявляемое нами изобретение отличается от [Рубцов М.А., Сыркина М.С., Вейко В.П., Окорокова Н.А., Замятнин А.А., Патент RU 2577138, опуб. 10.03.2016] тем, что мы не используем меланома-адресующий олигопептид в составе получаемого белка, целью нашего изобретения является диагностика вирусного гепатита С. Соответственно, в нашем случае стрептавидин соединен с CD81 человека, получаемый белок не может быть использован для диагностики меланомы, но может быть использован для диагностики гепатита С.
Технической задачей, решаемой предлагаемым нами изобретением, является создание химерного белка, который можно использовать для осуществления диагностики вируса гепатита С на основе детекции вирусной РНК вируса гепатита С при помощи ПЦР.
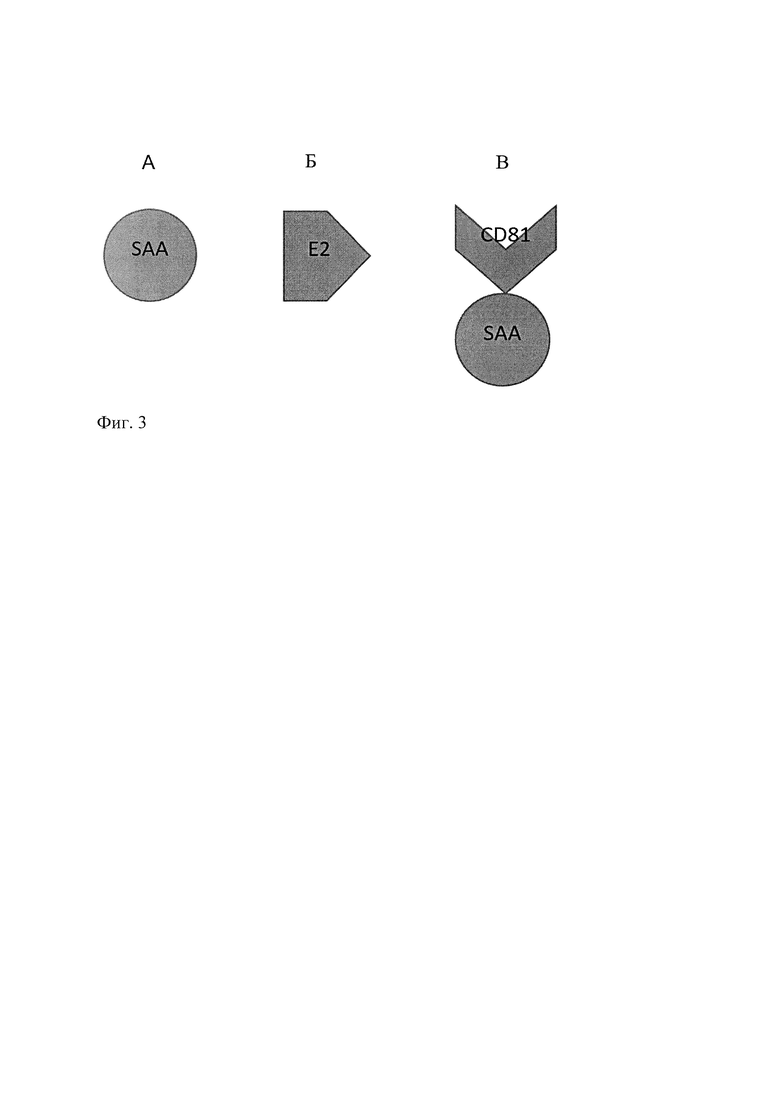
Техническим результатом является повышение чувствительности существующих методов диагностики вируса гепатита С на основе ПЦР-анализа, для чего разработана генетическая конструкция, обеспечивающая синтез белка слияния стрептавидина с большой экстраклеточной петлей CD81 (SAA-CD81), при этом каждый из четырех мономеров стрептавидина ковалентно связан с молекулой большой экстраклеточной петли CD81 (фиг. 1). В перечне последовательностей под номером 2 (SEQ ID No: 2) приведена аминокислотная последовательность рекомбинантного химерного белка CD81-SAA. А.к.о. с 3 по 91 соответствуют большой экстраклеточной петле CD81, а.к.о. с 95 по 222 соответствуют последовательности стрептавидина (SAA).
На фиг 3 изображены: А - мономер стрептавидина, Б - белок Е2 капсида вируса гепатита С, В - химерный белок слияния СВ81 и стрептавидина. Стрептавидин - бактериальный белок с молекулярной массой около 60 кДа, впервые выделенный из бактерий Streptomyces avidinii. Вторичная структура мономера стрептавидина состоит из восьми антипараллельных β-нитей, которые сворачиваются в третичную бочкообразную структуру. Четвертичная структура данного белка представляет собой гомотетрамер, состоящий из четырех мономеров стрептавидина. Вирус гепатита С проникает в клетки, в частности в гепатоциты, используя большую экстраклеточную петлю CD81. Идея данного изобретения заключается в том, что рекомбинантные аналоги этого рецептора могут служить в качестве соединения, антигенно неспецифично связывающего вирусные частицы. Использование для этой цели антител против антигенов гепатита С недостаточно эффективно, так как данный вирус обладает высокой вариабельностью, что позволяет ему постоянно «ускользать» от иммунного ответа. Соответственно, невозможно искусственно получить такие антитела, которые связывали бы все образующиеся в организме больного типы вируса гепатита С. При этом все типы этого вируса обязательно способны связывать большую экстраклеточную петлю CD81. Синтезированный нами рекомбинантный белок слияния стрептавидина и большой экстраклеточной петли CD81 связывает поверхностный лиганд большой экстраклеточной петли CD81, а именно Е2 - поверхностный белок вируса гепатита С.
Предлагаемый нами рекомбинантный белок слияния может увеличить чувствительность обратной транскрипции (с последующей вирус-специфичной ПЦР) за счет увеличения количества вирионов в пробе. Каждая молекула SAA-CD81 является тетрамером и содержит по 4 фрагмента большой экстраклеточной петли CD81, взаимодействующего с Е2 (фиг. 1). Таким образом, каждая молекула SAA-CD81 может связывать более одного вириона вируса гепатита С за счет взаимодействия с белком Е2. Вирион гепатита С содержит много молекул Е2 на своей поверхности, следовательно, каждая вирусная частица может связывать более одной молекулы SAA-CD81. Это позволяет образовывать конгломерат, состоящий из большого числа вирионов, связанных между собой химерными белками стрептавидина с большой экстраклеточной петлей CD81. Полученный конгломерат может быть легко осажден центрифугированием (фиг. 2).
Белок CD81-SAA содержит присущие стрептавидину активные центры, связывающие с высокой аффинностью биотин и биотинилированные молекулы, что позволяет сорбировать на биотинилированном высокомолекулярном носителе CD81-SAA, в том числе CD81-SAA, предварительно связавший ВГС. Таким носителем могут быть, например, микрочастицы, состоящие из полимера молочной кислоты. Кроме того, белок CD81-SAA может быть присоединен к микрочастицам иными способами, в том числе при помощи ковалентной химической связи, в том числе с использованием линкеров (фиг. 4). На фиг. 4 изображены вирионы вируса гепатита С, сорбированные на микрочастице при помощи CD81-SAA.
CD81-SAA, также как и стрептавидин, является тетрамерным белком, что выгодно отличает CD81-SAA от свободного CD81 или от большой экстраклеточной петли человеческого рецептора CD81.
Тетрамерная четвертичная структура CD81-SAA позволяет одной молекуле данного белка связывать более одного вириона вируса гепатита С (ВГС) за счет специфического взаимодействия с белка Е2 капсида вируса гепатита С и рецептора CD81. Вирион ВГС может связываться более, чем с одной молекулой человеческого рецептора CD81, таким образом, вирионы ВГС, при добавлении раствора CD81-SAA, могут образовывать агрегаты, состоящие из нескольких вирионов. Такие агрегаты легко осаждаются центрифугированием за счет своего большого размера.
Белок CD81-SAA содержит присущие стрептавидину активные центры, связывающие с высокой аффинностью биотин и биотинилированные молекулы, что позволяет сорбировать на биотинилированном высокомолекулярном носителе CD81-SAA, в том числе белок CD81-SAA, предварительно связавший ВГС.
При синтезе CD81-SAA в E.coli стрептавидиновая часть обеспечивает накопление получаемого целевого белка в тельцах включения, что позволяет удешевить и облегчить производство CD81-SAA по сравнению со свободным CD81 или с большой экстраклеточной петли человеческого рецептора CD81.
Таким образом, был создан рекомбинантный химерный белок CD81-SAA, обладающий способностью связывать вирионы вируса гепатита С за счет специфического взаимодействия CD81 с белком Е2 капсида вируса гепатита С, характеризующийся последовательностью SEQ ID No: 2. и отличающийся тем, что содержит не только аминокислотную последовательность большой экстраклеточной петли человеческого рецептора CD81, но и аминокислотную последовательность стрептавидина. Для обеспечения возможности выделения белка на никель-агарозном сорбенте в структуру белка также была включена олигогистидиновая последовательность.
Кроме того, для создания специфических для вируса ловушек за счет взаимодействия рецептора CD81 с вирионами вируса гепатита С, созданный рекомбинантный белок ковалентно присоединяли к поверхности микрочастиц, состоящих из полимера молочной кислоты. Предварительное биотинилирование полимерных микрочастиц позволило достичь более эффективного образования конгломератов за счет высокого сродства биотина к стрептавидину, входящему в состав рекомбинантного белка.
Пример 1. Создание плазмиды pET22b+-SA-CD81(pelB+)
Для создания плазмиды, которая включает нуклеотидную последовательность стрептавидина дикого типа, слитого с большой экстраклеточной петлей CD81, pelB-лидерным пептидом и олигогистидиновой последовательность, использовали исходный вектор pET22b(+) [Novagen, рЕТ System Manual, 11th Ed.], содержащий ген устойчивости к ампициллину, олигогистидиновую последовательность и нуклеотидную последовательность pelB-лидерного пептида [Novagen, рЕТ System Manual, 11th Ed.], необходимого для направленного транспорта белка в периплазму.
Для наработки исходного вектора pET22b(+)использовали штамм E.coli DH5(α). К 100 мкл компетентных клеток E.coli DH5(α) добавили от 100 до 300 нг плазмидной ДНК pET22b(+). Затем инкубировали во льду 15 минут. Для осуществления теплового шока суспензию клеток инкубировали в течение 5 минут при 42°С на водяной бане, с последующей инкубацией во льду 2 минуты. К суспензии добавили 900 мкл среды LB и инкубировали 1 час при 37°С. Клетки высевали на чашки, содержащие агаризованную LB-среду с ампициллином (100 мкг/мл). Чашки инкубировали в течение ночи при 37°. Клетки E.coli DH5(α), трансформированные pET22b(+), выращивались при 37°С в условиях аэрации, осаждались центрифугированием и использовали для выделения плазмидной ДНК фенол-хлороформным методом. Супернатант сливали, остаток клеток ресуспендировали в 4 мл среды и осаждали центрифугированием, затем супернатант снова сливали. Добавляли по 200 мкл раствора I в каждую пробирку. Раствор I имеет следующий состав: 50 мМ глюкозы, 25 мМ TrisHCl рН 8.0, 10 мМ EDTA рН 8.0. Смесь ресуспендировали на вортексе и добавляли по 400 мкл раствора II, следующего состава: 0.2Н NaOH, 1% SDS. Получившуюся суспензию перемешивали быстрым переворачиванием в течение 5 минут и добавляли по 300 мкл раствора III (5М CH3COOK, 11.5% СН3СООН), несколько раз переворачивали и инкубировали во льду в течение 5 минут. Клетки осаждали центрифугированием и отбирали по 600 мкл суспензии и переносили в чистые эппендорфы и затем добавляли по 600 мкл изопропилового спирта (-200С). Затем суспензию инкубировали при -200С в течение 10 минут и осаждали центрифугированием. Спирт сливали и осадок высушивали. Растворяли осадок в 200 мкл воды. Добавляли 250 мкл смеси фенол: хлороформ (1:1) и перемешивали. Суспензию осаждали центрифугированием, супернатант отбирали и добавляли 250 мкл смеси хлороформ: изоамиловый спирт (24:1) и перемешивали. Суспензию осаждали центрифугированием. Получившийся супернатант отбирали, добавляли 2.5 объема 96% этилового спирта и инкубировали при -200С в течение 30 минут. Затем осаждали центрифугированием, спирт сливали и добавляли 1 мл 70% этилового спирта. Затем смесь осаждали центрифугированием, спирт сливали. Высушивали осадок до исчезновения запаха спирта. Осадок растворяли в 200 мкл воды. Полученную плазмидную ДНК разделяли в 0.8% агарозном геле. Состав геля: 0.8% агароза; 0.5х ТВЕ буфер; 1 мкг/мл этидиум бромид. Состав буфера для образцов: 30% -ный глицерин (v/v); 0.025% ксиленцианол (w/v); 0.025% бромфеноловый синий (w/v). Электродный буфер: 0.5х буфер ТВЕ. Состав 10х буфера ТВЕ: 890 мМ Tris; 890 мМ борная кислота (рН 8.0); 20М EDTA.
Для приготовления геля смесь компонентов прогревали до полного растворения агарозы, после чего охлаждали до 500С, добавляли бромид этидия до концентрации 0.5 мг/мл и заливали на горизонтальную платформу размером 80×110 мм. Толщина геля составляла 5 мм. Напряженность электрического поля составляла 5 В/см В качестве маркеров использовали коммерческие маркеры 250-10000 п. н. («Медиген»). Очистка плазмиды из агарозного геля проводилась с использованием специального набора фирмы Promega (WizardSV Gel and PCR Clean-Up System, США).
Для вставки нуклеотидной последовательности стрептавидина дикого типа (SA) в исходную плазмиду использовались «липкие концы», получаемые за счет обработки вектора эндонуклеазми рестрикции NcoI и XhoI. Реакционная смесь рестрикции имела следующий состав (V=60 мкл, t0=37°C, 1 час): pET22b(+): 22 мкл; NcoI 2,5 мкл; XhoI 2,5 мкл; 10Хбуфер 6 мкл; H2O 27 мкл.
После процедуры гидролиза, получившийся линейный вектор подвергался электрофоретическом разделению в 0.8% агарозном геле с использование протокола, указанного выше в тексте. Очистка плазмиды из агарозного геля проводилась с использованием специального набора фирмы Promega (WizardSV Gel and PCR Clean-Up System, США). Для наработки необходимого количества нуклеотидной последовательности SA проводили ПЦР с использованием специально подобранных олигонуклеотидов.
В качестве матрицы для наработки нуклеотидной последовательности использовалась плазмида, содержащая нуклеотидную последовательность стрептавидина дикого типа [J Chromatogr А. 1994 Aug 5; 676(2):337-45]. Для получения нуклеотидной последовательности нами были подобраны специальные олигонуклеотиды, которые представлены в перечне последовательностей под номерами SEQ ID No: 3 и SEQ ID No: 4.
f-SA-NCO: 5'- (SEQ ID No: 3) ctgccatggctgaagctggtatcacc - олигонуклеотид с сайтом рестрикции для NcoI и последовательностью, комплементарной последовательности гена стрептавидина -
r-SA-stop-XHO: 5'- (SEQ ID No: 4) ctgctcgagtcattaggaagcagcggacggtt - с сайтом рестрикции XhoI и последовательностью комплементарной последовательности гена стрептавидина.
Полимеразную цепную реакцию (ПЦР) проводили в реакционной смеси конечным объемом 30 мкл. Состав реакционной смеси: Олигонуклеотиды (прямой и обратный) по 10 пМоль; Буфер для Taq-полимеразы x1, (dATP, dTTP, dGTP, dCTP) 6 нМоль; MgCl2 50 нМоль; Taq-полимераза 1 единица.
ПЦР проводилась в микроцентрифужных пробирках объемом 0.5 мл на аппарате «Терцик» (Россия) с набором программ, определяющих температурный режим ПЦР. Была проведена амплификация нуклеотидных последовательностей методом ПЦР. Температурный профиль ПЦР: 5 минут 950С, 1 минута 950С (денатурация), 1 минута Т0отжига=560С 30 циклов, 1 минута 720С (достройка), 5 минут 720С.
Встраивание нуклеотидной последовательности SA в плазмиду pET22b(+) производили следующим способом. Полученные продукты амплификации нуклеотидной последовательности SA обрабатывали эндонуклеазами рестрикции XhoI и NcoI. Состав реакционной смеси для NcoI и XhoI (V=60 мкл, t0=370C, 1 час): нуклеотидная последовательность SA: 35 мкл; NcoI 2,5 мкл; XhoI 2,5 мкл; 10Хбуфер 6 мкл; H2O 16 мкл.
Таким образом, нами были подготовлены плазмида pET22b(+)/NcoI/XhoI и продукты амплификации нуклеотидной последовательности SA, имеющие идентичные липкие концы. Продукты рестрикции нуклеотидной последовательности SA смешивались с подготовленным вектором и затем лигировались. Молярное соотношение плазмиды и ПЦР-продукта брали 1/20. Для лигирования использовали лигазу фирмы «Fermentas» (Литва). Состав реакционной смеси (объем пробы составлял 10мкл.): нуклеотидная последовательность SAD 65 нг (4 мкл), Лигаза 1 мкл, Лигазный буфер 1 мкл, Плазмида 40 нг (4 мкл). Лигирование проводили в течение 16 часов при температуре +4°С. В результате была получена генетическая конструкция, названная нами pEP22b(+)-SA(pelB+), кодирующая белок SA с PelB-лидерным пептидом и олигогистидиновой последовательностью.
Отбор колоний, содержащих плазмиды со вставкой нуклеотидной последовательности SA, производился следующим образом. Полученной лигазной смесью были трансформированы компетентные клетки штамма DH5(α) E.coli. К 100 мкл компетентных клеток E.coli DH5(α) добавили от 100 до 300 нг плазмидной ДНК pET22b(+)-SA(pelB+) и далее проводили трансформацию с помощью аналогичного метода, изложенного выше. Трансформанты были высеяны на чашку Петри с агаризованной LB средой, в состав которой входил антибиотик ампициллин. Таким образом, на селективной среде выросли клетки, резистентные к ампициллину, содержащие плазмиды - продукты лигирования.
Клетки E.coli DH5(α), трансформированные pET22b(+)-SA(pelB+), выращивались при 37°С в условиях аэрации, осаждались центрифугированием при 4000 об/мин на центрифуге К23 при 40С в течение 30 минут и использовали для выделения плазмидной ДНК методом подробно изложенным выше в тексте.
Для проверки вставки с помощью ПЦР было выбрано несколько колоний. Нуклеотидная последовательность целевой генетической конструкции дополнительно была исследована с помощью секвенирования по Сэнгеру [J.Mol.Biol. 1975. V. 94. Р. 441-446].
Встраивание нуклеотидной последовательности, кодирующей большую экстраклеточную петлю CD81 в плазмиду pEP22b(+)-SA(pelB+) производили следующим способом. Полученный ранее вектор подготавливали к вставке нуклеотидной последовательности большой экстраклеточной петли CD81. Для этого вектор подвергался рестрикции по сайту NcoI. После процедуры гидролиза, получившийся линейный вектор подвергался электрофоретическом разделению в 0.8% агарозном геле с использование протокола, указанного выше в тексте. Очистка плазмиды из агарозного геля проводилась с использованием набора фирмы Promega (WizardSV Gel and PCR Clean-Up System, США).
Продукты амплификации нуклеотидной последовательности большой экстроклеточной петли CD81 предварительно обрабатывались эндонуклеазой рестрикции NcoI. Реакционная смесь для NcoI. (V=60 мкл, t0=370C, 1 час): нуклеотидная последовательность экстраклеточной петли CD81: 35 мкл; NcoI. 4 мкл; 10Хбуфер 6 мкл; Н2О 15 мкл.
Продукты рестрикции нуклеотидной последовательности большой экстраклеточной петли CD81 смешивались с подготовленным вектором и затем лигировались. Молярное соотношение плазмиды и ПЦР-продукта брали 1/100. Для лигирования использовали лигазу фирмы «Fermentas» (Литва). Состав реакционной смеси (объем пробы составлял 10мкл.): нуклеотидная последовательность большой экстроклеточной петли CD81 65 нг (4 мкл), Лигаза 1 мкл, Лигазный буфер 1 мкл, Плазмида 40 нг (4 мкл). Лигирование проводили в течение 16 часов при температуре +4°С. В результате была получена генетическая конструкция, условно названная нами pEP22b(+)-SA-CD81(pelB+), экспрессирующая нуклеотидную последовательность SA, сцепленную с нуклеотидной последовательностью большой экстраклеточной петли CD81, олигогистидиновой последовательностью и с pelB-лидерным пептидом.
Полученной лигазной смесью были трансформированы компетентные клетки штамма DH5(α) E.coli. К 100 мкл компетентных клеток E.coli DH5(α) добавили от 100 до 300 нг плазмидной ДНК pEP22b(+)-SA-CD81(pelB+) и далее проводили трансформацию с помощью аналогичного метода, изложенного выше. Трансформанты были высеяны на чашку Петри с агаризованной LB средой, в состав которой входил антибиотик ампициллин. Таким образом, на селективной среде выросли клетки, резистентные к ампициллину, содержащие плазмиды - продукты лигирования. Клетки E.coli DH5(α), трансформированные pEP22b(+)-SA-CD81(pelB+), выращивали при 37°С в условиях аэрации, осаждали центрифугированием и использовали для выделения плазмидной ДНК.
Для проверки вставки с помощью ПЦР было выбрано несколько колоний. Нуклеотидную последовательность целевой генетической конструкции проверяли с помощью секвенирования по Сэнгеру [J.Mol.Biol. 1975. V. 94. Р. 441-446].
Пример 2. Создание плазмиды pET22b+-SA- CD81(pelB-)
Для создания плазмиды, которая включает нуклеотидную последовательность стрептавидина дикого типа, слитого с большой экстраклеточной петлей CD81 и олигогистидиновой последовательностью, был использован исходный вектор pET22b(+) [Novagen, рЕТ System Manual, 11th Edition], содержащий ген устойчивости к ампициллину и олигогистидиновую последовательность, которая была необходима для последующей очистки целевого белка на никель-агарозном сорбенте. Для наработки исходного вектора pET22b(+) был использован штамм E.coli DH5(α). К 100 мкл компетентных клеток E.coli DH5(α) добавили от 100 до 300 нг плазмидной ДНК pET22b(+) и далее проводили трансформацию с помощью аналогичного метода, изложенного выше. Клетки E.coli DH5(α), трансформированные pET22b(+), выращивались при 37°С в условиях аэрации, осаждались центрифугированием и использовали для выделения плазмидной ДНК методом подробно изложенным выше в тексте. Полученную плазмидную ДНК разделяли в 0.8% агарозном геле с использование протокола, указанного выше в тексте. Очистка плазмиды из агарозного геля проводилась с использованием набора фирмы Promega (WizardSV Gel and PCR Clean-Up System, США).
Для вставки фрагментов нуклеотидной последовательности стрептавидина дикого типа (SA) в исходную плазмиду, использовались «липкие концы», получаемые за счет обработки вектора эндонуклеазами рестрикции NdeI и XhoI. В данном случае вектор разрезался по сайту эндонуклеазы рестрикции NdeI для получения варианта генетической конструкции не несущей в себе последовательность pelB-лидерного пептида. Реакционная смесь рестрикции для NdeI и XhoI имела следующий состав: (V=60 мкл, t0=370C, 1 час): pET22b(+): 22 мкл, NdeI 2,5 мкл, XhoI 2,5 мкл, 10Хбуфер 6 мкл, H2O 27 мкл.
После процедуры гидролиза, получившийся линейный вектор подвергали электрофоретическому разделению в 0.8% агарозном геле с использованием протокола, указанного выше в тексте. Очистка плазмиды из агарозного геля. Для наработки необходимого количества нуклеотидной последовательности SA проводили ПЦР с использованием специально подобранных олигонуклеотидов. В качестве матрицы для наработки нуклеотидной последовательности использовали плазмиду, содержащую нуклеотидную последовательность стрептавидина дикого типа [J Chromatogr А. 1994 Aug 5; 676(2):337-45]. Для получения нуклеотидной последовательности SA нами были подобраны специальные олигонуклеотиды, которые представлены в перечне последовательностей под номерами SEQ ID No: 4 и SEQ ID No: 5.
r-SA-XHO: 5'- (SEQ ID No: 4) ctgctcgagggaagcagcggacggtt - олигонуклеотид с сайтом рестрикции для XhoI, характеризующийся последовательностью, комплементарной последовательности гена стрептавидина.
f-SA-NDE: 5'- (SEQ ID No: 5) ctgttatgctgaagctggtatcacc - олигонуклеотид с сайтом рестрикции для NdeI и характеризующийся последовательностью, комплементарной последовательности гена стрептавидина.
Встраивание нуклеотидной последовательности SA в плазмиду pET22b(+) проводилось следующим способом. Полученные продукты амплификации SA предварительно обрабатывали эндонуклеазами рестрикции NdeI и XbaI. Состав реакционной смеси для NdeI и XhoI (V=60 мкл, t0=370С, 1 час): нуклеотидная последовательность SA: 35 мкл, NdeI 2,5 мкл, XhoI 2,5 мкл, 10Xбyфep 6 мкл, Н2О 16 мкл.
Таким образом, нами были подготовлены плазмида pET22b(+)/NdeI /XhoI и продукты амплификации нуклеотидной последовательности SA, имеющие идентичные липкие концы. Продукты рестрикции нуклеотидной последовательности SA смешивались с подготовленным вектором и затем лигировались. Молярное соотношение плазмиды и ПЦР-продукта брали 1/20. Состав реакционной смеси (объем пробы составлял 10мкл.): нуклеотидная последовательность SA 65 нг (4 мкл), Лигаза 1 мкл, Лигазный буфер 1 мкл, Плазмида 40 нг (4 мкл). Лигирование проводили в течение 16 часов при температуре +4°С. В результате была получена генетическая конструкция, условно названная нами pEP22b(+)-SA(pelB-), экспрессирующая ген SA, сцепленный с олигогистидиновой последовательностью.
Отбор колоний, содержащих плазмиды со вставкой нуклеотидной последовательности SA, производили следующим способом. Полученной лигазной смесью были трансформированы компетентные клетки штамма DH5(α) E.coli. К 100 мкл компетентных клеток E.coli DH5(α) добавили от 100 до 300 нг плазмидной ДНК pET22b(+)-SA(pelB-) и далее проводили трансформацию с помощью аналогичного метода, изложенного выше. Трансформанты были высеяны на чашку Петри с агаризованной LB средой, в состав которой входил антибиотик ампициллин. Таким образом, на селективной среде выросли клетки, резистентные к ампициллину, содержащие плазмиды - продукты лигирования.
Клетки E.coli DH5(α), трансформированные pET22b(+)-SA(pelB-), выращивались при 37°С в условиях аэрации, осаждались центрифугированием при 4°С в течение 30 минут и использовали для выделения плазмидной ДНК методом подробно изложенным выше в тексте.
Для проверки вставки с помощью ПЦР было выбрано несколько колоний. Нуклеотидная последовательность целевой генетической конструкции дополнительно была исследована с помощью секвенирования по Сэнгеру.
Встраивание нуклеотидной последовательности, кодирующей большую экстраклеточную петлю CD81 в плазмиду pEP22b(+)-SA(pelB-) производилось следующим способом. Полученный ранее вектор подготавливали к вставке нуклеотидной последовательности большой экстраклеточной петли CD81. Для этого вектор подвергался рестрикции по сайту NdeI. Состав реакционной смеси для NdeI (V=60мкл, t0=370C, 1 час): pET22b(+)-SA(pelB-): 22 мкл, NdeI 4 мкл, 10Хбуфер 6 мкл, Н2О 28 мкл.
После процедуры гидролиза получившийся линейный вектор подвергали электрофоретическому разделению в 0.8% агарозном геле.
Продукты амплификации нуклеотидной последовательности большой экстраклеточной петли CD81 предварительно обрабатывались эндонуклеазой рестрикции NdeI. Реакционная смесь для NdeI_(V=60 мкл, t0=370C, 1 час): нуклеотидная последовательность большой экстроклеточной петли CD81: 35 мкл, NdeI 4 мкл, 10Xбyфep 6 мкл, Н2О 15 мкл.
Продукты рестрикции нуклеотидной последовательности большой экстроклеточной петли CD81 смешивались с подготовленным вектором и затем лигировались. Молярное соотношение плазмиды и ПЦР-продукта брали 1/100. Состав реакционной смеси (объем пробы составлял 10мкл.): нуклеотидная последовательность большой экстраклеточной петли CD81 65 нг (4 мкл), Лигаза 1 мкл, Лигазный буфер 1 мкл, Плазмида 40 нг (4 мкл). Лигирование проводили в течение 16 часов при температуре +4°С. В результате была получена генетическая конструкция условно названная нами pEP22b(+)-SA-CD81(pelB-), экспрессирующая нуклеотидную последовательность SA, сцепленную с нуклеотидной последовательностью большой экстраклеточной петли CD81 и олигогистидиновой последовательностью.
Полученной лигазной смесью были трансформированы компетентные клетки штамма DH5(α) E.coli. К 100 мкл компетентных клеток E.coli DH5(α) добавили от 100 до 300 нг плазмидной ДНК pET22b(+)-SA-CD81(pelB-) и далее проводили трансформацию с помощью аналогичного метода, изложенного выше. Трансформанты были высеяны на чашку Петри с агаризованной LB средой, в состав которой входил антибиотик ампициллин. Таким образом, на селективной среде выросли клетки, резистентные к ампициллину, содержащие плазмиды - продукты лигирования.
Клетки E.coli DH5(α), трансформированные pET22b(+)-SA-CD81(pelB-), выращивались при 37°С в условиях аэрации, осаждались центрифугированием и использовались для выделения плазмидной ДНК, изложенным выше в тексте.
Для проверки вставки с помощью ПЦР было выбрано несколько колоний. Нуклеотидная последовательность целевой генетической конструкции проверялась с помощью секвенирования по Сэнгеру.
Пример 3. Трансформация штамма E.coli BL21(DE3) конструкциями pET22b+-SA-CD81(pelB+) и pET22b+-SA-CD81(pelB-).
Полученные конструкции pET22b+-SA-CD81 (pelB+) и pET22b+-SA-CD81(pelB-) были использованы для трансформации клеткок E.coli BL21(DE3). Для этого к одной суспензии компетентных клеткок E.coli BL21(DE3) (100 мкл) добавили от 100 нг плазмидной ДНК pET22b+-SA-CD81(pelB+), а к другой суспензии компетентных клеткок E.coli BL21(DE3) (100 мкл) от 100 нг плазмидной ДНК pET22b+-SA-CD81(pelB-). Затем инкубировали во льду 15 минут. Для осуществления теплового шока суспензию клеток инкубировали в течение 5 минут при 42°С на водяной бане, с последующей инкубацией во льду 2 минуты. Добавляли 900 мкл среды LB и инкубировали 1 час при 37°С. Клетки высевали на чашки, содержащие агаризованную LB-среду с ампицилином (100 мкг/мл). Чашки инкубировали в течение ночи при 37°.
Пример 4.
Культивирование штамма E.coli BL21(DE3)/pET22h(+)-SA-CD81(pelB+) и E.coli BL21(DE3)/pET22b(+)-SA-CD81(pelB-).
Полученные трансформаты E.coli BL21(DE3)/pET22b(+) SA-CD81(pelB+) и E.coli BL21(DE3)/pET22b(+) -SA-CD81(pelB-) засевали в две раздельные колбы с LB-средой (10 мл) с добавлением ампмциллина (100 мкг/мл) и растили в течение ночи при 37°С при постоянном покачивании. Утром инокулят переливали в 500 мл LB-среды. Для селекции трансформированных клеток производилось добавление антибиотика ампициллина (в расчете 100 мкг и 50 мкг соответственно на 1 мл среды). Клетки выращивали при 37°С в условиях аэрации до плотности А600=0.6-1. Синтез белка индуцировали добавлением IPTG (0,5 ммоль/л), культивирование E.coli BL21(DE3)/pET22b(+) -SA-CD81(pelB+) продолжали в течение ночи при 26°С, культивирование E.coli BL21(DE3)/pET22b(+) -SA-CD81(pelB-) продолжали в течение ночи при 37°С.
Пример 5.
Выделение белка слияния из культуральной среды E.coli BL21(DE3)/pET22b(+) -SA-CD81 (pelB+).
Бактериальные клетки отделяли от среды культивирования путем центрифугирования. Среду культивирования подвергали хроматографической очистке на металл-хелатном никелевом сорбенте (Invitrogen) (объем колонки 1.5 мл), согласно стандартному протоколу производителя.
Пример 6. Выделение белка слияния из периплазматической фракции E.coli BL21(DE3)/pET22b(+) -SA-CD81(pelB+)
После отделения бактериальных клеток путем центрифугирования в течение 15 минут при 10 000 g, периплазматическую фракцию получали методом «осмотического шока» [Current Protocols in Molecular Biology. 1989. John Wiley & Sons, New York]. Белок слияния был аффинно очищен на металл-хелатном никель-агарозном сорбенте. Для этого к полученному содержимому периплазмы бактерий добавляли фенилметилсульфонилфторид и имидазол (конечная концентрация 1 mM и 10 mM соответственно). Раствор фильтровали через металл-хелатный сорбент. Балластные белки отмывали 0,5 м раствором NaCl на 0,1 M К-фосфатном буфере, рН=8,0, содержащем 20 мМ имидазола. Далее белок элюировали 0,15 М NaCl, рН=7,4, содержащем 200 мМ имидазола.
Пример 7. Выделение белка слияния из растворимой клеточной фракции E.coli BL21(DE3)/pET22b(+) -SA-CD81(pelB-)
Клетки ресуспендировали в ФБР и осаждали, а затем разрушали ультразвуком с помощью ультразвукового дезинтегратора в условиях охлаждения с добавлением стеклянных шариков (Glass Beads, 500 microns, Sigma). Затем супернатант и клеточную массу разделяли, предварительно убрав стеклянные шарики, на центрифуге. Профильтрованный через бумажный фильтр супернатант подвергали хроматографической очистке на металл-хелатном никелевом сорбенте, согласно стандартному протоколу производителя.
Пример 8. Выделение белка слияния из телец включения E.coli BL21(DE3)/pET22b(+) -SA-CD81 (pelB-)
Осадок клеток, оставшийся после выделения из растворимой клеточной фракции, отмывали ФБР, растворяли в 6 М гуанидин-хлориде рН 1.5 и оставляли на 1 ч. Затем осадок центрифугировали. Профильтрованный через бумажный фильтр супернатант подвергали хроматографической очистке на металл-хелатном никелевом сорбенте, согласно стандартному протоколу производителя, предварительно доводя рН супернатанта до 7.
Профильтрованный через бумажный фильтр супернатант подвергали хроматографической очистке на металл-хелатном никелевом сорбенте.
Пример 9. Получение частиц на основе полимолочной кислоты (ПМК)
Частицы на основе ПМК получали методом одинарной эмульсии. 300 мг ПМК (молекулярная масса 15 000 - 30 000) растворяли в 7.5 мл дихлорметана (4 масс./об.%), содержащего 50 мг лецитина. Полученную «маслянную» фазу диспергировали в 75 мл охлажденного льдом водного раствора додецилсульфата натрия (1 масс. %) и Lutrol F-68 (5 масс. %) с применением ультразвукового диспергатора (Sonopuls HD2070, Bandelin, Germany) и магнитной мешалки (MR Hei-Mix S, Heidolph, Germany) при скорости перемешивания 750 об./мин. Полученную эмульсию разбавляли в 250 мл охлажденного льдом 1 масс. % водного раствора поливинилового спирта (молекулярная масса 70 000). Дихлорметан удаляли испарением с использованием роторного испарителя (Hei-VAP Precision ML/G3B, Heidolph, Germany) при остаточном давлении 100 мБар в течение 2-3 часов. Образовавшиеся частицы выделяли центрифугированием при 10 000 g и промывали водой.
Пример 10. Связывание белка β2M-sfGFP с частицами
На первом этапе производили активацию частиц. Генерировали карбоксильные группы на поверхности частиц за счет их обработки 0,1 М раствором NaOH: навеску частиц помещали в пластиковую центрифужную пробирку, прибавляли 0,1 М раствор NaOH, перемешивали при комнатной температуре в течение 30 минут, центрифугировали и отбирали надосадочную жидкость. После этого частицы промывали 4-5 раз водой (центрифугируя раствор и отбирая надосадочную жидкость). Следующим этапом связывания являлась активация карбоксильных групп на поверхности частиц с помощью N-гидроксибензотриазола (НОВТ) и гидрохлорида (N-3-диметиламинопропил)-N-этилкарбодиимида (CDI). Реакцию проводили в 0,05 М буферном растворе 2-(N-морфолино)этансульфоновой кислоты (МЭС) рН 5,6. После частицы промывали 5 раз водой, центрифугируя и отбирая надосадочную жидкость. Далее осуществляли связывание на поверхности частиц флуоресцентного белка. В 0,1 М боратном буферном растворе, рН 8.4, растворяли белок, перемешивали и выдерживали раствор при комнатной температуре 15-20 мин, далее этот раствор добавили к частицам, перемешивали на качалке при комнатной температуре 2 ч. После частицы промывали 5 раз водой, центрифугируя и отбирая надосадочную жидкость.
Пример 11. Связывание вирусного белка E2-sfGFP с рецептором CD81, конъюгированным на частицах.
Были созданы микрочастицы из полимолочной кислоты (PLAMP) с иммобилизированной на поверхности большой экстраклеточной петлей CD81 человека (LELCD81). Для лучшей визуализации на конфокальном микроскопе было проведено фракционирование полученных частиц. Тщательно ресуспендированные в PBS частицы PLAMP-LELCD81 последовательно центрифугировались при 0,8 g в течение 3 минут и при 1,5 g в течение 3 минут.Осадки, содержащие крупные частицы (2-5 мкм и 0,8-2 мкм соответственно) отбирались для дальнейших экспериментов. Цель - установить, взаимодействуют ли частицы PLAMP-LELCD81 с созданной нами «зеленой» моделью вируса гепатита С (см. выше раздел «Получение белка слияния оболочечного белка Е2 core вируса гепатита С с зеленым флуоресцентным белком Superfolder»). Для этого мы взяли 2 белка: E2-sfGFP и контрольный белок sfGFP. Оба белка проинкубировали с частицами PLAMP-LELCD81, после чего частицы отмыли и подвергли конфокальной флуоресцентной микроскопии (рисунок 33). Оказалось, что поверхность частиц, проинкубированных с Е2-sfGFP, обладает зеленой флуоресценцией при облучении синим лазером. При этом поверхность частиц, проинкубированных с контролем - sfGFP - при тех же условиях микроскопирования флуоресценцией не обладает.Ниже приведен протокол данного опыта.
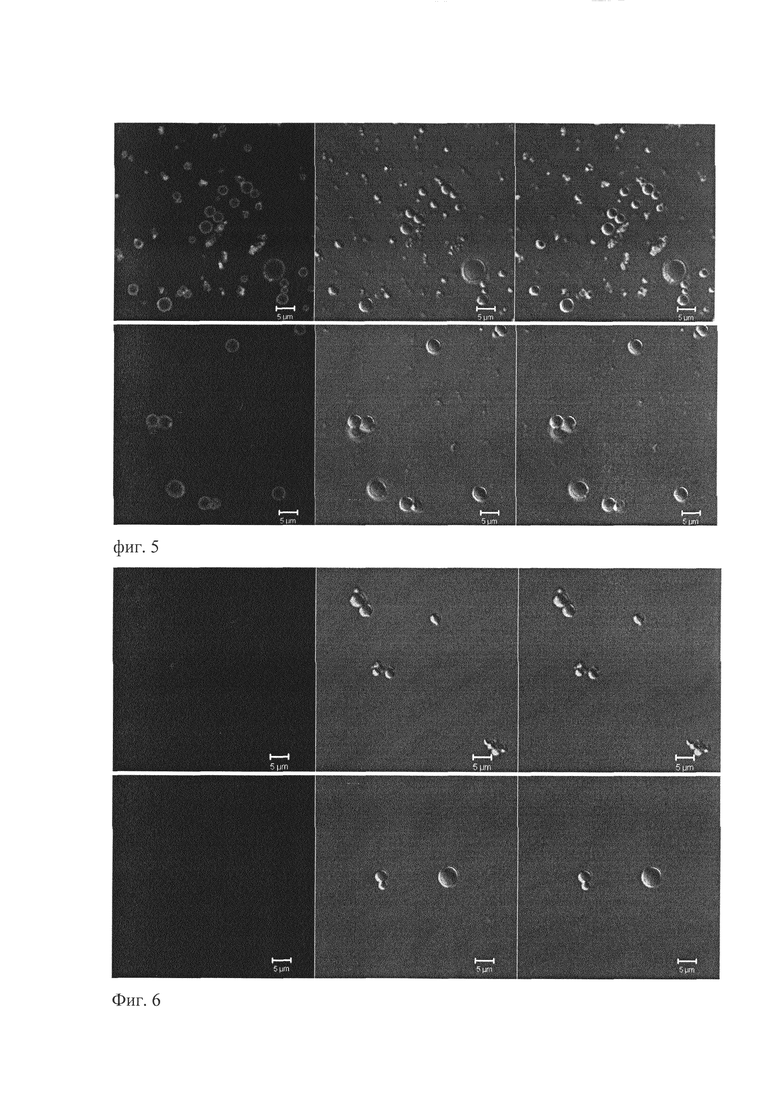
К суспензии, содержащей крупные частицы PLAMP-LELCD81 (в 500 мкл PBS), был добавлен зеленый белок E2-sfGFP до конечной концентрации 0,5 мг/мл. В контрольном эксперименте вместо E2-sfGFP было добавлено столько же молей sfGFP. Полученные смеси инкубировались 1 час при комнатной температуре при постоянном перемешивании. После этого PLAMP были осаждены центрифугированием при 12000 g в течение 15 минут и затем отмыты (тщательно ресуспендированы в 500 мкл PBS и снова инкубированы 15 минут при комнатной температуре при постоянном перемешивании). После повторного осаждения PLAMP (12000 g в течение 15 минут) супернатант был слит, а осадок ресуспендирован в 50 мкл PBS. Полученная суспензия была проанализирована при помощи SDS-электрофореза и лазерной сканирующей конфокальной микроскопии (фиг. 5, 6). В результате PLAMP-LELCD81, проинкубированные с E2-sfGFP, обладают яркой зеленой флуоресценцией при облучении лазером с длиной волны 488 нм (фиг. 5). При этом контрольные PLAMP-LELCD81, проинкубированные с sfGFP, зеленой флуоресценцией не обладают (фиг. 6). Фотографии сделаны одновременно при одинаковых настройках микроскопа.
На фиг. 5 приведены 2 поля зрения микрочастиц на основе ПМК с иммобилизированной на поверхности большой экстраклеточной петлей CD81 человека (PLAMP-LELCD81) после инкубации с E2-sfGFP. На фиг. 6 приведены 2 поля зрения микрочастиц на основе ПМК с иммобилизированной на поверхности большой экстраклеточной петлей CD81 человека (PLAMP -LELCD81) после инкубации с sfGFP. Слева: флуоресценция sfGFP при возбуждении лазером с длиной волны 488 нм; по центру: дифференциально-интерференционный контраст (DIC); справа: совмещенное изображение. Конфокальные изображения получали с использованием инвертированного конфокального лазерного сканирующего микроскопа «LSM 510 Meta» (Zeiss, Германия), с иммерсионным объективом C-Apochromat 40×/1.2 W Korr UV-VIS-IR М27. Флуоресценцию sfGFP детектировали с использованием оптического фильтра 505 нм при возбуждении флуоресценции лазером с длинной волны 488 нм. В проходящем свете изображения получали при помощи метода дифференциально-интерференционного контраста. Обработку изображений осуществляли при помощи прилагаемого к микроскопу программного обеспечения «LSM 510».
Таким образом показано, что полученный нами впервые из бактерий рекомбинантный зеленый флуоресцентный белок слияния E2-sfGFP связывается с CD81 человека, иммобилизированном на PLAMP. Кроме того, важным выводом из данного эксперимента является тот факт, что иммобилизированная на PLAMP большая экстраклеточная петля CD81 человека легко связывает Е2 вируса гепатита С. Такие частицы потенциально могут служить ловушками вируса гепатита С у людей.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ


Изобретение относится к генной инженерии, конкретно к получению ловушек вируса гепатита С в виде рекомбинантных химерных белков, и может быть использовано в медицинской диагностике для обнаружения вируса гепатита С в биологических жидкостях. Разработан рекомбинантный химерный белок CD81-SAA, обладающий способностью связывать вирионы вируса гепатита С, который содержит аминокислотную последовательность большой экстраклеточной петли человеческого рецептора CD81, слитую с аминокислотной последовательностью стрептавидина. Причем для обеспечения возможности выделения белка на никель-агарозном сорбенте в структуру белка также была включена олигогистидиновая последовательность. Также предложены микрочастицы, состоящие из полимера молочной кислоты, к поверхности которых ковалентно присоединен созданный рекомбинантный белок. Предварительное биотинилирование полимерных микрочастиц позволило достичь более эффективного образования конгломератов за счет высокого сродства биотина к стрептавидину, входящему в состав рекомбинантного белка. Изобретение обеспечивает получение белка, способного связывать вирионы вируса гепатита С за счет специфического взаимодействия CD81 с белком Е2 вирусного капсида. 2 н. и 1 з.п. ф-лы, 6 ил., 11 пр.
1. Рекомбинантный химерный белок, обладающий способностью связывать вирионы вируса гепатита С за счет взаимодействия CD81 с белком Е2 капсида вируса гепатита С, характеризующийся последовательностью SEQ ID No: 2.
2. Микрочастица из полимера молочной кислоты с рекомбинантным химерным белком по п. 1, ковалентно присоединенным к ее поверхности, используемая в качестве специфической для вируса гепатита С ловушки.
3. Микрочастица полимера молочной кислоты п. 2, отличающаяся тем, что полимер молочной кислоты предварительно подвергают биотинилированию.
| US 20120066779 A1, 15.03.2012, RU 2577138 C1, 10.03.2016, RU 2153535 C1, 27.07.2000, RU 2018143867 A, 11.06.2020. |
Авторы
Даты
2022-08-16—Публикация
2020-12-25—Подача