Настоящее изобретение относится к области фармацевтики, а именно к средству для лечения инфекционных заболеваний и способу лечения инфекционных заболеваний.
Инфекционные заболевания - группа заболеваний, вызываемых проникновением в организм патогенных (болезнетворных) микроорганизмов, вирусов и прионов. Бактериальная инфекция - это инфекция, вызванная бактериями. Это широкий спектр заболеваний от банальной кожной инфекции до таких тяжелых болезней, как чума. Помимо бактерий, инфекции могут вызываться вирусами. Бактериальные инфекции могут стать следствием прогрессирующей вирусной инфекции, либо инфекция может развиваться независимо. Часто вирусная инфекция осложняется бактериальной. Это происходит тогда, когда вирусная инфекция принимает более тяжелые формы.
Инфекции можно разделить на простые - вызванные одним возбудителем, и смешанные - вызванные двумя и более возбудителями. От смешанных инфекций следует отличать вторичные инфекции (суперинфекции), возникающие на фоне уже имеющегося заболевания. Реинфекция - это повторное заражение после полного выздоровления тем же видом возбудителя; возникает при отсутствии иммунитета.
Острая респираторная вирусная инфекция (ОРВИ) - самая распространенная в мире группа заболеваний, объединяющая грипп, парагрипп, респираторно-синцитиальную инфекцию, риновирусную и аденовирусную инфекции и другие катаральные воспаления верхних дыхательных путей. Распространение вирусов происходит чаще всего путем самоинокуляции на слизистую оболочку носа или конъюнктиву с рук, загрязненных при контакте с больным или с зараженными вирусом поверхностями. Другой путь - воздушно-капельный - при вдыхании частичек аэрозоля, содержащего вирус, или при попадании более крупных капель на слизистые оболочки при тесном контакте с больным. При отсутствии должного лечения или при неэффективной терапии могут развиться серьезные осложнения, такие как отит, синусит, ангина, ДВС-синдром и другие.
Анализ данных официальной статистики Всемирной организации здравоохранения (ВОЗ) показал, что к началу XXI в. смертность от инфекционных болезней составляла четвертую часть всех смертей в мире, а в развивающихся странах - практически половину. Можно констатировать, что инфекционные болезни по-прежнему занимают значительное место среди причин смертности населения во всем мире. Разработка новых способов лечения данного типа заболеваний - одна из передовых задач в области медицины и фармацевтики.
Из уровня техники известны препараты для лечения инфекционных заболеваний в частности лекарственные препараты для лечения бактериальных инфекций, например, «Амоксициллин», «Гентамицин», «Тетрациклин», «Левомецитин» и другие
[https://www.rlsnet.ru/tn_index_id_222.htm //
https://www.rlsnet.ru/tn_index_id_876.htm //
https://www.rlsnet.ru/mnn_index_id_82.htm //
https://www.rlsnet.ru/tn_index_id_4699.htm]. Препараты класса антибиотиков обладают двумя основными проблемами: увеличивающееся число микроорганизмов, резистентных к антибиотикам и широкий спектр противопоказаний и побочных эффектов при применении антибиотиков [Белозерцева В.Н. и др. Антибиотики - резистентность и токсичность. Новые Санкт-Петербургские врачебные ведомости, г. 2017. - N 2. - С. 59-61].
Также из уровня техники известны препараты для лечения инфекционных заболеваний, в частности противовирусные препараты, например «Арбидол», «Амиксин» и другие
[https://www.rlsnet.ru/tn_index_id_4196.htm,
https://www.rlsnet.ru/tn_index_id_1526.htm]. Препараты указанного класса также имеют побочные эффекты и малоэффективны для лечения некоторых вирусных заболеваний [Leneva I.A. et al. Characteristics of arbidol-resistant mutants of influenza virus: implications for the mechanism of anti-influenza action of arbidol. Antiviral Res 2009 81(2):132-40].
Из уровня техники известно лекарственное средство, содержащее активированную форму сверхмалых доз моноклональных, поликлональных иммунных или естественных антител к антигену главного комплекса гистосовместимости (система HLA) или к комплексу антигена системы HLA и ассоциированного с ним пептида [патент RU 2205025 C1, 26.12.2001]. Полученное в соответствии с изобретением иммунотропное лекарственное средство представляет собой новый фармакологический препарат, который характеризуется наличием иммунотропной активности, отсутствием побочных эффектов, экологической чистотой и низкой себестоимостью. Однако не известно об эффективности данного препарата для лечения бактериальных и/или вирусных инфекций.
Из уровня техники известно комплексное лекарственное средство для лечения вирусных заболеваний, характеризующееся тем, что содержит в качестве действующих компонентов активированную-потенцированную форму антител к гамма-интерферону человека и активированную-потенцированную форму антител к CD4 рецептору [патент RU 2521392, 06.08.2010]. Однако не известно об эффективности данного препарата для лечения бактериальных или смешанных инфекций.
Аналогом заявленного средства является лекарственный препарат «Эргоферон» [https://www.rlsnet.ru/tn_index_id_46844.htm]. Спектр фармакологической активности «Эргоферона» включает в себя противовирусную, иммуномодулирующую активность, а также препарат применяется в комплексной терапии бактериальных инфекций. Препарат «Эргоферон» содержит активированную - потенцированную форму антител к гамма-интерферону человека (IFN-γ), активированную - потенцированную форму антител к CD4 рецептору Т-лимфоцитов (CD4) и активированную - потенцированную форму антител к гистамину (Г).
Настоящее изобретение направлено на создание нового эффективного комплексного средства, обладающего высокой противовирусной, антибактериальной, иммуномодулирующей активностью, при этом не оказывающего токсического или мутагенного действия на организм пациента.
Решение поставленной задачи обеспечивается тем, что заявленное лекарственное средство для лечения инфекционных заболеваний, обладает антибактериальной и противовирусной активностью, представляет собой продукт технологической обработки методом последовательных множественных разведений исходных субстанций а) антител к β1 - домену молекулы главного комплекса гистосовместимости класса 2 (HLA-DRB1), б) антител к β2-микроглобулину (β2-МГ), в) антител к интерферону-гамма (IFN-γ), г) антител к CD4.
Лекарственное средство по настоящему изобретению может быть использовано для лечения вирусных инфекций. При этом указанная вирусная инфекция вызвана, например: вирусами, содержащими двуцепочечную ДНК (например, Herpesvirales, Adenoviridae, Papillomavirida, Polyomaviridae.); вирусами, содержащими одноцепочечную ДНК (например, Circoviridae, Parvoviridae); вирусами, в которых РНК способна к репликации (например, Reoviridae, Birnaviridae); вирусами, содержащими одноцепочечную (+)РНК (например, Nidovirales, Picornavirales, Tymovirales, Astroviridae, Caliciviridae, Flaviviridae, Togaviridae, Virgaviridae); вирусами, содержащими одноцепочечную (-)PHK (например, Bunyavirales, Mononegavirales, Arenaviridae, Ophioviridae, Orthomyxoviridae, Deltavirus); вирусами, содержащими одноцепочечную (+)PHK, реплицирующиеся через стадию ДНК (например, Retroviridae); вирусами, содержащими двуцепочечную ДНК, реплицирующие через стадию одноцепочечной РНК (например. Caulimoviridae, Hepadnaviridae) [https://ru.wikipedia.org/wiki/Классификация_вирусов_по_Балтимору].
Заявленное лекарственное средство обладает широким спектром антибактериального действия. При этом указанная бактериальная инфекция вызвана бактериями, выбранными из группы, например: спирохеты (например, Treponema, Borrelia, Leptospira); аэробные и микроаэрофильные, подвижные, спиральные и изогнутые грамотрицательные бактерии (например, Campylobacter, Helicobacter, Spirillum); грамотрицательные аэробные и микроаэрофильные палочки и кокки (например, Achromobacter, Bordetella, Kingella, Neisseria); факультативно-анаэробные грамотрицательные палочки (например, Cedecea, Escherihia, Klebsiella, Plesiomona, Haemophilus, Streptobacillus); грамотрицательные анаэробные прямые, изогнутые и спиральные бактерии (например, Anaerobiospirrilum, Bacteroides, Porphyromonas); анаэробные грамотрицательные кокки (например, Veillonella); риккетсии и хламидии (например, Ehrlichia, Chlamydophila); грамположительные кокки (например, Aerococcus, Staphylococcus, Streptococcus);
грамположительные палочки и кокки, образующие эндоспоры (например, Bacillus, Clostridium); не образующие спор грамположительные палочки правильной формы (например, Erysipelothrix, Listeria); не образующие спор грамположительные палочки неправильное формы (например, Bifidobacterium, Corinebacterium, Rothia); микобактерии (например, Mycobacterium); актиномицеты (например, Actinomadura, Nocardia, Streptomyces); микоплазмы (например, Mycoplasma, Ureaplasma) [И.В. Смирнов. Возбудители бактериальных инфекций человека. Клиническая микробиология и антимикробная химиотерапия, №2, Том 2, 2000, с. 4-11].
Кроме того, настоящее лекарственное средство эффективно для лечения смешенных инфекций - развивающихся в организме при одновременном воздействий двух и более разных возбудителей, как вирусных, так и бактериальных, и вторичных (суперинфекций) - развивающихся в результате заражения организма инфекцией с последующим повторным заражением через какое-то время иной инфекцией.
Технический результат настоящего изобретения заключается в расширении арсенала лекарственных средств, обладающих комплексным противовирусным и антибактериальным действием, в создании средства широкого спектра действия. Также заявленное средство обладает низкой токсичностью и мутагенностью.
Продукты технологической обработки методом последовательных множественных разведений исходных субстанций антител к HLA-DRB1, антител к β2-МГ, антител к IFN-γ и антител к CD4 представляют собой водное или водно-спиртовое разведение антител (или сочетание таких разведений), полученное путем последовательного многократного разведения (потенцирования) матричного исходного раствора антител с внешним воздействием - встряхиванием каждого разведения.
В предшествующих работах [см. RU 2205025 C1, 26.12.2001; RU 2500422 C2 06.08.2010 и др.] заявитель для описания продуктов технологической обработки методом последовательных множественных разведений исходных субстанций антител использовал термины «активированная форма антител», «активированная-потенцированная форма антител», «сверхвысокие разведения», «сверхмалые дозы антител». При этом заявитель обращает внимание на то, что термин «релиз-активная форма» и термин «активированная форма антител», «активированная-потенцированная форма антител», «сверхмалые дозы антител», «сверхвысокие разведения», «активные разведения» полностью взаимозаменяемые [Эпштейн О.И. Релиз-активность (современный взгляд на гомеопатию и негомеопатию). М.: Издательство РАМН, 2017. 48 с. // Эпштейн О.И. Сверхмалые дозы (история одного исследования). М.: Издательство РАМН, 2008. 336 с.].
При этом, под разведением антител к IFNγ, антител к CD4, антител к HLA-DRB1 и антител к β2-МГ следует понимать любые, в том числе десятичные, сотенные, тысячные разведения матричного раствора антител, начиная с С2 (т.е. с разведения матричного раствора в 100 раз), а также любые их сочетания (например, C2+D34+M45, D20+C4 и др.) и соотношения (например, 1:1:2, 2:3 и др.).
Для приготовления заявленного лекарственного средства в качестве исходной субстанции антител используют естественные, моноклональные или, преимущественно, поликлональные антитела, которые могут быть получены по известным технологиям - методикам описанным, например, в: Мягкова М.А., Морозова B.C. Иммунохимические свойства естественных антител к физиологически активным соединениям, Фундаментальные исследования №11, 2014, с. 1066-1070 и Иммунологические методы, под ред. Г. Фримеля, М., «Медицина», 1987, с. 9-33; или, например, в статье Laffly Е., Sodoyer R. Hum. Antibodies. Monoclonal and recombinant antibodies, 30 years after. - 2005 - Vol. 14. - N 1-2. P. 33-55 и обладающие специфичностью в отношении соответствующих антигенов: HLA-DRB1, β2-МГ, IFNγ и CD4.
Естественные антитела - иммуноглобулины, которые вырабатываются организмом в строго определенных количествах в полном отсутствии какой-либо внешней антигенной стимуляции, поэтому эти антитела, как правило, циркулируют в кровотоке даже здоровых людей. Естественные аутоантитела как правило полиреактивны и имеют достаточно низкую аффинность к определенному набору аутоантигенов.
Моноклональные антитела - это гетерогенные антитела к конкретному эпитопу антигена, полученные из одного клона антител-продуцирующих В-клеток [Lipman NS1, Jackson LR, Trudel LJ, Weis-Garcia F. Monoclonal versus polyclonal antibodies: distinguishing characteristics, applications, and information resources. ILAR J. 2005; 46(3):258-68. // IHC Staining Methods. Fifth edition. Preface Chapter 1. Thomas Boenisch. Antibodies. р: 1-9]. Моноклональные антитела получают, например, с помощью гибридомной технологии. Причем начальная стадия процесса включает иммунизацию, основанную на принципах, уже разработанных при приготовлении поликлональных антисывороток. Дальнейшие этапы работы предусматривают получение гибридных клеток, продуцирующих клоны одинаковых по специфичности антител. Их выделение в индивидуальном виде проводится теми же методами, что и в случае поликлональных антисывороток.
Поликлональные антитела - это совокупность иммуноглобулинов, реагирующих с различными эпитопами специфического антигена и секретируемые В-клетками различных линий организма [Lipman NS1, Jackson LR, Trudel LJ, Weis-Garcia F. Monoclonal versus polyclonal antibodies: distinguishing characteristics, applications, and information resources. ILAR J. 2005; 46(3):258-68. // IHC Staining Methods. Fifth edition. Preface Chapter 1. Thomas Boenisch. Antibodies. р: 1-9]. Поликлональные антитела могут быть получены активной иммунизацией животных. Для этого по специально разработанной схеме животным делают серию инъекций требуемым в соответствии с изобретением веществом - антигеном. В результате проведения такой процедуры получают моноспецифические антисыворотки с высоким содержанием антител, которые используют в технологической обработки методом последовательных множественных разведений для получения конечного продукта. При необходимости проводят очистку антител, присутствующих в антисыворотке, например, методом аффинной хроматографии, путем применения фракционирования солевым осаждением или ионообменной хроматографии.
Согласно вышесказанному, под термином «антитела» понимают иммуноглобулины любого происхождения (естественные, поликлональные или моноклональные антитела), которые специфически связываются с молекулой-мишенью (антигеном). При этом, способность антител распознавать определенный тип эпитопов молекулы антигена и взаимодействовать с ним - специфичность - ключевое свойство антител, определяющее весь спектр эффектов того или иного антитела [Boyd WC. Fundamentals of immunology. Fundam. Immunol. 1946; Langman RE. The specificity of immunological reactions. Mol. Immunol. 2000; 37: 555-561]. Специфичность не зависит от природы происхождения и способа получения последних: естественные, поликлональные или моноклональные антитела при одной и той же специфичности будут воздействовать на одну и ту же мишень [А. Ройт и др., Иммунология. Пер. с англ. - М.: Мир, 2000, с. 149-161, 527-544], а следовательно, могут применяться для получения заявленного средства.
Вариантом для приготовления заявленного лекарственного средства является использование поликлональных антител, которые в качестве матричного (первичного) раствора с концентрацией 0,5÷5,0 мг/мл, используют для технологической обработки методом последовательных множественных разведений исходных субстанций антител с получением конечного продукта.
Технологическая обработка методом последовательных множественных разведений исходных субстанций антител представляет собой равномерное уменьшение концентрации в результате последовательного разведения 1 части упомянутого матричного раствора в 9 частях (для десятичного разведения D) или в 99 частях (для сотенного разведения С) или в 999 частях (для тысячного разведения М) нейтрального растворителя в сочетании с внешним воздействием (например, в виде встряхивания) на каждое полученное разведение и использованием отдельных емкостей для каждого последующего разведения [см. В. Швабе "Гомеопатические лекарственные средства", М., 1967 г., с. 14-29].
Было установлено, что внешне простая процедура последовательного многократного уменьшения концентрации веществ является сложной технологией, продукты которой приобретают уникальные свойства. Исторически продукты технологии потенцирования называют «малыми дозами», «потенцированными препаратами», «высокими разведениями».
Конечный продукт может быть представлен в различных лекарственных формах [ОФС.1.6.2.001.18 Государственная фармакопея РФ, издание XIV] и содержать фармацевтически приемлемые добавки.
Так, например, заявленное лекарственное средство может быть выполнено в твердой лекарственной форме и содержать технологически необходимое (эффективное) количество фармацевтически приемлемой добавки, представляющей собой нейтральный носитель (например, лактоза), насыщенный смесью продуктов технологической обработки методом последовательных множественных разведений исходных субстанций антител к HLA-DRB1, β2-МГ, IFNγ и CD4, и фармацевтически приемлемые вспомогательные вещества (эксципиенты), которые включают, например, гипромеллоза, мальтитол, глицерол, сорбат калия, лиманная кислота безводная, изомальт, кремния диоксид, цикламат натрия, сахарин натрия, целлюлозу микрокристаллическую, магния стеарат и другие.
Для получения твердой оральной формы заявленного лекарственного средства в установке кипящего слоя (например, типа «Huttlin Pilotlab» производства компании Hiittlin GmbH) производят орошение до насыщения вводимых в псевдоожиженный - кипящий слой гранул нейтрального носителя - лактозы (молочного сахара), предварительно полученным водным или водно-спиртовым раствором (концентрация подбирается экспериментальным путем, ОФС.1.6.2.0010.18 Государственная Фармакопея) продуктов технологической обработки методом последовательных множественных разведений исходных субстанций антител с одновременной сушкой в потоке подаваемого под решетку нагретого воздуха при температуре не выше 40°С. Полученную таблеточную массу равномерно перемешивают и таблетируют прямым сухим прессованием (например, в таблет-прессе Korsch - XL 400) [WO 2007105981 (A1), 20.09.2007]. После таблетирования получают таблетки массой 300 мг, пропитанные водным или водно-спиртовым раствором продуктов технологической обработки методом последовательных множественных разведений исходных субстанций а) антител к HLA-DRB1, б) антител к β2-микроглобулину, в) антител к интерферону-гамма, г) антител к CD4.
Настоящее изобретение проиллюстрировано ниже представленными примерами вместе с прилагаемыми чертежами:
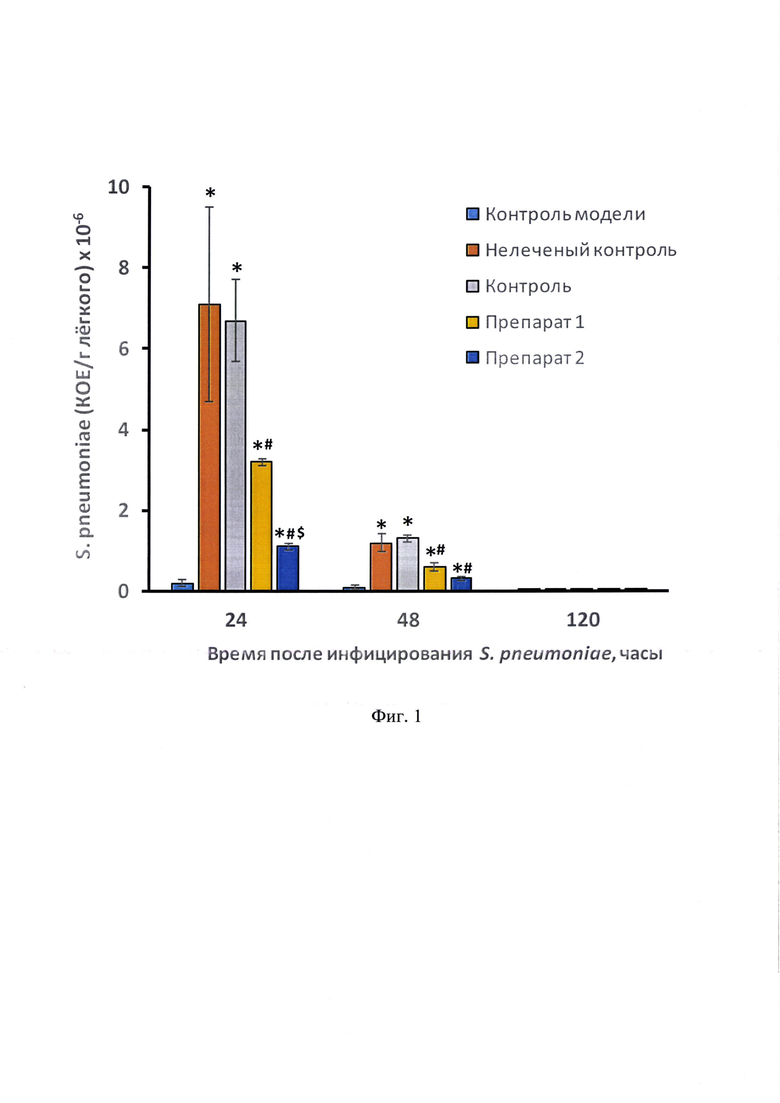
Фиг. 1. - Влияние Препаратов 1 и 2 на содержание КОЕ S. pneumoniae в легких мышей после последовательного инфицирования вирусом A/New Jersey/8/76 (H1N1) и S. pneumoniae. Примечание: * - отличие от группы «Контроль модели» статистически значимо, р<0,05; # - отличие от группы «Нелеченый контроль» и «Контроль» статистически значимо, р<0,05; $ - отличие от группы «Препарат 1» статистически значимо, р<0,05.
Пример 1
Противовирусное действие заявленного лекарственного средства на модели летальной гриппозной инфекции, вызванной штаммом вируса гриппа A/California/07/09(H1N1)pdm09 у белых мышей.
Данное исследование является слепым плацебоконтролируемым. Целью исследования является изучение противовирусной эффективности заявленного препарата в сравнении с препаратом Тамифлю™ (Осельтамивир) в его эффективной дозе на штамме вируса гриппа А/California/07/09 (H1N1) pdm09 in vivo. Препарат по настоящему изобретению содержит в соотношении 1:1:1:1 по объему, продукты технологической обработки методом последовательных множественных разведений исходных субстанций а) антител к HLA-DRB1 (в разведении С12С30С50 в соотношении 1:3:1), б) антител к β2-микроглобулину (в разведении С12С30С50 в соотношении 1:3:1), в) антител к интерферону-гамма (в разведении С12С30С50 в соотношении 1:3:1), г) антител к CD4 (в разведении С12С30С50 в соотношении 1:3:1):
А) продукт технологической обработки методом последовательных множественных разведений исходных субстанций поликлональных антител к β1 - домену молекулы главного комплекса гистосовместимости класса 2 (HLA-DRB1), получают путем объединения трех различных последовательных разведений исходного (матричного) раствора поликлональных антител к HLA-DRB1 в водном растворителе (концентрация 2,5 мг/мл). В соотношении 1:3:1 по объему смешивались следующие разведения:
1) разведение исходного (матричного) раствора в 10012 раз, что эквивалентно сотенному разведению С12 в сочетании с внешним механическим воздействием - встряхиванием каждого разведения,
2) разведение исходного (матричного) раствора в 10030 раз, что эквивалентно сотенному разведению С30 в сочетании с внешним механическим воздействием - встряхиванием каждого разведения,
3) разведение исходного (матричного) раствора в 10050 раз, что эквивалентно сотенному разведению С50 в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Б) продукт технологической обработки методом последовательных множественных разведений исходных субстанций поликлональных антител к β2-микроглобулину (β2-МГ), получают путем объединения трех различных последовательных разведений исходного (матричного) раствора поликлональных антител к β2-МГ в водном растворителе (концентрация 1,0 мг/мл). В соотношении 1:3:1 по объему смешивались следующие разведения:
1) разведение исходного (матричного) раствора в 10012 раз, что эквивалентно сотенному разведению С12 в сочетании с внешним механическим воздействием - встряхиванием каждого разведения,
2) разведение исходного (матричного) раствора в 10030 раз, что эквивалентно сотенному разведению С30 в сочетании с внешним механическим воздействием - встряхиванием каждого разведения,
3) разведение исходного (матричного) раствора в 10050 раз, что эквивалентно сотенному разведению С50 в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
В) продукт технологической обработки методом последовательных множественных разведений исходных субстанций поликлональных антител к гамма интерферону (IFN-γ), получают путем объединения трех различных последовательных разведений исходного (матричного) раствора поликлональных антител к IFN-γ в водном растворителе (концентрация 2,5 мг/мл). В соотношении 1:3:1 по объему смешивались следующие разведения:
1) разведение исходного (матричного) раствора в 10012 раз, что эквивалентно сотенному разведению С12 в сочетании с внешним механическим воздействием - встряхиванием каждого разведения,
2) разведение исходного (матричного) раствора в 10030 раз, что эквивалентно сотенному разведению С30 в сочетании с внешним механическим воздействием - встряхиванием каждого разведения,
3) разведение исходного (матричного) раствора в 10050 раз, что эквивалентно сотенному разведению С50 в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Г) продукт технологической обработки методом последовательных множественных разведений исходных субстанций поликлональных антител к CD4, получают путем объединения трех различных последовательных разведений исходного (матричного) раствора поликлональных антител к CD4 в водном растворителе (концентрация 1,0 мг/мл). В соотношении 1:3:1 по объему смешивались следующие разведения:
1) разведение исходного (матричного) раствора в 10012 раз, что эквивалентно сотенному разведению С12 в сочетании с внешним механическим воздействием - встряхиванием каждого разведения,
2) разведение исходного (матричного) раствора в 10030 раз, что эквивалентно сотенному разведению С30 в сочетании с внешним механическим воздействием - встряхиванием каждого разведения,
3) разведение исходного (матричного) раствора в 10050 раз, что эквивалентно сотенному разведению С50 в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Экспериментальные группы:
Группа 1 - группа животных, которым вводили плацебо в течение всего эксперимента (n=30) (отрицательный контроль («вирусный контроль»)).
Группа 2 - группа мышей, которым вводился препарат сравнения Тамифлю™ (Осельтамивир) в течение 5 дней после заражения, а в остальное время вводилось открытое плацебо (n=30) (положительный контроль-препарат сравнения).
Группа 3 - мыши, получавшие заявленный препарат в течение всего эксперимента (n=30).
Группа 4 - мыши, получавшие активированную-потенцированную форму антител к интерферону-гамма в течение всего эксперимента (n=30).
Группа 5 - мыши, получавшие активированную-потенцированную форму антител к CD4 в течение всего эксперимента (n=30).
Группа 6 - мыши, получавшие активированную-потенцированную форму антител к HLA-DRB1 в течение всего эксперимента (n=30).
Группа 7 - мыши, получавшие активированную-потенцированную форму антител к β2-микроглобулину в течение всего эксперимента (n=30).
Дизайн исследования:
Животные получали заявленный препарат перорально ежесуточно в объеме 0,4 мл/мышь 2 раза в день, утром и вечером в 10.00 и 17.00 (0,8 мл/мышь/сут.) курсом в течение 5 дней до заражения, в день инфицирования за 4 часа до и после заражения и 14 дней после заражения вирусом, до окончания эксперимента (общий курс введения тестируемых образцов - 20 дней) [«Руководства по проведению доклинических исследований лекарственных средств» под ред. Миронова А.Н. (Москва, 2012)].
Вирус вводили животным интраназально в объеме 0,05 мл/мышь (2.5×103 TCID50, 5 LD50) [Не В, Fu Y, Xia S, et al. Intranasal application of polyethyleneimine suppresses influenza virus infection in mice. Emerging Microbes & Infections. 2016; 5(4):e41 - .doi: 10.1038/emi.2016.64].
Препарат сравнения Тамифлю™ (Осельтамивир) вводили перорально с помощью желудочного зонда в дозе 15 мг/кг в объеме 0,4 мл/мышь 2 раза в день в 10.00 и 17.00 (30 мг/мышь/сут.) в течение 5 суток после заражения вирусом (начиная введение за 1 час до инфицирования) [Озельтамивир при свином гриппе // Journal of Antimicrobial Chemotherapy, 2005, 55, р. 5-21]. В течение 5 суток до и, начиная с 6 суток по 14 сутки после заражения (до окончания наблюдения за животными), мышам этой группы вводили дистиллированную воду в объеме 0,4 мл/мышь, дважды в сутки (0,8 мл/мышь/сут). Группе отрицательного контроля также вводили плацебо в дозе 0,4 мл/мышь, дважды в сутки (0,8 мл/мышь/сут) в течение всего периода наблюдения.
У всех мышей изучали зоотехнические показатели (живую массу, сохранность, среднюю продолжительность жизни животных (СПЖ), индекс защиты), проводили вирусологические исследования.
Результаты исследования:
Первичные данные об активности заявленного препарата с указанием смертности, средней продолжительности жизни (СПЖ) животных и индекс защиты приведены таблице 1. Наблюдение животными осуществляли в течение 14 дней после инфицирования. Ежедневно фиксировали смертность животных в контрольных и опытных группах. На основании полученных данных в каждой группе рассчитывали:
• процент смертности - отношение числа павших за 14 дней животных к общему числу зараженных животных в группе: М (% смертности)=М/Nt;
• индекс защиты - отношение разницы процентов смертности в контрольной и опытной группах к проценту смертности в контрольной группе: IP=((Мс - Me) / Мс) × 100%;
• среднюю продолжительность жизни животных из расчета 14 дней наблюдения: MDD=(∑ N × D) / Nt;
где М - число павших за 14 дней животных в группе; Мс и Me - смертность в процентах в контрольной («контроль вируса») и опытной группах, соответственно; N - количество животных, проживших D дней; Nt - общее число животных в группе.

Как следует из приведенных данных инфицирование мышей вирусом гриппа A/California/097/09 (H1N1)pdm09 приводило к развитию патологического процесса и гибели 75% животных в среднем через 8,5 суток после инфицирования. Применение заявленного препарата снижало показатель гибели до 25% (индекс защиты 64,2%). Показатель СПЖ составил в этой группе 8,9 суток.
При анализе изменения массы животных учитывались данные только тех особей, на которых проводился анализ смертности в течение 14 дней после инфицирования.
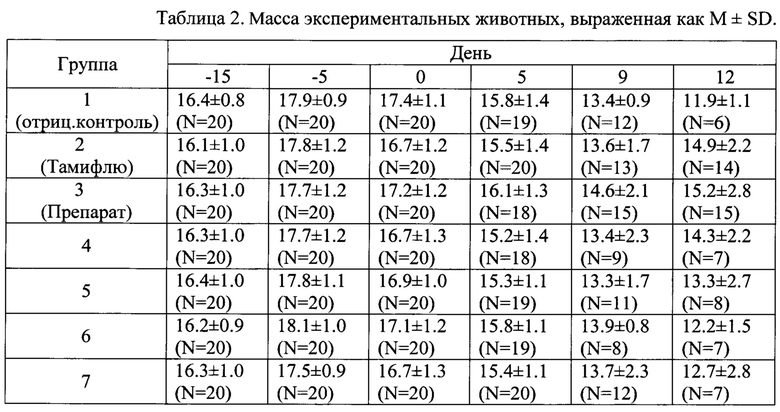
В ткани легких на 5 сутки после инфицирования животных (n=10) определялся титр вируса. Усредненные значения инфекционной активности вируса гриппа в легких животных для каждой группы приведены в таблице 3.
В соответствии с Руководством по проведению доклинических исследований лекарственных средств [Руководство по проведению доклинических исследований лекарственных средств / Под ред. А.Н. Миронова. - М.: ЗАО «Гриф и К». - 2012. - Часть первая. - 944 с.], снижение титра вируса на 1,75 lg и более в группе леченых животных свидетельствует об угнетении его репродукции. Заявленный препарат в данном исследовании снижал титр вируса на 2,4 lgTCID50. Вывод:
Наибольшую активность в отношении снижения смертности проявило заявленное лекарственное средство (ИЗ=64,2), при этом эффективность средства выше эффективности, проявляемой его отдельными компонентами. Кроме того, препарат по настоящему изобретению проявлял выраженное противовирусное действие, снижал титр вируса на 2,4 lgTCID50.
Пример 2
Изучение противомикробной активности препаратов 1 и 2 после последовательного in vivo заражения животных вирусом гриппа A/New Jersey/8/76 (H1N1) и Streptococcus pneumoniae (S. pneumoniae).
Целью исследования является сравнительная оценка противомикробного действия препаратов 1 и 2 по отношению к пневмококковой инфекции, вызванной S. pneumoniae, через 7 дней после заражения животных вирусом гриппа A/New Jersey/8/76 (H1N1).
Препарат 1
- смесь трех активных водно-спиртовых разведений 10012, 10030, 10050 антител к γ-интерферону человека, антител к гистамину и антител к CD4 (препарат «Эргоферон»). Препарат 2 по настоящему изобретению содержит в соотношении 1:1:1:1 по объему, продукты технологической обработки методом последовательных множественных разведений исходных субстанций а) антител к HLA-DRB1 (в разведении С12С30С50 в соотношении 1:1:1), б) антител к β2-микроглобулину (в разведении С12С30С50 в соотношении 1:1:1)., в) антител к интерферону-гамма (в разведении С12С30С50 в соотношении 1:1:1), г) антител к CD4 (в разведении С12С30С50 в соотношении 1:1:1).
Экспериментальные группы:
Группа 1 - мыши-самки, получали Препарат 1 каждый день внутрижелудочно в суммарной дозе 20 мл/кг/сут (2 раза в сутки примерно по 0,2 мл/мышь с интервалом 2 ч) в течение 5 дней до инфицирования вирусом и в день инфицирования за 2 ч. до заражения (n=15).
Группа 2 - мыши-самки, получали заявленный Препарат 2 каждый день внутрижелудочно в суммарной дозе 20 мл/кг/сут (2 раза в сутки примерно по 0,2 мл/мышь с интервалом 2 ч) в течение 5 дней до инфицирования вирусом и в день инфицирования за 2 ч. до заражения (n=15).
Группа 3 - контроль, мыши-самки, получали очищенную воду каждый день внутрижелудочно в суммарной дозе 20 мл/кг/сут (2 раза в сутки примерно по 0,2 мл/мышь с интервалом 2 ч) в течение 5 дней до инфицирования и в день инфицирования за 2 ч. до инфекции вирусом (n=15).
Группа 4 - нелеченый контроль, мыши-самки, которые были заражены вирусом A/New Jersey/8/76 (H1N1) и спустя 7 дней - S. pneumoniae. Такой контроль позволяет выделить эффект плацебо группы 2 (n=15).
Группа 5 - контроль модели, мыши-самки, которые были заражены только S. pneumoniae. Такой контроль позволяет выделить эффект предварительного вирусного заражения на итоговое количество КОЕ (n=15).
Дизайн исследования:
Животных интраназально инфицировали вирусом A/New Jersey/8/76 (H1N1) в дозе 1×106 ЦПД50/мышь и на 7 день после инфицирования вирусом интратрахеально заражали 1×106 КОЕ S. pneumoniae. Через 24, 48 и 120 часов после введения S. pneumoniae по 5 мышей из каждой группы умерщвляли, выделяли легкие и оценивали их бактериальную обсемененность. Для этого легкие гомогенизировали в стерильном фосфатном буфере и готовили серийные разведения, и делали посев на плотную питательную среду в чашки Петри с дальнейшим подсчетом выросших колоний. Полученные результаты выражали в КОЕ/г легких.
Резулътаты исследования:
В ходе исследования изучали противомикробное действие препаратов 1 и 2 по отношению пневмококковой инфекции, вызванной S. pneumoniae, через 7 дней после заражения животных вирусом гриппа A/New Jersey/8/76 (H1N1). А также сравнивали эффективность препаратов 1 и 2 в отношении смоделированной патологии.
Через 24 часа после инфицирования мышей S. pneumoniae самое значительное количество КОЕ S. pneumoniae наблюдалось в группах нелеченого контроля (мыши, последовательно зараженные вирусом гриппа A/New Jersey/8/76 (H1N1) и S. pneumoniae, без лечения) и контроля (мыши, последовательно зараженные вирусом гриппа A/New Jersey/8/76 (H1N1) и S. pneumoniae, леченные очищенной водой) (фиг. 1). К этому сроку препарат 1 и препарат 2 статистически значимо уменьшили бактериальную обсемененность легких инфицированных вирусом и бактериями мышей в 2 и 6 раз по сравнению с контролем (группа 3), соответственно. При этом по выраженности эффекта препарат 2 был в 3 раза активнее Препарата 1.
Через 48 часов после инфицирования мышей S. pneumoniae самое значительное количество КОЕ S. pneumoniae все еще наблюдалось в группах нелеченого контроля и контроля. Однако в абсолютных значениях количество КОЕ в этих группах уменьшилось более чем в 5 раз. Выраженность противомикробного эффекта Препарата 1 к этому сроку, по-прежнему, в 2 раза превосходила контрольные значения (группы 3 и 4), тогда как в легких мышей, получавших Препарат 2 (группа 2), бактериальная обсемененность составила 24.4% от контроля (группа 3) и 26.7% от нелеченого контроля (группа 4). Статистически значимые отличия между значениями групп Препарат 1 и Препарат 2 отсутствовали.
Через 120 часов после инфицирования мышей S. pneumoniae во всех группах наблюдались только единичные случаи появления КОЕ S. pneumoniae.
Вывод:
В результате исследования противомикробной активности Препаратов 1 и 2 было показано, что каждый из указанных препаратов обладает выраженным антибактериальным действием. Сравнительный анализ специфической активности Препаратов 1 и 2 показал более выраженный эффект заявленного по настоящему изобретению лекарственного средства (Препарата 2) по отношению к Препарату 1.
Пример 3
Токсичность.
Токсикологические исследования были проведены в соответствии с принципами надлежащей лабораторной практики (ГОСТ 33044-2014) и «Руководством по проведению доклинических исследований лекарственных средств» [Миронов АН, Бунатян НД. Руководство по проведению доклинических исследований лекарственных средств. М Гриф и К. 2012; 944 с.].
В связи с тем, что привычные параллели фармакокинетики и фармакодинамики (связь доза - концентрация - эффект), принятые для большинства лекарственных средств, к заявленному лекарственному препарату не применимы (существующие физико-химические и иммунологические методы не позволяют регистрировать концентрации препарата в биологических средах организма) при подборе доз для токсикологических исследований ориентировались на физиологически приемлемые объемы носителя (в экспериментальных исследованиях - очищенной воды), в которых вносится лекарственный препарат.
Токсичность при остром введении:
Исследование выполнено на нелинейных половозрелых белых мышах обоего пола (масса 22-26 г, возраст 2,5 мес) и половозрелых крысах линии Вистар обоего пола (масса 225-250 г, возраст 4 мес) при внутрижелудочном введении. Исследуемый препарат (n=18) или очищенную воду (контроль, n=18) вводили дважды с интервалом в 2 часа в максимально допустимых объемах: внутрижелудочно - 25 мл/кг мышам и 20 мл/кг крысам. Интактная группа не получала никаких веществ (n=18). После введения веществ наблюдение за животными вели в течение 2 недель.
Полученные данные анализировали с помощью многофакторного дисперсионного анализа (two-way ANOVA) с последующим сравнением всех групп друг с другом пост-хок критерием Тьюки. Различия считали статистически значимыми при р<0,05.
Введение заявленного лекарственного средства, содержащего продукты технологической обработки методом последовательных множественных разведений исходных субстанций а) антител к HLA-DRB1 (в разведении С12С30С50 в соотношении 1:3:1), б) антител к β2-МГ (в разведении С12С30С50 в соотношении 1:3:1), в) антител к IFN-γ (в разведении С12С30С50 в соотношении 1:3:1), г) антител к CD4 (в разведении С12С30С50 в соотношении 1:3:1) внутрижелудочно в максимально допустимых объемах половозрелым мышам и крысам не меняло общего состояния животных (отсутствовали признаки беспокойства, изменения аппетита, выделений, состояния слизистых, шерсти, кожи и др.) и не влияло на прирост общей массы крыс и мышей (как самок, так и самцов).
Отсутствие летальности у животных, получавших препарат, не позволило определить показатель ЛД50. Условно за ЛД50 приняли дозу, превышающую максимальный введенный животным объем препарата.
Учитывая, что двукратное внутрижелудочное введение заявленного препарата в максимально допустимых объемах не оказало токсического действия на организм животных, можно сделать вывод о его безвредности и основание отнести к классу малотоксичных или к 5 категории по классификации GHS.
Токсичность при введении повторных доз:
Исследование проведено на 200 половозрелых белых конвенциональных крысах обоего пола (масса 180-242 г, возраст 3,5-4 мес.) и 24 половозрелых кроликах породы «Шиншилла» обоего пола (масса 1,9 кг, возраст 2,5-3 мес.). Поскольку не удалось определить величину ЛД50 для препарата, в исследовании хронической токсичности на крысах заявленный препарат, содержащий в соотношении по объему 1:1:1:1, продукты технологической обработки методом последовательных множественных разведений исходных субстанций а) антител к HLA-DRB1 (в разведении С12С30С50 в соотношении 1:3:1), б) антител к β2-МГ (в разведении С12С30С50 в соотношении 1:3:1), в) антител к IFN-γ (в разведении С12С30С50 в соотношении 1:3:1), г) антител к CD4 (в разведении С12С30С50 в соотношении 1:3:1) или очищенную воду вводили внутрижелудочно в максимально допустимом объеме для внутрижелудочного введения и в 1/4 максимально допустимого объема. Кролики получали препарат в объеме, приближенном к ежесуточной норме потребления воды.
Продолжительность введения составляла 6 месяцев, состояние крыс и кроликов оценивали через 3 и 6 месяцев после начала введения препарата, а также спустя месяц отмены.
Хроническое внутрижелудочное введение препарата по настоящему изобретению взрослым крысам обоего пола в дозах, превышающих более чем в 100 раз рекомендованные суточные дозы для человека, не вызывало гибели животных в течение 6 месяцев введения, значимых изменений по сравнению с контрольной группой в поведенческой активности, морфологических и функциональных показателей периферической крови - через 3 и 6 месяцев введения, а также через 1 месяц после отмены препарата
Хроническое введение препарата в указанных дозах также не сопровождалось значимыми изменениями в макро- и микроморфологическом состоянии и гистологической архитектоники внутренних органов крыс.
В исследовании на кроликах весь период исследования также не было отмечено гибели животных. Хроническое введение препарата не оказывало значимого влияния на общее состояние, поведение, массу тела животных, а также на показатели периферической крови и костномозгового кроветворения. По результатам биохимических исследований плазмы крови у кроликов существенных изменений не обнаружено. Не выявлено также изменений при обследовании мочи у кроликов, получавших препарат в течение 6-ти месяцев. При макроскопическом обзоре внутренних органов кроликов, получавших препарат в течение 6-ти месяцев, патологических изменений не выявлено. При гистологическом исследовании тканей органов также не зафиксировано патологических изменений.
Таким образом, на основании проведенных исследований можно заключить, что заявленный препарат при шестимесячном внутрижелудочном введении половозрелым крысам в дозе 10 мл/кг и кроликам в дозе 50 мл/кг (более чем в 100 раз превышающих средние суточные дозы для человека) не оказывает существенного влияния на общее состояние и поведение животных; не вызывает патологических и морфофункциональных изменений со стороны сердечно-сосудистой, пищеварительной и выделительной систем.
Изобретение относится к области фармацевтической промышленности, а именно к лекарственному средству для лечения инфекционных заболеваний. Лекарственное средство для лечения инфекционных заболеваний, вызванных бактериями, выбранными из Pseudomonas aeruginosa, Porphyromonas gingivalis, Streptococcus Pneumanie, Mycobacterium tuberculosis, Staphylococcus aureus и ОРВИ, представляющее собой смесь, включающую в эффективном количестве в виде десятичных и сотенных разведений в соотношении 1:1:1:1 а) продукт технологической обработки методом последовательных множественных разведений исходной субстанции антител к β1 - домену молекулы главного комплекса гистосовместимости класса 2 (HLA-DRB1), б) продукт технологической обработки методом последовательных множественных разведений исходной субстанции антител к 02-микроглобулину (β2-МГ), в) продукт технологической обработки методом последовательных множественных разведений исходной субстанции антител к интерферону-гамма (IFN-γ), г) продукт технологической обработки методом последовательных множественных разведений исходной субстанции антител к CD4, где продукт технологической обработки методом последовательных множественных разведений исходной субстанции антител представляет собой водный или водно-спиртовой раствор, полученный путем многократного последовательного разведения матричного исходного раствора антител в сочетании с внешним механическим воздействием - многократным встряхиванием каждого разведения, при этом в качестве матричного раствора используется концентрация антител 0,5÷5,0 мг/мл. Вышеописанное средство позволяет эффективно лечить инфекционные заболевания, вызванные бактериями, выбранными из Pseudomonas aeruginosa, Porphyromonas gingivalis, Streptococcus Pneumanie, Mycobacterium tuberculosis, Staphylococcus aureus и ОРВИ. 7 з.п. ф-лы, 3 табл., 3 пр., 1 ил.
1. Лекарственное средство для лечения инфекционных заболеваний, вызванных бактериями, выбранными из Pseudomonas aeruginosa, Porphyromonas gingivalis, Streptococcus Pneumanie, Mycobacterium tuberculosis, Staphylococcus aureus и ОРВИ, представляющее собой смесь, включающую в эффективном количестве в виде десятичных и сотенных разведений в соотношении 1:1:1:1 а) продукт технологической обработки методом последовательных множественных разведений исходной субстанции антител к β1 - домену молекулы главного комплекса гистосовместимости класса 2 (HLA-DRB1), б) продукт технологической обработки методом последовательных множественных разведений исходной субстанции антител к 02-микроглобулину (β2-МГ), в) продукт технологической обработки методом последовательных множественных разведений исходной субстанции антител к интерферону-гамма (IFN-γ), г) продукт технологической обработки методом последовательных множественных разведений исходной субстанции антител к CD4, где продукт технологической обработки методом последовательных множественных разведений исходной субстанции антител представляет собой водный или водно-спиртовой раствор, полученный путем многократного последовательного разведения матричного исходного раствора антител в сочетании с внешним механическим воздействием - многократным встряхиванием каждого разведения, при этом в качестве матричного раствора используется концентрация антител 0,5÷5,0 мг/мл.
2. Лекарственное средство по п. 1, где инфекционное заболевание представляет собой смешанную инфекцию.
3. Лекарственное средство по п. 1, где антитело представляет собой моноклональное, поликлональное или естественное антитело к HLA-DRB1.
4. Лекарственное средство по п. 1, где антитело представляет собой моноклональное, поликлональное или естественное антитело к β2-микроглобулину.
5. Лекарственное средство по п. 1, где антитело представляет собой моноклональное, поликлональное или естественное антитело к интерферону-гамма.
6. Лекарственное средство по п. 1, где антитело представляет собой моноклональное, поликлональное или естественное антитело к CD4.
7. Лекарственное средство по п. 1, дополнительно включающее фармацевтически приемлемые добавки.
8. Лекарственное средство по п. 1, выполненное в твердой лекарственной форме и содержащее эффективное количество гранул нейтрального носителя, насыщенного продуктом технологической обработки методом последовательных множественных разведений исходных субстанций антител к HLA DRB1, антител к β2-МГ, антител к IFN-γ и антител к CD4 и фармацевтически приемлемые вспомогательные вещества.
| КОМПЛЕКСНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ВИРУСНЫХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2519862C2 |
| СПОСОБ КОРРЕКЦИИ ИММУННОГО ОТВЕТА И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2001 |
|
RU2205025C1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2022-08-22—Публикация
2019-08-29—Подача