Изобретение относится к медицине и биологии, в частности к диагностике, а именно: к ДНК-анализу, и может быть использовано для выявления маркеров резистентности к фторхинолоновым антибиотикам у Mycoplasma genitalium.
- Известен способ выявления мутаций, приводящих к резистентности к фторхинолоновым антибиотикам у Mycoplasma bovis, основанный на полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) в варианте TaqMan, включающий: амплификацию целевого фрагмента и детектирование точечных мутаций с использованием пары праймеров и четырех зондов. В одном из существующих на данный момент методов выявления мутаций, основанных на ПЦР-РВ, детектирование мутаций: G250A, Т252С (согласно нумерации, для Е. coli) осуществляется с помощью праймеров к участку гена parC М. bovis и зондов, которые содержат флуорофор на 5'-конце и гаситель на 3'-конце; связывание этого зонда с ампликоном и последующее расщепление за счет 5'-экзонуклеазной активности Taq-полимеразы сопровождается нарастанием флуоресценции. Выявление нуклеотидных замен осуществляется за счет разной эффективности гибридизации зондов к матричной ДНК, в зависимости от наличия тех или иных мутаций и, как следствие, разной эффективности расщепления зондов. Выявление мутаций проводят путем анализа кривых нарастания флюоресценции на каналах FAM и HEX, сигналы на данных каналах считаются положительным, если кривая накопления флюоресценции пересекает линию порога (М. Ben Shabat, I. Mikula, I. Gerchman, and I. Lysnyansky Development and Evaluation of a Novel Single-Nucleotide-Polymorphism Real-Time PCR Assay for Rapid Detection of Fluoroquinolone-Resistant Mycoplasma bovis). Основные недостатки этого способа:
1. Существующий метод, основанный на ПЦР-РВ разработан для М. bovis (вызывает заболевания у крупного рогатого скота) и не адаптирован для выявления мутаций у М. genitalium, инфицирующих человека.
2. Позволяет выявлять мутации только в гене parC QRDR.
3. Не позволяет выявлять все возможные виды мутаций, метод детектирует наличие только строго двух: в позиции G250A и Т252С в гене parC QRDR. Наиболее близким аналогом изобретения является способ выявления мутаций, приводящих к резистентности у Mycoplasma genitalium к макролидным и фторхинолоновым антибиотикам, основанный на полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) в варианте TaqMan с использованием трех пар праймеров и трех зондов, причем зонды полностью комплементарны варианту нуклеотидной последовательности «дикого типа» (патент № RU 2725477). Он включает амплификацию фрагмента гена гиразы gyrB, участка V домена гена 23 S рРНК и участка QRDR гена parC М. genitalium с флуоресцентной детекцией накопления продуктов амплификации. Выявление нуклеотидных замен также основано на разной эффективности гибридизации зондов к матричной ДНК, в зависимости от наличия тех или иных мутаций и, как следствие, разной эффективности расщепления зондов. Поскольку зонд полностью комплементарен последовательности «дикого типа», в случае наличия мутаций в QRDR участке, расщепление зонда будет происходить с меньшей эффективностью, о чем свидетельствуют: меньший уровень максимальной флуоресценции, более пологая кривая нарастания флуоресценции, а также более поздний пороговый цикл по сравнению с геном gyrB. Для заключения о наличии или отсутствии мутаций в исследуемых участках предлагается вычислить соотношение уровня флуоресценции исследуемого участка к максимальному уровню флуоресценции во всех образцах данного сета, вычислить тангенс угла наклона линейного участка нарастания флуоресценции к оси X и сравнить log 10 концентрации исследуемого фрагмента и концентрации участка гена gyrB. Основные недостатки этого способа:
1. Позволяет выявлять мутации только в гене parC QRDR.
2. Не позволяет дифференцировать типы мутации
3. Необходимо выполнение сложных математических вычислений после проведения ПЦР.
4. Для дополнительного вычисления требуется время и специальное программное обеспечение.
Техническим результатом предлагаемого способа является выявление наличия всех возможных мутаций в генах parC, а также gyrA М. genitalium непосредственно в клиническом материале пациента для выбора адекватной антибиотикотерапии и контролем за эпидемиологическим процессом. Сущность предлагаемого способа состоит в том, что осуществляют выявление любых нуклеотидных замен в гене parC и gyrA QRDR М. genitalium с помощью ПЦР-РВ и последующего анализа кривых плавления зондов на двух каналах FAM и R6G, непосредственно в клиническом материале в мультиплексном формате (в одной пробирке). Система праймеров и зондов построена следующим образом: две пары праймеров, амплифицирующие участки генов parC и gyrA ORDR и два олигонуклеотидных зонда, содержащих флуорофоры на 3'- конце FAM и R6G для QRDR участков parC и gyrA соответственно, позволяют получить в ходе реакции амплификационный продукт, при этом о наличии в исследуемом образце олигонуклеотидных замен судят по характерным пикам плавления, которые имеют меньшую температуру плавления относительно образцов, имеющих генотип WT-дикий тип. Используемые зонды и праймеры удовлетворяют следующим требованиям:
1) 100% консервативность участков связывания во всех известных последовательностях гена parC и gyrA QRDR внутри детектируемого вида;
2) Специфичность последовательностей для детектируемого вида;
3) длина от 23 до 25 нуклеотидов;
4) большее содержание С по сравнению с G;
5) отсутствие 4 последовательно расположенных G;
6) не более двух G/С на 3’-конце
7) температура плавления зондов на 7-8°С выше температуры плавления праймеров;
Способ осуществляется следующим образом. Образцы ДНК М. genitalium выделяют из клинического материала (моча, урогенитальные мазки, образцы тканей, сперма) и используют как мишень для последующего анализа.
Этап амплификации и одновременного детектирования флуоресцентного сигнала, а также последующий анализ кривых плавления ПЦР-продуктов проводят с помощью ДНК- амплификатора, работающего в режиме реального времени. В пробирке смешивают реакционную смесь объемом 25 мкл: к воде добавляют олигонуклеотидные праймеры и зонды (синтез ЗАО «Синтол», Россия) в концентрации, указанной в таблице 1, 0,2 мМ дНТФ, 2 мМ MgCl2, 5 ед. ДНК-полимеразы SNP-detect, lx ПЦР буфер SNP detect (Evrogen, Россия) и 5 мкл образца ДНК. Используют специальную полимеразу SNP-detect с характеристиками, позволяющими с высокой точностью выявлять однонуклеотидные полиморфизмы, а также обеспечить горячий старт реакции. Амплификацию проводят с использованием прибора Rotor-Gene 6000 (Corbett Research, Австралия) согласно следующему протоколу: начальная инкубация 3 мин. при 95°С; затем 55 циклов: 20-сек. денатурации при 95°С и 15-сек. отжига-элонгации при 55°С с детекцией флуоресценции на каналах FAM и R6G; затем проводят анализ кривых плавления с начальной инкубацией 2 мин. при 40°С и последующим повышением температуры на 1°С каждые 10 сек. до 77°С с детекцией флуоресценции не только на канале FAM, но и на канале R6G.

В соответствии с описанным выше дизайном, мутации в участке QRDR М. genitalium выявляют с помощью постамплификационного анализа кривых плавления зондов: образцы, содержащие однонуклеотидные замены в области связывания зонда, характеризуются сниженной аффинностью и, соответственно, меньшей температурой плавления (Tm) зонда. В качестве целевого фрагмента для выявления мутаций выбирают специфичный участок, который характеризуется областью с высокой ГЦ (гуанин-цитозин) насыщенностью и содержанием вторичных структур («сложное» генетическое окружение), окружающее полиморфизмы. Несмотря на «сложное» генетическое окружение способ выявляет различные (известные и неизвестные) мутации в заданных позициях. После этапа плавления зондов визуально оценивают полученные пики одновременно на двух детектируемых каналах FAM и R6G, сравнивают температуры плавления полученных пиков с контрольными образцами и делают вывод о наличии мутации в исследуемом образце: если на канале FAM исследуемый образец имеет Tm=57°С±0,5°С, это свидетельствует о наличии «дикого» фенотипа-без мутации; если Тт находится в диапазоне Tm=45-49°С, это свидетельствует о наличии мутации; если на канале JOE исследуемый образец имеет Tm=63-64°С, это свидетельствует о наличии «дикого» фенотипа-без мутации; если Tm находится в диапазоне Tm=57-59°С, это свидетельствует о наличии мутации, что представлено в таблице 2.

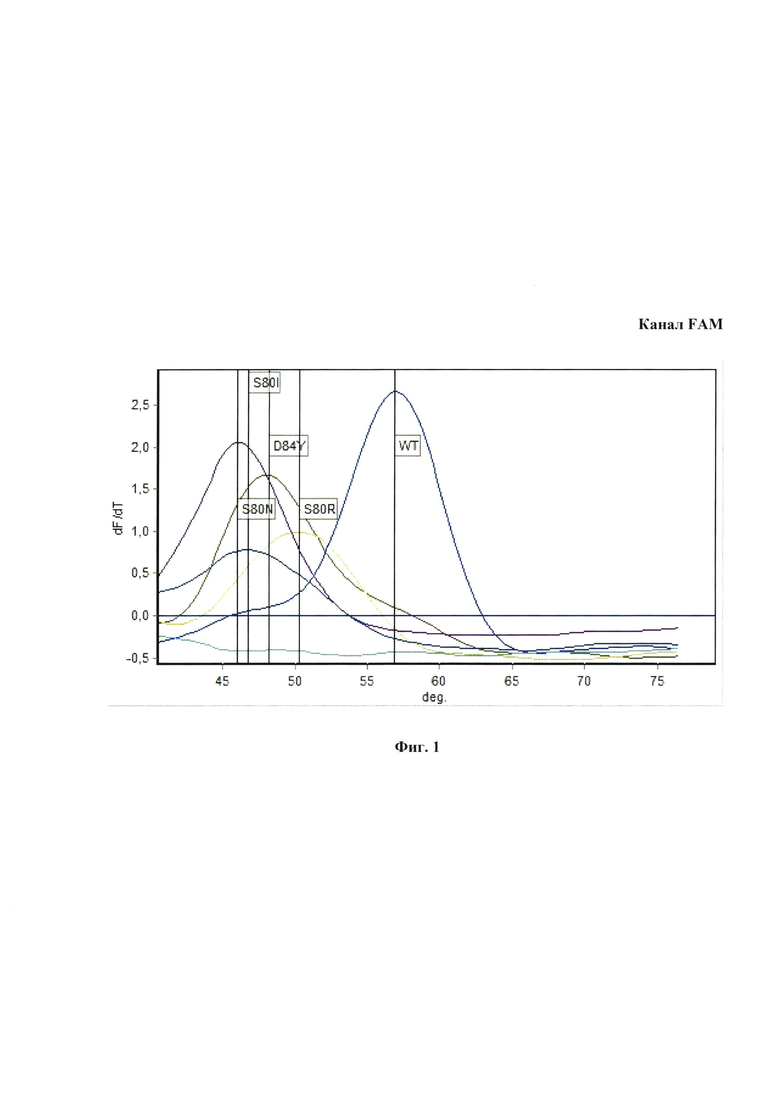
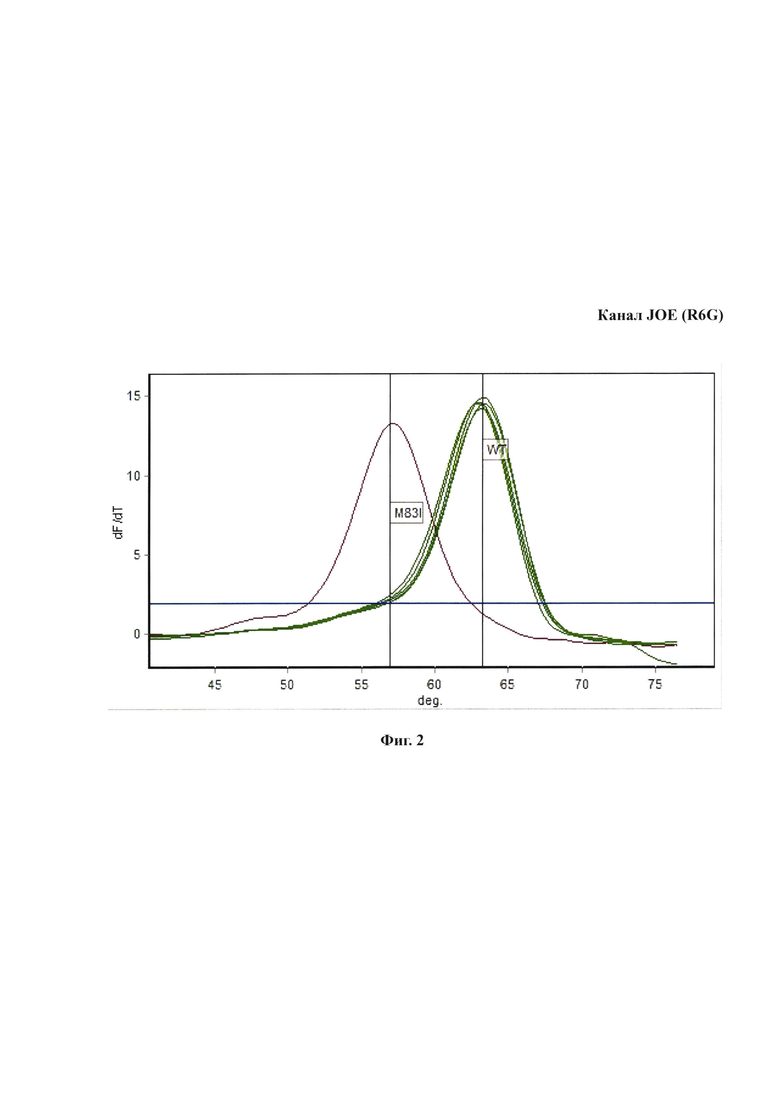
Пример одновременного выявления наиболее значимых мутаций устойчивости к фторхинолонам в гене parC QRDR с помощью оценки кривых плавления флюоресцентно-меченных зондов после проведения мультиплексной ПЦР-РВ на канале FAM представлен на Фиг. 1. Пример одновременного выявления наиболее значимых мутаций устойчивости к фторхинолонам в гене gyrA QRDR с помощью оценки кривых плавления флюоресцентно-меченных зондов после проведения мультиплексной ПЦР-РВ на канале JOE (R6G), представлен на Фиг. 2.
При использовании контрольных образцов ДНК М. genitalium с известными мутациями, тип аминокислотной замены в клинических образцах выявляют на основании сравнения температуры плавления клинического и контрольного образцов.
Контрольные образцы ДНК М. genitalium, несущие мутации D84N, D79A, D84G, D84Y, S80I, S80N и S80R (нумерация по Е. coli) демонстрируют на канале FAM пики 45-53°С и хорошо дифференцируют от образцов «дикого типа» по Tm зонда Mge_parC_Pb1. Аналогично, на канале JOE контрольные образцы ДНК, несущие мутации M83I, дают пики 57-59°С и хорошо дифференцируют от образцов «дикого типа» по температуре плавления зонда Mge_gyrA_Pb. Анализ расчетных и экспериментальных Tm показывает, что значимые мутации в позициях D84N, D79A, D84G, D84Y, S80I, S80N, S80R и M83I хорошо визуально отличают от образцов «дикого типа» по профилям кривых плавления, а также дифференцируются при скрининговом анализе, что отражено в таблице 3.
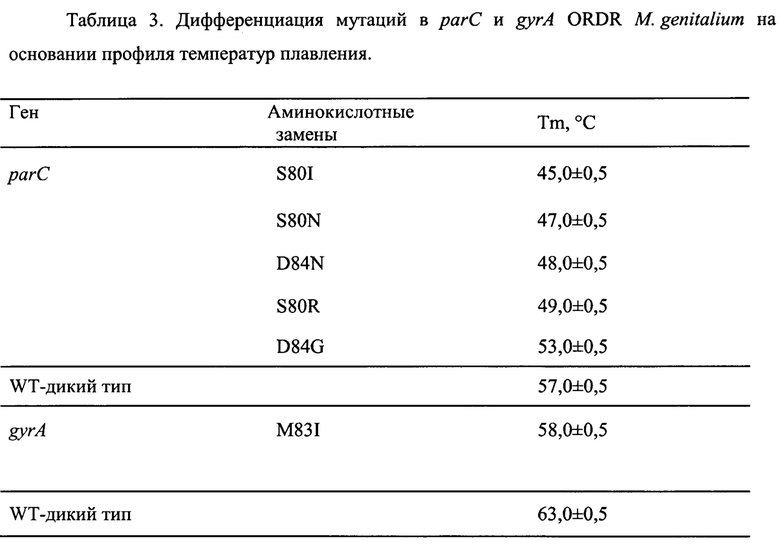
Таким образом, предложенный способ характеризуется хорошей дискриминирующей способностью, что согласуется с результатами, полученными для контрольных образцов.
Пример 1. Пациент Е., 36 лет, обратился в кожно-венерологический диспансер (КВД) г. Смоленска с жалобами на слизисто-гнойные выделения из половых органов, беспокоящие в течение 2 недель, учащенное и болезненное мочеиспускание, тянущие боли в области лобка. В анамнезе незащищенный половой контакт около 3х недель назад. На протяжении 7 дней занимался самолечением: принимал Левофлоксацин по 250 мг в день. Ввиду отсутствия улучшений, обратился за медицинской помощью. Пациенту был сделан анализ соскоба из уретры с использованием коммерческой системы методом ПЦР в режиме реального времени, который показал наличие ДНК Mycoplasma genitalium. Также клинический образец был исследован на наличие мутаций, приводящих к устойчивости Mycoplasma genitalium к макролидам и фторхинолонам с использованием предложенного способа. В результате выполненного анализа, была обнаружена мутация в гене parC ORDR, приводящая к аминокислотной замене S80I (Ser-80-Ile). Мутаций, приводящих к устойчивости к макролидам не обнаружено. На основании результатов исследований, пациенту был назначен однократный прием внутрь 1000 мг Азитромицина. На контрольном визите пациент чувствовал себя хорошо, жалобы отсутствовали, ДНК Mycoplasma genitalium не обнаружена.
Пример 2. Для оценки клинической чувствительности и специфичности предложенного способа проведен параллельный анализ 873 урогенитальных образцов, для которых получены типичные профили плавления зондов MgegyrAPb и Mge_parC_Pbl «дикого типа». Специфические последовательности гена parC QRDR и гена gyrA QRDR М. genitalium были обнаружены в 847 образцах (относительная чувствительность 97%). Пример 3. Пациент Б. 1991 г. р. обратился в частную клинику г. Смоленска с жалобами на зуд и жжение в области половых органов, появившиеся вскоре после незащищенного полового контакта с новым половым партнером. После осмотра, клинический материал (соскоб из уретры) пациента был направлен в лабораторию НИИ антимикробной химиотерапиии и проанализирован на наличие инфекций, передающихся половым путем метода ПЦР. Обнаружена ДНК М. genitalium. В качестве эрадикационной терапии был назначен джозамицин в дозе 500 мг 3 раза в сутки перорально в течение 10 дней. Результаты контрольного теста через три недели показали наличие в соскобе ДНК М. genitalium. Терапия была изменена на моксифлоксацин в дозе 400 мг 2 раза в сутки перорально в течение 10 дней. Контрольный тест через две недели подтвердил наличие ДНК М. genitalium несмотря на терапию препаратом другой группы. Все пробы пациента были исследованы на наличие мутаций, приводящих к устойчивости М. genitalium к макролидным и фторхинолоновым антибиотикам. По результатам выполненного исследования, во всех образцах биологического материала, полученного у пациента, как до, так и после назначения терапии молекулярно-генетическая характеристика показала наличие мутации A2058G в 23S рРНК М. genitalium, приводящей к устойчивости к макролидам. Данный факт объясняет неудачу лечения джозамицином. В результате применения предложенного способа была выявлена мутация в гене parC QRDR, приводящая к аминокислотной замене D87N, обуславливающая устойчивость к фторхинолонам. Исследование методом секвенирования по Сэнгеру подтвердило наличие мутаций в указанных локусах. Поскольку лечение моксифлоксацином не привело к эрадикации М. genitalium, пациенту был назначен антибиотик тетрациклиновой группы -доксициклина моногидрат в дозе 100 мг перорально 2 раза в сутки в течение 10 дней. На контроль лечения пациент не явился.
Предлагаемый способ выявления мутаций к фторхинолоновым антибиотикам у Mycoplasma genitalium с помощью ПЦР-РВ с эффектом гашения флуоресценции зонда праймером обеспечивает следующие преимущества:
1. Позволяет выявлять любые нуклеотидные замены в участках генов parC и gyrA ORDR Mycoplasma genitalium с помощью анализа кривых плавления зондов непосредственно после проведения амплификации в мультиплексном формате с использованием уникальных праймеров и зондов.
2. Благодаря высокой чувствительности и специфичности может использоваться не только для анализа культивированных штаммов, но и для прямой диагностики в образцах клинического материала.
3. Предложенный способ может быть использован для прогнозирования возможной устойчивости к антибиотикам, при наличии неуспехов терапии.
4. Позволяет снизить трудозатраты и время анализа за счет использования технологии ПЦР в режиме реального времени.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выявления наличия мутаций, приводящих к резистентности у Mycoplasma genitalium к макролидным и фторхинолоновым антибиотикам | 2019 |
|
RU2725477C1 |
| СПОСОБ ВЫЯВЛЕНИЯ МУТАЦИЙ, ПРИВОДЯЩИХ К РЕЗИСТЕНТНОСТИ У Mycoplasma genitalium И Mycoplasma pneumoniae К МАКРОЛИДНЫМ АНТИБИОТИКАМ | 2017 |
|
RU2646123C1 |
| СПОСОБ ДЕТЕКЦИИ СПЕЦИФИЧЕСКИХ НУКЛЕОТИДНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ И НУКЛЕОТИДНЫХ ЗАМЕН С ПОМОЩЬЮ ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ С ЭФФЕКТОМ ГАШЕНИЯ ФЛУОРЕСЦЕНЦИИ ЗОНДА ПРАЙМЕРОМ | 2010 |
|
RU2451086C1 |
| ДНК-ЧИП ДЛЯ ИДЕНТИФИКАЦИИ ГЕНЕТИЧЕСКИХ ДЕТЕРМИНАНТ АНТИБИОТИКОРЕЗИСТЕНТНОСТИ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИЙ, ПРИВОДЯЩИХ К НАРУШЕНИЮ РЕПРОДУКТИВНЫХ ФУНКЦИЙ ЧЕЛОВЕКА, НАБОР ОЛИГОНУКЛЕОТИДОВ ДЛЯ ИММОБИЛИЗАЦИИ НА ДНК-ЧИПЕ | 2016 |
|
RU2685188C2 |
| СПОСОБ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДЕТЕКЦИИ УСТОЙЧИВОСТИ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА К ПРОТИВОТУБЕРКУЛЕЗНЫМ ПРЕПАРАТАМ ВТОРОГО РЯДА (ФТОРХИНОЛОНАМ, АМИНОГЛИКОЗИДАМ И КАПРЕОМИЦИНУ) | 2015 |
|
RU2633507C2 |
| СПОСОБ ОДНОВРЕМЕННОЙ ГЕНОДИАГНОСТИКИ ДВУХ МУТАНТНЫХ АЛЛЕЛЕЙ, ВЫЗЫВАЮЩИХ CVM И BLAD У КРУПНОГО РОГАТОГО СКОТА, И ТЕСТ-СИСТЕМА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2015 |
|
RU2601151C2 |
| ПРАЙМЕРЫ И ЗОНДЫ ДЛЯ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ ДЛЯ ОБНАРУЖЕНИЯ MYCOBACTERIUM TUBERCULOSIS | 2015 |
|
RU2832754C1 |
| Способ выявления ДНК микроорганизмов класса Mollicutes в крови и других биоматериалах методом ПЦР-РВ | 2023 |
|
RU2831277C1 |
| Олигонуклеотиды для определения мутации S:L452R SARS-CoV-2 | 2022 |
|
RU2795018C1 |
| НАБОР ПОСЛЕДОВАТЕЛЬНОСТИ ПРАЙМЕРОВ И АЛЛЕЛЬ-СПЕЦИФИЧЕСКИХ ЗОНДОВ ДЛЯ ОДНОВРЕМЕННОЙ ГЕНОДИАГНОСТИКИ ДВУХ МУТАНТНЫХ АЛЛЕЛЕЙ, ВЫЗЫВАЮЩИХ CVM И BLAD У КРУПНОГО РОГАТОГО СКОТА | 2015 |
|
RU2577990C1 |
Изобретение относится к области медицины и биологии. Осуществляют ПЦР-амплификацию QRDR-области гена parC и gyrA M. genitalium. Осуществляют детекцию целевой последовательности с флуорофорами FAM и R6G. Сравнивают температуры плавления (Tm) полученных пиков с контрольными образцами и делают вывод о наличии мутации в исследуемом образце. Если на канале FAM исследуемый образец имеет Tm=57°С±0,5°С, это свидетельствует о наличии дикого фенотипа. Если Tm=45-49°С, это свидетельствует о наличии мутации в parC QRDR. Если на канале R6G исследуемый образец имеет Tm=63-64°С, это свидетельствует о наличии дикого фенотипа. Если Tm=57-59°С, это свидетельствует о наличии мутации в gyrA QRDR. Изобретение обеспечивает выявление наличия всех возможных мутаций в генах parC и gyrA М. genitalium непосредственно в клиническом материале пациента для выбора адекватной антибиотикотерапии и контроля за эпидемиологическим процессом. 2 ил., 3 табл., 2 пр.
Способ выявления мутаций в участках генов parC и gyrA QRDR, приводящих к резистентности у Mycoplasma genitalium к антибиотикам фторхинолонового ряда, включающий амплификацию выделенной ДНК исследуемого образца, ПЦР-амплификацию мишени: QRDR-области гена parC и gyrA Mycoplasma genitalium, и детектирование точечных мутаций с использованием пары праймеров и четырех зондов, характеризующийся тем, что в реакционную пробирку в мультиплексном варианте добавляют пару праймеров и один зонд для каждой позиции Mycoplasma genitalium, для детекции мутаций в мультиплексном варианте в двух целевых участках Mycoplasma genitalium, включающих позиции 83-87 QRDR-области гена parC и gyrA, добавляют два реверсных праймера: Mge_parC_Rpml GCTTTGGGACATTCTGATAATTG и Mge_gyrA_Rpm GTCTTGAGCCATTCTTGACA(T-BHQ1)G; для детекции целевой последовательности, располагающейся внутри участка связывания праймеров, добавляют два олигонуклеотидных зонда, содержащих флуорофор FAM и флуорофор R6G на 3'-конце и полностью комплементарные последовательностям QRDR-области гена parC и gyrA дикого типа, содержащих флуорофор FAM и флуорофор R6G для каждой детектируемой мишени QRDR-области гена parC и gyrA Mycoplasma genitalium, проводят амплификацию ДНК-мишени с последующим этапом плавления зондов, при этом визуально оценивают полученные пики одновременно на двух детектируемых каналах FAM и R6G, сравнивают температуры плавления полученных пиков с контрольными образцами и делают вывод о наличии мутации в исследуемом образце: если на канале FAM исследуемый образец имеет Tm=57°С±0,5°С, это свидетельствует о наличии дикого фенотипа - без мутации; если Tm находится в диапазоне Tm=45-49°С, это свидетельствует о наличии мутации в parC QRDR; если на канале R6G исследуемый образец имеет Tm=63-64°С, это свидетельствует о наличии дикого фенотипа - без мутации; если Tm находится в диапазоне Tm=57-59°С, это свидетельствует о наличии мутации в gyrA QRDR.
| Способ выявления наличия мутаций, приводящих к резистентности у Mycoplasma genitalium к макролидным и фторхинолоновым антибиотикам | 2019 |
|
RU2725477C1 |
| СПОСОБ ВЫЯВЛЕНИЯ МУТАЦИЙ, ПРИВОДЯЩИХ К РЕЗИСТЕНТНОСТИ У Mycoplasma genitalium И Mycoplasma pneumoniae К МАКРОЛИДНЫМ АНТИБИОТИКАМ | 2017 |
|
RU2646123C1 |
| CN 105392896 A, 09.03.2016 | |||
| ЧЕРНОВА О.А | |||
| и др | |||
| Микоплазмы и их устойчивость к антибиотикам: проблемы и перспективы контроля микоплазменных инфекций и контаминаций клеточных культур | |||
| Acta Naturae | |||
| Токарный резец | 1924 |
|
SU2016A1 |
Авторы
Даты
2022-08-22—Публикация
2021-09-27—Подача