Область техники
Данная заявка относится к способам изготовления белка, содержащего последовательность аннексина A5 (AnxA5). Более конкретно, указанный способ заключается в выделении и/или очистке белка AnxA5, особенно из рекомбинантной клетки-хозяина, такой как бактериальная клетка-хозяин. Описанные в данном документе способы являются высокоэффективными и экономически выгодными и могут применяться в промышленном масштабе (например, с культурами рекомбинантных клеток-хозяев, имеющими объем культивирования около 1000 л или более) для быстрого и удобного получения белкового продукта AnxA5 фармацевтического класса.
Уровень техники
Перечисление или обсуждение явно ранее опубликованного документа в этом описании не обязательно должно рассматриваться как подтверждение того, что указанный документ является частью современного уровня техники или представляет собой общедоступные сведения.
Атеротромбоз, возникающий вследствие образований атеросклеротических бляшек, является ключевым патогенетическим механизмом, лежащим в основе большинства клинически выраженных сердечно-сосудистых ишемических заболеваний, включая острую коронарную недостаточность и окклюзию цереброваскулярных и периферических артерий. Как обсуждалось в публикации Cederholm and Frostegård, 2007, Drug News Perspect., 20(5): 321-6, аннексин A5 (ранее известный как аннексин V), представитель надсемейства аннексина, представляет собой белок с мощными и уникальными антитромботическими свойствами. Предполагается, что антитромботический эффект, проявляемый аннексином A5, опосредуется главным образом механически защитным эффектом фосфолипидов, в частности фосфатидилсерина, тем самым снижая их доступность для реакций коагуляции. Вместе с тем сообщалось о других интересных свойствах аннексина А5, потенциально способствующих его антитромботической функции, особенно в результате подавления поверхностного экспрессированного тканевого фактора, или взаимодействия с дополнительными лигандами, участвующими в гемостазе, такими как сульфатид и гепарин, а также в результате повышения активности активатора плазминогена урокиназного типа. Кроме того, высказывается предположение о биологической значимости аннексина А5 как части эндогенной антитромботической системы in vivo для большого сосудистого русла, а также для плацентарной микроциркуляции.
Действительно, известно, что аннексин А5 имеет широкий спектр применения в медицине, обеспечивая прямые терапевтические эффекты. Примеры включают применение аннексина А5:
для предотвращения атеротромбоза и/или разлома бляшек, как описано в WO 2005/099744 (содержание которого включено в данный документ посредством ссылки);
для лечения сосудистой дисфункции, уменьшения интенсивности ишемической боли и/или лечения сосудистых заболеваний, сопровождающихся нарушением целостности сосудов, как описано в WO 2009/077764 (содержание которого включено в данный документ посредством ссылки);
для профилактики или лечения рестеноза, как описано в WO 2009/103977 (содержание которого включено в данный документ посредством ссылки);
для применения с целью ингибирования активности окисленного кардиолипина (oxCL), а также для лечения, предотвращения и/или снижения риска развития сердечно-сосудистого заболевания, аутоиммунного заболевания или воспалительного патологического состояния, как описано в WO 2010/069605 (содержание которого включено в данный документ посредством ссылки); а также
для предотвращения и/или уменьшения пери- или послеоперационных осложнений после хирургического вмешательства, таких как осложнения после оперативного вмешательства на сосудах, особенно периферических, как описано в WO 2012/136819 (содержание которого включено в данный документ посредством ссылки).
В связи с этим аннексин А5 представляет собой белок с высоким терапевтическим интересом и потенциалом. Таким образом, существует настоятельная потребность в разработке эффективного способа получения белка аннексина A5 терапевтического класса, применяя с этой целью эффективный и экономически выгодный процесс, который можно реализовывать в промышленных масштабах и удобно применять для коммерческого изготовления (например, для получения белка аннексина A5 из культур рекомбинантных клеток-хозяев, имеющих объем культивирования около 1000 л или более).
Особенные затруднения представляют случаи, когда рекомбинантно экспрессированый аннексин А5 в стандартных бактериальных клетках-хозяевах, таких как E. coli, является загрязненным компонентами клетки-хозяина, и, в частности, эндотоксином. Эндотоксин представляет собой липополисахарид (ЛПС), который образован липидом и полисахаридом, состоящим из O-антигена, внешнего ядра и внутреннего ядра, соединенных ковалентной связью; ЛПС обнаруживается во внешней мембране грамотрицательных бактерий и вызывает сильные иммунные реакции у животных. Аннексин А5 характеризуется сильным связыванием с биологическими мембранами, содержащими отрицательно заряженные фосфолипиды, и поэтому характеризуется особенно высокой аффинностью к эндотоксину. Это еще больше усложняет получение аннексина A5 от хозяев, продуцирующих эндотоксин, в больших промышленных масштабах.
На сегодняшний день не существует способа получения белка аннексина A5 терапевтического класса, который представлял бы собой эффективный и экономически выгодный процесс, который можно реализовывать в промышленных масштабах и удобно применять для коммерческого изготовления (например, для получения белка аннексина A5 из культур рекомбинантных клеток-хозяев, имеющих объем культивирования около 1000 л или более), не говоря уже о проблеме загрязнения эндотоксином.
В 1991 году Кумар (Kumar) сообщил о разработке способа изготовления и очистки аннексина A5 (дипломная работа бакалавра колледжа по теме: "Экспрессия, очистка и изготовление в крупных масштабах рекомбинантного белка аннексин-V человека", защищенная на кафедре химико-технологического колледжа в составе Технического университета штата Арканзас, Фейетвилл, штат Арканзас, которая доступна в Интернете по адресу: https://uarkive.uark.edu/xmlui/handle/10826/981). Способ Кумара включал экспрессию аннексина А5 в рекомбинантных клетках-хозяевах E. coli в 100 мл культуральных флаконах, гранулирование клеток, ресуспендирование клеток в присутствии буфера для гомогенизации/лизиса, состоящего из 50 мМ Трис-HCl, 10 мМ CaCl2 при рН 7,2, с последующим разрушением клеток путем обработки ультразвуком для высвобождения белка аннексина А5. Добавление CaCl2 обуславливало связывание аннексина А5 с клеточными мембранами в дебрисе кальций-зависимым способом; затем смесь подвергали первому этапу очищающего центрифугирования в течение 20 минут, после чего удаляли надосадочную жидкость и извлекали осадок, содержащий клеточный дебрис и связанный аннексин А5. Аннексин A5 высвобождали из осадка с применением ЭДТА, после чего осуществляли второй этап очищающего центрифугирования в течение 20 минут и собирали аннексин А5 в супернатанте. Затем в течение ночи проводили диализ с целью изменения буфера для аннексина А5 на Трис-HCl при рН 8,0, с последующим этапом анионообмена на колонке с DEAE-сефарозой и элюированием аннексина А5 с применением солевого градиента.
Заявителю стало понятно, что существует множество ограничений и недостатков в способе, предложенном Кумаром. Во-первых, указанный способ продемонстрирован только в небольших масштабах, с применением 100 мл культур и требует двух отдельных этапов центрифугирования во время процесса очистки. Способ Кумара нет возможности применять в промышленных масштабах, которые эффективно используют культуру большого объема (например, 1000 литров или более). Как обсуждается ниже, центрифугирование таких больших объемов жидкости будет чрезвычайно трудоемким и дорогостоящим. В то же время, подход, предложенный Кумаром, который опирается на применение индуцированного кальцием связывания аннексина А5 с мембранами в клеточном дебрисе в качестве предварительной этапа захвата, обуславлавливает необходимость в центрифугировании. Во-вторых, заявителям стало понятно, что способ Кумара приводит к высоким потерям белка аннексина A5, например, удалении растворимого аннексина А5, который не связывается в супернатанте продукта на первом этапе очищающего центрифугирования. В-третьих, с помощью способа Кумара нет возможности полностью удалять эндотоксин до уровня, допустимого для терапевтического применения, и следует отметить, что не проводятся какие-либо анализы уровней эндотоксина в конечном продукте. Таким образом, способ Кумара не может эффективно и с минимальными затратами времени применяться для получения белка аннексина A5 в промышленных масштабах, поскольку обуславливает его высокие потери (т.е. низкий выход) и приводит к низкой степени очистки белка, что является не пригодным для терапевтического применения.
В 2008 году на кафедре лабораторной медицины при Медицинском центре Университета штата Вашингтон, сотрудниками исследовательской лаборатории Tait была опубликована работа под названием "Получение рекомбинантного аннексина V из плазмиды pET12a-PAPI". Указанная работа доступна в Интернете по адресу: https://depts.washington.edu/labweb/Faculty/Tait/108.pdf. Описанный способ очень похож на методологию, предложенную Кумаром. Этот способ включал экспрессию аннексина А5 в рекомбинантных клетках-хозяевах E. coli в культурах 1 л, гранулирование клеток, ресуспендирование клеток в присутствии буфера для гомогенизации/лизиса, состоящего из 50 мМ Трис-HCl, 10 мМ CaCl2 при рН 7,2, с последующим разрушением клеток путем обработки ультразвуком для высвобождения белка аннексина А5. Добавление CaCl2 обуславливало связывание аннексина А5 с клеточными мембранами в дебрисе кальций-зависимым способом; затем смесь подвергали первому этапу очищающего центрифугирования в течение 20 минут, после чего удаляли надосадочную жидкость и извлекали осадок, содержащий клеточный дебрис и связанный аннексин А5. Аннексин A5 высвобождали из осадка с применением ЭДТА, после чего осуществляли второй этап очищающего центрифугирования в течение 20 минут и собирали аннексин А5 в супернатанте. Затем проводили диализ с целью изменения буфера для аннексина А5 на Трис-HCl при рН 8,0, с последующим этапом анионообмена на колонке Mono Q и элюированием аннексина А5 с применением солевого градиента. Заявителю стало понятно, что и в этом способе существует множество ограничений и недостатков, характерных для способа Кумара.
В 2014 году был предложен еще один способ очистки аннексина А5 в публикации Marder et al., 2014, BMC Biotechnology, 14:33, имеющей название "Получение рекомбинантного аннексина V человека с помощью культивирования с подпиткой". Мардер с соавт. (Marder et al.), сообщает, что его способ представляет собой принцип культивирования с подпиткой с целью получения рекомбинантного аннексина V человека в крупных масштабах, и предполагает, что предложенный им способ сможет расширить коммерческое применение рекомбинантного аннексина A5, например, в визуализационных исследованиях in vivo.
В очередной раз следует отметить, что способ Мардера с соавт. очень похож на способ Кумара, предложенный в 1991 году, и на способ, разработанный на кафедре лабораторной медицины при Медицинском центре Университета штата Вашингтон в 2008 году. Мардер с соавт. экспрессирует аннексин A5 в рекомбинантных клетках-хозяевах E. coli в культурах 1 л, содержащихся в резервуарах емкостью 2 л. Как обсуждалось (в разделе "Очистка" в описании способов Мардера с соавт), собранные клетки ресуспендировали в присутствии буфера для гомогенизации/лизиса (буфер А), состоящего из 50 мМ Трис-HCl, 10 мМ CaCl2 при рН 7,2, с последующим разрушением клеток путем обработки ультразвуком для высвобождения белка аннексина А5. Добавление CaCl2 обуславливало связывание аннексина А5 с клеточными мембранами в дебрисе кальций-зависимым способом; затем смесь подвергали первому этапу очищающего центрифугирования в течение 30 минут, после чего удаляли надосадочную жидкость и извлекали осадок, содержащий клеточный дебрис и связанный аннексин А5. Аннексин A5 высвобождали из осадка с применением ЭДТА, после чего осуществляли второй этап очищающего центрифугирования в течение 30 минут и собирали аннексин А5 в супернатанте. Затем проводили этап диализа с целью изменения буфера для аннексина А5 на Трис-HCl при рН 8,0, с последующим третьим этапом очищающего центрифугирования в течение 20 минут для удаления остаточного осадка, и этапом анионообмена на колонке Mono Q и элюированием аннексина А5 с применением солевого градиента. Опять же, заявителю стало понятно, что и в этом способе существует множество ограничений и недостатков, характерных для способа Кумара.
Способ Кумара, предложенный в 1997 году, и способ, разработанный на кафедре лабораторной медицины при Медицинском центре Университета штата Вашингтон в 2008 году, а также способ Мардера с соавт., 2014 года ясно показывают, что в этой области техники разработан и установлен подход к изготовлению и очистке продуктов, содержащих аннексин А5, в коммерческих целях, хотя ограничения и недостатки этих способов были недооценены в данной области техники, без какой-либо общедоступной альтернативы.
Все эти способы предшествующего уровня техники для выделения Анексина А5 были продемонстрированы только в лабораторном масштабе и не могут быть адаптированы для крупных масштабов или учитывать промышленные стандарты или оборудование, применяемые для более крупных масштабов. Указанные способы имеют присущие им недостатки, что обуславливает их непригодность для крупномасштабного изготовления. В частности, существенно ограничивающими характеристиками этих способов предшествующего уровня техники являются два или (в случае способа Мардера с соавт. 2014 года) три центрифугирования с ускорением силы тяжести высокой степени, при этом для осуществления указанных способов необходимо, чтобы аннексин А5 поочерёдно находился в растворе или в виде осадка. Объективно можно оценить, что способ изготовления с применением только двух этапов центрифугирования для обработки одной партии 1000 л займет около 12 недель с 12-часовым ежедневным сдвигом на любом хорошо оборудованном биопромышленном предприятии, что будет обуславливать неприемлемо высокую стоимость изготовления. См. сравнительный Пример 1
Соответственно, целью данного изобретения является предоставление методологических этапов для очистки и выделения аннексина А5, которые являются эффективными и экономически выгодными для производственного процесса, функционирующего в промышленном масштабе (например, культуры рекомбинантных клеток-хозяев с культуральным объемом около 1000 литров или более) и, кроме того, преодоления недостатков, заключающихся в потере количества получаемого продукта и низкой чистоты (включая загрязнение эндотоксинами), свойственных для способов предшествующего уровня техники.
Кроме того, целью данного изобретения является предоставление фармацевтических продуктов, содержащих аннексин А5, которые получают с помощью способов по данному изобретению.
Краткое описание сущности изобретения
Заявитель внес многочисленные изменения и усовершенствования в способ изготовления белка, содержащего последовательность аннексина A5 (AnxA5), и разработал несколько высокоэффективных этапов очистки, которые можно применять независимо и/или применять в комбинации для оптимизации существующих способов. Наиболее предпочтительно, чтобы способ изготовления аннексина А5 содержал все разработанные этапы способа.
В частности, разработки заявителя обеспечивают возможность высокоэффективного способа выделения белка AnxA5, в котором белок AnxA5 предпочтительно остается в растворе на всех этапах способа (за исключением случаев, когда он временно связывается с хроматографическими смолами). То есть, разработки заявителя обеспечивают способ выделения белка AnxA5, который может быть выполнен предпочтительно без необходимости применять какие-либо этапы очищающего центрифугирования для белка AnxA5 после выделения указанного белка AnxA5 из клетки-хозяина. Данное изобретение имеет огромную промышленную выгоду, поскольку центрифугирование с применением ускорения силы тяжести высокой степени для сбора преципитатов является сложным, медленным и дорогостоящим процессом на биофармацевтических заводах с крупномасштабным производством. Кроме того, это означает, что все способы по данному изобретению могут быть выполнены без применения способности аннексина А5 к присоединению к мембранам (например, мембранам клеток-хозяев и/или липосом), что часто могут приводить к очищению аннексина А5 вместе с нежелательными загрязняющими примесями, такими как эндотоксин.
Соответственно, этот способ можно применять для обработки больших объемов (например, около 100 л, 500 л, 1000 л, 5000 л, 10000 л, 50 000 л, 100 000 л или более) культур клеток-хозяев с минимальными затратами времени и без ограничений, обусловленных одним или большим количеством этапов очищающего центрифугирования. Например, может быть предпочтительным, чтобы процесс очистки проводили за 5, 4, 3, 2 недель или менее и, как правило, менее чем за 1 неделю на 1000 л культуры клеток-хозяев. Кроме того, неожиданно было установлено, что этот способ можно применять для получения большего количества получаемого продукта и/или повышения степени чистоты (включая, например, улучшение удаления эндотоксина) по сравнению с более медленными и менее эффективными способами предшествующего уровня техники.
Соответственно, первый аспект данного изобретения обеспечивает оптимизированный этап высвобождения белка из клетки-хозяина. Более конкретно, в первом аспекте предлагается способ выделения и/или очистки рекомбинантно экспрессированного внутриклеточного белка, содержащего последовательность аннексина A5 (AnxA5), из клетки-хозяина, продуцирующей эндотоксин, с клеточной стенкой, при этом указанный способ включает высвобождение внутриклеточного белка из клетки-хозяина, и характеризуется тем, что этап высвобождения внутриклеточного белка AnxA5 проводят в присутствии буфера для гомогенизации, содержащего неионный детергент. Предпочтительно неионным детергентом является полисорбат, более предпочтительно полисорбат, выбранный из Твин 20 и Твин 80, а наиболее предпочтительно - Твин 80.
Заявитель также обнаружил (как обсуждается дополнительно в Примере 2 ниже), что в отличие от общеизвестных способов, в которых последовательное добавление этапов очистки приводит к постоянно увеличивающейся потере получаемого продукта (поскольку на каждом этапе наблюдается утрата продукта), комбинация анионообменного этапа и этапа аффинной хроматографии с гепарином имеет удивительное преимущество, заключающееся в достижении высокой степени чистоты, которую получают также и при применении одного лишь этапа аффинной хроматографии с гепарином, но с существенно увеличенным количеством получаемого продукта (т.е. выделение увеличивается с около 30-40% до около 70-90%). Это прямая противоположность тому, что обычно можно ожидать от комбинации этапов очистки.
Соответственно, во втором аспекте данного изобретения предлагается способ выделения и/или очистки белка, содержащего последовательность аннексина А5 (AnxA5), из раствора, содержащего белок AnxA5 и одну или большее количество примесей, при этом способ включает
подвергание раствора, содержащего белок AnxA5 и одну или большее количество примесей, воздействию анионообменной смолы с целью осуществления первого анионообменного этапа, и получение таким образом продукта первого анионообмена, который содержит высвобожденный белок AnxA5; а также
подвергание продукта первого анионообмена, прямо или опосредованно, этапу аффинной хроматографии, и получение таким образом продукта первой аффинной хроматографии, который содержит высвобожденный белок AnxA5.
Предпочтительно, согласно способу по второму аспекту данного изобретения, этап аффинной хроматографии может включать связывание белка AnxA5 с иммобилизованным гепарином и при этом связывание необязательно стимулируют добавлением ионов кальция и, кроме того, белок AnxA5 необязательно элюируют из иммобилизованного гепарина с помощью буфера для элюирования, содержащего хелатор ионов кальция, такой как ЭДТА.
Кроме того, как описано в Примере 3, заявитель обнаружил, что на этапе аффинной хроматографии с гепарином Твин 80 обладает особенно полезным эффектом (по сравнению с другими неионными детергентами, включая другие Твин, такие как Твин 20). Включение Твин 80, например около 0,1% (мас./об.), в буферы, применяемые на этапе аффинной хроматографии с гепарином, может помочь элюировать белок AnxA5 в одном пике, уменьшить давление и предотвратить осаждение.
Соответственно, в третьем аспекте данного изобретения предлагается способ выделения и/или очистки белка, содержащего последовательность аннексина А5 (AnxA5), из раствора, содержащего белок AnxA5 и одну или большее количество примесей, при этом способ включает подвергание раствора, включающего белок AnxA5 и одну или большее количество примесей (который может быть или может не быть прямым или опосредованным продуктом первого этапа анионообменной хроматографии захвата, как обсуждалось в данном документе), этапу аффинной хроматографии с гепарином в присутствии Твин 80 (предпочтительно в присутствие около 0,1% мас./об. Твин 80), в результате чего получают продукт первой аффинной хроматографии, который содержит высвобожденный белок AnxA5.
Четвертый аспект данного изобретения основан на осознании заявителем того, что хелаторы ионов металлического кальция (например, ЭДТА) могут отрицательно влиять на эффективность анионообменных этапов. Свободная ЭДТА (или другой хелатор) может непосредственно связываться с функциональными анионообменными группами и тем самым уменьшать емкость, а также разделение, достигнутое на анионообменном этапе. С другой стороны, попытки удаления хелатора ионов металлического кальция до анионообменного этапа требуют много времени и, следовательно, увеличивают затраты. Поэтому способы предшествующего уровня техники, включающие медленные этапы диализа для замены буфера, являются неэффективными. Кроме того, включение хелатора ионов кальция в продукт AnxA5 на анионообменном этапе может быть важным компонентом для предотвращения кальций-зависимого связывания белка AnxA5 с примесями, включая эндотоксин. Поэтому было бы удобно и эффективно вводить добавку, которая блокирует или уменьшает связывание хелатора ионов кальция с анионообменной смолой, что позволило бы проводить анионообменный этап без затруднений и затрат, связанных с диализом, и без предупреждения положительного действия хелатора ионов кальция на анионообменном этапе.
Заявителю стало понятно, что это может быть достигнуто путем включения в белковый продукт AnxA5 перед анионообменом одного или большего количества типов дополнительных выбранных ионов металлов, при этом дополнительные выбранные ионы металлов выбраны так, что хелатор ионов металлического кальция характеризуется аффинностью связывания для выбранных ионов металлов, которая является выше, чем аффинность связывания для анионообменной смолы, но ниже, чем его аффинность связывания для ионов кальция. Выбор соответствующих дополнительных ионов металлов будет зависеть от природы хелатора ионов кальция и природы анионообменной смолы. Например, в случае применения ЭДТА в качестве хелатора ионов кальция, ионы Mg2+, как правило, являются пригодными для достижения цели данного изобретения и могут быть добавлены к белковому продукту AnxA5 до анионообменного этапа.
Соответственно, в четвертом аспекте данного изобретения предлагается способ выделения и/или очистки белка, содержащего последовательность аннексина А5 (AnxA5) из композиции, которая содержит белок AnxA5 и хелатор ионов металлического кальция, характеризующийся тем, что способ включает подвергание композиции воздействию анионообменной смолы для проведения анионообменного этапа и, таким образом, выделение и/или очистку белка AnxA5 из композиции и
дополнительно характеризуется тем, что анионообменного этапа проводят в присутствии дополнительных выбранных ионов металлов,
при этом дополнительные выбранные ионы металлов выбраны так, что хелатор ионов металлического кальция характеризуется аффинностью связывания для выбранных ионов металлов, которая является выше, чем аффинность связывания для анионообменной смолы, но ниже, чем его аффинность связывания для ионов кальция.
В пятом аспекте данного изобретения предлагается композиция, содержащая белок AnxA5, при этом композиция представляет собой прямой или опосредованный продукт (получаемый в результате прямого или опосредованного) процесса согласно любому одному из первого, второго, третьего или четвертого аспектов данного изобретения. Необязательно указанная композиция представляет собой фармацевтически приемлемую и/или ветеринарно приемлемую композицию.
В шестом аспекте данного изобретения также предлагается композиция по пятому аспекту данного изобретения для применения в медицине. Другими словами, в шестом аспекте данного изобретения предлагается способ, включающий введение человеку или животному, нуждающемуся в этом, терапевтически эффективного количества композиции по пятому аспекту данного изобретения.
Предполагается, что любой способ или композиция, описанные в данном документе, могут быть реализованы в отношении любого другого способа или композиции, описанных в данном документе.
В данном контексте слово в единственном числе при применении в сочетании с термином "содержащий" в формуле изобретения и/или описании может означать "один", но оно также соответствует значению "один или большее количество", "по меньшей мере один" и "один или больше, чем один".
Эти и дополнительные аспекты данного изобретения можно будет лучше оценить и понять при рассмотрении в сочетании со следующим описанием и прилагаемыми графическими материалами. Однако следует понимать, что нижеследующее описание с указанием различных аспектов и вариантов осуществления данного изобретения и многочисленных конкретных его подробностей приводится в качестве иллюстрации, а не ограничения. Многие замены, модификации, добавления и/или перегруппировки могут быть сделаны в рамках объема данного изобретения без отхода от его сущности, при этом данное изобретение включает в себя все такие замены, модификации, добавления и/или перегруппировки.
Описание графических материалов
На фиг. 1 изображена последовательность SEQ ID NO: 1, которая представляет собой последовательность аннексина A5 человека.
На фиг. 2 изображена блок-схема полного технологического процесса для аннексина А5, представленного в качестве примера.
На фиг. 3 изображена блок-схема процесса хроматографии захвата AX, представленного в качестве примера.
На фиг. 4 изображена блок-схема процесса промежуточной аффинной хроматографии, представленного в качестве примера.
На фиг. 5 изображена блок-схема этапа заключительной хроматографической очистки AX, представленного в качестве примера.
На фиг. 6 изображена блок-схема процесса ультра/диафильтрации и составления аннексина А5, представленного в качестве примера.
На фиг. 7 приведены результаты Примера 3, который демонстрирует влияние Твин 80 на очищение аннексина А5 аффинной хроматографией с гепарином, при этом на фиг. 7А приведены результаты теста 1 (без Твин 80), а на фиг. 7В приведены результаты теста 2 (с Твин 80).
Подробное описание сущности изобретения
А. Белок aннексин A5
Данное изобретение относится к способам очистки и/или выделения белка, содержащего последовательность аннексина А5 (AnxA5), и продуцируемых таким образом продуктов и составов, содержащих белок AnxA5.
Согласно одному из вариантов осуществления данного изобретения белок AnxA5, который очищают и/или извлекают, может содержать, состоять по существу из, или состоять из белков, имеющих последовательность аннексина A5 человека (SEQ ID NO: 1, как показано на фиг. 1), либо с N-концевым метионином, либо без него.
В другом варианте осуществления данного изобретения белок AnxA5, который очищают и/или извлекают, может содержать, состоять по существу из, или состоять из варианта или мутанта белка, имеющего последовательность аннексина A5 человека (SEQ ID NO: 1, как показано на фиг. 1), либо с N-концевым метионином, либо без него. Например, вариант или мутант может отличаться от SEQ ID NO: 1 (либо с N-концевым метионином, либо без него) в любом одном или большем количестве положений, равном или меньше 1, 2, 3, 4 , 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65 , 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160 или в большем количестве положений.
Таким образом, вариант или мутант аннексина А5 может представлять собой белок, в котором в одном или большем количестве положений были осуществлены аминокислотные вставки, делеции или замены, либо консервативные, либо неконсервативные. Предпочтительно, чтобы в результате модификаций получали белок без существенных изменений его основных свойств, заключающихся в функционировании в способ, эквивалентный аннексину A5. Термин "значительно" в этом контексте означает, что специалист в данной области техники сказал бы, что свойства варианта могут все еще быть отличающимися, но не будут неочевидны по сравнению с исходными белками.
Предпочтительно изоэлектрическая точка (pI) варианта или мутанта не изменяется по сравнению с немодифицированным белком или не модифицируется более чем на 1, 0,9, 0,8, 0,7, 0,6, 0,5, 0,4, 0,3, 0,2 или 0,1 единиц рН.
В предпочтительном варианте осуществления данного изобретения белок AnxA5 способен связываться с фосфатидилсерином на биологической мембране, предпочтительно до уровня, который составляет по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или около 100% от того, который демонстрирует аннексин A5 человека (SEQ ID NO: 1) при тех же условиях. В данной области техники известен пригодный способ измерения связывания аннексина А5 с фосфатидилсерином на биологической мембране (Vermes et al. (1995) J Immunol Methods,184(1): p. 39-51).
Под термином "консервативные замены" подразумеваются комбинации, такие как Gly, Ala; Val, Ile, Leu; Asp, Glu; Asn, Gln; Ser, Thr; Lys, Arg; и Phe, Tyr.
Варианты и мутанты могут быть получены с помощью способов белковой инженерии и сайт-направленного мутагенеза, которые хорошо известны в данной области техники.
В следующем варианте осуществления данного изобретения белок AnxA5, который очищают и/или извлекают, может представлять собой димер белка, который содержит, состоит по существу из, или состоит из белка, имеющего последовательность аннексина A5 человека (SEQ ID NO: 1, как показано на фиг.1), либо с N-концевым метионином, либо без него, или с его вариантом или мутантом, как описано выше.
В дополнительном варианте осуществления данного изобретения белок AnxA5, который очищают и/или извлекают, может представлять собой слитый белок, который содержит, состоит по существу из, или состоит из: (а) одной или большего количества белковых последовательностей, содержащих последовательность партнера по слиянию, которая(ые) является/являются слитым(и); (b) одной или большего количества белковых последовательностей, которая содержит, состоит по существу из, или состоит из белка, имеющего последовательность аннексина A5 человека (SEQ ID NO: 1, как показано на фиг. 1), либо с N-концевым метионином, либо без него, или с его вариантом, или мутантом, или димером, как описано выше. Например, без ограничения, слитый белок может иметь общую структуру, выбранную из:
- в случае слияния двух аминокислотных последовательностей, например: H2N-(a)-(b)-COOH; или H2N-(b)-(a)-COOH; или
- в случае слияния трех аминокислотных последовательностей, например: H2N-(a)-(b)-(a)-COOH; или H2N-(b)-(a)-(b)-COOH; или H2N-(a)-(b)-(b)-COOH; или H2N-(b)-(b)-(a)-COOH; или H2N-(a)-(a)-(b)-COOH; или H2N-(b)-(a)-(a)-COOH; или
- в случае слияния четырех аминокислотных последовательностей, например: H2N-(a)-(a)-(a)-(b)-COOH; или H2N-(a)-(a)-(b)-(a)-COOH; или H2N-(a)-(b)-(a)-(a)-COOH; или H2N-(b)-(a)-(a)-(a)-COOH; или H2N-(a)-(a)-(b)-(b)-COOH; или H2N-(a)-(b)-(a)-(b)-COOH; или H2N-(b)-(a)-(a)-(b)-COOH; или H2N-(a)-(b)-(b)-(a)-COOH; или H2N-(b)-(a)-(b)-(a)-COOH; или H2N-(b)-(b)-(a)-(a)-COOH; или H2N-(b)-(b)-(b)-(a)-COOH; или H2N-(b)-(b)-(a)-(b)-COOH; или H2N-(b)-(a)-(b)-(b)-COOH; или H2N-(a)-(b)-(b)-(b)-COOH; или
- в случае слияния пяти аминокислотных последовательностей, например: или H2N-(a)-(a)-(a)-(a)-(b)-COOH; или H2N-(a)-(a)-(a)-(b)-(a)-COOH; или H2N-(a)-(a)-(b)-(a)-(a)-COOH; или H2N-(a)-(b)-(a)-(a)-(a)-COOH; или H2N-(b)-(a)-(a)-(a)-(a)-COOH; или H2N-(a)-(a)-(a)-(b)-(b)-COOH; или H2N-(a)-(a)-(b)-(a)-(b)-COOH; или H2N-(a)-(b)-(a)-(a)-(b)-COOH; или H2N-(b)-(a)-(a)-(a)-(b)-COOH; или H2N-(a)-(a)-(b)-(b)-(a)-COOH; или H2N-(a)-(b)-(a)-(b)-(a)-COOH; или H2N-(b)-(a)-(a)-(b)-(a)-COOH; или H2N-(a)-(b)-(b)-(a)-(a)-COOH; или H2N-(b)-(a)-(b)-(a)-(a)-COOH; или H2N-(b)-(b)-(a)-(a)-(a)-COOH; или H2N-(a)-(a)-(b)-(b)-(b)-COOH; или H2N-(a)-(b)-(a)-(b)-(b)-COOH; или H2N-(b)-(a)-(a)-(b)-(b)-COOH; или H2N-(a)-(b)-(b)-(a)-(b)-COOH; или H2N-(b)-(a)-(b)-(a)-(b)-COOH; или H2N-(b)-(b)-(a)-(a)-(b)-COOH; или H2N-(a)-(b)-(b)-(b)-(a)-COOH; или H2N-(b)-(a)-(b)-(b)-(a)-COOH; или H2N-(b)-(b)-(b)-(a)-(a)-COOH; или H2N-(a)-(b)-(b)-(b)-(b)-COOH; или H2N-(b)-(a)-(b)-(b)-(b)-COOH; или H2N-(b)-(b)-(a)-(b)-(b)-COOH; или H2N-(b)-(b)-(b)-(a)-(b)-COOH; или H2N-(b)-(b)-(b)-(b)-(a)-COOH,
где (a) и (b) являются такими, как определено выше в этом пункте. В случае множественных белков-партнеров по слиянию, как определено в (а), партнеры по множественному слиянию могут быть одинаковыми или разными. Может применяться любой партнер по слиянию, представляющий интерес. Например, полипептидная последовательность(и) партнера по слиянию может быть пригодной для продления периода полувыведения молекулы из системы кровообращения пациента и/или добавления дополнительной функциональности молекуле, например, добавление дополнительных терапевтических свойств (например, антикоагулянтных свойств, ингибирования и/или разрушения клеток и т.д.). В случае слитых белков, содержащих множество белковых последовательностей, имеющих последовательность аннексина А5 человека (SEQ ID NO: 1, как показано на фиг. 1), либо с N-концевым метионином, либо без него, или с его вариантом или мутантом или димером, как описано выше, и как определено в пункте (b), эти белки могут быть одинаковыми или разными.
Согласно дополнительному вариантом осуществления данного изобретения белок AnxA5, который очищают и/или извлекают, может представлять собой белок, который содержит, состоит по существу из, или состоит из последовательности аннексина A5 или его функционального варианта или мутанта, выбранного из:
а) аннексина A5 человека (SEQ ID NO: 1), с N-концевым метионином или без него;
b) ортолога млекопитающего аннексина А5 человека;
c) аллельного или генетического варианта a) или b);
d) белка, который является идентичным более чем на 50%, 60%, 70%, 75%, например, более чем на 80%, 85%, более чем на 90% или даже более предпочтительно более чем на 95% или 99% любому из элементов по пункту а), b) или c);
e) димера элемента по любому из пунктов a), b), c) или d); или
f) слитого белка, содержащего один или большее количество партнеров по слиянию, слитых с любым элементом по пункту a), b), c), d) или e).
В конкретных вариантах осуществления данного изобретения белок AnxA5 представляет собой функциональный вариант или мутант аннексина А5, который является идентичным более чем на 50%, 60%, 70%, 75%, например, более чем на 80%, 85%, более чем на 90% или даже более предпочтительно более чем на 95% или 99% аннексину А5 человека, SEQ ID NO: 1, с N-концевым метионином или без него.
Процент идентичности между двумя аминокислотными последовательностями определяется следующим образом. Во-первых, аминокислотную последовательность сравнивают, например, с SEQ ID NO: 1, с помощью программы BLAST 2 Sequences (Bl2seq) из автономной версии BLASTZ, содержащей BLASTN версии 2.0.14 и BLASTP версии 2.0.14. Указанную автономную версию BLASTZ можно найти на веб-сайте Национального центра биотехнологии США по адресу ncbi.nlm.nih.gov. Инструкции по применению программы Bl2seq можно найти в файле "readme", сопровождающем BLASTZ. Bl2seq выполняет сравнение между двумя аминокислотными последовательностями с применением алгоритма BLASTP. Чтобы сравнить две аминокислотные последовательности, параметры Bl2seq устанавливают следующим образом: -i устанавливают в файл, содержащий первую аминокислотную последовательность, которую нужно сравнить (например, C:\seq1.txt); - j устанавливают в файл, содержащий вторую аминокислотную последовательность, подлежащую сравнению (например, C:\seq2.txt); -p устанавливают в blastp; -o устанавливают в любое желаемое название файла (например, C:\output.txt); все остальные параметры оставляют по умолчанию. Например, для генерации выходного файла, содержащего сравнение между двумя аминокислотными последовательностями, может применяться следующая команда: C:\Bl2seq –i c:\seq1.txt –j c:\seq2.txt –p blastp –o c:\output.txt. Если две сравниваемые последовательности характеризуются гомологией, то указанный выходной файл будет представлять эти области гомологии как выровненные последовательности. Если две сравниваемые последовательности не характеризуются гомологией, то указанный выходной файл не будет представлять выровненные последовательности. После выравнивания количество совпадений определяется путем подсчета количества положений, в которых идентичный нуклеотидный или аминокислотный остаток представлен в обеих последовательностях.
Процент идентичности определяется путем деления числа совпадений на длину последовательности, указанной в идентифицированной последовательности, с последующим умножением полученного значения на 100. Например, если последовательность сравнивают с последовательностью, указанной в SEQ ID NO: 1 (длина последовательности, указанной в SEQ ID NO: 1, равна 320), а количество совпадений равно 288, то последовательность характеризуется процентном идентичности 90 (т.е. 288 ÷ 320 * 100 = 90) с последовательностью, указанной в SEQ ID NO: 1.
Белок AnxA5 может быть димером аннексина A5 (такого как дианнексин) или его функционального варианта или мутанта. ДианнексинA5 описан в WO 02/067857.
Предпочтительно, белок AnxA5 не включает в себя His-тег, а для его выделения и очистки не применяется этап аффинного связывания с последовательностью His-тега.
His-тег представляет собой полигистидиновый аминокислотный мотив в белках, который обычно состоит из по меньшей мере шести гистидиновых (His) остатков и часто (хотя и не обязательно) размещается на N- или С-конце белка. Полигистидиновые теги часто применяются для аффинной очистки меченых полигистидином рекомбинантных белков, экспрессируемых в Escherichia coli и других прокариотических системах экспрессии, путем инкубации с аффинной смолой, содержащей связанные двухвалентные никелевые или кобальтовые ионы, которые являются коммерчески доступными в разных вариантах. Эти смолы обычно представляют собой сефарозу/агарозу, функционализированную хелатором, таким как иминодиуксусная кислота (Ni-IDA) и нитрилотриуксусная кислота (Ni-NTA) для никеля и карбоксиметиласпартат (Co-CMA) для кобальта, с которой полигистидиновый тег связывается с микромолярной аффинностью. Затем смолу обычно промывают фосфатным буфером для удаления белков, которые специфически не взаимодействуют с ионом кобальта или никеля. При применении способов на основе Ni эффективность промывки может быть улучшена за счет добавления 20 мМ имидазола (как правило, белки элюируют с помощью 150-300 мМ имидазола).
Несмотря на то, что подход с применением His-тега удобен для очистки, присутствие ненативных полигистидиновых мотивов в терапевтических белках, включая белок AnxA5, является нежелательным, так как это может привести к развитию неблагоприятных эффектов у пациентов, таким как иммунологические реакции. Кроме того, попытки удаления мотивов His-тегов после продукции белка являются обременительными, трудоемкими и высокозатратными, при этом на практике белковые препараты, из которых были удалены His-теги, как правило, сохраняют один или большее количество внешних гистидиновых остатков.
Следовательно, является предпочтительным вариант, когда белок AnxA5 не включает в себя His-тег, а для его выделения и очистки не применяется этап аффинного связывания с последовательностью His-тега.
Белок AnxA5 по данному изобретению может представлять собой или не представлять собой (предпочтительно не представлять собой) вариант варианта или мутанта белка, имеющего последовательность аннексина A5 человека, который модифицирован с целью содержания одного или большего количества, например, до двадцати, мотивов RGD (аргинин-глицин-аспартат), как описано в WO 2010/140886, содержание которого включено в данный документ посредством ссылки. Как описано в WO 2010/140886, добавление одного или большего количества мотивов RGD можно осуществлять для усиления фагоцитоза с применением вариантов AnxA5, которые связываются с фосфатидилсерином (PS) на апоптотических клетках и активируют фагоциты для поглощения апоптотической клетки вместо ингибирования фагоцитоза.
B. Культура клеток-хозяев
Белок AnxA5 может быть экспрессирован рекомбинантно в культуре клеток-хозяев. Предпочтительными культурами клеток-хозяев, которые экспрессируют белок AnxA5, согласно данному изобретению, являются культуры, которые доступны в промышленном масштабе для продукции белка AnxA5, такие как культуры с объемом культивирования около 100 л, около 200 л, около 300 л, около 400 л, около 500 л , около 600 л, около 700 л, около 800 л, около 900 л, около 1000 л, около 2000 л, около 3000 л, около 4000 л, около 5000 л, около 6000 л, около 7000 л, около 8000 л, около 9000 л, около 10 000 л, около 20 000 л, около 30 000 л, около 40 000 л, около 50 000 л, около 60 000 л, около 70 000 л, около 80000 л, около 90 000 л, около 100 000 л или больше. Термин "около" в этом контексте может включать в себя значение ± 50%, 40%, 30%, 20%, 10%, 5%, 4%, 3%, 2% или 1% от указанного объема.
Способы рекомбинантной экспрессии представляющего интерес гена хорошо известны в данной области техники.
Как правило, нуклеотидную последовательность, кодирующую белок AnxA5, в культуре клеток-хозяев экспрессируют рекомбинантно. Например, последовательность, кодирующую белок AnxA5, можно вводить в клетку-хозяина путем трансформации клетки-хозяина с помощью плазмиды или другого вектора, содержащего последовательность, кодирующую белок AnxA5, и, необязательно, последовательность, кодирующая белок AnxA5, можно интегрировать в хромосомы (или пластомы) клетки-хозяина или поддерживать на реплицируемом внехромосомном векторе.
Соответственно, клетка-хозяин может быть трансформирована полинуклеотидной векторной конструкцией, содержащей последовательность, кодирующую белок AnxA5.
Клетка-хозяин может быть либо прокариотической, либо эукариотической.
В контексте данного изобретения бактериальные клетки являются предпочтительными прокариотическими клетками-хозяевами. Бактериальные клетки-хозяева могут быть, например, грамположительными или грамотрицательными клетками-хозяевами (хотя также можно применять грамнейтральные и грамвариабельные бактерии). Примеры грамотрицательных бактерий включают в себя, но не ограничиваются ими, Escherichia coli, Salmonella, Shigella, Pseudomonas, Neisseria, Haemophilus influenzae, Bordetella pertussis и Vibrio cholera.
По меньшей мере, в контексте первого аспекта данного изобретения и, необязательно, в контексте всех аспектов данного изобретения, клетка-хозяин является эндотоксин-продуцирующей клеткой-хозяином с клеточной стенкой и, следовательно, обычно представляет собой грамотрицательные бактерии, такие как E. coli, например, штаммы E. coli DH5, доступные от компании Bethesda Research Laboratories Inc., Бетесда, штат Мэриленд, США, и RR1, доступные в Американской коллекции типовых культур (ATCC) Роквилл, штат Мэриленд, США (No ATCC 31343).
Во избежание неоднозначности толкования термин "эндотоксин-продуцирующая клетка-хозяин с клеточной стенкой" может быть объяснен таким образом, что исключает дрожжи, такие как Saccharomyces cerevisiae и другие эукариотические клетки.
Еще одним особенно предпочтительным эндотоксин-продуцирующим штаммом E. coli является штамм BL21 (DE3) (например, который широкодоступный на рынке и описанный в Marder et al., 2014, BMC Biotechnology, 14:33). Однако заявителем было обнаружено, что аннексин А5, экспрессированный из штамма BL21 (DE3), неожиданно демонстрировал непредвиденно высокие уровни нежелательного посттрансляционного глюконоилирования, в результате чего около 40% белка аннексина A5 получали глюконоилированным. Это намного выше уровня глюконоилирования для большинства других рекомбинантно экспрессированных белков в BL21 (DE3), которые обычно демонстрируют уровни, составляющие около 5-10% глюконоилирования. Поэтому более предпочтительно, чтобы эндотоксин-продуцирующий штамм E. coli представлял собой штамм BL21 (DE3), который позволяет снизить уровень глюконоилирования белка AnxA5, например, путем сверхэкспрессирующей фосфоглюконолактоназы (PGL), как описано в публикации Aon et al. (Appl. Env. Microbiol., 2008, 74(4): 950-958; содержание которой включено в данный документ посредством ссылки) и тем самым подавить посттрансляционное глюконоилирование рекомбинантно экспрессированного белка и, таким образом уменьшить образование глюконоилированных вариантов белка AnxA5 до уровня ниже 40%, например, ниже 30%, 20%, 10%, 9%. 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% и предпочтительно по существу до 0%.
Как правило, бактериальная клетка-хозяин для применения в данном изобретении представляет собой бактериальную клетку-хозяина со стенкой и поэтому предпочтительно исключает клетки, лишенные клеточной стенки, а также (в случае грамотрицательных бактерий) наружной мембраны, такой как сферопласт (как описано в публикации Liu et al, 2006, J. Exp. Microbiol., 9: 81-85; содержание которой включено в данный документ посредством ссылки). Сферопласты в контексте данной заявки не являются эндотоксин-продуцирующими клетками-хозяевами и не имеют клеточной стенки. Сферопласты совершенно непригодны для промышленного производства, особенно из-за их чувствительности и хрупкости, учитывая отсутствие клеточной стенки, что серьезно ограничивает их способность продуктивно выращиваться в больших объемах.
Необязательно, клетка-хозяин представляет собой эндотоксин-продуцирующая клетку-хозяина с клеточной стенкой, которая не может быть лизирована с помощью воздействия осмотическим шоком и/или замораживания/оттаивания.
В еще одном варианте культура клеток-хозяев представляет собой культуру, в которой клетка-хозяин не культивируется или не была культивирована в присутствии антибиотика, к которому она не имеет резистентности, и, необязательно, в отсутствие любого антибиотика. Конкретными антибиотиками, которых следует избегать, в одном варианте осуществления данного изобретения являются антибиотики, которые приводят к образованию сферобластов, такие как ампициллин.
Эукариотические клетки-хозяева могут включать клетки дрожжей и млекопитающих, предпочтительно клетки позвоночных, такие как линии клеток мыши, крысы, обезьяны или линии фибробластических клеток человека. Дрожжевые клетки-хозяева включают YPH499, YPH500 и YPH501, которые являются общедоступными от компании Stratagene Cloning Systems, Ла-Джолла, штат Калифорния, 92037, США. Предпочтительные клетки-хозяева млекопитающих включают клетки яичника китайского хомячка (CHO), доступные в АТСС как CCL61, эмбриональные клетки мыши NIH Swiss NIH/3T3, доступные в АТСС как CRL 1658, и клетки COS-1, получаемые от обезьян и доступные в АТСС как CRL 1650. Предпочтительными клетками насекомых являются клетки Sf9, которые могут быть трансфицированы экспрессионными векторами бакуловируса.
Типовыми прокариотическими векторными плазмидами являются: pUC18, pUC19, pBR322 и pBR329, доступные от компании Biorad Laboratories (Ричмонд, штат Калифорния, США); pTrc99A, pKK223-3, pKK233-3, pDR540 и pRIT5, доступные от компании Pharmacia (Пискатауэй, штат Нью Джерси, США); векторы pBS, векторы Phagescript, векторы Bluescript, pNH8A, pNH16A, pNH18A, pNH46A, доступные от компании Stratagene Cloning Systems (Ла-Джолла, штат Калифорния 92037, США).
Типовой векторной плазмидой клеток млекопитающих является pSVL, доступная от компании Pharmacia (Пискатауэй, штат Нью Джерси, США). Этот вектор использует поздний промотор SV40 для стимулирования экспрессии клонированных генов, причем самый высокий уровень экспрессии обнаруживается в клетках, продуцирующих T-антиген, таких как клетки COS-1. Примером индуцируемого экспрессионного вектора млекопитающих является pMSG, также доступный от компании Pharmacia (Пискатауэй, штат Нью Джерси, США). Этот вектор использует индуцируемый глюкокортикоидом промотор длинного концевого повтора вируса опухоли молочной железы мыши для стимуляции экспрессии клонированного гена.
Пригодные дрожжевые плазмидные векторы включают pRS403-406 и pRS413-416, которые являются общедоступными от компании Stratagene Cloning Systems (Ла-Джолла, штат Калифорния, 92037, США). Плазмиды pRS403, pRS404, pRS405 и pRS406 представляют собой дрожжевые интегрирующие плазмиды (YIps) и включают селективные маркеры дрожжей HIS3, TRP1, LEU2, а также URA3. Плазмиды pRS413-416 представляют собой дрожжевые центромерные плазмиды (YCps).
Способы, хорошо известные специалистам в данной области техники, могут применяться для конструирования экспрессионных векторов, содержащих последовательность, кодирующую белок AnxA5, и, например, пригодных транскрипционных или трансляционных контролей. Один из таких способов включает лигирование посредством гомополимерных хвостов. Гомополимерные полидА (или полидC) хвосты добавляют с целью воздействия 3'-OH-групп на фрагмент ДНК, который необходимо клонировать посредством терминальных дезоксинуклеотидилтрансфераз. После этого фрагмент обретает способность к отжигу до хвостов полидT (или полидG), добавленных к концам линеаризованного плазмидного вектора. Промежутки, оставшиеся после отжига, могут быть заполнены ДНК-полимеразой и свободными концами, соединенными с помощью ДНК-лигазы.
Другой способ включает лигирование посредством "липких концов". Совместимые "липкие концы" можно сгенерировать на фрагменте и векторе ДНК под действием пригодных рестрикционных ферментов. Эти концы будут быстро отжигать посредством комплементарного спаривания оснований, а оставшиеся одноцепочечные разрывы можно закрыть с помощью действия ДНК-лигазы.
В другом способе применяются синтетические молекулы, называемые линкерами и адапторами. Фрагменты ДНК с тупыми концами генерируют с помощью Т4 ДНК-полимеразы бактериофага или ДНК-полимеразы I Е. coli, которые удаляют выступающие 3'-концы и заполняют утопленные 3'-концы. Синтетические линкеры, фрагменты двухцепочечной ДНК с тупым концом, которые содержат распознающие последовательности для определенных рестрикционных ферментов, можно лигировать с фрагментами ДНК с тупыми концами с помощью T4 ДНК-лигазы. Затем их расщепляют с помощью соответствующих рестрикционных ферментов для создания "липких концов" и лигируют с экспрессионным вектором совместимыми концами. Адаптеры также представляют собой химически синтезированные фрагменты ДНК, которые содержат один тупой конец, применяемый для лигирования, но также имеют один предварительно сформированный "липкий конец".
Синтетические линкеры, содержащие множество участков рестрикционной эндонуклеазы, коммерчески доступны из ряда источников, включая компанию International Biotechnologies Inc, Нью-Хейвен, штат Коннектикут, США.
Желательным способом модификации ДНК, кодирующей белок AnxA5, является применение полимеразной цепной реакции, как описано Saiki et al (1988) Science 239, 487-491. В этом способе ДНК, подлежащую ферментативной амплифиции, фланкируют двумя специфическими олигонуклеотидными праймерами, которые сами встраиваются в амплифицированную ДНК. Указанные специфические праймеры могут содержать участки распознавания рестрикционной эндонуклеазы, которые могут применяться для клонирования в экспрессионные векторы с помощью способов, известных в данной области техники.
Трансформация соответствующих клеток-хозяев с применением конструкции ДНК, содержащей последовательность, кодирующую белок AnxA5, осуществляется с помощью общеизвестных способов, которые обычно зависят от типа применяемого вектора.
В части, касающейся трансформации прокариотических клеток-хозяев, см., например, Cohen et al (1972) Proc. Natl. Acad. Sci. USA 69, 2110 и Sambrook et al (2001) Molecular Cloning, A Laboratory Manual, 3rd Ed. Cold Spring Harbor Laboratory, Cold Spring Harbor, NY. Трансформация дрожжевых клеток описана в Sherman et al (1986) Methods In Yeast Genetics, A Laboratory Manual, Cold Spring Harbor, NY. Также можно применять способ Беггса (1978)Nature 275, 104-109. В части, касающейся клеток позвоночных, реагенты, пригодные для трансфекции таких клеток, например, фосфат кальция и DEAE-декстран или липосомные составы, доступны от компании Stratagene Cloning Systems или Life Technologies Inc., Гейтерсберг, штат Мэриленд, 20877, США.
Электропорация также является пригодной для трансформации клеток и хорошо известна в данной области техники для трансформации дрожжевых клеток, бактериальных клеток и клеток позвоночных.
Например, многие виды бактерий могут быть трансформированы с помощью способов, описанных в публикации Luchansky et al (1988) Mol. Microbiol. 2, 637-646, которая включена в данный документ посредством ссылки. Наибольшее количество трансформантов последовательно восстанавливают после электропорации смеси ДНК-клеток, суспендированной в 2,5X PEB, с применением 6250 В на см при 25 μFD.
Способы трансформации дрожжей с помощью электропорации описаны в Becker & Guarente (1990) Methods Enzymol. 194, 182.
Физические способы можно применять для введения ДНК в клетки животных и растений. Например, для микроинъекции применяется очень тонкая пипетка для введения молекул ДНК непосредственно в ядро клеток, подлежащих трансформации. Другим примером является бомбардировка клеток высокоскоростными микрочастицами, обычно частицами золота или вольфрама, которые покрыты ДНК.
Успешно трансформированные клетки, т.е. клетки, которые содержат ДНК-конструкцию, содержащую последовательность, кодирующую белок AnxA5, могут быть идентифицированы с помощью хорошо известных способов. Например, одна методика выбора предусматривает включение в экспрессионный вектор последовательности ДНК (маркера), которая кодирует выбираемый признак в трансформированной клетке. Эти маркеры включают дигидрофолатредуктазу, G418 или гены резистентности к неомицину для культуры эукариотичесих клеток, а также гены резистентности к тетрациклину, канамицину или ампициллину для культивирования в Е. coli и других бактериях. В альтернативном варианте ген для такого выбираемого признака может быть на другом векторе, который применяется для совместной трансформации желаемой клетки-хозяина.
Маркерный ген можно применять для идентификации трансформантов, но желательно определить, какая из клеток содержит молекулы рекомбинантной ДНК и которые содержат самолигированные векторные молекулы. Это может быть достигнуто с применением клонирующего вектора, при этом введение фрагмента ДНК разрушает целостность одного из генов, присутствующих на молекуле. Поэтому рекомбинанты могут быть идентифицированы на основании потери функции этого гена.
Другой способ идентификации успешно трансформированных клеток включает в себя выращивание клеток, полученных в результате введения экспрессионной конструкции, содержащей последовательность, кодирующую белок AnxA5, для получения полипептида по данному изобретению. Клетки можно собирать и лизировать, а их содержание ДНК исследовать на присутствие ДНК с помощью способа, описанного Southern (1975) J. Mol. Biol. 98, 503 или Berent et al (1985) Biotech. 3, 208. В альтернативнои варианте, присутствие белка в супернатанте можно обнаружить с применением антител, как описано ниже.
В дополнение к прямому анализу на присутствие рекомбинантной ДНК, успешную трансформацию можно подтвердить с помощью хорошо известных иммунологических способов, когда рекомбинантная ДНК способна направлять экспрессию белка. Например, клетки, успешно трансформированные экспрессионным вектором, продуцируют белки, проявляющие соответствующую антигенность. Образцы клеток с ожидаемой трансформацией собирают и анализируют на белок с применением пригодных антител.
Таким образом, сами трансформированные клетки-хозяева можно культивировать для получения трансформированной культуры клеток-хозяев, экспрессирующих белок AnxA5. Культурой может быть моноклональная (клонально гомогенная) культура или культура, полученная из моноклональной культуры, в питательной среде.
Культуру трансформированных клеток-хозяев, экспрессирующих белок AnxA5, выращивают в пригодных условиях выращивания до достижения требуемой плотности клеток, которую, как правило, выбирают так, чтобы сбалансировать производительность по времени и стоимости, ассоциированной с культуральной фазой, после чего клетки, как правило, собирают. Оптимальное время сбора клеток можно определить эмпирически для любой данной культуры.
Например, сбор клеток может включать сбор клеток-хозяев (которые, как правило, являются интактными и которые, как правило, сохраняют по существу весь (например, более 80%, 90%, 95%, 99% или 100%) белок AnxA5 внутриклеточно) из культуральной среды. Как правило, это может быть достигнуто путем центрифугирования или фильтрации, для сбора культивируемых клеток-хозяев в виде биомассы. В случае центрифугирования супернатант можно извлечь, и клеточный осадок можно перенести прямо или опосредовано (например, после хранения, например замораживания) для применения в этапе гомогенизации культуры клеток.
C. Гомогенизация культуры клеток
Как обсуждалось выше, первый аспект данного изобретения обеспечивает оптимизированный этап высвобождения белка из клетки-хозяина. Более конкретно, в первом аспекте предлагается способ выделения и/или очистки рекомбинантно экспрессированного внутриклеточного белка, содержащего последовательность аннексина A5 (AnxA5), из клетки-хозяина, продуцирующей эндотоксин, с клеточной стенкой, при этом указанный способ включает высвобождение внутриклеточного белка из клетки-хозяина, и характеризуется тем, что этап высвобождения внутриклеточного белка AnxA5 проводят в присутствии буфера для гомогенизации, содержащего неионный детергент.
Предпочтительно неионным детергентом является полисорбат, более предпочтительно полисорбат, выбранный из Твин 20 и Твин 80, а наиболее предпочтительно - Твин 80. В альтернативном, хотя и менее предпочтительном варианте можно применять другой неионный детергент, хотя предпочтительно избегать (как на этапе гомогенизации культуры клеток, так и на любых других этапах способа) применения неионных детергентов, которые характеризуются показателем УФ-абсорбции λmax, который является аналогичным показателю максимуму абсорбции белков в диапазоне между 275 и 280 нм, так как это может препятствовать способности УФ-абсорбции контролировать наличие белка в процессе выделения. В этом контексте термин "аналогичный" может включать в себя λmax, который находится в пределах 10 нм, 9 нм, 8 нм, 7 нм, 6 нм, 5 нм, 4 нм, 3 нм, 2 нм или 1 нм максимумов абсорбции белка AnxA5, являющегося очищенным. Так, например, может быть предпочтительно, чтобы неионогенный детергент был не Тритоном X-100, который имеет λmax = 275 нм, и поэтому может быть предпочтительно, чтобы Тритон X-100 не применяли на этапе гомогенизации культуры клеток и или на любом другом этапе способа по данному изобретению.
Следует отметить, что неионный детергент можно включить в буфер для гомогенизации, который добавляют к клеткам (например, буфер для гомогенизации может быть "предварительно сформирован" с присутствующим неионным детергентом); или клетки можно суспендировать в буфере для гомогенизации без неионного детергента, а затем неионный детергент можно добавить и смешать с суспендированными клетками в буфере для гомогенизации перед гомогенизацией клеток для высвобождения внутриклеточного белка AnxA5.
Предпочтительно этап высвобождения внутриклеточного белка AnxA5 проводят в присутствии буфера для гомогенизации, содержащего количество неионного детергента, которое эффективно снижает (например, на 50%, 60%, 70%, 80%, 90%, 95%, 98%, 99% или более) или предотвращает связывание аннексина A5 с эндотоксином. Уровни эндотоксинов можно измерить с помощью способов, хорошо известных и общепринятых в данной области техники, например, с помощью теста с лизатом амебоцитов мечехвоста (LAL).
Например, буфер для гомогенизации может содержать от 0,01 до 10% (мас./мас.) неионного детергента, например, от 0,02 до 5% (мас./мас.), от 0,05 до 2% (мас./мас.) или около 1% (мас./мас.) неионного детергента. Термин "около" в этом контексте может включать в себя значение ± 0,5%, 0,4%, 0,3%, 0,2% или 0,1% (мас./мас.).
Предпочтительно не добавлять или не включать в буфер для гомогенизации никаких ионов кальция или ионизируемых соединений кальция (таких как CaCl2) Соответственно, предпочтительно, чтобы концентрация свободного кальция в буфере для гомогенизации во время высвобождения внутриклеточного белка AnxA5 из клетки-хозяина была ниже 10 мМ, предпочтительно ниже 5 мМ, 4 мМ, 3 мМ, 2 мМ или 1 мМ, более предпочтительно ниже 500 мкM, 400 мкM, 300 мкM, 200 мкM, 100 мкM, 50мкM, 40 мкM, 30 мкM, 20 мкM, 10 мкM, 5 мкM, 4 мкM, 3 мкM, 2 мкм, 1 мкм или по существу нуль.
В одном варианте осуществления данного изобретения буфер для гомогенизации может содержать хелатор ионов металлического кальция. Может быть предпочтительным, с учетом необязательных последующих этапов, включающих ферментативную обработку, при которой такие ферменты используют Mg2+ в качестве кофактора, выбирать хелатор ионов кальция, который не сильно связывает Mg2+, такой как этиленгликольтетрауксусная кислота (ЭГТА). В альтернативном варианте необязательные последующие этапы, включающие ферментативную обработку, при которой такие ферменты используют Mg2+ в качестве кофактора, можно заменить другими этапами, не требующими Mg2+. В этом случае любой хелатор ионов кальция, такой как ЭГТА или этилендиаминтетрауксусная кислота (ЭДТА), можно включить в буфер для гомогенизации.
Необязательно, концентрация свободных ионов кальция и/или количество хелатора ионов кальция в буфере для гомогенизации представляет (или представляют) собой количество, эффективное для уменьшения (например, на 50%, 60%, 70%, 80%, 90 %, 95%, 98%, 99% или более) или предотвращения связывания между аннексином A5 и компонентами клеточной мембраны и/или стенки клетки-хозяина, например, по сравнению с уровнем связывания, который наблюдался бы в присутствии буфера для гомогенизации, состоящего из 50 мМ Трис-HCl, 10 мМ CaCl2 при рН 7,2.
Например, буфер для гомогенизации согласно первому аспекту данного изобретения может содержать от 0,01 до 500 мМ, например от 0,05 до 100 мМ, от 0,5 до 20 мМ, от 1 до 15 мМ, от 2 до 10 мМ или около 4 мМ хелатора ионов металлического кальция, и предпочтительно, при этом хелатор ионов металлического кальция представляет собой ЭДТА или ЭГТА.
Как обсуждалось выше, этап гомогенизации культуры клеток согласно первому аспекту данного изобретения не включает этап центрифугирования для очистки и отделения высвобождаемого белка AnxA5 от дебриса клеток-хозяев. Тем не менее с целью установления толерантности к свободным ионам кальция и/или эффективному количеству хелатора ионов кальция в буфере для гомогенизации, можно провести простой тест с применением этапа центрифугирования на аликвоте лизированных клеток. После гомогенизации клеток, аликвоту (например, 100 мл) лизированных клеток подвергают центрифугированию (например, при 38,900 г в течение 30 минут), а затем отделяют супернатант и осадок. Для получения уровня "свободного" белка AnxA5 определяют количество белка AnxA5 в супернатанте. Осадок ресуспендируют в 50 мМ Трис-HCl, 20 мМ ЭДТА, pH 7,2, при перемешивании в течение 30 минут при 4°C, чтобы высвободить любой связанный белок AnxA5, а затем центрифугируют при 38,900 г в течение 30 минут при 4°C, и для получения уровня «связанного» белка AnxA5 определяют количество связанного белка AnxA5, которое высвобождается в супернатант. В этом контексте процент связывания AnxA5 с компонентами клеточной мембраны и/или стенки клетки-хозяина = (уровень "связанного" белка AnxA5 / (уровень "связанного" белка AnxA5 + "свободного" белка AnxA5)) x 100.
Предпочтительно, как определено вышеописанным способом, процент связанного AnxA5 в полученном гомогенате биомассы составляет менее 50%, 40%, 30%, 25%, 24%, 23%, 22%, 21%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3% 2%, 1%, 0,5%, 0,1% или по существу 0%.
Несмотря на то, что этот термин упоминается в данном документе как "буфер для гомогенизации", для раствора не обязательно важно быть буфером рН. Однако необязательно буфер для гомогенизации может дополнительно содержать дополнительные компоненты, включая буферы (например, Трис), и необязательно может быть доведен, по необходимости, например, до около рН 6-8, более предпочтительно в диапазоне рН 7-8,5, например, рН 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1, 8,2, 8,3, 8,4 или 8,5. В одном варианте осуществления данного изобретения для применения можно выбрать рН 7,4.
Как обсуждалось выше, в некоторых вариантах, в которых последующие этапы включают ферментативную обработку ферментами, требующих кофакторов, таких как Mg2+, также может быть предпочтительным включение кофактора в буфер для гомогенизации.
В одном типовом варианте осуществления данного изобретения буфер для гомогенизации для применения согласно первому аспекту данного изобретения содержит, состоит по существу из, или состоит из водного раствора 50 мМ Трис, рН 7,4, 1 мМ MgCl2 и 1% (мас./мас.) Твин 80.
Способ по первому аспекту данного изобретения может включать этап смешивания биомассы из культуры клеток-хозяев в буфере для гомогенизации в концентрации от 1 до 300 г биомассы (влажный вес) на литр буфера для гомогенизации, например, при концентрации от 10 до 200 г биомассы на литр буфера для гомогенизации. Типовые концентрации могут составлять около 10 г/л, 20 г/л, 30 г/л, 40 г/л, 50 г/л, 60 г/л, 70 г/л, 80 г/л, 90 г/л, 100 г/л, 110 г/л, 120 г/л, 130 г/л, 140 г/л, 150 г/л, 160 г/л, 170 г/л, 180 г/л, 190 г/л или 200 г/л. Особенно предпочтительным является коэффициент ресуспендирования около 100 г биомассы на литр буфера для гомогенизации. В этом контексте термин "около" предназначен для включения ± 5 г/л, 4 г/л, 3 г/л, 2 г/л или 1 г/л от указанного значения.
Как правило, смешивание проводят при комнатной температуре, т.е., как правило, около 18°C до 28°C, например, около 19°C, 20°C, 21°C, 22°C, 23°C, 24°C, 25°C, 26°C или 27°C. Предпочтительно контролировать температуру во время процесса смешивания для поддержания ее на уровне или около (например, ± 5, 4, 3, 2 или 1°C) показателя температуры, выбранного из приведенного выше перечня, хотя активный контроль температуры на этом этапе обычно не требуется.
Необязательно буфер гомогенизации может также включать один или большее количество ферментов, пригодных для ферментативной обработки, которые можно также добавить к буферу после смешивания с биомассой, но перед гомогенизацией клеток-хозяев. Например, может быть целесообразным включать или добавлять один или большее количество ферментов нуклеазы, чтобы способствовать расщеплению нуклеиновых кислот (включая ДНК и/или РНК) в клетках-хозяевах после гомогенизации. Это уменьшит вязкость получаемого впоследствии гомогената и тем самым помогает в последующих этапах обработки. С этой целью можно применять любые пригодные ферменты. Фермент может представлять собой, например, нуклеазу, такую как нуклеаза А, предпочтительно нуклеаза А из Serratia marescens. Одним из таких типовых ферментов, представляющих интерес, является нуклеаза бензоназы, эндонуклеаза из Serratia marcescens, которая доступна из многочисленных коммерческих источников, включая Merck/Novagen, Sigma Aldrich и тому подобное, которые можно применять для расщепления всех форм ДНК и РНК при отсутствии протеолитической активности. Указанный фермент эффективен в широком диапазоне условий и обладает высокой специфической активностью. Фермент полностью расщепляет нуклеиновые кислоты до 5'-монофосфатных конечных олигонуклеотидов длиной от 2 до 5 оснований (ниже предела гибридизации), что идеально подходит для удаления нуклеиновых кислот из рекомбинантных белков и позволяет соблюдать рекомендации FDA относительно контаминации нуклеиновой кислоты. Для активации фермента бензоназы необходимо 1-2 мМ Mg2+, при этом фермент остается активным в присутствии ионных и неионных детергентов, восстановителей, ингибитора протеазы PMSF (1 mM), хелатора ЭДТА (1 мМ) и мочевины (относительная активность зависит от конкретных условий). Специалист в данной области техники легко сможет определить эффективную концентрацию таких нуклеазных ферментов, хотя заявитель обнаружил, что бензоназа эффективна по меньшей мере при применении предварительно разбавленной до концентрации около 3,3 Ед на литр культуры клеток-хозяев или около 1,85 Ед на литр ресуспендированной биомассы. Термин "около" в этом контексте может включать ± 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20% или 10% от указанного количества единиц.
Этап высвобождения внутриклеточного белка AnxA5 из клетки-хозяина в буфере для гомогенизации может основываться на любом подходе к гомогенизации или лизису клеток. Например, указанный этап может включать лизирование, разрушение или другое гомогенизирующее, ультразвуковое воздействие или воздействие давлением на клетку-хозяина, в результате чего клеточная стенка и барьер клеточной мембраны клетки-хозяина разрушаются и, как следствие, высвобождается внутриклеточный белок AnxA5. В некоторых вариантах первого аспекта данного изобретения этот этап не включает воздействие осмотическим шоком и/или этап замораживания-оттаивания.
В одном предпочтительном варианте осуществления первого аспекта данного изобретения этап высвобождения внутриклеточного белка AnxA5 из клетки-хозяина включает гомогенизацию под высоким давлением, например, один или большее количество циклов гомогенизации под высоким давлением в диапазоне от около 400 бар до около 2500 бар, предпочтительно три цикла гомогенизации около 600 бар или два цикла гомогенизации около 800 бар. В этом контексте термин "около" может включать в себя ± 500, 400, 300, 200, 100, 50, 40, 30, 20 или 10 бар указанного значения.
Необязательно, например, в ситуациях, когда ферменты нуклеазы не добавляли для расщепления нуклеиновых кислот (например, когда концентрации Mg2+ в буфере для гомогенизации являются слишком низкими, например, из-за включения хелатора Mg2+), то может оказаться полезным осуществить несколько дополнительных циклов гомогенизации под высоким давлением (например, от 2 до 4 циклов при давлении в диапазоне от около 600 до 2500 бар) для расщепления нуклеиновых кислот и снижения вязкости гомогената.
Соответственно, после гомогенизации клеток в результате этапа высвобождения внутриклеточного белка AnxA5 можно получить гомогенат биомассы, содержащий высвобожденный белок AnxA5. Предпочтительно гомогенат биомассы является гомогенным; при этом под этим термином следует понимать, что по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, 96%, 97%, 98%, 99% или по существу 100% клеток биомассы являются дезинтегрированными.
В зависимости от применяемого принципа гомогенизации клеток метод может обуславливать повышение температуры гомогената. Может быть предпочтительнее применять метод гомогенизации клеток таким образом, чтобы предотвращать нежелательное повышение температуры, и/или осуществлять регулирование температуры с этой целью. Однако, например, в случае, когда гомогенат обрабатывают ферментом, таким как бензоназа, тогда может быть целесообразно осуществлять повышение температуры для приближения к оптимальному температурному диапазону фермента и, предпочтительно, внутри него. В случае применения бензоназы диапазон температуры от 36 до 40°C может быть особенно пригодным.
В том случае, если процесс гомогенизации клеток включает ферментативную обработку ферментом, для которого необходим кофактор ионов металлов (например, Mg2+), и, кроме того, в случае, когда буфер для гомогенизации исключает хелатор ионов металлического кальция, то в одном из вариантов хелатор ионов кальция можно добавить после завершения ферментативной обработки. Это может происходить до или после этапа осветления, как описано ниже.
После гомогенизации клеток гомогенат биомассы, как правило, дополнительно содержит одну или большее количество (как правило, все) примесей, выбранных из группы, состоящей из белков клетки-хозяина, компонентов стенки клетки-хозяина, компонентов мембраны клетки-хозяина, нуклеиновой кислоты клетки-хозяина и эндотоксина.
Предпочтительно, чтобы вязкость гомогената была достаточно низкой, чтобы помочь в последующих этапах обработки.
D. Осветление гомогената
Необязательно, и в предпочтительном варианте осуществления данного изобретения, после получения гомогената биомассы, его обрабатывают на этапе осветления.
Соответственно, в дополнительном варианте осуществления первого аспекта данного изобретения способ дополнительно включает этап осветления гомогената биомассы, в результате чего получают осветленный продукт, содержащий высвобожденный белок AnxA5. Этот этап проводится для уменьшения содержания нуклеиновых кислот и, кроме того, для получения раствора с уменьшенным количеством частиц, который можно применять на последующих этапах очистки, таких как хроматография захвата, как описано ниже.
Можно осуществить любой пригодный этап очистки или комбинацию этапов. Например, способ осветления может включать (предпочтительно после обработки нуклеазой) этап пропускания гомогената биомассы, содержащего высвобожденный белок AnxA5, через фильтр, такой как целлюлозный или полипропиленовый фильтр, в котором фильтрат представляет собой осветленный продукт, содержащий высвобожденный белок AnxA5.
Предпочтительно фильтр представляет собой глубинный фильтр и/или предпочтительно фильтр имеет границу пропускания, составляющую менее 4 мкм, например, границу пропускания, составляющую менее 3мкм, 2мкм или 1мкм, и наиболее предпочтительно границу пропускания в пределах от 0,2 до 0,6мкм. Например, гомогенат можно очистить фильтрованием с применением глубинного фильтра с границей пропускания 0,6-0,2 мкм; примеры такого фильтра являются коммерчески доступными, например, такие как доступные глубинные фильтры Cuno 60 SP на основе целлюлозы. Примеры других глубинных фильтров, которые обеспечивают надлежащую производительность (т.е. надлежащую фильтрацию без потери продукта), хотя и несколько меньшую по сравнению с предпочтительными глубинными фильтрами с целлюлозой Cuno 60 SP с границей пропускания 0,6-0,2 мкм, включают в себя фильтр с целлюлозы + кизельгура с границей пропускания 0,5 мкм (например, фильтр PR12 UP, который доступный от компании Begerow); полипропиленовый фильтр с границей пропускания 1,2 мкм (например, фильтр Sartopure PP2, который доступный от компании Sartorius); целлюлозный фильтр с границей пропускания 0,1 мкм (например, фильтр Sartoclear S9, который доступный от компании Sartorius); полипропиленовый фильтр с границей пропускания 0,65 мкм (например, фильтр Sartopure PP2, который доступный от компании Sartorius); и целлюлозный фильтр с границей пропускания 0,2-0,5 мкм (например, фильтры K 1P или EKM-P, оба из которых доступны от компании Pall, с надлежащей производительностью, но низкой скоростью фильтрования). Дальнейшие испытания показали, что с помощью фильтров с большой границей пропускания (например, > 4 мкм) достигается только умеренное удаление частиц, и поэтому они менее предпочтительны.
Заявитель также обнаружил, что положительно заряженные фильтры на основе целлюлозы дополнительно уменьшают содержание ДНК в осветленном гомогенате и поэтому могут представлять собой особенно предпочтительный класс фильтров для применения на этапе осветления.
Кроме того, было обнаружено, что фильтры на основе целлюлозы требуют меньшей площади фильтра для обеспечения эффективного осветления по сравнению с соответствующими полипропиленовыми фильтрами. Это может быть еще одной причиной для особого предпочтения класса фильтров на основе целлюлозы для применения на этапе осветления.
Выбор области фильтра также может зависеть от степени и характера применяемой гомогенизации. Например, заявитель обнаружил, что в случае гомогенизации клеток с выполнением трех циклов гомогенизации около 600 бар, площадь фильтра составляет около 60 см2 на 1 л гомогената, тогда как в случае гомогенизации клеток с двумя циклами гомогенизации около 800 бар, площадь фильтра составляет около 180 см2 на 1 л гомогената. Соответственно, глубинный фильтр может быть необязательно выбран с площадью от 10 до 500 см2 на 1л осветленного гомогената, например, от 30 до 400 см2/л, от 40 до 250 см2/л, от 50 до 200 см2/л или от 60 до 180 см2/л, например, от 50-100 см2/л, или 60-80 см2/л; или от 120-240 см2/л, или 150-210 см2/л.
После осветления очищенный продукт можно дополнительно подготовить путем добавления одной или большего количества дополнительных добавок для применения в последующих этапах. Например, для кондиционирования осветленного продукта может быть пригодным добавление одного или обоих из веществ: (а) неионного детергента, такого как полисорбат, и наиболее предпочтительно Твин 80; и (b) хелатора ионов металлического кальция, такого как ЭДТА, если только осветленный продукт уже не содержит надлежащих уровней хелатора после его включения в буфер гомогенизации и/или добавления его после этапа ферментативной обработки.
В одном типовом варианте осуществления данного изобретения осветленный продукт разбавляют примерно в 2 раза 1% неионным детергентом (наиболее предпочтительно Твин 80) и добавляют хелатор ионов кальция (наиболее предпочтительно ЭДТА) до конечной концентрации около 2 мМ.
Еще одной предпочтительной особенностью способа по данному изобретению является отсутствие необходимости в каких-либо трудоемких этапах диализа для осветленного продукта перед дополнительными этапами хроматографического захвата, таких как анионообменный захват, как обсуждается ниже. Соответственно, в варианте осуществления данного изобретения осветленный продукт не подвергается диализу перед хроматографическим захватом белка AnxA5.
E. Анионообменный захват
Способ согласно первому аспекту данного изобретения может дополнительно включать этап подвергания освобожденного белка AnxA5 воздействию анионообменной смолы для выполнения первого этапа анионообменного захвата и, таким образом, получения продукта первого анионообмена, который содержит высвобожденный белок AnxA5.
Как правило, захват белка с помощью анионообменной хроматографии из бактериального (например, E. coli) гомогената/лизата не является стратегией первого выбора, так как высокие количества белков клетки-хозяина (БКХ) и ДНК связываются с захватной смолой, влияющей на связывающие способности целевого продукта и даже подтверждая эффективность смолы. Однако заявитель определил, что описанные выше процедуры гомогенизации и осветления клеток согласно первому аспекту данного изобретения являются эффективными для получения белкового продукта AnxA5, который можно эффективно дополнительно очистить с помощью анионообменной хроматографии.
Соответственно, в одном варианте осуществления данного изобретения осветленный продукт, содержащий высвобожденный белок AnxA5, полученный на этапе очистки гомогената/лизата и/или расщепления нуклеиновых кислот, как обсуждалось выше, подвергают первому этапу анионообменного захвата, в результате чего получают продукт первого анионообмена, который содержит высвобожденный белок AnxA5.
Необязательно, перед первым анионообменным этапом корректируется один или большее количество параметров среды высвобожденного белка AnxA5, выбранных из группы, состоящей из рН, проводимости, уровня хелатора ионов кальция и уровня неионного детергента. Например, белковая композиция AnxA5, которую подвергают анионообменному этапу, может быть составлена при рН около 6,9, необязательно ± 1, 0,9, 0,8, 0,7, 0,6, 0,5, 0,4, 0,3, 0,2 или 0,1 единицы рН (в одном варианте предпочтительный интервал составляет рН 6-8,5, более предпочтительно - 6,5-7,5, наиболее предпочтительно - 6,9. Заявитель обнаружил, что низкие значения рН в этом диапазоне (например, рН 6) имеют тенденцию обуславливать наличие детектируемых белков клетки-хозяина в элюированном продукте; в то время как степень разделения несколько уменьшается на уровне или выше рН 8. Композицию белка AnxA5, которая подвергается стадии обмена анионом, необязательно может быть отрегулирована с удельной проводимостью около 2,8 мСм/см, ± 1, 0,9, 0,8, 0,7, 0,6, 0,5, 0,4, 0,3, 0,2 или 0,1 мСм/см. После осветления очищенный продукт можно дополнительно подготовить путем добавления одной или большего количества дополнительных добавок для применения в последующих этапах. Как уже обсуждалось выше, для кондиционирования белковой композиции AnxA5, которая будет подвергаться анионообменному этапу, перед первым анионообменным этапом может быть пригодным добавление одного или обоих из веществ: (а) неионного детергента, такого как полисорбат, а наиболее предпочтительно Твин 80; и (b) хелатора ионов металлического кальция, такого как ЭДТА, если только осветленный продукт уже не содержит надлежащих уровней хелатора после его включения в буфер гомогенизации и/или добавления его после этапа ферментативной обработки. В одном типовом варианте осуществления данного изобретения белковую композицию AnxA5, которую подвергают анионообменному этапу, разбавляют примерно в 2 раза 1% неионным детергентом (наиболее предпочтительно Твин 80) и добавляют хелатор ионов кальция (наиболее предпочтительно ЭДТА) до конечной концентрации около 2 мМ.
В этом контексте, для усиления отделения белка AnxA5 от примесей клетки-хозяина (включая компоненты клеточной стенки, компоненты клеточной мембраны, эндотоксин, нуклеиновые кислоты и т.д.) на первом этапу анионообменного захвата может быть очень полезным применение неионного детергента и/или хелатора ионов металлического кальция для кондиционирования белковой композиции AnxA5, которую подвергают указанному первому этапу анионообменного захвата. Например, заявитель продемонстрировал высокоэффективное удаление эндотоксина (снижение уровня на около 99%) на первом этапе анионообменного захвата, проводимом при наличии неионного детергента и хелатора ионов металлического кальция.
Несмотря на то, что ниже в основном приведено обсуждение в контексте второго этапа анионообменной очистки, для варианта, в котором хелатор ионов кальция (например, ЭДТА) присутствует в белковой композиции AnxA5, которая подвергается первому этапу анионообменного захвата, для надлежащего функционирования указанного первого этапа анионообменного захвата также может быть полезными включение одного или большего количества типов дополнительных выбранных ионов металлов (не кальция), при этом дополнительные выбранные ионы металлов выбраны так, что хелатор ионов кальция характеризуется аффинностью связывания для выбранных ионов металлов, которая является выше, чем аффинность связывания для анионообменной смолы, но ниже, чем его аффинность связывания для ионов кальция. Одним из примеров ионов металла является Mg2+.
Как правило, перед приведением в контакт анионообменной смолы и продукта AnxA5 анионообменную смолу уравновешивают. С этой целью можно применять любой пригодный способ уравновешивания. Например, анионообменная смола может быть уравновешена буфером (например, 20 мМ Трис, рН 7,4), неионным детергентом (например, 0,1% полисорбатом, предпочтительно Твин 80) и солью (например, 25 мМ NaCl). Можно применять любой пригодный равновесный объем; без ограничения, заявитель обнаружил 3 объема колонки (ОК) в качестве пригодного объема в варианте осуществления данного изобретения, приведенного в качестве примера.
Предпочтительно первый этап анионообменного захвата выполняют в положительном режиме по отношению к белку AnxA5, и поэтому белок AnxA5 временно связывают с анионообменником во время анионообменного этапа, при этом, как правило, промывочный раствор пропускают через колонку для удаления примеси из связанного белка AnxA5, а затем продукт первого анионообмена, который содержит высвобожденный белок AnxA5, получают путем нанесения буфера для элюирования на анионообменную смолу для высвобождения связанного белка AnxA5.
Предпочтительными являются сильные анионообменные смолы, поскольку заявитель обнаружил, что они обеспечивают приемлемые возможности для захвата белка AnxA5, тогда как производительность со слабыми анионообменными смолами была менее приемлемой. Сильные анионообменные смолы хорошо известны в данной области техники, а их примеры включают в себя смолы с функциональной группой четвертичного аммония, такие как смола типа I, содержащая триалкиламмонийхлорид или гидроксид, или смолы типа II, содержащие диалкил 2-гидроксиэтиламмонийхлорид или гидроксид (например, Q Sepharose XL от компании GE Healthcare, Capto Q от компании GE Healthcare, Unosphere Q от компании Biorad или Eshmuno Q от компании Merck). Слабые анионообменные смолы не являются предпочтительными; их примеры включают в себя смолу DEAE с диэтиламиноэтильной функциональной группой. Смола Q Sepharose XL (например, предоставленная компанией GE Healthcare) может быть наиболее предпочтительной.
После загрузки на анионообменную смолу, в положительном режиме, белок AnxA5 временно связывается со смолой и может быть промыт для уменьшения/удаления примесей. Можно применять любые пригодные условия промывания. Например, промывочный раствор может содержать, состоять по существу, или состоять из водного раствора буфера (например, 20 мМ Трис, рН 7,4), неионного детергента (например, 0,1% полисорбата, предпочтительно Твин 80) и соли (например, 25 мМ NaCl). Можно применять любой пригодный объем для промывания; без ограничения, заявитель обнаружил 10 объемов колонки (ОК) в качестве пригодного объема в варианте осуществления данного изобретения, приведенного в качестве примера.
Затем связанный белок AnxA5 высвобождают из анионообменной смолы с применением буфера для элюирования. С этой целью можно применять любой пригодный буфер для элюирования. Например, буфер для элюирования может содержать, состоять по существу, или состоять из водного раствора буфера (например, 20 мМ Трис, рН 7,4), неионного детергента (например, от 0,01 до 1% (мас./об.), более предпочтительно 0,1% (мас./об.) полисорбата, предпочтительно Твин 80) и соли в концентрации выше, чем промывочный раствор (например, 300 мМ NaCl, необязательно ± 100, 90, 80, 70, 60, 50, 40, 30, 20, 10 или 5 мМ). Можно применять любой пригодный объем элюирования; без ограничения, заявитель обнаружил 9 объемов колонки (ОК) в качестве пригодного объема элюирования в варианте осуществления данного изобретения, приведенного в качестве примера.
Соответственно, белок AnxA5 захватывается в буфере для элюирования, в результате чего получают продукт первого анионообмена.
Затем анионообменную смолу можно регенерировать и очистить. Пригодные способы регенерации и очистки известны в данной области техники, и один из таких пригодных протоколов обсуждается в примерах.
Как правило, продукт первого анионообмена, который содержит высвобожденный белок AnxA5, содержит по существу более 50% белка AnxA5, который высвобождается из клеток-хозяев. Предпочтительно продукт первого анионообмена содержит более 60%, 70% или 80% белка AnxA5, который был получен из клеток-хозяев. По сравнению со способом Мардера с соавт. (выше), очевидно, что в способах предшествующего уровня техники наблюдаются большие потери продукта, составляющие около 50% или более. Например, способ Мардера с соавт., (выше) включает начальный этап очищающего центрифугирования, в котором удаляют супернатант и собирают аннексин A5, связанный с осадком. Относительные количества аннексина А5 в удаленном супернатанте и аннексина А5, выделенного из осадка, приведены на фиг. 3, дорожки 2 и 3 соответственно, по Мардеру с соавт. (выше). Из этой Фигуры видно, что в способе Мардера с соавт. (выше) около половины высвобожденного аннексина А5 удаляется, что определяет указанный способ как низкопродуктивный.
В качестве дополнительного параметра сравнения заявитель обнаружил, что в проиллюстрированном примере обеспечивается выход около 5 г белка AnxA5 на литр культуры в конце первого этапа анионообменной хроматографии захвата, что является намного больше, чем выход, о котором сообщал Мардер с соавт. (выше). (см. «Выводы», второй абзац), составляющий 0,953 г очищенного аннексина А5 на литр культуры.
Соответственно, согласно первому аспекту данного изобретения предпочтительно, чтобы продукт первого анионообмена содержал более 1 г, более 2 г, более 3 г, более 4 г или около 5 г белка AnxA5 на литр культуры.
Необязательно продукт первого анионообмена подвергают, прямо или опосредованно, этапу фильтрации (например, этапу стерилизующей фильтрации). Было установлено, что, например, без ограничения, пригодным является этап фильтрации 0,45-0,2 мкM.
F. Аффинная хроматография
Заявитель также обнаружил (например, см. Пример 2 ниже), что в отличие от общеизвестных способов, в которых последовательное добавление этапов очистки приводит к постоянно увеличивающейся потере получаемого продукта (поскольку на каждом этапе наблюдается утрата продукта), комбинация анионообменного этапа и этапа аффинной хроматографии с гепарином имеет удивительное преимущество, заключающееся в достижении высокой степени чистоты, которую получают также и при применении одного лишь этапа аффинной хроматографии с гепарином, но с существенно увеличенным количеством получаемого продукта (т.е. выделение увеличивается с около 30-40% до около 70-90%). Существенное увеличение количества получаемого продукта, связанное с добавлением этапа очистки, является прямой противоположностью тому, что обычно можно ожидать от комбинации этапов очистки.
Соответственно, во втором аспекте данного изобретения предлагается способ выделения и/или очистки белка, содержащего последовательность аннексина А5 (AnxA5), из раствора, содержащего белок AnxA5 и одну или большее количество примесей (которые могут быть или могут не быть продуктом этапа осветления, как описано выше), при этом способ включает подвергание раствора, содержащего белок AnxA5 и одну или большее количество примесей (этот раствор может быть или может не быть прямым или опосредованным продуктом этапа гомогенизации, осветления и/или первой анионообменной хроматографии, как обсуждалось выше) воздействию анионообменной смолы с целью осуществления первого анионообменного этапа, и получение таким образом продукта первого анионообмена, который содержит белок AnxA5; а также
подвергание продукта первого анионообмена, прямо или опосредованно, этапу аффинной хроматографии, и получение таким образом продукта первой аффинной хроматографии, который содержит высвобожденный белок AnxA5.
Предпочтительно, согласно способу по второму аспекту данного изобретения, этап аффинной хроматографии может включать связывание белка AnxA5 с иммобилизованным гепарином и при этом связывание необязательно стимулируют добавлением ионов кальция и, кроме того, белок AnxA5 необязательно элюируют из иммобилизованного гепарина с помощью буфера для элюирования, содержащего хелатор ионов кальция, такой как ЭДТА.
Кроме того, как описано в Примере 3, заявитель обнаружил, что на этапе аффинной хроматографии с гепарином Твин 80 обладает особенно полезным эффектом (по сравнению с другими неионными детергентами, включая другие Твин, такие как Твин 20). Включение Твин 80, например около 0,1% (мас./об.), в буферы, применяемые на этапе аффинной хроматографии с гепарином, может помочь элюировать белок AnxA5 в одном пике, уменьшить давление и предотвратить осаждение.
Соответственно, в третьем аспекте данного изобретения предлагается способ выделения и/или очистки белка, содержащего последовательность аннексина А5 (AnxA5), из раствора, содержащего белок AnxA5 и одну или большее количество примесей, при этом способ включает подвергание раствора, включающего белок AnxA5 и одну или большее количество примесей (которые могут быть или могут не быть прямым или опосредованным продуктом этапа гомогенизации, осветления и/или первой анионообменной хроматографии, как обсуждалось выше), этапу аффинной хроматографии с гепарином в присутствии Твин 80 (предпочтительно в присутствие 0,1% Твин 80), в результате чего получают продукт первой аффинной хроматографии, который содержит высвобожденный белок AnxA5.
Таким образом, как второй, так и третий аспекты данного изобретения, которые могут применяться независимо друг от друга или в комбинации (т.е. этап аффинной хроматографии с гепарином во втором аспекте данного изобретения может включать Твин 80 (например, около 0,1% (мас./об.)) в буферах, применяемых на этапе аффинной хроматографии с гепарином,
В более общем смысле, однако, первый аспект данного изобретения может включать этап подвергания высвобожденного белка AnxA5 этапу аффинной хроматографии, и получение таким образом продукта первой аффинной хроматографии, который содержит высвобожденный белок AnxA5. Может быть особенно предпочтительно, чтобы белок AnxA5 в продукте первого анионообмена, например, полученный с помощью способа, описанного выше, можно было прямо или опосредованно подвергнуть этапу аффинной хроматографии (например, после стерилизующей фильтрации и/или добавления дополнительных компонентов).
Соответственно, в одном варианте осуществления первого аспекта данного изобретения (который может быть комбинирован с одним или обоими признаками второго и третьего аспектов данного изобретения), способ включает в себя этапы, на которых:
(a) гомогенат биомассы, содержащий высвобожденный белок AnxA5, как описано выше, осветляют с помощью способа осветления, как описано выше, и, таким образом, получают осветленный продукт, содержащий высвобожденный белок AnxA5, а также
(b) белок AnxA5 в осветленном продукте подвергают воздействию анионообменной смолы с целью осуществления первого анионообменного этапа, как описано выше, и таким образом получают продукт первого анионообмена, который содержит белок AnxA5; а также
(c) белок AnxA5 в продукте первого анионообмена подвергают (прямо или опосредовано) этапу аффинной хроматографии.
Предпочтительно, этап аффинной хроматографии включает связывание белка AnxA5 с иммобилизованным гепарином и, необязательно, связывание стимулируют добавлением ионов кальция.
Соответственно, до этапа аффинности с гепарином продукт AnxA5 можно кондиционировать путем добавления любого одного или большего количества ионов кальция (например, CaCl2), неионного детергента (предпочтительно Твин 80) и, необязательно, буферизации (например, буфер Трис при рН 7,4). Без ограничения заявитель продемонстрировал положительный эффект в тех случаях, когда отфильтрованный продукт анионного обмена разбавляли в около 8 раз разбавляющим буфером, содержащим 20 мМ Трис, рН 7,4, 0,1% Твин 80 и 2 мМ CaCl2.
Поэтому может быть предпочтительным, чтобы продукт AnxA5 кондиционировали полисорбатом 80 и более предпочтительно, когда полисорбат 80 имеет конечную концентрацию от около 0,01% до около 10% (мас./об.), например, около 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,10%, 0,11%, 0,12%, 0,13%, 0,14%, 0,15%, 0,16%, 0,17%, 0,18%, 0,19%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,9%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% или 10%. Термин "около" в этом контексте относится к ± 50%, 40%, 30%, 20%, 10% или 5% от указанного значения.
Разбавление кальцием способствует связыванию аннексина A5 с гепарином при проведении иммобилизованной гепарином хроматографии. Это взаимодействие, по сравнению с ионным взаимодействием, медленное. Важным является время контакта, поэтому хроматографию предпочтительно проводят с ≤ 100 см/ч.
Условия, применяемые при загрузке колонки аффинной хроматографии (например, колонка аффинной хроматографией с гепарином), позволяют связывать белок AnxA5 с гепарином. То есть, аффинная хроматография обычно выполняется в положительном режиме по отношению к белку AnxA5.
Аффинную хроматографическую колонку (например, колонку аффинной хроматографией с гепарином) можно загружать желаемым уровнем продукта AnxA5. Например, загрузка может быть проведена в объеме, составляющем около, или более чем 5 г на литр объема смолы колонки, например, около 10 г/л, около 15 г/л, около 20 г/л, около 25 г/л, около 30 г/л или более. Термин "около" в этом контексте относится к ± 50%, 40%, 30%, 20%, 10% или 5% от указанного значения. На практике заявитель обнаружил, что загрузка от около 20 до 30 г продукта AnxA5 на литр объема смолы колонки обеспечивает весьма удовлетворительные результаты с точки зрения эффективности процесса и очистки и восстановления продукта. В контексте таких высоких загрузок заявитель обнаружил, что наличие полисорбата 80 в загружаемой смеси особенно целесообразно для предотвращения осаждения белка AnxA5 или нерастворимости. Если полисорбат 80 не применять, наблюдается осаждение и увеличение противодавления, и этап аффинной хроматографии становится менее эффективным. См. Примеры 3 и 4.
После загрузки белка AnxA5 колонку, как правило, промывают один или большее количество раз для удаления примесей. Можно применять любой пригодный протокол промывания. Заявитель обнаружил, без ограничения, что пригодный протокол промывания включает двухэтапное промывание. Например, на первом этапе промывания можно проводить с применением первого промывочного буфера, содержащего кальций (например, 20 мМ Трис, рН 7,4, 0,1% Твин 80, 2 мМ CaCl2). Объем для первого этапа промывания может варьироваться в зависимости от желаемого результата и основных свойств применяемого промывочного раствора. Без ограничений, заявитель обнаружил, например, что типовой промывочный буфер, указанный выше, можно успешно применять при промывании 15 ОК. На втором этапе промывания промывочный буфер может содержать кальций в количестве, которое меньше, чем при первом промывании, или предпочтительно не содержать кальция (например, 20 мМ Трис, рН 7,4; 0,1% Твин 80). Объем для второго этапа промывания может варьироваться в зависимости от желаемого результата и основных свойств применяемого промывочного раствора на втором этапе промывания. Без ограничений, заявитель обнаружил, например, что типовой промывочный буфер второго этапа промывания, указанный выше, можно успешно применять с 2 ОК для промывания.
После этого белок AnxA5 элюируют из колонки аффинной хроматографии с применением буфера для элюирования, и получают таким образом продукт первой аффинной хроматографии, который содержит высвобожденный белок AnxA5. В случае применения колонки аффинной хроматографии с гепарином может быть предпочтительным применять буфер для элюирования, включающий хелатор ионов металлического кальция, такой как ЭДТА или ЭГТА.
Например, без ограничений, заявитель обнаружил, что пригодным буфером для элюирования является 20 мМ Трис, рН 7,4; 0,1% Твин 80; 10 мМ ЭДТА; 25 мМ NaCl, который хелатирует ионы кальция. Реакция хелатирования специфически элюирует аннексин А5, который может связываться только с гепарином в присутствии кальция.
Во время элюирования, с целью повышения концентрации продукта, может быть предпочтительным снизить скорость потока до менее 100 см/ч. Например, без ограничений, в примерах заявитель допускал концентрированное элюирование путем снижения скорости потока до ≤ 60 см/ч при элюировании. Полный пик элюирования, например, можно получить, начиная с повышения УФ-сигнала при 0,05 ЕОП до 0,05 ЕОП в нисходящем пике, представляющем около 7 ОК. Предпочтительно профиль элюирования демонстрирует один пик, который наиболее идеально представляет собой острый пик.
Соответственно, продукт первой аффинной хроматографии содержит высвобожденный белок AnxA5 и хелатор ионов кальция, такой как ЭДТА или ЭГТА, при этом необязательно хелатор ионов кальция присутствует в диапазоне от около 0,1 мМ до 500 мМ, например, от около 1 мМ до около 100 мМ, более типично в диапазоне от около 2 мМ до около 50 мМ, более предпочтительно в диапазоне от около 5 мМ до около 15 мМ и наиболее предпочтительно около 10 мМ. Термин "около" в этом контексте может включать в себя значение ± 50%, 40%, 30%, 20%, 10%, 5% или 1% от указанной концентрации (концентраций).
Этап аффинной хроматографии может представлять собой самый мощный этап очистки в схеме процесса. Белок AnxA5 связывается с ионами кальция, и в этом связанном с кальцием состоянии продукт может образовывать высокоспецифичную связь с гепарином. Как правило, только правильно сложенные белковые формы AnxA5, которые способны комбинироваться с кальцием, могут связываться с гепарином. Таким образом, этап аффинной хроматографии может быть пригодным для того, чтобы способствовать различению продукта с правильной и неправильной структурой. Кроме того, при промежуточном этапе достигаются высокие коэффициенты обеднения, поскольку высокоспецифическое взаимодействие сочетается со специфическим режимом элюирования посредством хелатной реакции кальция с ЭДТА. Поэтому наблюдается сильное снижение уровня эндотоксина и БКХ в сочетании с умеренным снижением содержания ДНК. Как правило, уровень эндотоксина, являющийся уже сниженным (предпочтительно на около 97%), во время предшествующего этапа анионообменного захвата дополнительно снижают (предпочтительно на около 99%), тем самым предпочтительно доводят уровни эндотоксина доводят до 0,03% от его уровней в осветленном продукте перед первым этапом анионообменного захвата.
G. Анионообменная очистка
В дополнительном варианте осуществления первого, второго и/или третьего аспектов данного изобретения продукт AnxA5 (например, полученный на этапе аффинной хроматографии) можно, прямо или опосредовано, дополнительно очистить на этапе анионообменной очистки.
В случае, когда продукт AnxA5, полученный на этапе аффинной хроматографии, опосредовано дополнительно очищают на этапе анионообменной очистки, то этапы аффинной хроматографии и этап анионообменной очистки можно отделить путем добавления одной или большего количества кондиционирующих добавок к продукту, полученного на этапе аффинной хроматографии.
Пригодные добавки могут включать в себя, например, разбавитель (например, воду) для дополнительного разбавления белка AnxA5 в продукте, полученном на этапе аффинной хроматографии; буфер (например, Трис, например, 35 мМ, при рН 8); неионный детергент (например, полисорбат, более предпочтительно Твин 80, например, в концентрации около 0,1% мас./об.); и/или одну или большее количество дополнительных добавок на основе четвертого аспекта данного изобретения, как обсуждается ниже.
Имеется в виду, что четвертый аспект данного изобретения основан на осознании заявителем того, что хелаторы ионов металлического кальция (например, ЭДТА) могут отрицательно влиять на эффективность анионообменных этапов. Свободная ЭДТА (или другой хелатор) может непосредственно связываться с функциональными анионообменными группами и тем самым уменьшать емкость, а также разделение, достигнутое на анионообменном этапе. Существуют определенные ограничения в случае проведения анионообмена на продукте, полученном на этапе аффинной хроматографии с гепарином, в котором белок AnxA5 связан с гепарином в присутствии ионов кальция, с последующим применением хелатора ионов металлического кальция (например, ЭДТА) для элюирования связанного белка AnxA5. Как следствие, элюированный продукт AnxA5, полученный на этапе аффинной хроматографии с гепарином, содержит высокие уровни хелатора ионов кальция. Как правило, желательно иметь возможность дополнительно очищать продукт AnxA5 с помощью дополнительного анионообменного этапа, но применение хелатора ионов кальция может быть затруднено во время этого дополнительного анионообменного этапа. С другой стороны, попытки удаления хелатора ионов металлического кальция до анионообменного этапа требуют много времени и, следовательно, увеличивают затраты. Следовательно, способы предшествующего уровня техники, включающие, например, этапы диализа для замены буфера, являются медленными и неэффективными и, следовательно, повышают себестоимость продукции. Кроме того, включение хелатора ионов металлического кальция в продукт AnxA5 на анионообменном этапе может быть важным компонентом для предотвращения кальций-зависимого связывания белка AnxA5 с примесями, включая эндотоксин. Поэтому было бы удобно и эффективно вводить добавку, которая блокирует или уменьшает связывание хелатора ионов кальция с анионообменной смолой, что позволило бы проводить анионообменный этап без затруднений и затрат, связанных с диализом, и без предупреждения положительного действия хелатора ионов металлического кальция на анионообменном этапе.
Заявителю стало понятно, что это может быть достигнуто путем включения в белковый продукт AnxA5 перед анионообменом одного или большего количества типов дополнительных выбранных ионов металлов, при этом дополнительные выбранные ионы металлов выбраны так, что хелатор ионов металлического кальция характеризуется аффинностью связывания для выбранных ионов металлов, которая является выше, чем аффинность связывания для анионообменной смолы, но ниже, чем его аффинность связывания для ионов кальция. Выбор соответствующих дополнительных ионов металлов будет зависеть от природы хелатора ионов кальция и природы анионообменной смолы. Например, в случае применения ЭДТА в качестве хелатора ионов кальция, ионы Mg2+, как правило, являются пригодными для достижения цели данного изобретения и могут быть добавлены к белковому продукту AnxA5 до анионообменного этапа.
Соответственно, в четвертом аспекте данного изобретения предлагается способ выделения и/или очистки белка, содержащего последовательность аннексина А5 (AnxA5) из композиции, которая содержит белок AnxA5 и хелатор ионов металлического кальция, характеризующийся тем, что способ включает подвергание композиции воздействию анионообменной смолы для проведения анионообменного этапа и, таким образом, выделение и/или очистку белка AnxA5 из композиции и
дополнительно характеризуется тем, что анионообменного этапа проводят в присутствии дополнительных выбранных ионов металлов,
при этом дополнительные выбранные ионы металлов выбраны так, что хелатор ионов металлического кальция характеризуется аффинностью связывания для выбранных ионов металлов, которая является выше, чем аффинность связывания для анионообменной смолы, но ниже, чем его аффинность связывания для ионов кальция.
Предпочтительно, дополнительные выбранные ионы металлов смешивают с композицией, которая содержит белок AnxA5 и хелатор ионов металлического кальция, до начала воздействия анионообменной смолы на указанную композицию. Растворы, применяемые на последующих анионообменных этапах (например, промывочные растворы и/или буферы для элюирования), могут включать или не включать дополнительные выбранные ионы металлов. Поэтому в одном варианте осуществления этого аспекта изобретения этап проведения анионообменного этапа в присутствии дополнительных выбранных ионов металлов предусматривает добавление дополнительных выбранных ионов металлов к композиции, которая содержит белок AnxA5 и хелатор ионов металлического кальция, до начала воздействия анионообменной смолы на указанную композицию.
В одном варианте осуществления четвертого аспекта данного изобретения хелатор ионов металлического кальция выбирают из ЭДТА или ее соли, ЭГТА или ее соли, а наиболее предпочтительно ЭДТА.
Хелатор ионов металлического кальция может присутствовать в композиции в избытке и/или в концентрации в диапазоне от около 0,1 мМ до 500 мМ, например, от около 1 мМ до около 100 мМ, более типично, в диапазоне от около 2 мМ до около 50 мМ, например, в концентрации около 0,1 мМ, 0,5 мМ, 1 мМ, 2 мМ, 3 мМ, 4 мМ, 5 мМ, 6 мМ, 7 мМ, 8 мМ, 9 мМ, 10 мМ, 11 мМ, 12 мМ, 13 мМ, 14 мМ, 15 мМ, 16 мМ, 17 мМ, 18 мМ, 19 мМ, 20 мМ или более. В этом контексте термин "около" может включать в себя значение ± 0,5, 0,4, 0,3, 0,2 или 0,1 мМ от указанного значения. В вышеприведенном контексте термин "избыток" может означать то, что присутствует достаточное количество хелатора ионов металлического кальция для удаления любого двухвалентного иона, что может способствовать связыванию белка AnxA5 с иммобилизованным гепарином на колонке на предшествующем этапе аффинной хроматографии, в результате чего белок AnxA5 может высвобождаться из колонки в раствор, а затем прямо или опосредовано применяться на этапе анионообменной очистки.
В одном типовом варианте осуществления четвертого аспекта данного изобретения выбранными ионами металлов являются двухвалентные катионы, такие как ионы Mg2+
Предпочтительно, чтобы выбранные ионы металлов присутствовали на анионообменном этапе в количестве, эффективном для уменьшения (например, на около 50%, 60%, 70%, 80%, 90%, 95%, 98%, 99% или более) или предотвращения взаимодействия между хелатором ионов кальция и анионообменной смолой в процессе приведения в контакт композиции с анионообменной смолой. Например, выбранные ионы металлов могут присутствовать на анионообменном этапе в количестве, эффективном для уменьшения или предотвращения взаимодействия между хелатором ионов кальция и анионообменной смолой во время загрузки композиции на анионообменную смолу и/или на одном или большем количестве этапов промывания, в которых белок AnxA5 связывается с анионообменной смолой, а примеси удаляются путем промывания.
Может быть предпочтительным, чтобы выбранные ионы металлов присутствовали на анионообменном этапе в количестве, эффективном для увеличения связывания белка AnxA5 с анионообменной смолой в присутствии хелатора ионов кальция и тем самым уменьшали (например, на около 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 60%, 70%, 80%, 90%, 95%, 98%, 99% или более) потери белка AnxA5 в фильтрате анионообменного этапа по сравнению с уровнем потерь, наблюдаемых в тех случаях, когда на анионообменном этапе не применяют выбранных ионов металлов.
Может быть предпочтительным, чтобы выбранные ионы металлов присутствовали на анионообменном этапе в концентрации от около 1 до около 100 мМ, например, от около 2 до около 50 мМ, от около 5 до около 25 мМ, от около 10 до около 15 мМ или около 12,5 мМ.
Кроме того, может быть предпочтительным, чтобы хелатором ионов металлического кальция была ЭДТА, а выбранными ионами металла были ионы Mg2+ и, более предпочтительно, чтобы молярное отношение ионов Mg2+ и ЭДТА находилось в диапазоне от 0,5:1 до 2:1, наиболее предпочтительно по меньшей мере 1:1 или > 1:1.
В контексте четвертого аспекта данного изобретения, в следующем варианте осуществления данного изобретения, композиция, которая содержит белок AnxA5 и хелатор ионов металлического кальция, и которая подвергается воздействию анионообменной смолы, может быть прямым или опосредованным продуктом предшествующего процесса, который включает этап подвергания белка AnxA5 этапу аффинной хроматографии и элюирование белка AnxA5 с помощью хелатора ионов кальция, в результате чего получают продукт аффинной хроматографии, который представляет собой композицию, содержащую белок AnxA5 и хелатор ионов металлического кальция. Например, предшествующий этап аффинная хроматографии может включать связывание белка AnxA5 с иммобилизованным гепарином, и при этом связывание необязательно стимулируют добавлением ионов кальция и, кроме того, белок AnxA5 необязательно элюируют из иммобилизованного гепарина с помощью буфера для элюирования, содержащего хелатор ионов кальция, такой как ЭДТА.
Кроме того, может быть предпочтительно не осуществлять этап диализа между предшествующем этапом аффинной хроматографии и анионообменным этапом и/или не осуществлять удаление хелатора ионов кальция из продукта предшествующего этапа аффинной хроматографии перед применением прямого или опосредованного продукта на анионообменном этапе.
В контексте четвертого аспекта данного изобретения, в дополнительном варианте осуществления данного изобретения, выбранные ионы металлов добавляют к композиции до или во время анионообменного этапа.
В предпочтительном варианте осуществления данного изобретения продукт этапа аффинной хроматографии согласно любому из первого, второго или третьего аспектов данного изобретения обрабатывают на дополнительном анионообменном этапе, таком как анионообменный этап согласно четвертому аспекту данного изобретения.
Необязательно, перед (вторым) анионообменным этапом очистки корректируется один или большее количество параметров среды высвобожденного белка AnxA5, выбранных из группы, состоящей из концентрации белка AnxA5, рН, проводимости, уровня хелатора ионов кальция и уровня неионного детергента, или уровня выбранных дополнительных ионов металлов (согласно четвертому аспекту данного изобретения).
Как правило, перед приведением в контакт (второй) анионообменной смолы на этапе очистки и продукта AnxA5 анионообменную смолу уравновешивают. С этой целью можно применять любой пригодный способ уравновешивания. Например, анионообменная смола может быть уравновешена буфером (например, 20 мМ Трис, рН 7,4), неионным детергентом (например, 0,1% полисорбатом, предпочтительно Твин 80) и солью (например, 25 мМ NaCl). Можно применять любой пригодный равновесный объем; без ограничения, заявитель обнаружил 3 объема колонки (ОК) в качестве пригодного объема в варианте осуществления данного изобретения, приведенного в качестве примера.
Предпочтительно (второй) этап анионообменной очистки выполняют в положительном режиме по отношению к белку AnxA5, и поэтому белок AnxA5 временно связывают с анионообменником во время анионообменного этапа, при этом, как правило, промывочный раствор пропускают через колонку для удаления примеси из связанного белка AnxA5, а затем продукт второго анионообмена, который содержит высвобожденный белок AnxA5, получают путем нанесения буфера для элюирования на анионообменную смолу для высвобождения связанного белка AnxA5.
Предпочтительно применение сильных анионообменных смол. Сильные анионообменные смолы хорошо известны в данной области техники, и их примеры включают в себя смолы с функциональной группой четвертичного аммония, такие как смола типа I, содержащая триалкиламмонийхлорид или гидроксид, или смолы типа II, содержащие диалкил 2-гидроксиэтиламмонийхлорид или гидроксид. Без ограничения, одним из примеров пригодной анионообменной смолы для второго этапа очистки является Source 15Q. Анионообменная смола Source 15Q может быть определена как полимерный сильный анионообменник и может дополнительно характеризоваться наличием четвертичного аммониевого лиганда, со средним размером частиц распределения суммарного объема около 15 мкм (d50v), матрицей из полистирола/дивинилбензола и/или параметрами давления/потока около 400 см/ч, 1000 кПа, при оценивании ее как колонки FineLine 100 с высотой слоя 10 см.
Без ограничения, дополнительным примером пригодной анионообменной смолы для второго этапа очистки является Capto Q ImpRes. Анионообменная смола Capto Q ImpRes может быть определена как сильный анионообменник и может дополнительно характеризоваться наличием четвертичного аминного лиганда, высокопотоковой агарозной матрицы, со средним размером частиц около 36-44 мкм (d50v), ионной емкостью около 0,15-0,18 ммоль Cl-/мл среды, связывающей способностью/мл хроматографической среды > 55 мг BSA и > 48 мг β-лактоглобулина и/или параметрами давления/потока около 300 кПа при мин. 220 см/ч, при оценивании ее как колонки диаметром 1 м с высотой слоя 20 см.
Не ограничиваясь теорией, заявитель обнаружил, что применение анионообменной смолы Capto Q ImpRes для (второго) этапа анионообменной очистки может быть особенно целесообразным, когда белок AnxA5, подлежащий очищению, получают из рекомбинантного источника (такого как E. coli BL21 (DE3), который дополнительно продуцирует сверхэкспрессирующий PGL, как описано в публикации Aon et al. (Appl. Env. Microbiol., 2008, 74(4): 950-958; содержание которой включено в данное описание посредством ссылки), который не обуславливает или обуславливает низкий уровень глюконоилирования белка AnxA5, экспрессируемого им. Термин "низкий» в этом контексте может включать значение, означающее, что уровень глюконоилирования является меньше (например, меньше 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 10% 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1%), чем уровень глюконоилирования белка AnxA5, который экспрессируется в штамме BL21 E. coli (DE3) (например, как это широко коммерчески доступно, и, как описано в Marder et al., 2014, BMC Biotechnology, 14:33). Например, возможно, что уровень глюконоилированного белка AnxA5 в продукте, который применяется к анионообменной смоле Capto Q ImpRes для (второго) этапа анионообменной очистки, находится в пределах от 0,5 до 30% или от 0,5 до 20%, или от 0,5 до 15%, или от 0,5 до 10% от общего содержания белка AnxA5 в применяемом продукте. Глюконоилированные варианты Anx5 можно, например, измерять и количественно оценивать, с помощью сверхвысокоэффективной жидкостной хроматографии (СВЖХ) или высокоэффективной жидкостной хроматографии (ВЭЖХ), используя соответствующие колонки с анионообменной или обратной фазой. Различные пики можно дополнительно идентифицировать и охарактеризовать с помощью масс-спектроскопии (МС).
Заявитель обнаружил, что применение анионообменной смолы Capto Q ImpRes для (второго) этапа анионообменной очистки, когда белок AnxA5, подлежащий указанной очистке, не характеризуется или характеризуется низким уровнем глюконоилирования, приводит к еще более эффективному процессу (по сравнению, скажем, с применением анионообменной смолы Source 15Q для (второго) этапа анионообменной очистки), поскольку анионообменная смола Capto Q ImpRes обладает высокой связывающей способностью, пригодна для высоких скоростей потока без противодавления, может быть упакована на более высокий слой и имеет более низкую цену. Качество и чистота конечного продукта поддерживаются на надлежащем уровне независимо от того, применяется ли анионообменная смола Source 15Q или Capto Q ImpRes. Однако считается, что переход от анионообменной смолы Source 15Q (с размером частиц 15 мкм) к анионообменной смоле Capto Q ImpRes (с диаметром частиц 40 мкм) обеспечивает увеличение производительности, которое может быть более чем в около пять раз (5х), за счет сокращения времени, необходимого для функционирования всего процесса (в частности, поскольку второй анионообменный этап, применяемый для очистки, является одним из наиболее трудоемких этапов), и может снизить общую стоимость изготовления более чем на 50%. Отказ от применения смолы с очень небольшим размером гранул (<30 мкм) обеспечивает высокую скорость потока и позволяет хроматографическую колонку упаковывать на более высокий слой смолы без возникновения неприемлемого противодавления. Это увеличивает производительность, так как при заданном размере (диаметре колонки) в колонку можно упаковать больше смолы, и поэтому больше белка может связаться, что в то же время позволяет системе функционировать быстрее из-за более высокой скорости потока.
После загрузки на анионообменную смолу на (втором) этапе очистки, в положительном режиме, белок AnxA5 временно связывается со смолой и может быть промыт для уменьшения/удаления примесей. Можно применять любые пригодные условия промывания. Например, промывочный раствор может содержать, состоять по существу, или состоять из водного раствора буфера (например, 20 мМ Бис-Трис, рН 7) и соли (например, 25 мМ NaCl) и необязательно неионного буфера (например, полисорбат, предпочтительно Твин 80, например, в концентрации около 0,1 мас./об.). Можно применять любой пригодный объем для промывания; без ограничения, заявитель обнаружил 3 объема колонки (ОК) в качестве пригодных объемов в варианте осуществления данного изобретения, приведенного в качестве примера.
Затем связанный белок AnxA5 высвобождают из анионообменной смолы с применением буфера для элюирования. С этой целью можно применять любой пригодный буфер для элюирования. Например, буфер для элюирования может содержать, состоять по существу, или состоять из водного раствора буфера (например, 20 мМ Бис-Трис, pH 7), соли в концентрации выше, чем промывочный раствор (например, 180 мМ NaCl, необязательно ± 100, 90, 80, 70, 60, 50, 40, 30, 20, 10 или 5 мМ) и необязательно неионного буфера (например, полисорбат, предпочтительно Твин 80, например, в концентрации около 0,1 мас./об.). Можно применять любой пригодный объем элюирования; без ограничения, заявитель обнаружил 33 объема колонки (ОК), увеличивая концентрацию буфера для элюирования от 0 до 100% в линейном градиенте, чтобы получить пригодный объем для элюирования в варианте осуществления данного изобретения, приведенного в качестве примера.
Соответственно, белок AnxA5 высвобождается в буфере для элюирования, в результате чего получают очищенный продукт (второго) анионообмена. Как обсуждалось в Примере 1, способ с применением 0,1% Твин 80, увеличивал выход продукта после промежуточного этапа на около 30%.
Затем (вторую) анионообменную смолу можно регенерировать и очистить. Пригодные способы регенерации и очистки известны в данной области техники, и один из таких пригодных протоколов обсуждается в примерах.
Этап очистки в основном необходим для уменьшения уровня примесей, связанных с продуктом, например, разделения различных изоформ аннексина А5. Кроме того, на этапе очистки достигается наивысший коэффициент обеднения для остаточной ДНК и сильно снижается уровень БКХ. Уровень эндотоксина, имеющий уже сниженные показатели после промежуточного этапа, дополнительно снижается на около 99% (при применении в комбинации с предшествующей гомогенизацией клеток, обработкой нуклеазой, осветлением, анионообменным захватом, фильтрованием (например, этап стерилизующей фильтрации) и этапом аффинности гепарина), в результате чего уровни эндотоксина доводят до 0,0003% от его уровней в осветленном продукте перед первым этапом АХ.
Соответственно, в дополнительном варианте осуществления первого, второго, третьего и/или четвертого аспектов данного изобретения предлагается способ восстановления и/или очистки рекомбинантно экспрессируемого внутриклеточного белка, включающий последовательность аннексина A5 (AnxA5) из клетки-хозяина с клеточной стенкой или культуры согласно первому аспекту данного изобретения и предпочтительно, при этом указанный способ включает выделение и/или очистку рекомбинантно экспрессируемого внутриклеточного белка AnxA5 из культуры клеток-хозяев и при этом культура имеет объем, составляющий по меньшей мере около 100 л, около 200 л, около 300 л, около 400 л, около 500 л, около 600 л, около 700 л, около 800 л, около 900 л, около 1000 л, около 2000 л, около 3000 л, около 4000 л , около 5000 л, около 6000 л, около 7000 л, около 8000 л, около 9000 л, около 10 000 л, около 20 000 л, около 30 000 л, около 40 000 л, около 50 000 л, около 60 000 л, около 70 000 л, около 80 000 л, около 90 000 л, около 100 000 л или больше, при этом:
(a) способ включает высвобождение внутриклеточного белка из клетки-хозяина в присутствии буфера для гомогенизации, содержащего неионный детергент согласно первому аспекту данного изобретения;
(b) необязательно, при этом этап высвобождения соответствует любому одному или большему количеству вариантов осуществления первого аспекта данного изобретения, как описано выше в подразделе С;
(c) дополнительно необязательно, при этом способ включает этап очистки гомогената биомассы согласно любому одному или большему количеству вариантов осуществления данного изобретения, как описано выше в подразделе D; а также
(d) при этом способ дополнительно включает этап подвергания прямому или опосредованному воздействию анионообменной смолы на высвобожденный белок AnxA5, для проведения первого анионообменного этапа и, таким образом, получение продукта первого анионообмена, который содержит высвобожденный белок AnxA5 согласно любому одному или большему количеству вариантов осуществления данного изобретения, как описано выше в подразделе E; а также
(e) при этом способ дополнительно включает этап подвергания высвобожденного белка AnxA5, прямо или опосредованно, этапу аффинной хроматографии согласно любому из первого, второго и/или третьего аспектов данного изобретения, как описано выше в разделе F, а также
(f) при этом продуктом этапа аффинной хроматографии является композиция, которая содержит белок AnxA5 и хелатор ионов металлического кальция; а также
(g) при этом прямой или опосредованный продукт этапа аффинной хроматографии, который содержит белок AnxA5 и хелатор ионов металлического кальция, подвергают анионообменному этапу согласно любому из вариантов осуществления данного изобретения, описанных выше в этом разделе (т.е. в разделе G).
H. Состав продукта
Способ по любому из первого, второго, третьего или четвертого аспектов данного изобретения может дополнительно включать, предпочтительно в конце способа, один или большее количество дополнительных этапов, выбранных из группы, состоящей из концентрирования, замены буфера, кондиционирования и фильтрации (например, этап стерилизующей фильтрации) и, необязательно, конечного этапа хранения белка, содержащего белок AnxA5, в стерильном контейнере.
Например, одним из дополнительных этапов, применяемых для приготовления продукта, может быть ультрафильтрация/диафильтрация (УФ/ДФ), необязательно, при этом продукт этапа УФ/ДФ содержит белок AnxA5 в концентрации по меньшей мере около 1 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл, 11 мг/мл, 12 мг/мл, 13 мг/мл, 14 мг/мл, 15 мг/мл, 16 мг/мл, 17 мг/мл, 18 мг/мл, 19 мг/мл, 20 мг/мл, 25 мг/мл, 30 мг/мл, 35 мг/мл, 40 мг/мл, 45 мг/мл, 50 мг/мл, 60 мг/мл, 70 мг/мл, 80 мг/мл, 90 мг/мл, 100 мг/мл, 125 мг/мл или выше.
В другом примере одним из дополнительных этапов, применяемых для приготовления продукта, может быть добавление неионного поверхностно-активного вещества, предпочтительно полисорбата, а более предпочтительно Твин 80. Неионное поверхностно-активное вещество можно добавить в количестве, необходимом для конечного продукта, например, до конечной концентрации около 0,05% (мас./мас.) (например, ± 0,05, 0,04, 0,03, 0,02 или 0,01% мас./об.).
В другом примере одним из дополнительных этапов, применяемых для приготовления продукта, может быть этап фильтрации (такой как этап стерилизующей фильтрации), например, с применением фильтра 0,45-0,2 мкм или 0,22 мкм.
Как указано выше, способ по первому, второму, третьему или четвертому аспектах данного изобретения может заканчиваться этапом стерилизующей фильтрации и помещения стерильного фильтрованного продукта, содержащего белок AnxA5, в стерильный контейнер.
Конечная концентрация белка AnxA5 в заполненном контейнере можно скорректировать по мере необходимости. Без ограничения, заявитель привел в качестве примера конечную концентрацию 10 мг/мл. Пригодная концентрация может составлять, например, 1-125 мг/мл, 2-100 мг/мл, 5-50 мг/мл, 7-30 мг/мл или около 10-20 мг/мл.
Необязательно, способы по данному изобретению могут обеспечить конечный стерильный белковый продукт AnxA5 в нефосфатном буфере (таком как буфер Бис-Трис или Трис) при рН около 7,4 (например, ± 0,5, 0,4, 0,3, 0,2 или 0,1 единицы pH), содержащий около 150 мМ NaCl (например, 50, 40, 30, 20 или 10 мМ), около 1 мМ CaCl2 (например, ± 500, 400, 300, 200, 100 или 50 мкM), около 0,05% (мас./мас.) (например, ± 0,05, 0,04, 0,03, 0,02 или 0,01% мас./об.) полисорбата, такого как Твин 80 или другого неионного детергента. Значение рН около 7,4 представляет собой типовое целевое значение рН для составов, предназначенных для применения у людей (особенно для внутривенного введения), так как оно соответствует рН крови человека и обеспечивает надлежащую растворимость для стабильного белка AnxA5. При значениях рН ниже 7 и, в частности, до около рН 6 белок AnxA5 теряет растворимость и может начать осаждаться.
NaCl может быть пригодной средой для поддержания продукта AnxA5 в мономерной форме во время хранения. Соответственно, с помощью способов по данному изобретению можно получить конечный стерильный белковый продукт AnxA5, при этом концентрация присутствующего NaCl поддерживает белок AnxA5 в форме, которая является преимущественно (то есть более 50%, такой как 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или по существу 100%) мономерной. Процентные уровни мономеров можно легко определить с помощью хорошо известных в данной области техники методов, таких как гельпроникающая хроматография (ГПХ).
В одном варианте осуществления данного изобретения с помощью способов по данному изобретению получают конечный стерильный, терапевтически приемлемый белковый продукт AnxA5 с общим выходом более 1 г белка AnxA5 на 1 л культуры клеток-хозяев, более предпочтительно по меньшей мере около 1,5 г/л, еще более предпочтительно в диапазоне от около 2 до около 4 г/л. В этом контексте термин "около" может включать в себя ± 0,4, 0,3, 0,2 или 0,1 г/л от указанного значения.
В другом варианте осуществления данного изобретения с помощью способов по данному изобретению получают конечный стерильный, терапевтически приемлемый белковый продукт AnxA5 с общим выделением белка AnxA5 по меньшей мере около 24 мас.% (например, ± 10, 9, 8, 7, 6, 5, 4, 3, 2, 1%) или больше белка AnxA5, присутствующего в культуре клеток-хозяев. Это можно определить, например, путем измерения растворимого белка AnxA5 в исходном гомогенате (который можно зафиксировать и измерить путем центрифугирования аликвоты гомогената и проверки уровня AnxA5 в супернатанте) и в конечном очищенном продукте.
Кроме того, в любой момент процесса (если это необходимо, до заполнения стерильного контейнера) и, как правило, после конечного этапа очистки, как описано выше, белок AnxA5 можно химически модифицировать. Например, белок AnxA5 можно ПЭГилировать. ПЭГилированный аннексин А5 описан в WO 02/067857. ПЭГилирование представляет собой способ, хорошо известный специалистам в данной области техники, при котором полипептид или пептидомиметическое соединение (для целей данного изобретения, белка AnxA5) модифицируют таким образом, что одну или большее количество молекул полиэтиленгликоля (ПЭГ) ковалентно прикрепляют к боковой цепи одной или большего количества аминокислот или их производных. Это одна из важнейших методик молекулярных модификаций в структурной химии (MASC). Также можно применять и другие методы MASC; такие методы могут улучшить фармакодинамические характеристики молекулы, например, продлить ее период полувыведения in vivo. Конъюгат ПЭГ-белка образуется путем первой активации фрагмента ПЭГ, вследствие чего он будет взаимодействовать с белком или пептидомиметическим соединением по данному изобретению и связываться с ним. Фрагменты ПЭГ значительно различаются по молекулярной массе и конформации, причем ранние фрагменты (монофункциональные ПЭГ, мПЭГ) являются линейными с молекулярными массами 12 кДа или меньше, а более поздние фрагменты имеют повышенные молекулярные массы. ПЭГ2, одна из последних инноваций в технологии ПЭГ, включает в себя соединение мПЭГ 30 кДа (или меньше) с аминокислотой лизином (хотя ПЭГилирование может распространяться на добавление ПЭГ к другим аминокислотам), которое в последствии реагирует с образованием разветвленной структуры, функционирующей как линейный мПЭГ с гораздо большей молекулярной массой (Kozlowski et al., 2001). Способы, которые можно применять для ковалентного присоединения молекул ПЭГ к полипептидам, дополнительно описаны в публикациях Roberts et al. (2002) Adv Drug Deliv Rev, 54, 459 – 476; Bhadra et al. (2002) Pharmazie 57, 5 – 29; Kozlowski et al. (2001) J Control Release 72, 217 – 224; and Veronese (2001) Biomaterials 22, 405 – 417 и ссылках, упомянутых в них. Преимущества ПЭГилирования включают снижение почечного клиренса, что для некоторых продуктов обеспечивает более устойчивую адсорбцию после введения, а также к ограниченному распространению, что может обуславливать более постоянную и устойчивую концентрацию в плазме и, следовательно, повышение клинической эффективности (Harris et al. (2001) Clin Pharmacokinet 40, 539 – 551). Другие преимущества могут включать в себя снижение иммуногенности терапевтического соединения (Reddy (2001) Ann Pharmacother, 34, 915 - 923) и более низкую токсичность (Kozlowski et al. (2001), Biodrugs 15, 419 – 429). В случае, если белок AnxA5 химически модифицирован, может быть целесообразным выполнить один или большее количество дополнительных этапов очистки, таких как уменьшение уровня или удаление непрореагировавших компонентов и/или выбор гомогенной популяции химически модифицированного белка AnxA5 для включения в конечный продукт. Специалисту в данной области техники известен пригодный способ очистки химически модифицированных белков из процесса реакции.
Конечный продукт может быть или может быть впоследствии составлен для образования фармацевтической или ветеринарной композиции.
Конечный продукт может быть представлен в виде дозированной лекарственной формы. Например, дозированная лекарственная форма может содержать около 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 мг белка AnxA5 (при этом термин "около" относится к ± 0,5, 0,4, 0,3, 0,2 или 0,1 мг) или более, например, в пределах от 0,1 до 1000 мг или от 1 до 100 мг.
Фармацевтическая или ветеринарная композиция может содержать белок AnxA5 в смеси с фармацевтически или ветеринарно приемлемым адъювантом, разбавителем или носителем, который, как правило, выбирают с учетом предполагаемого пути введения и стандартной фармацевтической практики. Композиция может быть в форме для немедленного, замедленного или контролируемого высвобождения. Предпочтительно, состав представляет собой дозировку, содержащую суточную дозу или единицу, суточную часть дозы или соответствующую долю ее активного ингредиента.
Фразы "фармацевтические или ветеринарные приемлемые" означают композиции, которые не приводят к нежелательной, аллергической или другой неблагоприятной реакции при введении животному или человеку, если такое введение является необходимым. Получение таких фармацевтических или ветеринарных композиций известно специалистам в данной области техники в свете данного описания, как продемонстрировано на примерах в публикации Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, включенной в данный документ посредством ссылки. Кроме того, при введении животным или человеку следует понимать, что препараты должны соответствовать требованиям стерильности, пирогенности, общим стандартам безопасности и чистоты, как того требует Управление по биологическим стандартам FDA.
В данном контексте термин "фармацевтически или ветеринарно приемлемый носитель" включает в себя любые и все растворители, дисперсионные среды, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (например, антибактериальные агенты, противогрибковые агенты), изотонические агенты, соли, консерванты, лекарственные средства, стабилизаторы лекарственного средства, вспомогательные вещества, дезинтегрирующие агенты, такие как материалы и их комбинации, которые известны специалисту в данной области техники. В терапевтических или фармацевтических композициях возможно применение любого обычного носителя, за исключением случаев, когда он несовместим с активным ингредиентом.
Фармацевтические или ветеринарные композиции согласно данному изобретению могут быть или могут не быть предназначены и, таким образом, составлены с помощью способа, пригодного для парентерального, внутривенного, внутриартериального, внутрибрюшинного, внутримышечного, внутриглазного, внутричерепного, внутримозгового, внутрикостного, внутрижелудочкового, интратекального или подкожного введения, введения из стента с лекарственным покрытием, введения путем инфузионных методов, или местного введения (например, в форме, пригодной для накожного нанесения, например, в виде крема или мази, ингаляции, введения в офтальмологических/глазных каплях, отических/ушных каплях или через слизистые оболочки организма). Стерильные инъекционные растворы можно получить путем введения активного соединения в необходимое количество пригодного растворителя с различными другими ингредиентами, перечисленными выше, с последующей стерилизацией, в случае необходимости. Фармацевтические композиции удобнее всего применять в виде стерильного водного раствора, который может содержать другие вещества, например, достаточное количество солей или глюкозы для того, чтобы получить раствор, являющийся изотоничным по отношению к крови. Водные растворы должны быть соответствующим образом забуференными (предпочтительно до рН от 3 до 9), если это необходимо. Приготовление пригодных фармацевтических составов в стерильных условиях легко осуществить с помощью стандартных фармацевтических методов, хорошо известных специалистам в данной области техники.
Фармацевтические или ветеринарные композиции по данному изобретению можно, кроме того, составить в форме порошка, такого как стерильный порошок, который может быть лиофилизированным порошком.
Терапевтически эффективное количество белка AnxA5 для введения пациенту, например, пациенту, на основе уровня суточного дозирования может составлять от 0,01 до 1000 мг белка AnxA5 на взрослого человека (например, от около 0,001 до 20 мг на кг веса тела пациента, например, 0,01-10 мг/кг, например, более 0,1 мг/кг и до или менее 20, 10, 5, 4, 3 или 2 мг/кг, например, около 1 мг/кг), вводимых в виде разовых или разделенных доз.
Врач в любом случае определит фактическую дозу, которая будет наиболее пригодной для любого отдельного пациента, и эта доза будет варьироваться в зависимости от возраста, веса и реакции конкретного пациента. Вышеуказанные дозы являются типовыми для среднего случая. Несомненно, могут быть отдельные случаи, когда возможно применение более высоких или более низких диапазонов доз, при этом такие диапазоны включены в объем данного изобретения.
Для ветеринарного применения соединение по данному изобретению вводят в виде пригодной приемлемой композиции согласно общепринятой ветеринарной практике, и ветеринар будет определять схему и путь введения доз, который будет наиболее пригодным для конкретного животного.
I. Характеристики продукта
С помощью способов по данному изобретению получают продукт AnxA5, как определено выше. Таким образом, продукт, полученный с помощью заявленного способа, также является дополнительным, пятым аспектом данного изобретения.
В дополнительном варианте осуществления данного изобретения с помощью способа по любому из аспектов данного изобретения можно получить продукт, содержащий белок AnxA5, о степенью чистоты, пригодной для инъекционного фармацевтического средства для применения человеку. Как правило, с помощью описанного в данном документе способа удаляют связанные с процессом примеси до приемлемых уровней, таких как белок клеток-хозяев, ниже 20 нг на мг белка AnxA5, ДНК ниже 10 мкг на мг белка AnxA5 и эндотоксины ниже 1 ЕС на мг белка AnxA5.
В дополнительном варианте осуществления данного изобретения с помощью способа по любому из аспектов данного изобретения можно получить продукт, содержащий белок без AnxA5, в частности белок клетки-хозяина (за исключением рекомбинантно экспрессированного белка AnxA5), на уровне менее 100, 90, 80, 70, 60, 50, 40, 30, 20, 10, 5 нг или менее на мг белка AnxA5. По требованиям FDA и EMA уровень белка клетки-хозяина должен быть менее 100 нг/мг, и заявитель продемонстрировал уровень белка клетки-хозяина менее 20 нг/мг. Содержание белка в клетках-хозяевах можно, например, измерять с применением антител против белка клетки-хозяина с помощью "сэндвич"-метода ELISA или других способов, одобренных EMA и FDA.
В дополнительном варианте осуществления данного изобретения с помощью способа по любому из аспектов данного изобретения можно получить продукт, содержащий эндотоксин в количестве менее 100, 90, 80, 70, 60, 50 45, 40, 35, 30, 35, 20, 15 и предпочтительно менее 10, 5 или 1 ЕЭ на мг белка AnxA5, и/или предпочтительно, при этом с помощью способа получают продукт в виде дозированной лекарственной формы, и продукт содержит менее 100, 90, 80, 70, 60, 50, 45, 40, 35, 30, 35, 20, 15 и предпочтительно менее 10, 5 или 1 ЕЭ на дозировку. По требованиям FDA и EMA уровень эндотоксинов должен быть менее 100 ЕЭ/дозу (максимально допустимое значение составляет 350 ЕЭ/дозу); ожидаемый уровень составляет менее 10 ЕЭ/мг при дозе 10 мг. В пределах этих параметров, дозированная лекарственная форма может содержать около 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 мг белка AnxA5 или более (например, в пределах от 0,1 до 1000 мг или 1 до 100 мг). Количество эндотоксинов можно, например, измерить с помощью методов на основе LAL-теста или других способов, одобренных EMA и FDA.
В дополнительном варианте осуществления данного изобретения с помощью способа по любому из аспектов данного изобретения можно получить продукт, содержащий уровни нуклеиновой кислоты (например, ДНК), такие как уровни нуклеиновой кислоты (например, ДНК) клетки-хозяина, менее 1000 пг на мг белка AnxA5, предпочтительно менее 500 пг на мг белка AnxA5, менее 400 пг на мг белка AnxA5, менее 300 пг на мг белка AnxA5, менее 200 пг на мг белка AnxA5, менее 100 пг на мг белка AnxA5 , менее 50 пг на мг белка AnxA5, менее 40 пг на мг белка AnxA5, менее 30 пг на мг белка AnxA5, менее 20 пг на мг белка AnxA5, менее 15 пг на мг белка AnxA5 , менее 10 мкг на мг белка AnxA5, менее 9 пг на мг белка AnxA5, менее 8 пг на мг белка AnxA5, менее 7 пг на мг белка AnxA5, менее 6 пг на мг белка AnxA5 , менее 5 пг на мг белка AnxA5, например, около 4 пг на мг белка AnxA5. Количество ДНК, например, можно измерить с помощью методов количественной полимеразной цепной реакции (колПЦР) или других способов, одобренных EMA и FDA.
В особенно предпочтительном варианте осуществления данного изобретения с помощью способа по любому из аспектов данного изобретения можно получить продукт, обладающий любой одной или большим количеством характеристик, выбранных из перечня, состоящего из:
- концентрации белка AnxA5, которая как правило, составляет около 8-12 г/л;
- уровней белка клетки-хозяина, равных или ниже 100 нг/мг и более предпочтительно 20 нг/мг (что определяется с помощью ELISA);
- уровней ДНК клетки-хозяина, равных или ниже 100 пг/мг; и более предпочтительно 10 пг/мг
- уровней эндотоксина, равных или ниже 35 ЕЭ/мг и более предпочтительно 1 ЕЭ/мг,
- степени чистоты > 95%, что определяется с помощью эксклюзионной хроматографии;
- бионагрузки < 1 КОЕ/мл (что определено в Европейской Фармакопее 2.6.12);
- прозрачного, бесцветного вид, несодержащего видимых частиц; а также
- при этом основная полоса, обнаруженная при вестерн-блот-анализе, соответствует эталонному аннексину А5.
В еще одном особенно предпочтительном варианте осуществления данного изобретения белок AnxA5 в продукте может иметь низкий уровень глюконоилирования. Термин "низкий» в этом контексте может включать значение, означающее, что уровень глюконоилирования является меньше (например, меньше 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 10% 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1%), чем уровень глюконоилирования белка AnxA5, который экспрессируется в штамме BL21 E. coli (DE3) (например, как это широко коммерчески доступно, и, как описано в Marder et al., 2014, BMC Biotechnology, 14:33). Например, возможно, что уровень глюконоилированного белка AnxA5 в продукте находится в пределах от 0,5 до 30% или от 0,5 до 20% или от 0,5 до 15% или от 0,5 до 10% от общего содержания белка AnxA5 в продукте. Другими словами, может быть так, что уровень глюконоилированного белка AnxA5 в продукте является ниже 40%, например, ниже 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% и предпочтительно по существу до 0%. Глюконоилированные варианты Anx5 можно, например, измерять и количественно оценивать, с помощью приборов для хроматографии СВЖХ или ВЭЖХ с применением соответствующих колонок анионообмена или обращенной фазы.
Соответственно, в пятом аспекте данного изобретения предлагается композиция, содержащая белок AnxA5, при этом композиция представляет собой прямой или опосредованный продукт (получаемый в результате прямого или опосредованного) процесса согласно любому одному из первого, второго, третьего или четвертого аспектов данного изобретения. Необязательно указанная композиция представляет собой фармацевтически приемлемую и/или ветеринарно приемлемую композицию.
J. Пременение в медицине и ветеринарии
В шестом аспекте данного изобретения также предлагается композиция по пятому аспекту данного изобретения для применения в медицине. Другими словами, в шестом аспекте данного изобретения предлагается способ, включающий введение человеку или животному, имеющему для этого показания, терапевтически эффективного количества композиции по пятому аспекту данного изобретения.
В некоторых вариантах осуществления шестого аспекта данного изобретения может применяться композиция по пятому аспекту данного изобретения:
(a) для профилактики или снижения риска тромбоза (например, атеротромбоза) и/или разрыва бляшки, или для введения пациентам, входящим в группу риска, включая, но не ограничиваясь ими, пациентов с системной красной волчанкой (СКВ) и/или пациентов, которые имеют или имели (или подвергаются риску) инфекции верхних дыхательных путей или другие инфекции (включая пневмококковую инфекцию), которые могут обуславливать образование повышенного уровня связанных с антифосфолипидом антител, или для лечения (активного или профилактического) или снижения риска тромбоэмболии, геморрагического или васкулитического инсульта, инфаркта миокарда, стенокардии или перемежающейся хромоты, нестабильной стенокардии, других форм тяжелой стенокардии или транзиторных ишемических атак (ТИА), например, как дополнительно описано в WO 2005/099744 (содержание которого включено в данное описание посредством ссылки);
(b) для лечения, профилактики или снижения риска сосудистой дисфункции, стенокардии, ишемической болезни сердца, заболеваний периферических артерий, систолической гипертензии, мигрени, диабета типа 2 и эректильной дисфункции, снижения интенсивности ишемической боли и/или лечения заболеваний, связанных с разрывом сосудов, например, как описано в WO 2009/077764 (содержание которого включено в данное описание посредством ссылки);
(c) для профилактики или лечения рестеноза (в частности, образования или утолщения неоинтимы) или воспаления сосудов, например, как описано в WO 2009/103977 (содержание которого включено в данное описание посредством ссылки);
(d) для применения с целью ингибирования активности окисленного кардиолипина (oxCL), а также для лечения, предотвращения и/или снижения риска развития сердечно-сосудистого заболевания, аутоиммунного заболевания или воспалительного патологического состояния, например, как описано в WO 2010/069605 (содержание которого включено в данное описание посредством ссылки), включая, но не ограничиваясь следующими заболеваниями: сердечно-сосудистые заболевания (ССЗ), диабет II, болезнь Альцгеймера, деменцию в целом, ревматические заболевания, атеросклероз, высокое кровяное давление, острые и/или хронические воспалительные состояния, инфаркт миокарда, острый коронарный синдром, инсульт, транзиторную ишемическую атаку (ТИА), хромоту, стенокардию, диабет типа I, ревматоидный артрит, псориаз, псориатический артрит, анкилозирующий спондилоартрит, синдром Рейтера, системную красную волчанку, дерматомиозит, синдром Шегрена, красную волчанку, рассеянный склероз, миастению, астму, энцефалит, воспалительное заболевание кишечника, хроническое обструктивное заболевание легких (ХОЗЛ), артрит, включая остеоартрит, идиопатические воспалительные миопатии (ИВМ), дерматомиозит (ДМ), полимиозит (ПМ), миозит с включёнными тельцами, аллергические состояния и/или остеоартрит у млекопитающих; а также
(e) для предотвращения и/или уменьшения пери- или послеоперационных осложнений после хирургического вмешательства, таких как осложнения после оперативного вмешательства на сосудах, особенно периферических, например, как описано в WO 2012/136819 (содержание которого включено в данный документ посредством ссылки).
В следующем варианте осуществления шестого аспекта данного изобретения композицию по пятому аспекту данного изобретения можно применять в профилактическом или терапевтическом способе лечения, предотвращения или снижения риска гематологических нарушений, включая, но не ограничиваясь ею, серповидноклеточную анемию.
В следующем варианте осуществления шестого аспекта данного изобретения композицию по пятому аспекту данного изобретения можно применять в профилактическом или терапевтическом способе лечения, предотвращения или снижения риска острого и хронического воспаления сосудов, первичного или вторичного васкулита, включая, но не ограничиваясь этим, васкулит с аутоиммунными компонентами и/или медикаментозно индуцированный васкулит. Соответственно, в данном изобретении также предлагается профилактический или терапевтический способ лечения, предотвращения или снижения риска васкулитов, включая болезнь Бехчета, кожный васкулит, эозинофильный гранулематоз с полиангититом (ЭГРА), гигантоклеточный артериит, гранулематоз с полиангититом (ГПА), иммуноглобулин A-ассоциированный васкулит (IgAВ), микроскопический полиангиит (MПA), узелковый полиартериит (УПА), ревматическую полимиалгию и артерит такайсу. Особый интерес может представлять собой ревматическая полимиалгия.
В следующем варианте осуществления шестого аспекта данного изобретения композицию по пятому аспекту данного изобретения можно применять в профилактическом или терапевтическом способе лечения, предотвращения или снижения риска окклюзии вены сетчатки.
В следующем варианте осуществления шестого аспекта данного изобретения композицию по пятому аспекту данного изобретения можно применять в профилактическом или терапевтическом способе (i) предотвращения или снижения темпов передачи вирусной инфекции; (ii) предотвращения или защиты от вирусной инфекции; или (iii) лечения вирусной инфекции у субъекта, при этом вирусная инфекция вызвана вирусом, выбранным из группы, состоящей из:
(a) вируса, способного вызывать геморрагическую лихорадку (ВГЛ), и
(b) вирус, который содержит фосфатидилсерин (ФС), и опосредует инфицирование клетки и/или интернализацию посредством связывания с ФС.
Соответственно, в еще одном варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения в профилактическом или терапевтическом способе предотвращения или снижения скорости передачи вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, способным вызывать геморрагическую лихорадку (ВГЛ).
Таким образом, в данном изобретении предлагается профилактический или терапевтический способ предотвращения или снижения скорости передачи вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, способным вызывать геморрагическую лихорадку (ВГЛ), включающий введение субъекту терапевтически эффективного количества композиции по пятому аспекту данного изобретения.
Другими словами, в этом варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения при изготовлении лекарственного средства для профилактики или лечения путем предотвращения или снижения скорости передачи вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, способным вызывать геморрагическую лихорадку (ВГЛ).
В другом варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения в профилактическом или терапевтическом способе предотвращения или снижения скорости передачи вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, который содержит фосфатидилсерин (ФС) и опосредует инфицирование клетки и/или интернализацию посредством связывания с ФС.
Таким образом, в данном изобретении предлагается профилактический или терапевтический способ предотвращения или снижения скорости передачи вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, который содержит фосфатидилсерин (ФС) и опосредует инфицирование клетки и/или интернализацию посредством связывания с ФС, при этом способ включает введение субъекту терапевтически эффективного количества композиции по пятому аспекту данного изобретения.
Другими словами, в этом варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения при изготовлении лекарственного средства для профилактики или лечения путем предотвращения или снижения скорости передачи вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, который содержит фосфатидилсерин (ФС) и опосредует инфицирование клетки и/или интернализацию посредством связывания с ФС.
В другом варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения в профилактическом или терапевтическом способе предотвращения или защиты от вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, способным вызывать геморрагическую лихорадку (ВГЛ).
Таким образом, в данном изобретении предлагается профилактический или терапевтический способ предотвращения или защиты от вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, способным вызывать геморрагическую лихорадку (ВГЛ), включающий введение субъекту терапевтически эффективного количества композиции по пятому аспекту данного изобретения.
Другими словами, в этом варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения при изготовлении лекарственного средства для профилактики или лечения путем предотвращения или защиты от вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, способным вызывать геморрагическую лихорадку (ВГЛ).
В другом варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения в профилактическом или терапевтическом способе предотвращения или защиты от вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, который содержит фосфатидилсерин (ФС) и опосредует инфицирование клетки и/или интернализацию посредством связывания с ФС.
Таким образом, в данном изобретении предлагается профилактический или терапевтический способ предотвращения или защиты от вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, который содержит фосфатидилсерин (ФС) и опосредует инфицирование клетки и/или интернализацию посредством связывания с ФС, при этом способ включает введение субъекту терапевтически эффективного количества композиции по пятому аспекту данного изобретения.
Другими словами, в этом варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения при изготовлении лекарственного средства для профилактики или лечения путем предотвращения или защиты от вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, который содержит фосфатидилсерин (ФС) и опосредует инфицирование клетки и/или интернализацию посредством связывания с ФС.
В другом варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения в профилактическом или терапевтическом способе лечения вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, способным вызывать геморрагическую лихорадку (ВГЛ).
Таким образом, в данном изобретении предлагается профилактический или терапевтический способ лечения вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, способным вызывать геморрагическую лихорадку (ВГЛ), включающий введение субъекту терапевтически эффективного количества композиции по пятому аспекту данного изобретения.
Другими словами, в этом варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения при изготовлении лекарственного средства для профилактики или терапевтического воздействия путем лечения вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, способным вызывать геморрагическую лихорадку (ВГЛ).
В другом варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения в профилактическом или терапевтическом способе лечения вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, который содержит фосфатидилсерин (ФС) и опосредует инфицирование клетки и/или интернализацию посредством связывания с ФС.
Таким образом, в данном изобретении предлагается профилактический или терапевтический способ лечения вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, который содержит фосфатидилсерин (ФС) и опосредует инфицирование клетки и/или интернализацию посредством связывания с ФС, при этом способ включает введение субъекту терапевтически эффективного количества композиции по пятому аспекту данного изобретения.
Другими словами, в этом варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения при изготовлении лекарственного средства для профилактики или терапевтического воздействия путем лечения вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, который содержит фосфатидилсерин (ФС) и опосредует инфицирование клетки и/или интернализацию посредством связывания с ФС.
Согласно еще одному варианту осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения в способе лечения субъекта, инфицированного или подозреваемого в инфицировании патогеном, способным вызывать геморрагическую лихорадку, таким как вирус, способный вызывать геморрагическую лихорадку (ВГЛ) или бактерии, способные вызывать геморрагическую лихорадку (БГЛ).
Другими словами, в этом варианте осуществления данного изобретения предлагается способ лечения субъекта, инфицированного или подозреваемого в инфицировании патогеном, способным вызывать геморрагическую лихорадку, таким как вирус, способный вызывать геморрагическую лихорадку (ВГЛ) или бактерии, способные вызывать геморрагическую лихорадку (БГЛ), при этом способ включает введение субъекту терапевтически эффективного количества композиции по пятому аспекту данного изобретения.
Другими словами, в этом варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения при изготовлении лекарственного средства для лечения субъекта, инфицированного или подозреваемого в инфицировании патогеном, способным вызывать геморрагическую лихорадку, таким как вирус, способный вызывать геморрагическую лихорадку (ВГЛ) или бактерии, способные вызывать геморрагическую лихорадку (БГЛ).
Согласно другому варианту осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения в способе лечения субъекта, который находился в контакте с другим субъектом, инфицированным или подозреваемым в инфицировании патогеном, способным вызывать геморрагическую лихорадку, таким как вирус, способный вызывать геморрагическую лихорадку (ВГЛ) или бактерии, способные вызывать геморрагическую лихорадку (БГЛ).
Другими словами, в этом варианте осуществления данного изобретения предлагается способ лечения субъекта, который находился в контакте с другим субъектом, инфицированным или подозреваемым в инфицировании патогеном, способным вызывать геморрагическую лихорадку, таким как вирус, способный вызывать геморрагическую лихорадку (ВГЛ) или бактерии, способные вызывать геморрагическую лихорадку (БГЛ), при этом способ включает введение субъекту терапевтически эффективного количества композиции по пятому аспекту данного изобретения.
Другими словами, в этом варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения при изготовлении лекарственного средства для лечения субъекта, который находился в контакте с другим субъектом, инфицированным или подозреваемым в инфицировании патогеном, способным вызывать геморрагическую лихорадку, таким как вирус, способный вызывать геморрагическую лихорадку (ВГЛ) или бактерии, способные вызывать геморрагическую лихорадку (БГЛ).
Согласно еще одному варианту осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения в способе лечения субъекта, который находился в контакте с биологическим материалом, присутствующим в организме другого субъекта или выделяемым другим субъектом, который является инфицированным или подозревается в инфицировании патогеном, способным вызывать геморрагическую лихорадку, таким как вирус, способный вызывать геморрагическую лихорадку (ВГЛ) или бактерии, способные вызывать геморрагическую лихорадку (БГЛ).
Другими словами, в этом варианте осуществления данного изобретения предлагается способ лечения субъекта, который находился в контакте с биологическим материалом, присутствующим в организме другого субъекта или выделяемым другим субъектом, который является инфицированным или подозревается в инфицировании патогеном, способным вызывать геморрагическую лихорадку, таким как вирус, способный вызывать геморрагическую лихорадку (ВГЛ) или бактерии, способные вызывать геморрагическую лихорадку (БГЛ), при этом способ включает введение субъекту терапевтически эффективного количества композиции по пятому аспекту данного изобретения.
Другими словами, в этом варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения при изготовлении лекарственного средства для лечения субъекта, который находился в контакте с биологическим материалом, присутствующим в организме другого субъекта или выделяемым другим субъектом, который является инфицированным или подозревается в инфицировании патогеном, способным вызывать геморрагическую лихорадку, таким как вирус, способный вызывать геморрагическую лихорадку (ВГЛ) или бактерии, способные вызывать геморрагическую лихорадку (БГЛ).
Согласно этим вышеприведенным вариантам осуществления данного изобретения патогеном, способным вызывать геморрагическую лихорадку, может быть ВГЛ.
Вирусные геморрагические (или геморрагические) лихорадки (ВГЛ) представляют собой группу из разных заболеваний животных и человека, которые могут быть вызваны по меньшей мере пятью отдельными семействами РНК-содержащих вирусов: семействами Arenaviridae, Filoviridae, Bunyaviridae, Flaviviridae, а также Rhabdoviridae. Все типы ВГЛ могут характеризоваться лихорадкой и кровотечениями, и во многих случаях все они могут прогрессировать с развитием гипертермии высокого уровня, шока и смерти.
Субъект, подозреваемый в инфицировании патогеном, способным вызывать геморрагическую лихорадку, таким как вирус, способный вызывать геморрагическую лихорадку (ВГЛ), или бактерии, способные вызывать геморрагическую лихорадку (БГЛ), может быть субъектом, имеющим контакт с заболеванием в анамнезе (например, при исполнении профессиональных обязанностей в качестве медицинского работника или при инфицировании члена семьи) и/или может быть субъектом, у которого отмечается один или большее количество признаков или симптомов инфицирования до подтверждения диагноза.
Признаки и симптомы ВГЛ характеризуются лихорадкой и повышенной склонностью к кровотечениям (геморрагический диатез). Проявления ВГЛ часто включают в себя также покраснение кожи лица и грудной клетки, небольшие красные или фиолетовые пятна (петехии), открытое кровотечение, припухание, обусловленное отеком, снижение кровяного давления (гипотензия) и шок. Часто возникает чувство общего недомогания, боль в мышцах (миалгия), головная боль, рвота и диарея. Тяжесть симптомов варьируется в зависимости от типа вируса, "синдрома ВГЛ" (повышенная проницаемость капилляров, геморрагический диатез и нарушение кровообращения, приводящие к шоку), возникающего у большинства пациентов с филовирусными геморрагическими лихорадками (например, Эбола и Марбург), конго-крымской геморрагической лихорадкой (ККГЛ), и южноамериканскими геморрагическими лихорадками, и у небольшой части пациентов с лихорадкой денге, лихорадкой Рифт-Валли (РВЛ) и лихорадкой Ласса.
Согласно шестому аспекту данного изобретения ВГЛ может представлять собой лихорадку Эбола, при этом у субъект может отмечаться один или большее количество симптомов лихорадки Эбола, таких как симптомы, выбранные из первичных клинических симптомов, такие как чрезмерное или обильное потоотделение, лихорадка, миалгия, общее недомогание и/или озноб; и/или гриппоподобные симптомы, необязательно сопровождаемые желудочно-кишечными симптомами; макулопапулярная сыпь, петехии, конъюнктивальное кровоизлияние, носовое кровотечение, мелена, гематемезис, шок и/или энцефалопатия; лейкопения (например, связанная с повышенным апоптозом лимфоидных клеток), тромбоцитопения, повышенные уровни аминотрансферазы, тромбина и/или частичного тромбопластина, продукты расщепления фибрина, обнаруживаемые в крови, и/или диссеминированное внутрисосудистое свёртывание (ДВС).
Как правило, подтверждение диагноза проводят в референс-лаборатории с повышенными требованиями к безопасности. Результаты лабораторных исследований несколько различаются между вирусами, но в целом происходит снижение общего количества лейкоцитов (особенно лимфоцитов), снижение количества тромбоцитов, увеличение активности ферментов печени в сыворотке крови и снижение способности к свертыванию крови, что измеряется как увеличение протромбинового (ПВ) и активированного частичного тромбопластинового времени (аЧТВ). Может быть повышен гематокрит. Могут повышаться уровни мочевины и креатина в сыворотки, но это будет зависит от состояния гидратации пациента. Время кровотечения имеет тенденцию к увеличению.
Например, будучи агентом BSL-4, подтверждающая клиническая лабораторная диагностика виремии во время острой фазы инфекции, вызванной вирусом Эбола, возможна с применением пригодного лабораторного оборудования. Анализы, которые могут применяться, зависят от стадии заболевания.
Во время острого заболевания анализы включают: a) выделение вируса с применением линий клеток Vero или Vero E6, b) исследования с применением от-ПЦР и количественной ПЦР в реальном времени с соответствующими ложноотрицательными и ложноположительными контролями, c) ELISA с захватом антигена и d) IgM ELISA.
Позже, в динамике болезни можно применять исследования, которые, включают: а) IgM и IgG ELISA с применением аутентичных вирусных антигенов, а в случае смерти можно исследовать ткани аутопсии для обнаружения антигена с помощью методов иммуноокрашивания, b) иммуногистохимическое обнаружение антигена вируса Ebola (Zaki et al, J Infect Dis, 1999;179(Suppl. 1): S36e47., содержание которого включено в данный документ посредством ссылки во всей его полноте) и c) гибридизацию in-situ для обнаружения вирусной РНК.
Детали каждого из этих методов были обобщены в публикации Saijo et al., Clin Vaccine Immunol 2006, 13: 444e51, содержание которой включено в данный документ посредством ссылки во всей своей полноте.
Анализ на основе ELISA был стандартизован CDC для обнаружения специфических антител к Эболавирусу. Анализ характеризовался высокой чувствительностью и, как было показано, способен обнаруживать антитела в сыворотке людей, проконтактировавших с вирусом Эбола 10 лет назад. Также был разработан анализ бляшкообразования на основе клеток и анализ титрования конечной точки (TCID50) для обнаружения и количественного определения филовирусов для применения в доклинических исследованиях (Shurtleff et al., Viruses 2012;4:3511e30; Smither et al., J Virol Methods 2013;193:565e71, содержание которых включено в данный документ посредством ссылки во всей их полноте).
Например, ВГЛ может представлять собой вирус из семейства, выбранного из Filoviridae, Arenaviridae, Bunyaviridae, Flaviviridae или Rhabdoviridae.
Семейство Arenaviridae включает в себя вирусы, вызывающие лихорадку Ласса, аргентинскую, боливийскую, бразильскую и венесуэльскую геморрагические лихорадки, а также вирус Луджо.
Семейство Bunyaviridae включает в себя представителей рода Hantavirus, которые вызывают геморрагическую лихорадку с почечным синдромом (ГЛПС), вирус конго-крымской геморрагической лихорадки (ККГЛ) из рода Nairovirus, вирус Гарисса (Garissa) и вирус Илеша (Ilesha) из рода Orthobunyavirus и вирус лихорадки Рифт-Валли (РВЛ) из рода Phlebovirus.
Семейство Filoviridae в себя вирус Эбола и вирус Марбурга.
Семейство Flaviviridae включает в себя вирусы, вызывающие лихорадку денге, желтую лихорадку и два вируса из группы клещевого энцефалита, которые вызывают ВГЛ: вирус омской геморрагической лихорадки и вирус болезни Кьясанурского леса.
Также сообщается о 2 смертельных и 2 несмертельных случаях геморрагической лихорадки в районе Бас-Конго в Демократической Республике Конг, обусловленных выделенным представителем семейства Rhabdoviridae. Несмертельные случаи зафиксированы у медицинских работников, занимающихся лечением двух других пациентов, в связи с чем предполагается возможность передачи вируса от человека к человеку.
Соответственно, например, в одном варианте осуществления данного изобретения, представляющем особый интерес, данное изобретение может быть применено относительно вирусов семейства Filoviridae, таких как вирус Эбола и вирус Марбурга. В другом варианте осуществления данного изобретения, представляющем особый интерес, данное изобретение может быть применено относительно вирусов семейства Flaviviridae, таких как вирус денге.
Соответственно, в данном изобретении предлагаются композиция по пятому аспекту данного изобретения для применения в профилактическом или терапевтическом способе, как описано выше, для (i) предотвращения или снижения скорости передачи инфекции Эбола; (ii) предотвращения или защиты от инфекции Эбола; или (iii) лечение инфекции Эбола у субъекта, инфицированного или подозреваемого в инфицировании вирусом Эбола, или если субъект находился или предполагается, что будет находится в контакте с другим субъектом, который является инфицированным или подозревается в инфицировании вирусом Эбола, или если субъект находился или предполагается, что будет находится в контакте с биологическим материалом, присутствующим в организме другого субъекта или выделяемым другим субъектом, который является инфицированным или подозревается в инфицировании вирусом Эбола.
Соответственно, в данном изобретении предлагаются композиция по пятому аспекту данного изобретения для применения в профилактическом или терапевтическом способе, как описано выше, для (i) предотвращения или снижения скорости передачи инфекции Марбурга; (ii) предотвращения или защиты от инфекции Марбурга; или (iii) лечения инфекции Марбурга, при этом субъект является инфицированным или подозревается в инфицировании вирусом Марбурга, или субъект находился или предполагается, что будет находится в контакте с другим субъектом, который является инфицированным или подозревается в инфицировании вирусом Марбурга, или субъект находился или предполагается, что будет находится в контакте с биологическим материалом, присутствующим в организме другого субъекта или выделяемым другим субъектом, который является инфицированным или подозревается в инфицировании вирусом Марбурга.
Соответственно, в данном изобретении предлагаются композиция по пятому аспекту данного изобретения для применения в профилактическом или терапевтическом способе, как описано выше, для (i) предотвращения или снижения скорости передачи вируса лихорадки денге; (ii) предотвращения или защиты от вируса лихорадки денге; или (iii) лечение вируса лихорадки денге, при этом субъект является инфицированным или подозревается в инфицировании вирусом лихорадки денге, или субъект находился или предполагается, что будет находится в контакте с другим субъектом, который является инфицированным или подозревается в инфицировании вирусом лихорадки денге, или субъект находился или предполагается, что будет находится в контакте с биологическим материалом, присутствующим в организме другого субъекта или выделяемым другим субъектом, который является инфицированным или подозревается в инфицировании вирусом лихорадки денге.
В данном изобретении также предлагается композиция по пятому аспекту данного изобретения для применения в описанном выше способе, с целью лечения, препятствия развитию и/или замедления прогрессирования инфекции у субъекта, вызванной ВГЛ или БГЛ.
В данном изобретении также предлагается композиция по пятому аспекту данного изобретения для применения в описанном выше способе, с целью предотвращения, снижения тяжести, препятствия развитию и/или замедления прогрессирования прямого и/или опосредованного бактериального или вирусного поражения иммунной и/или сосудистой системы у субъекта, вызванного БГЛ или ВГЛ.
Например, данное изобретение можно применять с целью предотвращения, снижения тяжести, препятствия развитию и/или замедления прогрессирования прямого и/или опосредованного бактериального или вирусного поражения иммунной системы у субъекта, например, в случае инфекции Эбола. Например, бактериальное или вирусное поражение может быть выбрано из поражения врожденного иммунного ответа, поражения приобретенного гуморального ответа, поражения дендритных клеток, поражения регуляции продукции воспалительных факторов, например, продукции интерферона (включая продукцию IL1), поражения макрофагов и/или поражения моноцитов.
Данное изобретение можно применять с целью предотвращения, снижения тяжести, препятствия развитию и/или замедления прогрессирования кровотечения (геморрагий), гипотензии, снижения артериального давления, шока или смерти у субъекта.
Данное изобретение можно применять с целью предотвращения, снижения тяжести, препятствия развитию и/или замедления прогрессирования вирус-индуцированного повреждения сосудистого эндотелия субъекта оксидом азота.
В данном изобретении предлагается композиция по пятому аспекту данного изобретения для применения в способе предотвращения, снижения тяжести, препятствия развитию и/или замедления прогрессирования поражения активации, гибели и/или нарушения целостности, сосудистого эндотелия или его эндотелиальных клеток, у субъекта, инфицированного или подозреваемого в инфицировании патогеном, способным вызывать геморрагическую лихорадку, таким как ВГЛ или БГЛ. Целостность сосудистого эндотелия или его эндотелиальных клеток можно определить, например, по степени клеточного или сосудистого эпителиального просачивания и/или путем обнаружения одного или большего количества геморрагических элементов или образования отеков и/или дегидратации субъекта.
В данном изобретении предлагается композиция по пятому аспекту данного изобретения для применения в способе предотвращения, снижения тяжести, препятствия развитию и/или замедления прогрессирования поражения, активации, гибели и/или нарушения целостности сосудистого эндотелия или его эндотелиальных клеток у субъекта, который находился или предполагается, что будет находится в контакте с другим субъектом, являющимся инфицированным или с подозрением на инфицирование патогеном, способным вызывать геморрагическую лихорадку, таким как ВГЛ или БГЛ.
В данном изобретении предлагается композиция по пятому аспекту данного изобретения для применения в способе предотвращения, снижения тяжести, препятствия развитию и/или замедления прогрессирования поражения, активации, гибели и/или нарушения целостности сосудистого эндотелия или его эндотелиальных клеток у субъекта, который находился или предполагается, что будет находится в контакте с биологическим материалом, присутствующим в организме другого субъекта или выделяемым другим субъектом, являющимся инфицированным или с подозрением на инфицирование патогеном, способным вызывать геморрагическую лихорадку, таким как ВГЛ или БГЛ.
В дополнительном варианте осуществления данного изобретения предлагается композиция по пятому аспекту данного изобретения для применения, как описано выше, со ссылкой на различные варианты осуществления данного изобретения в профилактическом или терапевтическом способе, при этом вирусная инфекция вызвана вирусом, который содержит фосфатидилсерин (ФС) и опосредует инфицирование клетки и/или интернализацию посредством связывания с ФС. В альтернативном варианте вирусная инфекция может быть вызвана вирусом, который содержит один или большее количество других типов фосфолипидов, которые связываются аннексином A5, и/или других фрагментов, которые связываются аннексином A5.
Вирусы, которые содержат фосфатидилсерин (ФС) и опосредуют инфицирование клетки и/или интернализацию посредством связывания с ФС, могут, в частности, включать в себя вирусы с оболочкой, в которой содержится фосфатидилсерин (ФС), особенно во внешнем слое. Содержание ФС в вирусе можно определить с помощью способов, известных в данной области техники, например, с помощью исследования ELISA для измерения связывания аннексина A5 с вирусом. Пригодный способ может, например, включать в себя измерение связывания гемагглютинин (НА)-меченного аннексина A5 с анти-HA-антисывороткой с помощью ELISA, как описано в публикации Moller-Tank, et al, 2013, J. Virol., 87(15), 8327-8341 (содержание которой включено в данный документ посредством ссылки).
Группа вирусов, представляющих особый интерес для данного изобретения, включает те, которые опосредуют инфицирование клетки и/или интернализацию посредством связывания с рецептором, повышающим проникновение вируса, опосредованное фосфатидилсерином (PVEER). PVEER обсуждаются в публикации Moller Tank, et al, 2013, J. Virol., 87(15), 8327-8341, и одним из их примеров является рецептор Т-клеточного иммуноглобулина и муцина 1 (TIM-1). Другие примеры могут включать в себя TIM-4, Gas6 или белок S/Axl, Mer и Tyro3, а MFG-E8/интегрин αvβ3 или αvβ5
Эбола является примером одного вируса, представляющего особый интерес, который содержит фосфатидилсерин (ФС) и опосредует инфицирование клетки и/или интернализацию посредством связывания ФС с TIM-1. Moller Tank, et al, 2013, J. Virol., 87(15), 8327-8341.
В данном изобретении определено, что аннексин А5 и композицию по пятому аспекту данного изобретения можно применять для ингибирования или прерывания опосредованной ФС-инфицирования и/или интернализации клеток вирусами, такими как вирус Эбола, посредством PVEER, таких как TIM -1 и, следовательно, может быть пригодным для применения в профилактическом или терапевтическом способе (i) предотвращения или снижения скорости передачи вирусной инфекции у субъекта, (ii) предотвращения или защиты от вирусной инфекции; или (iii) лечения вирусной инфекции у субъекта, при этом вирусная инфекция обусловлена вирусом, который содержит фосфатидилсерин (ФС) и опосредует инфицирование клетки и/или интернализацию посредством связывания с ФС.
Вирусы, содержащие фосфатидилсерин (ФС), можно, например, выбрать из группы, состоящей из вируса семейства Filoviridae (например, вируса Эбола и Марбург); семейства Flaviviridae; вируса гепатита А; альфа-вирусов; бакуловирусов; и аренавирусов. Вирусы могут инфицировать людей, или только людей. Вирусы могут инфицировать животных, или только нечеловекоподобных животных, таких как любой один или большее количество животных, выбранных из группы, состоящей из собак, кошек, крупного рогатого скота, овец, свиней, коз, грызунов, верблюдов, домашних животных и диких животных.
PVEER, такие как TIM-1, могут быть вовлечены в процесс интернализации вирусов в различные типы клеток. В одном варианте осуществления данного изобретения типы клеток, представляющие особый интерес в контексте защиты и/или лечения согласно данному изобретению, могут включать один или большее количество типов клеток, выбранных из группы, состоящей из эпителиальных клеток (включая сосудистые эпителиальные клетки), тучных клеток, В-клеток, и Т-клеток, таких как CD4+ клетки или CD8+ клетки и особенно активированные CD4+ клетки.
TIM-1, также известный как HAVCR1 и KIM-1, был идентифицирован как ген восприимчивости к астме человека (Mclntire et al, 2003, Nature 425:576). Одна опубликованная аминокислотная последовательность для белка TIM-1 человека показана как:
MHPQVVILSLILHLADSVAGSVKVGGEAGPSVTLPCHYSGAVTSMCWRGSC SLFTCQNGIVWTNGTHVTYRKDTRYKLLGDLSRRDVSLTIENTAVSDSGVYC CRVEHRGWFNDMKITVSLEIVPPKVTTTPIVTTVPTVTTVRTSTTVPTTTTVPM TTVPTTTVPTTMSIPTTTTVLTTMTVSTTTSVPTTTSIPTTTSVPVTTTVSTFVPP MPLPRQNHEPVATSPSSPQPAETHPTTLQGAIRREPTSSPLYSYTTDGNDTVTE SSDGLWNNQTQLFLEHSLLTANTTKGIYAGVCISVLVLLALLGVIIAKKYFF KKEVQQLSVSFSSLQIKALQNAVEKEVQAEDNIYIENSLYATD (SEQ ID NO: 2).
TIM-1 представляет собой мембранный белок типа I с внеклеточной областью, содержащей домен IgV, богатый муцинами домен и мембрано-проксимальный стебель, содержащий N-связанные участки гликозилирования (Ichimura et al, 1998, J, Biol, Chem. 273(7):4135-42). Домен ΤIΜ-1 IgV имеет дисульфидзависимую конформацию, в которой петля CC' свернута на нитях GFC β, что приводит к характерной "расщелине", образованной петлями CC' и FG (Santiago et al, 2007, Immunity 26(3):299-310). Расщелина, образованная петлями CC' и FG, является участком связывания для фосфатидилсерина (Kobayashi et al, 2007, Immunity 27(6):927-40). Антитела, направленные в расщелину CC'/FG домена IgV TIM-1, ингибируют связывание TIM-1 с фосфатидилсерином и дендритными клетками и проявляют терапевтическую активность in vivo в модели гуманизированных мышей с аллергической астмой (Sonar et al, 2010, J. Clin. Invest. 120: 2767-81).
Еще один вариант осуществления данного изобретения основан на применении композиции по пятому аспекту данного изобретения для предотвращения, ингибирования или снижения способности IgV-домена TIM-1 и других PVEER связываться с ФС, представленным в нем. Белок AnxA5 в композиции по пятому аспекту данного изобретения предпочтительно также имеет способность связывать ФС и согласно этому варианту осуществления данного изобретения способен конкурировать с PVEER относительно связывания с ФС.
Соответственно, в еще одном варианте осуществления данного изобретения композицию по пятому аспекту данного изобретения можно применять в способе, который ингибирует связывание фосфатидилсерина с TIM-1 (или другим PVEER).
Например, это может быть профилактически или терапевтически полезно в случае ингибирования, снижения или предотвращения инфицирования клеток вирусами, которые содержат фосфатидилсерин (ФС), и опосредуют инфицирование клетки и/или интернализацию посредством ФС.
В альтернативном варианте, это может быть профилактически или терапевтически полезно в случае других медицинских состояний, для которого характерно связывание ФС с TIM-1 (или другими PVEER). Нарушения, ассоциированные с TIM-1, обсуждаются ниже.
Поэтому в другом варианте осуществления данного изобретения предлагается способ ингибирования или уменьшения связывания TIM-1 или другого PVEER с фосфатидилсерином, при этом способ включает в себя приведение в контакт первой клетки, которая экспрессирует TIM-1 или другой PVEER, с количеством композиции по пятому аспекту данного изобретения, которая является эффективной для ингибирования или уменьшения связывания первой клетки со второй клеткой, которая содержит фосфатидилсерин на своей поверхности, или с вирусом, который содержит фосфатидилсерин (ФС) на своей поверхности. Этот способ может представлять собой способ in vivo или in vitro. В случае применения способа in vivo, он может заключаться в лечении или предотвращении патологического состояния, для которого характерно связывание ФС с TIM-1 или другим PVEER.
Другими словами, в этом варианте осуществления данного изобретения также предлагается композиция по пятому аспекту данного изобретения для применения в профилактическом или терапевтическом способе с целью ингибирования или уменьшения связывания TIM-1 или другого PVEER с фосфатидилсерином у пациента, имеющего для этого показания.
В другом варианте осуществления данного изобретения предлагается способ ингибирования или уменьшения связывания ФС с TIM-1 или другим PVEER на дендритной клетке, при этом способ включает в себя приведение в контакт дендритной клетки, которая экспрессирует TIM-1 или другой PVEER, с количеством композиции по пятому аспекту данного изобретения, которая является эффективной для ингибирования или уменьшения связывания ФС с дендритной клеткой. Этот способ может представлять собой способ in vivo или in vitro. В случае применения способа in vivo, он может заключаться в лечении или предотвращении патологического состояния, для которого характерно связывание ФС с TIM-1 или другим PVEER на дендритной клетке.
Другими словами, в этом варианте осуществления данного изобретения также предлагается композиция по пятому аспекту данного изобретения для применения в профилактическом или терапевтическом способе с целью ингибирования или уменьшения связывания ФС с TIM-1 или другим PVEER на дендритной клетке, у пациента, имеющего для этого показания.
Также описан способ лечения или предотвращения воспалительного или аутоиммунного состояния, при этом способ включает в себя введение млекопитающему, имеющему воспалительное или аутоиммунное состояние, фармацевтической композиции, содержащей терапевтически эффективное количество композиции по пятому аспекту данного изобретения.
Другими словами, в этом варианте осуществления данного изобретения также предлагается композиция по пятому аспекту данного изобретения для применения в профилактическом или терапевтическом способе предотвращения, лечения или снижения тяжести воспалительного или аутоиммунного состояния.
Также описан способ лечения или предотвращения астмы, при этом способ включает в себя введение млекопитающему, имеющему астму, фармацевтической композиции, содержащей композицию по пятому аспекту данного изобретения.
Другими словами, в этом варианте осуществления данного изобретения также предлагается композиция по пятому аспекту данного изобретения для применения в профилактическом или терапевтическом способе предотвращения, лечения или снижения тяжести астмы.
Также описан способ лечения или предотвращения атопического нарушения, при этом способ включает в себя введение млекопитающему, имеющему атопическое нарушение, фармацевтической композиции, содержащей терапевтически эффективное количество композиции по пятому аспекту данного изобретения. Атопическое нарушение может представлять собой, например, атопический дерматит, контактный дерматит, крапивницу, аллергический ринит, ангионевротический отек, аллергию на латекс или аллергическую патологию легких (например, астму, аллергический бронхолегочный аспергиллез или гиперчувствительный пневмонит).
Другими словами, в этом варианте осуществления данного изобретения также предлагается композиция по пятому аспекту данного изобретения для применения в профилактическом или терапевтическом способе предотвращения, лечения или снижения тяжести атопического нарушения.
Композицию по пятому аспекту данного изобретения применяют, как описано в данном документе, для лечения или предотвращения различных ассоциированных с TIM-1 нарушений и других ассоциированных с PVEER нарушений, включая иммунологические нарушения, такие как воспалительные и аутоиммунные нарушения.
Термин "лечение" означает введение вещества или композиции, описанных в данном документе, в количестве, в способ и/или по схеме, эффективных для улучшения патологического состояния, симптома или параметра, ассоциированного с нарушением, или для предотвращения прогрессирования или обострения нарушения (включая вторичное поражение, вызванное нарушением) либо до статистически значимой степени, либо до степени, определяемой специалистом в данной области техники.
Субъекту, который подвергается риску, с диагностированным или имеющим одно из этих нарушений, можно вводить композицию по пятому аспекту данного изобретения в количестве и в течение времени, чтобы обеспечить общий терапевтический эффект. Композицию по пятому аспекту данного изобретения можно вводить отдельно (монотерапия) или в комбинации с другими агентами (комбинированная терапия) либо в смеси, либо путем отдельного, одновременного или последовательного введения. В случае комбинированной терапии количество и время введения могут быть такими, которые обеспечивают, например, дополнительный или синергический терапевтический эффект. Кроме того, введение композиции по пятому аспекту данного изобретения (со вторым агентом или без него) можно применять в качестве основной, например, первой линии терапии или в качестве вторичной терапии, например, для субъектов, которые демонстрируют недостаточный ответ на ранее введенную терапию (т.е. терапию, не относящуюся к терапии белком AnxA5).
Заболевания или патологические состояния, которые можно лечить с применением композиции по пятому аспекту данного изобретения, описанной в данном документе, включают в себя, например, ишемически-реперфузионное поражение (например, ишемически-реперфузионное поражение органов, таких как ишемически-реперфузионное поражение печени или почек), аллергию, астму, воспалительное заболевание кишечника (ВЗК), болезнь Крона, отторжение трансплантата, панкреатит и гиперчувствительность замедленного типа (ГЗТ).
Дополнительные заболевания или патологические состояния, которые можно лечить с применением композиции по пятому аспекту данного изобретения, описанной в данном документе, включают в себя, например, аутоиммунные нарушения.
Системная красная волчанка (СКВ; люпус) представляет собой TH-2-опосредованное аутоиммунное нарушение, характеризующиеся высоким уровнем аутоантител, направленным против внутриклеточных антигенов, таких как двухцепочечная ДНК, одноцепочечная ДНК и гистоны.
Примерами других органоспецифических или системных аутоиммунных заболеваний, которые можно лечить с применением композиции по пятому аспекту данного изобретения, описанной в данном документе, являются миастения гравис, аутоиммунная гемолитическая анемия, болезнь Шагаса, болезнь Грейвса, идиопатическая тромбоцитопения пурпура (ИПТ), гранулематоз Вегенера узелковый полиартериит и быстро прогрессирующий серповидный гломерулонефрит. См., например, Benjamini et al.,1996, Immunology, A Short Course, Third Ed. (Wiley-Liss, New York). Кроме того, с помощью аннексина A5 можно лечить ревматоидный артрит (РА), как описано в данном документе.
Дополнительные связанные с TIM-1 заболевания или патологические состояния, которые можно лечить с применением композиции по пятому аспекту данного изобретения, описанной в данном документе, включают в себя, например, болезнь "трансплантат против хозяина" (БТПХ). БТПХ представляет собой патологическое состояние, опосредованное Т-клеткой, которое можно лечить с применением аннексина А5, описанного в данном документе. БТПХ инициируется, когда антигены хозяина распознаются донорными Т-клетками как чужеродные. БТПХ, часто являющаяся у пациентов-людей смертельным исходом трансплантации костного мозга (ТКМ), может быть острой или хронической. Острые и хронические формы БТПХ характеризуются развитием антигенспецифических ответов Th1 и Th2, соответственно. Острая БТПХ возникает в течение первых двух месяцев после ТКМ и характеризуется донорским цитотоксическим опосредованным Т-клетками поражением кожи, кишечника, печени и других органов. Хроническая БТПХ проявляется позже (через 100 дней после ТКМ) и характеризуется гиперпродукцией иммуноглобулина (Ig), включая аутоантитела, и поражением кожи, почек и других органов, вызванных осаждением Ig. Почти у 90% пациентов острая БТПХ переходит в хроническую БТПХ. Хроническая БТПХ, по-видимому, является опосредуемой Th2 T-клеткой (De Wit et al, 1993, J. Immunol. 150:361-366). Острая БТПХ представляет собой Thl-опосредованное заболевание (Krenger et al, 1996, Immunol. Res. 15:50-73; Williamson et al, 1996, J. Immunol. 157: 689-699). Т-клеточная цитотоксичность является характерной особенностью острой БТПХ. Последствия донорской цитотоксичности, направленной против организма хозяина, могут быть разными. Во-первых, лимфоциты хозяина быстро разрушаются, в результате чего мыши с острой БТПХ имеют глубокую иммуносупрессию. Во-вторых, донорские лимфоциты становятся привитыми и размножаются в селезенке хозяина, и их цитотоксическая активность может быть непосредственно измерена in vitro с помощью линий клеток, экспрессирующих антигены хозяина, которые могут распознаваться донорскими клетками (как чужеродные). В-третьих, болезнь становится смертельной, поскольку разрушаются дополнительные ткани и клеточные популяции.
Дополнительные ассоциированные с TIM-1 заболевания или патологические состояния, которые можно лечить с применением композиции по пятому аспекту данного изобретения, описанной в данном документе, включают в себя, например, атопические нарушения. Атопические нарушения характеризуются экспрессией клетками иммунной системы, включая активированные Т-клетки и APC, цитокинов, хемокинов и других молекул, которые характерны для ответов Th2, таких как цитокины IL-4, IL-5 и IL-13, наряду с некоторыми другими. Таким образом, по поводу таких атопических нарушений будет проводиться лечение с применением композиции по пятому аспекту данного изобретения, как описано в данном документе. Атопические нарушения включают в себя гиперчувствительность дыхательных путей и дистресс-синдром, атопический дерматит, контактный дерматит, крапивницу, аллергический ринит, ангионевротический отек, аллергию на латекс и аллергическую патологию легких (например, астму, аллергический бронхолегочный аспергиллез и гиперчувствительный пневмонит).
Дополнительные ассоциированные с TIM-1 заболевания или патологические состояния, которые можно лечить с применением композиции по пятому аспекту данного изобретения, описанной в данном документе, включают в себя, например, многочисленные иммунные или воспалительные нарушения. Иммунные или воспалительные заболевания включают, но не ограничиваются ими, аллергический ринит, аутоиммунную гемолитическую анемию; чернеющий акантоз; болезнь Аддисона; гнездную алопецию; универсальную алопецию; амилоидоз; анафилактоидную пурпуру; анафилактоидную реакцию; апластическую анемию; анкилозирующий спондилоартрит; краниальный артериит; гигантоклеточный артериит Такаясу; темпоральный артериит, атаксию-телеангиэктазию; аутоиммунный оофорит; аутоиммунный орхит; аутоиммунную полиэндокринную недостаточность; болезнь Бехчета; болезнь Бергера; болезнь Бюргера; бронхит; буллезная пузырчатка; хронический кожно-слизистый кандидоз; синдром Каплана; синдром после перенесенного инфаркта миокарда; постперикардиотомический синдром; кардит; целиакию-спру; болезнь Шагаса; синдром Чедиак-Хигаши; болезнь Чарга-Стросса; синдром Когана; болезнь холодовых агглютининов; CREST-синдром; болезнь Крона; криоглобулинемия; криптогенный фиброзный альвеолит; герпетиформный дерматит; дерматомиозит; сахарный диабет; синдром Даймонда-Блэкфана; синдром ДиДжорджи; дискоидная красная волчанка; эозинофильный фасцит; эписклерит; cтойкая возвышающаяся эритема ревматоидная эритема; мультиформная эритема; узловатая эритема; cемейная средиземноморская лихорадка; cиндром Фелти; легочный фиброз; гломерулонефрит, анафилактоидый гломерулонефрит; аутоиммунный гломерулонефрит; постстрептококковый гломерулонефрит; посттрансплантационный гломерулонефрит; мембранозная гломерулопатия; синдром Гудпасчера; иммуно-опосредованная гранулоцитопения; кольцевидная гранулёма; аллергический гранулематоз; гранулематозный миозит; болезнь Грейвса; тиреоидит Хашимото; гемолитическая болезнь новорожденного; идиопатический гемохроматоз; пурпура Шонлейн-Геноха; хронический активный и хронический прогрессирующий гепатит; гистиоцитоз X; гиперэозинофильный синдром; идиопатическая тромбоцитопеническая пурпура; синдром Джоба; ювенильный дерматомиозит; ювенильный ревматоидный артрит (ювенильный хронический артрит); болезнь Кавасаки; кератит; сухой кератоконъюнктивит; синдром Ландри-Гийена-Барре-Штроля; лепроматозная лепра; синдром Лоффлера; волчанка; синдром Лайелла; болезнь Лайма; лимфоматоидный гранулематоз; системный мастоцитоз; смешанную болезнь соединительной ткани; множественный мононеврит; синдром Маккле-Уэллса; синдром кожно-слизистых лимфоузлов; синдром кожно-слизистых лимфоузлов; многоцентровый ретикулогистиоцитоз; рассеянный склероз; миастению гравис; фунгоидный микоз; системный некротизирующий васкулит; нефротический синдром; перекрёстный синдром; панникулит; пароксизмальную холодовую гемоглобинурию; пароксизмальную ночную гемоглобинурию; пемфигоид; пузырчатку; эритематозную спузырчатку; листовидную пузырчатку; обычную пузырчатку; аллергоз голубеводов; узелковый полиартериит; ревматическую полимиалгию; полимиозит; идиопатический полиневрит; португальские семейные полинейропатии; преэклампсию/эклампсию; первичный билиарный цирроз; прогрессирующий системный склероз (склеродермия); псориаз; псориатический артрит; лёгочный альвеолярный протеиноз; легочный фиброз, феномен/синдром Рейно; тиреоидит Рейделя; синдром Рейтера, рецидивирующий полихондрит; ревматическую лихорадку; ревматоидный артрит; саркоидоз; склерит; склерозирующий холангит; сывороточная болезнь; синдром Сезари; синдром Шегрена; синдром Стивенса-Джонсона; болезнь Стилла; подострый склерозирующий панэнцефалит; симпатическую офтальмию; системную красную волчанку; отторжение трансплантанта; язвенный колит; недифференцированное заболевание соединительной ткани; хроническая крапивницу; холодовую крапивницу; увеит; витилиго; болезнь Вебера - Кристиана; гранулематоза Вегенера или синдрома Вискотта-Олдрича.
Далее данное изобретение будет описано со ссылкой на один или большее количество примеров, не имеющих ограничительного характера.
Примеры
Следующие примеры включены для демонстрации конкретных вариантов осуществления данного изобретения. Специалистам в данной области техники должно быть понятно, что методы, описанные в следующих далее примерах, представляют собой методы, открытые авторами данного изобретения с целью надлежащего функционирования при реализации данного изобретения и, таким образом, могут считаться предпочтительными способами для его реализации. Однако специалистам в данной области техники в свете данного описания следует понять, что в конкретных описанных вариантах осуществления могут быть осуществлены многие изменения без отхода от сущности и объема изобретения с получением аналогичных или сходных результатов.
Сравнительный Пример 1
Способ Мардера с соавт., 2014, BMC Biotechnology, 14:33 предполагает обработку 1 л культуры и состоит из двух этапов центрифугирования 38,900 г продолжительностью 30 минут, при этом на первом этапе центрифугирования осаждают аннексин А5, связанный с клеточным дебрисом, а на втором этапе центрифугирования осаждают клеточный дебрис, сохраняя при этом аннексин A5 в растворе.
Следующий анализ приведен для расчета последствий, связанных с увеличением масштабов изготовления продукта в способе Мардера с соавт., от 1 л до коммерчески значимого объема культуры 1000 л.
Если брать во внимание лучшие в настоящее время центрифуги с лучшими роторами для максимальной пропускной способности, то такие центрифуги могут вмещать 6x250 мл = 1,5 литра и могут достигать 30 200-38 400 г. Примерами являются дорогостоящий ротор из углеродного волокна (Fiberlite F14-6 x 250y с фиксированным углом) для применения в суперскоростных центрифугах Thermo Scientific™ Sorvall™ LYNX или ротор JLA-16.250 с фиксированным углом, алюминием и колпаком для биобезопасности, 6 x 250 мл, 38 400 x г для применения в Beckmancoulters Avanti JXN-26. При применении таких современных высокопроизводительных высокоэффективных центрифуг, для того чтобы загрузить центрифугу, начать центрифугирование и ускорить до необходимой скорости, провести 30 минут при максимальной динамической перегрузке для обеспечения тщательного осаждения и последующей остановки так, чтобы не нарушить осадок, и затем опорожнить ротор, необходимо будет около 45 минут.
То есть, лучшие в настоящее время центрифуги позволяют обрабатывать 1,5 литра за 45 мин.
Мардер с соавт. указал (в разделе, озаглавленном "Очистка»), что 3 г влажного веса клеток суспендировали в 30 мл буфера перед обработкой ультразвуком и центрифугированием. Соответственно, концентрация по весу влажной клетки (WCW), применяемая Мардером с соавт., во время центрифугирования (3 г в 30 мл буфера) = 9,1% WCW.
Мардер с соавт. также указал (под заголовком "Биореакторное культивирование" на второй странице) среднее значение 27,48 г (DCW) L-1 (SD = 1,96) для концентрации биомассы. Поэтому концентрация по весу сухой клетки (DCW) в ферментере Мардера составляла 27,48 г/л = 2,748%. Известно, что 1 грамм DCW = около 4 граммов веса влажной клетки (WCW). Поэтому в ферментаторе концентрации клеток концентрация WCW составляла 2,748 × 4 = 11,0%. Если довести этот объем до 1000 литров культуры и с осторожностью предположить о 5% -ной потере клеток во время получения готового продукта с 1000 л, то WCW в резервуаре 1000 л с применением способа Мардера будет = 1000 х 11% х 0,95 = 104,5 кг WCW.
С способе центрифугирования Мардера в ходе этапа центрифугирования применялась концентрация WCW 9,1%. Поэтому 104,5 кг WCW из культуры 1000 л необходимо разбавить до концентрации 9,1% WCW, что требует центрифугирования полного объема 1148 л.
Если сделать оптимистическое предположение о том, что биопроизводственные мощности имеют две высокопроизводительные центрифуги, то первую центрифугу можно применять для осаждения аннексина с клеточным дебрисом (первое центрифугирование), в то время как с помощью второй центрифуги можно параллельно осуществлять второе центрифугирование, когда аннексин находится в растворе, с последующим осаждением клеточного дебриса.
Общее время центрифугирования раствора объемом 1148 л рассчитывают с учетом того, что центрифуги могут обрабатывать 1,5 литра за 45 мин = 1148/1,5 = 766 центрифугирований по 45 мин каждое = 34 470 мин = 574,5 часа.
Если предположить, что биопроизводственные мощности функционируют 12 часов в сутки, то обработка WCW из резервуара 1000 л по способу Мардера с соавт. займет 48 рабочих дней или (при условии пяти рабочих дней в неделю) 10 недель только центрифугирования.
В общей сложности потребуется около двух недель для ферментации, последующей обработки и других операций. На предприятии-изготовителе это займет 12 недель при подготовке и обработке клеток из культуры 1000 л, если предположить, что биопроизводственные мощности будут полностью задействованы в этот один процесс, и поэтому на одних и тех же мощностях не может быть другого производства. Это несмотря на оптимистическое предположение о наличии двух центрифуг. Если применяют только одну центрифугу, время изготовления составляет 22 недели для одной партии 1000 литров.
Напротив, как обсуждается ниже, согласно способам по данному изобретению можно обрабатывать культуру 1000 л всего за две недели, то есть примерно в 6 раз быстрее (что также обеспечивает продукт более высокого качества с гораздо более высоким выходом, чем продукт по способу Мардера с соавт.).
Стоимость изготовления прямо пропорциональна времени изготовления, так как предприятие-изготовитель будет занято, а одних и тех же мощностях не может быть другого производства.
Рассчитано, что количество получаемого аннексина А5 в способе по данному изобретению будет в 2-3 раза выше на партию по сравнению с количеством продукта, получаемого по способу Мардера с соавт. Вследствие этого стоимость изготовления одного грамма белка аннексина A5 по способу Мардера в 12-18 раз выше (6 x 2-3).
Более того, чистота белка, полученного по способу Мардера, не пригодна для применения для организма человека. Несмотря на тщательно продуманные центрифугирования, применяется только один этап анионообменной хроматографии, которая по существу не удовлетворяет требованиям к достижению достаточной степени чистоты в отношении как связанных с изготовлением примесей (особенно эндотоксина), так и связанных с продуктом вариантов. Мардер не предоставляет каких-либо данных об уровнях эндотоксина или других примесей, что указывает на отсутствие пригодности для фармацевтического применения.
Кроме того, в ходе очень медленных операций центрифугирования по способу Мардера необходимо, чтобы белок аннексин A5 находился в неустойчивой среде в течение длительного периода времени. Это, вероятно, приводит к разложению продукта или модификации продукта и является еще одним недостатком длительного времени изготовления, с отрицательными последствиями для качества продукции.
Пример 1
Сокращения:
Введение:
Рекомбинантный белок аннексин А5 ~36 кДа, содержащий 320 аминокислот, экспрессируется в цитоплазме E. coli BL21/pHIP.ANXA5. Рекомбинантный белок аннексин А5 продуцируется главным образом в его растворимой форме. С этой целью применяют термоиндуцируемую экспрессирующую плазмиду pHIP, несущую кодирующую последовательность для аннексина А5. Селективный маркер представляет собой ген устойчивости к канамицину. MCB соответствующего клона определен и широко охарактеризован.
Производственный процесс расширяется от лабораторного масштаба, эквивалентного объему ферментации 3 л, до крупного масштаба, эквивалентного объему ферментации 100 л.
Разработанный процесс включает в себя эффективный анионообменный захват из исходного лизата с последующим этапом аффинности на иммобилизованном гепарине в присутствии кальция. Этот промежуточный аффинный этап является высокоспецифичным для аннексина А5. В качестве конечного этапа очистки применяют анионообменную хроматографию высокого разрешения. Этап очистки позволяет отделить примеси, связанные с продуктом. Состав подвергают ультрадиафильтрации с применением кассеты NMWCO 10 кДа.
В этом примере описаны и оценены плановые адаптации/изменения производственного процесса, определены рабочие параметры и необходимые меры для обеспечения успешного переноса, а также приведены критерии приемлемости для определения его успеха. Успешный перенос демонстрируется по результатам нижерасположенного процесса, включающего адаптацию к процедуре лабораторного масштаба в отношении увеличения масштабов изготовления, в результате чего получают ЛС с сопоставимым выходом и качеством продукции.
Общая цель проекта - разработка способа изготовления cGMP для аннексина A5.
Процедура - сравнение и оценка способов
В этом разделе оцениваются параметры способа, сырье, расходные материалы, буферы и оборудование.
На фиг. 2 приведен схематический обзор полного процесса изготовления аннексина А5.
В таблице 1 приведено сравнение и оценка сырья, применяемого в способах на 3 л и 100 л.
Таблица 1. Сравнение сырья, применяемого в способах на 3 л и 100 л
1,3-бис[трис(гидроксиметил)метиламино]пропан
Biochrom
В таблице 2 приведено сравнение и оценка расходных материалов, применяемых в способах на 3 л и 100 л. Расходные материалы (устройства для отбора проб и соединительные трубки) не должны влиять на качество и выход продукта в ходе НРП. Все применяемые материалы соответствуют требуемой спецификации.
Таблица 2. Перечень расходных материалов
Cuno SP 60
(AX смола)
(AF смола)
(AX смола)
Sartopore 2 0,45-0,2 мкм
EKV, Supor
Общие примечания:
• Все применяемые расходные материалы - одноразовые или ориентированные на продукт материалы.
• Пакеты, применяемые в ходе осуществления процесса для хранения буферов и в качестве контейнера для промежуточного продукта со слоем PE/EVOH (пленка CX5-14) поставляла компания Sartorius. Пакеты были валидированы изготовителем в отношении, например, стерильности, низкого уровня эндотоксина, а также выщелачиваемых и экстрагируемых веществ.
• Все другие расходные материалы, включая материалы, контактирующие с продуктом, такие как трубки, соединители, системы отбора образцов или контейнеры для образцов являются пригодными для применения на соответствующем этапе процесса. Это включает, как правило, сертификацию USP по классу VI, стерильность и/или низкий уровень эндотоксина, если это применимо. Трубка из вулканизированного платиной силикона применяется в ходе всего НРП, за исключением трубок C-Flex, предварительно помещенных в пакеты. Все применяемые расходные материалы не содержат компонентов животного происхождения или имеют сертификат TSE.
В таблице 3 приведено сравнение оборудования, применяемого в способах на 3л и на 100 л при изготовлении аннексина А5.
Таблица 3. Список применяемого оборудования
принтер
HI
730P
Hanna
WTW
ламинарным потоком воздуха (ЛПВ)
проверки целостности фильтров
Exacta
Millipore
Среда, буферы и растворы, как указано в таблице 4. Спецификации буферов адаптированы только по отношению к проводимости и на основе анализируемых буферных препаратов. Буферы готовили перед осуществлением процесса, проверяли на соответствие спецификации, подвергали микрофильтрации (фильтр 0,2 мкм) и хранили (срок сохранности ≤ 3 месяца при комнатной температуре). Взятие образцов буферов (в качестве эталона; для анализа: эндотоксина, бионагрузки) выполняли на момент применения.
Таблица 4. Перечень сред и растворов
гомогенизации 1
буфер A
буфер В
CIP1
CIP 2
буфер A
промывочный буфер
буфер В
CIP 1
CIP 2
Хранение
буфер A
буфер В
буфер
На промышленной установке разработан и расширен процесс ферментации с подпиткой и возможностью увеличения масштабов изготовления. Последующий процесс очистки включает в себя три этапа хроматографии. После обработки бензоназой отфильтрованный и разбавленный поток поступающего материала вносили в систему хроматографии AX (Q Sepharose XL, GE Healthcare) в качестве первого этапа захвата. Элюат кондиционировали путем разбавления с промежуточной очисткой с помощью аффинной хроматографии (Heparin Hyper DM, Pall). Пул AF разбавляли и применяли на заключительном этапе хроматографии AX (Source15 Q, GE Healthcare). Наконец, изменение концентрации и буфера осуществляли с помощью УФ/ДФ.
Успешный пробный прогон проводили в ходе НРП, с объемом ферментации, эквивалентным 3 л, чтобы продемонстрировать надлежащую производительность для всех этапов способа.
Целевые диапазоны определяли при малом масштабе и применяли для оценки результата, полученного при увеличении масштаба.
Сравнение способа
В следующих разделах нижерасположенный процесс (НРП) лабораторного масштаба подробно описан на основе пробного прогона, выполненного в ходе процесса в масштабе, эквивалентном объему ферментации 3 л. Как правило, помимо загрузки на этапе первого захвата, хроматографические этапы выполняли в лабораторном масштабе с помощью системы Aekta Explorer. В больших масштабах все хроматографические этапы проводили с помощью системы Bioprocess. Коэффициент масштабирования для НРП был равен 33 (от 3 лВРП до 100 лВРП).
1.1.1. Ресуспендирование биомассы, обработка бензоназой и разрушение клеток
После ферментации биомассу собирали с помощью центрифугирования и хранили при -20°C. Последующую обработку начинали с оттаивания биомассы и ресуспендирования в буфере для гомогенизации 1. Заранее гомогенизированную бензоназу, предварительно разбавленную в буфере для гомогенизации (3,300 Ед/лВРП или 1,850 Ед/лресуспендированной биомассы), добавляли к ресуспендированным клеткам. Коэффициент ресуспендирования устанавливали на 1 г биомассы/10 мл. Гомогенизацию проводили в три цикла с 600 бар для достижения высокой степени гомогенности, что предпочтительно для следующего этапа захвата. При гомогенизации не требуется активного охлаждения, учитывая, что желательным является повышение температуры до 40°C с целью обеспечения оптимального расщепления нуклеиновых кислот бензоназой. При изготовлении в небольших масштабах значения температур находились в диапазоне 36-40°C.
На фиг. 8 приведена блок-схема способа ресуспендирования биомассы, обработки бензоназой и разрушения клеток.
1.1.2. Осветление, кондиционирование и хроматография захвата
После гомогенизации лизат осветляли фильтрованием с применением глубинного фильтра Cuno 60 SP (0,6-0,2 мкм). Этот этап проводили с целью дополнительного снижения уровня содержания нуклеиновых кислот и получения раствора с уменьшенным количеством частиц, который можно применять для хроматографии захвата. Глубинный фильтр предварительно промывали водой согласно инструкциям производителя.
После фильтрации лизат двукратно разбавляли 1% Твин 80. ЭДТА добавляли для получения конечной концентрации 2 мМ.
Этот кондиционированный пул применяли в автономном режиме с перистальтическим насосом для хроматографии захвата AX. Колонку захвата AX уравновешивали двумя объемами колонки (ОК) (20 мМ Трис pH 7,4, 0,1% Твин 80, 25 мМ NaCl) при линейной скорости нагнетания 200 см/ч.
После загрузки колонку промывали в автономном режиме уравновешивающим буфером с 5 ОК, а затем переносили в хроматографическую систему для дополнительного промывания 5 ОК. Элюирование аннексина A5 проводили с помощью этапного элюирования с 9 ОК с применением более высокой концентрации соли (20 мМ Трис, pH 7,4; 0,1% Твин 80, 300 мМ NaCl). Фракционирование определяли при повышении сигнала УФ280 нм на 0,1 единицы оптической плотности (ЕОП) до 0,2 ЕОП в нисходящем пике. Весь пик элюирования дополнительно обрабатывали.
Проводили двухэтапную процедуру CIP для регенерации и очистки колонки (этап 1: 2 М NaCl для 3 ОК 100 см/ч; восходящий поток / этап 2: 1 М NaOH, 3 ОК, инкубация в течение > 15 ч, 40 см/ч восходящий поток). Затем колонку хранили в 20 мМ NaOH.
На фиг. 3 продемонстрирована блок-схема процесса хроматографии захвата AX, представленного в качестве примера.
Как правило, этап захвата можно рассматривать как этап кондиционирования для повышения производительности промежуточного этапа. На этом этапе продукт концентрируется, а матрица нагрузки значительно изменяется. Кроме того, наблюдается сильное снижение уровня эндотоксина (на около 97%) и умеренное снижение ДНК и БКХ.
1.1.3. Промежуточный этап - аффинная хроматография
Полученный элюционный пул AX (250 мл /LВРП) фильтровали (Sartopore2 0,45-0,2 мкм) перед промежуточной хроматографией.
Затем отфильтрованный пул AX разбавляли 8 раз (буфер для разбавления: 20 мМ Трис, рН 7,4, 0,1% Твин 80, 2 мМ CaCl2). Разбавление кальцием способствует связыванию аннексина A5 с гепарином при проведении иммобилизованной гепарином хроматографии. Это взаимодействие, по сравнению с ионным взаимодействием, медленное. Крайне важным является время контакта, поэтому хроматографию проводили с ≤ 100 см/ч.
Осуществляли два этапа промывания. Этап промывания 1 проводили для 15 ОК (20 мМ Трис, рН 7,4, 0,1% Твин 80, 2 CaCl2), а затем проводили второй этап промывания для 2 ОК с буфером, не содержащим кальций (20 мМ Трис, pH 7,4, 0,1% Твин 80).
Элюирование осуществляли с помощью этапного элюирования с применением буфера, содержащего ЭДТА (20 мМ Трис, рН 7,4, 0,1% Твин 80, 10 мМ ЭДТА, 25 мМ NaCl), который хелатирует ионы кальция. Реакция хелатирования специфически элюирует аннексин А5, который может связываться только с гепарином в присутствии кальция. Для обеспечения концентрированного элюирования при элюировании скорость потока снижали до ≤ 60 см/ч. Полный пик элюирования получали, начиная с повышения УФ-сигнала при 0,05 ЕОП до 0,05 ЕОП в нисходящем пике, представляющем около 7 ОК. Профиль элюирования демонстрировал один острый пик.
Проводили двухэтапную процедуру CIP для регенерации и очистки колонки (этап 1: 2 М NaCl для 3 ОК 100 см/ч; восходящий поток / этап 2: 0,1 М NaOH, 3 ОК, инкубация в течение > 15 ч, 40 см/ч восходящий поток). Затем колонку хранили в 1 М NaCl в 25% EtOH.
На фиг. 4 продемонстрирована блок-схема процесса промежуточной аффинной хроматографии.
Промежуточный этап является самым мощным этапом очистки в схеме процесса. Аннексин А5 связывается с ионами кальция. В этом связанном с кальцием состоянии продукт может образовывать высокоспецифичную связь с гепарином. Только правильно сложенные формы аннексина AnxA5, которые способны комбинироваться с кальцием, могут связываться с гепарином. Таким образом, с помощью хроматографии можно различать продукта с правильно и неправильно сложенной структурой. Кроме того, при промежуточном этапе достигаются высокие коэффициенты обеднения, поскольку высокоспецифическое взаимодействие сочетается со специфическим режимом элюирования посредством хелатной реакции кальция с ЭДТА. Поэтому наблюдается сильное снижение уровня эндотоксина (дальнейшее снижение на около 99%) и БКХ в сочетании с умеренным снижением содержания ДНК.
В результате объединенного эффекта снижения уровня эндотоксина на первом этапе захвата AX (около 97%) и этапа промежуточной аффинной хроматографии (около 99%) получают продукт аннексин А5, в котором уровни эндотоксинов снижены до около 0,03% уровней осветленного продукта, измеренных перед первым этапом AX.
1.1.4. Очистка - Хроматография AX
Полученный элюционный пул AF (300 мл/LВРП) дважды разбавляли (35 мМ Трис, pH 8, 0,1% Твин 80, 12,5 мМ MgCl2) и фильтровали (Sartopore2 0,45-0,2 мкм) перед этапом очищающей хроматографии. В результате разведения уменьшается проводимость загрузки AX, но также образуются комплексы свободных молекул ЭДТА с ионами Mg. В противном случае свободная ЭДТА связывается с колонкой, тем самым уменьшая на этом этапе главным образом емкость, но также и разделение.
Очищающей смолой является Source15 Q со средним диаметром смолы 15 мкм. Это очищающая смола с высоким разрешением, имеющая недостаток высокого противодавления. Поэтому хроматографию проводили со скоростью 100 см/ч. Загрузка должна составлять <16 г/л смолы с целью обеспечения соответствующего разрешения.
Промывание после загрузки проводили с применением буфера A (20 мМ Бис-Трис pH 7, 25 мМ NaCl) для 3 ОК. Элюирование проводили с применением линейного градиента до 100% B (20 мМ Бис-Трис pH 7; 180 мМ NaCl) в 33 ОК. Этот хроматографический этап в основном предназначен для удаления примесей, связанных с продуктом. Различные формы аннексина А5 элиюровали из 40-100% В, начиная с основного пика, второго уменьшенного пика и нескольких меньших пиков, которые следуют за ними.
Снимали первый основной пик от 0,05 ЕОП до впадины между пиком 1 и пиком 2, представляющим около 7 ОК.
Проводили двухэтапную процедуру CIP для регенерации и очистки колонки (этап 1: 2 М NaCl для 3 ОК 100 см/ч; восходящий поток / этап 2: 1 М NaOH, 3 ОК, инкубация в течение > 15 ч, 40 см/ч восходящий поток). Затем колонку хранили в 25 мМ NaCl.
Недавние результаты, полученные в небольших экспериментах, продемонстрировали положительные эффекты Твин 80. Способ с применением 0,1% Твин 80, увеличивал выход продукта после промежуточного этапа на около 30%. Загрузка на этапе очистки ограничивалась количеством смолы 16 г/л для обеспечения соответствующего разрешения. Повышение выхода продукта также влияет на план действий относительно увеличения масштабов изготовления. Вычисленный размер колонки на этапе очистки планировали с двумя циклами. Повышение выхода продукта обуславливает необходимость 4-5 циклов, если обрабатывается общее количество в масштабе от 100 лВРП.
На фиг. 2 продемонстрирована блок-схема этапа заключительной хроматографической очистки AX.
Этап очистки в основном необходим для уменьшения уровня примесей, связанных с продуктом, например, разделения различных изоформ аннексина А5. Кроме того, на этапе очистки достигается наивысший коэффициент обеднения для остаточной ДНК и сильно снижается уровень БКХ. Уровень эндотоксина, имеющий уже сниженные показатели после промежуточного этапа, дополнительно снижают на около 99%, в результате чего уровни эндотоксина доводят до 0,0003% уровней в осветленном продукте перед первым этапом АХ.
1.1.5. Ультра/диафильтрация и составление аннексина А5
Пул AX непосредственно подвергали УФ/ДФ для повышения концентрации продукта и замены буфера. После замены буфера добавляли Твин 80 для получения конечной концентрации 0,05%, а лекарственное вещество подвергали стерилизующей фильтрации.
На первом этапе процесса пул AX концентрировали в 6-8 раз. После этого осуществляли замену буфера с 8-10 объемами диафильтрации в буфере для приготовления, не содержащем Твин (20 мМ Бис-Трис, 150 мМ NaCl, 1 мМ CaCl2 рН 7 или рН 7,4). После замены буфера осуществляли второе концентрирование для достижения конечной концентрации 12 г/л. Это позволяло добавить первое промывание кассеты и добавить Твин 80 до конечной концентрации 0,05% с целью достижения конечной концентрации 10 г/л после стерилизующей фильтрации. Этап УФ/ДФ проводили с низким TMД 0,9-1,1 бар для минимизации образования покрывающего слоя.
На фиг. 6 продемонстрирована блок-схема процесса ультра/диафильтрации и составления аннексина А5.
2. Целевые значения и критерии приемлемости
Следующие целевые значения и критерии приемлемости определены для оценки производительности и масштабов процесса по сравнению с НРП небольшого масштаба. Целевые значения определяли на основе анализа IPC/нерасфасованного вещества при пробном прогоне. Ключевые параметры процесса характеризовали с целью указания ключевых этапов способа и повышения надежности его производительности.
2.1. Основные параметры способа
В таблице 5 приведены основные параметры способа. Достижение целевых диапазонов при осуществлении способа свидетельствует о успешном увеличении его масштабов.
Таблица 5. Параметры этапов способа и соответствующие целевые значения
AX хроматография
(Q Сефароза XL)
[10 LВРП /л смолы]]
10-12
Критерии элюирования [УФ 280, 2 мм]
Пул (0,1 ЕОП-0,2 ЕОП)
AF хроматография
(Гепарин HyperD)
Пул (0,1 ЕОП - 0,1 ЕОП)
AX хроматография
(Source15 Q)
2.2. Основные параметры способа
Высокая степень гомогенности суспензии перед осуществлением хроматографии захвата имеет важное значение. Для достижения этой цели можно применять три цикла гомогенизации. Более того, при повышении температуры при гомогенизации можно получить температурные показатели лизата в диапазоне 37°С. Это имеет важное значение для активности бензоназы, которая оказывает прямое влияние на этап фильтрации и эффективность захвата.
Объединение с этапом очистки также важно, поскольку этот этап применяется для разделения примесей, связанных с продуктом. Этап УФ/ДФ выполняли в условиях среднего значения TMД с целью минимизации образования покрывающего слоя.
Таблица 6. Важные параметры способа
2.3. Контроль в ходе осуществления способа
В таблице 7 приведены элементы контроля в ходе осуществления способа. Достижение целевых диапазонов в ходе осуществления способа свидетельствует о успешном увеличении его масштабов. Целевые диапазоны были установлены только на основе наблюдений в предыдущих прогонах с небольшим масштабом, которые выполняли с внесенными изменениями.
классификация:
способ на 3 л способ на 100 л
IPC-D01
IPC-03.1
ДСН-ПААГ-электрофорез [г/л]
(после цикла 3)
IPC-D05
(после цикла 3)
IPC-03
ДСН-ПААГ-электрофорез [г/л]
IPC-D07
IPC-04
ДСН-ПААГ-электрофорез [г/л]
IPC-D07a
для захвата
IPC-05.1
ДСН-ПААГ-электрофорез [г/л]
ДСН-ПААГ-электрофорез Кумасси
БКХ (WB)
БКХ (ELISA) [нг/мг]
ДНК (колПЦР) [пг/мг]
Эндотоксин
[ЕЭ/мг]; [ЕЭ/мл]
FT
IPC-D08
FT
IPC-05.2
ДСН-ПААГ-электрофорез Кумасси
элюционный пул
IPC-D09
элюционный пул
IPC-05
AX-ВЭЖХ [г/л]
ДСН-ПААГ-электрофорез [г/л]
ДСН-ПААГ-электрофорез Кумасси
ИЭФ
БКХ (WB)
БКХ (ELISA) [нг/мг]
ДНК (колПЦР) [пг/мг]
Эндотоксин
[ЕЭ/мг]; [ЕЭ/мл]
AX-ВЭЖХ [%]
Соль CIP
IPC-D10
Соль CIP
IPC-05.3
IPC-D11
IPC-06.1
IPC-D12
IPC-06.2
AX-ВЭЖХ [г/л]
FT + промывание
IPC-D13
FT
IPC-06.3
AX-ВЭЖХ [г/л]
ДСН-ПААГ-электрофорез Кумасси
Элюционный пул
IPC-D14
Элюционный пул
IPC-06
AX-ВЭЖХ [г/л]
УФ 280 [г/л]
ДСН-ПААГ-электрофорез Кумасси
ИЭФ
БКХ (WB)
БКХ (ELISA) [нг/мг]
ДНК (колПЦР) [пг/мг]
Эндотоксин
[ЕЭ/мг]; [ЕЭ/мл]
AX-ВЭЖХ [%]
ЭХ [%]
IPC-D17
IPC-07.1
FT + промывание
IPC-D18
FT
IPC-07.2
ДСН-ПААГ-электрофорез Кумасси
FQKA-HB005
Соль CIP
IPC-D20
Соль CIP
IPC-07.3
IPC-07.4
ИЭФ
AX-ВЭЖХ [%]
IPC-07.5
ИЭФ
AX-ВЭЖХ [%]
IPC-07.6
ИЭФ
AX-ВЭЖХ [%]
IPC-07.7
ИЭФ
AX-ВЭЖХ [%]
Элюционный пул
IPC-D19
Элюционный пул
IPC-07
AX-ВЭЖХ [г/л]
УФ 280 [г/л]
ДСН-ПААГ-электрофорез Кумасси
ИЭФ
БКХ (WB)
БКХ (ELISA) [нг/мг]
ДНК (колПЦР) [пг/мг]
Эндотоксин
[ЕЭ/мг]; [ЕЭ/мл]
AX-ВЭЖХ [%]
ЭХ [%]
IPC-D21
IPC-08.1
IPC-D22
IPC-08.2
УФ 280 [г/л]
IPC-D23
IPC-08.3
УФ 280 [г/л]
IPC-D24
IPC-08
УФ 280 [г/л]
стерилизующе фильтрованное
IPC-D25
стерилизующе фильтрованное
IPC-09
ДСН-ПААГ-электрофорез восстан.
ИЭФ
УФ 280 [г/л]
БКХ (WB)
БКХ (ELISA) [нг/мг]
ДНК (колПЦР) [пг/мг]
Эндотоксин
AX-ВЭЖХ [%]
ЭХ [%]
Ph. Eur. 2.6.12
ДСН-ПААГ-электрофорез невосстан. Серебро
AX-ВЭЖХ [г/л]
Вестерн-блот
3. Выводы
Вышеупомянутый способ изготовления хорошо адаптирован для крупномасштабного изготовления без каких-либо без ограничений для увеличения масштаба до 10 000 литров, если это необходимо.
После пробного прогона с применением увеличенного масштаба до 200 л на экспериментальной установке GMP, в результате осуществления способа получали продукт, содержащий 1,8 пг ДНК клетки хозяина на мг белка AnxA5; 16,6 нг белка клетки хозяина на мг белка AnxA5; и 0,1 ЕЭ на мг белка AnxA5.
В ходе всего процесса изготовления белок аннексин A5 сохранялся в растворе в активной форме, при этом он не связывался временно с хроматографическими смолами.
При применении культуры на 1000 л общее время, необходимое предприятию-изготовителю для осуществления способа, будет составлять одну неделю для ферментации, сбора продукта, разрушения клеток и обработки перед хроматографией, и следующую неделю для последующей обработки. Таким образом время для осуществления всех этапов способа на предприятии GMP составит 2 недели. Затраченное время не зависит от масштаба и идеально подходит для промышленного стандарта, при этом способ может применяться любой контрактной производственной организацией (КПО) или фармацевтическим производителем.
Как отмечено выше, для сравнения, для способа Мардера с соавт. требуется около 12 недель для обработки культуры 1000 л.
Более того, выход продукта при осуществлении настоящего способа в 2-3 раза выше, чем у способа Мардера с соавт. Вследствие этого стоимость изготовления одного грамма лекарственного вещества аннексина A5 по способу Мардера в 12-24 раз выше (6-8 x 2-3).
Кроме того, в дополнение к обеспечению процесса очистки, который является более быстрым и характеризуется более высоким выходом продукта по сравнению с процессом, описанным в способе Мардера с соавт., в результате осуществления способа по настоящему изобретению также получают продукт с более высокой степенью чистоты. Как обсуждалось выше в сравнительном Примере 1, степень чистоты белка, полученного по способу Мардера, не пригодна для применения для организма человека. Несмотря на тщательно продуманные центрифугирования, в способе Мардера применяется только один этап анионообменной хроматографии, которая по существу не удовлетворяет требованиям к достижению достаточной степени чистоты в отношении как связанных с изготовлением примесей (особенно эндотоксина), так и связанных с продуктом вариантов. Мардер не предоставляет каких-либо данных об уровнях эндотоксина или других примесей, что указывает на отсутствие пригодности для фармацевтического применения.
Напротив, в результате применения способа по данной заявке получают белковый продукт аннексин А5 высокой степени чистоты, имеющий характеристики, перечисленные ниже:
- концентрация, как правило, составляет около 8-12 г/л;
- уровни белка клетки-хозяина равные или ниже 100 нг/м, более типично ниже 20 нг/мг (что определяется с помощью ELISA);
- уровни ДНК клетки-хозяина равные или ниже 100 пг/мг; более типично ниже 10 пг/мг;
- уровни эндотоксина равные или ниже 35 ЕЭ/мг; более типично ниже 1 ЕЭ/мг,
- степени чистоты > 95%, что определяется с помощью эксклюзионной хроматографии;
- бионагрузка < 1 КОЕ/мл (что определено в Европейской Фармакопее 2.6.12);
- прозрачный, бесцветный вид, несодержащий видимых частиц; а также
- при этом основная полоса, обнаруженная при вестерн-блот-анализе, соответствует эталонному аннексину А5.
Процесс повторяли с применением Capto Q ImpRes для второго этапа очистки вместо Source 15Q. Это обеспечило еще более эффективный процесс, так как анионообменная смола Capto Q ImpRes обладает высокой связывающей способностью, пригодна для высоких скоростей потока с низким противодавлением, может быть упакована с более высоким слоем и имеет более низкую цену. Поддерживали качество и степень чистоты конечного продукта.
По сравнению с Source 15Q, смола Capto Q ImpRes характеризуется:
• Более чем удвоенная емкость относительно грамма/литра смолы
• Допускает более чем в 2 раза выше скорость потока при одинаковом противодавлении
• Может быть упакована с более высоким слоем, как правило, на 35-60% выше, что обеспечивает более высокую емкость для каждой отдельно взятой колонки; а также
• Стоимость в два раза ниже при покупке на литр смолы.
Пример 2
В примере проиллюстрировано сравнение анионообменного (AX) захвата и аффинного захвата с помощью гепариновой хроматографии.
Захват AX и аффинную хроматографию захвата с гепарином сравнивали по показателях выхода и степени чистоты аннексина А5 в элюате захвата. Обе стратегии сравнивали в параллельных экспериментах в оптимизированных условиях.
Параметры анализов:
Хроматография AX:
Серийный режим: 500 мкл смолы (75% суспензия)
Буфер AX A: 20 мМ фосфата Na; pH 7; 5 мМ ЭДТА; 250 мМ NaCl
Буфер AX B: 20 мМ фосфата Na; pH 6,5; 5 мМ ЭДТА
Хроматография AX: нагрузка: 10 мл предварительно фильтрованного лизата
CIP: 1 М NaOH
Аффинная хроматография с гепарином:
Серийный режим: 500 мкл смолы (75% суспензия)
Загрузка: 10 мл предварительно фильтрованного лизата; + 10 мМ CaCl2
Буфер AF A: 50 мМ Трис, pH 7,4, 5 мМ CaCl2
Буфер AF B: 50 мМ Трис; pH 7,4;40 мМ ЭГТА; 50 мМ NaCl
CIP: 3 М NaCl
Таблица 8. Сравнение хроматографии AX и аффинной хроматографии захвата с гепарином
(Q Сефароза XL)
Эти результаты демонстрируют, что осуществление захвата AX перед аффинной хроматографией не значительно повышает степень чистоты, но оказывает значительное влияние на продуктивность этапа с гепарином. Кроме того, дорогостоящая аффинная смола может быть пригодна в течение длительного срока, если ее применять в качестве промежуточного этапа. Количество получаемого продукта имеет важное значение.
Захват с помощью AX может рассматриваться как этап кондиционирования, который позволяет эффективно применять этап высокоспецифической аффинности, используя для этого хроматографию с гепарином.
Пример 3
Частично очищенный продукт аннексин A5 получали с помощью способов, аналогичных Примеру 1, вплоть до первого этапа анионообменной хроматографии захвата.
Вкратце, рекомбинантную E. Coli, экспрессирующую аннексин А5, ресуспендировали в буфере для гомогенизации (50 мМ Трис, 1 мМ MgCl, 1% Твин 20, pH 7,5), с 3200 Ед бензоназы и гомогенизировали с помощью трех циклов с давлением 600 бар. Температуру после гомогенизации измеряли при 36°С. Затем проводили этап осветления с помощью Cuno 60 SP 0,6-0,2 мкм, и осветленный раствор разводили 1:2 в 1% Твин 20 с добавлением ЭДТА. Раствор пост-кондиционирования для захвата характеризовался рН 6,9 и проводимостью 2,7 мСм/см. Анионный обмен проводили с применением Q Сефарозы XL (GE), промывали буфером A (20 мМ Трис, 25 мМ NaCl, 0,1% Твин 20, pH 7,4), а затем элюировали с применением буфера B (20 мМ Трис, 300 мМ NaCl, 0,1% Твин 20, pH 7,4). Полученный продукт затем подвергали стерилизующей фильтрации с помощью фильтра 0,2 мкм.
Полученный стерильный фильтрованный анионообменный продукт очищали с помощью аффинной хроматографии с гепарином и анализировали при различных условиях.
Применяемые условия аффинной хроматографии с гепарином были следующими:
50 до 50 мЕОП в нисходящем пике) (мл)
-УФ 2 мм-
Стерилизующую фильтрацию элюционного пула захвата проводили с помощью Sartopore 2 0,45-0,2 мкм. Этот пул 8 раз разбавляли буфером А (1050 мл) из хроматографии с гепарином. Полученный пул имел рН 7,4 и проводимость 6,8 мСм. Элюирование проводили с уменьшенной скоростью потока 60 см/ч.
Анализы 1 и 2 выполняли для определения воздействия Твин 80 с применением буфера A для промывания и буфера B для элюирования следующим образом:
Анализ 1:
Буфер A 20 мМ Трис, 25 мМ NaCl, 2 мМ CaCl2, 0,1% Твин 20, pH 7,4
Буфер B 20 мМ Трис, 10 мМ ЭДТА, 25 мМ NaCl, 0,1% Твин 20, pH 7,4
Анализ 2:
Буфер A 20 мМ Трис, 25 мМ NaCl, 2 мМ CaCl2, 0,1% Твин 20, 0,1% Твин 80 pH 7,4
Буфер B 20 мМ Трис, 10 мМ ЭДТА, 100 мМ NaCl, 0,1% Твин 20, 0,1% Твин 80 pH 7,4
Результаты анализа 1 приведены на фиг. 7A, а результаты анализа 2 приведены на фиг. 7B.
Полученные результаты демонстрируют, что после добавления Твин 80 наблюдали сдвиг элюата до одного пика, в отличие от разделенных пиков элюата в стандартных условиях (анализ 1). По-видимому, Твин 80 стабилизирует аннексин А5. Возможное объяснение изменения профиля элюирования заключается в том, что
предотвращается теоретическое осаждение на колонке. Можно описать два основных положительных эффекта при применении Твин 80 на этапе аффинной хроматографии с гепарином:
- Пониженное давление: Давление на колонку, которое увеличилось при загрузке от 0,5 до 2-3 бар, явно снизилось до 0,5 бар. Это особенно полезно при изготовлении продукта в больших масштабах. Причиной повышения давления может быть небольшое количество осадка, наблюдаемое после продолжительной инкубации.
- Предотвращение образование осадка: Второй положительный эффект, наблюдаемый при элюировании. При фракционировании элюата высококонцентрированные фракции основного пика имеют тенденцию к осаждению. После объединения фракций осаждения больше не наблюдается; предполагают, что этот эффект связан с очень высокой концентрацией аннексина А5 в основном пике; более того, образование осадка, по-видимому, является обратимым процессом. Предотвратить осаждение в главном пике путем повышения концентрации соли в элюате не удалось. В отличие от этого добавление Твин 80 также препятствовало образованию осадков в фракциях основного пика.
Исходя из этих результатов, представляется целесообразным дополнительно добавлять Твин 80 во все промежуточные хроматографические буферы, поскольку он оказывает стабилизирующее действие на аннексин A5.
Пример 4
Частично очищенный продукт аннексин A5 получали с помощью способов, аналогичных Примеру 1, вплоть до первого этапа анионообменной хроматографии захвата.
1,25 мл продукта анионообменного этапа затем смешивали с 8,75 мл различных форм анализируемого буфера для разбавления. Затем смеси инкубировали при температуре окружающей среды и визуально оценивали через 30 минут, 18 часов и 4 дня.
Результаты приведены в таблице ниже:
Эти результаты продемонстрировали преимущество добавления Твин 80 (т.е. полисорбата 80) с целью предотвращения осаждения продукта в образце. Это важно применительно к кондиционированию продукта AnxA5 перед нанесением на хроматографическую колонку, такую как колонка для аффинной хроматографии, с целью уменьшения осаждения и предотвращения повышения противодавления при работе колонки.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ЭТАПОВ ОЧИСТКИ БЕЛКА, НАХОДЯЩИХСЯ НИЖЕ ПО ПОТОКУ, С ИСПОЛЬЗОВАНИЕМ МЕМБРАННОЙ ИОНООБМЕННОЙ ХРОМАТОГРАФИИ | 2012 |
|
RU2648999C2 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2824045C2 |
| ПРОМЫВОЧНЫЙ РАСТВОР И СПОСОБ ПРОМЫВКИ ДЛЯ АФФИННОЙ ХРОМАТОГРАФИИ | 2010 |
|
RU2564569C2 |
| КОЛОНОЧНЫЕ СПОСОБЫ ОЧИСТКИ ВЕКТОРА НА ОСНОВЕ AAV | 2018 |
|
RU2772876C2 |
| СПОСОБ ОЧИСТКИ БЕЛКА СЛИЯНИЯ | 2015 |
|
RU2698654C2 |
| СНИЖЕНИЕ СОДЕРЖАНИЯ БЕЛКОВЫХ ПРИМЕСЕЙ В КОМПОЗИЦИЯХ, СОДЕРЖАЩИХ ИНТЕРЕСУЮЩИЙ ВИТАМИН К-ЗАВИСИМЫЙ БЕЛОК | 2005 |
|
RU2460735C2 |
| ОЧИСТКА ПОЛИПЕПТИДОВ | 2009 |
|
RU2544860C2 |
| СПОСОБЫ ОЧИСТКИ БЕЛКОВ, СОДЕРЖАЩИХ ОБЛАСТЬ Fc | 2006 |
|
RU2415865C2 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2795973C1 |
| СПОСОБЫ ОЧИСТКИ ГЕТЕРОДИМЕРНЫХ ПОЛИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2019 |
|
RU2820588C2 |

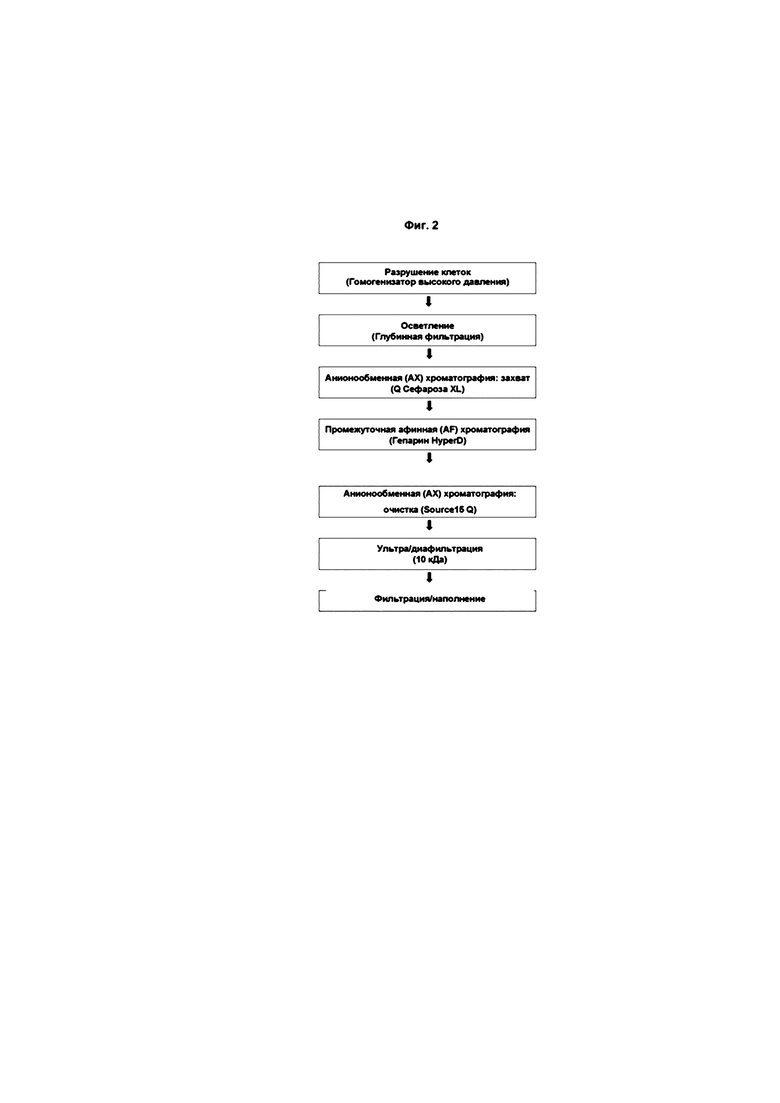
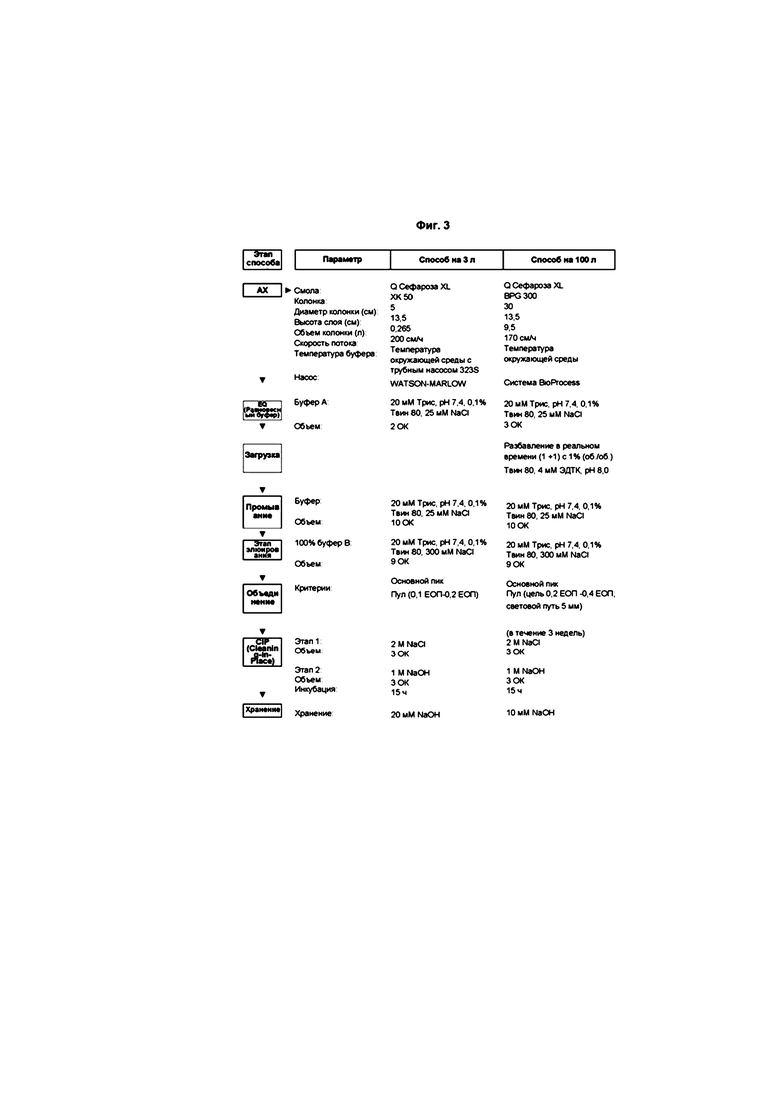



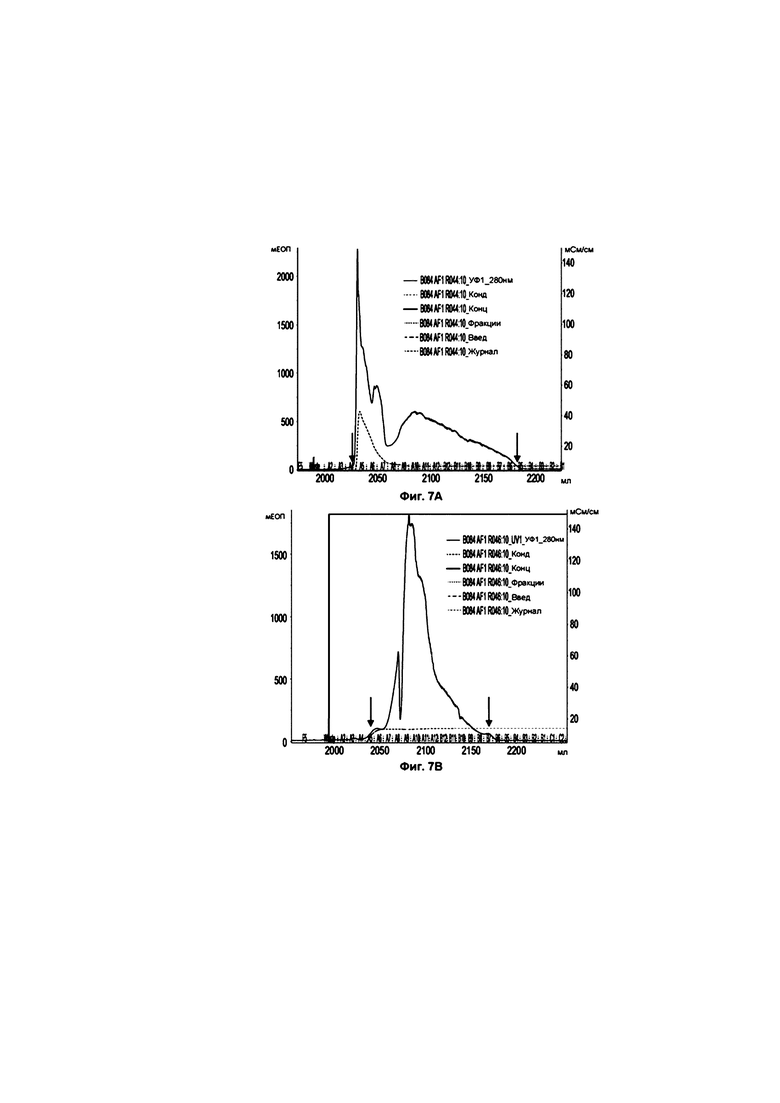

Группа изобретений относится к биотехнологии, в частности к способам выделения и очистки рекомбинантно экспрессированного внутриклеточного белка аннексина A5 (AnxA5) из клетки-хозяина, продуцирующей эндотоксин, с клеточной стенкой, и его применению. Способы включают высвобождение внутриклеточного белка AnxA5 из клетки-хозяина в присутствии буфера для гомогенизации, содержащего неионный детергент, выбранный из Твин 20 и Твин 80. Затем проводят воздействие на композицию, содержащую белок AnxA5 и хелатор ионов металлического кальция AnxA5, анионообменной смолой в присутствии дополнительных выбранных ионов металлов. При этом белок AnxA5 остается в растворе на всех этапах способов за исключением случаев, когда он временно связывается с какими-либо хроматографическими смолами. Изобретения исключают необходимость применять какие-либо этапы очищающего центрифугирования для белка AnxA5 после выделения из клетки-хозяина, позволяют минимизировать степень связывания эндотоксина и АnхА5 на начальных этапах выделения и способствуют получению очищенного продукта аннексина A5 в промышленном масштабе, пригодного для терапевтического применения. 6 н. и 92 з.п. ф-лы, 8 ил., 11 табл., 4 пр.
1. Способ выделения и/или очистки рекомбинантно экспрессированного внутриклеточного белка, содержащего последовательность аннексина A5 (AnxA5), из продуцирующей эндотоксин клетки-хозяина с клеточной стенкой, где указанный способ включает высвобождение внутриклеточного белка из этой клетки-хозяина, отличающийся тем, что
указанный этап высвобождения внутриклеточного белка AnxA5 проводят в присутствии буфера для гомогенизации, содержащего неионный детергент, выбранный из Твин 20 и Твин 80, и
при этом способ не включает в себя какие-либо этапы центрифугирования для выделения и/или очистки белка AnxA5 после его высвобождения из клетки-хозяина, и/или в способе белок AnxA5 остается в растворе на всех этапах способа за исключением случаев, когда он временно связывается с какими-либо хроматографическими смолами, и
где концентрация свободных ионов кальция в буфере для гомогенизации во время этапа высвобождения внутриклеточного белка AnxA5 из клетки-хозяина или после высвобождения белка AnxA5 из клетки-хозяина, но до наступления любой последующей хроматографической очистки, составляет менее чем 10 мМ.
2. Способ по п. 1, где неионным детергентом является Твин 80.
3. Способ по п. 1 или 2, отличающийся тем, что этап высвобождения внутриклеточного белка AnxA5 проводят в присутствии буфера для гомогенизации, содержащего количество неионного детергента, которое является эффективным для уменьшения или предотвращения связывания аннексина A5 с эндотоксином.
4. Способ по любому из предшествующих пунктов, отличающийся тем, что этап высвобождения внутриклеточного белка AnxA5 проводят в присутствии буфера для гомогенизации, содержащего от 0,01 до 10% (мас./мас.) неионного детергента, например от 0,02 до 5% (мас./мас.), от 0,05 до 2% (мас./мас.) или около 1% (мас./мас.) неионного детергента.
5. Способ по любому из предшествующих пунктов для выделения и/или очистки рекомбинантно экспрессированного внутриклеточного белка, содержащего последовательность аннексина A5 (AnxA5), из клетки-хозяина с клеточной стенкой, при этом указанный способ включает высвобождение внутриклеточного белка AnxA5 из этой клетки-хозяина,
при этом концентрация свободных ионов кальция в буфере для гомогенизации во время высвобождения внутриклеточного белка AnxA5 из клетки-хозяина или после высвобождения внутриклеточного белка AnxA5 из клетки-хозяина, но до наступления любой последующей хроматографической очистки, составляет менее чем 5 мМ, 1 мМ, более предпочтительно меньше 500 мкM или по существу ноль и/или
при этом буфер для гомогенизации содержит хелатор ионов металлического кальция или модифицирован с целью включения хелатора ионов металлического кальция после высвобождения внутриклеточного белка AnxA5.
6. Способ по п. 5, отличающийся тем, что хелатор ионов металлического кальция выбирают из ЭДТА или ее соли, ЭГТА или ее соли, но наиболее предпочтительно представляет собой ЭДТА.
7. Способ по п. 5 или 6, отличающийся тем, что уровень свободных ионов кальция и/или количество хелатора ионов металлического кальция является эффективным для уменьшения или предотвращения связывания аннексина А5 с компонентами клеточной стенки клетки-хозяина.
8. Способ по любому из пп. 5-7, отличающийся тем, что буфер для гомогенизации содержит или доведен до или после высвобождения белка AnxA5 до такого состава, что в результате содержит от 0,01 до 500 мМ, например от 0,05 до 100 мМ, от 0,5 до 20 мМ, от 1 до 15 мМ, от 2 до 10 мМ или около 4 мМ, хелатора ионов металлического кальция, и предпочтительно при этом хелатор ионов металлического кальция представляет собой ЭДТА.
9. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный способ включает выделение и/или очистку рекомбинантно экспрессируемого внутриклеточного белка AnxA5 из культуры клеток-хозяев, и при этом эта культура имеет объем по меньшей мере 100 л, 500 л, 1000 л, 5000 л или 10 000 л.
10. Способ по любому из предшествующих пунктов, включающий этап смешивания биомассы из культуры клеток-хозяев в буфере для гомогенизации в концентрации около 10 г биомассы на мл буфера для гомогенизации.
11. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный этап высвобождения внутриклеточного белка AnxA5 из клетки-хозяина в буфере для гомогенизации включает лизирующее, разрушающее, гомогенизирующее, ультразвуковое воздействие или воздействие давлением на клетку-хозяина, в результате чего клеточная стенка и барьер клеточной мембраны клетки-хозяина разрушаются и, как следствие, высвобождается внутриклеточный белок AnxA5, и необязательно при этом указанный этап не включает воздействия осмотическим шоком и/или этап замораживания/оттаивания.
12. Способ по п. 11, отличающийся тем, что этап высвобождения внутриклеточного белка AnxA5 из клетки-хозяина включает гомогенизацию под высоким давлением, например один или большее количество циклов гомогенизации под высоким давлением в диапазоне от около 400 бар до около 2500 бар, предпочтительно три цикла гомогенизации при около 600 бар или два цикла гомогенизации при около 800 бар.
13. Способ по любому из предшествующих пунктов, отличающийся тем, что в результате этапа высвобождения внутриклеточного белка AnxA5 можно получить гомогенат биомассы, содержащий высвобожденный белок AnxA5.
14. Способ по п. 13, отличающийся тем, что гомогенат биомассы дополнительно содержит одну или большее количество, как правило, все из примесей, выбранных из группы, состоящей из белков клетки-хозяина, компонентов клеточной стенки клетки-хозяина, мембраны клетки-хозяина, нуклеиновой кислоты клетки-хозяина и эндотоксина.
15. Способ по п. 13 или 14, дополнительно включающий этап осветления гомогената биомассы, в результате чего получают осветленный продукт, содержащий высвобожденный белок AnxA5.
16. Способ по п. 15, отличающийся тем, что этап осветления гомогената биомассы включает обработку гомогената нуклеазой, такой как нуклеаза А, предпочтительно нуклеазой А из Serratia marescens, и необязательно при этом нуклеаза включена в буфер для гомогенизации до высвобождения внутриклеточного белка AnxA5.
17. Способ по п. 15 или 16, отличающийся тем, что этап осветления гомогената биомассы включает предпочтительно после обработки нуклеазой по п. 15 или 16 этап пропускания гомогената биомассы, содержащего высвобожденный белок AnxA5, через фильтр, такой как целлюлозный или полипропиленовый фильтр, предпочтительно при этом фильтр представляет собой глубинный фильтр и/или предпочтительно при этом фильтр имеет граничный размер пор менее 4 мкм; и при этом фильтрат представляет собой осветленный продукт, содержащий высвобожденный белок AnxA5.
18. Способ по любому из предшествующих пунктов, дополнительно включающий этап воздействия на высвобожденный белок AnxA5 анионообменной смолы с целью осуществления первого анионообменного этапа и получения посредством этого продукта первого анионообмена, который содержит высвобожденный белок AnxA5.
19. Способ по п. 18, отличающийся тем, что осветленный продукт, содержащий высвобожденный белок AnxA5, полученный по способу по п. 17, подвергают первому анионообменному этапу, в результате чего получают продукт первого анионообмена, который содержит высвобожденный белок AnxA5.
20. Способ по п. 18 или 19, отличающийся тем, что перед первым анионообменным этапом корректируют один или большее количество параметров среды высвобожденного белка AnxA5, выбранных из группы, состоящей из рН, проводимости, уровня хелатора ионов кальция и уровня неионного детергента.
21. Способ по любому из пп. 18-20, отличающийся тем, что высвобожденный белок AnxA5, который подвергают анионообменному этапу, готовят при рН около 6,9, проводимости около 2,8 мСм/см, концентрации хелатора ионов кальция около 1 мМ и разбавляют с применением неионного детергента, например, с целью получения конечной концентрации неионного детергента от 0,01 до 1% (мас./об.), более предпочтительно около 0,1% (мас./об.).
22. Способ по любому из пп. 18-21, отличающийся тем, что белок AnxA5 связывается во время анионообменного этапа, и продукт первого анионообмена, который содержит высвобожденный белок AnxA5, получают путем нанесения промывочного раствора и/или буфера для элюирования на анионообменную смолу для высвобождения связанного белка AnxA5, при этом необязательно буфер для элюирования содержит NaCl, например около 300 мМ NaCl.
23. Способ по любому из пп. 1-22, дополнительно включающий проведение этапа аффинной хроматографии в отношении высвобожденного белка AnxA5, в результате чего получают продукт первой аффинной хроматографии, который содержит высвобожденный белок AnxA5.
24. Способ по п. 23, отличающийся тем, что белок AnxA5 в продукте первого анионообмена, полученный по любому из пп. 18-22, подвергают этапу аффинной хроматографии.
25. Способ по п. 24, включающий этапы, в которых:
(а) гомогенат биомассы, содержащий высвобожденный белок AnxA5, по п. 13 или 14, осветляют согласно любому из пп. 15, 16 или 17, в результате чего получают осветленный продукт, содержащий высвобожденный белок AnxA5, а также
(б) белок AnxA5 в осветленном продукте подвергают воздействию анионообменной смолы с целью осуществления первого анионообменного этапа, согласно любому из пп. 18-22, и таким образом получают продукт первого анионообмена, который содержит белок AnxA5; и
(в) при этом белок AnxA5 в продукте первого анионообмена подвергают этапу аффинной хроматографии согласно п. 23 или 24.
26. Способ по любому из пп. 23-25, отличающийся тем, что этап аффинной хроматографии включает связывание белка AnxA5 с иммобилизованным гепарином, и при этом необязательно связывание стимулируют присутствием ионов кальция.
27. Способ по п. 26, отличающийся тем, что белок AnxA5 элюируют с иммобилизованного гепарина с помощью буфера для элюирования, содержащего хелатор ионов кальция, такой как ЭДТА.
28. Способ по любому из пп. 23-27, отличающийся тем, что продукт первой аффинной хроматографии содержит высвобожденный белок AnxA5 и хелатор ионов кальция, такой как ЭДТА или ЭГТА, необязательно в диапазоне от 0,1 до 500 мМ, более предпочтительно около 10 мМ.
29. Способ выделения и/или очистки белка, содержащего последовательность аннексина А5 (AnxA5), из композиции, которая содержит белок AnxA5 и хелатор ионов металлического кальция, отличающийся тем, что способ включает:
воздействие анионообменной смолы на эту композицию для проведения анионообменного этапа и выделение таким образом и/или очистку белка AnxA5 из композиции, и
где анионообменный этап проводят в присутствии дополнительных выбранных ионов металлов, и
при этом дополнительные выбранные ионы металлов выбраны так, что хелатор ионов металлического кальция имеет аффинность связывания с выбранными ионами металлов выше, чем аффинность его связывания с анионообменной смолой, но ниже, чем его аффинность связывания с ионами кальция,
при этом белок AnxA5 остается в растворе на всех этапах анионообменной хромотографии за исключением случаев, когда он временно связывается с указанной хроматографической смолой.
30. Способ по п. 29, отличающийся тем, что хелатор ионов металлического кальция выбирают из ЭДТА или ее соли, ЭГТА или ее соли, но наиболее предпочтительно представляет собой ЭДТА.
31. Способ по п. 29 или 30, отличающийся тем, что хелатор ионов металлического кальция присутствует в композиции в избытке и/или в концентрации около 0,1 мМ, 0,5 мМ, 1 мМ, 5 мМ, 10 мМ, 15 мМ, 20 мМ или более.
32. Способ по любому из пп. 29-31, отличающийся тем, что выбранными ионами металлов являются двухвалентные катионы, такие как ионы Mg2+.
33. Способ по любому из пп. 29-32, отличающийся тем, что выбранные ионы металлов присутствуют на анионообменном этапе в количестве, эффективном для уменьшения или предотвращения взаимодействия между хелатором ионов кальция и анионообменной смолой во время процесса воздействия на указанную композицию анионообменной смолы.
34. Способ по любому из пп. 29-33, отличающийся тем, что выбранные ионы металлов присутствуют на анионообменном этапе в количестве, эффективном для увеличения связывания белка AnxA5 с анионообменной смолой в присутствии хелатора ионов кальция и тем самым уменьшения потери белка AnxA5 при прохождении потока через анионообменный этап по сравнению с уровнем потерь, наблюдаемым в тех случаях, когда на анионообменном этапе не присутствуют выбранные ионы металлов.
35. Способ по любому из пп. 29-34, отличающийся тем, что выбранные ионы металлов присутствуют на анионообменном этапе, например, в результате добавления к композиции, содержащей белок AnxA5 и хелатор ионов металлического кальция, перед воздействием на эту композицию анионообменной смолы, в концентрации от около 1 до около 100 мМ, например от около 2 до около 50 мМ, от около 5 до около 25 мМ, от около 10 до около 15 мМ или около 12,5 мМ.
36. Способ по любому из пп. 29-35, отличающийся тем, что хелатором ионов металлического кальция является ЭДТА, а выбранными ионами металла являются ионы Mg2+, и предпочтительно молярное отношение ионов Mg2+ к ЭДТА находится в диапазоне от 0,5:1 до 2:1, наиболее предпочтительно по меньшей мере 1:1 или выше.
37. Способ по любому из пп. 29-36, отличающийся тем, что
композиция, которая содержит белок AnxA5 и хелатор ионов металлического кальция и на которую воздействуют анионообменной смолой, представляет собой
непосредственный или опосредованный продукт предшествующего процесса, который включает этап проведения этапа аффинной хроматографии в отношении белка AnxA5 и элюирование белка AnxA5 с помощью хелатора ионов кальция, в результате чего получают продукт аффинной хроматографии, который представляет собой композицию, содержащую белок AnxA5 и хелатор ионов металлического кальция.
38. Способ по п. 37, отличающийся тем, что предшествующий этап аффинной хроматографии включает связывание белка AnxA5 с иммобилизованным гепарином, и при этом необязательно связывание стимулируют добавлением ионов кальция.
39. Способ по п. 38, отличающийся тем, что белок AnxA5 элюируют с иммобилизованного гепарина с помощью буфера для элюирования, содержащего хелатор ионов кальция, такой как ЭДТА и ЭГТА.
40. Способ по любому из пп. 37-39, отличающийся тем, что между предшествующим этапом аффинной хроматографии и анионообменным этапом не осуществляют этап диализа и/или не осуществляют удаление хелатора ионов кальция из продукта предшествующего этапа аффинной хроматографии перед непосредственным или опосредованным употреблением продукта на анионообменном этапе.
41. Способ по любому из пп. 29-40, отличающийся тем, что выбранные ионы металлов добавляют к композиции до или во время анионообменного этапа.
42. Способ по любому из пп. 1-28, отличающийся тем, что указанный способ включает анионообменный этап по любому из пп. 29-41.
43. Способ выделения и/или очистки рекомбинантно экспрессированного внутриклеточного белка, содержащего последовательность аннексина A5 (AnxA5), из продуцирующей эндотоксин клетки-хозяина с клеточной стенкой или из культуры этой клетки-хозяина, как определено в п. 9, при этом этот способ включает:
(a) высвобождение внутриклеточного белка из этой клетки-хозяина в присутствии буфера для гомогенизации, содержащего неионный детергент, согласно любому из пп. 1-4;
(b) проведение способа в отношении высвобожденного белка AnxA5 непосредственно или опосредованного, который включает
i. этап воздействия на этот высвобожденный белок AnxA5 непосредственно или опосредованно анионообменной смолы для проведения первого анионообменного этапа и получения таким образом продукта первого анионообменного этапа, который содержит этот высвобожденный белок AnxA5, и
ii. проведение этапа аффинной хроматографии в отношении этого высвобожденного белка AnxA5 продукта первой анионообменной хроматографии непосредственно или опосредованно, причем
необязательно указанный высвобожденный белок AnxA5 подвергают воздействию анионообменной смолы в присутствии хелатора ионов кальция, и продукт этапа аффинной хроматографии является композицией, которая содержит белок AnxA5 и хелатор ионов металлического кальция; и
(с) при этом непосредственный или опосредованный продукт этапа аффинной хроматографии, который содержит белок AnxA5 и хелатор ионов металлического кальция, подвергают анионообменному этапу согласно любому из пп. 29-42;
и при этом белок AnxA5 остается растворимым за исключением временного связывания с фазами анионообменной и аффинной хроматографии в ходе этапов (а)-(с) этого способа.
44. Способ по п. 43, в котором этап высвобождения включает стадию смешивания биомассы из культуры клеток-хозяев в буфере для гомогенизации при концентрации около 10 г биомассы на мл буфера для гомогенизации и/или где стадия высвобождения включает лизис, разрушение, гомогенизацию, обработку ультразвуком или обработку под давлением клетки-хозяина, так что клеточная стенка и барьер клеточной мембраны клетки-хозяина разрушаются, и таким образом высвобождается внутриклеточный белок AnxA5, и, необязательно, где эта стадия не включает использование осмотического шока и/или стадии замораживания-оттаивания;
необязательно, где гомогенизация включает гомогенизацию под высоким давлением, такую как один или несколько циклов гомогенизации под высоким давлением от около 400 бар до около 2500 бар, предпочтительно три цикла гомогенизации при около 600 бар или два цикла гомогенизации при около 800 бар.
45. Способ по п. 43 или 44, в котором способ включает стадию осветления гомогената биомассы, получая таким образом осветленный продукт, содержащий высвобожденный белок AnxA5; необязательно, где стадия осветления гомогената биомассы включает обработку гомогената нуклеазой, такой как нуклеаза А, предпочтительно нуклеаза А Serratia marescens, и необязательно нуклеазу добавляют в гомогенизационный буфер перед высвобождением внутриклеточного белка AnxA5, и/или стадия осветления гомогената биомассы включает предпочтительно после обработки нуклеазой стадию пропускания гомогената биомассы, содержащего высвобожденный белок AnxA5, через фильтр; такой как целлюлозный или полипропиленовый фильтр, предпочтительно в котором фильтр представляет собой глубинный фильтр и/или предпочтительно в котором фильтр имеет предел отсечения менее 4 мкм; и при этом отфильтрованный поток представляет собой осветленный продукт, содержащий высвобожденный белок AnxA5.
46. Способ по любому из пп. 43-45, где стадия аффинной хроматографии (ii) включает связывание белка AnxA5 с иммобилизованным гепарином и где указанное связывание стимулируют посредством обеспечения присутствия ионов кальция.
47. Способ по п. 46, в котором белок AnxA5 элюируют с иммобилизованного гепарина с помощью буфера для элюирования, содержащего хелатор ионов кальция, такой как ЭДТА.
48. Способ по п. 47, в котором аффинная хроматография этапа (ii) включает проведение стадии аффинной хроматографии с иммобилизованным гепарином в присутствии Твин 80, предпочтительно в присутствии 0,1% Твин 80, в отношении раствора, содержащего белок AnxA5 и одну или несколько примесей, тем самым получая первый продукт аффинной хроматографии, который содержит высвобожденный белок AnxA5.
49. Способ по п. 48, в котором белок AnxA5 остается в растворе на протяжении всего процесса, включая любые предшествующие или последующие этапы, за исключением случаев, когда он временно связан с какими-либо хроматографическими смолами.
50. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный способ включает, предпочтительно в конце способа, как определено любым предшествующим пунктом, один или большее количество дополнительных этапов, выбранных из группы, состоящей из концентрирования, замены буфера, кондиционирования и фильтрации, например стерилизующей фильтрации, и необязательно конечный этап хранения продукта, содержащего белок AnxA5, в стерильном контейнере.
51. Способ по п. 50, отличающийся тем, что один из дополнительных этапов представляет собой диафильтрацию, при этом необязательно продукт этапа диафильтрации содержит белок AnxA5 в концентрации по меньшей мере около 1 мг/мл, 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл, 50 мг/мл, 100 мг/мл или выше.
52. Способ по п. 50 или 51, отличающийся тем, что для фильтрации применяют фильтр 0,45-0,2 мкм или фильтр 0,22 мкм, при этом фильтрация предпочтительно представляет собой этап стерилизующей фильтрации.
53. Способ по любому из пп. 50-52, отличающийся тем, что стерилизующая фильтрация представляет собой конечный этап очистки перед хранением продукта, содержащего белок AnxA5, в стерильном контейнере.
54. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный способ включает этапы, необходимые для получения конечного стерильного белкового продукта AnxA5 в бесфосфатном буфере, таком как Бис-Трис или Трис-буфер, при рН около 7,4, содержащем около 150 мМ NaCl, около 1 мМ CaCl2, около 0,05% (мас./мас.) полисорбата, такого как Твин 80, или другого неионогенного детергента, и необязательно при этом концентрация белка AnxA5 в конечном стерильном белковом продукте AnxA5 составляет около 10 мг/мл.
55. Способ по любому из предшествующих пунктов, отличающийся тем, что указанным способом получают конечный стерильный белковый продукт AnxA5, при этом NaCl присутствует в концентрации, которая поддерживает белок AnxA5 в форме, которая преимущественно является мономерной.
56. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный способ обеспечивает общий выход продукта более 1 г белка AnxA5 на 1 л культуры клетки-хозяина, более предпочтительно по меньшей мере около 1,5 г/л, еще более предпочтительно в диапазоне от около 2 до около 4 г/л.
57. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный способ обеспечивает получение общего количества белка AnxA5, составляющее около 24 мас.% белка AnxA5, присутствующего в культуре клетки-хозяина.
58. Способ по любому из предшествующих пунктов, отличающийся тем, что указанным способом получают продукт, содержащий белок клетки- хозяина, отличающийся от рекомбинантно экспрессированного белка AnxA5, на уровне менее 100, 90, 80, 70, 60, 50, 40, 30, 20 нг или менее на мг белка AnxA5.
59. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный способ обеспечивает получение продукта, содержащего уровень эндотоксина менее 100, 90, 80, 70, 60, 50, 45, 40, 35, 30, 35, 20, 15 и предпочтительно менее 10, 5 или 1 ЕЭ на мг белка AnxA5, и/или предпочтительно при этом указанный способ обеспечивает получение продукта в виде дозированной лекарственной формы, при этом продукт содержит менее 100, 90, 80, 70, 60, 50, 45, 40, 35, 30, 35, 20, 15 и предпочтительно менее 10, 5 или 1 ЕЭ на единицу дозирования.
60. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный способ обеспечивает получение продукта, содержащего уровни нуклеиновой кислоты клетки-хозяина менее 1000 пг на мг белка AnxA5, предпочтительно менее 100 пг на мг белка AnxA5, более предпочтительно менее 10 пг на мг белка AnxA5.
61. Способ по любому из предшествующих пунктов, включающий этап химической модификации белка AnxA5, и
необязательно также содержащий один или более дополнительных этапов очистки, таких как этапы для уменьшения или удаления непрореагировавших компонентов и/или как этапы для выбора гомогенной популяции химически модифицированного белка AnxA5.
62. Композиция, содержащая белок AnxA5, для применения при терапии белком аннексин А5, отличающаяся тем, что указанную композицию получают непосредственно или опосредовано с помощью способа согласно любому из пп. 46-49 и пунктов, зависимых от них, и где
(а) композиция была подвергнута этапу стерильной фильтрации и представляет собой стерильную композицию;
(б) композицию хранят в стерильном контейнере;
(в) эндотоксин содержится в композиции в количестве менее 100, 50, 20, 10, 5 или 1 ЕЭ на мг белка AnxA5;
(г) нуклеиновая кислота, такая как нуклеиновая кислота клетки-хозяина, содержится в композиции на уровне менее 1000 пг, 100 пг или 10 пг на мг белка AnxA5; и
(д) белок AnxA5 не содержит His-метки.
63. Композиция по п. 62, отличающаяся тем, что указанная композиция представляет собой непосредственный или опосредованный продукт способа по любому из пп. 46-49, где в указанном способе этап аффинной хроматографии включает связывание белка AnxA5 с иммобилизованным гепарином, где это связывание промотируется присутствием ионов кальция и где белок AnxA5 элюируют с иммобилизованного гепарина с использованием буфера для элюирования, содержащего хелатор ионов кальция, такой как ЭДТА.
64. Композиция по п. 62 или 63, которая содержит белок AnxA5 в концентрации по меньшей мере около 1 мг/мл, 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл, 50 мг/мл, 100 мг/мл или выше.
65. Композиция по любому из пп. 62-64, отличающаяся тем, что указанная композиция содержит стерильный белковый продукт AnxA5 в нефосфатном буфере, таком как Бис-Трис или Трис-буфер при рН около 7,4, содержащем около 150 мМ NaCl, около 1 мМ CaCl2, около 0,05% (мас./мас.) полисорбата, такого как Твин 80, или другого неионогенного детергента и необязательно при этом концентрация белка AnxA5 в конечном стерильном белковом продукте AnxA5 составляет около 10 мг/мл.
66. Композиция по любому из пп. 62-65, отличающаяся тем, что NaCl присутствует в концентрации, которая поддерживает белок AnxA5 в форме, которая преимущественно является мономерной.
67. Композиция по любому из пп. 62-66, которая содержит белок, не являющийся AnxA5, такой как белок клетки-хозяина, на уровне менее 20 нг на мг белка AnxA5, при этом необязательно клетка-хозяин представляет собой прокариотическую клетку, такую как грамположительная или грамотрицательная клетка, и, в частности, может быть грамотрицательной бактериальной клеткой, продуцирующей эндотоксин, и необязательно дополнительно белок клетки-хозяина содержится в композиции на обнаруживаемом уровне, хотя и менее 20 нг на мг белка AnxA5.
68. Композиция по любому из пп. 62-67, которая содержит эндотоксин на детектируемом уровне, в количестве менее 100, 50, 20, 10, 5 или 1 ЕЭ на мг белка AnxA5, в композиции.
69. Композиция по любому из пп. 62-68, которая содержит эндотоксин на детектируемом уровне, в количестве менее 100, 50, 20, 10, 5 или 1 ЕЭ на мг дозирования, в композиции.
70. Композиция по любому из пп. 62-69, которая содержит нуклеиновую кислоту, например нуклеиновую кислоту клетки-хозяина, на уровне менее 1000 пг, 100 пг или 10 пг на мг белка AnxA5, необязательно при этом клетка-хозяин представляет собой прокариотическую клетку, такую как грамположительная или грамотрицательная клетка, и, в частности, может быть грамотрицательной бактериальной клеткой, продуцирующей эндотоксин, и дополнительно необязательно нуклеиновая кислота клетки-хозяина содержится в композиции на обнаруживаемом уровне, хотя и менее 1000 пг, 100 пг или 10 пг на мг белка AnxA5.
71. Композиция по любому из пп. 62-70, отличающаяся тем, что уровень глюконоилированного белка AnxA5 в композиции находится в пределах от 0,5 до 30%, или от 0,5 до 20%, или от 0,5 до 15%, или от 0,5 до 10% от общего содержания белка AnxA5 в продукте.
72. Композиция по любому из пп. 62-71, отличающаяся тем, что уровень глюконоилированного белка AnxA5 в композиции находится ниже 40%, 30%, 20%, 10%, 5%, 4%, 3%, 2% или 1% и предпочтительно составляет по существу 0%.
73. Композиция по любому из пп. 62-72, отличающаяся тем, что белок AnxA5 не содержит одного или большего количества мотивов RGD.
74. Композиция по любому из пп. 62-73, где белок AnxA5 является химически модифицированным и/или где белок AnxA5 является слитым белком, содержащим белок AnxA5 и партнера по слиянию.
75. Композиция по любому из пп. 62-74, отличающаяся тем, что указанная композиция представляет собой фармацевтически приемлемую и/или ветеринарно приемлемую композицию.
76. Композиция по п. 75 в форме фармацевтической или ветеринарной композиции, которая подходит для парентерального, внутривенного, внутриартериального, внутрибрюшинного, внутримышечного, внутриглазного, внутричерепного, внутримозгового, внутрикостного, интрацеребровентрикулярного, интратекального, подкожного или местного введения.
77. Композиция по п. 76, которая пригодна для местного применения и представляет собой крем, мазь или находится в форме глазных капель.
78. Композиция по п. 62, где белок AnxA5 в композиции представлен в форме фармацевтической или ветеринарной композиции, содержащей белок AnxA5 в смеси с фармацевтически или ветеринарно приемлемым носителем, где носитель представляет собой покрытие.
79. Композиция по п. 78, где композиция находится в форме применения с немедленным, отсроченным или контролируемым высвобождением.
80. Композиция по п. 62 в форме фармацевтической или ветеринарной композиции, которая представляет собой стент, элюирующий лекарственное средство.
81. Композиция по любому из пп. 75-80, где композиция предназначена для лечения, предотвращения и/или снижения риска развития сердечно-сосудистого заболевания, аутоиммунного заболевания или воспалительного состояния.
82. Композиция по любому из пп. 75-80, где композиция предназначена для предотвращения или уменьшения риска тромбоза.
83. Композиция по любому из пп. 75-80, где композиция предназначена для лечения, предотвращения или уменьшения риска окклюзии вен сетчатки.
84. Композиция по любому из пп.75-80, где композиция предназначена для лечения, предотвращения или снижения риска гематологических нарушений, включая серповидноклеточную анемию, но не ограничиваясь ими.
85. Композиция по любому из пп. 75-80, где композиция предназначена для лечения, предотвращения или уменьшения риска легочного фиброза.
86. Композиция по любому из пп. 75-80, где композиция предназначена для лечения, предотвращения и/или снижения риска развития атеросклероза, острого коронарного синдрома, инсульта, хромоты, стенокардии, ишемической болезни сердца, заболевания периферических артерий, систолической гипертонии, тромбоэмболии, геморрагического или васкулитного инсульта, инфаркта миокарда, стенокардии или перемежающейся хромоты, нестабильной стенокардии, других форм тяжелой стенокардии или преходящих ишемических приступов (TIA).
87. Композиция по любому из пп. 75-80, где композиция предназначена для лечения, профилактики или снижения риска сосудистой дисфункции.
88. Композиция по любому из пп. 75-80, где композиция предназначена для уменьшения ишемической боли.
89. Композиция по любому из пп. 75-80, где композиция предназначена для профилактики или лечения рестеноза, например образования или утолщения неоинтимы.
90. Композиция по любому из пп. 75-80, где композиция предназначена для лечения, профилактики или снижения риска ишемически-реперфузионного повреждения, ишемически-реперфузионного поражения органа, такого как ишемически-реперфузионного повреждения печени или почки, отторжения трансплантата, болезни трансплантат против хозяина (GVHD), включая острую и/или хроническую GVHD, или для лечения субъекта после трансплантации.
91. Композиция по любому из пп. 75-80, где композиция предназначена для предотвращения и/или уменьшения пери- или послеоперационных осложнений после хирургического вмешательства, таких как осложнения после операции на сосудах, например операции на периферических сосудах.
92. Композиция по любому из пп. 75-80, где композиция предназначена для профилактики или лечения воспаления сосудов, для лечения, предотвращения или снижения риска острого и хронического воспаления сосудов или кардита.
93. Композиция по любому из пп. 75-80, где композиция предназначена для лечения, предотвращения и/или уменьшения риска развития острых и/или хронических воспалительных состояний и/или воспалительного заболевания кишечника.
94. Композиция по любому из пп. 75-80, где композиция предназначена для лечения, предотвращения и/или снижения риска развития ревматических заболеваний и/или артрита, включая остеоартрит, ревматоидный артрит, псориатический артрит.
95. Композиция по любому из пп. 75-80, где композиция предназначена для лечения, предотвращения и/или снижения риска развития болезни Альцгеймера, деменции в целом, рассеянного склероза или миастении.
96. Применение композиции по любому из пп. 62-80 в способе:
лечения, предупреждения и/или снижения риска развития сердечно-сосудистых заболеваний, аутоиммунных заболеваний или воспалительных состояний,
предотвращения или снижения риска тромбоза,
лечения, предупреждения или снижения риска окклюзии вен сетчатки,
лечения, предупреждения или снижения риска гематологических нарушений, включая серповидно-клеточную анемию, но не ограничиваясь ими,
лечения, предотвращения или снижения риска легочного фиброза,
лечения, предупреждения и/или снижения риска развития атеросклероза, острого коронарного синдрома, инсульта, хромоты, стенокардии, ишемической болезни сердца, заболевания периферических артерий, систолической гипертонии, тромбоэмболии, геморрагического или васкулитического инсульта, инфаркта миокарда, стенокардии или перемежающейся хромоты, нестабильной стенокардии, других форм тяжелой стенокардии или преходящих ишемических приступов (TIA),
лечения, профилактики или снижения риска сосудистой дисфункции, уменьшения ишемической боли,
профилактики или лечения рестеноза, например образования или утолщения неоинтимы,
лечения, профилактики или снижения риска ишемически-реперфузионного повреждения, ишемически-реперфузионного повреждения органа, такого как ишемически-реперфузионного повреждения печени или почек, отторжение трансплантата, болезни трансплантат против хозяина (GVHD), включая острую и/или хроническую GVHD, или для лечения субъекта после трансплантации,
предотвращения и/или уменьшения пери- или послеоперационных осложнений после хирургического вмешательства, таких как осложнения после операции на сосудах, например операции на периферических сосудах,
профилактики или лечения воспаления сосудов, лечения, предотвращения или снижения риска острого и хронического воспаления сосудов или кардита,
лечения, профилактики и/или снижения риска развития острых и/или хронических воспалительных состояний и/или воспалительного заболевания кишечника,
лечения, предупреждения и/или снижения риска развития ревматических заболеваний и/или артрита, включая остеоартрит, ревматоидный артрит, псориатический артрит, или
лечения, предупреждения и/или снижения риска развития болезни Альцгеймера, деменции в целом, рассеянного склероза или миастении гравис.
97. Способ лечения человека или животного, нуждающегося в терапии композицией белка аннексина А5 по любому из пп. 62-80, отличающийся тем, что включает введение терапевтически эффективного количества белка AnxA5 по любому из пп. 62-80 субъекту.
98. Способ по п. 97, в котором способ предназначен для одного из следующего:
лечения, предупреждения и/или снижения риска развития сердечно-сосудистых заболеваний, аутоиммунных заболеваний или воспалительных состояний, предотвращения или снижения риска тромбоза,
лечения, предупреждения или снижения риска окклюзии вен сетчатки,
лечения, предупреждения или снижения риска гематологических нарушений, включая серповидно-клеточную анемию, но не ограничиваясь ими,
лечения, предотвращения или снижения риска легочного фиброза,
лечения, предупреждения и/или снижения риска развития атеросклероза, острого коронарного синдрома, инсульта, хромоты, стенокардии, ишемической болезни сердца, заболевания периферических артерий, систолической гипертонии, тромбоэмболии, геморрагического или васкулитического инсульта, инфаркта миокарда, стенокардии или перемежающейся хромоты, нестабильной стенокардии, других форм тяжелой стенокардии или преходящих ишемических приступов (TIA),
лечения, профилактики или снижения риска сосудистой дисфункции, уменьшения ишемической боли,
профилактики или лечения рестеноза, например образования или утолщения неоинтимы,
лечения, профилактики или снижения риска ишемически-реперфузионного повреждения, ишемически-реперфузионного повреждения органа, такого как ишемически-реперфузионного повреждения печени или почек, отторжения трансплантата, болезни трансплантат против хозяина (GVHD), включая острую и/или хроническую GVHD, или для лечения субъекта после трансплантации,
предотвращения и/или уменьшения пери- или послеоперационных осложнений после хирургического вмешательства, таких как осложнения после операции на сосудах, например операции на периферических сосудах,
профилактики или лечения воспаления сосудов, лечения, предотвращения или снижения риска острого и хронического воспаления сосудов или кардита,
лечения, профилактики и/или снижения риска развития острых и/или хронических воспалительных состояний и/или воспалительного заболевания кишечника,
лечения, предупреждения и/или снижения риска развития ревматических заболеваний и/или артрита, включая остеоартрит, ревматоидный артрит, псориатический артрит, и
лечения, предупреждения и/или снижения риска развития болезни Альцгеймера, деменции в целом, рассеянного склероза или миастении гравис.
| Алмазно-абразивная паста | 1965 |
|
SU441274A1 |
| Преобразователь угол-код | 1973 |
|
SU452849A1 |
| EP 0457371 A1, 21.11.1991 | |||
| ПОЛИМЕРНАЯ КОМПОЗИЦИЯВПТ ВФОНД тшп | 1971 |
|
SU430121A1 |
| Пюпитр для работы на пишущих машинах | 1922 |
|
SU86A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| EP 0286830 A3, 24.01.1990 | |||
| US 5258497 A, 02.11.1993 | |||
| СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ РЕКОМБИНАНТНОЙ ЧЕЛОВЕЧЕСКОЙ ПРОУРОКИНАЗЫ М5 | 2013 |
|
RU2553533C2 |
| НОВЫЙ МУТАНТ E.COLI С СУПРЕССИРОВАННОЙ ПРОДУКЦИЕЙ ОРГАНИЧЕСКОЙ КИСЛОТЫ | 1996 |
|
RU2180351C2 |
| WANG F | |||
| ET AL | |||
| "Non-fusion expression in Escherichia coli: Single-step | |||
Авторы
Даты
2022-08-31—Публикация
2016-09-16—Подача