Изобретение относится к медицине, а именно к фармакологии и клинической фармакологии, и предназначено для ингибирования белка-транспортера гликопротеина-Р (Pgp) в эксперименте in vitro.
Pgp локализован в энтероцитах кишечника, гепатоцитах, эпителиоцитах почечных канальцев, эндотелиальных клетках гистогематических барьеров и участвует в транспорте многих эндогенных и экзогенных веществ, в том числе лекарственных препаратов. Изменение активности Pgp в эксперименте in vitro может применяться для изучения роли данного транспортера в фармакокинетике лекарственных веществ.
Известно, что прогестерон в концентрации 100 мкМ оказывает ингибирующее влияние на Pgp на клетках линии Caco-2 [Изучение влияния прогестерона на активность гликопротеина-Р in vitro
Ерохина П.Д., Абаленихина Ю.В., Щулькин А.В., Черных И.В., Попова Н.М., Слепнев А.А., Якушева Е.Н.
Российский медико-биологический вестник имени академика И.П. Павлова. 2020. Т. 28. № 2. С. 135-142]. Известно, что полисахаридный комплекс, выделенный из цветков пижмы обыкновенной, снижает активность Pgp на клеточной линии Caco-2 в концентрациях 10 и 100 мкМ [Влияние полисахаридных комплексов растений средней полосы россии на активность белка-транспортера гликопротеина-P in vitro
Черных И.В., Щулькин А.В., Кириченко Е.Е., Правкин С.К., Якушева Е.Н.
Химия растительного сырья. 2020. № 4. С. 73-81]. Известно, что воздействие H2O2 в концентрациях 10 и 50 мкМ в течение 3 ч снижало активность Pgp на клетках линии Caco-2 [Влияние окислительного стресса на транспорт субстрата Р-гликопротеина через клеточный монослой
Щулькин А.В., Абаленихина Ю.В., Сеидкулиева А.А., Черных И.В., Якушева Е.Н.
Биологические мембраны. 2021. Т. 38. № 4. С. 292-305].
Техническим результатом настоящего изобретения является разработка простого и доступного способа ингибирования белка-транспортера гликопротеина-Р (Pgp) в эксперименте in vitro.
С данной целью был выполнен эксперимент на клеточной линии аденокарциномы ободочной кишки человека (Caco-2) (ЦКП «Коллекция культур клеток позвоночных», Санкт-Петербург, Россия). Клетки культивировали при 37ºС и 5% содержании СО2 в инкубаторе WS-189C («World Science», Корея) в Дульбекко модифицированной среде Игла (DMEM) с высоким содержанием глюкозы (4500 мг/л) («Sigma-Aldrich», Германия), содержащей L-глутамин (4 мМ) («Sigma-Aldrich», Германия), 15% эмбриональной бычьей сыворотки («Sigma-Aldrich», Германия), 100 ЕД/мл и 100 мкг/мл пенициллина и стрептомицина («Sigma-Aldrich», Германия) соответственно. После достижения 70−90% конфлюентности клетки снимали с флакона добавлением раствора трипсин-ЭДТА (0,25% трипсина и 0,2% ЭДТА, «Sigma-Aldrich», Германия) и высеивали в специальные трансвелл-системы (12 mm Transwell® with 0.4 µm Pore Polycarbonate Membrane Insert, Sterile, «Corning», США), которые состоят из двух камер апикальной и базальной, разделенных полупроницаемой мембраной, где и высеивали клетки. Клетки линии Caco-2 культивировали в трансвелл-системе в питательной среде в течение 21 сут., поскольку при данном сроке происходит их спонтанная дифференцировка в клетки подобные энтероцитам тонкого кишечника, гиперэкспрессирующие Pgp.
В последние сутки культивирования в питательную среду в апикальную и базолатеральную камеры добавляли DL-бутионинсульфоксимин (БСО) («Sigma-Aldrich», Германия) до достижения его концентраций в среде 1, 5, 10, 50, 100 и 500 мкМ и инкубацией в течение 3 ч. На каждый эксперимент было выполнено по 3 повторения.
Активность P-gp оценивали по транспорту его маркерного субстрата – фексофенадина через монослой клеток линии Caco-2. Для этого питательную среду заменяли на транспортную, представляющую собой раствор Хэнкса («Sigma-Aldrich», Германия) с 25 мМ Хепес («Sigma-Aldrich», Германия) и 1% диметилсульфоксида («ПанЭко», Россия).
Затем добавляли субстрат P-gp – фексофенадин («Sigma-Aldrich», Германия) в апикальную камеру в конечной концентрации 150 мкМ [Elsby R., Surry D.D., Smith V.N., Gray A.J. 2008. Validation and application of Caco-2 assays for the in vitro evaluation of development candidate drugs as substrates or inhibitors of P-glycoprotein to support regulatory submissions, Xenobiotic, 38, 1140–1164]. Через 1, 2 и 3 ч. забирали образцы из базолатеральной камеры-реципиента для определения концентрации субстрата (a-b транспорт, обусловленный пассивной диффузией против функционирования P-gp).
В аналогичных трансвелл-системах оценивали транспорт фексофенадина из базолатеральной камеры в апикальную (b-a транспорт, обусловленный пассивной диффузией и функционированием P-gp). Для этого субстрат в той же концентрации добавляли в базолатеральную камеру, а затем через 1, 2 и 3 ч. забирали образцы из апикальной камеры для определения концентрации фексофенадина.
Транспорт маркерного субстрата рассчитывали по формуле [Petri N., Tannergren C., Rungstad D., Lennernäs H. 2004. Transport Characteristics of Fexofenadine in the Caco-2 Cell Model. Pharmac. Res. 21 (8), 1398–1404]:
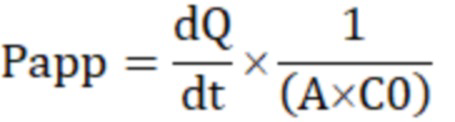
где Рарр – коэффициент кажущейся проницаемости (apparent permeability coefficient, см/сек), dQ/dt – изменение количества субстрата в камере реципиенте за время инкубации (мкМ*мл/сек), A – площадь полупроницаемой мембраны лунки в трансвелл-системе (см2), C0 – начальная концентрация субстрата в камере-доноре (мкМ).
Затем рассчитывали отношение коэффициентов кажущейся проницаемости: b-a к a-b.
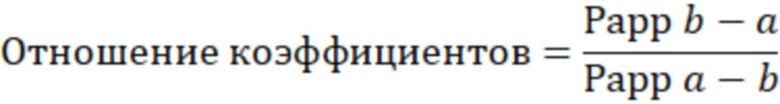
Данный параметр является интегральным и оценивает общий вклад Pgp в транспорт фексофенадина через билипидную мембрану.
Концентрации фексофенадина в транспортной среде определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с УФ детектированием при длине волны 220 нм. Исследование выполнялось на ВЭЖХ хроматографе «Стайер» (Россия) по оригинальной методике [Ерохина П.Д., Абаленихина Ю.В., Щулькин А.В.,Черных И.В., Попова Н.М., Слепнев А.А., Якушева Е.Н. 2020. Изучение влияния прогестерона на активность гликопротеина-Р in vitro. Российский медико-биологический вестник им. акад. И.П. Павлова. 28 (2), 135–142].
Полученные результаты обрабатывали дисперсионным анализом.
Коэффициент кажущейся проницаемости b-a фексофенадина, характеризующий его транспорт из базолатеральной камеры в апикальную за счет пассивной диффузии и функционирования Pgp, составил 3,02 · 10-6 ± 0,12 · 10-6 см/сек, коэффициент кажущейся проницаемости a-b, оценивающий транспорт из апикальной камеры в базолатеральную за счет пассивной диффузии против функции P-gp, равнялся 1,11 ⋅ 10-6 ± 0,37 ⋅ 10-6 см/сек. Из представленных данных видно, что транспорт обусловленный Pgp в 3,27 раз выше транспорта, происходящего за счет пассивной диффузии, против работы белка-транспортера (р=0,013) (таблица 1).
Воздействие БСО в концентрациях 1, 5 и 10 мкМ в течение 3 ч не влияло на коэффициент кажущейся проницаемости b-a и отношение коэффициентов кажущейся проницаемости (b-a)/(a-b) (таблица 1).
Воздействие БСО в концентрациях 50, 100 и 500 мкМ в течение 3 ч приводило к снижению коэффициента кажущейся проницаемости b-a на 37,7% (р=0,001), 47,4% (р=0,001) и 57,3% (р=0,005) (табл. 1) и отношения коэффициентов кажущейся проницаемости (b-a)/(a-b) на 48,9% (р=0,048), 62,4% (р=0,03) и 65,9% (р=0,03), что свидетельствует о снижении активности белка-транспортера.
Таблица 1
Влияние БСО на транспорт субстрата P-gp (фексофенадина) через билипидную мембрану клеток Caco-2 (M±SD, n=3)
мкМ
см/сек
×10-6 см/сек
роль
Таким образом, при добавлении Дульбекко модифицированную среду Игла DL-бутионинсульфоксимина до достижения его концентрации в среде 50, 100 и 500 мкМ с последующей инкубацией в течение 3 ч отмечалось его ингибирующее действие на Pgp.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИНГИБИРОВАНИЯ АВСВ1-БЕЛКА В ЭКСПЕРИМЕНТЕ IN VITRO | 2023 |
|
RU2811993C1 |
| СПОСОБ ПОВЫШЕНИЯ КОЛИЧЕСТВА ПРЕГНАН Х РЕЦЕПТОРА В ЭКСПЕРИМЕНТЕ IN VITRO | 2023 |
|
RU2808299C1 |
| СПОСОБ ПОВЫШЕНИЯ КОЛИЧЕСТВА КОНСТИТУТИВНОГО АНДРОСТАНОВОГО РЕЦЕПТОРА В ЭКСПЕРИМЕНТЕ IN VITRO | 2023 |
|
RU2812629C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ СОСТОЯНИЯ ИНГИБИРОВАНИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ГЛИКОПРОТЕИНА-Р ЛИНЕСТРЕНОЛОМ В ЭКСПЕРИМЕНТЕ | 2014 |
|
RU2553362C1 |
| ИНГИБИТОР АТФ-ЗАВИСИМЫХ ОБРАТНЫХ ТРАНСПОРТЕРОВ КЛЕТОК И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2641304C1 |
| УСОВЕРШЕНСТВОВАНИЕ ВСАСЫВАНИЯ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ ЧЕРЕЗ СЛИЗИСТЫЕ ОБОЛОЧКИ ИЛИ КОЖУ | 2009 |
|
RU2519193C2 |
| СПОСОБ ОЦЕНКИ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ГЛИКОПРОТЕИНА-P В ГЕМАТОЭНЦЕФАЛИЧЕСКОМ БАРЬЕРЕ | 2018 |
|
RU2677286C1 |
| СРЕДСТВО ДЛЯ СНИЖЕНИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ И ЭКСПРЕССИИ ГЛИКОПРОТЕИНА-Р | 2017 |
|
RU2649134C1 |
| ПРИМЕНЕНИЕ САМОЭМУЛЬГИРУЮЩИХСЯ СМЕСЕЙ ЛИПИДНЫХ ЭКСЦИПИЕНТОВ В ГАЛЕНОВЫХ ПРЕПАРАТАХ | 2005 |
|
RU2381789C2 |
| СИСТЕМА КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2012 |
|
RU2612915C2 |
Изобретение относится к клеточной биологии и медицине, в частности к клинической фармакологии, и раскрывает способ ингибирования белка-транспортера гликопротеина-Р в эксперименте in vitro. Для осуществления указанного способа линию клеток аденокарциномы ободочной кишки человека (Caco-2) культивируют в Дульбекко модифицированной среде Игла с содержанием глюкозы 4500 мг/л в течение 21 суток. Указанная среда также содержит L-глутамин 4 мМ, 15% бычьей сыворотки, 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина. После чего в среду добавляют DL-бутионинсульфоксимин до достижения его концентрации в среде 50, 100 или 500 мкМ и инкубируют её в течение 3 часов. Настоящее изобретение позволяет осуществить простой и доступный способ ингибирования белка-транспортера гликопротеина-Р в эксперименте in vitro. 1 табл., 1 пр.
Способ ингибирования гликопротеина-Р в эксперименте in vitro, включающий культивирование линии клеток аденокарциномы ободочной кишки человека в Дульбекко модифицированной среде Игла с содержанием глюкозы 4500 мг/л, содержащей L-глутамин 4 мМ, 15% бычьей сыворотки, 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина в течение 21 суток, отличающийся последующим добавлением в среду DL-бутионинсульфоксимина до достижения его концентрации в среде 50; 100, 500 мкМ с инкубацией в течение 3 часов.
| ГИДРОЛИЗАТ ПОЛИСАХАРИДНОГО КОМПЛЕКСА ЦВЕТКОВ ПИЖМЫ ОБЫКНОВЕННОЙ КАК ИНГИБИТОР БЕЛКА-ТРАНСПОРТЕРА ГЛИКОПРОТЕИНА-Р | 2019 |
|
RU2699042C1 |
| ЧЕРНЫХ И.В | |||
| и др., Возможности применения некрахмальных полисахаридов растительного происхождения в клинической практике, Российский медико-биологический вестник им | |||
| академика И.П | |||
| Павлова, 2018, т | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Держатель для поленьев при винтовом колуне | 1920 |
|
SU305A1 |
| ЯКУШЕВА Е.Н | |||
| и др., Гликопротеин-Р: структура, физиологическая | |||
Авторы
Даты
2022-09-05—Публикация
2021-11-18—Подача