Изобретение относится к области синтеза биологически активных аналогов природных соединений, а именно к получению проп-2-ин-1-ил-(2Ζ)-2-[(3α, 4α, 8α, 11α, 14β, 16β)-16-(ацетилокси)-3,11-дигидрокси-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еноата формулы (1),
обладающего высокой активностью по отношению к Staphylococcus aureus (MRSA):
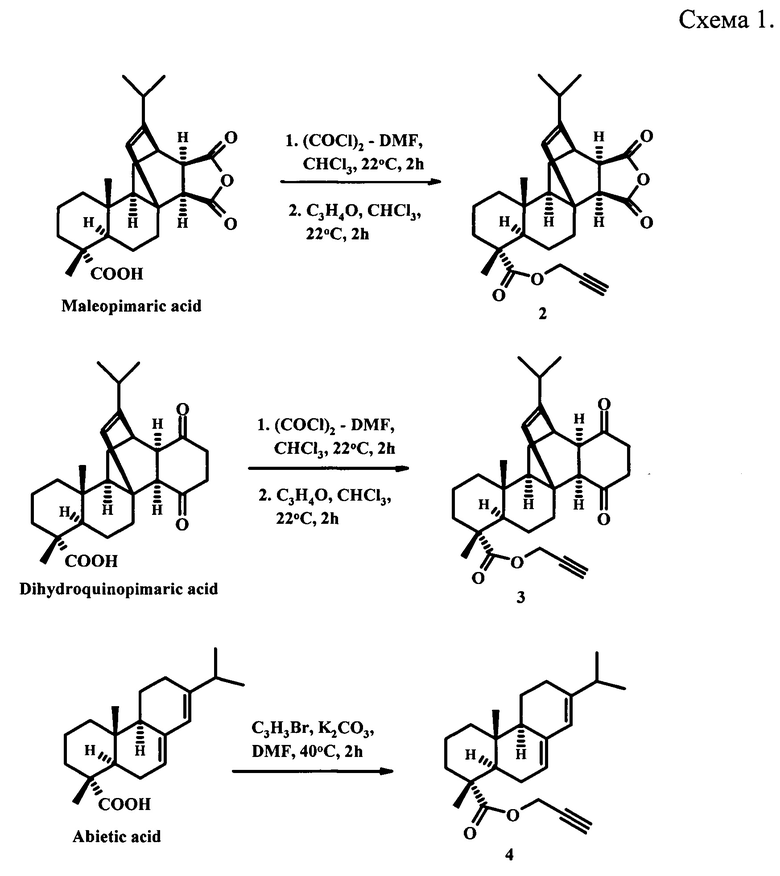
Известны терминальные дитерпеновые ацетилены (2-4), полученные взаимодействием хлорангидридов малеопимаровой и дигидрохинопимаровой кислот с пропаргиловым спиртом в хлороформе при комнатной температуре или реакцией абиетиновой кислоты с пропаргилбромидом при нагревании в среде ДМФА в присутствии основания K2CO3 [Ε.V. Tret'yakova, G.F. Zakirova, Ε.V. Salimova, О.S. Kukovinets, V.N. Odinokov, L.V. Parfenova. Convenient one-pot synthesis of resin acid Mannich bases as novel anticancer and antifungal agents. Medicinal Chemistry Research. 2018, 27(9), P. 2199-2213] (схема 1).
Изучение антибактериальной активности полученных соединений in vitro в отношении грамположительных (S. aureus) и грамотрицательных (Е. coli, K. Pneumoniae, A. baumannii, P. aeruginosa) микроорганизмов, а также двух грибковых культур (С.albicans, С.neoformans) показало, что дитерпеновые пропаргиловые эфиры неактивны в отношении исследуемых патогенов.
Известны терминальные пропаргильные производные дитерпеноидов (6) и (8), полученные взаимодействием дитерпеновых спиртов (5) и (7) с пропаргилбромидом при кипячении в среде ДМФА в присутствии NaH в качестве основания [Ε. V. Tret'yakova, Ε. V. Salimova, L.V. Parfenova.
Synthesis, modification, and biological activity of propargylated methyl dihydroquinopimarates. Natural Product Research. Published online: 12 May 2020, doi.org/10.1080/14786419.2020.1762187] (схема 2).

Скрининг биологической активности in vitro полученных соединений показал, что они проявляют высокую противоопухолевую активность, полностью подавляя рост клеточных линий лейкемии (CCRF-CEM и SR), немелкоклеточного рака легкого (NCI-H522), меланомы (LOX IMVI и MALME-3M), клеток рака яичников (IGROV1) и рака почки (786-0, UO-31). Изучение антибактериальнго действия in vitro в отношении грамположительных (S. aureus) и грамотрицательных (Е. coli, K. Pneumoniae, A. baumannii, P. aeruginosa) микроорганизмов, а также двух грибковых культур (С.albicans, С.neoformans) установило, что полученные пропаргильные производные не проявляют противомикробного действия в отношении указанных патогенов.
Известны терминальные ацетиленовые производные пентациклических тритерпеноидов (9-12), полученные этерификацией соответствующих тритерпеновых кислот с пропаргилбромидом в ДМФА с использованием K2CO3 в качестве основания [Е.Yu. Yamansarov, I.V. Saltykova, S.V. Kovalev, R.A. Petrov, D.O. Shkil', Ε.I. Seleznev, Ε.K. Beloglazkina, A.G. Majouga. Synthesis and cytotoxicity of new alkyne derivatives of pentacyclic triterpenoids. Russian Chemical Bulletin, International Edition. 2019, 68(4), P. 855-861] (схема 3).
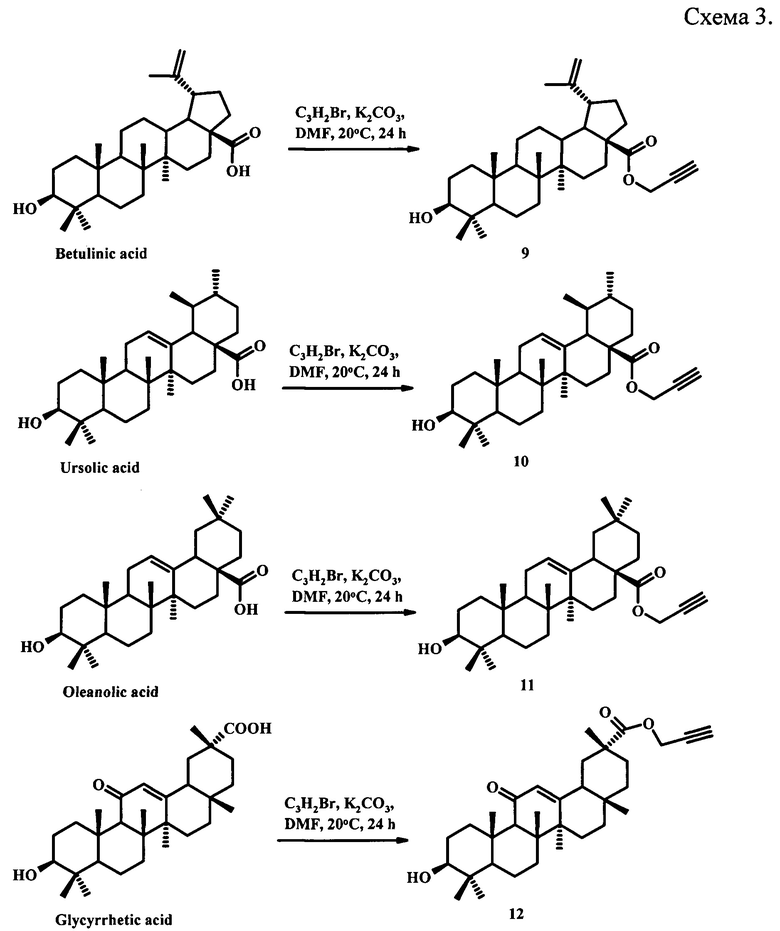
Скрининг противоопухолевой активности полученных соединений in vitro в отношении клеток гепатоцеллюлярной карциномы (HepG2 и Huh7) и рака простаты (РС3) показал, что алкильные производные (6-8) проявляют умеренное цитотоксическое действие в отношении указанных клеточных линий. Изучение антибактериальной активности не проводилось.
Таким образом, синтез пропаргилового эфира фузидовой кислоты (1) в литературе не описан.
Антимикробное и противогрибковое действие данного соединения на штаммах возбудителей бактериальных и грибковых инфекций человека и животных изучено не было.
Задачей предлагаемого изобретения является разработка способа получения нового соединения - проп-2-ин-1-ил-(2Z)-2-[(3α, 4α, 8α, 11α, 14β, 16β)-16-(ацетилокси)-3,11 -дигидрокси-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еноата (1), а также исследование in vitro его антимикробных и противогрибковых свойств.
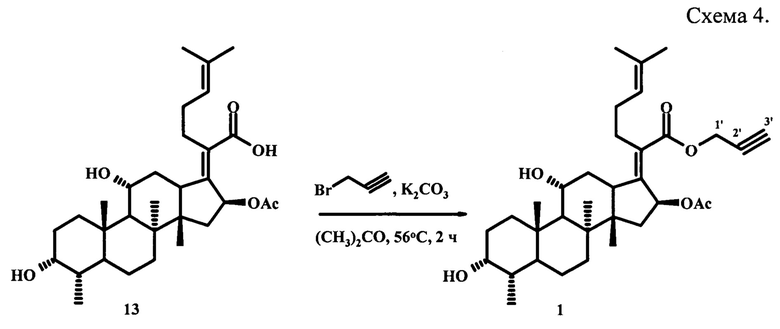
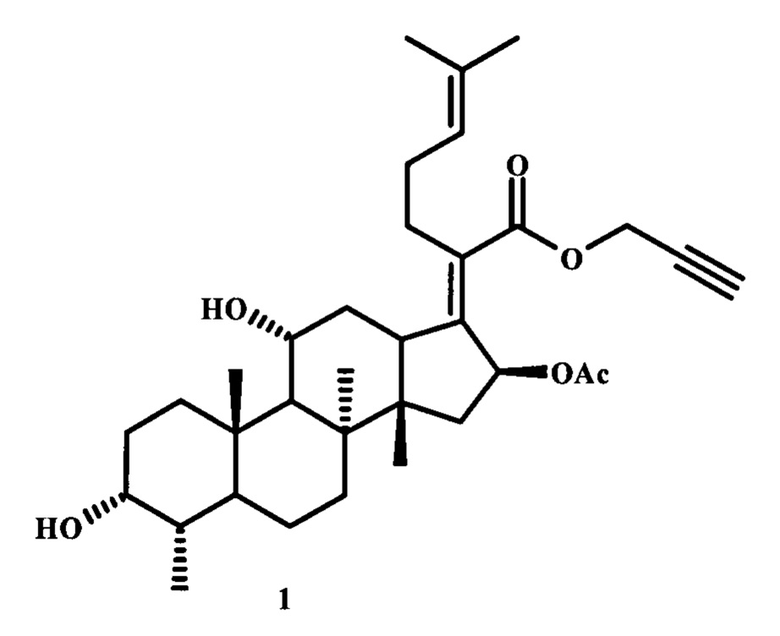
Синтез заявленного соединения (1) осуществляли следующим образом: фузидовую кислоту (13) вовлекали во взаимодействие с эквимолярным количеством пропаргилбромида в среде ацетона при кипячении в течение 2 часов с использованием K2CO3 в качестве основания (схема 4). После выделения получали пропаргилфузидат (1) с количественным выходом, который представлял собой порошок белого цвета (т.пл. 118-120°С),  Структура соединения (1) установлена с помощью 1D и 2D спектроскопии ЯМР Ή и Си масс-спектрометрии MALDI TOF/TOF.
Структура соединения (1) установлена с помощью 1D и 2D спектроскопии ЯМР Ή и Си масс-спектрометрии MALDI TOF/TOF.
Преимущества предлагаемого способа.
В известном способе для получения пропаргильных производных в качестве растворителя используется ДМФА. Очистка реакционной смеси от данного растворителя представляет собой трудоемкий процесс, включающий в себя промывание реакционной массы раствором HCl и последующую нейтрализацию органического экстракта.
В отличие от известного, в предлагаемом способе синтез пропаргильного производного проводится в ацетоне, использование которого в качестве растворителя многократно упрощает процесс выделения и, как следствие, приводит к увеличению выхода конечного продукта.
Сущность изобретения поясняется следующими примерами.
Пример 1. К смеси 0.5 г (0.95 ммоль) фузидовой кислоты (13) и 0.19 г (0.72 ммоль) свежепрокаленного K2CO3 в 30 мл сухого ацетона добавляли по каплям 0.075 мл (0.95 ммоль) пропаргилбромида. Реакционную массу кипятили 2 часа, затем охлаждали. Смесь выливали в ледяную Н2О, выпавший осадок фильтровали, промывали на фильтре 50 мл Н2О и сушили на воздухе. Выход 0.53 г (99%), порошок белого цвета. Т.пл. 118-120°С. 
Спектральные характеристики проп-2-ин-1-ил (2Ζ)-2-[(3α, 4α, 8α, 11α, 14β, 16β)-16-(ацетилокси)-3,11-дигидрокси-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еноата (1)1.
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.91 с (3Н, Н18), 0.92 д (3Н, Н28, 3J 7,1 Гц), 0.98 с (3Н, Н19), 0.99-1.17 м (1Н, Н6), 1.05-1.19 м (1Н, Н7), 1.26-1.39 м (1Н, Н15), 1.38 c (3H,H30), 1.45-1.61 м (1Н, Η5), 1.50 д (1Н, Н1, 2J 12.1 Гц), 1.51-1.59 м (1Н, Н9), 1.53-1.71 м (1Н, Н6), 1.61 с (3Н, Н27), 1.63-1.78 м (1Н, Н7), 1.65-1.79 м (1Н, Н2), 1.68 с (3Н, Н26), 1.76-1.88 м (1Н, Н12), 1.80-1.93 м (1Н, Н2), 1.98 с (3Н, ОСОСН3), 2.02-2.24 м (2Н, Н23), 2.03-2.16 м (1Н, Н4), 2.09-2.21 м (1Н, Н1), 2.14-2.26 м (1Н, Н15), 2.32 д (1Н, Н12, 2J 13.0 Гц), 2.40-2.72 м (2Н, Н22), 2.43-2.51 м (1Н, Н3'), 3.06 д (1Н, Н13, 3J 11.5 Гц), 3.68-3.77 м (1Н, Н3), 4.29-4.38 м (1Η, Η11), 4.60 дд (1Н, Н1', 3J 1.3 Гц, 2J 15.5 Гц), 4.71 дд (1Н, Н1', 3J 1.3 Гц, 2J 15.5 Гц), 5.10 т (1Н, Н24, 3J6.5 Гц), 5.86 д (1Н, Н16, 3J8.5 Гц).
Спектр ЯМР 13С (CDCl3), δ, м.д.: 15.96 (С28), 17.77 (С27), 17.79 (С18), 20.87 (С6), 21.08 (ОСОСНз), 23.04 (С19), 23.88 (С30), 25.74 (С26), 28.36 (С23), 28.92 (С22), 29.88 (С2), 30.12 (С1), 32.06 (С7), 35.54 (С12), 35.88 (С4), 36.42 (С5), 36.89 (С10), 38.99 (С15), 39.45 (С8), 44.19 (С13), 48.67 (С14), 49.28 (С9), 51.71 (С1'), 68.21 (С11), 71.42 (С3), 74.40 (С16), 74.87 (С2'), 77.62 (С3'), 122.98 (С24), 129.57 (С20), 132.69 (С25), 149.79 (С17), 169.07 (С21), 170.33 (ОСОСН3).
Масс-спектр (MALDI TOF/TOF), m/z (Ioтн, %): 577 (63.9) [M+Na]+, 593 (100) [М+K]+.
1Контроль реакции осуществляли методом ТСХ на пластинах Sorbfil (Сорбполимер, Краснодар, Россия), проявляли 10% раствором серной кислоты. Температура плавления определена на приборе РНМК 80/2617. Спектры ЯМР 1D (1H, 13С) и 2D (COSY, NOESY, HSQC, НМВС) сняты на спектрометре Bruker Avance 500 (125.78 МГц для 13С и 500.17 МГц для 1Н) с использованием стандартных импульсных последовательностей фирмы Bruker, внутренний стандарт Me4Si, растворитель - CDCI3. Оптические углы измерены на поляриметре Perkin-Elmer 341. Масс-спектры MALDI TOF/TOF получены на спектрометре Bruker Autoflex ТМ III Smartbeam с использованием матрицы 3-(4-гидрокси-3,5-диметоксифенил)проп-2-еновой кислоты (синапиновая кислота).
Пример 2. Противомикробный скрининг соединения (1) проводили в CO-ADD (The Community for Antimicrobial Drug Discovery), финансируемым Wellcome Trust (Великобритания) и Университетом Квинсленда (Австралия), на пяти бактериальных штаммах: Escherichia coli (Е. coli) АТСС 25922, Klebsiella pneumoniae (К. pneumoniae) АТСС 700603, Acinetobacter baumannii (A. baumannii) АТСС 19606, Pseudomonas aeruginosa (P. aeruginosa) ATCC 27853 и Staphylococcus aureus (S. aureus (MRSA)) ATCC 43300. Противогрибковую активность определяли на двух грибковых штаммах: Candida albicans (С.albicans) ATCC 90028 и Cryptococcus neoformans (C. neoformans) ATCC 208821.
Первичный скрининг противомикробной активности проводился путем тестов на ингибирование размножения клеток, используя образцы в одной (32 мкг/мл) концентрации. Аликвоту каждого образца в ДМСО помещали в 384-луночный планшет и обрабатывали соответствующей бактериальной культурой. Ингибирование роста бактерий определяли измерением поглощения при 600 нм (OD600) с использованием монохромного микропланшетного ридера Tecan M1000 Pro. Процент ингибирования роста рассчитывали для каждой лунки с использованием отрицательного контроля (только для среды) и положительного контроля (бактерии без ингибиторов) на той же пластинке. Все тесты продублированы. В случае если один или оба раза наблюдалось ингибирование роста ≥ 80%, соединение считалось активным.
При первичном скрининге было выявлено наличие противомикробной активности у проп-2-ин-1-ил-(2Z)-2-[(3α, 4α, 8α, 11α, 14β, 16β)-16-(ацетил-окси)-3,11-дигидрокси-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еноата (1) в отношении культуры бактерий Staphylococcus aureus (MRSA). Для соединения (1) была определена минимальная ингибирующая концентрация в отношении вышеуказанной культуры, а также изучена цитотоксическая и гемолитическая активности.
Минимальную ингибирующую концентрацию (MIC; мкг/мл) определяли в соответствии с рекомендациями Института клинических и лабораторных стандартов (CLSI, https://clsi.org/), определяя самую низкую концентрацию, при которой было обнаружено полное ингибирование бактерий или грибов. Тесты проводились в двойном повторе. Максимальный процент ингибирования роста обозначался как Dmax. Хиты были классифицированы при MIC ≤ 16 мкг/мл или MIC ≤ 10 мкМ в любой реплике (n=2 на разных планшетах).
Цитотоксическое действие (Hk; СС50 (мкг/мл)) определяли на клеточной линии эмбриональных почек человека HEK293 путем определения концентрации, вызывающей гибель 50% клеток. Ингибирование роста клеток НЕК293 определяли, измеряя флуоресценцию после добавления 5 мкл 25 мкг / мл резазурина (конечная концентрация 2.3 мкг/мл) и после инкубации в течение еще 3 ч при 37°С в 5% СО2. Интенсивность флуоресценции измеряли с использованием монохромного микропланшетного ридера Tecan Μ1000 Pro с использованием автоматического вычисления коэффициента усиления. Максимальный процент цитотоксичности обозначали как Dmax. Соединение считалось токсичным при СС50 ≤ 32 мкг / мл или СС50 ≤ 10 мкМ. Кроме того, образцы были отмечены как частичные цитотоксические, если Dmax ≥ 50%, даже при СС50 выше максимальной тестируемой концентрации.
Гемолитическую активность (Hm; НС50 (мкг/мл)) определяли путем измерения поглощения при 405 мм супернатанта - надосадочной жидкости, образованной после инкубации в течение 1 ч при 37°С планшетов, содержащих образцы соединений с добавленными к ним промытыми клетками крови человека, и последующего центрифугирования при 1000 об/мин в течение 10 мин. Абсорбцию измеряли с использованием монохромного микропланшетного ридера Tecan Μ1000 Pro. Максимальный процент гемолиза представлен как Dmax. Низкое значение Dmax при НС50 ≥ 32 мкг/мл (максимально испытанная концентрация) указывает на образцы без гемолитической активности. Образцы, обладающие гемолитической активностью, были охарактеризованы при НС50 ≤ 32 мкг/мл. Кроме того, образцы были помечены как частично гемолитические, если Dmax ≥ 50%, даже при НС50 > максимальной тестируемой концентрации.
«Колистин» и «Ванкомицин» использованы в качестве положительных стандартов оценки бактериального ингибирования для грамотрицательных и грамположительных бактерий, соответственно. «Флуконазол» использован в качестве стандартного фунгицидного средства для С.albicans и С.neoformans. «Тамоксифен» и «Мелиттин» использованы в качестве положительного стандарта оценки цитотоксичности и гемолитического эффекта, соответственно. Методики тестирования противомикробной, фунгицидной, цитотоксической и гемолитической активности in vitro соединений приведены на сайте http://www.co-add.org.
Образец проп-2-ин-1-ил-(2Z)-2-[(3α, 4α, 8α, 11α, 14β, 16β)-16-(ацетил-окси)-3,11-дигидрокси-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еноата (1) в концентрации 0.25 мкг/мл показал противомикробную активность, ингибируя рост и размножение>80% грамположительных бактерий Staphylococcus aureus (MRSA). Гемолитическая активность соединения (1) не превышает 7% даже при максимально тестируемой концентрации 32 мкг/мл, что ниже таковой у фузидовой кислоты в 1.5 раза. Цитотоксичность соединения (1) сравнима с аналогичным показателем у фузидовой кислотой (Таблица 1).
Таким образом, соединение (1) проявляет противомикробную активность в отношении патогенных микроорганизмов Staphylococcus aureus (MRSA) при низкой токсичности и обладает минимальным гемолитическим действием при максимально тестируемой концентрации.

Изобретение относится к области синтеза биологически активных аналогов природных соединений, а именно к получению нового представителя ацетиленовых производных фузидовой кислоты - проп-2-ин-1-ил-(2Z)-2-[(3α, 4α, 8α, 11α, 14β, 16β)-16-(ацетилокси)-3,11-дигидрокси-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еноата, обладающего высокой антибактериальной активностью по отношению к Staphylococcus aureus (MRSA) при низкой токсичности, проявляющего минимальное гемолитическое действие при максимально тестируемой концентрации. Проп-2-ин-1-ил-(2Z)-2-[(3α, 4α, 8α, 11α, 14β, 16β)-16-(ацетилокси)-3,11-дигидрокси-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еноат получен на основе фузидовой кислоты взаимодействием с эквимолярным количеством пропаргилбромида в среде ацетона при кипячении в течение 2 часов с использованием K2СО3 в качестве основания. Выход проп-2-ин-1-ил-(2Ζ)-2-[(3α, 4α, 8α, 11α, 14β, 16β)-16-(ацетилокси)-3,11-дигидрокси-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еноата составил 99%. 3 н.п. ф-лы, 2 пр., 1 табл.
1. Проп-2-ин-1-ил-(2Z)-2-[(3α, 4α, 8α, 11α, 14β, 16β)-16-(ацетилокси)-3,11-дигидрокси-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еноат (1)
2. Способ получения проп-2-ин-1-ил-(2Z)-2-[(3α, 4α, 8α, 11α, 14β, 16β)-16-(ацетилокси)-3,11-дигидрокси-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еноата (1), заключающийся во взаимодействии фузидовой кислоты с эквимолярным количеством пропаргилбромида в среде ацетона при кипячении в течение 2 часов с использованием K2СО3 в качестве основания.
3. Применение соединения формулы (1) в качестве средства с антибактериальной активностью для борьбы с заболеваниями человека и животных, вызванными грамположительными бактериями Staphylococcus aureus (MRSА).
| Salimova E.V., Mamaev A.G., Tret’yakova E.V., Kukovinets O.S., Mavzyutov A.R., Shvets K.Y., et al | |||
| Synthesis and Biological Activity of Cyanoethyl Derivatives of Fusidic Acid | |||
| Russ | |||
| J | |||
| Org | |||
| Chem | |||
| Видоизменение прибора для получения стереоскопических впечатлений от двух изображений различного масштаба | 1919 |
|
SU54A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Salimova E.V., Tret’yakova E.V., Parfenova L.V | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2022-09-19—Публикация
2021-09-13—Подача