Изобретение относится к области ветеринарии, в частности к лечению инфекционных заболеваний кошек. В неограничивающем варианте осуществления настоящего изобретения предлагается фармацевтическая композиция для противовирусной терапии инфекционного перитонита кошек, которая включает аналог нуклеозида (2R,3R,4S,5R)-2-(4-аминопирроло[2,1-f][1,2,4]триазин-7-ил)-3,4-дигидрокси-5-(гидроксиметил) оксолан-2-карбонитрил в качестве активного ингредиента в комбинации с таурином.
Инфекционный перитонит кошек (FIP) - это хроническое, прогрессирующее и смертельное заболевание, вызываемое патогенным коронавирусом кошек (FIPV), в основном характеризующееся перитонитом и большим количеством плеврального выпота, имеет высокий уровень смертности среди больных кошек.
Инфекционный перитонит кошек (FIP) - это вирусное заболевание кошек, вызываемое определенными штаммами вируса, называемого коронавирусом кошек. Большинство штаммов коронавируса кошек обнаруживаются в желудочно-кишечном тракте и не вызывают серьезных заболеваний. Они называются кишечным коронавирусом кошек (FCoV). FCoV - это общие название, которое широко применяется ко всем серотипам и биотипам коронавирусов кошек. Кошки, инфицированные FCoV, обычно не проявляют никаких симптомов во время первоначальной вирусной инфекции, но иногда могут испытывать короткие приступы диареи и / или легкие клинические симптомы со стороны верхних дыхательных путей, при этом выздоровление происходит спонтанно. У кошек, инфицированных FCoV, обычно возникает иммунный ответ, благодаря которому в течение 7-10 дней после заражения вырабатываются антитела против вируса. При этом кишечный биотипом FCoV является FECV. Так примерно у 5 - 10% кошек, инфицированных FCoV, одна или несколько мутаций вируса способна изменить его биологическое поведение. В результате лейкоциты (макрофаги/нейтрофилы) поражаются вирусом, образовывают иммунокомплекс и распространяются по всему телу кошки. Такой механизм воздействия на организм, технически вызывает - FIPV. Так FECV является только кишечным биотипом FCoV, а FIPV - биотипом только FIP. [1] Интенсивная воспалительная реакция на FIPV стремительно возникает вокруг сосудов в тканях и органах, по распростронению инфицированных комплексов, часто в брюшной полости, почках или головном мозге. Таким образом происходит развитие патологических процессов при FIP, которые в основном характеризуются перитонитом и большим количеством плеврального выпота, иммея, при этом, высокий уровень смертности среди больных кошек. Как только у кошки развивается клинический FIP, заболевание обычно прогрессирует и почти всегда заканчивается смертельным исходом. В настоящие время не существует общедоступной и эффективной терапии против FIPV. При этом вся терапия, при FIPV направлена на устранение осложнений и борьбу с патогенной бактериальной флорой, которая, как правило, присоединяется позднее.
(2R,3R,4S,5R)-2-(4-Аминопиролло[2,1-f][1,2,4]триазин-7-ил)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-карбонитрил (VS-121354) и его аналоги, представляет собой класс низкомолекулярных противовирусных средств. Это экспериментальный противовирусный аналог нуклеозида, исследуемый для лечения вируса инфекционного перитонита кошек (FIPV). Эти аналоги действуют как альтернативный субстрат и терминатор РНК-цепи вирусной РНК-зависимой РНК-полимеразы.
Известно применение VS-121354 для лечения FIP (CN 111135184 A от 05.03.2020, CN 113185519 A от 30.07.2020), в том числе композиции, содержащие VS-121354 в комбинации с ингибитором 3C-подобной протеазы (GC376) (CN 110215456 A от 25.06.2019, CN 111135166 A от 05.03.2020).
Существенным недостатком известных изобретений является плохая биодоступность VS-121354, обуславливающая довольно быстро возникающие рецидивы заболевания (4-6 недель), а также приводящая к потребности во введении высокой дозы лекарственного препарата на протяжении длительного периода. В этих исследованиях кошки получали VS-121354 подкожно в течение различных периодов времени, как правило, в течение 12 недель или дольше. Подкожные инъекции в течение такого длительного периода времени трудно выполнять владельцам, они могут быть очень болезненными для кошек из-за низкого pH этих нелицензированных и неконтролируемых препаратов и приводить к побочным эффектам, сопряженным с парентеральным введением препарата, таким как злокачественные новообразования, стерильные абсцессы и некрозы.
Технической задачей является создание лекарственного препарата, имеющего улучшенную терапевтическую активность у кошек в борьбе с вирусным перитонитом, в том числе, создание лекарственного препарата для перорального введения.
Для решения данной технической задачи была разработана фармацевтическая композиция, содержащая VS-121354 в сочетании с таурином в качестве активных ингредиентов.
Комплексное действие VS-121354 и таурина в одном препарате способны усилить терапевтическую эффективность друг друга в борьбе с вирусным заболеванием кошек - вирусным перитонитом. Таурин способен повысить биодоступность VS-121354, за счет лучшей переносимости инъекционной формы VS-121354, а их сочетание способно в значительной мере усилить действия друг друга и как следствие повысить эффективность против вирусного перитонита кошек.
Таурин - это незаменимая аминокислота для хищников, в частности для кошек. Часто используемый в отношении таурина термин заменимый, из-за невыясненной его роли в синтезе белка, является устаревшим. Таким образом, для поддержания нормальных обменных процессов необходимо постоянное поступление в организм относительно большого количества таурина, получаемого в рационе. Представители кошачьих, в отличии от всеядных животных, только в малых количествах могут синтезировать таурин для своей жизнедеятельности из других аминокислот (в частности, трансформировать метионин в цистеин и в таурин через декарбоксилазу цистеинсульфиновой кислоты (ДЦК) и обычно требует окисления гипотаурина до таурина в качестве заключительного этапа) [2]. Не способность кошек к самостоятельному синтезу таурина заключается в недостаточном количестве фермента, необходимого для его образования из цистеина, так как он же необходим для других физиологических процессов, что в результате сказывается на его недостатке в организме животного. Таким образом, способность кошек производить таурин в своем теле физиологически ограничена. Этот процесс принципиально усугубляется недостатком его в рационе или, в значительной мере, наличием воспалительных патологических процессов в желудочно-кишечном тракте, что, в частности, наблюдается при инфекционном перитоните кошек (FIP).
Ранее было показано, что таурин играет в обменных процессах значительную роль. Он присутствует почти во всех органах и тканях (в почках, головном мозге, где он локализуется в глиальных клетках). Уровень фермента ДЦК у кошек весьма низок, но употребление мяса и морепродуктов или добавок таурина, помогает поддерживать нормальную концентрацию таурина в тканях. При FIP у кошек наблюдаются воспалительные процессы в желудочно-кишечном тракте, в связи с чем даже при полноценном рационе, наблюдается снижение усвояемости питательных веществ. На недостаток таурина остро реагируют центральная нервная система формированием невропатий, так как каждая область мозга, которая была протестирована, содержит и поглощает таурин; это включает шишковидную железу [3], мозговой мост [4], гипоталамус [5], полосатое тело [6] и мозжечок [7-8]. Более того, появляется все больше доказательств того, что истощение таурина приводит к широкому спектру патологических состояний, включая тяжёлую кардиомиопатию [9], почечную дисфункцию [10], нарушение функции β-клеток поджелудочной железы [11] и потерю фоторецепторов сетчатки [12]. Тесная взаимосвязь между уровнем таурина и дегенерацией подтверждается тем, что добавление таурина может ингибировать эти процессы [13]. Существует длинный список заболеваний, на которые влияет таурин, хотя точный биохимический механизм действия часто не совсем ясен. Показательным примером является его роль при диабете. Многочисленные исследования показали, что таурин играет важную роль в обменных процессах. Это доказывает его способность в преодолении инсулинорезистентности и других факторов риска на животных моделях диабета 1 и 2 типа [14-16]. В частности, было показано, что введение таурина предотвращает вызванную высоким уровнем глюкозы микроангиопатию, то есть апоптоз эндотелиальных клеток сосудов [17], было обнаружено, что он восстанавливает активность ферментов, метаболизирующих глюкозу, и улучшает чувствительность к инсулину путем изменения пострецепторных событий действия инсулина [18]. Предположение о том, что оксид азота (NO) может быть вовлечен в патогенез диабета, побудило исследователей определить, могут ли быть нарушены эндогенный синтез NO или местная реактивность к эндогенному NO у пациентов с инсулинозависимым сахарным диабетом 1 типа [19]. Результаты показали, что, либо активность NO-синтазы увеличивается, либо чувствительность к NO снижается у пациентов с типом 1, что является хорошим показателем того, что система L-аргинин-NO участвует в патофизиологии диабета и его последствий, например, диабетической ретинопатии. Впоследствии было показано, что повышенный уровень NO вызывает активацию гена транспортера таурина и сопутствующее увеличение поглощения таурина клетками пигментного эпителия сетчатки [20].
Также таурин влияет на функцию почек [21], особенно в том, что касается стрептозотоцин-индуцированного диабета на животных моделях. Таурин улучшает диабетическую нефропатию за счет уменьшения перекисного окисления липидов и уменьшения накопления конечных продуктов гликирования в почках [22]. В этой связи важно отметить, что таурин снижает секрецию инсулина β-клетками in vitro [23].
Дефицит таурина, может иметь серьезные последствия, и их симптоматика удивительным образом совпадает с клиническими признаками FIP у кошек, что имеет крайне критичные последствия при развитии инфекционного процесса. Таурин - одна из самых распространенных аминокислот в головном и спинном мозге, лейкоцитах, сердечных и мышечных клетках, сетчатке и почти во всех тканях организма. Поэтому недостаток таурина, особенно при FIP, как правило, приводит к катастрофическим последствиям.
Большинство смертей от FIP происходит у кошек в возрасте 3-16 месяцев и редко после 5 лет [1, 24-25]. Самые частые поражения при FIP у кошек - поражения печени, почек, селезенки, глазные поражения, поражения в центральной и периферической системе. Это связано с тем, что FIP является результатом системного распространения вируса FECV из кишечника в моноциты крови. Самые ранние признаки явного FIP, помимо способности развиваться у молодых кошек, включают прогрессивно ухудшающееся недомогание, колеблющуюся лихорадку, отсутствие аппетита и потерю веса. На эти основные признаки болезни накладываются другие признаки заболевания в зависимости от формы и распределения воспаления по органам.
При этом таурин оказывает противовоспалительное и антиоксидантное действие, предотвращая окислительный стресс во всех органах и тканях, который усугубляет патологические повреждения, вызванные воспалительными клетками [26], в том числе, в органах-мишенях, которые поражаются при FIP. Таурин является абсолютно безопасным и стабильным соединением, при любом введении (энтеральном или парентеральном). Помимо всего прочего таурин способен регулировать клеточные кальциевые каналы, что занимает значительное место в антибактериальном и противовирусном иммунитете [27]. Очевидно, существует широкий спектр механизмов, с помощью которых таурин выполняет свою цитопротекторную роль, но молекулярная идентичность таурин-селективного рецептора остается загадкой. Несколько исследований показали, что метаботропный сайт связывания GABA B опосредует действие таурина, особенно в областях мозга мышей и крыс [28 -29], а также в сетчатке млекопитающих [30]. Однако путь, связывающий рецептор ГАМК В с его физиологическим действием, еще предстоит идентифицировать, и существует высокий уровень неопределенности в отношении существования или природы таурин-специфического рецептора.
Таким образом таурин является цито протектором, который способен оказывать прямое воздействие на клетку и купировать патологические процессы, которые индуцирует FIP. Помимо всего прочего для поддержания лекарственной стабильности инъекционной формы VS-121354 и как следствие его терапевтической эффективности, необходимо обеспечить pH препарата достаточно кислой - pH 1,5 [31], в связи с чем животное, даже при подкожном введении, ощущает значительную болевую реакцию, которая приводит к местному воспалению. При этом только инъекционная форма VS-121354 способна обеспечить терапевтическую тканевую концентрацию при тяжелых формах заболевания FIP. В очаге воспаления таурин реагирует с хлорноватистой кислотой, вырабатываемой системой нейтрофилов миелопероксидаза (МПО) - галогенид, и выводит токсины из нее. Эта реакция приводит к образованию менее токсичного тауринхлорамина (TauCl). Оба галоамина, TauCl и тауринбромамин (TauBr), продукт реакции таурина с бромистоводородной кислотой (HOBr), обладают в свою очередь антимикробными и противовоспалительными свойствами [32]. Сочетанное введение VS-121354 и таурина способно в значительно степени снизить патологические процессе в месте введения, тем самым повысив его биодоступность.
Таким образом сочетанный вклад VS-121354, таурина и галоаминов таурина в патогенезе воспалительного процесса, способно оказать не только противовирусное воздействие на вирус FECV, который вызывает клиническое развитие FIP, но и стимулировать клеточный иммунитет и купировать тканевые патологии, за счет противоокислительного и противовоспалительного действия. Также комплексное воздействие препаратов способно оптимизировать биодоступность, за счет возможности использования инъекционной формы препарата, так как оральная форма препарата при значительных воспалительных изменения желудочно-кишечного тракта является мало эффективной [33].
В связи со всем выше изложенным считаем, что сочетанное влияние VS-121354 и таурина, в одном препарате, способно в значительной мере повысить терапевтическую эффективность при лечении вирусного перитонита кошек - FIP, за счет противовирусных свойств VS-121354 и противовоспалительных и антиоксидантных свойств таурина. А также, таурин способен повысить биодоступность VS-121354, благодаря профилактике побочных явления от инъекционной формы VS-121354.
Сущность изобретения
В настоящем изобретении раскрыта фармацевтическая композиция для противовирусной терапии инфекционного перитонита кошек, содержащая в качестве активных ингредиентов (2R,3R,4S,5R)-2-(4-Аминопиролло[2,1-f][1,2,4]триазин-7-ил)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-карбонитрил (VS-121354) и таурин в эффективном количестве.
В одном из вариантов реализации фармацевтическая композиция содержит в себе соединение формулы (I) и таурин.
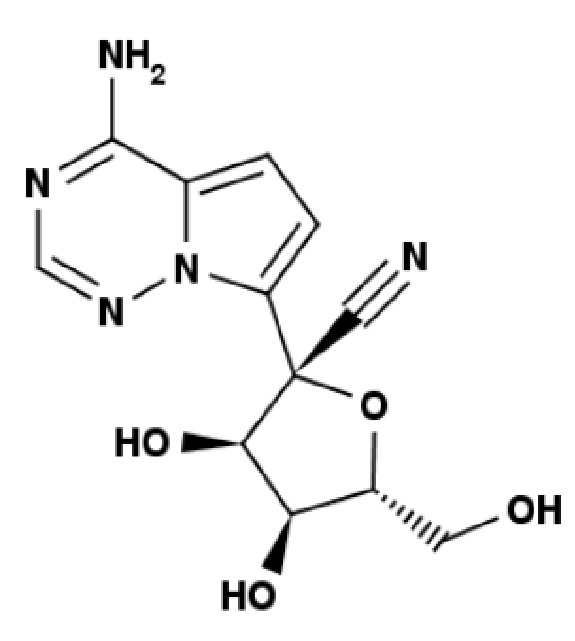
формула (I)
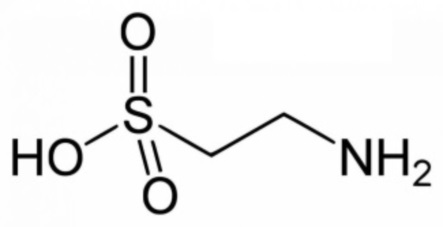 таурин.
таурин.
В одном из вариантов реализации изобретения фармацевтическая композиция содержит один или более чем один фармацевтически приемлемый эксципиент, где фармацевтически приемлемый эксципиент может быть выбран из этанола, пропиленгликоля, полиэтиленгликоля (PEG 400) и т.д.
В некоторых вариантах реализации фармацевтическая композиция представляет собой раствор для инъекций. В некоторых вариантах реализации раствор для инъекций представляет собой раствор для подкожного, внутримышечного или внутривенного введения.
В некоторых вариантах реализации фармацевтическая композиция выполнена в форме для перорального введения, в более предпочтительном варианте в форме таблетки.
В некоторых вариантах осуществления фармацевтическая композиция содержит в себе VS-121354 в количестве от 5 до 20 мг/мл, в более предпочтительном варианте от 5 до 15 мг/мл, в более предпочтительном варианте от 10 до 15 мг/мл.
В некоторых вариантах осуществления фармацевтическая композиция содержит таурин в количестве от 30 до 70 мг/мл, в более предпочтительном варианте от 40 до 60 мг/мл, в более предпочтительном варианте 50 мг/мл.
В некоторых вариантах осуществления фармацевтическая композиция имеет рН примерно от 1,5 до 1,9 за счет добавления соляной кислоты (HCl).
В некоторых вариантах осуществления изобретение относится к способу противовирусной терапии инфекционного перитонита кошек (FIP), включающий введение фармацевтической композиции, содержащей (2R,3R,4S,5R)-2-(4-Аминопиролло[2,1-f][1,2,4]триазин-7-ил)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-карбонитрил (VS-121354) и таурин в эффективном количестве.
В некоторых вариантах осуществления изобретение относится к способу противовирусной терапии инфекционного перитонита кошек влажной или выпотной формы.
В некоторых вариантах осуществления изобретение относится к способу противовирусной терапии инфекционного перитонита кошек сухой или невыпотной формы.
В некоторых вариантах осуществления изобретение относится к применению фармацевтической композиции в способе противовирусной терапии инфекционного перитонита кошек.
В некоторых вариантах осуществления изобретение относится к применению фармацевтической композиции в способе противовирусной терапии инфекционного перитонита кошек влажной или выпотной формы.
В некоторых вариантах осуществления изобретение относится к применению фармацевтической композиции в способе противовирусной терапии инфекционного перитонита кошек сухой или невыпотной формы.
Примеры
Исследование противовирусной активности.
Кошек лечили перорально в течение 70 дней (с 0 по 69 день). Дозировка соединения была выбрана на основе описанных исследований с VS-121354 и корректировалась в зависимости от возникающих побочных эффектов. Кошек лечили перорально, а также введением подкожно, внутримышечно или внутривенно, путем введения композиции, содержащей от 5 до 10 мг/мл VS-121354 и от 50 до 70 мг/мл таурина каждые 24 часа, если у них не было неврологических и/или глазных признаков, и от 10 до 20 мг/мл VS-121354 и от 30 до 50 мг/мл таурина перорально каждые 24 часа, если у них были неврологические и/или глазные признаки. Дозировку ежедневно корректировали до определенного веса, и таблетки всегда вводили в одно и то же время натощак. Через полчаса после приема таблетки кошкам давали корм.
ОТ-ПЦР для выявления мутаций гена S
грудной выпот
Все кошки были госпитализированы в течение первых 8 дней (с 0 по 7 день). В течение этого времени кошки находились под интенсивным наблюдением и медицинским уходом со стороны сертифицированных специалистов по внутренним болезням и интенсивной терапии в течение 24 часов в сутки, и все диагностические процедуры, поддерживающие меры и симптоматическое лечение применялись по мере необходимости. В день 0, перед введением фармацевтической композиции, у каждой кошки были получены анамнез и полное обследование, а также гематологические и клинические биохимические параметры. Некоторые параметры оценивали в течение первых 8 дней и в нескольких временных точках в течение оставшейся части периода лечения (Таблица 2). Обследование включало измерение массы тела, УЗИ брюшной полости, гематологию и клиническую химию (включая симметричный диметиларгинин (SDMA) и сывороточный амилоид A (SAA)), а также измерение вирусной нагрузки крови (день 0, 2, 4, 7, 14, 28, 69), вирусной нагрузки выпота (в случае выпота, доступного для дренажа) и сывороточных антител к FCoV (день 0, 7, 14, 28, 69). Пока у кошек были излияния в брюшной или грудной отделах, ежедневно выполнялись УЗИ брюшной или грудной полости и, если возможно, абдоминальный или торакоцентез, соответственно, и сохранялась жидкость для определения вирусной нагрузки.
Для оценки общего состояния и благополучия кошек использовалась шкала Карновского, модифицированная для кошек Хартманном и Куффером (1998), с использованием классификации от 0% (мертвые) до 50% (нормальное состояние здоровья). Гематологию проводили с использованием автоматического анализатора (Cell-Dyn 3500, Abott Laboratories, IL, США). Кроме того, вручную выполняли дифференциальный анализ крови на мазках крови, подвергнутых окрашиванию Haema Quick Staining / Diff-Quick, если гематологические параметры были отклонены от нормы. Параметры биохимии сыворотки измеряли с помощью автоматического анализатора (Hitachi 911, Roche, Grenzach-Wyhlen, Германия), SDMA анализировали в IDEXX Diavet AG (Bäch, Швейцария) с помощью высокопроизводительного иммуноанализа, а SAA определяли с помощью турбидиметрического анализатора агглютинации латекса. реакция иммуноанализа (LZ Test SAA, Eiken Chemical Co., Ltd., Токио, Япония) на клиническом химическом анализаторе cobas® c 501 (Roche Diagnostics AG, Роткройц, Швейцария). Кошек выписывали на 7 день (если клиническое состояние не требовало длительного стационарного лечения), и владельцы продолжали ежедневное введение исследуемого препарата. В период лечения кошек не допускали на улицу.
РНК-нагрузка коронавируса кошек определялась в течение нескольких дней в образцах крови и выпота (пока они присутствовали). Образцы хранили при -80°C и вместе анализировали с помощью RT-количественной ПЦР (RT-qPCR). Суммарные вирусные нуклеиновые кислоты (TNA) экстрагировали из 200 мкл выпота или 100 мкл цельной крови с антикоагулянтом этилендиаминтетрауксусной кислоты (EDTA) с использованием MagNa Pure 96 (Roche Diagnostics AG, Rotkreuz, Швейцария) и набора MagNA Pure 96 DNA и Viral NA SV Kit. (Roche Diagnostics AG, Риш-Роткройц, Швейцария) в соответствии с инструкциями производителя с объемом элюирования 100 мкл. Для всех образцов был применен протокол внешнего лизиса вирусной нуклеиновой кислоты (NA) в плазме SV 4.0. Для каждой партии экстрактов отрицательный контроль запускался параллельно для проверки перекрестного загрязнения.
Антитела против FCoV измеряли в дни 0, 14, 28, 69. Образцы сыворотки хранили при -80◦C и анализировали с помощью непрямого иммунофлуоресцентного анализа (IFA). Вкратце, образцы кошек были протестированы при разведении 1:25, 1:100, 1:400, 1:1600 и 1:6400. Вторичное антитело, конъюгированное с флуоресцеинизотиоцианатом (FITC) (кроличий анти-кошачий IgG (H + L) (Nordic-MUbio, Sustern, Нидерланды; LuBio Sience GmBH, Люцерн, Швейцария), разводили в соотношении 1:40. Слайды готовили с использованием клеток почек свиньи (Клетки PD-5), инфицированных вирусом трансмиссивного гастроэнтерита (TGEV, штамм Purdue). Препараты антигена тестировали на отсутствие контаминирующих вирусов методами ОТ-КПЦР и КПЦР. Положительный контроль (аликвотный образец сыворотки Полевая кошка, положительная по FCoV-антителам) и отрицательный контроль (аликвоты сыворотки от кошки, отрицательной по FCoV-антителам, не содержащей специфических патогенов), были проанализированы с каждым предметным стеклом.
Все 15 кошек полностью выздоровели клинически в течение 70 дней лечения. Рецидива не произошло, на момент через 99 дней после того, как последняя кошка закончила курс лечения, все кошки были живы.
Литература
[1] Pedersen N. C. A review of feline infectious peritonitis virus infection: 1963-2008. J Feline Med Surg., 2009, vol. 11(4), p. 225-258. doi:10.1016/j.jfms.2008.09.008
[2] Stipanuk M. H. Metabolism of sulfur-containing amino acids. Annu Rev Nutr. 1986, vol. 6, p. 179-209. doi: 10.1146/annurev.nu.06.070186.001143.
[3] Klein D. C., Wheler G. H., Weller J. L. Taurine in the pineal gland. Prog Clin Biol Res. 1983, vol. 125, p. 169-81; Omura Y., Hach A., Furukawa E., Ueck M., Lake N. Immunocytochemical localization of taurine in the pineal organ and retina of an anadromous fish, Plecoglossus altivelis. Arch Histol Cytol. 1997, vol. 60, p. 153-62
[4] Agrawal H. C., Davison A. N., Kaczmarek L. K. Subcellular distribution of taurine and cysteinsulphinate decarboxylase in developing rat brain. Biochem J. 1971, vol. 122, p. 759-63
[5] Junyent F., De Lemos L., Utrera J., Paco S., Aguado F., Camins A., Pallàs M., Romero R., Auladell C.. Content and traffic of taurine in hippocampal reactive astrocytes. Hippocampus. 2011, vol. 21, p. 185-97
[6] Fordahl S. C., Anderson J. G., Cooney P. T., Weaver T. L., Colyer C. L., Erikson K. M. Manganese exposure inhibits the clearance of extracellular GABA and influences taurine homeostasis in the striatum of developing rats. Neurotoxicology. 2010, vol. 31, p. 639-46
[7] Chan-Palay V., Lin C.-T., Palay S., Yamamoto M., Wu J.-Y. Taurine in the mammalian cerebellum: demonstration by autoradiography with [3H]taurine and immunocyto- chemistry with antibodies against the taurine- synthesizing enzyme, cysteine-sulfinic acid decarboxylase. Proc Natl Acad Sci USA. 1982, vol. 79, p. 2695-9.
[8] Taranukhin A. G., Taranukhina E. Y., Saransaari P., Podkletnova I. M., Pelto-Huikko M., Oja S. S. Neuroprotection by taurine in ethanol-induced apoptosis in the developing cerebellum. J Biomed Sci. 2010, vol. 24; Suppl 1:S12, 11 p. 27 , 28
[9] Zulli A. Taurine in cardiovascular disease. Curr Opin Clin Nutr Metab Care. 2011, vol. 14, p. 57-60.
[10] Yamori Y., Taguchi T., Hamada A., Kunimasa K., Mori H., Mori M. Taurine in health and diseases: consistent evidence from experimental and epidemiological studies. J Biomed Sci. 2010, 17 (Suppl 1): S6.
[11] Amoreaux W. J., Cuttitta C., Santora A., Blaize J. F., Tachjadi J., El Idrissi A. Taurine regulates insulin release from pancreatic beta cell lines. J Biomed Sci. 2010, 17 (Suppl 1): S11
[12] Schmidt S. Y., Berson E. L., Hayes K. C. Retinal degeneration in cats fed casein. I. Taurine deficiency. Invest Ophthalmol. 1976, vol. 15, p. 47-52.
[13] Ripps H., Shen W. Review: taurine: a "very essential" amino acid. Mol Vis. 2012, vol. 18, p. 2673-2686.
[14] Trachtman H., Futterweit S., Maesaka J., Ma C., Valderrama E., Fuchs A., Tarectecan A. A., Rao P. S., Sturman J. A., Boles T. H. Taurine ameliorates chronic streptozotocin-induced diabetic neuropathy in rats. Am J Physiol. 1995, vol. 269, F429-38.
[15] De la Puerta C., Arrieta F. J., Balsa J. A., Botella-Carretero J. I., Zamarrón I., Vázquez C. Taurine and glucose metabolism. Nutr Hosp. 2010, vol. 25, p. 910-9.
[16] De la Puerta C., Arrieta F. J., Balsa J. A., Botella-Carretero J. I., Zamarrón I., Vázquez C. Taurine and glucose metabolism. Nutr Hosp. 2010 vol. 25 p. 910-9.
[17] Wu Q. D., Wang J. H., Fennessy F., Redmond H. P. Bouchier-Hayes. Taurine prevents high glucose-induced human vascular endothelial cell apoptosis. Am J Physiol. 1999, vol. 277, p. C1299-1238.
[18] Nandhini A. T.. Thirunavukkarasu, Anuradha CV. Taurine modifies insulin signaling enzymes in the fructose-fed insulin resistant rats. Diabetes Metab. 2005, vol. 31, p. 337-44.
[19] Schmetterer L, Findl O, Fasching P, Ferber W, Strenn K, Breiteneder H, Adam H, Eichler HG, Wolzt M. Nitric oxide and ocular blood flow in patients with IDDM. Diabetes. 1997, vol. 46, p. 653-8.
[20] Bridges CC, Ola MS, Prasad PD, El-Sherbeny A, Ganapathy V, Smith SB. Regulation of taurine transporter expression by NO in cultured human retinal pigment epithelial cells. Am J Physiol Cell Physiol. 2001, vol. 281, p. C1825-36
[21] Chesney RW, Han X, Patters AB. Taurine and the renal system. J Biomed Sci. 2010, vol. 17 (Suppl 1): S4.
[22] Trachtman H, Futterweit S, Maesaka J, Ma C, Valderrama E, Fuchs A, Tarectecan AA, Rao PS, Sturman JA, Boles TH. Taurine ameliorates chronic streptozotocin-induced diabetic neuropathy in rats. Am J Physiol. 1995, vol. 269, p. F429-38.
[23] Kulakowski EC, Maturo J. Hypoglycemic properties of taurine: not mediated by enhanced insulin release. Biochem Pharmacol. 1984, vol. 33, p. 2835-8.
[24] Pedersen N.C. Feline infectious peritonitis. Something old, something new. Feline Pract. 1976, vol. 6, p. 42-51.
[25] Foley J. E., Poland A., Carlson J., Pedersen N. C. Risk factors for feline infectious peritonitis among cats in multiple-cat environments with endemic feline enteric coronavirus. J Am Vet Med Assoc. 1997, vol. 210, p. 1313-1318.
Изобретение относится к области ветеринарии, в частности к лечению инфекционных заболеваний кошек. Предложена фармацевтическая композиция для противовирусной терапии инфекционного перитонита кошек (FIP), которая включает (2R,3R,4S,5R)-2-(4-аминопирроло[2,1-f][1,2,4]триазин-7-ил)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-карбонитрил и таурин в качестве активных ингредиентов. Изобретение расширяет арсенал противовирусных средств для лечения инфекционного перитонита кошек. 3 н. и 6 з.п. ф-лы, 3 табл., 15 пр.
1. Фармацевтическая композиция для противовирусной терапии инфекционного перитонита кошек (FIP), где композиция содержит вещество формулы (I) в эффективном количестве
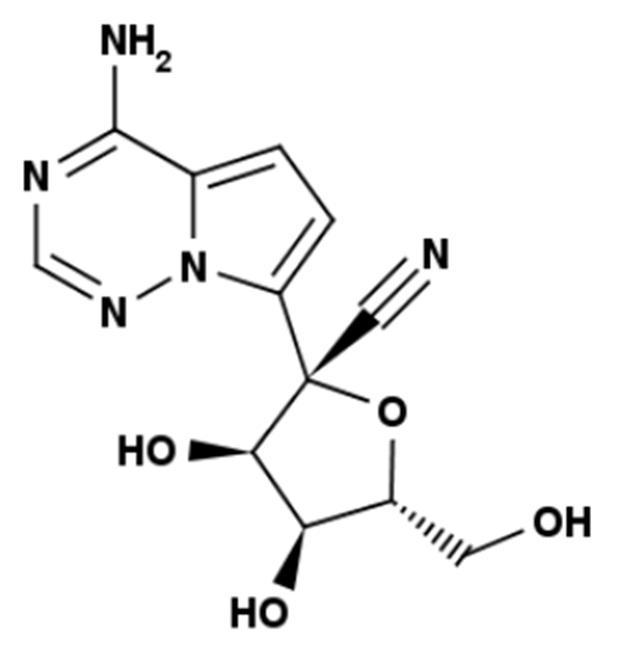
формула (I)
и 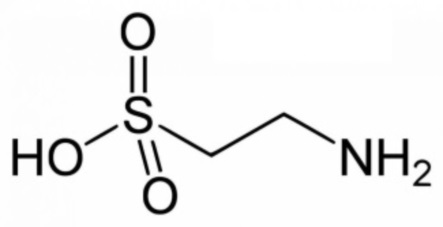 таурин.
таурин.
2. Композиция по п. 1, содержащая
(2R, 3R, 4S, 5R)-2-(4-аминопирроло[2,1-f][1,2,4]триазин-7-ил) -3,4-дигидрокси-5-(гидроксиметил)оксолан-2-карбонитрил.
3. Композиция по п. 1 или 2, содержащая один или более чем один фармацевтически приемлемый эксципиент.
4. Композиция по пп. 1-3 в виде раствора для инъекций.
5. Композиция по п. 4 для подкожного, внутримышечного или внутривенного введения.
6. Композиция по пп. 1-3 для перорального введения.
7. Композиция по п. 6 в виде таблетки.
8. Способ противовирусной терапии инфекционного перитонита кошек, включающий введение фармацевтической композиции по пп. 1-7.
9. Применение композиции по пп. 1-7 в способе противовирусной терапии инфекционного перитонита кошек.
| Daniela Krentz et al., "Curing Cats with Feline Infectious Peritonitis with an Oral Multi-Component Drug Containing GS-441524", 2021, Viruses, Vol | |||
| Насос | 1917 |
|
SU13A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| US 2006052438 A1, 09.03.2006 | |||
| WO 2018169946 A1, 20.09.2018 | |||
| CN 111961057 A, 20.11.2020 | |||
| CN 111135184 A, 12.05.2020 | |||
| CN 110215456 А, 10.09.2019 | |||
| Murphy B.G | |||
| et al., "The nucleoside analog | |||
Авторы
Даты
2022-09-19—Публикация
2021-12-24—Подача