Область изобретения
Группа изобретений относится к биотехнологии и иммунологии, а именно к иммуногенным генетическим конструкциям, направленным на стимулирование иммунного ответа против коронавируса кошек FCoV.
Описание предшествующего уровня техники
Коронавирус кошек (FCoV) - это сложный РНК-содержащий вирус, входящий в семейство Coronaviridae. Вирус по структуре состоит из нуклеокапсида, содержащего вирусный геном, и внешней оболочки. Эти два элемента стабилизируют и защищают РНК-геном [Masters P.S., Perlman S. Coronaviridae. In: Knipe, D.M., Howley, P.M. (Eds.), Fields Virology, 6th ed. Lippincot Williams & Wilkins, Philadelphia, PA, pp.825-858, 2013]. Геном FCoV кодирует четыре основных структурных белка: поверхностный белок шипа (S), белок нуклеокапсида (N), белок оболочки (Е) и мембранный белок (М); и семь неструктурных белков: два белка репликазы (1а и 1b) и пять вспомогательных белков (3а, 3b, 3c, 7а и 7b) [de Barros B.D.C.V., Castro C.M.O.D., Pereira D., et al. First complete genome sequence of a feline Alphacoronavirus 1 strain from Brazil. Microbiol Resour Announc. 2019; 8:e01535-18; Tekes G., Thiel H.J. Feline Coronaviruses: Pathogenesis of Feline Infectious Peritonitis. Adv Virus Res. 2016; 96:193-218].
На основании различий в структуре гена, кодирующего поверхностный белок шипа S (спайк), коронавирус кошек разделяют на два патотипа: менее летальный возбудитель коронавирусного энтерита (FECV - Feline enteritis coronavirus), который широко распространен среди диких и домашних животных, а вызванная им болезнь протекает относительно легко и может хронизироваться; и вирус инфекционного перитонита кошек (FIPV Feline infectious peritonitis virus), встречающийся реже, но способный вызывать системное летальное заболевание [Щелканов М.Ю., Попова А.Ю., Дедков В.Г. и др. История изучения и современная классификация коронавирусов (Nidovirales: Coronaviridae). Инфекция и иммунитет.2020; 10(2): 221-246].
Белок S представляет собой крупный гликопротеин (180-220 кДа), образующий пепломеры, которые выступают с поверхности вирионов и отвечают за связывание рецепторов, индукцию межклеточного слияния, слияние вирусной оболочки с клеточными мембранами-мишенями и индукцию нейтрализующих антител [Jaimes J.A., Whittaker G.R. Feline coronavirus: Insights into viral pathogenesis based on the spike protein structure and function. Virology. 2018; 517: 108-121]. В зависимости от аминокислотной последовательности данного белка и нейтрализующих антител вирус разделяют на I и II серотипы [Kipar A., Meli M.L. Feline infectious peritonitis: still an enigma? Veterinary pathology. 2014; 51(2): 505-526; Lewis C.S., Porter E., Matthews D., et al. Genotyping coronaviruses associated with feline infectious peritonitis. Journal of General Virology. 2015; 96:1358-1368]. Серотип I является первоначальным и преобладающим типом с S-белком, произошедшим из FCoV. Штаммы из этого серотипа распространены шире и имеют более высокую эпидемиологическую значимость [Benetka V., Kubber-Heiss A., Kolodziejek J., et al. Prevalence of feline coronavirus types I and II in cats with histopathologically verified feline infectious peritonitis. Vet Microbiol. 2004; 99(1): 31-42; Pedersen N.C. A review of feline infectious peritonitis virus infection: 1963-2008. Journal of Feline Medicine & Surgery. 2009; 11(4): 225-258]. Вирусы серотипа II встречаются реже, и в отличие от вирусов серотипа I, их геном сформирован рекомбинацией между по меньшей мере двумя различными вирусами, что подтверждается экспериментами in vitro и in vivo [Herrewegh A.A.P.M., Smeenk I., Horzinek M.C., et al. Feline Coronavirus Type II Strains 79-1683 and 79-1146 Originate from a Double Recombination between Feline Coronavirus Type I and Canine Coronavirus. Journal of Virology. 1998; 72(5): 4508-4514]. Серотип I распространен преимущественно в Европе и Северной Америке, а серотип II чаще встречается в азиатских и африканских странах. Также имеются данные о коинфекциях FCoV I и II [An D. J., Jeoung H.Y., Jeong W., et al. Prevalence of Korean cats with natural feline coronavirus infections. Virol J. 2011; 8: 455]. Оба серотипа FCoV могут встречаться в двух антигенно и морфологически неразличимых патотипах: FECV и FIPV [Shiba N., Maeda K., Kato Н., et al. Differentiation of feline coronavirus type I and II infections by virus neutralization test. Veterinary Microbiology. 2007; 124(3-4): 348-352]. Белок S является основным регулятором инфекционного процесса FCoV в клетке-хозяине и определяет вирулентность FCoV: мутации данного белка (вместе с мутациями ORF неструктурных белков) определяют переход FECV в FIPV [Jaimes J.А., Whittaker G.R. Feline coronavirus: Insights into viral pathogenesis based on the spike protein structure and function. Virology. 2018; 517: 108-121].
Заболеванию FCoV подвержены популяции домашних и диких кошек по всему миру. Серопозитивность к FCoV составляет 20-60% среди домашних кошек и до 90% в домохозяйствах с несколькими кошками или приютах [Гильмутдинов Р.Я., Малев А.В. Коронавирусные инфекции диких животных кошачьи (Felidae). Актуальные вопросы зоологии, экологии и охраны природы. 2021; 3: 36-41; Пальцева Е.Д., Плешакова В.И. Коронавирусы в популяции домашних кошек. Вестник Омского ГАУ. 2022; 1(45): 94-101]. Пути передачи FCoV могут быть как вертикальные (трансплацентарный путь), так и горизонтальные (фекально-оральный путь). Сезонность не регистрируется. Источником возбудителя инфекции являются больные, переболевшие животные и вирусоносители, у которых выделение вируса происходит с фекалиями и слюной. Котята чаще всего заражаются через молозиво или фекалии. Молодых и возрастных животных болезнь поражает чаще [Пальцева Е.Д., Плешакова В.И. Коронавирусы в популяции домашних кошек. Вестник Омского ГАУ. 2022; 1(45): 94-101].
Коронавирусный энтерит кошек - это заболевание, вызванное патотипом FECV. Он имеет низкую патогенность и не угрожает жизни животного. Клиническим признаком заболевания является диарея, но инфекция также может протекать и бессимптомно [Pedersen N.C. A review of feline infectious peritonitis virus infection: 1963-2008. Journal of Feline Medicine & Surgery. 2009; 11(4): 225-258].
Однако в 8-10% случаев низкопатогенный FECV мутирует в FIPV, вызывая вирусный инфекционный перитонит кошек, смертность при котором составляет до 90% [Pedersen N.C. A review of feline infectious peritonitis virus infection: 1963-2008. Journal of Feline Medicine & Surgery. 2009; 11(4): 225-258].
Инфекционный перитонит кошек (FIP), вместе с геморрагическими лихорадками Денге и Эбола, инфекционной анемией лошадей, инфекцией дыхательных путей RSV и некоторыми другими болезнями человека и животных, относится к заболеваниям, для которых характерно антителозависимое усиление инфекции (antibody-dependent enhancement, ADE) [Миронов А.А., Супотницкий М.В., Лебединская Е.В. Феномен антитело-зависимого усиления инфекции у вакцинированных и переболевших. Биопрепараты. 2013; 3:1225].
ADE возникает, когда антитела, образующиеся во время иммунного ответа, распознают и связываются с патогеном, но не могут предотвратить инфекцию. Вместо этого антитела действуют как «троянский конь», позволяя возбудителю проникнуть в клетки (моноциты и макрофаги). В составе данных клеток вирус быстро распространяется в мезентериальные лимфатические узлы и по организму. Высокая степень виремии приводит к отложению иммунных комплексов и макрофагов, содержащих вирусные частицы, вокруг небольших венул, вызывая иммуноопосредованный васкулит и фокальное гранулематозное поражение всех органов [Cloutier М., Nandi М., flisan A.U., et al. ADE and hyperinflanimation in SARS-CoV2 infection-comparison with dengue hemorrhagic fever and feline infectious peritonitis. Cytokine. 2020; 136:155256]. Это приводит к таким осложнениям FIP как почечная недостаточность, сопровождающиеся неврологической симптоматикой повреждения головного и спинного мозга, паренхиматозная желтуха и токсическая дистрофия печени, интерстициальная пневмония, ателектаз и эмфизема легких, общая интоксикация организма, стойкая лихорадка и смерть [Куликов Е.В., Ватников Ю.А., Сахно Н.В. и др. Патологоанатомическая характеристика вирусного перитонита кошек. Российский журнал сельскохозяйственных и социально-экономических наук. 2017; 64(4): 270-280.].
Современных исследований, посвященных разработке идеальной и эффективной вакцины против коронавируса кошек, практически не ведется, в связи с длительным изучением классических подходов по разработке вакцин, которые или не оказывали защитного действия или наоборот вызывали усиление инфекции [Pedersen N.C. Animal virus infections that defy vaccination: equine infectious anemia, caprine arthritis-encephalitis, maedi-visna, and feline infectious peritonitis. Adv. Vet. Sci. Сотр. Med. 1989; 3:413-428]. Вакцинация близкородственными гетерологичными живыми штаммами CoV вообще не обеспечивала защиты [Barlough J.E., Johnson-Lussenburg СМ., Stoddart С.A., et al. Experimental inoculation of cats with human coronavirus 229E and subsequent challenge with feline infectious peritonitis virus. Can. J. Сотр. Med. 1985; 49: 303-307]. Подобно инактивированным и рекомбинантным субъединичным вакцинам против FCoV [Напета B.J., Rottier P.J.M., de Groot R.J. Coronaviruses. Caister Academic Press; UK: Norfolk. Caister Academic Press: 2007. Feline coronaviruses: a tale of two-faced types], иммунизация FECV, низковирулентным FIPV или сублетальными количествами вирулентного FIPV вызывала лишь частичную защиту [Pedersen N.C, Black J.W. Attempted immunization of cats against feline infectious peritonitis, using avirulent live virus or sublethal amounts of virulent virus. Am. J. Vet. Res. 1983; 44: 229-234; Pedersen N.C, Floyd K. Experimental studies with three new strains of feline infectious peritonitis virus: FIPV-UCD2 FIPV-UCD3, and FIPV-UCD4. Compend. Contin. Educ. Pract. Vet. 1985; 7:1001-1011], что часто приводило к ADE и так называемому синдрому ранней смерти. Наиболее многообещающие результаты были получены с рекомбинантными мутантами FIPV, лишенными областей ORF3abc или ORF7ab, которые обеспечивали 100% и 80% защиту после летального гомологичного заражения [Haijema В.J., Volders Н., Rottier P.J. Live, attenuated coronavirus vaccines through the directed deletion of group-specific genes provide protection against feline infectious peritonitis. J. Virol. 2004; 78: 3863-3871], соответственно. Однако никаких последующих исследований с использованием этих вакцин-кандидатов опубликовано не было.
Единственная зарегистрированная вакцина для профилактической иммунизации здоровых кошек против вирусного перитонита Vanguard® Feline FIP Intranasal производства компании Zoetis (ранее Pfizer Animal Health, США), известная также под названиями Примуцел FIP® и FELOCELL FIP, не рекомендована к использованию многими ветеринарными организациями, такими как «Американская ассоциация практикующих врачей-фелинологов» [Scherk М.А., Ford R.B., Gaskell R.M., et al. 2013 AAFP feline vaccination advisory panel report. Journal of feline medicine and surgery. 2013; 15(9): 785-808], и может вызывать ADE эффект. В состав вакцины Vanguard® Feline FIP Intranasal входит аттенуированный штамм вируса перитонита кошек DF2-FIPV. Поскольку известно, что стимулирование системного ответа IgG только усугубляет течение FIP, не давая должной защиты [Cloutier М., Nandi М., Ihsan A.U., et al. ADE and hyperinflammation in SARS-CoV2 infection-comparison with dengue hemorrhagic fever and feline infectious peritonitis. Cytokine. 2020; 136: 155256], была принята альтернативная стратегия местной вакцинации. Вакцина Vanguard® Feline FIP Intranasal вводится интраназально для стимуляции ответа с иммуноглобулинами IgA, предотвращающими вирусную инвазию в ротоглотке и при этом не вызывающими интенсификацию патологического процесса [Tizard I.R. Vaccination against coronaviruses in domestic animals. Vaccine. 2020; 38(33):5123-5130]. Согласно инструкциям по применению, препарат можно использовать только для вакцинации животных, достигших 16-недельного возраста. В высокоэндемичных ситуациях, когда котята заражаются FCoV в раннем возрасте или внутриутробно, такой режим применения вакцины является неэффективным. Кроме того, фактически интраназальная вакцинация повышает как локальные титры антител IgA, так и титры IgG к S-белку FCoV в сыворотке крови. По данным исследования Fred W. Scott у 48 из 49 кошек, вакцинированных интраназально вакциной Примуцел FIP®, в сыворотке крови обнаруживалось увеличение титра IgG [Scott F.W. Evaluation of risks and benefits associated with vaccination against coronavirus infections in cats. Advances in Veterinary Medicine. 1999; 41: 347]. Это также может приводить к ADE у вакцинированных животных и является лимитирующим фактором использования интраназальных вакцин.
На сегодня FIP является высоколетальным и повсеместно распространенным заболеванием кошек, для которого не разработаны эффективные вакцины и не существует лечения, одобренного контролирующими организациями ведущих стран. Это приводит к незаконному распространению на «черном рынке» экспериментальных образцов лекарств, не прошедших полномасштабные доклинические и клинические исследования [https://abc7.com/cats-covid-coronavirus-cure/6253361/, дата обращения 22.07.2023].
Различные данные свидетельствуют о том, что для придания долговременного иммунитета против FCoV необходим надежный опосредованный Т-клетками иммунитет. Животные, пережившие острую инфекцию, имели устойчивые Т-клеточные реакции на более поздних стадиях инфекции. Кроме того, выжившие особи были устойчивы к последующему заражению патогенным вирусом FCoV [Mustaffa-Kamal F., Liu FL, Pedersen N.C, Sparger E.E. Characterization of antiviral T cell responses during primary and secondary challenge of laboratory cats with feline infectious peritonitis virus (FIPV). BMC Vet Res. 2019; 15 (1): 165]. При FIP происходит ингибирование Т-клеточно-опосредованных процессов, чего не происходит у FCoV серопозитивных кошек, не болеющих FIP [Malbon A. J., Russo G., Burgener С, et al. The Effect of Natural Feline Coronavirus Infection on the Host Immune Response: A Whole-Transcriptome Analysis of the Mesenteric Lymph Nodes in Cats with and without Feline Infectious Peritonitis. Pathogens. 2020; 9(7): 524]. А у когорты лабораторных кошек, устойчивых к развитию FIP, как при первичном инфицировании, так и при вторичном реинфицировании вирусом наблюдались схожие вирус-специфические Т-клеточные иммунологические корреляты протективности, возможно, обеспечивающие долговременную защиту от вируса [Mustaffa-Kamal F., Liu Н., Pedersen N.C. et al. Characterization of antiviral T cell responses during primary and secondary challenge of laboratory cats with feline infectious peritonitis virus (FIPV). BMC Vet Res. 2019; 15: 165].
Так в работах до 2003 года упоминается исследование N-белка коронавируса кошек как антигена в составе вирусных векторов (оспа вирус - Vennema Н., de Groot R.J., Harbour D. A. et al. Primary structure of the membrane and nucleocapsid protein genes of feline infectious peritonitis virus and immunogenicity of recombinant vaccinia viruses in kittens. Virology. 1991; 181: 327-335; вирус оспы енотов - Wasmoen T.L., KadakiaN.P., Unfer R.C. et al. Protection of cats from infectious peritonitis by vaccination with a recombinant raccoon poxvirus expressing the nucleocapsid gene of feline infectious peritonitis virus. Adv. Exp.Med. Biol. 1995; 280: 221-228; плазмидного вектора - Glansbeek H.L., Haagmans B.L., te Lintelo E.G. et al. Adverse effects of feline IL-12 during DNA vaccination against feline infectious peritonitis virus. J. Gen. Virol. 2002; 83: 1-10; или клеточного лизата, содержащего экспрессированный бакуловирусом белок - Hohdatsu Т., Yamato Н., Ohkawa Т. et al. Vaccine efficacy of a cell lysate with recombinant baculovirus-expressed feline infectious peritonitis (FIP) virus nucleocapsid protein against progression of FIP. Vet Microbiol. 2003 Dec 2; 97(1): 31-44; заявка на патент US 20120107390 A1). Векторная вакцина, исследованная группой Vennema et al., как и ДНК-вакцина Glansbeek et al. не обладали протективным действием. Векторная вакцина Wasmoen et al. была эффективна против низкодозового заражения вирусом FIPV, однако, оценить вклад именно вакцины в данный эффект затруднительно, так как после иммунизации авторы вначале проводили инфицирование не вызывающим тяжелых последствий коронавирусом FECV, а уже после этого коронавирусом FIPV, вызывающим перитонит.Наиболее многообещающие данные были получены группой Т. Hohdatsu et al. После вакцинации лизатом клеток насекомых SF-9 (Spodoptera frugiperda), содержащим экспрессированный бакуловирусом N-белок FIPV, совместно с адъювантом (инактивированная вакцина для кошек Felidovac PCR, содержащая адъювант гидроксид алюминия), кошки получали 62,5% защиту от летального инфицирования FIPV. Достаточно низкую (62,5%), но все-таки эффективность клеточного лизата можно объяснить присутствием в его составе адъюванта на основе гидроксида алюминия, который эффективно стимулирует гуморальный иммунный ответ, но не эффективно стимулирует антигенспецифический Т-клеточный ответ, кроме этого в составе лизата параллельно вводилась вакцина Felidovac PCR, которая также стимулировала гуморальный иммунный ответ.
Таким образом, техническая задача, на решение которой направлено настоящее изобретение, состоит в создании средства для иммунизации против коронавируса кошек.
Сущность изобретения
Одной из технических проблем, на решение которой направлено настоящее изобретение, является создание иммуногена против коронавируса кошек (FCoV).
Решением проблемы может стать разработка новой эффективной стратегии вакцинации, основанной на применении профилактического препарата на основе консервативного рекомбинантного белка нуклеокапсида коронавируса кошек (N-FCoV) и специфического адъюванта, представляющего собой смесь сквалана, а-токоферола (витамина Е) и полисорбата-80, который эффективно индуцирует Т-клеточный ответ.
Техническим результатом является иммунный ответ в отношении коронавируса кошек.
Настоящая группа изобретений предлагает рекомбинантный белок нуклеокапсида коронавируса кошек, далее называемый также N-FCoV, содержащий аминокислотную последовательность SEQ ID NO:2, который может быть использован для иммунизации кошек против FCoV. Рекомбинантный белок по настоящему изобретению может дополнительно содержать 6-10 остатков гистидина, называемых гистидиновой меткой (His-tag).
Также предлагается рекомбинантная нуклеиновая кислота, кодирующая рекомбинантный белок по настоящему изобретению. Упомянутая нуклеиновая кислота в одном из вариантов осуществления изобретения содержит последовательность нуклеотидов SEQ ID NO:l длиной 1128 п. н.
Упомянутая нуклеиновая кислота может быть включена в состав любого из плазмидных экспрессионных векторов семейства рЕТ или аналогичных. Указанные плазмидные экспрессионные векторы используются для трансформации штаммов клеток Escherichia coli с целью экспрессии рекомбинантного белка N-FCoV.
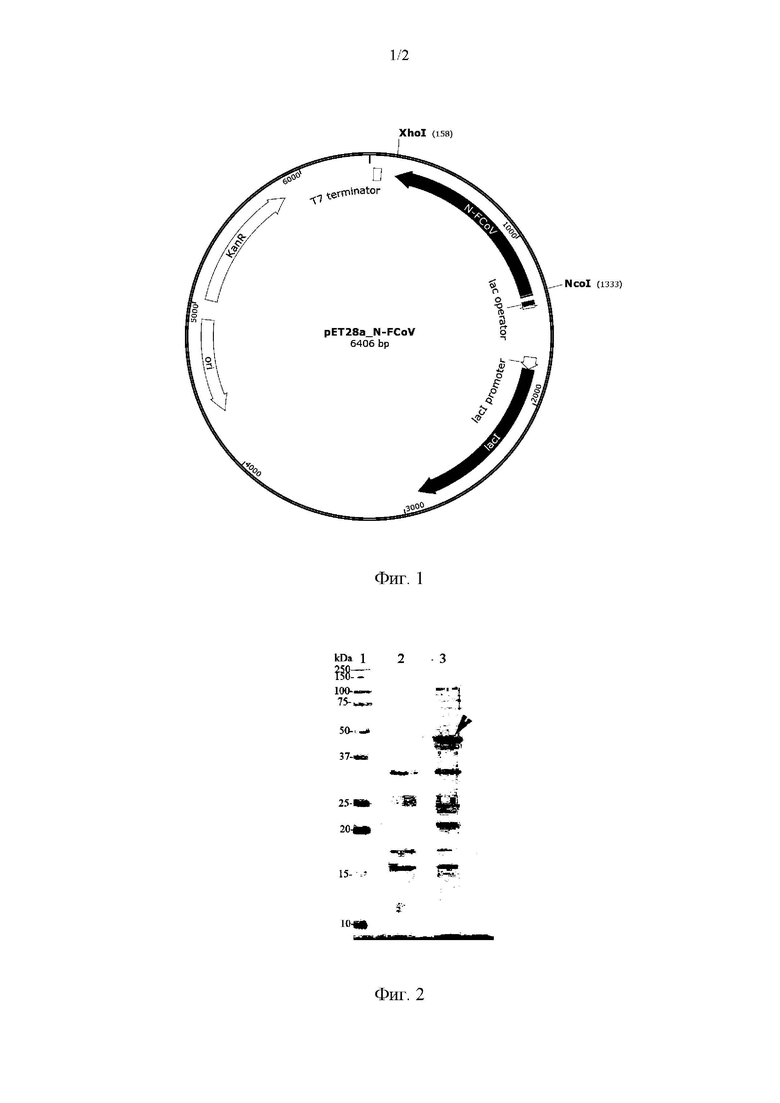
Также, в группе изобретений предлагается рекомбинантный плазмидный экспрессионный вектор pET-28a(+)-N-FCoV, предназначенный для получения рекомбинантного штамма Escherichia coli - продуцента рекомбинантного белка N-FCoV. Упомянутый рекомбинантный плазмидный экспрессионный вектор размером 6406 п. н., согласно карте, представленной на Фиг. 1, содержит:
KanR - ген устойчивости к канамицину, обеспечивающий устойчивость трансформантов Е. coli к селективному антибиотику канамицину (координаты 5032-5847);
ori (ori, origin of replication) участок инициации репликации (координаты 4322 4910);
lad - транскрипционный репрессор lad связывается с оператором lac, чтобы ингибировать транскрипцию в Е. coli (координаты 1810 2892). Это ингибирование можно снять, добавив лактозу или изопропил-р-О-тиогалактопиранозид (ИПТГ);
lad promoter - промотор для связывания РНК-полимеразы, транскрибирующей ген lad (координаты 1732-1809);
Т7 promoter промотор РНК-полимеразы бактериофага Т7 (координаты 1405 1423);
lac operator оператор для связывания LacI (координаты 1380-1404);
RBS (ribosome binding site) - эффективный сайт связывания рибосомы из гена 10 бактериофага Т7 (координаты 1344-1349);
Т7 terminator - терминатор транскрипции РНК-полимеразы бактериофага Т7 (координаты 26-73);
NcoI/XhoI фрагмент, содержащий искусственный ген SEQ ID NO: 1, используемый для получения белка N-FCoV, кодирующий искусственный белок-иммуноген (координаты 164-1336). Нуклеотидная последовательность плазмидного экспрессионного вектора рЕТ-28a(+)-N-FCoV включает последовательность SEQ ID NO: 3.
Также группа изобретений предлагает штамм Escherichia coli - продуцент рекомбинантного белка N-FCoV, полученный трансформацией компетентных клеток. Е'. coli штамма BL21[DE3] плазмидным экспрессионный вектором по настоящему изобретению.
Также группа изобретений предлагает композицию для иммунизации против коронавируса кошек, содержащую рекомбинантный белок N-FCoV, сквалан, α-токоферол и полисорбат 80 в весовом соотношении 1: 750: 250: 50.
Также группа изобретений предлагает способ применения упомянутой композиции для профилактики коронавирус ной инфекции у кошек, заключающийся в том, что кошкам вводят композицию из расчета 25 мкг белка на кошку двукратно с интервалом в 21 день.
Изобретение иллюстрируется следующими графическими материалами:
На Фиг. 1 представлена карта плазмидного экспрессионного вектора pET-28a(+)-N-FCoV.
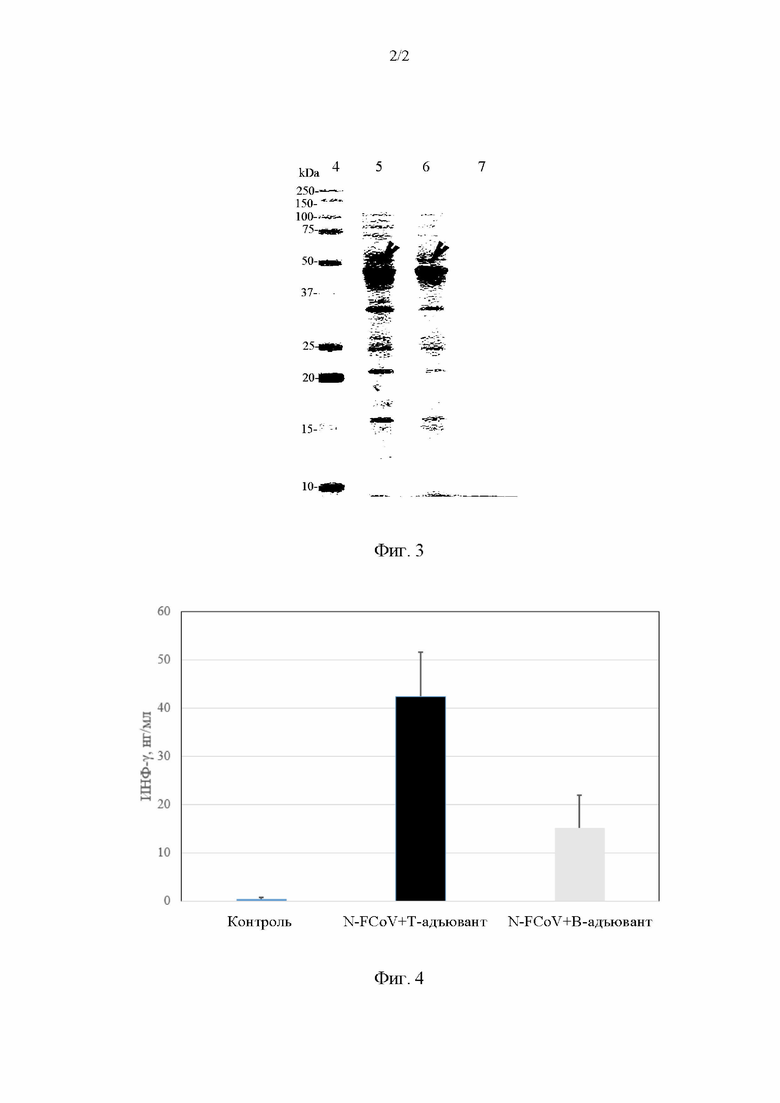
На Фиг. 2 представлена электрофореграмма лизатов клеток Е. coli, содержащих плазмидную ДНК pET-28a-N-FCoV, после индукции экспрессии и без индукции. 1 - маркер Bio-Rad Precision Plus Protein Standards; 2 - отрицательный контроль без индукции экспрессии; 3 общий лизат клеток после индукции экспрессии 1 мМ ИПТГ. Стрелкой показан целевой белок.
На Фиг. 3 представлена электрофореграмма растворимой и нерастворимой фракций лизатов клеток Е. coli, содержащих плазмидную ДНК pET-28a-N-FCoV, после индукции экспрессии и последующего разделения на фракции центрифугированием. 4 маркер Bio-Rad Precision Plus Protein Standards; 5 общий клеточный лизат без центрифугирования; 6
- растворимая фракция (супернатант после центрифугирования); 7 - нерастворимая фракция (осадок после центрифугирования). Стрелкой показан целевой белок.
На Фиг. 4 представлен результат оценки Th1-клеточного (Т-хелперы 1) иммунного ответа на стимуляцию рекомбинантным белком N-FCoV мононуклеарных клеток периферической крови (PBMCs), выделенных из иммунизированных кошек. Контроль -среда, N-FCoV+T-адъювант - N-FCoV с Т-клеточным адъювантом, N-FCoV+B-адъювант - N-FCoV с В-клеточным адъювантом.
Детальное описание изобретения
Настоящая группа изобретений предлагает рекомбинантный белок нуклеокапсида коронавируса кошек N-FCoV, содержащий аминокислотную последовательность SEQ ID NO: 2, который может быть использован для иммунизации кошек против FCoV.
Упомянутый белок N-FCo V может использоваться в качестве антигена для получения вакцины или иммуногенной композиции, предназначенной для выработки иммунитета против коронавируса кошек.
Входящий в состав вакцины рекомбинантный белок N-FCoV является консервативным и общим для обоих серотипов и патотипов коронавируса кошек, то есть создание вакцины на его основе может обеспечить наиболее полную защиту животных вне зависимости от их географического проживания, а также в условиях как моно-, так и коинфекции I и II серотипами. Рекомбинантный белок по настоящему изобретению может быть получен любым известным из уровня техники способом получения полипептидов и белков, включая, в качестве неограничивающих примеров, рекомбинантные способы, такие как синтез в клетках, трансфицированных или трансдуцированных экспрессионными векторами, кодирующими упомянутый полипептид, и другими, а также способами химического синтеза. Рекомбинантный белок по настоящему изобретению вызывает иммунный ответ, как гуморальный, так и клеточный, против коронавируса кошек, таким образом, он обеспечивает достижение технического результата изобретения.
В одном из вариантов осуществления, рекомбинантный белок по настоящему изобретению может дополнительно содержать 6 10 остатков гистидина, называемых гистидиновой меткой (His-tag). Гистидиновая метка позволяет дополнительно использовать для очистки рекомбинантного белка по настоящему изобретению аффинную хроматографию [см., например, Spriestersbach A, Kubicek J, Schafer F, et al. Purification of His-Tagged Proteins. Methods Enzymol. 2015;559:1-15. doi: 10.1016/bs.mie.2014.11.003].
Также предлагается рекомбинантная нуклеиновая кислота, кодирующая упомянутый рекомбинантный белок. Рекомбинантный белок N-FCoV по настоящему изобретению может кодироваться нуклеиновыми кислотами с различными нуклеотидными последовательностями ввиду вырожденности генетического кода в соответствии с таблицей стандартного генетического кода [см., например, Griffiths A.J.F. et al., An Introduction to Genetic Analysis. New York: W.H. Freeman; 2000]. В одном из вариантов осуществления изобретения предлагается искусственная нуклеиновая кислота, предназначенная для получения рекомбинантного белка N-FCoV. Упомянутая нуклеиновая кислота кодирует рекомбинантный белок N-FCoV и содержит последовательность нуклеотидов SEQ ID NO: 1 длиной 1128 п. н. Упомянутая нуклеиновая кислота может быть включена в состав известных из уровня техники экспрессионных векторов для получения рекомбинантного белка - РСоV, таких как плазмидные экспрессионные векторы, вирусные экспрессионные векторы и т.п.
Упомянутая нуклеиновая кислота может быть включена в состав любого из плазмидных экспрессионных векторов семейства рЕТ или аналогичных. Указанные плазмидные экспрессионные векторы используются для трансформации штаммов клеток Escherichia coli с целью экспрессии рекомбинантного белка N-FCoV.
Также, в группе изобретений предлагается рекомбинантный плазмидный экспрессионный вектор pET-28a(+)-N-FCoV, предназначенный для получения рекомбинантного штамма Escherichia coli - продуцента рекомбинантного белок N-FCoV. Упомянутый рекомбинантный плазмидный экспрессионный вектор размером 6406 п. н., согласно карте, представленной на Фиг. 1, содержит:
KanR ген устойчивости к канамицину, обеспечивающий устойчивость трансформантов Е. coli к селективному антибиотику канамицину (координаты 5032-5847);
ori (ori, origin of replication) - участок инициации репликации (координаты 4322-4910);
lad транскрипционный репрессор lad связывается с оператором lac, чтобы ингибировать транскрипцию в Е. coli (координаты 1810-2892). Это ингибирование можно снять, добавив лактозу или изопропил-р-О-тиогалактопиранозид (ИПТГ);
lad promoter промотор для связывания РНК полимеразы, транскрибирующей ген lad (координаты 1732-1809);
Т7 promoter - промотор РНК-полимеразы бактериофага Т7 (координаты 1405-1423);
lac operator - оператор для связывания LacI (координаты 1380-1404);
RBS (ribosome binding site) эффективный сайт связывания рибосомы из гена 10 бактериофага Т7 (координаты 1344 1349);
Т7 terminator - терминатор транскрипции РНК-полимеразы бактериофага Т7 (координаты 26-73);
NcoI/XhoI - фрагмент, содержащий искусственный ген SEQ ID NO: 1, кодирующий рекомбинантный белок N-FCoV (координаты 164-1336).
Нуклеотидная последовательность плазмидного экспрессионного вектора рЕТ-28a(+)-N-FCoV включает последовательность SEQ ID NO:3. Упомянутый плазмидный экспрессионный вектор по настоящему изобретению позволяет получить трансформированные клеточные линии Е. coli, синтезирующие белок N-FCoV, содержащий последовательность аминокислот SEQ ID NO:2. Таким образом, рекомбинантный белок N-FCoV по настоящему изобретению содержит аминокислотную последовательность SEQ ID NO:2 длиной 376 а.к.о. и может быть получен с помощью плазмидного экспрессионного вектора, содержащего нуклеиновую кислоту по настоящему изобретению.
Также группа изобретений предлагает штамм Escherichia coli - продуцент рекомбинантного белка N-FCoV, полученный трансформацией компетентных клеток. Е'. coli штамма BL21[DE3] плазмидным экспрессионным вектором по настоящему изобретению. Полученный штамм-продуцент демонстрирует стабильный рост в суспензионной культуре и экспрессию рекомбинантного белка по настоящему изобретению в растворимой форме.
Рекомбинантный белок N-FCoV по настоящему изобретению может быть использован для получения вакцины в отношении FCoV в виде композиции, содержащей растворитель, а также адъювант и иные вспомогательные вещества, например, стабилизаторы или консерванты, буферные растворы, или в виде лиофилизата, например, с применением лиопротектора или без него.
Также группа изобретений предлагает композицию для иммунизации против коронавируса кошек, содержащую рекомбинантный белок N-FCoV, сквалан, а-токоферол и полисорбат 80 в весовом соотношении 1: 750: 250: 50.
Сквалан, а-токоферол и полисорбат 80 представляют собой адъювант в виде эмульсии «масло в воде». Подобные адъюванты, содержащие полностью метаболизируемый липид сквалан, формирующий эмульсию, и иммуностимулятор а-токоферол (витамин Е) эффективно вызывают развитие Т-клеточного иммунного ответа на совместно вводимый антиген [Del Giudice G, Rappuoli R., Didierlaurent A.M. Correlates of adjuvanticity: A review on adjuvants in licensed vaccines. Seminars in Immunology. 2018; 39: 14-21]. Адъювантные свойства данной эмульсии обусловлены ее способностью к рекрутированию и активации антигенпрезентирующих клеток. При введении такого адъюванта происходит усиление антиген-специфического синтеза цитокинов Th1 (IFN-γ) и Th2 (IL-5 и IL-13), что обеспечивает активацию Т-клеточного иммунного ответа на вводимый антиген [Андреев Ю.Ю., Топтыгина А.П. Адъюванты и иммуномодуляторы в составе вакцин. Иммунология. 2021; 42(6): 720-729; Morel S. et al. Adjuvant System AS03 containing a-tocopherol modulates innate immune response and leads to improved adaptive immunity. Vaccine. 2011; 29(13): 2461-2473].
Также группа изобретений предлагает способ применения упомянутой композиции для профилактики коронавирус ной инфекции у кошек, заключающийся в том, что кошкам вводят композицию из расчета 25 мкг белка на кошку двукратно с интервалом в 21 день.
Далее изобретение будет проиллюстрировано примерами, которые не носят ограничительный характер.
Пример 1. Получение плазмидного экспрессионного вектора, содержащей ген белка
Из базы данных NCBI (https://www.ncbi.nlm.nih.gov/guide/al1/, дата обращения 18.07.2023) были выгружены все полноразмерные аминокислотные последовательности белка нуклеокапсида коронавируса кошек FCoV. Последовательности были выровнены в программе Geneious Prime 2023.1, после чего была определена консенсусная последовательность белка (SEQ ID NO:2). Консенсусная последовательность -искусственная последовательность белка, содержащая в каждой позиции остаток аминокислоты, наиболее часто встречающийся у нескольких гомологичных последовательностей. Она представляет собой результат множественного выравнивания последовательностей, в которых гомологичные последовательности сравниваются друг с другом. Соответственно, консенсусная последовательность рекомбинантного белка N-FCoV по настоящему изобретению обладает свойствами последовательностей, используемых при выравнивании.
Полученная консенсусная аминокислотная последовательность была использована для дизайна искусственной нуклеотидной последовательности с учетом кодонового предпочтения и предпочтения пар кодонов для Е. coli. Полученная нуклеотидная последовательность на 5'- и 3'-концах фланкировалась последовательностями для распознавания эндонуклеазами Ncol (CCATGG) и XhoI (CTCGAG), необходимыми для встраивания в плазмидную ДНК. Синтез нуклеиновой кислоты, содержащей последовательность по настоящему изобретению, и встраивание по указанным сайтам рестрикции в плазмидный экспрессионный вектор рЕТ-28а(+) проводили по стандартной методике.
Полученный плазмидный экспрессионный вектор секвенировали с помощью праймеров Т7 promotor (TAATACGACTCACTATAGGG), Т7 Terminator (GCTAGTTATTGCTCAGCGG) для подтверждения нуклеотидной последовательности, последовательность не содержала вставок, делеций и замен.
Нуклеотидная последовательность полученной ДНК соответствовала последовательности SEQ ID NO: 1.
Пример 2. Создание штамма продуцента рекомбинантного белка N-FCoV
Для получения штамма - продуцента рекомбинантного белка N-FCoV проводили трансформацию компетентных клеток Е. coli штамма BL21[DE3] методом электропорации по стандартной методике. Вектор рЕТ28а, приведенный в SEQ ID NO:3, содержит промотор для Т7 РНК полимеразы, а используемый штамм содержит в геноме ген Т7 РНК полимеразы под контролем lacUV5 промотора, что позволяет индуцировать экспрессию рекомбинантного белка с помощью ИПТГ или лактозы.
Таким образом получали штамм-продуцент Е. coli с включением нуклеиновой кислоты по настоящему изобретению.
Полученный штамм-продуцент из рабочего банка высевали на чашки Петри с селективной агаризованной средой LB. После инкубирования чашек Петри в течение 16 часов при плюс 37°С пересевали единичную колонию в жидкую среду LB24, содержащую 30 мкг/мл сульфата канамицина, 1% глюкозы и 1% глицерина. Культивировали в шейкер-инкубаторе при плюс 37°С, 250 об/мин в течение 16 часов. На следующий день ночную культуру разводили средой LB24, содержащей 30 мкг/мл сульфата канамицина и 0,2% глюкозы, до ОП600нм≈0,1. После чего культивировали 1,5 3 часа при плюс 30°С, 220 об/мин в термошейкере до достижения ОП600нм≈0,6-0,8. По достижении клетками начала логарифмической фазы роста температуру в шейкере-инкубаторе снижали до 25°С и добавляли ИПТГ до конечной концентрации 1 мМ. После внесения индуктора бактерии культивировали 16-18 часов при плюс 25°С, 220 об/мин. После окончания процесса культивирования проводили анализ уровня экспрессии методом вертикального диск-электрофореза в полиакрил амид ном геле (ПААГ) в денатурирующих условиях.
На электрофореграмме клеток Е. coli, содержащих плазмидную ДНК pET-28a-N-FCoV, после индукции экспрессии и без индукции (Фиг. 2) видно, что целевой белок присутствует в пробе общего лизата клеток после индукции экспрессии 1 мМ ИПТГ. Это свидетельствует о том, что полученный штамм-продуцент экспрессирует рекомбинантный плазмидный экспрессионный вектор и синтезирует, а также секретирует в культуральную жидкость рекомбинантный белок N-FCoV. Экспрессия ДНК с оптимизированной последовательностью нуклеотидов обеспечило высокий уровень целевого белка - около 20% от общих клеточных белков. В качестве контроля использовали лизат клеток штамма-продуцента без индукции ИПТГ, полоса целевого белка на электрофореграмме отсутствует, что говорит об отсутствии неконтролируемой экспрессии целевой последовательности.
Пример 3. Получение рекомбинантного белка N-FCoV
Биомассу Е. coli, содержащую синтезированный белок N-FCoV, лизировали на льду в буфере 20 мМ Трис - HCl, рН 8,5, 0,5 М NaCl из расчета 10 мл буфера на 1 г влажной биомассы клеток с использованием ультразвукового гомогенизатора И10-840 при следующих условиях: время воздействия 4 мин, мощность 100%, частота 43,5 кГц, импульс - 10 сек., пауза - 5 сек. В чистую пробирку отбирали общий лизат для последующего анализа методом вертикального диск-электрофореза в ПААГ в денатурирующих условиях. Лизированную биомассу осаждали центрифугированием в течение 15 мин при 10000 g при плюс 4°С. Супернатант фильтровали через фильтр с диаметром пор 0,22 мкм и использовали для дальнейшей очистки. Пробу супернатанта отбирали в чистую пробирку для последующего анализа растворимой фракции методом вертикального диск-электрофореза в ПААГ в денатурирующих условиях. Осадок в пробирках повторно ресуспендировали в лизирующем буферном растворе, центрифугировали в течение 30 мин при 10000 g при плюс 4°С. Супернатант сливали, а образовавшийся осадок ресуспендировали в лизирующем буферном растворе, в чистую пробирку отбирали пробу суспензии для последующего анализа нерастворимой фракции методом вертикального диск-электрофореза в ПААГ в денатурирующих условиях.
На электрофореграмме фракций лизата клеток Е. coli, содержащих плазмидную ДНК pET-28a-N-FCoV, после индукции экспрессии и последующего разделения на фракции центрифугированием (Фиг. 3) видно, что целевой белок присутствует в пробе общего клеточного лизата до центрифугирования и в растворимой фракции (супернатант после центрифугирования) и отсутствует в нерастворимой фракции (осадок после центрифугирования). Таким образом, было показано, что при экспрессии в клетках Е. coli белок N-FCoV находится в растворимой фракции, что косвенно свидетельствует о его правильной трехмерной структуре.
Для проведения хроматографической очистки супернатант наносили на колонку, содержащую 20 мл сорбента Ni Sepharose High Performance (GE Healthcare, США), уравновешенную десятью объемами буферного раствора А (20 мМ Трис HCl, рН 8,5, 0,5 М NaCl), с использованием хроматографа АКТА Explorer. После нанесения образца на колонку, ее промывали буферным раствором А со скоростью 3 мл/мин до выхода значений поглощения при длине волны 280 нм на плато. После этого на колонку подавали 10% буферного раствора Б (20 мМ Трис - HCl, рН 8,5, 0,15 М NaCl, 0,5 М имидазола) для того, чтобы смыть слабо связанные примеси, при этом скорость потока составляла 3 мл/мин. После выхода пика колонку промывали 100% буферным раствором Б для того, чтобы смыть целевой продукт. Фракции с поглощением более 50 mAU (единицы оптической плотности) анализировали методом вертикального диск-электрофореза в полиакриламидном геле в денатурирующих условиях
Выход целевого белка происходит при концентрации имидазола 0,5 М (100% буферного раствора Б). Фракции, в которых присутствует целевой белок, объединяли.
Сконцентрированные фракции объемом 30 мл наносили на колонку, содержащую сорбент для эксклюзионной хроматографии Sephacryl S-200HR (GE Healthcare, США), уравновешенный буферным раствором В (20 мМ Трис-HCl, рН 8,5, 100 мМ NaCl). Скорость потока составляла 0,75 мл/мин, объем элюции - 1000 мл.
Фракции с поглощением более 50 mAU анализировали методом вертикального диск-электрофореза в полиакриламидном геле в денатурирующих условиях.
Полученный после второй стадии раствор белка N-FCoV диализировали против буфера (NaH2PO4 0,010 М, KH2PO4 0,0018 М, NaCl 0,137 М, KCl 0,0027 М, рН 7,4).
Выход белка составил 50 мг/л с чистотой более 95%.
Пример 4. Определение защитных свойств белка N-FCoV
Исследование протективных (защитных) свойств белка N-FCoV проводили на лабораторных животных. Исследование проводили на нелинейных, не SPF (Specific Pathogen Free) кошках обоего пола. Возраст кошек - 14-18 недель к моменту иммунизации, вес 800-1200 г. Животные содержались в раздельных группах в условиях вивария с соблюдением основных зоогигиенических требований. Перед началом иммунизации кошки были проверены на отсутствие вирусов FCoV, FPV, FHV, FCV, FIV, FELV методом ИФА и ПЦР с использованием коммерческих наборов.
Лабораторных животных разделили на 6 групп:
группа 10М 5 самок, иммунизированных белком с водно-масляным адъювантом; группа 20М - 5 самцов, иммунизированных белком с водно-масляным адъювантом; группа 30А - 5 самок, иммунизированных белком с адъювантом гидроксидом алюминия;
группа 40А 5 самцов, иммунизированных белком с адъювантом гидроксидом алюминия;
группа 5Кк и - 3 не иммунизированных самки; группа 3 не иммунизированных самца.
Животных из групп 10М, 20М, 30А, 40А иммунизировали двукратно с интервалом в 21 день композицией, содержащей в 1 мл 25 мкг белка и 18,75 мг сквалана, 6,25 мг α-токоферола и 1,25 мг полисорбата 80 для групп 10М и 20М, или композицией, содержащей в 1 мл 25 мкг белка и адъювант на основе гидроксида алюминия (Alhydrogel® 2%, Brenntag Biosector A/S) в соотношении 1: 2 (адъювант: антиген) для групп 30А и 40А. Контрольной группе вводили физиологический раствор. Через 21 день после последней иммунизации животным ороназально вводили вирус FCoV в дозе 1000 (3,0 lg) ТЦД50 на животное (доза, инфицирующая 50% культуры клеток с цитопатическим действием в 50% клеток монослоя). За 1 сутки до введения вируса у лабораторных животных проводили прижизненный отбор крови для определения титра специфических антител и анализа индукции специфического Т-клеточного иммунного ответа.
Животных наблюдали в течение 6 месяцев. Определяли день наступления смерти и коэффициент проявления клинических признаков наступления заболевания (инфекционного перитонита). Каждый день анализировали и оценивали следующие параметры:
- депрессия (неактивность в течение 3 дней подряд, 1 балл);
- анорексия (неупотребление пищи в течение 3 дней подряд, 1 балл);
- неврологические расстройства (1 балл).
Каждую неделю анализировали и оценивали следующие параметры:
- лихорадка (40,1°С, 1 балл);
- желтуха (желтая плазма, 1 балл);
- лимфопения (количество лимфоцитов менее 0,5*109/л, 1 балл);
- потеря в весе (потеря 2,5% веса тела, 1 балл).
Результаты расчета коэффициента проявления клинических признаков наступления заболевания (инфекционного перитонита) и день смерти после инфицирования представлены в Таблице 1.
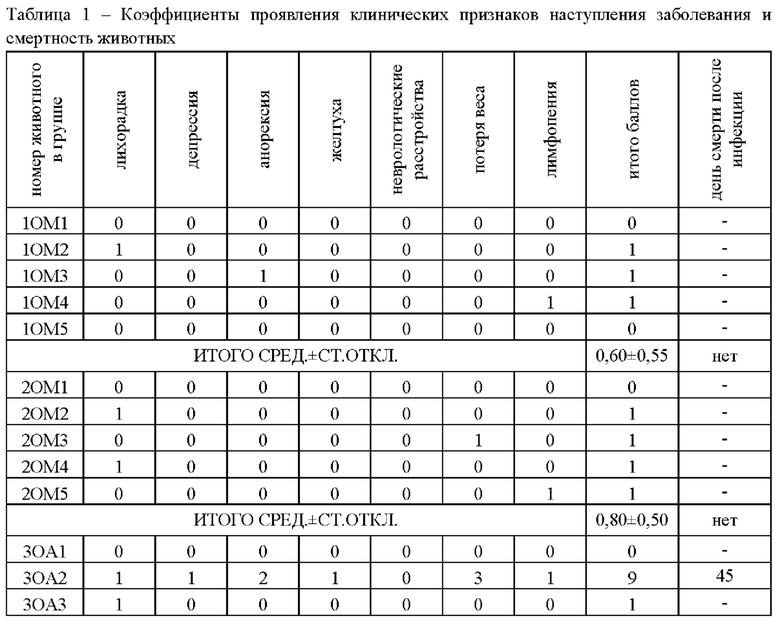
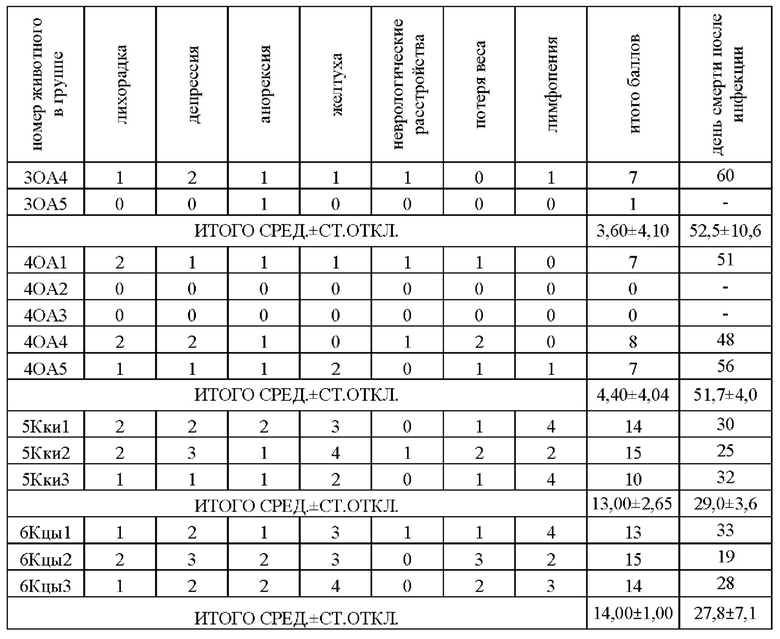
В ходе анализа полученных данных было установлено, что у кошек, иммунизированных белком по настоящему изобретению вместе с водно-масляным адъювантом, стимулирующим Т-клеточный ответ, смертность во всех группах отсутствует, протективная (защитная) эффективность составила 100%, средний коэффициент проявления заболевания составил всего 0,60±0,55 и 0,80±0,50. В группе, иммунизированной белком по настоящему изобретению вместе с адъювантом гидроксидом алюминия, стимулирующим гуморальный В-клеточный иммунный ответ, смертность и протективная эффективность составили 50%, средний коэффициент проявления заболевания составил 3,60±4,10 и 4,40±4,04. Все животные в контрольных группах погибли.
Пример 5. Определение титра антител
Титр антител, вырабатываемых после введения белка согласно изобретению, определяли по следующей методике.
После проведения двух иммунизаций на 41-й день у всех животных забирали кровь. Кровь центрифугировали при 4000 об/мин и отбирали сыворотку для проведения ИФА.
Предварительно в каждую лунку микротитровального планшета вносили по 200 мкл 5 мкг/мл раствора рекомбинантного белка N-FCoV по настоящему изобретению (далее АГ) в карбонатном буфере, рН 9,6. Планшеты инкубировали ночь при 4°С.Далее удаляли раствор АГ из лунок и вносили в каждую лунку по 200 мкл блокирующего буфера (10 мМ Н2РО4, 150 мМ NaCl, 10% казеина, 5% сахарозы). Инкубировали 30 мин при 37°С. Содержимое лунок тщательно удаляли. Вносили во все лунки планшета кроме первого ряда по 100 мкл раствора для разведения (РР) (1×ТБС, 0,1% казеин), в первый ряд вносили по 125 мкл раствора сывороток, разведенных в 100 раз РР, и титровали с шагом в х5. Планшеты инкубировали 1 час при 37°С в термостате. После удаления содержимого, промывали планшеты 3 раза промывочным буфером (ПБ) (1хТБС, 0,05% Твин 20). Конъюгат козьих анти-кошачьих антител класса IgG с пероксидазой хрена (Sigma, США) разводили РР 1:20000. Вносили по 100 мкл конъюгата в лунку. Инкубировали планшеты с конъюгатом 30 минут при 37°С. После удаления конъюгата отмывали планшеты 4 раза ПБ. В каждую лунку вносили по 100 мкл раствора тетраметилбензидина (ТМБ) и выдерживали 15 минут, после чего останавливали реакцию внесением в каждую лунку по 100 мкл 1М H2SO4. Считывание оптической плотности (ОП) производили на планшетном ридере спектрофотометра Epoch (Biotek) при длине волны 450 нм. Результаты приведены в таблицах 25.
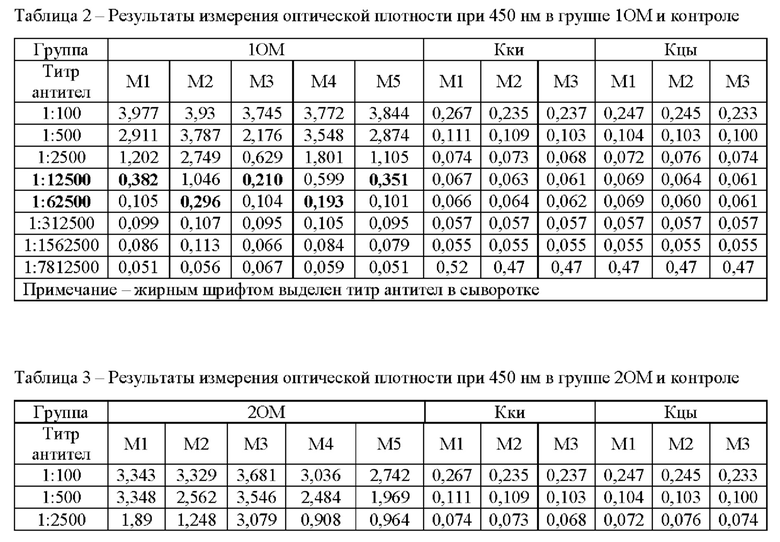
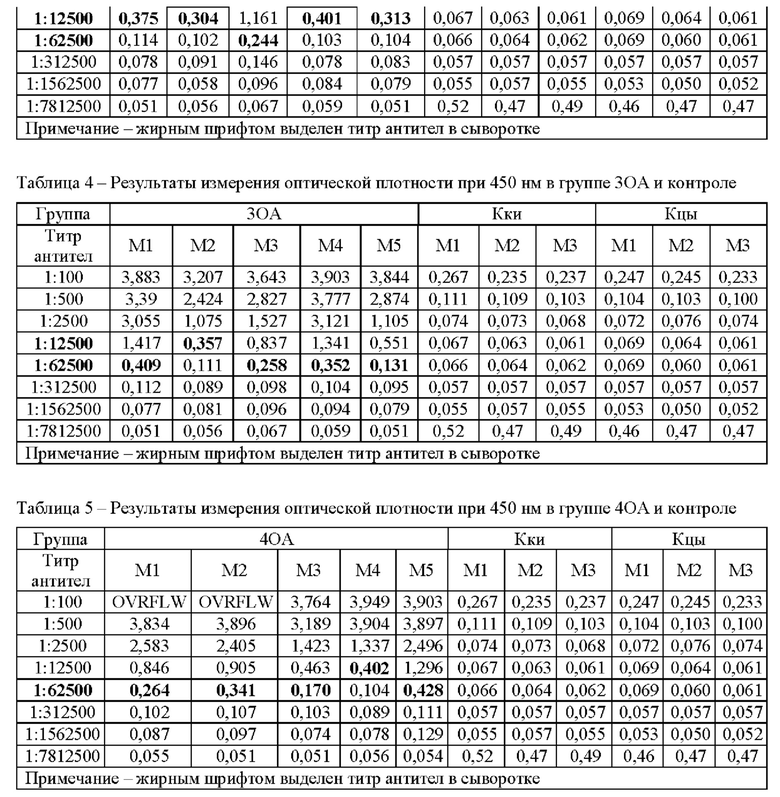
Титр это максимальное разведение сыворотки, при котором еще обнаруживается положительный результат. Положительным считается значение оптической плотности, более чем в 2 раза превышающее значение ОП для сыворотки от не иммунизированных животных в том же разведении.
По полученным результатам, приведенным в таблицах 2 5, можно видеть, что средний титр AT к АГ спустя месяц после начала иммунизации в группах ОМ составил 1:27500, в группах OA - 1:52500. Титр антител в группах, иммунизированных рекомбинантный белком с адъювантом, стимулирующим гуморальный ответ, значительно выше, чем в группах с адъювантом, стимулирующим Т-клеточный ответ.
Пример 6. Определение Т-клеточного иммунного ответа
После проведения двух иммунизации на 41-й день у всех животных забирали кровь. Мононуклеарные клетки периферической крови (PBMCs) были выделены с использованием пробирок для центрифугирования в градиенте плотности SepMate™-15 (RUO) (STEMCELL Technologies, США).
Отобранные PBMCs инокулировали в количестве 5-106 клеток/мл в объеме 200 мкл среды RPMI 1640 с добавками 10% фетальной бычьей сыворотки, 2 мМ L-глютамин, 1% неосновные аминокислоты, 1% пируват натрия, 50 Е/мл пенициллин и стрептомицин, в лунки 96-луночного культурального планшета и инкубировали в термостате при 37°С в атмосфере 5% СО2 в течение 7 дней. Для стимуляции антиген-специфического синтеза интерферона гамма (ИФНγ) добавляли белок N-FCoV по настоящему изобретению, а в качестве отрицательного контроля использовали клетки в культуральной среде.
Концентрацию ИФНγ в кондиционированной культуральной жидкости после стимуляции клеток белком N-FCoV определяли с использованием коммерческой ИФА тест-системы Feline IFN gamma ELISA Kit (Abeam, США). Чувствительность метода составляет 0,24 нг/мл, диапазон измерения 0,24 - 60 нг/мл.
Результаты измерений представлены на Фиг. 4. Белок N-FCoV совместно с Т-клеточным адъювантом достоверно (р<0,01) вызывает более сильный Т-клеточный ответ по сравнению с В-клеточным адъювантом.
Таким образом, с помощью заявленной группы изобретений можно добиться иммунного ответа в отношении коронавируса кошек, в том числе, в частном случае, клеточного иммунного ответа, в том числе, в частном случае, защитного иммунного ответа.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3"
fileName="2023122759_listing.xml" softwareName="WIPO Sequence"
softwareVersion="2.3.0" productionDate="2023-09-01">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>2023122759</ApplicationNumberText>
<FilingDate>2023-09-01</FilingDate>
</ApplicationIdentification>
<ApplicantName languageCode="ru">ОБЩЕСТВО С ОГРАНИЧЕННОЙ
ОТВЕТСТВЕННОСТЬЮ "ИННОВА ПЛЮС"</ApplicantName>
<ApplicantNameLatin>Innova plus LLC</ApplicantNameLatin>
<InventionTitle languageCode="ru">Рекомбинантный белок для
иммунизации против коронавируса кошек</InventionTitle>
<SequenceTotalQuantity>3</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>1128</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1128</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q11">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gcgacccagggtcagcgtgttaactggggtgacgaaccgtctaaacgtc
gtggtcgttctaactctcgtggtcgtaaaaacggtaacatcccgctgtcttacttcaacccgatcaccct
ggaatctggttctaaattctggaacgtttgcccgcgtgacttcgttccgaaaggtatcggtaacaaagac
cagcagatcggttactggaaccgtcaggaacgttaccgtatcgttaaaggtcagcgtaaagaactgccgg
aacgttggttcttctacttcctgggtaccggtccgcacgcggacgcgaaattcaaagacaaaatcgacgg
tgttttctgggttgcgcgtgacggtgcgatgaacaaaccgaccaccctgggtacccgtggtaccaacaac
gaatctaaaccgctgaaattcgacggtaaaatcccgccgcagttccagctggaagttaaccgttctcgta
acaactctcgttctggttctcagtctcgttctgtttctcgtaaccgttctcagtctcgtggtcgtcagca
gtctaacaaccagaacaacaacgttgaagacaccatcgttgcggttctgcagaaactgggtgttaccgac
aaacagcgttctcgttctaaatctcgtgaccgttctgactctaaatctcgtgacaccaccccgaaaaacg
cgaacaaacacacctggaaaaaaaccgcgggtaaaggtgacgttaccaacttctacggtgcgcgttctgc
gtctgcgaacttcggtgactctgacctggttgcgaacggtaacgcggcgaaatgctacccgcagatcgcg
gaatgcgttccgtctgtttcttctatgctgttcggttctcagtggtctgcggaagaagcgggtgaccagg
ttaaagttaccctgacccacacctactacctgccgaaagacgacgcgaaaacctctcagttcctggaaca
gatcgacgcgtacaaacgtccgtctcaggttgcgaaagaccagcgtcagcgtaaatctcgttctaaatct
gcggacaaaaaaccggaagaactgtctgttaccctggttgaagcgtacaccgacgttttcgacgacaccc
aggttgaaatgatcgacgaagttaccaac</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>376</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..376</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q12">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ATQGQRVNWGDEPSKRRGRSNSRGRKNGNIPLSYFNPITLESGSKFWNV
CPRDFVPKGIGNKDQQIGYWNRQERYRIVKGQRKELPERWFFYFLGTGPHADAKFKDKIDGVFWVARDGA
MNKPTTLGTRGTNNESKPLKFDGKIPPQFQLEVNRSRNNSRSGSQSRSVSRNRSQSRGRQQSNNQNNNVE
DTIVAVLQKLGVTDKQRSRSKSRDRSDSKSRDTTPKNANKHTWKKTAGKGDVTNFYGARSASANFGDSDL
VANGNAAKCYPQIAECVPSVSSMLFGSQWSAEEAGDQVKVTLTHTYYLPKDDAKTSQFLEQIDAYKRPSQ
VAKDQRQRKSRSKSADKKPEELSVTLVEAYTDVFDDTQVEMIDEVTN</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>6406</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..6406</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q6">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tggcgaatgggacgcgccctgtagcggcgcattaagcgcggcgggtgtg
gtggttacgcgcagcgtgaccgctacacttgccagcgccctagcgcccgctcctttcgctttcttccctt
cctttctcgccacgttcgccggctttccccgtcaagctctaaatcgggggctccctttagggttccgatt
tagtgctttacggcacctcgaccccaaaaaacttgattagggtgatggttcacgtagtgggccatcgccc
tgatagacggtttttcgccctttgacgttggagtccacgttctttaatagtggactcttgttccaaactg
gaacaacactcaaccctatctcggtctattcttttgatttataagggattttgccgatttcggcctattg
gttaaaaaatgagctgatttaacaaaaatttaacgcgaattttaacaaaatattaacgtttacaatttca
ggtggcacttttcggggaaatgtgcgcggaacccctatttgtttatttttctaaatacattcaaatatgt
atccgctcatgaattaattcttagaaaaactcatcgagcatcaaatgaaactgcaatttattcatatcag
gattatcaataccatatttttgaaaaagccgtttctgtaatgaaggagaaaactcaccgaggcagttcca
taggatggcaagatcctggtatcggtctgcgattccgactcgtccaacatcaatacaacctattaatttc
ccctcgtcaaaaataaggttatcaagtgagaaatcaccatgagtgacgactgaatccggtgagaatggca
aaagtttatgcatttctttccagacttgttcaacaggccagccattacgctcgtcatcaaaatcactcgc
atcaaccaaaccgttattcattcgtgattgcgcctgagcgagacgaaatacgcgatcgctgttaaaagga
caattacaaacaggaatcgaatgcaaccggcgcaggaacactgccagcgcatcaacaatattttcacctg
aatcaggatattcttctaatacctggaatgctgttttcccggggatcgcagtggtgagtaaccatgcatc
atcaggagtacggataaaatgcttgatggtcggaagaggcataaattccgtcagccagtttagtctgacc
atctcatctgtaacatcattggcaacgctacctttgccatgtttcagaaacaactctggcgcatcgggct
tcccatacaatcgatagattgtcgcacctgattgcccgacattatcgcgagcccatttatacccatataa
atcagcatccatgttggaatttaatcgcggcctagagcaagacgtttcccgttgaatatggctcataaca
ccccttgtattactgtttatgtaagcagacagttttattgttcatgaccaaaatcccttaacgtgagttt
tcgttccactgagcgtcagaccccgtagaaaagatcaaaggatcttcttgagatcctttttttctgcgcg
taatctgctgcttgcaaacaaaaaaaccaccgctaccagcggtggtttgtttgccggatcaagagctacc
aactctttttccgaaggtaactggcttcagcagagcgcagataccaaatactgtccttctagtgtagccg
tagttaggccaccacttcaagaactctgtagcaccgcctacatacctcgctctgctaatcctgttaccag
tggctgctgccagtggcgataagtcgtgtcttaccgggttggactcaagacgatagttaccggataaggc
gcagcggtcgggctgaacggggggttcgtgcacacagcccagcttggagcgaacgacctacaccgaactg
agatacctacagcgtgagctatgagaaagcgccacgcttcccgaagggagaaaggcggacaggtatccgg
taagcggcagggtcggaacaggagagcgcacgagggagcttccagggggaaacgcctggtatctttatag
tcctgtcgggtttcgccacctctgacttgagcgtcgatttttgtgatgctcgtcaggggggcggagccta
tggaaaaacgccagcaacgcggcctttttacggttcctggccttttgctggccttttgctcacatgttct
ttcctgcgttatcccctgattctgtggataaccgtattaccgcctttgagtgagctgataccgctcgccg
cagccgaacgaccgagcgcagcgagtcagtgagcgaggaagcggaagagcgcctgatgcggtattttctc
cttacgcatctgtgcggtatttcacaccgcatatatggtgcactctcagtacaatctgctctgatgccgc
atagttaagccagtatacactccgctatcgctacgtgactgggtcatggctgcgccccgacacccgccaa
cacccgctgacgcgccctgacgggcttgtctgctcccggcatccgcttacagacaagctgtgaccgtctc
cgggagctgcatgtgtcagaggttttcaccgtcatcaccgaaacgcgcgaggcagctgcggtaaagctca
tcagcgtggtcgtgaagcgattcacagatgtctgcctgttcatccgcgtccagctcgttgagtttctcca
gaagcgttaatgtctggcttctgataaagcgggccatgttaagggcggttttttcctgtttggtcactga
tgcctccgtgtaagggggatttctgttcatgggggtaatgataccgatgaaacgagagaggatgctcacg
atacgggttactgatgatgaacatgcccggttactggaacgttgtgagggtaaacaactggcggtatgga
tgcggcgggaccagagaaaaatcactcagggtcaatgccagcgcttcgttaatacagatgtaggtgttcc
acagggtagccagcagcatcctgcgatgcagatccggaacataatggtgcagggcgctgacttccgcgtt
tccagactttacgaaacacggaaaccgaagaccattcatgttgttgctcaggtcgcagacgttttgcagc
agcagtcgcttcacgttcgctcgcgtatcggtgattcattctgctaaccagtaaggcaaccccgccagcc
tagccgggtcctcaacgacaggagcacgatcatgcgcacccgtggggccgccatgccggcgataatggcc
tgcttctcgccgaaacgtttggtggcgggaccagtgacgaaggcttgagcgagggcgtgcaagattccga
ataccgcaagcgacaggccgatcatcgtcgcgctccagcgaaagcggtcctcgccgaaaatgacccagag
cgctgccggcacctgtcctacgagttgcatgataaagaagacagtcataagtgcggcgacgatagtcatg
ccccgcgcccaccggaaggagctgactgggttgaaggctctcaagggcatcggtcgagatcccggtgcct
aatgagtgagctaacttacattaattgcgttgcgctcactgcccgctttccagtcgggaaacctgtcgtg
ccagctgcattaatgaatcggccaacgcgcggggagaggcggtttgcgtattgggcgccagggtggtttt
tcttttcaccagtgagacgggcaacagctgattgcccttcaccgcctggccctgagagagttgcagcaag
cggtccacgctggtttgccccagcaggcgaaaatcctgtttgatggtggttaacggcgggatataacatg
agctgtcttcggtatcgtcgtatcccactaccgagatatccgcaccaacgcgcagcccggactcggtaat
ggcgcgcattgcgcccagcgccatctgatcgttggcaaccagcatcgcagtgggaacgatgccctcattc
agcatttgcatggtttgttgaaaaccggacatggcactccagtcgccttcccgttccgctatcggctgaa
tttgattgcgagtgagatatttatgccagccagccagacgcagacgcgccgagacagaacttaatgggcc
cgctaacagcgcgatttgctggtgacccaatgcgaccagatgctccacgcccagtcgcgtaccgtcttca
tgggagaaaataatactgttgatgggtgtctggtcagagacatcaagaaataacgccggaacattagtgc
aggcagcttccacagcaatggcatcctggtcatccagcggatagttaatgatcagcccactgacgcgttg
cgcgagaagattgtgcaccgccgctttacaggcttcgacgccgcttcgttctaccatcgacaccaccacg
ctggcacccagttgatcggcgcgagatttaatcgccgcgacaatttgcgacggcgcgtgcagggccagac
tggaggtggcaacgccaatcagcaacgactgtttgcccgccagttgttgtgccacgcggttgggaatgta
attcagctccgccatcgccgcttccactttttcccgcgttttcgcagaaacgtggctggcctggttcacc
acgcgggaaacggtctgataagagacaccggcatactctgcgacatcgtataacgttactggtttcacat
tcaccaccctgaattgactctcttccgggcgctatcatgccataccgcgaaaggttttgcgccattcgat
ggtgtccgggatctcgacgctctcccttatgcgactcctgcattaggaagcagcccagtagtaggttgag
gccgttgagcaccgccgccgcaaggaatggtgcatgcaaggagatggcgcccaacagtcccccggccacg
gggcctgccaccatacccacgccgaaacaagcgctcatgagcccgaagtggcgagcccgatcttccccat
cggtgatgtcggcgatataggcgccagcaaccgcacctgtggcgccggtgatgccggccacgatgcgtcc
ggcgtagaggatcgagatctcgatcccgcgaaattaatacgactcactataggggaattgtgagcggata
acaattcccctctagaaataattttgtttaactttaagaaggagatataccatgggcagcagccatcatc
atcatcatcacagcagcggcgcgacccagggtcagcgtgttaactggggtgacgaaccgtctaaacgtcg
tggtcgttctaactctcgtggtcgtaaaaacggtaacatcccgctgtcttacttcaacccgatcaccctg
gaatctggttctaaattctggaacgtttgcccgcgtgacttcgttccgaaaggtatcggtaacaaagacc
agcagatcggttactggaaccgtcaggaacgttaccgtatcgttaaaggtcagcgtaaagaactgccgga
acgttggttcttctacttcctgggtaccggtccgcacgcggacgcgaaattcaaagacaaaatcgacggt
gttttctgggttgcgcgtgacggtgcgatgaacaaaccgaccaccctgggtacccgtggtaccaacaacg
aatctaaaccgctgaaattcgacggtaaaatcccgccgcagttccagctggaagttaaccgttctcgtaa
caactctcgttctggttctcagtctcgttctgtttctcgtaaccgttctcagtctcgtggtcgtcagcag
tctaacaaccagaacaacaacgttgaagacaccatcgttgcggttctgcagaaactgggtgttaccgaca
aacagcgttctcgttctaaatctcgtgaccgttctgactctaaatctcgtgacaccaccccgaaaaacgc
gaacaaacacacctggaaaaaaaccgcgggtaaaggtgacgttaccaacttctacggtgcgcgttctgcg
tctgcgaacttcggtgactctgacctggttgcgaacggtaacgcggcgaaatgctacccgcagatcgcgg
aatgcgttccgtctgtttcttctatgctgttcggttctcagtggtctgcggaagaagcgggtgaccaggt
taaagttaccctgacccacacctactacctgccgaaagacgacgcgaaaacctctcagttcctggaacag
atcgacgcgtacaaacgtccgtctcaggttgcgaaagaccagcgtcagcgtaaatctcgttctaaatctg
cggacaaaaaaccggaagaactgtctgttaccctggttgaagcgtacaccgacgttttcgacgacaccca
ggttgaaatgatcgacgaagttaccaactaatgactcgagcaccaccaccaccaccactgagatccggct
gctaacaaagcccgaaaggaagctgagttggctgctgccaccgctgagcaataactagcataaccccttg
gggcctctaaacgggtcttgaggggttttttgctgaaaggaggaactatatccggat</INSDSeq_seq
uence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Композиция для лечения инфекционного перитонита кошек | 2021 |
|
RU2780097C1 |
| ШТАММ Feline coronavirus, ИСПОЛЬЗУЕМЫЙ ДЛЯ КОНТРОЛЯ ИММУНОГЕННОЙ АКТИВНОСТИ ВАКЦИН И ИЗГОТОВЛЕНИЯ БИОПРЕПАРАТОВ ДЛЯ ДИАГНОСТИКИ ИНФЕКЦИОННОГО ПЕРИТОНИТА КОШЕК | 2003 |
|
RU2250260C1 |
| Набор специфических олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченого зонда для идентификации фрагмента гена N, кодирующего нуклеокапсидный белок коронавируса кошек/вируса инфекционного перитонита кошек (FCoV, FIP) | 2022 |
|
RU2802929C1 |
| Пептидные иммуногены и вакцинная композиция против коронавирусной инфекции COVID-19 с использованием пептидных иммуногенов | 2020 |
|
RU2743593C1 |
| Вакцинная композиция против коронавирусной инфекции COVID-19 | 2020 |
|
RU2743595C1 |
| Пептидные иммуногены, используемые в качестве компонентов вакцинной композиции против коронавирусной инфекции COVID-19 | 2020 |
|
RU2743594C1 |
| Интегративный плазмидный вектор pVEAL3-RBDdel, обеспечивающий синтез и секрецию рекомбинантного белка рецепторсвязывающего домена RBDdelta коронавируса SARS-CoV-2 в клетках млекопитающих, рекомбинантный штамм клеточной линии CHO-K1- RBDdelta и рекомбинантный белок RBDdelta SARS-CoV-2, продуцируемый штаммом клеточной линии | 2023 |
|
RU2816175C1 |
| Пептидные иммуногены и вакцинная композиция против коронавирусной инфекции COVID-19 с использованием пептидных иммуногенов | 2020 |
|
RU2738081C1 |
| Искусственная генетическая конструкция для гетерологической экспрессии рецептор-связывающего домена S-белка в слитной полипептидной цепи с нуклеокапсидным белком | 2022 |
|
RU2801597C1 |
| Рекомбинантная ДНК, обеспечивающая получение рекомбинантного белка Cov1, обладающего иммуногенными свойствами в отношении вируса SARS-CoV-2 | 2021 |
|
RU2776484C1 |
Изобретение относится к области биотехнологии, конкретно к рекомбинантному получению иммуногенного белка коронавируса кошек, и может быть использовано в ветеринарии для получения вакцины против коронавируса кошек. Предложена новая стратегия вакцинации, основанная на применении профилактического препарата на основе консервативного рекомбинантного белка нуклеокапсида коронавируса кошек (N-FCoV) с SEQ ID NO:2 и специфического адъюванта, представляющего собой смесь сквалана, α-токоферола (витамина Е) и полисорбата-80, который эффективно индуцирует Т-клеточный ответ в отношении коронавируса кошек. 6 н. и 3 з.п. ф-лы, 4 ил., 5 табл., 6 пр.
1. Рекомбинантный белок для иммунизации против коронавируса кошек, содержащий аминокислотную последовательность SEQ ID NO:2.
2. Белок по п. 1, дополнительно содержащий гистидиновую метку из 6-10 остатков гистидина.
3. Нуклеиновая кислота, кодирующая белок по любому из пп. 1 или 2.
4. Нуклеиновая кислота по п. 3, содержащая последовательность SEQ ID NO:1.
5. Экспрессионный вектор для трансформации штаммов клеток Escherichia coli, содержащий нуклеиновую кислоту по любому из пп. 3 или 4.
6. Вектор по п. 5, представляющий собой плазмидный экспрессионный вектор.
7. Вектор по п. 6, который включает SEQ ID NO:3.
8. Штамм Escherichia coli - продуцент рекомбинантного белка по п. 1, полученный трансформацией компетентных клеток Е. coli штамма BL21[DE3] плазмидным экспрессионным вектором по п. 6.
9. Композиция для иммунизации против коронавируса кошек, содержащая рекомбинантный белок по п. 1, сквалан, α-токоферол и полисорбат 80 в весовом соотношении 1 : 750 : 250 : 50.
10. Способ применения композиции по п. 9 для профилактики коронавирусной инфекции у кошек, заключающийся в том, что кошкам вводят композицию из расчёта 25 мкг белка на кошку двукратно с интервалом в 21 день.
| US 20120107390 A1, 03.05.2012, US 20050053622 A1, 10.03.2005, RU 2797538 C2, 07.06.2023, RU 2784533 C2, 28.11.2022, JP 2000302692 A, 31.10.2000. |
Авторы
Даты
2023-12-05—Публикация
2023-09-01—Подача