Изобретение относится к области электрохимии и электрокатализа, в частности к материалам, использующимся в качестве электрокатализаторов для получения молекулярного водорода в присутствии гетерополициклических органических соединений.
В связи со стремительным переходом прямых методов получения водорода путем электролиза, требующих использование катализаторов на основе дорогостоящих платины и иных металлов платиновой группы, вопрос их замены на более доступные, но не уступающие в эффективности системы, бесспорно актуален.
В ходе продолжительных исследований были предложены электрокаталитические системы на основе комплексов переходных металлов, обладающих достаточной каталитической активностью, однако они не удовлетворяют основным предъявляемым к ним требованиям, а именно высокая химическая и термодинамическая устойчивость, отсутствие необходимости в создании специальных условий протекания процесса, а так же коммерческая конкурентоспособность относительно существующих ныне катализаторов. К тому же, приоритетной задачей является частичный или полный переход от металлических катализаторов к синтетическим аналогам, что позволит при той же эффективности существенно снизить стоимость каталитической системы.
Активные разработки в этой области поспособствовали выявлению основных подходов к получению электрокатализаторов на основе органических соединений. Суть состоит в постадийном синтезе молекул, которые затем иммобилизуются на поверхности углеродного носителя - катода.
Известен катализатор для получения молекулярного водорода. В решении описано применение органического стабильного электронно-избыточного радикала в качестве катализатора для получения молекулярного водорода (RU 2480283, МПК B01J 31/00, C01B 3/16, C25B 1/44, опубл. 27.04.2013).
Недостатком известного решения является низкая каталитическая активность и невозможность к иммобилизации на рабочем электроде.
Из уровня техники известно применение материала на основе безметального электрокатализатора для получения молекулярного водорода из воды в присутствии органических солей. Изобретение относится к применению материала на основе безметального электрокатализатора, представляющего собой акридин, 9-фенил-акридин или N-метил-9-фенилакридин, адсорбированный на углеродном материале, для получения молекулярного водорода из воды в присутствии органических солей (RU 2706117, МПК B01J 31/02, C25B 1/04, опубл. 14.11.2019).
Используемый материал является синтетически доступным и термодинамически устойчивым. Недостатком известного решения является невысокое время работы в непрерывном режиме. Происходит его деактивация.
Технический результат, при использовании заявленного изобретения, заключается в применении электрокатализатора на основе гетероциклических соединений способных к физической адсорбции на углеродной поверхности по механизму π-π-стейкинга, что обеспечивает высокие скорости процесса и рекордную устойчивость в процессе электрохимического получения молекулярного водорода из воды.
Сущность изобретения заключается в том, что предлагается применение гибридного материала на основе безметального электрокатализатора, представляющего собой органические гетероциклические соединения 4,4’-бипиридин, 2,2’-бипиридин и 1,10-фенантролин, иммобилизованные на поверхности углерод-содержащего катода, для генерирования молекулярного водорода из воды.
Сущность изобретения поясняется чертежами, где:
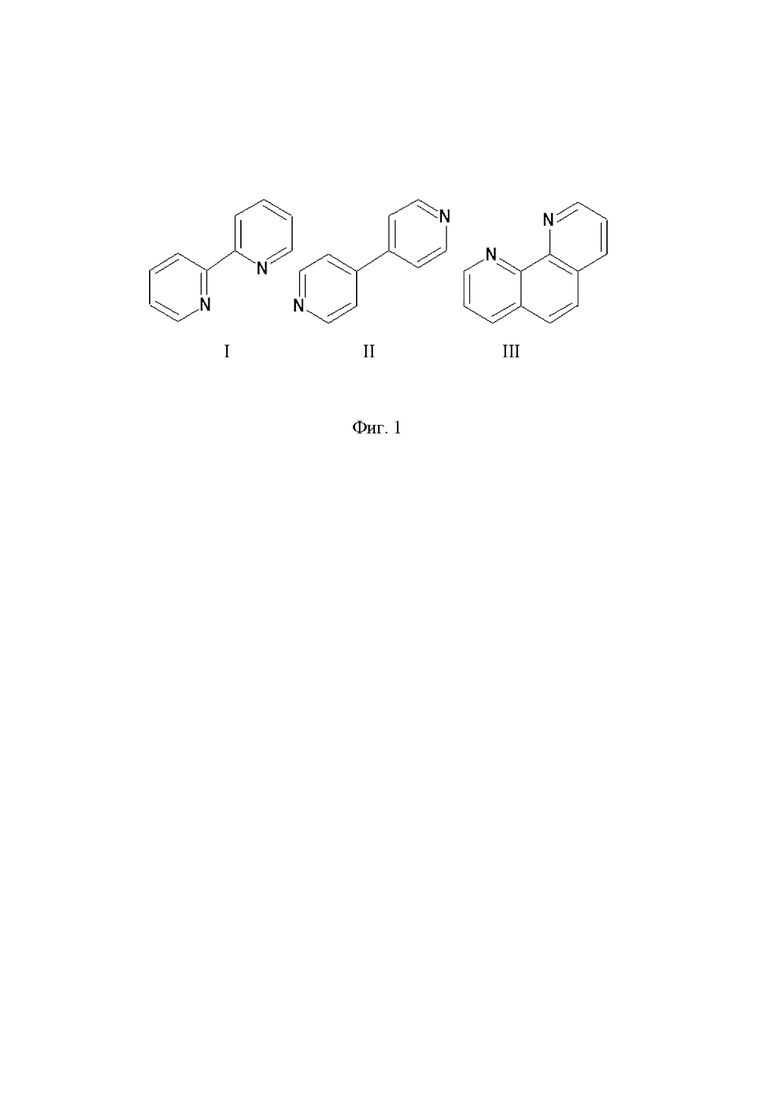
на Фиг. 1 представлены структурные формулы 2,2’-бипиридина (I), 4,4’-бипиридина (II) и 1,10-фенантролина (III);
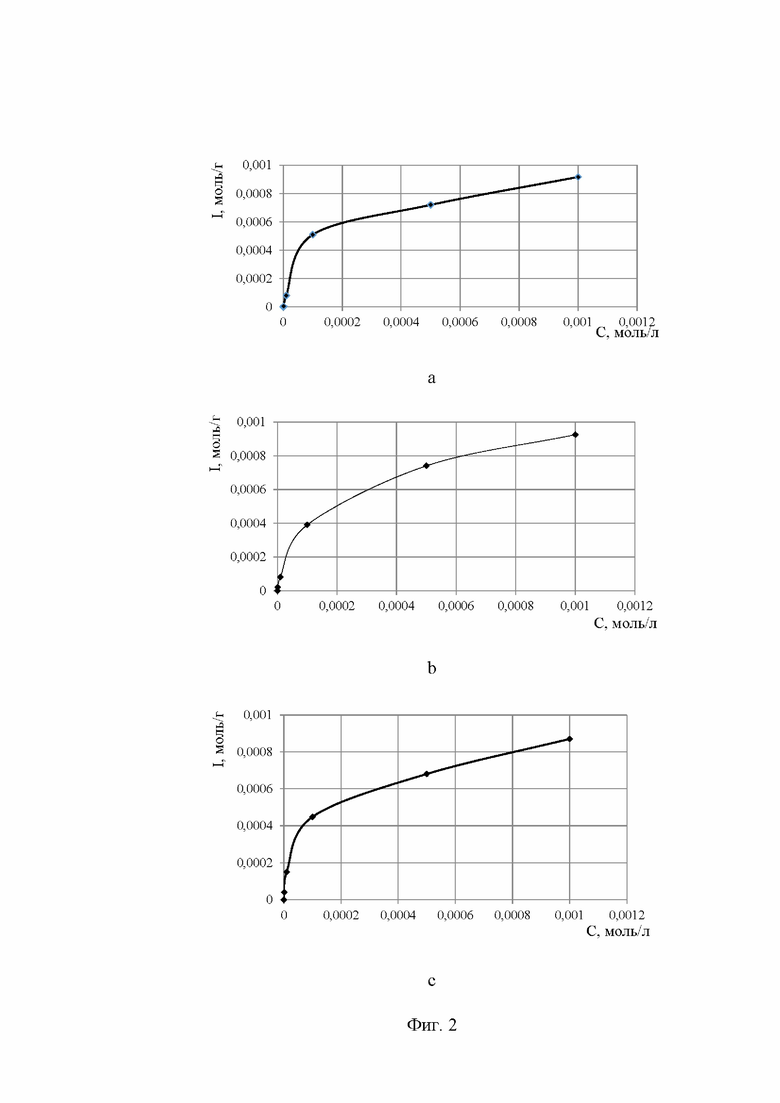
на Фиг. 2 показана сорбция соединений I (а), II (b) и III (с) на углеродном носителе VulcanXC-72 в ацетонитриле;
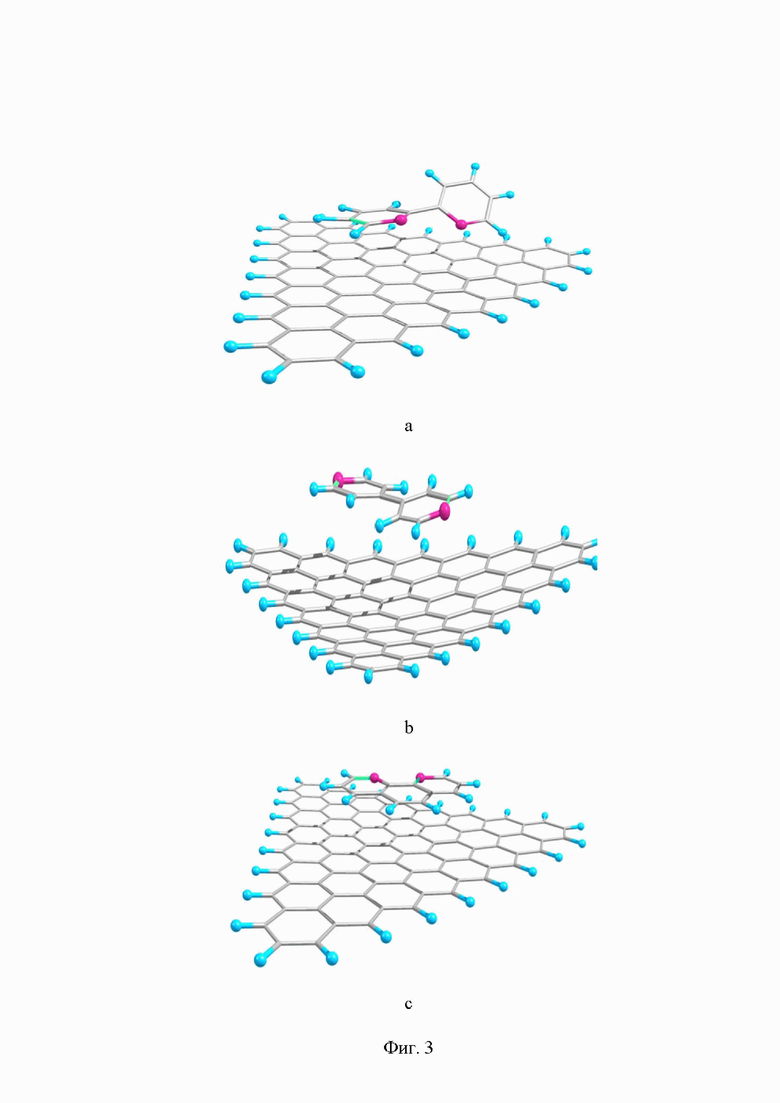
на Фиг. 3 изображены равновесные состояния, полученные с помощью метода DFT на базисе B3LIP/6-31+G(2d,p) для адсорбции соединений I-а, II-b и III-с на поверхности углеродного носителя;
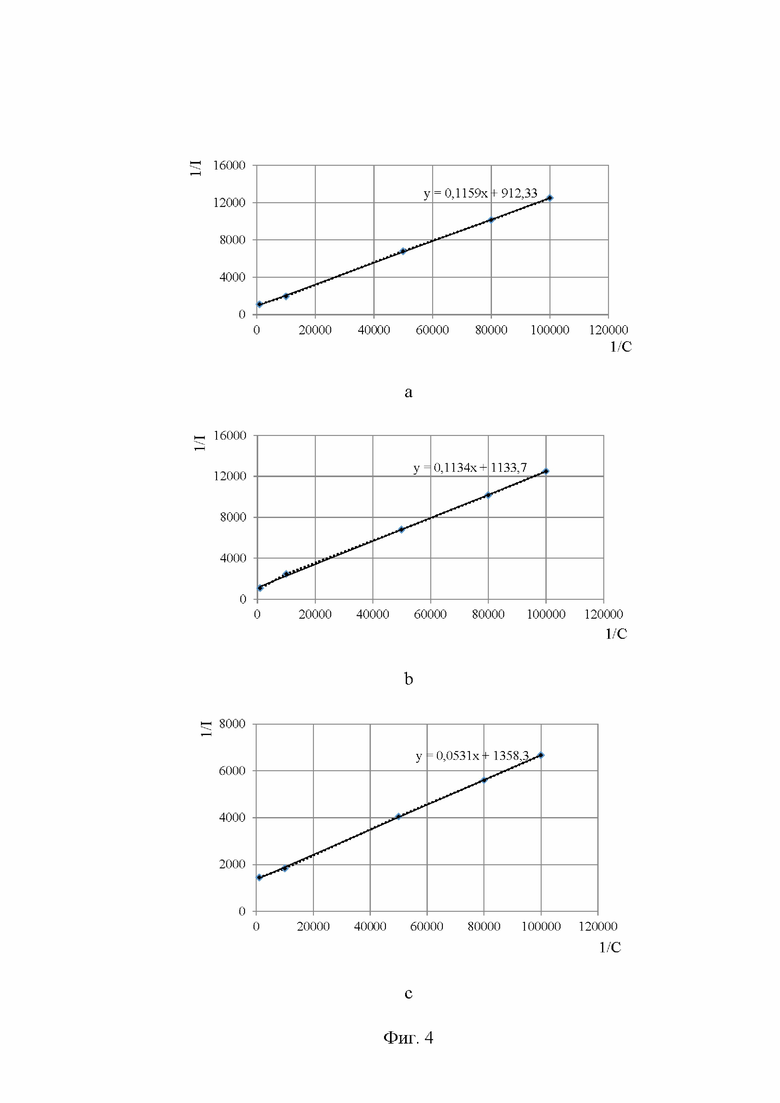
на Фиг. 4 показаны изотермы адсорбции соединений соединений I-а, II-b и III-с углеродсодержащим сорбентом в ацентонитриле в координатах линейной формы уравнения Ленгмюра;
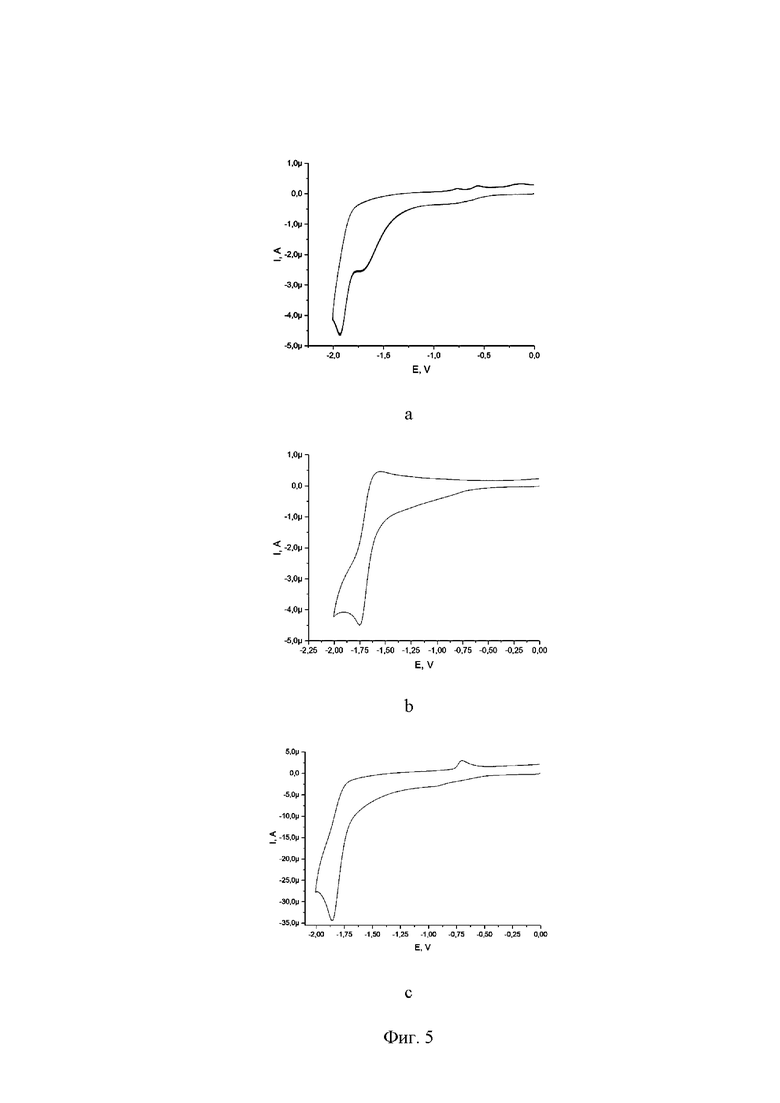
на Фиг. 5 представлены циклические вольтамперограммы для соединений I, II и III, иммобилизованных на углеродном носителе VulcanXC-72. Условия съемки: ацетонитрил, v = 100 mV/s, Ag/AgCl/KCl;
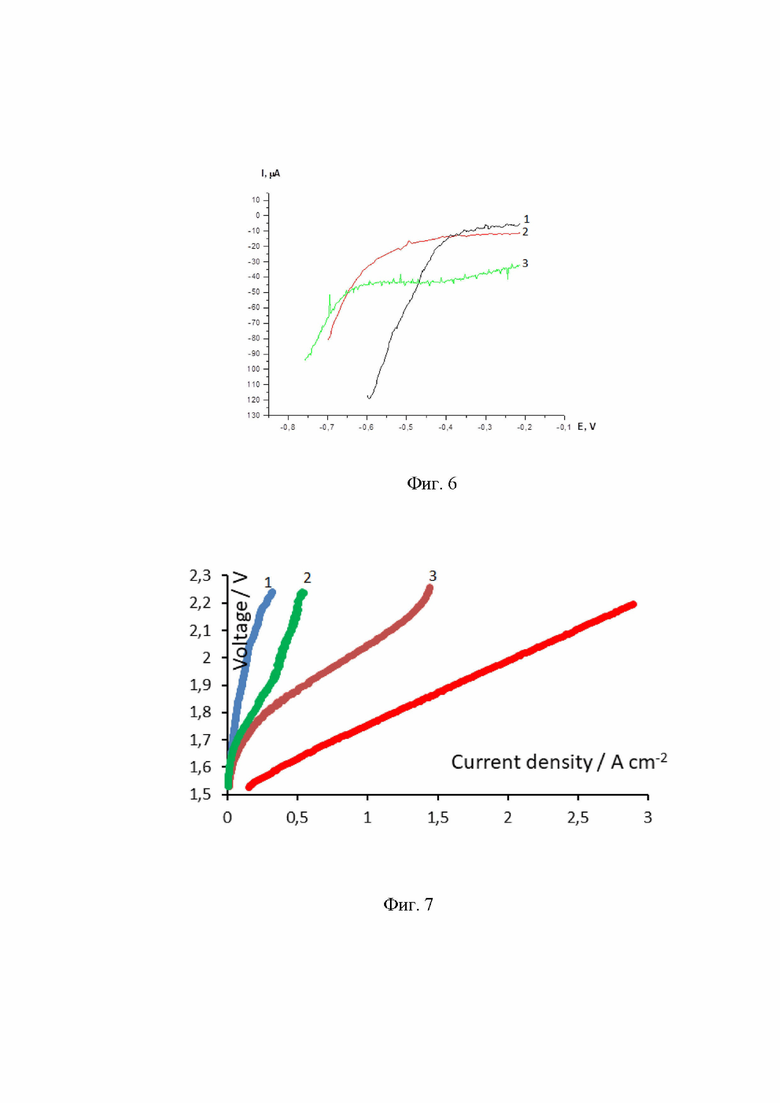
на Фиг. 6 отражены поляризационные кривые, полученные для соединений 1, 2 и 3, иммобилизованных на углеродном носителе VulcanXC-72 в присутствии хлорсульфоновой кислоты (0,1 моль/л). Условия съемки: хлористый метилен, v = 5 мВ/с;
на Фиг. 7 показаны результаты препаративного электролиза на основе соединений I, II и III на катоде, а также на основе аналогичного углеродного материала, активированного металлической платиной, используемого в качестве контрольного образца (4).
Осуществление изобретения
Изготовление и применение безметального электрокатализатора на основе органических гетероциклических соединений, иммобилизованных на поверхность углеродного носителя, осуществляют следующим образом. Измельченный сорбент, предварительно промытый дистиллированной водой, отфильтрованный и высушенный при температуре 440-450°C, поочередно смешивают с ацетонитрильными растворами 2,2’-бипиридина, 4,4’-бипиридина и 1,10’-фенантролина (10-3 моль/л). Сорбцию проводят статическим методом, который реализовывают в перемешивающем устройстве. Растворы непрерывно перемешивают при комнатной температуре в течение 30 минут.
Исследования люминесцентных свойств гетероциклических полиароматических соединений проводили с помощью метода флуоресцентной оптической спектрометрии. Спектры люминесценции снимали на спектрофлуориметре RF-5301PC фирмы «Shimadzu». Источник излучения в лампе - ксеноновая лампа мощностью 150 Вт с деозонатором. Оптический диапазон: возбуждение 220-900 нм, эмиссия 220-900 нм. Спектрофлуориметр RF-5301PC предназначены для количественного химического анализа органических и неорганических веществ.
Были использованы следующие материалы:
1. Углеродный носитель VulcanXC-72 производства «CabotCorporation-Additives».
2. 2,2’-бипиридин (х.ч). Молекулярная формула: C10H8N2. Молекулярный вес: 156,188.
3. 4,4’-бипиридин (х.ч) Молекулярная формула: C10H8N2. Молекулярный вес: 156,188.
4. 1,10-фенантролин (х.ч) Молекулярная формула: C12H8N2. Молекулярный вес: 180,21.
В заявленном изобретении показаны результаты исследований сорбции 2,2’-бипиридина, 4,4’-бипиридина и 1,10-фенантролина (Фиг. 1), использованных в качестве адсорбатов, на углеродном носителе, а также электрохимические свойства полученных электрокаталитических систем.
Целью исследования являлось выявление оптимальных условий процесса сорбции, а также выявление ее конкретного механизма, что в дальнейшем позволит более детально регулировать процесс создания безметальных электрокатализаторов на основе других, более сложных систем.
Время установления равновесных условий сорбции является наименьшим для соединения I, затем для соединения III, а для соединения II установление равновесия самое медленное. Соединение III имеет плоскую структуру, которая должна прекрасно подходить для адсорбции на поверхности углеродных носителей за счет π-π - стейкинга, с чем и связанна его довольно большая скорость при сорбции. Такая геометрия молекулы в большей мере будет способствовать иммобилизации на поверхности носителя. Для подтверждения полученных результатов были проведены квантово-химические расчеты процесса адсорбции соединений I, II, III на модели углеродного носителя при помощи метода DFT на базисе B3LIP/6-31+G(2d,p). Для проведения расчетов использовалась модель графеновой поверхности, состоящая из 28 сопряженных между собой циклов (Фиг. 3).
Предположительно, структура 1,10-фенантролина - плоская, структурно-жесткая молекула, которая сорбируется исключительно по механизму π-π -стейкинга. Это соединение не может адсорбироваться порами, так как молекула большая и жесткая. Энергетически такой вид сорбции не особо выгоден, поэтому процесс протекает достаточно долго. В случае молекулы 4,4'-бипиридина энергетически более выгодна плоская конфигурация, в отличие от 2,2'-бипиридина, для сорбции по механизму π-π стейкинга, поскольку в случае 2,2'-бипиридина неподеленные электронные пары азота в плоской конфигурации будут в большей степени отталкиваться друг от друг, следовательно, энергетически такая ситуация не выгодна. Поэтому можно допустить, что 2,2'-бипиридин будет сорбироваться за счет структурного типа сорбции, то есть будет сорбироваться только порами углеродного материала. Тогда как в случае молекулы 4,4'-бипиридина сорбция может протекать по смешанному механизму: по π-π - стейкингу, и по структурному типу взаимодействия.
Чтобы удостовериться в достоверности полученных результатов, были построены изотермы Ленгмюра и рассчитаны константа адсорбции (K), предельное значение адсорбции (А∞) и свободная энергия процесса адсорбции (ΔG°адс). В табл. 1 представлены параметры сорбции ацетонитрильных растворов органических соединений на углеродсодержащем носителе VulcanXC-72. О характере поверхности сорбента можно судить по формам изотерм адсорбции (Фиг. 2). Можно отметить, что все изотермы характеризуются выпуклой формой, что соответствует мономолекулярному типу адсорбции. Подобный тип равновесия описывается уравнением Ленгмюра:

где А - величина адсорбции, моль/кг;
А∞ - предельная мономолекулярная адсорбция;
К - константа адсорбционного равновесия;
С - концентрация адсорбата в растворе, кмоль/м3.
Экспериментальные результаты адсорбции обрабатывают с помощью уравнения Ленгмюра, записанного в линейной форме:

Графическая зависимость 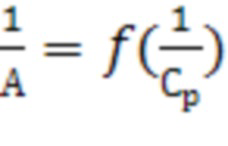 выражается прямой, пересекающей ось ординат. Отрезок, отсекаемый на оси ординат, определяет величину, обратную емкости монослоя
выражается прямой, пересекающей ось ординат. Отрезок, отсекаемый на оси ординат, определяет величину, обратную емкости монослоя 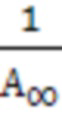 . Тангенс угла наклона прямой равен
. Тангенс угла наклона прямой равен 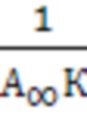 , что позволяет найти константу адсорбционного равновесия Кравн.
, что позволяет найти константу адсорбционного равновесия Кравн.
Изотермы приведены к линейной форме (Фиг. 4), для которых рассчитаны следующие параметры: tgα (тангенс угла наклона прямой), Kравн (константу адсорбционного равновесия), ΔG°адс (изменение энергии Гиббса адсорбции).
Для I соединения 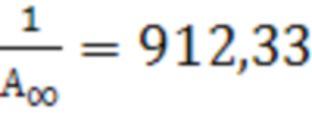 ;
;
для II 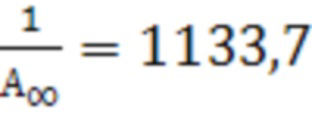 ;
;
для III 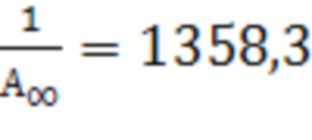 .
.
Тангенс угла наклона прямой равен:

Для I : tg α = 0,1159;
II : tg α = 0,1134;
III : tg α = 0,0531;
и позволяет найти константу адсорбционного равновесия Кравн.:

Для I: Кравн.=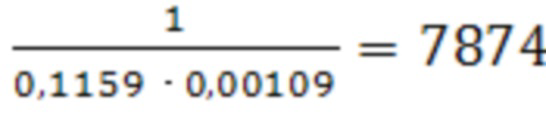 ;
;
II: Кравн.=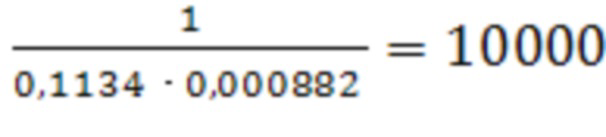 ;
;
III: Кравн.=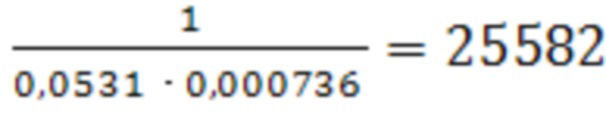 .
.
Зная константу адсорбционного равновесия можно рассчитать изменение энергии Гиббса адсорбции:

Для I : ΔG°адс = - 8,31 ⋅ 298 ⋅ ln 7874 = -22216,41 Дж
II : ΔG°адс = - 8,31 ⋅ 298 ⋅ ln 10000 = -22808,3 Дж
III : ΔG°адс = - 8,31 ⋅ 298 ⋅ ln 25582 = -25134,37 Дж
Как видно из данных, приведенных в таблице 1, параметр А∞, который характеризует эффективность процесса, наибольший для соединения I, затем для II и уменьшается для III. Увеличение размера и объема молекулы соединения III, по сравнению с соединением I, приводит к тому, что практически в полтора раза понижается максимальная адсорбция А∞, что хорошо согласуется с выводом о том, что лимитирующим видом адсорбции является структурный тип.
Интересно отметить, что изменение положения азота в молекуле 4,4'-бипиридина приводит к незначительному уменьшению параметра А∞, тогда как наличие дополнительного конденсированного цикла приводит к тому, что параметр А∞ снижается практически в 1,5 раза по сравнению с соединением I. Также важно отметить, что при наименьших значениях А∞ для соединения III, значение К практически в три раза больше чем значения К для соединений I и II, и значение ΔG°адс также существенно выше.
Значения свободной энергии адсорбции во всех случаях примерно одинаковые, что говорит о схожем процессе адсорбции. Так же, все значения ΔG°адс отрицательные, то есть процесс протекает самопроизвольно. Для 1,10-фенантролина изменение энергии Гиббса адсорбции ΔG°адс выше, чем у двух других соединений, поэтому аналитический процесс сорбции наиболее выгоден. В связи с низкой скоростью адсорбции, количество участков, способных к сорбции незначительно, а сам процесс намного выгоднее за счет π-π - взаимодействия.
Таким образом, исходя из полученных данных, можно сделать вывод, что молекула I адсорбируется в порах на углеродном носителе не по механизму π-π-стейкинга, а за счет физической адсорбции. Тогда как молекула III сорбируется исключительно по π-π - взаимодействию на участках углеродного материала, обладающего подходящей геометрией углеродного полотна. А молекула II в свою очередь может сорбироваться по двум параллельным механизмам: за счет π-π-стейкинга, и за счет механизма физической сорбции порами сорбента.
Для изучения электрохимических свойств представленных систем был использован метод циклической вольтамперометрии (ЦВА). Все соединения, иммобилизованные на поверхности углеродного носителя, электрохимически активны в катодной области при потенциалах, близких к потенциалам исходных соединений (Фиг. 5). Кроме этого, для всех систем была исследована зависимость lgIp-lgv, в результате чего получили наклон кривой, близкий к 1. Это позволяет говорить о том, что лимитирующей стадией процесса является быстрая миграция электрона с поверхности электрода к каталитическому центру. Полученные значения свидетельствуют о высокой эффективности изучаемых электрокаталитических систем.
Кроме этого, были построены поляризационные кривые (Фиг. 6), на основании которых отметим, что во всех случаях наблюдается наклон равный 57 мВ/дек, что соответствует протеканию процесса по механизму Гейровского.
Далее для иммобилизованных соединений I, II и III были получены вольтамперные характеристики с использованием препаративного электролиза. Вольтамперные характеристики электролизера воды с мембранно-электродными блоками на основе образцов I, II и III на катоде, а также на основе аналогичного углеродного материала, активированного нанесенной на углеродный носитель Vulcan XC-72 металлической платиной и используемого в качестве контрольного образца (Фиг. 7). Видно, что для всех соединений близки между собой.
Таким образом, полученные синтетические системы являются перспективными для использования в электролизерах воды, хотя активность этих электрокатализаторов уступает таковой для платиносодержащих материалов.
Изобретение относится к области электрохимии и электрокатализа, в частности к материалам, использующимся в качестве электрокатализаторов для получения молекулярного водорода в присутствии гетерополициклических органических соединений. Предлагается применение гибридного материала на основе безметального электрокатализатора, представляющего собой органические гетероциклические соединения 4,4'-бипиридин, 2,2'-бипиридин и 1,10-фенантролин, иммобилизованные на поверхности углеродсодержащего катода, для генерирования молекулярного водорода из воды. Технический результат при использовании заявленного изобретения заключается в применении электрокатализатора на основе гетероциклических соединений, способных к физической адсорбции на углеродной поверхности по механизму π-π стейкинга, что обеспечивает высокие скорости процесса и рекордную устойчивость в процессе электрохимического получения молекулярного водорода из воды. 7 ил., 1 табл.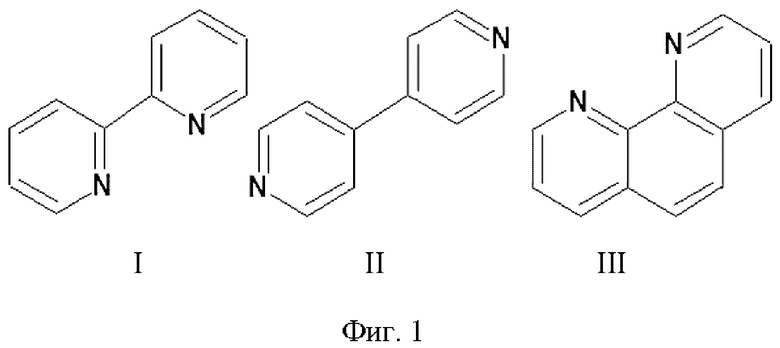
Применение гибридного материала на основе безметального электрокатализатора, представляющего собой органические гетероциклические соединения 4,4’-бипиридин, 2,2’-бипиридин и 1,10-фенантролин, иммобилизованные на поверхности углеродсодержащего катода, для генерирования молекулярного водорода из воды.
| СПОСОБ ПОЛУЧЕНИЯ МОЛЕКУЛЯРНОГО ВОДОРОДА | 2011 |
|
RU2487965C2 |
| WO 2022018243 A1, 27.01.2022 | |||
| CN 108325565 A, 27.07.2018. | |||
Авторы
Даты
2022-10-11—Публикация
2021-12-22—Подача