Изобретение относится к области биотехнологии, иммунологии, вирусологии, генетики, молекулярной биологии и медицинской вирусологии. Более конкретно, настоящее изобретение относится к рекомбинантному штамму на основе вируса гриппа для индукции специфического иммунитета к вирусу гриппа и коронавирусу SARS-CoV-2 и может быть использовано в здравоохранении для профилактики заболеваний, вызванных вирусом гриппа и/или коронавирусом SARS-CoV-2.
Грипп - острое респираторное заболевание, вызванное вирусами гриппа, характеризующееся высокой заболеваемостью и смертностью среди населения, что определяет его высокую социально-экономическую значимость. Ежегодно вирусы гриппа вызывают эпидемии, а раз в 10-40 лет - пандемии гриппа, что связано с высокой антигенной изменчивостью вируса и возможностью реассортации с вирусами гриппа животных, прежде всего птиц [https://www.who.int/bulletin/volumes/90/4/12-020412/ru/].
Коронавирусная инфекция COVID-19 - острое респираторное заболевание, вызванное бета-коронавирусами SARS-CoV-2. Возникшая в 2020 году пандемия COVID-19 уже унесла более 6 млн человеческих жизней во всем мире [https://www.worldometers.info/coronavirus/]. Данное заболевание отличается высокой частотой осложнений, часто приводящих к летальному исходу либо инвалидизации, а также высокой скоростью глобального распространения. Отсутствие высокоэффективной специфической противовирусной терапии делает особенно острым вопрос профилактики инфекции.
Известен способ профилактики гриппа с использованием инактивированных вакцин. К недостаткам такого типа вакцин можно отнести то, что препараты из данной группы направлены на стимуляцию прежде всего гуморального иммунного ответа. Также недостатком является инвазивный путь введения.
Применяются также препараты живой гриппозной вакцины с интраназальным путем введения. В Российской Федерации живая гриппозная интраназальная вакцина была зарегистрирована в 1987 году и применяется для профилактики гриппа у детей старше 3 лети и взрослых без ограничения возраста. Многолетние пострегистрационные исследования показали, что данный препарат является безопасным и эффективно защищает от инфицирования гриппом, а также предотвращает развитие осложненной гриппозной инфекции [Дорошенко Е.М., Григорьева Е.П. Безопасность, иммуногенность и эффективность живых гриппозных аттенуированных интраназальных вакцин - опыт многолетнего применения в различных возрастных группах. Эпидемиология и вакцинопрофилактика. 2013. №4(71). С.67-73.], но не обладает профилактическим действием против коронавирусной инфекции.
Близким техническим решением для профилактики коронавирусной инфекции является использование векторной вакцины на основе аденовирусных векторов, экспрессирующих белок шипа коронавируса [Logunov DY, Dolzhikova IV, Shcheblyakov DV et. al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021 Feb 20; 397(10275):671-681. doi: 10.1016/S0140-6736(21)00234-8. Epub 2021 Feb 2. Erratum in: Lancet. 2021 Feb 20;397(10275):670. PMID: 33545094; PMCID: PMC7852454; Halperin SA, Ye L, MacKinnon-Cameron D et al. Final efficacy analysis, interim safety analysis, and immunogenicity of a single dose of recombinant novel coronavirus vaccine (adenovirus type 5 vector) in adults 18 years and older: an international, multicentre, randomised, double-blinded, placebo-controlled phase 3 trial. Lancet. 2022 Jan 15;399(10321):237-248. doi: 10.1016/SO 140-6736(21)02753-7. Epub 2021 Dec 23. Erratum in: Lancet. 2022 Jan 15; 399(10321):236. PMID: 34953526; PMCID: РМС8700283]. Недостатком данного решения по сравнению с предлагаемым изобретением является отсутствие формирования иммунитета к гриппозной инфекции, инвазивный путь введения, а также сложность замены векторной платформы на антигенно отличающуюся, что необходимо для избегания иммунного ответа на вектор при повторном введении. Настоящее изобретение направлено на сочетанную профилактику гриппозной и коронавирусной инфекций, что значительно облегчит задачи практического здравоохранения, поскольку с помощью одной прививочной кампании будет обеспечена защита от двух наиболее актуальных респираторных вирусных инфекций.
Задачей, на решение которой направлено заявляемое изобретение, является получение рекомбинантного штамма на основе аттенуированного холодоадаптированного вируса гриппа для индукции специфического иммунитета к вирусу гриппа и коронавирусу SARS-CoV-2 и/или профилактики заболеваний, вызванных вирусом гриппа и/или коронавирусом SARS-CoV-2. В данном аспекте в геном известного штамма живой гриппозной вакцины встраиваются антигенные детерминантны коронавируса SARS-CoV-2 с использованием методов генной инженерии. Данный препарат может быть использован в качестве интраназальной вакцины, его преимуществами является способность эффективно индуцировать развитие иммунного ответа как на вирус гриппа, так и на коронавирус, способность стимулировать развитие местного иммунного ответа во входных воротах респираторных инфекций, простота замены антигенных детерминант вектора для избегания бустирования иммунного ответа на вектор.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Авторами изобретения был разработан рекомбинантный штамм на основе вируса гриппа для индукции специфического иммунитета к вирусу гриппа и коронавирусу SARS-CoV-2 и/или профилактики заболеваний, вызванных вирусом гриппа и/или коронавирусом SARS-CoV-2. Авторы изобретения установили, что разработанный рекомбинантный вирус при интраназальном введении млекопитающим индуцирует развитие гуморального и Т-клеточного иммунного ответа к вирусу гриппа и коронавирусу SARS-CoV-2, а также обеспечивает комбинированную защиту от гриппа и SARS-CoV-2.
Краткое описание изобретения
Настоящее изобретение относится к рекомбинантному штамму на основе вируса гриппа для индукции специфического иммунитета к вирусу гриппа и коронавирусу SARS-CoV-2 и/или профилактики заболеваний, вызванных вирусом гриппа и/или коронавирусом SARS-CoV-2. Рекомбинантный штамм вируса гриппа сконструирован путем целенаправленной модификации генома аттенуированного холодоадаптированного штамма живой гриппозной вакцины, а именно за счет встраивания антигенной детерминанты вируса SARS-CoV-2, ответственной за выработку гуморального и Т-клеточного иммунитета, в ген гемагглютинина вируса гриппа таким образом, что антиген SARS-CoV-2 экспонируется на поверхности вирусной частицы.
Краткое описание фигур
Фиг. 1. Схематическое изображение генетической конструкции и визуализация химерного белка гемагглютинина. А. Схема химерного гена. НТР - нетранслируемые регионы. СП - последовательность, кодирующая сигнальный пептид гемагглютинина. RBD194 - последовательность, кодирующая рецептор-связывающий домен белка шипа коронавируса. НА1, НА2 - субъединицы гемагглютинина. Стрелкой показан гибкий линкер. Б. Визуализация химерного белка гемагглютинина, полученная с использованием программы Chimera 1.14. В качестве основы использованы модель тримера гемагглютинина вируса гриппа Н7, построенная методом моделирования по гомологии с использованием сервиса swissmodel.expasy.org и фрагмент рецептор-связывающего домена белка шипа коронавируса SARS-CoV-2 (PDBID 6vxx). На визуализации фрагмент белка коронавируса представлен только на одном из мономеров, для удобства восприятия. Фрагмент белка коронавируса показан черным цветом.
Фиг. 2. Ростовые характеристики рекомбинантного и контрольного вируса в РКЭ и культуре клеток MDCK при оптимальной температуре инкубации. В качестве контроля был использован вакцинный штамм на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), имеющий поверхностные гены НА и NA штамма А/Ануи/1/2013 (H7N9) - ЖГВ, тогда как рекомбинантный штамм дополнительно имел вставку RBD194 в молекуле НА - ЖГВ/Н7+RBD194.
Фиг. 3. Ростовые характеристики рекомбинантного и контрольного вируса в РКЭ при различных температурах инкубации. В качестве контроля был использован вакцинный штамм на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), имеющий поверхностные гены НА и NA штамма А/Ануи/1/2013 (H7N9) - ЖГВ, тогда как рекомбинантный штамм дополнительно имел вставку RBD194 в молекуле НА - ЖГВ/H7+RBD194.
Фиг.4. Кинетика накопления рекомбинантного и контрольного вируса в культуре клеток MDCK при оптимальной температуре инкубации и различных множественностях заражения (А - 0,01; Б - 0,001). В качестве контроля был использован вакцинный штамм на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), имеющий поверхностные гены НА и NA штамма А/Ануи/1/2013 (H7N9) - ЖГВ, тогда как рекомбинантный штамм дополнительно имел вставку RBD194 в молекуле НА - ЖГВ/Н7+RBD194.
Фиг. 5. Оценка экспрессии RBD белка рекомбинантным и контрольным вирусами. А. электрофоретическое разделение белков в невосстанавливающих условиях (-) и в восстанавливающих условиях (+). Б. Вестерн блот анализ тех же белков при проявке первичными анти-RBD антителами. В. Вестерн блот анализ тех же белков при проявке гипериммунной мышиной сывороткой к ЖГВ H7N9. В качестве контроля был использован вакцинный штамм на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), имеющий поверхностные гены НА и NA штамма А/Ануи/1/2013 (H7N9) - ЖГВ, тогда как рекомбинантный штамм дополнительно имел вставку RBD194 в молекуле НА - ЖГВ/Н7+RBD194. Также в качестве контроля при проведении анализа был использован рекомбинантный белок RBD.
Фиг. 6. Уровень экспрессии белка RBD в клетках MDCK, инфицированных рекомбинантным вирусом и вирусным вектором с множественностью заражения 0,002. В качестве контроля был использован вакцинный штамм на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), имеющий поверхностные гены НА и NA штамма А/Ануи/1/2013 (H7N9) - ЖГВ, тогда как рекомбинантный штамм дополнительно имел вставку RBD194 в молекуле НА - ЖГВ/Н7+RBD194.
Фиг. 7. Титры вирусов в респираторном тракте мышей линии BALB/c по результатам титрования в РКЭ. В качестве контроля был использован вакцинный штамм на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), имеющий поверхностные гены НА и NA штамма А/Ануи/1/2013 (H7N9) - ЖГВ, тогда как рекомбинантный штамм дополнительно имел вставку RBD194 в молекуле НА - ЖГВ/H7+RBD194.
Фиг. 8. Титры вирусов в респираторном тракте сирийских хомячков (Фрагменты А, В - носовые ходы; Б, Г - легкие) по результатам титрования в РКЭ (А, Б) и по результатам определения методом qPCR (В, Г). В качестве контроля был использован вакцинный штамм на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), имеющий поверхностные гены НА и NA штамма А/Ануи/1/2013 (H7N9) - ЖГВ, тогда как рекомбинантный штамм дополнительно имел вставку RBD194 в молекуле НА - ЖГВ/Н7+RBD194. Животные из группы плацебо получали раствор фосфатно-солевого буфера - PBS.
Фиг. 9. Уровни IgG антител, специфических цельному вирусу гриппа (А) и RBD белку (Б), в сыворотке крови мышей линии BALB/c, двукратно иммунизированных указанными вирусами. В качестве контроля был использован вакцинный штамм на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), имеющий поверхностные гены НА и NA штамма А/Ануи/1/2013 (H7N9) - ЖГВ, тогда как рекомбинантный штамм дополнительно имел вставку RBD194 в молекуле НА - ЖГВ/H7+RBD194. Животные из группы плацебо получали раствор фосфатно-солевого буфера - PBS.
Фиг. 10. Уровни IgG антител, специфических цельному вирусу гриппа (верхняя панель) или RBD домену коронавируса (нижняя панель), в сыворотке крови сирийских хомячков, двукратно иммунизированных указанными вирусами. В качестве контроля был использован вакцинный штамм на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), имеющий поверхностные гены НА и NA штамма А/Ануи/1/2013 (H7N9) - ЖГВ, тогда как рекомбинантный штамм дополнительно имел вставку RBD194 в молекуле НА - ЖГВ/Н7+RBD194. Животные из группы плацебо получали раствор фосфатно-солевого буфера - PBS.
Фиг. 11. Защитная эффективность рекомбинантного и контрольного вируса в отношении коронавируса SARS-CoV-2 на модели сирийских хомячков. В качестве контроля был использован вакцинный штамм на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), имеющий поверхностные гены НА и NA штамма А/Ануи/1/2013 (H7N9) - ЖГВ, тогда как рекомбинантный штамм дополнительно имел вставку RBD194 в молекуле НА - ЖГВ/Н7+RBD194. Животные из группы плацебо получали раствор фосфатно-солевого буфера - PBS. Фрагмент А. Динамика изменения массы тела животных. Фрагмент Б. Сумма баллов клинических проявлений заболевания в течение периода наблюдения (5 дней после заражения). Фрагмент В. Титр вируса SARS-CoV-2 в носовых ходах хомяков на 5 сутки после заражения. Фрагмент Г. Титр вируса SARS-CoV-2 в тканях легких хомяков на 5 сутки после заражения.
Фиг. 12. Защитная эффективность рекомбинантного и контрольного вирусов гриппа в отношении вируса гриппа А на модели сирийских хомяков. Титр вируса гриппа А (вирулентный штамм вируса гриппа H7N9/PR8, который содержит гены НА и NA от штамма А/Шанхай/2/2013 (H7N9), а остальные шесть генов - от лабораторного штамма A/PR/8/34 (H1N1)) в легочной ткани хомяков на 5 сутки после заражения. В качестве контроля был использован вакцинный штамм на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), имеющий поверхностные гены НА и NA штамма А/Ануи/1/2013 (H7N9) - ЖГВ, тогда как рекомбинантный штамм дополнительно имел вставку RBD194 в молекуле НА - ЖГВ/Н7+RBD194. Животные из группы плацебо получали раствор фосфатно-солевого буфера - PBS.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение представляет собой рекомбинантный штамм на основе вируса гриппа, разработанный для индукции специфического иммунитета к вирусу гриппа и коронавирусу и/или профилактики заболеваний, вызванных вирусом гриппа и коронавирусом. Принцип работы изобретения заключается в следующем: в ген гемагглютинина вируса гриппа вставлен генетический материал коронавируса и фрагмент, кодирующий линкер, таким образом, чтобы в зрелой вирусной частице к N-концу мономера гемагглютинина через гибкий линкер был присоединен фрагмент белка шипа коронавируса. При этом вирус гриппа подготовлен на основе донора аттенуации живой гриппозной вакцины - вируса А/Ленинград/134/17/57 (H2N2): от данного вируса унаследованы 6 генов, кодирующих внутренние и неструктурные белки вируса (РВ2, РВ1, PA, NP, М, NS) [Isakova-Sivak I, Chen LM, Matsuoka Y, Voeten JT, Kiseleva I, Heldens JG, den Bosch Hv, Klimov A, Rudenko L, Cox NJ, Donis RO. Genetic bases of the temperature-sensitive phenotype of a master donor virus used in live attenuated influenza vaccines: A/Leningrad/134/17/57 (H2N2). Virology. 2011 Apr 10; 412(2):297-305. doi: 10.1016/j.virol.2011.01.004]. В разных вариантах осуществления изобретения ген гемагглютинина вируса в составе изобретения может быть унаследован от вируса гриппа А и модифицирован путем встраивания генетического фрагмента, кодирующего фрагмент белка шипа коронавируса, соединенного с фрагментом, кодирующим гибкий линкер, между последовательностью, кодирующей сигнальный пептид гемагглютинина вируса гриппа и последовательностью, кодирующей субъединицу НА1 вируса гриппа. Нейраминидаза вируса в составе изобретения может быть унаследована от того же штамма, от которого использована последовательность гена гемагглютинина, либо штамма того же подтипа, либо другого штамма вируса гриппа А, обеспечивающая способность вируса указанной конструкции к эффективной репликации.
В некоторых вариантах осуществления изобретения участок белка шипа коронавируса составляет 194 аминокислотных остатка и соответствует позициям 333-526 белка Spike коронавируса hCoV-19/St_Petersburg-3524S/2020 (RBD194) с аминокислотной последовательностью SEQ ID NO: 1, нуклеотидной последовательностью SEQ ID NO: 2.
Под признаком «вирус гриппа» подразумеваются вирусы из семейства ортомиксовирусов {Orthomyxoviridae), включающие в себя монотипные роды Alphainfluenzavirus (ранее - вирус гриппа типа A), Betainfluenzavirus (ранее -вирус гриппа типа В), Gammainfluenzavirus (ранее - вирус гриппа типа С) и Deltainfluenzavirus (ранее - вирус гриппа типа D), у которых разделение по родам определяется за счет антигенных свойств рибонуклеопротеинового комплекса. Вирус гриппа представляет собой оболочечный вирус сферической формы диаметром 100-120 нм, внешний слой которого состоит из липидной мембраны, на которой экспонированы основные гликопротеины вируса -гемагглютинин (НА) и нейраминидаза (NA), - и матриксный белок М2, формирующий ионные каналы. Под липидной мембраной расположен матриксный белок 1 (Ml), определяющий форму вирусной частицы. Геном вируса гриппа сегментирован и представлен минус-нитевой РНК, которая находится внутри вириона в виде рибонуклеопротеинового комплекса (РНП). У вируса гриппа типа А 8 фрагментов РНК кодируют, по меньшей мере, 12 белков: НА, M1, М2, NA, NP, NS1, NS2, PA, РА-Х, РВ1, PB1-F2, РВ2. На основании антигенных свойств поверхностных антигенов НА и NA вирусы гриппа А делятся на сероподтипы, например, H1N1, H1N2, H2N2, H3N2, H5N1 и т.д.
В некоторых вариантах выделенный рекомбинантный вирус на основе вируса гриппа представляет собой вакцинные штаммы вируса гриппа.
Вакцинные штаммы характеризуются тем, что содержат гены, кодирующие внутренние и неструктурные белки вируса гриппа (M1, М2, NP, NS1, NS2, РА, РА-Х, РВ1, PB1-F2, РВ2), от специального лабораторного штамма А/Ленинград/134/17/57 (H2N2) или его производных. Штамм А/Ленинград/134/17/57 (H2N2) был получен методом холодовой адаптации эпидемического вируса А/Ленинград/134/57 (H2N2), путем его 17-кратного пассирования в развивающихся куриных эмбрионах при пониженной до 25°С температуре [Alexandrova G.I., Smorodintsev А.А. Obtaining of an additionally attenuated vaccinating cryophilic influenza strain // Rev Roum Inframicrobiol. - 1965. - V. 2. - №. - p. 179-189.]. В результате пассажей вирус А/Ленинград/134/17/57 (H2N2) приобрел набор мутаций в генах, кодирующих поверхностные и внутренние белки вириона (таблица 1), которые обусловили его температурочувствительный, холодоадаптированный и аттенуированный фенотип. У штамма была определена первичная нуклеотидная последовательность (номер изолята в базе GISAID EPI_ISL_169836, коды доступа генов EPI555079 до EPI555086). Ранее было показано, что мутантный белок РВ2 является основным определяющим фактором аттенуированного фенотипа у штамма А/Ленинград/134/17/57 (H2N2), а полимеразные гены РВ1 и РА дополняют этот признак [Klimov A.I., Kiseleva I.V., Alexandrova G.L, Cox N.J. Genes coding for polymerase proteins are essential for attenuation of the cold-adapted A/Leningrad/134/17/57 (H2N2) influenza virus, in Options for the Control of Influenza IV. 2001. Okinawa, Japan: Elsevier Science BV.]. Также была определена роль индивидуальных мутаций в геноме штамма А/Ленинград/134/17/57 (H2N2) в проявлении основного фенотипического признака вируса - чувствительности к повышенным температурам инкубации [Isakova-Sivak I, Chen LM, Matsuoka Y, Voeten JT, Kiseleva I, Heldens JG, den Bosch Hv, Klimov A, Rudenko L, Cox NJ, Donis RO. Genetic bases of the temperature-sensitive phenotype of a master donor virus used in live attenuated influenza vaccines: A/Leningrad/134/17/57 (H2N2). Virology. 2011 Apr 10; 412(2):297-305. doi: 10.1016/j.virol.2011.01.004].
В некоторых вариантах осуществления изобретения выделенный рекомбинантный вирус на основе вируса гриппа получают из аттенуированного вируса гриппа.
В некоторых вариантах осуществления изобретения выделенный рекомбинантный вирус на основе вируса гриппа получают из холодоадаптивного вируса гриппа.
В некоторых вариантах осуществления изобретения выделенный рекомбинантный вирус на основе вируса гриппа получают из вируса гриппа типа H2N2.
В некоторых вариантах осуществления изобретения выделенный рекомбинантный вирус на основе вируса гриппа получают из вируса А/Ленинград/134/17/57 (H2N2) или его производных.
К производным вируса А/Ленинград/134/17/57 (H2N2) относятся:
1) вирусы гриппа типа А, у которых поверхностные антигены НА и NA принадлежат ранее циркулировавшим, потенциально пандемическим, пандемическим или сезонным эпидемическим вирусам гриппа А подтипов H1N1, H1N2, H2N2, H3N2, H5N1, H5N2, H5N6, H5N8, H6N1, H7N2, H7N3, H7N7, H7N9, H9N2, H10N7, H17N10, H18N11, а гены внутренних и неструктурных белков - штамму А/Ленинград/134/17/57 (H2N2);
2) вирусы гриппа типа А, у которых один и более генов А/Ленинград/134/17/57 (H2N2) заменены на соответствующие гены любого другого вируса гриппа типа А;
3) вирусы гриппа типа А, имеющие идентичную с А/Ленинград/134/17/57 (H2N2) аминокислотную последовательность вирусных белков, кодируемых любой нуклеотидной последовательностью (учитывается вырожденность кодонов для ряда аминокислот);
4) вирусы гриппа типа А любого сероподтипа, содержащие аминокислотные остатки во внутренних и неструктурных белках, описанные для донора аттенуации А/Ленинград/134/17/57 (H2N2) (PB2-Leu478; РВ1-Asn265; PB1-Ile591; PA-Pro28; PA-Leu341; M1-Val15; M1-Leu144; NS2-Ile100), в полном объеме или в различных комбинациях;
5) вирусы гриппа типа А, последовательность внутренних и неструктурных белков которых (M1, М2, NP, NS1, NS2, РА, РА-Х, РВ1, РВ1-F2, РВ2) отличается от вируса А/Ленинград/134/17/57 (H2N2) на ряд аминокислот;
6) вирус гриппа А любого сероподтипа, содержащий модифицированные гены штамма А/Ленинград/134/17/57 (H2N2) (учитывается укорочение рамки считывания NS1 гена).
ПРИМЕРЫ
Для наилучшего понимания изобретения приводятся следующие примеры. Эти примеры приведены только в иллюстративных целях и не должны толковаться как ограничивающие сферу применения изобретения в любой форме.
Хотя вышеупомянутое изобретение было довольно подробно описано путем иллюстрации и примера в целях исключения двусмысленного толкования, специалистам в данной области на основе идей, раскрытых в данном изобретении, будет вполне понятно, что могут быть внесены определенные изменения и модификации без отклонения от сущности и объема прилагаемых вариантов осуществления изобретения.
Пример 1. Получение вектора для обратной генетики вируса гриппа, кодирующего модифицированный гемагглютинин вируса гриппа со вставкой антигенного фрагмента коронавируса.
Получение вектора для обратной генетики вируса гриппа, кодирующего модифицированный гемагглютинин вируса гриппа со вставкой антигенного фрагмента коронавируса, проводили в два этапа. На первом этапе готовили генетически-модифицированный ген гемагглютинина, содержащий сайт для клонирования целевого фрагмента по известным сайтам рестрикции. На втором этапе проводили клонирование антигенного фрагмента коронавируса в подготовленный генетически модифицированный ген гемагглютинина.
Принципы получения и использования генетически-модифицированного гена гемагглютинина, описанные в настоящем примере, не ограничиваются генетическими последовательностями гемагглютинина приведенных для примера штаммов вируса гриппа А, с использованием того же принципа могут быть получены конструкции на основе генетической последовательности гемагглютинина других вирусов гриппа, приводящие в итоговой генетической конструкции к получению химерного гена гемагглютинина с сайтами рестрикции, по которым между генетической последовательностью, кодирующей сигнальный пептид, и генетической последовательностью, кодирующей субъединицу НА1 молекулы гемагглютинина, можно встроить подготовленный чужеродный генетический материал с помощью лигирования.
Для получения вектора, кодирующего генетически-модифицированный ген гемагглютинина вируса гриппа, подготовленный для встраивания чужеродного генетического материала по сайтам рестрикции, получали ДНК-копию химерного гена гемагглютинина. Химерный ген получали методом перекрывающейся ПЦР (оверлап-ПЦР) на основе двух ДНК-фрагментов, полученных из материала ДНК-копии гена гемагглютинина соответствующего вируса гриппа, встроенного в вектор, с применением метода ПЦР с использованием специфических олигонуклеотидов. Плазмидная ДНК на основе вектора pCIPolISapIT, кодирующая ген НА, была разработана в отделе вирусологии ФГБНУ «ИЭМ» и является собственностью отдела [Е.А. Stepanova, Т.S. Kotomina, V.A. Matyushenko, Т.A. Smolonogina, V.S. Shapovalova, L.G. Rudenko, and I.N. Isakova-Sivak. Amino Acid Substitutions N123D and N149D in Hemagglutinin Molecule Enhance Immunigenicity of Live Attenuated Influenza H7N9 Vaccine Strain in Experiment. Bulletin of Experimental Biology and Medicine, 2019 March, 166(5). doi: 10.1007/s10517-019-04407-1]. Для получения фрагментов на первом этапе для гена использованного в примере вируса А/Ануи/1/2013 (H7N9) были использованы пары олигонуклеотидов 1+4 и 2+3 (табл.2). Для получения полной последовательности измененного гена на основе фрагментов методом оверлап-ПЦР была использована пара олигонуклеотидов 5+6 (табл.2). Полная последовательность измененного гена гемагглютинина соответствует SEQ ID NO: 3.

Химерный ген, полученный на предыдущем этапе, амплифицированный с использованием олигонуклеотидов 5+6, очищали с помощью электрофореза в 1% агарозном геле с последующим выделением из геля с использованием набора реагентов Clean-Up S-cup (Евроген, Россия). Очищенную ДНК обрабатывали эндонуклеазой рестрикции SapI (необходимые для рестрикции последовательности были добавлены на концы химерного гена с помощью олигонуклеотидов 5+6 таблица 2) и методом лигирования клонировали в вектор для обратной генетики вируса гриппа pCIPolISapIT по сайтам SapI.
Конечный вектор представляет собой конструкцию, позволяющую осуществлять получение на ее основе различных комбинаций гемагглютинина вируса гриппа и вставок генетического материала различного происхождения, кодирующих антигенные фрагменты, в том числе антигенные фрагменты коронавируса SARS-CoV-2.
Встраивание фрагмента коронавируса в полученный вектор (вектор для обратной генетики вируса гриппа со вставкой последовательности, соответствующей SEQ ID NO: 3) производили методом клонирования с помощью рестрикции эндонуклеазой BsmBI с последующим лигированием. Для этого производили амплификацию фрагмента гена, кодирующего RBD домен S-белка коронавируса, методом ПЦР с обратной транскрипцией с помощью специфических олигонуклеотидов, приведенных в таблице 3. С помощью данных олигонуклеотидов к С-концу фрагмента гена S-белка коронавируса вносили последовательность гибкого линкера, а также на оба конца фрагмента вносили последовательности, необходимые для рестрикции эндонуклеазой BsmBI с формированием концов ДНК, необходимых для лигирования в вектор, содержащий последовательность, кодирующую модифицированный гемагглютинин SEQ ID NO: 3, описанный выше.

Далее производили рестрикцию с помощью эндонуклеазы BsmBI, после чего лигировали фрагмент в обработанный рестриктазой BsmBI вектор, содержащий последовательность SEQ ID NO:3, кодирующую модифицированный гемагглютинин, описанный выше. Материалом лигирования трансформировали компетентные клетки E.coli, производили скрининг колоний; биомассу из колонии бактерий, содержащую нужную плазмиду, накапливали и производили очистку плазмиды.
Конечный вектор содержит все необходимые элементы для экспрессии химерного гена вируса гриппа со встроенными фрагментами генетического материала коронавируса, а также сборки жизнеспособного рекомбинантного вакцинного штамма. Аминокислотная последовательность белка гемагглютинина, получающегося в результате трансляции химерного гена, соответствует последовательности SEQ ID NO: 4. Нуклеотидная последовательность гена, кодирующего химерный гемагглютинин со вставкой последовательности RBD194 фрагмента, соответствует последовательности SEQ ID NO: 5.
Схема конструкции и визуализация химерного белка гемагглютинина, полученная с использованием программы Chimera приведена на фиг. 1. Так, после трансляции и сборки вирусной частицы, фрагмент S белка коронавируса экспонирован снаружи вируса, что позволяет ему вступать в контакт с клетками иммунной системы в виде поверхностной структурной единицы вирусной частицы. Гибкий линкер необходим для корректного процессинга и фолдинга фрагмента белка коронавируса как структурно отдельной единицы, и корректного фолдинга, тримеризации и функционирования гемагглютинина вируса гриппа.
Пример 2. Сборка рекомбинантного штамма на основе аттенуированного вируса гриппа.
Получение рекомбинантного штамма с модифицированным гемагглютинином осуществляли на основе обратно-генетической системы, разработанной для донора аттенуации для живой гриппозной вакцины, штамма А/Ленинград/134/17/57 [Isakova-Sivak, I. et al., "Characterization of reverse genetics-derived cold-adapted master donor virus A/Leningrad/134/17/57 (H2N2) and reassortants with H5N1 surface genes in a mouse model.", 2014, Clin Vaccine Immunol 21(5): 722-731 и Isakova-Sivak, I. et al., "Genetic bases of the temperature-sensitive phenotype of a master donor virus used in live attenuated influenza vaccines: A/Leningrad/134/17/57 (H2N2).", 2011, Virology 412(2): 297-305].
Сборку вируса осуществляли методом электропорации сертифицированной линии клеток Vero (WHO) плазмидами, необходимыми для сборки жизнеспособного вируса гриппа. В данном примере показано получение жизнеспособных рекомбинантных вирусов гриппа с модифицированным гемагглютинином, на N-конце которого присутствует вставка антигенного участка коронавируса, присоединенная к молекуле мономера гемагглютинина через гибкий линкер. Для сборки химерного вируса гриппа использовались следующие плазмиды:
1. Плазмиды (вектор для обратной генетики вируса гриппа), со вставкой, кодирующей гены донора аттенуации живой гриппозной вакцины А/Ленинград/134/17/57 (H2N2). В каждой из использованных плазмид закодирован один из следующих генов вируса А/Ленинград/134/17/57 (H2N2): РВ2, РВ1, PA, NP, M, NS. Плазмиды разработаны в отделе вирусологии ФГБНУ «ИЭМ» и являются собственностью отдела.
2. Вектор для обратной генетики вируса гриппа со вставкой, кодирующей модифицированный гемагглютинин вируса гриппа А/Ануи/1/2013 (H7N9) со вставкой RBD домена Spike-белка коронавируса, полученный в примере 1. Последовательность вставки соответствует SEQ ID NO: 5. В качестве примера использована последовательность исходного коронавируса SARS-CoV-2, выделенного в первую эпидемическую волну в начале 2020 года.
Специалистам в данной области технологии понятно, что для конструирования рекомбинантного вакцинного штамма могут быть использованы гены гемагглютинина вируса гриппа и других подтипов, а также последовательности RBD фрагмента эволюционно (антигенно) измененных коронавирусов человека, включая варианты SARS-CoV-2 альфа, бета, гамма, дельта, омикрон и др.
Для культивирования клеток использовались следующие материалы: бессывороточная питательная среда для культивирования клеток, добавка для роста клеток не сывороточного происхождения, клеточная линия Vero (сертифицированная), реагент для диссоциации адгезионной клеточной культуры, раствор антибиотика, антимикотика, трипсин, флаконы и стерильные чашки петри для адгезионных культур клеток, раствор Дульбекко фосфатно-солевой. Для концентрирования плазмидной ДНК использовались следующие реагенты: 70% раствор этанола, Трис-ЭДТА буфер, ЗМ натрий-ацетатный буфер (рН 4,8). Для осуществления процедуры электропорации использовались следующие материалы: электропоратор Neon (Thermo Scientific) в полной комплектации с прилагающимися компонентами, совместимый набор реагентов для проведения процедуры электропорации (буферы, капилляры). Для последующего культивирования вируса использовали 10-11-дневные SPF развивающиеся куриные эмбрионы.
Подготовка плазмид для получения вируса гриппа (сборка и концентрирование). Не позднее, чем за 18 часов до электропорации, плазмиды, кодирующие 8 генов вируса гриппа, смешивали в 1 пробирке типа эппендорф, из расчета 2 мкг каждой плазмиды (6 плазмид со вставкой генов РВ2, РВ1, PA, NP, М, NS вируса А/Ленинград/134/17/57 (H2N2); плазмида, со вставкой, кодирующей модифицированный гемагглютинин со вставкой генетического материала коронавируса; плазмида со вставкой, кодирующей нейраминидазу подтипа, соответствующего подтипу гемагглютинина). Далее добавляли 2,5-кратный объем натрий-ацетатного буфера, но не менее 120 мкл. Перемешивали на вортексе в течение 5 секунд, после чего инкубировали на -20°С в течение 16-18 часов. Через 16-18 часов эппендорфы с плазмидами центрифугировали при 4°С при 14 000 g в течение 15 минут, немедленно после центрифугирования полностью отбирали супернатант, не задевая осадок (при отсутствии осадка протокол начинали заново с момента сборки плазмид). Далее промывали осадок в 70% этаноле (120 мкл) и производили повторное центрифугирование при 14000 g в течение 5 минут при 4°С. Остатки этанола удаляли методом высушивания при комнатной температуре в течение 15 минут в пробирках с открытыми крышками. Осадок ресуспендировали в 8 мкл Трис-ЭДТА буфера.
Подготовка клеточной линии Vero. Для подготовки к трансфекции монослой клеток Vero с конфлюэнтностью 95-100% переносили на новый флакон в дозе, достаточной для получения монослоя с конфлюэнтностью 95-100% на момент процедуры электропорации (через 16-20 часов). Клетки культивировали в стерильной бессывороточной среде без добавления антибиотика и антимикотика при 37°С в СО2 инкубаторе. На следующий день клетки снимали с субстрата аккутазой, следуя тому же протоколу. Добавляли 10 мл разогретой до 37°С среды без антибиотика/антимикотика, переносили клетки в среде в стерильную пробирку и центрифугировали 15 минут при 1500 rpm и 20°С.
Электропорация. Перед проведением трансфекции дозатор для электропоратора, кюветы для электропорации, аппарат для проведения электропорации помещали в ламинарный бокс и облучали ультрафиолетом в течение 30 минут.
Клеточный монослой снимали с субстрата реагентом для диссоциации, после чего отмывали бессывороточной средой без антибиотика, предварительно разогретой до 37°С. Для этого клетки заливали 10 мл среды и центрифугировали при комнатной температуре при 1500 об/мин в течение 15 минут. Среду полностью удаляли и ресуспендировали клетки в буфере для ресуспендирования, совместимом с прибором для электропорации (Neon Transfection System, Thermofisher). Ресуспендирование производилось с расчетом 2-4 × 105 клеток на 1 трансфекцию (110 мкл буфера R в использованном примере). В 6-луночный планшет для культивирования клеток добавляли по 3 мл разогретой бессывороточной среды без антибиотика/антимикотика. В кювету для трансфекции наливали 3 мл электролитического буфера (Е2) и помещали в аппарат для проведения электропорации (Neon Pipette Station).
110 мкл суспензии клеток Vero добавляли в эппендорф с 8 мкл предварительно сконцентрированной плазмидной ДНК. Аккуратно перемешивали суспензию клеток с раствором плазмид, далее набирали суспензию в наконечник-капилляр и помещали дозатор Neon в аппарат для электропорации с подготовленной кюветой. Проводили электропорацию по протоколу 1150 V, 20 ms, 2 импульса. Далее суспензию раскапывали по подготовленной культуральной чашке, содержащей 3 мл предварительно разогретой бессывороточной среды без антибиотика/антимикотика. Чашку помещали в СО2 инкубатор на 37°С на 6 часов для прикрепления клеток, спустя 6 часов среду удаляли, дважды отмывали клетки стерильным фосфатно-буферным раствором и добавляли по 3 мл бессывороточной среды с добавлением антибиотика-антимикотика и трипсина, после чего планшет инкубировали при 33°С в СО2 инкубаторе в течение 64-72 часов.
Заражение развивающихся куриных эмбрионов (РКЭ) материалом после трансфекции. После 64-72 часов инкубации, трансфецированные клетки Vero снимали с субстрата с помощью скрепера для клеток и ресуспендировали в среде. В 10-11 дневный развивающийся куриный эмбрион вносили по 0,2 мл неразведенной среды со взвесью клеток и инкубировали в термостате температуре 33°С в течение 64-72 часов. После инкубации, эмбрионы охлаждали при температуре +4°С в течение 3-4 часов, после чего переходили к детекции вируса. Эмбрионы вскрывали и фиксировали наличие гемагглютинирующих вирусных частиц по стандартному протоколу реакции гемагглютинации с 1% эритроцитами курицы.
Получение стока рекомбинантного вируса. При наличии гемагглютинации, далее с рекомбинантным вирусом работали по стандартным протоколам, принятым для работы с вирусом гриппа [World Health Organization. (2011). Manual for the laboratory diagnosis and virological surveillance of influenza. World Health Organization. ISBN 978 92 4 154809 0 https://apps.who.int/iris/bitstream/handle/10665/44518/9789241548090 eng.pdf.?se quence=1]. Вирус клонировали в развивающихся куриных эмбрионах методом предельных разведений, анализировали генетический материал отдельных клонов методом секвенирования, на основе биоматериала верифицированных клонов стерильно накапливали рабочий сток вируса, осветляли центрифугированием, аликвотили и хранили при температуре -70°С для дальнейших исследований.
Пример 3. Оценка свойств рекомбинантного вируса in vitro. Инфекционный титр вируса в РКЭ и культуре клеток.
Инфекционную активность вирусов определяли в РКЭ и культуре клеток MDCK. Для титрования в РКЭ готовили 10-кратные разведения аликвоты стока вируса на стерильном, забуференном фосфатом физиологическом растворе, рН 7,4 (PBS), заражали материалом разведений куриные эмбрионы в объеме 0,2 мл на 1 РКЭ, через 72 часа детектировали наличие вируса в РКЭ методом гемагглютинации с 1% куриными эритроцитами. Титр вычисляли по методу Reed&Muench [Reed L.J., Muench H. A simple method of estimating fifty per cent endpoints // American journal of epidemiology. - 1938. - T. 27. - №. 3. - С.493-497] и выражали в 50%-ных эмбриональных инфекционных дозах (ЭИД50). Титрование производилось не менее 3 раз. Результат титрования представлен на фиг. 2. Для титрования в культуре клеток готовили 10-кратные разведения аликвоты стока вируса на питательной среде DMEM с трипсином, на предварительно подготовленный клеточный монослой с конфлюентностью 95-100% в 96-луночном планшете вносили по 25 мкл вируса в каждую лунку, инкубировали в течение 1 часа, удаляли вируссодержащий материал, добавляли питательной среды DMEM с трипсином и инкубировали в течение 72 часов при 33°С в атмосфере 5% CO2. Далее определяли наличие вируса в лунках планшета методом гемагглютинации с 1% куриными эритроцитами. Титр вычисляли по методу Reed&Muench и выражали в 50%-ных тканевых цитопатогенных инфекционных дозах (ТЦИД50). Титрование производилось не менее 3 раз. Результат титрования представлен на фиг. 2.
Фенотипические свойства рекомбинантного вируса гриппа.
Контроль температурочувствительности и холодоадаптированности вируса в РКЭ производился методом титрования в РКЭ с последующей инкубацией в течение 72 часов при температуре 39°С, либо в течение 6 суток при температуре 26°С. Титрование и детекцию производили по тому же протоколу, что и при определении инфекционной активности. Результаты определения фенотипов рекомбинантного и контрольного вирусов приведены на фиг. 3.
Кинетика репродукции рекомбинантного вируса в культуре клеток MDCK.
В настоящее время подавляющее большинство противогриппозных вакцин производится на развивающихся куриных эмбрионах, тогда как успешная платформа для создания векторных вакцин должна базироваться на клеточных технологиях, с возможностью быстрого масштабирования производства в условиях пандемии. Технология производства вакцины на перевиваемых клеточных линиях позволит повысить безопасность препаратов, особенно для лиц, имеющих противопоказания к вакцинации ввиду наличия аллергических реакций к куриному белку. Кроме того, в случае пандемии, вызванной вирусом гриппа птиц, новая технология позволит производить вакцину в больших объемах без риска потери основного субстрата. Эта технология также имеет важную экономическую составляющую, т.к. позволит сохранить куриные яйца как ценный пищевой ресурс. В этой связи было важно оценить способность рекомбинантного штамма вируса гриппа реплицироваться в наиболее распространенной клеточной линии - культуре клеток MDCK - в условиях их культивирования в стандартных лабораторных условиях (адгезионные клетки, среда с содержанием фетальной бычьей сыворотки), которая затем может быть адаптирована к суспензионному культивированию в бессывороточных средах в биореакторах на соответствующих производственных площадках.
Оценку репликативных свойств рекомбинантного штамма в сравнении с контрольным штаммом живой гриппозной вакцины ЖГВ H7N9 проводили путем инфицирования суточной культуры клеток MDCK на 6-луночных планшетах исследуемыми вирусами в двух множественностях заражения (MOI, multiplicity of infection - количество инфекционных единиц, выраженных в ТЦИД50, на одну клетку) - 0,01 и 0,001. Заражение клеток проводили по вышеописанной схеме, с добавлением 3 мл среды DMEM с трипсином и отбором проб каждые 12 часов. Отобранные образцы хранились при -70°С до их титрования на 96-луночных планшетах по методике, приведенной выше. Результаты эксперимента приведены на фиг. 4. Видно, что рекомбинантный штамм вируса гриппа, содержащий вставку фрагмента коронавируса, уступал в скорости накопления вирусной биомассы немодифицированному штамму живой гриппозной вакцины при множественности заражения 0,01, однако практически соответствовал ростовым характеристикам контрольного вируса при использовании MOI=0,001 (фиг. 4). Эти данные указывают на необходимость подбора заражающей дозы химерного вируса гриппа для оптимального накопления вирусной биомассы в производственных условиях.
Генетическая стабильность рекомбинантного вируса.
Верификация последовательности генома производилась методом секвенирования по Сэнгеру. Контроль генетической стабильности рекомбинантного вируса производился спустя 5 и 10 последовательных пассажей в развивающихся куриных эмбрионах. Анализировали последовательность гена гемагглютинина, содержащего вставку, а также сохранность мутаций, ответственных за аттенуацию вакцинного штамма [Isakova-Sivak, I. et al., "Genetic bases of the temperature-sensitive phenotype of a master donor virus used in live attenuated influenza vaccines: A/Leningrad/134/17/57 (H2N2).", 2011, Virology 412(2): 297-305)]. Для этого амплифицировали последовательности интересующих участков генов с помощью специфических праймеров (последовательность гена НА - полностью, последовательность генов, содержащих мутации, отвечающие за аттенуацию вируса - частично, фрагменты, содержащие интересующую нуклеотидную позицию), очищали с помощью электрофореза в 1% агарозном геле с последующей очисткой и производили секвенирование на автоматическом капиллярном секвенаторе ABI Prism 3031x1 Genetic Analyzer (Applied Biosystems, USA) с набором реагентов BrilliantDye™Terminator, v 3.1.
Была подтверждена сохранность всех аттенуирующих мутаций как на 5, так и на 10 пассаже вируса в РКЭ. Было подтверждено отсутствие мутаций в последовательности гемагглютинина вируса гриппа и последовательности вставки фрагмента гена белка шипа коронавируса. При исследовании генетической стабильности вируса была обнаружена вариабельность в области гибкого линкера, соединяющего фрагмент белка шипа коронавируса с гемагглютинином, не приводящая к изменению антигенных свойств вируса либо вставки. Варьировали аминокислоты в шестой и седьмой позициях линкера: GGGGS G/D/C G/R GGS (обнаружены на стадии клонирования популяции вируса). В итоговой популяции закрепился вариант, содержащий линкер GGGGSDGGGS.
Детекция экспресии вставки в составе гемагглютинина в вирусной частице методом вестерн-блот.
Электрофорез белков в ПААГ проводили по ранее описанной методике [Westermeier, R., Electrophoresis in practice: a guide to methods and applications of DNA and protein separations, fifth ed., Wiley-VCH, Verlag, 2016]. В работе использовался разделяющий гель с концентрацией акриламида 12,5% и концентрирующий гель с концентрацией акриламида 5%. Для приготовления разделяющего геля использовали 50 мМ трис-HCl буфер (рН 6,8), концентрирующего - 0,375 мМ трис-HCl буфер (рН 8,8), в качестве электродного - буфер, содержащий 25 мМ трис-HCl и 192 мМ глицина, рН 8,3. Для приготовления проб использовали двукратный буфер следующего состава: 0,125 М трис-HCl, 4% SDS, 20% глицерина, 0,02% бромфенолового синего, 2% β-меркаптоэтанола (для проб, анализируемых в восстанавливающих условиях), рН 6,8. Пробы, для приготовления которых использовали буфер с β-меркаптоэтанолом, после смешивания подвергали кипячению в течение 5 минут. Концентрация проб по белку 0.2 мг/мл (3.2 мкг белка на дорожку геля). После нанесения проб объемом 15 мкл электрофорез проводили при напряжении 40 V (из расчета на один гель) в течение 20 мин и далее - при силе тока 200 А до конца электрофоретического разделения. Затем гели извлекали из электрофоретической установки, промывали дистиллированной водой, и визуализировали результаты электрофореза с помощью окрашивания раствором Кумасси G-250 в течение 30 минут при комнатной температуре с последующей двукратной отмывкой по 2 часа 5% раствором уксусной кислоты при комнатной температуре.
В ряде случаев анализ результатов электрофоретического разделения проводили методом иммуноблоттинга по стандартному протоколу [Mahmood Т., Yang Р. С.Western blot: technique, theory, and troubleshooting // North American journal of medical sciences. - 2012. - Vol.4. - №9. - P. 429-434]. Для этого белки влажным способом переносили на нитроцеллюлозную мембрану с диаметром пор 0,45 мкм в течение 1 ч при силе тока 350 мА (в качестве электродного использовали буфер, содержащий 25 мМ трис-HCl, 192 мМ глицина и 20% метанола, рН 8,3). Затем мембрану промывали дистиллированной водой и окрашивали раствором Понсо для проверки эффективности переноса. После этого мембрану инкубировали в PBS, содержащем 0,05% Tween-20 и 2% бычьего сывороточного альбумина в течение 1 часа на шейкере при 37°С, после чего добавляли раствор первичных поликлональных анти-RBD антител кролика в том же буфере с концентрацией 5 мкг/мл (или 1:100 в случае использования анти-H7N9 сыворотки) и инкубировали в течение 18 ч при 4°С. Затем, после трехкратной отмывки мембраны PBS, содержащим 0,05% Tween-20, ее погружали в раствор соответствующих антивидовых вторичных антител, конъюгированных с пероксидазой хрена (1:3000, Bio-Rad, США) в PBS, содержащем 0,05% Tween-20 и 2% бычьего сывороточного альбумина, и инкубировали на шейкере при 37°С в течение 1 часа. После трехкратной отмывки мембраны PBS, содержащим 0,05% Tween-20, результат окрашивания проявляли с помощью 0,05% раствора диаминобензидина (ДАБ) (Sigma, США) в PBS, содержащем 1% DMSO (Sigma, США) и 1% перекиси водорода. Останавливали окрашивание промывкой мембраны дистиллированной водой.
При анализе пробы RBD белка Spike SARS-CoV-2 (фиг. 5, А) на электрофореграмме визуализируются соответствующие по молекулярной массе бенды (около 40 кДа как в восстанавливающих, так и в невосстанавливающих условиях, а также около 80 кДа в отсутствие восстановителя), паттерн которых свидетельствует о частичной димеризации белка. В случае электрофоретического анализа очищенного вируса ЖГВ/H7+RBD194 в невосстанавливающих условиях выявляются мажорные бенды с кажущейся молекулярной массой около 28, 46, 100, 240 кДа, а в присутствии восстановителя - 28, 46, 62, 70 кДа, соответствующие полимеризованным и мономерным формам мажорных белков вириона - M1 (28 кДа), нейраминидазы (50 кДа) и гемагглютинина (62 кДа). Электрофоретический анализ пробы очищенного вируса H7N9 позволил выявить бенды с кажущимися молекулярными массами около 28, 70, 180, 220 кДа в отсутствие восстановителя и 28, 32, 46, 60 кДа - в восстанавливающих условиях, что также соответствует различным формам белков вириона: M1 (28 кДа), нейраминидазы (50 кДа) и гемагглютинина (62 кДа).
Методом вестерн-блот анализа с использованием первичных поликлональных антител кролика против RBD белка Spike SARS-CoV-2 были визуализированы бенды, соответствующие очищенному RBD (около 40 кДа), в том числе частично полимеризованному (около 80 кДа, 120 кДа) (фиг. 5 Б). Кроме того, таким образом было показано наличие RBD в пробе ЖГВ/H7+RBD194; о том, что этот домен присутствует в составе мономерных и полимеризованных молекул гемагглютинина, свидетельствует наличие бендов с соответствующей молекулярной массой около 120 кДа (в невосстанавливающих условиях) и 62 и 120 кДа (в восстанавливающих условиях).
Использование в качестве первичных антител мышиной гипериммунной сыворотки против вируса H7N9 позволило проявить как очищенный вирус H7N9 (бенды с молекулярными массами около 28, 70, 130, 240 кДа в невосстанавливающих условиях и 28, 32, 46, 62, 70 кДа - в восстанавливающих условиях), так и белки в составе очищенного вируса ЖГВ/H7+RBD194 (28, 62, 130, 240 кДа, в присутствии восстановителя - 28, 32, 62 кДа) (фиг. 5 В). При этом наблюдается колокализация бендов, по молекулярной массе соответствующих гемагглютинину в составе ЖГВ/H7+RBD194 (около 62 кДа), при обработке как антителами против RBD, так и сывороткой против H7N9, что также может являться доказательством наличия RBD в составе гемагглютинина, экспрессируемого ЖГВ/H7+RBD194.
Экспрессия RBD в зараженных клетках.
Для оценки уровня экспресии встроенного фрагмента RBD рекомбинантным вирусом гриппа проводили определение концентрации белка RBD в лизате клеток MDCK, зараженных исследуемым вирусом и контрольным штаммом-вектором. Монослой клеток MDCK, выращенный на 6-луночных планшетах, заражали целевыми вирусами с множественностью заражения (multiplicity of infection, MOI) 0,002 (т.е. 0,002 TCID50 вируса на каждую клетку), в трипликатах. После 60-часовой инкубации зараженных клеток в среде DMEM, содержащей 1× антибиотик-антимикотик и 1 мкг/мл ТРСК трисин, супернатант удаляли и клетки лизировали в 450 мкл лизис-буфера (250 mM сахароза, 50 mM Tris-HCl, 25 гаМ NaCl, 2 mM EDTA, 0.1% Triton Х-100, 1 мкг/мл ингибитора трипсина, 1 mM PMSF) на льду в течение 5 минут с периодическим покачиванием. После центрифугирования образцов при 13000 g при 4°С в течение 10 минут супернатанты отбирали и хранили при -20°С. Анализ экспрессии RBD белка проводили с помощью сэндвич ИФА. Для этого высокосорбционные планшеты для ИФА покрывали анти-RBD поликлональным антителом кролика (производство ЗАО «БИОКАД») в концентрации 100 нг на лунку, в 100 мкл карбонатно-бикарбонатного буфера. После 18-часовой инкубации при +4°С планшеты отмывали три раза PBS с твином, проводили блокировку неспецифического связывания с помощью обезжиренного молока, после чего на лунки наносили образцы супернатантов (каждый образец в дупликате) в объеме 100 мкл. В качестве стандарта в соответствующие лунки планшета наносили 4-кратные разведения RBD белка с известной концентрацией (производство ЗАО «БИОКАД»), начиная с 20 мкг/мл. После 1-часовой инкубации при 37°С планшеты отмывали три раза PBST и добавляли моноклональное анти-RBD антитело мыши (любезно предоставленное д.б.н. А.В. Соколовым, ФГБНУ «ИЭМ»), в концентрации 1 мкг/мл Далее планшет инкубировали 1 час при 37°С и после трехкратной отмывки PBST добавляли вторичные анти-mouse IgG антитела, конъюгированные с пероксидазой хрена (BioRad, США) и инкубировали дополнительно 60 минут при 37°С. Связывание антител проявляли при помощи субстрата One-Step ТМВ Ultra (Thermo, США) и окарску останавливали добавлением серной кислоты. Оптическую плотность лунок при длине волны 450 нм (ОП450) считывали на планшетном спектрофотометре и концентрацию RBD белка вычисляли путем построения регрессионной кривой концентрации RBD стандарта и нормализации значений ОП450 исследуемых образцов на данную кривую. Было показано, что белок RBD активно экспрессировался при заражении клеток рекомбинантным вирусом ЖГВ/H7+RBD194, но не вирусным вектором (фиг. 6).
Пример 4. Оценка аттенуации рекомбинантного вируса in vivo на модели мышей.
Данный эксперимент был проведен для оценки аттенуированного фенотипа рекомбинантного штамма на модели мышей. Безвредность штаммов живой гриппозной вакцины контролируется по способности вирусов репродуцироваться в тканях верхних и нижних дыхательных путей животных. Классические аттенуированные холодоадаптированные вирусы гриппа активно реплицируются в верхних отделах респираторного тракта мышей, но практически не способны к активной репликации в тканях легких [Isakova-Sivak, I., L.М. Chen, М. Bourgeois, Y. Matsuoka, J.Т. Voeten, J.G. Heldens, H. van den Bosch, A. Klimov, L. Rudenko, N.J. Cox and R.O. Donis (2014). "Characterization of reverse genetics-derived cold-adapted master donor virus A/Leningrad/134/17/57 (H2N2) and reassortants with H5N1 surface genes in a mouse model." Clin Vaccine Immunol 21(5): 722-731]. В работе использовались мыши BALB/c (Пущино, Московская область). Мышей иммунизировали интраназально исследуемыми вирусами в дозе 106 ЭИД50, в объеме 50 мкл. На 3 сутки после иммунизации мышей подвергали эвтаназии и забирали органы респираторного тракта для оценки активности репликации вирусов.
Мышей, усыпленных в камере с изофлюраном, умерщвляли при помощи процедуры цервикальной дислокации. Далее освобождали верхнюю часть головы от мягких тканей и асептически забирали участок черепа от носа до глазниц и замораживали при -70°С в стерильном 2,0 мл круглодонном эппендорфе. Легкие (целиком) асептически извлекали из грудной клетки и также хранили при -70°С до титрования в 2,0 мл эппендорфах.
В пробирку с органом добавляли 1 мл стерильного PBS, содержащего антибиотик-антимикотик (AbAm), и одну металлическую дробь 5 мм.
Гомогенизацию проводили в приборе TissueLyser LT (QIAGEN) в течение 10 мин, частота колебания 50 Гц (макс). Далее пробы центрифугировали при 6000 rpm 2 мин при комнатной температуре и надосадочную жидкость использовали для определения титра вируса.
В стерильных пробирках готовили серийные 10-кратные разведения гомогенатов. Далее подготовленными разведениями заражали 10-12-дневные развивающиеся куриные эмбрионы в аллантоисную полость, в объеме 200 мкл/РКЭ, по 3 РКЭ на каждое разведение. РКЭ инкубировали при 33°С в течение 3 дней, после чего определяли наличие вируса в каждом эмбрионе в реакции гемагглютинации с 0,5% раствором куриных эритроцитов. Титр вируса вычисляли по вышеописанной методике Reed & Muench.
Результаты титрования представлены на фиг. 7, где видно, что рекомбинантный вирус реплицировался в верхних дыхательных путях со сниженной эффективностью по сравнению с контрольным вакцинным вирусом. Важно отметить, что оба исследуемых вируса были не способны к активной репликации в легких иммунизированных мышей (фиг. 7, Б), что указывает на аттенуированный фенотип вирусов.
Оценка аттенуации рекомбинантного вируса на модели сирийских хомячков.
Данный эксперимент был проведен для оценки способности вирусов к репликации на сирийских хомячках, а также аттенуированного фенотипа рекомбинантного штамма на модели сирийских хомячков. В работе использовались самки сирийских хомяков в возрасте 6-8 недель (АО «НПО «ДОМ ФАРМАЦИИ», Россия). Хомячков иммунизировали интраназально исследуемыми вирусами в дозе 106 ЭИД50, в объеме 100 мкл. На 2 сутки после иммунизации хомяков подвергали эвтаназии и забирали органы респираторного тракта для оценки активности репликации вирусов (4 животных на группу).
Забор и гомогенизацию органов проводили по тому же протоколу, что и у мышей, но с пересчетом титра вируса на грамм ткани. Определение титра вирусов в РКЭ производили по тому же протоколу. Кроме того, определяли титр вируса в органах методом ПЦР в реальном времени. Для этого из 100 мкл суспензии, полученной при гомогенизации органов, выделяли РНК с использованием набора Биолабмикс (Набор для выделения РНК из клеток животных/бактерий, мазка/соскоба эпителиальных клеток, вирусов на колонках) и проводили реакцию ПЦР с обратной транскрипцией с детекцией результатов в реальном времени с набором реагентов OneTube RT-PCR TaqMan (Евроген) и комплектом специфических праймеров и зондом для детекции вируса гриппа:
• (прямой праймер GTCTTCTAACCGAGGTCGAAACGT,
• обратный праймер AGGGCATTTTGGACAAAGCGTCTA,
• гибридизационный зонд /6-FAM/-TGCAGTCCTCGCTCACTGGGCACG-/BHQ-1/).
Программа для амплификации использовалась следующая: 45°С в течение 15 минут для обратной транскрипции, 95°С в течение 5 минут для предварительной денатурации, далее 40 циклов: 95°С в течение 15 секунд, 58°С в течение 40 секунд с регистрацией флуоресценции. Амплификацию проводили с использованием прибора QuantStudio 1, анализ результатов производили в программе QuantStudio™ Design and Analysis Software. Каждый образец тестировали в дупликатах и определяли порог флюоресценции (Ct, cycle threshold), обратно коррелирующий с концентрацией вирусной РНК в исходных образцах, с помощью амплификатора с детекцией в режиме реального времени и соответствующего программного обеспечения. Для построения градуировочной кривой производили параллельную реакцию для стандартного образца (РНК, выделенная из стока вируса H7N9 вектор с известным инфекционным титром) в пяти 10-кратных разбавлениях. По образцам известных разбавлений вирусной РНК строили стандартную кривую, по которой нормализовали значения Ct в образцах и вычисляли титр вируса.
Статистическая обработка результатов проводилась с использованием программного обеспечения GraphPad Prizm 7.0.
Результаты титрования в РКЭ представлены на фиг. 8, из которой видно, что репликация рекомбинантного вируса была ниже порога детекции метода титрования в РКЭ, контрольный вирус реплицировался со средним титром 3,09 lg ЭИД50/мл в носовых ходах, и не был способен к репродукции в легких, что указывает на аттенуированный фенотип вирусов. По результатам определения титра вирусов методом qPCR РНК контрольного вируса-вектора, а также рекомбинантного вируса присутствовала в носовых ходах на 2 сутки после иммунизации, тогда как в легких вирусная РНК не обнаруживалась (фиг. 8).
Пример 5. Оценка способности рекомбинантного вируса к индукции иммунного ответа in vivo. Индукция гуморального иммунного ответа к вирусу гриппа и к коронавирусу SARS-CoV-2 при интраназальной иммунизации мышей
Оценку иммуногенных свойств рекомбинантных вирусов проводили в экспериментах на BALB/c мышах (Пущино, Московская область). Мышей иммунизировали интраназально исследуемыми вирусами в дозе 106 ЭИД50, в объеме 50 мкл под легкой анестезией изофлюраном. Через 3 недели проводили повторное введение вирусов в аналогичных условиях. На 21 сутки после повторной иммунизации у мышей забирали образцы сыворотки крови для оценки уровней IgG антител к вирусу гриппа и к коронавирусному антигену в иммуноферментном анализе. Исследуемый антиген вносили в концентрации 50 нг/лунку в планшет для ИФА. Антигены добавляли в планшеты в объеме 50 мкл/лунку. Заклеивали клейкой пленкой и оставляли на ночь при 4°С. На следующий день планшеты с антигеном промывали трижды раствором PBS, содержащим 0.05% Tween 20 (PBS-T) в объеме 150 мкл/лунку PBS-T. Далее в лунки вносили по 50 мкл 1% раствора BSA, инкубировали при 37°С в течение 30 мин. Двукратные разведения сывороток мышей готовили в лунках U-образного планшета на PBS. Планшет после блокировки неспецифического связывания промывали 3 раза PBS-T, после чего вносили по 50 мкл образца в каждую лунку планшета и инкубировали 1 час при 37°С. Далее планшет для ИФА промывали 3 раза PBS-T и вносили в каждую лунку по 50 мкл разведенных 1:3000 вторичных антител, конъюгированных с пероксидазой хрена. Инкубировали 30-60 минут при 37°С, после чего планшеты промывали 4 раза раствором PBS-T, просушивали и добавляли 50 мкл предварительно прогретого субстрата ТМВ. Планшеты инкубировали в темном месте в течение 5-10 мин, затем реакцию останавливали 25 мкл 1М серной кислоты. Результаты считывали на спектрофотометре BIORAD xMark Microplate при длине волны 450 нм. В результате эксперимента определяли конечный титр антител IgG, который соответствовал максимальному разведению сыворотки, при котором оптическая плотность раствора превышала оптическую плотность контрольных лунок (без добавления сыворотки) как минимум в 2 раза. Визуализацию полученных результатов и статистическую обработку проводили с помощью GraphPad Prism-5. На фиг. 9 представлены результаты оценки вирус-специфических антител в сыворотках крови иммунизированных мышей. Видно, что рекомбинантный штамм вируса гриппа, несущий вставку иммуногенного фрагмента SARS-CoV-2, по иммуногенности в отношении цельного вируса гриппа не уступал свойству контрольного вакцинного штамма живой гриппозной вакцины (фиг. 9А). При использовании в качестве антигена в ИФА рекомбинантного белка RBD специфические IgG антитела определялись только в группе мышей, иммунизированных рекомбинантным вакцинным штаммом, но не контрольным штаммом ЖГВ. Эти данные указывают на способность рекомбинантного штамма вируса гриппа формировать специфический гуморальный иммунный ответ и к вирусу гриппа, и к встроенному целевому антигену - RBD фрагменту Spike-белка коронавируса SARS-CoV-2.
Индукция гуморального иммунного ответа к вирусу гриппа и к коронавирусу SARS-CoV-2 при интраназальной иммунизации сирийских хомячков
Оценку иммуногенных свойств рекомбинантных вирусов проводили в экспериментах на сирийских хомячках, поскольку данный вид животных является оптимальной моделью для оценки протективных свойств вакцин в отношении новой коронавирусной инфекции. В работе использовались самки сирийских хомяков в возрасте 6-8 недель (АО «НПО «ДОМ ФАРМАЦИИ», Россия). Хомячков иммунизировали интраназально исследуемыми вирусами в дозе 106 ЭИД50, в объеме 100 мкл, двукратно с интервалом 3 недели. На 21 сутки после повторной иммунизации хомяков подвергали эвтаназии и забирали образцы сыворотки крови для оценки гуморального иммунного ответа в иммуноферментном анализе (6 животных на группу). ИФА проводили по вышеописанной схеме, а уровни вырабатываемых антител IgG антител вычисляли по параметру «площадь под кривой» оптической плотности (area under the curve, AUC), который рассчитывали по правилу трапеций отдельно для каждой сыворотки. На фиг. 10 представлены результаты оценки вирус-специфических антител в сыворотках крови иммунизированных сирийских хомячков. Рекомбинантный штамм вируса гриппа, несущий вставку иммуногенного фрагмента SARS-CoV-2, имел сниженные уровни антител, реагирующих с цельным вирусом гриппа, в сравнении с контрольным вакцинным штаммом живой гриппозной вакцины (фиг. 10А). Тем не менее, уровни вирус-специфических IgG антител были значительно выше в сравнении с контрольными животными группы плацебо. При использовании в качестве антигена в ИФА рекомбинантного белка RBD специфические IgG антитела определялись только в группе хомячков, иммунизированных рекомбинантным вакцинным штаммом, но не контрольным штаммом ЖГВ. Эти данные подтверждают способность рекомбинантного штамма вируса гриппа формировать специфический гуморальный иммунный ответ и к вирусу гриппа, и к встроенному целевому антигену - RBD фрагменту Spike-белка коронавируса SARS-CoV-2 при интраназальном введении млекопитающему.
Пример 6. Защитная эффективность рекомбинантной вакцины при интраназальной иммунизации сирийских хомячков.
Протективную активность рекомбинантного штамма вируса гриппа в отношении коронавируса SARS-CoV-2 определяли в эксперименте на сирийских хомячках. В работе использовались самки сирийских хомяков в возрасте 6-8 недель (питомник «Столбовая», Россия). Хомячков иммунизировали интраназально исследуемыми вирусами в дозе 5×106 ЭИД50, в объеме 100 мкл, двукратно с интервалом 3 недели. В качестве контроля был использован вакцинный штамм на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), имеющий поверхностные гены НА и NA штамма А/Ануи/1/2013 (H7N9) - ЖГВ, тогда как рекомбинантный штамм дополнительно имел вставку RBD194 в молекуле НА - ЖГВ/H7+RBD194. На 21 сутки после повторной иммунизации хомячков заражали интраназально челлендж-вирусом SARS-CoV-2 в дозе 105 ТЦИД50 в объеме 100 мкл. В течение 5 суток после экспериментального заражения проводили клиническое наблюдение за животными, включающее в себя измерение массы тела и оценку клинической картины по пяти параметрам: (1) поведение в клетке (0 -норма, 1 - угнетение); (2) поведение на открытой площадке клетке (0 - норма, 1 - угнетение); (3) реакция при взятии в руки (0 - норма, 1 - угнетение); (4) интерес к пище (0 - норма, 1 - угнетение); (5) состояние шерсти (0 - норма, 1 - всклоченность). Изменение массы тела выражали в % от исходной массы для каждого животного. Клинические симптомы оценивали по сумме баллов за все 5 дней после челленджа для каждого животного. На фиг. 11 представлены результаты изучения протективной активности рекомбинантного и контрольного штаммов вируса гриппа, несущего вставку иммуногенного фрагмента SARS-CoV-2, в отношении коронавируса SARS-CoV-2. Животные, иммунизированные рекомбинантным вирусом кандидатом, меньше теряли в весе (фиг. 11 А) и проявляли меньше клинических признаков заболевания (фиг. 11 Б) по сравнению с группой плацебо, а также контрольной группой животных, иммунизированных контрольным штаммом. У зараженных животных на 5 сутки проводилась экстирпация органов респираторного тракта (легкие и носовые ходы), в гомогенатах которых определяли титр вируса SARS-CoV-2 методом предельных разведений на клетках Vero-CCL81. В органах животных, иммунизированных рекомбинантным вакцинным штаммом, определялось значительно меньшее количество инфекционного вируса SARS-CoV-2, чем в тканях животных, получивших контрольный вирус (вектор), а также препарат плацебо (фиг. 11 В и Г).
Протективная активность рекомбинантного штамма вируса гриппа в отношении вируса гриппа А
Протективную активность рекомбинантного штамма вируса гриппа в отношении вируса гриппа А определяли в эксперименте на сирийских хомячках. Хомячков иммунизировали интраназально исследуемыми вирусами в дозе 5×106 ЭИД50, в объеме 100 мкл, двукратно с интервалом 3 недели. В качестве контроля был использован вакцинный штамм на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), имеющий поверхностные гены НА и NA штамма А/Ануи/1/2013 (H7N9) - ЖГВ, тогда как рекомбинантный штамм дополнительно имел вставку RBD194 в молекуле НА - ЖГВ/Н7+RBD194. Животные из группы плацебо получали раствор фосфатно-солевого буфера - PBS. На 21 сутки после повторной иммунизации хомячков заражали интраназально вирулентным штаммом вируса гриппа H7N9/PR8, которые содержит гены НА и NA от штамма А/Шанхай/2/2013 (H7N9), а остальные шесть генов - от лабораторного штамма A/PR/8/34 (H1N1). На 5 сутки после заражения у хомяков забирали легкие, в которых определяли титр вируса гриппа методом предельных разведений на клетках MDCK. В органах животных, иммунизированных рекомбинантным вакцинным штаммом либо контрольным штаммом, определялось значительно меньшее количество инфекционного вируса гриппа, чем в тканях животных, получивших препарат плацебо (Фиг. 12).
Таким образом, рекомбинантный вакцинный штамм вируса гриппа, несущий фрагмент RBD194 коронавируса SARS-CoV-2, обеспечивает комбинированную защиту животных от заражения вирусом гриппа и коронавирусом SARS-CoV-2.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ФГБНУ «ИЭМ» (FSBSI “IEM”)
<120> Рекомбинантный вакцинный штамм для живой интраназальной вакцины,
обеспечивающей сочетанную профилактику гриппозной и коронавирусной
инфекций
<140>
<141>
<150>
<151>
<160> 5
<210> 1
<211> 194
<212> Аминокислотная последовательность
<213> Природная последовательность
<223> Аминокислотная последовательность рецептор-связывающего домена (RBD)
гликопротеина S вируса SARS-CoV-2
<400> 1
Thr Asn Leu Cys Pro Phe Gly Glu Val Phe Asn Ala Thr Arg Phe Ala
1 5 10 15
Ser Val Tyr Ala Trp Asn Arg Lys Arg Ile Ser Asn Cys Val Ala Asp
20 25 30
Tyr Ser Val Leu Tyr Asn Ser Ala Ser Phe Ser Thr Phe Lys Cys Tyr
35 40 45
Gly Val Ser Pro Thr Lys Leu Asn Asp Leu Cys Phe Thr Asn Val Tyr
50 55 60
Ala Asp Ser Phe Val Ile Arg Gly Asp Glu Val Arg Gln Ile Ala Pro
65 70 75 80
Gly Gln Thr Gly Lys Ile Ala Asp Tyr Asn Tyr Lys Leu Pro Asp Asp
85 90 95
Phe Thr Gly Cys Val Ile Ala Trp Asn Ser Asn Asn Leu Asp Ser Lys
100 105 110
Val Gly Gly Asn Tyr Asn Tyr Leu Tyr Arg Leu Phe Arg Lys Ser Asn
115 120 125
Leu Lys Pro Phe Glu Arg Asp Ile Ser Thr Glu Ile Tyr Gln Ala Gly
130 135 140
Ser Thr Pro Cys Asn Gly Val Glu Gly Phe Asn Cys Tyr Phe Pro Leu
145 150 155 160
Gln Ser Tyr Gly Phe Gln Pro Thr Asn Gly Val Gly Tyr Gln Pro Tyr
165 170 175
Arg Val Val Val Leu Ser Phe Glu Leu Leu His Ala Pro Ala Thr Val
180 185 190
Cys Gly
194
<210> 2
<211> 582
<212> Нуклеотидная последовательность
<213> Природная последовательность
<223> Нуклеиновая кислота, кодирующая рецептор-связывающий домен (RBD)
гликопротеина S вируса SARS-CoV-2
<400> 2
acaaacttgt gcccttttgg tgaagttttt aacgccacca gatttgcatc tgtttatgct 60
tggaacagga agagaatcag caactgtgtt gctgattatt ctgtcctata taattccgca 120
tcattttcca cttttaagtg ttatggagtg tctcctacta aattaaatga tctctgcttt 180
actaatgtct atgcagattc atttgtaatt agaggtgatg aagtcagaca aatcgctcca 240
gggcaaactg gaaagattgc tgattataat tataaattac cagatgattt tacaggctgc 300
gttatagctt ggaattctaa caatcttgat tctaaggttg gtggtaatta taattacctg 360
tatagattgt ttaggaagtc taatctcaaa ccttttgaga gagatatttc aactgaaatc 420
tatcaggccg gtagcacacc ttgtaatggt gttgaaggtt ttaattgtta ctttccttta 480
caatcatatg gtttccaacc cactaatggt gttggttacc aaccatacag agtagtagta 540
ctttcttttg aacttctaca tgcaccagca actgtttgtg ga 582
<210> 3
<211> 1751
<212> Нуклеотидная последовательность
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая ген гемагглютинина вируса гриппа со
вставкой последовательности, содержащей сайты рестрикции BsmBI, для
формирования липких концов между последовательностью, соответствующей
сигнальному пептиду гемагглютинина, и последовательностью, соответствующей
началу НА1
<400> 3
agcaaaagca ggggatacaa aatgaacact caaatcctgg tattcgctct gattgcgatc 60
attccaacaa atgcatgaga cgatatcgtc tcagacaaaa tctgcctcgg acatcatgcc 120
gtgtcaaacg gaaccaaagt aaacacatta actgaaagag gagtggaagt cgtcaatgca 180
actgaaacag tggaacgaac aaacatcccc aggatctgct caaaagggaa aaggacagtt 240
gacctcggtc aatgtggact cctggggaca atcactggac cacctcaatg tgaccaattc 300
ctagaatttt cagccgattt aattattgag aggcgagaag gaagtgatgt ctgttatcct 360
gggaaattcg tgaatgaaga agctctgagg caaattctca gagaatcagg cggaattgac 420
aaggaagcaa tgggattcac atacagtgga ataagaactg atggagcaac cagtgcatgt 480
aggagatcag gatcttcatt ctatgcagaa atgaaatggc tcctgtcaaa cacagatgat 540
gctgcattcc cgcagatgac taagtcatat aaaaatacaa gaaaaagccc agctctaata 600
gtatggggga tccatcattc cgtatcaact gcagagcaaa ccaagctata tgggagtgga 660
aacaaactgg tgacagttgg gagttctaat tatcaacaat cttttgtacc gagtccagga 720
gcgagaccac aagttaatgg tctatctgga agaattgact ttcattggct aatgctaaat 780
cccaatgata cagtcacttt cagtttcaat ggggctttca tagctccaga ccgtgcaagc 840
ttcctgagag gaaaatctat gggaatccag agtggagtac aggttgatgc caattgtgaa 900
ggggactgct atcatagtgg agggacaata ataagtaact tgccatttca gaacatagat 960
agcagggcag ttggaaaatg tccgagatat gttaagcaaa ggagtctgct gctagcaaca 1020
gggatgaaga atgttcctga gattccaaag ggaagaggcc tatttggtgc tatagcgggt 1080
ttcattgaaa atggatggga aggcctaatt gatggttggt atggtttcag acaccagaat 1140
gcacagggag agggaactgc tgcagattac aaaagcactc aatcggcaat tgatcaaata 1200
acaggaaaat taaaccggct tatagaaaaa accaaccaac aatttgagtt gatagacaat 1260
gaattcaatg aggtagagaa gcaaatcggt aatgtgataa attggaccag agattctata 1320
acagaagtgt ggtcatacaa tgctgaactc ttggtagcaa tggagaacca gcatacaatt 1380
gatctggctg attcagaaat ggacaaactg tacgaacgag tgaaaagaca gctgagagag 1440
aatgctgaag aagatggcac tggttgcttt gaaatatttc acaagtgtga tgatgactgt 1500
atggccagta ttagaaataa cacctatgat cacagcaaat acagggaaga ggcaatgcaa 1560
aatagaatac agattgaccc agtcaaacta agcagcggct acaaagatgt gatactttgg 1620
tttagcttcg gggcatcatg tttcatactt ctagccattg taatgggcct tgtcttcata 1680
tgtgtaaaga atggaaacat gcggtgcact atttgtatat aagtttgaaa aaaaacaccc 1740
ttgtttctac t 1751
<210> 4
<211> 764
<212> Аминокислотная последовательность
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность гемагглютинина вируса гриппа (HA0) со
вставкой рецептор-связывающего домена (RBD194) гликопротеина S вируса
SARS-CoV-2
<400> 4
Met Asn Thr Gln Ile Leu Val Phe Ala Leu Ile Ala Ile Ile Pro Thr
1 5 10 15
Asn Ala Thr Asn Leu Cys Pro Phe Gly Glu Val Phe Asn Ala Thr Arg
20 25 30
Phe Ala Ser Val Tyr Ala Trp Asn Arg Lys Arg Ile Ser Asn Cys Val
35 40 45
Ala Asp Tyr Ser Val Leu Tyr Asn Ser Ala Ser Phe Ser Thr Phe Lys
50 55 60
Cys Tyr Gly Val Ser Pro Thr Lys Leu Asn Asp Leu Cys Phe Thr Asn
65 70 75 80
Val Tyr Ala Asp Ser Phe Val Ile Arg Gly Asp Glu Val Arg Gln Ile
85 90 95
Ala Pro Gly Gln Thr Gly Lys Ile Ala Asp Tyr Asn Tyr Lys Leu Pro
100 105 110
Asp Asp Phe Thr Gly Cys Val Ile Ala Trp Asn Ser Asn Asn Leu Asp
115 120 125
Ser Lys Val Gly Gly Asn Tyr Asn Tyr Leu Tyr Arg Leu Phe Arg Lys
130 135 140
Ser Asn Leu Lys Pro Phe Glu Arg Asp Ile Ser Thr Glu Ile Tyr Gln
145 150 155 160
Ala Gly Ser Thr Pro Cys Asn Gly Val Glu Gly Phe Asn Cys Tyr Phe
165 170 175
Pro Leu Gln Ser Tyr Gly Phe Gln Pro Thr Asn Gly Val Gly Tyr Gln
180 185 190
Pro Tyr Arg Val Val Val Leu Ser Phe Glu Leu Leu His Ala Pro Ala
195 200 205
Thr Val Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Lys
210 215 220
Ile Cys Leu Gly His His Ala Val Ser Asn Gly Thr Lys Val Asn Thr
225 230 235 240
Leu Thr Glu Arg Gly Val Glu Val Val Asn Ala Thr Glu Thr Val Glu
245 250 255
Arg Thr Asn Ile Pro Arg Ile Cys Ser Lys Gly Lys Arg Thr Val Asp
260 265 270
Leu Gly Gln Cys Gly Leu Leu Gly Thr Ile Thr Gly Pro Pro Gln Cys
275 280 285
Asp Gln Phe Leu Glu Phe Ser Ala Asp Leu Ile Ile Glu Arg Arg Glu
290 295 300
Gly Ser Asp Val Cys Tyr Pro Gly Lys Phe Val Asn Glu Glu Ala Leu
305 310 315 320
Arg Gln Ile Leu Arg Glu Ser Gly Gly Ile Asp Lys Glu Ala Met Gly
325 330 335
Phe Thr Tyr Ser Gly Ile Arg Thr Asp Gly Ala Thr Ser Ala Cys Arg
340 345 350
Arg Ser Gly Ser Ser Phe Tyr Ala Glu Met Lys Trp Leu Leu Ser Asn
355 360 365
Thr Asp Asp Ala Ala Phe Pro Gln Met Thr Lys Ser Tyr Lys Asn Thr
370 375 380
Arg Lys Ser Pro Ala Leu Ile Val Trp Gly Ile His His Ser Val Ser
385 390 395 400
Thr Ala Glu Gln Thr Lys Leu Tyr Gly Ser Gly Asn Lys Leu Val Thr
405 410 415
Val Gly Ser Ser Asn Tyr Gln Gln Ser Phe Val Pro Ser Pro Gly Ala
420 425 430
Arg Pro Gln Val Asn Gly Leu Ser Gly Arg Ile Asp Phe His Trp Leu
435 440 445
Met Leu Asn Pro Asn Asp Thr Val Thr Phe Ser Phe Asn Gly Ala Phe
450 455 460
Ile Ala Pro Asp Arg Ala Ser Phe Leu Arg Gly Lys Ser Met Gly Ile
465 470 475 480
Gln Ser Gly Val Gln Val Asp Ala Asn Cys Glu Gly Asp Cys Tyr His
485 490 495
Ser Gly Gly Thr Ile Ile Ser Asn Leu Pro Phe Gln Asn Ile Asp Ser
500 505 510
Arg Ala Val Gly Lys Cys Pro Arg Tyr Val Lys Gln Arg Ser Leu Leu
515 520 525
Leu Ala Thr Gly Met Lys Asn Val Pro Glu Ile Pro Lys Gly Arg Gly
530 535 540
Leu Phe Gly Ala Ile Ala Gly Phe Ile Glu Asn Gly Trp Glu Gly Leu
545 550 555 560
Ile Asp Gly Trp Tyr Gly Phe Arg His Gln Asn Ala Gln Gly Glu Gly
565 570 575
Thr Ala Ala Asp Tyr Lys Ser Thr Gln Ser Ala Ile Asp Gln Ile Thr
580 585 590
Gly Lys Leu Asn Arg Leu Ile Glu Lys Thr Asn Gln Gln Phe Glu Leu
595 600 605
Ile Asp Asn Glu Phe Asn Glu Val Glu Lys Gln Ile Gly Asn Val Ile
610 615 620
Asn Trp Thr Arg Asp Ser Ile Thr Glu Val Trp Ser Tyr Asn Ala Glu
625 630 635 640
Leu Leu Val Ala Met Glu Asn Gln His Thr Ile Asp Leu Ala Asp Ser
645 650 655
Glu Met Asp Lys Leu Tyr Glu Arg Val Lys Arg Gln Leu Arg Glu Asn
660 665 670
Ala Glu Glu Asp Gly Thr Gly Cys Phe Glu Ile Phe His Lys Cys Asp
675 680 685
Asp Asp Cys Met Ala Ser Ile Arg Asn Asn Thr Tyr Asp His Ser Lys
690 695 700
Tyr Arg Glu Glu Ala Met Gln Asn Arg Ile Gln Ile Asp Pro Val Lys
705 710 715 720
Leu Ser Ser Gly Tyr Lys Asp Val Ile Leu Trp Phe Ser Phe Gly Ala
725 730 735
Ser Cys Phe Ile Leu Leu Ala Ile Val Met Gly Leu Val Phe Ile Cys
740 745 750
Val Lys Asn Gly Asn Met Arg Cys Thr Ile Cys Ile
755 760 764
<210> 5
<211> 2345
<212> Нуклеотидная последовательность
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая ген гемагглютинина вируса гриппа со
вставкой рецептор-связывающего домена (RBD194) гликопротеина S вируса
SARS-CoV-2
<400> 5
agcaaaagca ggggatacaa aatgaacact caaatcctgg tattcgctct gattgcgatc 60
attccaacaa atgcaacaaa cttgtgccct tttggtgaag tttttaacgc caccagattt 120
gcatctgttt atgcttggaa caggaagaga atcagcaact gtgttgctga ttattctgtc 180
ctatataatt ccgcatcatt ttccactttt aagtgttatg gagtgtctcc tactaaatta 240
aatgatctct gctttactaa tgtctatgca gattcatttg taattagagg tgatgaagtc 300
agacaaatcg ctccagggca aactggaaag attgctgatt ataattataa attaccagat 360
gattttacag gctgcgttat agcttggaat tctaacaatc ttgattctaa ggttggtggt 420
aattataatt acctgtatag attgtttagg aagtctaatc tcaaaccttt tgagagagat 480
atttcaactg aaatctatca ggccggtagc acaccttgta atggtgttga aggttttaat 540
tgttactttc ctttacaatc atatggtttc caacccacta atggtgttgg ttaccaacca 600
tacagagtag tagtactttc ttttgaactt ctacatgcac cagcaactgt ttgtggagga 660
ggtggaggta gtggtggagg aggtagtgac aaaatctgcc tcggacatca tgccgtgtca 720
aacggaacca aagtaaacac attaactgaa agaggagtgg aagtcgtcaa tgcaactgaa 780
acagtggaac gaacaaacat ccccaggatc tgctcaaaag ggaaaaggac agttgacctc 840
ggtcaatgtg gactcctggg gacaatcact ggaccacctc aatgtgacca attcctagaa 900
ttttcagccg atttaattat tgagaggcga gaaggaagtg atgtctgtta tcctgggaaa 960
ttcgtgaatg aagaagctct gaggcaaatt ctcagagaat caggcggaat tgacaaggaa 1020
gcaatgggat tcacatacag tggaataaga actgatggag caaccagtgc atgtaggaga 1080
tcaggatctt cattctatgc agaaatgaaa tggctcctgt caaacacaga tgatgctgca 1140
ttcccgcaga tgactaagtc atataaaaat acaagaaaaa gcccagctct aatagtatgg 1200
gggatccatc attccgtatc aactgcagag caaaccaagc tatatgggag tggaaacaaa 1260
ctggtgacag ttgggagttc taattatcaa caatcttttg taccgagtcc aggagcgaga 1320
ccacaagtta atggtctatc tggaagaatt gactttcatt ggctaatgct aaatcccaat 1380
gatacagtca ctttcagttt caatggggct ttcatagctc cagaccgtgc aagcttcctg 1440
agaggaaaat ctatgggaat ccagagtgga gtacaggttg atgccaattg tgaaggggac 1500
tgctatcata gtggagggac aataataagt aacttgccat ttcagaacat agatagcagg 1560
gcagttggaa aatgtccgag atatgttaag caaaggagtc tgctgctagc aacagggatg 1620
aagaatgttc ctgagattcc aaagggaaga ggcctatttg gtgctatagc gggtttcatt 1680
gaaaatggat gggaaggcct aattgatggt tggtatggtt tcagacacca gaatgcacag 1740
ggagagggaa ctgctgcaga ttacaaaagc actcaatcgg caattgatca aataacagga 1800
aaattaaacc ggcttataga aaaaaccaac caacaatttg agttgataga caatgaattc 1860
aatgaggtag agaagcaaat cggtaatgtg ataaattgga ccagagattc tataacagaa 1920
gtgtggtcat acaatgctga actcttggta gcaatggaga accagcatac aattgatctg 1980
gctgattcag aaatggacaa actgtacgaa cgagtgaaaa gacagctgag agagaatgct 2040
gaagaagatg gcactggttg ctttgaaata tttcacaagt gtgatgatga ctgtatggcc 2100
agtattagaa ataacaccta tgatcacagc aaatacaggg aagaggcaat gcaaaataga 2160
atacagattg acccagtcaa actaagcagc ggctacaaag atgtgatact ttggtttagc 2220
ttcggggcat catgtttcat acttctagcc attgtaatgg gccttgtctt catatgtgta 2280
aagaatggaa acatgcggtg cactatttgt atataagttt gaaaaaaaac acccttgttt 2340
ctact 2345
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Выделенный рекомбинантный вирус на основе вируса гриппа для индукции специфического иммунитета к вирусу гриппа и/или профилактики заболеваний, вызванных вирусом гриппа | 2021 |
|
RU2813150C2 |
| УСОВЕРШЕНСТВОВАННАЯ КОРОНАВИРУСНАЯ ВАКЦИНА | 2022 |
|
RU2816182C2 |
| БЕЛОК И ВАКЦИНА ПРОТИВ ИНФЕКЦИИ SARS-CoV-2 | 2020 |
|
RU2815060C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2760301C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2783313C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2021 |
|
RU2761879C1 |
| Способ создания живого штамма энтерококка L3-SARS на основе биологически активного штамма Е. faecium L3 | 2021 |
|
RU2782529C1 |
| СПОСОБ ПОВЫШЕНИЯ ИММУНОГЕННОСТИ БЕЛКОВОГО/ПЕПТИДНОГО АНТИГЕНА | 2021 |
|
RU2830627C1 |
| Генная конструкция для экспрессии рекомбинантных белков на основе участка S-белка SARS-CoV-2, включающего RBD и SD1, слитого с Fc фрагментом IgG, способ получения рекомбинантных белков, антигены и антигенные композиции для индукции длительного антительного и клеточного иммунитета против вируса SARS-CoV-2 | 2021 |
|
RU2802825C2 |
| ВАКЦИНЫ НА ОСНОВЕ ИНФОРМАЦИОННОЙ РНК ПРОТИВ ШИРОКОГО СПЕКТРА ВАРИАНТОВ КОРОНАВИРУСА | 2022 |
|
RU2826172C2 |
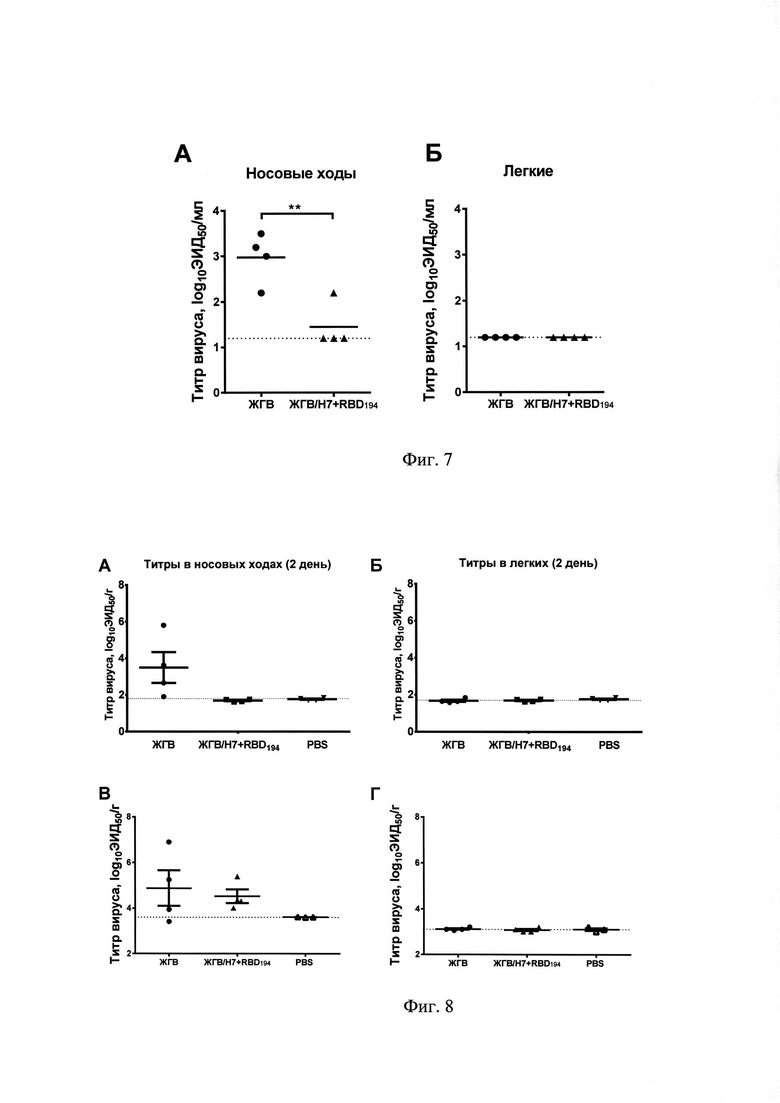
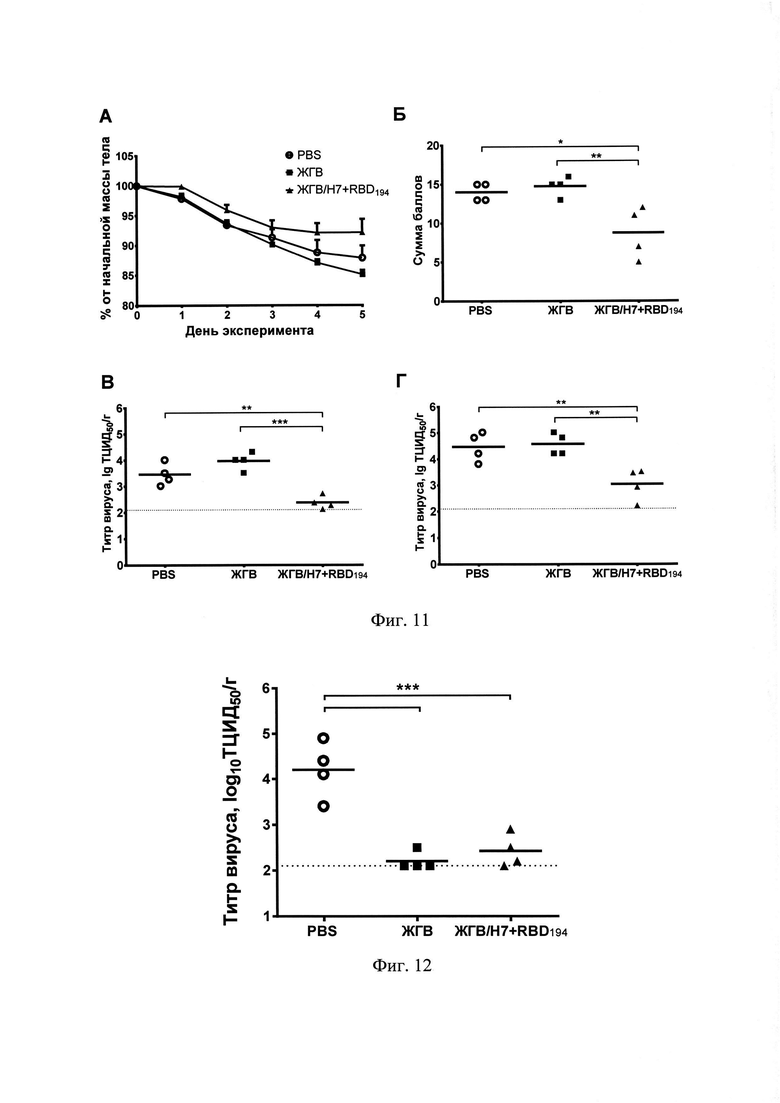
Настоящее изобретение относится к области биотехнологии, иммунологии, вирусологии, генетики, молекулярной биологии и медицинской вирусологии. Описан рекомбинантный вирус на основе вируса гриппа для индукции специфического иммунитета к вирусу гриппа и коронавирусу SARS-CoV-2 и/или профилактики заболеваний, вызванных вирусом гриппа и коронавирусом SARS-CoV-2. Комбинированный вакцинный штамм ЖГВ/H7+RBD194 - полученный методом обратной генетики реассортант, формула генома 6:2 которого соответствует требованиям, предъявляемым к штаммам живой аттенуированной гриппозной вакцины: гены, кодирующие поверхностные белки гемагглютинин (НА) и нейраминидазу (NA) принадлежат вирусу гриппа, а гены, кодирующие внутренние и неструктурные белки (РВ2, РВ1, PA, NP, М, NS), принадлежат донору аттенуации А/Ленинград/134/17/57 (H2N2). При этом ген, кодирующий поверхностный белок НА, модифицирован: после сигнального пептида в ген встроен фрагмент коронавируса SARS-CoV-2. Комбинированный вакцинный штамм ЖГВ/Н7+RBD194 активно размножается в развивающихся куриных эмбрионах при оптимальной температуре 33°С, характеризуется температурочувствительностью, холодоадаптированностью, способностью к активной репликации в культуре клеток MDCK и безвредностью для лабораторных животных. Изобретение позволяет получить вирус с высокой генетической стабильностью и иммуногенный как против вируса гриппа, так и против коронавируса. Изобретение обладает защитной эффективностью в челлендж-исследованиях при заражении гриппом, а также коронавирусом. 2 з.п. ф-лы, 12 ил., 3 табл., 6 пр.
1. Рекомбинантный вакцинный штамм вируса гриппа для производства комбинированной вакцины против гриппа А и инфекции, вызываемой коронавирусом SARS-CoV-2, содержащий нуклеиновую кислоту, кодирующую домен RBD вируса SARS-CoV-2 и характеризующуюся последовательностью SEQ ID NO:1.
2. Рекомбинантный вакцинный штамм вируса гриппа по п.1, отличающийся тем, что нуклеиновая кислота, кодирующая домен RBD вируса SARS-CoV-2 и имеющая последовательность SEQ ID NO:1, находится в гене гемагглютинина вируса гриппа.
3. Рекомбинантный вакцинный штамм вируса гриппа по п.1, отличающийся тем, что рекомбинантный штамм получают из вируса гриппа А/Ленинград/134/17/57 (H2N2) или его производных.
Авторы
Даты
2022-10-28—Публикация
2022-04-15—Подача