Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к замещенным производным 2-(бензилокси)пиримидина формулы Ib, формулы Ia и формулы I, включая их полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, которые являются ингибиторами активации PD-1/PD-L1. Настоящее изобретение также относится к способу синтеза соединений формулы Ib, формулы Ia и формулы I.
[0002] Соединения, описанные здесь, являются ингибиторами активации PD-1/PD-L1, и они могут быть использованы при лечении рака и других заболеваний или состояний, связанных с активацией PD-1/PD-L1.
Предпосылки создания изобретения
[0003] Развитие опухоли и выживание является хаотически регулируется процессом, включающим взаимодействие между раковыми клетками, нормальными стромальными клетками и защитными механизмами хозяина (Vinay DS et al., Seminars in Cancer Biology, 2015, 35: S185-S198). Как правило, CD8+ цитотоксические Т-клетки (CTL) и CD4+ хелперные Т-клетки (клетки ТЫ) сдерживают развитие раковых клеток через механизмы, обычно связанных с продукцией интерферона (IFN) γ и цитотоксинов (Zamarron BF et al., Intl. J. Biol. Sciences, 2011, 7(5):651-658). Однако опухоли выработали ряд механизмов, позволяющих избежать иммунного уничтожения. Молекулярный путь PD-1/PD-L1 является одним из таких первичных механизмов уклонения рака от действия иммунитета.
[0004] PD-1 представляет собой трансмембранный белок типа 1, кодируемый геном PDCD1. Он входит в расширенное семейство иммуноглобулинов CD28/CTLA-4 и является одним из наиболее важных ингибиторных корецепторов, экспрессируемых Т-клетками (Не J et al., Scientific Reports, 2015, 5: 1-9). PD-1 отсутствует в покоящихся Т-клетках, но он индуцируется в активированных Т-клетках. Он также экспрессируется на В-клетках, NK-клетках, дендритных клетках (DC) и макрофагах. Запрограммированный белок клеточной гибели (PD-1) подавляет иммунную систему и не дает ей уничтожать раковые клетки, присутствующие в организме. При раке, высокие уровни PD-1 обнаруживаются в инфильтрирующих опухоль Т-клетках, и эта экспрессия связана с нарушением функции CD8+ Т-клеток (Leung J et al., Immune Network, 2014, 14 (6): 265-276).
[0005] PD-1 имеет два лиганда: PD-L1 (также называемый В7-H1; CD274) и PD-L2 (B7-DC; CD273), которые являются одновременно ко-ингибирующими (Flies DB et al., Yale J. Biology Medicine, 2011, 84(4): 409-421). PD-L1, экспрессируемый почти на всех опухолевых клетках у мышей, является основным лигандом для опосредованной PD-1 иммунной супрессии. Он конститутивно экспрессируется на АРС, и может быть широко индуцирован на клетках в лимфоидных тканях и в нелимфоидных периферических тканях, с последующей клеточной активацией (Flies DB et al., Yale J. Biology Medicine, 2011, 84(4): 409-421; Dong Y et al., Oncotarget, 2017, 8(2): 2171-2186). Цитокин IFN-α особенно эффективен в повышающей регуляции экспрессии PD-L1 благодаря элементам ответа IFN-β в промоторной области PD-L1 (Lee SJ et al., FEBS Letters, 2006, 580: 755-762; Flies DB et al., Immunotherapy, 2007, 30(3): 251-260). Экспрессия B7-DC/PD-L2 в значительной степени ограничена миелоидными дендритными клетками (DC) и макрофагами в лимфоидных компартментах и незначительно экспрессируется в периферических тканях (Flies DB et al., Yale J. Biology Medicine, 2011, 84(4): 409-421). При раке PD-L1 экспрессируется на поверхности опухолевых клеток при различных солидных злокачественных новообразованиях, таких как плоскоклеточная карцинома головы и шеи, меланома, карциномы головного мозга, щитовидной железы, тимуса, пищевода, легкого, молочной железы, желудочно-кишечного тракта, ободочной и прямой кишки, печени, поджелудочной железы, почки и т.п. (Topalian SL et al., Curr. Opin. Immunol., 2012, 24(2): 207-212; Wang X et al., Oncotargets and Therapy, 2016, 9: 5023-5039). При гепатоцеллюлярной карциноме, меланоме и раке молочной железы положительный ответ на наличие PD-L1 коррелировал с худшим прогнозом (Muenst S et al., Breast Cancer Res. Treat., 2014, 146 (1): 15-24; Leung J et al., Immune Network, 2014, 14(6): 265-276; Wang Q et al., Medicine (Baltimore), 2017, 96(18): e6369). Напротив, нормальные ткани человека редко экспрессируют белок PD-L1 на своей клеточной поверхности, что указывает на то, что PD-L1 может быть селективной мишенью для противоопухолевой терапии (Chen L et al., J Clin. Invest, 2015, 125(9): 3384-3391).
[0006] Микросреда при раке воздействует на путь PD-1/PD-L1; индукция экспрессии PD-L1 связана с ингибированием иммунных ответов против рака, что позволяет раку прогрессировать и метастазировать (Не J et al., Scientific Reports, 2015, 5: 1-9; Bardhan K et al., Frontiers in Immunology, 2016, 7(550): 1-17). Активация пути PD-1/PD-L1 вызывает апоптоз активированных Т-клеток (Dong Het al., Nature Medicine, 2002, 8(8): 793-800; Curiel TJ et al., Nature Medicine, 2003, 9(5): 562-567), способствует анергии и истощению Т-клеток (Barber DL et al., Nature, 2005, 439(7077): 682-687), усиливает функцию регуляторных Т-клеток (Francisco LM et al., J. Exp. Med., 2009, 206(13): 3015-3029) и ингибирует пролиферацию Т-клеток (Sheppard KA et al., FEBS Letters, 2004, 574: 37-41; Patsoukis H. et al., Cell Cycle, 2012, 11(23): 4305-4309). Таким образом, блокирование этого пути восстановит пролиферацию и цитотоксичность CTL, ингибирующих функцию регуляторных Т-клеток (Treg), а также приведет к снижению Т-клеточного апоптоза.
[0007] Как было показано, блокада сигнального пути PD-1/PD-L1 с помощью терапевтических антител предотвращает ингибирующую сигнализацию от раковых клеток, и позволяет CTL вызывать реакцию иммунной системы против мишени - раковых клеток (Zou W et al., Sci. Transl. Med., 2016, 8 (328):328rv4; Smahel M, Int. J. Mol. Sci., 2017, 18(6):1331). Ряд противораковых иммунотерапевтических средств, нацеленных на PD-1, был разработан ранее и одобрен для применения при ряде злокачественных новообразований, включая меланому, рак легкого, рак почки, лимфому Ходжкина, рак головы и шеи и уротелиальный рак. Первое терапевтическое анти-PD-L1-антитело было одобрено FDA в мае 2016 года, и в настоящее время дополнительные методы лечения находятся на стадии разработки (https://www.fda.gov/). Тем не менее, проводится не менее 500 клинических исследований антител PD-1/PD-L1 против 20 типов солидных опухолей и гематологических злокачественных новообразований. Тем не менее, еще существует потребность в эффективных и селективных низкомолекулярных ингибиторах сигнального пути PD-1/PD-L1.
[0008] Общие побочные эффекты (АЕ), связанные с введением лекарств, таких как анти-PD-1-антитела и анти-PD-L1-антитела, включают усталость, сыпь, диарею, зуд, снижение аппетита, боли в суставах и тошноту. Были зарегистрированы иммунные АЕ (irAE), такие как дерматит, колит, гепатиты, витилиго и тиреоидит, и приблизительно у 10% пациентов развивались irAE 3 или 4 уровня тяжести (Hamanishi J et al., Int. J. Clin. Oncol., 2016, 21: 462-473). Длительное применение моноклональных антител (mAb) может вносить вклад в эти АЕ, которые можно частично обойти, используя низкомолекулярный ингибитор. Кроме того, исследования с использованием проникающих в клетки биопрепаратов с меньшим размером молекулы и ДНК-аптамеров показали, что они проявляют функции, имитирующие действие антител, и они имеют преимущество перед антителами благодаря своей искусственной химической природе, низкой иммуногенности и эффективному проникновению в ткани (Lai WY et al., Mol. Therapy - Nucl. Acids, 2016, 5: e397). Следовательно, низкомолекулярные ингибиторы могут обеспечивать повышенную пероральную биодоступность, повышенную биоэффективность и более короткий период полувыведения, что обеспечивает более контролируемое лечение, особенно в случае аутоиммунных или других неблагоприятных эффектов.
[0009] Как описано выше, соединения, ингибирующие PD-1/PD-L1, имеют большую пользу для повышающей регуляции иммунной системы для эффективной борьбы с раком. Следовательно, необходимо идентифицировать химический фрагмент, особенно низкомолекулярные ингибиторы, который способствует этому ингибированию. Следовательно, идентификация и получение новых соединений, ингибирующих Pd-1/PD-L1, для лечения рака и других заболеваний или состояний, связанных с активацией PD-1/PD-L1, откроет новые возможности в области лечения рака.
Сущность изобретения
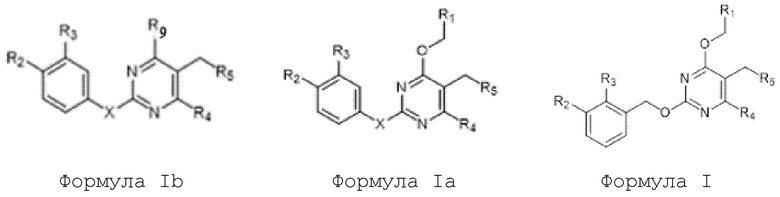
[00010] В качестве одного аспекта настоящего изобретения предлагается соединение формулы Ib
его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где X выбран из -CH2O-, -ОСН2-, -C(O)NH- или -NHC(O)-; R2, R3, R4, и R9 независимо выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, С1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, C1-10 алкокси, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила или -COORa, где C1-6 алкил, C1-6 алкокси и C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из гидрокси, циано, C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано; и Ra выбран из водорода, галогена, циано, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R5 представляет собой -NR7R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, C1-6 алкил, С2-6 алкенил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены одним или более заместителями, выбранными из оксо, циано, галогена, гидроксила, морфолино, C(O)NH2, C(O)CH2CN, NHR6, СООН, COOR6, NHC(O)R6, C1-6 алкила, C1-6 галогеналкила, С3-10 циклоалкила, С5-6 арила, SR6 или 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из оксо, гидроксила, галогена, C1-6 алкила, СООН, COOR6, R6, NHR6, C(O)NHR6, C(O)NHSO2R6, С(O)(CH2)nNHC(О)СН3 и их комбинаций, где C1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН и NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(O)C1-6 алкила и их комбинаций, где C1-6 алкил и C(O)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(O)NHR6 и их комбинаций.
[00011] В другом аспекте настоящего изобретения предлагается соединение формулы 1а
его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где X выбран из -CH2O, -OCH2, C(O)NH или NHC(O); R1, R2, R3, и R4 независимо выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино С1-6 алкила, С2-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где С1-10 алкил, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из группы, состоящей из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, С1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, С1-10 гетероциклила, -COORa, где С2-6 алкил, C1-6 алкокси, С1-10 гетероциклил необязательно замещены одной или более группами, выбранными из C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано, и Ra выбран из водорода, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарил или C1-6 гетероарилалкила; R5 представляет собой -NR7 R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, С1-6 алкил, С2-6 алкенил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены одним или более заместителями, выбранными из оксо, циано, галогена, гидроксила, морфолино, C(O)NH2, C(O)CH2CN, NHR6, СООН, COOR6, NHC(O)R6, C1-6 алкила, C1-6 галогеналкила, С3-10 циклоалкила, С5-6 арила, SR6 или 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из группы, состоящей из оксо, гидроксила, галогена, C1-6 алкила, СООН, COOR6, R6, NHR6, C(O)NHR6, C(O)NHSO2R6, С(О)(CH2)nNHC(О)CH3 и их комбинаций, где C1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(O)C1-6 алкила и их комбинаций, где C1-6 алкил и C(O)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(O)NHR6 и их комбинаций.
[00012] В другом аспекте настоящего изобретения предлагается соединение формулы I
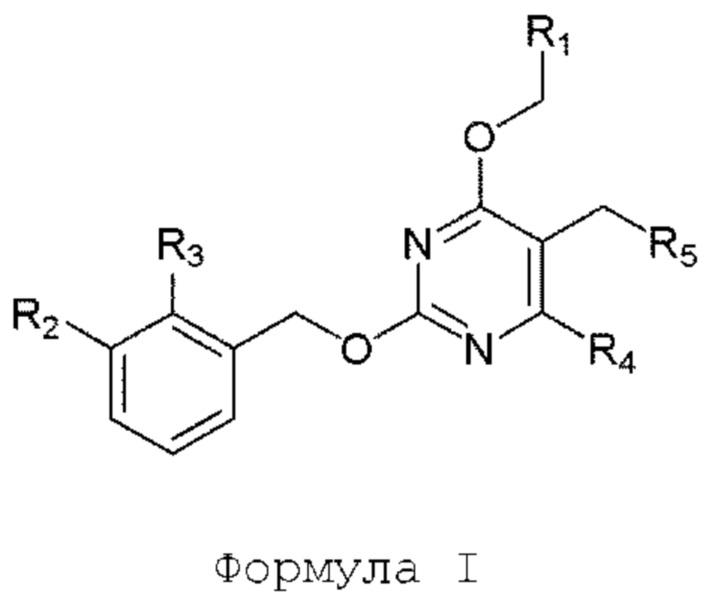
его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где R1, R2, R3, и R4 независимо выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, C1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, С2-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила, -COORa, где C1-6 алкил, C1-6 алкокси и C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси и COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано, и Ra выбран из водорода, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R5 представляет собой -NR7R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, C1-6 алкил, С2-6 алкенил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены заместителями, выбранными из оксо, циано, галогена, гидроксила, морфолино, C(O)NH2, C(O)CH2CN, NHR6, СООН, COOR6, NHC(O)R6, С1-6 алкила, C1-6 галогеналкила, С3-10 циклоалкила, С5-6 арила, SR6, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из оксо, гидроксила, C1-6 алкила, СООН, COOR6, R6, NHR6, C(O)NHR6, C(O)NHSO2R6, С(O)(CH2)nNHC(О)CH3 и их комбинаций, где C1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(O)C1-6 алкила и их комбинаций, где C1-6 алкил и C(O)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(O)NHR6 и их комбинаций.
[00013] В одном аспекте настоящего изобретения предлагается способ получения соединений формулы Ib, формулы Ia и формулы I или их полиморфов, стереоизомеров, таутомеров, пролекарств, сольватов и фармацевтически приемлемых солей.
[00014] В одном аспекте настоящего изобретения предлагается фармацевтическая композиция, содержащая соединение формулы Ib, формулы Ia, формулы I или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым носителем, необязательно в комбинации с одной или более другими фармацевтическими композициями.
[00015] В одном аспекте настоящего изобретения предлагается способ лечения и/или профилактики различных заболеваний, в том числе злокачественных опухолей и инфекционных заболеваний, включающий введение нуждающемуся в этом субъекту, страдающему от пролиферативного заболевания или рака, терапевтически эффективного количества соединения формулы Ib, формулы Ia, формулы I или фармацевтической композиции, необязательно с другими клинически значимыми цитотоксическими агентами или нецитотоксическими агентами.
[00016] В одном аспекте настоящего изобретения предлагается способ лечения и/или профилактики различных заболеваний, в том числе злокачественных опухолей и инфекционных заболеваний, включающий введение нуждающемуся в этом субъекту, страдающему от инфекционных заболеваний, таких как ВИЧ, грипп, герпес, гепатит А, гепатит В, гепатит С, гепатит D, терапевтически эффективного количества соединения формулы Ib, формулы Ia, формулы I или фармацевтической композиции, необязательно с другими клинически значимыми противовирусными лекарственными средствами.
[00017] В одном аспекте настоящего изобретения предлагается применение соединений формулы Ib, формулы Ia, формулы I или фармацевтической композиции для лечения и/или профилактики различных заболеваний, в том числе пролиферативного нарушения или рака; или для лечения рака вместе с другими клинически значимыми цитотоксическими агентами или нецитотоксическими агентами.
[00018] Эти и другие особенности, аспекты и преимущества настоящего изобретения станут более понятными со ссылкой на следующее описание. Вышеприведенное краткое изложение предоставлено для общего понятия сути изобретения в упрощенной форме. Это краткое изложение не предназначено для определения ключевых или существенных признаков изобретения, и также оно не предназначено для ограничения объема изобретения. Краткое описание фигур
[00019] Фигура 1 иллюстрирует эффективность соединения 45 в условиях in vivo в почечной модели RENCA, в соответствии с осуществлением настоящего изобретения. Подробное описание
[00020] Специалистам в данной области техники понятно, что настоящее изобретение может подвергаться изменениям и модификациям, отличающимся от конкретно описанных вариантов. Следует понимать, что настоящее описание охватывает все такие варианты и модификации. Описание также включает все стадии, этапы, признаки, составы и соединения, которые упомянуты или указаны в данном описании индивидуально или обобщенно, а также любые и все комбинации любых или всех таких стадий или признаков.
Определения
[00021] Для удобства восприятия, перед дальнейшим описанием настоящего изобретения, здесь представлены термины и определения, используемые в описании и в примерах. Эти определения должны пониматься специалистом в данной области в свете остальной части раскрытия. Используемые здесь термины имеют значения, признанные и известные специалистам в данной области техники, однако для удобства и полноты раскрытия эти конкретные термины и их смысловые значения изложены ниже.
[00022] Существительные в единственном числе используются для обозначения как одного объекта, так и более чем одного (т.е., по меньшей мере, одного) объекта.
[00023] Во всем описании и формуле изобретения, которая прилагается к описанию, подразумевается, если контекст не требует иного, что слово «содержит»/«включает» и такие варианты, как «содержащий»/«включающий», подразумевают включение указанного целого значения или показателя группы целых значений или показателей, не исключая любое другое целое значение или группу целых значений или показателей.
[00024] Термин «включающий» используется для обозначения «включающий без ограничения». «Включающий» и «включающий без ограничения» используются здесь взаимозаменяемо.
[00025] В приведенных здесь структурных формулах и по тексту описания используются указанные ниже следующие термины, но они могут означать иное, если это специально указано.
[00026] Кроме того, соединения формулы Ib, формулы Ia и формулы I могут быть их производными, аналогами, стереоизомерами, диастереомерами, геометрическими изомерами, полиморфами, сольватами, сокристаллами, промежуточными соединениями, метаболитами, пролекарствами или фармацевтически приемлемыми солями и фармацевтическими композициями.
[00027] Соединения формулы Ib, формулы Ia, формула I и их полиморфы, стереоизомеры, пролекарства, сольваты, сокристаллы, промежуточные соединения, фармацевтически приемлемые соли и метаболиты также могут называться здесь как «соединения по изобретению».
[00028] Соединения формулы Ib, формулы Ia и формулы I могут иметь один или более асимметричных центров (также называемых как хиральные центры), и, следовательно, они могут существовать в виде отдельных энантиомеров, диастереоизомеров или других стереоизомерных форм, или в виде их смесей. Хиральные центры, такие как хиральные атомы углерода, также могут присутствовать в заместителе, таком как алкильная группа. Если не указана стереохимия хирального центра, присутствующего в структуре соединений формулы Ib, формулы Ia и формулы I, или в любой другой химической структуре, представленной здесь, то подразумевается, что такая структура охватывает любые стереоизомеры и все их смеси. Таким образом, соединения формулы Ib, формулы Ia и формулы I, содержащие один или более хиральных центров, могут быть использованы в качестве рацемических модификаций, включая рацемические смеси и рацематы, энантиомерно-обогащенных смесей, или в виде энантиомерно-чистых индивидуальных стереоизомеров.
[00029] Индивидуальные стереоизомеры соединения формулы Ib, формулы Ia и формулы I, которые содержат один или более асимметрических центров, могут быть разделены с помощью способов, известных специалистам в данной области техники. Например, такое разделение может быть выполнено (1) путем образования диастереоизомерных солей, комплексов или других производных; (2) селективным взаимодействием со стереоизомер-специфическим реагентом, например, путем ферментативного окисления или восстановления; или (3) газожидкостной или жидкостной хроматографией в хиральной среде, например, на хиральном носителе, таком как диоксид кремния со связанным хиральным лигандом, или в присутствии хирального растворителя. Понятно, что когда требуемый стереоизомер превращается в другой химический объект с помощью одной из процедур разделения, указанных выше, требуется дополнительная стадия для выделения желаемой формы.
[00030] В качестве альтернативы, специфические стереоизомеры могут быть синтезированы путем асимметричного синтеза с использованием оптически активных реагентов, субстратов, катализаторов или растворителей, или путем конвертирования одного энантиомера в другой с помощью асимметричной трансформации.
[00031] Следует понимать, что ссылки на соединения формулы Ib, формулы Ia, формулы I и их соли, охватывают соединения формулы Ib, формулы Ia и формулы I в виде свободных оснований или в виде их солей, например, в виде их фармацевтически приемлемых солей. Таким образом, в одном варианте осуществления, настоящее изобретение относится к соединениям формулы Ib, формулы Ia и формулы I в виде свободного основания. В другом варианте осуществления, настоящее изобретение относится к соединениям формулы Ib, формулы Ia, формулы I и их солям. В дополнительном варианте осуществления, настоящее изобретение относится к соединениям формулы Ib, формулы Ia, формулы I и их фармацевтически приемлемым солям.
[00032] Следует понимать, что могут быть получены фармацевтически приемлемые соли соединений формулы Ib, формулы Ia и формулы I. Действительно, в некоторых вариантах осуществления настоящего изобретения, фармацевтически приемлемые соли соединений формулы Ib, формулы Ia и формулы I могут быть более предпочтительными по сравнению с соответствующим свободными основаниями, поскольку такие соли обеспечивают большую стабильность или растворимость молекул, облегчая тем самым приготовление лекарственных форм. Соответственно, настоящее изобретение также относится к соединениям формулы Ib, формулы Ia, формула I и их фармацевтически приемлемым солям.
[00033] В объем определения «соединения по изобретению» входят все сольваты (в том числе и гидраты), комплексы, полиморфы, пролекарства, меченные радиоактивным изотопом производные, а также стереоизомеры соединений формулы Ib, формулы Ia, формулы I и их солей.
[00034] Соединения по изобретению могут существовать в твердой или жидкой форме. В твердом состоянии соединения по изобретению могут существовать в кристаллической или некристаллической форме или в виде их смеси. В отношении соединений по изобретению, которые находятся в кристаллической форме, специалисту в данной области понятно, что могут образовываться фармацевтически приемлемые сольваты, когда во время кристаллизации молекулы растворителя включаются в кристаллическую решетку. Сольваты могут включать неводные растворители, такие как этанол, изопропиловый спирт, диметилсульфоксид (DMSO), уксусную кислоту, этаноламин и этилацетат, или они могут включать воду в качестве растворителя, который вводится в кристаллическую решетку. Сольваты, в которых растворителем является вода, включенная в кристаллическую решетку, обычно называют «гидратами». Гидраты включают стехиометрические гидраты, а также композиции, содержащие различные количества воды. Изобретение охватывает все такие сольваты.
[00035] Далее будет понятно, что некоторые соединения по изобретению, которые существуют в кристаллической форме, включая различные сольваты, могут проявлять полиморфизм (т.е. способность находиться в различных кристаллических структурах). Эти различные кристаллические формы обычно известны как «полиморфы». Изобретение охватывает такие полиморфы. Полиморфы имеют одинаковый химический состав, но отличаются упаковкой, геометрическим расположением и другими свойствами, характерными для твердого кристаллического состояния. Следовательно, полиморфы могут иметь различные физические свойства, такие как форма, плотность, твердость, деформируемость, стабильность и свойства растворения. Полиморфы, как правило, имеют разные точки плавления, ИК-спектры и рентгенограммы, которые могут использоваться для их идентификации. Понятно, что различные полиморфы могут быть получены, например, путем изменения или корректировки условий реакции или используемых реагентов при получении соединения. Например, изменения температуры, давления или растворителя могут привести к различным полиморфам. Кроме того, при определенных условиях один полиморф может самопроизвольно превращаться в другой полиморф.
[00036] Термин «полиморфы» относится к кристаллическим формам одной и той же молекулы, и разные полиморфы, в результате расположения или конформации молекул в кристаллической решетке, могут иметь разные физические свойства, такие как, например, температура плавления, теплота плавления, растворимость, скорость растворения и/или колебательный спектр.
[00037] Термин «замещенный» применительно к группе означает, что атом водорода в этой группе заменен. Следует понимать, что термин «замещенный» включает неявное указание о том, что такое замещение должно соответствовать допустимой валентности замещенного атома и заместителя, и что замещение приводит к стабильному соединению (то есть к тому, которое не подвергается самопроизвольному превращению, такому как перестановка, циклизация или удаление). В определенных вариантах осуществления изобретения, один атом может быть замещен более чем одним заместителем, если такое замещение соответствует допустимой валентности атома. Подходящие заместители определены здесь для каждой замещенной или необязательно замещенной группы.
[00038] Термин «пролекарство» относится к предшественнику соединения формулы Ib, формулы Ia и формулы I, который, после введения, подвергается химическим превращениям посредством метаболических процессов, прежде чем стать активными фармакологическими веществами. Как правило, такие пролекарства являются функциональными производными соединения по изобретению, которые легко превращаются в условиях in vivo в соединение по изобретению.
[00039] Термин «эффективное количество» относится к количеству или концентрации соединения формулы Ib, формулы Ia и формулы I, которое вызывает биологический ответ либо индивидуально, либо когда оно присутствует в фармацевтической композиции. Термины эффективное количество и эффективная доза могут использоваться взаимозаменяемо, когда измерения проводятся в условиях in vivo или in vitro.
[00040] Термин «алкил» относится к насыщенной углеводородной цепи, имеющей указанное число атомов углерода. Так, например, без ограничения, C1-10 алкил относится к алкильной группе, имеющей от 1-10 атомов углерода, 1-6 атомов углерода или 1-4 атома углерода. Алкильные группы могут быть группами с прямой или разветвленной цепью. Типичные разветвленные алкильные группы имеют одно, два или три ответвления. Предпочтительные алкильные группы включают, без ограничения, метил, этил, н-пропил, изопропил, бутил, изобутил и трет-бутил.
[00041] Термин «алкокси» относится к алкильной группе, присоединенной через кислородную связь к остальной части молекулы. Так, например, C1-10 алкокси относится к алкильной группе, имеющей от 1-10 атомов углерода, или 1-6 атомов углерода, или 1-4 атома углерода, присоединенных через атом кислорода, связанного с остальной частью молекулы. Предпочтительные алкоксигруппы включают, без ограничения, -OCH3 (метокси), -ОС2Н5 (этокси) и тому подобное.
[00042] Термин «алкиламино» относится к алкильной группе, как определено выше, присоединенной через аминогруппу к остальной части молекулы. Например, C1-6 алкиламино относится к алкильной группе, имеющей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной через аминогруппу к остальной части молекулы. Предпочтительные группы алкиламино включают, без ограничения, -NHCH3, -N(CH3)2 и тому подобное.
[00043] Термин «ациламино» относится к ацильной группе, присоединенной посредством аминогруппы к остальной части молекулы. Например, C1-6 ациламино относится к ацильной группе, имеющей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной посредством аминогруппы к остальной части молекулы. Предпочтительные группы ациламино включают, без ограничения, CH3(CO)NH- и тому подобное.
[00044] Термин «галогеналкил» относится к алкильной группе, как определено выше, содержащей галоген, и присоединенной через алкильную связь к остальной части молекулы. Например, C1-6 галогеналкил относится к алкильной группе, имеющей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной связи к остальной части молекулы. Предпочтительные группы галогеналкила включают, без ограничения, -CH2Cl, -CHCl2, и тому подобное.
[00045] Термин «галогеналкокси» относится к алкоксигруппе, как определено выше, содержащей галоген и присоединенную через атом кислорода посредством алкокси-связи к остальной части молекулы. Например, C1-6 галогеналкокси относится к алкоксигруппе, имеющей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной к остальной части молекулы. Предпочтительные группы галогеналкокси включают, без ограничения, -OCH2Cl, -OCHCl2 и тому подобное.
[00046] Термин «галоген» относится к радикалу галогена, например, фтору, хлору, брому или йоду. «Галогеналкил» относится к алкильной группе, как определено здесь выше, где по меньшей мере один из атомов водорода замещен радикалом галогена. «C1-6 галогеналкил» относится к C1-6 алкильной группе, где по меньшей мере один из атомов водорода замещен атомом галогена. Примером "галогеналкила" является трифторметил или 2,2,2-трифторэтил.
[00047] Термин «циклоалкил» относится к насыщенному углеводородному кольцу, имеющему определенное количество атомов углерода. Например, без ограничения, С3-10 циклоалкил относится к циклоалкильной группе, имеющей от 3 до 10 атомов. Предпочтительные группы циклоалкила включают, без ограничения, циклопропил, циклобутил, циклопентил, циклогексил, адамантана групп, и тому подобное.
[00048] Термин «арил» относится к ароматическому кольцу, имеющему определенное количество атомов углерода. Так, например, С5-10 арил относится к арильной группе, имеющей от 5 до 10 атомов. Предпочтительные группы арила включают, без ограничения, фенил, бензил, нафтил и тому подобное.
[0004 9] Термин «гетероарил» относится к ароматическим кольцам, содержащим от 1 до 3 гетероатомов в кольце. «Гетероарильные» группы могут быть замещены одним или более заместителями, как определено здесь. «C1-6 гетероарильные» кольца содержат 1-6 атомов углерода. «Гетероарил» включает пиридинил, тетразолил и пиразолил. «Гетероатом» относится к атому азота, серы или кислорода, например, атому азота или атому кислорода.
[00050] Термины «гетероциклический» и «гетероциклил» относятся к насыщенным или ненасыщенным моноциклическим алифатическим кольцам, содержащим 5, 6 или 7 кольцевых атомов, включая 1 или 2 гетероатома, или к насыщенным или ненасыщенным бициклическим алифатическим кольцам, содержащим 5, 6 или 7 кольцевых атомов, включая 1-5 гетероатомов. В определенных вариантах осуществления «гетероциклильные» группы являются насыщенными. В других вариантах осуществления «гетероциклильные» группы являются ненасыщенными. «Гетероциклильные» группы, содержащие более одного гетероатома, могут содержать разные гетероатомы. «Гетероциклильные» группы могут быть замещены одним или более заместителями, как определено здесь. «Гетероциклил» включает пиперидинил, тетрагидропиранил, азепинил, оксазепинил, азабицикло[3.1.0]гексанил. В некоторых вариантах осуществления гетероциклическое кольцо представляет собой моноциклическое или бициклическое или спироциклическое кольцо, которое может быть насыщенным или ненасыщенным. В некоторых других вариантах осуществления моноциклическое или бициклическое или спироциклическое гетероциклическое кольцо может содержать один или более гетероатомов, выбранных из N, S или О.
[00051] Фраза «фармацевтически приемлемый» относится к тем соединениям, материалам, композициям и дозированным формам, которые с точки зрения медицины подходят для использования в контакте с тканями людей и животных без чрезмерной токсичности, раздражения и других проблем или осложнений, соразмерно с разумным соотношением польза/риск.
[00052] Используемый здесь термин «фармацевтически приемлемые соли» относится к солям, которые сохраняют желаемую биологическую активность целевого соединения и проявляют минимальные нежелательные токсикологические эффекты. Эти фармацевтически приемлемые соли могут быть получены in situ во время конечного выделения и очистки соединения, или путем отдельной реакции очищенного соединения в форме свободного основания с подходящей кислотой.
[00053] Соли и сольваты, имеющие не фармацевтически приемлемые противоионы или связанные растворители, входят в объем настоящего изобретения, например, для использования в качестве промежуточных соединений при получении других соединений формулы Ib, формулы Ia, формулы I и их фармацевтически приемлемых солей. Таким образом, один вариант осуществления настоящего изобретения включает соединение формулы Ib, формулы Ia, формулы I и их соли. Соединения формулы Ib, формулы Ia, формулы I содержат основную функциональную группу, и, следовательно, способны образовывать фармацевтически приемлемые кислотно-аддитивные соли путем обработки подходящей кислотой. Подходящие кислоты включают фармацевтически приемлемые неорганические кислоты и фармацевтически приемлемые органические кислоты. Типичные фармацевтически приемлемые соли присоединения кислоты включают гидрохлорид, гидробромид, нитрат, метилнитрат, сульфат, бисульфат, сульфамат, фосфат, ацетат, гидроксиацетат, фенилацетат, пропионат, бутират, изобутират, валерат, малеат, гидроксималеат, акрилат, фумарат, малат, тартрат, цитрат, салицилат, гликолит, лактат, гептаноит, фталат, оксалат, сукцинат, бензоат, о-ацетоксибензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, нафтоат, гидроксинафтоат, манделат, таннат, формиат, стеарат, аскорбат, пальмитат, олеат, пируват, памоат, малонат, лаурат, глутарат, глутамат, эстолат, метансульфонат (мезилат), этансульфонат (эзилат), 2-гидроксиэтансульфонат, бензолсульфонат (безилат), аминобензолсульфонат, п-толуолсульфонат (тозилат) и нафталин-2-сульфонат.
[00054] Термин «ингибитор PD-1/PD-L1», «ингибирующие соединения» или «ингибитор активации PD-1/PD-L1» используется для идентификации соединения, которое способно блокировать сигнальный путь PD-1/PD-L1, чтобы предотвратить ингибирующую сигнализацию раковых клеток, и позволяющее CTL вызывать иммунный ответ против мишени - раковых клеток, и, таким образом, обеспечить лечение рака и других заболеваний или состояний, связанных с активацией PD1/PD-L1.
[00055] Термин, который был однажды описан, применяется в этом значении по всему тексту описания.
[00056] Как обсуждено выше при описании уровня техники, идентификация и разработка новых соединений-ингибиторов PD-1/PD-L1 для лечения рака и других заболеваний или состояний, связанных с активацией PD-1/PD-L1, открывают новые возможности в области лечения рака.
[00057] Термин «цитотоксические агенты» или «ингибиторы» используется для идентификации любых агентов или лекарств, которые способны убивать клетки, включая раковые клетки. Эти агенты или ингибиторы могут препятствовать росту и делению раковых клеток и могут приводить к уменьшению размеров опухолей.
[00058] Термин «нецитотоксические агенты» или «ингибиторы» используется для идентификации любых агентов или ингибиторов, которые непосредственно не убивают клетки, но вместо этого воздействуют на клеточный транспорт и метаболические функции, что в конечном итоге приводит к гибели клеток.
[00059] Термин «ингибиторы иммунной контрольной точки» или «иммуномодуляторы» используется для идентификации любых агентов или ингибиторов, которые блокируют определенные белки, вырабатываемые некоторыми типами клеток иммунной системы, такими как Т-клетки, и некоторыми раковыми клетками. Эти белки помогают контролировать иммунные реакции и могут удерживать Т-клетки от уничтожения раковых клеток. Когда эти белки блокируются, освобождаются «тормоза» иммунной системы, и Т-клетки способны лучше убивать раковые клетки. Ингибиторы иммунной контрольной точки включают ингибиторы, действующие против иммунных молекул контрольных точек, такие как CD27, CD28, CD40, CD122, CD96, CD73, CD47, ОХ40, GITR, CSF1R, JAK, PI3K дельта, PI3K гамма, ТАМ, аргиназа, CD137 (также известный как 4-1ВВ), ICOS, A2AR, В7-Н3, В7-Н4, BTLA, CTLA-4, LAG3, TIM3, VISTA, PD-1, PD-L1 и PD-L2. Термины «иммуномодуляторы» и «ингибиторы иммунной контрольной точки» в настоящем описании используются взаимозаменяемо.
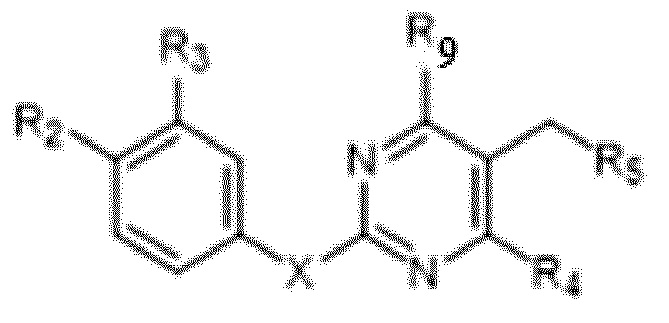
[00060] В одном варианте осуществления настоящего изобретения предлагается соединения формулы Ib
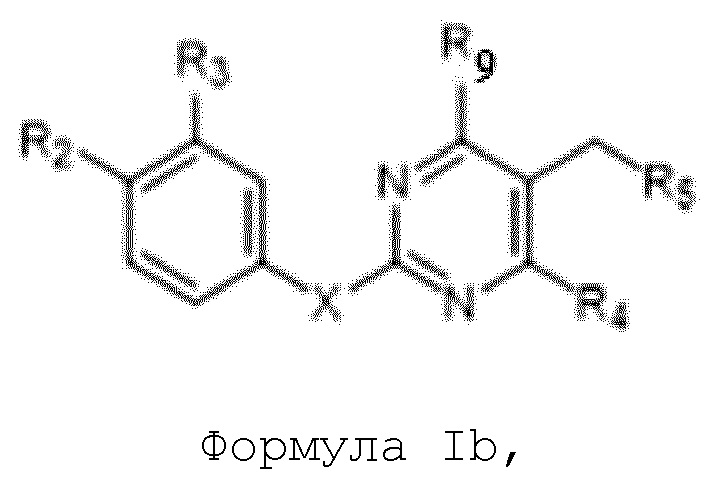
их полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли,
где X выбран из -CH2O-, -OCH2-, -C(O)NH- или -NHC(O)-; R2, R3, R4, и R9 независимо выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, С1-6 галогеналкокси, C3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, C1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, C1-10 алкокси, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила или -COORa, где C1-6 алкил, C1-6 алкокси и C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из гидрокси, циано, C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано; и Ra выбран из водорода, галогена, циано, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R5 представляет собой -NR7R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, C1-6 алкил, С2-6 алкенил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены одним или более заместителями, выбранными из оксо, циано, галогена, гидроксила, морфолино, C(O)NH2, C(O)CH2CN, NHR6, СООН, COOR6, NHC(O)R6, C1-6 алкила, C1-6 галогеналкила, С3-10 циклоалкила, С5-6 арила, SR6 или 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из оксо, гидроксила, галогена, C1-6 алкила, СООН, COOR6, NHR6, C(О)NHR6, C(О)NHSO2R6, С(О) (CH2)nNHC(О) СН3 и их комбинаций, где C1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(О)C1-6 алкила и их комбинаций, где C1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00061] В одном варианте осуществления настоящего изобретения предлагается соединение формулы Ib, его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где X представляет собой -CH2O-, где группа СН2 в -CH2O- присоединена к арильному кольцу, а O-присоединен к гетероарильному кольцу; R2, R3, R4, и R9 независимо выбраны из водорода, циано, С1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, C3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, С1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, C1-10 алкокси, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила или -COORa, где C1-6 алкил, C1-6 алкокси и C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из гидрокси, циано, C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано; и Ra выбран из водорода, галогена, циано, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R5 представляет собой -NR7R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, C1-6 алкил, С2-6 алкенил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены одним или более заместителями, выбранными из оксо, циано, галогена, гидроксила, морфолино, C(О)NH2, C(О)CH2CN, NHR6, СООН, COOR6, NHC(О)R6, C1-6 алкила, C1-6 галогеналкила, С3-10 циклоалкила, С5-6 арила, SR6 или 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из оксо, гидроксила, галогена, C1-6 алкила, СООН, COOR6, R6, NHR6, C(О)NHR6, C(О)NHSO2R6, C(О) (CH2)nNHC (О) CH3 и их комбинаций, где C1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(О)C1-6 алкила и их комбинаций, где C1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00062] В одном варианте осуществления настоящего изобретения предлагается соединение формулы Ib, его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где X представляет собой -CH2O-, где группа СН2 в -CH2O- присоединена к арильному кольцу, а О-присоединен к гетероарильному кольцу; R2, R3 и R4 независимо выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, С1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или O, где C1-10 алкил, C1-10 алкокси, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила или -COORa, где C1-6 алкил, C1-6 алкокси и C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из гидрокси, циано, C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано; и Ra выбран из водорода, галогена, циано, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкил; R9 представляет собой C1-6 алкокси, где C1-6 алкокси, необязательно замещен одной или более группами, выбранными из гидрокси, C1-4 галогеналкила, C5-6 арила или C1-6 гетероарила, где С5-6 арил или C1-6 гетероарил необязательно замещены одной или более группами, выбранными из галогена или циано; R5 представляет собой -NR7R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, С1-6 алкил, С2-6 алкенил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены одним или более заместителями, выбранными из оксо, циано, галогена, гидроксила, морфолино, C(О)NH2, C(О)CH2CN, NHR6, СООН, COOR6, NHC(О)R6, C1-6 алкила, C1-6 галогеналкила, С3-10 циклоалкила, C5-6 арила, SR6 или 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из оксо, гидроксила, галогена, C1-6 алкила, СООН, COOR6, R6, NHR6, C(О)NHR6, C(О)NHSO2R6, С (О) (CH2)nNHC (О) CH3 и их комбинаций, где С1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(О)C1-6 алкила и их комбинаций, где C1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00063] В одном варианте осуществления настоящего изобретения предлагается соединение формулы Ib, его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где X представляет собой -CH2O-, где группа СН2 в -CH2O- присоединена к арильному кольцу, а O-присоединен к гетероарильному кольцу; R2, R3 и R4 независимо выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, С1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, C1-10 алкокси, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила или -COORa, где C1-6 алкил, C1-6 алкокси и C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из гидрокси, циано, C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано; и Ra выбран из водорода, галогена, циано, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R9 представляет собой C1-6 алкил; R5 представляет собой -NR7R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, C1-6 алкил, С2-6 алкенил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены одним или более заместителями, выбранными из оксо, циано, галогена, гидроксила, морфолино, C(О)NH2, C(О)CH2CN, NHR6, СООН, COOR6, NHC(О)R6, C1-6 алкила, C1-6 галогеналкила, С3-10 циклоалкила, C5-6 арила, SR6 или 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или
бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из оксо, гидроксила, галогена, C1-6 алкила, СООН, COOR6, R6, NHR6, C(О)NHR6, C(О)NHSO2R6, C(О) (CH2)nNHC (О) CH3 и их комбинаций, где C1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(О)C1-6 алкила и их комбинаций, где C1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00064] В одном варианте осуществления настоящего изобретения предлагается соединение формулы Ib, его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где X представляет собой -CH2O-, где группа СН2 в -CH2O- присоединена к арильному кольцу, а O-присоединен к гетероарильному кольцу; R2 и R9 независимо выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, C1-6 алкоксиамино, С1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или O, где C1-10 алкил, С1-10 алкокси, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкил, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила или -COORa, где C1-6 алкил, C1-6 алкокси и C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из гидрокси, циано, С1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано; и Ra выбран из водорода, галогена, циано, C1-6 алкила, С3-8 циклоалкила, C5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R3 и R4 независимо выбраны из водорода, C1-6 алкила и C1-6 алкокси; R5 представляет собой -NR7R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, С1-6 алкил, С2-6 алкенил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены одним или более заместителями, выбранными из оксо, циано, галогена, гидроксила, морфолино, C(О)NH2, C(О)CH2CN, NHR6, СООН, COOR6, NHC(О)R6, C1-6 алкила, C1-6 галогеналкила, С3-10 циклоалкила, C5-6 арила, SR6 или 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из оксо, гидроксила, галогена, C1-6 алкила, СООН, COOR6, R6, NHR6, C(О)NHR6, C(О)NHSO2R6, С (О) (CH2)nNHC (О) CH3 и их комбинаций, где С1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(О)C1-6 алкила и их комбинаций, где C1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00065] В одном варианте осуществления настоящего изобретения предлагается соединение формулы Ib, его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где X представляет собой -CH2O-, где группа СН2 в -CH2O- присоединена к арильному кольцу, а 0-присоединен к гетероарильному кольцу; R3, R4 и R9 независимо выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, С1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, C1-10 алкокси, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила или -COORa, где C1-6 алкил, C1-6 алкокси и C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из гидрокси, циано, C1-6 алкил, С3-6 циклоалкила, C1-6 гетероциклил, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано; и Ra выбран из водорода, галогена, циано, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R2 выбран из водорода, циано, C1-10 алкила, C1-10 алкокси, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, C1-10 алкокси, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила или -COORa, где C1-6 алкил, C1-6 алкокси и C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из гидрокси, галогена, циано, C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила или C1-6 алкокси, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано; R5 представляет собой -NR7R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, C1-6 алкил, C2-6 алкенил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены одним или более заместителями, выбранными из оксо, циано, галогена, гидроксила, морфолино, C(О)NH2, C(О)CH2CN, NHR6, СООН, COOR6, NHC(О)R6, C1-6 алкила, С1-6 галогеналкила, С3-10 циклоалкила, С5-6 арила, SR6 или 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из оксо, гидроксила, галогена, C1-6 алкила, СООН, COOR6, R6, NHR6, C(О)NHR6, C(О)NHSO2R6, C(О) (CH2)nNHC (О) CH3 и их комбинаций, где C1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(О)C1-6 алкила и их комбинаций, где C1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00066] В одном варианте осуществления настоящего изобретения предлагается соединение формулы Ib, его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где X представляет собой -CH2O-, где группа СН2 в -CH2O- присоединена к арильному кольцу, а O-присоединен к гетероарильному кольцу; R2, R3, R4, и R9 независимо выбраны из водорода, циано, С1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, С1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или O, где C1-10 алкил, C1-10 алкокси, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила или -COORa, где C1-6 алкил, C1-6 алкокси и C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из гидрокси, циано, C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано; и Ra выбран из водорода, галогена, циано, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R5 выбран из
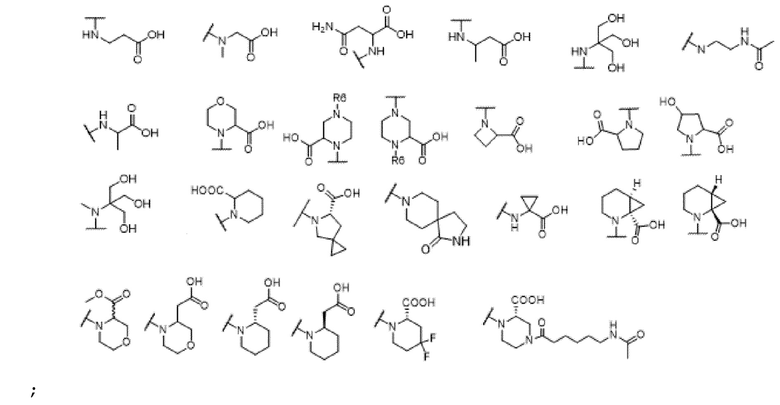
и R6 выбран из группы, состоящей из водорода, C1-6 алкила, С(О)С1-6 алкила и их комбинаций, где C1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
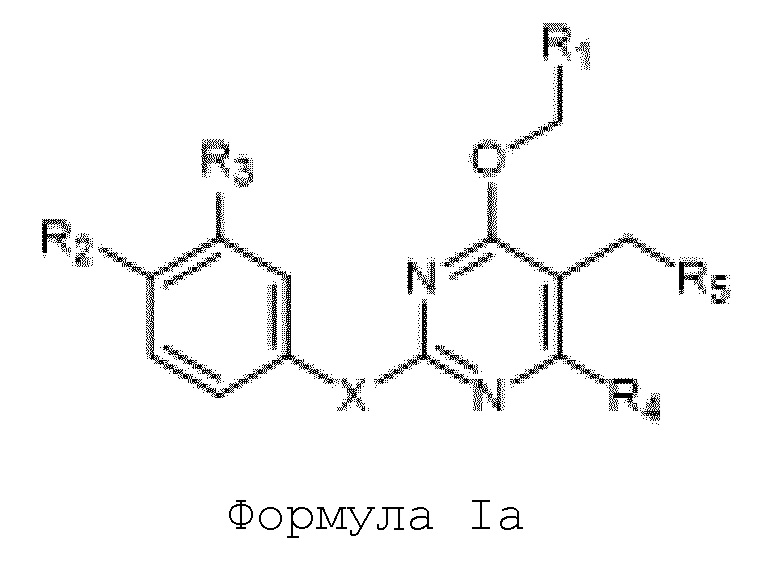
[00067] В одном варианте осуществления настоящего изобретения предлагаются соединения формулы Ia
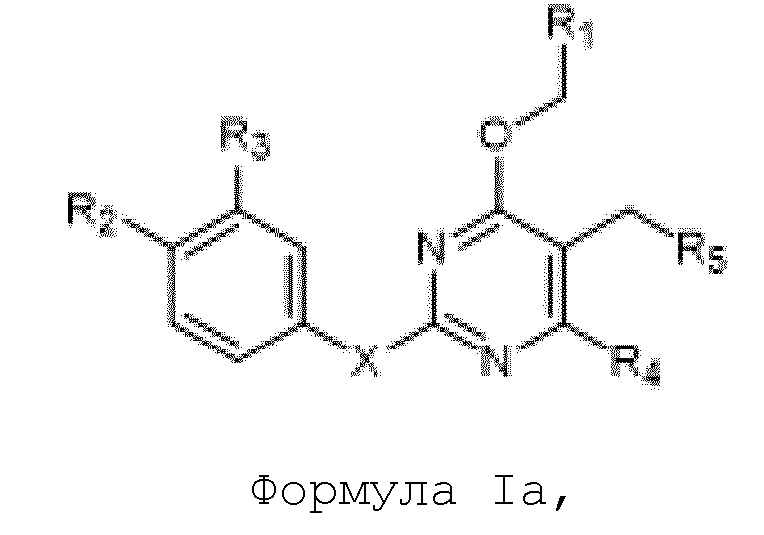
их полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли,
где X выбран из -CH2O -, -ОСН2-, - C(О)NH- или - NHC(O)-; R1, R2, R3, и R4 независимо выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, С1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила, -COORa, где C1-6 алкил, C1-6 алкокси, C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано, и Ra выбран из водорода, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, C5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R5 представляет собой -NR7R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, C1-6 алкил, С2-6 алкенил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены одним или более заместителями, выбранными из оксо, циано, галогена, гидроксила, морфолино, C(О)NH2, C(О)CH2, CN, NHR6, СООН, COOR6, NHC(О)R6, C1-6 алкила, C1-6 галогеналкила, С3-10 циклоалкила, С5-6 арила, SR6 или 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из группы, состоящей из оксо, гидроксила, галогена, C1-6 алкила, СООН, COOR6, R6, NHR6, C(О)NHR6, C(О)NHSO2R6, C(О) (CH2)nNHC (О) CH3 и их комбинаций, где C1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(О)C1-6 алкила, и их комбинаций, где C1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00068] В одном варианте осуществления настоящего изобретения предлагается соединение формулы Ia, его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где X представляет собой -CH2O-, где группа СН2 из -CH2O- присоединена к арильному кольцу, а O-присоединен к гетероарильному кольцу; R1, R2, R3, и R4 независимо выбраны из водорода, циано, С1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, С1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или O, где C1-10 алкил, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила, -COOR, где C1-6 алкил, C1-6 алкокси, C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из C1-6 алкила, С3-6 циклоалкила, С1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано, и Ra выбран из водорода, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R5 представляет собой -NR7R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, C1-6 алкил, С2-6 алкенил и 5-10-членный моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены одним или более заместителями, выбранными из оксо, циано, галогена, гидроксила, морфолино, C(О)NH2, C(О)CH2CN, NHR6, СООН, COOR6, NHC(О)R6, C1-6 алкила, C1-6 галогеналкила, С3-10 циклоалкила, С5-6 арила, SR6 или 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из группы, состоящей из оксо, гидроксила, галогена, C1-6 алкила, СООН, COOR6, R6, NHR6, C(О)NHR6, C(О)NHSO2R6, С (О) (CH2)nNHC (О) CH3 и их комбинаций, где C1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(О)C1-6 алкила, и их комбинаций, где C1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00069] В одном варианте осуществления настоящего изобретения предлагается соединение формулы Ia, его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где X представляет собой -OCH2-, где О из -OCH2 присоединен к арильному кольцу, а группа СН2-присоединена к гетероарильному кольцу; R1, R2, R3, и R4 независимо выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, C1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила, -COOR, где C1-6 алкил, C1-6 алкокси, C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано, и Ra выбран из водорода, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R5 представляет собой -NR7 R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, C1-6 алкил, С2-6 алкенил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены одним или более заместителями, выбранными из оксо, циано, галогена, гидроксила, морфолино, C(О)NH2, C(О)CH2CN, NHR6, СООН, COOR6, NHC(О)R6, C1-6 алкила, C1-6 галогеналкила, С3-10 циклоалкила, C5-6 арила, SR6 или 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из группы, состоящей из оксо, гидроксила, галогена, C1-6 алкила, СООН, COOR6, R6, NHR6, C(О)NHR6, C(О)NHSO2R6, -С (О) (CH2)nNHC (О) CH3 и их комбинаций, где C1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(О)C1-6 алкила, и их комбинаций, где C1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00070] В одном варианте осуществления настоящего изобретения предлагается соединение формулы Ia, его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где X представляет собой -OCH2-, где О в -OCH2 присоединен к арильному кольцу и группа СН2-присоединена к гетероарильному кольцу; R1, R2, R3 и R4 независимо выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, С1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила, -COORa, где C1-6 алкил, C1-6 алкокси, C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из C1-6 алкила, С3-6 циклоалкила, С1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано, и Ra выбран из водорода, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R5 выбран из
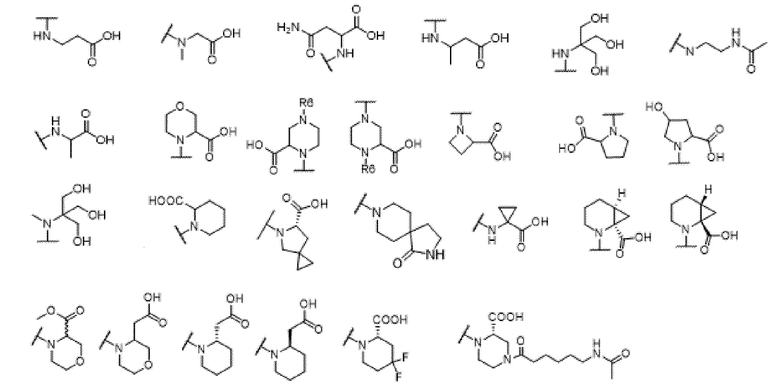
; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, С (О)C1-6 алкила и их комбинаций, где С1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00071] В одном варианте осуществления настоящего изобретения предлагается соединение формулы Ia, его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где X представляет собой C(О)NH-, где группа -С(О) из -C(О)NH присоединена к арильному кольцу и группа NH- присоединена к гетероарильному кольцу; R1, R2, R3, и R4 независимо выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, C1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила, -COOR, где C1-6 алкил, C1-6 алкокси, C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано, и Ra выбран из водорода, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R5 представляет собой -NR7R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, С1-6 алкил, С2-6 алкенил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо, необязательно замещенное одним или более заместителями, выбранными из оксо, циано, галогена, гидрокси, морфолино, C(О)NH2, C(О)CH2, CN, NHR6, СООН, COOR6, NHC(О)R6, С1-6 алкила, C1-6 галогеналкила, С3-10 циклоалкила, С5-6 арила, SR6 или 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из группы, состоящей из оксо, гидроксила, галогена, C1-6 алкила, СООН, COOR6, R6, NHR6, C(О)NHR6, C(О)NHSO2R6, С (О) (CH2)nNHC (О) CH3, и их комбинаций, где C1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(О)C1-6 алкила, и их комбинаций, где C1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00072] В одном варианте осуществления настоящего изобретения предлагается соединение формулы Ia, его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где X представляет собой NH(О)-, где группа -NH из -NHC(О)- присоединена к арильному кольцу и группа С(О)- присоединена к гетероарильному кольцу; R1, R2, R3, и R4 независимо выбраны из водорода, циано, С1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, С1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила, -COOR, где C1-6 алкил, C1-6 алкокси, C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано, и Ra выбран из водорода, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R5 представляет собой -NR7R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, C1-6 алкил, С2-6 алкенил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены одним или более заместителями, выбранными из оксо, циано, галогена, гидроксила, морфолино, C(О)NH2, C(О)CH2CN, NHR6, СООН, COOR6, NHC(О)R6, C1-6 алкила, C1-6 галогеналкила, С3-10 циклоалкила, С5-6 арила, SR6 или 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из группы, состоящей из оксо, галогена, гидроксила, C1-6 алкила, СООН, COOR6, R6, NHR6, C(О)NHR6, C(О)NHSO2R6, С (О) (CH2)nNHC (О) CH3 и их комбинаций, где C1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(О)C1-6 алкила, и их комбинаций, где C1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00073] В одном варианте осуществления настоящего изобретения предлагается соединение формулы I
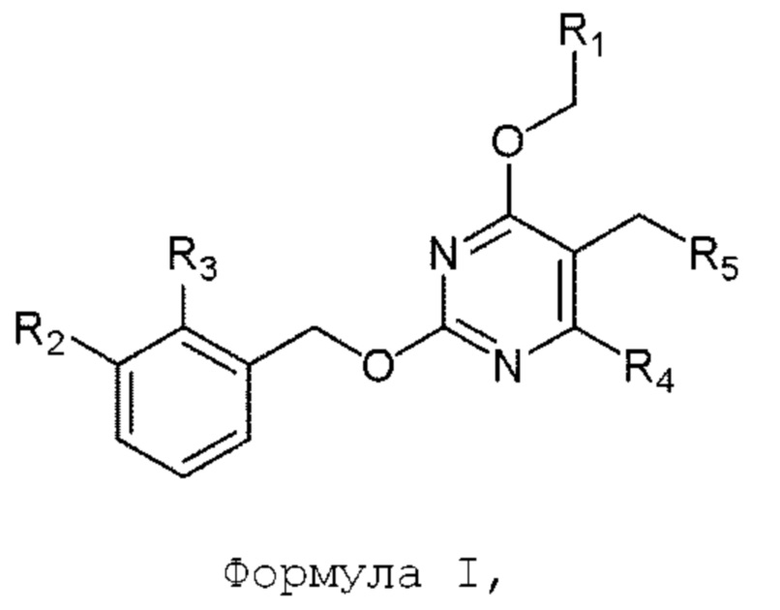
его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где R1, R2, R3, и R4 независимо выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, C1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, С1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила, -COOR, где C1-6 алкил, C1-6 алкокси и C1-10 гетероциклил замещены одной или более группами, выбранными из C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси и COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано, и Ra выбран из водорода, C1-6 алкила, С3-8 циклоалкила, C1-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R5 представляет собой -NR7 R8, где R7 и R8 выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, C1-6 алкил, С2-6 алкенил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены заместителями, выбранными из оксо, циано, галогена, гидрокси, морфолино, C(О)NH2, C(О)CH2, CN, NHR6, СООН, COOR6, NHC(О)R6, C1-6 алкила, С1-6 галогеналкила, С3-10 циклоалкила, С5-6 арила, SR6, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или
бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из оксо, гидроксила, C1-6 алкила, СООН, COOR6, Re, NHR6, C(О)NHR6, C(О)NHSO2R6, С (О) (CH2)nNHC (О) CH3 и их комбинаций, где C1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(О)C1-6 алкила, и их комбинаций, где C1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00074] В одном варианте осуществления настоящего изобретения предлагается соединение формулы I, его полиморфы, стереоизомеры, таутомеры, пролекарства, сольваты и их фармацевтически приемлемые соли, где R1, R2, R3, и R4 независимо друг от друга выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино С1-6 алкила, C1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-6 гетероциклила, -COORa, где C1-6 алкил, C1-6 алкокси, и C1-6 гетероциклил замещены одной или более группами, выбранными из C1-6 алкила, С3-6 циклоалкила, С1-6 гетероциклила, C1-6 алкокси и COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано, и Ra выбран из водорода, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; и R5 выбран из
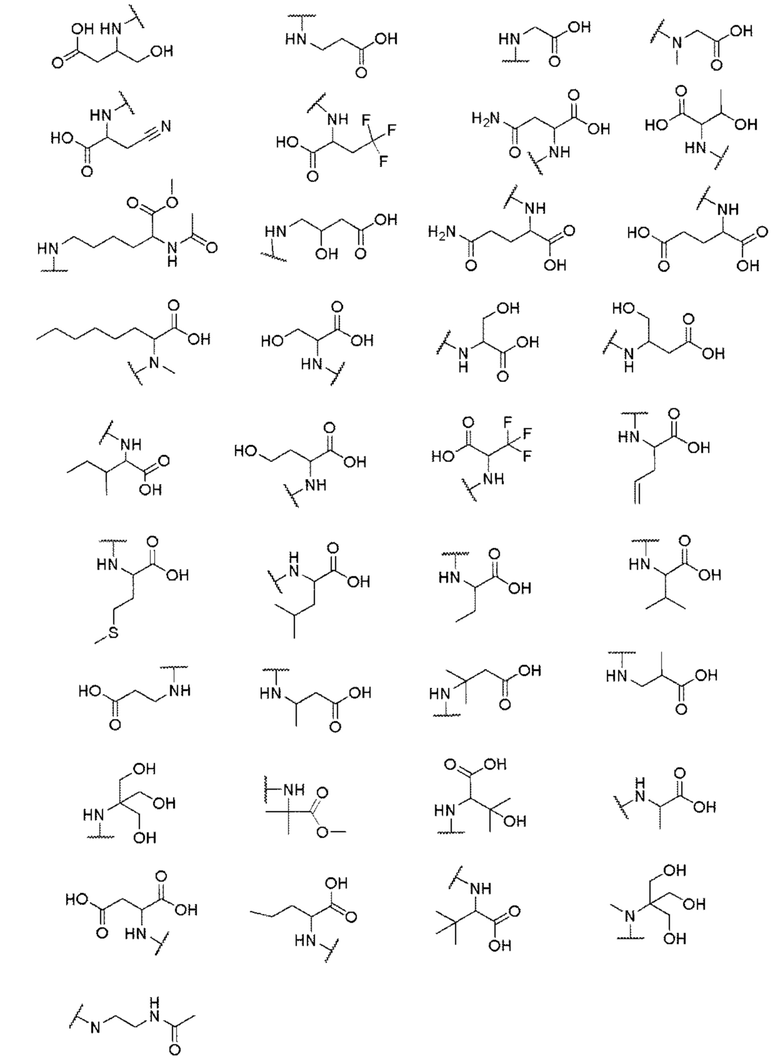
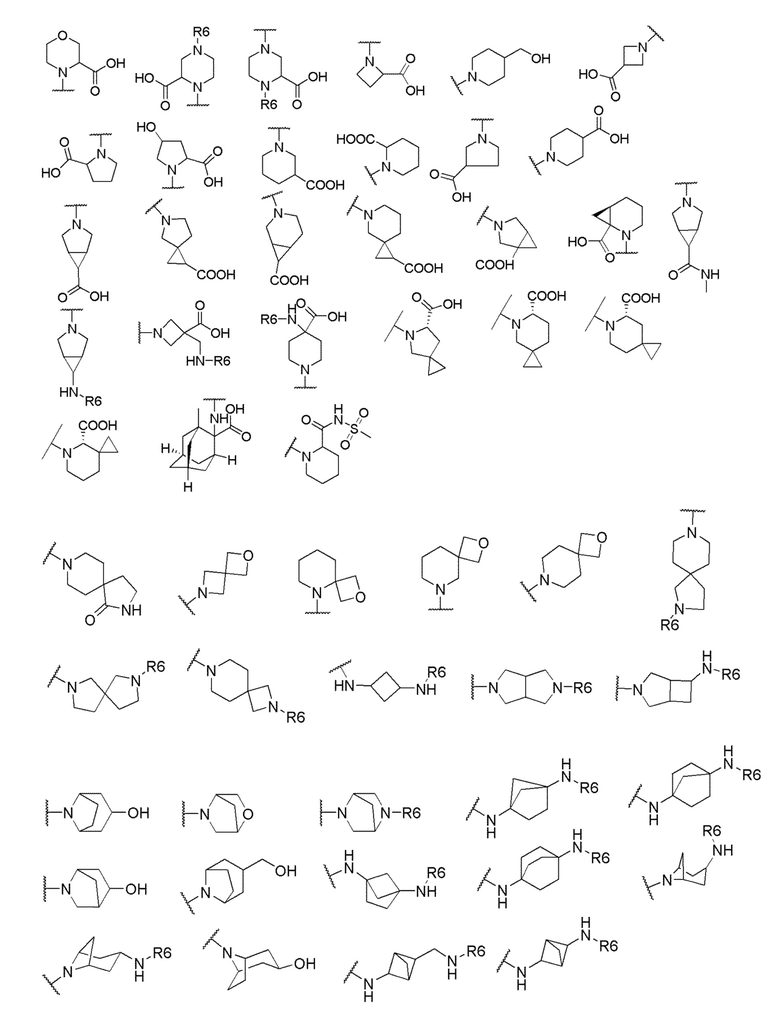
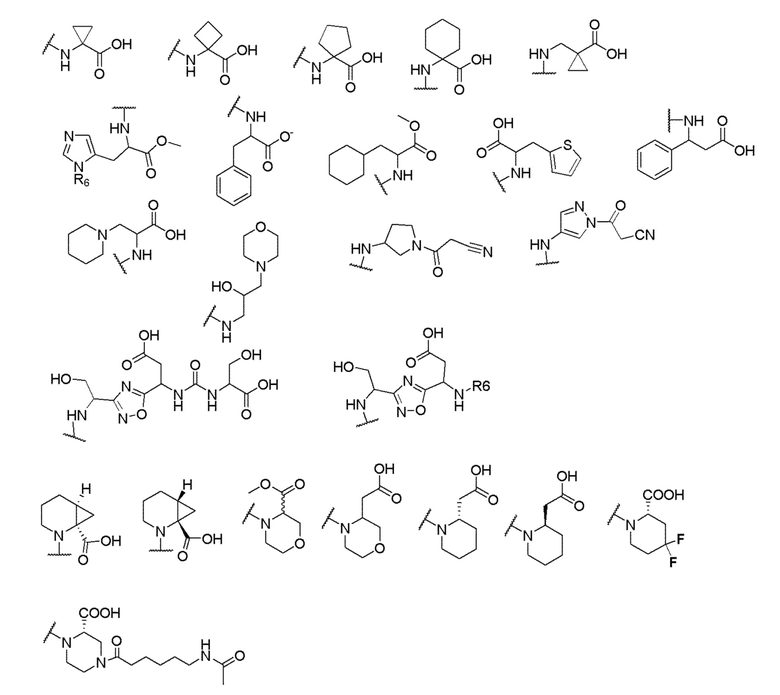
где R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(O)C1-6 алкила и их комбинаций, где C1-6 алкил и C(O)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(O)NHR6 и их комбинаций.
[00075] В одном варианте осуществления настоящего изобретения предлагается соединение формулы I, как описано здесь, где R1, R2, R3, и R4 независимо выбраны из водорода, циано, C1-6 алкила, C1-6 алкокси, C1-4 галогеналкила, C1-4 галогеналкокси, С3-6 циклоалкила, C1-4 алкиламино, амино C1-4 алкила, C1-4 алкоксиамино, C1-4 ациламино, С5-6 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-6 алкил, C5-6 арил, и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, C3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила, -COORa, где C1-6 алкил, C1-6 алкокси, C1-10 гетероциклил необязательно замещены одной или более группами, выбранными из C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси и COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано, и Ra выбран из водорода, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; и R5 выбран из
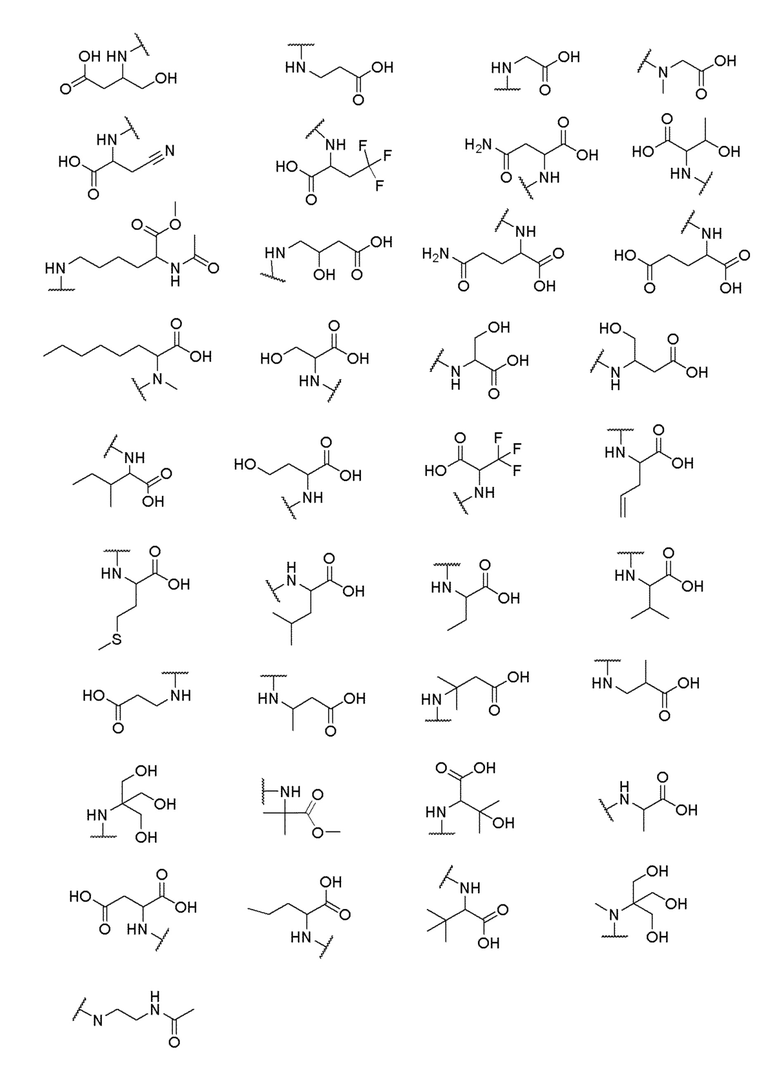
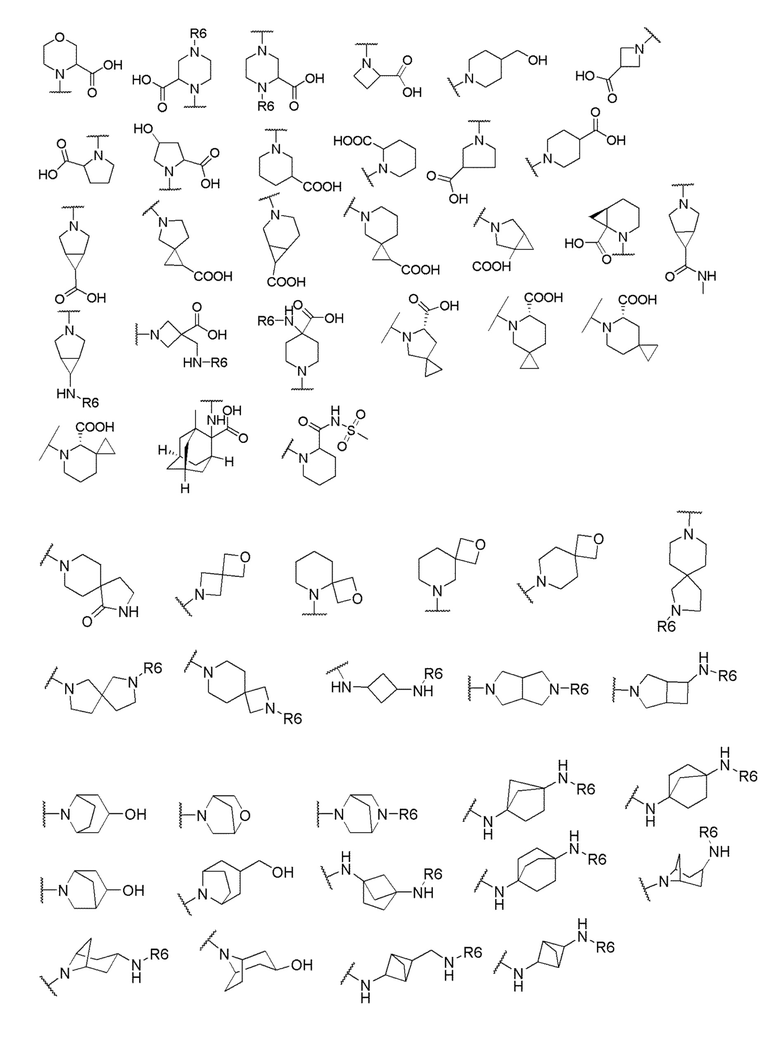
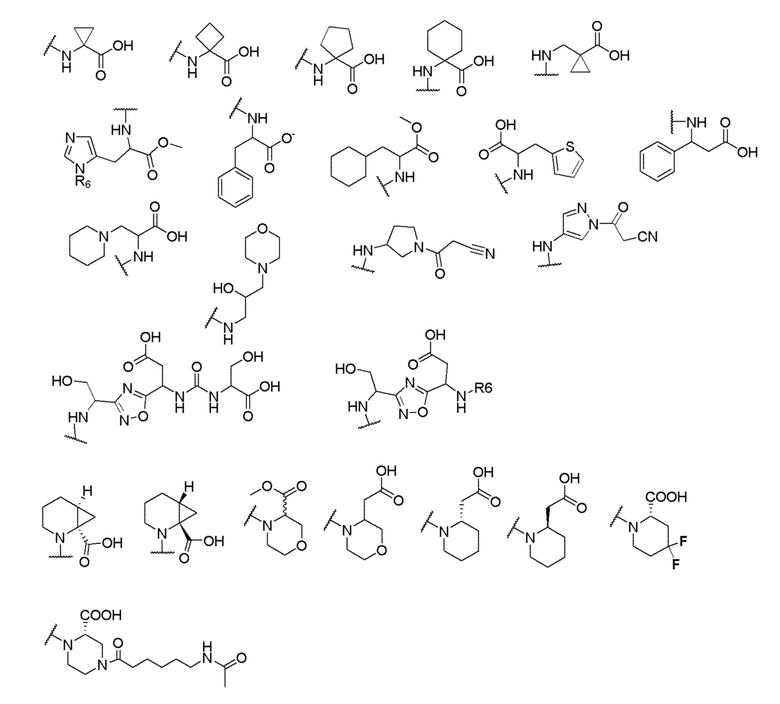
R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(O)C1-6 алкила и их комбинаций, где C1-6 алкил и C(O)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(O)NHR6 и их комбинаций.
[00076] В одном варианте осуществления настоящего изобретения предлагается соединение формулы I, как описано здесь, где R1 выбран из водорода, C1-4 алкила, С3-6 циклоалкила, С5-6 арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-4 алкил, С5-6 арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-4 алкила, C1-4 алкокси, C1-4 галогеналкила или C1-4 галогеналкокси; R2 выбран из водорода, С5-6 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где С5-6 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, фтора, хлора, брома, йода, гидроксила, циано, C1-4 алкила, C1-4 алкокси, C1-4 галогеналкила, C1-4 галогеналкокси, С3-6 циклоалкила, C1-4 алкиламино, амино C1-6 алкила, C1-4 алкоксиамино, C1-4 ациламино, C1-8 гетероциклила, COORa, где C1-4 алкил, C1-4 алкокси, C1-8 гетероциклил необязательно замещены одной или более группами, выбранными из C1-4 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-4 алкокси и COORa; где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано, и Ra независимо выбран из водорода, C1-4 алкила, C3-6 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R3 и R4 независимо выбраны из водорода, циано, C1-4 алкила, C1-4 алкокси, C1-4 галогеналкила, C1-4 галогеналкокси, С3-6 циклоалкила, C1-4 алкиламино, амино C1-4 алкила, C1-4 алкоксиамино, C1-4 ациламино, С5-6 арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где С5-6 арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-4 алкила, C1-4 алкокси, C1-4 галогеналкила, C1-4 галогеналкокси, С3-6 циклоалкила, C1-4 алкиламино, C1-4 алкоксиамино, C1-4 ациламино или C1-6 гетероциклила; и R5 выбран из
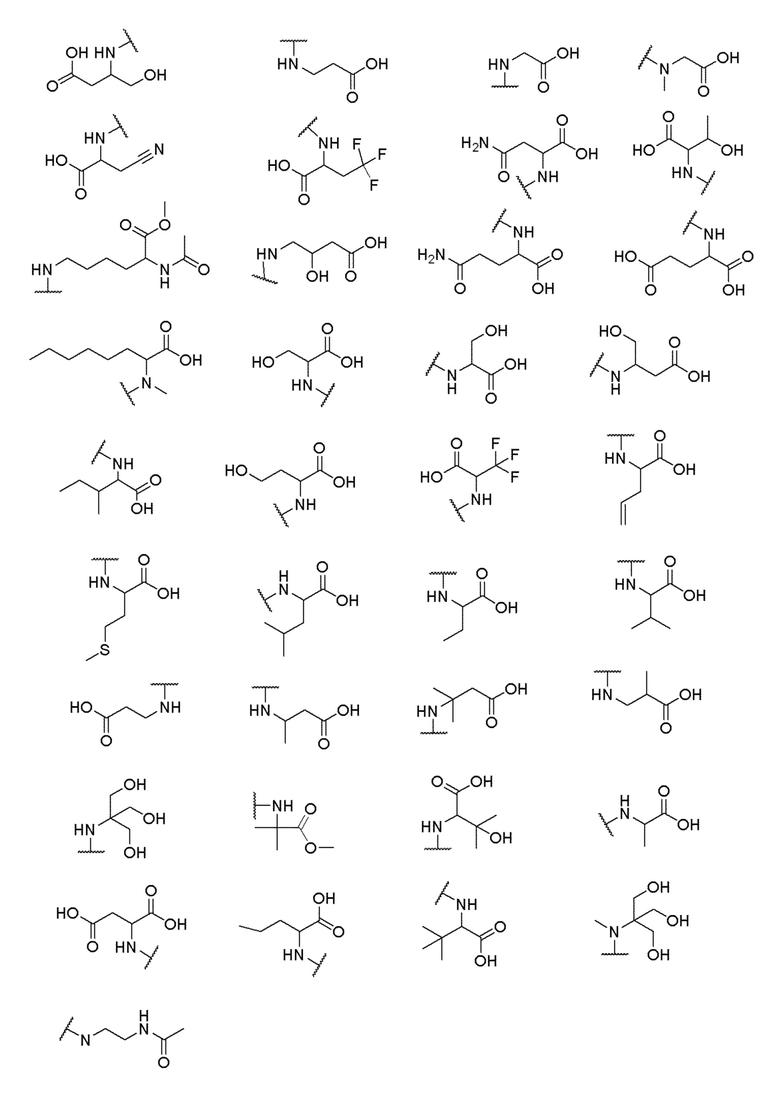
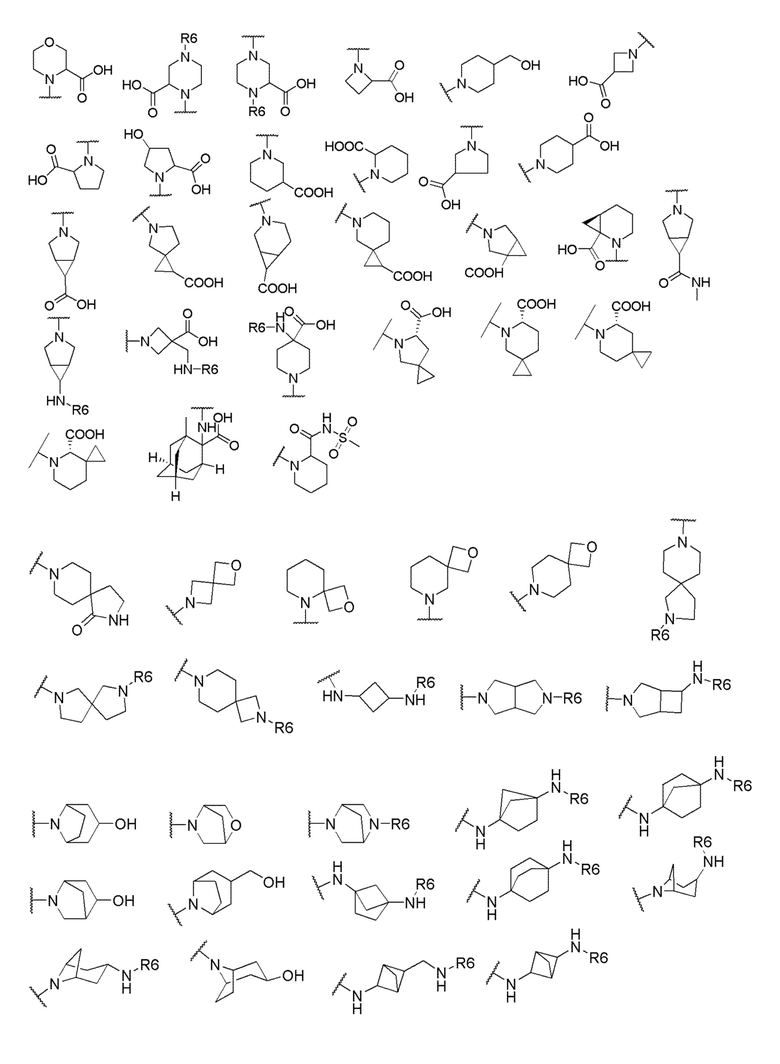
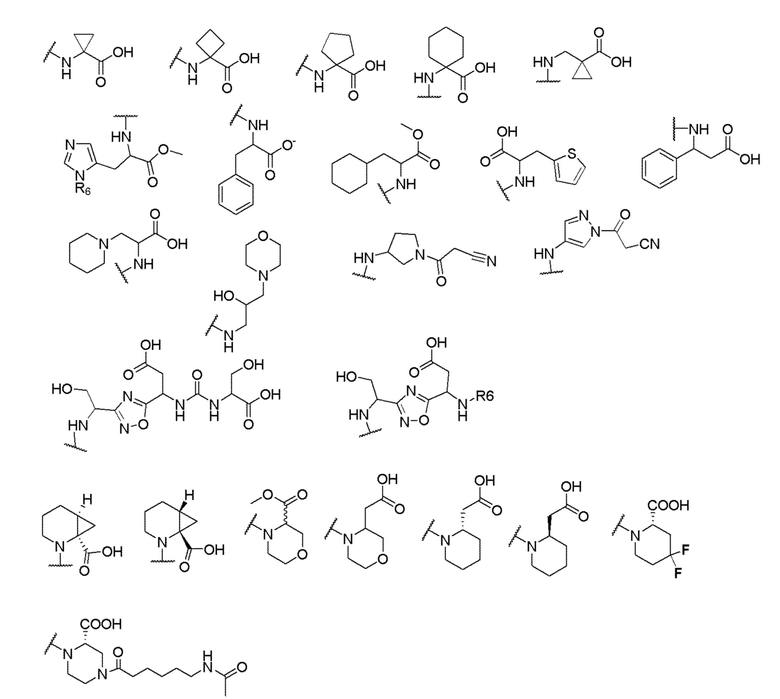
где R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(O)C1-6 алкила и их комбинаций, где C1-6 алкил и C(O)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(O)NHR6 и их комбинаций.
[00077] В одном варианте осуществления настоящего изобретения предлагается соединение формулы I, как описано здесь, где R1 и R2 независимо выбраны из водорода, C1-6 алкила, C1-6 алкокси, C1-4 галогеналкила, C1-4 галогеналкокси, С3-6 циклоалкила, С1-4 алкиламино, амино C1-4 алкила, C1-4 алкоксиамино, C1-4 ациламино, С5-6 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-6 алкил, С5-6 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-4 алкила, C1-4 алкокси, C1-4 галогеналкила, C1-4 галогеналкокси, С3-6 циклоалкила, C1-4 алкиламино, C1-4 алкоксиамино, C1-4 ациламино, C1-6 гетероциклила, COORa, где C1-4 алкил, C1-4 алкокси, и C1-6 гетероциклил необязательно замещены одной или более группами, выбранными из C1-4 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-4 алкокси и COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано, и Ra независимо выбран из водорода, C1-4 алкила, C3-6 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R3 и R4 независимо выбраны из группы, состоящей из водорода, циано, C1-4 алкила, C1-4 алкокси, C1-4 галогеналкила, C1-4 галогеналкокси, С3-6 циклоалкила, C1-4 алкиламино, C1-4 алкоксиамино, C1-4 ациламино и их комбинаций; и R5 выбран из
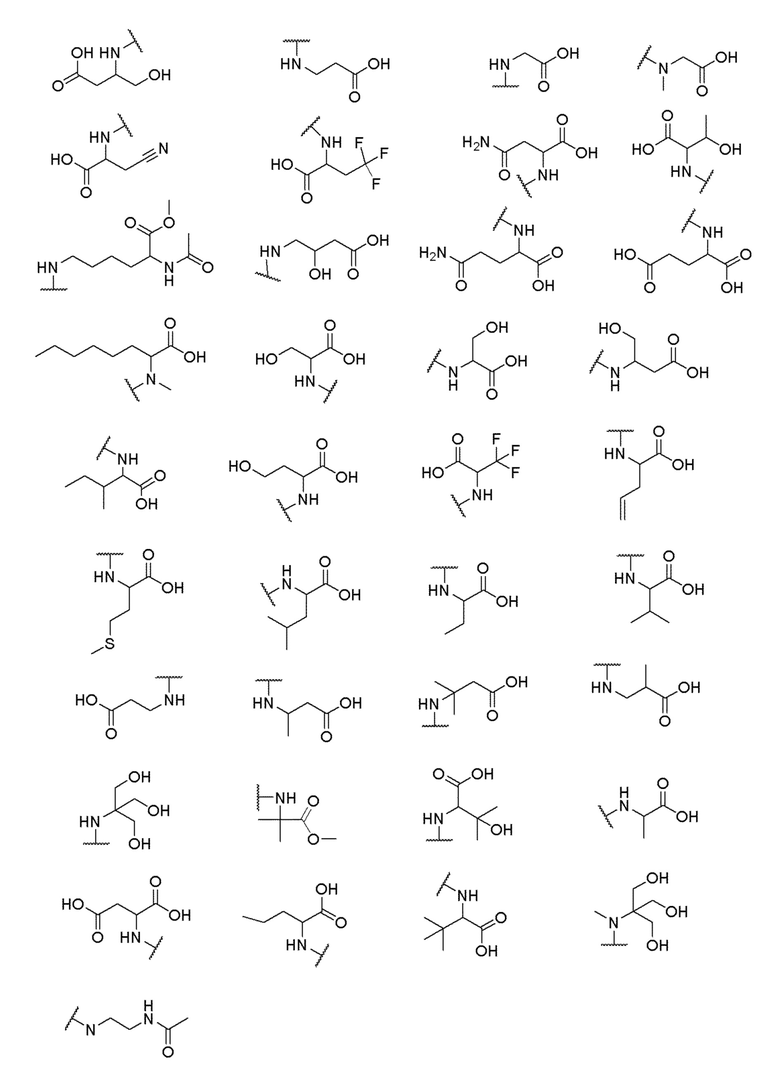
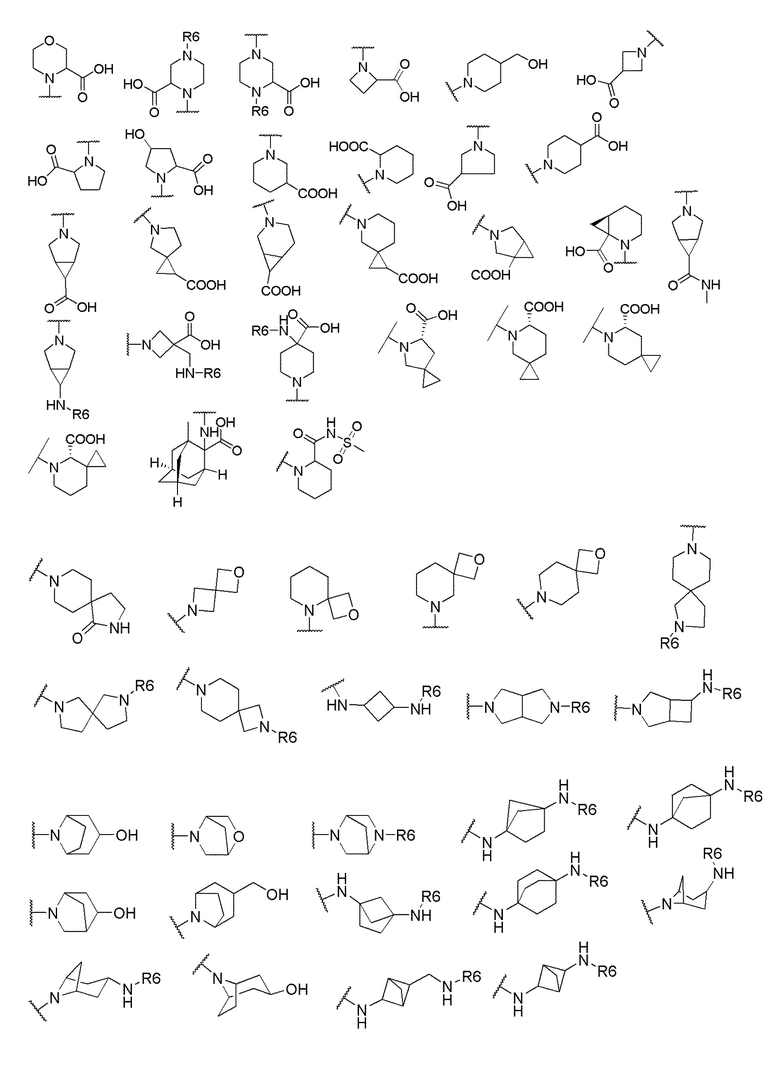
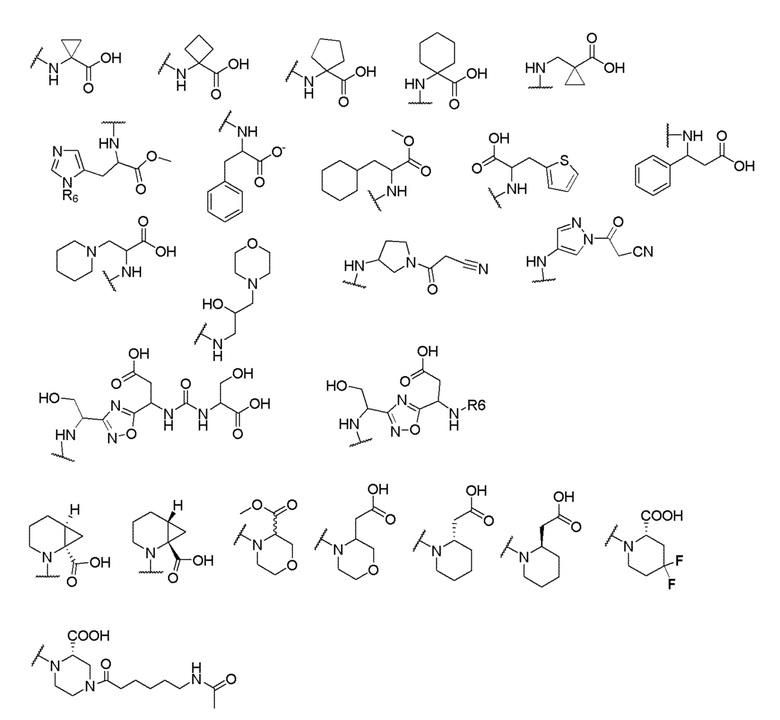
где R6 выбран из водорода, C1-6 алкила и C(O)C1-6 алкила.
[00078] В одном варианте осуществления настоящего изобретения предлагается соединение формулы I, как описано здесь, где R1, R2, R3, и R4 независимо выбраны из водорода, циано, C1-6 алкила, C1-6 алкокси, C1-4 галогеналкила, C1-4 галогеналкокси, С3-6 циклоалкила, C1-4 алкиламино, амино C1-4 алкила, C1-4 алкоксиамино, C1-4 ациламино C5-9 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-6 алкил, С5-9 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-4 алкила, C1-4 алкокси, С1-4 галогеналкила, C1-4 галогеналкокси, С3-6 циклоалкила, C1-4 алкиламино, C1-4 алкоксиамино, C1-4 ациламино, C1-6 гетероциклила или -COORa, где C1-4 алкил, C1-4 алкокси, C1-9 гетероциклил необязательно замещены одной или более группами, выбранными из С1-4 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-4 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано; и Ra выбран из водорода, C1-4 алкила, С3-6 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; и R5 выбран из
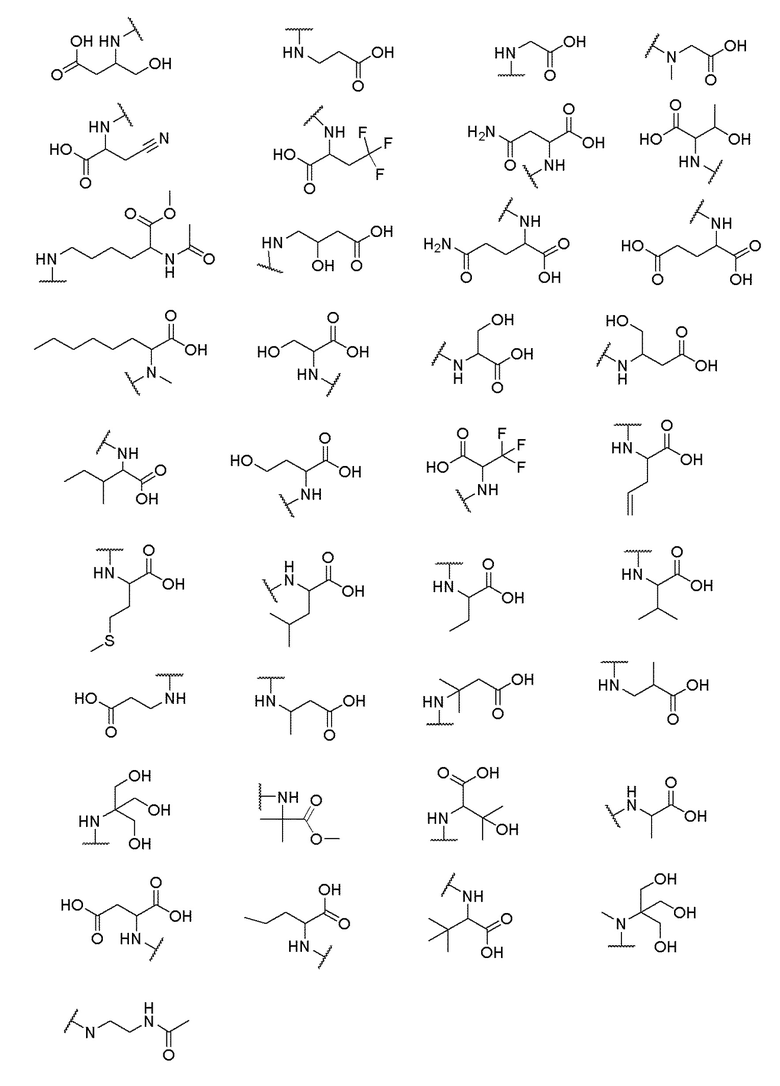
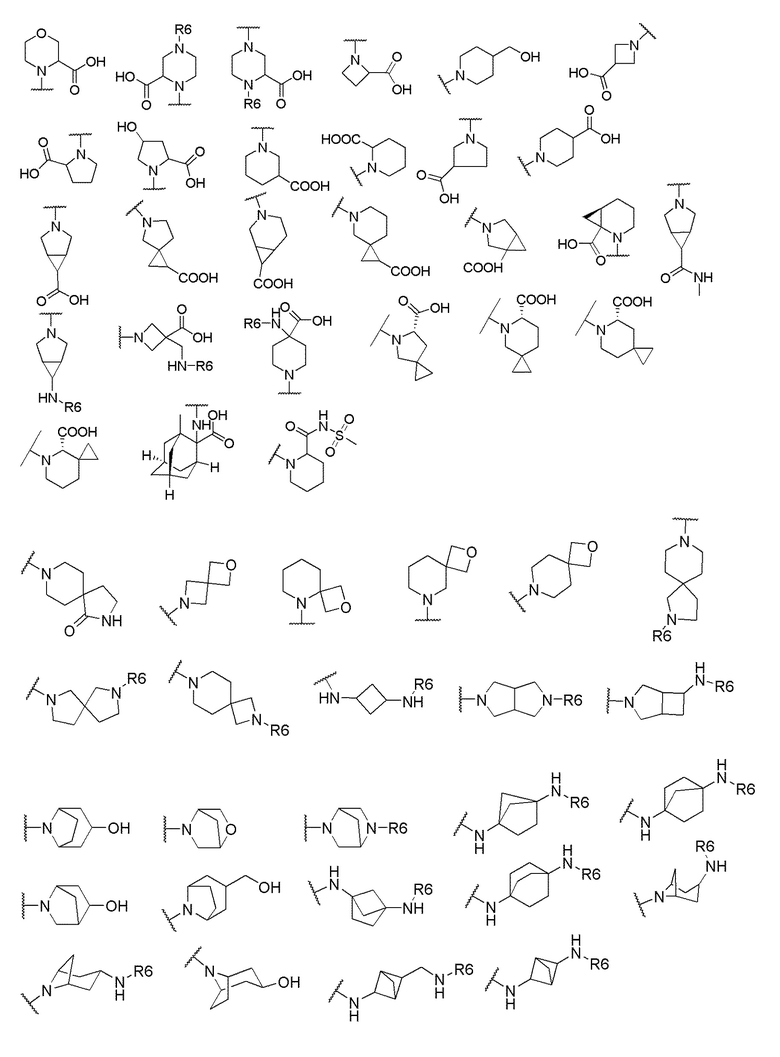
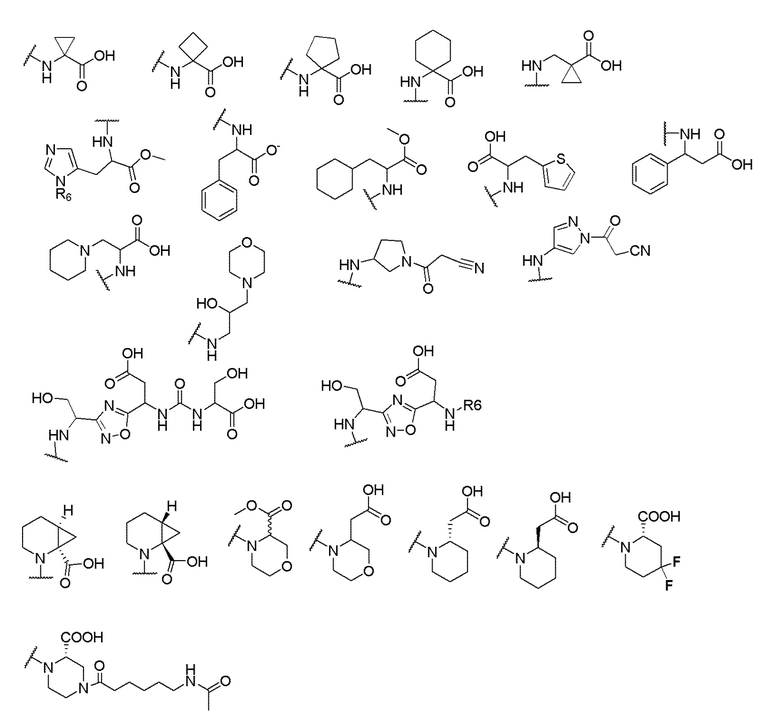
где R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(O)C1-6 алкила и их комбинаций, где C1-6 алкил и C(O)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, COOH, NHR6, NHC(O)NHR6 и их комбинаций.
[00079] В одном варианте осуществления настоящего изобретения предлагается соединение формулы I, как описано здесь, где R1 выбран из водорода, C1-4 алкила, С3-6 циклоалкила, С5-6 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или O, где C1-4 алкил, С5-6 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-4 алкила, С1-4 алкокси, C1-4 галогеналкила, C1-4 галогеналкокси или С1-6 гетероциклила; R2 выбран из водорода, С5-6 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или O, где С5-6 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, фтора, хлора, брома, йода, гидроксила, циано, C1-4 алкила, C1-4 алкокси, C1-4 галогеналкила, C1-4 галогеналкокси, С3-6 циклоалкила, C1-4 алкиламино, амино C1-6 алкила, C1-4 алкоксиамино, C1-4 ациламино, C1-8 гетероциклила или COORa, где C1-4 алкил, C1-4 алкокси, и C1-8 гетероциклил необязательно замещены одной или более группами, выбранными из C1-4 алкила, С3-6 циклоалкила, С1-6 гетероциклила, C1-4 алкокси, и COORa; где C1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано; и Ra независимо выбран из водорода, C1-4 алкила, С3-6 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R3 и R4 независимо выбраны из группы, состоящей из водорода, циано, C1-4 алкила, C1-4 алкокси, С1-4 галогеналкила, C1-4 галогеналкокси, С3-6 циклоалкила, C1-4 алкиламино, C1-4 алкоксиамино, C1-4 ациламино и их комбинаций; и R5 выбран из
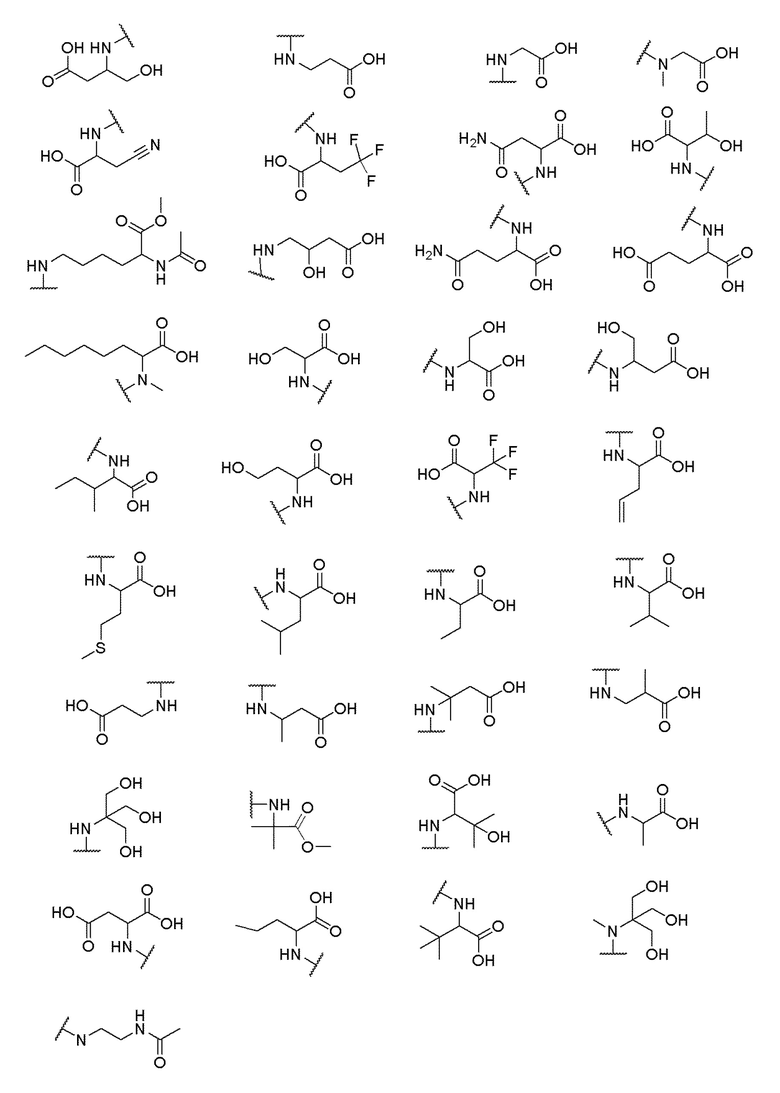
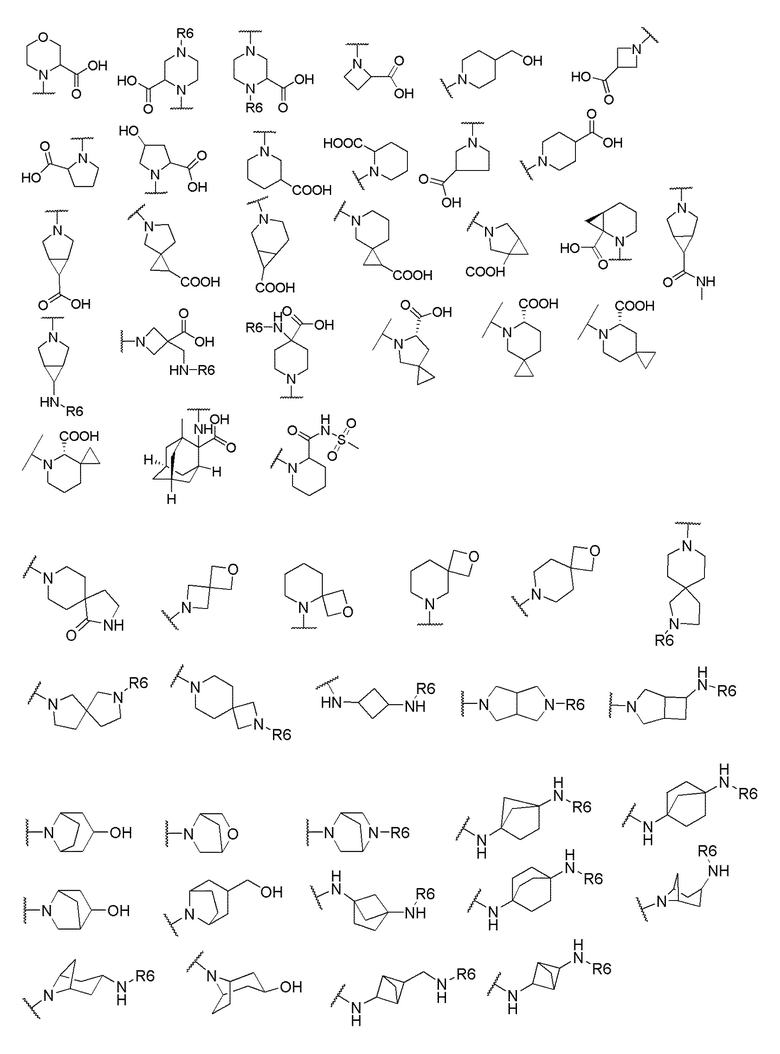
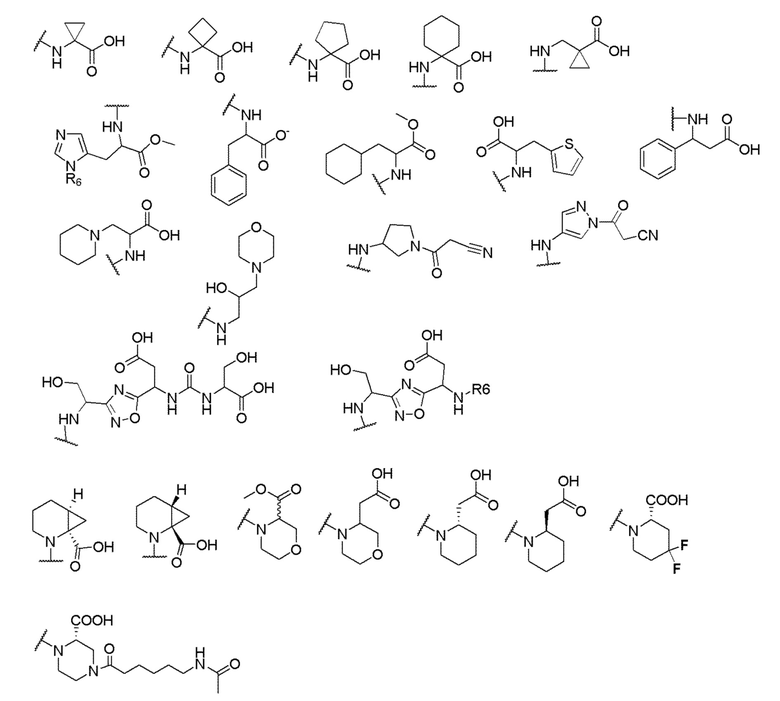
где R6 выбран из группы, состоящей из водорода, С1-6 алкила, C(O)С1-6 алкила и их комбинаций, где C1-6 алкил и C(О)С1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, COOH, NHR6, NHC(О)NHR6 и их комбинаций.
[00080] В одном варианте осуществления настоящего изобретения предлагается соединение формулы I, как описано здесь, где R1 выбран из водорода, С1-4 алкила, С3-6 циклоалкила, С5-6 арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-4 алкил, С5-6 арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, С1-4 алкила, С1-4 алкокси, С1-4 галогеналкила, С1-4 галогеналкокси, С1-6 гетероциклила или COORa, где Ra независимо выбран из водорода, С1-4 алкила, С3-6 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, С1-6 гетероарила или С1-6 гетероарилалкила; R2 выбран из водорода, С5-6 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где С5-6 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, фтора, хлора, брома, йода, гидроксила, циано, С1-4 алкила, С1-4 алкокси, С1-4 галогеналкила, С1-4 галогеналкокси, С3-6 циклоалкила, С1-4 алкиламино, амино С1-6 алкила, С1-4 алкоксиамино, С1-4 ациламино, С1-6 гетероциклила, COORa, где С1-4 алкил, С1-4 алкокси, C1-6 гетероциклил необязательно замещены одной или более группами, выбранными из С1-4 алкила, С3-6 циклоалкила, С1-6 гетероциклила и С1-4 алкокси, где С1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано; R3 и R4 независимо выбраны из водорода, циано, С1-4 алкила, С1-4 алкокси, С1-4 галогеналкила, С1-4 галогеналкокси, С3-6 циклоалкила, С1-4 алкиламино, С1-4 алкоксиамино или С1-4 ациламино; и R5 выбран из
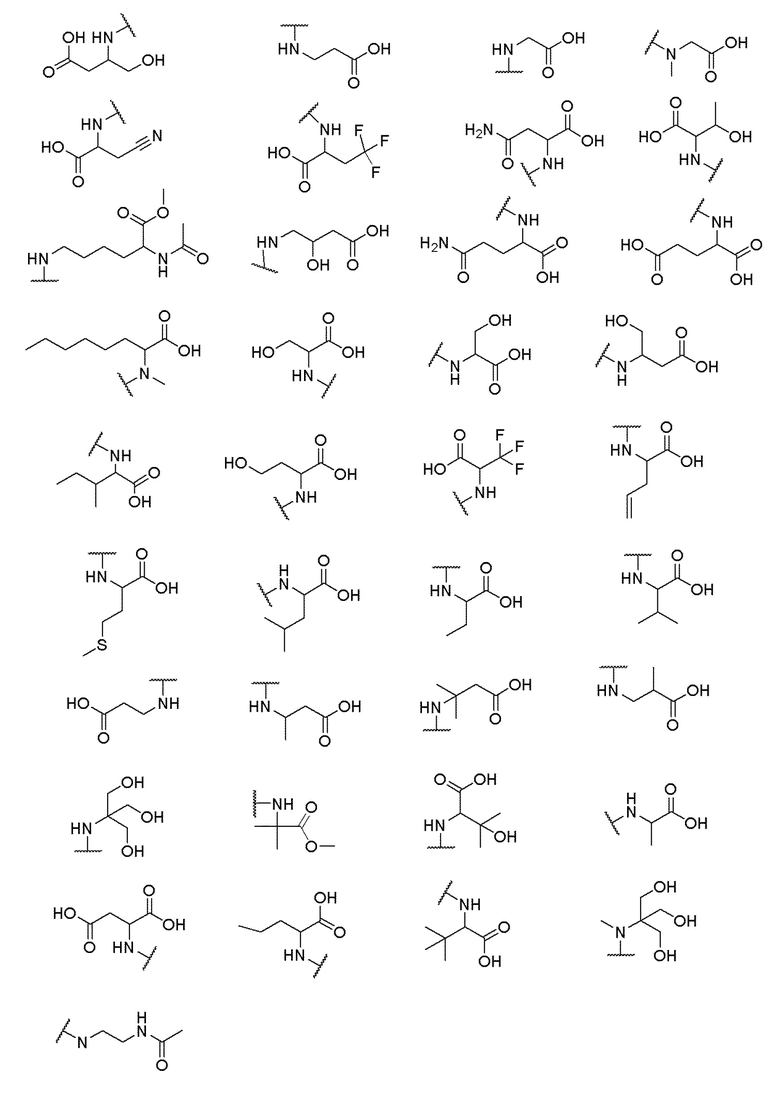
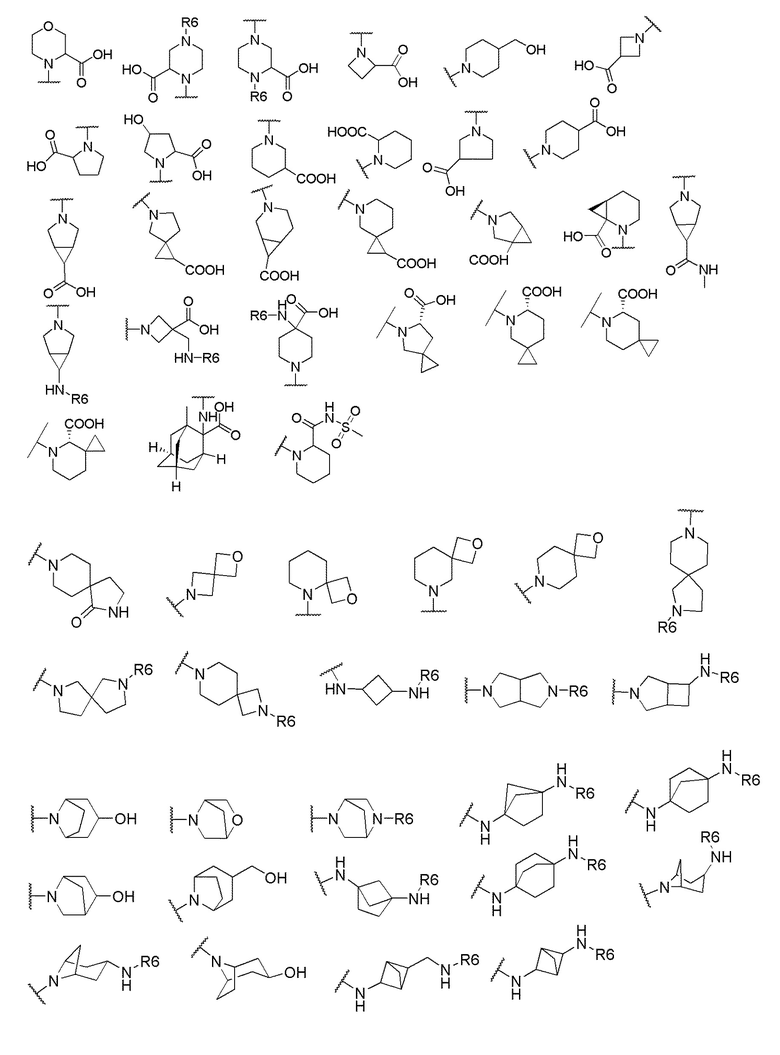
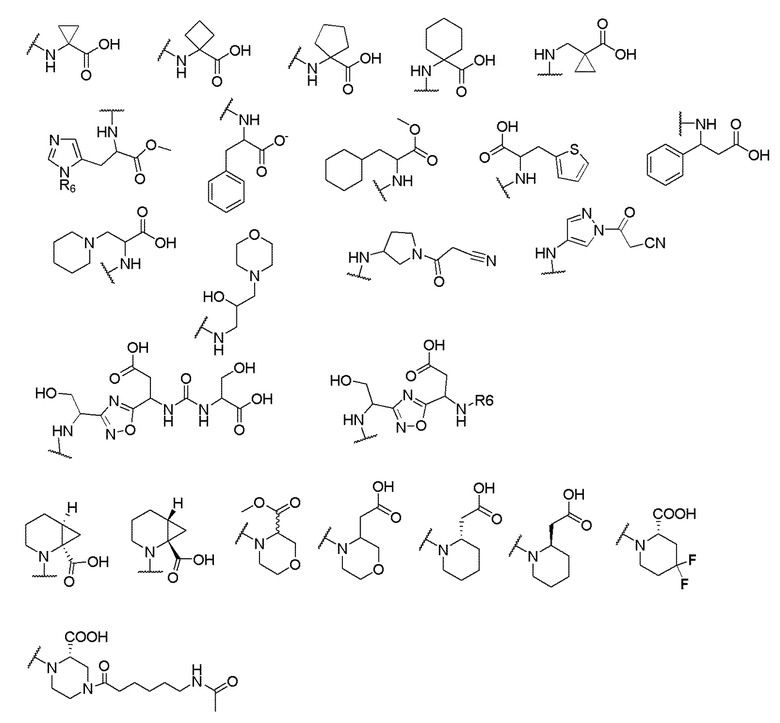
где R6 выбран из группы, состоящей из водорода, С1-6 алкила, С(О)С1-6 алкила и их комбинаций, где С1-6 алкил и C(О)С1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00081] В одном варианте осуществления настоящего изобретения предлагается соединение формулы I, как описано в здесь, где R1 выбран из водорода, С1-4 алкила, С3-6 циклоалкила, С5-6 арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где С1-4 алкил, С5-6 арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, С1-4 алкила, С1-4 алкокси, С1-4 галогеналкила, С1-4 галогеналкокси или С1-6 гетероциклила; R2 выбран из водорода, С5-6 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где С5-6 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, фтора, хлора, брома, йода, гидроксила, циано, С1-4 алкила, С1-4 алкокси, С1-4 галогеналкила, С1-4 галогеналкокси, С3-6 циклоалкила, С1-4 алкиламино, амино С1-6 алкила, С1-4 алкоксиамино, С1-4 ациламино, С1-6 гетероциклила, COORa, где С1-4 алкил, С1-4 алкокси, С1-6 гетероциклил необязательно замещены одной или более группами, выбранными из С1-4 алкила, С3-6 циклоалкила, С1-6 гетероциклила и С1-4 алкокси, где С1-6 гетероциклил необязательно замещен одной или более группами, выбранными из гидрокси, галогена или циано; R3 и R4 независимо выбраны из водорода, циано, С1-4 алкила, С1-4 алкокси, С1-4 галогеналкила, С1-4 галогеналкокси, C3-6 циклоалкила, С1-4 алкиламино, С1-4 алкоксиамино или С1-4 ациламино; и R5 выбран из
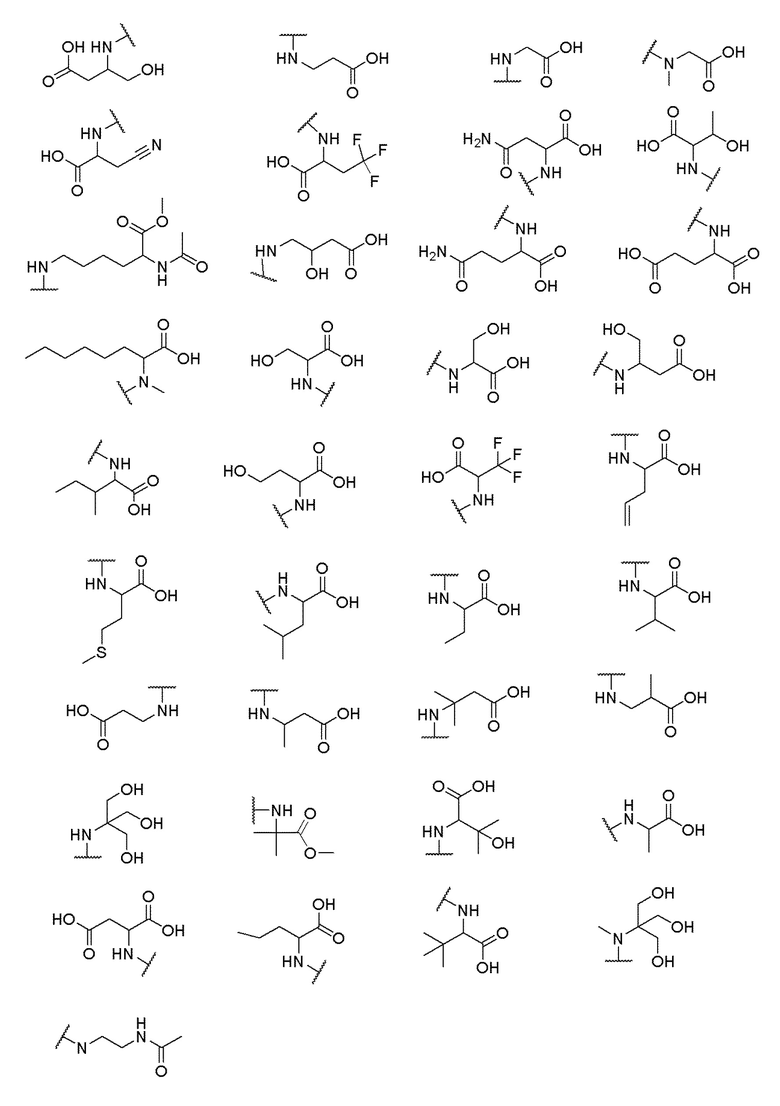
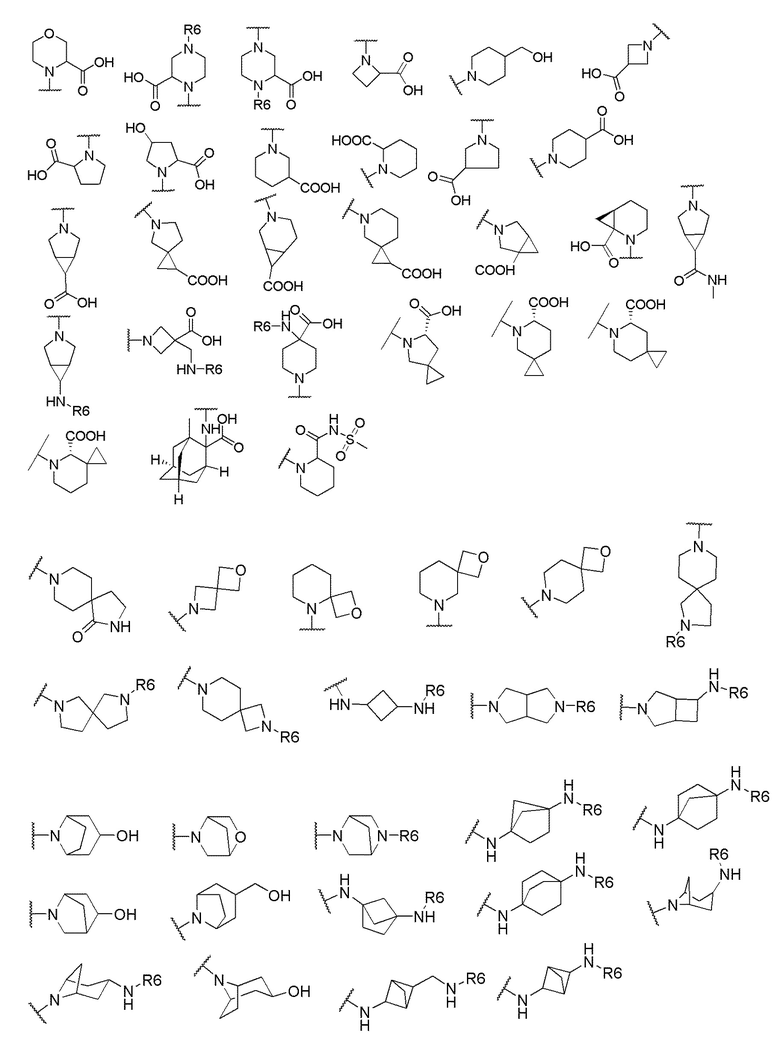
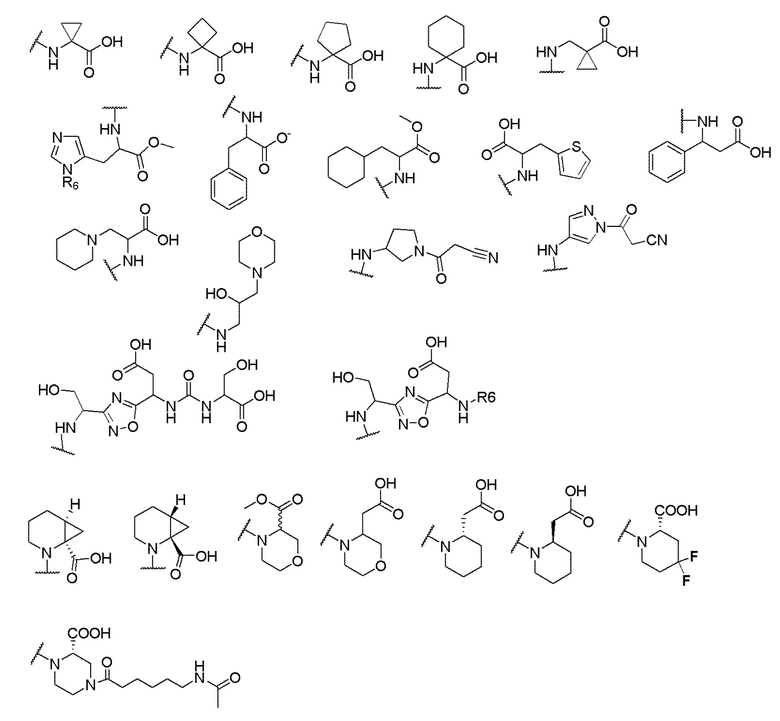
где R6 выбран из группы, состоящей из водорода, С1-6 алкила, C(О)C1-6 алкила и их комбинаций, где С1-6 алкил и C(О)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00082] В одном варианте осуществления настоящего изобретения предлагается соединение формулы I, как описано здесь, где R1 выбран из водорода, С1-6 алкила, С3-6 циклоалкила, С5-6 арила, и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-6 алкил, С5-6 арил, и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, С1-4 алкила, С1-4 алкокси, С1-4 галогеналкила, С1-4 галогеналкокси, C1-8 гетероциклила или COORa, где C1-4 алкил, С1-4 алкокси, C1-8 гетероциклил необязательно замещены одной или более группами, выбранными из С1-4 алкила, С3-6 циклоалкил С1-6 гетероциклила, С1-4 алкокси и COORa, где Ra независимо выбран из водорода, С1-4 алкила, С3-6 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, С1-6 гетероарила или С1-6 гетероарилалкила; R2 выбран из С5-6 арила, где C5-6 арил необязательно замещен одной или более группами, выбранными из водорода, фтора, хлора, брома, йода, гидроксила и циано; R3 и R4 независимо выбраны из группы, состоящей из водорода, циано, С1-4 алкила, С1-4 алкокси, С1-4 галогеналкила, С1-4 галогеналкокси, С3-6 циклоалкила, С1-4 алкиламино, С1-4 алкоксиамино, С1-4 ациламино и их комбинаций; и R5 выбран из
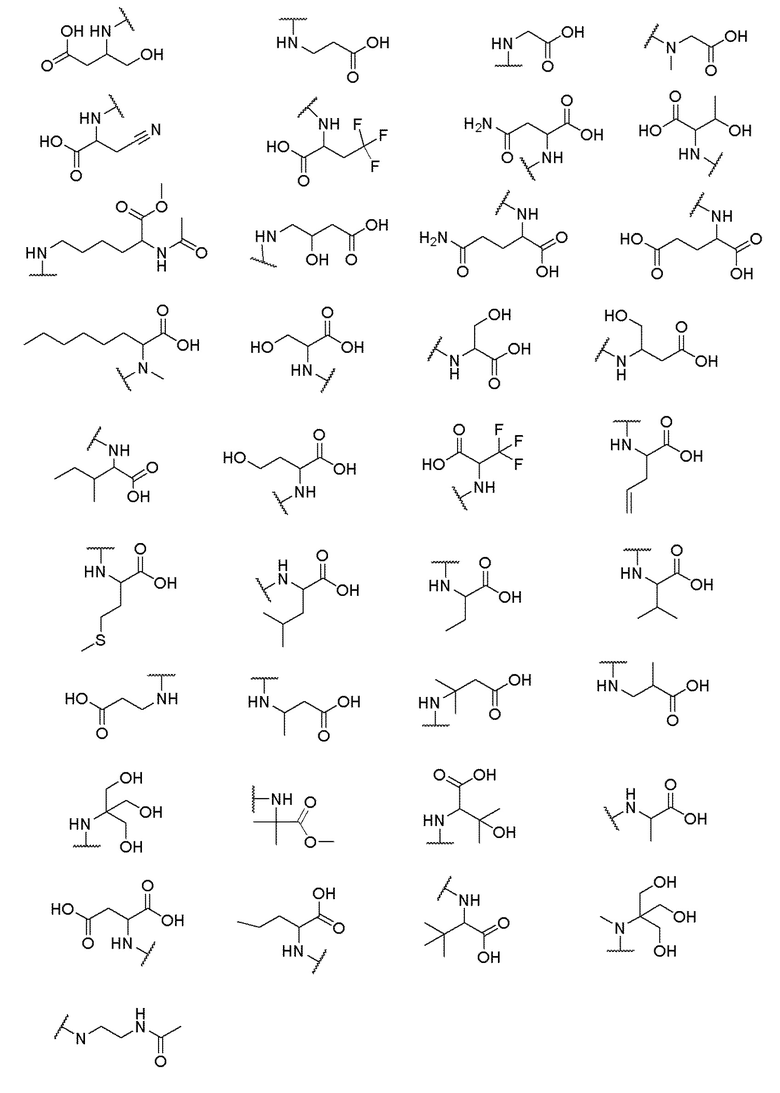
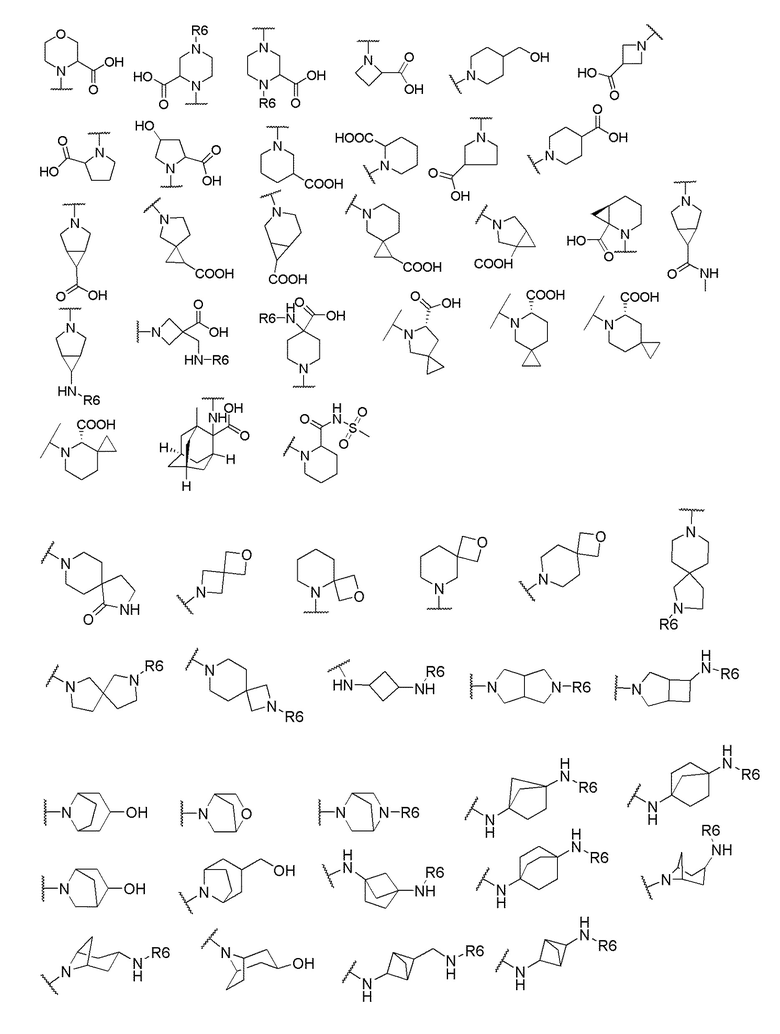
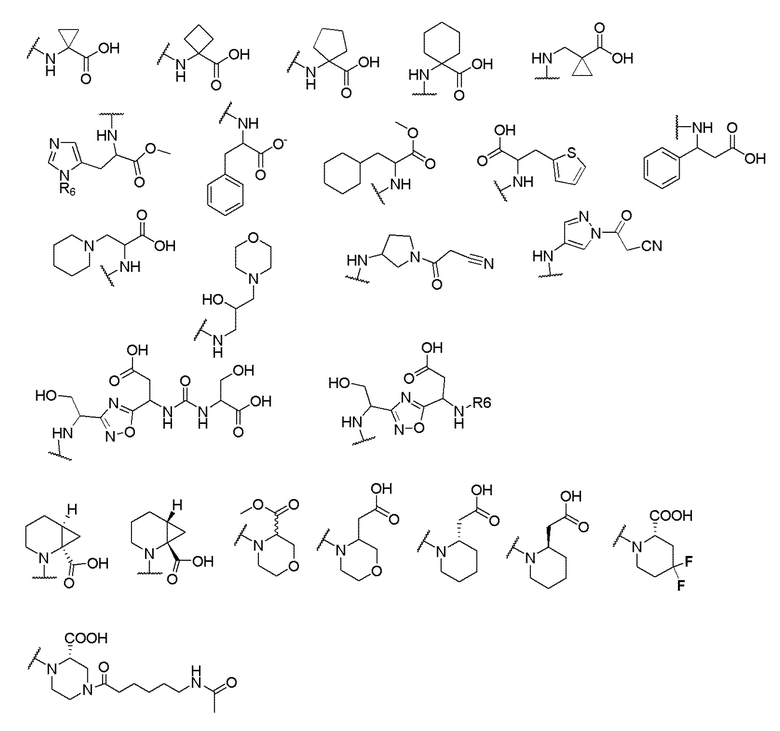
где R6 выбран из группы, состоящей из водорода, С1-6 алкила, C(О)C1-6 алкил и их комбинаций, где С1-6 алкил и C(О)С1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00083] В одном варианте осуществления настоящего изобретения предлагается соединение формулы I, как описано здесь, где R1 выбран из водорода, С1-4 алкила, С3-6 циклоалкила, С5-6 арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где С5-6 арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из группы, состоящей из водорода, галогена, гидроксила, циано, С1-4 алкила, С1-4 алкокси, галогеналкила, С1-4 галогеналкокси, С1-6 гетероциклила, COORa и их комбинаций; где С1-4 алкил, C1-4 алкокси, C1-6 гетероциклил необязательно замещены одной или более группами, выбранными из С1-4 алкила, С3-6 циклоалкила, С1-6 гетероциклила, С1-4 алкокси, и COORa; где Ra независимо выбран из водорода, С1-4 алкила, С3-6 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, С1-6 гетероарила или C1-6 гетероарилалкила; R2 выбран из водорода, С5-6 арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C5-6 арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из группы, состоящей из водорода, фтора, хлора, брома, йода, гидроксила, циано, С1-4 алкила, С1-4 алкокси, С1-4 галогеналкила, С1-4 галогеналкокси, С3-6 циклоалкила, С1-4 алкиламино, амино С1-6 алкила, С1-4 алкоксиамино, С1-4 ациламино, С1-6 гетероциклила, COORa и их комбинаций; где С1-4 алкил, С1-4 алкокси, С1-6 гетероциклил необязательно замещены одной или более группами, выбранными из С1-4 алкила, С3-6 циклоалкила, С1-6 гетероциклила, С1-4 алкокси, и COORa; где Ra независимо выбран из водорода, С1-4 алкила, С3-6 циклоалкила, C5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, С1-6 гетероарила или С1-6 гетероарилалкила; R3 выбран из водорода, циано, С1-4 алкила и С1-4 галогеналкила; R4 выбран из группы, состоящей из водорода, С1-4 алкила, С1-4 алкокси, С1-4 галогеналкила, С1-4 галогеналкокси, С3-6 циклоалкила, С1-4 алкиламино, С1-4 алкоксиамино, С1-4 ациламино и их комбинаций; и R5 выбран из
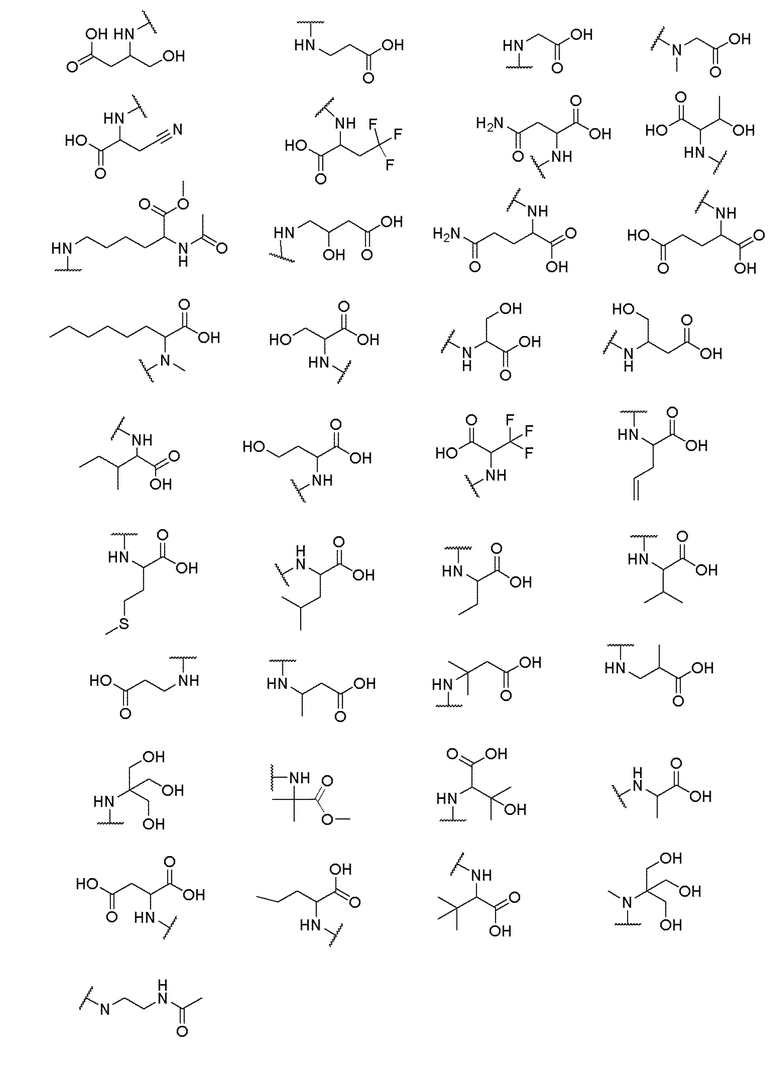
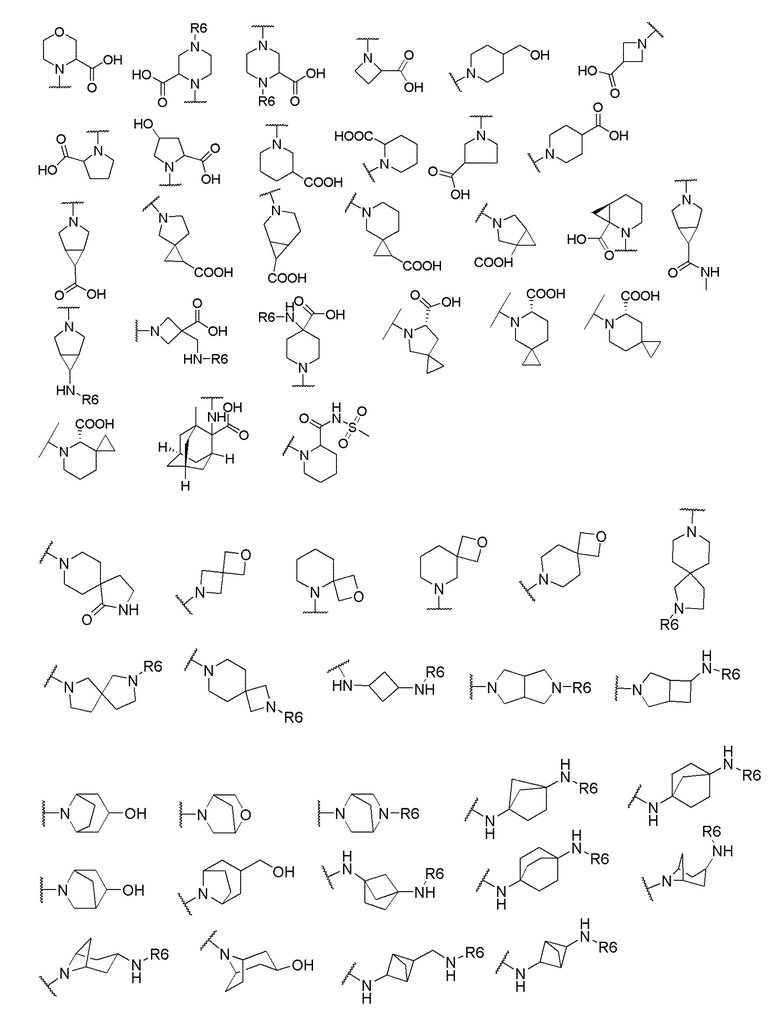
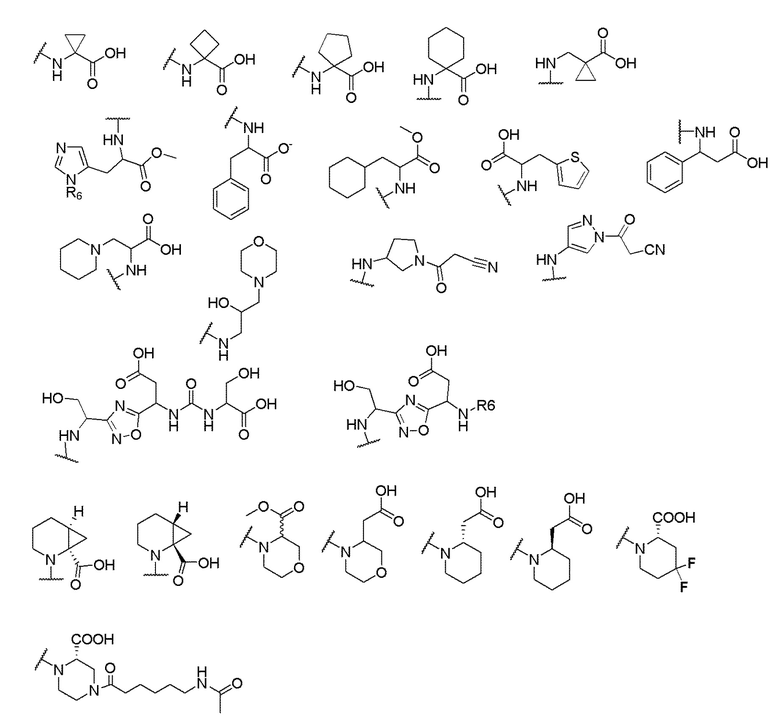
где R6 выбран из группы, состоящей из водорода, С1-6 алкила, C(О)C1-6 алкила и их комбинаций, где С1-6 алкил и C(О)С1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00084] В одном варианте осуществления настоящего изобретения предлагается соединение формулы I, как описано здесь, где R1 выбран из водорода, С1-4 алкила, С3-6 циклоалкила, С5-6 арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где С5-6 арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из группы, состоящей из водорода, галогена, гидроксила, циано, С1-4 алкила, С1-4 алкокси, С1-4 галогеналкила, С1-4 галогеналкокси, С1-6 гетероциклила, COORa и их комбинаций; где С1-4 алкил, С1-4 алкокси, С1-6 гетероциклил необязательно замещены одной или более группами, выбранными из С1-4 алкила, C3-6 циклоалкила, С1-6 гетероциклила, С1-4 алкокси и COORa; где Ra независимо выбран из водорода, С1-4 алкила, С3-6 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, С1-6 гетероарила или C1-6 гетероарилалкила; R2 выбран из водорода, С5-6 арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C5-6 арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из группы, состоящей из водорода, фтора, хлора, брома, йода, гидроксила, циано, С1-4 алкила, С1-4 алкокси, С1-4 галогеналкила, С1-4 галогеналкокси, С3-6 циклоалкила, С1-4 алкиламино, амино С1-6 алкила, С1-4 алкоксиамино, С1-4 ациламино, С1-6 гетероциклила, COORa и их комбинаций; где С1-4 алкил, С1-4 алкокси, С1-6 гетероциклил необязательно замещены одной или более группами, выбранными из С1-4 алкила, С3-6 циклоалкила, С1-6 гетероциклила, С1-4 алкокси и COORa; где Ra независимо выбран из водорода, С1-4 алкила, С3-6 циклоалкила, C5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, С1-6 гетероарила или С1-6 гетероарилалкила; R3 выбран из группы, состоящей из водорода, циано, С1-4 алкила, С1-4 алкокси, С1-4 галогеналкила, С1-4 галогеналкокси, С3-6 циклоалкила, С1-4 алкиламино, С1-4 алкоксиамино, С1-4 ациламино и их комбинаций; R4 выбран из водорода, С1-4 алкила, С1-4 алкокси и С1-4 алкиламино; и R5 выбран из
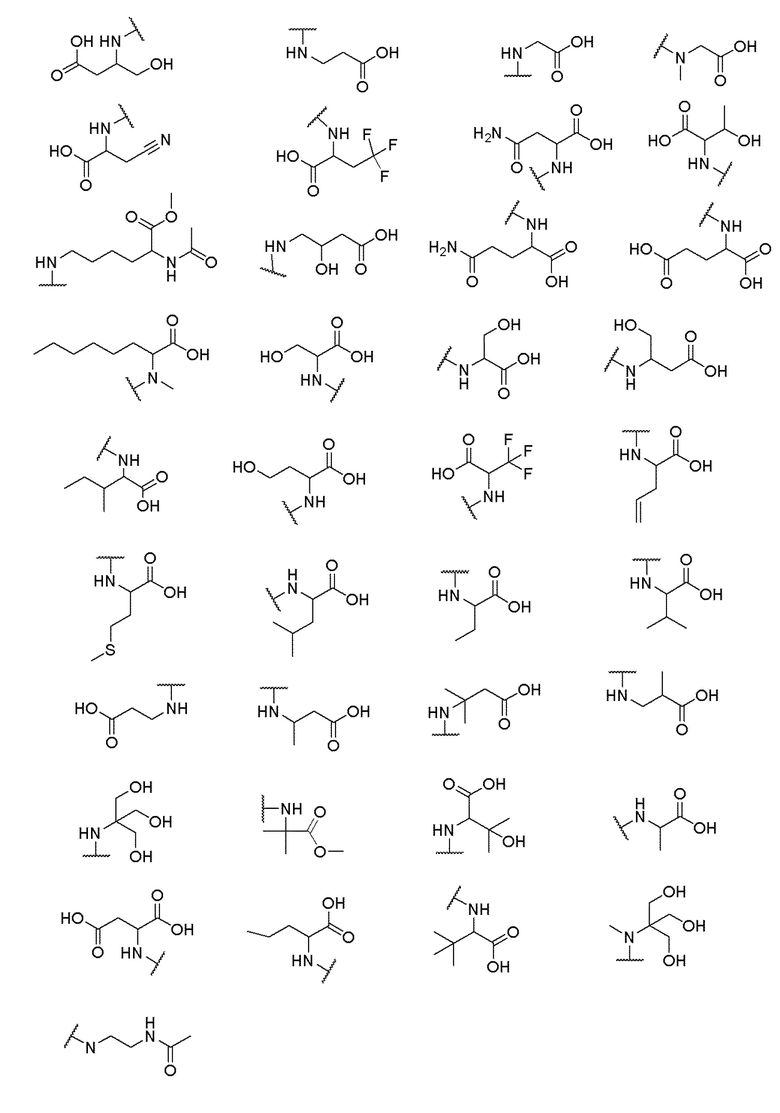
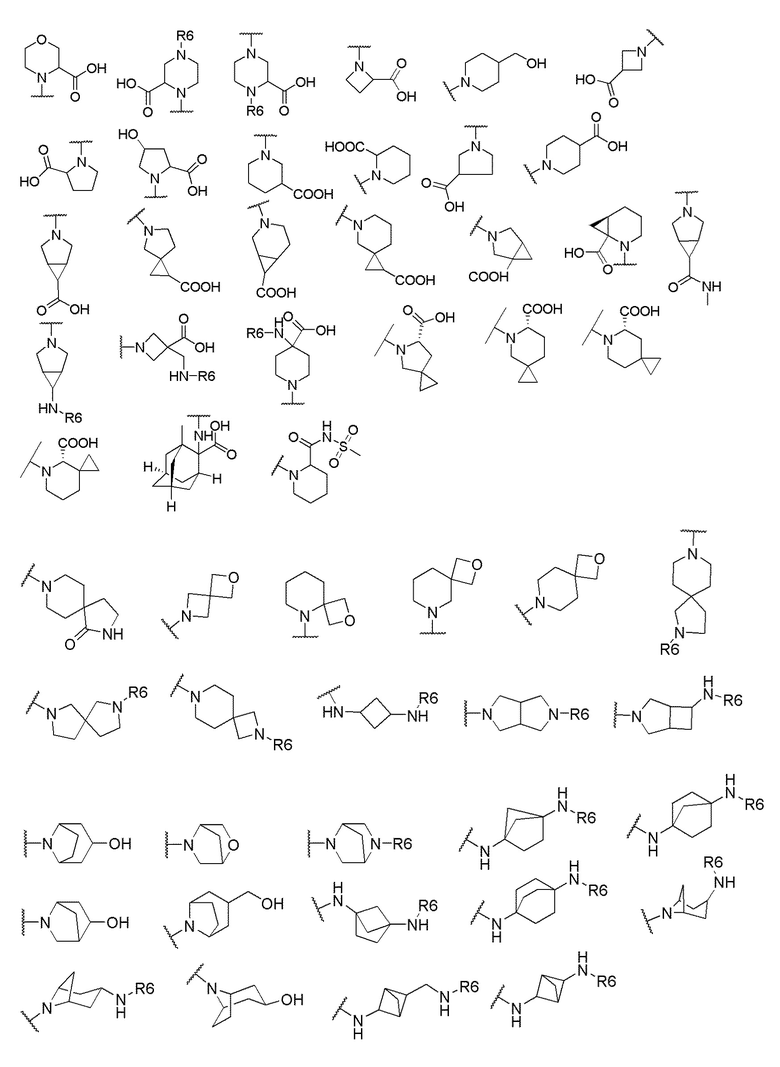
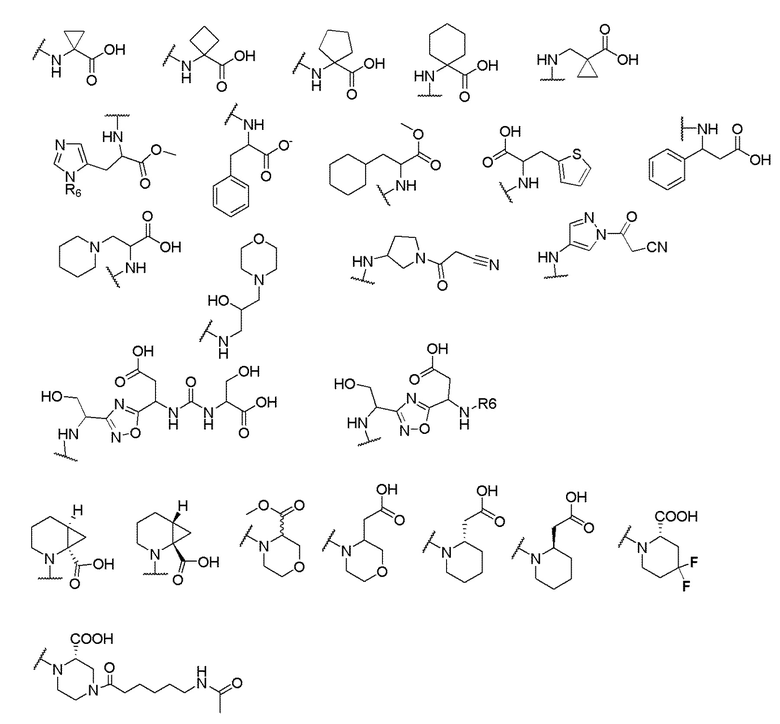
где R6 выбран из группы, состоящей из водорода, С1-6 алкила, С(О)С1-6 алкила и их комбинаций, где С1-6 алкил и C(О)С1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(О)NHR6 и их комбинаций.
[00085] В одном варианте осуществления настоящего изобретения предлагается соединение формулы I, как описано здесь, где R1 выбран из водорода, С1-4 алкила, С3-6 циклоалкила, С5-6 арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где С5-6 арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из группы, состоящей из водорода, галогена, гидроксила, циано, С1-4 алкила, С1-4 алкокси, С1-4 галогеналкила, С1-4 галогеналкокси, С1-6 гетероциклила, COORa и их комбинаций; где С1-4 алкил, С1-4 алкокси, С1-6 гетероциклил необязательно замещены одной или более группами, выбранными из С1-4 алкила, С3-6 циклоалкила, С1-6 гетероциклила, С1-4 алкокси и COORa; где Ra независимо выбран из водорода, C1-4 алкила, С3-6 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R2 выбран из водорода, С5-6 арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C5-6 арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из группы, состоящей из водорода, фтора, хлора, брома, йода, гидроксила, циано, C1-4 алкила, C1-4 алкокси, C1-4 галогеналкила, C1-4 галогеналкокси, С3-6 циклоалкила, C1-4 алкиламино, амино C1-6 алкила, C1-4 алкоксиамино, C1-4 ациламино, C1-6 гетероциклила, COORa и их комбинаций; где C1-4 алкил, C1-4 алкокси, C1-6 гетероциклил необязательно замещены одной или более группами, выбранными из C1-4 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-4 алкокси, и COORa; где Ra независимо выбран из водорода, C1-4 алкила, C3-6 циклоалкила, C5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; R3 выбран из группы, состоящей из водорода, циано, C1-4 алкила, C1-4 алкокси, C1-4 галогеналкила, C1-4 галогеналкокси, С3-6 циклоалкила, C1-4 алкиламино, C1-4 алкоксиамино, C1-4 ациламино и их комбинаций; R4 выбран из водорода, C1-4 алкила, C1-4 алкокси и C1-4 алкиламино; и R5 выбран из
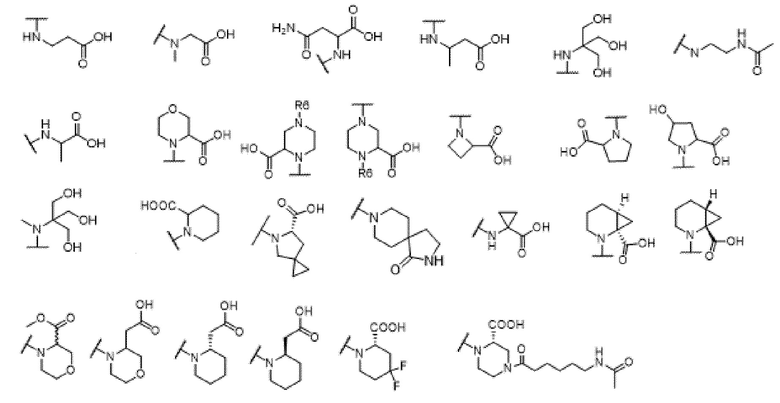
где R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(O)C1-6 алкила и их комбинаций, где C1-6 алкил и C(O)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(O)NHR6 и их комбинаций.
[00086] В одном варианте осуществления настоящее изобретение относится к соединению формулы I или его полиморфам, стереоизомерам, таутомерам, пролекарствам, сольватам и их фармацевтически приемлемым солям, которые выбраны из группы, состоящей из следующих соединений:
N-(2-(((2-((4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 1),
N-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-N-метилглицин (Соединение 2),
N-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-N-метилглицин (Соединение 3),
(1R,6R)-2-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2-азабицикло[4.1.0]гептан-1-карбоновая кислота (Соединение 4),
(1S,6R)-2-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2-азабицикло[4.1.0]гептан-1-карбоновая кислота (Соединение 5),
N-(2-(((4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 6),
(S)-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 7),
(S)-1-((4-((3-циано-4-фторбензил)окси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 8),
(S)-1-((2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-4-(2,2,2-трифторэтокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 9),
(S)-1-((4-(4-гидроксибутокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 10),
(2S,4R)-1-((2-((3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 11),
(S)-1-((4-((5-цианопиридин-3-ил)метокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 12),
(S)-1-((2-((3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 13),
N-(2-(((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 14),
(R)-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 15),
(S)-1-((2-((4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 16),
(S)-1-((2-((3'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 17),
N-(2-(((2-((3'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 18),
(S)-1-((2-((2'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 19),
N-(2-(((2-((2'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 20),
N-(2-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 21),
(S)-1-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 22),
1-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)циклопропан-1-карбоновая кислота (Соединение 23),
(3-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)пропионовая кислота (Соединение 24),
2-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 25),
(2-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)(метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 26),
(S)-3-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)масляная кислота (Соединение 27),
((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-D-аланин (Соединение 28),
((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)аспарагин (Соединение 29),
(2R,4R)-1-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 30),
1-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)азетидин-2-карбоновая кислота (Соединение 31),
N-(2-(((4-(бензилокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 32),
1-((4-(бензилокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 33),
(2S,4R)-1-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 34),
2-(((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 35),
((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-L-пролин (Соединение 36),
Мэтил 4-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)морфолин-3-карбоксилат (Соединение 37),
4-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)морфолин-3-карбоновая кислота (Соединение 38),
(2S,4R)-1-((4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 39),
((S)-1-((4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 40),
2-(((4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 41),
2-(((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 42),
(S)-4-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)морфолин-3-карбоновая кислота (Соединение 43),
2-(4-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)морфолин-3-ил)уксусная кислота (Соединение 44),
(S)-1-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 45),
(S)-5-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-5-азаспиро[2.4]гептан-6-карбоновая кислота (Соединение 46),
7-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2,7-диазаспиро[4.5]декан-1-он (Соединение 47),
рац-(1R,6S)-2-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2-азабицикло[4.1.0]гептан-1-карбоновая кислота (Соединение 48),
(S)-4-ацетил-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперазин-2-карбоновая кислота (Соединение 49),
(S)-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперазин-2-карбоновая кислота (Соединение 50),
(S)-5-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-5-азаспиро[2.4]гептан-6-карбоновая кислота (Соединение 51),
7-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2,7-диазаспиро[4.5]декан-1-он (Соединение 52),
N-(2-(((4-((3-циано-4-фторбензил)окси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 53),
(2S,4R)-1-((4-((3-циано-4-фторбензил)окси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 54),
(S)-1-((2-((3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 55),
N-(2-(((2-((3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 56),
N-(2-(((2-((3',4'-диметокси-2-метил-[1,1'-бифенил]-3-ил)метокси)-4,6-диметоксипиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 57),
((2S,4R)-1-((2-((3',4'-диметокси-2-метил-[1,1'-бифенил]-3-ил)метокси)-4,6-диметоксипиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 58),
(2S,4R)-1-((4-((5-цианопиридин-3-ил)метокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 59),
(S)-2-(1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-ил)уксусная кислота (Соединение 60),
(R)-2-(1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-ил)уксусная кислота (Соединение 61),
(S)-4-(6-ацетамидогексаноил)-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперазин-2-карбоновая кислота (Соединение 62),
(S)-4,4-дифтор-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 63),
(S)-1-((4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 64) и
N-(2-(((4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 65).
[00087] В одном варианте осуществления настоящего изобретения предлагается способ получения соединений формулы Ib, формулы Ia и формулы I, описанных здесь, или их полиморфов, стереоизомеров, таутомеров, пролекарств, сольватов и их фармацевтически приемлемых солей.
[00088] В одном варианте осуществления настоящего изобретения предлагается способ получения соединений формулы Ib, формулы Ia, формулы I, описанных здесь, где указанный способ включает стадии, на которых осуществляют: (а) взаимодействие соединения формулы IV и формулы В3 в присутствии основания, растворителя и, необязательно, реагента реакции сочетания, с получением соединений формулы V или формулы XIII; (b) обработку соединений формулы V и формулы XIII с получением соединений формулы VII; и (с) взаимодействие соединений формулы VII с замещенными аминами в присутствии восстановителя и третьего растворителя, с получением соединений формулы I, Ia или Ib:
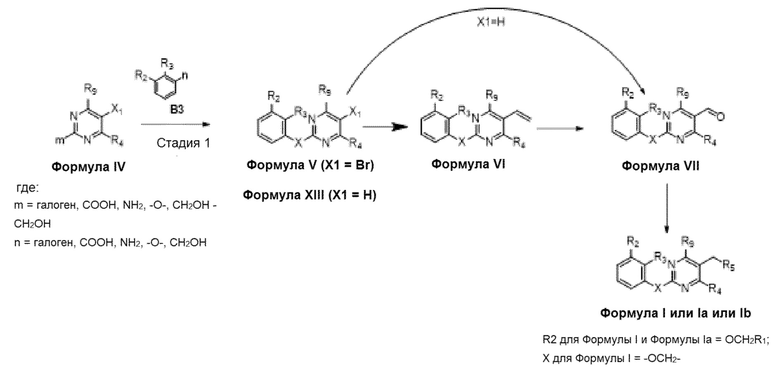
где X в формуле V, формуле VI, формуле VII, формуле Ia и формуле Ib выбран из -CH2O-, -ОСН2-, -C(O)NH- или -NHC(O)-; R9, R2, R3 и R4 в формуле Ib, формуле IV, формуле V, формуле VI, формуле VII и формуле XIII независимо выбраны из водорода, циано, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, С1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, амино C1-6 алкила, C1-6 алкоксиамино, C1-6 ациламино, С5-10 арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где C1-10 алкил, C1-10 алкокси, С5-10 арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены одним или более заместителями, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила, C1-6 алкокси, C1-6 галогеналкила, C1-6 галогеналкокси, С3-6 циклоалкила, C1-6 алкиламино, C1-6 алкоксиамино, C1-6 ациламино, C1-10 гетероциклила или -COORa, где C1-6 алкил, C1-6 алкокси и C1-10 гетероциклил необязательно замещены одним или более заместителями, выбранными из гидрокси, циано, C1-6 алкила, С3-6 циклоалкила, C1-6 гетероциклила, C1-6 алкокси или COORa, где C1-6 гетероциклил необязательно замещен одним или более заместителями, выбранными из гидрокси, галогена или циано; и Ra выбран из водорода, галогена, циано, C1-6 алкила, С3-8 циклоалкила, С5-6 арила, С5-6 арилалкила, С2-6 гетероциклила, C1-6 гетероарила или C1-6 гетероарилалкила; X в формуле Ib, формуле Ia, формуле V, формуле VI, формуле VII и формуле XIII выбран из -CH2O-, -ОСН2-, -C(O)NH- или -NHC(O)-; R5 в формуле Ib представляет собой -NR7 R8, где R7 и R8 независимо выбраны из группы, состоящей из водорода, С3-10 циклоалкила, C1-6 алкила, С2-6 алкенила, 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, и их комбинаций, где С3-10 циклоалкил, C1-6 алкил, С2-6 алкенил, и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещены одним или более заместителями, выбранными из оксо, циано, галогена, гидроксила, морфолино, C(O)NH2, C(O)CH2CN, NHR6, СООН, COOR6, NHC(O)R6, C1-6 алкила, C1-6 галогеналкила, С3-10 циклоалкила, С5-6 арила, SR6 или 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где C1-6 алкил и 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо независимо замещены одним или более заместителями, выбранными из гидроксила и R6; или R7 и R8 вместе могут образовывать 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо с 1-3 гетероатомами, выбранными из N, S или О, где 4-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из гидроксила, галогена, C1-6 алкила, СООН, R6, NHR6, C(O)NHR6, C(O)NHSO2R6, С(O) (CH2)nNHC (О) CH3 и их комбинаций, где C1-6 алкил дополнительно замещен группами, выбранными из гидроксила, СООН или NHR6; n равно 1-6; и R6 выбран из группы, состоящей из водорода, C1-6 алкила, C(O)C1-6 алкила и их комбинаций, где C1-6 алкил и C(O)C1-6 алкил необязательно замещены заместителями, выбранными из группы, состоящей из гидроксила, СООН, NHR6, NHC(O)NHR6 и их комбинаций.
[00089] В одном варианте осуществления настоящего изобретения предлагается способ получения соединений формулы Ib, формулы Ia и формулы I, как описано здесь, где обработка соединений формулы V, с получением соединений формулы VII, включает: а) алкенилирование соединений формулы V в присутствии второго основания и второго растворителя, с получением соединений формулы VI; и (b)окисление соединений формулы VI, с получением соединений формулы VII.
[00090] В одном варианте осуществления настоящего изобретения предлагается способ получения соединений формулы Ib, формулы Ia и формулы I, как описано здесь, где обработка соединений формулы XIII, с получением соединений формулы VII, включает форматирование соединений формулы XIII, с получением соединения формулы VII.
[00091] В одном варианте осуществления настоящего изобретения предлагается способ получения соединений формулы Ib, формулы Ia, формулы I, как описано здесь, где указанный способ включает стадии, где осуществляется: (а) взаимодействие соединений формулы IV и формулы В3 в присутствии основания, растворителя и, необязательно, реагента реакции сочетания, с получением соединений формулы V или формулы XIII; (b) алкенилирование соединений формулы V в присутствии второго основания и второго растворителя, с получением соединений формулы VI; (с) окисление соединений формулы VI, с получением соединений формулы VII; и (d) взаимодействие соединений формулы VII с замещенными аминами в присутствии восстановителя и третьего растворителя, с получением соединений формулы I, Ia или Ib.
[00092] В одном варианте осуществления настоящего изобретения предлагается способ получения соединений формулы Ib, формулы Ia, формулы I, как описано здесь, где указанный способ включает стадии, где осуществляется: (а) взаимодействие соединения формулы IV и формулы В3 в присутствии основания, растворителя и, необязательно, реагента реакции сочетания, с получением соединений формулы V или формулы XIII; (b) форматирование соединений формулы XIII, с получением соединений формулы VII; и (с) взаимодействие соединений формулы VII с замещенными аминами в присутствии восстановителя и третьего растворителя, с получением соединений формулы I, Ia или Ib.
[00093] В одном варианте осуществления настоящего изобретения предлагается способ получения соединений формулы Ib, формулы Ia, формулы I, как описано здесь, где реагент реакции сочетания выбран из гексафторфосфата 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазол[4,5-b]пиридиний-3-оксида (HATU), N,N'-дициклогексилкарбодиимида (DCC) или пропилфосфонового ангидрида; растворитель выбран из группы, состоящей из метанола, этанола, изопропилового спирта, трет-бутилового спирта, дихлорметана, этилацетата, диоксана, диэтилового эфира, N,N-диметилформамида, диметилсульфоксида и их комбинаций; основание выбрано из группы, состоящей из гидрида натрия, бутиллития, диизопропиламида лития, карбоната калия, карбоната цезия, триэтиламина, диизопропилэтиламина, 4-диметиламинопиридина, пиридина и их комбинаций; второе основание выбрано из группы, состоящей из бутиллития, гидрида натрия, диизопропиламида лития, карбоната калия, карбоната цезия, триэтиламина, диизопропилэтиламина, 4-диметиламинопиридина, пиридина и их комбинаций; второй растворитель выбран из группы, состоящей из N,N-диметилформамида, дихлорметана, этилацетата, диоксана, изопропилового спирта, диэтилового эфира, трет-бутилового спирта, N,N-диметилформамида, диметилсульфоксида и их комбинаций, третий растворитель выбран из группы, состоящей из уксусной кислоты, метанола, N,N-диметилформамида и их комбинаций, и восстановитель выбран из группы, состоящей из цианоборогидрида натрия, борогидрида натрия, гидрида литийалюминия, гидрида диизобутилалюминия и их комбинаций.
[00094] В одном варианте осуществления настоящего изобретения предлагается фармацевтическая композиция, содержащая соединение формулы Ib, формулы Ia, формула I, как описано здесь, или их фармацевтически приемлемые соли вместе с фармацевтически приемлемым носителем, необязательно в комбинации с одним или более другими фармацевтическими композициями.
[00095] В другом варианте осуществления настоящего изобретения предлагается фармацевтическая композиция, как описано здесь, где композиция находится в форме, выбранной из группы, состоящей из таблетки, капсулы, порошка, сиропа, раствора, аэрозоля и суспензии.
[00096] В одном варианте осуществления настоящего изобретения предлагаются соединения формулы Ib, формулы Ia, формула I или их фармацевтически приемлемые соли, как описано здесь, где фармацевтически приемлемая соль выбрана из солей неорганических оснований, таких как соли Li, Na, K, Са, Mg, Fe, Cu, Zn и Mn; солей органических оснований, таких как N,N'-диацетилэтилендиамин, глюкамин, триэтиламин, холин, дициклогексиламин, бензиламин, триалкиламин, тиамин, гуанидин, диэтаноламин, α-фенилэтиламин, пиперидин, морфолин, пиридин, гидроксиэтилпирролидин, гидроксиэтилпиперидин, аммоний, соли замещенного аммония, соли алюминия и т.п. Соли также включают соли аминокислот, таких как глицин, аланин, цистин, цистеин, лизин, аргинин, фенилаланин и гуанидин. Соли могут включать кислотно-аддитивные соли, где это целесообразно, которые представляют собой сульфаты, нитраты, фосфаты, перхлораты, бораты, гидрогалогениды, ацетаты, тартраты, малеаты, цитраты, сукцинаты, пальмоаты, метансульфонаты, тозилаты, бензоаты, салицилаты, гидроксинафтоаты, бензолсульфонаты, аскорбаты, глицерофосфаты, кетоглутараты.
[00097] В одном варианте осуществления настоящего изобретения предлагается способ лечения и/или профилактики различных заболеваний, в том числе злокачественных опухолей и инфекционных заболеваний, где способ включает введение нуждающемуся в этом субъекту, страдающему от пролиферативного нарушения или рака, терапевтически эффективного количества соединения формулы Ib, формулы Ia, формулы I или фармацевтической композиции, как описано здесь, с другими клинически значимыми цитотоксическими агентами или нецитотоксическими агентами.
[00098] В одном варианте осуществления настоящего изобретения предлагается способ лечения и/или профилактики пролиферативного расстройства или рака, или ВИЧ, или гепатита В, гепатита С, гепатита D, или инфекций как бактериальной или вирусной природы, включающему введение нуждающемуся в этом субъекту, страдающему от пролиферативного нарушения или рака или вирусного заболевания, терапевтически эффективного количества соединения формулы Ib, формулы Ia, формулы I или их фармацевтически приемлемых солей, вместе с фармацевтически приемлемым носителем, с другими клинически значимыми цитотоксическими агентами или нецитотоксическими агентами.
[00099] Настоящее изобретение предлагает способ лечения расстройства, вызванного, связанного с или сопровождаемого нарушениями пролиферации клеток и/или ангиогенеза с последующим метастазированием, где способ включает введение терапевтически эффективного количества соединения формулы I.
[000100] Настоящее изобретение предлагает способ лечения рака у пациента, включающий введение эффективного количества соединений формулы Ib, формулы Ia и формулы I. Рак может быть гематологическим злокачественным новообразованием или солидной опухолью. Гематологическая злокачественное новообразование выбрано из группы, состоящей из В-клеточной лимфомы, Т-клеточной лимфомы и лейкемии. В случае солидных опухолей, опухоли выбраны из группы, состоящей из рака молочной железы, рака легкого, рака яичника, рака простаты, рака головы, рака шеи, рака почки, рака желудка, рака толстой кишки, рака поджелудочной железы и рака головного мозга.
[000101] Соединения по изобретению способны замедлять рост опухоли, останавливать рост опухоли или вызывать регрессию опухолей и предотвращать образование метастазов опухоли (включая микрометастазы) и рост метастазов (включая микрометастазы). Кроме того, они могут быть использованы при гиперпролиферации эпидермиса.
[000102] Соединение формулы I настоящего изобретения может быть использовано в качестве профилактического или терапевтического средства для лечения рака. Примеры рака включают, без ограничения, рак молочной железы, рак простаты, рак поджелудочной железы, рак желудка, рак легких, рак толстой кишки, рак прямой кишки, рак пищевода, рак двенадцатиперстной кишки, рак языка, рак глотки, опухоль головного мозга, невриному, немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак печени, рак почки, рак желчных протоков, рак матки, рак шейки матки, рак яичников, рак мочевого пузыря, рак кожи, гемангиому, злокачественную лимфому, злокачественную меланому, рак щитовидной железы, опухоль костей, сосудистую фиброму, ретинобластому, рак полового члена, солидный рак детей, лимфому, миелому и лейкемию (включая, например, острый миелогенный лейкоз (AML), хронический миелогенный лейкоз (CML), хронический нейтрофильный лейкоз, хронический эозинофильный лейкоз, хронический лимфоцитарный лейкоз (CLL), острый лимфобластный лейкоз (ALL) или волосатоклеточный лейкоз).
[000103] «Комбинированная терапия» включает введение соединений по изобретению в комбинации с другими биологически активными ингредиентами, такими как, но без ограничения, различными противоопухолевыми средствами, и с немедикаментозной терапией, такой как, но без ограничения, хирургическое вмешательство или лучевая терапия. Соединения, описанные здесь, можно использовать в комбинации с другими фармацевтически активными соединениями, которые, предпочтительно, будут усиливать действие соединений по изобретению. Соединения можно вводить одновременно или последовательно по отношению к другой лекарственной терапии.
[000104] В одном варианте осуществления настоящее изобретение относится к применению соединений формулы Ib, формулы Ia, формулы I или их фармацевтически приемлемых солей вместе с фармацевтически приемлемым носителем, для лечения и/или профилактики различных заболеваний, в том числе пролиферативного нарушения или рака; или для лечения рака вместе с другими клинически значимыми цитотоксическими агентами или нецитотоксическими агентами.
[000105] В одном варианте осуществления настоящее изобретение относится к применению соединений формулы Ib, формулы Ia, формулы I или их фармацевтически приемлемых солей вместе с фармацевтически приемлемым носителем, для лечения и/или профилактики различных заболеваний, в том числе пролиферативного нарушения или рака; или для лечения рака вместе с другими клинически значимыми цитотоксическими агентами или нецитотоксическими агентами, где другие клинически значимые цитотоксические агенты или нецитотоксические агенты выбирают из группы, состоящей из карбоплатина, бортезомиба, карфилзомиба, леналидомида, помалидомида, доксорубицина, даунорубицина, децитабина, денилеукина, денилеукин дифитокса, дексразоксана, доцетаксела, доксорубицина, дромостанолон пропионата, циклофосфамида, 5-фторурацила, иматиниба, метотрексата, иринотекана, топтекана, винбластина, этопозида, винкристина, кармустина, паклитаксела, вориностата, белиностата, панбиностата, ромидепсина, чиадарина, энтиностата, моцетиностата, афатиниба, босутиниба, цетуксимаба, энтерцтиниба, лапатиниба, нилотиниба, пазопаниба, рукслотиниба, сорафеениба, сунитиниба, вермурафениба, акситиниба, гефитиниба, кобиметиниба, карбозантиниба, темозоломида, идарубицина, абареликса, алдеслейкина, алемтузумаба, аллопуринола, алтретамина, анастрозола, аспарагиназа, бексаротина, барицитиниба, блеомицина, бусульфана, капецитабина, кладрибина, клофарабина, цитарабина, дакарбазина, дактиномицина, содиума, дазатиниба, летрозола, тамоксифена, оксалиплатина, прокарбазина, золероната и их комбинаций.
[000106] В одном варианте осуществления настоящее изобретение относится к способу лечения рака, как описано здесь, где указанный способ включает введение нуждающемуся в этом субъекту комбинации соединения формулы Ib, формулы Ia, формулы I или их фармацевтически приемлемых солей вместе с фармацевтически приемлемым носителем и другими клинически значимыми цитотоксическими агентами или нецитотоксическими агентами.
[000107] В одном варианте осуществления настоящее изобретение относится к способу лечения и/или профилактики различных заболеваний, включая рак и инфекционные заболевания, включающему введение нуждающемуся в этом субъекту, страдающему вирусными инфекционными заболеваниями, такими как ВИЧ, грипп, герпес, гепатит А, гепатит В, гепатит С, гепатит D, терапевтически эффективного количества соединения формулы Ib, формулы Ia и формулы I или фармацевтической композиции, как описано здесь, с другими клинически значимыми противовирусными лекарственными средствами.
[000108] В одном варианте осуществления настоящее изобретение относится к способу лечения рака, как описано здесь, где указанный способ включает введение комбинации соединения формулы Ib, формулы Ia, формулы I или фармацевтической композиции с другими клинически значимыми ингибиторами иммунной контрольной точки. В другом варианте осуществления настоящего изобретения ингибиторы иммунной контрольной точки выбирают из группы, состоящей из CD27, CD28, CD40, CD122, CD96, CD73, CD47, 0X40, GITR, CSF1R, JAK, PI3K дельта, PI3K гамма, ТАМ, аргиназы, CD137 (4-1ВВ), ICOS, A2AR, В7-Н3, В7-Н4, BTLA, CTLA-4, LAG3, TIM3, VISTA, PD-1, PD-L1, PD-L2 и их комбинаций.
[000109] В одном варианте осуществления настоящее изобретение относится к способу лечения рака, как описано здесь, где указанный способ включает введение нуждающемуся в этом субъекту комбинации соединения формулы Ib, формулы Ia, формулы I или фармацевтической композиции с другими клинически значимыми иммунными ингибиторами контрольной точки, такими как ниволумаб, пембролизумаб, пидилимумаб, bms-986016, эпакадостат, тремелимумаб, ингибиторы CD73 и ингибиторы аргиназы.
[000110] В другом варианте осуществления изобретения, соединения, раскрытые здесь, могут быть объединены с противоопухолевыми агентами (например, малыми молекулами, цитотоксическими агентами, нецитотоксическими агентами, моноклональными антителами, антисмысловыми РНК и белками слияния), которые ингибируют одну или более биологических мишеней. Такая комбинация может усиливать терапевтическую эффективность, по сравнению с эффективностью, достигаемой любым одним агентом, и может предотвращать или задерживать появление устойчивых вариантов.
[000111] В другом варианте осуществления изобретения, соединения, раскрытые здесь, могут быть объединены с иммунонкологическими лекарственными средствами, такими как, но без ограничения, PD-1, IDO, TDO, аргиназа, CD73, TIM3, CTLA4 или любыми другими лекарственными средствами, которые участвуют в процессе иммунной модуляции.
[000112] В другом варианте осуществления изобретения, соединения, раскрытые здесь, можно комбинировать с CART-терапией Т-клетками, усиливая эффект CART-терапии Т-клетками.
ПРИМЕРЫ
[000113] Используемые здесь символы и условные обозначения, применяемые при описании процессов, в схемах и в примерах, соответствуют тем, которые используются в современной научной литературе, например, в Journal of the American Chemical Society или в Journal of Biological Chemistry. Стандартные однобуквенные или трехбуквенные сокращения обычно используются для обозначения аминокислотных остатков, которые, как предполагается, находятся в L-конфигурации, если не указано иное. Если не указано иное, все исходные материалы были получены от коммерческих поставщиков и использовались без дальнейшей очистки. В частности, в примерах и в описании могут использоваться следующие сокращения и аббревиатуры.
Сокращения:
Ас ацетил;
Ac2O уксусный ангидрид;
ACN ацетонитрил;
AIBN азобис(изобутиронитрил);
BINAP 2,2'-бис(дифенилфосфино)-1,1'-бинафтил;
BMS комплекс боран-диметилсульфоксид;
Bn бензил;
Boc трет-бутоксикарбонил;
Boc2O ди-трет-бутилдикарбонат;
BuLi бутиллитий;
CSF фторид цезия;
DCE 1,2-дихлорэтан;
DCM дихлорметан;
DDQ 2,3-дихлор-5,6-дициано-1,4-бензохинон;
DMS диметилсульфид;
АТР АТФ, аденозинтрифосфат;
Бис-пинаколатодиборон 4,4,4',4',5,5,5',5'-октаметил-2,2'-би-1,3,2-диоксаборолан;
BSA бычий сывороточный альбумин;
С18 обозначает алкильные группы с 18 атомами углерода на силиконе, используемые в стационарной фазе для HPLC (ВЭЖХ);
CH3CN ацетонитрил;
Су циклогексил;
DCC N,N'-дициклогексилкарбодиимид;
DIPEA основание Хунига, N-этил-N-(1-метилэтил)-2-пропанамин;
Диоксан 1,4-диоксан;
DMAP 4-диметиламинопиридин;
DME 1,2-диметоксиэтан;
DMF N,N-диметилформамид, ДМФА;
DMSO диметилсульфоксид;
DPPA дифенилфосфорилазид;
EtOAc этилацетат;
EtOH этанол;
Et2O диэтиловый эфир;
HATU гексафторфосфат 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний-3-оксид;
НОАс уксусная кислота;
HPLC высокоэффективная жидкостная хроматография высокого давления;
HMDS гексаметилдисилазид;
IPA изопропиловый спирт;
LAH литийалюминий гидрид;
LDA литий диизопропиламид;
LHMDS литий гексаметилдисилазид;
МеОН метанол;
MPLC жидкостная хроматография среднего давления;
МТВЕ метил-трет-бутиловый эфир;
mCPBA м-хлорпербезойная кислота;
NaHMDS натрий гексаметилдисилазид;
NBS N-бромсукцинимид;
ЯМР ядерный магнитный резонанс;
Pd2 (dba)3 трис(дибензилиденацетон)дипалладий (0);
Комплекс Pd(dppf)Cl2 DCM комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) и дихлорметана;
RPHPLC жидкостная хроматография высокого давления с обращенной фазой;
RT комнатная температура;
Sat. насыщенный, насыщ.;
SGC хроматография на силикагеле;
СМ исходный материал;
Т3Р пропилфосфоновый ангидрид;
TCL тонкослойная хроматография;
TEA триэтиламин;
TFA трифторуксусная кислота; и
THF тетрагидрофуран, ТГФ.
[000114] Следующие примеры предоставляют детали и подробности в отношении синтеза, активности и применениях соединений по изобретению. Следует понимать, что нижеприведенные материалы являются исключительно иллюстративными сведениями, и настоящее изобретение не может быть ограничено частными деталями, изложенными в этих примерах.
[000115] Соединения по изобретению могут быть получены различными способами, включая стандартную химию. Любая ранее определенная переменная иметь ранее определенное значение, если не указано иное. Иллюстративные общие способы синтеза показаны на следующих схемах, и они могут быть легко адаптированы для получения других соединений по изобретению.
[000116] Здесь также предлагается способ, который показан на Схеме 1 и на Схеме 1а, обеспечивающий получение соединений формулы I, где все группы имеют определения, представленные выше.
Общая методика синтеза соединений формулы I
Схема 1
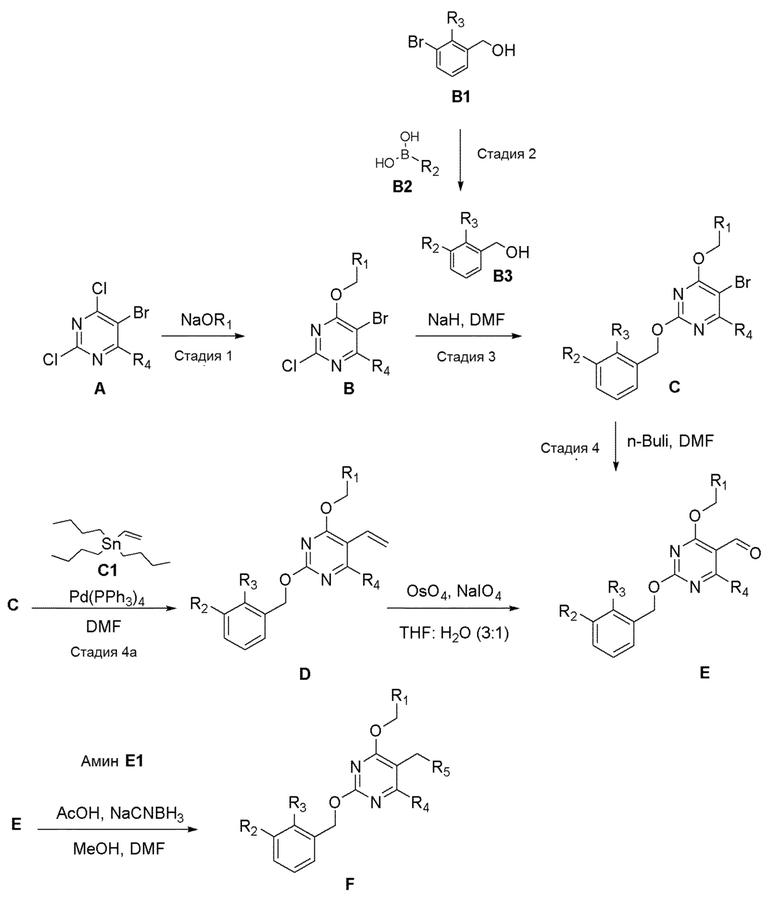
Указанный способ получения соединений формулы I включает следующие стадии:
Стадия 1: Соединение А (5-бром-2,4-дихлорпиримидин) подвергали взаимодействию с натриевой или калиевой солью алкоксида в подходящем растворителе с получением соответствующего 5-бром-2-хлор-4-алкоксипиримидина (Соединение В).
Стадия 2: Соединение В3 (2,3-замещенный бензиловый спирт) синтезировали путем катализируемого палладием сочетания Сузуки замещенного бромбензола В1 с соответствующими бороновыми кислотами В2, с получением В3.
Стадия 3: Промежуточное соединение В3 дополнительно подвергали взаимодействию с соединением В в присутствии основания, такого как гидрид натрия, с получением 2-бензилокси-4-алкокси-5-бромпиримидина (Соединение С).
Стадия 4а: Промежуточное соединение С подвергали взаимодействию с трибутил(винил)оловом (Соединение С1), с получением соответствующего винилового производного D.
Стадия 4b: Соединение D подвергали окислению с метапериодатом натрия и тетраоксидом осмия, с получением соответствующего альдегида Е.
Стадия 4: Альдегид Е может альтернативно быть синтезирован литиированием соединения С с н-BuLi и гашением N,N-диметилформамидом.
Стадия 5: Восстановительное аминирование промежуточного соединения Е различными замещенными алифатическими, ароматическими, гетероциклическими и циклическими аминами (Е1), получая соединения (Соединение F) настоящего изобретения.
Общая методика синтеза соединений формулы I
Схема 1а
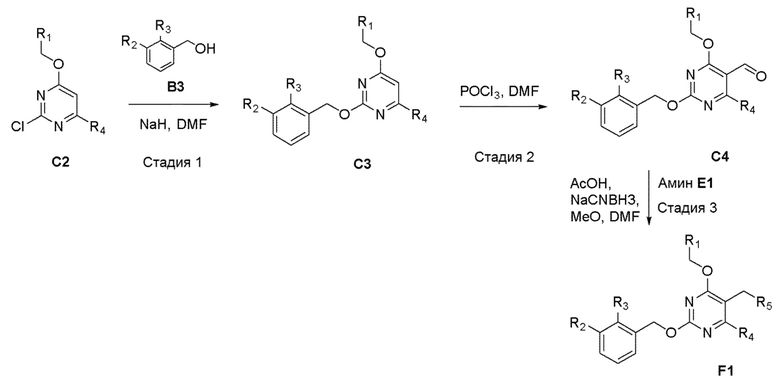
Стадия 1: Промежуточное соединение С2 подвергали взаимодействию с соединением В3 в присутствии основания, такого как гидрид натрия, с получением 2-бензилокси-4-алкокси-5-бромпиримидина (Соединение С3).
Стадия 2: Форматирование промежуточного соединения С3 проводили с использованием POCl3 и DMF, с получением промежуточного соединения С4.
Стадия 3: Восстановительное аминирование промежуточного соединения С4 различными замещенными алифатическими, ароматическими, гетероциклическими и циклическими аминами (Е1), полученными с помощью соединений (Соединение F) настоящего изобретения.
Общая методика синтеза соединений формулы Ib
Соединения общей формулы Ib, где R9 представляет собой алкил или арил, могут быть получены по следующей схеме.
Схема 1b
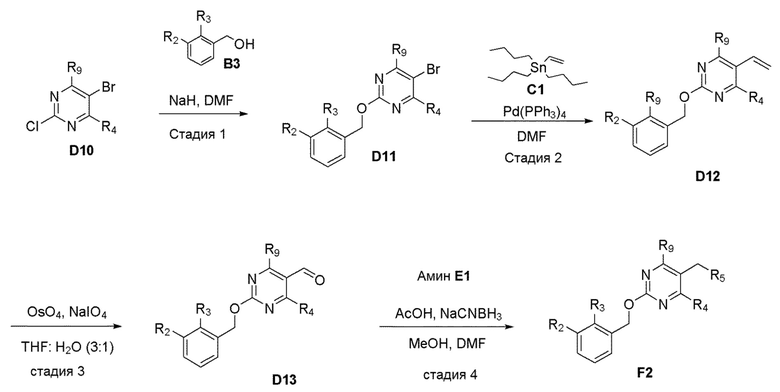
Стадия 1: В3 подвергали взаимодействию с соединением D10 в присутствии основания, такого как гидрид натрия, с получением пиримидинового производного соединения D11.
Стадия 2: Промежуточное соединение D11 подвергали взаимодействию с трибутил(винил)оловом (Соединение С1), с получением соответствующих виниловых производных D12.
Стадия 3: Соединение D12 подвергали окислению метапериодатом натрия и тетраоксидом осмия, с получением соответствующего альдегида D13.
Стадия 4: Восстановительное аминирование промежуточного соединения D13 различными замещенными алифатическими, ароматическими, гетероциклическими и циклическими аминами (Е1), с получением соединений (Соединение F2) настоящего изобретения.
Общие сведения и аналитические методы
[000117] В реакционных процессах, если не указано иное, использовали коммерчески доступные соединения. Данные ЯМР получены на спектрометре Varian 4 00 МГц. Все соединения были охарактеризованы с помощью ХН ЯМР, HPLC и масс-спектрометрии (LCMS (ES), жидкостная хроматография - масс-спектрометрия). Все химические сдвиги 1Н представлены в долях на миллион (м.д.) и их измеряли относительно TMS или остаточного дейтерированного DMSO в качестве растворителя. Измерения LCMS (ES) проводили на масс-спектрометре Agilent-LCMS D-SL (G1456B). Выход соединений указан для чистых соединений.
[000118] Примеры, приведенные ниже, приведены только в качестве иллюстрации и поэтому они не должны рассматриваться как ограничивающие объем изобретения.
[000119] Кроме того, класс соединений формулы I получали с использованием общей процедуры, описанной на схеме 1 или схеме 2, приведенных выше.
Общая процедура синтеза промежуточных продуктов
Синтез (4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метанола (промежуточное соединение для соединений 1, 5-9)
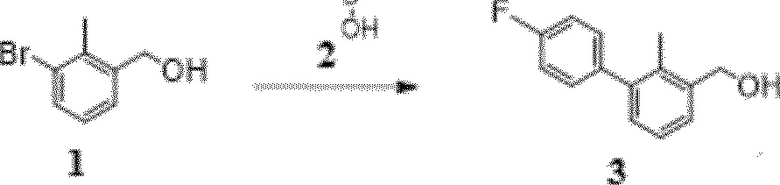
[000120] К перемешиваемому раствору (3-бром-2-метилфенил)метанола (1, 1 г, 5 ммоль), (4-фторфенил)бороновой кислоты (2, 1,4 г, 10 ммоль) в толуоле (12 мл) и EtOH (4 мл) добавляли PdCl2 (dppf)⋅DCM (0,04 г, 0,05 ммоль) и 2М водный раствор NaHCO3 (4 мл), и реакционную смесь дегазировали газообразным N2 в течение 10 минут. Затем реакционную смесь нагревали в герметизированной пробирке при 80°С в течение 12 часов. Реакционную смесь фильтровали через целит; фильтрат разбавляли водой и экстрагировали этилацетатом (2×100 мл). Органический слой сушили над сульфатом натрия, выпаривали, и неочищенный продукт очищали MPLC на Combiflash, используя 20% этилацетат в гексане в качестве элюента, с получением (4'-фтор-2-метил[1,1'-бифенил]-3-ил)метанола в виде не совсем белого твердого вещества (3, выход: 0,81 г, 73%).
LCMS (ES) m/z=199,1 [М+Н-OH]+; 1Н ЯМР (400 МГц, DMSO-d6) δ м.д.: 2,08 (с, 3Н), 4,52 (д, J=5, 6 Гц, 2Н), 5,09 (т, J=5,2 Гц, 1Н), 7,05 (д, J=7,6 Гц, 1H), 7,18-7,25 (м, 3Н), 7,27-7,31 (м, 2Н), 7,38 (д, J=7,6 Гц, 1Н).
Синтез (2-метил-[1,1'-бифенил]-3-ил)метанола (промежуточное соединение для соединений 2-4, 10-15)
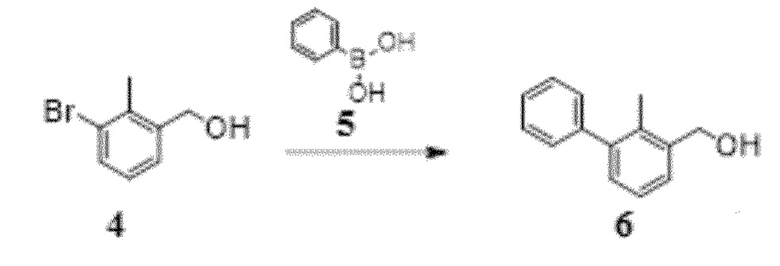
[000121] К перемешиваемому раствору (3-бром-2-метилфенил)метанола (4, 1 г, 5 ммоль), фенилбороновой кислоты
(5, 1,4 г, 10 ммоль) в толуоле (12 мл) и EtOH (4 мл) добавляли PdCl2(dppf)⋅DCM (0,04 г, 0,05 ммоль) и 2М водный раствор NaHCO3 (4 мл), и реакционную смесь дегазировали газообразным азотом в течение 10 минут. Затем реакционную смесь нагревали в герметичной пробирке при 80°С в течение 12 часов. Реакционную смесь фильтровали через целит; фильтрат разбавляли водой и экстрагировали этилацетатом (2×100 мл). Органический слой сушили над сульфатом натрия, выпаривали, и неочищенный продукт очищали MPLC на Combiflash, используя 20% этилацетат в гексане в качестве элюента, с получением (2-метил-[1,1'-бифенил]-3-ил)метанола в виде не совсем белого твердого вещества (6, выход: 0,81 г, 73%). LCMS (ES) m/z=199,1 [М+Н]+.
Синтез N-(2-(((2-((4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)амино)этил)ацетамида
(Соединение 1)
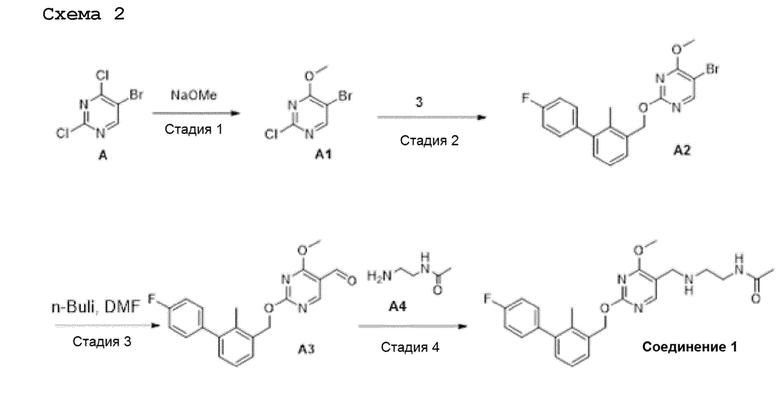
Стадия 1: Получение 5-бром-2-хлор-4-метоксипиримидина (А1)
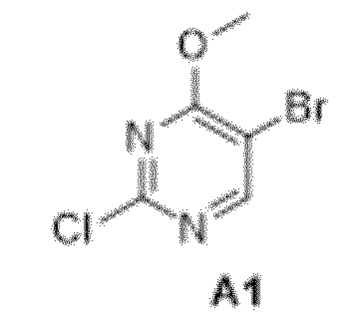
[000122] К перемешиваемому раствору 5-бром-2,4-дихлорпиримидина (А, 5 г, 22,2 ммоль) в МеОН (100 мл) при 0°С добавляли NaOMe (1,6 г, 2 8,88 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь упаривали; неочищенный продукт переносили в воду и экстрагировали этилацетатом (2×150 мл). Объединенный органический слой промывали насыщенным раствором соли, сушили над сульфатом натрия и выпаривали. Неочищенный продукт очищали MPLC на Combiflash с использованием 2% этилацетата в гексане в качестве элюента, с получением 5-бром-2-хлор-4-метоксипиримидина в виде белого кристаллического твердого вещества (А1, выход: 4 г, 82%).
LCMS (ES) m/z=222,9, 224, 9 [М]+, [М+2Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ м.д.: 4,01 (с, 3Н), 8,69 (с, 1Н).
Стадия 2: Получение 5-бром-2-((4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидина (А2)
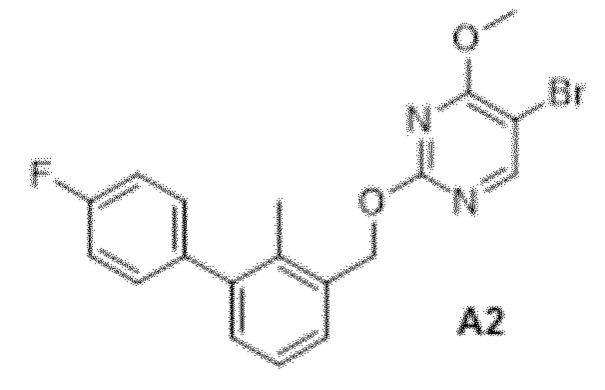
[000123] К перемешиваемому раствору (4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метанола (промежуточное соединение 3, 0,5 г, 2,31 ммоль) в THF (15 мл) при 0°С добавляли 60% NaH в минеральном масле (0,184 г, 4,61 ммоль), и реакционную смесь перемешивали при этой температуре в течение 0,5 часа. Затем к реакционной смеси при 0°С добавляли 5-бром-2-хлор-4-метоксипиримидин (А1, 0,51 г, 2,31 ммоль) в THF (3 мл), и реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь гасили льдом, экстрагировали этилацетатом. Органический слой промывали ледяной водой, насыщенным раствором соли и сушили над сульфатом натрия. Затем органический слой выпаривали, неочищенный продукт очищали с помощью MPLC на Combiflash, используя 2,5% этилацетат в гексане в качестве элюента, получая 5-бром-2-((4'-фтор-2-метил-[1,1'-бифенил])-3-ил)метокси)-4-метоксипиримидин в виде белого твердого вещества (А2, выход; 0,8 г, 8 6%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,17 (с, 3Н), 3,97 (с, 3Н), 5,45 (с, 2Н), 7,18 (д, J=7,2 Гц, 1Н), 7, 22-7, 27 (м, 3Н), 7,31-7,35 (м, 2Н), 7,42 (д, J=7,6 Гц, 1Н), 8,51 (с, 1Н).
Стадия 3: Получение 2-((4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-карбальдегида (A3)
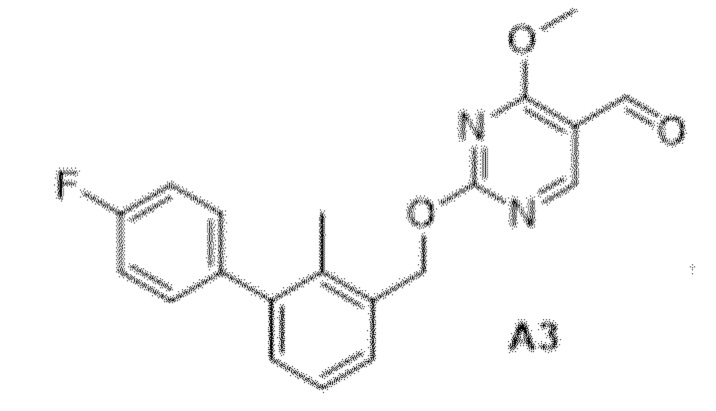
[000124] К перемешиваемому раствору 5-бром-2-((4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидина (А2, 0,3 г, 0,74 ммоль) в THF (5 мл) при -78°С добавляли H-BuLi (1,2 М раствор в гексане, 0,61 мл, 0,74 ммоль) и перемешивали при -78°С в течение 10 минут.Реакционная смесь превращалась в темно-коричневую массу, и полученный анион гасили DMF (0,15 мл, 1,48 ммоль). Реакционной смеси давали нагреться до 0°С, и ее гасили насыщенным раствором NH4Cl (3 мл). Реакционную смесь разбавляли этилацетатом (20 мл), и органический слой отделяли. Органический слой сушили над сульфатом натрия и концентрировали, с получением неочищенного остатка, который очищали MPLC на Combiflash, используя 10% этилацетат в гексане в качестве элюента, с получением 2-((4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-карбальдегида в виде бесцветного вязкого жидкого (A3, выход: 0,12 г, 46%).
LCMS (ES) m/z=353,1 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ м.д.: 2,19 (с, 3Н), 4,04 (с, 3Н), 5,56 (с, 2Н), 7,20 (д, J=7,6 Гц, 1Н), 7, 23-7, 29 (м, 3Н), 7, 32-7, 35 (м, 2Н), 7,45 (д, J=7,6 Гц, 1Н), 8,78 (с, 1Н), 10,03 (с, 1Н).
Стадия 4: Получение N-(2-(((2-((4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)амино)этил)ацетамида (Соединение 1)
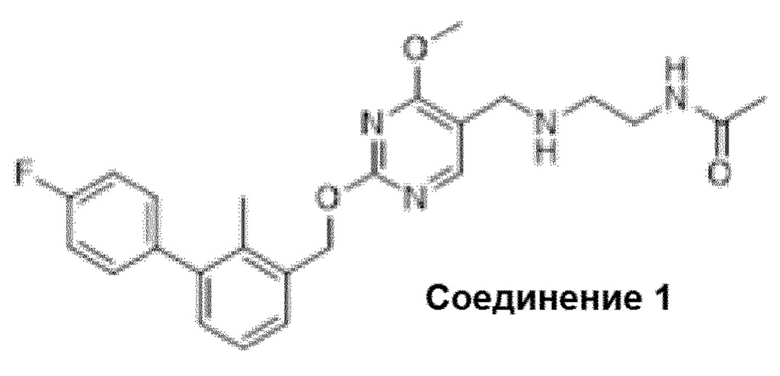
[000125] К раствору 2-((4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-карбальдегида (A3, 0,12 г, 0,34 ммоль) в МеОН (2 мл) и DMF (2 мл) при 0°С одновременно добавляли N-(2-аминоэтил)ацетамид (А4, 0,2 г, 2,04 ммоль) и уксусную кислоту (0,05 мл), и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь охлаждали до 0°С, добавляли NaCNBH3 (0,065 г, 1,02 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь выпаривали, неочищенный продукт переносили в DCM (15 мл), и промывали водой и солевым раствором. Органический слой сушили над сульфатом натрия и концентрировали, с получением неочищенного остатка, который очищали MPLC на Combiflash с использованием 7% метанола в дихлорметане в качестве элюента, с получением N-(2-(((2-((4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)амино)этил)ацетамида (Соединение 1) в виде вязкого твердого вещества (выход 0,06 г, 41%).
LCMS (ES) m/z=439,2 [М+Н]+; 1Н ЯМР (4 00 МГц, DMSO-d6) δ м.д.: 1,78 (с, 3Н), 2,18 (с, 3Н), 2,61-2,69 (м, 1Н), 3,16 (д, J=5,6 Гц, 2Н), 3,70 (шир. с, 2Н), 3,92 (с, 3Н), 5,43 (с, 2Н), 7,17 (д, J=6,8 Гц, 1Н), 7, 23-7, 27 (м, 3Н), 7,31-7,35 (м, 2Н), 7,43 (д, J=7,2 Гц, 1Н), 7,82 (шир. с, 1Н), 8,27 (с, 1Н); HPLC при 280 нм, 98,33%.
Синтез N-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-N-метилглицина (Соединение 2))
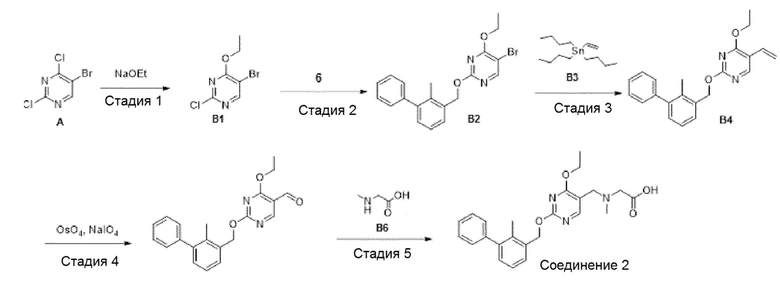
Стадия 1: Получение 5-бром-2-хлор-4-этоксипиримидина (В1)
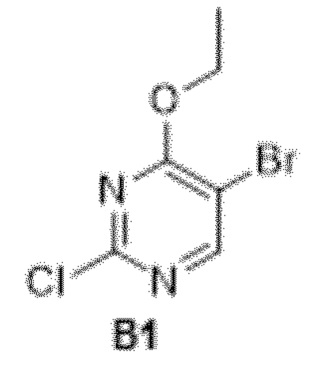
[000126] К перемешиваемому раствору 5-бром-2,4-дихлорпиримидина (А, 2 г, 8,8 5 ммоль) в EtOH(20 мл) добавляли NaOEt (21% в EtOH, 3,4 мл, 10,62 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь упаривали; неочищенный продукт переносили в воду и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и выпаривали. Неочищенный продукт очищали MPLC на Combiflash с использованием 2% этилацетата в гексане в качестве элюента, с получением 5-бром-2-хлор-4-этоксипиримидина в виде белого кристаллического твердого вещества (В1, выход: 1,6 г, 80%).
LCMS (ES) m/z=237, 239 [М]+, [М+2Н]+; 1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,46 (т, J=7,2 Гц, 3Н), 4,53 (д, J=7,2 Гц, 2Н), 8,41 (с, 1Н).
Стадия 2: Получение 5-бром-4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидина (В2)
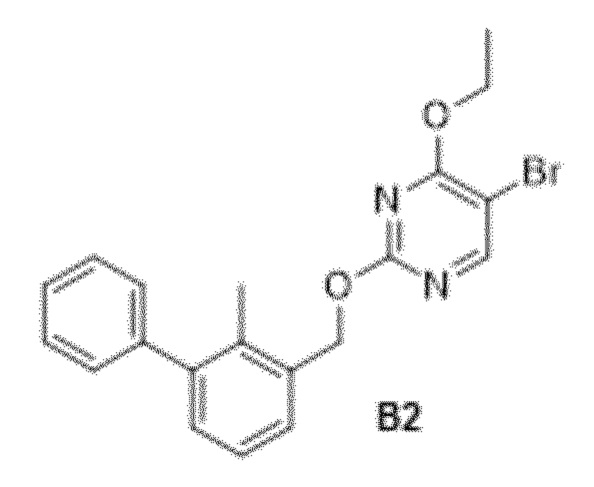
[000127] К перемешиваемому раствору (2-метил-[1, 1' -бифенил]-3-ил) метанола (6, 0,83 г, 4,21 ммоль) в THF (20 мл) добавляли 60% NaH в минеральном масле (0,36 г, 8,42 ммоль) при 0°С, и реакционную смесь перемешивали при этой температуре в течение 0,5 часа. Затем к реакционной смеси добавляли 5-бром-2-хлор-4-этоксипиримидин (В1, 1,0 г, 4,21 ммоль) в THF (5 мл) при 0°С, и реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь гасили льдом, экстрагировали этилацетатом. Органические слои промывали ледяной водой, насыщенным раствором соли и сушили над сульфатом натрия. Затем органический слой выпаривали, неочищенный продукт очищали с помощью MPLC на Combiflash, используя 2% этилацетат в гексане в качестве элюента, получая 5-бром-4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин в виде белого твердого вещества (В2, выход: 0,6 г, 32%).
LCMS (ES) m/z=399, 401 [М+2Н]+; 1Н ЯМР (400 МГц, CDCl3) δ м.д.: 1,44 (т, J=7,6 Гц, 3Н), 2,27 (с, 3Н), 4,50 (кв, J=7,2 Гц, 2Н), 5,44 (с, 2Н), 7,21-7,23 (м, 2Н), 7,29 (д, J=7,2 Гц, 2Н), 7,32-7,35 (м, 1Н), 7,39-7,44 (м, 3Н), 8,32 (с, 1Н).
Стадия 3: Получение 4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидина (В4)
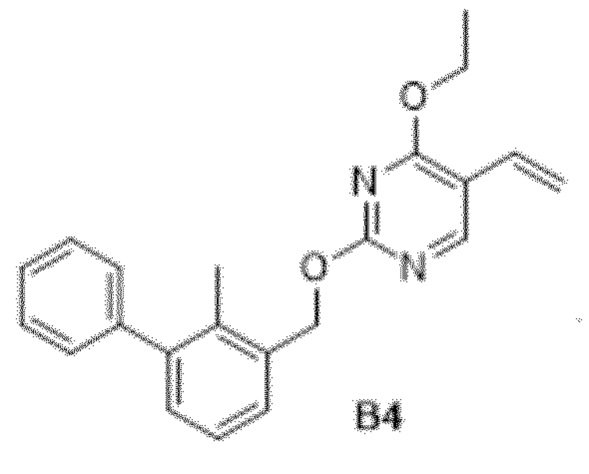
[000128] К перемешиваемому раствору 5-бром-4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидина (В2, 4,4 г, 11,03 ммоль) в В DMF (60 мл) добавляли трибутилвинилолово (В3, 5 мл, 16,48 ммоль), и реакционную смесь дегазировали газообразным азотом в течение 10 минут. Затем добавляли Pd(PPh3)4 (1,3 г, 1,13 ммоль), и реакционную смесь нагревали при 100°С в течение 16 часов. Реакционную смесь фильтровали через целит; фильтрат разбавляли водой и экстрагировали этилацетатом (2×100 мл). Органический слой сушили над сульфатом натрия, выпаривали, и неочищенный продукт очищали MPLC на Combiflash, используя 10% этилацетат в гексане в качестве элюента, с получением 4-этокси-2-((2-метил[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидина в виде желтой маслянистой жидкости (В4, выход: 1,7 г, 32%).
LCMS (ES) m/z=347,1 [М+Н]+; 1Н ЯМР (4 00 МГц, DMSO-d6) δ м.д.: 1,34 (т, J=7,2 Гц, 3Н), 2,18 (с, 3Н), 4, 39-4, 45 (м, 2Н), 5, 27-5, 30 (м, 1Н), 5,44 (с, 2Н), 5, 85-5, 90 (м, 1Н), 6,57-6,65 (м, 1Н), 7,16-7,30 (м, 4Н), 7-34-7,46 (м, 4Н), 8,46 (с, 1Н).
Стадия 4: Получение 4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида (В5)
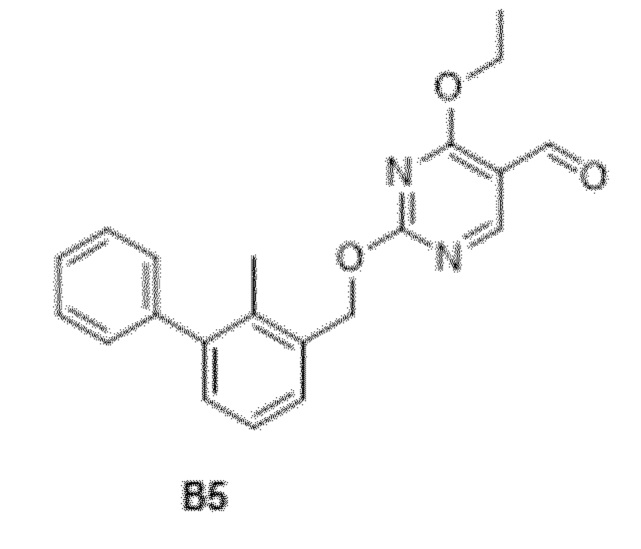
[000129] К перемешиваемому раствору 4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидина (В4, 2,2 г, 6,36 ммоль) в THF (40 мл) и воде (20 мл), добавляли OsO4 (4 мл, 0,63 ммоль) и перемешивали при 0°С в течение 15 минут с последующим добавлением NaIO4 (2,8 г, 13,14 ммоль). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли водой и экстрагировали этилацетатом (2×100 мл). Органический слой сушили над сульфатом натрия, выпаривали, и неочищенный продукт очищали MPLC на Combiflash с использованием 13% этилацетата в гексане в качестве элюента, с получением 4-этокси-2-((2-метил[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида в виде не совсем белого твердого вещества (В5, выход: 1,1 г, 50%).
LCMS (ES) m/z=349,3 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ м.д.: 1,36 (т, J=7,2 Гц, 3Н), 2,20 (с, 3Н), 4, 50-4, 55 (м, 2Н), 5,55 (с, 2Н), 7,19-7,30 (м, 4Н), 7, 35-7, 45 (м, 4Н), 8,77 (с, 1Н), 10,03 (с, 1Н).
Стадия 5: Получение N-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-N-метилглицина (Соединение 2)
[000130] К раствору 4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида (В5, 0,15 г, 0,43 ммоль) в МеОН (2 мл) и DMF (2 мл) при 0°С одновременно добавляли метилглицин (В6, 0,12 г, 1,35 ммоль) и уксусную кислоту (0,1 мл), и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь охлаждали до 0°С, добавляли NaCNBH3 (0,08 г, 1,29 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь упаривали; неочищенный продукт переносили в DCM (15 мл) и промывали водой и солевым раствором. Органический слой сушили над сульфатом натрия и концентрировали, с получением неочищенного остатка, который очищали MPLC на Combiflash с использованием 10% метанола в дихлорметане в качестве элюента, с получением N-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-N-метилглицина (Соединение 2) в виде вязкого твердого вещества (выход 0,035 г, 19%).
LCMS (ES) m/z=422,2 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ м.д.: 1,22-1,31 (м, 3Н), 2,18 (с, 3Н), 2,28 (с, 3Н), 3,15 (с, 2Н), 3,59 (с, 3Н), 4, 34-4, 39 (м, 2Н), 5,41(с, 2Н), 7,16-7,18 (м, 1Н), 7,23-7,30 (м, 3Н) 7,36-7,48 (м, 4Н), 8,23 (с, 1Н): HPLC при 254 нм: 99,38%.
Синтез N-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-N-метилглицина (Соединение 3)
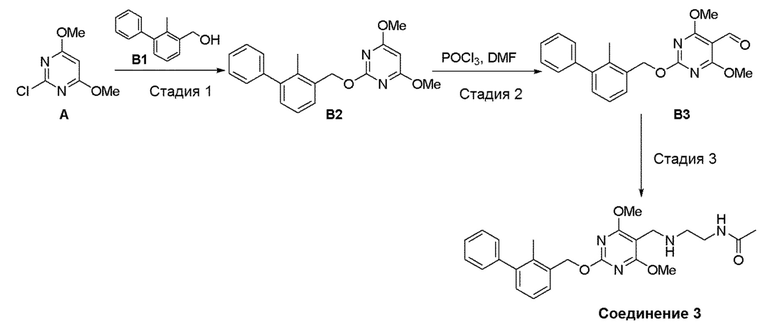
Стадия 1: Получение 4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидина
[000131] К перемешиваемому раствору (2-метил-[1,1'-бифенил]-3-ил) метанола (1 г, 5,05 ммоль) в DMF (15 мл) при 0°С добавляли NaH (0,2 4 г, 6, Об ммоль), и реакционную смесь перемешивали в течение 3 0 минут при комнатной температуре. Затем к реакционной смеси при 0°С добавляли 2-хлор-4,б-диметоксипиримидин (0,97 г, 5,55 ммоль) в DMF (5 мл), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь гасили льдом и экстрагировали этилацетатом. Органический слой промывали ледяной водой, солевым раствором и сушили над сульфатом натрия. Затем органический слой выпаривали, неочищенный продукт очищали с помощью MPLC на Combiflash, используя 3% этилацетат в гексане в качестве элюента, получая 4,б-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин в виде бесцветного вязкого масла (1,4 г, 83%).
LCMS (ES) m/z=337 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ м.д. 2,16 (с, 3Н), 3,86 (с, 6Н), 5,42 (с, 2Н), 5,87 (с, 1Н), 7,18 (д, J=7,2 Гц, 1Н), 7, 24-7, 30 (м, 3Н), 7, 36-7, 37 (м, 1Н), 7,39-7,43 (м, 3Н).
Стадия 2: Получение 4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида
[000132] К перемешиваемому раствору 4,3-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидина (0,8 г, 2,38 ммоль) в DMF (6 мл) добавляли POCl3 (5 мл 16,48 ммоль), и реакционную смесь дегазированной газообразным N2 в течение 10 минут, добавляли Pd(Pph3)4 (0,7 мл, 7,82 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь выливали на лед и подщелачивали с помощью насыщенного раствора NaHCO3. Осажденное твердое вещество отфильтровывали и высушивали под вакуумом с получением неочищенного продукта. Неочищенный продукт очищали с помощью MPLC на Combiflash с использованием 20% этилацетата в гексане в качестве элюента, с получением 4,б-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида в виде белого твердого вещества (0,38 г, 44%).
LCMS (ES) m/z=365,1 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ м.д. 2,21 (с, 3Н), 3,99 (с, 6Н), 5,55 (с, 2Н), 7,20 (д, J=7,2 Гц, 1Н), 7, 26-7,30 (м, 3Н), 7, 34-7,38 (м, 1Н), 7, 42-7, 47 (м, 3Н), 10, 05 (с, 1Н).
Стадия 3: Получение N-(2-(((4,б-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамида
[000133] К раствору 4,б-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида (0,19 г, 0,52 ммоль) в МеОН (3 мл) и 3 мл DMF) при 0°С добавляли одновременно N-(2-аминоэтил)ацетамид (0,203 г, 1,56 ммоль) и уксусную кислоту (0,1 мл), и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь охлаждали до 0°С, добавляли NaCNBH3 (0,09 г, 1,56 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь выпаривали, неочищенный продукт переносили в DCM (15 мл) и промывали водой и солевым раствором. Органический слой сушили над сульфатом натрия и концентрировали, с получением неочищенного остатка, который очищали с помощью MPLC на Combiflash, используя 10% метанол в дихлорметане в качестве элюента, с получением N-(2-(((4,б-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамида в виде не совсем белого твердого вещества (0,05 г, 23%).
LCMS (ES) m/z=451,2 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ м.д. 1,76 (с, 3Н), 2,20 (с, 3Н), 3,14 (с, 1Н), 2, 52-2, 54 (м, 2Н), 3,10 (кв, J=6 Гц, 2Н), 3,58 (с, 2Н), 3,89 (с, 6Н), 5,44 (с, 2Н), 7,17 (д, J=7,2 Гц, 1Н), 7, 23-7,29 (м, 3Н) 7,33-7,37 (м, 1Н), 7,43 (т, J=7,6 Гц, 3Н), 7,76 (шир. с, 1Н): HPLC при 254 нм: 98,47%.
Синтез (1R,6R)-2-((4,б-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2-азабицикло[4.1.0]гептан-1-карбоновой кислоты (Соединение 4) и (1S,6R)-2-((4,б-диметокси-2-((2-метил-[1,1'-])бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2-азабицикло[4.1.0]гептан-1-карбоновой кислоты (Соединение 5)
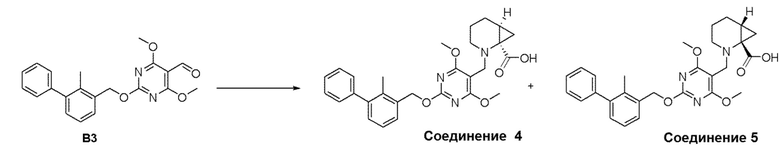
[000134] К раствору 4,б-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида (0,2 г, 0,54 ммоль) в МеОН (4 мл) и DMF (4 мл) добавляли гидрохлорид рац-(1R,6S)-2-азабицикло[4.1.0]гептан-1-карбоновой кислоты (97 мг, 0,54 ммоль), триэтиламин (81 мг, 0,81 ммоль), и перемешивали в течение 5 минут.К этой смеси добавляли уксусную кислоту (0,1 мл), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. К этой реакционной смеси добавляли NaCNBH3 (101 мг, 1,6 ммоль), и продолжали перемешивание при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли водой (100 мл) и экстрагировали 10% МеОН в DCM (2×150 мл). Объединенный органический слой промывали водой (40 мл) и солевым раствором (40 мл), сушили над сульфатом натрия и концентрировали, с получением неочищенного остатка, который очищали хроматографией на Combiflash, с использованием 8% метанола в дихлорметане в качестве элюента, с получением рац(1R,6S)-2-((4,б-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2-азабицикло[4.1.0]гептан-1-карбоновой кислоты в виде светло-белого твердого вещества (выход: 165 мг, 62%). Рацемическую смесь очищали с помощью сверхкритической жидкостной хроматографии (Waters SFC 200q, колонка: CHIRALCEL OJ-H (250×21 мм), 5 мкм), используя CO2 и 0,2% TEA в МеОН в качестве подвижной фазы (метод: 60 г (CO2) 15% (сорастворитель) 100 бар (ABPR)), загрузка 5,0 мг/инжекция в 5-минутном цикле. Собирали два пика через 6,8 минут (пик-1, изомер-1) и 8,3 минуты (пик-2, изомер-2), и концентрировали, получая соединение 4 (73 мг) и соединение 5 (82 мг). Пик-1:
(1R,6R)-2-((4,б-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2-азабицикло[4.1.0]гептан-1-карбоновая кислота (Соединение 4)
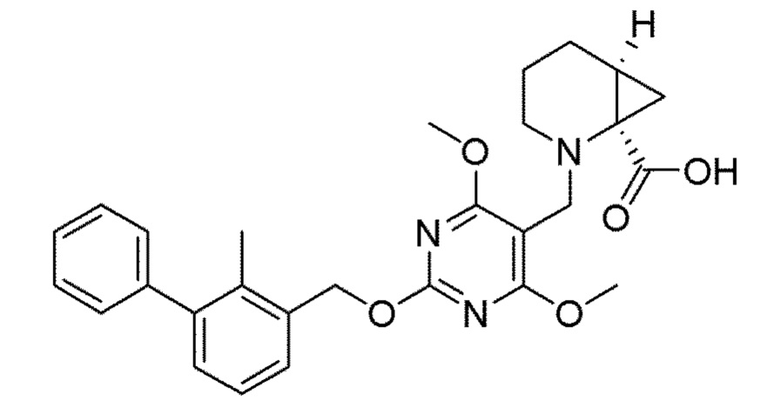
[000135] LCMS (ES) m/z=490,39 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,09-1,18 (м, 1Н), 1,26-1, 22 (м, 2Н), 1, 35-1,36 (м, 1Н), 1,51-1,59 (м, 1Н), 1, 77-1,83 (м, 2Н), 2,22 (с, 3Н), 2,49 (м, 2Н), 3,36 (м, 1Н), 3,65 (м, 1Н), 3,92 (с, 6Н), 5,46 (с, 2Н), 7,19-7,21 (м, 1Н), 7,26-7,32 (м, 3Н), 7,35-7,39 (м, 1Н), 7,44-7,48 (м, 3Н), 11,82 (шир. с, 1Н); HPLC при 214 нм: 98,96%.
Пик-2: (1S,6R)-2-((4,б-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2-азабицикло[4.1.0]гептан-1-карбоновая кислота (Соединение 5)
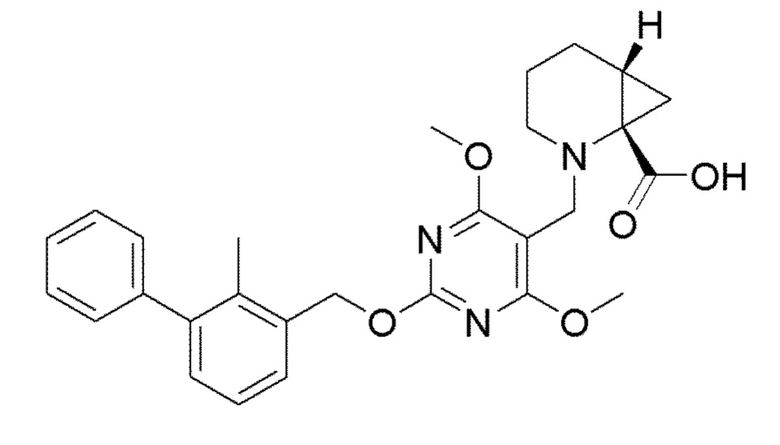
[000136] LCMS (ES) m/z=490,39 [М+Н]+; 1Н ЯМР (400 МГц, DMS0-d6): δ 1,15-1,26 (м, 3Н), 1,35-1,36 (м, 1Н), 1,51-1,59 (м, 1Н), 1,77-1,83 (м, 2Н), 2,22 (с, 3Н), 2,49 (м, 2Н), 3,36 (м, 1Н), 3,65 (м, 1Н), 3,92 (с, 6Н), 5,46 (с, 2Н), 7,19-7,21 (м, 1Н), 7, 26-7, 32 (м, 3Н), 7, 35-7, 39 (м, 1Н), 7, 44-7, 48 (м, 3Н), 11,82 (шир. с, 1Н), HPLC при 214 нм: 99,23%.
Синтез N-(2-(((4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этила)ацетамида (Соединение 6)
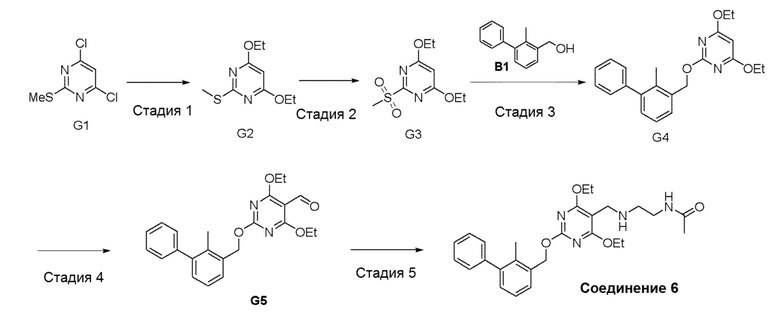
Стадия 1: Получение 4,6-диэтокси-2-(метилтио)пиримидина [000137] К перемешиваемому раствору 4,б-дихлор-2-(метилтио) пиримидина (5 г, 2 5 моль) в EtOH(30 мл) при 0°С добавляли NaOEt (21% в EtOH, 20 мл, 56 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь упаривали, и неочищенный продукт переносили в воду (100 мл), и экстрагировали этилацетатом (2×300 мл). Объединенные органические слои промывали насыщенным раствором соли, сушили над сульфатом натрия и выпаривали, с получением 4,б-диэтокси-2-(метилтио)пиримидина в виде белого твердого вещества (выход: 4,7 г, 85,5%).
1H ЯМР (400 МГц, CDCl3): δ 1,37 (д, J=7,04 Гц, 6Н), 2,51 (с, 3Н), 4, 32-4, 37 (т, J=7,04 Гц, 4Н), 5,67 (с, 1Н).
Стадия 2: Получение 4,6-диэтокси-2-(метилсуль фонил)пиримидина
[000138] К перемешиваемому раствору 4,б-диэтокси-2-(ме тил тио) пиримидина (51 г, 4 ммоль) в DCM (30 мл) при 0°С добавляли mCPBA (4,31 г, 24 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 2 0 часов. Реакционную смесь гасили ледяной водой (30 мл) и экстрагировали DCM (3×100 мл). Органический слой промывали насыщенным раствором бикарбоната натрия и солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали с помощью флэш-хроматографии, с использованием 8% этилацетата в гексане в качестве элюента, с получением 4,6-диэтокси-2-(метилсульфонил)пиримидина в виде белого твердого вещества (выход: 1 г, 81%).
1H ЯМР (400 МГц, CDCl3): δ 1,41 (д, J=7,08 Гц, 6Н), 3,30 (с, 3Н), 4,32-4,48 (т, J=7,12 Гц, 4Н), 6,12 (с, 1Н).
Стадия 3: Получение 4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидина
[000139] К перемешиваемому раствору 4,б-диэтокси-2-(метилсульфонил) пиримидина (4,5 г, 18. 2 ммоль) в DMF (40 мл) добавляли (2-метил[1,1'-бифенил]-3-ил)метанол (3,62 г, 18,2 ммоль) и карбонат калия (2,53 г, 18. 2 м ют моль). Реакционную смесь нагревали при 80°С в течение 8 часов. Реакционную смесь разбавляли водой (50 мл) и экстрагировали этилацетатом (2×100 мл). Органический слой сушили над сульфатом натрия и упаривали, получая неочищенный продукт. Неочищенный продукт очищали флэш-хроматографией с использованием 10% этилацетата в гексане в качестве элюента, с получением 4,б-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидина в виде твердого вещества белого цвета (выход: 3,5 г, 52%).
LCMS (ES) m/z=365,21 [М+Н]+, purity при 214 нм: 89,77%,; 1H ЯМР (400 МГц, DMSO-d6) δ м.д.: 1,30 (м, 6Н), 2,20 (с, 3Н), 4,29-4,33 (м, 4Н), 5,40 (с, 2Н), 7,20 (м, 1Н), 7,25-7, 30 (м, 3Н), 7,39 (м, 1Н), 7,44-7,48 (м, 4Н).
Стадия 4: Получение 4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида
[000140] Раствор фосфорилхлорида (5 мл) в DMF (10 мл) перемешивали при 0°С в атмосфере азота в течение 1 часа. Добавляли по каплям раствор 4,б-диэтокси-2-((2-метил-[1, 1'-бифенил]-3-ил) метокси) пиримидина (3,5 г, 9. 6 ммоль) в DCE (30 мл). Затем реакционную смесь перемешивали при комнатной температуре в течение 30 минут, после чего ее нагревали при 80°С в течение 3 часов. После завершения реакции реакционную смесь концентрировали в вакууме и разбавляли DCM (50 мл). Органический слой промывали водой (25 мл), насыщенным раствором соли, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, с получением неочищенного продукта, который очищали хроматографией на силикагеле (10% EtOAc в гексане) с получением 4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида в виде белого твердого вещества (выход: 1,5 г, 39%).
1H ЯМР (400 МГц, DMSO-d6): δ 1,34 (т, J=7,08 Гц, 6Н), 2,22 (с, 3Н), 4,46-4,51 (м, 4Н), 5,52 (с, 2Н), 7,21 (м, 1Н), 7,26-7,30 (м, 3Н), 7,40 (м, 1Н), 7,44-7,48 (м, 3Н), 10,07 (с, 1Н).
Стадия 5: Получение N-(2-(((4,б-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамида
[000141] К раствору 4,б-диэтокси-2-((2-метил-[1, 1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида (0,15 г, 0,38 ммоль) в МеОН (3 мл) и DMF (3 мл) при комнатной температуре одновременно добавляли N-(2-аминоэтил)ацетамид (60 мг, 0,57 ммоль) и уксусную кислоту (0,1 мл), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. К этой реакционной смеси добавляли NaCNBH3 (0,08 г, 1,29 ммоль) и перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли водой (10 мл) и экстрагировали смесью DCM:MeOH (9:1) (3×2 5 мл). Органический слой промывали водой, солевым раствором, сушили над сульфатом натрия и концентрировали, получая неочищенный остаток, который очищали флэш-хроматографией, используя 8% метанол в дихлорметане в качестве элюента, получая N-(2-(((4,б-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид в виде белого твердого вещества (выход 0,091 г, 49%).
LCMS (ES) m/z=479,24 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,19-1,30 (т, 6Н), 1,82 (с, 3Н), 2,19 (с, 3Н), 2,93 (м, 2Н), 3,30 (м, 2Н), 3,89 (с, 2Н), 4, 35-4, 40 (кв, 4Н), 5,43 (с, 2Н), 7,21 (м, 1Н), 7, 26 -7, 30 (м, 3Н), 7,40 (м, 1Н), 7, 44-7, 48 (м, 3Н), 8,03 (с, 1Н), 8,23 (шир. с, 1Н), HPLC при 214 нм: 98,19%.
Синтез (S)-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты (Соединение 7)
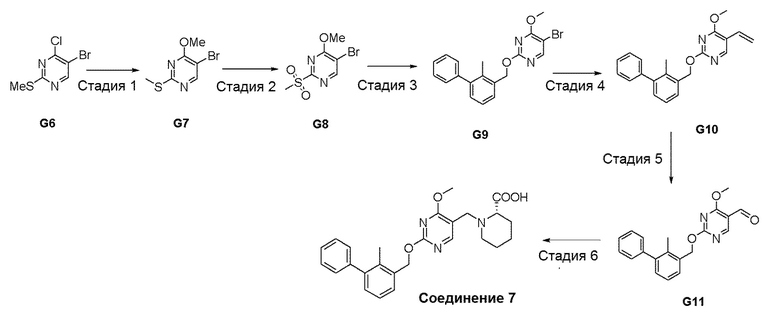
Стадия 1: Синтез 5-бром-4-метокси-2-(метилтио)пиримидина
[000142] К перемешиваемому раствору 5-бром-4-хлор-2-(метилтио) пиримидина (25 г, 105 ммоль) в метаноле (2 00 мл) при 0°С добавляли NaOMe (21% в МеОН, 30 мл, 136 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 8 часов. После завершения реакции реакционную смесь концентрировали в вакууме. Неочищенный продукт разбавляли водой (500 мл) и экстрагировали этилацетатом (2×900 мл). Объединенный органический слой промывали солевым раствором (100 мл), сушили над сульфатом натрия и упаривали, получая 5-бром-4-метокси-2-(метилтио)пиримидин в виде белого твердого вещества (выход: 22 г, 8 9%).
LCMS (ES) m/z=235,19 [М+Н]+; 1Н ЯМР (400 МГц, CDCl3): δ 2,54 (с, 3Н), 4,05 (с, 3Н), 8,34 (с, 1Н).
Стадия 2: Синтез 5-бром-4-метокси-2-(метилтио)пиримидина
[000143] К перемешиваемому раствору 5-бром-4-метокси-2-(метилтио) пиримидина (14 0 г, 595 ммоль) в DCM (2 л) при 0°С добавляли мета-хлорпербензойную кислоту (308 г, 178 0 м моль), и реакционную смесь перемешивали при комнатной температуре в течение 2 0 часов. Реакционную смесь гасили ледяной водой (1 л) и экстрагировали DCM (3×2 л). Объединенный органический слой промывали насыщенным с раствором бикарбоната натрия (1 л), солевым раствором (500 мл) и сушили над сульфатом натрия. Органический слой упаривали, и неочищенный продукт очищали хроматографией на Combiflash, с использованием 8% этилацетата в гексане в качестве элюента, с получением 5-бром-4-метокси-2-(метилсульфонил)пиримидина в виде белого твердого вещества (выход: 72 г, 45,38%).
LCMS (ES) m/z=267,25 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 3,40 (с, 3Н), 4,11 (с, 3Н), 9,02 (с, 1Н).
Стадия 3. Синтез 5-бром-4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидина
[000144] К перемешиваемому раствору 5-бром-4-метокси-2-(метилсульфонил)пиримидина (80 г, 2 99 ммоль) в DMF (4 00 мл) добавляли (2-метил[1,1'-бифенил]-3-ил)метанол (59,49 г, 300 ммоль) и карбонат калия (123 г, 90 0 м моль), и реакционную смесь нагревали при 80°С в течение 12 часов. После завершения реакции реакционную смесь разбавляли водой (1 л) и экстрагировали этилацетатом (2×2 л). Объединенный органический слой сушили над сульфатом натрия, фильтровали и упаривали, получая неочищенный продукт. Неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 10% этилацетат в гексане в качестве элюента, с получением 5-бром-4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидина в виде белого твердого вещества (выход: 47 г, 40,8%).
LCMS (ES) m/z=385,37 [М+Н]+; 1Н ЯМР (400 МГц, CDCl3): δ 2,28 (с, 3Н), 4,05 (с, 3Н), 5,46 (с, 2Н), 7,21-7,25 (м, 2Н), 7,31-7,34 (м, 2Н), 7, 36-7, 39 (м, 1Н), 7,41-7,46 (м, 3Н), 8,33 (с, 1Н).
Стадия 4: Синтез 4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидина
[000145] К перемешиваемому раствору 5-бром-4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)птримидин f (48 г, 124 ммоль) в DMF (150 мл) добавляли трибутилвинилолово (71,1 г, 220 ммоль) и реакционную смесь дегазировали газообразным азотом в течение 10 минут.К этой смеси добавляли Pd(PPh3)4 (7,1 г 6,2 ммоль), и реакционную смесь нагревали при 100°С в течение 16 часов. После завершения реакции реакционную смесь фильтровали через целит, фильтрат разбавляли водой (500 мл) и экстрагировали этилацетатом (2×1 л). Объединенный органический слой сушили над сульфатом натрия, упаривали, и неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 3% этилацетат в гексане в качестве элюента, с получением 4-метокси-2-((2-метил-[1,1'-бифенил)]-3-ил)метокси)-5-винилпиримидина в виде желтой маслянистой жидкости (выход: 30 г, 72,8%).
LCMS (ES) m/z=333,47 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 2,21 (с, 3Н), 3,92 (с, 3Н), 5,31 (д, J=11,6 Гц, 1Н), 5,55 (с, 2Н), 5,89 (д, J=16,6 Гц, 1Н), 6, 62-6,69 (м, 1Н), 7,21-7,31 (м, 4Н), 7,37-7,46 (м, 4Н), 8,51 (с, 1Н).
Стадия 5: Синтез 4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида
[000146] К перемешиваемому раствору 4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидина (24 г, 72 ммоль) в THF (80 мл) и воде (80 мл) при 0°С добавляли OsO4 (73 мл, раствора 2,5% по массе в трет-бутаноле, 7,2 ммоль) и перемешивали в течение 15 минут. К этой смеси добавляли NaIO4 (23 г, 108 ммоль), и реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 часов. После завершения реакции реакционную смесь разбавляли водой (300 мл) и экстрагировали этилацетатом (2×800 мл). Органический слой сушили над сульфатом натрия, фильтровали и упаривали, получая неочищенный продукт. Неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 12% этилацетат в гексане в качестве элюента, с получением 4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида в виде не совсем белого твердого вещества (выход: 18 г, 60%).
LCMS (ES) m/z=335,38 [М+Н]+; 1Н ЯМР (400 МГц, CDCl3): δ 2,29 (с, 3Н), 4,13 (с, 3Н), 5,58 (с, 2Н), 7,24-7,31 (м, 3Н), 7,35-7,45 (м, 5Н), 8,81 (с, 1Н), 10,18 (с, 1Н).
Стадия 6: Синтез (S)-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты
[000147] К раствору 4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида (30 г, 89 ммоль) в EtOH (45 мл) и DMF (45 мл) одновременно добавляли (S)-пиперидин-2-карбоновую кислоту (11,58 г, 89 ммоль) и уксусную кислоту (0,3 мл), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. К этой реакционной смеси добавляли NaCNBH3 (16,91 г, 269 ммоль), и продолжали перемешивание при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли водой (100 мл) и экстрагировали 10% МеОН в DCM (2×150 мл). Объединенный органический слой промывали водой (40 мл) и солевым раствором (40 мл), сушили над сульфатом натрия и концентрировали, получая неочищенный продукт (16 г), который очищали с помощью хроматографии на Combiflash, используя 8% метанол в дихлорметане в качестве элюента, с получением (S)-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты в виде твердого вещества светло-желтого цвета (выход: 10,5 г, 26,1%).
LCMS (ES) m/z=448,24 [М+Н]+ и чистота при 214 нм: 99,36%; 1H ЯМР (400 МГц, DMSO-d6): 5 1,35 (м, 1Н), 1,46 (м, 3Н), 1,70 (м, 2Н), 2,20 (м, 4Н), 2,89 (м, 1Н), 3,07 (ш, 1Н), 3,55 (д, 1Н), 3,66 (д, 1Н), 3,90 (с, 3Н), 5,43 (с, 2Н), 7,21 (м, 1Н), 7,26-7,30 (м, 3Н), 7,37 (м, 1Н), 7,44-7,48 (м, 3Н), 8,25 (с, 1Н).
Синтез (S)-1-((4-((3-циано-4-фторбензил)окси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты (Соединение 8)
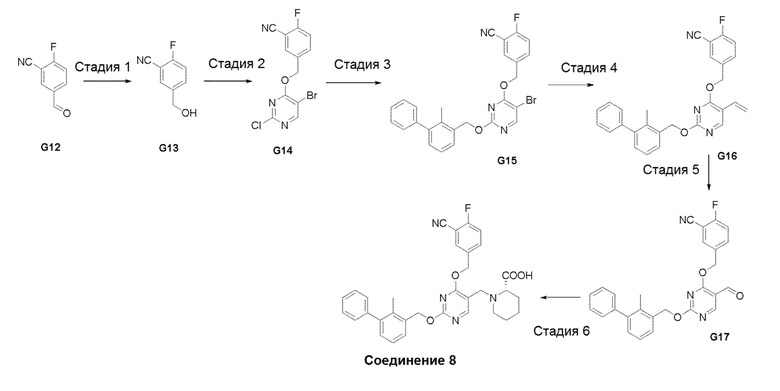
Стадия 1: Синтез 2-фтор-5-(гидроксиметил)бензонитрила (2)
[000148] К перемешиваемому раствору 2-фтор-5-формилбензонитрила (10 г, 67 ммоль) в этаноле (100 мл) при 0°С добавляли боргидрид натрия (3,0 г, 8 0 ммоль) и продолжали перемешивание при 0°С в течение 2 часов. После того как TLC показала завершение реакции, реакционную смесь гасили ледяной водой (50 мл) и экстрагировали DCM (2×50 мл). Органический слой сушили над сульфатом натрия и концентрировали, с получением 2-фтор-5-(гидроксиметил)бензонитрила в виде белого твердого вещества (выход: 10 г, 100%).
1H ЯМР (400 МГц, CDCl3): δ 2, 33 (с, 1Н), 4,69 (с, 2Н), 7,21 (с, 1Н), 7,57-7,63 (м, 2Н).
Стадия 2: Синтез 5-(((5-бром-2-хлорпиримидин-4-ил)окси)метил)-2-фторбензонитрила
[000149] К перемешиваемому раствору 2-фтор-5-(гидроксиметил) бензонитрила (5,0 г, 34 ммоль) в THF (200 мл) при 0°С добавляли гидрид натрия (1,36 г, 60% в минеральном масле, 34 ммоль), и смесь перемешивали при 0°С в течение 1 часа. К этой смеси добавляли 5-бром-2,4-дихлорпиримидин (7,5 г, 34 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 5 часов. После завершения реакции реакционную смесь гасили ледяной водой (100 мл) и экстрагировали 10% IPA в хлороформе (4×100 мл). Объединенный органический слой сушили над сульфатом натрия и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 10 0-200 меш), используя 20% EtOAc в гексане, с получением 5-(((5-бром-2-хлорпиримидин-4-ил)окси)метил)-2-фторбензонитрила в виде белого твердого вещества (выход: 4,9 г, 65%).
LCMS (ES) m/z=342,19 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 5,51 (с, 2Н), 7,59 (м, 1Н), 7,91 (м, 1Н), 8,06 (м, 1Н), 8,78 (шир. с, 1Н).
Стадия 3: Синтез 5-(((5-бром-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-4-ил)окси)метил)-2-фторбензонитрила
[000150] К перемешиваемому раствору (2-метил-[1,1'-бифенил]-3-ил) метанола (2,7 г, 14 ммоль) в DMF (100 мл) при 0°С добавляли гидрид натрия (0,67 г, 60% в минеральном масле, 17 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. К этой смеси добавляли 5-(((5-бром-2-хлорпиримидин-4-ил)окси)метил)-2-фторбензонитрил (5,5 г, 16 ммоль), и оставляли перемешиваться при комнатной температуре в течение 16 часов. После завершения реакции реакционную смесь разбавляли водой (100 мл) и экстрагировали этилацетатом (2×200 мл). Объединенный органический слой сушили над сульфатом натрия, фильтровали и упаривали, получая неочищенный продукт. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 100-200 меш) с использованием 15% этилацетата в гексане в качестве элюента, с получением 5-(((5-бром-2-((2-метил-[1,1'-)бифенил]-3-ил)метокси)пиримидин-4-ил)окси)метил)-2-фторбензонитрила в виде твердого вещества белого цвета (выход: 2,8 г, 41%).
LCMS (ES) m/z=504,32 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 2,21 (с, 3Н), 5,38 (с, 2Н), 5,53 (с, 2Н), 7,21-7,23 (м, 1Н), 7,31-7,34 (м, 3Н), 7, 36-7, 39 (м, 1Н), 7,41-7,45 (м, 3Н), 7,56 (м, 1Н), 7,89 (м, 1Н), 8,05 (м, 1Н), 8,58 (с, 1Н). Чистота по HPLC при 214 нм: 88,94%.
Стадия 4: Синтез 2-фтор-5-(((2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидин-4-ил)окси)метил)бензонитрила
[000151] К перемешиваемому раствору 5-(((5-бром-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-4-ил)окси)метил)-2-фторбензонитрила (2,8 г, 5. 5 м, моль) в DMF (30 мл) добавили трибутилвинилолово (4,4 г, 13 ммоль), и реакционную смесь дегазировали газообразным азотом в течение 10 минут. К этой смеси добавляли Pd(PPh3)4 (0,6 г, 0,5 ммоль), и реакционную смесь нагревали при 100°С в течение 3 часов. После завершения реакции реакционную смесь фильтровали через целит, фильтрат разбавляли водой (50 мл) и экстрагировали этилацетатом (2 × 100 мл). Объединенный органический слой сушили над сульфатом натрия, упаривали, и неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 25% этилацетат в гексане в качестве элюента, с получением 2-фтор-5-(((2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидин-4-ил)окси)метил)бензонитрила в виде не совсем белого твердого вещества (выход: 1,6 г, 66,6%).
LCMS (ES) m/z=452,42 [М+Н]+; 1Н ЯМР (400 МГц, CDCl3): δ 2,26 (с, 3Н), 5,30 (д, J=11,6 Гц, 1Н), 5,42 (с, 2Н), 5,52 (с, 2Н), 5,80 (д, J=16,8 Гц, 1Н), 6,68 (м, 1Н), 7,21-7,23 (м, 1Н), 7,31-7,34 (м, 3Н), 7,36-7,39 (м, 1Н), 7,41-7,45 (м, 4Н), 7,72 (м, 1Н), 7,78 (м, 1Н), 8,32 (с, 1Н); чистота по HPLC при 214 нм: 94,70%.
Стадия 5: Синтез 2-фтор-5-(((5-формил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-4-ил)окси)метила)бензонитрила
[000152] К перемешиваемому раствору 2-фтор-5-(((2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидин-4-ил)окси)метил)бензонитрила (1,6 г, 3 ммоль) в ацетоне (80 мл) и воде (16 мл) при 0°С добавляли OsO4 (3 мл, 2,5 мас. % раствор в трет-бутаноле, 0,3 ммоль) и N-метилморфолин N-оксид (1,0 г, 8,7 ммоль) и перемешивали в течение 15 минут. К этой смеси добавляли NaIO4 (2,1 г, 10 ммоль) и реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 часов. После завершения реакции реакционную смесь разбавляли водой (100 мл) и экстрагировали DCM (2 × 100 мл). Органический слой сушили над сульфатом натрия, фильтровали и упаривали, получая неочищенный продукт. Неочищенный продукт очищали с помощью хроматографии на Combiflash, с использованием 30% этилацетата в гексане в качестве элюента, с получением 2-фтор-5-(((5-формил-2-((2-метил-[1,1'-бифенил]-3)ил)метокси)пиримидин-4-ил)окси)метил)бензонитрила в виде темного твердого вещества (выход: 0,2 г, 15,3%).
LCMS (ES) m/z=454,37 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ 2,23 (с, 3Н), 5,55 (с, 2Н), 5,62 (с, 2Н), 7,22-7,32 (м, 4Н), 7,38 (м, 1Н), 7,46 (м, 2Н), 7,52 (м, 1Н), 7,59 (м, 1Н), 7,93 (м, 1Н), 8,08 (м, 1Н), 8,85 (с, 1Н), 10,07 (с, 1Н).
Стадия 6: Синтез (S)-1-((4-((3-циано-4-фторбензил)окси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты
[000153] К раствору 2-фтор-5-(((5-формил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-4-ил)окси)метил)бензонитрила (1 г, 0,22 ммоль) в МеОН (2 мл) и DMF (2 мл) одновременно добавляли (S)-пиперидин-2-карбоновую кислоту (20 мг, 0,19 ммоль) и уксусную кислоту (1 капля). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. К этой реакционной смеси добавляли NaCNBH3 (30 мг, 0,6 ммоль) и продолжали перемешивание при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли водой (10 мл) и экстрагировали 10% МеОН в DCM (2 × 10 мл). Объединенный органический слой промывали водой (3 мл) и солевым раствором (3 мл), сушили над сульфатом натрия и концентрировали, получая неочищенный продукт, который очищали с помощью препаративной TLC, используя 10% метанол в дихлорметане в качестве элюента, с получением (S)-1-((4-((3-циано-4-фторбензил)окси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты в виде твердого вещества белого цвета (выход: 20 мг, 16,1%).
LCMS (ES) m/z=567,29 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,33 (м, 1Н), 1,39 (м, 3Н), 1,72 (м, 2H), 2,19 (с, 3Н), 2,30 (м, 1Н), 2,87 (м, 1Н), 3,20 (м, 1Н), 3,55 (д, J=14,4 Гц, 1Н), 3,66 (д, J=14,4 Гц, 1Н), 5,40 (с, 2Н), 5,48 (с, 2Н), 7,21 (м, 1Н), 7,26-7,30 (м, 3Н), 7,37 (м, 1Н), 7,43-7,47 (м, 3Н), 7,55 (т, J=9,2 Гц, 1Н), 7,89 (м, 1Н), 8,04 (м, 1Н), 8,26 (с, 1Н); чистота по HPLC при 214 нм: 91,83%.
Синтез (S)-1-((2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-4-(2,2,2-трифторэтокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты (Соединение 9)
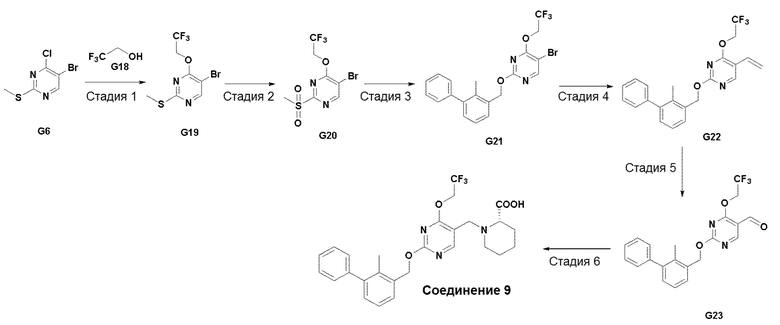
Стадия 1: Синтез 5-бром-2-(метилсульфонил)-4-(2,2,2-трифторэтокси)пиримидина
[000154] К перемешиваемому раствору 5-бром-4-хлор-2-(метилтио)пиримидина (6 г, 25 ммоль) в THF (200 мл) при 0°С добавляли NaH (1,48 г, 60% в минеральном масло, 37 ммоль), и реакционную смесь перемешивали при 0°С в течение 1 часа. К этой смеси добавляли раствор 2,2,2-трифторэтан-1-ола (5,7 г, 25 ммоль) в THF (20 мл), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. После завершения реакции реакционную смесь гасили ледяной водой (250 мл) и экстрагировали этилацетатом (2 × 500 мл). Объединенный органический слой промывали солевым раствором (200 мл), сушили над сульфатом натрия и выпаривали, с получением 5-бром-2-(метилсульфонил)-4-(2,2,2-трифторэтокси)пиримидина в виде белого твердого вещества (выход: 8 г, неочищенный).
LCMS (ES) m/z=303,26; 1Н ЯМР (400 МГц, DMSO-d6): δ 2,50 (с, 3Н), 5,12-5,19 (м, 2Н), 8,69 (с, 1Н).
Стадия 2: Синтез 5-бром-2-(метилсульфонил)-4-(2,2,2-трифторэтокси)пиримидина
[000155] К перемешиваемому раствору 5-бром-2-(метилтио)-4-(2,2,2-трифторэтокси)пиримидина (8 г, 26,4 ммоль) в DCM (150 мл) при 0°С добавляли мета-хлорпербензойную кислоту (11,4 г, 66 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь гасили ледяной водой (100 мл), и экстрагировали DCM (3 × 200 мл). Объединенный органический слой промывали насыщенным раствором бикарбоната натрия (300 мл), солевым раствором (100 мл) и сушили над сульфатом натрия. Органический слой выпаривали, и неочищенный продукт очищали с помощью комбинированной флэш-хроматографии, используя 8% этилацетат в гексане в качестве элюента, с получением 5-бром-2-(метилсульфонил)-4-(2,2,2-трифторэтокси)пиримидина в виде белого твердого вещества (выход: 8,4 г, 95%).
LCMS (ES) m/z=335,23 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 3,34 (с, 3Н), 5,23-5,29 (м, 2Н), 9,16 (с, 1Н).
Стадия 3: Синтез 5-бром-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-4-(2,2,2-трифторэтокси)пиримидина
[000156] К перемешиваемому раствору 5-бром-2-(метилсульфонил)-4-(2,2,2-трифторэтокси)пиримидина (5 г, 25 ммоль) в DMF (70 мл) добавляли (2-метил-[1,1'-бифенил]-3-ил) метанол (8,4 г, 25 ммоль) и карбонат калия (5,1 г, 37,5 моль), и реакционную смесь нагревали при 80°С в течение 12 часов. После завершения реакции реакционную смесь разбавляли водой (150 мл) и экстрагировали этилацетатом (2 × 250 мл). Объединенный органический слой промывали ледяной водой (250 мл), солевым раствором (250 мл) и сушили над сульфатом натрия. Органический слой выпаривали, и неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 10% этилацетат в гексане в качестве элюента, с получением 5-бром-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-4-(2,2,2-трифторэтокси)пиримидина в виде бесцветной вязкой жидкости (выход: 5,6 г, 53%).
LCMS (ES) m/z=453,29 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 2,20 (с, 3Н), 5,10-5,22 (м, 2Н), 5,58 (с, 2Н), 7,19-7,21 (м, 1Н), 7,24-7,27 (м, 3Н), 7,31-7,37 (м, 1Н), 7,39-7,47 (м, 3Н), 8,67 (с, 1Н).
Стадия 4: Синтез 2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-4-(2,2,2-трифторэтокси)-5-винилпиримидина
[000157] К перемешиваемому раствору 5-бром-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-4-(2,2,2-трифторэтокси)пиримидина (5,5 г, 12 ммоль) в DMF (50 мл) добавляли трибутилвинилолово (9,6 г, 30 м моль), и реакционную смесь дегазировали газообразным азотом в течение 10 минут. К этой смеси добавляли Pd(PPh3)4 (1,3 г 1,2 ммоль), и реакционную смесь нагревали при 100°С в течение 8 часов. После завершения реакции реакционную смесь фильтровали через целит, фильтрат разбавляли водой (200 мл) и экстрагировали этилацетатом (2 × 500 мл). Объединенный органический слой сушили над сульфатом натрия, упаривали, и неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 3% этилацетат в гексане в качестве элюента, с получением 2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-4-(2,2,2-трифторэтокси)-5-винилпиримидина в виде желтой маслянистой жидкости (выход: 3,1 г, 64,5%).
LCMS (ES) m/z=401,13 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 2.20 (с, 3Н), 5,10-5,18 (м, 2Н), 5,42 (д, J=12 Гц, 1Н), 5,49 (с, 2Н), 5,99 (д, J=16,6 Гц, 1Н), 6,60-6,71 (м, 1Н), 7,21-7,19 (м, 1Н), 7,26-7,31 (м, 3Н), 7,36-7,39 (м, 1Н), 7,43-7,47 (м, 3Н), 8,51 (с, 1Н).
Стадия 5: синтез 2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-4-(2,2,2-трифторэтокси)пиримидин-5-карбальдегида
[000158] К перемешиваемому раствору 2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-4-(2,2,2-трифторэтокси)-5-винилпиримидина (7, 0,5 г, 1,2 ммоль) в THF (20 мл) и воде (6 мл) при 0°С добавляли OsO4 (1 мл, 2,5 мас. % раствор в трет-бутаноле, 0,12 ммоль), и перемешивали в течение 15 минут. К этой смеси добавляли NaIO4 (0,21 г, 1,87 ммоль), и реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 часов. После завершения реакции реакционную смесь разбавляли водой (100 мл) и экстрагировали этилацетатом (2 × 200 мл). Органический слой сушили над сульфатом натрия, выпаривали, и неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 12% этилацетат в гексане в качестве элюента, с получением 2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-4-(2,2,2-трифторэтокси)пиримидин-5-карбальдегида в виде серого твердого вещества (выход: 0,45 г, 95%).
LCMS (ES) m/z=403,57 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ 2.21 (с, 3Н), 5,19-5,26 (м, 2Н), 5,61 (с, 2Н), 7,22-7, 7,23 (м, 1Н), 7,27-7,32 (м, 3Н), 7,38-7,40 (м, 1Н), 7,44-7,47 (м, 3Н), 8,92 (с, 1Н), 10,05 (с, 1Н).
Стадия 6: (S)-1-((2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-4-(2,2,2-трифторэтокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты
[000159] К раствору 2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-4-(2,2,2-трифторэтокси)пиримидин-5-карбальдегида (0,2 г, 0,51 ммоль) в МеОН (3 мл) и DMF (3 мл) одновременно добавляли (S)-пиперидин-2-карбоновую кислоту (0,1 г, 0,77 ммоль) и уксусную кислоту (0,1 мл), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. К этой реакционной смеси добавляли NaCNBH3 (97 мг, 15 ммоль), и продолжали перемешивание при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли водой (10 мл) и экстрагировали 10% МеОН в DCM (2 × 20 мл). Объединенный органический слой промывали водой (5 мл) и солевым раствором (5 мл), сушили над сульфатом натрия и концентрировали, с получением неочищенного остатка, который очищали с помощью хроматографии на Combiflash, используя 8% метанол в дихлорметане в качестве элюента, с получением (S)-1-((2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-4-(2,2,2-трифторэтокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты в виде белого твердого вещества (выход: 50 мг, 18,7%).
LCMS (ES) m/z=516,35 [М+Н]+ и чистота при 214 нм: 99,86%; 1H ЯМР (400 МГц, DMSO-d6): δ 1,40-1,44 (м, 4Н), 1,74 (м, 2Н), 2,20 (с, 3Н), 2,32 (м, 1Н), 2,88 (м, 1Н), 3,21 (м, 1Н), 3,55 (д, J=14,4 Гц, 1Н), 3,68 (д, J=14,4 Гц, 1Н), 5,01-5,10 (м, 2Н), 5,46 (с, 2Н), 7,19-7,21 (м, 1Н), 7,26-7,30 (м, 3Н), 7,37 (м, 1Н), 7,44-7,48 (м, 3Н), 8,37 (с, 1Н).
Синтез (S)-1-((4-(4-гидроксибутокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидина-2-карбоновая кислота (Соединение 10)
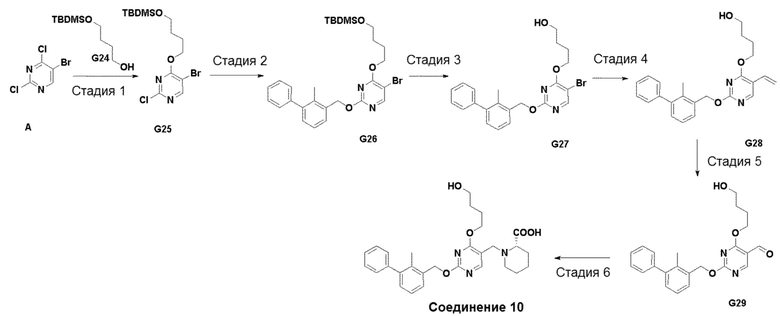
Стадия 1: Синтез 5-бром-4-(4-((трет-бутилдиметилсилил)окси)бутокси)-2-хлорпиримидина
[000160] К раствору 4-((трет-бутилдиметилсилил)окси)бутан-1-ола (8,52 г, 41,73 ммоль) в THF (100 мл) при 0°С добавляли гидрид натрия (2,5 г, 60% в минеральном масле, 62,7 ммоль) и реакционную смесь перемешивали в течение 10 минут. К этой смеси добавляли 5-бром-2,4-дихлорпиримидин (9,5 г, 41,73 ммоль) и смесь перемешивали при комнатной температуре в течение 3 часов. После завершения реакции реакционную смесь гасили ледяной водой (100 мл) и смесь экстрагировали EtOAc (3 × 100 мл). Объединенный органический слой сушили над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали флэш-хроматографией с использованием 20% EtOAc в гексане в качестве элюента, с получением 5-бром-4-(4-((трет-бутилдиметилсилил)окси)бутокси)-2-хлорпиримидина в виде липкого твердого вещества (выход: 16 г, 97%).
Стадия 2: Синтез 5-бром-4-(4-((трет-бутилдиметилсилил)окси)бутокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидина
[000161] К перемешиваемому раствору (2-метил-[1,1'-бифенил]-3-ил) метанола (8,01 г, 40. 4 ммоль) в THF (100 мл) при 0°С добавляли гидрид натрия (2,42 г, 60% в минеральном масле, 60,6 ммоль), и перемешивали при комнатной температуре в течение 30 минут. К этой смеси добавляли 5-бром-4-(4-((трет-бутилдиметилсилил)окси)бутокси)-2-хлорпиримидин (16 г, 40,4 ммоль), и перемешивали при комнатной температуре в течение 3 часов. После завершения реакции реакционную смесь разбавляли водой (100 мл) и экстрагировали этилацетатом (2 × 200 мл). Объединенный органический слой сушили над сульфатом натрия, фильтровали и упаривали, получая неочищенный продукт. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 100-200 меш), используя 20% этилацетат в гексане в качестве элюента, с получением 5-бром-4-(4-((трет-бутилдиметилсилил)окси)бутокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидина в виде желтой вязкой жидкости (выход: 11,04 г, 49%).
LCMS (ES) m/z=557,40 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 0,016 (с, 6Н), 0,83 (с, 9Н), 1,60 (м, 2Н), 1,72 (м, 2Н), 2,20 (с, 3Н), 3,62 (м, 2Н), 4,44 (м, 2Н), 5,47 (с, 2Н), 7,21-7,23 (м, 1Н), 7,25-7,31 (м, 3Н), 7,37-7,49 (м, 4Н), 8,47 (с, 1Н).
Стадия 3: Синтез 4-((5-бром-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-4-ил)окси)бутан-1-ола
[000162] К раствору 5-бром-4-(4-((трет-бутилдиметилсилил) окси)бутокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидина (5,5 г, 9,86 ммоль) в THF (50 мл) при 0°С добавляли TBAF (1М раствор в THF, 1 экв.) и смесь перемешивали при комнатной температуре в течение 3 часов. После завершения реакции реакционную смесь разбавляли водой (50 мл) и экстрагировали EtOAc (3 × 100 мл). Объединенный органический слой сушили над сульфатом натрия, фильтровали и упаривали, получая неочищенный продукт. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 100-200 меш) с использованием 20% этилацетата в гексане в качестве элюента, с получением 4-((5-бром-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-4-ил)окси)бутан-1-ола в виде желтой вязкой жидкости (выход: 2,03 г, 46%).
LCMS (ES) m/z=443,37 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,65 (м, 2Н), 1,76 (м, 2Н), 2,19 (с, 3Н), 3,44 (м, 2Н), 4,42 (м, 2Н), 4,46 (м, 1H), 5,43 (с, 2Н), 7,21-7,23 (м, 1Н), 7,25-7,31 (м, 3Н), 7,39-7,52 (м, 4Н), 8,53 (с, 1Н); чистота по HPLC при 214 нм: 98,91%.
Стадия 4: Синтез 4-((2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидин-4-ил)окси)бутан-1-ола
[000163] К перемешиваемому раствору 4-((5-бром-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-4-ил)окси)бутан-1-ола (1,0 г, 2,26 ммоль) в DMF (15 мл) добавляли трибутилвинилолово (1,79 г, 5,64 ммоль), и реакционную смесь дегазировали газообразным азотом в течение 10 минут. К этой смеси добавляли Pd(PPh3)4 (0,3 г, 0,23 ммоль), и реакционную смесь нагревали при 100°С в течение 3 часов. После завершения реакции реакционную смесь фильтровали через целит, фильтрат разбавляли водой (50 мл) и экстрагировали этилацетатом (2 × 100 мл). Объединенный органический слой сушили над сульфатом натрия, упаривали и неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 25% этилацетат в гексане в качестве элюента, с получением 4-((2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидин-4-ил)окси)бутан-1-ола в виде желтого твердого вещества (выход: 0,7 г, 79%).
LCMS (ES) m/z=391,47 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,56 (м, 2Н), 1,77 (м, 2Н), 2,20 (с, 3Н), 3,43 (м, 2Н), 4,40 (м, 2Н), 4,45 (м, 1H), 5,30 (д, J=12 Гц, 1Н), 5,45 (с, 2Н), 5,90 (д, J=17,6 Гц, 1Н), 6,62 (м, 1Н), 7,19 (м, 1Н), 7,25-7,32 (м, 3Н), 7,36-7,39 (м, 1Н), 7,43-7,47 (м, 3Н), 8,48 (с, 1Н).
Стадия 5: Синтез 4-(4-гидроксибутокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида
[000164] К перемешиваемому раствору 4-((2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидин-4-ил)окси)бутан-1-ола (0,7 г, 1,79 ммоль) в THF (10 мл) и воде (10 мл) при 0°С добавляли OsO4 (1,8 мл, 2,5 мас. % раствор в трет-бутаноле, 0,18 ммоль), и перемешивали в течение 15 минут. К этой смеси добавляли NaIO4 (0,57 г, 2,7 ммоль), и реакционную смесь оставляли перемешиваться при комнатной температуре в течение 5 часов. После завершения реакции реакционную смесь разбавляли водой (30 мл) и экстрагировали DCM (2 × 50 мл). Органический слой сушили над сульфатом натрия, фильтровали и упаривали, получая неочищенный продукт. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 100-200 меш), используя 40% этилацетат в гексане в качестве элюента, с получением 4-(4-гидроксибутокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида в виде липкого маслянистого соединения (выход: 0,5 г, 62%).
LCMS (ES) m/z=393,38 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,56 (м, 2Н), 1,77 (м, 2H), 2,22 (с, 3Н), 3,44 (м, 2H), 4,42 (м, 1H), 4,51 (м, 2H), 5,56 (с, 2H), 7,21 (м, 1H), 7,27-7,33 (м, 3Н), 7,36 (м, 1Н), 7,39-7,46 (м, 3Н), 8,79 (с, 1Н), 10,06 (с, 1Н); чистота по HPLC при 214 нм: 99,52%.
Стадия 6: Синтез (S)-1-((4-(4-гидроксибутокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты
[000165] К раствору 4-(4-гидроксибутокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида (0,24 г, 0,61 ммоль) в МеОН (2 мл) и DMF (2 мл) одновременно добавляли (S)-пиперидин-2-карбоновую кислоту (79 мг, 0,61 ммоль) и уксусную кислоту (1 капля), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. К этой реакционной смеси добавляли NaCNBH3 (115 мг, 1,83 ммоль) и продолжали перемешивание при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли насыщенным раствором бикарбоната натрия (10 мл), и экстрагировали DCM (2 × 25 мл). Объединенный органический слой промывали водой (5 мл) и солевым раствором (5 мл), сушили над сульфатом натрия и концентрировали, получая неочищенный продукт, который очищали флэш-хроматографией, используя 10% метанол в дихлорметане в качестве элюента, с получением (S)-1-((4-(4-гидроксибутокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты в виде белого твердого вещества (выход: 250 мг, 80,8%).
LCMS (ES) m/z=506,43 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,33-1,54 (м, 7Н), 1,74 (м, 4Н), 2,20 (с, 3Н), 2,30 (м, 1Н), 2,91 (м, 1Н), 3,17 (м, 1Н), 3,43 (м, 2Н), 3,55 (д, J=14 Гц, 1Н), 3,66 (д, J=14 Гц, 1Н), 4,33 (м, 2Н), 5,42 (с, 2Н), 7,18 (м, 1Н), 7,25-7,32 (м, 3Н), 7,37 (м, 1Н), 7,43-7,47 (м, 3Н), 8,23 (с, 1Н); чистота по HPLC при 214 нм: 97,43%.
Синтез (2S,4R)-1-((2-((3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновой кислоты (Соединение 11)
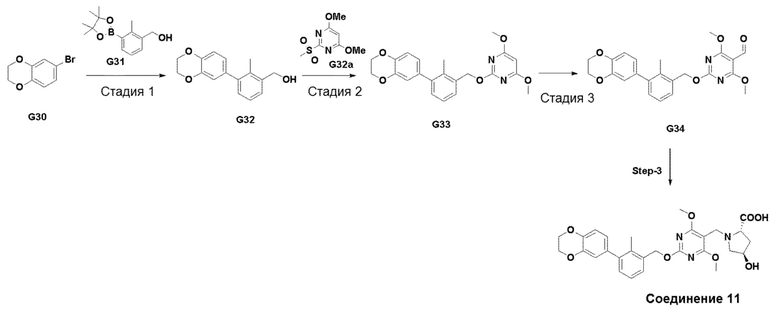
Стадия 1: Синтез (3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилфенил)метанола
[000166] К раствору 6-бром-2,3-дигидробензо[b][1,4]диоксина (б г, 0,027 моль) и (2-метил-3-(4,4,5,5-тетраметил)-1,3,2-диоксаборолан-2-ил)фенил)метанола (8,3 г, 33 ммоль) в смеси толуол : этанол : вода (1:1:1) (120 мл) при комнатной температуре добавляли карбонат калия (11,5 г, 83 ммоль), и дегазировали смесь при комнатной температуре в течение 15 минут с использованием азота. К этой смеси добавляли комплекс Pd(dppf)Cl2⋅DCM (1,4 г, 1,3 ммоль), и реакционную смесь дегазировали снова в течение 10 минут с использованием азота. После перемешивания реакционной смеси при 95°С в течение 12 часов смесь охлаждали до комнатной температуры, и фильтровали через слой целита. Фильтрат разбавляли водой (100 мл) и водную смесь экстрагировали EtOAc (2 × 500 мл). Органический слой промывали солевым раствором (500 мл), сушили над сульфатом натрия и концентрировали, получая неочищенное соединение. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 100-200 меш), с использованием гексана в качестве элюента, с получением (3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилфенил)метанола в виде светло-красной жидкости (выход: 7 г, 97,9%).
1H ЯМР (400 МГц, DMSO-d6): δ 2,12 (с, 3Н), 4,27 (м, 4Н), 4,52 (м, 2Н), 5,75 (с, 1Н), 6,90 (м, 2Н), 7,05 (м 1Н), 7,16 (м, 1Н), 7,20 (м, 1H), 7,36 (м, 1Н).
Стадия 2: Синтез 2-((3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидина
[000167] К перемешиваемому раствору (3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилфенил)метанола (8,2 г, 32 ммоль) в DMF (40 мл) добавляли 4,6-диметокси-2-(метилсульфонил)пиримидин (7 г, 32 ммоль) и карбонат калия (13,2 г, 96 ммоль), и реакционную смесь нагревали при 80°С в течение 12 часов. После завершения реакции реакционную смесь разбавляли водой (150 мл) и экстрагировали этилацетатом (2 × 250 мл). Объединенный органический слой промывали ледяной водой (250 мл), солевым раствором (250 мл), сушили над сульфатом натрия, выпаривали, и неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 10% этилацетат в гексане в качестве элюента, с получением 2-((3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидина в виде бесцветной вязкой жидкости (выход: 9 г, 71,4%).
Стадия 3: Синтез 2-((3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидин-5-карбальдегида
[000168] Раствор фосфорилхлорида (8 мл) в DMF (8 мл) при 0°С в атмосфере азота перемешивали в течение 1 часа, и его добавляли по каплям к раствору 2-((3-(2,3-дигидробензо)[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидина (3 г, 7,6 ммоль) в DCE (30 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут, а затем нагревали при 80°С в течение 3 часов. После завершения реакции реакционную смесь концентрировали в вакууме, и разбавляли DCM (100 мл). Органическую смесь промывали водой (25 мл), солевым раствором (25 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением неочищенного продукта, который очищали с помощью хроматографии на силикагеле (10% EtOAc в гексане), с получением 2-((3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидин-5-карбальдегида в виде твердого вещества светло-желтого цвета (выход: 1,5 г, 46,8%).
LCMS (ES) m/z=423,36 [М+Н]+ и чистота при 214 нм: 98,13%,; 1Н ЯМР (400 МГц, DMSO-d6): δ 2,24 (с, 3Н), 4,00 (с, 6Н), 4,28 (с, 4Н), 5,54 (с, 2Н), 6,73-6,77 (м, 2Н), 6,92 (д, J=8,0 Гц, 1Н), 7,17-7,19 (м, 1Н), 7,22-7,26 (м, 1Н), 7,44 (д, J=7,6 Гц, 1Н), 10,07 (с, 1Н).
Стадия 4: Получение (2S,4R)-1-((2-((3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновой кислоты
[000169] К раствору 2-((3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидин-5-карбальдегида (0,5 г, 1,1 ммоль) в DMF (8 мл) одновременно добавляли (2S,4R)-4-гидроксипирролидин-2-карбоновую кислоту (0,15 г, 1,1 ммоль), NaCNBH3 (0,2 г, 3,3 ммоль) и уксусную кислоту (0,1 мл). Реакционную смесь нагревали при 70°С в течение 4 часов. Реакционную смесь разбавляли водой (100 мл) и экстрагировали 10% МеОН в DCM (2 × 150 мл). Объединенный органический слой промывали водой (40 мл) и солевым раствором (40 мл), сушили над сульфатом натрия и концентрировали, с получением неочищенного остатка, который очищали с помощью хроматографии на Combiflash, с использованием 8% метанола в дихлорметане в качестве элюента, с получением (2S,4R)-1-((2-((3-(2,3-дигидро[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновой кислоты в виде белого твердого вещества (выход: 0,29 г, 49%).
LCMS (ES) m/z=538,34 [М+Н]+ и чистота при 214 нм: 98,13%,; 1H ЯМР (400 МГц, DMSO-d6): δ 1,91 (м, 2Н), 2,23 (с, 3Н), 3,25-3,41 (м, 3Н), 3,78-3,86 (м, 2Н), 3,90 (с, 6Н), 4,16 (м, 1Н), 4,27 (с, 4Н), 4,98 (шир.с, 1Н), 5,44 (с, 2Н), 6,73-6,77 (м, 2Н), 6,92 (д, J=8,12 Гц, 1Н), 7,15-7,17 (м, 1Н), 7,22-7,26 (м, 1Н), 7,44 (д, J=7,16 Гц, 1Н).
Синтез (S)-1-((4-((5-цианопиридин-3-ил)метокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 12).
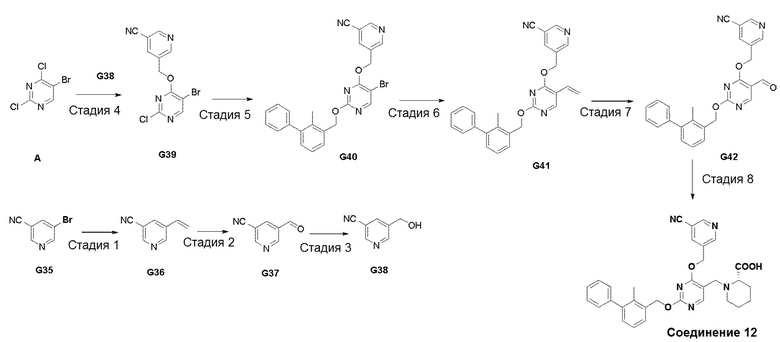
Стадия 1: Синтез 5-винилникотинонитрила
[000170] Перемешиваемый раствор 5-bromonicotinonitrile (2 г, 0,12 моль) и трибутилвинилолова (95,3 г, 300 ммоль) в DMF (200 мл) при комнатной температуре продували азотом в течение 10 минут. К этой смеси добавляли Pd(PPh3)4 (13,84 г, 12 ммоль) и снова продували азотом в течение 20 минут. Затем смесь нагревали при 80°С в течение 4 часов. После завершения реакции реакционную смесь разбавляли водой (200 мл) и экстрагировали EtOAC (3 × 200 мл). Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 100-200 меш), используя 10% EtOAc в гексане в качестве элюента, с получением 5-винилникотинонитрила в виде не совсем белого твердого вещества (выход: 10,5 г, 67%).
1H ЯМР (400 МГц, DMSO-d6): δ 5,55 (д, J=10,8 Гц, 1Н), 6,17 (д, J=17,6 Гц, 1Н), 6,80 (м, 1Н), 8,52 (с, 1Н), 8,90 (с, 1Н), 9,03 (с, 1Н).
Стадия 2: Синтез 5-формилникотинонитрила
[000171] К перемешиваемому раствору 5-винилникотинонитрила (10,5 г, 81 ммоль) в ацетоне (200 мл) и воды (40 мл) при 0°С добавляли O3O4 (82 мл, 2,5 мас. % раствора в трет-бутаноле, 8,1 ммоль) и N-оксид N-метилморфолина (29 г, 242 ммоль), и перемешивали в течение 3 часов. К этой смеси добавляли NaIO4 (60 г, 282 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 12 часов. После завершения реакции реакционную смесь разбавляли водой (300 мл) и экстрагировали DCM (2 × 400 мл). Органический слой сушили над сульфатом натрия, фильтровали и упаривали, получая неочищенный продукт. Неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 30% этилацетат в гексане в качестве элюента, получая 5-формилникотинонитрил в виде твердого вещества желтого цвета (выход: 7,9 г, 74%).
1H ЯМР (400 МГц, DMSO-d6): δ 8,77 (с, 1Н), 9,29 (с, 1Н), 9, 31 (с, 1Н), 10,12 (с, 1Н).
Стадия 3: Синтез 5-(гидроксиметил)никотинонитрила
[000172] К перемешиваемому раствору 5-формилникотинонитрила (12 г, 91 ммоль) в метаноле (100 мл) при 0°С в течение 30 минут добавляли порциями боргидрид натрия (5,12 г, 136 ммоль), и смесь перемешивали при 0°С в течение 2 часов. После завершения реакции с контролем TLC, реакционную смесь концентрировали, и остаток разбавляли водой (100 мл) и DCM (200 мл). Органический слой сушили над сульфатом натрия и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 100-200 меш), с использованием 1% МеОН в DCM в качестве элюента, с получением 5-(гидроксиметил)никотинонитрила в виде твердого вещества желтого цвета (выход: 7,4 г, 60,7%).
1Н ЯМР (400 МГц, DMSO-d6): δ 4,50 (шир.с, 1Н), 5,54 (с, 2Н), 8,19 (с, 1Н), 8,80 (с, 1Н), 8,91 (с, 1Н).
Стадия 4: Синтез 5-(((5-бром-2-хлорпиримидин-4-ил)окси)метил)никотинонитрила
[000173] К перемешиваемому раствору 5-(гидроксиметил)никотинонитрила (0,59 г, 4,3 ммоль) в THF (20 мл) при 0°С добавляли гидрид натрия (0,26 г, 60% в минеральном масле, 6,5 ммоль), и смесь перемешивали при 0°С в течение 30 минут. К этой смеси добавляли раствор 5-бром-2,4-дихлорпиримидина (1,0 г, 4,3 ммоль) в THF (5 мл), и реакционную смесь перемешивали при комнатной температуре в течение 5 часов. После завершения реакции ее гасили ледяной водой (100 мл) и экстрагировали 10% IPA в хлороформе (4 × 100 мл). Объединенный органический слой сушили над сульфатом натрия и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 100-200 меш), используя 5% МеОН в DCM в качестве элюента, с получением 5-(((5-бром-2-хлорпиримидин-4-ил)окси)метил)никотинонитрила в виде желтого твердого вещества (выход: 1,0 г, 70%).
1Н ЯМР (400 МГц, DMSO-d6): δ 5,59 (с, 2Н), 8,43 (с, 1Н), 8,80 (с, 1Н), 9,00 (с, 1Н), 9,05 (с, 1Н); чистота по HPLC при 214 нм: 97,07%.
Стадия 5: Синтез 5-(((5-бром-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-4-ил)окси)метил)никотинонитрила
[000174] К перемешиваемому раствору (2-метил-[1,1'-бифенил]-3-ил)метанола (0,61 г, 3,1 ммоль) в DMF (20 мл) при 0°С добавляли гидрид натрия (0,184 г, 60% в минеральном масле, 4,6 ммоль), и перемешивали при комнатной температуре в течение 30 минут. К этой смеси добавляли 5-(((5-бром-2-хлорпиримидин-4-ил)окси)метил)никотинонитрил (1 г, 3,1 ммоль), и оставляли перемешиваться при комнатной температуре в течение 3 часов. После завершения реакции реакционную смесь разбавляли насыщенным раствором хлорида аммония (20 мл), и затем разбавляли водой (50 мл). Водную смесь экстрагировали этилацетатом (2 × 100 мл) и объединенный органический слой сушили над сульфатом натрия, фильтровали и упаривали, получая неочищенный продукт. Неочищенный продукт очищали с помощью флэш-хроматографии (силикагель), используя 50% этилацетат в гексане в качестве элюента, с получением 5-(((5-бром-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-4-ил)окси)метил)никотинонитрила в виде липкого твердого вещества (выход: 0,7 г, 47%).
LCMS (ES) m/z=487,21 [М+Н]+;] 1Н ЯМР (400 МГц, DMSO-d6): δ 2,20 (с, 3Н), 5,50 (с, 2Н), 5,53 (с, 2Н), 7,21-7,23 (м, 1Н), 7,27-7,31 (м, 3Н), 7,36-7,38 (м, 1Н), 7,44-7,47 (м, 3Н), 8,43 (м, 1Н), 8,59 (с, 1Н), 8,98 (с, 1Н), 9,01 (с, 1Н); чистота по HPLC при 254 нм: 97,78%.
Стадия 4: Синтез 5-(((2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидин-4-ил)окси)метил)никотинонитрила
[000175] К перемешиваемому раствору 5-(((5-бром-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-4-ил)окси)метил)никотинонитрила (0,3 г, 0,62 ммоль) в DMF (10 мл) добавляли трибутилвинилолово (0,57 г, 1,86 ммоль), и реакционную смесь дегазировали газообразным азотом в течение 10 минут. К этой смеси добавляли Pd(PPh3)4 (72 мг, 0,061 ммоль), и реакционную смесь нагревали при 80°С в течение 3 часов. После завершения реакции реакционную смесь разбавляли водой (20 мл) и экстрагировали этилацетатом (2 × 50 мл). Объединенный органический слой сушили над сульфатом натрия, упаривали, и неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 30% этилацетат в гексане в качестве элюента, с получением 5-(((2-((2-метил-[1,1'-]бифенил]-3-ил)метокси)-5-винилпиримидин-4-ил)окси)метил)никотинонитрила в виде липкого масла (выход: 0,225 г, 75%).
LCMS (ES) m/z=435,44 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 2,20 (с, 3Н), 5,32 (д, J=11,2 Гц, 1Н), 5,52 (с, 4Н), 5,89 (д, J=17,6 Гц, 1Н), 6,67 (м, 1Н), 7,21-7,23 (м, 1Н), 7,27-7,31 (м, 3Н), 7,36-7,38 (м, 1Н), 7,42-7,45 (м, 3Н), 8,43 (м, 1Н), 8,55 (с, 1Н), 8,98 (с, 1Н), 9,01 (с, 1Н); чистота по HPLC при 254 нм: 92, 44%.
Стадия 5: Синтез 5-(((5-формил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-4-ил)окси)метил)никотинонитрила
[000176] К перемешиваемому раствору 5-(((2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидин-4-ил)окси)метил)никотинонитрила (220 мг, 0,43 ммоль) в ацетоне (8 мл) и воде (2 мл) при 0°С добавляли OsO4 (0, 44 мл, 2,5 мас. % раствор в трет-бутаноле, 0,043 ммоль) и N-оксид N-метилморфолина (152 мг, 1,35 ммоль), и перемешивали в течение 2 часов. К этой смеси добавляли NaIO4 (324 мг, 1,513 ммоль) и реакционную смесь оставляли перемешиваться при комнатной температуре в течение 3 часов. После завершения реакции реакционную смесь разбавляли водой (25 мл) и экстрагировали DCM (2 × 25 мл). Органический слой сушили над сульфатом натрия, фильтровали и упаривали, получая неочищенный продукт. Неочищенный продукт очищали с помощью хроматографии на Combiflash с использованием 30% этилацетата в гексане в качестве элюента, с получением 5-(((5-формил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси))пиримидин-4-ил)окси)метил)никотинонитрила в виде желтого твердого вещества (выход: 95 мг, 47%).
LCMS (ES) m/z=437,37 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ 2,22 (с, 3Н), 5,61 (с, 4Н), 7,21-7,23 (м, 1Н), 7,27-7,31 (м, 3Н), 7,36-7,38 (м, 1Н), 7,44-7,52 (м, 3Н), 8,47 (м, 1Н), 8,85 (с, 1Н), 9,01 (с, 1Н), 9,03 (с, 1Н), 10,07 (с, 1Н).
Стадия 6: Синтез (S)-1-((4-((5-цианопиридин-3-ил)метокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты
[000177] К раствору 5-(((5-формил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-4-ил)окси)метил)никотинонитрила (150 мг, 0,34 ммоль) в МеОН (2 мл) и DMF (2 мл) одновременно добавляли (S)-пиперидин-2-карбоновую кислоту (32 мг, 0,515 ммоль) и уксусную кислоту (2 капли), и реакционную смесь перемешивали при комнатной температуре в течение 3 часов. К этой реакционной смеси добавляли NaCNBH3 (35 мг, 1,03 ммоль) и продолжали перемешивание при комнатной температуре в течение 5 часов. Реакционную смесь разбавляли водой (10 мл) и экстрагировали DCM (2 × 25 мл). Объединенный органический слой промывали водой (5 мл) и солевым раствором (5 мл), сушили над сульфатом натрия и концентрировали, получая неочищенный продукт, который очищали флэш-хроматографией, используя 10% метанол в дихлорметане в качестве элюента, с получением (S)-1-((4-((5-цианопиридин-3-ил)метокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты в виде белого твердого вещества (выход: 33 мг, 18%).
LCMS (ES) m/z=550,22 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,33 (м, 1H), 1,39 (м, 3Н), 1,72 (м, 2Н), 2,19 (с, 3Н), 2,32 (м, 1Н), 2,89 (м, 1Н), 3,23 (м, 1Н), 3,54 (д, J=14,0 Гц, 1Н), 3,68 (д, J=14,0 Гц, 1Н), 5,48 (с, 4Н), 7,21-7,22 (м, 1Н), 7,24-7,31 (м, 3Н), 7,36-7,38 (м, 1Н), 7,43-7,48 (м, 3Н), 8,28 (с, 1Н), 8,43 (с, 1Н), 8,98 (с, 1Н), 9,00 (с, 1Н); чистота по HPLC при 214 нм: 99,32%.
Синтез (S)-1-((2-((3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты (Соединение 13)
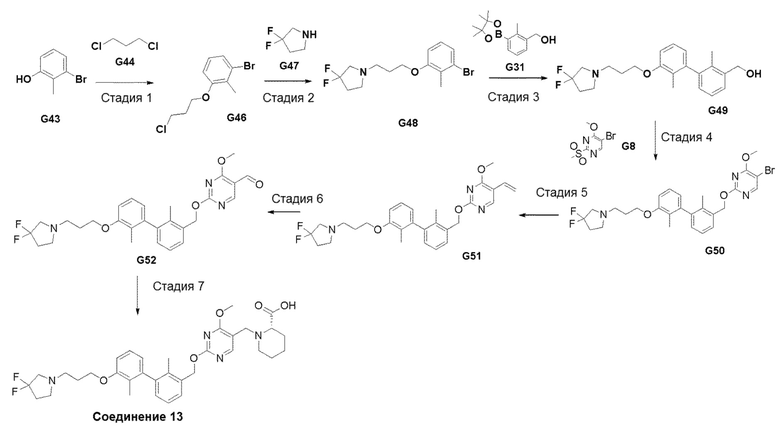
Стадия 1: Получение 1-бром-3-(3-хлорпропокси)-2-метилбензола
[000178] К перемешиваемому раствору 3-бром-2-метилфенола (1, 9,8 г, 52 ммоль) в DMF (80 мл) добавляли 1, 3-дихлорпропан (73 г, 100 ммоль) и карбонат калия (21,5 г, 156 ммоль), и реакционную смесь перемешивали при 80°С в течение 12 часов в атмосфере азота. После того, как TLC показала завершение реакции, смесь охлаждали до комнатной температуры и разбавляли EtOAc (100 мл), промывали ледяной водой (50 мл) и солевым раствором (30 мл). Органическую фазу сушили над сульфатом натрия и концентрировали в вакууме, получая неочищенный продукт. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 100-200 меш), используя 10% EtOAc в гексане в качестве элюента, с получением 1-(3-(3-бром-2-метилфенокси)пропил)-3,3-дифторпирролидина в виде желтой жидкости (выход: 10,1 г, 73,7%).
1Н ЯМР (400 МГц, CDCl3): δ 2,25-2,31 (м, 5Н), 3,77 (м, 2Н), 4,12 (м, 2Н), 6,80 (д, J=8,2 Гц, 1Н), 6,98-7,02 (м, 1Н), 7,17 (д, J=8 Гц, 1Н).
Стадия 2: Получение 1-(3-(3-бром-2-метилфенокси)пропил)-3,3-дифторпирролидина
[000179] К перемешиваемому раствору 1-бром-3-(3-хлорпропокси)-2-метилбензола (10,1 г, 38 ммоль) в DMF (60 мл) добавляли 3,3-дифторпирролидин (11 г, 76 ммоль), карбонат калия (22,5 г, 163 ммоль) и йодид натрия (8,5 г, 57 ммоль), и реакционную смесь нагревали при 80°С в течение 12 часов в атмосфере азота. После того, как TLC показала завершение реакции, реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc (100 мл), промывали ледяной водой (50 мл), солевым раствором (50 мл), органическую фазу сушили над сульфатом натрия и концентрировали в вакууме, получая неочищенный продукт. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 100-200 меш), используя 15% EtOAc в гексане в качестве элюента, с получением 1-(3-(3-бром-2-метилфенокси)пропил)-3,3-дифторпирролидина в виде желтой жидкости (7,1 г, 56,3%).
LCMS (ES) m/z=334,30 [М+Н]+; 1Н ЯМР (400 МГц, CDCl3): δ 1,96 (м, 2Н), 2,22-2,33 (м, 5Н), 2,66 (м, 2Н), 2,75 (м, 2Н), 2,94 (м, 2Н), 4,01 (м, 2Н), 6,78 (д, J=8,0 Гц, 1Н), 6,96-7,00 (м, 1Н), 7, 15 (д, J=8,0 Гц, 1Н).
Стадия 3: Получение (3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метанола
[000180] К раствору 1-(3-(3-бром-2-метилфенокси)пропил)-3,3-дифторпирролидина (2 г, 59 ммоль) и (2-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)метанола (1,78 г, 71 ммоль) в смеси толуол : этанол : вода (1:1:1) (30 мл) при комнатной температуре добавляли карбонат калия (2,47 г, 17 ммоль), и смесь дегазировал в течение 15 минут с использованием азота. К этой смеси добавляли Pd(dppf)Cl2⋅DCM (0,24 г, 0,29 ммоль), и реакционную смесь снова дегазировали в течение 10 минут с использованием азота, и нагревали при 95°С в течение 12 часов. После завершения реакции реакционную смесь охлаждали до комнатной температуры и фильтровали через слой целита. Фильтрат разбавляли водой (50 мл) и смесь экстрагировали EtOAc (2 × 100 мл). Органический слой промывали солевым раствором (20 мл), сушили над сульфатом натрия и концентрировали, получая неочищенное соединение. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 100-200 меш), используя 10% EtOAc в гексане в качестве элюента, с получением (3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метанола в виде не совсем белого твердого вещества (выход: 2 г, 90%).
LCMS (ES) m/z=376,18 [М+Н]+, 1H ЯМР (400 МГц, DMSO-d6): δ 1,77 (с, 3Н), 1,94 (с, 3Н), 2,20-2,32 (м, 4Н), 2,62-2,68 (м, 4Н), 2,92 (м, 2Н), 4,06 (м, 2Н), 4,54 (м, 2Н), 5,09 (м, 1Н), 6,64 (д, J=7,44 Гц, 1Н), 6,94 (д, J=7,84 Гц, 2Н), 7,15-7,22 (м, 2Н), 7,39 (д, J=7,44 Гц, 1Н).
Стадия 4: Получение 5-бром-2-((3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидина
[000181] К перемешиваемому раствору (3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метанола (1,41 г, 3,7 ммоль) в DMF (30 мл) добавляли 5-бром-4-метокси-2-(метилсульфонил)пиримидин (2 г, 7,49 ммоль) и карбонат калия (3,1 г, 22 ммоль), и реакционную смесь нагревали при 80°С в течение 12 часов. После завершения реакции реакционную смесь разбавляли водой (60 мл) и экстрагировали этилацетатом (2 × 120 мл). Объединенный органический слой промывали ледяной водой (50 мл), солевым раствором (50 мл), сушили над сульфатом натрия, упаривали, и неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 10% этилацетат в гексане в качестве элюента, с получением 5-бром-2-((3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидина в виде липкой жидкости (выход: 0,7 г, 17%).
LCMS (ES) m/z=562,32 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,83 (с, 3Н), 1,93 (м, 2Н), 2,03 (с, 3Н), 2,26 (м, 2Н), 2,62 (м, 2Н), 2,71 (м, 2Н), 2,88-2,92 (м, 2Н), 3,98 (с, 3Н), 4,06 (м, 2Н), 5,43 (с, 2Н), 6,65 (м, 1Н), 6,95 (м, 1Н), 7,07 (м, 1Н), 7,19-7,39 (м, 2Н), 7,43 (м, 1Н), 8,53 (с, 1Н).
Стадия 5: Получение 2-((3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метокси)-4-метокси-5-винилпиримидина
[000182] К перемешиваемому раствору 5-бром-2-((3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидина (0,7 г, 1,24 ммоль) в DMF (10 мл) добавляли трибутилвинилолово (1,18 г, 3,7 ммоль), и реакционную смесь дегазировали с газообразным азотом в течение 10 минут. К этой смеси добавляли Pd(PPh3)4 (140 мг, 0,12 ммоль), и реакционную смесь нагревали при 100°С в течение 8 часов. После завершения реакции реакционную смесь фильтровали через целит, фильтрат разбавляли водой (30 мл) и экстрагировали этилацетатом (2 × 50 мл). Объединенный органический слой сушили над сульфатом натрия, упаривали, и неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 3% этилацетат в гексане в качестве элюента, с получением 2-((3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метокси)-4-метокси-5-винилпиримидина в виде липкого твердого вещества (выход: 0,32 г, 47,5%).
LCMS (ES) m/z=510,19 [М+Н]+, чистота при 214 нм: 87,14%.
Стадия 6: Получение 2-((3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-карбальдегида
[000183] К перемешиваемому раствору 2-((3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метокси)-4-метокси-5-винилпиримидина (0,32 г, 0,62 ммоль) в ацетоне (10 мл) и воде (2 мл) при 0°С добавляли OsO4 (0,6 мл, 2,5 мас. % раствор в трет-бутаноле, 0,062 ммоль), N-оксид N-метилморфолина (103 мг, 0,87 ммоль), и перемешивали в течение 2 часов. К этой смеси добавляли NaIO4 (0,22 г, 1 ммоль), и реакционную смесь оставляли перемешиваться при комнатной температуре в течение 3 часов. После завершения реакции реакционную смесь разбавляли водой (30 мл) и экстрагировали этилацетатом (2 × 100 мл). Органический слой сушили над сульфатом натрия, упаривали, и неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 12% этилацетат в гексане в качестве элюента, с получением 2-((3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-карбальдегида в виде белого липкого твердого вещества (выход: 80 мг, 53%).
LCMS (ES) m/z=512,45 [М+Н]+ и чистота при 214 нм: 95,24%; 1H ЯМР (400 МГц, DMSO-d6) δ м.д.: 1,83 (с, 3Н), 1,93 (м, 2Н), 2,00 (с, 3Н), 2,17-2,24 (м, 2Н), 2,59 (м, 2Н), 2,68-2,70 (м, 2Н), 2,89 (м, 2Н), 4,04 (м, 2Н), 4,06 (с, 3Н), 5,57 (с, 2Н), 6,66 (д, J=7,6 Гц, 1Н), 6,95 (д, J=9,2 Гц, 1Н), 7,08 (д, J=7,36 Гц, 1Н), 7,17-7,27 (м, 2Н), 7,44 (д, J=7,2 Гц, 1Н), 8,80 (с, 1Н), 10,04 (с, 1Н).
Стадия 7: Получение (S)-1-((2-((3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты
[000184] К раствору 2-((3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-карбальдегида (70 мг, 0,1368 ммоль) в МеОН (3 мл) и DMF (3 мл) одновременно добавляли (S)-пиперидин-2-карбоновую кислоту (26 мг, 0,2052 ммоль) и уксусную кислоту (0,1 мл), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. К этой реакционной смеси добавляли NaCNBH3 (25 мг, 0,41 ммоль) и продолжали перемешивание при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли водой (10 мл) и экстрагировали 10% МеОН в DCM (2×20 мл). Объединенный органический слой промывали водой (5 мл) и солевым раствором (5 мл), сушили над сульфатом натрия и концентрировали, получая неочищенный остаток, который очищали с помощью хроматографии на Combiflash, используя 8% метанол в дихлорметане в качестве элюента, с получением (S)-1-((2-((3'-(3-(3, 3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты в виде светло-белого твердого вещества (выход: 33 мг, 39%).
LCMS (ES) m/z=625,35 [М+Н]+ и чистота при 214 нм: 95,52%; 1Н ЯМР (400 МГц, DMSO-d6) δ м.д.: 1,35-1,50 (м, 4Н), 1,70-1,73 (м, 2Н), 1,83 (с, 3Н), 1,80-1,93 (м, 2Н), 2,00 (с, 3Н), 2,17-2,32 (м, 3Н), 2,53-2,71 (м, 4Н), 2,92 (м, 3Н), 3,12 (м, 1Н), 3,54-3,66 (м, 2Н), 3,89 (с, 3Н), 4,06 (м, 2Н), 5,43 (с, 2Н), 6,67 (д, J=7,48 Гц, 1H), 6,95 (д, J=8,21 Гц, 1H), 7,05 (д, J=7,36 Гц, 1H), 7,17-7,27 (м, 2H), 7,44 (д, J=7,48 Гц, 1Н), 8,24 (с, 1Н).
[000185] Следующие соединения синтезировали с использованием процедуры, аналогичной процедуре, описанной выше для Соединений 1-13.
N-(2-(((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 14)
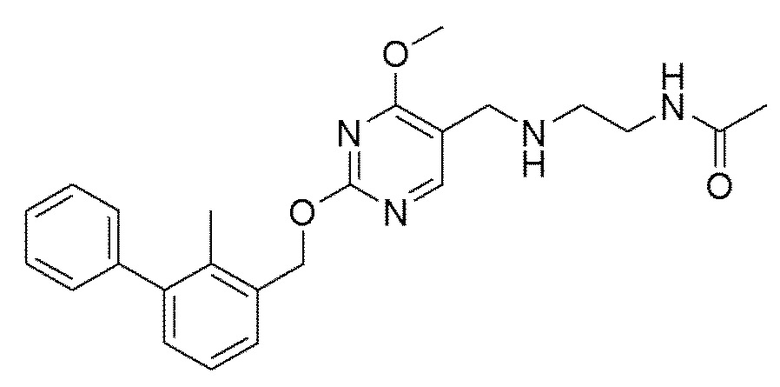
[000186] LCMS (ES) m/z=421,3 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,73 (с, 3Н), 2,19 (с, 3Н), 3,08-3,12 (м, 2Н), 3,55 (с, 3Н), 3,91 (с, 3Н), 5,42 (с, 2Н), 7,17 (д, J=7,6 Гц, 1Н), 7,24 (д, J=7,6 Гц, 1Н), 7,29 (д, J=7,2 Гц, 2Н), 7,36, (д, J=7,2 Гц, 1Н), 7,41-7,45 (м, 3Н), 7,73 (шир.с, 1Н), 8,22 (с, 1Н).
Соединение 15: (R)-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота
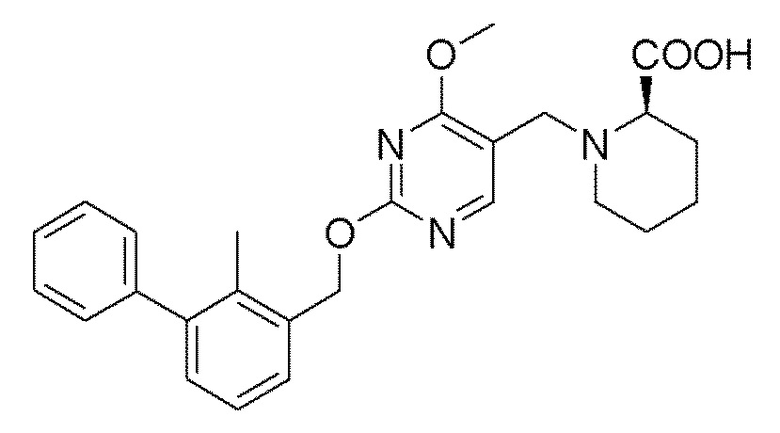
[000187] LCMS (ES) m/z=448,24 [М+Н]+ и чистота при 214 нм: 99,9%; 1H ЯМР (400 МГц, DMSO-d6): δ 1,35 (м, 1Н), 1,46 (м, 3Н), 1,70 (м, 2Н), 2,20 (м, 4Н), 2,89 (м, 1Н), 3,07 (шир.с, 1Н), 3,55 (д, J=14 Гц, 1Н), 3,66 (д, J=14 Гц, 1Н), 3,90 (с, 3Н), 5,43 (с, 2Н), 7,21 (м, 1Н), 7,26-7, 30 (м, 3Н), 7,37 (м, 1Н), 7,44-7,48 (м, 3Н), 8,25 (с, 1Н).
(S)-1-((2-((4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 16)
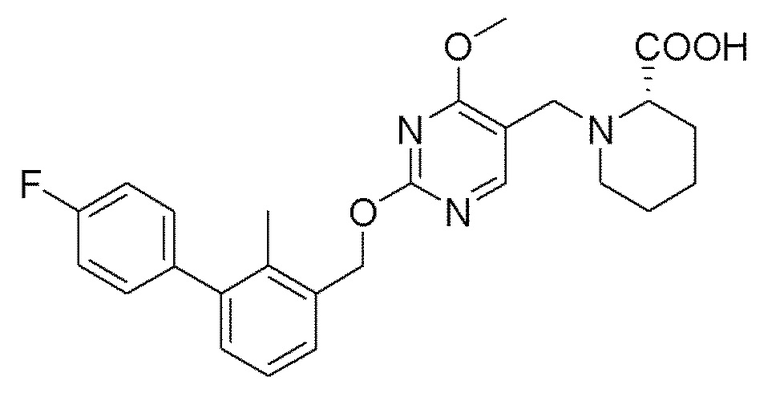
[000188] LCMS (ES) m/z=466,3 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,33 (шир.с, 1H), 1,45 (с, 3H), 1,71 (шир.с, 2H), 2,18 (с, 3Н), 2,20-2,25 (м, 1Н), 2,86-2,89 (м, 1Н), 3,05-3,15 (м, 1Н), 3,51-3,64 (м, 2Н), 3,88 (с, 3Н), 5,41 (с, 2Н), 7,17 (д, J=7,6 Гц, 1Н), 7,23-7,27 (м, 3Н), 7,31-7,35 (м, 2Н), 7,43 (д, J=7,2 Гц, 1Н), 8,23 (с, 1Н).
(S)-1-((2-((3'-фтор-2-метил[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 17)
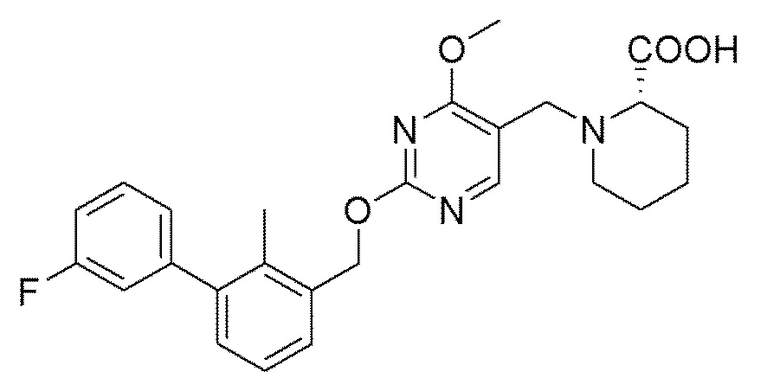
[000189] LCMS (ES) m/z=466,2 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,35 (шир.с, 1Н), 1, 40-1, 50 (м, 3Н), 1,65-1,78 (м, 2Н), 2,20 (с, 3Н), 2,30-2,47 (м, 1Н), 2,86-2,89 (м, 1Н), 3,10 (шир.с, 1Н), 3,52-3, 55 (м, 1Н), 3,61-3,64 (м, 1Н), 3,88 (с, 3Н), 5,42 (с, 2Н), 7,14 (д, J=8 Гц, 2Н), 7,19-7,20 (м, 2Н), 7,27 (т, J=7,2 Гц, 2Н), 7,44-7,50 (м, 2Н), 8,23 (с, 1Н).
N-(2-(((2-((3'-фтор-2-метил[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 18)
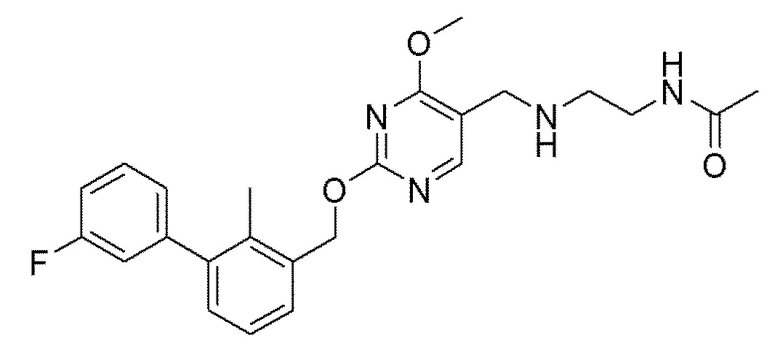
[000190] LCMS (ES) m/z=439,2 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,77 (с, 3Н), 2,19 (с, 3Н), 2,54 (т, J=6,4 Гц, 2Н), 3,12 (кв, J=6,0 Гц, 2H), 3,59 (с, 2Н), 3,91 (с, 3Н), 5,42 (с, 2Н), 7,13 (д, J=8,0 Гц, 2Н), 7,18-7,20 (м, 2Н), 7,26 (т, J=7,6 Гц, 1Н), 7,44-7,50 (м, 2Н), 7,76 (шир.с, 1Н), 8,24 (с, 1Н).
(S)-1-((2-((2'-фтор-2-метил[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 19)
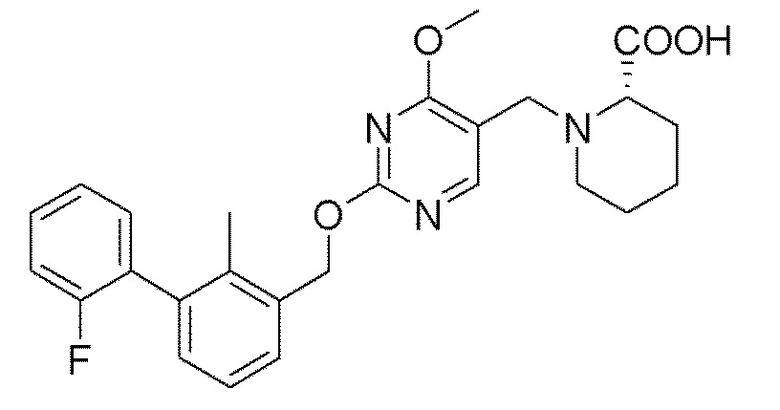
[000191] LCMS (ES) m/z=466,2 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,33 (шир.с, 1Н), 1, 40-1, 50 (м, 3Н), 1,76-1,78 (м, 2Н), 2,11 (с, 3Н), 2,23-2,30 (м, 1Н), 2,86-2,89 (м, 1Н), 3,10 (шир.с, 1Н), 3,51-3,54 (м, 1Н), 3,61-3,65 (м, 1Н), 3,88 (с, 3Н), 5,42 (с, 2Н), 7,18 (д, J=7,2, 1Н), 7, 26-7, 29 (м, 4Н), 7,43-7,48 (м, 2Н), 8,25 (с, 1Н).
N-(2-(((2-((2'-фтор-2-метил[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 20)
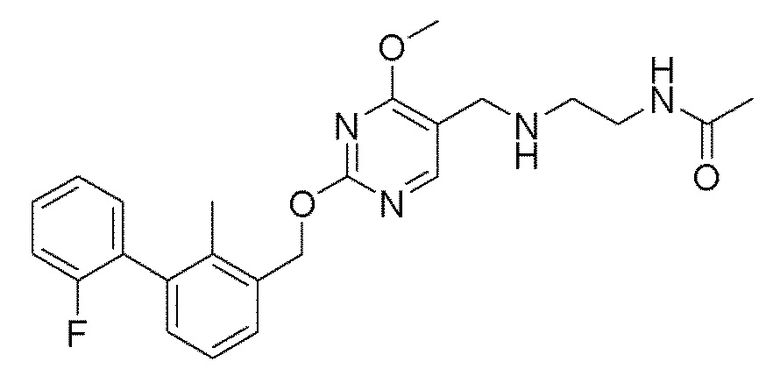
[000192] LCMS (ES) m/z=439,2 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,77 (с, 3Н), 2,11 (с, 3Н), 2,55-2,61 (м, 2Н), 3,10-3,15 (м, 2Н), 3,32 (с, 1Н), 3,62 (с, 2Н), 3,91 (с, 3Н), 5,43 (с, 2Н), 7,18 (д, J=7,2, 1Н), 7,26-7,31 (м, 4Н), 7,41-7,47 (м, 2Н), 7,78 (шир.с, 1Н), 8,25 (с, 1Н).
N-(2-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 21)
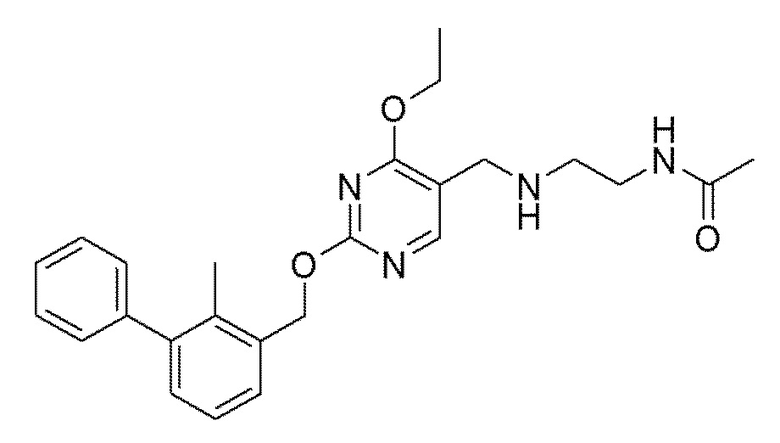
[000193] LCMS (ES) m/z=435,3 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6): δ1,30 (т, J=7,2 Гц, 3H), 1,76 (с, 3H), 2,18 (с, 3H), 2,52-2,53 (м, 2H), 3,08-3,13 (м, 2H), 3,56 (с, 2H), 4,37 (кв, J=7,2 Гц, 2Н), 5,40 (с, 2Н), 7,16 (д, J=7,2 Гц, 1Н), 7,23-7,29 (м, 3Н) 7, 35-7, 37 (м, 1Н), 7, 39-7, 45 (м, 3Н), 7,74 (шир.с, 1Н), 8,22 (с, 1Н).
(S)-1-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 22)
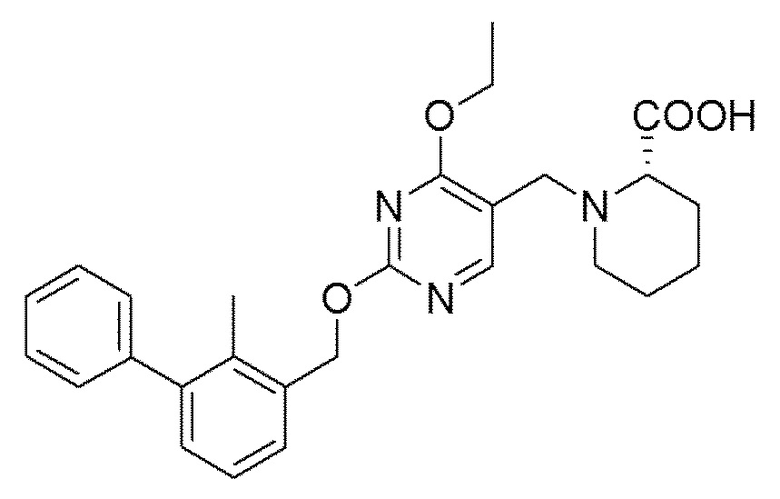
[000194] LCMS (ES) m/z=462,2 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,28 (т, J=7,2 Гц, 3Н), 1,35-1,45 (м, 3Н), 1,66-1,78 (м, 2Н), 2,18 (с, 3Н), 2, 87-2, 90 (м, 2Н), 3,09-3,13 (м, 2Н), 3,50-3,54 (м, 1Н), 3,60-3,63 (м, 1Н), 4,35 (кв, J=6, 8 Гц, 2Н), 5,40 (с, 2Н), 7,17 (д, J=6,8 Гц, 1Н), 7, 25-7, 30 (м, 3Н) 7, 34-7, 37 (м, 1Н), 7,40-7,45 (м, 3Н), 8,22 (с, 1Н).
1-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)циклопропан-1-карбоновая кислота (Соединение 23)
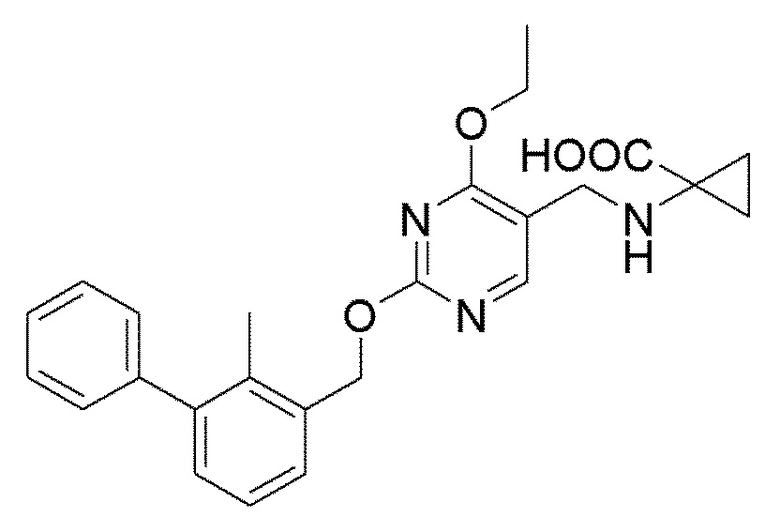
[000195] LCMS (ES) m/z=434,1 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6): δ0,88-0,89 (м, 2H), 1,05-1,09 (м, 2Н), 1,30 (т, J=6,8 Гц, 3Н), 2,17 (с, 3Н), 3,67 (с, 3Н), 4,35 (кв, J=6,8 Гц, 2Н), 5,39 (с, 2Н) 7,16 (д, J=7,2 Гц, 1Н), 7,22-7,29 (м, 3Н) 7,34-7,45 (м, 5Н), 8,15 (с, 1Н).
(3-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)пропионовая кислота (Соединение 24)
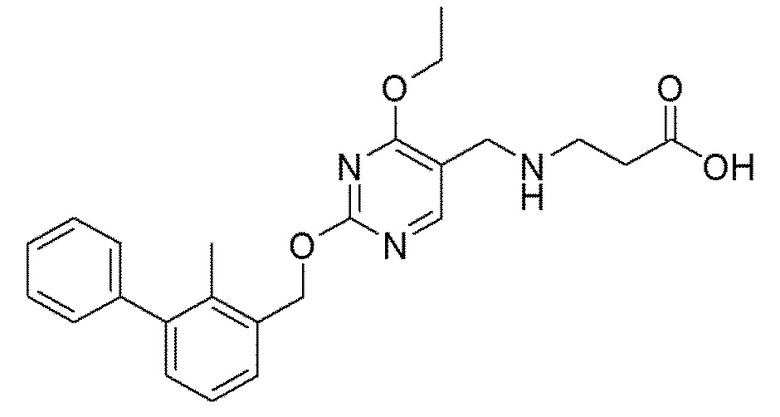
[000196] LCMS (ES) m/z=422 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ1,30 (т, J=6,8 Гц, 3Н), 2,18-2,20 (м, 6Н), 2,65 (с, 2Н), 3,58 (с, 2Н), 4,37 (кв, J=7,2 Гц, 2Н), 5,40 (с, 2Н) 7,16 (д, J=7,6 Гц, 1Н), 7,23-7,29 (м, 3Н) 7,34-7,45 (м, 4Н), 8,23 (с, 1Н).
2-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 25)
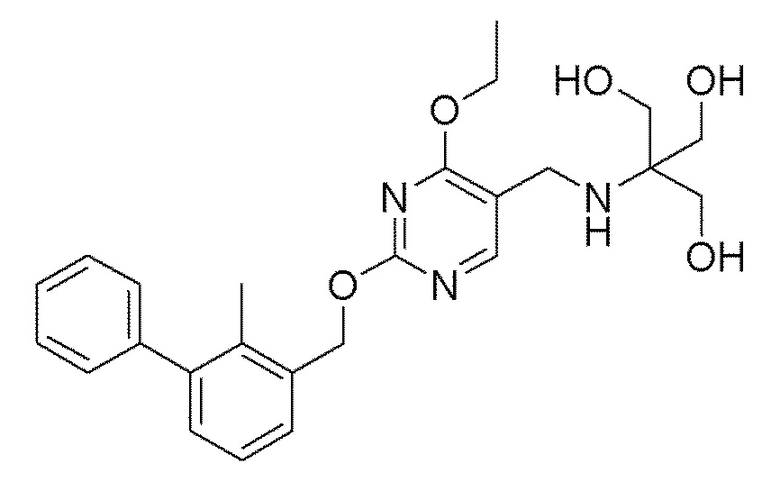
[000197] LCMS (ES) m/z=454 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ1,29 (т, J=6, 8 Гц, 3H), 1,77 (шир.с, 1Н), 2,18 (с, 3Н), 3,35-3,36 (м, 6Н), 3,60 (с, 2Н), 4,20 (с, 3Н), 4,36 (кв, J=7,2 Гц, 2Н), 5,40 (с, 2Н), 7,16 (д, J=7,6 Гц, 1Н), 7, 23-7, 30 (м, 3Н) 7,34-7,45 (м, 4Н), 8,25 (с, 1Н).
(2-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)(метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 26)
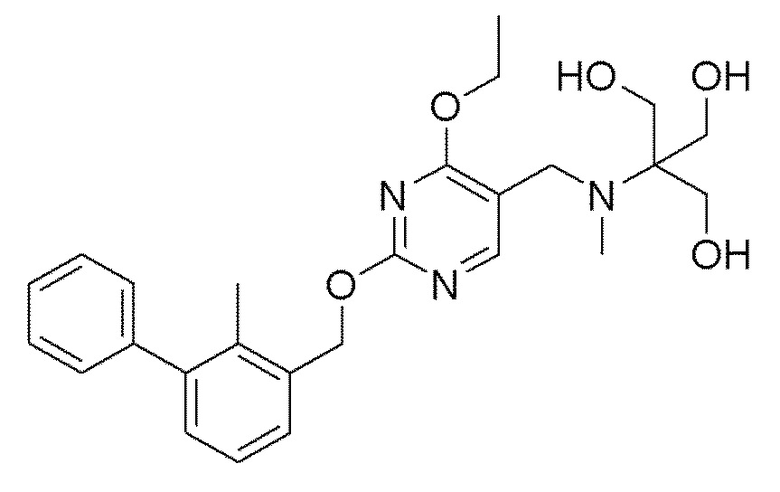
[000198] LCMS (ES) m/z=468,2 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ1,30 (т, J=7,2 Гц, 3Н), 2,18 (с, 6Н), 3,50-3,51 (м, 6Н), 3,66 (с, 2Н), 4,20 (с, 3Н), 4,35 (кв, J=6, 8 Гц, 2Н), 5,40 (с, 2Н), 7,17 (д, J=7,8 Гц, 1Н), 7, 23-7, 30 (м, 3Н) 7, 34-7, 45 (м, 4Н), 8,25 (с, 1Н).
(S)-3-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)масляная кислота (Соединение 27)
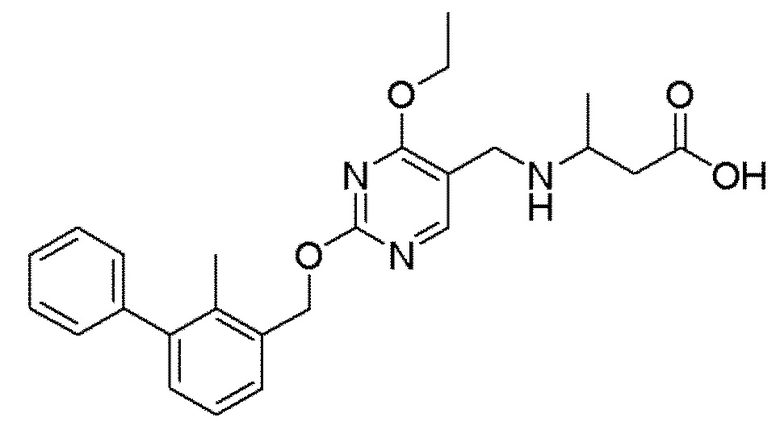
[000199] LCMS (ES) m/z=436,52 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,09 (д, J=6,4 Гц, 3Н) 1,30-1,26 (м, 2Н), 1,33-1,30 (м, 3Н), 2,22-2,18 (м, 5Н), 2,97-2,94 (м, 1Н), 3,74-3,61 (м, 2Н), 4,39-4,37 (м, 2Н), 5,42 (с, 2Н), 7,18-7,16 (м, 1Н), 7,30-7,23 (м, 3Н) 7,45-7,40 (м, 4Н), 8,28 (с, 1Н).
((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-D-аланин (Соединение 28)
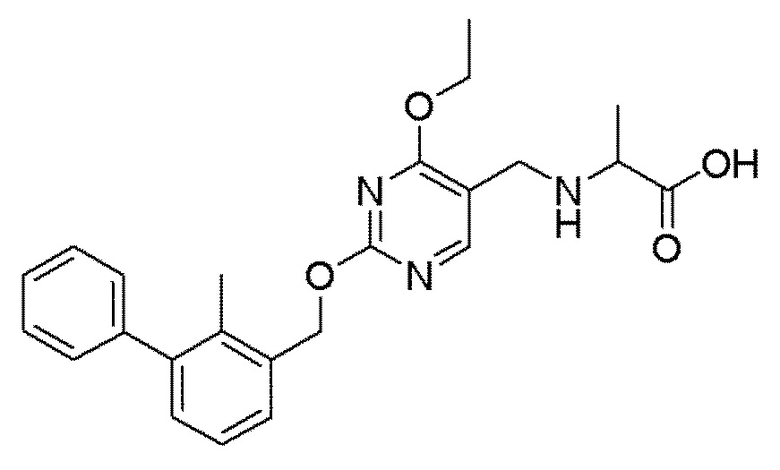
[000200] LCMS (ES) m/z=464,52 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,31 (т, J=7,2 Гц, 3Н), 2,18 (с, 3Н), 3,38 (шир.с, 2Н), 3,77-3,68 (м, 2Н), 4, 40-4, 35 (м, 2Н), 5,42 (с, 2Н), 6,93 (с, 1Н), 7,30-7,23 (м, 3Н) 7,50-7,34 (м, 4Н), 8,28 (с, 1Н).
((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)аспарагин (Соединение 29)
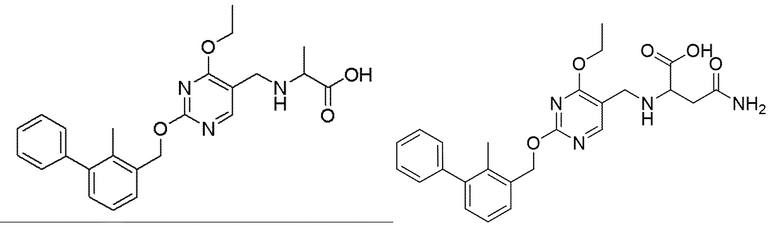
[000201] LCMS (ES) m/z=464,52 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,31 (т, J=7,2 Гц, 3Н), 2,18 (с, 3Н), 3,38 (шир.с, 2Н), 3,77-3,68 (м, 2Н), 4, 40-4, 35 (м, 2Н), 5,42 (с, 2Н), 6,93 (с, 1Н), 7,30-7,23 (м, 3Н) 7,50-7,34 (м, 4Н), 8,28 (с, 1Н).
(2R,4R)-1-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 30)
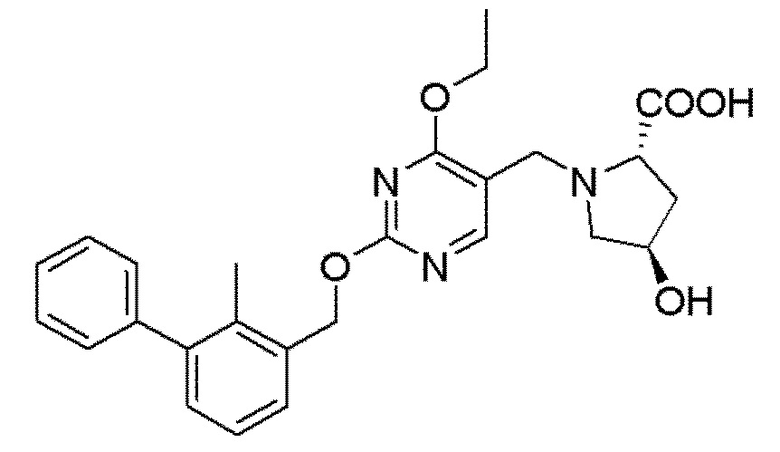
[000202] LCMS (ES) m/z=464,2 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,33 (т, J=7,2 Гц, 3Н), 1,98-1,90 (м, 2Н), 2,13 (с, 3Н), 2,42-2,39 (м, 1Н) 3,21-3,17 (м, 2Н), 3,46-3,42 (м, 2Н), 3,79-3,73 (м, 2Н), 4,17 (с, 1Н), 4, 38-4, 33 (м, 2Н), 5,41 (с, 2Н), 7,17-7,16 (м, 1Н), 7,30-7,23 (м, 3Н), 7,37-7,33 (м, 1Н), 7,45-7,40 (м, 3Н), 8,23 (с, 1Н).
1-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)азетидин-2-карбоновая кислота (Соединение 31)
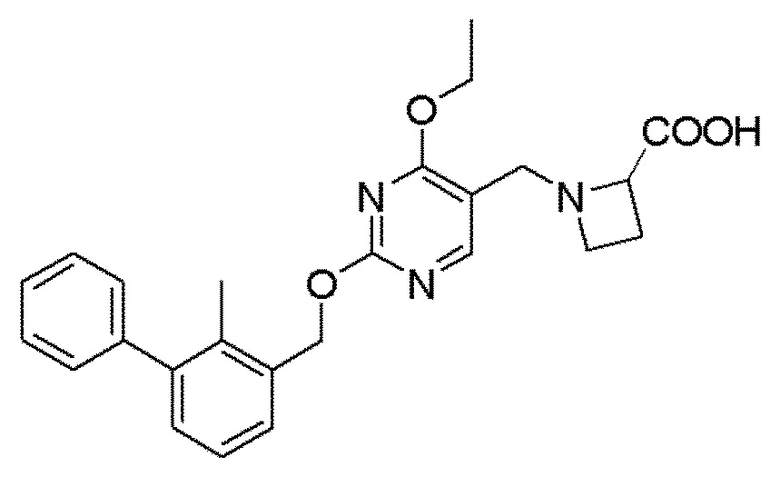
[000203] LCMS (ES) m/z=433,51 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,29 (кв, J=4,2 Гц, 3Н), 2,05-1,82 (м, 2H), 2,18 (с, 3Н), 3,20-3,11 (м, 4Н), 3,74-3,70 (м, 1Н), 4, 38-4, 32 (м, 2Н), 5,39 (с, 2Н), 7,30-7,15 (м, 5Н), 7,45-7,37 (м, 5Н), 8,20 (с, 1Н).
N-(2-(((4-(бензилокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 32)
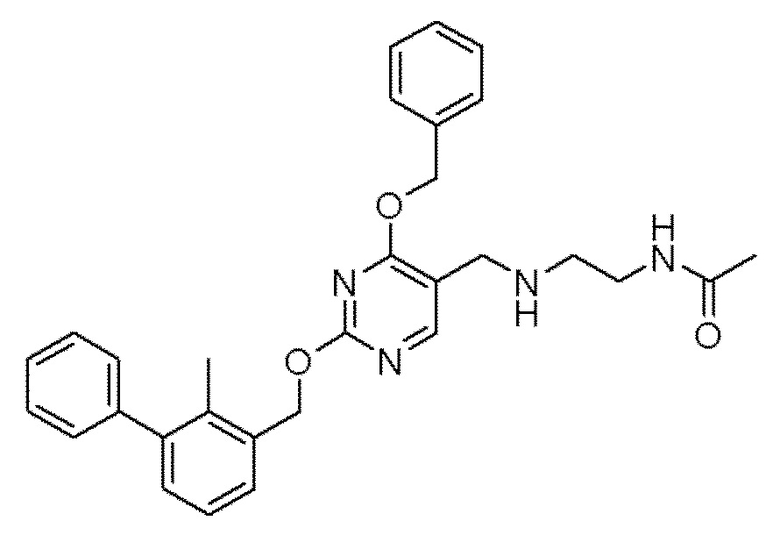
[000204] LCMS (ES) m/z=496,61 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,72 (с, 3Н), 2,17 (с, 3Н), 2,555-2,53 (м, 3Н), 3,14-3,08 (м, 2Н), 3,64 (с, 2Н), 5,47-5,37 (м, 4Н) 7,17-7,16 (м, 2Н), 7,34-7,27 (м, 3Н) 7,36-7,34 (м, 5Н), 7,45-7,37 (м, 4Н), 8,26 (с, 1Н).
1-((4-(бензилокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 33)
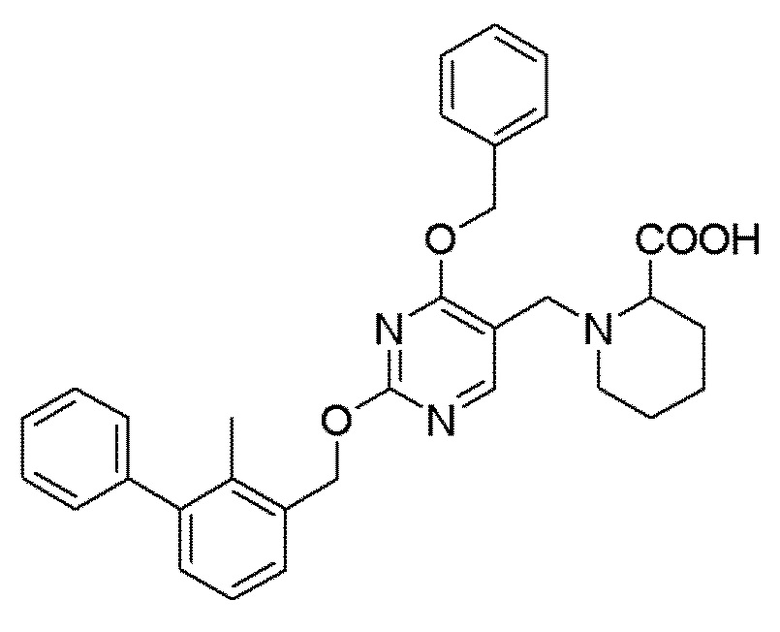
[000205] LCMS (ES) m/z=523,63 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,21 (с, 1H), 1,43-1,39 (м, 4H), 1,72-1,70 (м, 2H), 2,17 (с, 3Н), 2,30-2,21 (м, 1Н), 2,86-2,85 (м, 1Н), 3,16-3,15 (м, 2Н), 3,67-3,51 (м, 2Н), 5,41 (д, J=5,6 Гц, 2Н), 7,18-7,16 (м, 2Н), 7,34-7,27 (м, 3Н), 7,36-7,34 (м, 5Н), 7, 45-7, 37 (м, 4Н), 8,25 (с, 1Н).
(2S,4R)-1-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 34)
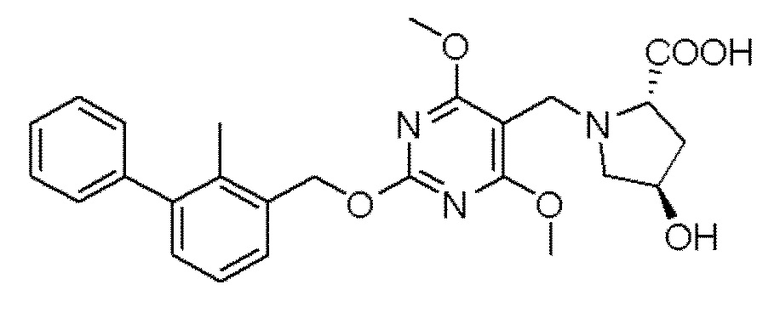
[000206] LCMS (ES) m/z=480,2 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,88-1,90 (м, 2Н), 2,21 (с, 3Н), 3,14 (с, 1Н), 3,35-3,19 (м, 1Н), 3,76-3,83 (м, 3Н), 3,88 (с, 6Н), 4,15 (шир.с, 1Н), 4,94 (шир.с, 1Н), 5,44 (с, 2Н), 7,18 (д, J=7, 6 Гц, 1Н), 7,24-7,30 (м, 3Н) 7,33-7,37 (м, 1Н), 7,41-7,46 (м, 3Н).
2-(((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 35)
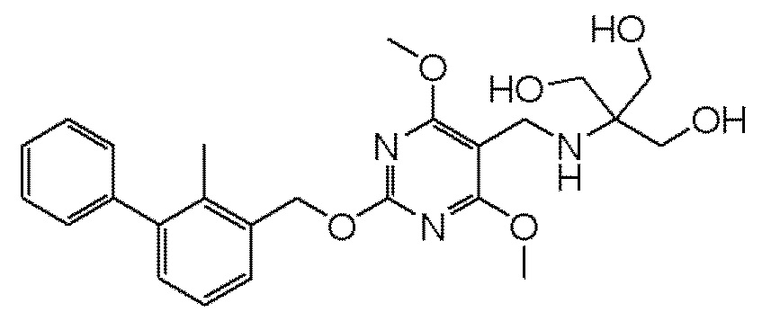
[000207] LCMS (ES) m/z=470,2 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 2,20 (с, 3Н), 3,34 (д, J=4,8 Гц, 6Н), 3,54 (с, 2Н), 3,88 (с, 6Н), 4,12, шс, 3Н), 5,43 (с, 2Н), 7,16 (д, J=7,6 Гц, 1Н), 7,24-7,30 (м, 3Н), 7,34-7,39 (м, 1Н), 7,43 (т, J=7,6 Гц, 3Н).
((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-L-пролин (Соединение 36)
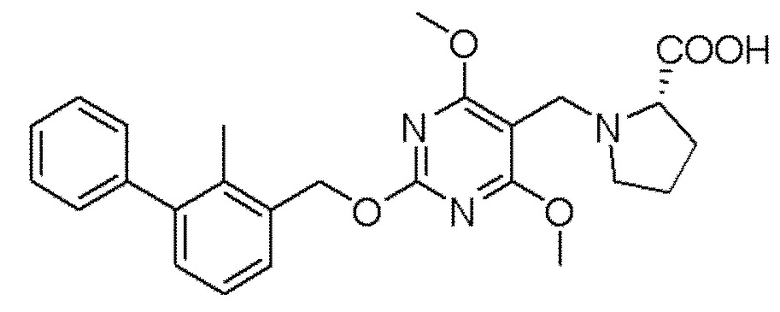
[000208] LCMS (ES) m/z=464,4 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,55-1,89 (м, 3Н), 2,01-2,22 (м, 1Н), 2,21 (с, 3Н), 2,65 (шир.с, 1Н), 3,05-3,09 (м, 1Н), 3,18-3,29 (м, 1Н), 3,86 (с, 2Н), 3,90 (S, 6Н), 5,45 (с, 2Н), 7,19 (д, J=7,6 Гц, 1Н), 7,25-7,30 (м, 3Н), 7,34-7,38 (м, 1Н), 7,42-7,47 (м, 3Н).
Метил-4-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)морфолин-3-карбоксилат (Соединение 37)
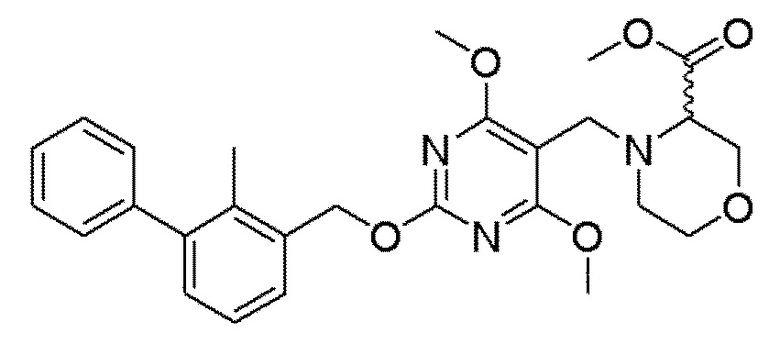
[000209] LCMS (ES) m/z=494,4 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 2,21 (с, 3Н), 2,29-2,32 (м, 1Н), 3,09 (т, J=8,4 Гц, 1Н), 3,16-3,27 (м, 1Н), 3,45-3,50 (м, 1Н), 3,52-3,69 (м, 7Н), 3,85 (с, 6Н), 5,44 (с, 2Н), 7,18 (д, J=8 Гц, 1Н), 7,24-7,38 (м, 3Н), 7,34-7,38 (м, 1Н), 7,42-7,46 (м, 3Н).
4-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)морфолин-3-карбоновая кислота (Соединение 38)
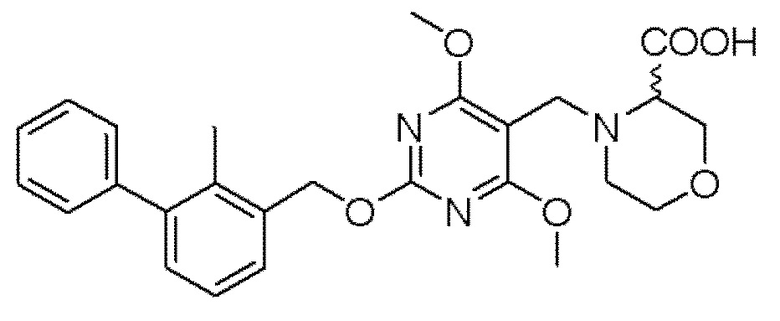
[000210] LCMS (ES) m/z=480 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ 2,21 (с, 3Н), 2,29-2,32 (м, 1Н), 2,99-3,04 (м, 1Н), 3,42-3,49 (м, 2Н), 3,51-3,64 (м, 3Н), 3,66-3,72 (м, 2Н), 3,85 (с, 6Н), 5,43 (с, 2Н), 7,18 (д, J=8 Гц, 1Н), 7,24-7,38 (м, 3Н), 7,34-7,38 (м, 1Н), 7,42-7,46 (м, 3Н).
(2S,4R)-1-((4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 39)
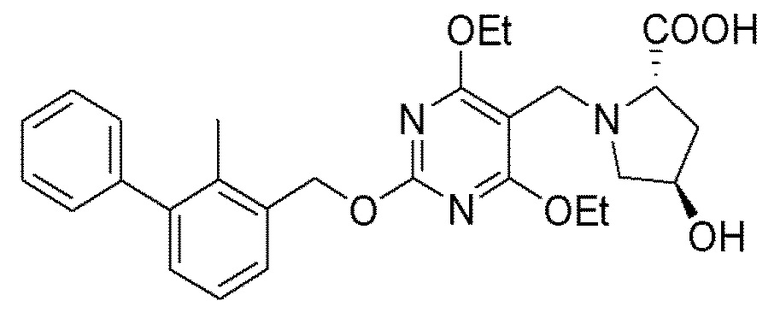
[000211] LCMS (ES) m/z=508,19 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,30-1,32 (т, 6Н), 1,93 (м, 2Н), 2,21 (с, 3Н), 2,66 (м, 1Н), 3,23-3,27 (шир.с, 1Н), 3,36-3,46 (шир.с, 1Н), 3,82 (д, 1Н), 3,92 (д, 1Н), 4,17 (с, 1Н), 4,35-4,38 (м, 4Н), 4,97 (шир.с, 1Н), 5,43 (с, 2Н), 7,20 (м, 1Н), 7,26-7,30 (м, 3Н), 7,40 (м, 1Н), 7,44-7,48 (м, 3Н), HPLC при 214 нм: 99,78%.
((S)-1-((4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 40)
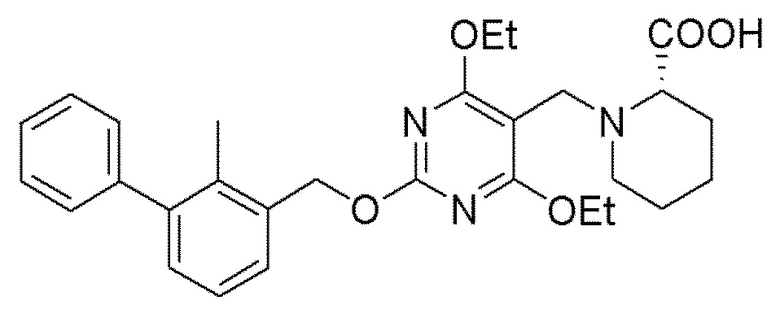
[000212] LCMS (ES) m/z=506,19 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,26-1,28 (м, 6Н), 1,33 (м, 2Н), 1,46 (м, 2Н), 1,70 (с, 2Н), 2,21 (с, 3Н), 2,37 (м, 1Н), 3,00 (с, 1Н), 3,11 (с, 1Н), 3,62 (д, J=13,2 Гц, 1Н), 3,74 (д, J=13,2 Гц, 1Н), 4,33 (м, 4Н), 5,41 (с, 2Н), 7,20 (м, 1Н), 7,26-7,30 (м, 3Н), 7,40 (м, 1Н), 7,44-7,48 (м, 3Н), HPLC при 214 нм: 99,60%.
2-(((4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 41)
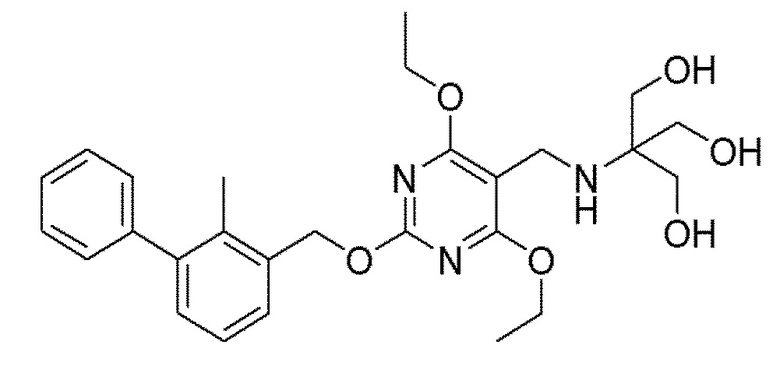
[000213] LCMS (ES) m/z=498,2 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,28 (м, 6H), 2,21 (с, 3H), 3,40 (м, 4H), 3,56 (шир.с, 2H), 4,15 (шир.с, 2Н), 4,33-4,38 (м, 4Н), 5,42 (м, 2Н), 7,20 (м, 1Н), 7,26-7,30 (м, 3Н), 7,40 (м, 1Н), 7,44-7,48 (м, 3Н), HPLC при 214 нм: 99,77%.
2-(((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 42)
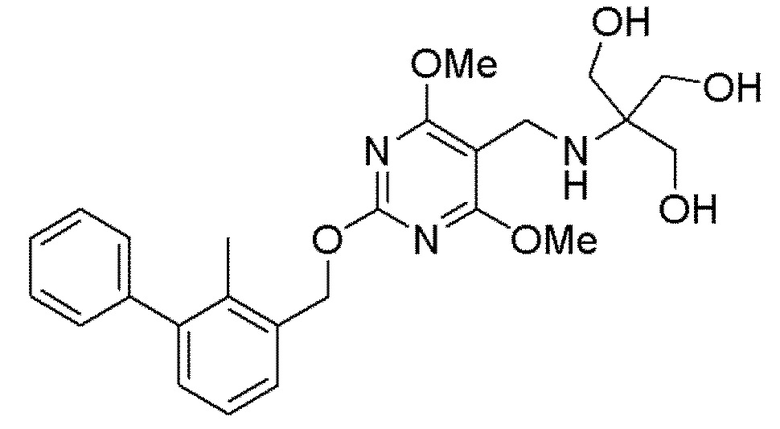
[000214] LCMS (ES) m/z=470,362 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 2, 22 (с, 3Н), 3,38 (м, 4Н), 3,57 (м, 2Н), 3,90 (с, 6Н), 4,71 (шир.с, 2Н), 5,45 (с, 2Н), 7,20 (м, 1Н), 7,26-7,30 (м, 3Н), 7,37 (м, 1Н), 7,44-7,48 (м, 3Н), HPLC при 214 нм: 97,42%.
(S)-4-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)морфолин-3-карбоновая кислота (Соединение 43)
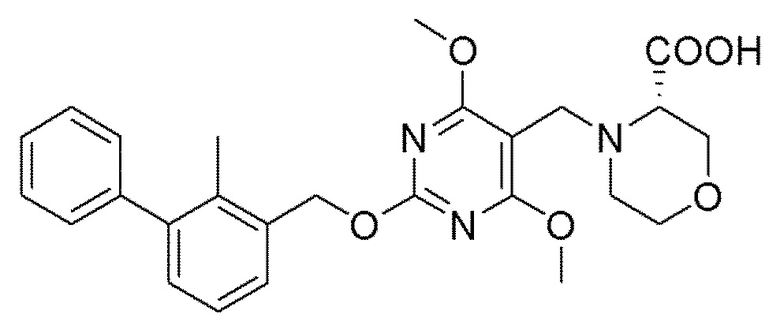
[000215] LCMS (ES) m/z=480,25 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 2,22 (с, 3Н), 3,03 (м, 2Н), 3,32 (м, 1Н), 3,50 (м, 1Н), 3,59 (м, 3Н), 3,67 (м, 2Н), 3,87 (с, 6Н), 5,45 (с, 2Н), 7,20 (м, 1Н), 7, 26-7, 30 (м, 3Н), 7,37 (м, 1Н), 7,44-7,48 (м, 3Н), HPLC при 214 нм: 98,9%.
2-(4-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)морфолин-3-ил)уксусная кислота (Соединение 44)
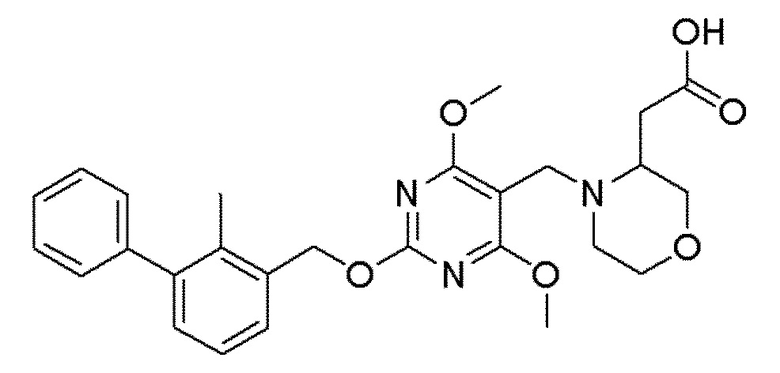
[000216] LCMS (ES) m/z=494,30 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6) δ м.д.: 2,20 (м, 5H), 2,50 (м, 1H), 2,71 (м, 2H), 3,22 (м, 2Н), 3,40-3,63 (м, 4Н), 3,88 (с, 6Н), 5,45 (с, 2Н), 7,20 (м, 1Н), 7,26-7,30 (м, 3Н), 7,39 (м, 1Н), 7,44-7,48 (м, 3Н), HPLC при 214 нм: 98,43%.
(S)-1-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота кислота (Соединение 45)
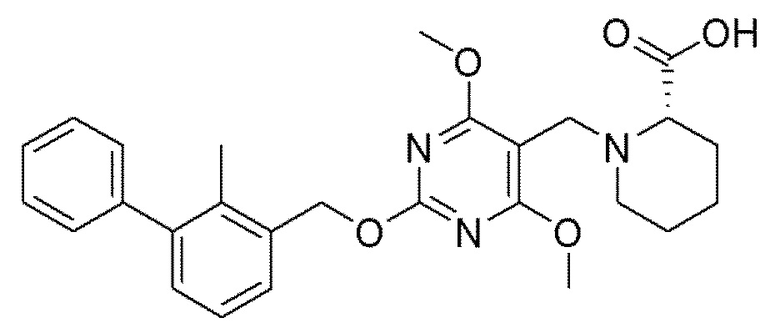
[000217] LCMS (ES) m/z=478,36 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,23-1,31 (м, 4Н), 1,63 (м, 1Н), 1,71 (м, 1Н), 2,23 (с, 3Н), 2,33 (м, 1Н), 3, 03-2, 97 (м, 2Н), 3,63 (м, 1Н), 3,77 (м, 1Н), 3,91 (с, 6Н), 5,45 (с, 2Н), 7,20 (м, 1Н), 7,26-7,32 (м, 3Н), 7,37 (м, 1Н), 7,44-7,48 (м, 3Н), HPLC при 214 нм: 99,83%.
(S)-5-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-5-азаспиро[2.4]гептан-6-карбоновая кислота (Соединение 46)
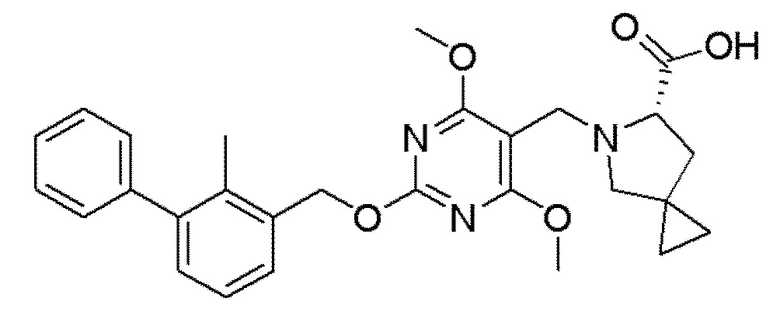
[000218] LCMS (ES) m/z=490,39 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 0,42-0,55 (м, 4Н), 1,23 (м, 2Н), 1,71-1,75 (м, 1Н), 2,23 (с, 3Н), 2,27 (м, 1Н), 2,87 (м, 1Н), 2,94 (м, 1Н), 3,59 (м, 1Н), 3,97 (с, 6Н), 5,47 (с, 2Н), 7,19-7,21 (м, 1Н), 7,26-7,32 (м, 3Н), 7,35-7,39 (м, 1Н), 7,43-7,47 (м, 3Н), HPLC при 214 нм: 99,30%.
7-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2,7-диазаспиро[4.5]декан-1-он (Соединение 47)
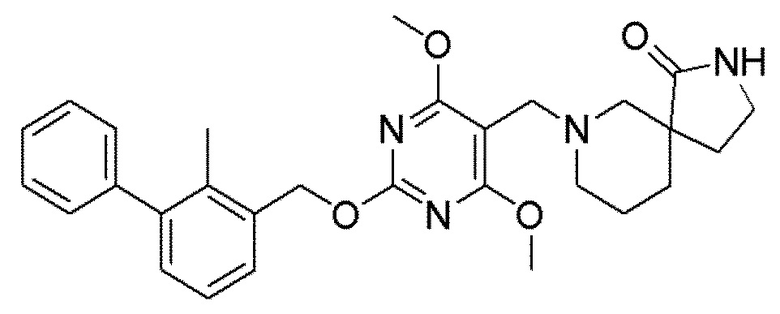
[000219] LCMS (ES) m/z=503,44 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ: 1,33-1,47 (м, 4Н), 1,78-1,97 (м, 3Н), 2,07-2,05 (м, 1Н), 2,22 (с, 3Н), 2,39 (м, 1Н), 2,72 (м, 1Н), 3,09 (м, 2Н), 3,33 (м, 2Н), 3,88 (с, 6Н), 5,45 (с, 2Н), 7,19-7,21 (м, 1Н), 7,26-7,32 (м, 3Н), 7, 35-7, 39 (м, 1Н), 7, 43-7, 47 (м, 4Н), HPLC при 214 нм: 99,84%.
рац-(1R,6S)-2-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2-азабицикло[4.1.0]гептан-1-карбоновая кислота (Соединение 48)
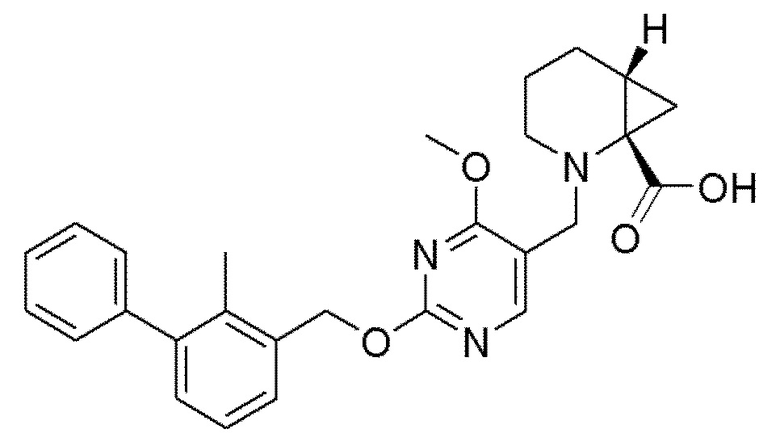
[000220] LCMS (ES) m/z=460,43 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 0,99-1,00 (м, 1Н), 1,19-1,22 (м, 2Н), 1,56-1,59 (м, 2Н), 1,80-1,84 (м, 1Н), 2,21 (с, 3Н), 2,33-2,36 (м, 1Н), 2,53 (м, 2Н), 3,67-3,55 (м, 2Н), 3,89 (с, 3Н), 5,51 (с, 2Н), 7,19-7,21 (м, 1Н), 7,26-7,32 (м, 3Н), 7, 35-7, 39 (м, 1Н), 7,43-7,47 (м, 3Н), 8,37 (с, 1Н), 11,82 (шир.с, 1Н), HPLC при 214 нм: 99,23%.
(S)-4-ацетил-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперазин-2-карбоновая кислота (Соединение 49)
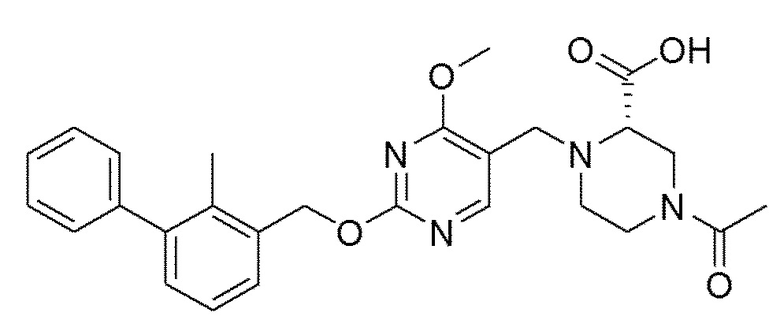
[000221] LCMS (ES) m/z=491,46 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,95 (м, 3Н), 2,20 (с, 3Н), 2,32 (шир.с, 1Н), 2,84-3,01 (м, 2Н), 3,15 (м, 1Н), 3,45 (м, 1Н), 3,55-3,79 (м, 2Н), 3,89 (м, 5Н), 5,49 (с, 2Н), 7,17-7,19 (м, 1Н), 7,26-7,32 (м, 3Н), 7,35-7,39 (м, 1Н), 7,43-7,47 (м, 3Н), 8,26 (шир.с, 1Н), HPLC при 214 нм: 99,86%.
(S)-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперазин-2-карбоновая кислота (Соединение 50)
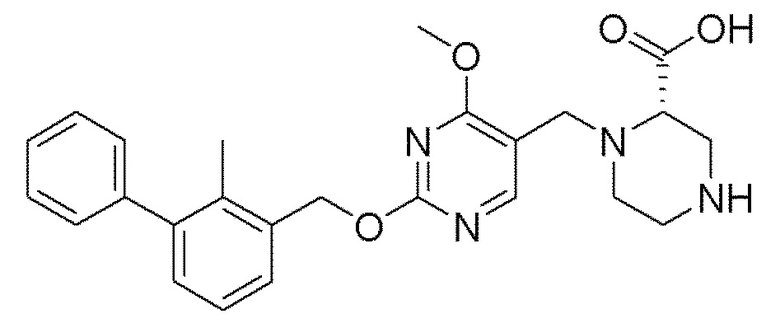
[000222] LCMS (ES) m/z=449,23[М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 2,21 (с, 3Н), 2,49 (м, 1Н), 2,66-2,88 (м, 3Н), 2,98-2,95 (м, 1Н), 3,09 (м, 1Н), 3,12 (м, 1Н), 3,54-3,57 (м, 1Н), 3,66-3,69 (м, 1Н), 3,89 (с, 3Н), 5,49 (с, 2Н), 7,17-7,19 (м, 1Н), 7,24-7,32 (м, 3Н), 7,35-7,39 (м, 1Н), 7,43-7,47 (м, 3Н), 8,31 (шир.с, 1Н), HPLC при 214 нм: 97,83%.
(S)-5-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-5-азаспиро[2,4]гептан-6-карбоновая кислота (Соединение 51)
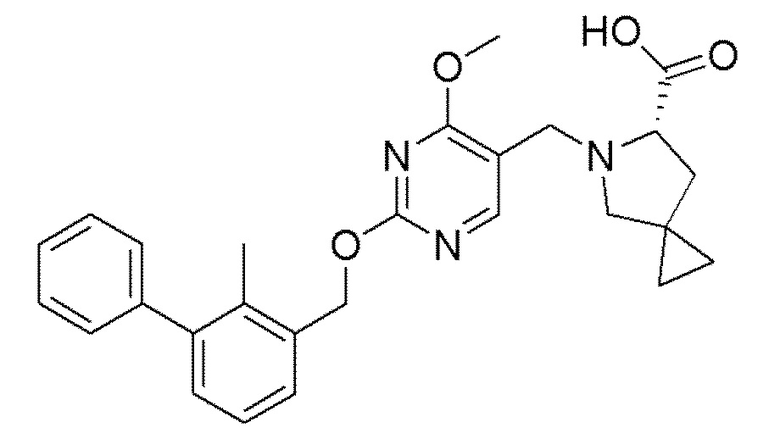
[000223] LCMS (ES) m/z=460,36 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 0,42-0,51 (м, 4Н), 1,73-1,78 (м, 1Н), 2,14 (м, 1Н), 2,23 (с, 3Н), 2,68 (м, 1Н), 2,78 (м, 1Н), 3,57 (м, 1Н), 3,74 (м, 1Н), 3,88 (м, 1Н), 3,91 (с, 3Н), 5,51 (с, 2Н), 7,19-7,21 (м, 1Н), 7,24-7,32 (м, 3Н), 7,35-7,39 (м, 1Н), 7,43-7,49 (м, 3Н), 8,30 (с, 1Н); чистота по HPLC при 214 нм: 99,70%.
7-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2,7-диазаспиро[4.5]декан-1-он (Соединение 52)
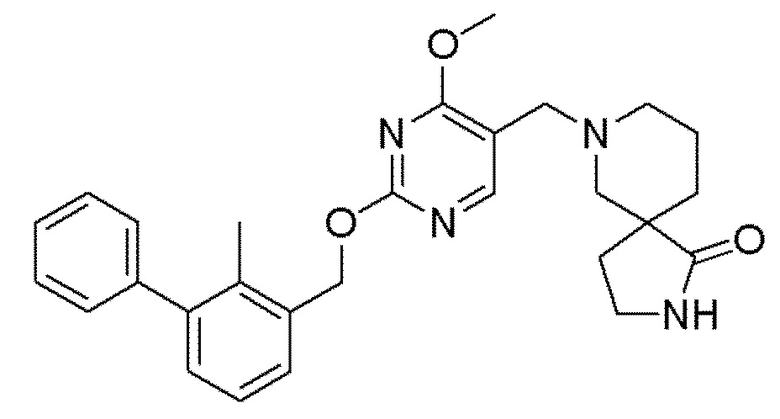
[000224] LCMS (ES) m/z=473,44 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ: 1,33-1,51 (м, 4Н), 1,76-1,89 (м, 2Н), 1,95-2,03 (м, 2Н), 2,21 (с, 3Н), 2,43 (м, 1Н), 2,76 (м, 1Н), 2,96-3,06 (м, 2Н), 3,36 (м, 2Н), 3,89 (с, 3Н), 5,44-5,52 (м, 2Н), 7,19-7,21 (м, 1Н), 7,24-7,32 (м, 3Н), 7,35-7,39 (м, 1Н), 7,43-7,49 (м, 4Н), 8,21 (с, 1Н); чистота по HPLC при 214 нм: 95,84%.
N-(2-(((4-((3-циано-4-фторбензил)окси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 53)
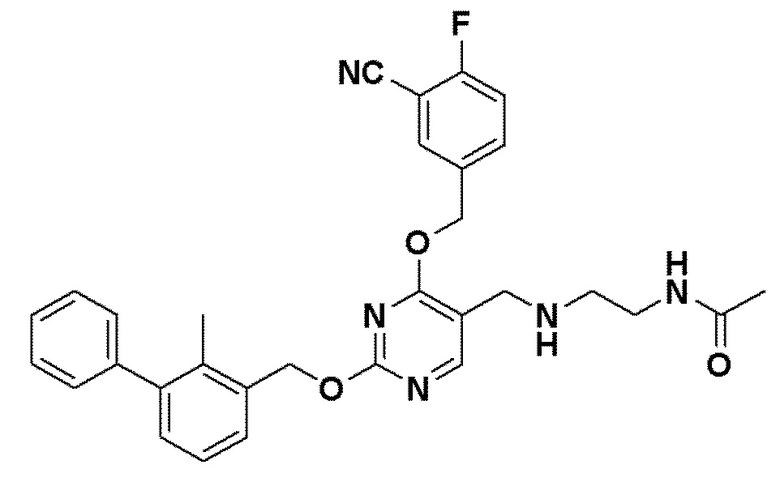
[000225] LCMS (ES) m/z=540,32 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,75 (с, 3Н), 2,19 (с, 3Н), 2,55 (м, 2Н), 3,10 (м, 2Н), 3,64 (с, 2Н), 5,40 (с, 2Н), 5,48 (с, 2Н), 7,21 (м, 1Н), 7,26-7,31 (м, 3Н), 7,37 (м, 1Н), 7,43-7,47 (м, 3Н), 7,55 (т, J=9,2 Гц, 1Н), 7,77 (м, 1Н), 7,88 (м, 1Н), 8,04 (м, 1Н), 8,30 (с, 1Н); чистота по HPLC при 214 нм: 96,36%.
(2S,4R)-1-((4-((3-циано-4-фторбензил)окси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 54)
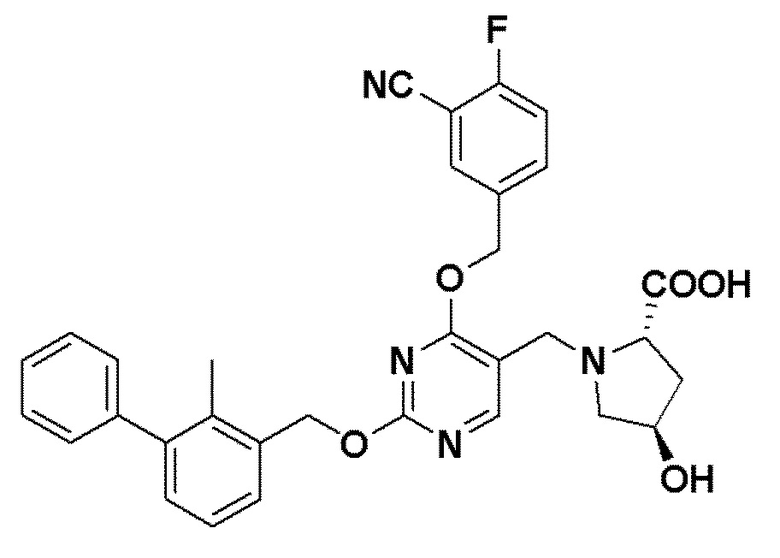
[000226] LCMS (ES) m/z=569,28 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,87-2,02 (м, 2H), 2,20 (с, 3Н), 2,40 (м, 1Н), 3,18 (м, 1Н), 3,46 (м, 1Н), 3,70 (д, J=14 Гц, 1Н), 3,82 (д, J=14 Гц, 1Н), 4,20 (м, 1Н), 4,90 (шир.с, 1Н), 5,40 (с, 2Н), 5,48 (с, 2Н), 7,21 (м, 1Н), 7,26-7,31 (м, 3Н), 7,37 (м, 1Н), 7,43-7,47 (м, 3Н), 7,55 (т, J=9,2 Гц, 1Н), 7,88 (м, 1Н), 8,04 (м, 1Н), 8,32 (с, 1Н); чистота по HPLC при 214 нм: 98,12%.
(S)-1-((2-((3-(2,3-дигидро[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 55)
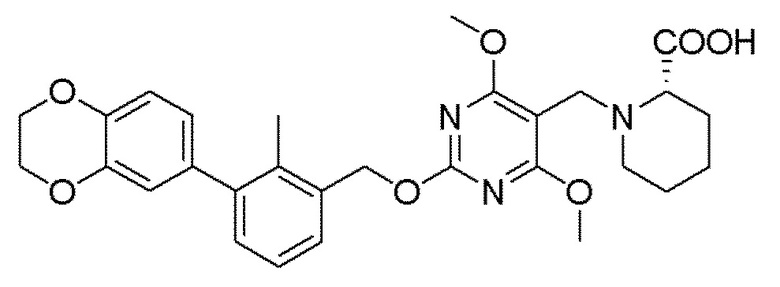
[000227] LCMS (ES) m/z=536,26 [М+Н]+ и чистота при 214 нм: 98, 69%,; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,49-1,44 (м, 2Н), 1,63-1,70 (м, 2Н), 1,89 (с, 2Н), 2,23 (с, 3Н), 2,30 (м, 1Н), 2,96-3,04 (шир.с, 2Н), 3,63-3,76 (м, 2Н), 3,87 (с, 6Н), 4,27 (с, 4Н), 5,43 (с, 2Н), 6,73-6,77 (м, 2Н), 6,92 (д, J=8,12 Гц, 1Н), 7,15-7,17 (м, 1Н), 7,22-7,26 (м, 1Н), 7,44 (д, J=7, 16 Гц, 1Н).
N-(2-(((2-((3-(2,3-дигидро[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 56)
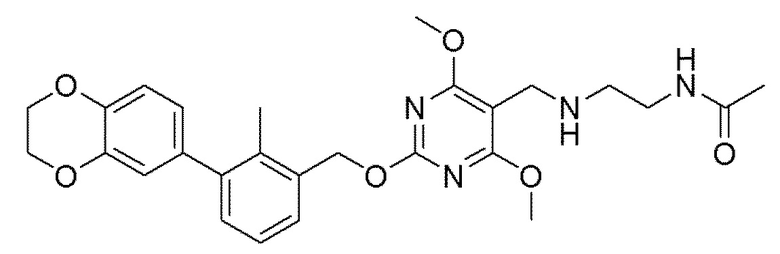
[000228] LCMS (ES) m/z=509,23 [М+Н]+ и чистота при 214 нм: 96,7%,; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,82 (с, 3Н), 2,23 (с, 3Н), 2,82 (шир.с, 2Н), 3,24-3,25 (м, 2Н), 3,83 (м, 2Н), 3,94 (с, 6Н), 4,27 (с, 4Н), 5,47 (с, 2Н), 6, 73-6, 77 (м, 2Н), 6,92 (д, J=8,12 Гц, 1Н), 7,15-7,17 (м, 1Н), 7, 22-7, 26 (м, 1Н), 7,44 (д, J=7, 16 Гц, 1Н), 7,95-7,97 (м, 1Н).
N-(2-(((2-((3',4'-диметокси-2-метил[1,1'-бифенил]-3-ил)метокси)-4,6-диметоксипиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 57)
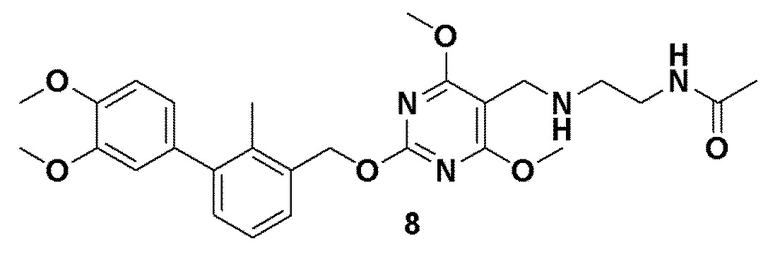
[000229] LCMS (ES) m/z=511,33 [М+Н]+ и чистота при 214 нм: 95,1%,; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,78 (с, 3Н), 2,25 (с, 3Н), 2,56 (м, 2Н), 3,13 (м, 2Н), 3,60 (м, 2Н), 3,76 (с, 3Н), 3,79 (с, 3Н), 3,90 (с, 6Н), 5,44 (с, 2Н), 6,82 (д, J=8,12 Гц, 1Н), 6,86 (с, 1Н), 7,02 (д, J=8,2 Гц, 1Н), 7,20-7,21 (м, 2Н), 7,45 (д, J=7 Гц, 1Н), 7,81 (шир.с, 1Н).
((2S,4R)-1-((2-((3',4'-диметокси-2-метил[1,1'-бифенил]-3-ил)метокси)-4,6-диметоксипиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 58)
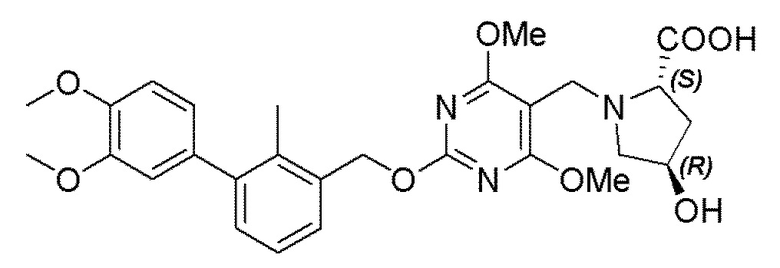
[000230] LCMS (ES) m/z=540,33 [М+Н]+ и чистота при 214 нм: 99, 69%,; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,85-1,91 (м, 2Н), 2,25 (с, 3Н), 2,50 (с, 2Н), 3,35-3,41 (м, 2Н), 3,76-3,82 (м, 8Н), 3,90 (с, 6Н), 4,18 (м, 1Н), 4,99 (шир.с, 1Н), 5,45 (с, 2Н), 6,82 (д, J=8,12 Гц, 1Н), 6,86 (с, 1Н), 7,08 (д, J=8, 2 Гц, 1Н), 7,20-7,21 (м, 2Н), 7, 45 (д, J=7 Гц, 1Н).
(2S,4R)-1-((4-((5-цианопиридин-3-ил)метокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 59)
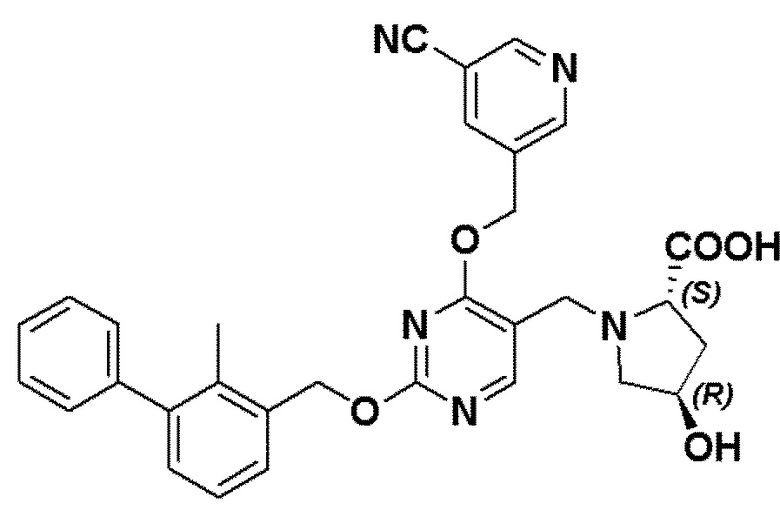
[000231] LCMS (ES) m/z=552,0 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,93-2,00 (м, 2H), 2,20 (с, 3Н), 2,40 (м, 1Н), 3,18 (м, 1Н), 3,47 (м, 1Н), 3,71 (д, J=14 Гц, 1Н), 3,82 (д, J=14 Гц, 1Н), 4,20 (м, 1Н), 4,91 (шир.с, 1Н), 5,48 (с, 4Н), 7,18-7,20 (м, 1Н), 7,24-7,32 (м, 3Н), 7, 36-7, 38 (м, 1Н), 7,43-7,47 (м, 3Н), 8,32 (с, 1Н), 8,43 (с, 1Н), 8,98 (с, 1Н), 9,00 (с, 1Н); чистота по HPLC при 214 нм: 99,59%.
(S)-2-(1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-ил)уксусная кислота (Соединение 60)
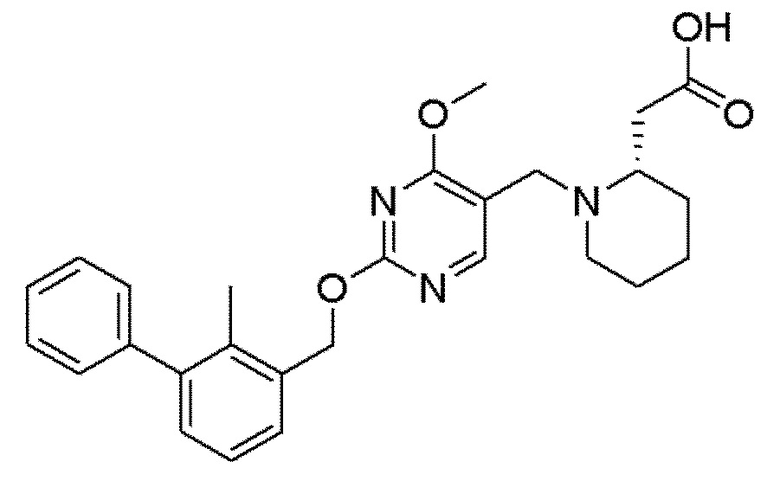
[000232] LCMS (ES) m/z=462,38 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6): δ 1,33-1,36 (м, 2Н), 1,46 (м, 3Н), 1,70 (м, 1Н), 2,20 (с, 3Н), 2,23-2,32 (м, 2Н), 2,63 (м, 2Н), 2,87 (м, 1Н), 3,40 (д, J=14 Гц, 1Н), 3,68 (д, J=14 Гц, 1Н), 3,90 (с, 3Н), 5,43 (с, 2Н), 7,18 (м, 1Н), 7,26-7,32 (м, 3Н), 7,37 (м, 1Н), 7,44-7,48 (м, 3Н), 8,25 (с, 1Н), HPLC при 214 нм: 96%.
[000233] Соединения 61-63 получали способом, аналогичным способу, используемому для Соединения 60.
(R)-2-(1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-ил)уксусная кислота (Соединение 61)
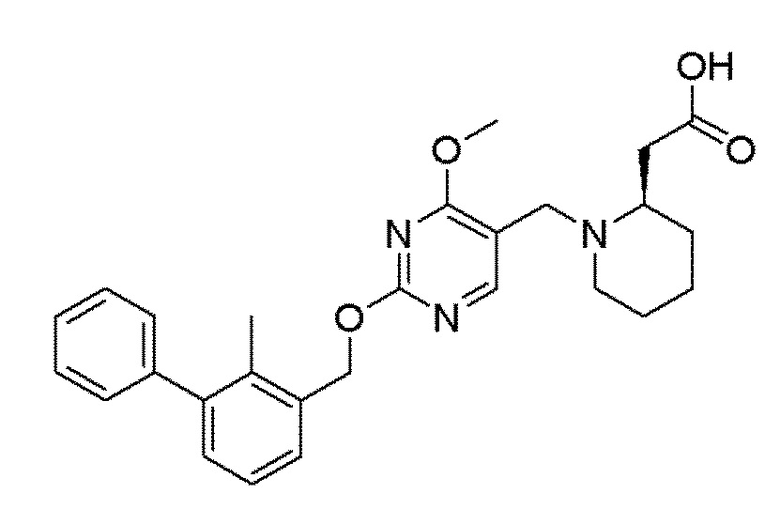
[000234] LCMS (ES) m/z=462,23 [M+H]+.
(S)-4-(6-ацетамидогексаноил)-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперазин-2-карбоновая кислота (Соединение 62)
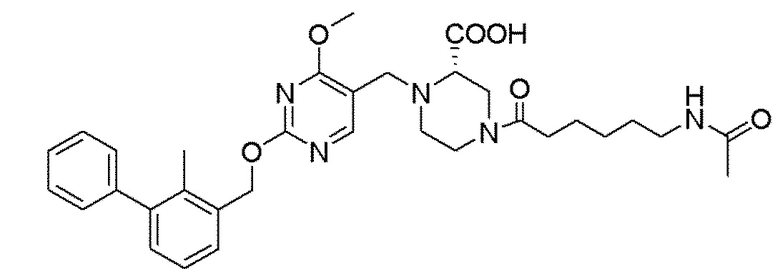
[000235] LCMS (ES) m/z=604,3 [M+H]+.
(S)-4,4-дифтор-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 63)
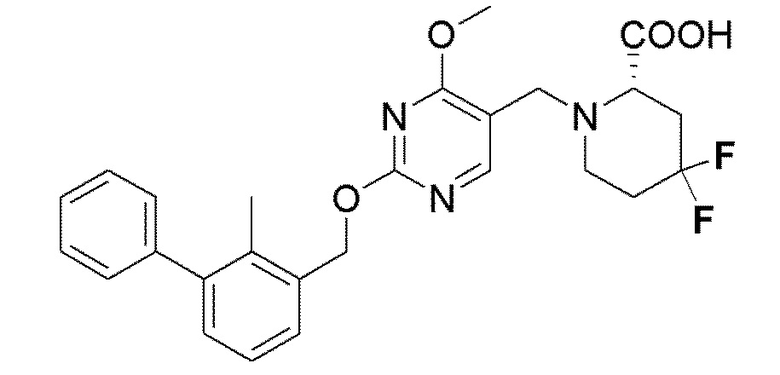
[000236] LCMS (ES) m/z=484,3 [M+H]+.
Синтез (S)-1-((4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты (Соединение 64)
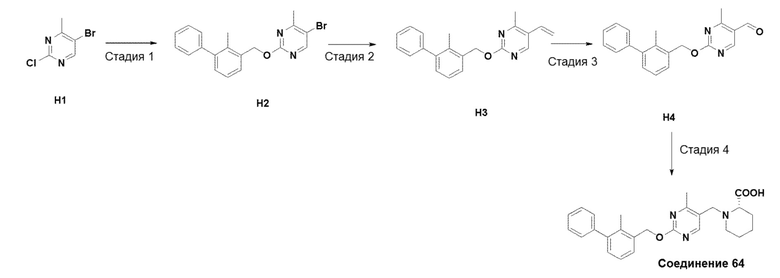
Стадия 1: Синтез 5-бром-4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидина
[000237] К перемешиваемому раствору (2-метил-[1,1'-бифенил]-3-ил) метанола (7,1 г, 0,036 моль) в DMF (60 мл) при 0°С добавляли гидрид натрия (1,73 г, 60% в минеральном масле, 0,043 моль) и перемешивали при комнатной температуре в течение 30 минут. К этой смеси добавляли 5-бром-2-хлор-4-метилпиримидин (5 г, 0,024 моль) и оставляли перемешиваться при комнатной температуре в течение 16 часов. После завершения реакции реакционную смесь разбавляли водой (50 мл) и экстрагировали этилацетатом (2×100 мл). Объединенный органический слой сушили над сульфатом натрия, фильтровали и упаривали, получая неочищенный продукт. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 100-200 меш), с использованием 10% этилацетата в гексане в качестве элюента, с получением 5-бром-4-метил-2-((2-метил-[1,1'-бифенил)]-3-ил)метокси)пиримидина в виде не совсем белого твердого вещества (выход: 1,5 г, 17%).
LCMS (ES) m/z=369,01 [M+H]+; 1H ЯМР (400 МГц, CDCl3): δ 2,31 (с, 3Н), 2,58 (с, 3Н), 5,47 (с, 2Н), 7,21-7,23 (м, 2Н), 7,25-7,30 (м, 2Н), 7,35 (м, 1Н), 7,39-7,43 (м, 2Н), 7,49 (м, 1Н), 8,47 (с, 1Н); чистота по HPLC при 214 нм: 99,78%.
Стадия 2: Синтез 4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидина
[000238] К перемешиваемому раствору 5-бром-4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидина (1/5 г, 0,0041 моль) в DMF (20 мл) добавляли трибутилвинилолово (3,2 г, 0,011 моль), и реакционную смесь дегазировали газообразным азотом в течение 10 минут. К этой смеси добавляли Pd(PPh3)4 (0,46 г, 0,4 ммоль) и реакционную смесь нагревали при 100°С в течение 2 часов. После завершения реакции реакционную смесь фильтровали через целит, фильтрат разбавляли водой (50 мл) и экстрагировали этилацетатом (2×100 мл). Объединенный органический слой сушили над сульфатом натрия, упаривали, и неочищенный продукт очищали с помощью хроматографии на Combiflash, используя 25% этилацетат в гексане в качестве элюента, с получением 4-метил-2-((2-метил-[1,1'-бифенил).]-3-ил)метокси)-5-винилпиримидина в виде желтоватой жидкости (выход: 1,2 г, 92%).
LCMS (ES) m/z=317,42 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6): δ 2,20 (с, 3Н), 2,46 (с, 3Н), 5,30 (д, J=11, 2 Гц, 1Н), 5,45 (с, 2Н), 5,78 (д, J=17,6 Гц, 1Н), 6,82 (м, 1Н), 7,19 (м, 1Н), 7,25-7,32 (м, 3Н), 7,36-7,39 (м, 1Н), 7,43-7,47 (м, 3Н), 8,67 (с, 1Н); чистота по HPLC при 214 нм: 99,04%.
Стадия 3: Синтез 4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида
[000239] К перемешиваемому раствору 4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-5-винилпиримидина (0,9 г, 0,003 моль) в THF (25 мл) и воде (25 мл) при 0°С добавляли OsO4 (42 мл, 2,5 мас. % раствор в трет-бутаноле, 0,0042 моль), и перемешивали в течение 15 минут. К этой смеси добавляли NaIO4 (0,89 г, 0,0042 моль), и реакционную смесь оставляли перемешиваться при комнатной температуре в течение 5 часов. После завершения реакции реакционную смесь разбавляли водой (50 мл) и экстрагировали DCM (2×50 мл). Органический слой сушили над сульфатом натрия, фильтровали и упаривали, получая неочищенный продукт. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель, 100-200 меш), используя 20% этилацетат в гексане в качестве элюента, с получением 4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида в виде не совсем белого твердого вещества (выход: 0,64 г, 73%).
LCMS (ES) m/z=319,36 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ 2,22 (с, 3Н), 2,73 (с, 3Н), 5,57 (с, 2Н), 7,21 (м, 1Н), 7,27-7,33 (м, 3Н), 7,38 (м, 1Н), 7,46 (м, 3Н), 8,99 (с, 1Н), 10,12 (с, 1Н); чистота по HPLC при 214 нм: 97,18%.
Стадия 4: Синтез (S)-1-((4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты
[000240] К раствору 4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-карбальдегида (0,2 г, 0,62 ммоль) в МеОН (2 мл) и DMF (2 мл) одновременно добавляли (S)-пиперидин-2-карбоновую кислоту (73 мг, 0,56 ммоль) и уксусную кислоту (1 капля), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. К этой реакционной смеси добавляли NaCNBH3 (110 мг, 1,86 ммоль) и продолжали перемешивание при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли водой (10 мл) и экстрагировали 10% МеОН в DCM (2×10 мл). Объединенный органический слой промывали водой (3 мл) и солевым раствором (3 мл), сушили над сульфатом натрия и концентрировали, получая неочищенный продукт, который очищали с помощью препаративной TLC, используя 10% метанол в дихлорметане в качестве элюента, с получением (S)-1-((4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновой кислоты в виде белого твердого вещества (выход: 90 мг, 35%).
LCMS (ES) m/z=432,25 [М+Н]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,33-1,42 (м, 4Н), 1,72 (м, 2Н), 2,16 (м, 1Н), 2,20 (с, 3Н), 2,49 (с, 3Н), 2,78 (м, 1Н), 3,08 (м, 1Н), 3,39 (м, 1Н), 3,75 (м, 1Н), 5,41 (с, 2Н), 7,18 (м, 1Н), 7,25-7,32 (м, 3Н), 7,37 (м, 1Н), 7,43-7,47 (м, 3Н), 8,31 (с, 1Н); чистота по HPLC при 214 нм: 99,20%.
[000241] Соединение 65 получали способом, аналогичным способу, описанному выше для соединения 64.
N-(2-(((4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 65)
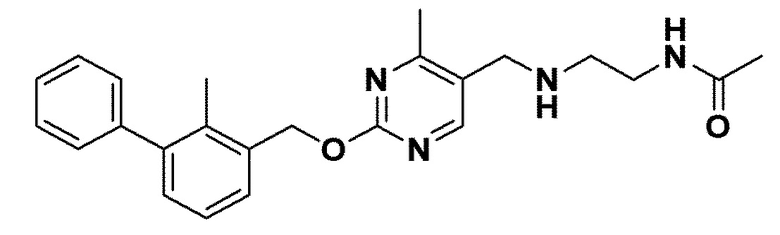
[000242] LCMS (ES) m/z=405,24 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6): δ 1,78 (с, 3Н), 2,20 (с, 3Н), 2,45 (с, 3Н), 2,55 (м, 2Н), 3,13 (м, 2Н), 3,64 (с, 2Н), 5,42 (с, 2Н), 7,18 (м, 1Н), 7,25-7,32 (м, 3Н), 7,37 (м, 1Н), 7,43-7,47 (м, 3Н), 7,77 (шир.с, 1Н), 8,37 (с, 1Н); чистота по HPLC при 214 нм: 98,84%.
Пример 5
Общие процедуры для биологических оценок
Анализ фермента PD-L1: анализ связывания с использованием метода гомогенной флуоресценции с временным разрешением (HTRF)
[000243] Все исследования связывания выполняли с использованием набора для анализа связывания PD-1/PD-L1 от CisBio (№ по каталогу 63ADK000CPAPEG), в соответствии с протоколом производителя. Взаимодействие между Tag1-PD-1 и Tag2-PD-1 детектировали с использованием антител анти-Tag1-Eu3+ (донор HTRF) и анти-Tag2-XL665 (акцептор HTRF). Когда донорные и акцепторные антитела входили в непосредственную близость благодаря связыванию PD-1 и PD-L1, возбуждение донорного антитела вызвало передачу энергии флуоресцентного резонанса (FRET) к акцепторному антителу, которое, в свою очередь, специфически излучало свет при длине волны 665 нм. Этот специфический сигнал прямо пропорционален взаимодействию PD-1/PD-L1. Соединения, блокирующие взаимодействие PD-1/PD-L1, вызывают снижение сигнала HTRF. Необходимые реагенты смешивали в следующем порядке: 2 мкл соединения (или буфера-разбавителя), 4 мкл белка PD-L1, 4 мкл белка PD-1. После 15-минутной инкубации добавляли 5 мкл антитела анти-Tag1-Eu3+ и 5 мкл антитела анти-Tag2-XL665. Планшет закрывали и инкубировали при комнатной температуре в течение 1 часа. Флуоресцентное излучение считывали на двух различных длинах волн (665 нм и 620 нм) на мультипланшетном ридере BMG PheraStar®. Результаты, полученные от сигналов флуоресценции при 665 нм и 620 нм, использовали для расчета соотношения HTRF=(665 нм/620 нм)×104. Оценка биологической активности:
[000244] В Таблице 1, приведенной ниже, показана биологическая активность соединений по изобретению, определенная в анализе ингибирования PD1/PD-L1. Соединения, имеющие IC50<100 нМ, обозначены как «А»; 100-500 нМ обозначены как «В»; и >500 нМ обозначены как «С», соответственно.
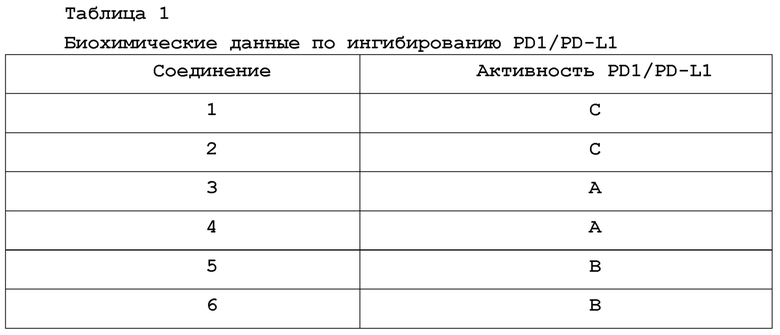
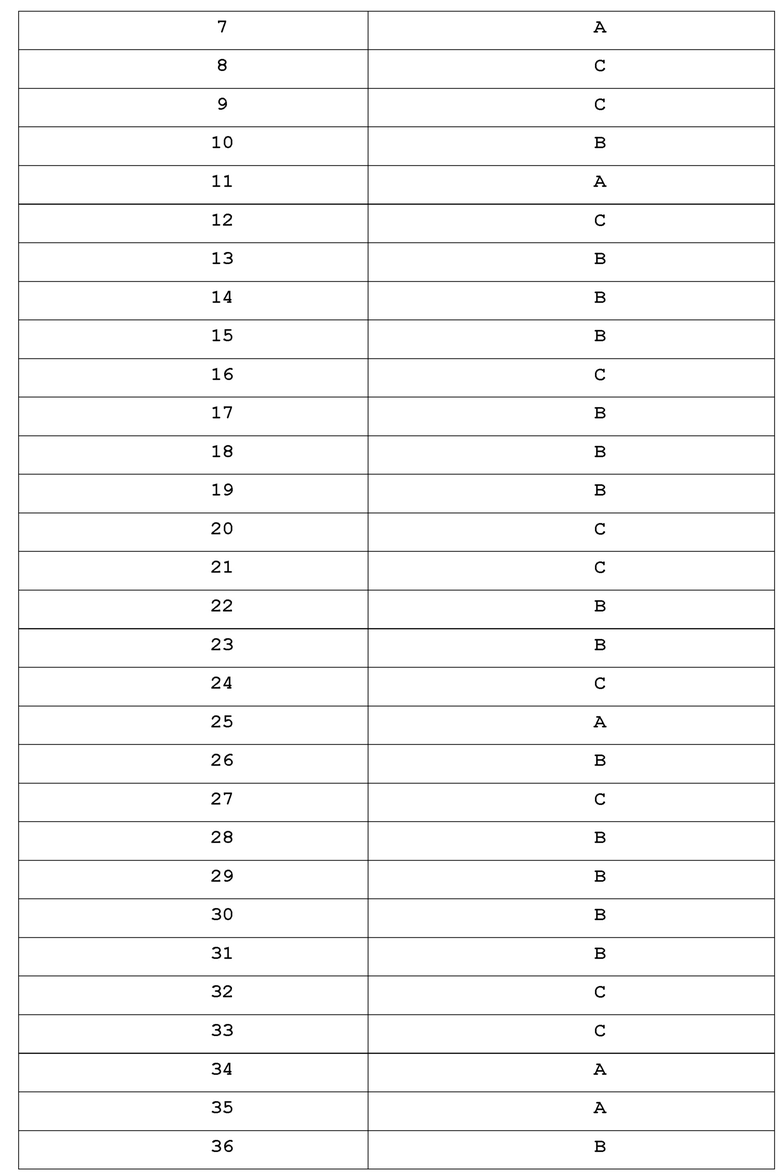

[000245] В Таблице 1 показаны результаты, что большинство испытанных соединений эффективно блокируют PD1/PD-L1 при их оценке методом анализа связывания с гомогенной флуоресценцией во времени (HTRF). Значения IC50 показывают эффективность соединений в отношении ингибирования активации PD1/PD-L1. Значение IC50 указывает, какое количество конкретного лекарства или соединения необходимо для ингибирования взаимодействия PD1/PD-L1 на 50%. Низкое значение IC50 означает высокую ингибирующую эффективность испытуемого соединения (соединения 1-65, описанные выше). В приведенной выше Таблице 1 уровень эффективности обозначен буквами «А», «В» и «С», где «А» соответствует наименьшему значению IC50, и, таким образом, наибольшей эффективности.
[000246] Указанные выше соединения имеет достаточную эффективность, чтобы признать их потенциал для использования в качестве лекарственных средств по снижению активности PD1/PD-L1, и, таким образом, их приемлемости для лечения рака и других заболеваний или состояний, связанных с активацией PD1/PD-L1.
Пример 6
Оценка фармакокинетики Соединения 45: общие сведения о проведении экспериментов на животных
[000247] Ведомственный комитет по уходу и этике использования животных (IAEC) Jubilant Biosys (IAEC/JDC/2018/158), назначенный государственным Комитетом по контролю и надзору за экспериментами на животных (CPCSEA), одобрил фармакокинетические эксперименты на мышах. Самцов мышей Balb/c (возраст ~ 6-8 недель, диапазон массы тела 22-25 г) закупали в Vivo Biotech, Хайдарабад, Индия. Животных помещали на карантин в животнике Jubilant Biosys Animal House в течение 7 дней с циклами свет:темнота 12:12 час., и до исследования животных распределяли в соответствии с массой тела. Животные имели свободный доступ к корму (Altromin Spezialfutter GmbH& Co. KG., Im Seelenkamp 20, D-32791, Lage, Germany) и воде ad libitum.
[000248] Внутривенное и пероральное исследование фармакокинетики проводили для доз 2 и 10 мг/кг, при объеме дозы 10 мл/кг. Серийные образцы крови (200 мкл) отбирали из ретроорбитального сплетения в моменты времени, соответствующие 0,083 (только для в/в), 0,15, 0,5, 1, 2, 4, 8, 10 (только для п/о) и 24 часа. Образцы крови собирали в пробирки, содержащие K2EDTA в качестве антикоагулянта, и для разделения плазмы их центрифугировали в течение 5 минут при 14000 об/мин в центрифуге с охлаждением (Biofuge, Heraeus, Germany) при 4°С.
[000249] Группа I (пероральное введение, п/о) (масса тела 22-25 г) получала соединение 45 в дозе 10 мг/кг (суспензионная композиция, приготовленная с использованием 0,5% метилцеллюлозы и Твин-80; объем дозы: 10 мл/кг), тогда как группа II (масса тела 24-25 г) получала внутривенно (в/в) соединение 45 [5% DMSO, 5% солутол:абсолютный спирт (1:1/ об./об.) и 90% физиологического раствора; нагрузка: 0,2 мг/мл; объем дозы: 10 мл/кг] при дозе 2,0 мг/кг. После дозирования отбирали серийные образцы крови (200 мкл), проводили выборочный отбор проб (для забора крови в каждый момент времени использовали трех мышей) через регулярные промежутки времени с использованием гепаринизированных капилляров для забора крови через ретроорбитальное сплетение в полипропиленовые пробирки, содержащие раствор K2EDTA в качестве антикоагулянта. Животных допускали к корму через 2 часа после введения дозы соединения 45. Данные по зависимости концентрации соединения 45 в крови во времени анализировали некомпартментным методом с использованием программного обеспечения Phoenix WinNonlin Version 7.0.
[000250] Полученные результаты приведены ниже в Таблице 2.
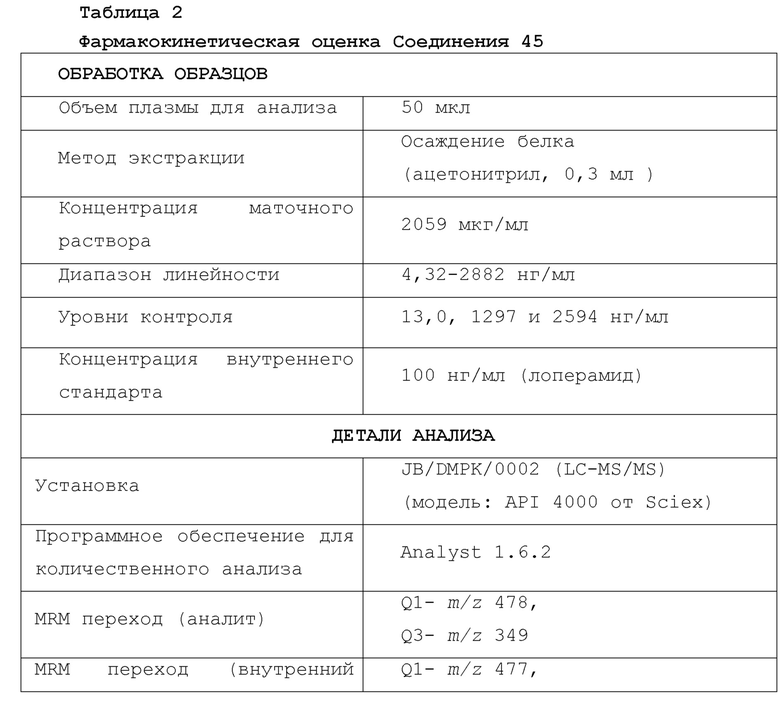
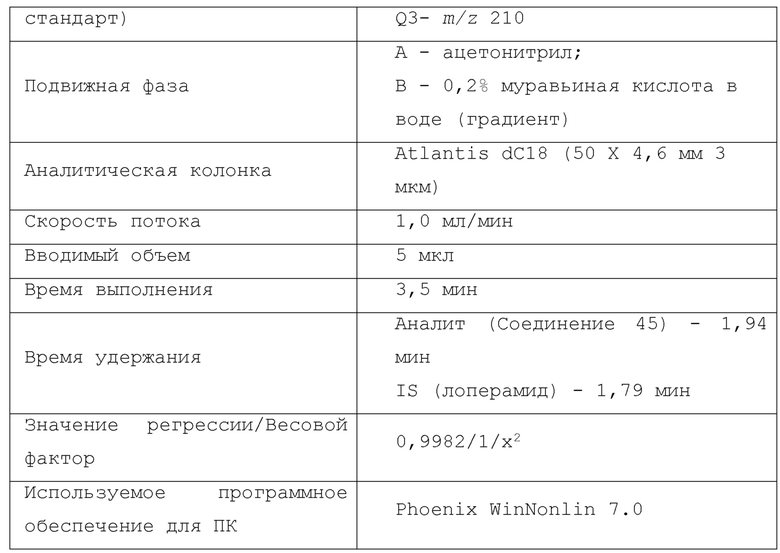
Пример 7
ADME (всасывание, распределение, метаболизм и выделение) и фармакокинетика Соединения 45
Метаболическая стабильность в микросомах печени
[000251] Процедура: калий-фосфатный буфер (66,7 мМ, рН 7,4), содержащий микросомы печени мыши или крысы, собаки или обезьяны или человека (0,5 мг/мл), предварительно инкубировали отдельно с испытуемым соединением (1 мкМ) и положительным контролем (верапамил, 1 мкМ) в водяной бане при 37°С в течение 5 минут. Реакции инициировали добавлением 20 мкл 10 мМ NADPH. Реакции без NADPH (0 и 30 минут) также инкубировали, чтобы исключить метаболизм не связанный с NADPH или химическую нестабильность в инкубационном буфере. Все реакции прекращали с использованием 200 мкл охлажденного на льду ацетонитрила, содержащего внутренний стандарт, через 0, 5, 15 и 30 минут. Флаконы центрифугировали при 3000 об/мин в течение 15 минут. Реакционные смеси (полученные из вышеуказанных исследований) извлекали, обрабатывали и анализировали с помощью LC-MS [установка серии Shimadzu SIL LC (Киото, Япония) с масс-спектрометром API-4000 (MDS Sciex, Торонто, Канада)] для контроля исчезновения соединения.
Вывод
Метаболическая стабильность Соединения 45: установлена высокая стабильность (>80%) для разных видов микросом Соединения 45 в печени у мышей, крыс, собак и человека.
Проницаемость для клеток Сасо-2
[000252] Процедура: эпителиальные клетки кишечника человека Сасо-2 высевали в двухкамерные планшеты 24-Transwell® (Millipore, Billerica, МА, США) (плотность клеток 80000 клеток/см2 в день 1). Исследования проницаемости проводились с монослоями, культивируемыми в течение 21-22 дней в культуре клеток. Целостность каждого монослоя клеток Сасо-2 была подтверждена тестом трансэпителиального электрического сопротивления (TEER) (предварительный эксперимент) и определением проницаемости эталонного соединения, т.е., люцифера желтого. Для экспериментов использовали монослои клеток Сасо-2 со значениями TEER более 500 Ом⋅см2. Дигоксин (5 мкМ) использовали в качестве положительного контроля для субстрата Р-gp. Концентрации соединения, используемого в анализе, составляли 5 мкМ. Буфер HBSS использовали в качестве среды для анализа переноса, и конечная концентрация DMSO в растворе после добавлений составляла 0,05%. Исследование двунаправленной проницаемости инициировали добавлением соответствующего объема буфера HBSS, содержащего соединение, в соответствующие апикальные и базолатеральные камеры (n=3). Аликвоту образца (100 мкл) отбирали из обеих камер в 0 и 60 минут после инкубации. К этому равному объему добавляли ацетонитрил, осторожно перемешивали и центрифугировали при 4000 об/мин в течение 10 минут. Аликвоту 100 мкл переносили в автоматический пробоотборник и для анализа методом LC-MS/MS в установку вводили 10 мкл.
Вывод:
Установлено, что Соединение 45 обладает средней проницаемостью и высоким уровнем оттока/выделения в анализе на клетках Сасо-2, и оно может быть субстратом активного переносчика оттока.
Связывание с белками плазмы
Процедура:
[000253] Для оценки способности соединения по изобретению связывать белки плазмы использовали наиболее распространенный метод анализа связывания белков плазмы с использованием равновесного диализа. Испытуемое соединение оценивали при конечной концентрации 3 мкМ в плазме крови мыши, крысы, человека или собаки. Аликвоту объемом 150 мкл плазмы, содержащей соединение, добавляли в первую половину (со стороны плазмы) лунки 96-луночного устройства для микроравновесного диализа. Аликвоту 150 мкл 100 мМ натрий-фосфатного буфера, рН 7,4, добавляли во вторую половину (со стороны буфера) лунки 96-луночного НТ-равновесного диализного устройства. Планшет, содержащий плазму и буфер, уравновешивали при 37+1°С в течение 4,5 часов с постоянным встряхиванием при 120 об/мин на орбитальном шейкере. После завершения времени инкубации из соответствующих половинок отбирали образцы. Белки осаждали с помощью органических растворителей. Образцы подвергали центрифугированию и супернатанты анализировали на установке LC-MS/MS.
Вывод:
Соединение 45 показало высокое связывание с плазмой у мышей, при наличии несвязанной фракции 0,039. Стабильность и способность к восстановлению у Соединения 45 в плазме были хорошими.
Ингибирование CYP
Процедура:
[000254] Эффективность ингибирования CYP соединением по изобретению оценивали в микросомах печени человека (получены от GIBCO Invitrogen) против CYP3A4, 2D6, 2С9, 2С19 и 1А2 способом, включающим следующие последовательные стадии. Стандартная реакционная смесь (конечный объем 300 мкл) содержала 66,7М калий-фосфатный буфер (рН 7,4), белок (концентрации 0,1, 0,25, 0,5, 0,5 и 0,5 мг/мл для CYP3A4, 2D6, 2С9 2С19 и 1А2 соответственно) и испытуемое соединение (при восьми различных уровнях концентраций в диапазоне от 0,091 до 20,0 мкМ, добавленных в 0,9 мкл раствора DMSO с конечной концентрацией DMSO 0,1%). Смеси предварительно инкубировали при 37±1°С в течение 5 минут. Реакцию (в двух повторах) инициировали добавлением 30 мкл NADPH (10 мМ). Реакцию прекращали через 10 минут добавлением 300 мкл ацетонитрила. Активность микросом печени подтверждали положительными контролями, т.е. контролируя гидроксилирование мидазолама для CYP 3A4, гидроксилирование буфуралола для CYP 2D6, гидроксилирование диклофенака для CYP 2С9, гидроксилирование омепразола для CYP2C19 и O-деэтилирование для CYP 1А2. Реакционные смеси (полученные из указанных выше исследований) извлекали, обрабатывали и анализировали с помощью метода LC-MS [установка серии Shimadzu SIL LC (Киото, Япония), соединенной с масс-спектрометром API-4000 (MDS Sciex, Торонто, Канада)].
Вывод:
Ожидаемые значения IC50 для Соединения 45 определены для CYP-специфического гидроксилирования мидазолама, буфуралола, диклофенака и омепразола для CYP 3A4, 2D6 и 2С9, соответственно. Соединение 45 не показало заметного ингибирования в отношении этих ферментов, и было обнаружено, что предсказанные значения IC50 для Соединения 45 для указанных белков составляют >10 мкМ, соответственно, что указывает на то, что он является слабым ингибитором в отношении тестируемых CYP.
Фармакокинетический профиль:
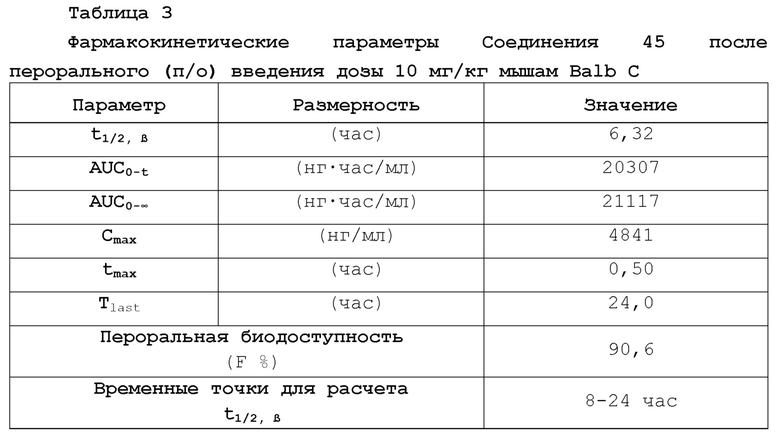
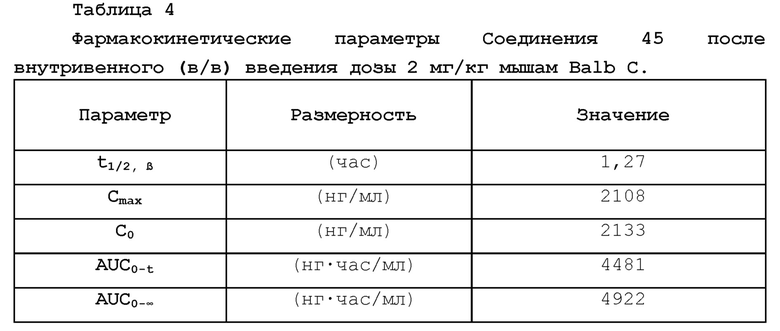
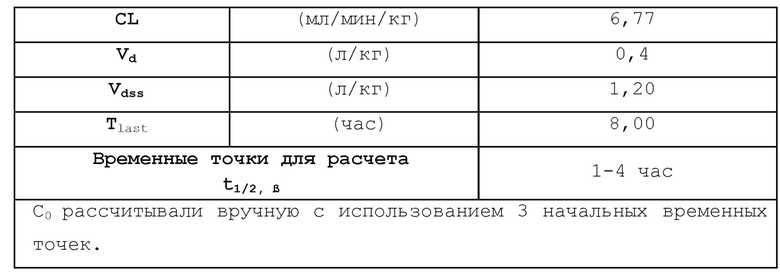
t1/2, β: конечное значение полужизни;
AUC0-t: площадь под кривой концентрация-время в плазме от нуля до последней измеряемой временной точки;
AUC0-∞: площадь под кривой концентрация-время в плазме от нуля до бесконечности;
Cmax: максимальная наблюдаемая концентрация в плазме;
tmax: время до максимальной наблюдаемой концентрации в плазме;
CL: клиренс;
С0: экстраполированная концентрация в нулевой момент времени;
Vd: объем распределения;
Vdss: объем распределения в равновесной фазе;
Tlast: время последней точки с количественно определяемой концентрацией;
F: пероральная биодоступность.
[000255] Профили концентрации соединения 45 в плазме после однократного перорального и внутривенного введения мышам. У мышей концентрации соединения 45 в плазме после внутривенного введения дозы 1 мг/кг снижались моноэкспоненциально. Клиренс составлял 6,77 мл/мин/кг [8% печеночного кровотока (HBF)]. В условиях in vivo клиренс был немного выше, чем клиренс, предсказанный на основании результатов, полученных в условиях in vitro (на микросомах). Соединение 45 имело высокий объем распределения у мышей, которое составило 0,74 л/кг, что в 40 раз превышает общий объем воды в организме (TBW). Время, соответствующее конечному значению полужизни (t1/2) составило 1,27 часов. После перорального введения максимальные концентрации в плазме (Cmax: 4841 нг/мл) достигались через 0,5 часа, что указывает на быстрое всасывание из желудочно-кишечного тракта. Конечное значение t1/2 (6,32 часа), определенное после перорального введения, было больше, чем после внутривенного введения (1,27 часа), что может указывать на множественные участки абсорбции. Значение AUC0-∞, достигаемое после введения пероральной дозы, составляло 21117 нг⋅ч/мл. Пероральная биодоступность у мышей для дозы 10 мг/кг составляла 91%.
Пример 8
Эффективность соединения 45 в условиях in vivo в почечной модели RENCA (Фигура 1)
[000256] Используемая линия клеток рака почки RENCA была закуплена в АТСС, США, и ее выращивали в рекомендуемых средах и при рекомендованных условиях культивирования. Клетки в фазе экспоненциального роста смешивали с равным объемом матригеля в соотношении 1:1, с последующей подкожной имплантацией клеток (1×106 клеток/100 мкл) в правый бок иммунокомпетентных мышей Balb/c (1 инъекция на мышь). Опухолевые клетки приживлялись в месте инъекции в течение 1-2 недель после имплантации, и лечение начинали путем рандомизации мышей в исследуемые группы (N=10), когда средний объем опухоли достигал 100 мм3. Мыши с опухолью получали носитель (перорально, п/о), носитель (интраперитонеально, и/п), соединение В (перорально, в дозе 30 мг/кг, два раза в день) или моноклональное антитело (mAb) анти-PD-L1 (клон 10F.9G2, BioXcell) в дозе 0,1 мг/мышь, в режиме Q4D. Объем опухоли и массу тела мыши измеряли три раза в неделю во время лечения, пока объем опухоли не достигал максимума, составляющего 2000 мм3. Объем опухоли (мм3) рассчитывали с использованием формулы: (длина опухоли) × (ширина опухоли)2/2. Для оценки фармакокинетических параметров соединения В в конце исследования выделяли плазму и опухоли, которые подвергали анализу. Ингибирование роста опухоли (TGI) рассчитывали после нормализации объема опухоли в данный день (TVFinal) / по сравнению с объемом в день 1 (TVInitial) / по приведенной ниже формуле:
% TGI = [1-(TVFinal (при лечении) - TVInitial (при лечении)) / (TVFinal (носитель) - TVInitial (носитель))] × 100
[000257] Как показано на Фиг. 1, соединение 45 показало лучшую или аналогичную эффективность, по сравнению с моноклональным антителом анти-PD-L1 (mAb анти-PD-L1), при пероральном введении (п/о). Во время лечения не наблюдалось значительного снижения массы тела.
Преимущества и технические результаты
[000258] Низкомолекулярные соединения по изобретению достаточно стабильны в микросомах печени мыши, крысы и собаки, и имеют очень хорошую растворимость. Эти соединения показали очень хорошее действие при пероральном введении, и они эффективны в сингенной модели при пероральном введении. Некоторые побочны эффекты, связанные с токсичностью, которые наблюдали из-за низкого клиренса при использовании моноклонального антитела анти-PD-L1, можно преодолеть с помощью низкомолекулярных соединений по изобретению.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ ПИРИМИДИН-4,6-ДИАМИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2022 |
|
RU2834353C2 |
| ИНГИБИТОР, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ ПРОИЗВОДНОЕ ПИРИДАЗИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2807611C2 |
| СОЕДИНЕНИЕ, НАЦЕЛЕННОЕ НА БЕЛОК И ЕГО ДЕГРАДАЦИЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2829459C1 |
| ФАРМАЦЕВТИЧЕСКИЕ СОЕДИНЕНИЯ | 2009 |
|
RU2553451C2 |
| СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ TRPM8 | 2012 |
|
RU2563030C2 |
| СОЕДИНЕНИЯ-ИНГИБИТОРЫ EGFR | 2017 |
|
RU2751341C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА | 2020 |
|
RU2839897C2 |
| НОВЫЕ АНТИГЕЛЬМИНТНЫЕ ХИНОЛИН-3-КАРБОКСАМИДНЫЕ ПРОИЗВОДНЫЕ | 2017 |
|
RU2772283C2 |
| НОВЫЙ КЛАСС СЕЛЕКТИВНЫХ АГОНИСТОВ СОМАТОСТАТИНОВЫХ РЕЦЕПТОРОВ | 2014 |
|
RU2603962C2 |
| КЛАСС КОНДЕНСИРОВАННЫХ КОЛЬЦЕВЫХ СОЕДИНЕНИЙ И ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2021 |
|
RU2831125C1 |
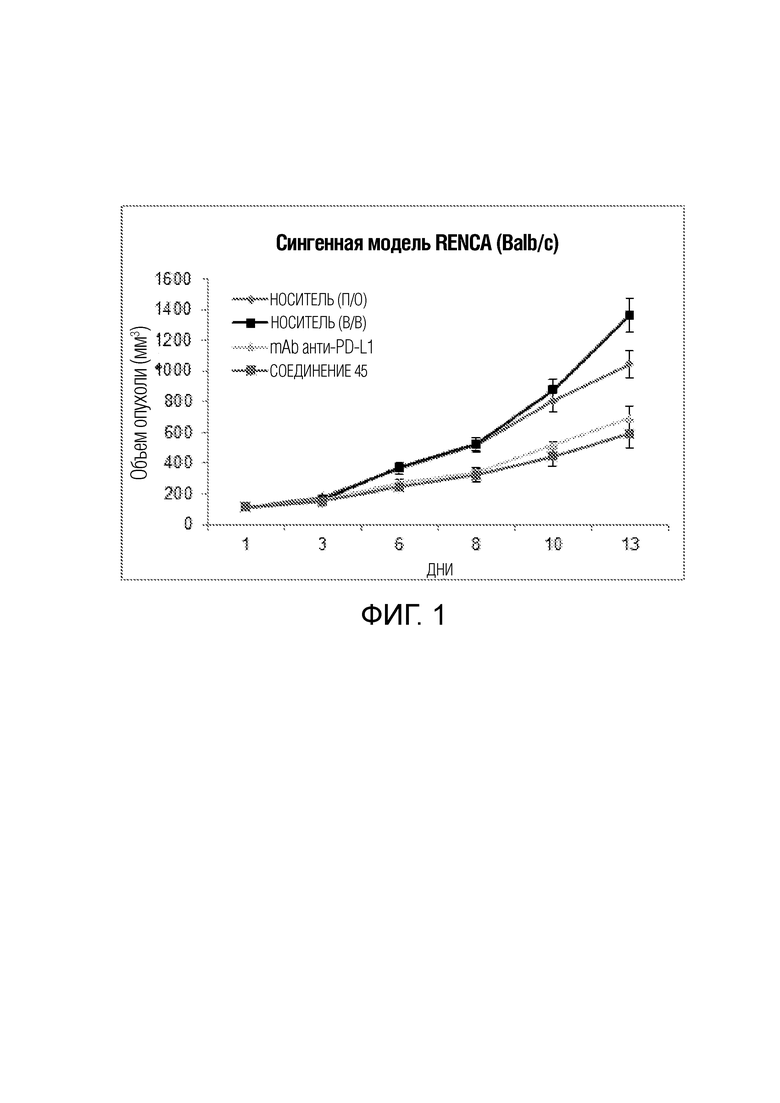
Изобретение относится к новым соединениям формулы I, его стереоизомерам и их фармацевтически приемлемым солям, где R1, R2, R3 и R4 независимо выбраны из водорода, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C6 арила и 6 или 10-членного моноциклического или бициклического гетероарила с 1-2 гетероатомами, выбранными из N или O, где C1-10 алкил, C6 арил и 6 или 10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила или C1-6 алкокси, где C1-6 алкокси необязательно замещен C4-5 гетероциклилом с одним гетероатомом азота, где C4-5 гетероциклил необязательно замещен одной или более группами, выбранными из галогена; O отсутствует или представляет собой кислород; R5 выбран из
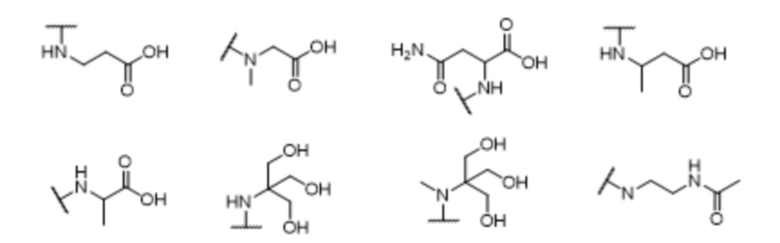
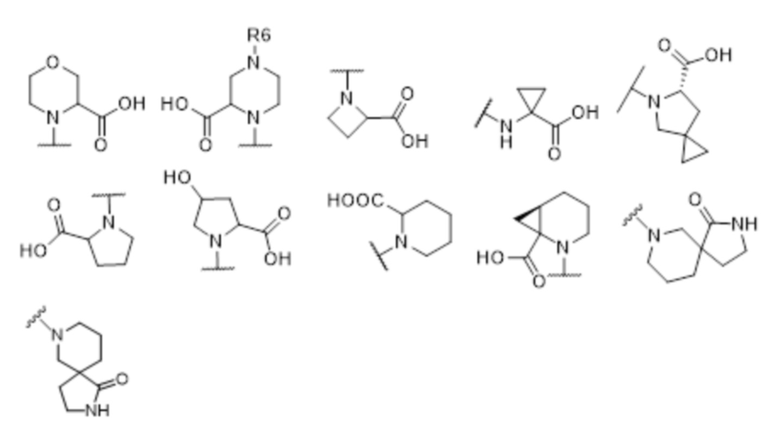
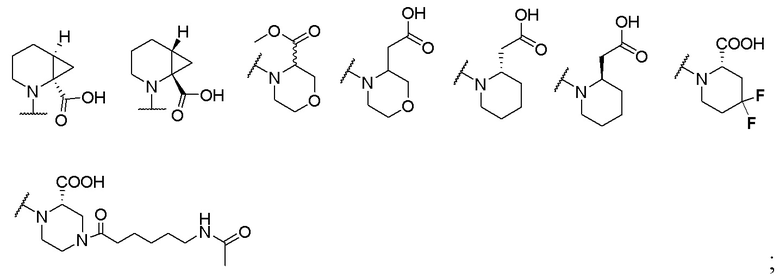 и
и
R6 выбран из группы, состоящей из водорода, C(O)C1-6 алкила. Также описан способ получения соединений формулы I. Описанные соединения представляют собой производные 2-(бензилокси)пиримидина, которые являются ингибиторами активации PD-1/PD-L1. 6 н. и 5 з.п. ф-лы, 1 ил., 4 табл., 8 пр.
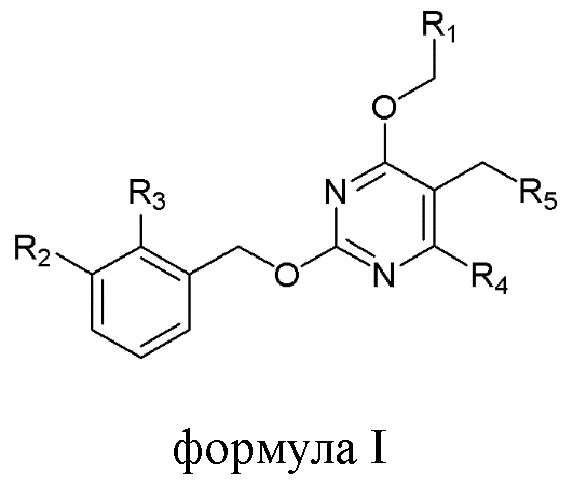
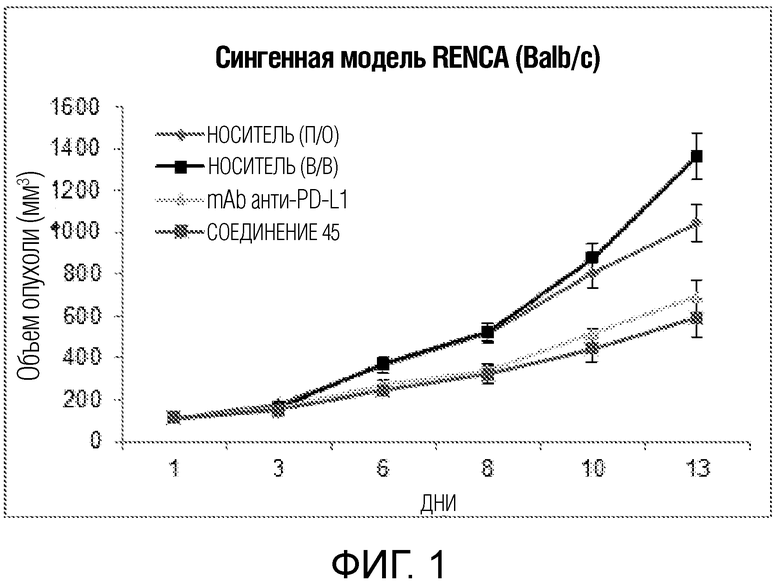
1. Соединение формулы I
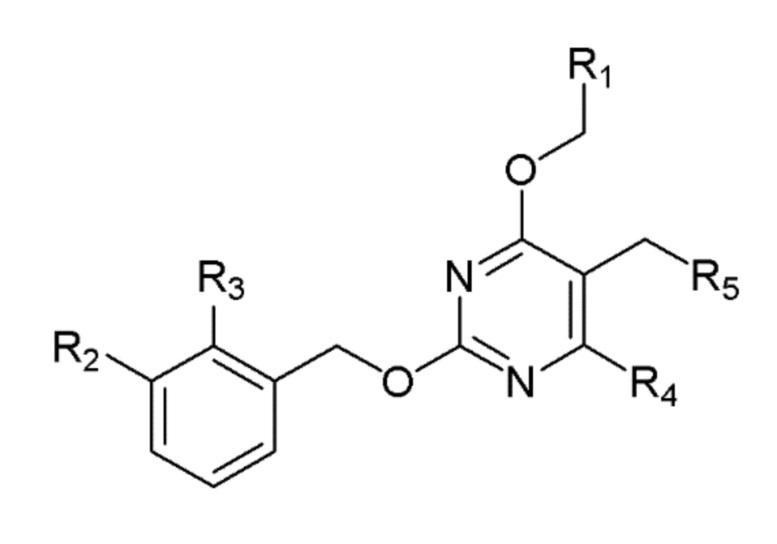
Формула I
его стереоизомеры, и их фармацевтически приемлемые соли,
где R1, R2, R3 и R4 независимо выбраны из водорода, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C6 арила и 6 или 10-членного моноциклического или бициклического гетероарила с 1-2 гетероатомами, выбранными из N или O,
где C1-10 алкил, C6 арил и 6- или 10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила или C1-6 алкокси,
где C1-6 алкокси необязательно замещен C4-5 гетероциклилом с одним гетероатомом азота,
где C4-5 гетероциклил необязательно замещен одной или более группами, выбранными из галогена;
O отсутствует или представляет собой кислород;
R5 выбран из
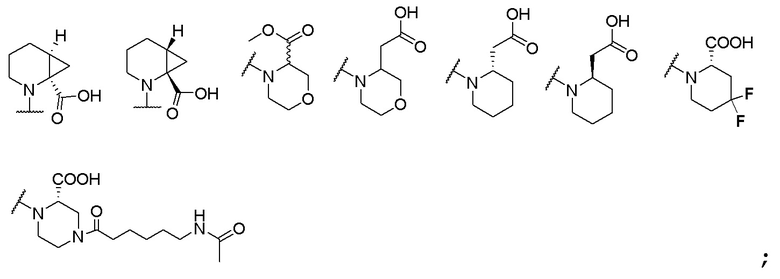 и
и
R6 выбран из группы, состоящей из водорода, C(O)C1-6 алкила.
2. Соединение формулы I по п. 1, его стереоизомеры и их фармацевтически приемлемые соли, где
R1, R2, R3 и R4 независимо выбраны из водорода, C1-6 алкила, C1-6 алкокси, C1-4 галогеналкила, C6 арила и 6- или 10-членного моноциклического или бициклического гетероарила с 1-2 гетероатомами, выбранными из N или O, где C1-6 алкил, C6 арил и 6- или 10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-4 алкила или C1-4 алкокси,
где C1-4 алкокси необязательно замещен C4-5 гетероциклилом с одним гетероатомом азота,
где C4-5 гетероциклил необязательно замещен одной или более группами, выбранными из галогена;
O отсутствует или представляет собой кислород;
R5 выбран из


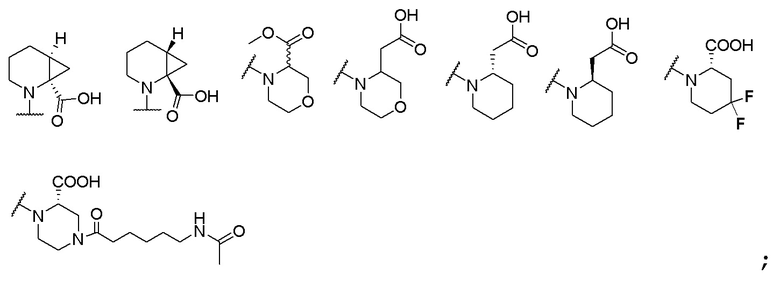 ; и
; и
R6 выбран из группы, состоящей из водорода или C(O)C1-6 алкила.
3. Соединение формулы I по п. 1, его стереоизомеры и их фармацевтически приемлемые соли, где
R1 выбран из водорода, C1-4 алкила, C6 арила и 6-членного моноциклического гетероарила с 1 гетероатомом, выбранными из N, где C1-4 алкил, C6 арил и 6-членный моноциклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-4 алкила или C1-4 алкокси;
R2 выбран из водорода, C6 арила и 10-членного бициклического гетероарила с 1-2 гетероатомами, выбранными из O, где C6 арил и 10-членный бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, фтора, гидроксила, циано, C1-4 алкила или C1-4 алкокси,
где C1-4 алкокси необязательно замещен C4-5 гетероциклилом с одним гетероатомом азота,
где C4-5 гетероциклил необязательно замещен одной или более группами, выбранными из галогена;
R3 и R4 независимо выбраны из водорода, C1-4 алкила и C1-4 алкокси;
O отсутствует или представляет собой кислород;
R5 выбран из


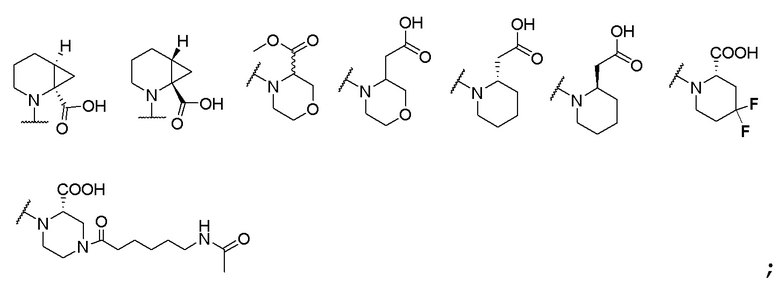 и
и
R6 выбран из группы, состоящей из водорода или C(O)C1-6 алкила.
4. Соединение или его стереоизомеры и их фармацевтически приемлемые соли, выбранное из группы, состоящей из следующих соединений:
N-(2-(((2-((4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 1),
N-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-N-метилглицин (Соединение 2),
N-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-N-метилглицин (Соединение 3),
(1R,6R)-2-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2-азабицикло[4.1.0]гептан-1-карбоновая кислота (Соединение 4),
(1S,6R)-2-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2-азабицикло[4.1.0]гептан-1-карбоновая кислота (Соединение 5),
N-(2-(((4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 6),
(S)-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 7),
S)-1-((4-((3-циано-4-фторбензил)окси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 8),
(S)-1-((2-((2-метил-[1,1'-бифенил]-3-ил)метокси)-4-(2,2,2-трифторэтокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 9),
(S)-1-((4-(4-гидроксибутокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 10),
(2S,4R)-1-((2-((3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 11),
(S)-1-((4-((5-цианопиридин-3-ил)метокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 12),
(S)-1-((2-((3'-(3-(3,3-дифторпирролидин-1-ил)пропокси)-2,2'-диметил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 13),
N-(2-(((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 14),
(R)-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 15),
(S)-1-((2-((4'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 16),
(S)-1-((2-((3'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 17),
N-(2-(((2-((3'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 18),
(S)-1-((2-((2'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 19),
N-(2-(((2-((2'-фтор-2-метил-[1,1'-бифенил]-3-ил)метокси)-4-метоксипиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 20),
N-(2-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 21),
(S)-1-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил) пиперидин-2-карбоновая кислота (Соединение 22),
1-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)циклопропан-1-карбоновая кислота (Соединение 23),
(3-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)пропионовая кислота (Соединение 24),
2-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 25),
(2-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил) (метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 26),
(S)-3-(((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)масляная кислота (Соединение 27),
((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-D-аланин (Соединение 28),
((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)аспарагин (Соединение 29),
(2R,4R)-1-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 30),
1-((4-этокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)азетидин-2-карбоновая кислота (Соединение 31),
N-(2-(((4-(бензилокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 32),
1-((4-(бензилокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 33),
(2S,4R)-1-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 34),
2-(((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 35),
((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-L-пролин (Соединение 36),
метил-4-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)морфолин-3-карбоксилат (Соединение 37),
4-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)морфолин-3-карбоновая кислота (Соединение 38),
(2S,4R)-1-((4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 39),
((S)-1-((4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 40),
2-(((4,6-диэтокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 41),
2-(((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)-2-(гидроксиметил)пропан-1,3-диол (Соединение 42),
(S)-4-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)морфолин-3-карбоновая кислота (Соединение 43),
2-(4-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)морфолин-3-ил)уксусная кислота (Соединение 44),
(S)-1-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 45),
(S)-5-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-5-азаспиро[2.4]гептан-6-карбоновая кислота (Соединение 46),
7-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2,7-диазаспиро[4.5]декан-1-он (Соединение 47),
рац-(1R,6S)-2-((4,6-диметокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2-азабицикло[4.1.0]гептан-1-карбоновая кислота (Соединение 48),
(S)-4-ацетил-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперазин-2-карбоновая кислота (Соединение 49),
(S)-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперазин-2-карбоновая кислота (Соединение 50),
(S)-5-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-5-азаспиро[2.4]гептан-6-карбоновая кислота (Соединение 51),
7-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-2,7-диазаспиро[4.5]декан-1-он (Соединение 52),
N-(2-(((4-((3-циано-4-фторбензил)окси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 53),
(2S,4R)-1-((4-((3-циано-4-фторбензил)окси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 54),
(S)-1-((2-((3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 55),
N-(2-(((2-((3-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-2-метилбензил)окси)-4,6-диметоксипиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 56),
N-(2-(((2-((3',4'-диметокси-2-метил-[1,1'-бифенил]-3-ил)метокси)-4,6-диметоксипиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 57),
((2S,4R)-1-((2-((3',4'-диметокси-2-метил-[1,1'-бифенил]-3-ил)метокси)-4,6-диметоксипиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 58),
(2S,4R)-1-((4-((5-цианопиридин-3-ил)метокси)-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)-4-гидроксипирролидин-2-карбоновая кислота (Соединение 59),
(S)-2-(1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-ил)уксусная кислота (Соединение 60),
(R)-2-(1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-ил)уксусная кислота (Соединение 61),
(S)-4-(6-ацетамидогексаноил)-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперазин-2-карбоновая кислота (Соединение 62),
(S)-4,4-дифтор-1-((4-метокси-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 63),
(S)-1-((4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)пиперидин-2-карбоновая кислота (Соединение 64) и
N-(2-(((4-метил-2-((2-метил-[1,1'-бифенил]-3-ил)метокси)пиримидин-5-ил)метил)амино)этил)ацетамид (Соединение 65).
5. Способ получения соединений формулы I по любому из пп. 1-4 или их стереоизомеров и их фармацевтически приемлемых солей, где способ включает а) взаимодействие соединений формулы IV и формулы B3 в присутствии основания, растворителя и, необязательно, реагента реакции сочетания, с получением соединений формулы V или формулы XIII; (b) обработку соединений формулы V и формулы XIII, с получением соединений формулы VII; и (c) взаимодействие соединений формулы VII с замещенными аминами в присутствии восстановителя и третьего растворителя, с получением соединений формулы I:
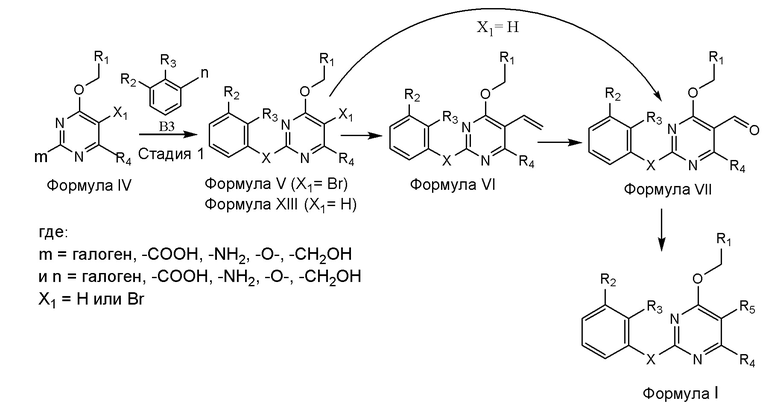
где X в формуле I, формуле V, формуле VI, формуле VII и формуле XIII выбран из -CH2O-; R1, R2, R3 и R4 в формуле I, формуле IV, формуле V, формуле VI, формуле VII и формуле XIII независимо выбраны из водорода, C1-10 алкила, C1-10 алкокси, C1-6 галогеналкила, C6 арила и 6- или 10-членного моноциклического или бициклического гетероарила с 1-2 гетероатомами, выбранными из N или O, где C1-10 алкил, C6 арил и 6- или 10-членный моноциклический или бициклический гетероарил необязательно замещены одной или более группами, выбранными из водорода, галогена, гидроксила, циано, C1-6 алкила или C1-6 алкокси, где C1-6 алкокси необязательно замещен C4-5 гетероциклилом, , где C4-5 гетероциклил необязательно замещен одной или более группами, выбранными из галогена; О в формуле I, формуле IV, формуле V, формуле VI, формуле VII и формуле XIII отсутствует или представляет собой кислород, R5 в формуле I представляет собой


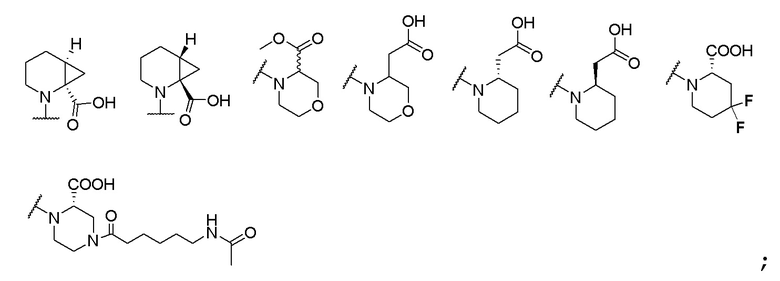 и
и
R6 выбран из группы, состоящей из водорода или C(O)C1-6 алкила.
6. Способ по п. 5, где обработка соединений формулы V, с получением соединений формулы VII включает: (а) алкенилирование соединений формулы V в присутствии второго основания и второго растворителя, с получением соединений формулы VI; и (b)окисление соединений формулы VI, с получением соединений формулы VII.
7. Способ по п. 5, где обработка соединений формулы XIII, с получением соединений формулы VII включает формилирование соединений формулы XIII, с получением соединений формулы VII.
8. Способ по любому из пп. 5-7, где реагент реакции сочетания выбран из гексафторфосфата 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазол[4,5-b]пиридиний-3-оксида (HATU), N,N'-дициклогексилкарбодиимида (DCC) или пропилфосфонового ангидрида; растворитель выбран из группы, состоящей из метанола, этанола, изопропилового спирта, трет-бутилового спирта, дихлорметана, этилацетата, диоксана, диэтилового эфира, N,N-диметилформамида, диметилсульфоксида и их комбинаций; основание выбрано из группы, состоящей из гидрида натрия, бутиллития, диизопропиламида лития, карбоната калия, карбоната цезия, триэтиламина, диизопропилэтиламина, 4-диметиламинопиридина, пиридина и их комбинаций; второе основание выбрано из группы, состоящей из бутиллития, гидрида натрия, диизопропиламида лития, карбоната калия, карбоната цезия, триэтиламина, диизопропилэтиламина, 4-диметиламинопиридина, пиридина и их комбинаций; второй растворитель выбран из группы, состоящей из N,N-диметилформамида, дихлорметана, этилацетата, диоксана, изопропилового спирта, диэтилового эфира, трет-бутилового спирта, N,N-диметилформамида, диметилсульфоксида и их комбинаций, третий растворитель выбран из группы, состоящей из уксусной кислоты, метанола, N,N-диметилформамида и их комбинаций, и восстановитель выбран из группы, состоящей из цианоборогидрида натрия, борогидрида натрия, гидрида литийалюминия, гидрида диизобутилалюминия и их комбинаций.
9. Способ лечения и/или профилактики заболеваний, связанных с активацией PD1/PD-L1, выбранных из пролиферативного расстройства или рака, включающий введение субъекту, страдающему пролиферативным расстройством или раком, терапевтически эффективного количества соединения по любому из пп. 1-4.
10. Применение соединений по любому из пп. 1-4 для лечения и/или профилактики различных заболеваний, связанных с активацией PD1/PD-L1, в том числе пролиферативного нарушения или рака.
11. Способ лечения и/или профилактики инфекционных заболеваний, связанных с активацией PD1/PD-L1, где способ включает введение субъекту, страдающему от инфекционных заболеваний, выбранных из ВИЧ, гриппа, вируса герпеса, гепатита А, гепатита В, гепатита C и гепатита D, терапевтически эффективного количества соединения по любому из пп. 1-4.
| EA 201690316 A1, 29.07.2016 | |||
| WO 2017106634 A1, 22.06.2017 | |||
| WO 2017118762 A1, 13.07.2017 | |||
| WO 8605519 A1, 25.09.1986. |
Авторы
Даты
2022-11-10—Публикация
2018-11-06—Подача