Изобретение относится к области медицины, в частности к урологии, и может быть использовано для оперативного лечения доброкачественной гиперплазии предстательной железы (ДГПЖ).
Проблема разработки эффективных хирургических методов лечения доброкачественной гиперплазии предстательной железы (ДГПЖ) занимает ключевое положение в области охраны мужской мочеполовой сферы. Современная урология располагает широким арсеналом методик, которые могут применяться для оперативного лечения ДГПЖ, что позволяет восстановить физиологическую траекторию оттока мочи во избежание переполнения и разрыва мочевого пузыря, развития и прогрессирования хронической болезни почек (ХБП), обструкции семявыводящих путей, восстановления надлежащей сексуальной функции, повышению шансов для достижения здорового долголетия (/1/ Montiel-Jarquín AJ, Gutiérrez-Quiroz CT, Pérez-Vázquez AL, Ortiz-Agustín JJ, García-Galicia A, Loría-Castellanos J. Quality of life and erectile dysfunction in patients with benign prostatic hyperplasia. Calidad de vida у disfuncion eréctil en pacientes con hiperplasia prostática benigna. Cir Cir. 2021; 89(2):218-222. doi:10.24875/CIRU.20000071).
Чреспузырная аденомэктомия - исторически наиболее старый хирургический доступ при лечении ДГПЖ. Операция может выполняться при любом размере доброкачественной гиперплазии предстательной железы, что обеспечивается за счет хирургического разреза в направлении от лобкового сочленения к пупочному кольцу, а также послойного рассечения тканей.
Основные минусы данной методики заключаются в необходимости цистотомии (разрезе стенки мочевого пузыря) для обеспечения прямого доступа к простате, приводящего обычно к развитию функциональных нарушений мочевого пузыря. Удаление ткани предстательной железы пальцевым вылущиванием сопряжено с риском массивного кровотечения из позадилобкового венозного сплетения, а также недержанием мочи в результате повреждения сфинктера. Кроме того, остающаяся зияющая раневая поверхность зачастую заживает длительное время с образованием грубого рубца (/2/ Сергиенко В.И., Петросян Э.А., Фраучи И.В. (под общей ред. Ю.М. Лопухина). Топографическая анатомия и оперативная хирургия. В 2-х томах. Том 1: учебник / 3-е изд., испр. - Москва: ГЭОТАР-Медиа, 2014. - с. 371).
В случае сочетания большого размера гиперплазированный ткани простаты и внепузырного направления, когда чреспузырный доступ не дает возможности осуществить полноценный доступ, проводят позадилонную аденомэктомию. При этом отсутствует необходимость вскрытия стенки мочевого пузыря, т.к. после послойного рассечения хирург получает возможность полноценно иссекать аденоматозные узлы и не травмировать мочевыводящие структуры. При этой операции имеется серьезный риск повреждения позадилобкового венозного сплетения с возможностью высокой кровопотери (См. /2/ Сергиенко В.И.…).
Трансуретральная резекция гиперплазии предстательной железы - ТУР (См. там же), некогда считавшаяся «золотым стандартом» лечения ДГПЖ, имеет свои недостатки. Ее высокая популярность была обусловлена сравнительно малой инвазивностью на момент внедрения (40-50 гг. XX века) в широкую практику (/3/ Sauer JS, Greenwald RJ, Bovard MA, et al. Morcellator. US Patent No. 5562694. 1996 Oct. 8, 1996), а также возможностью выполнять ее пациентам с осложненным соматическим статусом и под спинномозговой анестезией. Техника основана на манипуляции с тканью простаты посредством наблюдения через проводник, предварительно введенный в мочеиспускательный канал; что исключает необходимость травмирующих разрезов (см. /2/, /4/ Stormont G, Chargui S. Transurethral Resection Of The Prostate. In: StatPearls. Treasure Island (FL): StatPearls Publishing; July 19, 2021). Минусами данного подхода является риск повреждения мочеиспускательного канала, являющегося по своей гистологической природе нежной структурой, склонной к образованию посттравматических стриктур. Сама ТУР не является радикальной методикой, поэтому ДГПЖ потенциально сохраняет способность к рецидивированию, что повышает риск повторного вмешательства. После выполнения ТУР возможно серьезное осложнение, известное как ТУР-синдром, характеризующийся развитием гипонатриемии, гипоосмолярности, гиперволемии, застойной сердечной недостаточности, отека легких и головного мозга, гемолизом и интоксикацией компонентами орошающей жидкости (глюкоза) (/5/ Kumar V, Vineet K, Deb A. TUR syndrome - A report. Urol Case Rep. 2019 Jul 26;26:100982. doi: 10.1016/j.eucr.2019.100982. PMID: 31388497; PMCID: PMC6677916).
Современным методом хирургического лечения ДГПЖ является трансуретральная лазерная энуклеация ГПЖ. Метод основан на введении в мочеиспускательный канал лазерных проводников-световодов, обеспечивающих прижигающее действие на подлежащие удалению ткани простаты. К его достоинствам можно отнести возможность применения у больных с практически любым объемом предстательной железы (вплоть до 200 см3 и выше); и сравнительно короткий период реабилитации (2-3 дня) по сравнению с ТУ (5 дней) и открытыми вмешательством (7 дней) (/6/ Lerner LB, Rajender A. Laser prostate enucleation techniques. Can J Urol. 2015; 22 Suppl 1:53-59).
К минусам лазер-опосредованных вмешательств относятся их высокая стоимость, низкая доступность для государственного здравоохранения и высокая длительность обучения. Вследствие осуществления оперативного доступа через мочеиспускательный канал, у пациентов могут наблюдаться стриктуры мочеиспускательного канала, требующие впоследствии проведение бужирования (/7/ Rivera ME, Lingeman JE, Krambeck AE. Holmium Laser Enucleation of the Prostate. J Endourol. 2018 May; 32(S1):S7-S9. doi: 10.1089/end.2017.0710. PMID: 29774816).
Известен способ профилактики интраоперационного кровотечения во время проведения эндовидеохирургической аденомэктомии (/8/ Патент РФ №2763253, приоритет от 05.07.2021 г.). Способ заключается в том, что после осуществления позадилонного доступа к простате посредством введения в позадилонное пространство оптического троакара и двух рабочих троакаров и инсуфляции углекислого газа в позадилонное пространство, выделяют переднюю поверхность предстательной железы с переходом на тазовую фасцию латерально с обеих сторон, тазовую фасцию рассекают по латеральной поверхности предстательной железы до пубопростатических связок с одной и другой стороны, мобилизуют область дорзального сосудисто-венозного комплекса предстательной железы, на который накладывают сосудистый зажим, заведенный через 10 мм троакар, затем производят поперечный разрез передней поверхности капсулы предстательной железы на 1,5-2 см ниже и проксимальнее пубопростатических связок длиной 5-7 см, выделяют слой между капсулой и аденоматозной тканью правой и левой долей предстательной железы; затем тупым способом и с помощью аппарата THUNDERBEAT отсекают аденоматозные узлы, узлы погружают в контейнер; затем производят коагуляцию мелких сосудов биполярной коагуляцией, после удаления аденоматозных тканей производят фиксацию задней стенки мочевого пузыря с уретрой проксимальнее на 1 см семявыносящего бугорка непрерывной нитью V-Loc с иглой 5/8 длиной 15 см, производят «тригонизацию» задней стенки мочевого пузыря с последующим выколом иглы на переднюю поверхность верхнего листка капсулы предстательной железы и производят ушивание по правой полуокружности капсулы предстательной железы с захватом стенки мочевого пузыря по боковой, с переходом на переднюю поверхность, симметрично выполняют ушивание тканей с левой стороны; удаляют сосудистый зажим с дорзального комплекса; осуществляют контроль герметичности анастомоза; затем контейнер извлекают; в позадилонное пространство устанавливают трубчатый дренаж; накладывают швы на кожу, производят обработку йодом и наложение асептической повязки.
Здесь под «тригонизацией» (Тригональный [лат. trigonalis] - треугольный. Словарь иностранных слов. - М.: Изд. Русс. яз., 1986, стр. 507) подразумевается «точечная» фиксация слизистой мочевого пузыря от треугольной области Льето - у задней стенки мочевого пузыря - к уретре, такая фиксация по определению является частичной или точечной фиксацией слизистой мочевого пузыря.
Недостатки аналога. При выделении дорзального сосудисто-венозного комплекса есть опасность повреждения хрупких сосудов, что может привести к дополнительному кровотечению. Предлагаемое в аналоге решение уменьшения интраоперационной кровопотери анатомически недостаточно обосновано и не профилактирует снижение кровотечения, эти сосуды являются периферическими структурами относительно предстательной железы. Поэтому остаются основные источники интраоперационного кровотечения.
Также недостатком является момент снятия зажима с дорзального комплекса, когда поверхность капсулы предстательной железы уже зашита и отсутствует возможность контроля и коагуляции кровотечения внутри нее. При этом сохраняющееся кровотечение во время хирургических манипуляций приводит к существенной (до 500-700 мл) кровопотере, и как следствие, к более длительному периоду реабилитации, в ряде случаев, остается необходимость гемотрансфузии (переливание крови), возможность инфаркта или инсульта.
Недостаток тригонизации заключается в том, что, ввиду неполного закрытия раневой поверхности, кровотечение в просвет мочевого пузыря сохраняется в послеоперационный период, что тяжело контролировать и требуется содержание пациента в палате интенсивной терапии. Соответственно, необходимая длительная катетеризация (послеоперационно 7-14 дней) по сравнению с предлагаемым способом (с герметичным анастомозом и с катетеризацией до 3-4-х дней), приводит к увеличению сроков госпитализации, что увеличивает финансовые затраты на пациента.
В связи с сохраняющейся высокой кровопотерей сохраняется более длительная нетрудоспособность пациента.
Известен способ экстраперитонеоскопической аденомэктомии предстательной железы объемом более 80 см3 (/9/ Патент РФ №2667612, приоритет от 28.02.2017), принятый в качестве прототипа. Способ включает в себя доступ к аденоме предстательной железы и удаление аденомы, при этом перед выполнением экстраперитонеоскопической аденомэктомии определяют объем предстательной железы, ее форму, факт наличия «средней доли», оценивают состояние мочевого пузыря и верхних мочевых путей, затем при положении пациента на спине под общей комбинированной анестезией устанавливают в стерильных условиях уретральный катетер, выполняют ниже пупочного кольца по средней линии разрез длиной 2 см кожного покрова, подкожной клетчатки и апоневроза, в котором указательным пальцем формируют в предбрюшинном пространстве в направлении лонного сочленения полость, формирование которой завершают с использованием баллона-диссектора, после удаления которого в сформированную полость устанавливают в предбрюшинном пространстве 10 мм оптический троакар, на разрез апоневроза накладывают Z-образный шов и затягивают, через установленный 10 мм оптический троакар в предбрюшинное пространство подают углекислый газ под давлением 12-14 мм рт.ст. и вводят эндоскоп с видеокамерой, обеспечивающей контроль хода оперативного вмешательства, изображение с которой выводят на мониторы, затем, не повреждая нижних эпигастральных сосудов, слева по среднеключичной линии на 2-4 см ниже установленного 10 мм оптического троакара устанавливают 10 мм троакар и размещают в нем ультразвуковой диссектор, дополнительно устанавливают три 5 мм инструментальных троакара с возможностью установки в верхнем их них лапароскопического зажима, в нижнем из них аспиратора, затем с использованием ультразвукового диссектора мобилизуют переднюю поверхность предстательной железы от жировой клетчатки, выполняют в средней части предстательной железы разрез ее капсулы в поперечном направлении длиной 5-7 см с одновременным выполнением ультразвуковой коагуляции мелких сосудов и биполярной коагуляции крупных сосудов, по всей длине разреза капсулы формируют пространство между капсулой простаты и узлами аденомы с коагуляцией сосудов и визуализацией операционного поля с использованием аспиратора, выполняют последовательную энуклеацию аденоматозных узлов от основания, боковых поверхностей и верхушки капсулы простаты с ее правой и левой стороны с выполнением коагуляции простатических артерий и более мелких сосудов и с тракцией узлов лапароскопическим зажимом попеременно вправо, влево, вверх и вниз в области основания простаты и шейки мочевого пузыря, после удаления уретрального катетера, удаляют простатический отдел уретры с выполнением монополярной коагуляции ложа аденомы пуговчатым электродом в режиме «спрей», заднюю полуокружность шейки мочевого пузыря подшивают к нижней полуокружности уретры с выполнением тригонизации ложа простаты, вновь устанавливают уретральный катетер, ушивают разрез капсулы простаты интракорпоральным швом, дренируют предбрюшинное пространство, энуклеированные узлы аденомы простаты размещают в эндоскопическом пластиковом контейнере, который затем удаляют после удаления оптического троакара через расширенный околопупочный разрез, удаляют все инструменты и троакары, накладывают послойный шов на раны. Кроме того, удаление средней доли простаты выполняют через выполненный разрез капсулы простаты, за счет поэтапной тракции вправо, влево, вверх и вниз, при удалении средней доли отсекают часть слизистой мочевого пузыря, оставшейся на средней доле, с коагуляцией сосудов и контролем устьев мочеточников.
Недостатки. В прототипе решается другая задача - осуществляется экстраперитонеоскопический (внебрюшинный) доступ к области предстательной железы. Такой доступ обеспечивает минимальный объем полости, заполненной газом (стесненное пространство для обзора и маневра инструментом).
Недостаток тригонизации или неполного закрытия раневой поверхности заключается в том, что в послеоперационный период сохраняется кровотечение в просвет мочевого пузыря, что тяжело контролировать и требуется содержание пациента в палате интенсивной терапии. При этом возможно потребуется гемотрансфузия (переливание крови), и существует возможность инфаркта или инсульта.
Способ по прототипу нельзя использовать у пациентов, страдающих коагулопатией, либо получающих кроворазжижающие препараты, у которых повышен риск кровотечения, как во время операции, так и в послеоперационный период. Длительная катетеризация (послеоперационно 7-14 дней) по сравнению с предлагаемым способом (3-4 дня) приводит к увеличению сроков госпитализации, что увеличивает финансовые затраты на пациента.
В связи с сохраняющейся возможностью высокой кровопотери сохраняется более длительная нетрудоспособность пациента.
Задачей изобретения является предоставление пациенту оптимального оперативного пособия, соответствующего его статусу по анамнезу и диагностическим показателям (пояснение см. ниже), уменьшение травматичности с последующим укорочением реабилитационного периода, кровоточивости хирургической раны из ткани простаты в уретру, минимизация просачивания мочи. Повышается результат лечения и минимизация побочных эффектов операции.
В данном изобретении авторы предлагают новый способ выполнения операции: лапароскопическую позадилонную аденомэктомию, дополненную уретроцистоанастомозом и временным пережатием внутренних подвздошных артерий (ВПА).
Исследование проводилось в ФГБУ "НМИЦ эндокринологии" Минздрава России, Москва, с 2020 г. по настоящее время. Получено информированное согласие пациентов на участие в исследовании.
Критериями не включения в исследование являются: отказ от участия в исследовании, противопоказания к хирургическому лечению, злокачественные новообразования половых органов и подтвержденные онкологические заболевания, терминальная стадия хронических заболеваний, острая фаза и обострение хронических инфекционных заболеваний.
Пациенты могут исключаться из исследования на любом этапе его проведения (наличие общесоматических сопутствующих хронических заболеваний в фазе декомпенсации).
Ввиду большого количества факторов, определяющих выбор того или иного метода или подхода к оперативному лечению больных с ДГПЖ, до сих пор не выработано методики, полностью удовлетворяющей решению задачи хирургом по выполнению аденомэктомии, соответственно отсутствуют четкие стандарты по выбору типа указанных операций.
Поэтому важным показателем назначения и применимости данного изобретения к каждому пациенту являются показания и противопоказания для выполнения указанного способа. С их учетом была определена категория пациентов, которым рекомендовано выполнение лапароскопической позадилонной аденомэктомии, дополненной уретроцистоанастомозом и временным пережатием ВПА.
Показания для выполнения операции:
Обструктивное мочеиспускание по причине ГПЖ.
Хроническая задержка мочеиспускания по причине ГПЖ.
Противопоказания:
Обструктивное мочеиспускание не по причине ГПЖ (стриктура уретры, нейрогенный мочевой пузырь).
Соматические противопоказания (воспалительные заболевания, невозможность проведения общей анестезии).
Специфическими противопоказаниями, характеризующими границы применения данного способа, являются проявление у пациента выраженного атеросклероза подвздошных сосудов, спаечного процесса, не позволяющих безопасно выделить сосуды, с одновременными признаками тяжести состояния пациента (нестабильное состояние, гиперкопния, ишемические проявления), не позволяющие выполнить этапы уретроцистоанастомоза (причем возможность выполнения или невыполнения этапов временного пережатия ВПА и/или уретроцистоанастомоза, оценку их длительности хирург определяет по конкретному состоянию пациента в текущий период, вплоть до начала операции), а также техническая невозможность выполнить анастомоз, в силу анатомических или эргономических причин (узкий таз пациента, ограничения в манипуляции инструментом), или затрудненная визуализация и высокая вероятность прошивания устьев мочеточников, в силу их близости к зоне анастомоза.
Технический результат. Одновременное применение в ходе оперативного лечения ГПЖ (при лапароскопической позадилонной аденомэктомии) временного пережатия внутренних подвздошных артерий (ВПА) и уретроцистоанастомоза позволяет значительно сократить воздействие коагулирующих инструментов на ткань предстательной железы без риска кровопотери. Эти достаточно просто совместно реализуемые приемы (временное пережатие ВПА сокращает до 30 минут время операции, а уретроцистоанастомоз обеспечивает дублирующее укрытие мочевыделительной системы, ускоряет заживление раневой поверхности ложа простаты и уретры, исключая послеоперационное кровотечение), не требуют дополнительных ресурсов, как технических (простота решений, сокращение времени, значительное уменьшение времени наблюдения за пациентом), так и других. Их совместное использование является крайне эффективными для решения поставленной задачи по сравнению с известными методиками: уменьшение кровопотери (в 3-4 раза), быстрое послеоперационное восстановления пациента (3-4 дня) с уменьшением количества интра- и послеоперационных осложнений мочеполовой сферы в 2-4 раза. Как следствие увеличивается скорость заживления послеоперационной области без риска эректильной дисфункции. В заявляемом решении в основе способа лежит лапароскопический доступ, который благодаря значительному объему заполнения полости газом, дает больше возможности маневра и эргономики движения инструмента по сравнению с прототипом и др. аналогами, указанный больший объем CO2 позволяет более равномерно заполнять полость или снижать ее объем).
Для осуществления временного пережатия ВПА рассекают брюшину в проекции бифуркации наружной подвздошной артерии и ВПА справа, и то же самое выполняют слева, в области перекреста общих подвздошных артерий и мочеточников, с использованием энергетических инструментов выполняют мобилизацию обеих ВПА, ВПА берут на силиконовую держалку, выполняют гемостаз в зоне бифуркации общей подвздошной артерии, накладывают сосудистые зажимы типа «Бульдог» на ВПА справа и слева. После выполнения этапа энуклеации аденоматозных узлов зажимы снимают, при этом остается возможность контроля и коагуляции кровоточащих сосудов ложа капсулы предстательной железы (визуализация через зону разреза капсулы простаты, ушивание этого разреза выполняют позже, на другом этапе). В результате уже на этом этапе значительно снижается интраоперационная кровопотеря (не более 100 мл), уменьшается количество послеоперационных осложнений, уменьшается срок реабилитации пациента. При этом сроки госпитализации снижаются со стандартных 7-14 до 3-4 дней, что обеспечивает снижение затрат на оказание медицинской помощи.
Ввиду лучшей визуализации операционного поля (минимизации кровоточивости) значительно возрастает эффективность выполнения основных этапов операции, что отражается как в качестве, так и в уменьшении длительности проведения операции.
Основное преимущество уретроцистоанастомоза заключается в восстановлении слизистой простатического отдела мочеиспускательного тракта, что профилактирует рубцовые, склеротические изменения в этой области. Обеспечивается отсутствие стенозов и стриктур этой области, в результате, восстанавливаются нормальное функционирование мочеиспускательного канала.
Также, в связи с тем, что по результатам операции локализован раневой дефект (открытая раневая поверхность ложа простаты изолирована от уретры, закрыта анастомозом), то сроки, необходимые для катетеризации уретры, сокращаются до 3-4 дней, что отражается на времени восстановления пациента, его реабилитации. Кроме того, предотвращается возможность кровотечения в послеоперационный период, это позволяет спрогнозировать и уменьшить сроки реабилитации пациента.
При этом в предлагаемом способе аденомэктомии не является очевидным условие одновременного применения уретроцистоанастомоза и временного пережатия ВПА еще и потому, что требует подробного анализа показаний и противопоказаний (см. выше критерии включения пациентов в исследование и противопоказания) при выборе пациентов для лечения указанным способом.
В связи с совместным применением указанных приемов и значительной локализацией источников кровотечения, появилась новая категория пациентов, для которых применим данный способ, это пациенты, которые страдают коагулопатией, либо получают кроворазжижающие препараты (при значительном уменьшении кровопотери как в интра-, так и в послеоперационный период).
В итоге, предлагаемый способ обеспечивает быструю активизацию и надежную реабилитацию широкого круга больных, что имеет не только медицинское, но и социальное значение - улучшается здоровье и качество жизни пациентов.
Способ лапароскопической позадилонной аденомэктомии характеризуется следующими этапами. В предоперационный период пациент подписывает согласие на проведение операции, дополненной временным пережатием ВПА и уретроцистоанастомозом.
Предварительно определяют объем предстательной железы, ее форму, факт наличия средней доли, оценивают состояние мочевого пузыря и верхних мочевых путей, наличие дивертикулов, конкрементов и возможных новообразований мочевого пузыря.
Осуществляют эндовидеоскопический доступ, в позадилонное пространство устанавливают оптический и рабочие троакары, под общим обезболиванием создают карбоксиперитонеум, выполняют лапароскопию - осмотр брюшной полости, выполняют аденомэктомию, выделяют поверхность предстательной железы, капсулу предстательной железы рассекают в поперечном направлении, проводят контроль гемостаза, выделяют слой между капсулой и аденоматозной тканью правой и левой долей предстательной железы, аденоматозные узлы отсекают от уретры и помещают в контейнер, кроме того, при наличии, удаляют среднюю долю простаты через разрез капсулы простаты, осуществляют контроль гемостаза и коагуляцию сосудов, сопоставляют ткани шейки мочевого пузыря с уретрой, капсулу предстательной железы ушивают непрерывным швом нитью V-lock, затем контейнер извлекают.
Способ отличается тем, что указанную аденомэктомию дополняют этапами временного пережатия внутренних подвздошных артерий - ВПА и уретроцистоанастомоза,
осуществляют лапароскопический доступ, при этом устанавливают 4 рабочих троакара параректально в правой и левой подвздошных областях,
рассекают брюшину в проекции бифуркации наружной подвздошной артерии и ВПА справа, в области перекреста общей подвздошной артерии и мочеточника, с использованием энергетических инструментов выполняют мобилизацию ВПА, ВПА берут на силиконовую держалку, выполняют гемостаз в зоне работы,
рассекают брюшину в проекции бифуркации наружной подвздошной артерии и ВПА слева, в области перекреста общей подвздошной артерии и мочеточника, с использованием энергетических инструментов выполняют мобилизацию ВПА, ВПА берут на силиконовую держалку, выполняют гемостаз в зоне работы,
мобилизацию передней и боковых поверхностей предстательной железы выполняют до внутритазовой фасции, на ВПА справа и слева в области бифуркаций накладывают сосудистые зажимы типа «Бульдог»,
после рассечения капсулы предстательной железы и идентификации слоя между аденомотозными узлами правой и левой долей капсулы и ее внутренней поверхностью, узлы выделяют единым блоком, шейку мочевого пузыря смещают с преобладанием тупой диссекции, после отсечения аденоматозных узлов от уретры и помещения их в контейнер с ВПА снимают сосудистые зажимы, проводят контроль гемостаза ложа аденоматозных узлов, при наличии кровоточащих сосудов осуществляют их коагуляцию,
затем выполняют уретроцистоанастомоз: после адекватной идентификации шейки мочевого пузыря выполняют наложение анастомоза двумя нитями V-lock 3/0, между уретрой и шейкой мочевого пузыря непрерывным швом, начиная с задней стенки, от 6-ти часов условного циферблата, в противоположные стороны, до пересечения на передней поверхности анастомоза на 12-ти часах условного циферблата,
после этого устанавливают уретральный катетер Фолея №20, в мочевой пузырь вводят 150 мл физиологического раствора, с целью проверки герметичности анастомоза шейки мочевого пузыря, капсулу предстательной железы ушивают непрерывным швом нитью V-lock 3/0, ревизия раны, гемостаз, контейнер с макропрепаратами удаляют через супраумбиликальный доступ.
В малый таз через контрапертуру устанавливают страховой дренаж. Послойно ушивают рану. Асептическая наклейка.
Осуществление предложенного способа лапароскопической позадилонной аденомэктомии, дополненной уретроцистоанастомозом и временным пережатием внутренних подвздошных артерий - ВПА, иллюстрируется следующим клиническим примером (см. схематические изображения на фиг. 1-6).
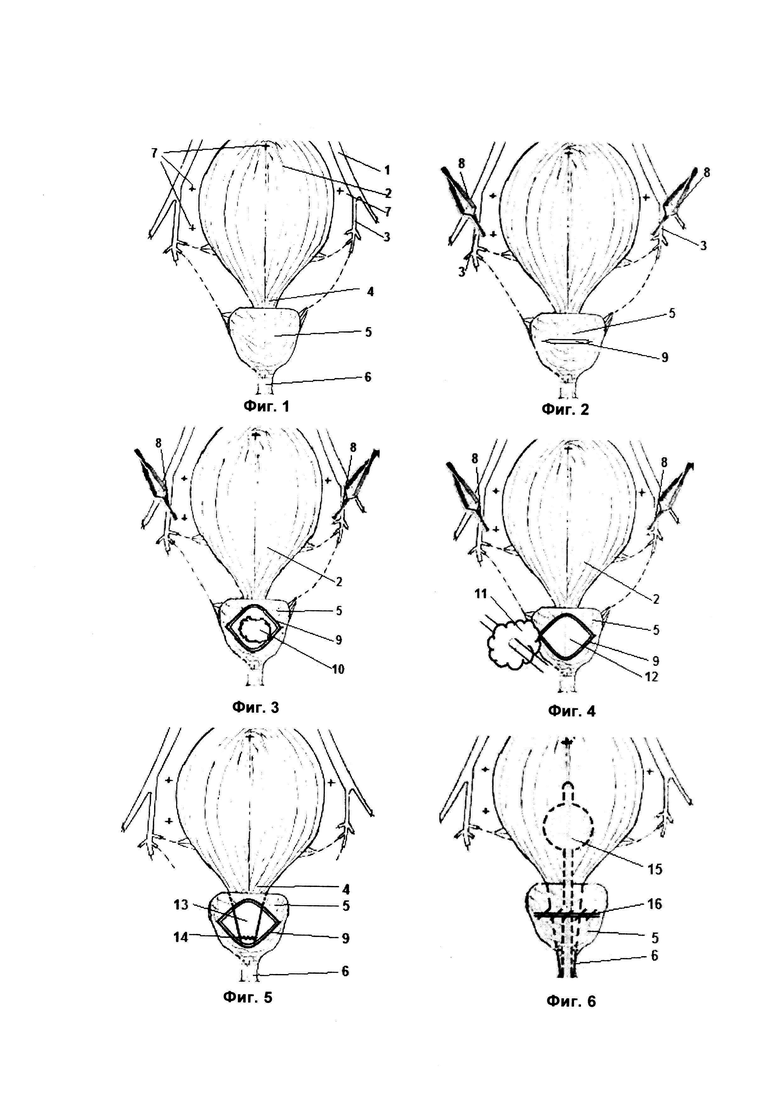
На фиг. 1 показана схема взаимоотношений мочевого пузыря, предстательной железы и подвздошных сосудов до операции и выделения анатомических структур.
Обозначения (относятся ко всем фигурам):
1 - Общая подвздошная артерия, 2 - мочевой пузырь, 3 - внутренняя подвздошная артерия (ВПА), 4 - шейка мочевого пузыря, 5 - предстательная железа, 6 - уретра, 7 - точки установки троакаров, 8 - зажим типа «бульдог», 9 - зона разреза предстательной железы 5, 10 - выделяемые аденоматозные узлы, 11 - удаляемая аденоматозная ткань, 12 - ложе предстательной железы 5, 13 - участок шейки 4 мочевого пузыря, подтягиваемый к уретре 6 для анастомоза, 14 - зона уретроцистоанастомоза, 15 - уретральный катетер, 16 - линия шва капсулы предстательной железы 5.
На фиг. 2 показаны этапы наложения зажимов 8 на ВПА 3 и разреза 9 капсулы предстательной железы 5.
На фиг. 3 показан этап выделения аденоматозных узлов 10.
На фиг. 4 показаны этап удаления аденоматозных узлов (ткани) 11 и вид ложа 12 предстательной железы 5.
На фиг. 5 показан этап наложения уретроцистоанастомоза и формирования зоны анастомоза 14, соединения тканей 13 шейки 4 мочевого пузыря с уретрой 6.
На фиг. 6 показаны этапы завершения операции с ушиванием (шов 16) капсулы предстательной железы 5 и установкой уретрального катетера 15.
Клинический пример. Пациент К., 75 лет, поступил в клинику 10.11.2021 г. с диагнозом: «Аденома предстательной железы 2 ст. Функционирующая цистостома». Методом ультразвуковой диагностики определили объем предстательной железы, ее форму, факт наличия «средней доли», оценили состояние мочевого пузыря и верхних мочевых путей, а также наличие дивертикулов, конкрементов и возможных новообразований мочевого пузыря. В просвете мочевого пузыря определяется дистальный фрагмент цистостомического дренажа, установленного в сентябре 2021 г. Аденома простаты объемом до 130 см3, почки обычно расположены, с четкими ровными контурами, толщина паренхимы в пределах возрастной нормы. Уродинамика обеих почек не нарушена. Мочеточники не визуализируются. Нарушения уродинамики верхних мочевых путей и патологии со стороны мочевого пузыря не обнаружено. Простата с четкими, ровными контурами шаровидной формы, структура неоднородная за счет гипоэхогенных узлов. Обнаружено наличие у пациента средней доли простаты. Заключение. По данным обследования больному показано оперативное лечение в объеме: лапароскопическая позадилонная аденомэктомия, дополненная временным пережатием внутренних подвздошных артерий и уретроцистоанастомозом.
12.11.2021 г. пациенту выполнена лапароскопическая позадилонная аденомэктомия, дополненная временным пережатием внутренних подвздошных артерий и уретроцистоанастомозом. Осуществляют лапароскопический доступ. Под общим обезболиванием в параумбиликальной области с помощью иглы Вереша создают карбоксиперитонеум и устанавливают оптический порт. Выполняют лапароскопию. В правой и левой подвздошных областях параректально устанавливают 4 рабочих троакара (на фиг. 1-6. Точки 7 установки троакаров показаны крестиками). Рассекают брюшину в проекции бифуркации наружной подвздошной артерии и ВПА 3 справа, в области перекреста общей подвздошной артерии 1 и мочеточника. С использованием энергетических инструментов выполняют мобилизацию ВПА 3, которую берут силиконовой держалкой. Выполняют гемостаз в зоне работы. Рассекают брюшину в проекции бифуркации наружной подвздошной артерии и ВПА 3 слева, в области перекреста общей подвздошной артерии 1 и мочеточника. С использованием энергетических инструментов выполняют мобилизацию ВПА 3, которую берут силиконовой держалкой. Выполняют гемостаз в зоне работы. Выполняют мобилизацию передней и боковых поверхностей предстательной железы 5 до внутритазовой фасции. Накладывают сосудистые зажимы 8 типа «Бульдог» на ВПА 3 справа и слева в области бифуркации, фиг. 2. Капсулу предстательной железы 5 рассекают в поперечном направлении (зона разреза 9), фиг. 2. Проводят контроль гемостаза, коагуляция кровоточащих сосудов. После идентификации слоя между капсулой предстательной железы 5 и аденоматозным узлом, узлы выделяют единым блоком 10, фиг. 3, шейку 4 мочевого пузыря смещают с преобладанием тупой диссекции. Аденоматозные узлы отсекают от уретры (ткань 11), помещают в контейнер, фиг. 4. С ВПА 3 снимают сосудистые зажимы 8. Проводят контроль гемостаза ложа 12 аденоматозных узлов. После адекватной идентификации шейки 4 мочевого пузыря выполняют наложение уретроцистоанастомоза двумя нитями V-lock 3/0, между уретрой 6 и шейкой 4 мочевого пузыря непрерывным швом 14 начиная с задней стенки (6 часов условного циферблата) в противоположные стороны, до пересечения на передней поверхности анастомоза (12 часах условного циферблата), фиг. 5, после чего устанавливают уретральный катетер Фолея №20 (обозначение 15). В мочевой пузырь вводят 150 мл физ. раствора, с целью проверки герметичности анастомоза. Капсулу предстательной железы 5 ушивают непрерывным швом 16 нитью V-lock 3/0, фиг. 6. Ревизия раны, гемостаз. Контейнер с макропрепаратами удаляют через супраумбиликальный доступ. Кровопотеря: 100 мл. В малый таз через контрапертуру устанавливают страховой дренаж. Послойно ушивают рану. Асептическая наклейка. На третьи сутки, моча светлая. Уретральный катетер удален.
Ранний послеоперационный период относительно гладкий. Проводилась антибактериальная и противовоспалительная терапия. После удаления уретрального катетера восстановилось самостоятельное мочеиспускание удовлетворительного качества. По данным контрольного ультразвукового обследования через 3 месяца нарушения уродинамики почек и остаточной мочи нет.
Список литературы
1. Montiel-Jarquín Áj, Gutiérrez-Quiroz CT, Pérez-Vázquez AL, Ortiz-Agustín JJ, García-Galicia A, Loría-Castellanos J. Quality of life and erectile dysfunction in patients with benign prostatic hyperplasia. Calidad de vida у disfunción eréctil en pacientes con hiperplasia prostática benigna. Cir Cir. 2021; 89(2):218-222. doi:10.24875/CIRU.20000071.
2. Сергиенко В.И., Петросян Э.А., Фраучи И.В. (под общей ред. Ю.М. Лопухина). Топографическая анатомия и оперативная хирургия. В 2-х томах. Том 1: учебник /.3-е изд., испр. - Москва: ГЭОТАР-Медиа, 2014. - с. 370-374.
3. Sauer JS, Greenwald RJ, Bovard MA, et al. Morcellator. US Patent No. 5562694. 1996 Oct 8, 1996.
4. Stormont G, Chargui S. Transurethral Resection Of The Prostate. In: StatPearls. Treasure Island (FL): StatPearls Publishing; July 19, 2021.
5. Kumar V, Vineet K, Deb A. TUR syndrome - A report. Urol Case Rep. 2019 Jul 26;26:100982. doi: 10.1016/j.eucr.2019.100982. PMID: 31388497; PMCID: PMC6677916.
6. Lemer LB, Rajender A. Laser prostate enucleation techniques. Can J Urol. 2015; 22 Suppl 1:53-59.
7. Rivera ME, Lingeman JE, Krambeck AE. Holmium Laser Enucleation of the Prostate. J Endourol. 2018 May; 32(S1):S7-S9. doi: 10.1089/end.2017.0710. PMID: 29774816.
8. Патент РФ №2763253, приоритет от 05.07.2021. Способ профилактики интраоперационного кровотечения во время проведения эндовидеохирургической аденомэктомии.
9. Патент РФ №2667612, приоритет от 28.02.2017. Способ экстраперитонео-скопической аденомэктомии предстательной железы объемом более 80 см.куб.
| название | год | авторы | номер документа |
|---|---|---|---|
| Лапароскопическая позадилонная аденомэктомия, дополненная временным пережатием внутренних подвздошных артерий | 2022 |
|
RU2784181C2 |
| Лапароскопическая позадилонная аденомэктомия, дополненная уретроцистоанастомозом | 2022 |
|
RU2784180C2 |
| Способ проведения радикальной роботассистированной простатэктомии с временным пережатием внутренних подвздошных артерий | 2023 |
|
RU2819718C1 |
| Способ позадилонной монопортовой аденомэктомии, дополненный непрерывным уретровезикоанастомозом с дипликатурой | 2023 |
|
RU2802851C1 |
| Способ выполнения экстрауретральной позадилонной аденомэктомии | 2022 |
|
RU2802130C2 |
| Способ везикализации ложа аденомы простаты при лапароскопической трансвезикальной аденомэктомии | 2023 |
|
RU2826615C1 |
| Способ экстраперитонеоскопической аденомэктомии предстательной железы объёмом более 80 см | 2017 |
|
RU2667612C2 |
| СПОСОБ ПРОВЕДЕНИЯ ЭНДОВИДЕОХИРУРГИЧЕСКОЙ АДЕНОМЭКТОМИИ ВНЕБРЮШИННЫМ ДОСТУПОМ С ИСПОЛЬЗОВАНИЕМ МОРЦЕЛЛЯТОРА | 2021 |
|
RU2763252C1 |
| СПОСОБ ПРОВЕДЕНИЯ ЛАПАРОСКОПИЧЕСКОГО ЧРЕЗПУЗЫРНОГО УДАЛЕНИЯ АДЕНОМЫ ПРОСТАТЫ | 2018 |
|
RU2697766C1 |
| Способ проведения робот-ассистированной лапароскопической радикальной простатэктомии с латеральной реконструкцией малого таза при лечении рака предстательной железы | 2023 |
|
RU2811659C1 |
Изобретение относится к медицине, а именно к оперативной урологии. Под общим обезболиванием в параумбиликальной области с помощью иглы Вереша создают карбоксиперитонеум и устанавливают оптический порт. Выполняют лапароскопию. В правой и левой подвздошных областях параректально устанавливают рабочие троакары. Рассекают брюшину в проекции бифуркации наружной подвздошной артерии и ВПА справа, в области перекреста общей подвздошной артерии и мочеточника. Выполняют мобилизацию ВПА, их берут на силиконовую держалку, выполняют гемостаз в зоне работы. То же выполняют слева. Выполняют мобилизацию передней и боковых поверхностей предстательной железы. На ВПА справа и слева накладывают сосудистые зажимы типа «Бульдог». После рассечения капсулы предстательной железы и идентификации слоя между аденомотозными узлами правой и левой долей капсулы и ее внутренней поверхностью, узлы выделяются единым блоком, шейка мочевого пузыря смещается с преобладанием тупой диссекции, кровоточащие сосуды коагулируют, затем выполняют уретроцистоанастомоз. После идентификации шейки мочевого пузыря выполняют наложение анастомоза двумя нитями V-lock 3/0, между уретрой и шейкой мочевого пузыря непрерывным швом, начиная с задней стенки, от 6-ти часов условного циферблата, в противоположные стороны, до пересечения на передней поверхности анастомоза, на 12-ти часах условного циферблата. После этого устанавливают уретральный катетер Фолея N20, в мочевой пузырь вводят 150 мл физ. раствора. Капсулу предстательной железы ушивают непрерывным швом нитью V-lock 3/0, ревизия раны, гемостаз. Контейнер с макропрепаратами удаляют через супраумбиликальный доступ. Способ обеспечивает ускоренное восстановление слизистой простатического отдела мочеиспускательного тракта и, соответственно, лучший функциональный результат лечения, значительно снижает объем послеоперационной кровопотери, при этом сроки госпитализации снижаются до 3-4 дней, в итоге, повышая качество жизни пациентов. 6 ил., 1 пр.
Способ лапароскопической позадилонной аденомэктомии, заключающийся в том, что осуществляют эндовидеоскопический доступ, в позадилонное пространство устанавливают оптический и рабочие троакары, под общим обезболиванием создают карбоксиперитонеум, выполняют лапароскопию - осмотр брюшной полости, выполняют аденомэктомию, выделяют поверхность предстательной железы, капсулу предстательной железы рассекают в поперечном направлении, проводят контроль гемостаза, выделяют слой между капсулой и аденоматозной тканью правой и левой долей предстательной железы, аденоматозные узлы отсекают от уретры и помещают в контейнер, кроме того, при наличии, удаляют среднюю долю простаты, осуществляют контроль гемостаза и коагуляцию сосудов, сопоставляют ткани шейки мочевого пузыря с уретрой, капсулу предстательной железы ушивают непрерывным швом нитью V-lock, затем контейнер извлекают, отличающийся тем, что указанную аденомэктомию дополняют этапами временного пережатия внутренних подвздошных артерий - ВПА и уретроцистоанастомоза, осуществляют лапароскопический доступ, при этом устанавливают 4 рабочих троакара параректально в правой и левой подвздошных областях, рассекают брюшину в проекции бифуркации наружной подвздошной артерии и ВПА справа, в области перекреста общей подвздошной артерии и мочеточника, с использованием энергетических инструментов выполняют мобилизацию ВПА, ВПА берут на силиконовую держалку, выполняют гемостаз в зоне работы, рассекают брюшину в проекции бифуркации наружной подвздошной артерии и ВПА слева, в области перекреста общей подвздошной артерии и мочеточника, с использованием энергетических инструментов выполняют мобилизацию ВПА, ВПА берут на силиконовую держалку, выполняют гемостаз в зоне работы, мобилизацию передней и боковых поверхностей предстательной железы выполняют до внутритазовой фасции, на ВПА справа и слева в области бифуркаций накладывают сосудистые зажимы типа «Бульдог», после рассечения капсулы предстательной железы и идентификации слоя между аденомотозными узлами правой и левой долей капсулы и ее внутренней поверхностью узлы выделяют единым блоком, шейку мочевого пузыря смещают с преобладанием тупой диссекции, после отсечения аденоматозных узлов от уретры и помещения их в контейнер с ВПА снимают сосудистые зажимы, проводят контроль гемостаза ложа аденоматозных узлов, при наличии кровоточащих сосудов осуществляют их коагуляцию, затем выполняют уретроцистоанастомоз: после адекватной идентификации шейки мочевого пузыря выполняют наложение анастомоза двумя нитями V-lock 3/0, между уретрой и шейкой мочевого пузыря непрерывным швом, начиная с задней стенки, от 6-ти часов условного циферблата, в противоположные стороны, до пересечения на передней поверхности анастомоза, на 12-ти часах условного циферблата, после этого устанавливают уретральный катетер Фолея №20, в мочевой пузырь вводят 150 мл физиологического раствора, с целью проверки герметичности анастомоза шейки мочевого пузыря, капсулу предстательной железы ушивают непрерывным швом нитью V-lock 3/0, ревизия раны, гемостаз, контейнер с макропрепаратами удаляют через супраумбиликальный доступ.
| Способ экстраперитонеоскопической аденомэктомии предстательной железы объёмом более 80 см | 2017 |
|
RU2667612C2 |
| СПОСОБ ПРОФИЛАКТИКИ ИНТРАОПЕРАЦИОННОГО КРОВОТЕЧЕНИЯ ВО ВРЕМЯ ПРОВЕДЕНИЯ ЭНДОВИДИХИРУРГИЧЕСКОЙ АДЕНОМЭКТОМИИ | 2021 |
|
RU2763253C1 |
| Способ эндовидеохирургической аденомэктомии с использованием эпидуральной анестезии | 2019 |
|
RU2713787C1 |
| АПОЛИХИН О.И | |||
| и др | |||
| Новый способ формирования уретровезикального анастомоза при лапароскопической радикальной простатэктомии с помощью рассасывающегося инструмента ушивания раны V-Loc | |||
| Экспериментальная и клиническая урология | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Приспособление в центрифугах для регулирования количества жидкости или газа, оставляемых в обрабатываемом в формах материале, в особенности при пробеливании рафинада | 0 |
|
SU74A1 |
Авторы
Даты
2022-11-23—Публикация
2022-04-18—Подача