Область техники
Настоящее изобретение относится к применению молочного белка бета-казеина А2 для предотвращения или снижения риска воспаления кишечника. В частности, настоящее изобретение относится к молоку и продуктам питания, полученным из молока, и к избеганию употребления молока и молочных продуктов, которые содержат высокие уровни белка бета-казеина А1, который, как было показано, является причиной острого и хронического воспаления кишечника. Настоящее изобретение относится к предотвращению воспаления кишечника, в том числе общего раздражения кишечника, а также воспалительных заболеваний кишечника и синдрома раздраженного кишечника.
Уровень техники
Воспаление кишечника может быть результатом различных нарушений или заболеваний, которые характеризуются воспалением толстой кишки и тонкой кишки. Такие нарушения или заболевания включают воспалительное заболевание кишечника (ВЗК) и синдром раздраженного кишечника (СРК). ВЗК в целом относится к клинически определенным и трудноизлечимым заболеваниям, главным образом к болезни Крона и язвенному колиту. ВЗК, как правило, относится к аутоиммунным заболеваниям, где собственная иммунная система организма атакует органы пищеварительной системы. СРК представляет собой нарушение, характеризующееся болью в области живота или дискомфортом и изменением нормального функционирования кишечника (как правило, хроническая или рецидивирующая диарея, запор или и то, и другое). По имеющимся данным, от СРК страдает от 25 до 45 миллионов людей только в США. Примерно двое из каждых трех больных СРК - женщины. СРК поражает людей всех возрастов, включая детей. Предполагается, что примерно от 10 до 25% мирового населения страдают от СРК. Проявление СРК может варьироваться от легкого беспокойства до тяжелого истощения. Люди со степенью СРК от умеренной до тяжелой борются с симптомами, которые часто ухудшают их физическое, эмоциональное, экономическое, образовательное и социальное благополучие.
Точные причины воспаления кишечника известны не до конца. Тем не менее, по всей видимости, большое значение имеет рацион питания, особенно в случае СРК. Как полагают, молоко и молочные жиры, в частности, являются одним из способствующих факторов. Многие воспалительные заболевания кишечника скорее контролируются, а не излечиваются. Часто лечение включает комбинацию диеты, управления стрессовыми ситуациями и медикаментозной терапии.
Молоко, в основном коровье молоко, употребляемое населением по всему миру, является основным источникам белка в рационе человека. Коровье молоко обычно содержит около 30 г белка на литр. Казеины составляют наибольшую составляющую (80%) этого белка. В последние два десятилетия наблюдается растущее количество доказательств вовлечения белков казеина, особенно бета-казеинов, в ряд заболеваний.
Бета-казеины можно подразделить на бета-казеин А1 и бета-казеин А2. Эти два белка представляют собой преобладающие бета-казеины в молоке, потребляемом большинством населения. Бета-казеин А1 отличается от бета-казеина А2 одной аминокислотой. Аминокислота гистидин расположена в 67 позиции 209 аминокислотной последовательности бета-казеина А1, в то время как в той же позиции бета-казеина А2 расположен пролин. Это различие в одной аминокислоте, однако, крайне важно для ферментативного расщепления бета-казеинов в кишечнике. Наличие гистидина в позиции 67 позволяет белковому фрагменту, содержащему 7 аминокислот, известному как бета-казоморфин-7 (БКМ-7), образовываться при ферментативном расщеплении. Таким образом, БКМ-7 представляет собой продукт расщепления бета-казеина А1. В случае бета-казеина А2, позицию 67 занимает пролин, что препятствует расщеплению аминокислотной связи в этом месте. Таким образом, БКМ-7 не представляет собой продукт расщепления бета-казеина А2.
Другие варианты бета-казеина, такие как бета-казеин B и C, также имеют гистидин в 67 позиции, а другие варианты, такие как A3, D и E, имеют пролин в позиции 67. Однако эти варианты можно найти только в очень малых количествах или вообще не найти в молоке коров европейского происхождения. Таким образом, в контексте настоящего изобретения, термин бета-казеин А1 относится к любому бета-казеину, имеющему гистидин в 67 позиции, а термин бета-казеин А2 относится к любому бета-казеину, имеющему пролин в 67 позиции.
БКМ-7 представляет собой опиоидный пептид и может активировать опиоидные рецепторы по всему телу. БКМ-7 имеет способность проникать в стенку желудочно-кишечного тракта и попадать в кровоток, что позволяет ему оказывать влияние на системную и клеточную активность с помощью опиоидных рецепторов. Ранее заявитель и другие установили связь между потреблением бета-казеина А1 в молоке и молочных продуктах и случаями определенных заболеваний, включая диабет I типа (WO 1996/014577), ишемическую болезнь сердца (WO 1996/036239) и неврологические нарушения (WO 2002/019832).
Было предположено, что БКМ-7 также может оказывать влияние на пищеварительную функцию. Сообщалось, что опиоидные рецепторы играют важную роль в регулировании желудочно-кишечной функции, включая регулирование моторики желудочно-кишечного тракта, выработку слизи и выработку гормонов (например, Mihatsch, W.A, et al., Biol. Neonate, 2005, 87(3):160-3). Считается, что казеины, найденные в молоке, связаны с ингибированием моторики желудочно-кишечного тракта, что может привести к запорам (Gunn T.R. and Stunzer D., NZ Med. J., 1986, 99(813):843-6), и исследования по казоморфинам и синтетическим производным казоморфинов указывают, что БКМ-7 способствует этому опосредованному эффекту опиоидных рецепторов (Charlin V. et al., Rev. Med. Chil., 1992, 120(6):666-9). Тем не менее, пока есть некоторые данные in vitro о связи между казоморфинами и временем пассажа в кишечнике, очевидно, что эффект не обязательно может быть экстраполирован на in vivo эффект в организме человека. Например, по меньшей мере одно исследование смогло продемонстрировать отсутствие связи между потреблением бета-казеина А1 или бета-казеина А2 и запором (Crowley, E.T., Nutrients, 2013, 5, 253-266). Было показано, что БКМ-7 стимулирует выработку слизи через опосредованные пути μ-опиоидного рецептора (Zoghbi, S., Am. J. Physiol. Gastrointest. Liver Physiol., 2006, 290(6):G1105-13), и снижает интенсивность пролиферации собственной пластинки лимфоцитов (Elitsur, Y. and Luk, G.D., Clin. Exp. Immunol., 1991, 85(3):493-7), которые являются клетками связанными с иммунной системой.
Приведенные выше данные показывают наличие связи между казеинами и казоморфинами (включая БКМ-7) и пищеварительной функцией. Эти данные основаны на исследованиях с применением молочных белков или казеинов в целом, либо на исследованиях с применением самого БКМ-7. Тем не менее, на сегодняшний день, не было ни одной публикации непосредственно связывающей потребление бета-казеина А1 с воспалением кишечника. Кроме того, поступали казуистические сообщения от потребителей, относящиеся к улучшению пищеварительной функции после употребления молока с высоким содержанием бета-казеина А2 (и наоборот с низким содержанием казеина А2), но они не являются научными данными и неспецифичны по причине какого-либо улучшения функции. Помимо того, существует также много казуистических сообщений об отсутствии эффекта улучшения при употреблении такого молока. Эти сообщения противоречивы в том, что они включают данные о непрерывном влиянии на пищеварение от запора вплоть до диареи. Нельзя с уверенностью сделать выводы из казуистических сообщений, в частности, в случае пищевых продуктов и физиологических функций, где число переменных, которые могут повлиять на результаты, очень велико.
В данный момент заявитель располагает убедительными научными доказательствами прямой связи между потреблением бета-казеина А1 и воспалением кишечника по отношению к потреблению бета-казеина А2. Учитывая множество факторов в рационе человека, которые могут повлиять на здоровье кишечника, и то что молоко и молочные продукты содержат широкий спектр белковых компонентов и других компонентов, получение заявителем данных о четкой прямой связи между бета-казеином А1 и воспалительными заболеваниями кишечника является неожиданным. Примечательно, что заявитель обнаружил доказательства не только острого воспалительного ответа кишечника на прием бета-казеина А1, но и долгосрочного хронического воспаления кишечника в результате краткосрочного воздействия бета-казеина А1.
Поэтому задачей изобретения является создание способа предотвращения или снижения риска воспаления кишечника, или по меньшей мере обеспечение полезной альтернативы существующим профилактическим или лечебным терапиям.
Краткое описание изобретения
В первом аспекте настоящего изобретения предлагается применение композиции для предотвращения и снижения риска воспаления кишечника у животного, причем композиция содержит бета-казеин и причем бета-казеин включает по меньшей мере 50% по массе бета-казеина А2.
Во втором аспекте настоящего изобретения предлагается композиция для профилактики и снижения риска воспаления кишечника у животного, причем композиция содержит бета-казеин и причем бета-казеин содержит по меньшей мере 50% по массе бета-казеина А2.
В другом аспекте настоящего изобретения предлагается применение молока в производстве композиции для предотвращения и снижения риска воспаления кишечника у животного, причем молоко содержит бета-казеин и причем бета-казеин содержит по меньшей мере 50% по массе бета-казеина А2.
В еще одном аспекте настоящего изобретения предлагается способ предотвращения и снижения риска воспаления кишечника у животного, включающий потребление животным композиции, содержащей бета-казеин, или обеспечение животного композицией для потребления, причем бета-казеин содержит по меньшей мере 50% по массе бета-казеина А2.
Количеством бета-казеина A2 может быть любое количество в диапазоне от 50% до 100% от массы бета-казеина, например, по меньшей мере 90%, по меньшей мере 99% или даже 100%.
В некоторых вариантах реализации настоящего изобретения, композиция представляет собой молоко или молочный продукт. Молоко может быть сухим молоком или жидким молоком. Жидкое молоко может быть в виде свежего молока, жидкого молока, восстановленного из сухого, обезжиренного молока, гомогенизированного молока, сгущенного молока, концентрированного молока без сахара, пастеризованного молока или непастеризованного молока, УВТ-молока или любого другого вида молока. Молочный продукт может быть сливками, йогуртом, творогом, сыром, маслом, мороженым или любым другим молочным продуктом.
Воспаление кишечника может быть, но не ограничивается, воспалительным заболеванием кишечника или синдромом раздраженного кишечника. Воспалительное заболевание кишечника может быть, но не ограничивается, болезнью Крона или язвенным колитом.
В большинстве вариантов реализации настоящего изобретения, животное представляет собой человека. Тем не менее, в других вариантах реализации, животным может быть собака, кошка или любое другое домашнее животное, корм которых обогащен молоком.
Краткое описание графических материалов
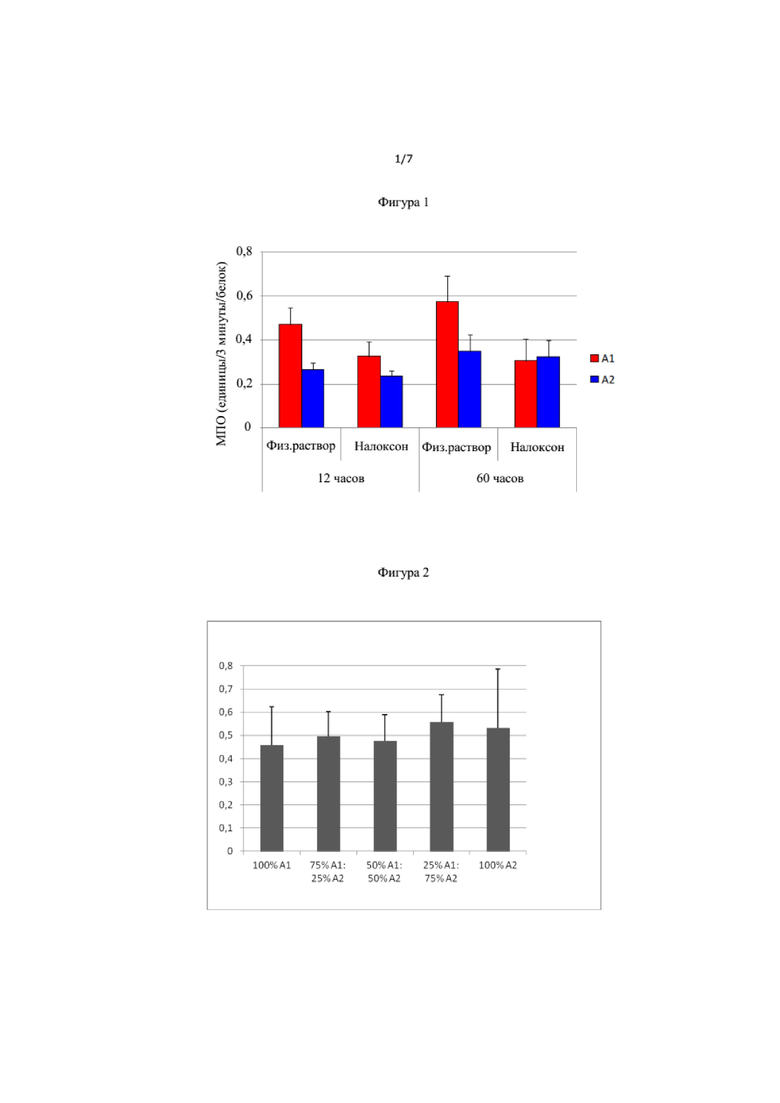
На Фиг. 1 показана миелопероксидазная активность в толстой кишке у крыс, получавших корм по рациону Примера 1.
На Фиг. 2 показана миелопероксидазная активность в тонкой кишке у крыс, получавших корм по рациону Примера 1.
На Фиг. 3 показаны уровни сывороточного амилоида А в плазме у крыс, получавших корм по рациону Примера 1.
На Фиг. 4 показаны гистологические оценки для отрезков кишечника, взятых у крыс, получавших корм по рациону Примера 1.
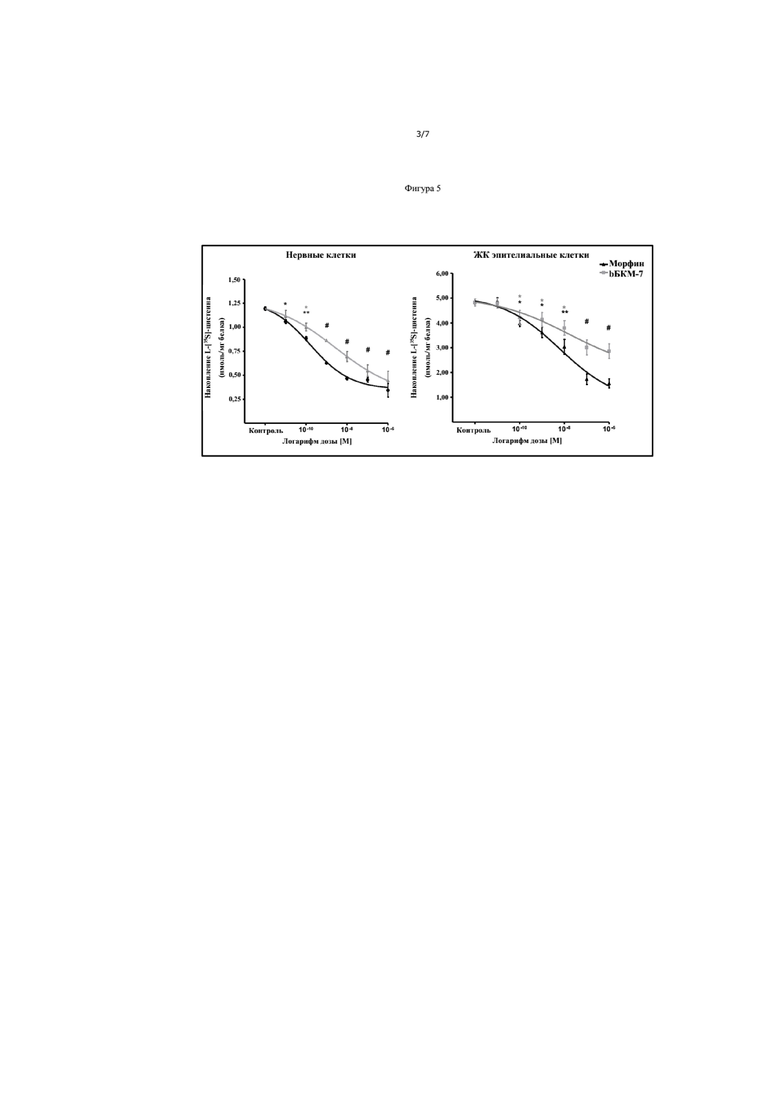
На Фиг. 5 показаны концентрации морфина и БКМ-7 зависимые от накопления цистеина в нервных клетках и ЖК эпителиальных клеток.
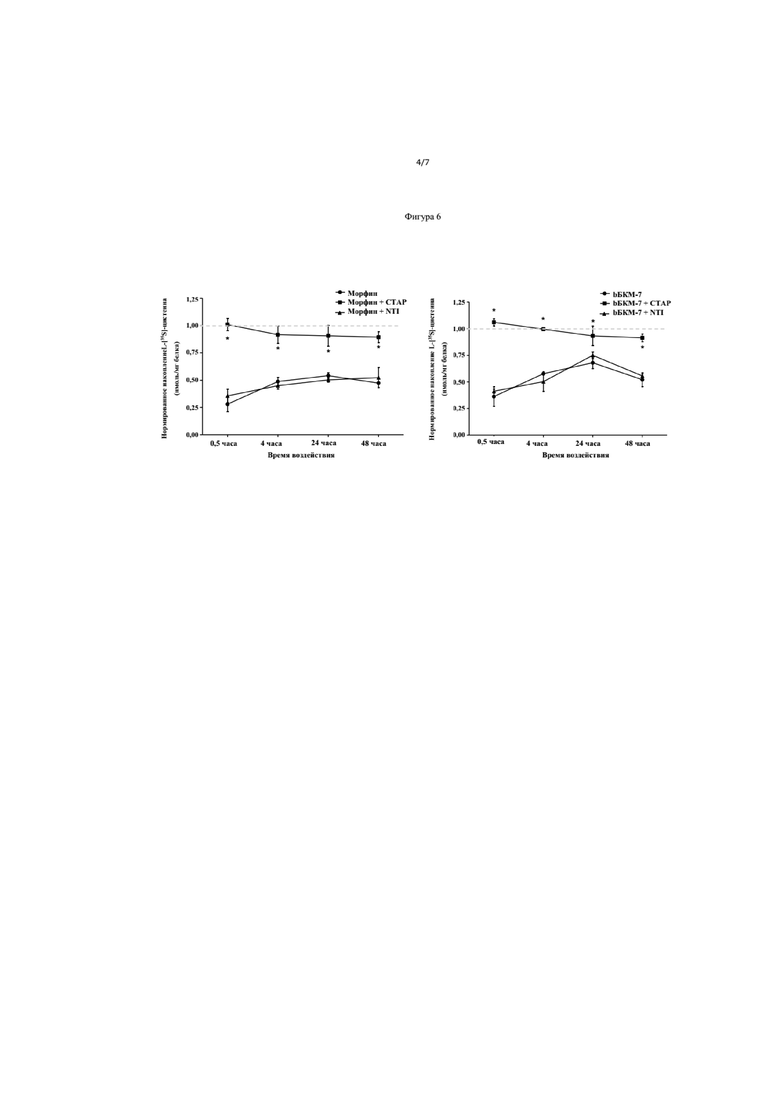
На Фиг. 6 показано накопление цистеина в нервных клетках и ЖК эпителиальных клетках в динамике.
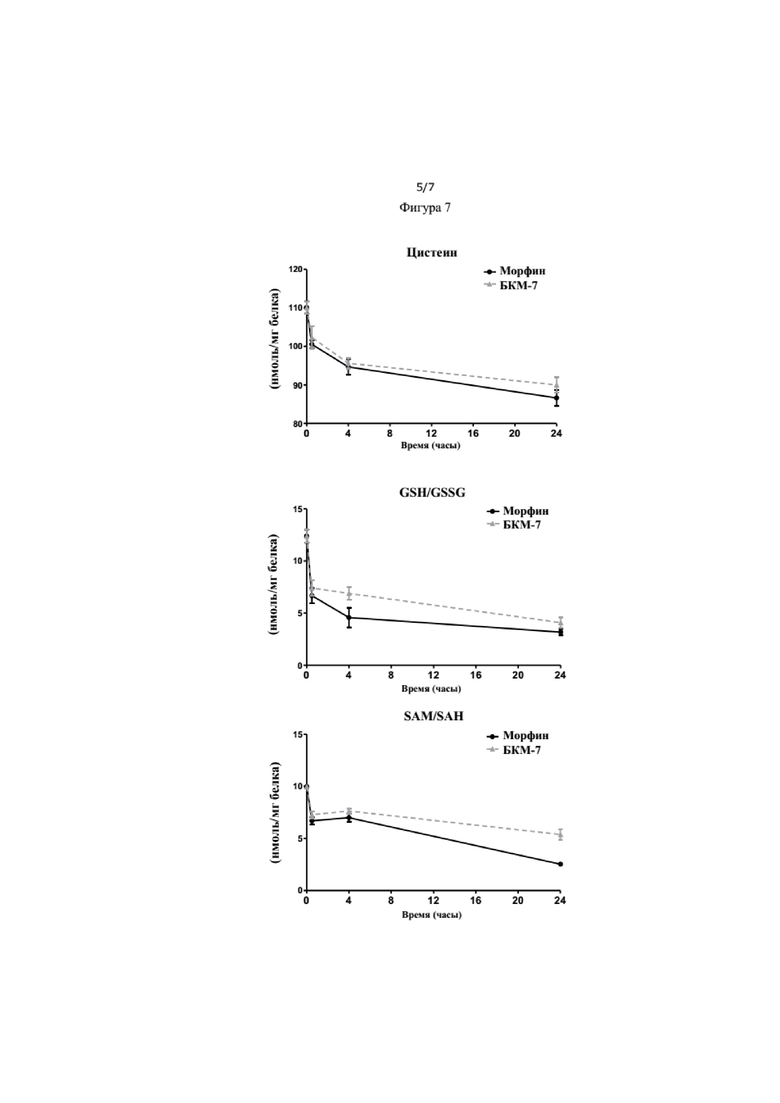
На Фиг. 7 показано влияние БКМ-7 и морфина на цистеин, GSH/GSSG и SAM/SAH в динамике.
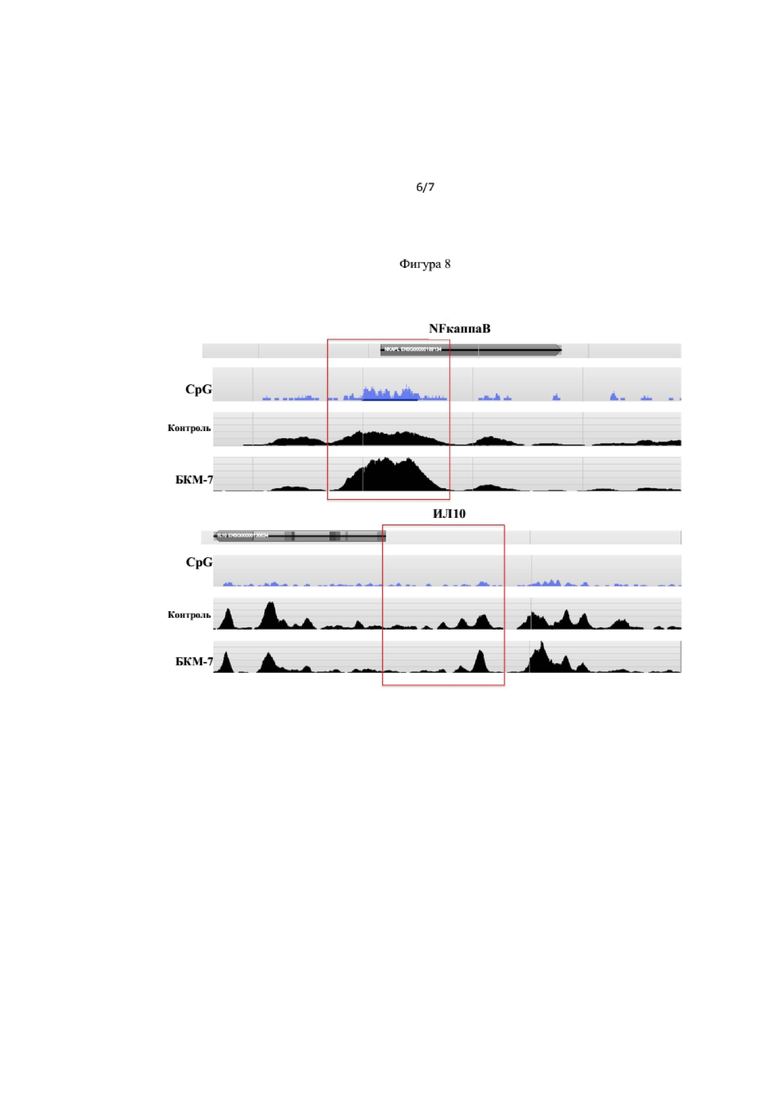
На Фиг. 8 показаны изменения CpG метилирования в генах, участвующих в воспалительной реакции (NFkappaB и ИЛ10) под действием БКМ-7.
На Фиг. 9 показаны изменения CpG метилирования в генах, участвующих в воспалительной реакции (МРО), и генах, участвующих в иммунном ответе (ИЛ1О)
Подробное описание изобретения
Настоящее изобретение относится к композиции, содержащей белок бета-казеин и ее применению для предотвращения воспаления кишечника или по меньшей мере снижения риска развития воспаления кишечника. Важно отметить, что бета-казеин представляет собой А2 вариант бета-казеина, или составляет по меньшей мере 50% по массе от общего числа вариантов бета-казеина, присутствующих в композиции. Важность преобладания А2 варианта в композиции связана с ием, что заявитель показал, что существует прямая связь между А1 вариантом и биологическими маркерами воспаления кишечника у человека. Таким образом, можно ожидать улучшение здоровья кишечника, если избегать потребление А1 варианта.
В настоящей заявке термин "воспаление кишечника" относится к любой болезни, нарушению или заболеванию, которое характеризуется острым, переходным или хроническим и постоянным воспалением толстой кишки и/или тонкой кишки. Такие болезни, нарушения и заболевания включают, но не ограничиваются, воспалительное заболевание кишечника (ВЗК) и синдром раздраженного кишечника (СРК), в дополнение к неспецифическим раздражениям кишечника. ВЗК в целом относится к клинически выявленным и трудноизлечимым заболеваниям, главным образом к болезни Крона и язвенному колиту.
В настоящей заявке термин "А1 молоко" относится к молоку, содержащему бета-казеин, причем бета-казеин преимущественно в форме бета-казеина А1 (или любой другой вариант бета-казеина, имеющий гистидин в 67 позиции его 209 аминокислотной последовательности). А1 молоко может иметь более чем 50% компонента бета-казеина, обычно более чем 90% (в идеале 100%) бета-казеина А1.
В настоящей заявке термин "А2 молоко" относится к молоку, содержащему бета-казеин, причем бета-казеин преимущественно в форме бета-казеина А2 (или любой другой вариант бета-казеина, имеющий пролин в 67 позиции его 209 аминокислотной последовательности). А2 молоко может иметь более чем 50% компонента бета-казеина, обычно более чем 90% (в идеале 100%) бета-казеина А2.
Поскольку основным, если не единственным, источником бета-казеинов в рационе населения является молоко или продукты, полученные из молока, и поскольку наболее потребляемое молоко содержит смесь только А1 и А2 вариантов бета-казеина, то потребление молока (или продуктов, изготовленных из такого молока), имеющего высокое содержание А2 варианта будет обязательно означать, что потребление А1 варианта является низким. Для последующего анализа, если источник потребления бета-казеинов включает только А2 вариант и никаких других вариантов, то потребление с пищей А1 варианта исключено и также можно ожидать, что исключено негативное последствие для здоровья воспаления кишечника, возникающее вследствие потребления бета-казеина А1.
Соответсвенно, изобретение согласно настоящей заявке основано на уменьшении или исключении бета-казеина А1 в рационе животных (особенно людей) и это достигается за счет того, что бета-казеин в пищевых композициях, включающих бета-казеин, особенно молоко и молочные продукты, представляет собой преимущественно или даже исключительно бета-казеина А2.
В идеале, бета-казеин в композиции представляет собой 100% бета-казеин А2. Вследствие полного исключения бета-казеина А1 максимально увеличивается польза для здоровья путем уменьшения или исключения совокупного риска воспаления кишечника, вызванного бета-казеином А1 (и БКМ-7). Тем не менее, риск может быть снижен в любой композиции, где бета-казеин представляет собой преимущественно бета-казеин А2, то есть любое количество между 50% по массе и 100%, включая, но не ограничиваясь, 60%, 70%, 75%, 80%, 90%, 95%, 98% и 99% по массе.
Поскольку настоящее изобретение относится к применению композиции, содержащей бета-казеин, где бета-казеин содержит по меньшей мере 50% по массе бета-казеина А2, и, как выше сказано, бета-казеин А1 и бета-казеин А2 являются фактически единственными вариантами бета-казеинов, присутствующими в молоке, потребляемом большинством населения, то настоящее изобретение также относится к применению композиции, содержащей бета-казеин, где бета-казеин содержит менее чем 50% по массе бета-казеина А1. Предпочтительно, композиция содержит менее чем 60%, 70%, 75%, 80%, 90%, 95%, 98% или 99% по массе бета-казеина А1, и в идеале не содержит бета-казеина А1 вообще.
Композиция настоящего изобретения обычно представляет собой молоко, но может быть любым продуктом, полученным из молока, таким как сливки, йогурт, творог, сыр, масло или мороженое. Композиция также может представлять собой немолочный продукт, содержащий бета-казеин, полученный из молока. Композиция может представлять собой сам бета-казеин, или быть получена из бета-казеина, где бета-казеин может быть в твердой форме, такой как порошок, гранулы или в форме твердого осадка.
В то время как молоко может быть получено из любого млекопитающего, включая людей, коз, свиней и буйволов, в предпочтительных вариантах реализации настоящего изобретения молоко представляет собой коровье молоко.
Молоко может быть в виде свежего молока, сухого молока, жидкого молока, восстановленного из сухого, обезжиренного молока, гомогенизированного молока, сгущенного молока, концентрированного молока без сахара, пастеризованного молока или непастеризованного молока, УВТ-молока или любого другого вида молока.
Композиция настоящего изобретения пригодна для потребления в первую очередь людьми, но следует понимать, что польза для здоровья также актуальна и для некоторых других животных, такие как кошки, собаки и другие домашние животные.
Обоснование настоящего изобретения приведено в экспериментах, описанных в Примерах.
В частности, Пример 2 относится к влиянию раицона с бета-казеином А1 и бета-казеином А2 на миелопероксидазную (МПО) активность в толстой кишке крыс. МПО активность является маркером воспаления (Krawisz, et al., Gastroenterology, 1984, 87(6):1344-1350 and Dommels, Y.E.M., et al., Genes Nutr., 2007, 2(2):209-223). Было установлено, что МПО активность в толстой кишке крыс, которых кормили бета-казеином А1 повышена по сравнению с крысами, которых кормили бета-казеином А2, что указывает на повышение уровня клеток нейтрофилов у крыс, которых кормили бета-казеином А1, что в свою очередь является показателем воспалительной реакции. Данный эффект не наблюдали у крыс, получавших налоксон (известный антагонист опиоидного рецептора), что показывает, что данный эффект осоредован взаимодействием БКМ-7 с μ-опиоидными рецепторами.
Пример 3 относится к воздействию на МПО активность в тонкой кишке. Результаты показывают отсутствие повышения активности при воспалении в тонкой кишке при потреблении бета-казеина А1. Это контрастирует с Примером 2, который показывает воспаление в толстой кишке. Результат Примера 3 подтверждает, что воспаление, индуцированное потреблением бета-казеина А1 локализуется в толстой кишке, а не во всем кишечнике.
Пример 4 относится к концентрациям сывороточного амилоида А (САА), представляющий собой белок, который серкретируется в первую очередь в печени в период острой фазы воспаления (Uhlar, C.M. and Whitehead, A.S., Eur. J. Biochem., 1999, 265(2):501-523). Уровни САА являются индикатором системного воспаления. Пример 4 показывает, что нет никаких существенный различий в концентрации САА в плазме крови между любыми экспериментальными группами. Другими словами, в настоящем исследовании нет четких доказательств системного воспаления.
Пример 5, который относится к гистологическим исследованиям, отражает то, что воспаление в толстой кишке является слабовыраженным и может протекать бессимптомно. Несмотря на данные по МПО, подтверждающие воспалительную реакцию в ткани, это было неочевидно, ввиду отсутствия значимости, вытекающей из широкого спектра наборов данных.
В других исследованиях системного воспаления не наблюдалось никаких признаков достоверности экспериментов САА и МПО в тонкой кишке. Это согласуется с БКМ-7 опосредованной воспалительной реакцией. Не желая быть связанными с какой-либо теорией, это можно объяснить тем, что воспаление в кишечнике, опоредованное БКМ-7, представляет собой локальную воспалительную реакцию. Другими словами, отсутствие данных о системном воспалении (САА и гистологические исследования), в сочетании с данными о локальном воспалении (МПО исследования), являются сильным показателем того, что БКМ-7, полученный от употребления продуктов, содержащих бета-казеин А1, вызывает воспаление кишечника, несмотря на то, что не имеет системного действия и не влияет на тонкую кишку.
Кроме того, настоящее открытие является неожиданным в свете опубликованных данных о том, что БКМ-7 может противодействовать воспалению. Например, было установлено, что БКМ-7 снижает окислительный стресс в почках (Zhang, W., et al., http://www.ncbi.nlm.nih.gov/pubmed/23658831). Окислительный стресс представляет собой воспалительное действие. Таким образом, было сообщено об обнаружении, что БКМ-7 снижает этот воспалительное действие, что указывает на непредсказуемость БКМ-7 как фактора, влияющего на здоровье, связанного с физиологическими процессами.
Пример 6 описывает попытку проверить каким образом молоко, содержащее бета-казеин А1, влияет на желудочно-кишечные симптомы по сравнению с молоком, содержащим бета-казеин А2. Основным выводом является статистически значимая разница в консистенции стула после употребления молока, содержащего 100% бета-казеина А1, по сравнению с молоком, содержащим 100% бета-казеина А2 (p = 0,038). Статистические данные более показательны в случае, когда женщины рассматриваются отдельно (p = 0,013). Данные остаются показательными, когда из анализа исключаются те, которые считают, что у них есть непереносимость молока (p = 0,044). Очевидно, что диета, на молоке, содержащем бета-казеин А1, по сравнению с диетой на молоке, содержащем бета-казеин А2, в целом приводит к более мягким фекалиям. Аномальная функция поглощения воды приводит к более мягким фекалиям, что свидетельствует о более высоком уровне воспаления кишечника при потреблении бета-казеина А1 по сравнению с бета-казеином А2.
Заявитель также исследовал и обнаружил прямые связи между БКМ (из бета-казеина А1) и показателями воспаления, такими как уровни цистеина и глутатиона.
Связь между активными формами кислорода (АФК), которые представляют собой химически активные молекулы, содержащие кислород, такие как ионы кислорода и перекиси, и ВЗК может быть выведена из данных о том, что повышенные уровни АФК и пониженные уровни антиоксидантов представляют собой основные факторы, которые приводят к патогенным механизмам при ВЗК, болезни Крона и язвенных колитах. АФК также может усиливать иммунные реакции при ВЗК с помощью повышения воспалительных лейкоцитов. Кроме того, воспаление и прогрессирование воспалительного заболевания также связаны с дефектами антиоксидантной защиты, относящейся к слизистой оболочке, особенно к уровню глутатиона, относящемуся к слизистой оболочке. Лекарственные средства с антиоксидантными свойствами, как сообщается, показывают положительный эффект в лечении ВЗК.
Уровни цистеина и селена в крови являются критическими для поддержания и сохранения синтеза глутатиона, а он, в свою очередь, зависит от абсорбции серосодержащих аминокислот цистеина и метионина, поглощенных с пищей, в желудочно-кишечном (ЖК) тракте с помощью различных транспортеров на поверхности кишечной эпителиальной границы.
Дефицит в незаменимом микроэлементе селене (Se) считается фактором риска для ряда хронических заболеваний, связанных с окислительным стрессом и воспалением в организме человека, включая болезнь Крона. Se имеет важное значение для активности глутатиона пероксидаз GPX2 или GPX1, оба из которых являются ключевыми ферментами, участвующими в регуляции уровней глутатиона в головном мозге и слизистой оболочке. GPX1, как известно, связан с ВЗК, и его активность зависит от присутствия Se.
Среди различных аминокислотных транспортеров в эпителиальных клетках ЖК, EAAT3 (транспортер возбуждающей аминокислоты 3, EAAC1) является селективным для транспорта цистеина и изначально был клонирован из эпителиальных клеток ЖК. EAAT3 наиболее выражен в тонком кишечнике, особенно в подвздошной кишке, самые высокие уровни находятся в клетках кишечных крипт и нижних отделах ворсинок. Это является основной локализацией для мультипотентных стволовых клеток, обеспечивающих эпителиальную выстилку кишечника. Следовательно, имеет место уменьшение EAAT3-зависимой абсорбции цистеина, с локальными и системными последствиями низких уровней глутатиона.
Вышеописанные эффекты представляют собой немедленное воздействие изменений, опосредованных любым модулятором EAAT3, особенно в ЖК тракте. Тем не менее, нарушение ЖК абсорбции цистеина, основного предшественника глутатиона, не только приводит к локальному и системному окислительному стрессу, но также вызывать последующее разрушение нормальной эпигенетической регуляции экспрессии генов. Это происходит с помощью активности фермента метионин синтазы и регуляции уровней S-аденозилметионин (SAM). SAM действует как донор метильной группы для ДНК и метилирования гистонов, и превращается в S-аденозилгомоцистеин (SAH). Способность клетки к метилированию называется циклом SAM/SAH. Адаптивные эпигенетические реакции на изменения в окислительно-восстановительном состоянии, вероятно, играют важную роль при различных заболеваниях, особенно те, которые можно проследить до расстройства с антиоксидантным гомеостазом, таким как воспаление ЖК тракта, и более особенно ВЗК и болезнь Крона.
Пример 7 показывает, что БКМ-7 может ингибировать накопление цистеина в зависимости от концентрации с эффективностью морфина на порядок больше, чем БКМ-7, и IC50 значения 0,16 и 1,31 нМ в нервных клетках и 6,38 и 15,95 нМ, соответственно, в ЖК эпителиальных клетках (Фиг. 5). Ингибирование накопления цистеина полностью развилось за 30 минут и поддерживалось в течение 48 часов воздействием морфина или БКМ-7 (Фиг. 6), что указывает на долгосрочный хронический эффект накопления цистеина после однократного воздействия на БКМ-7. Эти эффекты опосредованы μ-опиоидным рецептором, на что указывает блокада в присутствии селективного μ-антагониста, а не дельта опиоидного рецептора.
Пример 8 показывает, что БКМ-7 и морфин вызывают снижение уровней цистеина и глутатиона, зависящее от времени. Внутриклеточные уровни цистеина в нервных клетках, окислительно-восстановительное состояние клеток отражаются отношением GSH/GSSG глутатиона (GSH) к его окисленной форме дисульфиду глутатиона(GSSG), которое также снижается (Фиг. 7), потенциально указывая на состояние окислительного стресса. Кроме того, отношение SAM/SAH (способность к метилированию) также зависит от воздействия БКМ-7 в различные моменты времени (Фиг. 7). Следовательно, БКМ-7 вызывает снижение основных внутриклеточных антиоксидантных уровней, особенно уровней глутатиона, и потенциально способен приводить к воспалительному изменению с помощью сигнального пути окислительного стресса. Кроме того, изменения, опосредованные уровнями SAM, могут вызвать эпигенетические изменения в генах, ответственных за пути воспаления.
Пример 9 показывает, что лечение с помощью прототипа опиоидного морфина приводит к 7592 дифференциально экспрессированным транскриптам (ДЭТ), в то время как лечение БКМ-7 дало 1467 ДЭТ. 501 ДЭТ были разделены между морфином и БКМ-7. Кроме того, эти результаты указывают на болезни и нарушения, которые, как было обнаружено, значительно связаны с наблюдаемыми изменениями в глобальном метилировании ДНК. БКМ-7 дифференциально метилированные промоторы транскриптов (ДМТ) были ассоциированы с воспалительной болезнью (Таблица 5). Следовательно, немедленное воздействие БКМ-7 на антиоксидантные уровни глутатиона и окислительный стресс главным образом преобразуется в хронические адаптивные изменения экспрессии генов. Гены, которые были эпигенетически изменены под влиянием БКМ-7, непосредственно участвуют в регуляции клеточных функций, а также в развитии воспалительного заболевания, и транскрипционно регулируемые гены также участвуют в клеточных функциях и окислительно-восстановительном гомеостазе (Таблица 5).
Пример 10 показывает, что изменения метилирования ДНК в генах ответственны за опосредованную воспалительную реакцию под влиянием БКМ-7. Эпигенетический статус цитокинов, таких как NFkappaB, и интерлейкинов, таких как ИЛ1 (Фиг. 8) был изменен после воздействия БКМ-7. Следовательно, изменения в окислительно-восстановительном статусе опосредованы долгосрочными изменениями в эпигенетическом статусе цитокинов. Данный процесс может служить в качестве памяти молекулярных повреждающих факторов, потенциально способствующих долгосрочным хроническим изменениям и воспалительным реакциям в таких заболеваниях, как ВЗК. Кроме того, измененный эпигенетический статус очевиден из Примера 10. Поэтому, БКМ-7 не только изменяет МПО активность, как видно из исследований потребления бета-казеина А1, но также изменяет эпигенетический статус гена МПО (Фиг. 9).
Настоящие исследования представляют первое четкое научное доказательство связи между потреблением бета-казеина А1 и воспалением кишечника. Предшествующие, неубедительные и противоречивые казуистические сообщения и исследования, связанные с БКМ-7 (в отличии от самого бета-казеина А1) приводили к путанице среди специалистов в данной области, согласно многим предположениям такие связи отсутствовали. Благодаря открытию заявителя, в данный момент найдено альтернативное потенциальное решение проблем, вызванных различными воспалительными заболеваниями кишечника, от которых пострадало множество людей по всему миру в течение многих лет, а именно. избегание присутствия в рационе бета-казеина А1. Это может быть достигнуто путем производства молока, имеющего в своем составе преимущественно бета-казеин А2 (и отсутствие бета-казеина А1) или создания доступности такого молока и продуктов, полученных из такого молока, с целью лечения, избегания или снижения риска заболеваний или симптомов, связанных с воспалением кишечника. Молоко коров может быть проверено на относительные пропорции бета-казеина А1 и бета-казеина А2. Кроме того, коровы могут быть генетически проверены на способность продуцировать молоко, содержащее бета-казеин А1 или бета-казеин А2 или их комбинацию. Эти методы хорошо известны.
Настоящее изобретение имеет существенные преимущества по сравнению с существующими способами лечения или предотвращения воспалительных кишечных заболеваний. Большинство существующих методов или способов основаны на медицинском вмешательствепосредством лекарственных препаратов, управлении стрессовыми ситуациями или модификации диеты, многие из которых часто ограничены и не приносят реального успеха. Согласно настоящему изобретению предложено решение, сравнительно легко реализуемое, т.е. преобразование рациона питания в рацион без бета-казеина А1 путем замены "обычного" молока (содержащее бета-казеин А1) в рационе питания на молоко, с высоким содержанием бета-казеина А2, предпочтительно, где все бета-казеины представляют собой бета-казеин А2. Настоящее изобретение значительно дешевле, чем фармацевтическое вмешательство, и также позволяет избежать необходимости модификации диеты в промышленных масштабах, таких как избегание молочных продуктов питания или других распространненных продуктов питания.
Любые ссылки на документы известного уровня техники в этом описании не следует рассматривать как признание факта, что такой известный уровень техники широко известен и формирует часть общих знаний в данной области.
В данном описании используемые слова “содержит”, “содержащий”, и подобные слова не следует интерпретировать в исключительном или исчерпывающем смысле. Другими словами, они предназначены для обозначения “в том числе”, но не ограничиваются ими.
Далее настоящее изобретение описано с ссылками на следующие примеры. Следует иметь в виду, что примеры являются чисто иллюстративными и не ограничивают настоящее изобретение каким-либо образом.
ПРИМЕРЫ
Пример 1: Метод кормления
Были использованы семьдесят два отлученных от матери (четырехнедельных) самца крыс линии Вистар (Wistar). После 7-дневного периода акклиматизации на контрольном рационе, крыс кормили в течение 12 или 60 часов в соответствии с одним из трех рационов: 100% А1 рацион, 100% А2 рацион, контрольный рацион (n=6 на кормление). Белковые компоненты рационов были получены из обезжиренного молока (для А1 и А2 рационов) и яичного белка (для немолочного белкового контрольного рациона), и были сбалансированы по энергетической ценности и композиции макроэлементов (Таблица 1).
За пятнадцать минут до окончания периода времени, крысы получали или налоксон, или физиологический раствор (контроль) путем внутрибрюшинной инъекции, а затем перорально, через желудочный зонд получали неусваиваемый индикатор, диоксид титана. Образцы кала и мочи отбирали в 7 временных точках в течение следующих 24 часов, и хранили при -20°C (кал) или при -80°C (моча) до момента анализа.
Таблица 1: Состав рационов:
Пример 2: Миелопероксидазная активность в толстой кишке.
Активность миелопероксидазы (МПО) в ткани толстой кишки крыс, получавших корм по рациону Примера 1, измеряли с помощью разработанного метода (Grisham, M.B., et al., Methods Enzymol., 1990, 186:729-742). Ткань толстой кишки (50 мг) гомогенизировали, разделяли центрифугированием, разрушали с помощью ультразвукового зонда и подвергали циклу замораживания-оттаивания.
Эндогенная МПО катализирует H2O2-зависимое окисление 3,3',5,5'-тетраметил-бензидинового субстрата, измеряемое колориметрически при длине волны 562 нм. Активность МПО была нормализована с помощью определения белка методом с бицинхониновой кислотой (БХК) (Smith, P.K., et al., Anal. Biochem., 1985, 150(1):76-85). для этого же гомогената. Результаты показаны на Фиг. 1.
Пример 3: Миелопероксидазная активность в тонкой кишке.
В этом примере, были проанализированы образцы тканей, взятые из тонкой кишки. Использованный метод был таким же, как в Примере 2. Результаты приведены в Таблице 2 и на Фиг. 2.
Таблица 2 Миелопероксидазная активность в тканях толстой и тонкой кишки
Пример 4: Уровни сывороточного амилоида А (САА)
Уровни САА измеряли в плазме, взятой у крыс, получавших корм по рациону Примера 1. Измерения проводили с использованием коммерчески доступного набора ELISA (Tridelta Development Limited, Maynooth, Ireland). Результаты показаны в Таблице 3 и на Фиг.3.
Таблица 3. Уровни САА в плазме
Пример 5: Гистология кишечника
Процедура, использованная для анализа изменения морфологии желудочно-кишечного тракта крыс, основана на гистологической оценке срезов тканей, окрашенных гематоксилин-эозином, под световым микроскопом (Knoch, B. et al., J. Nutrigenet. Nutrigenomics, 2009, 2(1):9-28 and Barnett, M.P., BMC Immunol., 2010, 11:39). Этим способом были проанализированы срезы ткани толстой кишки у крыс, получавших корм по 100% А1 рациону, или по 100% А2 рациону, для определения воздействия вариантов бета-казеина на воспаление кишечника. Результаты показаны на Фиг. 4. Данные (Среднее ± Ст.Ош.Ср.) показали, что существует значительное (Р < 0.05) различие между крысами, которых кормили бета-казеином А1 и крысами, которых кормили бета-казеином A2 в 60 часовой налоксоновой группе, причем крысы, которых кормили бета-казеином A2, имели значительно более высокие показатели. Тем не менее, величина этих гистологических показателей не свидетельствует о воспалении, и общий анализ не предоставляет никаких доказательств воздействия рациона, времени или налоксоновой терапии на гистологические показатели.
Пример 6: Желудочно-кишечные симптомы
В этом 8-недельном рандомизированном перекрестном исследовании, участники (n=41) были рандомизированы в одну из двух групп с последующим 2-недельным вымыванием молока: 1) A1 молокo (n=21); или 2) А2 молоко (n=20). Участники подвергались второму 2-недельному вымыванию молока и затем переходили к альтернативному режиму воздействия молока, так что к концу 8-недельного исследования, все участники (n=37) подвергались воздействию двух видов молока.
В исследование были включены мужчины (12) и женщины (29) в возрасте от 19 до 68 лет. Критериями исключения были: (1) аллергия на молоко; 2) медицинской диагноз непереносимость лактозы; 3) беременность и кормление грудью; 4) сердечно-сосудистые нарушения в течение последних 6 месяцев; 5) употребления опиоидных препаратов; 6) лечение антибиотиками в течение последних 8 недель; и 7) иммуносупрессорная терапия или прием противовоспалительных препаратов в последние 4 недели, предшествующие скринингу. Участники начинали с 14-дневного периода вымывания молока (где молоко было заменено предоставленным рисовым молоком), а затем рандомизированы для 2 недельной диеты на А1 или А2 молоке. После завершения первого режима лечения исследования, участники проходили вторую 2 неделю вымывания молока перед переходом к другому режиму воздействия молока.
Вымывание рисового молока – Участники были проинструктированы заменять все молоко предоставленным рисовым молоком в течение 14-дневных периодов вымывания и избегать употребления всех других молочных продуктов в течение всего периода исследования. Участникам была предоставлена информация о скрытых источниках молока, таких как печенье и шоколад, а также список альтернативных продуктов, не содержащих молока. Участникам было также предоставлено достаточное количество рисового молока (So Natural Rice Milk, Freedom Foods, Australia), чтобы употреблять 750 мл рисового молока/день, в течение каждого из 14 дневных периодов вымывания. Рисовое молоко предоставлялось в 1 л ультра-высокотемпературных (УВТ) упаковках и имело следующую пищевую ценность на 100 мл: энергетическая ценность - 212 кДж, белки - 0.3 г, жиры - 1.0 г и углеводы - 10.4 г.
А1 Молоко – Участники были проинструктированы заменять все молоко предоставленным A1 молоком и, избегать употребления всех других молочных продуктов и скрытых источников молока. Во время 2-недельного воздействия А1 молока, участники были проинструктированы употреблять 750 мл/сутки (~ 7.5 г бета-казеина A1) А1 молока на протяжении всего дня. С помощью хромато-масс-спектрометрического анализа Nano-LC ESI MS (Nano-Liquid Chromatography Electro Spray Ionization Mass Spectrometry) молока (APAF, Sydney) обнаружили, что в А1 молоке доля А1 суммарного бета-казеина составляла> 99%.
А2 Молоко - Участники были проинструктированы, чтобы заменить все молочные молоко на предоставленное А2 молоко и, чтобы избегать употребления всех других молочных продуктов и все скрытых источников молока. Во время 2-недельного воздействия А2 молока, участники были проинструктированы, употреблять 750 мл/сутки (~ 7,5 г бета-казеина A2) А2 молока на протяжении всего дня. С помощью хромато-масс-спектрометрического анализа Nano-LC ESI MS А2 молока (APAF, Sydney) обнаружили, что в А2 молоке доля А1 суммарного бета-казеина составляла 0.1-0.5%.
А1 молоко и А2 молоко были предоставлены участникам в 1-литровых УВТ упаковках и имели следующую пищевую ценность на 100 мл: энергетическая ценность - 189 кДж, белки - 3.1 г, жиры - 2.5 г и углеводы (в том числе лактоза) - 5.2 г. Участники регистрировали объем молока, потребляемого за день, в календаре соблюдения режима терапии. Соблюдение режима терапии оценивалось в процентах, путем деления потребленного объема молока на ожидаемый объем потребления молока каждый день, и умножения на 100. А1 молоко и А2 молоко были предоставлены в идентичных немаркированных упаковках, чтобы участники не знали о действии молока, которое они получают.
В качестве косвенного показателя времени пассажа через толстую кишку была использована Бристольская шкала стула (Lewis S.J. and Heaton K.W., Scand. J. Gastroenterol. 1997, 32(9):920–4). Результаты показаны в Таблице 4.
Таблица 4 Анализ консистенции стула по Бристольской шкале стула
(n=36)
(n=28)
A1-A2 (±ст.ош.)
(A1, A2)
Пример 7: Влияние БКМ-7 на накопление цистеина
Анализ накопления радиоактивного [35S]-цистеина проводили в эпителиальных клетках кишечника Сасо-2 и нервных клетках, в присутствии БКМ-7, полученного из A1 молока, и сравнивали с необработанными контрольными, а также морфином; прототипным агонистом опиоидного рецептора. Предварительную обработку в клетках проводили в различные временные точки 30 мин, 4 ч, 24 ч 48 ч, как было описано ранее (Trivedi M., et al.; Mol. Pharm., 2014). Вкратце, нервные клетки человека SH-SY5Y и эпителиальные клетки кишечника Сасо-2 высевали в шестилуночные планшеты, предварительно обрабатывали препаратами, и инкубировали в течение различных отрезков времени перед измерением поглощения. Среды отсасывали и клетки промывали 600 мкл HBSS при 37°С. Не-радиоактивный HBSS отсасывали, заменяли на 600 мкл 37°C HBSS, содержащий [35S]-цистеин (1 мкКи/1 мл), 10 мкМ немеченого цистеина и 100 мкМ DTT, и клетки инкубировали в течение 5 мин. Смесь [35S]-цистеин/HBSS отсасывали и обработку прекращали двумя промывками ледяным HBSS. Дополнительно, действие морфина и БКМ-7 на накопление цистеина были также охарактеризованы в присутствии D-Phe-Cys-Tyr-D-Trp-Arg-Thr-Pen-Thr (CTAP), селективного μ-антагониста, и дельта антагониста нальтриндол (NTI). Результаты показаны на Фигурах 5 и 6. Каждый символ * на этих Фигурах обозначает статистически значимое различие (р<0.05) при сравнении с необработанным контролем, и каждый символ # обозначает статистически значимое различие (р <0.005) при сравнении с необработанным контролем. Затем клетки лизировали 600 мкл dH2O, соскабливали, собирали в 1.5 мл микроцентрифужные пробирки, и обрабатывали ультразвуком в течение 10 с. 100 мкл каждого образца делили на аликвоты для белкового анализа. 200 мкл каждого образца (в трех экземплярах) разносили на аликвоты в сцинтилляционные флаконы с 4 мл сцинтилляционной жидкости, перемешивали и измеряли радиоактивность, нормализованную на содержание белка.
Пример 8: Влияние БКМ-7 на уровни GSH
В этом примере исследовали, может ли снижение поглощения цистеина, как наблюдали в примере 7, потенциально привести к изменению GSH и повлиять на уровни антиоксидантов. Внутриклеточные уровни GSH измеряли с БКМ-7, а также морфином в различные временные точки (30 мин, 4 ч, 24 ч) с использованием ВЭЖХ высокоэффективной жидкостной хроматографии и метода детекции электрохимического градиента, использованного ранее (Hodgson et al., J. Alzh. Dis. 2013, Trivedi M., et al., Mol. Pharm. 2014). Вкратце, нервные клетки SH-SY5Y выращивали до конфлуентности в среде α-МЕМ. Среду отсасывали и клетки дважды промывали 1 мл ледяного HBSS. HBSS отсасывали и добавляли к клеткам 0.6 мл ледяной dH2O. Клетки соскребали с флакона/чашки и суспендировали в dH2O. Суспензию клеток обрабатывали ультразвуком в течение 15 с на льду, и 100 мкл суспензии использовали для определения содержания белка. Оставшийся лизат переносили в микроцентрифужную пробирку и к нему добавляли равный объем 0.4 Н перхлорной кислоты с последующим инкубированием на льду в течение 5 мин. Образцы центрифугировали при 5000хg, и супернатант переносили в новые микроцентрифужные пробирки. 100 мкл образца переносили в коническую виалку микро-автосамплера и хранили при 4°С в охлаждающем поддоне автосамплера. 10 мкл этой пробы инъецировали в систему ВЭЖХ.
Разделение метаболитов окислительно-восстановительного пути и пути метилирования осуществляли с использованием аналитической колонки Agilent Eclipse, XDB-C8 (3×150 мм; 3.5 мкм) и защитной колонки Agilent Eclipse, XDB-C8 (4.6×12.5 мм; 5 мкм). Были использованы две подвижные фазы: Подвижная фаза А представляла собой 0% ацетонитрил, 25 мМ фосфат натрия, 1.4 мМ 1-октансульфоновую кислоту, доведенную до рН 2.65 фосфорной кислотой. Подвижная фаза В представляла собой 50% ацетонитрил. Скорость потока была первоначально установлена на уровне 0.6 мл/мин и был использован ступенчатый градиент: 0-9 мин 0% B, 9-19 мин 50% B, 19-30 мин 50% В. Колонку затем уравновешивали 5% В в течение 12 мин до следующего запуска. Температуру поддерживали на уровне 27°С. Электрохимический детектор был ESA CoulArray с аналитическими ячейками BDD модели 5040 и рабочий потенциал была установлен на уровне 1500 мВ. Концентрации образцов были определены из площадей пиков метаболитов с использованием стандартных калибровочных кривых и ESA-прилагаемого программного обеспечения ВЭЖХ. Концентрации образцов были нормализованы на содержание белка. В некоторых случаях образцы разводили в подвижной фазе как необходимо, или вводили до 50 мкл образца для обеспечения того, чтобы уровни тиола были в пределах стандартной кривой. Результаты показаны на Фиг. 7.
Пример 9: Влияние БКМ-7 на уровни метилирования ДНК и экспрессии генов
Изменения SAM/SAH потенциально могут влиять на глобальное метилирование ДНК, затрагивая гены, участвующие в различных функциях. Уровни глобального метилирования ДНК, индуцированного БКМ-7, были исследованы с помощью секвенирования генома, обогащенного белком с метил-CpG-связывающим доменом (MBD, methyl-CpG binding domain), (MBD-секвенирования), как описано ранее (Trivedi M., et al., Mol. Pharm. 2014), в то время как данные микроматричного анализа трансляции мРНК были получены с использованием микрочипов Agilent V3, на необработанных контрольных клетках SH-SY5Y, и клетках, обработанных в течение 4 часов 1 мкМ БКМ-7.
Вкратце, геномную ДНК экстрагировали из образцов с набором Easy DNA kit (Invitrogen K1800-01) с использованием соответствующего протокола для клеточных линий. Фрагментацию ДНК выполняли на приборе Covaris S2 со следующими настройками: рабочий цикл 10%, интенсивность 5, 200 циклов на разрыв в течение 200 сек. Были получены фрагменты, имеющие среднюю длину 200 п.о. Режим питания представлял собой режим качания частоты, температура 6-8°C, уровень воды 12. Максимум 5 мкг было добавлено к 130 мкл трис-ЭДТА в микропробирку с AFA (Adaptive Focused Acoustics) усилителем. Для образцов с введением меньшего количества ДНК (до 500 нг) ДНК разводили в соотношении 1:5 в Tris-ЭДТА. ДНК с введением 5-3 мкг анализировали на биоанализаторе Agilent 2100 с использованием набора для анализа ДНК DNA 1000 Kit. ДНК с введением ниже 3 мкг концентрировали в роторном испарителе до 25 мкл и проверяли распределение фрагментов на ДНК-чипе с высокой чувствительностью. Захват метилированной ДНК осуществляли с использованием набора MethylCap (Diagenode, Belgium). Выход был обычно между 0.5 и 8 нг от общей захваченной ДНК. Фрагменты были последовательно секвенированы, с помощью секвенатора Illumina Genome Analyzer II. Концентрации фрагментированной ДНК и захваченной были определены на ридере для считывания многолуночных планшетов Fluostar Optima с набором для количественного определения двухцепочечной ДНК Quant-iT PicoGreen dsDNA Assay Kit (Invitrogen P7589) при длине волны 480/520 нм.
Для приготовления библиотеки ДНК, был использован набор DNA Sample Prep Master Mix Set 1 (NEB E6040) в комбинации с набором Multiplexing Sample Preparation Oligo Kit (96 samples, Illumina PE-400-1001). Вся фрагментированная ДНК была использована в соответствии с протоколами NEB (New England Biolabs), с использованием адаптеров для мультиплексирования образцов, предусмотренных в наборе Multiplexing Sample Preparation Oligo Kit. Отбор фрагментов библиотеки нужного размера проводили в 2% агарозном геле (Low Range Ultra Agarose, Biorad 161-3107). Использовали маркер размеров 1 Кб Plus ladder (Invitrogen 10787-018) и электрофорез проводили при 120 В в течение 2 часов. Фрагменты размером 300 п.о. +/- 50 п.о. вырезали и элюировали на колонке из набора Qiagen Gel Extraction Kit (Qiagen 28704) и элюировали в 23 мкл EB.
Протокол амплификации библиотеки одновременно с ее индексированием для платформы Illumina был использован со следующими изменениями: использовали 22 мкл ДНК и осуществляли 21 цикл. Образец очищали на колонке для очистки продуктов ПЦР Qiaquick PCR Purification column (Qiagen 28101) и элюировали в 50 мкл EB, разводили в соотношении 1: 5, концентрировали в роторном испарителе до 10 мкл. 1 мкл наносили на высокочувствительный ДНК-чип от Agilent 2100 и концентрацию определяли путем анализа шмера на Agilent 2100. Образцы разбавляли до концентрации 10 нM. После денатурации с NaOH образцы разбавляли до концентрации 16 пM. Подготовку ячейки для парно-концевых (Paired-End) прочтений осуществляли в соответствии с Руководством Пользователя для Cluster Station. Секвенирование проводили в соответствии с руководством пользователя для секвенатора HiSeq (проведение мультиплексного парноконцевого прочтения), с 2 х 51 циклов для парно-концевых прочтений.
Для полногеномной гибридизации на микрочипах, 500 нг тотальной РНК из каждого образца метили флуоресцентным красителем (Cy3; Amersham Biosciences Corp., Piscataway, NJ) с использованием набора Low RNA Input Linear Amplification Labelling kit (Agilent Technologies, Palo Alto, CA) в соответствии с протоколом производителя. Количество и качество флуоресцентно меченой кРНК оценивали с помощью спектрофотометра NanoDrop ND-1000 и анализатора Bioanalyzer (компания Agilent). Согласно спецификациям производителя, 1.6 мг Су3-меченой кРНК гибридизовали на экспрессионных микрочипах Human Whole Genome Oligo Microarray (Agilent Technologies, Inc., Palo Alto, CA) в течение 17 часов перед отмывками и сканированием. Данные, извлекали из отсканированных изображений с помощью программного обеспечения Feature Extraction (Agilent Technologies, Inc., Palo Alto, CA).
Полногеномное секвенирование ДНК методом MBD-seq выявило транскрипты с дифференциально метилированными промоторами (ДМТ), как определено методом оценки доли ложноположительных результатов (FDR, false discovery rate) <0.1 и данные микроматричного анализа мРНК, показали дифференциально экспрессируемые транскрипты (ДЭТ), определенные методом оценки FDR<0.1. Транскрипты включают оба гена и некодирующие РНК, которые были дифференциально метилированы/транскрибированы. Эпигенетические изменения, а также изменения транскрипции, вызванные БКМ-7 в конкретных биологических или функционально соответствующих путях, были оценены с помощью анализа Ingenuity Pathway Analysis (IPA), и были определены пути, оказывающие наибольшее действие. Результаты показаны в таблице 5.
Таблица 5: Воспалительные заболевания и БКМ-7 дифференциально экспрессированные транскрипты
Пример 10: Влияние БКМ-7 на эпигенетический статус цитокинов
Несколько индивидуальных цитокинов, как сообщается, участвуют в опосредовании воспалительной реакции при таких заболеваниях, как IBD и болезнь Крона. Одним из примеров является ядерный фактор NF-kappa B (nuclear factor kappa-light-chain-enhancer of activated B cells). Сходным образом, интерлейкины, такие как ИЛ1, ИЛ10, ИЛ33 и т.д., также сообщается, участвуют в опосредовании воспалительной реакции в ВЗК. Эпигенетические действия БКМ-7 на интерлейкины и NF-kappa B были исследованы методом, описанным выше в Примере 9.
Фиг.8 и 9 показывают действие БКМ-7 опосредованные метилированием ДНК изменения внутригенной или около-промоторной области этих генов, а именно MPO, IL1, IL1R и NF-kappa B-активирующего белка. "CpG" обозначает нормальный уровень CpG островков (участков с высокой частотой динуклеотидов цитозин-гуанин) обнаруженные в этом специфическом генном локусе. "Контроль" обозначает, необработанные контроли.
Несмотря на то, что изобретение было описано в виде примера, следует понимать, что варианты и модификации могут быть сделаны без отступления от сущности и объема изобретения, как определено в формуле изобретения. Кроме того, если существуют известные эквиваленты специфических особенностей, такие эквиваленты включены, как если бы конкретно упоминались в данном описании.
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕТА-КАЗЕИН А2 И ПРЕДОТВРАЩЕНИЕ ВОСПАЛЕНИЯ КИШЕЧНИКА | 2014 |
|
RU2669553C2 |
| БЕТА-КАЗЕИН А2 И УМЕНЬШЕНИЕ ИЛИ ПРЕДОТВРАЩЕНИЕ СИМПТОМОВ НЕПЕРЕНОСИМОСТИ ЛАКТОЗЫ | 2014 |
|
RU2671562C2 |
| БЕТА-КАЗЕИН А2 И УМЕНЬШЕНИЕ ИЛИ ПРЕДОТВРАЩЕНИЕ СИМПТОМОВ НЕПЕРЕНОСИМОСТИ ЛАКТОЗЫ | 2014 |
|
RU2791693C2 |
| БЕТА-КАЗЕИН A2 И УРОВЕНЬ ГЛЮКОЗЫ В КРОВИ | 2014 |
|
RU2802806C1 |
| БЕТА-КАЗЕИН А2 И УРОВЕНЬ ГЛЮКОЗЫ В КРОВИ | 2014 |
|
RU2698794C2 |
| БЕТА-КАЗЕИН И КОГНИТИВНАЯ ФУНКЦИЯ | 2017 |
|
RU2766194C2 |
| БЕТА-КАЗЕИНЫ И КИШЕЧНАЯ МИКРОБИОТА | 2016 |
|
RU2769989C2 |
| БЕТА-КАЗЕИН А2 И АНТИОКСИДАНТНАЯ СПОСОБНОСТЬ | 2016 |
|
RU2751945C2 |
| КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНОГО СОСТОЯНИЯ КИШЕЧНИКА | 2008 |
|
RU2495121C2 |
| АНАЛИЗ БЕТА-КАЗЕИНА МОЛОКА И МОЛОЧНЫХ ПРОДУКТОВ | 2019 |
|
RU2830136C2 |


Группа изобретений относится к фармацевтической промышленности, а именно к способу предотвращения хронического воспаления у человека путем поддержания эпигенетического статуса одного или более генов, ответственных за опосредование воспалительного ответа. Предлагается способ предотвращения хронического воспаления у человека путем поддержания эпигенетического статуса одного или более генов, ответственных за опосредование воспалительного ответа, согласно которому указанный человек употребляет молочный продукт, или человека обеспечивают молочным продуктом для употребления, где указанный молочный продукт содержит бета-казеин, при этом указанный бета-казеин содержит по меньшей мере 50% по массе вариантов бета-казеина, содержащих пролин в положении 67 аминокислотной последовательности бета-казеина, и содержит менее 50% по массе вариантов бета-казеина, содержащих гистидин в положении 67 аминокислотной последовательности бета-казеина, при этом указанные один или более генов выбраны из группы, включающей МРО, IL1R, IL10 и NFKappaB. Молочный продукт для предотвращения хронического воспаления у человека путем поддержания эпигенетического статуса одного или более генов, ответственных за опосредование воспалительного ответа, при этом указанный молочный продукт содержит бета-казеин, где указанный бета-казеин содержит по меньшей мере 50% по массе вариантов бета-казеина, содержащих пролин в положении 67 аминокислотной последовательности бета-казеина, и содержит менее 50% по массе вариантов бета-казеина, содержащих гистидин в положении 67 аминокислотной последовательности бета-казеина, и при этом указанные один или более генов выбраны из группы, включающей МРО, IL1R, IL10 и NFKappaB. Применение молока для получения молочного продукта для предотвращения хронического воспаления у человека путем поддержания эпигенетического статуса одного или более генов, ответственных за опосредование воспалительного ответа, при этом указанное молоко содержит бета-казеин, где указанный бета-казеин содержит по меньшей мере 50% по массе вариантов бета-казеина, содержащих пролин в положении 67 аминокислотной последовательности бета-казеина, и содержит менее 50% по массе вариантов бета-казеина, содержащих гистидин в положении 67 аминокислотной последовательности бета-казеина, и при этом указанные один или более генов выбраны из группы, включающей МРО, IL1R, IL10 и NFKappaB. Вышеописанная группа изобретений способствует эффективному предотвращению хронического воспаления у человека путем поддержания эпигенетического статуса одного или более генов, ответственных за опосредование воспалительного ответа, которые выбраны из группы, включающей МРО, IL1R, IL10 и NFKappaB. 3 н. и 14 з.п. ф-лы, 9 ил., 5 табл., 10 пр.
1. Способ предотвращения хронического воспаления у человека путем поддержания эпигенетического статуса одного или более генов, ответственных за опосредование воспалительного ответа, согласно которому указанный человек употребляет молочный продукт, или человека обеспечивают молочным продуктом для употребления, где указанный молочный продукт содержит бета-казеин, при этом указанный бета-казеин содержит по меньшей мере 50% по массе вариантов бета-казеина, содержащих пролин в положении 67 аминокислотной последовательности бета-казеина, и содержит менее 50% по массе вариантов бета-казеина, содержащих гистидин в положении 67 аминокислотной последовательности бета-казеина, при этом указанные один или более генов выбраны из группы, включающей МРО, IL1R, IL10 и NFKappaB.
2. Способ по п. 1, отличающийся тем, что указанный бета-казеин содержит по меньшей мере 50% по массе бета-казеина А2.
3. Способ по п. 1, отличающийся тем, что указанный бета-казеин содержит менее 50% по массе вариантов бета-казеина, способных высвобождать бета-казоморфин-7 при ферментативном расщеплении в кишечнике у животного.
4. Способ по любому из пп. 1-3, отличающийся тем, что поддержание эпигенетического статуса одного или более генов уменьшает риск развития воспаления кишечника.
5. Способ по п. 4, отличающийся тем, что указанное воспаление кишечника представляет собой воспалительное заболевание кишечника.
6. Способ по п. 5, отличающийся тем, что указанное воспалительное заболевание кишечника представляет собой болезнь Крона или язвенный колит.
7. Способ по п. 4, отличающийся тем, что указанное воспаление кишечника представляет собой синдром раздраженного кишечника.
8. Способ по любому из пп. 1-7, отличающийся тем, что указанный бета-казеин содержит по меньшей мере 90% по массе бета-казеина А2.
9. Способ по п. 8, отличающийся тем, что указанный бета-казеин содержит по меньшей мере 99% по массе бета-казеина А2.
10. Способ по любому из пп. 1-9, отличающийся тем, что указанный бета-казеин содержит менее 50% по массе бета-казеина А1.
11. Способ по п. 10, отличающийся тем, что указанный бета-казеин содержит менее 10% по массе бета-казеина А1.
12. Способ по п. 11, отличающийся тем, что указанный бета-казеин содержит менее 1% по массе бета-казеина А1.
13. Способ по п. 1, отличающийся тем, что указанный молочный продукт получен от коров, которые известны как имеющие генотип А2А2 по бета-казеину.
14. Способ по любому из пп. 1-13, отличающийся тем, что указанный молочный продукт представляет собой свежее молоко, сухое молоко, восстановленное из сухого жидкое молоко, обезжиренное молоко, гомогенизированное молоко, сгущенное молоко, концентрированное молоко, пастеризованное молоко, непастеризованное молоко или молоко ультравысокотемпературной обработки (УВТ-молоко).
15. Способ по любому из пп. 1-13, отличающийся тем, что указанный молочный продукт представляет собой сливки, йогурт, творог, сыр, масло или мороженое.
16. Молочный продукт для предотвращения хронического воспаления у человека путем поддержания эпигенетического статуса одного или более генов, ответственных за опосредование воспалительного ответа, при этом указанный молочный продукт содержит бета-казеин, где указанный бета-казеин содержит по меньшей мере 50% по массе вариантов бета-казеина, содержащих пролин в положении 67 аминокислотной последовательности бета-казеина, и содержит менее 50% по массе вариантов бета-казеина, содержащих гистидин в положении 67 аминокислотной последовательности бета-казеина, и при этом указанные один или более генов выбраны из группы, включающей МРО, IL1R, IL10 и NFKappaB.
17. Применение молока для получения молочного продукта для предотвращения хронического воспаления у человека путем поддержания эпигенетического статуса одного или более генов, ответственных за опосредование воспалительного ответа, при этом указанное молоко содержит бета-казеин, где указанный бета-казеин содержит по меньшей мере 50% по массе вариантов бета-казеина, содержащих пролин в положении 67 аминокислотной последовательности бета-казеина, и содержит менее 50% по массе вариантов бета-казеина, содержащих гистидин в положении 67 аминокислотной последовательности бета-казеина, и при этом указанные один или более генов выбраны из группы, включающей МРО, IL1R, IL10 и NFKappaB.
| US 20120070469 A1, 22.03.2012 | |||
| US 20060280802 A1, 14.12.2006 | |||
| WO 9614577 A1, 03.11.1995 | |||
| WO 9636239 A1, 21.11.1996. |
Авторы
Даты
2022-11-30—Публикация
2014-05-30—Подача