Настоящая заявка испрашивает приоритет на основании заявки на патент Китая №201910281978.2, поданной в Национальное ведомство по интеллектуальной собственности Китая 9 апреля 2019 года под названием «КРИОКОНСЕРВИРУЮЩИЙ РАСТВОР, НЕ СОДЕРЖАЩИЙ ДМСО, И СПОСОБ ЕГО ПОЛУЧЕНИЯ», и заявки на патент Китая №201910281986.7 под названием «ПЕПТИДНОЕ СОЕДИНЕНИЕ И СОДЕРЖАЩИЙ ЕГО КРИОКОНСЕРВИРУЮЩИЙ РАСТВОР», каждая из которых включена в настоящую заявку в полном объеме посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к технической области биомедицинских материалов и, в частности, к криоконсервирующему раствору, не содержащему ДМСО, и способу его получения.
УРОВЕНЬ ТЕХНИКИ
Технология криоконсервации стала одной из самых незаменимых исследовательских методик в области естественных наук с момента ее создания и имеет широкое применение. С улучшением качества жизни и развитием медицинской техники криоконсервация половых клеток человека (сперматозоидов и ооцитов), гонадных тканей и т.п. становится важным средством сохранения репродуктивной способности. Кроме того, по мере старения мировой популяции, быстро растет потребность в криоконсервации донорских клеток, тканей или органов человека, которые могут быть использованы для регенеративной медицины и трансплантации органов. Следовательно, вопрос эффективной криоконсервации ценных клеток, тканей и органов становится важной темой в области естественных наук.
В настоящее время наиболее распространенным способом криоконсервации является витрификация. Несмотря на то, что технология витрификации обеспечивает витрификацию жидкости внутри и снаружи клетки непосредственно в ходе процесса быстрой заморозки, что позволяет избегать повреждения, обусловленного образованием кристаллов льда в процессе замораживания, реагенты для криоконсервации, известные из уровня техники, являются неэффективными в отношении контроля роста и перекристаллизации кристаллов льда в ходе процесса размораживания, что, таким образом, приводит к повреждению клетки. Диметилсульфоксид (ДМСО) является широко используемым сорастворителем и криоконсервантом для клеток проникающего типа для клеточной культуры in vitro. Однако ДМСО оказывает неблагоприятное побочное действие в клинических исследованиях, а также проявляет высокую цитотоксичность. Различные типы клеток характеризуются разными показателями чувствительности к концентрации ДМСО, что приводит к токсическим и побочным эффектам реагентов для криоконсервации при поглощении клетками ДМСО в качестве основного компонента защитного агента. Таким образом, применение реагентов для криоконсервации ограничено. В настоящее время при витрификации обычно используется высокая концентрация (≥15%) ДМСО, что оказывает серьезное влияние на выживаемость и даже безопасность (потомства) и проявления функциональности у криоконсервированных объектов после восстановления. В заключение, реагенты для криоконсервации, используемые в настоящее время, характеризуются проблемами, связанными с их неспособностью обеспечивать эффективный контроль роста и перекристаллизации кристаллов льда в ходе процесса размораживания, а также с их высокой токсичностью.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Для преодоления вышеуказанных недостатков предшествующего уровня техники согласно настоящему изобретению предложены криоконсервирующий раствор, не содержащий ДМСО, и способ его получения.
Согласно настоящему изобретению предложено следующее техническое решение:
криоконсервирующий раствор, не содержащий ДМСО, содержащий в пересчете на объем 100 мл 0,01-50,0 г биомиметического материала для подавления нарастания льда, 5,0-45 мл многоатомного спирта, водорастворимый сахарид в концентрации 0,1-1 моль/л, 0-30 мл сыворотки, и остальное составляет буфер, причем биомиметический материал для подавления нарастания льда выбран из поливинилового спирта (ЛВС) и/или аминокислотного биомиметического материала для подавления нарастания льда, при этом криоконсервирующий раствор не содержит диметилсульфоксида (ДМСО).
Согласно настоящему изобретению аминокислотный биомиметический материал для подавления нарастания льда выбран из одного или двух или более из следующих компонентов: полиаминокислота (со степенью полимеризации ≥2, предпочтительно 8-40, такой как 8, 15 или 20 и т.д.), аминокислота и пептидное соединение.
Согласно настоящему изобретению пептидное соединение представляет собой полипептид (предпочтительно пептид, состоящий из 2-8 разных аминокислот, такой как дипептид, трипептид или тетрапептид), производное гликопептида или соединение формулы (I):
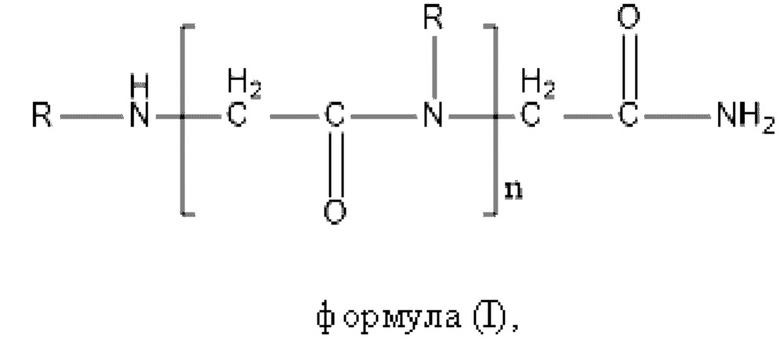
где R выбран из замещенного или незамещенного алкила, причем заместитель может быть выбран из -ОН, -NH2, -СООН, -CONH2 и т.п.; например, R представляет собой замещенный или незамещенный C1-6алкил, и предпочтительно R представляет собой -CH3, -СН2СН3 или -СН2СН2СООН; n представляет собой целое число, которое больше или равняется 1 и меньше или равняется 1000, и, например, может представлять собой целое число в диапазоне от 1 до 100. Согласно некоторым вариантам реализации настоящего изобретения n представляет собой целое число, такое как 2, 3, 4, 5, 6, 7, 8, 9 или 10.
Согласно настоящему изобретению многоатомный спирт может представлять собой многоатомный С2-5-спирт, предпочтительно С2-С3 двухатомный спирт и трехатомный спирт, и, например, любой из этиленгликоля, пропиленгликоля и глицерина.
Согласно настоящему изобретению водорастворимый сахарид может представлять собой по меньшей мере одно из невосстанавливающего дисахарида, водорастворимого полисахарида, водорастворимой целлюлозы и гликозида, например, может быть выбран из сахарозы, трегалозы, полисахарозы и гидроксипропилметилцеллюлозы. Водорастворимый сахарид может защищать клеточные мембраны и препятствовать седиментации клеток. Согласно настоящему изобретению буфер может представлять собой по меньшей мере один из DPBS, HEPES-забуференного HTF-буфера и других буферов для клеток.
Согласно настоящему изобретению сыворотка может представлять собой человеческий сывороточный альбумин или его заменитель, такой как додецилсульфат натрия (ДСН), для криоконсервации материала, полученного из организма человека, и может представлять собой фетальную бычью сыворотку или бычий сывороточный альбумин для криоконсервации материала, полученного из организма, отличного от человека.
В криоконсервирующем растворе, раскрытом в настоящей заявке, биомиметический материал для подавления нарастания льда может представлять собой ПВС, при этом содержание ПВС составляет 0,1-6,0 г, например, 0,5-5,0 г, и, в частности, может составлять 1,0 г, 2,0 г, 3,0 г или 4,0 г.
В соответствии с криоконсервирующим раствором, раскрытым в настоящей заявке, биомиметический материал для подавления нарастания льда может представлять собой полиаминокислоту или аминокислоту, при этом содержание полиаминокислоты или аминокислоты составляет 0,01-50 г, например, 1,5-50 г, и, в частности, может составлять 8,0 г, 10 г, 15 г, 20 г, 30 г или 40 г.
В соответствии с криоконсервирующим раствором, раскрытым в настоящей заявке, материал для подавления нарастания льда может представлять собой комбинацию ПВС и полиаминокислоты, например, состоит из 0,1-5,0 г ПВС и 1,0-9,0 г полиаминокислоты.
В соответствии с криоконсервирующим раствором, раскрытым в настоящей заявке, материал для подавления нарастания льда может представлять собой комбинацию ПВС и аминокислоты, например, состоит из 0,1-5,0 г ПВС и 8,0-35 г аминокислоты.
В соответствии с криоконсервирующим раствором, раскрытым в настоящей заявке, содержание многоатомного спирта составляет 6,0-28 мл, например, 7,0-20 мл или 10-15 мл на 100 мл криоконсервирующего раствора.
В соответствии с криоконсервирующим раствором, раскрытым в настоящей заявке, содержание сыворотки составляет 0,1-30 мл, например, 5,0-20 мл или 10-15 мл на 100 мл криоконсервирующего раствора.
В криоконсервирующем растворе, раскрытом в настоящей заявке, содержание сыворотки предпочтительно составляет 0 на 100 мл криоконсервирующего раствора.
В криоконсервирующем растворе, раскрытом в настоящей заявке, содержание водорастворимого сахарида составляет 0,1-1,0 моль/л на 100 мл криоконсервирующего раствора, например, 0,1-0,8 моль/л или 0,2-0,6 моль/л, и, в частности, например, 0,25 моль/л, 0,5 моль/л или 1,0 моль/л.
В соответствии с криоконсервирующим раствором, раскрытым в настоящей заявке, рН криоконсервирующего раствора составляет 6,5-7,6, например, 6,9-7,2.
В качестве варианта реализации настоящего изобретения криоконсервирующий раствор состоит из следующих компонентов в пересчете на объем 100 мл:
0,01 6,0 г ПВС,
5,0-45 мл многоатомного спирта,
0,1-30 мл сыворотки,
водорастворимый сахарид в концентрации 0,1-1,0 моль/л, и
остальное составляет буфер.
Предпочтительно криоконсервирующий раствор состоит из следующих компонентов в пересчете на объем 100 мл:
1,0-6,0 г ПВС,
5-30 мл этиленгликоля,
0,1-20 мл сыворотки,
сахароза в концентрации 0,2-0,8 моль/л, и
остальное составляет DPBS.
В качестве варианта реализации настоящего изобретения криоконсервирующий раствор состоит из следующих компонентов на 100 мл в объеме:
1,0-5,0 г ПВС,
10-45 мл многоатомного спирта,
водорастворимый сахарид в концентрации 0,1-1,0 моль/л, и
остальное составляет буфер.
Предпочтительно криоконсервирующий раствор состоит из следующих компонентов в пересчете на объем 100 мл:
1,0-5,0 г ПВС,
10-30 мл этиленгликоля,
сахароза в концентрации 0,2-0,8 моль/л, и
остальное составляет DPBS.
В качестве варианта реализации настоящего изобретения криоконсервирующий раствор состоит из следующих компонентов в пересчете на объем 100 мл:
2,0-50 г аминокислоты,
0,1-6 г ПВС,
10-30 мл многоатомного спирта,
водорастворимый сахарид в концентрации 0,1-1,0 моль/л,
10-20 мл сыворотки, и
остальное составляет буфер.
Предпочтительно криоконсервирующий раствор состоит из следующих компонентов в пересчете на объем 100 мл:
5,0-18 г L-Arg,
3,0-12 г L-Thr,
1,0-6,0 г ПВС,
10-20 мл этиленгликоля,
сахароза в концентрации 0,2-0,8 моль/л,
10-20 мл сыворотки, и
остальное составляет DPBS.
В качестве варианта реализации настоящего изобретения криоконсервирующий раствор состоит из следующих компонентов в пересчете на объем 100 мл:
0,1-9,0 г полиаминокислоты,
0,01-6,0 г ПВС,
10-30 мл многоатомного спирта,
водорастворимый сахарид в концентрации 0,1-1,0 моль/л, и
остальное составляет буфер.
Предпочтительно криоконсервирующий раствор состоит из следующих компонентов в пересчете на объем 100 мл:
0,1-5,0 г полипролина или полиаргинина,
1,0-6,0 г ПВС,
10-20 мл этиленгликоля,
сахароза в концентрации 0,2-0,8 моль/л, и
остальное составляет DPBS.
Согласно настоящему изобретению также предложен способ получения криоконсервирующего раствора, который включает следующие стадии: растворение в DPBS биомиметического материала для подавления нарастания льда, охлаждение до комнатной температуры перед регулированием рН, растворение других компонентов, за исключением сыворотки, в оставшемся DPBS, и смешивание после охлаждения, и снова подтверждение или регулирование рН, а также добавление буфера для достижения заданного объема, причем сыворотку добавляют при применении криоконсервирующего раствора.
Способ получения согласно настоящему изобретению включает следующие стадии:
(1) растворение ПВС в порции буфера и охлаждение до комнатной температуры перед регулированием рН с получением раствора 1;
(2) необязательно растворение полиаминокислоты или аминокислоты в порции буфера и охлаждение до комнатной температуры перед регулированием рН с получением раствора 2;
(3) растворение водорастворимого сахарида в другой порции буфера и после полного растворения водорастворимого сахарида добавление других компонентов, за исключением сыворотки, с получением раствора 3; и
(4) смешивание раствора 1, необязательно раствора 2 и раствора 3 после их охлаждения до комнатной температуры, и регулирование рН, и доведение объема до заданного объема буфером с получением криоконсервирующего раствора.
Способ получения согласно настоящему изобретению включает следующие стадии:
(1) растворение полиаминокислоты или аминокислоты в порции буфера и охлаждение до комнатной температуры перед регулированием рН с получением раствора 1;
(2) растворение ПВС в порции буфера и охлаждение до комнатной температуры перед регулированием рН с получением раствора 2;
(3) растворение водорастворимого сахарида в другой порции буфера и после полного растворения водорастворимого сахарида добавление других компонентов, за исключением сыворотки, с получением раствора 3; и
(4) смешивание раствора 1, необязательно раствора 2 и раствора 3 после их охлаждения до комнатной температуры, и регулирование рН, и доведение объема до заданного объема буфером с получением криоконсервирующего раствора.
Согласно способу получения, раскрытому в настоящей заявке, если криоконсервирующий раствор содержит сыворотку, то сыворотку добавляют при применении криоконсервирующего раствора.
Согласно способу получения, раскрытому в настоящей заявке, на стадии (1) ПВС растворяют при нагревании на теплой бане, например, при нагревании на масляной бане или на водяной бане. Например, температура водяной бани составляет 60-95°С, предпочтительно 80°С. На стадии (1) растворение включает стадию перемешивания.
Согласно способу получения, раскрытому в настоящей заявке, на стадии (2) растворение представляет собой растворение с помощью ультразвука.
Предложен не содержащий ДМСО замораживающий уравновешивающий раствор, содержащий в пересчете на объем 100 мл 0-5,0 г ПВС, 5,0-45 мл многоатомного спирта, 0-30 мл сыворотки, и остальное составляет буфер.
В замораживающем уравновешивающем растворе, раскрытом в настоящей заявке, содержание ПВС составляет 0,1-5,0 г, например, 0,1 г, 0,5 г, 1,0 г или 2,0 г.
В замораживающем уравновешивающем растворе, раскрытом в настоящей заявке, содержание многоатомного спирта составляет 6,0-28 мл, например, 7,0-20 мл или 10-15 мл.
В замораживающем уравновешивающем растворе, раскрытом в настоящей заявке, содержание сыворотки составляет 0,1-30 мл, например, 5,0-20 мл или 10-15 мл. В качестве варианта реализации настоящего изобретения содержание сыворотки составляет 0.
В качестве варианта реализации настоящего изобретения замораживающий уравновешивающий раствор в пересчете на объем 100 мл содержит 7,5-15 мл многоатомного спирта, 10-20 мл сыворотки, и остальное составляет DPBS.
В качестве варианта реализации настоящего изобретения замораживающий уравновешивающий раствор в пересчете на объем 100 мл содержит 1,0-5,0 г ПВС, 7,5-15 мл многоатомного спирта, и остальное составляет буфер.
В замораживающем уравновешивающем растворе, раскрытом в настоящей заявке, ПВС, многоатомный спирт и сыворотка могут быть выбраны из типов соответствующих компонентов криоконсервирующего раствора.
Согласно настоящему изобретению дополнительно предложен способ получения замораживающего уравновешивающего раствора, который включает растворение соответствующих компонентов в буфере, при этом сыворотку хранят отдельно и добавляют к замораживающему уравновешивающему раствору при его применении.
Предложен криоконсервирующий реагент, не содержащий ДМСО, содержащий замораживающий уравновешивающий раствор, описанный выше, и криоконсервирующий раствор, описанный выше, причем замораживающий уравновешивающий раствор и криоконсервирующий раствор представлены независимо соответственно.
Согласно криоконсервирующему реагенту, раскрытому в настоящей заявке, содержание сыворотки в криоконсервирующем растворе составляет 0, при этом замораживающий уравновешивающий раствор содержит в пересчете на объем 100 мл 1,0-5,0 г ПВС, 7,5-15 мл многоатомного спирта, и остальное составляет буфер.
В криоконсервирующем реагенте, раскрытом в настоящей заявке, замораживающий уравновешивающий раствор содержит в пересчете на объем 100 мл следующие компоненты:
0-5,0 г ПВС,
0-15 г полиаминокислоты,
5,0-45 мл многоатомного спирта,
0-30 мл сыворотки, и
остальное составляет буфер;
криоконсервирующий раствор содержит следующие компоненты в пересчете на общий объем 100 мл:
0,01-6,0 г ПВС,
0-50 г аминокислоты или полиаминокислоты,
5,0-45 мл многоатомного спирта,
0-30 мл сыворотки,
водорастворимый сахарид в концентрации
0,1-1,0 моль/л, и
остальное составляет буфер.
Согласно настоящему изобретению ПВС выбран из одного или комбинации двух или более ПВС, таких как изотактический ПВС, синдиотактический ПВС и атактический ПВС. Например, ПВС характеризуется синдиотактичностью 15-60%, предпочтительно 45-60%, такой как 50-55%.
Согласно настоящему изобретению ПВС может быть выбран из ПВС с молекулярной массой 10-500 кДа или более, такой как 10-30 кДа, 30-50 кДа, 80-90 кДа или 200-500 кДа.
Согласно настоящему изобретению ПВС может быть выбран из ПВС со степенью гидролиза более 80%, такой как 80-99%, 82-87%, 87-89%, 89-99% или 98-99%.
Согласно настоящему изобретению полиаминокислота может представлять собой гомополимер (со степенью полимеризации ≥2) по меньшей мере одного, выбранного из лизина, аргинина, пролина, треонина, гистидина, глутаминовой кислоты, аспарагиновой кислоты, глицина и т.п.
Согласно настоящему изобретению пептидное соединение представляет собой полипептид, который состоит из двух или более аминокислот и может быть выбран из одного или более из L-Thr-L-Arg (TR), L-Thr-L-Pro (TP), L-Arg-L-Thr (RT), L-Pro-L-Thr (PT), L-Thr-L-Arg-L-Thr (TRT), L-Thr-L-Pro-L-Thr (TPT) и L-Ala-L-Ala-L-Thr (AAT). Эти полипептиды могут быть синтезированы с применением способа синтеза полипептидов, известного из уровня техники, такого как способ твердофазного синтеза.
Согласно настоящему изобретению гликопептидное производное синтезировано с использованием сахарида и аминокислоты, например, представляет собой молекулу, состоящую из глюконо-дельта-лактона (GDL) и аминокислоты, характеризующейся сродством со льдом, посредством химического связывания, и, например, представляет собой GDL-L-Thr, GDL-L-Gln, GDL-L-Asn, GDL-L-Phe, GDL-L-Tyr или GDL-L-Thr. Гликопептидное соединение может быть получено путем осуществления реакции сахарида, известного из уровня техники, с аминокислотой, например, способом твердофазного синтеза или путем осуществления реакции сахарида с аминокислотой в органическом растворителе.
Согласно настоящему изобретению пептидное соединение имеет структуру в соответствии с любой из формул (1) - (8):
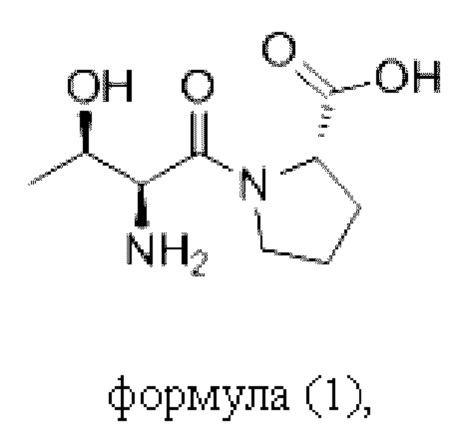
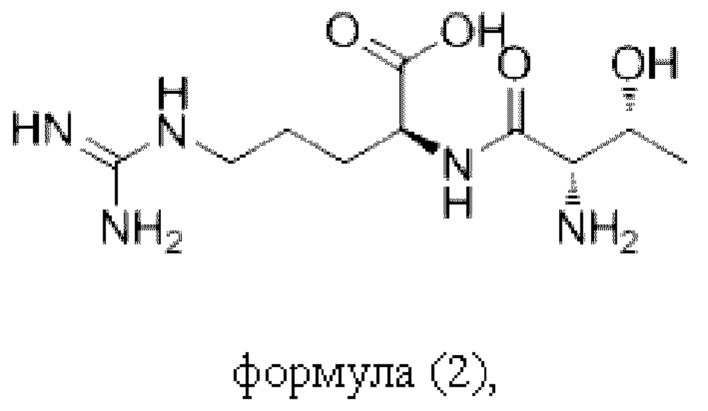
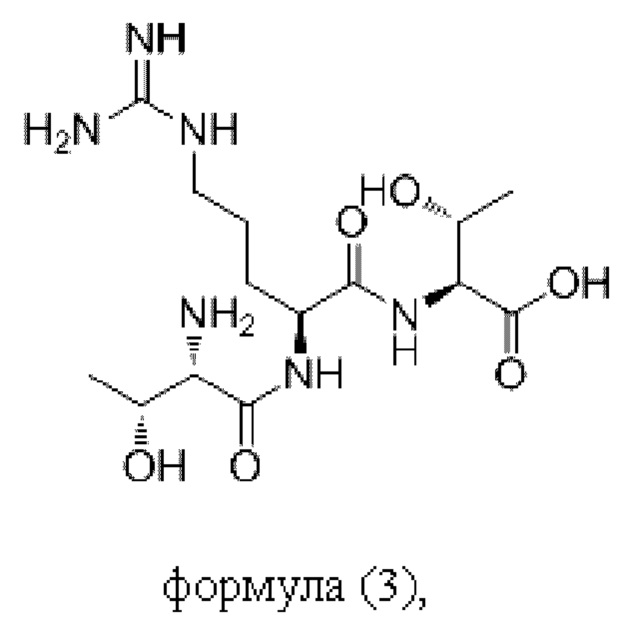
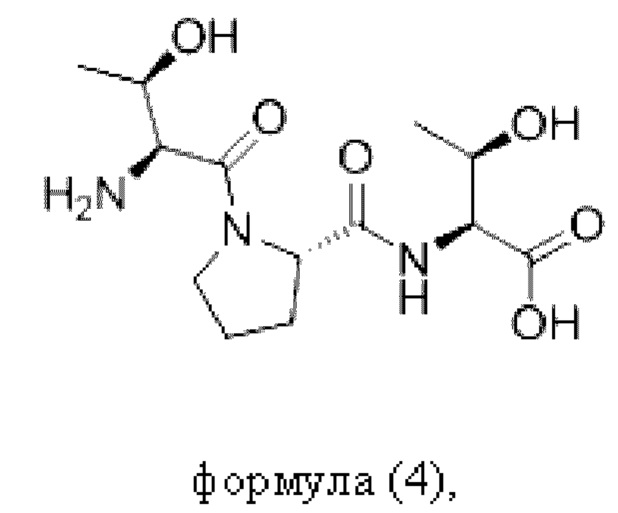
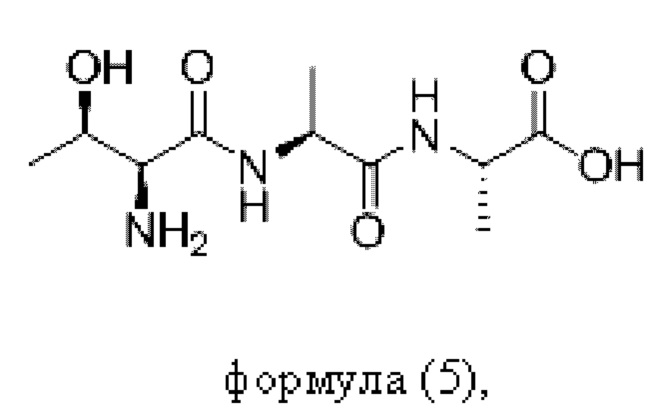
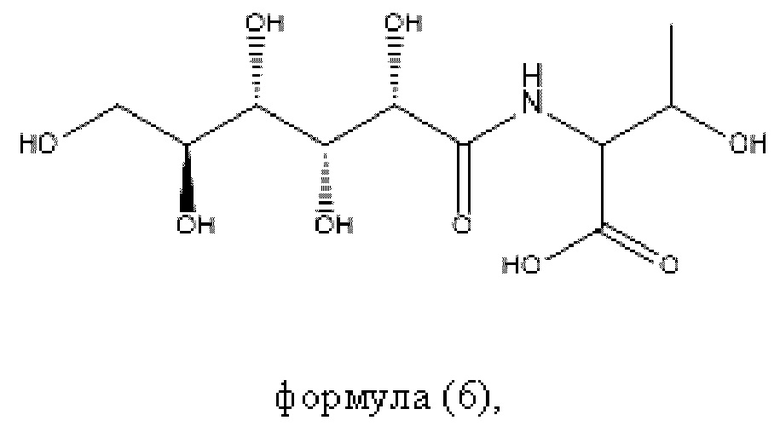
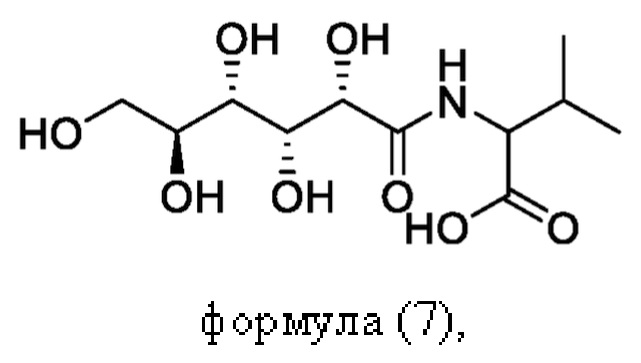
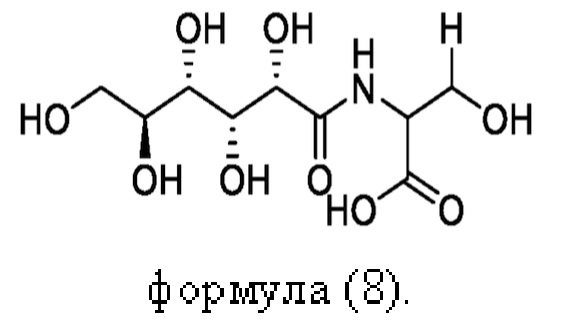
Согласно настоящему изобретению соединение формулы (I) имеет структуру, соответствующую любой из представленных:
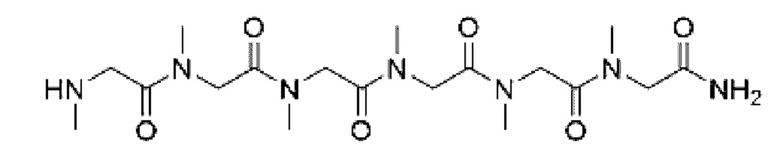
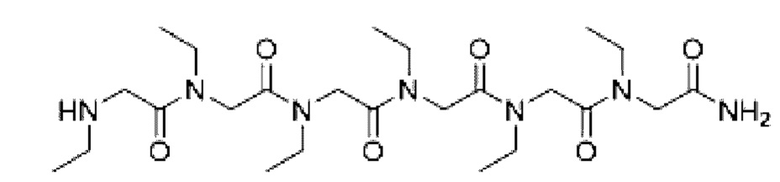
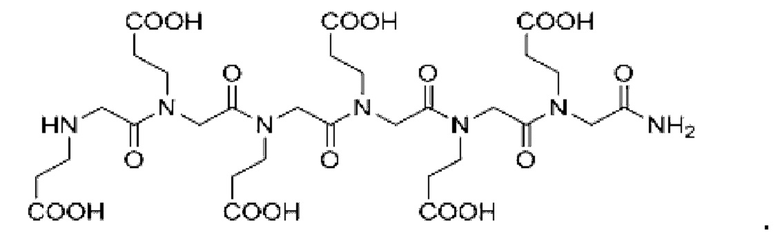
Согласно настоящему изобретению соединение, представленное формулой (9), получают с применением следующего пути синтеза:
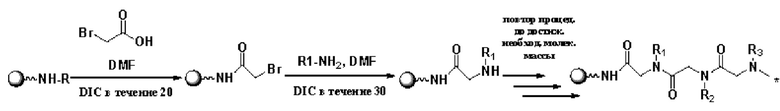
В криоконсервирующем растворе и замораживающем уравновешивающем растворе, раскрытых в настоящей заявке, количества всех компонентов представлены в пересчете на общий объем раствора 100 мл, при этом остальное представляет собой буфер.
Согласно настоящему изобретению дополнительно предложено применение криоконсервирующего раствора при криоконсервации различных клеток, органов и тканей, включая криоконсервацию ооцитов, эмбрионов, различных стволовых клеток, органов и тканей, причем органы и ткани включают, но не ограничиваются ими, овариальные органы и овариальные ткани.
Согласно настоящему изобретению также предложен способ замораживания и размораживания клеток или эмбрионов, включающий:
(1) помещение клеток или эмбрионов в криоконсервирующий раствор, раскрытый в настоящей заявке, с получением суспензии клеток, и замораживание; и
(2) помещение замороженных клеток или эмбрионов в размораживающий раствор для размораживания и восстановления.
Согласно способу замораживания и восстановления, раскрытому в настоящей заявке, клетки или эмбрионы помещают в уравновешивающий раствор для уравновешивания перед их помещением в криоконсервирующий раствор.
Согласно настоящему изобретению дополнительно предложен способ криоконсервации стволовых клеток, в котором применяют микрокапельный метод. Например, способ криоконсервации стволовых клеток включает следующие стадии: добавление к стволовым клеткам криоконсервирующего раствора, пипетирование смеси с диспергированием стволовых клеток с получением суспензии стволовых клеток и помещение суспензии стволовых клеток на предметное стекло для замораживания и осуществление криоконсервации в жидком азоте (-196°С).
Согласно одному варианту реализации настоящего изобретения размораживание криоконсервированных стволовых клеток включает помещение предметного стекла для замораживания со стволовыми клетками в среду а-МЕМ и размораживание клеток при температуре 37°С.
Согласно одному варианту реализации настоящего изобретения стволовые клетки представляют собой различные стволовые клетки, которые известны в данной области техники и способны к дифференциации, такие как тотипотентные, плюрипотентные или унипотентные стволовые клетки, включая, но не ограничиваясь ими, эмбриональные стволовые клетки, мезенхимальные стволовые клетки различных типов (например, мезенхимальные стволовые клетки пуповины, мезенхимальные стволовые клетки жировой ткани и мезенхимальные стволовые клетки костного мозга), гемопоэтические стволовые клетки и т.п.
Согласно настоящему изобретению дополнительно предложен способ криоконсервации органов и/или тканей, включающий: помещение органа и/или ткани в замораживающий уравновешивающий раствор для уравновешивания, помещение указанных органа и/или ткани в криоконсервирующий раствор, помещение указанных органа и/или ткани на предметное стекло для замораживания и осуществление криоконсервации в жидком азоте.
Согласно одному варианту реализации настоящего изобретения орган и/или ткань представляют собой овариальную ткань или овариальный орган, которые могут представлять собой срез овариальной ткани или цельную овариальную ткань.
Согласно настоящему изобретению термины «криоконсервация» и «криогенная консервация» имеют одно и то же значение и используются взаимозаменяемо для обозначения консервации вещества или клетки, ткани или органа при низкой температуре с сохранением их исходной физико-химической и/или биологической активности, а также их физиологических и биохимических функций.
Согласно настоящему изобретению тип «стволовых клеток» конкретно не ограничен. Криоконсервирующий раствор, раскрытый в настоящей заявке, можно применять для криоконсервации различных стволовых клеток, известных в данной области техники, включая, но не ограничиваясь ими, мезенхимальные стволовые клетки пуповины, мезенхимальные стволовые клетки костного мозга, мезенхимальные стволовые клетки жировой ткани, гемопоэтические стволовые клетки и т.п.
Согласно настоящему изобретению биологическая ткань может быть получена из животных, включая теплокровных млекопитающих, таких как люди и приматы; птиц; домашних или сельскохозяйственных животных, таких как кошки, собаки, овцы, козы, крупный рогатый скот, лошади и свиньи; лабораторных животных, таких как мыши, крысы и морские свинки; рыб; рептилий; и зоопарковых животных, и диких животных, и т.п.
Преимущества
Криоконсервирующий раствор и замораживающий уравновешивающий раствор, раскрытые в настоящей заявке, не содержат ДМСО. При применении для криоконсервации ооцитов и эмбрионов мышей они могут обеспечивать достижение показателей выживаемости клеток и тканей, а также стабильности проявления функциональности, аналогичных или даже выше, чем у коммерческого криоконсервирующего раствора (содержащего ДМСО в объемной концентрации 15%), и, таким образом, они обладают относительно высокой эффективностью консервации. Криоконсервирующий раствор, не содержащий ДМСО и не содержащий сыворотки, дополнительно обеспечивает решение проблем, заключающихся в том, что коммерческие криоконсервирующие растворы, обычно используемые в клинической практике в настоящее время, являются недостаточно стабильными и склонны к включению паразитарных биологических загрязнителей, обусловленных наличием сыворотки. Криоконсервирующий раствор, раскрытый в настоящей заявке, характеризуется простотой состава, легкодоступностью исходных материалов и низкой стоимостью, а также может широко применяться при криоконсервации ооцитов, клеточных клеток (таких как эмбрионы), стволовых клеток, тканей и органов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ. 1 представляет собой изображение окрашенного среза свежего (незамороженного) овариального органа новорожденной мыши 3-дневного возраста;
ФИГ. 2 представляет собой изображение окрашенного среза криоконсервированного интактного овариального органа согласно сравнительному варианту реализации 7 после размораживания;
ФИГ. 3 представляет собой изображение окрашенного среза криоконсервированного интактного овариального органа согласно варианту применения 14 после размораживания;
ФИГ. 4 представляет собой изображение окрашенного среза криоконсервированного интактного овариального органа согласно варианту применения 15 после размораживания;
ФИГ. 5 представляет собой изображение окрашенного среза криоконсервированного овариального органа согласно варианту реализации 16 после размораживания;
ФИГ. 6 представляет собой изображение окрашенного среза свежей (незамороженной) овариальной ткани половозрелой мыши;
ФИГ. 7 представляет собой изображение окрашенного среза криоконсервированной овариальной ткани согласно сравнительному варианту реализации 8 после размораживания;
ФИГ. 8 представляет собой изображение окрашенного среза криоконсервированной овариальной ткани согласно варианту применения 17 после размораживания;
ФИГ. 9 представляет собой изображение окрашенного среза криоконсервированной овариальной ткани согласно варианту применения 18 после размораживания; и
ФИГ. 10 представляет собой изображение окрашенного среза криоконсервированной овариальной ткани согласно варианту применения 19 после размораживания.
ПОДРОБНОЕ ОПИСАНИЕ
Способ получения согласно настоящему изобретению будет более подробно проиллюстрирован со ссылкой на следующие конкретные примеры. Следует понимать, что следующие примеры представлены лишь с целью типичной иллюстрации и пояснения настоящего изобретения, и их не следует рассматривать как ограничивающие объем правовой охраны настоящего изобретения. Все методики, разрабатываемые на основании вышеуказанного содержания настоящего изобретения, подпадают под объем правовой охраны настоящего изобретения.
Если не указано иное, экспериментальные методы, используемые в следующих примерах, представляют собой традиционные методы. Если не указано иное, реагенты, материалы и т.п., используемые в следующих примерах, являются коммерчески доступными.
ПВС, используемый в примерах настоящего изобретения, характеризуется синдиотактичностью 50-55%, молекулярной массой 13-23 кДа и степенью гидролиза 98%.
В примерах настоящего изобретения поли-L-пролин, используемый в замораживающем растворе, характеризуется степенью полимеризации 8 или 15 и молекулярной массой 795 или 1475, при этом используемый поли-L-аргинин характеризуется степенью полимеризации 8 и молекулярной массой 1267. Поли-L-пролин в размораживающем растворе характеризуется степенью полимеризации 8 и молекулярной массой 795.
Показатель выживаемости в примерах настоящего изобретения представляет собой среднее для показателя выживаемости в 3 12 повторных экспериментах.
Пример 1. Криоконсервация ооцитов и эмбрионов мышей
1. Получение криоконсервирующих растворов: криоконсервирующие растворы получали согласно приведенным ниже составам.
Криоконсервирующий раствор А содержит на 100 мл следующие компоненты:


2,0 г ПВС растворяли в 25 мл DPBS на водяной бане при 80°С с использованием магнитной мешалки при нагревании и доводили рН до 7,0 с получением раствора 1; 1,5 г поли-L-пролина растворяли под воздействием ультразвука в дополнительных 20 мл DPBS и доводили рН до 7,0 с получением раствора 2; 17 г (0,05 моль) сахарозы (конечная концентрация сахарозы в криоконсервирующем растворе составляла 0,5 моль/л) растворяли под воздействием ультразвука в 25 мл DPBS и после полного растворения сахарозы добавляли 10 мл этиленгликоля с получением раствора 3; после повторного достижения комнатной температуры раствор 1, раствор 2 и раствор 3 хорошо смешивали, доводили рН до 7,0 и доводили объем до общего объема 100 мл с помощью DPBS с получением криоконсервирующего раствора А для последующего применения.
Криоконсервирующий раствор В содержит на 100 мл следующие компоненты:
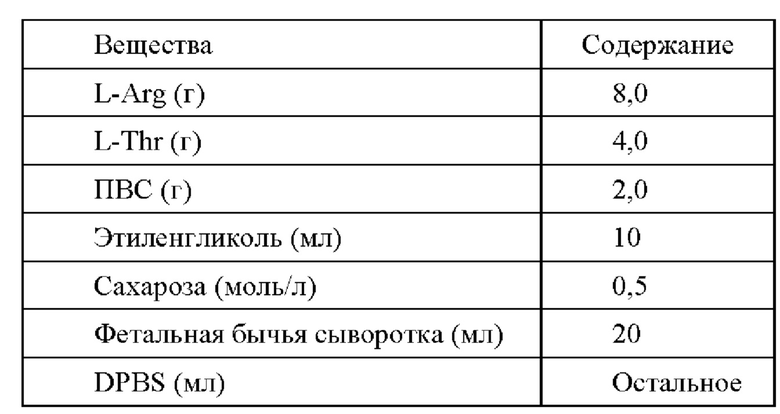
Стадии получения криоконсервирующего раствора В: 2,0 г ПВС растворяли в 20 мл DPBS на водяной бане при 80°С при нагревании и с использованием магнитной мешалки и доводили рН до 7,1 с получением раствора 1; 8,0 г L-Arg и 4,0 г L-Thr растворяли в 20 мл DPBS и доводили рН до 7,1 с получением раствора 2; 17 г (0,05 моль) сахарозы (конечная концентрация сахарозы в криоконсервирующем растворе составляла 0,5 моль/л) растворяли под воздействием ультразвука в 20 мл DPBS и после полного растворения сахарозы добавляли 10 мл этиленгликоля с получением раствора 3; после повторного достижения комнатной температуры раствор 1, раствор 2 и раствор 3 хорошо смешивали, доводили рН до 7,1 и объем доводили до 80% от общего объема с помощью DPBS; при применении криоконсервирующего раствора добавляли 20 мл сыворотки.
Криоконсервирующий раствор С содержит в пересчете на объем 100 мл следующие компоненты:


2,0 г ПВС растворяли в 25 мл DPBS на водяной бане при 80°С с использованием магнитной мешалки при нагревании и доводили рН до 6,9 с получением раствора 1; 17 г (0,05 моль) сахарозы (конечная концентрация сахарозы в криоконсервирующем растворе составляла 0,5 моль/л) растворяли под воздействием ультразвука в 25 мл DPBS и после полного растворения сахарозы добавляли 10 мл этиленгликоля с получением раствора 2; после повторного достижения комнатной температуры раствор 1 и раствор 2 хорошо смешивали, регулировали рН и объем доводили до 80% от общего объема; 20 мл сыворотки хранили отдельно и добавляли при применении криоконсервирующего раствора.
Криоконсервирующий раствор D содержит в пересчете на объем 100 мл следующие компоненты:
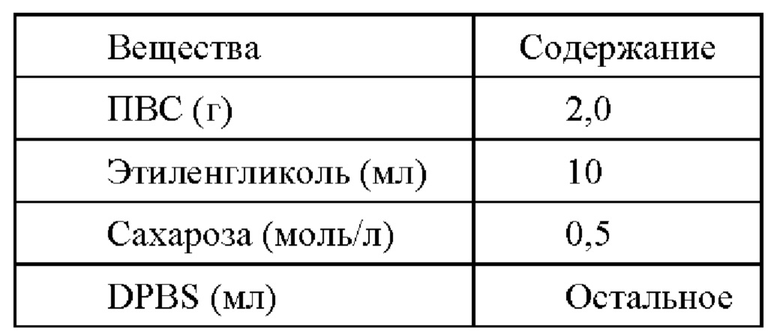
2,0 г ПВС растворяли в 30 мл DPBS на водяной бане при 80°С при нагревании и с использованием магнитной мешалки и доводили рН до 7,0 с получением раствора 1; 17 г (0,05 моль) сахарозы (конечная концентрация сахарозы в криоконсервирующем растворе составляла 0,5 моль/л) растворяли под воздействием ультразвука в 25 мл DPBS и после полного растворения сахарозы добавляли 10 мл этиленгликоля с получением раствора 2; после повторного достижения комнатной температуры раствор 1 и раствор 2 хорошо смешивали, регулировали рН и доводили объем до общего объема 100 мл с получением криоконсервирующего раствора D для последующего применения.
2. Получение замораживающих уравновешивающих растворов: замораживающие уравновешивающие растворы получали согласно приведенным ниже составам.
Замораживающий уравновешивающий раствор а: 2,0 г ПВС растворяли в 50 мл буфера DPBS на водяной бане при 80°С с использованием магнитной мешалки при нагревании и после полного растворения ПВС доводили рН до 7,0, добавляли 7,5 мл этиленгликоля, тщательно перемешивали все компоненты и доводили объем до 100 мл с помощью буфера DPBS с получением замораживающего уравновешивающего раствора а для последующего применения.
Замораживающий уравновешивающий раствор b (общий объем: 100 мл): 7,5 мл этиленгликоля растворяли в 72,5 мл DPBS, и тщательно перемешивали, и при применении замораживающего уравновешивающего раствора добавляли 20 мл сыворотки.
Сравнительный пример 1
Замораживающий уравновешивающий раствор №1 содержит, в пересчете на 1 мл, 7,5% (об./об.) ДМСО, 7,5% (об./об.) этиленгликоля, 20% (об./об.) фетальной бычьей сыворотки, и остальное составляет DPBS.
Криоконсервирующий раствор №1 содержит, в пересчете на 1 мл, 15% (об./об.) ДМСО, 15% (об./об.) этиленгликоля, 20% (об./об.) фетальной бычьей сыворотки, 0,5 М сахарозы, и остальное составляет DPBS.
Замораживающий уравновешивающий раствор b содержит, в пересчете на 1 мл, 7,5% (об./об.) этиленгликоля, 20% (об./об.) фетальной бычьей сыворотки, и остальное составляет DPBS.
Криоконсервирующий раствор №2 содержит, в пересчете на 1 мл, 10% (об./об.) этиленгликоля, 20% (об./об.) фетальной бычьей сыворотки, 0,5 М сахарозы, и остальное составляет DPBS.
Три состава размораживающих растворов, используемых в Примере 1 и Сравнительном примере 1, описанных в настоящей заявке, представляли собой следующие:
Размораживающий раствор №1 содержит размораживающий раствор I (содержащий сахарозу в концентрации 1,0 моль/л, 20% сыворотки, и остальное составляет DPBS), размораживающий раствор II (содержащий сахарозу в концентрации 0,5 моль/л, 20% сыворотки, и остальное составляет DPBS), размораживающий раствор III (содержащий сахарозу в концентрации 0,25 моль/л, 20% сыворотки, и остальное составляет DPBS) и размораживающий раствор IV (20% сыворотки, и остальное составляет DPBS).
Размораживающий раствор №2 содержит размораживающий раствор I (содержащий сахарозу в концентрации 1,0 моль/л, ПВС в концентрации 20 мг/мл, и остальное составляет DPBS), размораживающий раствор II (содержащий сахарозу в концентрации 0,5 моль/л, ПВС в концентрации 20 мг/мл, и остальное составляет DPBS), размораживающий раствор III (содержащий сахарозу в концентрации 0,25 моль/л, ПВС в концентрации 20 мг/мл, и остальное составляет DPBS) и размораживающий раствор IV (содержащий ПВС в концентрации 20 мг/мл, и остальное составляет DPBS).
Размораживающий раствор №3 содержит размораживающий раствор I (содержащий сахарозу в концентрации 1,0 моль/л, ПВС в концентрации 20 мг/мл, полипролин в концентрации 10 мг/мл, и остальное составляет DPBS), размораживающий раствор II (содержащий сахарозу в концентрации 0,5 моль/л, ПВС в концентрации 20 мг/мл, полипролин в концентрации 5,0 мг/мл, и остальное составляет DPBS), размораживающий раствор III (содержащий сахарозу в концентрации 0,25 моль/л, ПВС в концентрации 20 мг/мл, полипролин в концентрации 2,5 мг/мл, и остальное составляет DPBS) и размораживающий раствор IV (ПВС в концентрации 20 мг/мл, и остальное составляет DPBS).
Пример применения 1:
Замораживающие уравновешивающие растворы и криоконсервирующие растворы из примера и сравнительного примера, описанных выше, применяли для криоконсервирования ооцитов и эмбрионов согласно схемам, представленным в Таблице 1 и Таблице 2, соответственно.
1. Криоконсервация ооцитов
Ооциты мышей сначала уравновешивали в замораживающем уравновешивающем растворе в течение 5 минут, а затем уравновешивали в полученном криоконсервирующем растворе в течение 1 минуты. Ооциты, уравновешенные в криоконсервирующем растворе, загружали на соломинки и соломинки быстро помещали в жидкий азот (-196°С), а затем закрывали для криоконсервации. Во время размораживания криоконсервированные ооциты уравновешивали в размораживающем растворе I при 37°С в течение 5 минут, а затем уравновешивали последовательно в размораживающих растворах II-IV по 3 минуты в каждом. После того, как размороженные ооциты инкубировали в течение 2 ч, наблюдали количество выживших клеток и рассчитывали показатели выживаемости (см. Таблицу 1).
2. Криоконсервация эмбрионов
Эмбрионы мышей сначала уравновешивали в замораживающем уравновешивающем растворе в течение 5 мин, а затем уравновешивали в полученном криоконсервирующем растворе в течение 50 с. Эмбрионы, уравновешенные в криоконсервирующем растворе, загружали на соломинки, и соломинки быстро помещали в жидкий азот (-196°С) и закрывали для криоконсервации. При размораживании замороженные эмбрионы уравновешивали в размораживающем растворе I при 37°С в течение 3 минут, а затем последовательно уравновешивали в размораживающих растворах II-IV по 3 минуты в каждом. После того, как размороженные эмбрионы инкубировали в течение 2 ч, наблюдали количество выживших эмбрионов и рассчитывали показатели выживаемости (см. Таблицу 2).
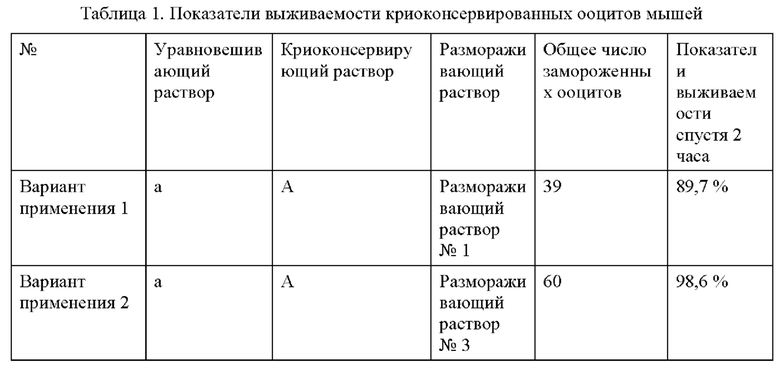
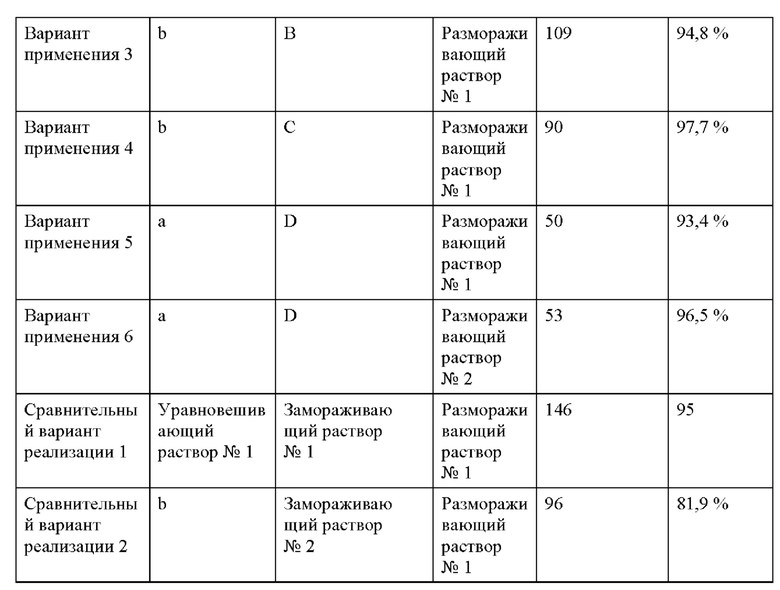
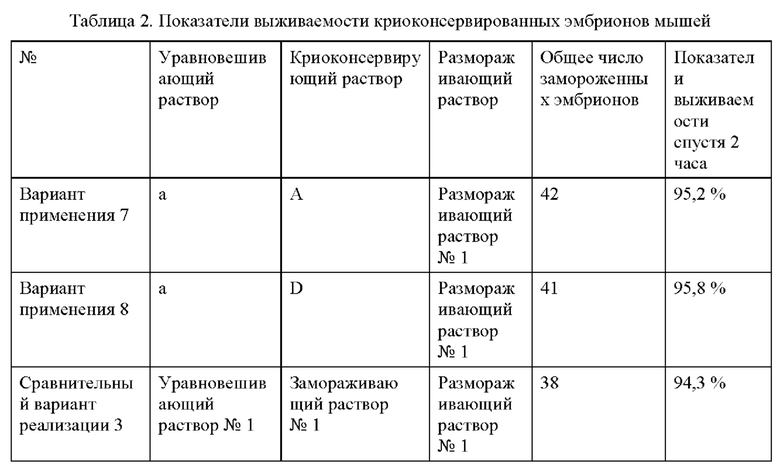

Согласно данным каждого из Примера 1 и Сравнительного примера 1 видно, что несмотря на отсутствие добавления ДМСО не содержащие ДМСО криоконсервирующий раствор и замораживающий уравновешивающий раствор, раскрытые в настоящей заявке, за счет синергетического эффекта всех компонентов по-прежнему обеспечивают надлежащее криоконсервирующее действие в отношении ооцитов и эмбрионов и обеспечивают устранение дефекта, заключающегося в том, что существующие криоконсервирующие растворы токсичны для клеток или эмбрионов из-за добавления ДМСО в относительно высокой концентрации. Кроме того, как видно из вариантов применения 2 и 6-8, когда в уравновешивающем растворе, замораживающем растворе и размораживающем растворе отсутствуют сыворотка и ДМСО, показатели выживаемости криоконсервированных ооцитов и эмбрионов могут превосходить таковые для существующих коммерческих криоконсервирующих растворов при совместном действии биомиметического материала для подавления нарастания льда, раскрытого в настоящей заявке, проницаемого защитного вещества, а именно этиленгликоля, и т.п. Дополнительно решаются проблемы, заключающиеся в том, что коммерческие криоконсервирующие растворы, обычно используемые в клинической практике в настоящее время, имеют короткий срок годности и склонны к включению паразитарных биологических загрязнителей, обусловленных наличием сыворотки.
Пример 2. Криоконсервация пуповинных мезенхимальных стволовых клеток человека
1. Получение криоконсервирующих растворов: криоконсервирующие растворы получали согласно приведенным ниже составам.
Криоконсервирующий раствор Е (общий объем: 100 мл) содержит 10 мл этиленгликоля, 20 мл сыворотки, 17 г сахарозы (0,5 моль/л), 4,0 г поли-L-аргинина (со степенью полимеризации 8), 1,0 г ПВС, и остальное составляет DPBS.
Криоконсервирующий раствор F (общий объем: 100 мл) содержит 20 мл этиленгликоля, 20 мл сыворотки, 17 г сахарозы (0,5 моль/л), 16 г L-Arg, 8,0 г L-Thr, и остальное составляет DPBS.
Криоконсервирующий раствор G (общий объем: 100 мл) содержит 10 мл этиленгликоля, 20 мл сыворотки, 17 г сахарозы (0,5 моль/л), 2,0 г ПВС, и остальное составляет DPBS.
Криоконсервирующий раствор Н (общий объем: 100 мл) содержит 10 мл этиленгликоля, 20 мл сыворотки, 17 г сахарозы (0,5 моль/л), 28 г TR, и остальное составляет DPBS.
Криоконсервирующий раствор I (общий объем: 100 мл) содержит 10 мл этиленгликоля, 17 г сахарозы (0,5 моль/л), 2,0 г ПВС, и остальное составляет DPBS.
Способы составления криоконсервирующих растворов были аналогичны таковым из Примера 1.
Способ получения TR заключается в следующем:
(1) 2-хлортритилхлоридную смолу помещали в реакционную пробирку и добавляли ДХМ (20 мл/г). Полученную смесь встряхивали в течение 30 мин. С помощью воронки с фильтром с песчаным сердечником удаляли растворитель путем отсасывания. К полученному остатку добавляли трехкратный молярный избыток Fmoc-L-Thr(tBu)-OH и восьмикратный молярный избыток DIEA, после чего добавляли ДМФА с обеспечением растворения. Полученную смесь встряхивали в течение 30 мин. Для блокирования концевых групп применяли обработку метанолом в течение 30 мин.
(2) Удаляли растворитель ДМФА. Затем добавляли 20% раствор пиперидина в ДМФА (10 мл/г) и через 5 мин удаляли растворитель; затем снова добавляли 20% раствор пиперидина в ДМФА (10 мл/г) и через 15 мин удаляли раствор пиперидина. Отбирали небольшое количество смолы и промывали этанолом три раза, затем добавляли нингидриновый реагент и нагревали при 105-110°С в течение 5 мин. Появлялось темно-синее окрашивание, что предусматривает положительную реакцию.
(3) После того как продукт, полученный в результате вышеприведенной реакции, последовательно промыли ДМФА (15 мл/г, дважды), метанолом (15 мл/г, дважды) и ДМФА (15 мл/г, дважды), в реакционную пробирку добавляли двукратный избыток Fmoc-Arg(Pbf)-OH, растворенный в как можно меньшем количестве ДМФА, и добавляли двукратный избыток HBTU. Сразу после этого добавляли восьмикратный избыток DIEA и оставляли для протекания реакции на 30 мин.
(4) После удаления раствора путем отсасывания отбирали небольшое количество смолы и промывали этанолом три раза, затем добавляли нингидриновый реагент и нагревали при 105-110°С в течение 5 мин. Бесцветная смесь предполагала отрицательную реакцию, то есть реакция была завершена.
(5) После того как продукт, полученный в результате вышеприведенной реакции, последовательно промыли ДМФА (15 мл/г, дважды), метанолом (15 мл/г, дважды) и ДМФА (15 мл/г, дважды), растворитель удаляли. Затем добавляли 20% раствор пиперидина в ДМФА (10 мл/г) и через 5 мин удаляли растворитель; затем снова добавляли 20% раствор пиперидина в ДМФА (10 мл/г) и через 15 мин удаляли раствор пиперидина. Отбирали небольшое количество смолы и промывали этанолом, добавляли нингидриновый реагент и нагревали при 105-110°С в течение 5 минут. Появлялось темно-синее окрашивание, что предусматривает положительную реакцию.
(6) После того как продукт, полученный в результате вышеприведенной реакции, последовательно промыли ДМФА (15 мл/г, дважды), метанолом (15 мл/г, дважды) и ДХМ (15 мл/г, дважды), смолу высушивали путем отсасывания.
(7) Полученный продукт отделяли с помощью отщепляющей жидкости (15 мл/г, ТФУК: вода: EDT:Tis=95:1:2:2, об./об.) в течение 90 мин. Отщепляющую жидкость продували до сухого состояния азотом, а затем лиофилизировали с получением неочищенного продукта, представляющего собой полипептид.
(8) Полипептид очищали с помощью ВЭЖХ и подвергали солевой трансформации или обессоливанию. ВЭЖХ: tR=4,8 мин (модель колонки для очистки: Kromasil 100-5С18, 4,6 мм*250 мм; градиент элюента: ацетонитрил с 0,1% ТФУК и водный раствор с 0,1% ТФУК, 0 мин 1:99, 20 мин 1:4. Очищенный раствор лиофилизировали с получением готового продукта L-Thr-L-Arg (TR). Выход составлял около 80%. Масс-спектр соответствовал [М+Н]+ при 276,2.
Сравнительный пример 2:
Криоконсервирующий раствор №3 содержит, в пересчете на 1 мл: 10% (об./об.) ДМСО, 15% (об./об.) фетальной бычьей сыворотки, и остальное составляет среда а-МЕМ (С12571500 ВТ, Invitrogen, США).
Пуповинные мезенхимальные стволовые клетки человека подвергали криоконсервации с применением криоконсервирующих растворов, описанных выше, согласно схеме, представленной в Таблице 3. Способ криоконсервации пуповинных стволовых клеток человека представляет собой, в частности, микрокапельный способ, а именно: пуповинные мезенхимальные стволовые клетки человека в чашке для культивирования расщепляли с использованием 25% панкреатина в течение 2 мин, помещали в культуральный раствор (10% FBS + культуральная среда а-МЕМ) того же объема и осторожно пипетировали до полного отделения стволовых клеток; клетки добавляли в центрифужную пробирку вместимостью 1,5 мл для центрифугирования в течение 5 мин при 1000 об/мин и отбрасывали надосадочную жидкость для отделения клеток от культуральной среды; добавляли 10 мкл замораживающего раствора в нижнюю часть центрифужной пробирки, осторожно пипетировали стволовые клетки с диспергированием кластеров стволовых клеток и помещали 10 мкл замораживающего раствора со стволовыми клетками на предметное стекло для замораживания, а затем криоконсервировали в жидком азоте (-196°С). При размораживании предметное стекло для замораживания с клетками и замораживающим раствором помещали непосредственно в среду а-МЕМ при 37°С для размораживания. После размораживания клетки окрашивали трипановым синим для изучения показателей выживаемости и подсчитывали число клеток с использованием прибора JIMBIO-FIL; показатель выживаемости представляет собой отношение числа живых клеток к общему числу клеток (см. Таблицу 3).
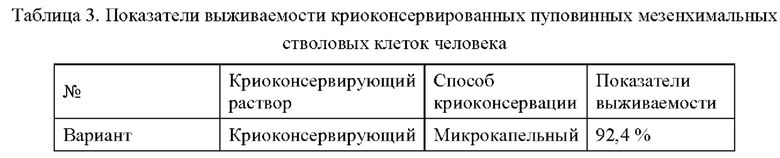
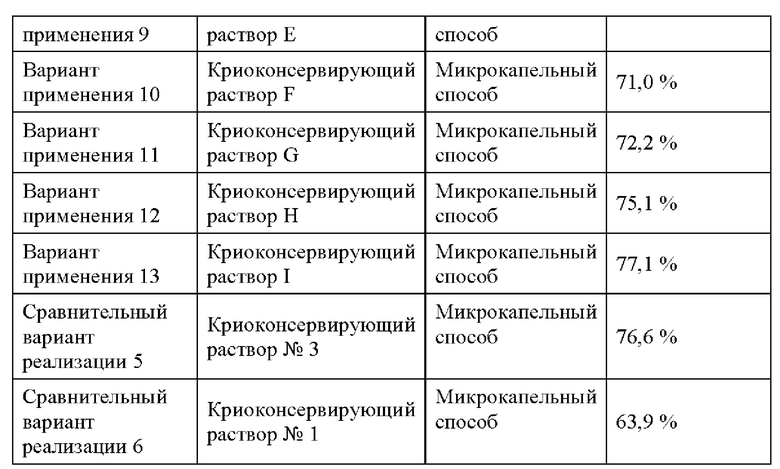
Когда раскрытый в настоящей заявке криоконсервирующий раствор применяют для криоконсервации пуповинных мезенхимальных стволовых клеток человека, показатель выживаемости стволовых клеток может достигать 92,4% (Вариант применения 9), несмотря на отсутствие добавления ДМСО, и может достигать 77,1% (Вариант применения 13) даже при отсутствии добавления ДМСО и сыворотки. Это означает, что криоконсервирующий реагент может обеспечивать достижение такой же эффективности, что и традиционный замораживающий раствор при замораживании стволовых клеток, при этом показатель выживаемости после размораживания для него даже значительно выше, чем для криоконсервирующего раствора (Сравнительный вариант реализации 5), содержащего 10% ДМСО, обычно используемого в настоящее время, и криоконсервирующий эффект криоконсервирующего раствора на основе ПВС значительно превосходит эффект криоконсервирующего раствора на основе ПВС, используемого в Сравнительном варианте реализации 6 без ПВС.
Пример 3. Криоконсервация интактных овариальных органов и срезов овариальной ткани
Криоконсервирующий раствор J (общий объем: 100 мл) содержит 10 мл этиленгликоля, 17 г сахарозы (0,5 моль/л), 2,0 г ПВС, и остальное составляет DPBS.
Криоконсервирующий раствор K (общий объем: 100 мл) содержит 10 мл этиленгликоля, 20 мл сыворотки, 17 г сахарозы (0,5 моль/л), 1,0 г ПВС, и остальное составляет DPBS.
Криоконсервирующий раствор L содержит 10 мл этиленгликоля, 20 мл сыворотки, 17 г сахарозы (0,5 моль/л), 4,0 г поли L-аргинина (со степенью полимеризации 8), 1,0 г ПВС, и остальное составляет DPBS.
Сравнительный пример 3: криоконсервирующий раствор содержит, в пересчете на 1 мл, 15% (об./об.) ДМСО, 15% (об./об.) этиленгликоля, 20% (об./об.) сыворотки, 0,5 М сахарозы, и остальное составляет DPBS.
Замораживающий уравновешивающий раствор а: 2,0 г ПВС растворяли в 50 мл буфера DPBS на водяной бане при 80°С с использованием магнитной мешалки при нагревании и после полного растворения ПВС доводили рН до 7,0, добавляли 7,5 мл этиленгликоля, тщательно перемешивали все компоненты, регулировали рН и объем доводили до 100 мл с получением замораживающего уравновешивающего раствора а для последующего применения.
Замораживающий уравновешивающий раствор b: 7,5 мл этиленгликоля добавляли в 72,5 мл DPBS, и тщательно перемешивали, и при применении замораживающего уравновешивающего раствора добавляли 20 мл сыворотки.
Сравнительный пример 3:
Замораживающий уравновешивающий раствор №1 содержит, в пересчете на 1 мл, 7,5% (об./об.) ДМСО, 7,5% (об./об.) этиленгликоля, 20% (об./об.) фетальной бычьей сыворотки, и остальное составляет DPBS.
Криоконсервирующий раствор №1 содержит, в пересчете на 1 мл: 15% (об./об.) ДМСО, 15% (об./об.) этиленгликоля, 20% (об./об.) фетальной бычьей сыворотки, сахарозу в концентрации 0,5 моль/л, и остальное составляет DPBS.
Размораживающий раствор №1 содержит размораживающий раствор I (содержащий сахарозу в концентрации 1,0 моль/л, 20% сыворотки, и остальное составляет DPBS), размораживающий раствор II (содержащий сахарозу в концентрации 0,5 моль/л, 20% сыворотки, и остальное составляет DPBS), размораживающий раствор III (содержащий сахарозу в концентрации 0,25 моль/л, 20% сыворотки, и остальное составляет DPBS) и размораживающий раствор IV (содержащий 20% сыворотки, и остальное составляет DPBS).
Размораживающий раствор №2 содержит размораживающий раствор I (содержащий сахарозу в концентрации 1,0 моль/л, ПВС в концентрации 20 мг/мл, и остальное составляет DPBS), размораживающий раствор II (содержащий сахарозу в концентрации 0,5 моль/л, ПВС в концентрации 20 мг/мл, и остальное составляет DPBS), размораживающий раствор III (содержащий сахарозу в концентрации 0,25 моль/л, ПВС в концентрации 20 мг/мл, и остальное составляет DPBS) и размораживающий раствор IV (содержащий ПВС в концентрации 20 мг/мл, и остальное составляет DPBS).
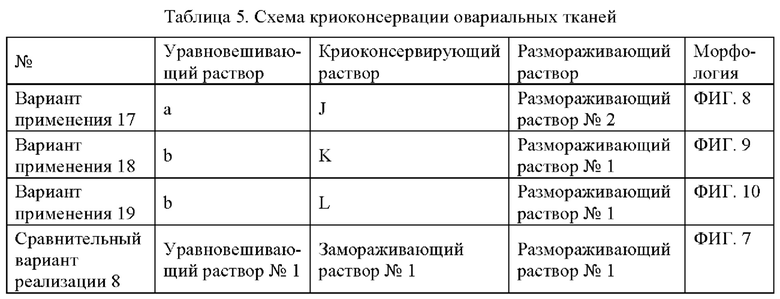
Интактные овариальные органы новорожденных мышей возрастом до 3 дней и срезы овариальной ткани половозрелых мышей подвергали криоконсервации с использованием криоконсервирующих растворов, описанных выше, и замораживающих уравновешивающих растворов и криоконсервирующих растворов из сравнительного примера согласно схемам, представленным в Таблице 4 и Таблице 5.
Цельные овариальные органы или срезы овариальной ткани сначала уравновешивали в уравновешивающем растворе при комнатной температуре в течение 25 мин, затем уравновешивали в полученном криоконсервирующем растворе в течение 15 мин и после этого загружали на соломинки; соломинки помещали в жидкий азот для консервации. После размораживания интактные овариальные органы или срезы овариальной ткани инкубировали в культуральном растворе (10% FBS+а-МЕМ) в инкубаторе при 37°С/5% СО2 в течение 2 ч для дальнейшего размораживания, а затем фиксировали с использованием 4% параформальдегида, заливали в парафин и окрашивали НЕ для морфологического исследования. Результаты показаны на ФИГ. 1-10. ФИГ. 1 представляет собой изображение среза свежего незамороженного овариального органа, и ФИГ. 6 представляет собой изображение среза свежей незамороженной овариальной ткани.
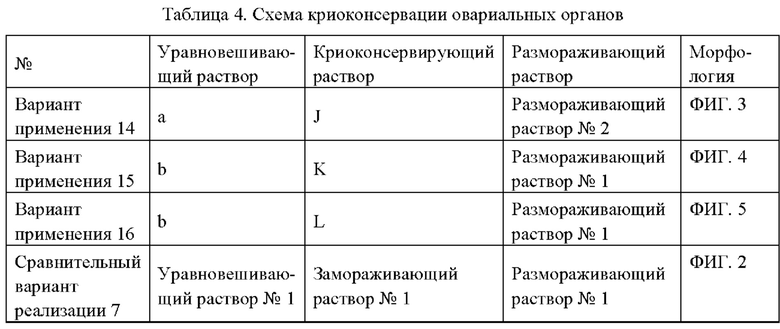
Как видно на ФИГ. 1-5, по отношению к Сравнительному варианту реализации 7, в котором отсутствует аминокислотный биомиметический материал для подавления нарастания льда, и свежим, незамороженным овариальным органам, примеры 14-16 характеризуются следующим: исходная структура фолликул остается относительно интактной, интерстициальная структура остается относительно интактной, цитоплазма клеток является однородной и слегка окрашенной в относительно небольшом количестве, а сокращения ядер и глубокое окрашивание являются относительно умеренными, структура сосудистой стенки является интактной, разрушение просвета является относительно небольшим, цитоплазма клеток эндотелия является однородной и слегка окрашенной, а сокращения ядер и глубокое окрашивание являются относительно умеренными. Видно, что примеры 14-16 характеризуются лучшим эффектом криоконсервации в отношении овариальных органов.
Как видно на ФИГ. 6-10, по отношению к Сравнительному варианту реализации 8 и свежей незамороженной овариальной ткани, схемы из Примеров 17-19 характеризуются следующим: структура антральных фолликул является относительно интактной, интерстициальная структура является относительно интактной, цитоплазма клеток является однородной и слегка окрашенной в относительно небольшом количестве, а сокращения ядер и глубокое окрашивание являются относительно умеренными. Видно, что раскрытые в настоящей заявке криоконсервирующие растворы оказывают лучший эффект в отношении криоконсервации овариальных тканей по сравнению с криоконсервирующими растворами, известными из уровня техники.
Выше были описаны конкретные примеры согласно настоящему изобретению. Однако настоящее изобретение не ограничено вышеприведенными примерами. Какая-либо модификация, эквивалент, улучшение и т.п., выполненные без отступления от сущности и принципа настоящего изобретения, безусловно подпадают под действие правовой охраны настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОМИМЕТИЧЕСКИЙ МАТЕРИАЛ, ПОДАВЛЯЮЩИЙ РОСТ ЛЬДА, И КРИОКОНСЕРВИРУЮЩИЙ РАСТВОР, СОДЕРЖАЩИЙ ЭТОТ МАТЕРИАЛ | 2020 |
|
RU2787934C1 |
| РАЗМОРАЖИВАЮЩАЯ ЖИДКОСТЬ, СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ И ЕЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2791227C1 |
| КРИОКОНСЕРВАЦИЯ ЭМБРИОНОВ КОПЫТНЫХ | 2016 |
|
RU2730597C2 |
| КОМПОЗИЦИИ И СПОСОБЫ КРИОКОНСЕРВАЦИИ КЛЕТОК | 2021 |
|
RU2840854C1 |
| СПОСОБ ВИТРИФИКАЦИИ ОВАРИАЛЬНОЙ ТКАНИ | 2018 |
|
RU2678106C2 |
| КОМБИНИРОВАННЫЙ КРИОПРОТЕКТОР "ДИМЕТИЛСУЛЬФОКСИД/РЕОПОЛИГЛЮКИН" ДЛЯ КРИОКОНСЕРВАЦИИ СТВОЛОВЫХ КЛЕТОК И СПОСОБ ИХ КРИОКОНСЕРВАЦИИ ДЛЯ КЛИНИЧЕСКОГО ПРИМЕНЕНИЯ | 2014 |
|
RU2563117C1 |
| СПОСОБЫ ВЫДЕЛЕНИЯ И КУЛЬТИВИРОВАНИЯ ЧЕЛОВЕЧЕСКИХ РЕТИНАЛЬНЫХ КЛЕТОК-ПРЕДШЕСТВЕННИКОВ | 2019 |
|
RU2809003C2 |
| Способ оптимизации криоконсервации овариальной ткани для долгосрочного хранения | 2022 |
|
RU2794963C1 |
| СПОСОБ КРИОКОНСЕРВАЦИИ КЛЕТОК, ИСКУССТВЕННЫЕ КЛЕТОЧНЫЕ КОНСТРУКЦИИ ИЛИ ТРЕХМЕРНЫЕ СЛОЖНЫЕ КОМПЛЕКСЫ ТКАНЕЙ | 2010 |
|
RU2573307C2 |
| УЛУЧШЕННАЯ КЛЕТОЧНАЯ КОМПОЗИЦИЯ И СПОСОБЫ ЕЕ ПОЛУЧЕНИЯ | 2009 |
|
RU2563518C2 |



Изобретение относится к области биотехнологии. Описана группа изобретений, включающая криоконсервирующий раствор, не содержащий ДМСО, способ получения криоконсервирующего раствора, замораживающий уравновешивающий раствор, не содержащий ДМСО, криоконсервирующий реагент, не содержащий ДМСО, и применение криоконсервирующего раствора и/или замораживающего уравновешивающего раствора для криоконсервации биологических тканей. В одном из вариантов реализации криоконсервирующий раствор содержит на 100 мл 0,01–50 г биомиметического материала для подавления нарастания льда, 5,0–45 мл многоатомного спирта, водорастворимый сахарид в концентрации 0,1–1,0 моль/л, 0–30 мл сыворотки, и остальное составляет буфер, где биомиметический материал для подавления нарастания льда выбран из атактического ПВС, характеризующегося синдиотактичностью, составляющей 15–60%, молекулярной массой 10–500 кДа или более, и степенью гидролиза более 80%, или указанного атактического ПВС и аминокислотного биомиметического материала для подавления нарастания льда. Изобретение расширяет арсенал средств для криоконсервации. 5 н. и 7 з.п. ф-лы, 10 ил., 9 табл., 8 пр.
1. Криоконсервирующий раствор, не содержащий ДМСО, содержащий на 100 мл 0,01–50 г биомиметического материала для подавления нарастания льда, 5,0–45 мл многоатомного спирта, водорастворимый сахарид в концентрации 0,1–1,0 моль/л, 0–30 мл сыворотки, и остальное составляет буфер,
характеризующийся тем, что
биомиметический материал для подавления нарастания льда выбран из атактического ПВС, характеризующегося синдиотактичностью, составляющей 15–60%, молекулярной массой 10–500 кДа или более, и степенью гидролиза более 80%, или указанного атактического ПВС и аминокислотного биомиметического материала для подавления нарастания льда,
при этом аминокислотный биомиметический материал для подавления нарастания льда выбран из одного или двух или более из полиаминокислоты со степенью полимеризации ≥ 2, аминокислоты и пептидного соединения;
при этом пептидное соединение представляет собой полипептид, производное гликопептида или соединение формулы (I):
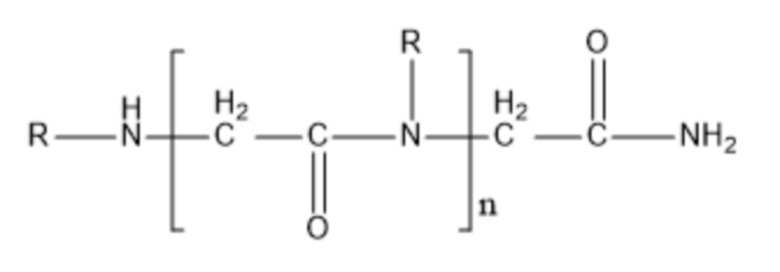
формула (I),
где R выбран из замещенного или незамещенного алкила, причем заместитель может быть выбран из -OH, -NH2, -COOH, -CONH2; n представляет собой целое число, которое больше или равняется 1 и меньше или равняется 1000,
при этом полипептид выбран из L-Thr-L-Arg (TR), L-Thr-L-Pro (TP), L-Arg-L-Thr (RT), L-Pro-L-Thr (PT), L-Thr-L-Arg-L-Thr (TRT), L-Thr-L-Pro-L-Thr (TPT) и L-Ala-L-Ala-L-Thr (AAT);
при этом производное гликопептида представляет собой по меньшей мере одно из GDL-L-Thr, GDL-L-Gln, GDL-L-Asn, GDL-L-Phe, GDL-L-Tyr, GDL-L-Val и GDL-L-Ser.
2. Криоконсервирующий раствор по п. 1, в котором R представляет собой замещенный или незамещенный C1–6алкил, и предпочтительно R представляет собой -CH3, -CH2CH3 или -CH2CH2COOH.
3. Криоконсервирующий раствор по п. 1 или 2, в котором содержание атактического ПВС составляет 0,1–6,0 г;
при этом предпочтительно многоатомный спирт может представлять собой многоатомный C2–5-спирт, такой как любой из этиленгликоля, пропиленгликоля и глицерина;
предпочтительно водорастворимый сахарид может представлять собой по меньшей мере одно из невосстанавливающего дисахарида, водорастворимого полисахарида и гликозида, например, выбран из сахарозы, водорастворимой целлюлозы (например, гидроксипропилметилцеллюлозы), трегалозы и полисахарозы;
предпочтительно буфер может представлять собой по меньшей мере одно из DPBS, HEPES-забуференного HTF-буфера и других буферов для клеток;
согласно настоящему изобретению сыворотка может быть выбрана из человеческого сывороточного альбумина или его заменителя, такого как додецилсульфат натрия, для криоконсервации материала, полученного из организма человека, и может представлять собой фетальную бычью сыворотку или бычий сывороточный альбумин для криоконсервации материала, полученного из организма, отличного от человека.
4. Криоконсервирующий раствор по любому из пп. 1–3, в котором материал для подавления нарастания льда представляет собой комбинацию атактического ПВС и аминокислоты и/или полиаминокислоты, и, например, состоит из 0,1–5,0 г ПВС, 8,0–35 г аминокислоты и/или 1,0–9,0 г полиаминокислоты.
5. Криоконсервирующий раствор по любому из пп. 1–4, в котором атактический ПВС характеризуется синдиотактичностью, составляющей 50–60%;
предпочтительно полиаминокислота представляет собой гомополимер по меньшей мере одного, выбранного из лизина, аргинина, пролина, треонина, гистидина, глутаминовой кислоты, аспарагиновой кислоты, глицина.
6. Криоконсервирующий раствор по любому из пп. 1–5, в котором содержание многоатомного спирта составляет 6,0–28 мл;
при этом предпочтительно содержание сыворотки составляет 0;
предпочтительно содержание водорастворимого сахарида составляет 0,1–1,0 моль/л;
предпочтительно pH криоконсервирующего раствора составляет 6,5–7,6.
7. Способ получения криоконсервирующего раствора по любому из пп. 1–6, включающий: растворение материала для подавления нарастания льда в буфере, охлаждение до комнатной температуры перед регулированием рН, растворение других компонентов в остальном количестве буфера и перемешивание после охлаждения; при этом
предпочтительно способ получения включает:
(1) растворение атактического ПВС в порции буфера и охлаждение до комнатной температуры перед регулированием pH с получением раствора 1;
(2) необязательно растворение полиаминокислоты или аминокислоты в порции буфера и охлаждение до комнатной температуры перед регулированием pH с получением раствора 2;
(3) растворение водорастворимого сахарида в порции буфера и после полного растворения водорастворимого сахарида добавление других компонентов, за исключением сыворотки, с получением раствора 3; и
(4) смешивание раствора 1, необязательно раствора 2 и раствора 3 после их охлаждения до комнатной температуры, и регулирование pH, и доведение объема до заданного объема буфером с получением криоконсервирующего раствора;
необязательно, если криоконсервирующий раствор содержит сыворотку, то сыворотку добавляют при применении криоконсервирующего раствора.
8. Замораживающий уравновешивающий раствор, не содержащий ДМСО, содержащий на 100 мл 0–5,0 г атактического ПВС, 5,0–45 мл многоатомного спирта, 0–30 мл сыворотки, и остальное составляет буфер; характеризующийся тем, что атактический ПВС представляет собой атактический ПВС, характеризующийся синдиотактичностью, составляющей 15–60%, молекулярной массой 10–500 кДа или более, и степенью гидролиза более 80%.
9. Замораживающий уравновешивающий раствор по п. 8, в котором замораживающий уравновешивающий раствор содержит на 100 мл 7,5–15 мл многоатомного спирта, 10–20 мл сыворотки, и остальное составляет буфер;
при этом предпочтительно замораживающий уравновешивающий раствор содержит на 100 мл 0,5–3,5 г ПВС, 7,5–15 мл многоатомного спирта, и остальное составляет буфер.
10. Криоконсервирующий реагент, не содержащий ДМСО, содержащий криоконсервирующий раствор по любому из пп. 1–6 и замораживающий уравновешивающий раствор по любому из пп. 8, 9, причем криоконсервирующий раствор и замораживающий уравновешивающий раствор представлены независимо;
при этом предпочтительно содержание сыворотки составляет 0, и замораживающий уравновешивающий раствор содержит на 100 мл 0,5–2,5 г атактического ПВС, 7,5–15 мл многоатомного спирта, и остальное составляет буфер.
11. Применение криоконсервирующего раствора по любому из пп. 1–6 и/или замораживающего уравновешивающего раствора по любому из пп. 8, 9 для криоконсервации биологических тканей.
12. Применение по п. 11, в котором биологическая ткань выбрана из по меньшей мере одного из ооцита, эмбриона, стволовой клетки, органа и ткани.
| WO 2013117925 A1 15.08.2013 | |||
| WO 1991010361 A1 25.07.1991 | |||
| НОВЫЙ СПОСОБ ПОЛУЧЕНИЯ ДИФФЕРЕНЦИРОВАННЫХ КЛЕТОК | 2010 |
|
RU2661107C1 |
Авторы
Даты
2022-12-05—Публикация
2020-03-02—Подача