Изобретение относится к сельскому хозяйству, в частности к птицеводству, а именно к стимуляции эмбрионального и постэмбрионального развития сельскохозяйственной птицы.
Для успешного роста и развития цыплят особенно мясного направления очень важен начальный период развития in ovo.
Для повышения общей резистентности эмбриона и цыплят в раннем постнатальном периоде используют различные подходы.
Так известен способ [Патент РФ №2700095] увеличения скорости роста цыплят, при котором увеличивается скорость роста цыплят, включающий инъекцию в экстраэмбриональную жидкость 0,5 мл 10%-ным раствором декстрина путем прокалывания продезинфицированной скорлупы и подскорлупной оболочки с тупого конца яйца, однократно, после чего яйца с эмбрионами помещают в выводной шкаф до конца инкубации. Данный способ, по мнению авторов, призван стимулировать обменные процессы эмбриона в выводной период инкубации, способствует раннему развитию органов желудочно-кишечного тракта и увеличению скорости роста выведенного молодняка.
Данный метод имеет ряд недостатков. Во-первых, дестрин является сложным олигосахаридом растительного происхождения, что может повлиять на иммунную систему животного. Кроме того, хотя инъекция декстрина повышает уровень глюкозы в крови эмбриона, однако нельзя исключить, что данный подъем может быть связан с мобилизацией глюкозы из эндогенных депо в тканях эмбриона, которое происходит под действием инъекционного стресса.
Также известен способ увеличения и синхронизации вылупления цыплят, при котором проводят однократную обработку яиц за 3-4 часа до закладки в инкубатор путем орошения поверхности яичной скорлупы 0,01% водным раствором аэрозольного метода «Йодофол» [Патент РФ №2567898].
Однако при данном методе проникновению активного вещества к эмбриону препятствует яичная скорлупа.
Известны также способ инкубации куриных яиц [Патент РФ №2557908], при котором авторы выдерживают яица при температуре 37,8°С в течение 21 суток до проклевывания и вводят in ovo биопрепарат. В качестве биопрепарата используют «Пролам» и вводят его в амнион яйца в дозе 0,1-0,2 мл на 18-е сутки инкубации. «Пролам» представляет собой изготовлений из живых культур штаммов молочнокислых бактерий Lactobacillus delbrueckii subsp.bulgaricus (ВКПМ В-5788), Bacillus sporothermodurans 43 с (ВКПМ В-3235), молочнокислых стрептококков Lactococcus lactis subsp.lactis 574 (ВКПМ B-3145) и Lactococcus lactis subsp.lactis 1704-5 (ВКПМ B-3192), бифидобактерий Bifidobacterium animalis 83 (ВКПМ AC-1248), с добавлением вспомогательных веществ - сыворотки молочной (3,35%), кукурузного экстракта (1,3%) и воды (93,7%).
Заявленный способ направлен на повышение иммунного статуса выводимых цыплят, повышения сохранности и продуктивности молодняка птицы.
Недостатками данного метода является, то что во-первых, препарат представляет собой смесь бактериальных культур и может привести к бактериальному заражению тканей цыпленка, во-вторых, препарат можно вводить только на самых поздних стадиях развития эмбриона, в-третьих, массивное введение бактерий может привести к иммунологическому параличу.
Известен способ усиления иммунного ответа у видов птиц [Патент РФ №2570732], при котором повышается вылупляемость оплодотворенного куриного яйца, зараженного Е. coli. Для этого in ovo вводят от 0,05 микрограмма до около 10 микрограммов композиции иммуномодулятора. Композиция иммуномодулятора содержит: катионное липосомальное средство доставки и молекулу нуклеиновой кислоты бактериального происхождения, не кодирующую иммуноген. Данный способ обеспечивает снижение смертности цыпленка, вылупившегося из оплодотворенного куриного яйца, зараженного Е. coli.
Однако, эффективность данного метода была показана только для яиц, зараженных E.coli и эффект от такой вакцинации направлен на сохранение жизнеспособности эмбриона, а не на повышение его массы и темпов развития.
Известен способ повышения жизнеспособности эмбрионов сельскохозяйственной птицы [Патент РФ №2616424]. Изобретение относится к сельскому хозяйству, а именно к инкубации сельскохозяйственной птицы. При данном методе осуществляют отбор эмбрионов на 18 сутки инкубации и производят инъекцию в экстраэмбриональную жидкость L-карнитина, разведенного физиологическим раствором до концентрации 0,4% в объеме 0,5 мл путем однократного прокалывания подскорлупной оболочки. По мнению авторов, это обеспечивает стимулирование энергетического обмена развивающегося эмбриона в период инкубации и повышение выхода здорового молодняка.
Недостатком данного метода является позднее (18 сутки) сроки введения препарата, что не позволяет воздействовать на ранние сроки эмбриогенеза.
Наиболее близким аналогом является способ стимуляции эмбрионального и раннего постэмбрионального развития сельскохозяйственной птицы, в частности цыплят [Патент РФ №2262228]. Способ включает предынкубационную обработку яиц химическим соединением и физическим воздействием, отличающийся тем, что яйца подвергают ультрафиолетовому облучению однократно в течение 20 с или озонируют, а затем непосредственно после облучения или озонирования за 6-12 ч до инкубации скорлупу яиц обрабатывают раствором янтарной кислоты в концентрации 0,01-0,3% при температуре 20-22°С, из расчета 1,2-1,5 мл раствора не 120-150 яиц. Недостатком данного способа является возможность повреждения нитей ДНК и химическая модификация белков под действием высокоэнергитеческого УФ облучения. Кроме того, при обработке поверхности скорлупы яиц неизвестно количество доступного для эмбриона действующего вещества.
Заявленный способ стимуляции эмбрионального и постэмбрионального развития сельскохозяйственной птицы включает обработку яиц, при этом in ovo с соблюдением правил асептики и антисептики на 5 сутки инкубации в пугу яйца вводят средство на основе культуральной среды мезенхимальных стволовых клеток в дозе 50 мкл на яйцо.
Техническим результатом заявленного изобретения является снижение эмбриональной смертности, повышение общее количество выхода птицы из яиц, а также увеличение прироста живой массы и показателя среднесуточного прироста живой массы птицы путем применения в раннем эмбриональном периоде на 5 сутки инкубации средства на основе культуральной среды аллогенных мезенхимальных стволовых клеток in ovo в дозе 50 мкл на яйцо. Предлагаемый способ высокотехнологичен, используемое средство на основе культуральной среды аллогенных мезенхимальных стволовых клеток в концентрации 50 мкл на яйцо не токсично, высокоактивно, поскольку участвует в важных биологических процессах эмбрионального и постэмбрионального развития сельскохозяйственной птицы.
Краткое описание фигур
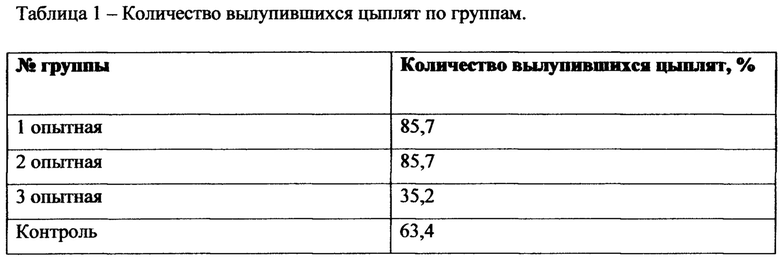
Фиг. 1. Восстановленное изображение бедра перепела. Увеличение 50. Окраска гематоксилин и эозин.
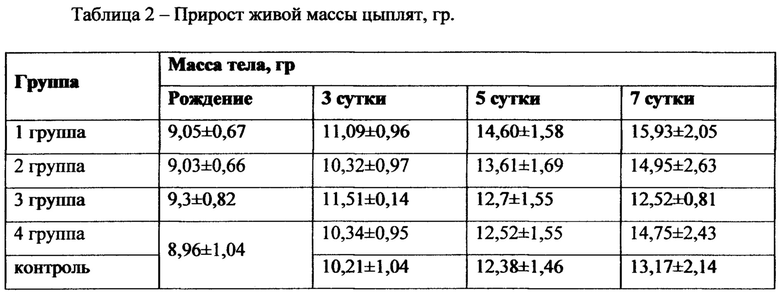
Фиг. 2. Выделение зоны обсчета.
Фиг. 3. Выделение объектов для обсчета.
Фиг. 4. Инкубатор «Блиц 48».
Фиг. 5. Инъекции исследуемым средством.
Фиг. 6. Заклеенное место прокола.
Фиг. 7. Выход перепелов из яйца в процентах.
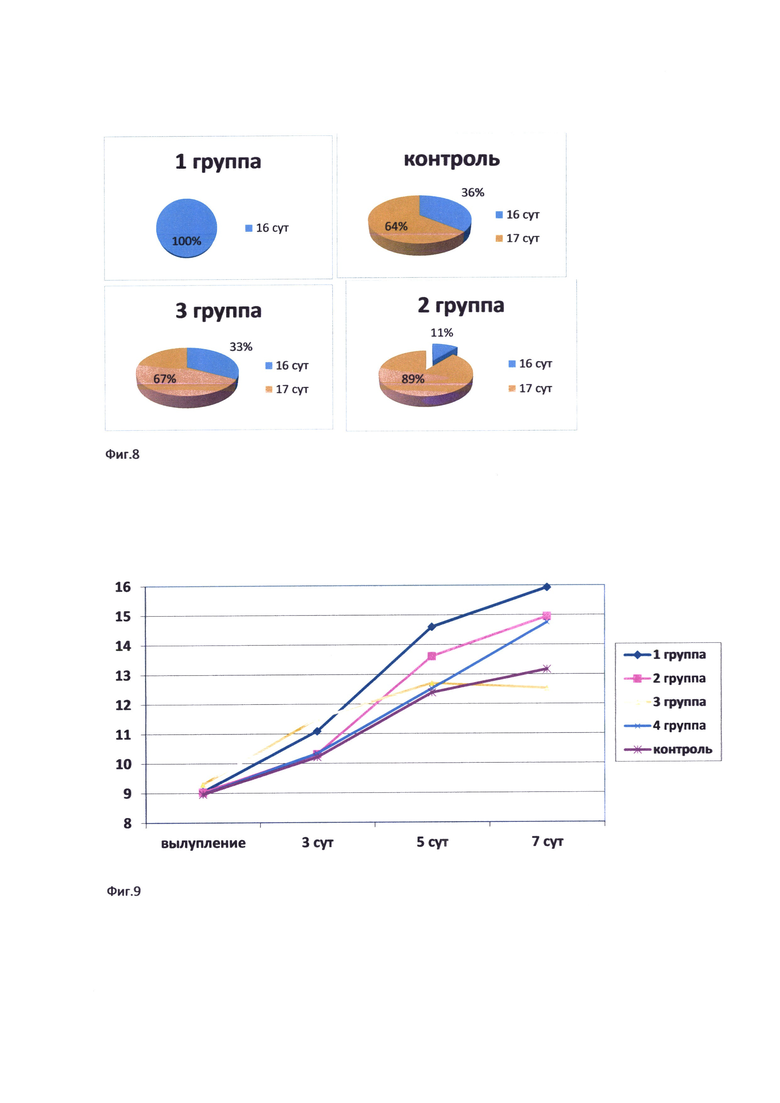
Фиг. 8. Выход перепелов из яиц по суткам.
Фиг. 9. Динамика прироста живой массы перепелов в опыте.
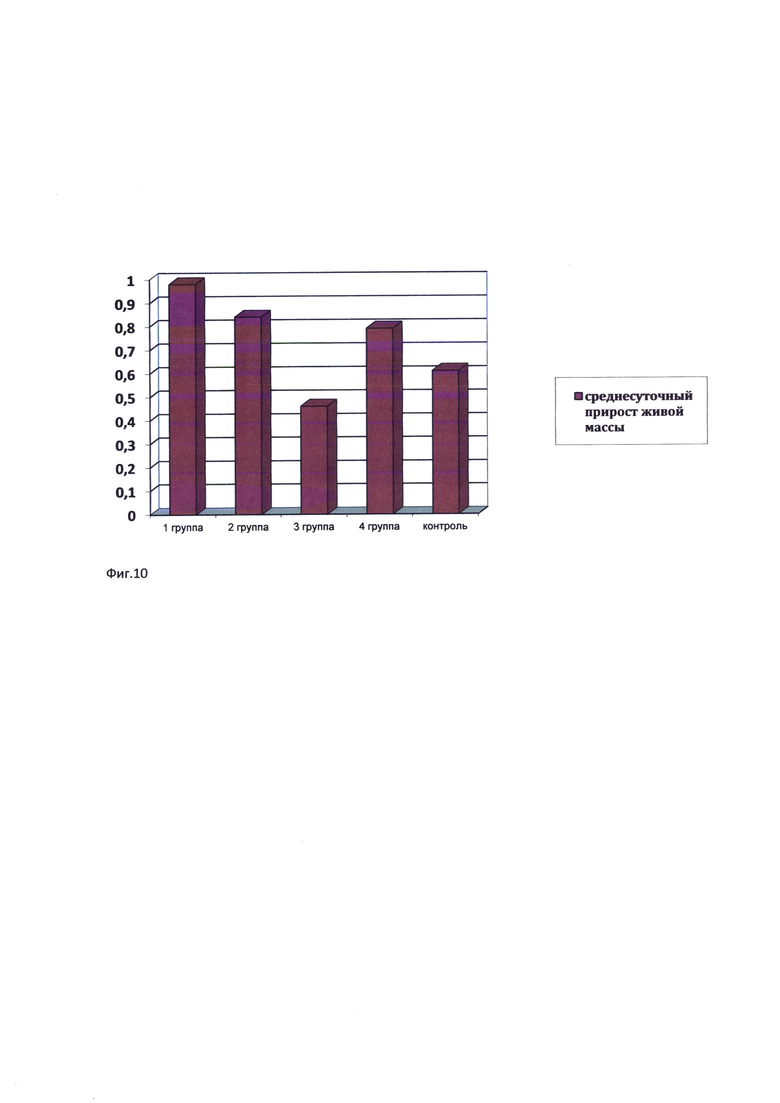
Фиг. 10. Среднесуточный прирост живой массы перепелят, г/сут.
Подробное описание изобретения
Работа выполнялась на базе лаборатории болезней молодняка Института экспериментальной ветеринарии Сибири и Дальнего Востока Сибирского федерального научного центра агробиотехнологий РАН (ИЭВСиДВ СФНЦА РАН).
В исследовании использовали средство на основе кондиционированной среды мезенхимальных стволовых клеток (МСК) птицы, полученный из костного мозга.
Пример 1. Получение средства на основе кондиционированной среды мезенхимальных стволовых клеток (МСК) птицы.
1.1. Получение МСК для культивирования.
Стволовые клетки получают из костного мозга интактной птицы, находящейся под общим наркозом. Костный мозг забирают из бедренной кости, пунктируя кость и промывая ее раствором Хенкса. Из аспирата костномозговой взвеси удаляют эритроциты. Для удаления эритроцитов можно использовать градиентное центрифугирование, лизис эритроцитов лизирующим раствором или комбинацию этих методов с другими, в результате чего наступает разделение эритроцитов и ядросодержащих клеток. Данные ядросодержащие клетки содержат как лимфоидные, так и МСК.
Культивирование клеток
Полученные клетки ресуспендируют в культуральной ростовой среде. Клетки культивируют при 42°С в атмосфере, содержащей 5% СО2 и 95% влажности, в течение 30 суток.
Эти клетки могут быть культивированы любым известным способом, например в монослое, на гранулах или в трехмерном слое и любым другим способом (т.е. в чашках для культивирования, в роллер-флаконах, в системах с непрерывным потоком и т.п.). Методы культивирования клеток и тканей хорошо известны специалистам и описаны (Freshney. Culture of Animal Cells: A Manual of Basic Techniques, 1987).
В другом варианте клетки культивируются в культуральной среде в СО2-инкубаторе при содержании СО2 от 4 до 6%, кислорода от 2% до 22% при 42°С (СО2-инкубатор «Thermo Scientific серии WJ» с контролем содержания О2). При изменении содержания кислорода происходит изменение спектра синтезируемых белков (в частности HIF (гипоксия индуцированный фактор)), что вызывает повышение активности препарата (Antonina Lavrentieva, Ingrida Majore, Cornelia Kasper, Ralf Hass // Effects of hypoxic culture conditions on umbilical cord-derived human mesenchymal stem cells// Cell Commun Signal., 2010; 8: 18).
Кроме того, культуральная среда может быть подвергнута концентрированию с использованием концентрирующего устройства, работающего при избыточном давлении и имеющего фильтр с отсечкой 100000 мол. масс.(«Amicon», «Beverly»).
Получение средства
После культивирования клетки вместе с культуральной средой переносят в пробирки, в которых клетки подвергаются разрушению с использованием физических (замораживание-оттаивание) приводящих к нарушению клеточных структур.
Полученный раствор пропускают через систему ультрафильтрации Pellicon 2 (фирмы «Millipor» с фильтрами «Biomax») для удаления белков выше 120 кДа.
В процессе культивирования стволовые клетки выделяют в среду культивирования цитокины, ростовые факторы и другие биологически активные пептиды.
Полученное средство кроме солевого состава, который аналогичен солевому составу плазмы крови, содержит пептиды в концентрации 0,5 мг/мл.
Полученное средство подвергают стерилизующей фильтрации через мембранный фильтр с диаметром пор не более 0,22 мкм, разливают в стерильные стеклянные флаконы и закупоривают.
После фильтрации полученный раствор замораживают до -80°С и помещают в лиофильную сушку «Thermo Scientific P16000» для лиофилизации.
Перед использованием лиофильный порошок растворяют в стерильной дистиллированной воде, восстанавливая концентрацию белка 0,5 мг/мл.
Пример 2. Исследование in ovo на яйцах перепелов.
Опыт по изучению влияния данного средства на онто- и филогенез, проводили на перепелах, разделенных по принципу аналогов на пять групп (n=20).
Во время инкубации всем эмбрионам по правилам асептики и антисептики in ovo производились инъекции кондиционированной средой мезенхимальных стволовых клеток.
Первой опытной группе исследуемое средство вводилось в дозе 50 микролитров на яйцо в конце первого триместра (5 сутки).
Второй опытной группе исследуемое средство вводилось в дозе 50 микролитров на яйцо в конце второго триместра (10 сутки).
Третьей опытной группе исследуемое средство вводилось в дозе 50 микролитров на яйцо в конце третьего триместра (15 сутки).
Четвертой опытной группе исследуемое средство вводилось в дозе 50 микролитров на птицу внутримышечно в область бедра сразу после рождения.
В пятой группе отсутствовало введение средства (не вводили ни в яйцо, ни после рождения).
Через каждые 2-3 дня после выхода из яйца производилось контрольное взвешивание перепелов. Была изучена динамика выхода перепелят из яйца и показатели привесов в период раннего филогенеза.
Для оценки соотношения костной и мышечной ткани проводили морфометрические исследования.
Для этого:
1. Ткань бедра перепела фиксировали в 10% растворе формалина и заливали в парафин. Из блоков готовили срезы толщиной 5 мкм (костную ткань у 7 дневных животных декальцинировали). Срезы окрашивали гематоксилином и эозином, для окраски на гликоген использовали Шик реакцию.
2. Гистологический препарат фотографировали при увеличении 50 и стандартном световом потоке. Затем в программе Photoshop CS проводили полное восстановление изображение из отдельных полей зрения (фиг 1).
Морфометрический анализ изображения был проведен с использованием программы ImageJ.
Анализ проводился в следующие этапы:
1. Для калибровки программы был заснят участок камеры Горяева с тем же увеличением, что и гистологические объекты.
Известно, что длина малого квадрата в камере Горяева составляет 0,05 мм, что позволяет откалибровать программу для дальнейшего измерения.
2. Изображение переводилось в 8 битный формат. И в функции «Threshold» выделяли мышечную ткань (фиг 2).
3. При анализе изображения задавали размерность и геометрические параметры объектов (фиг 3).
4. Определяли общую площадь мышечной ткани и отдельно общую площадь костной ткани.
5. Анализировали % содержание мышечной и костной ткани и их соотношение у каждого животного.
Результаты исследования
Инкубация проходила 16-17 дней при температуре 37.8°С в инкубаторе «Блиц 48» (фиг. 4).
Во время инкубации перепелиных яиц по правилам асептики и антисептики, после обработки скорлупы яйца спиртом, стерильным инсулиновым шприцом производили in ovo инъекцию исследуемого средства через скорлупу в пугу яйца. Иглу вводили на 1-2 мм (фиг. 5).
Затем герметично заклеивали место прокола клеем «Момент» (фиг. 6). За всеми перепелами после выхода из яйца вели наблюдение: учитывали общее клиническое состояние, скорость роста и набора веса.
Пример 3. Динамика выхода перепелов из яйца.
Так как на данном этапе опыта учитывали только показатели групп, которым вводили исследуемое средство в период инкубации. Т.к. в четвертой группе средство вводили только после рождения, то при изучении динамике выхода перепелов из яйца в качестве контроля использовались данные, полученные суммированием показателей группы 4 и группы 5.
Полученные результаты приведены в таблице 1.
Максимальное количество вылупившихся перепелят, наблюдается в первой и во второй опытных группах - 85,7%, что на 22,3% выше аналогичного показателя контрольной группы.
Данный факт объясняется тем, что раннее введение исследуемого средства способствует более быстрому развитию эмбриона, способствуя повышению жизнеспособности на последних стадиях.
Выживаемость животных в третьей опытной группе, которым средство вводили в полость яйца на 15 сутки инкубации составила 35,2%. (фиг. 7).
Исследуемое средство ускоряет развитие и последующую атрофию аллантоиса (эмбрионального органа дыхания), что вынуждает перепелят раньше положенного срока проклевывать скорлупу, когда желток еще не втянут и организм в целом не готов к переходу к постэмбриональной жизни. Происходит несовпадение во времени (гетерохрония) столь важных физиологических процессов, как перемещение желточного мешка в брюшную полость, проклев скорлупы и переход на легочное дыхание.
Следует обратить внимание на такой немаловажный факт, как сроки выхода цыплят из яйца.
Так, в первой опытной группе, все цыплята вылупились на 16 сутки опыта (фиг. 8). Во второй опытной группе на 16 сутки опыта вылупилось 11% цыплят от общего числа рожденных, на 17 сутки - 89%.
Результаты третьей опытной группы практически не отличаются от результатов контроля и составляют 33% на 16 сутки опыта, и 67% - на 17 сутки.
Исходя из полученных результатов можно сделать вывод, что для снижения эмбриональной смертности и повышения общего количества выхода перепелов из яйца рекомендуется применение средства на основе культуральной среды мезенхимальных стволовых клеток на 5 инкубации, в дозе 50 мкл на яйцо.
Пример 4. Динамика среднесуточных привесов.
Результаты изучения динамики прироста живой массы перепелят приведены в таблице 2.
Как следует из представленных данных, максимальный вес при рождении наблюдается у перепелят третьей опытной группы - 9,3±0,67 гр., что на 3,7% выше аналогичного результата контроля. Однако на 7 сутки опыта, животные данной группы существенно снизили привесы - на 4,94% относительно контрольной группы (фиг. 9).
В первой и второй опытной группах вес перепелят при рождении существенно не отличается. Однако уже на третьи сутки опыта животные 1-й опытной группы наблюдается положительная динамика прироста живой массы - на 7 сутки данный показатель составляет 15,93 г, что на 20,09% выше аналогичного показателя контрольной группы. У перепелят 2 и 4 опытных групп так же прослеживается положительная динамика привесов, однако на 7 сутки опыта разница с контролем составляет лишь 13,5% и 11,9% соответственно.
Максимальный среднесуточный прирост живой массы на всем протяжении опыта наблюдался у перепелят 1-й опытной группы и составил 0,98 г/сут, превысив аналогичный показатель контрольной группы на 60,6% (табл. 3).

Во 2-й и 4-й опытной группе данный показатель отличались от контрольных значений на 37,7% и 29,5% соответственно (фиг. 10).
Минимальное значение данного показателя отмечено в 3-й опытной группе - 0,46 г/сут.
Анализ гистологических срезов на соотношение костной и мышечной ткани показал следующие результаты (таблица 4).
Как видно из представленной таблицы, в группе экспериментальных животных соотношение костной и мышечной ткани сдвинуто в пользу последней.
Следовательно, увеличение массы тела животных происходит именно за счет увеличения мышечной ткани.
Полученные результаты демонстрируют следующее:
1. Применение средства на основе культуральной среды мезенхимальных стволовых клеток in ovo в дозе 50 мкл на яйцо на 5 сутки инкубации, снижает эмбриональную смертность и повышает общее количество выхода перепелов из яйца на 22,3% по сравнению с контролем.
2. Применение средства на основе культуральной среды мезенхимальных стволовых клеток in ovo в дозе 50 мкл на яйцо на 5 сутки инкубации, способствует увеличению прироста живой массы перепелят на 20,09%, а показатель среднесуточного прироста живой массы на 60,6% по сравнению с аналогичными показателями контрольной группы.
Для повешения выхода перепелят из яйца и улучшения показателей среднесуточного прироста живой массы рекомендуется применение средства на основе кондиционированной среды мезенхимальных стволовых клеток в дозе 50 мкл на яйцо птицы. Средство следует вводить in ovo с соблюдением правил асептики и антисептики в пугу яйца через скорлупу на 5-е сутки инкубации.
Таким образом, заявленный способ высокотехнологичен, используемое средство на основе культуральной среды аллогенных мезенхимальных стволовых клеток в концентрации 50 мкл на яйцо не токсично, высокоактивно, поскольку участвует в важных биологических процессах эмбрионального и постэмбрионального развития сельскохозяйственной птицы.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВВЕДЕНИЯ ПРИМОРДИАЛЬНЫХ ПОЛОВЫХ КЛЕТОК ПТИЦ В ЭМБРИОН "IN OVO" | 2023 |
|
RU2818641C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРИМОРДИАЛЬНЫХ ПОЛОВЫХ КЛЕТОК ПТИЦ | 2024 |
|
RU2832977C1 |
| Способ повышения стрессоустойчивости перепелов | 2022 |
|
RU2798789C1 |
| Способ повышения жизнеспособности эмбрионов перепелов | 2021 |
|
RU2778157C1 |
| Способ повышения жизнеспособности эмбрионов сельскохозяйственной птицы | 2015 |
|
RU2616424C1 |
| СПОСОБ СВЕТОЛАЗЕРНОЙ ОБРАБОТКИ ЭМБРИОНОВ КУР | 1998 |
|
RU2142225C1 |
| СПОСОБ ПОДБОРА ЭМБРИОНОВ КУР ДЛЯ СВЕТОЛАЗЕРНОЙ ОБРАБОТКИ | 1998 |
|
RU2159541C2 |
| СВЕТОЛАЗЕРНАЯ ТЕХНОЛОГИЯ ПРОИЗВОДСТВА БРОЙЛЕРОВ | 1998 |
|
RU2150826C1 |
| Способ увеличения выводимости яиц кур после длительного хранения | 2023 |
|
RU2821730C1 |
| СПОСОБ ВАКЦИНАЦИИ IN OVO ПРОТИВ КОКЦИДИОЗА | 1996 |
|
RU2125890C1 |


Изобретение относится к области биотехнологии. Изобретение представляет собой способ стимуляции эмбрионального и постэмбрионального развития сельскохозяйственной птицы, включающий обработку яиц, отличающийся тем, что in ovo с соблюдением правил асептики и антисептики на 5 сутки инкубации в пугу яйца вводят в концентрации 0,5 мг/мл в дозе 50 мкл на яйцо кондиционированную культуральную среду после культивирования аллогенных мезенхимальных стволовых клеток, подвергнутую воздействию физических факторов, приводящих к нарушению клеточных структур, с последующей ультрафильтрацией для удаления белков выше 120 кДа. Изобретение позволяет снизить эмбриональную смертность, повысить общее количество выхода птицы из яиц, а также увеличить прирост живой массы и показатель среднесуточного прироста живой массы птицы. 10 ил., 4 табл., 4 пр.
Способ стимуляции эмбрионального и постэмбрионального развития сельскохозяйственной птицы, включающий обработку яиц, отличающийся тем, что in ovo с соблюдением правил асептики и антисептики на 5 сутки инкубации в пугу яйца вводят в концентрации 0,5 мг/мл в дозе 50 мкл на яйцо кондиционированную культуральную среду после культивирования аллогенных мезенхимальных стволовых клеток, подвергнутую воздействию физических факторов, приводящих к нарушению клеточных структур, с последующей ультрафильтрацией для удаления белков выше 120 кДа.
| СПОСОБ СТИМУЛЯЦИИ ЭМБРИОНАЛЬНОГО И РАННЕГО ПОСТЭМБРИОНАЛЬНОГО РАЗВИТИЯ СЕЛЬСКОХОЗЯЙСТВЕННОЙ ПТИЦЫ | 2004 |
|
RU2262228C1 |
| СПОСОБ КОРРЕКЦИИ ЭМБРИОНАЛЬНОГО И ПОСТЭМБРИОНАЛЬНОГО РАЗВИТИЯ ПТИЦЫ | 2011 |
|
RU2490882C1 |
| БРЮШИНИН Н.В., Применение экологически безопасных препаратов для стимуляции эмбрионального и постэмбрионального развития бройлеров, их резистентности и продуктивности, Москва, 2004, весь документ | |||
| US 20100143403 A1, 10.06.2010. | |||
Авторы
Даты
2022-12-29—Публикация
2021-12-20—Подача