Область техники, к которой относится изобретение
Изобретение относится к области изучения фармакодинамики антимикробных препаратов, их эффективности в отношении патогенных микроорганизмов и процессов развития антибиотикорезистентности в динамических системах in vitro, и касается оптимизации конструкции динамической системы in vitro.
Уровень техники
Снижение чувствительности возбудителей инфекционных заболеваний к старым антибиотикам на фоне замедления темпов создания новых препаратов является актуальной проблемой современного здравоохранения. Одним из путей предотвращения развития устойчивости бактерий к антибиотикам является оптимизация их применения. В основе оптимизации антибиотикотерапии лежит знание зависимости «концентрация - резистентность». Одним из перспективных направлений исследований, которое позволяет изучать такие зависимости, является фармакокинетико-фармакодинамическое моделирование, основным инструментом которого являются динамические системы in vitro. При помощи таких систем оказывается возможным изучать закономерности развития резистентности бактерий под воздействием антибиотика в условиях его меняющейся концентрации так, как это происходит в организме человека. Исследования в динамических системах позволяют: устанавливать зависимость между резистентностью и фармакокинетико-фармакодинамическими параметрами антибиотика, прогнозировать развитие резистентности бактерий при клинических режимах антибиотикотерапии, определять пороговые значения фармакокинетико-фармакодинамических параметров, при которых наблюдается подавление развития резистентности бактерий.
Конструкция и принцип работы динамических систем in vitro впервые были описаны в 1970-80-х годах [1-5]. Такие системы были созданы для изучения фармакодинамики антибактериальных препаратов в условиях in vitro при моделировании фармакокинетики антибиотиков, наблюдаемой в организме у человека. Это реализуется за счет контролируемого разбавления питательного раствора с антибиотиком в камере системы, также содержащей клетки микроорганизма при сохранении постоянства ее объема. Согласно литературным данным существует большое разнообразие динамических систем in vitro, которые отличаются друг от друга конструкцией, наличием или отсутствием в составе фильтрующего элемента, предотвращающего вымывание из системы бактериальных клеток.
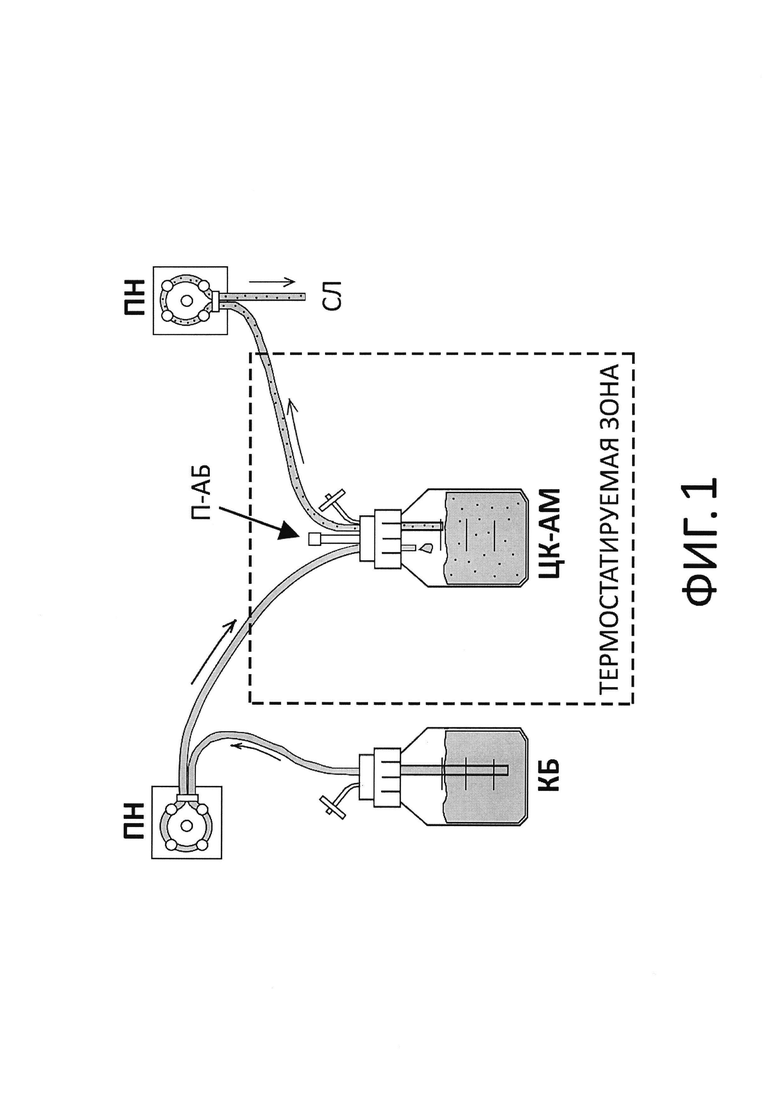
До настоящего времени одной из наиболее распространенных динамических систем in vitro (аналог изобретения), применяемой для моделирования фармакокинетики антибиотиков и изучения их фармакодинамики, была одночастевая динамическая система in vitro («Dilution Infection Model», DIM) (см. фиг. 1) [2]. Эта система имеет простую структуру и включает две соединенные между собой камеры (стеклянных сосуда), одна из которых (камера КБ) содержит свежий питательный бульон, а другая (центральная камера, ЦК-AM) - свежий питательный бульон с антибиотиком и клетками микроорганизма. При помощи DIM была изучена фармакодинамика антибиотиков разных классов, включая фторхинолоны [6], липо- и гликопептиды [7], оксазолидиноны [8]. Главным недостатком данной системы является то, что в ней не обеспечивается удерживание клеток микроорганизма в ЦК-AM, которые в процессе эксперимента вымываются с током среды. Это, в свою очередь, может искажать результаты эксперимента, в особенности в случае с антибиотиками с коротким периодом полувыведения (например, дорипенем), для которых требуется относительно высокая скорость выведения излишков питательной среды из системы. Кроме того, вымываемые из ЦК-AM клетки патогенных микроорганизмов могут попадать в окружающую среду.
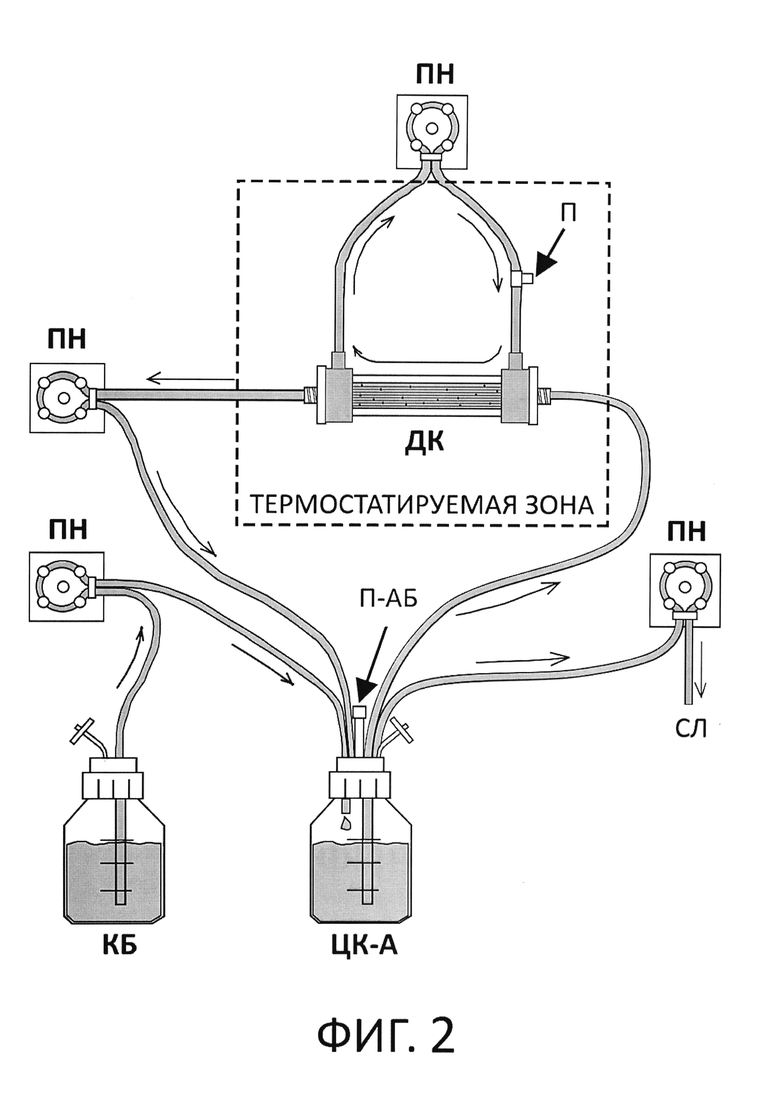
Указанный недостаток DIM был преодолен в более сложной по своей конструкции двухчастевой динамической системе, «Hollow-Fiber Infection Model» (HFIM) (прототип изобретения, фиг. 2). Впервые HFIM была предложена Zinner SH и соавторами в 1981 году [9] и по сегодняшний день имеет наиболее широкое применение при изучении фармакодинамики антибиотиков [10, 11]. Ключевым отличием HFIM от DIM является то, что в HFIM дозирование антибиотика и культивирование микроорганизмов разделено и происходит в разных камерах, центральной (сосуд ЦК-А) и периферической, соответственно. В качестве периферической камеры для размещения микробных клеток используется не простой стеклянный сосуд, а биореактор диализного типа (диализная камера, ДК). Биореактор наполнен фильтрующими волокнами, которые позволяют предотвратить вымывание клеток микроорганизма из системы (недостаток DIM). ЦК-А при помощи шлангов соединена с ДК и снабжает ее питательной средой с антибиотиком посредством перистальтических насосов. За счет постоянной циркуляции бульона с антибиотиком между ЦК-А и ДК обеспечивается постоянное равновесие и фармакокинетический профиль антибиотика, воспроизводимый в ЦК-А, полностью повторяется в ДК. Для поддержания равновесия концентраций антибиотика между камерами необходимо обеспечивать высокую скорость потока питательной среды (80-120 мл/мин). Это, в свою очередь, ведет к ускоренному износу оборудования и шлангов. Также представленная система из-за наличия нескольких камер предполагает использование относительно высоких объемов питательной среды, необходимой для обеспечения ее работы, что приводит к удорожанию эксплуатации.
Предлагаемая в настоящем изобретении модифицированная динамическая система in vitro (М-ДС) лишена недостатков указанных выше систем (см. фиг. 3).
Технической проблемой, которую решает данное изобретение является упрощение конструкции прототипа изобретения, HFIM, за счет сокращения количества структурных элементов и, как следствие, повышение простоты работы с системой, ее управляемости и экономичности.
Технический результат заявленного изобретения обеспечивается за счет оптимизации конструкции прототипа изобретения - «Hollow-Fiber Infection Model» (HFIM), а именно, изъятия основного ее элемента, центральной камеры, в которой смешивают раствор антибиотика и питательной среды, ее функция перенесена в биореактор, в котором также осуществляют культивирование микробной культуры; сокращения расхода питательной среды (до 50%) в эксперименте за счет снижения общего объема системы М-ДС по сравнению с HFIM; экономии расходного материала (в том числе трущихся частей системы - шлангов) за счет снижения (на порядок относительно HFIM) необходимой объемной скорости перемещения питательной среды через биореактор; экономии используемых единиц оборудования (в частности, перистальтических насосов); снижения энергоемкости системы и, как следствие, удешевления стоимости эксплуатации М-ДС.
Указанная система поясняется следующими графическими материалами:
На фиг. 1 представлена схема с аналогом изобретения, Dilution Infection Model - одночастевой динамической системой in vitro без удерживания клеток микроорганизма. Камера ЦК-AM (стеклянный сосуд) содержит антибиотик в питательном бульоне и клетки микроорганизма.
На фиг. 2 представлена схема с аналогом (прототипом) изобретения, Hollow-Fiber Infection Model - двухчастевой динамической системой in vitro с биореактором диализного типа.
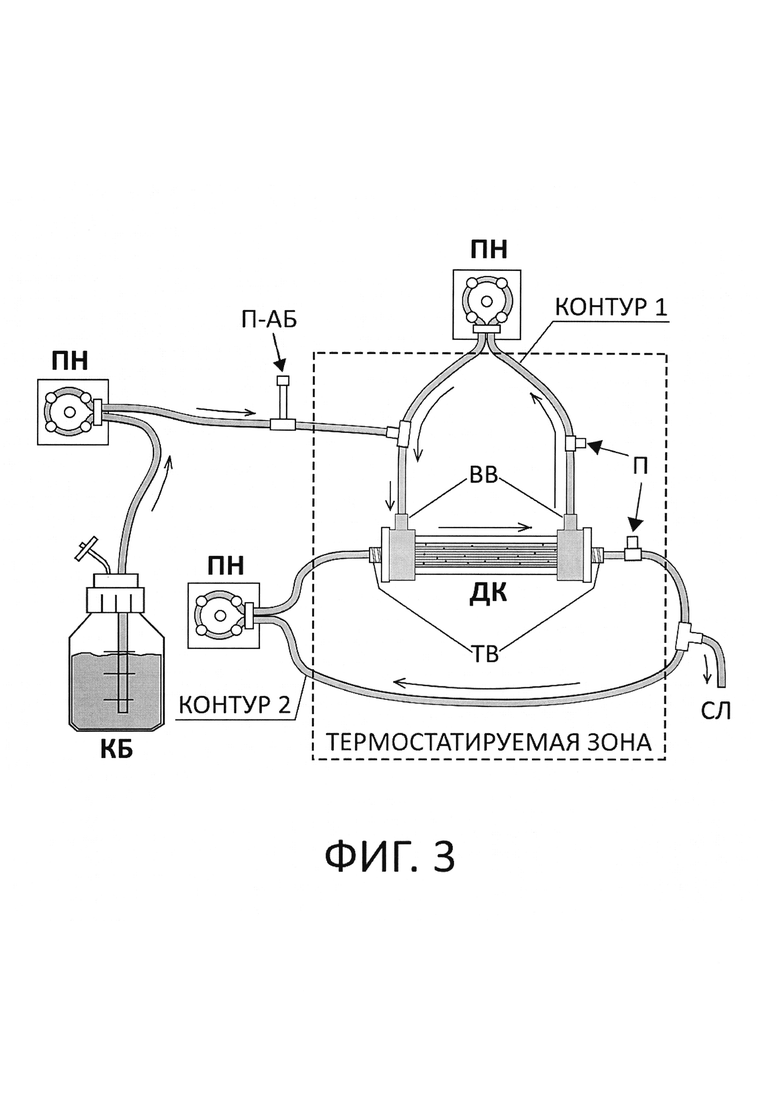
На фиг. 3 показана схема с объектом изобретения, модифицированной динамической системой in vitro с оптимизированной структурой - М-ДС. В данной системе биореактор используется как в качестве камеры, в которую вносится антибиотик и где моделируется его фармакокинетический профиль, так и камеры для культивирования микроорганизмов, предусматривающей удерживание патогенных клеток внутри биореактора.
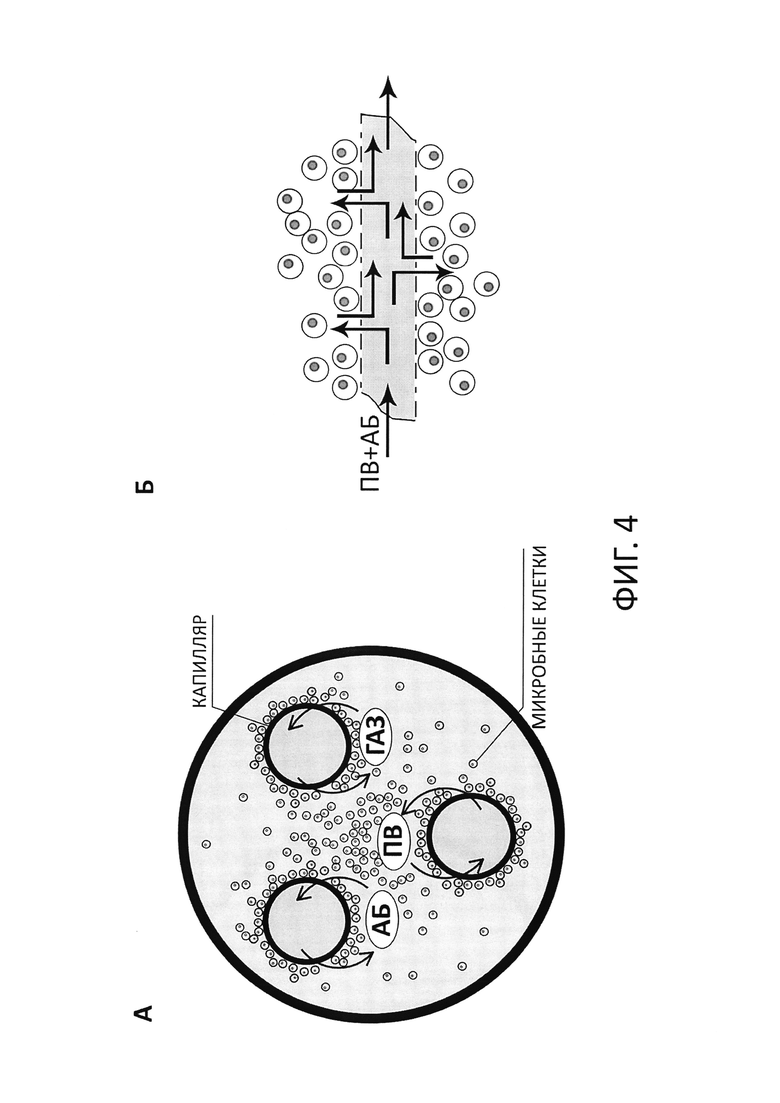
На фиг. 4А схематично представлен поперечный срез биореактора, состоящего из корпуса и размещенных в нем полупроницаемых капилляров. Стрелками показаны направления движения питательных веществ, газов и антибиотика.
На фиг. 4Б схематично представлен продольный срез капилляра биореактора, схематично изображен процесс поступления питательных веществ и антибиотика сквозь поры в стенке капилляра во внекапиллярное пространство к клеткам микроорганизма и обратно.
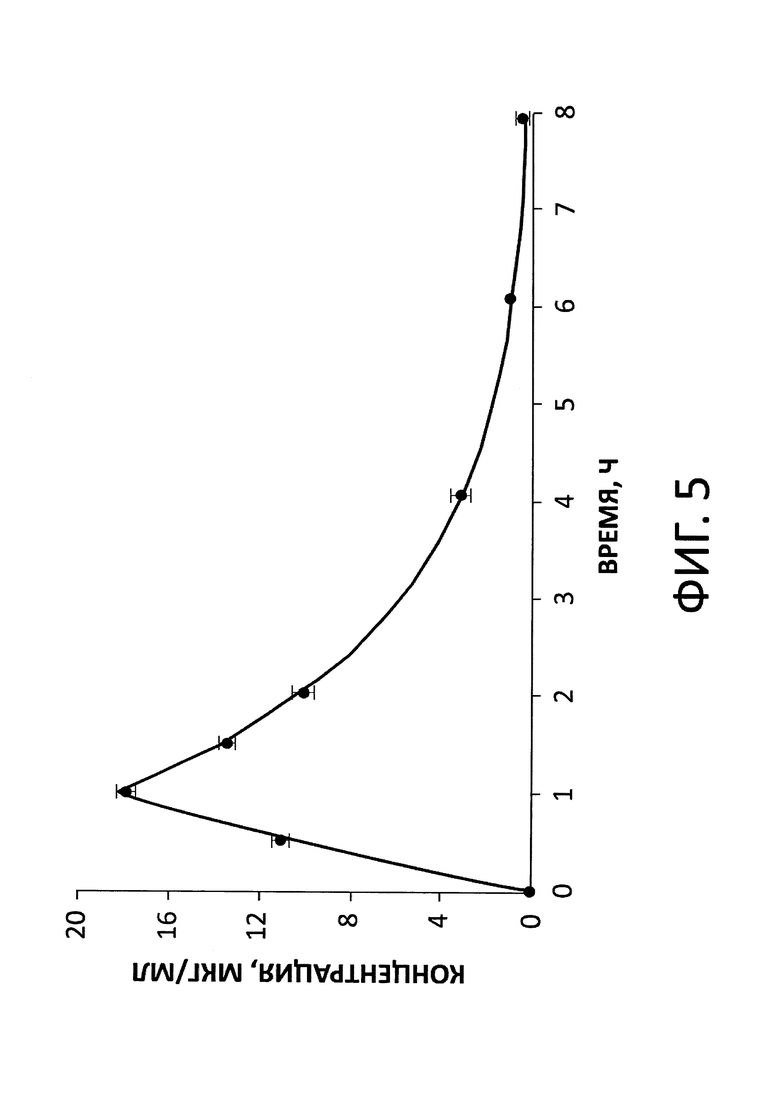
На фиг. 5 показаны результаты воспроизведения фармакокинетического профиля дорипенема в М-ДС, продемонстрировано соответствие между заданными значениями концентрации дорипенема, обозначенными на графике сплошной линией (-), и фактическими - обозначенными заполненными кружками (•). Данные представлены как арифметическое среднее, посчитанное по трем повторностям, ± стандартное отклонение.
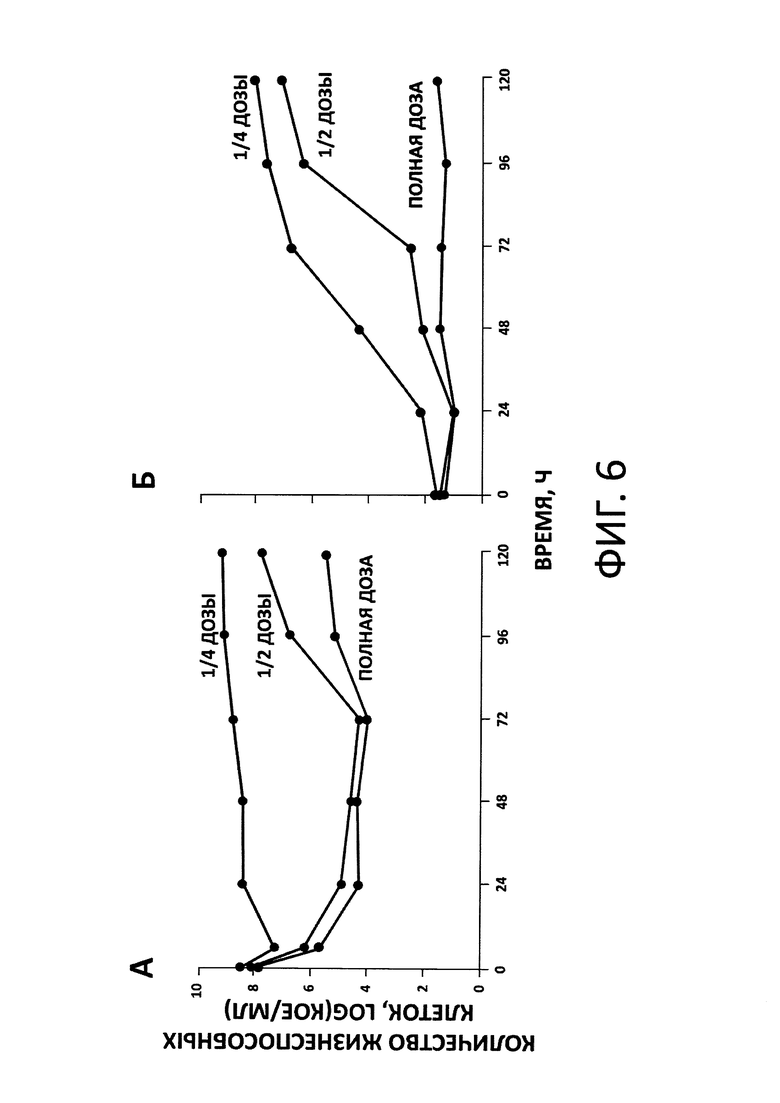
На фиг. 6 показаны кинетические кривые изменения численности клеток Pseudomonas aeruginosa (на примере штамма АТСС 27853) во времени при моделировании в М-ДС различных доз дорипенема. Количество жизнеспособных клеток выражено как логарифм колониеобразующих единиц, КОЕ, на мл. На фиг. 7А приведены данные для общей популяции Pseudomonas aeruginosa, а на фиг. 7Б - для резистентных к антибиотику популяций микроорганизма (клетки, устойчивые к антибиотику в концентрации 4-кратно превышающей его минимальную подавляющую концентрацию).
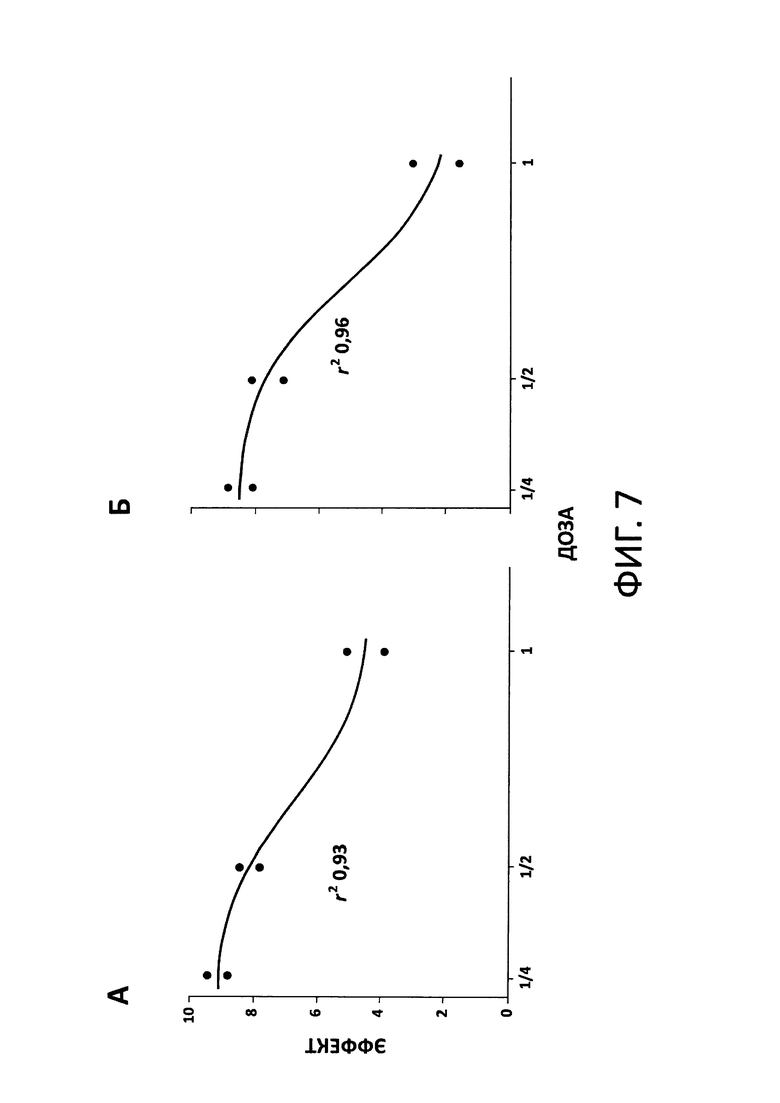
На фиг. 7 показаны зависимости между моделируемой в системе дозой дорипенема и его эффектом в отношении общей популяции Pseudomonas aeruginosa (А) и популяции микроорганизмов, резистентных к антибиотику (Б), установленные по результатам экспериментов в М-ДС. Эффект антибиотика в каждом случае был выражен как численность патогенных клеток к концу эксперимента (логарифм КОЕ на мл). Данные были скомбинированы для двух штаммов Pseudomonas aeruginosa. Регрессионные зависимости для указанных данных были установлены при помощи сигмоидной функции.
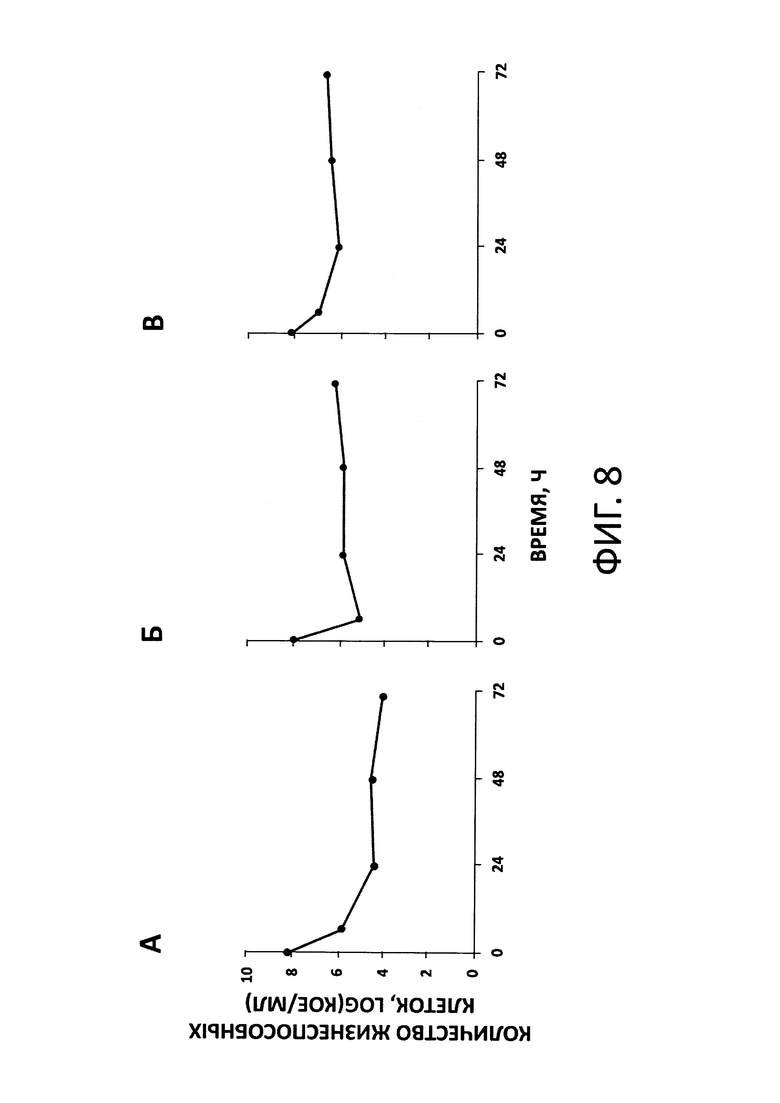
На фиг. 8 показаны кинетические кривые изменения численности клеток Pseudomonas aeruginosa во времени под воздействием дорипенема при моделировании его терапевтической дозы (500 мг каждые 8 часов), полученные в разных типах динамической системы in vitro, а именно, в М-ДС (A), DIM (Б) и HFIM (В). Количество жизнеспособных клеток выражено как логарифм колониеобразующих единиц, КОЕ, на мл. Для корректности сопоставления собственных данных с литературными все кинетические кривые изменения численности клеток псевдомонад во времени были ограничены 72 часами (реконструированные данные).
Условные обозначения
КБ - камера с бульоном без микроорганизмов и без антибиотика
ЦК-А - камера с бульоном для культивирования микроорганизмов и антибиотиком
ЦК-AM - камера с бульоном, антибиотиком и клетками микроорганизма
ДК - диализная камера (биореактор диализного типа)
ТВ - торцевые выходы биореактора
ВВ - вертикальные выходы биореактора
СЛ - слив
ПН - перистальтический насос
П-АБ - порт для дозирования антибиотика
П - порт для отбора проб
ПВ - питательные вещества
ПВ+АБ - питательные вещества с антибиотиком
Раскрытие сущности изобретения
Предлагаемое изобретение - модифицированная динамическая система in vitro (М-ДС) включает в себя 2 камеры: камера с запасом свежей питательной среды (КБ) и диализная камера (ДК, биореактор диализного типа). Указанные камеры последовательно соединены между собой шлангами, по которым при помощи перистальтического насоса питательная среда из камеры КБ постоянно перемещается в диализную камеру. В ДК производят дозирование антибиотика, его элиминацию, а также культивируют микробные клетки (см. фиг. 3).
Ключевым отличием настоящего изобретения от прототипа, «Hollow-Fiber Infection Model» (HFIM), является отсутствие в структуре системы основного элемента HFIM - центральной камеры с антибиотиком (ЦК-А), в которой воспроизводится фармакокинетический профиль антимикробного препарата. В М-ДС функция ЦК-А перенесена в ДК. Таким образом, в ДК, где культивируют клетки микроорганизма (так же как в HFIM), одновременно производят и моделирование фармакокинетики антибиотика за счет его дозирования и последующей элиминации. В результате, благодаря исключению ЦК-А удается значительно упростить структуру динамической системы, повысить ее управляемость и экономичность.
Биореактор (ДК), размещаемый в термостате, представляет собой цилиндр, заполненный пористыми капиллярами (из полисульфона или целлюлозы), выполняющими фильтрующую функцию (см. фиг. 4, А, Б). Внутри пористых капилляров биореактора движется питательная среда с антибиотиком, которая сквозь поры поступает во внекапиллярное пространство биореактора, где культивируют клетки микроорганизма, и обратно. Поры в стенках капилляров (порог пропускной способности пор - соединения с молекулярным весом 5 кДа или более в зависимости от размера клеток микроорганизма) пропускают питательные вещества и антибиотик, но не пропускают клетки микроорганизма, благодаря чему патогенные клетки не проникают во внутреннее пространство волокон и не вымываются из системы с током питательной среды. Для данного изобретения размер пор в стенках капилляров не является существенным признаком, поскольку объектом изобретения является сама система.
Как видно на фигуре 3, биореактор снабжен торцевыми выходами (ТВ), обеспечивающими доступ к внутреннему пространству капилляров, наполняющих ячейку. Наряду с этим, биореактор снабжен вертикальными выходами (ВВ), которые открывают доступ к внекапиллярному пространству биореактора. Указанные порты (торцевые и вертикальные) используются для создания двух контуров, по которым при помощи перистальтических насосов обеспечивается перемешивание жидкости в биореакторе. Контуры снабжены портами для отбора проб (П). Контур 1, проходящий через вертикальные выходы, обеспечивает циркуляцию клеток микроорганизмов во внекапиллярном пространстве биореактора, а контур 2, проходящий через торцевые выходы, обеспечивает циркуляцию питательной среды с антибиотиком и равномерное распределение всех веществ в биореакторе. Объемная скорость перемещения среды в обоих контурах составляет 15-20 мл/мин. Наряду с функцией перемешивания клеток во внекапиллярном пространстве, контур 1 также используется для подачи питательной среды из камеры КБ и раствора антибиотика в биореактор. Для этого на шланге контура 1 расположены отдельные порты. На шлангах контура 2 находится ответвление, при помощи которого производится самопроизвольный слив из системы излишков питательной среды.
Примеры осуществления
Преимущества настоящего изобретения по сравнению с указанными аналогами иллюстрируются следующими примерами его осуществления.
Пример 1
Экономическая эффективность в отношении расхода питательной среды при проведении экспериментальных работ в М-ДС в сравнении с HFIM.
Потребность в питательной среде была рассчитана для стандартных 5-дневных фармакодинамических экспериментов по изучению антимикробной эффективности дорипенема в отношении Pseudomonas aeruginosa и процессов развития антибиотикорезистентности псевдомонад в HFIM и М-ДС. В обеих системах диализные камеры представлены одним и тем же типом биореактора.
Расчет объема заполнения динамической системы питательной средой перед началом эксперимента:
объем биореактора в обеих системах составляет 25 мл, а объем шлангов - около 15 мл. В данном примере в системе HFIM объем центральной камеры (ЦК-А) составляет 50 мл. В системе М-ДС согласно настоящему изобретению функцию центральной камеры выполняет биореактор. Таким образом, суммарный объем (V) системы HFIM составляет 25 мл + 15 мл + 50 мл = 90 мл, а системы М-ДС - 25 мл + 15 мл = 40 мл.
Расчет расхода среды в ходе 5-дневного (120 часового) эксперимента:
на основании фундаментальных уравнений фармакокинетики лекарственных средств, применяемых для расчетов при работе с динамической системой, объемная скорость поступления среды в систему (F, мл/ч) для воспроизведения процесса элиминации антибиотика равна произведению V на константу элиминации (KEL). KEL рассчитывается как отношение натурального логарифма от 2 (LN (2) = 0,693) к периоду полувыведения (Т1/2). Таким образом, для моделирования фармакокинетики дорипенема с Т1/2, равным 1,2 ч, в системе HFIM при настоящих исходных данных (V и KEL) необходимый объем среды за 5 дней составит:
90 мл × (0,693/1,2) ч-1 × 120 ч = 6237 мл.
При объеме системы М-ДС, равном 40 мл, необходимый объем среды за 5 дней составит:
40 мл × (0,693/1,2) ч-1 × 120 ч = 2772 мл.
При изучении фармакодинамики препарата требуемый минимум экспериментов с учетом необходимости проведения трех повторностей на выборке из трех штаммов микроорганизма составляет, соответственно 9 опытов. В результате общий объем среды на цикл из 9 экспериментов составит:
для HFIM - (6237 мл × 9) + (90 мл × 9) = 56943 мл (56,943 л);
для М-ДС - (2772 мл × 9) + (40 мл × 9) = 25308 мл (25,308 л).
При стоимости одного литра среды для данного вида экспериментов от 546 рублей, экономическая выгода от применения М-ДС составит 17272,71 рублей.
Пример 2
В М-ДС были проведены эксперименты, направленные на оценку соответствия параметров фармакокинетики дорипенема, задаваемых в эксперименте, полученным в ходе клинических испытаний антибиотика на здоровых добровольцах [12]. Для описания фармакокинетики препарата использовали одночастевую модель, элиминация антибиотика из системы описывалась уравнением моноэкспоненты. Результаты моделирования фармакокинетического профиля дорипенема в М-ДС показаны на фиг. 5. Было получено соответствие экспериментальных данных расчетным - ожидаемым концентрациям антибиотика. Фактическое значение периода полувыведения дорипенема (1,24 ч) практически совпадало с расчетным (1,2 ч). Данный пример наглядно показывает, что снижение скорости перемешивания питательной среды в контурах системы до 15-20 мл/мин (в настоящем примере 15 мл/мин вместо 80-120 мл/мин как в аналоге изобретения, см. выше) не влияет на качество воспроизведения фармакокинетической кривой дорипенема.
Пример 3
Применимость М-ДС для изучения фармакодинамики антибиотиков была подтверждена в экспериментах с дорипенемом по изучению его эффективности в отношении двух штаммов Pseudomonas aeruginosa и процессов развития резистентности псевдомонад на фоне антибиотикотерапии. В М-ДС воспроизводили фармакокинетические профили дорипенема, соответствующие терапевтической и субтерапевтическим дозам антибиотика. Плотность инокулята псевдомонад в начале эксперимента составляла 10^8 КОЕ/мл. Длительность эксперимента составляла 120 ч.
Были получены кинетические кривые изменения численности клеток общей и резистентной популяций Pseudomonas aeruginosa во времени под воздействием дорипенема (фиг. 6). Из фигуры видно, что повышение дозы антибиотика приводило к снижению численности жизнеспособных клеток микроорганизма на протяжении всего эксперимента как в случае общей (А), так и резистентной популяций псевдомонад (Б).
Существование логичной взаимосвязи между моделируемой в системе дозой дорипенема и его эффектом на патогенные клетки было подтверждено по результатам регрессионного анализа. Зависимости «доза - эффект» для общей и резистентной популяций Pseudomonas aeruginosa были описаны сигмоидной функцией с высокими коэффициентами корреляции, r2=0,93 и 0,96, соответственно (фиг. 7А, Б).
Кроме того, результаты, полученные в М-ДС (динамика общей численности псевдомонад при моделировании терапевтической дозы антибиотика, равной 500 мг каждые 8 ч), согласуются с результатами аналогичных экспериментов, ранее проведенных другими исследователями с теми же объектами в динамических системах аналогах М-ДС, DIM [13] и HFIM [14] (фиг. 8А, Б, В).
На основании представленных результатов можно сделать заключение о высоких функциональных характеристиках изобретения.
СПИСОК ЛИТЕРАТУРЫ:
1) Al-Asadi, M.J.S., Greenwood, D. & O'Grady, F. (1979). In vitro model simulating the form of exposure of bacteria to antimicrobial drugs encountered in infection. Antimicrobial Agents and Chemotherapy 16, 77-80.
2) Grasso, S., Meinardi, G., De Carneri, I. & Tamassia, V. (1978). New in vitro model to study the effect of antibiotic concentration and rate of elimination on antibacterial activity. Antimicrobial Agents and Chemotherapy 13, 570-6.
3) Murakawa, Т., Sakamoto, H., Hirose, T. & Nishida, M. (1980). New in vitro kinetic model for evaluating bactericidal efficacy of antibiotics. Antimicrobial Agents and Chemotherapy 18, 377-81.
4) Shah, P.M. (1980). An improved method to study antibacterial activity of antibiotics in an in vitro model simulating serum levels. Methods and Findings in Experimental and Clinical Pharmacology 2, 171-6.
5) Toothaker, R.D., Welling, P.G. & Craig, W.A. (1982). An in vitro model for the study of antibacterial dosage regimen design. Journal of Pharmaceutical Sciences 71, 861-4.
6) Strukova EN, Portnoy YA, Romanov AV, Edelstein MV, Zinner SH, Firsov AA. (2015) Searching for the Optimal Predictor of Ciprofloxacin Resistance in Klebsiella pneumoniae by Using In Vitro Dynamic Models. Antimicrob Agents Chemother 60, 1208-15. doi: 10.1128/AAC.02334-15.
7) Firsov AA, Smirnova MV, Lubenko IY, Vostrov SN, Portnoy YA, Zinner SH. (2006) Testing the mutant selection window hypothesis with Staphylococcus aureus exposed to daptomycin and vancomycin in an in vitro dynamic model. J Antimicrob Chemother 58, 1185-92. doi: 10.1093/jac/dkl387.
8) Firsov AA, Golikova MV, Strukova EN, Portnoy YA, Romanov AV, Edelstein MV, Zinner SH. (2015) In vitro resistance studies with bacteria that exhibit low mutation frequencies: prediction of "antimutant" linezolid concentrations using a mixed inoculum containing both susceptible and resistant Staphylococcus aureus. Antimicrob Agents Chemother 59, 1014-9. doi: 10.1128/AAC.04214-14.
9) Zinner SH, Husson M, Klastersky J. (1981). An artificial capillary in vitro kinetic model of antibiotic bactericidal activity. J Infect Dis 144(6), 583-7. doi: 10.1093/infdis/144.6.583.
10) Cadwell J (2015) The Hollow Fiber Infection Model: Principles and Practice. Adv Antibiotics Antibodies 1, 101. doi: 10.4172/aaa.1000101.
11) Sadouki Z, McHugh TD, Aarnoutse R, Ortiz Canseco J, Darlow C, Hope W, van Ingen J, Longshaw C, Manissero D, Mead A, Pelligand L, Phee L, Readman J, Ruth MM, Standing JF, Stone N, Wey EQ, Kloprogge F. (2021) Application of the hollow fibre infection model (HFIM) in antimicrobial development: a systematic review and recommendations of reporting. J Antimicrob Chemother 76(9), 2252-2259. doi: 10.1093/jac/dkab160.
12) Cirillo I., Vaccaro N., Turner K., Solanki В., Natarajan J., Redman R. (2009) Pharmacokinetics, safety, and tolerability of doripenem after 0.5-, 1-, and 4-hour infusions in healthy volunteers. J Clin Pharmacol 49(7), 798-806. doi: 10.1177/0091270009337012.
13) Bergen PJ, Tsuji ВТ, Bulitta JB, Forrest A, Jacob J, Sidjabat HE, Paterson DL, Nation RL, Li J. (2011) Synergistic killing of multidrug-resistant Pseudomonas aeruginosa at multiple inocula by colistin combined with doripenem in an in vitro pharmacokinetic/pharmacodynamic model. Antimicrob Agents Chemother 55(12), 5685-95. doi: 10.1128/AAC.05298-11.
14) Louie A, Bied A, Fregeau C, Van Scoy B, Brown D, Liu W, Bush K, Queenan AM, Morrow B, Khashab M, Kahn JB, Nicholson S, Kulawy R, Drusano GL. (2010) Impact of different carbapenems and regimens of administration on resistance emergence for three isogenic Pseudomonas aeruginosa strains with differing mechanisms of resistance. Antimicrob Agents Chemother 54(6), 2638-45. doi: 10.1128/AAC.01721-09.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ моделирования внутрибрюшного синегнойного инфекционного процесса | 2019 |
|
RU2725136C1 |
| ДИФФЕРЕНЦИАЛЬНО-ДИАГНОСТИЧЕСКАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ОПРЕДЕЛЕНИЯ ПОРИН-ЗАВИСИМЫХ МЕХАНИЗМОВ УСТОЙЧИВОСТИ БАКТЕРИЙ PSEUDOMONAS AERUGINOSA К БЕТА-ЛАКТАМНЫМ АНТИБИОТИКАМ | 2015 |
|
RU2603085C1 |
| СРЕДСТВО ДЛЯ СЕЛЕКТИВНОГО ВЛИЯНИЯ НА БИОПЛЕНКООБРАЗОВАНИЕ МИКРООРГАНИЗМАМИ | 2016 |
|
RU2646488C2 |
| Способ определения гетерорезистентных популяций в моновидовых культурах быстрорастущих бактерий | 2021 |
|
RU2774904C1 |
| ПРОТИВОМИКРОБНЫЕ ТЕКСТИЛЬНЫЕ ИЗДЕЛИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2660050C2 |
| Применение 4-(3-этокси-4-гидроксибензил)-5-оксо-5,6-дигидро-4Н-[1,3,4]-тиадиазин-2-(2,4-дифторфенил)-карбоксамида для подавления инфекции, вызванной устойчивыми к антибиотикам штаммами Pseudomonas aeruginosa, и способ подавления этой инфекции | 2016 |
|
RU2624846C1 |
| ШТАММ БАКТЕРИЙ Lactobacillus rhamnosus 7 дс, ОБЛАДАЮЩИЙ ШИРОКИМ СПЕКТРОМ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТИ ПО ОТНОШЕНИЮ К ПАТОГЕННЫМ И УСЛОВНО-ПАТОГЕННЫМ МИКРООРГАНИЗМАМ | 2016 |
|
RU2627165C1 |
| Модифицированный эндолизин и антибактериальные композиции на его основе для лечения инфекций, вызванных бактериями Acinetobacter baumannii, Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli | 2023 |
|
RU2813626C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pPA-OPRF-ETA, КОДИРУЮЩАЯ СИНТЕЗ РЕКОМБИНАНТНОГО БЕЛКА OPRF-ETA Pseudomonas aeruginosa, ШТАММ Escherichia coli PA-OPRF-ETA - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО БЕЛКА OPRF-ETA Pseudomonas aeruginosa И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА OPRF-ETA Pseudomonas aeruginosa | 2012 |
|
RU2529359C2 |
| СПОСОБ ОЦЕНКИ ЦИТОТОКСИЧНОСТИ ШТАММОВ ВОЗБУДИТЕЛЯ МЕЛИОИДОЗА BURKHOLDERIA PSEUDOMALLEI ПО ИХ ВЛИЯНИЮ НА ЦИСТООБРАЗУЮЩУЮ АКТИВНОСТЬ TETRAHYMENA PYRIFORMIS | 2016 |
|
RU2623175C1 |
Изобретение относится к области изучения фармакодинамики антимикробных препаратов, их эффективности в отношении патогенных микроорганизмов и процессов развития антибиотикорезистентности в динамических системах in vitro. Динамическая система in vitro для изучения фармакодинамики антимикробных препаратов представляет собой систему камер, соединенных между собой шлангами. При этом она содержит биореактор, в котором одновременно осуществляют культивирование микробной культуры и смешивание раствора антибиотика и питательной среды. К биореактору подсоединены шланги с портами для отбора проб, образующие два контура, один из которых связывает между собой вертикальные выходы биореактора и обеспечивает циркуляцию клеток микроорганизма внутри биореактора, а другой - связывает торцевые выходы биореактора и обеспечивает равномерное распределение раствора антибиотика в нем. Осуществление изобретения обеспечивает оптимизацию конструкции динамической системы in vitro путём её упрощения за счет сокращения количества структурных элементов и, как следствие, повышение простоты работы с системой, ее управляемости и экономичности. 8 ил., 3 пр.
Динамическая система in vitro для изучения фармакодинамики антимикробных препаратов, представляющая собой систему камер, соединенных между собой шлангами, а именно, камеру с запасом питательной среды, камеру в которой осуществляют смешивание раствора антибиотика и питательной среды - центральная камера, камеру в которой культивируют клетки микроорганизмов - половолоконный биореактор диализного типа; перемещение среды между камерами осуществляют по шлангам посредством перистальтических насосов, отличающаяся тем, что система содержит биореактор, в котором одновременно осуществляют культивирование микробной культуры и смешивание раствора антибиотика и питательной среды; к биореактору подсоединены шланги с портами для отбора проб, образующие два контура, один из которых связывает между собой вертикальные выходы биореактора и обеспечивает циркуляцию клеток микроорганизма внутри биореактора, а другой - связывает торцевые выходы биореактора и обеспечивает равномерное распределение раствора антибиотика в нем.
| ZINNER SH, HUSSON M, KLASTERSKY J | |||
| An artificial capillary in vitro kinetic model of antibiotic bactericidal activity | |||
| Аппарат для электрической передачи изображений без проводов | 1920 |
|
SU144A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ МИКРООРГАНИЗМОВ К АНТИМИКРОБНЫМ ВЕЩЕСТВАМ | 2012 |
|
RU2505813C1 |
| FR 0002863273 В1, 08.02.2008 | |||
| FIRSOV A.A., STRUKOVA E.N., PORTNOY Y.A., ZINNER S.H | |||
| Bacterial antibiotic resistance studies using in vitro dynamic models: Population | |||
Авторы
Даты
2023-01-09—Публикация
2022-04-27—Подача