Область техники
Изобретение относится к микробиологии и медицине, а именно, к диагностическим процедурам, включающим оценку антибиотикорезистентности бактерий. Изобретение обеспечивает способ выявления гетерорезистентных популяций в моновидовых культурах клинически актуальных видов бактерий. Изобретение может быть использовано в диагностических целях в клинической и санитарной микробиологии.
Определения
Резистентность микроорганизмов - это свойство микроорганизмов, определяющее их способность размножаться в присутствии концентраций лекарств, превьппающих терапевтические концентрации при лечении человека (WHO Library Cataloguing-in-Publication Data, 2015. Avaiable at: https://www.who.int/antimicrobial-resistance/publications/global-action-plan/en/ (accessed 1 October 2019)).
Гетерорезистентность - это явление, при котором в популяции микробных клеток сосуществуют субпопуляции с разным проявлением устойчивости к антибиотикам [Andersson D.I., Nicoloff Н., Hjort K. Mechanisms and clinical relevance of bacterial heteroresistance. Nature Reviews Microbiology. 2019; 17:479-496. Avaiable at: https://d0i.0rg/10.1038/s41579-019-0218-1].
Быстрорастущие бактерии - бактерии, которые в течение 7 суток дают визуально определяемый рост [Stahl D.A., Urbance J.W. The division between fast-and slow-growing species corresponds to natural relationships among the mycobacteria. Journal of bacteriology. 1990; 172(1):116-124]. Большинство клинически значимых условно-патогенных бактерий, включая Acinetobacter spp., Pseudomonas aeruginosa, Klebsiella pneumoniae, Enterobacter spp., Staphylococcus spp., Enterococcus spp., Streptococcus spp., Escherichia coli, Shigella spp., Salmonella spp.и др., принадлежат к быстрорастущим бактериям.
Уровень техники
Устойчивость или резистентность бактерий к антибиотикам является важной проблемой современной медицины. Всемирные масштабы и высокая степень опасности резистентных к антибиотикам бактерий стали расцениваться как глобальная угроза для всего человечества [Klein E.Y., Van Boeckel Т.Р., Martinez E.M., Pant S., Gandra S. et al. Global increase and geographic convergence in antibiotic consumption between 2000 and 2015. Proc. Natl. Acad. Sci. USA. 2018; 115(15):E3463-E3470. Avaiable at: https://doi.org/10.1073/pnas.1717295115]. Глобальный план действий ВОЗ по борьбе с устойчивостью к противомикробным препаратам (WHO Global action plan on antimicrobial resistance) предполагает «улучшение понимания вопросов устойчивости к противомикробным препаратам» (WHO Library Cataloguing-in-Publication Data, 2015. Avaiable at: https://www.who.int/antimicrobial-resistance/publications/global-action-plan/en/ (accessed 1 October 2019)). Для оценки резистентности разработаны надежные методы и критерии, признанные на межнациональном уровне (European Committee on Antimicrobial Susceptibility Testing [электронный ресурс] // EUCAST Experts rules, 2016; P. 143 - URL: http://www.eucast.org/expert rules and intrinsic resistance; European Committee on Antimicrobial Susceptibility Testing [электронный ресурс] // Breakpoint tables for interpretation of MICs and zone diameters. - P. 11. - URL: http://www.eucast.org/clinical breakpoints; The Clinical Laboratory Standards Institute (CLSI) [Электронный ресурс] // Performance Standards for antimicrobial susceptibility testing, 28th Edition, 2018; P.38. - URL: http://em100.edaptivedocs.info/dashboard.aspx).
Однако указанные методы направлены на оценку резистентности чистой культуры изолированного микроорганизма и не учитывают возможности присутствия в культуре популяций бактерий, которые различаются по степени чувствительности к антибиотикам. Тем не менее, феномен неоднородности, который получил название гетерорезистентности, часто наблюдается у клинически важных изолятов бактерий Acinetobacter spp., Pseudomonas aeruginosa, Klebsiella pneumoniae, Enterobacter spp., Staphylococcus spp., Escherichia coli и др. [Andersson D.I., Nicoloff H., Hjort K. Mechanisms and clinical relevance of bacterial heteroresistance //Nature Reviews Microbiology. 2019; 17:479-496. https://doi.org/10.1038/s41579-019-0218-1].
Важность выявления гетерорезистентности обусловлена следующими причинами:
1) Гомогенность исследуемой культуры в микробиологии является необходимым условием оценки свойств этой культуры.
2) Игнорирование феномена гетерорезистентности приводит к ошибкам в лечении инфекций и негативным исходам заболевания [Di Gregorio, S. et al. Clinical, microbiological, and genetic characteristics of heteroresistant vancomycinintermediate Staphylococcus aureus bacteremia in a teaching hospital. Microb. Drug Resist. 2015; 21:25-34; Moosavian, M. et al. Post neurosurgical meningitis due to colistin heteroresistant Acinetobacter baumannii. Jundishapur J. Microbiol. 2014; 7: el2287; Sieradzki K., Roberts R. В., Serur D., Hargrave J. Tomasz A. Heterogeneously vancomycin- resistant Staphylococcus epidermidis strain causing recurrent peritonitis in a dialysis patient during vancomycin therapy. J. Clin. Microbiol. 1999; 37: 39-44]. И наоборот, выявление резистентной субпопуляции внутри общей популяции изолированных от пациента бактерий позволяет избежать ошибок в назначении антибиотикотерапии конкретному пациенту.
3) Определение характеристик гетерорезистентности позволяет прогнозировать эволюцию антибиотикорезистентности и на основании этого планировать применение антибиотиков в рамках стационара и даже региона [Tan С.-Н., Li J., Nation R.L. Activity of colistin against heteroresistant Acinetobacter baumannii and emergence of resistance in an in vitro pharmacokinetic/pharmacodynamic model. Antimicrob. Agents Chemother. 2007; 51:3413-3415].
Определение гетерорезистентных бактерий является непростой задачей из-за высокой степени сродства фенотипических признаков антибиотикочувствительных и антибиотикорезистентных популяций чистой культуры микроорганизма.
Для выявления гетерорезистентности используется ряд методов:
1) Определение гетерорезистентности при помощи культуральных методов.
Известно выявление феномена гетерорезистентности при помощи культивирования микробов на специальных искусственных питательных средах. Примером таких сред является плотная питательная среда в чашке Петри, которая представляет собой двухслойный агар, нижний слой которого содержит антибиотик, а верхний слой - не содержит антибиотика [Hunt D.E., Sandham H.J. Improved agar gradient-plate technique. Applied microbiology. 1969: 17(2): 329]. Указанная среда сконструирована таким образом, что распределение концентрации антибиотика является неравномерным и нарастает линейно от одного полюса чашки Петри к другому полюсу. Исследуемый микроорганизм в составе суспензии равномерно распределяется по поверхности указанного агара, чашка инкубируется при условиях, являющихся оптимальными. После инкубации оценивается равномерность роста на поверхности агара. Равномерный рост либо резкая граница между участками с ростом микробов и участками без роста микробов являются признаками гомогенности микроба по отношению к антибиотику. Неравномерный рост на всей поверхности чашки свидетельствует о гетерорезистентности исследуемой популяции микроорганизма. Главным недостатком описанного метода является ограничение срока годности двухслойного агара - он должен быть использован немедленно после его приготовления и не может храниться до использования более нескольких часов (в зависимости от типа антибиотика). Существенным недостатком также является длительность выполнения - не менее суток.
2) Определение гетерорезистентности при помощи генетических методов
Другая технология выявления гетерорезистентности основана на использовании амплификации целевого локуса генома микроорганизма, который может содержать вариант, детерминирующий антибиотикорезистентность с последующим секвенированием на платформе секвенирования следующего поколения (NGS) и выполнением согласно специальному алгоритму выравнивания полученных сиквенсов и анализа выровненных данных для обнаружения по крайней мере одного минорного варианта целевого локуса, а следовательно - гетерорезистентной популяции патогена [Colman R. et al. «Single molecule-overlapping read analysis for minor variant mutation detection in pathogen samples» United States Patent No10508311 (2019)]. Главными недостатками указанного способа являются: 1) длительность выполнения (более 2-х суток); 2) высокая стоимость выполнения анализа и необходимость использования дорогостоящего оборудования - амплификаторов и секвенаторов следующего поколения.
3) Определение гетерорезистентности при помощи микроскопических методов.
Известный метод выявление гетерорезистентности реализуется при помощи покадровой микроскопической визуализации [Chang Y.C., Lamichhane А.К., Kwon-Chung K.J. Cryptococcus neoformans, unlike Candida albicans, forms aneuploid clones directly from uninucleated cells under fluconazole stress. Mbio. 2018; 9(6):е01290-18]. Другим вариантом микроскопического выявления гетерорезистентности является трансмиссионная электронная микроскопия, которая выявляет субпоппуляции метициллин-резистентных стафилококков по нарушению у них ультраструктур клеточной стенки [Markova N. et al. Cell wall deficiency and its effect on methicillin heteroresistance in Staphylococcus aureus. International journal of antimicrobial agents. 2008; 31(3):255-260].
Существенными недостатками микроскопических методов выявления гетерорезистентности являются: 1) необходимость специального дорогостоящего микроскопического оборудования, обеспеченного специальными программными продуктами для визуализации изображения; 2) наблюдение за отдельными клетками и группами клеток, ограничивающее оценку свойства всей популяции микробов, исчисляемой сотнями миллионов и миллиардами клеток.
Наиболее близким к предлагаемому изобретению является способ оценки гетерорезистентности бактериальной популяции Acinetobacter baumannii к колистину при помощи популяционного анализа профилей (population analysis profiles (PAPs)) резистентности [Li J., Rayner C.R., Nation R.L., Owen R.J., Spelman D., Tan K.E., Liolios L. Heteroresistance to colistin in multidrug-resistant Acinetobacter baumannii //Antimicrobial agents and chemotherapy. 2006; 50(9): 2946-2950]. Этот способ осуществляется путем спирального нанесения 50 мкл суспензии бактериальных клеток, используя автоматическую спиральную посевную машину Whitley (Synbiosis, Cambridge, United Kingdom), которая обеспечивает различную плотность посева в зависимости от радиуса на чашке Петри. Посев производили на поверхность агара Мюллера-Хинтона в чашках Петри без колистина сульфата или с различными концентрациями (0,5, 1,2, 3,4, 5,6, 8, и 10 мкг/мл) колистина сульфата. После инкубации при 35°С в течение 48 часов осуществляли подсчет колоний выросших бактерий. Количественные характеристики роста оценивали по количеству колониеобразующих единиц (КОЕ), которое подсчитывали автоматическим счетчиком колоний ProtoCOL (Synbiosis, Cambridge, United Kingdom). Наличие гетерорезистентных популяций определяли по степени роста на среде, содержащей антибиотик, через 48 часов инкубации. Полное отсутствие роста говорило о гомогенной чувствительной к данной концентрации антибиотика популяции бактерий. Рост колоний, равномерно занимающий всю поверхность питательной среды (конфлюентный рост), говорил о гомогенной резистентной к данной концентрации антибиотика популяции. Если на среде с антибиотиком в течение 48 ч обнаруживалось счетное число колоний (от 1 до 30), то популяция считалась гетерорезистентной, т.е. содержит не менее 2-х субпопуляций микробов с разными уровнями чувствительности к антибиотику.
Однако, и указанный способ обладал рядом недостатков, к которым относятся: 1) длительность выполнения (48 часов для быстрорастущих бактерий), которая в клинических условиях может привести к фатальным последствиям для пациента; 2) потребность в наличии свежих питательных сред с разными концентрациями антибиотика, сроки хранения которых могут быть ограничены 24 часами из-за быстрого гидролиза некоторых классов антибиотиков (бета-лактамы) в водных растворах (все плотные питательные среды для роста микроорганизмов готовятся на основе воды).
Задачей предлагаемого изобретения является создание способа, который позволяет установить наличие либо отсутствие феномена гетерорезистентности в популяциях патогенных и условно-патогенных (оппортунистических) быстрорастущих бактерий в течение нескольких часов и не требует использования плотных питательных сред.
Технический результат, достигаемый при осуществлении изобретения, заключается в ускорении определения степени гетерогенности бактериального изолята по признаку чувствительности к антибиотику при сохранении его точности.
Способ выгодно отличается от известных из уровня техники методов быстротой выполнения (до 8 часов для ведущих клинических быстрорастущих патогенных и условно-патогенных бактерий) и возможностью выполнения на минимальных объемах жидких питательных сред, которые крайне просты в изготовлении, а также низкой себестоимостью. Способ не требует дорогостоящего оборудования и высококвалифицированного персонала. Данные, полученные с помощью предлагаемого способа, могут быть использованы для оценки качества изоляции чистых культур из биологических образцов и последующего выбора оптимальной антибиотикотерапии.
Способ основан на сравнении скорости роста исследуемой популяции бактерий в жидкой питательной среде в присутствии антибиотика со скоростью роста этой же популяции бактерий в аналогичной среде без антибиотика. Учет результатов выполняется на основании наблюдения за изменением концентрации бактерий, которая оценивается при помощи физических методов определения денситометрических показателей среды (светопоглощение, угловое светоотражение) при помощи методов турбодиметрии или нефелометрии.
Сущность изобретения
Для определения гетерорезистентных популяций в моновидовой культуре быстрорастущих бактерий регистрируют временные зависимости показателя денситометрической плотности жидкой питательной среды с исследуемой культурой быстрорастущих бактерий в присутствии и отсутствии антибиотика. При этом указанные зависимости регистрируют с момента начала роста определяемого показателя у референсного штамма гомогенной популяции бактерий того же вида, резистентного к используемому антибиотику, и продолжают до 8 часов от начала инкубации. Показатели денситометрической плотности регистрируют с интервалом от 10 секунд до 10 минут.
Далее вычисляют относительный денситометрический показатель концентрации бактерий по формуле:
A(t)=100-Х/Y×100, где
A(t) - относительный денситометрический показатель концентрации бактерий;
X - показатель денситометрической плотности жидкой питательной среды с исследуемой культурой быстрорастущих бактерий в присутствии антибиотика;
Y - показатель денситометрической плотности жидкой питательной среды с исследуемой культурой быстрорастущих бактерий без антибиотика;
а присутствие гетерорезистентной популяции определяют по уменьшению величины A(t) после достижения ею максимального значения.
Осуществление изобретения
1. В качестве объекта исследования используется культура жизнеспособных бактерий, выросшая на плотной питательной среде. Исследуемый материал забирается из колонии микроорганизмов и стандартизуется по концентрации бактерий при помощи турбодиметрического метода.
2. Из стандартизованной взвеси бактерий в питательной среде, подходящей для культивирования данного вида бактерий, получают 2 варианта проб для определения денситометрических показателей, отражающих концентрацию бактерий: первая проба не содержит антибиотика, вторая проба содержит концентрацию антибиотика, соответствующую минимальной подавляющей концентрации (МПК) этого антибиотика для категории чувствительных бактерий (European Committee on Antimicrobial Susceptibility Testing [электронный ресурс] // EUCAST Experts rules, 2016; P. 143 - URL: http://www.eucast.org/expert_mles_and_mtrinsic_resistance; European Committee on Antimicrobial Susceptibility Testing [электронный ресурс] // Breakpoint tables for interpretation of MICs and zone diameters. - P. 11. - URL: http://www.eucast.org/clinical breakpoints; The Clinical Laboratory Standards Institute (CLSI) [Электронный ресурс] // Performance Standards for antimicrobial susceptibility testing, 28th Edition, 2018; P.38. - URL: http://em100.edaptivedocs.info/dashboard.aspx). Для повышения достоверности результатов все пробы подготавливаются в трех повторениях.
3. Параллельно подготавливают 2 контрольных образца: 1) на основе референсного штамма бактерии того же вида, чувствительного ко всем антибиотикам (Контроль-1), и 2) на основе референсного штамма бактерии того же вида, резистентного к используемым антибиотикам (Контроль-2). Контрольные образцы позволяют проверить ростовые качества используемой питательной среды и активность антибиотика. Подготовка контрольных образцов проводится так же, как подготовка изучаемого образца (см. п.п. 1. и 2. настоящего раздела). Для повышения достоверности результатов все пробы подготавливаются в трех повторениях.
4. Все подготовленные пробы инкубируются при температуре, оптимальной для размножения данного вида бактерий. Немедленно после начала инкубации начинается регистрация турбодиметрических или нефелометрических показателей для каждой из проб. Регистрация этих показателей может выполняться через интервалы времени от 10 секунд до 10 минут.
5. В качестве результатов исследования используют временной график относительных показателей, рассчитанных на основе сравнения полученных денситометрических показателей (светопоглощение либо угловое светоотражение) пробы исследуемого образца в присутствии антибиотика с аналогичными показателями этого образца в среде без антибиотика согласно формуле:
A(t)=100-Х/Y×100, где
A(t) - относительный денситометрический показатель концентрации бактерий;
X - показатель денситометрической плотности исследуемой культуры быстрорастущих бактерий в присутствии антибиотика;
Y - показатель денситометрической плотности исследуемой культуры быстрорастущих бактерий без антибиотика.
6. На основе полученных результатов выполняют построение кривых изменения относительных денситометрических показателей за промежуток времени, который включает диапазон с момента начала роста абсолютных денситометрических показателей Контроля-2 до 8 часов от начала инкубации. Полученная кривая отражает изменение концентрации микробных клеток в исследуемой пробе.
7. Отсутствие роста относительного показателя A(t) у исследуемого образца бактериальных клеток в присутствии МПК антибиотика для категории чувствительных бактерий говорит о присутствии в исследуемом образце гомогенной (однородной) популяции бактерий, резистентных к данному антибиотику. Если кривая восходящего роста относительного показателя A(t) у исследуемого образца не имеет признаков явного снижения либо задержки роста исследуемого образца бактерий в присутствии антибиотика, то это говорит о присутствии в исследуемом образце гомогенной (однородной) популяции бактерий, чувствительных к данному антибиотику. Кривая относительного показателя A(t), которая имеет подъем и спад, говорит о гетерорезистентности исследуемой популяции бактерий к использованному антибиотику.
На Фигуре представлены схематические изображения графиков изменения во времени относительного денситометрического показателя A(t) концентрации бактерий, где 1 - однородная (гомогенная) популяция чувствительных к антибиотику бактерий, 2 - однородная (гомогенная) популяция резистентных к антибиотику бактерий, 3 - гетерогенная популяция бактерий, содержащая чувствительные и резистентные к антибиотику бактерии; по оси абсцисс - время (часы), по оси ординат - величина A(t) в относительных единицах.
8. Интерпретация результатов может производиться при условии наличия логарифмического размножения бактериальных клеток во всех исследуемых и контрольных пробах в среде без антибиотиков. Интерпретация результатов может производиться при условии отсутствия логарифмического роста контрольного образца чувствительной бактерий в присутствии антибиотика.
Приводим данные, подтверждающие возможность реализации заявленного назначения и достижения указанного технического результата. Представленные примеры предназначены для лучшего понимания сущности заявленного изобретения, но не должны рассматриваться как ограничивающие данное изобретение.
Примеры.
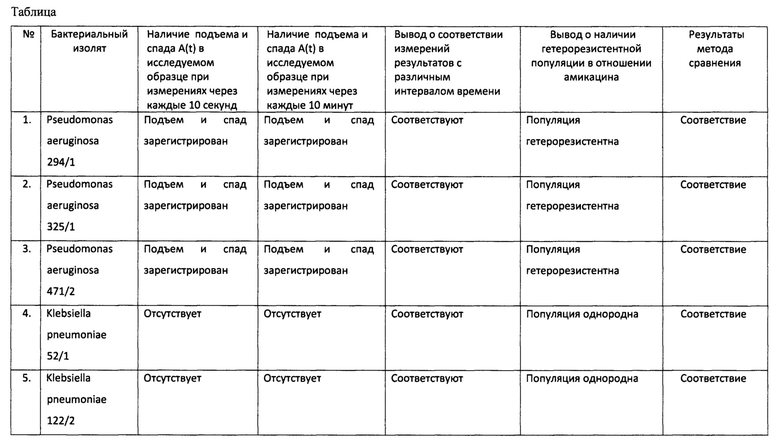
1. Целью исследований было выявление гетерорезистентных в отношении амикацина популяций клинически актуальных видов Pseudomonas aeruginosa, Klebsiella pneumoniae, Acinetobacter baumannii, Staphylococcus aureus, Escherichia coli, Salmonella enterica. В качестве объекта исследования были использованы суточные культуры 18 госпитальных изолятов, выросшие на плотной питательной среде - сердечно-мозговом агаре. Материал забирали из колонии бактерий при помощи бактериальной петли, инокулировали в пробирку с жидкой питательной средой - бульоном Мюллера-Хинтона. Затем концентрация бактерий была стандартизована при помощи турбодиметрического метода на фотометре-денситометре DEN-1 (Biosan, Латвия) до показателя мутности 0,5 единицы МакФарланда и была разбавлена в этой же средой в 10000 раз.
По 0,03 мл полученной взвеси бактерий были инокулированы в лунки 96-луночного планшета Nuclon Surface (лунки с плоским дном, Thermo Fisher Scientific, США). Затем к половине исследуемых образцов добавляли по 0,3 мл раствора амикацина в бульоне Мюллера-Хинтона. Концентрации амикацина были выбраны в соответствии с его минимальной ингибирующей концентрации в отношении бактерий категории «чувствительные», определенной международными стандартами European Committee on Antimicrobial Susceptibility Testing (https://www.eucast.org) в отношении конкретного вида бактерий: для Pseudomonas aeruginosa конечная концентрация амикацина в лунке была 16 мкг/мл, для Klebsiella pneumoniae, Escherichia coli, Salmonella enterica и Staphylococcus aureus - 8 мкг/мл, для Acinetobacter baumannii - 4 мкг/мл. К другой половине исследуемых образцов добавляли по 0, 3 мл бульона Мюллера-Хинтона без амикацина. В качестве контрольных образцов использовали чувствительные и резистентные к амикацину референсные штаммы Pseudomonas aeruginosa, Klebsiella pneumoniae, Acinetobacter baumannii, Staphylococcus aureus, Escherichia coli, Salmonella enterica. Для повышения достоверности результатов все пробы повторялись в трех повторениях.
Планшеты помещали в планшетный ридер Infinite 200 PRO (Tecan Austria GmbH, Австрия), где они инкубировались при 37°С при постоянном покачивании (100 движений/мин) в течение 8 часов. Регистрация светопоглощения (денситометрической плотности) производилась в двух режимах: каждые 10 секунд и каждые 10 мин при длине волны 535 нм. Результаты 3-х повторов каждой пробы усреднялись при помощи статистического программного пакета, поддерживаемого Infinite 200 PRO.
A(t)=100-Х/Y×100, где
A(t) - относительный денситометрический показатель концентрации бактерий;
X - показатель денситометрической плотности исследуемой культуры быстрорастущих бактерий в присутствии антибиотика;
Y - показатель денситометрической плотности исследуемой культуры быстрорастущих бактерий без антибиотика.
На основе полученных результатов были построены кривые изменения относительных денситометрических показателей за промежуток времени, который включал диапазон с момента начала роста абсолютных денситометрических показателей Контроля-2 до 8 часов от начала инкубации.
Все случаи, при которых кривые относительного показателя, которые имели подъем и спад, были интерпретированы как гетерорезистентные в отношении амикацина популяции.
В параллельных экспериментах эти же изоляты бактерий были исследованы на основе методики, описанной в известном способе определения гетерорезистентности [Li, J., Rayner, С.R., Nation, R.L., Owen, R.J., Spelman, D., Tan, K.E., & Liolios, L. Heteroresistance to colistin in multidrug-resistant Acinetobacter baumannii //Antimicrobial agents and chemotherapy. - 2006. - T. 50. - №. 9. - C. 2946-2950]. Посев изолятов, предварительно стандартизированных в бульоне Мюллера-Хинтона до показателя мутности 0,5 единицы МакФарланда, производили при помощи бактериального шпателя на поверхность агара Мюллера-Хинтона в чашках Петри без амикацина или с различными концентрациями (0, 1, 2, 4, 8, 16 и 32 мкг/мл) амикацина. После инкубации при 35°С в течение 48 часов осуществляли подсчет колоний выросших бактерий. Количественные характеристики роста оценивали по количеству колониеобразующих единиц (КОЕ), которое подсчитывали автоматическим счетчиком колоний Scan 1200 (Interscience). Наличие гетерорезистентных популяций определяли по степени роста на среде, содержащей антибиотик, через 48 часов инкубации. Полное отсутствие роста говорило о гомогенной чувствительной к данной концентрации антибиотика популяции бактерий. Рост колоний, равномерно занимающий всю поверхность питательной среды (конфлюентный рост), говорил о гомогенной резистентной к данной концентрации антибиотика популяции. Если на среде с антибиотиком в течение 48 ч обнаруживалось счетное число колоний (от 1 до 30), то популяция считалась гетерорезистентной, т.е. содержит не менее 2-х субпопуляций микробов с разными уровнями чувствительности к антибиотику. В таблице суммированы результаты экспериментов, которые доказывают: 1) соответствие результатов измерений, проведенных с разными интервалами времени (через 10 секунд и через 10 минут); 2) полное соответствие результатам известного способа.



Изобретение относится к биотехнологии и микробиологии. Предложен способ определения гетерорезистентной популяции в моновидовой культуре быстрорастущих бактерий, включающий культивирование исследуемой культуры бактерий на жидких питательных средах с добавлением антибиотика и без него, регистрирование временных зависимостей показателя денситометрической плотности жидкой питательной среды с исследуемой культурой быстрорастущих бактерий в присутствии и отсутствии антибиотика в течение времени до 8 ч с интервалом от 10 с до 10 мин; далее вычисляют относительный денситометрический показатель концентрации бактерий по предложенной формуле и по уменьшению его величины после достижения максимального значения определяют присутствие гетерорезистентной популяции бактерий. Изобретение обеспечивает расширение арсенала способов определения гетерогенности бактериального изолята в популяциях патогенных и условно-патогенных быстрорастущих бактерий для последующего выбора оптимальной антибиотикотерапии. 1 ил., 1 табл., 1 пр.
Способ определения гетерорезистентной популяции в моновидовой культуре быстрорастущих бактерий, включающий подготовку образцов, культивирование моновидовой культуры жизнеспособных бактерий на жидких питательных средах с добавлением антибиотика и без него, отличающийся тем, что регистрируют временные зависимости показателя денситометрической плотности жидкой питательной среды с исследуемой культурой быстрорастущих бактерий в присутствии и отсутствии антибиотика, при этом указанные зависимости регистрируют с момента начала роста определяемого показателя у референсного штамма гомогенной популяции бактерий того же вида, резистентного к используемому антибиотику, и продолжают до 8 часов от начала инкубации, причем показатели денситометрической плотности регистрируют с интервалом от 10 с до 10 мин;
далее вычисляют относительный денситометрический показатель концентрации бактерий по формуле:
A(t)=100-Х/Y×100, где
A(t) - относительный денситометрический показатель концентрации бактерий;
X - показатель денситометрической плотности жидкой питательной среды с исследуемой культурой быстрорастущих бактерий в присутствии антибиотика;
Y - показатель денситометрической плотности жидкой питательной среды с исследуемой культурой быстрорастущих бактерий без антибиотика;
а присутствие гетерорезистентной популяции определяют по уменьшению величины A(t) после достижения ею максимального значения.
| JIAN LI ET AL., "Heteroresistance of colistin in multidrug - resistant Acinetobacter baumannii"; Antimicrobial agents and chemotherapy, 2006, v | |||
| Устройство для выпрямления многофазного тока | 1923 |
|
SU50A1 |
| Электрический аккумулятор | 1925 |
|
SU2946A1 |
| ШАМИНА О.В | |||
| "Молекулярная характеристика и механизмы устойчивости к колистину карбапенемрезистентных Klebsiella pneumoniae"; Диссертация на соискание ученой степени к.м.н., 2020, | |||
Авторы
Даты
2022-06-24—Публикация
2021-07-23—Подача