ВВЕДЕНИЕ
Настоящее изобретение относится к соединениям, которые ингибируют контрольную точку веретена киназ монополярного веретена 1 (Mps1 - также обозначаемых, как TTK), непосредственно или косвенно путем взаимодействия с самой киназой Mps1. В частности, настоящее изобретение относится к соединениям для применения в качестве терапевтических средств для лечения и/или предупреждения пролиферативных заболеваний, таких как рак. Настоящее изобретение также относится к способам получения этих соединений и к содержащим их фармацевтическим композициям.
УРОВЕНЬ ТЕХНИКИ
Рак вызывается неконтролируемой и нерегулируемой пролиферации клеток. Вопрос о том, что именно делает клетку злокачественной и пролиферирующей неконтролируемым и нерегулируемым образом, являлся центральным объектом интенсивных исследований в последние десятилетия. Эти исследования были направлены на механизмы контроля, такие как ответственные за регуляцию клеточного цикла противораковыми средствами. Например, опубликованная заявка на патент WO 2009/103966 (CANCER RESEARCH TECHNOLOGY LIMITED) относится к ингибированию киназной функции киназы контрольной точки 1 (CHK1) бициклиларилариламинами при лечении рака.
Основной ролью клеточного цикла является обеспечение безошибочной репликации ДНК, сегрегации хромосом и цитокинеза. Механизмы контроля, так называемые пути контрольной точки, наблюдают за прохождение через митоз на разных стадиях. Одной из наиболее изученных является контрольная точка сборки веретена деления, которая предупреждает начало анафазы при соответствующем напряжении и обеспечивает притяжение через кинетохоры (HARDWICK KG, 1998, "The spindle checkpoint", Trends Genet 14, 1-4). Большинство белков, участвующих в контрольной точке, осуществляют свои функции с помощью связывающих взаимодействий белков с участием только небольшого количества киназ (MUSACCHIO A et al, 2007, "The spindle-assembly checkpoint in space and time", Nature Reviews, Molecular and Cell Biology, 8, 379-393). Митотический комплекс контрольной точки (MCC), который содержит три белка контрольной точки (Mad2, BubR1/Mad3, Bub3) и кофактор APC/C, CDC20, концентрируется на кинетохорах и действует в качестве эффектора контрольной точки веретена. Другие капсидные белки, необходимые для усиления сигнала контрольной точки, включают Mad1 и киназы Bub1, Mps1 (также обозначаемые, как TTK) и Aurora-B (MUSACCHIO, ссылку см. выше).
Одним из первых компонентов сигнала контрольной точки сборки веретена, идентифицированным с помощью генетического скрининга почкующихся дрожжей, являлась усеченное Mps1 (монополярное веретено 1) для монополярных веретен, продуцируемое с помощью Mps1 мутантных клеток (WEISS E, 1996, "The Saccharomyces cerevisiae spindle pole body duplication gene MPS1 is part of a mitotic checkpoint", J Cell Biol 132, 111-123), однако оно все еще является одним из наименее изученных компонентов контрольной точки у высших эукариотов. Затем было показано, что ген Mps1 кодирует незаменимую обладающую двойной специфичностью киназу (LAUZE et al, 1995, "Yeast spindle pole body duplication gene MPS1 encodes essential dual specificity protein kinase", EMBO J 14, 1655-1663 и также POCH et al, 1994, "RPK1, essential yeast protein kinase involved in the regulation of the onset of mitosis, shows homology to mammalian dual-specificity kinases", Mol Gen Genet 243, 641-653), сохраняющуюся при переходе от дрожжей к людям (MILLS et al, 1992, "Expression of TTK, a novel human protein kinase, is associated with cell proliferation", J Biol Chem 267, 16000-16006). Активность Mps1 максимальна при переходе G2/M и повышается при активации контрольной точки веретена нокодазолом (STUCKE et al, 2002, "Human Mps1 kinase is required for the spindle assembly checkpoint but not for centrosome duplication", EMBO J 21, 1723-1732 и также LIU et al, 2003, "Human MPS1 kinase is required for mitotic arrest induced by the loss of CENP-E from kinetochores", Mol Biol Cell 14, 1638-1651). Идентифицировано аутофосфорилирование Mps1 по Thr676 в петле активации и оно существенно для функции Mps1 (MATTISON et al, 2007, "Mps1 activation loop autophosphorylation enhances kinase activity", J Biol Chem 282, 30553-30561).
С учетом важности Mps1 при активации контрольной точки веретена разработка ингибиторов Mps1 должна быть важной не только как инструмента для дальнейших исследований ее связанных с клеточным циклом функций, но и в качестве формы противораковой терапии. Описаны ингибиторы Mps1 первого поколения. Цинкреазин, вызывающий ошибочную сегрегацию хромосом и гибель дрожжевых клеток (DORER et al, 2005, "A small-molecule inhibitor of Mps1 blocks the spindle-checkpoint response to a lack of tension on mitotic chromosomes", Curr Biol 15, 1070-1076) и SP600125, ингибитор JNK (c-Jun аминоконцевая киназа), также нарушают функцию контрольной точки веретена JNK-независимым образом путем ингибирования Mps1 (SCHMIDT et al, 2005, "Ablation of the spindle assembly checkpoint by a compound targeting Mps1", EMBO Rep 6, 866-872). Недавно идентифицированы три малые молекулы-ингибиторы Mps1 (KWIATOWSKI et al, 2010, "Small-molecule kinase inhibitors provide insight into Mps1 cell cycle function", Nat Chem Biol 6, 359-368; HEWITT et al, 2010, "Sustained Mps1 activity is required in mitosis to recruit O-Mad2 to the Mad1-C-Mad2 core complex", J Cell Biol 190, 25-34; и SANTAGUIDA et al, 2010, "Dissecting the role of MPS1 in chromosome biorientation и the spindle checkpoint through the small molecule inhibitor reversine", J Cell Biol 190, 73-87). Химическое ингибирование Mps1 вызывает преждевременное прекращение митоза, анеуплоидию Гросса и гибель линий раковых клеток человека (KWIATOWSKI, above). Ингибиторы Mps1 AZ3146 и реверсин сильно нарушают рекрутинг Mad1, Mad2 и CENP-E в кинетохоры (HEWITT, и SANTAGUIDA, above).
Признано, что нарушение регуляции митотической контрольной точки является признаком процесса злокачественной трансформации. Нарушение функции митотической контрольной точки в опухолях делает возможной разработки терапевтической стратегии с использованием малых молекул. Это основано на предположении о том, что фармакологическое разрушение уже поврежденной митотической контрольной точки может селективно сенсибилизировать опухоли. Это наблюдение привело к гипотезе о том, что ингибирование Mps1 может быть терапевтически полезным.
Задачей настоящего изобретения является получение соединений, которые являются активными ингибиторами Mps1.
Другой задачей настоящего изобретения является получение соединений, которые обладают одной или большим количеством полезных фармацевтических характеристик, такими как, например, благоприятная активность в клетках и/или in vivo, хорошая растворимость, и/или одной или большим количеством полезных характеристик DMPK (например, благоприятный профиль метаболической стабильности, полезное ингибирование Cyp, благоприятный профиль hERG, благоприятный профиль клиренса, благоприятный объем распределения и т.п.).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Одним объектом настоящего изобретения является соединение или его фармацевтически приемлемая соль или сольват, определенное в настоящем изобретении.
Другим объектом настоящего изобретения является фармацевтическая композиция, которая включает соединение, определенное в настоящем изобретении, или его фармацевтически приемлемую соль или сольват и один или большее количество фармацевтически приемлемых инертные наполнители.
Другим объектом настоящего изобретения является соединение, определенное в настоящем изобретении, или его фармацевтически приемлемая соль или сольват, или фармацевтическая композиция, определенная в настоящем изобретении, для применения в терапии.
Другим объектом настоящего изобретения является соединение, определенное в настоящем изобретении, или его фармацевтически приемлемая соль или сольват, или фармацевтическая композиция, определенная в настоящем изобретении, для применения для лечения пролиферативного патологического состояния.
Другим объектом настоящего изобретения является соединение, определенное в настоящем изобретении, или его фармацевтически приемлемая соль или сольват, или фармацевтическая композиция, определенная в настоящем изобретении, для применения для лечения рака. В предпочтительном варианте осуществления раком является рак человека.
Другим объектом настоящего изобретения является соединение, определенное в настоящем изобретении, или его фармацевтически приемлемая соль или сольват, или фармацевтическая композиция, определенная в настоящем изобретении, для применения для оказания ингибирующего воздействия на киназу Mps1.
Другим объектом настоящего изобретения является применение соединения, определенного в настоящем изобретении, или его фармацевтически приемлемой соли или сольвата для приготовления лекарственного средства для применения для лечения пролиферативного патологического состояния.
Другим объектом настоящего изобретения является применение соединения, определенного в настоящем изобретении, или его фармацевтически приемлемой соли или сольвата для приготовления лекарственного средства для применения для лечения рака. Предпочтительно, если лекарственное средство предназначено для лечения рака человека.
Другим объектом настоящего изобретения является применение соединения, определенного в настоящем изобретении, или его фармацевтически приемлемой соли или сольвата для приготовления лекарственного средства для применения для оказания ингибирующего воздействия на киназу Mps1.
Другим объектом настоящего изобретения является способ ингибирования киназы Mps1 in vitro или in vivo, указанный способ включает взаимодействие клетки с эффективным количеством соединения, определенного в настоящем изобретении, или его фармацевтически приемлемой соли или сольвата.
Другим объектом настоящего изобретения является способ ингибирования пролиферации клеток in vitro или in vivo, указанный способ включает взаимодействие клетки с эффективным количеством соединения, определенного в настоящем изобретении, или его фармацевтически приемлемой соли или сольвата.
Другим объектом настоящего изобретения является способ лечения пролиферативного нарушения у пациента, нуждающегося в таком лечении, указанный способ включает введение указанному пациенту терапевтически эффективного количества соединения, определенного в настоящем изобретении, или его фармацевтически приемлемой соли или сольвата, или фармацевтической композиции, определенной в настоящем изобретении.
Другим объектом настоящего изобретения является способ лечения рака у пациента, нуждающегося в таком лечении, указанный способ включает введение указанному пациенту терапевтически эффективного количества соединения, определенного в настоящем изобретении, или его фармацевтически приемлемой соли или сольвата, или фармацевтической композиции, определенной в настоящем изобретении.
Настоящее изобретение также относится к способу синтеза соединения, определенного в настоящем изобретении, или его фармацевтически приемлемой соли или сольвата.
Другим объектом настоящего изобретения является соединение, определенное в настоящем изобретении, или его фармацевтически приемлемая соль или сольват, которое можно получить или получено, или непосредственно получено способом синтеза, определенным в настоящем изобретении.
Другим объектом настоящего изобретения являются новые промежуточные продукты, определенные в настоящем изобретении, которые являются подходящими для применения в любом из способов синтеза, указанных в настоящем изобретении.
Предпочтительные, подходящие и необязательные признаки любого конкретного объекта настоящего изобретения также являются предпочтительными, подходящими и необязательными признаками любого другого объекта.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Если не указано иное, то приведенные ниже термины, использующиеся в описании и формуле изобретения, обладают указанными ниже значениями.
Следует понимать, что указание на "лечение" включает профилактику, а также облегчение проявляющихся симптомов патологического состояния. Поэтому "лечение" заболевания, нарушения или патологического состояния включает: (1) предупреждение или задержку проявления клинических симптомов заболевания, нарушения или патологического состояния, развивающегося у человека, которые могут привести или предрасположить к заболеванию, нарушению или патологическому состоянию, но когда пока не предполагаются или проявляются клинические или субклинические симптомы заболевания, нарушения или патологического состояния, (2) подавление заболевания, нарушения или патологического состояния, т.е. остановку, ослабление или задержку развития заболевания или его рецидива (в случае поддерживающего лечения) или по меньшей мере одного его клинического или субклинического симптома или (3) облегчение или смягчение протекания заболевания, т.е. обеспечение регрессии заболевания, нарушения или патологического состояния, по меньшей мере одного из его клинических или субклинических симптомов.
"Терапевтически эффективное количество" означает количество соединения, которое при введении млекопитающему для лечения заболевания достаточно для проведения такого лечения заболевания. "Терапевтически эффективное количество" меняется в зависимости от соединения, заболевания и его тяжести и возраста, массы тела и т.п. подвергающегося лечению млекопитающего.
В настоящем описании термин "алкил" включают обладающие и линейной, и разветвленной цепью алкильные группы. Указания на отдельные алкильные группы, такие как "пропил", специфичны только для вариантов с линейной цепью и указания на отдельные алкильные группы с разветвленной цепью, такие как "изопропил", специфичны только для вариантов с разветвленной цепью. Например, "(C1-C6)алкил" включает (C1-C4)алкил, (C1-C3)алкил, пропил, изопропил и трет-бутил. Аналогичное правило применимо к другим радикалам, например, "фенил(C1-C6)алкил" включает фенил(C1-C4)алкил, бензил, 1-фенилэтил и 2-фенилэтил.
Термин "(Cm-Cn)" или "группа (Cm-Cn)" при использовании по отдельности или в виде приставки означает любую группу, содержащую от m до n атомов углерода.
Термин "алкилен" используется в настоящем изобретении для обозначения обладающих и линейной, и разветвленной цепью мостиковых алкиленовых групп. Например, указание на (C1-C4)алкиленовые группы включает метилен (-CH2-), этилен (-CH2-CH2-), пропилен (-CH2-CH2-CH2-) и бутилен (-CH2-CH2-CH2-CH2-), а также разветвленные группы, такие как, например, -CH(CH3)-, -C(CH3)2- или -CH2-CH(CH3)-.
Термин "(C3-C8)циклоалкил" означает углеводородное кольцо, содержащее от 3 до 8 атомов углерода, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или бицикло[2.2.2]октан, бицикло[2.1.1]гексан, бицикло[1.1.1]пентан и бицикло[2.2.1]гептил.
Термин "(C1-C8)гетероалкил" означает алкильную цепь, содержащую 1-8 атомов углерода, которая дополнительно содержит 1, 2 или 3 гетероатома, находящиеся в алкильной цепи, которые выбраны из группы, включающей N, O или S.
Термин "галоген" означает фтор, хлор, бром и йод.
Термин "фторалкил" используется в настоящем изобретении для обозначения алкильной группы, в которой один или большее количество атомов водорода заменены атомами фтора. Примеры фторалкильных групп включают -CHF2, -CH2CF3 или перфторалкильные группы, такие как -CF3 или -CF2CF3.
Термин "фторалкоксигруппа" используется в настоящем изобретении для обозначения алкоксигруппы, в которой один или большее количество атомов водорода заменены атомами фтора. Примеры фторалкоксигрупп включают -OCHF2, -OCH2CF3 или перфторалкоксигруппы, такие как -OCF3 или -OCF2CF3.
Термин "гетероциклил", "гетероциклический" или "гетероцикл" означает неароматическую насыщенную моноциклическую, конденсированную или спиросочлененную бициклическую гетероциклическую кольцевую систему (системы). Моноциклические гетероциклические кольца содержат примерно от 3 до 12 (предпочтительно от 3 до 7) кольцевых атомов и содержат в кольце от 1 до 5 (предпочтительно 1, 2 или 3) гетероатомов, выбранных из группы, включающей азот, кислород или серу. Бициклические гетероциклы содержат в кольце от 7 до 17 атомов, предпочтительно от 7 до 12 атомов. Бициклические гетероциклические кольца могут быть конденсированными, спиросочлененными или мостиковыми кольцевыми системами. Примеры гетероциклических групп включают циклические простые эфирные, такие как оксиранил, оксетанил, тетрагидрофуранил, диоксанил и замещенные циклические простые эфирные. Гетероциклы, содержащие азот, включают, например, азетидинил, пирролидинил, пиперидинил, пиперазинил, тетрагидротриазинил, тетрагидропиразолил и т.п. Типичные серусодержащие гетероциклы включают тетрагидротиенил, дигидро-1,3-дитиол, тетрагидро-2H-тиопиран, и гексагидротиепин. Другие гетероциклы включают дигидрооксатиолил, тетрагидрооксазолил, тетрагидрооксадиазолил, тетрагидродиоксазолил, тетрагидрооксатиазолил, гексагидротриазинил, тетрагидрооксазинил, морфолинил, тиоморфолинил, тетрагидропиримидинил, диоксолинил, октагидробензофуранил, октагидробензимидазолил, и октагидробензотиазолил. В число гетероциклов, содержащих серу, также включены окисленные серусодержащие гетероциклы, содержащие группы SO или SO2. Примеры включают сульфоксидные и сульфоновые формы тетрагидротиенила и тиоморфолинила, такие как тетрагидротиен-1,1-диоксид и тиоморфолинил 1,1-диоксид. Подходящими гетероциклильными группами, которые содержат 1 или 2 оксогруппу (=O) или тиооксогруппу (=S) в качестве заместителей, являются, например, 2-оксопирролидинил, 2-тиоксопирролидинил, 2-оксоимидазолидинил, 2-тиоксоимидазолидинил, 2-оксопиперидинил, 2,5-диоксопирролидинил, 2,5-диоксоимидазолидинил или 2,6-диоксопиперидинил. Предпочтительными гетероциклильными группами являются насыщенные моноциклические 3- - 7-членные гетероциклилы, содержащие 1, 2 или 3 гетероатома, выбранных из группы, включающей азот, кислород или серу, например, азетидинил, тетрагидрофуранил, тетрагидропиранил, пирролидинил, морфолинил, тетрагидротиенил, тетрагидротиенил 1,1-диоксид, тиоморфолинил, тиоморфолинил 1,1-диоксид, пиперидинил, гомопиперидинил, пиперазинил или гомопиперазинил. Как должен понимать специалист в данной области техники, любой гетероцикл может быть связан с другой группой через любой подходящий атом, например, через атом углерода или атом азота. Однако в настоящем изобретении указание на пиперидиновую группу или морфолиновую группу означает пиперидин-1-ильное или морфолин-4-ильное кольцо, которое присоединени через кольцевой атом азота.
"Мостиковые кольцевые системы" означают кольцевые системы, в которых два кольца обладают более, чем двумя общими атомами, см., например, Advanced Organic Chemistry, by Jerry March, 4th Edition, Wiley Interscience, pages 131-133, 1992. Примеры мостиковых гетероциклильных кольцевых систем включают азабицикло[2.2.1]гептан, 2-окса-5-азабицикло[2.2.1]гептан, азабицикло[2.2.2]октан, азабицикло[3.2.1]октан и хинуклидин.
"Спиросочлененные бициклические кольцевые системы" являются такими, в которых две кольцевые системы обладают одним общим спирановым атомом углерода, т.е. гетероциклическое кольцо связано с другим карбоциклическим или гетероциклическим кольцом через один общий спирановый атом углерода. Примеры спиросочлененных кольцевых систем включают 6-азаспиро[3.4]октан, 2-окса-6-азаспиро[3.4]октан, 2-азаспиро[3.3]гептаны, 2-окса-6-азаспиро[3.3]гептаны, 7-окса-2-азаспиро[3.5]нонан, 6-окса-2-азаспиро[3.4]октан, 2-окса-7-азаспиро[3.5]нонан и 2-окса-6-азаспиро[3.5]нонан.
"Гетероциклил(Cm-Cn)алкил" означает гетероциклильную группу, ковалентно присоединенную к (Cm-Cn)алкиленовой группе, которые обе определены в настоящем изобретении.
Термин "гетероарил" или "гетероароматический" означает ароматическое моно-, би- или полициклическое кольцо, содержащее один или большее количество (например, 1-4, предпочтительно 1, 2 или 3) гетероатомов, выбранных из группы, включающей азот, кислород или серу. Примерами гетероарильных групп являются моноциклические и бициклические группы, содержащие от 5 до 12 элементов кольца и чаще от 5 до 10 элементов кольца. Гетероарильной группой может быть, например, 5- или 6-членное моноциклическое кольцо или 9- или 10-членное бициклическое кольцо, например, бициклическая структура, образованная из конденсированных 5- и 6-членных колец или двух конденсированных 6-членных колец. Каждое кольцо может содержать примерно до 4 гетероатомов, обычно выбранных из группы, включающей азот, серу и кислород. Обычно гетероарильное кольцо содержит до 3 гетероатомов, чаще до 2, например, 1 гетероатом. В одном варианте осуществления гетероарильное кольцо содержит по меньшей мере один кольцевой атом азота. Атомы азота в гетероарильных кольцах могут быть основными, как в случае имидазола или пиридина, или в основном не основными, как в случае индола или пиррола. Обычно количество основных атомов азота, содержащихся в гетероарильной группе, включая любую аминогруппу, являющуюся заместителем в цикле, равно менее 5.
Примеры гетероарила включают фурил, пирролил, тиенил, оксазолил, изоксазолил, имидазолил, пиразолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиридил, пиридазинил, пиримидинил, пиразинил, 1,3,5-триазенил, бензофуранил, индолил, изоиндолил, бензотиенил, бензоксазолил, бензимидазолил, бензотиазолил, бензотиазолил, индазолил, пуринил, бензофуразанил, хинолил, изохинолил, хиназолинил, хиноксалинил, циннолинил, птеридинил, нафтиридинил, карбазолил, феназинил, бензизохинолинил, пиридопиразинил, тиено[2,3-b]фуранил, 2H-фуро[3,2-b]-пиранил, 5H-пиридо[2,3-d]-o-оксазинил, 1H-пиразоло[4,3-d]-оксазолил, 4H-имидазо[4,5-d]тиазолил, пиразино[2,3-d]пиридазинил, имидазо[2,1-b]тиазолил, имидазо[1,2-b][1,2,4]триазинил. "Гетероарил" также включает частично ароматические би- или полициклические кольцевые системы, в которых по меньшей мере одно кольцо является ароматическим кольцом и одно или большее количество других колец является неароматическим, насыщенным или частично насыщенным кольцом при условии, что по меньшей мере одно кольцо содержит один или большее количество гетероатомов, выбранных из группы, включающей азот, кислород или серу. Примеры частично ароматических гетероарильных групп включают например, тетрагидроизохинолинил, тетрагидрохинолинил, 2-оксо-1,2,3,4-тетрагидрохинолинил, дигидробензтиенил, дигидробензофуранил, 2,3-дигидробензо[1,4]диоксинил, бензо[1,3]диоксолил, 2,2-диоксо-1,3-дигидро-2-бензотиенил, 4,5,6,7-тетрагидробензофуранил, индолинил, 1,2,3,4-тетрагидро-1,8-нафтиридинил, 1,2,3,4-тетрагидропиридо[2,3-b]пиразинил и 3,4-дигидро-2H-пиридо[3,2-b][1,4]оксазинил.
Примеры 5-членных гетероарильных групп включают, но не ограничиваются только ими, пирролильную, фуранильную, тиенильную, имидазолильную, фуразанильную, оксазолильную, оксадиазолильную, оксатриазолильную, изоксазолильную, тиазолильную, изотиазолильную, пиразолильную, триазолильную и тетразолильную группы.
Примеры 6-членных гетероарильных групп включают, но не ограничиваются только ими, пиридил, пиразинил, пиридазинил, пиримидинил и триазинил.
Бициклическая гетероарильная группа может представлять собой, например, группу, выбранную из группы, включающей:
a) бензольное кольцо, сконденсированное с 5- или 6-членным кольцом, содержащим 1, 2 или 3 кольцевых гетероатома;
b) пиридиновое кольцо, сконденсированное с 5- или 6-членным кольцом, содержащим 1, 2 или 3 кольцевых гетероатома;
c) пиримидиновое кольцо, сконденсированное с 5- или 6-членным кольцом, содержащим 1 или 2 кольцевых гетероатома;
d) пиррольное кольцо, сконденсированное с 5- или 6-членным кольцом, содержащим 1, 2 или 3 кольцевых гетероатома;
e) пиразольное кольцо, сконденсированное с 5- или 6-членным кольцом, содержащим 1 или 2 кольцевых гетероатома;
f) пиразиновое кольцо, сконденсированное с 5- или 6-членным кольцом, содержащим 1 или 2 кольцевых гетероатома;
g) имидазольное кольцо, сконденсированное с 5- или 6-членным кольцом, содержащим 1 или 2 кольцевых гетероатома;
h) оксазольное кольцо, сконденсированное с 5- или 6-членным кольцом, содержащим 1 или 2 кольцевых гетероатома;
i) изоксазольное кольцо, сконденсированное с 5- или 6-членным кольцом, содержащим 1 или 2 кольцевых гетероатома;
j) тиазольное кольцо, сконденсированное с 5- или 6-членным кольцом, содержащим 1 или 2 кольцевых гетероатома;
k) изотиазольное кольцо, сконденсированное с 5- или 6-членным кольцом, содержащим 1 или 2 кольцевых гетероатома;
l) тиофеновое кольцо, сконденсированное с 5- или 6-членным кольцом, содержащим 1, 2 или 3 кольцевых гетероатома;
m) фурановое кольцо, сконденсированное с 5- или 6-членным кольцом, содержащим 1, 2 или 3 кольцевых гетероатома;
n) циклогексильное кольцо, сконденсированное с 5- или 6-членным гетероароматическим кольцом, содержащим 1, 2 или 3 кольцевых гетероатома; и
o) циклопентильное кольцо, сконденсированное с 5- или 6-членным гетероароматическим кольцом, содержащим 1, 2 или 3 кольцевых гетероатома.
Конкретные примеры бициклических гетероарильных групп, содержащих 6-членное кольцо, сконденсированное с 5-членным кольцом, включают, но не ограничиваются только ими, бензофуранильную, бензотиофенильную, бензимидазолильную, бензоксазолильную, бензизоксазолильную, бензотиазолильную, бензизотиазолильную, изобензофуранильную, индолильную, изоиндолильную, индолизинильную, индолинильную, изоиндолинильную, пуринильную (например, аденинильную, гуанинильную), индазолильную, бензодиоксолильную, пирролопиридиновую и пиразолопиридинильную группы.
Конкретные примеры бициклических гетероарильных групп, содержащих два сконденсированных 6-членных кольца включают, но не ограничиваются только ими, хинолинильную, изохинолинильную, хроманильную, тиохроманильную, хроменильную, изохроменильную, хроманильную, изохроманильную, бензодиоксанильную, хинолизинильную, бензоксазинильную, бензодиазинильную, пиридопиридинильную, хиноксалинильную, хиназолинильную, циннолинильную, фталазинильную, нафтиридинильную и птеридинильную группы.
"Гетероарил(Cm-Cn)алкил" означает гетероарильную группу, ковалентно присоединенную к (Cm-Cn)алкиленовой группе, которые обе определены в настоящем изобретении. Примеры гетероарилалкильных групп включают пиридин-3-илметил, 3-(бензофуран-2-ил)пропил и т.п.
Термин "арил" означает циклическое или полициклическое ароматическое кольцо, содержащее от 5 to 12 атомов углерода. Термин арил включает и одновалентные, и двухвалентные системы. Примеры арильных групп включают, но не ограничиваются только ими, фенил, бифенил, нафтил и т.п. В предпочтительном варианте осуществления арилом является фенил.
Термин "арил(Cm-Cn)алкил" означает арильную группу, ковалентно присоединенную к (Cm-Cn)алкиленовой группе, которые обе определены в настоящем изобретении. Примеры арил-(Cm-Cn)алкильных групп включают бензил, фенилэтил и т.п.
В настоящем описании также используются некоторые объединенные термины для описания групп, содержащих более одной функциональной группы. Такие термины должны быть понятны специалисту в данной области техники. Например, гетероциклил(Cm-Cn)алкил представляет собой (Cm-Cn)алкил, замещенный гетероциклилом.
Термин "необязательно замещенный" означает группы, структуры или молекулы, которые замещены, и те, которые не замещены.
Если необязательные заместители выбраны из "одной или большего количества" групп, следует понимать, что это определение включает все заместители, выбранные в виде одной из указанных групп, или заместители, выбранные из числа двух или большего количества указанных групп.
Выражение "соединение, предлагаемое в настоящем изобретении" означает такие соединения, которые раскрыты в настоящем изобретении, как типовые и конкретные.
Соединения, предлагаемые в настоящем изобретении
Одним объектом настоящего изобретения является соединение формулы I, приведенной ниже:
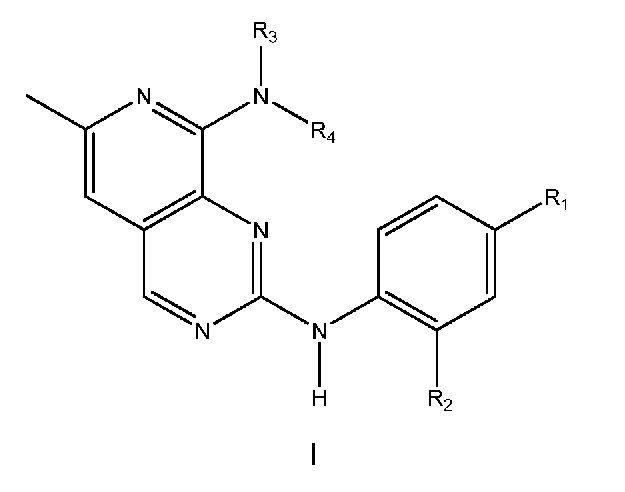
в которой:
R1 выбран из группы, включающей:
(i) 5- или 6-членный гетероарил, необязательно содержащий один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRaRb, ORa, C(O)Ra, C(O)ORa, OC(O)Ra, N(Rb)ORa, C(O)N(Rb)Ra, N(Rb)C(O)Ra, S(O)pRa (где p равно 0, 1 или 2), SO2N(Rb)Ra или N(Rb)SO2Ra,
где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C4)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, 4- - 7-членный гетероциклил, NRcRd, ORc, C(O)Rc, C(O)ORc, OC(O)Rc, N(Rd)ORc, C(O)N(Rd)Rc, N(Rd)C(O)Rc, S(O)qRc (где q равно 0, 1 или 2), SO2N(Rd)Rc или N(Rd)SO2Rc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C4)алкил; или
где 5- или 6-членный гетероарил необязательно сконденсирован с 4-, 5-, 6- или 7-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRkRl, ORk, C(O)Rk, C(O)ORk, OC(O)Rk, N(Rl)ORk, C(O)N(Rl)Rk, N(Rl)C(O)Rk, S(O)pRk (где p равно 0, 1 или 2), SO2N(Rk)Rl или N(Rk)SO2Rl, где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C4)алкил,
и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, 4- - 7-членный гетероциклил, NRmRn, ORm, C(O)Rm, C(O)ORm, OC(O)Rm, N(Rn)ORm, C(O)N(Rn)Rm, N(Rn)C(O)Rm, S(O)qRm (где q равно 0, 1 или 2), SO2N(Rn)Rm или N(Rn)SO2Rm, где Rm и Rn все независимо выбраны из группы, включающей H или (C1-C4)алкил; или
(ii) группу -C(O)N(Rf)Re- или -S(O)2N(Rf)Re-;
где Re и Rf все независимо выбраны из группы, включающей H или (C1-C4)алкил, который необязательно замещен галогеном или (C1-C2)алкоксигруппой;
или Re и Rf связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют 4-, 5- или 6-членное гетероциклическое кольцо, где указанное кольцо необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRgRh, ORg, C(O)Rg, C(O)ORg, OC(O)Rg, N(Rh)ORg, C(O)N(Rh)Rg, N(Rh)C(O)Rg, S(O)pRh (где p равно 0, 1 или 2), SO2N(Rh)Rg или N(Rh)SO2Rg, где Rg и Rh все независимо выбраны из группы, включающей H или (C1-C4)алкил;
R2 выбран из группы, включающей водород, фтор, хлор, (C1-C3)алкоксигруппу или (C1-C3)фторалкоксигруппу;
и или:
(i) R3 выбран из группы, включающей водород или (C1-C3)алкил, и R4 выбран из группы, включающей (C1-C6)алкил, (C3-C9)циклоалкил, (C3-C9)циклоалкил-(C1-C4)алкил, арил, арил-(C1-C4)алкил, гетероциклил, гетероциклил-(C1-C4)алкил, гетероарил, гетероарил-(C1-C4)алкил, и где R4 необязательно дополнительно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу, фтор, хлор, цианогруппу, CF3, CHF2, OCF3, OCHF2, (C1-C4)алкил, NRoRp, ORo, C(O)Ro, C(O)ORp, OC(O)Ro, N(Rp)ORo, C(O)N(Rp)Ro, N(Rp)C(O)Ro, S(O)pRo (где p равно 0, 1 или 2), SO2N(Rp)Ro или N(Rp)SO2Ro или (C3-C6)циклоалкил, (C3-C6)циклоалкил-(C1-C2)алкил, 4-, 5- или 6-членный гетероциклил, 4-, 5- или 6-членный гетероциклил-(C1-C2)алкил, где Ro и Rp все независимо выбраны из группы, включающей H или (C1-C4)алкил, (C3-C6)циклоалкил или (C3-C6)циклоалкил-(C1-C4)алкил; или
(ii) R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют связанное атомом азота 4-, 5- 6- или 7-членное гетероциклическое кольцо,
где указанное кольцо необязательно сконденсировано с дополнительным 3-, 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом, 5- или 6-членным гетероарильным кольцом или фенильным кольцом с образованием бициклической гетероциклической системы, или
связано через спирановый атом углерода с дополнительным 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием спиробициклической кольцевой системы;
и где гетероциклическое кольцо, бициклическая кольцевая система или спиробициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRiRj, ORi, C(O)Ri, C(O)ORi, OC(O)Ri, N(Rj)ORi, C(O)N(Rj)Ri, N(Rj)C(O)Ri, S(O)qRi (где q равно 0, 1 или 2), SO2N(Rj)Ri или N(Rj)SO2Ri, где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C4)алкил;
или его фармацевтически приемлемая соль или сольват.
В одном варианте осуществления соединением является соединение формулы I, определенное в настоящем изобретении, при условии, что указанным соединением не является одно из следующих:
N2-(2-метокси-4-(1-метил-1H-пиразол-4-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-N8-(2-метокси-2-метилпропил)-6-метилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N8-(2-метокси-2-метилпропил)-N2-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-метокси-4-(1-(2-метоксиэтил)-2-метил-1H-имидазол-5-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-метокси-4-(4-(метилсульфонил)пиперазин-1-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(4-(1,3-диметил-1H-пиразол-4-ил)-2-метоксифенил)-N8-(2-метокси-2-метилпропил)-6-метилпиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(6-окса-2-азаспиро[3.4]октан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N8-(2-метокси-2-метилпропил)-N2-(2-метокси-4-(1-метил-1H-1,2,4-триазол-5-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-(дифторметокси)-4-(1-метил-1H-пиразол-4-ил)фенил)-N8-(2-метокси-2-метилпропил)-6-метилпиридо[3,4-d]пиримидин-2,8-диамин;
(4-(3-метокси-4-((8-((2-метокси-2-метилпропил)амино)-6-метилпиридо[3,4-d]пиримидин-2-ил)амино)фенил)-1-метил-1H-пиразол-5-ил)метанол.
Конкретные соединения, предлагаемые в настоящем изобретении, включают, например, соединения формулы I, или их фармацевтически приемлемые соли или сольваты, где, если не указано иное, каждый из R1, R2, R3, R4 или Ra-o обладает любым из значений, определенных выше в настоящем изобретении, или в любом из параграфов (1)-(58) ниже в настоящем изобретении:
(1) R1 выбран из группы, включающей:
(i) 5- или 6-членный гетероарил, необязательно содержащий один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRaRb, ORa, C(O)Ra, C(O)ORa, OC(O)Ra, N(Rb)ORa, C(O)N(Rb)Ra, N(Rb)C(O)Ra, S(O)pRa (где p равно 0, 1 или 2), SO2N(Rb)Ra или N(Rb)SO2Ra,
где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, (C1-C2)алкил, 4- - 7-членный гетероциклил, NRcRd, ORc, C(O)Rc, C(O)ORc, OC(O)Rc, N(Rd)ORc, C(O)N(Rd)Rc, N(Rd)C(O)Rc, S(O)qRc (где q равно 0, 1 или 2), SO2N(Rd)Rc или N(Rd)SO2Rc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C2)алкил; или
где 5- или 6-членный гетероарил необязательно сконденсирован с 4-, 5-, 6- или 7-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRkRl, ORk, C(O)Rk, C(O)ORk, OC(O)Rk, N(Rl)ORk, C(O)N(Rl)Rk, N(Rl)C(O)Rk, S(O)pRk (где p равно 0, 1 или 2), SO2N(Rk)Rl или N(Rk)SO2Rl, где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C2)алкил,
и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRmRn, ORm, C(O)Rm, C(O)ORm, OC(O)Rm, N(Rn)ORm, C(O)N(Rn)Rm, N(Rn)C(O)Rm, S(O)qRm (где q равно 0, 1 или 2), SO2N(Rn)Rm или N(Rn)SO2Rm, где Rm и Rn все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(ii) группу -C(O)N(Rf)Re- или -S(O)2N(Rf)Re-;
где Re и Rf все независимо выбраны из группы, включающей H или (C1-C4)алкил, который необязательно замещен галогеном или (C1-C2)алкоксигруппой;
или Re и Rf связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют 4-, 5- или 6-членное гетероциклическое кольцо, где указанное кольцо необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRgRh, ORg, C(O)Rg, C(O)ORg, OC(O)Rg, N(Rh)ORg, C(O)N(Rh)Rg, N(Rh)C(O)Rg, S(O)pRh (где p равно 0, 1 или 2), SO2N(Rh)Rg или N(Rh)SO2Rg, где Rg и Rh все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(2) R1 выбран из группы, включающей:
(i) 5- или 6-членный гетероарил, необязательно содержащий один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRaRb, ORa, C(O)Ra, C(O)ORa, OC(O)Ra, N(Rb)ORa, C(O)N(Rb)Ra, N(Rb)C(O)Ra, S(O)pRa (где p равно 0, 1 или 2), SO2N(Rb)Ra или N(Rb)SO2Ra,
где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил;
и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, цианогруппу, NRcRd, ORc, или S(O)qRc (где q равно 0, 1 или 2), где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C2)алкил;
или
где 5- или 6-членный гетероарил необязательно сконденсирован с 4-, 5-, 6- или 7-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRkRl, ORk, C(O)Rk, C(O)ORk, OC(O)Rk, N(Rl)ORk, C(O)N(Rl)Rk, N(Rl)C(O)Rk, S(O)pRk (где p равно 0, 1 или 2), SO2N(Rk)Rl или N(Rk)SO2Rl, где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(ii) группу -C(O)N(Rf)Re- или -S(O)2N(Rf)Re-;
где Re и Rf все независимо выбраны из группы, включающей H или (C1-C4)алкил, который необязательно замещен галогеном или (C1-C2)алкоксигруппой;
или Re и Rf связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют 4-, 5- или 6-членное гетероциклическое кольцо, где указанное кольцо необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRgRh, ORg, C(O)Rg, C(O)ORg, OC(O)Rg, N(Rh)ORg, C(O)N(Rh)Rg, N(Rh)C(O)Rg, S(O)pRh (где p равно 0, 1 или 2), SO2N(Rh)Rg или N(Rh)SO2Rg, где Rg и Rh все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(3) R1 выбран из группы, включающей:
(i) 5- или 6-членный гетероарил, необязательно содержащий один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRaRb, ORa, C(O)Ra, или S(O)pRa (где p равно 0, 1 или 2), где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей ORc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C2)алкил; или
где 5- или 6-членный гетероарил необязательно сконденсирован с 4-, 5-, 6- или 7-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRkRl, ORk, C(O)Rk, или S(O)pRk (где p равно 0, 1 или 2), где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(ii) группу -C(O)N(Rf)Re- или -S(O)2N(Rf)Re-;
где Re и Rf все независимо выбраны из группы, включающей H или (C1-C2)алкил;
или Re и Rf связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют 4-, 5- или 6-членное гетероциклическое кольцо, где указанное кольцо необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRgRh, ORg, C(O)Rg, или S(O)pRh (где p равно 0, 1 или 2), где Rg и Rh все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(4) R1 выбран из группы, включающей:
(i) 5- или 6-членный гетероарил, необязательно содержащий один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, (C1-C2)алкил, NRaRb или ORa, где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей ORc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C2)алкил; или
где 5- или 6-членный гетероарил необязательно сконденсирован с 4-, 5-, или 6-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, (C1-C2)алкил, NRkRl или ORk, где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(ii) группу -C(O)N(Rf)Re- или -S(O)2N(Rf)Re-;
где Re и Rf все независимо выбраны из группы, включающей H или (C1-C2)алкил;
или Re и Rf связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют 4-, 5- или 6-членное гетероциклическое кольцо, где указанное кольцо необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRgRh или ORg, где Rg и Rh все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(5) R1 выбран из группы, включающей:
(i) 5- или 6-членный гетероарил, содержащий 1, 2, 3 или 4 атома азота или 1 или 2 атома азота и один атом кислорода, указанный гетероарил необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, (C1-C2)алкил, NRaRb или ORa, где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей ORc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C2)алкил; или
где 5- или 6-членный гетероарил необязательно сконденсирован с 4-, 5-, или 6-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, (C1-C2)алкил, NRkRl или ORk, где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(ii) группу -C(O)N(Rf)Re- или -S(O)2N(Rf)Re-;
где Re и Rf все независимо выбраны из группы, включающей H или (C1-C2)алкил;
или Re и Rf связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют 4-, 5- или 6-членное гетероциклическое кольцо, содержащее 1 или 2 дополнительных гетероатома, выбранных из группы, включающей N, O или S, где указанное кольцо необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRgRh или ORg, где Rg и Rh все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(6) R1 выбран из группы, включающей:
(i) 5-членный гетероарил, необязательно содержащий один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, (C1-C2)алкил, NRaRb или ORa, где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей ORc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C2)алкил; или
где 5-членный гетероарил необязательно сконденсирован с 4-, 5-, или 6-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, (C1-C2)алкил, NRkRl или ORk, где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(ii) группу -C(O)N(Rf)Re- или -S(O)2N(Rf)Re-;
где Re и Rf все независимо выбраны из группы, включающей H или (C1-C2)алкил;
или Re и Rf связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют 4-, 5- или 6-членное гетероциклическое кольцо, где указанное кольцо необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRgRh или ORg, где Rg и Rh все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(7) R1 выбран из группы, включающей:
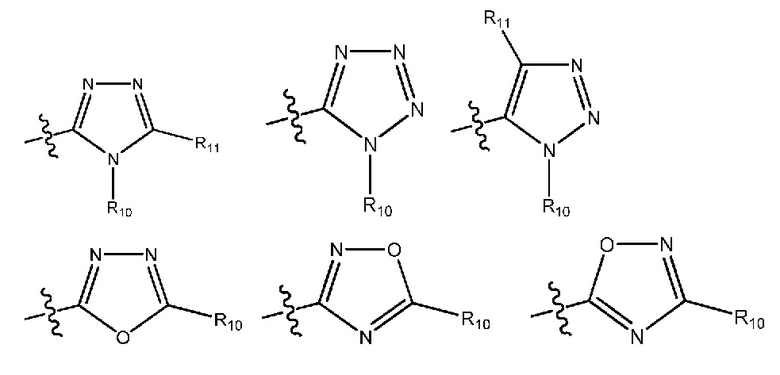
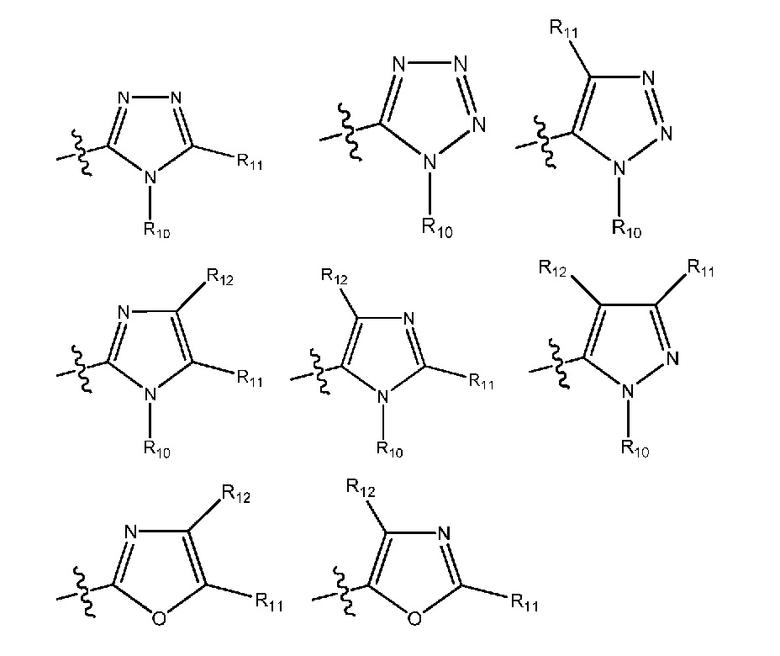
(i) гетероарил формулы:
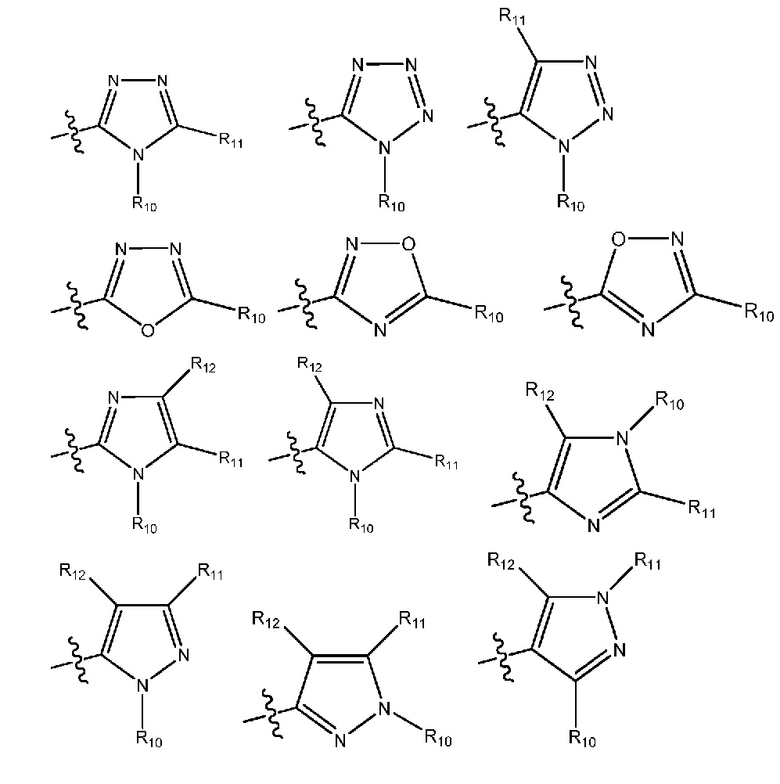
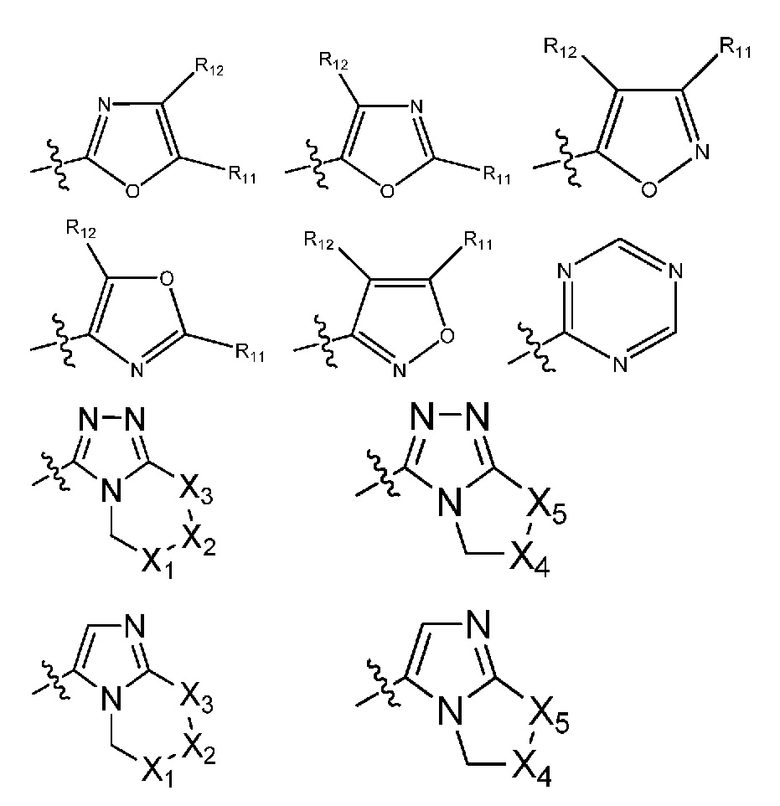
где R10, R11 и R12 все независимо выбраны из группы, включающей водород галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRaRb, ORa, где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, цианогруппу, NRcRd, ORc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C2)алкил;
и один из X1, X2 и X3 означает O или NR13, где R13 означает водород или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, гидроксигруппу и (C1-C2)алкоксигруппу;
и один из X4 и X5 означает O или NR14, где R14 означает водород или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, гидроксигруппу и (C1-C2)алкоксигруппу; или
(ii) группу -C(O)N(Rf)Re- или -S(O)2N(Rf)Re-;
где Re и Rf все независимо выбраны из группы, включающей H или (C1-C2)алкил;
или Re и Rf связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют 4-, 5- или 6-членное гетероциклическое кольцо, где указанное кольцо необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRgRh или ORg, где Rg и Rh все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(8) R1 выбран из группы, включающей:
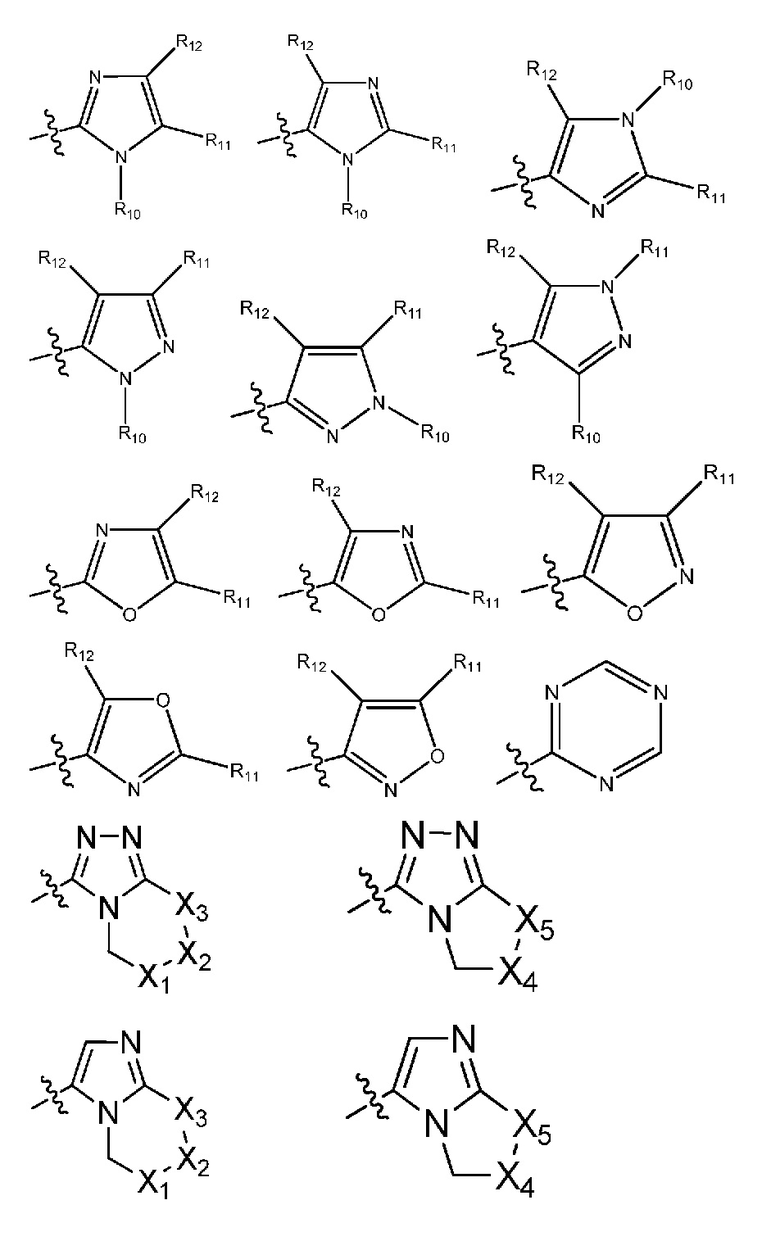
(i) гетероарил формулы:

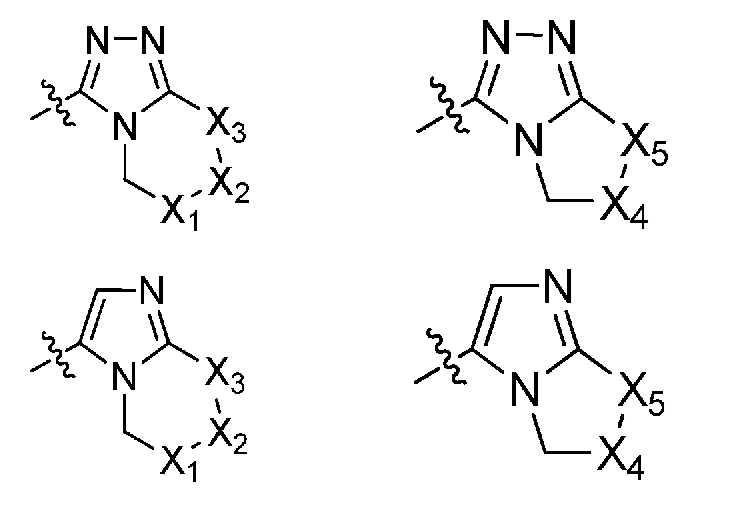
где R10, R11 и R12 все независимо выбраны из группы, включающей водород, цианогруппу или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу и (C1-C2)алкоксигруппу;
и один из X1, X2 и X3 означает O или NR13, где R13 означает водород или (C1-C2)алкильную группу;
и один из X4 и X5 означает O или NR14, где R14 означает водород или (C1-C2)алкильную группу; или
(ii) группу -C(O)N(Rf)Re- или -S(O)2N(Rf)Re-;
где Re и Rf все независимо выбраны из группы, включающей H или (C1-C2)алкил;
или Re и Rf связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют 4-, 5- или 6-членное гетероциклическое кольцо, где указанное кольцо необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRgRh или ORg, где Rg и Rh все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(9) R1 выбран из группы, включающей:
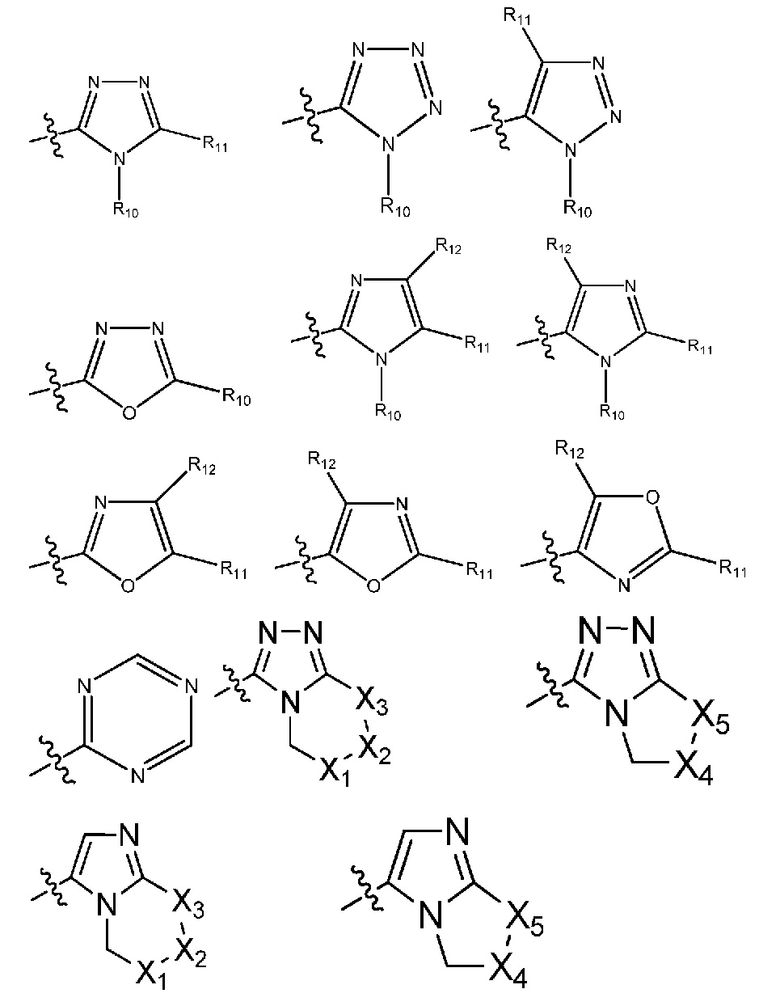
(i) гетероарил формулы:
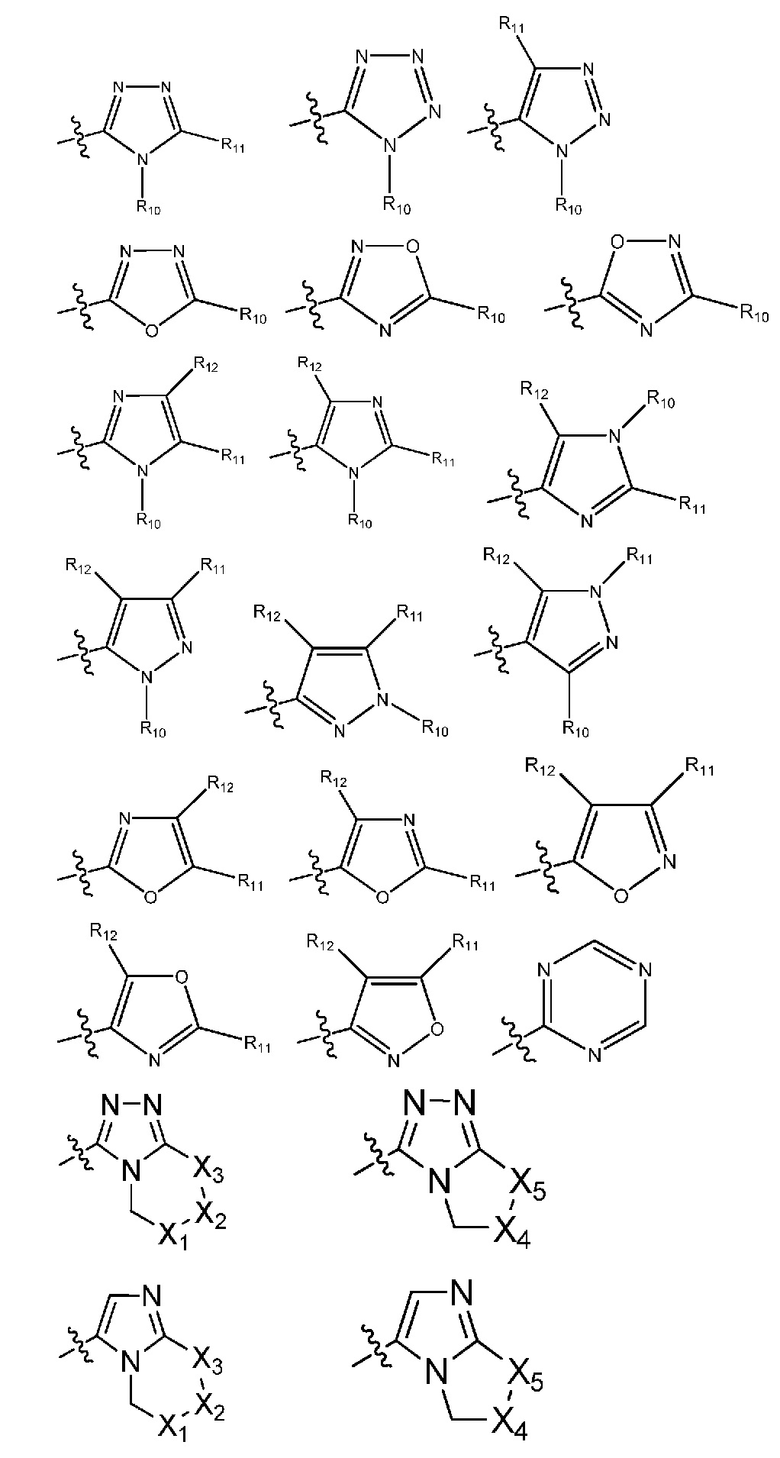
где R10, R11 и R12 все независимо выбраны из группы, включающей водород, цианогруппу или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу и (C1-C2)алкоксигруппу;
и один из X1, X2 и X3 означает O или NR13, где R13 означает водород или (C1-C2)алкильную группу;
и один из X4 и X5 означает O или NR14, где R14 означает водород или (C1-C2)алкильную группу; или
(ii) группу -C(O)N(Rf)Re- или -S(O)2N(Rf)Re-;
где Re и Rf все независимо выбраны из группы, включающей H или (C1-C2)алкил;
или Re и Rf связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют 4-, 5- или 6-членное гетероциклическое кольцо, где указанное кольцо необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRgRh или ORg, где Rg и Rh все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(10) R1 выбран из группы, включающей:
(i) 5-членный гетероарил формулы:


где R10, R11 и R12 все независимо выбраны из группы, включающей водород или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу и (C1-C2)алкоксигруппу; или
(ii) группу -C(O)N(Rf)Re- или -S(O)2N(Rf)Re-;
где Re и Rf все независимо выбраны из группы, включающей H или (C1-C2)алкил;
или Re и Rf связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют 4-, 5- или 6-членное гетероциклическое кольцо, где указанное кольцо необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRgRh или ORg, где Rg и Rh все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(11) R1 выбран из группы, включающей:
(i) 5-членный гетероарил формулы:
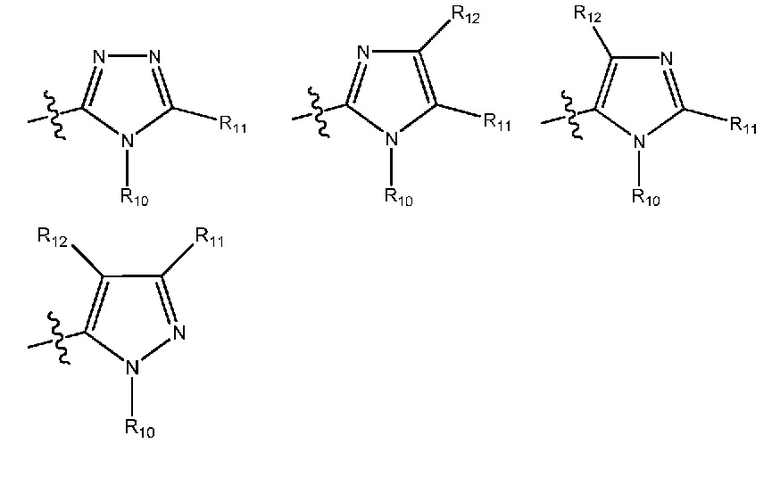
где R10, R11 и R12 все независимо выбраны из группы, включающей водород или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу и (C1-C2)алкоксигруппу; или
(ii) группу -C(O)N(Rf)Re- или -S(O)2N(Rf)Re-;
где Re и Rf все независимо выбраны из группы, включающей H или (C1-C2)алкил, или Re и Rf связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют 4-, 5- или 6-членное гетероциклическое кольцо;
(12) R1 означает 5- или 6-членный гетероарил, необязательно содержащий один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRaRb, ORa, C(O)Ra, C(O)ORa, OC(O)Ra, N(Rb)ORa, C(O)N(Rb)Ra, N(Rb)C(O)Ra, S(O)pRa (где p равно 0, 1 или 2), SO2N(Rb)Ra или N(Rb)SO2Ra,
где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, (C1-C2)алкил, 4- - 7-членный гетероциклил, NRcRd, ORc, C(O)Rc, C(O)ORc, OC(O)Rc, N(Rd)ORc, C(O)N(Rd)Rc, N(Rd)C(O)Rc, S(O)qRc (где q равно 0, 1 или 2), SO2N(Rd)Rc или N(Rd)SO2Rc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C2)алкил;
или где 5- или 6-членный гетероарил необязательно сконденсирован с 4-, 5-, 6- или 7-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRkRl, ORk, C(O)Rk, C(O)ORk, OC(O)Rk, N(Rl)ORk, C(O)N(Rl)Rk, N(Rl)C(O)Rk, S(O)pRk (где p равно 0, 1 или 2), SO2N(Rk)Rl или N(Rk)SO2Rl; где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C2)алкил;
и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRmRn, ORm, C(O)Rm, C(O)ORm, OC(O)Rm, N(Rn)ORm, C(O)N(Rn)Rm, N(Rn)C(O)Rm, S(O)qRm (где q равно 0, 1 или 2), SO2N(Rn)Rm или N(Rn)SO2Rm, где Rm и Rn все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(13) R1 означает 5- или 6-членный гетероарил, необязательно содержащий один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRaRb, ORa, C(O)Ra, C(O)ORa, OC(O)Ra, N(Rb)ORa, C(O)N(Rb)Ra, N(Rb)C(O)Ra, S(O)pRa (где p равно 0, 1 или 2), SO2N(Rb)Ra или N(Rb)SO2Ra,
где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил;
и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, цианогруппу, NRcRd, ORc, или S(O)qRc (где q равно 0, 1 или 2), где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C2)алкил; или
где 5- или 6-членный гетероарил необязательно сконденсирован с 4-, 5-, 6- или 7-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRkRl, ORk, C(O)Rk, C(O)ORk, OC(O)Rk, N(Rl)ORk, C(O)N(Rl)Rk, N(Rl)C(O)Rk, S(O)pRk (где p равно 0, 1 или 2), SO2N(Rk)Rl или N(Rk)SO2Rl; где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(14) R1 означает 5- или 6-членный гетероарил, необязательно содержащий один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRaRb, ORa, C(O)Ra, или S(O)pRa (где p равно 0, 1 или 2), где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей ORc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C2)алкил; или
где 5- или 6-членный гетероарил необязательно сконденсирован с 4-, 5-, 6- или 7-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRkRl, ORk, C(O)Rk, или S(O)pRk (где p равно 0, 1 или 2), где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(15) R1 означает 5- или 6-членный гетероарил, необязательно содержащий один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, (C1-C2)алкил, NRaRb или ORa, где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей ORc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C2)алкил; или
где 5- или 6-членный гетероарил необязательно сконденсирован с 4-, 5-, или 6-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, (C1-C2)алкил, NRkRl или ORk, где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(16) R1 означает 5- или 6-членный гетероарил, содержащий 1, 2, 3 или 4 атома азота или 1 или 2 атома азота и один атом кислорода, указанный гетероарил необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, (C1-C2)алкил, NRaRb или ORa, где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей ORc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C2)алкил; или
где 5- или 6-членный гетероарил необязательно сконденсирован с 4-, 5-, или 6-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, (C1-C2)алкил, NRkRl или ORk, где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(17) R1 означает 5-членный гетероарил, необязательно содержащий один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, (C1-C2)алкил, NRaRb или ORa, где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей ORc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C2)алкил; или
где 5-членный гетероарил необязательно сконденсирован с 4-, 5-, или 6-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, (C1-C2)алкил, NRkRl или ORk, где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(18) R1 означает гетероарил формулы:
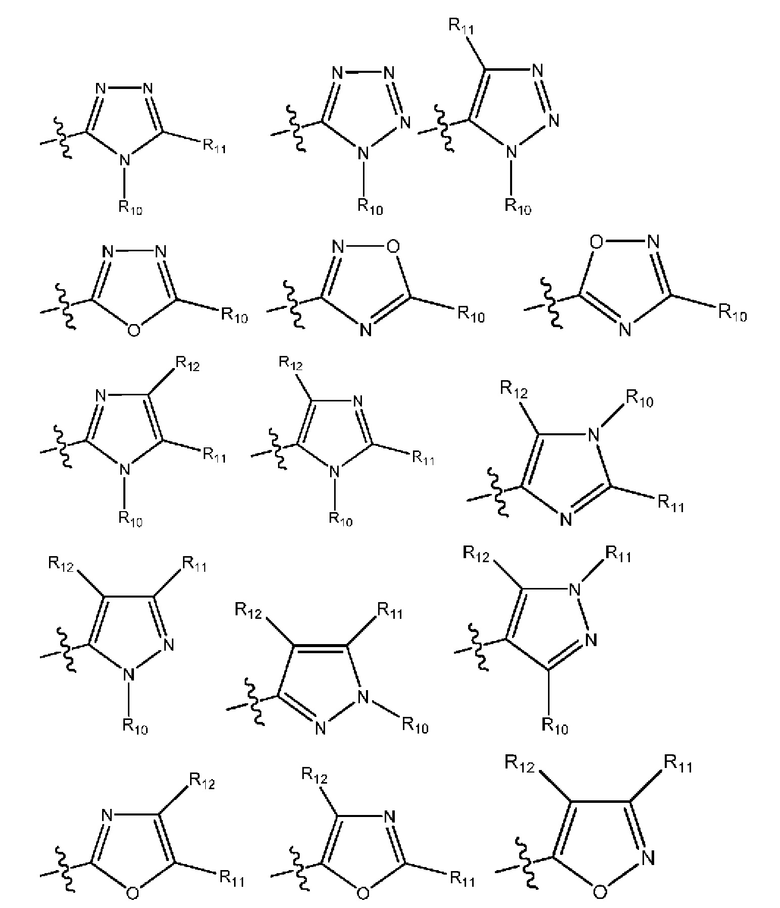
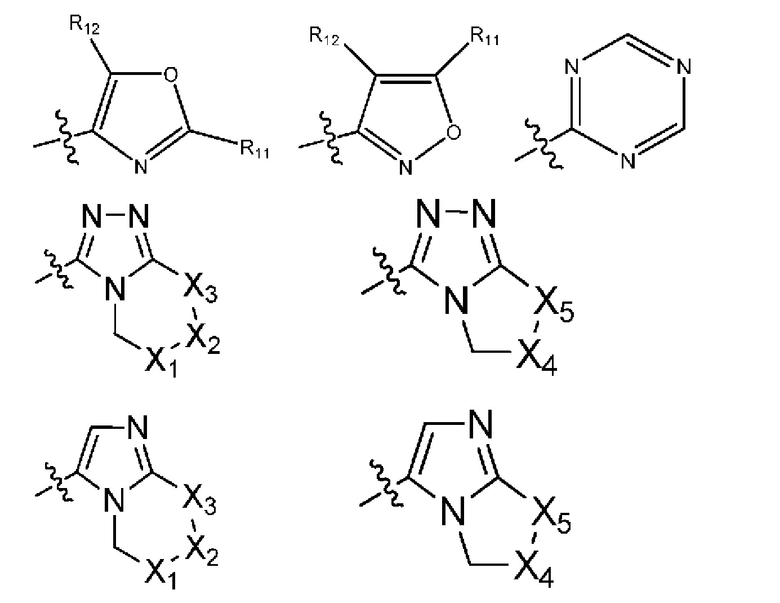
где R10, R11 и R12 все независимо выбраны из группы, включающей водород галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C2)алкил, NRaRb, ORa, где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, цианогруппу, NRcRd, ORc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C2)алкил;
и один из X1, X2 и X3 означает O или NR13, где R13 означает водород или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, гидроксигруппу и (C1-C2)алкоксигруппу;
и один из X4 и X5 означает O или NR14, где R14 означает водород или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, гидроксигруппу и (C1-C2)алкоксигруппу;
(19) R1 означает гетероарил формулы:

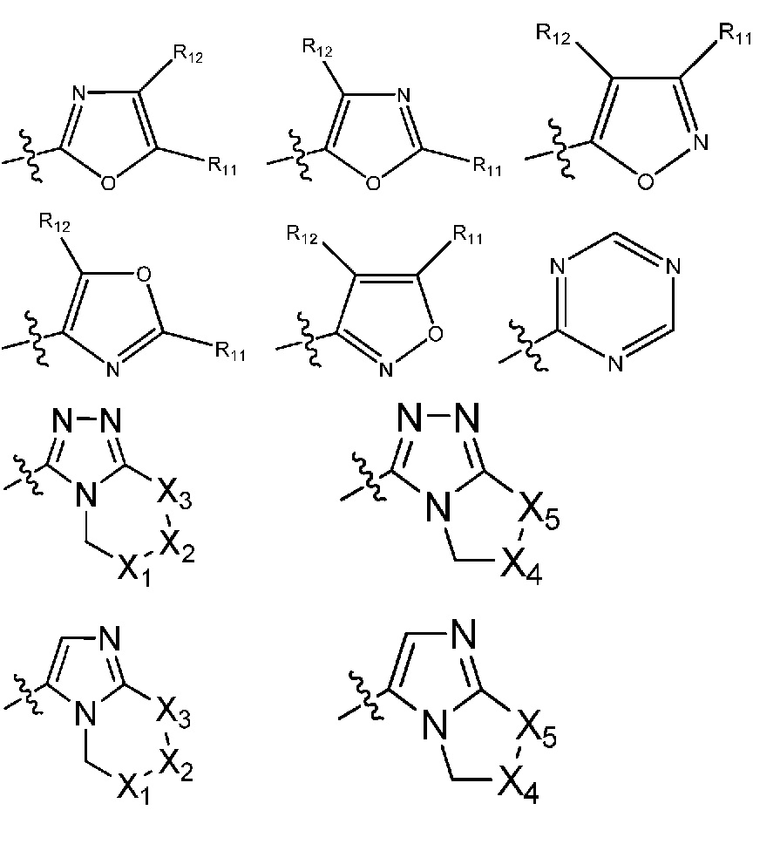
где R10, R11 и R12 все независимо выбраны из группы, включающей водород цианогруппу или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу и (C1-C2)алкоксигруппу;
и один из X1, X2 и X3 означает O или NR13, где R13 означает водород или (C1-C2)алкильную группу;
и один из X4 и X5 означает O или NR14, где R14 означает водород или (C1-C2)алкильную группу;
(20) R1 означает гетероарил формулы:
где R10, R11 и R12 все независимо выбраны из группы, включающей водород, цианогруппу или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу и (C1-C2)алкоксигруппу;
и один из X1, X2 и X3 означает O или NR13, где R13 означает водород или (C1-C2)алкильную группу;
и один из X4 и X5 означает O или NR14, где R14 означает водород или (C1-C2)алкильную группу;
(21) R1 означает гетероарил формулы:
где R10, R11 и R12 все независимо выбраны из группы, включающей водород или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу и (C1-C2)алкоксигруппу;
и один из X1, X2 и X3 означает O или NR13, где R13 означает водород или (C1-C2)алкильную группу;
и один из X4 и X5 означает O или NR14, где R14 означает водород или (C1-C2)алкильную группу;
(22) R1 означает гетероарил формулы:
где R10, R11 и R12 все независимо выбраны из группы, включающей водород или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу и (C1-C2)алкоксигруппу;
(23) R1 означает 5-членный гетероарил формулы:
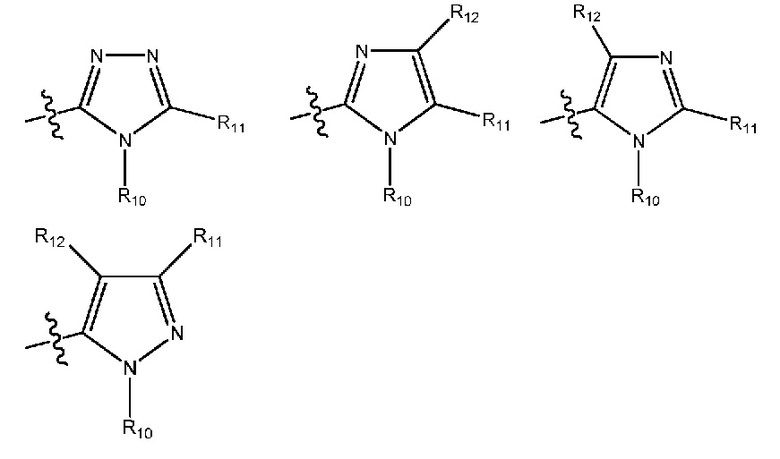
где R10, R11 и R12 все независимо выбраны из группы, включающей водород или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу и (C1-C2)алкоксигруппу;
(24) R1 означает 5-членный гетероарил формулы:
где R10, R11 и R12 все независимо выбраны из группы, включающей водород или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу и (C1-C2)алкоксигруппу;
(25) R1 означает 5-членный гетероарил формулы:
где R10, R11 и R12 все независимо выбраны из группы, включающей водород или (C1-C2)алкильную группу;
(26) R1 означает 5-членный гетероарил формулы:
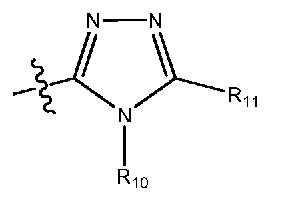
где R10 и R11 все независимо выбраны из группы, включающей водород или (C1-C2)алкильную группу, которая необязательно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу и (C1-C2)алкоксигруппу;
(27) R1 означает 5-членный гетероарил формулы:

где R10 и R11 все независимо выбраны из группы, включающей водород или (C1-C2)алкильную группу;
(28) R1 означает 5- или 6-членный гетероарил формулы:
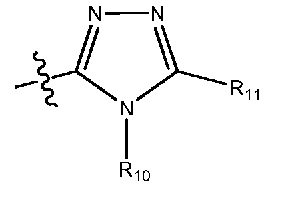
где R10 означает метил и R11 означает водород или метил;
(29) R1 означает 5-членный гетероарил формулы:

(30) R1 означает триазольное или имидазольное кольцо, необязательно содержащее один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRaRb, ORa, C(O)Ra, C(O)ORa, OC(O)Ra, N(Rb)ORa, C(O)N(Rb)Ra, N(Rb)C(O)Ra, S(O)pRa (где p равно 0, 1 или 2), SO2N(Rb)Ra или N(Rb)SO2Ra,
где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C4)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, 4- - 7-членный гетероциклил, NRcRd, ORc, C(O)Rc, C(O)ORc, OC(O)Rc, N(Rd)ORc, C(O)N(Rd)Rc, N(Rd)C(O)Rc, S(O)qRc (где q равно 0, 1 или 2), SO2N(Rd)Rc или N(Rd)SO2Rc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C4)алкил;
где триазольное или имидазольное кольцо необязательно сконденсировано с 4-, 5-, 6- или 7-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRkRl, ORk, C(O)Rk, C(O)ORk, OC(O)Rk, N(Rl)ORk, C(O)N(Rl)Rk, N(Rl)C(O)Rk, S(O)pRk (где p равно 0, 1 или 2), SO2N(Rk)Rl или N(Rk)SO2Rl, где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C4)алкил,
и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, 4- - 7-членный гетероциклил, NRmRn, ORm, C(O)Rm, C(O)ORm, OC(O)Rm, N(Rn)ORm, C(O)N(Rn)Rm, N(Rn)C(O)Rm, S(O)qRm (где q равно 0, 1 или 2), SO2N(Rn)Rm или N(Rn)SO2Rm, где Rm и Rn все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(31) R1 означает триазольное или имидазольное кольцо, необязательно содержащее один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRaRb, ORa, C(O)Ra, C(O)ORa, OC(O)Ra, N(Rb)ORa, C(O)N(Rb)Ra, N(Rb)C(O)Ra, S(O)pRa (где p равно 0, 1 или 2), SO2N(Rb)Ra или N(Rb)SO2Ra,
где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C4)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, 4- - 7-членный гетероциклил, NRcRd, ORc, C(O)Rc, C(O)ORc, OC(O)Rc, N(Rd)ORc, C(O)N(Rd)Rc, N(Rd)C(O)Rc, S(O)qRc (где q равно 0, 1 или 2), SO2N(Rd)Rc или N(Rd)SO2Rc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(32) R1 означает триазольное или имидазольное кольцо, необязательно содержащее один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRaRb, ORa, C(O)Ra, C(O)ORa, OC(O)Ra, N(Rb)ORa, C(O)N(Rb)Ra, N(Rb)C(O)Ra, S(O)pRa (где p равно 0, 1 или 2), SO2N(Rb)Ra или N(Rb)SO2Ra, где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(33) R1 означает триазольное или имидазольное кольцо, необязательно содержащее один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, (C1-C4)алкил, NRaRb, ORa, где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(34) R1 означает триазольное или имидазольное кольцо, необязательно замещенное группой (C1-C2)алкил;
(35) R1 означает триазольное кольцо, необязательно содержащее один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRaRb, ORa, C(O)Ra, C(O)ORa, OC(O)Ra, N(Rb)ORa, C(O)N(Rb)Ra, N(Rb)C(O)Ra, S(O)pRa (где p равно 0, 1 или 2), SO2N(Rb)Ra или N(Rb)SO2Ra,
где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C4)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, 4- - 7-членный гетероциклил, NRcRd, ORc, C(O)Rc, C(O)ORc, OC(O)Rc, N(Rd)ORc, C(O)N(Rd)Rc, N(Rd)C(O)Rc, S(O)qRc (где q равно 0, 1 или 2), SO2N(Rd)Rc или N(Rd)SO2Rc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C4)алкил;
где триазольное или имидазольное кольцо необязательно сконденсировано с 4-, 5-, 6- или 7-членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRkRl, ORk, C(O)Rk, C(O)ORk, OC(O)Rk, N(Rl)ORk, C(O)N(Rl)Rk, N(Rl)C(O)Rk, S(O)pRk (где p равно 0, 1 или 2), SO2N(Rk)Rl или N(Rk)SO2Rl, где Rk и Rl все независимо выбраны из группы, включающей H или (C1-C4)алкил,
и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, 4- - 7-членный гетероциклил, NRmRn, ORm, C(O)Rm, C(O)ORm, OC(O)Rm, N(Rn)ORm, C(O)N(Rn)Rm, N(Rn)C(O)Rm, S(O)qRm (где q равно 0, 1 или 2), SO2N(Rn)Rm или N(Rn)SO2Rm, где Rm и Rn все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(36) R1 означает триазольное кольцо, необязательно содержащее один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRaRb, ORa, C(O)Ra, C(O)ORa, OC(O)Ra, N(Rb)ORa, C(O)N(Rb)Ra, N(Rb)C(O)Ra, S(O)pRa (где p равно 0, 1 или 2), SO2N(Rb)Ra или N(Rb)SO2Ra,
где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C4)алкил, и где любой алкильный фрагмент, содержащийся в замещающей группе, необязательно содержит один или большее количество заместителей, выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, 4- - 7-членный гетероциклил, NRcRd, ORc, C(O)Rc, C(O)ORc, OC(O)Rc, N(Rd)ORc, C(O)N(Rd)Rc, N(Rd)C(O)Rc, S(O)qRc (где q равно 0, 1 или 2), SO2N(Rd)Rc или N(Rd)SO2Rc, где Rc и Rd все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(37) R1 означает триазольное кольцо, необязательно содержащее один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRaRb, ORa, C(O)Ra, C(O)ORa, OC(O)Ra, N(Rb)ORa, C(O)N(Rb)Ra, N(Rb)C(O)Ra, S(O)pRa (где p равно 0, 1 или 2), SO2N(Rb)Ra или N(Rb)SO2Ra, где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(38) R1 означает триазольное кольцо, необязательно содержащее один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, (C1-C4)алкил, NRaRb, ORa, где Ra и Rb все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(39) R1 означает триазольное кольцо, необязательно замещенное группой (C1-C2)алкил;
(40) R2 выбран из группы, включающей хлор, (C1-C2)алкоксигруппу или (C1-C2)фторалкоксигруппу;
(41) R2 выбран из группы, включающей хлор, метоксигруппу, этоксигруппу, дифторметоксигруппу или трифторметоксигруппу;
(42) R2 выбран из группы, включающей метоксигруппу, этоксигруппу, или дифторметоксигруппу;
(43) R2 означает метоксигруппу;
(44) R2 означает этоксигруппу;
(45) R2 означает дифторметоксигруппу;
(46) или:
(i) R3 выбран из группы, включающей водород или (C1-C2)алкил, и R4 выбран из группы, включающей (C1-C6)алкил, (C3-C9)циклоалкил, (C3-C9)циклоалкил-(C1-C2)алкил, арил, арил-(C1-C2)алкил, гетероциклил, гетероциклил-(C1-C2)алкил, гетероарил, гетероарил-(C1-C2)алкил, и где R4 необязательно дополнительно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу, фтор, хлор, цианогруппу, CF3, CHF2, OCF3, OCHF2, (C1-C4)алкил, NRoRp, ORo, C(O)Ro, C(O)ORp, OC(O)Ro, N(Rp)ORo, C(O)N(Rp)Ro, N(Rp)C(O)Ro, S(O)pRo (где p равно 0, 1 или 2), SO2N(Rp)Ro или N(Rp)SO2Ro или (C3-C6)циклоалкил, (C3-C6)циклоалкил-(C1-C2)алкил, где Ro и Rp все независимо выбраны из группы, включающей H или (C1-C4)алкил, (C3-C6)циклоалкил или (C3-C6)циклоалкил-(C1-C2)алкил; или
(ii) R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют связанное атомом азота 4-, 5- 6- или 7-членное гетероциклическое кольцо,
где указанное кольцо необязательно сконденсировано с дополнительным 3-, 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом, 5- или 6-членным гетероарильным кольцом или фенильным кольцом с образованием бициклической гетероциклической системы, или
связано через спирановый атом углерода с дополнительным 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием спиробициклической кольцевой системы;
и где гетероциклическое кольцо, бициклическая кольцевая система или спиробициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRiRj, ORi, C(O)Ri, C(O)ORi, OC(O)Ri, N(Rj)ORi, C(O)N(Rj)Ri, N(Rj)C(O)Ri, S(O)qRi (где q равно 0, 1 или 2), SO2N(Rj)Ri или N(Rj)SO2Ri, где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(47) или:
(i) R3 выбран из группы, включающей водород или метил и R4 выбран из группы, включающей (C1-C6)алкил, (C3-C6)циклоалкил, (C3-C6)циклоалкил-(C1-C2)алкил, 4-, 5- или 6-членный гетероциклил, 4-, 5- или 6-членный гетероциклил-(C1-C2)алкил, и где R4 необязательно дополнительно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу, фтор, хлор, цианогруппу, CF3, CHF2, OCF3, OCHF2, (C1-C4)алкил, NRoRp, ORo, C(O)Ro, C(O)ORp, OC(O)Ro, N(Rp)ORo, C(O)N(Rp)Ro, N(Rp)C(O)Ro, S(O)pRo (где p равно 0, 1 или 2), SO2N(Rp)Ro, N(Rp)SO2Ro или (C3-C6)циклоалкил, где Ro и Rp все независимо выбраны из группы, включающей H или (C1-C4)алкил, (C3-C6)циклоалкил или (C3-C6)циклоалкил-(C1-C2)алкил; или
(ii) R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют связанное атомом азота 4-, 5- 6- или 7-членное гетероциклическое кольцо,
где указанное кольцо необязательно сконденсировано с дополнительным 3-, 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием бициклической гетероциклической системы, или
связано через спирановый атом углерода с дополнительным 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием спиробициклической кольцевой системы;
и где гетероциклическое кольцо, бициклическая кольцевая система или спиробициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRiRj, ORi, C(O)Ri, C(O)ORi, OC(O)Ri, N(Rj)ORi, C(O)N(Rj)Ri, N(Rj)C(O)Ri, S(O)qRi (где q равно 0, 1 или 2), SO2N(Rj)Ri или N(Rj)SO2Ri, где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(48) или:
(i) R3 выбран из группы, включающей водород или метил и R4 выбран из группы, включающей (C1-C6)алкил, (C3-C6)циклоалкил, (C3-C6)циклоалкил-(C1-C2)алкил, 4-, 5- или 6-членный гетероциклил, 4-, 5- или 6-членный гетероциклил-(C1-C2)алкил, и где R4 необязательно дополнительно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу, фтор, хлор, цианогруппу, CF3, CHF2, OCF3, OCHF2, (C1-C4)алкил, NRoRp, ORo, S(O)pRo (где p равно 0, 1 или 2), или (C3-C6)циклоалкил, где Ro и Rp все независимо выбраны из группы, включающей H или (C1-C4)алкил, (C3-C6)циклоалкил или (C3-C6)циклоалкил-(C1-C2)алкил; или
(ii) R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют связанное атомом азота 4-, 5- 6- или 7-членное гетероциклическое кольцо,
где указанное кольцо необязательно сконденсировано с дополнительным 3-, 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием бициклической гетероциклической системы, или
связано через спирановый атом углерода с дополнительным 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием спиробициклической кольцевой системы;
и где гетероциклическое кольцо, бициклическая кольцевая система или спиробициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRiRj, ORi, C(O)Ri, S(O)qRi (где q равно 0, 1 или 2), где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(49) или:
(i) R3 выбран из группы, включающей водород и R4 выбран из группы, включающей (C1-C6)алкил, (C3-C6)циклоалкил, (C3-C6)циклоалкил-(C1-C2)алкил, 4-, 5- или 6-членный гетероциклил, 4-, 5- или 6-членный гетероциклил-(C1-C2)алкил, и где R4 необязательно дополнительно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу, фтор, хлор, цианогруппу, CF3, CHF2, OCF3, OCHF2, (C1-C4)алкил, NRoRp, ORo, S(O)pRo (где p равно 0, 1 или 2), или (C3-C6)циклоалкил, где Ro и Rp все независимо выбраны из группы, включающей H или (C1-C4)алкил, (C3-C6)циклоалкил или (C3-C6)циклоалкил-(C1-C2)алкил; или
(ii) R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют связанное атомом азота 4-, 5-, или 6-членное гетероциклическое кольцо,
где указанное кольцо необязательно связано через спирановый атом углерода с дополнительным 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием спиробициклической кольцевой системы;
и где гетероциклическое кольцо, бициклическая кольцевая система или спиробициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRiRj, ORi, C(O)Ri, S(O)qRi (где q равно 0, 1 или 2), где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(50) или:
(i) R3 выбран из группы, включающей водород и R4 выбран из группы, включающей (C1-C6)алкил, (C3-C6)циклоалкил-(C1-C2)алкил, 4-, 5- или 6-членный гетероциклил, 4-, 5- или 6-членный гетероциклил-(C1-C2)алкил, и где R4 необязательно дополнительно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу, фтор, хлор, цианогруппу, CF3, CHF2, OCF3, OCHF2, (C1-C4)алкил, NRoRp или ORo, где Ro и Rp все независимо выбраны из группы, включающей H или (C1-C4)алкил; или
(ii) R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют связанное атомом азота 4-, 5-, или 6-членное гетероциклическое кольцо,
где указанное кольцо необязательно связано через спирановый атом углерода с дополнительным 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием спиробициклической кольцевой системы;
и где гетероциклическое кольцо, бициклическая кольцевая система или спиробициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRiRj, ORi, C(O)Ri, S(O)qRi (где q равно 0, 1 или 2), где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(51) или:
(i) R3 выбран из группы, включающей водород и R4 выбран из группы, включающей (C1-C6)алкил, (C3-C6)циклоалкил-(C1-C2)алкил, 4-, 5- или 6-членный гетероциклил, 4-, 5- или 6-членный гетероциклил-(C1-C2)алкил, и где R4 необязательно дополнительно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу, (C1-C4)алкил или ORo, где Ro выбран из группы, включающей H или (C1-C2)алкил; или
(ii) R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют связанное атомом азота 4-, 5-, или 6-членное гетероциклическое кольцо,
где указанное кольцо необязательно связано через спирановый атом углерода с дополнительным 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием спиробициклической кольцевой системы;
и где гетероциклическое кольцо, бициклическая кольцевая система или спиробициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, цианогруппу, (C1-C4)алкил, NRiRj, ORi,, где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C2)алкил;
(52) R3 выбран из группы, включающей водород или (C1-C3)алкил, и R4 выбран из группы, включающей (C1-C6)алкил, (C3-C9)циклоалкил, (C3-C9)циклоалкил-(C1-C4)алкил, арил, арил-(C1-C4)алкил, гетероциклил, гетероциклил-(C1-C4)алкил, гетероарил, гетероарил-(C1-C4)алкил, и где R4 необязательно дополнительно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу, фтор, хлор, цианогруппу, CF3, CHF2, OCF3, OCHF2, (C1-C4)алкил, NRoRp, ORo, C(O)Ro, C(O)ORp, OC(O)Ro, N(Rp)ORo, C(O)N(Rp)Ro, N(Rp)C(O)Ro, S(O)pRo (где p равно 0, 1 или 2), SO2N(Rp)Ro или N(Rp)SO2Ro или (C3-C6)циклоалкил, (C3-C6)циклоалкил-(C1-C2)алкил, 4-, 5- или 6-членный гетероциклил, 4-, 5- или 6-членный гетероциклил-(C1-C2)алкил, где Ro и Rp все независимо выбраны из группы, включающей H или (C1-C4)алкил, (C3-C6)циклоалкил или (C3-C6)циклоалкил-(C1-C4)алкил;
(53) R3 выбран из группы, включающей водород и R4 выбран из группы, включающей (C1-C6)алкил, (C3-C6)циклоалкил-(C1-C2)алкил, 4-, 5- или 6-членный гетероциклил, 4-, 5- или 6-членный гетероциклил-(C1-C2)алкил, и где R4 необязательно дополнительно содержит один или большее количество заместителей, выбранных из группы, включающей гидроксигруппу, (C1-C4)алкил или ORo, где Ro выбран из группы, включающей H или (C1-C2)алкил
(54) R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют связанное атомом азота 4-, 5- 6- или 7-членное гетероциклическое кольцо; и где гетероциклическое кольцо необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRiRj, ORi, C(O)Ri, C(O)ORi, OC(O)Ri, N(Rj)ORi, C(O)N(Rj)Ri, N(Rj)C(O)Ri, S(O)qRi (где q равно 0, 1 или 2), SO2N(Rj)Ri или N(Rj)SO2Ri, где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(55) R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют связанное атомом азота 4-, 5- 6- или 7-членное гетероциклическое кольцо, где указанное кольцо сконденсировано с дополнительным 3-, 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом, 5- или 6-членным гетероарильным кольцом или фенильным кольцом с образованием бициклической гетероциклической системы; и где бициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRiRj, ORi, C(O)Ri, C(O)ORi, OC(O)Ri, N(Rj)ORi, C(O)N(Rj)Ri, N(Rj)C(O)Ri, S(O)qRi (где q равно 0, 1 или 2), SO2N(Rj)Ri или N(Rj)SO2Ri, где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(56) R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют связанное атомом азота 4-, 5- 6- или 7-членное гетероциклическое кольцо где указанное кольцо сконденсировано с дополнительным 3-, 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом, 5- или 6-членным гетероарильным кольцом или фенильным кольцом с образованием бициклической гетероциклической системы; и где бициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRiRj, ORi, C(O)Ri, C(O)ORi, OC(O)Ri, N(Rj)ORi, C(O)N(Rj)Ri, N(Rj)C(O)Ri, S(O)qRi (где q равно 0, 1 или 2), SO2N(Rj)Ri или N(Rj)SO2Ri, где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(57) R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют связанное атомом азота 4-, 5- 6- или 7-членное гетероциклическое кольцо где указанное кольцо связано через спирановый атом углерода с дополнительным 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием спиробициклической кольцевой системы;
и где спиробициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, трифторметоксигруппу, дифторметоксигруппу, цианогруппу, нитрогруппу, (C1-C4)алкил, NRiRj, ORi, C(O)Ri, C(O)ORi, OC(O)Ri, N(Rj)ORi, C(O)N(Rj)Ri, N(Rj)C(O)Ri, S(O)qRi (где q равно 0, 1 или 2), SO2N(Rj)Ri или N(Rj)SO2Ri, где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C4)алкил;
(58) R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, они образуют связанное атомом азота 4-, 5- 6- или 7-членное гетероциклическое кольцо где указанное кольцо связано через спирановый атом углерода с дополнительным 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием спиробициклической кольцевой системы;
и где спиробициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, цианогруппу, (C1-C4)алкил, NRiRj, ORi,, где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C2)алкил.
Предпочтительно, если R1 является таким, как определено выше в любом из параграфов (1)-(39). В одном варианте осуществления R1 является таким, как определено выше в любом из параграфов (12)-(39). В предпочтительном варианте осуществления R1 является таким, как определено выше в любом из параграфов (20)-(39).
Предпочтительно, если R2 является таким, как определено выше в любом из параграфов (40)-(45). В одном варианте осуществления R2 является таким, как определено выше в параграфе (42). В предпочтительном варианте осуществления R1 является таким, как определено выше в параграфе (44).
Предпочтительно, если R3 и R4 являются такими, как определено выше в любом из параграфов (46)-(58). В одном варианте осуществления R3 и R4 являются такими, как определено выше в параграфе (49).
В одном варианте осуществления R1 означает триазол или имидазол, который необязательно замещен, как определено выше в настоящем изобретении.
В предпочтительной группе соединений, предлагаемых в настоящем изобретении:
R1 является таким, как определено выше в любом из параграфов (1)-(39);
R2 является таким, как определено выше в любом из параграфов (40)-(45); и
R3 и R4 все описываются любым из определений, приведенных в настоящем изобретении.
В другой группе соединений, предлагаемых в настоящем изобретении:
R1 является таким, как определено выше в любом из параграфов (12)-(39);
R2 является таким, как определено выше в параграфе (42); и
R3 и R4 все описываются любым из определений, приведенных в настоящем изобретении.
В другой группе соединений, предлагаемых в настоящем изобретении:
R1 является таким, как определено выше в любом из параграфов (20)-(39);
R2 является таким, как определено выше в параграфе (42); и
R3 и R4 все описываются любым из определений, приведенных в настоящем изобретении.
В другой группе соединений, предлагаемых в настоящем изобретении:
R1 является таким, как определено выше в любом из параграфов (22)-(39);
R2 является таким, как определено выше в параграфе (42); и
R3 и R4 все описываются любым из определений, приведенных в настоящем изобретении.
В другой группе соединений, предлагаемых в настоящем изобретении:
R1 является таким, как определено выше в параграфе (25);
R2 является таким, как определено выше в параграфе (42); и
R3 и R4 все описываются любым из определений, приведенных в настоящем изобретении.
В другой группе соединений, предлагаемых в настоящем изобретении:
R1 является таким, как определено выше в параграфе (26);
R2 является таким, как определено выше в параграфе (42); и
R3 и R4 все описываются любым из определений, приведенных в настоящем изобретении.
В другой группе соединений, предлагаемых в настоящем изобретении:
R1 является таким, как определено выше в параграфе (27);
R2 является таким, как определено выше в параграфе (42); и
R3 и R4 все описываются любым из определений, приведенных в настоящем изобретении.
В другой группе соединений, предлагаемых в настоящем изобретении:
R1 является таким, как определено выше в любом из параграфов (12)-(39);
R2 является таким, как определено выше в параграфе (43); и
R3 и R4 все описываются любым из определений, приведенных в настоящем изобретении.
В другой группе соединений, предлагаемых в настоящем изобретении:
R1 является таким, как определено выше в любом из параграфов (12)-(39);
R2 является таким, как определено выше в параграфе (44); и
R3 и R4 все описываются любым из определений, приведенных в настоящем изобретении.
В другой группе соединений, предлагаемых в настоящем изобретении:
R1 является таким, как определено выше в любом из параграфов (21)-(39);
R2 является таким, как определено выше в параграфе (43); и
R3 и R4 все описываются любым из определений, приведенных в настоящем изобретении.
В другой группе соединений, предлагаемых в настоящем изобретении:
R1 является таким, как определено выше в любом из параграфов (21)-(39);
R2 является таким, как определено выше в параграфе (44); и
R3 и R4 все описываются любым из определений, приведенных в настоящем изобретении.
В другой группе соединений, предлагаемых в настоящем изобретении:
R1 является таким, как определено выше в параграфе (25);
R2 является таким, как определено выше в параграфе (43); и
R3 и R4 все описываются любым из определений, приведенных в настоящем изобретении.
В другой группе соединений, предлагаемых в настоящем изобретении:
R1 является таким, как определено выше в параграфе (25);
R2 является таким, как определено выше в параграфе (44); и
R3 и R4 все описываются любым из определений, приведенных в настоящем изобретении.
Конкретные соединения, предлагаемые в настоящем изобретении, включают любое из соединений, примеры которых приведены в настоящей заявке, или его фармацевтически приемлемую соль или сольват, и, в частности, любое из следующих:
N2-(2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
1-(((2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)амино)метил)циклобутанол;
1-(2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)пиперидин-4-карбонитрил;
1-(2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-ол;
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-((3-метилоксетан-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(((2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)амино)метил)циклопропанол;
N2-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)пиперидин-4-карбонитрил;
1-(2-((4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(2-метокси-4-(1-метил-1H-пиразол-3-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
8-(3,3-дифторазетидин-1-ил)-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-8-(3-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(2-метилморфолино)пиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
8-(3-азабицикло[3.1.0]гексан-3-ил)-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
8-(3-(диметиламино)азетидин-1-ил)-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)пиперидин-4-ол;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-8-(3-метокси-3-метилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилпирролидин-3-ол;
1-(2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
1-(2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)пирролидин-3-карбонитрил;
N2-(2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-метокси-4-(1-метил-1H-пиразол-5-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-метокси-4-(оксазол-2-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-8-(3-метоксипирролидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
8-(3,3-диметилазетидин-1-ил)-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилпирролидин-3-карбонитрил;
8-(2,2-диметилазетидин-1-ил)-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(3-(трифторметил)азетидин-1-ил)пиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(2-азаспиро[3.3]гептан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
(R)-N8-(3,3-диметилбутан-2-ил)-N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2,8-диамин;
(S)-N8-(3,3-диметилбутан-2-ил)-N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-N8-((1-метоксициклобутил)метил)-6-метилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(1-метилазетидин-3-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(оксетан-3-илметил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(пирролидин-1-ил)пиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(2-азаспиро[3.4]октан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-этилазетидин-3-ол;
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(1-метилпиперидин-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
8-(4-(диметиламино)пиперидин-1-ил)-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-((тетрагидро-2H-пиран-4-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-((4-метилтетрагидро-2H-пиран-4-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
1-(2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-этилпиперидин-4-карбонитрил;
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(2-(3-метилтетрагидрофуран-3-ил)этил)пиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(1-(тетрагидро-2H-пиран-4-ил)этил)пиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(пентан-3-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(тетрагидрофуран-3-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
8-(3-этокси-3-метилазетидин-1-ил)-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-8-(3-этил-3-метоксиазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
8-(3-этокси-3-этилазетидин-1-ил)-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-8-(3-изопропил-3-метоксиазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
8-(3-этокси-3-isopropylazetidin-1-ил)-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-этилазетидин-3-карбонитрил;
1-(2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-isopropylazetidine-3-карбонитрил;
1-(2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-2,2,3-trimethylazetidine-3-карбонитрил;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-8-(3-метокси-2,2-диметилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-8-(3-метокси-2,2,3-триметилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-2,2-диметилазетидин-3-карбонитрил;
N2-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(1-метилпиперидин-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
8-(4-(диметиламино)пиперидин-1-ил)-N-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N2-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-((тетрагидро-2H-пиран-4-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-((4-метилтетрагидро-2H-пиран-4-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
4-этил-1-(2-((2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)пиперидин-4-карбонитрил;
N2-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(2-(3-метилтетрагидрофуран-3-ил)этил)пиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(1-(тетрагидро-2H-пиран-4-ил)этил)пиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(пентан-3-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(тетрагидрофуран-3-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
8-(3-этокси-3-метилазетидин-1-ил)-N-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
8-(3-этил-3-метоксиазетидин-1-ил)-N-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
8-(3-этокси-3-этилазетидин-1-ил)-N-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
8-(3-изопропил-3-метоксиазетидин-1-ил)-N-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
8-(3-этокси-3-изопропилазетидин-1-ил)-N-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
3-этил-1-(2-((2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)азетидин-3-карбонитрил;
3-изопропил-1-(2-((2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)азетидин-3-карбонитрил;
1-(2-((2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-2,2,3-trimethylazetidine-3-карбонитрил;
8-(3-метокси-2,2-диметилазетидин-1-ил)-N-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
8-(3-метокси-2,2,3-триметилазетидин-1-ил)-N-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-2,2-диметилазетидин-3-карбонитрил;
8-(3,3-диметилазетидин-1-ил)-N-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
8-(3-метокси-3-метилазетидин-1-ил)-N-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N2-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-8-(3,3-диметилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
N-(2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-8-(3-метокси-3-метилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N2-(2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
8-(3,3-диметилазетидин-1-ил)-N-(4-(4-этил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(4-этил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
N-(4-(4-этил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-8-(3-метокси-3-метилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(4-этил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(4-этил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(4-этил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(4-этил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N2-(4-(4-этил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(4-этил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(4-этил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(4-этил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(4-этил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
8-(3,3-диметилазетидин-1-ил)-N-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
N-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)-8-(3-метокси-3-метилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N2-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-8-(3,3-диметилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-8-(3-метокси-3-метилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N2-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)-8-(3,3-диметилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)-8-(3-метокси-3-метилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N2-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
8-(3,3-диметилазетидин-1-ил)-N-(2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
8-(3-метокси-3-метилазетидин-1-ил)-N-(2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N2-(2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-8-(3,3-диметилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-8-(3-метокси-3-метилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N-(4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксифенил)-8-(3,3-диметилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
N-(4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксифенил)-8-(3-метокси-3-метилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксифенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксифенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксифенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N2-(4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксифенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксифенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксифенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксифенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксифенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
8-(3,3-диметилазетидин-1-ил)-N-(2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
8-(3-метокси-3-метилазетидин-1-ил)-N-(2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N2-(2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
8-(3,3-диметилазетидин-1-ил)-N-(4-(2,4-диметилоксазол-5-ил)-2-метоксифенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(2,4-диметилоксазол-5-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
N-(4-(2,4-диметилоксазол-5-ил)-2-метоксифенил)-8-(3-метокси-3-метилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(2,4-диметилоксазол-5-ил)-2-метоксифенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(2,4-диметилоксазол-5-ил)-2-метоксифенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(2,4-диметилоксазол-5-ил)-2-метоксифенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(2,4-диметилоксазол-5-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N2-(4-(2,4-диметилоксазол-5-ил)-2-метоксифенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(2,4-диметилоксазол-5-ил)-2-метоксифенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(2,4-диметилоксазол-5-ил)-2-метоксифенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(2,4-диметилоксазол-5-ил)-2-метоксифенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(2,4-диметилоксазол-5-ил)-2-метоксифенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
8-(3,3-диметилазетидин-1-ил)-N-(4-(2,4-диметилоксазол-5-ил)-2-этоксифенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(2,4-диметилоксазол-5-ил)-2-этоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
N-(4-(2,4-диметилоксазол-5-ил)-2-этоксифенил)-8-(3-метокси-3-метилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(2,4-диметилоксазол-5-ил)-2-этоксифенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(2,4-диметилоксазол-5-ил)-2-этоксифенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(2,4-диметилоксазол-5-ил)-2-этоксифенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(2,4-диметилоксазол-5-ил)-2-этоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N2-(4-(2,4-диметилоксазол-5-ил)-2-этоксифенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(2,4-диметилоксазол-5-ил)-2-этоксифенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(2,4-диметилоксазол-5-ил)-2-этоксифенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(2,4-диметилоксазол-5-ил)-2-этоксифенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(2,4-диметилоксазол-5-ил)-2-этоксифенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
8-(3,3-диметилазетидин-1-ил)-N-(4-(2,5-диметилоксазол-4-ил)-2-метоксифенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(2,5-диметилоксазол-4-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
N-(4-(2,5-диметилоксазол-4-ил)-2-метоксифенил)-8-(3-метокси-3-метилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(2,5-диметилоксазол-4-ил)-2-метоксифенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(2,5-диметилоксазол-4-ил)-2-метоксифенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(2,5-диметилоксазол-4-ил)-2-метоксифенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(2,5-диметилоксазол-4-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N2-(4-(2,5-диметилоксазол-4-ил)-2-метоксифенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(2,5-диметилоксазол-4-ил)-2-метоксифенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(2,5-диметилоксазол-4-ил)-2-метоксифенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(2,5-диметилоксазол-4-ил)-2-метоксифенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(2,5-диметилоксазол-4-ил)-2-метоксифенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
8-(3,3-диметилазетидин-1-ил)-N-(4-(2,5-диметилоксазол-4-ил)-2-этоксифенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(2,5-диметилоксазол-4-ил)-2-этоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
N-(4-(2,5-диметилоксазол-4-ил)-2-этоксифенил)-8-(3-метокси-3-метилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(2,5-диметилоксазол-4-ил)-2-этоксифенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(2,5-диметилоксазол-4-ил)-2-этоксифенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(2,5-диметилоксазол-4-ил)-2-этоксифенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(2,5-диметилоксазол-4-ил)-2-этоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N2-(4-(2,5-диметилоксазол-4-ил)-2-этоксифенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(2,5-диметилоксазол-4-ил)-2-этоксифенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(2,5-диметилоксазол-4-ил)-2-этоксифенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(2,5-диметилоксазол-4-ил)-2-этоксифенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(2,5-диметилоксазол-4-ил)-2-этоксифенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
или его фармацевтически приемлемую соль или сольват.
Различные функциональные группы и заместители, образующие соединения, предлагаемые в настоящем изобретении, обычно выбирают так, чтобы молекулярная масса соединения не превышала 1000. Чаще молекулярная масса соединения не превышает 750, например, равна менее 700 или менее 650, или менее 600, или менее 550. Более предпочтительно, если молекулярная масса равна менее 525 и, например, равна 500 или менее.
Подходящие и предпочтительные признаки любых соединений, предлагаемых в настоящем изобретении, также могут быть подходящими признаками любого другого объекта.
Подходящей фармацевтически приемлемой солью соединения, предлагаемого в настоящем изобретении, является, например, соль присоединения с кислотой соединения, предлагаемого в настоящем изобретении, которая является достаточно основной, например, соль присоединения, например, с неорганической или органической кислотой, например, хлористоводородной, бромистоводородной, серной, фосфорной, трифторуксусной, муравьиной, лимонной или малеиновой кислотой. Кроме того подходящей фармацевтически приемлемой солью соединения, предлагаемого в настоящем изобретении, которая является достаточно кислой, является соль щелочного металла, например, натриевая или калиевая соль, соль щелочноземельного металла, например, кальциевая или магниевая соль, соль аммония или соль с органическим основанием, которое образует физиологически приемлемый катион, например, соль с метиламином, диметиламином, триметиламином, пиперидином, морфолином или трис-(2-гидроксиэтил)амином.
Соединения, которые обладают одинаковыми молекулярными формулами, но различаются по природе или последовательности связей между их атомами или по расположению их атомов в пространстве, называются "изомерами". Изомеры, которые различаются по расположению их атомов в пространстве, называются "стереоизомерами". Стереоизомеры, которые не являются зеркальными изображениями друг друга, называются "диастереоизомерами" и те, которые являются не налагающимися друг на друга зеркальными изображениями друг друга, называются "энантиомерами". Если соединение содержит асимметрический центр, например, оно связано с 4 разными группами, возможна пара энантиомеров. Энантиомер можно охарактеризовать абсолютной конфигурацией его асимметрического центра и описать с помощью R- и S-правил Кана и Прелога или тем, как молекула вращает плоскость поляризации поляризованного света, и обозначить, как правовращающий или левовращающий (т.е. как (+) или (-)-изомеры соответственно). Хиральное соединение может существовать в виде отдельного энантиомера или в виде их смеси. Смесь, содержащая одинаковые количества энантиомеров называется "рацемической смесью".
Соединения, предлагаемые в настоящем изобретении, могут содержать один или большее количество асимметрических центров; поэтому такие соединения можно получить в виде отдельных (R)- или (S)-стереоизомеров или в виде их смесей. Если не указано иное, то подразумевается, что описание или название конкретного соединения в настоящем описании и формуле изобретения включает и отдельные энантиомеры, и смеси, рацемические или другие. Методики определения стереохимической конфигурации и разделения стереоизомеров хорошо известны в данной области техники (см. обсуждение в Chapter 4 в "Advanced Organic Chemistry", 4th edition J. March, John Wiley и Sons, New York, 2001), например, проводят путем синтеза из оптически активных исходных веществ или путем разделения рацемической формы. Некоторые из соединений, предлагаемых в настоящем изобретении, могут содержать геометрические изомерные центры (E- и Z- изомеры). Следует понимать, что в объем настоящего изобретения входят все оптические, диастереоизомеры и геометрические изомеры и их смеси, которые обладают ингибирующей активностью по отношению к киназе Mps1.
В объем настоящего изобретения также входят соединения, предлагаемые в настоящем изобретении, определенные в настоящем изобретении, которые включают один или большее количество изотопно замещенных форм. Например, H может находиться в любой изотопной форме, включая 1H, 2H(D), и 3H (T); C может находиться в любой изотопной форме, включая 12C, 13C, и 14C; и O может находиться в любой изотопной форме, включая 16O и 18O; и т.п.
Также следует понимать, что некоторые соединения, предлагаемые в настоящем изобретении, могут находиться в сольватированной, а также несольватированной формах, таких как, например, гидратированные формы. Следует понимать, что в объем настоящего изобретения входят все такие сольватированные формы, которые обладают ингибирующей активностью по отношению к киназе Mps1.
Также следует понимать, что некоторые соединения, предлагаемые в настоящем изобретении, могут обладать полиморфизмом и что в объем настоящего изобретения входят все такие формы, которые обладают ингибирующей активностью по отношению к киназе Mps1.
Соединения, предлагаемые в настоящем изобретении, могут существовать в виде ряда разных таутомерных форм и указание на соединения, предлагаемые в настоящем изобретении, включает все такие формы. Для исключения сомнений отметим, что, когда соединение может существовать в виде одной из нескольких таутомерных форм и только одна явно описана или представлена, все же все остальные входят в число соединений, предлагаемых в настоящем изобретении. Примеры таутомерных форм включают кето-, енольные и енолятные формы, как, например, в следующих таутомерных парах: кето/енольная (приведена ниже), имино/енаминовая, амидо/иминоспирт, амидино/амидиновая, нитрозо/оксимная, тиокетонно/ентиольная и нитро/кислая нитро.
кетонная формаенольная формаенолят
Соединения, предлагаемые в настоящем изобретении, содержащие аминогруппу, также могут образовывать N-оксиды. В настоящем изобретении указание на соединение формулы I, которое содержит аминогруппу, также включает указание на N-оксид. Если соединение содержит несколько аминогрупп, то один или больше, чем один, атом азота можно окислить с образованием N-оксида. Конкретными примерами N-оксидов являются N-оксиды третичного амина или атома азота азотсодержащего гетероцикла. N-Оксиды можно получить путем обработки соответствующего амина окислительным реагентом, таким как пероксид водорода или надкислота (например, пероксикарбоновая кислота), см., например, Advanced Organic Chemistry, by Jerry March, 4th Edition, Wiley Interscience, pages. Точнее, N-оксиды можно получить по методике, приведенной в публикации L. W. Deady (Син. Comm. 1977, 7, 509-514), в которой амин вводят в реакцию с м-хлорпероксибензойной кислотой (МХПБК), например, в инертном растворителе, таком как дихлорметан.
Соединения, предлагаемые в настоящем изобретении, можно вводить в виде пролекарства, которое разлагается в организме человека или животного с выделением соединения, предлагаемого в настоящем изобретении. Пролекарство можно использовать для изменения физических характеристик и/или фармакокинетических характеристик соединения, предлагаемого в настоящем изобретении. Пролекарство можно получить, когда соединение, предлагаемое в настоящем изобретении, содержит подходящую группу или заместитель, к которому можно присоединить изменяющую характеристику группу. Примеры пролекарств включают расщепляющиеся in vivo сложноэфирные производные, которые можно образовать по карбоксигруппе или гидроксигруппе в соединении, предлагаемом в настоящем изобретении, и расщепляющиеся in vivo амидные производные, которые можно образовать по карбоксигруппе или аминогруппе в соединении, предлагаемом в настоящем изобретении.
Соответственно, настоящее изобретение включает такие соединения формулы I, определенной выше в настоящем изобретении, которые получают с помощью органического синтеза и которые становятся доступными в организме человека или животного вследствие происходящего в нем расщепления пролекарства. Соответственно, настоящее изобретение включает такие соединения формулы I, которые получают с помощью средств органического синтеза, и также такие соединения, которые образуются в организме человека или животного вследствие метаболизма предшественника соединения, т.е. соединение формулы I может быть полученным синтетически соединением или полученным метаболически соединением.
Подходящее фармацевтически приемлемое пролекарство соединения формулы I является таким, которое основано на разумном медицинском решении, как являющееся подходящим для введения в организм человека или животного без проявления нежелательной фармакологической активности и без чрезмерной токсичности.
Различные формы пролекарства описаны, например, в следующих документах:
a) Methods in Enzymology, Vol. 42, p. 309-396, edited by K. Widder, et al. (Academic Press, 1985);
b) Design of Pro-drugs, edited by H. Bundgaard, (Elsevier, 1985);
c) A Textbook of Drug Design and Development, edited by Krogsgaard-Larsen and H. Bundgaard, Chapter 5 "Design and Application of Pro-drugs", by H. Bundgaard p. 113-191 (1991);
d) H. Bundgaard, Advanced Drug Delivery Reviews, 8, 1-38 (1992);
e) H. Bundgaard, et al., Journal of Pharmaceutical Sciences, 77, 285 (1988);
f) N. Kakeya, et al., Chem. Pharm. Bull., 32, 692 (1984);
g) T. Higuchi and V. Stella, "Pro-Drugs as Novel Delivery Systems", A.C.S. Symposium Series, Volume 14; and
h) E. Roche (editor), "Bioreversible Carriers in Drug Design", Pergamon Press, 1987.
Подходящее фармацевтически приемлемое пролекарство соединения формулы I, которое содержит карбоксигруппу, например, представляет собой его расщепляющийся in vivo эфир. Расщепляющийся in vivo эфир соединения формулы I, содержащий карбоксигруппу, представляет собой например, фармацевтически приемлемый эфир, который расщепляется в организме человека или животного с образованием исходной кислоты. Подходящие фармацевтически приемлемые эфиры соединения, содержащего карбоксигруппу, включают C1-C6-алкиловые эфиры, такие как метил, этил и трет-бутил, C1-C6-алкоксиметиловые эфиры, такие как метоксиметиловые эфиры, C1-C6-алканоилоксиметиловые эфиры, такие как пивалоилоксиметиловые эфиры, 3-фталидиловые эфиры, C3-C8-циклоалкилкарбонилокси-C1-C6-алкиловые эфиры, такие как циклопентилкарбонилоксиметиловый и 1-циклогексилкарбонилоксиэтиловый эфиры, 2-оксо-1,3-диоксоленилметиловые эфиры, такие как 5-метил-2-оксо-1,3-диоксолен-4-илметиловые эфиры и C1-C6-алкоксикарбонилокси- C1-C6-алкиловые эфиры, такие как метоксикарбонилоксиметиловый и 1-метоксикарбонилоксиэтиловый эфиры.
Подходящее фармацевтически приемлемое пролекарство соединения формулы I, которые содержат гидроксигруппу, представляет собой, например, его расщепляющийся in vivo сложный эфир или простой эфир. Расщепляющийся in vivo сложный эфир или простой эфир соединения формулы I, содержащий гидроксигруппу, представляет собой, например, фармацевтически приемлемый сложный эфир или простой эфир, который расщепляется в организме человека или животного с образованием исходного гидроксисоединения. Подходящие для гидроксигруппы фармацевтически приемлемые образующие сложный эфир группы включают неорганические сложноэфирные группы, такие как фосфаты (включая фосфорамидные циклические сложноэфирные группы). Другие подходящие для гидроксигруппы фармацевтически приемлемые образующие сложный эфир группы включают C1-C10-алканоильные группы, такие как ацетильные, бензоильные, фенилацетильные и замещенные бензоильные и фенилацетильные группы, C1-C10-алкоксикарбонильные группы, такие как этоксикарбонильные, N,N-(C1-C6)2карбамоильные, 2-диалкиламиноацетильные и 2-карбоксиацетильные группы. Примеры заместители кольца фенилацетильных и бензоильных групп включают аминометил, N-алкиламинометил, N,N-диалкилкаминометил, морфолинометил, пиперазин-1-илметил и 4-(C1-C4-алкил)пиперазин-1-илметил. Подходящие для гидроксигруппы фармацевтически приемлемые образующие простой эфир группы включают α-ацилоксиалкильные группы, такие как ацетоксиметильные и пивалоилоксиметильные группы.
Подходящее фармацевтически приемлемое пролекарство соединения формулы I, которое содержит карбоксигруппу, например, представляет собой его расщепляющийся in vivo амид, например, амид, образующийся с амином, таким как аммиак, C1-C4-алкиламином, таким как метиламин, (C1-C4-алкил)2-амином, таким как диметиламин, N-этил-N-метиламин или диэтиламин, C1-C4-алкокси-C2-C4-алкиламином, таким как 2-метоксиэтиламин, фенил-C1-C4-алкиламином, таким как бензиламин, и аминокислотами, такими как глицин или его сложный эфир.
Подходящее фармацевтически приемлемое пролекарство соединения формулы I, которое содержит аминогруппу, например, представляет собой его расщепляющийся in vivo амидное производное. Подходящие фармацевтически приемлемые амиды, образующиеся из аминогруппы, включают, например, амид, образованный с C1-C10-алканоильными группами, такими как ацетильная, бензоильная, фенилацетильные и замещенные бензоильные и фенилацетильные группы. Примеры заместители кольца фенилацетильных и бензоильных групп включают аминометил, N-алкиламинометил, N,N-диалкилкаминометил, морфолинометил, пиперазин-1-илметил и 4-(C1-C4-алкил)пиперазин-1-илметил.
Воздействия in vivo соединения формулы I могут частично оказывать один или большее количество метаболитов, которые образуются в организме человека или животного после введения соединения формулы I. Как указано выше в настоящем изобретении, воздействия in vivo соединения формулы I также могут оказываться путем метаболизма предшественника соединения (пролекарства).
Также следует понимать, что соединения формулы I также могут быть ковалентно связаны (в любом подходящем положении) с другими группами, такими как, например, солюбилизирующие фрагменты (например, полимеры ПЭГ (полиэтиленгликоль)), которые позволяют им связываться с твердой подложкой (такие как, например, содержащие биотин фрагменты) и направляющие лиганды (такие как антитела или фрагменты антител).
Синтез
При описании методик синтеза ниже и в упомянутых методиках синтеза, которые используются для получения исходных веществ, следует понимать, что все предложенные условия проведения реакций, включая выбор растворителя, атмосферы, в которой проводят реакцию, температуры, при которой проводят реакцию, длительности эксперимента и процедур обработки, может выбрать специалист в данной области техники.
Специалист в области органического синтеза должен понимать, что функциональные группы, содержащиеся в разных частях молекулы, должны быть совместимы с использующимися реагентами и условиями проведения реакций.
Необходимые исходные вещества можно получить по стандартным методикам органической химии. Получение таких исходных веществ описано вместе с приведенными ниже типичными вариантами методик и приложенными примерами. Альтернативно, необходимые исходные вещества можно получить по методика, аналогичным приведенным, которые входят в компетенцию химика-органика с общей подготовкой.
Следует понимать, что во время синтеза соединений, предлагаемых в настоящем изобретении, в методиках, описанных ниже, или во время синтеза некоторых исходных веществ может оказаться необходимой защита некоторых замещающих групп для предупреждения нежелательных реакций. Специалист-химик должен понимать, когда необходима такая защита и как можно ввести и затем удалить такие защитные группы.
Примеры защитных групп приведены в одном из многих общих руководств по этому вопросу, например, в публикации ‘Protective Groups in Organic Synthesis’ by Theodora Green (publisher: John Wiley & Sons). Защитные группы можно удалять по любой обычной методике, описанной в литературе и известной специалисту-химику в качестве подходящей для удаления рассматриваемой защитной группы, такие методики выбирают так, чтобы удаление защитной группы приводило к минимальному влиянию на другие группы молекулы.
Таким образом, если реагенты содержат, например, такие группы, как аминогруппу, карбоксигруппу или гидроксигруппу, может быть желательной защита группы в некоторых из реакций, указанных в настоящем изобретении.
Например, подходящей защитной группой для аминогруппы или алкиламиногруппы является, например, ацильная группа, например, алканоильная группа, такая как ацетильная, алкоксикарбонильная группа, например, метоксикарбонильная, этоксикарбонильная или трет-бутоксикарбонильная группа, арилметоксикарбонильная группа, например, бензилоксикарбонильная или ароильная группа, например, бензоил. Условия удаления указанных выше защитных групп неизбежно меняются при изменении выбранной защитной группы. Так, например, ацильную группу, такую как алканоильная или алкоксикарбонильная группа или ароильная группа, можно удалить с помощью, например, гидролиза подходящим основанием, таким как гидроксид щелочного металла, например, гидроксид лития или натрия. Альтернативно ацильную группу, такую как трет-бутоксикарбонильная группа, можно удалить, например, путем обработки подходящей кислотой, такой как хлористоводородная, серная или фосфорная кислота, или трифторуксусная кислота, и арилметоксикарбонильную группу, такую как бензилоксикарбонильная группа можно удалить, например, путем гидрирования над катализатором, таким как палладий на угле, или путем обработки кислотой Льюиса, например, BF3.OEt2. Подходящей альтернативной защитной группой для первичной аминогруппы является, например, фталоильная группа, которую можно удалить путем обработки алкиламином, например, диметиламинопропиламином, или гидразином.
Подходящей защитной группой для гидроксигруппы является, например, ацильная группа, например, алканоильная группа, такая как ацетильная группа, ароильная группа, например, бензоильная группа, или арилметильная группа, например, бензильная группа. Условия удаления указанных выше защитных групп неизбежно меняются при изменении выбранной защитной группы. Так, например, ацильную группу, такую как алканоильная или ароильная группа, можно удалить, например, с помощью гидролиза подходящим основанием, таким как гидроксид щелочного металла, например, гидроксид лития, натрия или аммония. Альтернативно, арилметильную группу, такую как бензильная группа, можно удалить, например, путем гидрирования над катализатором, таким как палладий на угле.
Подходящей защитной группой для карбоксигруппы является, например, этерифицирующая группа, например, метильная или этильная группа, которую можно удалить, например, с помощью гидролиза основанием, таким как гидроксид натрия, или например, трет-бутильная группа, которую можно удалить, например, путем обработки кислотой, например, органической кислотой, такой как трифторуксусная кислота, или например, бензильная группа, которую можно удалить, например, путем гидрирования над катализатором, таким как палладий на угле.
В качестве защитной группы также можно использовать смолы.
В предпочтительном объекте настоящее изобретение относится к способу синтеза соединения формулы I, или его фармацевтически приемлемой соли или сольвата, способ включает:
a) реакцию соединения формулы A:
Формула A
где R3 и R4 все обладают любым из значений, определенных выше в настоящем изобретении, и LGA означает подходящую отщепляющуюся группу;
с соединением формулы B:
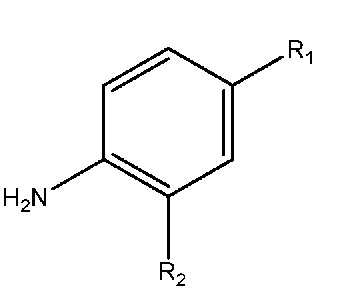
Формула B
где R1 и R2 являются такими, как определено в настоящем изобретении; и
b) затем необязательно и если необходимо:
i) удаление любых содержащихся защитных групп;
ii) превращение соединения формулы I в другое соединения формулы I; и/или
iii) образование его фармацевтически приемлемой соли или сольвата.
LGA может быть любой подходящей отщепляющейся группой. Предпочтительно, если LGA означает галоген или любую другую подходящую отщепляющуюся группу (например, трифторметилсульфонат и т.п.). Предпочтительно, если LGA может означать хлор, бром или трифторметилсульфонат.
Предпочтительно, если реакция сочетания между соединением A и соединением B протекает в присутствии подходящего растворителя. Любой подходящий растворитель или смесь растворителей можно использовать для этой реакции. Специалист в данной области техники должен знать, как выбрать подходящие растворители или смеси растворителей для использования в этих реакциях. Примеры подходящих растворителей включают ДМА (диметиламин), 1,4-диоксан, толуол, ДМФ (диметилформамид), tBuOH, ТГФ (тетрагидрофуран) и H2O.
Специалист в данной области техники должен уметь выбрать подходящие использующиеся условия проведения реакции, чтобы облегчить проведение этой реакции. Предпочтительно, если реакцию проводят в безводной среде и в инертной атмосфере, такой как атмосфера аргона или азота. Реакцию также можно провести при повышенной температуре, такой как, например, находящаяся в диапазоне от 80 до 160°C или, более предпочтительно, находящаяся в диапазоне от 100 до 160°C (в зависимости от использующегося растворителя), в течение подходящего периода времени, например, равного от 2 ч до 7 дней, или, более предпочтительно, равного от 2 до 10 ч при обычном нагревании или при нагревании микроволновым излучением.
Предпочтительно, если реакция сочетания между соединением A и соединением B протекает в присутствии катализатора, предпочтительно содержащего палладий катализатора, такого как Pd или Pd2(dba)3, или путем использования кислотного катализатора, такого как трифторуксусная кислота.
Предпочтительно, если реакция сочетания между соединением A и соединением B протекает в присутствии фосфорорганического соединения, предпочтительно фосфорорганического соединения, которое выступает в качестве лиганда для катализатора. Фосфорорганическое соединение предпочтительно может быть производным фосфина, таким как Xantphos.
Предпочтительно, если реакция сочетания между соединением A и соединением B протекает в присутствии основания, например, карбоната металла, такой как карбонат цезия, или гидридов металлов, таких как гидрид натрия.
Соединение формулы A можно получить по методикам, известным в данной области техники, и предпочтительно по методикам, описанным в настоящем изобретении со ссылкой на примеры.
Соединение формулы B можно получить по методикам, известным в данной области техники, и предпочтительно по методикам, описанным в настоящем изобретении со ссылкой на примеры.
Рацемические соединение формулы I можно разделить с помощью подходящей хиральной разделительной хроматографии и получить желательные энантиомеры.
Другим объектом настоящего изобретения является способ синтеза соединения формулы I, или его фармацевтически приемлемой соли или сольвата, способ включает:
a) реакцию соединения формулы C:
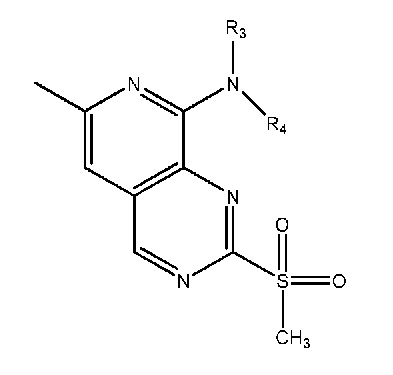
Формула C
где R3 и R4 все обладают любым из значений, определенных выше в настоящем изобретении;
с соединением формулы B, определенным выше в настоящем изобретении, или соединением формулы D:

Формула D
где R1 и R2 являются такими, как определено в настоящем изобретении; и
b) затем необязательно и если необходимо:
i) удаление любых содержащихся защитных групп;
ii) превращение соединения формулы I в другое соединения формулы I; и/или
iii) образование его фармацевтически приемлемой соли или сольвата.
Предпочтительно, если реакция сочетания между соединением C и соединением B или D протекает в присутствии подходящего растворителя. Любой подходящий растворитель или смесь растворителей можно использовать для этой реакции. Специалист в данной области техники должен знать, как выбрать подходящие растворители или смеси растворителей для использования в этих реакциях. Примеры подходящих растворителей включают ТГФ, ТФЭ (1,2,3-трифторэтанол) или ДМФ.
Специалист в данной области техники должен уметь выбрать подходящие использующиеся условия проведения реакции, чтобы облегчить проведение этой реакции. Предпочтительно, если реакцию проводят в безводной среде и в инертной атмосфере, такой как атмосфера аргона или азота. Реакцию также можно провести при повышенной температуре, такой как, например, находящаяся в диапазоне от 30 до 170°C или, более предпочтительно, находящаяся в диапазоне от 30 до 50°C для соединений формулы D и 120 до 170 50°C для соединений формулы B (в зависимости от использующегося растворителя), в течение подходящего периода времени, например, равного от 2 ч до 7 дней, или, более предпочтительно, равного от 2 до 10 ч при обычном нагревании или при нагревании микроволновым излучением.
Предпочтительно, если реакция сочетания между соединением C и соединениями B или D протекает в присутствии катализатора, предпочтительно содержащего палладий катализатора, такого как Pd или Pd2(dba)3, или путем использования кислотного катализатора, такого как трифторуксусная кислота.
Предпочтительно, если реакция сочетания между соединением C и соединениями B или D протекает в присутствии фосфорорганического соединения, предпочтительно фосфорорганического соединения, которое выступает в качестве лиганда для катализатора. Фосфорорганическое соединение предпочтительно может быть производным фосфина, таким как Xantphos.
Предпочтительно, если реакция сочетания между соединением C и соединениями B или D протекает в присутствии основания, например, карбоната металла, такого как карбонат цезия, или гидридов металлов, таких как гидрид натрия.
Соединение формулы C можно получить по методикам, известным в данной области техники, и предпочтительно по методикам, описанным в настоящем изобретении со ссылкой на примеры.
Соединение формулы D можно получить по методикам, известным в данной области техники, и предпочтительно по методикам, описанным в настоящем изобретении со ссылкой на примеры.
Другим объектом настоящего изобретения является способ синтеза соединения формулы I, или его фармацевтически приемлемой соли или сольвата, способ включает:
реакцию соединения формулы E:

Формула E
где R1 и R2 все обладают любым из значений, определенных выше в настоящем изобретении, и LGA означает подходящую отщепляющуюся группу, такую как определенная выше в настоящем изобретении;
с соединением формулы F:
HNR3R4
Формула F
и
затем необязательно и если необходимо:
удаление любых содержащихся защитных групп;
превращение соединения формулы I в другое соединения формулы I; и/или
образование его фармацевтически приемлемой соли или сольвата.
Как отмечено выше, LGA может быть любой подходящей отщепляющейся группой. Предпочтительно, если LGA означает галоген или любую другую подходящую отщепляющуюся группу (например, трифторметилсульфонат и т.п.). Предпочтительно, если LGA может означать хлор или бром.
Предпочтительно, если реакция сочетания между соединением E и соединением F протекает в присутствии подходящего растворителя. Любой подходящий растворитель или смесь растворителей можно использовать для этой реакции. Специалист в данной области техники должен знать, как выбрать подходящие растворители или смеси растворителей для использования в этих реакциях. Примеры подходящих растворителей включают диоксан, ДМА, NMP, ТГФ или ТФЭ.
Специалист в данной области техники должен уметь выбрать подходящие использующиеся условия проведения реакции, чтобы облегчить проведение этой реакции. Предпочтительно, если реакцию проводят в безводной среде и в инертной атмосфере, такой как атмосфера аргона или азота. Реакцию также можно провести при повышенной температуре, такой как, например, находящаяся в диапазоне от 100 до 140°C (в зависимости от использующегося растворителя), в течение подходящего периода времени, например, равного от 2 ч до 7 дней, или, более предпочтительно, равного от 2 до 10 ч при обычном нагревании или при нагревании микроволновым излучением.
Предпочтительно, если реакция сочетания между соединением E и соединением F протекает в присутствии катализатора, предпочтительно содержащего палладий катализатора, такого как Pd или Pd2(dba)3, Pd(PPh3)4 или Pd(dppf)Cl2, или путем использования кислотного катализатора, такого как трифторуксусная кислота.
Предпочтительно, если реакция сочетания между соединением E и соединением F протекает в присутствии фосфорорганического соединения, предпочтительно фосфорорганического соединения, которое выступает в качестве лиганда для катализатора. Фосфорорганическое соединение предпочтительно может быть производным фосфина, таким как Xantphos или DavePhos.
Предпочтительно, если реакция сочетания между соединением E и соединением F протекает в присутствии основания, например, карбоната металла, такого как карбонат цезия, или гидридов металлов, таких как гидрид натрия.
Соединение формулы E можно получить по методикам, известным в данной области техники, и/или по методикам, описанным в настоящем изобретении со ссылкой на примеры.
Соединение формулы F можно получить по методикам, известным в данной области техники, и/или по методикам, описанным в настоящем изобретении со ссылкой на примеры.
Полученное соединение формулы I можно выделить и очистить по методикам, хорошо известным в данной области техники.
Способы, определенные в настоящем изобретении, могут дополнительно включать стадию проведения для соединения формулы I солевого обмена, в особенности в случаях, когда соединение формулы I получают в виде смеси разных солевых форм. Солевой обмен предпочтительно включает иммобилизацию соединения формулы I на подходящей твердой подложке или смоле и элюирование соединений подходящей кислотой с получением одной соли соединения формулы I.
Другим объектом настоящего изобретения является соединение формулы I, которое можно получить любым из способов, определенных в настоящем изобретении.
Другим объектом настоящего изобретения является соединение формулы I, полученное любым из способов, определенных в настоящем изобретении.
Другим объектом настоящего изобретения является соединение формулы I, непосредственно полученное любым из способов, определенных в настоящем изобретении.
Например, конкретные схемы синтеза, с помощью которых можно получить соединения, предлагаемые в настоящем изобретении, приведены ниже на схемах 1-3:
Общая схема 1

Общая схема 2
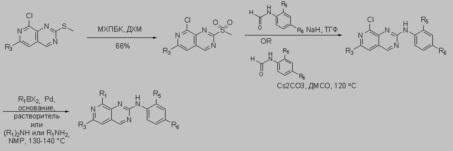
Общая схема 3

Биологическая активность
Описанные ниже биологические исследования можно использовать для изучения фармакологических характеристик соединений, предлагаемых в настоящем изобретении.
Исследование ингибирования киназы MPS1
Реакцию фермента (полный объем равен 10 мкл) проводили в черных 384-луночных малообъемных планшетах, содержащих полноразмерный MPS1 (12,5 нМ или 3 нМ), пептид с флуоресцентной меткой [известный под обозначением H236, который обладает последовательностью: 5FAM-DHTGFLTEYVATR-CONH2] (5 мкМ), АТФ (аденозинтрифосфат) (10 мкМ), или ДМСО (диметилсульфоксид) (1% об./об.). или исследуемое соединение (в диапазоне 0,25 нМ - 100 мкМ в 1% ДМСО) и буфер для анализа (50 мМ HEPES (pH 7,0), 0,02% NaN3, 0,01% БСА (бычий сывороточный альбумин), 0,1 мМ ортованадата, 10 мкМ MgCl2, 1мкМ ДТТ (дитиотреитол), ингибитор протеазы, выпускающийся фирмой Roche). Реакцию проводили в течение 60 мин при комнатной температуре и останавливали путем добавления буфера (10 мкл), содержащего 20 мМ ЭДТК (этилендиаминтетрауксусная кислота), 0,05% (об./об.) Brij-35 в 0,1M забуференном с помощью HEPES физиологическом растворе (свободная кислота, Sigma, UK). Планшеты считывали с помощью считывающего устройства Caliper EZ reader II (Caliper Life Sciences).
Считывающее устройство включает программное обеспечение (‘Reviewer’), которое преобразует высоты пиков в выраженную в% степень превращения путем измерения пиков продукта и субстрата и также дает возможность выбора контрольных лунок, соответствующих ингибированию на 0% и 100% соответственно. Выраженное в% ингибирование соединениями рассчитывают относительно среднего значения для выбранных контрольных лунок. Значения IC50 определяют путем исследования соединений в диапазоне концентраций, составляющем 0,25 нМ -100 мкМ. Затем выраженное в% ингибирование при каждой концентрации аппроксимируют 4-параметрической логической зависимостью:
y=(a+((b-a)/(1+((c/x^d))))
где a=asym мин, b=asym max, c=IC50 и d = коэффициент Хилла.
Обычно активность, которой обладают соединения формулы I, при исследовании ингибирования можно продемонстрировать с помощью значения IC50, равного менее 15 мкМ. Предпочтительно, если соединения обладают значением IC50, равным менее 10 мкМ, более предпочтительно менее 1 мкМ, более предпочтительно менее 0,1 мкМ и более предпочтительно менее 0,01 мкМ (т.е. менее 10 нМ).
Активности соединений, предлагаемых в настоящем изобретении, по данным указанных выше исследований приведены в прилагаемом разделе, посвященном примерам.
Фармацевтические композиции
Другим объектом настоящего изобретения является фармацевтическая композиция, которая включает соединение, предлагаемое в настоящем изобретении, определенное выше в настоящем изобретении, или его фармацевтически приемлемую соль или сольват, вместе с фармацевтически приемлемым разбавителем или носителем.
Композиции, предлагаемые в настоящем изобретении, могут находиться в форме, подходящей для перорального применения (например, такие как таблетки, пастилки, твердые или мягкие капсулы, водные или масляные суспензии, эмульсии, диспергирующиеся порошки или гранулы, сиропы или эликсиры), для местного применения (например, такие как кремы, мази, гели, или водные или масляные растворы или суспензии), для введения путем ингаляции (например, такие как тонкоизмельченный порошок или жидкий аэрозоль), для введения путем вдувания (например, такие как тонкоизмельченный порошок) или для парентерального введения (например, такие как стерильный водный или масляный раствор для внутривенного, подкожного, внутримышечного, внутрибрюшинного или внутримышечного введения или в форме суппозитория для ректального введения).
Композиции, предлагаемые в настоящем изобретении, можно получить по обычным методикам с использованием обычных фармацевтических инертных наполнителей, хорошо известных в данной области техники. Таким образом, композиции, предназначенная для перорального применения, может содержать, например, один или большее количество окрашивающих, подслащивающих, придающих вкус и/или консервирующих агентов.
Эффективное количество соединения, предлагаемого в настоящем изобретении, для применения в терапии пролиферативного заболевания означает количество, достаточное для ослабления у теплокровного животного, предпочтительно человека, симптомов инфекции, для замедления прогрессирования инфекции или уменьшения опасности ухудшения состояния у пациентов с симптомами инфекции.
Количество активного ингредиента, который объединяют с одним или большим количеством инертных наполнителей для получения разовой лекарственной формы, обязательно меняется в зависимости от подвергающегося лечению реципиента и конкретного пути введения. Например, состав, предназначенный для перорального введения людям, обычно содержит, например, от 0,5 мг до 0,5 г активного агента (более предпочтительно от 0,5 до 100 мг, например, от 1 до 30 мг) объединенного с подходящим и удобным количеством инертных наполнителей, которое может составлять от примерно 5 до примерно 98 масс.% в пересчете на всю композицию.
Величина предназначенной для терапевтических или профилактических целей дозы соединения формулы I естественным образом может меняться в соответствии с характером и тяжестью патологических состояний, возраста и пола животного или пациента и пути введения в соответствии с хорошо известными положениями медицины.
При использовании соединения, предлагаемого в настоящем изобретении, для терапевтических или профилактических целей его обычно вводят так, чтобы обеспечить суточную дозу, находящуюся в диапазоне, например, от 0,1 мг/кг до 75 мг/(кг массы тела), при необходимости вводимую в виде разделенных доз. Обычно меньшие дозы вводят, когда используют парентеральный путь. Так, например, для внутривенного или внутрибрюшинного введения, обычно используют дозу, находящуюся в диапазоне, например, от 0,1 мг/кг до 30 мг/(кг массы тела). Аналогичным образом, для введения путем ингаляции используют дозу, находящуюся в диапазоне, например, от 0,05 мг/кг до 25 мг/(кг массы тела). Пероральное введение также может быть подходящим, особенно в виде таблетки. Обычно готовят разовую дозу, которая содержит примерно от 0,5 мг до 0,5 г соединения, предлагаемого в настоящем изобретении.
Терапевтические применения и приложения
Одним объектом настоящего изобретения является соединение формулы I, или его фармацевтически приемлемая соль или сольват, или фармацевтическая композиция, определенная в настоящем изобретении, для применения в терапии.
Соединения, предлагаемые в настоящем изобретении, может ингибировать активность киназы Mps1. Таким образом, другим объектом настоящего изобретения является способ ингибирования активности киназы Mps1 в клетке, способ включает введение в указанную клетку соединения формулы I, определенного в настоящем изобретении, или его фармацевтически приемлемой соли или сольвата.
Другим объектом настоящего изобретения является способ ингибирования киназы Mps1 in vitro или in vivo, указанный способ включает взаимодействие клетки с эффективным количеством соединения или его фармацевтически приемлемой соли или сольвата, определенного в настоящем изобретении.
Другим объектом настоящего изобретения является способ ингибирования активности киназы Mps1 у человека или животного, нуждающегося в таком ингибировании, способ включает введение указанному субъекту эффективного количества соединения формулы I, определенного в настоящем изобретении, или его фармацевтически приемлемой соли или сольвата.
Другим объектом настоящего изобретения является соединение формулы I, определенное в настоящем изобретении, или его фармацевтически приемлемая соль или сольват для применения для лечения заболевания или патологического состояния, связанного с активностью киназы Mps1.
Другим объектом настоящего изобретения является применение соединения формулы I, определенного в настоящем изобретении, или его фармацевтически приемлемой соли или сольвата, для приготовления лекарственного средства для применения для лечения заболевания или патологического состояния, связанного с активностью киназы Mps1.
Другим объектом настоящего изобретения является способ лечения пролиферативного нарушения у человека или животного, способ включает введение указанному субъекту терапевтически приемлемого количества соединения формулы I, определенного в настоящем изобретении, или его фармацевтически приемлемой соли или сольвата.
Еще одним объектом настоящего изобретения является соединение формулы I, определенное в настоящем изобретении, или его фармацевтически приемлемая соль или сольват для применения для лечения пролиферативного нарушения.
Еще одним объектом настоящего изобретения является применение соединения формулы I, определенного в настоящем изобретении, или его фармацевтически приемлемой соли или сольвата, для приготовления лекарственного средства для применения для лечения пролиферативного нарушения.
Термин "пролиферативное нарушение" используется в настоящем изобретении взаимозаменяемым образом и относится к нежелательной или неконтролируемой пролиферации клеток с образованием избыточного количества клеток или аномальных клеток, что нежелательно, такой как, новообразовательный или гиперпластический рост in vitro или in vivo. Примеры пролиферативных патологических состояний включают, но не ограничиваются только ими, предраковая и злокачественная пролиферация, включая, но не ограничиваясь только ими, злокачественные неоплазии и опухоли, рак, лейкозы, псориаз, заболевания кости, фибропролиферативные нарушения (например, соединительных тканей) и атеросклероз. Можно лечить любые типы клеток, включая, но не ограничиваясь только ими, клетки легких, толстой кишки, молочной железы, яичников, предстательной железы, печени, поджелудочной железы, головного мозга и кожи.
Антипролиферативные воздействия соединений, предлагаемых в настоящем изобретении, находят конкретное применение при лечении раковых заболеваний человека вследствие их способности ингибировать киназу Mps1.
Противораковое воздействие может проявляться по
WO 02/30932PCT/GBOI/04557
одному или большему количеству механизмов, включая, но не ограничиваясь только ими, регулирование пролиферации клеток, ингибирование ангиогенеза (образования новых кровеносных сосудов), ингибирование метастазирования (распространение опухоли их ее источника), ингибирование инвазии (распространение опухолевых клеток на соседние нормальные структуры) или стимулирование апоптоза (запрограммированная гибель клеток).
Поэтому другим объектом настоящего изобретения является соединение или его фармацевтически приемлемая соль или сольват, или фармацевтическая композиция, определенная в настоящем изобретении, для применения для лечения рака.
Еще одним объектом настоящего изобретения является применение соединения или его фармацевтически приемлемой соли или сольвата, определенного в настоящем изобретении, для приготовления лекарственного средства для применения для лечения рака.
Другим объектом настоящего изобретения является способ лечения рака у пациента, нуждающегося в таком лечении, указанный способ включает введение указанному пациенту терапевтически эффективного количества соединения или его фармацевтически приемлемой соли или сольвата, или фармацевтической композиции, определенной в настоящем изобретении.
Настоящее изобретение также относится к способу лечения организма человека или животного, способ включает введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества активного соединения, предпочтительно в форме фармацевтической композиции.
Пути введения
Соединения, предлагаемые в настоящем изобретении, или фармацевтическую композицию, содержащую активное соединение, можно вводить субъекту по любому обычному пути введения, системно/периферически или местно (т.е. на участок желательного воздействия).
Пути введения включают, но не ограничиваются только ими, пероральный (например, путем проглатывании); трансбуккальный; сублингвальный; чрескожный (включая, например, с помощью повязки, пластыря и т.п.); через слизистую оболочку (включая, например, с помощью повязки, пластыря и т.п.); интраназальный (например, с помощью назального спрея); глазной (например, с помощью глазных капель); легочный (например, с помощью ингаляции или вдувания с использованием, например, аэрозоля, например, через нос или рот); ректальный (например, с помощью суппозитория или спринцовки); вагинальный (например, с помощью пессария); парентеральный, например, с помощью инъекции, включая подкожный, внутрикожный, внутримышечный, внутривенный, внутриартериальный, внутрисердечный, внутриоболочечный, внутрипозвоночный, внутрикапсулярный, подкапсулярный, внутриорбитальный, внутрибрюшинный, внутритрахеальный, субкутикулярный, внутрисуставной, субарахноидальный и надчревный; с помощью имплантата депо или резервуара, например, подкожно или внутримышечно.
Комбинационные терапии
Антипролиферативное лечение, определенное выше в настоящем изобретении, можно использовать в качестве единственного средства лечения или в дополнение к соединению, предлагаемому в настоящем изобретении, оно может включать обычную хирургию или радиотерапию, или химиотерапию. Такая химиотерапия может включать один или большее количество следующих категорий противоопухолевых средств:
(i) другие антипролиферативные/противоопухолевые лекарственные средства и их комбинации, использующиеся в медицинской онкологии, такие как алкилирующие средства (например, цисплатин, оксалиплатин, карбоплатин, циклофосфамид, азотистый иприт, мелфалан, хлорамбуцил, бусульфан, темозоламид и нитрозомочевины); антиметаболиты (например, гемцитабин и антифолаты, такие как фторпиримидины, такие как 5-фторурацил и тегафур, ралтитрексед, метотрексат, цитозинарабинозид и гидроксимочевина); противоопухолевые антибиотики (например, антрациклины, такие как адриамицин, блеомицин, доксорубицин, дауномицин, эпирубицин, идарубицин, митомицин-C, дактиномицин и митрамицин); антимитотические средства (например, алкалоиды барвинка, такие как винкристин, винбластин, виндезин и винорелбин, и таксоиды, таксол и таксотер и ингибиторы киназы polo); и ингибиторы топоизомеразы (например, эпиподофиллотоксины, такие как этопозид и тенипозид, амсакрин, топотекан и камптотецин);
(ii) цитостатические средства, такие как антиэстрогены (например, тамоксифен, фулвестрант, торемифен, ралоксифен, дролоксифен и йодоксифен), антиандрогены (например, бикалутамид, флутамид, нилутамид и ципротеронацетат), антагонисты LHRH или агонисты LHRH (например, гозерелин, лейпрорелин и бусерелин), прогестогены (например, мегэстролацетат), ингибиторы ароматазы (например, такие как анастрозол, летрозол, воразол и эксеместан) и ингибиторы 5α-редуктазы, такие как финастерид;
(iii) противоинвазивные средства [например, ингибиторы семейства киназ c-Src, такие как 4-(6-хлор-2,3-метилендиоксианилино)-7-[2-(4-метилпиперазин-1-ил)этокси]-5-тетрагидропиран-4-илоксихиназолин (AZD0530; заявка на междунарожный патент WO 01/94341), N-(2-хлор-6-метилфенил)-2-{6-[4-(2-гидроксиэтил)пиперазин-1-ил]-2-метилпиримидин-4-иламино}тиазол-5-карбоксамид (дасатиниб, BMS-354825; J. Med. Chem., 2004, 47, 6658-6661) и босутиниб (SKI-606) и ингибиторы металлопротеиназы, такие как маримастат, ингибиторы функции активатора рецептора плазминогена урокиназы или антитела к гепараназе];
(iv) ингибиторы функции фактора роста: например, такие ингибиторы включают антитела к фактору роста и антитела к рецептору фактора роста (например, антитела к erbB2 трастузумаб [герцептин™], антитела к EGFR панитумумаб, антитела к erbB1 цетуксимаб [эрбутукс, C225] и антитела к любому фактору роста и антитела к любому рецептору фактора роста, рассмотренные в публикации Stern et al. Critical reviews in oncology/haematology, 2005, Vol. 54, pp11-29); такие ингибиторы также включают ингибиторы тирозинкиназы, например, ингибиторы семейства эпидермальных факторов роста (например, ингибиторы семейства тирозинкиназ EGFR, такие как N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолинопропокси)хиназолин-4-амин (гефитиниб, ZD1839), N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амин (эрлотиниб, OSI-774) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3-морфолинопропокси)-хиназолин-4-амин (CI 1033), ингибиторы тирозинкиназы erbB2, такие как лапатиниб); ингибиторы семейства гепатоцитарных факторов роста; ингибиторы семейства инсулиных факторов роста; ингибиторы семейства тромбоцитарных факторов роста, такие как иматиниб и/или нилотиниб (AMN107); ингибиторы серин/треонинкиназ (например, ингибиторы передачи сигналов Ras/Raf, такие как ингибиторы фарнезилтрансферазы, например, сорафениб (BAY 43-9006), типифарниб (R115777) и лонафарниб (SCH66336)), ингибиторы передачи сигналов клеток через киназы MEK и/или AKT, ингибиторы c-kit, ингибиторы киназы abl, ингибиторы киназы PI3, ингибиторы киназы Plt3, ингибиторы киназы CSF-1R, ингибиторы киназы рецептора IGF (инсулиноподобный фактор роста); ингибиторы киназы aurora (например, AZD1152, PH739358, VX-680, MLN8054, R763, MP235, MP529, VX-528 И AX39459) и ингибиторы циклинзависимой киназы, такие как ингибиторы CDK2 и/или CDK4;
(v) антиангиогенные средства, такие как, которые ингибируют воздействие сосудистого эндотелиального фактора роста [например, антитела к фактору роста эндотелиальных клеток сосудов бевацизумаб (авастин™) и, например, ингибитор тирозинкиназы рецептора VEGF, такой как вандетаниб (ZD6474), ваталаниб (PTK787), сунитиниб (SU11248), акситиниб (AG-013736), пазопаниб (GW 786034) и 4-(4-фтор-2-метилиндол-5-илокси)-6-метокси-7-(3-пирролидин-1-илпропокси)хиназолин (AZD2171; пример 240 в WO 00/47212), соединения, такие как раскрытые в заявках на международный патент WO97/22596, WO 97/30035, WO 97/32856 и WO 98/13354, и соединения, которые действуют по другим механизмам (например, линомид, ингибиторы функции интегрина αvβ3 и ангиостатин)];
(vi) повреждающие сосуды средства, такие как комбретастатин A4 и соединения, раскрытые в заявках на международный патент WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и WO 02/08213;
(vii) антагонист эндотелинового рецептора, например, зиботентан (ZD4054) или атрасентан;
(viii) антисмысловые средства, например, такое, которые направлены на мишени, перечисленные выше, такие как ISIS 2503, антисмысловое средство против ras;
(ix) средства генной терапии, включая например, средства для замены аберрантных генов, такие как аберрантный p53 или аберрантный BRCA1 или BRCA2, GDEPT (направленное на гены ферментное пролекарственное средство), такие как те, в которых используют цитозиндезаминазу, тимидинкиназу или бактериальный фермент нитроредуктазу, и средства для улучшения переносимости пациентом химиотерапии или радиотерапии, такое как генная терапия в случае рекарственной мультирезистентности; и
(x) средства иммунотерапии, включая например, средства ex vivo и in vivo для усиления иммуногенности опухолевых клеток пациента, такие как трансфицирование цитокинами, такими как интерлейкин 2, интерлейкин 4 или гранулоцитарно-макрофагально колониестимулирующий фактор, средства для снижения анергии T-клеток, средства, в которых используют трансфицированные иммунные клетки, такие как трансфицированные цитокином дендритные клетки, средства, в которых используют трансфицированные цитокином линии опухолевых клеток, и средства, в которых используют антиидиотипические антитела.
Такое объединенное лечение можно провести с помощью одновременного, последовательного или раздельного введения отдельных компонентов средства. В таких комбинированных продуктах используются соединения, предлагаемые в настоящем изобретении, с применением диапазонов доз, описанных выше в настоящем изобретении, и другой фармацевтически активный агент с применением утвержденного для него диапазона доз.
Этим объектом настоящего изобретения является комбинация, подходящая для применения для лечения рака (например, рака, включающего солидную опухоль), включающая соединение, предлагаемое в настоящем изобретении, определенное выше в настоящем изобретении, или его фармацевтически приемлемую соль или сольват и другое противоопухолевое средство.
Этим объектом настоящего изобретения является комбинация, подходящая для применения для лечения рака (например, рака, включающего сóлидную опухоль), включающая соединение, предлагаемое в настоящем изобретении, определенное выше в настоящем изобретении, или его фармацевтически приемлемую соль или сольват и любое из противоопухолевых средств, перечисленных выше в разделах (i)-(ix).
Другим объектом настоящего изобретения является соединение, предлагаемое в настоящем изобретении, или его фармацевтически приемлемая соль или сольват в комбинации с противоопухолевым средством, выбранным из числа перечисленных в разделах (i)-(ix) выше в настоящем изобретении.
В настоящем изобретении при использовании термина "комбинация" следует понимать, что это означает одновременное, раздельное или последовательное введение. В одном объекте настоящего изобретения "комбинация" означает одновременное введение. В другом объекте настоящего изобретения "комбинация" означает раздельное введение. В другом объекте настоящего изобретения "комбинация" означает последовательное введение. Если введение является последовательным или раздельным, то задержка введения второго компонента не должна быть такой, чтобы утрачивался благоприятный результат использования комбинации.
Другим объектом настоящего изобретения является фармацевтическая композиция, которая включает соединение, предлагаемое в настоящем изобретении, или его фармацевтически приемлемую соль или сольват в комбинации с противоопухолевым средством, выбранным из числа перечисленных в разделах (i)-(ix) выше в настоящем изобретении, вместе с фармацевтически приемлемым разбавителем или носителем.
Примеры
Общие экспериментальные методики
Анализ с помощью ЖХ/МС (жидкостная хроматография/масс-спектроскопия) проводили с помощью прибора Waters Alliance 2795 Separations Module и детектора поглощения при двух длинах волн Waters 2487, соединенного с времяпролетным масс-спектрометром Waters/Micromass LCt с источником ИЭР. Аналитическое разделение проводили при 30°C на колонке Merck Chromolith SpeedROD (RP-18e, 50×4,6 мм) при скорости потока, равной 2 мл/мин, при проводимом в течение 3,5 мин элюировании в градиентном режиме с детектором при 254 нм или на колонке Merck Purospher STAR (RP-18e, 30×4 мм) при скорости потока, равной 1,5 мл/мин, при проводимом в течение 3,5 мин элюировании в градиентном режиме с детектором при 254 нм. Подвижная фаза представляла собой смесь MeOH (растворитель A) и воды (растворитель B), оба содержали муравьиную кислоту при концентрации, равной 0,1%. Элюирование в градиентном режиме проводили следующим образом: от 1:9 (A/B) до 9:1 (A/B) за 2,25 мин, 9:1 (A/B) в течение 0,75 мин и затем возвращение к 1:9 (A/B) за 0,3 мин, в заключение 1:9 (A/B) в течение 0,2 мин (ИЭР-МСВР (ионизация электрораспылением - масс-спектроскопия высокого разрешения) методика A).
Анализы с помощью ЖХ/МС и МСВР проводили на приборе Agilent 1200 series HPLC с детектором на диодной матрице, соединенным с времяпролетным масс-спектрометром 6210 двойным многомодовым работающем при атмосферном давлении источником ХИ (химическая ионизация)/ИЭР. Аналитическое разделение проводили при 30°C на колонке Merck Chromolith SpeedROD (RP-18e, 50×4,6 мм) при скорости потока, равной 2 мл/мин, при проводимом в течение 4 мин элюировании в градиентном режиме с детектором при 254 нм или на колонке Merck Purospher STAR (RP-18e, 30×4 мм) при скорости потока, равной 1,5 мл/мин, при проводимом в течение 4 мин элюировании в градиентном режиме с детектором при 254 нм. Подвижная фаза представляла собой смесь MeOH (растворитель A) и воды (растворитель B) оба содержали муравьиную кислоту при концентрации, равной 0,1%. Элюирование в градиентном режиме проводили следующим образом: от 1:9 (A/B) до 9:1 (A/B) за 2,5 мин, 9:1 (A/B) в течение 1 мин, и затем возвращение к 1:9 (A/B) за 0,3 мин, в заключение 1:9 (A/B) в течение 0,2 мин (методика по умолчанию, ее также называют ИЭР-МСВР методика B). Для анализа с помощью МСВР использовали следующие эталонные массы: кофеин [M+H]+ 195,087652; (гексакис(1H,1H,3H-тетрафторпентокси)фосфазен [M+H]+ 922,009798) и гексакис(2,2-дифторэтокси)фосфазен [M+H]+ 622,02896 или резерпин [M+H]+ 609,280657.
Анализ с помощью ЖХ/МС и МСВР также проводили с помощью прибора Waters Acquity UPLC и с детектором на диодной матрице, соединенным с масс-спектрометром Waters G2 QToF, снабженным многомодовым источником ИЭР/APCI. Аналитическое разделение проводили при 30°C на колонке Phenomenex Kinetex XB-C18 (30×2,1 мм, 1,7 мкм, 100A) при скорости потока, равной 0,3 мл/мин, при проводимом в течение 4 мин элюировании в градиентном режиме с детектором при 254 нм. Подвижная фаза представляла собой смесь метанола (растворитель A) и воды и они содержали муравьиную кислоту при концентрации, равной 0,1% (растворитель B). Элюирование в градиентном режиме проводили следующим образом: от 1:9 (A/B) до 9:1 (A/B) за 3 мин, 9:1 (A/B) в течение 0,5 мин, и затем возвращение к 1:9 (A/B) за 0,3 мин, в заключение 1:9 (A/B) в течение 0,2 мин (ее также называют ИЭР-МСВР методика C). Для анализа с помощью МСВР использовали следующие эталонные массы: фрагментный ион лейцина энкефалина [M+H]+ 397,1876 [C21H25N4O4+H]+
Общие методики ВЭЖХ (высокоэффективная жидкостная хроматография)
Fast2mins: Аналитическое разделение проводили при 40°C на колонке Merck Purospher STAR (RP-18e, 30×4 мм) при скорости потока, равной 3 мл/мин, при проводимом в течение 2 мин элюировании в градиентном режиме с детектором при 254 нм. Подвижная фаза представляла собой смесь метанола (растворитель A) и воды и они содержали муравьиную кислоту при концентрации, равной 0,1% (растворитель B). Элюирование в градиентном режиме проводили следующим образом: от 1:9 (A/B) до 9:1 (A/B) за 1,25 мин, 9:1 (A/B) в течение 0,5 мин, и затем возвращение к 1:9 (A/B) за 0,15 мин, в заключение 1:9 (A/B) в течение 0,1 мин.
Fast4mins: Аналитическое разделение проводили при 30°C на колонке Merck Purospher STAR (RP-18e, 30×4 мм) при скорости потока, равной 1,5 мл/мин, при проводимом в течение 4 мин элюировании в градиентном режиме с детектором при 254 нм. Подвижная фаза представляла собой смесь метанола (растворитель A) и воды и они содержали муравьиную кислоту при концентрации, равной 0,1% (растворитель B). Элюирование в градиентном режиме проводили следующим образом: от 1:9 (A/B) до 9:1 (A/B) за 2,5 мин, 9:1 (A/B) в течение 1 мин, и затем возвращение к 1:9 (A/B) за 0,3 мин, в заключение 1:9 (A/B) в течение 0,2 мин.
Пример 1
N2-(2-Метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин
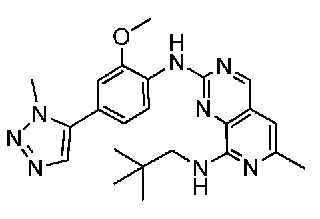
Методика 1
К раствору 6-метил-2-(метилсульфонил)-N-неопентилпиридо[3,4-d]пиримидин-8-амина (синтез 4, 29 мг, 0,094 ммоля) в ДМСО (7 мл) добавляли N-(2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)формамид (синтез 31, 22 мг, 0,094 ммоля) и Cs2CO3 (61 мг, 0,188 ммоля). Реакционную смесь нагревали при 100°C в течение 18 ч. Реакционную смесь разбавляли с помощью EtOAc и водой. Органический слой промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали путем элюирования через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH и получали искомое соединение (13,4 мг, 33%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 9,04 (s, 1H), 8,69 (d, J=8,5 Гц, 1H), 7,84 (s, 1H), 7,23 (d, J=2,0 Гц, 1H), 7,16 (d, J=8,5, 2,0 Гц, 1H), 6,71 (s, 1H), 4,16 (s, 3H), 4,05 (s, 3H), 3,47 (s, 2H), 2,44 (d, J=0,5 Гц, 3H), 1,09 (s, 9H).
МСВР (ИЭР) МС m/z рассчитано для C23H29N8O [M+H]+ 433,2459, найдено 433,2449
MPS1 IC50 (мкМ): 0,0005
Пример 2
N2-(2-Этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин
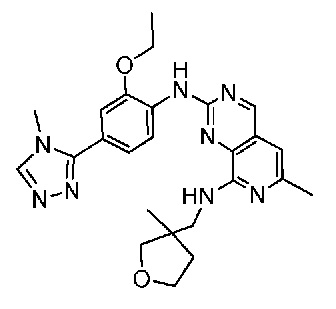
К раствору 6-метил-2-(метилсульфонил)-N-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-8-амина (синтез 5, 34 мг, 0,101 ммоля) в ДМСО (7 мл) добавляли N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)формамид (синтез 32, 30 мг, 0,121 ммоля) и Cs2CO3 (66 мг, 0,202 ммоля). Реакционную смесь нагревали при 100°C в течение 18 ч. Реакционную смесь разбавляли с помощью EtOAc и водой. Органический слой промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ (дихлорметан), затем путем элюирования через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH и получали искомое соединение (27,6 мг, 58%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 9,06 (s, 1H), 8,82 (d, J=8,5 Гц, 1H), 8,55 (s, 1H), 7,40-7,37 (m, 2H), 6,74 (s, 1H), 4,31 (q, J=7,0 Гц, 2H), 4,08 (td, J=8,5, 5,0 Гц, 1H), 3,93-3,90 (m, 2H), 3,87 (s, 3H), 3,71 (d, J=13,5 Гц, 1H), 3,64 (d, J=13,5 Гц, 1H), 3,52 (d, J=8,5 Гц, 1H), 2,45 (s, 3H), 2,08 (m, 1H), 1,82 (m, 1H), 1,56 (t, J=7,0 Гц, 3H), 1,29 (s, 3H).
МСВР (ИЭР) МС m/z рассчитано для C25H31N8O2 [M+H]+ 475,2564, найдено 475,2549.
MPS1 IC50 (мкМ): 0,002
Пример 3
1-(2-((2-Этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил
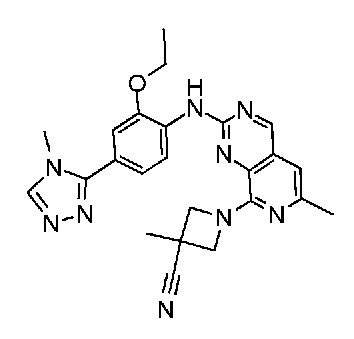
К раствору 3-метил-1-(6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидин-8-ил)азетидин-3-карбонитрила (синтез 7, 64 мг, 0,202 ммоля) в ДМСО (7 мл) добавляли N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)формамид (синтез 32, 60 мг, 0,242 ммоля) и Cs2CO3 (131 мг, 0,403 ммоля). Реакционную смесь нагревали при 100°C в течение 18 ч. Реакционную смесь разбавляли с помощью EtOAc и водой. Органический слой промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ, затем путем элюирования через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH и получали искомое соединение (34,6 мг, 38%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 9,10 (s, 1H), 8,56 (s, 1H), 8,46 (d, J=8,5 Гц, 1H), 7,40 (dd, J=8,5, 2,0 Гц, 1H), 7,39 (d, J=2,0 Гц, 1H), 6,91 (s, 1H), 4,75 (d, J=9,0 Гц, 2H), 4,39 (d, J=9,0 Гц, 2H), 4,28 (q, J=7,0 Гц, 2H), 3,88 (s, 3H), 2,47 (s, 3H), 1,75 (s, 3H), 1,53 (t, J=7,0 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C24H26N9O [M+H]+ 456,2255, найдено 456,2180.
MPS1 IC50 (мкМ): 0,003
Пример 4
N-(2-Этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин
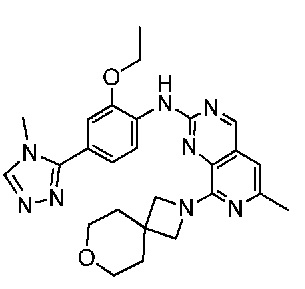
К раствору 2-(6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидин-8-ил)-7-окса-2-азаспиро[3.5]нонана (синтез 8, 15 мг, 0,044 ммоля) в ДМСО (4 мл) добавляли N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)формамид (синтез 32, 13 мг, 0,052 ммоля) и Cs2CO3 (28 мг, 0,087 ммоля). Реакционную смесь нагревали при 100°C в течение 18 ч. Реакционную смесь разбавляли с помощью EtOAc и водой. Органический слой промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ, затем путем элюирования через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH и получали искомое соединение (9,7 мг, 46%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 9,06 (s, 1H), 8,57 (d, J=8,5 Гц, 1H), 8,56 (s, 1H), 7,39 (d, J=2,0 Гц, 1H), 7,36 (dd, J=8,5, 2,0 Гц, 1H), 6,78 (s, 1H), 4,31-4,27 (m, 6H), 3,87 (s, 3H), 3,69 (кажущийся t, J=5,5 Гц, 4H), 2,44 (s, 3H), 1,89 (кажущийся t, J=5,5 Гц, 4H), 1,54 (t, J=7,0 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C26H31N8O2 [M+H]+ 487,2564, найдено 487,2511.
MPS1 IC50 (мкМ): 0,002
Пример 5
1-(2-((2-Этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)пиперидин-4-карбонитрил
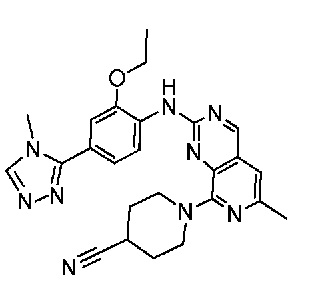
К раствору 1-(6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидин-8-ил)пиперидин-4-карбонитрила (синтез 9, 22 мг, 0,067 ммоля) в ДМСО (5 мл) добавляли N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)формамид (синтез 32, 20 мг, 0,081 ммоля) и Cs2CO3 (44 мг, 0,135 ммоля). Реакционную смесь нагревали при 100°C в течение 18 ч. Реакционную смесь разбавляли с помощью EtOAc и водой. Органический слой промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ, затем путем элюирования через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH и получали искомое соединение (14,7 мг, 47%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 9,16 (s, 1H), 8,84 (d, J=8,5 Гц, 1H), 8,56 (s, 1H), 7,41-7,39 (m, 2H), 7,07 (s, 1H), 4,31 (q, J=7,0 Гц, 2H), 4,20-4,15 (m, 2H), 3,89 (s, 3H), 3,69-3,64 (m, 2H), 3,10 (m, 1H), 2,51 (s, 3H), 2,24-2,18 (m, 2H), 2,12-2,07 (m, 2H), 1,56 (t, J=7,0 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C25H28N9O [M+H]+ 470,2411, найдено 470,2394.
MPS1 IC50 (мкМ): 0,003
Пример 6
N2-(2-Этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-2,8-диамин
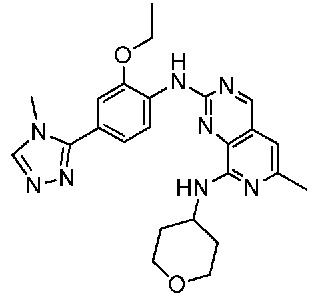
К раствору 6-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-8-амина (синтез 12, 19 мг, 0,059 ммоля) в ДМСО (5 мл) добавляли N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)формамид (синтез 32, 17 мг, 0,071 ммоля) и Cs2CO3 (38 мг, 0,118 ммоля). Реакционную смесь нагревали при 100°C в течение 18 ч. Реакционную смесь разбавляли с помощью EtOAc и водой. Органический слой промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ, затем путем элюирования через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH и получали искомое соединение (15 мг, 55%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 9,06 (s, 1H), 8,70 (d, J=9,0 Гц, 1H), 8,56 (s, 1H), 7,41-7,38 (m, 2H), 6,75 (d, J=0,5 Гц, 1H), 4,60 (br s, 2H), 4,36 (m, 1H), 4,31 (q, J=7,0 Гц, 2H), 4,03 (dt, J=12,0, 2,5 Гц, 1H), 3,88 (s, 3H), 3,65 (td, J=12,0, 2,5 Гц, 1H), 2,45 (d, J=0,5 Гц, 3H), 2,16-2,12 (m, 2H), 1,77-1,69 (m, 2H), 1,56 (t, J=7,0 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C24H29N8O2 [M+H]+ 461,2408, найдено 461,2388.
MPS1 IC50 (мкМ): 0,005
Пример 7
N2-(4-(4,5-Диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин
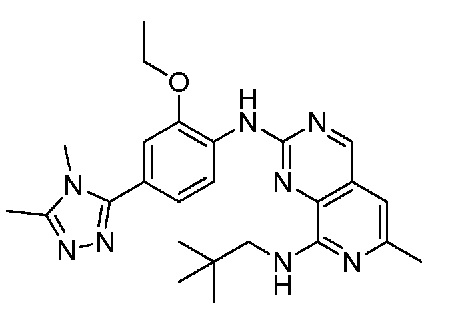
К 6-метил-2-(метилсульфонил)-N-неопентилпиридо[3,4-d]пиримидин-8-амину (синтез 4, 20 мг, 0,063 ммоля) добавляли Cs2CO3 (28 мг, 0,086 ммоля) и N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)формамид (синтез 43, 15 мг, 0,058 ммоля) в ДМСО (2,0 мл). Реакционную смесь нагревали при 100°C в течение 18 ч. Реакционную смесь разбавляли с помощью EtOAc и водой. Водный слой повторно экстрагировали с помощью EtOAc и объединенные органические слои сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ, затем путем элюирования через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH и получали искомое соединение (14,8 мг, 56%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 9,06 (s, 1H), 8,75 (d, J=8,5 Гц, 1H), 7,34 (d, J=1,9 Гц, 1H), 7,28 (dd, J=8,5, 1,9 Гц, 1H), 6,72 (s, 1H), 4,30 (q, J=7,2 Гц, 1H), 3,71 (s, 3H), 3,48 (s, 2H), 2,53 (s, 3H), 2,45 (s, 3H), 1,56 (t, J=7,2 Гц, 3H), 1,10 (s, 9H).
МСВР (ИЭР) МС m/z рассчитано для C25H33N8O [M+H]+ 461,2772, найдено 461,2756.
MPS1 IC50 (мкМ): 0,004
Примеры 8-26
Соединения указанных ниже примеров получали по методике 1 (пример 1), приведенной выше, с использованием подходящего метилсульфонилпиридопиримидина и подходящего формамида, как это описано. Неочищенные остатки реакции очищали, как указано выше, или по одной из следующих методик очистки (МО):
Методика очистки A: Колоночная хроматография на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ, затем путем элюирования через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH.
Методика очистки B: Колоночная хроматография на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ.
Методика очистки C: Колоночная хроматография на силикагеле при элюировании с помощью 0-30% EtOAc в циклогексане.
Методика очистки D: Колоночная хроматография на силикагеле при элюировании с помощью 0-5% MeOH в ДХМ.
Методика очистки E: Колоночная хроматография на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ, затем колоночная хроматография на силикагеле при элюировании с помощью 0-10% MeOH в EtOAc, затем путем элюирования через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH.
Методика очистки F: Колоночная хроматография на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ, затем колоночная хроматография на силикагеле при элюировании с помощью 3-10% MeOH в ДХМ.
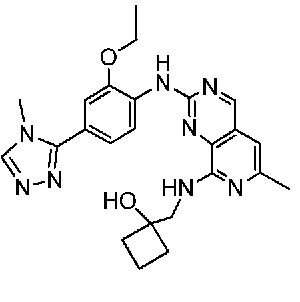
МСВР (ИЭР) МС m/z рассчитано для C24H29N8O2 [M+H]+ 461,2408, найдено 461,2391.
С использованием 1-(((6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидин-8-ил)амино)метил)циклобутанол (синтез 6) и N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)формамида (синтез 32).
МО A.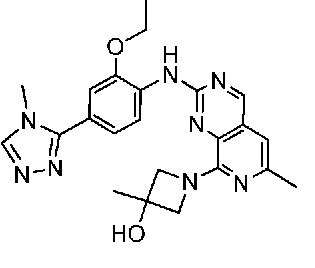
МСВР (ИЭР) МС m/z рассчитано для C23H27N8O2 [M+H]+ 447,2251, найдено 447,2207.
С использованием 3-метил-1-(6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидин-8-ил)азетидин-3-ол (синтез 10) и N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)формамида (синтез 32). МО A.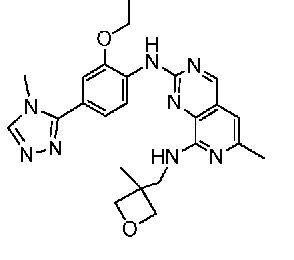
МСВР (ИЭР) МС m/z рассчитано для C24H29N8O2 [M+H]+ 461,2408, найдено 461,2407.
С использованием 6-метил-N-((3-метилоксетан-3-ил)метил)-2-(метилсульфонил)пиридо[3,4-d]пиримидин-8-амина (синтез 11) и N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)формамида (синтез 32).
МО A. 
МСВР (ИЭР) МС m/z рассчитано для C24H30N7O [M+H]+ 432,2506, найдено 432,2487.
С использованием 6-метил-2-(метилсульфонил)-N-неопентилпиридо[3,4-d]пиримидин-8-амина (синтез 4) и N-(2-метокси-4-(1-метил-1H-пиразол-3-ил)фенил)формамида (синтез 33).
МО A.
МСВР (ИЭР) МС m/z рассчитано для C24H30N7O [M+H]+ 433,2535, найдено 433,2512.
С использованием 6-метил-2-(метилсульфонил)-N-неопентилпиридо[3,4-d]пиримидин-8-амина (синтез 4) и N-(2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)формамида (синтез 34).
МО B.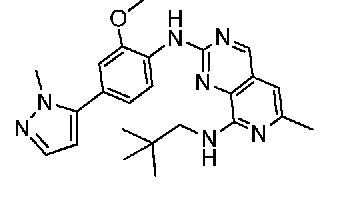
МСВР (ИЭР) МС m/z рассчитано для C24H30N7O [M+H]+ 432,2506, найдено 432,2503.
С использованием 6-метил-2-(метилсульфонил)-N-неопентилпиридо[3,4-d]пиримидин-8-амина (синтез 4) и N-(2-метокси-4-(1-метил-1H-пиразол-5-ил)фенил)формамида (синтез 35).
МО B.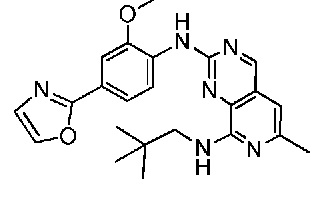
МСВР (ИЭР) МС m/z рассчитано для C23H27N6O2 [M+H]+ 419,219, найдено 419,217.
С использованием 6-метил-2-(метилсульфонил)-N-неопентилпиридо[3,4-d]пиримидин-8-амина (синтез 4) и N-(2-метокси-4-(оксазол-2-ил)фенил)формамида (синтез 36).
МО B.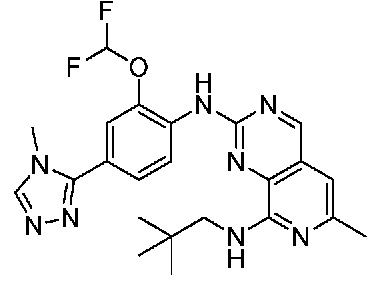
МСВР (ИЭР) МС m/z рассчитано для C23H27F2N8O [M+H]+ 469,2276, найдено 469,2263.
С использованием 6-метил-2-(метилсульфонил)-N-неопентилпиридо[3,4-d]пиримидин-8-амина (синтез 4) и N-(2-(Дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)формамида (синтез 38).
МО C.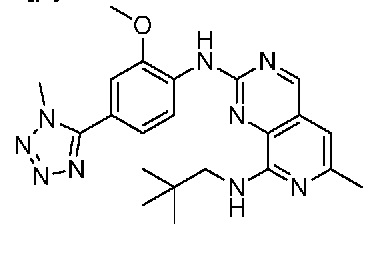
МСВР (ИЭР) МС m/z рассчитано для C22H28N9O [M+H]+ 434,2417, найдено 434,2406.
С использованием 6-метил-2-(метилсульфонил)-N-неопентилпиридо[3,4-d]пиримидин-8-амина (синтез 4) и N-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)формамида (синтез 39)
МО D.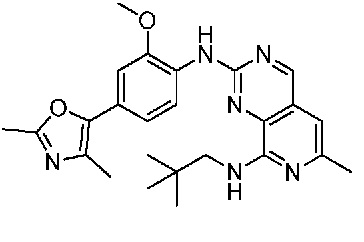
МСВР (ИЭР) МС m/z рассчитано для C25H31N6O2 [M+H]+ 447,2508, найдено 447,2508.
С использованием 6-метил-2-(метилсульфонил)-N-неопентилпиридо[3,4-d]пиримидин-8-амина (синтез 4) и N-(4-(2,4-диметилоксазол-5-ил)-2-метоксифенил)формамида (синтез 40).
МО A.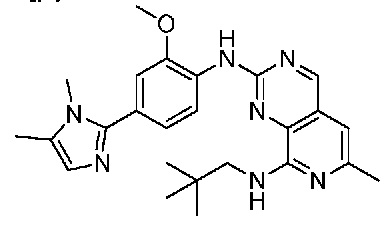
МСВР (ИЭР) МС/z рассчитано для C25H32N7O [M+H]+ 446,2668, найдено 446,2670.
С использованием 6-метил-2-(метилсульфонил)-N-неопентилпиридо[3,4-d]пиримидин-8-амина (синтез 4) и N-(4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксифенил)формамида (синтез 41).
МО A.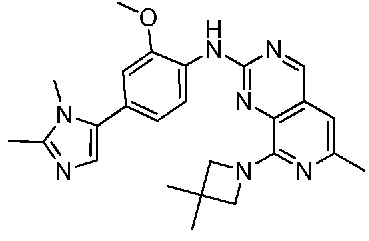
МСВР (ИЭР) МС m/z рассчитано для C25H30N7O [M+H]+ 444,2512, найдено 444,2516
С использованием 8-(3,3-диметилазетидин-1-ил)-6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидина (синтез 13) и N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)формамида (синтез 37) при 120°C в течение 18 ч.
МО A.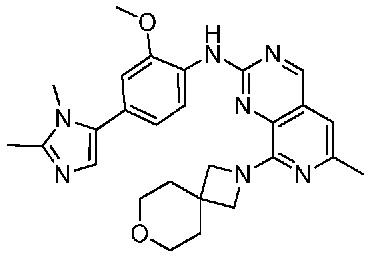
МСВР (ИЭР) МС m/z рассчитано для C27H31N7O2 [M+H]+ 486,2617, найдено 486,2623.
С использованием 2-(6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидин-8-ил)-7-окса-2-азаспиро[3.5]нонана (синтез 8) и N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)формамида (синтез 37) при 120°C в течение 18 ч.
МО E.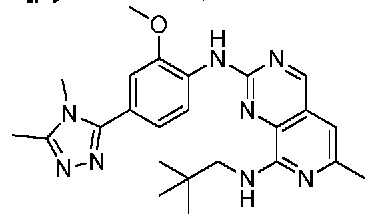
МСВР (ИЭР) МС m/z рассчитано для C24H31N8O [M+H]+ 447,2621, найдено 447,2626.
С использованием 6-метил-2-(метилсульфонил)-N-неопентилпиридо[3,4-d]пиримидин-8-амина (синтез 4) и N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-метоксифенил)формамида (синтез 37) при 120°C в течение 18 ч.
МО A.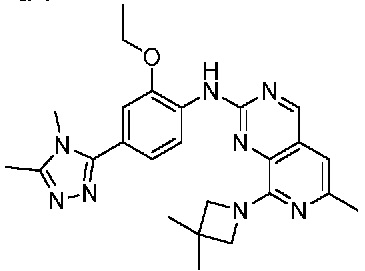
МСВР (ИЭР) МС m/z рассчитано для C25H31N8O [M+H]+ 459,2621, найдено 459,2660.
С использованием 8-(3,3-диметилазетидин-1-ил)-6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидина (синтез 13) и N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)формамида (синтез 43) при 120°C в течение 18 ч.
МО A.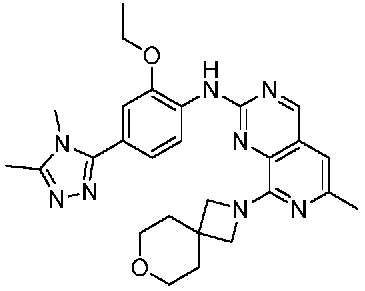
МСВР (ИЭР) МС m/z рассчитано для C27H33N8O2 [M+H]+ 501,2726, найдено 501,2726.
С использованием 2-(6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидин-8-ил)-7-окса-2-азаспиро[3.5]нонана (синтез 8) и N-(4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксифенил)формамида (синтез 43) при 120°C в течение 18 ч.
МО B.
МСВР (ИЭР) МС m/z рассчитано для C27H33N8O2 [M+H]+ 501,2721, найдено 501,2706
С использованием 2-(6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидин-8-ил)-7-окса-2-азаспиро[3.5]нонана (синтез 8) и N-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)формамида (синтез 44).
МО F.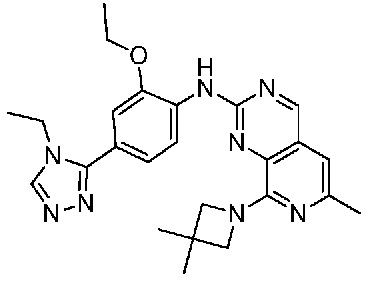
МСВР (ИЭР) МС m/z рассчитано для C25H31N8O [M+H]+ 459,2615, найдено 459,2601.
С использованием 8-(3,3-диметилазетидин-1-ил)-6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидина (синтез 13) и N-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)формамида (синтез 44).
МО A.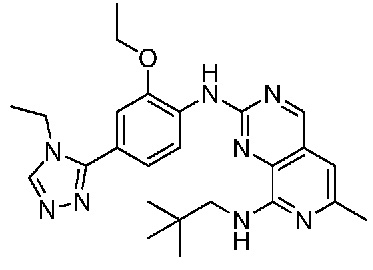
МСВР (ИЭР) МС m/z рассчитано для C25H33N8O [M+H]+ 461,2772, найдено 461,2752.
С использованием 6-метил-2-(метилсульфонил)-N-неопентилпиридо[3,4-d]пиримидин-8-амина (синтез 4) и N-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)формамида (синтез 44).
МО A.
Пример 27
N-(2-Этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин
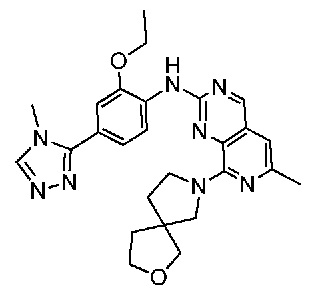
Методика 2
К раствору 8-хлор-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амина (синтез 1, 25 мг, 0,063 ммоля) в NMP (3 мл) добавляли 2-окса-7-азаспиро[4.4]нонан (16 мг, 0,126 ммоля) и триэтиламин (0,044 мл, 0,316 ммоля). Реакционную смесь нагревали при 100°C в закрытом крышкой флаконе в течение 18 ч. Реакционную смесь разбавляли с помощью EtOAc и водой. Органический слой промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-50% EtOAc в циклогексане и получали искомое соединение (20,4 мг, 66%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 9,03 (s, 1H), 8,56 (s, 1H), 8,50 (d, J=8,5 Гц, 1H), 7,38 (d, J=2,0 Гц, 1H), 7,35 (dd, J=8,5, 2,0 Гц, 1H), 6,75 (s, 1H), 4,28 (q, J=7,0 Гц, 2H), 4,17-4,14 (m, 2H), 4,07-4,01 (m, 2H), 3,96-3,88 (m, 2H), 3,87 (s, 3H), 3,74 (ABq, J=9,0 Гц, 2H), 2,44 (s, 3H), 2,08-1,98 (m, 4H), 1,54 (t, J=7,0 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C26H31N8O2 [M+H]+ 487,2564, найдено 487,2572.
MPS1 IC50 (мкМ): 0,004
Пример 28
1-(2-((2-Этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил
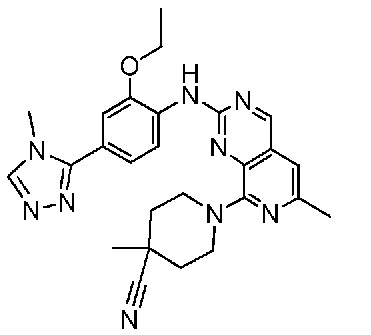
К раствору 8-хлор-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амина (синтез 1, 25 мг, 0,063 ммоля) в NMP (2 мл) добавляли 4-метилпиперидин-4-карбонитрил (20 мг, 0,126 ммоля) и триэтиламин (0,044 мл, 0,316 ммоля). Реакционную смесь нагревали при 100°C в закрытом крышкой флаконе в течение 18 ч. Добавляли дополнительное количество 4-метилпиперидин-4-карбонитрилгидрохлорида (40 мг, 0,252 ммоля) и реакционную смесь нагревали при 120°C в течение еще 5 ч. Реакционную смесь разбавляли с помощью EtOAc и водой. Органический слой сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-50% EtOAc в циклогексане, затем путем элюирования через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH. Остаток дополнительно очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-15% MeOH в EtOAc, затем путем элюирования через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH и получали искомое соединение (5,1 мг, 17%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 9,13 (s, 1H), 8,80 (d, J=8,5 Гц, 1H), 8,56 (s, 1H), 7,38 (d, J=2,0 Гц, 1H), 7,36 (dd, J=8,5, 2,0 Гц, 1H), 7,04 (s, 1H), 4,70 (br d, J=13,0 Гц, 2H), 4,29 (q, J=7,0 Гц, 2H), 3,88 (s, 3H), 3,26 (t, J=13,0 Гц, 2H), 2,50 (s, 3H), 2,10 (br d, J=13,0 Гц, 2H), 1,92 (td, J=13,0, 3,5 Гц, 2H), 1,56 (t, J=7,0 Гц, 3H), 1,51 (s, 3H).
МСВР (ИЭР) МС m/z рассчитано для C26H31N9O [M+2H]/2+ 242,632, найдено 242,6321.
MPS1 IC50 (мкМ): 0,002
Пример 29
8-(3,3-Диметилазетидин-1-ил)-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин
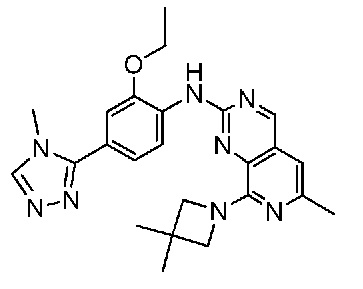
К раствору 8-хлор-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амина (синтез 1, 20 мг, 0,051 ммоля) в NMP (1 мл) добавляли 3,3-диметилазетидингидрохлорид (25 мг, 0,202 ммоля) и триэтиламин (0,057 мл, 0,404 ммоля). Реакционную смесь нагревали при 100°C в закрытом крышкой флаконе в течение 18 ч. Реакционную смесь разбавляли с помощью EtOAc и водой. Водный слой повторно экстрагировали с помощью EtOAc и объединенные органические слои сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ и получали искомое соединение (15,7 мг, 70%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 9,05 (s, 1H), 8,56 (d, J=8,5 Гц, 1H), 8,56 (s, 1H), 7,37 (d, J=1,5 Гц, 1H), 7,34 (dd, J=8,5, 1,5 Гц, 1H), 6,77 (s, 1H), 4,29 (q, J=7,0 Гц, 2H), 4,21 (br s, 4H), 3,87 (s, 3H), 2,44 (s, 3H), 1,54 (t, J=7,0 Гц, 3H), 1,38 (s, 6H).
МСВР (ИЭР) МС m/z рассчитано для C24H30N8O [M+2H]/2+ 223,1266, найдено 223,1261.
MPS1 IC50 (мкМ): 0,002
Пример 30
N-(2-Этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-8-(3-метокси-3-метилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин
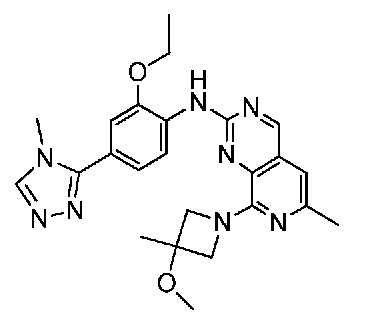
Смесь 8-хлор-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амина (синтез 1, 26 мг, 0,066 ммоля), триэтиламина (110 мкл, 0,795 ммоля) и 3-метокси-3-метилазетидингидрохлорида (48 мг, 0,349 ммоля) в NMP (0,5 мл) перемешивали при 130°C в закрытом крышкой флаконе в течение 18 ч. Реакцию останавливали насыщенным водным раствором NaHCO3 и экстрагировали с помощью EtOAc. Объединенные органические слои промывали водой, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-5% MeOH в ДХМ и получали искомое соединение (18 мг, 60%).
1H ЯМР (500 МГц, ДМСО-d6): δ част./млн 9,17 (s, 1H), 8,57 (s, 1H), 8,45 (s, 1H), 8,25 (d, J=8,2 Гц, 1H), 7,39 (d, J=1,8 Гц, 1H), 7,36 (dd, J=8,2, 1,8 Гц, 1H), 6,84 (s, 1H), 4,33-4,18 (br m, 4H), 4,15 (br d, J=8,6 Гц, 2H), 3,78 (s, 3H), 3,21 (s, 3H), 2,38 (s, 3H), 1,46 (s, 3H), 1,40 (t, J=6,9 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C24H29N8O2 [M+H]+ 461,2408, найдено 461,2385.
MPS1 IC50 (мкМ): 0,002
Примеры 31-62
Соединения указанных ниже примеров получали по методике 2 (пример 27), приведенной выше, с использованием 8-хлор-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амина (синтез 1) или 8-хлор-N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-6-метилпиридо[3,4-d]пиримидин-2-амина (синтез 2), или 8-хлор-N-(2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амина (синтез 3) и соответствующего амина, как это описано. При необходимости дополнительно добавляли требующееся количество эквивалентов амина и/или реакционную смесь продолжали нагревать для обеспечения максимального выхода. Неочищенные остатки реакции очищали, как указано выше, или по одной из следующих методик очистки (МО):
Методика очистки A: Колоночная хроматография на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ или EtOAc, затем дополнительная хроматография при элюировании с помощью 0-20% MeOH в EtOAc.
Методика очистки B: После описанной хроматографии остаток элюировали через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH, затем дополнительная колоночная хроматография на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ.
Методика очистки C: После описанной хроматографии остаток элюировали через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH.
Методика очистки D: Колоночная хроматография с обращенной фазой при элюировании водой, затем путем элюирования через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH.
Методика очистки E: Колоночная хроматография на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ, затем путем элюирования через картридж SCX-2 с помощью MeOH, затем с помощью 1M NH3 в MeOH.
Методика очистки F: Колоночная хроматография на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ или EtOAc.
Методика очистки G: Колоночная хроматография на силикагеле при элюировании с помощью 0-5% MeOH в ДХМ.
циклопропанол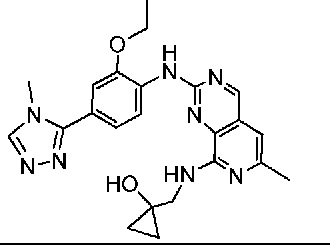
МСВР (ИЭР) МС m/z рассчитано для C23H27N8O2 [M+H]+ 448,2279, найдено 44,2283.
С использованием (1-аминометил)циклопропанола.
МО A.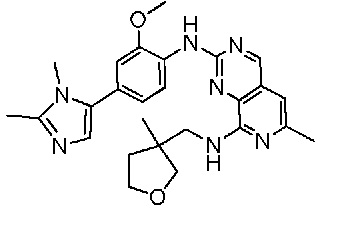
МСВР (ИЭР) МС m/z рассчитано для C26H33N7O2 [M+2H]/2+ 237,6342, найдено 237,6345.
С использованием (3-метилтетрагидрофуран-3-ил)метанамина в течение 60 ч.
МО B.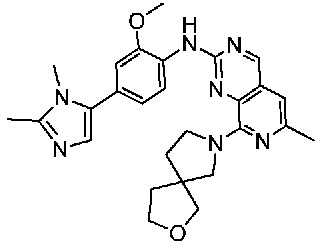
МСВР (ИЭР) МС m/z рассчитано для C27H33N7O2 [M+2H]/2+ 243,6342, найдено 243,6348.
С использованием 2-окса-7-азаспиро[4.4]нонана в течение 60 ч.
МО B.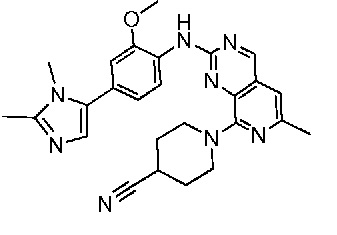
МСВР (ИЭР) МС m/z рассчитано для C26H29N8O [M+H]+ 470,2487, найдено 470,2468.
С использованием пиперидин-4-карбонитрила в течение 60 ч.
МО B.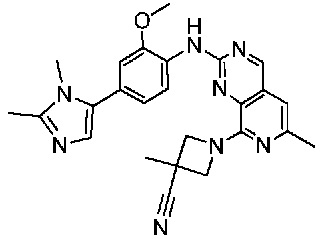
МСВР (ИЭР) МС m/z рассчитано для C25H28N8O [M+2H]/2+ 228,6201, найдено 228,6192.
С использованием 3-метилазетидин-3-карбонитрилгидрохлорида в течение 60 ч.
МО B.
МСВР (ИЭР) МС m/z рассчитано для C24H27N8O2 [M+H]+ 459,2251, найдено 459,2226.
С использованием оксалата 1-окса-6-азаспиро[3.3]гептана.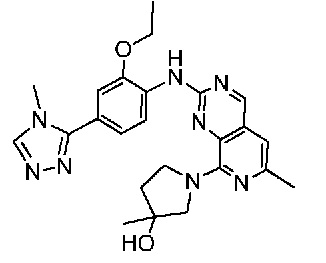
МСВР (ИЭР) МС m/z рассчитано для C24H29N8O2 [M+H]+ 461,2408, найдено 461,2393.
С использованием 3-метилпирролидин-3-олгидрохлорида при 120°C в течение 18 ч.
МО C.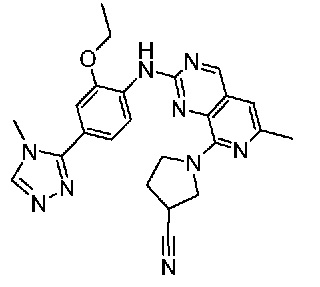
МСВР (ИЭР) МС m/z рассчитано для C24H27N9O [M+2H]/2+ 228,6164, найдено 228,6162.
С использованием пирролидин-3-карбонитрилгидрохлорида в течение 60 ч.
МО E.
МСВР (ИЭР) МС m/z рассчитано для C24H29N8O2 [M+H]+ 462,2436, найдено 462,2413.
С использованием 3-метоксипирролидингидрохлорида.
МО F.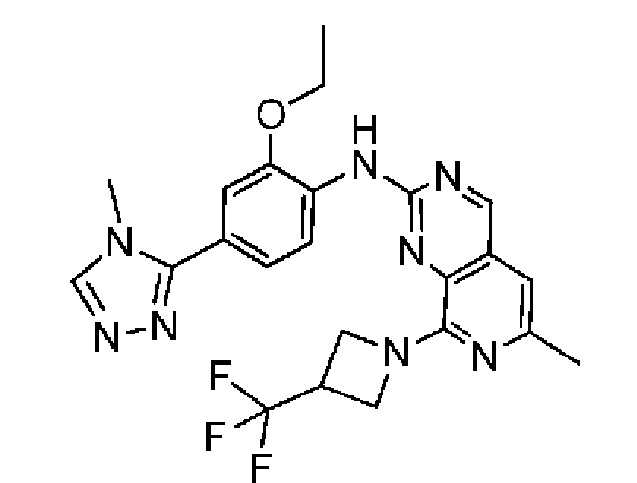
МСВР (ИЭР) МС m/z рассчитано для C23H24F3N8O [M+H]+ 485,202, найдено 485,2022.
С использованием 3-(трифторметил)азетидина.
МО A.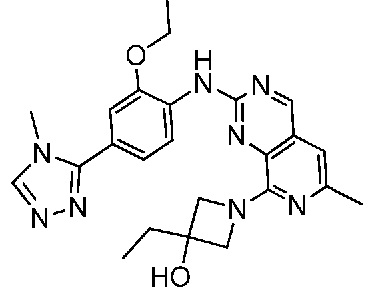
МСВР (ИЭР) МС m/z рассчитано для C24H30N8O2 [M+2H]/2+ 231,6254, найдено 231,6243.
С использованием 3-этил-3-гидроксиазетидина.
МО A.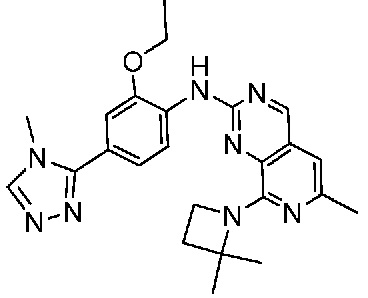
МСВР (ИЭР) МС m/z рассчитано для C24H29N8O [M+H]+ 445,2459, найдено 445,2461.
С использованием 2,2-диметилазетидина.
МО F.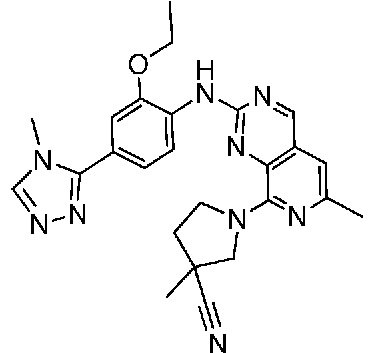
МСВР (ИЭР) МС m/z рассчитано для C25H29N9O [M+2H]/2+ 235,6242, найдено 235,6243.
С использованием 3-циано-3-метилпирролидингидрохлорида.
МО F.
МСВР (ИЭР) МС m/z рассчитано для C26H32N8O [M+2H]/2+ 235,1344, найдено 235,1336.
С использованием 2-азаспиро[3.4]октана.
МО F.
МСВР (ИЭР) МС m/z рассчитано для C22H24F2N8O [M+2H]/2+ 227,1015, найдено 227,1021.
С использованием 3,3-дифторазетидингидрохлорида при 130°C.
МО F.
МСВР (ИЭР) МС m/z рассчитано для C25H31N8O2 [M+H]+ 475,2564, найдено 475,2540.
С использованием 4-метоксипиперидингидрохлорида при 130°C.
МО F.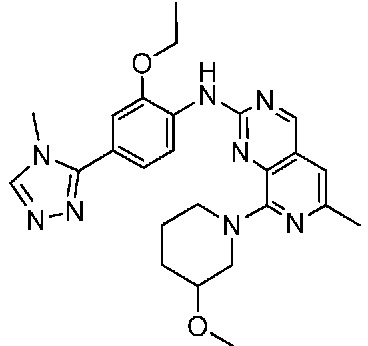
МСВР (ИЭР) МС m/z рассчитано для C25H31N8O2 [M+H]+ 475,2564, найдено 475,2547.
С использованием рацемического 3-метоксипиперидингидрохлорида при 130°C.
МО F.
МСВР (ИЭР) МС m/z рассчитано для C24H29N8O2 [M+H]+ 461,2408, найдено 461,2390.
С использованием рацемического 2-метилморфолингидрохлорида при 130°C.
МО B.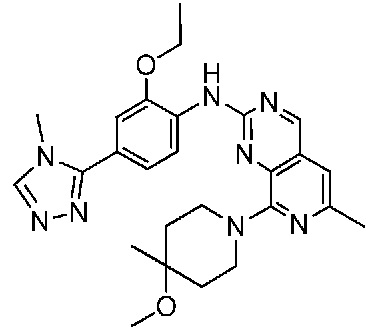
МСВР (ИЭР) МС m/z рассчитано для C26H34N8O2 [M+2H]/2+ 245,1397, найдено 245,1397.
С использованием 4-метокси-4-метилпиперидина при 130°C.
МО F.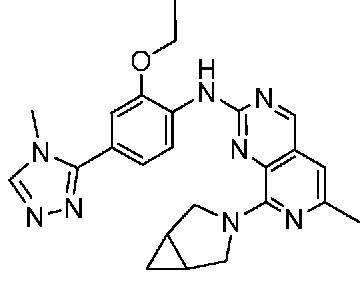
МСВР (ИЭР) МС m/z рассчитано для C24H27N8O [M+H]+ 443,2302, найдено 443,2281.
С использованием 3-азабицикло[3.1.0]гексангидрохлорида при 130°C.
МО F.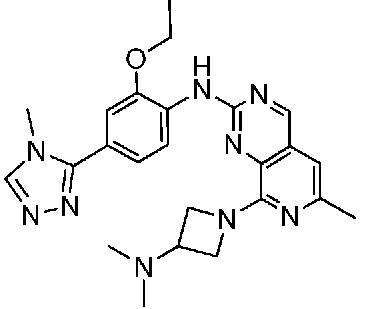
МСВР (ИЭР) МС m/z рассчитано для C24H30N9O [M+H]+ 460,2568, найдено 460,2545.
С использованием N,N-диметилазетидин-3-аминдигидрохлорида при 130°C.
МО F.
МСВР (ИЭР) МС m/z рассчитано для C24H29N8O2 [M+H]+ 461,2408, найдено 461,2390.
С использованием пиперидин-4-олгидрохлорида при 130°C.
МО F.
МСВР (ИЭР) МС m/z рассчитано для C25H33N8O [M+H]+ 461,2777, найдено 461,2772.
С использованием (R)-3,3-диметилбутан-2-амина при 130°C в течение 48 ч.
МО F.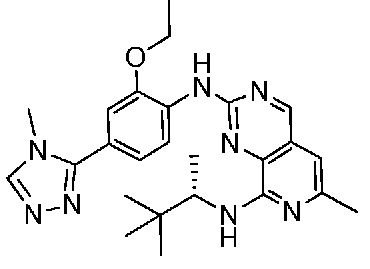
МСВР (ИЭР) МС m/z рассчитано для C25H33N8O [M+H]+ 461,2777, найдено 461,2777.
С использованием (S)-3,3-диметилбутан-2-амина при 130°C в течение 48 ч.
МО F.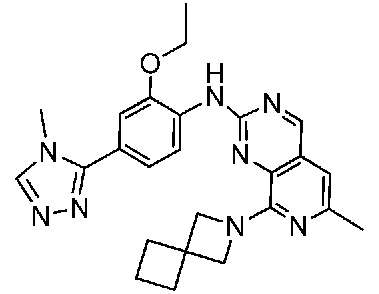
МСВР (ИЭР) МС m/z рассчитано для C25H29N8O [M+H]+ 457,2464, найдено 457,2473.
С использованием 2-азаспиро[3.3]гептангидрохлорида при 130°C.
МО F.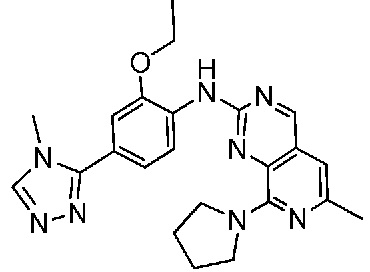
МСВР (ИЭР) МС m/z рассчитано для C23H27N8O [M+H]+ 431,2308, найдено 431,2315.
С использованием пирролидина при 130°C в течение 24 ч.
МО F.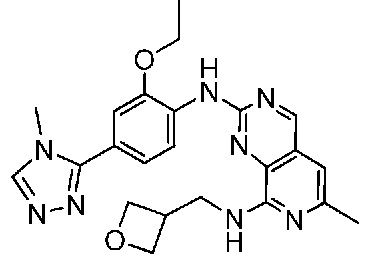
МСВР (ИЭР) МС m/z рассчитано для C23H27N8O2 [M+H]+ 447,2257, найдено 447,2260.
С использованием оксетан-3-илметанамина при 130°C в течение 24 ч.
МО F.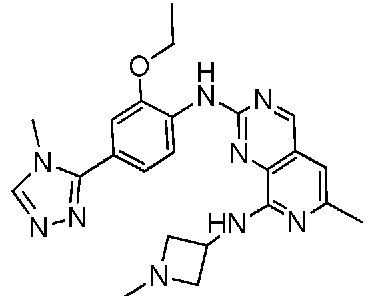
МСВР (ИЭР) МС m/z рассчитано для C23H28N9O [M+H]+ 446,2417, найдено 446,2421.
С использованием 1-метилазетидин-3-амина.
МО D.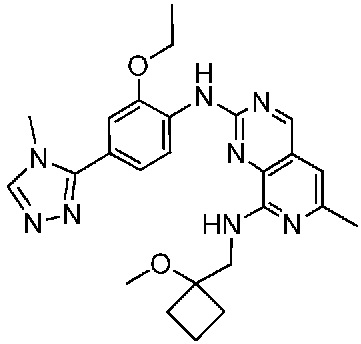
МСВР (ИЭР) МС m/z рассчитано для C25H31N8O2 [M+H]+ 475,2570, найдено 475,2571.
С использованием (1-метоксициклобутил)метанамингидрохлорида при 120°C в течение 4 дней.
МО E.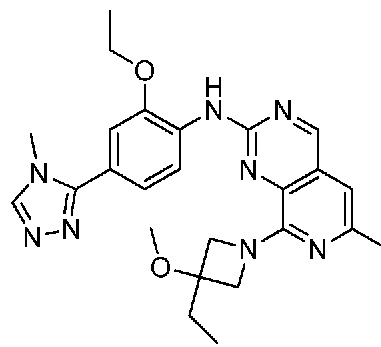
МСВР (ИЭР) МС m/z рассчитано для C25H31N8O2 [M+H]+ 475,2570, найдено 475,2567.
С использованием 3-этил-3-метоксиазетидингидрохлорида (синтез 66) при 130°C в течение 18 ч.
МО G.
МСВР (ИЭР) МС m/z рассчитано для C25H31N8O2 [M+H]+ 475,2570, найдено 475,2575.
С использованием 3-этокси-3-метилазетидингидрохлорида (синтез 67) при 130°C в течение 18 ч.
МО F.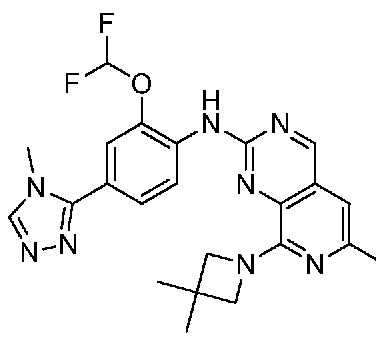
МСВР (ИЭР) МС m/z рассчитано для C23H25F2N8O [M+H]+ 467,2119, найдено 467,2117.
С использованием 3,3-диметилазетидингидрохлорида при 130°C в течение 60 ч.
МО G.
Синтез 1
8-Хлор-N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин
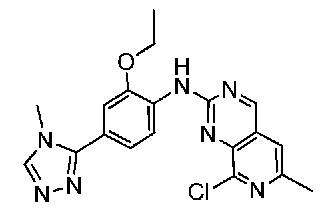
К раствору N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)формамид (синтез 32, 1,88 г, 7,63 ммоля) в ТГФ (70 мл) при 0°C добавляли гидрид натрия (60% мас./мас., 500 мг, 12,50 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем охлаждали до 0°C. Добавляли 8-хлор-6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидин (синтез 24, 2,50 г, 9,70 ммоля) и реакционную смесь перемешивали при нагревании до комнатной температуры в течение 18 ч. Добавляли 2M водный раствор NaOH и MeOH (25 мл каждого) и полученную смесь перемешивали при комнатной температуре в течение 1 ч, затем концентрировали в вакууме. Остаток подвергали распределению между ДХМ и водой. Водный слой экстрагировали с помощью ДХМ и объединенные органические слои сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-6% MeOH в ДХМ и получали искомое соединение (3,24 г, количественный выход).
1H ЯМР (500 МГц, ДМСО-d6): δ част./млн 9,46 (s, 1H), 8,85 (d, J=8,3 Гц, 1H), 8,79 (s, 1H), 8,56 (s, 1H), 7,74 (d, J=1,0 Гц, 1H), 7,49-7,36 (m, 2H), 4,25 (q, J=7,0 Гц, 2H), 3,80 (s, 3H), 2,58 (s, 3H), 1,43 (t, J=6,9 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C19H19ClN7O [M+H]+ 396,1339, найдено 396,1335.
Синтез 2
8-Хлор-N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-6-метилпиридо[3,4-d]пиримидин-2-амин

К раствору N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)формамида (синтез 37, 280 мг, 1,087 ммоля) в ТГФ (10 мл) при 0°C добавляли гидрид натрия (71 мг, 1,782 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем охлаждали до 0°C. Добавляли 8-хлор-6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидин (синтез 24, 333 мг, 1,087 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли водный раствор NaOH (2M) и MeOH (25 мл каждого) и полученную смесь перемешивали при комнатной температуре в течение 1 ч, затем концентрировали в вакууме. Остаток подвергали распределению между ДХМ и водой. Водный слой экстрагировали с помощью ДХМ и объединенные органические слои сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии с обращенной фазой при элюировании водой и MeOH и получали искомое соединение (230 мг, 54%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 9,29 (s, 1H), 9,09 (d, J=8,0 Гц, 1H), 7,62 (d, J=0,5 Гц, 1H), 7,12 (dd, J=8,0, 2,0 Гц, 1H), 7,09 (d, J=2,0 Гц, 1H), 6,91 (s, 1H), 4,04 (s, 3H), 3,64 (s, 3H), 2,63 (s, 3H), 2,45 (s, 3H).
МСВР (ИЭР) МС m/z рассчитано для C20H20N6ClO [M+H]+ 396,141, найдено 396,1389.
Синтез 3
8-Хлор-N-(2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин
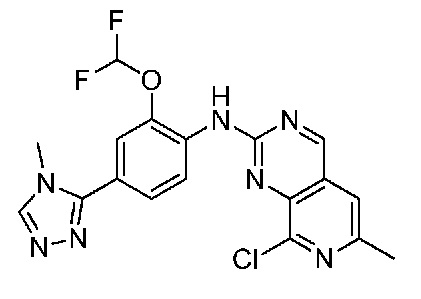
Раствор N-(2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)формамида (синтез 38, 102 мг, 0,380 ммоля) в ТГФ (3,5 мл) при 0°C обрабатывали гидридом натрия (60% мас./мас., 25 мг, 0,625 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем охлаждали до 0°C. Добавляли 8-хлор-6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидин (синтез 24, 122 мг, 0,473 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли водный раствор NaOH (2M, 0,5 мл) и MeOH (0,5 мл) и полученную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали в вакууме. Остаток подвергали распределению между ДХМ и водой. Водный слой экстрагировали с помощью ДХМ и объединенные органические вещества сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-7% MeOH в EtOAc и получали искомое соединение (30 мг, 19%).
1H ЯМР (500 МГц, CDCl3): δ част./млн 9,37 (d, J=8,6 Гц, 1H), 9,19 (s, 1H), 8,24 (s, 1H), 8,19 (s, 1H), 7,71 (m, 1H), 7,63 (dd, J=8,6, 2,0 Гц, 1H), 7,43 (d, J=0,9 Гц, 1H), 6,76 (t, J=72,7 Гц, 1H), 3,87 (s, 3H), 2,71 (d, J=0,8 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C18H15ClF2N7O [M+H]+ 418,0995, найдено 418,0990.
Синтез 4
6-Метил-2-(метилсульфонил)-N-неопентилпиридо[3,4-d]пиримидин-8-амин
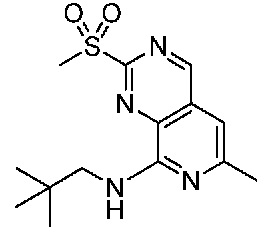
К охлажденному (0°C) раствору 6-метил-2-(метилтио)-N-неопентилпиридо[3,4-d]пиримидин-8-амина (синтез 14, 133 мг, 0,481 ммоля) в ДХМ (30 мл) добавляли МХПБК (77% мас./мас., 259 мг, 1,155 ммоля). Реакционную смесь перемешивали в течение 18 ч при нагревании медленно до комнатной температуры. Добавляли дополнительное количество МХПБК (30 мг) и реакцию продолжали проводить в течение 2 ч. Реакционную смесь разбавляли с помощью ДХМ и насыщенным водным раствором NaHCO3. Органический слой собирали, промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ и получали искомое соединение (140 мг, 94%).
1H ЯМР (500 МГц, ацетон-d6): δ част./млн 9,45 (s, 1H), 7,41 (br s, 1H), 6,95 (s, 1H), 3,59 (d, J=6,0 Гц, 2H), 3,44 (s, 3H), 2,51 (d, J=0,5 Гц, 3H), 1,03 (s, 9H).
МСВР (ИЭР) МС m/z рассчитано для C14H21N4O2S [M+H]+ 309,138, найдено 309,1364.
Следующие продукты синтеза получали по методике, описанной в синтезе 4, с использованием соответствующего метилтиопиридопиримидина, как описано ниже:
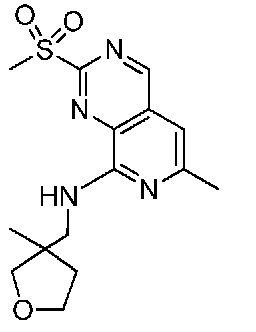
МСВР (ИЭР) МС m/z рассчитано для C15H21N4O3S [M+H]+ 337,1329, найдено 337,1319.
С использованием 6-метил-N-((3-метилтетрагидрофуран-3-ил)метил)-2-(метилтио)пиридо[3,4-d]пиримидин-8-амина (синтез 15).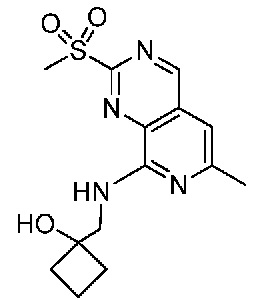
МСВР (ИЭР) МС m/z рассчитано для C14H19N4O3S [M+H]+ 323,1172, найдено 323,1158.
С использованием 1-(((6-метил-2-(метилтио)пиридо[3,4-d]пиримидин-8-ил)амино)метил)циклобутанола (синтез 16).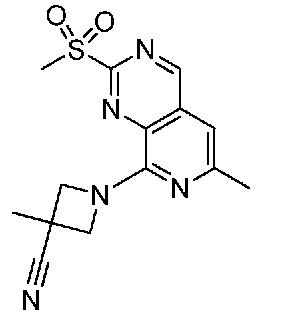
МСВР (ИЭР) МС m/z рассчитано для C14H16N5O2S [M+H]+ 318,1019, найдено 318,1009.
С использованием 3-метил-1-(6-метил-2-(метилтио)пиридо[3,4-d]пиримидин-8-ил)азетидин-3-карбонитрила (синтез 17).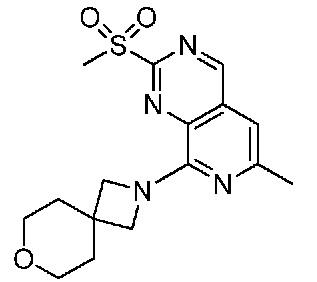
МСВР (ИЭР) МС m/z рассчитано для C16H21N4O3S [M+H]+ 349,1329, найдено 349,1318.
С использованием 2-(6-метил-2-(метилтио)пиридо[3,4-d]пиримидин-8-ил)-7-окса-2-азаспиро[3.5]нонана (синтез 18).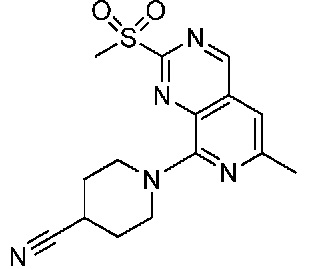
МСВР (ИЭР) МС m/z рассчитано для C15H18N5O2S [M+H]+ 332,1176, найдено 332,1164.
С использованием 1-(6-метил-2-(метилтио)пиридо[3,4-d]пиримидин-8-ил)пиперидин-4-карбонитрила (синтез 19).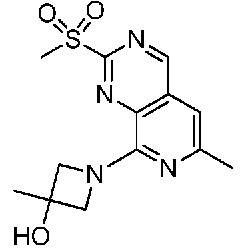
МСВР (ИЭР) МС m/z рассчитано для C13H17N4O3S [M+H]+ 309,1016, найдено 309,1006.
С использованием 3-метил-1-(6-метил-2-(метилтио)пиридо[3,4-d]пиримидин-8-ил)азетидин-3-ола (синтез 20).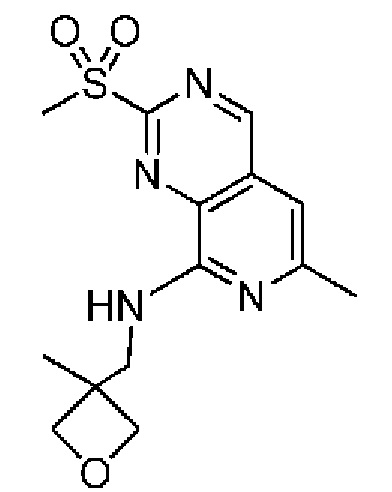
МСВР (ИЭР) МС m/z рассчитано для C14H19N4O3S [M+H]+ 323,1172, найдено 323,1165.
С использованием 6-метил-N-((3-метилоксетан-3-ил)метил)-2-(метилтио)пиридо[3,4-d]пиримидин-8-амина (синтез 21).
МСВР (ИЭР) МС m/z рассчитано для C14H19N4O3S [M+H]+ 323,1172, найдено 323,1158.
С использованием 6-метил-2-(метилтио)-N-(тетрагидро-2H-пиран-4-ил)пиридо[3,4-d]пиримидин-8-амина (синтез 22).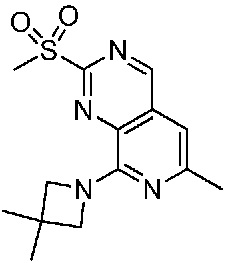
МСВР (ИЭР) МС m/z рассчитано для C14H19N4SO2 [M+H]+ 307,1229, найдено 307,1225.
С использованием 8-(3,3-диметилазетидин-1-ил)-6-метил-2-(метилтио)пиридо[3,4-d]пиримидина (синтез 23).
Синтез 14
6-Метил-2-(метилтио)-N-неопентилпиридо[3,4-d]пиримидин-8-амин

К раствору 8-хлор-6-метил-2-(метилтио)пиридо[3,4-d]пиримидина (синтез 25, 500 мг, 2,215 ммоля) в NMP (20 мл) добавляли неопентиламин (0,52 мл, 4,43 ммоля) и триэтиламин (1,56 мл, 11,08 ммоля). Реакционную смесь нагревали при 100°C в течение 36 ч. Реакционную смесь разбавляли с помощью EtOAc и водой, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-50% EtOAc в циклогексане и получали искомое соединение (548 мг, 89%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 9,02 (s, 1H), 6,71 (d, J=0,5 Гц, 1H), 3,47 (s, 2H), 2,66 (s, 3H), 2,44 (d, J=0,5 Гц, 3H), 1,05 (s, 9H).
МСВР (ИЭР) МС m/z рассчитано для C14H21N4S [M+H]+ 277,1481, найдено 277,1467.
Следующие продукты синтеза получали по методике, описанной в синтезе 14, с использованием 8-хлор-6-метил-2-(метилтио)пиридо[3,4-d]пиримидина (синтез 25) и соответствующего амина, как описано ниже:
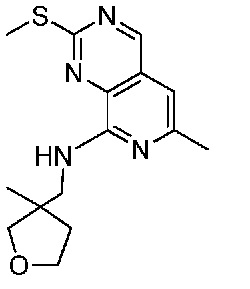
МСВР (ИЭР) МС m/z рассчитано для C15H21N4OS [M+H]+ 305,1431, найдено 305,1425.
С использованием (3-метилтетрагидрофуран-3-ил)метанамина.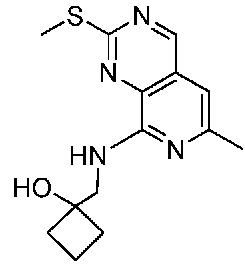
МСВР (ИЭР) МС m/z рассчитано для C14H19N4OS [M+H]+ 291,1274, найдено 291,1266.
С использованием 1-(аминометил)циклобутанола.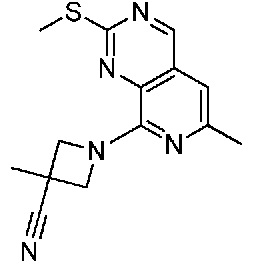
МСВР (ИЭР) МС m/z рассчитано для C14H16N5S [M+H]+ 268,1121, найдено 268,1119.
С использованием 3-метилазетидин-3-карбонитрилгидрохлорида.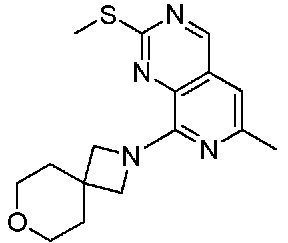
МСВР (ИЭР) МС m/z рассчитано для C16H21N4OS [M+H]+ 317,1431, найдено 317,1422.
С использованием 7-окса-2-азаспиро[3.5]нонана.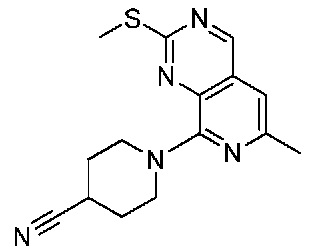
МСВР (ИЭР) МС m/z рассчитано для C15H18N5S [M+H]+ 300,1277, найдено 300,1266.
С использованием пиперидин-4-карбонитрила.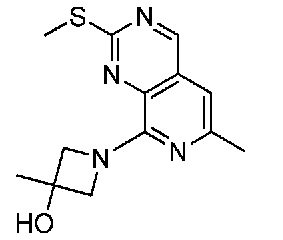
МСВР (ИЭР) МС m/z рассчитано для C13H17N4OS [M+H]+ 278,1144, найдено 278,1139.
С использованием 3-метилазетидин-3-олгидрохлорида.
МСВР (ИЭР) МС m/z рассчитано для C14H19N4OS [M+H]+ 291,1274, найдено 291,1265.
С использованием (3-метилоксетан-3-ил)метанамина.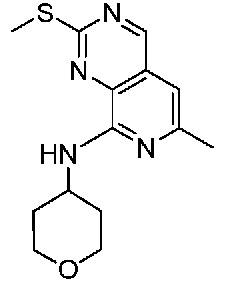
МСВР (ИЭР) МС m/z рассчитано для C14H19N4OS [M+H]+ 291,1274, найдено 291,1268.
С использованием тетрагидро-2H-пиран-4-амина.
МСВР (ИЭР) МС m/z рассчитано для C14H19N4S [M+H]+ 275,1330, найдено 275,1332.
С использованием 3,3-диметилазетидингидрохлорида.
Синтез 24
8-Хлор-6-метил-2-(метилсульфонил)пиридо[3,4-d]пиримидин
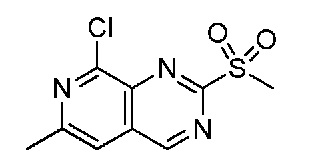
Суспензию 8-хлор-6-метил-2-(метилтио)пиридо[3,4-d]пиримидина (синтез 25, 1,13 г, 5,01 ммоля) в ДХМ (50 мл) обрабатывали с помощью МХПБК (77% мас./мас., 2,60 г, 11,57 ммоля) при 0°C и перемешивали при нагревании до комнатной температуры в течение 18 ч. Реакцию останавливали водой и экстрагировали с помощью ДХМ. Объединенные органические слои промывали насыщенным водным раствором NaHCO3, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-70% EtOAc в циклогексане и получали искомое соединение (972 мг, 75%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 9,82 (s, 1H), 7,96 (d, J=0,5 Гц, 1H), 3,54 (s, 3H), 2,78 (d, J=0,5 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C9H9ClN3O2S [M+H]+ 258,0099, найдено 258,0092.
Синтез 25
8-Хлор-6-метил-2-(метилтио)пиридо[3,4-d]пиримидин
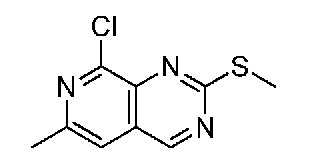
Раствор 6-метил-2-(метилтио)пиридо[3,4-d]пиримидин-8(7H)-она (синтез 26, 100 мг, 0,483 ммоля) в POCl3 (5 мл) нагревали при 70°C в течение 1 ч. Реакционную смесь концентрировали в вакууме. Остаток подвергали распределению между EtOAc и промывали водой, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-20% EtOAc в циклогексане и получали искомое соединение (28,4 мг, 52%).
1H ЯМР (500 МГц, CDCl3): δ част./млн 9,16 (s, 1H), 7,43 (s, 1H), 2,75 (s, 3H), 2,71 (s, 3H).
МСВР (ИЭР) МС m/z рассчитано для C9H9ClN3S [M+H]+ 226,0206, найдено 226,0204
Синтез 26
6-Метил-2-(метилтио)пиридо[3,4-d]пиримидин-8(7H)-он

К раствору 2-(метилтио)-5-(проп-1-ин-1-ил)пиримидин-4-карбоксамида (синтез 27, 270 мг, 1,303 ммоля) в толуоле (30 мл) добавляли п-толуолсульфоновую кислоту (50 мг, 0,261 ммоля). Реакционную смесь нагревали при 90°C в течение 18 ч. Реакционную смесь концентрировали в вакууме. Остаток растворяли в NH3 в MeOH (7M, 10 мл) и нагревали при 80°C в течение 18 ч. Реакционную смесь концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-5% MeOH в ДХМ и получали искомое соединение (150 мг, 56%).
АЛЬТЕРНАТИВНО
Суспензию пентан-2,4-диона (5,10 мл, 49,7 ммоля), йодида меди (487 мг, 2,56 ммоля), 5-бром-2-(метилтио)-N-фенилпиримидин-4-карбоксамида (синтез 30, 8,00 г, 24,68 ммоля) и Cs2CO3 (16,17 г, 49,6 ммоля) в MeCN (70 мл) нагревали при 85°C в течение 18 ч. Реакционную смесь обрабатывали с помощью AcOH (70 мл) и AcONH4 (28 г, 364 ммоля) и нагревали при 85°C в течение 5 ч. Реакционную смесь подвергали распределению между насыщенным водным раствором NaHCO3 и CHCl3. Водные слои экстрагировали с помощью CHCl3. Объединенные органические слои промывали водой, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 20-100% EtOAc в циклогексане, затем с помощью 0-20% MeOH в EtOAc и получали искомое соединение (3,22 г, 63%).
1H ЯМР (500 МГц, CDCl3): δ част./млн 10,52 (br s, 1H), 8,91 (s, 1H), 6,28 (s, 1H), 2,72 (s, 3H), 2,45 (s, 3H).
МСВР (ИЭР) МС m/z рассчитано для C9H10N3SO [M+H]+ 208,0545, найдено 208,0550.
Синтез 27
2-(Метилтио)-5-(проп-1-ин-1-ил)пиримидин-4-карбоксамид
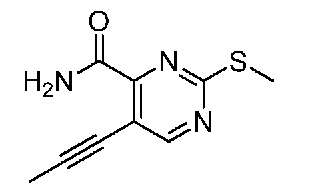
Раствор метил-2-(метилтио)-5-проп-1-ин-1-ил)пиримидин-4-карбоксилата (синтез 28, 410 мг, 1,845 ммоля) в NH3 в MeOH (7M, 12 мл) нагревали при 120°C в течение 18 ч. Реакционную смесь концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-5% MeOH в ДХМ и получали искомое соединение (280 мг, 73%).
1H ЯМР (500 МГц, CDCl3): δ част./млн 8,74 (s, 1H), 7,52 (br s, 1H), 5,61 (br s, 1H), 2,61 (s, 3H), 2,19 (s, 3H).
ЖХ/МС (ИЭР) Rt=1,87 мин, МС m/z 208,27 [M+H]+
Синтез 28
Метил-2-(метилтио)-5-проп-1-ин-1-ил)пиримидин-4-карбоксилат
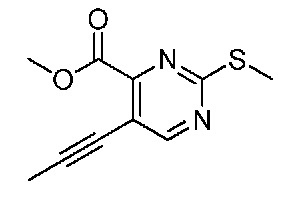
К раствору метил-5-бром-2-(метилтио)пиримидин-4-карбоксилата (синтез 29, 1,0 г, 3,80 ммоля) в ДМФ (10 мл) добавляли трибутилпропинилолово (1,4 мл, 4,56 ммоля) и Pd(PPh3)4 (132 мг, 0,114 ммоля). Реакционную смесь нагревали микроволновым излучением при 110°C в течение 30 мин. Реакционную смесь разбавляли с помощью EtOAc, промывали насыщенным водным раствором NaHCO3 и водой, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 50-100% ДХМ в циклогексане и получали искомое соединение (414 мг, 49%).
1H ЯМР (500 МГц, CDCl3): δ част./млн 8,67 (s, 1H), 4,00 (s, 3H), 2,61 (s, 3H), 2,14 (s, 3H).
МСВР (ИЭР) МС m/z рассчитано для C9H8N2O2S [M+H]+ 209,0379, найдено 209,038
Синтез 29
Метил-5-бром-2-(метилтио)пиримидин-4-карбоксилат
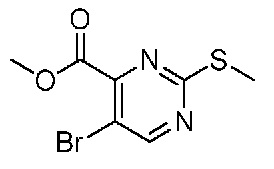
Раствор 5-бром-2-(метилтио)пиримидин-4-карбоновой кислоты (7,64 г, 30,7 ммоля) в MeOH (60 мл) обрабатывали серной кислотой (2 мл) и кипятили с обратным холодильником в течение 24 ч. Смесь выливали на лед с водой и экстрагировали с помощью ДХМ. Органический слой промывали насыщенным водным раствором NaHCO3, сушили (MgSO4) и концентрировали в вакууме и получали искомое соединение (6,42 г, 80%).
1H ЯМР (500 МГц, CDCl3): δ част./млн 8,72 (s, 1H), 4,01 (s, 3H), 2,58 (s, 3H).
ЖХ/МС (ИЭР) Rt=2,35 мин, МС m/z 263 [M+H]+
Синтез 30
5-Бром-2-(метилтио)-N-фенилпиримидин-4-карбоксамид
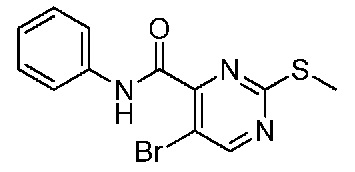
К раствору 5-бром-2-(метилтио)пиримидин-4-карбоновой кислоты (20,1 г, 81 ммоля) в ДХМ (300 мл) при 0°C добавляли каталитическое количество ДМФ (1 каплю) и оксалилхлорид (8,6 мл, 102 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали в вакууме. Остаток растворяли в ДХМ и при 0°C обрабатывали анилином (12 мл, 132 ммоля) и триэтиламином (24 мл, 173 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней. Реакцию останавливали с помощью 0,5M HCl и экстрагировали с помощью ДХМ. Объединенные органические слои промывали водой, сушили (MgSO4) и концентрировали в вакууме и получали искомое соединение (24,91 г, 95%).
1H ЯМР (500 МГц, CDCl3): δ част./млн 9,64 (br s, 1H), 8,86 (s, 1H), 7,75 (dd, J=8,6, 1,1 Гц, 2H), 7,42 (dd, J=8,5, 7,4 Гц, 2H), 7,22 (t, J=7,5 Гц, 1H), 2,66 (s, 3H).
МСВР (ИЭР) МС m/z рассчитано для C12H11BrN3OS [M+H]+ 325,9780, найдено 325,9767.
Синтез 31
N-(2-Метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)формамид
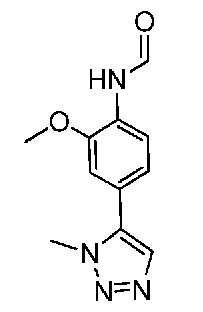
Раствор 2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)анилина (синтез 52, 25 мг, 0,122 ммоля) в муравьиной кислоте (3 мл) нагревали при 100°C в течение 1,5 ч. Реакционную смесь концентрировали в вакууме. Остаток разбавляли насыщенным водным раствором NaHCO3 и EtOAc. Водный слой повторно экстрагировали с помощью ДХМ. Объединенные органические слои сушили (MgSO4) и концентрировали в вакууме и получали искомое соединение (20 мг, 70%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 8,43 (d, J=8,5 Гц, 1H), 8,39 (s, 1H), 7,83 (s, 1H), 7,20 (d, J=2,0 Гц, 1H), 7,14 (dd, J=8,5, 2,0 Гц, 1H), 4,13 (s, 3H), 3,99 (s, 3H).
МСВР (ИЭР) МС m/z рассчитано для C11H13N4O2 [M+H]+ 233,1033, найдено 233,1032.
Следующие продукты синтеза получали по методике, описанной в синтезе 31, с использованием соответствующего анилина, как описано ниже. После концентрирования остатки обрабатывали, как описано выше, или по одной из методик очистки (МО) ниже:
Методика очистки A: Азеотропная перегонка с толуолом, затем колоночная хроматография на силикагеле при элюировании с помощью 0-85% EtOAc в циклогексане.
Методика очистки B: Азеотропная перегонка с толуолом, затем колоночная хроматография на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ.
Методика очистки C: Азеотропная перегонка с толуолом, затем очистка с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-20% MeOH в ДХМ.
Методика очистки D: Дополнительное количество вещества получали путем подкисления водного слоя с помощью 0,5M HCl и экстракции с помощью ДХМ, сушки (MgSO4) и концентрирования в вакууме.
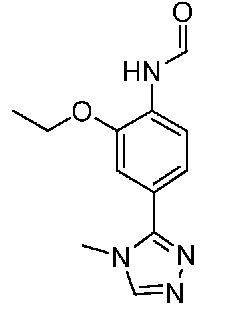
МСВР (ИЭР) МС m/z рассчитано для C12H15N4O2 [M+H]+ 247,1195, найдено 247,1195.
С использованием 2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)анилина (синтез 54).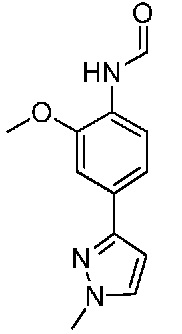
МСВР (ИЭР) МС m/z рассчитано для C12H14N3O2 [M+H]+ 232,1081, найдено 232,1079.
С использованием 2-метокси-4-(1-метил-1H-пиразол-3-ил)анилина (синтез 45).
МО A.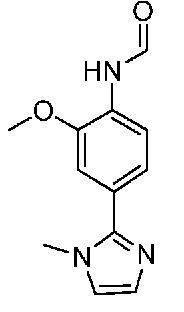
МСВР (ИЭР) МС m/z рассчитано для C12H14N3O2 [M+H]+ 232,1081, найдено 232,1082.
С использованием 2-метокси-4-(1-метил-1H-имидазол-2-ил)анилина (синтез 46).
МО B.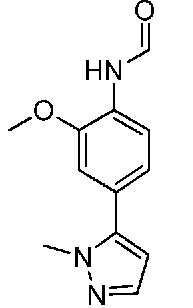
МСВР (ИЭР) МС m/z рассчитано для C12H14N3O2 [M+H]+ 232,1081, найдено 232,1091.
С использованием 2-метокси-4-(1-метил-1H-пиразол-5-ил)анилина (синтез 47).
МО A.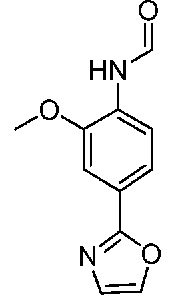
МСВР (ИЭР) МС m/z рассчитано для C11H11N2O3 [M+H]+ 219,0764, найдено 219,0765.
С использованием 2-метокси-4-(оксазол-2-ил)анилина (синтез 48).
МО A.
МСВР (ИЭР) МС m/z рассчитано для C13H16N3O2 [M+H]+ 246,1237, найдено 246,1233.
С использованием 4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксианилина (синтез 53).
МО D.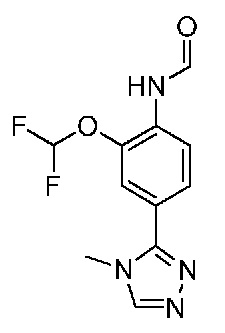
МСВР (ИЭР) МС m/z рассчитано для C11H11F2N4O2 [M+H]+ 269,0850, найдено 269,0854.
С использованием 2-(дифторметокси)-4-(4-метил-4H-1,2,4-триазол-3-ил)анилина (синтез 62).
МО B.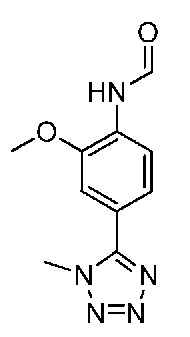
МСВР (ИЭР) МС m/z рассчитано для C10H12N5O2 [M+H]+ 234,0991, найдено 234,0992.
С использованием 2-метокси-4-(1-метил-1H-тетразол-5-ил)анилина (синтез 49).
МО A.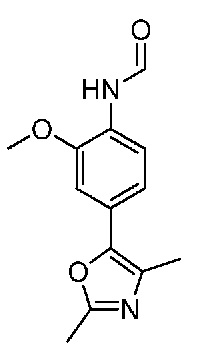
МСВР (ИЭР) МС m/z рассчитано для C13H15N2O3 [M+H]+ 247,1082, найдено 247,1085.
С использованием 4-(2,4-диметилоксазол-5-ил)-2-метоксианилина (синтез 50).
МО A.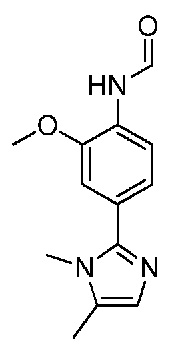
С использованием 4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксианилина (синтез 51).
МО B.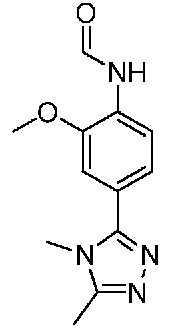
МСВР (ИЭР) МС m/z рассчитано для C12H15N4O2 [M+H]+ 247,1195, найдено 247,1195
С использованием 4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-метоксианилина (синтез 61).
МО C.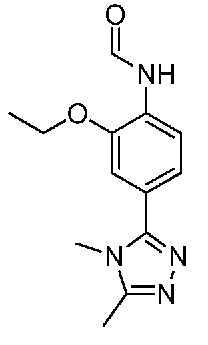
МСВР (ИЭР) МС m/z рассчитано для C13H17N4O2 [M+H]+ 261,1352, найдено 261,1345.
С использованием 4-(4,5-диметил-4H-1,2,4-триазол-3-ил)-2-этоксианилина (синтез 59).
МО B.
МСВР (ИЭР) МС m/z рассчитано для C13H17N4O2 [M+H]+ 261,1352, найдено 261,1352
С использованием 2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)анилина (синтез 60).
МО C.
Синтез 45
2-Метокси-4-(1-метил-1H-пиразол-3-ил)анилин
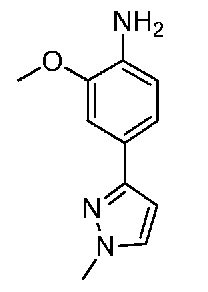
К раствору 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (310 мг, 1,244 ммоля) и 3-бром-1-метил-1H-пиразол (154 мг, 0,957 ммоля) в ТГФ (3 мл) добавляли Pd(dppf)Cl2⋅ДХМ (40 мг, 0,049 ммоля) и 2M водный раствор Na2CO3 (1 мл) и реакционную смесь нагревали при 65°C в течение 18 ч. Реакционную смесь разбавляли с помощью EtOAc и водой. Водный слой экстрагировали с помощью EtOAc, объединенные органические слои промывали водой, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-60% EtOAc в циклогексане и получали искомое соединение (34 мг, 18%).
1H ЯМР (500 МГц, CDCl3): δ част./млн 7,33 (d, J=18,8 Гц, 2H), 7,28 (d, J=1,2 Гц, 2H), 7,20 (d, J=7,9 Гц, 1H), 6,74 (dd, J=7,9, 1,2 Гц, 1H), 6,45 (dd, J=2,2, 1,2 Гц, 1H), 3,95 (m, 6H), 3,85 (br s, 2H).
МСВР (ИЭР) МС m/z рассчитано для C11H14N3O [M+H]+ 204,1131, найдено 204,1141.
Следующие продукты синтеза получали по методике, описанной в синтезе 45, с использованием соответствующего анилина и гетероцикла, как описано ниже. Неочищенные остатки реакции очищали, как указано выше, или по одной из следующих методик очистки (МО):
Методика очистки A: Колоночная хроматография на силикагеле при элюировании с помощью 0-5% MeOH в ДХМ.
Методика очистки B: Колоночная хроматография на силикагеле при элюировании с помощью 0-15% EtOAc в циклогексане.
Методика очистки C: Колоночная хроматография на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ.
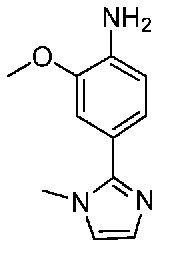
МСВР (ИЭР) МС m/z рассчитано для C11H14N3O [M+H]+ 204,1131, найдено 204,1139.
С использованием 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин и 2-бром-1-метил-1H-имидазола при 110°C при нагревании микроволновым излучением.
МО A.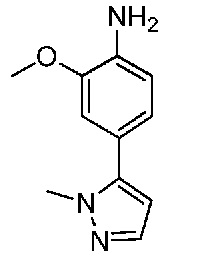
МСВР (ИЭР) МС m/z рассчитано для C11H14N3O [M+H]+ 204,1131, найдено 204,1140.
С использованием 4-бром-2-метоксианилина и 1-метил-1H-пиразол-5-илбороновой кислоты с Pd(PPh3)4 при 70°C. 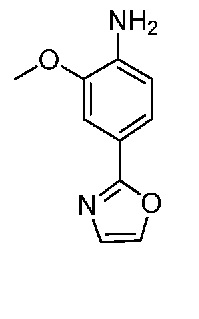
МСВР (ИЭР) МС m/z рассчитано для C10H11N2O2 [M+H]+ 191,0815, найдено 191,0825.
С использованием 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин и 2-бромоксазолгидрохлорида с Pd(PPh3)4 при 110°C при нагревании микроволновым излучением.
МО B.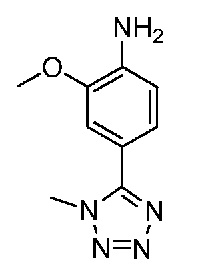
МСВР (ИЭР) МС m/z рассчитано для C9H12N5O [M+H]+ 206,1042, найдено 206,1046.
С использованием 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин и 5-бром-1-метил-1H-тетразола.
МСВР (ИЭР) МС m/z рассчитано для C12H15N2O2 [M+H]+ 219,1133, найдено 219,1128.
С использованием 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина и 5-бром-2,4-диметилоксазола.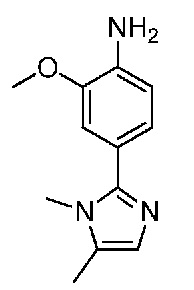
С использованием 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина и 2-бром-1,5-диметил-1H-имидазола с Pd(PPh3)4 при 100°C при нагревании микроволновым излучением.
МО C.
Синтез 52
2-Метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)анилин

Суспензию 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (122 мг, 0,490 ммоля), 5-йод-1-метил-1H-1,2,3-триазола (93 мг, 0,445 ммоля), CsF (203 мг, 1,335 ммоля) и Pd(PPh3)4 (51,4 мг, 0,045 ммоля) в смеси ДМЭ (диметиловый эфир)/MeOH (3:1, 4 мл) нагревали микроволновым излучением при 150°C в течение 1 ч. Реакционную смесь фильтровали и очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 50-70% EtOAc в циклогексане и получали искомое соединение (75 мг, 83%).
1H ЯМР (500 МГц, CDCl3): δ част./млн 7,67 (s, 1H), 6,85-6,84 (m, 2H), 6,80 (d, J=1,5 Гц, 1H), 4,06 (s, 3H), 3,91 (s, 3H).
МСВР (ИЭР) МС m/z рассчитано для C10H13N4O [M+H]+ 205,1084, найдено 205,1093.
Синтез 53
4-(1,2-Диметил-1H-имидазол-5-ил)-2-метоксианилин
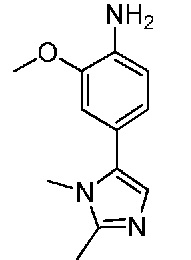
Суспензию 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (925 мг, 3,71 ммоля), 5-бром-1,2-диметилимидазола (650 мг, 3,71 ммоля), CsF (1,7 г, 11,14 ммоля) и Pd(PPh3)4 (86 мг, 0,074 ммоля) в ДМЭ/MeOH (2:1, 18 мл) нагревали микроволновым излучением при 150°C в течение 10 мин. Реакционную смесь разбавляли с помощью EtOAc и водой. Водный слой подщелачивали путем добавления 2M водного раствора Na2CO3 и экстрагировали с помощью EtOAc. Объединенные органические слои промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии с обращенной фазой при элюировании с помощью 100% воды и получали искомое соединение (800 мг, 99%).
1H ЯМР (500 МГц, MeOH-d4) δ част./млн 6,84 (d, J=2,0 Гц, 1H), 6,81 (s, 1H), 6,78 (d, J=2,0 Гц, 1H), 6,75 (s, 1H), 3,88 (s, 3H), 3,53 (s, 3H), 2,41 (s, 3H).
МСВР (ИЭР) МС m/z рассчитано для C12H16N3O [M+H]+ 218,1288, найдено 218,1200.
Синтез 54
2-Этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)анилин
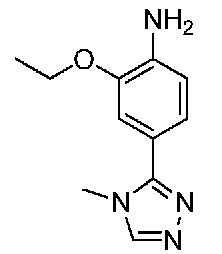
К раствору 3-(3-этокси-4-нитрофенил)-4-метил-4H-1,2,4-триазола (синтез 55, 748 мг 3,19 ммоля) в EtOH (50 мл) добавляли 10% Pd/C (130 мг, 0,123 ммоля). Реакционную смесь перемешивали в атмосфере водорода (1 атм.) при комнатной температуре в течение 18 ч. Реакционную смесь фильтровали через целит и концентрировали в вакууме и получали искомое соединение (539 мг, 83%).
1H ЯМР (500 МГц, MeOH-d4) δ част./млн 8,49 (s, 1H), 7,15 (d, J=2,0 Гц, 1H), 7,08 (dd, J=8,0, 2,0 Гц, 1H), 6,87 (d, J=8,0 Гц, 1H), 4,15 (q, J=7,0 Гц, 2H), 3,80 (s, 3H), 1,47 (t, J=7,0 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C11H14N4O [M+H]+ 249,0988, найдено 249,0992.
Синтез 55
3-(3-Этокси-4-нитрофенил)-4-метил-4H-1,2,4-триазол
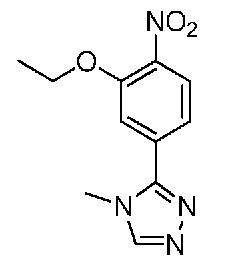
К охлажденной (0°C) суспензии 5-(3-этокси-4-нитрофенил)-4-метил-4H-1,2,4-триазол-3-тиола (синтез 56, 1,16 г 4,14 ммоля) в ДХМ (11,8 мл) по каплям добавляли 35% раствор пероксида водорода (0,91 мл, 12,2 ммоля) в уксусной кислоте (6 мл). Реакционную смесь перемешивали при комнатной температуре в течение 70 мин. Добавляли ДХМ (50 мл), затем 2M NaOH (48 мл) до получения нейтральной среды. Водный слой экстрагировали с помощью ДХМ. Объединенные органические слои сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 5-10% EtOH в ДХМ и получали искомое соединение (607 мг, 60%).
1H ЯМР (500 МГц, ДМСО-d6): δ част./млн 8,66 (s, 1H), 8,03 (d, J=8,5 Гц, 1H), 7,65 (d, J=1,6 Гц, 1H), 7,47 (dd, J=1,6, 8,5 Гц, 1H), 4,31 (q, J=7,3 Гц, 2H), 3,81 (s, 3H), 1,36 (t, J=6,9 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C11H13N4O3 [M+H]+ 249,0988, найдено 249,0985.
АЛЬТЕРНАТИВНО
К суспензии 3-этокси-N-метил-4-нитробензамида (синтез 58, 609 мг, 2,72 ммоля) в ДХЭ (дихлорэтан) (12 мл) добавляли тионилхлорид (0,79 мл, 10,86 ммоля). Смесь перемешивали при 90°C при нагревании микроволновым излучением в течение 3 ч. Реакционную смесь концентрировали в вакууме и полученное масло апельсинового цвета сушили в вакууме в течение 1 ч. Добавляли формилгидразид (196 мг, 3,26 ммоля) в ДМФ (10 мл) и реакционную смесь нагревали при 110°C микроволновым излучением в течение 1 ч. К реакционной смеси добавляли рассол. Полученный осадок отфильтровывали, промывали водой и сушили в вакууме и получали искомое соединение (290 мг, 43%).
Синтез 56
5-(3-Этокси-4-нитрофенил)-4-метил-4H-1,2,4-триазол-3-тиол

К раствору 3-этокси-4-нитробензогидразида (синтез 57, 1287 мг 5,72 ммоля) в ТГФ (26 мл) добавляли раствор метилизотиоцианата (422 мг 5,78 ммоля) в ТГФ (5 мл). Добавляли триэтиламин (102 мкл, 0,71 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 22 ч. Реакционную смесь концентрировали в вакууме и остаток растворяли в 1M NaOH (85 мл). Реакционную смесь перемешивали при 45oC в течение 2,5 ч. Реакционную смесь фильтровали через целит и фильтрат экстрагировали эфиром. Водный раствор подкисляли концентрированным HCl и экстрагировали с помощью EtOAc. Объединенный органический слой промывали водой и рассолом, сушили (Na2SO4) и концентрировали в вакууме и получали искомое соединение (1,16 г, 72%).
1H ЯМР (500 МГц, ДМСО-d6): δ част./млн 14,11 (br s, 1H), 8,03 (d, J=8,5 Гц, 1H), 7,66 (d, J=1,6 Гц, 1H), 7,44 (dd, J=1,9, 8,5 Гц, 1H), 4,29 (q, J=6,9 Гц, 2H), 3,56 (s, 3H), 1,35 (t, J=6,9 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C11H12N4O3S [M+H]+ 475,2570, найдено 475,2571
Синтез 57
3-Этокси-4-нитробензогидразид
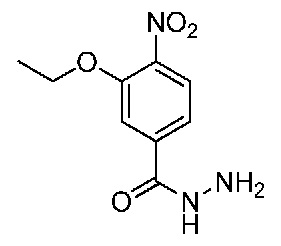
К охлажденному (0°C) раствору 3-этокси-4-нитробензойной кислоты (PCT Int Appl. 2008003958, 1,06 г, 5,02 ммоля) в ТГФ (10 мл) и триэтиламина (0,86 мл, 6,1 ммоля) по каплям добавляли этилхлорформиат (0,56 мл, 5,85 ммоля). Реакционную смесь перемешивали при 0°C в течение 15 мин. Одной порцией добавляли гидразингидрат (1,27 мл, 26 ммоля) и реакционную смесь перемешивали в течение 5 мин и затем при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали в вакууме, подвергали распределению между EtOAc и насыщенным водным раствором NaHCO3. Органический слой промывали рассолом, сушили (Na2SO4) и концентрировали в вакууме и получали искомое соединение (1,07 г, 95%).
1H ЯМР (500 МГц, ДМСО-d6): δ част./млн 10,05 (br s, 1H, NH), 7,92 (d, J=8,3 Гц, 1H), 7,69 (d, J=1,7 Гц, 1H), 7,51 (dd, J=8,3, 1,7 Гц, 1H), 4,70 (br s, 2H), 4,27 (q, J=6,9 Гц, 2H), 1,35 (t, J=6,9 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C9H11N3O4 [M+H]+ 226,0822, найдено 226,0828.
Синтез 58
3-Этокси-N-метил-4-нитробензамид
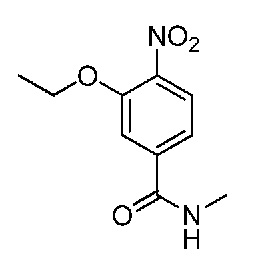
К суспензии 3-этокси-4-нитробензойной кислоты (PCT Int Appl. 2008003958, 2,57 г, 12,2 ммоля), метанамингидрохлорида (1,32 г, 19,5 ммоля), гидрата 1H-бензо[d][1,2,3]триазол-1-ола (3,73 г, 24,4 ммоля) и N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамингидрохлорида (4,67 г, 24,4 ммоля) в ДХМ (50 мл) добавляли N-этил-N-изопропилпропан-2-амин (10,6 мл, 60,9 ммоля). Полученный раствор перемешивали при комнатной температуре в течение 18 ч. Органическую фазу промывали водой, раствором лимонной кислоты, насыщенным водным раствором NaHCO3 и рассолом, сушили (Na2SO4) и концентрировали в вакууме и получали искомое соединение (2,41 г, 88%).
1H ЯМР (500 МГц, CDCl3): δ част./млн 7,83 (d, J=8,3 Гц, 1H), 7,60 (d, J=1,7 Гц, 1H), 7,25 (dd, J=8,3, 1,7 Гц, 1H), 6,23 (s, широкий, 1H), 4,26 (q, J=7,0 Гц, 2H), 3,05 (d, J=4,9 Гц, 3H), 1,50 (t, J=7,0 Гц, 3H).
ЖХ/МС (ИЭР) Rt=1,09 мин, МС m/z 225 [M+H]+.
Синтез 59
4-(4,5-Диметил-4H-1,2,4-триазол-3-ил)-2-этоксианилин
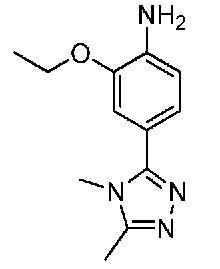
К раствору 4-бром-2-этоксианилина (150 мг, 0,694 ммоля) в толуоле (2 мл) в сосуде для микроволновой печи добавляли 3,4-диметилтриазол (135 мг, 1,39 ммоля), Pd(OAc)2 (16 мг, 0,069 ммоля), K2CO3 (585 мг, 4,23 ммоля), триметилуксусную кислоту (47 мг, 0,458 ммоля) и PCy3.HBF4 (51 мг, 0,139 ммоля). Реакционную смесь продували азотом, герметизировали и нагревали при 110°C в течение 18 ч. Реакционную смесь концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-20% MeOH в EtOAc и получали искомое соединение (51 мг, 32%).
1H ЯМР (500 МГц, MeOH-d4) 7,08 (d, J=1,7 Гц, 1H), 7,02 (dd, J=8,0, 1,7 Гц, 1H), 6,87 (d, J=8,0 Гц, 1H), 4,14 (q, J=7,0 Гц, 2H), 3,64 (s, 3H), 2,49 (s, 3H), 1,47 (t, J=7,0 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C12H17N4O [M+H]+ 233,1402, найдено 233,1402
Синтез 60
2-Этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)анилин
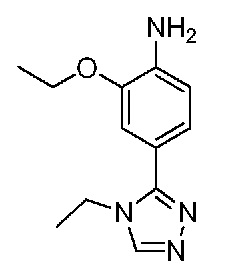
К раствору 4-бром-2-этоксианилина (75 мг, 0,347 ммоля) в толуоле (1 мл) в сосуде для микроволновой печи добавляли 4-этил-4H-1,2,4-триазол (50 мг, 0,521 ммоля), Pd(OAc)2 (8 мг, 0,035 ммоля), K2CO3 (293 мг, 2,12 ммоля), триметилуксусную кислоту (23 мг, 0,229 ммоля) и PCy3.HBF4 (26 мг, 0,069 ммоля). Реакционную смесь продували азотом, герметизировали и нагревали при 110°C в течение 18 ч. Реакционную смесь концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-20% MeOH в EtOAc и получали искомое соединение (51 мг, 63%).
1H ЯМР (500 МГц, MeOH-d4): δ част./млн 8,57 (s, 1H), 7,08 (d, J=1,8 Гц, 1H), 7,01 (dd, J=8,0, 1,8 Гц, 1H), 6,87 (d, J=8,0 Гц, 1H), 4,20-4,11 (m, 4H), 1,47 (t, J=7,0 Гц, 3H), 1,40 (t, J=7,2 Гц, 3H).
ЖХ/МС (ИЭР) Rt=1,04 мин, МС m/z 263,0838 [M+H]+.
АЛЬТЕРНАТИВНО
К раствору 3-(3-этокси-4-нитрофенил)-4-этил-4H-1,2,4-триазола (синтез 63, 410 мг, 1,563 ммоля) в EtOH (25 мл) добавляли 10% Pd/C (83 мг, 0,078 ммоля). Реакционную смесь перемешивали в атмосфере водорода (1 атм.) при комнатной температуре в течение 18 ч. Добавляли 10% Pd/C (83 мг, 0,078 ммоля) и реакционную смесь перемешивали в атмосфере водорода в течение еще 24 ч. Реакционную смесь фильтровали через целит, промывали с помощью EtOH и концентрировали в вакууме и получали искомое соединение (280 мг, 77%).
Следующие продукты синтеза получали по методике, описанной в синтезе 59, с использованием соответствующего анилина и гетероцикла, как описано ниже. Неочищенные остатки реакции очищали, как указано выше, или по одной из следующих методик очистки (МО):
Методика очистки A: Колоночная хроматография на силикагеле при элюировании с помощью 0-7% MeOH в EtOAc.
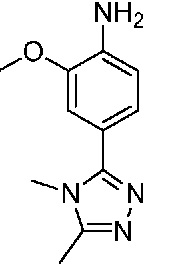
МСВР (ИЭР) МС m/z рассчитано для C11H15N4O [M+H]+ 219,1246, найдено 219,1252.
С использованием 4-бром-2-метоксианилина и 3,4-диметилтриазола.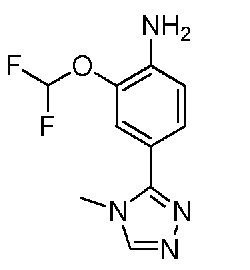
С использованием 4-бром-2-(дифторметокси)анилина и 4-метил-4H-1,2,4-триазола.
МО A.
Синтез 63
3-(3-Этокси-4-нитрофенил)-4-этил-4H-1,2,4-триазол
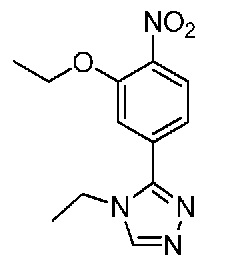
К охлажденной (0°C) суспензии 5-(3-этокси-4-нитрофенил)-4-этил-4H-1,2,4-триазол-3-тиола (синтез 64, 1,0 г, 3,40 ммоля) в ДХМ (11,5 мл) по каплям добавляли 35% раствор пероксида водорода (1,0 мл, 10,19 ммоля) в уксусной кислоте (4,67 мл, 82 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Добавляли ДХМ (12 мл), затем 1M NaOH до обеспечения нейтральной среды. Водный слой повторно экстрагировали с помощью ДХМ. Объединенные органические слои сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-10% MeOH в ДХМ и получали искомое соединение (410 мг, 46%).
1H ЯМР (500 МГц, MeOH-d4) δ част./млн 8,73 (s, 1H), 7,97 (d, J=8,1 Гц, 1H), 7,57 (d, J=1,7 Гц, 1H), 7,37 (dd, J=8,1, 1,7 Гц, 1H), 4,30 (q, J=6,9 Гц, 2H), 4,24 (q, J=7,4 Гц, 2H), 1,47 (t, J=6,9 Гц, 3H), 1,43 (t, J=7,4 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C2H4BrN4 [M+H]+ 162,9619, найдено 162,9640
Синтез 64
5-(3-Этокси-4-нитрофенил)-4-этил-4H-1,2,4-триазол-3-тиол

К раствору 3-этокси-4-нитробензогидразида (синтез 57, 1,5g, 6,66 ммоля) в ТГФ (32 мл) добавляли этилизотиоцианат (1,0 мл, 11,32 ммоля), затем триэтиламин (0,11 мл, 0,799 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли этилизотиоцианат (2 мл, 22,64 ммоля) и реакционную смесь перемешивали в течение еще 24 ч. Добавляли этилизотиоцианат (2 мл, 22,64 ммоля) и реакционную смесь перемешивали в течение еще 72 ч. Реакционную смесь концентрировали в вакууме и остаток повторно растворяли в 1M NaOH (15 мл). Реакционную смесь перемешивали при 45°C в течение 4 ч. Реакционную смесь фильтровали через целит и фильтрат экстрагировали эфиром. Водный слой подкисляли с помощью 1M HCl и экстрагировали с помощью EtOAc. Объединенный органический слой промывали водой и рассолом, сушили (MgSO4) и концентрировали в вакууме и получали искомое соединение (1,0 г, 51%).
1H ЯМР (500 МГц, MeOH-d4) δ част./млн 7,96 (d, J=8,2 Гц, 1H), 7,56 (d, J=1,6 Гц, 1H), 7,37 (dd, J=8,2, 1,6 Гц, 1H), 4,29 (q, J=6,9 Гц, 2H), 4,21 (q, J=7,0 Гц, 2H), 1,47 (t, J=6,9 Гц, 3H), 1,30 (t, J=7,0 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C12H15N4O3S [M+H]+ 295,0865, найдено 295,0857
Синтез 65
5-Бром-1-метил-1H-тетразол
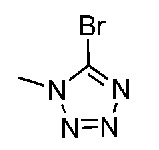
Суспензию бромида цинка (1,20 г, 5,33 ммоля) и 1-метил-1H-тетразол-5-тиола (302 мг, 2,60 ммоля) в AcOH (6 мл) нагревали при 40°C. После получения гомогенной смеси добавляли AcOOH (39% мас./мас. в AcOH, 2,65 мл, 15,64 ммоля). Полученную смесь нагревали при 80°C в течение 18 ч. Реакционную смесь разбавляли водой, добавляли NaHCO3 (твердый) до pH 6/7 и полученный раствор экстрагировали с помощью EtOAc. Объединенные органические вещества промывали с помощью 1M Na2SO3, насыщенным водным раствором NaHCO3, водой и рассолом, сушили (MgSO4) и концентрировали в вакууме и получали искомое соединение (276 мг, 65%).
1H ЯМР (500 МГц, CDCl3): δ част./млн 4,10 (s, 3H).
МСВР (ИЭР) МС m/z рассчитано для C2H4BrN4 [M+H]+ 162,9619, найдено 162,9640.
Синтез 66
3-Этил-3-метоксиазетидингидрохлорид

Раствор 1-бензгидрил-3-этил-3-метоксиазетидина (синтез 68, 340 мг, 1,208 ммоля) в ацетонитриле (8 мл) обрабатывали 1-хлорэтилхлорформиатом (175 мкл, 1,628 ммоля) при 0°C и затем кипятили с обратным холодильником в течение 1 ч. Смесь концентрировали в вакууме, повторно растворяли в MeOH (8 мл) и кипятили с обратным холодильником в течение 1,5 ч. Раствор концентрировали в вакууме, остаток растворяли в воде (8 мл) и дважды промывали циклогексаном. Водный слой концентрировали в вакууме и выпаривали вместе с EtOH (трижды) и ДХМ (дважды) и получали искомое соединение (173 мг, 95%).
1H ЯМР (500 МГц, ДМСО-d6): δ част./млн 9,29 (br s, 1H), 9,17 (br s, 1H), 3,83 (br s, 2H), 3,73 (br s, 2H), 3,13 (s, 3H), 1,84 (q, J=7,3 Гц, 2H), 0,77 (t, J=7,3 Гц, 3H).
Следующий продукт синтеза получали по методике, описанной в синтезе 66, с использованием соответствующего азетидина, как описано ниже. Неочищенные остатки реакции очищали, как указано выше.
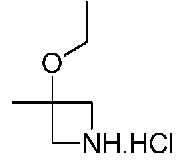
С использованием 1-бензгидрил-3-этокси-3-метилазетидина (синтез 69).
Синтез 68
1-Бензгидрил-3-этил-3-метоксиазетидин

Раствор 1-бензгидрил-3-этилазетидин-3-ола (синтез 70, 490 мг, 1,833 ммоля) в ДМФ (10 мл), охлажденный до 0°C, обрабатывали гидридом натрия (60% мас./мас. в минеральном масле, 115 мг, 2,88 ммоля) и перемешивали при комнатной температуре в течение 90 мин. Смесь охлаждали до 0°C, обрабатывали метилйодидом (150 мкл, 2,41 ммоля) и перемешивали при комнатной температуре в течение 2,5 ч. Реакцию останавливали водой и экстрагировали с помощью EtOAc. Объединенные органические вещества промывали водой, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-5% EtOAc в циклогексане и получали искомое соединение (347 мг, 67%).
1H ЯМР (500 МГц, CDCl3): δ част./млн 7,48-7,42 (m, 4H), 7,32-7,26 (m, 4H), 7,23-7,17 (m, 2H), 4,42 (s, 1H), 3,17 (s, 3H), 3,16-3,12 (m, 2H), 3,00 (d, J=8,6 Гц, 2H), 1,88 (q,
J=7,4 Гц, 2H), 0,92 (t, J=7,4 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C19H24NO [M+H]+ 282,1858, найдено 282,1860.
Следующий продукт синтеза получали по методике, описанной в синтезе 68, с использованием соответствующего азетидинола и алкилирующего реагента, как описано ниже. Неочищенные остатки реакции очищали, как указано выше.
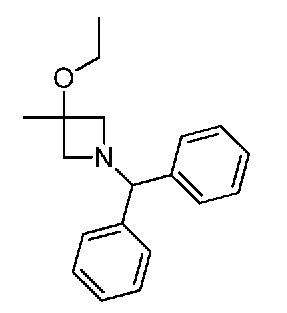
МСВР (ИЭР) МС m/z рассчитано для C19H24NO [M+H]+ 282,1858, найдено 282,1845.
С использованием 1-бензгидрил-3-метилазетидин-3-ола (синтез 71) и этилбромида при комнатной температуре в течение 18 ч.
Синтез 70
1-Бензгидрил-3-этилазетидин-3-ол
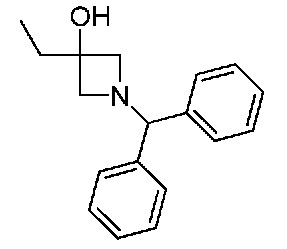
Раствор 1-бензгидрилазетидин-3-она (500 мг, 2,107 ммоля) в ТГФ (10 мл) обрабатывали с помощью EtMgCl (2M в ТГФ, 2,2 мл, 4,40 ммоля) при 0°C и перемешивали при комнатной температуре в течение 1 ч. Реакцию останавливали насыщенным водным раствором NH4Cl и экстрагировали с помощью EtOAc. Объединенные органические вещества промывали водой, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле при элюировании с помощью 0-20% EtOAc в циклогексане и получали искомое соединение (492 мг, 87%).
1H ЯМР (500 МГц, CDCl3): δ част./млн 7,50-7,37 (m, 4H), 7,32-7,25 (m, 4H), 7,25-7,15 (m, 2H), 4,39 (s, 1H), 3,23 (d, J=8,9 Гц, 2H), 2,97 (d, J=8,8 Гц, 2H), 1,93 (s, 1H), 1,83 (q, J=7,4 Гц, 2H), 0,99 (t, J=7,4 Гц, 3H).
МСВР (ИЭР) МС m/z рассчитано для C18H22NO [M+H]+ 268,1701, найдено 268,1699.
Следующий продукт синтеза получали по методике, описанной в синтезе 70, с использованием соответствующего магнийсодержащего реагента, как описано ниже. Неочищенные остатки реакции очищали, как указано выше.
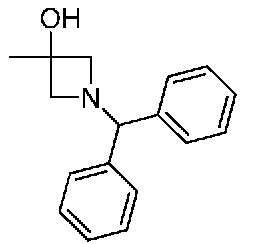
МСВР (ИЭР) МС m/z рассчитано для C17H20NO [M+H]+ 254,1545, найдено 254,1553.
С использованием MeMgBr (3M в Et2O)
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2673079C2 |
| СПОСОБЫ И МЕДИЦИНСКИЕ ПРИМЕНЕНИЯ | 2018 |
|
RU2788174C2 |
| СПОСОБЫ И МЕДИЦИНСКИЕ ПРИМЕНЕНИЯ | 2018 |
|
RU2788163C2 |
| ИНГИБИТОРЫ ФЕРМЕНТА ДИАЦИЛГЛИЦЕРИН-О-АЦИЛТРАНСФЕРАЗЫ ТИПА 1 | 2008 |
|
RU2486186C2 |
| Соединения формул (I) и (A), фармацевтическая композиция, лекарственное средство, применение и способ получения соединения формулы (I) | 2018 |
|
RU2822758C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2012 |
|
RU2592542C2 |
| ГЕТЕРОАРИЛ-БИФЕНИЛ АМИНЫ ДЛЯ ЛЕЧЕНИЯ PD-L1 ЗАБОЛЕВАНИЙ | 2020 |
|
RU2837843C1 |
| ИНГИБИТОР FGFR И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2745035C1 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ СПИРОПИПЕРИДИНИЛА И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2021 |
|
RU2839891C1 |
Изобретение относится к соединению формулы I или его фармацевтически приемлемой соли, где в формуле I R1 выбран из группы, включающей 5-членный гетероарил, необязательно содержащий один или большее количество (C1-C4)алкильных заместителей; R2 выбран из группы, включающей (C1-C3)алкоксигруппу или (C1-C3)фторалкоксигруппу; и R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, образуют связанное атомом азота 4-, 5-, 6- или 7-членное гетероциклическое кольцо, где указанное кольцо необязательно сконденсировано с дополнительным 3-членным карбоциклическим кольцом, с образованием бициклической гетероциклической системы, или необязательно связано через спирановый атом углерода с дополнительным 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием спиробициклической кольцевой системы; и где гетероциклическое кольцо, бициклическая кольцевая система или спиробициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, , цианогруппу, (C1-C4)алкил, NRiRj, ORi, где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C4)алкил; где каждый "гетероарил" может содержать от 1 до 4 гетероатомов, независимо выбранных из атомов O, N и S; и где каждый "гетероциклил" или "гетероциклическая группа" может содержать 1 или 2 гетероатома, независимо выбранных из атомов O, N и S. Изобретение также относится к способам получения указанных соединений и фармацевтической композиции для лечения заболевания или патологического состояния, связанного с активностью киназы Mps1, на основе этих соединений. Технический результат – получены новые соединения и фармацевтические композиции на их основе, которые могут найти применение в медицине для лечения и/или предупреждения пролиферативных заболеваний, таких как рак. 7 н. и 10 з.п. ф-лы, 62 пр.

1. Соединение формулы I, приведенной ниже:
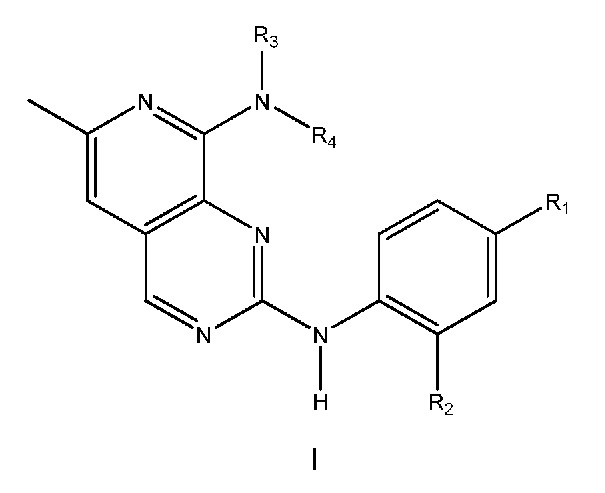
в которой R1 выбран из группы, включающей 5-членный гетероарил, необязательно содержащий один или большее количество (C1-C4)алкильных заместителей;
R2 выбран из группы, включающей (C1-C3)алкоксигруппу или (C1-C3)фторалкоксигруппу; и
R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, образуют связанное атомом азота 4-, 5-, 6- или 7-членное гетероциклическое кольцо,
где указанное кольцо необязательно сконденсировано с дополнительным 3-членным карбоциклическим кольцом, с образованием бициклической гетероциклической системы, или необязательно связано через спирановый атом углерода с дополнительным 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием спиробициклической кольцевой системы;
и где гетероциклическое кольцо, бициклическая кольцевая система или спиробициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, , цианогруппу, (C1-C4)алкил, NRiRj, ORi, где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C4)алкил;
где каждый "гетероарил" может содержать от 1 до 4 гетероатомов, независимо выбранных из атомов O, N и S; и
где каждый "гетероциклил" или "гетероциклическая группа" может содержать 1 или 2 гетероатома, независимо выбранных из атомов O, N и S;
или его фармацевтически приемлемая соль,
при условии, что указанным соединением не является следующее:
N-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(6-окса-2-азаспиро[3.4]октан-2-ил)пиридо[3,4-d]пиримидин-2-амин.
2. Соединение по п. 1, в котором R1 выбран из:
(i) 5-членного гетероарила, необязательно содержащего один или большее количество (C1-C2)алкильных заместителей.
3. Соединение по любому из предыдущих пунктов, в котором R1 выбран из группы, включающей:
(i) гетероарил формулы
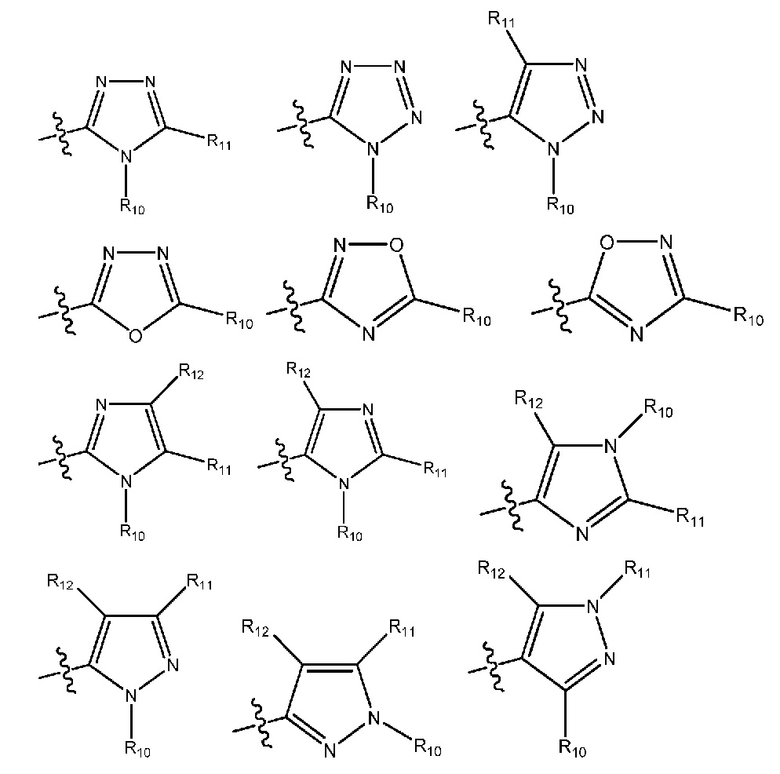
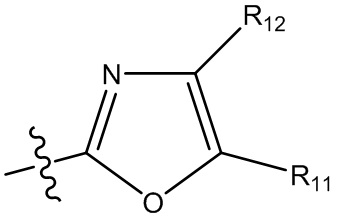

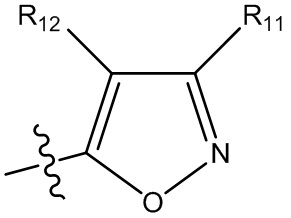
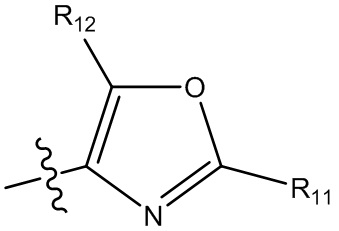
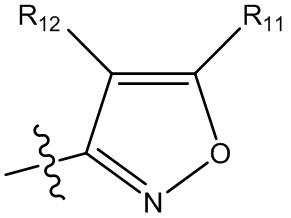
в которой R10, R11 и R12 все независимо выбраны из группы, включающей водород и (C1-C2)алкил.
4. Соединение по любому из предыдущих пунктов, в котором R1 означает триазольное или имидазольное кольцо, необязательно содержащее один или большее количество (C1-C4)алкильных заместителей.
5. Соединение по любому из предыдущих пунктов, в котором R2 выбран из группы, включающей (C1-C2)алкоксигруппу или (C1-C2)фторалкоксигруппу.
6. Соединение по любому из предыдущих пунктов, в котором R2 означает этоксигруппу.
7. Соединение по любому из предыдущих пунктов, в котором
R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, образуют связанное атомом азота 4-, 5-, 6- или 7-членное гетероциклическое кольцо,
где указанное кольцо необязательно сконденсировано с дополнительным 3-членным карбоциклическим кольцом, с образованием бициклической гетероциклической системы, или необязательно связано через спирановый атом углерода с дополнительным 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием спиробициклической кольцевой системы;
и где гетероциклическое кольцо, бициклическая кольцевая система или спиробициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, цианогруппу, (C1-C4)алкил, NRiRj, ORi, где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C4)алкил.
8. Соединение по любому из предыдущих пунктов, в котором
R3 и R4 связаны друг с другом так, что вместе с атомом азота, к которому они присоединены, образуют связанное с атомом азота 4-, 5- или 6-членное гетероциклическое кольцо,
где указанное кольцо необязательно связано через спирановый атом углерода с дополнительным 4-, 5- или 6-членным карбоциклическим или гетероциклическим кольцом с образованием спиробициклической кольцевой системы;
и где гетероциклическое кольцо или спиробициклическая кольцевая система необязательно содержит один или большее количество заместителей, независимо выбранных из группы, включающей галоген, трифторметил, дифторметил, цианогруппу, (C1-C4)алкил, NRiRj, ORi, где Ri и Rj все независимо выбраны из группы, включающей H или (C1-C4)алкил.
9. Соединение, выбранное из следующих:
N2-(2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
1-(((2-((2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)амино)метил)циклобутанол;
1-(2-((2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)пиперидин-4-карбоновой кислоты;
1-(2-((2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-ол;
N2-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метил-N8-((3-метилоксетан-3-ил)метил)пиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метил-N8- (тетрагидро-2Н-пиран-4-ил)пиридо[ 3,4-d]пиримидин-2,8-диамин;
N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(((2-((2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин -8-ил)амино)метил)циклопропанол;
N2-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-6-метил-N8-((3-метилтетрагидрофуран-3-ил)метил)пиридо[3,4- d]пиримидин-2,8-диамин;
N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-6-метил-8-(2-окса-7-азаспиро[4.4]нонан-7-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)пиперидина-4-карбонитрил;
1-(2-((4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилазетидин-3-карбонитрил;
N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метил-8-(1-окса-6-азаспиро[3.3]гептан-6-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(2-метокси-4-(1-метил-1Н-пиразол-3-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
8-(3,3-дифторазетидин-1-ил)-N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил) фенил) -6-метилпиридо[3 , 4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-8-(4-метоксипиперидин-1-ил)-6-метилпиридо[3,4 -d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-8-(3-метоксипиперидин-1-ил)-6-метилпиридо[3,4 -d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метил-8-(2-метилморфолино)пиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-8-(4-метокси-4-метилпиперидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
8-(3-азабицикло[3.1.0]гексан-3-ил)-N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
8-(3-(диметиламино)азетидин-1-ил)-N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[ 3,4-d]пиримидин-2-амин;
1-(2-((2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)пиперидин-4-ол;
N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-8-(3-метокси-3-метилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилпирролидин-3-ол;
1-(2-((2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-4-метилпиперидин-4-карбонитрил;
1-(2-((2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)пирролидин-3-карбонитрил;
N2-(2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-метокси-4-(1-метил-1Н-пиразол-5-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-метокси-4-(оксазол-2-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-8-(3-метоксипирролидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
8-(3,3-диметилазетидин-1-ил)-N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил) фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8-ил)-3-метилпирролидин-3-карбонитрил;
8-(2,2-диметилазетидин-1-ил)-N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метил-8-(3- (трифторметил)азетидин-1-ил)пиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метил-8-(2-азаспиро[3.3]гептан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
(R)-N8-(3,3-диметилбутан-2-ил)-N2-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2,8-диамин;
(S)-N8-(3,3-диметилбутан-2-ил)-N2-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-N8-((1-метоксициклобутил)метил)-6-метилпиридо[3,4- d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метил-N8-(1-метилазетидин-3-ил)пиридо[3, 4-d]пиримидин-2,8-диамин;
N2-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метил-N8- (оксетан-3-ил-метил)пиридо[3,4- d]пиримидин-2,8-диамин;
N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метил-8- (пирролидин-1-ил)пиридо[3,4- d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метил-8-(2-азаспиро[3,4]октан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
1-(2-((2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)амино)-6-метилпиридо[3,4-d]пиримидин-8 ил)-3-этилазетидин-3-ол;
8-(3-этокси-3-метилазетидин-1-ил)-N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-8-(3-этил-3-метоксиазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N2-(2-метокси-4-(1-метил-1Н-тетразол-5-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N-(2-(дифторметокси)-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-8-(3,3-диметилазетидин-1-ил)-6-метилпиридо[3,4-d] пиримидин-2-амин;
N2-(2-(дифторметокси)-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
8-(3,3-диметилазетидин-1-ил)-N-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил) фенил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(2-этокси-4-(4-этил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(4-(4,5-диметил-4Н-1,2,4-триазол-3-ил)-2-метоксифенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(4,5-диметил-4Н-1,2,4-триазол-3-ил)-2-этоксифенил)-8-(3,3-диметилазетидин-1-ил)-6-метилпиридо[ 3,4-d]пиримидин-2-амин;
N-(4-(4,5-диметил-4Н-1,2,4-триазол-3-ил)-2-этоксифенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(4,5-диметил-4Н-1,2,4-триазол-3-ил)-2-этоксифенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-8-(3,3-диметилазетидин-1-ил)-6-метилпиридо[3,4-d]пиримидин-2-амин;
N-(4-(1,2-диметил-1H-имидазол-5-ил)-2-метоксифенил)-6-метил-8-(7-окса-2-азаспиро[3.5]нонан-2-ил)пиридо[3,4-d]пиримидин-2-амин;
N2-(4-(1,5-диметил-1H-имидазол-2-ил)-2-метоксифенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
N2-(4-(2,4-диметилоксазол-5-ил)-2-метоксифенил)-6-метил-N8- неопентилпиридо[3,4-d]пиримидин-2,8-диамин;
или его фармацевтически приемлемая соль.
10. Соединение по любому из пп. 1-9 или его фармацевтически приемлемая соль, предназначенное для лечения заболевания или патологического состояния, связанного с активностью киназы Mps1.
11. Соединение по любому из пп. 1-9 или его фармацевтически приемлемая соль, предназначенное для лечения рака, связанного с активностью киназы Mps1.
12. Фармацевтическая композиция, предназначенная для лечения заболевания или патологического состояния, связанного с активностью киназы Mps1, содержащая соединение по пп. 1-9 или его фармацевтически приемлемую соль в смеси с фармацевтически приемлемым разбавителем или носителем.
13. Способ лечения пролиферативного нарушения, связанного с активностью киназы Mps1, у пациента, нуждающегося в таком лечении, где указанный способ включает введение указанному пациенту терапевтически эффективного количества соединения по пп. 1-9 или его фармацевтически приемлемой соли.
14. Способ по п. 13, в котором пролиферативным нарушением является рак.
15. Способ получения соединения формулы I или его фармацевтически приемлемой соли по п. 1, где способ включает:
a) взаимодействие соединения формулы A
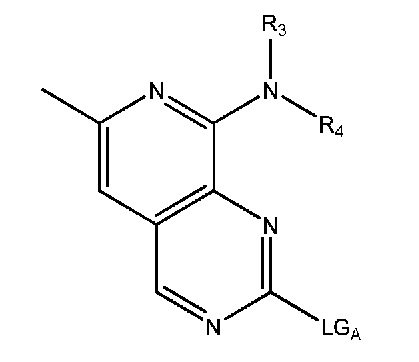
Формула A,
в которой R3 и R4 являются такими, как определено в п. 1, и LGA означает подходящую отщепляющуюся группу,
с соединением формулы B

Формула B,
в которой R1 и R2 являются такими, как определено в п. 1; и
затем необязательно и если необходимо:
i) удаление любых содержащихся защитных групп;
ii) превращение соединения формулы I в другое соединение формулы I; и/или
iii) образование его фармацевтически приемлемой соли.
16. Способ получения соединения формулы I или его фармацевтически приемлемой соли по п. 1, где способ включает:
взаимодействие соединения формулы C
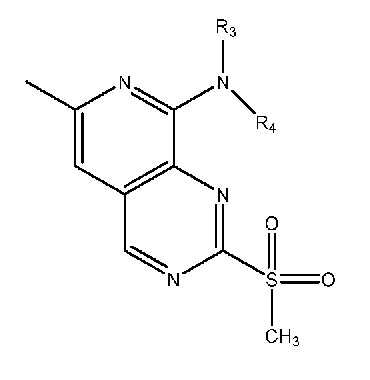
Формула C,
в которой R3 и R4 являются такими, как определено в п. 1,
с соединением формулы B, определенным выше в настоящем изобретении, или соединением формулы D

Формула D,
в которой R1 и R2 являются такими, как определено в п. 1; и
затем необязательно и если необходимо:
i) удаление любых содержащихся защитных групп;
ii) превращение соединения формулы I в другое соединение формулы I; и/или
iii) образование его фармацевтически приемлемой соли.
17. Способ получения соединения формулы I или его фармацевтически приемлемой соли по п. 1, где способ включает:
взаимодействие соединения формулы E
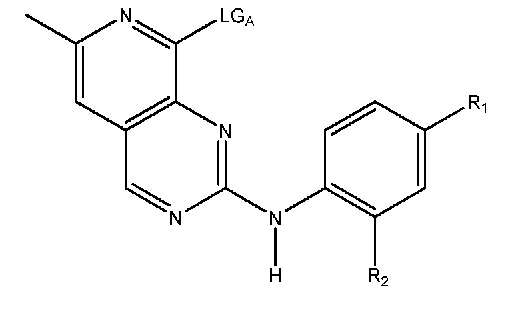
Формула E,
в которой R1 и R2 являются такими, как определено в п. 1, и LGA означает подходящую отщепляющуюся группу, определенную выше в настоящем изобретении,
с соединением формулы F
HNR3R4
Формула F,
в которой R3 и R4 являются такими, как определено в п. 1; и
затем необязательно и если необходимо:
i) удаление любых содержащихся защитных групп;
ii) превращение соединения формулы I в другое соединение формулы I; и/или
iii) образование его фармацевтически приемлемой соли или сольвата.
| WO 2012123745 A1, 20.09.2012 | |||
| WO 2012101032 A1, 02.08.2012 | |||
| Прицельное приспособление с глазным диоптром | 1929 |
|
SU18163A1 |
Авторы
Даты
2019-07-03—Публикация
2015-02-27—Подача