ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к композициям, содержащим берберин, для предупреждения и/или лечения дислипидемии, гиперхолестеринемии, метаболического синдрома или сердечно-сосудистого заболевания.
Уровень техники
Изобретение относится к композиции, содержащей берберин, для предупреждения и/или лечения дислипидемии, гиперхолестеринемии, метаболического синдрома и сердечно-сосудистого заболевания.
Уровень техники
Берберин (далее называемый "BBR") представляет собой алкалоид, присутствующий в различных растениях, таких как Berberis aristata, Coptis chinensis и Hydrastis canadensis, которые широко используются в китайской и индийской традиционной медицине вследствие их антипаразитарных, антибактериальных и противовоспалительных свойств.
Многочисленные более поздние исследования выявили очень широкий спектр фармакологической активности BBR, что указывает на его возможное клиническое применение в различных терапевтических областях, включая контроль метаболического синдрома. Это последнее применение, в частности, ассоциировано с основными антидислипидемическими и гипогликемическими эффектами, наблюдаемыми как на доклинических, так и на клинических уровнях [1,2].
Антидислипидемическая и гипогликемическая (постпрандиальная гликемия) активность BBR была продемонстрирована в многочисленных клинических испытаниях [1,2].
Также наблюдали важное действие на сосудистую стенку и на воспалительные механизмы, ассоциированные с сердечно-сосудистыми осложнениями метаболического синдрома [1,2].
Основным механизмом, посредством которого BBR обеспечивает защитный эффект в атеросклеротическом процессе, является снижение уровней LDL-C путем индукции синтеза печеночных рецепторов LDL-R и ингибирования экспрессии и секреции фермента PCSK9 [3]. Последний механизм в настоящее время является основной мишенью для разработки средств против дислипидемии последнего поколения. Недавно были выпущены в продажу моноклональные антитела против PCSK9 для лечения семейной гиперхолестеринемии, однако терапия ими имеет очень высокую стоимость и значительные побочные эффекты [2].
Что касается гипогликемических эффектов BBR, значительное количество клинических публикаций демонстрируют улучшение параметров глюкозы в крови (ассоциированных со снижением массы) у пациентов с T2DM, или метаболических параметров у пациентов с синдромом поликистоза яичников.
Также была продемонстрирована активность модулирования посредством BBR механизма регуляции клеточной энергии, ассоциированного с ферментом AMPk, который стал важной и широко исследуемой мишенью для регуляции уровня глюкозы в крови.
После перорального введения BBR пресистемно метаболизируется кишечной бактериальной флорой, образуя основной метаболит берберрубин, который затем всасывается и обратно конвертируется в BBR в печени и экскретируется с желчью [4].
Таким образом, печень, по-видимому, является основным органом-мишенью BBR с точки зрения как фармакокинетики, так и фармакодинамики, поскольку она обратно конвертирует всосавшийся метаболит, берберрубин, в BBR. Рецепторы LDL-R (одна из основных мишеней BBR) экспрессируются в клетках печени; печень играет важную роль в метаболизме углеводов, и является органом, где BBR связывается и выводится через желчь.
Активность BBR в печени также оказалась значительной в экспериментальных моделях in vivo в отношении контроля дегенеративных процессов, поражающих паренхиму печени, в основном стеатоза, ассоциированного с ожирением, индуцированным метаболическим синдромом [5]. Таким образом, BBR все в большей степени выступает в качестве продукта первой линии против метаболического синдрома, поскольку он действует против нескольких причин указанного синдрома, который имеет серьезные последствия здоровья в целом и сердечно-сосудистый риск в частности.
Основной проблемой использования BBR является его низкое пероральное всасывание, которое не превышает 0,5% от вводимой дозы, только 0,36% из которых достигает системного кровотока [6]. Это является следствием нескольких факторов: низкое всасывание в кишечнике, выведение посредством гликопротеинов проницаемости (Pgp), пресистемный метаболизм бактериальной флорой, печеночный метаболизм и выведение с желчью. Таким образом, необходимо вводить большие дозы (500-2000 мг) несколько раз в сутки, в результате чего возникает нарушение соблюдения пациентом режима лечения и серьезные желудочно-кишечные эффекты. Были предприняты многочисленные попытки увеличить уровни BBR в плазме посредством подходов составления или применения специфических ингибиторов Pgp, которые выводят BBR из энтероцитов. В частности, из научной литературы известно, что некоторые растительные экстракты, содержание нарингин из Citrus spp. [7] и процианидины из виноградных косточек [8], ингибируют активность Pgp.
В патенте Европы EP 2 149 377 [9] описаны композиции, содержащие BBR или экстракты, содержащие BBR в комбинации с силимарином или с экстрактами Silybum marianum, содержащими силимарин, для лечения гипергликемии.
Однако все еще остается необходимость в получении составов, способных повышать пероральную биодоступность BBR и повышать его терапевтический индекс.
Перечень чертежей
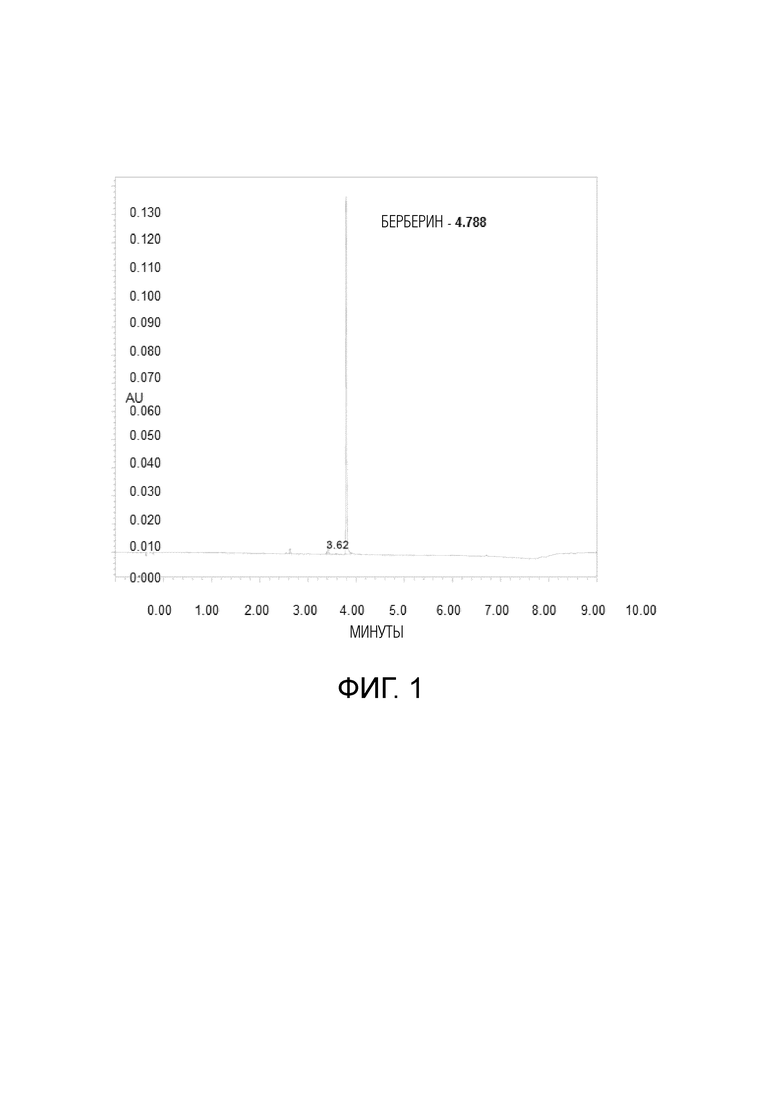
На фиг.1 представлена хроматограмма образца BBR в комбинации с белками гороха и лецитином согласно изобретению (раствор в метаноле, ~0,15 мг/мл).
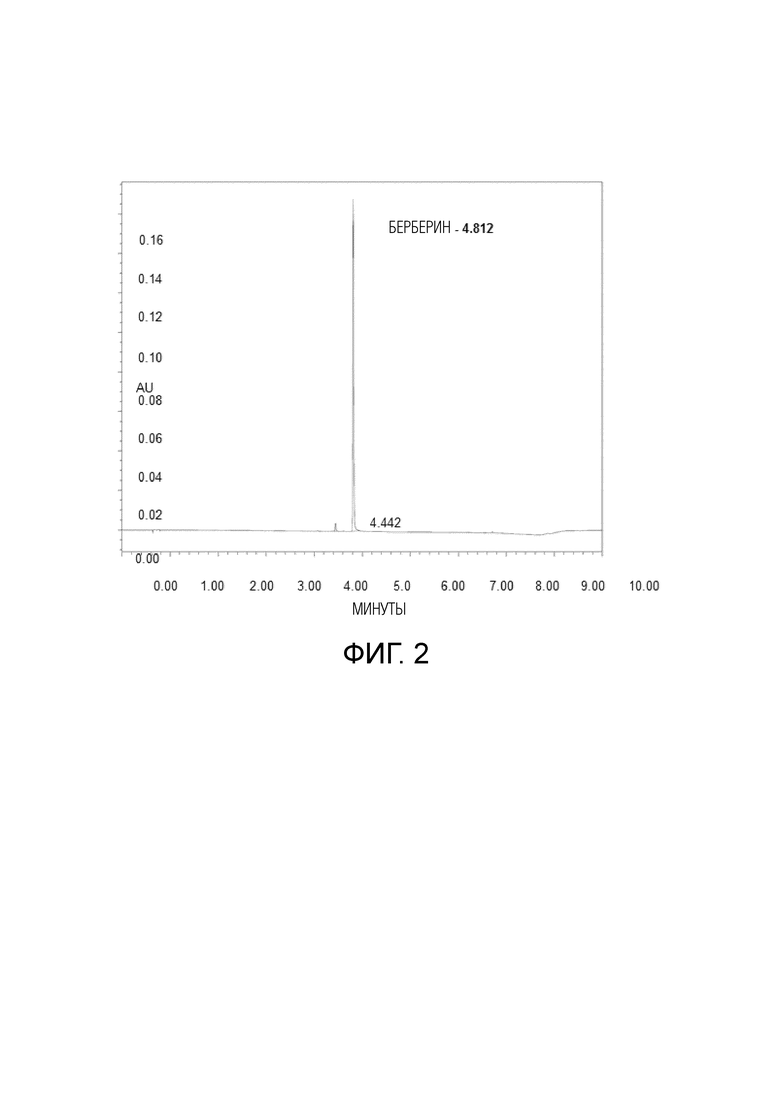
На фиг.2 представлена хроматограмма стандартного раствора хлорида BBR (раствор в метаноле, ~ 0,05 мг/мл).
Сущность изобретения
Настоящее изобретение относится к композиции, содержащей:
a) берберин (BBR);
b) белки гороха;
c) одно или несколько поверхностно-активных веществ;
и необязательно
d) растительный экстракт вида Vitis, или вида Citrus, или их комбинации.
Изобретение также относится к способам получения композиции, фармацевтических или нутрицевтических составов, содержащих композицию, и к применению композиции для предупреждения и/или лечения дислипидемии, гиперхолестеринемии, метаболического синдрома и сердечно-сосудистого заболевания.
Подробное описание изобретения
Было открыто, что, когда BBR комбинируют с белками гороха в присутствии по меньшей мере одного поверхностно-активного вещества растворимость BBR в водных растворах является более высокой, чем для BBR отдельно. Дальнейшее увеличение наблюдают, когда BBR комбинируют с белками гороха, поверхностно-активным веществом и экстрактом вида Vitis, предпочтительно экстрактом Vitis vinifera, и/или экстрактом растения Citrus, предпочтительно экстрактом Citrus bergamia. Без связи с теорией полагают, что присутствие по меньшей мере одного поверхностно-активного вещества способствует синергическому взаимодействию между BBR, белками гороха и, при наличии, экстрактами растений видов Vitis и/или Citrus, которые в свою очередь приводят к повышению растворимости и всасывания BBR.
В первом аспекте изобретение, таким образом, относится к композиции, содержащей:
a) берберин (BBR);
b) белки гороха;
c) одно или несколько поверхностно-активных веществ;
и необязательно
d) растительный экстракт вида Vitis или вида Citrus, или их комбинации.
Для целей настоящего изобретению BBR можно использовать в форме экстракта, получаемого посредством водной экстракции (водный экстракт) из корней Berberis aristata, Coptis chinensis или Hydrastis canadensis, более предпочтительно водного экстракта корней Berberis aristata. Предпочтительно водный экстракт имеет содержание BBR в диапазоне от 30 до 70% (масс./масс.), более предпочтительно 50% масс./масс. Экстракт можно получать общепринятыми способами, которые включают растирание корней, экстракцию в водной среде, преципитацию и сушку.
Еще более предпочтительно, BBR можно использовать в форме экстракта, далее называемого "чистым BBR", имеющего содержание берберина более 85% масс./масс., получаемого посредством дальнейшей очистки 50% масс./масс. водного экстракта на колонке со смолой.
Экстракты BBR и чистый BBR, которые также являются пригодными в соответствии с вариантом осуществления изобретения, являются коммерчески доступными, например, от Indian Herbs Extractions.
Выражение "белки гороха" определяет белки, получаемые посредством процесса водной экстракции из сухого гороха (Pisum sativum). Они являются коммерчески доступными, например, от Roquette (France), под торговым названием Nutralys®, и характеризуются высокой растворимостью (≥50%), высокой усвояемостью и сбалансированным профилем аминокислот.
Выражение "экстракт растения вида Vitis" означает один или несколько экстрактов вида Vitis, имеющих содержание проантоцианидина более 90% по массе. Предпочтительно используют экстракт семян Vitis vinifera, получаемый, как описано в WO 2007/017037 [10] или EP 0348781 [11], имеющий содержание проантоцианидина, равное или превышающее 95% по массе и содержание катехина и эпикатехина ≥5% по массе и ≤15% по массе. Указанный экстракт коммерчески доступен от Indena S.p.A. под торговым названием Enovita®.
Выражение "экстракт вида Citrus" обозначает один или несколько экстрактов вида Citrus, имеющий содержание флаванона, равное или превышающее 25% по массе. Предпочтительно используют экстракт Citrus bergamia (экстракт апельсина-бергамота), имеющий содержание флаванона более 28% по массе и сниженное содержание фурокумарина (бергаптен и бергамоттин), получаемый, как описано в WO 2010/055490 [12].
Соотношение между экстрактом, содержащим BBR, и белками гороха предпочтительно находится в диапазоне от 1:1 масс./масс. до 10:1 масс./масс., и более предпочтительно составляет 4:1 масс./масс., или соотношение между чистым BBR и белками гороха находится в диапазоне от 1:1 масс./масс. до 10:1 масс./масс., и более предпочтительно составляет 3:1 масс./масс.
В композициях по изобретению, которые содержат, в дополнение к белкам гороха, экстракт вида Vitis и/или экстракт вида Citrus, соотношение масс между экстрактом, содержащим BBR, или чистым BBR и массой белков гороха и экстракта вида Vitis и/или экстракта вида Citrus находится в диапазоне от 1:1 масс./масс. до 5:1 масс./масс. Соотношение между белками гороха и экстрактом вида Vitis и/или экстрактом вида Citrus находится в диапазоне от 1:3 масс./масс. до 3:1 масс./масс.
Для целей настоящего изобретения выражение "поверхностно-активное вещество" означает одно или несколько фармакологически приемлемых веществ, содержащих полярную группу (или головку) и неполярную группу (или хвост). Поверхностно-активные вещества, пригодные для получения композиций по изобретению, могут быть неионными, катионными, анионными или амфипатическими и могут быть выбраны из поверхностно-активных веществ, описанных в Remington: "The Science and Practice of Pharmacy", 22nd edition, Pharmaceutical Press, 2013. Предпочтительно поверхностно-активное вещество выбрано их фосфолипидов, сложных эфиров сахарозы, полисорбатов, производных полиоксиэтиленкасторового масла, D-α-токоферилполиэтиленгликоля сукцината (витамин E TPGS), или их смесей. Более предпочтительно, поверхностно-активное вещество представляет собой лецитин, в частности, фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин или их смеси; еще более предпочтительно, лецитин представляет собой лецитин сои или подсолнечника. В композициях по изобретению поверхностно-активное вещество присутствует в количествах от 5 до 30% масс./масс. от общей массы экстракта BBR или чистого BBR и белков гороха, и экстракта вида Vitis и/или экстракта вида Citrus при их наличии.
Композиции по изобретению предпочтительно не включают силимарин или экстракты Silybum marianum, содержащие силимарин.
Композиции по изобретению могут содержать другие активные ингредиенты растительного происхождения; однако в предпочтительном варианте осуществления композиции состоят из:
a) BBR;
b) белков гороха;
c) одного или нескольких поверхностно-активных веществ;
и необязательно
d) растительного экстракта вида Vitis или вида Citrus или их комбинаций.
Композиции по изобретению необязательно могут содержать фармацевтически приемлемые эксципиенты, пригодные для получения составов для перорального введения, такие как таблетки, капсулы и грануляты, причем указанные эксципиенты включают, например:
- нерастворимые и растворимые разбавители, такие как микрокристаллическая целлюлоза, фосфат кальция, карбонат кальция, маннит, мальтодекстрины, изомальт или их комбинации;
- смазывающие вещества и/или вещества, способствующие скольжению, такие как диоксид кремния, тальк, стеариновая кислота, стеарат магния или их комбинации.
Эти и другие эксципиенты описаны в Remington: "The Science and Practice of Pharmacy", 22nd edition, Pharmaceutical Press, 2013.
Как правило, составы содержат композицию по изобретению, предпочтительно в количествах в диапазоне от 500 до 2000 мг, более предпочтительно в количествах, составляющих 500 мг, и по меньшей мере один эксципиент. Как правило, соотношение масс между композициями по изобретению и по меньшей мере одним эксципиентом в дозированной форме находится в диапазоне от 1:5 до 5:1 масс./масс.
Во втором аспекте изобретение относится к способу [способ (P-1)] получения композиций и составов по изобретению. Эти композиции и составы можно получать путем добавления BBR, белков гороха и необязательно экстракта вида Vitis или экстракта вида Citrus, и/или эксципиентов к раствору или дисперсии поверхностно-активного вещества. BBR, белки гороха и необязательно экстракт вида Vitis или экстракт вида Citrus, и/или эксципиенты можно добавлять последовательными стадиями или за одну стадию.
Первым предпочтительный способ [способ (P-1)] включает следующие стадии:
a-1) солюбилизация или диспергирование поверхностно-активного вещества или смеси поверхностно-активных веществ в 50-100 объемах органического растворителя, предпочтительно выбранного из этилового спирта, этилацетата и ацетона до тех пор, пока не будет получен раствор или однородная дисперсия;
b-1) добавление BBR и необязательно экстракта вида Vitis и/или экстракта вида Citrus к раствору или дисперсии, полученным согласно стадии a-1), нагревание до температуры, предпочтительно находящейся в диапазоне от 40°C и 70°C, более предпочтительно 60°C, с получением дисперсии;
c-1) охлаждение дисперсии, полученной на стадии b-1), до комнатной температуры и добавление белков гороха при перемешивании, предпочтительно в течение приблизительно 10-15 минут до получения дисперсии;
d-1) необязательно добавление разбавителя, предпочтительно микрокристаллической целлюлозы, или смеси разбавителей к дисперсии, полученной на стадии c-1);
e-1) удаление растворителя посредством выпаривания при малых давлениях, предпочтительно от 100 до 500 мбар, из смеси, полученной на стадии c-1), поддержание температуры, предпочтительно находящейся в диапазоне от 50°C до 75°C, более предпочтительно ≤65°C, необязательно завершение сушки в вакууме в печи, установленной на температуру 60-65°C, до тех пор пока не будет получен остаток предпочтительно < 1,2% масс./масс.;
f-1) сортировка композиции, полученной в конце стадии e-1), на сите калибра 10 и необязательно добавление смазывающего вещества и/или вещества, способствующего скольжению, предпочтительно выбранного из стеариновой кислоты, стеарата магния и диоксида кремния, предпочтительно диоксида кремния.
Второй предпочтительный способ [способ (P-2)] включает следующие стадии:
a-2) солюбилизация или диспергирование поверхностно-активного вещества или смеси поверхностно-активных веществ в 5-10 объемах органического растворителя, предпочтительно выбранного из этилового спирта, этилацетата и ацетона, предпочтительно этилового спирта, до получения раствора или однородной суспензии;
b-2) отдельно от раствора или суспензии, полученных на стадии a-2), смешение экстракта, содержащего BBR с белками гороха, необязательно экстрактом вида Vitis и/или экстрактом вида Citrus, и разбавителя, предпочтительно микрокристаллической целлюлозой, до получения однородной смеси, как правило, в течение приблизительно 5 минут;
c-2) добавление смеси, полученной на стадии b-2), к раствору или суспензии, полученным на стадии a-2), с получением смеси; поддержание полученной смеси при перемешивании в течение приблизительно 10-15 минут;
d-2) сушка в печи смеси, полученной на стадии c-2), в вакууме при температуре приблизительно 60-65°C до тех пор, пока не будет достигнуто остаточное содержание растворителя <1,2% масс./масс.;
e-2) сортировка композиции, полученной в конце стадии d-2), на сите калибра 10 и необязательно добавление одного или нескольких смазывающих веществ и/или веществ, способствующих скольжению, предпочтительно выбранных из стеариновой кислоты, стеарата магния и диоксида кремния, предпочтительно диоксида кремния.
Для целей настоящего изобретения термин "раствор" указывает на жидкую композицию, которая выглядит прозрачной при визуальном исследовании; термин "дисперсия" указывает на жидкую композицию, в которой при визуальном исследовании заметны суспендированные частицы и которая выглядит непрозрачной и мутной; термин "смесь" указывает на однородную смесь твердых веществ и жидкостей отличных от раствора или дисперсии, которая является мягкой и тягучей.
Более того, во избежание сомнений, когда указаны числовые диапазоны в настоящем описании и формуле изобретения, включены крайние значения диапазонов.
Синергическое взаимодействие между BBR, белками гороха и необязательным экстрактом вида Vitis и/или экстрактом вида Citrus можно подтверждать посредством тестов растворимости в жидкостях, имитирующих биологические жидкости, такие как имитированный желудочный сок. Тесты можно проводить способами, известными специалисту в данной области, например, как описано в экспериментальном разделе ниже. Взаимодействие считают произошедшим, когда наблюдают повышение растворимости по меньшей мере приблизительно в три раза превышающее растворимость, полученную для BBR не в комбинации. Параметр растворимости считают прогнозирующим увеличение всасывания.
В следующем аспекте изобретение относится к применению композиций (C) в качестве лекарственного средства, в частности, для предупреждения и/или лечения дислипидемии, гиперхолистеринемии, метаболического синдрома и сердечно-сосудистого заболевания.
Примеры, указанные в экспериментальном разделе ниже, далее иллюстрируют изобретение.
ЭКСПЕРИМЕНТАЛЬНЫЙ РАЗДЕЛ
Материалы
Растительный экстракт из корней Berberis aristata с содержанием BBR приблизительно 50% и чистый BBR приобретали от Indian Herbs Extractions, Ramnagar.
Белки гороха получали от Roquette, Франция (Nutralys®).
Экстракт Vitis vinifera является коммерчески доступным от Indena S.p.A. под торговым названием Enovita®, и его получают посредством водно-спиртовой экстракции, фильтрации, очистки на колонке со смолой и сушки.
Экстракт Citrus bergamia (апельсин-бергамот) получали от H&AD Herbal and Antioxidant Derivates.
Лецитин сои получали от Cargill®.
Проценты ингредиентов в композициях согласно примерам выражены по массе в качестве доли от общей массы композиции.
Примеры получения
Пример 1 - Композиция, содержащая экстракт BBR, титрованный до 50% масс./масс., белки гороха и лецитин
50% масс./масс. экстракта BBR 60,0%
Белки гороха 15,0%
Лецитин 14,0%
Гидроксипропилцеллюлоза 5,0%
Диоксид кремния 2,0%
Полисорбат 80 4,0%
Композицию получали, следуя способу (P-1), включающему следующие стадии.
1. Полисорбат 80 и гидроксипропилцеллюлозу растворяли в этиловом спирте до получения раствора.
2. К раствору, полученному на стадии 1, добавляли экстракт BBR, титрованный до 50% масс./масс., при перемешивании с магнитной мешалкой, и нагревали до 60°C до получения дисперсии.
3. К дисперсии, полученной на стадии 2, добавляли лецитин при перемешивании магнитной мешалкой, и нагревали до 60°C.
4. Дисперсию, полученную на стадии 3, охлаждали до комнатной температуры и добавляли белки гороха для получения дисперсии.
5. Растворитель удаляли посредством выпаривания из дисперсии, полученной на стадии 4, поддерживая температуру ≤65°C.
6. Продукт, полученный на стадии 5, сушили в печи в вакууме при 65°C до тех пор, пока остаток этилового спирта не составлял <1,2%.
7. Продукт, полученный на стадии 6, калибровали на сите калибра 10, и добавляли диоксид кремния, предварительно просеянный через сито калибра 50.
Пример 2 - Композиция, содержащая экстракт BBR, титрованный до 50% масс./масс., белки гороха, лецитин и экстракт Citrus bergamia
Экстракт BBR, титрованный до 50% масс./масс. 54,6%
Белки гороха 13,2%
Лецитин 12,7%
Экстракт Citrus bergamia 9,1%
Гидроксипропилцеллюлоза 5,0%
Диоксид кремния 1,8%
Полисорбат 80 3,6%
Композицию получали, следуя способу, описанному в примере 1, с тем отличием, что также на стадии 2 добавляли экстракт Citrus bergamia.
Пример 3 - Композиция, содержащая 50% масс./масс. экстракта BBR, белки гороха, лецитин и экстракт семян Vitis vinifera
50% масс./масс. экстракта BBR 54,6%
Белки гороха 13,2%
Лецитин 12,7%
Экстракт семян Vitis vinifera 9,1%
Гидроксипропилцеллюлоза 5,0%
Диоксид кремния 1,8%
Полисорбат 80 3,6%
Композицию получали, следуя способу, описанному в примере 1, с тем отличием, что также на стадии 2 добавляли экстракт семян Vitis vinifera.
Пример 4 - Покрытые таблетки
Композиция согласно примеру 1 500,0 мг
Дикальцийфосфат дигидрат 200,0 мг
Маннит 150,0 мг
Поливинилполипирролидон 30,0 мг
Стеарат магния 10,0 мг
Коллоидный диоксид кремния 10,0 мг
Покрытие на основе гидроксипропилметилцеллюлозы 20,0 мг
Пример 5 - Твердые желатиновые капсулы
Композиция согласно примеру 3 550,0 мг
Микрокристаллическая целлюлоза 60,0 мг
Стеарат магния 10,0 мг
Коллоидный диоксид кремния 10,0 мг
Пример 6 - Диспергируемый в воде гранулят
Композиция согласно примеру 2 550,0 мг
Мальтодекстрин 1200,0 мг
Фруктоза 425,0 мг
Гуаровая камедь 200,0 мг
Вкусовая добавка со вкусом апельсином 100,0 мг
Сукралоза 20,0 мг
Коллоидный диоксид кремния 5,0 мг
Способы анализа
Тест растворимости в имитированных биологических жидкостях
Тест растворимости проводили путем сравнения образцов, содержащих равные количества BBR.
Композиции, полученные, как описано в примерах 1, 2 и 3, анализировали путем сравнения с чистым BBR (контроль 1) и с композицией, содержащей 33% экстракт BBR, титрованный до 50% масс./масс., 65% лецитин и 2% диоксид кремния (контроль 2), но без белков гороха, для оценки повышенной растворимости в имитированных биологических жидкостях.
Анализ проводили способом UPLC (Сверхвысокоэффективная жидкостная хроматография), описанным ниже:
УСТРОЙСТВО: Waters® Acquity UPLC® H-Class System.
Программное обеспечение Empower (Empower System Enterprise Client/Server).
КОЛОНКА: Стационарная фаза: Acquity UPLC® CSHTM C18; Размеры: l=100 мм; I.D.=2,1 мм; размер частиц: 1,7 мкм, производитель: Waters.
ПОДВИЖНАЯ ФАЗА: Растворитель A: 0,5% фосфорная кислота (масс./об.); растворитель B: ацетонитрил.
ЛИНЕЙНЫЙ ГРАДИЕНТ
Таблица 1
* Проценты растворителей A и B выражены по объему по сравнению с общим объемом.
УСЛОВИЯ АНАЛИЗА: скорость потока: 0,4 мл/минута; детекция: 348 нм.
СОЛЮБИЛИЗИРУЮЩИЙ РАСТВОРИТЕЛЬ: 80% метанол
ПУСТОЙ РАСТВОР: 80% метанол
РАСТВОР ОБРАЗЦА: 30 мг в 200 мл (хроматограмма типичного образца ~ 0,15 мг/мл, на фиг.1).
СТАНДАРТНЫЙ РАСТВОР: 10 мг чистого контрольного BBR в 200 мл метанола (стандартный раствор ~0,05 мг/мл, типичная хроматограмма на фиг.2).
Тест растворимости проводили с использованием имитированного желудочного сока натощак (FaSSGF), полученного, как описано ниже, в качестве растворителя.
2 г NaCl растворяли в 0,9 л очищенной воды, pH доводили до 1,6 посредством HCl и смесь доводили до требуемого объема очищенной водой (1 литр).
2) 0,06 г порошка* (FaSSGF-Biorelevant media) добавляли приблизительно к 500 мл раствора NaCl/HCl при комнатной температуре и доводили до объема (1 л) раствором NaCl/HCl с получением прозрачной готовой для применения жидкости.
* Конечная концентрация таурохлората натрия 0,08 мМ, конечная концентрация лецитина 0,02 мМ
В таблице 2 ниже представлены результаты испытания:
Таблица 2
(мг/мл)
Результаты, указанные в таблице 2, указывают на то, что композиции по изобретению демонстрируют более высокую растворимость в имитированном желудочном соке, чем чистый BBR, при использовании как отдельно, так и в комбинации только с лецитином. Добавление белков гороха очевидно приводит к дальнейшему повышению растворимости. Добавление экстракта Citrus bergamia или экстракта семян Vitis vinifera обеспечивает дальнейшее повышение растворимости BBR. В частности, растворимость BBR возрастает приблизительно в три раза, когда BBR комбинируют только с белками гороха и лецитином, но приблизительно в четыре раза, когда его комбинируют с экстрактом Citrus bergamia или экстрактом семян Vitis vinifera. Эти данные демонстрируют, что композиции по изобретению повышают растворимость BBR в водной среде, что устраняет наибольшее препятствие для всасывания в кишечнике.
Сравнительная оценка биодоступности и влияние на слизистую оболочку кишечника контрольных композиций, содержащих только экстракт BBR и лецитин, и композиций, содержащих BBR согласно изобретению (BBR, как описано в примере 3)
Всасывание и биодоступность BBR определяли с использованием модели эпителия кишечника человека in vitro на основе клеток аденокарциномы кишечника человека Caco-2 (ATCC, HTB-37TM), организованных в виде функционального монослоя на вкладышах Transwell®. Вкладыши Transwell® имеют два отделения, апикальное (или просветное) и базально-латеральное (или серозное), разделенные микропористой мембраной.
Для определения потенциального вовлечения во всасывание BBR гликопротеина-P (P-gp), мембранного насоса, который выкачивает широкий диапазон субстратов, всасываемых энтероцитами, в просвет кишечника, проводили эксперименты по всасыванию in vitro в присутствии верапамила, селективного ингибитора гликопротеина-P (P-gp).
Перед проведением теста всасывания in vitro дозу композиции, состоящей из экстракта BBR, титрованного до 50% масс./масс., и лецитина (контроль 2), и дозу композиции согласно примеру 3, подвергали воздействию в течение трех часов процессу расщепления in vitro, имитирующему физиологическое пищеварение. Затем два расщепленных состава добавляли на верхнее отделение эпителия кишечника in vitro для проведения теста всасывания. Как показано в таблице 3 всасывание BBR из композиции согласно примеру 3 значительно превышает всасывание BBR из композиции контроля 2.
Таблица 3
После воздействия расщепленных составов жизнеспособность клеток в модели кишечного эпителия оценивали с использованием анализа с MTS на основе восстановления соединения тетразола MTS жизнеспособными клетками для получения окрашенного продукта формазана, количественно определяемое путем определения поглощения при 490 нм. Полученные величины доза (концентрация (мг/мл)) - ответ (% жизнеспособность кишечного эпителия) указаны в таблицах 4 и 5 ниже:
Таблица 4
Таблица 5
Полученные величины доза-ответ демонстрируют, что при максимальной концентрации BBR (8,2 мг/мл), контроль 2 индуцирует снижение жизнеспособности кишечного эпителия 46,6%, что значительно превышает снижение жизнеспособности, индуцированное композицией согласно примеру 3 (21,9%).
Это указывает на то, что композиции согласно изобретению, в частности, композиция согласно примеру 3, в отличие от экстракта, не комбинированного с белками гороха, гарантирует более высокую биодоступность активного ингредиента BBR в присутствии ингибитора P-gp верапамила, что подтверждает важность этого клеточного механизма во всасывании в нижнем отделе кишечника BBR.
Более того, при равной концентрации BBR, композиция согласно примеру 3 оказалась более безопасной, чем контроль 2, на что указывает более высокая жизнеспособность кишечной слизистой оболочки, таким образом, неожиданно обеспечивая, несмотря на увеличенное всасывание, более низкое потенциальное возникновение желудочно-кишечных нарушений, типичных для BBR.
Тест фармакокинетики на крысах
Тест фармакокинетики проводили на крысах для оценки увеличенного всасывания, достигаемого с использованием композиции, описанной в примере 1.
Тест проводили путем перорального введения 1000 мг/кг композиции согласно примеру 1, эквивалентной 100 мг/кг чистого BBR, трем крысам Sprague Dawley, и 100 мг/кг чистого BBR трем крысам. Продукты вводили в дистиллированной воде с 1% по массе метилцеллюлозы в качестве солюбилизатора. Взятие образцов крови проводили из ретроорбитального синуса в объеме 0,5 мл в гепаринированных тест-пробирках через 15 мин, 30 мин, 1 ч, 2 ч, 4 ч и 6 ч.
Образцы, полученные таким образом, анализировали после экстракции и обработки глюкуронидазой и арилсульфатазой стандартным способом ВЭЖХ, сопряженным с масс/масс-спектрометрическим детектором.
Неожиданно было обнаружено увеличение приблизительно в шесть раз максимальных уровней BBR в плазме по сравнению с уровнями, достигнутыми после введения экстракта BBR в эквимолярной дозе.
Наблюдали приблизительно трехкратное увеличение по сравнению с площадями под кривой (AUC), отражающими общее всасывание соединения.
Эти данные демонстрируют прогностическую величину теста растворимости и подтверждают улучшение фармакокинетических параметров и биодоступности in vivo.
ССЫЛКИ
1) Alberico Luigi Catapano, Berberin, a plant alkaloid with lipid-and glucose-lowering properties: From in vitro evidence to clinical studies Atherosclerosis Volume 243, Issue 2, December 2015, Pages 449-461.
2) Anil Kumar, Current knowledge and pharmacological profile of Berberin: An update European Journal of Pharmacology 761(2015)288-297.
3) Jin~lwen Liu, Inhibition of PCSK9 Transcription by Берберин Involves Down-regulation of Hepatic HNF1 a Protein Expression through the Ubiquitin-Proteasome Degradation Pathway The Journal of Biological Chemistry vol. 290, no.7, pp. 4047-4058, 13,2015.
4) Jian-Dong Jiang, Transforming берберин into its intestine-absorbable form by the gut Microbiota Scientific Reports | 5:12155 | DOI: 10.1038/srep12155 2015).
5) Ting Guo, Berberin Ameliorates Hepatic Steatosis and Suppresses Liver and Adipose Tissue Inflammation in Mice with Diet-induced Obesity Scientific Reports 6: 22612 (2016).
6) Xiao-Ying Long, Research progress on berberin with a special focus on its oral bioavailability Fitoterapia 109 (2016) 274-282.
7) De Castro, Whocely Victor, et al. "Effect of grapefruit juice, naringin, naringenin, and bergamottin on the intestinal carrier-mediated transport of talinolol in rats." Journal of agricultural and food chemistry 56.12 (2008): 4840-4845.
8) Zhao, Bo-xin, et al. "Grape seed procyanidin reversal of p-glycoprotein associated multi-drug resistance via down-regulation of NF-κB and MAPK/ERK mediated YB-1 activity in A2780/T cells." PloS one 8.8 (2013): e71071.
9) EP 2 149 377 (Velleja Research SRL), опубликованная 03/02/2010 и одобренная 14/09/2016.
10) WO 2007/017037 (A1) (Indena S.p.A.), опубликованная 15/02/2007.
11) EP 0348781 (TECNOFARMACI S.p.A. and INDENA S.p.A.), опубликованная 03/01/1990 и одобренная 30/09/1992.
12) WO 2010/055490 (A1) (Herbal & Antioxidant Derivatives S.r.L.), опубликованная 20/05/2010.
Группа изобретений относится к области медицины, а именно к композиции для предупреждения и/или лечения дислипидемии и/или гиперхолестеринемии, и/или метаболического синдрома, и/или сердечно-сосудистого заболевания, содержащей: a) берберин (BBR); b) белки гороха; c) одно или несколько поверхностно-активных веществ, выбранных из лецитинов, полисорбата 80 или их комбинаций; где соотношение между берберином (BBR) и белками гороха находится в диапазоне от 1:1 до 10:1 масс./масс., также относится к применению композиции для получения лекарственного средства для предупреждения и/или лечения дислипидемии и/или гиперхолестеринемии, и/или метаболического синдрома, и/или сердечно-сосудистого заболевания, также относится к применению композиции для предупреждения и/или лечения дислипидемии и/или гиперхолестеринемии, и/или метаболического синдрома, и/или сердечно-сосудистого заболевания, также относится к способу получения композиции, включающему получение раствора или дисперсии поверхностно-активного вещества, выбранного из лецитинов, полисорбата 80 или их комбинаций, и добавление на одной или нескольких последовательных стадиях BBR и белков гороха, также относится к составу для предупреждения и/или лечения дислипидемии и/или гиперхолестеринемии, и/или метаболического синдрома, и/или сердечно-сосудистого заболевания, содержащему композицию, и по меньшей мере один подходящий фармацевтически приемлемый эксципиент, и способу получения состава. Группа изобретений обеспечивает увеличение растворимости и биодоступности берберина. 6 н. и 12 з.п. ф-лы, 2 ил., 5 табл., 6 пр.
1. Композиция для предупреждения и/или лечения дислипидемии и/или гиперхолестеринемии, и/или метаболического синдрома, и/или сердечно-сосудистого заболевания, содержащая:
a) берберин (BBR);
b) белки гороха;
c) одно или несколько поверхностно-активных веществ, выбранных из лецитинов, полисорбата 80 или их комбинаций;
где соотношение между берберином (BBR) и белками гороха находится в диапазоне от 1:1 до 10:1 масс./масс.
2. Композиция по п.1, где берберин находится в форме водного экстракта корней Berberis aristata, Coptis chinensis или Hydrastis Canadensis.
3. Композиция по п.2, где водный экстракт получен из корней Berberis aristata.
4. Композиция по п.2 или 3, где количество берберина в экстракте находится в диапазоне от 30 до 70% масс./масс.
5. Композиция по п.4, где количество берберина в экстракте равно 50% масс./масс.
6. Композиция по п.1, где берберин находится в форме экстракта, имеющего содержание берберина более 85% масс./масс.
7. Композиция по п.1, где поверхностно-активное вещество представляет собой лецитин.
8. Композиция по п.7, где лецитин представляет собой лецитин сои или лецитин подсолнечника.
9. Композиция по любому из пп.1-8, дополнительно содержащая экстракт семян Vitis vinifera или экстракт Citrus bergamia, или их комбинацию.
10. Композиция по п.9, где экстракт семян Vitis vinifera получен водно-спиртовой экстракцией.
11. Композиция по п.9, где экстракт Citrus bergamia имеет содержание флаванона более 28% по массе.
12. Применение композиции по любому из пп.1-11 для получения лекарственного средства для предупреждения и/или лечения дислипидемии и/или гиперхолестеринемии, и/или метаболического синдрома, и/или сердечно-сосудистого заболевания.
13. Применение композиции по любому из пп.1-11 для предупреждения и/или лечения дислипидемии и/или гиперхолестеринемии, и/или метаболического синдрома, и/или сердечно-сосудистого заболевания.
14. Способ получения композиции по любому из пп.1-11, включающий получение раствора или дисперсии поверхностно-активного вещества, выбранного из лецитинов, полисорбата 80 или их комбинаций, и добавление на одной или нескольких последовательных стадиях BBR и белков гороха.
15. Способ по п.14, дополнительно включающий добавление экстракта вида Vitis и/или экстракта вида Citrus.
16. Состав для предупреждения и/или лечения дислипидемии и/или гиперхолестеринемии, и/или метаболического синдрома, и/или сердечно-сосудистого заболевания, содержащий композицию по любому из пп.1-11, и по меньшей мере один подходящий фармацевтически приемлемый эксципиент.
17. Способ получения состава по п.16, включающий получение раствора или дисперсии поверхностно-активного вещества, выбранного из лецитинов, полисорбата 80 или их комбинаций, добавление на одной или нескольких последовательных стадиях BBR и белков гороха, и добавление по меньшей мере одного фармацевтически приемлемого эксципиента.
18. Способ по п.17, дополнительно включающий добавление экстракта вида Vitis и/или экстракта вида Citrus.
| CN 101606622 A, 23.12.2009 | |||
| US 2016015813 A1, 21.01.2016 | |||
| EP 3118215 A1, 18.01.2017 | |||
| EP 3064200 A1, 07.09.2016 | |||
| WO 2015136441 A1, 17.09.2015 | |||
| US 2016235822 A1, 18.08.2016. |
Авторы
Даты
2023-01-23—Публикация
2019-01-22—Подача