ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка испрашивает приоритет по предварительной заявке США №62/577,429, поданной 26 октября 2017 г., описание которой полностью включено в настоящий документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Глюкоцереброзидаза (ГЦБ) представляет собой белковый препарат, который можно использовать для лечения болезни Гоше, аутосомно-рецессивной лизосомной болезни накопления, характеризующейся дефицитом (ГЦБ).
[0003] Болезнь Гоше представляет собой аутосомно-рецессивное заболевание, вызванное мутациями в гене GBA, что приводит к дефициту лизосомного фермента бета-глюкоцереброзидазы. Глюкоцереброзидаза катализирует превращение сфинголипидного глюкоцереброзида в глюкозу и церамид. Дефицит ферментов вызывает накопление глюкоцереброзида прежде всего в лизосомном компартменте макрофагов, что приводит к образованию пенистых клеток или «клеток Гоше». При болезни Гоше различные формы мутантной ГЦазы имеют пониженную, незначительную или нулевую активность расщепления глюкозилцерамида в зависимости от мутированной аминокислоты или аминокислот. Тяжесть этого расстройства коррелирует с относительными уровнями остаточной активности фермента и результирующей степенью накопления субстрата.
[0004] ГЦБ представляет собой лизосомный фермент, который гидролизует гликолипид глюкоцереброзид, который образуется после разложения гликосфинголипидов в мембранах лейкоцитов и эритроцитов. Дефицит этого фермента вызывает накопление глюкоцереброзида в больших количествах в лизосомах фагоцитарных клеток, расположенных в печени, селезенке и костном мозге пациентов с болезнью Гоше. Накопление этих молекул вызывает ряд клинических проявлений, включая спленомегалию, гепатомегалию, нарушение скелета, тромбоцитопению и анемию. (Beutler et al. "Gaucher disease" The Metabolic and Molecular Bases of Inherited Disease (McGraw-Hill, Inc, New York, 1995, pp. 2625-2639.)
[0005] Альфа-велаглюцераза представляет собой форму ГЦБ, используемую для лечения болезни Гоше. VPRIV представляет собой композицию, содержащий альфа-велаглюцеразу. Альфа-велаглюцераза катализирует гидролиз глюкоцереброзида, уменьшая количество накопленного глюкоцереброзида. В клинических исследованиях VPRIV уменьшала размеры селезенки и печени, улучшала анемию и тромбоцитопению.
[0006] VPRIV и альфа-велаглюцераза и другие подобные лекарственные средства, которые содержат белок, хранят в жидкой или лиофилизированной, то есть, сублимированной форме. Лиофилизированное лекарственное средство часто восстанавливают путем добавления подходящего разбавителя для введения непосредственно перед применением пациентом. В результате физической нестабильности имеет место снижение количества альфа-велаглюцеразы или ГЦБ в жидкой или лиофилизированной форме, включая денатурацию и агрегацию, а также химической нестабильности, включая, например, гидролиз, дезамидирование и окисление.
[0007] Существует потребность в улучшенных композициях с улучшенной стабильностью ГЦБ, VPRIV или альфа-велаглюцеразы, особенно тех, которые подходят для подкожного (ПВ) введения. ГЦБ имеет предел растворимости менее 30 мг/мл при комнатной температуре в течение 24 часов. Удобный объем для инъекционного продукта ПК обычно составляет 2,5 мл или менее. Это требует наличия композиции, которая может быть сконцентрирована до достаточно высокого уровня для введения терапевтически адекватной дозы. Кроме того, композиции в идеале должны иметь соответствующую стабильность при хранении при комнатной температуре или в условиях охлаждения.
[0008] Также существует потребность в композициях для подкожного введения, которые имеют улучшенную биодоступность ГЦБ, VPRIV или альфа-велаглюцеразы. Существующая композиция VPRIV, которую вводят внутривенно (ВВ), обеспечивает приблизительно 1% биодоступность сыворотки. Подкожное (ПК) введение вряд ли обеспечит такое же воздействие на ткани, как при внутривенном введении. ГЦБ имеет период полураспада в сыворотки менее 15 минут в качестве препарата внутривенного введения. Улучшенная стабильность сыворотки позволила бы большему количеству ГЦБ, вводимых ПК, диспергировать из отделения ПК в системную циркуляцию. Улучшенная стабильность сыворотки также позволит поддерживать высокие концентрации циркулирующей ГЦБ, что позволяет поглощать больше ГЦБ моноцитами, макрофагами и тканевыми гистиоцитами.
СУТЬ ИЗОБРЕТЕНИЯ
[0009] В одном из аспектов предложена композиция, содержащая глюкоцереброзидазу (ГЦБ) и изофагомин (ИФМ) в молярном соотношении 1:1 или по меньшей мере около 1:>1 (например, 1:х, где х больше, чем 1). В некоторых вариантах реализации ГЦБ представляет собой альфа-велаглюцеразу. Альфа-велаглюцераза представляет собой рекомбинантно продуцируемый фермент с той же аминокислотной последовательностью, что и природная человеческая ГЦБ, продуцируемая в клеточной линии человека, и является особенно подходящей формой ГЦБ для практического применения изобретения. В некоторых вариантах реализации рН композиции составляет около 6,0. В некоторых вариантах реализации рН композиции составляет около 6,5. В некоторых вариантах реализации рН композиции составляет около 7,0. В некоторых вариантах реализации, молярное соотношение ГЦБ к ИФМ составляет от около 1:1 до около 1:30. В некоторых вариантах реализации молярное соотношение ГЦБ к ИФМ составляет от около 1:1 до около 1:10. В некоторых вариантах реализации молярное соотношение ГЦБ к ИФМ составляет от около 1:1 до около 1:5. В некоторых вариантах реализации молярное соотношение ГЦБ к ИФМ составляет от около 1:2 до около 1:10. В некоторых вариантах реализации молярное соотношение ГЦБ к ИФМ составляет от около 1:2,5 до около 1:10. В некоторых вариантах реализации молярное соотношение ГЦБ к ИФМ составляет от около 1:2,5 до около 1:5. В некоторых вариантах реализации молярное соотношение ГЦБ к ИФМ составляет от около 1:10 до около 1:30. В некоторых вариантах реализации молярное соотношение ГЦБ к ИФМ составляет от около 1:30 до около 1:100. В некоторых вариантах реализации молярное отношение ГЦБ к ИФМ составляет от около 1:2,5 до около 1:3,5. В некоторых вариантах реализации молярное соотношение ГЦБ к ИФМ составляет около 1:3,0. В некоторых вариантах реализации молярное соотношение ГЦБ к ИФМ составляет около 1:3,0, что особенно подходит для практического применения изобретения.
[0010] В некоторых вариантах реализации композиция находится при температуре по меньшей мере 20°C. В некоторых вариантах реализации композиция находится при температуре от 0°C до 20°C. В некоторых вариантах реализации композиция находится при температуре менее 0°C. В некоторых вариантах реализации композиция представляет собой водный раствор. В некоторых вариантах реализации композиция представляет собой лиофилизат.
[0011] В некоторых вариантах реализации композиция дополнительно содержит фармацевтически приемлемое вспомогательное вещество, фармацевтически приемлемую соль или как фармацевтически приемлемое вспомогательное вещество, так и фармацевтически приемлемую соль.
[0012] В некоторых вариантах реализации ИФМ представляет собой тартрат изофагомина (ИФМТ). В некоторых вариантах реализации тартрат изофагомина представляет собой D-тартрат изофагомина. ИФМТ и, в частности, D-тартрат изофагомина, является особенно подходящей солью ИФМ для практического применения изобретения. Тартрат изофагомина может преимущественно увеличивать активность ГЦБ в сыворотке выше верхнего предела, обычно достигаемого при подкожной дозе 2,5 мг/кг. Соответственно, ГЦБ объединенная с ИФМТ, может обеспечить биодоступность в сыворотке, которая обеспечивает подкожное введение, в частности, при молярном соотношении по меньшей мере 1:3,0 ГЦБ:ИФМТ. Комбинация ИФМТ также увеличивает общую активность фермента ГЦБ. В некоторых вариантах реализации ИФМ отличается от тартрата изофагомина. В некоторых вариантах реализации композиция представляет собой жидкость. В некоторых вариантах реализации композиция дополнительно содержит антиоксидант. В некоторых вариантах реализации композиция дополнительно содержит углевод. В некоторых вариантах реализации композиция дополнительно содержит поверхностно-активное вещество. В некоторых вариантах реализации композиция содержит 45-120 мг/мл альфа-велаглюцеразы и 0,2-1,8 мг/мл D-тартрата изофагомина. В некоторых вариантах реализации композиция содержит 60 мг/мл альфа-велаглюцеразы и 0,9 мг/мл D-тартрата изофагомина.
[0013] В некоторых вариантах реализации композиция дополнительно содержит цитрат или фосфат и полисорбат 20 (например, 50 ммоль цитрата натрия или фосфата натрия и 0,01% полисорбата 20). В некоторых вариантах реализации композиция дополнительно содержит 5-20 ммоль цитрата натрия и 0,01% полисорбата-20. В некоторых вариантах реализации композиция дополнительно содержит 10 ммоль цитрата натрия и 0,01% полисорбата-20. В некоторых вариантах реализации композиция дополнительно содержит 5-20 ммоль фосфата натрия и 0,01% полисорбата-20. В некоторых вариантах реализации композиция дополнительно содержит 10 ммоль фосфата натрия и 0,01% полисорбата-20. В некоторых вариантах реализации композиция дополнительно содержит 5-20 ммоль цитрата натрия и 0,01% (мас./об.) полисорбата-20. В некоторых вариантах реализации композиция дополнительно содержит 10 ммоль цитрата натрия и 0,01% (мас./об.) полисорбата-20. В некоторых вариантах реализации композиция дополнительно содержит 5-20 ммоль фосфата натрия и 0,01% (мас./об.) полисорбата-20. В некоторых вариантах реализации композиция дополнительно содержит 10 ммоль фосфата натрия и 0,01% (мас./об.) полисорбата-20. В некоторых вариантах реализации композиция дополнительно содержит 5-20 ммоль цитрата натрия и 0,01% (об./об.) полисорбата-20. В некоторых вариантах реализации композиция дополнительно содержит 10 ммоль цитрата натрия и 0,01% (об./об.) полисорбата-20. В некоторых вариантах реализации композиция дополнительно содержит 5-20 ммоль фосфата натрия и 0,01% (об./об.) полисорбата-20. В некоторых вариантах реализации композиция дополнительно содержит 10 ммоль фосфата натрия и 0,01% (об./об.) полисорбата-20. В некоторых вариантах реализации композиция имеет рН около 6,0. В некоторых вариантах реализации композиция имеет рН 6,0.
[0014] В другом аспекте предложен контейнер, содержащий любую из композиций, описанных в данном документе. В некоторых вариантах реализации контейнер выбирают из группы, состоящей из предварительно заполненного шприца, флакона или ампулы.
[0015] В другом аспекте предложен способ получения любой из композиций, описанных в данном документе. Способ включает растворение ИФМ (например, в воде), доведение рН до около 6,0 и добавление ГЦБ с получением композиции. В некоторых вариантах реализации способ дополнительно включает лиофилизацию ИФМ перед добавлением ГЦБ. В некоторых вариантах реализации способ дополнительно включает добавление 0,01% полисорбата 20. В некоторых вариантах реализации способ дополнительно включает добавление 0,01% (мас./об.) полисорбата 20. В некоторых вариантах реализации способ дополнительно включает добавление 0,01% (об./об.) полисорбата 20. В некоторых вариантах реализации способ дополнительно включает фильтрацию композиции через мембрану 0,22 мкм. В некоторых вариантах реализации ИФМ присутствует в количестве, достаточном для поддержания стабильности ГЦБ в композиции. В некоторых вариантах реализации ИФМ присутствует в количестве, достаточном для поддержания стабильности ГЦБ в композиции в течение по меньшей мере трех дней при 0-50°C. В некоторых вариантах реализации ИФМ присутствует в количестве, достаточном для поддержания стабильности ГЦБ в композиции в течение по меньшей мере 6 месяцев при 0-40°C.
[0016] В другом аспекте предложен способ лечения расстройства, связанного с дисфункцией пути ГЦазы, включающий введение любой из композиций, описанных в данном документе. В некоторых вариантах реализации способ эффективен для лечения расстройства. В некоторых вариантах реализации композицию вводят внутривенно или подкожно. В некоторых вариантах реализации композицию вводят подкожно, например, подкожной инъекцией, что особенно подходит для практического применения изобретения. В некоторых вариантах реализации композицию вводят два раза в неделю, один раз в неделю, реже, чем один раз в неделю или один раз в неделю. Как правило, композиции, описанные в данном документе, вводят подкожно инъекцией либо один или два раза в неделю, либо один раз каждые две недели. Композиции, описанные в данном документе (в частности, композиции с ИФМТ), вводимые подкожно, могут обеспечить значительно большее воздействие на сыворотку по сравнению с сопоставимыми внутривенными дозами только ГЦБ. Повышенная биодоступность в сыворотке преимущественно позволяет уменьшить количество подкожных инъекций, которые необходимо вводить субъекту. Например, для достижения терапевтически эффективного количества нужно вводить меньшее количество инъекций и/или интервал времени между подкожными инъекциями может быть увеличен.
[0017] В другом аспекте композиции, описанные в данном документе, предназначены для применения в терапии. В одном варианте реализации композиции, описанные в данном документе, предназначены для использования в способе лечения расстройства, связанного с дисфункцией пути ГЦазы, как описано в данном документе. В другом варианте реализации композиции, описанные в данном документе, предназначены для использования в производстве лекарственного средства для лечения расстройства, связанного с дисфункцией пути ГЦазы, например, способами, описанными в данном документе. В некоторых вариантах реализации композицию вводят внутривенно или подкожно. В некоторых вариантах реализации композицию вводят подкожно, например, подкожной инъекцией. В некоторых вариантах реализации композицию вводят два раза в неделю, один раз в неделю, реже, чем один раз в неделю или один раз в неделю. Как правило, композиции, описанные в данном документе, вводят подкожно инъекцией один или два раза в неделю или один раз каждые две недели.
[0018] В некоторых вариантах реализации расстройство включает дефект в активности ГЦазы. В некоторых вариантах реализации дефект в активности ГЦазы включает сниженную ферментативную активность. В некоторых вариантах реализации расстройство включает дисрегуляцию альфа-синуклеина. В некоторых вариантах реализации расстройство представляет собой лизосомную болезнь накопления, например болезнь Гоше, болезнь Фабри, болезнь Помпе, мукополисахаридоз или множественную системную атрофию. Композиции, описанные в данном документе, являются особенно подходящими для лечения болезни Гоше. В некоторых вариантах реализации расстройство представляет собой нейродегенеративное расстройство, например болезнь Паркинсона, болезнь Альцгеймера или деменцию с тельцами Леви.
[0019] В другом аспекте предложен способ лечения дисфункции пути ГЦазы, включающий введение субъекту, нуждающемуся в этом, любой из композиций, описанных в данном документе. В некоторых вариантах реализации субъект является человеком.
[0020] В другом аспекте обеспечивается способ лечения дисфункции пути ГЦазы, включающий введение субъекту композиции, содержащей от 0,5 до 5,0 мг/кг ГЦБ и ИФМ, например, где ИФМ находится в по меньшей мере около 1, 1,25, 1,5, 2, 2,5, 3, 4 или 5-кратном молярном избытке по отношению к ГЦБ, при этом композицию вводят подкожно. В другом аспекте обеспечивается композиция, содержащая от 0,5 до 5,0 мг/кг ГЦБ и ИФМ, например, где ИФМ находится в по меньшей мере около 1, 1,25, 1,5, 2, 2,5, 3, 4 или 5-кратном молярном избытке по отношению к ГЦБ, для использования в способе лечения дисфункции пути ГЦазы, при этом композицию вводят подкожно. В другом аспекте обеспечивается применение композиции, содержащей от 0,5 до 5,0 мг/кг ГЦБ и ИФМ, например, где ИФМ находится в по меньшей мере около 1, 1,25, 1,5, 2, 2,5, 3, 4 или 5-кратном молярном избытке по отношению к ГЦБ при изготовлении лекарственного средства для способа лечения дисфункции пути ГЦазы. В некоторых вариантах реализации ИФМ в композиции вводят в количестве, которое не увеличивает активность эндогенного ГЦБ в сыворотке. В некоторых вариантах реализации, композиция содержит от 0,8 до 4,0 мг/кг ГЦБ. В некоторых вариантах реализации, композиция содержит от 1,0 до 3,0 мг/кг ГЦБ. В некоторых вариантах реализации, композиция содержит от 1,2 до 2,0 мг/кг ГЦБ. В некоторых вариантах реализации, композиция содержит около 1,5 мг/кг ГЦБ. В некоторых вариантах реализации, композиция содержит 1,5 мг/кг ГЦБ. В некоторых вариантах реализации, композиция содержит от 2,0 до 5,0 мг/кг ГЦБ. В некоторых вариантах реализации, композиция содержит от 2,25 до 4,5 мг/кг ГЦБ. В некоторых вариантах реализации, композиция содержит от 2,25 до 3,75 мг/кг ГЦБ. В некоторых вариантах реализации, композиция содержит от 3,5 до 5,0 мг/кг ГЦБ. В некоторых вариантах реализации, ИФМ находится в 1-5 или 1-10-кратном молярном соотношении к ГЦБ. В некоторых вариантах реализации, ИФМ находится в 2-10-кратном молярном соотношении к ГЦБ. В некоторых вариантах реализации, ИФМ находится в 10-30-кратном молярном соотношении к ГЦБ. В некоторых вариантах реализации, ИФМ находится в 30-100-кратном молярном соотношении к ГЦБ. В некоторых вариантах реализации, ИФМ находится в 2,5-3,5-кратном молярном соотношении к ГЦБ. В некоторых вариантах реализации, ИФМ находится в 3-кратном молярном соотношении к ГЦБ. В некоторых вариантах реализации воздействие, активность или биодоступность ГЦБ увеличивается, например, по сравнению с воздействием, активностью или биодоступностью эквивалентного количества ГЦБ, вводимого внутривенно, отдельно. В некоторых вариантах реализации повышается воздействие, активность или биодоступность ГЦБ в селезенке. В некоторых вариантах реализации повышается воздействие, активность или биодоступность ГЦБ в печени. В некоторых вариантах реализации повышается воздействие, активность или биодоступность ГЦБ в сыворотке.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГ. 1 представляет собой блок-схему, иллюстрирующую процесс получения композиции глюкоцереброзидазы (ГЦБ) и изофагомина (ИФМ).
На ФИГ. 2А и 2В показано ДСН-ЭПАГ тестирование образцов ГЦБ в первый день после добавления ИФМ (2А) и через две недели после добавления ИФМ (2В). Регулировка рН ИФМ не проводилась.
На ФИГ. 3 показаны пробирки Эппендорфа, содержащие лиофилизированные растворы тартрата изофагомина с отрегулированным рН (ИФМТ).
На ФИГ. 4А и 4В показано ДСН-ЭПАГ тестирование образцов ГЦБ в тот же день, когда добавляли ИФМ (4А) и после трех дней хранения (4В). рН ИФМ отрегулировали.
На ФИГ. 5 показаны результаты анализа с помощью эксклюзионной хроматографии по размеру (ЭХР) ИФМТ с отрегулированным рН, добавленного к ГЦБ.
На ФИГ. 6А и 6В показаны результаты анализа эксклюзионной хроматографии по размеру (ЭХР) ИФМ с отрегулированным рН, добавленного к ГЦБ.
На ФИГ. 7A-7D показаны результаты исследований поверхностного плазмонного резонанса связывания ИФМ с ГЦБ.
На ФИГ. 8 показаны результаты анализа нанодифференциальной сканирующей флуориметрии (нано-ДСФ), оценивающего изменения температуры плавления ГЦБ с различными молярными соотношениями ИФМ в диапазоне от 1:3 до 1:100 ГЦБ:ИФМ.
На ФИГ. 9А-9С показаны результаты реакций ферментативной активности, проводимых с альфа-велаглюцеразой, предварительно инкубированной с ИФМТ. На ФИГ. 9А показана кривая ингибирования с синтетическим колориметрическим субстратом pNP-GPS. На ФИГ. 9В показана кривая ингибирования с синтетическим флуорометрическим субстратом 4MU-GPS. На ФИГ. 9С показано ингибирование природным гликосфинголипидным субстратом C12-GluCer.
На ФИГ. 10А показан внешний вид образцов ГЦБ/ИФМТ, хранящихся в течение трех недель при 40°C. На ФИГ. 10В показан анализ ДСН-ЭПАГ образцов ГЦБ/ИФМТ, хранящихся в течение трех недель. Растворы Групп 1-3 (G1, G2, G3) кажутся чистыми. Раствор Группы 4 (G4) кажется мутным.
На ФИГ. 11 показаны отрицательные и положительные контроли для иммуногистохимического анализа ГЦБ (ИГС) из фармакокинетического исследования внутривенного введения ГЦБ и подкожного введения ГЦБ с ИФМ у яванской макаки.
На ФИГ. 12 показано окрашивание ГЦБ в печени при 2-кратном увеличении в различные моменты времени после подкожной инъекции ГЦБ (верхние панели) и подкожной инъекции ГЦБ (нижние панели).
На ФИГ. 13 показано окрашивание ГЦБ в печени при 20-кратном увеличении в различные моменты времени после подкожной инъекции ГЦБ (верхние панели) и внутривенной инъекции ГЦБ (нижние панели).
На ФИГ. 14 показано окрашивание ГЦБ в селезенке при 2-кратном увеличении в различные моменты времени после подкожной инъекции ГЦБ (верхние панели) и внутривенной инъекции ГЦБ (нижние панели).
На ФИГ. 15 показано окрашивание ГЦБ в селезенке при 20-кратном увеличении в различные моменты времени после подкожного введения ГЦБ (верхние панели) и внутривенного введения ГЦБ (нижние панели).
На ФИГ. 16А и 16В показаны результаты анализа уровней активности белка и фермента альфа-велаглюцеразы в гомогенатах печени и селезенки после введения альфа-велаглюцеразы (16А) и альфа-велаглюцеразы с ИФМТ в молярном соотношении 1:3 (16В).
На ФИГ. 16С показаны результаты анализа уровней активности ГЦБ в сыворотке у яванских макак после подкожного введения альфа-велаглюцеразы с ИФМТ.
На ФИГ. 17А и 17В показаны результаты анализа ECL ELISA на биодоступность ГЦБ (17А) в сыворотке и анализа активности ГЦБ (17В) после подкожного введения 4 мг/кг альфа-велаглюцеразы и ИФМ при различных молярных соотношениях в диапазоне (1:3 - 1:100).
На ФИГ. 18А и 18В показаны результаты анализа ECL ELISA профиля содержания ГЦБ в печени (18А) и селезенке (18В) после внутривенного введения 10 мг/кг альфа-велаглюцеразы или подкожного введения 4 мг/кг альфа-велаглюцеразы и ИФМ в молярном соотношении 1:100.
На ФИГ. 19А и 19В показаны результаты анализа ECL ELISA на содержание ГЦБ в печени (19А) и селезенке (19В) после подкожного введения 4 мг/кг альфа-велаглюцеразы и ИФМ в молярном соотношении 1:3.
На ФИГ. 20А и 20В показаны результаты анализа ECL ELISA на биодоступность ГЦБ (20А) в сыворотке и анализа активности ГЦБ (20В) после подкожного введения 1,5 мг/кг альфа-велаглюцеразы и ИФМ при различных молярных соотношениях в диапазоне (1:1-1:30).
На ФИГ. 21 показаны результаты анализа активности VPRIV в сыворотке человека, инкубированной при 37°C без ИФМ, 3 нмоль ИФМ, 10 нмоль ИФМ, 30 нмоль ИФМ, 100 нмоль ИФМ, 300 нмоль ИФМ и 1000 нмоль ИФМ
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Обзор изобретения
[0021] Композиции, содержащие глюкоцереброзидазу (ГЦБ), могут выиграть от повышенной стабильности, например, когда композиции представляют собой жидкости. Три открытые свободные тиольные группы в ГЦБ могут вступать в реакции, которые приводят к снижению стабильности, например, путем агрегации молекул ГЦБ. Например, в буфере при рН 6, как правило, 1-2% белка агрегируется за один месяц хранения и около 15% агрегируется после 6 месяцев хранения. Не желая быть строго связанными теорией или механизмом, стабильность белка зависит от ряда факторов.
[0022] Добавление изофагомина (ИФМ), например, тартрата изофагомина (ИФМТ), улучшает стабильность ГЦБ in vitro, в частности, когда ИФМ, например, ИФМТ, доводят до рН 6,0 перед добавлением к ГЦБ. ИФМ имеет следующую структуру:

[0023] Не желая быть связанными теорией, ИФМ может взаимодействовать с аминокислотами, находящимися рядом с активным сайтом, чтобы заблокировать ГЦБ в конформацию, которая обеспечивает повышенную стабильность. См. Shen, J.S. et al., Biochem. Biophys. Res. Comm., 2008, 369:1071-1075. ИФМ может также предотвратить агрегацию ГЦБ, так как ИФМ может ассоциировать с ГЦБ, чтобы сделать ГЦБ более компактной и термически более стабильной.
[0024] Авторы настоящего изобретения показали, что молярное соотношение ИФМ к ГЦБ имеет решающее значение для стабилизации ГЦБ в жидких композициях. Как описано более подробно в данной заявке, композиции с молярным соотношением по меньшей мере 1:2,5 (ГЦБ:ИФМ) (т.е. 1:х (где х равно по меньшей мере 2,5)), могут иметь существенно меньшую агрегацию и разложение ГЦБ. Может иметь место значительно большая агрегация и разложение ГЦБ с молярными соотношениями существенно ниже 1:2,5.
[0025] Авторы настоящего изобретения также показали, что композиции с молярным соотношением ИФМ/ИФМТ к ГЦБ по меньшей мере 1:2,5 (ГЦБ:ИФМ) имеют улучшенную биодоступность, ГЦБ, активность, воздействие тканей и системное воздействие при подкожном введении. Улучшенная биодоступность может быть обнаружена одним или несколькими из повышенного окрашивания ткани ГЦБ в печени, повышенного окрашивания ткани ГЦБ в селезенке, повышенной концентрации ГЦБ в сыворотке и повышенной активности ГЦБ в сыворотке. Улучшенное системное воздействие может быть проанализировано путем измерения концентрации белка ГЦБ или активности фермента ГЦБ в сыворотке. Добавление ИФМ, например ИФМТ, к ГЦБ в молярном соотношении по меньшей мере 1:2,5 (ГЦБ:ИФМ) может позволить биодоступности, активности, тканевому воздействию или системному воздействию ГЦБ в подкожном составе быть похожими на или выше чем биодоступность ГЦБ, активность, воздействие на ткани или системное воздействие в композиции для внутривенного введения, особенно в композиции без ИФМ.
Определения
[0026] Термин «субъект» относится к любому млекопитающему, включая, но не ограничиваясь, любое животное, классифицированное как таковое, включая людей, приматов, не являющихся людьми, приматов, бабуинов, шимпанзе, обезьян, грызунов (например, мышей, крыс), кроликов, кошек, собак, лошадей, коров, овец, коз, свиней и т.д. Термин «субъект» можно использовать взаимозаменяемо с термином «пациент».
[0027] Термин «выделенный» относится к молекуле, которая является, по сути свободной от ее природной среды. Например, выделенный белок, по сути, свободен от клеточного материала или других белков из клеток или тканей источника, из которого он получен. Препараты, содержащие выделенный белок достаточно чисты, чтобы быть введенными в виде терапевтической композиции, или по меньшей мере на от 70% до 80% (мас./мас.) чистыми, более предпочтительно по меньшей мере на от 80% до 90% (мас./мас.) чистыми, еще более предпочтительно, на от 90 до 95% чистыми; и, наиболее предпочтительно по меньшей мере на 95%, 96%, 97%, 98%, 99%, 99,5%, 99,8% или 100% (мас./мас.) чистыми.
[0028] Используемый в данном документе термин «около» относится к до +/-10% от значения квалифицированного этим термином. Например, около 50 ммоль относится к 50 ммоль +/- 5 ммоль; около 4% относится к 4% +/- 0,4%.
[0029] Используемые в данном документе фразы «парентеральное введение», «введен парентерально» и «вводят парентерально» относятся к способам введения, отличным от энтерального и местного введения, обычно путем инъекции, и включают, без ограничения, внутривенные (ВВ), внутримышечные, внутриартериальные, внутритекальные, внутрикапсулярные, внутриорбитальные, внутрисердечные, внутрикожные, внутрибрюшинные, транстрахеальные, подкожные (ПК), субкутикулярные, внутрисуставные, субкапсулярные, субарахноидальные, внутриспинальные, эпидуральные и внутристенные инъекции и инфузии.
[0030] Термины «терапевтически эффективная доза» и «терапевтически эффективное количество» относятся к такому количеству соединения, которое приводит к профилактике симптомов, например, предотвращение на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% от симптомов, например, симптомы болезни Гоше у субъекта с диагностированной болезнью Гоше), задержке появления симптомов или облегчению симптомов болезни Гоше. Терапевтически эффективное количество будет, например, достаточным для лечения, предотвращения, уменьшения тяжести, задержки начала и/или уменьшения риска возникновения одного или нескольких симптомов расстройства, связанного с болезнью Гоше. Эффективное количество может быть определено с помощью способов, хорошо известных в данной области техники и как описано в последующих разделах настоящего описания.
[0031] Термины «лечение» и «терапевтический способ» относятся к лечению существующего расстройства и/или профилактическим/предупредительным мерам. К числу тех, кто нуждается в лечении, могут относиться лица, уже имеющие определенное медицинское расстройство, а также лица, которым грозит риск или которые в конечном итоге могут заболеть. Потребность в лечении оценивается, например, при наличии одного или нескольких факторов риска, связанных с развитием расстройства, наличием или прогрессированием расстройства, или вероятной восприимчивостью к лечению субъекта, имеющего расстройство. Лечение может включать замедление или обратное прогрессирование расстройства.
[0032] Термин «лечение» относится к назначению терапии в количестве, порядке и/или режиме, эффективном для улучшения или предотвращения состояния, симптома или параметра, связанного с расстройством (например, расстройством, описанным в данном документе), или для предотвращения начала, прогрессирования или обострения расстройства либо в статистически значимой степени, либо в степени, определяемой специалистом в данной области. Соответственно, лечение может достигать терапевтических и/или профилактических преимуществ. Эффективное количество, порядок или режим может изменяться в зависимости от субъекта и может быть адаптирован к предмету. В некоторых вариантах реализации, лечением расстройств, связанных с дисфункцией пути ГЦазы (например, болезнь Гоше), является лечение, которое приводит к одному или нескольким из: увеличение концентрации гемоглобина, увеличение уровня тромбоцитов, уменьшение объема печени, уменьшение объема селезенки или изменение в скелетном параметре (например, увеличение минеральной плотности кости), например, у субъекта, который не лечился от дисфункции пути ГЦазы. В некоторых вариантах реализации лечение расстройства, связанного с дисфункцией пути ГЦазы (например, болезнь Гоше), представляет собой лечение, которое приводит к одному или более из: увеличение концентрации гемоглобина, увеличения уровня тромбоцитов, уменьшения объема печени, уменьшение объема селезенки, или изменение скелетного параметра (например, увеличение минеральной плотности кости), или поддержание одного или нескольких из этих параметров, например, у субъекта, которого лечили от дисфункции пути ГЦазы.
[0033] Термин «комбинация» относится к применению двух или более агентов или терапии для лечения того же пациента, в котором использование или действие агентов или терапии перекрываются во времени. Агенты или терапии могут быть введены одновременно (например, в виде единой композиции, который вводят пациенту или в виде двух отдельных композиций, вводимых одновременно) или последовательно в любом порядке.
[0034] Термины «пролонгированное высвобождение», «доставка с замедленным высвобождением» и «доставка лекарственного средства с замедленным высвобождением» в контексте настоящего описания означают, что однократное введение лекарственного средства поддерживает эффективную концентрацию лекарственного средства в крови в течение длительного периода, например, 12 часов или дольше. Например, общий путь введения полипептидов представляет собой подкожную, внутримышечную или внутривенную (ВВ) инъекцию.
[0035] Термин «соли» охватывает соли присоединения свободных кислот или свободных оснований. Термин «фармацевтически приемлемая соль» относится к солям, которые обладают профилями токсичности в пределах диапазона, который обеспечивает применение в фармацевтических применениях. Соли, которые не являются фармацевтически приемлемыми солями, могут все еще быть полезными в синтезе, очистке или образовании композиций из-за таких свойств, как высокая кристалличность.
[0036] Термин «единица» в отношении ГЦБ, велаглюцеразы или альфа-велаглюцеразы относится к их количеству, которое требуется для превращения одного микромоля п-нитрофенил-бета-D-глюкопиранозида в п-нитрофенол или 4-метилумбеллиферон бета-D-глюкопиранозида в 4-метилумбеллиферон, за минуту при 37°C.
Глюкоцереброзидаза
[0037] Велаглюцераза представляет собой β-глюкоцереброзидазу человека, продуцируемую активацией гена в клеточной линии человека, например, путем направленной рекомбинации с промотором, который активирует эндогенный ген β-глюкоцереброзидазы в выбранной клеточной линии человека. Велаглюцераза секретируется в виде мономерного гликопротеина с массой приблизительно 63 кДа. Велаглюцераза состоит из 497 аминокислот с последовательностью, идентичной природному белку человека. См. Zimran et al., Blood Cells Mol. Dis., 2007, 39:115-118.
[0038] Гликозилирование альфа-велаглюцеразы может быть изменено путем использования кифунензина, ингибитора маннозидазы I, во время культивирования клеток, чтобы продуцировать секретируемый белок, содержащий в основном гликаны типа с высоким содержанием маннозы, имеющие 6-9 единиц маннозы на гликан, как более подробно описано в WO 2013/130963.
[0039] Имиглюцераза (Cerezyme®) является другой формой рекомбинантной человеческой β-глюкоцереброзидазы. Имиглюцераза рекомбинантно продуцируется в клетках яичника китайского хомячка (ЯКХ).
[0040] Альфа-талиглюцераза (Elelyso® или Uplyso®) представляет собой рекомбинантную глюкоцереброзидазу (prГЦБ), экспрессируемую в клетках растений. Растительная рекомбинантная глюкоцереброзидаза может быть получена способами, описанными по меньшей мере в патентных публикациях США №2009/0208477 и 2008/0038232 и публикациях РСТ № WO 2004/096978 и WO 2008/132743.
[0041] Любая из рекомбинантных ГЦБ может быть получена с использованием биореакторов и способов синтеза в промышленном масштабе, известных в данной области. Можно использовать любое количество систем очистки в промышленном масштабе.
Изофагомин
[0042] Могут быть использованы различные альтернативные формы изофагомина. Они включают любой из тартрата изофагомина, изофагомин HCl, свободного основания изофагомина и цитрата изофагомина. В некоторых вариантах реализации изофагомин включает один или более из изофагомин HCl, свободного основания изофагомина и цитрата изофагомина. В некоторых вариантах реализации изофагомин включает тартрат изофагомина.
[0043] Изофагомин HCl, описан в патенте США№5,844,102 и 7,501,439. Изофагомин HCl представляет собой желтое твердое вещество с низкой температурой плавления. Свободное основание изофагомина может быть получено путем превращения изофагомина HCl в форму свободного основания.
[0044] В любом из аспектов и вариантов реализации, описанных в данном документе, изофагомин может не быть в форме тартрата изофагомина, или композиция ГЦБ/ИФМ может не содержать тартрат изофагомина.
Тартрат изофагомина
[0045] Изофагомина тартрат (ИФМТ) представляет собой особую форму изофагомина (ИФМ), которая может использоваться в различных вариантах реализации, описанных в данном документе, и особенно подходит для практического применения изобретения. ИФМТ имеет следующую формулу:

[0046] ИФМТ обладает улучшенными характеристиками по сравнению с ИФМ, которые включают улучшенную синтетическую технологичность производства. Например, может быть легче очистить ИФМТ в растворителях, таких как вода и этанол. ИФМТ обладает большей стабильностью, чем другие известные соли форм изофагомина ИФМТ также особенно подходит для промышленного масштаба производства, например, производства больше 1 кг продукта
[0047] Композиция, содержащая ГЦБ и ИФМ, иногда упоминается в настоящей заявке как композиция ГЦБ/ИФМ. Композиция, содержащая ГЦБ и ИФМТ, иногда упоминается в данной заявке как композиция ГЦБ/ИФМТ.
Молярные соотношения ГЦБ к ИФМ ИФМТ
[0048] В различных вариантах реализации композиция содержит глюкоцереброзидазу (ГЦБ) и изофагомин (ИФМ), например, тартрат изофагомина (ИФМТ), в молярном соотношении по меньшей мере около 1:1, 1:1,5, 1:2, или 1:2,5 (ГЦБ:ИФМ). Молярное соотношение ГЦБ к ИФМ, например, ГЦБ к ИФМТ, может составлять 1:1, 1:1,5, 1:2, 1:2,5, 1:2,6, 1:2,7, 1:2,8, 1:2,9, 1:3,0, 1:3,1, 1:3,2, 1:3,3,1:3,4, 1:3,5, 1:3,6, 1:3,7, 1:3,8, 1:3,9, 1:4,0, 1:4,1, 1:4,2, 1:4.3, 1:4.4, 1:4.5, 1:4.6, 1:4.7, 1:4.8,1:4.9, 1:5.0, 1:5.1, 1:5.2, 1:5.3, 1:5.4, 1:5,5, 1:5,6, 1:5,7, 1:5,8, 1:5,9, 1:6,0, 1:6,1, 1:6,2, 1:6,3,1:6,4, 1:6,5, 1:6,6, 1:6,7, 1:6,8, 1:6,9, 1:7,0, 1:7,1, 1:7,2, 1:7,3, 1:7,4, 1:7,5, 1:7,6, 1:7,7, 1:7,8,1:7,9, 1:8,0, 1:8,1, 1:8,2, 1:8,3, 1:8,4, 1:8,5, 1:8,6, 1:8,7, 1:8,8, 1:8,9, 1:9,0, 1:9,1, 1:9,2, 1:9,3, 1:9,4, 1:9,5, 1:9,6, 1:9,7, 1:9,8, 1:9,9, 1:10,0, 1:10,1, 1:10,2, 1:10,3, 1:10,4, 1:10,5, 1:10,6, 1:10,7, 1:10,8, 1:10,9, 1:11,0, 1:11,1, 1:11,2, 1:11,3, 1:11,4, 1:11,5, 1:11,6, 1:11,7, 1:11,8, 1:11,9, 1:12,0, 1:12,1, 1:12,2, 1:12,3, 1:12,4, 1:12,5, 1:12,6, 1:12,7, 1:12,8, 1:12,9, 1:13,0, 1:13,1, 1:13,2, 1:13,3, 1:13,4, 1:13,5, 1:13,6, 1:13,7, 1:13,8, 1:13,9, 1:14,0, 1:14,1, 1:14,2, 1:14,3, 1:14,4, 1:14,5, 1:14,6, 1:14,7, 1:14,8, 1:14,9, 1:15,0, 1:15,1, 1:15,2, 1:15,3, 1:15,4, 1:15,5, 1:15,6, 1:15,7, 1:15,8, 1:15,9, 1:16,0, 1:16,1, 1:16,2 1:16,3, 1:16,4, 1:16,5, 1:16,6, 1:16,7, 1:16,8, 1:16,9, 1:17,0, 1:17,1, 1:17,2, 1:17,3, 1:17,4, 1:17,5, 1:17,6, 1:17,7, 1:17,8, 1:17,9, 1:18,0, 1:18,1, 1:18,2, 1:18,3, 1:18,4, 1:18,5, 1:18,6, 1:18,7 1:18,8, 1:18,9, 1:19,0, 1:19,1, 1:19,2, 1:19,3, 1:19,4, 1:19,5, 1:19,6, 1:19,7, 1:19,8, 1:19,9, 1:20,0, 1:20,1, 1:20,2, 1:20,3, 1:20,4, 1:20,5, 1:20,6, 1:20,7, 1:20,8, 1:20,9, 1:21,0, 1:21,1, 1:21,2, 1:21,3, 1:21,4, 1:21,5, 1:21,6, 1:21,7, 1:21,8, 1:21,9, 1:22,0, 1:22,1, 1:22,2, 1:22,3, 1:22,4, 1:22,5, 1:22,6, 1:22,7, 1:22,8, 1:22,9, 1:23,0, 1:23,1, 1:23,2, 1:23,3, 1:23,4, 1:23,5, 1:23,6, 1:23,7 1:23,8, 1:23,9, 1:23,9, 1:24,0, 1:24,1, 1:24,2, 1:24,3, 1:24,4, 1:24,5, 1:24,6, 1:24,7, 1:24,8, 1:24,9, 1:25,0, 1:25,1, 1:25,2, 1:25,3, 1:25,4, 1:25,5, 1:25,6, 1:25,7, 1:25,8, 1:25,9, 1:26,0, 1:26,1 1:26,2, 1:26,3, 1:26,4, 1:26,5, 1:26,6, 1:26,7, 1:26,8, 1:26,9, 1:27,0, 1:27,1, 1:27,2, 1:27,3, 1:27,4, 1:27,5, 1:27,6, 1:27,7, 1:27,8, 1:27,9, 1:28,0, 1:28,1, 1:28,2, 1:28,3, 1:28,4, 1:28,5, 1:28,6 1:28,7, 1:28,8, 1:28,9, 1:29,0, 1:29,1, 1:29,2, 1:29,3, 1:29,4, 1:29,5, 1:29,6, 1:29,7, 1:29,8, 1:29,9 или 1:30,0.
[0049] Молярное соотношение ГЦБ к ИФМ, например, ГЦБ к ИФМТ, может составлять от 1:2,5 до 1:3,5, от 1:2,6 до 1:3,4, от 1:2,7 до 1:3,5, от 1:2,7 до 1:3,4, от 1:2,5 до 1:3,3, от 1:2,8 до 1:3,5, от 1:2,8 до 1:3,3, от 1:2,7 до 1:3,2, от 1:2,6 до 1:3,1, от 1:От 2,5 до 1:3,0, от 1:2,9 до 1:3,3, от 1:2,8 до 1:3,2, от 1:2,7 до 1:3,1, от 1:2,6 до 1:3,0, от 1:2,5 до 1:2,9 от 1:3,0 до 1:3,4 или от 1:3,1 до 1:3,5.
[0050] Молярное соотношение ГЦБ к ИФМ, например, ГЦБ к ИФМТ, может составлять от 1:7 до 1:33, от 1:8 до 1:32, от 1:9 до 1:33, от 1:7 до 1:31, от 1:9 до 1:31, от 1:8 до 1:30, от 1:7 до 1:29, от 1:10 до 1:32, от 1:11 до 1:33, от 1:7 до 1:29, от 1:10 до 1:30, от 1:9 до 1:29, от 1:8 до 1:28, от 1:7 до 1:27, от 1:11 до 1:31 от 1:12 до 1:32, от 1:13 до 1:33, от 1:11 до 1:29, от 1:10 до 1:28, от 1:9 до 1:27, от 1:8 до 1:26, от 1:7 до 1:25, от 1:12 до 1:30, от 1:13 до 1:31, от 1:14 до 1:32, от 1:15 до 1:33, от 1:13 до 1:29, от 1:12 до 1:28, от 1:11 до 1:27, от 1:10 до 1:26, от 1:9 до 1:25, от 1:8 до 1:24, от 1:7 до 1:23, от 1:14 до 1:30, от 1:15 до 1:31, от 1:16 до 1:32, от 1:17 до 1:33, от 1:14 до 1:28, от 1:13 до 1:27, от 1:12 до 1:26, от 1:11 до 1:25, от 1:10 до 1:24, от 1:9 до 1:23, от 1:8 до 1:22, от 1:7 до 1:21, от 1:15 до 1:29, от 1:16 до 1:30, от 1:17 до 1:31, от 1:18 до 1:32, от 1:19 до 1:33, от 1:15 до 1:27, от 1:14 до 1:26, от 1:13 до 1:25, от 1:12 до 1:24, от 1:11 до 1:23, от 1:10 до 1:22, от 1:9 до 1:21, от 1:8 до 1:20, от 1:7 до 1:19, от 1:16 до 1:28, от 1:17 до 1:29, от 1:18 до 1:30, от 1:19 до 1:31, от 1:20 до 1:32 или от 1:21 до 1:33.
[0051] Молярное соотношение ГЦБ к ИФМ, например, ГЦБ к ИФМТ, может составлять от 1:16 до 1:26, от 1:15 до 1:25, от 1:14 до 1:24, от 1:13 до 1: 23, от 1:12 до 1:22, от 1:11 до 1:31, от 1:10 до 1:30, от 1:9 до 1:29, от 1:8 до 1:28, от 1:7 до 1:27, от 1:17 до 1:27, от 1:18 до 1:28, от 1:19 до 1:29, от 1:20 до 1:30, от 1:21 до 1:31 от 1:22 до 1:32, от 1:23 до 1:33, от 1:17 до 1:25, от 1:14 до 1:24, от 1:13 до 1:23, от 1:12 до 1:22, от 1:11 до 1:21, от 1:10 до 1:20, от 1: 9 до 1:19, от 1:18 до 1:26, от 1:19 до 1:27, от 1:20 до 1:28, от 1:21 до 1:29, от 1:22 до 1:30, от 1:23 до 1:31, от 1:18 до 1:24, от 1:17 до 1:23, от 1:16 до 1:22, от 1:15 до 1:21, от 1:14 до 1:20, от 1:13 до 1:19, от 1:12 до 1:18, от 1:11 до 1:17, от 1:19 до 1:25, от 1:20 до 1:26, от 1:21 до 1:27, от 1:22 до 1:28, от 1:23 до 1:29, от 1:24 до 1:30, от 1:19 до 1:23, от 1:17 до 1:21, от 1:15 до 1:19, от 1:13 до 1:17, от 1:11 до 1:15, от 1:9 до 1:13от 1:7 до 1:11, от 1:21 до 1:25, от 1:23 до 1:27, от 1:25 до 1:29, от 1:27 до 1:31, от 1:29 до 1:33, от 1:20 до 1:23, от 1:18 до 1:21, от 1:16 до 1:19, от 1:14 до 1:17, от 1:12 до 1:15, от 1:10 до 1:13, от 1: 8 до 1:11, от 1:22 до 1:25, от 1:24 до 1:27, от 1:26 до 1:29, от 1:28 до 1:31 или от 1:30 до 1:33.
[0052] Молярное соотношение ГЦБ к ИФМ, например, ГЦБ к ИФМТ, может составлять 1:31, 1:32, 1:33, 1:34, 1:35, 1:36, 1:37, 1:38, 1:39, 1:40, 1:41, 1:42, 1:43, 1:44, 1:45, 1:46, 1:47, 1:48, 1:49, 1:50, 1:51, 1: 52, 1:53, 1:54, 1:55, 1:56, 1:57, 1:58, 1:35, 1:59, 1:60, 1:61, 1:62, 1:63, 1:64, 1:65, 1:66, 1:67, 1:68, 1:69, 1:70, 1:71, 1:72, 1:73, 1:74, 1:75, 1: 76, 1:77, 1:78, 1:79, 1:80, 1:81, 1:82, 1:83, 1:84, 1:85, 1:86, 1:87, 1:88, 1:89, 1:90, 1:91, 1:92, 1:93, 1:94, 1:95, 1:96, 1:97, 1:98, 1:99 или 1:100
[0053] Молярное соотношение ГЦБ к ИФМ, например, ГЦБ к ИФМТ, может составлять от 1:30 до 1:100, от 1:30 до 1:80, от 1:40 до 1:90, от 1:50 до 1:100, от 1:30 до 1:60, от 1:40 до 1:70, от 1:50 до 1:80, от 1:60 до 1:90, от 1:70 до 1:100, от 1:30 до 1:50, от 1:40 до 1:60, от 1:50 до 1:70, от 1:60 до 1:80, от 1:70 до 1:90, от 1:80 до 1:100, от 1:30 до 1:40, от 1:40 до 1:50, от 1:50 до 1:60, от 1:60 до 1:70, от 1:70 до 1:80, от 1:80 до 1:90, или от 1:90 до 1:100.
[0054] В других различных вариантах реализации, описанных в данном документе, композиция содержит глюкоцереброзидазу (ГЦБ) и тартрат изофагомина (ИФМТ) в молярном соотношении по меньшей мере около 1:2,5.
[0055] В других различных вариантах реализации, описанных в данном документе, композиция содержит глюкоцереброзидазу (ГЦБ) и цитрат изофагомина в молярном соотношении по меньшей мере около 1:2,5.
[0056] В других различных вариантах реализации, описанных в данном документе, композиция содержит глюкоцереброзидазу (ГЦБ) и изофагомина HCl в молярном соотношении по меньшей мере около 1:2,5.
[0057] В других различных вариантах реализации, описанных в данном документе, композиция содержит глюкоцереброзидазу (ГЦБ) и свободное основание изофагомина в молярном соотношении по меньшей мере около 1:2,5.
[0058] В других различных вариантах реализации, описанных в данном документе, композиция содержит глюкоцереброзидазу (ГЦБ) и изофагомин, который не содержит ИФМТ, в молярном соотношении по меньшей мере около 1:2,5.
Концентрация ГЦБ
[0059] Концентрация ГЦБ в любой из композиций может составлять от около ОД до около 40 мг/мл, от около 0,5 до около 10 мг/мл, от около 5 до около 15 мг/мл, от около 10 до около 20 мг/мл, от около 15 до около 25 мг/мл, от около 20 до около 30 мг/мл, от около 25 до около 35 мг/мл, от около 30 до около 40 мг/мл, от около 2 до около 8 мг/мл, от около 5 до около 11 мг/мл, от около 8 до около 14 мг/мл, от около 11 до около 17 мг/мл, от около 14 до около 20 мг/мл, от около 17 до около 23 мг/мл, от около 20 до около 26 мг/мл, от около 23 до около 29 мг/мл, от около 26 до около 32 мг/мл, от около 29 до около 35 мг/мл, от около 32 до около 38 мг/мл, от около 2 до около 5 мг/мл, от около 5 до около 8 мг/мл, от около 8 до около 11 мг/мл, от около 11 до около 14 мг/мл, от около 14 до около 17 мг/мл, от около 17 до около 20 мг/мл, от около 20 до около 23 мг/мл, от около 23 до около 26 мг/мл, от около 26 до около 29 мг/мл, от около 29 до около 32 мг/мл, от около 32 до около 35 мг/мл, от около 35 до около 38 мг/мл, около 0,5 мг/мл, около 1 мг/мл, около 2 мг/мл, около 3 мг/мл, около 4 мг/мл, около 5 мг/мл, около 6 мг/мл, около 7 мг/мл, около 8 мг/мл, около 9 мг/мл, около 10 мг/мл, около 11 мг/мл, около 12 мг/мл, около 13 мг/мл, около 14 мг/мл, около 15 мг/мл, около 16 мг/мл, около 17 мг/мл, около 18 мг/мл, около 19 мг/мл, около 20 мг/мл, около 21 мг/мл, около 22 мг/мл, около 23 мг/мл, около 24 мг/мл, около 25 мг/мл, около 26 мг/мл, около 27 мг/мл, около 28 мг/мл, около 29 мг/мл, около 30 мг/мл, около 31 мг/мл, около 32 мг/мл, около 33 мг/мл, около 34 мг/мл, около 35 мг/мл, около 36 мг/мл, около 37 мг/мл, около 38 мг/мл, около 39 мг/мл или около 40 мг/мл.
[0060] Концентрация ГЦБ может составлять от 50 единиц/мл до 200 единиц/мл, от 70 единиц/мл до 160 единиц/мл, от 80 единиц/мл до 175 единиц/мл, от 90 единиц/мл до 190 единиц/мл, 60 единиц/мл до 145 единиц/мл, от 50 единиц/мл до 130 единиц/мл, от 80 единиц/мл до 140 единиц/мл, от 70 единиц/мл до 120 единиц/мл, от 60 единиц/мл до 100 единиц/мл, 50 единиц/мл до 85 единиц/мл, от 90 единиц/мл до 160 единиц/мл, от 100 единиц/мл до 180 единиц/мл, от 120 единиц/мл до 200 единиц/мл, от 90 единиц/мл до 125 единиц/мл, 80 единиц/мл до 105 единиц/мл, от 70 единиц/мл до 100 единиц/мл, от 60 единиц/мл до 90 единиц/мл, от 50 единиц/мл до 80 единиц/мл, от 100 единиц/мл до 140 единиц/мл, 115 единиц/мл до 160 единиц/мл, 130 единиц/мл до 180 единиц/мл, 145 единиц/мл до 200 единиц/мл, от 100 единиц/мл до 115 единиц/мл, от 90 единиц/мл до 105 единиц/мл, 80 единиц/мл до 95 единиц/мл, от 70 единиц/мл до 85 единиц/мл, от 60 единиц/мл до 75 единиц/мл, от 50 единиц/мл до 65 единиц/мл, от 110 единиц/мл до 125 единиц/мл, 120 единиц/мл до 135 единиц/мл, 130 единиц/мл до 145 единиц/мл, 140 единиц/мл до 160 единиц/мл, 160 единиц/мл до 180 единиц/мл, 180 единиц/мл до 200 единиц/мл, около 50 единиц/мл, около 60 единиц/мл, около 70 единиц/мл, около 80 единиц/мл, около 90 единиц/мл, около 100 единиц/мл, около 110 единиц/мл, около 120 единиц/мл, около 130 единиц/мл, около 140 единиц/мл, около 150 единиц/мл, около 160 единиц/мл, около 170 единиц/мл, около 180 единиц/мл, около 190 единиц/мл, около 200 единиц/мл, 50 единиц/мл, 60 единиц/мл, 70 единиц/мл, 80 единиц/мл, 90 единиц/мл, 100 единиц/мл, 110 единиц/мл, 120 единиц/мл, 130 единиц/мл, 140 единиц/мл, 150 единиц/мл, 160 единиц/мл, 170 единиц/мл, 180 единиц/мл, 190 единиц/мл или 200 единиц/мл.
Фармацевтические композиции
[0061] Фармацевтическая композиция может включать «терапевтически эффективное количество» ГЦБ/ИФМ, например ГЦБ/ИФМТ, композиции, описанной в данном документе. Такие эффективные количества могут быть определены на основе эффекта от введенной композиции. Терапевтически эффективное количество композиции ГЦБ/ИФМ, например, ГЦБ/ИФМТ, также может варьироваться в зависимости от таких факторов, как болезненное состояние, возраст, пол и масса индивидуума и способность композиции вызывать желаемый ответ у индивидуума, например, улучшение по меньшей мере одного симптома, состояния или расстройства, например, дефицита глюкоцереброзидазы, например, болезни Гоше. Терапевтически эффективное количество также является таким, при использовании которого, терапевтически благоприятные эффекты превосходят любые токсические или пагубные эффекты композиции.
[0062] Композиция ГЦБ/ИФМ может не содержать ИФМТ.
[0063] Фармацевтическая композиция изобретения может быть образована так, чтобы она была совместима с предполагаемым путем введения. Например, композицию ГЦБ/ИФМ, например, ГЦБ/ИФМТ, можно вводить парентеральным способом, например, внутривенной, подкожной, внутрибрюшинной или внутримышечной инъекцией. В различных вариантах реализации, способ введения является внутривенным. В различных вариантах реализации, способ введения является подкожным. Растворы или суспензии, используемые для парентерального применения, могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, жирные масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатообразующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулирования тонуса, такие как хлорид натрия или декстроза. РН фармацевтических композиций можно регулировать с помощью кислот или оснований, таких как соляная кислота или гидроксид натрия. Парентеральный препарат может быть заключен в ампулы, одноразовые шприцы или флаконы с несколькими дозами, изготовленные из стекла или пластика.
рН
[0064] рН может оказывать влияние на стабильность ГЦБ в различных композициях ГЦБ/ИФМ и ГЦБ/ИФМТ, описанных в данном документе. рН может влиять на конформацию, и/или агрегацию, и/или разложение, и/или реакционную способность ГЦБ. Например, при более высоком рН, кислород может быть более реактивным. рН предпочтительно меньше, чем 7,0, более предпочтительно в диапазоне от около 4,5 до около 6,5, более предпочтительно от около 5,0 до около 6,0 и более предпочтительно от около 5,5 до около 5,8, более предпочтительно около 5,7. С ГЦБ, агрегация может достигать нежелательных уровней при рН выше 7,0 и разложение (например, фрагментация) может достигать нежелательных уровней при рН 4,5 или при 5,0 или при рН выше 6,5 или 7,0.
[0065] Подходящий рН может быть проверен путем обеспечения для теста композиции ГЦБ/ИФМ, например, ГЦБ/ИФМТ, регулируя композицию до подходящей рН и продувкой композиции кислородом. Стабильность ГЦБ в композиции при подходящей рН может быть измерена, например, как процент агрегации или разложения, в заранее определенное время. Измеренная стабильность может быть сравнена с одним или несколькими стандартами. Например, подходящий стандарт будет представлять собой композицию аналогичной испытанной композиции, за исключением, что рН композиции не регулируют. Затем можно сравнивать стабильность композиций с отрегулированным рН и без отрегулированного рН. Композиция ГЦБ/ИФМ, например, ГЦБ/ИФМТ, может быть более подходящей, если ГЦБ является более стабильной, чем у стандартной композиции сравнения. Пригодность может быть продемонстрирована тестовой обработкой, увеличивающей стабильность по сравнению с этим стандартом. Например, если сравнительная стандартная композиция ГЦБ/ИФМ имеет рН 5,5, но повышенная стабильность ГЦБ наблюдается, когда композиция ГЦБ/ИФМ имеет рН 6,3, то композиция с рН 6,3 является более подходящей, поскольку ГЦБ более стабильна при рН 6,3, чем при рН 5,5.
[0066] Буферы, которые могут быть использованы для регулирования рН белковой композиции включают гистидин, цитрат, фосфат, глицин, сукцинат, ацетат, глютамат, Трис, тартрат, аспартат, малеат и лактат.
Анализы стабильности ГЦБ
[0067] Стабильность белков может быть измерена путем измерения агрегации белка или разложения белка. Агрегацию белка можно определить с помощью различных способов, которые включают, например, эксклюзионную хроматографию по размеру (ЭХР), неденатурирующий ЭПАГ, или другие способы определения размера и т.д. Разложение белка может быть определено, например, с помощью ВЭЖХ с обращенной фазой, неденатурирующей ЭПАГ, ионобменной хроматографии, пептидного картирования или подобных способов.
[0068] Стабильность, как используется в данном документе, включает такие параметры, как структура белка (например, минимизация или предотвращение изменений в структуре белка, например, агрегация белка или разложение белка (например, фрагментация)) и/или биологическая активность белка, например, способность превратить субстрат в продукт.
[0069] Стабильность ГЦБ может быть измерена, например, путем измерения агрегации белка, разложения белка или уровней биологической активности ГЦБ. Агрегация ГЦБ может быть определена, различными способами, в том числе эксклюзионной хроматографией по размеру, неденатурирующим ЭПАГ, и другими способами определения размера. Например, композиция может иметь менее чем 1, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50% увеличение степени агрегации белка ГЦБ (например, как измерено с помощью эксклюзионной хроматографии по размеру) по сравнению с количеством агрегации белка, которое было в композиции перед хранением (например, хранение при температуре 2-8°C в течение периода до 3, 6,9, 12 или 24 месяцев (или дольше)).
[0070] Разложение белка может быть определено различными способами, в том числе ВЭЖХ с обращенной фазой, неденатурирующим ЭПАГ, ионобменной хроматографией, пептидным картированием, или подобными способами. В качестве примера, композиция может иметь менее чем 1, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50% увеличение степени разложения ГХБ (например, как измерено ВЭЖХ с обращенной фазой)) по сравнению с количеством разложения ГХБ, которое было в композиции перед хранением (например, хранение при температуре 2-8°C в течение периода до 3, 6, 9, 12 или 24 месяцев (или дольше))). Биологическая активность ГЦБ может быть измерена, например, за счет анализов in vitro или in vivo, например, ELISA (например, для измерения связывающей или ферментативной активности) и других ферментативных анализов (например, спектрофотометрический, флуориметрический, калориметрический, хемилюминесцентный, радиометрический или хроматографический анализы), анализы киназы, и так далее. Например, композиция может иметь менее чем 1, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50% снижение биологической активности ГЦБ (например, ферментативной активности, например, как измеряется анализом in vitro) по сравнению с биологической активностью, которая была у композиции перед хранением (например, хранение при температуре 2-8°C в течение периода времени до 3, 6, 9, 12 или 24 месяца (или дольше)).
Антиоксиданты и стабилизаторы
[0071] Композиции ГЦБ/ИФМ и ГЦБ/ИФМТ, описанные в данном документе, могут дополнительно содержать антиоксидант. Один подходящий антиоксидант представляет собой цистеин. Цистеин может присутствовать в количестве от 0,030% до 0,100%, от 0,050% до 0,080%, от 0,040% до 0,070%, от 0,030% до 0,060%, от 0,060% до 0,090%, от 0,070% до 0,100%, от 0,065% до 0,080%, 0,060% до 0,075%, 0,055% до 0,070%, от 0,050% до 0,065%, от 0,070% до 0,085%, от 0,075% до 0,090%, около 0,065%, около 0,070%, около 0,075%, около 0,080%, 0,065%, 0,070%, 0,075% или 0,080%. Не желая быть связанными теорией, цистеин может дополнительно стабилизировать ГЦБ.
[0072] Композиции ГЦБ/ИФМ и ГЦБ/ИФМТ, описанные в данном документе, могут дополнительно содержать углевод, такой как сахароза или трегалоза. Углевод, например, сахароза или трегалоза, может присутствовать в количестве от 12% до 19%, от 13% до 18%, от 14% 17%, от 12% до 15%, от 13% до 16%, от 15% до 17%, около 16%, или 16%. Не желая быть связанными теорией, сахароза или трегалоза может дополнительно стабилизировать ГЦБ за счет уменьшения доступности тиольных (-SH) групп.
[0073] Композиции ГЦБ/ИФМ и ГЦБ/ИФМТ в данном документе могут дополнительно содержать детергент. Детергент может представлять собой полисорбат 20 (который является особенно подходящим для реализации данного изобретения), или любое количество соединения на основе полоксамеров.
[0074] В некоторых вариантах реализации, стабильность ГЦБ по меньшей мере на 5-80% больше (например, по меньшей мере около 5%, по меньшей мере около 10%, по меньшей мере около 15%, по меньшей мере около 20%, по меньшей мере около 25%, по меньшей мере около 30%, по меньшей мере около 35%, по меньшей мере около 40%, по меньшей мере около 45%, по меньшей мере около 50%, по меньшей мере около 55%, по меньшей мере около 60%, по меньшей мере около 65%, по меньшей мере около 70%, по меньшей мере около 75%, или по меньшей мере около на 80% больше), в предварительно выбранных условиях, чем стабильность ГЦБ в композиции, которая отличается отсутствием углевода (сахарозы или трегалозы), антиоксиданта или обоих углевода и антиоксиданта.
[0075] Композиции ГЦБ/ИФМ и ГЦБ/ИФМТ могут быть очищены от кислорода перед хранением в контейнере. Кроме того, контейнер идеально газонепроницаемый таким образом, чтобы предотвратить проникновение кислорода. ГЦБ в описанных в данном документе композициях, например, жидких композициях, содержащих ГЦБ, может обладать пролонгированной стабильностью. Например, в предварительно выбранных условиях, например, при хранении в газонепроницаемом контейнере, при температуре 2-8°C в течение периода до 3, 6, 9, 12 или 24 месяцев (или в некоторых вариантах реализации дольше), ГЦБ в композиции сохранит по меньшей мере 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 99 или 100% стабильности, которую он имел до хранения.
[0076] Подходящую концентрацию белка можно проверить, путем получения композиции, содержащей 0,075% цистеина, 16% сахарозы, доводя рН до 5,7, доводя ГЦБ до предполагаемой концентрации, и продувая композицию О2. Стабильность ГЦБ в композиции ГЦБ/ИФМ, например, композиции ГЦБ/ИФМТ при подходящей концентрации, измеренной, например, в виде процентной агрегации или разложения, в предварительно определенное время, сравнивают с одним или несколькими стандартами. Стабильность ГЦБ при каждой концентрации сравнивают. Пригодность может быть продемонстрирована подходящей концентрацией, имеющей сравнимое или лучшее влияние на стабильность, чем концентрация, описанная в данном документе.
[0077] Стабильность ГЦБ может быть измерена с помощью любого из способов, описанных в данной заявке, например, путем измерения агрегации белка или разложения белка. Агрегацию белка можно определить, например, с помощью эксклюзионной хроматографии по размеру, неденатурирующего ЭПАГ или других способов определения размера и т.д. Разложение белка можно определить, например, с помощью ВЭЖХ с обращенной фазой, неденатурирующего ЭПАГ, ионообменной хроматографии, ЭХР, ЭХР ВЭЖХ, пептидного картирования или подобных способов.
Поверхностно-активные вещества
[0078] Композиции ГЦБ/ИФМ и ГЦБ/ИФМТ, описанные в данном документе, могут дополнительно содержать одно или более поверхностно-активное вещество. Не желая быть связанными какой-либо теорией, поверхностно-активные вещества могут повышать стабильность белка, например, путем обеспечения границы раздела воздух/жидкость, которая может уменьшить разрушение белка при встряхивании или во время транспортировки. Может быть выбрано поверхностно-активное вещество, которое повышает стабильность белка, например, не вызывая разложения белка, в конкретной жидкой композиции. Типичным поверхностно-активным веществом является полоксамер 188 или Pluronic F68. Поверхностно-активное вещество может присутствовать в количестве от около 0,005% до около 5%, например, от около 0,01% до около 1%, например, около 0,025% и около 0,5%, например, около 0,03% и около 0,25%, например, от около 0,04 до около 0,1%, например, от около 0,05% до около 0,075%, например, 0,05%. Идеальным поверхностно-активным веществом является то, которое не модифицируется и не расщепляется ГЦБ.
[0079] Например, подходящее поверхностно-активное вещество можно тестировать, путем получения композиции, содержащей 2 мг/мл ГЦБ, некое количество ИФМ, 0,075% цистеина, 16% сахарозы, затем доводя рН до 5,7, затем добавляя подходящее поверхностно-активное вещество и продувая композицию О2. Стабильность композиции ГЦБ/ИФМ, содержащей подходящее поверхностно-активное вещество, измеряют, например, в виде процентной агрегации или разложения в заданное время по сравнению с одним или несколькими стандартами. Например, подходящим стандартом может быть композиция, аналогичная условиям испытаний, за исключением того, что поверхностно-активное вещество не добавляется в композицию. Стабильность обработанной (содержащей поверхностно-активное вещество) и необработанной (не содержащей поверхностно-активное веществе) композиции могут быть сопоставлены в условиях, имитирующих сценарии «реального мира», например, хранение и транспортировку. Стандарт может представлять собой композицию, аналогичную тестируемой композиции, за исключением того, что вместо полоксамера 188 используется другое поверхностно-активное вещество. Полоксамер 188 будет тогда стандартом для сравнения. Пригодность может быть показана подходящим поверхностно-активным веществом, имеющим сравнимое или лучшее влияние на стабильность, чем поверхностно-активное вещество, описанное в данном документе. Если определено, что подходящее поверхностно-активное вещество является подходящим (например, оно увеличивает стабильность композиции по сравнению с одним из стандартов), концентрация подходящего поверхностно-активного вещества может быть уточнена. Например, концентрацию можно увеличивать или уменьшать в диапазоне значений и сравнить со стандартом и с другими тестируемыми концентрациями, чтобы определить, какая концентрация вызывает наибольшее увеличение стабильности.
[0080] В качестве альтернативы, комбинацию двух или более поверхностно-активных веществ используют в композициях, описанных в данном документе. Пригодность комбинации может быть испытана, как описано выше, путем сравнения стабильности композиции ГЦБ/ИФМ с тестируемой комбинацией поверхностно-активных веществ со стабильностью композиции ГЦБ/ИФМ с полоксамером 188.
[0081] Стабильность белков может быть измерена, например, путем измерения агрегации белка или разложения белка. Агрегацию белка можно определить, например, с помощью эксклюзионной хроматографии по размеру, неденатурирующего ЭПАГ или других способов определения размера и т.д. Разложение белка можно определить, например, с помощью ВЭЖХ с обращенной фазой, неденатурирующего ЭПАГ, ионообменной хроматографии, пептидного картирования или подобных способов.
Фармацевтически приемлемая соль
[0082] Фармацевтическая композиция может дополнительно содержать соль или фармацевтически приемлемую соль.
[0083] Подходящие фармацевтически приемлемые соли присоединения кислоты могут быть получены из неорганической кислоты или из органической кислоты. Примеры неорганических кислот включают хлористоводородную, бромистоводородную, йодистоводородную, азотную, угольную, серную и фосфорную кислоты. Подходящие органические кислоты могут быть выбраны из алифатических, циклоалифатических, ароматических, аралифатических, гетероциклических, карбоксильных и сульфоновых классов органических кислот, примеры которых включают муравьиную, уксусную, пропионовую, янтарную, гликолевую, глюконовую, молочную, яблочную, винную, лимонную, аскорбиновую, глюкуроновую, малеиновую, фумаровую, пировиноградную, аспарагиновую, глутаминовую, бензойную, антраниловую, 4-гидроксибензойную, фенил ацетатную, миндальную, эмбоновую (памоевая), метансульфоновую, этансульфонофую, бензолсульфоновую, пантотеновую, трифторметансульфоновую, 2-гидроксиэтансульфоновую, п-толуолсульфоновую, сульфаниловую, циклогексиламиносульфоновую, стеариновую, альгиновую, β-гидроксимасляную, салициловая, галактаровую, щавелевую, малоновую и галактуроновую кислоты. Примеры фармацевтически неприемлемых солей присоединения кислоты включают, например, перхлораты и тетрафторбораты. Все эти соли присоединения кислоты могут быть получены из изофагомина или ГЦБ путем реакции, например, соответствующей кислоты с соединением.
[0084] Подходящие фармацевтически приемлемые соли присоединения основания изофагомина включают, например, соли металлов, в том числе щелочных металлов, щелочно-земельных металлов и солей переходных металлов, такие как, например, кальций, магний, калий, натрий и соль цинка. Фармацевтически приемлемые соли присоединения основания включают также органические соли, полученные из основных аминов, таких как, например, N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглумин (N-метилглюкамин) и прокаин. Примеры фармацевтически неприемлемых солей присоединения оснований включают соли лития и соли цианата. Все эти соли присоединения основания могут быть получены из изофагомина путем взаимодействия, например, подходящего основания с соединением.
Фармацевтические носители
[0085] Фармацевтические композиции, содержащие ГЦБ могут включать один или несколько фармацевтически приемлемых носителей. Используемый в данном документе термин «фармацевтически приемлемый носитель» предназначен для включения любых растворителей, вспомогательных веществ, дисперсионных сред, покрывающих веществ, антибактериальных и противогрибковых агентов, изотонических и задерживающих адсорбцию агентов и тому подобного, совместимых с фармацевтическим введением. Фармацевтическая композиция является хорошо известной технологией и дополнительно описана, например, в Gennaro (ed), Remington: The Science and Practice of Pharmacy, 20th ed., Lippincott, Williams & Wilkins (2000) (ISBN: 0683306472); Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th Ed., Lippincott Williams & Wilkins Publishers (1999) (ISBN: 0683305727); и Kibbe (ed.), Handbook of Pharmaceutical Excipients American Pharmaceutical Association, 3rd ed. (2000) (ISBN: 091733096X). За исключением случаев, когда какой-либо обычный носитель или агент несовместим с активным соединением, такие носители могут быть использованы в композициях изобретения. Дополнительные активные соединения также могут быть включены в композиции.
[0086] Фармацевтические композиции, описанные в настоящем документе, могут дополнительно включать носители, которые защищают соединение от быстрого выведения из организма, такие как композиция с контролируемым высвобождением, включая имплантаты и микрокапсулированные системы доставки. Могут использоваться биоразлагаемые, биосовместимые полимеры, такие как, этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы получения таких композиций будут очевидны специалистам в данной области техники. Липосомные суспензии (включая липосомы, нацеленные на инфицированные клетки с моноклональными антителами к вирусным антигенам) также могут быть использованы в качестве фармацевтически приемлемых носителей. Композиции могут быть получены в соответствии со способами, известными специалистам в данной области, например, как описано в патенте США №4,522,811.
[0087] Для внутривенного введения подходящие носители включают физиологический солевой раствор, бактериостатическую воду, CREMOPHOR EL™ (BASF, Parsippany, N.J.) или физиологический раствор с фосфатным буфером (ФБ). Во всех случаях композиция должна быть стерильной и должна быть жидкой до такой степени, чтобы ее можно было легко вводить через шприц. Композиция также должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может быть растворителем или дисперсионной средой, содержащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и тому подобное) и их подходящие смеси. Надлежащая текучесть может поддерживаться, например, путем использования покрывающего вещества, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем использования поверхностно-активных веществ. Предотвращение активности микроорганизмов может быть достигнуто с помощью различных антибактериальных и противогрибковых агентов, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и тому подобного. Во многих случаях будет предпочтительно включать в композицию изотонические агенты, например, сахара, полиспирты, такие как маннит, сорбит, хлорид натрия. Длительная стабильность инъецируемых композиций может быть достигнута включением агента, который задерживает адсорбцию, например, моностеарата алюминия, человеческого сывороточного альбумина и желатина.
[0088] Стерильные растворы для инъекций могут быть получены путем добавления ГЦБ/ИФМ в подходящий растворитель с одним или комбинацией ингредиентов, перечисленных выше, по мере необходимости, с последующей стерилизацией фильтрацией. Как правило, дисперсии готовят путем добавления активного соединения в стерильный носитель, который содержит основную дисперсионную среду и требуемые другие ингредиенты из перечисленных выше. В случае стерильных порошков для композиции стерильных растворов для инъекций предпочтительными способами композиции являются вакуумная сушка и лиофилизация, например, лиофилизация, которая дает порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из их предварительно стерильно отфильтрованного раствора.
[0089] Активные соединения (например, композиции ГЦБ, описанные в данном документе) могут быть получены с носителями, которые будут защищать соединение от быстрого выведения из организма, такими как композиция с контролируемым высвобождением, включая имплантаты и микрокапсулированные системы доставки. Могут использоваться биоразрушаемые, биосовместимые полимеры, такие как, этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы получения таких композиций будут очевидны для специалистов в данной области. Материалы также могут быть получены коммерчески от Alza Corporation и Nova Pharmaceuticals, Inc. Липосомные суспензии (включая липосомы, нацеленные на инфицированные клетки с моноклональными антителами к вирусным антигенам) также можно использовать в качестве фармацевтически приемлемых носителей. Композиции могут быть получены в соответствии со способами, известными специалистам в данной области, например, как описано в патенте США №4,522,811.
Упаковка и доставка
[0090] Описанные в данном документе композиции ГЦБ/ИФМ и ГЦБ/ИФМТ можно вводить с помощью различных медицинских устройств. Например, описанную в данном документе композицию можно вводить с помощью безигольного устройства для подкожных инъекций, такого как устройства, описанные в патентах США №5,399,163, 5,383,851, 5,312,335, 5,064,413, 4,941,880, 4,790,824, или 4,596,556. Примеры хорошо известных имплантатов и модулей, используемых в изобретении, включают: патент США №4,487,603, в котором описан имплантируемый микроинфузионный насос для дозирования лекарственного средства с контролируемой скоростью; патент США №4,486,194, в котором описано терапевтическое устройство для введения лекарственных средств через кожу; патент США №4,447,233, в котором описан насос для инфузии лекарственного средства для доставки лекарства с точной скоростью инфузии; патент США №4,447,224, в котором описан имплантируемый инфузионный аппарат с переменным потоком для непрерывной доставки лекарственного средства; патент США №4,439,196, в котором описана осмотическая система доставки лекарственного средства, имеющая многокамерные отделения; и в патенте США№4,475,196, в котором описана осмотическая система доставки лекарственного средства. Конечно, многие другие такие имплантаты, системы доставки и модули также известны.
[0091] Композиции ГЦБ/ИФМ и ГЦБ/ИФМТ, описанные в данном документе, могут быть помещены в две камеры шприца. Например, композиции ГЦБ/ИФМ и ГЦБ/ИФМТ в лиофилизированной форме могут быть помещены в первую камеру шприца, а жидкость может присутствовать во второй камере шприца (см., например, опубликованную заявку США №2004-0249339).
[0092] Композиции ГЦБ/ИФМ и ГЦБ/ИФМТ, описанные в данном документе, могут быть помещены в безигольный шприц (см., например, патент США№6,406,455 и 6,939,324). Вкратце, в качестве одного примера, инъекционное устройство включает: газовую камеру, содержащую газ или источник газа; порт, который может допускать выпуск газа из газовой камеры; поршень, который при выпуске газа из газовой камеры может вызвать движение по меньшей мере первого поршня; первый поршень; второй поршень; первую камеру, например камеру для хранения и смешивания лекарств; корпус поршня, в котором расположены первый поршень, второй поршень и первая камера; смещающий элемент, который может, независимо от движущей силы газа из газовой камеры, вызывать движение одного или обоих первого и второго поршней (смещающий элемент может быть поршнем или отдельным элементом); отверстие, подходящее для безигольной инъекции в сообщении с первой камерой; при этом первый и второй поршни расположены с возможностью скольжения в корпусе поршня, а смещающий элемент, источник газа и поршень расположены так, что: в первом положении поршней - вторая камера, например резервуар для жидкости в корпусе поршня определяется первым поршнем, корпусом поршня и вторым поршнем, смещающий элемент может перемещать один или оба поршня во второе положение, в котором первый поршень находится в таком положении, что вторая камера, которая может быть резервуаром для жидкости, сообщающимся с первой камерой, которая может быть камерой для хранения и смешивания лекарств, и второй поршень перемещается в направлении первого поршня, тем самым уменьшая объем второй камеры и обеспечивая передачу жидкости из второй камеры в первую камеру, плунжер после выпуска газа из газовой камеры заставляет первый поршень двигаться так, чтобы уменьшить объем первой камеры, позволяя веществу выталкивается через отверстие и из камеры и, например, субъекту.
[0093] Безигольный шприц может включать отдельные модули для первого компонента, например, сухого или жидкого компонента, и второго компонента, например, жидкого компонента. Модули могут быть предоставлены в виде двух отдельных компонентов и собраны, например, субъектом, который будет вводить компонент самому себе, или другим человеком, например, человеком, который предоставляет или оказывает медицинскую помощь. Вместе эти модули могут образовывать все или часть поршневого корпуса устройств, описанных в данном документе. Устройства могут использоваться для предоставления любого первого и второго компонента, где желательно хранить или предоставлять компоненты отдельно и объединять их до введения субъекту.
Способы лечения
[0094] Любая из композиций ГЦБ/ИФМ и ГЦБ/ИФМТ, описанных в данном документе, может быть введена пациенту. Композиции ГЦБ/ИФМ и ГЦБ/ИФМТ, описанные в данном документе, предназначены для использования в способах лечения расстройства, связанного с дисфункцией пути ГЦазы, в частности, болезни Гоше. Композиции также используются в производстве лекарственного средства для лечения таких заболеваний с помощью способов лечения, описанных в данном документе.
[0095] Доза может составлять около 60 единиц/кг или 60 единиц/кг, вводимых каждую вторую неделю. Доза может составлять около 30 единиц/кг или 30 единиц/кг, вводимых каждую неделю. Альтернативно, доза может составлять от 30 до 80 единиц/кг, вводимых каждую вторую неделю, от 40 до 70 единиц/кг, вводимых каждую вторую неделю, от 50 до 80 единиц/кг, вводимых каждую вторую неделю, от 45 до 65 единиц/кг, вводимых через неделю, каждую вторую неделю: от 40 до 60 единиц/кг, вводимых каждую вторую неделю, от 35 до 55 единиц/кг, вводимых каждую вторую неделю, от 30 до 50 единиц/кг, вводимых каждую вторую неделю, от 45 до 65 единиц/кг, вводимых каждую вторую неделю, от 50 до 70 единиц/кг, вводимых каждую вторую неделю, от 55 до 75 единиц/кг, вводимых каждую вторую неделю, от 60 до 80 единиц/кг, вводимых каждую вторую неделю, от 55 до 65 единиц/кг, вводимых каждую вторую неделю, от 45 до 55 единиц/кг, вводимых каждую вторую неделю, от 35 до 45 единиц/кг, вводимых каждую вторую неделю, или от 65 до 75 единиц/кг, вводимых каждую вторую неделю. Альтернативно, доза может варьироваться от 15 до 40 единиц/кг, вводимых каждую неделю, от 20 до 35 единиц/кг, вводимых каждую неделю, от 25 до 40 единиц/кг, вводимых каждую неделю, от 22,5 до 32,5 единиц/кг, вводимых каждую неделю, от 20 до 30 единиц/кг, вводимых каждую неделю, от 17,5 до 22,5 единиц/кг, вводимых каждую неделю, от 15 до 25 единиц/кг, вводимых каждую неделю, от 22,5 до 32,5 единиц/кг, вводимых каждую неделю, от 25 до 35 единиц/кг, вводимых каждую неделю, от 22,5 до 37,5 единиц/кг, вводимых каждую неделю, от 30 до 40 единиц/кг, вводимых каждую неделю, от 27,5 до 32,5 единиц/кг, вводимых каждую неделю, от 22,5 до 27,5 единиц/кг, вводимых каждую неделю, от 17,5 до 22,5 единиц/кг, вводимых каждую неделю, или от 32,5 до 37,5 единиц/кг, вводимых каждую неделю. Как правило, доза составляет 15-60 единиц/кг, вводимых каждую вторую неделю, в частности 60 единиц/кг, вводимых каждую вторую неделю. Корректировки дозы могут быть сделаны на индивидуальной основе с учетом достижения и поддержания терапевтических целей.
[0096] Доза может составлять около 1,5 мг/кг или 1,5 мг/кг, вводимых каждую вторую неделю. Доза может составлять около 0,75 мг/кг или 0,75 мг/кг, вводимых каждую неделю. Альтернативно, доза может составлять от 0,75 до 2,0 мг/кг, вводимых каждую вторую неделю, от 1,0 до 1,75 мг/кг, вводимых каждую вторую неделю, от 1,25 до 2,0 мг/кг, вводимых каждую вторую неделю, от 1,125 до 1,625 мг/кг, вводимых каждую вторую неделю, от 1,0 до 1,5 мг/кг, вводимых каждую вторую неделю, от 0,875 до 1,375 мг/кг, вводимых каждую вторую неделю, от 0,75 до 1,25 мг/кг, вводимых каждую вторую неделю, от 1,215 до 1,625 мг/кг, вводимых каждую вторую неделю, от 1,25 до 1,75 мг/кг, вводимых каждую вторую неделю, от 1,375 до 1,875 мг/кг, вводимых каждую вторую неделю, от 1,5 до 2,0 мг/кг, вводимых каждую вторую неделю, от 1,375 до 1,625 мг/кг, вводимых каждую вторую неделю, от 1,125 до 1,375 мг/кг, вводимых каждую вторую неделю, от 0,875 до 1,125 мг/кг, вводимых каждую вторую неделю, или от 1,625 до 1,875 мг/кг, вводимых каждую вторую неделю. Альтернативно, доза может составлять от 0,375 до 1,0 мг/кг, вводимых каждую неделю, от 0,5 до 0,875 мг/кг, вводимых каждую неделю, от 0,625 до 1,0 мг/кг, вводимых каждую неделю, от 0,5625 до 0,8125 мг/кг, вводимых каждую неделю, от 0,5 до 0,75 мг/кг, вводимых каждую неделю, от 0,4375 до 0,5625 мг/кг, вводимых каждую неделю, от 0,375 до 0,625 мг/кг, вводимых каждую неделю, от 0,5625 до 0,8125 мг/кг, вводимых каждую неделю, от 0,625 до 0,875 мг/кг, вводимых каждую неделю, от 0,5625 до 0,9375 мг/кг вводимых каждую неделю, от 0,75 до 1,0 мг/кг вводимых каждую неделю, от 0,6875 до 0,8125 мг/кг вводимых каждую неделю, от 0,5625 до 0,6875 мг/кг вводимых каждую неделю, от 0,4375 до 0,5625 мг/кг вводимых каждую неделю или от 0,8125 до 0,9375 мг/кг вводимых каждую неделю. Как правило, доза составляет 15 мг/кг, вводимая каждую вторую неделю, в частности, подкожным введением. Корректировки дозы могут быть сделаны на индивидуальной основе с учетом достижения и поддержания терапевтических целей.
[0097] Любая из композиций ГЦБ/ИФМ и ГЦБ/ИФМТ, описанных в данном документе, может быть введена пациенту. Доза может составлять от около 90 до 180 единиц/кг, вводимых каждую вторую неделю. Доза может составлять около 90 единиц/кг или 90 единиц/кг, вводимых каждую неделю. Альтернативно, доза может составлять от 90 до 150 единиц/кг, вводимых каждую вторую неделю, от 110 до 160 единиц/кг, вводимых каждую вторую неделю, от 120 до 180 единиц/кг, вводимых каждую вторую неделю, от 120 до 150 единиц/кг, вводимых каждую вторую неделю от 90 до 120 единиц/кг, вводимых каждую вторую неделю, от 100 до 130 единиц/кг, вводимых каждую вторую неделю, от 110 до 140 единиц/кг, вводимых каждую вторую неделю, от 120 до 150 единиц/кг, вводимых каждую вторую неделю, от 130 до 160 единиц/кг, вводимых каждую вторую неделю, от 140 до 170 единиц/кг, вводимых каждую вторую неделю, или от 150 до 180 единиц/кг, вводимых каждую вторую неделю. Альтернативно, доза может составлять от 90 до 110 единиц/кг, вводимых каждую вторую неделю, от 100 до 120 единиц/кг, вводимых каждую вторую неделю, от 110 до 130 единиц/кг, вводимых каждую вторую неделю, от 120 до 140 единиц/кг, вводимых каждую вторую неделю, от 130 до 150 единиц/кг, вводимых каждую вторую неделю, от 140 до 160 единиц/кг, вводимых каждую вторую неделю, от 150 до 170 единиц/кг, вводимых каждую вторую неделю, или от 160 до 180 единиц/кг, вводимых каждую вторую неделю.
[0098] Доза может составлять около 2,25 мг/кг или 4,5 мг/кг, вводимых каждую вторую неделю. Альтернативно, доза может составлять от 2,25 до 3,75 мг/кг, вводимых каждую вторую неделю, от 2,75 до 4,0 мг/кг, вводимых каждую вторую неделю, от 3,0 до 4,5 мг/кг, вводимых каждую вторую неделю, от 3,0 до 3,75 мг/кг, вводимых каждую вторую неделю, от 2,25 до 3,0 мг/кг, вводимых каждую вторую неделю, от 2,5 до 3,25 мг/кг, вводимых каждую вторую неделю, от 2,75 до 3,5 мг/кг, вводимых каждую вторую неделю, от 3,0 до 3,75 мг/кг, вводимых каждую вторую неделю, от 3,25 до 4,0 мг/кг, вводимых каждую вторую неделю, от 3,5 до 4,25 мг/кг, вводимых каждую вторую неделю, или от 3,75 до 4,5 мг/кг, вводимых каждую вторую неделю. Альтернативно, доза может составлять от 2,25 до 2,75 мг/кг, вводимых каждую вторую неделю, от 2,5 до 3,0 мг/кг, вводимых каждую вторую неделю, от 2,75 до 3,25 мг/кг, вводимых каждую вторую неделю, от 3,0 до 3,5 мг/кг, вводимых каждую вторую неделю, от 3,25 до 3,75 мг/кг, вводимых каждую вторую неделю, от 3,5 до 4,0 мг/кг, вводимых каждую вторую неделю, от 3,75 до 4,25 мг/кг, вводимых каждую вторую неделю, или от 4,0 до 4,5 мг/кг, вводимых каждую вторую неделю.
[0099] Введение композиций ГЦБ/ИФМ и ГЦБ/ИФМТ может быть предпринято для лечения расстройства, связанного с дисфункцией пути ГЦазы, такого как лизосомные болезни накопления. Типичные лизосомные болезни накопления включают болезнь Гоше, болезнь Фабри, болезнь Помпе, мукополисахаридоз и множественную системную атрофию. Композиции, описанные в данном документе, являются особенно подходящими для лечения болезни Гоше. Расстройство может представлять собой нейродегенеративное расстройство, например, болезнь Паркинсона, болезнь Альцгеймера или деменцию с тельцами Леви. Альтернативно, расстройство может включать дисрегуляцию альфа-синуклеина.
[00100] При лечении расстройства, композиции ГЦБ/ИФМ и ГЦБ/ИФМТ могут быть введены внутривенно или подкожно. Подкожное введение включает подкожную инъекцию, которая особенно подходит для реализации изобретения. Различные режимы дозирования могут быть использованы для введения композиций. Например, композицию можно вводить один раз в неделю, один раз в две недели или раз в месяц. Композицию можно вводить, например, один раз в три дня, каждый четыре дня, каждые пять дней, каждые шесть дней, каждые восемь дней, каждые девять дней, каждые 10 дней, каждые 11 дней, каждые 12 дней, каждые 13 дней, каждые 15 дней, или каждые 16 дней. Частота введения может быть изменена на протяжении всего курса лечения из-за различных факторов. Как правило, композиции, описанные в данном документе, вводят подкожно инъекцией либо один или два раза в неделю, либо один раз каждую вторую неделю.
[00101] Если композиции, описанные в данном документе, предназначены для подкожного введения, следует позаботиться, чтобы минимизировать дискомфорт пациента во время введения. Поэтому, как правило, общий объем вводимый пациенту на инъекцию не превышает 5 мл. Более типично, подкожно вводимый объем будет менее 2,5 мл на инъекцию. Если для достижения терапевтически эффективной дозы требуется несколько подкожных инъекций, их можно вводить в разных местах. Альтернативно, интервал лечения может быть уменьшен. Корректировки дозы могут быть сделаны на индивидуальной основе с учетом достижения и поддержания терапевтических целей.
ПРИМЕРЫ
[00102] Настоящее изобретение также описано и продемонстрировано с помощью следующих примеров. Однако использование этих и других примеров в любом месте описания является только иллюстративным и никоим образом не ограничивает объем и значение изобретения или любого приведенного в качестве примера термина. Кроме того, настоящее изобретение не ограничивается какими-либо конкретными предпочтительными вариантами реализации, описанными в данном документе. В действительности, многие модификации и вариации изобретения могут быть очевидны для специалистов в данной области техники после прочтения этого описания, и такие вариации могут быть сделаны без отклонения от сути изобретения в сути или в объеме. Следовательно, изобретение должно быть ограничено только условиями прилагаемой формулы изобретения вместе с полным объемом эквивалентов, на которые имеют право эти пункты формулы изобретения.
Пример 1: Концентрация ГЦБ
[00103] ГЦБ (5 мл 10 мг/мл) размораживали после хранения при -80°C. Затем ГЦБ концентрировали центробежной фильтрацией при 3800 об/мин, 4°C в течение 30 минут. Затем ГЦБ разбавляли в 50 раз и концентрацию измеряли при А280. Получали концентрацию ГЦБ 100 мг/мл. Затем добавляли 1% полисорбата 20 до конечной концентрации 0,1%. К некоторому раствору добавляли 20 мг изофагомина с отрегулированным рН.
[00104] Проводили фильтрование через мембрану с размером пор 0,22 мкм. Конкретный процесс показан на ФИГ. 1.
Пример 2: Добавление ИФМ, без отрегулированного рН, дестабилизирующего ГЦБ
[00105] Использовали ДСН-ЭПАГ для анализа различных образцов ГЦБ, как показано ниже. Образцы денатурировали при 37°C в течение 15 минут. Проводили ДСН-ЭПАГ на 8-16%-ном геле, предварительно обработанном триксглицином Novex™. В качестве восстановителя использовали 50 ммоль дитиотретиола. В некоторые образцы добавляли изофагомин, рН которого не регулировали. Результаты, полученные в первый день, показаны на ФИГ. 2А:
Полоска 1: Маркеры молекулярной массы
Полоска 2: 0,5% контроль анализа (60 нг ГЦБ)
Полоска 3: 1% контроль анализа (120 нг ГЦБ)
Полоска 4: 12 мкг эталонной ГЦБ, восстановленная
Полоска 5: 12 мкг ГЦБ (4°C) День 1, не восстановленная
Полоска 6: 12 мкг ГЦБ (4°C) День 1, восстановленная
Полоска 7: 12 мкг ГЦБ (4°C) День 1 с 12 мкг изофагомина, не восстановленная
Полоска 8: 12 мкг ГЦБ (4°C) День 1 с 12 мкг изофагомина, восстановленная
Полоска 9: 12 мкг ГЦБ (-80°C) День 1, не восстановленная
Полоска 10: 12 мкг ГЦБ (-80°C) День 1, восстановленная
Полоска 11: 12 мкг ГЦБ (-80°C) День 1 с 12 мкг изофагомина, не восстановленная
Полоска 12: 12 мкг ГЦБ (-80°C) День 1 с 12 мкг изофагомина, восстановленная
[00106] Результаты через две недели показаны на ФИГ. 2В:
Полоска 1: Маркеры молекулярной массы
Полоска 2: 0,5% контроль анализа (60 нг ГЦБ)
Полоска 3: 1% контроль анализа (120 нг ГЦБ)
Полоска 4: 12 мкг эталонной ГЦБ, восстановленная
Полоска 5: 12 мкг ГЦБ (4°C) Неделя 2, не восстановленная
Полоска 6: 12 мкг ГЦБ (4°C) Неделя 2, восстановленная
Полоска 7: 12 мкг ГЦБ (4°C) Неделя 2 с 12 мкг изофагомина, не восстановленная
Полоска 8: 12 мкг ГЦБ (4°C) Неделя 2 с 12 мкг изофагомина, восстановленная
Полоска 9: 12 мкг ГЦБ (-80°C) Неделя 2, не восстановленная
Полоска 10: 12 мкг ГЦБ (-80°C) Неделя 2, восстановленная
Полоска 11: 12 мкг ГЦБ (-80°C) Неделя 2 с 12 мкг изофагомина, не восстановленная
Полоска 12: 12 мкг ГЦБ (-80°C) Неделя 2 с 12 мкг изофагомина, восстановленная
[00107] Сама процедура концентрирования может вызывать связанную с цистеином олигомеризацию ГЦБ, как показано слабыми полосами от 150 кДа до 200 кДа на полосках 4-12, которые могут включать около 0,5% от общего белка. При добавлении изофагомина к ГЦБ при 4°C было заметно больше фрагментов ГЦБ, чем при добавлении изофагомина к ГЦБ при -80°C, как показано несколькими слабыми полосами при размерах менее 50 кДа на полосках 7 и 8 на ФИГ. 2А Появление слабых полос может быть связано с дестабилизацией ГЦБ кислотным изофагомином.
[00108] Добавление изофагомина давало фрагменты ГЦБ при 4°C, но не при -80°C. См. дорожки 5-8 на ФИГ. 2А и 2В.
Пример 3: Регулировка рН ИФМТ и последующая лиофилизация
[00109] Когда ИФМТ растворяется в воде, образуется кислый раствор. В частности, когда 103 мг тартрата изофагомина растворяют в 5 мл воды, рН раствора составляет 3,25. рН доводили до 6,0 путем добавления 15 мкл 10 М гидроксида натрия к раствору.
[00110] Аликвоты по 500 мкл раствора ИФМТ с отрегулированным рН добавляли в 2 мл пробирки Эппендорфа. Пробирки Эппендорфа, содержащие растворы, замораживали на сухом льду в течение часа, покрывали парафильмом, который протыкали иглой и лиофилизировали в течение ночи. Пробирки Эппендорфа с лиофилизатами показаны на ФИГ. 3.
Пример 4: Добавление ГЦБ к ИФМ с отрегулированным рН
[00111] Перед добавлением ГЦБ к ИФМТ с отрегулированным до рН 6,0, рН раствора ГЦБ также доводят до 6,0 с помощью цитрата натрия. В частности, 100 мг/мл ГЦБ в 50 ммоль цитрат натрия дает раствор с рН 6,0. Когда 100 ммоль/мл ИФМТ (при рН 6,0) добавляли к 100 мг/мл ГЦБ в 50 ммоль цитрата натрия, рН составлял 6,0.
Пример 5: Добавление ИФМ с отрегулированным рН, не дестабилизирующего ГЦБ
[00112] ДСН-ЭПАГ использовали для анализа множества образцов ГЦБ, полученных в тот же день (День 0) и после трех дней хранения (День 3), как показано ниже, которые содержат ГЦБ, добавленную к изофагомину с отрегулированным рН. Образцы денатурировали при 37°C в течение 15 минут. Проводили ДСН-ЭПАГ на 8-16%-ном геле, предварительно обработанном триксглицином Novex™. В качестве восстановителя использовали 50 ммоль дитиотретиол. В некоторые образцы добавляли изофагомин, рН которого не регулировали.
Полоска 1: Маркеры молекулярной массы
Полоска 2: 0,5% контроль анализа (60 нг ГЦБ)
Полоска 3: 1% контроль анализа (120 нг БМК)
Полоска 4: 12 мкг эталонной ГЦБ, не восстановленная
Полоска 5: 12 мкг ГЦБ из концентрации 100 мг/мл, не восстановленная
Полоска 6: 12 мкг ГЦБ из концентраци 100 мг/мл, восстановленная
Полоска 7: 12 мкг ГЦБ из концентрации 100 мг/мл с 12 мкг изофагомина с отрегулированным рН, не восстановленная
Полоска 8: 12 мкг ГЦБ из концентрации 100 мг/мл с 12 мкг изофагомина с отрегулированным рН, восстановленная
[00113] ЭХР ВЭЖХ проводили на образцах 3-го дня для подтверждения стабильности. Параметры включали Gibco ФСБД с добавлением 400 ммоль хлорида натрия в качестве подвижной фазы, скорость потока 0,8 мл/мин, Sepax Zenix-C SEC-150. 3 мкм, 150 А, 7,8×300 ммоль в качестве колонки ЭХР и температура колонки 25°C.
[00114] Результаты показаны на ФИГ. 4А для Дня 0 и на ФИГ. 4В для Дня 3. Полоса ГЦБ видна на полосках 4-8. Никаких более мелких полос, имеющих размеры менее 50 кДа, не наблюдалось ни в День 0, ни в День 3. Регулировка рН изофагомина до 6,0, которая аналогична таковой для ГЦБ, может минимизировать дестабилизацию ГЦБ.
Пример 6: Анализ влияния ИФМТ, с отрегулированным рН, на стабильность ГЦБ
[00115] ГЦБ концентрировали до 100 мг/мл. рН 100 мг/мл тартрата изофагомина (ИФМТ) доводили до 6,0. ИФМТ затем смешивали с ГЦБ. Когда регулировка рН ИФМТ не проводилась, ГЦБ/ИФМТ не был стабильным, и с помощью ДСН-ЭПАГ наблюдали отсечение белка.
[00116] Когда была проведена регулировка рН, ГЦБ в растворе была стабильной в течение по меньшей мере трех дней, как измерено с помощью ЭХР. Подвижная фаза представляла собой Gibco ФСБД с добавлением 400 ммоль хлорида натрия, скорость потока составляла 0,8 мл/мин, колонка ЭХР представляла собой Sepax Zenic-C SEC-150, 3 мкм, 150 А, 7,8×300 ммоль. Температура колонки составляла 25°C. Четыре образца анализировали с помощью ЭХР, как показано на ФИГ. 5. ГЦБ в буфере DS, эталонная ГЦБ с чистотой 98,8% и ГЦБ с чистотой 98,7% использовались в качестве стандартов. ГЦБ с нейтрализованным изофагомином (рН доводили до 6,0), которая хранилась в течение трех дней, также анализировали с ЭХР и казалась стабильной.
Пример 7: Анализ эксклюзионной хроматографией по размеру влияния ИФМ с отрегулированным рН на стабильность ГЦБ.
[00117] Анализ разделения ЭХР проводили по меньшей мере на следующих образцах, перечисленных в Таблице 1 ниже:

[00118] Для ЭХР использовали следующие параметры: в качестве подвижной фазы использовали Gibco ФСБД с добавлением 400 ммоль хлорида натрия. Скорость потока составляла 0,8 мл/мин. Колонка ЭХР представляла собой Sepax Zenix-C SEC-150. 3 мкм, 150 А, 7,8×300 ммоль. Температура колонки составляла 25°C.
[00119] Результаты показаны на Фиг.6А и 6В. Пептидные фрагменты, наблюдаемые с помощью ДСН-ЭПАГ, появляются в пике, элюирующемся через от около 10 минут и 30 секунд до 10 минут и 45 секунд. Образец при -80°C с изофагомином и ГЦБ имеет меньший пик, связанный с пептидными фрагментами, чем образец при 4°C или даже образец ГЦБ при -80°C.
Пример 8: Влияние концентрации ГЦБ и ИФМ на вязкость
[00120] Получали различные композиции (а) ГЦБ и (б) ГЦБ смешанная с изофагомином (ГЦБ/ИФМ). Композиции ГЦБ включали 10 мг/мл ГЦБ, 25 мг/мл ГЦБ, 50 мг/мл ГЦБ, 75 мг/мл ГЦБ, и 100 мг/мл ГЦБ. Композиции ГЦБ/ИФМ включали 10 мг/мл ГЦБ с 5 мг/мл ИФМ тартрата, 25 мг/мл ГЦБ с 12,5 мг/мл ИФМ тартрата, 50 мг/мл ГЦБ с 25 мг/мл ИФМ тартрата, 75 мг/мл ГЦБ с 37,5 мг/мл ИФМ тартрата и 100 мг/мл ГЦБ с 50 мг/мл ИФМ тартрата. Вязкость и скорость сдвига каждой композиции измеряли в вискозиметре (m-VROC от RheoSense, Сан-Рамон, Калифорния, США). Для каждого измерения требуется около 200 мкл образцов. Представлены результаты вязкости с наклоном кривой R квадрат >0,98. Результаты показаны в следующих таблицах:


[00121] Вязкость коррелирует с концентрацией ГЦБ. Композиция с 100 мг/мл ГЦБ и 50 мг/мл ИФМ тартрата имеет вязкость около 5 сП, которая поддается подкожной инъекции.
Пример 9: Связывание ИФМ с ГЦБ при рН 7,4 и рН 5,0, измеренное с помощью Biacore
[00122] Эксперименты проводили для характеристики аффинности и кинетики связывания ГЦБ и изофагомина при рН 7,4 и 5,0 с помощью поверхностного плазмонного резонанса (ППР). Эти значения рН могут иллюстрировать, как ГЦБ и изофагомин связываются друг с другом в различных средах, таких как компартменты плазмы, цитоплазмы и лизосом, которые имеют различные значения рН.
[00123] Все эксперименты ППР проводились на Biacore S-200 способом кинетики одного цикла. Для экспериментов при рН 7,4, 2 мг/мл ГЦБ разводили в ацетатном GE буфере рН 5,0 до конечной концентрации 100 мкг/мл. Рабочий буфер для иммобилизации представлял собой 10 ммоль HEPES, 5 ммоль EDTA, 0,01% Р-20, рН 7,4. Этот буфер впоследствии использовали непосредственно в анализе связывания.
[00124] Для экспериментов при рН 5,0 2 мг/мл ГЦБ разбавляли в ацетатном GE буфере рН 5,0 до конечной концентрации 100 мкг/мл. Рабочий буфер для иммобилизации представлял собой 20 ммоль фосфата натрия, 2,7 ммоль хлорида калия, 137 ммоль хлорида натрия, 5 ммоль тартрата, 0,01% Р-20, рН 5,0. Тартрат добавляли в рабочий буфер, чтобы устранить эффект растворенного вещества, введенный тартратом изофагомина. ГЦБ иммобилизовали на чипе СМ5 с использованием обычной процедуры присоединения имина. Целевой уровень иммобилизации 4000 RU.
[00125] Для экспериментов Biacore при рН 7,4, диапазон концентраций составлял 0,39-100 нмоль. Всего было 9 точек с 2-кратным серийным разведением. Для экспериментов Biacore при рН 5,0, диапазон концентраций составлял 0,39-100 нмоль. Всего было 9 точек с 2-кратным серийным разведением.
[00126] Условия для анализа связывания были следующими: скорость потока 30 мкл/мин, время ассоциации 120 с, время диссоциации 600 с и 3 моль хлорид магния в качестве реагента для регенерации. Концентрации изофагомина в диапазоне от 0,3 до 100 мкмоль пропускали через иммобилизованную альфа-велаглюцеразу в режиме одного цикла без регенерации поверхности.
[00127] Для каждого из исследований рН 5,0 и рН 7,4, были выполнены два повтора. Полученные данные представлены в следующих таблицах и на ФИГ. 7A-7D. Черные линии представляют собой фактические данные и красные линии представляют подбор модели.




[00128] KD связывания ГЦБ/ИФМ при рН 5,0 составляет 198-251 нмоль. KD связывания ГЦБ/ИФМ при рН 7,4 составляет 6,4-9,4 нмоль.
Пример 10: Повышение изофагомином температуры плавления альфа-велаглюцеразы
[00129] Термостабильность велаглюцеразы отдельно или в комбинации с различными соотношениями изофагомина оценивали с использованием нанодифференциальной сканирующей флуориметрии (нано-ДСФ) (ФИГ. 8). Образцы первоначально получали при указанном молярном соотношении изофагомина при концентрации альфа-велаглюцеразы 40 мг/мл. Перед загрузкой в аппарат нано-ДСФ образцы разбавляли до концентраций альфа-велаглюцеразы 2 мг/мл. Условия образца, перечисленные на ФИГ. 8, следующие:
Контроль: D-тартрат изофагомина (ИФМТ) отсутствует
Образец 1: 100х молярное соотношение ИФМТ
Образец 2: 30х молярное соотношение ИФМТ
Образец 3: 10х молярное соотношение ИФМТ
Образец 4: 3х молярное соотношение ИФМТ
Образец 5: ИФМТ отсутствует
Образец 7: 100х молярное соотношение гидрохлорида изофагомина
Образец 8: 100х молярное соотношение ацетата изофагомина
[00130] Связывание изофагомина с альфа-велаглюцеразой также определяли с помощью анализа активности фермента ГЦБ. Ферментативные реакции проводили в течение 1 часа при 37°C. Тартрат изофагомина предварительно инкубировали с альфа-велаглюцеразой в течение около 10 минут.
[00131] Концентрации анализа для тартрата изофагомина являются такими, как показано на графиках на ФИГ. 9А-9С. Конечные концентрации для анализа альфа-велаглюцеразы составляли ~1 нмоль при рН 5,0 и ~10 нмоль при рН 7,4. На ФИГ. 9А показана кривая ингибирования активности с синтетическим колориметрическим субстратом pNP-GPS. На ФИГ. 9В показана кривая ингибирования активности с синтетическим флуорометрическим субстратом 4MU-GPS. На ФИГ. 9С показано ингибирование активности природным гликосфинголипидным субстратом C12-GluCer. Реакцию расщепления С12-GluCer оценивали путем измерения продукции глюкозы с помощью набора для анализа глюкозооксидазы.
Пример 11: Исследование стабильности через три недели
[00132] Четыре различных смеси ГЦБ и D-тартрата изофагомина получали, как показано в Таблице 8 ниже.

[00133] В начальный момент времени и после хранения в течение трех недель при 40°C, удельная активность и чистоты, измеренной каждым из ЭХР, офВЭЖХ и ДСН-ЭПАГ были проанализированы. ЭХР может обнаруживать растворимые высокомолекулярные частицы, тогда как офВЭЖХ предоставляет информацию о химической стабильности ГЦБ, такой как устойчивость к окислению. ДСН-ЭПАГ может обнаружить отсечение и агрегацию белка. Для специфической активности, активности эталонного стандарта составляли 16 мкмоль/мин/мг (день 0) и 18 мкмоль/мин/мг (неделя 3). Значительная ежедневная изменчивость наблюдалась при анализе активности на основе флуоресценции. Все образцы стабильности имели немного более высокую активность, чем эталонный стандарт.
[00134] Также был проведен визуальный осмотр. Изображения образцов показаны на ФИГ. 10А. Данные представлены в таблицах ниже. В результатах ДСН-ЭПАГ, показанных на ФИГ. 10В, следующие полоски соответствуют вышеуказанным образцам:
Полоска 1: Маркеры молекулярной массы
Полоска 2: 12 мкг эталонной ГЦБ, не восстановленная
Полоска 3: 12 мкг ГЦБ Группы 1, не восстановленная
Полоска 4: 12 мкг ГЦБ Группы 2, не восстановленная
Полоска 5: 12 мкг ГЦБ Группы 3, не восстановленная
Полоска 6: 12 мкг ГЦБ Группы 4, не восстановленная




[00135] Молярное соотношение ГЦБ к ИФМ 1:1 было слишком низким для обеспечения стабильности в течение трех недель при 40°C. В анализе ДСН-ЭПАГ были видны агрегаты, и через три недели раствор казался мутным. Однако при молярном соотношении ГЦБ к ИФМ 1:3 и выше через три недели чистота составляла по меньшей мере 98% в ДСН-ЭПАГ и растворы казались прозрачными.
Пример 12: Фармакокинетическое исследование внутривенного введения ГЦБ и подкожного введения ГЦБ с ИФМ у яванских макак
[00136] Две группы яванских макак были протестированы на фармакокинетику ГЦБ. В Группе 1, ГЦБ вводили один раз путем внутривенной инъекции. В Группе 2, композицию ГЦБ с ИФМ вводили один раз путем подкожной инъекции. Три образца из печени и селезенки отбирали через каждые 1 час, 2 часа, 8 часов и 24 часа после введения дозы. Дополнительные детали плана исследования приведены в Таблице 13 ниже:

[00137] Отборы образцов в печени и селезенке проводили через 1, 2, 8 и 24 часа (n=3) после введения дозы.
[00138] Затем был проведен гистологический анализ всех образцов. Фиксированные 10%-ным NBF печень и селезенку обрабатывали для парафиновой блокады. Срезы толщиной 5 микрон получили для ИГХ ГЦБ (первичное антитело TK36-мыши анти-чГЦБ в соотношении 1:10000) и окрашивании гемотоксилином и эозином.
[00139] На ФИГ. 11 показан отрицательный и положительный контроль для ИГХ ГЦБ окрашивания на тканях обезьян в печени и селезенке. Незначительное окрашивание было видно в отсутствии антитела ИГХ ГЦБ (верхние панели). В присутствии антитела ИГХ ГЦБ, слабое окрашивание фона наблюдалось в необработанной печени (нижняя левая панель). Темное окрашивание наблюдалось в обработанной печени и селезенке в присутствии антитела ИГХ ГЦБ (нижняя средняя и нижняя правые панели). В частности, печень показала положительное окрашивание в клетках Купфера, эндотелия и гепатоците для ГЦБ, и селезенка показала положительное окрашивание эндотелия и макрофагов.
[00140] Биораспределение ГЦБ в печени изучали после доставки ГЦБ путем внутривенной инъекции и ГЦБ с ИФМ путем подкожной инъекции. В печени обезьяны, обработанной путем подкожной инъекции, сильная ГЦБ была замечена в момент времени 8 часов. Сильное окрашивание ГЦБ наблюдали в моменты времени один и два часа в печени обезьяны, получавшей внутривенную инъекцию. Результаты показаны на ФИГ. 12 (2-кратное увеличение) и ФИГ. 13 (20-кратное увеличение).
[00141] Аналогичные результаты наблюдались в селезенке, как показано на ФИГ. 14 (2-кратное увеличение) и ФИГ. 15 (20-кратное увеличение). Эти данные свидетельствуют о том, что подкожное введение ГЦБ с ИФМ может обеспечить сравнимое воздействие ГЦБ на ткани, что и внутривенное введения ГЦБ.
Пример 13: Корреляция активности альфа-велаглюцеразы с уровнем белка в печени и селезенке
[00142] Уровни активности белка и фермента альфа-велаглюцеразы оценивали в гомогенатах печени и селезенки после внутривенного введения дозы у яванских макак. Ткани отбирали в заранее определенные моменты времени после введения дозы (0,5-24 часа). Результаты показаны на ФИГ. 16А и 16В. В частности, на ФИГ. 16А показаны результаты внутривенного введения альфа-велаглюцеразы только в диапазоне 2-10 мг/кг. На ФИГ. 16В показаны результаты ПК введения альфа-велаглюцеразы в диапазоне 1,5-10 мг/кг, объединенной с соответствующим количеством изофагомина (0,0075-5 мг/кг), так что молярное соотношение альфа-велаглюцеразы к изофагомину составляет 1:3.
Пример 14: Уровни активности ГЦБ в сыворотке у яванских макак после подкожного введения тартрата изофагомина
[00143] Уровни активности ГЦБ в сыворотке крови анализировали у яванских макак после подкожного (ПК) введения альфа-велаглюцеразы с тартратом изофагомина. Данные показаны на ФИГ. 16С. Эндогенную активность ГЦБ в сыворотке определяли у животных-носителей и животных, получавших предварительную дозу (n=39), обработанных ГЦБ, и в диапазоне 4-14 нг/мл или 0,07-0,25 нмоль 4 МЕ/мин/мл. Тартрат изофагомина может увеличивать активность ГЦБ в сыворотке выше верхнего предела нормы при ПК дозе 2,5 мг/кг. Это увеличение активности сыворотки, вероятно, связано с предотвращением процессов разложения нативной ГЦБ, постоянно происходящих в сыворотке. Доза тартрата изофагомина, включенная в Vela-3хИФМТ (0,0225 мг/кг), не будет увеличивать активность эндогенной ГЦБ в сыворотке, основываясь на данных более высокой дозы 0,025 мг/кг.
Пример 15: ИФМ обеспечивает >25-кратное усиление подкожного воздействия сыворотки альфа-велаглюцеразы
[00144] Альфа-велаглюцераза и ИФМ в молярном соотношении 1:3, вводимые подкожно яванским макакам в дозе 4 мг/кг, были способны обеспечить более чем 25-кратное улучшение воздействия сыворотки по сравнению с дозой внутривенного введения альфа-велаглюцеразы 4 мг/кг. Соотношения ИФМ от 3-кратного до 100-кратного молярного избытка по сравнению с альфа-велаглюцеразой способствовали аналогичному увеличению воздействия сыворотки. Увеличение биодоступности в сыворотке, определенное из анализа ECL ELISA, было подтверждено анализом активности ГЦБ (субстрат 4MU-GPS). Результаты показаны на ФИГ. 17А и 17В. Добавление 0,07 мг/кг ИФМТ к 4 мг/кг ГЦБ существенно увеличивало количество ГЦБ в сыворотке (16А), а также общую ферментативную активность ГЦБ (16 В). Таким образом, данные демонстрируют, что когда ГЦБ объединена с ИФМ, например, ИФМТ, особенно в молярном соотношении по меньшей мере 1:3 (ГЦБ:ИФМ, например, ГЦБ:ИФМТ), она может обеспечивать биодоступность сыворотки, которая позволяет ПК введение.
Пример 16: Превосходное биораспределение в тканях при подкожном введении VPRIV с ИФМ в молярном соотношении 1:100 по сравнению с внутривенным введением только VPRIV
[00145] Альфа-велаглюцераза и ИФМ в молярном соотношении 1:100, вводимые подкожно яванским макакам в дозе 4 мг/кг, были способны обеспечить поглощение тканью альфа-велаглюцеразы, которое превышала дозу внутривенного введения альфа-велаглюцеразы 10 мг/кг. Стандарт лечения ВВ-инфузионной дозировкой VPRIV составляет 1,5 мг/кг. В некоторых вариантах реализации может быть использована целевая подкожная доза около 1,5 мг/кг. Около 250 мг ткани гомогенизировали в 1 мл буфера для лизиса HEPES/Triton Х-100. Содержание альфа-велаглюцеразы в тканях измеряли с помощью анализа ECL ELISA и нормализовали до общего содержания белка, как определено с помощью анализа БХА. Результаты показаны на ФИГ. 18А и 18В. Профиль воздействия ГЦБ, присутствующей в печени (18А) и селезенке (18В) после подкожного введения молярного соотношения ГЦБ: ИФМ 1:100, был выше, чем при внутривенном введении ГЦБ в течение 5 дней (120 часов).
Пример 17: Сравнение биораспределения в тканях при подкожном введения VPRIV с ИФМ в молярном соотношении 1:3 с внутривенным введением только VPRIV
[00146] Альфа-велаглюцераза и ИФМ в молярном соотношении 1:3, вводимые подкожно яваснким макакам при целевой клинической дозе 1,5 мг/кг, были способны обеспечить поглощение тканью альфа-велаглюцеразы, сравнимое с таковым для дозы 2 мг/кг при внутривенном введеним альфа-велаглюцеразы. Стандарт лечения ВВ-инфузионной дозировкой VPRIV составляет 1,5 мг/кг. Около 250 мг ткани гомогенизировали в 1 мл буфера для лизиса HEPES/Triton Х-100. Содержание альфа-велаглюцеразы в тканях измеряли с помощью анализа ECL ELISA и нормализовали до общего содержания белка, как определено с помощью анализа БХА. Результаты показаны на ФИГ. 19А и 19 В. Количество ГЦБ, присутствующей в печени после подкожного введения молярного соотношения ГЦБ:ИФМ 1:3, сравнимо с таковым при внутривенном введении ГЦБ в моменты времени 8 и 24 часа. Точно так же воздействие ГЦБ на ткани в селезенке после подкожного введения молярного соотношения ГЦБ:ИФМ 1:3 сравнимо с таковым при внутривенном введении ГЦБ в моменты времени 8 и 24 часа.
[00147] Точно так же воздействие ГЦБ на ткани в селезенке после подкожного введения молярного соотношения ГЦБ:ИФМ 1:3 сравнимо с таковым при внутривенном введении ГЦБ в моменты времени 8 и 24 часа. Таким образом, добавление ИФМ, например, ИФМТ, к композиции ГЦБ позволяет подкожное введение композиций, содержащих ГЦБ.
Пример 18: Соотношение изофагомина всего лишь 1:1, обеспечивает такое же воздействие на сыворотку, что и более высокое молярное соотношение изофагомина
[00148] Альфа-велаглюцераза и ИФМ в молярном соотношении 1:1, вводимые подкожно яванским макакам в дозе 1,5 мг/кг, способны обеспечить такое же воздействие ГЦБ в сыворотке, как и более высокие соотношения изофагомина. Для молярных соотношений между 1:1 и 1:100 не наблюдалось явных различий в воздействии ГЦБ на сыворотку. Увеличение биодоступности в сыворотке, определенное из анализа ECL ELISA, подтверждено анализом активности ГЦБ (субстрат 4MU-GPS). Результаты показаны на ФИГ. 20А и 20В.
[00149] Испытуемые образцы для введения получали в виде замороженных композиций, в виварии перед введением. Испытуемые образцы размораживали от около 1 до 3-х часов перед введением. Таким образом, данные показывают, что если обязательства по хранению при комнатной температуре можно обойти путем хранения при низких температурах (например, в замороженном виде), то, когда ГЦБ смешана с ИФМ, например, ИФМТ, особенно в молярном соотношении по меньшей мере 1:1 (ГЦБ:ИФМ, например, ГЦБ:ИФМТ), она может обеспечить достаточную биодоступность сыворотки, которая позволяет применять подкожное введение.
Пример 19: Изофагомин защищает VPRIV от термической денатурации при 37°C в сыворотке человека
[00150] Тестировали сыворотку, которая содержала 10 нмоль VPRIV (форма ГЦБ), чтобы определить, может ли ИФМ стабилизировать ГЦБ. ИФМ добавляли к VPRIV таким образом, чтобы ИФМ имел следующие концентрации ИФМ в сыворотке: 1 нмоль, 3 нмоль, 10 нмоль, 30 нмоль, 100 нмоль, 300 нмоль и 1000 нмоль. Использовали отрицательный контроль без добавления ИФМ.
[00151] Активность фермента измеряли путем расщепления субстрата 4-метилумбеллиферон b-D-глюкопиранозида. Активность снизилась со 100% до около 40% в течение 60 минут с отрицательным контролем, 1 нмоль ИФМ и 10 нмоль ИФМ. См. ФИГ. 21. Однако добавление концентраций 30 нмоль (3-кратное молярное соотношение) и выше предотвращало большую часть потери активности. ИФМ может быть эффективным для защиты ГЦБ от тепловой денатурации в сыворотке. ИФМ- и ИФМТ-обеспечиваемая защита ГЦБ от термического разложения может повысить биодоступность ГЦБ, повысить устойчивость ГЦБ в сыворотке и обеспечить более длительную продолжительность процессов поглощения ГЦБ клетками и тканями.
***
[00152] Настоящее изобретение не должно быть ограничено в объеме конкретными вариантами реализации, описанными в данной заявке. Действительно, различные модификации настоящего изобретения, дополнительно к описанным в данной заявке, станут очевидны специалистам в данной области из предшествующего описания и сопроводительных фигур. Предполагают, что такие модификации входят в объем прилагаемой формулы изобретения. Далее следует понимать, что все значения являются приблизительными и предназначены для описания.
[00153] Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в данном документе, включены посредством ссылки во всей их полноте. В случае возникновения противоречий, настоящая заявка, включая определения, имеет преимущественную силу. Кроме того, материалы, способы и примеры приведены только для иллюстрации и не предназначены для ограничения.



















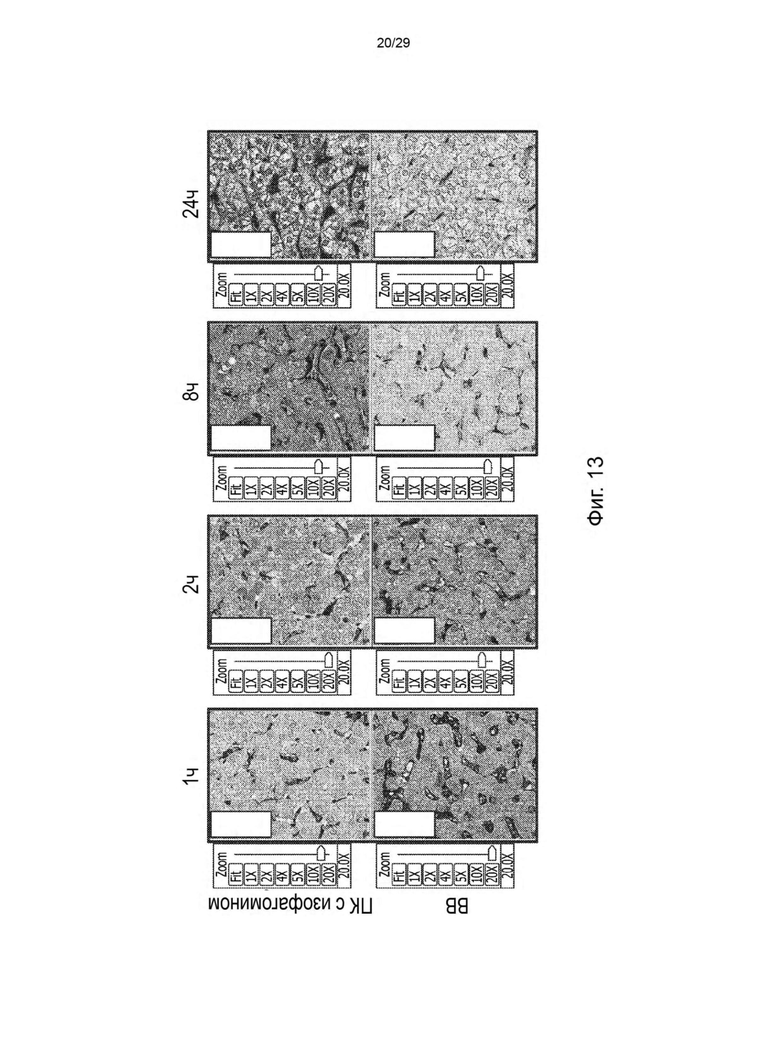









Группа изобретений относится к области медицины, а именно к терапии, и предназначена для лечения дисфункции пути ГЦазы (фермента глюкоцереброзидазы). Композиция для лечения дисфункции пути ГЦазы содержит глюкоцереброзидазу (ГЦБ) и изофагомин (ИФМ) в молярном соотношении по меньшей мере около 1:2,5. Композиция предназначена для подкожного введения. В других воплощениях представлены способ получения указанной композиции, способы лечения дисфункции пути ГЦазы и применение указанной композиции при получении лекарственного средства, а также контейнер, содержащий указанную композицию. Использование группы изобретений позволяет повысить активность и биодоступность, что уменьшает количество подкожных инъекций, которые необходимо вводить субъекту, а также обеспечивает улучшенную стабильность, позволяющую поддерживать высокие концентрации циркулирующей ГЦБ, что приводит к большему поглощению ГЦБ моноцитами, макрофагами и тканевыми гистиоцитами. 7 н. и 66 з.п. ф-лы, 21 ил., 13 табл., 19 пр.
1. Композиция для лечения дисфункции пути ГЦазы, содержащая глюкоцереброзидазу (ГЦБ) и изофагомин (ИФМ) в молярном соотношении по меньшей мере около 1:2,5, где композиция предназначена для введения подкожно.
2. Композиция по п. 1, отличающаяся тем, что ГЦБ представляет собой альфа-велаглюцеразу.
3. Композиция по п. 1 или 2, отличающаяся тем, что рН композиции составляет около 6,0, около 6,5 или около 7,0.
4. Композиция по любому из пп. 1-3, отличающаяся тем, что молярное соотношение ГЦБ к ИФМ составляет от около 1:2,5 до около 1:30.
5. Композиция по любому из пп. 1-3, отличающаяся тем, что молярное соотношение ГЦБ к ИФМ составляет от около 1:2,5 до около 1:10.
6. Композиция по любому из пп. 1-3, отличающаяся тем, что молярное соотношение ГЦБ к ИФМ составляет от около 1:10 до около 1:30.
7. Композиция по любому из пп. 1-3, отличающаяся тем, что молярное соотношение ГЦБ к ИФМ составляет от около 1:2,5 до около 1:3,5.
8. Композиция по любому из пп. 1-3, отличающаяся тем, что молярное соотношение ГЦБ к ИФМ составляет около 1:3,0.
9. Композиция по любому из пп. 1-3, отличающаяся тем, что молярное соотношение ГЦБ к ИФМ составляет 1:3,0.
10. Композиция по любому из пп. 1-9, отличающаяся тем, что температура композиции составляет по меньшей мере 20°C.
11. Композиция по любому из пп. 1-9, отличающаяся тем, что температура композиции составляет от 0°C до 20°C.
12. Композиция по любому из пп. 1-9, отличающаяся тем, что температура композиции составляет менее 0°C.
13. Композиция по любому из пп. 8-12, отличающаяся тем, что композиция представляет собой водный раствор.
14. Композиция по любому из пп. 1-9 и 12, отличающаяся тем, что композиция представляет собой лиофилизат.
15. Композиция по любому из пп. 1-14, дополнительно содержащая фармацевтически приемлемое вспомогательное вещество, фармацевтически приемлемую соль или как фармацевтически приемлемое вспомогательное вещество, так и фармацевтически приемлемую соль.
16. Композиция по любому из пп. 1-15, отличающаяся тем, что ИФМ представляет собой тартрат изофагомина.
17. Композиция по п. 16, отличающаяся тем, что ИФМ представляет собой D-тартрат изофагомина.
18. Композиция по любому из пп. 1-13 и 15-17, отличающаяся тем, что композиция представляет собой жидкость.
19. Композиция по любому из пп. 1-18, дополнительно содержащая антиоксидант.
20. Композиция по любому из пп. 1-19, дополнительно содержащая углевод.
21. Композиция по любому из пп. 1-20, дополнительно содержащая поверхностно-активное вещество.
22. Композиция по любому из пп. 1-21, отличающаяся тем, что композиция содержит 45-120 мг/мл ГЦБ и от 0,2 до 1,8 мг/мл изофагомина.
23. Композиция по п. 22, отличающаяся тем, что композиция содержит 60 мг/мл ГЦБ и 0,9 мг/мл изофагомина.
24. Композиция по п. 22 или 23, отличающаяся тем, что композиция дополнительно содержит 50 ммоль цитрата натрия или фосфата натрия и 0,01% полисорбата-20.
25. Композиция по п. 24, отличающаяся тем, что композиция содержит 5-20 ммоль цитрата натрия и 0,01% полисорбата-20.
26. Композиция по п. 25, отличающаяся тем, что композиция содержит 10 ммоль цитрата натрия и 0,01% полисорбата-20.
27. Композиция по п. 24, отличающаяся тем, что композиция содержит 5-20 ммоль фосфата натрия и 0,01% полисорбата-20.
28. Композиция по п. 27, отличающаяся тем, что композиция содержит 10 ммоль фосфата натрия и 0,01% полисорбата-20.
29. Композиция по любому из пп. 22-28, отличающаяся тем, что рН композиции составляет около 6,0.
30. Композиция по любому из пп. 22-28, отличающаяся тем, что рН композиции составляет 6,0.
31. Контейнер, содержащий композицию по любому из пп. 1-30.
32. Контейнер по п. 31, отличающийся тем, что контейнер выбран из группы, состоящей из предварительно заполненного шприца, флакона или ампулы.
33. Способ получения композиции по любому из пп. 1-30, включающий растворение ИФМ в воде, доведение рН до около 6,0 и добавление ГЦБ с получением композиции.
34. Способ по п. 33, дополнительно включающий лиофилизацию ИФМ перед добавлением ГЦБ.
35. Способ по п. 33 или 34, дополнительно включающий добавление 0,01% полисорбата 20.
36. Способ по любому из пп. 33-35, дополнительно включающий фильтрование композиции через мембрану с размером пор 0,22 мкм.
37. Способ по любому из пп. 33-36, отличающийся тем, что ИФМ присутствует в количестве, достаточном для поддержания стабильности ГЦБ в композиции.
38. Способ по любому из пп. 33-36, отличающийся тем, что ИФМ присутствует в количестве, достаточном для поддержания стабильности ГЦБ в композиции в течение по меньшей мере трех дней при 0-50°C.
39. Способ по любому из пп. 33-36, отличающийся тем, что ИФМ присутствует в количестве, достаточном для поддержания стабильности ГЦБ в композиции в течение по меньшей мере 6 месяцев при 0-40°C.
40. Способ лечения дисфункции пути ГЦазы, включающий введение композиции по любому из пп. 1-11, 13 и 15-30 пациенту, нуждающемуся в этом.
41. Способ по п. 40, отличающийся тем, что способ является эффективным для лечения дисфункции.
42. Способ по п. 40, отличающийся тем, что подкожное введение композиции осуществляют подкожной инъекцией.
43. Способ по любому из пп. 40-42, отличающийся тем, что композицию вводят дважды в неделю.
44. Способ по любому из пп. 40-42, отличающийся тем, что композицию вводят один раз в неделю.
45. Способ по любому из пп. 40-42, отличающийся тем, что композицию вводят менее чем один раз в неделю.
46. Способ по любому из пп. 40-42, отличающийся тем, что композицию вводят один раз в две недели.
47. Способ по любому из пп. 40-46, отличающийся тем, что указанная дисфункция включает дефект в активности ГЦазы.
48. Способ по п. 47, отличающийся тем, что указанный дефект в активности ГЦазы включает сниженную ферментативную активность.
49. Способ по любому из пп. 40-46, отличающийся тем, что указанная дисфункция включает дисрегуляцию альфа-синуклеина.
50. Способ по любому из пп. 40-49, отличающийся тем, что указанная дисфункция представляет собой лизосомную болезнь накопления.
51. Способ по п. 50, отличающийся тем, что указанная лизосомная болезнь накопления выбрана из болезни Гоше, болезни Фабри, болезни Помпе, мукополисахаридоза и множественной системной атрофии.
52. Способ по любому из пп. 40-51, отличающийся тем, что указанная дисфункция представляет собой нейродегенеративное расстройство.
53. Способ по п. 52, отличающийся тем, что нейродегенеративное расстройство выбрано из болезни Паркинсона, болезни Альцгеймера и деменции с тельцами Леви.
54. Способ по любому из пп. 40-53, отличающийся тем, что субъект является человеком.
55. Способ лечения дисфункции пути ГЦазы, включающий введение субъекту композиции, содержащей дозу от 0,5 до 5,0 мг/кг ГЦБ, и ИФМ в по меньшей мере около 3-кратном молярном избытке по отношению к ГЦБ, в котором композицию вводят подкожно.
56. Способ по п. 55, отличающийся тем, что доза содержит от 0,8 до 4,0 мг/кг ГЦБ.
57. Способ по п. 56, отличающийся тем, что доза содержит от 1 до 3,0 мг/кг ГЦБ.
58. Способ по п. 56, отличающийся тем, что доза содержит от 1,2 до 2,0 мг/кг ГЦБ.
59. Способ по п. 56, отличающийся тем, что доза содержит около 1,5 мг/кг ГЦБ.
60. Способ по п. 56, отличающийся тем, что доза содержит 1,5 мг/кг ГЦБ.
61. Способ по п. 55, отличающийся тем, что доза содержит от 2,0 до 5,0 мг/кг ГЦБ.
62. Способ по п. 55, отличающийся тем, что доза содержит от 2,25 до 4,5 мг/кг ГЦБ.
63. Способ по п. 55, отличающийся тем, что доза содержит от 2,25 до 3,75 мг/кг ГЦБ.
64. Способ по п. 55, отличающийся тем, что доза содержит от 3,5 до 5,0 мг/кг ГЦБ.
65. Способ по любому из пп. 56-64, отличающийся тем, что ИФМ находится в от 3 до 10-кратном молярном соотношении к ГЦБ.
66. Способ по любому из пп. 56-64, отличающийся тем, что ИФМ находится в от 10 до 30-кратном молярном соотношении к ГЦБ.
67. Способ по любому из пп. 56-64, отличающийся тем, что ИФМ находится в от 30 до 100-кратном молярном соотношении к ГЦБ.
68. Способ по любому из пп. 56-64, отличающийся тем, что ИФМ находится в 3-кратном молярном соотношении к ГЦБ.
69. Способ по любому из пп. 40-68, отличающийся тем, что воздействие, активность или биодоступность ГЦБ в селезенке увеличивается.
70. Способ по любому из пп. 40-69, отличающийся тем, что воздействие, активность или биодоступность ГЦБ в печени увеличивается.
71. Способ по любому из пп. 40-70, отличающийся тем, что воздействие, активность или биодоступность ГЦБ в сыворотке увеличивается.
72. Композиция по любому из пп. 1-11, 13 и 15-30 для применения в способе по любому из пп. 40-71.
73. Применение композиции по любому из пп. 1-11, 13 и 15-30 при получении лекарственного средства для способа по любому из пп. 40-72.
| US 2011143419 A1, 03.02.2011 | |||
| JIN-SONG SHEN et al | |||
| Isofagomine increases lysosomal delivery of exogenous glucocerebrosidase | |||
| Biochemical and Biophysical Research Communications, 2008, 369, 1071-1075 | |||
| US 2011027254 A1, 03.02.2011 | |||
| WO 2007150064 A2, 27.12.2007. |
Авторы
Даты
2023-02-15—Публикация
2018-10-25—Подача