Перекрестная ссылка на родственные заявки
[0001] Для настоящей заявки испрашивается приоритет в соответствии с предварительной патентной заявкой США № 62/511949, поданной 26 мая 2017 г., озаглавленной «СЕКВЕНИРОВАНИЕ ПОЛИНУКЛЕОТИДНЫХ БИБЛИОТЕК С ВЫСОКОЙ ПРОПУСКНОЙ СПОСОБНОСТЬЮ И АНАЛИЗ ТРАНСКРИПТОМОВ», содержание которой полностью включено в настоящий документ посредством ссылки.
Включение в описание изобретения сведений путем ссылки на список последовательностей
[0002] Настоящая заявка подается вместе со списком последовательностей в электронном формате. Список последовательностей представлен в виде текстового файла 735042011740SeqList.txt, созданного 25 мая 2018 года, размер которого составляет 444416 байт. Информация Списка последовательностей в электронном формате включена в настоящий документ посредством ссылки во всей ее полноте.
Область техники, к которой относится изобретение
[0003] Настоящее раскрытие относится к способам секвенирования генов-мишеней и штрих-кодирования отдельных клеток в сочетании с анализом экспрессии генов в отдельных клетках. В некоторых вариантах осуществления ген-мишень представляет собой иммунную молекулу, такую как антитело или TCR. В некоторых вариантах осуществления способы могут быть использованы для осуществления секвенирования транскриптома, например, при РНК-секвенировании, для репрезентации транскриптома отдельных клеток в совокупности с полноразмерными последовательностями иммунного рецептора таким образом, что возможно получение информации об иммунном репертуаре и транскриптоме клетки. Настоящее изобретение также относится к полинуклеотидным библиотекам, которые могут применяться для проведения анализа транскриптома и молекулы системы иммунитета, например, антитела или TCR, и для секвенирования.
Уровень техники
[0004] Определение транскриптомного содержимого клетки или ткани (то есть «профилирование экспрессии гена») обеспечивает способ функционального анализа нормальных и пораженных клеток или тканей и включает предоставление информации, характеризующей «состояние» клетки или ткани или идентифицирующей характеристики субпопуляций клеток. Существующие методы секвенирования транскриптомов отдельных клеток ограничены по своей пропускной способности и/или неспособны захватывать полноразмерные последовательности иммунных рецепторов. Таким образом, необходимы улучшенные методы. Предоставлены способы и композиции, которые удовлетворяют таким потребностям.
Сущность изобретения
[0005] Предлагаются способы получения полинуклеотидной библиотеки из отдельных клеток или множества клеток, которые не только обеспечивают получение одной или нескольких полноразмерных штрих-кодированных последовательностей-мишеней или их отдельных фрагментов, но и совместно генерируют множество штрих-кодированных полинуклеотидных последовательностей, совокупность которых, в значительной степени, представляет собой транскриптом или геном клетки или множества клеток. Штрих-кодирование позволяет анализировать и количественно характеризовать экспрессию или определять присутствие полинуклеотидов, происходящих из той же самой клетки. Также представлены полинуклеотидные библиотеки, полученные способами по настоящему изобретению. Также предоставлены способы анализа транскриптома отдельной клетки или множества клеток и сочетание анализа транскриптома с анализом последовательности(ей)-мишени(ей).
[0006] В некоторых вариантах осуществления способы включают получение полинуклеотидной библиотеки, которая включает добавление второго адаптера к каждому из множества штрих-кодированных одноцепочечных полинуклеотидов к концу или около конца, противоположного первому адаптеру, присоединенному к каждому из одноцепочечных штрих-кодированных полинуклеотидов, при этом множество одноцепочечных штрих-кодированных полинуклеотидов включает: (i) один или несколько одноцепочечных полинуклеотидов-мишеней, включая ампликон одного или нескольких полинуклеотидов-мишеней или комплементарные таковым, присутствующие в отдельной клетке, принадлежащей популяции клеток; и (ii) коллекцию одноцепочечных полинуклеотидов, каждый из которых содержит ампликон полинуклеотида или комплементарного таковому, в клетке; и где каждый из множества штрих-кодированных одноцепочечных полинуклеотидов включает в себя штрих-код носителя, являющийся одинаковым для всех полинуклеотидов (i) и (ii, происходящих из той же самой клетки, принадлежащей популяции клеток.
[0007] В некоторых вариантах осуществления множество одноцепочных полинуклеотидов со штрих-кодом включает полинуклеотиды (i) и (ii) из множества клеток из популяции клеток. В некоторых вариантах осуществления множество одноцепочечных полинуклеотидов со штрих-кодом дополнительно содержит молекулярный штрих-код, который является уникальным для каждого одноцепочечного полинуклеотида или его амплифицированного продукта.
[0008] В некоторых вариантах осуществления коллекция одноцепочечных полинуклеотидов из каждой клетки популяции клеток в совокупности содержит комплементарные цепи ДНК (кДНК) транскриптома или частичного транскриптома. В некоторых вариантах осуществления транскриптом или частичный транскриптом в совокупности содержат по меньшей мере 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% транскриптов, присутствующих в геноме клетки.
[0009] В некоторых вариантах осуществления способа каждый из одноцепочечных полинуклеотидов со штрих-кодом имеет размер, который более чем или более чем приблизительно 50 пар оснований, более чем 100 пар оснований, или более чем 200 пар оснований. В некоторых вариантах осуществления каждый из штрих-кодированных одноцепочечных полинуклеотидов имеет размер от или приблизительно от 50 пар оснований (н.п.) дo 1500 н.п., от 50 н.п. до 1250 н.п., от 50 н.п. до 1000 н.п., от 50 н.п. до 750 н.п., от 50 н.п. до 500 н.п., от 100 н.п. до 1500 н.п., от 100 н.п. до 1250 н.п., от 100 н.п. до 1000 н.п., от 100 н.п. до 750 н.п. от 100 н.п. до 500 н.п., от 200 н.п. до 1500 н.п.., от 200 н.п. до 1250 н.п., от 200 н.п. до 1000 н.п., от 200 н.п. до 750 н.п., или от 250 н.п. до 500 н.п.
[0010] В некоторых вариантах осуществления способа второй адаптер добавляют в гомогенную смесь, содержащую множество одноцепочечных штрих-кодированных полинуклеотидов.
[0011] В некоторых вариантах осуществления первый адаптер содержит штрих-код носителя.
[0012] В некоторых вариантах осуществления способов получения полинуклеотидной библиотеки способ включает в себя: (а) лизирование клеток в каждом из множества носителей, где каждый из указанных носителей содержит клетку из образца, содержащего популяцию клеток; (b) продуцирование в каждом носителе множества комплементарных полинуклеотидов, причем указанное продуцирование указанного множества комплементарных полинуклеотидов включает в себя (i) продуцирование одного или нескольких полинуклеотидов-мишеней, комплементарных одному или нескольким полинуклеотидам-мишеням, присутствующим в клетке, при использовании одного или нескольких специфичных для мишени праймеров; и (ii) получение коллекции полинуклеотидов, каждый из которых является комплементарным полинуклеотиду, присутствующему в клетке. В некоторых вариантах осуществления коллекция полинуклеотидов (ii) производится с использованием случайных, и/или вырожденных, и/или неспецифических олигопраймеров. В некоторых вариантах осуществления коллекция полинуклеотидов (ii) производится с использованием олиго-dT праймеров.
[0013] В некоторых вариантах осуществления каждый из указанных носителей дополнительно содержит множество олигонуклеотидов с молекулярным штрих-кодом, пул олигонуклеотидов со штрих-кодом носителя и, необязательно, первый адаптер, причем способ дополнительно включает в себя: (c) присоединение к множеству, необязательно к каждому из множества комплементарных полинуклеотидов, одного из множества олигонуклеотидов с молекулярным штрих-кодом, в результате чего образуется множество штрих-кодированных полинуклеотидов, таких как полинуклеотиды с молекулярным штрих-кодом, каждый из которых содержит молекулярный штрих-код, где, необязательно, конкретный молекулярный штрих-код отличается от молекулярных штрих-кодов, содержащихся в других штрих-кодированных полинуклеотидах внутри данного множества и/или является уникальным молекулярным штрих-кодом; (d) присоединение единичного или одного из пула олигонуклеотидов со штрих-кодом носителя или их амплифицированных продуктов к множеству, необязательно к каждому из штрих-кодированных полинуклеотидов, с образованием, таким образом, множества полинуклеотидов с двойным штрих-кодом, где каждый из полинуклеотидов с двойным штрих-кодом, принадлежащих одному носителю, содержат тот же самый штрих-код носителя. В некоторых вариантах осуществления стадия (d) включает присоединение единичного или одного из пула олигонуклеотидов со штрих-кодом носителя или амплифицированного продукта таковых, и первого адаптера или одного из пула первых адаптеров или амплифицированного продукта таковых, к множеству, необязательно к каждому, из полинуклеотидов с молекулярным штрих-кодом, тем самым генерируя множество полинуклеотидов с двойным штрих-кодом, необязательно одноцепочечных полинуклеотидов с двойным штрих-кодом, каждый из которых содержит молекулярный штрих-код и штрих-код носителя, причем каждый из полинуклеотидов с двойным штрих-кодом, принадлежащий тому же носителю, содержит тот же самый штрих-код.
[0014] В некоторых вариантах осуществления способы дополнительно включают в себя (e) получение одноцепочечного ампликона для множества полинуклеотидов с двойным штрих-кодом, необязательно для каждого из множества и/или (f) добавления второго адаптера к каждому из одноцепочечных ампликонов, что означает добавление адаптера к одноцепочечному полинуклеотиду с двойным штрих-кодом, причем первый адаптер и второй адаптер присутствуют на или около противоположных концов каждого из одноцепочечных полинуклеотидов с двойным штрих-кодом.
[0015] В некоторых вариантах осуществления способы получения библиотеки полинуклеотидов включают в себя следующие стадии: (а) лизирование клеток в каждом из множества носителей, где каждый из указанных носителей содержит клетку из образца, содержащего популяцию клеток, множество олигонуклеотидов с молекулярным штрих-кодом и единичный олигонуклеотид или пул олигонуклеотидов со штрих-кодом носителя и, необязательно, первый адаптер или пул первых адаптеров; (b) продуцирование в каждом носителе множества комплементарных полинуклеотидов, причем указанное продуцирование указанного множества включает, в том числе (i) продуцирование одного или нескольких полинуклеотидов-мишеней, комплементарных одному или нескольким полинуклеотидам-мишеням, присутствующим в клетке; и (ii) получение коллекции полинуклеотидов, каждый из которых индивидуально комплементарен полинуклеотиду в клетке; (c) присоединение к каждому комплементарному полинуклеотиду одного из множества олигонуклеотидов с молекулярной штрих-кодом, в результате чего образуется множество полинуклеотидов со штрих-кодом, каждый из которых содержит уникальный молекулярный штрих-код; (d) присоединение единичного или одного из пула олигонуклеотидов со штрих-кодом носителя или его амплифицированного продукта и первого адаптера или одного из пула первых адаптеров или амплифицированного продукта таковых к каждому из полинуклеотидов со штрих-кодом, в результате чего образуется множество полинуклеотидов с двойным штрих-кодом, необязательно одноцепочечных полинуклеотидов с двойным штрих-кодом, причем каждый из полинуклеотидов с двойным штрих-кодом содержит молекулярный штрих-код и штрих-код носителя, и каждый из полинуклеотидов с двойным штрих-кодом, принадлежащий к тому же самому носителю, содержит тот же самый штрих-код носителя; (е) получение одноцепочечного ампликона для каждого из множества полинуклеотидов с двойным штрих-кодом; и (f) добавление второго адаптера к каждому из одноцепочечных ампликонов, что означает добавление второго адаптера к одноцепочечному полинуклеотиду с двойным штрих-кодом, причем первый адаптер и второй адаптер расположены на противоположных концах (или около них) каждого из одноцепочечных полинуклеотидов с двойным штрих-кодом.
[0016] В некоторых вариантах осуществления адаптер, такой как первый адаптер, содержит олигонуклеотид со штрих-кодом носителя. В некоторых вариантах осуществления олигонуклеотид со штрих-кодом носителя содержит первый адаптер. В некоторых вариантах осуществления коллекция полинуклеотидов из каждой клетки популяции клеток в совокупности содержит последовательности, комплементарные транскриптам транскриптома или частичного транскриптома клетки. В некоторых вариантах осуществления транскриптом или частичный транскриптом содержит по меньшей мере 60%, 70%, 75%, 80%, 85%, 90% 95%, 96%, 97%, 98%, 99% или 100% транскриптов, присутствующих в геноме клетки.
[0017] В некоторых вариантах осуществления один или более полинуклеотид(ов)-мишень(ей) и/или полинуклеотид в клетке представляет собой ДНК. В некоторых вариантах осуществления один или более полинуклеотид(ов)-мишень(ей) из (i) и/или полинуклеотид из (ii), на основе которого(ых) получают ампликон в (i) и/или ампликон в (ii), представляет(ют) собой ДНК. В некоторых вариантах осуществления один или более полинуклеотид(ов)-мишень(ей) и/или полинуклеотид, находящийся в клетке, представляет собой РНК, такую как мРНК. В некоторых вариантах осуществления один или более полинуклеотид(ов)-мишень(ей) из (i) и/или полинуклеотид из (ii), на основе которого(ых) получают ампликон в (i) и/или ампликон в (ii), представляет(ют) собой РНК, такую как мРНК.
[0018] В некоторых вариантах осуществления каждый из или один или более комплементарных полинуклеотидов (b) представляет собой кДНК. В некоторых вариантах осуществления каждый из, или один или более штрих-кодированных одноцепочечных полинуклеотидов представляют собой цепь кДНК.
[0019] В некоторых вариантах осуществления способов первый адаптер и/или второй адаптер содержат по меньшей мере один универсальный сайт праймирования (также: праймер-сайт). В некоторых вариантах осуществления первый адаптер и второй адаптер отличаются; и/или первый адаптер содержит первый универсальный сайт праймирования, а второй адаптер содержит второй универсальный сайт праймирования, и где, необязательно, первый универсальный сайт праймирования и второй универсальный сайт праймирования различны. В некоторых вариантах осуществления первый универсальный сайт праймирования и/или второй универсальный сайт праймирования представляет собой или содержит сайт праймирования P7(C7) или его непрерывную часть, или сайт праймирования P5 или его непрерывную часть, и где, необязательно, непрерывная часть является достаточным для отжига комплементарной последовательности. В некоторых вариантах осуществления первый универсальный сайт праймирования представляет собой или содержит сайт праймирования P7 (C7) или его непрерывную часть, а второй универсальный сайт праймирования представляет собой или содержит сайт праймирования P5 (C5) или его непрерывную часть. В некоторых вариантах осуществления сайт праймирования P7 (C7) содержит последовательность AGATCGGAAGAGCACACGTCTGAACTCCA (SEQ ID NO: 77) или представляет собой ее непрерывную часть. В некоторых вариантах осуществления сайт праймирования P5 содержит последовательность AGATCGGAAGAGCGTCGTGTAGGGAAAGAGTGTAGATCTCGGTGGTCGCC GTATCATT (SEQ ID NO: 78) или представляет собой ее непрерывную часть. В некоторых вариантах осуществления непрерывная часть содержит по меньшей мере или по меньшей мере примерно 15, 20, 25 или 30 нуклеотидов в длину. В некоторых вариантах осуществления сайт праймирования P5 представляет собой непрерывный фрагмент, указанный в SEQ ID NO: 25 (AGATCGGAAGAGCGTCGTGT).
[0020] В некоторых вариантах осуществления добавление второго адаптера включает гибридизацию шарнирного (splint) олигонуклеотида с каждым из штрих-кодированных одноцепочечных полинуклеотидов в присутствии олигонуклеотида, включающего второй универсальный сайт праймирования, где шарнирный (splint) олигонуклеотид содержит (i) последовательность, комплементарную второму универсальному сайту праймирования и (ii) вырожденную последовательность выступа, способную случайным образом отжигать 3'-конец одноцепочечного полинуклеотида со штрих-кодом. В некоторых случаях перед гибридизацией шарнирный (splint) олигонуклеотид и олигонуклеотид, содержащий второй универсальный сайт праймирования, отжигают с образованием дуплекса адаптера с шарнирным (splint) полинуклеотидом. В некоторых аспектах вырожденная последовательность выступа содержит последовательность (N) 3-12, где N представляет собой любой нуклеотид.
[0021] В некоторых из любых таких вариантов осуществления вырожденная последовательность выступа содержит последовательность NNNNNN, где N представляет собой любой нуклеотид (SEQ ID NO: 24). В некоторых вариантах осуществления шарнирный (splint) олигонуклеотид содержит последовательность ACACGACGCTCTTCCGATCTNNNNNN, где N представляет собой любую аминокислоту (SEQ ID NO: 26). В некоторых из любых таких вариантов осуществления олигонуклеотид, содержащий второй универсальный сайт праймирования, содержит последовательность AGATCGGAAGAGCGTCGTGT (SEQ ID NO: 25).
[0022] В некоторых из любых таких вариантов осуществления олигонуклеотид со штрих-кодом носителя содержит по меньшей мере или по меньшей мере приблизительно 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40 или 50 нуклеотидов. В некоторых из любых таких вариантов осуществления олигонуклеотид со штрих-кодом носителя содержит от или приблизительно от 10 до 30 нуклеотидов. В некоторых из любых таких вариантов осуществления олигонуклеотид, содержащий штрихкод носителя, содержит вырожденную последовательность. В некоторых из любых таких вариантов осуществления олигонуклеотид, содержащий штрих-код носителя, содержит последовательность (N)14-17, где N представляет собой любой нуклеотид, и где, необязательно, по меньшей мере один или два N в последовательности представляют собой W, где W представляет собой аденин или тимин. В некоторых из любых таких вариантов осуществления изобретения, олигонуклеотид со штрих-кодом носителя содержит последовательность NNNNWNNNNWNNNN (SEQ ID NO: 80), WNNNNWNNNNWNNNN (SEQ ID NO: 81), NWNNNWNNNNWNNNN (SEQ ID NO: 82) или NNWNNNNWNNNNWNNNN (SEQ ID NO: 83), где N представляет собой любой нуклеотид и W представляет собой аденин или тимин.
[0023] В некоторых из любых таких вариантов осуществления каждый носитель содержит пул первых адаптеров, где каждый олигонуклеотид со штрих-кодом носителя из пула первых адаптеров содержит по меньшей мере одно смещенное (сдвиг) основание или добавочное основание по сравнению по меньшей мере с одним другим олигонуклеотидом со штрих-кодом носителя в пуле. В некоторых из любых таких вариантов осуществления изобретения, олигонуклеотиды со штрих-кодом носителя из пула первых адаптеров содержат последовательности NNNNWNNNNWNNNN (SEQ ID NO: 80), WNNNNWNNNNWNNNN (SEQ ID NO: 81), NWNNNWNNNNWNNNN (SEQ ID NO: 82) и NNWNNNNWNNNNWNNNN (SEQ ID NO: 83), где N представляет собой любой нуклеотид, а W представляет собой аденин или тимин.
[0024] В некоторых из любых таких вариантов осуществления на стадии (d) способ дополнительно включает амплификацию единичного олигонуклеотида или пула олигонуклеотидов со штрих-кодом носителя или единичного адаптера или пула первых адаптеров, где первые адаптеры представлены единственным олигонуклеотидом или пулом олигонуклеотидов со штрих-кодом носителя, причем амплификацию проводят до или одновременно с присоединением олигонуклеотида со штрих-кодом носителя к полинуклеотиду с молекулярным штрих-кодом. В некоторых вариантах осуществления присоединение олигонуклеотида со штрих-кодом носителя включает гибридизацию области олигонуклеотида со штрих-кодом носителя с областью каждого из комплементарных полинуклеотидов или с областью каждого из полинуклеотидов с молекулярной штрих-кодом, содержащей молекулярный штрих-код. В некоторых случаях область содержит 3'-маркированный/меченый полинуклеотид, комплементарный 3'-концевой области молекулярного штрих-кода штрих-кодированных полинуклеотидов. В некоторых вариантах осуществления область содержит 3'-маркированный полинуклеотид, комплементарный 5'-концевой области молекулярного штрих-кодированного олигонуклеотида.
[0025] В некоторых из любых таких вариантов осуществления на стадии (b) один или более полинуклеотид(ов)-мишень(ей) получают путем обратной транскрипции полинуклеотида(ов)-мишени(ей) в присутствии обратной транскриптазы и одного или нескольких мишень-специфичных праймеров, комплементарных последовательности-мишени полинуклеотида(ов)-мишени(ей); и/или коллекцию полинуклеотидов получают путем обратной транскрипции полинуклеотидов, таких как полинуклеотидные транскрипты, в клетке, в присутствии обратной транскриптазы и одного или более праймеров транскриптома, комплементарных полинуклеотиду, такому как полинуклеотидный транскрипт, в клетке.
[0026] В некоторых из любых таких вариантов осуществления один или более полинуклеотид(ов)-мишень(ей) включает полинуклеотид молекулы иммунной системы или ее цепи. В некоторых из любых таких вариантов осуществления один или несколько полинуклеотид(ов)-мишень(ей) включает по меньшей мере два полинуклеотида-мишени, каждый из которых включает полинуклеотид цепи иммунной молекулы.
[0027] В некоторых из любых таких вариантов осуществления один или более полинуклеотид(ов)-мишень(ей) включает полинуклеотид TCR или его цепь. В некоторых из любых таких вариантов осуществления один или более полинуклеотидов-мишеней включают первый полинуклеотид, принадлежащий Т-клеточному рецептору альфа (TCRα) и второй полинуклеотид, принадлежащий Т-клеточному рецептору (TCRβ). В некоторых вариантах осуществления один или более полинуклеотид(ов)-мишень(ей) включает первый полинуклеотид, принадлежащий Т-клеточному рецептору гамма (TCRγ) и второй полинуклеотид, принадлежащий Т-клеточному рецептору дельта (TCRdelta).
[0028] В некоторых из любых таких вариантов осуществления один или более полинуклеотид(ов)-мишень(ей) включает полинуклеотид антитела или его цепи. В некоторых вариантах осуществления один или более полинуклеотид(ов)-мишень(ей) включает первый полинуклеотид, принадлежащий полинуклеотиду тяжелой цепи иммуноглобулина (IgH), и второй полинуклеотид, принадлежащий полинуклеотиду легкой цепи иммуноглобулина (IgL). В некоторых вариантах осуществления один или более специфичных для мишени праймеров и/или один или более транскриптомных праймеров содержат поли (Т) последовательность.
[0029] В некоторых из любых таких вариантов осуществления один или более транскриптомных праймеров включают смесь случайных гексамерных олигонуклеотидных праймеров. В некоторых вариантах осуществления один или более специфичных для мишени праймеров включают один или более праймеров, комплементарных последовательности(ям) последовательности(ей)-мишени(ей) полинуклеотида-мишени. В некоторых случаях, один или более специфичных для мишени праймеров содержат по меньшей мере два праймера, например, первый праймер и второй праймер. В некоторых вариантах осуществления, один или более специфичных для мишени праймеров содержат праймеры для последовательности-мишени из множества полинуклеотидов-мишеней, каждый из которых кодирует иммунную молекулу или ее цепь. В некоторых аспектах молекула иммунной системы представляет собой Т-клеточный рецептор или антитело.
[0030] В некоторых из любых таких вариантов осуществления по меньшей мере первый праймер является комплементарным последовательности-мишени полинуклеотида первой цепи иммунной молекулы, а второй праймер является комплементарным последовательности-мишени полинуклеотида второй цепи молекулы иммунной системы. В некоторых вариантах осуществления первый и второй праймеры являются комплементарными последовательности-мишени различных полинуклеотидов цепи TCR молекулы TCR.
[0031] В некоторых из любых таких вариантов осуществления первый праймер является комплементарным последовательности-мишени полинуклеотидной последовательности TCRalpha, а второй праймер является комплементарным последовательности-мишени полинуклеотидной последовательности TCRbeta; или первый праймер является комплементарным последовательности-мишени полинуклеотидной последовательности TCRgamma, а второй праймер является комплементарным последовательности-мишени полинуклеотидной последовательности TCRdelta. В некоторых аспектах последовательность-мишень полинуклеотидов цепи TCR представляет собой последовательность константной области.
[0032] В некоторых из любых таких вариантов осуществления первый праймер является комплементарным последовательности-мишени последовательности константной области полинуклеотида TCRalpha, а второй праймер является комплементарным последовательности константной области полинуклеотида TCRbeta; или первый праймер является комплементарным последовательности-мишени последовательности константной области полинуклеотида TCRgamma, а второй праймер является комплементарным последовательности-мишени последовательности константной области полинуклеотида TCRdelta. В некоторых вариантах осуществления по меньшей мере первый и второй праймер являются комплементарными последовательности-мишени полинуклеотидов различных цепей антитела. В некоторых вариантах осуществления первый праймер является комплементарным последовательности-мишени полинуклеотидной последовательности тяжелой цепи иммуноглобулина (IgH), а второй праймер является комплементарным последовательности-мишени полинуклеотидной последовательности легкой цепи иммуноглобулина (IgL). В некоторых вариантах осуществления последовательность-мишень полинуклеотидов цепи антитела представляет собой последовательность константной области.
[0033] В некоторых из любых таких вариантов осуществления первый праймер комплементарен последовательности-мишени полинуклеотидной последовательности константной области тяжелой цепи (СН), а второй праймер является комплементарным последовательности-мишени полинуклеотидной последовательности константной области (CL) легкой цепи. В некоторых случаях последовательностью-мишенью полинуклеотида СН является IgM, IgD, IgA, IgE или IgG или их комбинации; и/или последовательность-мишень полинуклеотидной последовательности CL происходит из Igkappa, Iglambda или их комбинаций.
[0034] В некоторых из любых таких вариантов осуществления один или более полинуклеотид(ов)-мишень(ей) включает полноразмерную кодирующую последовательность. В некоторых из любых таких вариантов осуществления один или более полинуклеотид(ов)-мишень(ей) и коллекция полинуклеотидов продуцируются в носителе в одном и том же реакционном объеме.
[0035] В некоторых из любых таких вариантов осуществления способа на стадии (b) получение множества комплементарных полинуклеотидов включает использование нематричной терминальной трансферазы, где три или более нематричных нуклеотида, рибонуклеотида или их аналогов добавляются к 3'-концу каждого продуцируемого комплементарного полинуклеотида. В некоторых случаях нематричная терминальная трансфераза представляет собой обратную транскриптазу или полимеразу. В некоторых аспектах нематричная терминальная трансфераза представляет собой обратную транскриптазу, где обратная транскриптаза выбрана из списка: обратная транскриптаза Superscript II, обратная транскриптаза Maxima, обратная транскриптаза Protoscript II, обратная транскриптаза вируса мышиного лейкоза Малони (MMLV-RT), HighScriber обратная транскриптаза, обратная транскриптаза вируса птичьего миелобластоза (AMV), любая обратная транскриптаза, включающая терминальную дезоксинуклеотидилтрансферазную активность, или представляет собой их комбинации.
[0036] В некоторых из любых таких вариантов осуществления способа на стадии (с) присоединение включает в себя гибридизацию области одного из множества олигонуклеотидов с молекулярным штрих-кодом с тремя или более нематричными нуклеотидами каждого из комплементарных полинуклеотидов. В некоторых вариантах осуществления множество олигонуклеотидов с молекулярной штрих-кодом представлено в виде множества олигонуклеотидов с переключением матрицы, каждый из которых включает 3'-часть, комплементарную трем или более нематричным нуклеотидам. В некоторых случаях олигонуклеотид переключения матрицы дополнительно включает 5'-концевую область, комплементарную 3'-меченому полинуклеотиду первого адаптера, несущего штрих-код носителя. В некоторых случаях олигонуклеотид переключения матрицы также содержит 5'-концевую область, комплементарную фрагменту первого адаптера, причем первый адаптер содержит олигонуклеотид со штрих-кодом носителя.
[0037] В некоторых из любых таких вариантов осуществления обратная транскриптаза обладает активностью переключения матрицы; по меньшей мере некоторые цепи из множества продуцируемых комплементарных полинуклеотидов содержат 3'-выступ, содержащий три или более нематричных нуклеотидов; множество олигонуклеотидов с молекулярным штрих-кодом предоставляется в виде множества олигонуклеотидов с переключением матрицы, каждый из которых содержит (1) 5'-концевую область, которая комплементарна 3'-меченому олигонуклеотиду, включающему первый адаптер и олигонуклеотид со штрих-кодом носителя, (2) молекулярный штрих-код и (3) a 3' фрагмент, комплементарный трем или более нематричным нуклеотидам 3'- выступа; причем олигонуклеотид переключения матрицы служит матрицей для обратной транскриптазы, так что молекулярный штрих-код включается в каждый комплементарный полинуклеотид для получения молекулярных штрих-кодированных полинуклеотидов.
[0038] В некоторых из любых таких вариантов осуществления 3'-фрагмент, комплементарный трем или более нематричным нуклеотидам, включает в себя нуклеотид, рибонуклеотид или аналог таковых. В некоторых из любых таких вариантов осуществления три или более нематричных нуклеотида включают в себя три или более С-нуклеотида, а 3'-фрагмент, комплементарный трем или более нематричным нуклеотидам, содержит один или несколько G-нуклеотидов, рибонуклеотид или аналог таковых.
[0039] В некоторых из любых таких вариантов осуществления олигонуклеотид переключения матрицы также содержит 3'-модифицированный нуклеотид, блокирующий удлинение олигонуклеотида переключения матрицы посредством обратной транскриптазы или ДНК-полимеразы. В некоторых случаях модификация представляет собой дезокси, фосфатную, амино или алкильную модификацию 3'-концевого нуклеотида.
[0040] В некоторых из любых таких вариантов осуществления способа стадия (d) дополнительно включает удлинение каждого из множества комплементарных полинуклеотидов после присоединения. В некоторых вариантах осуществления стадия (d) дополнительно включает удлинение каждого из множества молекулярных полинуклеотидов с двойным штрих-кодом после присоединения, чтобы произвести множество полинуклеотидов с двойным штрих-кодом.
[0041] В некоторых из любых таких вариантов осуществления носитель представляет собой лунку, эмульсию, каплю или микрокапсулу.
[0042] В некоторых из любых таких вариантов осуществления перед стадией (е) способ включает объединение содержимого двух или более из множества носителей, в результате чего образуется гомогенная смесь, включающая два или более из множества одноцепочечных полинуклеотидов с двойным штрих-кодом. В некоторых аспектах объединение содержимого множества носителей включает разрушение двух или более носителей из множества и объединение одноцепочечных полинуклеотидов с двойными штрих-кодами из двух или более носителей.
[0043] В некоторых вариантах осуществления перед этапом (е) способ включает отбор или очистку одноцепочечных полинуклеотидов с двойным штрих-коом, имеющих размер, превышающий или превышающий приблизительно 50 пар оснований, превышающий 100 пар оснований или 200 пар оснований. В некоторых вариантах осуществления способ включает перед этапом (е) отбор или очистку одноцепочечных полинуклеотидов с двойным штрих-кодом, имеющих размер от или приблизительно от 50 пар оснований (н.п.) до 1500 н.п., от 50 н.п. до 1250 н.п., 50 н.п. до 1000 н.п., от 50 н.п. до 750 н.п., от 50 н.п. до 500 н.п., от 100 н.п. до 1500 н.п., от 100 н.п. до 1250 н.п., от 100 н.п. до 1000 н.п., от 100 н.п. до 750 н.п., от 100 н.п. до 500 н.п., от 200 н.п. до 1500 н.п. от 200 н.п. до 1250 н.п., от 200 н.п. до 1000 н.п., от 200 н.п. до 750 н.п. или от 250 н.п. до 500 н.п.
[0044] В некоторых из любых таких вариантов осуществления одноцепочечные полинуклеотиды с двойным штрих-кодом содержат в порядке (от 5' до 3'): первый адаптер, штрих-код носителя, молекулярный штрих-код и второй адаптер. В некоторых из любых таких вариантов осуществления первый адаптер расположен в или около 5'-области одноцепочечного штрих-кодированного полинуклеотида, необязательно одноцепочечного полинуклеотида с двойным штрих-кодом. В некоторых из любых таких вариантов осуществления второй адаптер расположен в или около 3'-области одноцепочечного штрих-кодированного полинуклеотида, необязательно одноцепочечного полинуклеотида с двойным штрих-кодом.
[0045] В некоторых из любых таких вариантов осуществления способа одну или несколько стадий (а) - (f) проводят в растворе и/или в отсутствие/присутствии твердой подложки, где, необязательно, подложка представляет собой гранулу. В некоторых из любых таких вариантов осуществления по меньшей мере стадии (с) и (d) проводят в растворе и/или в отсутствие/присутствии твердой подложки, где, необязательно, подложка представляет собой гранулу. В некоторых вариантах осуществления каждая из стадий (а)-(е) проводится в растворе и/или в отсутствие/присутствии твердой подложки, где, необязательно, подложка представляет собой гранулу.
[0046] В некоторых из любых таких вариантов осуществления популяция клеток содержит по меньшей мере или по меньшей мере приблизительно 1×103, 5×103, 1×104, 5×104, 1×105, 5×105, 1×106 или 5×106 клеток. В некоторых вариантах осуществления популяция клеток происходит из биологического образца, полученного от субъекта. В некоторых примерах биологический материал образца представляет собой или содержит биологический материал цельной крови, лейкоцитарной оболочки, мононуклеарных клеток периферической крови (PBMC), нефракционированных Т-клеток, лимфоцитов, лейкоцитов, продукт афереза, или продукт лейкафереза.
[0047] В некоторых из любых таких вариантов осуществления популяция клеток содержит иммунные клетки. В некоторых вариантах осуществления иммунные клетки включают лимфоциты или антиген-презентирующие клетки. В некоторых вариантах осуществления иммунная клетка представляет собой лимфоцит или его подтип, В-клетку или ее подтип, Т-клетку или ее подтип или их комбинацию. В некоторых примерах клетка иммунной системы является Т-клеткой, которая представляет собой Т-клетку CD4+ и/или CD8+.
[0048] В некоторых из любых таких вариантов осуществления популяция клеток обогащена или содержит центральные T-клетки памяти, эффекторные T-клетки памяти, наивные T-клетки, стволовые центральные T-клетки памяти, эффекторные T-клетки и регуляторные T-клетки. В некоторых из любых таких вариантов осуществления популяция клеток обогащена B-клетками памяти, наивными B-клетками или B-клетками плазмобласта.
[0049] В некоторых из любых таких вариантов осуществления субъект является человеком. В некоторых вариантах осуществления у субъекта наблюдается рак, инфекция или аутоиммунное состояние. В некоторых случаях инфекция представляет собой вирусную, бактериальную или грибковую инфекцию.
[0050] В некоторых из любых таких вариантов осуществления способ дополнительно включает амплификацию множества одноцепочечных полинуклеотидов со штрих-кодом, тем самым генерируя множество полинуклеотидных матриц. В некоторых из любых таких вариантов осуществления амплификацию множества одноцепочечных полинуклеотидов со штрих-кодом проводят в присутствии первого набора праймеров, включающего в себя первый праймер, комплементарный первой последовательности адаптера, и второй праймер, комплементарный второй последовательности адаптера. В некоторых случаях первый и/или второй праймер является универсальным праймером. В некоторых случаях первый и/или второй праймер является комплементарным сайту праймирования P7 (C7) или его непрерывному фрагменту или сайту праймирования P5 (C5) или его непрерывному фрагменту. В некоторых случаях первый праймер является комплементарным сайту праймирования P7 (C7) или его непрерывному фрагменту, а второй праймер является комплементарным сайту праймирования P5 (C5) или его непрерывному фрагменту. В некоторых вариантах осуществления праймер, комплементарный сайту праймирования P7 (C7) или его непрерывному фрагменту, имеет или содержит последовательность CAAGCAGAAGACGGCATACGAGAT (SEQ ID NO: 39); и/или праймер, комплементарный сайту праймирования Р5(С5) или его непрерывному фрагменту, содержит последовательность ACACGACGCTCTTCCGATCT (SEQ ID NO: 27). В некоторых из любых таких вариантов осуществления первый и/или второй праймер дополнительно содержит адаптер для секвенирования. В некоторых вариантах осуществления праймер, комплементарный сайту праймирования P7(C7) или его непрерывному фрагменту, дополнительно содержит последовательность CAAGCAGAAGACGGCATACGAGAT [NNNNNN] GTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT (SEQ ID NO: 28); и/или праймер, комплементарный сайту праймирования Р5(С5) или его непрерывному фрагменту, содержит последовательность AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCC (SEQ ID NO: 76).
[0051] В некоторых вариантах осуществления способ дополнительно включает очистку каждого из множества одноцепочечных штрих-кодированных полинуклеотидов, необязательно одноцепочечных полинуклеотидов с двойным штрих-кодом.
[0052] Предоставлена библиотека полинуклеотидов, содержащая множество штрих-кодированных полинуклеотидов, полученных способом по любому из описанных вариантов осуществления. Также предоставлена полинуклеотидная библиотека, содержащая множество штрих-кодированных полинуклеотидов, где множество штрих-кодированных полинуклеотидов содержит (i) один или несколько полинуклеотидов-мишеней, включающих ампликон одного или нескольких полинуклеотидов-мишеней, присутствующих в клетке, взятой из популяции клеток; и (ii) коллекцию полинуклеотидов, каждый из которых содержит ампликон клеточного полинуклеотида, где каждый штрих-кодированный полинуклеотид содержит первый адаптер, включающий первый универсальный сайт праймирования, комплементарный первому универсальному праймеру; олигонуклеотид со штрих-кодом носителя, содержащий штрих-код носителя, причем штрих-код носителя является одинаковым для всех штрих-кодированных полинуклеотидов (i) и (ii), принадлежащих одной и той же клетке, взятой из популяции клеток; и вторую последовательность адаптера, содержащую второй универсальный сайт праймирования, комплементарный второму универсальному праймеру.
[0053] В некоторых вариантах осуществления каждый из множества штрих-кодированных полинуклеотидов содержит молекулярный штрих-код, который является уникальным для каждого полинуклеотида или полинуклеотидной матрицы. В некоторых аспектах коллекция полинуклеотидных матриц со штрих-кодом из каждой клетки популяции клеток в совокупности содержит комплементарные цепи ДНК (кДНК) транскриптома или частичного транскриптома или комплементарные таковым. В некоторых вариантах осуществления транскриптом или частичный транскриптом в совокупности содержат по меньшей мере 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% транскриптов, присутствующих в геноме клетки.
[0054] В некоторых из любых таких вариантов осуществления каждый из штрих-кодированных полинуклеотидов имеет размер, который больше или приблизительно больше чем 50 пар оснований, больше чем 100 пар оснований или больше чем 200 пар оснований. В некоторых вариантах осуществления каждый из штрихкодированных одноцепочечных полинуклеотидов имеет размер от или приблизительно от 50 пар оснований (н.п.) до 1500 н.п., от 50 н.п. до 1250 н.п., от 50 н.п. до 1000 н.п., от 50 н.п. до 750 н.п., от 50 н.п. до 500 н.п., 100 н.п. до 1500 н.п., 100 н.п. до 1250 н.п., 100 н.п. до 1000 н.п., 100 н.п. 750 н.п., 100 н.п. до 500 н.п., от 200 н.п. до 1500 н.п., от 200 н.п. до 1250 н.п., от 200 н.п. до 1000 н.п., от 200 н.п. до 750 н.п. или от 250 н.п. до 500 н.п.
[0055] В некоторых из любых таких вариантов осуществления первый адаптер содержит штрих-код носителя. В некоторых вариантах осуществления штрих-кодированные полинуклеотиды являются одноцепочечными. В некоторых вариантах осуществления штрих-кодированные полинуклеотиды являются двухцепочечными. В некоторых вариантах осуществления первый адаптер и второй адаптер различаются.
[0056] В некоторых из любых таких вариантов осуществления первый универсальный сайт праймирования и/или второй универсальный сайт праймирования является или содержит сайт праймирования P7(C7) или его непрерывную часть, или сайт праймирования P5(C5), или его непрерывную часть, где, необязательно, непрерывная часть таковых достаточна для отжига комплементарной последовательности. В некоторых вариантах осуществления первый универсальный сайт праймирования представляет собой или содержит сайт праймирования P7(C7) или его непрерывную часть, а второй универсальный сайт праймирования представляет собой или содержит сайт праймирования P5(C5) или его непрерывную часть. В некоторых аспектах сайт праймирования P7(C7) содержит последовательность AGATCGGAAGAGCACACGTCTGAACTCCA (SEQ ID NO: 77) или представляет собой ее непрерывную часть. В некоторых примерах сайт праймирования P5 содержит последовательность AGATCGGAAGAGCGTCGTGTAGGGAAAGAGTGTAGATCTCGGTGGTCGCCGTATCATT (SEQ ID NO: 78) или представляет собой ее непрерывную часть.
[0057] В некоторых из любых таких вариантов осуществления непрерывная часть содержит по меньшей мере или по меньшей мере приблизительно 15, 20, 25 или 30 нуклеотидов в длину. В некоторых вариантах осуществления сайт праймирования P5 представляет собой непрерывную часть, указанную в SEQ ID NO: 25 (AGATCGGAAGAGCGTCGTGT).
[0058] В некоторых из любых таких вариантов осуществления олигонуклеотид, содержащий штрих-код носителя, содержит по меньшей мере или по меньшей мере приблизительно 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40 или 50 нуклеотидов. В некоторых вариантах осуществления олигонуклеотид со штрих-кодом носителя содержит от или приблизительно от 10 до 30 нуклеотидов.
[0059] В некоторых из любых таких вариантов осуществления один или несколько полинуклеотидов-мишеней включают полинуклеотид иммунной молекулы или ее цепи. В некоторых вариантах осуществления один или несколько полинуклеотидов-мишеней включают меньшей мере два полинуклеотида-мишени, каждый из которых представляет собой полинуклеотид цепи иммунной молекулы.
[0060] В некоторых из любых таких вариантов осуществления один или несколько полинуклеотидов-мишеней включают один или несколько полинуклеотидов TCR или цепей таковых. В некоторых вариантах осуществления один или несколько полинуклеотидов-мишеней содержат первый полинуклеотид, принадлежащий рецептору Т-клеток (TCRα) и второй полинуклеотид, принадлежащий рецептору Т-клеток (TCRβ). В некоторых вариантах осуществления один или несколько полинуклеотидов-мишеней содержат первый полинуклеотид, принадлежащий гамма-рецептору Т-клеток (TCRγ) и второй полинуклеотид, принадлежащий дельта- рецептору Т-клеток (TCRdelta).
[0061] В некоторых из любых таких вариантов осуществления один или несколько полинуклеотидов-мишеней включают один или несколько полинуклеотидов антител или цепей таковых. В некоторых вариантах осуществления один или несколько полинуклеотидов-мишеней содержат первый полинуклеотид, принадлежащий тяжелой цепи иммуноглобулина (IgH) и второй полинуклеотид, принадлежащий легкой цепи иммуноглобулина (IgL).
[0062] В некоторых из любых таких вариантов осуществления полинуклеотиды со штрих-кодом содержат в порядке (от 5' до 3'): первый адаптер, штрих-код носителя, молекулярный штрих-код и второй адаптер. В некоторых вариантах осуществления первый адаптер расположен в или около 5'-области одноцепочечного полинуклеотида с двойным штрих-кодом. В некоторых вариантах осуществления второй адаптер расположен в или около 3'-области одноцепочечного полинуклеотида с двойным штрих-кодом.
[0063] Предоставлены способы секвенирования, включающие секвенирование одного или более из множества полинуклеотидов, таких как полинуклеотиды со штрих-кодом (например, полинуклеотиды с двойным штрих-кодом), полученные любым способом из описанных вариантов осуществления или по любому из вариантов осуществления описанных библиотек полинуклеотидов. В некоторых примерах транскриптом на основе множества полинуклеотидов, таких, как полинуклеотидные матрицы, подвергается секвенированию. В некоторых случаях способ дополнительно включает амплификацию всего транскриптома или его части перед секвенированием. В некоторых аспектах амплификацию проводят с использованием первого набора праймеров, содержащего первый праймер и второй праймер, специфичные для первой и второй последовательностей адаптера, соответственно.
[0064] В некоторых вариантах осуществления секвенируют один или несколько полинуклеотидов-мишеней из множества полинуклеотидных матриц. В некоторых случаях способ дополнительно включает амплификацию одного или более полинуклеотида(ов)-мишени(ей) из множества полинуклеотидных матриц до секвенирования. В некоторых примерах амплифицируется полноразмерная последовательность (последовательности) одного или нескольких полинуклеотидов-мишеней.
[0065] В некоторых вариантах осуществления амплификацию проводят в присутствии второго набора праймеров, содержащего один или несколько первых праймеров, комплементарных одному или нескольким полинуклеотидам-мишеням, и второй праймер, комплементарный последовательности первого адаптера. В некоторых случаях второй праймер из второго набора праймеров комплементарен сайту праймирования P7(C7) или его непрерывной части, или сайту праймирования P5(C5) или его непрерывной части. В некоторых аспектах второй праймер из второго набора праймеров является комплементарным сайту праймирования P7(C7) или его непрерывной части. В некоторых вариантах осуществления второй праймер из второго набора праймеров представляет собой или содержит последовательность CAAGCAGAAGACGGCATACGAGAT (SEQ ID NO: 39) или CAAGCAGAAGACGGCATACGAGAT [NNNNNN] GTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT (SEQ ID NO: 28).
[0066] В некоторых вариантах осуществления один или несколько первых праймеров, комплементарных одному или нескольким полинуклеотидам-мишеням, являются специфичными для последовательности-мишени иммунной молекулы или ее цепи. В некоторых случаях молекула иммунной системы представляет собой рецептор Т-клетки или антитело. В некоторых аспектах один или несколько первых праймеров являются специфичными последовательности-мишени константной области иммунной молекулы.
[0067] В некоторых вариантах осуществления иммунная молекула представляет собой TCR, и один или несколько первых праймеров включают AGTCTCTCAGCTGGTACACGG (SEQ ID NO: 37), ATGGCTCAAACACAGCGACCTC (SEQ ID NO: 38) или их комбинацию. В некоторых вариантах осуществления иммунная молекула представляет собой антитело, и один или несколько первых праймеров включают любую из SEQ ID NO: 29-36 или их комбинацию.
[0068] В некоторых из любых таких вариантов осуществления способ включает определение клеточного происхождения одного или нескольких штрих-кодированных полинуклеотидов, необязательно полинуклеотидов с двойным штрих-кодом. В некоторых случаях определение клеточного происхождения включает в себя идентификацию информации о последовательности или последовательностей полинуклеотидов с двойным штрих-кодом, имеющих одинаковый штрих-код носителя, что свидедетельствует об их происхождении из одной и той же клетки.
[0069] В некоторых из любых таких вариантов осуществления полинуклеотид-мишень представляет собой иммунную молекулу, содержащую первую полинуклеотидную цепь и вторую полинуклеотидную цепь, и способ включает в себя определение соответствия первой полинуклеотидной цепи и второй полинуклеотидной цепи той же самой клетке при наличии того же самого штрих-кода носителя в секвенированных полинуклеотидах с двойным штрих-кодом. В некоторых вариантах осуществления способ дополнительно включает количественнeную оценку или определение числа полинуклеотидов с одним и тем же штрих-кодом, необязательно с одним и тем же молекулярным штрих-кодом и/или штрих-кодом носителя.
[0070] В некоторых из любых таких вариантов осуществления множество штрих-кодированных полинуклеотидов представляет собой полинуклеотиды с двойным штрих-кодом, содержащие молекулярный штрих-код и штрих-код носителя, а способ дополнительно включает в себя идентификацию последовательностей транскриптома и полинуклеотидных последовательностей-мишеней, имеющих один и тот же штрих-код носителя, тем самым идентифицируя транскриптомную информация клетки, содержащей полинуклеотид(ы)-мишень(и).
[0071] Предлагаются способы анализа транскриптома, включающие (а) секвенирование одного или нескольких полинуклеотидов-мишеней из множества штрих-кодированных полинуклеотидов, полученных любым из описанных способов, или из множества штрих-кодированных полинуклеотидов любой из описанных библиотек полинуклеотидов, где полинуклеотиды со штрих-кодом представляют собой полинуклеотиды с двойным штрих-кодом, содержащие молекулярный штрих-код и штрих-код носителя, и тем самым предоставляющие информацию о последовательности полинуклеотида-мишени из множества клеток; (b) секвенирование всего транскриптома или его части полученного на основе множества штрих-кодированных полинуклеотидов, полученных любым из описанных способов, или на основе множества штрих-кодированных полинуклеотидов любой из описанных библиотек полинуклеотидов, где штрих-кодированные полинуклеотиды представляют собой полинуклеотиды с двойным штрих-кодом и содержат молекулярный штрих-код и штрих-код носителя, тем самым предоставляя данные транскриптома из множества клеток; и (c) идентификацию информации о последовательностях из (a) и из (b), имеющих тот же самый штрих-код носителя, как происходящие из той же самой клетки.
[0072] Предоставлены способы анализа транскриптома выбранной отдельной клетки, включающие (а) амплификацию и секвенирование одного или нескольких полинуклеотидов-мишеней из множества штрих-кодированных полинуклеотидов, полученных любым из описанных способов или из множества штрих-кодированных полинуклеотидов любой из описанных библиотек полинуклеотидов, где штрих-кодированные полинуклеотиды представляют собой полинуклеотиды с двойным штрих-кодом, содержащие молекулярный штрих-код и штрих-код носителя, тем самым предоставляя информацию о последовательности для каждого из полинуклеотидов-мишеней по меньшей мере в одной из множества клеток; (b) идентификацию штрих-кода(-ов) носителя, связанного с одним из полинуклеотидов-мишеней, секвенированного в (а), таким образом идентифицируя выбранную отдельную клетку, несущую полинуклеотид-мишень; (c) амплификацию и секвенирование транскриптома или его части на основе множества штрихкодированных полинуклеотидов клетки, несущих штрих-код носителя, идентифицированный в (b), тем самым предоставляя данные транскриптома из выбранной клетки, экспрессирующей полипептид-мишень. В некоторых вариантах осуществления транскриптом или его часть из выбранной клетки амплифицируют или секвенируют с использованием праймера, специфичного для штрих-кода носителя, указанного в (b), и праймера, специфичного для второй последовательности адаптера штрих-кодированных полинуклеотидов.
[0073] В некоторых вариантах осуществления способ включает в себя сопоставление информации о последовательности транскриптома или его части и по меньшей мере одного из полинуклеотидов-мишеней, происходящих из одной и той же клетки, причем определяется информация о последовательности из множества штрихкодированных полинуклеотидов, полученных по любому из описанных способов или из множества штрих-кодированных полинуклеотидов любой из описанных полинуклеотидных библиотек, или определяется по любому из описанных способов, где штрих-кодированные полинуклеотиды представляют собой полинуклеотиды с двойным штрих-кодом, содержащие молекулярный штрих-код и штрих-код носителя. В некоторых случаях последовательности, имеющие один и тот же штрих-код носителя, группируются как принадлежащие той же самой клетке. В некоторых вариантах осуществления данные транскриптома включают параметр, характеристику, признак или фенотип, связанный с функцией или активностью клетки. В некоторых случаях данные транскриптома связаны с активацией, истощением или пролиферативной активностью клетки.
Краткое описание чертежей
[0074] На Фиг. 1А изображена схема стадии штрих-кода: примерный способ, описанный здесь. Эскиз иллюстрирует способ амплификации и штрих-кодирования двух или нескольких полинуклеотидов, таких как полинуклеотид-мишень, и одного или нескольких геномных или транскриптомных полинуклеотидов или парных последовательностей, таких как парные вариабельные Ig (например, мРНК VH и VL) или последовательностей TCR (например, мРНК Vα/Vβ и Vγ/Vδ), для подготовки библиотеки и секвенирования иммунного репертуара (immune repertoire sequencing). Штрих-код носителя (VB); Молекулярный штрих-код (MB). (Вверху) Одна капля (из множества капель) эмульсии представляет собой типичный носитель, содержащий одну клетку и другие компоненты реакции (например, ферменты, буферы, олигонуклеотиды). (В центре). Типичные способы лизиса клеток и обратной транскрипции РНК в лизированной клетке с использованием специфичных для мишени случайных и/или олиго-dT праймеров обратной транскрипции. (Внизу) Стадия переключения матриц и маркировка молекулярных штрих-кодов (MB) отдельных молекул во время стадии обратной транскрипции.
[0075] На Фиг. IB изображена схема стадии амплификации типичного способа, описанного здесь. Эскиз иллюстрирует способ амплификации и штрих-кодирования двух или более полинуклеотидов, таких как полинуклеотид-мишень, и одного или нескольких геномных или транскриптомных полинуклеотидов или парных последовательностей, таких как парные вариабельные Ig (например, мРНК VH и VL) и последовательности TCR (например, vРНК Vα/Vβ и Vγ/Vδ), для подготовки библиотеки и секвенирования иммунного репертуара (immune repertoire sequencing). (Вверху) Независимая амплификация штрих-кода носителя (VB) генерирует множество копий, идентичных VB в каждой капле. Молекулы кДНК с молекулярным штрих-кодом (MB) одновременно помечаются VB во время фаз отжига и достраивания цикла амплификации. (В центре) Одновременная амплификация молекул кДНК с двойным штрих-кодом во время цикла амплификации. (Внизу) Типичные молекулы кДНК с двойным штрих-кодом, готовые для дальнейшей обработки (например, очистки, выбора размера, лигирования адаптера, амплификации и секвенирования).
[0076] На Фиг. 2 изображена амплификация и секвенирование транскриптов с двойным штрих-кодом типичными методами, описанными здесь. (Вверху) Амплификация и секвенирование транскриптов, кодирующих интересующий ген-мишень с использованием праймера, специфичного для последовательности универсального праймера первого адаптера, и праймера, специфичного для мишени, причем каждый праймер связан с адаптером секвенирования для секвенирования. (Средняя) Амплификация и секвенирование всех транскриптов в библиотеке, например, транскриптома или его части одной или нескольких клеток с использованием праймеров, специфичных для универсальной последовательности праймирования первого адаптера и универсальной последовательности праймирования второго адаптера. (Внизу) Амплификация и секвенирование транскриптома выбранной интересующей клетки, такой как клетка, для которой определено, что она содержит транскрипты мРНК интересующего гена-мишени, с использованием праймера, специфичного для определенного штрих-кода носителя (VB), общего для всех полинуклеотидов из той же клетки и праймера, специфичный для универсальной последовательности праймирования второго адаптера.
[0077] На Фиг.3 показаны графики t-SNE для данных транскриптомов отдельной клетки, окрашенные в соответствии с предполагаемой кластерной идентичностью в соответствии с программным обеспечением Seurat (A; пунктирные линии указывают на кластеры событий, проявляющих преимущественно один и тот же цвет) или окрашенные в соответствии с типом полноразмерного секвенированного иммунного рецептора, B-клеточного рецептора (BCR) или T-клеточного рецептора (TCR) (B; пунктирные линии указывают на кластеры событий, проявляющих преимущественно одинаковый цвет).
[0078] На Фиг. 4 изображены графики t-SNE данных транскриптомов отдельных клеток, таких как на Фиг. 3, окрашенные для идентификации клеток, экспрессирующих обозначенные последовательности: Toll-подобный рецептор 7 (TLR7; A), эпсилон-цепь гликопротеина CD3 на поверхности Т-клеток (CD3E; B), гранулярный белок 7 натуральных клеток-киллеров (NKG7; C), рецептор маннозы C-Типа 1 (MRC1; D)
Подробное описание
[0079] В настоящем документе представлены способы и композиции для анализа экспрессии генов в отдельных клетках или во множестве отдельных клеток. Предложенные способы позволяют эффективно генерировать множество высококачественных полинуклеотидов (например, ДНК), принадлнжащих отдельной клетке, осуществлять секвенирование библиотек, содержащих полинуклеотиды полного транскриптома или его части, и одну или несколько полноразмерных полинуклеотидных последовательностей представляющего интерес гена-мишени, такого как полноразмерный продукт парного иммунного рецептора, например TCR или антитела, в результате чего полинуклеотид(ы)-мишень(и) и полинуклеотиды из полного или частичного транскриптома, происходящие из одной и той же клетки, могут быть идентифицированы. В некоторых вариантах осуществления каждый из множества полинуклеотидов библиотеки содержит адапторные последовательности (например, первый адаптер и второй адаптер), которые обеспечивают возможность секвенирования NGS всех восстановленных продуктов, в отличие от секвенирования конкретных генов, которые необходимо выбрирать в ходе эксперимента. Таким образом, в некоторых аспектах предоставленного способа последующая амплификация с помощью ПЦР может проводиться с использованием праймеров, специфичных для этих адапторных последовательностей, и/или праймеров, специфичных к представляющим интерес полинуклеотидам-мишеням, и/или клетко-специфических праймеров. В некоторых вариантах осуществления предоставленные способы позволяют обрабатывать десятки или сотни тысяч клеток в одном эксперименте, при этом, тем самым получая данные секвенирования отдельных клеток, например данные РНК-секвенирования, такие как количество мРНК, в сочетании с полноразмерными последовательностями иммунных молекул, например, антител или TCR, эффективным и высокопроизводительным способом.
[0080] В некоторых случаях прямое секвенирование всего или частичного содержания генома и мРНК в ткани все шире используется для обеспечения возможности анализа альтернативного сплайсинга, регуляторных/промоторных областей и сигналов полиаденилирования без необходимости предварительного выбора ранее известных генов (Cloonan et al., Nat Methods 5 (7): 613-9 (2008)). Однако современные методы анализа содержания мРНК в клетках путем прямого секвенирования основаны на анализе общей мРНК, полученной из образцов ткани, обычно содержащих миллионы клеток. Это означает, что большая часть функциональной информации, присутствующей в отдельных клетках, теряется или размывается при анализе экспрессии генов в общей мРНК. Кроме того, экспрессию генов во время динамических процессов, таких как клеточный цикл, трудно наблюдать как среднее по популяции. Поэтому, для некоторых применений, подходы прямого секвенирования на основе одной клетки предпочтительнее, чем работа на объемном образце.
[0081] В некоторых случаях желательно проанализировать содержание генома или мРНК в выбранной клетке, такой как клетка, экспрессирующая определенный ген или интересующие гены, такие как гены-мишени. В некоторых случаях желательно определить геномное или транскриптомное содержимое выбранной клетки, а также получить полноразмерную последовательность гена-мишени, такого как иммунный рецептор. Существующие инструменты секвенирования транскриптомов отдельной клети включают микрочипы, 96-луночные методы, такие как традиционная сортировка FACS по лункам, и микрофлюидные инструменты, такие как Fluidigm C1. Эти инструменты могут использоваться для подготовки полноразмерных транскриптомных и целевых библиотек, но их пропускная способность ограничена, поскольку они ограничены в количестве клеток, доступных для анализа (например, от сотен до тысяч клеток).
[0082] В некоторых случаях желательно проанализировать содержание генома или мРНК в выбранной клетке, такой как клетка, экспрессирующая определенный ген или интересующие гены, такие как гены-мишени (например, иммунный рецептор). Описаны методы сверхвысокой пропускной способности с использованием микролунковых матриц или эмульсий, и позволяющие проводить секвенирование транскриптома отдельной клетки (см., например, Klein et al., Cell (2015) 161 (5): 1187-1201; Macosko et al., Cell (2015).) 161 (5): 1202-1214; WO/2015/164212; WO/2016/040476), но эффективный захват полноразмерных последовательностей-мишеней, таких как полноразмерные последовательности иммунных рецепторов, невозможен при существующей технологии. Эти методы также ограничены меньшим количеством клеток, обычно несколькими тысячами из-за ограничений, налагаемых подходом на основе гранул, который требует капли большего размера и большего реакционного объема на клетку.
[0083] В вариантах осуществления предоставленных способов последовательности-мишени, такие как иммунные молекулы –мишени (например, антитело или TCR), и последовательности генома или транскриптома множества клеток, продуцируются в одной одновременной реакции и обеспечивают механизм для объединения информации о последовательностях для всех последовательностей, происходящих из одной и той же клетки. В некоторых аспектах раскрытые в настоящее время способы в сочетании с высокопропускной технологией секвенирования позволяют анализировать большое количество отдельных клеток и проводить анализ одной реакцией. В принципе, можно секвенировать любое количество клеток с любым количеством областей-мишеней на клетку. В некоторых аспектах количество отдельных клеток, которые могут быть обработаны, ограничено только практическими ограничениями, такими как скорость высокопропускного секвенирования. В некоторых вариантах осуществления способы, раскрытые в данном документе, являются адаптируемыми для использования гранул. В других вариантах осуществления способы, раскрытые в данном документе, не включают стадию секвенирования или амплификации на основе гранул.
[0084] В некоторых аспектах предложенные способы преодолевают или уменьшают проблемы существующих способов, предоставляя способ получения библиотек кДНК, который может использоваться для анализа экспрессии генов во множестве отдельных клеток. В некоторых вариантах осуществления предоставленные способы приводят к получению полинуклеотидной библиотеки для секвенирования, обладющего сверхвысокой пропускной способностью, которая позволяет воспроизведение готовых к синтезу полноразмерных последовательностей-мишеней, включая последовательности парных гетеродимерных или мультимерных мишеней, одновременно фиксируя дополнительную количественную геномную или транскриптомную информацию о клетках, идентифицированных как экспрессирующие данную(ые) последовательность(и)-мишень(и).
[0085] В частности, предоставленные способы предназначены для получения полинуклеотидной библиотеки, например библиотеки кДНК, из множества отдельных клеток. Методы основаны на определении уровней экспрессии генов популяции отдельных клеток, которые могут быть использованы для идентификации естественных изменений экспрессии генов на клеточном уровне. Методы также могут быть использованы для идентификации и характеристики клеточного состава популяции клеток, в том числе, даже при отсутствии подходящего маркера клеточной поверхности. Способы, описанные в данном документе, также обеспечивают преимущество создания библиотеки кДНК, представляющей РНК в клеточной популяции, при использовании отдельных клеток, тогда как библиотеки кДНК, полученные классическими методами, обычно требуют общей РНК, выделенной из большой популяции. Таким образом, в некоторых аспектах библиотека кДНК, полученная с использованием предоставленных способов, позволяет по меньшей мере достоверно представить содержание РНК в популяции клеток, используя меньшую субпопуляцию отдельных клеток наряду с дополнительными преимуществами, как описано здесь.
[0086] Представленные варианты осуществления базируются на эмульсионных способах секвенирования мишеней отдельной клетки, таких как секвенирование иммунной мишени и анализ транскриптома. В некотором аспекте клетки из образца, содержащего популяцию клеток, инкапсулируют в отдельном носителе (например, в каплях), например, с использованием способов на основе микрофлюидной эмульсии. Затем осуществляются способы присоединения специфических штрих-кодов носителей (например, капель) к полинуклеотидам-мишеням (например, ампликонам транскриптов мРНК-мишени) и/или ко множеству полинуклеотидов (например, ампликонов транскриптов мРНК полного или частичного транскриптома) в эмульсионных каплях, что позволяет проводить высокоэффективный генетический анализ и/или анализ экспрессии отдельных клеток, содержащихся в каплях. В некоторых аспектах штрих-коды носителей изначально присутствуют в виде отдельных ДНК-матриц с рандомизированным участком центральной последовательности, фланкированным известными сайтами праймеров. Матрицы могут быть подвергнуты обратной транскрипции для генерирования ампликона и/или быть амплифицированы с помощью ПЦР для получения одного или нескольких ампликонов в пределах носителя, таких как капли, и могут быть присоединены к нуклеиновым кислотам клеточного происхождения путем перекрывания последовательностей. В некоторых аспектах способа нуклеиновую кислоту клеточного происхождения амплифицируют с использованием ген-специфичного праймера ПЦР для амплификации гена-мишени или генов-мишеней, представляющих интерес, например, гена иммунной молекулы, такой как антитело или рецептор Т-клеток (TCR). В некоторых случаях возможность амплифицировать несколько генов-мишеней может предоставить информацию о различных особенностях клеток, таких как фенотип, активность или других особенности клетки.
[0087] В некоторых случаях добавление дополнительных генов-мишеней может связать информацию о конкретной иммунной молекуле, например, TCR, с информацией о клеточном фенотипе клетки. В других аспектах способа полноразмерные транскриптомные нуклеиновые кислоты клеточного происхождения могут быть амплифицированы с использованием праймеров, позволяющих секвенировать полный транскриптом клетки или его часть, а транскрипты, происходящие из одной и той же клетки, могут быть сгруппированы. В некоторых аспектах случайные праймеры обратной транскрипции используются для генерации ампликонов, соответствующих транскриптам транскриптома. В некоторых вариантах осуществления универсальный сайт праймирования может быть добавлен к концам штрих-кодированных полинуклеотидов, например, в добавленные первый и второй адаптеры, так что вся библиотека может быть амплифицирована и целиком секвенирована высокопропускным методом дробовика.
[0088] В некоторых вариантах осуществления реакцию амплификации нуклеиновой кислоты клеточного происхождения можно проводить реакциями в пределах однго носителя («в одной пробирке»), в которой производится a) клеточный лизис; b) обратная транскрипция мРНК-мишени; c) молекулярное штрих-кодирование каждой кДНК; d) ПЦР-амплификация пробо-специфичного ДНК-штрих-кода; и e) прикрепление копии штрих-кода носителя к каждой кДНК. В некоторых вариантах осуществления продукты могут быть воспроизведены и секвенированы, например, с использованием любой из множества платформ секвенирования. Например, можно использовать платформу Illumina MiSeq, используя 325×300bp для секвенирования всей длины каждого продукта. В некоторых аспектах штрих-коды носителей (капель) позволяют идентифицировать все продукты каждой отдельной клетки. В определенных аспектах молекулярные штрих-коды позволяют количественно определять экспрессию для каждой клетки и, в некоторых случаях, устранять ошибки секвенирования и ОТ-ПЦР (RT-PCR).
[0089] В представленных вариантах осуществления процесс секвенирования транскриптома может выполняться отдельно от целевого секвенирования нескольких выбранных транскриптов, таких как TCR, поскольку амплифицированная библиотека может обрабатываться отдельно. Это дает возможность применять способ несколько раз на отдельных аликвотах одной и той же амплифицированной штрих-кодированной библиотеке. С помощью предоставленных способов может быть реализовано множество полезных подходов благодаря возможности проведения различных экспериментов в разное время на одной и той же амплифицированной штрих-кодированной библиотеке. В одном примере способы могут быть использованы, чтобы сначала выполнить целевое секвенирование молекулы-мишени, представляющей интерес, например, TCR, в образце, что может привести к идентификации нескольких конкретных клеток, представляющих интерес. В некоторых аспектах ПЦР или «capture» (захватывающие) олигонуклеотиды могут быть затем разработаны для нацеливания на штрих-коды носителей, принадлежащих представляющим интерес клеткам, позволяя захватывать и секвенировать все штрих-кодированные транскрипты только этих клеток. В некоторых аспектах это значительно снижает затраты на секвенирование всей библиотеки.
[0090] В определенных аспектах способы и композиции, описанные в данном документе, выгодны для анализа отдельных клеток, например, анализа, направленного на изучение геномов, транскриптомов, протеомов, метаболических путей и тому подобного в комплексных клеточных образцах. Анализ множества клеток в гетерогенных клеточных популяциях особенно выгоден при изучении комплексных образцов или смесей. Комплексные образцы или смеси клеток включают, например, образцы мононуклеарных клеток периферической крови (PBMC), метагеномные образцы, срезы нормальной и раковой ткани, колонии эмбриональных и стволовых клеток. Секвенирование генома и транскриптома желательно для идентификации дивергирующих типов клеток или для изучения клеток на определенных стадиях, таких как различные стадии активации, истощения или пролиферации. Конкретные применения включают профилирование молекулярных Т- и В-клеток, гаплотипирование и типирование HLA.
[0091] «Метагеномные образцы» относятся к образцам, содержащим геномы из разных источников, таких как виды. Например, настоящий подход может быть применен к смесям бактерий разных видов для обеспечения возможности секвенирования нуклеиновых кислот из множества бактерий в одном анализе с последующей корреляцией последовательностей с той же самой бактериальной клеткой. Аналогично, последовательности нуклеиновых кислот одного типа клеток, находящихся среди клеток другого типа клеток, как, например, иммунные клетки, проникающие в опухоль. В таких случаях нуклеиновые кислоты иммунной клетки, инфильтрирующие опухоль, могут быть соотнесены с полноразмерной последовательностью (последовательностями) иммунного рецептора или его связывающего фрагмента с использованием представленных здесь способов.
[0092] Варианты осуществления предоставленных способов также позволяют создавать носители большого количества отдельных клеток. Используя сходство профилей экспрессии, можно построить карту клеток, показывающую, как эти клетки связаны между собой. Эта карта может использоваться для различения типа клеток in silico при обнаружении скоплений близкородственных клеток. Создавая носители не нескольких клеток, а большого числа отдельных клеток, можно использовать сходство профилей экспрессии для построения карты клеток и их взаимосвязей. Этот метод позволяет получить доступ к прямым данным экспрессии каждого отдельного типа клеток, присутствующих в популяции, без необходимости предварительной очистки/выделения этого типа клеток. Кроме того, если доступны известные маркеры, они могут использоваться in silico для определения позиции клеток, представляющих интерес.
[0093] В число представленных вариантов осуществления входит способ получения полинуклеотидной библиотеки, например библиотеки кДНК, из множества отдельных клеток путем высвобождения мРНК из каждой отдельной клетки для получения множества отдельных образцов, причем мРНК в каждом отдельном мРНК-образце взята из одной клетки, с последующим синтезом первой цепи кДНК (то есть ампликона) на мРНК в каждом отдельном образце мРНК и включением нуклеотидного штрих-кода (например, молекулярного штрих-кода и/или штрих-кода носителя) в ампликон кДНК для получения множества образцов кДНК со штрих-кодом (например, с двойным штрих-кодом) (иными словами, где кДНК в каждом штрих-кодированном образце кДНК, комплементарная мРНК отдельной клетки, объединяется с с другими штрих-кодированными кДНК с последующей амплификацией объединенных образцов кДНК для создания библиотеки кДНК, содержащей двухцепочечную кДНК со штрих-кодом). В некоторых вариантах осуществления полученный ампликон представляет собой одноцепочечную кДНК с двойным штрих-кодом, такую как одноцепочечная кДНК с двойным штрих-кодом, соответствующую одной или нескольким мРНК-матрицам. В некоторых вариантах осуществления двухцепочечная кДНК со штрих-кодом денатурируется для генерирования одноцепочечной кДНК со штрих-кодом для облегчения добавления адаптера, такого как адаптер для проведения секвенирования. Используя вышеуказанный метод, вполне возможно подготовить образцы для секвенирования из нескольких сотен отдельных клеток за короткое время. Традиционные способы получения библиотеки фрагментов РНК для секвенирования включают стадии удаления геля, являющиеся трудоемкими. В некоторых аспектах способов, описанных в настоящем документе, множество клеток получают в виде единого образца (после синтеза кДНК), что делает возможным подготовку большого количества, например нескольких сотен, клеток для секвенирования. Кроме того, технические вариации могут быть сведены к минимуму, поскольку каждую выборку из множества клеток подготавливают вместе (в одной пробирке).
[0094] В некоторых аспектах изобретения каждый образец кДНК, полученный из отдельной клетки, помечается штрих-кодом, который позволяет анализировать экспрессию генов на уровне отдельной клетки. Это позволяет изучать экспрессию во время динамических процессов, таких как клеточный цикл, и анализировать различные типы клеток в сложной ткани (например, мозге). В некоторых аспектах образцы кДНК могут быть объединены перед анализом. Объединение образцов упрощает обработку образцов из каждой отдельной клетки и уменьшает время, необходимое для анализа экспрессии генов в отдельных клетках, что позволяет проводить анализ экспрессии генов с высокой пропускной способностью. Объединение образцов кДНК до амплификации также обеспечивает преимущество, заключающееся в том, что технические различия между образцами практически исключаются. Кроме того, поскольку образцы кДНК объединяются перед амплификацией, требуется меньше реакций амплификации для генерирования достаточного количества кДНК для последующего анализа по сравнению с амплификацией и обработкой образцов кДНК из каждой отдельной клетки по отдельности. Это уменьшает ошибки амплификации, а также означает, что любое смещение амплификации в ту или другую сторону будет одинаковым для всех клеток, используемых для получения объединенных образцов кДНК. Очистка, хранение и обработка РНК также не требуются, что помогает устранить проблемы, вызванные нестабильной природой РНК.
[0095] Пары цепей рецепторов Т-клеток и пары цепей антител иммуноглобулинов принадлежат к тем типам иммунных рецепторов, которые предполагается секвенировать с использованием раскрытых в настоящее время способов. В некоторых вариантах осуществления предоставленные способы позволяют генерировать полинуклеотидные библиотеки для высокопропускного секвенирования и анализа экспрессии генов, включающих последовательности одной или нескольких последовательностей-мишеней, таких как одна или несколько последовательностей иммунного рецептора, и последовательностей, которые могут быть скомбинированы для получения геномной и/или транскриптомной информации при секвенировании. В некоторых вариантах осуществления может быть создана полинуклеотидная библиотека, которая представляет собой полученную от человека библиотеку-панель, используемую для обнаружения антител и/или TCR у пациента или группы (когорты) пациентов со специфическими общими признаками. В некоторых вариантах осуществления предоставленного способа исходным материалом может быть любой источник, содержащий популяцию клеток, представляющих интерес, которая, в свою очередь, содержит или может содержать полинуклеотид-мишень, такой как иммунная молекула или рецептор, например, антитело или TCR. В некоторых вариантах осуществления исходный материал может представлять собой периферическую кровь или биопсию ткани, из которой иммунные клетки легко выделяются или подразделяются на наивные клетки, клетки памяти и/или секретирующие антитела (ASC), если это желательно. В некоторых вариантах осуществления предлагаемый способ может применяться к множеству различных типов единичных или парных вариабельных последовательностей, например, к парам цепей рецепторов Т-клеток и парам цепей антител иммуноглобулинов.
[0096] В некоторых аспектах библиотеки кДНК, полученные с помощью предоставленных способов, подходят для анализа профилей экспрессии генов отдельных клеток путем прямого секвенирования, то есть эти библиотеки можно использовать для изучения экспрессии генов, включая экспрессию генов, ассоциированных с определенным полинуклеотидом-мишенью, представляющим интерес или клеток, несущих такой полинуклеотид, как, например, молекула иммунной системы или рецептор, например антиген, антитело или TCR. В некоторых вариантах осуществления могут быть проанализированы те профили экспрессии генов, которые не были известны ранее. В некоторых вариантах осуществления предоставленные способы могут использоваться для характеристики или сравнения состояния транскрипции каждой из множества клеток из образца, как, например, активированного, истощенного, пролиферирующего состояния или в соответствии с другим желаемым параметром или атрибутом клеток. В некоторых вариантах осуществления предоставленные способы могут использоваться для облегчения обнаружения молекул с терапевтическим потенциалом, таких как TCR, путем анализа ответа конкретных клеток, несущих конкретный TCR, специфичный к антигену, представляющему интерес. В некоторых вариантах осуществления предоставленных способов можно идентифицировать клетки, экспрессирующие TCR, ассоциированный с желаетельным клеточным ответом, например природным, или со степенью активации Т-клеток. В некоторых вариантах осуществления предоставленные способы позволяют собрать более представительный набор данных путем анализа всего транскриптома, в отличие от существующих способов, которые требуют уже существующего знания и/или выбора меньшей группы генов-кандидатов.
I. Полинуклеотидная библиотека для целевого и транскриптомного анализа
[0097] В некоторых вариантах осуществления способы, представленные в настоящем документе, направлены на амплификацию и секвенирование одной или нескольких полинуклеотидных молекул-мишеней и на амплификацию и секвенирование коллекции полинуклеотидов, таких, как одна или несколько молекул-мишеней, и коллекции полинуклеотидов из отдельной клетки или популяции клеток. В некоторых вариантах осуществления способы и композиции, описанные в настоящем документе, могут быть применимы для анализа отдельных клеток, например, для изучения геномов, транскриптомов, протеомов, метаболических путей и тому подобного в сложных(комплексных) образцах клеток. В других аспектах способы и композиции, описанные в настоящем документе, можно использовать для обнаружения иммунных рецепторов, например, путем сопоставления тяжелых и легких цепей рецепторов иммуноглобулинов или Т-клеточного рецептора в отдельных В- и Т-клетках, а также для HLA- типирования. В других вариантах осуществления информация о спаривании антител и анализ отдельных клеток могут быть объединены чтобы связать информацию о функции клетки или статусе клетки с экспрессией идентифицированной последовательности иммунного рецептора. В других аспектах способы и композиции, описанные в настоящем документе, можно использовать для мониторинга воздействия малых молекул и лекарств или иммунотерапии и эффекта таковых в сложных(комплексных) нормальных или раковых образцах для диагностики или поиска новых лекарств или схем лечения. В еще одном варианте осуществления способы и композиции можно использовать для обнаружения и анализа патогенов-мишеней, таких как бактерии или вирусы, в биологических образцах.
[0098] В некоторых вариантах осуществления предоставленные способы могут включать в себя различные признаки способов, описанных в международных публикациях № WO2012/048341, WO2014/144495, WO2016/044227, WO2016/176322 или WO2017/053902, каждый из которых включен во всей их полноте в качестве ссылки.
[0099] В настоящем изобретении используются стадии, на которых манипулируют нуклеиновыми кислотами с целью создания полинуклеотидных библиотек для секвенирования. В некоторых вариантах осуществления настоящего изобретения используются стадии, на которых манипулируют нуклеиновыми кислотами для получения полинуклеотидных молекул-мишеней, включающими последовательности, содержащие вариабельные области иммунного рецептора, такого как антитело или TCR, продуцируемые иммунной клеткой. В некоторых случаях эта полинуклеотидная молекула-мишень является молекулой рекомбинантных моноклональных антител. В некоторых вариантах осуществления настоящего изобретения используются стадии, на которых манипулируют нуклеиновыми кислотами для получения полинуклеотидов, представляющих собой транскриптом или геном одной или нескольких клеток. В общем смысле, в некоторых вариантах осуществления изобретения для амплификации генетических материалов клетки, такой как иммунная клетка и/или Т-клетка, используется полимеразная цепная реакция с обратной транскрипцией (RT-PCR; обратная транскрипция-ПЦР) для проведения кДНК-амплификации генетического материала иммунной клетки.
[0100] В некоторых вариантах осуществления способы можно использовать для получения информации о последовательности полинуклеотида-мишени, представляющего интерес, такого, как TCR или антитело, в пределах клетки. Гены-мишени могут быть получены из геномной ДНК или мРНК клетки из образца или популяции клеток. Образец или популяция клеток могут включать иммунные клетки. Например, для молекул-мишеней, являющихся антителами, гены иммуноглобулина могут быть получены из геномной ДНК или мРНК иммунных клеток или Т-клеток. РНК может принадлежать тяжелой цепи (V, D, J сегменты) или легкой цепи (V, J сегменты). В некоторых вариантах осуществления исходным материалом является РНК, полученная из иммунных клеток, и состоящая из сегментов гена V, D, J, кодирующая антитело и содержащая константную область.
[0101] В некоторых вариантах осуществления, в дополнение к получению данных о полноразмерной последовательности представляющего интерес полинуклеотида-мишени, например иммунной молекулы, такой как антитело или TCR, предоставленные способы также позволяют эффективно получать высококачественные библиотеки ДНК для секвенирования. как на основе полного транскриптомного продукта так и на основе полноразмерной мишени, которая включает мультисубъединичную мишень, полинуклеотид(ы), например антитела или TCR, содержащие полноразмерные продукты парных иммунных рецепторов.
[0102] В некоторых вариантах осуществления такие способы включают добавление (например, при лигировании) последовательности адапторной ДНК к одноцепочечным полинуклеотидным продуктам, что может позволить амплификацию и секвенирование следующего поколения (NGS) транскриптома одной клетки или множества одиночных клеток.
А. Полинуклеотидные библиотеки
[0103] Библиотека, полученная в соответствии со способами, описанными в данном документе, может являться библиотекой, содержащей последовательность-мишень, полноразмерную или значительной длины, такую как последовательность антитела или TCR, с соответствующими штрих-кодами, такими как штрих-код носителя и молекулярный штрих-коды. В некоторых вариантах осуществления библиотека содержит последовательность-мишень значительной или полноразмерной длины, например, последовательность антитела или TCR, включающая обе цепи антитела или TCR, и последовательности, соответствующие одному или нескольким транскриптам частичного или полного транскриптома клетки на основе исходной последовательности-мишени, например, антитела или TCR, каждую со штрих-кодом носителя и молекулярным штрих-кодом. В таких вариантах осуществления последовательность-мишень, значительной или полноразмерной длины, например, последовательность антитела или TCR, и последовательность(и), соответствующая одному или нескольким транскриптам частичного или полного транскриптома клетки, из которой происходит последовательность-мишень, например, антитела или TCR, содержат тот же самый штрих-код носителя а также содержат молекулярный штрих-код, являеющийся уникальным для каждого исходного транскрипта транскриптома. В некоторых аспектах штрих-код носителя включен в первый адаптер, который прикреплен к каждому полинуклеотиду-мишени а также к каждому полинуклеотиду из набора полинуклеотидов, представляющих транскрипты транскриптома.
[0104] В некоторых вариантах осуществления предложены способы получения библиотеки полинуклеотидов, где адаптер (в дальнейшем также называемый вторым адаптером) добавляют к каждому одноцепочечному полинуклеотиду со штрих-кодом из множества, помеченного предыдущим, или первым адаптером, так что адаптеры находятся на противоположных концах полинуклеотида, и где множество одноцепочечных полинуклеотидов со штрих-кодом включает (i) один или несколько одноцепочечных полинуклеотид(ов)-мишень(ей), которые комплементарны одному или нескольким полинуклеотидам-мишеням, присутствующим в клетке, принадлежащей популяции клеток; и (ii) коллекцию одноцепочечных полинуклеотидов, каждый из которых является комплементарным полинуклеотиду в клетке, где каждый из множества штрих-кодированных одноцепочечных полинуклеотидов содержит штрих-код носителя, который является одинаковым для всех комплементарных полинуклеотидов из одной и той же клетки, принадлежащей популяции клеток. Адаптер, такой, как каждый из первых и вторых адаптеров, содержит универсальную праймирующую последовательность, которая может использоваться для амплификации или секвенирования помеченых адаптером полинуклеотидов с двойным штрих-кодом.
[0105] В некоторых вариантах осуществления библиотека полинуклеотидов может быть секвенирована. В некоторых вариантах осуществления библиотека, созданная в соответствии со способами, описанными в данном документе, может содержать соответствующие сегменты кластеризации для секвенирования. В некоторых вариантах осуществления может быть получено множество копий идентичных молекулярных штрих-кодов. В некоторых вариантах осуществления множество копий полинуклеотидов, содержащих идентичные молекулярные штрих-коды, можно создать для каждой исходной уникальной полинуклеотидной молекулы-мишени. В некоторых вариантах осуществления множество копий полинуклеотидов, содержащих идентичные молекулярные штрих-коды, можно создавать для каждой исходной уникальной полинуклеотидной молекулы-мишени, помеченной штрих-кодом носителя. Любая или все последовательности могут быть секвенированы и скомпанованы, например, для определения полного или частичного транскриптома клетки, экспрессирующей последовательность(и)-мишень(и).
[0106] Исходный материал может представлять собой РНК или ДНК из клетки, например, из иммунных клеток, или Т-клеток. В некоторых случаях клетка может представлять собой клетку, которая, как известно, или по предположению, содержит желательный полинуклеотид-мишень, такой как иммунный рецептор, например, TCR, или антитело. Например, в случае антитела, клетка-мишень представляет собой клетку, содержащую генные сегменты V, D, J, кодирующие антитело, и включает константную область. В некоторых вариантах осуществления полинуклеотид-мишень содержит сегменты тяжелой цепи (сегменты V, D, J) или сегменты легкой цепи (сегменты V, J).
[0107] Исходный полинуклеотидный материал, такой как РНК, может быть подвергнут обратной транскрипции в кДНК с использованием одного полинуклеотида или целого пула. Примеры праймеров в пуле полинуклеотидов для обратной транскрипции полинуклеотида-мишени могут содержать часть, комплементарную области полинуклеотида-мишени, и/или могут включать последовательности для обратной транскрипции всего транскриптома или его части. В некоторых случаях полинуклеотиды могут включать область, комплементарную области РНК-мишени, такой как константная область мишени или поли-А-хвост мРНК. В некоторых случаях множественные олигонуклеотиды, такие как праймеры, могут быть использованы для отжига одной или нескольких последовательностей-мишеней, представляющие собой константные области. В некоторых аспектах один или несколько полинуклеотидов включают в себя специфичные, polydT и/или случайные гексамерные праймеры.
[0108] Для проведения реакции обратной транскрипции может быть использована обратная транскриптаза. В конкретных вариантах осуществления обратная транскриптаза может обладать нематричной терминальной трансферазной активностью. Когда обратная транскриптаза, обладающая нематричной активностью терминальной трансферазы, достигает конца матрицы, она может добавлять три или более нематричных остатка, например, три или более нематричных остатков цитозина. В некоторых вариантах осуществления для этой цели используется обратная транскриптаза Superscript II ™. В некоторых вариантах осуществления для этой цели используется обратная транскриптаза Maxima ™. В некоторых вариантах осуществления для этой цели используется обратная транскриптаза Protoscript II ™. В некоторых вариантах осуществления для этой цели используется обратная транскриптаза вируса мышиного лейкоза Малони (MMLV-RT). В некоторых вариантах осуществления для этой цели используется обратная транскриптаза HighScriber ™. В некоторых вариантах осуществления для этой цели используется терминальная дезоксинуклеотидилтрансфераза. В некоторых вариантах осуществления для этой цели используют обратную транскриптазу вируса миелобластоза птиц (AMV). Может быть использована любая обратная транскриптаза, способная транскрибировать РНК, и обладающая нематричной терминальной трансферазной активностью. Также, может быть использована любая обратная полимераза, способная транскрибировать РНК, и обладающая нематричной концевой трансферазной активностью. Можно использовать любую обратную полимеразу, способную транскрибировать ДНК, обладающую нематричной терминальной трансферазной активностью. кДНК, полученная в результате обратной транскрипции, может быть помечена одним или несколькими штрих-кодами. В некоторых примерах кДНК, полученная в результате обратной транскрипции, может быть помечена штрих-кодом носителя и молекулярным штрих-кодом. Для маркировки штрих-кодом могут быть использованы различные олигонуклеотиды конкретной конструкции.
[0109] В некоторых вариантах осуществления переключение матриц можно использовать для создания библиотек с целью, например, секвенирования иммунного репертуара и/или анализа транскриптома. Например, переключение матриц может использоваться в ходе обратной транскрипции для генерации области продукта обратной транскрипции, комплементарной полинуклеотиду, несущему штрих-код, такой как штрих-код носителя или молекулярному штрих-коду носителя. Переключение матриц может использоваться во время обратной транскрипции для устранения проблем, связанных с ПЦР. Эти методы можно использовать для секвенирования антител, например, с помощью высокопропускной платформы секвенирования.
[0110] В некоторых вариантах осуществления штрих-код носителя включает в себя участок рандомизированной последовательности, фланкированный сайтами известных праймеров. Например, кДНК может быть помечена штрих-кодом носителя, включающим участок из ~20 вырожденных нуклеотидов с/без одного или более определенных интеркалирующих оснований, такой как NNNNWNNNNWNNNNWNNNNW (SEQ ID NO: 99; где N - любое нуклеотид и W - конкретное интеркалирующее основание, представляющее собой A или T), или NNNNWISCNNNWISCNNN (SEQ ID NO: 100; где N - любой нуклеотид; W - конкретное интеркалирующее основание, представляющее собой A или T; I - конкретное интеркалирующее основание, представляющее собой A, T, G или C (то есть N); и где S представляет собой интеркалирующее основание, являющееся G или C; а C представляет собой конкретный интеркалирующий цитозин). Другие иллюстративные последовательности, включенные в олигонуклеотиды со штрих-кодом носителя, включают NNNNWNNNNWNNNN (SEQ ID NO:80), WNNNNWNNNNWNNNN (SEQ ID NO:81), NWNNNWNNNNWNNNN (SEQ ID NO:82) или NNWNNNNWNNNNWNNNN (SEQ ID NO:83), где N представляет собой любой нуклеотид, а W представляет собой аденин или тимин. Штрих-код носителя также может включать в себя сайты известных праймеров, которые могут распознаваться прямым и обратным праймерами для амплификации штрих-кодов носителей в реакционной смеси до их прикрепления к транскриптам или маркировки, например, в ходе отжига. Примеры праймеров со штрих-кодом носителя приведены в SEQ ID NO: 4 и SEQ ID NO: 5 или SEQ ID NO: 10 и SEQ ID NO: 11. В некоторых случаях совокупность штрих-кодов носителей, содержащих те же самые участки праймеров, но со смещением по основаниям в вырожденной части, на два или более, представленых любой из SEQ ID NO: 80, 81, 83, 99 или 100, добавляется в носителя для получения маркированных полинуклеотидных продуктов, смещенных по основанию для увеличения разнообразия продуктов в процессе секвенирования. В некоторых вариантах осуществления олигонуклеотид, содержащий штрих-код носителя, является частью адаптера, такого как первый адаптер, содержащий сайт универсального праймера (например, P7). Первый адаптер, как описано здесь, может включать в себя универсальный сайт праймирования и штрих-код носителя. Примеры таких олигонуклеотидов, содержащих штрих-коды носителей, включая универсальный сайт праймирования, вырожденную часть и праймеры, представлены SEQ ID NO: 2, 6, 7, 8 или 9 или представляют собой пул любых двух или более из SEQ ID NO: 6, 7, 8 или 9. В некоторых случаях штрих-код носителя или пул штрих-кодов носителя можно использовать для маркировки молекул кДНК, обработанных в одном носителе. В конкретных примерах молекулы кДНК, обработанные в одном носителе, являются комплементарными молекулам РНК одной и той же клетки.
[0111] В некоторых вариантах осуществления молекулярный штрих-код включает в себя вырожденную последовательность для уникальной маркировки полинуклеотидных транскриптов при реакции обратной транскрипции. В некоторых аспектах молекулярный штрих-код является частью олигонуклеотида переключения матрицы, причем олигонуклеотид переключения матрицы включает в себя последовательности матрицы для обратной транскриптазы, и, таким образом, молекулярный штрих-код включается в каждый комплементарный полинуклеотид. В некоторых вариантах осуществления олигонуклеотид переключения матрицы может содержать (1) 5'-концевую область, комплементарную 3'-маркированному полинуклеотиду первого адаптера, содержащему штрих-код носителя, (2) молекулярный штрих-код и (3) 3'-часть комплементарную 3'-концу выступа. В некоторых вариантах осуществления молекула переключения матрицы, такая как олигонуклеотид переключения матрицы, содержащий штрих-код (например, молекулярный штрих-код), может включать модифицированные основания для минимизации артефактов. Иллюстративный олигонуклеотид переключения матрицы, содержащий иллюстративный молекулярный штрих-код, приведен в SEQ ID NO: 3.
[0112] Реакции обратной транскрипции, такие как описанные выше, могут проводиться в присутствии 3'-маркированного (меченого) полинуклеотида. 3'-маркированный полинуклеотид может быть полинуклеотидом, используемым для добавления нуклеиновых кислот к 3'-концу выбранного полинуклеотида, такого как кДНК-мишень, или к полинуклеотиду (например, кДНК), комплементарному транскрипту клеточного транскриптома. 3'-маркированный полинуклеотид может быть полинуклеотидом, используемым в качестве матрицы для достройки нуклеиновых кислот на 3'-конце полинуклеотида-мишени, например, в кДНК. 3'-маркированный полинуклеотид может представлять собой полинуклеотид, который гибридизуется с 3'-концом полинуклеотида-мишени, такого как кДНК. 3'-маркированный полинуклеотид может представлять собой полинуклеотид, содержащий 3'-область, такую как 3'-концевая область, гибридизующуюся с 3'-концом полинуклеотида-мишени, например, кДНК. Например, 3'-маркированный полинуклеотид может содержать сегмент, такой как сегмент, который отжигается до трех или более нематричных остатков. В некоторых вариантах осуществления 3'-маркированный полинуклеотид представляет собой полинуклеотид, несущий молекулярный штрих-код. В некоторых вариантах осуществления 3'-маркированный полинуклеотид может содержать молекулярный штрих-код. В некоторых вариантах осуществления 3'-маркированный полинуклеотид может содержать 3'-остатки рибогуанозина или аналоги такового на 3'-конце (rGrGrG) (т.е. основания РНК), которые являются комплементарными и могут отжигаться с цепью, продуцируемой ферментом обратной транскрипции (например, последовательностью CCC). В некоторых вариантах осуществления три или более остатков гуанина можно использовать вместо остатков рибогуанозина (т.е. нуклеотиды ДНК вместо нуклеотидов РНК). В некоторых вариантах осуществления 3'-маркированный полинуклеотид может содержать 1 или 2 остатка рибогуанозина на 3'-конце и остаток рибогуанозина или его аналог на 3'-конце (rGrGG), которые являются комплементарными и применимыми для отжига цепи, полученной в результате работы фермента обратной транскрипции (например, последовательность CCC).
[0113] После отжига 3'-маркированного/меченого полинуклеотида с ССС цепи кДНК, обратная транскриптаза может продолжать удлинять кДНК по длине маркированного полинуклеотида, тем самым присоединяя молекулярный штрих-код или комплементарный ему к целевой популяции полинуклеотидов, таких как кДНК, в процессе реакции. Например, 3'-маркированный полинуклеотид может представлять собой полинуклеотид, содержащий участок от 5' до 3', который гибридизуется с 3' концом полинуклеотида-мишени. Участок от 5' до 3', гибридизующийся с 3' концом полинуклеотида-мишени, может содержать область, которая не комплементарна полинуклеотиду-мишени, представленному кДНК. Участок от 5' до 3', гибридизующийся с 3' концом полинуклеотида-мишени, может содержать молекулярный штрих-код. Участок от 5' до 3', гибридизующийся с 3' концом полинуклеотида-мишени, может содержать участок, комплементарный полинуклеотиду, со штрих-кодом носителя или быть комплементарным полинуклеотиду, комплементарному таковому. В других экспериментах переключение матриц можно проводить в отдельных реакциях. Например, 3'-маркированный полинуклеотид может быть добавлен после реакции обратной транскрипции, и ферменты, такие как обратная транскриптаза или полимераза, могут использоваться для достройки маркированного полинуклеотида. Поскольку маркированный полинуклеотид может содержать уникальный вырожденный молекулярный штрих-код на каждой молекуле носителя, каждая кДНК носителя может быть индивидуально помечена/маркирована молекулярным штрих-кодом. В некоторых вариантах осуществления переключение матрицы может быть выполнено одновременно с реакцией обратной транскрипции.
[0114] В некоторых вариантах осуществления 3'-маркированный полинуклеотид, такой как полинуклеотид с молекулярным штрих-кодом, может дополнительно содержать 5'-область, такую как 5'-концевая область, комплементарную 3'-маркированному полинуклеотиду или ей комплементарную и содержать другой штрих-код, например, штрих-код носителя. В некоторых вариантах осуществления полинуклеотид-мишень, содержащий молекулярный штрих-код или полинуклеотид, комплементарный таковому, такой как маркированная молекула кДНК, может содержать 3'-область, такую как 3'-концевая область, которая комплементарна 3'-маркированному полинуклеотиду или ей комплементарную, и содержащую другой штрих-код, такой как штрих-код носителя.
[0115] В некоторых вариантах 3'-маркированный полинуклеотид представляет собой полинуклеотид со штрих-кодом носителя. После генерации полинуклеотида, содержащего молекулярный штрих-код или его комплемент, из полинуклеотида-мишени, к полинуклеотиду-мишени с молекулярным штрих-кодом может быть добавлен штрих-код носителя. 3'-маркированный полинуклеотид может быть полинуклеотидом, используемым для достройки нуклеиновых кислот в направлении 3'-конца полинуклеотида-мишени, такого как полинуклеотид-мишень с молекулярным штрих-кодом. 3'-маркированный полинуклеотид может быть полинуклеотидом, используемым в качестве матрицы для достройки нуклеиновых кислот в направлении 3'-конца полинуклеотида-мишени, такого как полинуклеотид-мишень с молекулярным штрих-кодом. 3'-маркированный полинуклеотид может представлять собой полинуклеотид, который гибридизуется с 3'-концом полинуклеотида-мишени, такого как полинуклеотид-мишень с молекулярным штрих-кодом. 3'-маркированный полинуклеотид может быть полинуклеотидом, который содержит 3'-область, такую как 3'-концевая область, которая гибридизуется с 3'-концом полинуклеотида-мишени, такого как полинуклеотид-мишень с молекулярным штрих-кодом. Полинуклеотид со штрих-кодом носителя может содержать 3'-область, такую как 3'-концевая область, которая гибридизуется с 3'-концом полинуклеотида-мишени, обладающего молекулярным штрих-кодом.
[0116] После отжига 3'-маркированного полинуклеотида с полинуклеотидом-мишенью, обладающим молекулярным штрих-кодом, обратная транскриптаза может продолжать удлинять кДНК в направлении 3'-маркированного полинуклеотида, такого как полинуклеотид со штрих-кодом носителя, тем самым прикрепляя штрих-код носителя или его комплемент к целевой популяции полинуклеотидов, таких как полинуклеотиды-мишени с молекулярным штрих-кодом, в процессе реакции. Например, 3'-маркированный полинуклеотид может представлять собой полинуклеотид, содержащий участок от 5' до 3', который гибридизуется с 3' концом полинуклеотида-мишени с молекулярным штрих-кодом. Участок от 5' до 3', гибридизующийся с 3'-концом полинуклеотида-мишени с молекулярным штрих-кодом, может содержать область, которая не комплементарна полинуклеотиду-мишени или полинуклеотиду с молекулярным штрих-кодом. Участок от 5' до 3', который гибридизуется с 3'-концом полинуклеотида-мишени с молекулярным штрих-кодом, может содержать штриховой код носителя.
[0117] В некоторых вариантах осуществления 3'-маркированный полинуклеотид представляет собой продукт амплификации. В некоторых вариантах осуществления 3'-маркированный полинуклеотид представляет собой продукт амплификации одной молекулы. В некоторых вариантах осуществления 3'-маркированный полинуклеотид представляет собой продукт амплификации полинуклеотида со штрих-кодом носителя. В некоторых вариантах осуществления 3'-маркированный полинуклеотид представляет собой продукт амплификации единственного полинуклеотида со штрих-кодом носителя. Участок, расположенный в районе от 5' до 3' области, который гибридизуется с 3' концом полинуклеотида-мишени с молекулярным штрих-кодом, может содержать область, комплементарную праймеру или его комплементу. Участок 5'-3' области, которая гибридизуется с 3' концом полинуклеотида-мишени с молекулярным штрих-кодом, может содержать область, комплементарную праймеру или его комплементу, который может быть применен для амплификации полинуклеотида, несущего штрих-код носителя.
[0118] В некоторых вариантах осуществления 3'-меченый полинуклеотид может действовать в качестве праймера, например, как прямой праймер, для амплификации кДНК, содержащей молекулярный штрих-код, и ДНК-полимераза способна удлинять последовательность с образованием одноцепочечной полинуклеотидной молекулы с двойным штрих-кодом, которая комплементарна кДНК и содержит штрих-код носителя, молекулярный штрих-код и кодирующую последовательность гена-мишени или транскрипта. В некоторых вариантах осуществления одноцепочечная полинуклеотидная молекула с двойным штрих-кодом содержит в направлении от 5' до 3': штрих-код носителя, молекулярный штрих-код, кодирующую последовательность гена-мишени или транскрипта и первый адаптер. В некоторых вариантах осуществления олигонуклеотид, содержащий штрих-код носителя, содержит второй адаптер, а одноцепочечная полинуклеотидная молекула с двойным штрих-кодом содержит в направлении от 5' до 3': второй адаптер, штрих-код носителя, молекулярный штрих-код, кодирующую последовательность для гена-мишени или транскрипта и первый адаптер.
[0119] Меченая кДНК, полученная в результате обратной транскрипции, может быть амплифицирована один или несколько раз, например, с помощью ПЦР-амплификации. Для амплификации можно использовать различные праймеры определенной конструкции. Продукт первой реакции амплификации, такой как ПЦР, может быть амплифицирован с использованием второй реакции амплификации, такой как первая или вторая фаза ПЦР. Различные праймеры могут быть использованы для стадии амплификации. Библиотека амплифицированных полинуклеотидов может быть создана с использованием способов, описанных в настоящем документе. В некоторых примерах получающаяся библиотека может содержать полную или частичную последовательность антитела или TCR с соответствующими молекулярными штрих-кодами и штрих-кодами носителей. Библиотека также может содержать последовательности, соответствующие одному или нескольким транскриптам частичного или полного транскриптома с соответствующими молекулярными штрих-кодами и штрих-кодами носителей.
[0120] Затем может быть амплифицирован полинуклеотид-мишень с двойным штрих-кодом, такой как кДНК, содержащий молекулярный штрих-код и штрих-код носителя, например, посредством ПЦР. ПЦР можно проводить, например, с использованием набора праймеров. Продукт вышеупомянутой реакции ПЦР можно затем либо амплифицировать один или несколько раз, например, в процессе одного или нескольких циклов ПЦР, либо непосредственно секвенировать. В некоторых вариантах осуществления набор праймеров может включать прямой и/или обратный праймер(ы), спецефичные к первому и/или второму адаптеру. В некоторых вариантах осуществления набор праймеров может включать в себя олигонуклеотид, содержащий штрих-код носителя в качестве прямого праймера, и обратный праймер, специфичный для первого адаптера. В некоторых вариантах осуществления набор праймеров может включать в себя наборы праймеров, которые включают прямой и обратный праймеры, которые связывают второй и первый адаптеры, и олигонуклеотид, содержащий штрих- код носителя, в качестве дополнительного праймера, например, в качестве дополнительного прямого праймера. Примеры праймеров описаны в Примерах здесь.
[0121] При секвенировании последовательности с одинаковыми молекулярными штрих-кодами могут быть сгруппированы или спарены. При секвенировании последовательности с одинаковыми штрих-кодами носителей могут быть сгруппированы или спарены. При секвенировании последовательности с идентичными последовательностями-мишенями могут быть сгруппированы или спарены. В некоторых вариантах осуществления считывания последовательности могут быть объединены в консенсусные последовательности. Свертывание сгруппированных или парных последовательных считываний в консенсусную согласованную последовательность может, таким образом, уменьшить или устранить ошибки секвенирования и ПЦР. Секвенирование может быть выполнено с использованием сайта первого праймера для первого считывания. Секвенирование может быть выполнено с использованием сайта первого праймера для второго считывания. Секвенирование может быть выполнено с использованием сайта второго праймера для второго считывания.
[0122] В некоторых вариантах осуществления цепи иммунного рецептора, такие как цепи TCR или антитела, содержащие одинаковые штрих-коды носителей, могут быть спарены. В некоторых случаях тяжелые и легкие цепи антител, содержащие одинаковые штрих-коды носителя, могут быть спарены. В некоторых вариантах осуществления парные цепи могут быть клонированы в векторной системе для клеток млекопитающего. Конструкция иммунного рецептора, такого как антитело, может быть экспрессирована в других линиях клеток-хозяев человека или млекопитающих. Затем эту конструкцию можно проверить с помощью метода транзиентной трансфекции и вестерн-блоттинга экспрессированного антитела или TCR, представляющего интерес.
[0123] В некоторых аспектах изобретение обеспечивает способ создания библиотеки последовательностей антител тяжелой и легкой цепи и/или последовательностей TCR альфа- и бета-цепи и/или последовательностей TCR гамма- и дельта-цепи, включающий получение множества конструкций нуклеиновых кислот с уникальными штрих-кодами, где каждая конструкция включает в себя уникальный N-mer и функциональный N-mer. Функциональный N-mer может быть представлять собой случайный N-mer, ПЦР-праймер, универсальный праймер, антитело, липкий конец или любую другую последовательность. Способ может включать создание М наборов, каждый включающий N жидкостных компартментов, каждый из которых содержит одну или несколько копий уникальной конструкции. Этим методом можно создавать штрих-кодовые библиотеки более высокой сложности, добавляя дополнительную конструкцию к каждому компартменту в наборе и повторяя ее для каждого набора, так, чтобы создать M отделений, каждое из которых содержит уникальную пару конструкций. Эти пары могут быть гибридизованы или лигированы для получения новых конструкций. В каждой конструкции в штрих-кодовой библитеке каждый уникальный N-мер может быть подготовлен для идентификации методами секвенирования, гибридизации зонда-носителя, других методов или комбинации методов.
[0124] Способы амплификации РНК или ДНК хорошо известны и могут быть использованы в соответствии с настоящим изобретением, на основе предоставленных здесь инструкциях и руководствах, без чрезмерных экспериментов. Известные способы амплификации ДНК или РНК включают, но не ограничиваются ими, полимеразную цепную реакцию (ПЦР) и связанные с ней процессы амплификации (см., например, патенты США 4,683,195, 4,683,202, 4,800,159, 4,965,188, (Mullis, et al).; 4,795,699 and 4,921,794 (Tabor, et al); 5,142,033 (Innis); 5,122,464 (Wilson, et al.); 5,091,310 (Innis); 5,066,584 (Gyllensten, et al); 4,889,818 (Gelfand, et al).; 4,994,370 (Silver, et al.); 4,766,067( Biswas); 4,656,134 (Ringold) и РНК-опосредованная амплификацию, использующую антисмысловую РНК к последовательности-мишени в качестве матрицы для синтеза двухцепочечной ДНК (патент США № 5130238, (Malek et al) с торговым названием NASBA), при этом все содержание этих ссылок включено сюда посредством ссылки (см., например, Current Protocols in Molecular Biology (CPMB) (Fred M. Ausubel, et al. ed., John Wiley and Sons, Inc.); or J. Sambrook et al., “Molecular Cloning: A Laboratory Manual,” 1989, 2nd Ed., Cold Spring Harbour Laboratory Press: New York, N.Y.).
[0125] Удобством является то, что описанные здесь стадии способа, такие как амплификация, секвенирование и тому подобное, могут выполняться или не выполняться в формате мультиплексного анализа, использующего твердую фазу, на которой множество субстратов, например антигены, и тому подобные, могут быть иммобилизованы, например, в форме матрицы (array). В некоторых вариантах осуществления такая матрица представляет собой белковый биочип. Используя белковые биочипы, можно проверять сотни и даже тысячи антигенов. Используемый здесь термин «матрица», «микрочип» или «биочип» относится к твердой подложке, имеющей в целом плоскую поверхность, к которой прикреплен адсорбент. Часто поверхность биочипа содержит множество «адресных» позиций, каждое из которых имеет свой адсорбент. Биочипы могут быть адаптированы и использованы в качестве интерфейса зонда и, следовательно, функционировать как зонды. «Белковый биочип» относится к биочипу, приспособленному для распознавания и захвата полипептидов. Многие белковые биочипы описаны в данном уровне техники. Способы получения полипептидных матриц описаны, например, в De Wildt et al, 2000, Nat. Biotechnol. 18: 989-994; Lueking et al., 1999, Anal. Biochem. 270: 103-1 11; Ge, 2000, Nucleic Acids Res. 28, e3, 1- VH; MacBeath and Schreiber, 2000, Science 289: 1760-1763; WO 01/40803 и WO 99/51773A1. Использование матриц позволяет выполнять несколько стадий, таких как сортировка, машинизированным и/или высокопроизводительным способом. Полипептиды матрицы могут быть обнаружены с высокой скоростью, например, с использованием коммерчески доступного роботизированного устройства, например, производимого Genetic MicroSystems или BioRobotics. Подложкой матрицы может быть, например, нитроцеллюлоза, пластик, стекло, как, например, стекло с модифицированной поверхностью. Матрица также может включать пористый субстрат-подложку, например, акриламид, агарозу или другой полимер.
[0126] При захвате на биочипе, анализируемые молекулы могут быть обнаружены различными способами, выбранными, например, из метода газовой фазовой ионной спектрометрии, оптического метода, электрохимического метода, метода атомно-силовой микроскопии и радиочастотного метода. Особый интерес представляет использование масс-спектрометрии и, в частности, SELDI. Оптические методы включают, например, детекцию (выявление) флуоресценции, люминесценции, хемилюминесценции, оптической плотности, отражательной способности, коэффициента пропускания, двулучепреломления или показателя преломления (например, с помощьюим поверхностного плазменного резонанса, эллипсометрии, методом резонансного зеркала, методом волноводной решетки или интерферометрии). Оптические методы включают микроскопию (как конфокальную, так и неконфокальную), методы визуализации и методы без визуализации. Иммуноанализы различных форматов (например, ELISA) является популярным методом обнаружения аналитов (анализируемых молекул), зафиксированных на твердой фазе. Электрохимические методы включают методы вольтамперометрии и амперометрии. Радиочастотные методы включают многополярную резонансную спектроскопию.
[0127] В некоторых вариантах осуществления изобретения используются методики, созданные для работы с отдельными клетками или там, где необходим выбор конкретных популяций клеток. Одна иллюстративная методика включает специальное приспособление, которое может использоваться в FACS для направления отдельных ячеек в отдельные ячейки-контейнеры. Такие приспособления коммерчески доступны и хорошо известны в данной области. Такие приспособления применимы для расфасовки отдельных клеток в выбранные компартменты, например, стандартные 96-луночные планшеты для микротитрования. Альтернативно, клетки могут быть доставлены в микротитровальный планшет при соответствующем разведении, для обеспечения откладки единичных клеток.
[0128] Второй метод представляет собой ПЦР, выполняемую на отдельных иммунных клетках для амплификации сегментов VH и VL или Vα и Vβ или Vγ и Vδ в дополнение к необязательной амплификации транскриптома отдельных иммунных клеток. В некоторых вариантах осуществления ПЦР единичной клетки используется для сохранения нативного спаривания VL и VH или Vα и Vβ или Vγ и Vδ в отдельной клетке. Специфичность антитела или TCR определяется областями, определяющими комплементарность (CDR) в области VL и области VH, или областями Vα и Vβ или Vγ и Vδ соответственно.
[0129] Способы проведения ПЦР единичной клетки хорошо известны (например, Larrick, J.W. et al., Bio/Technology 7: 934 (1989)). Например, B-клетки, продуцирующие антитела, из библиотеки B-клеток или T-клетки, продуцирующие TCR из библиотеки T-клеток, можно фиксировать раствором фиксатора или раствором, содержащим химическое вещество, такое как формальдегид, глутаральдегид или тому подобное. Затем клетки пермеабилизируют пермеабилизирующим раствором, содержащим, например, детергент. Процесс фиксации и пермеабилизации должен обеспечивать достаточную пористость, позволяющую вводить ферменты, нуклеотиды и другие реагенты в клетки без чрезмерного разрушения их клеточных компартментов или нуклеиновых кислот в них. Добавление ферментов и нуклеотидов можно затем вводить в клетки для обеспечения обратной транскрипции клеточной мРНК, включая мРНК VH и VL или Vα и Vβ или Vγ и Vδ, например, в соответствующие последовательности кДНК. В других примерах ПЦР единичной клетки можно проводить в растворе из лизированных нефиксированных клеток, как описано здесь.
[0130] Обратную транскрипцию можно проводить в одну стадию или, необязательно, вместе с процедурой ПЦР, используя обратную транскриптазу, достаточное количество четырех dNTP и праймеров, которые связываются с мРНК, предоставляя 3'-гидроксильную группу для обратной транскриптазы для инициации полимеризации. Мишень-специфические праймеры и/или случайные гексамерные олигонуклеотидные праймеры могут быть использованы для инициации реакции обратной транскрипции и создания высококачественных библиотек секвенирования.
[0131] Для последовательностей-мишеней может быть использован любой праймер, комплементарный мРНК-мишени, однако предпочтительнее использовать праймеры, комплементарные 3'-концевому концу молекул VH и VL или Vα и Vβ или Vγ и Vδ, чтобы облегчить выбор вариабельной области мРНК. Многочисленные исследования показали, что вырожденные полинуклеотиды могут быть подготовлены в качестве 5'-концевых праймеров для VH и VL или Vα и Vβ или Vγ и Vδ. Комбинаторный библиотечный метод получения молекул-мишеней основан на использовании таких праймерах. Кроме того, многочисленные эксперименты показали, что ПЦР может амплифицировать генные сегменты, представляющие интерес, такие как VH и VL или Vα и Vβ или Vγ и Vδ, из отдельной клетки. Благодаря способности работать даже с одной клеткой, эта ПЦР-методика позволяет получать антитела даже когда иммунные клетки, представляющие интерес, встречаются с низкой частотой.
[0132] В некоторых вариантах осуществления после сортировки FACS, клетки библиотеки иммунных клеток объединяют и проводят обратную транскрипцию-ПЦР для всего пула клеток. Генерирование мРНК для клонирования антител или целей TCR легко осуществляется с помощью хорошо известных методик получения и определения характеристик антител или TCR (см., Например, «Antibodies: A Laboratory Manual, 1988»; включено в настоящее описание посредством ссылки). Например, общая РНК из библиотеки В-клеток выделяют с помощью соответствующих методов, являющихся стандартными и общепринятыми в данной области. Затем кДНК синтезируют из РНК соответствующими методами, например, используя случайные гексамерные полинуклеотиды, или специфичные для семейства C-гена или C-гена праймеры, или специфичные для семейства V-гена или V-гена праймеры. Опять же, эти процессы известны специалистам в данной области, как объяснено выше. Библиотеки молекул нуклеиновых кислот, полученных из В-клеточных или Т-клеточных библиотек, например, библиотеки молекул РНК или кДНК, полученных из таких В- или Т-лимфоцитов, могут быть клонированы в векторы экспрессии с образованием библиотек экспрессии. В некоторых вариантах осуществления амплифицируется только домен VH или Vα или Vγ, полученный из библиотеки иммунных клеток, для создания библиотеки доменов VH или Vα или Vγ. Библиотека VL или Vβ или Vδ из другого источника используется в сочетании с библиотекой VH или Vα или Vγ для генерирования антител или TCR способами, описанными здесь. Библиотеки фрагментов антител или TCR могут быть сконструированы путем объединения библиотек VH и VL или Vα и Vβ или Vγ и Vδ любым способом, известным специалистам в данной области. Например, каждая библиотека может быть создана в разных векторах, а векторы рекомбинированы in vitro или in vivo. Альтернативно, библиотеки могут быть клонированы последовательно в один и тот же вектор или собраны вместе посредством ПЦР и затем клонированы. ПЦР-сборка также может быть использована для oбъединения VH и VL или Vα и Vβ или Vγ и Vδ с ДНК, кодирующей гибкий пептидный спейсер, с образованием одноцепочечных библиотек Fv (scFv), как описано в другом месте данного документа. В еще одном методе внутриклеточная сборка методом ПЦР используется для объединения генов VH и VL или Vα и Vβ или Vγ и Vδ в лимфоцитах посредством ПЦР, а затем репертуар взаимосвязанных генов клонируется.
1. Полинуклеотиды-мишени
[0133] В вариантах осуществления способы, представленные в настоящем документе, направлены на амплификацию и секвенирование полинуклеотидной молекулы-мишени, такой как внутриклеточная полинуклеотидная молекула. В некоторых случаях способы, представленные в настоящем документе, направлены на амплификацию и секвенирование двух или более областей полинуклеотидной молекулы-мишени. В некоторых случаях способы, представленные в настоящем документе, направлены на амплификацию и секвенирование двух или более молекул-мишеней полинуклеотидов, таких как две или более молекул в естественной паре. В одном аспекте полинуклеотиды-мишени представляют собой РНК. В одном аспекте полинуклеотиды-мишени представляют собой геномные нуклеиновые кислоты. ДНК, полученная из генетического материала хромосом конкретного организма, может быть геномной ДНК.
[0134] В некоторых вариантах осуществления ссылка на «нуклеиновокислотную молекулу-мишень», «полинуклеотид-мишень», «полинуклеотидную молекулу-мишень» относится к любой представляющей интерес нуклеиновой кислоте.
[0135] В некоторых вариантах осуществления полинуклеотиды-мишени включают последовательности, содержащие вариабельные области иммунного рецептора, такого как антитело или TCR, продуцируемые иммунной клеткой.
[0136] В некоторых вариантах осуществления полинуклеотиды-мишени включают две или более цепей иммунного рецептора, которые естественным образом спарены для образования иммуно-рецептора или его связывающего фрагмента. В некоторых вариантах осуществления полинуклеотиды-мишени включают последовательности, содержащие вариабельную область тяжелой цепи антитела, продуцируемого иммунной клеткой. В некоторых вариантах осуществления полинуклеотиды-мишени включают последовательности, содержащие вариабельную область легкой цепи антитела, продуцируемого иммунной клеткой. В некоторых вариантах осуществления полинуклеотиды-мишени включают последовательности, содержащие вариабельную область тяжелой цепи, и последовательности, содержащие вариабельную область легкой цепи антитела, продуцируемого той же иммунной клеткой.
[0137] Таким образом, термин «антитело» в настоящем документе используется в самом широком смысле и включает поликлональные и моноклональные антитела, включая интактные антитела и их функциональные (антигенсвязывающие) фрагменты антител, включая фрагменты антигенсвязывающих (Fab) фрагментов, F(ab ')2 фрагментов, фрагменты Fab ', фрагменты Fv, фрагменты рекомбинантного IgG (rIgG), фрагменты одноцепочечных антител, включая вариабельные фрагменты с одной цепью (scFv), и фрагменты антител с одним доменом (например, sdAb, sdFv, nanobody). Термин охватывает генно-инженерные и/или иным образом модифицированные формы иммуноглобулинов, такие как внутриклеточные антитела, пептидные антитела, химерные антитела, полностью человеческие антитела, антитела, адаптированные для человека и гетероконъюгатные антитела, мультиспецифичные, например, биспецифичные, антитела, диатела, триатела и тетра-тела, тандем di-scFv, тандем tri-scFv. Если не указано иное, следует понимать, что термин «антитело» охватывает его функциональные фрагменты. Термин также охватывает интактные или полноразмерные антитела, включая антитела любого класса или подкласса, включая IgG и его подклассы, IgM, IgE, IgA и IgD.
[0138] В данной области известно, что термины «область, определяющая комплементарность» и «CDR», являются синонимами к терминам «гипервариабельная область» или «HVR» и относятся к несмежным последовательностям аминокислот в вариабельных областях антитела, которые придают антигену специфичность и/или аффинность при связывании. Как правило, в каждой вариабельной области тяжелой цепи имеется три CDR (CDR-H1, CDR-H2 и CDR-H3) и еще три CDR расположены в каждой вариабельной области легкой цепи (CDR-L1, CDR-L2 и CDR-L3). Термины «каркасные области» и «FR/framework regions» известны в данной области техники и относятся к фрагментам вариабельных областей тяжелой и легкой цепей, не относящимся к CDR. Как правило, в каждой вариабельной области полноразмерной тяжелой цепи (FR-H1, FR-H2, FR-H3 и FR-H4) имеется четыре FRs и четыре FR имеются в каждой вариабельной области полноразмерной легкой цепи (FR- L1, FR-L2, FR-L3 и FR-L4).
[0139] Точные границы аминокислотной последовательности данного CDR или FR могут быть легко определены с использованием любой из ряда хорошо известных схем, в том числе описанных Kabat et al. (1991), “Sequences of Proteins of Immunological Interest,” 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (“Kabat” numbering scheme), Al-Lazikani et al., (1997) JMB 273,927-948 (“Chothia” numbering scheme), MacCallum et al., J. Mol. Biol. 262:732-745 (1996), “Antibody-antigen interactions: Contact analysis and binding site topography,” J. Mol. Biol. 262, 732-745.” (“Contact” numbering scheme), Lefranc MP et al., “IMGT unique numbering for immunoglobulin and T cell receptor variable domains and Ig superfamily V-like domains,” Dev Comp Immunol, 2003 Jan;27(1):55-77 (“IMGT” numbering scheme), and Honegger A and Plückthun A, “Yet another numbering scheme for immunoglobulin variable domains: an automatic modeling and analysis tool,” J Mol Biol, 2001 Jun 8;309(3):657-70, (“Aho” numbering scheme).
[0140] Таким образом, если не указано иное, термины «CDR» или «область, определяющая комплементарность», или отдельные указанные CDR (например, «CDR-H1, CDR-H2) данного антитела или фрагмент такового, например, вариабельная область, следует понимать как охватывающую некую (или конкретную) область, определяющую комплементарность, как определено любой из вышеупомянутых схем. Например, если указано, что конкретный CDR (например, CDR-H3) содержит аминокислотную последовательность соответствующего CDR в данной аминокислотной последовательности VH или VL, то подразумевается, что такой CDR имеет последовательность, соответствующую CDR (например, CDR-H3) в вариабельной области, как определено любой из вышеупомянутых схем. В некоторых вариантах указаны конкретные последовательности CDR.
[0141] Аналогично, если не указано иное, следует понимать, что FR или отдельный указанный FR (например, FR-H1, FR-H2) данного антитела или его области, например, вариабельной области, охватывает некую (или конкретная) каркасную область, как определено любой из известных схем. В некоторых случаях указывается схема для идентификации конкретных CDR, FR или FR или CDR, таких как CDR, как определено методом Kabat, Chothia или Contact. В других случаях указана конкретная аминокислотная последовательность CDR или FR.
[0142] Термин «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно имеют сходные структуры, причем каждый домен содержит четыре консервативных каркасных области (FR) и три CDR. (См., Например, Kindt et al. Kuby Immunology, 6th ed., WH Freeman and Co., стр. 91 (2007). Одного домена VH или VL может быть достаточно для придания антигенсвязывающей специфичности. Кроме того, антитела, которые связывают конкретный антиген, могет быть выделены с использованием домена VH или VL антитела, связывающего антиген, для скрининга библиотеки комплементарных доменов VL или VH, соответственно. См., например, Portolano et al., J. Immunol. 150: 880-887 (1993); Clarkson et al., Nature 352: 624-628 (1991).
[0143] Среди предоставленных антител есть фрагменты антител. «Фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, связывающую антиген, с которым связывается интактное антитело. Примеры фрагментов антител включают, но не ограничиваются таковыми: Fv, Fab, Fab ', Fab'-SH, F (ab') 2; димеры; линейные антитела; молекулы одноцепочечных антител (например, scFv); и мультиспецифичные антитела, сформированные из фрагментов антител. В конкретных вариантах осуществления антитела представляют собой одноцепочечные фрагменты антител, содержащие вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, такую как scFv.
[0144] Иммуноглобулины (Igs), экспрессируемые В-клетками, в некоторых аспектах представляют собой белки, состоящие из четырех полипептидных цепей, двух тяжелых цепей (IgH) и двух легких цепей (IgL), образующих структуру H2L2. Каждая пара цепей IgH и IgL содержит гипервариабельный домен, состоящий из области VL и области VH, и константный домен. Цепи IgH Ig принадлежат к нескольким типам: μ, δ, γ, α и β. Разнообразие Igs в конкретном субъекте (человек) в основном определяется гипервариабельным доменом. Подобно TCR, V-домен цепей IgH создается комбинаторным соединением генных сегментов VH, DH и JH. Независимое добавление и делеция нуклеотидов на границах VH -DH, DH-JH и VH -JH в процессе перестройки гена Ig дополнительно увеличивает разнообразие последовательностей гипервариабельных доменов. Здесь иммунокомпетентность отражается в разнообразии Igs.
[0145] Термин «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно имеют сходные структуры, причем каждый домен содержит четыре консервативных каркасных области (FR) и три CDR. (См., например, Kindt et al. Kuby Immunology, 6th ed., WH Freeman and Co., стр. 91 (2007). Одного домена VH или VL может быть достаточно для придания антигенсвязывающей специфичности. Кроме того, антитела, которые связывают конкретный антиген, могет быть выделены с использованием домена VH или VL из антитела, связывающего антиген, для скрининга библиотеки комплементарных доменов VL или VH, соответственно. См., например, Portolano et al., J. Immunol. 150: 880-887 (1993); Clarkson et al., Nature 352: 624-628 (1991).
[0146] Термин «гипервариабельная область» относится к аминокислотным остаткам антитела или TCR, которые отвечают за связывание антигена. Гипервариабельная область содержит аминокислотные остатки области, определяющей комплементарность, или CDR. Остатки каркаса или FR представляют собой те остатки вариабельного домена, которые не являются остатками гипервариабельной области, как определено в настоящем документе.
[0147] Среди представленных антител представляют также фрагменты антител. «Фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, связывающую антиген, с которым связывается интактное антитело. Примеры фрагментов антител включают, но не ограничиваются ими, Fv, Fab, Fab ', Fab'-SH, F (ab') 2; димеры; линейные антитела; молекулы одноцепочечных антител (например, scFv); и мультиспецифичные антитела, сформированные из фрагментов антител. В конкретных вариантах осуществления антитела представляют собой одноцепочечные фрагменты антител, содержащие вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, такую как scFv.
[0148] Однодоменные антитела представляют собой фрагменты антител, включающие весь или часть вариабельного домена тяжелой цепи или весь или часть вариабельного домена легкой цепи антитела. В определенных вариантах осуществления однодоменное антитело представляет собой человеческое однодоменное антитело.
[0149] Фрагменты антител могут быть получены различными способами, включая, но не ограничиваясь таковыми: протеолитическое расщепление интактного антитела, а также продуцирование рекомбинантными клетками-хозяевами. В некоторых вариантах осуществления антитела представляют собой рекомбинантно продуцируемые фрагменты, такие как фрагменты, содержащие структуры, которые не встречаются в природе, такие как фрагменты с двумя или более областями или цепями антител, соединенными синтетическими линкерами, например пептидными линкерами, и/или те, которые могут не может быть произведены ферментативным расщеплением нативного интактного антитела. В некоторых аспектах фрагменты антител представляют собой scFv.
[0150] Антигенсвязывающие полипептиды также включают димеры тяжелых цепей, такие как, например, антитела верблюдовых и акул. Антитела верблюда и акулы содержат гомодимерную пару из двух цепей V-подобных и C-подобных доменов (ни одна из них не имеет легкой цепи). Поскольку область VH димера тяжелой цепи IgG верблюда не должна вызывать гидрофобные взаимодействия с легкой цепью, область тяжелой цепи, которая обычно связывается с легкой цепью, заменена на гидрофильные аминокислотные остатки у верблюдовых. Домены VH димерных IgGs тяжелой цепи называются доменами VHH. Ig-NAR акулы содержат гомодимер одного вариабельного домена (называемого доменом V-NAR) и пяти C-подобных константных доменов (доменов C-NAR). У верблюдовых разнообразие репертуара антител определяется CDR 1, 2 и 3 в областях VH или VHH. CDR3 в области VHH верблюдовых характеризуется его относительно большой длиной, составляющей в среднем 16 аминокислот (Muyldermans et al., 1994, Protein Engineering 7 (9): 1129).
[0151] Антитело «адаптированное для человека» представляет собой антитело, в котором все или по существу все аминокислотные остатки CDR получены из CDR, не принадлежащих человеку, а все, или по существу все аминокислотные остатки FR получены из человеческих FR. Адаптированное для человека антитело необязательно может включать по меньшей мере часть константной области антитела, полученной из человеческого антитела. «Форма адаптированного для человека» антитела, не принадлежащего человеку, относится к варианту антитела, не принадлежащего человеку, которое подверглосья изменениям/адаптациям, обычно для снижения иммуногенности для людей, сохраняя при этом специфичность и аффинность родительского антитела, не принадлежащего человеку. В некоторых вариантах осуществления некоторые остатки FR в антителе, адаптированном для человека, замещены соответствующими остатками антитела, не принадлежащего человеку, (например, антитела, из которого получены остатки CDR), например, для восстановления или улучшения специфичности или аффинности антитела.
[0152] Среди предоставленных антител находятся антитела человека. «Антитело человека» представляет собой антитело с аминокислотной последовательностью, соответствующей последовательности антитела, продуцируемого клеткой человека или источником, отличным от человека, который использует репертуар антител человека или другие последовательности, кодирующие антитела человека, включая библиотеки антител человека. Термин исключает формы антител, не принадлежащих человеку, но адаптированных для человека и содержащих «нечеловеческие» антигенсвязывающие области, такие как те, в которых все, или практически все CDR не являются «человеческими» (т.е. не принадлежат человеку).
[0153] Человеческие антитела могут быть получены введением иммуногена трансгенному животному, которое было модифицировано для производства интактных человеческих антител или интактных антител с вариабельными областями человека в ответ на антигенную стимуляцию. Такие животные обычно содержат все или часть локусов иммуноглобулина человека, заменяющие эндогенные локусы иммуноглобулина или присутствующие вне хромосом, или случайным образом интегрированные в хромосомы животного. У таких трансгенных животных эндогенные локусы иммуноглобулина обычно инактивированы. Антитела человека также могут быть получены из библиотек антител человека, включая библиотеки фагового дисплея и бесклеточные библиотеки, содержащие последовательности, кодирующие антитела, полученные из репертуара человека.
[0154] Среди предоставленных антител находятся моноклональные антитела, включая фрагменты моноклональных антител. Термин «моноклональное антитело» в контексте настоящего описания относится к антителу, полученному из популяции или в пределах популяции по существу гомогенных антител, то есть где отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных вариантов, содержащих встречающиеся в природе мутации или возникающий в процессе производства препарата моноклонального антитела, но такие варианты обычно присутствуют в небольших количествах. В отличие от препаратов поликлональных антител, которые обычно включают разные антитела, направленные против разных эпитопов, каждое моноклональное антитело препарата моноклональных антител направлено против одного эпитопа антигена. Термин не следует истолковывать как требующий получения антитела каким-либо конкретным способом. Моноклональное антитело может быть получено различными способами, включая, но не ограничиваясь этим, такими, как: получение из гибридомы, методами рекомбинантной ДНК, методом фагового дисплея и другими методами получения антител.
[0155] В некоторых вариантах осуществления полинуклеотиды-мишени включают последовательности, содержащие вариабельную область альфа-цепи TCR, продуцируемого иммунной клеткой. В некоторых вариантах осуществления полинуклеотиды-мишени включают последовательности, содержащие вариабельную область бета-цепи TCR, продуцируемого иммунной клеткой. В некоторых вариантах осуществления полинуклеотиды-мишени включают последовательности, содержащие вариабельную область альфа-цепи TCR, и последовательности, содержащие вариабельную область бета-цепи TCR, продуцируемого той же самой иммунной клеткой. В некоторых вариантах осуществления полинуклеотиды-мишени включают последовательности, содержащие вариабельную область гамма-цепи TCR, продуцируемого иммунной клеткой. В некоторых вариантах осуществления полинуклеотиды-мишени включают последовательности, содержащие вариабельную область дельта-цепи TCR, продуцируемого иммунной клеткой. В некоторых вариантах осуществления полинуклеотиды-мишени включают последовательности, содержащие вариабельную область гамма-цепи TCR, и последовательности, содержащие вариабельную область дельта-цепи TCR, продуцируемого той же самой иммунной клеткой.
[0156] В некоторых вариантах осуществления TCR охватывает полноразмерные TCR, а также их антигенсвязывающие части или антигенсвязывающие фрагменты (также называемые MHC-пептид-связывающими фрагментами). В некоторых вариантах осуществления TCR представляет собой неповрежденный или полноразмерный TCR. В некоторых вариантах осуществления TCR представляет собой антигенсвязывающую часть, которая меньше полноразмерного TCR, но которая связывается со специфическим антигенным пептидом, связанным (т.е. в контексте) с молекулой MHC, то есть с комплексом MHC-пептид, В некоторых случаях антигенсвязывающая часть или фрагмент TCR может содержать только часть структурных доменов полноразмерного или интактного TCR, но все же способна связывать эпитоп (например, MHC-пептидный комплекс), с которым связывается полноразмерный TCR. В некоторых случаях антигенсвязывающая часть или фрагмент TCR содержит вариабельные домены TCR, такие как вариабельная α-цепь и вариабельная β-цепь TCR, достаточные для формирования сайта связывания для связывания со специфическим комплексом MHC-пептид как, например, такие, где каждая цепь содержит три области, определяющие комплементарность. Термин включает полипептиды или белки, имеющие связывающий домен, который является антигенсвязывающим доменом или гомологичен антигенсвязывающему домену. Эти термины также охватывает grafted (сконструированные) антитела, несущие область, определяющую комплементарность (CDR), TCR и другие адаптированные для человека антитела и TCR (включая модификации CDR и модификации каркасной области). Следует отметить, что хотя ссылаться можно только на цепи иммуноглобулина (например, тяжелые цепи и легкие цепи), раскрытое изобретение может быть применено к множеству других различных типов парных последовательностей, например, к парам цепей рецепторов Т-клеток (TCRα и Цепи TCRβ и цепи TCRγ и TCRδ) и не ограничиваются иммуноглобулинами.
[0157] Способность Т-клеток распознавать антигены, связанные с различными видами рака или инфекционными организмами, обеспечивается их TCR, который состоит как из альфа (α) цепи, так и из бета (β) цепи или гамма (γ) и дельта (δ) цепей. Белки, которые представляют собой эти цепи, кодируются ДНК, которая использует уникальный механизм для создания огромного разнообразия TCR. Этот мультисубъединичный иммунный рецептор распознавания ассоциируется с комплексом CD3 и связывает пептиды, представленные белками МНС класса I и II, на поверхности антигенпрезентующих клеток (АРС). Связывание TCR с антигенным пептидом на поверхности APC является центральным событием в активации T-клеток, происходящим в иммунологическом синапсе в точке контакта между T-клеткой и APC.
[0158] Каждый TCR содержит области, определяющие вариабельную комплементарность (CDR), и каркасные области (FR). Петли аминокислотной последовательности третьей области, определяющей комплементарность (CDR3) вариабельных доменов α- и β-цепей в значительной степени определяет вариабельность последовательностей αβ Т-клеток, возникающее в результате рекомбинации между вариабельной (Vβ), разнообразной (Dβ) и присоединяющейся (Jβ) областями гена в локусе β-цепи и между аналогичными сегментами гена Vα и Jα в локусе гена α-цепи, соответственно. Наличие множества таких генных сегментов в локусах α и β цепи TCR позволяет кодировать большое количество различных последовательностей CDR3. Независимое добавление и делеция нуклеотидов в соединениях Vβ-Dβ, Dβ-Jβ и Vα-Jα во время процесса перестройки гена TCR дополнительно увеличивает разнообразие последовательностей CDR3. В этом отношении иммунокомпетентность выражается в разнообразии TCRs.
[0159] Также предоставлены фрагменты TCR, включая антигенсвязывающие фрагменты. В некоторых вариантах осуществления TCR представляет собой антигенсвязывающую часть такового, такую, как вариант полноразмерного TCR, не содержащий его трансмембранной и/или цитоплазматической области (областей), который может упоминаться как полностью растворимый TCR. В некоторых вариантах осуществления TCR представляет собой димерный TCR (dTCR). В некоторых вариантах осуществления TCR представляет собой одноцепочечный TCR (scTCR), такой как scTCR, имеющий структуру, описанную в патентных публикациях PCT с номерами WO 03/020763, WO 04/033685 или WO 2011/044186. В некоторых вариантах осуществления TCR представляет собой одноцепочечный фрагмент TCR, содержащий вариабельную область альфа-цепи, связанную с вариабельной областью бета-цепи, такую как scTv. В некоторых вариантах осуществления scTv также упоминается как scFv.
[0160] Одноцепочечный Fv, или scFv относится в некоторых аспектах к фрагментам антитела или TCR, которые включают домены вариабельной тяжелой цепи (VH) и вариабельной легкой цепи (VL) антитела или домены вариабельных альфа или гамма-цепей (Vα или Vγ) или домены вариабельных бета- или дельта-цепей (Vβ или Vδ) TCR, где эти домены присутствуют в одной полипептидной цепи. Обычно полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL или доменами Vα и Vβ или доменами Vγ и Vδ, который позволяет scFv формировать желаемую структуру для связывания антигена.
[0161] Диатело относится в некоторых аспектах к небольшим фрагментам антитела и/или TCR с двумя антигенсвязывающими сайтами, причем эти фрагменты содержат VH, связанный с VL в той же самой полипептидной цепи (VH - VL), или Vα, связанный с Vβ в той же самой полипептидной цепи (Vα-Vβ) или Vγ, связанной с Vδ в той же самой полипептидной цепи (Vγ-Vδ). Используя линкер, который является слишком коротким, чтобы разрешить спаривание между двумя доменами в одной цепи, домены вынуждены спариваться с комплементарными доменами другой цепи и создавать два антигенсвязывающих сайта. Типичные диатела описаны более полно, например, в ЕР404097 и WO93111161.
[0162] Биспецифическое антитело или биспецифический TCR в некоторых аспектах относится к антителу или TCR, которое проявляет специфичность к двум различным типам антигенов. Используемые здесь термины, в частности, включают, без ограничения, антитела и TCR, которые проявляют специфичность связывания для антигена-мишени и другой мишени, которая облегчает доставку в конкретную ткань. Аналогичным образом, мультиспецифичные антитела и TCR имеют две или более специфичности связывания.
[0163] Линейное антитело или «линейный TC» в некоторых аспектах относится к паре тандемных сегментов Fd (например, VH -CH1- VH -CH1 или Vα-Cα1-Vα-Cα1), которые образуют пару антигенсвязывающих областей. Линейные антитела и TCR могут быть биспецифичными или моноспецифичными, например, как описано в Zapata et al., Protein Eng. 8 (10): 1057-1062 (1995).
[0164] Антигенсвязывающий домен в некоторых аспектах относится к одному или нескольким фрагментам антитела или TCR, которые сохраняют способность специфически связываться с антигеном. Неограничивающие примеры фрагментов антител, включенных в такие термины, включают: (i) фрагмент Fab, одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) фрагмент F (ab ') 2, двухвалентный фрагмент, содержащий два фрагмента Fab, связанных дисульфидным мостиком в шарнирной области; (iii) фрагмент Fd, состоящий из доменов VH и CH1; (iv) фрагмент Fv, содержащий домены VL и VH одного плеча антитела, включая scFvs, (v) фрагмент dAb (Ward et al., (1989) Nature 341: 544 546), который содержит домен VH; и (vi) выделенный CDR, но не ограничиваются ими. Кроме того, в это определение включены антитела, содержащие одну тяжелую цепь и одну легкую цепь и TCR с одной альфа-цепью или одной бета-цепью.
[0165] Фрагменты «F(ab') 2» и «Fab ′» могут быть получены обработкой Ig протеазой, такой как пепсин и папаин, и включают фрагменты антител, полученные путем расщепления иммуноглобулина вблизи дисульфидных связей, существующих между шарнирными областями в каждой из двух тяжелых цепей. Например, папаин расщепляет IgG перед дисульфидными связями, существующими между шарнирными областями в каждой из двух тяжелых цепей, с образованием двух гомологичных фрагментов антител, в которых легкая цепь состоит из VL и CL, а фрагмент тяжелой цепи состоит из VH и CHγ1 (область γ1 в константной области тяжелой цепи) связанных в их C-концевых областях посредством дисульфидной связи. Каждый из этих двух гомологичных фрагментов антител называется «Fab». Пепсин также расщепляет IgG по ходу транскрипции от дисульфидных связей, существующих между шарнирными областями в каждой из двух тяжелых цепей, с образованием фрагмента антитела немного большего размера, чем фрагмент, в котором два вышеупомянутых 'Fab' связаны в шарнирной области. Этот фрагмент антитела называется F (’ab’) 2. Фрагмент Fab также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Фрагменты 'Fab' отличаются от фрагментов Fab добавлением нескольких остатков на карбоксильном конце домена CH1 тяжелой цепи, включая один или несколько цистеинов из шарнирной области антитела. Fab'-SH является здесь обозначением Fab', в котором остаток(ки) цистеина константных доменов несут свободную тиоловую группу. Фрагменты антител F(ab') 2 первоначально получают в виде пар Fab'-фрагментов, которые имеют между собой шарнирные цистеины.
[0166] Fv в некоторых аспектах относится к антителу или фрагменту TCR, который содержит полный сайт узнавания и связывания антигена. Эта область состоит из димера одной вариабельной области тяжелой цепи и вариабельного домена одной легкой цепи или одной цепи TCRα и одной цепи TCRβ или одной цепи TCRγ и одной цепи TCRδ в тесной нековалентной ассоциации. Именно в этой конфигурации три CDR каждого вариабельного домена взаимодействуют, образуя антигенсвязывающий сайт на поверхности димера VH - VL или димера Vα-Vβ или димера Vγ-Vδ. В совокупности комбинация одной или нескольких CDR из каждой из цепей VH и VL или цепей Vα и Vβ или цепей Vγ и Vδ придает антигенсвязывающую специфичность антителу или TCR. Например, следует понимать, что, например, CDRH3 и CDRL3 могут быть достаточными для придания антигенсвязывающей специфичности антителу или TCR при переносе в цепи VH и VL или цепи Vα и Vβ или цепи Vγ и Vδ в выбранное антитело реципиента, TCR или его антигенсвязывающий фрагмент, и эту комбинацию CDR можно проверить на связывание, аффинность и т. д. Даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных для антигена), обладает способностью распознавать и связывать антиген, хотя, вероятно, с более низкой аффинностью, чем в сочетании со вторым вариабельным доменом. Кроме того, хотя два домена Fv фрагмента (VL и VH или Vα и Vβ или Vγ и Vδ) кодируются отдельными генами, они могут быть объединены рекомбинантными методами с помощью синтетического линкера, который позволяет им существовать в виде одноцепочечной белковой цепи, в которой области VL и VH или Vα и Vβ или Vγ или Vδ соединяются с образованием моновалентных молекул (известных как одноцепочечные Fv (scFv); Bird et al. (1988) Science 242: 423-426; Huston et al. и др. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883 и Osbourn et al. (1998) Nat. Biotechnol. 16: 778). Такие scFv также предназначены для охвата термином «антигенсвязывающая часть» антитела. Любые последовательности VH и VL определенного scFv могут быть связаны с Fc областью кДНК или геномными последовательностями, для создания векторов экспрессии, кодирующих полноразмерные молекулы Ig (например, IgG) или другие изотипы. VH и VL также могут быть использованы для генерации Fab, Fv или других фрагментов Igs при использовании либо технологии химии белка, либо технологии рекомбинантной ДНК.
[0167] Термин «последовательность зародышевой линии» относится к генетической последовательности из зародышевой линии (гаплоидные гаметы и те диплоидные клетки, из которых они образованы). ДНК зародышевой линии содержит множество генных сегментов, которые кодируют одну тяжелую или легкую цепь Ig, или одну цепь TCRα или TCRβ, или одну цепь TCRγ или TCRδ. Эти генные сегменты переносятся в половых клетках, но не могут быть транскрибированы и транслированыдо тех пор пока они не сгруппированы в функциональные гены. Во время дифференцировки В-клеток и Т-клеток в костном мозге эти генные сегменты случайным образом перемешиваются динамической генетической системой, способной генерировать более 108 специфичных сочетаний. Большинство этих генных сегментов опубликованы и собраны базой данных зародышевой линии.
[0168] В некоторых вариантах осуществления иммунная молекула может быть или может представлять собой нейтрализующее антитело или нейтрализующий TCR. В некоторых аспектах нейтрализующее антитело или TCR представляет собой антитело или TCR, которое ингибирует репликацию патогена, такого как вирус или бактерия, независимо от механизма, посредством которого достигается нейтрализация.
[0169] В некоторых вариантах осуществления образец, такой как популяция клеток или отдельная клетка, может содержать иммунный репертуар, например репертуар антител или репертуар TCR, и таковой репертуар может быть определен с помощью предоставленных способов. В некоторых вариантах осуществления репертуар антител или репертуар TCR относится к совокупности антител, TCR или их фрагментов. В некоторых вариантах осуществления репертуар антител может, например, использоваться для выбора конкретного антитела или скрининга на конкретное свойство, такое как способность к связыванию, специфичность связывания, способность желудочно-кишечного транспорта, стабильность, аффинность и тому подобное. Этот термин, в частности, включает библиотеки антител и TCR, включая все формы комбинаторных библиотек, такие как, например, библиотеки фагового дисплея антитела, включая, без ограничения, одноцепочечные библиотеки Fv (scFv) и библиотеки фагового дисплея антитела Fab из любого источника, включая наивные, синтетические и полусинтетические библиотеки.
[0170] Полинуклеотиды-мишени могут быть получены практически из любого источника, и при использовании способов, известных в данной области. Например, полинуклеотиды-мишени могут быть непосредственно выделены без амплификации с использованием способов, известных в данной области, включая, без ограничения, выделение фрагментов геномной ДНК или мРНК из организма или клетки (например, иммунной клетки) для получения полинуклеотидов-мишеней. Термин «полинуклеотид-мишень» также может включать кДНК, сгенерированную из РНК (такой как мРНК) посредством обратной транскрипции-ПЦР. В некоторых случаях полинуклеотид-мишень представляет собой молекулу РНК. В некоторых случаях полинуклеотид-мишень представляет собой молекулу мРНК или кДНК, полученную из молекулы мРНК. В некоторых случаях полинуклеотид-мишень представляет собой молекулу мРНК или молекулу кДНК, полученную из молекулы мРНК из отдельной иммунной клетки. В некоторых случаях полинуклеотиды-мишени представляют собой молекулы мРНК или молекулы кДНК, полученные из молекул мРНК из отдельных иммунных клеток. В некоторых случаях полинуклеотидами-мишенями являются молекулы мРНК, кодирующие последовательность антител из отдельной иммунной клетки. В некоторых случаях полинуклеотиды-мишени представляют собой молекулы мРНК, кодирующие последовательности тяжелой цепи антител из отдельных иммунных клеток. В некоторых случаях полинуклеотиды-мишени представляют собой молекулы мРНК, кодирующие последовательность тяжелой цепи антител из отдельной иммунной клетки. В некоторых случаях полинуклеотиды-мишени представляют собой молекулы мРНК, кодирующие последовательности легкой цепи антител из отдельных иммунных клеток. В некоторых случаях полинуклеотиды-мишени представляют собой молекулы мРНК, кодирующие последовательность легкой цепи антител из отдельной иммунной клетки. В некоторых случаях полинуклеотиды-мишени представляют собой молекулы мРНК, кодирующие вариабельные последовательности антител из отдельных иммунных клеток. В некоторых случаях полинуклеотиды-мишени представляют собой молекулы мРНК, кодирующие вариабельную последовательность антитела из отдельной иммунной клетки. В некоторых случаях полинуклеотиды-мишени представляют собой молекулы мРНК, кодирующие вариабельные последовательности легкой цепи антител из отдельных иммунных клеток. В некоторых случаях полинуклеотиды-мишени представляют собой молекулы мРНК, кодирующие вариабельную последовательность легкой цепи антитела из отдельной иммунной клетки. В некоторых случаях полинуклеотиды-мишени представляют собой молекулы мРНК, кодирующие вариабельные последовательности тяжелой цепи антител из отдельных иммунных клеток. В некоторых случаях полинуклеотиды-мишени представляют собой молекулы мРНК, кодирующие вариабельную последовательность тяжелой цепи антитела из иммунной клетки. В некоторых случаях полинуклеотид-мишень может представлять собой нуклеиновую кислоту бесклеточной фракции, например, ДНК или РНК. В некоторых случаях полинуклеотидами-мишенями являются молекулы мРНК, кодирующие вариабельные последовательности альфа, бета, гамма и/или дельта цепи TCR из отдельных иммунных клеток.
[0171] Способы, описанные в данном документе, могут быть использованы для создания библиотеки полинуклеотидов из одного или нескольких полинуклеотидов-мишеней для секвенирования. Полинуклеотиды-мишени включают любые представляющие интерес полинуклеотиды, которые не являются продуктами реакции амплификации. Например, полинуклеотид-мишень может включать полинуклеотид в биологическом образце. Например, полинуклеотиды-мишени не включают продукты реакции ПЦР. Например, полинуклеотиды-мишени могут включать полинуклеотидную матрицу, используемую для генерации продуктов реакции амплификации, но не включают сами продукты амплификации. Например, полинуклеотиды-мишени могут включать полинуклеотидную матрицу, используемую для генерации продуктов реакции обратной транскрипции или реакции элонгации праймера, а также сами продукты реакции обратной транскрипции или реакции элонгации праймера. Например, полинуклеотиды-мишени включают представляющие интерес полинуклеотиды, которые могут быть подвергнуты реакции обратной транскрипции или реакции элонгации праймера. Например, полинуклеотиды-мишени включают РНК или ДНК. Например, полинуклеотиды-мишени включают кДНК. В некоторых вариантах осуществления полинуклеотиды-мишени РНК представляют собой мРНК. В некоторых вариантах осуществления полинуклеотиды-мишени РНК являются полиаденилированными. В некоторых вариантах осуществления РНК-полинуклеотиды не являются полиаденилированными. В некоторых вариантах осуществления полинуклеотиды-мишени представляют собой ДНК-полинуклеотиды. ДНК-полинуклеотиды могут быть представлены геномной ДНК. ДНК-полинуклеотиды могут содержать экзоны, интроны, нетранслируемые области или любую их комбинацию.
[0172] В некоторых вариантах осуществления библиотеки могут быть получены из двух или более областей полинуклеотида-мишени. В некоторых вариантах осуществления способов, библиотеки могут быть получены из двух или более полинуклеотидов-мишеней. В некоторых вариантах осуществления полинуклеотиды-мишени представляют собой геномные нуклеиновые кислоты или ДНК, полученные из хромосом. В некоторых вариантах осуществления полинуклеотиды-мишени включают последовательности, содержащие вариант, такой как полиморфизм или мутация. В некоторых вариантах осуществления полинуклеотиды-мишени включают ДНК, а не РНК. В некоторых вариантах осуществления полинуклеотиды-мишени включают РНК, а не ДНК. В некоторых вариантах осуществления полинуклеотиды-мишени включают ДНК и РНК. В некоторых вариантах осуществления полинуклеотид-мишень представляет собой молекулу мРНК. В некоторых вариантах осуществления полинуклеотид-мишень представляет собой молекулу ДНК. В некоторых вариантах осуществления полинуклеотид-мишень представляет собой одноцепочечный полинуклеотид. В некоторых вариантах осуществления полинуклеотид-мишень представляет собой двухцепочечный полинуклеотид. В некоторых вариантах осуществления полинуклеотид-мишень представляет собой одноцепочечный двухцепочечный полинуклеотид.
[0173] Полинуклеотиды-мишени могут быть получены из любого биологического образца при использовании способов, известных в данной области. В некоторых вариантах осуществления полинуклеотиды-мишени непосредственно выделяют без амплификации. Способы прямой изоляции известны в данной области техники. Неограничивающие примеры включают извлечение геномной ДНК или мРНК из биологического образца, организма или клетки.
[0174] В некоторых вариантах осуществления один или несколько полинуклеотидов-мишеней очищают из биологического образца. В некоторых вариантах осуществления полинуклеотид-мишень не очищается от биологического образца, в котором он содержится. В некоторых вариантах осуществления полинуклеотид-мишень выделяют из биологического образца. В некоторых вариантах осуществления полинуклеотид-мишень не выделяют из биологического образца, в котором он содержится. В некоторых вариантах осуществления полинуклеотид-мишень может представлять собой нуклеиновую кислоту бесклеточной фракции. В некоторых вариантах осуществления полинуклеотид-мишень может представлять собой фрагментированную нуклеиновую кислоту. В некоторых вариантах осуществления полинуклеотид-мишень может представлять собой транскрибированную нуклеиновую кислоту. В некоторых вариантах осуществления полинуклеотид-мишень представляет собой модифицированный полинуклеотид. В некоторых вариантах осуществления полинуклеотид-мишень представляет собой немодифицированный полинуклеотид.
[0175] В некоторых вариантах осуществления полинуклеотид-мишень представляет собой полинуклеотид из отдельной клетки. В некоторых вариантах осуществления полинуклеотиды-мишени происходят из отдельных клеток. В некоторых вариантах осуществления полинуклеотид-мишень представляет собой полинуклеотид из образца, содержащего множество клеток.
[0176] В некоторых вариантах осуществления полинуклеотид-мишень кодирует последовательность биомаркера. В некоторых вариантах осуществления полинуклеотид-мишень кодирует две или более последовательности биомаркеров. В некоторых вариантах осуществления множество полинуклеотидов-мишеней кодирует последовательность биомаркера. В некоторых вариантах осуществления множество полинуклеотидов-мишеней кодирует две или более последовательности биомаркеров. В некоторых вариантах осуществления множество полинуклеотидов-мишеней кодирует 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 или более последовательностей биомаркеров.
[0177] В некоторых вариантах осуществления множество полинуклеотидов-мишеней содержит панель последовательностей иммуноглобулинов. В некоторых вариантах осуществления множество полинуклеотидов-мишеней содержит панель последовательностей TCR. Например, панель последовательностей иммуноглобулинов может представлять собой последовательности VH и/или VL. В некоторых вариантах осуществления панель последовательностей иммуноглобулина или TCR содержит 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 последовательностей иммуноглобулина или TCR. В некоторых вариантах осуществления панель последовательностей иммуноглобулина или TCR содержит по меньшей мере приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 3000, 4000 5000, 6000, 7000, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 1000, 1500, 2000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, l×l06, 2×l06, 3×l06, 4×l06, 5×l06, 6×l06, 7×l06, 8×l06, 9×l06, l×l07, 2×l07, 3×l07, 4×l07, 5×l07, 6×l07, 7×l07, 8×l07, 9×l07, l×l08, 2×l08, 3×l08, 4×l08, 5×l08, 6×l08, 7×l08, 8×l08, 9×l08, l×l09, 2×l09, 3×l09, 4×l09, 5×l09, 6×l09, 7×l09, 8×l09, 9×l09, l×l010, 2×l010, 3×l010, 4×l010, 5×l010, 6×l010, 7×l010, 8×l010, 9×l010, l×l011, 2×l011, 3×l011, 4×l011, 5×l011,6×l011, 7×l011, 8×l011, 9×l011, l×l012, 2×l012, 3×l012, 4×l012, 5×l012, 6×l012, 7×l012, 8×l012, или 9×l012 последовательностей иммуноглобулина или TCR. В некоторых вариантах осуществления панель последовательностей иммуноглобулина или TCR содержит самое большее примерно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500 550, 600, 650, 700, 750, 800, 850, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, l×l06, 2×l06, 3×l06, 4×l06, 5×l06, 6×l06, 7×l06, 8×l06, 9×l06, l×l07, 2×l07, 3×l07, 4×l07, 5×l07, 6×l07, 7×l07, 8×l07, 9×l07, l×l08, 2×l08, 3×l08, 4×l08, 5×l08, 6×l08, 7×l08, 8×l08, 9×l08, l×l09, 2×l09, 3×l09, 4×l09, 5×l09, 6×l09, 7×l09, 8×, 9×l09, l×l010, 2×l010, 3×l010, 4×l010, 5×l010, 6×l010, 7×l010, 8×l010, 9×l010, l×l011, 2×l011, 3×l011, 4×l011, 5×l011, 6×l011, 7×l011, 8×l011, 9×l011, l×l012, 2×l012, 3×l012, 4×l012, 5×l012, 6×l012, 7×l012, 8×l012, или 9×l012 последовательностей иммуноглобулина или TCR. В некоторых вариантах осуществления панель последовательностей иммуноглобулина или TCR содержит примерно 10-20, 10-30, 10-40, 10-30, 10-40, 10-50, 10-60, 10-70, 10-80, 10-90, 10-100, 50-60, 50-70, 50-80, 50-90, 50-100, 100-200, 100-300, 100-400, 100-300, 100-400, 100- 500, 100-600, 100-700, 100-800, 100-900, 100-1000, 500-600, 500-700, 500-800, 500-900, 500-1000, 1000-2000, 1000-3000, 1000-4000, 1000-3000, 1000-4000, 1000-5000, 1000-6000, 1000-7000, 1000-8000, 1000-9000, 1000-10000, 5000-6000, 5000-7000, 5000-8000, 5000-9000, 5000-10000, 1-1×105, 1-2×105, 1-3×105, 1-4×105, 1-5×105, 1-6×105, 1-7×105, 1-8×105, 9×105, 1-1×106, 1-2×106, 1-3×106, 1-4×106, 1-5×106, 1-6×106, 1-7×106, 1-8×106, 9×106, 1-l×107, 1-2×107, 1-3×107, 1-4×107, 1-5×107, 1-6×107, 1-7×107, 1-8×107, 1-9×107, 1-1×108, 1-2×108, 1-3×108, 1-4×108, 1-5×108, 1-6×108, 1-7×108, 1-8×108, 1-9×108, 1-1×109, 1-2×109, 1-3×109, 1-4×109, 1-5×109, 1-6×109,1-7×109, 1-8×109, 1-9×109, 1-1×1010, 1-2×1010, 1-3×1010, 1-4×1010, 1-5×1010, 1-6×1010, 1-7×1010, 1-8×1010, 1-9×1010, 1-1×1011, 1-2×1011, 1-3×1011, 1-4×1011, 1-5×1011, 1-6×1011, 1-7×1011, 1-8×1011, 1-9×1011, 1-1×1012, 1-2×1012, 1-3×1012, 1-4×1012, 1-5×1012, 1-6×1012, 1-7×1012, 1-8×1012, или 1-9×1012 последовательностей иммуноглобулина или TCR.
[0178] В некоторых вариантах осуществления полинуклеотид-мишень составляет примерно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18 000, 19000 или 20000 оснований или пар оснований длиной. В некоторых вариантах осуществления полинуклеотид-мишень составляет по меньшей мере приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600 650, 700, 750, 800, 850, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000 или 20000 оснований или пар оснований длиной. В некоторых вариантах осуществления полинуклеотид-мишень составляет самое большее примерно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600 650, 700, 750, 800, 850, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000 или 20000 оснований или пар оснований длиной. В некоторых вариантах осуществления полинуклеотид-мишень составляет примерно 10-20, 10-30, 10-40, 10-30, 10-40, 10-50, 10-60, 10-70, 10-80, 10-90, 10-100, 50-60, 50-70, 50-80, 50-90, 50-100, 100-200, 100-300, 100-400, 100-300, 100-400, 100-500, 100- 600, 100-700, 100-800, 100-900, 100-1000, 500-600, 500-700, 500-800, 500-900, 500-1000, 1000-2000, 1000-3000, 1000-4000, 1000-3000, 1000-4000, 1000-5000, 1000-6000, 1000-7000, 1000-8000, 1000-9000, 1000-10000, 5000-6000, 5000-7000, 5000-8000, 5000-9000 или 5000-10000 оснований или пар оснований длиной. В некоторых вариантах осуществления средняя длина полинуклеотидов-мишеней или их фрагментов может составлять менее чем примерно 100, 200, 300, 400, 500 или 800 пар оснований или менее примерно 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 нуклеотидов или менее чем примерно 1, 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 килобаз. В некоторых вариантах осуществления последовательность-мишень из относительно короткой матрицы, такой как образец, содержащий полинуклеотид-мишень, составляет примерно 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 оснований. В некоторых вариантах осуществления данные секвенирования сопоставляются с известными или ожидаемыми последовательностями с использованием базы данных, содержащей эти последовательности или последовательности иммуноглобулина или TCR, связанные с заболеванием или состоянием.
2. Коллекции полинуклеотидов, например, транскриптом
[0179] Коллекция полинуклеотидов, соответствующих геномным или транскриптомным полинуклеотидам, может быть получена практически из любого источника, такого как отдельная клетка или множество клеток, и может быть получена с использованием способов, известных в данной области техники. Например, коллекция полинуклеотидов может быть непосредственно выделена из отдельной клетки или множества клеток без амплификации с использованием способов, известных в данной области техники, включая, без ограничения, выделение фрагмента геномной ДНК или мРНК из организма или клетки (например, из иммунной клетки) для получения коллекции полинуклеотидов. Коллекция геномных или транскриптомных полинуклеотидов может также включать кДНК, генерируемую из РНК (такой как мРНК) посредством метода обратной транскрипции-ПЦР. В некоторых случаях коллекция полинуклеотидов представляет собой коллекцию молекул РНК. В некоторых случаях коллекция полинуклеотидов представляет собой коллекцию молекул мРНК или коллекцию молекул кДНК, полученных из молекул мРНК. В некоторых случаях коллекция полинуклеотидов представляет собой коллекцию молекул мРНК или молекул кДНК, полученных из молекул мРНК, из отдельной иммунной клетки. В некоторых случаях набор полинуклеотидов представляет собой набор молекул мРНК или молекул кДНК, полученных из молекул мРНК, из отдельных иммунных клеток.
[0180] Способы, описанные в данном документе, можно использовать для создания библиотеки, содержащей коллекцию полинуклеотидов из одной или нескольких клеток для секвенирования. Коллекция полинуклеотидов может быть получена из геномной ДНК или РНК, такой как транскрипты мРНК одной или множества клеток биологического образца. Например, геномную ДНК или клеточную РНК, такую как мРНК, можно использовать в качестве матрицы для генерирования продуктов реакции амплификации, такой как реакция обратной транскрипции или реакция элонгации/удлинения праймера. В некоторых примерах коллекция полипептидов может быть получена из кДНК. В некоторых вариантах осуществления коллекция полинуклеотидов создается из РНК, полинуклеотиды представляют собой мРНК, и коллекция по существу представляет собой транскриптом одной или нескольких клеток биологического образца. В некоторых вариантах осуществления коллекция полинуклеотидов генерируется из полинуклеотидов РНК, которые являются полиаденилированными. В некоторых вариантах осуществления полинуклеотиды РНК не являются полиаденилированными. В некоторых вариантах осуществления коллекция полинуклеотидов генерируется из полинуклеотидов ДНК. Полинуклеотиды ДНК могут представлять собой геномную ДНК. Полинуклеотиды ДНК могут содержать экзоны, интроны, нетранслируемые области или любую их комбинацию. Например, коллекция полинуклеотидов по настоящему изобретению может содержать геномную или транскриптомную информацию по меньшей мере из 5, 10, 100, 250, 500, 750, 1000, 2500, 5000, 10000, 25000, 50000, 75000, 10000, 250000 500000, 750000, 1000000, 2500000, 5000000, 7500000 или 10000000 клеток носителя или отдельных клеток, таких как группы или отдельные иммунные клетки, экспрессирующие различные антитела или TCR.
[0181] В некоторых вариантах осуществления коллекция полинуклеотидов может быть получена путем реакции обратной транскриптазы или удлинения праймера с использованием случайных гексамерных праймеров. В некоторых вариантах осуществления коллекция полинуклеотидов может быть получена методом обратной транскриптазы или реакции удлинения праймера с использованием праймера, направленного против нуклеотидной последовательности polyА. В некоторых примерах коллекция полинуклеотидов может быть создана с помощью обратной транскриптазы или реакции удлинения праймера с использованием олиго-dT. В некоторых примерах праймеры могут быть биотинилированы. Коллекции полинуклеотидов, необязательно, могут быть очищены после реакций обратной транскрипции или удлинения праймера. Например, коллекции полинуклеотидов, полученные с использованием биотинилированных праймеров, могут быть необязательно очищены с использованием методов обработки стрептавидином. В других вариантах полинуклеотиды могут быть очищены одним или несколькими методами аффинной очистки, электрофорезом в агарозном геле.
3. Капельные библиотеки
[0182] В общем и целом, капельная библиотека состоит из нескольких элементов библиотеки, объединенных в одну коллекцию. Библиотеки могут различаться по сложности от одного элемента библиотеки до lxl015 или более элементов библиотеки. Каждый элемент библиотеки представляет собой один или несколько заданных компонентов с фиксированной концентрацией. Элемент могут быть, но таковыми не ограничиваются, клетки, гранулы, аминокислоты, белки, полипептиды, нуклеиновые кислоты, полинуклеотиды или химические соединения с малыми молекулами. Элемент может содержать идентификатор, такой как молекулярный штрих-код, штрих-код носителя или оба.
[0183] Элемент клеточной библиотеки может включать, но не ограничивается таковыми, гибридомы, В-клетки, Т-клетки, первичные клетки, культивируемые клеточные линии, раковые клетки, стволовые клетки или клетки любого другого типа. Элементы клеточной библиотеки подготавливаются путем инкапсулирования ряда клеток от одной до десятков тысяч в отдельные капли. Количество инкапсулированных клеток обычно определяется статистикой Пуассона исходя из плотности клеток и объема капли. Однако, в некоторых в случаях, это число отклоняется от статистики Пуассона, как описано в Edd et al., “Controlled encapsulation of single-cells into monodisperse picoliter drops.” Lab Chip, 8(8): 1262-1264, 2008. Природные программы клеток позволяет создавать библиотеки потоковым методом, с множеством вариантов клеток, таких как иммунные клетки, продуцирующие одно антитело или TCR каждый, все присутствующие в одной исходной среде, и затем эта среда разбивается на отдельные носители, такие как капли или капсулы, которые содержат в большем случае одну клетку. Затем клетки внутри отдельных носителей, например, капель или капсул, лизируются, и из носителя высвобождаются полинуклеотиды, такие как клеточная мРНК и геномная ДНК, включая целевую мРНК или ДНК (например, полинуклеотиды тяжелой цепи и легкой цепи, и/или полинуклеотиды альфа и бета-цепей и/или полинуклеотиды гамма- и дельта-цепей) из лизированных клеток, которые подвергаются штрих-кодированию молекулярными штрих-кодами и штрих-кодами носителя и амплифицируются. Полинуклеотидные продукты с двойным штрих-кодом затем комбинируют или объединяют для создания библиотеки, состоящей из элементов библиотеки транскриптомных или геномных и целевых (например, тяжелой и легкой цепи и/или альфа- и бета-цепи и/или гамма- и дельта-цепи) элементов библиотеки. В частности, транскриптомные и целевые библиотеки объединяются.
[0184] Элемент библиотеки на основе гранул содержит один или несколько гранул и может также содержать другие реагенты, такие как антитела, ферменты или другие белки. В случае, когда все элементы библиотеки содержат разные типы гранул, но находятся в одной среде, все элементы библиотеки могут быть приготовлены из одной исходной жидкости или из множества исходных жидкостей. В случае клеточных библиотек, приготовленных массово из набора вариантов, элементы библиотеки будут приготовлены из различных исходных жидкостей. Желательно иметь только одну ячейку на каплю, содержащую всего несколько каплель, содержащими более одной клетки, если начинать с множества клеток. В некоторых случаях можно получить отклонения от распределения Пуассона для обеспечения улучшенной загрузки капель, таким образом, что большинство капель содержит ровно одну клетку на каплю с несколькими исключениями для пустых капель или капель, содержащих более одной капли.
[0185] В некоторых вариантах осуществления желательно иметь ровно один полинуклеотид со штрих-кодом носителя на каплю, и только несколько капель, содержащих более одного полинуклеотида со штрих-кодом носителя, если начинать с множества полинуклеотидов со штрих-кодом носителя. В некоторых случаях могут быть достигнуты отклонения от распределения Пуассона, для обеспечения улучшенной загрузки капель, так что большинство капель содержит ровно один полинуклеотид со штрихкодом носителя на каплю, с несколькими исключениями пустых капель или капель, содержащих более одного полинуклеотида со штрих-кодом носителя.
[0186] Примерами капельных библиотек являются коллекции капель, имеющих различное содержание, начиная от гранул, клеток, малых молекул, ДНК, праймеров, антител и штрих-кодированных полинуклеотидов. Размер капель варьируется от примерно 0,5 мкм до 500 мкм в диаметре, что соответствует примерно 1 пиколитру на 1 нанолитр. Тем не менее, капли могут быть размером от 5 мкм и до 500 мкм. Предпочтительно, чтобы капли имели диаметр менее 100 мкм, примерно от 1 мкм до 100 мкм. Наиболее предпочтительный размер составляет примерно от 20 до 40 мкм в диаметре (от 10 до 100 пиколитров). Предпочтительные свойства исследуемых библиотек капель включают баланс осмотического давления, однородный размер и диапазоны размеров.
[0187] Капли, содержащиеся в капельной библиотеке, обеспечиваемой настоящим изобретением, предпочтительно имеют однородный размер. То есть диаметр любой капли в библиотеке будет варьироваться менее чем на 5%, 4%, 3%, 2%, 1% или 0,5% по сравнению с диаметром других капель в той же библиотеке. Однородный размер капель в библиотеке может быть критически важным для поддержания стабильности и целостности капель, а также может быть важным для последующего использования капель в библиотеке для различных биологических и химических анализов, описанных в настоящем документе.
[0188] Изобретение предоставляет капельную библиотеку, содержащую множество водных капель в несмешивающейся жидкости, причем каждая капля предпочтительно является по существу однородной по размеру и содержит разный элемент библиотеки. Изобретение обеспечивает способ формирования капельной библиотеки, включающий предоставление единой водной жидкой среды, содержащей различные элементы библиотеки, причем каждый элемент библиотеки заключен в водную каплю находящеюся в несмешивающейся жидкости.
[0189] В некоторых вариантах осуществления различные типы элементов (например, клетки или гранулы) объединяются в одном источнике, содержащемся в одной и той же среде. После первоначального объединения элементы инкапсулируются в капли, для формирования капельной библиотеки, в которой каждая капля с разным типом шарика или клетки представляет собой отдельный элемент библиотеки. Разбавление исходного раствора обеспечивает процесс инкапсуляции. В некоторых вариантах осуществления образовавшиеся капли либо будут содержать один элемент, либо не будут содержать ничего, то есть оказываются пустыми. В других вариантах осуществления образованные капли будут содержать множество копий библиотечного элемента. Инкапсулированные элементы, как правило, являются вариантами. В одном примере элементы являются иммунными клетками образца крови, и каждая иммунная клетка инкапсулирована для амплификации и штрих-кодирования нуклеотидов последовательностей антител в иммунных клетках.
[0190] Например, в эмульсионной библиотеке одного типа имеются элементы библиотеки, которые имеют разные частицы, то есть клетки или штрих-кодированные полинуклеотиды в другой среде, которые были инкапсулированы перед объединением. В одном примере указанное количество библиотечных элементов, то есть n- число различных клеток или штрих-кодированных полинуклеотидов, содержится в различных средах. Каждый из библиотечных элементов по отдельности эмульгируется и объединяется, и в какой-то момент момент каждый из n-различных объединенных библиотечных элементов комбинируется и объединяется в единый пул. Полученный пул содержит множество капель эмульсии вода-в-масле, каждая из которых содержит частицы различного типа.
[0191] В некоторых вариантах осуществления образованные капли будут либо содержать один элемент библиотеки, либо не будут содержать ничего, то есть окажутся пустыми. В других вариантах осуществления образованные капли будут содержать множество копий библиотечного элемента. Содержимое гранул соответствует распределению Пуассона, где есть дискретное распределение вероятностей, выражающее вероятность ряда событий, происходящих в определенный период времени, если эти события происходят с известной средней скоростью и независимо от времени с момента последнего события. Масла и поверхностно-активные вещества, используемые при создании библиотек, предотвращают обмен содержимого библиотеки между каплями.
B. Способы получения полинуклеотидной библиотеки отдельной клетки с двойным штрих-кодом
[0192] В некоторых вариантах осуществления предложены способы получения полинуклеотидной библиотеки, включающие следующие стадии: (а) лизис клеток в каждом из множества носителей, где каждый из указанных носителей содержит клетку из образца, содержащего популяцию клеток, множество олигонуклеотидов с молекулярной штрих-кодом и первый адаптер, содержащий олигонуклеотид со штрих-кодом носителя; (b) продуцирование в каждом носителе множества одноцепочечных полинуклеотидов, содержащих (i) один или несколько одноцепочечных полинуклеотидов-мишеней, комплементарных одному или нескольким полинуклеотидам-мишеням, присутствующим в клетке; и (ii) коллекцию одноцепочечных полинуклеотидов, каждый из которых является комплементарным полинуклеотиду в клетке; (c) присоединение к каждому одноцепочечному полинуклеотиду одного из множества олигонуклеотидов с молекулярным штрих-кодом, в результате чего образуется множество штрих-кодированных одноцепочечных полинуклеотидов, каждый из которых содержит уникальный молекулярный штрих-код; (d) прикрепление первого адаптера, содержащего олигонуклеотид со штрих-кодом носителя или его амплифицированный продукт, к каждому из одноцепочечных полинуклеотидов со штрих-кодом, в результате чего образуется множество одноцепочечных полинуклеотидов с двойным штрих-кодом, причем каждый из одноцепочечных полинуклеотидов с двойным штрих-кодом в одном носителе содержат один и тот же штрих-код носителя; и (е) добавление второго адаптера к каждому из одноцепочечных полинуклеотидов с двойным штрих-кодом, где первый адаптер и второй адаптер присутствуют на противоположных концахв каждого из одноцепочечных полинуклеотидов с двойным штрих-кодом или рядом с ними. Типичные носителя (вместилища носителей), на основе которых создается полинуклеотидная библиотека, включают лунки, эмульсии, капли или микрокапсулы.
1. Подготовка носителей
[0193] Любой биологический образец, включая образец, содержащий популяцию клеток и содержащий полинуклеотиды, можно использовать в способах, описанных в настоящем документе. Любой образец, содержащий клетку, обычно можно использовать в способах, описанных в настоящем документе. Например, образец может быть биологическим образцом от субъекта или полученным из такого образца, содержащим РНК или ДНК. Полинуклеотиды могут быть извлечены из биологического образца, или образец может быть непосредственно обработан способами без выделения или очистки полинуклеотидов. Образец может являться экстрагированной или выделенной ДНК или РНК. Образцом также может представлять собой общую РНК или ДНК, выделенную из биологического образца, или библиотеку кДНК, вирусную или геномную ДНК. В одном варианте осуществления полинуклеотиды выделяют из биологического образца, содержащего множество других компонентов, таких как белки, липиды и нематричные нуклеиновые кислоты. Матричные молекулы нуклеиновой кислоты могут быть получены из любого клеточного материала, полученного из животного, растения, бактерии, гриба или любого другого клеточного организма.
[0194] В определенных вариантах осуществления полинуклеотиды получают из одной клетки, такой как клетка, присутствующая в популяции клеток. Полинуклеотиды могут быть получены непосредственно из организма или из биологического образца, полученного из организма. Любой образец ткани или жидкости организма может быть использован в качестве источника нуклеиновой кислоты для использования в изобретении. Полинуклеотиды также могут быть выделены из культивируемых клеток, таких как первичная клеточная культура или клеточная линия. В некоторых вариантах осуществления такая клетка может быть клеткой крови, иммунной клеткой, тканевой клеткой или опухолевой клеткой. В некоторых вариантах осуществления клетка представляет собой иммунную клетку, такую как B-клетка или T-клетка. В-клетка может быть плазмобластом, В-клеткой памяти или клеткой плазмы. Клетки или ткани, из которых получены матричные нуклеиновые кислоты, могут быть инфицированы вирусом или другим внутриклеточным патогеном.
[0195] В некоторых вариантах осуществления популяция клеток, такая как популяция, содержащая иммунные клетки, может быть выделена из крови или других биологических образцов субъекта или хозяина, таких как человек или другое животное, которое было иммунизировано или страдает от инфекции, рака, аутоиммунного заболевания или любого другого заболевания. В некоторых вариантах осуществления, у человека может быть или не быть диагностировано заболевание, и человек может проявлять симптомы заболевания или не проявлять их. В некоторых вариантах субъектом или хозяином, например, человеком, может быть тот, который подвергался воздействию и/или тот, кто может производить TCR против инфекционного агента (например, вирусов, бактерий, паразитов, прионов и т. д.), антигена, заболевания или антигена, связанного с заболеванием или состоянием, например, такого, как опухолевый антиген. В некоторых вариантах осуществления иммунные клетки могут происходить из любого биологического образца, содержащего Т-клетки, такие как клетки, присутствующие среди мононуклеарных клетках перефиричнской крови (РВМС), селезенке или другом лимфоидном органе. В некоторых вариантах осуществления иммунные клетки происходят из источника Т-клеток нормального здорового субъекта. В некоторых вариантах осуществления иммунные клетки происходят из источника Т-клеток больного субъекта. В некоторых вариантах осуществления могут быть выделены или получены клетки CD4+ или CD8+. В некоторых случаях мононуклеарные клетки периферической крови (РВМС) могут быть выделены или получены. В некоторых случаях инфильтрирующие опухоль лимфоциты (TIL) могут быть выделены или получены.
[0196] В определенных вариантах осуществления антитело или TCR-продуцирующие иммунные клетки могут быть выделены из крови или других биологических образцов субъекта или хозяина, такого как человек или другое животное, которое было иммунизировано или который страдает от инфекции, рака, аутоиммунного состояния или любых других заболеваний, для идентификации патогенного, опухолевого и/или специфического для заболевания антитела или TCR, которые могут иметь клиническое значение. Например, у человека может быть диагностировано/не диагностировано заболевание, у него могут проявляться или отсутствовать симптомы заболевания. Например, таким человеком может быть тот, кто подвергался воздействию и/или тот кто может производить TCR против инфекционного агента (например, вирусов, бактерий, паразитов, прионов и т. д.), антигена или заболевания. В некоторых примерах, животное может быть тем, которое подвергалось воздействию и/или которое может вырабатывать полезные антитела или TCR против инфекционного агента (например, вирусов, бактерий, паразитов, прионов и т.д.), антигена или заболевания. В некоторых примерах животное, такое как человек, больше не проявляет симптомов заболевания или состояния. Определенные иммунные клетки от иммунизированных хозяев продуцируют антитела или TCR к одному или нескольким антигенам-мишеням и/или одному или нескольким неизвестным антигенам. В настоящем изобретении пул лимфоцитов может быть обогащен желаемыми иммунными клетками любым подходящим способом, например, таким как скрининг и сортировка клеток с использованием флуоресцентно-активированной сортировки клеток (FACS), магнитно-активированной сортировки клеток (MACS), пэннинга или другого метода скрининга для получения множества иммунных клеток из образца, такого как библиотека иммунных клеток, прежде чем цепи антител будут секвенированы, антитела образованы или библиотека(и) экспрессии созданы. В отличие от способов обогащения предшествующего уровня техники, которые могли обеспечить только несколько подмножеств иммунных клеток, экспрессирующих различные антитела, и, следовательно, только несколько встречающихся в природе комбинаций вариабельных доменов, библиотека иммунных клеток по настоящему изобретению содержит по меньшей мере два подмножества иммунных клеток или отдельные клетки, экспрессирующие различные антитела или TCR. Например, библиотека иммунных клеток по настоящему изобретению может содержать по меньшей мере 5, 10, 100, 250, 500, 750, 1000, 2500, 5000, 10000, 25000, 50000, 75000, 10000, 250 000, 500000, 750000, 1000000, 2500000, 5000000, 7500000 или 10000000 подмножеств/групп клеток или отдельных иммунных клеток, экспрессирующих различные антитела или TCR. Способы по настоящему изобретению максимизируют восстановление иммунных клеток и обеспечивают высокую степень разнообразия.
[0197] Т-клетки могут быть получены из ряда источников, включая мононуклеарные клетки периферической крови, костный мозг, тимус, биопсию ткани, опухоль, ткань лимфатического узла, кишечную лимфоидную ткань, слизистую лимфоидную ткань, ткань селезенки или любую другую. лимфоидную ткань и опухоли. Т-клетки могут быть получены из Т-клеточных линий и из аутологичных или аллогенных источников. Т-клетки могут быть получены от одного индивидуума или популяции индивидуумов, например, популяции индивидуумов, где все страдают от одного и того же заболевания, такого как рак или инфекционное заболевание. В некоторых вариантах осуществления клетки из циркулирующей крови индивидуума получают путем афереза или лейкафереза. Продукт афереза обычно содержит лимфоциты, включая Т-клетки, моноциты, гранулоциты, В-клетки, другие ядросодержащие лейкоциты, эритроциты и тромбоциты. В одном варианте осуществления клетки, собранные с помощью афереза или лейкафереза, могут быть промыты для удаления фракции плазмы и загрузки клеток в соответствующий буфер или среду для последующих стадий обработки. В одном варианте осуществления изобретения клетки промывают фосфатно-солевым буфером (PBS). В альтернативном варианте осуществления в промывочном растворе нет кальция и может не быть магния или многих, если не всех, двухвалентных катионов. Как легко поймут специалисты в данной области техники, стадия промывки может быть осуществлена способами, известными специалистам в данной области техники, такими как использование «проточной» полуавтоматической центрифуги.
[0198] После промывки клетки могут быть ресуспендированы в различных биосовместимых буферах, таких как, например, свободный от Ca++/Mg++ PBS. Альтернативно, нежелательные компоненты образца афереза могут быть удалены, и клетки непосредственно ресуспендируются в культуральной среде. В других вариантах осуществления Т-клетки выделяют из лимфоцитов периферической крови путем лизиса эритроцитов и центрифугированием в градиенте PERCOLL™. Специфическая субпопуляция Т-клеток, такая как CD28+, CD4+, CD8+, CD45RA+ и CD45RO+T-клетки, может быть дополнительно выделена методами положительной или отрицательной селекции. Например, CD3 +, CD28+ T-клетки могут быть отобраны методом положительной селекции с использованием конъюгированных CD3/CD28 магнитных шариков (например, DYNABEADS® M-450 T-клеточный экспандер CD3/CD28).
[0199] В некоторых вариантах осуществления обогащение популяции Т-клеток путем отрицательной селекции может быть достигнуто с помощью комбинации антител, направленных на поверхностные маркеры, уникальные для отрицательно выбранных клеток. Одним из таких методов является сортировка и/или отбор клеток методом отрицательной магнитной иммуноадгезии или проточной цитометрии, в которой используется набор моноклональных антител, направленных на маркеры клеточной поверхности, присутствующие на клетках, которые могут быть отобраны методом отрицательной селекции. Например, для обогащения клеток CD4+методом отрицательной селекции, коктейль моноклональных антител обычно включает антитела к CD14, CD20, CD11b, CD16, HLA-DR и CD8. Другим способом подготовки Т-клеток для стимуляции является стадия замораживания клеток после стадии промывки, которая не требует стадии удаления моноцитов. Стадия замораживания и последующего оттаивания может обеспечить более однородный продукт путем удаления гранулоцитов и, в некоторой степени, моноцитов в клеточной популяции. После стадии промывки, на которой удаляют плазму и тромбоциты, клетки могут быть суспендированы в замораживающем растворе. Хотя многие растворы и параметры для замораживания известны в данной области и будут полезны в этом контексте, один из способов включает использование PBS, содержащего 20% ДМСО и 8% человеческого сывороточного альбумина (HSA), или другие подходящие среды для замораживания клеток. Этот раствор разбавляют 1: 1 средой, так что конечная концентрация ДМСО и HSA составляет 10% и 4% соответственно. Затем клетки замораживают до -80°С со скоростью 1°С в минуту и хранят в паровой фазе резервуара для хранения жидкого азота.
[0200] В некоторых вариантах осуществления популяция клеток обогащена из образца. В некоторых вариантах осуществления клетки обогащены по определенной группе клеток или подтипа клетки. В некоторых вариантах осуществления популяция клеток обогащена или содержит Т-клетки или В-клетки. В некоторых вариантах осуществления популяция клеток обогащена или содержит клетки CD4+ или CD8+. В некоторых вариантах осуществления популяция клеток обогащена или содержит центральные T-клетки памяти, эффекторные T-клетки памяти, наивные T-клетки, стволовые T-клетки центральной памяти, эффекторные T-клетки и регуляторные T-клетки. В некоторых вариантах осуществления популяция клеток обогащена или содержит В-клетки памяти, наивные В-клетки или В-клетки плазмобластов.
[0201] В некоторых вариантах осуществления иммунные клетки могут быть выбраны на основе аффинности иммунных рецепторов клетки к выбранному целевому антигену или комплексу. В некоторых аспектах аффинность связана с константой равновесия для обратимого связывания двух агентов и выражается в виде KD. Аффинность связывающего белка к лиганду, такое как афиинность антитела к эпитопу или такое как аффинность к комплексу MHC-пептид, может составлять, например, от примерно 100 наномолярных (нМ) до примерно 0,1 нМ, примерно от 100 нМ до примерно 1 пикомолярного (пМ) или от примерно 100 нМ до примерно 1 фемтомолярного (фМ). Термин «авидность» относится к устойчивости комплекса из двух или более агентов к диссоциации после разбавления.
[0202] В некоторых вариантах осуществления эпитоп в некоторых аспектах относится к части антигена или другой макромолекулы, способной формировать взаимодействие связывания со связывающим карманом вариабельной области антитела или TCR. Такие связывающие взаимодействия могут проявляться в виде межмолекулярного контакта с одним или несколькими аминокислотными остатками одного или нескольких CDR. Связывание антигена может включать, например, CDR3, пару CDR3 или, в некоторых случаях, взаимодействия вплоть до всех шести CDR цепей VH и VL. Эпитоп может быть линейной пептидной последовательностью (то есть «непрерывной») или может состоять из несмежных аминокислотных последовательностей (то есть "конформационные" или "прерывистые"). Антитело или TCR могут распознавать одну или несколько аминокислотных последовательностей; следовательно, эпитоп может определять более чем одну отличную аминокислотную последовательность. В некоторых аспектах TCR может распознавать одну или несколько аминокислотных последовательностей или эпитопов в контексте MHC. Эпитопы, распознаваемые антителами и TCR, могут быть определены методами картирования пептидов и анализа последовательностей секванированием, хорошо известными специалисту в данной области. Связывающие взаимодействия проявляются в виде межмолекулярных контактов с одним или несколькими аминокислотными остатками CDR.
[0203] В некоторых вариантах осуществления ссылка на иммунный рецептор, эксперссируемый в иммунных клетках, например антитело или TCR, обладающий специфическим связыванием относится к ситуации, в которой антитело или TCR не демонстрируют какого-либо значительного связывания с молекулами другого типа, чем антиген, содержащий эпитоп, распознаваемый антителом или TCR. Термин также применим в том случае, когда, например, антигенсвязывающий домен является специфичным для конкретного эпитопа, который принадлежит ряду антигенов, и в этом случае выбранное антитело, TCR или его антигенсвязывающий фрагмент, несущий антигенсвязывающий домен, будет способен связываться с различными антигенами, несущими данный эпитоп.
[0204] Термины «предпочтительно связывает» или «специфически связывает» означают, что антитела, TCR или их фрагменты связываются с эпитопом с большей аффинностью, чем он связывает неродственные аминокислотные последовательности, и, даже если они перекрестно реагируют на другие полипептиды, содержащими эпитопы, то не являются токсичными при тех концентрациях, для которых они сформулированы для введения человеку. В одном аспекте такая аффинность по меньшей мере в 1 раз больше, по меньшей мере в 2 раза больше, по меньшей мере в 3 раза больше, по меньшей мере в 4 раза больше, по меньшей мере в 5 раз больше, по меньшей мере в 6 раз больше по меньшей мере в 7 раз больше, по меньшей мере в 8 раз больше, по меньшей мере в 9 раз больше, в 10 раз больше, по меньшей мере в 20 раз больше, по меньшей мере в 30 раз больше, по меньшей мере в 40 раз больше, по меньшей мере в 50 раз больше, по меньшей мере в 60 раз больше, по меньшей мере в 70 раз больше, по меньшей мере в 80 раз больше, по меньшей мере в 90 раз больше, по меньшей мере в 100 раз больше или по меньшей мере в 1000 раз больше, чем аффинность антитела, TCR или фрагментов таковых для неспецифичных аминокислотных последовательностей. Термин «связывание» относится к прямой ассоциации между двумя молекулами вследствие, например, ковалентных, электростатических, гидрофобных и ионных и/или водородных связей в физиологических условиях и включает такие взаимодействия, как солевые и водные мостики, а также любые другие известные средства связывания.
[0205] В некоторых вариантах осуществления термин «связывание» относится к прямой ассоциации между двумя молекулами, например, вследствие ковалентных, электростатических, гидрофобных и ионных и/или водородных связей в физиологических условиях и включает такие взаимодействия, как солевых и водные мостики, а также любые другие обычные средства связывания.
[0206] В некоторых вариантах осуществления иммунные клетки могут быть выбраны на основе аффинности иммуно-рецептора, например TCR клетки к тетрамеру или другому мультимерному MHC-пептиду. В некоторых вариантах осуществления термин «тетрамер» может относиться к комплексу, содержащему четыре субъединицы, связанные с одной молекулой стрептавидина, которые могут связываться и, таким образом, идентифицировать популяцию клеток. Субъединица может представлять собой комплекс MHC-пептид. Субъединица может представлять собой МНС без ассоциированного с ним пептида. Субъединица может быть антигеном В-клеточного рецептора. Популяция клеток, идентифицированных тетрамером, может представлять собой популяцию, экспрессирующую рецептор, такой как TCR или BCR, который связывается с субъединицей тетрамера. Популяция клеток может представлять собой антиген-специфичные Т-клетки. Популяция клеток может представлять собой антигенс-пецифичные В-клетки. Тетрамер может быть флуоресцентно помечен. Используемый здесь термин «MHC-пептидный тетрамер» может быть использован взаимозаменяемо с pMHC.
[0207] В некоторых примерах иммунные клетки могут быть отобраны на основе аффинности к аффинному олигонуклеотидному конъюгату (см., например, WO 2017/053905). Клетки, отобранные на основе связывания или распознавания выбранного антигена или комплекса-мишени, такого как конъюгат аффинного олигонуклеотида, могут быть дополнительно выделены с помощью методов положительной или отрицательной селекции, описанных здесь.
[0208] В некоторых вариантах осуществления используются иммунные клетки от неиммунизированных доноров человека или не являющихся человеком. Наивный репертуар животного (репертуар до заражения антигеном) обеспечивает животное антителами или TCR, которые могут связываться с умеренной аффинностью (KA от примерно 1×10-6 до 1×10-7 M) по существу с любой несобственной молекулой. Разнообразие последовательностей сайтов связывания антител или TCR не кодируется непосредственно в зародышевой линии, а обеспечивается комбинаторным образом сборкой из сегментов V-гена. Иммунизация запускает любую иммунную клетку продуцирующую комбинацию VH-VL или Vα-Vβ или Vγ-Vδ, которая связывает иммуноген, процесс пролиферации (клональной экспансии) и секретирования соответствующего антитела, как отмечено выше. Однако, использование клеток селезенки и/или иммунных клеток или других лимфоцитов периферической крови (PBL) неиммунизированного субъекта может способоствовать более точному представлению о возможном репертуаре антител или TCR, а также позволит сконструировать последующую B-клеточную, T-клеточную библиотеку антител или библиотеку TCR с использованием любых видов животных.
[0209] В некоторых вариантах осуществления образец представляет собой слюну. В некоторых вариантах осуществления образец представляет собой цельную кровь. В некоторых вариантах для того, чтобы получить достаточное количество полинуклеотидов для тестирования, объем крови составляет по меньшей мер, приблизительно 0,001, 0,005, 0,01, 0,05, 0,1, 0,5, 1, 2, 3, 4, 5, 10, 20, 25, 30, 35, 40, 45 или 50 мл. В некоторых случаях, чтобы получить достаточное количество нуклеиновой кислоты для тестирования, объем крови составляет по меньшей мере 0,001, 0,005, 0,01, 0,05, 0,1, 0,5, 1, 2, 3, 4, 5, 10, 20, 25, 30, 35, 40, 45 или 50 мл.
[0210] В некоторых случаях исходным материалом является периферическая кровь. Клетки периферической крови могут быть обогащены по определенному типу клеток (например, мононуклеарные клетки; эритроциты; клетки CD4+; клетки CD8+; иммунные клетки; Т-клетки, NK-клетки или подобным). Клетки периферической крови также могут быть избирательно истощены по типу клеток определенного типа (например, мононуклеарные клетки; эритроциты; клетки CD4+; клетки CD8+; иммунные клетки; T-клетки, NK-клетки или тому подобное).
[0211] В некоторых случаях исходным материалом может быть образец ткани, содержащий твердую ткань, с неограничивающими примерами, включающими кожу, мозг, печень, легкое, почку, предстательную железу, яичник, селезенку, лимфатический узел (включая миндалину), щитовидную железу, поджелудочную железу, сердце, скелетные мышцы, кишечник, гортань, пищевод и желудок. В других случаях исходным материалом могут быть клетки, содержащие нуклеиновые кислоты, иммунные клетки и, в частности, B-клетки или T-клетки. В некоторых случаях исходным материалом может быть образец, содержащий нуклеиновые кислоты из любого организма, из которого может быть получен генетический материал. В некоторых случаях образец представляет собой жидкость, например кровь, слюну, лимфу или мочу.
[0212] Образец может быть взят от субъекта с заболеванием. В некоторых случаях субъектом, у которого взята носитель, может быть пациент, например, больной раком или c подозрением на рак. Субъект может быть млекопитающим, например, человеком, мужчиной или женщиной. В некоторых случаях самка может быть беременной. Образец может представлять собой биопсию опухоли. Биопсия может быть выполнена, например, медицинским работником, включая врача, помощника врача, медсестру, ветеринарного врача, стоматолога, мануального терапевта, фельдшера, дерматолога, онколога, гастроэнтеролога или хирурга.
[0213] В некоторых случаях материал ненуклеиновой кислоты могут быть удален из исходного материала при ферментативной обработке (таких как расщепление протеазой).
[0214] В некоторых случаях кровь может быть собрана в устройство, содержащее хелаторы магния, включая, но не ограничиваясь этим, EDTA, и храниться при 4°С. Необязательно может быть добавлен хелатор кальция, включая, но не ограничиваясь этим, EGTA. В другом случае ингибитор клеточного лизиса добавляют в кровь, включая, но не ограничиваясь этим, формальдегид, производные формальдегида, формалин, глутаральдегид, производные глутаральдегида, кросс-линкер белка, кросс-линкер нуклеиновой кислоты, кросс-линкеры белка и нуклеиновой кислоты, аминореактивные кросс-линкеры, сульфгидрильно-реактивные кросс-линкеры, кросс-линкеры, способоствующие сульфгидрильно-аддитивному или дисульфидному восстановлению, углеводно-реактивные кросс-линкеры, карбоксильно-реактивные кросс-линкеры, фотореактивные кросс-линкеры или расщепляемые кросс-линкеры.
[0215] В некоторых случаях, когда экстрагированный материал содержит одноцепочечную РНК, двухцепочечную РНК или гибрид ДНК-РНК, эти молекулы могут быть преобразованы в двухцепочечную ДНК с использованием методик, известных в данной области. Например, обратная транскриптаза может быть использована для синтеза ДНК из молекул РНК. В некоторых случаях для преобразования РНК в ДНК может потребоваться предварительная стадия лигирования для лигирования фрагмента линкера с РНК, что позволяет использовать универсальные праймеры для инициации обратной транскрипции. В других случаях, например, хвост poly-А молекулы мРНК может быть использован для инициации обратной транскрипции. После преобразования РНК в ДНК методы, подробно описанные в настоящем документе, могут быть использованы, в некоторых случаях, для дальнейшего захвата, выбора, маркировки или выделения желаемой последовательности.
[0216] Молекулы нуклеиновой кислоты включают дезоксирибонуклеиновую кислоту (ДНК) и/или рибонуклеиновую кислоту (РНК). Молекулы нуклеиновой кислоты могут быть синтетическими или полученными из естественных источников. В одном варианте осуществления молекулы нуклеиновой кислоты выделяют из биологического образца, содержащего множество других компонентов, таких как белки, липиды и нематричные нуклеиновые кислоты. Матричные молекулы нуклеиновой кислоты могут быть получены из любого клеточного материала, выделенного из животного, растения, бактерии, гриба или любого другого клеточного организма. В определенных вариантах осуществления молекулы нуклеиновой кислоты получают из одной клетки. Биологические образцы для использования в настоящем изобретении включают вирусные частицы или их препараты. Молекулы нуклеиновой кислоты могут быть выделены непосредственно из организма или из биологического образца, полученного из организма, например, из крови, мочи, спинномозговой жидкости, семенной жидкости, слюны, мокроты, стула и ткани. Любой образец ткани или жидкости организма y использоваться в качестве источника нуклеиновой кислоты для использования в изобретении. Молекулы нуклеиновой кислоты также могут быть выделены из культивируемых клеток, таких как первичная клеточная культура или клеточная линия. Клетки или ткани, из которых получены матричные нуклеиновые кислоты, могут быть инфицированы вирусом или другим внутриклеточным патогеном.
[0217] Образец также может представлять собой общую РНК, полученную или сгенерированную из биологического материала, библиотеки кДНК, вирусной или геномной ДНК. В определенных вариантах осуществления молекулы нуклеиновой кислоты ассоциированы/связаны с другими молекулами-мишенями, такими как белки, ферменты, субстраты, антитела, связывающие агенты, гранулы, малые молекулы, пептиды или любые другие молекулы. Обычно нуклеиновая кислота может быть извлечена из биологического образца посредством различных методов, таких как описанных Sambrook and Russell, Molecular Cloning: A Laboratory Manual, Third Edition, Cold Spring Harbor, N.Y. (2001). Молекулы нуклеиновой кислоты могут быть одноцепочечными, двухцепочечными или двухцепочечными с одноцепочечными областями (например, стволовыми и петлевыми структурами).
[0218] Способы выделения ДНК хорошо известны в данной области. Классический протокол выделения ДНК основан на экстракции с использованием органических растворителей, таких как смесь фенола и хлороформа, с последующим осаждением этанолом (J. Sambrook et al., “Molecular Cloning: A Laboratory Manual,” 1989, 2nd Ed., Cold Spring Harbour Laboratory Press: New York, N.Y.). Другие способы включают: высаливание при ДНК-экстракции (P. Sunnucks et al., Genetics, 1996, 144: 747-756; S. M. Aljanabi et al., Nucl. Acids Res. 1997, 25: 4692-4693), ДНК-экстракцию с солями триметиламмония бромида (S. Gustincich et al., BioTechniques, 1991, 11: 298-302) и экстракцию ДНК с использованием тиоцианата гуанидиния (JBW Hammond et al., Biochemistry, 1996, 240: 298-300). В продаже имеются различные наборы для выделения ДНК из биологических образцов (например, BD Biosciences Clontech (Palo Alto, CA): Epicentre Technologies (Madison, WI); Gentra Systems, Inc. (Minneapolis, MN); MicroProbe Corp. (Bothell, WA); Organon Teknika (Durham, NC); и Qiagen Inc. (Valencia, CA)).
[0219] Способы выделения РНК также хорошо известны в данной области (например, J. Sambrook et al., “Molecular Cloning: A Laboratory Manual” 1989, 211d Ed., Cold Spring Harbour Laboratory Press: New York), и доступны наборы для экстракции РНК из биологических жидкостей коммерчески (например, Ambion, Inc. (Austin, TX); Amersham Biosciences (Piscataway, NJ); BD Biosciences Clontech (Palo Alto, CA); BioRad Laboratories (Hercules, CA); Dynal Biotech Inc. (Lake Success, NY); Epicentre Technologies (Madison, WI); Gentra Systems, Inc. (Minneapolis, MN); GIBCO BRL (Gaithersburg, MD); Invitrogen Life Technologies (Carlsbad, CA); MicroProbe Corp. (Bothell, WA); Organon Teknika (Durham, NC); Promega, Inc. (Madison, WI); и Qiagen Inc. (Valencia, CA)).
[0220] Один или более образцов могут происходить из одного или более источников. Один или более образцов могут происходить из двух или более источников. Один или более образцов могут происходить от одного или более субъектов. Один или более образцов могут происходить от двух или более субъектов. Один или более образцов могут происходить от одного и того же субъекта. Один или более образцов могут происходить из одного и того же вида. Один или более образцов могут происходить из разных видов. Один или более субъектов могут быть здоровыми. Один или более субъектов могут иметь заболевание, расстройство или состояние.
[0221] В некоторых вариантах осуществления образец представляет собой жидкость, такую как кровь, слюна, лимфа, моча, спинномозговая жидкость, семенная жидкость, мокрота, стул или тканевые гомогенаты.
[0222] Образец может быть взят от субъекта с состоянием, отличным от нормы. В некоторых вариантах осуществления субъект, у которого взята носитель, может быть пациентом, например, больным раком или у которого подозревается рак. Субъект может быть млекопитающим, например, человеком, и может быть мужчиной или женщиной. В некоторых вариантах осуществления женщина может быть беременна. Образец может представлять собой биопсию опухоли. Биопсия может быть выполнена, например, медицинским работником, включая врача, помощника врача, медсестру, ветеринарного врача, стоматолога, мануального терапевта, фельдшера, дерматолога, онколога, гастроэнтеролога или хирурга.
[0223] В некоторых вариантах осуществления полинуклеотиды связаны с другими молекулами-мишенями, такими как белки, ферменты, субстраты, антитела, связывающие агенты, шарики, небольшие молекулы, пептиды или любые другие молекулы. В некоторых вариантах полинуклеотиды не связаны с твердой подложкой. Нуклеиновые кислоты могут быть извлечены из биологического образца различными способами (Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Edition, Cold Spring Harbor, N.Y. (2001)).
[0224] В некоторых вариантах осуществления клеточные суспензии могут быть предварительно нагреты перед анализом. В некоторых вариантах осуществления клеточные суспензии нагревают непосредственно перед генерацией эмульсии (описанной ниже в разделе B.2) до температуры и в течение достаточной продолжительности для повышения активности ДНК-полимеразы внутри клетки, и для минимизации нежелательных эффектов, таких как деградация РНК. Таким образом, клетки нагревают, чтобы оптимизировать выход РНК в соответствии со способами, представленными здесь. В некоторых примерах клетки нагревают до приблизительно 30-70°С, например, от 30 до 60°С, от 25 до 60°С, от 30 до 60°С, от 40 до 60°С, от 45 до 55°С, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 минут. После нагревания клеток суспензию клеток можно выдерживать при комнатной температуре или помещать на лед от 30 секунд до 4 часов, например, 30 секунд, 45 секунд, 1 минута, 2 минуты, 3 минуты, 4 минуты, 5 минут, 6 минут, 7 минут, 8 минут, 9 минут, 10 минут, 15 минут, 20 минут, 25 минут, 30 минут, 35 минут, 40 минут, 45 минут, 1 час, 1,5 часа, 2 часа, 2,5 часа, 3 часа 3,5 часа или 4 часа до образования эмульсии.
[0225] Келичество образцов может содержать по меньшей мере 2, 3, 4, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 или более образцов. Количество образцов может содержать по меньшей мере примерно 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 или более образцов. Количесво образцов может содержать по меньшей мере примерно 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000 образцов, 9000 или 10000 образцов, или 100000 образцов, или 1000000 или более образцов. Количество образцов может содержать по меньшей мере примерно 10000 образцов.
[0226] Один или более полинуклеотидов первого образца могут отличаться от одного или более полинуклеотидов второго образца. Один или более полинуклеотидов первого образца могут отличаться от одного или более полинуклеотидов множества образцов. Один или более полинуклеотидов в образце могут содержать последовательности с по меньшей мере приблизительно 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% степенью идентичности. В некоторых вариантах осуществления один или несколько полинуклеотидов образца могут различаться менее чем на 100, 90, 80, 70, 60, 50, 40, 30, 25, 20, 25, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 нуклеотид или пару оснований. Множество полинуклеотидов в одном или более образцах из множества образцов может содержать две или более идентичных последовательностей. По меньшей мере примерно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40% 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% от общего количества полинуклеотидов в одном или более из множества образцов могут содержать одну и ту же последовательность. Множество полинуклеотидов в одном или более образцах из множества образцов может содержать по меньшей мере две разные последовательности. По меньшей мере примерно 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% всех полинуклеотидов в одном или более образце из множества образцов могут содержать по меньшей мере две разные последовательности. В некоторых вариантах осуществления один или более полинуклеотидов являются вариантами друг друга. Например, один или более полинуклеотидов могут содержать единичные нуклеотидные полиморфизмы или мутации других типов. В другом примере один или более полинуклеотидов являются вариантами сплайсинга.
[0227] Первый образец может содержать одну или более клеток, и второй образец может содержать одну или более клеток. Одна или более клеток первого образца могут быть того же типа, что и одна или более клеток второго образца. Одна или более клеток первого образца могут относиться к другому типу клетокб чем одна или более различных клеток, принадлежащих множеству образцов.
[0228] Множество образцов может быть получено параллельно. Множество образцов может быть получено одновременно. Множество образцов может быть получено последовательно. Множество образцов может быть получено в течение нескольких лет, например, 100 лет, 10 лет, 5 лет, 4 года, 3 года, 2 года или 1 год после получения одного или более различных образцов. Один или более образцов могут быть получены в течение примерно одного года после получения одного или более различных образцов. Один или более образцов могут быть получены в течение 12 месяцев, 11 месяцев, 10 месяцев, 9 месяцев, 8 месяцев, 7 месяцев, 6 месяцев, 5 месяцев, 4 месяцев, 3 месяцев, 2 месяцев или 1 месяца с момента получения одного или нескольких различных образцов. Один или более образцов могут быть получены в течение 30 дней, 28 дней, 26 дней, 24 дня, 21 дня, 20 дней, 18 дней, 17 дней, 16 дней, 15 дней, 14 дней, 13 дней, 12 дней, 11 дней, 10 дней, 9 дней, 8 дней, 7 дней, 6 дней, 5 дней, 4 дня, 3 дня, 2 дня или одного дня после получения одного или более различных образцов. Один или более образцов могут быть получены в течение примерно 24 часов, 22 часов, 20 часов, 18 часов, 16 часов, 14 часов, 12 часов, 10 часов, 8 часов, 6 часов, 4 часов, 2 часов или 1 часа с момента их получения одного или более различных образцов. Один или более образцов могут быть получены в течение примерно 60 секунд, 45 секунд, 30 секунд, 20 секунд, 10 секунд, 5 секунд, 2 секунд или 1 секунды с момента получения одного или более различных образцов. Один или более образцов могут быть получены в течение менее одной секунды после получения одного или более различных образцов.
[0229] Различные полинуклеотиды образца могут присутствовать в образце в различных концентрациях или количествах (например, различное количество молекул). Например, концентрация или количество одного полинуклеотида может быть больше, чем концентрация или количество другого полинуклеотида в образце. В некоторых вариантах осуществления концентрация или количество по меньшей мере одного полинуклеотида в образце может быть по меньшей мере приблизительно в 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000 или более раз больше, чем концентрация или количество по меньшей мере одного другого полинуклеотида в образце. В другом примере концентрация или количество одного полинуклеотида меньше, чем концентрация или количество другого полинуклеотида в образце. Концентрация или количество по меньшей мере одного полинуклеотида в образце может быть по меньшей мере примерно в 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000 или более раз меньше, чем концентрация или количество в хотя бы одного другого полинуклеотида в образце.
[0230] В некоторых вариантах два или более образцов могут содержать разные количества или концентрации полинуклеотидов. В некоторых вариантах осуществления концентрация или количество одного полинуклеотида в одном образце может быть больше, чем концентрация или количество того же полинуклеотида в другом образце. Например, образец крови может содержать большее количество конкретного полинуклеотида, чем образец мочи. Альтернативно, один образец может быть разделен на два или более образцов. Такие образцы могут содержать разные количества или концентрации одного и того же полинуклеотида. Концентрация или количество по меньшей мере одного полинуклеотида в одном образце может быть по меньшей мере приблизительно в 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25. В 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000 или более раз больше, чем концентрация или количество того же полинуклеотида в другом образце. Альтернативно, концентрация или количество одного полинуклеотида в одном образце может быть меньше, чем концентрация или количество того же полинуклеотида в другом образце. Например, концентрация или количество по меньшей мере одного полинуклеотида в одном образце может быть по меньшей мере примерно в 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000 или более раз меньше, чем концентрация или количество того же полинуклеотида в другом образце.
2. Получение капель и штрих-кодирование отдельных клеток
[0231] Для штрих-кодирования отдельных клеток с использованием штрих-кода носителя и молекулярного штрих-кода, носителя, такие как эмульсии вода-в-масле, могут быть созданы таким образом, чтобы в полученных носителях содержалось по 1 клетке или меньше на носителя. Носители могут быть созданы таким образом, чтобы полученные носители также содержали 1 штрих-код носителя на носителя. Носители могут быть созданы таким образом, чтобы полученные носители также содержали 1 полинуклеотид с молекулярной штрих-кодом на носителя. Носители могут быть созданы таким образом, чтобы полученные носители также содержали два или более полинуклеотидов с молекулярным штрих-кодом на носителя. Клетки/носители могут подвергаться протоколу штрих-кодирования РНК или ДНК одним кодом, как описано здесь, и штрих-код носителя и один или болеее молекулярных штрих-кодов каждого носителя могут быть слиты с интересующей мишенью, такой как клеточный полинуклеотид. В некоторых вариантах осуществления полинуклеотиды совпадающим штрих-кодом носителя могут быть слиты с клеточными компонентами, присутствующими в том же носителе, например, с одним или болеее полинуклеотидом с молекулярным штрих-кодом. После секвенирования можно использовать штрих-код носителя и молекулярный штрих-код, чтобы с помощью математических методов определить, какая РНК (или ДНК) произошла из какой клетки. В некоторых вариантах носители, такие как эмульсии вода-в-масле, могут быть созданы таким образом, чтобы полученные эмульсии содержали 1 клетку или более на эмульсию. В некоторых вариантах осуществления эмульсии вода-в-масле могут быть созданы таким образом, чтобы полученные эмульсии содержали 1 полинуклеотид с штрих-кодом носителя и два или более полинуклеотида с молекулярным штрих-кодом на носителя. В некоторых вариантах осуществления носители могут быть созданы таким образом, чтобы полученные носители содержали более одного полинуклеотида со штрих-кодом носителя и два или более полинуклеотида с молекулярным штрих-кодом на носителя. В некоторых вариантах осуществления штрих-код носителя и молекулярный штриховой код могут быть введены в носители в растворе. В некоторых вариантах осуществления штрих-код носителя и молекулярный штрих-код могут быть введены в носители, пока они не прикреплены к твердой подложке, такой как гранулы. Типичные носители представляют собой лунку, эмульсию, каплю и микрокапсулу.
[0232] В некоторых аспектах отдельные клетки могут быть заключены внутри эмульсии, которая может действовать как компартмент (например, носитель). Клетки могут быть лизированы и транскрипты клетки могут быть штрих-кодированы. Каждый из транскриптов может быть сшит с молекулярным штрих-кодом или штрих-кодом носителя таким образом, что при обнаружении двух или более РНК-транскриптов с одним и тем же штрих-кодом носителя они могут быть диагностированы как происходящие из одной и той же исходной клетки. Это может быть применено ко многим различным типам последовательностей. Одним конкретным применением может быть связка VH и VL или Vα и Vβ или Vγ и Vδ цепей антител с последовательностями TCR.
[0233] Одна или большее количество отдельных клеток может быть заключено в одной или нескольких эмульсиях в присутствии штрих-кода носителя и молекулярных штрих-кодов, так что одна носитель, такая как капля, из одной или нескольких эмульсий может содержать максимум 1 клетку или менее. Клетки можно химически лизировать с помощью буфера, содержащегося в эмульсии, или путем оттаивания, тем самым высвобождая содержимое клетки в эмульсии.
[0234] РНК одной клетки может быть транскрибирована в кДНК методом обратной транскрипции. Реакция обратной транскрипции может быть проведена с обратной транскриптазой, которая обладает нематричной терминальной трансферазной активностью, добавляет примерно 3 остатков цитозина, как описано выше. Все буферы обратной транскрипции, ферменты и нуклеотиды могут присутствовать при образовании эмульсии. В некоторых вариантах осуществления праймер представлять собой обобщенную последовательность (такой как полинуклеотид, содержащий последовательность poly dT) для нацеливания на всю мРНК. В некоторых вариантах осуществления может быть использована ДНК. В некоторых вариантах осуществления более 2 РНК могут служить мишенями.
[0235] В некоторых вариантах осуществления штрих-код носителя может быть связан с РНК во время обратной транскрипции. В некоторых вариантах осуществления молекулярный штрих-код может быть связан с РНК во время обратной транскрипции. В некоторых вариантах осуществления штрих-код носителя и молекулярный штрих-код могут быть связаны с РНК во время обратной транскрипции. Разделение образца множества клеток на небольшие реакционные объемы, в сочетании со штрих-кодированием полинуклеотидов молекулярным штрих-кодом и штрих-кодом носителя, принадлежащих или происходящих из отдельной клетки из множества клеток может обеспечить высокую пропускную способность. секвенирования репертуара последовательностей, таких как последовательности биомаркеров.
[0236] Разделение образца множества клеток на небольшие реакционные объемы или носителя, содержащие одну или несколько клеток, в сочетании со штрих-кодированием полинуклеотидов молекулярным штрих-кодом и штрих-кодом носителя, принадлежащих или происходящих из отдельной клетки из множества клеток может обеспечить высокую пропускную способность. секвенирования репертуара последовательностей, таких как последовательности представляющие процент транскриптома организма. Например, репертуар последовательностей может содержать множество последовательностей, представляющих по меньшей мере примерно 0,00001%, 0,00005%, 0,00010%, 0,00050%, 0,001%, 0,005%, 0,01%, 0,05%, 0,1%, 0,5%, 1%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30%, 35%, 40% 45, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98%, 99% или 100% транскриптома организма.
[0237] Разделение образца иммунных клеток на небольшие реакционные объемы или носителя, содержащие одну или несколько иммунных клеток, в сочетании со штрих-кодированием полинуклеотидов молекулярным штрих-кодом и штрих-кодом носителя, принадлежащих или происходящих из отдельной иммунной клетки из множества иммунных клеток может обеспечить высокую пропускную способность. секвенирования репертуара последовательностей тяжелой и легкой цепей. Эти методы также могут допускать соотнесение тяжелых и легких цепей после секвенирования на основе штрих-кодированных последовательностей. Разделение образца на небольшие реакционные объемы, как описано здесь, также может позволить использовать уменьшенные количества реагентов, тем самым снижая материальные затраты анализа.
[0238] В некоторых случаях реакцию обратной транскрипции и/или реакцию амплификации (например, ПЦР) проводят в каплях, таких как цифровая капельная ПЦР. В определенных аспектах изобретение обеспечивает жидкостные компартменты или носителя для вмещения всего или части целевого материала. В некоторых вариантах осуществления, компартмент или носитель представляет собой каплю. Хотя во всем описании упоминаются «капли», эти термины используются взаимозаменяемо с компартметом для вмещения жидкости и разграничением жидкости, если не указано иное. Носитель может содержать или состоять из такого компартмента для вмещения жидкости с определенными жидкостными разделителями/границами. Если не указано иное, для удобства используется термин «капля», но может использоваться любой ограничивающий жидкость отсек, перегородка или компартмент для жидкости. Капли, используемые в настоящем документе, могут включать эмульсионные композиции (или смеси двух или более несмешивающихся жидкостей), такие как описаны в патенте США № 7622280. Капли могут генерироваться устройствами, описанными в WO/2010/036352. Используемый здесь термин «эмульсия» может относиться к смеси несмешивающихся жидкостей (таких как масло и вода). Масляные и/или водно-масляные эмульсии позволяют разделять реакционные смеси внутри водных капель. Эмульсии могут содержать водные капли в непрерывной масляной фазе. Эмульсии, представленные здесь, могут быть эмульсиями масло-в-воде, где капли представляют собой капли масла в непрерывной водной фазе. Описанные здесь капли предназначены для предотвращения смешивания между компартментами, где каждый компартмент предохраняет свое содержимое от испарения и/или слияния с содержимым других компартментов.
[0239] Смеси или эмульсии, описанные здесь, могут быть стабильными или нестабильными. Эмульсии могут быть относительно стабильными и иметь минимальную коалесценцию. Коалесценция (объединение) происходит, когда маленькие капли объединяются с формированием прогрессивно более крупных капель. В некоторых случаях менее 0,00001%, 0,00005%, 0,00010%, 0,00050%, 0,001%, 0,005%, 0,01%, 0,05%, 0,1%, 0,5%, 1%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5%, 5%, 6%, 7%, 8%, 9% или 10% капель полученных с помщью генератора капель сливаются с другими каплями. Эмульсии могут также иметь ограниченную флокуляцию, процесс, посредством которого дисперсная фаза выходит из суспензии в виде рыхлых хлопьевидных агрегатов.
[0240] Могут быть получены капли, имеющие средний диаметр приблизительно, чуть меньше, или чуть больше, чем по меньшей мере примерно 0,001, 0,01, 0,05, 0,1, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 100, 120, 130, 140, 150, 160, 180, 200, 300, 400 или 500 мкм. Капли могут иметь средний диаметр от примерно 0,001 до примерно 500, от примерно 0,01 до примерно 500, от примерно 0,1 до примерно 500, от примерно 0,1 до примерно 100, от примерно 0,01 до примерно 100 или от примерно 1 до примерно 100 мкм. Известно, что микрофлюидные способы получения капель эмульсии с использованием микроканальной фокусировки с поперечным потоком или физического перемешивания позволяют получать либо монодисперсные, либо полидисперсные эмульсии. Капли могут являться монодисперсными каплями или носителями. Капли могут быть сформированы таким образом, что размер капель не изменяется более чем плюс-минус 5% от среднего размера капель. В некоторых случаях капли генерируются так, что размер капель не изменяется более чем плюс-минус 2% от среднего размера капель. Генератор капель может генерировать популяцию капель из одной образца, причем ни одна из капель не отличается по размеру более чем плюс-минус приблизительно 0,1%, 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5%, 5%, 5,5%, 6%, 6,5%, 7%, 7,5%, 8%, 8,5%, 9%, 9,5% или 10% от среднего размера всего населения капель.
[0241] Каплю или носителя можно сформировать, пропуская масляную фазу через водный образец. Водная фаза может содержать забуференный раствор и реагенты для проведения реакции амплификации, включая клетки, нуклеотиды, нуклеотидные аналоги, полинуклеотиды с молекулярными штрих-кодами, полинуклеотидные праймеры со штрих-кодом носителей, матричные нуклеиновые кислоты и ферменты, такие как ДНК-полимераза, РНК-полимераза и/или обратная транскриптаза. В некоторых вариантах осуществления водная фаза может содержать реагент для лизиса клеток, такой как химический реагент для лизиса клеток.
[0242] Водная фаза может содержать забуференный раствор и реагенты для проведения реакции амплификации на твердом субстрате, таком как гранула или без него. Забуференный раствор может содержать приблизительно, более чем приблизительно или менее чем приблизительно 1, 5, 10, 15, 20, 30, 50, 100 или 200 мМ Трис. В некоторых случаях концентрация хлорида калия может составлять приблизительно, более, чем приблизительно, или менее, чем приблизительно 10, 20, 30, 40, 50, 60, 80, 100, 200 мМ. Забуференный раствор может содержать примерно 15 мМ Трис и 50 мМ KCl. Нуклеотиды могут содержать молекулы дезоксирибонуклеотидтрифосфата, включая dATP, dCTP, dGTP и dTTP, в концентрациях приблизительно, более, чем приблизительно, или менее, чем приблизительно 50, 100, 200, 300, 400, 500, 600 или 700 мкМ каждый. В некоторых случаях dUTP добавляют в водной фазе до концентрации приблизительно, более, чем приблизительно, или менее, чем приблизительно 50, 100, 200, 300, 400, 500, 600 или 700, 800, 900 или 1000 мкМ. В некоторых случаях хлорид магния или ацетат магния (MgCl добавляют к водной фазе в концентрации приблизительно, более, чем приблизительно, или менее, чем приблизительно 1,0, 2,0, 3,0, 4,0 или 5,0 мМ). Концентрация MgCl может составлять примерно 3,2 мМ. В некоторых случаях используется ацетат магния или магния. В некоторых случаях используется сульфат магния.
[0243] Можно использовать неспецифический блокирующий агент, такой как BSA или желатин из бычьей кожи, где желатин или BSA присутствует в диапазоне концентраций приблизительно 0,1-0,9% мас/об. Другие возможные блокирующие агенты могут включать беталактоглобулин, казеин, сухое молоко или другие распространенные блокирующие агенты. В некоторых случаях предпочтительные концентрации BSA и желатина составляют примерно 0,1% мас/об.
[0244] Праймеры для амплификации в водной фазе могут иметь концентрацию приблизительно, более, чем приблизительно, или менее, чем приблизительно 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,2, 1,5. 1,7 или 2,0 мкМ. Концентрация праймера в водной фазе может составлять от приблизительно 0,05 до приблизительно 2, от приблизительно 0,1 до приблизительно 1,0, от приблизительно 0,2 до приблизительно 1,0, от приблизительно 0,3 до приблизительно 1,0, от приблизительно 0,4 до приблизительно 1,0 или от приблизительно 0,5 до приблизительно 1,0 мкМ. Концентрация праймеров может составлять приблизительно 0,5 мкМ. Подходящие диапазоны для целевых концентраций нуклеиновой кислоты в ПЦР включают, но не ограничиваются, от приблизительно 1 мкг до приблизительно 500 нг.
[0245] В некоторых случаях водная фаза также может содержать добавки, включая, но не ограничиваясь таковыми, неспецифический фон/блокирующие нуклеиновые кислоты (например, ДНК спермы лосося), биоконсерванты (например, азид натрия), усилители ПЦР (например, бетаин, трегалоза и др.) и ингибиторы (например, ингибиторы РНКазы). Другие добавки могут включать, например, диметилсульфоксид (ДМСО), глицерин, бетаин (моно) гидрат (N, N, N-триметилглицин = [карбоксиметил] триметиламмоний), трегалозу, 7-деаза-2'-дезоксигуанозин трифосфат (dC7GTP или 7-деаза-2′-dGTP), BSA (бычий сывороточный альбумин), формамид (метанамид), хлорид тетраметиламмония (TMAC), другие производные тетраалкиламмония (например, хлорид тетраэтиламмония (TEA-C1) и хлорид тетрапропиламмония (TPrACl), неионные детергенты (например, Triton X-100, TWEEN® 20, Nonidet P-40 (NP-40)) или PREXCEL-Q. В некоторых случаях водная фаза может содержать 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных добавок. В других случаях водная фаза может содержать по меньшей мере 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных добавок.
[0246] В некоторых случаях неионный блок-сополимер этиленоксида/пропиленоксида может быть добавлен к водной фазе в концентрации примерно 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%. 0,8%, 0,9% или 1,0%. Обычные биосурфактанты включают неионные поверхностно-активные вещества, такие как Pluronic F-68, Tetronics и Zonyl FSN. Pluronic F-68 может присутствовать в концентрации примерно 0,5% мас./об.
[0247] В некоторых случаях сульфат магния можно заменить хлоридом магния в аналогичных концентрациях. Широкий спектр распространенных коммерческих ПЦР-буферов от различных поставщиков может быть заменен буферным раствором.
[0248] Здесь подразумеваются носители, которые имеют жидкоподобную или твердоподобную поверхность раздела с окружающей фазой. Например, в некоторых вариантах осуществления эмульсия может быть приготовлена для получения высоко монодисперсных капель, служащих в качестве носителей, и имеющих жидкообразную межфазную пленку, которая может быть преобразована путем нагревания в микрокапсулы, имеющие твердоподобную межфазную пленку; такие микрокапсулы могут вести себя как биореакторы, способные удерживать свое содержимое в процессе реакции, такой как амплификация ПЦР. Преобразование формы носителя в форму микрокапсулы может происходить при нагревании. Например, такое преобразование может происходить при температуре, превышающей приблизительно 50°С, 60°С, 70°С, 80°С, 90°С или 95°С. В некоторых случаях этот нагрев осуществляется с помощью термоциклера. Во время процесса нагревания можно добавить жидкость или минеральное масло для предотвращения испарения. Избыток масла непрерывной фазы можно удалить или не удалять перед нагревом. Биосовместимые капсулы могут быть устойчивы к коалесценции и/или флокуляции в широком диапазоне термической и механической обработки. После преобразования в капсулу, таковые могут храниться при температуре приблизительно, более, чем приблизительно или менее, чем приблизительно чем 3°С, 4°С, 5°С, 6°С, 7°С, 8°С, 9°С, 10°С, 15°C, 20°C, 25°C, 30°C, 35°C или 40°C. Такие носители в форме капсул могут быть полезны для биомедицинского применения, таких как компьтер-процессированная стабильная инкапсуляция макромолекул, в частности водных биологических жидкостей, содержащих смесь нуклеиновых кислот или белка, или обоих вместе; доставка лекарств и вакцин; биомолекулярные библиотеки; приложения для клинической визуализации и другие.
[0249] Микрокапсулы могут содержать один или несколько полинуклеотидов и могут противостоять коалесценции, особенно при высоких температурах. Соответственно, реакции амплификации ПЦР могут происходить при очень высокой плотности (например, числа реакций на единицу объема). В некоторых случаях из расчета на мл может происходть более 100000, 500000, 1000000, 1500000, 2000000, 2500000, 5000000 или 10000000 отдельных реакций. В некоторых случаях реакции происходят в одной лунке, например, в лунке планшета для микротитрования, без перемешивания между реакционными объемами. Микрокапсулы также могут содержать другие компоненты, необходимые для обеспечения возможности обратной транскрипции, удлинения праймера и/или реакции ПЦР, например, праймеры, зонды, dNTP, ДНК- или РНК-полимеразы и т.д. Такие носители в форме капсул проявляют устойчивость к коалесценции и флокуляции в широком диапазоне термической и механической обработки.
[0250] В некоторых случаях стадия амплификации выполняется посредством выполнения цифровой ПЦР, такой как цифровая ПЦР на основе микрофлюидной жидкости или капельная цифровая ПЦР.
[0251] В некоторых вариантах носители могут представлять собой капли. Капли могут быть получены с использованием микрофлюидных систем или устройств. Используемый здесь префикс «микро» (например, «микроканал» или «микрофлюидный»), как правило, относится к элементам или изделиям, имеющим ширину или диаметр менее примерно 1 мм и менее примерно 100 мкм (микрометров). В некоторых случаях элемент или изделие содержит канал, по которому может протекать жидкость. Кроме того, «микрофлюидный», как используется в данном документе, относится к устройству, аппарату или системе, которая включает в себя по меньшей мере один канал в микро масштабе.
[0252] Микрожидкостные системы и устройства были описаны во множестве контекстов, как правило в контексте миниатюрного лабораторного (например, клинического) анализа. Другие применения были также описаны. Например, в публикациях международных патентных заявол № WO 01/89788; WO 2006/040551; WO 2006/040554; WO 2004/002627; WO 2008/063227; WO 2004/091763; WO 2005/021 151; WO 2006/096571; WO 2007/089541; WO 2007/081385 и WO 2008/063227.
[0253] Капля, как правило, включает в себя количество первой жидкости носителя во второй жидкости-носителе. Любая технология, известная в данной области техники для формирования капель, может быть использована в соответствии со способами по изобретению. Примерный способ включает протекание потока жидкости носителя, содержащего материал-мишень (например, иммунную клетку), таким образом, что что он пересекает два противоположно-направленных потока текущей жидкости-носителя. Жидкость-носитель не смешивается с жидкостью носителя. Пересечение образца жидкости с двумя противоположно-направленными потока текущей жидкости-носителя приводят к разделению жидкости образца на отдельные капли образца, которые могут служить носителями, содержащими целевой материал.
[0254] Жидкость-носитель может быть любой жидкостью, которая не смешивается с жидкостью носителя. Примером жидкости-носителя является масло. В определенных вариантах осуществления жидкость-носитель включает поверхностно-активное вещество.
[0255] Тот же метод может применяться для создания отдельных капель или носителей, которые содержат другие реагенты, такие как реагенты для реакции амплификации, такой как полимеразная цепная реакция (ПЦР), или реакции амплификации на основе не-ПЦР, такой как амплификация смещения мультицепи или другие способы, известные специалисту в данной области техники. Подходящие реагенты для проведения реакций амплификации на основе ПЦР известны специалистам в данной области техники и включают, но не ограничиваются такими как ДНК-полимеразы, прямые и обратные праймеры, дезоксинуклеотидтрифосфаты (dNTP) и один или несколько буферов.
[0256] В некоторых вариантах осуществления жидкостные отсеки формируются путем обеспечения первой жидкостной перегородки (например, капли), содержащей целевой материал (например, иммунную клетку и/или твердую подложку, такую как гранула) и вторую жидкость (например, поток жидкости или внутри капель). Первая и вторая жидкости объединяются для образования капли, которая может служить носителем для описанных способов. Слияние может быть достигнуто путем наложения электрического поля к двум жидкостям. В некоторых вариантах осуществления вторая жидкость содержит реагенты для проведения реакции амплификации, такой как полимеразная цепная реакция или реакция амплификации.
[0257] Повышенная механическая стабильность может быть полезна для микрофлюидных манипуляций и жидкостной обработки с большим напряжением (например, в микрожидкостных капиллярах или при поворотах жидкостного тракта на 90 градусов, например, в клапанах). До и после термически обработанные капли или капсулы могут быть механически устойчивы к стандартным манипуляциям пипеткой и центрифугированию.
3. Обратная транскрипция
[0258] В некоторых случаях полинуклеотиды-мишени получают из РНК, такой как мРНК, путем обратной транскрипции. В некоторых случаях полинуклеотиды-мишени получают из ДНК путем удлинения праймера, например, при использовании полимеразы. Во время реакции обратной транскрипции клеточная РНК, такая как мРНК, подвергается обратной транскрипции для получения комплементарной ДНК (кДНК), и уникальный молекулярный штрих-код добавляется к каждой кДНК для генерации штрих-кодированного одноцепочечного полинуклеотида, комплементарного клеточному транскрипту. Такие одноцепочечные полинуклеотиды со штрих-кодом могут быть созданы для каждого транскрипта в транскриптоме.
[0259] Способы, описанные в данном документе, можно использовать в связке ПЦР с реакцией обратной транскрипции (обратная ПЦР с транскрипцией). Например, обратная транскрипция и ПЦР могут проводиться в две разные стадии. Сначала кДНК-копию образца мРНК можно синтезировать с использованием либо полинуклеотидного праймера dT, специфичного к последовательности праймера, универсального праймера, смеси случайных гексамерных олигонуклеотидных праймеров или любого праймера, описанного в настоящем документе. В некоторых примерах осуществления кДНК-копия РНК может быть создана с использованием смеси праймеров, таких как праймер, специфичный к последовательности, и смеси случайных гексамерных олигонуклеотидных праймеров, например, для захвата специфических целевых молекул РНК клетки в дополнение к коллекции полинуклеотидов, которые по существу соответствуют транскриптому той же клетки.
[0260] Обратную транскрипцию и ПЦР можно проводить в одном закрытом реакционном носителе. Например, можно использовать множество праймеров, один или несколько праймеров для обратной транскрипции и два или более праймеров для ПЦР в однм и том же закрытом носителе. Праймер(ы) для обратной транскрипции может связываться с мРНК в 3' позиции первого ампликона ПЦР. В некоторых вариантах осуществления условия ПЦР можно модифицировать, чтобы существенно ограничить амплификацию первым адаптером или пулом первых адаптеров, используя специфичные для них праймеры, и ограничить амплификацию более крупной кДНК с молекулярным штрих-кодом. Хотя это и не существенно, праймер(ы) обратной транскрипции могут включать остатки РНК или их модифицированные аналоги, такие как 2'-O-метилированные основания РНК, которые не будут образовывать субстрат для РНКазы Н при гибридизации с мРНК.
[0261] Температура для проведения реакции обратной транскрипции зависит от используемой обратной транскриптазы. В некоторых случаях используется термостабильная обратная транскриптаза, и реакцию обратной транскрипции проводят при температуре от приблизительно 37 до приблизительно 75°С, при температуре от приблизительно 37 до приблизительно 50°С, при температуре от приблизительно 37 до приблизительно 55°С, при температуре от приблизительно 37 до приблизительно 60°С, при температуре от приблизительно 55 до приблизительно 75°С, при температуре от приблизительно 55 до приблизительно 60°С, при температуре приблизительно 37°С или при температуре приблизительно 60°С. В некоторых случаях используется обратная транскриптаза, которая переносит 3 или более нематричных концевых нуклеотидов на конец транскрибируемого продукта.
[0262] Реакция обратной транскрипции и реакция ПЦР, описанные в настоящем документе, могут проводиться в различных известных в данной области форматах, таких как пробирки, планшеты для микротитрования, микрофлюидная среда, или, предпочтительно, капли.
[0263] Реакцию обратной транскрипции можно проводить в объемах в диапазоне от 5 мкл до 100 мкл или в реакционных объемах от 10 мкл до 20 мкл. В каплях реакционные объемы могут составлять от 1 пл до 100 нл или от 10 пл до 1 нл. В некоторых случаях реакцию обратной транскрипции проводят в капле, имеющей объем, составляющий примерно 1 нл или менее.
[0264] Полинуклеотиды-мишени, такие как РНК, могут быть обратно-транскрибированы в кДНК с использованием одного или нескольких праймеров обратной транскрипции. Один или несколько праймеров обратной транскрипции могут содержать область, комплементарную области РНК, такую как константная область (например, константная область тяжелой или легкой цепи или polyA хвост мРНК). В некоторых вариантах осуществления праймеры обратной транскрипции могут содержать первый праймер обратной транскрипции с областью, комплементарной константной области первой РНК, и второй праймер обратной транскрипции с областью, комплементарной константной области второй РНК. В некоторых вариантах осуществления праймеры обратной транскрипции могут содержать первый праймер обратной транскрипции с областью, комплементарной константной области первой РНК, и один или несколько праймеров обратной транскрипции с областью, комплементарной константной области одной или нескольких РНК, соответственно.
[0265] В некоторых вариантах осуществления праймеры обратной транскрипции могут быть модифицированы для минимизации образования артефактов путем экспоненциальной амплификации продуктов переключения праймер-димер или праймер-матрица в реакции. В некоторых вариантах осуществления праймеры обратной транскрипции модифицируются путем добавления одного или нескольких 2'-O-метилированных оснований праймера. В некоторых вариантах осуществления одно или несколько 2'-O-метилированных оснований расположены вблизи центра последовательности праймера. Такие модифицированные праймеры обычно используются в реакциях, содержащих ДНК-полимеразу, которая не может включать основания напротив 2'O-метил-модифицированного остатка. Типичные 2'O-метил-модифицированные праймеры приведены в SEQ ID NO: 12-22).
[0266] В некоторых вариантах осуществления праймеры обратной транскрипции представляют собой смесь случайных гексамерных олигонуклеотидов. Такие праймеры могут связывать РНК в случайных местах, тем самым инициируя реакцию обратной транскрипции неизвестных последовательностей. В таких примерах достаточное количество случайных гексамерных праймеров используется для осуществления обратной транскрипции, по существу, транскриптома клетки. Таким образом, в таких вариантах осуществления создается коллекция полинуклеотидов, такая как коллекция полинуклеотидов кДНК, соответствующая транскриптому клетки.
[0267] В некоторых вариантах осуществления праймеры обратной транскрипции не содержат штрих-код.
[0268] Праймеры обратной транскрипции могут дополнительно содержать область, которая не комплементарна области РНК. В некоторых вариантах осуществления область, некомплементарная области РНК, находится в 5' позиции относительно области праймеров, которая комплементарна РНК. В некоторых вариантах осуществления область, которая не комплементарна области РНК, расположена в 3' позиции относительно области праймеров, которая комплементарна РНК. В некоторых вариантах осуществления область, некомплементарная области РНК, представляет собой 5'-выступающую область. В некоторых вариантах осуществления область, которая не комплементарна области РНК, содержит сайт праймирования для амплификации и/или реакции секвенирования, такой как адаптер. Используя один или несколько праймеров, описанных в настоящем документе, молекулы РНК подвергают обратной транскрипции с использованием подходящих реагентов, известных в данной области техники.
[0269] В конкретных вариантах осуществления обратная транскриптаза может содержать нематричную терминальную трансферазную активность. Когда обратная транскриптаза, включающая активность нематричной терминальной трансферазы, достигает конца матрицы, она может добавлять три или более нематричных остатка, таких как три или более нематричных остатка цитозина. В некоторых вариантах осуществления для этой цели используется обратная транскриптаза Superscript II™. В некоторых вариантах осуществления для этой цели используется обратная транскриптаза Maxima™. В некоторых вариантах осуществления для этой цели используется обратная транскриптаза Protoscript II™. В некоторых вариантах осуществления для этой цели используется обратная транскриптаза вируса мышиного лейкоза Малони (MMLV-RT). В некоторых вариантах осуществления для этой цели используется обратная транскриптаза HighScriber™. В некоторых вариантах осуществления для этой цели используется терминальная дезоксинуклеотидилтрансфераза. В некоторых вариантах осуществления для этой цели используется обратная транскриптазу вируса миелобластоза птиц (AMV). Может быть использована любая обратная транскриптаза, способная транскрибировать РНК, обладает нематричной терминальной трансферазной активностью. Может быть использована любая обратная полимераза, способная транскрибировать РНК, которая обладает нематричной терминальной трансферазной активностью. Можно использовать любую обратную полимеразу, способную транскрибировать ДНК, которая обладает нематричной терминальной трансферазной активностью.
[0270] Реакции обратной транскрипции, такие как описанные выше, могут проводиться в присутствии 3'-меченого полинуклеотида. 3'-меченый полинуклеотид может быть полинуклеотидом, используемым для добавления нуклеиновых кислот к 3'-концу полинуклеотида-мишени, такого как кДНК. 3'-меченый полинуклеотид может представлять собой полинуклеотид, используемый в качестве матрицы для добавления нуклеиновых кислот к 3'-концу полинуклеотида-мишени, такого как кДНК. 3'-меченый полинуклеотид может представлять собой полинуклеотид, который гибридизуется с 3'-концом полинуклеотида-мишени, такого как кДНК. 3'-меченый полинуклеотид может представлять собой полинуклеотид, который содержит 3'-область, такую как 3'-концевая область, которая гибридизуется с 3'-концом полинуклеотида-мишени, такого как кДНК. Например, 3'-меченый полинуклеотид может содержать сегмент, такой как сегмент, который отжигается до трех или более нематричных остатков. В некоторых вариантах осуществления 3'-меченый полинуклеотид представляет собой полинуклеотид молекулярного штрих-кода. В некоторых вариантах осуществления 3'-меченый полинуклеотид может содержать молекулярный штрих-код. В некоторых вариантах осуществления 3'-меченый полинуклеотид может содержать 3'-остатки рибогуанозина или его аналоги на 3'-конце (rGrGrG) (основания РНК), которые являются комплементарными и отжигаются с цепью, продуцируемой ферментом обратной транскрипции. В некоторых вариантах осуществления три или более остатков гуанина можно использовать вместо рибогуанозина (нуклеотид ДНК вместо нуклеотида РНК). В некоторых вариантах осуществления 3'-меченый полинуклеотид может содержать 1 или 2 остатка рибогуанозина на 3'-конце и остаток рибогуанозина или его аналог на 3'-конце (rGrGG), которые являются комплементарными и отжигаются по отношению к цепи, полученной в результате работы фермента обратной транскрипции.
[0271] При отжиге 3'-меченого полинуклеотида с ССС нити кДНК, обратная транскриптаза может продолжать удлинять кДНК до меченого полинуклеотида, тем самым прикрепляя молекулярный штрих-код или его комплемент к целевой популяции полинуклеотидов, таких как кДНК, в реакции. Например, 3'-меченый полинуклеотид может представлять собой полинуклеотид, который содержит область от 5' до 3', которая гибридизуется с 3' концом полинуклеотида-мишени. Область от 5' до 3', которая гибридизуется с 3' концом полинуклеотида-мишени, может содержать область, которая не комплементарна полинуклеотиду-мишени, такому как кДНК. Область от 5' до 3', которая гибридизуется с 3' концом полинуклеотида-мишени, может содержать молекулярный штрих-код. Область от 5' до 3', которая гибридизуется с 3' концом полинуклеотида-мишени, может содержать область, комплементарную полинуклеотиду со штрих-кодом носителя, или его комплементу. В других экспериментах переключение матриц можно проводить в отдельных реакциях. Например, 3'-меченый полинуклеотид может быть добавлен после реакции обратной транскрипции, и ферменты, такие как обратная транскриптаза или полимераза, могут использоваться для удлинения до меченого полинуклеотида. Поскольку меченый полинуклеотид может содержать уникальный вырожденный молекулярный штрих-код на каждой молекуле в носителе, каждая кДНК в носителе может быть уникально помечена молекулярным штрих-кодом. В некоторых вариантах осуществления переключение матрицы может быть выполнено одновременно с реакцией обратной транскрипции.
[0272] Реакцию обратной транскрипции можно проводить в присутствии 3'-меченого полинуклеотида. 3'-меченый полинуклеотид может содержать сегмент Р7, который может использоваться для отжига праймера для секвенирования. 3'-меченый полинуклеотид может содержать штрих-код носителя или молекулярный штрих-код. 3'-меченый полинуклеотид может содержать 3'-остатки рибогуанозина на 3'-конце (rGrGrG) (основания РНК), которые могут быть комплементарными и отжигаться с цепью, продуцируемой ферментом обратной транскрипции. Таким образом, штрих-код носителя и молекулярный штрих-код могут быть присоединены к терминальному концу кДНК в этой же эмульсии ферментами обратной транскрипции. В некоторых вариантах осуществления гуаниновые остатки могут быть использованы вместо рибогуанозина (нуклеотид ДНК вместо нуклеотида РНК). После отжига 3'-меченого полинуклеотида с CCC цепи кДНК, обратная транскриптаза продолжает удлинять кДНК до 3'-меченого полинуклеотида, создавая тем самым молекулярно-штрих-кодированную метку для всех кДНК в реакции. После отжига 3'-меченого полинуклеотида в область молекулярной штрих-кодированной кДНК обратная транскриптаза или полимераза продолжает удлинять кДНК с молекулярным штрих-кодом до другого 3'-меченого полинуклеотида, создавая тем самым штрих-код носителя для всех кДНК в реакции.
[0273] В некоторых вариантах осуществления переключение матрицы может быть выполнено в отдельной реакции, а не в то же время, когда может быть проведена реакция обратной транскрипции. В некоторых вариантах осуществления 3'-меченый полинуклеотид может быть добавлен после реакции обратной транскрипции, и ферменты, такие как обратная транскриптаза или полимераза, могут быть использованы для удлинения до меченого полинуклеотида сходным образом. Поскольку 3'-меченый полинуклеотид может содержать уникальный вырожденный молекулярный штрих-код на каждой отдельной молекуле, каждая кДНК может быть уникально помечена молекулярным штрих-кодом. Поскольку 3'-меченый полинуклеотид может содержать один и тот же вырожденный штрих-код носителя на каждой отдельной молекуле из одного носителя, каждая кДНК может быть помечена штрих-кодом носителя, уникальным для носителя.
[0274] В некоторых вариантах осуществления молекула переключения матрицы, такая как олигонуклеотид переключения матрицы, содержащий штрих-код (например, молекулярный штрих-код), может включать модифицированные основания для минимизации образования артефактов. В некоторых примерах осуществления олигонуклеотид с переключением матрицы может содержать 2'-дезоксиуридин, который может быть подвергаться обратной транскрипции, но не может быть скопирован ДНК-полимеразой. В некоторых вариантах осуществления рибогуанозин может быть включен в олигонуклеотид переключения матрицы. В некоторых вариантах осуществления олигонуклеотид переключением матрицы может быть модифицирован на 3'-конце для предотвращения удлинения обратной транскриптазой или ДНК-полимеразой. Такие модификации включают 3'-дезокси, 3'-фосфатную, 3'-амино- и 3'-алкильную модификацию для блокировки удлинения праймера.
4. Полимеразная цепная реакция (ПЦР)
[0275] После выполнения реакций обратной транскрипции молекул РНК, полученные в результате молекулы кДНК с одним штрих-кодом могут быть одновременно штрих-кодированы штрих-кодом носителя и амплифицированы одной или несколькими реакциями ПЦР с получением одного или нескольких ампликонов. В некоторых примерах ПЦР используется для создания цепи кДНК с двойным штрих-кодом, которая содержит кодирующую последовательность, соответствующую последовательности транскрипта мРНК, и является комплементарной цепи кДНК, генерируемой во время реакции обратной транскриптазы. Ферменты и дизайн праймеров для ПЦР известны, и неограничивающие примеры таких реагентов описаны здесь. Любой из таких реагентов может быть выбран и использован для ПЦР в предоставленных способах.
[0276] В некоторых случаях, реакция ПЦР происходит в капле, имеющей реакционный объем в диапазоне от 1пл до 100 нл, предпочтительно от 10пл до 1 нл. В некоторых случаях реакцию ПЦР проводят в капле, объем которой составляет примерно 1 нл или менее. В некоторых случаях реакцию обратной транскрипции и реакцию ПЦР проводят в одной и той же капле с объемом реакционной смеси от 1пл до 100 нл или от 10пл до 1 нл. В некоторых случаях реакцию обратной транскрипции и реакцию ПЦР проводят в капле, имеющей объем, составляющий примерно 1 нл или менее, или объем, составляющий примерно 1 мкл или менее. В некоторых случаях реакцию обратной транскрипции и реакцию ПЦР проводят в разных каплях. В некоторых случаях реакцию обратной транскрипции и реакцию ПЦР проводят во множестве капель, каждая из которых имеет реакционный объем в диапазоне от 1 пл до 100 нл или от 10 пл до 1 нл. В некоторых случаях реакцию обратной транскрипции и реакцию ПЦР проводят во множестве капель, каждая из которых имеет объем, составляющий примерно 1 нл или менее.
[0277]В некоторых случаях первая реакция ПЦР происходит в первой капле, реакционный объем которой находится в диапазоне от 1пл до 100 нл, предпочтительно от 10 пл до 1 нл, а вторая реакция ПЦР проходит во второй капле, объем реакции в которой составляет 1 пл до 100 нл, предпочтительно от 10 пл до 1 нл. В некоторых случаях первая реакция ПЦР происходит в первой капле, объем которой составляет приммерно 1 нл или менее, а вторая реакция ПЦР проходит во второй капле, объем которой составляет примерно 1 нл или менее.
[0278] В некоторых случаях первую реакцию ПЦР и вторую реакцию ПЦР проводят во множестве капель, каждая из которых имеет объем реакции в диапазоне от 1пл до 100 нл или от 10пл до 1 нл. В некоторых случаях первую реакцию ПЦР и вторую реакцию ПЦР проводят во множестве капель, каждая из которых имеет объем, который составляет примерно 1 нл или менее.
[0279] В некоторых вариантах осуществления способов, представленных в настоящем документе, условия реакций могут быть модифицированы для усиления амплификации выбранных последовательностей и минимизации амплификации других последовательностей. Такие модификации могут включать изменение температуры, например, температуры плавления, при ПЦР-термоциклировании. Например, «холодные» циклы ПЦР можно использовать для селективной амплификации более коротких олигонуклеотидов. «Холодные» циклы ПЦР отличаются от «горячих» циклов ПЦР своей температурой денатурации. «Холодные» циклы ПЦР влияют на денатурацию при более низкой температуре, для предпочтительной амплифиции более коротких последовательностей, которые легче денатурируются, чем более длинные двухцепочечные последовательности. Таким образом, «холодные» циклы ПЦР используются для амплификации более коротких последовательностей, в то же время ограничивая амплификацию более длинных последовательностей. В некоторых примерах осуществления комбинация «холодных» циклов и «горячих циклов» используется для создания желаемых ампликонов.
[0280] В некоторых вариантах осуществления продолжительность стадий денатурации, праймирования и/или удлинения ПЦР можно модифицировать для селективной или предпочтительной амплификации определенных последовательностей в реакционном объеме. В некоторых примерах праймеры, используемые для амплификации ПЦР, могут быть выбраны или модифицированы для уменьшения или усиления амплификации ПЦР в определенных условиях. В некоторых примерах осуществления термолабильные вспомогательные группы могут быть добавлены к 3'-концу большинства оснований посредством фосфотриэфирных связей, чтобы сделать олигонуклеотидные праймеры неактивными при более низких температурах, но активными после воздействия более высоких температур. В некоторых примерах осуществления олигонуклеотиды, связанные с термолабильной вспомогательной группой на 3'-конце, используются в предоставленных способах, вследствие чего олигонуклеотиды не способны к удлинению праймера при более низких температурах, таких как температуры, при которых происходят реакции при помощи обратной транскриптазы, но становятся активными при воздействии более высокой температуры, такой как до или во время ПЦР.
[0281] После выполнения реакций обратной транскрипции молекул РНК или удлинения праймера геномных молекул, олигонуклеотид, содержащий штрих-код носителя, амплифицируют с помощью полимеразной цепной реакции с получением множественных копий, которые присоединяются к полинуклеотидам с молекулярным штрих-кодом. В некоторых примерах олигонуклеотиды, содержащие штрих-код носителя, амплифицируются с использованием праймеров, модифицированых путем добавления термолабильной вспомогательной группы на 3'-конце для предотвращения удлинения праймера во время реакции обратной транскриптазы, но позволяют удлинение праймера и последующей амплификации во время ПЦР. В некоторых вариантах осуществления амплификацию олигонуклеотида, содержащего штрих-код носителя, осуществляли с использованием «холодного» термоциклирования, как описано здесь.
[0282] После выполнения реакций обратной транскрипции молекул РНК, полученные молекулы кДНК могут быть штрихкодированы молекулярным штрих-кодом и штрих-кодом носителя и амплифицированы одной или несколькими реакциями ПЦР, такими как первая и/или вторая реакции ПЦР. В первой и/или второй реакции ПЦР может использоваться пара праймеров или множество пар праймеров. В первой и/или второй реакции ПЦР может использоваться множество прямых/обратных праймеров и обратный праймер. В первой и/или второй реакции ПЦР может использоваться множество прямых/обратных праймеров и прямой праймер. Первый и/или второй праймер из множества прямых/обратных праймеров может представлять собой прямой/обратный праймер, содержащий область, комплементарную молекулам кДНК или молекулам кДНК со штрих-кодом. Первый и/или второй праймер из множества прямых/обратных праймеров может представлять собой прямой/обратный праймер, содержащий область, комплементарную молекулам кДНК со штрих-кодом.
[0283] В некоторых вариантах осуществления множество прямых/обратных праймеров содержит один или несколько прямых/обратных праймеров, где каждый из прямого/обратного праймеров из множества прямого/обратного праймеров содержит область, комплементарную одной или нескольким областям против хода транскрипции или по ходу транскрипции от V-сегмента кДНК или штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит прямой/обратный праймер, содержащий область, комплементарную области против хода транскрипции или по ходу транскрипции от V-сегмента кДНК или штрих-кодированной кДНК, и один или несколько других прямых/обратных праймеров, содержащих область, комплементарную одному или нескольким других участков против хода транскрипции или по ходу транскрипции от V-сегмента кДНК или штрих-кодированной кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймеры, содержащие область, комплементарную первой и/или второй области против хода транскрипции или по ходу транскрипции от V-сегмента кДНК или штрих-кодированных кДНК и второй прямой/обратный праймер, содержащий область, комплементарную второй области против хода транскрипции или по ходу транскрипции от V-сегмента кДНК или штрих-кодированной кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймеры, содержащие область, комплементарную первой и/или второй области против хода транскрипции или по ходу транскрипции от V-сегмента кДНК или штрих-кодированной кДНК, второй прямой/обратный праймер, содержащий область, комплементарную второй области против хода транскрипции или по ходу транскрипции от V-сегмента кДНК или штрих-кодированной кДНК, и третий прямой/обратный праймер, содержащий область, комплементарную третьей области против хода транскрипции или по ходу транскрипции от V-сегмента кДНК или кДНК со штрих-кодом и т. д. Праймеры во множестве прямых/обратных праймеров можно использовать для отжига во всех возможных областях против хода транскрипции или по ходу транскрипции от всех V-сегментов, экспрессируемых клетками, такими как иммунные В-клетки или Т-клетки, в образеце.
[0284] В некоторых вариантах осуществления множество прямых/обратных праймеров содержит один или несколько прямых/обратных праймеров, причем каждый из прямого/обратного праймеров из множестве прямых/обратных праймеров содержит область, комплементарную одной или нескольким областям против хода транскрипции или по ходу транскрипции от С-сегмента кДНК или штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит прямой/обратный праймер, содержащий область, комплементарную области против хода транскрипции или по ходу транскрипции от С-сегмента кДНК или штрих-кодированных кДНК, и один или несколько других прямых/обратных праймеров, содержащих область, комплементарную одной или нескольким другим областям против хода транскрипции или по ходу транскрипции от С-сегмента кДНК или штрих-кодированной кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймеры, содержащие область, комплементарную первой и/или второй области против хода транскрипции или по ходу транскрипции от С-сегмента кДНК или штрих-кодированных кДНК и второй прямой/обратный праймер, содержащий область, комплементарную второй области против хода транскрипции или по ходу транскрипции от С-сегмента кДНК или штрих-кодированной кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймер, содержащий область, комплементарную первой и/или второй области против хода транскрипции или по ходу транскрипции от С-сегмента кДНК или штрих-кодированной кДНК, второй прямой/обратный праймер, содержащий область, комплементарную второй области против хода транскрипции или по ходу транскрипции от С-сегмента кДНК или штрих-кодированной кДНК и третий прямой/обратный праймер, содержащий область, комплементарную третьей области против хода транскрипции или по ходу транскрипции от С-сегмента кДНК или штрих-кодированной кДНК и т. д. Праймеры во множестве прямых/обратные праймеры могут быть использованы для отжига всех возможных областей против хода транскрипции или по ходу транскрипции от всех С-сегментов, экспрессируемых клетками, такими как иммунные В-клетки или Т-клетки, в образце.
[0285] В некоторых вариантах осуществления множество прямых/обратных праймеров содержит один или несколько прямых/обратных праймеров, причем каждый из прямого/обратного праймеров из множества прямых/обратных праймеров содержит область, комплементарную одной или нескольким областям против хода транскрипции или по ходу транскрипции от молекулярного штрих-кода штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит прямой/обратный праймер, содержащий область, комплементарную области против хода транскрипции или по ходу транскрипции по отношению к молекулярному штрих-коду штрихкодированных кДНК, и один или несколько других прямых/обратных праймеров, содержащих область, комплементарную одной или более других областей против хода транскрипции или по ходу транскрипции по отношению к молекулярному штрих-коду штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймеры, содержащие область, комплементарную первой и/или второй области против хода транскрипции или по ходу транскрипции по отношению к молекулярному штрих-коду штрих-кодированных кДНК и второй прямой/обратный праймер, содержащий область, комплементарную второй области против хода транскрипции или по ходу транскрипции по отношению к молекулярному штрих-коду штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймеры, содержащие область, комплементарную первой и/или второй области против хода транскрипции или по ходу транскрипции по отношению к молекулярному штрих-коду штрихкодированных кДНК, второй прямой/обратный праймер, содержащий область, комплементарную второй области против хода транскрипции или по ходу транскрипции по отношению к молекулярному штрих-коду штрихкодированных кДНК, и третий прямой/обратный праймер, содержащий область, комплементарную третьей области против хода транскрипции или по ходу транскрипции по отношению к молекулярному штрих-коду штрих-кодированных кДНК и т.д. Множество прямых/обратных праймеров можно использовать для отжига всех возможных областей против хода транскрипции или по ходу транскрипции по отношению ко всем молекулярным штрих-кодам, экспрессируемых клетками, такими как иммунные В-клетки или Т-клетки, в образце.
[0286] В некоторых вариантах осуществления множество прямых/обратных праймеров содержит один или несколько прямых/обратных праймеров, где каждый из множества прямых/обратных праймеров из множества прямого/обратного праймеров содержит область, комплементарную одной или нескольким областям против хода транскрипции или по ходу транскрипции по отношению к штрих-коду носителя штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит прямой/обратный праймер, содержащий область, комплементарную области против хода транскрипции или по ходу транскрипции по отношению к штрих-коду носителя штрих-кодированных кДНК, и один или несколько других прямых/обратных праймеров, содержащих область, комплементарную одной или более других областей против хода транскрипции или по ходу транскрипции по отношению к штрих-коду носителя штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймеры, содержащие область, комплементарную первой и/или второй области против хода транскрипции или по ходу транскрипции по отношению к штрих-коду носителя штрих-кодированных кДНК и второй прямой/обратный канал праймер, содержащий область, комплементарную второй области против хода транскрипции или по ходу транскрипции по отношению к штрих-коду носителя штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймеры, содержащие область, комплементарную первой и/или второй области против хода транскрипции или по ходу транскрипции по отношению к штрих-коду носителя штрих-кодированных кДНК, второй прямой/обратный праймер, содержащий область, комплементарную второй области против хода транскрипции или по ходу транскрипции по отношению к штрих-коду носителя штрихкодированных кДНК, и третий прямой/обратный праймер, содержащий область, комплементарную третьей области против хода транскрипции или по ходу транскрипции по отношению к штрих-коду носителя штрих-кодированных кДНК и т.д. Праймеры во множестве прямых/обратных праймеров могут быть использованы для отжига во всех возможных областях против хода транскрипции или по ходу транскрипции по отношению ко всем штрих-кодам носителя, экспрессируемых клетками, такими как иммунные В-клетки или Т-клетки, в образце.
[0287] Прямой/обратный праймеры из множества прямых/обратных праймеров дополнительно содержат область, которая не комплементарна области РНК. В некоторых вариантах осуществления область, которая не комплементарна области РНК, находится в 5' позиции относительно области прямых/обратных праймеров, которая комплементарна РНК (то есть, области против хода транскрипции или по ходу транскрипции по отношению к сегменту V). В некоторых вариантах осуществления область, которая не комплементарна области РНК, расположена в 3' позиции относительно области прямых/обратных праймеров, комплементарной РНК. В некоторых вариантах осуществления область, которая не является комплементарным области РНК, представляет собой область 5'-выступа. В некоторых вариантах осуществления область, которая не комплементарна области РНК, содержит сайт праймирования для амплификации и/или второй реакции секвенирования. В некоторых вариантах осуществления область, которая не комплементарна области РНК, содержит сайт праймирования для амплификации и/или третьей реакции секвенирования. В некоторых вариантах осуществления область, которая не комплементарна области РНК, содержит сайт праймирования для второй и третьей реакции секвенирования. В некоторых вариантах осуществления последовательности сайта праймирования для второй и третьей реакций секвенирования являются идентичными. Используя один или несколько прямых/обратных праймеров и обратный праймер, как описано в настоящем документе, молекулы кДНК амплифицируют с использованием подходящих реагентов, известных в данной области техники. В некоторых вариантах осуществления область является комплементарной области РНК, такой как константная область или polyА-хвост мРНК.
5. Штрих-коды
[0288] Штрих-код может быть молекулярным штрих-кодом или штрих-кодом носителя. В некоторых вариантах осуществления штрих-код, такой как молекулярный штрих-код или штрих-код носителя, каждый может иметь длину в диапазоне от 2 до 36 нуклеотидов, от 4 до 36 нуклеотидов или от 6 до 30 нуклеотидов, или от 8 до 20 нуклеотидов. От 2 до 20 нуклеотидов, от 4 до 20 нуклеотидов или от 6 до 20 нуклеотидов. В определенных аспектах, температуры плавления штрих-кодов выборки находятся в пределах 10°C друг от друга, в пределах 5°C друг от друга или в пределах 2°C друг от друга. В определенных аспектах температуры плавления штрих-кодов выборки не находятся в пределах 10°C друг от друга, в пределах 5°C друг от друга или в пределах 2°C друг от друга. В других аспектах штрих-коды являются членами группы с минимальной перекрестной гибридизацией. Например, нуклеотидная последовательность каждого члена такой выборки может существенно отличаться от последовательности любого другого члена набора, так что ни один член не может образовывать стабильный дуплекс с комплементом любого другого члена в строгих условиях гибридизации. В некоторых вариантах осуществления нуклеотидная последовательность каждого члена группы с минимально перекрестной гибридизацтей отличается от последовательности каждого другого члена по меньшей мере на два нуклеотида. Технологии штрих-кода описаны в Winzeler et al. (1999) Science 285:901; Brenner (2000) Genome Biol. 1:1 Kumar et al. (2001) Nature Rev. 2:302; Giaever et al. (2004) Proc. Natl. Acad. Sci. USA 101:793; Eason et al. (2004) Proc. Natl. Acad. Sci. USA 101:1 1046; и Brenner (2004) Genome Biol. 5:240.
[0289] Используемый здесь молекулярный штрих-код содержит информацию, являющуюся уникальной для отдельной молекулы из одной клетки или из одного носителя, или для двух или более молекул из множества или библиотеки молекул из двух или более отдельных клеток или из двух или более отдельных носителей. Используемый здесь штрих-код носителя содержит информацию, которая является уникальной для полинуклеотидов из одной клетки или из одного носителя по сравнению с полинуклеотидами из другой отдельной клетки или из другого отдельного носителя. В некоторых вариантах осуществления уникальная информация содержит уникальную последовательность нуклеотидов. Например, последовательность молекулярного штрих-кода или штрих-кода носителя может быть определена, когда определяется идентичность и порядок уникальной или случайной последовательности нуклеотидов, содержащей молекулярный штрих-код или штрих-код носителя. В некоторых вариантах осуществления первый адаптер включает в себя последовательность штрих-кода носителя.
[0290] В некоторых вариантах осуществления уникальная информация не может быть использована для идентификации последовательности полинуклеотида-мишени. Например, молекулярный штрих-код может быть присоединен к одному полинуклеотиду-мишени, но молекулярный штрих-код не может быть использован для определения полинуклеотида-мишени, к которому он присоединен. В некоторых вариантах осуществления уникальная информация не является известной последовательностью, привязанной к идентичности последовательности полинуклеотида-мишени. Например, штрих-код носителя может быть прикреплен к одному или нескольким полинуклеотидам-мишеням, однако штрих-код носителя не может быть использован для определения к какому именно одному или нескольким полинуклеотидов-мишеней он присоединен. В некоторых вариантах осуществления уникальная информация содержит случайную последовательность нуклеотидов. В некоторых вариантах осуществления уникальная информация содержит одну или несколько уникальных последовательностей нуклеотидов, принадлежащих полинуклеотиду. В некоторых вариантах осуществления уникальная информация содержит вырожденную нуклеотидную последовательность или вырожденный штрих-код. Вырожденный штрих-код может содержать композицию вариабельных нуклеотидных оснований или последовательность. Например, вырожденный штрих-код может быть случайной последовательностью. В некоторых вариантах осуществления последовательность, комплементарная молекулярному штрих-коду или штрих-коду носителя также представляет собой последовательность молекулярного штрих-код или штрих-кода носителя.
[0291] Молекулярный штрих-код или штрих-код носителя может быть любой длины нуклеотидов. Например, молекулярный штрих-код или штрих-код носителя может содержать по меньшей мере примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 нуклеотидов. Например, молекулярный штрих-код или штрих-код носителя может содержать не более 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 нуклеотидов. В некоторых вариантах осуществления молекулярный штрих-код или штрих-код носителя имеет определенную длину. Например, молекулярный штрих-код или штрих-код носителя может составлять примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 нуклеотидов в длину.
[0292] В некоторых вариантах осуществления каждый молекулярный штрих-код или штрих-код носителя из множества молекулярных штрих-кодов или штрих-кодов носителя имеет по меньшей мере примерно 2 нуклеотидов. Например, каждый молекулярный штрих-код или штрих-код носителя из множества молекулярных штрих-кодов или штрих-кодов носителя может составлять по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 нуклеотидов в длину. В некоторых вариантах осуществления каждый молекулярный штрих-код или штрих-код носителя из множества молекулярных штрих-кодов или штрих-кодов носителя имеет самое большее примерно 1000 нуклеотидов. Например, каждый молекулярный штрих-код или штрих-код носителя из множества молекулярных штрих-кодов или штрих-кодов носителя может составлять самое большее примерно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 нуклеотидов в длину. В некоторых вариантах осуществления каждый молекулярный штрих-код или штрих-код носителя из множества молекулярных штрих-кодов или штрих-кодов носителя имеет одинаковое количество нуклеотидов в длину. Например, каждый молекулярный штрих-код или штрих-код носителя из множества молекулярных штрих-кодов или штрих-кодов носителя может составлять 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 нуклеотидов в длину. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов или штрих-кодов носителей из множества молекулярных штрих-кодов или штрих-кодов носителя имеют различное количество нуклеотидов в длину. Например, один или несколько первых молекулярных штрих-кодов или штрих-кодов носителя из множества молекулярных штрих-кодов или штрих-кодов носителей могут иметь примерно или по меньшей мер, примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 нуклеотидов и один или несколько вторых молекулярных штрих-кодов или штрих-кодов носителя из множества молекулярных штрих-кодов или штрих-кодов носителя могут иметь примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 нуклеотидов, где число нуклеотидов одного или нескольких первых молекулярных штрих-кодов или штрих-кодов носителя отличается от одного или нескольких вторых молекулярных штрих-кодов или штрих-кодов носителя.
[0293] Количество молекулярных штрих-кодов может превышать общее количество молекул, которые должны быть помечены во множестве носителей. Количество штрих-кодов носителей может превышать общее количество молекул, которые должны быть помечены во множестве носителей. Например, количество молекулярных штрих-кодов или штрих-кодов носителей может быть по меньшей мере примерно в 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, 50, 60, 70, 80, В 90 или в 100 раз больше, чем общее количество молекул, которые должны быть помечены во множестве носителей.
[0294] Количество различных молекулярных штрих-кодов может превышать общее количество молекул, которые должны быть помечены во множестве носителей. В некоторых вариантах число различных молекулярных штрих-кодов может быть по меньшей мере примерно в 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, В 50, 60, 70, 80, 90 или 100 раз больше, чем общее количество молекул, которые должны быть помечены во множестве носителей.
[0295] Количество различных молекулярных штрих-кодов в одном носителе может превышать количество различных молекул, которые должны быть помечены в одном носителе. В некоторых вариантах осуществления количество различных молекулярных штрих-кодов в одном носителе может быть, по меньшей мере, примерно в 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90 или 100 раз больше, чем количество различных молекул, которые должны быть помечены в одном носителе.
[0296] Количество различных штрих-кодов носителей может быть меньше, чем общее количество молекул, которые должны быть помечены во множестве носителей. В некоторых вариантах осуществлеия количество различных штрих-кодов носителей может быть по меньшей мере примерно в 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90 или 100 раз меньше, чем общее количество молекул, которые должны быть помечены во множестве носителей.
[0297] Количество молекул амплифицированного продукта полинуклеотидной молекулы штрих-кода носителя в одном носителе может превышать количество различных молекул, которые должны быть помечены в одном носителе. В некоторых вариантах осуществления количество молекул амплифицированного продукта полинуклеотидной молекулы со штрих-кодом носителя в одном носителе может быть по меньшей мере примерно в 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9, В 10, 15, 20, 30, 40, 50, 60, 70, 80, 90 или 100 раз больше, чем количество различных молекул, которые должны быть помечены в одном носителе.
[0298] Количество полинуклеотидных молекул со штрих-кодом носителя в одном носителе может быть меньше, чем количество различных молекул, которые должны быть помечены в одном носителе. В некоторых вариантах осуществления количество полинуклеотидных молекул со штрих-кодом носителя в одном носителе может быть по меньшей мере примерно в 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9, 10, 15, 20. В 30, 40, 50, 60, 70, 80, 90 или 100 раз меньше, чем количество различных молекул, которые должны быть помечены в одном носителе.
[0299] Количество молекул полинуклеотидов в одном носителе со штрих-кодом носителя может составлять одну молекулу. Количество неамплифицированных полинуклеотидных молекул со штрих-кодом носителя в одном носителе может составлять одну молекулу.
[0300] В некоторых вариантах осуществления по меньшей мере примерно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97% или 100% различных молекулярных штрих-кодов имеют одинаковую концентрацию. В некоторых вариантах по меньшей мере приблизительно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97% или 100% различных штрих-кодов носителя имеют одинаковаю концентрацию.
[0301] В некоторых вариантах осуществления по меньшей мере примерно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97% или 100% различных молекулярных штрих-кодов имеют различную концентрацию. В некоторых вариантах по меньшей мере примерно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97% или 100% различных штрих-кодов носителя имеют различную концентрацию.
[0302] Молекулярные штрих-коды или штрих-коды носителей в популяции молекулярных штрих-кодов или штрих-кодов носителей могут иметь по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000 или более различных последовательностей. Например, молекулярные штрих-коды или штрих-коды носителя в популяции могут иметь по меньшей мере 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 15000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, 1000000 или более различных последовательностей. Таким образом, множество молекулярных штрих-кодов или штрих-кодов носителя может быть использовано для создания по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400 500, 600, 700, 800, 900, 1000 или более различных последовательностей из одного или нескольких полинуклеотидов, таких как полинуклеотиды-мишени. Например, множество молекулярных штрих-кодов или штрих-кодов носителя может быть использовано для создания по меньшей мере 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 15000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, l×l06, 2×l06, 3×l06, 4×l06, 5×, 6×l06, 7×l06, 8×l06, 9×l06, l×l07, 2×l07, 3×l07, 4×l07, 5×l07, 6×l07, 7×l07, 8×l07, 9×l07, l×l08, 2×l08, 3×l08, 4×l08, 5×l08, 6×l08, 7×l08, 8×l08, 9×l08, l×l09, 2×l09, 3×l09, 4×l09, 5×l09, 6×l09, 7×l09, 8×l09, 9×l09, l×l010, 2×l010, 3×l010, 4×l010, 5×l010, 6×l010, 7×l010, 8×l010, 9×l010, l×l011, 2×l011, 3×l011, 4×l011, 5×l011, 6×l011, 7×l011, 8×l011, 9×l011, l×l012, 2×l012, 3×l012, 4×l012, 5×l012, 6×l012, 7×l012, 8×l012, 9×1012 или более различных последовательностей на основе одного или нескольких полинуклеотидов, таких как полинуклеотиды-мишени. Например, множество молекулярных штрих-кодов или штрих-кодов носителя может использоваться для создания по меньшей мере примерно 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 15000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, l×l06, 2×l06, 3×l06, 4×l06, 5×l06, 6×l06, 7×l06, 8×l06, 9×l06, l×l07, 2×l07, 3×l07, 4×l07, 5×l07, 6×l07, 7×l07, 8×l07, 9×l07, l×l08, 2×l08, 3×l08, 4×l08, 5×l08, 6×l08, 7×l08, 8×l08, 9×l08, l×l09, 2×l09, 3×l09, 4×l09, 5×l09, 6×l09, 7×l09, 8×l09, 9×l09, l×l010, 2×l010, 3×l010, 4×l010, 5×l010, 6×l010, 7×l010, 8×l010, 9×l010, l×l011, 2×l011, 3×l011, 4×l011, 5×l011, 6×l011, 7×l011, 8×l011, 9×l011, l×l012, 2×l012, 3×l012, 4×l012, 5×l012, 6×l012, 7×l012, 8×l012, 9×1012 или более различных последовательностей из по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 15000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, l×l06, 2×l06, 3×l06, 4×l06, 5×l06, 6×l06, 7×l06, 8×l06, 9×l06, l×l07, 2×l07, 3×l07, 4×l07, 5×l07, 6×l07, 7×l07, 8×l07, 9×l07, l×l08, 2×l08, 3×l08, 4×l08, 5×l08, 6×l08, 7×l08, 8×l08, 9×l08, l×l09, 2×l09, 3×l09, 4×l09, 5×l09, 6×l09, 7×l09, 8×l09, 9×l09, l×l010, 2×l010, 3×l010, 4×l010, 5×l010, 6×l010, 7×l010, 8×l010, 9×l010, l×l011, 2×l011, 3×l011, 4×l011, 5×l011, 6×l011, 7×l011, 8×l011, 9×l011, l×l012, 2×l012, 3×l012, 4×l012, 5×l012, 6×l012, 7×l012, 8×l012, 9×1012 или более полинуклеотид-мишеньов.
[0303] В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов используются для группировки или формирования выборок последовательностей. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов используются для группировки или формирования выборок последовательностей, где последовательности в каждой выборке содержат один и тот же молекулярный штрих-код. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов или штрих-кодов носителей используются для группировки или формирования выборок последовательностей, где последовательности в каждой выборке содержат набор ампликонов. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов используются для группировки или формирования выборок последовательностей, где последовательности в каждой выборке содержат множество последовательностей, в которых полинуклеотиды, на основе которых было получено множество последовательностей, происходят из одной и той же полинуклеотидной молекулы в реакции амплификации.
[0304] В некоторых вариантах осуществления один или несколько штрих-кодов носителя используются для группировки или формирования выборок последовательностей. В некоторых вариантах осуществления один или несколько штриховых кодов носителей используются для группировки или формирования выборок последовательностей, причем последовательности в каждой выборке содержат один и тот же штрих-код носителя. В некоторых вариантах осуществления один или несколько штрих-кодов носителя используются для группировки или формирования выборок последовательностей, причем последовательности в каждой выборке содержат один или несколько наборов ампликонов. В некоторых вариантах осуществления один или несколько штрих-кодов носителя используются для группировки или формирования выборок последовательностей, где последовательности в каждой выборке содержат множество последовательностей, в которых полинуклеотиды, на основе которых было получено множество последовательностей, происходят из полинуклеотидов из одного носителя или одной клетки.
[0305] В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов и штрих-кодов носителя используются для группировки или формирования выборок последовательностей. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов и штрих-кодов носителя используются для группировки или формирования выборок последовательностей, причем последовательности в каждой выборке содержат одинаковый молекулярный штрих-код и один и тот жесамый штрих-код носителя. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов и штрих-кодов носителя используются для группировки или формирования выборок последовательностей, где последовательности в каждой выборке содержат один или несколько наборов ампликонов. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов и штрих-кодов носителя используются для группировки или формирования выборок последовательностей, где последовательности в каждой выборке содержат множество последовательностей, в которых полинуклеотиды, на основе которых было получено множество последовательностей, происходят из одного и того же полинуклеотида в реакция амплификации и из одной и той же клетки или носителя. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов и штрих-кодов носителя не используются для объединения последовательностей.
[0306] В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов не используются для объединения последовательностей. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов используются для объяединения последовательностей. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов используются для группировки или формирования выборок последовательностей, а специфическая область-мишень используется для объединения последовательностей. В некоторых вариантах осуществления один или несколько штрих-кодов носителя не используются для объединения последовательностей. В некоторых вариантах осуществления один или несколько штрих-кодов носителя используются для объединения последовательностей. В некоторых вариантах осуществления один или несколько штрих-кодов носителей используются для группировки или формирования выборок последовательностей, а специфичная область-мишень используется для объединения последовательностей. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов и штрих-кодов носителя используются для объединения последовательностей. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов и штрих-кодов носителя используются для группировки или формирования выборок последовательностей, а конкретная область-мишень используется для объединения последовательностей.
[0307] В некоторых вариантах осуществления объединенные последовательности содержат один и тот же молекулярный штрих-код. В некоторых вариантах объединенные последовательности содержат один и тот же штрих-код носителя. В некоторых вариантах осуществления объединенные последовательности содержат одинаковый молекулярный штрих-код и штрих-код носителя. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов или штрих-кодов носителя используются для объединения последовательностей, где объединенные последовательности содержат две или более последовательностей из набора ампликонов. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов или штрих-кодов носителя используются для объединения последовательностей, где объединенные последовательности содержат множество последовательностей, на основе которых были получены полинуклеотиды происходят от одной и той же полинуклеотидной молекулы в реакции амплификации. В некоторых вариантах осуществления один или несколько молекулярных штрих-кодов или штрих-кодов носителей используются для объединения последовательностей, где объединенные последовательности содержат множество последовательностей, в которых полинуклеотиды, на основе которых было получено множество последовательностей, происходят из одной клетки или одного носителя.
C. Лигирование адаптеров
[0308] Перед лигированием адаптера полинуклеотиды или ампликоны с двойным штрих-кодом могут быть очищены и/или выбраны по размеру. Размер полинуклеотидов с двойным штрих-кодом может быть выбран для оптимизации выбранного способа секвенирования. Желаемый размер полинуклеотида определяется ограничениями инструментов для секвенирования и целью для которой, собственно, осуществляется секвенирование. В некоторых примерах осуществления желаемый размер полинуклеотида составляет от 0 пар оснований (п.н.) до 100000 п.н. (100 килобаз (кб)), от 50 п.н. до 50 кб, от 100 бп до 25 кб. В некоторых вариантах осуществления для определения последовательности полинуклеотидов, сгенерированных в настоящем документе, используют секвенатор для коротких последовательностей. Как правило, оптимальные размеры полинуклеотидов для секвенаторов, читающих короткие последовательности, варьируются по длине от примерно 20 пар оснований (п.н.) до 2000 п.н., от 50 до 1500 п.н., от 50 до 1250 п.н., от 50 до 1000 п.н., от 50 до 750 п.н., 50 от 500 до 500 п.н., от 100 до 1500 п.н., от 100 до 1250 п.н., от 100 до 1000 п.н., от 100 до 750 п.н., от 100 до 500 п.н., от 200 до 1500 п.н., от 200 до 1250 п.н. 1000 б.п., 200 б.п. до 750 б.п. или от 250 б.п. до 500 б.п.
[0309] В некоторых вариантах осуществления для определения последовательности полинуклеотидов, сгенерированных в данном документе, используют секвенатор для чтения длинных последовательностей. Как правило, оптимальные размеры полинуклеотидов для секвенаторов для чтения коротких последовательностей варьируются по длине от примерно 1 килобазы (кб) до 100 кб, например, от 1 кб до 50 кб, от 5 кб до 25 кб, от 5 кб до 20 кб или приблизительно 1 кб, 5 кб, 10 кб, 15 кб или 20 кб.
[0310] Для создания коллекции полинуклеотидов желаемого размера, коллекция полинуклеотидов может быть получена с желаемым размером путем изменения условий реакций обратной транскрипции или удлинения праймера, таких как модификация времени реакции на стадии удлинения. В некоторых вариантах осуществления коллекция полинуклеотидов может быть фрагментирована или доведена до желаемой длины физическими методами (то есть акустическим сдвигом и обработкой ультразвуком) или ферментативными способами (то есть применением смесей неспецифических эндонуклеаз и рекцией тагментации с использованием транспозазы). Полинуклеотиды желаемого размера могут быть выделены электрофорезом в агарозном геле, таким как электрофорез в денатурирующем геле, методы исключения по размеру или автоматизированными методами или при использовании коммерческих наборов (Quail et al., Electrophoresis (2012) 33 (23): 3521-3528; Duhaime et al., Environ Microbiol (2012) 14 (9): 2526-2537).
[0311] В некоторых вариантах осуществления двухцепочечные полинуклеотиды с двумя штрих-кодами очищают перед выбором полинуклеотидов соответствующего размера, например, аффинной очисткой. В некоторых вариантах осуществления двухцепочечные полинуклеотиды с двумя штрих-кодами денатурируют перед выбором полинуклеотидов соответствующего размера. В некоторых вариантах осуществления двухцепочечные полинуклеотиды с двумя штрих-кодами денатурируют путем разрыва водородных связей между комплементарными цепями ДНК. В некоторых вариантах осуществления денатурация двухцепочечной ДНК осуществляется путем применения кислоты или основания, концентрированного неорганического растворителя, органического растворителя (например, спирта или хлороформа), излучения или нагрева. В некоторых вариантах осуществления изобретения денатурация двухцепочечной ДНК осуществляется путем воздействия химических веществ, таких как формамид, гуанидин, салицилат натрия, диметилсульфоксид (DMS), пропиленгликоль, мочевина или NaOH. В некоторых вариантах осуществления молекулы двухцепочечной ДНК обрабатывают NaOH, таким как 0,1 М NaOH, для получения одноцепочечных молекул.
[0312] После выбора размера и/или очистки может быть добавлен второй адаптер к полинуклеотидам с двойным штрих-кодом, помеченным адаптером, и представляющим собой полинуклеотиды, полученные способом с применением первого адаптера с универсальной последовательностью праймирования, штрих-кода носителя и молекулярного штрих-кода. Адаптер содержит универсальную праймирующую последовательность, которую можно использовать для амплификации или секвенирования двойных штрихкодеотидов, меченных адаптером. Адаптеры могут содержать любую известную универсальную последовательность праймирования или ее фрагмент. Типичные универсальные последовательности праймирования включают в себя последовательности праймирования P7, C7, P5 или C5.
[0313] Добавление второго адаптера может быть осуществлено любым известным способом. Адаптер может быть добавлен к одноцепочечному полинуклеотиду или двухцепочечному полинуклеотиду. В некоторых примерах осуществления адаптер добавляют к одноцепочечному полинуклеотиду. В других примерах адаптер, такой как двухцепочечный адаптер, добавляют к двухцепочечному полинуклеотиду. В некоторых вариантах осуществления лигаза используется для лигирования одноцепочечного адаптера. Например, лигазы Thermostable App ligase (NEB) или CircLigase II (Epicenter) можно использовать для лигирования второго адаптера к одноцепочечному адаптеру к одноцепочечному, меченым адаптером, полинуклеотиду с двумя штрих-кодами.
[0314] В некоторых вариантах осуществления второй адаптер может быть добавлен к одноцепочечным, меченным адаптером, полинуклеотидам с двумя штрих-кодами путем отжига вырожденного шарнирного (splint) адаптера. Например, второй адаптер может быть добавлен путем добавления дуплекса шарнирного (splint) адаптера к концу одноцепочечного, меченого адаптером, полинуклеотида с двумя штрих-кодами. Такие дуплексы шарнирного (splint) адаптера содержат спаренный двухцепочечный олигонуклеотид с вырожденным выступом на одном конце молекулы. Вырожденный вылет может составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 оснований. Вырожденные нуклеотиды в выступающей части молекулы отжигают с концом одноцепочечного, меченного адаптером, полинуклеотида с двойным штрих кодом напротив конца с первой последовательностью адаптера. В некоторых вариантах осуществления способа дуплекс шарнирного (splint) адаптера с 3'-выступом отжигают на 3'-конце одноцепочечного, меченого адаптером полинуклеотида с двумя штрих-кодами, на противоположном конце к первому адаптеру. В некоторых вариантах осуществления способа дуплекс шарнирного (splint) адаптера с 5'-выступом отжигают на 5' конце одноцепочечного, меченого адаптером, полинуклеотида с двумя штрих-кодами напротив первого адаптера. Лигаза, такая как лигаза тупых концов/ТА-лигаза, может облегчать отжиг дуплекса шарнирного (splint) адаптера с одноцепочечными, мечеными адаптером, полинуклеотидами с двумя штрих-кодами.
[0315] В некоторых вариантах осуществления способа ферментативное достраивание нематричных нуклеотидов может быть произведено к концу одноцепочечных, меченых адаптером, полинуклеотидов с двумя штрих-кодами, к которым отожжен адаптер. В некоторых вариантах осуществления второй адаптер отжигают непосредственно с нематричными нуклеотидами при комплементарном спаривании оснований. В некоторых вариантах осуществления дуплекс шарнирного (splint) адаптера может быть отожжен с нематричными нуклеотидами для осуществления добавления адаптера к концу молекулы. В некоторых вариантах осуществления адаптер добавляют к 3'-концу одноцепочечных, меченых адаптером, полинуклеотидов с двумя штрих-кодами. В некоторых вариантах осуществления адаптер добавляют к 5'-концу одноцепочечных, меченых адаптером, полинуклеотидов с двумя штрих-кодами. Лигаза, такая как лигаза тупых концов/ТА-лигаза, может облегчить отжиг второго адаптера или дуплекса шарнирного (splint) адаптера с одноцепочечными, мечеными адаптером, полинуклеотидами с двумя штрих-кодами.
[0316] Второй адаптер содержит универсальную праймирующую последовательность или универсальный праймирующий сайт или непрерывную часть универсальной праймирующей последовательности или универсального праймирующего сайта, достаточной для отжига комплементарной последовательности. Универсальные праймирующие последовательности или универсальные праймирующие сайты содержат олигонуклеотидные последовательности, комплементарные универсальным праймерам или их непрерывной части. Примерные универсальные праймеры перечислены в разделе D ниже.
D. Амплификация и секвенирование
[0317] Образец, содержащий двойные штрихкодированные полинуклеотиды, с первым и вторым адаптером на или рядом с противоположными концами двойных штрихкодированных полинуклеотидов, соответствующих одной или нескольким полинуклеотидным последовательностям-мишеням и/или всей или части транскриптома клетки, такие как созданные в описанных выше процедурах, могут быть амплифицированы для генерирования множества копий библиотеки полинуклеотидов с двойным штрих-кодом. Амплификация может быть выполнена до секвенирования. В некоторых вариантах осуществления праймеры с адаптерами для секвенирования могут использоваться для амплификации одной или нескольких последовательностей в библиотеке. В некоторых вариантах осуществления выбранные транскрипты амплифицируются и подготавливаются для секвенирования.
[0318] В некоторых вариантах осуществления, праймеры-адаптеры с адаптерами для секвенирования используются для амплификации всех транскриптов в библиотеке и их подготовки для секвенирования. В некоторых вариантах осуществления праймер адаптера, несущий адаптер для секвенирования и специфичный для мишени праймер, несущий адаптер для секвенирования используются для амплификации гена-мишени и подготовки гена-мишени для секвенирования. В некоторых вариантах осуществления для амплификации транскриптома, специфичный для клетки праймер, такой как праймер штрих-кода носителя, несущий адаптер секвенирования и праймер для адаптера на противоположном (от штрих-кода носителя с адаптером секвенирования) конце транскрипта используется для амплификации транскриптомв выбранной клетки и подготовки его для секвенирования. Фигура 2 изображает иллюстративную выбранную амплификацию полинуклеотидов в созданной библиотеке с использованием выбранных праймеров, как описано здесь.
1. Амплификация
[0319] Образец, содержащий полинуклеотид-мишень, может содержать ДНК, соответствующую полному транскрипту мРНК или его фрагменту (ам), которые могут быть амплифицирован. В некоторых случаях средняя длина соответствующего транскрипта мРНК или его фрагмента(ов) может составлять менее примерно 100, 200, 300, 400, 500 или 800 пар оснований или менее примерно 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 нуклеотидов или менее чем примерно 1, 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 килобаз. В некоторых случаях амплифицируется последовательность-мишень относительно короткогй матрицы, такого как носитель, содержащая матрицу, составляющую примерно 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 оснований.
[0320] Реакция амплификации может включать одну или несколько добавок. В некоторых случаях добавляются одна или несколько добавок, такие как диметилсульфоксид (ДМСО), глицерин, бетаин (моно) гидрат N, N, N-триметилглицин = [карбоксиметил] триметиламмоний), трегалоза, 7-деаза-2'-дезоксигуанозин трифосфат (dC7GTP или 7-деаза-2'-dGTP), BSA (бычий сывороточный альбумин), формамид (метанамид), хлорид тетраметиламмония (TMAC), другие производные тетраалкиламмония (например, тетраэтамат) (TEA-C1) и тетрапропиламмонийхлорид (TPrA-Cl), неионогенное моющее средство (например, Triton X-100, TWEEN® 20, Nonidet P-40 (NP-40)) или PREXCEL-Q. В некоторых случаях реакция амплификации включает 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. различных добавок. В других случаях реакция амплификации включает по меньшей мере 0, 1, 2, 3, 4, 5 6, 7, 8, 9 или 10 различных добавок.
[0321] Реакции термоциклирования могут проводиться на образцах, содержащихся в реакционных объемах (например, каплях). Капельки могут быть полидисперсными или предпочтительно монодисперсными, генерируемыми путем перемешивания, обработки ультразвуком или микрожидкостным путем на стыке Т-каналов или другими способами, известными специалистам в данной области техники. Плотность может превышать 20 000 капель/40 мкл (капли объемом 1 нл), 200 000 капель/40 мкл (капли объемом 100 мкл). Капли могут оставаться интактными в процессе термоциклирования. Капли могут оставаться интактными в процессе термоциклирования при плотностях, превышающих примерно 10000 капель/мкл, 100 000 капель/мкл, 200000 капель/мкл, 300000 капель/мкл, 400000 капель/мкл, 500000 капель/мкл, 600000 капель/мкл, 700000 капель/мкл, 800000 капель/мкл, 900000 капель/мкл или 1000000 капель/мкл. В других случаях две или более капель не сливаются в процессе термоциклирования. В других случаях более 100 или более 1000 капель не сливаются в процессе термоциклирования.
[0322] Можно использовать любую ДНК-полимеразу, катализирующую удлинение праймера, включая, но не ограничиваясь этим, ДНК-полимеразу Е.coli, фрагмент Кленова ДНК-полимеразы 1 E.coli, ДНК-полимеразу Т7, ДНК-полимеразу Т4, полимеразу Taq, ДНК-полимеразу Pfu, ДНК-полимераза Vent, бактериофаг 29, REDTaq ™, геномную ДНК-полимеразу или секвеназу. В некоторых случаях используется термостабильная ДНК-полимераза. ПЦР с горячим стартом также может быть проведена, при этом реакцию нагревают до 95°С в течение двух минут перед добавлением полимеразы, или полимераза может оставаться неактивной до первой стадии нагревания в цикле 1. ПЦР с горячим стартом может использоваться для минимизации неспецифическая амплификации.
[0323] Любое количество циклов ПЦР может быть использовано для амплификации ДНК, например, примерно, больше или меньше, чем примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 или 45 циклов. Количество циклов амплификации может составлять примерно 1-45, 10-45, 20-45, 30-45, 35-45, 10-40, 10-30, 10-25, 10-20, 10-15, 20- 35, 25-35, 30-35 или 35-40.
[0324] Амплификацию целевых нуклеиновых кислот можно проводить любыми известными способами. Целевые нуклеиновые кислоты могут быть амплифицированы с помощью полимеразной цепной реакции (ПЦР) или изотермической амплификации ДНК. Примеры методов ПЦР, которые можно использовать, включают, но не ограничиваются ими, количественную ПЦР, количественную флуоресцентную ПЦР (QF-PCR), мультиплексную флуоресцентную ПЦР (MF-PCR), ПЦР в реальном времени (обратная транскрипция-ПЦР), одноклеточную ПЦР, ПЦР полиморфизма длины рестрикционных фрагментов (PCR-RFLP), PCR-RFLP/обратная транскрипция-PCR-RFLP, ПЦР с «горячим стартом», вложенную ПЦР, ПЦР колоний (polony=Polymerase-colony) in situ, амплификацию с кольцевыми матрицами in situ (RCA), цифровую ПЦР (dPCR), капельную цифровую ПЦР (ddPCR), мостиковую ПЦР, пиколитровуюя ПЦР и эмульсионную ПЦР. Другие подходящие способы амплификации включают лигазную цепную реакцию (LCR), амплификацию транскрипции, ПЦР с молекулярно-инверсионным зондом (MIP), самоподдерживающуюся репликацию последовательности, селективную амплификацию полинуклеотидных последовательностей-мишеней, полимеразную цепную реакцию с косенснусной последовательностью (CP-PCR), полимеразную цепную реакцию с произвольными праймерами (AP-PCR), ПЦРс вырожденными полинуклеотидными праймерами (DOP-PCR) и амплификацию последовательностей на основе нуклеиновых кислот (NABSA). Другие способы амплификации, которые можно использовать здесь, включают в себя те, которые описаны в патентах США No. №№ 5242774; 5494810; 4988617; и 6,582,938, а также включают амплификацию РНК опосредованную Q бета-репликазой. Амплификация может быть изотермической амплификацией, например, изотермическое линейное усиление.
[0325] В некоторых вариантах осуществления амплификация не осуществляется на твердой подложке. В некоторых вариантах осуществления амплификация не осуществояется на твердой подложке в каплле. В некоторых вариантах осуществления амплификация происходит на твердой подложке, когда амплификация проводится не в капле.
[0326] Реакция амплификации может включать одну или несколько добавок. В некоторых вариантах осуществления одна или несколько добавок представляют собой диметилсульфоксид (ДМСО), глицерин, бетаин (моно) гидрат (N, N, N-триметилглицин = [карбоксиметил] триметиламмоний), трегалозу, 7-деаза-2'-дезоксигуанозинтрифосфат (dC7GTP или 7-деаза-2'-dGTP), BSA (бычий сывороточный альбумин), формамид (метанамид), хлорид тетраметиламмония (TMAC), другие производные тетраалкиламмония (например, хлорид тетраэтиаммония (TEA-C1) и хлорид тетрапропиламмония (TPA) Cl), неионогенное моющее средство (например, Triton X-100, TWEEN® 20, Nonidet P-40 (NP-40)) или PREXCEL-Q. В некоторых вариантах осуществления реакция амплификации может содержать 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных добавок. В других случаях реакция амплификации может содержать по меньшей мере 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных добавок.
[0327] Обычно в реакции амплификации можно использовать одну или несколько пар праймеров; один праймер из пары праймеров может быть прямым праймером, а другой праймер из пары праймеров может быть обратным праймером.
[0328] В некоторых случаях первая пара праймеров может быть использована в реакции амплификации; один праймер первой пары может быть прямым праймером, комплементарным последовательности первой полинуклеотидной молекулы-мишени, и один праймер первой пары может быть обратным праймером комплементарным второй последовательности первой молекулы-мишени полинуклеотида и первой целевой локус может находиться между первой последовательностью и второй последовательностью. В некоторых вариантах осуществления первый целевой локус содержит последовательность VH или Vα или Vγ.
[0329] В некоторых случаях вторая пара праймеров может быть использована в реакции амплификации; один праймер второй пары может быть прямым праймером, комплементарным первой последовательности второй полинуклеотидной молекулы-мишени, и другой праймер второй пары может быть обратным праймером, комплементарным второй последовательности второй полинуклеотидной молекулы-мишени, и второй целевой локус может находиться между первой последовательностью и второй последовательностью. В некоторых вариантах осуществления второй локус-мишень содержит последовательность VL или Vβ или Vδ.
[0330] В некоторых случаях третью пару праймеров можно использовать в реакции амплификации; один праймер третьей пары может быть прямым праймером, комплементарным первой последовательности третьей полинуклеотидной молекулы-мишени, и другой праймер третьей пары может быть обратным праймером, комплементарным второй последовательности третьей полинуклеотидной молекулы-мишени, и третий целевой локус может находиться между первой последовательностью и второй последовательностью. В некоторых вариантах осуществления третий целевой локус содержит штриховой код, такой как молекулярный штриховой код или штрих-код носителя.
[0331] В некоторых случаях в реакции амплификации можно использовать несколько пар праймеров. В некоторых примерах один праймер из пары праймеров может быть прямым праймером, комплементарным первой последовательности адаптера, а другой праймер из пары праймеров может быть обратным праймером ко второй последовательности адаптера. В некоторых примерах один праймер из пары праймеров может быть прямым праймером, комплементарным последовательности второго адаптера, а другой праймер из пары праймеров может быть обратным праймером к последовательности первого адаптера.
[0332] Длина прямого праймера и обратного праймера может зависеть от последовательности полинуклеотида-мишени и локуса-мишени. Например, длина и/или Т прямого праймера и обратного праймера могут быть оптимизированы. В некоторых случаях праймер может составлять приблизительно более или менее, чем приблизительно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 нуклеотидов в длину. В некоторых случаях праймер составляет от приблизительно 15 до приблизительно 20, от приблизительно 15 до приблизительно 25, от приблизительно 15 до приблизительно 30, от приблизительно 15 до приблизительно 40, от приблизительно 15 до приблизительно 45, от приблизительно 15 до приблизительно 50, от приблизительно 15 до приблизительно 55, приблизительно От 15 до приблизительно 60, от приблизительно 20 до приблизительно 25, от приблизительно 20 до приблизительно 30, от приблизительно 20 до приблизительно 35, от приблизительно 20 до приблизительно 40, от приблизительно 20 до приблизительно 45, от приблизительно 20 до приблизительно 50, от приблизительно 20 до приблизительно 55 или приблизительно 20 до приблизительно 60 нуклеотидов в длину.
[0333] Праймер может представлять собой одноцепочечную ДНК перед связыванием матричного полинуклеотида. В некоторых случаях праймер изначально содержит двухцепочечную последовательность. Подходящая длина праймера может зависеть от предполагаемого использования праймера, и может варьироваться от примерно 6 до примерно 50 нуклеотидов или от примерно 15 до примерно 35 нуклеотидов. Молекулы короткого праймера обычно требуют более низких температур для образования достаточно стабильных гибридных комплексов с матрицей. В некоторых вариантах осуществления праймер не обязательно должен отражать точную последовательность матричной нуклеиновой кислоты, но может быть иметь достаточную комплементарность для гибридизации с матрицей. В некоторых случаях праймер может быть частично двухцепочечным перед связыванием с матричным полинуклеотидом. Праймер с двухцепочечной последовательностью может иметь шпилечную петлю примерно, более чем примерно или менее чем примерно 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 17, 18, 19 или 20 оснований. Двухцепочечная часть праймера может составлять примерно, более чем примерно, менее чем примерно или по меньшей мере примерно 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41 42, 43, 44, 45, 46, 47, 48, 49 или 50 пар оснований. Конструкция подходящих праймеров для амплификации последовательности-мишени хорошо известна в данной области техники.
[0334] Праймеры могут обладать дополнительными свойствами, позволяющими обнаруживать или иммобилизовать праймер, которые не изменяют основное свойство праймера (например, действия как инициатора точки начала синтеза ДНК). Например, праймеры могут содержать дополнительную последовательность нуклеиновой кислоты на 5'-конце, которая не гибридизуется с нуклеиновой кислотой-мишенью, но которая облегчает клонирование или дальнейшую амплификацию, или секвенирование амплифицированного продукта. Например, дополнительная последовательность может содержать сайт связывания праймера, такой как универсальный сайт связывания праймера, который может быть адаптером. Область праймера, которая достаточно комплементарна матрице для гибридизации, может упоминаться здесь как область гибридизации.
[0335] В другом случае праймер, используемый в описанных здесь способах и композициях, может содержать один или несколько универсальных нуклеозидов. Неограничивающими примерами универсальных нуклеозидов являются 5-нитроиндол и инозин, как описано в патентных заявках США № 2009/0325169 и 2010/0167353.
[0336] Праймеры могут быть сконструированы в соответствии с известными параметрами для избежания вторичных структур и самогибридизации. Различные пары праймеров могут отжигаться и плавиться при примерно одинаковых температурах, например, в пределах 1°С, 2°С, 3°С, 4°С, 5°С, 6°С, 7°С, 8°С, 9°C или 10°C от температур другой пары праймеров. В некоторых случаях первоначально используются более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 100, 200, 500, 1000, 5000, 10000 или более праймеров. Такие праймеры могут гибридизоваться с полинуклеотидами-мишенями, описанными здесь.
[0337] Праймеры могут быть получены различными способами, включая, но не ограничиваясь этим, такими, как клонирование соответствующих последовательностей и прямой химический синтез с использованием методик, хорошо известных в данной области техники (Narang et al., Methods Enzymol. 68:90 (1979); Brown et al., Methods Enzymol. 68: 109 (1979)). Праймеры также могут быть получены из коммерческих источников. Праймеры могут иметь одинаковую температуру плавления. Праймеры могут иметь неодинаковые температуры плавления. Длина праймеров может быть увеличена или уменьшена на 5'-конце или 3'-конце для получения праймеров с желаемой температурой плавления. Один из праймеров пары праймеров может быть длиннее другого праймера. 3'-длина отжига праймеров внутри пары праймеров может различаться. Кроме того, позиция отжига каждой пары праймеров может быть спроектирована таким образом, чтобы последовательность и длина пар праймеров давали желаемую температуру плавления. Уравнением для определения температуры плавления праймеров, длиной меньше 25 пар оснований, является правило Уолласа (T=2 (A+T) +4 (G+C)). Компьютерные программы также могут быть использованы для разработки дизайна праймеров. TM (температура плавления или отжига) каждого праймера может быть рассчитана с использованием программ. Температура отжига праймеров может быть пересчитана и увеличена после любого цикла амплификации, включая, но не ограничиваясь циклами 1, 2, 3, 4, 5, циклами 6-10, циклами 10-15, циклами 15-20, циклами 20 -25, циклами 25-30, циклами 30-35 или циклами 35-40. После начальных циклов амплификации 5'-часть праймеров может быть включена в продукты каждого локуса, представляющего интерес; и, таким образом, ТМ может быть пересчитана на основе как последовательностей 5' части праймеров, так и 3' -части каждого праймера.
[0338] Проведение одной или нескольких реакций описанных здесь способов может включать использование одного или нескольких праймеров. Используемый здесь праймер включает двухцепочечный, одноцепочечный или частично одноцепочечный полинуклеотид, который достаточно комплементарен для гибридизации с матричным полинуклеотидом. Праймер может представлять собой одноцепочечную ДНК до связывания с матричным полинуклеотидом. В некоторых вариантах осуществления праймер изначально содержит двухцепочечную последовательность. Сайт праймера включает область матрицы, с которой гибридизуется праймер. В некоторых вариантах осуществления праймеры способны действовать в качестве точки инициации для матрично-опосредованного синтеза нуклеиновой кислоты. Например, праймеры могут инициировать матрично-опосредованный синтез нуклеиновой кислоты, когда присутствуют четыре разных нуклеотида и агент полимеризации или фермент, такой как ДНК или РНК-полимераза или обратная транскриптаза.
[0339] Пара праймеров включает 2 праймера: первый праймер с 5' областью против хода транскрипции, которая гибридизуется с 5' концом последовательности матрицы, и второй праймер с 3' областью по ходу транскрипции, которая гибридизуется с областью, комплементарной 3' концу последовательности матрицы. Набор праймеров включает два или более праймеров: первый праймер или первое множество праймеров с 5' областью против хода транскрипции, которая гибридизуется с 5' концом последовательности матрицы или множеством последовательностей матрицы, и второй праймер или второе множество праймеров с 3' областью по ходу транскрипции, которая гибридизуется с областью, комплементарной 3' концу последовательности матрицы или множеством последовательностей матрицы.
[0340] В некоторых вариантах осуществления праймер содержит специфную последовательность-мишень. В некоторых вариантах осуществления праймер содержит вариант последовательности штрих-кода. В некоторых вариантах осуществления праймер содержит универсальную последовательность прайминга. В некоторых вариантах осуществления праймер содержит последовательность праймера для ПЦР. В некоторых вариантах осуществления праймер содержит последовательность праймера для ПЦР, используемую для инициации амплификации полинуклеотида. (Dieffenbach, PCR Primer: A Laboratory Manual, 2nd Edition (Cold Spring Harbor Press, New York (2003)). Универсальный сайт или последовательность связывания праймера позволяет присоединять универсальный праймер к полинуклеотиду и/или ампликону. Универсальные праймеры хорошо известны в данной области техники и включают, но не ограничиваются таковыми, -47F (M13F), alfaMF, AOX3′, AOX5′, BGHr, CMV-30, CMV-50, CVMf, LACrmt, lambda gt l0F, lambda gt 10R, lambda gt 11F, lambda gt 11R, M13 rev, M13Forward(-20), M13Reverse, male, pQEproseq, pQE, pA-120, pet4, pGAP Forward, pGLRVpr3, pGLpr2R, pKLAC14, pQEFS, pQERS, pucUl, pucU2, reversA, seqIREStam, seqIRESzpet, seqori, seqPCR, seqpIRES-, seqpIRES+, seqpSecTag, seqpSecTag+, seqretro+PSI, SP6, T3-prom, T7-prom, и T7-termInv.
[0341] Используемый здесь термин «прикрепление» может относиться как к ковалентным взаимодействиям, так и к нековалентным взаимодействиям. Присоединение универсального праймера к сайту связывания универсального праймера можно использовать для амплификации, детекции и/или секвенирования полинуклеотида и/или ампликона. Универсальный сайт связывания праймеров может содержать по меньшей мере примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 нуклеотидов или пар оснований. В другом примере универсальный сайт связывания праймера содержит по меньшей мере примерно 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 8500, 9000, 9500 или 10000 нуклеотидов или пар оснований. В некоторых вариантах осуществления сайт связывания универсального праймера содержит 1-10, 10-20, 10-30 или 10-100 нуклеотидов или пар оснований. В некоторых вариантах осуществления универсальный сайт связывания праймера включает примерно about 1-90, 1-80, 1-70, 1-60, 1-50, 1-40, 1-30, 1-20, 1-10, 2-90, 2-80, 2- 70, 2-60, 2-50, 2-40, 2-30, 2-20, 2-10, 1-900, 1-800, 1-700, 1-600, 1-500, 1-400, 1-300, 1-200, 1-100, 2-900, 2-800, 2-700, 2-600, 2-500, 2-400, 2-300, 2-200, 2-100, 5-90, 5-80, 5-70, 5-60, 5-50, 5- 40, 5-30, 5-20, 5-10, 10-90, 10-80, 10-70, 10-60, 10-50, 10-40, 10-30, 10-20, 10-10, 5-900, 5-800, 5- 700, 5-600, 5-500, 5-400, 5-300, 5-200, 5-100, 10-900, 10-800, 10-700, 10-600, 10-500, 10-400, 10- 300, 10-200, 10-100, 25-900, 25-800, 25-700, 25-600, 25-500, 25-400, 25-300, 25-200, 25-100, 100- 1000, 100-900, 100-800, 100-700, 100-600, 100-500, 100-400, 100-300, 100-200, 200-1000, 200- 900, 200-800, 200-700, 200-600, 200-500, 200-400, 200-300, 300-1000, 300-900, 300-800, 300-700, 300-600, 300-500, 300-400, 400-1000, 400-900, 400-800, 400-700, 400-600, 400-500, 500-1000, 500-900, 500-800, 500-700, 500-600, 600-1000, 600-900, 600-800, 600-700, 700-1000, 700-900, 700-800, 800-1000, 800-900, или 900-1000 нуклеотидов или пар оснований.
[0342] Праймеры могут иметь длину, совместимую с их использованием в синтезе продуктов удлинения праймеров. Праймер может представлять собой полинуклеотид длиной от 8 до 200 нуклеотидов. Длина праймера может зависеть от последовательности матричного полинуклеотида и локуса матрицы. Например, можно оптимизировать длину и/или температуру плавления (TM) праймера или набора праймеров. В некоторых случаях праймер может составлять приблизительно, более или менее чем приблизительно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 нуклеотидов в длину. В некоторых вариантах осуществления праймеры имеют длину примерно 8-100 нуклеотидов, например, 10-75, 15-60, 15-40, 18-30, 20-40, 21-50, 22-45, 25-40, 7. -9, 12-15, 15-20, 15-25, 15-30, 15-45, 15-50, 15-55, 15-60, 20-25, 20-30, 20-35, 20-45, 20-50, 20-55 или 20-60 нуклеотидов в длину и любую длину между ними. В некоторых вариантах осуществления праймеры составляют самое большее примерно 10, 12, 15, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 нуклеотидов в длину.
[0343] Как правило, одну или несколько пар праймеров можно использовать в реакции экспоненциальной амплификации; один праймер из пары праймеров может быть прямым праймером, а другой праймер из пары праймеров может быть обратным праймером. В некоторых вариантах осуществления первая пара праймеров может быть использована в реакции экспоненциальной амплификации; один праймер первой пары может быть прямым праймером, комплементарным последовательности первой матричной полинуклеотидной молекулы, а другой праймер первой пары может быть обратным праймером, комплементарным второй последовательности первой матричной полинуклеотидной молекулы, и первый локус матрицы может находиться между первой последовательностью и второй последовательностью. В некоторых вариантах осуществления вторая пара праймеров может быть использована в реакции амплификации; один праймер второй пары может быть прямым праймером, комплементарным первой последовательности второй полинуклеотид-мишеньной молекулы, а другой праймер второй пары может быть обратным праймером, комплементарным второй последовательности второй полинуклеотид-мишеньной молекулы, а второй целевой локус может находиться между первой последовательностью и второй последовательностью. В некоторых вариантах осуществления второй локус-мишень содержит последовательность вариабельной легкой цепи антитела. В некоторых вариантах осуществления в реакции амплификации может использоваться третья пара праймеров; один праймер третьей пары может быть прямым праймером, комплементарным первой последовательности третьей полинуклеотидной молекулы матрицы, а другой праймер третьей пары может быть обратным праймером, комплементарным второй последовательности третьей полинуклеотидной молекулы-матрицы, и третий локус матрицы может находиться между первой последовательностью и второй последовательностью.
[0344] Один или несколько праймеров могут отжигаться по меньшей мере с частью множества матричных полинуклеотидов. Один или несколько праймеров могут отжигаться с 3'-концом и/или 5' концом множества матричных полинуклеотидов. Один или несколько праймеров могут отжигаться со внутренней областью множества матричных полинуклеотидов. Внутренняя область может составлять по меньшей мере примерно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 100, 150, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 590, 600, 650, 700, 750, 800, 850, 900 или 1000 нуклеотидов, расположенных на 3' конце или 5' конце множество матричных полинуклеотидов. Один или несколько праймеров могут содержать фиксированную панель праймеров. Один или несколько праймеров могут содержать по меньшей мере один или несколько изготовленных на заказ праймеров. Один или несколько праймеров могут содержать по меньшей мере один или несколько контрольных праймеров. Один или несколько праймеров могут содержать по меньшей мере один или несколько праймеров для генов «домашнего хозяйства». Один или несколько праймеров могут содержать универсальный праймер. Универсальный праймер может отжигаться с сайтом связывания универсального праймера. В некоторых вариантах осуществления один или несколько изготовленных на заказ праймеров отжигают с SBC, целевой специфической областью, областями, комплементарным таковым или с любой их комбинацией. Один или несколько праймеров могут содержать универсальный праймер. Один или несколько праймеров-праймеров могут быть сконструированы для амплификации или выполнения удлинения праймера, обратной транскрипции, линейного удлинения, неэкспоненциальной амплификации, экспоненциальной амплификации, ПЦР или любого другого метода амплификации одного или нескольких полинуклеотидов-мишеней или матричных полинуклеотидов.
[0345] Целевая область может содержать по меньшей мере примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 100, 150, 200, 220, 230, 240, 250, 260, 270 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 650, 700, 750, 800, 850, 900 или 1000 нуклеотидов или пар оснований. В другом примере специфичная область-мишень включает по меньшей мере примерно 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 8500, 9000, 9500 или 10000 нуклеотидов или пар оснований; в некоторых вариантах осуществления целевая специфичная область содержит примерно 5-10, 10-15, 10-20, 10-30, 15-30, 10-75, 15-60, 15-40, 18-30, 20 -40, 21-50, 22-45, 25-40, 7-9, 12-15, 15-20, 15-25, 15-30, 15-45, 15-50, 15-55, 15-60 20-25, 20-30, 20-35, 20-45, 20-50, 20-55, 20-60, 2-900, 2-800, 2-700, 2-600, 2-500, 2-400, 2-300, 2-200, 2-100, 25-900, 25-800, 25-700, 25-600, 25-500, 25-400, 25-300, 25-200, 25-100 100-1000, 100-900, 100-800, 100-700, 100-600, 100-500, 100-400, 100-300, 100-200, 200-1000, 200-900, 200-800, 200 -700, 200-600, 200-500, 200-400, 200-300, 300-1000, 300-900, 300-800, 300-700, 300-600, 300-500, 300-400, 400-1000, 400-900, 400-800, 400-700, 400-600, 400-500, 500-1000, 500-900, 500-800, 500-700, 500-600, 600-1000, 600-900, 600 -800, 600-700, 700-1000, 700-900, 700-800, 800-1000, 800-900 или 900-1000 нуклеотидов или пар оснований.
[0346] Праймеры могут быть сконструированы в соответствии с известными параметрами для избежания образования вторичных структур и самогибридизации. В некоторых вариантах осуществления разные пары праймеров могут отжигаться и плавиться при примерно одинаковых температурах, например, в пределах 1°С, 2°С, 3°С, 4°С, 5°С, 6°С, 7°С, 8°C, 9°C или 10°C температуры плавления другой пары праймеров. В некоторых вариантах осуществления один или несколько праймеров из множества праймеров могут отжигаться и плавиться при примерно одинаковых температурах, например, в пределах 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10°C от температутры плавления другого праймера из множества праймеров. В некоторых вариантах осуществления один или несколько праймеров из множества праймеров могут отжигаться и плавиться при разных температурах, чем другой праймер из множества праймеров.
[0347] Множество праймеров для одного или нескольких стадий описанных здесь способов, могут содержать множество праймеров, содержащих примерно, примерно по большей мере или по меньшей мере примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 30000, 40000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, 1000000, 50000000, 100000000 различных праймеров. Например, каждый праймер из множества праймеров может содержать разные области или последовательности, специфичные для мишени или матрицы.
[0348] На Фиг.2 изображены типичные схемы реакции амплификации для амплификации полинуклеотидной библиотеки, представленной в настоящем документе, и сгенерированной способами, представленными в данном документе. В иллюстративных способах, предоставленных в настоящем документе, для амплификации библиотеки для целей секвенирования используют праймеры, связанные с адаптером секвенирования, который будет использоваться для секвенирования, такого как секвенирование следующего поколения. Такие праймеры известны и описаны здесь. Меченые адаптером праймеры для секвенирования используются в приведенных ниже типичных применениях.
[0349] В некоторых вариантах осуществления ген-мишень амплифицируют для секвенирования. В некоторых вариантах осуществления ген-мишень амплифицируют, используя праймер, направленный на последовательность адаптера на одном конце полинуклеотида, и специфический для мишени праймер, расположенный для взаимодействия с последовательностью полноразмерного полипептида-мишени или его выбранной части. В некоторых примерах последовательность-мишень может присутствовать в библиотеке на основе одной клетки или множества клеток. В некоторых вариантах осуществления одну или несколько последовательностей-мишеней амплифицируют с использованием праймеров, специфичных к универсальной праймирующей последовательности полинуклеотида, и одного или нескольких специфичных для мишени праймеров. В некоторых вариантах осуществления амплифицируют две или более последовательности-мишени, каждую с универсальной последовательностью и специфичными для мишени праймерами, как описано. В некоторых вариантах осуществления две или более последовательностей-мишеней связаны, например, две последовательности-мишени, которые коэкспрессируются в клетке, например, последовательности-мишени, которые коэкспрессируются как димер (например, гетеродимер). Таким образом, используя предоставленный вариант осуществления, можно получить информацию о парных последовательностях, такую как информацию о полноразмерных парных последовательностях, используя предоставленные способы.
[0350] В некоторых вариантах осуществления вся полученная библиотека полинуклеотидов может быть амплифицирована для секвенирования с использованием праймеров, специфичных к универсальной последовательности праймирования первого адаптера и универсальной последовательности праймирования второго адаптера. Амплификация полинуклеотидных библиотек, представленных в настоящем документе, с использованием праймеров, специфичных к универсальным праймирующим последовательностям расположенным на обоих концах полинуклеотидов библиотеки, может дать транскриптом, или геном, или их часть, всех клеток, используемых для создания библиотеки. Такая информация о транскриптоме может быть использована для получения данных в более поздние моменты времени и/или использована для оценки экспрессии (на уровне транскрипта) нескольких генов в популяции клеток, вошедших в образец. В некоторых вариантах осуществления транскриптомная информация всех клеток может быть проанализирована и использована для создания кластеров клеток с аналогичными профилями экспрессии транскрипта из общей популяции клеток, на основе которых была создана библиотека.
[0351] В некоторых вариантах осуществления полинуклеотиды из одной клетки могут быть специфически амплифицированы и секвенированы с использованием праймера, специфичного для последовательности штрих-кода носителя, и праймера, специфичного для универсального сайта прайминга, присутствующего во втором адаптере. В таких вариантах осуществления одна или несколько последовательностей-мишеней амплифицируются, как описано выше, и штрих-код(ы) носителя идентифицируются в последовательности(ях)-мишени(ях), как представляющие интерес. Поскольку все полинуклеотиды из одной и той же клетки имеют штрих-код с одним и тем же штрих-кодом носителя, это применение способа дает информацию о последовательности всех полинуклеотидов из выбранной клетки или клеток. Амплификация всех полинуклеотидов в библиотеке из выбранной клетки или клеток может затем показать профили экспрессии или генетические профили клетки или клеток, которые экспрессируют одну или несколько конкретных последовательностей-мишеней.
2. Секвенирование
[0352] После выполнения одного или нескольких способов или стадий способа, описанных в настоящем документе, можно секвенировать библиотеку полученных полинуклеотидов.
[0353] Секвенирование может быть выполнено любым способом секвенирования, известным в данной области техники. В некоторых вариантах осуществления секвенирование может выполняться с высокой пропускной способностью. Подходящие технологии секвенирования следующего поколения включают платформу 454 Life Sciences platform (Roche, Branford, CT) (Margulies et al., Nature, 437, 376-380 (2005)); lllumina’s Genome Analyzer, GoldenGate Methylation Assay или Infinium Methylation Assays, то есть Infinium HumanMethylation 27K BeadArray или VeraCode GoldenGate methylation array (Illumina, San Diego, CA; Bibkova et al, Genome Res. 16, 383-393 (2006); и патенты США No. 6,306,597, 7,598,035, 7,232,656), или ДНК-секвенирование путем лигирования, SOLiD System (Applied Biosystems/Life Technologies; патенты США No. 6,797,470, 7,083,917, 7,166,434, 7,320,865, 7,332,285, 7,364,858, и 7,429,453); или технология секвенирования the Helicos True Single Molecule DNA sequencing technology (Harris et al, Science, 320, 106-109 (2008); и патенты США No. 7,037,687, 7,645,596, 7,169,560, и 7,769,400), Pacific Biosciences технология секвенирования одиночной молекулы в реальном времени (SMRTTm), (Soni et al, Clin. Chem. 53, 1996-2001 (2007)). Эти системы позволяют мультиплексное параллельное секвенирование многих полинуклеотидов, выделенных из образца (Dear, Brief Funct. Genomic Proteomic, 1 (4), 397-416 (2003) и McCaughan et al., J. Pathol, 220, 297-306 (2010)).
[0354] В некоторых вариантах полинуклеотиды секвенируют с помощью методов секвенирования путем лигирования модифицированных красителем зондов, пиросеквенирования или секвенирования единичной молекулы. Определение последовательности полинуклеотида может быть выполнено с помощью методов секвенирования, таких как секвенирование одной молекулы Helioscope™, секвенирование ДНК Nanopore, Lynx Therapeutics’ Massively Parallel Signature Sequencing (MPSS), пиросеквенирование 454, секвенирование Single Molecule real time (RNAP), Illumina (Solexa) секвенирование, SOLiD секвенирование, Ion Torrent™, Ion semiconductor секвенирование, секвенирование Single Molecule SMRT(TM), секвенирование Polony, секвенирование DNA nanoball и метод VisiGen Biotechnologies. Альтернативно, для определения последовательности полинуклеотидов могут использоваться платформы для секвенирования, включая, но не ограничиваясь этим, Genome Analyzer IIx, HiSeq, и MiSeq, предлагаемые технологией Illumina, Single Molecule Real Time (SMRTTM) технологии, такие как система PacBio RS, предлагаемая Pacific Biosciences (Калифорния) и Solexa Sequencer, технология True Single Molecule Sequencing (tSMSTM), такая как секвенсор HeliScope™ Sequencer, предлагаемый Helicos Inc. (Кембридж, Массачусетс). Секвенирование может включать секвенирование MiSeq. Секвенирование может включать секвенирование HiSeq. В некоторых вариантах осуществления определение последовательности полинуклеотида включает в себя секвенирование спаренных концов, секвенирование нанопор, секвенирование с высокой пропускной способностью, секвенирование методом дробовика, секвенирование с использованием терминатора красителя, секвенирование ДНК с несколькими праймерами, секвенирование методом «прайсер-опосредованной прогулки», дидезокси секвенирование по Сэнгеру Sanger dideoxy sequencing), секвенирование по методу Максами-Гилберта (Maxim-Gilbert sequencing), пиросеквенирование, секвенирование единичной молекулы (true single molecule sequencing) или любую их комбинацию. Альтернативно, последовательность полинуклеотида может быть определена с помощью электронной микроскопии или с помощью матрицы химически-чувствительных полевых транзисторов (chemFET).
[0355] Способ может дополнительно включать секвенирование одного или нескольких полинуклеотидов в библиотеке. Способ может дополнительно включать совмещение одной или нескольких полинуклеотидных последовательностей, считываний последовательностей, последовательностей ампликонов или последовательностей набора ампликонов в библиотеке друг с другом.
[0356] Как используется в настоящем документе, «выравнивание» включает сравнение/сопоставление тестовой последовательности, в таком формате, как прочтение (рид, sequence read) последовательности, с одной или несколькими другими тестовыми последовательностями, контрольными/референсными последовательностями или их комбинацией. В некоторых вариантах осуществления «выравнивание» может использоваться для определения консенсусной последовательности из множества последовательностей или выровненных последовательностей. В некоторых вариантах осуществления выравнивание включает определение консенсусной последовательности из множества последовательностей, каждая из которых имеет идентичный молекулярный штрих-код или штрих-код носителя. В некоторых вариантах осуществления длина последовательности, выровненной для целей сравнения, составляет по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95% длины референсной последовательности. Фактическое сравнение двух или более последовательностей может быть выполнено известными способами, например, с использованием математического алгоритма. Неограничивающий пример такого математического алгоритма описан в Karlin, S. and Altschul, S., Proc. Natl. Acad. Sci. USA, 90- 5873-5877 (1993). Такой алгоритм включен в программы NBLAST и XBLAST (версия 2.0), как описано в Altschul, S. et al., Nucleic Acids Res., 25: 3389-3402 (1997). При использовании программ BLAST и Gapped BLAST могут использоваться любые соответствующие параметры соответствующих программ (например, NBLAST). Например, параметры для сравнения последовательностей могут быть установлены на оценку=100, длину слова=12 (score= 100, word length= 12) или могут варьироваться (например, W=5 или W=20). Другие примеры включают алгоритм Майерса и Миллера, CABIOS (1989), ADVANCE, ADAM, BLAT и FASTA. В некоторых вариантах осуществления процент идентичности между двумя аминокислотными последовательностями может быть посчитан с использованием, например, программы GAP в пакете программного обеспечения GCG (Accelrys, Cambridge, UK).
[0357] Секвенирование может включать секвенирование по меньшей мере примерно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или более нуклеотидов или пар оснований полинуклеотидов. В некоторых вариантах осуществления секвенирование включает в себя секвенирование по меньшей мере примерно 200, 300, 400, 500, 600, 700, 800, 900, 1000 или более нуклеотидов или пар оснований полинуклеотидов. В других случаях секвенирование включает в себя секвенирование по меньшей мере примерно 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000 или более нуклеотидов или пар оснований полинуклеотидов.
[0358] Секвенирование может включать по меньшей мере примерно 200, 300, 400, 500, 600, 700, 800, 900, 1000 или более операций считывания последовательности за цикл. Как используется в настоящем документе, прочтение/рид последовательности включает последовательность нуклеотидов, определенную из последовательности или массива данных, полученных с помощью технологий секвенирования. В некоторых вариантах осуществления секвенирование включает в себя секвенирование по меньшей мере, примерно 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000 9000, 10000 или более последовательных прочтений за цикл. Секвенирование может включать больше, меньше или быть равным примерно 1000000000 операций чтения последовательности за цикл. Секвенирование может включать более чем, менее чем или ровно примерно 200000000 операций чтения за цикл.
[0359] В некоторых вариантах осуществления число прочтений последовательности, используемых для определения консенсусной последовательности, составляет приблизительно от 2 до 1000 прочтений последовательности. Например, число прочтений последовательностей, используемых для определения консенсусной последовательности, может составлять примерно 2-900, 2-800, 2-700, 2-600, 2-500, 2-400, 2-300, 2-200, 2-100, 25-900, 25-800, 25-700, 25-600, 25-500, 25-400, 25-300, 25-200, 25-100, 100-1000, 100-900, 100- 800, 100-700, 100-600, 100-500, 100-400, 100-300, 100-200, 200-1000, 200-900, 200-800, 200-700, 200-600, 200-500, 200-400, 200-300, 300-1000, 300-900, 300-800, 300-700, 300-600, 300-500, 300-400, 400-1000, 400-900, 400-800, 400- 700, 400-600, 400-500, 500-1000, 500-900, 500-800, 500-700, 500-600, 600-1000, 600-900, 600-800, 600-700, 700-1000, 700-900, 700-800, 800-1000, 800-900 или 900-1000 операций прочтения последовательности. В некоторых вариантах осуществления число прочтнений последовательностей, используемых для определения консенсусной последовательности, составляет по меньшей мере примерно 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 55000, 60000, 65000, 70000, 75000, 80000, 85000, 90000, 95000, 100000, 150000, 200000, 250000, 300000 350000, 400000, 450000, 500000, 550000, 600000, 650000, 700000, 750000, 800000, 850000, 900000, 950000, 1000000, 50000000 или 100000000 операций прочтения. В некоторых вариантах осуществления число прочтений последовательностей, используемых для определения консенсусной последовательности, составляет по большей мере 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 55000, 60000, 65000, 70000, 75000, 80000, 85000, 90000, 95000, 100000, 150000, 200000, 250000, 300000 350000, 400000, 450000, 500000, 550000, 600000, 650000, 700000, 750000, 800000, 850000, 900000, 950000, 1000000, 50000000 или 100000000 операций прочтения.
[0360] Способ может содержать неправильные прочтения. Способ может содержать определение количества неправильных прочтений, например, для определения условий реакции или конструирования последовательностей праймеров. Сравнение количества ошибочных прочтений, созданных при одном или нескольких первоначальных условиях проведения реакции или группы условий, может использоваться для определения предпочтительного условия или набора условий. Например, первый способ может быть осуществлен при высокой концентрации соли во время реакции ПЦР, а второй способ может быть осуществлен при низкой концентрации соли во время реакции ПЦР, где первый и второй способы осуществляются по существу одинаково кроме разницы в концентрации соли. Если первый способ приводит к большему количеству неправильных прочтений, таких как большее число неправильных прочтений для конкретной полинуклеотидной последовательности-мишени или праймера, то можно заключить, что условия реакции с более низкой концентрацией соли предпочтительны для этой конкретной полинуклеотидной последовательности-мишени или праймера.
II. Клонирование и экспрессия генов-мишеней
[0361] В некоторых вариантах осуществления гены-мишени, идентифицированные и секвенированные в соответствии с предоставленными способами, могут быть клонированы в векторы для экспрессии в клетках или из клеток. Можно получить библиотеку экспрессии генов-мишеней, таких как иммунные рецепторы, например, антитела или TCR.
[0362] Термины «Экспрессионная Библиотека антител» или «Экспрессионная Библиотека TCR» или «Экспрессионная библиотека» в контексте настоящего описания могут относиться к совокупности молекул (то есть двух или более молекул) в формате нуклеиновой кислоты или белка. Таким образом, этот термин может относиться к совокупности векторов экспрессии, кодирующих множество молекул антитела или TCR (то есть в формате нуклеиновой кислоты), или может относиться к совокупности молекул антитела или TCR после того, как они были экспрессированы в соответствующей системе экспрессии (т.е. на уровне белка). Альтернативно, векторы экспрессии/экспрессионная библиотека могут содержаться в подходящих клетках-хозяевах, в которых они могут быть экспрессированы. Молекулы антител, которые кодируются или экспрессируются в экспрессионных библиотеках по изобретению, могут иметь любой подходящий формат, например, могут представлять собой молекулы цельного антитела или TCR или могут представлять собой фрагменты антител или TCR, например одноцепочечные антитела (например, антитела scFv), антитела Fv, антитела Fab', фрагменты (Fab')2, диатела и т. д. Термины «содержащая код» и «кодирующая..(наименование)», в контексте последовательности нуклеиновой кислоты «содержащей код/кодирующей ...», или кодирующей последовательности ДНК или нуклеотидной последовательности «содержащей код/кодирующей» определенный фермент, а также другие синонимичные термины, относятся к последовательности ДНК, которая транскрибируется и транслируется в фермент, когда находится под контролем соответствующих регуляторных последовательностей. «Промоторная последовательность» представляет собой регуляторную область ДНК, способную связывать РНК-полимеразу в клетке и инициировать транскрипцию по ее ходу (в направлении 3'-конца) кодирующей последовательности. Промотор является частью последовательности ДНК. Область последовательности начинается со стартового кодона на 3'-конце промотора. Промоторная последовательность включает минимальное количество оснований элементов, необходимых для инициации транскрипции на уровнях, наблюдаемых выше фона. Однако после того, как РНК-полимераза связывается с последовательностью и инициируется транскрипция, начиная со старт-кодона (на 3'-конце промотора), транскрипция продолжается по ее ходу в 3'-направлении. Внутри промоторной последовательности будет находится сайт инициации транскрипции (легко определяемый при картировании с помощью нуклеазы SI), а также белок-связывающие домены (консенсусные последовательности), ответственные за связывание РНК-полимеразы.
[0363] Молекулы антител или TCR, идентифицированные, полученные или выбранные или которые можно получить из экспрессионных библиотек антител или TCR по изобретению, представляют еще один дополнительный аспект изобретения. Опять же, этими антителами или молекулами TCR могут быть белки или нуклеиновые кислоты, кодирующие молекулы антител или TCR, которые, в свою очередь, могут быть встроены в подходящий вектор экспрессии и/или содержаться в подходящей клетке-хозяине.
[0364] Пул кДНК может быть подвергнут реакции ПЦР с использованием полинуклеотидов, которые гибридизуются с константной областью генов тяжелой цепи антител, и полинуклеотидов, которые гибридизуются с 5' концом области цепи VH или Vα или Vγ генов антител или TCR. Пул кДНК может быть подвергнут реакции ПЦР с использованием полинуклеотидов, которые гибридизуются с константной областью генов тяжелой цепи или альфа- или гамма-цепи антител или TCR и полинуклеотидов, которые гибридизуются с областью 5' до 5' конца области цепи VH или Vα или Vγ штрих-кодированного полинуклеотида, содержащего последовательность антитела или TCR. Реакцию ПЦР можно также проводить для амплификации пула цепей VL или Vβ или Vγ, например, типов каппа и лямбда. Пул кДНК может быть подвергнут реакции ПЦР с использованием полинуклеотидов, которые гибридизуются с константной областью гена легкой цепи антител, и полинуклеотидов, которые гибридизуются с 5' концом области генов цепи VL или Vβ или Vγ антитела или TCR. Пул кДНК может быть подвергнут реакции ПЦР с использованием полинуклеотидов, которые гибридизуются с константной областью генов легкой цепи антител, и полинуклеотидов, которые гибридизуются с областью 5' до 5' конца области генов цепи VL или Vβ или Vγ штрих-кодированного полинуклеотида, содержащего последовательность антитела или TCR. Такие олигонуклеотиды или праймеры могут быть сконструированы на основе известной и общедоступной информации из базы данных последовательностей генов иммуноглобулина или TCR.
[0365] В некоторых вариантах осуществления последовательности VH и VL или Vα и Vβ или Vγ или Vδ последовательности можно легко получить из библиотеки последовательностей VH и VL или Vα и Vβ или Vγ и Vδ, полученной амплификацией ПЦР с использованием одного или нескольких праймеров, которые являются неспецифичными для генов тяжелой или легкой цепи и, в частности, для одной или обеих концевых областей полинуклеотидов VH и VL или Vα и Vβ или Vγ и Vδ. В некоторых вариантах осуществления последовательности VH и VL могут быть легко получены из библиотеки последовательностей VH и VL или Vα и Vβ или Vγ и Vδ, полученной с помощью ПЦР-амплификации с использованием праймеров, специфичных к области штрих-кода носителя, кодируемого полинуклеотидом. В некоторых вариантах осуществления последовательности VH и VL могут быть легко получены из библиотеки последовательностей VH и VL или Vα и Vβ или Vγ и Vδ, полученной с помощью ПЦР-амплификации с использованием праймеров, специфичных для семейства C-генов, или праймеров, специфичных для C-гена. В некоторых вариантах осуществления последовательности VH и VL могут быть легко получены из библиотеки последовательностей VH и VL или Vα и Vβ или Vγ и Vδ, полученной с помощью ПЦР-амплификации, с использованием набора праймеров, где первый праймер специфичен к области штрих-кода носителя, кодируемым полинуклеотидом, и второй праймер или множество вторых праймеров являются праймерами, специфичными для семейства C-генов, или праймерами, специфичными для C-гена. В некоторых вариантах осуществления последовательности VH и VL или Vα и Vβ или Vγ и Vδ могут быть легко получены из библиотеки последовательностей VH и VL или Vα и Vβ или Vγ и Vδ, полученной с помощью ПЦР- амплификации с использованием набора праймеров, где первый праймер специфичен к области штрих-кода носителя полинуклеотида, а второй праймер специфичен для универсальной последовательности.
[0366] В некоторых вариантах осуществления, после рекции обратной транскрипции полученные последовательности кДНК могут быть амплифицированы с помощью ПЦР с использованием одного или нескольких праймеров, специфичных для генов иммуноглобулина и, в частности, для одной или обеих концевых областей VH и VL или Vα и Vβ или Vγ и Vδ полинуклеотидов. В некоторых вариантах осуществления последовательности VH и VL могут быть получены из библиотеки последовательностей VH и VL или Vα и Vβ или Vγ и Vδ, полученной с помощью ПЦР-амплификации с использованием специфических для семейства V-генов праймеров или праймеров специфичных для V-генов (Nicholls et al. J. Immunol. Meth., 1993, 165: 81; WO 93/12227) или разработанных в соответствии со стандартными, известными в данной области техники способами, на основе доступной информации о последовательности. (Последовательности VH и VL или Vα и Vβ или Vγ и Vδ можно лигировать, как правило, с промежуточной последовательностью спейсера (например, кодирующей гибкий пептидный спейсер в рамке считывания), образуя кассету, кодирующую одноцепочечное антитело). Последовательности V-области можно удобно клонировать в виде кДНК или продуктов амплификации ПЦР для экспрессирующих иммуноглобулин клеток. Области VH и VL или Vα и Vβ или Vγ и Vδ секвенируют, необязательно, с помощью описанных здесь способов и, в частности, после проведения определенных стадий, как отмечено здесь (например, после ПЦР единичной клетки; после появления на поверхности клеток млекопитающих или других клеток, после FACS скрининга, и так далее). Секвенирование может использоваться, среди прочего, для проверки того, что степень разнообразия находится на приемлемом уровне. Секвенирование может включать высокопроизводительное секвенирование, глубокое секвенирование (в котором один и тот же ген секвенируется из множества отдельных образцов для выявления различий в последовательностях) или их комбинации.
[0367] В некоторых вариантах осуществления нет необходимости физически связывать естественные комбинации VH и VL или Vα и Vβ или Vγ и Vδ, используя способы, описанные в данном документе. В некоторых вариантах осуществления кДНК, штрих-кодированные полинуклеотиды или ПЦР-амплифицированные штрих-кодированные кДНК физически не связаны. В некоторых вариантах осуществления кДНК, штрих-кодированные полинуклеотиды или ПЦР-амплифицированные штрих-кодированные кДНК физически не связаны в одной и той же реакции или носителе.
[0368] В некоторых вариантах осуществления естественные комбинации VH и VL или Vα и Vβ или Vγ или Vδ физически связаны с использованием, в дополнение к праймерам кДНК, одного праймера или множества праймеров к 5' концу VH или гены Vα или Vγ и другого праймера или множества праймеров к 5' концу гена VL, или Vβ, или Vδ. Эти праймеры также содержат комплементарные хвосты дополнительной последовательности, для обеспечения самосборки генов VH и VL, или Vα и Vβ, или Vγ и Vδ. После ПЦР-амплификации и связывания, вероятность получения смешанных продуктов, иными словами, смешанных вариабельных областей, минимальна, поскольку реакции амплификации и связывания проводились в пределах каждой клетки. Риск смешивания может быть дополнительно уменьшен путем использования больших по размеру реагентов, таких как дигоксигенин-меченые нуклеотиды, чтобы дополнительно гарантировать, что пары V-области кДНК не покидают клеточный компартмент и перемешиваются, но при этом сохраняются в клетке для ПЦР-амплификации и связывания. Амплифицированные последовательности связываются при гибридизации комплементарных концевых последовательностей. После связывания последовательности могут быть выделены из клеток для использования на дальнейших стадиях способа, описанных здесь. Например, выделенная ДНК может быть амплифицирована с помощью ПЦР с использованием терминальных праймеров, если необходимо, и клонирована в векторы, представляющие собой плазмиды, фаги, космиды, фагемиды, вирусные вектора или их комбинации, как подробно описано ниже. Удобные сайты рестрикционных ферментов могут быть включены в гибридизированные последовательности для облегчения клонирования. Эти векторы также могут быть сохранены в виде библиотеки связанных вариабельных областей для последующего использования.
[0369] В некоторых вариантах осуществления, в которых желательно обеспечить дополнительные комбинации VH и VL или Vα и Vβ или Vγ и Vδ, выбирается система экспрессии, способствующая облегчить действие. Например, системы экспрессии бактериофагов допускают случайную рекомбинацию последовательностей тяжелых и легких цепей. Другие подходящие системы экспрессии также известны специалистам в данной области техники.
[0370] Следует отметить, что в случае последовательностей VH и VL или Vα и Vβ или Vγ и Vδ, полученных от человека, в некоторых вариантах осуществления может быть предпочтительным получение генетических химер этих последовательностей с полным человеческим Fc. Используемый здесь термин «получение химер/химеризованный» относится к иммуноглобулину или TCR, где вариабельные области тяжелой и легкой цепи или области Vα и Vβ, или Vγ и Vδ не имеют человеческого происхождения и где константные области тяжелой и легкой цепей или Vα и Vβ или цепи Vγ и Vδ происходят от человека. На это влияют амплификация и клонирование вариабельных доменов в человеческий Fc. Человеческий Fc может являться частью вектора или отдельной молекулой, а также можно использовать библиотеку Fc. В предпочтительном варианте осуществления химеризованные молекулы, выращенные в клетках млекопитающих, таких как клетки CHO, дважды подвергают FACS -скринингу для обогащения клеточной популяции клетками, экспрессирующими антитело, представляющееинтерес. Химеризованные антитела или TCR характеризуются либо секвенированием с последующей функциональной характеристикой, либо прямой функциональной характеристикой или кинетикой. Рост, скрининг и определение характеристики подробно описаны ниже.
[0371] Важно отметить, что описанные выше реакции ПЦР описаны для клонирования антител в форме IgG. Они являются предпочтительными, поскольку они обычно связаны с более зрелым иммунным ответом и, как правило, проявляют более высокую аффинность, чем антитела IgM, что делает их более желательными для определенных терапевтических и диагностических применений. Однако очевидно, что могут быть сконструированы полинуклеотиды, которые позволят клонировать одну или несколько других форм молекул иммуноглобулина, например, IgM, IgA, IgE и IgD, если это желательно или целесообразно.
[0372] После того, как антитело или TCR было идентифицировано и соответствующая популяция указанных клеток была выделена в подходящее время и необязательно обогащена, как описано выше, библиотеки экспрессии антитела или TCR могут не генерироваться немедленно, при условии, что генетический материал, содержащийся в клетках, может сохраняться в первоначальныом сотоянии, что позволяет сделать библиотеку позже. Таким образом, например, клетки, клеточный лизат или нуклеиновая кислота, например, полученная из них РНК или ДНК, могут быть сохранены до более поздней даты соответствующими методами, например, путем замораживания, и библиотеки экспрессии могут быть созданы позднее, когда это необходимо.
[0373] После того как создана библиотека векторов экспрессии, кодированные молекулы антитела могут быть затем экспрессированы в подходящей системе экспрессии и подвергнуты скринингу с использованием соответствующих методик, которые хорошо известны и документированы в данной области техники. Таким образом, описанный выше способ по изобретению может включать дополнительные стадии экспрессии библиотеки векторов экспрессии в соответствующей системе экспрессии и скрининга экспрессированной библиотеки на антитела с желаемыми свойствами, как более детально объяснено ниже.
[0374] Как указано в настоящем документе, полинуклеотиды, полученные способами по настоящему изобретению, включающие полинуклеотиды, кодирующие антитело или последовательности TCR, могут включать, но не ограничиваться таковыми, те, которые кодируют аминокислотную последовательность антитела или фрагмента TCR, сами по себе, некодирующие последовательности для всего антитела или TCR или части таковых, кодирующие последовательности антитела или TCR, фрагмента или части таковых, а также дополнительные последовательности, такие как кодирующая последовательности по меньшей мере одного сигнального лидера или слитого пептида, с или без вышеупомянутых дополнительных кодирующих последовательностей, такие как по меньшей мере один интрон, наряду с дополнительными некодирующими последовательностями, включая, но не ограничиваясь таковыми, некодирующие 5' и 3' последовательности, такие как транскрибированные нетранслируемые последовательности, играющие роль в транскрипции, процессинге мРНК, включая сигналы сплайсинга и полиаденилирования (например, связывание рибосом и стабильность мРНК); дополнительную кодирующая последовательность, которая кодирует дополнительные аминокислоты, такие, как те, которые обеспечивают дополнительные функциональные возможности. Таким образом, последовательность, кодирующая антитело, может быть слита с маркерной последовательностью, такой как последовательность, кодирующая пептид, который облегчает очистку слитого антитела или TCR (или очистку части или фрагмента антитела или TCR).
[0375] Первичные продукты ПЦР могут затем быть необязательно подвергнуты второй реакции ПЦР с новыми полинуклеотидными наборами, которые гибридизуются с 5' и 3'концами антитела или вариабельными доменами TCR VH, VL каппа и VL лямбда или Vα и v или Vγ и Vδ (в зависимости от того, была ли разработана первичная реакция ПЦР, с которой используются новые наборы полинуклеотидов, для амплификации участков генов тяжелой или легкой цепи антител или генов TCR, Vα или Vβ, или Vγ или Vδ TCR-генов). Эти полинуклеотиды преимущественно включают последовательности ДНК, специфичные для определенного набора рестрикционных ферментов (то есть сайтов рестрикционных ферментов) для последующего клонирования. Выбранные рестриктазы должны быть выбраны так, чтобы не разрезать человеческие антитела или сегменты V-гена TCR. Такие полинуклеотиды могут быть сконструированы на основе известных и общедоступных последовательностей генов иммуноглобулина или TCR и информации базы данных рестриктаз. Однако, предпочтительными сайтами рестрикционных энзимов являются Ncol, Hind III, M и Notl. Продуктами таких вторичных реакций ПЦР являются репертуары различных фрагментов/доменов V-тяжелых, V-легких каппа и V-легких лямбда-антител. Поэтому этот тип вторичной реакции ПЦР обычно проводят, когда формат библиотеки экспрессии, представляющий интерес, является форматом scFv или Fv, где присутствуют только домены VH и VL или Vα и V или Vγ и Vδ антитела или TCR.
[0376] Продукты ПЦР также могут быть подвергнуты реакции ПЦР с новыми наборами праймеров, которые гибридизуются с 5 'и 3' концами полинуклеотидов со штрих-кодом. Эти полинуклеотиды могут преимущественно включать последовательности ДНК, специфичные для определенного набора рестрикционных ферментов (то есть сайтов рестрикционных ферментов) для последующего клонирования. Выбранные рестриктазы должны быть выбраны так, чтобы не разрезать в пределах последоваетльности человеческого антитела или сегментов V-гена TCR. Такие полинуклеотиды могут быть сконструированы на основе известных и общедоступных последовательностей генов иммуноглобулина или TCR и информации базы данных рестриктаз. Однако предпочтительными сайтами рестрикционных ферментов являются Ncol, Hind III, Mlul и Notl. Продуктами таких вторичных реакций ПЦР являются репертуары различных фрагментов/доменов VH, VL каппа и VL лямбда-антител или фрагментов/доменов Vα и Vβ или Vγ и Vδ TCR.
[0377] Специалист в данной области поймет, что с этой системой также можно использовать фрагменты тяжелой или легкой цепи Fv или Fab, Vα или Vβ-цепи или Vγ- или Vδ-цепи, или одноцепочечные антитела или TCR. Тяжелая или легкая цепь или цепь Vα или Vβ или цепь Vγ или Vδ могут быть мутагенизированы с последующим добавлением комплементарной цепи в раствор. Затем двум цепям дают возможность объединиться и сформировать функциональный фрагмент антитела. Добавление случайных неспецифических последовательностей легкой или тяжелой цепи или цепи Vα или Vβ или Vγ или Vδ позволяет создать комбинаторную систему для создания библиотек разнообразных компонентов.
[0378] Библиотеки таких репертуаров клонированных фрагментов, содержащих области вариабельной тяжелой цепи или Vα-цепи или Vγ-цепи или их фрагменты, и/или вариабельные области легкой цепи, или Vβ-цепи, или Vδ-цепи генов антител или TCR или фрагменты таковых, полученные из В- или Т-лимфоцитов иммуно-стимулированных хозяев, как описано в данном описании, образуют дополнительные аспекты изобретения. Такие библиотеки, содержащие клонированные вариабельные области, могут необязательно вставляться в векторы экспрессии, тем самым формируя библиотеки экспрессии.
[0379] В некоторых вариантах осуществления реакции ПЦР могут быть организованы таким образом, чтобы сохранить всю или часть константных областей различных антител или цепей TCR, содержащихся в изолированной популяции иммунных клеток. Это желательно, когда формат библиотеки экспрессии представляет собой формат Fab, где компонент тяжелой или альфа- или гамма-цепи содержит домены VH или Vα, или Vγ и CH или Cα или домены Cγ, а компонент легкой цепи или цепи Vβ или цепи Vγ содержит VL или Vβ, или Vδ цепь и CL или β или δ домены. Опять же, библиотеки таких клонированных фрагментов, включающих всю или часть константных областей антитела или цепей TCR, являются дополнительными аспектами изобретения.
[0380] Эти нуклеиновые кислоты могут легко включать последовательности в дополнение к полинуклеотиду по настоящему изобретению. Например, сайт мультиклонирования, содержащий один или несколько сайтов рестрикции эндонуклеазы, может быть вставлен в нуклеиновую кислоту, чтобы помочь в выделении полинуклеотида. Кроме того, транслируемые последовательности могут быть вставлены для помощи в выделении транслированного полинуклеотида по настоящему изобретению. Например, последовательность гекса-гистидинового маркера может быть удобным средством для очистки белков по настоящему изобретению. Нуклеиновая кислота по настоящему изобретению, исключая кодирующую последовательность, необязательно является вектором, адаптером или линкером для клонирования и/или экспрессии полинуклеотида по настоящему изобретению.
[0381] Дополнительные последовательности могут быть добавлены к таким последовательностям клонирования и/или экспрессии для оптимизации их функции при клонировании и/или экспрессии, для помощи в выделении полинуклеотида или для улучшения введения полинуклеотида в клетку. Использование векторов клонирования, векторов экспрессии, адаптеров и линкеров хорошо известно в данной области техники. (См., например, Current Protocols in Molecular Biology (CPMB) (Fred M. Ausubel, et al. Ed., John Wiley and Sons, Inc.) или J. Sambrook et al., “Molecular Cloning: A Laboratory Manual,” 1989, 2nd Ed., Cold Spring Harbour Laboratory Press: New York, N.Y.).
[0382] Библиотеки, раскрытые в данном документе, могут использоваться в различных приложениях. Как описано в данном документе, библиотека содержит множество молекул. В некоторых вариантах библиотека содержит множество полинуклеотидов. В некоторых вариантах библиотека содержит множество праймеров. В некоторых вариантах библиотека содержит множество последовательных прочитываний одного или нескольких полинуклеотидов, ампликонов или наборов ампликонов. Библиотека может храниться и использоваться несколько раз для генерации образцов для анализа. Некоторые приложения включают, например, генотипирование полиморфизмов, изучение процессинга РНК и отбор клональных представителей для проведения секвенирования в соответствии со способами, представленными в настоящем документе. Могут быть созданы библиотеки, содержащие множество полинуклеотидов, таких как праймеры или библиотеки для секвенирования или амплификации, где множество полинуклеотидов включает по меньшей мере примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 15000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 30000, 40000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, 1000000, 50000000, 100000000 или более молекулярных штрих-кодов или штрих-кодов носителя. В некоторых вариантах библиотеки полинуклеотидов содержат множество по меньшей мере примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 30000, 40000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, 1000000, 50000000, 100000000 или более уникальных полинуклеотидов, где каждый уникальный полинуклеотид содержит один или несколько молекулярных штрих-кодов и штрих-кодов носителя.
III. Транскриптомный анализ
[0383] В некоторых вариантах осуществления предоставленные способы могут быть использованы для выяснения информации о транскриптоме клеток, которая может быть проведена вместе с захватом полинуклеотид-мишеньной последовательности, например антитела или TCR конкретной клетки. В некоторых вариантах осуществления клетка или множество клеток, идентифицированных с помощью полинуклеотид-мишеньной последовательности, могут характеризоваться состоянием их транскрипции, в том числе по отношению к конкретному состоянию, признаку или атрибуту клетки. В некоторых вариантах осуществления могут быть определены индивидуализированные профили транскриптома клеток и предоставлена информация, относящаяся к одному или нескольким признакам клетки. Примеры таких признаков включают, но не ограничиваются таковыми: состояние активации, состояние пролиферации, состояние истощения, переходное состояние, стадия клеточного цикла или другой параметр, связанный с функциональным или фенотипическим состоянием клетки.
[0384] В некоторых вариантах осуществления информация о состоянии транскрипции может использоваться для идентификации клеток, экспрессирующих конкретный ген-мишень, например ген антитела или TCR, демонстрирующий желаемый или просто интересный ответ. В некоторых аспектах предоставленные способы позволяют сопоставлять профиль транскриптома клетки с полинуклеотидом-мишенью, например антителом или TCR, амплифицированным или секвенированным из клетки. В конкретных вариантах осуществления информация транскриптома и последовательность полинуклеотида-мишени сопоставляются благодаря амплифицированному и секвенированному транскриптому и полинуклеотидам-мишеням, имеющим один и тот же штрих-код носителя, идентифицирующий профили транскриптома и полинуклеотидов-мишеней, полученных из одной и той же клетки.
[0385] В данной области техники известны различные способы обработки данных транскриптома. В некоторых аспектах данные, полученные с помощью методов, могут быть визуализированы на карте. Карта количества и местоположения мишеней образца может быть построена с использованием информации, сгенерированной с использованием описанных здесь способов. Карта может быть использована для определения физического местоположения цели. Карта может быть использована для определения местоположения нескольких целей.
[0386] В некоторых вариантах осуществления система содержит машиночитаемый носитель, который включает в себя код для обеспечения анализа данных для выборки данных последовательности, сгенерированных с помощью предоставленных способов. Примеры функций анализа данных, которые могут быть предоставлены программным обеспечением для анализа данных, включают в себя, но не ограничиваются таковыми: (i) алгоритмы декодирования/демультиплексирования штрих-кода носителя для образца, молекулярного штрих-кода и последовательности-мишени или данных транскриптома, полученным в ходе секвенирования полинуклеотидной библиотеки, (ii) алгоритмы для определения количества считываний на ген на клетку и количества уникальных транскрипционных молекул на ген на клетку на основе данных и создания сводных таблиц, (iii) статистический анализ данных последовательности, например для кластеризации клеток по данным экспрессии генов или для прогнозирования доверительных интервалов для определения количества молекул транскрипта на ген на клетку и т. д., (iv) алгоритмы для идентификации субпопуляций редких клеток, например, с использованием базового компонентного анализа, иерархическая кластеризация, кластеризация k-средних, самоорганизующиеся карты, нейронные сети и т. д., (v) возможности выравнивания последовательностей для выравнивания данных последовательностей генов с известными эталонными/референсными последовательностеми и обнаружение мутаций, полиморфных маркеров и вариантов сплайсинга и (vi) автоматической кластеризации молекулярных меток для компенсации ошибок амплификации или секвенирования.
[0387] В некоторых вариантах осуществления вычислительные программы могут использоваться для сборки транскриптома. Примерные вычислительные программы для сборок транскриптомов с короткими прочтениями включают те, которые описаны Robertson et al., Nat Methods. 2010;7:909-12; Grabherr et al., Nat Biotechnol. 2011;29:644-52; Schulz et al., Bioinformatics. 2012;28:1086-92, и Xie et al., Bioinformatics. 2014;30:1660-6. Сборка транскриптома может быть сложной из-за большого различия уровней экспрессии транскриптов, ошибок смещения секвенирования и альтернативного сплайсинга. Таким образом, объединение сбрных транскриптомов, основанных на длинах k-mer, или использование фиксированного значения k-mer, можно использовать для компенсации разной степени представленности транскриптов и улучшения сборки транскриптомов (см., например, Robertson et al., Nat Methods. 2010;7:909-12, Grabherr et al., Nat Biotechnol. 2011;29:644-52 и Surget-Groba Genome Res. 2010;20:1432-40).
[0388] В некоторых вариантах осуществления, коммерчески доступное программное обеспечение может использоваться для выполнения всего или части анализа данных. В некоторых вариантах осуществления программное обеспечение анализа данных может включать в себя параметры для вывода результатов секвенирования в желательных графических форматах, например, «heat maps», которые указывают количество копий одного или нескольких генов, встречающихся в каждой клетке из коллекции клеток. В некоторых вариантах осуществления программное обеспечение анализа данных может дополнительно содержать алгоритмы для извлечения биологического значения из результатов секвенирования, например, путем корреляции числа копий одного или нескольких генов, встречающихся в каждой клетке из выборки клеток, с типом клетки, с типом редкой клетки или клетки, полученной от субъекта, имеющего конкретное заболевание или состояние. В некоторых вариантах осуществления программное обеспечение анализа данных может дополнительно содержать алгоритмы для сравнения популяций клеток в разных биологических образцах.
[0389] В некоторых вариантах осуществления все функциональные возможности анализа данных могут быть упакованы в один программный пакет. В некоторых вариантах осуществления полный набор возможностей анализа данных может содержать набор пакетов программного обеспечения. В некоторых вариантах осуществления программное обеспечение анализа данных может представлять собой автономный пакет, который предоставляется пользователям независимо от системы измерительных приборов. В некоторых вариантах осуществления программное обеспечение может быть доступно онлайн (web-based) и может позволять пользователям обмениваться данными.
[0390] В некоторых примерах кластерный анализ может быть выполнен для идентификации одной или нескольких различных клеточных популяций. В некоторых примерах клеточные популяции кластеризованы на основе экспрессии одного или нескольких генов-мишеней. Присутствие, активация или подавление известных генов или транскриптов, отражающих состояние транскрипции в клетке, могут быть использованы для кластеризации клеток множества клеток.
[0391] В некоторых вариантах осуществления, представляющие интерес гены транскриптома идентифицируют с помщью штрих-кода носителя и сопоставляют или объединяют с выходом амплификации и секвенирования представляющей интерес полноразмерной молекулы-мишени, например антитела или TCR. Соответственно, при практическом применении предоставленных способов каждый штрих-код носителя соответствует или может быть аннотирован информацией о количестве генов (например, транскриптом) и молекуле-мишени (например, полноразмерное антитело или TCR).
[0392] В некоторых вариантах осуществления может быть создан профиль экспрессии, представленный последовательностями нуклеиновых кислот, присутствующими в транскриптоме. Профили экспрессии могут быть сгенерированы из подмножества клеток, таких как клетки, экспрессирующие один или несколько генов-мишеней и имеющих общий штрих-код носителя.
V. Диагностика
[0393] В некоторых вариантах осуществления способ может дополнительно включать диагностику, прогнозирование, мониторинг, лечение, улучшение и/или профилактику заболевания, расстройства, симптома и/или состояния у субъекта. В некоторых вариантах осуществления способ может дополнительно включать диагностику, прогнозирование, мониторинг, лечение, улучшение и/или профилактику у субъекта заболевания, расстройства, симптома и/или состояния на основании наличия, отсутствия или определенного уровня полинуклеотида-мишени и/или конкретное состояние транскрипции в клетке, такое как состояние клетки, описанное здесь выше. В некоторых вариантах осуществления способ может дополнительно включать диагностику, прогнозирование, мониторинг, лечение, улучшение и/или предотвращение у субъекта заболевания, расстройства, симптома и/или состояния на основании наличия, отсутствия или определенного уровня одной или нескольких полинуклеотидов-мишеней и/или состояние транскрипции одной или нескольких клеток.
[0394] В некоторых вариантах осуществления способ может дополнительно включать диагностику, прогнозирование, мониторинг, лечение, улучшение и/или профилактику у субъекта заболевания, расстройства, симптома и/или состояния на основании наличия, отсутствия, определенного уровня или последовательности, соответствующей одной или нескольким последовательностям, полученных с использованием способов, описанных в настоящем документе. Например, диагноз заболевания может быть сделан на основании наличия, отсутствия, определенного уровня или последовательности, соответствующей вариантной последовательности, полученной с использованием способов, описанных в данном документе. В некоторых вариантах осуществления способ может дополнительно включать диагностику, прогнозирование, мониторинг, лечение, улучшение и/или предотвращение у субъекта заболевания, расстройства, симптома и/или состояния на основе наличия, отсутствия, определенного уровня или последовательности, одного или нескольких прочтений последовательности, полученных с использованием способов, описанных в настоящем документе. В некоторых вариантах осуществления способ может дополнительно включать диагностику, прогнозирование, мониторинг, лечение, улучшение и/или предотвращение у субъекта заболевания, расстройства, симптома и/или состояния на основании наличия, отсутствия, определенного уровня или последовательности, соответствующей одной или нескольким из консенсусных последовательностей, полученных с использованием способов, описанных в настоящем документе. В некоторых вариантах осуществления способ может дополнительно включать диагностику, прогнозирование, мониторинг, лечение, улучшение и/или предотвращение у субъекта заболевания, расстройства, симптома и/или состояния на основе определения уровня (например, количества или концентрации) полинуклеотида-мишени в образце. Уровень полинуклеотида-мишени в образце может быть определен на основе одного или нескольких прочтений последовательностей, последовательностей, консенсусных последовательностей или любой их комбинации. Уровень каждого из множества полинуклеотидов-мишеней в образце может быть определен с использованием методов описанных в настоящем документе. Уровень каждого из множества полинуклеотидов-мишеней в образце может быть определен на основе числа прочтений последовательностей, консенсусных последовательностей или любой комбинации каждого полинуклеотида-мишени из множества. Например, уровень первого полинуклеотида-мишени и уровень второго полинуклеотида-мишени могут быть определены с использованием способов, описанных в настоящем документе.
[0395] В некоторых вариантах осуществления первый и второй полинуклеотиды-мишени из множества полинуклеотидов-мишеней являются идентичными. Например, первый полинуклеотид-мишень может содержать первую копию молекулы мРНК, а второй полинуклеотид-мишень может содержать вторую копию молекулы мРНК. В некоторых вариантах осуществления первый и второй полинуклеотиды-мишени различаются. Например, первый полинуклеотид-мишень может содержать первую молекулу мРНК, а второй полинуклеотид-мишень может содержать вторую молекулу мРНК, транскрибированную с гена, отличного от гена первой молекулы мРНК. Например, первый полинуклеотид-мишень может содержать первый аллель, а второй полинуклеотид-мишень может содержать второй аллель. Например, первый полинуклеотид-мишень может содержать последовательность дикого типа, а второй полинуклеотид-мишень может содержатьдругой вариант последовательности.
[0396] В некоторых вариантах осуществления способ может дополнительно включать диагностику или прогнозирование заболевания, расстройства, симптома и/или состояния у субъекта с вероятностью по меньшей мере 50%. Например, диагноз или прогноз заболевания, расстройства, симптома и/или состояния у субъекта может быть определен по меньшей мере с 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% 90%, 95%, 98%, 99% или 100% вероятность. В некоторых вариантах осуществления диагноз или прогноз заболевания, расстройства, симптома и/или состояния у субъекта может быть определен с вероятностью 50-100%. Например, диагноз или прогноз заболевания, расстройства, симптома и/или состояния у субъекта может быть определен с 60% -100%, 70% -100%, 80% -100%, 90% -100%, 50-90%, 50-80%, 50-70%, 50-60%, 60-90%, 60-80%, 60-70%, 70-90%, 70% -80% или 80% -90% вероятностью.
[0397] В некоторых вариантах осуществления наличие, отсутствие, уровень, сама последовательность полинуклеотида-мишени такого как биомаркер, или любая их комбинация у субъекта, могут быть определены с вероятностью по меньшей мере на 50%. Например, наличие, отсутствие, уровень, сама последовательность полинуклеотида-мишени или любая их комбинация у субъекта могут быть определены по меньшей мере с 50%, 55%, 60%, 65%, 70%, 75%, 80% 85%, 90%, 95%, 98%, 99% или 100% вероятностью. В некоторых вариантах осуществления наличие, отсутствие, уровень, сама последовательность полинуклеотида-мишени или любая их комбинация у субъекта могут быть определены с вероятностью 50-100%. Например, наличие, отсутствие, уровень, сама последовательность полинуклеотида-мишени или любая их комбинация у субъекта могут быть определены с 60% - 100%, 70% - 100%, 80% - 100%, 90% - 100%, 50% -90%, 50% -80%, 50% -70%, 50% -60%, 60% -90%, 60% -80%, 60% -70%, 70% -90% 70% -80% или 80% -90% вероятности.
В. Ферменты
[0398] Способы и наборы, раскрытые в данном документе, могут содержать один или несколько ферментов. Примеры ферментов включают, но не ограничиваются таковыми: лигазы, обратные транскриптазы, полимеразы и рестрикционные нуклеазы.
[0399] В некоторых вариантах осуществления присоединение адаптера к полинуклеотидам включает использование одной или нескольких лигаз. Примеры лигаз включают, но не ограничиваются таковыми: ДНК-лигазы, такие как ДНК-лигаза I, ДНК-лигаза III, ДНК-лигаза IV, Т4-ДНК-лигаза, и РНК-лигазы, такие как Т4 РНК-лигаза I и Т4 РНК-лигаза II.
[0400] Способы и наборы, раскрытые в данном документе, могут дополнительно включать использование одной или нескольких обратных транскриптаз. В некоторых вариантах осуществления обратная транскриптаза представляет собой обратную транскриптазу HIV-1, обратную транскриптазу M¬MLV, обратную транскриптазу AMV и обратную транскриптазу теломеразы. В некоторых вариантах осуществления обратная транскриптаза представляет собой обратную транскриптазу M-MLV.
[0401] В некоторых вариантах осуществления способы и наборы, раскрытые в данном документе, включают использование одной или нескольких протеаз.
[0402] В некоторых вариантах осуществления способы и наборы, раскрытые в данном документе, включают использование одной или нескольких полимераз. Примеры полимераз включают, но не ограничиваются таковыми: ДНК-полимеразы и РНК-полимеразы. В некоторых вариантах осуществления ДНК-полимераза представляет собой ДНК-полимеразу I, ДНК-полимеразу II, холофермент ДНК-полимеразы III и ДНК-полимеразу IV. Коммерчески доступные ДНК-полимеразы включают, но не ограничиваются таковыми: Bst 2.0 ДНК полимеразу, Bst 2.0 WarmStart™ ДНК полимеразу, Bst ДНК полимеразу, Sulfolobus ДНК полимеразу IV, Taq ДНК полимеразу, 9°NTMm ДНК полимеразу, Deep VentR™ (exo-) ДНК полимеразу, Deep VentR™ ДНК полимеразу, Hemo KlenTaq™, LongAmp® Taq ДНК полимеразу, OneTaq® ДНК полимеразу, Phusion® ДНК полимеразу, Q5TM High-Fidelity ДНК полимеразу, Therminator™ γ ДНК полимеразу, Therminator™ ДНК полимеразу, Therminator™ II ДНК полимеразу, Therminator™ III ДНК полимеразу, VentR® ДНК полимеразу, VentR® (exo-) ДНК полимеразу, Bsu ДНК полимеразу, phi29 ДНК полимеразу, T4 ДНК полимеразу, T7 ДНК полимеразу, Terminal Transferase, Titanium® Taq Polymerase, KAPA Taq ДНК полимеразу и KAPA Taq Hot Start ДНК полимеразу.
[0403] В некоторых вариантах осуществления полимераза представляет собой РНК-полимеразу, такую как РНК-полимераза I, РНК-полимераза II, РНК-полимераза III, полимераза E.coli (A), РНК-полимераза phi6 (RdRP), Poly(U) полимераза, SP6 РНК-полимераза и Т7-РНК-полимераза.
VI. Наборы и дополнительные реагенты
[010] В данной секции описаны изделия или наборы, которые содержат один или несколько реагентов для осуществления предоставленных способов. Наборы могут при желании включать один или несколько компонентов, таких как инструкции по применению, устройства и дополнительные реагенты (например, стерилизованная вода или физиологические растворы для разбавления и/или восстановления реагентов или компонентов), и компоненты, такие как пробирки, контейнеры и шприцы для использования способов. В некоторых вариантах осуществления наборы могут дополнительно содержать реагенты для сбора образцов или подготовки и обработки образцов. В некоторых вариантах осуществления наборы могут быть предоставлены в виде изделий, которые включают упаковочные материалы для упаковки реагентов и компонентов набора. Например, наборы могут содержать контейнеры, бутылки, пробирки, флаконы и любой упаковочный материал, подходящий для разделения или упорядочивания компонентов набора.
[0404] Способы и наборы, раскрытые в данном документе, могут включать использование одного или нескольких реагентов. Примеры реагентов включают, но не ограничиваются таковыми: реагенты для ПЦР, реагенты для лигирования, реагенты для реакции обратной транскрипции, ферментные реагенты, реагенты для гибридизации, реагенты для подготовки образцов, реагенты для аффинного захвата, твердые подложки, такие как гранулы, и реагенты для очистки нуклеиновых кислот и/или их выделения.
[0405] Твердая подложка может содержать практически любой нерастворимый или твердый материал, и часто выбирается твердая подложка, которая нерастворима в воде. Например, твердая подложка может содержать или состоять по существу из силикагеля, стекла (например, стекла с контролируемыми порами (CPG)), нейлона, сефадекса®, сефарозы®, целлюлозы, металлической поверхности (например, стали, золота, серебра, алюминия, кремния и меди), магнитного материала, пластикового материала (например, полиэтилена, полипропилена, полиамида, полиэфира, поливинилидендифторида (PVDF)) и тому подобное. Примеры гранул для использования в соответствии с вариантами осуществления могут включать аффинный фрагмент, который позволяет грануле взаимодействовать с молекулой нуклеиновой кислоты. Твердая фаза (например, гранула) может содержать компонент пары связывания (например, авидин, стрептавидин или его производное). Например, гранула может представлять собой гранулу, покрытую стрептавидином, а молекула нуклеиновой кислоты может включать биотиновую группу для иммобилизации на грануле. В некоторых случаях каждая полинуклеотидная молекула может включать две аффинные части, такие как биотин, для дальнейшей стабилизации полинуклеотида. Гранулы могут обладать дополнительными свойствами для иммобилизации нуклеиновых кислот или для использования в последующих процессах скрининга или отбора. Например, гранула может включать связующий фрагмент, флуоресцентную метку или флуоресцентный гаситель. В некоторых случаях гранула может быть намагниченной. В некоторых случаях твердой подложкой является гранула. Примеры гранул включают, но не ограничиваются таковыми: гранулы стрептавидина, агарозные гранулы, магнитные гранулы, микрогранулы Dynabeads®, MACS®, гранулы, конъюгированные с антителами (например, микрогранулы с антииммуноглобулиновым покрытием), гранулы, конъюгированные с белком A, гранулы, конъюгированные с белком G, белок A/G- конъюгированные гранулы, гранулы, конъюгированные с белком L, гранулы, конъюгированные с полинуклеотидом-dT, гранулы диоксида кремния, гранулы, похожие на диоксид кремния, антибиотиновые микрогранулы, антифторхромные микрогранулы и BcMag ™ с карбокси-концевыми магнитными гранулами. Гранулы или частицы могут быть набухающими (например, полимерные гранулы, такие как смола Wang) или не набухающими (например, CPG). В некоторых вариантах осуществления твердая фаза является по существу гидрофильной. В некоторых вариантах осуществления твердая фаза (например, гранула) является по существу гидрофобной. В некоторых вариантах осуществления твердая фаза содержит компонент пары связывания (например, авидин, стрептавидин или их производное) и является по существу гидрофобной или по существу гидрофильной. В некоторых вариантах осуществления твердая фаза содержит элемент пары связывания (например, авидин, стрептавидин или их производное) и обладает емкостью связывания, превышающей приблизительно 1350 пикомолей свободного агента захвата (например, свободного биотина) на мг твердой подложки. В некоторых вариантах осуществления емкость связывания твердой фазы, содержащей элемент пары связывания, превышает 800, 900, 1000, 1100, 1200, 1250, 1300, 1350, 1400, 1450, 1500, 1600, 1800, 2000 пикомолей свободного агента захвата на мг твердой подложки. Другими примерами гранул, подходящими для использования в изобретении, являются коллоиды золота или гранулы, такие как полистирольные или кварцевые гранулы. По существу, могут использоваться гранулы любого радиуса. Примеры гранул могут включать гранулы, имеющие радиус в диапазоне от 150 нм до 10 мкм. Другие размеры также могут быть применимы.
[0406] Способы и наборы, раскрытые в данном документе, могут включать использование одного или нескольких буферов. Примеры буферов включают, но не ограничиваются таковыми: промывочные буферы, буферы лигирования, буферы гибридизации, буферы амплификации и буферы обратной транскрипции. В некоторых вариантах осуществления буфер гибридизации представляет собой коммерчески доступный буфер, такой как раствор TMAC Hyb, раствор гибридизации SSPE и буфер гибридизации ECONOTM. Раскрытые здесь буферы могут содержать один или несколько детергентов.
[0407] Способы и наборы, раскрытые в данном документе, могут включать использование одного или нескольких носителей. Носители могут усиливать или улучшать эффективность одной или нескольких описанных здесь реакций (например, реакции лигирования, обратной транскрипции, амплификации, гибридизации). Носители могут уменьшать или предотвращать неспецифическую потерю молекул или любых их продуктов (например, полинуклеотидов и/или ампликонов). Например, носитель может уменьшить неспецифическую потерю полинуклеотида вследствие абсорбции на поверхности. Носитель может снижать афиинность полинуклеотида к поверхности или субстрату (например, контейнер, пробирка Эппендорфа, наконечник пипетки). Альтернативно, носитель может увеличивать аффинность полинуклеотида к поверхности или субстрату (например, грануле, сетке, стеклу, предметному стеклу или микрочипу). Носители могут защищать полинуклеотид от деградации. Например, носители могут защищать молекулу РНК от рибонуклеаз. Альтернативно, носители могут защищать молекулу ДНК от ДНКазы. Примеры носителей включают, но не ограничиваются таковыми: полинуклеотиды, такие как ДНК и/или РНК, или полипептиды. Примеры носителей ДНК включают плазмиды, векторы, полиаденилированную ДНК и полинуклеотиды ДНК. Примеры носителей РНК включают полиаденилированную РНК, РНК фага, РНК фага MS2, РНК E.coli, РНК дрожжей, тРНК дрожжей, РНК млекопитающих, тРНК млекопитающих, короткие полиаденилированные синтетические рибонуклеотиды и полинуклеотиды РНК. Носитель РНК может представлять собой полиаденилированную РНК. Альтернативно, носитель РНК может представлять собой неполиаденилированную РНК. В некоторых вариантах осуществления носитель получен из бактерии, дрожжей или вируса. Например, носитель может быть полинуклеотидом или полипептидом, полученным из бактерии, дрожжей или вируса. Например, носитель представляет собой белок Bacillus subtilis. В другом примере носитель представляет собой полинуклеотид Escherichia coli. Альтернативно, носитель представляет собой полинуклеотид или пептид млекопитающего (например, человека, мыши, козы, крысы, коровы, овцы, свиньи, собаки или кролика), птицы, амфибии или рептилии.
[0408] Способы и наборы, раскрытые в данном документе, могут включать использование одного или нескольких контрольных агентов. Контрольные агенты могут включать контрольные полинуклеотиды, неактивные ферменты и/или их неспецифические конкуренты. Альтернативно, контрольные агенты включают агенты, обеспечивающие усиленную/яркую гибридизацию, зонды, обеспечающие яркость, матрицы нуклеиновых кислот, калибровочные (spike-in) контроли, контроли амплификации ПЦР. Контроли амплификации ПЦР могут быть положительными контролями. В других случаях контроли амплификации ПЦР представляют собой отрицательные контроли. Контроли матричной нуклеиновой кислоты могут иметь известные концентрации. Контрольные агенты могут содержать одну или несколько меток.
[0409] Калибровочные (spike-in) контроли могут представлять собой матрицы, добавленные в реакцию или образец. Например, в реакцию амплификации может быть добавлен калибровочная матрица. Калибровочная матрица может быть добавлена в реакцию амплификации в любое время после первого цикла амплификации. В некоторых вариантах осуществления калибровочную матрицу добавляют в реакцию амплификации после цикла № 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45 или 50. Калибровочная матрица может быть добавлена в реакцию амплификации в любое время до последнего цикла амплификации. Калибровочная матрица может содержать один или несколько нуклеотидов или пар оснований нуклеиновых кислот. Калибровочная матрица может содержать ДНК, РНК или любую их комбинацию. Калибровочная матрица может содержать одну или несколько меток.
[0410] В настоящем документе раскрыты молекулы, материалы, композиции и компоненты, которые могут использоваться в способах, могут использоваться в сочетании со способами, могут использоваться для подготовки способов или являются продуктами способов и композиций, раскрытых в данном документе. Подразумевается, что если при раскрытии комбинации, подмножества, взаимодействия, группы и т. д. этих материалов, конкретные ссылки на различные индивидуальные и коллективные комбинации и пермутации этих молекул и соединений не могут быть явным образом раскрыты, то каждая из них специально рассматривается и описывается в настоящем документе. Например, если раскрывается и обсуждается нуклеотид или нуклеиновая кислота и обсуждается ряд модификаций, которые могут быть внесены в ряд молекул, включая нуклеотид или нуклеиновую кислоту, то каждая комбинация и пермутация нуклеотида или нуклеиновой кислоты и их возможные модификации являются специально продуманы и предусмотрены, если не указано иное. Эта концепция применяется ко всем аспектам данной заявки, включая, но не ограничиваясь такими, как стадии способов изготовления и использования раскрытых способов и композиций. Таким образом, если существует множество дополнительных стадий, которые могут быть выполнены, то подразумевается, что каждая из этих дополнительных стадий может быть выполнена в сочетании с любым конкретным вариантом осуществления или комбинацией вариантов осуществления раскрытых способов, и что каждая такая комбинация специально предусмотрена и должна считаться раскрытой.
[0411] Хотя некоторые варианты осуществления, описанные в данном документе, были показаны и описаны в данном документе, такие варианты осуществления представлены только в качестве примера. Многочисленные вариации, изменения и замены теперь будут быть сделаны специалистами в данной области техники без отступления от раскрытия, предоставленного здесь. Следует понимать, что различные альтернативы вариантам осуществления, описанным в данном документе, могут использоваться при осуществлении способов, описанных в данном документе.
[0412] Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то значение/смысл, которое обычно понимается специалистами в данной области техники, к которой относится это раскрытие. Следующие ссылки содержащие варианты осуществления способов и композиций, которые могут быть применимы в данном случае: The Merck Manual of Diagnosis and Therapy, 18th Edition, published by Merck Research Laboratories, 2006 (ISBN 0-91 19102); Benjamin Lewin, Genes IX, published by Jones & Bartlett Publishing, 2007 (ISBN-13: 9780763740634); Kendrew et al. (eds.), The Encyclopedia of Mol. Biology, published by Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); and Robert A. Meyers (ed.), Mol. Biology and Biotechnology: a Comprehensive Desk Reference, published by VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8).
[0413] Стандартные процедуры настоящего раскрытия описаны, например, в Maniatis et al, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., USA (1982); Sambrook et al., Molecular Cloning: A Laboratory Manual (2 ed.), Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., USA (1989); Davis et al, Basic Methods in Molecular Biology, Elsevier Science Publishing, Inc., New York, USA (1986); or Methods in Enzymology: Guide to Molecular Cloning Techniques Vol. 152, S. L. Berger and A. R. Kimmerl (eds.), Academic Press Inc., San Diego, USA (1987)). Current Protocols in Molecular Biology (CPMB) (Fred M. Ausubel, et al. ed., John Wiley and Sons, Inc.), Current Protocols in Protein Science (CPPS) (John E. Coligan, et. al., ed., John Wiley and Sons, Inc.), Current Protocols in Immunology (CPI) (John E. Coligan, et. al., ed. John Wiley and Sons, Inc.), Current Protocols in Cell Biology (CPCB) (Juan S. Bonifacino et. al. ed., John Wiley and Sons, Inc.), Culture of Animal Cells: A Manual of Basic Technique by R. Ian Freshney, Publisher: Wiley-Liss; 5th edition (2005), and Animal Cell Culture Methods (Methods in Cell Biology, Vol. 57, Jennie P. Mather and David Barnes editors, Academic Press, 1st edition, 1998).
VII. Определения
[0414] Используемая здесь терминология предназначена только для описания конкретных случаев и не является ими ограниченой. Если не указано иное, все термины, обозначения и другие технические и научные термины или терминология, используемые в данном документе, имеют то же значение, которое обычно понимается специалистами в области техники, к которой относится данная заявка. В некоторых случаях термины с общепринятыми значениями определены здесь для ясности и/или для удобства ссылки, и включение таких определений в данное описание не обязательно должно истолковываться как представляющее существенную разницу по сравнению с тем значением, которое обычно понимается специалистами в данной области техники.
[0415] Как используется в данном документе, в той мере, в которой термины «включая», «включает», «имеющий», «имеет», «с» или их варианты используются в подробном описании и/или формуле изобретения, эти термины предназначены для обобщения способом, аналогичным термину «содержащий».
[0416] Термин «примерно» или «приблизительно» может означать «в пределах допустимого диапазона ошибок» для конкретного значения, определенного специалистом в данной области техники, и частично зависит от того, как измерено или определено значение, то есть ограничения системы измерения. Например, «примерно» может означать в пределах 1 или более 1 стандартного отклонения в соответствии с практикой в данной области техники. Альтернативно, «примерно» может означать диапазон до 20%, до 10%, до 5% или до 1% от заданного значения. Альтернативно, особенно в отношении биологических систем или процессов, этот термин может означать в пределах порядка, в 5 раз, и более предпочтительно в 2 раза от значения. Если конкретные значения описаны в заявке и формуле изобретения, и если не указано иное, то следует истолковать термин «примерно», как означающий «в пределах допустимого диапазона ошибок для конкретного значения».
[0417] Термины «полипептид» и «белок» используются взаимозаменяемо для обозначения полимера из аминокислотных остатков, не ограниченного минимальной длиной. Полипептиды, включая предоставленные антитела и цепи антител и другие пептиды, например линкеры и связывающие пептиды, могут содержать аминокислотные остатки, включая природные и/или неприродные аминокислотные остатки. Термины также включают модификации полипептида после экспрессии, например, гликозилирование, сиалилирование, ацетилирование, фосфорилирование и тому подобное. В некоторых аспектах полипептиды могут содержать модификации в отношении нативной или природной последовательности, если белок продолжает проявлять желаемую активность. Эти модификации могут быть преднамеренными, как через сайт-направленный мут агенез или можгут быть случайным, например, в результате мутаций хозяев, которые продуцируют белки, или ошибок вследствие амплификации ПЦР.
[0418] Полимеразная цепная реакция (ПЦР) означает реакцию амплификации полинуклеотидных последовательностей in vitro путем одновременного удлинения праймера комплементарных цепей двухцепочечного полинуклеотида. Реакции ПЦР дают копии матричного полинуклеотида, фланкированные сайтами связывания праймеров. Результатом амплифиации с двумя праймерами является экспоненциальное увеличение числа копий полинуклеотидной матрицы обеих цепей с каждым циклом, потому что с каждым циклом обе цепи реплицируются. Полинуклеотидный дуплекс имеет концы, соответствующие концам используемых праймеров. ПЦР может включать одно или несколько повторений денатурирования матричного полинуклеотида, отжига праймеров с сайтом связывания праймеров и удлинения праймеров ДНК- или РНК-полимеразой в присутствии нуклеотидов. Конкретные температуры, длительность каждого цикла и скорость перехода между циклами зависят от многих факторов, хорошо известных специалистам в данной области техники. (McPherson et al., IRL Press, Oxford (1991 и 1995)). Например, в обычной ПЦР с использованием ДНК-полимеразы Taq двухцепочечный матричный полинуклеотид может быть денатурирован при температуре > 90°C, праймеры могут быть отожжены при температуре в диапазоне 50-75°C, и праймеры могут быть удлинены при температуре в диапазоне 72-78 ° С. В некоторых вариантах осуществления, ПЦР включает ПЦР с обратной транскрипцией (ОТ-ПЦР), ПЦР в реальном времени, вложенную ПЦР, количественную ПЦР, мультиплексную ПЦР или тому подобное. В некоторых вариантах осуществления ПЦР не включает ОТ-ПЦР. (Патенты США №№ 5,168,038, 5,210,015, 6,174,670, 6,569,627 и 5,925,517; Mackay et al., Nucleic Acids Research, 30: 1292-1305 (2002)). ОТ-ПЦР включает реакцию ПЦР, которой предшествует реакция обратной транскрипции, и кДНК, полученная в результате, амплифицируется. Вложенная ПЦР включает двухстадийную ПЦР, в которой ампликон первой реакции ПЦР с использованием первого набора праймеров становится матрицей для второй реакции ПЦР с использованием второго набора праймеров, по меньшей мере один из которых связывается с внутренним местоположением ампликона первой реакции ПЦР. Мультиплексная ПЦР включает реакцию ПЦР, в которой множество полинуклеотидных последовательностей одновременно подвергают ПЦР в одной и той же реакционной смеси. Реакционные объемы ПЦР могут составлять от 0,2 пл до 1000 мкл. Количественная ПЦР включает реакцию ПЦР, предназначенную для измерения абсолютного или относительного количества, представлености или концентрации одной или нескольких последовательностей в образце. Количественные измерения могут включать сравнение одной или нескольких контрольных последовательностей или стандартов с интересующей полинуклеотидной последовательностью. (Freeman et al., Biotechniques, 26: 112-126 (1999); Becker-Andre и др., Nucleic Acids Research, 17: 9437-9447 (1989); Zimmerman et al., Biotechniques, 21: 268-279 (1996); Diviacco et al., Gene, 122: 3013-3020 (1992); Becker-Andre et al., Nucleic Acids Research, 17: 9437-9446 (1989)).
[0419] Термины «нуклеотид», «нуклеозид», «нуклеотидный остаток» и «нуклеозидный остаток» в контексте настоящего описания могут означать дезоксирибонуклеотидный или рибонуклеотидный остаток или другой аналог нуклеозидного аналога, который может служить в качестве компонента праймера, подходящего для использования в реакции амплификации (например, реакция ПЦР). Такие нуклеозиды и их производные могут быть использованы в качестве строительных блоков праймеров, описанных в настоящем документе, если не указано иное. Ничто в этой заявке не должно исключать использование нуклеозидных производных или оснований, которые были химически модифицированы для повышения их стабильности или полезности в реакции амплификации, при условии, что химическая модификация не препятствует их распознаванию полимеразой в качестве дезоксигуанина, дезоксицитозина, дезокситимидина или дезоксиаденина в зависимости от ситуации. В некоторых вариантах осуществления нуклеотидные аналоги могут стабилизировать формирование гибрида. В некоторых вариантах осуществления нуклеотидные аналоги могут дестабилизировать формирование гибрида. В некоторых вариантах осуществления нуклеотидные аналоги могут усиливать специфичность гибридизации. В некоторых вариантах осуществления нуклеотидные аналоги могут снижать специфичность гибридизации.
[0420] «Нуклеиновая кислота», или грамматические эквиваленты термина, относится либо к одному нуклеотиду, либо по меньшей мере к двум нуклеотидам, ковалентно связанным друг с другом.
[0421] «Полинуклеотид» или грамматические эквиваленты термина относятся по меньшей мере к двум нуклеотидам, ковалентно связанным друг с другом. «Полинуклеотид» включает молекулу, содержащую два или более нуклеотида. Полинуклеотид содержит полимерную форму нуклеотидов любой длины, либо рибонуклеотидов, дезоксирибонуклеотидов или пептидных нуклеиновых кислот (ПНК), которые содержат пуриновые и пиримидиновые основания, либо другие природные, неприродные, химически или биохимически модифицированные основания или производные нуклеотидных оснований. Основная цепь полинуклеотида может содержать сахара и фосфатные группы или модифицированные или замещенные сахарные или фосфатные группы. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и аналоги нуклеотидов. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. «Полинуклеотид» может включать другие молекулы, такие как другие гибридизированные полинуклеотиды. Полинуклеотиды включают последовательности дезоксирибонуклеиновой кислоты (ДНК), рибонуклеиновой кислоты (РНК) или их обеих. Неограничивающие примеры полинуклеотидов включают в себя ген, фрагмент гена, экзон, интрон, межгенную ДНК (включая, без ограничения, гетерохроматическую ДНК), мессенджер РНК (мРНК), транспортную РНК, рибосомную РНК, рибозимы, малую интерферирующую РНК (миРНК), кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенные ДНК последовательности, выделенные РНК последовательности, зонды нуклеиновых кислот и праймеры. Полинуклеотиды могут быть выделены из природных источников, рекомбинантными или искусственно синтезированными.
[0422] Полинуклеотиды могут включать нестандартные нуклеотиды, такие как аналоги нуклеотидов или модифицированные нуклеотиды. В некоторых вариантах осуществления нестандартные нуклеотиды могут стабилизировать образование гибридов. В некоторых вариантах осуществления нестандартные нуклеотиды могут дестабилизировать образование гибридов. В некоторых вариантах осуществления нестандартные нуклеотиды могут усиливать специфичность гибридизации. В некоторых вариантах осуществления нестандартные нуклеотиды могут снижать специфичность гибридизации. Примеры нестандартных нуклеотидных модификаций включают 2′O-Me, 2′O-аллил, 2′O-пропаргил, 2′O-алкил, 2′фторо, 2′арабино, 2′ксило, 2′фторарабино, фосфоротиоат, фосфородитиоат, фосфороамидаты, 2'-амино, 5-алкилзамещенный пиримидин, 3'-дезоксигуанозин, 5-галогензамещенный пиримидин, алкилзамещенный пурин, галогензамещенный пурин, бициклические нуклеотиды, 2'MOE, молекулы PNA, LNA-молекулы, LNA-подобные молекулы, диаминопурин, S2T, 5-фторурацил, 5-бромурацил, 5-хлорурацил, 5-йодоурацил, гипоксантин, ксантин, 4-ацетилцитозин, 5-(карбоксигидроксилметил) урацил, 5-карбоксиметиламиномиметил-2-тиоуридин, 5-карбоксиметиламинометилурацил, дигидроурацил, бета-D-галактозилкеозин, инозин, N6-изопентениладенин, 1-метилгуанин, 1-метилинозин, 2,2-диметилгуанин, 2-метиладенин, 2-метилгуанин, 3-метилцитозин, 5-метилцитозин, N6-аденин, 7-метилгуанин, 5-метиламинометилурацил, 5-метоксиаминометил-2-тиоурацил, бета-D-маннозилквеуозин, 5'5'-метоксикарбоксиметилурацил, 5-метоксиурацил, 2-метилтио-D46-изопентениладенин, урацил-5-оксиуксусную кислоту (v), вивутоксозин, псевдоурацил, кеозин, 2-тиоцитозин, 5-метил-2-тиоурацил, 4-тиоурацил, 5-метилурацил, метиловый эфир урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусную кислоту (v), 5-метил-2-тиоурацил, 3-(3-амино-3-N-2)-карбоксипропил) урацил, (acp3)w, 2,6-диаминопурин и их производные.
[0423] «Субъект», «индивидуум», «хозяин» или «пациент» относится к живому организму, такому как млекопитающее. Примеры субъектов и хозяев включают, но не ограничиваются ими, лошадей, коров, верблюдов, овец, свиней, коз, собак, кошек, кроликов, морских свинок, крыс, мышей (например, мышей, эеспрессирующих гены человека или несущих клетки или ткани человека), песчанок, приматов, не являющихся людьми (например, макаки), человека и человекообразных далее, и немлекопитающих, включая, например, позвоночных, не являющихся млекопитающими, таких как птицы (например, цыплята или утки), рыбы (например, акулы) или лягушки (например, Xenopus), и беспозвоночных, а также их трансгенные виды. В определенных аспектах субъект относится к одному организму (например, человеку). В определенных аспектах представлена группа индивидуумов, составляющих небольшую когорту, имеющую либо общий иммунный фактор для исследования и/или заболевание, и/или когорту индивидуумов без заболевания (например, отрицательный/нормальный контроль). Субъект, от которого получены образцы, может иметь заболевание и/или расстройство (например, одну или более аллергий, инфекций, рак или аутоиммунное расстройство и т.п.) и может сравниваться с субъектом отрицательного контроля, не пораженным болезнью.
[0424] «Набор» относится к системе для доставки материалов или реагентов для осуществления способа, раскрытого в данном документе. В некоторых вариантах осуществления наборы включают в себя системы, которые позволяют хранить, транспортировать или доставлять реакционные реагенты (например, зонды, ферменты и т. д. в соответствующих контейнерах) и/или вспомогательные материалы (например, буферы, письменные инструкции для проведения анализа). и т.д.) из одного места в другое. Например, наборы включают одну или несколько оболочек (например, коробок), содержащих соответствующие реакционные реагенты и/или вспомогательные материалы. Такое содержимое может быть доставлено предполагаемому адресату все вместе или по отдельности. Например, первый контейнер может содержать фермент для использования в анализе, тогда как второй контейнер содержит множество праймеров.
[0425] «Полипептид» в некоторых аспектах относится к молекуле, содержащей по меньшей мере две аминокислоты. В некоторых вариантах осуществления полипептид состоит из одного пептида. В некоторых вариантах осуществления полипептид содержит два или более пептидов. Например, полипептид может содержать по меньшей мере примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 пептидов или аминокислот. Примеры полипептидов включают, но не ограничиваются таковыми: аминокислотные цепи, протеины, пептиды, гормоны, полипептидные сахариды, липиды, гликолипиды, фосфолипиды, антитела, ферменты, киназы, рецепторы, факторы транскрипции и лиганды.
[0426] «Образец» относится в некоторых аспектах к биологическому, экологическому, медицинскому образцу, полученному от субъекта или пациента или образцу, содержащему полинуклеотид, такой как полинуклеотид-мишень.
[0427] «Фармацевтически приемлемый» относится к молекулярным веществам и композициям, которые являются физиологически переносимыми и, как правило, при введении человеку не вызывают аллергическую или подобную ей неблагоприятную реакцию, такую как расстройство желудка, головокружение и тому подобное.
[0428] «Профилактика» относится к профилактике, предотвращению появления симптомов, предотвращению прогрессирования заболевания или расстройства, связанного с избыточным уровнем белка или зависящего от активности белка.
[0429] «Ингибирование» и «лечение» используются взаимозаменяемо и относятся, например, к стабилизации/остановке прогрессирования симптомов, увеличению продолжительности жизни, частичному или полному ослаблению симптомов и частичному или полному устранению состояния, заболевания или расстройства, связанного с избыточным уровнем белка или коррелирующее с активностью белка. Например, лечение рака включает, но не ограничивается этим, стаз, частичное или полное устранение ракового роста или опухоли. Лечение или частичное устранение включает, например, кратное уменьшение роста или размера и/или объема опухоли, например, примерно в 2 раза, примерно в 3 раза, примерно в 4 раза, примерно в 5 раз, примерно в 10 раз, примерно в 20 раз. кратное, примерно 50-кратное или любое кратное уменьшение. Точно так же лечение или частичное устранение может включать процентное уменьшение роста или размера опухоли и/или объема приблизительно на 1%, 2%, 3%, 4%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или любое процентное уменьшение в этих пределах.
[0430] Все публикации, включая патентные документы, научные статьи и базы данных, упомянутые в настоящей заявке, включены в качестве ссылки во всей их полноте для всех целей в той же степени, как если бы каждая отдельная публикация была отдельно включена посредством ссылки. Если приведенное здесь определение противоречит или иным образом не согласуется с определением, изложенным в патентах, заявках, опубликованных заявках и других публикациях, которые включены сюда посредством ссылки, определение, изложенное здесь, имеет преимущество над определением, включенное ссылкой.
[0431] Несколько аспектов описаны ниже со ссылкой на примерные приложения для иллюстративных целей. Следует понимать, что многочисленные конкретные детали, взаимосвязи и способы изложены для обеспечения полного понимания особенностей, описанных в данном документе. Однако специалист в соответствующей области техники легко поймет, что признаки, описанные в данном документе, могут быть реализованы на практике с опущением одной или более конкретных деталей или с помощью других способов. Описанные здесь признаки не ограничиваются проиллюстрированным порядком действий или событий, поскольку некоторые действия могут происходить в разныом порядке и/или одновременно с другими действиями или событиями. Кроме того, не все проиллюстрированные действия или события требуются для реализации методологии в соответствии с признаками, описанными в данном документе.
[0432] Заголовок раздела, используемый здесь, предназначен только для организационных целей и не должен рассматриваться в качестве ограничения сути описываемого предмета.
VIII. Примерные варианты осуществления
[0433] Среди предоставленных вариантов осуществления находятся:
1. Способ получения полинуклеотидной библиотеки, включающий добавление второго адаптера к каждому из множества штрих-кодированных одноцепочечных полинуклеотидов расположенниых на или вблизи терминального конца, противоположного первому адаптеру, присоединенному к каждому из штрих-кодированных одноцепочечных полинуклеотидов, при этом множество штрихкодированных одноцепочечных полинуклеотидов, содержат:
(i) один или несколько одноцепочечных полинуклеотидов-мишеней, содержащих ампликон одного или нескольких полинуклеотидов-мишеней или комплементарных таковым, присутствующие в клетке из популяции клеток; а также
(ii) коллекцию одноцепочечных полинуклеотидов, каждый из которых содержит ампликон полинуклеотида или комплементарный таковому, в клетке; при этом
каждый из множества штрихкодированных одноцепочечных полинуклеотидов содержит штрих-код носителя, являющийся одинаковым для всех полинуклеотидов пунктов (i) и (ii), происходящих из одной и той же клетки, принадлежащей популяции клеток.
2. Способ по варианту осуществления 1, в котором множество одноцепочечных полинуклеотидов со штрих-кодом содержит полинуклеотиды пунктов (i) и (ii) множества клеток в популяции клеток.
3. Способ по варианту осуществления 1 или варианту осуществления 2, в котором каждый из множества штрих-кодированных одноцепочечных полинуклеотидов дополнительно содержит молекулярный штрих-код, который является уникальным для каждого одноцепочечного полинуклеотида.
4. Способ по любому из вариантов осуществления 1-3, в котором коллекция одноцепочечных полинуклеотидов из каждой клетки, принадлежащей популяции клеток в совокупности включает комплементарные цепи ДНК (кДНК) транскриптома или частичного транскриптома.
5. Способ по любому из вариантов осуществления 1-4, в котором транскриптом или частичный транскриптом, в совокупности, включает по меньшей мере 60%, 70%, 75%, 80%, 85%, 90% 95%, 96%, 97%, 98%, 99% или 100% транскриптов, присутствующих в геном клетки.
6. Способ по любому из вариантов осуществления 1-5, в котором каждый из одноцепочечных полинуклеотидов со штрих-кодом имеет размер более чем или приблизительно от 50 пар оснований (н.п.), более чем 100 пар оснований (н.п.) или более чем 200 пар оснований (н.п.).
7. Способ по любому из вариантов осуществления 1-6, в котором каждый из одноцепочечных полинуклеотидов со штрих-кодом имеет размер, начинающийся от или приблизительно от 50 пар оснований (п.н.) до 1500 н.п., от 50 н.п. до 1250 н.п., от 50 н.п. до 1000 н.п. От 50 до 750 н.п., от 50 до 500 н.п., от 100 до 1500 н.п., от 100 до 1250 н.п., от 100 до 1000 н.п., от 100 до 750 н.п., от 100 до 500 н.п., от 200 н.п. до 1500 н.п. до 1250 н.п., от 200 н.п. до 1000 н.п., от 200 н.п. до 750 н.п. или от 250 н.п. до 500 н.п.
8. Способ по любому из вариантов осуществления 1-7, в котором добавление второго адаптера осуществляют в гомогенной смеси, содержащей множество одноцепочечных полинуклеотидов со штрих-кодом.
9. Способ по любому из вариантов осуществления 1-8, в котором первый адаптер содержит штрих-код носителя.
10. Способ получения полинуклеотидной библиотеки, включающий:
(а) лизирование клетки в каждом из множества носителей, где каждый из указанных носителей содержит клетку из образца, содержащего популяцию клеток;
(b) продуцирование в каждом носителе множества комплементарных полинуклеотидов, причем указанное продуцирование указанного множества комплементарных полинуклеотидов включает (i) продуцирование одного или нескольких полинуклеотидов-мишеней, которые комплементарны одному или нескольким полинуклеотидам-мишеням, присутствующим в клетке с использованием одного или нескольких мишень-специфичных праймеров; и (ii) получение коллекции полинуклеотидов, каждый из которых комплементарен полинуклеотиду в клетке, с использованием случайных олигопраймеров.
11. Способ по варианту осуществления 10, в котором каждый из указанных носителей дополнительно содержит множество олигонуклеотидов, несущих молекулярный штрих-код, единичный или пул олигонуклеотидов со штрих-кодом и, необязательно, первый адаптер, причем способ дополнительно содержит:
(c) присоединение к множеству, необязательно, к каждому из множества комплементарных полинуклеотидов одного из множества молекулярных олигонуклеотидов со штрих-кодом, тем самым генерируя множество молекулярных штрих-кодированных полинуклеотидов, каждый из которых содержит молекулярный штрих-код, где, необязательно, молекулярный штрих-код каждого из молекулярных штрих-кодированных полинуклеотидов отличается от молекулярных штрих-кодов, содержащихся в других молекулярных штрих-кодированных полинуклеотидах из множества, и/или представляет собой уникальный молекулярный штрих-код;
(d) присоединение одного из единичного или пула олигонуклеотидов со штрих-кодом носителя, и первого адаптера, или его амплифицированного продукта, к множеству, или, необязательно, к каждому из полинуклеотидов со штрих-кодом, в результате чего образуется множество полинуклеотидов с двойным штрих-кодом, где каждый из полинуклеотидов с двойным штрих-кодом одной и той же носителя содержит один и тот же штрих-код носителя.
12. Способ воплощения изобретения по п.11, дополнительно включающий (e) получение одноцепочечного ампликона из множества, необязательно каждого из множества, полинуклеотидов с двумя штрих-кодами.
13. Способ воплощения изобретения по 11, дополнительно включающий (f) добавление второго адаптера к каждому из одноцепочечных ампликонов, при этом первый адаптер и второй адаптер расположены на или примерно противоположных концах каждого из одноцепочечных полинуклеотидов с двойным трих-кодом.
14. Способ получения полинуклеотидной библиотеки, включающий:
(а) лизирование клетки в каждом из множества носителей, где каждый из указанных носителей содержит клетку из образца, содержащего популяцию клеток, множество олигонуклеотидов с молекулярным штрих-кодом и единчный или пул олигонуклеотидов со штрих-кодом носителя и, необязательно, первый адаптер;
(b) продуцирование в каждом носителе множества комплементарных полинуклеотидов, причем указанное продуцирование указанного множества включает (i) продуцирование одного или нескольких полинуклеотидов-мишеней, комплементарных одному или нескольким полинуклеотидам-мишеням, присутствующим в клетке; и (ii) получение коллекции полинуклеотидов, каждый из которых индивидуально комплементарен полинуклеотиду в клетке;
(c) присоединение к каждому комплементарному полинуклеотиду одного из множества олигонуклеотидов с молекулярным штрих-кодом, тем самым генерируя множество полинуклеотидов со штрих-кодом, каждый из которых содержит уникальный молекулярный штрих-код;
(d) присоединение одного из единичного или пула олигонуклеотидов со штрих-кодом носителя или их амплифицированных продуктов к каждому из штрих-кодированных полинуклеотидов, в результате чего образуется множество полинуклеотидов с двойным штрих-кодом, где каждый из полинуклеотидов с двойным штрих-кодом, находящихся в одном и том же носителе, содержит тот же самый штрих-код носителя;
(е) получение одноцепочечного ампликона каждого из множества полинуклеотидов с двумя штрих-кодами; а также
(f) добавление второго адаптера к каждому из одноцепочечных ампликонов, что означает присоединение второго адаптера к одноцепочечному полинуклеотиду с двойным штрих-кодом, причем первый адаптер и второй расположены на или примерно противоположных концов каждого из одноцепочечных полинуклеотидов с двойным штрих-кодом.
15. Способ по любому из вариантов осуществления 11-14, в котором первый адаптер содержит олигонуклеотид со штрих-кодом носителя.
16. Способ по любому из вариантов осуществления 10-15, в котором совокупность полинуклеотидов каждой клетки из популяции клеток в совокупности включает последовательности, комплементарные транскриптам транскриптома или частичного транскриптома клетки.
17. Способ по любому из вариантов осуществления 16, где транскриптом или частичный транскриптом включает по меньшей мере 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% транскриптов, присутствующих в геноме клетки.
18. Способ по любому из вариантов осуществления 1-17, где один или несколько полинуклеотидов-мишеней и/или полинуклеотидов в клетке представляет собой ДНК.
19. Способ по любому из вариантов осуществления 1-18, где один или несколько полинуклеотидов-мишеней и/или полинуклеотидов в клетке представляет собой РНК.
20. Способ осуществления по п.19, где РНК представляет собой мРНК.
21. Способ по любому из вариантов осуществления 10-20, где каждый из единичного или нескольких комплементарных полинуклеотидов (b) представляет собой кДНК.
22. Способ по любому из вариантов осуществления 1-21, где каждый из или один или несколько штрихкодированных одноцепочечных полинуклеотидов представляет собой цепь кДНК.
23. Способ по любому из вариантов осуществления 1-22, в котором первый адаптер и/или второй адаптер содержат по меньшей мере один универсальный участок праймирования.
24. Способ по любому из вариантов осуществления 1-23, в котором:
первый адаптер и второй адаптер различны; и/или
первый адаптер содержит первый универсальный сайт праймирования, а второй адаптер содержит второй универсальный сайт праймирования, и где, необязательно, первый универсальный сайт праймирования и второй универсальный сайт праймирования различны.
25. Способ по варианту осуществления 24, в котором первый универсальный сайт праймирования и/или второй универсальный сайт праймирования представляет собой или содержит сайт праймирования P7 (C7) или его непрерывную часть, или сайт праймирования P5 (C5), или его непрерывную часть, и где, необязательно, непрерывная часть достаточна для отжига с комплементарной последовательностью.
26. Способ по варианту осуществления 24 или по варианту 25, в котором первый универсальный сайт праймирования представляет собой или содержит сайт праймирования P7 (C7) или его непрерывную часть, а второй универсальный сайт праймирования представляет собой или содержит сайт праймирования P5 (C5) или его непрерывую часть.
27. Способ по варианту осуществления 25 или по варианту 26, в котором сайт праймирования P7 (C7) содержит последовательность AGATCGGAAGAGCACACGTCTGAACTCCA (SEQ ID NO: 77) или представляет собой ее непрерывную часть.
28. Способ по варианту осуществления 25 или по варианту осуществления 26, в котором сайт праймирования P5 содержит последовательность AGATCGGAAGAGCGTCGTGTAGGGAAAGAGTGTAGATCTCGGTGGTCGCCGTATCATT (SEQ ID NO: 78) или представляет собой его непрерывную частью.
29. Способ по любому из вариантов осуществления 25-28, где непрерывная часть содержит по меньшей мере или по меньшей мере примерно 15, 20, 25 или 30 нуклеотидов в длину.
30. Способ по любому из вариантов осуществления 25, 26, 28 или 29, в котором сайт праймирования P5 представляет собой непрерывную часть, указанную в SEQ ID NO: 25 (AGATCGGAAGAGCGTCGTGT).
31. Способ по любому из вариантов осуществления 1-9 и 13-30, в котором добавление второго адаптера включает гибридизацию шарнирного (splint) олигонуклеотида с каждым из одноцепочечных полинуклеотидов со штрих-кодом в присутствии олигонуклеотида, содержащего второй универсальный сайт праймирования, где шарнирный (splint) олигонуклеотид включает (i) последовательность, комплементарную второму универсальному сайту праймированяия, и (ii) вырожденную последовательность выступа, способную случайным образом отжигать 3'-конец одноцепочечного полинуклеотида со штрих-кодом.
32. Способ по варианту осуществления 31, в котором перед гибридизацией шарнирный (splint) олигонуклеотид и олигонуклеотид, содержащий второй универсальный сайт праймирования, отжигают с образованием дуплекса адаптера с шарнирным (splint) олигонуклеотидом.
33. Способ по варианту осуществления 31 или 32, где вырожденная последовательность выступа включает последовательность (N)3-12, где N представляет собой любой нуклеотид.
34. Способ по любому из вариантов осуществления 31-33, где вырожденная последовательность выступа включает последовательность NNNNNN, где N представляет собой любой нуклеотид (SEQ ID NO: 24).
35. Способ по любому из вариантов осуществления 31-34, где шарнирный (splint) олигонуклеотид включает последовательность ACACGACGCTCTTCCGATCTNNNNNN, где N представляет собой любую аминокислоту (SEQ ID NO: 26).
36. Способ по любому из вариантов осуществления 31-35, где олигонуклеотид, содержащий второй универсальный сайт праймирования, содержит последовательность AGATCGGAAGAGCGTCGTGT (SEQ ID NO: 25).
37. Способ по любому из вариантов осуществления 1-9 и 11-36, в котором указанный олигонуклеотид со штрих-кодом носителя содержит по меньшей мере или по меньшей мере приблизительно 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40 или 50 нуклеотидов.
38. Способ по любому из вариантов осуществления 1-9 и 11-37, в котором указанный олигонуклеотид со штрих-кодом носителя содержит от или приблизительно от 10 до 30 нуклеотидов.
39. Способ по любому из вариантов осуществления 1-38, где указанный олигонуклеотид со штрих-кодом носителя содержит вырожденную последовательность.
40. Способ по любому из вариантов осуществления 1-9 и 11-39, где указанный олигонуклеотид со штрих-кодом носителя содержит последовательность (N)14-17, где N представляет собой любой нуклеотид, и где, необязательно, по меньшей мере один или два N в последовательности представляют собой W, где W представляет собой аденин или тимин.
41. Способ по любому из вариантов осуществления 1-9 и 11-40, где указанный олигонуклеотид со штрих-кодом носителя содержит последовательность NNNNWNNNNWNNNN (SEQ ID NO: 80), WNNNNWNNNNWNNNN (SEQ ID NO: 81), NWNNNWNNNNWNNNN: SEQ ID или NNWNNNNWNNNNWNNNN (SEQ ID NO: 83), и где N представляет собой любой нуклеотид, а W представляет собой аденин или тимин.
42. Способ по любому из вариантов осуществления 11-41, в котором каждый носитель содержит пул первых адаптеров, причем каждый олигонуклеотид со штрих-кодом носителя из пула первых адаптеров содержит по меньшей мере одно смещенное основание или добавленное основание по сравнению с по меньшей мере одним из других олигонуклеотидов со штрих-кодом носителя в пуле.
43. Способ по варианту осуществления 42, в котором олигонуклеотиды со штрих-кодом носителя из пула первых адаптеров содержит последовательности NNNNWNNNNWNNNN (SEQ ID NO: 80), WNNNNWNNNNWNNNN (SEQ ID NO: 81), NWNNNWNNNNWNNNN (SEQ ID NO: 82) и NNWNNNNWNNNNWNNNN (SEQ ID NO: 83), где N представляет собой любой нуклеотид, а W представляет собой аденин или тимин.
44. Способ по любому из вариантов осуществления 11-43, где на стадии (d) способ дополнительно включает амплификацию единичного или пула олигонуклеотидов со штрих-кодом носителя, пула первых адаптеров, включающих единичный или пул олигонуклеотидов со штрих-кодом носителя, и где амплификацию проводят до или одновременно с присоединением олигонуклеотида со штрих-кодом носителя.
45. Способ по любому из вариантов осуществления 11-44, где присоединение олигонуклеотида со штрих-кодом носителя включает гибридизацию области олигонуклеотида со штрих-кодом носителя с областью каждого из комплементарных полинуклеотидов или с областью каждого из полинуклеотидов с молекулярным штрих-кодом, содержащей молекулярный штрих-код.
46. Способ по варианту осуществления 45, в котором область содержит 3'-маркированный/меченый полинуклеотид, комплементарный 5'-концевой области молекулярного штрих-кода полинуклеотидов с молекулярным штрих-кодом.
47. Способ по любому из вариантов осуществления 10-46, в котором на стадии (b):
один или несколько полинуклеотидов-мишеней получают путем обратной транскрипции полинуклеотида(ов)-мишени(ей) в присутствии обратной транскриптазы и одного или нескольких мишень-специфичных праймеров, комплементарных целевой последовательности полинуклеотида(ов)-мишени(ей); и/или
коллекция полинуклеотидов производится путем обратной транскрипции полинуклеотидов в клетке в присутствии обратной транскриптазы и одного или нескольких транскриптомных праймеров, комплементарных полинуклеотиду в клетке.
48. Способ по любому из вариантов осуществления 1-47, где один или несколько полинуклеотидов-мишеней включают полинуклеотид иммунной молекулы или ее цепи.
49. Способ по любому из вариантов осуществления 1-48, где один или несколько полинуклеотидов-мишеней включают по меньшей мере два полинуклеотида-мишени, каждый из которых содержит полинуклеотид цепи молекулы иммунной системы.
50. Способ по любому из вариантов осуществления 1-49, где один или несколько полинуклеотидов-мишеней включают полинуклеотид TCR или его цепь.
51. Способ по любому из вариантов осуществления 1-50, где один или несколько полинуклеотидов-мишеней содержат полинуклеотид альфа-рецептора Т-клеток (TCRα), а второй является полинуклеотидом рецептора Т-клеток (TCRβ).
52. Способ по любому из вариантов осуществления 1-50, где один или несколько полинуклеотидов-мишеней включают полинуклеотид гамма-рецептора Т-клеток (TCRγ), а второй является полинуклеотидом дельты рецептора Т-клеток (TCRdelta).
53. Способ по любому из вариантов осуществления 1-49, где один или несколько полинуклеотидов-мишеней включают полинуклеотид антитела или его цепи.
54. Способ по любому из вариантов осуществления 1-49 и 53, где один или несколько полинуклеотидов-мишеней включают один полинуклеотид тяжелой цепи иммуноглобулина (IgH), а второй полинуклеотид является полинуклеотидом легкой цепи иммуноглобулина (IgL).
55. Способ по любому из вариантов осуществления 47-54, где один или несколько специфичных для мишени праймеров и/или один или несколько транскриптомных праймеров содержат poly(Т) последовательность.
56. Способ по любому из вариантов осуществления 47-54, где один или несколько транскриптомных праймеров включают смесь случайных гексамерных олигонуклеотидных праймеров.
57. Способ по любому из вариантов осуществления 47-56, в котором один или несколько специфичных для мишени праймеров содержат один или несколько праймеров, комплементарных последовательности(ям) целевой(ых) последовательности(ей) полинуклеотида-мишени.
58. Способ варианта осуществления 57, в котором один или несколько мишень-специфичных праймеров содержат по меньшей мере первый праймер и второй праймер.
59. Способ варианта осуществления 57 или варианта осуществления 58, в котором один или несколько мишень-специфичных праймеров включают праймеры для последовательности(ей)-мишени множества иммунных молекул или их цепей.
60. Способ варианта воплощения 59, где иммунная молекула представляет собой рецептор Т-клетки или антитело.
61. Способ по любому из вариантов осуществления 58-60, в котором по меньшей мере первый праймер является комплементарным последовательности-мишени полинуклеотида первой цепи иммунной молекулы, а второй праймер является комплементарным последовательности-мишени полинуклеотида второй цепи иммунной молекулы.
62. Способ по любому из вариантов осуществления 58-61, где первый и второй праймеры являются комплементарными последовательности-мишени различных цепей TCR полинуклеотидов TCR.
63. Способ по любому из вариантов осуществления 58-62, в котором:
первый праймер является комплементарным последовательности-мишени полинуклеотидной последовательности TCRalpha, а второй праймер является комплементарным последовательности-мишени полинуклеотидной последовательности TCRbeta; или
первый праймер является комплементарным последовательности-мишени полинуклеотидной последовательности TCRgamma, а второй праймер является комплементарным последовательности-мишени полинуклеотидной последовательности TCRdelta.
64. Способ варианта осуществления 62 или варианта осуществления 63, в котором последовательность-мишень полинуклеотидов цепи TCR представляет собой последовательность константной области.
65. Способ по любому из вариантов осуществления 58-64, в котором:
первый праймер является комплементарным последовательности-мишени константной области полинуклеотидной последовательности TCR-альфа, а второй праймер является комплементарным последовательности-мишени константной области полинуклеотидной последовательности TCR-бета; или
первый праймер является комплементарным последовательности-мишени константной области полинуклеотидной последовательности TCRgamma, а второй праймер является комплементарным последовательности-мишени константной области полинуклеотидной последовательности TCRdelta.
66. Способ по любому из вариантов осуществления 58-61, где по меньшей мере первый и второй праймеры являются комплементарными последовательности-мишени полинуклеотидных последовательностей различных цепей антитела.
67. Способ по любому из вариантов осуществления 58-61 и 66, в котором первый праймер является комплементарным последовательности-мишени, присутствующей в полинуклеотидной последовательности тяжелой цепи иммуноглобулина (IgH), а второй праймер является комплементарным последовательности-мишени, присутствующей в полинуклеотидной последовательности легкой цепи иммуноглобулина (IgL).
68. Способ варианта осуществления 66 или варианта осуществления 67, где последовательность-мишень полинуклеотидных последовательностей цепей антитела представляет собой последовательность константной области.
69. Способ по любому из вариантов осуществления 58-61 и 66-68, где первый праймер является комплементарным последовательности-мишени полинуклеотидной последовательности константной области (СН) тяжелой цепи, а второй праймер является комплементарным последовательности-мишени константной области легкой цепи (CL).
70. Способ варианта осуществления 68 или варианта осуществления 69, в котором:
последовательность-мишень полинуклеотида СН происходит из IgM, IgD, IgA, IgE или IgG или комбинации таковых; и/или
последовательность-мишень полинуклеотидной последовательности CL происходит из Igkappa, Iglambda или комбинаций таковых.
71. Способ по любому из вариантов осуществления 1-70, где один или несколько полинуклеотидов-мишеней представляют собой полноразмерную кодирующую последовательность.
72. Способ по любому из вариантов осуществления 10-71, где один или несколько полинуклеотидов-мишеней и коллекция полинуклеотидов сгенерирована в носителе в одном и том же реакционном объеме.
73. Способ по любому из вариантов осуществления 10-72, в котором на стадии (b) получение множества комплементарных полинуклеотидов включает использование нематричной терминальной трансферазы, и где три или более нематричных нуклеотида, рибонуклеотида или аналогов таковых добавляются к 3'-концу каждого продуцируемого комплементарного полинуклеотида.
74. Способ варианта осуществления 73, в котором нематричная терминальная трансфераза представляет собой обратную транскриптазу или полимеразу.
75. Способ варианта осуществления 73 или варианта осуществления 74, в котором нематричная терминальная трансфераза представляет собой обратную транскриптазу, и где обратная транскриптаза выбрана из списка: обратная транскриптаза Superscript II, обратная транскриптаза Maxima, обратная транскриптаза Protoscript II, обратная транскриптаза вируса мышиного лейкоза Малони. транскриптаза (MMLV-RT), обратная транскриптаза HighScriber, обратная транскриптаза вируса птичьего миелобластоза (AMV), любая обратная транскриптаза, обладающая терминальной активностью дезоксинуклеотидилтрансферазы, и их комбинации.
76. Способ по любому из вариантов осуществления 11-75, в котором на стадии (с) присоединение включает гибридизацию области одного из олигонуклеотидов, несущего молекулярный штрих-код с тремя или более нематричными нуклеотидами каждого из комплементарных полинуклеотидов.
77. Способ по любому из вариантов осуществления 73-75, где множество олигонуклеотидов с молекулярным штрих-кодом предоставлено в виде множества олигонуклеотидов с переключением матрицы, каждый из которых содержит 3'-часть, комплементарную трем или нескольким нематричным нуклеотидам.
78. Способ по варианту осуществления 77, в котором олигонуклеотид переключения матрицы также содержит 5'-концевую область, комплементарную 3'-меченому олигонуклеотиду первого адаптера, содержащего штрих-код носителя.
79. Способ по любому из вариантов осуществления 11-78, в котором:
обратная транскриптаза обладает активностью переключения матриц;
по меньшей мере некоторые цепи из множества полученных комплементарных полинуклеотидов содержат 3'-выступ, содержащий три или более нематричных нуклеотидов;
множество олигонуклеотидов с молекулярным штрих-кодом представлено в виде множества олигонуклеотидов с переключением матрицы, каждый из которых содержит (1) 5'-концевую область, комплементарную 3'области маркирующего олигонуклеотида первого адаптера, содержащего штрих-код носителя, (2) молекулярный штрих-код и (3) 3'-часть, комплементарную трем или более нематричным нуклеотидам 3'-выступа; и где
олигонуклеотид переключения матрицы служит матрицей для обратной транскриптазы, таким образом, что молекулярный штрих-код включается в каждый комплементарный полинуклеотид.
80. Способ по любому из вариантов осуществления 77-79, в котором 3'-область, комплементарная трем или более нематричным нуклеотидам, содержит нуклеотид, рибонуклеотид или аналог таковых.
81. Способ по любому из вариантов осуществления 73-80, в котором три или более нематричных нуклеотидов содержат три или более С нуклеотидов, а 3'-часть, комплементарная трем или более нематричным нуклеотидам, содержит один или несколько G нуклеотидов или рибонуклеотидов или аналогов таковых.
82. Способ по любому из вариантов осуществления 73-77, где олигонуклеотид переключения матрицы дополнительно содержит 3'-модифицированный нуклеотид, блокирующий удлинение посредством обратной транскриптазы или ДНК-полимеразы.
83. Способ по варианту осуществления 82, в котором модификация представляет собой дезокси, фосфатную, амино или алкильную модификацию 3'-нуклеотида.
84. Способ по любому из вариантов осуществления 11-83, в котором стадия (d) дополнительно включает удлинение каждого из множества комплементарных полинуклеотидов, несущих молекулярный штрих-код, после присоединения.
85. Способ по любому из вариантов осуществления 1-84, в котором носитель представляет собой содержимое лунки, эмульсию или каплю.
86. Способ по любому из вариантов осуществления 12-85, включающий в себя, перед стадией (е), объединение содержимого двух или более из множества носителей, и тем самым создание гомогенной смеси, содержащей два или более из множества одноцепочечных полинуклеотидов с двойным штрих-кодом.
87. Способ по варианту осуществления 86, в котором объединение содержимого множества носителей включает разрушение двух или более из множества носителей и объединение одноцепочечных полинуклеотидов с двойным штрих-кодом из двух или более выбранных носителей.
88. Способ по варианту осуществления 86 или по варианту 87, включающий перед стадией (е) отбор или очистку одноцепочечных полинуклеотидов с двойным штрих-кодом, имеющих размер, более чем или приблизительно более чем 50 пар оснований, более чем 100 пар оснований или более чем 200 пар оснований.
89. Способ по любому из вариантов осуществления 86-88, включающий перед стадией (е) отбор или очистку одноцепочечных полинуклеотидов с двойным штрих-кодом, имеющих размер от или приблизительно от 50 пар оснований (п.н.) до 1500 н.п., от 50 н.п. до 1250 н.п., от 50 до 1000 н.п., от 50 до 750 н.п., от 50 до 500 н.п., от 100 до 1500 н.п., от 100 до 1250 н.п., от 100 до 1000 н.п., от 100 до 750 н.п., от 100 н.п. до 500 н.п. от 200 н.п. до 1500 н.п., от 200 н.п. до 1250 н.п., от 200 н.п. до 1000 н.п., от 200 н.п. до 750 н.п. или от 250 н.п. до 500 н.п.
90. Способ по любому из вариантов осуществления 1-89, в котором одноцепочечные полинуклеотиды с двойным штрих-кодом содержат в порядке (от 5 'до 3'): первый адаптер, штрих-код носителя, молекулярный штрих-код и второй адаптер.
91. Способ по любому из вариантов осуществления 1-90, где первый адаптер расположен в или примерно 5 'области одноцепочечного полинуклеотида с двойным штрих-кодом.
92. Способ по любому из вариантов осуществления 1-91, где второй адаптер расположен в или примерно 3'-области одноцепочечного полинуклеотида с двойным штрих-кодом.
93. Способ по любому из вариантов осуществления 10-92, в котором одну или несколько стадий (а)-(f) проводят в растворе и в присутствии/отсутствии твердой подложки, необязательно гранулы.
94. Способ по любому из вариантов осуществления 11-93, в котором по меньшей мере стадии (с) и (d) проводят в растворе и в присутствии/отсутствии твердой подложки, необязательно гранулы.
95. Способ по любому из вариантов осуществления 10-94, в котором каждую из стадий (а)-(е) проводят в растворе и в присутствии/отсутствии твердой подложки, необязательно гранулы.
96. Способ по любому из вариантов осуществления 1-95, где популяция клеток включает по меньшей мере или примерно по меньшей мере 1×103, 5×103, 1×104, 5×104, 1×105, 5×105, 1×106, или 5×106 клеток.
97. Способ по любому из вариантов осуществления 1-96, где популяция клеток получена из биологического образца от субъекта.
98. Способ по варианту осуществления 97, в котором биологический образец представляет собой или содержит образец цельной крови, образец лейкоцитарной оболочки, образец мононуклеарных клеток периферической крови (PBMC), образец нефракционированных Т-клеток, образец лимфоцитов, образец лейкоцитов, продукт афереза или продукт лейкафереза.
99. Способ по любому из вариантов осуществления 1-98, где популяция клеток включает иммунные клетки.
100. Способ по любому из вариантов осуществления 1-99, где иммунные клетки включают лимфоциты или антиген-презентирующие клетки.
101. Способ по любому из вариантов осуществления 1-100, где иммунная клетка представляет собой лимфоцит или его подтип, В-клетку или подтип, Т-клетку или ее подтип, или комбинацию таковых.
102. Способ по варианту осуществления 101, где иммунная клетка представляет собой Т-клетку, представляющую собой CD4+ и/или CD8+ Т-клетку.
103. Способ по любому из вариантов осуществления 1-102, где популяция клеток обогащена или включает Т-клетки центральной памяти, Т-клетки эффекторной памяти, наивные Т-клетки, Т-клетки стволовой центральной памяти, Т-клетки эффектора и регуляторные Т-клетки.
104. Способ по любому из вариантов осуществления 1-101, где популяция клеток обогащена по В-клеткам памяти, наивным В-клеткам или В-клеткам плазмобласта.
105. Способ по любому из вариантов осуществления 97-104, где субъектом является человек.
106. Способ по любому из вариантов осуществления 97-105, где у субъекта наблюдается рак, инфекция или аутоиммунное состояние.
107. Способ по варианту осуществления 106, где инфекция представляет собой вирусную, бактериальную или грибковую инфекцию.
108. Способ по любому из вариантов осуществления 1-107, дополнительно включающий амплификацию множества одноцепочечных полинуклеотидов со штрих-кодом, и, таким образом генерирующий множество полинуклеотидных матриц.
109. Способ по любому из вариантов осуществления 1-108, в котором амплификацию проводят в присутствии первого набора праймеров, содержащего первый праймер, комплементарный первой последовательности адаптера, и второй праймер, комплементарный второй последовательности адаптера.
110. Способ по варианту осуществления 109, в котором первый и/или второй праймер представляет собой универсальный праймер.
111. Способ по варианту осуществления 110, в котором первый и/или второй праймер является комплементарным сайту праймирования P7 (C7) или его непрерывной части или сайту праймера P5 (C5) или его непрерывной части.
112. Способ по варианту осуществления 110 или по варианту осуществления 111, в котором первый праймер является комплементарным сайту праймирования P7(C7) или его непрерывной части, а второй праймер является комплементарным сайту праймирования P5 (C5) или его непрерывной части.
113. Способ по варианту осуществления 111 или варианту осуществления 112, в котором:
праймер, комплементарный праймирующему сайту Р7(С7) или его непрерывной части, имеет или содержит последовательность CAAGCAGAAGACGGCATACGAGAT (SEQ ID NO: 39); и/или
праймер, комплементарный праймирующему сайту Р5 (С5) или его непрерывной части, содержит последовательность ACACGACGCTCTTCCGATCT (SEQ ID NO: 27).
114. Способ по любому из вариантов осуществления 109-113, в котором первый и/или второй праймер дополнительно содержит адаптер для секвенирования.
115. Способ по варианту осуществления 114, в котором:
праймер, который комплементарный первичному сайту P7(C7) или его непрерывной части, дополнительно содержит последовательность CAAGCAGAAGACGGCATACGAGAT [NNNNNN] GTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT (SEQ ID NO: 28); и/или
праймер, комплементарный праймирующему сайту Р5 (С5) или его непрерывной части, содержит последовательность AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCC (SEQ ID NO: 76).
116. Способ по варианту осуществления 115, дополнительно включающий очистку каждого из множества штрих-кодированных полинуклеотидов.
117. Полинуклеотидная библиотека, содержащая множество штрих-кодированных полинуклеотидов, полученных способом по любому из вариантов осуществления 1-116.
118. Полинуклеотидная библиотека, содержащая множество штрих-кодированных полинуклеотидов, где множество штрих-кодированных полинуклеотидов содержит (i) один или несколько полинуклеотидов-мишеней, содержащих ампликон одного или нескольких полинуклеотидов-мишеней, присутствующих в клетке, принадлежащей популяции клеток; и (ii) коллекцию полинуклеотидов, каждый из которых содержит ампликон полинуклеотида в клетке, причем каждый штрих-кодированный полинуклеотид содержит:
первый адаптер, содержащий первый универсальный праймирующий сайт, комплементарный первому универсальному праймеру;
штрих-код носителя, который является одинаковым для всех штрих-кодированных полинуклеотидов пунктов (i) и (ii), происходящих из одной и той же клетки, принадлежащей популяции клеток; а также
вторую последовательность адаптера, содержащую второй универсальный праймирующий сайт, комплементарный второму универсальному праймеру.
119. Полинуклеотидная библиотека по варианту осуществления 118, в которой каждая из множества штрих-кодированных полинуклеотидных матриц содержит молекулярный штрих-код, являющийся уникальным для каждой полинуклеотидной матрицы.
120. Полинуклеотидная библиотека по варианту осуществления 118 или по варианту осуществления 119, в которой совокупность штрих-кодированных полинуклеотидных матриц каждой клетки из популяции клеток в совокупности включает комплементарные цепи ДНК (кДНК) транскриптома или частичного транскриптома.
121. Полинуклеотидная библиотека по любому из вариантов осуществления 118-120, где транскриптом или частичный транскриптом вместе содержат по меньшей мере 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% транскриптов, присутствующих в геноме клетки.
122. Полинуклеотидная библиотека по любому из вариантов осуществления 118-121, где каждая из штрих-кодированных полинуклеотидных матриц имеет размер, который больше или приблизительно больше чем 50 пар оснований, чем 100 пар оснований или чем 200 пар оснований.
123. Полинуклеотидная библиотека по любому из вариантов осуществления 118-122, где каждый из штрих-кодированных одноцепочечных полинуклеотидов имеет размер от или приблизительно от 50 пар оснований (н.п.) до 1500 н.п., от 50 н.п. до 1250 н.п., от 50 н.п. до 1000 н.п., от 50 н.п. до 750 н.п., от 50 н.п. до 500 н.п., от 100 н.п. до 1500 н.п., от 100 н.п. до 1250 н.п., от 100 н.п. до 1000 н.п., от 100 н.п. до 750 н.п., от 100 н.п. до 500 н.п., от 200 н.п. до 1500 н.п., от 200 н.п. до 1250 н.п., от 200 н.п. до 1000 н.п., от 200 н.п. до 750 н.п. или от 250 н.п. до 500 н.п. пар.
124. Полинуклеотидная библиотека по любому из вариантов осуществления 118-123, где первый адаптер содержит штрих-код носителя.
125. Полинуклеотидная библиотека по любому из вариантов осуществления 118-124, где первый адаптер и второй адаптер различаются.
126. Полинуклеотидная библиотека по любому из вариантов осуществления 118-125, где первый универсальный сайт праймирования и/или второй универсальный сайт праймирования представляет собой или содержит сайт праймирования P7(C7) или его непрерывную часть, или сайт праймирования P5(C5), или его непрерывную часть, и где, необязательно, непрерывная часть таковых достаточна для отжига с комплементарной последовательностью.
127. Полинуклеотидная библиотека по любому из вариантов осуществления 118-126, где первый универсальный сайт праймирования представляет собой или содержит сайт праймирования P7(C7) или его непрерывную часть, а второй универсальный сайт праймирования является или содержит сайт праймирования P5(C5) или его непрерывную часть.
128. Полинуклеотидная библиотека по варианту 126 или по варианту 127, в которой сайт праймирования P7(C7) содержит последовательность AGATCGGAAGAGCACACGTCTGAACTCCA (SEQ ID NO: 77) или представляет собой ее непрерывную часть.
129. Полинуклеотидная библиотека по варианту 126 или по варианту 127, в которой сайт праймирования P5 содержит последовательность AGATCGGAAGAGCGTCGTGTAGGGAAAGAGTGTAGATCTCGGTGGTCGCCGTATCATT (SEQ ID NO: 78) или является ее непрерывной частью.
130. Полинуклеотидная библиотека по любому из вариантов осуществления 126-129, где непрерывная часть содержит по меньшей мере или, по меньшей мере примерно 15, 20, 25 или 30 нуклеотидов в длину.
131. Полинуклеотидная библиотека по варианту осуществления 129 или 130, в которой сайт праймирования P5 представляет собой непрерывную часть, указанную в SEQ ID NO: 25 (AGATCGGAAGAGCGTCGTGT).
132. Полинуклеотидная библиотека по любому из вариантов осуществления 118-131, в которой олигонуклеотид с штрих-кодом носителя содержит по меньшей мере или приблизительно по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40 или 50 нуклеотидов.
133. Полинуклеотидная библиотека по любому из вариантов осуществления 118-132, в которой олигонуклеотид, содержащий штрих-код носителя, содержит от или приблизительно от 10 до 30 нуклеотидов.
134. Полинуклеотидная библиотека по любому из вариантов осуществления 118-133, где один или несколько полинуклеотидов-мишеней включают полинуклеотид иммунной молекулы или ее цепи.
135. Полинуклеотидная библиотека по любому из вариантов осуществления 118-134, где один или несколько полинуклеотидов-мишеней включают по меньшей мере два полинуклеотида-мишени, каждый из которых содержит полинуклеотид цепи иммунной молекулы.
136. Полинуклеотидная библиотека по любому из вариантов осуществления 118-135, где один или несколько полинуклеотидов-мишеней представляют собой полинуклеотид TCR или его цепь.
137. Полинуклеотидная библиотека по любому из вариантов осуществления 118-136, где один или несколько полинуклеотидов-мишеней представлены полинуклеотидом альфа-рецептора Т-клеток (TCRα) и полинуклеотидом рецептора Т-клеток (TCRβ).
138. Полинуклеотидная библиотека по любому из вариантов осуществления 118-136, где один или несколько полинуклеотидов-мишеней представлены полинуклеотидом гамма-рецептора Т-клеток (TCRγ) и полинуклеотидом дельта-рецептора Т-клеток (TCRdelta).
139. Полинуклеотидная библиотека по любому из вариантов осуществления 118-135, где один или несколько полинуклеотидов-мишеней включают полинуклеотид антитела или его цепи.
140. Полинуклеотидная библиотека по любому из вариантов осуществления 118-135 и 139, в которой один или несколько полинуклеотидов-мишеней включают первый полинуклеотид, являющийся полинуклеотидом тяжелой цепи иммуноглобулина (IgH) и второй полинуклеотид, являющийся полинуклеотидом легкой цепи иммуноглобулина (IgL).
141. Полинуклеотидная библиотека по любому из вариантов осуществления 118-140, где штрих-кодированные полинуклеотиды содержат в порядке (от 5' до 3'): первый адаптер, штрих-код носителя, молекулярный штрих-код и второй адаптер.
142. Полинуклеотидная библиотека по любому из вариантов осуществления 118-1141, где первый адаптер расположен в или примерно 5' области одноцепочечного полинуклеотида с двойным штрих-кодом.
143. Полинуклеотидная библиотека по любому из вариантов осуществления 118-137, где второй адаптер расположен в или примерно 3'-области одноцепочечного полинуклеотида с двойным штрих-кодом.
144. Способ секвенирования, включающий секвенирование одного или нескольких из множества штрих-кодированных полинуклеотидов, полученных по любому из вариантов осуществления 1-116 или из библиотеки полинуклеотидов по любому из вариантов осуществления 118-141.
145. Способ по варианту осуществления 144, где транскриптом, полученный из множества штрих-кодированных полинуклеотидов, подвергается секвенированию.
146. Способ по варианту осуществления 145, дополнительно включающий амплификацию всего транскриптома или его части перед секвенированием.
147. Способ по варианту осуществления 146, в котором амплификация проводится при использовании первого набора праймеров, содержащего первый праймер и второй праймер, специфичные для первой и второй последовательностей адаптера, соответственно.
148. Способ по варианту осуществления 146 или 147, в котором один или несколько полинуклеотидов-мишеней из множества штрихкодированных полинуклеотидов подвергаются секвенированию.
149. Способ по варианту осуществления 148, дополнительно включающий амплификацию одного или нескольких полинуклеотидов-мишеней из множества полинуклеотидных матриц перед секвенированием.
150. Способ по варианту осуществления 149, в котором полноразмерную последовательность(и) одного или нескольких полинуклеотидов-мишеней амплифицируют.
151. Способ варианта осуществления 149 или 150, в котором амплификацию проводят в присутствии второго набора праймеров, содержащего один или несколько первых праймеров, комплементарных одному или нескольким полинуклеотидам-мишеням, и второй праймер, комплементарный первой последовательности адаптера.
152. Способ по варианту осуществления 151, в котором второй праймер из второго набора праймеров является комплементарным сайту праймирования P7(C7) или его непрерывной части, или сайту праймера P5(C5), или его непрерывной части.
153. Способ по варианту осуществления 151 или 152, в котором второй праймер из второго набора праймеров является комплементарным сайту праймирования P7(C7) или его непрерывной части.
154. Способ по любому из вариантов осуществления 151-153, где второй праймер из второго набора праймеров имеет или включает последовательность CAAGCAGAAGACGGCATACGAGAT (SEQ ID NO: 39) или CAAGCAGAAGACGGCATACGAGAT [NNNNN] GTGACTGGAGTTCAGACGTGTGCTCTTQGCT: 28).
155. Способ по любому из вариантов осуществления 151-154, где один или несколько первых праймеров, комплементарных одному или нескольким полинуклеотидам-мишеням, специфичны для последовательности-мишени иммунной молекулы или ее цепи.
156. Способ по варианту осуществления 155, в котором молекула иммунной системы представляет собой рецептор Т-клетки или антитело.
157. Способ по варианту осуществления 155 или 156, в котором один или несколько первых праймеров специфичны для последовательности-мишени константной области иммунной молекулы.
158. Способ по любому из вариантов осуществления 155-157, где иммунная молекула представляет собой TCR, и один или несколько первых праймеров включают AGTCTCTCAGCTGGTACACGG (SEQ ID NO: 37), ATGGCTCAAACACAGCGACCTC (SEQ ID NO: 38) или их комбинацию.
159. Способ по любому из вариантов осуществления 155-158, где иммунная молекула представляет собой антитело, и один или несколько первых праймеров содержат любой из SEQ ID NO: 29-36 или их комбинацию.
160. Способ по любому из вариантов осуществления 144-159, включающий выявление клетки, из которой происходит один или нескольких штрихкодированных полинуклеотидов.
161. Способ по варианту осуществления 160, в котором выявление клетки, из которой происходят полинуклеотиды, включает в себя получение информации о последовательностях, имеющих тот же самый штрих-код носителя, как происходящие из одной клетки.
162. Способ по любому из вариантов осуществления 144-161, где целевой полинуклеотид представляет собой иммунную молекулу, имеющую первую полинуклеотидную цепь и вторую полинуклеотидную цепь, и способ включает группировку первой полинуклеотидной цепи и второй полинуклеотидной цепи одной и той же клетки, основанное на наличии одного и того же штрих-кода носителя.
163. Способ по любому из вариантов осуществления 154-162, который также включает количественное определение или определение числа полинуклеотидов, имеющих одинаковый молекулярный штрих-код.
164. Способ по любому из вариантов осуществления 154-163, в котором способ содержит идентификацию транскриптомных последовательностей и полинуклеотидных последовательностей-мишеней, имеющих один и тот же штрих-код носителя, тем самым предоставляя информацию о транскриптоме клетки, несущей полинуклеотид-мишень(ы).
165. Способ анализа транскриптома, включающий:
(a) секвенирование полинуклеотида-мишени из штрих-кодированных полинуклеотидов, принадлежащих множеству штрих-кодированных полинуклеотидов, полученных способом по любому из вариантов осуществления 1-116, или из множества штрих-кодированных полинуклеотидов, принадлежащих библиотеке полинуклеотидов по любому из вариантов осуществления 118-141, тем самым генерируя информацию о последовательности полинуклеотида-мишени из множества клеток;
(b) секвенирование всего транскриптома или его части из множества штрихкодированных полинуклеотидов, полученных способом по любому из вариантов осуществления 1-116, или из множества штрихкодированных полинуклеотидов библиотеки полинуклеотидов по любому из вариантов осуществления 118-141, и тем самым генерирование данных о транскриптоме из множества клеток; а также
(c) идентификацию информации о последовательностях из (a) и из (b), которые имеют тот же самый штрих-код носителя, как происходящие из одной клетки.
166. Способ анализа транскриптома выбранной отдельной клетки, включающий:
(а) амплификацию и секвенирование полинуклеотида-мишени из множества штрихкодированных полинуклеотидов, полученных способом по любому из вариантов осуществления 1-116, или из множества множеств штрихкодированных полинуклеотидов, полученных из библиотеки полинуклеотидов по любому из вариантов осуществления 118-141, тем самым генерируя информация о последовательности для каждого полинуклеотида-мишени по меньшей мере в одной из множества клеток;
(b) идентификацию штрих-кода(-ов) носителей, связанных с один из полинуклеотидов-мишеней, секвенированного в (а), таким образом идентифицируя выбранную отдельную клетку, несущую полинуклеотид-мишень;
(c) амплификацию и секвенирование транскриптома или его части на основе множества штрих-кодированных полинуклеотидов клетки, несущей штрих-код носителя, таким образом генерирующую данные транскриптома из выбранной клетки, экспрессирующей полипептид-мишень.
167. Способ по варианту осуществления 166, в котором транскриптом или его часть из выбранной клетки амплифицируют или секвенируют с использованием праймера, специфичного для штрих-кода носителя, указанного в (b), и праймера, специфичного для второй последовательности адаптера штрих-кодированных полинуклеотидов.
168. Способ анализа транскриптома, включающий сопоставление информации о последовательности транскриптома или его части и по меньшей мере одного или нескольких из полинуклеотидов-мишеней, которые происходят из одной и той же клетки, при этом информация о последовательности либо определяется на основе множества штрих-кодированных полинуклеотидов, полученных способом по любому из вариантов осуществления 1-114 или на основе множества полинуклеотидных матриц библиотеки полинуклеотидов по любому из вариантов осуществления 118-141, либо определяется способом по любому из вариантов осуществления 154-164.
169. Способ по варианту осуществления 168, в котором последовательности, которые имеют один и тот же штрих-код носителя, группируются как находящиеся в одной и той же клетке.
170. Способ по любому из вариантов осуществления 165-169, в котором данные транскриптома содержат параметр, характеристику, признак или фенотип, связанный с функцией или активностью клетки.
171. Способ по варианту осуществления 170, в котором данные транскриптома связаны с активацией, истощением или пролиферативной активностью клетки.
IX. Примеры
[0434] Следующие примеры включены только в иллюстративных целях и не должны рассматриваться как ограничивающие объем изобретения.
Пример 1. Штрих-кодирование транскриптов в эмульсии для секвенирования одноклеточных полинуклеотидов.
А. Подготовка клеток
[0435] Суспензии отдельных клеток для проведения секвенирования полинуклеотидов единичной клетки были получены из мононуклеарных клеток периферической крови (РВМС). Приблизительно 50 мл крови отбирали в пробирки Vacutainer CPT Cell Preparation Tubes для приготовления клеток с гепарином натрия (BD), центрифугировали в течение 20 минут при 1800×g, дважды промывали в буфере для приготовления клеток (1x PBS с добавлением 2% эмбриональной бычьей сыворотки и 2 мМ EDTA), откручивали при 200 × g для удаления тромбоцитов, и полученные РВМС были криоконсервированы в среде RPMI-1640 (Life Technologies) + 20% эмбриональной бычьей сыворотки+10% ДМСО при -80 ° C до последующих операций. Перед генерацией эмульсии РВМС оттаивали, дважды промывали в буфере клеток: 1 × фосфатно-солевой буфер Дульбекко (PBS) с центрифугированием (200 × g в течение 10 мин). Затем клетки разводили в клеточном буфере до концентрации клеток 3.5×106 клеток/мл. Суспензию затем пипетировали сквозь 20 мкм клеточный фильтр.
B. Штрих-кодирование в эмульсии
[0436] Была сформирована эмульсия, содержащая приготовленные клетки и реакционную смесь. Реакционную смесь готовили в виде 2-кратного концентрата, который смешивали в объемном соотношении 1: 1 с суспензией клеток во время процесса образования капель.
1. Приготовление эмульсионной реакционной смеси
[0437] Эмульсионную реакционную смесь, содержащую реагенты и олигонуклеотиды в приведенной ниже таблице Е1, смешивали при комнатной температуре в вытяжном шкафу, в котором не проводилась ПЦР.
(SEQ ID NO:1)
(SEQ ID NO:2)
(SEQ ID NO:3)
(SEQ ID NO:4)
(SEQ ID NO:5)
/iSpl8/ = 18-углеродный спэйсер
V=A, C, или G
N=любое основание
rG=рибогуанозин
W=A или T
2. Создание библиотек с двойным штрих-кодом на основе отдельных клеток
[0438] Обзор примерного способа генерирования полинуклеотидных библиотек с двумя штрих-кодами показан на Фиг.1А и Фиг.1В. Эмульсию получали с использованием приготовленных клеток и реакционной смеси. Платформа для генерирования эмульсии включала три Mitos P-Pumps (Dolomite Microfluidics), приводимые в действие одним воздушным компрессором, каждый насос был оборудован Mitos Flow Rate сенсором для обеспечения управляемого компьютером потока двух водных фаз и одной непрерывной фазы фторофильного масла Dolomite Small 2-Reagent чип со фторфильным покрытием. Один водный входной канал содержал клетки с требуемой плотностью для получения желаемого количества клеток на каплю (в некоторых вариантах осуществления этот желательное количество клеток на каплю равно единице), тогда как второй водный канал содержал реагентов смесь для лизиса и реакции.
[0439] Шприц Hamilton Microliter объемом 100 мкл использовали для загрузки пробоотборной петли трубки PEEK с внутренним диаметром 100 мкл двумя инъекциями объемом приблизительно по 100 мкл каждая реакционной смесью. Шприц Hamilton Gastight объемом 100 мкл использовали для загрузки приблизительно 110 мкл суспензии клеток в петлю FEP с внутренним диаметром ~110 мкл, 0,2 мм. Петля была прикреплена к механическому ротору, постоянно переворачивающему петлю с клетками приблизительно один раз каждые 1-2 секунды, чтобы предотвратить оседание и/или слипание клеток. Эмульсия была сформирована путем сфокусированных струй обеих водных фаз под давлением, проходящими с одинаковыми скоростями потока через Dolomite 2 чип-реагент с одновременным потоком масла из двух масляных каналов в чипе. Внешние масляные каналы содержали 0,5-5,0 (мас./об.) поверхностно-активного вещества (сурфактанта) на основе полиэтиленгликоля во фторуглеродном масле HFE7500 (Novec 7500). Струя эмульсии под давление пропускала поток с постоянной скоростью (равной скорости потока, содержащего клетки и каналов, несущих реакционную смесь). Выход эмульсионного чипа собирали через 12-сантиметровую трубку PEEK с внутренним диаметром 0,5 мм, по каплям в 0,2-мл пробирки для ПЦР в стрипах (Eppendorf), которые хранили при приблизительно 0°C в охлажденном блоке.
[0440] Избыточное масло удаляли со дна каждой пробирки с помощью капиллярной микропипетки. Каждую эмульсионную фракцию осторожно покрывали 40 мкл раствора для нанесения покрытия: 25 мМ Na-EDTA, pH 8,0.
[0441] Эмульсии инкубировали в термоциклере для реакции мечения транскрипта. Вкратце, во время 45-минутной стадии обратной транскрипции (RT) РНК подвергали обратной транскрипции при 42°C с использованием polyА-специфического RT-праймера (олиго-dT-праймера) (SEQ ID NO: 1) и последовательности универсального адаптера (SEQ ID NO: 3), содержащего рандомизированный молекулярный штрих-код (см., например, фиг. 1A) c добавленной последовательностью переключателя матрицы. После реакции обратной транскрипции (RT) эмульсии подвергали 40 циклам термоциклирования (каждый цикл: 82°C в течение 10 секунд, 65°C в течение 25 секунд) для проведения ПЦР-амплификации матрицы штрих-кода носителя (SEQ ID NO: 2), которую доводили в начальный лизисной и реакционную смеси до концентрации 30000 копий (cp-copies) / мкл, и создавая концентрацию в конечной смеси 15000 cp/мкл или ~ 1 на ~ 65 пл капли (см., например, Фиг. 1B). Один конец штрих-кода носителя (также называемый здесь «штрих-кодом капли») содержит сайт праймера Illumina read 2 («P7») (SEQ ID NO: 77), тогда как другой конец соответствует общей последовательности универсального адапторного олигонуклеотида (SEQ ID NO: 4). Следовательно, во время ПЦР кДНК с переключением матрицы может отжигать амплифицированные цепи со штрих-кодами носителя и сплайсироваться путем удлинения внахлест, таким образом приводя к получению полноразмерных продуктов, содержащие молекулярные штрих-коды и последовательности штрих-кода носителя.
[0442] Способы, описанные выше, могут быть адаптированы для добавления адаптера, как описано в Примере 5, и используются для транскриптомного и специфического анализа мишени, как описано в Примерах 6-8.
Пример 2 - Штрих-кодирование транскриптов в эмульсионных носителях с использованием целевых специфических праймеров для секвенирования полинуклеотидов отдельной клетки.
А. Подготовка клеток
[0443] 50 мл крови отбирали в пробирки Vacutainer CPT Cell Preparation Tubes для приготовления клеток с гепарином натрия (BD), центрифугировали в течение 20 минут при 1800×g, дважды промывали в буфере для приготовления клеток (1x PBS с добавлением 2% эмбриональной бычьей сыворотки и 2 мМ EDTA), откручивали при 200 × g для удаления тромбоцитов, и полученные РВМС были криоконсервированы в среде RPMI-1640 (Life Technologies) + 20% эмбриональной бычьей сыворотки+10% ДМСО при -80 ° C до последующих операций. Перед генерацией эмульсии РВМС оттаивали, дважды промывали в клеточном буфере: 1 × фосфатно-солевой буфер Дульбекко (PBS) с центрифугированием (200 × g в течение 10 мин) и подсчитывали. B-клетки выделяли с использованием набора для обогащения B-клеток человека на основе метода отрицательной селекции (Stem Cell Technologies). Клетки пропускали через 20 мкм клеточный фильтр и разводили до 6.2E+06 клеток/мл (3 миллиона B-клеток в эксперименте) или 3,1E+06 клеток/мл (PGT-донор и эксперименты с опухолями яичников) в буфере для подготовки клеток.
B. Штрих-кодирование иммунных рецепторов в эмульсионных носителях
[0444] Система генерирования эмульсии включала три Mitos P-Pumps (Dolomite Microfluidics), приводимые в действие одним воздушным компрессором, каждый насос был оборудован Mitos Flow Rate сенсором для обеспечения управляемого компьютером потока двух водных фаз и одной непрерывной фазы фторофильного масла Dolomite Small 2-Reagent чип со фторфильным покрытием. Один водный входной канал содержал клетки с требуемой плотностью для получения желаемого количества клеток на каплю (в некоторых вариантах осуществления этот желательное количество клеток на каплю равно единице), тогда как второй водный канал содержал смесь реагентов для лизиса и реакции, приведенных в Таблице Е2 ниже, 5 ед./мкл обратной транскриптазы на основе MuMLV (Thermo Scientific) и 0,1 ед./мкл ПЦР-полимеразы Herculase II. Шприц Hamilton Microliter объемом 100 мкл использовали для загрузки пробоотборной петли трубки PEEK с внутренним диаметром 100 мкл двумя инъекциями объемом приблизительно по 100 мкл каждая смесью LR. Шприц Hamilton Gastight объемом 100 мкл использовали для загрузки приблизительно 110 мкл суспензии клеток в петлю FEP ~100 мкл с внутренним диаметром 0,2 мм. Эмульсия была сформирована путем сфокусированной струй обеих водных фаз под давлением, проходящими с одинаковыми скоростями потока через Dolomite 2 чип-реагент с одновременным потоком масла из двух масляных каналов в чипе. Эмульсию, выходящую из канала выхода чипа, собирали каплями в 0,2-мл пробирки для ПЦР в стрипах (Eppendorf) на охлажденном блоке, после чего избыток масла удаляли пипеткой со дна пробирки, добавляли 40 мкл раствора для покрытия (25 мМ Na ЭДТА, рН 8,0) и затем пробирки переносили в стандартный термоциклер для реакции мечения транскрипта.
(SEQ ID NO:84)
(SEQ ID NO:85)
(SEQ ID NO:86)
(SEQ ID NO:87)
(SEQ ID NO:88)
(SEQ ID NO:89)
(SEQ ID NO:90)
(SEQ ID NO:91)
(SEQ ID NO:92)
(SEQ ID NO:93)
(SEQ ID NO:94)
(SEQ ID NO:44)
(SEQ ID NO:48)
(SEQ ID NO:52)
(SEQ ID NO:56)
(SEQ ID NO:40)
(SEQ ID NO:60)
(SEQ ID NO:64)
(SEQ ID NO:68)
(SEQ ID NO:72)
(SEQ ID NO:95)
(SEQ ID NO:96)
(SEQ ID NO:97)
(SEQ ID NO:98)
[0445] В течение 45-минутной обратной транскрипции (RT) РНК при 42° C с использованием специфичных для мишени праймеров RT (таблица E2) с добавлением переключения матрицы к универсальной адапторной последовательности, содержащей рандомизированный молекулярный штрих-код как было описано ранее (Shugay, M. et al. Towards error-free profiling of immune repertoires. Nat. Methods 11, 653-655 (2014); Islam, S. et al. Highly multiplexed and strand-specific single-cell RNA 5′ end sequencing. Nat. Protoc. 7, 813-828 (2012))) (см., например, фиг. 1A). После проведения обратной транскрипции эмульсионные носителя подвергали 40 циклам термоциклирования (каждый цикл: 82°С в течение 10 с, 65°С в течение 25 с) для проведения ПЦР-амплификации матриц штрих-кода капли, которые были разбавлены в первоначальной лизисной и реакционной смеси до 30000 копий/мкл, создавая концентрацию в конечной смеси 15000 копий/мкл или ~ 1 на ~ 65 мкл капли. Один конец штрих-кода носителя (штрих-код капли) содержал сайт праймера Illumina read 2 («P7») (SEQ ID NO: 77), тогда как другой конец соответствовал общей последовательности универсального адапторного олигонуклеотида (SEQ ID NO: 4) (см., например, Фиг. 1B). Следовательно, во время ПЦР кДНК с переключенной матрицей могли отжигать амплифицированные цепи штрих-кодов носителей и сплайсироваться путем удлинения внахлест для получения полноразмерных продуктов, содержащие последовательности-мишени, молекулярные штрих-коды и штрих-коды носителей.
[0446] Способы, описанные выше, могут быть адаптированы для включения праймеров для обратной транскрипции транскриптома или его части, например, путем включения случайных гексамерных олигонуклеотидов во время фазы обратной транскрипции. Эти методы также могут быть адаптированы для добавления адаптера, как описано в Примере 5, и используются для транскриптомного и специфического анализа мишени, как описано в Примерах 6-8.
Пример 3. Метод штрих-кодирования транскриптов целевой последовательности и транскриптома в эмульсии для секвенирования полинуклеотидов отдельной клетки.
A. Подготовка клеток
[0447] Криоконсервированную суспензию РВМС быстро размораживают и добавляют к 10 объемам RPMI+10% FBS при комнатной температуре. Клетки осаждали центрифугированием при 350×g в течение 8 минут и ресуспендировали в RPMI+10% FBS до 2×106 клеток/мл. РВМС помещали в инкубатор для тканевых культур приблизительно на 16 часов.
[0448] «Отдохнувшие» PBMC культивировали совместно с аутологичными антиген-презентирующими клетками в соотношении приблизительно 10:1 PBMC: APC. В этом случае APC представляли собой дендритные клетки, полученные из аутологичных моноцитов, подвергнутых воздействию облученных HSV-инфицированных клеток HeLa. Совместную культуру инкубировали в течение 5 часов. Без ограничения описанного здесь способа, предполагается, что время инкубации примерно 5 часов достаточно для того, чтобы антиген-специфические клетки могли экспрессировать новые мРНК в ответ на антиген или в ответ на цитокины, высвобождаемые в среду другими клетками.
[0449] РВМС были удалены из совместного культивирования путем осторожного пипетирования вверх и вниз и перемещения в новую пробирку. Клетки помещали на лед и промывали в буфере CELL (20 г/л желатина кожи рыб (Biotium), 155 мМ KCl, 0,05% азида натрия, 5 мМ HEPES-Na pH 7,5) с добавлением 2 мМ EDTA, затем просто в буфере CELL, и, наконец, пропускали через 20- микронный клеточный фильтр и ресуспендировали в буфере CELL. Клетки подсчитывали и оценивали жизнеспособность путем окрашивания пропидия йодидом (акридин-оранжевый). Конечную плотность клеток доводили до 3,5 × 106 жизнеспособных (пропидий йодид-отрицательных) клеток/мл и хранили на льду.
[0450] Непосредственно перед образованием эмульсии клеточную суспензию нагревали и снова помещали на лед на 1 мин.
B. Штрих-кодирование эмульсионных носителей
[0451] Как и в предыдущем примере, была получена эмульсия, содержащая приготовленные клетки и реакционную смесь для последующей реакции мечения транскрипта при добавлении молекулярного штрих-кода и штрих-кода клетки к полинуклеотидным молекулам отдельной клетки. Реакционную смесь готовят в виде 2-кратного концентрата, который смешивают в объемном соотношении 1: 1 с суспензией клеток в процессе образования капель.
1. Приготовление эмульсии реакционной смеси
[0452] Проводилась подготовка реакционной смесь, содержащую реагенты и олигонуклеотиды как показано в Таблице E3 ниже. Олигонуклеотиды VB 1 (SEQ ID NO: 6), 2 (SEQ ID NO: 7), 3 (SEQ ID NO: 8) и 4 (SEQ ID NO: 9) были добавлены в виде эквимолярной смеси для получения сдвинутого по основанию (ступенчатого) набора ампликонов для увеличения разнообразия при секвенировании. Реакционную смесь загружали в реакционной отсек-петлю устройства генерирования эмульсии, описанного в предыдущем примере.
(SEQ ID NO:6)
(SEQ ID NO:7)
(SEQ ID NO:8)
(SEQ ID NO:9)
(SEQ ID NO:10)
(SEQ ID NO:11)
(SEQ ID NO:12)
(SEQ ID NO:13)
(SEQ ID NO:14)
(SEQ ID NO:15)
(SEQ ID NO:16)
(SEQ ID NO:17)
(SEQ ID NO:18)
(SEQ ID NO:19)
(SEQ ID NO:20)
(SEQ ID NO:21)
(SEQ ID NO:22)
//(N)/T/[(po)rG]//[(po)rG]//{3-deoxyguanosine}/
(SEQ ID NO:23)
N=A/T/C/G
W=A/T
mA/mG/mC=2′ O-метил A/G/C
U=2′дезокси уридин
(po)rG=рибогуанозин (РНК -основание)
2. Создание двойных штрих-кодовых библиотек транскриптов из отдельных клеток
[0453] Эмульсию получали с использованием приготовленных клеток и реакционной смеси. Система генерирования эмульсии включала три Mitos P-Pumps (Dolomite Microfluidics), приводимые в действие одним воздушным компрессором, каждый насос был оборудован Mitos Flow Rate сенсором для обеспечения управляемого компьютером потока двух водных фаз и одной непрерывной фазы фторофильного масла Dolomite Small 2-Reagent чип со фторфильным покрытием. Один водный входной канал содержал клетки с требуемой плотностью для получения желаемого количества клеток на каплю (в некоторых вариантах осуществления этот желательное количество клеток на каплю равно единице), тогда как второй водный канал содержал смесь реагентов для лизиса и реакции.
[0454] Шприц Hamilton Microliter объемом 100 мкл использовали для загрузки пробоотборной петли трубки PEEK с внутренним диаметром 100 мкл двумя инъекциями объемом приблизительно по 100 мкл каждая реакционной смесью. Шприц Hamilton Gastight объемом 100 мкл использовали для загрузки приблизительно 110 мкл суспензии клеток в петлю FEP ~100 мкл с внутренним диаметром 0,2 мм. Петля была прикреплена к механическому ротору, постоянно переворачивающему петлю с клетками примерно один раз каждые 1-2 секунды, чтобы предотвратить оседание и/или слипание клеток. Эмульсия была сформирована путем сфокусированных струй обеих водных фаз под давлением, проходящими с одинаковыми скоростями потока через Dolomite 2 чип-реагент с одновременным потоком масла из двух масляных каналов в чипе. Внешние масляные каналы содержали 0,5-5,0 (мас./об.) поверхностно-активного вещества (сурфактанта) на основе полиэтиленгликоля во фторуглеродном масле HFE7500 (Novec 7500). Струя эмульсии под давление пропускала поток с постоянной скоростью (равной скорости потока, содержащего клетки и каналов, несущих реакционную смесь). Выход с эмульсионного чипа собирали через 12-сантиметровую трубку PEEK с внутренним диаметром 0,5 мм, по каплям в четыре 0,2-мл пробирки-реплики в стрипах (Eppendorf) для ПЦР, которые хранили при приблизительно 0°C в охлажденном блоке. Избыток масла удаляли со дна каждой пробирки с помощью капиллярной микропипетки.
[0455] Эмульсии инкубировали в термоцикле для мечения транскрипта. Вкратце, реакционную смесь предварительно охлаждали при 4°С в течение 10 минут. Затем, в течение 45-минутной стадии обратной транскрипции (RT) РНК подвергали обратной транскрипции при 37°С с использованием специфичных для мишени праймеров или случайным праймированием на основе связывания гексамерных олигонуклеотидов и универсального адаптера, содержащего рандомизированный молекулярный штрих-код с добавленной последовательностью переключения матрицы, таким образом генерируя молекулы кДНК, каждая из которых имеет уникальный молекулярный идентификатор (штрих-код). По окончании реакции обратной транскрипции температуру поддерживали при 94°С в течение 10 минут. Затем эмульсионный носителя подвергали 50 циклам термоциклирования (каждый цикл: 83°C в течение 10 секунд (денатурация), 6°C в течение 25 секунд (удлинение)) для амплификации олигонуклеотидов со штрих-кодом носителя. После амплификации VB oligo (олигонуклеотида) эмульсию подвергали 10 циклам термоциклирования при более высокой температуре (каждый цикл: 95°C в течение 10 секунд (денатурация), 63°C в течение 25 секунд (отжиг), 72°C в течение 2 минут 20 секунд (удлинение). После завершения циклов термоциклирования эмульсию выдерживали при 4°С.
Пример 4 - Очистка кДНК с двумя штрих-кодами
[0456] Для каждой пробирки с эмульсионной фракцией, после штрих-кодирования транскриптов кДНК двумя штрих-кодами, полученных в приведенных выше примерах, эмульсию разрушали (после ПЦР), смешивая с равным объемом 1: 1 (об: об) перфтороктанол: FC-40, и ЭДТА добавляли в конечный концентрация 5 мМ, для предотвращения полимеризации ДНК. Добавляли приблизительно 0,1 объема протеазы Qiagen Protease и разрушенную эмульсию инкубировали при 50°С в течение 10-15 минут с последующей инактивацией протеазы нагреванием путем инкубации пробирок при 95°С в течение 3 минут. Пробирку быстро центрифугировали, а верхнюю водную фазу переносили в новую пробирку.
[0457] кДНК с двойным штрих-кодом концентрировали и обессоливали методом очистки 1,8 объема AMPure XP (Beckman Coulter) в соответствии с рекомендациями производителя. кДНК элюировали с гранул и денатурировали путем добавления 8 мкл 0,1 М гидроксида натрия+1 мМ ЭДТА и нагревания до 50°С в течение 3 минут. Если полноразмерные продукты содержали биотин вследствие 5'-биотинилирования RT-праймера, такие полноразмерные продукты отделяли от остальных продуктов ПЦР со штрих-кодом в капле путем очистки на стрептавидиновых гранулах.
[0458] После добавления 2 мкл 6X красителя для нанесения образцов ДНК на гель (New England Biolabs), денатурированную одноцепочечную кДНК разгоняли/разделяли в 1,5% (мас./об.) агарозном геле в 30 мМ NaOH+1 мМ ЭДТА при 5 В/см в течение 35 минут. После нейтрализации рН геля вырезали гель, содержащий кДНК в диапазоне размеров, соответствующем 100-1000 н.п., и кДНК очищали от агарозы с помощью набора для восстановления ДНК (например, Zymoclean ™ Gel DNA Recovery Kit, Zymo Research.) с элюированием в 20 мкл 10 мМ Трис-Cl, рН 8,5+0,05% TWEEN® 20. Далее кДНК обессоливали добавлением 1,8 объема гранул AMPure XP, элюировали в 10,5 мкл 10 мМ Трис-Cl, рН 8,0+0,05% TWEEN® 20 при нагревании на 95°C в течение 10с и осаждении путем помещения на лед.
Пример 5 - Лигирование 3'-последовательности адаптера с транскриптами кДНК с двумя штрих-кодами
[0459] Последовательность адаптера, содержащую известный сайт праймирования, добавляли к транскриптам кДНК с двумя штрих-кодами, генерируемым, как описано в примере 3, после очистки, как описано в примере 4. Добавление последовательности адаптера позволяет амплифицию, клонирование или секвенирование, такое как секвенирование следующего поколения, всех транскриптов с известным праймером. Некоторые последовательности адаптера, такие как примерная последовательность адаптера P5, используемая в данном документе известны и обычно используются для секвенирования.
1. Способы добавления последовательности 3'-адаптера
[0460] Несколько способов было использовано для добавления адапторной последовательности к 3'-концу одноцепочечных, неизвестных последовательностей кДНК с двумя штрих-кодами. Лигазы, такие как Thermostable App ligase (NEB) и CircLigase II (Epicenter), которые лигируют ssDNA адаптер, были использованы для добавления последовательности адаптера к 3'-концу транскриптов кДНК с двойным штрих-кодом. Коммерческий набор (Swift Biosciences Accel-NGS 1S DNA Kit), обеспечивающий ферментативное добавление нематричных нуклеотидов к 3'-концу кДНК, также использовали для добавления последовательности адаптера. Кроме того, использовались способы, где вырожденный шарнирный splint олигонуклеотид отжигается с адаптером, выступающим над 3'-концом кДНК, с вырожденными выступами до 6 нуклеотидов (т.е. NNNNNN; SEQ ID NO: 24). Для вырожденных выступов, последовательность NNNNNN (SEQ ID NO: 24) показала себя наиболее успешной в протестированных протоколах.
2. Добавление 3'-последовательности адаптера к кДНК с двойным штрих-кодом с использованием вырожденного шины с выступом из 6 нуклеотидов
[0461] Дуплексную молекулу адаптер-шарнирный (splint) нуклеотид получали путем смешивания олигонуклеотидов, содержащих короткую праймирующую последовательность P5, /5Phos/ AGATCGGAAGAGCGTCGTGT /3AmMO/ (SEQ ID NO:25) и шарнирного (splint) олигонуклеотида, обозначенного как ACACGACGCTCTTCCGATCT NNNNNN /3AmMO/ (SEQ ID NO:26) в пропорции 1,2: 1. Буфер для отжига добавляли к 30 мМ HEPES-Na pH 7,5, 0,1 М KCl. Раствор нагревали при 85°С в течение 2 минут в термоциклере и охлаждали до 37°С со скоростью 0,1°С/сек.
[0462] Транскрипты кДНК с двумя штрих-кодами, выделенные из части А выше, затем смешивали с раствором адаптера-шарнирного олигонуклеотида. Затем адаптеры лигировали с транскриптами кДНК, добавляя к смеси равный объем мастер-смеси Blunt/TA Ligase Master Mix (New England Biolabs) и инкубируя при комнатной температуре. Избыток адапторной ДНК удаляли путем очистки смеси с помощью AMPure XP и элюирования ДНК в 10 мМ Трис-Cl, рН 8,0+0,05% TWEEN® 20.
Пример 6 - ПЦР-амплификация и секвенирование библиотеки транскриптома
А. Амплификация библиотеки полинуклеотидов
[0463] Очищенные последовательности, помеченные двойным штрих-кодом и маркированные универсальным адаптером, амплифицировали с помощью ПЦР в течение 8 циклов с использованием прямого праймера, комплементарного последовательности универсального адаптера C7 (SEQ ID NO: 28), расположенной 5' от двойного штрих-кода и кодирующей последовательности транскрипта (5' конец кДНК-транскрипта) и обратного праймера, комплементарного последовательности универсального адаптера P5 (SEQ ID NO: 27), расположенной в 3'-позиции от двойного штрих-кода и кодирующей последовательности транскрипта (3'-конец кДНК транскрипта) (ПЦР0).
[0464] Реакционную смесь ПЦР0 (содержащая кДНК, лигированная с адаптером и (полученная в Примере 5), ДНК-полимераза, прямой праймер C7, обратный праймер P5, dNTP и реакционный буфер) сначала денатурировали при 98°С в течение 1 мин, а затем проводили 8 циклов термоциклирования (каждый цикл: 98°С в течение 10 с, 69°С в течение 20 с, 72°С в течение 10 с) с конечным временем удлинения 2 мин при 72°С. После завершения ПЦР смесь выдерживали при 4°С.
[0465] Каждая последовательность кДНК, полученная в результате PCR0, содержала последовательность адаптера C7, последовательность штрих-кода носителя (для идентификации клетки-хозяина), молекулярный штрих-код (для идентификации транскрипта), транскрипт и последовательность адаптера P5. Затем амплифицированную библиотеку (продукт PCR0) очищали с использованием гранул AMPure XP и элюировали в 10 мМ Трис-Cl, рН 8,0+0,05% TWEEN® 20.
[0466] Очищенную библиотеку транскриптома затем использовали для секвенирования одного или нескольких из списка: один или несколько полноразмерных генов-мишеней, таких как иммунный рецептор, транскриптом всех клеток в эмульсии и/или транскриптом одной или нескольких выбранных клеток в эмульсии, как описано ниже.
B. Секвенирование генов-мишеней
1. ПЦР1: амплификация гена(ов)-мишени(ей)
[0467] Для амплификации выбранного гена-мишени, продукт ПЦР0 амплифицировали с использованием универсального прямого праймера, примененного для PCR0 (праймер C7-index-P7; SEQ ID NO: 28), и обратного праймера, специфичного для желательной последовательности(ей)-мишени(ей) (как, например, специфические рецепторы иммуноглобулина рецептора Т-клеток). Типичные мишень-специфичные праймеры, использованные для реакции ПЦР1, приведены в Таблице Е4 ниже.
(SEQ ID NO:29)
(SEQ ID NO:30)
(SEQ ID NO:31)
(SEQ ID NO:32)
(SEQ ID NO:33)
(SEQ ID NO:34)
(SEQ ID NO:35)
(SEQ ID NO:36)
(SEQ ID NO:37)
(SEQ ID NO:38)
[0468] Реакционную смесь ПЦР1 (содержащую продукт ПЦР0 (полученный в части A выше), ДНК-полимеразу, прямой праймер C7-index-P7, специфичный для мишени обратный праймер, dNTPs и реакционный буфер) первоначально денатурировали при 98°C. в течение 1 минуты с последующими 10 циклами термоциклирования (каждый цикл: 98°С в течение 10 с, 61°С в течение 20 с, 72°С в течение 20 с) с конечным временем удлинения 2 мин при 72°С. После завершения ПЦР1 смесь выдерживали при 4°С. Продукт ПЦР1 (последовательность(ти) гена-мишени) очищали гранулами AMPure XP и элюировали в 10 мМ Трис-Cl, рН 8,0+0,05% TWEEN® 20.
2. ПЦР2: амплификация гена-мишени с добавлением 3'-последовательности адапторной последовательности
[0469] Очищенный продукт ПЦР1 амплифицировали с использованием прямого праймера C7 (SEQ ID NO: 39) и мишень-специфичного обратного праймера, содержащего универсальную праймирующую последовательность P5 short. Типичные праймеры, использованные для реакции ПЦР2, приведены в Таблице E5 ниже.
(SEQ ID NO:29)
(SEQ ID NO:30)
(SEQ ID NO:31)
(SEQ ID NO:32)
(SEQ ID NO:33)
(SEQ ID NO:34)
(SEQ ID NO:35)
(SEQ ID NO:36)
(SEQ ID NO:37)
(SEQ ID NO:38)
[0470] Реакционную смесь ПЦР2 (содержащую продукт ПЦР1 (полученный в части B1 выше), ДНК-полимеразу, прямой праймер C7 (SEQ ID NO: 39), мишень-специфичный обратный короткий (short P5) праймер P5, dNTP и реакционный буфер) первоначально денатурировали при 98°С в течение 1 минуты, затем следовали 6 циклов термоциклирования (каждый цикл: 98°С в течение 10 с, 65°С в течение 20 с, 72°С в течение 20 с) и конечное время удлинения 2 мин при 72°С. После завершения ПЦР2 смесь выдерживали при 4°С. Продукт ПЦР2 (последовательность(ти) гена-мишени) очищали с помощью гранул AMPure XP и элюировали 10 мМ Трис-Cl, рН 8,0+0,05% TWEEN® 20.
3. Количественная ПЦР (qPCR3) и секвенирование гена-мишени
[0471] Очищенный продукт ПЦР2 или ПЦР0 использовали для количественной ПЦР (qPCR) для определения количества циклов амплификации для достижения конечной точки qPCR3. Предварительно амплифицированный лигированный с адаптером материал на выходе из ПЦР0 или полноразмерные IG или TR продукты ПЦР2 амплифицировали с помощью праймеров C7 (прямой; SEQ ID NO: 39) и C5-P5 (обратный; SEQ ID NO: 76).
[0472] Вкратце, реакционную смесь qPCR3 (содержащую продукт ПЦР0 или ПЦР2 (полученный в частях A или B1 выше, соответственно), ДНК-полимеразу, прямой праймер C7 (SEQ ID NO: 39), обратный праймер C5-P5 (SEQ ID NO: 76), dNTP, EvaGreen и реакционный буфер) сначала денатурировали при 98°С в течение 1 минуты, а затем проводили 3 цикла термоциклирования (каждый цикл: 98°С в течение 10 с, 60°С в течение 20 с, 72°С в течение 20 с), после чего следовало 30 циклов второго цикла термоциклирования (каждый цикл: 98°С в течение 10 с, 70°С в течение 20 с, 72°С в течение 20 с). График интенсивности кПЦР был проверен для определения цикла амплификации, при котором интенсивность флуоресценции была максимальной, но амплификация ДНК еще не заканчивалась. Это послужило для определения количества циклов для достижения конечной точки qPCR3.
[0473] После определения количества циклов ПЦР, необходимых для амплификации каждой библиотеки до экспоненциальной фазы, ту же самую ПЦР повторяли неколичественным образом до желаемого количества циклов и продукты ПЦР очищались помощью 1 AMPure XP и элюировали в 10 мМ Трис-Cl., рН 8,0+0,05% TWEEN® 20. Необязательно, результаты кПЦР3 (qPCR3) были нормализованы с помощью DASH (Gu et al., Genome Biology 2016, 17:41). Результаты были проанализированы c помощью Agilent Tapestation D1000, количественно оценены с помощью набора KAPA NGS Quant Kit for Illumina и секвенированы с помощью набора Illumina NextSeq high output 75-cycle kit (например, 32 цикла Read 1, 6 циклов Index Read I7, 54 цикла Read 2) для библиотеки с лигированными адаптерами или комплекта 600-тактного комплекта Illumina MiSeq V3 600-cycle kit (например, 325 циклов Read 1, 6 циклов Index Read I7, 300 циклов Read 2) для полноразмерных библиотек IG и TR. В некоторых случаях на секвенаторе NextSeq проводилось 56 циклов Read 1, 6 циклов Index Read I7 и 33 цикла Read 2.
C. Секвенирование транскриптомов из всех клеток
[0474] Для создания библиотеки транскриптома из всех клеток проводят реакции ПЦР1, ПЦР 2 и кПЦР3 (qPCR3), как описано выше, за исключением тех, где есть замена мишень-специфичных обратных праймеров универсальными обратными праймерами, направленными на 3'-адапторную последовательность (например, SEQ ID NO: 27 и 76) для использования в комбинации с универсальными прямыми праймерами (например, SEQ ID NO: 28 и 39) для амплификации. Таким образом, универсальные прямой и обратный праймеры могут быть использованы для последовательности всех транскриптов всех клеток в эмульсии.
D. Секвенирование транскриптома выбранных клеток
[0475] Для создания библиотеки транскриптома выбранных клеток реакции ПЦР1, ПЦР 2 и кПЦР3 (qPCR3) проводят, как описано выше, за исключением тех случаев, когда используются прямые праймеры, комплементарные штрих-коду носителя (VB) желаемой клетки или клеток, таких как клетка или клетки, содержащие молекулу Ig или представляющий интерес TCR, секвенированные в части A выше, и универсальные обратные праймеры, направленныена 3'-адапторную последовательности (например, SEQ ID NO: 27 и 76).
Пример 7 - Анализ данных последовательности
[0476] Прочтения Illumina MiSeq были обработаны для генерации консенсусных последовательностей полной длины молекул и мРНК капель, аннотированных с помощью IgBLAST и IMGT/HighV-QUEST, и обработанных с помощью пользовательских программ и пакета Change-0 для генерации статистики и цифр. MiSeq прочтения были демультиплексированы с использованием программного обеспечения Illumina. Результаты с качеством прочтения ниже Phred 5 были замаскированы с помощью Ns. Изотип-специфичные праймеры, штрих-коды носителей (VB), молекулярные штрих-коды (MB) и последовательности адаптера были идентифицированы в ампликоне и исключены с использованием pRESTO MaskPrimers-cut с максимальной ошибкой 0,2.
А. Анализ данных выбранной последовательности иммунных рецепторов
[0477] В одном примере были получены и секвенированы полноразмерные последовательности целевых иммунных рецепторов. Консенсусная последовательность Read 1 и консенсусная последовательность Read 2 были сгенерированы отдельно для каждой мРНК из прочтений, сгруппированных по уникальному молекулярному идентификатору (UMI), включающему VB и MB вместе, которые являются ПЦР-репликами, возникающими на основе одной и той же исходной молекулы мРНК. UMI группы прочтения были выровнены используя MUSCLE, и pRESTO применялась для построения консенсусных последовательностей со следующими параметрами: maxdiv=0.1; bf PRIMER; prfreq=0.6; maxmiss=0.5; q=5; > 60% совпадения последовательностей выбранных праймеров ПЦР для группы прочтения; максимальное разнообразие нуклеотидов=0,1; использование правила большинства на indel позициях; и маскирование выравнивнивания для столбцов с низким качеством консенснусной последовательности. Затем спаренные концевые консенсусные последовательности были выровнены в два раунда. Сначала, выравнивание без пробелов (ungapped alignment) концов консенснусных последовательности каждой считываемой пары было оптимизировано с использованием приближения Z-показателя и оценивалось с помощью биномиального значения p (p-value), в том виде, в котором это предоставлено в pRESTO AssemblePairs-align со следующими параметрами: минимальная длина=8; альфа l×105; и максимальная ошибка=0,3. Для пар прочтения, которые не удалось «сшить» таким образом, была предпринята попытка «сшивки» с использованием V-экзонов зародышевой линии BCR и TCR человека, для защиты каждого прочтение перед последующей «сшивкой» или выравниванием с пробелом, используя параметры-ссылки pRESTO AssemblePairs: минимальная идентичность=0,5; е значение l×105.
1. V D J сегментная аннотация и подтверждение изотипа
[0478] IgBLAST, Change-0 и пользовательские программы использовались для идентификации происхождения генов, V (D) J зародышевой линии, обрезания последовательностей мРНК до области V (D) J, идентификации областей CDR3 и подсчета мутаций в V нуклеотидных последовательностях зародышевой линии. IgBLAST подсчитывает Ns как несоответствия (mismatch), но последовательности мРНК с более чем 6 несоответствиями (Ns) в V-области были отобраны для анализа мутаций и точного анализа спаривания между фракциями. Для тяжелых цепей IG идентичность изотипа подтверждалась путем сопоставления непраймерных C-областей (экзонов константных областей) с ожидаемыми последовательностями с использованием параметров pRESTO MaskPrimers-Score: start=0; максимальная ошибка=0,2. Ампликоны с диссонирующими сигналами праймера/не-праймера в С-области отбрасывали, за исключением двух комбинаций праймера/не-праймера, где при наличии определенные помех взаимодействия все разрешалось визуальной проверкой.
2. Группировка V (D) J-последовательностей в клональные линии
[0479] Последовательности V(D)J были сгруппированы в клоны с использованием одноцепочечной кластеризации с учитываемым межклональным расстоянием. Кластеризация была выполнена с помощью пакета Change-0 DefineClones-by c параметрами группы: model=mln; gene=first; dist=4.0; norm=none. Сначала консенсусные последовательности всех функциональных Ig VH-цепочек капель были объединены в выборки, имеющие VJ-соединение, так что последовательности, возможно, являющиеся результатом одного и того же события начальной рекомбинации, были объединены вместе (на основе наилучшего совпадения гена Ig VH, наилучшего совпадения гена Ig JH и длины границы соединения как было определено IMGT/HighV-QUEST). Порог межклонального расстояния был выбран путем генерации гистограммы расстояний от ближайших соседей в пределах каждой VH Ig выборки с использованием функции distToNearest function of Change-0’s shm пакета и визуальной проверки гистограммы для определения естественного расстояния (во впадине бимодальной гистограммы). Клональные кластеры легких цепей были определены с использованием той же модели определения расстояния и его порогового значения.
3. Создание выборки капель, расчет точности спаривания
[0480] Достоверность спаривания (прочное-непрочное) была оценена двумя независимыми способами: на основе соответствия последовательностей мРНК внутри капли и соответствия последовательностей между репликами. мРНК-соответствие внутри капли определяли как среднее попарное нуклеотидное различие (Nei’s pi < 0.02) последовательностей V (D) J в пределах локуса. Последовательности мРНК обрезали до нуклеотидных кодирующих последовательностей V(D)J, используя IgBLAST-аннотации. Внутри каждой капли все рабочие последовательности мРНК были сгруппированы по V локусу. Внутри каждой группы несколько последовательностей были выровнены с использованием MUSCLE, в том виде как это представлено в pRESTO AlignSets с использованием параметров по умолчанию. Консенсусные цепи капель были построены из нескольких мРНК на локус с использованием параметров pRESTO: BuildConsensus.py; maximum div=0.2; maximum miss=0.5. Капли, взятые в случайном порядке, использовались для выбора ограничения разнообразия pi <0,02. В каплях, взятых в случайном порядке, менее 0,01% локусов тяжелых цепей (и <0,2% локусов) легких цепей соответствовали данному критерию. Капли, включающие несколько клеток или иммунные рецепторы, были отделены для дальнейшего точного анализа.
[0481] Точность спаривания рассчитывали на основе наблюдения одной и той же пары в том же клоне в нескольких репликах (отдельные эксперименты с эмульсиями), фокусируясь на тех кластерах VDJ, которые с наибольшей вероятностью содержат только одну линию, т. е. имеющие происхождение из одного и того же V(D)J путем VJ перестановки с последующим расширением. Подобные VDJ перестройки могут возникать в течение нескольких независимых периодов, что приводит к перегруппировке одной и той же тяжелой цепи V (D) J, естественным образом связанной с множеством разных перестроек легкой цепи VJ. Поскольку редкие перестановки V(D)J могли бы обеспечить более точную измерение технической точности достигаемой описанными здесь методами, длинные тяжелые CDR3 (CDR3H) не являлись фокусом этого анализа (в качестве прокси для более редких перестановок V (D) J). Последовательности с> 6N также были удалены для повышения достоверности клональной принадлежности. Точность спаривания увеличилась с длиной CDR 3 H до более чем 96% для самого длинного квартиля клонов, наблюдаемого среди фракций (2 604 клона с длиной соединения ≥ 54 нт). Поскольку вероятность соответствия пар- клонов является функцией общей вероятности истинных пар, в двух независимых экспериментах точность спаривания оценивалась как квадратный корень из парного соответствия по репликам, рассчитывается следующим образом: где  является числом 1 штрих-кодов носителей d со спаренными «тяжелым» клоном h и «легким» клоном 1, находящихся в физической фракции f. Средняя (квадратичная) точность спаривания для каждого эксперимента оценивается путем усреднения по тяжелым клонам h и по всем парам фракций (f, g), и соответствию спаренных «легких» клонов (1, k):
является числом 1 штрих-кодов носителей d со спаренными «тяжелым» клоном h и «легким» клоном 1, находящихся в физической фракции f. Средняя (квадратичная) точность спаривания для каждого эксперимента оценивается путем усреднения по тяжелым клонам h и по всем парам фракций (f, g), и соответствию спаренных «легких» клонов (1, k):

[0482] Следовательно, средняя точность каждого эксперимента (с точностью до дисперсии точности между экспериментами) составляла 96,1% в соответствии с этим иллюстративным экспериментом.
B. Анализ данных транскриптомной последовательности
[0483] Для полученных данных последовательности транскриптома, прочтения, содержащие один и тот же VB, были свернуты, и последовательности были сопоставлены с эталонным геномом человека для идентификации транскриптов (HiSAT2). Выравнивание файла на выходе осуществлялось с помощью samtools, и прочтения были приписаны транскриптам в соответствии с их геномной локадизацией.
[0484] Для каждого картирования VB-генома прочтения были свернуты путем MB. Матрица была построена исходя из рассчетов MB, картированных по отношению к каждому отдельному референсному гену на капллю. Затем эти данные были объединены с целевыми данными, например, с данными последовательностями иммунных рецепторов, обработанными, как описано выше в части А. Данные по каждому VB (капля) были аннотированы количеством генов и информацией о рецепторе. Объединенные наборы данных затем анализировали для изучения профиля последовательности РНК (scRNAseq) отдельной клетки. Редукцию по размерам, кластеризацию и визуализацию осуществляли с использованием t-SNE, Seurat, ZIFA, PCA, LDA и других типичных программ.
Пример 8. Иллюстративный анализ данных последовательности транскриптома секвенированных с высокой пропускной способностью и построение графиков на множестве единичных клеток
[0485] Было выделено примерно 7000 PBMC, транскриптомы и полноразмерные рецепторы BCR и TCR были секвенированы, как обычно описано в примерах 4A и 4B выше.
[0486] Перед анализом Illumina NextSeq библиотеки для секвенирования транскриптома эмульсионных носителей, полученные, как описано в Примере 4B, анализировали с помощью D1000 DNA tapestation. Транскриптом был представлен последовательностями размером приблизительно 170-900 п.н. Последовательности TCR полной длины, секвенированные путем целевого секвенирования, описанного в Примере 4A, также анализировали с помощью D1000 DNA tapestation перед анализом NextSeq, который показал альфа и бета пики TCR при 628 и 664 п.н. соответственно.
[0487] После анализа NextSeq все клеточных профилей в каплях с > 1000 считываний (n=6,707) были проанализированы с помощью стохастического вложение соседей с t-распределением (t-SNE) и кластеризации Сеурата. Многомерные данные транскриптомов отдельных клеток визуализировали с использованием графиков t-SNE, и клетки были прокодированы цветом на основе Seurat кластеризации клеток с аналогичным профилем транскрипции (Фиг. 3A) или в соответствии с природой секвенированного иммунного рецептора (т.е., BCR (красный/стандартный серый) или TCR (зеленый/темно-серый)) (Фиг. 3B), для демонстрации кластеризации клеток со сходными фенотипами.
[0488] Данные транскриптома для типичных генов в секвенированных клетках были проанализированы, и информация о последовательностях с тем же самым штрих-кодом носителя, что и у секвенированного иммунного рецептора, интерпретировалась как полученная из той же самой клетки. Данные транскриптома для типичных генов в транскриптоме единичной клетки кодированы цветом на тепловой карте уровней экспрессии и показаны для Toll-подобного рецептора 7 (TLR7; фиг. 4A), эпсилон-цепи гликопротеина CD3 на поверхности Т-клеток (CD3E; Фиг. 4B), белка 7 гранул натуральных клеток-киллеров (NKG7; Фиг. 4C), рецептора маннозы MRC1 C-типа 1 (MRC1; Фиг. 4D).
[0489] Эти результаты показывают, что профили экспрессии РНК в целом по геному могут быть определены вместе с иммунными рецепторами с высокой пропускной способностью, поскольку генетические маркеры, ассоциированные с T-клетками (CD3E) или B-клетками (TLR7), как правило, группируются в клетках, экспрессирующих полноразмерные TCR или BCR, соответственно. Аналогично, генетические маркеры, не связанные с Т-клетками или В-клетками, такие как типовой маркер NK-клеток NKG7 или типичный маркер моноцитов MRC1, по-видимому, не кластеризуются в клетках с полноразмерными иммунными рецепторами TCR или BCR.
[0490] Конкретные раскрытые варианты осуществления не предназначены для ограничения по объему настоящего изобретения, а предоставлены, например, для иллюстрации различных аспектов изобретения. Различные модификации описанных композиций и способов станут очевидными из описания и идей, приведенных здесь. Такие вариации могут применяться на практике без отклонения от истинного объема и сущности раскрытия и должны считаться попадающими в рамки настоящего раскрытия.
ПОСЛЕДОВАТЕЛЬНОСТИ
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Годфлесс, Стивен Джекоб
Бриггс, Адриан Рэнгхем
Чари, Раджагопал
Джианг, Ю
Хаус, Рональд
Вигно, Франсуа
<120> СЕКВЕНИРОВАНИЕ ПОЛИНУКЛЕОТИДНЫХ БИБЛИОТЕК С ВЫСОКОЙ ПРОПУСКНОЙ СПОСОБНОСТЬЮ
И АНАЛИЗ ТРАНСКРИПТОМА
<130> 735042011740
<140> назначение пока не определено
<141> Одновременно с таковым
<150> US 62/511,949
<151> 2017-05-26
<160> 100
<170> FastSEQ для Windows Version 4.0
<210> 1
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 5'Биотин-меченый олиго(dТ)-пришитый праймер для обратной транскрипции
<220>
<221> прочий_признак
<222> 1
<223> 5' модификация биотином со спэйсером из 18 углеродных остатков
<220>
<221> прочий_признак
<222> 27
<223> n = A, T, C или G
<400> 1
tttttttttt tttttttttt tttttvn 27
<210> 2
<211> 78
<212> ДНК
<213> Искусственная последовательность
<220>
<223> матрица штрих-кода носителя, олиго
<220>
<221> прочий_признак
<222> 30, 31, 32, 33, 35, 36, 37, 38, 40, 41, 42, 43
<223> n = A, T, C или G
<400> 2
atccatccac gactgacgga cgtattaaan nnnwnnnnwn nnnagatcgg aagagcacac 60
gtctgaactc cagtcacc 78
<210> 3
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<223> переключение матриц, олиго
<220>
<221> прочий_признак
<222> 33
<223> рибогуанозин
<220>
<221> прочий_признак
<222> 34
<223> рибогуанозин
<220>
<221> прочий_признак
<222> 24, 25, 27, 28, 30, 31
<223> n = A, T, C или G
<400> 3
aatacgtccg tcagtcgtgg atgnntnnan ntggg 35
<210> 4
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> прямой праймер/универсальный адаптер со штрих-кодом носителя,
олигонуклеотид
<400> 4
catccacgac tgacggacgt att 23
<210> 5
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> обратный праймер со штрих-кодом носителя
<400> 5
gtgactggag ttcagacgtg tgct 24
<210> 6
<211> 87
<212> ДНК
<213> Искусственная последовательность
<220>
<223> штрих-код носителя, олиго 1
<220>
<221> прочий_признак
<222> (1)...(5)
<223> фосфоротиоатная связь
<220>
<221> прочий_признак
<222> (83)...(87)
<223> фосфоротиоатная связь
<220>
<221> прочий_признак
<222> 41, 42, 43, 44, 46, 47, 48, 49, 51, 52, 53, 54
<223> n = A, T, C или G
<400> 6
tacgtctacg cgctgctctg ccacgactga cggacgtatt nnnnwnnnnw nnnnagatcg 60
gaagagcaca cgtctgaact ccagtca 87
<210> 7
<211> 88
<212> ДНК
<213> Искусственная последовательность
<220>
<223> штрих-код носителя, олиго 2
<220>
<221> прочий_признак
<222> (1)...(5)
<223> фосфоротиоатная связь
<220>
<221> прочий_признак
<222> (84)...(88)
<223> фосфоротиоатная связь
<220>
<221> прочий_признак
<222> 42, 43, 44, 45, 47, 48, 49, 50, 52, 53, 54, 55
<223> n = A, T, C или G
<400> 7
tacgtctacg cgctgctctg ccacgactga cggacgtatt wnnnnwnnnn wnnnnagatc 60
ggaagagcac acgtctgaac tccagtca 88
<210> 8
<211> 89
<212> ДНК
<213> Искусственная последовательность
<220>
<223> штрих-код носителя, олиго 3
<220>
<221> прочий_признак
<222> (1)...(5)
<223> фосфоротиоатная связь
<220>
<221> прочий_признак
<222> (85)...(89)
<223> фосфоротиоатная связь
<220>
<221> прочий_признак
<222> 41, 43, 44, 45, 46, 48, 49, 50, 51, 53, 54, 55, 56
<223> n = A, T, C или G
<400> 8
tacgtctacg cgctgctctg ccacgactga cggacgtatt nwnnnnwnnn nwnnnnagat 60
cggaagagca cacgtctgaa ctccagtca 89
<210> 9
<211> 90
<212> ДНК
<213> Искусственная последовательность
<220>
<223> штрих-код носителя, олиго 4
<220>
<221> прочий_признак
<222> (1)...(5)
<223> фосфоротиоат
<220>
<221> прочий_признак
<222> (86)...(90)
<223> фосфоротиоат
<220>
<221> прочий_признак
<222> 41, 42, 44, 45, 46, 47, 49, 50, 51, 52, 54, 55, 56, 57
<223> n = A, T, C или G
<400> 9
tacgtctacg cgctgctctg ccacgactga cggacgtatt nnwnnnnwnn nnwnnnnaga 60
tcggaagagc acacgtctga actccagtca 90
<210> 10
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> прямой праймер со штрих-кодом носителя
<400> 10
gtgactggag ttcagacgtg tgct 24
<210> 11
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> обратный праймер со штрих-кодом носителя
<400> 11
tacgtctacg cgctgctctg 20
<210> 12
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> RT праймер константной области IgG
<220>
<221> модифицированное основание
<222> 10
<223> gm
<220>
<221> модифицированное основание
<222> 11
<223> gm
<220>
<221> модифицированное основание
<222> 12
<223> gm
<400> 12
aggacagccg ggaaggtgt 19
<210> 13
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgL constant RT primer
<220>
<221> модифицированное основание
<222> 9
<223> gm
<220>
<221> модифицированное основание
<222> 11
<223> 2'-O-метиладенозин
<220>
<221> модифицированное основание
<222> 12
<223> gm
<400> 13
gctcccgggt agaagtca 18
<210> 14
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgK constant RT primer
<220>
<221> модифицированное основание
<222> 11
<223> gm
<220>
<221> модифицированное основание
<222> 12
<223> gm
<220>
<221> модифицированное основание
<222> 13
<223> 2'-O-метиладенозин
<400> 14
ggcctctctg ggatagaagt 20
<210> 15
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> RT праймер константной области IgM
<220>
<221> модифицированное основание
<222> 13
<223> gm
<220>
<221> модифицированное основание
<222> 14
<223> cm
<220>
<221> модифицированное основание
<222> 15
<223> gm
<400> 15
tgtgaggtgg ctgcgtactt g 21
<210> 16
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> RT праймер константной области IgA
<220>
<221> модифицированное основание
<222> 12
<223> gm
<220>
<221> модифицированное основание
<222> 13
<223> gm
<220>
<221> модифицированное основание
<222> 14
<223> 2'-O-метиладенозин
<400> 16
ctggctrggt gggaagtttc t 21
<210> 17
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> RT праймер константной области IgD
<220>
<221> модифицированное основание
<222> 12
<223> 2'-O-метиладенозин
<220>
<221> модифицированное основание
<222> 13
<223> gmcm
<220>
<221> модифицированное основание
<222> 15
<223> cm
<400> 17
cacgcatttg tactcgcctt g 21
<210> 18
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> RT праймер константной области IgE
<220>
<221> модифицированное основание
<222> 10
<223> 2'-O-метиладенозин
<220>
<221> модифицированное основание
<222> 12
<223> 2'-O-метиладенозин
<220>
<221> модифицированное основание
<222> 13
<223> gm
<400> 18
gatggtggca tagtgaccag 20
<210> 19
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> RT праймер константной области TRA
<220>
<221> модифицированное основание
<222> 15
<223> 2'-O-метиладенозин
<220>
<221> модифицированное основание
<222> 16
<223> 2'-O-метиладенозин
<220>
<221> модифицированное основание
<222> 18
<223> cm
<400> 19
tgtttgagaa tcaaaatcgg tgaa 24
<210> 20
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> RT праймер константной области TRB
<220>
<221> модифицированное основание
<222> 9
<223> gm
<220>
<221> модифицированное основание
<222> 10
<223> gm
<220>
<221> модифицированное основание
<222> 11
<223> gm
<400> 20
acgtggtcgg ggaagaag 18
<210> 21
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> RT праймер константной области TRG
<220>
<221> модифицированное основание
<222> 13
<223> ac4cgm
<220>
<221> модифицированное основание
<222> 14
<223> gm
<220>
<221> модифицированное основание
<222> 16
<223> 2'-O-метиладенозин
<400> 21
caagaagaca aaggtatgtt cc 22
<210> 22
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> RT праймер константной области TRD
<220>
<221> модифицированное основание
<222> 12
<223> gm
<220>
<221> модифицированное основание
<222> 13
<223> 2'-O-метиладенозин
<220>
<221> модифицированное основание
<222> 14
<223> cm
<400> 22
tcttcttgga tgacacgaga 20
<210> 23
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> переключение матриц, олиго
<220>
<221> модифицированное основание
<222> 24
<223> 2'-дезоксиуридин
<220>
<221> прочий_признак
<222> 34
<223> рибогуанозин
<220>
<221> прочий_признак
<222> 35
<223> рибогуанозин
<220>
<221> модифицированное основание
<222> 36
<223> 3-дезоксигуанозин
<220>
<221> прочий_признак
<222> 25, 26, 28, 29, 31, 32
<223> n = A, T, C или G
<400> 23
aatacgtccg tcagtcgtgg atgunntnna nntggg 36
<210> 24
<211> 6
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вырожденный выступ
<220>
<221> прочий_признак
<222> 1, 2, 3, 4, 5, 6
<223> n = A, T, C или G
<400> 24
nnnnnn 6
<210> 25
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера "short P5" (короткого P5)
<220>
<221> модифицированное основание
<222> 1
<223> фосфорилированный аденозин
<220>
<221> модифицированное основание
<222> 20
<223> 3' амино-модифицированный (3AmMO) тимин
<400> 25
agatcggaag agcgtcgtgt 20
<210> 26
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> шарнирный (splint) олигонуклеотид
<220>
<221> модифицированное основание
<222> 26
<223> 3'амино модифицированный (3AmMO) нуклеотид (a, g, c или t)
<220>
<221> прочий_признак
<222> 21, 22, 23, 24, 25, 26
<223> n = A, T, C или G
<400> 26
acacgacgct cttccgatct nnnnnn 26
<210> 27
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "short P5" (короткий P5) обратный праймер
<400> 27
acacgacgct cttccgatct 20
<210> 28
<211> 64
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C7-index-P7 прямой праймер
<220>
<221> прочий_признак
<222> 25, 26, 27, 28, 29, 30
<223> n = A, T, C или G
<400> 28
caagcagaag acggcatacg agatnnnnnn gtgactggag ttcagacgtg tgctcttccg 60
atct 64
<210> 29
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность обратного праймера константной области IgG
<400> 29
aagtagtcct tgaccaggca gc 22
<210> 30
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность обратного праймера константной области IgL
<400> 30
ggcttgaagc tcctcagagg a 21
<210> 31
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность обратного праймера константной области IgK
<400> 31
aggcacacaa cagaggcagt tc 22
<210> 32
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность обратного праймера константной области IgM
<400> 32
cgacggggaa ttctcacagg ag 22
<210> 33
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность обратного праймера константной области IgD
<400> 33
tgtctgcacc ctgatatgat gg 22
<210> 34
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность обратного праймера константной области 1 IgA
<400> 34
gggtgctgca gaggctcag 19
<210> 35
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность обратного праймера константной области 2 IgA
<400> 35
gggtgctgtc gaggctcag 19
<210> 36
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность обратного праймера константной области IgE
<400> 36
ggaatgtttt tgcagcagcg gg 22
<210> 37
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность обратного праймера константной области TRA
<400> 37
agtctctcag ctggtacacg g 21
<210> 38
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность обратного праймера константной области TRB
<400> 38
atggctcaaa cacagcgacc tc 22
<210> 39
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C7
<400> 39
caagcagaag acggcatacg agat 24
<210> 40
<211> 38
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgG мишень-специфичного обратного праймера
c меченым адаптером
<400> 40
acacgacgct cttccgatct ccagggggaa gacsgatg 38
<210> 41
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgG мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21
<223> n = A, T, C или G
<400> 41
acacgacgct cttccgatct nccaggggga agacsgatg 39
<210> 42
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgG мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22
<223> n = A, T, C или G
<400> 42
acacgacgct cttccgatct nnccaggggg aagacsgatg 40
<210> 43
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgG мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22, 23
<223> n = A, T, C или G
<400> 43
acacgacgct cttccgatct nnnccagggg gaagacsgat g 41
<210> 44
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgA adapter-tagged target-specific reverse primer
sequence
<400> 44
acacgacgct cttccgatct ggctcagcgg gaagaccttg 40
<210> 45
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgA мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21
<223> n = A, T, C или G
<400> 45
acacgacgct cttccgatct nggctcagcg ggaagacctt g 41
<210> 46
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgA мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22
<223> n = A, T, C или G
<400> 46
acacgacgct cttccgatct nnggctcagc gggaagacct tg 42
<210> 47
<211> 43
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgA мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22, 23
<223> n = A, T, C или G
<400> 47
acacgacgct cttccgatct nnnggctcag cgggaagacc ttg 43
<210> 48
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgE мишень-специфичного обратного праймера
c меченым адаптером
<400> 48
acacgacgct cttccgatct gggaagacgg atgggctctg 40
<210> 49
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgE мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21
<223> n = A, T, C или G
<400> 49
acacgacgct cttccgatct ngggaagacg gatgggctct g 41
<210> 50
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgE мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22
<223> n = A, T, C или G
<400> 50
acacgacgct cttccgatct nngggaagac ggatgggctc tg 42
<210> 51
<211> 43
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgE мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22, 23
<223> n = A, T, C или G
<400> 51
acacgacgct cttccgatct nnngggaaga cggatgggct ctg 43
<210> 52
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgM мишень-специфичного обратного праймера
c меченым адаптером
<400> 52
acacgacgct cttccgatct gagacgaggt ggaaaagggt tg 42
<210> 53
<211> 43
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgM мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21
<223> n = A, T, C или G
<400> 53
acacgacgct cttccgatct ngagacgagg tggaaaaggg ttg 43
<210> 54
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgM мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22
<223> n = A, T, C или G
<400> 54
acacgacgct cttccgatct nngagacgag gtggaaaagg gttg 44
<210> 55
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgM мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22, 23
<223> n = A, T, C или G
<400> 55
acacgacgct cttccgatct nnngagacga ggtggaaaag ggttg 45
<210> 56
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgD мишень-специфичного обратного праймера
c меченым адаптером
<400> 56
acacgacgct cttccgatct ggaacacatc cggagccttg 40
<210> 57
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgD мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21
<223> n = A, T, C или G
<400> 57
acacgacgct cttccgatct nggaacacat ccggagcctt g 41
<210> 58
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgD мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22
<223> n = A, T, C или G
<400> 58
acacgacgct cttccgatct nnggaacaca tccggagcct tg 42
<210> 59
<211> 43
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgD мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22, 23
<223> n = A, T, C или G
<400> 59
acacgacgct cttccgatct nnnggaacac atccggagcc ttg 43
<210> 60
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgL мишень-специфичного обратного праймера
c меченым адаптером
<400> 60
acacgacgct cttccgatct agggygggaa cagagtgac 39
<210> 61
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgL мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21
<223> n = A, T, C или G
<400> 61
acacgacgct cttccgatct nagggyggga acagagtgac 40
<210> 62
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgL мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22
<223> n = A, T, C или G
<400> 62
acacgacgct cttccgatct nnagggyggg aacagagtga c 41
<210> 63
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgL мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22, 23
<223> n = A, T, C или G
<400> 63
acacgacgct cttccgatct nnnagggygg gaacagagtg ac 42
<210> 64
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgK мишень-специфичного обратного праймера
c меченым адаптером
<400> 64
acacgacgct cttccgatct gacagatggt gcagccacag 40
<210> 65
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgK мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21
<223> n = A, T, C или G
<400> 65
acacgacgct cttccgatct ngacagatgg tgcagccaca g 41
<210> 66
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgK мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22
<223> n = A, T, C или G
<400> 66
acacgacgct cttccgatct nngacagatg gtgcagccac ag 42
<210> 67
<211> 43
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность IgK мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22, 23
<223> n = A, T, C или G
<400> 67
acacgacgct cttccgatct nnngacagat ggtgcagcca cag 43
<210> 68
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность TRA мишень-специфичного обратного праймера
c меченым адаптером
<400> 68
acacgacgct cttccgatct cacggcaggg tcagggttc 39
<210> 69
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность TRA мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21
<223> n = A, T, C или G
<400> 69
acacgacgct cttccgatct ncacggcagg gtcagggttc 40
<210> 70
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность TRA мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22
<223> n = A, T, C или G
<400> 70
acacgacgct cttccgatct nncacggcag ggtcagggtt c 41
<210> 71
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность TRA мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22, 23
<223> n = A, T, C или G
<400> 71
acacgacgct cttccgatct nnncacggca gggtcagggt tc 42
<210> 72
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность TRB мишень-специфичного обратного праймера
c меченым адаптером
<400> 72
acacgacgct cttccgatct cgacctcggg tgggaacac 39
<210> 73
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность TRB мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21
<223> n = A, T, C или G
<400> 73
acacgacgct cttccgatct ncgacctcgg gtgggaacac 40
<210> 74
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность TRB мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22
<223> n = A, T, C или G
<400> 74
acacgacgct cttccgatct nncgacctcg ggtgggaaca c 41
<210> 75
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность TRB мишень-специфичного обратного праймера
c меченым адаптером
<220>
<221> прочий_признак
<222> 21, 22, 23
<223> n = A, T, C или G
<400> 75
acacgacgct cttccgatct nnncgacctc gggtgggaac ac 42
<210> 76
<211> 53
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C5-P5 обратный праймер
<400> 76
aatgatacgg cgaccaccga gatctacact ctttccctac acgacgctct tcc 53
<210> 77
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> P7 сайт праймирования (C7)
<400> 77
agatcggaag agcacacgtc tgaactcca 29
<210> 78
<211> 58
<212> ДНК
<213> Искусственная последовательность
<220>
<223> P5 сайт праймирования
<400> 78
agatcggaag agcgtcgtgt agggaaagag tgtagatctc ggtggtcgcc gtatcatt 58
<210> 79
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Универсальный адаптер
<220>
<221> прочий_признак
<222> 21, 22, 23, 24, 25, 26
<223> n = A, T, C или G
<400> 79
acacgacgct cttccgatct nnnnnn 26
<210> 80
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Универсальный адаптер
<220>
<221> прочий_признак
<222> 1, 2, 3, 4, 6, 7, 8, 9, 11, 12, 13, 14
<223> n = A, T, C или G
<400> 80
nnnnwnnnnw nnnn 14
<210> 81
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Универсальный адаптер
<220>
<221> прочий_признак
<222> 2, 3, 4, 5, 7, 8, 9, 10, 12, 13, 14, 15
<223> n = A, T, C или G
<400> 81
wnnnnwnnnn wnnnn 15
<210> 82
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Универсальный адаптер
<220>
<221> прочий_признак
<222> 1, 3, 4, 5, 7, 8, 9, 10, 12, 13, 14, 15
<223> n = A, T, C или G
<400> 82
nwnnnwnnnn wnnnn 15
<210> 83
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Универсальный адаптер
<220>
<221> прочий_признак
<222> 1, 2, 4, 5, 6, 7, 9, 10, 11, 12, 14, 15, 16, 17
<223> n = A, T, C или G
<400> 83
nnwnnnnwnn nnwnnnn 17
<210> 84
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgM-RT праймер
<220>
<221> модифицированное основание
<222> 1
<223> биотин-модифицированный тимин
<400> 84
tgtgaggtgg ctgcgtactt g 21
<210> 85
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG-RT праймер
<220>
<221> модифицированное основание
<222> 1
<223> биотин-модифицированный аденин
<400> 85
aggacagccg ggaaggtgt 19
<210> 86
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgD-RT праймер
<220>
<221> модифицированное основание
<222> 1
<223> биотин-модифицированный цитозин
<400> 86
cacgcatttg tactcgcctt g 21
<210> 87
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgA-RT праймер
<220>
<221> модифицированное основание
<222> 1
<223> биотин-модифицированный цитозин
<400> 87
ctggctrggt gggaagtttc t 21
<210> 88
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgE-RT праймер
<220>
<221> модифицированное основание
<222> 1
<223> биотин-модифицированный гуанин
<400> 88
ggtggcatag tgaccagaga 20
<210> 89
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgK-RT праймер
<220>
<221> модифицированное основание
<222> 1
<223> биотин-модифицированный тимин
<400> 89
tattcagcag gcacacaaca ga 22
<210> 90
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgL-RT праймер
<220>
<221> модифицированное основание
<222> 1
<223> биотин-модифицированный аденин
<400> 90
agtgtggcct tgttggcttg 20
<210> 91
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TCR-A-RT праймер
<220>
<221> модифицированное основание
<222> 1
<223> биотин-модифицированный гуанин
<400> 91
gggagatctc tgcttctgat g 21
<210> 92
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TCR-B-RT праймер
<220>
<221> модифицированное основание
<222> 1
<223> биотин-модифицированный гуанин
<400> 92
ggtgaatagg cagacagact tg 22
<210> 93
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CD4-RT праймер
<220>
<221> модифицированное основание
<222> 1
<223> биотин-модифицированный гуанин
<400> 93
ggcagtcaat ccgaacact 19
<210> 94
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CD-8-RT праймер
<220>
<221> модифицированное основание
<222> 1
<223> биотин-модифицированный цитозин
<400> 94
ctacaaagtg ggcccttctg 20
<210> 95
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CD4-вложенный праймер
<400> 95
acacgacgct cttccgatct tgtggccttg ccgagggagg 40
<210> 96
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CD8-вложенный праймер
<400> 96
acacgacgct cttccgatct tgcggaatcc cagagggcca 40
<210> 97
<211> 64
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C7-bc-P7 праймер
<220>
<221> прочий_признак
<222> 25, 26, 27, 28, 29, 30
<223> n = A, T, C или G
<400> 97
caagcagaag acggcatacg agatnnnnnn gtgactggag ttcagacgtg tgctcttccg 60
atct 64
<210> 98
<211> 58
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C5-P5 праймер
<400> 98
aatgatacgg cgaccaccga gatctacact ctttccctac acgacgctct tccgatct 58
<210> 99
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность штрих-кода носителя
<220>
<221> прочий_признак
<222> 1, 2, 3, 4, 6, 7, 8, 9, 11, 12, 13, 14, 16, 17, 18, 19
<223> n = A, T, C или G
<400> 99
nnnnwnnnnw nnnnwnnnnw 20
<210> 100
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность штрих-кода носителя
<220>
<221> прочий_признак
<222> 1, 2, 3, 4, 6, 9, 10, 11, 13, 16, 17, 18
<223> n = A, T, C или G
<400> 100
nnnnwnscnn nwnscnnn 18
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТЫ АФФИННАЯ ЧАСТЬ-ОЛИГОНУКЛЕОТИД И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2778754C2 |
| ИДЕНТИФИКАЦИЯ АССОЦИИРОВАННЫХ С ОБРАЗЦОМ ПОЛИНУКЛЕОТИДОВ | 2012 |
|
RU2644681C2 |
| КОНЪЮГАТЫ АФФИННАЯ МОЛЕКУЛА-ОЛИГОНУКЛЕОТИД И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2763554C2 |
| ТРАНСПОЗИЦИЯ С СОХРАНЕНИЕМ СЦЕПЛЕНИЯ ГЕНОВ | 2015 |
|
RU2736728C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНОЕ СЕКВЕНИРОВАНИЕ ОДИНОЧНОЙ КЛЕТКИ СО СНИЖЕННОЙ ОШИБКОЙ АМПЛИФИКАЦИИ | 2019 |
|
RU2833615C2 |
| АНАЛИЗ МНОЖЕСТВА АНАЛИТОВ С ИСПОЛЬЗОВАНИЕМ ОДНОГО АНАЛИЗА | 2019 |
|
RU2824049C2 |
| СПОСОБЫ ИНКАПСУЛИРОВАНИЯ ОДИНОЧНЫХ КЛЕТОК, ИНКАПСУЛИРОВАННЫЕ КЛЕТКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2750567C2 |
| СИСТЕМА АНАЛИЗА ДЛЯ ОРТОГОНАЛЬНОГО ДОСТУПА К БИОМОЛЕКУЛАМ И ИХ МЕЧЕНИЯ В КЛЕТОЧНЫХ КОМПАРТМЕНТАХ | 2017 |
|
RU2771892C2 |
| СПОСОБЫ ИНКАПСУЛИРОВАНИЯ ОДИНОЧНЫХ КЛЕТОК, ИНКАПСУЛИРОВАННЫЕ КЛЕТКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2793717C2 |
| ПРЯМОЙ ЗАХВАТ, АМПЛИФИКАЦИЯ И СЕКВЕНИРОВАНИЕ ДНК-МИШЕНИ С ИСПОЛЬЗОВАНИЕМ ИММОБИЛИЗИРОВАННЫХ ПРАЙМЕРОВ | 2011 |
|
RU2565550C2 |

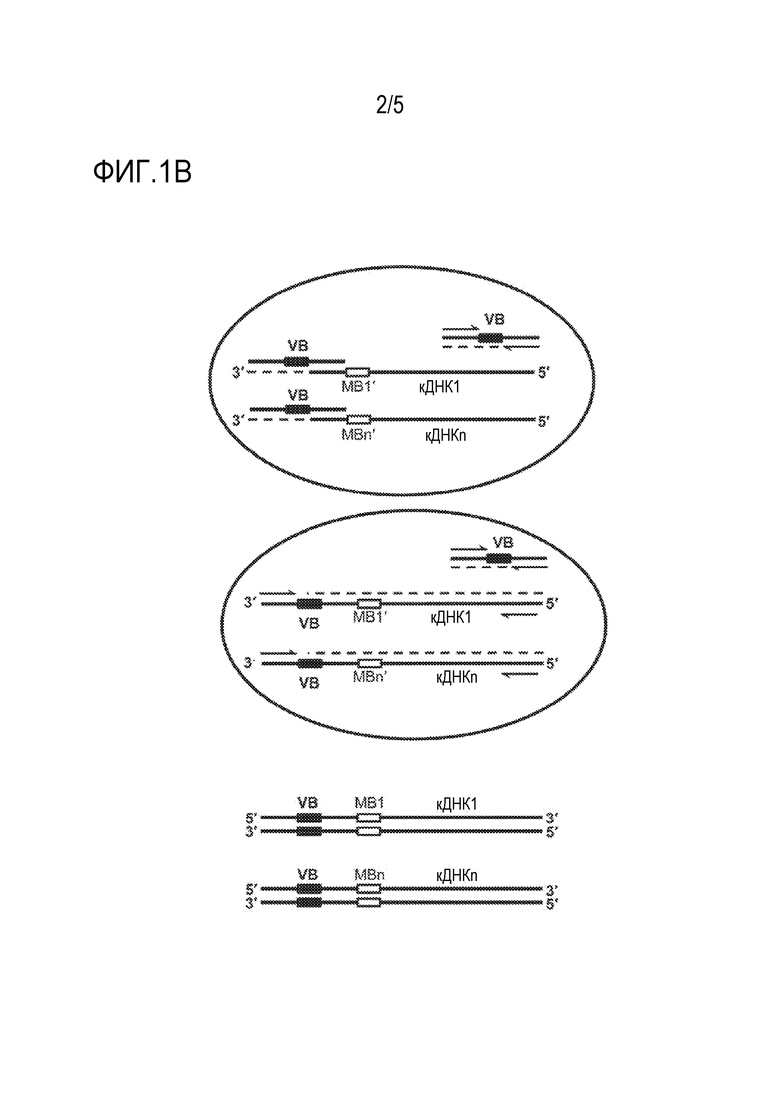

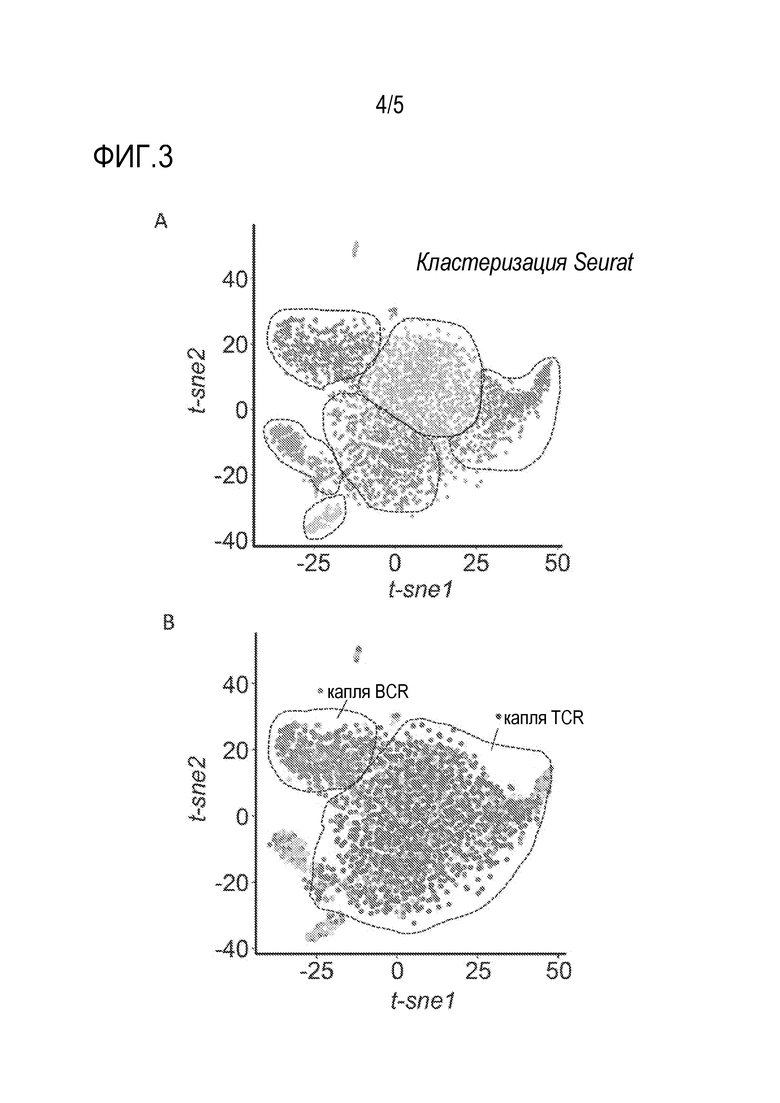

Изобретение относится к области биотехнологии. Представлен способ получения полинуклеотидной библиотеки. Также представлена полинуклеотидная библиотека, содержащая множество штрихкодированных полинуклеотидов, полученных указанным способом. Библиотека используется для секвенирования одного или нескольких из множества полинуклеотидов-мишеней. Кроме того, изобретение относится к способу секвенирования и способам анализа транскриптома. Изобретение может быть использовано для осуществления транскриптомного секвенирования, например РНК-секвенирования, для получения картины транскриптома отдельных клеток в сочетании с полноразмерными последовательностями иммунного рецептора, таким образом, что можно получить информацию об иммунном репертуаре и транскриптоме клетки. 6 н. и 131 з. п. ф-лы, 5 ил., 5 табл., 8 пр.
1. Способ получения полинуклеотидной библиотеки, включающий:
(а) лизирование клеток в каждом из множества носителей, где каждый из указанных носителей содержит клетку, принадлежащую популяции клеток, и дополнительно содержит множество олигонуклеотидов, несущих молекулярной штрихкод, единичный олигонуклеотид или пул олигонуклеотидов со штрихкодом носителя и первый адаптер или пул первых адаптеров;
(b) продуцирование в каждом носителе множества комплементарных полинуклеотидных транскриптов, причем указанное продуцирование включает:
(i) продуцирование одного или нескольких полинуклеотидов-мишеней, комплементарных одному или нескольким полинуклеотидам-мишеням, присутствующим в клетке, с использованием одного или нескольких специфичных для мишени праймеров; и
(ii) создание коллекции полинуклеотидов, каждый из которых является индивидуально комплементарным полинуклеотидному транскрипту в клетке;
(c) присоединение к множеству комплементарных полинуклеотидов одного из множества олигонуклеотидов, несущих молекулярный штрихкод, тем самым генерируя множество полинуклеотидов с молекулярным штрихкодом, каждый из которых содержит молекулярный штрихкод;
(d) присоединение одного из единичного олигонуклеотида или пула олигонуклеотидов, несущих штрихкод носителя или их амплифицированного продукта и первого адаптера или одного из пула первых адаптеров или амплифицированного продукта таковых ко множеству полинуклеотидов с молекулярным штрихкодом, тем самым генерируя множество полинуклеотидов с двойным штрихкодом;
(e) получение одноцепочечного ампликона из множества полинуклеотидов с двойным штрихкодом; и
(f) добавление второго адаптера к каждому из одноцепочечных ампликонов, где первый адаптер и второй адаптер присутствуют на или около противоположных концов каждого из одноцепочечных полинуклеотидов с двойным штрихкодом,
где первый адаптер и/или второй адаптер содержит по меньшей мере один универсальный сайт праймирования.
2. Способ по п. 1, в котором коллекцию полинуклеотидов в (ii) получают при использовании случайных олигопраймеров.
3. Способ по п. 1 или 2, в котором молекулярный штрихкод каждого из молекулярных штрихкодированных полинуклеотидов отличается от молекулярных штрихкодов, содержащихся в других молекулярных штрихкодированных полинуклеотидах данного множества.
4. Способ по любому из пп. 1-3, в котором молекулярный штрихкод каждого из молекулярных штрихкодированных полинуклеотидов представляет собой уникальный молекулярный штрихкод.
5. Способ по любому из пп. 1-3, в котором на стадии (d) генерируют одноцепочечные полинуклеотиды с двумя штрихкодами, каждый из которых содержит молекулярный штрихкод и штрихкод носителя, причем каждый из полинуклеотидов с двойным штрихкодами одного и того же носителя содержит тот же самый штрихкод носителя.
6. Способ по любому из пп. 1-5, включающий:
(а) лизирование клеток в каждом из множества носителей, где каждый из указанных носителей содержит клетку из образца, содержащего популяцию клеток, множество олигонуклеотидов с молекулярным штрихкодом, единичный олигонуклеотид или пул олигонуклеотидов с штрихкодом носителя и первый адаптер или пул первых адаптеров;
(b) продуцирование в каждом носителе множества комплементарных полинуклеотидных транскриптов, причем указанное продуцирование указанного множества комплементарных полинуклеотидов включает (i) продуцирование одного или нескольких полинуклеотидов-мишеней, комплементарных одному или нескольким целевым полинуклеотидным транскриптам, присутствующим в клетке; и (ii) создание коллекции полинуклеотидов, каждый из которых по отдельности комплементарен полинуклеотидному транскрипту в клетке;
(c) присоединение к каждому комплементарному полинуклеотиду одного из множества олигонуклеотидов, несущих молекулярный штрихкод, тем самым генерируя множество полинуклеотидов со штрихкодом, каждый из которых содержит уникальный молекулярный штрихкод;
(d) присоединение одного из единичного олигонуклеотида или пула олигонуклеотидов, несущих штрихкод носителя, или амплифицированного продукта таковых и первого адаптера или одного из пула первых адаптеров или их амплифицированного продукта к каждому из штрихкодированных полинуклеотидов, тем самым генерируя множество полинуклеотидов с двойным штрихкодами, необязательно одноцепочечных полинуклеотидов с двойным штрихкодом, где каждый из полинуклеотидов с двойным штрихкодом содержит молекулярный штрихкод и штрихкод носителя и где каждый из полинуклеотидов с двойным штрихкодом, принодлежащих одному носителю, содержит тот же самый и тот же штрихкод носителя;
(е) получение одноцепочечного ампликона каждого из множества полинуклеотидов с двумя штрихкодами; и
(f) добавление второго адаптера к каждому из одноцепочечных ампликонов, тем самым добавляя второй адаптер к одноцепочечному полинуклеотиду с двойным штрихкодом, где первый адаптер и второй адаптер присутствуют на или около противоположных концов каждого из одноцепочечных полинуклеотидов с двойным штрихкодами.
7. Способ по любому из пп. 1-6, где первый адаптер включает олигонуклеотид со штрихкодом.
8. Способ по любому из пп. 1-7, в котором коллекция полинуклеотидов из каждой клетки, принадлежащей популяции клеток, в совокупности включает последовательности, комплементарные транскриптам транскриптома или частичного транскриптома клетки.
9. Способ по п. 8, в котором транскриптом или частичный транскриптом включает по меньшей мере 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% транскриптов, присутствующих в геноме клетки.
10. Способ по любому из пп. 1-9, в котором один или несколько полинуклеотидов-мишеней из (i) и/или полинуклеотидов из (ii), на основе которых получены ампликон (i) и/или ампликон (II), является/происходят из ДНК.
11. Способ по любому из пп. 1-10, в котором один или несколько полинуклеотидов-мишеней из (i) и/или полинуклеотидов из (ii), на основе которых получены ампликон (i) и/или ампликон (II), является/происходит из РНК.
12. Способ по п. 11, в котором РНК представляет собой мРНК.
13. Способ по любому из пп. 1-12, в котором каждый из единичного или нескольких комплементарных полинуклеотидов из (b) представляет собой кДНК.
14. Способ по любому из пп. 1-13, в котором каждый из единичного или нескольких штрихкодированных одноцепочечных полинуклеотидов представляет собой цепь кДНК.
15. Способ по любому из пп. 1-14, в котором первый адаптер и/или второй адаптер содержит по меньшей мере один универсальный сайт праймирования.
16. Способ по любому из пп. 1-15, в котором:
первый адаптер и второй адаптер отличаются; и/или
первый адаптер содержит первый универсальный праймирующий сайт, а второй адаптер содержит второй универсальный праймирующий сайт, где, необязательно, первый универсальный праймирующий сайт и второй универсальный праймирующий сайт различны.
17. Способ по п. 16, в котором первый универсальный праймирующий сайт и/или второй универсальный праймирующий сайт представляет собой или содержит праймирующий сайт P7(C7) или непрерывную часть такового или праймирующий сайт P5 (C5) или непрерывную часть такового, и где, необязательно, непрерывная часть таковых достаточна для отжига комплементарной последовательности.
18. Способ по п. 16 или 17, в котором первый универсальный праймирующий сайт представляет собой или содержит праймирующий сайт P7(C7) или его непрерывную часть, а второй универсальный праймирующий сайт представляет собой или содержит праймирующий сайт P5(C5) или его непрерывную часть.
19. Способ по п. 17 или 18, в котором сайт праймирования P7(C7) содержит последовательность AGATCGGAAGAGCACACGTCTGAACTCCA (SEQ ID NO: 77) или представляет собой ее непрерывную часть.
20. Способ по п. 17 или 18, отличающийся тем, что праймирующий сайт Р5 содержит последовательность AGATCGGAAGAGCGTCGTGTAGGGAAAGAGTGTAGATCTCGGTGGTCGCCGTATCATT (SEQ ID NO: 78) или представляет собой его непрерывную часть.
21. Способ по любому из пп. 17-20, в котором непрерывная часть содержит по меньшей мере или по меньшей мере примерно 15, 20, 25 или 30 нуклеотидов в длину.
22. Способ по любому из пп. 17, 18, 19 или 20, в котором сайт праймирования P5 представляет собой непрерывную часть, указанную в SEQ ID NO: 25 (AGATCGGAAGAGCGTCGTGT).
23. Способ по любому из пп. 1-22, в котором добавление второго адаптера включает гибридизацию шарнирного (splint) олигонуклеотида с каждым из одноцепочечных полинуклеотидов со штрихкодом в присутствии олигонуклеотида, содержащего второй универсальный праймирующий сайт, и где шарнирный (splint) олигонуклеотид содежит (i) последовательность, комплементарную второму универсальному праймирующему сайту, и (ii) вырожденную последовательность выступа, способную случайным образом отжигаться с 3'-концом одноцепочечного полинуклеотида со штрихкодом.
24. Способ по п. 23, в котором перед гибридизацией шарнирный (splint) олигонуклеотид и олигонуклеотид, содержащий второй универсальный праймирующий сайт, отжигают с образованием дуплекса адаптера с шарнирным олигонуклеотидом.
25. Способ по п. 23 или 24, в котором вырожденная последовательность выступа содержит последовательность (N)3-12, где N представляет собой любой нуклеотид.
26. Способ по любому из пп. 23-25, в котором вырожденная последовательность выступа содержит последовательность NNNNNN, где N представляет собой любой нуклеотид (SEQ ID NO: 24).
27. Способ по любому из пп. 23-26, где шарнирный (splint) олигонуклеотид содержит последовательность ACACGACGCTCTTCCGATCTNNNNNN, где N представляет собой любую аминокислоту (SEQ ID NO: 26).
28. Способ по любому из пп. 23-27, где олигонуклеотид, содержащий второй универсальный сайт праймирования, содержит последовательность AGATCGGAAGAGCGTCGTGT (SEQ ID NO: 25).
29. Способ по любому из пп. 1-28, в котором олигонуклеотид со штрихкодом носителя содержит по меньшей мере или по меньшей мере приблизительно 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40 или 50 нуклеотидов.
30. Способ по любому из пп. 1-29, в котором олигонуклеотид со штрихкодом носителя содержит от или приблизительно от 10 до 30 нуклеотидов.
31. Способ по любому из пп. 1-30, в котором олигонуклеотид со штрихкодом носителя содержит вырожденную последовательность.
32. Способ по любому из пп. 1-31, в котором олигонуклеотид со штрихкодом носителя содержит последовательность (N)14-17, где N представляет собой любой нуклеотид и где, необязательно, по меньшей мере один или два N в последовательности представляют собой W, где W представляет собой аденин или тимин.
33. Способ по любому из пп. 1-32, в котором олигонуклеотид со штрихкодом носителя содержит последовательность NNNNWNNNNWNNNN (SEQ ID NO:80), WNNNNWNNNNWNNNN (SEQ ID NO:81), NWNNNWNNNNWNNNN (SEQ ID NO:82) или NNWNNNNWNNNNWNNNN (SEQ ID NO:83), где N представляет собой любой нуклеотид, а W представляет собой аденин или тимин.
34. Способ по любому из пп. 1-33, в котором каждый носитель содержит пул первых адаптеров, содержащий пул олигонуклеотидов со штрихкодом носителя, причем каждый олигонуклеотид со штрихкодом носителя пула первых адаптеров содержит по меньшей мере один сдвиг по основанию или добавленное основание, по сравнению с по меньшей мере одним другим из олигонуклеотидов со штрихкодом носителя.
35. Способ по п. 34, где олигонуклеотиды со штрихкодом носителя пула первых адаптеров содержат последовательности NNNNWNNNNWNNNN (SEQ ID NO:80), WNNNNWNNNNWNNNN (SEQ ID NO:81), NWNNNWNNNNWNNNN (SEQ ID NO:82) и NNWNNNNWNNNNWNNNN (SEQ ID NO:83), где N представляет собой любой нуклеотид, а W представляет собой аденин или тимин.
36. Способ по любому из пп. 1-35, в котором на стадии (d) способ дополнительно включает амплификацию:
единичного олигонуклеотида или пула олигонуклеотидов со штрихкодом носителя; или
единичного адаптера или пула первых адаптеров, где первые адаптеры включают единичный олигонуклеотид или пул олигонуклеотидов, несущих штрихкод носителя, где:
амплификацию проводят до или одновременно с прикреплением олигонуклеотида со штрихкодом носителя.
37. Способ по любому из пп. 1-36, в котором присоединение олигонуклеотида со штрихкодом носителя включает гибридизацию области олигонуклеотида, несущего штрихкод носителя, с областью каждого из комплементарных полинуклеотидов или с областью каждого из полинуклеотидов с молекулярным штрихкодом.
38. Способ по п. 37, в котором такая область содержит 3'-маркированый/меченый полинуклеотид, комплементарный 3'-концевой области молекулярного штрихкода полинуклеотидов, несущих молекулярный штрихкод.
39. Способ по любому из пп. 1-38, в котором на стадии (b):
один или несколько полинуклеотидов-мишеней получают путем обратной транскрипции полинуклеотида(ов)-мишени(ей) в присутствии обратной транскриптазы и одного или нескольких мишень-специфичных праймеров, комплементарных целевой последовательности полинуклеотида(ов)-мишени(ей); и/или
коллекцию полинуклеотидов получают путем обратной транскрипции полинуклеотидных транскриптов в клетке в присутствии обратной транскриптазы и одного или нескольких праймеров транскриптома, комплементарных полинуклеотидному транскрипту в клетке.
40. Способ по любому из пп. 1-39, в котором один или несколько полинуклеотидов-мишеней представляют собой полинуклеотид иммунной молекулы или ее цепи.
41. Способ по любому из пп. 1-40, в котором один или несколько полинуклеотидов-мишеней включают по меньшей мере два полинуклеотида-мишени, каждый из которых представляет собой полинуклеотид цепи иммунной молекулы.
42. Способ по любому из пп. 1-41, в котором один или несколько полинуклеотидов-мишеней включают полинуклеотид TCR или его цепь.
43. Способ по любому из пп. 1-42, в котором один или несколько полинуклеотидов-мишеней включают первый полинуклеотид, полинуклеотид альфа-рецептора Т-клеток (TCRα) и второй полинуклеотид рецептора Т-клеток (TCRβ).
44. Способ по любому из пп. 1-42, в котором один или несколько полинуклеотидов-мишеней включают первый полинуклеотид-полинулеотид гамма-рецептора Т-клеток (TCRγ) и второй полинуклеотид, полинуклеотид дельта рецептора Т-клеток (TCRdelta; TCRδ).
45. Способ по любому из пп. 1-41, в котором один или несколько полинуклеотидов-мишеней включают полинуклеотид антитела или его цепи.
46. Способ по любому из пп. 1-41 и 45, в котором один или несколько полинуклеотидов-мишеней включают первый полинуклеотид полинуклеотида тяжелой цепи иммуноглобулина (IgH) и второй полинуклеотид полинуклеотида легкой цепи иммуноглобулина (IgL).
47. Способ по любому из пп. 39-46, в котором один или несколько мишень-специфичных праймеров и/или один или несколько транскриптомных праймеров содержат poly(T) последовательность.
48. Способ по любому из пп. 39-46, в котором один или несколько транскриптомных праймеров включают смесь случайных гексамерных олигонуклеотидных праймеров.
49. Способ по любому из пп. 39-48, в котором один или несколько мишень-специфичных праймеров содержат один или несколько праймеров, комплементарных целевым последовательности(тям) полинуклеотида-мишени.
50. Способ по п. 49, в котором один или несколько мишень-специфичных праймеров включают по меньшей мере первый праймер и второй праймер.
51. Способ по п. 49 или 50, в котором один или несколько мишень-специфичных праймеров включают по меньшей мере праймеры к последовательности-мишени множества полинуклеотидов-мишеней, каждый из которых кодирует иммунную молекулу или ее цепь.
52. Способ по п. 51, где иммунная молекула представляет собой рецептор Т-клетки или антитело.
53. Способ по любому из пп. 50-52, в котором по меньшей мере первый праймер комплементарен последовательности-мишени полинуклеотида первой цепи иммунной молекулы, а второй праймер является комплементарным последовательности-мишени полинуклеотида второй цепи иммунной молекулы.
54. Способ по любому из пп. 50-53, в котором первый и второй праймеры являются комплементарными последовательности-мишени различных цепей TCR полинуклеотидов TCR.
55. Способ по любому из пп. 50-54, в котором:
первый праймер является комплементарным последовательности-мишени полинуклеотидной последовательности TCRalpha, а второй праймер является комплементарным последовательности-мишени полинуклеотидной последовательности TCRbeta; или
первый праймер является комплементарным последовательности-мишени полинуклеотидной последовательности TCRgamma, а второй праймер является комплементарным последовательности-мишени полинуклеотидной последовательности TCR-дельта.
56. Способ по п. 54 или 55, в котором последовательность-мишень полинуклеотидов цепей TCR представляет собой последовательность константной области.
57. Способ по любому из пп. 50-56, в котором:
первый праймер является комплементарным последовательности-мишени константной области полинуклеотидной последовательности TCR-альфа, а второй праймер является комплементарным последовательности-мишени константной области полинуклеотидной последовательности TCR-бета; или
первый праймер является комплементарным последовательности-мишени константной области полинуклеотидной последовательности TCRgamma, а второй праймер является комплементарным последовательности-мишени константной области полинуклеотидной последовательности TCR-дельта.
58. Способ по любому из пп. 50-53, в котором по меньшей мере первый и второй праймеры комплементарны последовательностям-мишеням полинуклеотидов различных цепей, принадлежащих антителу.
59. Способ по любому из пп. 50-53 и 58, в котором первый праймер комплементарен последовательности-мишени полинуклеотидной последовательности тяжелой цепи иммуноглобулина (IgH), а второй праймер является комплементарным последовательности-мишени полинуклеотидной последовательности легкой цепи иммуноглобулина (IgL).
60. Способ по п. 58 или 59, в котором последовательность-мишень полинуклеотидов последовательности цепи антитела представляет собой последовательность константной области.
61. Способ по любому из пп. 50-53 и 58-60, где первый праймер является комплементарным последовательности-мишени константной области (CH) последовательности полинуклеотида тяжелой цепи, а второй праймер является комплементарным последовательности-мишени константной области (СL) полинуклеотидной последовательности легкой цепи.
62. Способ по п. 60 или 61, в котором
последовательность-мишень полинуклеотида CH происходит из IgM, IgD, IgA, IgE или IgG или их комбинации; и/или
последовательность-мишень полинуклеотидной последовательности CL происходит из Igkappa, Iglambda или их комбинаций.
63. Способ по любому из пп. 1-62, в котором один или несколько полинуклеотидов-мишеней содержат полноразмерную кодирующую последовательность.
64. Способ по пп. 1-63, в котором один или несколько полинуклеотидов-мишеней и коллекция полинуклеотида(ов) продуцируются в носителе в том же самом реакционном объеме.
65. Способ по любому из пп. 1-64, в котором на стадии (b) получение множества комплементарных полинуклеотидов включает использование нематричной терминальной трансферазы, и при этом три или более нематричных нуклеотида, рибонуклеотида или их аналогов добавляются к 3'-концу каждого продуцируемого комплементарного полинуклеотида.
66. Способ по п. 65, в котором нематричная терминальная трансфераза представляет собой обратную транскриптазу или полимеразу.
67. Способ по п. 65 или 66, в котором нематричная терминальная трансфераза представляет собой обратную транскриптазу, и где обратная транскриптаза выбрана из списка: обратная транскриптаза Superscript II, обратная транскриптаза Maxima, обратная транскриптаза Protoscript II, обратная транскриптаза вируса мышиного лейкоза Малони (MMLV-RT), обратная транскриптаза HighScriber, обратная транскриптаза вируса птичьего миелобластоза (AMV), любая обратная транскриптаза, обладающая терминальной активностью дезоксинуклеотидил-трансферазы, и комбинации таковых.
68. Способ по любому из пп. 1-67, в котором на стадии (с) присоединение включает гибридизацию области одного из множества олигонуклеотидов, несущих молекулярный штрихкод, с тремя или более нематричными нуклеотидами каждого из комплементарных полинуклеотидов.
69. Способ по п. 68, где множество олигонуклеотидов, несущих молекулярный штрихкод, предоставлено в виде множества олигонуклеотидов с переключением матрицы, каждый из которых содержит 3'-часть, комплементарную трем или более нематричным нуклеотидам.
70. Способ по п. 69, в котором олигонуклеотид переключения матрицы также содержит 5'-концевую область, комплементарную части первого адаптера, причем первый адаптер включает олигонуклеотид со штрихкодом носителя.
71. Способ по любому из пп. 39-70, в котором:
обратная транскриптаза обладает активностью переключения матрицы;
по меньшей мере некоторые цепи из множества продуцируемых комплементарных полинуклеотидов содержат 3'-выступ, содержащий три или более нематричных нуклеотида;
множество олигонуклеотидов, несущих молекулярный штрихкод, представлено в виде множества олигонуклеотидов с переключением матрицы, каждый из которых содержит (1) 5'-концевую область, комплементарную 3'-меченому олигонуклеотиду, содержащему первый адаптер и олигонуклеотид со штрихкодом носителя, (2) молекулярный штрихкод и (3) 3'-часть, комплементарную трем или более нематричным нуклеотидам 3'-выступа; и
олигонуклеотид переключения матрицы служит матрицей для обратной транскриптазы, так что молекулярный штрихкод включается в каждый комплементарный полинуклеотид для получения полинуклеотидов с молекулярным штрихкодом.
72. Способ по любому из пп. 69-71, в котором 3'-часть, комплементарная трем или более нематричным нуклеотидам, содержит нуклеотид, рибонуклеотид или аналог таковых.
73. Способ по любому из пп. 65-72, в котором три или более нематричных нуклеотида содержат три или более С-нуклеотида, а 3'-часть, комплементарная трем или более нематричным нуклеотидам, содержит один или несколько G-нуклеотидов или рибонуклеотид или аналог таковых.
74. Способ по любому из пп. 65-73, в котором олигонуклеотид с переключением матрицы дополнительно содержит 3'-модифицированный нуклеотид, который блокирует удлинение олигонуклеотида с переключением матрицы обратной транскриптазой или ДНК-полимеразой.
75. Способ по п. 74, где модификация представляет собой дезокси-, фосфатную, амино- или алкильную модификацию 3'-концевого нуклеотида.
76. Способ по любому из пп. 1-75, в котором стадия (d) дополнительно включает удлинение каждого из множества полинуклеотидов с молекулярным штрихкодом после присоединения для генерирования множества полинуклеотидов с двойным штрихкодом.
77. Способ по любому из пп. 1-76, в котором носитель представляет собой лунку, эмульсию, каплю или микрокапсулу.
78. Способ по любому из пп. 1-77, включающий объединение содержимого двух или более из множества носителей перед стадией (е), в результате чего образуется гомогенная смесь, содержащая два или более из множества одноцепочечных полинуклеотидов с двойным штрихкодом.
79. Способ по п. 78, в котором объединение содержимого множества носителей включает разрушение двух или более из множества носителей и объединение одноцепочечных полинуклеотидов с двойным штрихкодом из двух или более разрушенных носителей.
80. Способ по п. 78 или 79, включающий перед стадией (е) отбор или очистку одноцепочечных полинуклеотидов с двойным штрихкодом, имеющих размер более чем или более чем приблизительно 50 пар оснований, более чем 100 пар оснований или более чем 200 пар оснований.
81. Способ по любому из пп. 78-80, включающий перед стадией (е) отбор или очистку одноцепочечных полинуклеотидов с двойным штрихкодом, имеющих размер от или приблизительно от 50 пар оснований (н.п.) до 1500 н.п., от 50 н.п. до 1250 н.п., от 50 н.п. до 1000 н.п., от 50 н.п. до 750 н.п., от 50 н.п. до 500 н.п., от 100 н.п. до 1500 н.п., от 100 н.п. до 1250 н.п., от 100 н.п. до 1000 н.п., от 100 н.п. до 750 н.п., от 100 н.п. до 500 н.п., 200 н.п. до 1500 н.п., от 200 н.п. до 1250 н.п., от 200 н.п. до 1000 н.п., от 200 н.п. до 750 н.п. или от 250 н.п. до 500 н.п.
82. Способ по любому из пп. 1-81, в котором одноцепочечные полинуклеотиды с двойным штрихкодом содержат в порядке (от 5' до 3'): первый адаптер, штрихкод носителя, молекулярный штрихкод и второй адаптер.
83. Способ по любому из пп. 1-82, в котором первый адаптер расположен в или около 5'-области одноцепочечного штрихкодированного полинуклеотида, необязательно одноцепочечного полинуклеотида с двойным штрихкодом.
84. Способ по любому из пп. 1-83, в котором второй адаптер расположен в или около 3'-области одноцепочечного штрихкодированного полинуклеотида, необязательно одноцепочечного полинуклеотида с двойным штрихкодом.
85. Способ по любому из пп. 21-84, в котором одну или несколько стадий (а)-(f) проводят в растворе и/или не проводят в присутствии твердой подложки, где, необязательно, твердая подложка представляет собой или содержит гранулу.
86. Способ по любому из пп. 19-85, в котором по меньшей мере стадии (с) и (d) проводят в растворе и/или не проводят в присутствии твердой подложки, где, необязательно, твердая подложка представляет собой или содержит гранулу.
87. Способ по любому из пп. 20-86, в котором каждую из стадий (а)-(е) проводят в растворе и/или не проводят в присутствии твердой подложки, где, необязательно, твердая подложка представляет собой или содержит гранулу.
88. Способ по любому из пп. 1-87, в котором популяция клеток включает в себя по меньшей мере или по меньшей мере примерно 1х103, 5х103, 1х104, 5х104, 1х105, 5х105, 1х106 или 5х106 клеток.
89. Способ по любому из пп. 1-88, в котором популяция клеток происходит из биологического образца, полученного от субъекта.
90. Способ по п. 89, в котором биологический образец представляет собой или содержит образец цельной крови, образец лейкоцитарной оболочки, образец мононуклеарных клеток периферической крови (PBMC), образец нефракционированных Т-клеток, образец лимфоцитов, образец лейкоцитов, продукт афереза или продукт лейкафереза.
91. Способ по любому из пп. 1-90, где популяция клеток содержит иммунные клетки.
92. Способ по п. 91, где иммунные клетки включают лимфоциты или антиген-презентирующие клетки.
93. Способ по п. 91 или 92, где иммунная клетка представляет собой лимфоцит или его подтип, В-клетку или ее подтип, Т-клетку или ее подтип или комбинацию таковых.
94. Способ по п. 93, где иммунная клетка представляет собой Т-клетку, которая является CD4+ и/или CD8+ Т-клеткой.
95. Способ по любому из пп. 1-94, в котором популяция клеток обогащена или включает Т-клетки центральной памяти, Т-клетки эффекторной памяти, наивные Т-клетки, Т-клетки стволовой центральной памяти, Т-клетки эффектора и регуляторные Т-клетки.
96. Способ по любому из пп. 1-93, в котором популяция клеток обогащена B-клетками памяти, наивными B-клетками или B-клетками плазмобластов.
97. Способ по любому из пп. 89-96, в котором субъект является человеком.
98. Способ по любому из пп. 89-97, где у субъекта наблюдается рак, инфекция или аутоиммунное состояние.
99. Способ по п. 98, где инфекция представляет собой вирусную, бактериальную или грибковую инфекцию.
100. Способ по любому из пп. 1-99, дополнительно включающий амплификацию множества одноцепочечных полинуклеотидов со штрихкодом, тем самым генерируя множество полинуклеотидных матриц.
101. Способ по п. 100, в котором амплификацию множества одноцепочечных полинуклеотидов со штрихкодом проводят в присутствии первого набора праймеров, содержащего первый праймер, комплементарный первой последовательности адаптера, и второй праймер, комплементарный второй последовательности адаптера.
102. Способ по п. 101, в котором первый и/или второй праймер представляет собой универсальный праймер.
103. Способ по п. 102, в котором первый и/или второй праймер является комплементарным сайту праймирования P7(C7) или его непрерывной части или сайту праймирования P5(C5) или его непрерывной части.
104. Способ по п. 102 или 103, в котором первый праймер является комплементарным сайту праймера P7(C7) или его непрерывной части, а второй праймер является комплементарным сайту праймера P5(C5) или его непрерывной части.
105. Способ по п. 103 или 104, в котором
праймер, комплементарный сайту праймирования Р7(С7) или его непрерывной части, имеет или включает последовательность CAAGCAGAAGACGGCATACGAGAT (SEQ ID NO:39); и/или
праймер, комплементарный сайту праймирования Р5(С5) или его непрерывной части, включает последовательность ACACGACGCTCTTCCGATCT (SEQ ID NO:27).
106. Способ по любому из пп. 101-105, в котором первый и/или второй праймер дополнительно содержит(ат) адаптер для секвенирования.
107. Способ по п. 106, в котором
праймер, комплементарный сайту праймирования Р7(С7) или его непрерывной части, дополнительно содержит последовательность CAAGCAGAAGACGGCATACGAGAT[NNNNNN]GTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT (SEQ ID NO:28); и/или
праймер, комплементарный сайту праймера Р5(С5) или его непрерывной части, содержит последовательность AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCC (SEQ ID NO:76).
108. Способ по любому из пп. 1-107, дополнительно включающий очистку каждого из одноцепочечных штрихкодированных полинуклеотидов, необязательно одноцепочечных полинуклеотидов с двойным штрихкодом.
109. Полинуклеотидная библиотека, содержащая множество штрихкодированных полинуклеотидов, полученных в соответствии со способом по любому из пп. 1-108, для секвенирования одного или нескольких из множества полинуклеотидов-мишеней.
110. Способ секвенирования одного или нескольких полинуклеотидов-мишеней и/или полного или частичного транскриптома одной или нескольких клеток, включающий секвенирование одного или нескольких множеств полинуклеотидов с двойным штрихкодом, полученных в соответствии со способом по любому из пп. 1-108 или из полинуклеотидной библиотеки по п. 109.
111. Способ по п. 110, в котором полный или частичный транскриптом одной или нескольких клеток секвенируют.
112. Способ по п. 111, дополнительно включающий амплификацию полного транскриптома или его части перед секвенированием.
113. Способ по п. 112, в котором амплификацию проводят с использованием первого набора праймеров, содержащего первый праймер и второй праймер, специфичные для первой и второй последовательностей адаптера соответственно.
114. Способ по любому из пп. 110-113, в котором секвенируют один или несколько полинуклеотидов-мишеней из множества штрихкодированных полинуклеотидов.
115. Способ по п. 114, дополнительно включающий амплификацию одного или нескольких полинуклеотидов-мишеней из множества штрихкодированных полинуклеотидов перед секвенированием.
116. Способ по п. 115, в котором полноразмерную последовательность одного или нескольких полинуклеотидов-мишеней амплифицируют.
117. Способ по п. 115 или 116, в котором амплификацию проводят в присутствии второго набора праймеров, содержащего один или несколько первых праймеров, комплементарных одному или нескольким полинуклеотидам-мишеням, и второго праймера, комплементарного последовательности первого адаптера.
118. Способ по п. 117, в котором второй праймер из второго набора праймеров является комплементарным сайту праймирования P7 (C7) или его непрерывной части или сайту праймтрования P5 (C5) или его непрерывной части.
119. Способ по п. 117 или 118, в котором второй праймер из второго набора праймеров является комплементарным сайту праймирования P7(C7) или непрерывной части таковой.
120. Способ по любому из пп. 117-119, в котором второй праймер из второго набора праймеров представляет или содержит последовательность CAAGCAGAAGACGGCATACGAGAT (SEQ ID NO: 39) или CAAGCAGAAGACGGCATACGAGAT[NNNNNN]GTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT (SEQ ID NO:28).
121. Способ по любому из пп. 117-120, в котором один или несколько первых праймеров, комплементарных одному или нескольким полинуклеотидам, специфичны для последовательности-мишени иммунной молекулы или ее цепи.
122. Способ по п. 121, где иммунная молекула представляет собой рецептор Т-клетки или антитело.
123. Способ по п. 121 или 122, в котором один или несколько первых праймеров специфичны для последовательности-мишени константной области иммунной молекулы.
124. Способ по любому из пп. 121-123, в котором иммунная молекула представляет собой TCR, и один или несколько первых праймеров включают AGTCTCTCAGCTGGTACACGG (SEQ ID NO: 37), ATGGCTCAAACACAGCGACCTC (SEQ ID NO: 38) или их комбинацию.
125. Способ по любому из пп. 121-124, в котором иммунная молекула представляет собой антитело, и где один или несколько первых праймеров содержат любую из SEQ ID NO: 29-36 или их комбинацию.
126. Способ по любому из пп. 110-125, дополнительно включающий определение клеточного происхождения одного или нескольких штрихкодированных полинуклеотидов, необязательно полинуклеотидов с двойным штрихкодом.
127. Способ по п. 126, в котором определение клетки происхождения включает идентификацию последовательностей полинуклеотидов с двойным штрихкодом, имеющих тот же самый штрихкод носителя, что говорит о происхождении из той же самой же клетки.
128. Способ по п. 126 или 127, где полинуклеотид-мишень представляет собой иммунную молекулу, содержащую первую полинуклеотидную цепь и вторую полинуклеотидную цепь, и способ включает выявление соответствия первой полинуклеотидной цепи и второй полинуклеотидной цепи одной и той же клетке на основании присутствия того же самого штрихкода носителя в секвенированных полинуклеотидах с двойным штрихкодом.
129. Способ по любому из пп. 120-128, который дополнительно содержит количественное определение или определение числа полинуклеотидов с одним и тем же штрихкодом, необязательно, с одним и тем же молекулярным штрихкодом.
130. Способ по любому из пп. 120-129, в котором множество штрихкодированных полинуклеотидов представляет собой полинуклеотиды с двойным штрихкодом, содержащие молекулярный штрихкод и штрихкод носителя, и способ дополнительно включает идентификацию последовательностей транскриптома и полинуклеотидных последовательностей-мишеней, имеющих одинаковый штрихкод носителя, тем самым предоставляя информацию о транскриптоме клетки, несущей полинуклеотид-мишень(ы).
131. Способ анализа транскриптома, включающий:
(а) секвенирование одного или нескольких полинуклеотидов-мишеней из многих, принадлежащих множеству штрихкодированных полинуклеотидов, полученных способом по любому из пп. 1-108, или из множества штрихкодированных полинуклеотидов библиотеки полинуклеотидов по п. 109, где полинуклеотиды со штрихкодом представляют собой полинуклеотиды с двойным штрихкодом, содержащие молекулярный штрихкод и штрихкод носителя, тем самым генерируя информацию о последовательности полинуклеотида-мишени из множества клеток;
(b) секвенирование всего транскриптома или его части из множества штрихкодированных полинуклеотидов, полученных способом по любому из пп. 1-108, или из множества штрихкодированных полинуклеотидов библиотеки полинуклеотидов по п. 109, где штрихкодированные полинуклеотиды представляют собой полинуклеотиды с двойным штрихкодом, содержащие молекулярный штрихкод и штрихкод носителя, тем самым генерируя данные транскриптома из множества клеток; и
(c) идентификацию информации о последовательностях из (a) и из (b), имеющих тот же самый штрихкод носителя, как происходящих из одной и той же клетки.
132. Способ анализа транскриптома выбранной отдельной клетки, включающий:
(а) амплификацию и секвенирование одного или нескольких полинуклеотидов-мишеней из множества штрихкодированных полинуклеотидов, полученных способом по любому из пп. 1-108, или из многих, принадлежащих множеству штрихкодированных полинуклеотидов из библиотеки полинуклеотидов по п. 109, где штрихкодированные полинуклеотиды представляют собой полинуклеотиды с двойным штрихкодом, содержащие молекулярный штрихкод и штрихкод носителя, тем самым генерируя информацию о последовательности для каждого из полинуклеотидов-мишеней по меньшей мере в одной из множества клеток;
(b) идентификацию штрихкода(-ов) носителя, ассоциированного с одним из полинуклеотида(-ов)-мишени(ей), секвенированного в (а), таким образом идентифицируя выбранную отдельную клетку, несущую полинуклеотид-мишень;
(c) амплификацию и секвенирование транскриптома или его части из множества штрихкодированных полинуклеотидов клетки, несущих штрихкод носителя, идентифицированный в (b), тем самым генерируя данные транскриптома из выбранной клетки, экспрессирующей полипептид-мишень.
133. Способ по п. 132, в котором транскриптом или его часть из выбранной клетки амплифицируют или секвенируют с использованием праймера, специфичного для штрихкода носителя, идентифицированного в (b), и праймера, специфичного для последовательности второго адаптера штрихкодированных полинуклеотидов.
134. Способ анализа транскриптома, включающий сопоставление информации о последовательности транскриптома или его части и по меньшей мере одного из полинуклеотидов-мишеней, происходящих из той же клетке, при этом информация о последовательности определяется на множестве штрихкодированных полинуклеотидов, полученных способом по любому из пп. 1-106, или на множестве штрихкодированных полинуклеотидов из библиотеки полинуклеотидов по п. 109, где штрихкодированные полинуклеотиды представляют собой полинуклеотиды с двойным штрихкодом, содержащие молекулярный штрихкод и штрихкод носителя, или определяется способом по любому из пп. 120-130.
135. Способ по п. 134, в котором последовательности, имеющие один и тот же штрихкод носителя, определяются как происходящие из одной и той же клетки.
136. Способ по любому из пп. 131-135, в котором данные транскриптома содержат параметр, характеристику, признак или фенотип, связанный с функцией или активностью клетки.
137. Способ по п. 136, в котором данные транскриптома связаны с активацией, истощением или пролиферативной активностью клетки.
| WO 2016044227 A1, 24.03.2016 | |||
| WO 2014108850 A2, 17.07.2014 | |||
| US 2016244742 A1, 25.08.2016 | |||
| JIANG Z | |||
| et al., Whole transcriptome analysis with sequencing: methods, challenges and potential solutions, Cellular and Molecular Life Sciences, 2015, vol.72(18), pp.3425-3439 | |||
| СПОСОБ ИДЕНТИФИКАЦИИ НАТИВНЫХ ПАР ФРАГМЕНТОВ ДНК ИЛИ РНК, ПРИСУТСТВУЮЩИХ В ОДНИХ И ТЕХ ЖЕ ЖИВЫХ КЛЕТКАХ | 2013 |
|
RU2578009C2 |
Авторы
Даты
2023-02-16—Публикация
2018-05-25—Подача