Ссылка на родственную заявку
[0001] Согласно настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США №62/232209, поданной 24 сентября 2015 г.; которая полностью включена в настоящий документ посредством отсылки.
Предшествующий уровень техники настоящего изобретения
[0002] Многие типы клеток можно идентифицировать и распределить по категориям по представленности специфических наборов белков, эндогенно экспрессируемых и расположенных на их плазматических мембранах. Это явление позволяет изучать клетки с использованием способа, известного как иммунофенотипирование, при котором клетки инкубируют с флуоресцентно-мечеными антителами и связываются ними, причем флуоресцентно-меченые антитела являются специфическими по отношению к известным поверхностным белкам клеток. Проточную цитометрию широко используют для измерения уровней связанных с поверхностью антител для каждой клетки. Тем не менее, подходы на основе проточной цитометрии ограничены количеством флуорофоров, которые можно использовать одновременно в одном и том же эксперименте. Кроме того, количество флуорофоров, которые можно использовать одновременно в одном и том же эксперименте с использованием подходов на основе проточной цитометрии ограничено спектральным наложением. Более того, проточная цитометрия не интегрируется со многими биологически релевантными анализами и последующим секвенированием ДНК.
Краткое раскрытие настоящего изобретения
[0003] Таким образом, существует потребность в способах определения характеристик, например, иммунофенотипирования, отдельно взятотдельно взятых клеток без указанных ограничений. В отличие от подходов на основе проточной цитометрии в описанных в настоящем документе способах используют считывание последовательности для анализа белков отдельно взятых клеток, и эти способы не ограничены количеством флуорофоров, которые можно использовать одновременно в одном и том же эксперименте или их спектральным наложением. Кроме того, описанные в настоящем документе способы интегрируются со многими биологически релевантными анализами и последующим секвенированием ДНК. В описанных в настоящем документе способах используют конъюгаты аффинная часть-олигонуклеотид (например, конъюгаты антитела с олигонуклеотидом). Олигонуклеотид конъюгата содержит последовательность идентификации антигена (AID), которую штрих-кодируют относительно поверхностного антигена, с которым специфически связывается аффинная часть конъюгата аффинная часть-олигонуклеотид. Таким образом, с использованием описанных в настоящем документе способов антиген (например, поверхностный белок) отдельно взятой клетки можно анализировать без потребности во флуорофорах. Например, представленный на поверхности белок отдельно взятой клетки можно идентифицировать из последовательности идентификации антигена. Один или более поверхностных белков отдельно взятой клетки можно использовать для установления идентичности, характеристик или релевантности отдельно взятой клетки.
[0004] Конъюгат аффинная часть-олигонуклеотид согласно описанным в настоящем документе способам можно использовать для преодоления проблем медленной сортировки клеток, сниженного выхода мишени, ассоциированного с сортировкой клеток, ограниченного количества выходных потоков и выбранных бинов, которые не соответствуют количественно определяемому свойству конъюгата аффинная часть-олигонуклеотид, такому как аффинность. Изображенный иллюстративный конъюгат аффинная часть-олигонуклеотид может заменить или усилить сортировку с помощью проведенных на отдельно взятой клетке измерений связывания тетрамера в сосудах. Изображенный иллюстративный конъюгат аффинная часть-олигонуклеотид можно использовать в описанных в настоящем документе способах, чтобы одновременно получить последовательности пар TCR, численность клона и относительные аффинности тетрамера.
[0005] В настоящем документе описан способ определения характеристик, например, иммунофенотипирования, клеток в сосудах (например, эмульсии) с помощью конъюгатов аффинная часть-олигонуклеотид. Согласно некоторым вариантам осуществления способ используют для идентификации клеточных субпопуляций способом, совместимым с анализом отдельно взятых клеток на основе эмульсии. Согласно некоторым вариантам осуществления способ используют для идентификации иммунных клеток, специфических в отношении антигена, способом, совместимым с анализом отдельно взятых клеток на основе эмульсии. Согласно некоторым вариантам осуществления перед клеточным анализом специфические к поверхностному белку антитела конъюгируют с олигонуклеотидами. Согласно некоторым вариантам осуществления олигонуклеотиды сконструированы так, чтобы содержать мотив последовательности, который является уникальным для специфичности конъюгированного антитела по отношению к мишени. Олигонуклеотид можно конъюгировать с аффинной частью конъюгата аффинная часть-олигонуклеотид (например, антителом) ковалентно или нековалентно (например, комплекс биотин-олигонуклеотид с комплексом стрептавидин-антитело).
[0006] Способ может предусматривать инкубацию клеток в смеси или растворе с одним или более конъюгатами аффинная часть-олигонуклеотид. Клетки можно отмывать для удаления несвязанных конъюгатов аффинная часть-олигонуклеотид. Клетки затем инкапсулируют в сосудах, например, эмульсии. Клетки могут присутствовать в сосудах с плотностью, составляющей отдельно взятую клетку на сосуд. Таким образом, конъюгаты аффинная часть-олигонуклеотид внутри сосуда, например, капли, связаны с клеточной поверхностью, например, посредством взаимодействия специфического антитела с поверхностным белком. Способ может предусматривать прикрепление специфической для сосуда последовательности ДНК (например, уникального штрих-кода сосуда) к аффинным конъюгированным олигонуклеотидам. Дополнительный клеточный анализ ДНК или иРНК, фенотипические измерения, функциональное тестирование, сортировку клеток или другие реакции можно проводить перед, одновременно или после штрихкодирования аффинного конъюгированного олигонуклеотида, (например, с помощью штрих-кода ДНК).
[0007] Способ может предусматривать экстрагирование нуклеиновых кислот из эмульсии, например, после проведения эксперимента с эмульсией. Экстрагированные нуклеиновые кислоты можно подготовить для секвенирования и секвенировать (например, с использованием технологии секвенирования нового поколения). Способ может предусматривать секвенирование полинуклеотидных молекул из сосудов, которые содержат как последовательность идентификации антигена, так и специфическую для капли штрих-кодовую последовательность. Последовательность идентификации антигена может определять специфический клеточный поверхностный белок, связанный антителом, конъюгированным с олигонуклеотидом. Последовательность идентификации антигена может определять специфическое антитело конъюгированного с олигонуклеотидом антитела, которое связывается с конкретным клеточным поверхностным белком. Таким образом, последовательность идентификации антигена может указывать, какой поверхностный белок экспрессировала анализируемая клетка. В сосуде, содержащем отдельно взятую клетку, все последовательности, содержащие общую специфическую для капли штрих-кодовую последовательность, ассоциированы с отдельно взятой клеткой. Следовательно, отдельно взятую клетку можно анализировать как представление набора поверхностных белков, который можно использовать для определения ее идентичности, характеристик или релевантности.
[0008] Согласно одному аспекту предусмотрен способ, включающий проведение реакции во множестве сосудов, причем реакция включает прикрепление штрих-кодированного полинуклеотида сосуда, содержащего штрих-кодовую последовательность сосуда, к олигонуклеотиду конъюгата аффинная часть-олигонуклеотид, связанного с целевым антигеном отдельно взятой клетки, выделенной в сосуде из множества сосудов.
[0009] Согласно одному аспекту в настоящем документе предусмотрен способ, включающий проведение реакции в сосуде из множества сосудов, причем реакция включает прикрепление штрих-кодированного полинуклеотида сосуда, который содержит штрих-кодовую последовательность сосуда, к олигонуклеотидной части конъюгата аффинная часть-олигонуклеотид, причем конъюгат аффинная часть-олигонуклеотид связывается с целевым антигеном, экспрессируемым клеткой, в сосуде из множества сосудов.
[0010] Согласно некоторым вариантам осуществления клетка представляет собой отдельно взятую клетку, содержащуюся внутри сосуда. Согласно некоторым вариантам осуществления сосуд содержит два или больше сосудов из множества сосудов. Согласно некоторым вариантам осуществления сосуд содержит каждый сосуд из множества сосудов. Согласно некоторым вариантам осуществления реакция происходит в двух или больше сосудах из множества сосудов. Согласно некоторым вариантам осуществления клетка в каждом сосуде происходит из одного и того же образца. Согласно некоторым вариантам осуществления клетка в сосуде первого множества сосудов их двух или больше множеств сосудов происходит из того же образца, что и клетка в сосуде во втором множестве сосудов из двух или больше множеств сосудов. Согласно некоторым вариантам осуществления олигонуклеотидная часть содержит последовательность идентификации антигена (AID). Согласно некоторым вариантам осуществления AID штрих-кодируют относительно целевого антигена или аффинной части конъюгата аффинная часть-олигонуклеотид.
[ООН] Согласно некоторым вариантам осуществления олигонуклеотид дополнительно содержит последовательность идентификации антигена (AID), штрих-кодированную относительно целевого антигена или аффинной части конъюгата аффинная часть-олигонуклеотид. Согласно некоторым вариантам осуществления последовательность идентификации антигена (AID) представляет собой известную последовательность.
[0012] Согласно некоторым вариантам осуществления штрих-кодированный полинуклеотид сосуда происходит из матричного штрих-кодированного полинуклеотида сосуда в сосуде.
[0013] Согласно некоторым вариантам осуществления способ дополнительно включает секвенирование олигонуклеотида или его ампликона для получения информации о последовательности.
[0014] Согласно некоторым вариантам осуществления способ дополнительно включает определение характеристики отдельно взятой клетки на основании информации о последовательности. Согласно некоторым вариантам осуществления информация о последовательности содержит последовательность идентификации антигена (AID). Согласно некоторым вариантам осуществления способ дополнительно включает определение характеристики отдельно взятой клетки на основании информации о последовательности. Согласно некоторым вариантам осуществления характеристика представляет собой фенотип. Согласно некоторым вариантам осуществления фенотип представляет собой иммунофенотип.
[0015] Согласно некоторым вариантам осуществления способ дополнительно включает приведение в контакт конъюгата аффинная часть-олигонуклеотид с множеством клеток, содержащим отдельно взятую клетку. Согласно некоторым вариантам осуществления приведение в контакт происходит перед тем, как отдельно взятую клетку выделяют в сосуде. Согласно некоторым вариантам осуществления способ дополнительно включает отмывание множества клеток после приведения в контакт.
[0016] Согласно некоторым вариантам осуществления сосуд не содержит конъюгат аффинная часть-олигонуклеотид, который не связан с целевым антигеном.
[0017] Согласно некоторым вариантам осуществления способ дополнительно включает выделение отдельно взятой клетки в сосуде. Согласно некоторым вариантам осуществления отдельно взятая клетка связывается с конъюгатом аффинная часть-олигонуклеотид до выделения.
[0018] Согласно некоторым вариантам осуществления способ дополнительно включает осуществление лизиса отдельно взятой клетки. Согласно некоторым вариантам осуществления лизис происходит после того, как отдельно взятую клетку выделяют в сосуде.
[0019] Согласно некоторым вариантам осуществления множество клеток представляет собой множество несортированных клеток.
[0020] Согласно некоторым вариантам осуществления штрих-кодовая последовательность сосуда штрих-кодированного полинуклеотида сосуда или его ампликона в первом сосуде из множества сосудов отличается от штрих-кодовой последовательности сосуда штрих-кодированного полинуклеотида сосуда или его ампликона во втором сосуде из множества сосудов. Согласно некоторым вариантам осуществления штрих-кодовая последовательность сосуда каждого штрих-кодированного полинуклеотида сосуда или его ампликона в отдельно взятом сосуде из множества сосудов содержит одинаковую штрих-кодовую последовательность сосуда. Согласно некоторым вариантам осуществления штрих-кодовая последовательность сосуда каждого штрих-кодированного полинуклеотида сосуда и его ампликона в любом отдельно взятом сосуде из множества сосудов является уникальной для штрих-кодовой последовательности сосуда каждого штрих-кодированного полинуклеотида сосуда и его ампликона в любом другом отдельно взятом сосуде из множества сосудов.
[0021] Согласно некоторым вариантам осуществления способ дополнительно включает прикрепление штрих-кодированного полинуклеотида сосуда к полинуклеотиду клетки из отдельно взятой клетки. Согласно некоторым вариантам осуществления прикрепление штрих-кодированного полинуклеотида сосуда к олигонуклеотиду конъюгата аффинная часть-олигонуклеотид и прикрепление штрих-кодированного полинуклеотида сосуда к полинуклеотиду клетки из отдельно взятой клетки проводят одновременно.
[0022] Согласно некоторым вариантам осуществления способ дополнительно включает амплификацию олигонуклеотида или комплементарной ему цепи. Согласно некоторым вариантам осуществления способ дополнительно включает амплификацию полинуклеотида клетки или комплементарной ему цепи. Согласно некоторым вариантам осуществления амплификацию олигонуклеотида или комплементарной ему цепи и амплификацию полинуклеотида клетки или комплементарной ему цепи проводят одновременно.
[0023] Согласно некоторым вариантам осуществления штрих-кодовая последовательность сосуда полинуклеотида клетки и штрих-кодовая последовательность сосуда олигонуклеотида являются одинаковыми.
[0024] Согласно некоторым вариантам осуществления способ дополнительно включает объединение олигонуклеотидов или их ампликонов из двух или больше сосудов из множества сосудов. Согласно некоторым вариантам осуществления способ дополнительно включает объединение олигонуклеотидов или их ампликонов и полинуклеотидов клетки или их ампликонов из двух или больше сосудов из множества сосудов. Согласно некоторым вариантам осуществления объединение происходит до секвенирования.
[0025] Согласно некоторым вариантам осуществления конъюгат аффинная часть-олигонуклеотид содержит множество различных конъюгатов аффинная часть-олигонуклеотид. Согласно некоторым вариантам осуществления каждый конъюгат аффинная часть-олигонуклеотид из множества конъюгатов аффинная часть-олигонуклеотид содержит уникальную последовательность идентификации антигена (AID). Согласно некоторым вариантам осуществления олигонуклеотид содержит штрих-кодовую последовательность аффинной молекулы (АМВ), которую штрих-кодируют относительно отдельно взятой молекулы конъюгата аффинная часть-олигонуклеотид из множества молекул конъюгата аффинная часть-олигонуклеотид. Согласно некоторым вариантам осуществления каждая молекула конъюгата аффинная часть-олигонуклеотид из множества молекул конъюгата аффинная часть-олигонуклеотид содержит уникальную штрих-кодовую последовательность аффинной молекулы (АМН).
[0026] Согласно некоторым вариантам осуществления олигонуклеотид содержит слитую последовательность, и прикрепление включает в себя прикрепление штрих-кодированного полинуклеотида сосуда к слитой последовательности. Согласно некоторым вариантам осуществления олигонуклеотид содержит связывающую праймер последовательность. Согласно некоторым вариантам осуществления олигонуклеотид содержит константную последовательность.
[0027] Согласно некоторым вариантам осуществления способ дополнительно включает секвенирование олигонуклеотида, комплементарных ему цепей, их амплифицированных продуктов или их комбинации, тем самым производя прочтения олигонуклеотидной последовательности. Согласно некоторым вариантам осуществления способ дополнительно включает сравнение одного или более первых прочтений олигонуклеотидной последовательности с одним или более вторыми прочтениями олигонуклеотидной последовательности. Согласно некоторым вариантам осуществления способ дополнительно включает анализ прочтений олигонуклеотидной последовательности. Согласно некоторым вариантам осуществления способ дополнительно включает анализ штрих-кодовых последовательностей сосуда прочтений олигонуклеотидной последовательности. Согласно некоторым вариантам осуществления способ дополнительно включает анализ последовательностей идентификации антигена (AID) прочтений олигонуклеотидной последовательности. Согласно некоторым вариантам осуществления способ дополнительно включает анализ штрих-кодовых последовательностей аффинной молекулы (АМВ) прочтений олигонуклеотидной последовательности. Согласно некоторым вариантам осуществления анализ включает определение частоты встречаемости одной или более штрих-кодовых последовательностей сосуда, одной или более последовательностей AID, одной или более штрих-кодовых последовательностей аффинной молекулы (АМВ) или их комбинации. Согласно некоторым вариантам осуществления анализ включает сравнение. Согласно некоторым вариантам осуществления способ дополнительно включает сравнение последовательностей идентификации антигена (AID) прочтений олигонуклеотидной последовательности с штрих-кодовыми последовательностями аффинной молекулы (АМВ) прочтений олигонуклеотидной последовательности.
[0028] Согласно некоторым вариантам осуществления способ дополнительно включает секвенирование полинуклеотида клетки, комплементарных ему цепей, их амплифицированных продуктов или их комбинации, тем самым производя прочтения последовательности полинуклеотида клетки. Согласно некоторым вариантам осуществления причем способ дополнительно включает сравнение прочтений олигонуклеотидной последовательности с прочтениями последовательности полинуклеотида клетки. Согласно некоторым вариантам осуществления способ дополнительно включает сравнение штрих-кодовых последовательностей сосуда прочтений олигонуклеотидной последовательности со штрих-кодовыми последовательностями сосуда прочтений последовательности полинуклеотида клетки. Согласно некоторым вариантам осуществления способ дополнительно включает сравнение прочтений последовательности полинуклеотида клетки. Согласно некоторым вариантам осуществления способ дополнительно включает анализ штрих-кодовых последовательностей сосуда прочтений последовательности полинуклеотида клетки. Согласно некоторым вариантам осуществления способ дополнительно включает анализ молекулярных штрих-кодовых последовательностей прочтений последовательности полинуклеотида клетки.
[0029] Согласно некоторым вариантам осуществления способ дополнительно включает определение характеристики клетки на основании анализа или сравнения. Согласно некоторым вариантам осуществления способ дополнительно включает выбор антитела или TCR на основании прочтений олигонуклеотидной последовательности. Согласно некоторым вариантам осуществления способ включает выбор антитела или TCR на основании прочтений последовательности полинуклеотида клетки.
[0030] Согласно некоторым вариантам осуществления штрих-кодированный полинуклеотид сосуда, прикрепленный к олигонуклеотиду, и штрих-кодированный полинуклеотид сосуда, прикрепленный к полинуклеотиду клетки, происходят из одного и того же матричного штрих-кодированного полинуклеотида сосуда в сосуде. Согласно некоторым вариантам осуществления штрих-кодированный полинуклеотид сосуда, прикрепленный к олигонуклеотиду, представляет собой продукт амплификации матричного штрих-кодированного полинуклеотида сосуда.
[0031] Согласно некоторым вариантам осуществления штрих-кодированный полинуклеотид сосуда, прикрепленный к полинуклеотиду клетки, представляет собой продукт амплификации матричного штрих-кодированного полинуклеотида сосуда.
[0032] Согласно некоторым вариантам осуществления сосуд содержит твердую подложку. Согласно некоторым вариантам осуществления сосуд не содержит твердую подложку. Согласно некоторым вариантам осуществления каждый сосуд из множества сосудов содержит отдельно взятую клетку. Согласно некоторым вариантам осуществления сосуд представляет собой лунку, эмульсию или каплю. Согласно некоторым вариантам осуществления матричный штрих-кодированный полинуклеотид сосуда не связан с твердой подложкой. Согласно некоторым вариантам осуществления матричный штрих-кодированный полинуклеотид сосуда связан с твердой подложкой.
[0033] Согласно некоторым вариантам осуществления способ дополнительно включает прикрепление молекулярной штрих-кодовой последовательности молекулярного штрих-кодированного полинуклеотида из множества молекулярных штрих-кодированных полинуклеотидов к полинуклеотиду клетки, причем молекулярную штрих-кодовую последовательность штрих-кодируют относительно молекулы полинуклеотида отдельно взятой клетки и его ампликонов.
[0034] Согласно некоторым вариантам осуществления прикрепление включает в себя лигирование полинуклеотида сосуда с олигонуклеотидом. Согласно некоторым вариантам осуществления прикрепление включает в себя прикрепление полинуклеотида сосуда к олигонуклеотиду с помощью фермента. Согласно некоторым вариантам осуществления прикрепление включает в себя гибридизацию полинуклеотида сосуда с олигонуклеотидом. Согласно некоторым вариантам осуществления прикрепление дополнительно включает в себя удлинение олигонуклеотида. Согласно некоторым вариантам осуществления прикрепление включает в себя амплификацию матричного штрих-кодированного полинуклеотида сосуда.
[0035] Согласно некоторым вариантам осуществления олигонуклеотид является двухцепочечным. Согласно некоторым вариантам осуществления олигонуклеотид является одноцепочечным. Согласно некоторым вариантам осуществления олигонуклеотид представляет собой ДНК. Согласно некоторым вариантам осуществления олигонуклеотид представляет собой РНК.
[0036] Согласно некоторым вариантам осуществления полинуклеотид клетки содержит последовательность вариабельной области. Согласно некоторым вариантам осуществления способ дополнительно включает спаривание последовательностей нативной цепи, содержащих последовательность вариабельной области. Согласно некоторым вариантам осуществления полинуклеотид клетки представляет собой ДНК. Согласно некоторым вариантам осуществления полинуклеотид клетки представляет собой РНК. Согласно некоторым вариантам осуществления РНК представляет собой иРНК.
[0037] Согласно некоторым вариантам осуществления отдельно взятая клетка представляет собой В-клетку. Согласно некоторым вариантам осуществления отдельно взятая клетка представляет собой Т-клетку.
[0038] Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид связывается с внеклеточным антигеном отдельно взятой клетки. Согласно некоторым вариантам осуществления внеклеточный антиген отдельно взятой клетки является антиген-специфическим относительно иммунной клетки. Согласно некоторым вариантам осуществления внеклеточный антиген отдельно взятой клетки является антиген-специфическим относительно Т-клетки. Согласно некоторым вариантам осуществления внеклеточный антиген представляет собой CD4. Согласно некоторым вариантам осуществления внеклеточный антиген представляет собой CD8. Согласно некоторым вариантам осуществления внеклеточный антиген отдельно взятой клетки является антиген-специфическим относительно В-клетки. Согласно некоторым вариантам осуществления внеклеточный антиген представляет собой иммуноглобулин.
[0039] Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид представляет собой антитело или его фрагмент. Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид представляет собой пептид. Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид представляет собой белок. Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид представляет собой аптамер. Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид представляет собой малую молекулу. Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид представляет собой лекарственное средство. Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид представляет собой клетку. Согласно некоторым вариантам осуществления клетка представляет собой антигенпрезентирующую клетку (АРС). Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид содержит главный комплекс гистосовместимости (МНС). Согласно некоторым вариантам осуществления МНС находится в растворимой и/или мультимерной (например, тетрамерной) форме. Согласно некоторым вариантам осуществления МНС связан с пептидом. Согласно некоторым вариантам осуществления пептид представляет собой синтетический пептид. Согласно некоторым вариантам осуществления МНС связывается с Т-клеточным рецептором (TCR) и/или TCR-подобной связывающей молекулой, такой как, например, TCR-подобное антитело или иммуноглобулин, или химерный антигенный рецептор отдельно взятой клетки.
[0040] Согласно некоторым вариантам осуществления аффинная часть специфически связывается с антиген-распознающей молекулой и/или иммунорецептором, такими как антитело, или иммуноглобулин, или их часть, или их слияние, сконструированный иммунорецептор, химерный антигенный рецептор (CAR), или TCR. Согласно некоторым таким вариантам осуществления аффинная часть содержит антиген, или эпитоп, или их часть, распознаваемые антителом или рецептором, таким как CAR. Согласно некоторым вариантам осуществления аффинная часть содержит антитело или его антигенсвязывающий фрагмент, которые специфически связываются с иммунорецептором. Согласно некоторым аспектам антитело или его антигенсвязывающая фрагмент специфически связываются с вариабельной и/или антигенсвязывающей частью рецептора, такого как идиотоп. Согласно некоторым аспектам аффинная молекула представляет собой антиидиотипическое антитело или его фрагмент.
[0041] Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид содержит главный комплекс гистосовместимости (МНС) или его функциональную или связывающую часть. Согласно некоторым вариантам осуществления аффинная часть содержит мультимер МНС, необязательно тетрамер МНС. Согласно некоторым вариантам осуществления МНС находится в растворимой форме. Согласно некоторым вариантам осуществления МНС связан с пептидом и/или содержит пептид внутри полости МНС. Согласно некоторым вариантам осуществления пептид представляет собой синтетический пептид. Согласно некоторым вариантам осуществления МНС связывается с Т-клеточным рецептором (TCR) отдельно взятой клетки. Согласно некоторым вариантам осуществления аффинная часть содержит пептид, который связывается с антителом или химерным антигенным рецептором (CAR), и/или при этом мишень представляет собой антитело или CAR. Согласно некоторым вариантам осуществления аффинная часть представляет собой или содержит антиген или эпитоп, специфически распознаваемый антителом или химерным антигенным рецептором, и/или содержит антитело, которое специфически связывается с ним, необязательно антиидиотипическое антитело, которое специфически связывается с ее антигенсвязывающей частью.
[0042] Согласно одному аспекту предусмотрена композиция, содержащая множество сосудов, причем каждый содержит отдельно взятую клетку из образца, содержащего множество клеток, конъюгат аффинная часть-олигонуклеотид, связанный с целевым антигеном отдельно взятой клетки, и штрих-кодированный полинуклеотид сосуда, содержащий штрих-кодовую последовательность сосуда. Согласно некоторым вариантам осуществления штрих-кодированный полинуклеотид сосуда или комплементарная ему цепь прикреплены к олигонуклеотиду конъюгата аффинная часть-олигонуклеотид.
[0043] Согласно одному аспекту предусмотрена композиция, содержащая множество сосудов, причем каждый содержит отдельно взятую лизированную клетку из образца, содержащего множество клеток, и конъюгат аффинная часть-олигонуклеотид, связанный с целевым антигеном отдельно взятой лизированной клетки; причем олигонуклеотид конъюгата аффинная часть-олигонуклеотид содержит штрих-кодовую последовательность сосуда, и причем полинуклеотид клетки из отдельно взятой лизированной клетки содержит такую же штрих-кодовую последовательность сосуда.
[0044] Согласно одному аспекту в настоящем документе предусмотрена композиция, содержащая множество сосудов, причем сосуд из множества сосудов содержит отдельно взятую клетку из образца, содержащего множество клеток, и штрих-кодированный полинуклеотид сосуда, содержащий штрих-кодовую последовательность сосуда, причем сосуд дополнительно содержит конъюгат аффинная часть-олигонуклеотид, который связывается с целевым антигеном отдельно взятой клетки, или олигонуклеотидную часть из него.
[0045] Согласно некоторым вариантам осуществления реакция происходит в двух или больше сосудах из множества сосудов. Согласно некоторым вариантам осуществления сосуд содержит каждый сосуд из множества сосудов. Согласно некоторым вариантам осуществления множество сосудов содержит два или больше множеств сосудов. Согласно некоторым вариантам осуществления клетка в каждом сосуде происходит из одного и того же образца. Согласно некоторым вариантам осуществления клетка в сосуде первого множества сосудов из двух или больше множеств сосудов происходит из того же образца, что и клетка в сосуде во втором множестве сосудов из двух или больше множеств сосудов. Согласно некоторым вариантам осуществления штрих-кодированный полинуклеотид сосуда или комплементарная ему цепь прикреплены к олигонуклеотиду конъюгата аффинная часть-олигонуклеотид. Согласно некоторым вариантам осуществления отдельно взятую клетку лизируют.
[0046] Согласно одному аспекту в настоящем документе предусмотрена композиция, содержащая множество сосудов, причем сосуд из множества сосудов содержит отдельно взятую лизированную клетку из образца, содержащего множество клеток, и конъюгат аффинная часть-олигонуклеотид, содержащий аффинную часть, которая связывается с целевым антигеном отдельно взятой лизированной клетки, или олигонуклеотидную часть конъюгата аффинная часть-олигонуклеотид; причем олигонуклеотидная часть конъюгата аффинная часть-олигонуклеотид содержит штрих-кодовую последовательность сосуда, и причем полинуклеотид клетки из отдельно взятой лизированной клетки содержит такую же штрих-кодовую последовательность сосуда.
[0047] Согласно одному аспекту предусмотрен набор, содержащий: первый контейнер, содержащий первый олигонуклеотид, содержащий первую последовательность идентификации антигена (AID), причем первая последовательность AID представляет собой известную последовательность; второй контейнер, содержащий второй олигонуклеотид, содержащий вторую последовательность идентификации антигена (AID), причем вторая последовательность AID представляет собой известную последовательность и отличается от первой последовательности AID; один или более третьих контейнеров, содержащих реагенты, способные конъюгировать первый олигонуклеотид с первой аффинной молекулой, и реагенты, способные конъюгировать второй олигонуклеотид со второй аффинной молекулой; набор инструкций, описывающий, как конъюгировать первый олигонуклеотид с первой аффинной молекулой и второй олигонуклеотид со второй аффинной молекулой.
[0048] Согласно одному аспекту предусмотрен набор, содержащий: первый контейнер, содержащий олигонуклеотид, содержащий последовательность идентификации антигена (AID), причем последовательность AID представляет собой известную последовательность; второй контейнер, содержащий реагенты, способные конъюгировать олигонуклеотид с аффинной молекулой; третий контейнер, содержащий множество штрих-кодированных полинуклеотидов сосуда; и набор инструкций, описывающий, как прикреплять штрих-кодированный полинуклеотид сосуда из множества штрих-кодированных полинуклеотидов сосуда к олигонуклеотиду при конъюгировании с аффинной молекулой.
[0049] Раскрытые в настоящем документе способы и композиции можно использовать для профилирования опухолей. Например, способы могут предусматривать связывание клеточных фенотипов с иммунным репертуаром в образцах пациента для идентификации опухолереактивных TCR. Раскрытые в настоящем документе способы и композиции можно использовать для адоптивной клеточной терапии. Например, способы могут предусматривать генетический анализ Т-клеток без сортировки. Например, способы могут предусматривать комбинирование Т-клеточной клональной информации (с использованием TCR) с профилями экспрессии генов во время производства продукта и лечения. Согласно некоторым вариантам осуществления раскрытые в настоящем документе способы можно использовать для отслеживания, определения характеристик, мониторинга и/или оценки адоптивно перенесенных клеток, полученных от пациента перед, во время курса или после адоптивной клеточной терапии. Раскрытые в настоящем документе способы и композиции можно использовать для идентификации TCR против известных мишеней. Например, способы могут предусматривать идентификацию высокоаффинных клонов, которые могут проявлять выраженные ответы на антиген, но слабо прилиферировать. Раскрытые в настоящем документе способы и композиции можно использовать для мультиплексирования клеточного образца. Например, эмульсию, содержащую объединенные клеточные образцы, приведенные в контакт с одним или более конъюгатами аффинная часть-олигонуклеотид, можно использовать для идентификации исходных клеточных образцов при обработке множественных образцов в одно и то же время.
Включение посредством ссылки
[0050] Все публикации, патенты и заявки на выдачу патента, упомянутые в настоящем описании изобретения, полностью включены в настоящий документ посредством ссылки для всех целей в той же степени, как если бы было указано, что каждая отдельная публикация, патент или заявка на выдачу патента специально и индивидуально включены в настоящий документ посредством ссылки.
Краткое описание графических материалов
[0051] Новые признаки, описанные в настоящем документе, конкретно представлены в прилагаемой формуле изобретения. Лучшее понимание признаков и преимуществ признаков, описанных в настоящем документе, можно будет получить, обращаясь к представленному ниже подробному описанию, в котором изложены иллюстративные примеры, в которых используют принципы признаков, описанных в настоящем документе, и прилагаемым графическим материалам, в которых:
[0052] На фиг. 1 изображено иллюстративное схематическое представление сосуда согласно описанным в настоящем документе способам.
[0053] На фиг. 2 изображена иллюстративная схема олигонуклеотидной метки, конъюгированной с антителом. Каждый цветной блок представляет часть полной олигонуклеотидной последовательности. Слитая последовательность используют для ферментативного прикрепления специфическая для капли штрих-кода ДНК внутри реакции эмульсии. Показано только одно возможное расположение последовательностей, хотя другие расположения являются совместимыми с описанным способом.
[0054] На фиг. 3А изображен иллюстративный совместный захват последовательностей иммунного рецептора с дополнительными иРНК и белковыми мишенями. Мишени - поверхностные белки количественно определяют путем предварительной инкубации клеток с помощью меченных ДНК окрашивающих антител перед секвенированием эмульсии.
[0055] На фиг. 3В изображены иллюстративные измерения иРНК и белка CD4 и CD8 на 3682 штрих-кодированных относительно капли парах VαVβ TCR, образованных из Т-клеток здорового человека.
[0056] На фиг. 3С изображено иллюстративное совпадение между измерениями иРНК и белка (каждая точка представляет собой штрих-код капли, связанный с парой VαVβTCR).
[0057] На фиг. 3D изображена иллюстративная таблица одновременного обнаружения иРНК и белка CD4 и CD8 из несортированных Т-клеток в эмульсии. Из 30000 введенных Т-клеток выделили 3682 пары TCR. Частоты встречаемости пар TCR, названных как CD4+ или CD8+ с помощью измерения иРНК по сравнению с белком (на основании молекулярного подсчета, правило большинства) показаны в матрице.
[0058] На фиг. 3Е изображены иллюстративные результаты от 45870 пар TCR отдельно взятых клеток с использованием конъюгата аффинная часть-олигонуклеотид, нацеленного на CD4, и конъюгата аффинная часть-олигонуклеотид, нацеленного на CD8.
[0059] На фиг. 4 изображено схематическое представление иллюстративного способа с использованием конъюгата аффинная часть-олигонуклеотид, нацеленного на CD4, и конъюгата аффинная часть-олигонуклеотид, нацеленного на CD8.
[0060] На фиг. 5A-5D иллюстративно представлены результаты способа штрихкодирования отдельно взятой иммунной клетки в эмульсии.
[0061] На фиг. 5А представляет собой иллюстративное изображение двух водных потоков, содержащих клетки и смесь лизис/реакция (LR), пропускаемую в масло, что производит монодисперсную эмульсию со скоростью свыше 8 млн. капель в час.
[0062] На фиг. 5В представлено иллюстративное изображение, показывающее, что клетки внутри сосудов лизируют и подвергают молекулярному и специфическому для капли штрихкодированию в одной реакции.
[0063] На фиг. 5С представлено иллюстративное изображение, показывающее, что целевую иРНК обратно транскрибируют и метят в отношении переключения матрицы с помощью универсальной адаптерной последовательности. Впоследствии происходит ПЦР-амплификация штрих-кодовой в отношении капли матрицы, изначально разведенной до ~1 молекулы на каплю. Амплифицированные штрих-коды прикрепляют к кДНК с переключенной матрицей путем комплементарной достройки за счет перекрытия. Продукты выделяют из эмульсии и очищают с использованием биотина на праймере ОТ перед дополнительными стадиями процессирования библиотеки и высокопроизводительного секвенирования.
[0064] На фиг. 5D представлено иллюстративное изображение, показывающее, что двойное штрихкодирование обеспечивает возможность кластеризации прочтений секвенирования в их исходные молекулы и капли, реконструируя спаривания цепей нативного рецептора при минимизации ошибок секвенирования и систематических ошибок амплификации.
[0065] На фиг. 6A-6F иллюстративно представлены результаты способа обнаружения BCR из выделенных здоровых В-клеток.
[0066] На фиг. 6А представлено иллюстративное изображение капель, в которых 3 млн. В-клеток пропустили в эмульсию с концентрацией 0,2 клетки/капля, получая в результате ~90% занятых клеток, содержащих отдельно взятые клетки.
[0067] На фиг. 6В представлено иллюстративное изображение точности спаривания VHVL. После штрихкодирования и секвенирования эмульсии данные обогащали данными от капель отдельно взятых клеток и точность спаривания VHVL оценивали с использованием постоянства пар среди размноженных клонов.
[0068] На фиг. 6С представлен иллюстративный график процентного отношения штрих-кода капли по сравнению с изотипом Ig. Показан изотип тяжелой цепи (наиболее распространенный изотип внутри каждой капли) и использование локуса легкой цепи для 259368 отфильтрованных пар VHVL.
[0069] На фиг. 6D представлен иллюстративный график ранговой численности 100 наиболее часто встречающихся клонов тяжелой цепи в каждой из шести независимых фракций эмульсии. Отмечены 0,05% общей частоты встречаемости.
[0070] На фиг. 6Е представлен иллюстративный график экспрессии VH по сравнению с VL в пределах клеток, что оценивали по количеству захваченных иРНК в пределах каждого штрих-кода капли. 5000 точек показаны для каждого изотипа.
[0071] На фиг. 6F представлен иллюстративный график корреляции мутации VH по сравнению с VL для пар BCR и распределений плотности в пределах каждого изотипа.
[0072] На фиг. 7А-7С иллюстративно представлены результаты способа исследования широко нейтрализующего ВИЧ антитела (bNAb).
[0073] На фиг. 7А представлен иллюстративный график распределение изотипа тяжелой цепи 38620 выделенных пар VHVL из В-клеток от элитного контроллера ВИЧ, введенных в эмульсию. Редко встречающаяся пропорция цепей IgG хорошо выравнивалась с ранее известными bNAb ("PGT-подобная").
[0074] На фиг. 7В представлено иллюстративное изображение филогенетических деревьев полных аминокислотных последовательностей VDJ известных bNAb (черным) вместе с вновь выделенными (красным, меченные штрих-кодом капли), при этом тяжелые (слева) и легкие цепи (справа) представлены на графике отдельно. Потенциально несовпадающие антитела PGT122 и PGT123 показаны синим.
[0075] На фиг. 7С представлено иллюстративное изображение активности нейтрализации (IC50, мкг/мл) 8 вновь обнаруженных PGT-подобных вариантов против штаммов HIV по сравнению с контрольным маточным раствором PGT121.
[0076] На фиг. 8A-8F иллюстративно представлены результаты способа определения характеристик TIL из опухоли яичника.
[0077] На фиг. 8А представлено иллюстративное изображение капель, в которых 400000 несортированных диссоциированных клеток из опухоли яичника вводили в эмульсию, и пары BCR и TCR одновременно выделяли с помощью штрихкодирования эмульсии.
[0078] На фиг. 8В представлен иллюстративный график штрих-кодов капли по сравнению с комбинациями цепей рецептора, показывающий количества всех комбинаций VH/VL и Vα/Vβ, наблюдаемых в пределах штрих-кодов капли после фильтрования.
[0079] На фиг. 8С представлен иллюстративный график процентного отношения штрих-кодов капли по сравнению с распределением изотипов тяжелой цепи извлеченных пар BCR.
[0080] На фиг. 8D представлен иллюстративный график корреляции мутаций VH по сравнению с VL для пар BCR и распределений плотности в пределах каждого изотипа.
[0081] На фиг. 8Е изображены иллюстративные графики количества захваченных иРНК для пар TCR и пар BCR в общем (сверху) и для различных изотипов (снизу).
[0082] На фиг. 8F изображены иллюстративные графики клонального анализа, показывающие ранговую численность 30 наиболее часто встречающихся клонов тяжелой цепи BCR (сверху) и 30 наиболее часто встречающихся клонов бета цепи TCR в каждой из шести независимых фракций эмульсии. Показаны 1% и 10% уровни общей частоты встречаемости.
[0083] На фиг. 9А-9Е иллюстративно представлен способ иммунофенотипирования с использованием конъюгатов антитела с олигонуклеотидом.
[0084] На фиг. 9А изображено иллюстративное схематическое представление, показывающее 2 сосуда, каждый из которых содержит отдельно взятую клетку, связанную с изображенными конъюгат антитела с олигонуклеотидом. (DB1 - штрих-код капли 1; DB2 - штрих-код капли 2; МВ1 - молекулярный штрих-код 1; МВ2 - молекулярный штрих-код 2; AID - штрих-код ID антигена; АМВ1 - молекулярный штрих-код антитела 1; АМВ2 - молекулярный штрих-код антитела 2).
[0085] На фиг. 9В изображено иллюстративное схематическое представление, показывающее 2 сосуда, каждый из которых содержит молекулы РНК из лизированной клетки сосуда из фиг. 9А. Молекулы РНК обратно транскрибируют и нематричные нуклеотиды добавляют к концу молекулы кДНК, созданной с помощью обратной транскрипции. Молекулярные штрих-коды гибридизируют с нематричными нуклеотидами, добавленными к концу молекулы кДНК, созданной с помощью обратной транскрипции.
[0086] На фиг. 9С изображено иллюстративное схематическое представление, показывающее 2 сосуда, каждый из которых содержит штрих-кодированный полинуклеотид матрицы, который амплифицируют и прикрепляют к кДНК сосуда из фиг. 9В посредством гибридизации и кДНК удлиняют (сверху). Удлиненную кДНК затем амплифицируют (снизу).
[0087] На фиг. 9D изображено иллюстративное схематическое представление, показывающее, что вида PHK-MB-DB с одинаковым молекулярным штрих-кодом (MB), прикрепленным к одинаковым идентичным последовательностям РНК, вероятно, является результатом дупликации ПЦР. Виды PHK-MB-DB с двумя различными MB, которые прикреплены к одинаковым идентичным последовательностям РНК (PHK1-MB1-DB и PHK1-MB2-DB) представляют собой две независимые исходные молекулы РНК и не являются результатом дупликации ПЦР.
[0088] На фиг. 9Е изображено иллюстративное схематическое представление, показывающее, что виды DB-AMB-AID с одинаковым молекулярным штрих-кодом антитела (АМВ), прикрепленным к последовательности с одинаковым штрих-кодом капли (DB) и штрих-кодом ID антигена (AID), вероятно, являются результатом дупликации ПЦР. Виды DB1-АМВ1-AID 1 и DB1-AMB2-AID1 с двумя различными АМВ, прикрепленными к последовательностям с одинаковым штрих-кодом капли (DB) и штрих-кодом ID антигена (AID) представляют собой две независимые олигонуклеотидные молекулы из двух независимых молекул конъюгата антитела с олигонуклеотидом, причем каждый содержит антитело, которое специфически связывается с одним и тем же целевым антигеном, прикрепленным к одной и той же отдельно взятой клетке в сосуде, и не является результатом дупликации ПЦР. Виды DB1-AMBn-AID1 и DB1-AMBn-AID2 с двумя различными AID, прикрепленными к последовательностям с одинаковым штрих-кодом капли (DB) и одинаковыми или различными молекулярными штрих-кодами антитела (АМВ), представляют собой две независимые олигонуклеотидные молекулы из двух независимых молекул конъюгата антитела с олигонуклеотидом, прикрепленных к одной и той же отдельно взятой клетке в сосуде, причем одна из молекул конъюгата антитела с олигонуклеотидом содержит антитело, которое специфически связывается с первым целевым антигеном, а другая молекула конъюгата антитела с олигонуклеотидом содержит антитело, которое специфически связывается со вторым целевым антигеном.
[0089] На фиг. 10А изображено схематическое представление иллюстративного конъюгата аффинная часть-олигонуклеотид согласно описанным в настоящем документе способам.
[0090] На фиг. 10В изображено схематическое представление иллюстративного конъюгата аффинная часть-олигонуклеотид согласно описанным в настоящем документе способам.
[0091] На фиг. 11А изображен иллюстративный график сигнала связывания для двух иллюстративных конъюгатов аффинная часть-олигонуклеотид согласно описанным в настоящем документе способам, которые содержат аффинную часть, которая связывается с TCR.
[0092] На фиг. 12А изображено иллюстративное схематическое представление Т-клетки, связанной с иллюстративным конъюгатом аффинная часть-олигонуклеотид согласно описанным в настоящем документе способам.
[0093] На фиг. 12В изображено иллюстративное схематическое представление Т-клетки в капле, связанной с иллюстративным конъюгатом аффинная часть-олигонуклеотид согласно описанным в настоящем документе способам. Нуклеиновые кислоты в капле отмечены с помощью идентифицирующей каплю последовательности и встроены в библиотеку секвенирования нового поколения.
[0094] На фиг. 13 изображено иллюстративное схематическое представление олигонуклеотидной метки, конъюгированной с иллюстративным тетрамером конъюгата аффинная часть-олигонуклеотид. ID тетрамера представляет собой короткую константную последовательность ДНК, которая соответствует серии тетрамера и обеспечивает возможность мультиплексирования различных мишеней, таких как мишени пептид-МНС, в одном эксперименте. Молекулярный штрих-код представляет собой вырожденную последовательность, которая обеспечивает возможность молекулярного подсчета для количественного определения связанных тетрамеров.
[0095] На фиг. 14 изображены схематические представления иллюстративного конъюгата аффинная часть-олигонуклеотид, образованного из меченных ДНК реагентов тетрамера МНС. Согласно одному варианту осуществления Су5-связанный олигонуклеотид ДНК синтезируют и конъюгируют со стрептавидином или нейтравидином. Согласно одному варианту осуществления нефлуоресцентный олигонуклеотид ДНК конъюгируют с комплексом АРС-стрептавидин. Согласно одному варианту осуществления смесь нефлуоресцентного олигонуклеотида ДНК и стрептавидина или нейтравидина конъюгируют с активированной АРС.
[0096] На фиг. 15 изображен иллюстративный способ конъюгирования олигонуклеотида с аффинной частью конъюгата аффинная часть-олигонуклеотид с использованием клик-химии.
[0097] На фиг. 16 изображено схематическое представление иллюстративной последовательности выполняемых действий для получения и определения характеристик иллюстративных аффинных олигонуклеотидов.
[0098] На фиг. 17 изображены результаты описанного в настоящем документе иллюстративного способа с использованием 6 различных конъюгатов аффинная часть-олигонуклеотид, нацеленных на CD3, CD19, CD4, CD8, HLA-DR и CTLA-4. Каждая точка представляет собой штрих-код капли/отдельно взятую клетку. Идентичность клетки выявляли по типу выделенной пары рецептора (TCR = Т-клетка; Ig = В-клетка).
Подробное раскрытие настоящего изобретения
[0099] Некоторые аспекты описаны ниже со ссылкой на являющиеся примером применения для иллюстрации. Следует понимать, что различные конкретные подробности, взаимоотношения и способы представлены для обеспечения полного понимания признаков, описанных в настоящем документе. Тем не менее, средний специалист в соответствующией области техники легко сможет установить, что признаки, описанные в настоящем документе, можно осуществить на практике без одной или более конкретных деталей или с помощью других способов. Описанные в настоящем документе признаки не ограничены порядком действий или событий, поскольку некоторые действия могут происходить в другом порядке и/или одновременно с другими действиями или событиями. Более того, не все проиллюстрированные действия или события являются необходимыми для осуществления методологии согласно признакам, описанным в настоящем документе.
[00100] Используемая в настоящем документе терминология предусмотрена исключительно с целью описания конкретных случаев, и не подразумевается, что она является ограничивающей. Подразумевается, что используемые в настоящем документе формы единственного числа включают в себя также формы множественного числа, если контекст явно не указывает на иное. Более того, в той степени, в которой термины "включая в себя", "включает в себя", "характеризующийся", "характеризуется", "с" или их варианты используют в подробном раскрытии настоящего изобретения и/или формуле изобретения, указанные термины, как подразумевается, являются включающими подобно термину "содержащий".
[00101] Термин "приблизительно" или "примерно" могут означать в пределах приемлемого диапазона ошибки для конкретного значения, определяемого средним специалистом в настоящей области техники, который будет зависеть частично от того, как измеряют или определяют значение, т.е. ограничений измерительной системы. Например, "приблизительно" может означать в пределах 1 или больше чем 1 стандартное отклонение согласно нормам в настоящей области техники. Альтернативно "приблизительно" могут означать диапазон вплоть до 20%, вплоть до 10%, вплоть до 5% или вплоть до 1% данного значения. Альтернативно, особенно по отношению к биологическим системам или процессам, термин может означать в пределах порядка величин, в пределах в 5 раз и более предпочтительно в пределах в 2 раза от значения. Когда конкретные значения описаны в настоящей заявке и формуле изобретения, если не указано иное, следует принять, что термин "приблизительно" означает в пределах приемлемого диапазона ошибки для конкретного значения.
[00102] Цель настоящего изобретения представляет собой обеспечение способов и композиций для фенотипирования отдельно взятых клеток (например, иммунных клеток с использованием конъюгатов аффинная часть-олигонуклеотид (например, конъюгатов антитела с олигонуклеотидом) (например, в эмульсиях).
Определения
[00103] Таким образом, термин "антитело" в настоящем документе используют в самом широком смысле, и он включает в себя поликлональные и моноклональные антитела, включая в себя интактные антитела и их функциональные (антигенсвязывающие) фрагменты антител, включая в себя антигенсвязывающие (Fab) фрагменты, фрагменты F(ab')2, фрагменты Fab', фрагменты Fv, фрагменты рекомбинантного IgG (rIgG), одноцепочечные фрагменты антител, включая в себя одноцепочечные вариабельные фрагменты (scFv) и однодоменные фрагменты антител (например, sdAb, sdFv, нанотело). Термин включает в себя генетически сконструированные и/или иным образом модифицированные формы иммуноглобулинов, такие как интратела, пептитела, химерные антитела, полностью человеческие антитела, гуманизированные антитела и гетероконъюгатные антитела, мультиспецифические, например, биспецифические, антитела, диатела, триатела и тетратела, тандемные ди-scFv, тандемные три-scFv. Если не указано иное, следует понимать, что термин "антитело" включает в себя их функциональные фрагменты антител. Термин также включает в себя интактные или полноразмерные антитела, включая в себя антитела любого класса или подкласса, включая в себя IgG и его подклассы, IgM, IgE, IgA и IgD.
[00104] Термины "определяющая комплементарность область" и "CDR", синонимичные с терминами "гипервариабельная область" или "HVR" известны в настоящей области техники как обозначающие несмежные последовательности аминокислот в пределах вариабельных областей антитела, которые придают антигенную специфичность и/или аффинность связывания. В общем, существуют три CDR в каждой вариабельной области тяжелой цепи (CDR-H1, CDR-H2, CDR-H3) и три CDR в каждой вариабельной области легкой цепи (CDR-L1, CDR-L2, CDR-L3). "Каркасные области" и "FR" известны в настоящей области техники как относящиеся к не-CDR частям вариабельных областей тяжелых и легких цепей. В общем, существуют четыре FR в каждой полноразмерной вариабельной области тяжелой цепи (FR-H1, FR-H2, FR-H3 и FR-Н4), и четыре FR в каждой полноразмерной вариабельной области легкой цепи (FR-L1, FR-L2, FR-L3 и FR-L4).
[00105] Точные границы аминокислотных последовательностей в данной CDR или FR можно легко определить с использованием любого числа хорошо известных схем, включая в себя описанные Kabat et al. (1991), "Sequences of Proteins of Immunological Interest," 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (схема нумерации "Kabat"), Al-Lazikani et al., (1997) JMB 273,927-948 (схема нумерации "Chothia"), MacCallum et al., J. Mol. Biol. 262:732-745 (1996), "Antibody-antigen interactions: Contact analysis and binding site topography," J. Mol. Biol. 262, 732-745." (схема нумерации "Contact"), Lefranc MP et al., "IMGT unique numbering for immunoglobulin and Т cell receptor variable domains and Ig superfamily V-like domains," Dev Comp Immunol, 2003 Jan; 27(1):55-77 (схема нумерации "IMGT") и Honegger A and Pluckthun A, "Yet another numbering scheme for immunoglobulin variable domains: an automatic modeling and analysis tool," J Mol Biol, 2001 Jun 8; 309(3):657-70, (схема нумерации "Aho").
[00106] Границы данной CDR или FR могут варьировать в зависимости от схемы, используемой для идентификации. Например, схема Kabat основана на структурных выравниваниях, при этом схема Chothia основана на структурной информации. Нумерация согласно как схеме Kabat, так и схеме Chothia основана на наиболее распространенных длинах последовательностей областей антитела, со вставками, снабженными буквенными обозначениями вставки, например, "30а," и делениями, возникающими в некоторых антителах. Две схемы помещают определенные вставки и делеции ("инсерционно-делеционные мутации") в различные положения, давая в результате отличительную нумерацию. Схема Contact основана на анализе сложных кристаллических структур и аналогична во многих аспектах схеме нумерации Chothia.
[00107] В таблице А, ниже, перечислены иллюстративные границы положений CDR-L1, CDR-L2, CDR-L3 и CDR-H1, CDR-H2, CDR-H3, идентифицированные с помощью схем Kabat, Chothia и Contact, соответственно. Для CDR-H1, нумерация остатков перечислена с использованием схем нумерации как Kabat, так и Chothia. FR расположены между CDR, например, при этом FR-L1 расположена между CDR-L1 и CDR-L2 и т.д. Следует отметить, что поскольку показанная схема нумерации Kabat помещает вставки в Н35А и Н35В, конец петли CDR-H1 согласно Chothia при нумерации с использованием показанной системы нумерации Kabat варьирует между Н32 и Н34 в зависимости от длины петли.

[00108] Таким образом, если не указано иное, следует понимать, что "CDR" или "определяющая комплементарность область" или индивидуальные указанные CDR (например, "CDR-H1, CDR-H2) данного антитела или его области, такой как его вариабельная область, включают в себя (или конкретную) определяющую комплементарность область, определяемую с помощью любой их вышеупомянутых схем. Например, если указано, что конкретная CDR (например, CDR-H3) содержит аминокислотную последовательность соответствующей CDR в данной аминокислотной последовательности VH или VL, следует понимать, что такая CDR содержит последовательность соответствующей CDR (например, CDR-H3) в пределах вариабельной области, что определено с помощью любой из вышеупомянутых схем. Согласно некоторым вариантам осуществления указаны определенные последовательности CDR.
[00109] Аналогично, если не указано иное, следует понимать, что FR или индивидуальные указанные FR (например, FR-H1, FR-H2) данного антитело или его области, такой как его вариабельная область, включают в себя (или конкретную) каркасную область, что определено с помощью любой из известных схем. В некоторых случаях указана схема идентификации конкретной CDR, FR, или FR или CDR, таких как CDR, определенная с помощью способа Kabat, Chothia или Contact. В других случаях представлена конкретная аминокислотная последовательность CDR или FR.
[00110] Термин "вариабельная область" или "вариабельный домен" относится к домену тяжелой или легкой цепи антитела, который вовлечен в связывание антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела, как правило, характеризуются сходными структурами, при этом каждый домен содержит четыре консервативные каркасные области (FR) и три CDR. (См., например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007). Один домен VH или VL может являться достаточным для обеспечения антигенсвязывающей специфичности. Более того, антитела, которые связывают конкретный антиген, можно выделить с использованием домена VH или VL из антитела, которое связывает антиген, для скрининга библиотеки комплементарных доменов VL или VH, соответственно. См., например, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
[00111] Предусмотренные антитела включают в себя фрагменты антител. "Фрагмент антитела" относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, которая связывает антиген, с которым связывается интактное антитело. Примеры фрагменты антитела включают в себя без ограничения Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; молекулы одноцепочечных антител (например, scFv); и мультиспецифические антитела, образованные из фрагментов антител. Согласно конкретным вариантам осуществления антитела представляют собой одноцепочечные фрагменты антитела, содержащие вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, такие как scFv.
[00112] Если не указано иное, следует понимать, что термин "TCR" включает в себя полные TCR, а также их антигенсвязывающие части или антигенсвязывающие фрагменты (также называемые связывающие комплекс МНС-пептид фрагменты). Согласно некоторым вариантам осуществления TCR представляет собой интактный или полноразмерный TCR. Согласно некоторым вариантам осуществления TCR представляет собой антигенсвязывающую часть, которая меньше чем полноразмерный TCR, но которая связывается со специфическим антигенным пептидом, связанным с (т.е. находится в контексте) молекулы МНС, т.е. комплексом МНС-пептид. В некоторых случаях антигенсвязывающая часть или фрагмент TCR может содержать только часть структурных доменов полноразмерного или интактного TCR, но все еще является способной связывать эпитоп (например, комплекс МНС-пептид), с которым связывается полный TCR. В некоторых случаях антигенсвязывающая часть или фрагмент TCR содержит вариабельные домены TCR, такие как вариабельная а цепь и вариабельная (3 цепь TCR, достаточные для образования связывающего сайта для связывания с конкретным комплексом МНС-пептид, такие как, как правило, в которых каждая цепь содержит три определяющих комплементарность области. Предусмотрены полипептиды или белки, характеризующиеся связывающим доменом, который представляет собой антигенсвязывающий домен или является гомологичным антигенсвязывающему домену. Антитела и TCR с привитой определяющей комплементарность областью (CDR) и другие гуманизированные антитела и TCR (включая в себя модификации CDR и модификации каркасной области) также подразумеваются под указанными терминами. Следует отметить, что наряду с тем, что могут быть указаны только цепи иммуноглобулина (например, тяжелые цепи и легкие цепи), раскрытое изобретение можно применять по отношению к многочисленным другим различным типам спаренных последовательностей, например, пары цепей Т-клеточного рецептора (цепи TCRα и TCRβ и цепи TCRγ и TCRδ), и не ограничено иммуноглобулинами.
[00113] Способность Т-клеток распознавать антигены, ассоциированные с различными злокачественными опухолями или инфекционными организмами, обеспечивается их TCR, который образован как альфа (α) цепью, так и бета (β) цепью или гамма (γ) и дельта (δ) цепью. Белки, которые образуют указанные цепи, колируются ДНК, которая использует уникальный механизм создания огромного разнообразия TCR. Этот мультисубъотдельно взятый рецептор иммунного распознавания ассоциирован с комплексом CD3 и связывает пептиды, презентированные белками МНС класса I и II на поверхности антигенпрезентирующих клеток (АРС). Связывание TCR с антигенным пептидом на АРС представляет собой центральное событие в активации Т-клетки, которое происходит на иммунологическом синапсе в точке контакта между Т-клеткой и АРС.
[00114] Каждый TCR содержит вариабельные определяющие комплементарность области (CDR), а также каркасная области (FR). Аминокислотная последовательность петель третей определяющей комплементарность области (CDR3) вариабельных доменов α и β цепи, главным образом, определяет разнообразие последовательностей αβ Т-клеток, возникающее из рекомбинации между вариабельными (Vβ), дополнительными (Dβ) и соединительными (Jβ) генными сегментами в локусе β цепи и между аналогичными Vα и Jα генными сегментами в локусе α цепи, соответственно. Существование множества таких генных сегментов в локусах α и β цепей TCR обеспечивает кодирования большого количества отличающихся последовательностей CDR3. Независимое добавление и делеция нуклеотидов на соединениях Vβ-Dβ, Dβ-Jβ и Vα-Jα во время процесса генной реаранжировки TCR дополнительно увеличивает разнообразие последовательностей CDR3. В этом смысле, иммунокомпетентность отражена в разнообразии TCR.
[00115] Иммуноглобулины (Ig), экспрессируемые В-клетками представляют собой в некоторых аспектах белки, состоящие из четырех полипептидных цепей, двух тяжелых цепей (IgH) и двух легких цепей (IgL), образуя структуру H2L2. Каждая пара цепей IgH и IgL содержит гипервариабельный домен, состоящий из VL и VH области, и константный домен. Цепи IgH Ig принадлежат к нескольким типам, μ, δ, γ, α и β. Разнообразие Ig в пределах индивидуума, главным образом, определяется гипервариабельным доменом. Аналогично TCR, V домен цепей IgH создан путем комбинаторного соединения VH, DH и JH генных сегментов. Независимое добавление и делеция нуклеотидов на соединениях VH-DH, DH-JH и VH-JH во время процесса генной реаранжировки Ig дополнительно увеличивает разнообразие последовательностей гипервариабельного домена. В этом смысле, иммунокомпетентность отражена в разнообразии Ig.
[00116] Термин "вариабельная область" или "вариабельный домен" относится к домену тяжелой или легкой цепи антитела, который вовлечен в связывание антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела, как правило, характеризуются сходными структурами, причем каждый домен содержит четыре консервативные каркасные области (FR) и три CDR. (См., например, Kindt et а1. Kuby Immunology, 6th ed., W.H. Freeman и Co., page 91 (2007). Один домен VH или VL может являться достаточным для обеспечения антигенсвязывающей специфичности. Более того, антитела, которые связывают конкретный антиген, можно выделить с использованием домена VH или VL из антитела, которое связывает антиген, для скрининга библиотеки комплементарных доменов VL или VH, соответственно. См., например, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
[00117] "Аффинная часть" относится к части конъюгата аффинная часть-олигонуклеотид, которая взаимодействует с целевым антигеном. Иллюстративные аффинные части включают в себя антитела, пептиды, белки, аптамеры, малые молекулы, лекарственные средства, клетки, МНС и другое.
[00118] "Гипервариабельная область" относится к аминокислотным остаткам антитела или TCR, которые отвечают за связывание с антигеном. Гипервариабельная область содержит аминокислотные остатки из определяющей комплементарность области, или CDR. Каркасные остатки, или остатки FR представляют собой остатки вариабельного домена, отличные от остатков гипервариабельной области, как определено в настоящем документе.
[00119] Предусмотренные антитела включают в себя фрагменты антител. "Фрагмент антитело" относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, которая связывает антиген, с которым связывается интактное антитело. Примеры фрагментов антител включают в себя без ограничения Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; молекулы одноцепочечных антител (например, scFv); и мультиспецифические антитела, образованные из фрагментов антител. Согласно конкретным вариантам осуществления антитела представляют собой фрагменты одноцепочечных антител, содержащие вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, такие как scFv.
[00120] Однодоменные антитела представляют собой фрагменты антител, содержащие весь или часть вариабельного домена тяжелой цепи или весь или часть вариабельного домена легкой цепи антитела. Согласно определенным вариантам осуществления однодоменное антитело представляет собой однодоменное антитело человека.
[00121] Фрагменты антител можно получить с помощью различных техник, включая в себя без ограничения протеолитическую обработку интактного антитела, а также получение рекомбинантных клеток-хозяев. Согласно некоторым вариантам осуществления антитела представляют собой рекомбинантно полученные фрагменты, такие как фрагменты, содержащие аранжировки, которые не встречаются в природе, такие как аранжировки с двумя или больше областями или цепями антитела, соединенными с помощью синтетических линкеров, например, пептидных линкеров, и/или которые можно получить с помощью ферментативной обработки встречающегося в природе интактного антитела. Согласно некоторым аспектам фрагменты антител представляют собой scFv.
[00122] Кроме того, предусмотрены фрагменты TCR, включая в себя антигенсвязывающие фрагменты. Согласно некоторым вариантам осуществления TCR представляет собой его антигенсвязывающую часть, такую как вариант полноразмерного TCR, не содержащий его трансмембранную и/или цитоплазматическую область(и), который можно назвать полностью растворимый TCR. Согласно некоторым вариантам осуществления TCR представляет собой димерный TCR (dTCR). Согласно некоторым вариантам осуществления TCR представляет собой одноцепочечный TCR (scTCR), такой как scTCR, характеризующийся структурой, описанной в патентных публикациях согласно РСТ №№ WO 03/020763, WO 04/033685 или WO 2011/044186. Согласно определенным вариантам осуществления TCR представляет собой фрагмент одноцепочечного TCR, содержащий вариабельную область альфа цепи, соединенную с вариабельной областью бета цепи, такой как scTv. Согласно некоторым вариантам осуществления scTv также называют scFv
[00123] Одноцепочечный Fv или scFv в некоторых аспектах относится к фрагментам антитела или TCR, которые содержат вариабельные домены тяжелой цепи (VH) и вариабельные домены легкой цепи (VL) антитела или вариабельные домены альфа или гамма цепи (Vα или Vγ) и вариабельные домены бета или дельта цепи (Vβ или Vδ) TCR, причем указанные домены присутствуют в одной полипептидной цепи. Как правило, полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL или доменами Vα и Vβ или доменами Vγ и Vδ, который позволяет sFv формировать требуемую структуру для связывания антигена.
[00124] Диатело в некоторых аспектах относится к небольшим фрагментам антитела и/или TCR с двумя антигенсвязывающими сайтами, причем эти фрагменты содержат VH, соединенный с VL в одной и той же полипептидной цепи (VH-VL) или Vα, соединенный с Vβ в одной и той же полипептидной цепи (Vα-Vβ) или Vγ, соединенный с Vδ в одной и той же полипептидной цепи (Vγ-Vδ). За счет использования линкера, который является слишком коротким, чтобы обеспечить спаривание между двумя доменами на одной цепи, доменам приходится образовывать пары с комплементарными доменами другой цепи и создавать два антигенсвязывающих сайта. Иллюстративные диатела описаны более полно, например, в европейском патенте № ЕР 404097 и международной патентной публикации № WO 93111161.
[00125] Биспецифические антитело или биспецифический TCR в некоторых аспектах относится к антителу или TCR, которые демонстрируют специфичности к двум различным типам антигенов. Используемые в настоящем документе термины специально включают в себя без ограничения антитела и TCR, которые демонстрируют специфичность связывания в отношении целевого антигена и другой мишени, которая облегчает доставку к конкретной ткани. Аналогично мультиспецифические антитела и TCR характеризуются двумя или больше специфичностями связывания.
[00126] Линейное антитело или линейный ТС в некоторых аспектах относится к паре тандемных сегментов Fd (например, VH-CH1-VH-CH1 или Vα-Cα1-Vα-Cα1), которые образуют пару антигенсвязывающих областей. Линейные антитела и TCR могут являться биспецифическими или моноспецифическими, например, как описано Zapata et al., Protein Eng. 8(10):1057-1062 (1995).
[00127] Антигенсвязывающий домен в некоторых аспектах относится к одному или более фрагментам антитела или TCR, которые сохраняют способность специфически связывать антиген. Неограничивающие примеры фрагментов антител, включенных в такие термины, включают в себя без ограничения: (i) фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) фрагмент F(ab')2, бивалентный фрагмент, содержащие два фрагмента Fab, соединенные дисульфидным мостиком на шарнирной области; (iii) фрагмент Fd, состоящий из доменов VH и CH1; (iv) фрагмент Fv, содержащий домены VL и VH в одном плече антитела, включая в себя scFv, (v) фрагмент dAb (Ward et al., (1989) Nature 341:544 546), который содержит домен VH; и (vi) выделенная CDR. Кроме того, в настоящее определение включены антитела, содержащие единственную тяжелую цепь и единственную легкую цепь, или TCR с единственной альфа цепью или единственной бета цепью.
[00128] Фрагменты "F(ab')2" и "Fab'" можно получить путем обработки Ig такой протеазой, как пепсин и папаин, и они включают в себя фрагменты антител, образованные путем ферментативной обработки иммуноглобулина вблизи дисульфидных связей, существующих между шарнирными областями в каждой из двух тяжелых цепей. Например, папаин расщепляет IgG выше дисульфидных связей, существующих между шарнирными областями в каждой из двух тяжелых цепей с образованием двух гомологичных фрагментов антитела, в которых легкая цепь, состоящая из VL и CL, и фрагмент тяжелой цепи, состоящий из VH и CHγ1 (область γ1 в константной области тяжелой цепи) соединены на своих С-концевых областях посредством дисульфидной связи. Каждый из этих двух гомологичных фрагментов антитела называется 'Fab'. Пепсин также расщепляет IgG ниже дисульфидных связей, существующих между шарнирными областями в каждой из двух тяжелых цепей с образованием фрагмента антитела, которое немного больше, чем фрагмент, в котором два вышеупомянутых 'Fab' соединены на шарнирной области. Этот фрагмент антитела называется F('ab')2. Фрагмент Fab также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Фрагменты 'Fab' отличаются от фрагментов Fab добавлением нескольких остатков на карбоксильном конце домена CH1 тяжелой цепи, включая в себя один или более цистеинов из шарнирной области антитела. Fab'-SH в настоящем документе представляет собой обозначение для Fab', в котором остаток(остатки) цистеина константных доменов содержат свободную тиольную группу. Фрагменты антитела F(ab')2 изначально производятся в виде пар фрагментов Fab', которые содержат шарнирные цистеины между ними.
[00129] Fv в некоторых аспектах относится к фрагменту антитела или TCR, который содержит полный антигенраспознающий и антигенсвязывающий сайт. Эта область состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи или одной TCRα цепи и одной TCRβ цепи или одной TCRγ цепи и одной TCRδ цепи в тесной, нековалентной ассоциации. Он находится в этой конфигурации, в которой три CDR каждого вариабельного домена взаимодействуют, определяя антигенсвязывающий сайт на поверхности димера VH-VL, или димера Vα-Vβ, или димера Vγ-Vδ. Обобщенно, комбинация одной или более CDR из каждой из цепей VH и VL или цепей Vα-Vβ, или цепей Vγ-Vδ придает антигенсвязывающую специфичность антителу или TCR. Например, следует понимать, что, например, CDRH3 и CDRL3 могут являться достаточными для придания антигенсвязывающей специфичности антителу или TCR, будучи перенесенными на цепи VH и VL или цепи Vα и Vβ или цепи Vγ-Vδ реципиентного выбранного антитела, TCR или их антигенсвязывающего фрагмента, и эту комбинацию CDR можно проанализировать в отношении связывания, аффинности и т.д. Даже единственный вариабельный домен (или половина Fv, содержащая только три CDR, специфические в отношении антигена) характеризуется способность распознавать и связывать антиген, хотя, вероятно, с меньшей аффинностью, чем при комбинировании со вторым вариабельным доменом. Более того, хотя два домена фрагмента Fv (VL и VH или Vα и Vβ или Vγ и Vδ) кодируются отдельными генами, и можно соединить с использованием рекомбинантных способов с помощью синтетического линкера, который позволяет им организоваться в виде одной белковой цепи, в которой области цепи VL и VH или Vα и Vβ или Vγ и Vδ образуют пары с образованием моновалентных молекул (известных как одноцепочечный Fv (scFv); Bird et al. (1988) Science 242:423-426; Huston et а1. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883; и Osboum et а1. (1998) Nat. Biotechnol. 16:778). Такая scFv также, как подразумевается, включены в термин "антигенсвязывающая часть" антитела. Любые последовательности VH и VL конкретного scFv можно соединить с кДНК или геномными последовательностями Fc области для образования экспрессионных векторов, кодирующих полные молекулы Ig (например, IgG) или другие изотипы. VH и VL также можно использовать в создании Fab, Fv или других фрагментов Ig с использованием любой химии белка или технологии рекомбинантной ДНК.
[00130] Антигенсвязывающие полипептиды также включают в себя димеры тяжелой цепи, такие как, например, антитела от верблюжьих и акул. Антитела верблюжьих и акул содержат гомодимерную пару двух цепей V-подобных и С-подобных доменов (ни одна из них не содержит легкую цепь). Поскольку области VH IgG димера тяжелой цепи у верблюжьих не нужно вступать в гидрофобные взаимодействия с легкой цепью, область в тяжелой цепи, которая, как обычно, контактирует с легкой цепью, заменяют на гидрофильные аминокислотные остатки у верблюжьих. Домены VH IgG димера тяжелой цепи называют домены VHH. Ig-NAR акулы содержат гомодимер одного вариабельного домена (названного домен V-NAR) и пять С-подобных константных доменов (домены C-NAR). У верблюжьих разнообразие репертуара антител определяется CDR 1, 2 и 3 в областях VH или VHH. CDR3 в области VHH верблюда характеризуется своей относительно большой длиной, в среднем составляющей 16 аминокислот (Muyldermans et al., 1994, Protein Engineering 7(9): 1129).
[00131] "Гуманизированное" антитело представляет собой антитело, в котором все или по существу все аминокислотные остатки CDR происходят из не относящихся к человеку CDR, и все или по существу все аминокислотные остатки FR происходят из FR человека. Гуманизированное антитело необязательно может включать в себя по меньшей мере часть константной области антитела, происходящей из антитела человека. "Гуманизированная форма" не относящегося к человеку антитела относится к варианту не относящегося к человеку антитела, которое было подвергнуто гуманизации, как правило, для снижения иммуногенности в отношении людей, при этом сохраняя специфичность и аффинность исходного не относящегося к человеку антитела. Согласно некоторым вариантам осуществления некоторые остатки FR в гуманизированном антителе замещены соответствующими остатками из не относящегося к человеку антитела (например, антитела, из которого происходят остатки CDR), например, для восстановления или улучшения специфичности или аффинности антитела.
[00132] Предусмотренные антитела включают в себя антитела человек. "Антитело человека" представляет собой антитело с аминокислотной последовательностью, соответствующей таковой у антитела, произведенного человеком или клеткой человека, или не относящимся к человеку источником, который использует репертуара антитела человека или другие кодирующие антитела человека последовательности, включая в себя библиотеки антител человека. Термин исключает гуманизированные формы не относящихся к человеку антител, содержащие не относящиеся к человеку антигенсвязывающие области, такие как те, в которых все или по существу все CDR являются не относящимися к человеку.
[00133] Антитела человека можно получить путем введения иммуногена трансгенному животному, которое было модифицировано, чтобы продуцировать интактные антитела человека или интактные антитела с вариабельными областями человека в ответ на антигенную сенсибилизацию. Такие животные, как правило, содержат все или часть локусов иммуноглобулина человека, которые замещают эндогенные локусы иммуноглобулина или которые присутствуют внехромосомно или интегрированы в хромосомы животного. У таких трансгенных животных эндогенные локусы иммуноглобулина, как правило, инактивированы. Антитела человека также можно получить из библиотек антител человека, включая в себя библиотеки фагового дисплея и бесклеточные библиотеки, содержащие кодирующие антитело последовательности, происходящие из репертуара человека.
[00134] Предусмотренные антитела включают в себя моноклональные антитела, включая в себя моноклональные фрагменты антител. Используемый в настоящем документе термин "моноклональное антитело" относится к антителу, полученному из или внутри популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных вариантов, содержащих встречающиеся в природе мутации или возникающие во время получения препарата моноклональных антител, причем такие варианты, как правило, присутствуют в минорных количествах. В отличие от препаратов поликлональных антител, которые, как правило, включают в себя различные антитела, направленные против различных эпитопов, каждое моноклональное антитело препарата моноклональных антител направлено против одного эпитопа на антигене. Термин не следует толковать как требующий получения антитела каким-либо конкретным способом. Моноклональное антитело можно получить с помощью разнообразных техник, включая в себя без ограничения получение из гибридомы, способы рекомбинантной ДНК, способы фагового дисплея и другие способы дисплеев антител.
[00135] Термины "полипептид" и "белок" используют взаимозаменяемо для обозначения полимера аминокислотных остатков, и отсутствуют ограничения относительно минимальной длины. Полипептиды, включая в себя предусмотренные антитела и цепи антител и другие пептиды, например, линкеры и связывающие пептиды, могут включать в себя аминокислотные остатки, включая в себя природные и/или неприродные аминокислотные остатки. Термины также включают в себя постэкспрессионные модификации полипептида, например, гликозилирование, сиалирование, ацетилирование, фосфорилирование и тому подобное. Согласно некоторым аспектам полипептиды могут содержать модификации в отношении нативной или природной последовательности при условии, что белок сохраняет требуемую активность. Указанные модификации могут являться преднамеренными, например, посредством сайт-направленного мутагенеза, или могут являться случайными, например, посредством мутаций хозяев, которые производят белки или ошибки вследствие ПЦР-амплификации.
[00136] "Последовательность зародышевой линии" относится к генетической последовательности из зародышевой линии (гаплоидных гамет и таких диплоидных клеток, из которых они образованы). ДНК Зародышевой линии содержит множественные генные сегменты, которые кодируют одну тяжелую или легкую цепь Ig, или одну цепь TCRα или цепь TCRβ, или одну цепь TCRγ или цепь TCRδ. Указанные генные сегменты переносятся в зародышевые клетки, но не могут траскрибироваться и транслироваться, пока они не аранжируются в функциональные гены. Во время дифференировки В-клеток и Т-клеток в костном мозге указанные генные сегменты случайным образом перетасовываются динамической генетической системой, способной создавать более чем 108 специфичностей. Большинство из указанных генных сегментов опубликовано и собрано в базу данных зародышевой линии.
[00137] Аффинность относится к константе равновесия для обратимого связывания двух агентов и ее выражают как KD. Аффинность связывания белка с лигандом, такая как аффинность антитела к эпитопу или такая как аффинность TCR к комплексу МСН-пептид может составлять, например, от приблизительно 100 наномоль (нМ) до приблизительно 0,1 нМ, от приблизительно 100 нМ до приблизительно 1 пикомоль (пМ) или от приблизительно 100 нМ до приблизительно 1 фемтомоль (фМ). Термин "авидность" относится к устойчивости комплекса двух или больше агентов к диссоциации после разведения.
[00138] Эпитоп в некоторых аспектах относится к части антигена или другой макромолекулы, способной образовывать взаимодействие связывания с связывающим карманом вариабельной области антитела или TCR. Такие взаимодействия связывания могут проявляться как межмолекулярный контакт с одним или более аминокислотными остатками одной или более CDR. Связывание антигена может вовлекать, например, CDR3, пару CDR3 или в некоторых случаях взаимодействия вплоть до всех шести CDR цепей VH и VL. Эпитоп может представлять собой линейную пептидную последовательность (т.е. "непрерывный") или может состоять из несмежных аминокислотных последовательностей (т.е. "конформационный" или "прерывистый"). Антитело или TCR может распознавать одну или более аминокислотных последовательностей; следовательно, эпитоп может определять больше одной отличающейся аминокислотной последовательности. Согласно некоторым аспектам TCR может распознавать одну или более аминокислотных последовательностей или эпитопов в контексте МНС. Эпитопы, распознаваемые антителами и TCR, можно определить с помощью составления пептидных карт и техник анализа последовательностей, хорошо известных специалисту в настоящей области техники. Взаимодействия связывания проявляются как межмолекулярные контакты с одним или более аминокислотными остатками CDR.
[00139] Согласно некоторым вариантам осуществления ссылка на антитело или TCR со специфическим связыванием относится к ситуации, в которой антитело или TCR не будет показывать какого-либо существенного связывания с молекулами, отличными от антигена, содержащего эпитоп, распознаваемый антителом или TCR. Термин также является применимым, когда, например, антигенсвязывающий домен является специфическим в отношении конкретного эпитопа, который содержится в ряде антигенов, в случае чего выбранное антитело, TCR или их антигенсвязывающий фрагмент, несущие антигенсвязывающий домен, будут способны связываться с различными антигенами, несущими этот эпитоп. Термины "предпочтительно связывает" или "специфически связывает" означает, что антитела, TCR или их фрагменты связываются с эпитопом с большей аффинностью, чем они связывают несвязанные аминокислотные последовательности, и, если они перекрестие реагируют с другими полипептидами, содержащими эпитоп, они являться нетоксичными на уровнях, при которых их составляют для введения для применения у людей. Согласно одному аспекту такая аффинность составляет по меньшей мере в 1 раз больше, по меньшей мере в 2 раза больше, по меньшей мере в 3 раза больше, по меньшей мере в 4 раза больше, по меньшей мере в 5 раз больше, по меньшей мере в 6 раз больше, по меньшей мере в 7 раз больше, по меньшей мере в 8 раз больше, по меньшей мере в 9 раз больше, в 10 раз больше, по меньшей мере в 20 раз больше, по меньшей мере в 30 раз больше, по меньшей мере в 40 раз больше, по меньшей мере в 50 раз больше, по меньшей мере в 60 раз больше, по меньшей мере в 70 раз больше, по меньшей мере в 80 раз больше, по меньшей мере в 90 раз больше, по меньшей мере в 100 раз больше или по меньшей мере в 1000 раз больше, чем аффинность антитела, TCR или их фрагмента в отношении несвязанных аминокислотных последовательностей. Термин "связывание" относится к прямой ассоциации между двумя молекулами, вследствие, например, ковалентного, электростатического, гидрофобного и ионного взаимодействий и/или взаимодействия за счет образования водородных связей при физиологических условиях, и включает в себя такие взаимодействия, как солевые мостики и водные мостики, а также любые другие ковалентные способы связывания.
[00140] Термин "связывание" относится к прямой ассоциации между двумя молекулами за счет, например, ковалентного, электростатического, гидрофобного и ионного взаимодействий и/или взаимодействий за счет образования водородных связей при физиологических условиях и включает в себя такие взаимодействия, как солевые мостики и водные мостики, а также любые другие общепринятые средства связывания.
[00141] "Фармацевтически приемлемый" относится к молекулярным структурам и композициям, которые являются физиологически переносимыми и, как правило, не производят аллергическую или сходную нежелательную реакцию, такую как расстройство желудка, головокружение и тому подобное, при введении человеку.
[00142] "Предотвращение" относится к профилактике, предотвращению появления симптомов, предотвращению прогрессирования заболевания или нарушения, ассоциированного с избыточными содержаниями белка или коррелирующего с активностью белка.
[00143] "Ингибирование," "лечение" и "осуществление лечения" используют взаимозаменяемо, и они относятся, например, к остановке развития симптомов, увеличению продолжительности выживаемости, частичному или полному устранению симптомов и частичному или полному устранению состояния, заболевания или нарушения, ассоциированного с избыточными содержаниями белка или коррелирующего с активностью белка. Например, лечение злокачественной опухоли включает в себя без ограничения остановку развития, частичное или полное устранение роста злокачественной опухоли или частичное или полное устранение опухоли. Лечение или частичное устранение включает в себя, например, кратное снижение роста или размера опухоли и/или объема опухоли, например, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 10 раз, приблизительно в 20 раз, приблизительно в 50 раз или любое кратное снижение между указанными значениями. Аналогично, лечение или частичное устранение может включать в себя процентное снижение роста или размера опухоли и/или объема опухоли, составляющее приблизительно 1%, 2%, 3%, 4%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или любое процентное снижение между указанными значениями.
[00144] Нейтрализующее антитело или нейтрализующий TCR в некоторых аспектах относится к любому антителу или TCR, которые ингибируют репликацию патогена, такого как вирус или бактерии, независимо от механизма, за счет которого достигается нейтрализация.
[00145] Репертуар антител или репертуар TCR относится к набору антител, TCR или их фрагментов. Репертуар антител, например, можно использовать для выбора конкретного антитела или скрининга в отношении конкретного свойства, такого как связывающая способность, специфичность связывания, способность к транспорту через желудочно-кишечный тракт, стабильность, аффинность и тому подобное. Термин, в частности, включает в себя библиотеки антител и TCR, включая в себя все формы комбинаторных библиотек, таких как, например, библиотеки антител на основе фагового дисплея, включая в себя без ограничения библиотеки одноцепочечных антител Fv (scFv) и Fab на основе фагового дисплея из любого источника, включая в себя наивные, синтетические и полусинтетические библиотеки.
[00146] "Целевая молекула нуклеиновой кислоты", "целевой полинуклеотид", "целевая молекула полинуклеотида" относится к любой представляющей интерес нуклеиновой кислоте.
[00147] Полимеразная цепная реакция (ПЦР) относится к in vitro реакции амплификации полинуклеотидных последовательностей с помощью одновременной достройки праймера комплементарных цепей двухцепочечного полинуклеотида. Реакции ПЦР производят копии матричного полинуклеотида, фланкированного сайтами связывания праймера. Результат, с двумя праймерами, представляет собой экспоненциальное увеличение числа копий матричного полинуклеотида обоих цепей с каждым циклом, поскольку с каждым циклом обе цепи реплицируются. Полинуклеотидный дуплекс содержит концы, соответствующие концам используемых праймеров. ПЦР может содержать один или более повторов денатурации матричного полинуклеотида, отжига праймеров с сайтами связывания праймера и удлинения праймеров с помощью ДНК- или РНК-полимеразы в присутствии нуклеотидов. Конкретные температуры, продолжительности на каждой стадии и скорости изменения между стадиями зависят от многих факторов, хорошо известных средним специалистам в настоящей области техники. (McPherson et al., IRL Press, Oxford (1991 и 1995)). Например, в общепринятой ПЦР с использованием ДНК-полимеразы Taq, двухцепочечный матричный полинуклеотид можно денатурировать при температуре >90°С, праймеры можно отжигать при температуре в диапазоне 50-75°С и праймеры можно удлинять при температуре в диапазоне 72-78°С. Согласно некоторым вариантам осуществления ПЦР включает в себя ПЦР с обратной транскрипцией (ОТ-ПЦР), ПЦР в режиме реального времени, вложенную ПЦР, количественную ПЦР, мультиплексированную ПЦР или тому подобное. Согласно некоторым вариантам осуществления ПЦР не включает в себя ОТ-ПЦР. (Патенты США №№5168038, 5210015, 6174670, 6569627 и 5925517; Mackay et al., Nucleic Acids Research, 30: 1292-1305 (2002)). ОТ-ПЦР включает в себя реакцию ПЦР, которой предшествует реакция обратной транскрипции и которая дает в результате амплифицированную кДНК, Вложенная ПЦР включает в себя двухстадийную ПЦР, при которой ампликон первой реакции ПЦР с использованием первого набора праймеров становится образцом для второй реакции ПЦР с использованием второго набора праймеров, по меньшей мере один из которых связывается с внутренним положением ампликона первой реакции ПЦР. Мультиплексированная ПЦР включает в себя реакцию ПЦР, при которой множество полинуклеотидных последовательностей подвергают ПЦР в одной и той же реакционной смеси одновременно. Объемы реакции ПЦР могут составлять любые в диапазоне 0,2 пл-1000 мкл. Количественная ПЦР включает в себя реакцию ПЦР, разработанную для измерения абсолютного или относительного количества, копийности или концентрации одной или более последовательностей в образце. Количественные измерения могут включать в себя сравнение одной или более эталонных последовательностей или стандартов с представляющей интерес полинуклеотидной последовательностью. (Freeman et al., Biotechniques, 26: 112-126 (1999); Becker-Andre et al., Nucleic Acids Research, 17: 9437-9447 (1989); Zimmerman et al., Biotechniques, 21: 268-279 (1996); Diviacco et al., Gene, 122: 3013- 3020 (1992); Becker-Andre et al.. Nucleic Acids Research, 17: 9437-9446 (1989)).
[00148] Используемые в настоящем документе термины "нуклеотид", "нуклеозид", "нуклеотидный остаток" и "нуклеозидный остаток" могут означать дезоксирибонуклеотидный или рибонуклеотидный остаток или другой сходный нуклеозидный аналог, способный служить в качестве компонента праймера, подходящего для применения в реакции амплификации (например, реакции ПЦР). Такие нуклеозиды и их производные можно использовать в качестве строительных блоков праймеров, описанных в настоящем документе, за исключением тех случаев, в которых указано иное. Ничто в настоящей заявке не предназначено для предотвращения использования нуклеозидных производных или оснований, которые были химически модифицированы для усиления их стабильности или применимости в реакции амплификации, при условии, что химическая модификация не оказывает влияние на их распознавание полимеразой как дезоксигуанин, дезоксицитозин, дезокситимидин или дезоксиаденин, в соответствующих случаях. Согласно некоторым вариантам осуществления нуклеотидные аналоги могут стабилизировать образование гибрида. Согласно некоторым вариантам осуществления нуклеотидные аналоги могут дестабилизировать гибрид образование. Согласно некоторым вариантам осуществления нуклеотидные аналоги могут усиливать специфичность гибридизации. Согласно некоторым вариантам осуществления нуклеотидные аналоги могут снижать специфичность гибридизации.
[00149] "Нуклеиновая кислота" или грамматические эквиваленты относятся или к отдельно взятому нуклеотиду, или по меньшей мере двум нуклеотидам, ковалентно связанным вместе.
[00150] "Полинуклеотид" или грамматические эквиваленты относятся по меньшей мере к двум нуклеотидам, ковалентно связанным вместе. Полинуклеотид содержит молекулу, содержащую два или больше нуклеотидов. Полинуклеотид содержит полимерную форму нуклеотидов любой длины, или рибонуклеотиды, дезоксирибонуклеотиды, или пептидные нуклеиновые кислоты (PNA), которые содержат пуриновые и пиримидиновые основания или другие природные, химически или биохимически модифицированные, неприродные или производные нуклеотидные основания. Остов полинуклеотида может содержать сахара и фосфатные группы или модифицированные или замещенные группы сахара или фосфатные группы. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и нуклеотидные аналоги. Последовательность нуклеотидов может прерываться ненуклеотидными компонентами. Полинуклеотид может включать в себя другие молекулы, такие как другие гибридизированный полинуклеотид. Полинуклеотиды включают в себя последовательности дезоксирибонуклеиновой кислоты (ДНК), рибонуклеиновой кислоты (РНК) или той, и другой. Неограничивающие примеры полинуклеотидов включают в себя ген, фрагмент гена, экзон, интрон, межгенную ДНК (включая в себя без ограничения гетерохроматическую ДНК), информационную РНК (иРНК), транспортную РНК, рибсомальную РНК, рибозимы, короткую интерферирующую РНК (киРНК), кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенную ДНК последовательности, выделенную РНК последовательности, нуклеиновокислотные зонды и праймеры. Полинуклеотиды можно выделить из природных источников, рекомбинантно или искусственно синтезировать.
[00151] Полинуклеотиды могут включать в себя нестандартные нуклеотиды, такие как нуклеотидные аналоги или модифицированные нуклеотиды. Согласно некоторым вариантам осуществления нестандартные нуклеотиды могут стабилизировать образование гибрида. Согласно некоторым вариантам осуществления нестандартные нуклеотиды могут дестабилизировать образование гибрида. Согласно некоторым вариантам осуществления нестандартные нуклеотиды могут усиливать специфичность гибридизации. Согласно некоторым вариантам осуществления нестандартные нуклеотиды могут снижать специфичность гибридизации. Примеры модификаций нестандартных нуклеотидов включают в себя следующее: 2' O-Ме, 2' O-аллил, 2' O-пропаргил, 2' O-алкил, 2' фтор, 2' арабино, 2' ксило, 2' фторарабино, фосфоротиоат, фосфородитиоат, фосфорамидаты, 2' амино, 5-алкил-замещенный пиримидин, 3' дезоксигуанозин, 5-галогензамещенный пиримидин, алкилзамещенный пурин, галогензамещенный пурин, бициклические нуклеотиды, 2'МОЕ, молекулы PNA, молекулы LNA (закрытая нуклеиновая кислота), LNA-подобные молекулы, диаминопурин, S2T, 5-фторурацил, 5-бромурацил, 5-хлорурацил, 5-йодурацил, гипоксантин, ксантин, 4-ацетилцитозин, 5-(карбоксигидроксилметил)урацил, 5-карбоксиметиламинометил-2-тиоуридин, 5-карбоксиметиламинометилурацил, дигидроурацил, бета-D-галактозилквеуозин, инозин, N6-изопентениладенин, 1-метилгуанин, 1-метилинозин, 2,2-диметилгуанин, 2-метиладенин, 2-метилгуанин, 3-метилцитозин, 5-метилцитозин, N6-аденин, 7-метилгуанин, 5-метиламинометилурацил, 5-метоксиаминометил-2-тиоурацил, бета-D-маннозилквеуозин, 5'-метоксикарбоксиметилурацил, 5-метоксиурацил, 2-метилтио-D46-изопентениладенин, урацил-5-оксиуксусная кислота (v), вибутоксозин, псевдоурацил, квеуозин, 2-тиоцитозин, 5-метил-2-тиоурацил, 2-тиоурацил, 4-тиоурацил, 5-метилурацил, метиловый эфир урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусная кислота (v), 5-метил-2-тиоурацил, 3-(3-амино-3-N-2- карбоксипропил)урацил, (acp3)w, 2,6-диаминопурин и их производные.
[00152] "Субъект", "индивидуум", "хозяин" или "пациент" относится к живым организмам, таким как млекопитающие. Примеры субъектов и хозяев включают в себя без ограничения лошадей, коров, верблюдов, овец, свиней, коз, собак, кошек, кроликов, морских свинок, крыс, мышей (например, гуманизированных мышей), карликовых песчанок, не являющихся человеком приматов (например, макак), людей и тому подобное, не млекопитающих, включая в себя, например, не являющихся млекопитающими позвоночных, таких как птицы (например, курицы или утки), рыбы (например, акулы) или лягушки (например, Xenopus), и не являющихся млекопитающими беспозвоночные, а также их трансгенные виды. Согласно определенным аспектам субъект относится к одному организму (например, человеку). Согласно определенным аспектам предусмотрена группа индивидуумов, составляющая небольшую когорту, характеризующуюся или общим иммунным фактором, подлежащим исследованию, и/или заболеванием, и/или когорту индивидуумов без заболевания (например, отрицательный/нормальный контроль). Субъект, из которого получают образцы, может быть либо инфицирован заболеванием и/или нарушением (например, одним или более из аллергий, инфекций, злокачественных опухолей или аутоиммунных нарушений или тому подобного), и его можно сравнить с субъектом - отрицательным контролем, который не поражен заболеванием.
[00153] "Набор" относится к системе доставки для доставки материалов или реагентов для проведения раскрытого в настоящем документе способа. Согласно некоторым вариантам осуществления наборы включают в себя системы, которые обеспечивают возможность хранения, транспортировки или доставки реагентов реакции (например, зонды, ферменты и т.д. в соответствующих контейнерах) и/или вспомогательные материалы (например, буферы, письменные инструкции для проведения анализа и т.д.) из одного места в другое. Например, наборы включают в себя один или более вложений (например, коробок), содержащих соответствующие реагенты реакции и/или вспомогательных материалов. Такие разновидности содержимого можно доставить предусмотренному реципиенту вместе или отдельно. Например, первый контейнер может содержать фермент для применения в анализе, а второй контейнер содержит множество праймеров.
[00154] Полипептид в некоторых аспектах относится к молекуле, содержащей по меньшей мере две аминокислоты. Согласно некоторым вариантам осуществления полипептид состоит из одного пептида. Согласно некоторым вариантам осуществления полипептид содержит два или больше пептидов. Например, полипептид может содержать по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17,18, 19, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 пептидов или аминокислот. Примеры полипептидов включают в себя без ограничения аминокислотные цепи, белки, пептиды, гормоны, полипептидные сахариды, липиды, гликолипиды, фосфолипиды, антитела, ферменты, киназы, рецепторы, факторы транскрипции и лиганды.
[00155] Образец в некоторых аспектах относится к биологическому образцу, образцу окружающей среды, медицинскому образцу, образцу субъекта или пациента или образцу, содержащему полинуклеотид, такой как целевой полинуклеотид.
Конъюгаты аффинная часть-олигонуклеотид
[00156] Конъюгат аффинная часть-олигонуклеотид содержит часть -аффинную молекулу (например, антитело или комплекс МНС-пептид) и олигонуклеотидную часть. Последовательность идентификации антигена олигонуклеотид конъюгата аффинная часть-олигонуклеотид можно использовать для идентификации одного или более антигенов, в которыми специфически взаимодействует конъюгат аффинная часть-олигонуклеотид. Согласно некоторым вариантам осуществления олигонуклеотид прикреплен ковалентно к аффинной части конъюгата. Согласно некоторым вариантам осуществления олигонуклеотид прикреплен нековалентно к аффинной части конъюгата.
[00157] Согласно некоторым вариантам осуществления конъюгат аффинная часть-олигонуклеотид содержит одну аффинную часть. Согласно некоторым вариантам осуществления конъюгаты аффинная часть-олигонуклеотид представляют собой мультивалентные конъюгаты аффинная часть-олигонуклеотид. Например, мультивалентные конъюгаты аффинная часть-олигонуклеотид могут содержать антигенсвязывающие домены по меньшей мере двух аффинных молекул, конъюгированных с одним или более олигонуклеотидами. Например, мультивалентные конъюгаты аффинная часть-олигонуклеотид могут содержать антигенсвязывающие домены по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 50, 100, 200, 500 или 1000 аффинных молекул, конъюгированных с одним или более олигонуклеотидами.
[00158] Согласно некоторым вариантам осуществления конъюгат аффинная часть-олигонуклеотид содержит один олигонуклеотид. Согласно некоторым вариантам осуществления конъюгат аффинная часть-олигонуклеотид содержит 2 или больше олигонуклеотидов. Например, конъюгат аффинная часть-олигонуклеотид может содержать по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 50, 100, 200, 500 или 1000 олигонуклеотидов, конъюгированных с одной или более аффинными молекулами (например, антителом или комплексом МНС-пептид). Согласно некоторым вариантам осуществления конъюгат аффинная часть-олигонуклеотид содержит 2 или больше олигонуклеотидов, содержащих одинаковую последовательность идентификации антигена (AID). Например, конъюгат аффинная часть-олигонуклеотид может содержать по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 50, 100, 200, 500 или 1000 олигонуклеотидов, содержащих одинаковую последовательность AID.
Аффинная часть конъюгатов аффинная часть-олигонуклеотид
[00159] Аффинная часть (или домен) конъюгата аффинная часть-олигонуклеотид содержит область, молекулу, домен, часть, фрагмент или элемент конъюгата аффинная часть-олигонуклеотид, которые связываются с целевым антигеном. Таким образом, аффинная часть обеспечивает способность связываться или специфически связываться с данным целевым антигеном, таким как внеклеточный домен белка клеточной поверхности. Согласно некоторым вариантам осуществления аффинная часть по существу не взаимодействует с антигеном другого конъюгата аффинная часть-олигонуклеотид, содержащего отличающуюся последовательность идентификации антигена. Согласно некоторым вариантам осуществления аффинная часть представляет собой молекулу, которая может содержать нуклеиновую кислоту или к которой может быть прикреплен олигонуклеотид, по существу не нарушая связывание аффинной части с целевым антигеном.
[00160] Аффинная часть конъюгата аффинная часть-олигонуклеотид может представлять собой молекулу нуклеиновой кислоты или может являться белковой. Аффинные части включают в себя без ограничения РНК, ДНК, гибриды РНК-ДНК, малые молекулы (например, лекарственные средства), аптамеры, полипептиды, белки, антитела и их фрагменты, TCR и их фрагменты, вирусы, вирусные частицы, клетки, их фрагменты и их комбинации. (См., например, Fredriksson et al., (2002) Nat Biotech 20:473-77; Gullberg et al., (2004) PNAS, 101:8420-24). Например, аффинная часть может представлять собой одноцепочечную РНК, двухцепочечную РНК, одноцепочечную ДНК, двухцепочечную ДНК, ДНК или РНК, содержащую одну или более двухцепочечных областей и одну или более одноцепочечных областей, гибрид РНК-ДНК, малую молекулу, аптамер, полипептид, белок, антитело, фрагмент антитела, TCR, фрагмент TCR, MHC, комплекс МНС-пептид, вирусную частицу, клетку или любую их комбинацию.
[00161] Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид нацелена на клетку. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может являться нацеленной на Т-клетку или В-клетку. Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид нацелена на конкретный тип клеток или подкласс клеток. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может являться нацеленной на CD4+ Т-клетку или CD8+ Т-клетку. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может являться нацеленной на Т-клетку, содержащую TCR, который специфически распознает конкретный антиген. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может являться нацеленной на Т-клетку, содержащую TCR, который специфически распознает конкретный комплекс МНС-пептид.
[00162] Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид нацелена на внеклеточный домен мишени клетки. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может являться нацеленной на внеклеточный домен рецептора клетки, например, Т-клеточного рецептора. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может являться нацеленной на гликозилированную область внеклеточного домена рецептора клетки. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может являться нацеленной на лигандсвязывающую область внеклеточного домена рецептора клетки. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может являться нацеленной на область внеклеточного домена рецептора клетки, которая не связывается с лигандом.
Белки
[00163] Согласно некоторым вариантам осуществления аффинная часть представляет собой полипептид, белок или любой их фрагмент. Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид представляет собой белок. Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид представляет собой пептид. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может представлять собой антитело, такое как связывающий домен антитела. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может представлять собой комплекс МНС-пептид. Например, аффинная часть может представлять собой следующее: очищенный полипептид, выделенный полипептид, слитый меченый полипептид, полипептид, прикрепленный к мембране клетки или вируса или вириона или являющийся трансмембранным, цитоплазматический белок, внутриклеточный белок, внеклеточный белок, киназа, фосфатаза, ароматаза, хеликаза, протеаза, оксидоредуктаза, редуктаза, трансфераза, гидролаза, лиаза, изомераза, гликозилаза, белок внеклеточного матрикса, лигаза, переносчик ионов, канал, пора, апоптотический белок, белок клеточной адгезии, патогенный белок, аберрантно экспрессируемый белок, фактор транскрипции, регулятор транскрипции, трансляционный белок, шаперон, секретированный белок, лиганд, гормон, цитокин, хемокин, ядерный белок, рецептор, трансмембранный рецептор, передатчик сигнала, антитело, мембранный белок, интегральный мембранный белок, периферический мембранный белок, белок клеточной стенки, глобулярный белок, волокнистый белок, гликопротеин, липопротеин, хромосомный белок, любой их фрагмент или любая их комбинация. Согласно некоторым вариантам осуществления аффинная часть представляет собой гетерологичный полипептид. Согласно некоторым вариантам осуществления аффинная часть представляет собой белок, избыточно экспрессируемый в клетке с использованием молекулярных техник, таких как трансфекция. Согласно некоторым вариантам осуществления аффинная часть представляет собой рекомбинантный полипептид. Например, аффинная часть может содержать образцы, произведенные в бактериальных (например, Е. coil), дрожжевых клетках, клетках млекопитающего или насекомого (например, белки, избыточно экспрессируемые организмами). Согласно некоторым вариантам осуществления аффинная часть представляет собой полипептид, содержащий мутацию, вставку, делецию или полиморфизм. Согласно некоторым вариантам осуществления аффинная часть представляет собой антиген, такой как полипептид, используемый для иммунизации организма или получения иммунного ответа в организме, такого как продукция антител.
Антитела
[00164] Согласно некоторым вариантам осуществления аффинная часть представляет собой антитело, например, связывающий фрагмент антитела. Антитело может специфически связываться с конкретной пространственной и полярной организацией другой молекулы. Например, антитело может представлять собой очищенное антитело, выделенное антитело, фрагмент антитела или слитое меченое антитело. Согласно некоторым вариантам осуществления антитело избыточно экспрессируют в клетке с использованием молекулярных техник, таких как трансфекция. Согласно некоторым вариантам осуществления антитело представляет собой рекомбинантное антитело. Антитело может специфически связываться с конкретной пространственной и полярной организацией другой молекулы, такой как молекула клеточной поверхности. Антитело может представлять собой моноклональное, поликлональное или рекомбинантное антитело, и его можно получить с помощью техник, которые хорошо известны в настоящей области техники, такой как иммунизация хозяина и сбор сывороток (поликлональные антитела) или путем получения непрерывных гибридных клеточных линий и сбора секретированного белка (моноклональные антитела) или путем клонирования и экспрессии нуклеотидных последовательностей или их подвергнутых мутагенезу версий, кодирующий по меньшей мере аминокислотные последовательности, необходимые для специфического связывания природных антител. Кроме того, агрегаты, полимеры и конъюгаты иммуноглобулинов или их фрагменты можно использовать при необходимости при условии, что сохраняется аффинность связывания в отношении конкретной молекулы. Примеры фрагментов антител включают в себя фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; фрагмент F(ab)2, бивалентный фрагмент, содержащий два фрагмента Fab, соединенные дисульфидным мостиком на шарнирной области; фрагмент Fd, состоящий из доменов VH и CH1; фрагмент Fv, состоящий из доменов VL и VH в одном плече антитела; фрагмент однодоменного антитела (dAb) (Ward et al., (1989) Nature 341:544-46), который состоит из домена VH; и выделенную CDR и одноцепочечный фрагмент (scFv), в котором области VL и VH образуют пару с формированием моновалентных молекул (известных как одноцепочечное Fv (scFv); см., например, Bird et al., (1988) Science 242:423-26; и Huston et al., (1988) PNAS 85:5879-83). Таким образом, фрагменты антител включают в себя Fab, F(ab)2, scFv, Fv, dAb и тому подобное. Хотя два домена VL и VH кодируются отдельными генами, их можно соединить с использованием рекомбинантных способов, с помощью искусственного пептидного линкера, который обеспечивает их получение в виде отдельной белковой цепи. Такие одноцепочечные антитела включают в себя один или более антигенсвязывающих фрагментов. Указанные фрагменты антител можно получить с использованием общепринятых техник, известных специалистам в настоящей области техники, и фрагменты можно подвергать скринингу в отношении применимости тем же способом, что и интактные антитела. Антитела могут являться человеческими, гуманизированными, химерными, выделенными, представлять собой антитела собаки, кошки, осла, овцы, любого растения, животного или млекопитающего.
МНС
[00165] Распознавание антигенных структур системой клеточного иммунитета в некоторых случаях опосредовано экспресируемыми на поверхности главными комплексами гистосовместимости (МНС). Клетки, такие как антигенпрезентирующие клетки (АРС), в некоторых аспектах процессируют белки, такие как антигены, до коротких пептидов, которые могут быть презентированы в специфической пептидсвязывающей укладке молекулы МНС и в некоторых аспектах могут, таким образом, распознаваться Т-клетками. Специфическое распознавание эпитопа (пептидного фрагмента) Т-клеточным рецептором (TCR), как правило, требует одновременного взаимодействия с молекулой МНС. Стабильный мультимерный комплекс можно получить с белковыми субъединицами МНС, содержащими связанный пептид. Комплекс МНС-антиген может формировать стабильную структуру с Т-клетками, распознающими комплекс посредством своего антигенного рецептора, тем самым обеспечивая возможность связывания с Т-клетками, которые специфически распознают антиген. Аффинная часть конъюгата аффинная часть-олигонуклеотид может являться нацеленной на Т-клетка. Аффинная часть конъюгата аффинная часть-олигонуклеотид может быть специфически нацелена на Т-клетку. Аффинная часть конъюгата аффинная часть-олигонуклеотид может являться нацеленной на Т-клеточный рецептор или TCR-подобную молекулу, такую как TCR-подобный CAR. Аффинная часть конъюгата аффинная часть-олигонуклеотид может быть специфически нацелена на Т-клеточный рецептор. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может содержать молекулу МНС. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может содержать комплекс МНС-пептид (МНС-р). Аффинная часть конъюгата аффинная часть-олигонуклеотид может характеризоваться формулой (А-В-Р)n, где А представляет собой α-цепь белка МНС класса I или МНС класса II, В представляет собой β-цепь белка МНС класса II или β2 микроглобулин для белка МНС класса I, и Р представляет собой пептид. Согласно некоторым вариантам осуществления n представляет собой 1. Согласно некоторым вариантам осуществления n больше чем или равно 2. Белковые субъединицы МНС могут представлять собой растворимую форму. Например, растворимые белковые субъединицы МНС можно получить из нативных белковых субъединиц МНС путем делеции трансмембранного домена или его части. Согласно некоторым вариантам осуществления белковые субъединицы МНС не содержат цитоплазматический домен. Согласно некоторым вариантам осуществления белковые субъединицы МНС не содержат трансмембранный домен.
[00166] Пептид (Р) может составлять приблизительно 6-12 аминокислот в длину для комплексов с белками МНС класса I, например, приблизительно 8-10 аминокислот. Пептид может составлять приблизительно 6-20 аминокислот в длину для комплексов с белками МНС класса II, например, приблизительно 10-18 аминокислот. Пептиды могут характеризоваться последовательностью, полученной из широко спектра белков. Пептиды могут представлять собой Т-клеточные эпитопы. Эпитопные последовательности из ряда антигенов являться известными в настоящей области техники. Альтернативно эпитопную последовательность можно определить эмпирически, путем выделения и секвенирования пептидов, связанных с нативными белками МНС, путем синтеза серий пептидов из целевой последовательности, затем анализа в отношении Т-клеточной реактивности к различным пептидам или путем получения серий связывающих комплексов с различными пептидами и количественного определения Т-клеточного связывания. Получение фрагментов, идентификация последовательностей и идентификация минимальной последовательности описаны в патенте США №5019384 и ссылках, процитированных в нем. Пептиды можно получить разнообразными путями. Традиционно их можно синтезировать с помощью общепринятых техник с использованием автоматических устройств для синтеза или можно синтезировать вручную. Альтернативно можно получить последовательности ДНК, которые кодируют конкретный пептид, и их можно клонировать и экспрессировать с получением требуемого пептида. В этом случае метионин может являться первой аминокислотой. Кроме того, пептиды можно получить с помощью рекомбинантных способов в виде слияния с белками, которые представляют собой белок из участвующей в специфическом связывании пары, обеспечивая очистку белка слияния с помощью аффинных реагентов с последующим протеолитическим расщеплением, как правило, в сконструированном сайте с получением на выходе требуемого пептида (см., например, Driscoll et al. (1993) J. Mol. Bio. 232:342-350). Пептиды также можно выделить из природных источников и очистить с помощью известных техник, включая в себя, например, хроматографию на ионообменных материалах, разделение по размеру, иммуноаффинную хроматографию и электрофорез.
[00167] Согласно некоторым вариантам осуществления α- и β-субъединицы получают отдельно и позволяют им ассоциироваться in vitro с образованием стабильного гетеродуплексного комплекса (см., например, Altman et al. (1993) или Garboczi et al. (1992)). Согласно некоторым вариантам осуществления α- и β-субъединицы экспрссируют вместе в одной клетке. Согласно некоторым вариантам осуществления используют одну молекулу, характеризующуюся α- и β-субъединицами. Например, одноцепочечный гетеродимер можно создать путем слияния вместе двух субъединиц с использованием короткого пептидного линкера, например, пептида или линкера, составляющего 15-25 аминокислот в длину (см., например, Bedzyk et al. (1990) J. Biol. Chem. 265:18615). Растворимые гетеродимеры также можно получить путем выделения нативного гетеродимера и расщепления с помощью протеазы, например, папаина, с получением растворимого продукта.
[00168] Растворимые субъединицы можно независимо экспрессировать из конструкта ДНК, кодирующего процессированный белок. Для экспрессии последовательности ДНК можно вставить в соответствующий экспрессионный вектор, в котором можно использовать нативную область инициации транскрипции или экзогенную область инициации транскрипции, например, промотор, отличный от промотора, который ассоциирован с геном во встречающейся в природе хромосоме. Промотор можно ввести с помощью рекомбинантных способов in vitro или в результате гомологичной интеграции последовательности в хромосому. Области инициации транскрипции известны для широкого спектра хозяев экспрессии. Хозяева экспрессии могут включать в себя прокариот или эукариот, в частности, Е. coli, В. subtilis, клетки млекопитающего, такие как клетки СНО, клетки COS, клетки почки обезьяны, лимфоидные клетки, клеточные линии человека и тому подобное.
[00169] Субъединицы можно экспрессировать в подходящей клетке-хозяине и при необходимости солюбилизировать. Две субъединицы можно комбинировать с пептидом и обеспечить им возможность укладки in vitro с образованием стабильного гетеродимерного комплекса с доменами, связанными межцепочечными дисульфидными связями. Пептид можно включить в начальную реакцию укладки или можно добавить к пустому гетеродимеру на более поздней стадии. Связывающий сайт МНС может не содержать пептиды до добавления пептида. Исключением будут те случаи, когда необходимо пометить Т-клетки с помощью природного комплекса пептид-МНС, например, такого, который может присутствовать на поверхности клеток, которые являются мишенью для аутоиммунной атаки и т.д. Гетеродимер МНС будет связываться с пептидом в полости, образованной двумя мембранными дистальными доменами, или α2 и α1 для класса I, или α1 и β1 для класса II. Условия, которые обеспечивают возможность укладки и ассоциации субъединиц и пептида, известны в настоящей области техники (см., например, Altman et al. (1993) и Garboczi et al. (1992)). В качестве одного примера пермиссивных условий, примерно эквимолярные количества солюбилизированных аир субъединиц смешивают в растворе мочевины. Повторную укладку инициируют путем разведения или диализа в забуференном растворе без мочевины. Пептиды загружают в пустые гетеродимеры класса II при рН приблизительно 5-5,5 в течение приблизительно 1-3 дней с последующей нейтрализацией, концентрированием и заменой буфера. Тем не менее, специалисту в настоящей области техники будет понятно, что конкретные условия укладки не являются критическими для осуществления настоящего изобретения на практике.
[00170] Согласно некоторым вариантам осуществления мономерный комплекс (α-β-Р) можно подвергнуть мультимеризации. Например, мультимер может быть образован путем связывания мономеров с мультивалентной молекулой посредством специфических сайтов прикрепления на α или β субъединице. Согласно некоторым вариантам осуществления мультимер образован с помощью химического поперечного сшивания мономеров. Ряд реагентов, способных поперечно сшивать белки, известен в настоящей области техники, включая в себя без ограничения следующее: азидобензоил гидразид, N-[4-(п-азидосалициламино)бутил]-3'-[2'-пиридилдитио]пропионамид), бис-сульфосукцинимидилсуберат, диметиладипимидат, дисукцинимидилтартрат, N-γ-малеимидобутирилоксисукцинимидовый сложный эфир, N-гидроксисульфосукцинимидил-4-азидобензоат, N-сукцинимидил-[4-азидофенил]-1,3'-дитиопропионат, N-сукцинимидил-[4-йодацетил]аминобензоат, глутаральдегид, формальдегид и сукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилат. Сайт прикрепления для связывания мультивалентной молекулой может являться встречающимся в природе или его можно ввести посредством генной инженерии. Сайт может представлять собой компонент участвующей в специфическом связывании пары или сайт, который модифицирован для получения компонента участвующей в специфическом связывании пары, где комплементарная пара содержит множество сайтов специфического связывания. Связывание с комплементарным компонентом связывания может представлять собой химическую реакцию, связывание эпитопа с рецептором или связывание гаптена с рецептором, где гаптен соединен с цепью субъединицы. Согласно предпочтительному варианту осуществления одну из субъединиц подвергают слиянию с аминокислотной последовательностью, обеспечивая сайт распознавания для модифицирующего фермента. Последовательность распознавания, как правило, подвергают слиянию проксимально относительно карбокси-конца одной из субъединиц во избежание потенциального затруднения на сайте связывания антигенного пептида. В целях удобства экспрессионная кассета будет включать в себя последовательность, кодирующую сайт распознавания.
[00171] Представляющие интерес модифицирующие ферменты включают в себя BirA, различные гликозилазы, фарнезилпротеинтрансферазу, протеинкиназы и тому подобное. Субъединицу можно вводить в реакцию с модифицирующим ферментом в любое удобное время, как правило, после образования мономера. Группа, введенная с помощью модифицирующего фермента, например, биотин, сахар, фосфат, фарнезил и т.д., обеспечивает комплементарный компонент пары связывания или уникальный сайт для дополнительной модификации, такой как химическое поперечное сшивание, биотинилирование и т.д., которая будет обеспечивать комплементарный компонент участвующая в связывании пары. Альтернативная стратегия состоит во введении неспаренного остатка цистеина в субъединицу, тем самым вводя уникальный и химически реакционноспособный сайт для связывания. Сайт прикрепления также может представлять собой встречающийся в природе или введенный эпитоп, где мультивалентный партнер по связыванию будет представлять собой антитело, например, IgG, IgM и т.д. Любая модификация будет происходить на сайте, например, проксимальном относительно С-конца, что не будет препятствовать связыванию. Иллюстративное образование мультимера представляет собой введение последовательности распознавания для фермента BirA, который катализирует биотинилирование белкового субстрата. Мономер с биотинилированной субъединицей затем связывают с мультивалентным партнером по связыванию, например, стрептавидином или авидином, с которым биотин связывается с очень высокой аффинностью. Стрептавидин характеризуется валентностью 4, давая в результате мультимер (α-β-Р)4. Мультивалентный партнер по связыванию может быть свободным в растворе или может являться прикрепленным к нерастворимой подложке. Примеры подходящих нерастворимых подложек включают в себя шарики, например, магнитные шарики, мембраны и планшеты для микротитрования. Как правило, они изготовлены из стекла, пластика (например, полистирола), полисахаридов, нейлона или нитроцеллюлозы. Прикрепление к нерастворимой подложке является применимым, когда связывающий комплекс подлежит применению для разделения Т-клеток.
Клетки
[00172] Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид представляет собой клетку. Например, аффинная часть может представлять собой интактную клетку, клетку, обработанную с помощью соединения (например, лекарственного средства), фиксированную клетку, лизированную клетку или любую их комбинацию. Согласно некоторым вариантам осуществления аффинная часть представляет собой отдельно взятую клетку. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может представлять собой Т-клетку или В-клетку. Согласно некоторым вариантам осуществления аффинная часть представляет собой множество клеток. Согласно некоторым вариантам осуществления аффинная часть представляет собой Т-клетку. Согласно некоторым вариантам осуществления аффинная часть представляет собой В-клетку. Согласно некоторым вариантам осуществления аффинная часть представляет собой антигенпрезентирующую клетку (АРС). Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид представляет собой конкретный тип клеток или подкласс клеток. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может представлять собой CD4+ Т-клетку или CD8+ Т-клетку. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может представлять собой Т-клетку, содержащую TCR, который специфически распознает конкретный антиген. Например, аффинная часть конъюгата аффинная часть-олигонуклеотид может представлять собой Т-клетку, содержащую TCR, который специфически распознает конкретный комплекс МНС-пептид. Согласно некоторым вариантам осуществления аффинная часть представляет собой клетку.
Малые молекулы
[00173] Согласно некоторым вариантам осуществления аффинная часть конъюгата аффинная часть-олигонуклеотид представляет собой малую молекулу, такую как лекарственное средство. Например, малая молекула может представлять собой макроциклическую молекулу, ингибитор, лекарственное средство или химическое соединение. Согласно некоторым вариантам осуществления малая молекула содержит не больше чем пять доноров водородной связи. Согласно некоторым вариантам осуществления малая молекула содержит не больше чем десять акцепторов водородной связи. Согласно некоторым вариантам осуществления малая молекула характеризуется молекулярной массой, составляющей 500 Да или меньше. Согласно некоторым вариантам осуществления малая молекула характеризуется молекулярной массой, составляющей приблизительно 180-500 Да. Согласно некоторым вариантам осуществления малая молекула характеризуется log Р концентрационного коэффициента распределения октанол-вода, составляющим не больше чем 5. Согласно некоторым вариантам осуществления малая молекула характеризуется log Р концентрационного коэффициента распределения, составляющим -0,4 - 5,6. Согласно некоторым вариантам осуществления малая молекула характеризуется молярным коэффициентом преломления, составляющим 40-130. Согласно некоторым вариантам осуществления малая молекула содержит приблизительно 20 - приблизительно 70 атомов. Согласно некоторым вариантам осуществления малая молекула характеризуется площадью полярной поверхности, составляющей 140 ангстрем2 или меньше.
Нуклеиновые кислоты
[00174] Согласно некоторым вариантам осуществления аффинная часть представляет собой полимерную форму рибонуклеотидов и/или дезоксирибонуклеотидов (аденина, гуанина, тимина или цитозина), такую как ДНК или РНК (например, иРНК). ДНК включает в себя двухцепочечную ДНК, встречающуюся в линейных молекулах ДНК (например, рестрикционных фрагментах), вирусах, плазмидах и хромосомах. Согласно некоторым вариантам осуществления полинуклеотид аффинная часть представляет собой следующее: одноцепочечная, двухцепочечная, короткая интерферирующая РНК (киРНК), информационная РНК (иРНК), транспортная РНК (тРНК), хромосома, ген, некодирующая геномная последовательность, геномная ДНК (например, фрагментированная геномная ДНК), очищенный полинуклеотид, выделенный полинуклеотид, гибридизированный полинуклеотид, сайт связывания фактора транскрипции, митохондриальная ДНК, рибосомная РНК, эукариотический полинуклеотид, прокариотический полинуклеотид, синтезированный полинуклеотид, дотированный полинуклеотид, рекомбинантный полинуклеотид, полинуклеотид, содержащий аналог нуклеиновой кислоты, метилированный полинуклеотид, деметилированный полинуклеотид, любой их фрагмент или любая их комбинация. Согласно некоторым вариантам осуществления аффинная часть представляет собой полинуклеотид, содержащий двухцепочечную область и конец, который не является двухцепочечным (например, 5' или 3' «липкая» область). Согласно некоторым вариантам осуществления аффинная часть представляет собой рекомбинантный полинуклеотид. Согласно некоторым вариантам осуществления аффинная часть представляет собой гетерологичный полинуклеотид. Например, аффинная часть может содержать полинуклеотиды, произведенные в бактериальных (например, Е. coli), дрожжевых клетках, клетках млекопитающего или насекомого (например, полинуклеотиды, гетеро логичные организмам). Согласно некоторым вариантам осуществления аффинная часть представляет собой полинуклеотид, содержащий мутацию, вставку, делецию или полиморфизм.
[00175] Согласно некоторым вариантам осуществления аффинная часть представляет собой аптамер. Аптамер представляет собой выделенную молекулу нуклеиновой кислоты, которая связывается с высокой специфичностью и аффинностью с целевым аналитом, таким как белок. Аптамер представляет собой трехмерную структуру, поддерживающуюся в определенной(ых) конформации(ях), которая(ые) обеспечивает(ют) химические контакты для специфического связывания с данной мишенью. Хотя аптамеры представляют собой молекулы на основе нуклеиновой кислоты, существует фундаментальное отличие между аптамерами и другими молекулами нуклеиновых кислот, такими как гены и иРНК. В последних структура нуклеиновой кислоты кодирует информацию посредством своей линейной последовательности оснований, и, таким образом, эта последовательность является очень важной для функции хранения информации. В полной противоположности этому, функция аптамера, которая основана на специфическом связывании с целевой молекулой, не целиком зависит от консервативной линейной основной последовательности оснований (некодирующей последовательности), а скорее от конкретной вторичной/третичной/четвертичной структуры. Любой потенциал к кодированию, которым может обладать аптамер, является полностью случайным и не играет никакой роли в связывании аптамера со своей когнатной мишенью. Аптамеры также следует отличать от встречающихся в природе последовательностей нуклеиновых кислот, которые связываются с определенными белками. Последние последовательности представляют собой встречающиеся в природе последовательности, заключенные в пределы генома организма, которые связываются со специализированной подгруппой белков, которые вовлечены в транскрипцию, трансляцию и транспорт встречающихся в природе нуклеиновых кислот (например, связывающие нуклеиновые кислоты белки). Аптамеры, с другой стороны, представляют собой короткие, выделенные, не встречающиеся в природе молекулы нуклеиновой кислоты. Наряду с тем, что можно идентифицировать аптамеры, которые связываются со связывающими нуклеиновые кислоты белками, в большинстве случаев такие аптамеры характеризуются небольшой или не характеризуются идентичностью последовательности относительно последовательностей, распознаваемых связывающими нуклеиновые кислоты белками в природе. Еще более важным является то, что аптамеры могут связываться фактически с любым белком (не только со связывающими нуклеиновые кислоты белками), а также почти с любой мишенью, представляющей интерес, включая в себя малые молекулы, углеводы, пептиды т.д. Для большинства мишеней, даже белков, встречающаяся в природе последовательность нуклеиновой кислоты, с которой он связывается, не существует. Для тех мишеней, которые все-таки содержат такую последовательность, например, связывающие нуклеиновые кислоты белки, такие последовательности будут отличаться от аптамеров в результате относительно низкой аффинности связывания, используемой в природе, по сравнению с тесно связывающими аптамерами. Аптамеры способны специфически связываться с выбранными мишенями и модулировать активность или взаимодействия связывания мишеней, например, посредством связывания, аптамеры могут блокировать способность своей мишени к функционированию. Функциональное свойство специфического связывания с мишенью представляет собой неотъемлемым свойством аптамера. Размер типичного аптамера составляет 6-35 кДа (20-100 нуклеотидов), он связывается со своей мишенью с микромолярной - субнаномолярной аффинностью и может различать близкородственные мишени (например, аптамеры могут селективно связывать родственные белки из одного и того же семейства генов). Аптамеры способны использовать обычные межмолекулярные взаимодействия, такие как образование водородных связей, электростатические взаимодополняемости, гидрофобные контакты и пространственное исключение, для связывания с конкретной мишенью. Аптамеры характеризуются рядом требуемых характеристик для применения в качестве терапевтических средств и диагностических средств, включая в себя высокую специфичность и аффинность, низкую иммуногенность, биологическую эффективность и превосходные фармакокинетические свойства. Аптамер может содержать молекулярную структуру стебля и петли, образовнанную из гибридизации комплементарных полинуклеотидов, которые являются ковалентно связанными (например, структура петли типа «шпилька»). «Стебель» содержит гибридизированные полинуклеотиды, и «петля» представляет собой область, которая ковалентно связывает два комплементарных полинуклеотида.
[00176] Согласно некоторым вариантам осуществления аффинная часть представляет собой множество аффинных частей, например, смесь или библиотеку аффинных частей. Согласно некоторым вариантам осуществления аффинная часть представляет собой множество различных аффинных частей. Например, аффинная часть может содержать множество, составляющее по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 500, 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 25000 или 30000 аффинных частей.
Олигонуклеотидная часть конъюгатов аффинная часть-олигонуклеотид
[00177] Олигонуклеотидная часть конъюгата аффинная часть-олигонуклеотид представляет собой нуклеиновую кислоту, которая соединена с аффинной частью конъюгата аффинная часть-олигонуклеотид. Согласно некоторым вариантам осуществления олигонуклеотид соединен напрямую с аффинной частью. Согласно некоторым вариантам осуществления олигонуклеотид соединен опосредованно с аффинной частью. Согласно некоторым вариантам осуществления олигонуклеотид соединен нековалентно с аффинной частью. Согласно некоторым вариантам осуществления олигонуклеотид соединен ковалентно с аффинной частью. Согласно некоторым вариантам осуществления олигонуклеотид представляет собой синтезированный олигонуклеотид. Согласно предпочтительным вариантам осуществления олигонуклеотид по существу не взаимодействует с целевым аналитом аффинной части напрямую.
[00178] Олигонуклеотид, соединенный с аффинной частью конъюгата аффинная часть-олигонуклеотид, может содержать один или более штрих-кодовых последовательностей. Например, олигонуклеотид, соединенный с аффинной частью конъюгата аффинная часть-олигонуклеотид, может содержать последовательность идентификации антигена (AID) и молекулярную штрих-кодовую последовательность антигена (АМВ). Олигонуклеотид может содержать последовательность идентификации антигена (AID), слитая последовательность, сайт праймера, молекулярную штрих-кодовую последовательность, константную последовательность или любую их комбинацию.
[00179] Олигонуклеотид может содержать химическую модификацию для обеспечения возможности конъюгации с аффинной частью конъюгата аффинная часть-олигонуклеотид (например, амин, тиол или биотин).
[00180] Олигонуклеотид может содержать множество олигонуклеотидов. Множество олигонуклеотиды может быть составлено множеством конъюгатов аффинная часть-олигонуклеотид. Например, олигонуклеотид может содержать множество, составляющее по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 500, 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 25000 или 30000 олигонуклеотидов. Например, множество, составляющее по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 500, 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 25000 или 30000 олигонуклеотидов, может быть составлено множеством, составляющим по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 500, 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 25000 или 30000 конъюгатов аффинная часть-олигонуклеотид.
[00181] Олигонуклеотид может содержать штрих-кодовую последовательность олигонуклеотида, слитая последовательность олигонуклеотида, связывающую праймер последовательность олигонуклеотида, константную последовательность олигонуклеотида или любую их комбинацию.
Последовательность идентификации антигена ID (AID) олигонуклеотида
[00182] Олигонуклеотид может содержать антигенную штрих-кодовую последовательность олигонуклеотида или комплементарную ей цепь. Антигенный штрих-код олигонуклеотида может обеспечивать возможность идентификации аффинного олигонуклеотидного комплекса, содержащего антигенный штрих-код олигонуклеотида. Антигенный штрих-код олигонуклеотида может обеспечивать возможность идентификации аффинной части, к которой прикреплен антигенный штрих-код олигонуклеотида. Антигенный штрих-код олигонуклеотида можно использовать для идентификации аффинной части из множества различных аффинных частей, которая связывается с различными целевыми аналитами. Антигенный штрих-код олигонуклеотида можно штрих-кодировать относительно исключительно аффинного олигонуклеотидного комплекса. Антигенный штрих-код олигонуклеотида можно штрих-кодировать относительно исключительно аффинной части. Таким образом, антигенную штрих-кодовую последовательность олигонуклеотида можно штрих-кодировать относительно конкретной аффинной части.
[00183] Антигенный штрих-код олигонуклеотида может представлять собой уникальную штрих-кодовую последовательность. Например, любой один антигенный штрих-код олигонуклеотида из множества антигенных штрих-кодов олигонуклеотида может представлять собой уникальную штрих-кодовую последовательность. Теоретически возможно, что число различных антигенных штрих-кодовых последовательностей напрямую зависит от длины штрих-кодовой последовательности. Например, если можно использовать штрих-код ДНК с собранными в случайном порядке адениновыми, тимидиновыми, гуанозиновыми и цитидиновыми нуклеотидами, теоретическое максимальное число штрих-кодовых последовательностей, возможно, может составлять 1048576 для длины, составляющей 10 нуклеотидов, и может составлять 1073741824 для длины, составляющей 15 нуклеотидов. Антигенная штрих-кодовая последовательность олигонуклеотида может содержать последовательность, составляющую по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 40, 45 или 50 или больше следующих друг за другом нуклеотидов. Олигонуклеотид может содержать две или больше антигенных штрих-кодовых последовательностей олигонуклеотида или комплементарных им цепей. Антигенная штрих-кодовая последовательность олигонуклеотида может содержать собранную в случайном порядке последовательность нуклеотидов. Антигенная штрих-кодовая последовательность олигонуклеотида может представлять собой вырожденную последовательность. Антигенная штрих-кодовая последовательность олигонуклеотида может представлять собой известную последовательность. Антигенная штрих-кодовая последовательность олигонуклеотида может представлять собой предварительно определенную последовательность. Согласно предпочтительному варианту осуществления антигенная штрих-кодовая последовательность олигонуклеотида представляет собой известную, уникальную последовательность, которую штрих-кодируют относительно аффинной части, с которой она соединена так, чтобы сигнал, содержащий антигенный штрих-код олигонуклеотида (например, прочтение последовательности) или комплементарную ей цепь, можно было использовать для идентификации аффинной части из множества различных аффинных частей, которые взаимодействуют с различными целевыми аналитами.
[00184] Например, олигонуклеотид, соединенный с аффинной частью конъюгата аффинная часть-олигонуклеотид, может содержать штрих-код, который представляет собой последовательность идентификации антигена (AID). Последовательность AID можно штрих-кодировать относительно аффинной части конъюгата аффинная часть-олигонуклеотид. Последовательность AID можно штрих-кодировать относительно антигена, на который нацелена аффинная часть. Последовательность AID можно использовать для идентификации аффинной части конъюгата аффинная часть-олигонуклеотид и/или антигена, на который нацелена аффинная часть. Например, последовательность AID можно штрих-кодировать относительно антитела конъюгата антитела с олигонуклеотидом. Например, последовательность AID можно штрих-кодировать относительно антигена, на который нацелено антитело конъюгата антитела с олигонуклеотидом. Например, последовательность AID можно использовать для иммунофенотипирования клеток. Например, последовательность AID можно штрих-кодировать относительно пептида комплекса МНС-пептид.
[00185] Последовательность AID может являться уникальной для каждого антигена, на который нацелена аффинная часть конъюгатов аффинная часть-олигонуклеотид. Последовательность AID может являться уникальной для аффинной части конъюгатов аффинная часть-олигонуклеотид. Например, последовательность AID может являться уникальной для каждого антитела, которое специфически связывается с различным целевым антигеном клетки. Согласно некоторым вариантам осуществления последовательность AID представляет собой заданную последовательность. Согласно некоторым вариантам осуществления последовательность AID представляет собой известную последовательность. Последовательность AID для каждого олигонуклеотида можно определить путем секвенирования олигонуклеотида или продуктов амплификации олигонуклеотида, например, путем секвенирования нового поколения.
Молекулярная штрих-кодовая последовательность олигонуклеотида
[00186] Олигонуклеотид может содержать молекулярную штрих-кодовую последовательность олигонуклеотида или комплементарную ей цепь. Штрих-код олигонуклеотида может обеспечивать возможность идентификации молекулы аффинного олигонуклеотидного комплекса, содержащего штрих-код олигонуклеотида. молекулярный штрих-код олигонуклеотида можно штрих-кодировать относительно исключительно молекулы аффинного олигонуклеотидного комплекса. Олигонуклеотид молекулярный штрих-код можно штрих-кодировать относительно исключительно молекулы аффинной части. Таким образом, молекулярную штрих-кодовую последовательность олигонуклеотида можно штрих-кодировать относительно специфической молекулы аффинной части.
[00187] Молекулярный штрих-код олигонуклеотида может представлять собой уникальную штрих-кодовую последовательность. Например, любой один молекулярный штрих-код олигонуклеотида из множества молекулярных штрих-кодов олигонуклеотида может представлять собой уникальную штрих-кодовую последовательность. Теоретически возможно, что число различных молекулярных штрих-кодовых последовательностей напрямую зависит от длины штрих-кодовой последовательности. Например, если можно использовать штрих-код ДНК с собранными в случайном порядке адениновыми, тимидиновыми, гуанозиновыми и цитидиновыми нуклеотидами, теоретическое максимальное число штрих-кодовых последовательностей, возможно, может составлять 1048576 для длины, составляющей 10 нуклеотидов, и может составлять 1073741824 для длины, составляющей 15 нуклеотидов. Молекулярная штрих-кодовая последовательность олигонуклеотида может содержать последовательность, составляющую по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 40, 45 или 50 или больше следующих друг за другом нуклеотидов. Олигонуклеотид может содержать две или больше молекулярных штрих-кодовых последовательностей олигонуклеотида или комплементарных им цепей. Молекулярная штрих-кодовая последовательность олигонуклеотида может содержать собранную в случайном порядке последовательность нуклеотидов. Молекулярная штрих-кодовая последовательность олигонуклеотида может представлять собой вырожденную последовательность. Молекулярная штрих-кодовая последовательность олигонуклеотида может представлять собой известную последовательность. Молекулярная штрих-кодовая последовательность олигонуклеотида может представлять собой предварительно определенную последовательность. Согласно предпочтительному варианту осуществления молекулярная штрих-кодовая последовательность олигонуклеотида представляет собой уникальную последовательность, которую можно использовать для идентификации аффинной части молекулы из множества молекул аффинной части, которые провзаимодействовали с целевым аналитом.
[00188] Например, олигонуклеотид, соединенный с аффинной частью конъюгата аффинная часть-олигонуклеотид, может содержать штрих-код, который представляет собой молекулярную штрих-кодовую последовательность антигена (АМВ). Молекулярная штрих-кодовая последовательность антигена (АМВ) может являться уникальной для каждой молекулы олигонуклеотида конъюгата аффинная часть-олигонуклеотид. Последовательность АМВ может обеспечивать возможность подсчета числа молекул олигонуклеотида конъюгата аффинная часть-олигонуклеотид, которые связаны с антигеном, таким как антиген отдельной клетки в сосуде, например, капле эмульсии. Последовательность АМВ для каждого олигонуклеотида можно определить путем секвенирования олигонуклеотида или продуктов амплификации олигонуклеотида, например, путем секвенирования нового поколения.
Слитая последовательность олигонуклеотида
[00189] Олигонуклеотид, соединенный с аффинной частью конъюгата аффинная часть-олигонуклеотид, может содержать слитую последовательность. Слитая последовательность может обеспечивать возможность достройки посредством ПЦР специфической для капли штрих-кодовой последовательности на олигонуклеотиде конъюгата аффинная часть-олигонуклеотид, например, связанного с клеточной поверхностью конъюгата аффинная часть-олигонуклеотид. Слитая последовательность каждого олигонуклеотида из множества олигонуклеотидов может являться идентичной. Слитая последовательность может содержать последовательность, которая является комплементарной последовательности штрих-кода капли. Согласно некоторым вариантам осуществления слитая последовательность расположена на конце олигонуклеотида. Согласно некоторым вариантам осуществления слитая последовательность на конце олигонуклеотида не является напрямую конъюгированной с аффинной частью конъюгата антитела с олигонуклеотидом. Согласно некоторым вариантам осуществления слитая последовательность на конце олигонуклеотида содержит свободный конец.
[00190] Слитая последовательность может содержать область, комплементарную области вводящего на 3'-конец метку полинуклеотида, такого как полинуклеотид, содержащий штрих-код сосуда. Слитая последовательность может содержать область, комплементарную комплементарной цепи области полинуклеотида, такого как полинуклеотид, содержащий штрих-код сосуда. Например, слитая последовательность может содержать 3' область, такую как 3' концевую область, которая является комплементарной вводящему на 3'-конец метку полинуклеотиду или комплементарной ему цепи, содержащим штрих-код, такой как штрих-код сосуда.
[00191] Вводящий на 3'-конец метку полинуклеотид может представлять собой полинуклеотид, используемый для добавления нуклеиновых кислот к 3'-концу целевого полинуклеотида, такого как олигонуклеотид конъюгата аффинная часть-олигонуклеотид. Вводящий на 3'-конец метку полинуклеотид может представлять собой полинуклеотид, используемый в качестве матрицы для добавления нуклеиновых кислот к 3'-концу целевого полинуклеотида, такого как олигонуклеотид конъюгата аффинная часть-олигонуклеотид. Вводящий на 3'-конец метку полинуклеотид может представлять собой полинуклеотид, который гибридизуется с 3'-концом целевого полинуклеотида, такого как олигонуклеотид конъюгата аффинная часть-олигонуклеотид. Вводящий на 3'-конец метку полинуклеотид может представлять собой полинуклеотид, который содержит 3'-область, такую как 3'-концевую область, которая гибридизуется с 3'-концом целевого полинуклеотида, такого как олигонуклеотид конъюгата аффинная часть-олигонуклеотид.
[00192] Согласно некоторым вариантам осуществления вводящий на 3'-конец метку полинуклеотид представляет собой штрих-кодированный полинуклеотид сосуда. Штрих-код сосуда можно добавить к олигонуклеотиду конъюгата аффинная часть-олигонуклеотид. Например, штрих-код сосуда можно гибридизировать с олигонуклеотидом конъюгата аффинная часть-олигонуклеотид. Штрих-кодированный полинуклеотид сосуда может содержать 3'-область, такую как 3'-концевая область, которая гибридизуется с 3'-концом олигонуклеотида конъюгата аффинная часть-олигонуклеотид.
[00193] Согласно некоторым вариантам осуществления вводящий на 3'-конец метку полинуклеотид представляет собой амплифицированный продукт. Согласно некоторым вариантам осуществления вводящий на 3'-конец метку полинуклеотид представляет собой амплифицированный продукт, происходящий из отдельно взятой молекулы. Согласно некоторым вариантам осуществления вводящий на 3'-конец метку полинуклеотид представляет собой амплифицированный продукт штрих-кодированного полинуклеотида сосуда. Согласно некоторым вариантам осуществления вводящий на 3'-конец метку полинуклеотид представляет собой амплифицированный продукт, происходящий из отдельно взятого штрих-кодированного полинуклеотида сосуда. Область 5' относительно 3'-области, которая гибридизуется с 3'-концом олигонуклеотида конъюгата аффинная часть-олигонуклеотид, может содержать область, комплементарную праймеру или комплементарной ему цепи. Область 5' относительно 3'-области, которая гибридизуется с 3'-концом олигонуклеотида конъюгата аффинная часть-олигонуклеотид, может содержать область, комплементарную праймеру, который можно использовать для амплификации олигонуклеотида конъюгата аффинная часть-олигонуклеотид. Например, набор праймеров, содержащий первый праймер, который является комплементарным области 5' относительно 3'-области, которая гибридизуется с 3'-концом олигонуклеотида конъюгата аффинная часть-олигонуклеотид, или комплементарной ему цепи и второй праймер, который является комплементарным сайту праймера олигонуклеотида конъюгата аффинная часть-олигонуклеотид, можно использовать для амплификации олигонуклеотида конъюгата аффинная часть-олигонуклеотид.
[00194] Область 5' относительно 3'-области, которая гибридизуется с 3'-концом олигонуклеотида конъюгата аффинная часть-олигонуклеотид, может содержать область, комплементарную праймеру или комплементарной ему цепи, которую использовали для амплификации штрих-кодированного полинуклеотида сосуда.
[00195] Слитая последовательность олигонуклеотида может составлять по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или больше следующих друг за другом нуклеотидов. Олигонуклеотид слитая последовательность может представлять собой последовательность известной длины. Слитая последовательность олигонуклеотида может представлять собой известную последовательность. Слитая последовательность олигонуклеотида может представлять собой предварительно определенную последовательность. Слитая последовательность олигонуклеотида может представлять собой неизвестную последовательность известной длины. Слитая последовательность олигонуклеотида может представлять собой известную последовательность известной длины.
Константная последовательность олигонуклеотида
[00196] Олигонуклеотид, соединенный с аффинной частью конъюгата аффинная часть-олигонуклеотид, может содержать константную последовательность. Константная последовательность является необязательной. Константная последовательность каждого олигонуклеотида из множества конъюгатов аффинная часть-олигонуклеотид может являться идентичной.
[00197] Константную последовательность олигонуклеотида можно использовать для увеличения длины олигонуклеотида или для отделения друг от друга одного или более из следующего: штрих-код олигонуклеотида, слияние олигонуклеотида и связывающий праймер сайт олигонуклеотида. Согласно некоторым вариантам осуществления олигонуклеотид не содержит константную последовательность олигонуклеотида. Например, олигонуклеотид может являться соединенной с аффинной частью на конце олигонуклеотида, содержащего связывающий праймер сайт олигонуклеотида.
[00198] Согласно некоторым вариантам осуществления константная последовательность олигонуклеотида прикреплена к аффинной части аффинного олигонуклеотидного комплекса. Согласно некоторым вариантам осуществления константная последовательность олигонуклеотида расположена выше, относительно хода транскрипции, связывающей праймер последовательности олигонуклеотида. Например, константная последовательность олигонуклеотида может быть расположена 5' относительно связывающей праймер последовательности олигонуклеотида. Согласно некоторым вариантам осуществления константная последовательность олигонуклеотида расположена ниже, относительно хода транскрипции, связывающей праймер последовательности олигонуклеотида. Например, константная последовательность олигонуклеотида может быть расположена 3' относительно связывающей праймер последовательности олигонуклеотида. Согласно некоторым вариантам осуществления константная последовательность олигонуклеотида расположена выше, относительно хода транскрипции, штрих-кода олигонуклеотида. Например, константная последовательность олигонуклеотида может быть расположена 5' относительно штрих-кода олигонуклеотида. Согласно некоторым вариантам осуществления константная последовательность олигонуклеотида расположена ниже, относительно хода транскрипции, штрих-кода олигонуклеотида. Например, константная последовательность олигонуклеотида может быть расположена 3' относительно штрих-кода олигонуклеотида. Согласно некоторым вариантам осуществления константная последовательность олигонуклеотида расположена выше, относительно хода транскрипции, слитой последовательности олигонуклеотида. Например, константная последовательность олигонуклеотида может быть расположена 5' относительно слитой последовательности олигонуклеотида.
[0001] Согласно некоторым вариантам осуществления константная последовательность олигонуклеотида помещена между связывающей праймер последовательностью олигонуклеотида и аффинная часть аффинного олигонуклеотидного комплекса. Например, константная последовательность олигонуклеотида может быть расположена 5' относительно связывающей праймер последовательности олигонуклеотида и прикреплена к аффинной части олигонуклеотида. Согласно некоторым вариантам осуществления константная последовательность олигонуклеотида помещена между связывающей праймер последовательностью олигонуклеотида и штрих-кодом олигонуклеотида. Например, константная последовательность олигонуклеотида может быть расположена 3' относительно связывающей праймер последовательности олигонуклеотида и 5' относительно штрих-кода олигонуклеотида. Согласно некоторым вариантам осуществления олигонуклеотид константная помещена между слитой последовательностью олигонуклеотида и штрих-кодом олигонуклеотида. Например, константная последовательность олигонуклеотида может быть расположена 3' относительно штрих-кода олигонуклеотида и 5' относительно слитой последовательности олигонуклеотида.
[0002] Константная последовательность олигонуклеотида может составлять по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 250, 300, 400, 500 или больше следующих друг за другом нуклеотидов. Константная последовательность олигонуклеотида может содержать неслучайную последовательность нуклеотидов. Константная последовательность олигонуклеотида может представлять собой последовательность известной длины. Константная последовательность олигонуклеотида может представлять собой известную последовательность. Константная последовательность олигонуклеотида может представлять собой предварительно определенную последовательность. Константная последовательность олигонуклеотида может представлять собой неизвестную последовательность известной длины. Константная последовательность олигонуклеотида может представлять собой известную последовательность известной длины.
Связывающий праймер сайт олигонуклеотида
[00199] Олигонуклеотид, соединенный с аффинной частью конъюгата аффинная часть-олигонуклеотид, может содержать сайт праймера. Сайт праймера может содержать последовательность, которая является комплементарной праймеру, такому как праймер амплификации. Связывающую праймер последовательность олигонуклеотида можно использовать в качестве связывающего праймер сайта для такой реакции, как амплификация или секвенирование. Связывающая праймер последовательность олигонуклеотида может представлять собой первую связывающую праймер последовательность для пары праймеров, используемых для такой реакции, как амплификация или секвенирование. Например, связывающая праймер последовательность олигонуклеотида может представлять собой связывающий прямой праймер сайт. Например, олигонуклеотид связывающую праймер сайт может представлять собой связывающий обратный праймер сайт. Например, связывающий праймер сайт олигонуклеотида может представлять собой связывающий прямой праймер сайт, и связывающая праймер последовательность штрих-кодированного полинуклеотида сосуда, прикрепленного к олигонуклеотиду, может представлять собой связывающую обратный праймер последовательность. Согласно некоторым вариантам осуществления связывающая праймер последовательность олигонуклеотида представляет собой универсальную связывающую праймер последовательность.
[00200] Связывающая праймер последовательность олигонуклеотида и связывающую праймер последовательность полинуклеотида, прикрепленного к олигонуклеотиду (например, штрих-кодированного полинуклеотида сосуда) может характеризоваться температурами плавления, которые различаются не больше чем на 6, 5, 4, 3, 2 или 1 градусов Цельсия. Нуклеотидная последовательность связывающей праймер последовательности олигонуклеотида и связывающей праймер последовательности полинуклеотида, прикрепленного к олигонуклеотиду, могут отличаться так, чтобы полинуклеотид, который гибридизуется со связывающей праймер последовательностью олигонуклеотида, не гибридизовался со связывающей праймер последовательностью полинуклеотида, прикрепленного к олигонуклеотиду. Нуклеотидная последовательность связывающей праймер последовательности олигонуклеотида и связывающей праймер последовательности полинуклеотида, прикрепленного к олигонуклеотиду, могут отличаться так, чтобы полинуклеотид, который гибридизуется со связывающей праймер последовательностью полинуклеотида, прикрепленного к олигонуклеотиду, не гибридизовался со связывающей праймер последовательностью олигонуклеотида.
Расположение элементов олигонуклеотида
[00201] Олигонуклеотид может быть организован в таком порядке, что слитая последовательность олигонуклеотида расположена на одном конце олигонуклеотида. Олигонуклеотид может быть организован в таком порядке, что он содержит штрих-код олигонуклеотида выше, относительно хода транскрипции, слитой последовательности олигонуклеотида. Олигонуклеотид может быть организован в таком порядке, что он содержит связывающая праймер последовательность олигонуклеотида выше, относительно хода транскрипции, штрих-кода олигонуклеотида. Олигонуклеотид может быть организован в таком порядке, что константная последовательность олигонуклеотида расположена выше или ниже, относительно хода транскрипции, связывающей праймер последовательности олигонуклеотида. Олигонуклеотид может быть организован в таком порядке, что константная последовательность олигонуклеотида расположена выше, относительно хода транскрипции, штрих-кодовой последовательности олигонуклеотида. Олигонуклеотид может быть организован в таком порядке, что константная последовательность олигонуклеотида расположена на одном конце олигонуклеотида, например, на конце олигонуклеотида, который не содержит слитую последовательность олигонуклеотида. Например, олигонуклеотид может быть организован в следующем порядке: слитая последовательность олигонуклеотида, штрих-кодовая последовательность олигонуклеотида, связывающая праймер последовательность олигонуклеотида и константная последовательность олигонуклеотида. Например, олигонуклеотид может быть организован в следующем порядке: слитая последовательность олигонуклеотида, штрих-кодовая последовательность олигонуклеотида, связывающая праймер последовательность олигонуклеотида и константная последовательность олигонуклеотида, распространяясь в направлении от аффинной части. Например, олигонуклеотид может быть организован в следующем порядке: слитая последовательность олигонуклеотида, штрих-кодовая последовательность олигонуклеотида, связывающая праймер последовательность олигонуклеотида и константная последовательность олигонуклеотида от 5'-конца к 3'-концу или от 3'-конца к 5'-концу. Например, олигонуклеотид может содержать следующее: 5' слитая последовательность олигонуклеотида, уникальная штрих-кодовая последовательность олигонуклеотида, связывающая обратный праймер последовательность олигонуклеотида и 3' константная последовательность олигонуклеотида, прикрепленная к аффинной части (например, через группу первичного амина, прикрепленную к 3'-концу) в указанном порядке. Например, олигонуклеотид, прикрепленный к аффинной части, может быть организован, распространяясь в направлении к аффинной части, в следующем порядке: слитая последовательность олигонуклеотида, штрих-кодовая последовательность олигонуклеотида, константная последовательность олигонуклеотида и последовательность связывающего праймер сайта олигонуклеотида.
[00202] Олигонуклеотид может быть организован в таком порядке, что слитая последовательность расположена на одном конце олигонуклеотида. Олигонуклеотид может быть организован в таком порядке, что слитая последовательность расположена ниже, относительно хода транскрипции, последовательности AID. Олигонуклеотид может быть организован в таком порядке, что слитая последовательность расположена ниже, относительно хода транскрипции, последовательности АМВ. Олигонуклеотид может быть организован в таком порядке, что слитая последовательность расположена ниже, относительно хода транскрипции, константной последовательности. Олигонуклеотид может быть организован в таком порядке, что слитая последовательность расположена ниже, относительно хода транскрипции, сайта праймера.
[00203] Олигонуклеотид может быть организован в таком порядке, что сайт праймера расположен на одном конце олигонуклеотида. Олигонуклеотид может быть организован в таком порядке, что сайт праймера расположен выше, относительно хода транскрипции, последовательности AID. Олигонуклеотид может быть организован в таком порядке, что сайт праймера расположен выше, относительно хода транскрипции, последовательности АМВ. Олигонуклеотид может быть организован в таком порядке, что сайт праймера расположен выше, относительно хода транскрипции, константной последовательности. Олигонуклеотид может быть организован в таком порядке, что сайт праймера расположен выше, относительно хода транскрипции, слитой последовательности.
[00204] Олигонуклеотид может быть организован в таком порядке, что он содержит последовательность AID выше, относительно хода транскрипции, слитой последовательности. Олигонуклеотид может быть организован в таком порядке, что он содержит последовательность AID ниже, относительно хода транскрипции, сайта праймера. Последовательность AID может быть расположена выше или ниже, относительно хода транскрипции, последовательности АМВ. Последовательность AID может быть расположена выше или ниже, относительно хода транскрипции, константной последовательности. Олигонуклеотид может быть организован в таком порядке, что он содержит последовательность AID между слитой последовательностью и сайтом праймера.
[00205] Олигонуклеотид может быть организован в таком порядке, что он содержит последовательность АМВ выше, относительно хода транскрипции, слитой последовательности. Олигонуклеотид может быть организован в таком порядке, что он содержит последовательность АМВ ниже, относительно хода транскрипции, сайта праймера. Последовательность АМВ может быть расположена выше или ниже, относительно хода транскрипции, последовательности AID. Последовательность АМВ может быть расположена выше или ниже, относительно хода транскрипции, константной последовательности. Олигонуклеотид может быть организован в таком порядке, что он содержит последовательность АМВ между слитой последовательностью и сайтом праймера.
[00206] Олигонуклеотид может быть организован в таком порядке, что он содержит константную последовательность выше, относительно хода транскрипции, слитой последовательности. Олигонуклеотид может быть организован в таком порядке, что он содержит константную последовательность ниже, относительно хода транскрипции, сайта праймера. Константная последовательность может быть расположена выше или ниже, относительно хода транскрипции, последовательности AID. Константная последовательность может быть расположена выше или ниже, относительно хода транскрипции, последовательности АМВ. Олигонуклеотид может быть организован в таком порядке, что он содержит константную последовательность между слитой последовательностью и сайтом праймера.
[00207] Олигонуклеотид может быть организован в таком порядке, что последовательность АМВ и/или последовательность AID не расположена на одном конце олигонуклеотида, например, конце олигонуклеотида, который содержит слитую последовательность или сайт праймера. Например, олигонуклеотид может быть организован в следующем порядке: слитая последовательность, последовательность AID, последовательность АМВ и сайт праймера. Например, олигонуклеотид может быть организован в следующем порядке: слитая последовательность, последовательность АМВ, последовательность AID и сайт праймера.
[00208] Например, олигонуклеотид может быть организован в следующем порядке: слитая последовательность, последовательность AID, последовательность АМВ, константная последовательность и сайт праймера. Например, олигонуклеотид может быть организован в следующем порядке: слитая последовательность, последовательность АМВ, последовательность AID, константная последовательность и сайт праймера. Например, олигонуклеотид может быть организован в следующем порядке: слитая последовательность, константная последовательность, последовательность AID, последовательность АМВ и сайт праймера. Например, олигонуклеотид может быть организован в следующем порядке: слитая последовательность, константная последовательность, последовательность АМВ, последовательность AID и сайт праймера. Например, олигонуклеотид может быть организован в следующем порядке: слитая последовательность, последовательность AID, константная последовательность, последовательность АМВ и сайт праймера. Например, олигонуклеотид может быть организован в следующем порядке: слитая последовательность, последовательность АМВ, константная последовательность, последовательность AID и сайт праймера.
[00209] Например, олигонуклеотид может быть организован в следующем порядке: слитая последовательность, последовательность AID, последовательность АМВ, константная последовательность и сайт праймера, распространяясь в направлении к аффинной части конъюгата аффинная часть-олигонуклеотид. Например, олигонуклеотид может быть организован в следующем порядке: слитая последовательность, последовательность AID, последовательность АМВ, константная последовательность и сайт праймера, от 5'-конца к 3'-концу олигонуклеотида. Например, олигонуклеотид может содержать следующее: 5' слитая последовательность, последовательность AID, последовательность АМВ, константная последовательность и 3' сайт праймера, прикрепленный к аффинной части конъюгата аффинная часть-олигонуклеотид (например, через группу первичного амина антитела, прикрепленного к 3'-концу олигонуклеотида) в указанном порядке.
Получение конъюгата аффинная часть-олигонуклеотид
[00210] Конъюгаты аффинная часть-олигонуклеотид, используемые в способах и композициях, описанных в настоящем документе, можно получить с использованием любого удобного способа. Аффинную часть можно соединить напрямую или опосредованно (например, посредством линкера) с олигонуклеотидом. Аффинную часть можно соединить ковалентно (например, посредством химического поперечного сшивания) или нековалентно (например, посредством комплекса стрептавидин-биотин) с олигонуклеотидом. Структура и получение конъюгатов аффинная часть-олигонуклеотид широко описаны в настоящей области техники, включая в себя различные отличающиеся друг от друга аффинные части, которые можно использовать, структуру олигонуклеотидов для анализов близкого лигирования и соединение таких олигонуклеотидов с аффинными частями с образованием конъюгатов аффинная часть-олигонуклеотид. Подробности и принципы, описанные в настоящей области техники, можно применять для разработки конъюгатов аффинная часть-олигонуклеотид для применения в способах согласно изобретению (см., например, международную патентную публикацию WO2007107743 и патенты США №№7306904 и 6878515).
[00211] между олигонуклеотидом и аффинной частью, например, если каждый из компонентов обладает функциональной группой (например, заместителем или химической группой-перемычкой), способной реагировать с функциональной группой на другом компоненте. Функциональные группы могут присутствовать на олигонуклеотиде или аффинной части или их можно вводить на указанные компоненты (например, посредством реакций окисления, реакций восстановления, реакций расщепления и тому подобного). Были описаны способы получения конъюгатов нуклеиновой кислоты с полипептидом (См., например, патент США №5733523).
[00212] Функциональные группы антитела или полипептида, которые можно использовать для соединения с олигонуклеотидом, включают в себя без ограничения углеводы, тиольные группы (HS-) аминокислот, аминогруппы (H2N-) аминокислот и карбоксигруппы аминокислот. Например, углеводные структуры можно окислять до альдегидов и приводить в реакцию с содержащим H2NNH группу соединением с образованием функциональной группы -C=NH-NH-. Например, тиольные группы можно приводить в реакцию с реакционноспособной в отношении тиола группой с образованием простого тиоэфира или дисульфида. Например, свободные тиольные группы белков можно вводить в белки путем тиолирования или расщепления дисульфидов в нативных остатках цистеина. Например, аминогруппу (например, амино-конца или омега-аминогруппу остатка лизина) можно приводить в реакцию с электрофильной группой (например, активированной карбоксигруппой) с образованием амидной группы. Например, карбоксигруппу (например, карбокси-конец или карбоксигруппу двухосновной альфа-аминокислоты) можно активировать и приводить в контакт с аминогруппой с образованием амидной группы. Другие иллюстративные функциональные группы включают в себя, например, SPDP, карбодиимид, глутаральдегид и тому подобное.
[00213] Согласно иллюстративному варианту осуществления олигонуклеотид ковалентно соединяют с аффинной частью с использованием коммерческого набора ("All-in-One Antibody-Oligonucleotide Conjugation Kit"; Solulink, Inc.). Например, во-первых, 3'-амино-олигонуклеотид можно дериватизировать с помощью группы Sulfo-S-4FB. Во-вторых, аффинную часть можно модифицировать с помощью группы S-HyNic. В-третьих, HyNic-модифицированную аффинную часть можно приводить в реакцию с 4FB-модифицированным олигонуклеотидом с получением на выходе опосредованного бис-арилгидразоном конъюгата аффинная часть-олигонуклеотид. Избыток 4FB-модифицированного олигонуклеотида можно дополнительно удалить посредством магнитной аффинной матрицы. Общее извлечение аффинной части может составлять по меньшей мере приблизительно 95%, 96%, 97%, 98%, 99% или 100% от свободной HyNic-модифицированной аффинной части и 4РВ-модифицированного олигонуклеотида. Бис-арилгидразоновая связь может являться стабильной как к нагреванию (например, 94°С), так и к рН (например, 3-10).
[00214] Если используют сшивающие группы, такие линкеры можно выбрать для обеспечения ковалентного прикрепления или нековалентного прикрепления аффинной части и олигонуклеотид посредством сшивающей группы. Разнообразные подходящие линкеры известны в настоящей области техники. Согласно некоторым вариантам осуществления линкер составляет по меньшей мере приблизительно 50 или 100 Да. Согласно некоторым вариантам осуществления линкер не превышает приблизительно 300; 500; 1000; 10000 или 100000 Да. Линкер может содержать функциональную группу на любом конце с реакционноспособной функциональной группой, способной образовывать связь с олигонуклеотидом. Линкер может содержать функциональную группу на любом конце с реакционноспособной функциональной группой, способной образовывать с аффинной частью. Функциональные группы могу присутствовать на олигонуклеотиде, аффинной части и/или линкере, или их можно вводить на указанные компоненты (например, посредством реакций окисления, реакций восстановления, реакций расщепления и тому подобного).
[00215] Иллюстративные линкеры включают в себя полимеры, алифатические углеводородные цепи, ненасыщенные углеводородные цепи, полипептиды, полинуклеотиды, циклические линкеры, ациклические линкеры, углеводы, простые эфиры, полиамины и другие соединения, известные в настоящей области техники. Иллюстративные функциональные группы линкеров включают в себя нуклеофильные функциональные группы (например, амины, аминогруппы, гидроксигруппы, сульфгидрильные группы, аминогруппы, спирты, тиолы и гидразиды), электрофильные функциональные группы (например, альдегиды, сложные эфиры, винилкетоны, эпоксиды, изоцианаты и малеимиды) и функциональные группы, способные к реакциям циклоприсоединения, формированию дисульфидных связей или связыванию с металлами. Например, функциональные группы линкеров могут представлять собой первичные амины, вторичные амины, гидроксамовые кислоты, N-гидроксисукцинимидиловые сложные эфиры, N-гидроксисукцинимидилкарбонаты, оксикарбонилимидазолы, сложные нитрофенилэфиры, трифторэтиловые сложные эфиры, глицидиловые простые эфиры, винил сульфонаты, малеимиды, азидобензоилгидразид, N-[4-(n-азидосалициламино)бутил]-3'-[2'-пиридилдитио]пропионамид), бис-сульфосукцинимидилсуберат, диметиладипимидат, дисукцинимидилтартрат, N- малеимидобутирилоксисукцинимидовый сложный эфир, N-гидроксисульфосукцинимидил-4-азидобензоат, N-сукцинимидил-[4-ази дофенил]-1,3'-дитиопропионат, N-сукцинимидил-[4-йодацетил]аминобензоат, глутаральдегид и сукцинимидил-4-[N-малеимидометил]пиклогексан-1-карбоксилат, N-гидроксисукцинимидный эфир 3-(2-пиридилдитио)пропионовой кислоты (SPDP), N-гидроксисукцинимидный эфир 4-(N-малеимидометил)-циклогексан-1-карбоновой кислоты (SMCC) и тому подобное.
[00216] Согласно другим вариантам осуществления конъюгаты аффинная часть-олигонуклеотид можно получить с использованием in vitro протоколов, которые дают на выходе конъюгаты аффинная часть-олигонуклеотид, таких как получение аффинной части in vitro из векторов, которые кодируют аффинную часть. Примеры таких in vitro протоколов, представляющих интерес, включают в себя: основанные на Rep А протоколы (см., например, Fitzgerald et al, Drug Discov Today (2000) 5:253-58 и WO 9837186), основанные на рибосомном дисплее протоколы (см., например, Hanes et al., PNAS (1997) 94:4937-42; Roberts et al, Curr Opin Chem Biol (1999) Jun; 3: 268-73; Schaffitzel et al, J Immunol Methods (1999) Dec 10; 231:119-35; и W09854312) и т.д.
[00217] Техники конъюгирования молекул нуклеиновых кислот с антителами хорошо известны в настоящей области техники (см., например, Arnon et al, "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy," в Monoclonal Antibodies And Cancer Therapy (Reisfeld et al. eds., Alan R. Liss, Inc., 1985); Hellstrom et al., "Antibodies For Drug Delivery," в Controlled Drug Delivery (Robinson et al. eds., Marcel Deiker, Inc., 2nd ed. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review," в Monoclonal Antibodies '84: Biological And Clinical Applications (Pinchera et al. eds., 1985); "Analysis, Results, and Future Prospective of the Therapeutic Use of Radiolabeled Antibody In Cancer Therapy," в Monoclonal Antibodies For Cancer Detection And Therapy (Baldwin et al. eds., Academic Press, 1985); и Thorpe et al, 1982, Immunol. Rev. 62: 119-58. См. также, например, международную патентную публикацию согласно РСТ № WO 89/12624.). Например, молекулу нуклеиновой кислоты можно ковалентно прикрепить к лизинам или цистеинам на антителе, например, посредством N-гидроксисукцинимидного сложного эфира или малеимидной функциональной группы, соответственно.
Целевые антигены
[00218] Целевой антиген аффинной части может представлять собой молекулу нуклеиновой кислоты или может являться белковым, таким как целевой белок или пептид. Целевой антиген может представлять собой соединение или композицию, которая присутствует на клетке в образце. Согласно некоторым вариантам осуществления целевой антиген может представлять собой соединение или композицию, способные вызывать клеточно-опосредованный иммунный ответ (т.е. адаптивный иммунный ответ), особенно у млекопитающего, такого как человек. Согласно некоторым вариантам осуществления целевой антиген может являться распознаваемым Т-клеткой в контексте молекулы МНС. Целевые антигены включают в себя без ограничения клетки, экстракты тканей, тканевые или клеточные лизаты, белки, отдельно или в виде смеси, множество белков, пептиды, смеси пептидов, липиды, углеводы, сахара и тому подобное. Целевой антиген может представлять собой характеристику заболевания, такого как инфекционное заболевание, аутоиммунное заболевание или злокачественная опухоль. Целевой антиген может представлять собой, например, вирусный антиген, бактериальный антиген, антиген злокачественной опухоли и т.д.
[00219] Согласно некоторым вариантам осуществления целевой антиген представляет собой вирусный антиген. Вирусные антигены включают в себя, например, вирусный оболочечный белок, антиген вируса гриппа, антиген ВИЧ, антиген гепатита В или антиген гепатита С.
[00220] Согласно некоторым вариантам осуществления целевой антиген представляет собой антиген злокачественной опухоли (например, белок, пептид, липид, углевод и т.д.), который экспрессируется или избыточно экспрессруется исключительно или преимущественно опухолевой клеткой или злокачественной клеткой так, что антиген ассоциируют с опухолью или злокачественной опухолью. Антиген злокачественной опухоли может представлять собой антиген злокачественной опухоли только одного типа злокачественной опухоли или опухоли так, что антиген злокачественной опухоли ассоциируют только с одним типом злокачественной опухоли или опухоли, или он является характерным только для одного типа злокачественной опухоли или опухоли. Альтернативно антиген злокачественной опухоли может представлять собой антиген злокачественной опухоли (например, может являться характерным для) больше чем одного типа злокачественной опухоли или опухоли. Например, антиген злокачественной опухоли может экспрессироваться клетками злокачественной опухоли как молочной железы, так и предстательной железы и не экспрессироваться совсем нормальными, неопухолевыми или незлокачественными клетками или экспрессироваться лишь на минимальном уровне. Антиген злокачественной опухоли может представлять собой антиген злокачественной опухоли меланомы или антиген злокачественной опухоли молочной железы. Иллюстративные антигены злокачественной опухоли включают в себя антигены злокачественной опухоли из группы, состоящей из gp100, MART-1, NY-ESO-1, представителя семейства белков MAGE, например, MAGE-A1, мезотелин, тирозиназы, TRP-1, TRP-2, PMSA, Нег-2 и р53.
[00221] Целевой антиген может являться природно, искусственно, синтетически или рекомбинантно произведенным. Таким образом, целевой антиген может представлять собой синтетический, рекомбинантный, выделенный и/или очищенный белок, полипептид или пептид. Способы создания или получения таких антигенов известны в настоящей области техники. Например, подходящие способы de novo синтезирования полипептидов и белков (например, антигенных полипептидов и белков) описаны в Chan et al., Fmoc Solid Phase Peptide Synthesis, Oxford University Press. Oxford, United Kingdom, 2005; Peptide and Protein Drug Analysis, ed. Reid, R., Marcel Dekker, Inc., 2000; Epitope Mapping, ed. Westwood et al., Oxford University Press. Oxford. United Kingdom, 2000; и патенте США №5449752. Кроме того, полипептиды и белки (например, антигенные полипептиды и белки) можно получить рекомбинантно с использованием нуклеиновых кислот, которые кодируют полипептид или белок, с использованием стандартных рекомбинантных способов. См., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 3rd ed. Cold Spring Harbor Press, Cold Spring Harbor, N.Y. 2001; и Ausubel et al., Current Protocols in Molecular Biology. Greene Publishing Associates and John Wiley & Sons, NY, 1994. Нуклеотидные последовательности многих антигенов известны в настоящей области техники и доступны из базы данных GenBank Интернет-сайта Национального центра биотехнологической информации (NCBI). Кроме того, антиген можно выделить и/или очистить из такого источника, как растение, бактерия, насекомое, млекопитающее, например, крыса, человек и т.д. Способы выделения и очистки хорошо известны в настоящей области техники.
[00222] Антиген может представлять собой свободный антиген, например, несвязанный антигенный пептид (например, свободный пептид), или может представлять собой связанный антиген, например, тетрамер комплекса МНС-пептид или антигенный пептид, презентрированный клеткой-носителем, в которую ввели пептид.
[00223] Согласно некоторым вариантам осуществления целевой аналит представляет собой мембраносвязанный белок. Согласно одному варианту осуществления мембраносвязанный белок представляет собой CD4, классический мембранный белок типа I с единственным трансмембранным (ТМ) доменом. (Carr et al., (1989) J. Biol. Chem. 264:21286-95). Согласно другому варианту осуществления мембраносвязанный белок представляет собой GPR77, несколько раз проходящий через мембрану, сопряженный с G-белком рецепторный (GPCR) мембранный белок. (Cain & Monk, (2002) J. Biol. Chem. 277:7165-69).
[00224] Дополнительные иллюстративные мембраносвязанные белки включают в себя без ограничения следующие: GPCR (например, адренергические рецепторы, ангиотензиновые рецепторы, холецистокининовые рецепторы, мускариновые ацетилхолиновые рецепторы, нейротензиновые рецепторы, галаниновые рецепторы, дофаминовые рецепторы, опиоидные рецепторы, эротониновые рецепторы, соматостатиновые рецепторы и т.д.), ионные каналы (например, никотиновые ацетилхолиновые рецепторы, натриевые каналы, калиевые каналы и т.д.), рецепторные гуанилатциклазы, рецепторные серин/треонинкиназы, рецепторные гуанилатциклазы, рецепторы фактора роста и гормонов (например, рецептор эпидермального фактора роста (EGF)) и другие. Мутантные или модифицированные варианты мембраносвязанных белков также можно использовать. Например, некоторые точечные или многоточечные мутации GPCR сохраняют функцию и вовлечены в заболевание (См., например, Stadel et al., (1997) Trends in Pharmacological Review 18:430-37).
Определение характеристик отдельно взятой клетки, штрихкодирование полинуклеотида клетки и спаривание цепей
[00225] Описанные в настоящем документе способы могут предусматривать определение характеристик клеток с использованием конъюгатов аффинная часть-олигонуклеотид. Множество клеток можно приводить в контакт с одним или более конъюгатами аффинная часть-олигонуклеотид. Клетки можно отмывать для удаления несвязанных конъюгатов. Клетки можно выделить в сосудах в виде отдельно взятых клеток. Конъюгаты аффинная часть-олигонуклеотид, связанные с выделенными клетками, можно модифицировать, чтобы они содержали штрих-кодовую последовательность сосуда, например, путем прикрепления штрих-кодированного полинуклеотида сосуда к олигонуклеотиду конъюгатов.
[00226] Полинуклеотид, содержащий штрих-код сосуда, также можно вводить во время образования сосудов. Указанные штрих-кодированные полинуклеотиды сосуда могут нести вырожденные штрих-коды так, чтобы каждый олигонуклеотид, содержащий штрих-код сосуда, содержал уникальный код идентичности, соответствующий сосуду, в котором они находятся.
[00227] Олигонуклеотиды можно амплифицировать и амплифицированные продукты реакции можно выделить из сосуда. Амплифицированные продукты можно обогатить с помощью ПЦР для добавления меток секвенирования нового поколения (NGS). Библиотеку можно секвенировать с использованием платформы высокопроизводительного секвенирования с последующим анализом штрих-кодовых последовательностей сосуда и/или последовательностей AID и/или последовательностей АМВ. Поскольку каждую отдельно взятую клетку выделяют в ее соответственном сосуде, для каждого штрих-кода сосуда, наблюдаемого дважды, секвенированные амплифицированные олигонуклеотидные продукты произошли из одного и того же сосуда и, следовательно, из уникальной отдельно взятой клетки. Поскольку каждая AID олигонуклеотида штрих-кодируют относительно аффинной части конъюгата аффинная часть-олигонуклеотид, к которой она прикреплена, и каждую отдельно взятую клетку выделяют в ее соответственном сосуде, для каждой AID, наблюдаемой для последовательностей, содержащих одинаковый штрих-код сосуда, секвенированные амплифицированные олигонуклеотидные продукты произошли из конкретного конъюгата аффинная часть-олигонуклеотид, связанного с отдельно взятой клеткой в одном и том же сосуде. Для каждой различной АМВ, отдельно, наблюдаемой среди набора последовательностей, все из которых содержат одинаковый штрих-код сосуда, амплифицированные олигонуклеотидные продукты, характеризующиеся АМВ в секвенированном наборе, произошли из отличающейся (по сравнению с другими индивидуальными АМВ) отдельно взятой олигонуклеотидной части отдельно взятой молекулы конъюгата аффинная часть-олигонуклеотид, связанной с клеткой в одном и том же сосуде, например, в случаях, в которых используют сосуды отдельно взятой клетки, связанного с отдельно взятой клеткой в сосуде. Для каждой отдельно взятой наблюдаемой АМВ все амплифицированные олигонуклеотидные продукты с последовательностями, содержащими указанный одинаковый штрих-код сосуда, произошли из олигонуклеотидной части отдельно взятой (одинаковой) молекулы конъюгата аффинная часть-олигонуклеотид (например, репрезентирующие ПЦР дупликаты или ампликоны). Таким образом, каждый олигонуклеотид, наблюдаемый с данной комбинацией конкретной АМВ и конкретного штрих-кода сосуда, указывает на отдельно взятую молекулу конъюгата аффинная часть-олигонуклеотид, связанного с отдельно взятой клеткой; таким образом, обнаружение данного числа (например, 2, 3, 4 или больше) многочисленных секвенированных олигонуклеотидов с такой комбинацией АМВ/штрих-код сосуда является показателем числа (например, 2, 3, 4 или больше) конъюгатов аффинная часть-олигонуклеотид, связанных с отдельно взятой клеткой, например, в пределах анализируемой клеточной популяции или образца. Таким образом, такое число может являться показателем числа молекул на клетке, с которой, как разработано, данная аффинная часть конъюгата аффинная часть-олигонуклеотид связывается, например, число копий, экспрессированных на или в отдельно взятой клетке.
[00228] Согласно некоторым вариантам осуществления описанные в настоящем документе способы дополнительно предусматривают штрихкодирование полинуклеотидов, полученных из клеток, и/или полинуклеотидов в сосуде, которые отличаются от конъюгатов аффинная часть-олигонуклеотид и отличаются от их частей или копий. Например, отдельно взятые клетки, инкапсулированные в сосудах, которые являются связанными или являлись связанными с конъюгатами аффинная часть-олигонуклеотид, можно лизировать и дополнительно полинуклеотиды, такие как полинуклеотиды из или внутри отдельно взятой клетки, можно штрих-кодировать. Согласно некоторым вариантам осуществления олигонуклеотидную часть конъюгата аффинная часть-олигонуклеотид в сосуде, например, олигонуклеотидную часть, который является или являлась связанной с отдельно взятой клеткой в сосуде, и/или ее копию или амплифицированный продукт можно штрих-кодировать с помощью штрих-кодовой последовательности сосуда. Согласно некоторым вариантам осуществления один или более полинуклеотидов клетки из отдельно взятой клетки можно штрих-кодировать с помощью одинаковой штрих-кодированной последовательности сосуда; такой дополнительный один или более полинуклеотидов клетки согласно некоторым вариантам осуществления дополнительно штрих-кодируют с помощью молекулярных штрих-кодов.
[00229] Пары цепей Т-клеточного рецептора и пары иммуноглобулиновых цепей антитела представляют собой типы иммунных рецепторов. Согласно некоторым вариантам осуществления полинуклеотид клетки представляет собой кодирующий иммуноглобулиновую цепь антитела (или часть) полинуклеотид; согласно некоторым вариантам осуществления он представляет собой или содержит кодирующий TCR (или часть) полинуклеотид. Согласно некоторым вариантам осуществления антиген, связанный конъюгатом аффинная часть-олигонуклеотид, представляет собой TCR, или антитело, или их цепь, или их часть. Согласно одному аспекту описанные в настоящем документе способы дополнительно предусматривают создание полинуклеотидных библиотек для высокопроизводительного секвенирования и диагностики. Согласно одному аспекту описанные в настоящем документе способы дополнительно предусматривают разработку полученных от человека панелей библиотеки для исследования антител и/или TCR от пациента или когорт с конкретными общими характерными признаками. Раскрытое изобретение можно применять к многочисленным различным типам спаренных вариабельных последовательностей, например, парам цепей Т-клеточного рецептора и парам иммуноглобулиновых цепей антитела, вместе с определением характеристик отдельно взятой клетки с использованием конъюгатов аффинная часть-олигонуклеотид. Например, полинуклеотиды, комплементарные полинуклеотидам клетки, такие как тяжелая и/или легкая цепь, например, цепи антитела VH и/или VL, и/или альфа и/или бета и/или гамма и/или дельта цепи, например, Vα/Vβ и Vγ/Vδ цепи Т-клеточного рецептора (TCR) (такие как цепи, полученные из их каркасных частей), можно вводить во время образования (или включать внутрь) сосудов. Полинуклеотид, содержащий штрих-код сосуда, также можно вводить во время образования (или включать внутрь) сосуда. Указанные штрих-кодированные полинуклеотиды сосуда могут нести вырожденные штрих-коды так, что каждый полинуклеотид клетки, содержащий штрих-код сосуда, содержит уникальный код идентичности, соответствующий сосуду, в котором он находится во время реакции(й). Таким образом, согласно некоторым таким вариантам осуществления множество полинуклеотидов с одинаковым уникальным кодом идентичности, как полагают, произошли из одного и того же сосуда и в некоторых аспектах, таким образом, из одной клетки. Множество полинуклеотидов, содержащих молекулярный штрих-код, также можно вводить во время образования сосудов или включать в сосуды. Указанные молекулярные штрих-кодированные полинуклеотиды могут нести вырожденные штрих-коды так, что каждая молекула полинуклеотида клетки, содержащая молекулярный штрих-код, содержит уникальный код идентичности, соответствующий молекуле полинуклеотида отдельно взятой клетки, из которой они происходят. Миллионы отдельно взятых иммунных клеток можно лизировать внутри эмульсии и клеточные транскрипты, такие как транскрипты цепей VH и VL и/или Vα/Vβ и/или Vγ/Vδ, можно обратно транскрибировать или копировать с использованием праймеров с последующим мечением с помощью штрих-кода сосуда и молекулярного штрих-кода и ПЦР-амплификации штрих-кодированных полинуклеотидов. Каждая цепь VH и VL и/или Vα/Vβ и/или Vγ/Vδ, выходящая из отдельно взятой иммунной клетки (например, В-клетки или Т-клетки) можно фактически соединить с любой другой с такой же идентичностью штрих-кода сосуда.
[00230] Цепи VH и VL и/или Vα/Vβ и/или Vγ/Vδ можно затем выделить из сосудов и обогатить с помощью ПЦР для добавления меток секвенирования нового поколения (NGS). Библиотеку можно секвенировать с использованием платформы высокопроизводительного секвенирования с последующим анализом разнообразия репертуара, частоты встречаемости антитела, определения характеристик CDR3, филогенетического анализа соматических гипермутаций и т.д. Базу данных правильно совпадающих пар VH и VL и/или Vα/Vβ и/или Vγ/Vδ можно создать с помощью деконволюции штрих-кодовых последовательностей сосуда и молекулярных штрих-кодовых последовательностей. Поскольку каждую отдельно взятую иммунную клетку выделяют в ее соответственном сосуде, для каждого штрих-кода сосуда, наблюдаемого дважды, секвенированные транскрипты произошли из одинаковых капель эмульсии и, следовательно, из уникальной отдельно взятой клетки. Для каждого наблюдаемого отличающегося молекулярного штрих-кода, для последовательностей, содержащих одинаковый штрих-код сосуда, секвенированные транскрипты произошли из отличающейся молекулы транскрипта из отдельно взятой клетки. Для каждого одинакового наблюдаемого молекулярного штрих-кода, для последовательностей, содержащих одинаковый штрих-код сосуда, секвенированные транскрипты произошли из одной и той же молекулы транскрипта из отдельно взятой клетки (например, ПЦР-дупликаты).
[00231] Параллельно секвенированию библиотеку цепей VH и VL и/или Vα/Vβ и/или Vγ/Vδ, выделенных из сосудов, можно клонировать в векторы экспрессии антител и котрансфицировать для скрининга на основе дрожжевого дисплея. Клонирование этого пула идентичных библиотек является предпочтительным способом по сравнению с разделением биологического образца в начале, поскольку некоторые редкие иммунные клетки можно захватить только том или ином анализе. Библиотеку полученных от человека цепей VH и VL и/или Vα и Vβ и/или Vγ и Vδ можно экспрессировать независимо от правильного или неправильного совпадения пар, как в классических анализах дисплея. Анализ дрожжевого дисплея затем можно провести против одной или более антигенных мишеней для обогащения потенциальных кандидатов антител.
[00232] Положительные антитела-кандидаты, полученные из технологий дисплея, таких как дрожжевой дисплей, можно секвенировать и можно осуществить запрос в базе данных штрих-кодов совпавших пар. Каждую подвергнутую дрожжевому дисплею цепь VH и/или Vα и/или Vγ можно вновь сопоставить с ее соответственной цепью VL или Vβ или Vδ, соответственно, и каждую подвергнутую дрожжевому дисплею цепь VL и/или Vβ и/или Vδ можно вновь сопоставить с ее соответственной цепью VH или Vα или Vγ, соответственно. Указанных правильно спаренных кандидатов можно подвергать синтезу генов и экспрессировать в клеточных линиях млекопитающих и функционально валидизировать против представляющей интерес мишени. Указанные кандидаты могут представлять собой полностью человеческие антитела и/или TCR.
Образцы
[00233] Согласно некоторым вариантам осуществления любой образец, содержащий полинуклеотиды, можно использовать в описанных в настоящем документе способах. Любой образец, содержащий клетку, как правило, можно использовать в описанных в настоящем документе способах. Например, образец может представлять собой биологический образец от субъекта или из образца, полученного от него, содержащий РНК или ДНК. Полинуклеотиды можно экстрагировать из биологического образца или образец можно напрямую подвергать способам без экстракции или очистки полинуклеотидов. Образец может представлять собой экстрагированную или выделенную ДНК или РНК. Образец также может представлять собой общую РНК или ДНК, экстрагированную из биологического образца, библиотеки кДНК, вирусной или геномной ДНК. Согласно одному варианту осуществления полинуклеотиды выделяют из биологического образца, содержащего разнообразие других компонентов, таких как белки, липиды и нематричные нуклеиновые кислоты. Матричные молекулы нуклеиновых кислот можно получить из любого клеточного материала, полученного из организма животного, растения, бактерии, гриба или любого другого клеточного организма. Согласно определенным вариантам осуществления полинуклеотиды получают из отдельно взятой клетки. Полинуклеотиды можно получить напрямую из организма или из биологического образца, полученного из организма. Любой образец ткани или жидкости организма можно использовать в качестве источника нуклеиновой кислоты для применения в настоящем изобретении. Полинуклеотиды также можно выделить из культивированных клеток, таких как первичная клеточная культура или клеточная линия. Клетки или ткани, из которых получают матричные нуклеиновые кислоты, можно инфицировать вирусом или другим внутриклеточным патогеном.
[00234] Согласно определенным вариантам осуществления продуцирующие антитело или TCR иммунные клетки можно выделить из крови или других биологических образцов субъекта или хозяина, такого как человек или другое животное, такое как человек или другое животное, которое было иммунизировано или которое страдает от инфекции, злокачественной опухоли, аутоиммунного состояния или любых других заболеваний, для идентификации специфического в отношении патогена, опухоли и/или заболевания антитела или TCR потенциальной клинической значимости. Например, у человека могут диагностировать заболевание, он может проявлять симптомы заболевания, у него могут не диагностировать заболевание, или он может не проявлять симптомы заболевания. Например, человек может представлять собой человека, который подвергся воздействию и/или который может производить применимые антитела или TCR против инфекционного агента (например, вирусов, бактерий, простейших, прионов и т.д.), антигена или заболевания. Например, животное может представлять собой животное, которое подверглось воздействию и/или которое может производить применимые антитела или TCR против инфекционного агента (например, вирусов, бактерий, простейших, прионов и т.д.), антигена или заболевания. Определенные иммунные клетки из иммунизированных хозяев производят антитела или TCR к одному или более рассматриваемым целевым антигенам и/или одному или более неизвестным антигенам. Согласно настоящему изобретению пул лимфоцитов можно обогатить в отношении требуемых иммунных клеток с помощью любого подходящего способа, такого как скрининг и сортировка клеток с использованием сортировка клеток с активированной флуоресценцией (FACS), активируемая магнитным полем сортировка клеток (MACS), пэннинг или другой способ скрининга для получения множества иммунных клеток из образца, такого как библиотека иммунных клеток, до секвенирования цепи антител, получения антитела или создания экспрессионной библиотеки. В отличие от способов обогащения предшествующего уровня техники, которые обеспечивают лишь небольшое количество подклассов иммунных клеток, экспрессирующих различные антитела, и, следовательно, только небольшое количество встречающихся в природе комбинаций вариабельных доменов, библиотека иммунных клеток согласно настоящему изобретению содержит по меньшей мере 2 подкласса иммунных клеток или индивидуальные иммунные клетки, экспрессирующие различные антитела или TCR. Например, библиотека иммунных клеток согласно настоящему изобретению может содержать по меньшей мере 5, 10, 100, 250, 500, 750, 1000, 2500, 5000, 10000, 25000, 50000, 75000, 10000, 250000, 500000, 750000, 1000000, 2500000, 5000000, 7500000 или 10000000 подклассов иммунных клеток или индивидуальных иммунных клеток, экспрессирующих различные антитела или TCR. Способы согласно настоящему изобретению делают выделение иммунных клеток максимальным, и обеспечивают очень высокое разнообразие.
[00235] Т-клетки можно получить из ряда источников, включая в себя следующее: мононуклеары периферической крови, костный мозг, тимус, тканевой биоптат, опухоль, ткань лимфатического узла, ассоциированная с кишечником лимфоидная ткань, ассоциированная со слизистой лимфоидная ткань, ткань селезенки или любая другая лимфоидная ткань и опухоли. Т-клетки можно получить из Т-клеточных линий и из аутологических или аллогенных источников. Т-клетки можно получить из одного индивидуума или популяции индивидуумов, например, популяции индивидуумов, все из которых страдают от одинакового заболевания, такого как злокачественная опухоль или инфекционное заболевание. Согласно некоторым вариантам осуществления клетки из циркулирующей крови индивидуума получают путем афереза или лейкафереза. Продукт афереза, как правило, содержит лимфоциты, включая в себя Т-клетки, моноциты, гранулоциты, В-клетки, другие ядросодержащие лейкоциты, эритроциты и тромбоциты. Согласно одному варианту осуществления клетки, собранные с помощью афереза или лейкафереза, можно отмывать для удаления фракции плазмы и помещать клетки в соответствующий буфер или среды для стадий последующей обработки. Согласно одному варианту осуществления настоящего изобретения клетки отмывают с помощью натрий-фосфатного буфера (PBS). Согласно альтернативному варианту осуществления раствор отмывки не содержит кальций и может не содержать магний или может не содержать многие, если не все, двухвалентные катионы. Как понятно специалистам в настоящей области техники, стадию отмывания можно осуществить с помощью способов, известных специалистам в настоящей области техники, например, путем использования полуавтоматической "проточной" центрифуги. После отмывания клетки можно ресуспендировать в разнообразных биосовместимых буферах, таких как, например, не содержащий Ca++/Mg++ PBS. Альтернативно ненужные компоненты образца афереза можно удалить и клетки напрямую можно ресуспендировать в средах культивирования. Согласно другим вариантам осуществления Т-клетки выделяют из лимфоцитов периферической крови путем лизирования эритроцитов и путем центрифугирования через градиент PERCOLL™. Специфическую субпопуляцию Т-клеток, такую как CD28+, CD4+, CD8+, CD45RA+ и CD45RO+ Т-клетки, можно дополнительно выделить с помощью техник положительной или отрицательной селекции. Например, CD3+, CD28+ Т-клетки можно положительно селектировать с использованием конъюгированных с CD3/CD28 магнитных шариков (например, DYNABEADS® М-450 CD3/CD28 Т Cell Expander). Согласно некоторым вариантам осуществления обогащение Т-клеточной популяции с помощью отрицательной селекции можно осуществить с помощью комбинации антител, направленных к поверхностным маркерам, уникальным для отрицательно селектированных клеток. Один такой способ представляет собой сортировку и/или селекцию клеток посредством отрицательной магнитной иммуноадгезии или проточной цитометрии, в которой используют коктейль моноклональных антител к маркерам клеточной поверхности, присутствующим на отрицательно селектированных клетках. Например, для обогащения в отношении CD4+ клеток с помощью отрицательной селекции коктейль моноклональных антител, как правило, включает в себя антитела к CD14, CD20, CD11b, CD16, HLA-DR и CD8. Другой способ получения Т-клетки для стимуляции заключается в замораживании клеток после стадии отмывания, причем эта стадия не требует проведения стадии удаления моноцитов. Не желая быть связанным какой-либо теорией, следует отметить, что стадия замораживания и последующего обеспечивает более однородный продукт путем удаления гранулоцитов и в некоторой степени моноцитов в клеточной популяции. После стадии отмывания, которая удаляет плазму и тромбоциты, клетки можно суспендировать в растворе для замораживания. Наряду с тем, что многие растворы и параметры замораживания известны в настоящей области техники и будут применяться в этом контексте, один способ включает использование PBS, содержащего 20% DMSO и 8% сывороточного альбумина человека (HSA), или другие подходящие среды для замораживания клеток. Затем ее разбавляют 1:1 средой так, чтобы конечная концентрация DMSO и HSA составляла 10% и 4%, соответственно. Затем клетки замораживают до -80°С, со скоростью, составляющей 1°С в минуту и хранят в паровой фазе резервуара для хранения с жидким азотом.
[00236] Согласно некоторым вариантам осуществления используют иммунные клетки от неиммунизированного человека или не являющихся человеком доноров. Наивный репертуар животного (репертуар до сенсибилизации антигеном) обеспечивает животного антителами или TCR, которые могут связываться с умеренной аффинностью (KA, составляющей приблизительно 1×10-6 - 1×10-7 М) по существу с любой несобственной молекулой. Разнообразие последовательностей связывающий сайтов антител или TCR не кодируется непосредственно в зародышевой линии, но подвергается сборке комбинаторным образом из V генных сегментов. Иммунизации запускают любую иммунную клетку, производящую комбинацию VH-VL, или Vα-Vβ, или Vγ-Vδ, которая связывает иммуноген для пролиферации (клональной экспансии) и секреции соответствующего антитела, как указано выше. Тем не менее, применение клеток селезенки и/или иммунных клеток или других лимфоцитов периферической крови (PBL) от неиммунизированного субъекта может обеспечить лучшую репрезентацию репертуара возможных антител или TCR, а также обеспечивает возможность конструирования последующей В-клеточной или Т-клеточной библиотеки антител или TCR с использованием любого вида животных.
[00237] В некоторых случаях для получения достаточной нуклеиновой кислоты для исследования производят забор крови объемом по меньшей мере 0,001, 0,005, 0,01, 0,05, 0,1, 0,5, 1, 2, 3, 4, 5, 10, 20, 25, 30, 35, 40, 45 или 50 мл.
[00238] В некоторых случаях исходный материал представляет собой периферическую кровь. Клетки периферической крови можно обогащать в отношении конкретного типа клеток (например, мононуклеаров; эритроцитов; CD4+ клеток; CD8+ клеток; иммунных клеток; Т-клеток, NK-клеток или тому подобного). Клетки периферической крови также можно селективно истощать в отношении конкретного типа клеток (например, мононуклеаров; эритроцитов; CD4+ клеток; CD8+ клеток; иммунных клеток; Т-клеток, NK-клеток или тому подобного).
[00239] В некоторых случаях исходный материал может представлять собой образец ткани, содержащий твердую ткань, при этом неограничивающие ее примеры включают в себя головной мозг, печень, легкое, почку, предстательную железу, яичник, селезенку, лимфатический узел (включая в себя небную миндалину), щитовидную железу, поджелудочную железу, сердце, скелетную мышцу, кишечник, гортань, пищевод и желудок. В других случаях исходный материал может представлять собой клетки, содержащие нуклеиновые кислоты, иммунные клетки и, в частности, В-клетки или Т-клетки. В некоторых случаях исходный материал может представлять собой образец, содержащий нуклеиновые кислоты из любого организма, из которого можно получить генетический материал. В некоторых случаях образец представляет собой жидкость, например, кровь, слюну, лимфу или мочу.
[00240] Образец можно получить от субъекта с состоянием. В некоторых случаях субъект, от которого берут образец, может представлять собой пациента, например, пациента со злокачественной опухолью или пациента, у которого предполагают наличие злокачественной опухоли. Субъект может представлять собой млекопитающее, например, человека, и может являться мужчиной или женщиной. В некоторых случаях женщина является беременной. Образец может представлять собой биоптат опухоли. Биопсию может проводить, например, лица, предоставляющие медицинские услуги, включая в себя врача, помощника врача, медсестру, ветеринара, стоматолога, мануального терапевта, врача скорой помощи, дерматолога, онколога, гастроэнтеролога или хирурга.
[00241] В некоторых случаях не относящийся к нуклеиновым кислотам материал можно удалить из исходного материала с использованием ферментативных обработок (таких как обработка протеазой).
[00242] В некоторых случаях кровь можно собирать в прибор, содержащий хелатор магния, включая в себя без ограничения EDTA, и хранить при 4°С. Необязательно можно добавить хелатор кальция, включая в себя без ограничения EGTA. В другом случае к крови добавляют ингибитор лизиса клеток, включая в себя без ограничения формальдегид, производные формальдегида, формалин, глутаральдегид, производные глутаральдегида, перекрестносшивающее белок средство, перекрестносшивающее нуклеиновую кислоту средство, перекрестносшивающее белок и нуклеиновую кислоту средство, реакционноспособные в отношении первичных аминов перекрестносшивающие средства, реакционноспособные в отношении сульфгидрильных групп перекрестносшивающие средства, добавление сульфгидрильной группы или восстановление дисульфидной группы, реакционноспособные в отношении углевода перекрестносшивающие средства, реакционноспособные в отношении карбоксила перекрестносшивающие средства, фотореакционноспособные перекрестносшивающие средства или отщепляемые перекрестносшивающие средства.
[00243] В некоторых случаях, если экстрагированный материал содержит одноцепочечную РНК, двухцепочечную РНК или гибрид ДНК-РНК, указанные молекулы можно превратить в двухцепочечную ДНК с использованием техник, известных в настоящей области техники. Например, обратную транскриптазу можно использовать для синтеза ДНК из молекул РНК. В некоторых случаях превращение РНК в ДНК может требовать проведение предшествующей стадии лигирования для лигирования линкерного фрагмента с РНК, тем самым обеспечивая возможность использования универсальных праймеров для инициации обратной транскрипции. В других случаях поли-А хвост молекулы иРНК, например, можно использовать для инициации обратной транскрипции. После превращения в ДНК способы, подробно описанные в настоящем документе, можно использовать, в некоторых случаях для дополнительного захвата, селекции, мечения или выделения требуемой последовательности.
[00244] Молекулы нуклеиновых кислот включают в себя дезоксирибонуклеиновую кислоту (ДНК) и/или рибонуклеиновую кислоту (РНК). Молекулы нуклеиновых кислот можно синтезировать или получить из встречающихся в природе источников. Согласно одному варианту осуществления молекулы нуклеиновых кислот выделяют из биологического образца, содержащего разнообразие других компонентов, таких как белки, липиды и нематричные нуклеиновые кислоты. Матричные молекулы нуклеиновых кислот можно получить из любого клеточного материала, полученного из организма животного, растения, бактерии, гриба или любого другого клеточного организма. Согласно определенным вариантам осуществления молекулы нуклеиновых кислот получают из отдельно взятой клетки. Биологические образцы для применения согласно настоящему изобретению включают в себя вирусные частицы или препараты. Молекулы нуклеиновых кислот можно получить непосредственно из организма или из биологического образца, полученного из организма, например, из крови, мочи, спинномозговой жидкости, семенной жидкости, слюна, мокроты, кала и ткани. Любой образец ткани или жидкости организма можно использовать в качестве источника нуклеиновой кислоты для применения согласно настоящему изобретению. Молекулы нуклеиновых кислот также можно выделить из культивированных клеток, таких как первичная клеточная культура или клеточная линия. Клетки или ткани, из которых получают матричные нуклеиновые кислоты, можно инфицировать вирусом или другим внутриклеточным патогеном.
[00245] Образец также может представлять собой общую РНК, экстрагированную из биологического образца, библиотеки кДНК, вирусной или геномной ДНК. Согласно определенным вариантам осуществления молекулы нуклеиновых кислот связаны с другими целевыми молекулами, такими как белки, ферменты, субстраты, антитела, связывающие средства, шарики, малые молекулы, пептиды или любая другая молекула. Как правило, нуклеиновую кислоту можно экстрагировать из биологического образца с помощью разнообразных техник, таких как техники, описанные Sambrook and Russell, Molecular Cloning: A Laboratory Manual, Third Edition, Cold Spring Harbor, N.Y. (2001). Молекулы нуклеиновых кислот могут являться одноцепочечными, двухцепочечными или двухцепочечными с одноцепочечными областями (например, структуры «стебель» и «петля»).
[00246] Способы экстракции ДНК хорошо известны в настоящей области техники. Классический протокол выделения ДНК основан на экстракции с использованием органических растворителей, таких как смесь фенола и хлороформа, с последующим осаждением с помощью этанола (J. Sambrook et al., "Molecular Cloning: A Laboratory Manual," 1989, 2nd Ed., Cold Spring Harbour Laboratory Press: New York, N.Y.). Другие способы включают в себя следующее: экстракция ДНК путем высаливания (Р. Sunnucks et al., Genetics, 1996, 144: 747-756; S. M. Aljanabi et al., Nucl. Acids Res. 1997, 25: 4692-4693), экстракция ДНК с помощью триметиламмонийбромидными солями (S. Gustincich et al., BioTechniques, 1991, 11: 298-302) и экстракция ДНК с помощью гуанидинийтиоцианата (J. В. W. Hammond et al., Biochemistry, 1996, 240: 298-300). Разнообразные наборы являются коммерчески доступными для экстрагирования ДНК из биологических образцов (например, BD Biosciences Clontech (Palo Alto, CA): Epicentre Technologies (Madison, WI); Gentra Systems, Inc. (Minneapolis, MN); MicroProbe Corp.(Bothell, WA); Organon Teknika (Durham, NC); и Qiagen Inc. (Valencia, CA)).
[00247] Способы экстракции РНК также хорошо известны в настоящей области техники (например, J. Sambrook et al., "Molecular Cloning: A Laboratory Manual" 1989, 211d Ed., Cold Spring Harbour Laboratory Press: New York), и наборы для экстракции РНК из жидкостей организма являются коммерчески доступными (например, Ambion, Inc. (Austin, ТХ); Amersham Biosciences (Piscataway, NJ); BD Biosciences Clontech (Palo Alto, CA); BioRad Laboratories (Hercules, CA); Dynal Biotech Inc. (Lake Success, NY); Epicentre Technologies (Madison, WI); Gentra Systems, Inc. (Minneapolis, MN); GIBCO BRL (Gaithersburg, MD); Invitrogen Life Technologies (Carlsbad, CA); MicroProbe Corp. (Bothell, WA); Organon Teknika (Durham, NC); Promega, Inc. (Madison, WI); и Qiagen Inc. (Valencia, CA)).
[00248] Один или более образцов могут происходить из одного или более источников. Один или более образцов могут происходить из двух или больше источников. Один или более образцов можно получить от одного или более субъектов. Один или более образцов можно получить от двух или больше субъектов. Один или более образцов можно получить от одного и того же субъекта. Один или более субъектов могут принадлежать к одному и тому же виду. Один или более субъектов могут принадлежать к различным видам. Один или более субъектов могут являться здоровыми. Один или более субъектов могут являться пораженными заболеванием, нарушением или состоянием.
[00249] Согласно некоторым вариантам осуществления образец представляет собой жидкость, такую как кровь, слюна, лимфа, моча, спинномозговая жидкость, семенная жидкость, мокрота, кал или тканевые гомогенаты.
[00250] Образец можно получить от субъекта с состоянием. Согласно некоторым вариантам осуществления субъект, от которого берут образец, может представлять собой пациента, например, пациента со злокачественной опухолью или пациента, у которого предполагают наличие злокачественной опухоли. Субъект может представлять собой млекопитающее, например, человека, и может являться мужчиной или женщиной. Согласно некоторым вариантам осуществления женщина является беременной. Образец может представлять собой биоптат опухоли. Биопсию может проводить, например, лицо, предоставляющее медицинские услуги, включая в себя врача, помощника врача, медсестру, ветеринара, стоматолога, мануального терапевта, врача скорой помощи, дерматолога, онколога, гастроэнтеролога или хирурга.
[00251] Согласно некоторым вариантам осуществления полинуклеотиды связаны с другими целевыми молекулами, такими как белки, ферменты, субстраты, антитела, связывающие средства, шарики, малые молекулы, пептиды или любая другая молекула. Согласно некоторым вариантам осуществления полинуклеотиды не связаны с твердой подложкой. Нуклеиновые кислоты можно экстрагировать из биологического образца с помощью разнообразных техник (Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Edition, Cold Spring Harbor, N.Y. (2001)).
[00252] Согласно некоторым вариантам осуществления образец представляет собой слюну. Согласно некоторым вариантам осуществления образец представляет собой цельную кровь. Согласно некоторым вариантам осуществления для получения достаточного количества полинуклеотидов для исследования производят забор крови объемом, составляющим по меньшей мере приблизительно 0,001, 0,005, 0,01, 0,05, 0,1, 0,5, 1, 2, 3, 4, 5, 10, 20, 25, 30, 35, 40, 45 или 50 мл. Согласно некоторым вариантам осуществления кровь можно собирать в прибор, содержащий хелатор магния, включая в себя без ограничения EDTA, и хранить при 4°С. Необязательно можно добавить хелатор кальция, включая в себя без ограничения EGTA.
[00253] Согласно некоторым вариантам осуществления к крови добавляют ингибитор лизиса клеток, включая в себя без ограничения формальдегид, производные формальдегида, формалин, глутаральдегид, производные глутаральдегида, перекрестносшивающее белок средство, перекрестносшивающее нуклеиновую кислоту средство, перекрестносшивающее белок и нуклеиновую кислоту средство, реакционноспособные в отношении первичных аминов перекрестносшивающие средства, реакционноспособные в отношении сульфгидрильных групп перекрестносшивающие средства, добавление сульфгидрильной группы или восстановление дисульфидной группы, реакционноспособные в отношении углевода перекрестносшивающие средства, реакционноспособные в отношении карбоксила перекрестносшивающие средства, фотореакционноспособные перекрестносшивающие средства или отщепляемые перекрестносшивающие средства. Согласно некоторым вариантам осуществления не относящиеся к нуклеиновым кислотам материалы можно удалить из исходного материала с использованием ферментативных обработок (таких как обработка протеазой).
[00254] Множество образцов может содержать по меньшей мере 2, 3, 4, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 или больше образцов. Множество образцов может содержать по меньшей мере приблизительно 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 или больше образцов. Множество образцов может содержать по меньшей мере приблизительно 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000 образцов, 9000 или 10000 образцов, или 100000 образцов, или 1000000 или больше образцов. Множество образцов может содержать по меньшей мере приблизительно 10000 образцов.
[00255] Один или более полинуклеотидов в первом образце могут отличаться от одного или более полинуклеотидов во втором образце. Один или более полинуклеотидов в первом образце могут отличаться от одного или более полинуклеотидов во множестве образцов. Один или более полинуклеотидов в образце могут характеризоваться по меньшей мере приблизительно 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности. Согласно некоторым вариантам осуществления один или более полинуклеотидов в образце могут отличаться меньше чем приблизительно на 100, 90, 80, 70, 60, 50, 40, 30, 25, 20, 25, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 пару нуклеотидов или оснований. Множество полинуклеотидов в одном или более образцах из множества образцов может содержать две или больше идентичных последовательностей. По меньшей мере приблизительно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% общих полинуклеотидов в одном или более из множества образцов могут содержать одинаковую последовательность. Множество полинуклеотидов в одном или более образцах из множества образцов могут содержать по меньшей мере две различные последовательности. По меньшей мере приблизительно 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% общих полинуклеотидов в одном или более из множества образцов могут содержать по меньшей мере две различные последовательности. Согласно некоторым вариантам осуществления один или более полинуклеотидов представляют собой варианты друг друга. Например, один или более полинуклеотидов могут содержать однонуклеотидные полиморфизмы или другие типы мутаций. В другом примере один или более полинуклеотидов представляют собой сплайс-варианты.
[00256] Первый образец может содержать одну или более клеток, и второй образец может содержать одну или более клеток. Одна или более клеток первого образца могут принадлежать к тому же типу клеток, что и одна или более клеток второго образца.
Одна или более клеток первого образца могут принадлежать к типу клеток, отличающемуся от одной или более различных клеток из множества образцов.
[00257] Множество образцов можно получить одновременно. Множество образцов можно получить в одно и то же время. Множество образцов можно получить последовательно. Множество образцов можно получить в течение нескольких лет, например, 100 лет, 10 лет, 5 лет, 4 лет, 3 лет, 2 лет или 1 года от получения одного или более различных образцов. Один или более образцов можно получить в пределах приблизительно одного года от получения одного или более различных образцов. Один или более образцов можно получить в пределах 12 месяцев, 11 месяцев, 10 месяцев, 9 месяцев, 8 месяцев, 7 месяцев, 6 месяцев, 4 месяцев, 3 месяцев, 2 месяцев или 1 месяца от получения одного или более различных образцов. Один или более образцов можно получить в пределах 30 дней, 28 дней, 26 дней, 24 дней, 21 дней, 20 дней, 18 дней, 17 дней, 16 дней, 15 дней, 14 дней, 13 дней, 12 дней, 11 дней, 10 дней, 9 дней, 8 дней, 7 дней, 6 дней, 5 дней, 4 дней, 3 дней, 2 дней или 1 дня от получения одного или более различных образцов. Один или более образцы можно получить в пределах приблизительно 24 часов, 22 часов, 20 часов, 18 часов, 16 часов, 14 часов, 12 часов, 10 часов, 8 часов, 6 часов, 4 часов, 2 часов или 1 часа от получения одного или более различных образцов. Один или более образцы можно получить в пределах приблизительно 60 секунд, 45 секунд, 30 секунд, 20 секунд, 10 секунд, 5 секунд, 2 секунд или 1 секунды от получения одного или более различных образцов. Один или более образцы можно получить в пределах меньше чем одной секунды от получения одного или более различных образцов.
[00258] Различные полинуклеотиды образца могут присутствовать в образце в различных концентрациях или количествах (например, различное число молекул). Например, концентрация или количество одного полинуклеотида может превышать концентрацию или количество другого полинуклеотида в образце. Согласно некоторым вариантам осуществления концентрация или количество по меньшей мере одного полинуклеотида в образце по меньшей мере приблизительно в 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000 или больше раз превышать концентрацию или количество по меньшей мере одного другого полинуклеотида в образце. В другом примере концентрация или количество одного полинуклеотида меньше, чем концентрация или количество другого полинуклеотида в образце. Концентрация или количество по меньшей мере одного полинуклеотида в образце может являться по меньшей мере приблизительно в 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000 или больше раз меньше, чем концентрация или количество по меньшей мере одного другого полинуклеотида в образце.
[00259] Согласно некоторым вариантам осуществления два или больше образца могут содержать различные количества или концентрации полинуклеотидов. Согласно некоторым вариантам осуществления концентрация или количество одного полинуклеотида в одном образце может превышать концентрацию или количество того же полинуклеотида в отличающемся образце. Например, образец крови может содержать более высокое количество конкретного полинуклеотида, чем образец мочи. Альтернативно один образец можно разделить на два или больше субобразцов. Субобразцы могут содержать различные количества или концентрации одного и того полинуклеотида. Концентрация или количество по меньшей мере одного полинуклеотида в одном образце может по меньшей мере приблизительно в 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000 или больше раз превышать концентрацию или количество того же полинуклеотида в другом образце. Альтернативно концентрация или количество одного полинуклеотида в одном образце может быть меньше, чем концентрация или количество того же полинуклеотида в отличающемся образце. Например, концентрация или количество по меньшей мере одного полинуклеотида в одном образце может являться по меньшей мере приблизительно в 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000 или больше раз меньше, чем концентрация или количество того же полинуклеотида в другом образце.
Целевые полинуклеотиды
[00260] В некоторых случаях предусмотренные в настоящем документе способы направлены на амплификацию и секвенирование целевой полинуклеотидной молекулы, такой как полинуклеотидная молекула из клетки, олигонуклеотид конъюгата аффинная часть-олигонуклеотид или их ампликоны. В некоторых случаях предусмотренные в настоящем документе способы направлены на амплификацию и секвенирование по меньшей мере одной области целевой полинуклеотидной молекулы. В некоторых случаях предусмотренные в настоящем документе способы направлены на амплификацию и секвенирование по меньшей мере одной целевой полинуклеотидной молекулы. Согласно одному аспекту целевые полинуклеотиды представляют собой олигонуклеотиды конъюгатов аффинная часть-олигонуклеотид. Согласно одному аспекту целевые полинуклеотиды представляют собой РНК. Согласно некоторым вариантам осуществления целевые полинуклеотиды РНК представляют собой иРНК. Согласно некоторым вариантам осуществления целевые полинуклеотиды РНК являются полиаденилированными. Согласно некоторым вариантам осуществления полинуклеотиды РНК не являются полиаденилированными. Согласно некоторым вариантам осуществления целевые полинуклеотиды представляют собой полинуклеотиды ДНК. Например, целевые полинуклеотиды включают в себя кДНК. Полинуклеотиды ДНК могут представлять собой геномную ДНК. Полинуклеотиды ДНК могут содержать экзоны, интроны, нетранслируемые области или любую их комбинацию.
[00261] Согласно одному аспекту целевые полинуклеотиды представляют собой геномные нуклеиновые кислоты. ДНК, происходящая из генетического материала в хромосомах конкретного организма, может представлять собой геномную ДНК. Согласно некоторым вариантам осуществления целевые полинуклеотиды включают в себя последовательности, содержащие вариабельные области антитела или TCR, произведенных иммунной клеткой. Согласно некоторым вариантам осуществления целевые полинуклеотиды включают в себя последовательности, содержащие вариабельную область тяжелой цепи антитела, произведенного иммунной клеткой. Согласно некоторым вариантам осуществления целевые полинуклеотиды включают в себя последовательности, содержащие вариабельную область легкой цепи антитела, произведенного иммунной клеткой. Согласно некоторым вариантам осуществления целевые полинуклеотиды включают в себя последовательности, содержащие вариабельную область альфа цепи TCR, произведенного иммунной клеткой. Согласно некоторым вариантам осуществления целевые полинуклеотиды включают в себя последовательности, содержащие вариабельную область бета цепи TCR, произведенного иммунной клеткой. Согласно некоторым вариантам осуществления целевые полинуклеотиды включают в себя последовательности, содержащие вариабельную область гамма цепи TCR, произведенного иммунной клеткой. Согласно некоторым вариантам осуществления целевые полинуклеотиды включают в себя последовательности, содержащие вариабельную область дельта цепи TCR, произведенного иммунной клеткой. Например, целевые полинуклеотиды могут включать в себя полинуклеотидную матрицу, используемую для создания продуктов реакции обратной транскрипции или реакции достройки праймера, а также включают в себя сами продукты реакции обратной транскрипции или реакции достройки праймера. Например, целевые полинуклеотиды включают в себя представляющие интерес полинуклеотиды, которые можно подвергать реакции обратной транскрипции или реакции достройки праймера.
[00262] Согласно некоторым вариантам осуществления целевые полинуклеотиды включают в себя последовательности, содержащие AID олигонуклеотидов конъюгатов аффинная часть-олигонуклеотид. Согласно некоторым вариантам осуществления целевые полинуклеотиды включают в себя последовательности, содержащие AMD олигонуклеотидов конъюгатов аффинная часть-олигонуклеотид. Например, целевые полинуклеотиды включают в себя РНК или ДНК. Например, целевые полинуклеотиды включают в себя синтезированные олигонуклеотиды. Например, целевые полинуклеотиды включают в себя олигонуклеотиды, содержащие AID и/или АМВ.
[00263] Целевые полинуклеотиды можно получить фактически из любого источника и можно получить с использованием способов, известных в настоящей области техники. Например, целевые полинуклеотиды можно выделить напрямую без амплификации с использованием способов, известных в настоящей области техники, включая в себя без ограничение экстрагирование фрагмента геномной ДНК или иРНК из организма или клетки (например, иммунной клетки) для получения целевых полинуклеотидов. Целевой полинуклеотид также может включать в себя кДНК, образованную из РНК (такой как иРНК) посредством ПЦР с обратной транскрипцией. В некоторых случаях целевой полинуклеотид представляет собой молекулу РНК. В некоторых случаях целевой полинуклеотид представляет собой молекулу иРНК или кДНК, полученную из молекулы иРНК. В некоторых случаях целевой полинуклеотид представляет собой молекулу иРНК или молекулу кДНК, полученную из молекулы иРНК, из отдельно взятой иммунной клетки. В некоторых случаях целевые полинуклеотиды представляют собой молекулы иРНК или молекулы кДНК, полученные из молекул иРНК, из индивидуальных иммунных клеток. В некоторых случаях целевые полинуклеотиды представляют собой молекулы иРНК, кодирующие последовательность антитела из отдельно взятой иммунной клетки. В некоторых случаях целевые полинуклеотиды представляют собой молекулы иРНК, кодирующие последовательности тяжелой цепи антитела из индивидуальных иммунных клеток. В некоторых случаях целевые полинуклеотиды представляют собой молекулы иРНК, кодирующие последовательность тяжелой цепи антитела из отдельно взятой иммунной клетки. В некоторых случаях целевые полинуклеотиды представляют собой молекулы иРНК, кодирующие последовательности легкой цепи антитела из индивидуальных иммунных клеток. В некоторых случаях целевые полинуклеотиды представляют собой молекулы иРНК, кодирующие последовательность легкой цепи антитела из отдельно взятой иммунной клетки. В некоторых случаях целевые полинуклеотиды представляют собой молекулы иРНК, кодирующие вариабельные последовательности антитела из индивидуальных иммунных клеток. В некоторых случаях целевые полинуклеотиды представляют собой молекулы иРНК, кодирующие вариабельную последовательность антитела из отдельно взятой иммунной клетки. В некоторых случаях целевые полинуклеотиды представляют собой молекулы иРНК, кодирующие последовательности вариабельной области легкой цепи антитела из индивидуальных иммунных клеток. В некоторых случаях целевые полинуклеотиды представляют собой молекулы иРНК, кодирующие последовательность вариабельной области легкой цепи антитела из отдельно взятой иммунной клетки. В некоторых случаях целевые полинуклеотиды представляют собой молекулы иРНК, кодирующие последовательности вариабельной области тяжелой цепи антитело из индивидуальных иммунных клеток. В некоторых случаях целевые полинуклеотиды представляют собой молекулы иРНК, кодирующие последовательность вариабельной области тяжелой цепи антитела из отдельно взятой иммунной клетки. В некоторых случаях целевой полинуклеотид может представлять собой бесклеточную нуклеиновую кислоту, например, ДНК или РНК. В некоторых случаях целевые полинуклеотиды представляют собой молекулы иРНК, кодирующие последовательности вариабельной области альфа, бета, гамма и/или дельта цепи TCR из индивидуальных иммунных клеток.
[00264] Описанные в настоящем документе способы можно использовать для создания библиотеки полинуклеотидов из одного или более целевых полинуклеотидов для секвенирования. Согласно некоторым вариантам осуществления библиотеки можно создать из двух или больше областей целевого полинуклеотида. Согласно некоторым вариантам осуществления способов библиотеки можно создать из двух или больше целевых полинуклеотидов. Согласно некоторым вариантам осуществления целевые полинуклеотиды представляют собой геномные нуклеиновые кислоты или ДНК, происходящие из хромосом. Согласно некоторым вариантам осуществления целевые полинуклеотиды включают в себя последовательности, содержащие вариант, такой как полиморфизм или мутацию. Согласно некоторым вариантам осуществления целевые полинуклеотиды включают в себя ДНК и не включают в себя РНК. Согласно некоторым вариантам осуществления целевые полинуклеотиды включают в себя РНК и не включают в себя ДНК. Согласно некоторым вариантам осуществления целевые полинуклеотиды включают в себя ДНК и РНК. Согласно некоторым вариантам осуществления целевой полинуклеотид представляет собой одноцепочечный полинуклеотид. Согласно некоторым вариантам осуществления целевой полинуклеотид представляет собой двухцепочечный полинуклеотид. Согласно некоторым вариантам осуществления целевой полинуклеотид представляет собой одну цепь двухцепочечного полинуклеотида.
[00265] Целевые полинуклеотиды можно синтезировать или получить из любого биологического образца и получить с использованием способов, известных в настоящей области техники. Согласно некоторым вариантам осуществления целевые полинуклеотиды выделяют напрямую без амплификации. Способы прямого выделения известны в настоящей области техники. Неограничивающие примеры включают в себя экстрагирование геномной ДНК или иРНК из биологического образца, организма или клетки. Согласно некоторым вариантам осуществления один или более целевых полинуклеотидов очищают из биологического образца. Согласно некоторым вариантам осуществления целевой полинуклеотид не очищают из биологического образца, в котором он содержится. Согласно некоторым вариантам осуществления целевой полинуклеотид выделяют из биологического образца. Согласно некоторым вариантам осуществления целевой полинуклеотид не выделяют из биологического образца, в котором он содержится. Согласно некоторым вариантам осуществления целевой полинуклеотид может представлять собой бесклеточную нуклеиновую кислоту. Согласно некоторым вариантам осуществления целевой полинуклеотид может представлять собой фрагментированную нуклеиновую кислоту. Согласно некоторым вариантам осуществления целевой полинуклеотид может представлять собой транскрибированную нуклеиновую кислоту. Согласно некоторым вариантам осуществления целевой полинуклеотид представляет собой модифицированный полинуклеотид. Согласно некоторым вариантам осуществления целевой полинуклеотид представляет собой немодифицированный полинуклеотид.
[00266] Согласно некоторым вариантам осуществления целевой полинуклеотид представляет собой олигонуклеотид из конъюгата аффинная часть-олигонуклеотид. Согласно некоторым вариантам осуществления множество целевых полинуклеотидов содержит множество олигонуклеотидов из множества конъюгатов аффинная часть-олигонуклеотид. Согласно некоторым вариантам осуществления множество целевых полинуклеотидов содержит 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900 или 1000 или больше олигонуклеотидов из множества конъюгатов аффинная часть-олигонуклеотид. Согласно некоторым вариантам осуществления множество целевых полинуклеотидов содержит множество олигонуклеотидов из 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900 или 1000 или больше конъюгатов аффинная часть-олигонуклеотид. Согласно некоторым вариантам осуществления множество целевых полинуклеотидов содержит 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900 или 1000 или больше олигонуклеотидов из 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900 или 1000 или больше конъюгатов аффинная часть-олигонуклеотид.
[00267] Согласно некоторым вариантам осуществления целевой полинуклеотид содержит последовательность AID. Согласно некоторым вариантам осуществления множество целевых полинуклеотидов содержит 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900 или 1000 или больше последовательностей AID. Согласно некоторым вариантам осуществления целевой полинуклеотид содержит последовательность АМВ. Согласно некоторым вариантам осуществления множество целевых полинуклеотидов содержит по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, 1×106, 2×106, 3×106, 4×106, 5×106, 6×106, 7×106, 8×106, 9×106, 1×107, 2×107, 3×107, 4×107, 5×10 , 6×107, 7×107, 8×107, 9×107, 1×108, 2×108, 3×108, 4×108, 5×108, 6×108, 7×108, 8×108, 9×108, 1×109, 2×109, 3×109, 4×109, 5×109, 6×109, 7×109, 8×109, 9×109, 1×1010, 2×1010, 3×1010, 4×1010, 5×1010, 6×1010, 7×1010, 8×1010, 9×1010, 1×1011, 2×1011, 3×1011, 4×1011, 5×1011, 6×1011, 7×1011, 8×1011, 9×1011, 1×1012, 2×1012, 3×1012, 4×1012, 5×1012, 6×1012, 7×1012, 8×1012 или 9×1012 или больше последовательностей АМВ.
[00268] Согласно некоторым вариантам осуществления целевой полинуклеотид представляет собой полинуклеотид из отдельно взятой клетки. Согласно некоторым вариантам осуществления целевые полинуклеотиды происходят из индивидуальных клеток. Согласно некоторым вариантам осуществления целевой полинуклеотид представляет собой полинуклеотид из образца, содержащего множество клеток.
[00269] Согласно некоторым вариантам осуществления целевой полинуклеотид кодирует последовательность биомаркера. Согласно некоторым вариантам осуществления целевой полинуклеотид кодирует две или больше последовательностей биомаркера. Согласно некоторым вариантам осуществления множество целевых полинуклеотидов кодирует последовательность биомаркера. Согласно некоторым вариантам осуществления множество целевых полинуклеотидов кодирует две или больше последовательностей биомаркера. Согласно некоторым вариантам осуществления множество целевых полинуклеотидов кодирует 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 или больше последовательностей биомаркера.
[00270] Согласно некоторым вариантам осуществления множество целевых полинуклеотидов содержит панель последовательностей олигонуклеотида. Согласно некоторым вариантам осуществления множество целевых полинуклеотидов содержит панель последовательностей иммуноглобулина. Согласно некоторым вариантам осуществления множество целевых полинуклеотидов содержит панель последовательностей TCR. Например, панель последовательностей иммуноглобулин может представлять собой последовательности VH и/или VL. Согласно некоторым вариантам осуществления панель последовательностей иммуноглобулина или TCR содержит 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 последовательностей иммуноглобулина или TCR. Согласно некоторым вариантам осуществления панель последовательностей иммуноглобулина или TCR содержит по меньшей мере приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, 1×106, 2×106, 3×106, 4×106, 5×106, 6×106, 7×106, 8×106, 9×106, 1×107, 2×107, 3×10 7, 4×107, 5×107, 6×107, 7×107, 8×107, 9×107, 1×108, 2×108, 3×108, 4×108, 5×108, 6×108, 7×108, 8×108, 9×108, 1×109, 2×109, 3×109, 4×109, 5×109, 6×109, 7×109, 8×109, 9×109, 1×1010, 2×1010, 3×1010, 4×1010, 5×1010, 6×1010, 7×1010, 8×1010, 9×1010, 1×1011, 2×1011, 3×1011, 4×1011, 5×1011, 6×1011, 7×1011, 8×1011, 9×1011, 1×1012, 2×1012, 3×1012, 4×1012, 5×1012, 6×1012, 7×1012, 8×1012 или 9×1012 последовательностей иммуноглобулина или TCR. Согласно некоторым вариантам осуществления панель последовательностей иммуноглобулина или TCR содержит не больше чем приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, 1×106, 2×106, 3×10 6, 4×106, 5×106, 6×106, 7×106, 8×106, 9×106, 1×107, 2×107, 3×107, 4×107, 5×107, 6×107, 7×107, 8×107, 9×107, 1×108, 2×108, 3×108, 4×108, 5×108, 6×108, 7×108, 8×108, 9×108, 1×109, 2×109, 3×109, 4×109, 5×109, 6×109, 7×109, 8×109, 9×109, 1×1010, 2×1010, 3×1010, 4×1010, 5×1010, 6×1010, 7×1010, 8×1010, 9×1010, 1×1011, 2×1011, 3×1011, 4×105×1011, 6×1011, 7×1011, 8×1011, 9×1011, 1×1012, 2×1012, 3×1012, 4×1012, 5×1012, 6×1012, 7×1011, 8×1012 или 9×1012 последовательностей иммуноглобулина или TCR. Согласно некоторым вариантам осуществления панель последовательностей иммуноглобулина или TCR содержит приблизительно 10-20, 10-30, 10-40, 10-30, 10-40, 10-50, 10-60, 10-70, 10-80, 10-90, 10-100, 50-60, 50-70, 50-80, 50-90, 50-100, 100-200, 100-300, 100-400, 100-300, 100-400, 100-500, 100-600, 100-700, 100-800, 100-900, 100-1000, 500-600, 500-700, 500-800, 500-900, 500-1000, 1000-2000, 1000-3000, 1000-4000, 1000-3000, 1000-4000, 1000-5000, 1000-6000, 1000-7000, 1000-8000, 1000-9000, 1000-10000, 5000-6000, 5000-7000, 5000-8000, 5000-9000, 5000-10000, 1-1×105, 1-2×105, 1-3×105, 1-4×105, 1-5×105, 1-6×105, 1-7×105, 1-8×105, 9×105, 1-1×106, 1-2×106, 1-3×106, 1-4×106, 1-5×106, 1-6×106, 1-7×106, 1-8×106, 9×106, 1×107, 1-2×107, 1-3×10 7, 1-4×107, 1-5×107, 1-6×107, 1-7×107, 1-8×107, 1-9×107, 1-1×108, 1-2×108, 1-3×108, 1-4×108, 1-5×108, 1-6×108, 1-7×108, 1-8×108, 1-9×108, 1-1×109, 1-2×109, 1-3×109, 1-4×109, 1-5×109, 1-6×109, 1-7×109, 1-8×109, 1-9×109, 1-1×1010, 1-2×1010, 1-3×10,0, 1-4×1010, 1-5×1010, 1-6×1010, 1-7×1010, 1-8×1010, 1-9×10,0, 1-1×1011, 1-2×1011, 1-3×1011, 1-4×1011, 1-5×1011, 1-6×1011, 1-7×1011, 1-8×1011, 1-9×1011, 1-1×1012, 1-2×1012, 1-3×1012, 1-4×1012, 1-5×1012, 1-6×1012, 1-7×1012, 1-8×1012 или 1-9×1012 последовательностей иммуноглобулина или TCR.
[00271] Согласно некоторым вариантам осуществления целевой полинуклеотид составляет приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000 или 20000 оснований или пар оснований в длину. Согласно некоторым вариантам осуществления целевой полинуклеотид составляет по меньшей мере приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000 или 20000 оснований или пар оснований в длину. Согласно некоторым вариантам осуществления целевой полинуклеотид составляет не больше чем приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000 или 20000 оснований или пар оснований в длину. Согласно некоторым вариантам осуществления целевой полинуклеотид составляет приблизительно 10-20, 10-30, 10-40, 10-30, 10-40, 10-50, 10-60, 10-70, 10-80, 10-90, 10-100, 50-60, 50-70, 50-80, 50-90, 50-100, 100-200, 100-300, 100-400, 100-300, 100-400, 100-500, 100-600, 100-700, 100-800, 100-900, 100-1000, 500-600, 500-700, 500-800, 500-900, 500-1000, 1000-2000, 1000-3000, 1000-4000, 1000-3000, 1000-4000, 1000-5000, 1000-6000, 1000-7000, 1000-8000, 1000-9000, 1000-10000, 5000-6000, 5000-7000, 5000-8000, 5000-9000 или 5000-10000 оснований или пар оснований в длину. Согласно некоторым вариантам осуществления средняя длина целевых полинуклеотидов или их фрагментов может составлять меньше чем приблизительно 100, 200, 300, 400, 500 или 800 пар оснований, или меньше чем приблизительно 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 нуклеотидов, или меньше чем приблизительно 1, 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 тысяч оснований. Согласно некоторым вариантам осуществления целевая последовательность из относительно короткой матрицы, такой как образец, содержащий целевой полинуклеотид, составляет приблизительно 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 оснований. Согласно определенным вариантам осуществления секвенирование данные выравнивают против известных или предполагаемых последовательностей с использованием базы данных, содержащей последовательности или последовательности иммуноглобулина или TCR, ассоциированные с заболеванием или состоянием.
[00272] Согласно некоторым вариантам осуществления способ дополнительно включает определение последовательности зародышевой линии первого полинуклеотида клетки, второго полинуклеотида клетки или обоих, причем первый полинуклеотид клетки содержит последовательность IgH или VH, и причем второй полинуклеотид клетки содержит последовательность IgL или VL или любую их комбинацию. Согласно некоторым вариантам осуществления способ дополнительно включает определение отклонения последовательности IgL IgH, VH, VL или любой их комбинации от последовательности IgL IgH, VH, VL или любой их комбинации зародышевой линии. Согласно некоторым вариантам осуществления способ дополнительно включает определение по меньшей мере одного из общего числа уникальный последовательностей IgH; общего числа уникальных последовательностей IgL; общего числа уникальных последовательностей IgH и IgL; общего числа уникальных спаренных последовательностей IgL и IgH; частоты встречаемости последовательности IgH или последовательности IgL; или частоты встречаемости комбинации последовательности IgH и последовательности IgL по сравнению с одной или более другими.
[00273] Согласно некоторым вариантам осуществления способ дополнительно включает определение последовательность зародышевой линии первого полинуклеотида клетки, второго полинуклеотида клетки или обоих, причем первый полинуклеотид клетки содержит последовательность TCRα или Vα, и причем второй полинуклеотид клетки содержит последовательность TCRβ или Vβ или любую их комбинацию. Согласно некоторым вариантам осуществления способ дополнительно включает определение отклонения последовательности TCRα, TCRβ, Vα, Vβ или любой их комбинации от последовательности TCRα, TCRβ, Vα, Vβ или любой их комбинации зародышевой линии.
[00274] Согласно некоторым вариантам осуществления способ дополнительно включает определение по меньшей мере одного из следующего: общее число уникальных последовательностей TCRα; общее число уникальных последовательностей TCRβ; общее число уникальных последовательностей TCRα и TCRβ; общее число уникальных спаренных последовательностей TCRβ и TCRα; частота встречаемости последовательности TCRα или последовательности TCRβ; или частота встречаемости комбинации последовательности TCRα и последовательности TCRβ по сравнению с одной или более другими. Согласно некоторым вариантам осуществления способ дополнительно включает определение последовательности зародышевой линии первого полинуклеотида клетки, второго полинуклеотида клетки или обоих, причем первый полинуклеотид клетки содержит последовательность TCRγ или Vγ, и причем второй полинуклеотид клетки содержит последовательность TCRδ или Vδ, или любую их комбинацию. Согласно некоторым вариантам осуществления способ дополнительно включает определение отклонения последовательности TCRγ, TCRδ, Vγ, Vδ или любой их комбинации от последовательности TCRγ, TCRδ, Vγ, Vδ или любой их комбинации зародышевой линии. Согласно некоторым вариантам осуществления способ дополнительно включает определение по меньшей мере одного из следующего: общее число уникальных последовательностей TCRγ; общее число уникальных последовательностей TCRδ; общее число уникальных последовательностей TCRγ и TCRδ; общее число уникальных спаренных последовательностей TCRδ и TCRγ; частота встречаемости последовательности TCRγ или последовательности TCRδ; или частота встречаемости комбинации последовательности TCRγ и последовательности TCRδ по сравнению с одной или более другими. Согласно некоторым вариантам осуществления способ дополнительно включает определение по меньшей мере одного из следующего: общее число последовательностей из первого гена; общее число последовательностей из второго гена; общее число уникальных последовательностей из первого гена; общее число уникальных последовательности из второго гена; или частота встречаемости последовательности из первого гена или последовательности из второго гена.
[00275] Согласно некоторым вариантам осуществления способ дополнительно включает выбор антитела или TCR на основании общего количества одной или более пар индивидуально спаренных последовательностей IgL и IgH, или последовательностей TCRα и TCRβ, или последовательностей TCRγ и TCRδ, и отклонения от зародышевой линии. Согласно некоторым вариантам осуществления способ дополнительно включает выбор антитела или TCR на основании одной или более последовательностей IgL или IgH, последовательностей TCRα и TCRβ, или последовательностей TCRγ и TCRδ, и отклонения от зародышевой линии. Согласно некоторым вариантам осуществления способ дополнительно включает выбор антитела или TCR на основании одного или более из следующего: профили последовательностей, дисерсионный анализ, динамические характеристики или частота встречаемости. Согласно некоторым вариантам осуществления способ дополнительно включает выбор антитела или TCR на основании частоты встречаемости.
Клонирование и экспрессия антител и TCR
[00276] Используемые в настоящем документе термины "экспрессионная библиотека антител" или "экспрессионная библиотека TCR" или "экспрессионная библиотека" могут относиться к набору молекул (т.е. двум или больше молекулам) или на уровне нуклеиновых кислот, или на уровне белка. Таким образом, этот термин может относиться к набору экспрессионных векторов, которые кодируют множество молекул антител или TCR (т.е. на уровне нуклеиновых кислот) или может относиться к набору молекул антител или TCR после того, как они были экспрессированы в соответствующей экспрессионной системе (т.е. на уровне белка). Альтернативно экспрессионные векторы/экспрессионная библиотека могут содержаться в подходящих клетках-хозяевах, в которых их можно экспрессировать. Молекулы антитело, которые кодируют или экспрессируют в экспрессионных библиотеках согласно настоящему изобретению, могут находиться в любом соответствующем формате, например, могут представлять собой целые молекулы антитела или TCR или могут представлять собой фрагменты антитела или TCR, например, одноцепочечные антитела (например, антитела scFv), антитела Fv, антитела Fab', фрагменты (Fab')2, диатела и т.д. Термины "кодирующий", как и последовательность нуклеиновой кислоты, "кодирующая" или кодирующая последовательность ДНК или нуклеотидная последовательность, "кодирующая" конкретный фермент, а также другие синонимичные термины относятся к последовательности ДНК, которая транскрибируется и транслируется в фермент, будучи помещенной под контроль соответствующих регуляторных последовательностей. "Промоторная последовательность" представляет собой регуляторную область ДНК, способную связываться с РНК-полимеразой в клетке и инициировать транскрипцию расположенной ниже, относительно хода транскрипции, (3' направление) кодирующей последовательности. Промотор представляет собой часть последовательности ДНК. Указанная область последовательности содержит старт-кодон на своем 3'-конце. Промоторная последовательность включает в себя минимальное число оснований с элементами, необходимыми для инициации транскрипции на уровнях, обнаруживаемых выше фонового значения. Тем не менее, после того, как РНК-полимераза связывается с последовательностью, и транскрипция инициируется на старт-кодоне (3'-конец с промотором), транскрипция протекает ниже, относительно хода транскрипции, в 3'-направлении. В пределах промоторной последовательности можно обнаружить сайт инициации транскрипции (успешно определяемый с помощью картирования с использованием нуклеазы S1), а также связывающие белок домены (консенсусные последовательности), отвечающие за связывание РНК-полимеразы.
[00277] Молекулы антитела или TCR, идентифицированные с помощью, происходящие из, выбранные из или получаемые из экспрессионных библиотек антител или TCR согласно настоящему изобретению, образуют еще один дополнительный аспект настоящего изобретения. Снова указанные молекулы антитела или TCR могут представлять собой белки или нуклеиновые кислоты, кодирующие молекулы антитела или TCR, причем указанные нуклеиновые кислоты могут, в свою очередь, быть встроены в соответствующий экспрессионный вектор и/или содержаться в подходящей клетке-хозяине.
[00278] Пул кДНК можно подвергать реакции ПЦР с полинуклеотидами, которые гибридизуются с константной областью тяжелой цепи генов антитела, и полинуклеотидами, которые гибридизуются с 5'-концом области цепи VH или Vα или Vγ генов антитела или TCR. Пул кДНК можно подвергать реакции ПЦР с полинуклеотидами, которые гибридизуются с константной областью тяжелой цепи или альфа или гамма цепи генов антитела или TCR, и полинуклеотидами, которые гибридизуются с областью 5' относительно 5'-конца области цепи VH или Vα или Vγ штрих-кодированного полинуклеотида, содержащего последовательность антитела или TCR. Реакцию ПЦР также можно установить для амплификации пула цепей VL, или Vβ, или Vδ, например, каппа и лямбда классов. Пул кДНК можно подвергать реакции ПЦР с полинуклеотидами, которые гибридизуются с константной областью легкой цепи генов антитела, и полинуклеотидами, которые гибридизуются с 5'-концом области цепи VL, или Vβ, или Vδ генов антитела или TCR. Пул кДНК можно подвергать реакции ПЦР с полинуклеотидами, которые гибридизуются с константной областью легкой цепи генов антитела, и полинуклеотидами, которые гибридизуются с областью 5' относительно 5'-конца области цепи VL, или Vβ, или Vδ штрих-кодированного полинуклеотида, содержащего последовательность антитела или TCR. Такие олигонуклеотиды или праймеры можно разработать на основании известной и общедоступной информации баз данных о генных последовательностях иммуноглобулинов или TCR.
[00279] Согласно некоторым вариантам осуществления последовательности VH и VL или Vα и Vβ или Vγ и Vδ можно успешно получить из библиотеки последовательностей VH и VL или Vα и Vβ или Vγ и Vδ, полученных с помощью ПЦР-амплификации с использованием одного или более праймеров, которые не являются специфическими для генов тяжелых или легких цепей, и, в частности, для одной или обеих концевых областей полинуклеотидов VH и VL или Vα и Vβ или Vγ и Vδ. Согласно некоторым вариантам осуществления последовательности VH и VL можно успешно получить из библиотеки последовательностей VH и VL или Vα и Vβ или Vγ и Vδ, полученных с помощью ПЦР-амплификации с использованием праймеров, специфических в отношении области штрих-кодированного полинуклеотида сосуда. Согласно некоторым вариантам осуществления последовательности VH и VL можно успешно получить из библиотеки последовательностей VH и VL или Vα и Vβ или Vγ и Vδ, полученных с помощью ПЦР-амплификации с использованием праймеров, специфических в отношении семейства С-генов, или специфических в отношении С-гена праймеров. Согласно некоторым вариантам осуществления последовательности VH и VL можно успешно получить из библиотеки последовательностей VH и VL или Vα и Vβ или Vγ и Vδ, полученных с помощью ПЦР-амплификации с использованием набора праймеров, в котором первый праймер является специфическим в отношении области штрих-кодированного полинуклеотида сосуда, а второй праймер или множество вторых праймеров являются праймерами, специфическими в отношении семейства С-гена, или специфическими в отношении С-гена праймерами. Согласно некоторым вариантам осуществления последовательности VH и VL или Vα и Vβ или Vγ и Vδ можно успешно получить из библиотеки последовательностей VH и VL или Vα и Vβ или Vγ и Vδ, полученных с помощью ПЦР-амплификации с использованием набора праймеров, в котором первый праймер является специфическим в отношении области штрих-кодированного полинуклеотида сосуда, а второй праймер является специфическим в отношении универсальной последовательности.
[00280] Согласно некоторым вариантам осуществления при обратной транскрипции полученные последовательности кДНК можно амплифицировать с помощью ПЦР с использованием одного или более праймеров, специфических в отношении генов иммуноглобулина и, в частности, в отношении одной или обеих концевых областей полинуклеотидов VH и VL или Vα и Vβ или Vγ и Vδ. Согласно некоторым вариантам осуществления последовательности VH и VL можно получить из библиотеки последовательностей VH и VL или Vα и Vβ или Vγ и Vδ, полученных с помощью ПЦР-амплификации с использованием специфических в отношении семейства V-гена праймеров или специфических в отношении V-гена праймеров (Nicholls et al., J. Immunol. Meth., 1993, 165:81; W093/12227) или разработать в соответствии со стандартными известными в настоящей области техники способами на основании доступной информации о последовательности. (Последовательности VH и VL или Vα и Vβ или Vγ и Vδ можно лигировать, как правило, с промежуточной спейсерной последовательностью (например, кодирующей находящийся внутри рамки считывания гибкий пептидный спейсер), образуя кассету, кодирующую одноцепочечное антитело). Последовательности V-области можно успешно клонировать как кДНК или продукты ПЦР-амплификации для экспрессирующих иммуноглобулин клеток. Области VH и VL или Vα и Vβ или Vγ и Vδ секвенируют, необязательно, согласно описанным в настоящем документе способам и, в частности, после определенных стадий, как указано (например, после ПЦР отдельно взятой клетки; после представления поверхности клетки млекопитающего или другой клетки, после скрининга FACS и тому подобного). Секвенирование можно использовать, среди других причин, для верификации того, что уровень разнообразия находится на приемлемом уровне. Секвенирование может включать в себя высокопроизводительное секвенирование, глубокое секвенирование (при котором один и тот же ген секвенируют из множества отдельных образцов для идентификации различий в последовательностях) или комбинации двух указанных способов.
[00281] Согласно некоторым вариантам осуществления отсутствует необходимость физически соединять комбинации природных VH и VL или Vα и Vp или Vγ и Vδ с использованием описанных в настоящем документе способов. Согласно некоторым вариантам осуществления кДНК, штрих-кодированные полинуклеотиды или ПЦР-амплифицированные штрих-кодированные кДНК не соединяют физически. Согласно некоторым вариантам осуществления кДНК, штрих-кодированные полинуклеотиды или ПЦР-амплифицированные штрих-кодированные кДНК не соединяют физически в одной и той же реакции или сосуде.
[00282] Согласно некоторым вариантам осуществления комбинации природных VH и VL или Vα и Vβ или Vγ и Vδ физически соединяют с использованием, в дополнение к праймерам кДНК, один праймер или множество праймеров для 5'-конца гена VH, или Vα или Vγ и другой праймер или множество праймеров для 5'-конца гена VL или, Vβ или Vδ. Указанные праймеры также содержат комплементарные хвосты дополнительной последовательности для обеспечения самосборки генов VH и VL или Vα и Vβ или Vγ и Vδ. После ПЦР-амплификация и соединения шанс получить смешанные продукты, иными словами, смешанные вариабельные области, является минимальным, поскольку реакции амплификации и соединения проводят внутри каждой клетки. Риск смешивания можно дополнительно снизить за счет использования больших по объему реагентов, таких как меченные дигоксигенином нуклеотиды, чтобы дополнительно убедиться в том, что пары V области кДНК не покинули клеточный компартмент и перемешались, а остались внутри клетки для ПЦР-амплификации и соединения. Амплифицированные последовательности соединяют с помощью гибридизации комплементарные концевые последовательности. После соединения последовательности можно выделить из клеток для использования в дополнительных стадиях способа, описанных в настоящем документе. Например, выделенные ДНК можно ПЦР-амплифицировать с использованием концевых праймеров, при необходимости, и клонировать в векторы, которые могут представлять собой плазмиды, фаги, космиды, фагемиды, вирусные векторы или их комбинации, как подробно описано ниже. Подходящие сайты рестрикции можно встроить в гибридизированные последовательности для облегчения клонирования. Указанные векторы также могут служить в качестве библиотеки соединенных вариабельных областей для дальнейшего использования.
[00283] Для обеспечения дополнительных комбинаций VH и VL или Vα и Vβ или Vγ и Vδ можно выбрать экспрессионную систему. Например, бактериофаговые экспрессионные системы обеспечивают возможность случайной рекомбинации последовательностей тяжелых и легких цепей. Другие подходящие экспрессионные системы известны специалистам в настоящей области техники.
[00284] Следует отметить, что в случае последовательностей VH и VL или Vα и Vβ или Vγ и Vδ, полученных из субъектов, не являющихся людьми, согласно некоторым вариантам осуществления может являться предпочтительным химеризовать указанные последовательности с помощью полностью человеческой Fc. Используемый в настоящем документе термин "химеризованный" относится к иммуноглобулину или TCR, в которых вариабельные области тяжелой и легкой цепи или области Vα и Vβ или Vγ и Vδ происходят не из организма человека, и в которых константные области тяжелой и легкой цепей или цепи Vα и Vβ или Vγ и Vδ происходят из организма человека. Это достигают с помощью амплификации и клонирования вариабельных доменов в Fc человека. Fc человека может являться частью вектора или находиться в отдельной молекуле, а также можно использовать библиотеку Fc. Согласно предпочтительному варианту осуществления химеризованные молекулы, выращенные в клетках млекопитающего, таких как клетки СНО, подвергают скринингу с помощью FACS дважды для обогащения клеточной популяции в отношении клеток, экспрессирующих антитело, представляющее интерес. Химеризованные антитела или TCR подвергают определению характеристик, с помощью либо секвенирования с последующим определением функциональных характеристик, либо прямого определения функциональных характеристик или кинетических параметров. Рост, скрининг и определение характеристик описаны подробно ниже.
[00285] Важно отметить, что описанные выше ПЦР-реакции описаны для клонирования антител в форме IgG. Они являются предпочтительными, поскольку они, как правило, ассоциированы с более зрелым иммунным ответом и, как правило, проявляют более высокую аффинность, чем антитела IgM, что делает их боле желательными для определенных терапевтических и диагностических применений. Тем не менее, понятно, что можно разработать полинуклеотиды, которые обеспечат возможность клонирования одного или более других форм молекул иммуноглобулина, например, IgM, IgA, IgE и IgD при желании или необходимости.
[00286] После того, как антитело или TCR идентифицировали и соответствующие популяции клеток выделили в соответствующий момент времени и необязательно обогатили, как описано выше, нет необходимости немедленно создавать экспрессионные библиотеки антител или TCR, при условии, что генетический материал, содержащийся в клетках, можно сохранить интактным, тем самым обеспечивая возможность получить библиотеку позднее. Таким образом, например, клетки, клеточный лизат, или нуклеиновую кислоту, например, РНК или ДНК, полученные из них, можно хранить до более поздней даты с помощью соответствующих способов, например, путем замораживания, и экспрессионные библиотеки можно создать позднее при необходимости.
[00287] После того, как создали библиотеку экспрессионные векторы, кодируемые молекулы антитела можно экспрессировать в соответствующей экспрессионной системе и подвергать скринингу с использованием соответствующих техник, которые хорошо известны и описаны в литературе в настоящей области техники. Таким образом, определенный выше способ согласно настоящему изобретению может предусматривать дополнительные стадии экспрессии библиотеки экспрессионных векторов в соответствующей экспрессионной системе и скрининга экспрессированной библиотеки в отношении антител с требуемыми свойствами.
[00288] Как указано в настоящем документе, полинуклеотиды, полученные с помощью способов согласно настоящему раскрытию, которые содержат полинуклеотид, кодирующий последовательности антитела или TCR, может включать в себя без ограничения полинуклеотиды, кодирующие аминокислотную последовательность фрагмента антитела или TCR, сами по себе, некодирующую последовательность для целого антитела или TCR или их части, кодирующую последовательность для антитела или TCR, фрагмента или части, а также дополнительные последовательности, такие как кодирующая последовательность по меньшей мере одного сигнального лидерного или слитого пептида, с вышеупомянутыми дополнительными кодирующими последовательностями или без них, такими как по меньшей мере один интрон, вместе с дополнительными, некодирующими последовательностями, включая в себя без ограничения следующее: некодирующие 5' и 3' последовательности, такие как транскрибированные, нетранслируемые последовательности, которые играют роль в транскрипции, процессинге иРНК, включая в себя сигналы сплайсинга и полиаденилирования (например, связывание с рибосомой и стабильность иРНК); дополнительная кодирующая последовательность, которая кодирует дополнительные аминокислоты, такие как те, которые обеспечивают дополнительные функциональные группы. Таким образом, последовательность, кодирующая антитело, можно слить с маркерной последовательностью, такой как последовательность, кодирующая пептид, который облегчает очистку слитого антитела или TCR, содержащего фрагмент или часть антитела или TCR.
[00289] Первичные продукты ПЦР затем можно необязательно подвергнуть вторичной реакции ПЦР с новыми наборами полинуклеотидов, которые гибридизуются с 5' и 3'-концами вариабельными доменами антитела или TCR VH, VL каппа и VL лямбда или Vα и Vβ или Vγ и Vδ (в соответствующих случаях в зависимости от того, была ли разработана первичная реакция ПЦР, с которой используют новые наборы полинуклеотидов, для амплификации частей генов тяжелой или легкой цепей или генов TCR Vα или Vβ или генов TCR Vγ или Vδ). Указанные полинуклеотиды предпочтительно включают в себя последовательности ДНК, специфические для заданного набора рестрикционных ферментов (т.е. сайтов рестрикционных ферментов) для последующего клонирования. Выбранные рестрикционные ферменты необходимо выбирать так, чтобы они не осуществляли рестрикцию в пределах V-генных сегментов антитела или TCR человека. Такие полинуклеотиды можно разработать на основании информации из известных и общедоступных баз данных о последовательностях генов иммуноглобулинов или TCR и рестрикционных ферментов. Тем не менее, предпочтительные сайты рестрикционных ферментов, которые следует включать, представляют собой NcoI, Hind III, MluI и NotI. Продукты таких вторичных реакций ПЦР представляют собой репертуары различных фрагментов/доменов V-тяжелой, V-легкой каппа и V-легкой лямбда цепей антител. Следовательно, этот тип вторичной реакции ПЦР, как правило, проводят, когда представляющий интерес формат экспрессионной библиотеки представляет собой формат scFv или Fv, в котором только присутствуют домены VH и VL или Vα и Vβ или Vγ и Vδ антитела или TCR.
[00290] Продукты ПЦР также можно подвергать реакции ПЦР с новыми наборами праймеров, которые гибридизуются с 5' и 3'-концами штрих-кодированных полинуклеотидов. Указанные полинуклеотиды могут предпочтительно включать в себя последовательности ДНК, специфических для заданного набора рестрикционных ферментов (т.е. сайтов рестрикционных ферментов) для последующего клонирования. Выбранные рестрикционные ферменты необходимо выбирать так, чтобы они не осуществляли рестрикцию в пределах V-генных сегментов антитела или TCR человека. Такие полинуклеотиды можно разработать на основании информации из известных и общедоступных баз данных о последовательностях генов иммуноглобулинов или TCR и рестрикционных ферментов. Тем не менее, предпочтительные сайты рестрикционных ферментов, подлежащих включению, представляют собой NcoI, Hind III, MluI и NotI. Продукты таких вторичных реакций ПЦР представляют собой репертуары различных фрагментов/доменов VH, VL каппа и VL лямбда антител или фрагментов/доменов Vα и Vβ или Vγ и Vδ TCR.
[00291] Фрагменты Fv или Fab тяжелой или легкой цепи или цепи Vα или Vβ или цепи Vγ или Vδ или одноцепочечные антитела или TCR также можно использовать с указанной системой. Тяжелую или легкую цепь, или цепь Vα или Vβ или цепь Vγ или Vδ можно подвергнуть мутагенезу с последующим добавлением комплементарной цепи к раствору. Двум цепям затем позволяют комбинироваться и образовывать функциональный фрагмент антитела. Добавление случайных неспецифических последовательностей легкой или тяжелой цепи, или цепи Vα или Vβ или цепи Vγ или Vδ обеспечивает возможность получения комбинаторной системы для создания библиотеки разнообразных представителей.
[00292] Библиотеки таких репертуаров клонированных фрагментов, содержащих вариабельные области тяжелой цепи или цепи Vα или цепи Vγ или их фрагменты, и/или вариабельные области легкой цепи или цепи Vβ или цепи Vδ или их фрагменты генов антитела или TCR, полученных из В- или Т-лимфоцитов хозяев, подвергнутых иммунологической сенсибилизации, как определено в настоящем документе, образуют дополнительные аспекты настоящего изобретения. Указанные библиотеки, содержащие клонированные вариабельные области, можно необязательно ввести в экспрессионные векторы с образованием экспрессионных библиотек.
[00293] Согласно некоторым вариантам осуществления реакции ПЦР можно установить так, чтобы сохранить все или часть константных областей различных цепей антитела или TCR, содержащихся в выделенной популяции иммунных клеток. Это является желательным, когда формат экспрессионной библиотеки представляет собой формат Fab, в котором компонент тяжелой или альфа или гамма цепи содержит домены VH или Vα или Vγ и CH или Сα или Сγ и компонент легкой цепи или цепи Vβ или цепи Vδ содержит цепь VL или Vβ или Vδ и домены CL или Cβ или Сδ. Аналогично вышеуказанному, библиотеки таких клонированных фрагментов, содержащие все или часть константных областей цепей антитела или TCR, образуют дополнительные аспекты настоящего изобретения.
[00294] Указанные нуклеиновые кислоты могут в целях удобства содержать последовательности в дополнение к полинуклеотиду согласно настоящему изобретению. Например, сайт множественного клонирования, содержащий один или более рестрикционных сайтов эндонуклеазы можно ввести в нуклеиновую кислоту для содействия в выделении полинуклеотида. Кроме того, транслируемые последовательности можно ввести для содействия в выделении транслированного полинуклеотида согласно настоящему изобретению. Например, гексагистидиновая маркерная последовательность обеспечивает удобное средство для очистки белков согласно настоящему изобретению. Нуклеиновая кислота согласно настоящему изобретению, за исключением кодирующей последовательности, представляет собой необязательно вектор, адаптер или линкер для клонирования и/или экспрессии полинуклеотида согласно настоящему изобретению.
[00295] Дополнительные последовательности можно добавить к таким клонирующим и/или экспрессионным последовательностям для оптимизации их функций в клонировании и/или экспрессии, для содействия в выделении полинуклеотида или для улучшения введения полинуклеотида в клетку. Применение клонирующих векторов, экспрессионных векторов, адаптеров и линкеров хорошо известно в настоящей области техники. (См., например, Ausubel, ранее; или Sambrook, ранее).
[00296] Библиотеки, раскрытые в настоящем документе, можно использовать в разнообразных применениях. Используемая в настоящем документе библиотека содержит множество молекул. Согласно некоторым вариантам осуществления библиотека содержит множество полинуклеотидов. Согласно некоторым вариантам осуществления библиотека содержит множество праймеров. Согласно некоторым вариантам осуществления библиотека содержит множество прочтений последовательности из одного или более полинуклеотидов, ампликонов или наборов ампликонов. Библиотеку можно хранить и использовать множество раз для создания образцов для анализа. Некоторые применения включают в себя, например, генотипирование полиморфизмов, исследование процессинга РНК и выбор клональных представителей для осуществления секвенирования согласно способам, предусмотренным в настоящем документе. Можно создать библиотеки, содержащие множество полинуклеотидов, таких как праймеры или библиотеки для секвенирования или амплификации, причем множество полинуклеотиды содержит по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 30000, 40000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, 1000000, 50000000, 100000000 или больше молекулярных штрих-кодов или штрих-кодов сосуда. Согласно некоторым вариантам осуществления библиотеки полинуклеотидов содержат множество, составляющее по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 30000, 40000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, 1000000, 50000000, 100000000 или больше уникальных полинуклеотидов, причем каждый уникальный полинуклеотид содержит один или более молекулярных штрих-кодов и штрих-кодов сосуда.
Штрих-коды
[00297] Молекулярный штрих-код, такой как антигенный молекулярный штрих-код, содержит информацию, которая является уникальной для отдельно взятой молекулы, такой как отдельно взятый олигонуклеотид комплекса аффинная часть-олигонуклеотид или молекула полинуклеотида из отдельно взятой клетки или из отдельно взятого сосуда. Штрих-код сосуда содержит информацию, который является уникальным для полинуклеотидов из отдельно взятой клетки или присутствующих в отдельно взятом сосуде, по сравнению с полинуклеотидами из отличающейся отдельно взятой клетки или присутствующими в отличающемся отдельно взятом сосуде. Согласно некоторым вариантам осуществления уникальная информация содержит уникальную последовательность нуклеотидов. Например, последовательность молекулярного штрих-кода или штрих-кода сосуда можно определить путем определения идентичности и порядка уникальной или случайной последовательности нуклеотидов, содержащих молекулярный штрих-код или штрих-код сосуда. Согласно некоторым вариантам осуществления уникальную информацию нельзя использовать для идентификации последовательности целевого полинуклеотида. Например, молекулярный штрих-код можно прикрепить к одному целевому полинуклеотиду, но молекулярный штрих-код нельзя использовать для определения целевого полинуклеотида, к которому он прикреплен. Согласно некоторым вариантам осуществления уникальная информация не представляет собой известную последовательность, соединенную с идентичностью последовательности целевого полинуклеотида. Например, штрих-код сосуда можно прикрепить к одному или более целевым полинуклеотидам, но штрих-код сосуда нельзя использовать для определения того, к какому из одного или более целевых полинуклеотидов он прикреплен. Согласно некоторым вариантам осуществления уникальная информация содержит случайную последовательность нуклеотидов. Согласно некоторым вариантам осуществления уникальная информация содержит одну или более уникальных последовательностей нуклеотидов на полинуклеотиде. Согласно некоторым вариантам осуществления уникальная информация содержит вырожденную нуклеотидную последовательность или вырожденный штрих-код. Вырожденный штрих-код может содержать вариабельную композицию или последовательность нуклеотидных оснований. Например, вырожденный штрих-код может представлять собой случайную последовательность. Согласно некоторым вариантам осуществления комплементарная последовательность молекулярного штрих-кода или штрих-кода сосуда также представляет собой последовательность молекулярного штрих-кода или штрих-кода сосуда.
[00298] Штрих-код может характеризоваться любой длиной нуклеотидов. Например, любой из штрих-кодов, описанных в настоящем документе, может характеризоваться длиной в пределах диапазона, составляющего 2-36 нуклеотидов, 4-36 нуклеотидов или 6-30 нуклеотидов или 8-20 нуклеотидов, 2-20 нуклеотидов, 4-20 нуклеотидов или 6-20 нуклеотидов. Согласно определенным аспектам температуры плавления штрих-кодов в пределах набора находятся в пределах 10°С друг от друга, в пределах 5°С друг от друга или в пределах 2°С друг от друга. Согласно определенным аспектам температуры плавления штрих-кодов в пределах набора находятся в пределах 10°С друг от друга, в пределах 5°С друг от друга или в пределах 2°С друг от друга. Согласно некоторым аспектам штрих-коды являются представителями набора минимальной перекрестной гибридизации. Например, нуклеотидная последовательность каждого представителя такого набора может являться достаточно отличающейся от нуклеотидной последовательности каждого другого представителя набора так, что ни один представитель не может формировать стабильный дуплекс с комплементарной цепью какого-либо другого представителя при жестких условиях гибридизации. Согласно некоторым вариантам осуществления нуклеотидная последовательность каждого представителя набора минимальной перекрестной гибридизации отличается от нуклеотидных последовательностей каждого другого представителя по меньшей мере на два нуклеотида. Технологии штрихкодирования описаны в Winzeler et al. (1999) Science 285:901; Brenner (2000) Genome Biol, 1:1 Kumar et al. (2001) Nature Rev. 2:302; Giaever et al. (2004) Proc. Natl. Acad. Sci. USA 101:793; Eason et al. (2004) Proc. Natl. Acad. Sci. USA 101:11046; и Brenner (2004) Genome Biol. 5:240.
[00299] Например, штрих-код может содержать по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 нуклеотиды. Например, штрих-код может содержать не больше чем приблизительно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 нуклеотидов. Согласно некоторым вариантам осуществления штрих-код характеризуется конкретной длиной нуклеотидов. Например, штрих-код может составлять приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 нуклеотидов в длину.
[00300] Согласно некоторым вариантам осуществления каждый штрих-код во множестве штрих-кодов содержит по меньшей мере приблизительно 2 нуклеотида. Например, каждый штрих-код во множестве штрих-кодов может составлять по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, И, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 нуклеотидов в длину. Согласно некоторым вариантам осуществления каждый штрих-код во множестве штрих-кодов содержит не больше чем приблизительно 1000 нуклеотидов. Например, каждый штрих-код во множестве штрих-кодов может составлять не больше чем приблизительно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20,21,22, 23,24, 25, 26, 27, 28, 29, 30,31,32,33,34,35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 нуклеотидов в длину.
[00301] Число молекулярных штрих-кодов может находиться в избытке от общего числа молекул, подлежащих мечению во множестве сосудов. Число штрих-коды сосуда может находиться в избытке от общего числа молекул, подлежащих мечению во множестве сосудов. Например, число молекулярных штрих-кодов или штрих-кодов сосуда может по меньшей мере приблизительно в 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90 или 100 раз превышать общее число молекул, подлежащих мечению во множестве сосудов.
[00302] Число различных молекулярных штрих-кодов может находиться в избытке от общего числа молекул, подлежащих мечению во множестве сосудов. Согласно некоторым вариантам осуществления число различных молекулярных штрих-кодов по меньшей мере приблизительно в 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90 или 100 раз превышает общее число молекул, подлежащих мечению во множестве сосудов.
[00303] Число различных молекулярных штрих-кодов в отдельно взятом сосуде может находиться в избытке от числа различных молекул, подлежащих мечению в отдельно взятом сосуде. Согласно некоторым вариантам осуществления число различных молекулярных штрих-кодов в отдельно взятом сосуде по меньшей мере приблизительно в 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90 или 100 раз превышает число различных молекул, подлежащих мечению в отдельно взятом сосуде.
[00304] Число различных штрих-кодов сосуда может быть меньше, чем общее число молекул, подлежащих мечению во множестве сосудов. Согласно некоторым вариантам осуществления число различных штрих-кодов сосуда по меньшей мере приблизительно в 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, или 100 раз меньше, чем общее число молекул, подлежащих мечению во множестве сосудов.
[00305] Число молекул амплифицированного продукта из молекулы штрих-кодированного полинуклеотида сосуда в отдельно взятом сосуде может находиться в избытке от числа различных молекул, подлежащих мечению в отдельно взятом сосуде. Согласно некоторым вариантам осуществления число молекул амплифицированного продукта из молекулы штрих-кодированного полинуклеотида сосуда в отдельно взятом сосуде по меньшей мере приблизительно в 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, или 100 раз превышает число различных молекул, подлежащих мечению в отдельно взятом сосуде.
[00306] Число молекул штрих-кодированного полинуклеотида сосуда в отдельно взятом сосуде может быть меньше, чем число различных молекул, подлежащих мечению в отдельно взятом сосуде. Согласно некоторым вариантам осуществления число молекул штрих-кодированного полинуклеотида сосуда в отдельно взятом сосуде по меньшей мере приблизительно в 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90 или 100 раз меньше, чем число различных молекул, подлежащих мечению в отдельно взятом сосуде.
[00307] Число молекул штрих-кодированного полинуклеотида сосуда в отдельно взятом сосуде может составлять одну молекулу. Число неамплифицированных молекул штрих-кодированного полинуклеотида сосуда в отдельно взятом сосуде может составлять одну молекулу.
[00308] Согласно некоторым вариантам осуществления по меньшей мере приблизительно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97% или 100% различных молекулярных штрих-кодов характеризуются одинаковой концентрацией. Согласно некоторым вариантам осуществления по меньшей мере приблизительно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97% или 100% различных штрих-кодов сосуда характеризуются одинаковой концентрацией.
[00309] Согласно некоторым вариантам осуществления по меньшей мере приблизительно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97% или 100% различных молекулярных штрих-кодов характеризуются различной концентрацией. Согласно некоторым вариантам осуществления по меньшей мере приблизительно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97% или 100% различных штрих-кодов сосуда характеризуются различной концентрацией.
[00310] Молекулярные штрих-коды или штрих-коды сосуда в популяции молекулярных штрих-кодов или штрих-кодов сосуда могут содержать по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000 или больше различных последовательностей. Например, молекулярные штрих-коды или штрих-коды сосуда в популяции могут содержать по меньшей мере 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 15000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, 1000000 или больше различных последовательностей. Таким образом, множество молекулярных штрих-кодов или штрих-кодов сосуда можно использовать для создания по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000 или больше различных последовательностей из одного или более полинуклеотидов, таких как целевые полинуклеотиды. Например, множество молекулярных штрих-кодов или штрих-кодов сосуда можно использовать для создания по меньшей мере 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 15000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, 1×106, 2×106, 3×10 6, 4×106, 5×106, 6×106, 7×106, 8×106, 9×106, 1×107, 2×107, 3×107, 4×107, 5×107, 6×107, 7×107, 8×107, 9×107, 1×108, 2×108, 3×108, 4×108, 5×108, 6×108, 7×108, 8×108, 9×108, 1×109, 2×109, 3×109, 4×109, 5×109, 6×109, 7×109, 8×109, 9×109, 1×1010, 2×1010, 3×1010, 4×1010, 5×1010, 6×1010, 7×1010, 8×1010, 9×1010, 1×1011, 2×1011, 3×1011, 4×1011, 5×106×1011, 7×1011, 8×1011, 9×1011, 1×1012, 2×1012, 3×1012, 4×1012, 5×1012, 6×1012, 7×1012, 8×1012, 9×1012 или больше различных последовательностей из одного или более полинуклеотидов, таких как целевые полинуклеотиды. Например, множество молекулярных штрих-кодов или штрих-кодов сосуда можно использовать для создания по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 15000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, 1×106, 2×106, 3×106, 4×106, 5×106, 6×106, 7×106, 8×106, 9×106, 1×107, 2×107, 3×10 7, 4×107, 5×107, 6×107, 7×107, 8×107, 9×107, 1×108, 2×108, 3×108, 4×108, 5×108, 6×108, 7×108, 8×108, 9×108, 1×109, 2×109, 3×109, 4×109, 5×109, 6×109, 7×109, 8×109, 9×109, 1×1010, 2×1010, 3×1010, 4×1010, 5×1010, 6×1010, 7×1010, 8×1010, 9×1010, 1×1011, 2×1011, 3×1011, 4×1011, 5×1011, 6×1011, 7×1011, 8×1011, 9×1011, 1×1012, 2×1012, 3×1012, 4×1011, 5×1012, 6×1012, 7×1012, 8×1012, 9×1012 или больше различных последовательностей по меньшей мере из приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 15000, 20000, 25000, 30000, 35000, 40000, 45000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, 1×106, 2×106, 3×106, 4×106, 5×106, 6×106, 7×106, 8×106, 9×106, 1×107, 2×107, 3×10 7, 4×107, 5×107, 6×107, 7×107, 8×107, 9×107, 1×108, 2×108, 3×108, 4×108, 5×108, 6×108, 7×108, 8×108, 9×108, 1×109, 2×109, 3×109, 4×109, 5×109, 6×109, 7×109, 8×109, 9×109, 1×1010, 2×1010, 3×1010, 4×1010, 5×1010, 6×1010, 7×1010, 8×1010, 9×1010, 1×1011, 2×1011, 3×1011, 4×1011, 5×1011, 6×1011, 7×1011, 8×1011, 9×1011, 1×1012, 2×1012, 3×1012, 4×1012, 5×1012, 6×1012, 7×1012, 8×1012, 9×1012 или больше целевых полинуклеотидов.
[00311] Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов используют для группировки или биннинга последовательностей. Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат одинаковый молекулярный штрих-код. Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов или штрих-кодов сосуда используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат набор ампликонов. Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат множество последовательностей, причем полинуклеотиды, из которых образовано множество последовательностей, произошли из одной и той же полинуклеотидной молекулы в реакции амплификации.
[00312] Согласно некоторым вариантам осуществления один или более штрих-кодов сосуда используют для группировки или биннинга последовательностей. Согласно некоторым вариантам осуществления один или более штрих-кодов сосуда используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат одинаковый штрих-код сосуда. Согласно некоторым вариантам осуществления один или более штрих-кодов сосуда используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат один или более наборов ампликонов. Согласно некоторым вариантам осуществления один или более штрих-кодов сосуда используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат множество последовательностей, причем полинуклеотиды, из которых образовано множество последовательностей, произошли из полинуклеотидов из отдельно взятого сосуда или отдельно взятой клетки.
[00313] Согласно некоторым вариантам осуществления одну или более последовательностей AID используют для группировки или биннинга последовательностей. Согласно некоторым вариантам осуществления одну или более последовательностей AID используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат одинаковую последовательность AID. Согласно некоторым вариантам осуществления одну или более последовательностей AID используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат один или более наборов ампликонов. Согласно некоторым вариантам осуществления одну или более последовательностей AID используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат множество последовательностей, причем полинуклеотиды, из которых образовано множество последовательностей, произошли из полинуклеотидов из отдельно взятого сосуда или отдельно взятой клетки.
[00314] Согласно некоторым вариантам осуществления одну или более последовательностей АМВ используют для группировки или биннинга последовательностей. Согласно некоторым вариантам осуществления одну или более последовательностей АМВ используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат одинаковую последовательность АМВ. Согласно некоторым вариантам осуществления одну или более последовательностей АМВ используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат один или более наборов ампликонов. Согласно некоторым вариантам осуществления одну или более последовательностей АМВ используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат множество последовательностей, причем полинуклеотиды, из которых образовано множество последовательностей, произошли из полинуклеотидов из отдельно взятого сосуда или отдельно взятой клетки.
[00315] Согласно некоторым вариантам осуществления одну или более последовательностей AID и последовательностей АМВ используют для группировки или биннинга последовательностей. Согласно некоторым вариантам осуществления одну или более последовательностей AID и последовательностей АМВ используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат одинаковую последовательность AID. Согласно некоторым вариантам осуществления одну или более последовательностей AID и последовательностей АМВ используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат одинаковую последовательность AID и отличающуюся последовательность АМВ. Согласно некоторым вариантам осуществления одну или более последовательностей AID и последовательностей АМВ используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат одинаковую последовательность AID и одинаковую последовательность АМВ. Согласно некоторым вариантам осуществления одну или более последовательностей AID и последовательностей АМВ используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат один или более наборов ампликонов. Согласно некоторым вариантам осуществления одну или более последовательностей AID и последовательностей АМВ используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат множество последовательностей, причем полинуклеотиды, из которых образовано множество последовательностей, произошли из одинакового полинуклеотида в реакции амплификации и из одинаковой отдельно взятой клетки или сосуда.
[00316] Согласно некоторым вариантам осуществления один или более штрих-кодов сосуда и последовательностей АМВ используют для группировки или биннинга последовательностей. Согласно некоторым вариантам осуществления один или более штрих-кодов сосуда и последовательностей АМВ используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат одинаковый штрих-код сосуда. Согласно некоторым вариантам осуществления один или более штрих-кодов сосуда и последовательностей АМВ используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат одинаковый штрих-код сосуда и отличающуюся последовательность АМВ. Согласно некоторым вариантам осуществления один или более штрих-кодов сосуда и последовательностей АМВ используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат одинаковый штрих-код сосуда и одинаковую последовательность АМВ. Согласно некоторым вариантам осуществления один или более штрих-кодов сосуда и последовательностей АМВ используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат один или более наборов ампликонов. Согласно некоторым вариантам осуществления один или более штрих-кодов сосуда и последовательностей АМВ используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат множество последовательностей, причем полинуклеотиды, из которых образовано множество последовательностей, произошли из одинакового полинуклеотида в реакции амплификации и из одинаковой отдельно взятой клетки или сосуда.
[00317] Согласно некоторым вариантам осуществления одну или более последовательностей AID и штрих-кодов сосуда используют для группировки или биннинга последовательностей. Согласно некоторым вариантам осуществления одну или более последовательностей AID и штрих-кодов сосуда используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат одинаковую последовательность AID. Согласно некоторым вариантам осуществления одну или более последовательностей AID и штрих-кодов сосуда используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат одинаковую последовательность AID и одинаковый штрих-код сосуда. Согласно некоторым вариантам осуществления одну или более последовательностей AID и штрих-кодов сосуда используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат один или более наборов ампликонов. Согласно некоторым вариантам осуществления одну или более последовательностей AID и штрих-кодов сосуда используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат множество последовательностей, причем полинуклеотиды, из которых образовано множество последовательностей, произошли из одинакового полинуклеотида в реакции амплификации и из одинаковой отдельно взятой клетки или сосуда.
[00318] Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов и штрих-кодов сосуда используют для группировки или биннинга последовательностей. Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов и штрих-кодов сосуда используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат одинаковый молекулярный штрих-код и одинаковый штрих-код сосуда. Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов и штрих-кодов сосуда используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат один или более наборов ампликонов. Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов и штрих-кодов сосуда используют для группировки или биннинга последовательностей, причем последовательности в каждом бине содержат множество последовательностей, причем полинуклеотиды, из которых образовано множество последовательностей, произошли из одинакового полинуклеотида в реакции амплификации и из одинаковой отдельно взятой клетки или сосуда. Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов и штрих-кодов сосуда не используют для выравнивания последовательностей.
[00319] Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов не используют для выравнивания последовательностей. Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов используют для выравнивания последовательностей. Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов используют для группировки или биннинга последовательностей и специфическую для мишени область используют для выравнивания последовательностей. Согласно некоторым вариантам осуществления один или более штрих-кодов сосуда не используют для выравнивания последовательностей. Согласно некоторым вариантам осуществления один или более штрих-кодов сосуда используют для выравнивания последовательностей. Согласно некоторым вариантам осуществления один или более штрих-кодов сосуда используют для группировки или биннинга последовательностей и специфическую для мишени область используют для выравнивания последовательностей. Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов и штрих-кодов сосуда используют для выравнивания последовательностей. Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов и штрих-кодов сосуда используют для группировки или биннинга последовательностей и специфическую для мишени область используют для выравнивания последовательностей.
[00320] Согласно некоторым вариантам осуществления выровненные последовательности содержат одинаковую AID. Согласно некоторым вариантам осуществления выровненные последовательности содержат одинаковую АМВ. Согласно некоторым вариантам осуществления выровненные последовательности содержат одинаковые AID и АМВ. Согласно некоторым вариантам осуществления выровненные последовательности содержат одинаковые AID и штрих-код сосуда. Согласно некоторым вариантам осуществления выровненные последовательности содержат одинаковые АМВ и штрих-код сосуда. Согласно некоторым вариантам осуществления выровненные последовательности содержат одинаковый молекулярный штрих-код. Согласно некоторым вариантам осуществления выровненные последовательности содержат одинаковый штрих-код сосуда. Согласно некоторым вариантам осуществления выровненные последовательности содержат одинаковый молекулярный штрих-код и штрих-код сосуда. Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов или штрих-кодов сосуда используют для выравнивания последовательностей, причем выровненные последовательности содержат две или больше последовательностей из набора ампликонов. Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов или штрих-кодов сосуда используют для выравнивания последовательностей, причем выровненные последовательности содержат множество последовательностей, причем полинуклеотиды, из которых образовано множество последовательностей, произошли из одной и той же полинуклеотидной молекулы в реакции амплификации. Согласно некоторым вариантам осуществления один или более молекулярных штрих-кодов или штрих-кодов сосуда используют для выравнивания последовательностей, причем выровненные последовательности содержат множество последовательностей, причем полинуклеотиды, из которых образовано множество последовательностей, произошли из отдельно взятой клетки или отдельно взятого сосуда.
Создание капель
[00321] Разделение образца из множества клеток на небольшие реакционные объемы в сочетании с молекулярным штрихкодированием и штрихкодированием сосуда полинуклеотидов из или происходящих из отдельной клетки из множества клеток может обеспечивать возможность высокопроизводительного секвенирования репертуара последовательностей, таких как последовательностей биомаркеров.
[00322] Разделение образца из множества клеток на небольшие реакционные объемы в сочетании с молекулярным штрихкодированием и штрихкодированием сосуда полинуклеотидов из или происходящих из отдельной клетки из множества клеток может обеспечивать возможность высокопроизводительного секвенирования репертуара последовательностей, таких как последовательности, репрезентирующие процентное отношение транскриптома организма. Например, репертуар последовательностей может содержать множество последовательностей, репрезентирующих по меньшей мере приблизительно 000001%, 000005%, 000010%, 000050%, 0,001%, 0,005%, 0,01%, 0,05%, 0,1%, 0,5%, 1%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98%, 99% или 100% транскриптома организма.
[00323] Разделение образца иммунных клеток на небольшие реакционные объемы в сочетании с молекулярным штрихкодированием и штрихкодированием сосуда полинуклеотидов из или происходящих из отдельной иммунной клетки из множества иммунных клеток может обеспечивать возможность высокопроизводительного секвенирования репертуара последовательностей тяжелой и легкой цепей. Указанные способы также могут обеспечивать возможность спаривания тяжелых и легких цепей после секвенирования на основе штрих-кодированных последовательностей. Разделение образца на небольшие реакционные объемы, как описано в настоящем документе, также может обеспечивать возможность применения сниженных количеств реагентов, тем самым снижая материальные затраты анализа.
[00324] В некоторых случаях реакцию обратной транскрипции и/или реакцию амплификации (например, ПЦР) проводят в каплях, например, цифровая капельная ПЦР. Согласно определенным аспектам настоящего изобретения предусмотрено, что жидкостные компартменты содержат весь или часть целевого материала. Согласно некоторым вариантам осуществления компартмент представляет собой каплю. Наряду с тем, что во всем описании настоящего изобретения делают ссылку на "капли", этот термин используют взаимозаменяемо с компартментом и отсеком для жидкости, если не указано иное. Если не указано иное, термин "капля" используют в целях удобства и можно использовать любой жидкостный отсек или компартмент для жидкости. Капли, используемые в настоящем документе, могут включать в себя эмульсионные композиции (или смеси двух или больше несмешивающихся жидкостей), такие как описаны в патенте США №7622280. Капли можно создать с помощью устройств, описанных в международной патентной публикации № WO/2010/036352. Используемый в настоящем документе термин «эмульсия» относится к смеси несмешивающихся жидкостей (таких как масло и вода). Эмульсии масляной фазы и/или вода-в-масле обеспечивают компартментализацию реакционных смесей в пределах водных капель. Эмульсии могут содержать водные капли в пределах диспергиирующей масляной фазы. Предусмотренные в настоящем документе эмульсии могут представлять собой эмульсии масло-в-воде, причем капли представляют собой масляные капли в пределах диспергиирующей водной фазы. Предусмотренные в настоящем документе капли сконструированы так, чтобы предотвращать смешивание между компартментами, при этом каждый компартмент защищает свое содержимое от испарения и коалесценции с содержимым других компартментов.
[00325] Описанные в настоящем документе смеси или эмульсии могут являться стабильными или нестабильными. Эмульсии могут являться относительно стабильными и характеризоваться минимальной коалесценцией. Коалесценция происходит, когда небольшие капли комбинируются с образованием постепенно более крупные капли. В некоторых случаях меньше чем 000001%, 000005%, 000010%, 000050%, 0,001%, 0,005%, 0,01%, 0,05%, 0,1%, 0,5%, 1%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5%, 5%, 6%, 7%, 8%, 9% или 10% капель, образованных из генератора капель коалесцируют с другими каплями. Эмульсии также могут характеризоваться ограниченной флокуляцией, процессом, при котором диспергированная фаза выходит из суспензии в хлопьях.
[00326] Можно создать капли, характеризующиеся средним диаметром, составляющим приблизительно, меньше чем приблизительно, или больше чем приблизительно, или по меньшей мере приблизительно 0,001, 0,01, 0,05, 0,1, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 100, 120, 130, 140, 150, 160, 180, 200, 300, 400 или 500 мкм. Капли могут характеризоваться средним диаметром, составляющим приблизительно 0,001 - приблизительно 500, приблизительно 0,01 - приблизительно 500, приблизительно 0,1 - приблизительно 500, приблизительно 0,1 - приблизительно 100, приблизительно 0,01 - приблизительно 100 или приблизительно 1 - приблизительно 100 мкм. Микрожидкостные способы получения эмульсионных капель с использованием микроканального перекрестноточного фокусирования или физического перемешивания известны для получения либо монодисперсных, либо полидисперсных эмульсий. Капли могут представлять собой монодисперсные капли. Капли можно создать так, чтобы размер капель не варьировал на больше чем плюс или минус 5% от среднего размера капель. В некоторых случаях капли создают так, чтобы размер капель не варьировал на больше чем плюс или минус 2% от среднего размера капель. Генератор капель может создавать популяцию капель из одного образца, в которой ни одна из капель не варьирует в размере на больше чем плюс или минус приблизительно 0,1%, 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5%, 5%, 5,5%, 6%, 6,5%, 7%, 7,5%, 8%, 8,5%, 9%, 9,5% или 10% от среднего размера общей популяции капель.
[00327] Повышенная механическая стабильность может являться применимой для микрожидкостных манипуляций и жидкостной обработки с повышенным сдвигом (например, в микрожидкостных капиллярах или при поворотах на 90 градусов, например, в клапанах, в жидкостном пути). Капли или капсулы до и после термической обработки могут являться механически стабильными для стандартных манипуляций с помощью пипеток и центрифугирования.
[00328] Каплю можно сформировать за счет протекания масляной фазы через водный образец. Водная фаза может содержать забуференный раствор и реагенты для проведения реакции амплификации, включая в себя клетки, нуклеотиды, нуклеотидные аналоги, молекулярные штрих-кодированные полинуклеотиды, штрих-кодированные полинуклеотиды сосуда, праймеры, матричные нуклеиновые кислоты и ферменты, такие как ДНК-полимераза, РНК-полимераза и/или обратная транскриптаза.
[00329] Водная фаза может содержать забуференный раствор и реагенты для проведения реакции амплификации с твердой поверхности, такой как шарик, или без нее. Забуференный раствор может содержать приблизительно, больше чем приблизительно или меньше чем приблизительно 1, 5, 10, 15, 20, 30, 50, 100 или 200 мМ Tris. В некоторых случаях концентрация хлорида калия может составлять приблизительно, больше чем приблизительно или меньше чем приблизительно 10, 20, 30, 40, 50, 60, 80, 100, 200 мМ. Забуференный раствор может содержать приблизительно 15 мМ Tris и 50 мМ KCl. Нуклеотиды могут содержать молекулы дезоксирибонуклеотидтрифосфата, включая в себя dATP, dCTP, dGTP и dTTP, в концентрациях, составляющих приблизительно, больше чем приблизительно или меньше чем приблизительно 50, 100, 200, 300, 400, 500, 600 или 700 мкМ каждый. В некоторых случаях dUTP добавляют в водную фазу до концентрации, составляющей приблизительно, больше чем приблизительно или меньше чем приблизительно 50, 100, 200, 300, 400, 500, 600 или 700, 800, 900 или 1000 мкМ. В некоторых случаях хлорид магния (MgCh) или ацетат магния добавляют к водной фазе в концентрации, составляющей приблизительно, больше чем приблизительно или меньше чем приблизительно 1,0, 2,0, 3,0, 4,0 или 5,0 мМ. Концентрация MgCh может составлять приблизительно 3,2 мМ. В некоторых случаях используют ацетат магния или магний. В некоторых случаях используют сульфат магния.
[00330] Можно использовать такое неспецифическое блокирующее средство, как BSA или желатин из кожи крупного рогатого скота, причем желатин или BSA присутствует в диапазоне концентраций, составляющем примерно 0,1-0,9% масс./объем. Другие возможные блокирующие средства могут включать в себя бета-лактоглобулин, казеин, сухое молоко или другие общепринятые блокирующие средства. В некоторых случаях предпочтительные концентрации BSA и желатина составляют приблизительно 0,1% масс./объем.
[00331] Праймеры для амплификации в пределах водной фазы могут характеризоваться концентрацией, составляющей приблизительно, больше чем приблизительно или меньше чем приблизительно 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,2, 1,5, 1,7 или 2,0 мкМ. Концентрация праймеров в пределах водной фазы может составлять приблизительно 0,05 - приблизительно 2, приблизительно 0,1 - приблизительно 1,0, приблизительно 0,2 - приблизительно 1,0, приблизительно 0,3 - приблизительно 1,0, приблизительно 0,4 - приблизительно 1,0 или приблизительно 0,5 - приблизительно 1,0 мкМ. Концентрация праймеров может составлять приблизительно 0,5 мкМ. Подходящие диапазоны для концентраций целевых нуклеиновых кислот в ПЦР включают в себя без ограничения от приблизительно 1 пг до приблизительно 500 нг.
[00332] В некоторых случаях водная фаза может также содержать добавки, включая в себя без ограничения неспецифические фоновые/блокирующие нуклеиновые кислоты (например, ДНК из молок лососевых), биоконсерванты (например, азид натрия), энхансеры ПЦР (например, бетаин, трегалоза и т.д.) и ингибиторы (например, ингибиторы РНКазы). Другие добавки могут включать в себя, например, следующее: диметилсульфоксид (DMSO), глицерин, бетаин (моно)гидрат (N,N,N-триметилглицин = [карбокси-метил]триметиламмоний), трегалоза, 7-деаза-2'-дезоксигуанозинтрифосфат (dC7GTP или 7-деаза-2'-dGTP), BSA (бычий сывороточный альбумин), формамид (метанамид), тетраметиламмонийхлорид (ТМАС), другие производные тетраалкиламмония (например, тетраэтиламмонийхлорид (ТЕА-Cl) и тетрапропиламмонийхлорид (TPrA-Cl), неионный детергент (например, Triton Х-100, Tween 20, Nonidet Р-40 (NP-40)) или PREXCEL-Q. В некоторых случаях водная фаза может содержать 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных добавок. В других случаях водная фаза может содержать по меньшей мере 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных добавок.
[00333] В некоторых случаях неионный блок-сополимер этиленоксида и пропиленоксида можно добавить к водной фазе в концентрации, составляющей приблизительно 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9% или 1,0%. Общепринятые поверхностно-активные биовещества включают в себя неионные поверхностно-активные вещества, такие как Pluronic F-68, Tetronic и Zonyl FSN. Pluronic F-68 может присутствовать в концентрации, составляющей приблизительно 0,5% масс./объем.
[00334] В некоторых случаях сульфат магния можно заменить хлоридом магния в сходных концентрациях. Широкий спектр общепринятых, коммерческих буферов для ПЦР от различных поставщиков может заменить забуференный раствор.
[00335] Эмульсию можно составить для получения в высокой степени монодисперсных капель, характеризующихся жидкоподобной пленкой на границе раздела двух фаз, которые можно превратить путем нагревания в микрокапсулы, характеризующиеся твердоподобной пленкой на границе раздела двух фаз; такие микрокапсулы могут вести себя как биореакторы, способные удерживать свое содержимое в ходе реакции, такой как ПЦР-амплификация. Превращение в форму микрокапсулы может происходить при нагревании. Например, такое превращение может происходить при температуре, составляющей больше чем приблизительно 50°С, 60°С, 70°С, 80°С, 90°С или 95°С. В некоторых случаях указанное нагревание происходит с использованием термоциклер. Во время процесса нагревания поверхностный слой жидкости или минерального масла можно использовать для предотвращения испарения. Избыток диспергирующей масляной фазы можно удалять или не удалять перед нагреванием. Биосовместимые капсулы могут являться устойчивыми к коалесценции и/или флокуляции в широком диапазоне термической и механической обработки. После превращения капсулы можно хранить при приблизительно, больше чем приблизительно или меньше чем приблизительно 3°С, 4°С, 5°С, 6°С, 7°С, 8°С, 9°С 10°С, 15°С, 20°С, 25°С, 30°С, 35°С или 40°С.Указанные капсулы могут являться применимыми в биомедицинских применениях, таких как стабильное, цифровое инкапсулирование макромолекул, особенно водных биологических жидкостей, содержащих смесь нуклеиновых кислот или белок, или и то, и другое вместе; доставка лекарственных средств и вакцин; биомолекулярные библиотеки; клинические применения для получения изображений и другое.
[00336] Микрокапсулы могут содержать один или более полинуклеотидов и могут являться устойчивыми к коалесценции, особенно при высоких температурах. Соответственно, реакции ПЦР-амплификации могут происходить при очень высокой плотности (например, число реакций на единицу объема). В некоторых случаях больше чем 100000, 500000, 1000000, 1500000, 2000000, 2500000, 5000000 или 10000000 отдельных реакций могут происходить на мл. В некоторых случаях реакции происходят в отдельно взятой лунке, например, лунке планшета для микротитрования, без перемешивания между реакционными объемами. Микрокапсулы также могут содержать другие компоненты, необходимые для обеспечения осуществления обратной транскрипции, достройки праймеров и/или ПЦР-реакции, например, праймеры, зонды, dNTP, ДНК- или РНК-полимеразы и т.д. Указанные капсулы проявляют устойчивость к коалесценции и флокуляции в широком диапазоне термической и механической обработки.
[00337] В некоторых случаях стадию амплификации проводят с помощью проведения цифровой ПЦР, такой как микрожидкостной цифровой ПЦР или капельной цифровой ПЦР.
[00338] Капли можно создать с использованием микрожидкостных систем или приборов. Используемая в настоящем документе приставка "микро-" (например, как "микроканал" или "микрожидкостный"), как правило, относится к элементам или изделиям, характеризующимся шириной или диаметром, составляющим меньше чем приблизительно 1 мм и меньше чем приблизительно 100 мкм в некоторых случаях. В некоторых случаях элемент или изделие включает в себя канал, через который может протекать жидкость. Кроме того, используемый в настоящем документе "микрожидкостный" относится к прибору, аппарату или системе, которые включают в себя по меньшей мере один микроразмерный канал.
[00339] Микрожидкостные системы и приборы были описаны в разнообразных контекстах, как правило, в контексте анализа в миниатюрной лаборатории (например, клинического анализа). Также были описаны другие применения. Например, международные патентные публикации №№ WO 01/89788; WO 2006/040551; WO 2006/040554; WO 2004/002627; WO 2008/063227; WO 2004/091763; WO 2005/021151; WO 2006/096571; WO 2007/089541; WO 2007/081385 и WO 2008/063227.
[00340] Капля, как правило, включает в себя количество первой жидкости-образца во второй жидкости-носителе. Любую технику, известную в настоящей области техники для образования капель, можно использовать вместе со способами согласно настоящему изобретению. Иллюстративный способ включает протекание потока жидкости-образца, содержащей целевой материал (например, иммунную клетку) так, что он пересекает два противоположных потока протекающей жидкости-носителя. Жидкость-носитель является несмешивающейся с жидкостью-образцом. Пересечение жидкости-образца двумя противоположными потоками протекающей жидкости-носителя приводит в результате к разделению жидкости-образца в индивидуальные капли-образцы, содержащие целевой материал.
[00341] Жидкость-носитель может представлять собой любую жидкость, которая является несмешивающейся с жидкостью-образцом. Иллюстративная жидкость носитель представляет собой масло. Согласно определенным вариантам осуществления жидкость-носитель включает в себя поверхностно-активное вещество.
[00342] Одинаковый способ можно применять для создания индивидуальных капель, которые содержат другие реагенты, такие как реагенты для реакции амплификации, такой как полимеразная цепная реакция (ПЦР) или реакция амплификации не на основе ПЦР, такая как амплификация с множественным вытеснением цепи, или другие способы, известные среднему специалисту в настоящей области техники. Подходящие реагенты для проведения реакций амплификации на основе ПЦР известны средним специалистам в настоящей области техники и включают в себя без ограничения ДНК-полимеразы, прямые и обратные праймеры, дезоксинуклеотидтрифосфаты (dNTP) и один или более буферов.
[00343] Согласно определенным вариантам осуществления жидкостные компартменты образуют путем обеспечения первого отсека для жидкости (например, капли), содержащего целевой материал (например, иммунную клетку и/или твердую подложку, такую как шарик) и второй жидкости (например, как поток жидкости или внутри капель). Первую и вторую жидкости объединяют с образованием капли. Объединение можно осуществлять путем приложения электрического поля к двум жидкостям. Согласно определенным вариантам осуществления вторая жидкость содержит реагенты для проведения реакции амплификации, такой как полимеразная цепная реакция или реакция амплификации.
[00344] Согласно определенным аспектам настоящего изобретения предусмотрен способ получения библиотеки уникальным образом штрих-кодированных последовательностей тяжелой и легкой цепей антитела и/или последовательности альфа и бета цепи TCR и/или последовательности гамма и дельта цепи TCR, включая в себя получение множества нуклеиновокислотных конструктов, в которых каждый конструкт включает в себя уникальный N-мер и функциональный N-мер. Функциональный N-мер может представлять собой случайный N-мер, праймер для ПЦР, универсальный праймер, антитело, липкий конец или любую другую последовательность. Способ может предусматривать получение М наборов числа N жидкостных компартментов, каждый из которых содержит одну или более копий уникального конструкта. Способ может создавать библиотеки штрих-кодов повышенной сложности путем добавления дополнительного конструкта к каждому компартменту в наборе и повторения, что для каждого набора получают N×M компартментов, каждый из которых содержит уникальную пару конструктов. Пары можно гибридизовать или лигировать с получением новых конструктов. В каждом конструкте в библиотеке штрих-кодов каждый уникальный N-мер можно адаптировать для идентификации путем секвенирования, гибридизации зондов, других способов или комбинации способов. Библиотеки капель
[00345] В общем, библиотека капель состоит из некоторого числа элементов библиотеки, которые объединены вместе в единую коллекцию. Библиотеки могут варьировать по сложности от отдельно взятого элемента библиотеки до 1×1015 элементов библиотеки или больше. Каждый элемент библиотеки представляет собой один или более данных компонентов в фиксированной концентрации. Элемент может представлять собой без ограничения клетки, шарики, аминокислоты, белки, полипептиды, нуклеиновые кислоты, полинуклеотиды или низкомолекулярные химические соединения. Элемент может содержать идентификатор, такой как молекулярный штрих-код, штрих-код сосуда или и то, и другое.
[00346] Элемент библиотеки клеток может включать в себя без ограничения гибридомы, В-клетки, Т-клетки, первичные клетки, культивированные клеточные линии, злокачественные клетки, стволовые клетки или любой другой тип клеток. Элементы библиотеки клеток получают путем инкапсулирования некоторого числа клеток от одной до десятков тысяч в отдельные капли. Число инкапсулированных клеток, как правило, получают с помощью статистики Пуассона из численной плотности клеток и объема капли. Тем не менее, в некоторых случаях число отклоняется от статистики Пуассона, как описано в Edd et al., Lab Chip, 8(8):1262-1264, 2008. Скрытый характер клеток обеспечивает возможность получения библиотек в массе со множеством клеточных вариантов, таких как иммунные клетки, каждая из которых производит одно антитело или TCR, при этом все они присутствуют в единой исходной среде и затем эту среду разделяют на отдельные капсулы-капли, которые содержат не больше чем одну клетку. Клетки в пределах индивидуальных капсул-капель затем лизируют, полинуклеотиды тяжелой цепи и легкой цепи и/или полинуклеотиды альфа и бета цепи и/или полинуклеотиды гамма и дельта цепи из лизированных клеток штрих-кодируют с помощью молекулярных штрих-кодов и штрих-кодов сосуда и амплифицируют и затем комбинируют или объединяют с образованием библиотеки, состоящей из элементов библиотеки тяжелой и легкой цепи и/или альфа и бета цепи и/или гамма и дельта цепи.
[00347] Элемент библиотеки на основе шарика содержит один или более шариков и может также содержать другие реагенты, такие как антитела, ферменты или другие белки. В случае, когда все элементы библиотеки содержат различные типы шариков, но одинаковую окружающую их среду, все элементы библиотеки можно получить из одной исходной жидкости или можно обеспечить разнообразие исходных жидкостей. В случае клеточных библиотек, полученных в массе из коллекции вариантов, элементы библиотеки будут получены из разнообразия исходных жидкостей. Желательно иметь точно одну клетку на каплю, при этом желательно, чтобы только несколько капель содержали больше одной клетки, когда начинают со множества клеток. В некоторых случаях отклонения от статистики Пуассона могут быть достигнуты для обеспечения усиленной загрузки капель, с тем чтобы существовало больше капель, содержащих точно одну клетку на каплю, и несколько исключений в виде пустых капель или капель, содержащих больше чем одну клетку.
[00348] Согласно некоторым вариантам осуществления желательно обеспечить точно один штрих-кодированный полинуклеотид сосуда на каплю, при этом желательно, чтобы только несколько капель содержало больше чем один штрих-кодированный полинуклеотид сосуда, когда начинают со множества штрих-кодированного полинуклеотида сосуда. В некоторых случаях отклонения от статистики Пуассона могут быть достигнуты для обеспечения усиленной загрузки капель, с тем чтобы существовало больше капель, содержащих точно один штрих-кодированный полинуклеотид сосуда на каплю, и несколько исключений в виде пустых капель или капель, содержащих больше чем один штрих-кодированный полинуклеотид сосуда.
[00349] Примеры библиотек капель представляют собой коллекции капель, которые характеризуются различным содержимым в диапазоне от шариков, клеток, малых молекул, ДНК, праймеров, антител и штрих-кодированных полинуклеотидов. Диапазон размера капель составляет приблизительно 0,5 мкм - 500 мкм в диаметре, что соответствует приблизительно 1 пл - 1 нл. Тем не менее, капли могут быть не менее 5 мкм и не более 500 мкм. Капли предпочтительно составляют меньше чем 100 мкм, приблизительно 1 мкм - приблизительно 100 мкм в диаметре. Наиболее предпочтительный размер составляет приблизительно 20 - 40 мкм в диаметре (10-100 пл). Предпочтительные исследуемые свойства библиотек капель включают в себя равновесие осмотического давления, однородный размер и диапазоны размеров.
[00350] Капли, содержащиеся в пределах библиотеки капель, предусмотренной настоящим изобретением, предпочтительно являются однородными по размеру. Иными словами, диаметр любой капли в пределах библиотеки будет варьировать меньше чем на 5%, 4%, 3%, 2%, 1% или 0,5% по сравнению с диаметром других капель в пределах той же библиотеки. Однородный размер капель в библиотеке может являться критически важным для поддержания стабильности и целостности капель, а также может являться необходимым для последующего применения капель в пределах библиотеки для различных биологических и химических анализов, описанных в настоящем документе.
[00351] Согласно настоящему изобретению предусмотрена библиотека капель, содержащая множество водных капель в пределах несмешивающейся жидкости, причем каждый капля является предпочтительно по существу однородной по размеру и содержит отличающийся элемент библиотеки. Согласно настоящему изобретению предусмотрен способ образования библиотеки капель, включающий получение отдельно взятой водной жидкости, содержащей различные элементы библиотеки, инкапсулирование каждого элемента библиотеки в водную каплю в пределах несмешивающейся жидкости.
[00352] Согласно определенным вариантам осуществления различные типы элементов (например, клеток или шариков), объединяют в отдельный источник, содержащийся в одной и той же среде. После начального объединения элементы инкапсулируют в каплях для создания библиотеки капель, причем каждая капля с отличающимся типом шарика или клетки представляет собой отличающийся элемент библиотеки. Разведение начального раствора обеспечивает процесс инкапсулирования. Согласно некоторым вариантам осуществления образованные капли будут либо содержать отдельно взятый элемент, либо не будут содержать ничего, т.е. будут пустыми. Согласно другим вариантам осуществления образованные капли будут содержать множественные копии элемента библиотеки. Инкапсулируемые элементы, как правило, представляют собой варианты типа. Согласно одному примеру элементы представляют собой иммунные клетки образца крови, и каждая иммунная клетка инкапсулирована для амплификации нуклеотидов в иммунных клетках и штрихкодирования их в отношении последовательностей антитела.
[00353] Например, в одном типе библиотеки эмульсий существуют элементы библиотеки, которые содержат различные частицы, т.е. клетки или штрих-кодированные полинуклеотиды в различной среде, и их инкапсулируют перед объединением. Согласно одному примеру заданное число элементов библиотеки, т.е. п число различных клеток или штрих-кодированных полинуклеотидов, содержится в пределах различных сред. Каждый из элементов библиотеки отдельно эмульгируют и объединяют, в этот момент каждый из п числа объединенных различных элементов библиотеки комбинируют и объединяют в единый пул. Полученный пул содержит множество капель эмульсии вода-в-масле, каждая из которых содержит различный тип частицы.
[00354] Согласно некоторым вариантам осуществления образованные капли будут либо содержать отдельно взятый элемент библиотеки, либо не будут содержать ничего, т.е. будут пустыми. Согласно другим вариантам осуществления образованные капли будут содержать множественные копии элемента библиотеки. Содержимое шариков следует распределению Пуассона, при котором существует дискретное распределен вероятности, которая выражает вероятность числа событий, происходящих в определенный период времени, если указанные события происходят с известной средней частотой и независимо от времени с момента последнего события. Масла и поверхностно-активные вещества, используемые для создания библиотек, препятствуют обмену содержимым библиотеки между каплями.
Праймеры
[00355] Как правило, одну или более пар праймеров можно использовать в реакции амплификации; один праймер из пары праймеров может представлять собой прямой праймер, и один праймер из пары праймеров может представлять собой обратный праймер.
[00356] В некоторых случаях первую пару праймеров можно использовать в реакции амплификации; один праймер первой пары может представлять собой прямой праймер, комплементарный последовательности первой целевой полинуклеотидной молекулы, и один праймер первой пары может представлять собой обратный праймер, который может являться комплементарным второй последовательности первой целевой полинуклеотидной молекулы, и первый целевой локус может находиться между первой последовательностью и второй последовательностью. Согласно некоторым вариантам осуществления первый целевой локус содержит последовательность VH или Vα или Vγ. Согласно некоторым вариантам осуществления первый целевой локус содержит последовательность AID и/или последовательность АМВ.
[00357] В некоторых случаях вторую пару праймеров можно использовать в реакции амплификации; один праймер второй пары может представлять собой прямой праймер, комплементарный первой последовательности второй целевой полинуклеотидной молекулы, и один праймер второй пары может представлять собой обратный праймер, комплементарный второй последовательности второй целевой полинуклеотидной молекулы, и второй целевой локус может находиться между первой последовательностью и второй последовательностью. Согласно некоторым вариантам осуществления второй целевой локус содержит последовательность VL или Vβ или Vδ.
[00358] В некоторых случаях третью пару праймеров можно использовать в реакции амплификации; один праймер третьей пары может представлять собой прямой праймер, комплементарный первой последовательности третьей целевой полинуклеотидной молекулы, и один праймер третьей пары может представлять собой обратный праймер, комплементарный второй последовательности третьей целевой полинуклеотидной молекулы, и третий целевой локус может находиться между первой последовательностью и второй последовательностью. Согласно некоторым вариантам осуществления третий целевой локус содержит штрих-код, такой как молекулярный штрих-код или штрих-код сосуда.
[00359] Длина прямого праймера и обратного праймера может зависеть от последовательности целевого полинуклеотида и целевого локуса. Например, длину и/или TM прямого праймера и обратного праймера можно оптимизировать. В некоторых случаях праймер может составлять приблизительно, больше чем приблизительно или меньше чем приблизительно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 нуклеотидов в длину. В некоторых случаях праймер составляет приблизительно 15 - приблизительно 20, приблизительно 15 - приблизительно 25, приблизительно 15 - приблизительно 30, приблизительно 15 - приблизительно 40, приблизительно 15 - приблизительно 45, приблизительно 15 - приблизительно 50, приблизительно 15 - приблизительно 55, приблизительно 15 - приблизительно 60, приблизительно 20 - приблизительно 25, приблизительно 20 - приблизительно 30, приблизительно 20 - приблизительно 35, приблизительно 20 - приблизительно 40, приблизительно 20 - приблизительно 45, приблизительно 20 - приблизительно 50, приблизительно 20 - приблизительно 55, или приблизительно 20 - приблизительно 60 нуклеотидов в длину.
[00360] Праймер может представлять собой одноцепочечную ДНК перед связыванием с матричным полинуклеотидом. В некоторых случаях праймер изначально содержит двухцепочечную последовательность. Соответствующая длина праймера может зависеть от предусмотренного применения праймера, но может находиться в диапазоне, составляющем приблизительно 6 - приблизительно 50 нуклеотидов или приблизительно 15 - приблизительно 35 нуклеотидов. Короткие молекулы праймера, как правило, могут требовать более низких температур для формирования достаточно стабильных гибридных комплексов с матрицей. Согласно некоторым вариантам осуществления нет необходимости в том, чтобы праймер отражал точную последовательность матричной нуклеиновой кислоты, но он может являться достаточно комплементарным, чтобы гибридизоваться с матрицей. В некоторых случаях праймер может являться частично двухцепочечным до связывания с матричным полинуклеотидом. Праймер с двухцепочечной последовательностью может содержать петлю «шпилька», составляющую приблизительно, больше чем приблизительно или меньше чем приблизительно 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 оснований. Двухцепочечная часть праймера может составлять приблизительно, больше чем приблизительно, меньше чем приблизительно или по меньшей мере приблизительно 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 пар оснований. Структура подходящих праймеров для амплификации данной целевой последовательности хорошо известна в настоящей области техники.
[00361] Праймеры могут вводить дополнительные признаки, которые обеспечивают возможность обнаружения или иммобилизации праймера, но не изменяют основное свойство праймера (например, действие в качестве точки инициации синтеза ДНК). Например, праймеры могут содержать дополнительную последовательность нуклеиновой кислоты на 5'-конце, которая не гибридизуется с целевой нуклеиновой кислотой, но которая облегчает клонирование или дополнительную амплификацию или секвенирование амплифицированного продукта. Например, дополнительная последовательность может содержать связывающий праймер сайт, такой как сайт связывания универсального праймера. Область праймера, которая является достаточно комплементарной матрице, чтобы гибридизоваться, может называться в настоящем документе область гибридизации.
[00362] В другом случае праймер, используемый в способах и композициях, описанных в настоящем документе, может содержать один или более универсальных нуклеозидов. Неограничивающие примеры универсальных нуклеозидов представляют собой 5-нитроиндол и инозин, как описано в публикациях на выдачу патентов США №№2009/0325169 и 2010/0167353.
[00363] Праймеры можно разработать в соответствии с известными параметрами во избежание вторичных структур и самогибридизации. Различные пары праймеров можно отжигать и подвергать плавлению при приблизительно одинаковых температурах, например, в пределах 1°С, 2°С, 3°С, 4°С, 5°С, 6°С, 7°С, 8°С, 9°С или 10°С от другой пары праймеров. В некоторых случаях больше чем 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 100, 200, 500, 1000, 5000, 10000 или больше праймеров используют изначально. Такие праймеры могут гибридизоваться с целевыми полинуклеотидами, описанными в настоящем документе.
[00364] Праймеры можно получить с помощью разнообразных способов, включая в себя без ограничения клонирование соответствующих последовательностей и прямой химический синтез с использованием способов, хорошо известных в настоящей области техники (Narang et al., Methods Enzymol. 68:90 (1979); Brown et al., Methods Enzymol. 68:109 (1979)). Праймеры также можно получить из коммерческих источников. Праймеры могут характеризоваться идентичной температурой плавления. Праймеры могут характеризоваться неидентичной температурой плавления. Длины праймеров можно увеличить или уменьшить на 5'-конце или 3'-конце для получения праймеров с требуемыми температурами плавления. Один из праймеров в паре праймеров может быть длиннее, чем другой праймер. Длины 3'отжига праймеров, в пределах пары праймеров, могут отличаться. Также, положение отжига каждой пары праймеров можно разработать так, что последовательность и длина пар праймеров дают на выходе требуемую температуру плавления. Уравнение для определения температуры плавления праймеров, меньших чем 25 пар оснований представляет собой правило Уоллеса (TM=2(A+T)+4(G+C)). Компьютерные программы также можно использовать для разработки праймеров. ТМ (температуру плавления или отжига) каждого праймера можно рассчитать с использованием программ пакета программного обеспечения. Температуру отжига праймеров можно пересчитать и увеличить после любого цикла амплификации, включая в себя без ограничения цикл 1, 2, 3, 4, 5, циклы 6-10, циклы 10-15, циклы 15-20, циклы 20-25, циклы 25-30, циклы 30-35 или циклы 35-40. После начальных циклов амплификации 5' половину праймеров можно ввести в продукты из каждого из локусов, представляющих интерес; таким образом, ТМ можно пересчитать на основании обеих последовательностей 5' половины и 3' половины каждого праймера.
[00365] Сайт праймера включает в себя область матрицы, с которой гибридизуется праймер. Согласно некоторым вариантам осуществления праймеры способны действовать как точка инициации управляемого матрицей синтеза нуклеиновой кислоты. Например, праймеры могут инициировать управляемый матрицей синтез нуклеиновой кислоты, когда присутствуют четыре различных нуклеотида и средство или фермент полимеризации, такой как ДНК- или РНК-полимераза или обратная транскриптаза. Пара праймеров включает в себя 2 праймера: первый праймер с 5' вышележащей, относительно хода транскрипции, областью, которая гибридизуется с 5'-концом матричной последовательности, и второй праймер с 3' нижележащей, относительно хода транскрипции, областью, которая гибридизуется с комплементарной цепью 3'-конца матричной последовательности. Набор праймеров включает в себя два или больше праймеров: первый праймер или первое множество праймеров с 5' вышележащей, относительно хода транскрипции, областью, которая гибридизуется с 5'-концом матричной последовательности или множеством матричных последовательностей, и второй праймер или второе множество праймеров с 3' нижележащей, относительно хода транскрипции, областью, которая гибридизуется с комплементарной цепью 3'-конца матричной последовательности или множеством матричных последовательностей. Согласно некоторым вариантам осуществления праймер содержит специфическую в отношении мишени последовательность. Согласно некоторым вариантам осуществления праймер содержит штрих-кодовую последовательность образца. Согласно некоторым вариантам осуществления праймер содержит универсальную праймирующую последовательность. Согласно некоторым вариантам осуществления праймер содержит праймирующую ПЦР последовательность. Согласно некоторым вариантам осуществления праймер содержит праймирующая ПЦР последовательность, используемую для инициации амплификации полинуклеотида. (Dieffenbach, PCR Primer: A Laboratory Manual, 2nd Edition (Cold Spring Harbor Press, New York (2003)). Сайт или последовательность связывания универсального праймера обеспечивает возможность прикрепления универсального праймера к полинуклеотиду и/или ампликону. Универсальные праймеры хорошо известны в настоящей области техники и включают в себя без ограничения -47F (M13F), alfaMF, АОХ3', АОХ5', BGHr, CMV-30, CMV-50, CVMf, LACrmt, lambda gt10F, lambda gt10R, lambda gt11F, lambda gt11R, M13 rev, M13Forward(-20), M13Reverse, male, p10SEQPpQE, pA-120, pet4, pGAP Forward, pGLRVpr3, pGLpr2R, pKLAC14, pQEFS, pQERS, pucU1, pucU2, reversA, seqIREStam, seqIRESzpet, seqori, seqPCR, seqpIRES-, seqpIRES+, seqpSecTag, seqpSecTag+, seqretro+PSI, SP6, T3-prom, T7-prom и T7-termInv. Используемое в настоящем документе прикрепление может относиться к обоим или любому из ковалентных взаимодействий и нековалентных взаимодействий. Прикрепление универсального праймера к сайту связывания универсального праймера можно использовать для амплификации, обнаружения и/или секвенирования полинуклеотида и/или ампликона. Сайт связывания универсального праймера может содержать по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 нуклеотидов или пар оснований. Согласно другому примеру сайт связывания универсального праймера содержит по меньшей мере приблизительно 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 8500, 9000, 9500 или 10000 нуклеотидов или пар оснований. Согласно некоторым вариантам осуществления сайт связывания универсального праймера содержит 1-10, 10-20, 10-30 или 10-100 нуклеотидов или пар оснований. Согласно некоторым вариантам осуществления сайт связывания универсального праймера содержит приблизительно 1-90, 1-80, 1-70, 1-60, 1-50, 1-40, 1-30, 1-20, 1-10, 2-90, 2-80, 2-70, 2-60, 2-50, 2-40, 2-30, 2-20, 2-10, 1-900, 1-800, 1-700, 1-600, 1-500, 1-400, 1-300, 1-200, 1-100, 2-900, 2-800, 2-700, 2-600, 2-500, 2-400, 2-300, 2-200, 2-100, 5-90, 5-80, 5-70, 5-60, 5-50, 5-40, 5-30, 5-20, 5-10, 10-90, 10-80, 10-70, 10-60, 10-50, 10-40, 10-30, 10-20, 10-10, 5-900, 5-800, 5-700, 5-600, 5-500, 5-400, 5-300, 5-200, 5-100, 10-900, 10-800, 10-700, 10-600, 10-500, 10-400, 10-300, 10-200, 10-100, 25-900, 25-800, 25-700, 25-600, 25-500, 25-400, 25-300, 25-200, 25-100, 100-1000, 100-900, 100-800, 100-700, 100-600, 100-500, 100-400, 100-300, 100-200, 200-1000, 200-900, 200-800, 200-700, 200-600, 200-500, 200-400, 200-300, 300-1000, 300-900, 300-800, 300-700, 300-600, 300-500, 300-400, 400-1000, 400-900, 400-800, 400-700, 400-600, 400-500, 500-1000, 500-900, 500-800, 500-700, 500-600, 600-1000, 600-900, 600-800, 600-700, 700-1000, 700-900, 700-800, 800-1000, 800-900 или 900-1000 нуклеотидов или пар оснований.
[00366] Праймеры могут характеризоваться длиной, совместимой с их применением в синтезе продуктов достройки праймеров. Праймер может представлять собой полинуклеотид, который составляет 8-200 нуклеотидов в длину. Длина праймера может зависеть от последовательности матричного полинуклеотида и матричного локуса. Например, длину и/или температуру плавления (ТМ) праймера или набора праймеров можно оптимизировать. В определенном случае праймер может составлять приблизительно, больше чем приблизительно или меньше чем приблизительно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 нуклеотидов в длину. Согласно некоторым вариантам осуществления праймеры составляют приблизительно 8-100 нуклеотидов в длину, например, 10-75, 15-60, 15-40, 18-30, 20-40, 21-50, 22-45, 25-40, 7-9, 12-15, 15-20, 15-25, 15-30, 15-45, 15-50, 15-55, 15-60, 20-25, 20-30, 20-35, 20-45, 20-50, 20-55 или 20-60 нуклеотидов в длину и любую длину между указанными значениями. Согласно некоторым вариантам осуществления праймеры составляют не больше чем приблизительно 10, 12, 15, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 нуклеотидов в длину.
[00367] Как правило, одну или более пар праймеров можно использовать в реакции экспотенциальной амплификации; один праймер пары праймеров может представлять собой прямой праймер, и один праймер пары праймеров может представлять собой обратный праймер. Согласно некоторым вариантам осуществления первую пару праймеров можно использовать в реакции экспоненциальной амплификации; один праймер первой пары может представлять собой прямой праймер, комплементарный последовательности первой матричной полинуклеотидной молекуле, и один праймер первой пары может представлять собой обратный праймер, комплементарный второй последовательности первой матричной полинуклеотидной молекуле, и первый матричный локус может находиться между первой последовательностью и второй последовательностью. Согласно некоторым вариантам осуществления вторую пару праймеров можно использовать в реакции амплификации; один праймер второй пары может представлять собой прямой праймер, комплементарный первой последовательности второй целевой полинуклеотидной молекулы, и один праймер второй пары может представлять собой обратный праймер, комплементарный второй последовательности второй целевой полинуклеотидной молекулы, и второй целевой локус может находиться между первой последовательностью и второй последовательностью. Согласно некоторым вариантам осуществления второй целевой локус содержит последовательность вариабельной области легкой цепи антитела. Согласно некоторым вариантам осуществления третью пару праймеров можно использовать в реакции амплификации; один праймер третьей пары может представлять собой прямой праймер, комплементарный первой последовательности третьей матричной полинуклеотидной молекулы, и один праймер третьей пары может представлять собой обратный праймер, комплементарный второй последовательности третьей матричной полинуклеотидной молекулы, и третий матричный локус может находиться между первой последовательностью и второй последовательностью.
[00368] Один или более праймеров можно отжигать по меньшей мере с частью множества матричных полинуклеотидов. Один или более праймеров можно отжигать с 3'-концом и/или 5'-концом из множества матричных полинуклеотидов. Один или более праймеров можно отжигать с внутренней областью из множества матричных полинуклеотидов. Внутренняя область может составлять по меньшей мере приблизительно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 100, 150, 200, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 650, 700, 750, 800, 850, 900 или 1000 нуклеотидов от 3'-концов или 5'-концов множества матричных полинуклеотидов. Один или более праймеров может содержать фиксированную панель праймеров. Один или более праймеров может содержать по меньшей мере один или более специально созданных праймеров. Один или более праймеров может содержать по меньшей мере один или более контрольных праймеров. Один или более праймеров может содержать по меньшей мере один или более праймеров конститутивных генов. Один или более праймеров может содержать универсальный праймер. Универсальный праймер можно отжигать с сайтом связывания универсального праймера. Согласно некоторым вариантам осуществления один или более специально созданных праймеров отжигаются с SBC, специфической в отношении мишени областью, комплементарным ей цепям или любой их комбинацией. Один или более праймеров может содержать универсальный праймер. Один или более праймеров можно разработать для амплификации или проведения достройки праймера, обратной транскрипции, линейной достройки, неэкспоненциальной амплификации, экспоненциальной амплификации, ПЦР или любого другого способа амплификации одного или более целевых или матричных полинуклеотидов.
[00369] Специфическая в отношении мишени область может содержать по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 100, 150, 200, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 650, 700, 750, 800, 850, 900 или 1000 нуклеотидов или пар оснований. Согласно другому примеру специфическая в отношении мишени область содержит по меньшей мере приблизительно 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 8500, 9000, 9500 или 10000 нуклеотидов или пар оснований. Согласно некоторым вариантам осуществления специфическая в отношении мишени область содержит приблизительно 5-10, 10-15, 10-20, 10-30, 15-30, 10-75, 15-60, 15-40, 18-30, 20-40, 21-50, 22-45, 25-40, 7-9, 12-15, 15-20, 15-25, 15-30, 15-45, 15-50, 15-55, 15-60, 20-25, 20-30, 20-35, 20-45, 20-50, 20-55, 20-60, 2-900, 2-800, 2-700, 2-600, 2-500, 2-400, 2-300, 2-200, 2-100, 25-900, 25-800, 25-700, 25-600, 25-500, 25-400, 25-300, 25-200, 25-100, 100-1000, 100-900, 100-800, 100-700, 100-600, 100-500, 100-400, 100-300, 100-200, 200-1000, 200-900, 200-800, 200-700, 200-600, 200-500, 200-400, 200-300, 300-1000, 300-900, 300-800, 300-700, 300-600, 300-500, 300-400, 400-1000, 400-900, 400-800, 400-700, 400-600, 400-500, 500-1000, 500-900, 500-800, 500-700, 500-600, 600-1000, 600-900, 600-800, 600-700, 700-1000, 700-900, 700-800, 800-1000, 800-900 или 900-1000 нуклеотидов или пар оснований.
[00370] Праймеры можно разработать в соответствии с известными параметрами во избежание вторичных структур и самогибридизации. Согласно некоторым вариантам осуществления различные пары праймеров можно отжигать и подвергать плавлению при приблизительно одинаковых температурах, например, в пределах 1°С, 2°С, 3°С, 4°С, 5°С, 6°С, 7°С, 8°С, 9°С или 10°С от другой пары праймеров. Согласно некоторым вариантам осуществления один или более праймеров во множестве праймеров можно отжигать и подвергать плавлению при приблизительно одинаковых температурах, например, в пределах 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10°С от другого праймера во множестве праймеров. Согласно некоторым вариантам осуществления один или более праймеров во множестве можно отжигать и подвергать плавлению при температурах, отличающихся от другого праймера во множестве праймеров.
[00371] Множество праймеров для одной или более стадий согласно описанным в настоящем документе способам может содержать множество праймеров, содержащее приблизительно, не больше чем приблизительно или по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000, 17000, 18000, 19000, 20000, 30000, 40000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000, 1000000, 50000000, 100000000 различных праймеров. Например, каждый праймер во множестве праймеров может содержать различную специфическую в отношении мишени или матрицы область или последовательность.
Обратная транскрипция
[00372] В некоторых случаях целевые полинуклеотиды получают из РНК с помощью обратной транскрипции. В некоторых случаях целевые полинуклеотиды получают из ДНК с помощью достройки праймера, например, с использованием полимеразы.
[00373] Описанные в настоящем документе способы можно использовать в объединенной обратной транскрипции-ПЦР (обратная транскрипция-ПЦР). Например, обратную транскрипцию и ПЦР можно проводить в двух отдельных стадиях. Сначала кДНК-копию иРНК образца можно синтезировать с использованием или полинуклеотидного dT праймера, специфического в отношении последовательности праймера, универсального праймера, или любого праймера, описанного в настоящем документе.
[00374] Обратную транскрипцию и ПЦР можно проводить в одной реакции в закрытом сосуде. Например, можно использовать три праймера, один для обратной транскрипции и два для ПЦР. Праймер для обратной транскрипции может связываться с иРНК 3' относительно положения ПЦР-ампликона. Хотя это не является необходимым, праймер обратной транскрипции может включать в себя остатки РНК или модифицированные аналоги, такие как 2'-O-метиловые основания РНК, которые не будут формировать субстрат для РНКазы Н при гибридизации с иРНК.
[00375] Температура для проведения реакции обратной транскрипции зависит от используемой обратной транскриптазы. В некоторых случаях используют термостабильную обратную транскриптазу и реакцию обратной транскрипции проводят при приблизительно 37°С - приблизительно 75°С, при приблизительно 37°С - приблизительно 50°С, при приблизительно 37°С - приблизительно 55°С, при приблизительно 37°С - приблизительно 60°С, при приблизительно 55°С - приблизительно 75°С, при приблизительно 55°С - приблизительно 60°С, при приблизительно 37°С или при приблизительно 60°С. В некоторых случаях используют обратную транскриптазу, которая переносит 3 или больше нематричных концевых нуклеотидов на конец транскрибированного продукта.
[00376] Реакцию обратной транскрипции и ПЦР-реакцию, описанные в настоящем документе, можно проводить в различных форматах, известных в настоящей области техники, например, в пробирках, планшетах для микротитрования, микрожидкостных приборах или предпочтительно каплях.
[00377] Реакцию обратной транскрипции можно проводить в объемах в диапазонах от 5 мкл до 100 мкл или от 10 мкл до 20 мкл реакционных объемах. В каплях реакционные объемы могут находиться в диапазоне 1 пл - 100 нл или 10 пл - 1 нл. В некоторых случаях реакцию обратной транскрипции проводят в капле, характеризующейся объемом, который составляет приблизительно или меньше чем 1 нл. В некоторых случаях ПЦР-реакция происходит в капле, характеризующейся реакционным объемом в диапазоне от 1 пл до 100 нл, предпочтительно от 10 пл до 1 нл. В некоторых случаях ПЦР-реакцию проводят в капле, характеризующейся объемом, который составляет приблизительно или меньше чем 1 нл. В некоторых случаях реакцию обратной транскрипции и ПЦР-реакцию проводят в одной и той же капле, характеризующейся реакционным объемом в диапазоне от 1 пл до 100 нл или от 10 пл до 1 нл. В некоторых случаях реакцию обратной транскрипции и ПЦР-реакцию проводят в капле, характеризующейся объемом, который составляет приблизительно или меньше чем 1 нл, или объемом, который составляет приблизительно или меньше чем 1 пл. В некоторых случаях реакцию обратной транскрипции и ПЦР-реакцию проводят в различных каплях. В некоторых случаях реакцию обратной транскрипции и ПЦР-реакцию проводят во множестве капель, каждая из которых характеризуется реакционным объемом в диапазоне от 1 пл до 100 нл или от 10 пл до 1 нл. В некоторых случаях реакцию обратной транскрипции и ПЦР-реакцию проводят во множестве капель, каждая из которых характеризуется объемом, который составляет приблизительно или меньше чем 1 нл.
[00378] В некоторых случаях первая ПЦР-реакция происходит в первой капле, характеризующейся реакционным объемом в диапазоне от 1 пл до 100 нл, предпочтительно от 10 пл до 1 нл, и вторая ПЦР-реакция происходит во второй капле, характеризующейся реакционным объемом в диапазоне от 1 пл до 100 нл, предпочтительно от 10 пл до 1 нл. В некоторых случаях первая ПЦР-реакция происходит в первой капле, характеризующейся объемом, который составляет приблизительно или меньше чем 1 нл, и вторая ПЦР-реакция происходит во второй капле, характеризующейся объемом, который составляет приблизительно или меньше чем 1 нл.
[00379] В некоторых случаях первую ПЦР-реакцию и вторую ПЦР-реакцию проводят во множестве капель, каждая из которых характеризуется реакционным объемом в диапазоне от 1 пл до 100 нл или от 10 пл до 1 нл. В некоторых случаях первую ПЦР-реакцию и вторую ПЦР-реакцию проводят во множестве капель, каждая из которых характеризуется объемом, который составляет приблизительно или меньше чем 1 нл.
[00380] Целевые полинуклеотиды, такие как РНК, можно обратно транскрибировать в кДНК с использованием одного или более праймеров обратной транскрипции. Один или более праймеров обратной транскрипции могут содержать область, комплементарную области РНК, такой как константная область (например, константная область тяжелой или легкой цепи или поли-А хвост иРНК). Согласно некоторым вариантам осуществления праймеры обратной транскрипции могут содержать первый праймер обратной транскрипции с областью, комплементарной константной области первой РНК, и второй праймер обратной транскрипции с областью, комплементарной константной области второй РНК. Согласно некоторым вариантам осуществления праймеры обратной транскрипции могут содержать первый праймер обратной транскрипции с областью, комплементарной константной области первой РНК, и один или более праймеров обратной транскрипции с областью, комплементарной константной области одной или более РНК, соответственно.
[00381] Согласно некоторым вариантам осуществления праймеры обратной транскрипции не содержат штрих-код.
[00382] Праймеры обратной транскрипции могут дополнительно содержать область, которая не является комплементарной области РНК. Согласно некоторым вариантам осуществления область, которая не является комплементарной области РНК, находится 5' относительно области праймеров, которая является комплементарной РНК. Согласно некоторым вариантам осуществления область, которая не является комплементарной области РНК, находится 3' относительно области праймеров, которая является комплементарной РНК. Согласно некоторым вариантам осуществления область, которая не является комплементарной области РНК, представляет собой 5' липкую область. Согласно некоторым вариантам осуществления область, которая не является комплементарной области РНК, содержит праймирующий сайт для реакции амплификации и/или секвенирования. С использованием одного или более праймеров, описанных в настоящем документе, молекулы РНК обратно транскрибируют с использованием подходящих реагентов, известных в настоящей области техники.
[00383] После проведения реакций обратной транскрипции молекул РНК полученные молекулы кДНК можно штрих-кодировать с помощью молекулярного штрих-кода и штрих-кода сосуда и амплифицировать с помощью одной или более ПЦР-реакций, таких как первый и/или вторая ПЦР-реакция. В первой и/или второй ПЦР-реакции можно использовать пару праймеров или множество пар праймеров. В первой и/или второй ПЦР-реакции можно использовать множество прямых/обратных праймеров и обратный праймер. В первой и/или второй ПЦР-реакции можно использовать множество прямых/обратных праймеров и прямой праймер. Первый и/или второй праймер из множества прямых/обратных праймеров может представлять собой прямой/обратный праймер, содержащий область, комплементарную молекулам кДНК или штрих-кодированным молекулам кДНК. Первый и/или второй праймер из множества прямых/обратных праймеров может представлять собой прямой/обратный праймер, содержащий область, комплементарную штрих-кодированным молекулам кДНК.
[00384] Согласно некоторым вариантам осуществления множество прямых/обратных праймеров содержит один или более прямых/обратных праймеров, причем каждый из прямых/обратных праймеров во множестве прямых/обратных праймеров содержит область, комплементарную одной или более расположенным выше или ниже, относительно хода транскрипции, областям относительно V-сегмента кДНК или штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит прямой/обратный праймер, содержащий область, комплементарную расположенной выше или ниже, относительно хода транскрипции, области относительно V-сегмента кДНК или штрих-кодированных кДНК и один или более других прямых/обратных праймеров, содержащих область, комплементарную одной или более другим расположенным выше или ниже, относительно хода транскрипции, областям относительно V-сегмента кДНК или штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймер, содержащий область, комплементарную первой и/или второй расположенной выше или ниже, относительно хода транскрипции, области относительно V-сегмента кДНК или штрих-кодированных кДНК, и второй прямой/обратный праймер, содержащий область, комплементарную второй расположенной выше или ниже, относительно хода транскрипции, области относительно V-сегмента кДНК или штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймер, содержащий область, комплементарную первой и/или второй расположенной выше или ниже, относительно хода транскрипции, области относительно V-сегмента кДНК или штрих-кодированных кДНК, второй прямой/обратный праймер, содержащий область, комплементарную второй расположенной выше или ниже, относительно хода транскрипции, области относительно V-сегмента кДНК или штрих-кодированных кДНК, и третий прямой/обратный праймер, содержащий область, комплементарную третьей расположенной выше или ниже, относительно хода транскрипции, области относительно V-сегмента кДНК или штрих-кодированных кДНК и т.д. Праймеры во множестве прямых/обратных праймеров можно использовать для отжига со всеми возможными расположенными выше или ниже, относительно хода транскрипции, областями всех V-сегментов, экспрессируемых клетками, такими как иммунные В-клетки или Т-клетки, в образце.
[00385] Согласно некоторым вариантам осуществления множество прямых/обратных праймеров содержит один или более прямых/обратных праймеров, причем каждый из прямых/обратных праймеров во множестве прямых/обратных праймеров содержит область, комплементарную одной или более расположенным выше или ниже, относительно хода транскрипции, областям относительно С-сегмента кДНК или штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит прямой/обратный праймер, содержащий область, комплементарную расположенной выше или ниже, относительно хода транскрипции, области относительно С-сегмента кДНК или штрих-кодированных кДНК, и один или более других прямых/обратных праймеров, содержащих область, комплементарную одной или более другим расположенным выше или ниже, относительно хода транскрипции, областям относительно С-сегмента кДНК или штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймер, содержащий область, комплементарную первой и/или второй расположенной выше или ниже, относительно хода транскрипции, области относительно С-сегмента кДНК или штрих-кодированных кДНК, и второй прямой/обратный праймер, содержащий область, комплементарную второй расположенной выше или ниже, относительно хода транскрипции, области относительно С-сегмента кДНК или штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймер, содержащий область, комплементарную первой и/или второй расположенной выше или ниже, относительно хода транскрипции, области относительно С-сегмента кДНК или штрих-кодированных кДНК, второй прямой/обратный праймер, содержащий область, комплементарную второй расположенной выше или ниже, относительно хода транскрипции, области относительно С-сегмента кДНК или штрих-кодированных кДНК, и третий прямой/обратный праймер, содержащий область, комплементарную третьей расположенной выше или ниже, относительно хода транскрипции, области относительно С-сегмента кДНК или штрих-кодированных кДНК и т.д. Праймеры во множестве прямых/обратных праймеров можно использовать для отжига со всеми возможными расположенными выше или ниже, относительно хода транскрипции, областями всех С-сегментов, экспрессируемых клетками, такими как иммунные В-клетки или Т-клетки, в образце.
[00386] Согласно некоторым вариантам осуществления множество прямых/обратных праймеров содержит один или более прямых/обратных праймеров, причем каждый из прямых/обратных праймеров во множестве прямых/обратных праймеров содержит область, комплементарную одной или более расположенным выше или ниже, относительно хода транскрипции, областям относительно молекулярного штрих-кода штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит прямой/обратный праймер, содержащий область, комплементарную расположенной выше или ниже, относительно хода транскрипции, области относительно молекулярного штрих-кода штрих-кодированных кДНК, и один или более других прямых/обратных праймеров, содержащих область, комплементарную одной или более другим расположенным выше или ниже, относительно хода транскрипции, областям относительно молекулярного штрих-кода штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймер, содержащий область, комплементарную первой и/или второй расположенной выше или ниже, относительно хода транскрипции, области относительно молекулярного штрих-кода штрих-кодированных кДНК, и второй прямой/обратный праймер, содержащий область, комплементарную второй расположенной выше или ниже, относительно хода транскрипции, области относительно молекулярного штрих-кода штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймер, содержащий область, комплементарную первой и/или второй расположенной выше или ниже, относительно хода транскрипции, области относительно молекулярного штрих-кода штрих-кодированных кДНК, второй прямой/обратный праймер, содержащий область, комплементарную второй расположенной выше или ниже, относительно хода транскрипции, области относительно молекулярного штрих-кода штрих-кодированных кДНК, и третий прямой/обратный праймер, содержащий область, комплементарную третьей расположенной выше или ниже, относительно хода транскрипции, области относительно молекулярного штрих-кода штрих-кодированных кДНК и т.д. Множество прямых/обратных праймеров можно использовать для отжига со всеми возможными расположенными выше и ниже, относительно хода транскрипции, областями всех молекулярных штрих-кодов, экспрессируемых клетками, такими как иммунные В-клетки или Т-клетки, в образце.
[00387] Согласно некоторым вариантам осуществления множество прямых/обратных праймеров содержит один или более прямых/обратных праймеров, причем каждый из прямых/обратных праймеров во множестве прямых/обратных праймеров содержит область, комплементарную одной или более расположенным выше или ниже, относительно хода транскрипции, областям относительно штрих-кода сосуда штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит прямой/обратный праймер, содержащий область, комплементарную расположенной выше или ниже, относительно хода транскрипции, области относительно штрих-кода сосуда штрих-кодированных кДНК, и один или более других прямых/обратных праймеров, содержащих область, комплементарную одной или более другим расположенным выше или ниже, относительно хода транскрипции, областям относительно штрих-кода сосуда штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймер, содержащий область, комплементарную первой и/или второй расположенной выше или ниже, относительно хода транскрипции, области относительно штрих-кода сосуда штрих-кодированных кДНК, и второй прямой/обратный праймер, содержащий область, комплементарную второй расположенной выше или ниже, относительно хода транскрипции, области относительно штрих-кода сосуда штрих-кодированных кДНК. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймер, содержащий область, комплементарную первой и/или второй расположенной выше или ниже, относительно хода транскрипции, области относительно штрих-кода сосуда штрих-кодированных кДНК, второй прямой/обратный праймер, содержащий область, комплементарную второй расположенной выше или ниже, относительно хода транскрипции, области относительно штрих-кода сосуда штрих-кодированных кДНК, и третий прямой/обратный праймер, содержащий область, комплементарную третьей расположенной выше или ниже, относительно хода транскрипции, области относительно штрих-кода сосуда штрих-кодированных кДНК и т.д. Праймеры во множестве прямых/обратных праймеров можно использовать для отжига со всеми возможными расположенными выше и ниже, относительно хода транскрипции, областями всех штрих-кодов сосуда, экспрессируемых клетками, такими как иммунные В-клетки или Т-клетки, в образце.
[00388] Прямой/обратный праймеры во множестве прямых/обратных праймеров дополнительно содержат область, которая не является комплементарной области РНК. Согласно некоторым вариантам осуществления область, которая не является комплементарной области РНК, расположена 5' относительно области прямого/обратного праймеров, которая является комплементарной РНК (т.е. расположенные выше или ниже, относительно хода транскрипции, области V-сегмента). Согласно некоторым вариантам осуществления область, которая не является комплементарной области РНК, расположена 3' относительно области прямого/обратного праймеров, которая является комплементарной РНК. Согласно некоторым вариантам осуществления область, которая не является комплементарной области РНК, представляет собой 5' липкую область. Согласно некоторым вариантам осуществления область, которая не является комплементарной области РНК, содержит праймирующий сайт для реакции амплификации и/или второй реакции секвенирования. Согласно некоторым вариантам осуществления область, которая не является комплементарной области РНК, содержит праймирующий сайт для реакции амплификации и/или третьей реакции секвенирования. Согласно некоторым вариантам осуществления область, которая не является комплементарной области РНК, содержит праймирующий сайт для второй и третьей реакции секвенирования. Согласно некоторым вариантам осуществления последовательности праймирующего сайта для второй и третьей реакции секвенирования являются одинаковыми. С использованием одного или более прямых/обратных праймеров и обратного праймера, как описано в настоящем документе, молекулы кДНК амплифицируют с использованием подходящих реагентов, известных в настоящей области техники. Согласно некоторым вариантам осуществления область является комплементарной области РНК, такой как константная область или поли-А хвост иРНК.
[00389] Согласно некоторым вариантам осуществления множество прямых/обратных праймеров содержит один или более прямых/обратных праймеров, причем каждый из прямых/обратных праймеров во множестве прямых/обратных праймеров содержит область, комплементарную одной или более расположенным выше или ниже, относительно хода транскрипции, областям относительно штрих-кода сосуда штрих-кодированных олигонуклеотидов конъюгатов аффинная часть-олигонуклеотид. Согласно некоторым вариантам осуществления множество прямых/обратных праймеров содержит один или более прямых/обратных праймеров, причем каждый из прямых/обратных праймеров во множестве прямых/обратных праймеров содержит область, комплементарную одной или более расположенным выше или ниже, относительно хода транскрипции, областям относительно штрих-кодированных в отношении AID олигонуклеотидов конъюгатов аффинная часть-олигонуклеотид. Согласно некоторым вариантам осуществления множество прямых/обратных праймеров содержит один или более прямых/обратных праймеров, причем каждый из прямых/обратных праймеров во множестве прямых/обратных праймеров содержит область, комплементарную одной или более расположенным выше или ниже, относительно хода транскрипции, областям относительно штрих-кодированных в отношении АМВ олигонуклеотидов конъюгатов аффинная часть-олигонуклеотид. Например, множество прямых/обратных праймеров содержит прямой/обратный праймер, содержащий область, комплементарную расположенной выше или ниже, относительно хода транскрипции, области относительно штрих-кода сосуда, штрих-кодированных в отношении AID и/или АМВ олигонуклеотидов конъюгатов аффинная часть-олигонуклеотид, и один или более других прямых/обратных праймеров, содержащих область, комплементарную одной или более другим расположенным выше или ниже, относительно хода транскрипции, областям относительно штрих-кода сосуда, штрих-кодированных в отношении AID и/или АМВ олигонуклеотидов конъюгатов аффинная часть-олигонуклеотид. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймер, содержащий область, комплементарную первой и/или второй расположенной выше или ниже, относительно хода транскрипции, области относительно штрих-кода сосуда, штрих-кодированных в отношении AID и/или АМВ олигонуклеотидов конъюгатов аффинная часть-олигонуклеотид, и второй прямой/обратный праймер, содержащий область, комплементарную второй расположенной выше или ниже, относительно хода транскрипции, области относительно штрих-кода сосуда, штрих-кодированных в отношении AID и/или АМВ олигонуклеотидов конъюгатов аффинная часть-олигонуклеотид. Например, множество прямых/обратных праймеров содержит первый и/или второй прямой/обратный праймер, содержащий область, комплементарную первой и/или второй расположенной выше или ниже, относительно хода транскрипции, области относительно штрих-кода сосуда, штрих-кодированных в отношении AID и/или АМВ олигонуклеотидов конъюгатов аффинная часть-олигонуклеотид, второй прямой/обратный праймер, содержащий область, комплементарную второй расположенной выше или ниже, относительно хода транскрипции, области относительно штрих-кода сосуда, штрих-кодированных в отношении AID и/или АМВ олигонуклеотидов конъюгатов аффинная часть-олигонуклеотид, и третий прямой/обратный праймер, содержащий область, комплементарную третьей расположенной выше или ниже, относительно хода транскрипции, области относительно штрих-кода сосуда штрих-кодированных в отношении AID и/или АМВ олигонуклеотидов конъюгатов аффинная часть-олигонуклеотид и т.д.
Амплификация
[00390] После добавления штрих-кода сосуда к целевому полинуклеотиду целевой полинуклеотид можно амплифицировать. Например, после добавления штрих-кода сосуда к олигонуклеотиду конъюгата аффинная часть-олигонуклеотид олигонуклеотид можно амплифицировать. Например, после добавления штрих-кода сосуда к полинуклеотиду клетки штрих-кодированный относительно сосуда полинуклеотид клетки можно амплифицировать.
[00391] Реакция амплификации может содержать одну или более добавок. В некоторых случаях одна или более добавок представляют собой следующее: диметилсульфоксид (DMSO), глицерин, бетаин (моно)гидрат (N,N,N-триметилглицин=[карбокси-метил]триметиламмоний), трегалоза, 7-деаза-2'-дезоксигуанозинтрифосфат (dC7GTP или 7-деаза-2'-dGTP), BSA (бычий сывороточный альбумин), формамид (метанамид), тетраметиламмонийхлорид (ТМАС), другие производные тетраалкиламмония (например, тетраэтиламмонийхлорид (ТЕА-Cl) и тетрапропиламмонийхлорид (ТРгА-Cl), неионный детергент (например, Triton Х-100, Tween 20, Nonidet Р-40 (NP-40)) или PREXCEL-Q. В некоторых случаях реакция амплификации содержит 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных добавок. В других случаях реакция амплификации содержит по меньшей мере 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных добавок.
[00392] Реакции термоциклирования можно проводить на образцах, содержащихся в реакционных объемах (например, каплях). Капли могут являться полидисперсными или предпочтительно монодисперсными, образованными посредством перемешивания, обработки ультразвуком или микрожидкостным способом через Т-канальное соединение или другие средства, известные специалистам в настоящей области техники. Плотности могут превышать 20000 капель/40 мкл (1 нл капли), 200000 капель/40 мкл (100 пл капли). Капли могут оставаться интактными во время термоциклирования. Капли могут оставаться интактными во время термоциклирования при плотностях, составляющих больше чем приблизительно 10000 капель/мкл, 100000 капель/мкл, 200000 капель/мкл, 300000 капель/мкл, 400000 капель/мкл, 500000 капель/мкл, 600000 капель/мкл, 700000 капель/мкл, 800000 капель/мкл, 900000 капель/мкл или 1000000 капель/мкл. В других случаях две или больше капли не коалесцируют во время термоциклирования. В других случаях больше чем 100 или больше чем 1000 капель не коалесцируют во время термоциклирования.
[00393] Любую ДНК-полимеразу, которая катализирует достройку праймера, можно использовать, включая в себя без ограничения ДНК-полимеразу Е. coli, фрагмент Кленова ДНК-полимеразы 1 Е. coli, ДНК-полимеразу Т7, ДНК-полимеразу Т4, полимеразу Taq, ДНК-полимеразу Pfu, ДНК-полимеразу Vent, бактериофаг 29, REDTaq™, геномную ДНК-полимеразу или секвеназу. В некоторых случаях используют термостабильную ДНК-полимеразу. Также можно проводить ПЦР с горячим стартом, при которой реакцию нагревают до 95°С в течение двух минут перед добавлением полимеразы или полимеразу могут оставлять неактивной до первой стадии нагревания в цикле 1. ПЦР с горячим стартом можно использовать для минимизации неспецифической амплификации. Любое число циклов ПЦР можно использовать для амплификации ДНК, например, приблизительно, больше чем приблизительно или меньше чем приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 или 45 циклов. Число циклов амплификации может составлять приблизительно 1-45, 10-45, 20-45, 30-45, 35-45, 10-40, 10-30, 10-25, 10-20, 10-15, 20-35, 25-35, 30-35 или 35-40.
[00394] Амплификацию целевых нуклеиновых кислот можно проводить с помощью любых средств, известных в настоящей области техники. Целевые нуклеиновые кислоты можно амплифицировать с помощью полимеразной цепной реакции (ПЦР) или изотермической амплификации ДНК. Примеры техник ПЦР, которые можно использовать, включают в себя без ограничения следующее: количественная ПЦР, количественная флуоресцентная ПЦР (КФ-ПЦР), мультиплексная флуоресцентная ПЦР (МФ-ПЦР), ПЦР в режиме реального времени (ПЦР с обратной транскрипцией), ПЦР отдельно взятой клетки, ПЦР полиморфизма длин рестрикционных фрагментов (ПЦР-ПДРФ), ПЦР-ПДРФ-ПЦР с обратной транскрипцией-ПДРФ, ПЦР с горячим стартом, вложенная ПЦР, in situ полони-ПЦР, in situ амплификация по типу катящегося колеса (RCA), цифровая ПЦР (цПЦР), капельная цифровая ПЦР (кцПЦР), мостиковая ПЦР, пиколитровая ПЦР и эмульсионная ПЦР. Другие подходящие способы амплификации включают в себя лигазную цепную реакцию (ЛЦР), транскрипционную амплификацию, ПЦР молекулярного инвертируемого зонда (MIP), самоподдерживающаяся репликация последовательности, селективная амплификация целевых полинуклеотидных последовательностей, праймированная консенсусной последовательностью полимеразная цепная реакция (СР-ПЦР), произвольно праймированная полимеразная цепная реакция (АР-ПЦР), праймированная вырожденным полинуклеотидом ПЦР (DOP-ПЦР) и амплификация последовательности на основе нуклеиновой кислоты (NABSA). Другие способы амплификации, которые можно использовать в настоящем документе, включают в себя способы, описанные в патентах США №№5242794; 5494810; 4988617 и 6582938, а также включают в себя опосредованную Q бета репликазой РНК-амплификацию. Амплификация может представлять собой изотермическую амплификацию, например, изотермическую линейную амплификацию.
[00395] Согласно некоторым вариантам осуществления амплификация не происходит на твердой подложке. Согласно некоторым вариантам осуществления амплификация не происходит на твердой подложке в капле. Согласно некоторым вариантам осуществления амплификация происходит на твердой подложке, когда амплификация происходит не в капле.
Секвенирование
[00396] После проведения одного или более способов или стадий способа, описанных в настоящем документе, созданную библиотеку полинуклеотидов можно секвенировать.
[00397] Секвенирование можно проводить с помощью любого способа секвенирования, известного в настоящей области техники. Согласно некоторым вариантам осуществления секвенирование можно проводить с высокой производительностью. Подходящие технологии секвенирования нового поколения включают в себя платформу 454 Life Sciences (Roche, Branford, CT) (Margulies et al., Nature, 437, 376-380 (2005)); анализатор генома lllumina Genome Analyzer, анализ метилирования GoldenGate Methylation Assay или анализы метилирования Infinium Methylation Assay, т.е. Infinium HumanMethylation 27K BeadArray или матрица метилирования VeraCode GoldenGate methylation array (lllumina, San Diego, CA; Bibkova et al, Genome Res. 16, 383-393 (2006); и патенты США №№6306597, 7598035, 7232656) или система секвенирования ДНК путем лигирования, SOLiD System (Applied Biosystems/Life Technologies; патенты США №№6797470, 7083917, 7166434, 7320865, 7332285, 7364858 и 7429453); или технология одномолекулярного секвенирования ДНК Helicos True Single Molecule DNA sequencing technology (Harris et al., Science, 320, 106-109 (2008); и патенты США №№7037687, 7645596, 7169560 и 7769400), технология одномолекулярная технология в режиме реального времени (SMRTTm) от Pacific Biosciences и секвенирование (Soni et al., Clin. Chem. 53, 1996-2001 (2007)). Указанные системы обеспечивают возможность мультиплексированного параллельного секвенирования многих полинуклеотидов, выделенных из образца (Dear, Brief Funct. Genomic Proteomic, 1(4), 397-416 (2003) и McCaughan et al., J. Pathol., 220, 297-306 (2010)). Согласно некоторым вариантам осуществления полинуклеотиды секвенируют с помощью секвенирования путем лигирования модифицированных красителем зондов, пиросеквенирования или одномолекулярного секвенирования. Определение последовательности полинуклеотида можно проводить с помощью способов секвенирования, таких как одномолекулярное секвенирование Helioscope, секвенирование ДНК Nanopore, Lynx Therapeutics' Massively Parallel Signature Sequencing (MPSS), 454 пиросеквенирование, одномолекулярное секвенирование в режиме реального времени (RNAP), секвенирование Illumina (Solexa), секвенирование SOLiD, Ion Torrent™, ионное пролупроводниковое секвенирование, одномолекулярное секвенирование SMRT™, полони-секвенирование, секвенирование ДНК на наносферах и подход VisiGen Biotechnologies. Альтернативно определение последовательности полинуклеотидов может использовать платформы секвенирования, включая в себя без ограничения анализатор генома Genome Analyzer Их, HiSeq и MiSeq, предлагаемые Illumina, одномолекулярная технология в режиме реального времени Single Molecule Real Time (SMRT™), такая как система PacBio RS, предлагаемая Pacific Biosciences (California) и секвенатор Solexa Sequencer, технология True Single Molecule Sequencing (tSMS™), такая как секвенатор HeliScope™ Sequencer, предлагаемый Helicos Inc. (Cambridge, MA). Секвенирование может включать в себя секвенирование MiSeq. Секвенирование может включать в себя секвенирование HiSeq. Согласно некоторым вариантам осуществления определение последовательностей полинуклеотида включает секвенирование спаренных концов, нанопоровое секвенирование, высокопроизводительное секвенирование, секвенирование методом дробовика, секвенирование по технологии красителя-терминатора, многопраймерное секвенирование ДНК, «блуждающий» праймер, дидезокси-метод секвенирования по Сэнгеру, секвенирование по Максиму-Гилберту, пиросеквенирование, действительно одномолекулярное секвенирование или любую их комбинацию. Альтернативно последовательность полинуклеотида можно определить с помощью электронной микроскопии или матрицы химически чувствительного полевого транзистора (chemFET).
[00398] Способ может дополнительно предусматривать секвенирование одного или более полинуклеотидов в библиотеке. Способ может дополнительно предусматривать выравнивание одной или более полинуклеотидных последовательностей, прочтений последовательностей, последовательностей ампликона или последовательностей набора ампликонов в библиотеке друг с другом.
[00399] Выравнивание может включать в себя сравнение исследуемой последовательности, такой как прочтение последовательности, с одной или более другими исследуемыми последовательностями, эталонными последовательностями или их комбинацией. Согласно некоторым вариантам осуществления выравнивание можно использовать для определения консенсусной последовательности из множества последовательностей или выровненных последовательностей. Согласно некоторым вариантам осуществления выравнивание включает в себя определение консенсусной последовательности из множества последовательностей, каждая из которых содержит идентичный молекулярный штрих-код или штрих-код сосуда. Согласно некоторым вариантам осуществления длина последовательности, выровненной для целей сравнения, составляет по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95% от длины эталонной последовательности. Фактическое сравнение двух или больше последовательностей можно осуществить с помощью хорошо известных способов, например, с использованием математического алгоритма. Неограничивающий пример такого математического алгоритма описан в Karlin, S. и Altschul, S., Proc. Natl. Acad. Sci. USA, 90-5873-5877 (1993). Такой алгоритм встроен в программы NBLAST и XBLAST (версия 2.0), как описано в Altschul, S. et al., Nucleic Acids Res., 25:3389-3402 (1997). При использовании программ BLAST и Gapped BLAST можно использовать любые релевантные параметры соответственных программ (например, NBLAST). Например, параметры для сравнения последовательностей можно установить на балл=100, длина слова=12 или их можно изменять (например, W=5 или W=20). Другие примеры включают в себя алгоритм Myers и Miller, CABIOS (1989), ADVANCE, ADAM, BLAT и FASTA. Согласно некоторым вариантам осуществления выраженную в процентах идентичность между двумя аминокислотными последовательностями можно определить с использованием, например, программы GAP в пакете программного обеспечения GCG (Accelrys, Cambridge, UK).
[00400] Секвенирование может включать в себя секвенирование по меньшей мере приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или больше нуклеотидов или пар оснований полинуклеотидов. Согласно некоторым вариантам осуществления секвенирование содержит секвенирование по меньшей мере приблизительно 200, 300, 400, 500, 600, 700, 800, 900, 1000 или больше нуклеотидов или пар оснований полинуклеотидов. В других случаях секвенирование включает в себя секвенирование по меньшей мере приблизительно 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000 или больше нуклеотидов или пар оснований полинуклеотидов.
[00401] Секвенирование может содержать по меньшей мере приблизительно 200, 300, 400, 500, 600, 700, 800, 900, 1000 или больше прочтений секвенирования за одну серию. Используемый в настоящем документе термин «прочтение последовательности» содержит последовательность нуклеотидов, определенную из последовательности или потока данных, образованного с помощью техники секвенирования. Согласно некоторым вариантам осуществления секвенирование включает в себя секвенирование по меньшей мере приблизительно 1500, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000 или больше прочтений секвенирования за одну серию. Секвенирование может содержать больше чем, меньше чем или равно приблизительно 1000000000 прочтений секвенирования за одну серию. Секвенирование может содержать больше чем, меньше чем или равно приблизительно 200000000 прочтений за одну серию. Ферменты
[00402] Способы и наборы, раскрытые в настоящем документе, могут содержать один или более ферментов. Примеры ферменты включают в себя без ограничения лигазы, обратные транскриптазы, полимеразы и рестрикционные нуклеазы.
[00403] Согласно некоторым вариантам осуществления прикрепление адаптера к полинуклеотидам включает применение одной или более лигаз. Примеры лигаз включают в себя без ограничения ДНК-лигазы, такие как ДНК-лигаза I, ДНК-лигаза III, ДНК-лигаза IV и ДНК-лигаза Т4, и РНК лигазы, такие как РНК-лигаза I Т4 и РНК-лигаза II Т4.
[00404] Способы и наборы, раскрытые в настоящем документе, могут дополнительно предусматривать применение одной или более обратных транскриптаз. Согласно некоторым вариантам осуществления обратная транскриптаза представляет собой обратную транскриптазу HIV-1 (вирус иммунодефицита человека), обратную транскриптазу M-MLV (вирус мышиного лейкоза Молони), обратную транскриптазу AMV (вирус миелобластоза птиц) и теломеразную обратную транскриптазу. Согласно некоторым вариантам осуществления обратная транскриптаза представляет собой обратную транскриптазу M-MLV.
[00405] Согласно некоторым вариантам осуществления способы и наборы, раскрытые в настоящем документе, предусматривают применение одной или более протеаз.
[00406] Согласно некоторым вариантам осуществления способы и наборы, раскрытые в настоящем документе, предусматривают применение одной или более полимераз. Примеры полимераз включают в себя без ограничения ДНК-полимеразы и РНК-полимеразы. Согласно некоторым вариантам осуществления ДНК-полимераза представляет собой ДНК-полимеразу I, ДНК-полимеразу II, холофермент ДНК-полимеразы III и ДНК-полимеразу IV. Коммерчески доступные ДНК-полимеразы включают в себя без ограничения Bst 2.0 ДНК-полимеразу, Bst 2.0 WarmStart™ ДНК-полимеразу, Bst ДНК-полимеразу, Sulfolobus ДНК-полимеразу IV, Taq ДНК-полимеразу, 9°N™m ДНК-полимеразу, Deep VentR™ (экзо-) ДНК-полимеразу, Deep VentR™ ДНК-полимеразу, Hemo KlenTaq™, LongAmp® Taq ДНК-полимеразу, OneTaq® ДНК полимеразу, Phusion® ДНК-полимеразу, Q5™ ДНК-полимеразу с высокой точностью, Therminator™ у ДНК-полимеразу, Therminator™ ДНК-полимеразу, Therminator™ II ДНК-полимеразу, Therminator™ III ДНК-полимеразу, VentR® ДНК-полимеразу, VentR® (экзо-) ДНК-полимеразу, Bsu ДНК-полимеразу, phi29 ДНК-полимеразу, Т4 ДНК-полимеразу, Т7 ДНК-полимеразу, концевую трансферазу, Titanium® Taq полимеразу, КАРА Taq ДНК-полимеразу и КАРА Taq ДНК-полимеразу с горячим стартом.
[00407] Согласно некоторым вариантам осуществления полимераза представляет собой РНК-полимеразы, такие как РНК-полимераза I, РНК-полимераза II, РНК-полимераза III, поли(А)-полимераза Е. coli, РНК-полимераза phi6 (RdRP), поли(U)-полимераза, РНК-полимераза SP6 и РНК-полимераза Т7.
Дополнительные реагенты
[00408] Способы и наборы, раскрытые в настоящем документе, могут предусматривать применение одного или более реагентов. Примеры реагентов включают в себя без ограничения реагенты для ПЦР, реагенты для лигирования, реагенты для обратной транскрипции, реагенты-фермент, реагенты для гибридизации, реагенты для получения образцов, реагенты для аффинного захвата, твердые подложки, такие как шарики, и реагенты для очистки и/или выделения нуклеиновых кислот.
[00409] Согласно другим вариантам осуществления способы, наборы и композиции, раскрытые в настоящем документе, могут содержать подложку. Согласно некоторым вариантам осуществления способы, наборы и композиции, раскрытые в настоящем документе, не содержат подложку. Как правило, твердая подложка содержит один или более материалов, содержащих один или более жестких или полужестких поверхностей. Согласно некоторым вариантам осуществления подложка представляет собой нетвердую подложку. Подложка или субстрат может содержать мембрану, бумагу, пластик, покрытую оболочкой поверхность, плоскую поверхность, стекло, предметное стекло, чип или любую их комбинацию. Согласно некоторым вариантам осуществления одна или более поверхностей подложки являются по существу плоскими, хотя согласно некоторым вариантам осуществления может быть желательным физически отделить области синтеза для различных соединений, например, с помощью лунок, приподнятых участков, штифтов, вытравленных канавок или тому подобного. Согласно некоторым вариантам осуществления твердые подложки содержат шарики, смолы, гели, микросферы или другие геометрические конфигурации. Альтернативно твердые подложки могут содержать кремнеземные чипы, микрочастицы, наночастицы, планшеты и матрицы. Твердая подложка может предусматривать применение шариков, которые способны к самосборке в микролунках. Например, твердая подложка содержит технологию BeadArray от Illumina. Альтернативно твердая подложка содержит технологию Bead Array от Abbott Molecular и систему FlexiPlex™ от Applied Microarray. В других случаях твердая подложка представляет собой планшет. Примеры планшетов включают в себя без ограничения мультиматричные планшеты MSD, планшеты MSD Multi-Spot®, микропланшет, микропланшет ProteOn, AlphaPlate, планшет DELFIA, IsoPlate и LumaPlate. Согласно некоторым вариантам осуществления подложка может содержать множество шариков. Согласно некоторым вариантам осуществления подложка может содержать матрицу. Согласно некоторым вариантам осуществления подложка может содержать стеклянное предметное стекло. Способы, субстраты и техники, применимые к полимерами (патенты США №№5744305, 5143854, 5242974, 5252743, 5324633, 5384261, 5405783, 5424186, 5451683, 5482867, 5491074, 5527681, 5550215, 5571639, 5578832, 5593839, 5599695, 5624711, 5631734, 5795716, 5831070, 5837832, 5856101, 5858659, 5936324, 5968740, 5974164, 5981185, 5981956, 6025601, 6033860, 6040193, 6090555, 6136269, 6269846 и 6428752; публикации заявок на выдачу патентов США №№20090149340, 20080038559, 20050074787; и международные патентные публикации согласно РСТ №№WO 00/58516, WO 99/36760 и WO 01/58593). Прикрепление полинуклеотидов к подложке может предусматривать амин-тиольное поперечное сшивание, малеимидное поперечное сшивание, применение N-гидроксисукцинимида или N-гидроксисульфосукцинимида, Zenon или SiteClick. Прикрепление меченых нуклеиновых кислот к подложке может предусматривать прикрепление биотина ко множеству полинуклеотидов и нанесение на одну или более шариков стрептавидина. Согласно некоторым вариантам осуществления твердая подложка представляет собой шарик. Примеры шариков включают в себя без ограничения стрептавидиновые шарики, агарозные шарики, магнитные шарики, Dynabeads®, микрошарики MACS®, конъюгированные с антителом шарики (например, микрошарик к иммуноглобулину), конъюгированные с белком А шарики, конъюгированные с белком G шарики, конъюгированные с белком A/G шарики, конъюгированные с белком L шарики, конъюгированные с полинуклеотидом dT шарики, кремнеземные шарики, кремнеземоподобные шарики, микрошарик к биотину, микрошарик к флуорохрому и магнитные шарики с карбокси-концом BcMag™. Диаметр шариков может составлять приблизительно 5 мкм, 10 мкм, 20 мкм, 25 мкм, 30 мкм, 35 мкм, 40 мкм, 45 мкм или 50 мкм. Твердая подложка может представлять собой матрица или микроматрицу. Твердая подложка может содержать дискретные участки. Твердая подложка может представлять собой матрицу, например, адресуемую матрицу.
[00410] Твердая подложка может содержать фактически любой нерастворимый или твердый материал, и часто состав твердой подложки выбирают так, чтобы она являлась нерастворимой в воде. Например, твердая подложка может содержать или состоять по существу из следующего: силикагель, стекло (например, стекло с регулируемой пористостью (CPG)), нейлон, Sephadex®, Sepharose®, целлюлоза, металлическая поверхность (например, сталь, золото, серебро, алюминий, кремний и медь), магнитный материал, пластиковый материал (например, полиэтилен, полипропилен, полиамид, сложный полиэфир, поливинилидендифторид (PVDF)) и тому подобное. Примеры шариков для применения согласно вариантам осуществления могут включать в себя аффинный фрагмент, который позволяет шарику взаимодействовать с молекулой нуклеиновой кислоты. Твердая фаза (например, шарик) может содержать компонент участвующей в связывании пары (например, авидин, стрептавидин или их производное). Например, шарик может представлять собой покрытый стрептавидином шарик, и молекула нуклеиновой кислоты для иммобилизации на шарике может включать в себя фрагмент биотина. В некоторых случаях каждая полинуклеотидная молекула может включать в себя два аффинных фрагмента, таких как биотин, для дополнительной стабилизации полинуклеотида. Шарики могут включать в себя дополнительные признаки для применения в иммобилизации нуклеиновых кислот или которые можно использовать в дальнейших процессах скрининга или селекции. Например, шарик может включать в себя аффинную часть, флуоресцентную метку или гаситель флуоресценции. В некоторых случаях шарик может являться магнитным. В некоторых случаях твердая подложка представляет собой шарик. Примеры шариков включают в себя без ограничения стрептавидиновые шарики, агарозные шарики, магнитные шарики, Dynabeads®, микрошарики MACS®, конъюгированные с антителом шарики (например, микрошарик к иммуноглобулину), конъюгированные с белком А шарики, конъюгированные с белком G шарики, конъюгированные с белком A/G шарики, конъюгированные с белком L шарики, конъюгированные с полинуклеотидом dT шарики, кремнеземные шарики, кремнеземоподобные шарики, микрошарик к биотину, микрошарик к флуорохрому и магнитные шарики с карбокси-концом BcMag™. Шарики или частицы могут являться поддающиеся разбуханию (например, полимерные шарики, такие как смола Ванга) или не поддающиеся разбуханию (например, CPG). Согласно некоторым вариантам осуществления твердая фаза является по существу гидрофильной. Согласно некоторым вариантам осуществления твердая фаза (например, шарик) является по существу гидрофобной. Согласно некоторым вариантам осуществления твердая фаза содержит компонент участвующей в связывании пары (например, авидин, стрептавидин или их производное) и являются по существу гидрофобным или по существу гидрофильным. Согласно некоторым вариантам осуществления твердая фаза содержит компонент участвующей в связывании пары (например, авидин, стрептавидин или их производное) и характеризуется связывающей способностью, составляющей больше чем приблизительно 1350 пмоль свободного агента захвата (например, свободного биотина) на мг твердой подложки. Согласно некоторым вариантам осуществления связывающая способность твердой фазы, содержащей компонент участвующей в связывании пары, составляет больше чем 800, 900, 1000, 1100, 1200, 1250, 1300, 1350, 1400, 1450, 1500, 1600, 1800, 2000 пмоль свободного агента захвата на мг твердой подложки. Другие примеры шариков, которые являются подходящими для настоящего изобретения, представляют собой коллоидное золото или такие шарики, как полистирольные шарики или кремнеземные шарики. По существу можно использовать любые радиусы шариков. Примеры шариков могут включать в себя шарики, характеризующиеся радиусом в диапазоне от 150 нм до 10 мкм. Также можно использовать другие размеры.
[00411] Способы и наборы, раскрытые в настоящем документе, могут предусматривать применение одного или более буферов. Примеры буферов включают в себя без ограничения отмывочные буферы, буферы для лигирования, буферы для гибридизации, буферы для амплификации и буферы для обратной транскрипции. Согласно некоторым вариантам осуществления буфер для гибридизации представляет собой коммерчески доступный буфер, такой как раствор ТМАС Hyb, раствор для гибридизации SSPE и буфер для гибридизации ECONO™. Буферы, раскрытые в настоящем документе, могут содержать один или более детергентов.
[00412] Способы и наборы, раскрытые в настоящем документе, могут предусматривать применение одного или более носителей. Носители могут усиливать или улучшать эффективность одной или более реакций, раскрытых в настоящем документе (например, реакции лигирования, обратной транскрипции, амплификации, гибридизации). Носители могут уменьшать или предотвращать неспецифическую потерю молекул или любых их продуктов (например, полинуклеотида и/или ампликона). Например, носитель может уменьшать неспецифическую потерю полинуклеотида посредством абсорбции на поверхностях. Носитель может уменьшать аффинность полинуклеотида к поверхности или субстрату (например, контейнеру, пробирки типа Эппендорф, кончику пипетки). Альтернативно носитель может увеличивать аффинность полинуклеотида к поверхности или субстрату (например, шарику, матрице, стеклу, предметному стеклу, чипу). Носители могут защищать полинуклеотид от разложения. Например, носители могут защищать молекулу РНК от рибонуклеаз. Альтернативно носители могут защищать молекулу ДНК от ДНКазы. Примеры носителей включают в себя без ограничения полинуклеотиды, такие как ДНК и/или РНК, или полипептиды. Примеры носителей ДНК включают в себя плазмиды, векторы, полиаденилированную ДНК и полинуклеотиды ДНК. Примеры носителей РНК включают в себя полиаденилированную РНК, фаговую РНК, РНК фага MS2, РНК Е. coli, дрожжевую РНК, дрожжевую тРНК, РНК млекопитающего, тРНК млекопитающего, короткие полиаденилированные синтетические рибонуклеотиды и полинуклеотиды РНК. Носитель РНК может представлять собой полиаденилированную РНК. Альтернативно РНК может представлять собой неполиаденилированную РНК. Согласно некоторым вариантам осуществления носитель происходит из бактерий, дрожжей или вируса. Например, носитель может представлять собой полинуклеотид или полипептид, происходящий из бактерий, дрожжей или вируса. Например, носитель представляет собой белок из Bacillus subtilis. В другом примере носитель представляет собой полинуклеотид из Escherichia coli. Альтернативно носитель представляет собой полинуклеотид или пептид из организма млекопитающего (например, человека, мыши, козы, крысы, коровы, овцы, свиньи, собаки или кролика), птицы, амфибии или рептилии.
[00413] Способы и наборы, раскрытые в настоящем документе, могут предусматривать применение одного или более контрольных средств. Контрольные средства могут включать в себя контрольные полинуклеотиды, неактивные ферменты, неспецифические конкурирующие средства. Альтернативно контрольные средства включают в себя гибридизацию с ярким сигналом, контроли-зонды с ярким сигналом, нуклеиновокислотные матрицы, контроли - внутренние стандарты, контроли ПЦР-амплификация. Контроли ПЦР-амплификации могут представлять собой положительные контроли. В других случаях контроли ПЦР-амплификации представляют собой отрицательные контроли. Нуклеиновокислотные матрицы - контроли могут находиться в известных концентрациях. Контрольные средства могут содержать одну или более меток.
[00414] Контроли - внутренние стандарты могут представлять собой матрицы, которые добавляют к реакции или образцу. Например, матрицу - внутренний стандарт можно добавить к реакции амплификации. Матрицу - внутренний стандарт можно добавить к реакции амплификации в любое время после первого цикла амплификации. Согласно некоторым вариантам осуществления матрицу - внутренний стандарт добавляют к реакции амплификации после 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45 или 50 циклов. Матрицу - внутренний стандарт можно добавить к реакции амплификации в любое время до последнего цикла амплификации. Матрица - внутренний стандарт может содержать один или более нуклеотидов или пар оснований нуклеиновой кислоты. Матрица - внутренний стандарт может содержать ДНК, РНК или любую их комбинацию. Матрица - внутренний стандарт может содержать одну или более меток.
[00415] В настоящем документе раскрыты молекулы, материалы, композиции и компоненты, которые можно использовать для, можно использовать совместно с, можно использовать в получении для или представляют собой продукты способов и композиций, раскрытых в настоящем документе. Следует понимать, что, когда раскрыты комбинации, подклассы, взаимодействия, группы и т.д. указанных материалов и при этом конкретная ссылка на каждую отличающуюся индивидуальную и коллективные комбинации и перестановку указанных молекулах и соединений не может быть явно раскрыта, каждая из них специально предусмотрена и описана в настоящем документе. Например, если раскрывают и обсуждают нуклеотид или нуклеиновую кислоту, и обсуждают ряд модификаций, которые можно произвести в отношении ряда молекул, включая в себя нуклеотид или нуклеиновую кислоту, каждая в отдельности комбинация и перестановка нуклеотида или нуклеиновой кислоты и модификации, которые являются возможными, специально предусмотрены, если специально не указано иное. Эта концепция применима ко всем аспектам настоящей заявки, включая в себя без ограничения стадии в способах получения и использования раскрытых способов и композиций. Таким образом, если существует разнообразие дополнительных стадий, которые можно проводить, следует понимать, что каждую из указанных дополнительных стадий можно проводить с любым конкретным вариантом осуществления или комбинации вариантов осуществления раскрытых способов, и что каждая такая комбинация специально предусмотрена и ее следует рассматривать как раскрытую.
[00416] Наряду с тем, что некоторые варианты осуществления, описанные в настоящем документе, были показаны и описаны в настоящем документе, такие варианты осуществления предусмотрены исключительно в качестве примера. Различные вариации, изменения и замены могут быть внесены специалистами в настоящей области техники, не отклоняясь от раскрытия, предусмотренного в настоящем документе. Следует понимать, что различные альтернативы вариантам осуществления, описанным в настоящем документе, можно использовать в осуществлении на практике описанных в настоящем документе способов.
[00417] Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют то же значение, что и значение, которое обычно понятно специалисту в данной области техники, к которому принадлежит настоящее раскрытие. Следующие ссылки включают в себя варианты осуществления способов и композиций, которые можно использовать в настоящем документе: The Merck Manual of Diagnosis and Therapy, 18th Edition, published by Merck Research Laboratories, 2006 (ISBN 0-9119102); Benjamin Lewin, Genes IX, published by Jones & Bartlett Publishing, 2007 (ISBN-13: 9780763740634); Kendrew et al. (eds.), The Encyclopedia of Mol. Biology, published by Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); and Robert A. Meyers (ed.), Mol. Biology and Biotechnology: a Comprehensive Desk Reference, published by VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8).
[00418] Стандартные процедуры согласно настоящему раскрытию описаны, например, в Maniatis et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., USA (1982); Sambrook et al., Molecular Cloning: A Laboratory Manual (2 ed.), Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., USA (1989); Davis et al., Basic Methods in Molecular Biology, Elsevier Science Publishing, Inc., New York, USA (1986); или Methods in Enzymology: Guide to Molecular Cloning Techniques Vol. 152, S.L. Berger and A.R. Kimmerl (eds.), Academic Press Inc., San Diego, USA (1987)). Current Protocols in Molecular Biology (CPMB) (Fred M. Ausubel, et al. ed., John Wiley and Sons, Inc.), Current Protocols in Protein Science (CPPS) (John E. Coligan, et al., ed., John Wiley and Sons, Inc.), Current Protocols in Immunology (CPI) (John E. Coligan, et al., ed. John Wiley and Sons, Inc.), Current Protocols in Cell Biology (CPCB) (Juan S. Bonifacino et al. ed., John Wiley and Sons, Inc.), Culture of Animal Cells: A Manual of Basic Technique by R. Ian Freshney, Publisher: Wiley-Liss; 5th edition (2005) и Animal Cell Culture Methods (Methods in Cell Biology, Vol. 57, Jennie P. Mather and David Barnes editors, Academic Press, 1st edition, 1998).
ПРИМЕРЫ
Пример 1 - Иммунотипирование отдельно взятых Т-лимфоцитов в популяции Т-клеток
[00419] Способы иммунофенотипирования, описанное в настоящем документе, валидизировали с помощью анализа экспрессии как CD4 и CD8 иРНК, так и CD4 и CD8 поверхностного белка в Т-лимфоцитах человека. Канонически зрелые Т-клетки, как предполагают, относятся либо к CD4 подтипу, либо к CD8 подтипу. CD4 подтип должен экспрессировать CD4 иРНК и CD4 белок вместе, но должен экспрессировать или CD8 иРНК, или CD8 белок. CD8 подтип должен экспрессировать CD8 иРНК и CD8 белок вместе, но должен экспрессировать или CD4 иРНК, или CD4 белок.
[00420] 30000 Т-клеток инкубировали как с конъюгатом CD4-специфического антитела с олигонуклеотидом, содержащим последовательность идентификации антигена CD4, так и с конъюгатом CD8-специфического антитела с олигонуклеотидом, содержащим последовательность идентификации антигена CD8. Содержание CD4, CD8 и TCR иРНК Т-клеток также анализировали в эксперименте с одноклеточной эмульсией. Т-клеточный рецептор альфа, Т-клеточный рецептор бета, CD4 и CD8 иРНК обратно транскрибировали до кДНК и специфическую для капли штрих-кодовую последовательность сливали как с кДНК, так и конъюгированными с антителом олигонуклеотидами посредством полимеразной цепной реакции. Эту ДНК экстрагировали из эмульсии и анализировали с помощью секвенирования нового поколения.
[00421] Почти все штрих-коды капли (относящиеся к отдельно взятой клетке) ассоциировали либо с CD4-специфической последовательностью идентификации антигена, либо с CDS-специфической последовательностью идентификации антигена. Обнаружено значимое соответствие между интерпретациями данных в отношении иРНК и поверхностного белка (фиг. 3).
Пример 2
[00422] Секвенирование иммунного репертуара характеризуется широким спектром применений в общей иммунологии, в области аутоиммунитета, инфекционных заболеваний и онкологии. Наряду с тем, что многие исследования были посвящены разнообразию BCR и TCR в циркулирующей крови, существует растущий интерес к иммунным рецепторам TIL, чьи функции в высокой степени релевантны росту или регрессии злокачественных опухолей, при этом они являются вариабельными и часто не охарактеризованными. Критически важным шагом в направлении лучшего понимания TIL будет извлечение и определение функциональных характеристик их BCR и TCR, поскольку это может обеспечить идентификацию новых опухолеассоциированных антигенов. Опухолевые антигены являются критически необходимыми для разработки противораковых вакцин, понимания роли ингибиторов контрольных точек иммунного ответа и положительного эффекта терапии с использованием Т-клеток с химерными антигенными рецепторами (CAR-T) в лечении солидных опухолей. Тем не менее, несмотря на десятилетия технического прогресса в иммунном секвенировании, ни в одном исследовании не выделили полноразмерные, нативно спаренные BCR (тяжелая и легкие цепи) и TCR (альфа и бета цепи) из гетерогенного образца, такого как опухоль, без in vitro культивирования или сортировки клеток, стадий, которые ограничивают и искажают наблюдаемый репертуар. Технические трудности особенно высоки, поскольку первичные некультивированные иммунные клетки могут содержать в 100 раз меньше РНК рецептора, чем in vitro стимулированные клетки. Для обеспечения возможности исчерпывающего анализа нативно спаренных BCR и TCR из сложных гетерогенных образцов, разработали способ на основе микрожидкостной эмульсии для параллельного выделения и штрихкодирования ДНК больших количеств отдельно взятых клеток. Вплоть до миллиона клеток в час выделяют в отдельные ~65 пл капли эмульсия. Внутри капли клетки лизируют, целевую иРНК обратно транскрибируют с помощью специфических для мишени праймеров, и двухстадийный способ штрихкодирования ДНК прикрепляет как специфические для молекулы, так и специфические для капли штрих-коды к кДНК. После последующего извлечения и секвенирования нового поколения стратегия двойного штрихкодирования обеспечивает возможность кластеризации прочтений последовательности как в их молекулы, так и в клетки, из которых они происходят. Это обеспечивает возможность обширной коррекции ошибок и систематических ошибок амплификации, подсчета клонов как на уровне иРНК, так и на клеточном уровне, определения изотипа тяжелой цепи и, что важно, излечения полноразмерных, нативно спаренных V(D)J последовательностей BCR и TCR одновременно с очень высокой производительностью.
[00423] Инфильтрирующие опухоль лимфоциты (TIL) являются критически важными для противоопухолевых иммунных ответов, но сложными для исследования вследствие их непредсказуемой численности, фенотипов и функции. Авторами настоящего изобретения разработан способ фундаментального определение характеристик TIL без необходимости в сортировке клеток, стимуляции или культивировании. Способ штрихкодирования отдельно взятых клеток на основе эмульсии захватывает нативно спаренные последовательности В-клеточного и Т-клеточного рецепторов (BCR и TCR) из лимфоцитов среди миллионов вводимых клеток. В отличие от предыдущих подходов, выделенные вариабельные области являются полноразмерными, и они могут сопровождаться дополнительной иРНК и белковыми мишенями. Способ валидизировали с помощью 3 млн. В-клеток из крови здорового человека и 350000 В-клеток от пациента с ВИЧ перед обработкой 400000 несортированных клеток из аденокарциномы яичника, извлекая спаренные BCR и TCR из свыше 11000 TIL. Результаты авторов настоящего изобретения представляют самый глубокий подход к получению образца репертуара любых спаренных BCR или TCR, а также первую демонстрацию одновременного секвенирования РНК и измерений белка из отдельно взятых клеток в эмульсии.
Пример 3 - Крупномасштабное извлечение В-клеточных пар VHVL из здорового образца крови
[00424] Технология разработали первоначально, и способность и производительность спаривания оценивали с помощью 3 млн. В-клеток, выделенных с помощью отрицательного обогащения шариков из периферической крови здорового волонтера. Эмульсию разделяли на шесть отдельных фракций, которые обрабатывали параллельно и повторно не перемешивали до секвенирования. Эмульсию загружали с плотностью 0,2 клетки на каплю, получая ожидание Пуассона, которое составляет ~90% занятых капли, содержащих отдельно взятые клетки, что согласовывалось с данными наблюдений, полученных от капель эмульсии (фиг. 6А). После разделения эмульсии и дополнительных стадий обработки библиотеки секвенирование спаренных концов 325+300 п.н. проводили на Illumina MiSeq. Для обработки данных секвенирования штрих-коды капли и молекулярные штрих-коды использовали вместе для сбора прочтений ПЦР в повторностях из каждой исходной иРНК молекулы и определяли консенсусную последовательность для каждой иРНК, отслеживая только последовательности иРНК, построенные из по меньшей мере двух прочтений. Прямое и обратное прочтения сшивали для создания полноразмерных продуктов, содержащих 5' UTR, полную V(D)J последовательность и константную область, достаточные для определения изотипа. Реаранжированные последовательности тяжелой и легкой цепи иммуноглобулина снабжали аннотацией IMGT High-VQuest и/или IgBLAST.
[00425] Полученный набор данных содержал 324988 штрих-кодов капель, которые ассоциировали по меньшей мере с одной иРНК тяжелой цепи (VH) и одной иРНК легкой цепи (VL), при этом присутствовали 229869 отдельных VH клональньгх линий по оценкам с помощью кластерного анализа тяжелой цепи. Поскольку этот необработанный набор включает в себя данные от капель, содержащих многочисленные клетки, а также капель, содержащих отдельно взятую клетку, данные от капель, содержащих отдельно взятую клетку, обогащали путем отфильтровывания штрих-кодов капли, соединенных с не всеобщими V(D)J последовательностями тяжелой или легкой цепи (фиг. 6В). Эта стадия стала возможной за счет высокого разнообразия типичных иммунных репертуаров, в которых VH или VL иРНК из двух случайных клеток почти никогда не совпадут. Полученный обогащенный набор данных содержал 259368 VHVL штрих-кодов капли и содержал 182745 VH клональньгх линий, представляя легко осуществляемый глубокий подход к получению образца спаренного иммунного репертуара на сегодняшний день. Точность VHVL спариваний по идентификации частоты случаев клональной экспансии оценивали напрямую, поскольку относящиеся к клону клетки должны показывать однородность в своих VHVL спариваниях. Идентифицировали 2604 VH, которые наблюдали в больше чем одной фракции эмульсии с высокой достоверностью того, что они являются подвергнутыми клональной экспансии клетками. Однородность VL последовательностей, спаренных с указанными VH клонами во всех фракциях, являлась очень высокой и указывала на точность спаривания, составляющую 96,1%, обеспечивая высокую достоверность в полном отфильтрованном наборе данных 259368 VHVL пар.
Межфракционные VH и VL последовательности всегда ассоциировали с различными штрих-кодами капли и молекулярными штрих-кодами в каждой фракции, и, таким образом, они не представляли перекрестную контаминацию библиотеки. Анализ может недооценивать точность спаривания, поскольку некоторые В-клетки, как известно, экспрессируют многочисленные легкие цепи. 75,0% из 259368 отфильтрованных VHVL штрих-кодов капли или "VHVL пар" содержали IgM и/или IgD (фиг. 6С), которые часто наблюдали вместе, как предполагали, принимая во внимание типичный IgM+IgD+ фенотип наивных В-клеток. Также обнаружили низкие, но значимые фракции VHVL пар IgA (18,3%) и IgG (6,6%). Все VH изотипы являлись спаренными с Igκ или Igλ, в соотношении ~3:2. Среди 182745 VH клональных линий экспансию клона оценивали двумя путями: число штрих-кодов капли, ассоциированных с клоном, и данные от клона во всех фракциях эмульсии. Клоны, наблюдаемые в нескольких штрих-кодах капель могли отражать клональную экспансию или капли с несколькими штрих-кодами, которые ожидают в ~37% капель, принимая во внимание начальное λ=1 рассеяние Пуассона штрих-кодов в капли. Тем не менее, любой клон, представленный > 8 штрих-кодов капли, вероятно, является подлинно размноженным (вероятность Пуассона в отдельно взятой капле < 10-6). Наряду с тем, что всего 6,0% клонов наблюдали в больше чем одной фракции, для клонов, наблюдаемых в больше чем 8 штрих-кодах капли (0,7% всего), 99% из них наблюдали в больше чем одной фракции. Все из 100 наиболее частых клонов (30-137 штрих-кодов капли каждый, фиг. 6D) наблюдали по меньшей мере в пяти из шести фракций. Комбинация подсчета штрих-кодов и независимый анализ фракций, таким образом, обеспечивает возможность обнаружения редких размноженных линий среди обширного фона неразмноженных клонов. Следует отметить, тем не менее, что даже наиболее распространенный размноженный клон присутствовал в концентрации меньше чем одна клетка на тысячу, являясь примером огромного разнообразия периферических иммунных репертуаров человека.
[00426] Число захваченных иРНК каждой VH и VL цепи в пределах пары является показателем уровня экспрессии (фиг. 6Е). Как правило, меньше чем 10 иРНК тяжелой цепи (в среднем 2,0) и легкой цепи (в среднем 4,0) захватывали на один штрих-код капли, наблюдали небольшую популяцию штрих-кодов капли с десятками - сотнями захваченных иРНК тяжелой и легкой цепи на клетку, почти исключительно из экспрессирующих IgG и IgA клеток. Интересно, что степень VH и VL мутации в пределах пары сильно коррелировала как в пределах каждого изотипа (например, VH по сравнению с VL для IgG), так и между изотипами (например, IgG по сравнению с IgM) (фиг. 6F). Более того, пары IgG и IgA являлись почти все по существу мутированными как в своих VH, так и VL цепях, тогда как пары IgM и IgD, главным образом, демонстрировали небольшую VH или VL мутацию. Указанные результаты согласуются с механизмом В-клеточной активации, ведущей к переключению класса с IgM и IgD на IgG или IgA, увеличенной экспрессии иммуноглобулина и соматической гипермутации, которая поражает локусы как тяжелой, так и легкой цепей в клетке. В дополнение к этому наблюдению, что в высокой степени мутированные VH цепи характеризуются тенденцией спариваться с в высокой степени мутированными VL цепями, указанный способ способен создавать большие количества полноразмерных, нативно спаренных BCR из репертуаров отдыхающих В-клеток человек.
Пример 4 - Извлечение известных VHVL пар с низкой частотой встречаемости от элитного контроллера ВИЧ.
[00427] В качестве дополнительной валидации чувствительности и точности анализа спаривания обрабатывали образец, где несколько редких (<1 клетки в 10000) нативных VHVL спариваний уже известны и являются общедоступно известными. Получали периферические В-клетки от элитного контроллера ВИЧ, чьи В-клетки памяти были всесторонне проанализированы за последние годы в отношении антител, проявляющих нейтрализующую ВИЧ активность. 350000 В-клеток обрабатывали для создания в общем 38620 отфильтрованных VHVL пар. Интересно, что этот индивидуум показывал большую пропорцию IgG, чем предыдущий здоровый образец (фиг. 7А) или типичные здоровые периферические В-клеточные репертуары. VH последовательности из этого набора данных сравнивали со всеми описанными широко нейтрализующими антителами (bNAb) от этого индивидуума, включая в себя PGT121 и обнаруженные 8 близкие или идентичные VH последовательности, указывая на то, что это семейство bNAb представляет меньше чем 0,03% циркулирующих В-клеток. Важно отметить, что все легкие цепи, спаренные с указанными тяжелыми цепями, происходили из предполагаемой и аналогичной редкой линии bNAb, проявляя одинаковую реаранжировку Igλ-V3-21/J3 и отличительную вставку трех кодонов, как сообщалось ранее, подтверждая высокую точность и чувствительность способа согласно настоящему изобретению. Более того, на филогенетическом дереве всех известных и вновь созданных PGT121-подобных VHVL пар от этого индивидуума (фиг. 7В) VH и VL деревья показывают поразительно сходную топологию по сравнению со спаренными VH и VL последовательностями, занимающими зеркальные положения, вероятно, отражая общую филогенетическую историю. Вариантные пары, обнаруженные здесь, хорошо согласуются с этим правилом. Интересно, что два опубликованных антитела PGT122 и PGT123 появляются в качестве исключений; подтверждение для указанных двух спариваний не обнаружили, но вместо этого обнаружили POT122VH:POT123VL-подобные и POT123VH:POT122VL-подобные пары, обращаясь к неподтвержденному спариванию в исходном отчете. Синтезировали ДНК, кодирующие полные V(D)J области 8 новых PGT-подобных VHVL пар, экспрессировали антитела как полные IgG и исследовали их способность нейтрализовать многочисленные псевдоштаммы ВИЧ (фиг. 1С). Антитела хорошо экспрессировались, и все антитела показали сильную нейтрализующую активность против вируса, демонстрируя применимость раскрытого в настоящем документе подхода в быстром создании нативно спаренных функциональных вариантов антител из релевантного биологического образца.
Пример 5 - Пары В-клеточного и Т-клеточного рецептора из инфильтрирующих опухоль лимфоцитов
[00428] Валидизировав штрихкодирование эмульсии для
высокопроизводительного извлечения спаренных рецепторов, иммунные рецепторы извлекали напрямую из опухоли. Диссоциированный протеазой, резецированный образец аденокарциномы яичника получали и вводили 400000 несортированных клеток в эмульсию. CD3/CD19 окрашивание отдельной аликвоты образца подтвердило значительные количества инфильтрирующих В- (~5%) и Т-клеток (~20%) в материале. Рассредоточение отдельно взятых клеток в эмульсии являлось сходным с очищенными клетками, хотя и с некоторым видимым ограниченным скоплением и обширной вариацией в размере и форме клеток в пределах капель, как ожидалось, учитывая гетерогенность образца в отношении типов клеток (фиг. 8А).
[00429] Праймеры, нацеленные на константные области альфа и бета цепей Т-клеточного рецептора вместе, использовали с праймерами BCR, используемыми ранее, и после секвенирования и фильтрации в жестких условиях извлекали тысячи штрих-кодов капли, соединенных с продуктами BCR или TCR. Для оценки точности отдельно взятой клетки все возможные комбинации четырех целевых локусов (VH, VL, Vα, Vβ) в пределах штрих-кодов капли подсчитывали (фиг. 8В). Превалирующее большинство (97,9%) штрих-кодов капли с больше чем одной целевой цепью содержали биологически ожидаемые спаривания BCR VH+VL или TCR Vα+Vβ, при этом только 2,1% содержали смешанные BCR-TCR комбинации. Поскольку штрихкодирование продуктов является неискаженным в отношении целевой цепи, этот результат обеспечивает высокую степень достоверности в полученных 6056 VHVL BCR и 5217 парах VαVβ TCR. BCR показали удивительное преобладание IgG (>80%) по сравнению с другими изотипами (фиг. 8С), хотя все из них присутствовали (только IgE<0,05%). Каппа и лямбда легкие цепи присутствовали в сходных соотношениях по сравнению с наборами данных из периферической крови.
[00430] Аналогично периферической крови наблюдали корреляцию между изотопом BCR и уровнем мутации как VH, так и VL цепей, при этом пары IgG и IgA показывали большую мутацию VH и VL, чем IgD и IgM, и общую корреляцию мутации между VH и VL в пределах каждого изотипа (фиг. 8D). Интересно, что наряду с тем, что пары IgD, IgM и IgA показали очень сходные мутационные распределения между наборами данных из опухоли и периферической крови, фракции IgG опухоль также содержали значимую пропорцию от слегка мутированных до немутированных последовательностей, которую не наблюдали в периферической крови. Для TCR и для BCR, содержащих IgD, сходные количества захваченных иРНК наблюдали на каждый штрих-код капли по сравнению с результатами BCR из периферической крови (фиг. 8Е, главным образом < 10 на штрих-код капли). Это резко контрастирует с тем, что полученные из опухоли пары IgM, IgA и IgG показали 10-100-кратно увеличенный средний уровень экспрессии с сотнями или тысячами целевых иРНК, захваченных во многих штрих-кодах капли. Разнообразие захваченных репертуаров TIL-TCR и BCR затем оценивали (фиг. 8F). Среди всего 5217 пар TCR наблюдали 2423 отдельных клонов бета TCR. 7 клонов присутствовали с частотой встречаемости > 1%, при этом топовый клон представлял 16,9% всех штрих-кодов капли. Среди всего 6056 пар BCR наблюдали 1518 отдельных клонов тяжелой цепи с 15 клонами с > 1% частотой встречаемости, но ни одного > 5%. Наряду с тем, что это представляет по существу более ограниченного разнообразие, чем здоровый репертуар периферических BCR (в котором отсутствуют клоны, присутствующие с больше чем 0,06% частотой встречаемости), присутствие так многих клонов с переключенным классом, мутированных и высоко экспрессированных клонов в образце опухоли демонстрирует необходимость в глубоком и чувствительном подходе получения образца для определения характеристик TIL. Указанный способ обеспечивает возможность быстрого извлечения больших количеств пар иммунных рецепторов TIL, как из В-, так и из Т-клеток одновременно, без необходимости предварительной сортировки или экзогенной активации заданных популяций TIL.
Пример 6 Захват дополнительных представляющих интерес фенотипических маркеров
[00431] Спаривание цепей рецептор с помощью штрихкодирования капель потенциально обеспечивает возможность захвата дополнительных мишеней, кроме иммунных рецепторов. Для исследования этой возможности здоровые Т-клетки в CD4+ и CD8+ популяциях разделяли с помощью обогащения магнитных шариков и вводили 20000 клеток каждого типа в отдельные серии эмульсии, с праймерами, нацеленными на альфа и бета цепи TCR и CD4 и CD8 иРНК. После секвенирования 47,0% 3861 штрих-кодов капель, содержащих TCR Vα и Vβ ("пары TCR") из CD4+ выделенных клеток, соединяли с CD4 иРНК, при этом только 0,3% соединяли с CD8 иРНК. Напротив, 50,6% из 2235 пар TCR из CD8+ выделенных клеток ассоциировали с CD8 иРНК, при этом только 0,6% соединяли с CD4 иРНК. Это демонстрирует высокую специфичность, но ограниченную чувствительность основанного на иРНК подхода к фенотипированию клеток, аналогично предыдущему отчету. Напротив, такие белки, как рецепторы клеточной поверхности, как правило, присутствуют в намного больших количествах (1000-100000 на клетку), чем их кодирующие иРНК, потенциально делая их более легкими для обнаружения, а также являясь потенциально более прямо релевантными клеточному фенотипу. Для измерения содержаний целевого белка на каждой клетке, специально созданные олигонуклеотидные метки ДНК конъюгировали с антителами CD4 и CD8k человека, и инкубировали меченые антитела с неразделенной смесью CD4+ и CD8+ Т-клеток перед вводом 30000 клеток в эмульсию (фиг. 3А). Метки ДНК несут маркеры специфической для антитела последовательности, а также молекулярные штрих-коды и последовательность, комплементарную амплифицированным штрих-кодам капли, обеспечивая штрихкодирование капель эмульсии и молекулярный подсчет, аналогично тому, который осуществляли для иРНК. Метки ДНК нацеливали также, как и TCR, CD4 и CD8 иРНК одновременно. После секвенирования и фильтрации 3682 штрих-кодов капель идентифицировали с высокой достоверностью пары VαVβ TCR. Согласуясь с предыдущим экспериментом, примерно половине (52%) пар TCR можно было присвоить статус CD4 или CD8 на основании иРНК (фиг. 3В-3С). Тем не менее, свыше 95% штрих-кодов капель можно было присвоить статус CD4 или CD8 на основании белка, со средним числом молекул на каплю существенно выше для CD4/8 белков (в среднем 20,5), чем CD4/8 иРНК (в среднем 1,0). Совпадение между сигналами иРНК и белка являлось высоким (фиг. 3D): 96,0% капель, получивших сигналы как иРНК, так и белка, находились в согласии. В некоторых редких случаях обнаруживали как CD4, так и CD8 белки, вероятно, результат капель, которые содержали две или больше клетки. Штрихкодирование эмульсии обеспечивает возможность, во-первых, прямо связывать иммунные рецепторы отдельно взятой клетки с иРНК и белковыми маркерами, представляющими интерес, все с высокой производительностью. Применение настоящего подхода к TIL с расширенным, иммунно-онкеологически релевантным набором маркеров, таких как антитела к PD-1 и к CTLA-4, является гарантированным.
Пример 7 - Образцы человека
[00432] Образец крови для валидизации здорового репертуара собирали при одобрении Personal Genome Project. РВМС для эксперимента с bNAb ВИЧ получали от донора 17, инфицированного ВИЧ-1 донора из когорты G протокола IAVI. Все образцы ВИЧ человека собирали с письменным информированным согласием согласно клиническим протоколам, одобренным следующими комитетами: the Republic of Rwanda National Ethics Committee, the Emory University Institutional Review Board, the University of Zambia Research Ethics Committee, the Charing Cross Research Ethics Committee, the UVRI Science and Ethics Committee, the University of New South Wales Research Ethics Committee. St. Vincent's Hospital and Eastern Sydney Area Health Service, Kenyatta National Hospital Ethics and Research Committee, University of Cape Town Research Ethics Committee, the International Institutional Review Board, the Mahidol University Ethics Committee, the Walter Reed Army Institute of Research (WRAIR) Institutional Review Board и the Ivory Coast Comite "National d'Ethique des Sciences de la Vie et de la Sante" (CNESVS). Криоконсервированную, диссоциированную резецированную аденокарциному яичника от одного донора получали от Conversant Biologies с письменным информированным согласием согласно одобренному IRB протоколу.
Пример 8 - Получение клеток
[00433] Для исследования 3 млн. здоровых В-клеток 50 мл крови отбирали в пробирки для клеточных препаратов Vacutainer СРТ с гепарином натрия (BD), центрифугировали в течение 20 мин при 1800 × g, отмывали дважды в буфере для получения клеток (1x PBS, дополненном 2% фетальной бычьей сывороткой и 2 мМ EDTA), с использованием центрифуги при 200 × g для удаления тромбоцитов и полученные РВМС криоконсервировали в среде RPMI-1640 (Life Technologies) + 20% фетальной бычьей сыворотки + 10% DMSO при -80°С до использования. Перед созданием эмульсии РВМС оттаивали, отмывали дважды в буфере для получения клеток и подсчитывали. В-клетки выделяли с использованием набора для обогащения В-клеток человек на основе отрицательной селекции (Stem Cell Technologies) согласно инструкциям производителя. Клетки пропускали через 20 мкм клеточное сито и разводили до 6,2×106 клеток/мл (эксперимент с использованием 3 млн. В-клеток) или 3,1×106 клеток/мл (эксперименты с использованием PGT-донора и опухоли яичника) в буфере для получения клеток.
Пример 9 - Штрихкодирование иммунного рецептора в эмульсии
[00434] Платформа создания эмульсии, состоящая из трех насосов Mitos Р-Pumps (Dolomite Microfluidics), управляемых единственным воздушным компрессором, каждый из которых снабжен датчиком скорости потока Mitos Flow Rate для обеспечения контролируемого компьютером потока двух водных фаз и одной флуорофильной диспергирующей фазы в покрытый флуорофильной оболочкой кварцевый чип для 2 реагентов Dolomite Small 2-Reagent. Один водный входной канал содержал клетки с требуемой плотностью для получения требуемого уровня заполненного в количестве клеток на каплю, тогда как второй водный канал содержал лизирующую и реакционную смесь, состоящую из реакционного буфера AbPair™ и олигонуклеотидов (www.abvitro.com/catalog AV2070-1S и AV2080-1S), 5 единиц/мкл обратной транскриптазы на основе MuMLV (Thermo Scientific) и 0,1 единиц/мкл ПЦР-полимеразы Herculase П. 100 мкл микролитровый шприц Гамильтона использовали для избыточной загрузки внутреннего диаметра 100-мкл петли трубы для образца РЕЕК за две инъекции по ~100 мкл каждой из смеси LR. 100 мкл газонепроницаемый шприц Гамильтона использовали для загрузки ~110 мкл клеточной суспензии в ~100 мкл петлю трубы FEP, с внутренним диаметром 0,2 мм. Эмульсию формировали путем сфокусированной струйной инъекции водных фаз с идентичными скоростями потока через чип для 2 реагентов с одновременным потоком масла из двух масляных каналов в чип. Эмульсия, выходящая из выходного канала чипа, стекала по каплям в 0,2 мл пробирки в полоске для ПЦР (Eppendorf) на холодном элементе, после чего избыток масла удаляли с помощью пипетки со дна пробирки, добавляли 40 мкл покрывающего раствора (25 мМ Na-EDTA, рН 8,0) и пробирки переносили на стандартный термоциклер для реакции мечения транскрипта. Во время 45 мин стадии обратной транскрипции (ОТ) РНК обратно транскрибировали при 42°С со специфическими для мишени праймерами ОТ, с основанным на переключении матрицы добавлением универсальной адаптерной последовательности, содержащей рандомизированный молекулярный штрих-код. После ОТ эмульсии подвергали 40 циклам термоциклирования (каждый цикл: 82°С в течение 10 секунд, 65°С в течение 25 секунд) для проведения ПЦР-амплификации матриц штрих-кода капли, которые разводили в исходной лизирующей и реакционной смеси до 30000 сП/мкл, образуя концентрацию в конечной смеси, составляющую 15000 сП/мкл или ~1 на ~65 пл каплю. Один конец штрих-кода капли содержит сайт праймера прочтения 2 Illumina ("Р7"), тогда как другой конец совпадает с обычной последовательностью универсального адаптерного олигонуклеотида. Следовательно, во время ПЦР кДНК с переключенной матрицей можно отжигать для амплификации цепей штрих-кода капли, и чтобы они становились сплайсированными с помощью достройки перекрытием для получения полноразмерных продуктов, содержащих целевые последовательности, молекулярные штрих-кодовые последовательности и штрих-кодовые последовательности капли.
Пример 10 - Разрушение эмульсии, очистка, последующие ПЦР, объединение и секвенирование
[00435] После термоциклирования покрывающий раствор удаляли с помощью пипетки и добавляли 40 мкл разрушающего эмульсию раствора (1:1 FC-40:перфтороктанол) вместе с 15 мкл осветляющего лизат раствора (12,5 мкл Qiagen Protease, 2,5 мкл 0,5 М Na-EDTA, рН 8,0). После переворачивания 10 раз для разрушения эмульсии, смесь инкубировали в течение 15 минут при 50°С и 3 минут при 95°С для инактивации протеазы. После центрифугирования при 15000×g в течение 1 мин для выделения водной фазы извлеченный материал тщательно очищали для удаления олигонуклеотидов, реагентов и избытка ПЦР-продуктов штрих-кода капли. Поскольку полноразмерные продукты содержат биотин вследствие 5' биотинилирования праймера ОТ, их можно эффективно отделить от избытка ПЦР-продуктов штрих-кода капли путем очистки на стрептавидиновых шариках, таким образом минимизируя последующие артефакты рекомбинации ПЦР, распространенную проблему в подходах на основании достройки путем перекрытия. Сначала продукты очищали с использованием шариков AMPure ХР (Agencourt) с использованием инструкций производителя при соотношении 1:1, с последующей очисткой с использованием стрептавидиновых шариков (New England Biolabs), также с использованием инструкций производителя, с последующим элюированием в деионизированной воде при 95°С, с последующей второй очисткой с помощью шариков AMPure ХР в соотношении 1:1. Продукты затем вводили в ПЦР обогащения мишени, в которой праймеры, специфические к мишеням - константным областям В- или Т-клеточного рецептора, использовали вместе с праймером, специфическим в отношении универсального конца штрих-кодовой последовательности капли. Этот обратный праймер также содержал штрих-код с шестиосновным индексом для мультиплексированного секвенирования на приборе MiSeq согласно инструкциям производителя. Таким образом, только полноразмерные, штрих-кодированные в отношении капли целевые последовательности амплифицируют на этой стадии. Все мишени сначала амплифицировали вместе в течение семи циклов при 98°С 10 секунд; 64°С в течение 20 секунд; 72°С в течение 15 секунд, с использованием Q5 полимеразы с горячим стартом (New England Biolabs) при рекомендуемых производителем условиях, включая в себя 2 мин при 98°С стадию активации полимеразы в начале реакции. За этим следовала очистка AMPure ХР при соотношении 1,5:1 шариков к ПЦР. Затем проводили второе нацеливание из семи циклов каждой цепи (VH, VL, Vα, Vβ) отдельно с использованием таких же условий термоциклирования, как ранее, с последующей очисткой AMPure ХР. Затем проводили конечную ПЦР с теми же условиями термоциклирования и 5-15 циклами (в зависимости от выхода, о чем судили по кПЦР) для добавления полноразмерных адаптеров для секвенирования lllumina и создания достаточного материала для количественного определения TapeStation D1000 (Agilent). Библиотеки затем объединяли и секвенировали на платформе V3 2×300 п.н. MiSeq (Illumina).
Пример 11 - Модификации платформы MiSeq
[00436] Реконструкция полной вариабельной V(D)J области BCR или TCR требует сшивания двух прочтений со спаренными концами Illumina. Для улучшения этого процесса прямое прочтение набора из 2×300 п.н. достраивали до 325 п.н. 10% внутренний стандарт phiX использовали для облегчения проблем с ограниченным разнообразием библиотек, поскольку библиотеки иммунных рецепторов характеризуются ограниченным разнообразием в сайтах праймеров константной области.
Пример 12 - Обзор биоинформационной обработки прочтений
[00437] Прочтения Illumina MiSeq обрабатывали с использованием специально созданных магистралей вокруг пакета pRESTO (версия 0.4) для создания полноразмерных консенсусных последовательностей для молекул иРНК из каждой капли, снабженной аннотацией IgBLAST и/или IMGT/HighV-QUEST, и дополнительно выравнивали, фильтровали и обрабатывали с помощью специально созданных скриптов и пакета Change-O для получения статистических данных.
Пример 13 - Обработка прочтений и аннотирование, присвоение изотипа
[00438] Обработку необработанных прочтений, аннотирование V(D)J и присвоение клону изотипа проводили с помощью специально созданных магистралей, использующих пакеты pRESTO и Change-O. Вкратце, необработанные прочтения со спаренными концами 325+300 п.н. Illumina подвергали контролю качества, триммировали праймером и идентифицировали специфические для капли (DB) и специфические для молекулы штрих-коды (MB) посредством неточного совпадения сайтов праймера. Вместе DB и MB уникальным образом определяют молекулу-источник, и этот уникальный молекулярный идентификатор (UMI) использовали для группировки согласующихся прочтения ПЦР в повторностях (минимум двух), происходящих из одной и той же молекулы для создания консенсуса для каждой последовательности иРНК. Специфическое для изотипа праймирование подтверждали с помощью неточного совпадения известных специфических для изотипа константных областей в пределах триммированных праймером последовательностей. V(D)J сегменты зародышевой линии и структуру реаранжировки определяли с использованием IgBLAST и подтверждали с помощью IMGT/HighV-QUEST, в соответствующих случаях, интерпретировали с помощью Change-0 и специально созданных скриптов.
[00439] Клонам присваивали изотип посредством кластерного анализа методом ближнего соседа в пределах групп функциональных V(D)J последовательностей, характеризующихся совпадающим геном IGHV, геном IGHJ и длиной соединения, как это реализовано в Change-O. Для набора данных 3 млн. циркулирующих клеток взвешенное внутриклональное расстояние, составляющее 4.0, с использованием симметризованной модели транзиции/трансверсии использовали в качестве предельное значения расстояния до ближнего соседа в пределах клонов.
Пример 14 - Фильтрация включений иммунных рецепторов капли и расчет точности воспроизведения спаривания
[00440] Точность извлечения В-клеточной последовательности из капли можно оценить двумя путями с помощью раскрытого способа штрихкодирования: с использованием согласования последовательностей иРНК внутри капли и посредством согласования спаривания между фракциями. В пределах каждой капли множество иРНК захвачено на каждый локус; экспрессированные V(D)J последовательности из одной клетки следует согласовывать. Присутствие больше чем одной продуктивной VDJ и одной продуктивной VJ последовательности на каплю помечают биоинформационно как предполагаемое включение иммунного рецептора или размещение на нескольких клетках, с использованием предельного значения, составляющего 2% разнообразия последовательностей (средние попарные различия нуклеотидов pi55 <0,02) многочисленных выровненных V(D)J сегментов для определения согласования последовательностей. Консенсусные последовательности тяжелой и легкой цепи строили для каждой аллельно исключенной капли и использовали для определения клона и анализа спаривания между фракциями. Для набора данных от 3 млн. циркулирующих В-клеток каждую VH линию ассоциируют с одним (в идеальном случае) из >20000 клонов легкой цепи в наборе данных. Среди 259368 исключенных по иммунным локусам капель с VHVL парами 10870 кластеров реаранжировки VDJ тяжелого локуса присутствовали по меньшей мере в двух из шести физически разделенных фракциях эмульсии. Указанные кластеры представляют либо размноженные линии, либо независимую, но сходную реаранжировку одинаковых VJ экзонов. Если VDJ реаранжировка спарена с одинаковой VJ реаранжировкой в двух повторностях, оба эксперимента независимо производили действительно положительные результаты (33157 из 35922 возможных попарных сравнений для 2604 клонов с более редкими реаранжировками). Таким образом, точность для каждой повторности составляет 96,1% (0,923∧0,5).
Пример 15 - Извлечение кандидатной последовательности ВИЧ bNAb
[00441] Новые нативно спаренные широко нейтрализующие антитела (BNAb) к ВИЧ обнаружили путем интеллектуального анализа наших 38620 VHVL пар в отношении сходства с известными bNAb HCDR3, VDJ последовательностями и линиями донора 17, отобранных из литературы с использованием tblastx, MUSCLE и PhyML, с последующим неавтоматизированной проверки филогенетических деревьев полной V(D)J аминокислотной последовательности для выбора кандидатов антител, чередующихся с известными последовательностями bNAb.
Пример 16 - Экспрессия и очистка белка bNAb ВИЧ
[00442] Последовательности антитела синтезировали и клонировали в ранее описанные векторы тяжелой и легкой цепей. Плазмиды тяжелой и легкой цепей котрансфицировали (соотношение 1:1) в 293 клетки FreeStyle с использованием 293fectin (Invitrogen) согласно протоколу производителя. Супернатанты антител собирали через четыре дня после трансфекции и очищали с помощью аффинной хроматографии с использованием белка А. Очищенные антитела подвергали замене буфера в PBS перед применением в дополнительных анализах.
Пример 17 - Получение псевдовирусов и анализы нейтрализации
[00443] Псевдовирусы создавали с помощью трансфекции клеток 293Т с экспрессирующей ВИЧ-1 Env плазмидой и дефицитной в отношении Env плазмидой геномного остова (pSG3ΔEnv). Псевдовирусы собирали через 72 ч после трансфекции для применения в анализах нейтрализации. Нейтрализующую активность оценивали с использованием одного раунда анализа репликации псевдовируса и целевых клеток TZM-Bl. Вкратце, клетки TZM-Bl высеивали в 96-луночный плоскодонный планшет. К этому планшету добавляли псевдовирус, который предварительно инкубировали с серийными разведениями антитела в течение 1 ч при 37°С. Экспрессию репортерного гена люциферазы количественно определяли через 72 ч после инфицирования при лизисе и добавлении субстрата люциферазы Bright-Glo Luciferase (Promega). Для определения значений IC50 кривые зависимости ответа от дозы аппроксимировали с помощью нелинейной регрессии.
Пример 18 - Идентификация целевой цепи опухоли яичника
[00444] После одновременного захвата BCR и TCR из диссоциированной ткани опухоли яичника в эмульсии, прочтения фильтровали с использованием молекулярных штрих-кодов и штрих-кодов капель, как описано ранее, но затем искали присутствие каждого из четырех возможных типов целевых цепей (BCR VH, BCR VL, TCR Vα, TCR Vβ). Целевые цепи сохраняли, если их подтверждали с помощью по меньшей мере двух иРНК, каждая с помощью по меньшей мере двух прочтений секвенирования. Все штрих-коды капель, содержащие только VHVL BCR или VαVβ TCR пары, анализировали дополнительно. Клоны тяжелой цепи BCR и TCR бета цепи называли на основании отдельных аминокислотных последовательностей CDR3.
Пример 19 - Обнаружение белка в эмульсии посредством окрашивания меченным ДНК антителом
[00445] Одноцепочечные, 200 п.н. олигонуклеотиды ДНК обрабатывали так, чтобы они содержали уникальные 5 п.н. последовательности идентификации антигена и модифицировали с помощью 5' аминогруппы (Integrated DNA Technologies). Мышиные моноклональные антитела к CD4 человека (BioLegend, № по кат. 300516) и CD8a (BioLegend, № по кат. 301018) конъюгировали с олигонуклеотидными метками ДНК с использованием набора Thunder-Link (Innova Biosciences) согласно протоколу производителя. Для мечения клеток перед получением эмульсии два млн. отрицательно селектированных Т-клеток из периферической крови разводили в 400 мкл клеточного буфера + 2 мМ EDTA + 0,05% азида натрия. Одноцепочечную ДНК из молок лососевых добавляли к клеткам до конечной концентрации, составляющей 200 мкг/мл, и клетки центрифугировали при комнатной температуре в течение пяти минут. Смесь ДНК-меченных антител к CD4 и CD8a (каждое в конечной концентрации, составляющей 5 нМ) добавляли к клеткам и инкубировали при комнатной температуре в течение 30 минут. Клетки отмывали три раза с помощью клеточного буфера + 2 мМ EDTA + 0,05% азида натрия + 200 мкг/мл одноцепочечной ДНК из молок лососевых. Клетки ресуспендировали в клеточном буфере + 0,05% азида натрия до введения в анализ эмульсии. 30000 клеток использовали для секвенирования эмульсии.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТЫ АФФИННАЯ МОЛЕКУЛА-ОЛИГОНУКЛЕОТИД И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2763554C2 |
| СЕКВЕНИРОВАНИЕ ПОЛИНУКЛЕОТИДНЫХ БИБЛИОТЕК С ВЫСОКОЙ ПРОПУСКНОЙ СПОСОБНОСТЬЮ И АНАЛИЗ ТРАНСКРИПТОМОВ | 2018 |
|
RU2790291C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ АНАЛИЗА КЛЕТОЧНЫХ КОМПОНЕНТОВ | 2016 |
|
RU2761432C2 |
| ИДЕНТИФИКАЦИЯ АССОЦИИРОВАННЫХ С ОБРАЗЦОМ ПОЛИНУКЛЕОТИДОВ | 2012 |
|
RU2644681C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ АНАЛИЗА КЛЕТОЧНЫХ КОМПОНЕНТОВ | 2016 |
|
RU2717491C2 |
| СПОСОБЫ И СРЕДСТВА ПОЛУЧЕНИЯ БИБЛИОТЕКИ ДЛЯ СЕКВЕНИРОВАНИЯ | 2019 |
|
RU2815513C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИЗМЕРЕНИЯ И КАЛИБРОВКИ СИСТЕМАТИЧЕСКОЙ ОШИБКИ АМПЛИФИКАЦИИ В МУЛЬТИПЛЕКСНЫХ ПЦР-РЕАКЦИЯХ | 2013 |
|
RU2631797C2 |
| ТРАНСПОЗИЦИЯ С СОХРАНЕНИЕМ СЦЕПЛЕНИЯ ГЕНОВ | 2015 |
|
RU2736728C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНОЕ СЕКВЕНИРОВАНИЕ ОДИНОЧНОЙ КЛЕТКИ СО СНИЖЕННОЙ ОШИБКОЙ АМПЛИФИКАЦИИ | 2019 |
|
RU2833615C2 |
| СОПРЯЖЕННЫЕ С G-БЕЛКОМ РЕЦЕПТОРЫ DROSOPHILA, НУКЛЕИНОВЫЕ КИСЛОТЫ И СПОСОБЫ, ИМЕЮЩИЕ К НИМ ОТНОШЕНИЕ | 2003 |
|
RU2326385C2 |

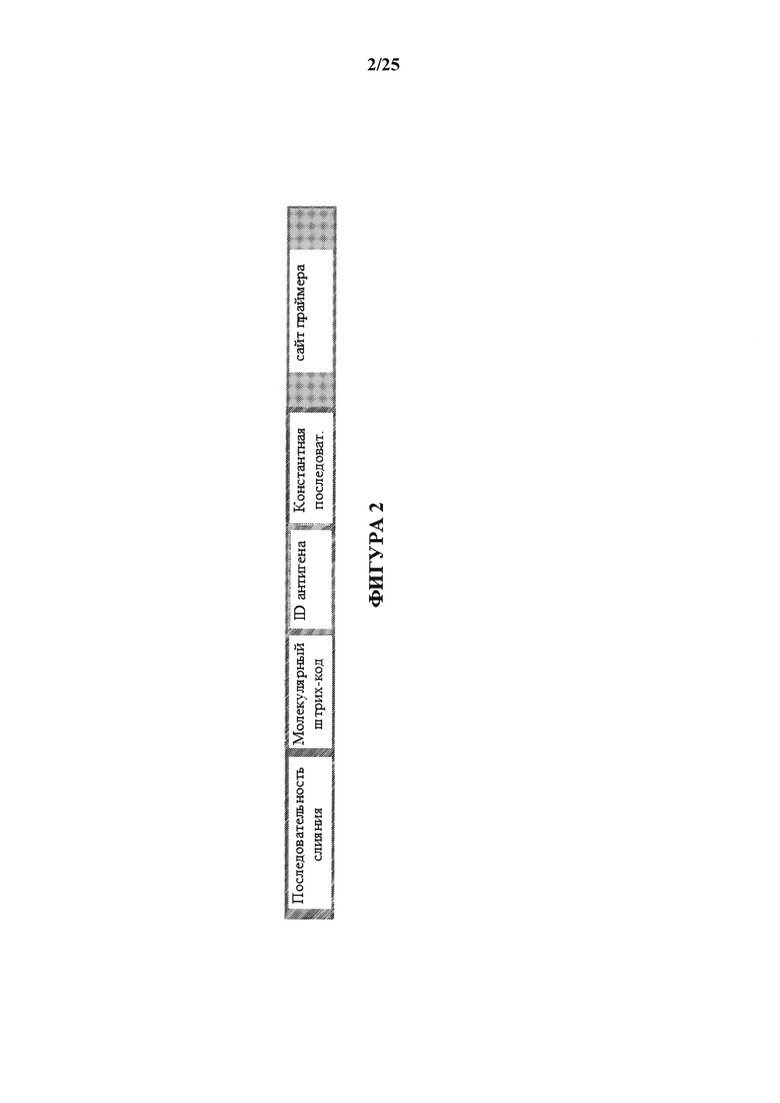
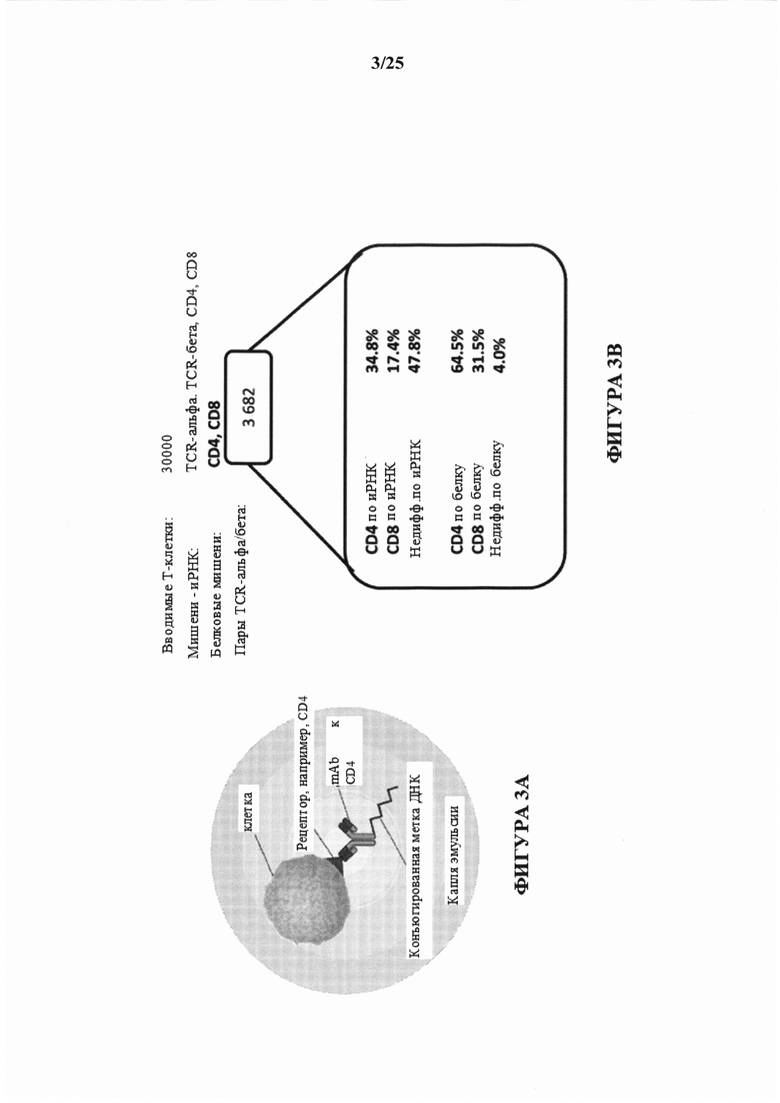

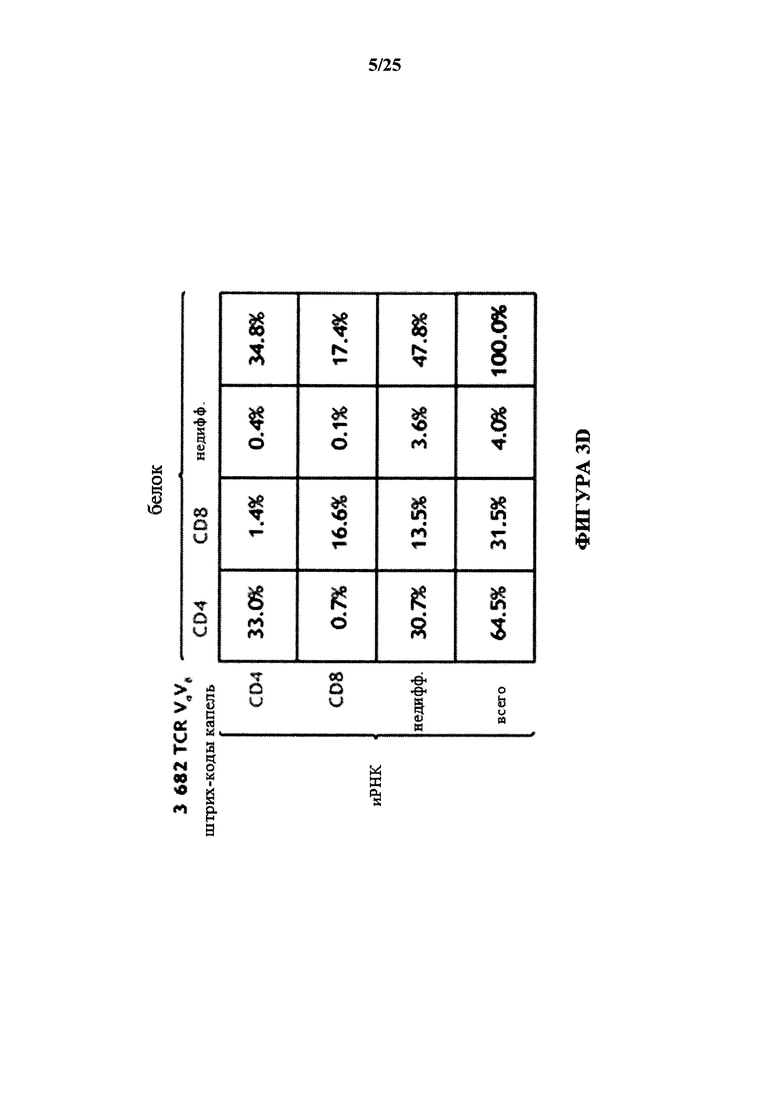
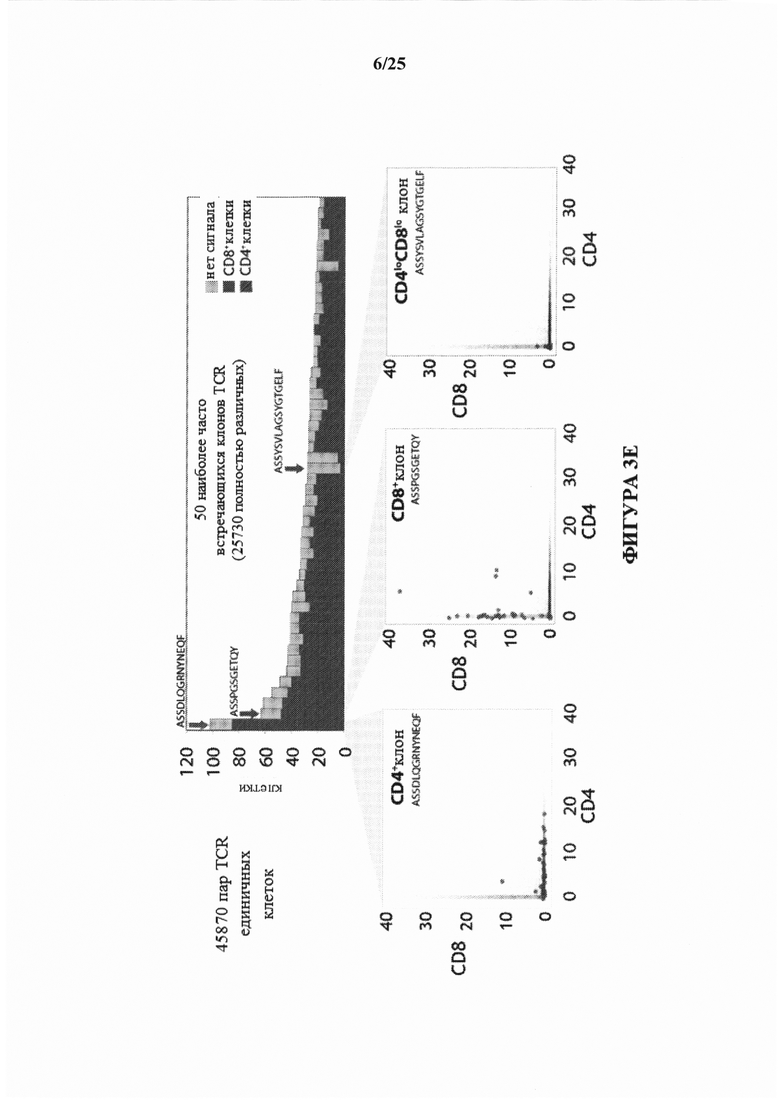













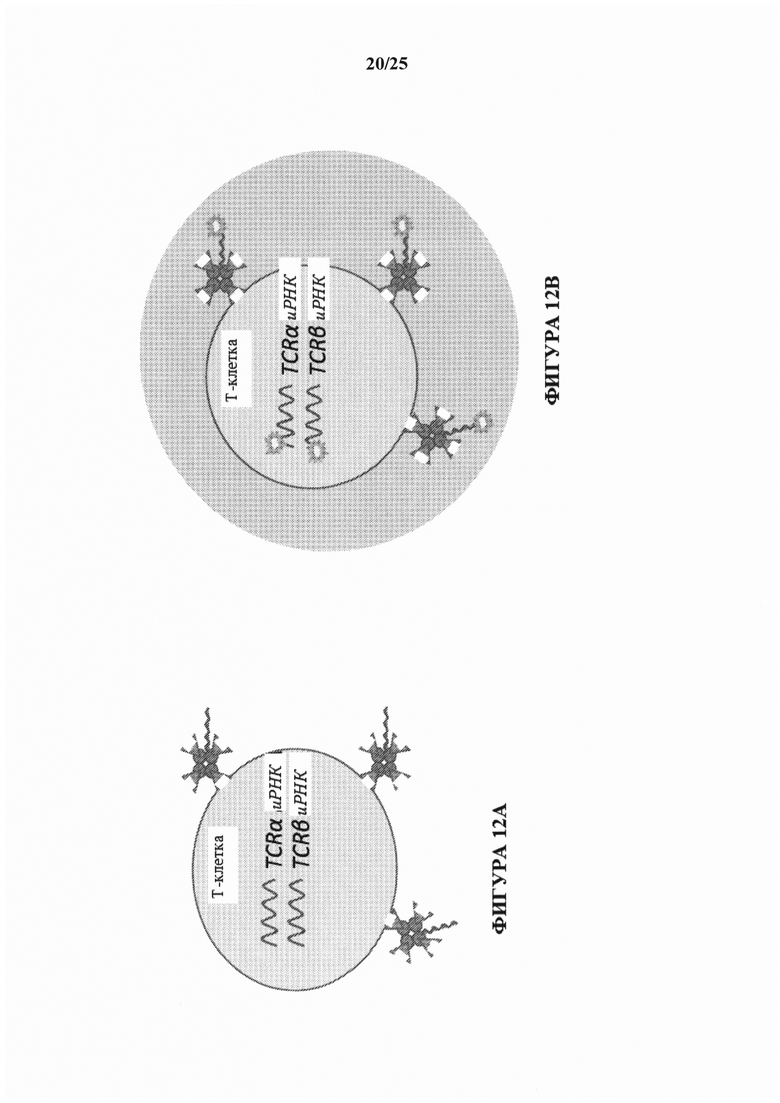

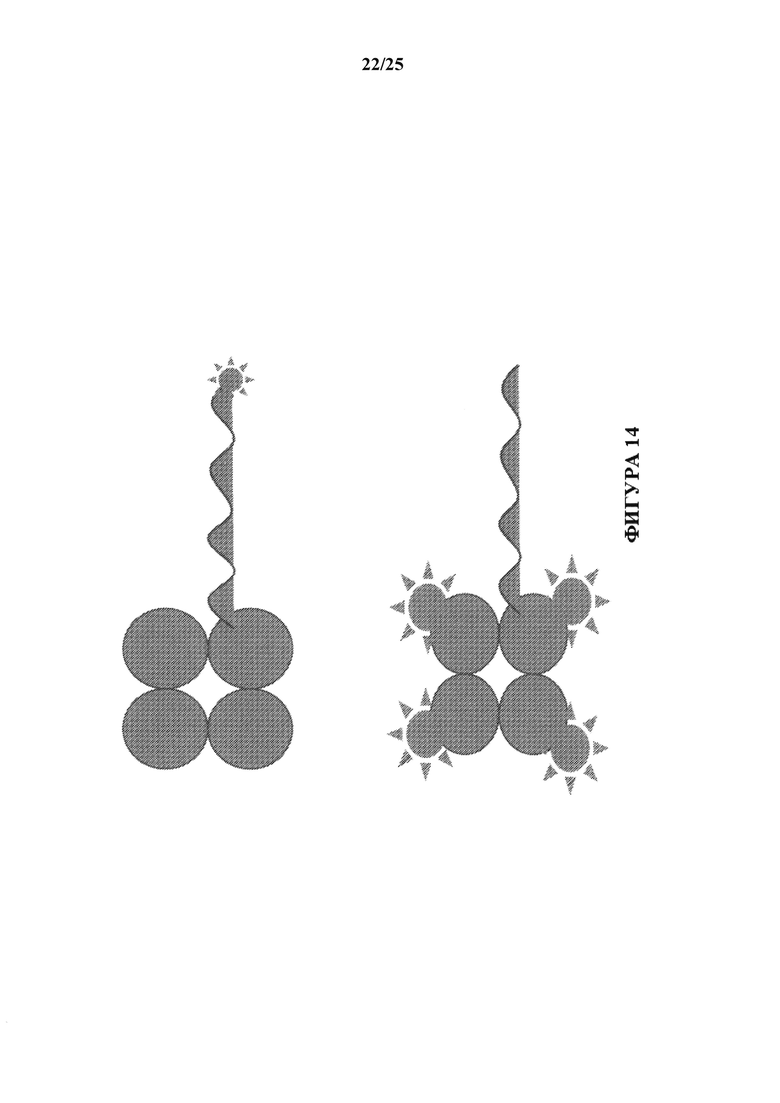



Группа изобретений относится к области биотехнологии. Предложен способ и композиция для получения характеристики клеток, а также набор для получения конъюгатов аффинная часть-олигонуклеотид. Способ включает проведение реакции в капле, причем реакция включает в себя прикрепление штрих-кодированного полинуклеотида капли к олигонуклеотидной части конъюгата аффинная часть-олигонуклеотид, где аффинная часть конъюгата связывается с экспрессируемым отдельно взятой клеткой целевым антигеном, а олигонуклеотидная часть конъюгата содержит последовательность идентификации антигена, секвенирование олигонуклеотидной части конъюгата с получением информации о последовательности и определение характеристики клетки в капле. Композиция содержит множество капель, где отдельно взятая капля включает клетку, штрих-кодированный полинуклеотид капли и конъюгат аффинная часть-олигонуклеотид. Набор включает первый контейнер с содержащим первую последовательность идентификации антигена (AID) и первую штрих-кодовую последовательность аффинной молекулы (АМВ) первым олигонуклеотидом, второй контейнер с содержащим вторую последовательность идентификации антигена (AID) и вторую штрих-кодовую последовательность аффинной молекулы (АМВ) вторым олигонуклеотидом, а также контейнеры с реагентами. Причем вторые последовательности AID, АМВ отличаются от первых последовательностей AID, АМВ. Изобретения обеспечивают возможность анализирования антигена отдельно взятой клетки без потребности в сортировке клеток. 3 н. и 17 з.п. ф-лы, 42 ил., 19 пр.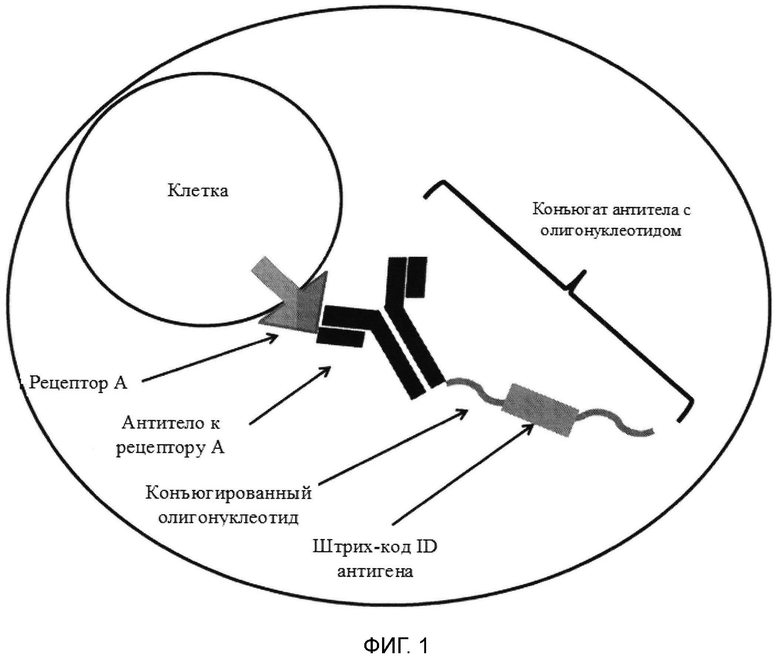
1. Способ получения характеристики клеток, включающий:
проведение реакции в по меньшей мере одной отдельно взятой капле из множества капель, причем реакция включает в себя прикрепление штрих-кодированного полинуклеотида первой капли, который содержит штрих-кодовую последовательность первой капли, к олигонуклеотидной части конъюгата аффинная часть-олигонуклеотид,
причем аффинная часть конъюгата аффинная часть-олигонуклеотид связывается с целевым антигеном, экспрессируемым отдельно взятой клеткой, выделенной в указанной по меньшей мере одной отдельно взятой капле множества капель,
причем олигонуклеотидная часть содержит последовательность идентификации антигена (AID),
секвенирование олигонуклеотидной части конъюгата аффинная часть-олигонуклеотид, комплементарной ей последовательности, ее амплифицированного продукта или их комбинации с получением информации о последовательности и
определение по меньшей мере одной характеристики отдельно взятой клетки в по меньшей мере одной отдельно взятой капле на основании информации о последовательности,
необязательно причем целевой антиген является внеклеточным антигеном.
2. Способ по п. 1, в котором указанная отдельно взятая клетка происходит из множества клеток из одного образца.
3. Способ по п. 1, в котором последовательность AID штрих-кодируют в отношении целевого антигена или аффинной части конъюгата аффинная часть-олигонуклеотид.
4. Способ по п. 1, причем способ дополнительно включает приведение в контакт множества клеток, содержащего указанную отдельно взятую клетку, с конъюгатом аффинная часть-олигонуклеотид до того, как указанную отдельно взятую клетку выделяют в по меньшей мере одной отдельно взятой капле.
5. Способ по п. 1, при котором штрих-кодовая последовательность первой капли штрих-кодированного полинуклеотида первой капли или его ампликона в любой отдельно взятой капле из множества капель является уникальной для данной одной отдельно взятой капли.
6. Способ по любому из предыдущих пунктов, причем способ дополнительно включает лизирование указанной отдельно взятой клетки в указанной по меньшей мере одной отдельно взятой капле и прикрепление штрих-кодированного полинуклеотида второй капли, содержащего штрих-кодовую последовательность второй капли, к полинуклеотиду клетки из указанной отдельно взятой клетки и необязательно одновременное прикрепление указанного штрих-кодированного полинуклеотида первой капли и указанного штрих-кодированного полинуклеотида второй капли.
7. Способ по п. 6, в котором олигонуклеотидная часть первого или второго конъюгата аффинная часть-олигонуклеотид дополнительно содержит по меньшей мере одну из штрих-кодовой последовательности аффинной молекулы (АМВ), последовательности связывания праймера, слитой последовательности или константной последовательности.
8. Способ по п. 6, причем способ дополнительно включает секвенирование олигонуклеотидной части конъюгата аффинная часть-олигонуклеотид вместе с прикрепленным штрих-кодированным полинуклеотидом капли, комплементарными ему последовательностями, их амплифицированными продуктами или их комбинацией, тем самым производя прочтения олигонуклеотидной последовательности, и/или секвенирование полинуклеотида клетки вместе с прикрепленным штрих-кодированным полинуклеотидом капли, комплементарными ему последовательностями, их амплифицированными продуктами или их комбинацией, тем самым производя прочтения полинуклеотида клетки.
9. Способ по п. 8, причем способ дополнительно включает сравнение прочтений олигонуклеотидной последовательности с прочтениями полинуклеотидной последовательности клетки, штрих-кодовых последовательностей капли прочтений олигонуклеотидной последовательности с штрих-кодовыми последовательностями капли прочтений полинуклеотидной последовательности клетки, последовательностей идентификации антигена (AID) прочтений олигонуклеотидной последовательности с штрих-кодовыми последовательностями аффинной молекулы (АМВ) прочтений олигонуклеотидной последовательности или прочтений полинуклеотидной последовательности клетки; и/или анализ штрих-кодовых последовательностей капли прочтений полинуклеотидной последовательности клетки или штрих-кодовых последовательностей молекулы прочтений полинуклеотидной последовательности клетки,
причем способ необязательно дополнительно включает определение характеристики клетки на основании сравнения и/или анализа.
10. Способ по п. 6, в котором указанная штрих-кодовая последовательность первой капли указанного штрих-кодированного полинуклеотида первой капли, прикрепленного к олигонуклеотидной части конъюгата аффинная часть-олигонуклеотид, и указанная штрих-кодовая последовательность второй капли указанного штрих-кодированного полинуклеотида второй капли, прикрепленного к полинуклеотиду клетки, являются одной и той же и/или происходят из одного и того же матричного штрих-кодированного полинуклеотида капли в по меньшей мере одной отдельно взятой капле.
11. Способ по п. 1, в котором указанная по меньшей мере одна отдельно взятая капля является каплей эмульсии.
12. Способ по п. 6, причем способ дополнительно включает прикрепление молекулярного штрих-кодированного полинуклеотида, содержащего молекулярную штрих-кодовую последовательность, к указанному полинуклеотиду клетки, причем молекулярную штрих-кодовую последовательность штрих-кодируют в отношении указанного полинуклеотида клетки и/или его ампликонов.
13. Способ по п. 6, в котором прикрепление указанного штрих-кодированного полинуклеотида первой капли к олигонуклеотидной части или прикрепление указанного штрих-кодированного полинуклеотида второй капли к полинуклеотиду клетки включает реакцию лигирования, ферментативную реакцию, реакцию гибридизации, реакцию достройки или реакцию амплификации.
14. Способ по п. 1, в котором внеклеточный антиген отдельно взятой клетки представляет собой антиген, специфический в отношении иммунной клетки, необязательно Т-клетки или В-клетки, или экспрессируемый ею.
15. Способ по п. 14, в котором внеклеточный антиген выбирают из группы, состоящей из CD154, CD4, CD8, CD137, CD40L, CD80, CD86, CD11c, CD25, CD69, CD44, CD125, CD2, CD3, CD5, CD14 и CD19.
16. Способ по п. 1, в котором аффинная часть конъюгата аффинная часть-олигонуклеотид представляет собой антитело или его фрагмент, пептид, белок, аптамер, малую молекулу, лекарственное средство или клетку.
17. Способ по п. 16, в котором аффинная часть конъюгата аффинная часть-олигонуклеотид содержит одно из главного комплекса гистосовместимости (МНС) или его функциональной или связывающей части или пептида, который связывается с антителом или химерным антигенным рецептором (CAR).
18. Композиция для получения характеристики клеток, содержащая множество капель, причем по меньшей мере одна отдельно взятая капля из множества капель содержит следующее:
(а) отдельно взятая клетка из образца, содержащего множество клеток;
(b) штрих-кодированный полинуклеотид капли или комплементарная ему последовательность, содержащие штрих-кодовую последовательность капли; и
(c) конъюгат аффинная часть-олигонуклеотид, причем аффинная часть конъюгата аффинная часть-олигонуклеотид связывается с целевым антигеном отдельно взятой клетки;
причем штрих-кодированный полинуклеотид капли или комплементарная ему последовательность прикреплены к олигонуклеотидной части конъюгата аффинная часть-олигонуклеотид;
причем секвенирование олигонуклеотидной части конъюгата аффинная часть-олигонуклеотид, комплементарной ему последовательности, их амплифицированного продукта или их комбинации дает информацию о последовательности, которую можно применять для определения по меньшей мере одной характеристики отдельно взятой клетки; и
необязательно причем отдельно взятую клетку лизируют.
19. Набор для получения конъюгатов аффинная часть-олигонуклеотид, содержащий:
(a) первый контейнер, содержащий первый олигонуклеотид, содержащий первую последовательность идентификации антигена (AID) и первую штрих-кодовую последовательность аффинной молекулы (АМВ), причем первая последовательность AID и первая последовательность АМВ являются известными последовательностями;
(b) второй контейнер, содержащий второй олигонуклеотид, содержащий вторую последовательность идентификации антигена (AID) и вторую штрих-кодовую последовательность аффинной молекулы (АМВ), причем вторая последовательность AID представляет собой известную последовательность и отличается от первой последовательности AID, и причем вторая последовательность АМВ представляет собой известную последовательность и отличается от первой последовательности АМВ;
(c) один или несколько дополнительных контейнеров, содержащих реагенты, способные конъюгировать первый олигонуклеотид с первой аффинной молекулой, и/или содержащих реагенты, способные конъюгировать второй олигонуклеотид со второй аффинной молекулой,
причем первая аффинная молекула способна связываться с первым внеклеточным белком клетки, а вторая аффинная молекула способна связываться со вторым внеклеточным белком клетки, причем первый внеклеточный белок отличается от второго внеклеточного белка; и
(d) набор инструкций, описывающих, как конъюгировать первый олигонуклеотид с первой аффинной молекулой и второй олигонуклеотид со второй аффинной молекулой.
20. Набор по п. 19, дополнительно содержащий следующее:
(e) дополнительный контейнер, содержащий множество штрих-кодированных полинуклеотидов капли, причем каждый штрих-кодированный полинуклеотид капли из множества штрих-кодированных полинуклеотидов капли содержит уникальную штрих-кодированную последовательность капли; и
(f) реагенты и набор инструкций для прикрепления штрих-кодированного полинуклеотида капли из множества штрих-кодированных полинуклеотидов капли к первому или второму олигонуклеотиду при конъюгировании с первой или второй аффинной молекулой.
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| СПОСОБ ИММУНОЛОГИЧЕСКОГО АНАЛИЗА БЕЛКА CXCL1 ЧЕЛОВЕКА | 2009 |
|
RU2521669C2 |
Авторы
Даты
2022-08-24—Публикация
2016-09-24—Подача