ОБЛАСТЬ ТЕХНИКИ
Системы, способы и композиции, предлагаемые в настоящем документе, относятся к полым гранулам, инкапсулирующим одну клетку, способам изготовления полых гранул и способам применения полых гранул для проведения множества совместных анализов на инкапсулированной клетке, включая, например, секвенирование с пространственным индексированием и получение библиотеки нуклеиновых кислот.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Детекцию специфических последовательностей нуклеиновых кислот, присутствующих в биологическом образце, используют, например, как способ выявления и классификации микроорганизмов, способ диагностики инфекционных заболеваний, для выявления и характеристики генетических аномалий, выявления генетических изменений, связанных со злокачественной опухолью, изучения генетической предрасположенности к заболеванию, и измерения ответа на различные виды лечения. Распространенным способом обнаружения специфических последовательностей нуклеиновых кислот в биологическом образце является секвенирование нуклеиновой кислоты.
Секвенирования следующего поколения представляют собой мощные инструменты, которые генерируют большие объемы геномных данных за цикл. Интерпретация и анализ такого большого количества данных может быть сложной задачей. Секвенирование ДНК одиночной клетки возникло как инструмент для изучения геномной гетерогенности. Конкретно, микробиом, который несет множество повторяющихся геномных областей, может быть секвенирован путем получения последовательностей ДНК только из одной клетки. Проведение множественных ферментативных реакций на одной клетке ненадежно из-за проблем, связанных с ограничением доступа к внутриклеточным биомолекулам в одной клетке во время множества анализов. Например, многие анализы на основе клеток не могут обеспечить безопасность внутриклеточных молекул, что приводит к потере биомолекул во время проведения анализа.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к системам, способам и композициям для проведения множества совместных анализов на одиночной клетке, где одиночная клетка инкапсулирована в полую гранулу, таким образом, что одиночная клетка локализована для проведения множества совместных анализов, включая, например, лизис, анализ ДНК, анализ РНК, анализ белков, тагментацию, амплификацию нуклеиновых кислот, секвенирование нуклеиновых кислот, получение библиотеки ДНК, анализ для оценки хроматина, доступного для транспозазы, с использованием секвенирования (ATAC-seq), транспозицию, сохраняющую смежность (CPT-seq), комбинаторное индексированное секвенирование одиночной клетки (SCI-seq), или амплификацию генома одиночной клетки, или любое их сочетание, проводимое последовательно на одиночной клетке.
Некоторые варианты осуществления, предлагаемые в настоящем документе, относятся к полой грануле, инкапсулирующей одиночную клетку. В некоторых вариантах осуществления полая гранула включает полимерную оболочку и одиночную клетку, расположенную внутри полимерной оболочки. В некоторых вариантах осуществления полимерная оболочка содержит поры, которые позволяют реагентам диффундировать через полимерную оболочку с одновременным сохранением одиночной клетки.
Дополнительные варианты осуществления относятся к способу проведения множества последовательных совместных анализов на одиночной клетке, инкапсулированной в полой грануле. В некоторых вариантах осуществления способ включает получение полой гранулы, как описано в настоящем документе, где полая гранула инкапсулирует одиночную клетку, и последовательное контактирование одиночной клетки с реагентами для проведения множества последовательных совместных анализов.
Некоторые варианты осуществления, предлагаемые в настоящем документе, относятся к способу инкапсуляции одиночной клетки внутри полой гранулы. В некоторых вариантах осуществления способ включает смешивание одиночной клетки с полимером для образования смеси и смешивание смеси с маслом для перекрестного сшивания для образования полимерной оболочки, инкапсулирующей одиночную клетку, где полимерная оболочка содержит поры, которые позволяют реагентам диффундировать через полимерную оболочку с одновременным сохранением одиночной клетки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ. 1 представляет собой схематическую диаграмму варианта осуществления микрофлюидной системы генератора капель, которую можно использовать для получения полых гранул, инкапсулирующих клетку.
ФИГ. 2 показывает микрофотографии и схематическое представление варианта осуществления полых гранул, которые способны к увеличению размера в присутствии водного буфера. Микрофотографии показывают гранулы в различных состояниях, в том числе (слева направо): дегидратированные гранулы; начало контакта гранул с водной фазой; гранулы, начинающие разбухать; и полностью разбухшие гранулы.
ФИГ. 3 представляет собой схематическое изображение, которое показывает вариант осуществления для повышения пористости гранул температурными или химическими способами. Как показано на ФИГ. 3, увеличение пористости гранул может повысить поток частиц внутрь или наружу гранулы, и контроль над пористостью обеспечивает контроль над частицами (включая размер частиц), которые текут внутрь или наружу гранулы.
ФИГ. 4 представляет собой схематическое изображение, которое показывает вариант осуществления способа инкапсуляции клеток без использования устройств путем размещения мономерных единиц полимера над одиночной клеткой.
ФИГ. 5 представляет собой схематическое изображение, которое показывает вариант осуществления инкапсулированной клетки внутри полимера, образованной способами без использования устройств, где полимерная оболочка присоединена к клетке путем специфических взаимодействий при помощи молекул для специфического связывания.
ФИГ. 6 показывает микрофотографии гранул, окрашенных флуоресцентными красителями, которые показывают клетки, инкапсулированные внутри гранул. Микрофотографии показывают (слева направо): окрашивание тиол-специфическими флуорофорами, нацеленными на свободный ПЭГ-малеинимид; окрашивание флуорофорами с техасским красным, нацеленными на свободные -SH группы; и окрашивание ядер окраской по Хехсту.
ФИГ. 7 представляет собой схематическое изображение, которое показывает вариант осуществления способа проведения множества совместных анализов на полой грануле, инкапсулирующей клетку. ФИГ. 7 показывает вариант осуществления проведения тагментации для получения фрагментов для ATAC-seq, обратной транскрипции для инициации синтеза кДНК, и реакций ПЦР для получения индексированной библиотеки.
ФИГ. 8 представляет собой схематическое изображение, которое показывает вариант осуществления способа проведения множества совместных анализов на полой грануле, инкапсулирующей клетку. ФИГ. 8 показывает вариант осуществления проведения тагментации для получения фрагментов для ATAC-seq, обратной транскрипции для инициации синтеза кДНК, и реакций ПЦР со случайным расширением для секвенирования полноразмерной РНК для получения индексированной библиотеки.
ФИГ. 9 представляет собой схематическое изображение, которое показывает вариант осуществления способа проведения множества совместных анализов на полой грануле, инкапсулирующей клетку. ФИГ. 9 показывает подход трехуровневого комбинаторного индексирования с использованием двух раундов индексированного расщепленного лигирования и одного раунда индексированной ПЦР.
ФИГ. 10 представляет собой схематическое изображение, которое показывает вариант осуществления способа проведения множества совместных анализов на полой грануле, инкапсулирующей клетку. ФИГ. 10 показывает множество совместных анализов для комбинаторного индексирования с индексированными транспосомами.
ФИГ. 11 представляет собой схематическое изображение, которое показывает вариант осуществления способа проведения множества совместных анализов на полой грануле, инкапсулирующей клетку. ФИГ. 11 показывает множество совместных анализов для полногеномной амплификации одиночной клетки.
ФИГ. 12 представляет собой технологическую схему, которая показывает вариант осуществления способа получения полногеномной библиотеки при помощи полой гранулы, инкапсулирующей клетку.
ПОДРОБНОЕ ОПИСАНИЕ
В следующем подробном описании дается ссылка на прилагаемые чертежи, которые являются его частью. На чертежах аналогичные символы, как правило, обозначают аналогичные компоненты, если контекст не требует иного. Иллюстративные варианты, описанные в подробном описании, чертежах и пунктах формулы изобретения не являются ограничивающими. Могут быть использованы и другие варианты, и могут быть внесены другие изменения, не выходящие за рамки сущности или объема объекта изобретения, представленного в настоящем документе. Понятно, что аспекты настоящего раскрытия, как, в основном, описано в настоящем документе и проиллюстрировано на фигурах, могут быть расположены, заменены, объединены, разделены и выполнены в широком разнообразии различных конфигураций, причем все они явно рассматриваются в настоящем документе.
Варианты осуществления, представленные в настоящем документе, относятся к полым гранулам, инкапсулирующим одиночную клетку, способам получения полых гранул, и способам проведения множества совместных анализов на одиночной клетке, инкапсулированной в полой грануле. Полые гранулы могут включать гидрогелевые полимеры и кросслинкеры, которые смешивают в присутствии клетки и которые формируют полые гранулы, инкапсулирующие клетку. Полые гранулы могут содержать поры, которые позволяют реагентам диффундировать через полую гранулу с сохранением клетки внутри полой гранулы, и таким образом, позволять реакциям проходить внутри полых гранул. В некоторых вариантах осуществления полые гранулы позволяют проводить coвместные анализы на одной и той же одиночной клетке с одновременным поддержанием клеточной смежности. В частности, способы, системы и композиции, предлагаемые в настоящем документе позволяют локализовать внутриклеточные биомолекулы и получить к ним доступ в инкапсулированных клетках. Таким образом, в некоторых вариантах осуществления полые гранулы, описываемые в настоящем документе, обозначают в настоящем документе как частицы для поддержания смежности. Таким образом, Как применяют в настоящем документе термин «частица для поддержания смежности» относится к полой грануле, инкапсулирующему одиночную клетку.
Частицы для поддержания смежности, описываемые в настоящем документе, можно использовать для компартментализации клетки для способов «следующего поколения» и для проведения анализов с множеством аналитов на отдельной клетке. Частицы для поддержания смежности и способы их применения, описываемые в настоящем документе, позволяют эффективно анализировать миллионы клеток по отдельности и, таким образом, снижать стоимость получения образца и поддержания смежности образца. Композиции и способы, описываемые в настоящем документе, поддерживают клеточную смежность без использования стратегий внешней компартментализации (микрофлюидная техника), таких как эмульсии, иммобилизация или другие микрокомпартменты.
В некоторых вариантах осуществления частицы для поддержания смежности, как описано в настоящем документе, можно использовать в анализах для исследования одиночной клетки. Анализы, которые можно проводить на одиночной клетке, могут включать, например, лизис клеток, анализ ДНК, анализ РНК, секвенирование нуклеиновых кислот, анализ белков, тагментацию, амплификацию нуклеиновых кислот, получение библиотеки ДНК, анализ для оценки хроматина, доступного для транспозазы, с использованием секвенирования (ATAC-seq), транспозицию, сохраняющую смежность (CPT-seq), комбинаторное индексированное секвенирование одиночной клетки (SCI-seq), или амплификацию генома одиночной клетки, или любое их сочетание, проводимое последовательно.
Применение частиц для поддержания смежности для проведения одного или нескольких анализов на одиночной клетке можно использовать одновременно на множестве частиц для поддержания смежности для того чтобы одновременно проводить совместные анализы на ряде одиночных клеток, например, от 10000 до 1 миллиона одиночных клеток, таких как 10000, 50000, 100000, 500000 или 1 миллион одиночных клеток.
Размер пор частицы для поддержания смежности можно сконструировать таким образом, чтобы обеспечить диффузию реагентов, таких как ферменты, химические вещества, и праймеры меньшего размера (˂ 50 п.о), с одновременным сохранением одиночной клетки самой по себе или с одновременным сохранением других более крупных частиц, таких как более крупные нуклеиновые кислоты (˃ 300 п.о.) внутри полой гранулы во время проведения одного или нескольких анализов.
Как применяют в настоящем документе, термин «реагент» описывает вещество или смесь двух или более веществ, подходящих для реагирования, взаидействия с образцом, растворения образца или добавления к образцу, и может включать вещества, применяемые в анализах, описываемых в настоящем документе, включая вещества для лизиса, анализа нуклеиновых кислот, реакций амплификации нуклеиновых кислот, анализа белков, реакций тагментации, реакций ATAC-seq, CPT-seq или SCI-seq, или других анализов. Таким образом, реагенты могут включать, например, буферы, химические вещества, ферменты, полимеразу, праймеры с размером менее чем 50 пар оснований, матричные нуклеиновые кислоты, нуклеотиды, метки, краски, или нуклеазы. В некоторых вариантах осуществления реагент включает лизоцим, протеиназу K, случайные гексамеры, полимеразу (например, Φ29 ДНК-полимеразу, Taq-полимеразу, Bsu-полимеразу), транспозазу (например, Tn5), праймеры (например, адаптерные последовательности P5 и P7), лигазу, катализирующий фермент, дезоксинуклеотид трифосфаты, буферы, или двухвалентные катионы.
Частицы для поддержания смежности
В некоторых вариантах осуществления полая гранула имеет полимерную оболочку, которую получали из композиции гидрогеля. Как применяют в настоящем документе, термин «гидрогель» относится к веществу, которое образуется, когда органический полимер (природный или синтетический) перекрестно сшивают посредством ковалентных, ионных, или водородных связей для получения трехмерной структуры с открытой решеткой, которая захватывает молекулы воды для формирования геля. В некоторых вариантах осуществления гидрогель может быть биосовместимым гидрогелем. Как применяют в настоящем документе, термин «биосовместимый гидрогель» относится к полимеру, который образует гель, не токсичный для живых клеток и обеспечивающий достаточную диффузию кислорода и питательных веществ к захваченным клеткам для обеспечения жизнеспособности. В некоторых вариантах осуществления материал для гидрогеля включает альгинат, акриламид, или полиэтиленгликоль (ПЭГ), ПЭГ-акрилат, ПЭГ-амин, ПЭГ-карбоксилат, ПЭГ-дитиол, ПЭГ-эпоксид, ПЭГ-изоцианат, ПЭГ-малеинимид, полиакриловую кислоту (PAA), поли(метил метакрилат) (PMMA), полистирол (PS), полистирола сульфонат (PSS), поливинилпирролидон (PVPON), N, N’-бис(акрилоил)цистамин, полипропиленоксид (PPO), поли(гидроксиэтил метакрилат) (PHEMA), поли(N-изопропилакриламид) (PNIPAAm), поли(молочную кислоту) (PLA), сополимер молочной и гликолевой кислот (PLGA), поликапролактон (PCL), поли(винилсульфоновую кислоту) (PVSA), поли(L-аспарагиновую кислоту), поли(L-глутаминовую кислоту), полилизин, агар, агарозу, гепарин, альгината сульфат, декстрана сульфат, гиалуроновую кислоту, пектин, каррагенан, желатин, хитозан, целлюлозу, коллаген, бисакриламид, диакрилат, диаллиламин, триаллиламин, дивинил сульфон, диаллиловый простой эфир диэтиленгликоля, этиленгликоль диакрилат, полиметиленгликоль диакрилат, полиэтиленгликоль диакрилат, триметилопропоан триметакрилат, этоксилированный триметилол триакрилат, или этоксилированный пентаэритритол тетракрилат, или комбинации, или их смеси. В некоторых вариантах осуществления гидрогель представляет собой альгинат, акриламид, или материал на основе ПЭГ. В некоторых вариантах осуществления гидрогель представляет собой материал на основе ПЭГ с химическим составом на основе реакций акрилат-дитиола и эпоксид-амина. В некоторых вариантах осуществления гидрогель формирует полимерную оболочку, которая включает ПЭГ-малеинимид/дитиоловое масло, ПЭГ-эпоксид/аминовое масло, ПЭГ-эпоксид/ПЭГ-амин, или ПЭГ-дитиол/ПЭГ-акрилат. В некоторых вариантах осуществления материал для гидрогеля выбран, чтобы избежать образования свободных радикалов, которые имеют потенциал для повреждения внутриклеточных биомолекул. В некоторых вариантах осуществления гидрогелевый полимер включает 60-90% жидкости, такой как вода, и 10-30% полимера. В определенных вариантах осуществления содержание воды в гидрогеле составляет приблизительно 70-80%. Как применяют в настоящем документе, термин «приблизительно» или «примерно» при модификации числового значения относится к вариациям, которые могут происходить с числовым значением. Например, вариации могут происходить из-за различий в производстве определенного субстрата или компонента. В одном из вариантов осуществления термин «приблизительно» означает в пределах 1%, 5%, или до 10% от указанного числового значения.
Как применяют в настоящем документе, полимерная оболочка представляет собой полимерную поверхность полой гранулы, имеющего оболочку с внутренней частью, которая инкапсулирует одиночную клетку. Из-за природы полых гранул, описываемых в настоящем документе, частицы для поддержания смежности могут сохранять генетический материал после нескольких анализов и могут высвобождать его путем физической силы, расщепления химических веществ, или путем создания осмотического дисбаланса в зависимости от толщины полимерной оболочки.
Гидрогели можно получать путем перекрестного сшивания гидрофильных биополимеров или синтетических полимеров. Таким образом, в некоторых вариантах осуществления гидрогель может включать кросслинкер. Как применяют в настоящем документе, термин «кросслинкер» относится к молекуле, которая может формировать трехмерную сеть при реагировании с подходящими базовыми мономерами. Примеры гидрогелевых полимеров, которые могут содержать один или несколько кросслинкеров, в качестве неограничивающих примеров включают, гиалуроновые кислоты, хитозаны, агар, гепарин, сульфат, целлюлозу, альгинаты (включая альгината сульфат), коллаген, декстраны (включая декстрансульфат), пектин, каррагенан, полилизин, желатины (включая желатин типа A), агарозу, (мет)акрилат-олиголактид-PEO-олиголактид-(мет)акрилат, PEO-PPO-PEO сополимеры (Плюроники), поли(фосфазен), поли(метакрилаты), поли(N-винилпирролидон), PL(G)A-PEO-PL(G)A сополимеры, поли(этилен имин), полиэтиленгликоль (ПЭГ)-тиол, ПЭГ-акрилат, акриламид, N, N’-бис(акрилoил)цистамин, ПЭГ, полипропиленоксид (PPO), полиакриловую кислоту, поли(гидроксиэтил метакрилат) (PHEMA), поли(метил метакрилат) (PMMA), поли(N-изопропилакриламид) (PNIPAAm), поли(молочную кислоту) (PLA), сополимер молочной и гликолевой кислот (PLGA), поликапролактон (PCL), поли(винилсульфоновую кислоту) (PVSA), поли(L-аспарагиновую кислоту), поли(L-глутаминовую кислоту), бисакриламид, диакрилат, диаллиламин, триаллиламин, дивинил сульфон, диаллиловый простой эфир диэтиленгликоля, этиленгликоль диакрилат, полиметиленгликоль диакрилат, полиэтиленгликоль диакрилат, триметилопропоан триметакрилат, этоксилированный триметилол триакрилат, или этоксилированный пентаэритритол тетракрилат, или их сочетания. Таким образом, например, комбинация может включать полимер и кросслинкер, например полиэтиленгликоль (ПЭГ)-тиол/ПЭГ-акрилат, акриламид/N, N’-бис(акрилоил)цистамин (BACy), или ПЭГ/полипропиленоксид (PPO). В некоторых вариантах осуществления полимерная оболочка включает полиэтиленгликоль (ПЭГ) с четырьмя функциональными концами. В некоторых вариантах осуществления полиэтиленгликоль (ПЭГ) с четырьмя функциональными концами выбран из группы, состоящей из ПЭГ-акрилата, ПЭГ-амина, ПЭГ-карбоксилата, ПЭГ-дитиола, ПЭГ-эпоксида, ПЭГ-изоцианата, и ПЭГ-малеинимида.
В одном из вариантов осуществления, кросслинкер представляет собой кросслинкер мгновенного действия или медленный кросслинкер. Кросслинкер мгновенного действия представляет собой кросслинкер, который мгновенно образует перекрестные сшивки в полимере гидрогеля, и в настоящем документе он также называется «клик-химией». Кросслинкеры мгновенного действия могут включать дитиоловое масло+ПЭГ-малеинимид или ПЭГ эпоксид+аминовое масло. Медленный кросслинкер представляет собой кросслинкер, который медленно образует перекрестные сшивки в полимере гидрогеля, и может включать ПЭГ-эпоксид+ПЭГ-амин или ПЭГ-дитиол+ПЭГ-акрилат. Медленному кросслинкеру может потребоваться более нескольких часов для образования перекрестных сшивок, например, более чем 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, или 12 часов для перекрестного сшивания. В некоторых вариантах осуществления, предлагаемых в настоящем документе, частицы для поддержания смежности формулируют при помощи кросслинкера мгновенного действия, и, таким образом, сохраняют состояние клетки лучшим, по сравнению с медленным кросслинкером. Без связи с какой-либо теорией, клетки, возможно, могут подвергаться физиологическим изменениям за счет внутриклеточных сигнальных механизмов во время более долгого перекрестного сшивания.
В некоторых вариантах осуществления кросслинкер образует дисульфидную связь в полимере гидрогеля, таким образом, связывая полимеры гидрогеля. В некоторых вариантах осуществления полимеры гидрогеля образуют матрицу гидрогеля с порами (например, пористую матрицу гидрогеля). Эти поры способны к удержанию внутри полимерной оболочки достаточно больших частиц, таких как одиночная клетка или выделенные из нее нуклеиновые кислоты, но позволяют другим материалам, таким как реагенты, проходить через поры, таким образом, пропуская их внутрь и наружу полых гранул. В некоторых вариантах осуществления размер пор полимерной оболочки точно настроен путем варьирования соотношения концентрации полимера и концентрации кросслинкера. В некоторых вариантах осуществления соотношение полимера к кросслинкеру составляет 30:1, 25:1, 20:1, 19:1, 18:1, 17:1, 16:1, 15:1, 14:1, 13:1, 12:1, 11:1, 10:1, 9:1, 8:1, 7:1, 6:1, 5:1, 4:1, 3:1, 2:1, 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 1:15, 1:20, или 1:30, или соотношение в пределах диапазона, определенного любыми двумя вышеуказанными соотношениями. В некоторых вариантах осуществления к полимерной матрице могут быть пришиты дополнительные группы, такие как ДНК-праймер или заряженные химические группы, для того чтобы соответствовать требованиям различных применений.
Как применяют в настоящем документе, термин «пористость» означает долю объема (без размеров) гидрогеля, которая состоит из открытого пространства, например, пор или других отверстий. Таким образом, «пористость» измеряет пустые места в материале и представляет собой долю объема пустот по отношению к общему объему, в процентах от 0 и до 100% (или между 0 и 1). Пористость гидрогеля может находиться в диапазоне от 0,5 до 0,99, приблизительно от 0,75 до приблизительно 0,99, или приблизительно от 0,8 до приблизительно 0,95.
Полимерная оболочка может иметь любой размер пор , который обеспечивает достаточную диффузию реагентов с одновременным сохранением одиночной клетки или выделенных из нее нуклеиновых кислот. Как применяют в настоящем документе, термин «размер пор» относится к диаметру или эффективному диаметру поперечного сечения пор. Термин «размер пор» может таке относиться к среднему диаметру или среднему эффективному диаметру поперечного сечения пор, на основании измерения множества пор. Эффективный диаметр не круглого поперечного сечения равен диаметру круглого поперечного сечения, имеющего ту же площадь поперечного сечения, что и некруглое поперечное сечение. В некоторых вариантах осуществления гидрогель может набухать, когда гидрогель является гидратированным. Размеры пор могут изменяться в зависимости от содержания воды в гидрогеле. В некоторых вариантах осуществления поры гидрогеля могут иметь пору достаточного размера, чтобы удерживать инкапсулированную клетку внутри гидрогеля, но позволяют реагентам проходить через них. В некоторых вариантах осуществления внутренняя часть полимерной оболочки представляет собой водную среду. В некоторых вариантах осуществления одиночная клетка, расположенная в полимерной оболочке, не взаимодействует с полимерной оболочкой и/или не контактирует с полимерной оболочкой. В некоторых вариантах осуществления полимерная оболочка формируется вокруг клетки (как описано в настоящем документе более подробно), и клетка находится в контакте с полимерной оболочкой из-за того, что полимерная оболочка доставляется к клеточной поверхности путем пассивной адсорбции или нацеленным способом, таким как присоединение к антителу или другой молекуле для специфического связывания.
В некоторых вариантах осуществления частицы для поддержания смежности имеют размер, достаточный для инкапсуляции одиночной клетки. В некоторых вариантах осуществления частица для поддержания смежности имеет диаметр приблизительно от 20 мкм до приблизительно 200 мкм, такой как 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, или 200 мкм, или диаметр в диапазоне, определенном любыми двумя вышеуказанными значениями. Размер частицы для поддержания смежности может меняться из-за факторов окружающей среды. В некоторых вариантах осуществления частицы для поддержания смежности расширяются, когда их отделяют от непрерывной масляной фазы и погружают в водную фазу, как показано на ФИГ. 2. В некоторых вариантах осуществления расширение частиц для поддержания смежности повышает эффективность проведения анализов на генетическом материале внутри инкапсулированных клеток. В некоторых вариантах осуществления расширение частиц для поддержания смежности создает большую среду для индексированных вставок, которые необходимо амплифицировать во время ПЦР, что в ином случае может быть ограничено в современных клеточных анализах.
В некоторых вариантах осуществления размер пор увеличен достаточно для удержания инкапсулированной клетки, но позволяет выделенным нуклеиновым кислотам диффундировать через полимерную оболочку, как показано на ФИГ. 3. В некоторых вариантах осуществления размер пор частиц для поддержания смежности можно котролировать, изменяя химию перекрестного сшивания. Окончательный размер перекрестно-сшитых пор можно дополнительно изменять при помощи окружения частицы для поддержания смежности, например, изменяя концентрацию соли, pH, или температуру, таким образом, позволяя иммобилизованным молекулам высвобождаться из частицы для поддержания смежности.
В некоторых вариантах осуществления кросслинкер представляет собой обратимый кросслинкер. В некоторых вариантах осуществления обратимый кросслинкер способен обратимо сшивать полимер гидрогеля и и способен становиться не сшитым в присутствии расщепителя. В некоторых вариантах осуществления кросслинкер можно расщеплять при помощи восстановителя, при помощи повышенной температуры, или при помощи электрического поля. В некоторых вариантах осуществления обратимый кросслинкер может быть N, N’-бис(акрилoил)цистамином, обратимым кросслинкером для полиакриламидных гелей, где дисульфидная связь может быть разрушена в присутствии подходящего восстановителя. Как показано на ФИГ. 3, пористость гранул можно повышать температурными или химическими способами, таким образом, облегчая контакт кросслинкера восстановителем, который расщепляет дисульфидные связи кросслинкера, разрушая полые гранулы. Полые гранулы разрушаются и высвобождают содержимое, которое удерживалось внутри, такое как нуклеиновые кислоты. В некоторых вариантах осуществления кросслинкер расщепляют, повышая температуру выше чем 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, или 100°C. В некоторых вариантах осуществления кросслинкер расщепляют путем контакта полых гранул с восстановителем. В некоторых вариантах осуществления восстановители включают фосфиновые соединения, водорастворимые фосфины, азот-содержащие фосфины, и их соли и производные, дитиоэритритол (DTE), дитиотрейтол (DTT) (цис- и транс-изомеры, соответственно, 2,3-дигидрокси-l,4-дитиолбутана), 2-меркаптоэтанол или β-меркаптоэтанол (BME), 2-меркаптоэтанол или аминоэтантиол, глутатион, тиогликолат или тиогликолевую кислоту, 2,3-димеркаптопропанол, трис(2-карбоксиэтил)фосфин (TCEP), трис(гидроксиметил)фосфин (THP), или P-[трис(гидроксиметил)фосфин] пропионовую кислоту (THPP).
В некоторых вариантах осуществления повышение температуры для увеличения диффузии или контакта с восстановителем разрушает кросслинкер, таким образом, высвобождая инкапсулированный генетический материал из частицы для поддержания смежности.
В некоторых вариантах осуществления перекрестные сшивки кросслинкера устанавливают поры в частице для поддержания смежности. В некоторых вариантах осуществления размер пор в полимерной оболочке является регулируемым и его создают для инкапсуляции клеток или нуклеиновых кислот, размером больше чем приблизительно 300 пар оснований, но позволяющим более мелким частицам, таким как реагенты, или более мелким нуклеиновым кислотам, размерам менее чем приблизительно 50 пар оснований, таким как праймеры, проходить через поры. В некоторых вариантах осуществления реагенты включают реагенты для обработки генетического материала, такие как реагенты для выделения нуклеиновых кислот из клетки, для амплификации или секвенирования нуклеиновых кислот или для получения библиотек нуклеиновых кислот. В некоторых вариантах осуществления реагенты включают, например, лизоцим, протеиназу K, случайные гексамеры, полимеразу (например, Φ29 ДНК-полимеразу, Taq-полимеразу, Bsu-полимеразу), транпозазу (например, Tn5), праймеры (например, адаптерные последовательности P5 и P7), лигазу, катализирующий фермент, дезоксинуклеотид трифосфаты, буферы, или двухвалентные катионы.
Примеры типов клеток, которые можно использовать в частице для поддержания смежности, могут включать, например, клетки, выделенные из ткани при биопсии (например, из ткани с заболеванием, например, раком толстой кишки, молочной железы, предстательной железы, легкого, кожи, или тканей, инфицированных патогеном и т.д.) и нормальные клетки из той же ткани, например, от того же пациента; клетки, выращенные в тканевой культуре, которые являются бессмертными (например, клетки с пролиферативной мутацией или иммортализирующим трансгеном), инфицированные патогеном или обработанные (например, с помощью экологических или химических агентов, таких как пептиды, гормоны, измененная температура, условия роста, физический стресс, клеточная трансформация и т. д.) и нормальные клетки (например, клетки, которые идентичны экспериментальным клеткам, за исключением того, что они не иммортализованы, не инфицированы или не обработаны и т. д.); клетки, выделенные из млекопитающего с злокачественной опухолью, заболеванием, пожилого млекопитающего или больного млекопитающего, и клетки из млекопитающего того же вида, например, из того же семейства, но здорового или молодого; и дифференцированные клетки и недифференцированные клетки от одного и того же млекопитающего (например, одна клетка является прародителем другой у млекопитающего, например). В одном из вариантов осуществления можно сравнивать клетки разных типов, например, нейрональные и не нервные клетки, или клетки разного статуса (например, до и после стимуляции на клетках). В другом варианте осуществления, экспериментальный материал представляет собой клетки, восприимчивые к инфекции патогеном, таким как вирус, например, вирус иммунодефицита человека (ВИЧ) и т. д., а контрольным материалом являются клетки, устойчивые к инфекции патогеном. В другом варианте осуществления изобретения, пара образцов представлена недифференцированными клетками, например, стволовыми клетками, и дифференцированными клетками. Можно использовать в способах по изобретению клетки из дрожжей, растений и животных, таких как рыбы, птицы, пресмыкающиеся, амфибии и млекопитающие. В определенных вариантах осуществления можно использовать клетки млекопитающих, т.е., от мышей, кроликов, приматов или людей, или их культивированные производные.
Способы получения частиц для поддержания смежности
Некоторые варианты осуществления, предлагаемые в настоящем документе, относятся к способам инкапсуляции одиночной клетки внутри полимерной оболочки для формирования частицы для поддержания смежности. В некоторых вариантах осуществления получают образец, содержащий клетки, которые необходимо инкапсулировать внутри частицы для поддержания смежности. В некоторых вариантах осуществления клетки могут быть фиксированы с помощью фиксатора до инкапсуляции внутри частицы для поддержания смежности. Как применяют в этом документе, фиксатор, в основном, относится к веществу, которое может фиксировать клетки. Например, фиксированные клетки могут стабилизировать белковые комплексы, комплексы нуклеиновой кислоты или белок-нуклеиновые кислотные комплексы в клетке. Подходящие фиксаторы и кросслинкеры могут включать в себя фиксаторы на основе спирта или альдегида, формальдегид, глутаральдегид, фиксаторы на основе этанола, фиксаторы на основе метанола, ацетон, уксусную кислоту, тетраоксид осмия, дихромат калия, хромовую кислоту, перманганат калия, соединения ртути, пикраты, формалин, параформальдегид, амин-реактивные кросслинкеры на основе NHS-сложного эфира, такие как бис[сульфосукцинимидил] суберат (BS3), 3,3'-дитиобис[сульфосукцинимидилпропионат] (DTSSP), этиленгликоль бис[сульфосукцинимидилсукцинат] (сульфо-EGS), дивукцинимидил глутарат (DSG), дитиобис[сукцинимидил пропионат] (DSP), дисукцинимидил суберат (DSS), этиленгликоль бис[сукцинимидилсукцинат] (EGS), кросслинкеры на основе NHS-сложный эфир/диазирина, такие как NHS-диазирин, NHS-LC-диазирин, NHS-SS-диазирин, сульфо-NHS-диазирин, сульфо-NHS-LC-диазирин и сульфо-NHS-SS-диазирин. В некоторых вариантах осуществления фиксированная клетка сохраняет внутреннее состояние клетки, таким образом, предотвращая модификацию клетки во время инкапсуляции клетки внутрь частицы для поддержания смежности.
В некоторых вариантах осуществления частицу для поддержания смежности получают статическими способами, такими как микропланшетные/микропанельные способы для одиночной клетки или способы микродиссекции, без необходимости использования микрофлюидного устройства. Таким образом, в некоторых вариантах осуществления частицы для поддержания смежности, описываеме в настоящем документе, можно получать способом, не требующим устройства. Не требующие устройства способы могут включать инициацию полимеризации на клеточной поверхности путем контакта клетки с полимером с образованием полимерной оболочки вокруг клетки. Инициирование полимеризации может происходить путем химической реакции активной группы на мономерных единицах с определенными группами мембранных белков, гликанов или других низкомолекулярных соединений. Начальная стадия полимеризации мономеров может сопровождаться одним или несколькими раундами осаждения мономерных единиц, вызванными электростатическими или гидрофобными силами. Некоторые из слоев мономеров могут содержать функциональные группы, такие как биотин или другие лиганды, которые можно использовать позже для специфического захвата инкапсулированнных клеток. Например, погруженные клетки могут содержать биотин, а покрытие погруженных клеток магнитными шариками стрептавидина сделает их магнитными, что позволит автоматизировать и упростить обработку, как показано на ФИГ. 4. Альтернативно, инкапсуляция живой или фиксированной клетки может быть инициирована светом или другими физическими или химическими средствами, когда инициаторные молекулы попадают на клеточную поверхность либо пассивной адсорбцией, либо целенаправленно, например, прикрепляются к антителу или другой молекуле для специфического связывания и способствуют локализованной полимерной амплификации, как показано на ФИГ. 5.
Клетки для инкапсуляции в способе нацеленной поверхностно-инициированной полимеризации позволяют пользователю специально выбирать интересующие клетки и одновременно готовят клетки для последующих анализов, таким образом, комбинируя потоковую сортировку с анализами на одиночных клетках. Можно проводить обогащение определенных типов клеток, используя наборы для разделения клеток с использованием шариков с магнитными метками или связывающих молекул по заказу, специфичных для определенных клеточных мембранных белков, конъюгированных с поверхностью для обогащения.
В некоторых вариантах осуществления частицу для поддержания смежности получают динамическими способами, такими как получение эмульсии при помощи вортексирования, получение капель микрофлюидным способом, или микрофлюидика на основе клапанов. Как применяют в настоящем документе, получение эмульсии при помощи вортексирования относится к вортексированию полимера гидрогеля с клеткой, включая фиксированную клетку, как описано в настоящем документе, в контейнере, таком как пробирка, флакон, или реакционный сосуд. Компоненты можно смешивать, например, путем ручного или механического вортексирования или встряхивания. В некоторых вариантах осуществления в результате ручного смешивания получают полые гранулы, которые инкапсулируют генетический материал с размером 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, или 200 мкм в диаметре, или или с размером в диапазоне, определяемом любыми двумя вышеуказанными величинами. В некоторых вариантах осуществления размер гранул является неоднородным, и, таким образом, размер гранул включает гранулы различных диаметров.
В некоторых вариантах осуществления частицы для поддержания смежности получают способами микрофлюидного потока. Микрофлюидный поток включает использование микрофлюидного устройства для вспомогательной генерации гель-эмульсии, как показано на ФИГ. 1. В некоторых вариантах осуществления микрофлюидное устройство включает микроканалы, настроенные для получения частицы для поддержания смежности желаемого размера и настроенные для инкапсуляции одной клетки на частицу для поддержания смежности. В некоторых вариантах осуществления микрофлюидное устройство имеет высоту 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 мкм, или высоту в диапазоне, определяемом любыми двумя из указанных выше значений. В некоторых вариантах осуществления микрофлюидное устройство включает один или несколько каналов. В некоторых вариантах осуществления микрофлюидное устройство включает канал для введения клетки, включая фиксированную клетку, которая была введена в полимер, канал для введения кросслинкера и канал для несмешивающейся жидкости. В некоторых вариантах осуществления ширина одного или нескольких каналов одинакова. В некоторых вариантах осуществления ширина одного или нескольких каналов различна. В некоторых вариантах осуществления ширина одного или нескольких каналов составляет 20, 30, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145 или 150. мкм, или ширина находится в пределах диапазона, определенного любыми двумя из указанных выше значений. Ширина и высота канала не обязательно ограничены значениями, описанными в настоящем документе, и специалист в данной области понимает, что размер частицы для поддержания смежности будет частично зависеть от размера каналов микрофлюидного устройства. Таким образом, размер частицы для поддержания смежности может быть частично настроен путем изменения размера каналов. Помимо размера микрофлюидного устройства и ширины каналов, скорость потока каналов также может влиять на размер частицы для поддержания смежности, а также может влиять на количество клеток, инкапсулированных в каждой частице для поддержания смежности.
В некоторых вариантах осуществления скорость потока клетки в полимере, включая фиксированную клетку, смешанную с полимером, через микрофлюидный канал составляет 1, 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, или 150 мкл/мин, или скорость в пределах диапазона, определенного любыми двумя из указанных выше значений. В некоторых вариантах осуществления скорость потока кросслинкера в микрофлюидном канале составляет 1, 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, или 150 мкл/мин, или скорость в пределах диапазона, определенного любыми двумя из указанных выше значений. В некоторых вариантах осуществления скорость потока несмешивающейся жидкости в микрофлюидном канале равна 20, 30, 50, 80, 100, 150, 160, 170, 180, 190, 200, 225, 250, 275, 300, 325, 350, 375 или 400 мкл/мин, или скорости в пределах диапазона, определенного любыми двумя из указанных выше значений. В некоторых вариантах осуществления клетки, смешанные с полимером, включая фиксированные клетки, смешанные с полимером, и кросслинкер контактируют друг с другом в микрофлюидном генераторе капель перед несмешивающейся жидкостью. Частицы для поддержания смежности начинают формироваться при контакте с кросслинкером, инкапсулируя клетки внутри полимерной оболочки. Формирующаяся частицы для поддержания смежности продолжают течь через микрофлюидный генератор капель в несмешивающуюся жидкость, такую как разделительное масло и/или масло для перекрестного сшивания, со скоростью потока, меньшей скорости потока несмешиваемой жидкости, таким образом, образуя капли. В некоторых вариантах осуществления несмешивающаяся жидкость вводится в два этапа, как показано на ФИГ. 1, включая как разделительное масло, так и масло для перекрестного сшивания. В некоторых вариантах осуществления разделительным маслом является минеральное масло, углеводородное масло, силиконовое масло, фторуглеродное масло или полидиметилсилоксановое масло или их смеси. Разделительное масло, как применяют в настоящем документе, используют, чтобы избежать перекрестного сшивания полимера в канале водно-масляной интерфазы.
В некоторых вариантах осуществления частицы для поддержания смежности образуются мгновенно путем перекрестного сшивания при помощи кросслинкера мгновенного действия. Например, клетки, инкапсулированные при помощи полимеров, таких как ПЭГ-малеинимид с четырьмя плечами или эпоксид с использованием микрофлюидного генератора капель можно мгновенно перекресно сшивать с использованием кросслинкеров, растворимых в маслах, таких как минеральное масло или фторуглеродное масло, как HFE-7500, формируя масло для перекрестного сшивания. В некоторых вариантах осуществления масло для перекрестного сшивания включает толуол, ацетон, тетрагидрофуран с дитиолом, аминовые функциональные группы как в случае толуол-3,4-дитиола, 2,4 диаминотолуола, гександитиола, которые легко диффундируют в формирующиеся капли, таким образом, мгновенно сшивая частицы для поддержания смежности.
В некоторых вариантах осуществления частицы для поддержания смежности формулируют в равномерном распределении по размеру. В некоторых вариантах осуществления размеры частиц для поддержания смежности точно настраивают путем регулировки размера микрофлюидного устройства, размера одного или нескольких каналов или скорости потока через микрофлюидные каналы. В некоторых вариантах осуществления полученная частица для поддержания смежности имеет диаметр в диапазоне от 20 до 200 мкм, например, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, или 200 мкм, или диаметр в пределах диапазона, определенного любыми двумя из указанных выше значений.
В некоторых вариантах осуществления размер и однородность частиц для поддержания смежности можно дополнительно контролировать путем контакта полимеров гидрогеля до образования частиц с модификатором текучести, например, со спиртом, включая изопропиловый спирт. В отсутствие изопропилового спирта, частицы для поддержания смежности имеют больший диаметр, чем частицы для поддержания смежности, сформированные в присутствии изопропилового спирта. Изопропиловый спирт влияет на текучесть полимеров гидрогеля, позволяя регулировать размер частиц для поддержания смежности.
Как будет понятно специалистам в данной области, микрофлюидное устройство, изображенное на ФИГ. 1, является примером трехканального микрофлюидного устройства, но микрофлюидное устройство может быть модифицировано, изменено или иметь вариации для создания частиц для поддержания смежности определенного размера или для создания частиц для поддержания смежности, сформированных из различных гидрогелевых материалов или кросслинкеров.
В некоторых вариантах осуществления частица для поддержания смежности, приготовленная или путем эмульсии при помощи вортексирования или эмульсии при помощи микрофлюидного инерциального потока, инкапсулирует одиночную клетку, включая одиночную фиксированную клетку, как описано в настоящем документе. В некоторых вариантах осуществления можно контролировать количество клеток в частице для поддержания смежности путем разбавления или концентрирования раствора, содержащего клетку во введенном образце. Образец, включающий клетку смешивают с полимерами гидрогеля, и полимеры гидрогеля, содержащие клетки, поступают в эмульсию при помощи вортексирования или эмульсию при помощи микрофлюидного инерциального потока, как описано в настоящем документе.
В некоторых вариантах осуществления частицы для поддержания смежности функционализируют при помощи нуклеотида. В некоторых вариантах осуществления нуклеотид представляет собой олигонуклеотид или поли T нуклеотид. В некоторых вариантах осуществления нуклеотид связан с частицами для поддержания смежности, и функционализированные частицы для поддержания смежности можно использовать для нацеленного захвата интересующего нуклеотида.
В некоторых вариантах осуществления частицы для поддержания смежности, инкапсулирующие одиночную клетку, обрабатывают для поддержания проведения множественных совместных анализов на одиночной частице для поддержания смежности, включая несколько промывок буфером, несколько смен реагентов, и несколько анализов на основании выполняемого анализа. Формулированные частицы для поддержания смежности, приготовленные любым из способов, описываемых в настоящем документе, включая способы поверхностно-инициируемой полимеризации, вортексирование, или микрофлюидные способы, можно загружать или высаживать на структурированную проточную ячейку, микропанель, планшет с лунками, травленную поверхность, микрофлюидный канал, гранулу, колонку, или другую поверхность для проведения множественных совместных анализов на инкапсулированной клетке.
Способы проведения множественных совместных анализов на клетках, инкапсулированных внутри частиц для поддержания смежности
Некоторые варианты осуществления, предлагаемые в настоящем документе, относятся к способам проведения множественных последовательных совместных анализов на одиночной клетке, инкапсулированной внутри частицы для поддержания смежности. В некоторых вариантах осуществления способ включает получение частицы для поддержания смежности, как описано в настоящем документе, и последовательный контакт одиночной клетки, инкапсулированной внутри частицы для поддержания смежности, с реагентами для проведения нескольких последовательных совместных анализов.
В некоторых вариантах осуществления частицы для поддержания смежности получают, как описано в настоящем документе, и частицы для поддержания смежности загружают на поверхность, такую как устройство с проточными ячейками, лунка планшета, предметное стекло, или структурированная поверхность. В некоторых вариантах осуществления поверхность представляет собой устройство с проточными ячейками, и включает вкладыш с микролунками или микростолбиками в устройстве для распределения частиц для поддержания смежности для пространственного индексирования в устройстве с проточными ячейками. В некоторых вариантах осуществления частицы для поддержания смежности загружают на планшет с лунками по одной частице для поддержания смежности в каждую лунку. Планшет с лунками может включать, например, 12-луночный планшет, 24-луночный планшет, 48-луночный планшет, 96-луночный планшет, 384-луночный планшет, 1536-луночный планшет, 3456-луночный планшет, или 9600-луночный планшет, или планшет с любым числом лунок в планшете, с одиночной частицей для поддержания смежности, и, таким образом, одиночной клеткой, размещенной в каждой лунке. В некоторых вариантах осуществления частицы для поддержания смежности делают проницаемыми при помощи агента для повышения проницаемости. В некоторых вариантах осуществления агент для повышения проницаемости включает в себя мягкий детергент, такой как TritonX-100. В некоторых вариантах осуществления агента для повышения проницаемости повышает проницаемость мембраны клетки внутри частицы для поддержания смежности для повышения доступности клеточных нуклеиновых кислот, таких как геномная ДНК и РНК. В некоторых вариантах осуществления the планшет с лунками с одиночной частицей для поддержания смежности, размещенной в каждой лунке, подвергаюь множеству последовательных совместных анализов, включая, например, промывание буфером, лизис, анализ ДНК, анализ РНК, анализ белков, тагментацию, амплификацию нуклеиновых кислот, секвенирование нуклеиновых кислот, получение библиотеки ДНК, анализ для оценки хроматина, доступного для транспозазы, с использованием секвенирования (ATAC-seq), транспозицию, сохраняющую смежность (CPT-seq), комбинаторное индексированное секвенирование одиночной клетки (SCI-seq), или амплификацию генома одиночной клетки, или любое их сочетание, проводимое последовательно.
В некоторых вариантах осуществления частицу для поддержания смежности, инкапсулирующую клетку или вирусную частицу, обрабатывают для очистки и выделения нуклеиновых кислот из клетки. Таким образом, например, частица для поддержания смежности контактирует с лизирующим буфером. Как применяют в настоящем документе, «лизис» означает нарушение или изменение клеточной стенки или вирусной частицы, облегчающее доступ к клеточной РНК или ДНК или высвобождение клеточной РНК или ДНК. Ни полное разрушение, ни разрушение клеточной стенки не является обязательным требованием для лизиса. Под термином «лизирующий буфер» понимают буфер, который содержит, по меньшей мере, один лизирующий агент. Типичные ферментативные лизирующие агенты в качестве неограничивающих примеров включают лизоцим, глюколазу, зимолозу, литиказу, протеиназу К, протеиназу Е и вирусные эндолизины и экзолизины. Таким образом, например, лизис клеток в частицах для поддержания смежности можно проводить путем введения лизирующих агентов, таких как лизоцим и протеиназа K, в частицы для поддержания смежности. Теперь гДНК из клеток содержится в частицах для поддержания смежности. В некоторых случаях после лизирующей обработки выделенная нуклеиновая кислота остается в пределах частицы для поддержания смежности и может использоваться для дальнейшей обработки.
«Анализ ДНК» относится к любому способу, используемому для амплификации, секвенирования или иного анализа ДНК, содержащейся в инкапсулированной клетке. Амплификация ДНК может быть выполнена с использованием методов ПЦР или пиросеквенирования. Анализ ДНК может также включать не нацеленные, не основанные на ПЦР методы секвенирования ДНК (например, метагеномику). В качестве неограничивающего примера, анализ ДНК может включать в себя секвенирование гипервариабельной области 16S рДНК (рибосомной ДНК) и использование секвенирования для идентификации видов по ДНК.
«Анализ РНК» относится к любому способу, используемому для амплификации, секвенирования или иного анализа РНК, содержащейся в инкапсулированной клетке. Для амплификации и секвенирования РНК можно использовать те же способы, которые использовали для анализа ДНК. РНК, которая менее стабильна, чем ДНК, является прочтением ДНК в ответ на раздражители. Таким образом, анализ РНК может дать более точную картину метаболически активных членов сообщества и может использоваться для предоставления информации о функции сообщества организмов в образце. «Секвенирование нуклеиновых кислот» относится к использованию секвенирования для определения порядка нуклеотидов в последовательности молекулы нуклеиновой кислоты, такой как ДНК или РНК.
Как применяют в настоящем документе термин «секвенирование», относится к способу, которым устанавливают идентичность, по меньшей мере, 10 последовательных нуклеотидов (например, идентичность, по меньшей мере, 20, по меньшей мере, 50, по меньшей мере, 100 или, по меньшей мере, 200 или более последовательных нуклеотидов) в полинуклеотиде.
Термины «секвенирование следующего поколения» или «высокопроизводительное секвенирование» или «NGS», в основном, относятся к технологиям высокопроизводительного секвенирования, включая в качестве неограничивающих примеров, массивно-параллельное опознавательное секвенирование, высокопроизводительное секвенирование, секвенирование посредством лигирования (например, секвенирование SOLiD), протон-ионное полупроводниковое секвенирование, секвенирование ДНК на наносферах, секвенирование одночных молекул, и секвенирование с использованием нанопоры и могут относиться к распараллеленным платформам секвенирования посредством синтеза или секвенирования посредством лигирования, которые в настоящее время используются Illumina, Life Technologies, или Roche, и т.д. Способы секвенирования следующего поколения также могут включать способы секвенирования с использованием нанопоры или способы на основе электронной детекции, такие как технология Ion Torrent, запущенная в серийное производство у Life Technologies или способ для одиночных молекул на основе флуоресценции, запущенный в серийное производство у Pacific Biosciences.
«Анализ белков» относится к изучению белков в инкапсулированной клетке, и может включать протеомный анализ, определение посттрансляционной модификации белков, представляющих интерес, определение уровней экспрессии белка, или определение взаимодействия белка с другими молекулами, в том числе с другими белками или с нуклеиновыми кислотами.
Как применяют в настоящем документе, термин «тагментация» относится к модификации ДНК с помощью транспозомного комплекса, включающего фермент транспозазу в комплексе с адаптерами, включающими последовательность конца транспозона. Тагментация приводит к одновременной фрагментации ДНК и лигированию адаптеров к 5'-концам обеих нитей дуплексных фрагментов. После этапа очистки для удаления фермента транспозазы, к концам адаптированных фрагментов можно добавлять дополнительные последовательности, например, с помощью ПЦР, лигирования или любого другого подходящего способа, известного специалистам в данной области.
Анализ для оценки хроматина, доступного для транспозазы, с использованием секвенирования (ATAC-seq) относится к быстрому и чувствительному способу интегративного эпигеномного анализа. ATAC-seq захватывает участки открытого хроматина и выявляет взаимодействие между геномной локализацией открытого хроматина, ДНК-связывающими белками, отдельными нуклеосомами и уплотнением высшего порядка в регуляторных областях с разрешением на уровне нуклеотидов. Были обнаружены классы связывающего ДНК фактора, которые строго избегают нуклеосом, могут допускать присутствие нуклеосом или имеют тенденцию перекрываться с нуклеосомами. С использованием ATAC-seq измеряли и оценивали серийные суточные эпигеномы покоящихся Т-клеток человека у пробанда при помощи стандартных анализов крови, демонстрируя возможность считывания личных эпигеномов в клинических временных рамках для мониторинга состояния здоровья и заболевания. Более конкретно, ATAC-последовательность можно проводить, обрабатывая хроматин из одной инкапсулированнной клетки в частицах для поддержания смежности комплексом инсерционных ферментов с получением меченых фрагментов геномной ДНК. На этом этапе хроматин тагментируют (например, фрагментируют и метят в одной и той же реакции) с использованием инсерционного фермента, такого как Tn5 или MuA, который расщепляет геномную ДНК в открытых областях в хроматине и добавляет адаптеры к обоим концам фрагментов.
В некоторых случаях условия могут быть скорректированы для получения желаемого уровня вставки в хроматин (например, вставка, которая происходит в среднем каждые 50-200 пар оснований в открытых областях). Хроматин, используемый в способе, может быть получен любым подходящим способом. В некоторых вариантах осуществления ядра могут быть выделены, лизированы, а хроматин может быть дополнительно очищен, например, от ядерной оболочки. В других вариантах осуществления хроматин может быть выделен путем контакта выделенных ядер с реакционным буфером. В этих вариантах осуществления выделенные ядра можно лизировать, когда они контактируют с реакционным буфером (включающим инсерционные ферментные комплексы и другие необходимые реагенты), который позволяет инсерционным ферментным комплексам получить доступ к хроматину. В этих вариантах осуществления способ может включать выделение ядер из популяции клеток и объединение выделенных ядер с транспозазой и адаптерами, где объединение приводит как к лизису ядер с выделением указанного хроматина, так и к образованию фрагментов геномной ДНК, меченных адаптером. Хроматин не требует перекрестного связывания, как в других способах (например, способах ChIP-SEQ).
После того, как хроматин был фрагментирован и помечен для получения меченых фрагментов геномной ДНК, по меньшей мере, некоторые из фрагментов, меченых адаптерами, секвенируют для создания множества последовательных считываний. Фрагменты могут быть секвенированы любым подходящим способом. Например, фрагменты могут быть секвенированы с использованием способа с обратимым терминированием от Illumina, способа пиросеквенирования от Roche (454), секвенирования путем лигирования от Life Technologies (платформа SOLiD) или платформы Ion Torrent от Life Technologies. Примеры таких способов описаны в следующих ссылках: Margulies et al. (Nature 2005 437: 376-80); Ronaghi et al. (Analytical Biochemistry 1996 242: 84-9); Shendure et al. (Science 2005 309: 1728-32); Imelfort et al. (Brief Bioinform. 2009 10:609-18); Fox et al. (Methods Mol Biol. 2009;553:79-108); Appleby et al. (Methods Mol Biol. 2009; 513:19-39) и Morozova et al. (Genomics. 2008 92:255-64), которые включены в качестве ссылки в настоящий документ для общего описания способов и конкретных этапов способов, включая все исходные продукты, способы для получения библиотеки, реагенты и конечные продукты для каждого из этапов. Как будет очевидно, сайты праймеров для прямого и обратного секвенирования, которые совместимы с выбранной платформой для секвенирования следующего поколения, можно добавлять к концам фрагментов на этапе амплификации. В определенных вариантах осуществления фрагменты могут быть амплифицированы с использованием праймеров для ПЦР, которые гибридизуются с метками, которые были добавлены к фрагментам, где праймеры, используемые для ПЦР, имеют 5'-хвосты, которые совместимы с конкретной платформой для секвенирования. Способы проведения ATAC-seq изложены в заявке PCT № PCT/US2014/038825, которая полностью включена в настоящий документ в качестве ссылки.
Как применяют в настоящем документе термин «хроматин», относится к комплексу молекул, включая белки и полинуклеотиды (например, ДНК, РНК), которые находятся в ядре эукариотической клетки. Хроматин состоит частично из гистоновых белков, которые образуют нуклеосомы, геномной ДНК и других ДНК-связывающих белков (например, факторов транскрипции), которые, в основном, связаны с геномной ДНК.
Секвенирование на основе транспозиции, сохраняющей смежность (CPT-seq) относится к способу секвенирования с одновременным сохранением информации о смежности путем использования транспозазы для поддержания ассоциации матричной нуклеиновой кислоты с фрагментами, смежными с целевой нуклеиновой кислотой. Например, CPT можно проводить на нуклеиновой кислоте, такой как ДНК или РНК. СРТ-нуклеиновая кислота может быть захвачена путем гибридизации с комплементарными олигонуклеотидами, имеющих уникальные индексы или штрих-коды и иммобилизованных на твердой подложке. В некоторых вариантах осуществления олигонуклеотид, иммобилизованный на твердой подложке, может дополнительно содержать участки связывания праймера, уникальные молекулярные индексы, помимо штрих-кодов. Преимуществов в том, что такое использование транспозом для поддержания физической близости фрагментированных нуклеиновых кислот увеличивает вероятность того, что фрагментированные нуклеиновые кислоты из того же самой исходной молекулы, например, хромосомы, получат тот же уникальный штрих-код и информацию индекса от олигонуклеотидов, иммобилизованных на твердой подложке. Это приведет к смежно-связанной секвенирующей библиотеке с уникальными штрих-кодами. Смежно-связанная секвенирующая библиотека может быть секвенирована для получения информации о смежных последовательностях. Частицы для поддержания смежности, описываемые в настоящем документе, могут быть приведены в контакт с реагентами CPT-seq для выполнения CPT-seq на нуклеиновых кислотах, извлеченных из инкапсулированной клетки.
Как применяют в настоящем документе термин «информация о смежности» относится к пространственной взаимосвязи между двумя или более фрагментами ДНК, основанной на общей информации. Этот общий аспект информации может относиться к смежным, блочным и удаленным пространственным взаимосвязям. Информация об этих взаимосвязях в свою очередь облегчает иерархическую сборку или картирование последовательностей ридов, полученных из фрагментов ДНК. Эта информация о смежности повышает эффективность и точность такой сборки или картирования, потому что традиционные способы сборки или картирования, используемые в связи с общепринятным секвенированием способом дробовика, не учитывают относительное геномное происхождение или координаты индивидуальных последовательностей ридов, поскольку они относятся к пространственным взаимосвязям между двумя или более фрагментами ДНК, из которых была получена индивидуальная последовательность ридов.
Таким образом, в соответствии с вариантами осуществления, описываемыми в настоящем документе, способы получения информации о смежности могут быть реализованы с помощью способов смежности малой дальности для определения смежных пространственных связей, способов смежности средней дальности для определения блочных пространственных связей или способов смежности большой дальности для определения удаленных пространственных связей. Эти способы повышают точность и качество сборки или картирования последовательности ДНК, и их можно использовать с любым способом секвенирования, описанным в настоящем документе.
Информация о смежности включает относительное исходное геномное положение или координаты последовательностей отдельных ридов, поскольку они относятся к пространственным связям между двумя или более фрагментами ДНК, из которых были получены последовательности отдельных ридов. В некоторых вариантах осуществления информация о смежности включает информацию о последовательности из неперекрывающихся последовательностей ридов.
В некоторых вариантах осуществления информация о смежности для целевой последовательности нуклеиновой кислоты указывает на информацию о гаплотипе. В некоторых вариантах осуществления информация о смежности для целевой последовательности нуклеиновой кислоты указывает на геномные варианты.
Комбинаторное индексированное секвенирование одиночной клетки (SCI-seq) представляет собой способ секвенирования с одновременным одновременно созданием низкочастотных библиотек из одиночной клетки для выявления соматических вариантов числа копий.
Таким образом, на одиночной клетке можно проводить множество совместных анализов с целью анализа клетки или нуклеиновых кислот из клетки, включая анализы, описываемые в настоящем документе, по отдельности или в комбинации с любым другим анализом.
Индексированные частицы для поддержания смежности можно также напрямую загружать в проточные ячейки, которые удерживаются устройством из держателей/микролунок. Индексированные библиотеки высвобождаются из частиц для поддержания смежности (химическое/температурное высвобождение) и связываются с проточной ячейкой. Это позволяет использовать мощный подход к индексированию, когда первичный уровень индексации приходит из пространственного местоположения, а затем следующий уровень приходит из индексированных библиотек из одной частицы для поддержания смежности. Альтернативно, индексированные библиотеки, выделенные из частиц для поддержания смежности можно совместно загружать на проточную ячейку.
В некоторых вариантах осуществления клетка, инкапсулированная в частице для поддержания смежности, контактирует с одним или несколькими реагентами для обработки нуклеиновых кислот. В некоторых вариантах осуществления клетка удерживается в частице для поддержания смежности, и реагенты способны проходить через поры частицы для поддержания смежности. В некоторых вариантах осуществления реагенты могут включать лизирующие вещества, вещества для очистки нуклеиновых кислот, вещества для амплификации ДНК, вещества для тагментации, вещества для ПЦР, или другие вещества, которые используют для обработки генетических материалов. Таким образом, частица для поддержания смежности обеспечивает микроокружение для контролируемых реакций клеток, включая нуклеиновые кислоты, выделяемые из, внутри частицы для поддержания смежности за счет обеспечения барьера из полимерной оболочки, который реагенты могут пересекать внутрь и наружу, с одновременным удержанием клетки внутри частицы для поддержания смежности. В некоторых вариантах осуществления поры полимерной оболочка изменяют, чтобы обеспечить поток реагентов и также поток нуклеиновых кислот, таких как ДНК и РНК, выделенные из клетки, через полимерную оболочку.
В некоторых вариантах осуществления получение полной ДНК-библиотеки можно беспрепятственно осуществлять внутри частицы для поддержания смежности с помощью нескольких смен реагентов, проходящих через пористый гидрогель, сохраняя при этом геномную ДНК и продукты в виде ее библиотеки в полимерной оболочке. Гидрогель может быть устойчивым к высокой температуре до 95°С в течение нескольких часов для поддержания различных биохимических реакций.
Как применяют в настоящем документе, термины «выделенный», «выделять», «выделение», «очищенный», «очищать», «очистка» и их грамматические эквиваленты, как применяют в настоящем документе, если не указано иначе, относятся к снижению количества, по меньшей мере, одного загрязнителя (такого как белок и/или последовательность нуклеиновой кислоты) из образца или из источника (например, клетка), из которого выделяют материал. Таким образом очистка приводит к «обогащению», например, увеличению количества желаемого белка и/или последовательности нуклеиновой кислоты в образце.
После лизиса и выделения нуклеиновых кислот можно проводить амплификацию, такую как амплификация со множественным замещением (MDA), которая широко используется для амплификации небольших количеств ДНК, особенно из отдельных клеток. В некоторых вариантах осуществления инкапсулированные нуклеиновые кислоты амплифицируют, секвенируют кислоту, или используют для получения библиотек нуклеиновых кислот. Термины «амплифицировать» или «амплифицированный» при использовании по отношению к нуклеиновой кислоте или реакции с нуклеиновой кислотой относятся к способам получения копий определенной нуклеиновой кислоты in vitro, такой как целевая нуклеиновая кислота или нуклеиновая кислота, инкапсулированная в частице для поддержания смежности, например, при помощи варианта осуществления настоящего изобретения. В данной области известны многочисленные способы амплификации нуклеиновых кислот, и реакции амплификации включают в себя полимеразные цепные реакции, лигазные цепные реакции, реакции амплификации с замещением цепей, реакции амплификации по типу катящегося кольца, циклы амплификации с многократным отжигом и образованием петли (MALBAC), способы амплификации, опосредованной транскрипцией, такие как NASBA, способы амплификации, опосредованной петлей (например, амплификация «LAMP» с использованием последовательностей, образующих петли). Нуклеиновая кислота, которую амплифицируют, может представлять собой ДНК, содержащую, включающую ДНК или РНК или состоящую из ДНК или РНК, или смесь ДНК и РНК, включая модифицированную ДНК и/или РНК. Продукты, полученные в результате амплификации молекулы или молекул нуклеиновой кислоты (например, «продукты амплификации»), независимо от того, является ли исходная нуклеиновая кислота ДНК, РНК или обеими, могут быть либо ДНК, либо РНК, либо смесью нуклеозидов или нуклеотидов как ДНК, так и РНК, или они могут включать нуклеозиды или нуклеотиды модифицированной ДНК или РНК. «Копия» не обязательно означает совершенную комплементарность или идентичность последовательности с целевой последовательностью. Например, копии могут включать нуклеотидные аналоги, такие как дезоксиинозин или дезоксиуридин, преднамеренные изменения последовательности (такие как изменения последовательности, введенные посредством праймера, содержащего последовательность, которая гибридизуется, но не является комплементарной, с целевой последовательностью, и/или ошибки последовательности, возникающие во время амплификации.
Инкапсулированные нуклеиновые кислоты, которые изолированы внутри частицы для поддержания смежности, можно амплифицировать в соотвествии с любым подходящим способом амплификации, известным в данной области. В некоторых вариантах осуществления инкапсулированные нуклеиновые кислоты амплифицируют внутри частицы для поддержания смежности. В некоторых вариантах осуществления частица для поддержания смежности захвачена на твердую подложку и разрушена, при этом инкапсулированные нуклеиновые кислоты высвобождаются на твердую подложку, и нуклеиновые кислоты амплифицируют на твердой подложке.
В некоторых вариантах осуществления инкапсулированные нуклеиновые кислоты амплифицируют внутри частицы для поддержания смежности. Например, в некоторых вариантах осуществления праймеры и ферменты для амплификации проходят через поры частицы для поддержания смежности и гибридизуются с инкапсулированными нуклеиновыми кислотами.
Следует понимать, что любой из способов амплификации, описанных в настоящем документе или, как правило, известный в данной области, может быть использован с универсальными или целевыми специфическими праймерами для амплификации инкапсулированных нуклеиновых кислот. Подходящие способы амплификации в качестве неограничивающих примеров включают в себя полимеразную цепную реакцию (ПЦР), амплификацию с замещением цепей (SDA), амплификацию, опосредованную транскрипцией (TMA) с транскрипцией и амплификацию на основе последовательности нуклеиновой кислоты (NASBA), как описано в патенте США № 8003354, включенном в настоящий документ в качестве ссылки в полном объеме. Вышеуказанные способы амплификации могут быть использованы для амплификации одной или нескольких нуклеиновых кислот, представляющих интерес. Например, можно использовать ПЦР, включая мультиплексную ПЦР, SDA, TMA, NASBA и т.п. для амплификации инкапсулированных нуклеиновых кислот. В некоторых вариантах осуществления в реакцию амплификации включены праймеры, направленные конкретно на интересующую нуклеиновую кислоту.
Другие подходящие способы амплификации нуклеиновых кислот могут включать удлинение и лигирование олигонуклеотидов, амплификацию по типу «катящегося кольца» (RCA) (Lizardi et al., Nat. Genet. 19: 225-232 (1998), включенный в настоящий документ в качестве ссылок) и технологии анализа олигонуклеотидного лигирования (OLA) (См. в основном патенты США №№ 7582420, 5185243, 5679524 и 5573907; EP 0 320 308 B1; EP 0 336 731 B1; EP 0 439 182 B1; WO 90/01069; WO 89/12696 и WO 89/09835, все включены в качестве ссылки). Следует понимать, что эти способы амплификации могут быть разработаны для амплификации инкапсулированных нуклеиновых кислот. Например, в некоторых вариантах осуществления способ амплификации может включать реакции амплификации с лигированными зондами или лигированными олигонуклеотидами (OLA), которые могут содержать праймеры, направленные конкретно на интересующую нуклеиновую кислоту. В некоторых вариантах осуществления способ амплификации может включать реакцию удлинения-лигирования праймеров, которая содержит праймеры, направленные конкретно на интересующую нуклеиновую кислоту и способные проходить через поры гидрогеля. В качестве неограничивающего примера праймеров для реакции удлинения и лигирования праймеров, которые могут быть специально разработаны для амплификации интересующей нуклеиновой кислоты, амплификация может включать праймеры, используемые для анализа GoldenGate (Illumina, Inc., Сан-Диего, Калифорния), на примере патентов США №№ 7582420 и 7611869, каждый из которых включен в настоящий документ в качестве ссылки в полном объеме. В каждом из описанных способов реагенты и компоненты, участвующие в реакции нуклеиновой кислоты, способны проходить через поры частицы для поддержания смежности, сохраняя при этом саму нуклеиновую кислоту в пределах частицы для поддержания смежности.
В некоторых вариантах осуществления инкапсулированные нуклеиновые кислоты амплифицируют с использованием способов кластерной амплификации, раскрытых в патентах США №№ 7985565 и 7115400, содержание каждого из которых включено в настоящий документ в качестве ссылки в полном объеме. Во включенных материалах патентов США №№ 7985565 и 7115400 описаны способы амплификации нуклеиновой кислоты, которые позволяют амплифицировать продукты амплификации на твердой подложке для формирования массивов, состоящих из кластеров или «колоний» иммобилизованных нуклеиновых кислот. Каждый кластер или колония на таком массиве образован из множества идентичных иммобилизованных цепей полинуклеотида и множества идентичных иммобилизованных комплементарных цепей полинуклеотида. Сформированные массивы, в основном, именуются в настоящем документе как «кластерные массивы». Продукты реакций твердофазной амплификации, также как и те, которые описаны в патенте США №№ 7985565 и 7115400, представляют собой так называемые «мостиковые» структуры, образованные отжигом пар иммобилизованных полинуклеотидных цепей и иммобилизованных комплементарных цепей, причем обе цепочки иммобилизованы на твердой подложке 5'-концом, предпочтительно через ковалентное присоединение. Способы кластерной амплификации являются примерами способов, где матрицу иммобилизованной нуклеиновой кислоты применяют для получения иммобилизованных ампликонов. Также можно использовать другие подходящие способы для получения иммобилизованных ампликонов из иммобилизованных фрагментов ДНК, полученных в соответствии со способами, приведенными в настоящем документе. Например, один или несколько кластеров или колоний могут быть сформированы посредством твердофазной ПЦР, где иммобилизован один или оба праймера каждой пары амплификационных праймеров. В некоторых вариантах осуществления инкапсулированные нуклеиновые кислоты амплифицируют в пределах частицы для поддержания смежности, а затем осаждают на планшет или на твердой подложке в кластер.
Дополнительные способы амплификации включают изотермическую амплификацию. Типичные способы изотермической амплификации, которые можно использовать в качестве неограничивающих примеров, включают в себя амплификацию множественного замещения (MDA), например, Dean et al., Proc. Natl. Акад. Sci. США 99: 5261-66 (2002) или изотермическую амплификацию с замещением цепи нуклеиновой кислоты, например, в патенте США № 6214587, каждый из которых включен в настоящий документ в качестве ссылки в полном объеме. Другие не основанные на ПЦР способы, которые можно использовать в настоящем изобретении, включают, например, амплификацию с замещением цепей (SDA), которая описана, например, Walker et al., Molecular Methods for Virus Detection, Academic Press, Inc., 1995; патенты США №№ 5455166 и 5130238, и Walker et al., Nucl. Acids Res. 20: 1691-96 (1992) или амплификацию с замещением гиперразветвленной цепи, описанную, например, в Lage et al., Genom Research 13: 294-307 (2003), каждая из которых включена в настоящий документ в качестве ссылки в полном объеме. Способы изотермической амплификации можно использовать с вытесняющей цепь полимеразой Phi 29 или большим фрагментом Bst ДНК-полимеразы Bst, 5′->3 ′ экзо- для амплификации геномной ДНК со случайным праймером. Использование эти полимеразы дает пееимущество из-за их высокой процессивности высокую технологичность и активности по вытеснению цепей. Высокая процессивность позволяет синтезировать фрагменты размером 10-20 т.п.н. в длину.
Как указано выше, более мелкие фрагменты можно получать в изотермических условиях с использованием полимеразы, обладающей низкой процессивностью и активностью по вытеснению цепей, такой как полимераза Кленова. Дополнительное описание реакций амплификации, условий и компонентов подробно изложено в раскрытии патента США № 7670810, включенного в настоящий документ в качестве ссылки в полном объеме В некоторых вариантах осуществления полимеразы, реагенты, и компоненты необходимые для проведения этих реакций амплификации способны проходить через поры частиц для поддержания смежности для взаимодействия с инкапсулированными нуклеиновыми кислотами, таким образом, амплифицируя нуклеиновые кислоты в пределах частиц для поддержания смежности. В некоторых вариантах осуществления случайные гексамеры отжигаются на денатурированной ДНК с последующим синтезом замещения цепей при постоянной температуре в присутствии катализирующего фермента, Phi 29. Это приводит к амплификации ДНК в частицах для поддержания смежности, что подтверждается увеличением интенсивности флуоресценции (ДНК окрашивали с помощью SYTOX) после MDA. Независимо, могут также быть проведены основанная на Nextera тагментация после лизиса и очистки и последующая амплификация геномной ДНК с помощью ПЦР, как указывает значительное увеличение интенсивности флуоресценции в частицах для поддержания смежности после тагментации Nextera и ПЦР. После этого получения библиотеки Nextera частицы для поддержания смежности можно нагревать до 80°C в течение 3 минут, чтобы высвободить содержимое частиц для поддержания смежности, а именно, продуктов, содержащих готовую для секвенирования библиотеку, из клетки.
Другой способ амплификации нуклеиновых кислот, который подходит для настоящего изобретения, представляет собой меченую ПЦР, которая использует популяцию двухдоменных праймеров, имеющих постоянную 5-область, за которой следует случайная 3'-область, как показано, например, в Grothues et al. Nucleic Acids Res. 21 (5): 1321-2 (1993), включенной в настоящий документ в качестве ссылки в полном объеме. Первые раунды амплификации проводят для обеспечения множества точек инициации на ДНК, денатурированной при помощи высокой температуры, на основании индивидуальной гибридизации из случайно синтезированной 3'-области. Из-за природы 3'-области сайты инициации считаются случайными на всем протяжении генома. После этого несвязанные праймеры могут быть удалены, и дальнейшая репликация может осуществляться с использованием праймеров, комплементарных константной 5'-области.
В некоторых вариантах осуществления инкапсулированные нуклеиновые кислоты секвенировую полностью или частично в пределах частиц для поддержания смежности. Инкапсулированные нуклеиновые кислоты можно секвенировать в соответствии с любым подходящим способом секвенирования, таким как прямое секвенирование, включая секвенирование путем синтеза, секвенирование путем лигирования, секвенирование путем гибридизации, секвенирование с использованием нанопоры и т.п.
Одним из из способов секвенирования является секвенирование путем синтеза (SBS). При SBS отслеживают удлинение праймера нуклеиновой кислоты вдоль матрицы нуклеиновой кислоты (например, целевой нуклеиновой кислоты или ее ампликона) для определения последовательности нуклеотидов в матрице. Основным химическим процессом может быть полимеризация (например, катализируемая полимеразным ферментом). В конкретном варианте осуществления SBS на основе полимеразы, флуоресцентно меченные нуклеотиды добавляют к праймеру (таким образом, удлиняя праймер) зависимым от матрицы образом, таким образом, что обнаружение порядка и типа нуклеотидов, добавленных к праймеру, можно использовать для определения последовательности матрицы.
Одну или несколько амплифицированных инкапсулированных нуклеиновых кислот можно подвергать SBS или другом способу детекции, который включает повторную доставку реагентов в циклах. Например, чтобы инициировать первый цикл SBS, один или несколько меченых нуклеотидов, ДНК-полимераза и т. д. могут быть направлены в/через частицу для поддержания смежности, в которой находится одна или несколько амплифицированных нуклеиновых кислот. Можно детектировать те сайты, где удлинение праймера вызывает включение меченого нуклеотида. Необязательно, нуклеотиды могут дополнительно включать свойство обратимого терминирования, которое прекращает дальнейшее удилинение праймера, как только нуклеотид был добавлен к праймеру. Например, к праймеру можно добавлять нуклеотидный аналог с группой обратимого терминирования, таким образом, что последующее удлинение не может произойти, пока не будет доставлен деблокирующий агент для удаления группы. Таким образом, для вариантов осуществления, которые используют обратимое терминирование, можно доставлять деблокирующий реагент в проточную ячейку (до или после детекции). Между различными этапами доставки можно проводить отмывки. Затем цикл можно повторить n раз, чтобы удлинить праймер с помощью n нуклеотидов, таким образом, обнаруживая последовательность длиной n. Примеры способов SBS, жидкостных систем и платформы для детекции, которые могут быть легко адаптированы для использования с ампликонами, полученными способами по настоящему изобретению, описаны, например, в Bentley et al., Nature 456: 53-59 (2008), WO 04/018497; патент США № 7057026; WO 91/06678; WO 07/123744; патент США № 7329492; патент США № 7211414; патент США № 7315019; патент США № 7405281 и US 2008/0108082, каждый из которых включен в настоящий документ в качестве ссылки.
Можно использовать другие способы секвенирования, которые используют циклические реакции, такие как пиросеквенирование. Пиросеквенирование обнаруживает высвобождение неорганического пирофосфата (PPi), когда определенные нуклеотиды включаются в образующуюся цепь нуклеиновой кислоты (Ronaghi, et al., Analytical Biochemistry 242 (1), 84-9 (1996); Ronaghi, Genom Res. 11 (1) ), 3-11 (2001); Ronaghi и др. Science 281 (5375), 363 (1998); патент США № 6210891; патент США № 6258568 и патент США № 6274320, каждый из которых включен в настоящий документ в качестве ссылок). При пиросеквенировании высвобождаемый PPi может быть обнаружен путем немедленного превращения в аденозин трифосфат (АТФ) с помощью сульфурилазы АТФ, а уровень генерируемого АТФ может быть обнаружен с помощью фотонов, производимых люциферазой. Таким образом, реакция секвенирования может контролироваться с помощью системы детекции люминесценции. Источники возбуждения излучения, используемые для систем детекции на основе флуоресценции, не нужны для способов пиросеквенирования. Подходящие жидкостные системы, детекторы и способы, которые могут быть адаптированы для применения пиросеквенирования к ампликонам, произведенным по настоящему изобретению, описаны, например, в патентной заявке WIPO с серийным номером PCT/US11/57111, US 2005/0191698 A1, патенте США № 7595883 и патенте США № 7244559, каждый из которых включен в настоящий документ в качестве ссылки.
В некоторых вариантах осуществления могут использоваться способы, включающие мониторинг активности ДНК-полимеразы в режиме реального времени. Например, включения нуклеотидов могут быть обнаружены через взаимодействия резонансного переноса энергии флуоресценции (FRET) между флуорофорсодержащей формулой и меченными γ-фосфатом нуклеотидами или с волноводами с нулевой модой (ZMW). Способы и реагенты для секвенирования на основе FRET описаны, например, в Levene et al. Science 299, 682-686 (2003); Lundquist et al. Opt. Lett. 33, 1026-1028 (2008); Korlach et al. Proc. Natl. Acad. Sci. USA 105, 1176-1181 (2008), описания которых включены в настоящий документ в качестве ссылок.
Некоторые варианты осуествления SBS включают обнаружение протона, высвобождаемого при включении нуклеотида в продукт удлинения. Например, секвенирование, основанное на обнаружении высвобождаемых протонов, может использовать электрический детектор и связанные с ним способы, которые являются коммерчески доступными. Примерами таких секвенирующих систем являются пиросеквенирование (например, коммерчески доступная платформа от 454 Life Sciences, дочерней компании Roche), секвенирование с использованием γ-фосфат-меченных нуклеотидов (например, коммерчески доступная платформа от Pacific Biosciences) и секвенирование с использованием обнаружения протонов (например, коммерчески доступная платформа от Ion Torrent, дочерней компании Life Technologies) или способы и системы секвенирования, описанные в US 2009/0026082 A1; US 2009/0127589 A1; US 2010/0137143 A1; или US 2010/0282617 A1, каждый из которых включен в настоящий документ в качестве ссылки. Способы, изложенные в настоящем документе для амплификации целевых нуклеиновых кислот с использованием кинетического исключения, могут быть легко применены к субстратам, используемым для обнаружения протонов. Более конкретно, способы, изложенные в настоящем документе, можно использовать для получения клональных популяций ампликонов, которые применяют для обнаружения протонов.
Другой способ секвенирования представляет собой секвенирование на основе нанопоры (см., например, Deamer et al. Trends Biotechnol. 18, 147-151 (2000); Deamer et al. Acc. Chem. Res. 35:817-825 (2002); Li et al. Nat. Mater. 2:611-615 (2003), описания которых включены в настоящий документ в качестве ссылок). В некоторых вариантах осуществления на основе нанопор, целевая нуклеиновая кислота или отдельные нуклеотиды, удаленные из целевой нуклеиновой кислоты, проходят через нанопоры. Когда нуклеиновая кислота или нуклеотид проходит через нанопоры, каждый тип нуклеотидов может быть идентифицирован путем измерения колебаний электропроводности поры. (патент США № 7001792; Soni et al. Clin. Chem. 53, 1996-2001 (2007); Healy, Nanomed. 2, 459-481 (2007); Cockroft et al. J. Am. Chem. Soc. 130, 818-820 (2008), описания которых включены в настоящий документ в качестве ссылки).
Примерные способы массивного анализа для экспрессии и генотипирования, которые могут быть применены для детекции в соответствии с настоящим изобретением, описаны в патенте США № 7582420; 6890741; 6913884 или 6355431 или патентной публикации США № 2005/0053980 А1; 2009/0186349 А1 или США 2005/0181440 А1, каждый из которых включен в настоящий документ в качестве ссылки.
В способах выделения нуклеиновых кислот, амплификации и секвенирования, как указано в данном документе, применяют различные реагенты для выделения и получения нуклеиновых кислот. Такие реагенты могут включать, например, лизоцим, протеиназу K, случайные гексамеры, полимеразу (например, Φ29 ДНК-полимеразу, Taq-полимеразу, Bsu-полимеразу), транспозазу (например, Tn5), праймеры (например, адаптерные последовательности P5 и P7), лигазу, катализирующий фермент, дезоксинуклеотид трифосфаты, буферы или двухвалентные катионы. Эти реагенты проходят через поры частиц для для поддержания смежности, в то время как генетический материал сохраняется в пределах частиц для поддержания смежности. Преимущество способов, изложенных в настоящем документе, состоит в том, что они обеспечивают инкапсулированную микросреду для обработки нуклеиновых кислот в пределах частицы для поддержания смежности. Это позволяет обрабатывать одиночную клетку для быстрой и эффективной обработки целевой нуклеиновой кислоты.
Адаптеры могут включать участки праймеров для секвенирования, участки праймеров для амплификации и индексы. Как применяют в настоящем документе «индекс» может включать последовательность нуклеотидов, которые можно использовать в качестве молекулярного идентификатора и/или штрих-кода для мечения нуклеиновой кислоты, и/или для идентификации источника нуклеиновой кислоты. В некоторых вариантах осуществления можно использовать индекс можно использовать для идентификации одной нуклеиновой кислоты или субпопуляции нуклеиновых кислот. В некоторых вариантах осуществления библиотеки нуклеиновых кислот можно получать в частице для поддержания смежности. В некоторых вариантах осуществления одиночную клетку, инкапсулированную в частице для поддержания смежности можно использовать для комбинаторного индексирования одиночной клетки, например, с использованием способа транспозиции, сохраняющей смежность (CPT-seq). В некоторых вариантах осуществления ДНК из одиночной клетки может быть помечена штрих-кодом путем инкапсуляции одиночной клетки после амплификации WGA с другой частицей для поддержания смежности, несущей транспозоны со штрих-кодом, и растворения гелевой матрицы путем контакта с восстановителем, например, чтобы высвободить геномную ДНК для штрих-кодирования.
Варианты осуществления способов и подходов «пространственного индексирования», описываемые в настоящем документе, сокращают анализ данных и упрощают процесс получения библиотеки из одиночных клеток и длинных молекул ДНК. Существующие протоколы для секвенирования одиночной клетки требуют эффективного физического разделения клеток и уникального штрихового кодирования каждой выделенной клетки и объединения всего вместе, чтобы сделать секвенирование. Текущие протоколы для синтетических длинных ридов также требуют громоздких шагов штрих-кодирования, и объединения всех штрих-кодированных фрагментов вместе для секвенирования, и позволяют анализу данных различать генетическую информацию, поступающую из каждой штрих-кодированной клетки. Во время этих длительных процессов также происходит потеря генетического материала, который вызывает пробелы в последовательности. Варианты осуществления, описываемые в настоящем документе, не только сокращают процесс, но и увеличивают разрешение данных для одиночных клеток. Кроме того, варианты осуществления, предлагаемые в настоящем документе, упрощают сборку геномов новых организмов. Варианты осуществления, описываемые в настоящем документе, можно использовать для выявления редких генетических вариаций и одновременного возникновения мутаций. В некоторых вариантах осуществления ДНК-библиотеки, находящейся в пределах частицы для поддержания смежности до момента выпуска, есть возможность контролировать размер фрагментов, которые высвобождаются на поверхности, контролируя процесс высвобождения и состав гидрогеля.
В некоторых вариантах осуществления библиотеку можно амплифицировать с использованием участков праймеров в адаптерных последовательностях, и секвенировать с использованием участков праймеров для секвенирования в адаптерных последовательностях. В некоторых вариантах осуществления адаптерные последовательности могут включать индексы для определения источника нуклеиновых кислот. Эффективность последующих этапов амплификации может быть снижена путем образования димеров праймеров. Для повышения эффективности последующих этапов амплификации можно удалить нелигированныеодноцепочечнные адаптеры из продуктов лигирования.
Получение библиотек нуклеиновых кислот при помощи частиц для поддержания смежности
Некоторые варианты осуществления систем, способов и композиций, предоставляемых в данном документе, включают в себя способы, в которых адаптеры лигированы для нацеливания на нуклеиновые кислоты. Адаптеры могут включать участки связывания праймеров для секвенирования, участки связывания праймеров для амплификации и индексы. Например, адаптер может включать в себя последовательность P5, последовательность P7 или косплементарную им последовательность. Как указано в настоящем документе, последовательность P5 содержит последовательность, определенную SEQ ID NO: 1 (AATGATACGGCGACCACCGA), а последовательность P7 содержит последовательность, определенную SEQ ID NO: 2 (CAAGCAGAAGACGGCATACGA). В некоторых вариантах осуществления последовательность P5 или P7 может дополнительно включать спейсерный полинуклеотид, который может быть от 1 до 20, такой как от 1 до 15, или от 1 до 10 нуклеотидов, такой как 2, 3, 4, 5, 6, 7, 8, 9, или 10 нуклеотидов в длину. В некоторых вариантах осуществления спейсер включает 10 нуклеотидов. В некоторых случаях указанным спейсером является поли Т-спейсер, такой как спейсер 10Т. Спейсерные нуклеотиды можно включать на 5'-концах полинуклеотидов, которые могут быть прикреплены к подходящей подложке, посредством связи с 5'-концом полинуклеотидов. Присоединение может быть достигнуто с помощью серосодержащего нуклеофила, такого как тиофосфат, присутствующий на 5'-конце полинуклеотида. В некоторых вариантах осуществления полинуклеотид будет включать поли Т-спейсер и 5'-группу тиофосфата. Таким образом, в некоторых вариантах осуществления последовательность P5 представляет собой 5´тиофосфат-TTTTTTTTTTAATGATACGGCGACCACCGA-3´ (SEQ ID NO: 3 и в некоторых вариантах осуществления последовательность P7 представляет собой 5´тиофосфат-TTTTTTTTT CAAGCAGAAGACGGCATACGA-3´ (SEQ ID: 4).
Индексы могут быть полезны для выявления источника молекулы нуклеиновой кислоты. В некоторых вариантах осуществления адаптер может быть модифицирован для предотвращения образования конкатемеров, например, путем добавления блокирующих групп, которые предотвращают удлинение адаптера на одном или обоих концах. Примеры 3'-блокирующих групп включают 3'-спейсер C3, дидезоксинуклеотид и прикрепление к субстрату. Примеры 5′ блокирующих групп включают в себя дефосфорилированный 5′ нуклеотид и прикрепление к субстрату.
Адаптеры включают в себя нуклеиновые кислоты, такие как одноцепочечные нуклеиновые кислоты. Адаптеры могут включать короткие нуклеиновые кислоты, имеющие длину менее чем, большую или равную примерно 5 нуклеотидов, 10 нуклеотидов, 20 нуклеотидов, 30 нуклеотидов, 40 нуклеотидов, 50 нуклеотидов, 60 нуклеотидов, 70 нуклеотидов, 80 нуклеотидов, 90 нуклеотидов, 100 нуклеотиды, или в диапазоне между любыми двумя из указанных выше размеров. В некоторых вариантах осуществления они имеют достаточный размер для прохождения пор частиц для поддержания смежности. Целевые нуклеиновые кислоты включают ДНК, такую как геномную или кДНК; РНК, такую как мРНК, рРНК или рРНК; или гибрид ДНК и РНК. Нуклеиновая кислота может быть выделена из одиночной клетки, инкапсулированной в частице для поддержания смежности. Нуклеиновая кислота может содержать фосфодиэфирные связи и может включать другие типы остова, включая, например, фосфоамидные, тиофосфатные, фосфо-дитиоатные, O-метилфосфороамидитные и пептидные остовы и связи нуклеиновой кислоты. Нуклеиновая кислота может содержать любую комбинацию дезоксирибо- и рибонуклеотидов и любую комбинацию оснований, включая урацил, аденин, тимин, цитозин, гуанин, инозин, ксантанин, гипоксантанин, изоцитозин, изогуанин и аналоги оснований, такие как нитропиррол (включая 3-нитропиррол) и нитроиндол (включая 5-нитроиндол). В некоторых вариантах осуществления нуклеиновая кислота может включать в себя, по меньшей мере, одно нерегулярное основание. Нерегулярное основание может быть парой оснований с более чем одним различным типом основания, и это может быть полезно, например, при включении в олигонуклеотидные праймеры или вставки, которые применяют для случайной гибридизации в сложных образцах нуклеиновой кислоты, таких как образцы геномной ДНК. Пример нерегулярного основания включает инозин, который может сочетаться с аденином, тимином или цитозином. Другие примеры включают гипоксантин, 5-нитроиндол, ациловый 5-нитроиндол, 4-нитропиразол, 4-нитроимидазол и 3-нитропиррол. Можно использовать нерегулярные основания, которые могут образовывать пару, по меньшей мере, с двумя, тремя, четырьмя или более типами оснований.
Целевые нуклеиновые кислоты могут включать образец, в котором средний размер нуклеиновой кислоты в образце меньше чем, больше чем или равен примерно 2 т.п.н., 1 т.п.н., 500 п.н., 400 п.н., 200 п.н., 100 п.н., 50 п.н., или диапазону между любыми двумя из указанных выше размеров. В некоторых вариантах осуществления средний размер нуклеиновой кислоты в образце меньше чем, больше чем или равен приблизительно 2000 нуклеотидам, 1000 нуклеотидам, 500 нуклеотидам, 400 нуклеотидам, 200 нуклеотидам, 100 нуклеотидам, 50 нуклеотидам, или диапазону между любыми двумя указанными выше размерами. В некоторых вариантах осуществления нуклеиновая кислота имеет достаточный размер, чтобы нуклеиновая кислота была захвачена внутрь частиц для поддержания смежности, так чтобы она не могла пройти через поры частиц для поддержания смежности.
Пример способа включает дефосфорилирование 5'-концов целевых нуклеиновых кислот для предотвращения образования конкатемеров на последующих этапах лигирования; лигирование первых адаптеров к 3'-концам дефосфорилированных мишеней с использованием лигазы, при этом 3'-концы первых адаптеров блокированы; повторное фосфорилирование 5'-концов лигированных мишеней; лигирование второго адаптера с 5'-концами дефосфорилированных мишеней с использованием лигазы для одной цепи, при этом 5'-концы вторых адаптеров нефосфорилированы.
Другой пример включает частичное расщепление нуклеиновой кислоты 5'-экзонуклеазой с образованием двухцепочечной нуклеиновой кислоты с одноцепочечными 3'-«липкими концами». Адаптер, содержащий 3′-блокирующую группу, можно лигировать с 3′-концами двухцепочечной нуклеиновой кислоты с 3'-«липкими концами». Двухцепочечная нуклеиновая кислота 3'-«липкими концами» с лигированными адаптерами может быть гибридизирована с образованием одноцепочечных нуклеиновых кислот. Адаптер, содержащий нефосфорилированный 5'-конец, может быть лигирован с 5'-концом одноцепочечнной нуклеиновой кислоты.
Способы дефосфорилирования нуклеиновых кислот, например, 5'-нуклеотида нуклеиновой кислоты, включают контакт нуклеиновой кислоты с фосфатазой. Примерами фосфатаз являются кишечная фосфатаза теленка, щелочная фосфатаза креветок, антарктическая фосфатаза и щелочная фосфатаза APEX (Epicentre).
Способы лигирования нуклеиновых кислот включают контакт нуклеиновых кислот с лигазой. Примеры лигаз включают T4 РНК-лигазу 1, T4-РНК-лигазу 2, RtcB-лигазу, РНК-лигазу Methanobacterium и РНК-лигазу TS2126 (CIRCLIGASE).
Способы фосфорилирования нуклеиновых кислот, например, 5'-нуклеотида нуклеиновой кислоты, включают контакт нуклеиновой кислоты с киназой. Примеры киназ включают T4 полинуклеотид киназу.
Варианты осуществления, предлагаемые в настоящем документе, относятся к получению библиотек нуклеиновых кислот в частице для поддержания смежности, таким образом, что библиотеку нуклеиновых кислот получают в одном объеме реакционной смеси.
Варианты осуществления систем и способов, предлагаемых в настоящем документе, включают наборы, содержащие любые один или несколько полимеров гидрогеля, кросслинкеры или микрофлюидные устройства для приготовления частиц для поддержания смежности, которые инкапсулируют клетку, и, кроме того, включают компоненты, подходящие для обработки генетического материала, включая агенты для лизиса клетки, и для амплификации и секвенирования нуклеиновых кислот, или для получения библиотек нуклеиновых кислот, включая лизоцим, протеиназу K, случайные гексамеры, полимеразу (например, ДНК-полимеразу Φ29, Taq-полимеразу, Bsu-полимеразу), транспозазу (например, Tn5), праймеры (например, адаптерные последовательности P5 и P7), лигазу, катализирующий фермент, дезоксинуклеотид трифосфаты, буферы, или двувалентные катионы, как описано в настоящем документе, и которые используют для соответствующей обработки генетического материала.
ПРИМЕРЫ
Пример 1. Получение частиц для поддержания смежности
В следующем примере демонстрируется вариант осуществления получения частиц для поддержания смежности, инкапсулирующих одиночную клетку с использованием микрожидкостного генератора капель.
Образцы, содержащие клетки и хранящиеся при -80°С, оттаивали при комнатной температуре. 100 мкл каждого образца переносили в стерильную пробирку объемом 1,7 мл, и образец отмывали один раз с 1 мл 0,85% NaCl. Образец осаждали и удаляли промывочный раствор. Клеточный осадок смешивали с раствором гидрогеля, чтобы ресуспендировать клетки в растворе гидрогеля.
Чтобы получить частицы для поддержания смежности с однородным распределением размеров, применяли микрофлюидные генераторы капель, такие как генератор, показанный на ФИГ. 1. Раствор, содержащий полимер гидрогеля и клетку, вводили в первый канал микрофлюидного генератора капель. Минеральное масло, используемое в качестве разделительного масла, добавляли во второй канал, а кросслинкер добавляли в третий канал. При контакте с кросслинкером в третьем канале, гидрогель мгновенно формировал частицы для поддержания смежности, инкапсулирующие одиночную клетку. Как изображено на ФИГ. 6, частицы для поддержания смежности окрашивали флуоресцентным красителем, который нацелен на группы -SH полимерной оболочки частиц для поддержания смежности. Правая панель ФИГ. 6 показывает окрашивание одиночной клетки в пределах частицы для поддержания смежности, демонстрируя 60-кратное увеличение изображения частицы для поддержания смежности, окрашенной Hoechst (пятно с синим ядром) и AF-647 BSA, который диффундирует в частицу для поддержания смежности через поры полимерной оболочки. Тип сшивающего масла выбирали для настройки скорости сшивания, в том числе медленный кросслинкер или кросслинкер мгновенного действия, как показано в таблице 1:
Таблица 1: Химия перекрестного сшивания
Пример 2. Совместные анализы, проводимые на частицах для поддержания смежности
Следующий пример показывает примеры анализов, проводимых на частицах для поддержания смежности из Примера 1, включая SCI-seq, ATAC-seq, комбинаторное индексирование и полногеномную амплификацию одиночной клетки.
Получали частицы для поддержания смежности из Примера 1 и наносили на планшет с лунками, таким образом, что одна частица для поддержания смежности была размещена в одной лунке. Клетки лизировали, вводя лизирующий буфер, затем отмывали, таким образом, выделяя нуклеиновые кислоты из клеток. Частицы для поддержания смежности с лизированными клетками затем подвергали серии анализов, как описано ниже.
Как указано на ФИГ. 7, индексированные транспозомы (TSM) использовали для тагментации геномной ДНК, получая фрагменты для ATAC-seq. После обработки протеиназой/SDS, олиго T с тем же индексом, что и TSM, добавляли в каждую лунку для инициации синтеза кДНК путем обратной транскрипции (RT). Адаптер для ПЦР на другом конце вводили путем удлинения рандомера. Так получали Индекс 1. Частицы для поддержания смежности из каждой лунки объединяли вместе, а затем разделяли на планшет для индексированной ПЦР для получения Индекса 2. Это двухуровневое индексирование может быть масштабировано до 150000 (384×384) клеток. Конечная генерируемая библиотека представляла собой смесь ATAC-seq и РНК-seq, в которой гДНК и кДНК из одной и той же клетки были сгруппированы по одному и тому же индексу, а паттерн олиго T-UMI служил в качестве внутреннего маркера для различения сигнала РНК от сигнала ATAC.
Кроме того, случайное удлинение также использовали для полноразмерного РНК-seq, как показано в ФИГ. 8. В этом случае индексы TSM отличались от индексов рандомеров. Сопоставление «один к одному» между этими двумя индексами помогло идентифицировать риды от одиночной клетки и дифференцировать сигналы ДНК и РНК. UMI также применяли в этом способе для повышения точности анализа ридов.
Трехуровневый комбинаторный индексирующий анализ также проводили с использованием двух раундов индексированного шунт-лигирования и одного раунда индексированной ПЦР, как указано на схеме на ФИГ. 9. В этом способе, TSM и олиго T являются универсальными, оба содержат фрагмент splint1, который позволяет добавлять индекс путем шунт-лигирования. Трехуровневая индексация достигла пропускной способности до 1 млн. клеток (96×96×96). Еще одна трехуровневая комбинаторная индексация для ATAC-seq предусматривает использование индексированной TSM для увеличения пропускной способности клеток, как указано на ФИГ. 10. Вместо того, чтобы использовать универсальный TSM, TSM содержали уникальный индекс на стороне B7G и A7G. Два разных шунта применяли для прикрепления индексированных адаптеров, необходимых для индексированной ПЦР. На фигуре 10 индексирование включает следующие компоненты: последовательность адаптера B15 (SEQ ID NO: 5), N6 и Link1, вместе образующие последовательность B15_N6_Link1 (SEQ ID NO: 11); последовательность Phos_Link2, A7G (SEQ ID NO: 9) и последовательность ME (SEQ ID NO: 7), вместе образующие последовательность Phos_Link2_A7G_ME (SEQ ID NO: 12); последовательность адаптера A14 (SEQ ID NO: 6), N6 и Link1, вместе образующие последовательность A14_N6_Link1 (SEQ ID NO: 13); и Phos_Link2, B7G (SEQ ID NO: 10) и последовательность ME (SEQ ID NO: 7), вместе образующие последовательность Phos_Link2_B7G_ME (SEQ ID NO: 14). Фигура 10 также предоставляет последовательность, комплементарную ME (SEQ ID NO: 8), последовательность Splint 1 (SEQ ID NO: 15) и последовательность Splint 2 (SEQ ID NO: 16).
Полногеномную амплификацию одиночной клетки также проводили с использованием частиц для поддержания смежности, как указано на ФИГ. 11. Это делали с использованием индексированной T7 транспозиции частиц для поддержания смежности в отдельных лунках с последующим объединением и удлинением при помощи T7 в линейной амплификации с транскрипцией in vitro (IVT). Гранулы разделяли снова для индексированного случайного удлинения, объединяли и разделяли снова для конечной индексированной ПЦР.
Частицы для поддержания смежности показали эффективную тагментацию, когда они были нацелены на меченные FAM транспозомы. Ядра окрашивали Hoechst (пятно ДНК с синим излучением), а перенесенные ядра окрашивали флуоресцентным зеленым с FAM (флуоресцентный краситель). Лизис клеток с SDS увеличивал фоновую флуоресценцию частиц для поддержания смежности, в то время как от частиц для поддержания смежности без клеток не наблюдали никакого сигнала. Результаты демонстрируют, что библиотеку для ATAC-seq можно получать для клеткок, инкапсулированных внутри частиц для поддержания смежности, только с небольшой долей утечки коротких фрагментов из тагментации.
Пример 3. Получение библиотеки нуклеиновых кислот в частицах для поддержания смежности
Следующий пример показывает способ для получения полногеномной библиотеки из клетки, инкапсулированной в частице для поддержания смежности.
ФИГ. 12 изображает схему для получения полногеномной библиотеки на одиночной клетке, инкапсулированной в частице для поддержания смежности. Как указано на схеме ФИГ. 12, частицу для поддержания смежности использовали для создания полногеномной библиотеки Nextera. Частицы для поддержания смежности получали, как указано в Примере 1. Частицы для поддержания смежности (СР) загружали на клеточное сито 45 мкм и несколько раз промывали PBS или трис-Cl, чтобы удалить любые неинкапсулированнные клетки. Одним из преимуществ инкапсулированной клетки в частице для поддержания смежности является улучшенная способность работать с ними и обрабатывать их. Одним из простых способов сделать это является использование центрифужных колонок или планшетов для фильтрования. Размер пор фильтра может быть меньше диаметра гранулы. Примеры планшетов для фильтрования включают, но не ограничиваясь, планшеты для фильтрования MultiScreen-Mesh Millipore с размером пор 20, 40 и 60 мкм, планшеты для фильтрования MultiScreen-Migration Invasion and Chemotaxis Millipore с порами 8,0 мкм или 96-луночные планшеты для фильтрования для водной фильтрации Pall’s AcroPrep Advance с порами 30-40 мкм. С помощью этих планшетов для фильтрования гранулы с инкапсулированными клетками были легко отделены от раствора, что позволило несколько менять буфер.
Отмытые гранулы суспендировали в буфере и удаляли из фильтра. Чтобы оценить конечную концентрацию гранул, эффективность загрузки клеток и убедиться, что не осталось не инкапсулированных клеток, аликвоту гранул визуализировали под микроскопом.
Для выполнения тагментации Nextera использовали планшеты для фильтрования Millipore Nylon MultiScreen-Mesh 20 мкм. Чтобы ограничить прилипание гранул к фильтру, их предварительно смачивали Плюроник F-127. После центрифугирования планшета в течение 30 сек при 500 g, буфер протекал через фильтр, сохраняя гранулы. Гранулы отмывали дважды с 200 мкл буфера Трис-Cl, затем суспендировали в буфере для лизиса (0,1% SDS). Гранулы инкубировали в лизирующем буфере за 1 мин до удаления посредством центрифугирования. Чтобы удалить остаточный буфер для лизиса, проводили два дополнительных промывания 200 мкл трис-Cl. Затем клетки суспендировали в 45 мкл 1× буфера для тагментации путем пипеттирования вверх и вниз, затем переносили в стрип с пробирками. К 45 мкл гранул добавляли 5 мкл фермента для тагментации ДНК (TDE, Illumina Inc.) и инкубировали в термоциклере в течение 1 часа при комнатной температуре, 30 минут при 55°C. Альтернативно, тагментацию можно проводить на планшете для фильтрования путем суспендирования клеток, инкапсулированных в гранулах, в мастер-миксе для тагментации и последующего инкубирования в термостате. После тагментации аликвоту гранул окрашивали краской по Хехсту и визуализировали под микроскопом. Визуализация подтвердила, что ДНК остается в грануле.
Тагментированные шарики (25 мкл) амплифицировали в ПЦР с использованием мастер-микса Illumina Nextera PCR MM (NPM, Illumina) и праймеров для ПЦР. К основной смеси ПЦР добавляли 0,1% SDS, чтобы удалить Tn5, связанный с ДНК. Предварительную инкубацию проводили при температуре 75°C, чтобы помочь удалению Tn5 в присутствии SDS. Одиннадцать циклов ПЦР проводилидля создания конечной библиотеки. После ПЦР, библиотеки очищали с использованием 0,9×SPRI, измеряли количество с использованием dsDNA qubit и/или BioAnalyzer, и секвенировали на MiSeq и/или NextSeq.
Способ, описанный в этом примере, может быть масштабирован для выполнения секвенирования одиночной клетки с использованием подхода, аналогичного sciSEQ (Vitak et al. Nat Meth. 2017; 14: 302-308). Например, использование 96-луночного планшета для фильтрования для проведения 96 реакций тагментации-индексирования одновременно можно проводить в масштабной форме. После того, как гранулы добавляют на планшет, один за другим добавляют буферы, затем удаляют посредством центрифугирования или вакуума. После тагментации гранулы собирают из фильтра и объединяют. Объединенные гранулы перераспределяют во второй 96-луночный планшет для ПЦР для мультиплексной ПЦР. В этой схеме двухуровневого индексирования (индексирование при тагментации и ПЦР) все фрагменты ДНК из одной клетки, инкапсулированной в грануле, получают один и тот же штрих-код, который можно расшифровать для реконструкции генома клетки.
Этапы, описанные в этом примере, поддаются автоматизации на платформах для обработки жидкостей путем добавления вакуумного коллектора, например вакуумного коллектора Millipore MultiScreen HTS или вакуумного коллектора с 96-луночным планшетом от Orochem. Эти вакуумные коллекторы можно добавлять ко многим платформам для обработки жидкостей, включая Biomek FX, Microlab Star, Tecan Genesis и т.д. Тагментация может быть автоматизирована путем переноса планшета для фильтрования в термоблок. Затем планшет возвращается в вакуумный коллектор для промывок после тагментации.
Варианты осуществления, примеры и рисунки, описываемые в настоящем документе, предлагают композиции, способы и системы для удержания генетического материала в физически замкнутом пространстве в течение процесса от лизиса до создания библиотеки. Некоторые варианты осуществления предлагают библиотеки, происходящую из одиночной длинной молекулы ДНК или одиночной клетки, которая высвобождается на поверхность проточной ячейки в замкнутом пространстве. Как только библиотека из одной молекулы ДНК или одиночной клетки в отдельных отсеках высвобождается на поверхность проточной ячейки, библиотека из каждого отсека высевается в непосредственной близости друг от друга.
Как применяют в настоящем документе термин «содержащий» является синонимом слова «включающий», «включая» или «характеризуется», и является включающим или открытым и не исключает дополнительные, не отмеченные элементы или этапы способов.
Приведенное выше описание раскрывает несколько способов и материалов по настоящему изобретению. В этом изобретении допускаются изменения в способах и материалах, а также изменения в способах изготовления и оборудовании. Такие модификации станут очевидными специалистам в данной области из рассмотрения этого описания или практическом применении описываемого в настоящем документе изобретения. Таким образом, следует понимать, что это изобретение не должно быть ограничено конкретными вариантами осуществления, описываемыми в настоящем документе, но оно охватывает все модификации и альтернативы, входящие в истинный объем и сущность изобретения.
Все цитируемые в настоящем документе ссылки, включая в качестве неограничивающих примеров все опубликованные и неопубликованные заявки, патенты и литературные ссылки, включены в настоящий документ в качестве ссылки в полном объеме и, таким образом, являются частью настоящего описания. В той степени, в которой публикации и патенты или патентные заявки, включенные посредством ссылки, противоречат изобретению, содержащемуся в описании, описание предназначено для того, чтобы заменить и/или иметь приоритет над любым таким противоречивым материалом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ИНКАПСУЛИРОВАНИЯ ОДИНОЧНЫХ КЛЕТОК, ИНКАПСУЛИРОВАННЫЕ КЛЕТКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2750567C2 |
| МОДУЛЯЦИЯ ПОЛИМЕРНЫХ ГРАНУЛ ДЛЯ ОБРАБОТКИ ДНК | 2019 |
|
RU2822154C2 |
| АНАЛИЗ МНОЖЕСТВА АНАЛИТОВ С ИСПОЛЬЗОВАНИЕМ ОДНОГО АНАЛИЗА | 2019 |
|
RU2824049C2 |
| СПОСОБЫ И СРЕДСТВА ПОЛУЧЕНИЯ БИБЛИОТЕКИ ДЛЯ СЕКВЕНИРОВАНИЯ | 2019 |
|
RU2815513C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНЫЕ БИБЛИОТЕКИ ОДИНОЧНЫХ КЛЕТОК И СПОСОБЫ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ | 2020 |
|
RU2838946C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНЫЕ БИБЛИОТЕКИ ОДИНОЧНЫХ ЯДЕР И ОДИНОЧНЫХ КЛЕТОК И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ | 2020 |
|
RU2838545C2 |
| ТРЕХМЕРНЫЕ ПОЛИМЕРНЫЕ СТРУКТУРЫ НА ПРОТОЧНЫХ КЮВЕТАХ | 2020 |
|
RU2833937C1 |
| ТАГМЕНТАЦИЯ С ПРИМЕНЕНИЕМ ИММОБИЛИЗОВАННЫХ ТРАНСПОСОМ С ЛИНКЕРАМИ | 2018 |
|
RU2783536C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНОЕ СЕКВЕНИРОВАНИЕ ОДИНОЧНОЙ КЛЕТКИ СО СНИЖЕННОЙ ОШИБКОЙ АМПЛИФИКАЦИИ | 2019 |
|
RU2744175C1 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНОЕ СЕКВЕНИРОВАНИЕ ОДИНОЧНОЙ КЛЕТКИ СО СНИЖЕННОЙ ОШИБКОЙ АМПЛИФИКАЦИИ | 2019 |
|
RU2833615C2 |
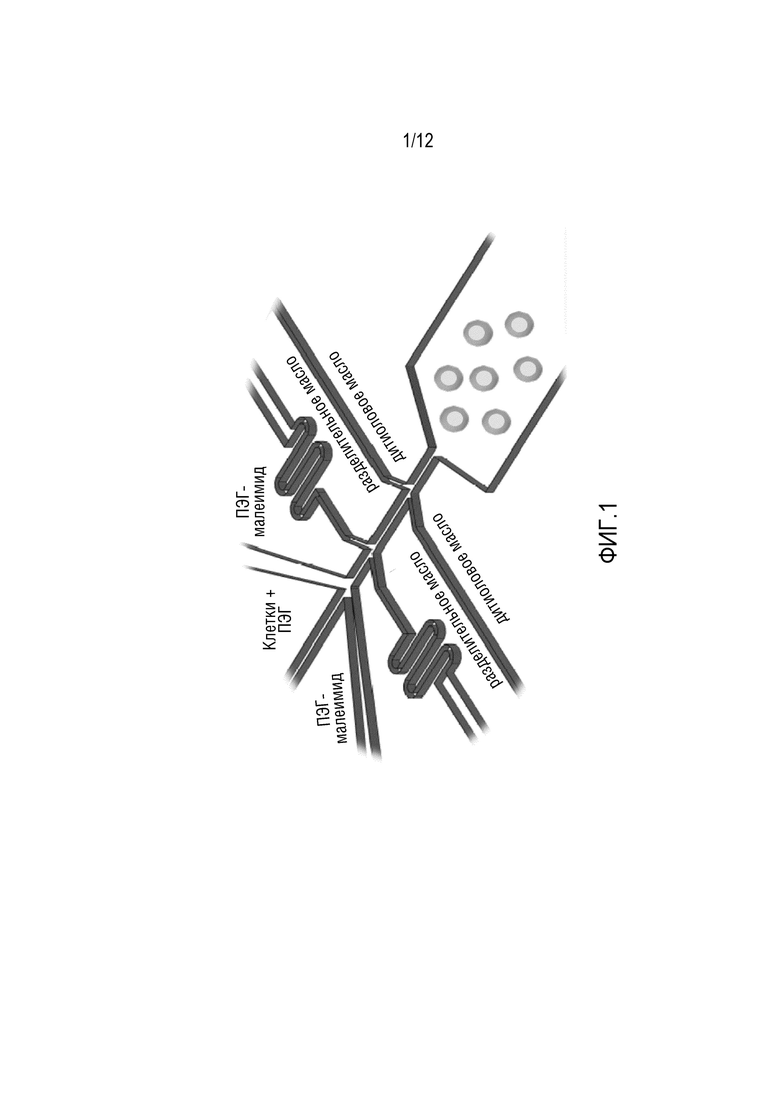
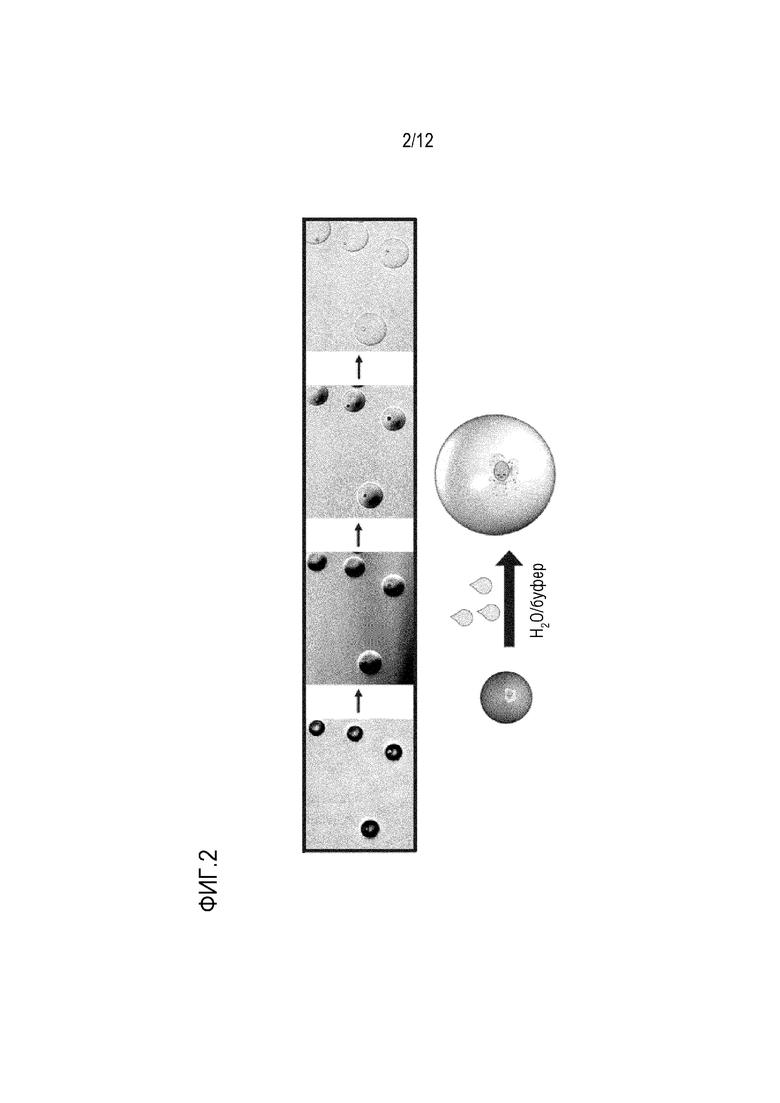
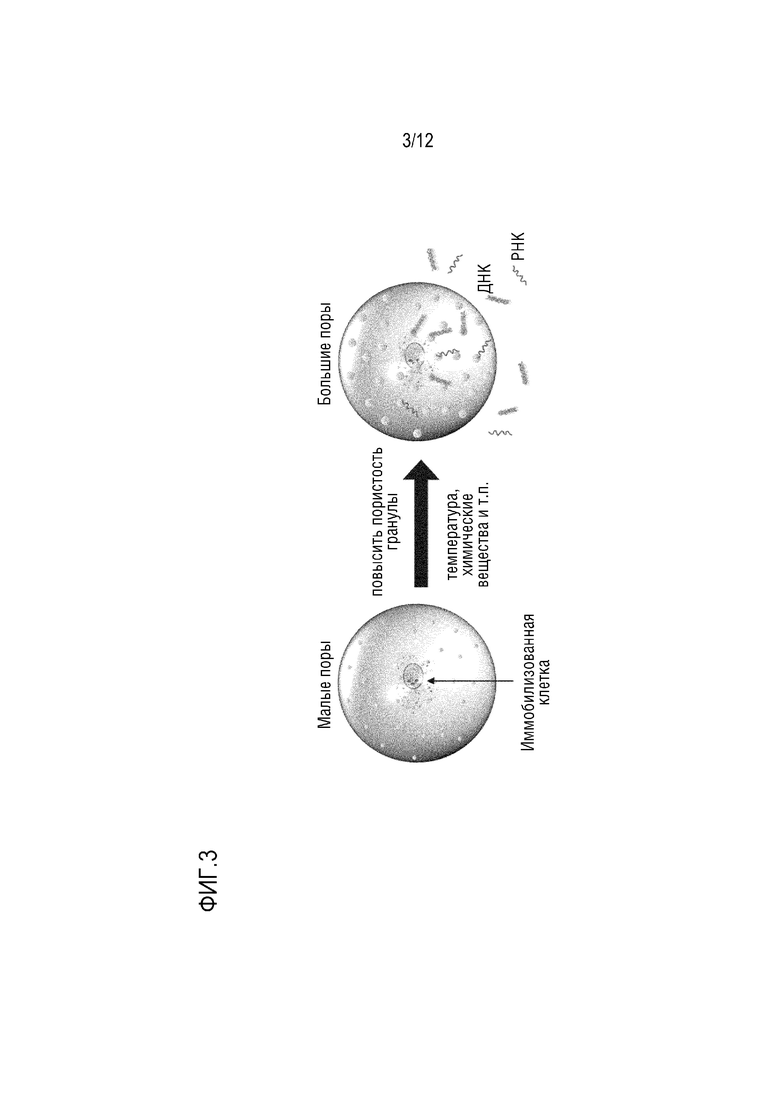
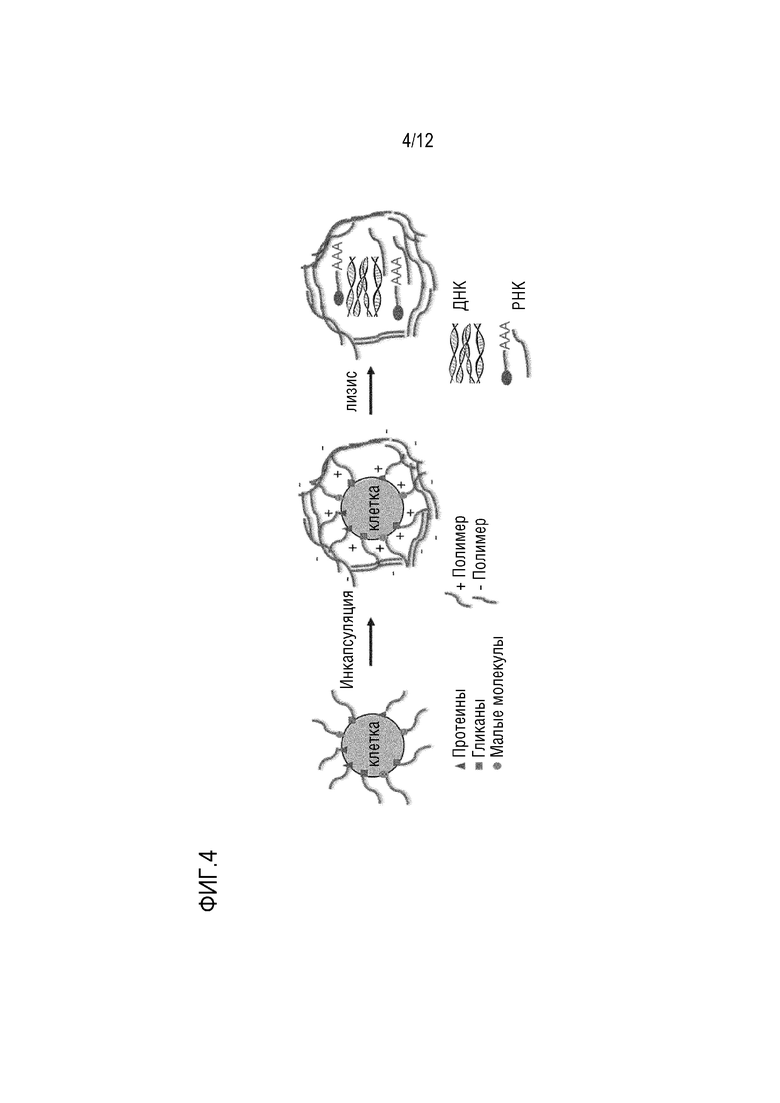
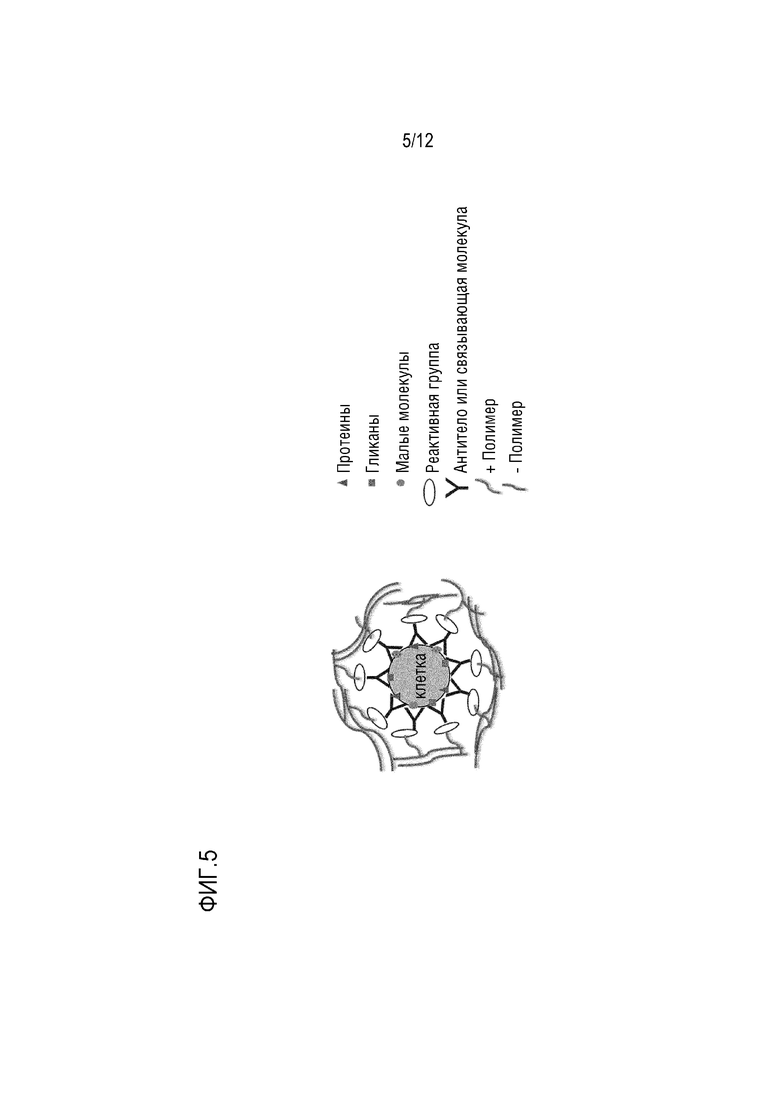

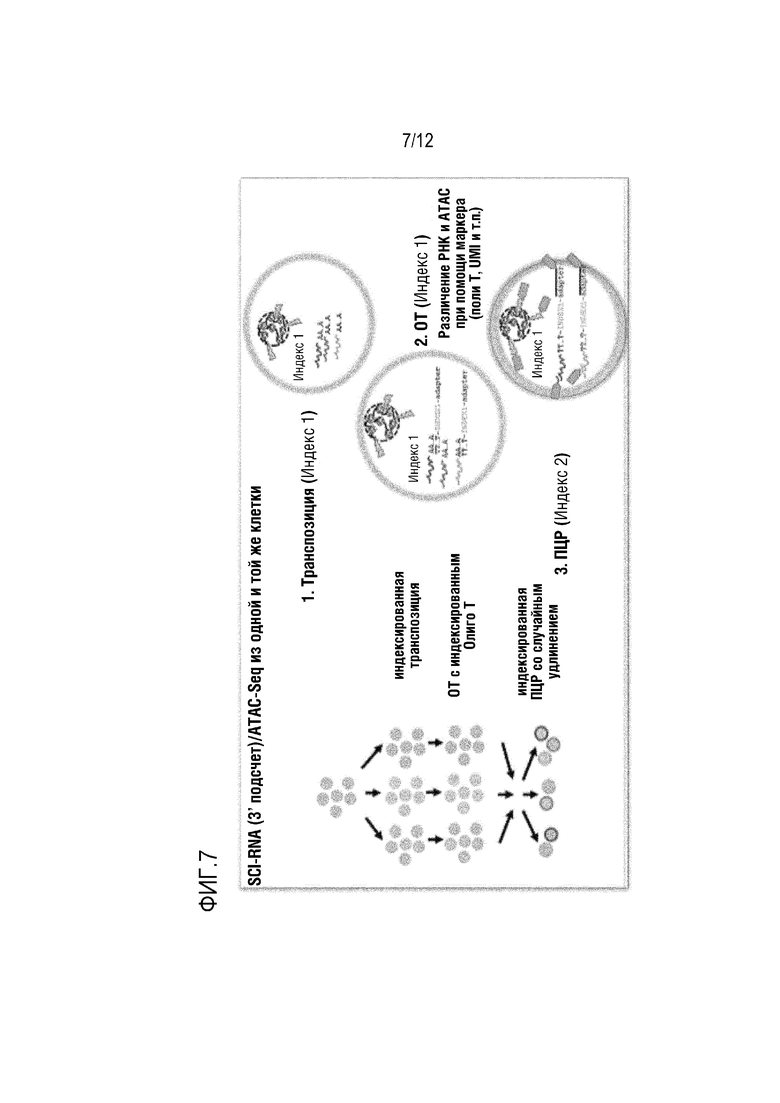
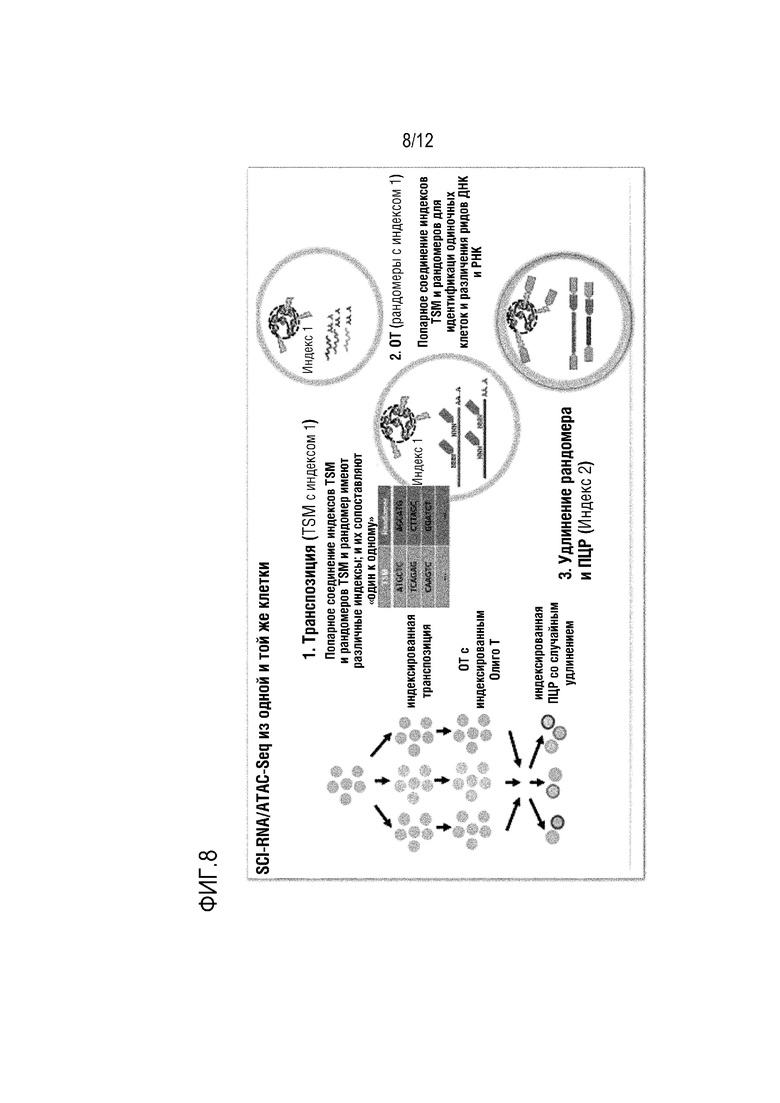


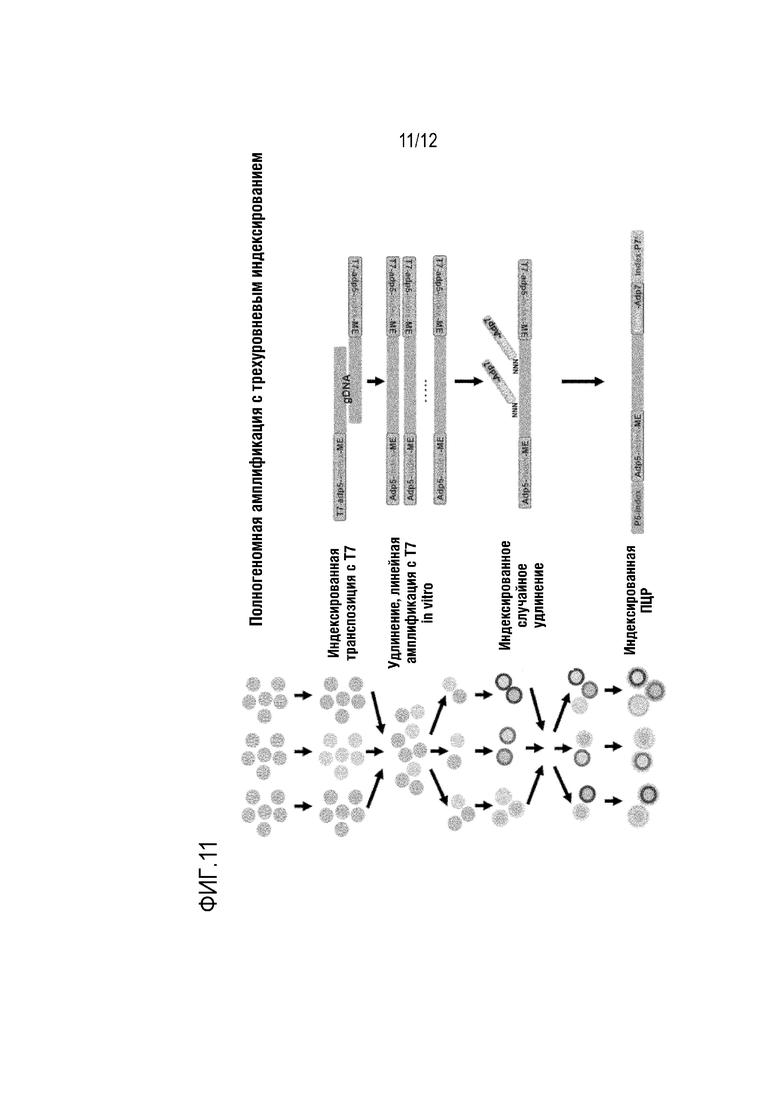
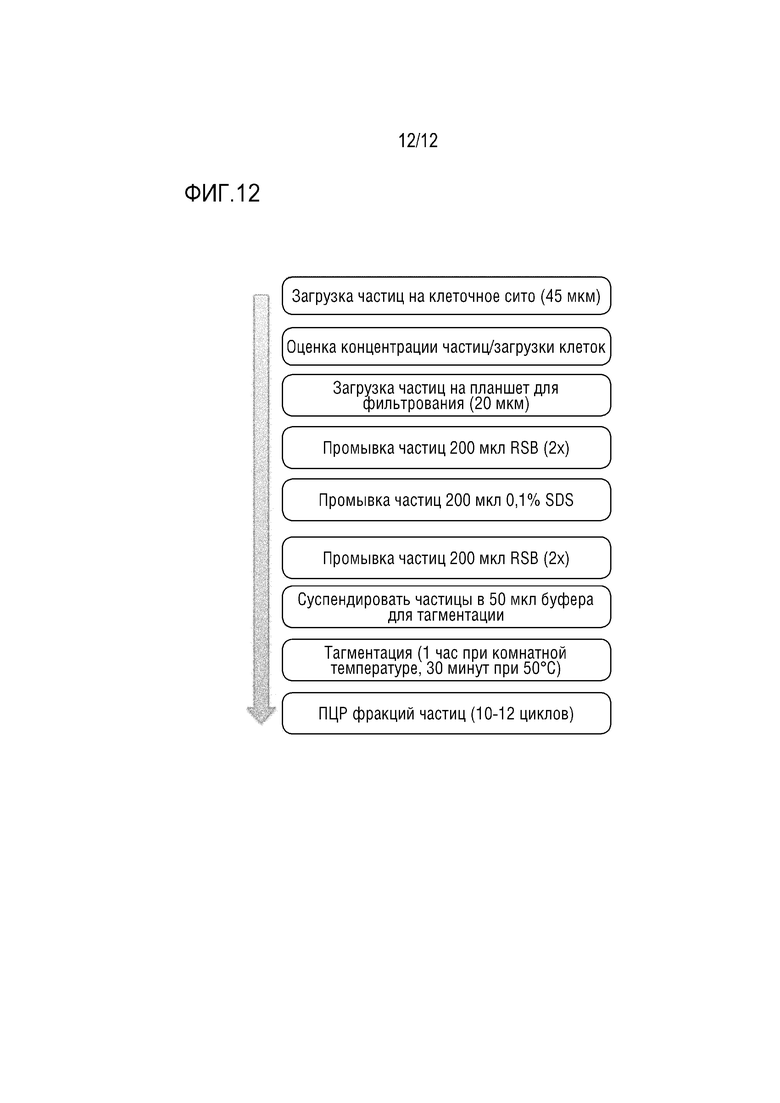
Настоящее изобретение относится к биотехнологии, в частности к твердой подложке для секвенирования нуклеиновых кислот и способу проведения множества последовательных совместных анализов отдельных клеток в популяции клеток с помощью указанной подложки. Указанная твердая подложка включает множество полых гранул, причем каждая гранула содержит полимерную оболочку и одиночную клетку, расположенную внутри полимерной оболочки. Полимерная оболочка содержит поры, которые обеспечивают диффузию реагента через полимерную оболочку с одновременным удержанием одиночной клетки. А твердая подложка представляет собой устройство с проточными ячейками, планшет с лунками, микропанель, микрофлюидный канал, предметное стекло или структурированная поверхность. Для осуществления указанного способа сначала осуществляют контактирование популяции клеток с полимером в разделительном масле для образования смеси (a). После чего проводят перемешивание смеси (a) с маслом для перекрестного сшивания для образования множества гранул, каждая гранула инкапсулирует одиночную клетку. Далее производят последовательное контактирование отдельных клеток внутри множества гранул с реагентом для выполнения множества последовательных совместных анализов популяции клеток. В завершение способа осуществляют разделение гранул на твердой подложке и модификацию разделенных гранул, чтобы обеспечить диффузию инкапсулированного материала из разделенных гранул. Настоящее изобретение обеспечивает возможность проведения нескольких анализов, сохраняя при этом целостность клетки. 2 н. и 17 з.п. ф-лы, 12 ил., 1 табл., 3 пр.
1. Твердая подложка для секвенирования нуклеиновых кислот, включающая множество полых гранул, где каждая гранула содержит:
полимерную оболочку; и
одиночную клетку, расположенную внутри полимерной оболочки,
где полимерная оболочка содержит поры, которые обеспечивают диффузию реагента через полимерную оболочку с одновременным удержанием одиночной клетки;
где твердая подложка представляет собой устройство с проточными ячейками, планшет с лунками, микропанель, микрофлюидный канал, предметное стекло или структурированная поверхность.
2. Твердая подложка по п. 1, где твердая подложка представляет собой устройство с проточными ячейками, включающее вкладыш с микролунками или микростолбиками в устройстве для распределения множества гранул для поддержания смежности для пространственного индексирования в устройстве с проточными ячейками.
3. Твердая подложка по п. 1, где твердая подложка представляет собой планшет с лунками, включающий множество лунок, где каждая из множеств гранул загружена в каждую лунку из множества лунок.
4. Твердая подложка по п. 3, где планшет с лунками включает от приблизительно 12 до 960 лунок.
5. Твердая подложка по п. 1, где каждая гранула имеет диаметр приблизительно от 20 мкм до приблизительно 200 мкм.
6. Твердая подложка по п. 1, где полимерная оболочка содержит ПЭГ-малеинимид/дитиоловое масло, ПЭГ-эпоксид/аминовое масло, ПЭГ-эпоксид/ПЭГ-амин, или ПЭГ-дитиол/ПЭГ-акрилат.
7. Твердая подложка по п. 1, где полимерная оболочка содержит обратимый кросслинкер.
8. Твердая подложка по п. 7, где обратимый кросслинкер представляет собой N,N’-бис(акрилoил)цистамин.
9. Способ проведения множества последовательных совместных анализов отдельных клеток в популяции клеток, включающий:
контактирование популяции клеток с полимером в разделительном масле для образования смеси (a);
перемешивание смеси (a) с маслом для перекрестного сшивания для образования множества гранул, каждая гранула инкапсулирует одиночную клетку, где каждая гранула содержит поры, которые обеспечивают диффузию реагента через гранулу с одновременным удержанием одиночной клетки;
последовательное контактирование отдельных клеток внутри множества гранул с реагентом для выполнения множества последовательных совместных анализов популяции клеток;
разделение гранул на твердой подложке как определено в пп. 1-8; и модификация разделенных гранул, чтобы обеспечить диффузию инкапсулированного материала из разделенных гранул.
10. Способ по п. 9, где модификация разделенных гранул включает повышение температуры гранул.
11. Способ по п. 10, в котором температуру повышают более чем 50°C.
12. Способ по п. 9, где модификация разделенных гранул включает разрушение крослинкера гранул.
13. Способ по п. 12, где разложение включает приведение гранул в контакт с восстановителем.
14. Способ по п. 13, где восстановитель представляет собой дитиоэритритол (DTE), дитиотрейтол (DTT), 2-меркаптоэтанол, аминоэтантиол, глутатион, тиогликолат, 2,3-димеркаптопропанол, трис(2-карбоксиэтил)фосфин (TCEP), трис(гидроксиметил)фосфин (THP), или P-[трис(гидроксиметил)фосфин] пропионовую кислоту (THPP).
15. Способ по п. 9, где модификация разделенных гранул включает воздействие на гранулы электрического поля.
16. Способ по п. 9, где множественные последовательные совместные анализы включают лизис, анализ ДНК, анализ РНК, анализ белков, тагментацию, амплификацию нуклеиновых кислот, секвенирование нуклеиновых кислот, получение библиотеки ДНК, анализ для оценки хроматина, доступного для транспозазы, с использованием секвенирования (ATAC-seq), транспозицию, сохраняющую смежность (CPT-seq), комбинаторное индексированное секвенирование одиночной клетки (SCI-seq), или амплификацию генома одиночной клетки, или любое их сочетание, проводимое последовательно.
17. Способ по п. 9, где каждая гранула имеет диаметр приблизительно от 20 мкм до приблизительно 200 мкм.
18. Способ по п. 9, где разделительное масло включает минеральное масло или фторуглеродное масло.
19. Способ по п. 9, в котором смешивание включает помещение одиночной клетки, полимера, разделительного масла и масла для перекрестного сшивания в генератор капель, где необязательно генератор капель необязательно представляет собой микрофлюидный чип.
| US 2016271064 A1, 22.09.2016 | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| RAMLI ROS AZLINAWATI,et al., Core-shell polymers: a review, RSC Adv., 2013, 3, 15543-15565, DOI: 10.1039/c3ra41296b | |||
| ОПРЕДЕЛЕНИЕ КОМПЛЕКСА HCV-АНТИГЕН/АНТИТЕЛО | 2001 |
|
RU2274863C2 |
Авторы
Даты
2023-04-05—Публикация
2019-04-15—Подача