Область техники
Группа изобретений относится к химии, а именно к способу получения нового химического соединения, производного N4-гидроксицитидина, которое может применятся для ингибирования репликации РНК и ДНК-содержащих вирусов (коронавируса, Арбовируса и Ортопоксвируса).
Уровень техники
Вирусы, переносимые членистоногими (арбовирусы), такими как комары, клещи и мухи, в основном относятся к семействам Flaviviridae, Togaviridae и Bunyaviridae,и передаются ими человеку или другим позвоночным [10.1007/3-211-29981-5_4]. Эти вирусы передаются позвоночным через слюну, когда инфицированный членистоногий переносчик питается кровью. Существует более 250 видов арбовирусов, и не менее 80 из них вызывают заболевания человека, в том числе геморрагическую лихорадку, энцефалит, артрит и менингит [10.1099/0022-1317-82-8-1867]. Болезни, вызванные арбовирусами, составляют большую часть трансмиссивных болезней, и 80% населения мира проживает в районах, в которых один является эндемичным [https://www.who.int/publications/i/item/9789240013155]. Вспышки, переносимых комарами вирусных заболеваний, вызывают обеспокоенность международного сообщества и продолжают оказывать серьезное влияние на глобальное здравоохранение и социально-экономические системы.
В настоящее время во всем мире происходят регулярные вспышки новой коронавирусной инфекции (COVID-19 или SARS-Cov-2). Несмотря на интенсивные контрмеры, принятые во всем мире, заболеваемость и смертность остаются высокими, и многие страны сталкиваются с новыми волнами инфекции. Вакцины являются важным инструментом в борьбе с COVID-19, но разработка противовирусных препаратов также является приоритетной задачей, особенно в связи с появлением вариантов, которые могут частично уклоняться от вакцин. Поэтому, в клинике остро необходим безопасный и эффективный препарат для профилактики и лечения новой коронавирусной инфекции. Исходя из того, что существующие противовирусные препараты имеют в большей или меньшей степени недостатки, создание противовирусных препаратов с лучшим лечебным эффектом является проблемой, требующей срочного решения в настоящее время.
Поксвирусы широко распространены почти во всех странах мира. Род ортопоксвирусов, кроме вируса оспы, включает еще 12 представителей. Некоторые представители этого рода являются зоонозами, однако, нормально циркулируя среди животных, могут вызывать заболевания у человека. Наибольшую озабоченность в последнее десятилетие вызывает рост заболеваемости обезьяньей оспой (4). Широко распространенная вакцинация была прекращена после прекращения циркуляции вируса натуральной оспы. Имеющиеся данные уже проведенных исследований указывают на существование перекрестного иммунитета у вакцинированных людей (Gilchuk I. Et al., Cross-Neutralizing and Protective Human Antibody Specificities to Poxvirus Infections. Cell. 2016 Oct 20; 167(3):684-694)..e9.doi: 10.1016/j.cell.2016.09.049, PMID: 27768891; PMCID: PMC5093772). Исследования свидетельствуют о том, что перекрестный иммунитет среди ортопоксвирусов (в том числе вирусов коровьей оспы, натуральной оспы, оспы обезьян и др.) настолько силен, что позволяет рассчитывать на успешную экстраполяцию полученных данных для защиты от вируса оспы обезьян. Прекращение массовой вакцинации для профилактики оспы увеличило количество людей, проживающих на территории природного очага оспы обезьян в Африке, не имеющих иммунитета. Наибольшее беспокойство вызвала текущая вспышка оспы обезьян, начавшаяся в апреле 2022 г. Менее чем за три месяца оспа обезьян была подтверждена более чем у 30 тысяч человек (8). В России также был выявлен один случай оспы обезьян (9). В результате ВОЗ объявила вспышку оспы обезьян в 2022 году чрезвычайной ситуацией в области общественного здравоохранения. Таким образом, разработка препаратов специфического действия является крайне актуальной задачей.
Известны производные N4-гидроксицитидина, применяемые для лечения или профилактики вирусных инфекций, в частности, восточного, западного и венесуэльского энцефалита лошадей (EEE, WEE и VEE соответственно), лихорадки Чикунгунья (CHIK), лихорадки Эбола, гриппа, сезонных и пандемических коронавирусов (MERS и SARS), респираторно-синцитиального вируса (RSV) и вируса Зика [WO2019113462, WO2016106050, US20190022116]. Однако, для большинства производных N4-гидроксицитидина активность против новых вариантов SARS-CoV-2, как и для других вирусов, остается неизвестной. Изучена активность некоторых пролекарств N4-гидроксицитидина против рекомбинантного SARS-CoV-2 [CN111548384A]. Известно соединение 5'-изопропиловыйэфир β-D-N4-гидроксицитидина (Молнупиравир), которое ингибирует репликацию SARS-CoV-2. Препарат Lagevrio на основе данного соединения применяется для лечения COVID-19 [10.1038/s41564-020-00835-2, https://clinicaltrials.gov/ct2/show/NCT04405739, 10.3389/fimmu.2022.855496, 10.1056/NEJMoa2116044]. Также известны производные N4-гидроксицитидина обладающие активностью против SARS-CoV-2 [WO2021159044]. Данное решение взято нами в качестве прототипа.
В качестве ближайшего аналога изобретения выделен патент WO2021159044, в котором описывается подход к получению замещенных производных N-4-гидроксицитидина. Способ получения заявленных соединений включает пятистадийный подход и основан на синтетическом подходе предложенным Университетом Эмори для получения молнупиравира в патенте US20200276219. Подход заключается в предварительной защите вицинальных 2 и 3 гидроксильных групп в молекуле уридина при помощи ацетонидной защиты и последующую реакцию с соответствующей карбоновой кислотой в присутствии 1,3-дициклогексилкарбодиимида Дальнейшее взаимодействие с 1,2,4-триазолом в присутствии оксихлорида фосфора приводит к образованию реакционноспособного промежуточного продукта, в котором триазоловый фрагмент замещается гидроксиламином. Удаление защитной группы с помощью муравьиной кислоты приводит к образованию целевых замещенных N-4-гидроксицитидинов. Однако выходы промежуточных соединений при применении этого подхода невелики (менее 30%) из-за чего суммарный выход целевых замещенных производных N-4-гидроксицитидина по этому методу не превышает 17-20%.
Таким образом, в области техники существует потребность в создании способа получения нового замещенного N-4-гидроксицитидина, имеющего простую схему синтеза и обладающего высоким выходом продукта на всех стадиях синтеза.
Раскрытие сущности изобретения
Техническим результатом заявленного изобретения является разработка нового способа получения сложноэфирного производного N4-гидроксицитидина с карбоновой кислотой, обладающего выходом на всех стадиях синтеза в диапазоне 52-85%. Также технический результат заключается в разработке нового соединения, обладающего высокой активностью против коронавируса SARS-CoV-2, арбовирусов и проявляющего противовирусный эффект против Ортопоксвирусов.
Указанный технический результат достигается тем, что разработан способ получения 5'-О-(3-фенилпропионил)-N4-гидроксицитидина из β-D-N4-гидроксицитидина, включающий: (а) блокирование вицинальных 2 и 3 гидроксильных групп при помощи ацетонидной защиты с получением промежуточного соединения 5'-О-(3-фенилпропионил)-N4-гидроксицитидина; (б) блокирование гидроксильной группы в 4 положении N4-гидроксицитидина с помощью тритильной защитной группы с получением промежуточного соединения N4-тритилокси-2',3'-О-изопропилиденцитидина; (в) реакцию N4-тритилокси-2',3'-О-изопропилиденцитидина с фенилпропионовой кислотой в присутствии 1,3-дициклогексилкарбодиимида в хлористом метилене с получением промежуточного соединения - 3-фенилпропионовой кислоты 2,2-диметил-6-(2-оксо-4-тритилоксиамино-2Н-пиримидин-1-ил)-тетрагидро-фуро[3,4-d][1,3]диоксол-4-ил метиловый эфира; (г) кислотный гидролиз промежуточного соединения 3-фенилпропионовой кислоты 2,2-диметил -6-(2-оксо-4-тритилоксиамино-2Н-пиримидин-1-ил)-тетрагидро-фуро[3,4-d][1,3]диоксол-4-ил метиловый эфира с образованием 5'-О-(3-фенилпропионил)- N4- гидроксицитидина.
В частном случае выполнения способа блокирование вицинальных 2 и 3 гидроксильных групп проводится путем добавления пара-толуолсульфокислоты к N4-гидроксицитидину в сухом ацетоне.
В частном случае выполнения способа блокирование гидроксильной группы в 4 положении N4-гидроксицитидина проводится путем добавления триэтиламина и 4-диметиламинопиридина к суспензии 2,3-О-изопропилиден-N4-гидроксицитидина в дихлорметане, а затем добавления тритилхлорида в дихлорметане.
В частном случае выполнения способа кислотный гидролиз проводится с муравьиной кислотой.
Краткое описание чертежей
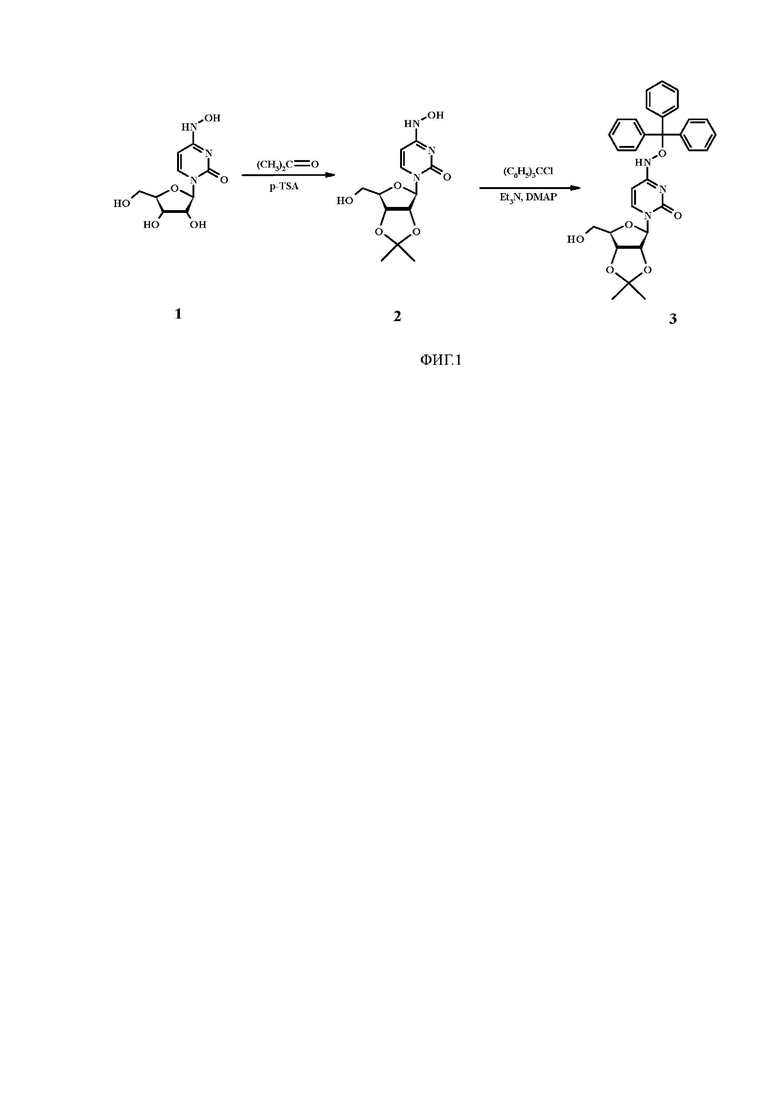
На фиг. 1 представлено получение N4-тритилокси-2',3'-О-изопропилиденцитидина (3).
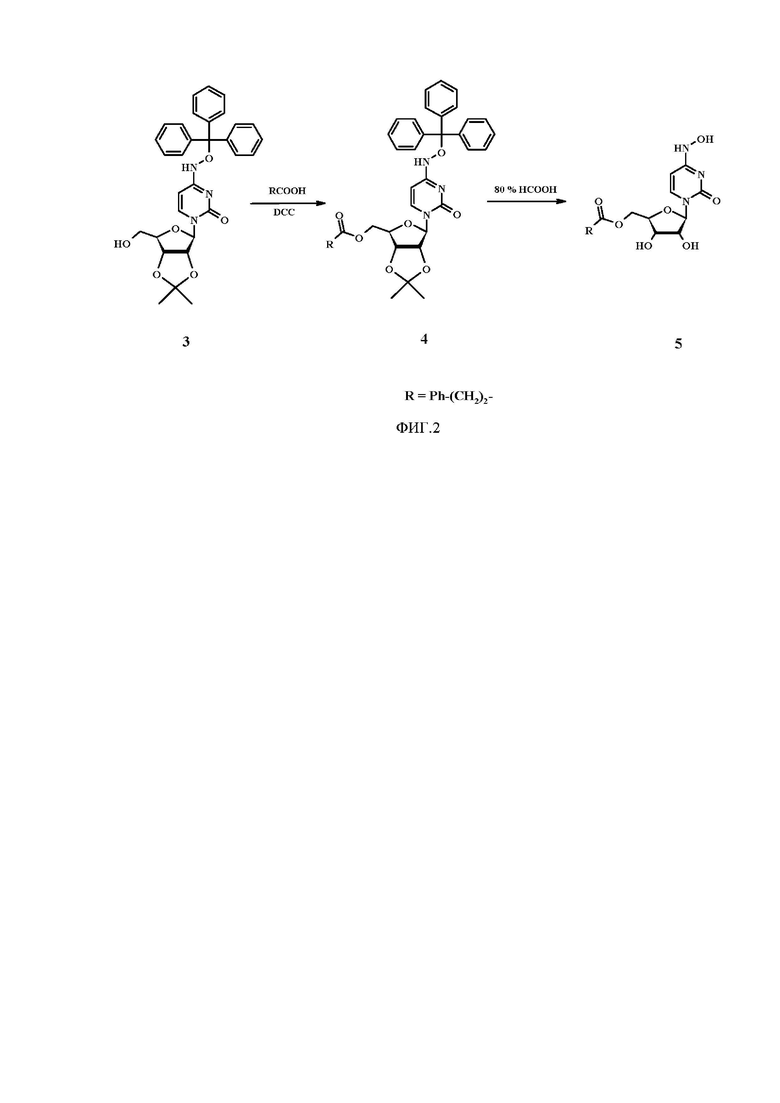
На фиг. 2 представлено получение 5'-О-(3-фенилпропионил)-N4-гидроксицитидина(5).
На фиг. 3 представлены дозозависимые кривые и значения IC50(μМ) ингибирования СРЕ различных вариантов SARS-CoV-2 с помощью исследуемого соединения.
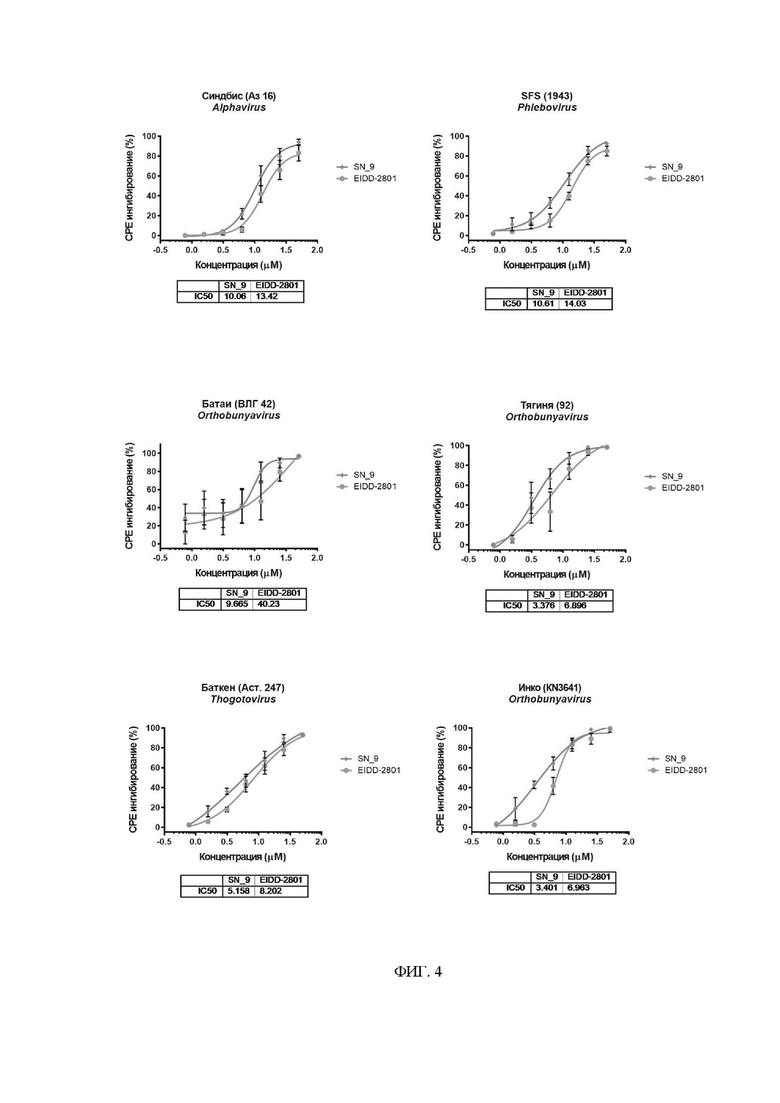
На фиг. 4 представлены дозозависимые кривые и значения IC50(μМ) ингибирования СРЕ различных вариантов Арбовирусов с помощью исследуемого соединения.
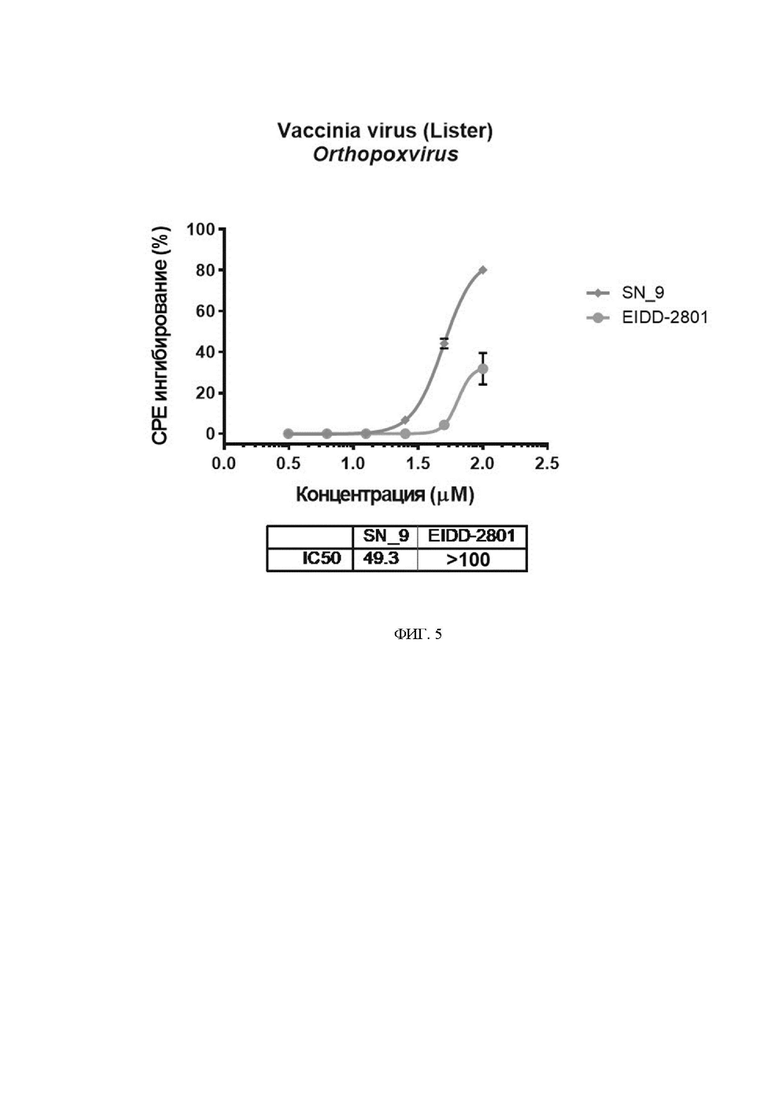
На фиг. 5 представлены дозозависимые кривые и значения IC50(μМ) ингибирования СРЕ вакцинного штамма (Lister)вируса оспы с помощью исследуемого соединения.
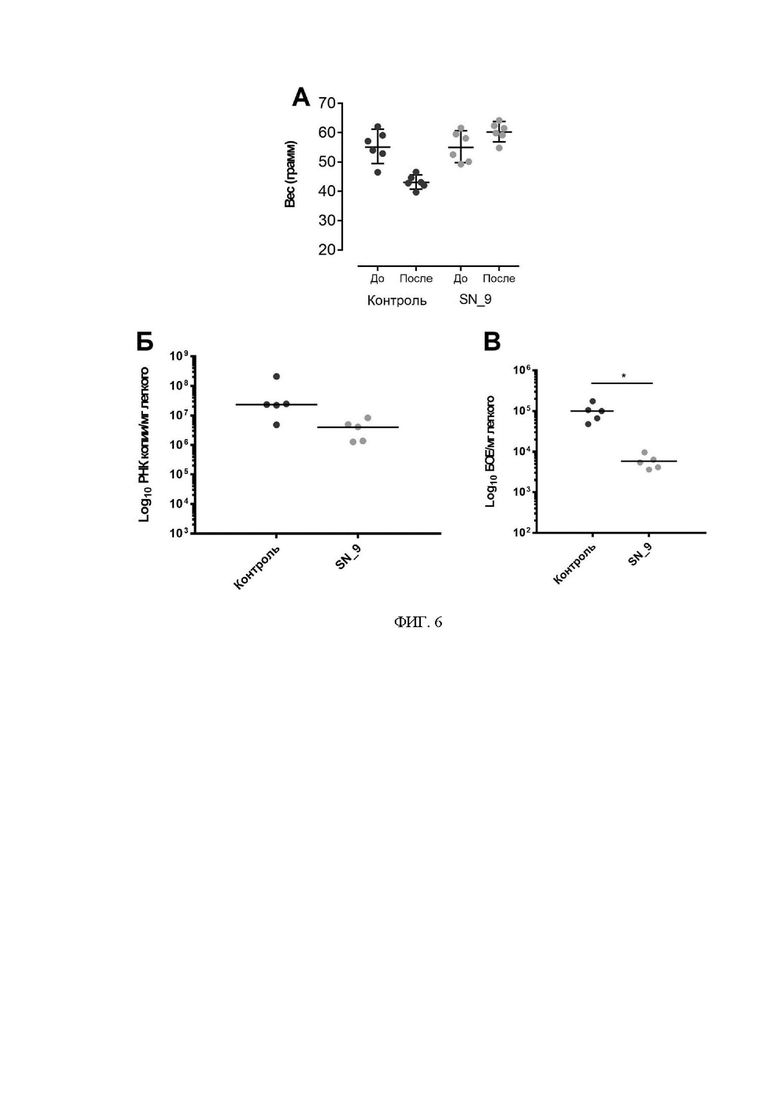
На фиг. 6 представлены данные по эффективности полученного соединения SN_9 против SARS-CoV-2 инфекции invivo. Показана динамика изменения веса животных до и после заражения (А), изменения вирусной нагрузки (Б) и титра вируса (В) в тканях легких в контрольной группе животных и животных получавших изучаемые препараты. Kruskal-Wallis тест: *р<0.05 - статистически достоверно.
Осуществление изобретения
Получение 5'-О-(3-фенилпропионил)-N4-гидроксицитидинасостоит из нескольких этапов.
На первом этапе проводили блокирование вицинальных 2 и 3 гидроксильных групп β-D-N4-гидроксицитидина (NHC)при помощи ацетонидной защиты. При этом оптимальными условиями реакции являлись использование пара-толуолсульфокислоты (p-TSA) в качестве катализатора, проведение реакции в ацетоне при комнатной температуре в течение 2 ч.
На втором этапе проводили блокирование гидроксильной группы в 4 положении N4-гидроксицитидина. Для этих целей была выбрана тритильная (Tr) защитная группа, выбор обусловлен легкостью введения защиты, а также ее кислотолабильностью, что делает возможным деблокирование всех защитных групп в кислых условиях. Реакцию проводили в хлористом метилене действием тритилхлорида (Tr-Cl) в присутствии 4-диметиламинопиридина (DMAP) в качестве катализатора, а также триэтиламина.
На следующем этапе проводили реакцию N4-диметокситритилокси-2',3'-О-изопропилиденцитидина с фенилпропионовой кислотой в присутствии 1,3-дициклогексилкарбодиимида в хлористом метилене, перемешивание осуществляли при комнатной температуре в течение 2 ч. Промежуточный продукт очищали на силикагеле и подвергали кислотному гидролизу действием 80%-ного водного раствора муравьиной кислоты, перемешивали при комнатной температуре 20 ч. Соединение выделяли флэш-хроматографией на силикагеле в системе хлороформ:метанол (5% метанола). В результате выполнения работы было получено новое соединение - 5'-О-(3-фенилпропионил)-N4-гидроксицитидин.
Было показано, что полученное соединение способно ингибировать репликацию коронавируса SARS-CoV-2, а также вирусов из группы Арбовирус с эффективностью, значительно превышающей эффективность прототипа. Кроме того, данное соединение обладает принципиально новым свойством в сравнении с прототипом - противовирусной активностью против вирусов рода Orthopoxvirus. Данное свойство 5'-О-(3-фенилпропионил)-N4-гидроксицитидинане следует явным образом из уровня техники и не является очевидным для среднего специалиста в данной области.
Осуществление изобретения подтверждается следующими примерами.
Пример 1. Синтез 5'-О-(3-фенилпропионил)- N4- гидроксицитидина.
Соединение получали в 4 стадии. Схема синтеза представлена на Фиг. 1 и Фиг. 2. На первом этапе проводили получение промежуточного продукта 2,3-О-изопропилиден-N4-гидроксицитидина (2) (Фиг. 1). Для этого к 1.7 г (6.56 ммоль) N4-гидроксицитидина (1) в сухом ацетоне (240 мл) добавляли 3.7 г (19.69 ммоль) пара-толуолсульфокислоты, полученную смесь перемешивали при комнатной температуре в течение 2 ч. Реакцию нейтрализовывали добавлением триэтиламина, растворители отгоняли, остаток очищали флэш-хроматографией на силикагеле в системе хлороформ:метанол (5% метанола).
Выход соединения (2) 1.6 г (85%), Rf 0.42, Т пл. = 195-196°С.
1Н-ЯМР-спектр (CDCl3), δ, м.д.): 1.32 (2c, 6H, 2CH3), 2.00 (c, 1H, NHOH), 3.65-3.94 (м, 2Н, 5'-СН2), 4.14-4.27 (м, 1Н, 4'-СН), 4.87-5.08 (м, 2Н, 2' и 3'-СН), 5.38 (д, J=2.6 Гц, 1Н, 1'-СН), 5.62 (д, J=7.8 Гц, 1Н, Н-5 Cyt), 6.65 (д, J=8.1 Гц, 1Н, Н-6 Cyt), 8.13 (c, 1H, NHOH)
На втором этапе проводили получение промежуточного продукта N4-тритилокси-2',3'-О-изопропилиденцитидина (3) (Фиг. 2). Для этого к суспензии 1.6 г (5.37 ммоль) 2,3-О-изопропилиден-N4-гидроксицитидина (2) в дихлорметане (100 мл) при перемешивании при комнатной температуре добавляли 1.1 мл (8.06 ммоль) триэтиламина и 7 мг (0.054 ммоль) 4-диметиламинопиридина, смесь перемешивали в течение 15 мин. Затем в реакционную колбу по каплям добавляли раствор 1.5 г (5.37 ммоль) тритилхлорида в дихлорметане (50 мл), перемешивали при комнатной температуре в течение ночи. Растворитель отгоняли на роторном испарителе, остаток очищали флэш-хроматографией на силикагеле в градиенте систем - гексан:этилацетат:триэтиламин (7:3:0.25) с последующим элюированием системой хлороформ:триэтиламин (2.5% триэтиламина).
Выход соединения (3) 2.1 г (72 %), Rf 0.47, Т пл. = 132-133°С.
1Н-ЯМР-спектр (CDCl3, δ, м.д.): 1.29 (c, 3H, CH3), 1.47 (c, 3H, CH3), 3.66-3.99 (м, 2Н, 5'-СН2), 4.12-4.25 (м, 1Н, 4'-СН), 4.89-5.11 (м, 2Н, 2' и 3'-СН), 5.34 (д, J=3.1 Гц, 1Н, 1'-СН), 5.51 (д, J=8.1 Гц, 1Н, Н-5 Cyt), 6.46 (д, J=8.2 Гц, 1Н, Н-6 Cyt), 6.79-6.86, 7.16-7.25 , 7.28-7.33 (3м, 15Н в Tr), 9.97 (c, 1H, NHOH).
На следующем этапе раствор 145.2 мг (0.268 ммоль) N4-тритилокси-2',3'-О-изопропилиденцитидина (3), 60.3 мг (0.402 ммоль) 3-фенилпропановой кислоты и 99.4 мг (0.482 ммоль) 1,3-дициклогексилкарбодиимида в хлористом метилене (15 мл) перемешивали при комнатной температуре в течение 2 ч. Реакционную массу предочищали на силикагеле в системе хлороформ:гексан:триэтиламин (7:3:0.25).
На последнем этапе промежуточный продукт (4) подвергали действию 80%-ного водного раствора муравьиной кислоты (5 мл), перемешивали при комнатной температуре 20 ч, упаривали и очищали флэш-хроматографией на силикагеле в смеси растворителей хлороформ:метанол (5% метанола).
Выход соединения (5) 58 мг (52 %), Rf 0.33, Т пл. = 144-146°С.
1Н-ЯМР-спектр (DMSO-d6, δ, м.д.): 2.67 (т, J=7.4 Гц, 2Н, СН2-СО), 2.85 (т, J=7.5 Гц, 2Н, СН2-Ph), 3.92-4.03 (м, 2Н, 5'-СН2), 4.08-4.22 (м, 1Н, 4'-СН), 5.21-5.35 (м, 2Н, 2' и 3'-СН), 5.56 (д, J=8.2 Гц, 1Н, 1'-СН), 5.70 (д, J=5.5 Гц, 1Н, Н-5 Cyt), 6.82 (д, J=8.2 Гц, 1Н, Н-6 Cyt), 7.16-7.28 (м, 5Н, Ph), 9.56 (c, 1H, NHOH), 10.01 (c, 1H, NHOH),.
Таким образом, в результате проведенной работы было получено новое соединение 5'-О-(3-фенилпропионил)-N4-гидроксицитидин.
Пример 2. Исследование антивирусного эффекта против вариантов SARS-CoV-2.
Целью данного эксперимента является оценка способности полученного соединения (5'-О-(3-фенилпропионил)-N4-гидроксицитидина) ингибировать репликацию различных вариантов вируса SARS-CoV-2.
Эксперимент проводили на клеточной линии Vero E6 (ATCC CRL-1586). Клетки культивировали в ростовой среде DMEM (Gibco, USA), дополненной 5% эмбриональной бычьей сывороткой (FBS; HyClone, USA), 1× антибиотик-антимикотик (CapricornScientificGmbH) и 1× GlutaMAX (Gibco, USA). Для исследования антивирусного эффекта, клетки Vero E6 (2×104 клеток/лунка) высевали в 96-луночные планшеты в полной ростовой среде DMEM за день до эксперимента. Затем, к монослою клеток добавляли различные разведения исследуемого соединения и инкубировали в течение 1 ч при 37°С и 5% CO2. После этого, производили заражение вирусом SARS-CoV-2при 100TCID50 (TCID50- тканевая цитопатогенная доза, вызывающая гибель 50% клеток монослоя). В данном эксперименте использовали следующие варианты вируса SARS-CoV-2: «Ухань» B.1.1 (PMVL-4), «Омикрон» ВА.4.6 (PMVL-55), «Омикрон» BA.5 (PMVL-52) и «Омикрон» BA.5.2 (PMVL-54). Ингибирование вирус-индуцированного цитопатического эффекта (СРЕ) под действием соединения определяли с помощью МТТ-теста [10.1007/s00018-021-03985-6]. Через 72 ч после добавления коронавируса в каждую лунку добавляли раствор 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромида (МТТ) в фосфатно-солевом буфере до конечной концентрации 0,5 мг/мл. Метод основан на способности МТТ восстанавливаться до окрашенного формазана в присутствии митохондриальных ферментов живых клеток. После 2-часовой инкубации из лунок удаляли среду и добавляли 150 мкл диметилсульфоксида. Далее измеряли оптическую плотность раствора формазана, при длине волны 590 нм, с помощью планшетного спектрофотометра. Результаты эксперимента представлены на Фиг. 3.
Анализ антивирусного действия 5'-О-(3-фенилпропионил)-N4- гидроксицитидина против четырех вариантов вируса SARS-CoV-2 показал, что данное соединение обладает активностью в ~2 раза большей (Фиг. 3), чем прототип, который одобрен для лечения COVID-19.
Пример 3. Исследование антивирусного эффекта против Арбовирусов.
Целью данного эксперимента является оценка способности полученного соединения (5'-О-(3-фенилпропионил)-N4-гидроксицитидина) ингибировать репликацию различных вирусов из группы Арбовирусы.
Эксперимент проводили на клеточной линии Vero E6 (ATCC CRL-1586). Клетки культивировали в ростовой среде DMEM (Gibco, USA), дополненной 5% эмбриональной бычьей сывороткой (FBS; HyClone, USA), 1× антибиотик-антимикотик (CapricornScientificGmbH) и 1× GlutaMAX (Gibco, USA). Для исследования антивирусного эффекта, клетки Vero E6 (2×104 клеток/лунка) высевали в 96-луночные планшеты в полной ростовой среде DMEM за день до эксперимента. К клеткам VeroE6 добавляли различные концентрации исследуемого соединения, после чего производили заражение арбовирусом в дозе 100 БОЕ (бляшкообразующие единицы) на лунку. В данном исследовании использовали следующие Арбовирусы: Синдбис (штамм Аз16), Москитная лихорадка Сицилия (SFS 1943), Баткен (штамм Аст. 247), Инко (штамм KN3641), Батаи (штамм ВЛГ 42) и Тягиня (штамм 92). Ингибирование вирус-индуцированного цитопатического эффекта (СРЕ) под действием соединения определяли с помощью МТТ-теста через 72 часа после инфекции. Результаты эксперимента представлены на Фиг. 4.
Таким образом, противовирусный эффект 5'-О-(3-фенилпропионил)-N4- гидроксицитидина был изучен с использованием шести представителей группы Арбовирусы. При этом было определено, что полученное соединение ингибировало репликацию всех вирусов из данной группы с более низкими значениями IC50 (концентрация полумакимального ингибирования), по сравнению с прототипом (Фиг. 4).
Пример 4. Исследование антивирусного эффекта против вируса оспы.
Целью данного эксперимента является оценка способности полученного соединения (5'-О-(3-фенилпропионил)- N4- гидроксицитидина) ингибировать репликацию вируса оспы.
Эксперимент проводили на клеточной линии Vero E6 (ATCC CRL-1586). Клетки культивировали в ростовой среде DMEM (Gibco, USA), дополненной 5% эмбриональной бычьей сывороткой (FBS; HyClone, USA), 1× антибиотик-антимикотик (CapricornScientificGmbH) и 1× GlutaMAX (Gibco, USA). Для исследования антивирусного эффекта, клетки Vero E6 (2×104 клеток/лунка) высевали в 96-луночные планшеты в полной ростовой среде DMEM за день до эксперимента. Двукратные разведения исследуемых соединений готовили в 96-луночных планшетах, после чего переносили их к монослою клеток VeroE6. Для экспериментов использовали вакцинный штамм вируса оспы (Lister; Микроген, Россия) и клетки VeroE6.Клетки заражали вирусом оспы при 100TCID50. Ингибирование вирус-индуцированного цитопатического эффекта под действием соединенияопределялис помощью МТТ-тестачерез 72 часа после инфекции. Результаты эксперимента представлены на Фиг. 5.
При исследовании антивирусной активности против вируса оспы было установлено, что разработанное производное N4-гидроксицитидина SN_9, ингибирует вирус-индуцированный цитопатический эффект (СРЕ) со значением IC5049.3μM (Фиг. 5), тогда как прототип не проявлял выраженного ингибирующего эффекта.
Пример 5. Исследование эффективности полученного соединения против вируса SARS-CoV-2 на животных.
Полученное соединение может вводиться в организм млекопитающих любым путем. Предварительные исследования показали, что оптимальным путем введения является пероральный путь. Максимальная доза препарата была определена как 350 мг/кг.
В эксперименте использовали самок сирийских хомячков. Животные были разделены на две группы по 5 голов, которым вводили:
5'-О-(3-фенилпропионил)-N4- гидроксицитидин, 200 мг/кг;
Фосфатно-солевой буфер (отрицательный контроль).
Затем, производили интраназальное заражение животных при 105TCID50SARS-CoV-2PMVL-4. В течение 4 дней животным вводили исследуемые препараты два раза в день.После эвтаназии животных на пятый день эксперимента, производится их вскрытие и забор легких. Легкие хомяков подвергали гомогенизации с последующим отделением супернатанта низкоскоростным центрифугированием. Титр вирусаопределяли в монослое клеток Vero Е6, выращенных в 48-луночных планшетах. Титр вируса для каждого образца гомогената легких определялиспустя 72 часа, и выражалив виде БОЕ/мг легкого. Тотальная РНК из гомогенатов легких выделяласьс помощью реагента ExtractRNA (Евроген, Россия) согласно инструкции производителя. Реакцию обратной транскрипции выполняли с помощью набора реагентов для количественного определения РНК коронавируса SARS-CoV-2 «SARS-CoV-2 FRT» с использованием панели охарактеризованных по количеству копий амплифицируемого фрагмента SARS-CoV-2 (НИЦЭМ им. Н.Ф. Гамалеи). Результаты выразили в виде чисел, преобразованных в log10 вирусной нагрузки SARS-CoV-2 на мг ткани легкого.
В ходе исследования эффективности препаратов было установлено, что животные из группы отрицательного контроля в значительной степени потеряли вес. Животные, которые получали лечение полученным соединением набрали вес в ходе инфекции (Фиг. 6А), что указывает на наличие эффективности исследуемого препарата и отсутствие токсичности для животных.
Также было определено, что у животных, которым вводили полученное соединение,наблюдалось снижение количества РНК SARS-CoV-2 в тканях легких (Фиг. 6Б).
При определении титра инфекционного вируса в легких у животных было обнаружено, что лечение животных с помощью полученного соединения снижает титр жизнеспособного вируса в легких на ~1.5 Lg (Фиг. 6В).
Таким образом, технический результат изобретения подтверждается тем, что заявляемое соединение - 5'-О-(3-фенилпропионил)-N4-гидроксицитидин- отличается от известных прототипов производных N4-гидроксицитидина и проявляет более высокий антивирусный эффект против вируса оспы, различных вариантов SARS-CoV-2 и Арбовирусов. Кроме того, данное соединение проявляет терапевтическую активность против SARS-CoV-2 инфекции in vivo, и может быть использовано для лечения/профилактики COVID-19.
Промышленная применимость.
Полученное соединение (5'-О-(3-фенилпропионил)-N4-гидроксицитидин) может быть использовано в здравоохранении как новый лекарственный препарат для лечения различных вирусных инфекций. Разработанное и исследованное соединение обладает специфическим противовирусным и политаргетным действием. Политаргетность заключается в антивирусном эффекте против различных вирусных инфекций, представленных коронавирусами SARS-CoV-2, Арбовирусами и Ортопоксвирусами.
| название | год | авторы | номер документа |
|---|---|---|---|
| 5'-О-(3-фенилпропионил)-N4-гидроксицитидин и его применение | 2022 |
|
RU2791523C1 |
| 5'-О-(4-фенилбутаноил)-N4- гидроксицитидин и его применение | 2023 |
|
RU2817201C1 |
| 5'-О-(4-хлорфеноксиацетил)-N4-гидроксицитидин и его применение | 2023 |
|
RU2817609C1 |
| Применение 5'-О-(3-фенилпропионил)-N4-гидроксицитидина для ингибирования репликации вируса гриппа in vitro и in vivo | 2022 |
|
RU2791806C1 |
| Фармацевтическая композиция, содержащая 5'-О-(3-фенилпропионил)-N4-гидроксицитидин | 2024 |
|
RU2838512C1 |
| ПРОИЗВОДНЫЕ УРАЦИЛА, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ SARS-COV-2 | 2021 |
|
RU2769828C1 |
| Модифицированный антисмысловой олигонуклеотид против вируса SARS-CoV-2 | 2020 |
|
RU2750584C1 |
| Вектор на основе мРНК для увеличенной продукции целевого белка в клетках млекопитающих (варианты) | 2022 |
|
RU2792231C1 |
| Средство для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2 в жидкой форме (варианты) | 2021 |
|
RU2743963C1 |
| Средство для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2 в лиофилизированной форме (варианты) | 2021 |
|
RU2743962C1 |

Изобретение относится к области органической химии и фармацевтике, а именно к способу получения нового производного N4-гидроксицитидина, которое может применяться для ингибирования репликации РНК и ДНК-содержащих вирусов. Раскрывается способ получения 5'-О-(3-фенилпропионил)-N4-гидроксицитидина из β-D-N4-гидроксицитидина, включающий: (а) блокирование вицинальных 2' и 3' гидроксильных групп при помощи ацетонидной защиты с получением промежуточного соединения 5'-О-(3-фенилпропионил)-N4-гидроксицитидина; (б) блокирование гидроксильной группы в 4' положении N4-гидроксицитидина с помощью тритильной защитной группы с получением промежуточного соединения N4-тритилокси-2',3'-О-изопропилиденцитидина; (в) реакцию N4-тритилокси-2',3'-О-изопропилиденцитидина с фенилпропионовой кислотой в присутствии 1,3-дициклогексилкарбодиимида в хлористом метилене с получением промежуточного соединения - 3-фенилпропионовой кислоты 2,2-диметил-6-(2-оксо-4-тритилоксиамино-2Н-пиримидин-1-ил)-тетрагидро-фуро[3,4-d][1,3]диоксол-4-ил метиловый эфира; (г) кислотный гидролиз промежуточного соединения 3-фенилпропионовой кислоты 2,2-диметил -6-(2-оксо-4-тритилоксиамино-2Н-пиримидин-1-ил)-тетрагидро-фуро[3,4-d][1,3]диоксол-4-ил метиловый эфира с образованием 5'-О-(3-фенилпропионил)-N4-гидроксицитидина. Изобретение обеспечивает получение нового сложноэфирного производного N4-гидроксицитидина с карбоновой кислотой с высоким выходом. 3 з.п. ф-лы, 6 ил., 5 пр.
1. Способ получения 5'-О-(3-фенилпропионил)-N4-гидроксицитидина из β-D-N4-гидроксицитидина, включающий:
(а) блокирование вицинальных 2' и 3' гидроксильных групп при помощи ацетонидной защиты с получением промежуточного соединения 5'-О-(3-фенилпропионил)-N4-гидроксицитидина;
(б) блокирование гидроксильной группы в 4' положении N4-гидроксицитидина с помощью тритильной защитной группы с получением промежуточного соединения N4-тритилокси-2',3'-О-изопропилиденцитидина;
(в) реакцию N4-тритилокси-2',3'-О-изопропилиденцитидина с фенилпропионовой кислотой в присутствии 1,3-дициклогексилкарбодиимида в хлористом метилене с получением промежуточного соединения - 3-фенилпропионовой кислоты 2,2-диметил-6-(2-оксо-4-тритилоксиамино-2Н-пиримидин-1-ил)-тетрагидро-фуро[3,4-d][1,3]диоксол-4-ил метиловый эфира;
(г) кислотный гидролиз промежуточного соединения 3-фенилпропионовой кислоты 2,2-диметил -6-(2-оксо-4-тритилоксиамино-2Н-пиримидин-1-ил)-тетрагидро-фуро[3,4-d][1,3]диоксол-4-ил метиловый эфира с образованием 5'-О-(3-фенилпропионил)-N4-гидроксицитидина.
2. Способ получения по п.1, где блокирование вицинальных 2' и 3' гидроксильных групп проводится путем добавления пара-толуолсульфокислоты к N4-гидроксицитидину в сухом ацетоне.
3. Способ получения по п.1, где блокирование гидроксильной группы в 4' положении N4-гидроксицитидина проводится путем добавления триэтиламина и 4-диметиламинопиридина к суспензии 2',3'-О-изопропилиден-N4-гидроксицитидина в дихлорметане, а затем добавления тритилхлорида в дихлорметане.
4. Способ получения по п.1, где кислотный гидролиз проводится с муравьиной кислотой.
| WO 2021159044 A1, 12.08.2021 | |||
| WO 2021137913 A3, 08.07.2021 | |||
| CN 113321694 A, 31.08.2021 | |||
| WO 2016106050 A1, 30.06.2016 | |||
| RU 2015119999 A, 20.12.2016. |
Авторы
Даты
2023-03-14—Публикация
2022-12-08—Подача