Изобретение относится к способу получения 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов общей формулы 1:
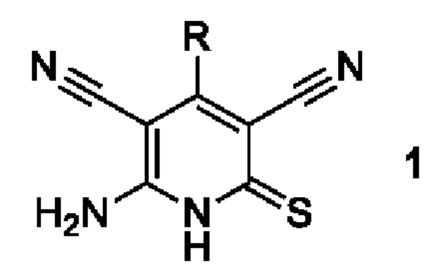
где R=(не)замещенный ароматический или гетероциклический заместитель, являющихся промежуточными продуктами в синтезе:
- антималярийных агентов [Schweda, S.I. 4-Arylthieno[2,3-b]pyridine-2-carboxamides are a new class of antiplasmodial agents / S.I. Schweda, A. Alder, T. Gilberger, C. Kunick // Molecules. - 2020. - V. 25. - №. 14. - Paper 3187];
- селективных агонистов аденозиновых рецепторов [Louvel, J. Structure-kinetics relationships of Capadenoson derivatives as adenosine A1 receptor agonists / J. Louvel, D. Guo, M. Soethoudt, T.A.M. Mocking, E.B. Lenselink, T. Mulder-Krieger, L.H. Heitman, A.P. IJzerman // European Journal of Medicinal Chemistry. - 2015. - V. 101. - P. 681-691; Catarzi, D. Amino-3,5-dicyanopyridines targeting the adenosine receptors. Ranging from pan ligands to combined A1/A2B partial agonists / D. Catarzi, F. Varano, K. Varani, F. Vincenzi, S. Pasquini, D. Dal Ben, R. Volpini, V. Colotta // Pharmaceuticals. - 2019. - Vol. 12. - №. 4. - Paper N 159; Betti, M. The aminopyridine-3,5-dicarbonitrile core for the design of new non-nucleoside-like agonists of the human adenosine A2B receptor / M. Betti, D. Catarzi, F. Varano, M. Falsini, K. Varani, F. Vincenzi, D. Dal Ben, C. Lambertucci, V. Colotta // European Journal of Medicinal Chemistry. - 2018. - Vol. 150. - P. 127-139; Beukers, M.W. New, non-adenosine, high-potency agonists for the human adenosine A2B receptor with an improved selectivity profile compared to the reference agonist N-ethylcarboxamidoadenosine. M.W. Beukers, L.C.W. Chang, J.K. von Frijtag Drabbe Künzel, T. Mulder-Krieger, R.F. Spanjersberg, J. Brussee, A.P. IJzerman // J. Med. Chem. - 2004. - Vol. 47. - P. 3707-3709; Chang, L.C.W. A series of ligand displaying a remarkable agonistic-antagonistic profile at the adenosine A1 receptor / L.C.W. Chang, J.K. von Frijtag Drabbe Künzel, T. Mulder-Krieger, R.F. Spanjersberg, S.F. Roerink, G. van den Hout, M.W. Beukers, J. Brussee, A.P. IJzerman // J. Med. Chem. - 2005. - Vol. 48. - P. 2045-2053]; - антиприонных агентов [May, B.C.H. Structure-activity relationship study of prion inhibition by 2-aminopyridine-3,5-dicarbonitrile-based compounds: parallel synthesis, bioactivity, and in vitro pharmacokinetics /B.C.H. May, J.A. Zorn, J. Witkop, J. Sherrill, A.C. Wallace, G. Legname, S.B. Prusiner, F.E. Cohen // Journal of medicinal chemistry. - 2007. - V. 50. - №. 1. - P. 65-73] и ряда других соединений.
Известен способ получения 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов 1 взаимодействием эквимолярных количеств цианотиоацетамида 2 и арилметиленмалононитрила 3 в присутствии органических оснований при кипячении в этаноле [Attia, А.М. New 2-Oxopyridine/2-Thiopyridine Derivatives Tethered to a Benzotriazole with Cytotoxicity on MCF7 Cell Lines and with Antiviral Activities / A.M. Attia, A.I. Khodair, E.A. Gendy, M. Abu El-Magd and Y.A. M. M. Elshaier // Letters in drug design and discovery. - 2020. - vol. 17. - №2. - P. 124-137; Шаранин Ю.А. Реакции циклизации нитрилов XXX. Синтез, структура и свойства 6-амино-4-арил(гетарил)-3,5-дициано-2(1Н)-пиридинтионов / Ю.А. Шаранин, А.М. Шестопалов, В.Н. Нестеров, С.Н. Меленчук, В.К. Промоненков, В.Е. Шкловер, Ю.Т. Стручков, В.П. Литвинов // Журн. органической химии. -1989. - Т. 25. - №3. - С. 622-628; May, B.C.H. Structure-activity relationship study of prion inhibition by 2-aminopyridine-3,5-dicarbonitrile-based compounds: parallel synthesis, bioactivity, and in vitro pharmacokinetics / B.C.H. May, J.A. Zorn, J. Witkop, J. Sherrill, A.C. Wallace, G. Legname, S.B. Prusiner, F.E. Cohen // Journal of medicinal chemistry. - 2007. - V. 50. - №. 1. - P. 65-73] по схеме:
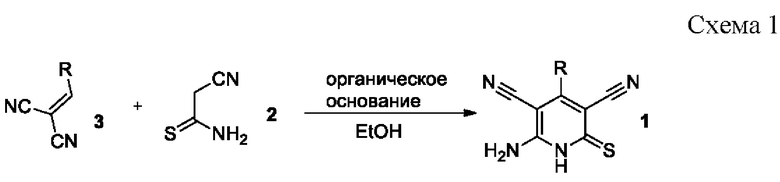
Недостатком данного метода являются низкие (менее 60%) выходы целевых продуктов, а также необходимость предварительного получения арилметиленмалононитрилов.
Известен способ получения 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов 1 взаимодействием эквимолярных количеств малононитрила 4 и 3-арил-2-цианопроп-2-ентиоамидов 5 в кипящем этаноле в присутствии органических оснований [Attia, А.М. New 2-Oxopyridine/2-Thiopyridine Derivatives Tethered to a Benzotriazole with Cytotoxicity on MCF7 Cell Lines and with Antiviral Activities / A.M. Attia, A.I. Khodair, E.A. Gendy, M. Abu El-Magd and Y. A. M. M. Elshaier // Letters in drag design and discovery. - 2020. - vol. 17. - №2. - P. 124-137; Шаранин Ю.А. Реакции циклизации нитрилов XXX. Синтез, структура и свойства 6-амино-4-арил(гетарил)-3,5-дициано-2(1Н)-пиридинтионов / Ю.А. Шаранин, А.М. Шестопалов, В.Н. Нестеров, С.Н. Меленчук, В.К. Промоненков, В.Е. Шкловер, Ю.Т. Стручков, В.П. Литвинов // Журн. органической химии. -1989. - Т. 25. - №3. - С.622-628; Abbas, A.A. Versatile starting materials for novel 1,ω-bis(pyridin-4-ylphenoxy)alkanes, and their corresponding bis(thieno[2,3-b]pyridin-4-ylphenoxy)derivatives / A.A. Abbas, M.A.A. Elneairy, Y.N. Mabkhot // Journal of Chemical Research, Miniprint. - 2001. - N 4. - P. 411-427] по схеме:
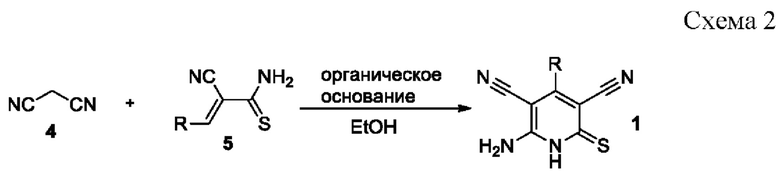
Недостатком данного метода являются низкие (менее 50%) выходы целевых продуктов, а также необходимость предварительного получения 3-арил-2-цианопроп-2-ентиоамидов.
Известен способ получения 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов 1 взаимодействием эквимолярных количеств цианотиоацетамида 2 и 3-арил-2-цианопроп-2-ентиоамидов 5 в кипящем этаноле в присутствии этилата натрия либо третичных аминов [Dyachenko, V.D. Michael reaction in synthesis of 6-amino-4-(4-butoxyphenyl)-3,5-dicyanopyridine-2(1H)-thione / V.D. Dyachenko, V.P. Litvinov // Chemistry of Heterocyclic Compounds. - 1998. - Vol.34. - №2. - P. 188-194; Abbas, A.A. Versatile starting materials for novel 1,ω-bis(pyridin-4-ylphenoxy)alkanes, and their corresponding bis(thieno[2,3-b]pyridin-4-ylphenoxy)derivatives / A.A. Abbas, M.A.A. Elneairy, Y.N. Mabkhot // Journal of Chemical Research, Miniprint. - 2001. -N 4. - P. 411-427; Sanad, S.M.H.; Pyridine-2(1H)-thiones: versatile precursors for novel pyrazolo[3,4-b]pyridine, thieno[2,3-b]pyridines, and their fused azines / S. M.H. Sanad, A.M. Abdel-Fattah, F.A. Attaby, M.A.A. Elneairy // Journal of Heterocyclic Chemistry. - 2019. - Vol. 56. - N 2. - P. 651-662; El-Torgoman, A. M. Nitriles in heterocyclic synthesis: the reaction of 2-thiocarbamoyl cinnamonitriles with active methylene reagents / A.M. El-Torgoman, S.M. El-Kousy, Z. El-Shahat Kandeel // Zeitschrift fur Naturforschung, B: Chemical Sciences. - 1987. - Vol. 42. - N 1. - P. 107-112; Шаранин Ю.А. Реакции циклизации нитрилов XXX. Синтез, структура и свойства 6-амино-4-арил(гетарил)-3,5-дициано-2(1Н)-пиридинтионов / Ю.А. Шаранин, А.М. Шестопалов, В.Н. Нестеров, С.Н. Меленчук, В.К. Промоненков, В.Е. Шкловер, Ю.Т. Стручков, В.П. Литвинов // Журн. органической химии. -1989. - Т. 25. -№3. - С. 622-628] согласно схеме:
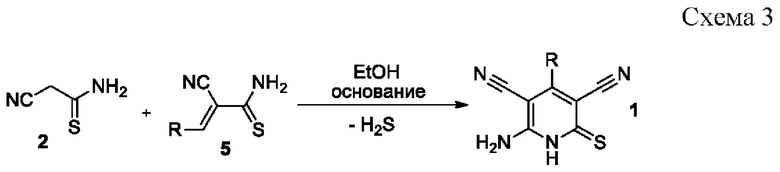
Недостатком данного метода является необходимость предварительного получения 3-арил-2-цианопроп-2-ентиоамидов 5, а также выделение в ходе реакции токсичного и обладающего неприятным запахом сероводорода.
Известен способ получения 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов 1 взаимодействием ароматических альдегидов с двукратным избытком цианотиоацетамида 2 в этаноле в присутствии N-метилморфолина [Dyachenko, V.D. Michael reaction in synthesis of 6-amino-4-(4-butoxyphenyl)-3,5-dicyanopyridine-2(lH)-thione / V.D. Dyachenko, V.P. Litvinov // Chemistry of Heterocyclic Compounds. - 1998. - Vol. 34. - №2. - P. 188-194; Dyachenko, V.D. New Route to 6-Amino-4-aryl-3,5-dicyanopyridine-2(1H)-thiones / V.D. Dyachenko, S.G. Krivokolysko, Yu.A. Sharanin, V.P. Litvinov // Russian Journal of Organic Chemistry. - 1997. - Vol.33. -N 7. -P. 1014-1017] согласно схеме:
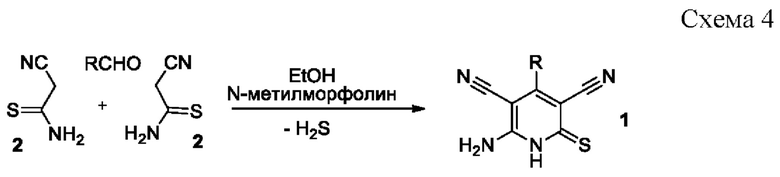
Недостатком данного метода является длительность процесса, а также выделение в ходе реакции токсичного и обладающего неприятным запахом сероводорода.
Известен способ получения 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов 1 реакцией рециклизации 2,6-диамино-4-арил-4Н-тиопиран-3,5-дикарбонитрилов 6 в кипящем этаноле или изопропаноле в присутствии N-метилморфолина [Dyachenko, V.D. New Route to 6-Amino-4-aryl-3,5-dicyanopyridine-2(lH)-thiones / V.D. Dyachenko, S.G. Krivokolysko, Yu.A. Sharanin, V.P. Litvinov // Russian Journal of Organic Chemistry. - 1997. - Vol.33. - N 7. - P. 1014-1017; Dyachenko, V.D. Michael reaction in synthesis of 6-amino-4-(4-butoxyphenyl)-3,5-dicyanopyridine-2(lH)-thione / V.D. Dyachenko, V.P. Litvinov // Chemistry of Heterocyclic Compounds. - 1998. - Vol. 34. - №2. - P. 188-194; Шаранин Ю.А. Реакции циклизации нитрилов XXX. Синтез, структура и свойства 6-амино-4-арил(гетарил)-3,5-дициано-2(1Н)-пиридинтионов / Ю.А. Шаранин, А.М. Шестопалов, В.Н. Нестеров, С.Н. Меленчук, В.К. Промоненков, В.Е. Шкловер, Ю.Т. Стручков, В.П. Литвинов // Журн. органической химии. - 1989. - Т. 25. - №3. - С. 622-628; Dyachenko, V.D. Synthesis and Recyclization of 4-Aryl-2,6-diamino-3,5-dicyano-4H-thiopyrans / V.D. Dyachenko, V.P. Litvinov // Russian Journal of Organic Chemistry. - 1998. - Vol. 34. - №4. - P. 557-563] по схеме:
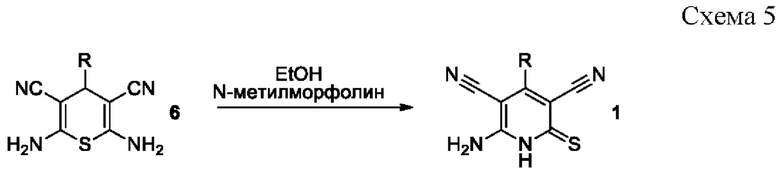
Недостатком данного метода являются обычно невысокие выходы, выделение в ходе реакции токсичного и обладающего неприятным запахом сероводорода, а также необходимость предварительного получения 2,6-диамино-4-арил-4Н-тиопиран-3,5-дикарбонитрилов 6.
Известен способ получения 6-амино-4-(индол-3-ил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила 7 взаимодействием 3-(1H-индол-3-ил)-2-цианопроп-2-ентиоамида 8 со спиртовым раствором KOH при кипячении в течение 3 часов и последующим подкислением [Новый подход к синтезу функциональных производных 3-(4-пиридинил)-1Н-индола и 4-(1Н-индол-3-ил)тиено[2,3-b]пиридина / В.В. Доценко, С.Г. Кривоколыско, Б.С. Кривоколыско, К.А. Фролов // Журнал общей химии. - 2018. - Т. 88. - Вып. 4. - С. 599-605] по схеме:
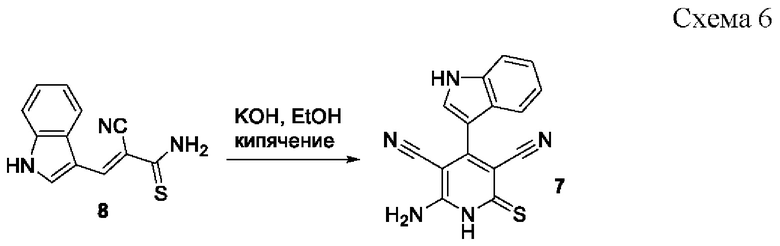
Однако недостатком данного метода являются сравнительно низкий выход целевого продукта (37% в расчете в расчете на исходные реагенты), а также низкая атом-экономность процесса, связанная с побочным образованием индол-3-карбальдегида.
Известен способ получения 6-амино-4-(индол-3-ил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила 7 взаимодействием индол-3-карбальдегида с цианотиоацетамидом 2 в присутствии каталитических количеств N-метилморфолина в течение 2 часов при нагревании в растворе этанола, и последующей обработкой продукта спиртовым раствором KOH при кипячении в течение 3 часов и последующим подкислением [Новый подход к синтезу функциональных производных 3-(4-пиридинил)-1Н-индола и 4-(1Н-индол-3-ил)тиено[2,3-b]пиридина / В.В. Доценко, С.Г. Кривоколыско, Б.С.Кривоколыско, К.А. Фролов // Журнал общей химии. - 2018. - Т. 88. - Вып. 4. - С. 599-605] согласно схеме:
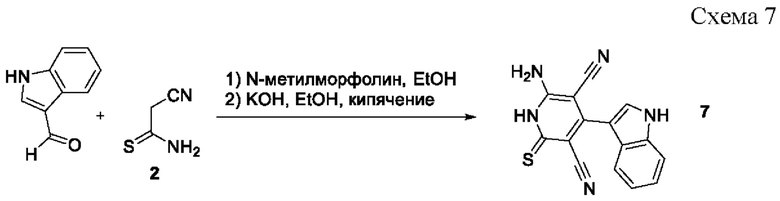
Однако недостатком данного метода являются сравнительно низкий выход целевого продукта 7 (46% в расчете на исходные реагенты), многостадийность процесса, а также низкая атом-экономность, связанная с побочным выделением индол-3-карбальдегида и сероводорода.
Известен способ получения 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов 1 взаимодействием 2-амино-4-арил-6-(фенилсульфанил)пиридин-3,5-дикарбонитрилов 9 с сульфидом натрия в безводном N,N-диметилформамиде при 80°С, с последующим подкислением 1М HCl [Catarzi, D. Amino-3,5-dicyanopyridines targeting the adenosine receptors. Ranging from pan ligands to combined A1/A2B partial agonists / D. Catarzi, F. Varano, K. Varani, F. Vincenzi, S. Pasquini, D. Dal Ben, R. Volpini, V. Colotta // Pharmaceuticals. - 2019. - Vol. 12. - №. 4. - Paper N 159; Betti, M. The aminopyridine-3,5-dicarbonitrile core for the design of new non-nucleoside-like agonists of the human adenosine A2B receptor / M. Betti, D. Catarzi, F. Varano, M. Falsini, K. Varani, F. Vincenzi, D. Dal Ben, C. Lambertucci, V. Colotta // European Journal of Medicinal Chemistry. - 2018. - Vol. 150. - P. 127-139; Beukers, M.W. New, non-adenosine, high-potency agonists for the human adenosine A2B receptor with an improved selectivity profile compared to the reference agonist N-ethylcarboxamidoadenosine. M.W. Beukers, L.C.W. Chang, J.K. von Frijtag Drabbe Künzel, T. Mulder-Krieger, R.F. Spanjersberg, J. Brussee, A.P. IJzerman // J. Med. Chem. - 2004. - Vol. 47. - P. 3707-3709; Chang, L.C.W. A series of ligand displaying a remarkable agonistic-antagonistic profile at the adenosine A1 receptor / L.C.W. Chang, J.K. von Frijtag Drabbe Künzel, T. Mulder-Krieger, R.F. Spanjersberg, S.F. Roerink, G. van den Hout, M.W. Beukers, J. Brussee, A.P. IJzerman // J. Med. Chem. - 2005. - Vol. 48. - №6. - P. 2045-2053; Alinaghizadeh, F. Cascade synthesis of thieno[2,3-b]pyridines by using intramolecular cyclization reactions of 3-cyano-2-(organylmethylthio)pyridines / F. Alinaghizadeh, M. Zahedifar, M. Seifia, H. Sheibani // Journal of the Brazilian Chemical Society. - 2016. - Vol. 27. - N 4. - P. 663-669]. 2-Амино-4-арил-6-(фенилсульфанил)пиридин-3,5-дикарбонитрилы 9, в свою очередь, доступны реакцией 2 эквивалентов малононитрила, ароматического альдегида и тиофенола [Alinaghizadeh, F. Cascade synthesis of thieno[2,3-b]pyridines by using intramolecular cyclization reactions of 3-cyano-2-(organylmethylthio)pyridines / F. Alinaghizadeh, M. Zahedifar, M. Seifia, H. Sheibani // Journal of the Brazilian Chemical Society. - 2016. - Vol.27. - N 4. - P. 663-669; Catarzi, D. Amino-3,5-dicyanopyridines targeting the adenosine receptors. Ranging from pan ligands to combined A1/A2B partial agonists / D. Catarzi, F. Varano, K. Varani, F. Vincenzi, S. Pasquini, D. Dal Ben, R. Volpini, V. Colotta // Pharmaceuticals. - 2019. - Vol.12. - №. 4. - Paper N 159; Kambe, S. Synthetic studies using α,β-unsaturated nitriles: Facile synthesis of pyridine derivatives / S. Kambe, K. Saito, A. Sakurai, H. Midorikawa // Synthesis. - 1981. - N 7. - P. 531-533; Guo, K. Mechanistic studies leading to a new procedure for rapid, microwave assisted generation of pyridine-3,5-dicarbonitrile libraries / Guo K., Thompson M.J., Reddy T.R., Mutter R., Chen B. // Tetrahedron. - 2007. - Vol. 63. - №. 24. - P. 5300-5311; Ranu В.C, Jana R., Sowmiah S. An improved procedure for the three-component synthesis of highly substituted pyridines using ionic liquid // The Journal of Organic Chemistry. - 2007. - Vol. 72. - №. 8. - P. 3152-3154]. Процесс протекает согласно схеме:

Недостатками данного метода являются многостадийность, суммарные невысокие (менее 60%) выходы целевых продуктов 1, а также необходимость работы с отвратительно пахнущим и весьма токсичным тиофенолом.
Известен способ получения 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов 1 на основе реакции обмена метиленовыми компонентами между цианотиоацетамидом 2 и арилметилиденовыми производными метиленактивных соединений -малонового эфира или 3-метил-1-фенилпиразолин-5-она [Geies, А.А. Reinvestigation of the reaction of arylidene malononitrile with cyanothioacetamide: new approach for the synthesis of pyridine derivatives / Geies A.A., El-Dean A.M. K., Monem M.I.A. // Zeitschrift für Naturforschung В. - 1992. - Vol. 47. - №. 10. - P. 1438-1440], протекающей согласно схеме:
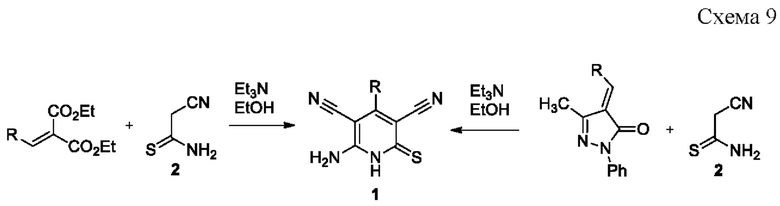
Недостатками данного метода являются: необходимость предварительного синтеза арилметилиденовых производных диэтилмалоната или 3-метил-1-фенилпиразолин-5-она, выделение в ходе реакции токсичного и обладающего неприятным запахом сероводорода, а также низкая атом-экономность синтеза, связанная с побочным образованием в ходе реакции диэтилмалоната или 3-метил-1-фенилпиразолин-5-она.
Наиболее близким аналогом (прототипом) к предлагаемому техническому решению является способ получения 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов 1 взаимодействием эквимолярных количеств ароматического альдегида, малононитрила 4 и цианотиоацетамида 2 в кипящем этаноле либо изопропаноле в присутствии вторичных либо третичных аминов [Шаранин, Ю.А. Реакции циклизации нитрилов. Синтез, структура и свойства 6-амино-4-арил(гетерил)-3,5-дициано-2(1Н)-пиридинтионов / Ю.А. Шаранин, В.К. Промоненков, A.M. Шестопалов, В.Н. Нестеров, С.Н. Меленчук, В.Е. Шкловер, Ю.Т. Стручков // Журнал органической химии. - 1989. - Т. 25. - №. 3. - С. 622-628; Brandt, W. Inhibitors of the RET tyrosine kinase based on a 2-(alkylsulfanyl)-4-(3-thienyl)nicotinonitrile scaffold / W. Brandt, L. Mologni, L. Preu, T. Lemcke, C. Gambacorti-Passerini, C. Kunick // European Journal of Medicinal Chemistry. - 2010. - Vol. 45. - P. 2919-2927; Schweda, S.I. 4-Arylthieno[2,3-b]pyridine-2-carboxamides are a new class of antiplasmodial agents / S.I. Schweda, A. Alder, T. Gilberger, C. Kunick // Molecules. - 2020. - V. 25. - №. 14. - Paper 3187; Hoelzemann, G. 5-Cyanothienopyridines for the treatment of tumours / G. Hoelzemann, U. Graedler, H. Greiner, C. Amendt, D. Musil, P. Hillertz. Patent US 2010234369 (A1) - 2010-09-16] согласно схеме:
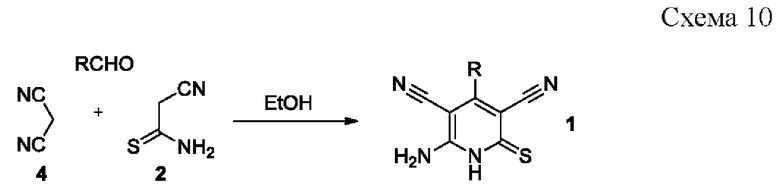
Однако, недостатком прототипа являются низкие (менее 50%) выходы целевых продуктов, а также протекание альтернативных процессов, сопровождающихся образованием побочных продуктов - тиопиранов 6.
Задачей изобретения является расширение арсенала способов получения 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов и увеличение выходов целевых продуктов.
Техническим результатом предлагаемого способа является увеличение выходов целевых продуктов.
Технический результат предлагаемого изобретения достигается путем взаимодействия цианотиоацетамида 2 с двукратным избытком ароматического альдегида и двукратным избытком малононитрила 4 в среде кипящего этанола в присутствии органического основания (триэтиламина, морфолина, N-метилморфолина) в течение 3-5 часов по нижеприведенной схеме (Схема 11).
В прототипе ароматический альдегид, малононитрил 4 и цианотиоацетамид 2 используются в мольном соотношении 1:1:1. Согласно химизму процесса (Схема 11), половина образующегося арилметиленмалононитрила 3 расходуется на окисление промежуточно образующегося тетрагидропиридина 10, что обуславливает низкие (менее 50%) выходы в прототипе.
В предлагаемом изобретении повышение выходов целевых продуктов достигается за счет образования в ходе реакции дополнительного эквимольного количества арилметиленмалононитрила 3, который выступает окислителем для ожидаемого интермедиата процесса, тетрагидропиридина 10.
Побочно образующиеся арилметилмалононитрилы 11, в свою очередь, являются ценными реагентами для тонкого органического синтеза (Alexander, D. Symmetrical Tris(4,6-diamino-5-methylene-2-pyrimidones): New Building Blocks for Self-Assembly of Hollow Spherical Supramolecules Locked by Hydrogen Bonds/ Alexander D., Holý P., Fiedler P., Havlas Z., Závada J. // Collection of Czechoslovak chemical communications. - 1996. - Vol. 61. - №. 10. - P. 1464-1472; Khalil К.D., Al-Matar H.M. Studies on 2-Arylhydrazononitriles: Synthesis of 3-Aryl-2-arylhydrazopropanenitriles and Their Utility as Precursors to 2-Substituted Indoles, 2-Substituted-1,2,3-Triazoles, and 1-Substituted Pyrazolo[4,3-d]pyrimidines // Molecules. - 2012. - Vol. 17. - №. 10. - P. 12225-12233) и могут быть легко отделены от соединений 1 за счет сильно отличающейся растворимости в этаноле.
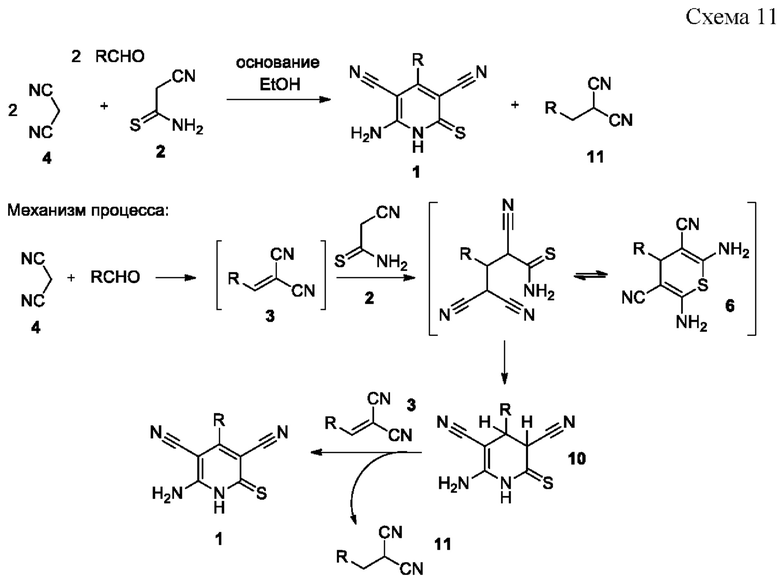
где R=незамещенный или замещенный ароматический или гетероциклический заместитель.
Тиопираны 6, которые отмечены как побочные продукты в примерах прототипа, являются кинетически контролируемыми продуктами взаимодействия малононитрила 4, альдегидов и цианотиоацетамида 2, тогда как 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилы 1 являются продуктами термодинамического контроля. В предлагаемом способе образование тиопиранов 6 в качестве изолируемых побочных продуктов подавляется за счет проведения реакции в термодинамически контролируемых условиях, а также за счет более эффективного смещения равновесия в сторону образования продуктов 1 при использовании избытка альдегида и малононитрила.
Дальнейшее изменение количества вводимых в реакцию альдегидов или малононитрила в сторону увеличения не приводит к увеличению выхода целевого продукта, но приводит к загрязнению продукта за счет образования избытка арилметиленмалононитрилов 3. Повышение температуры или замена растворителя не дают значимого повышения выхода целевых продуктов.
Общими признаками предлагаемого способа и прототипа являются: использование ароматических альдегидов, малононитрила и цианотиоацетамида в качестве исходных соединений в среде растворителя;
- использование в качестве катализаторов органических оснований;
- проведение реакции в среде органического растворителя (этанола). Отличительными признаками являются:
- использование двукратного избытка малононитрила относительно цианотиоацетамида;
- использование двукратного избытка ароматического альдегида относительно цианотиоацетамида;
- образование арилметилмалононитрилов в качестве побочных продуктов.
Пример 1. Получение 6-амино-4-(4-метоксифенил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила.
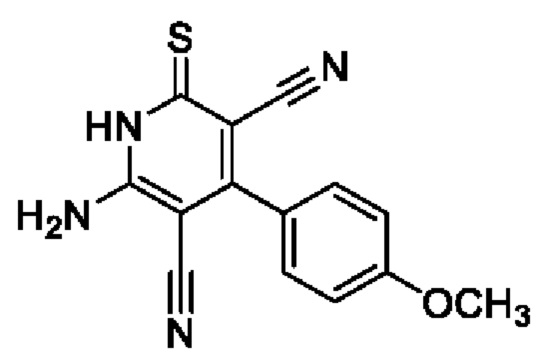
В круглодонную колбу объемом 100 мл помещают 2,00 г (0,03 моль) малононитрила 4, 3,70 мл (0,03 моль) анисового альдегида, 10 мл 96%-ного этанола и 2 капли морфолина, смесь перемешивают 5 минут, добавляют 1,51 г (0,015 моль) цианотиоацетамида 2 и 1,4 мл морфолина и 20 мл этанола. Смесь кипятят с интенсивным перемешиванием в течение 5 часов (контроль по результатам тонкослойной хроматографии (ТСХ) на пластинах Сорбфил-А, элюент - этилацетат: гексан=2:1). Смесь охлаждают до комнатной температуры, подкисляют 30% HCl до рН 3. Выпавший осадок отфильтровывают, промывают теплым этанолом и затем петролейным эфиром. Получают 4,10 г 6-амино-4-(4-метоксифенил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила в виде желто-оранжевого порошка в аналитически чистом виде (ТСХ), выход 97%, т.пл. 285-290°С. ИК-спектр, ν, см-1: 3450, 3330 (N-H); 2220 (2 C≡N). ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д.: 3.85 (s, 3Н, ОСН3), 6.89 (д, 2Н, Ar, 3J=8.1 Гц), 7.32 (д, 2Н, Ar, 3J=8.1 Гц), 7.55 (уш. с, 2Н, NH2), 12.80 (уш. с, 1H, NH). Найдено, %: С 59.67; Н 3.69; N 19.70. C14H10N4S (М 282.32). Вычислено, %: С 59.56; Н 3.57; N 19.85.
Пример 2. Получение 6-амино-2-тиоксо-4-(4-хлорфенил)-1,2-дигидропиридин-3,5-дикарбонитрила.
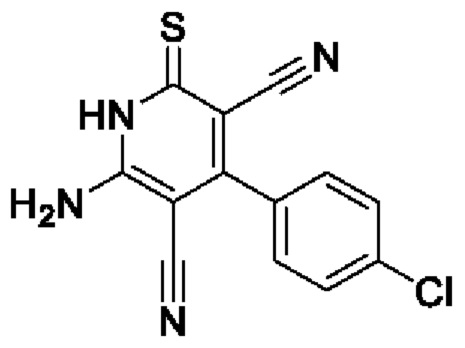
В круглодонную колбу объемом 100 мл помещают 2,35 г (3,56 ммоль) малононитрила 4, 5,0 г (3,56 ммоль) 4-хлорбензальдегида, 15 мл 96%-ного этанола, подогревают до растворения, добавляют 2 капли морфолина. Смесь перемешивают 3 минуты, добавляют 1,78 г (1,78 ммоль) цианотиоацетамида 2, 1,55 мл морфолина и 20 мл этанола. Смесь кипятят с интенсивным перемешиванием в течение 5 часов (контроль по результатам ТСХ на пластинах Сорбфил-А, элюент - ацетон: гексан=2:1). Смесь охлаждают до комнатной температуры, подкисляют 30%) HCl до рН 3. Выпавший желтый осадок отфильтровывают, промывают теплым этанолом и затем петролейным эфиром. Получают 4,54 г 6-амино-2-тиоксо-4-(4-хлорфенил)-1,2-дигидропиридин-3,5-дикарбонитрила в виде желто-оранжевого порошка в аналитически чистом виде (ТСХ), выход 89%, т.пл. 230-240°С (разл.). ИК-спектр, ν, см-1: 3420-3320 (N-H); 2220 (2 C≡N). ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.: 7.55 (д, 2H, Ar, 3J=8.0 Гц), 7.63 (уш. с, 2Н, NH2), 7.70 (д, 2Н, Ar, 3J=8.0 Гц), 12.90 (уш. с, 1Н, NH). Найдено, %: С 54.50; Н 2.53; N 19.50. C13H7ClN4S (М 286.74). Вычислено, %: С 54.46; Н 2.46; N 19.54.
Пример 3. Получение 6-амино-4-(3,4-диметоксифенил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила.
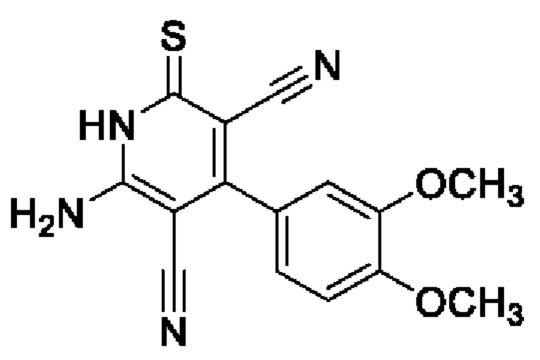
В круглодонную колбу объемом 100 мл помещают 2,00 г (0,03 моль) малононитрила 4, 4,99 г (0,03 моль) вератрового альдегида (3,4-диметоксибензальдегида), 15 мл 96%-ного этанола и 2 капли морфолина, смесь перемешивают при нагревании (40-50°С) 5 минут, добавляют 1.51 г (0,015 моль) цианотиоацетамида 2, 1,4 мл морфолина и 25 мл этанола. Смесь кипятят с интенсивным перемешиванием в течение 3 часов (контроль по результатам тонкослойной хроматографии (ТСХ) на пластинах Сорбфил-А, элюент - этилацетат: гексан=2:1). Смесь охлаждают до комнатной температуры, подкисляют 30% HCl до рН 3. Выпавший осадок отфильтровывают, промывают теплым этанолом и затем петролейным эфиром. Получают 4,50 г 6-амино-4-(3,4-диметоксифенил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила в виде желтого порошка в аналитически чистом виде (ТСХ), выход 96%,т.пл. 280-285°С.ИК-спектр, ν, см-1: 3450, 3330 (N-H); 2220 (2 C≡N). ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д.: 3.82 (s, 3Н, ОСН3), 3.85 (s, 3Н, ОСН3), 7.15-7.22 (м, 3Н, Ar), 7.55 (у.ш. с, 2H, NH2), 13.00 (уш. с, 1Н, NH). Найдено, %: С 57.70; Н 3.99; N 17.85. C15H12N4O2S (М 312.35). Вычислено, %: С 57.68; Н 3.87; N 17.94.
Пример 4. Получение 6-амино-4-(1Н-индол-3-ил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила.
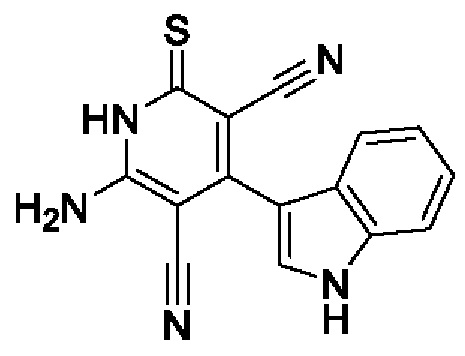
В круглодонную колбу объемом 100 мл помещают 2,00 г (0,03 моль) малононитрила 4, 4,36 г (0,03 моль) 1H-индол-3-карбальдегида, 15 мл 96%-ного этанола и 2 капли морфолина, смесь перемешивают при нагревании (40-50°С) 5 минут, добавляют 1.51 г (0,015 моль) цианотиоацетамида 2, 1,4 мл морфолина и 25 мл этанола. Смесь кипятят с интенсивным перемешиванием в течение 4 часов (контроль по результатам тонкослойной хроматографии (ТСХ) на пластинах Сорбфил-А, элюент - этилацетат: гексан=2:1). Смесь охлаждают до комнатной температуры, подкисляют 30% HCl до рН 3. Выпавший осадок отфильтровывают, промывают теплым этанолом и затем петролейным эфиром. Получают 4,02 г 6-амино-4-(1Н-индол-3-ил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила в виде ярко-желтого порошка в аналитически чистом виде (ТСХ), выход 92%, т.пл. 290°С. ИК спектр, ν, см-1: 3220, 3330, 3410 (N-H), 2220 (C≡N). Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м. д.: 7.08-7.20 (м, 2Н, Ar), 7.50-7.65 (м, 4Н, NH2 и Ar), 7.75 (д, 1H, индолил Н-2, 3JCH-NH=2.5 Гц), 11.80 (с, 1H, индолил NH), 12.90 (уш.с, 1H, NH). Найдено, %: С 61.87; Н 3.19; N 24.00. C15H9N5S (М 291.34). Вычислено, %: С 61.84; Н 3.11; N24.04.
Пример 5. Получение 6-амино-4-(4-бромфенил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила.
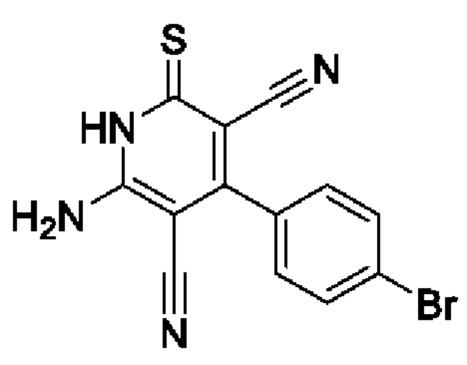
В круглодонную колбу объемом 100 мл помещают 2,00 г (30 ммоль) малононитрила 4, 5,55 г (30 ммоль) 4-бромбензальдегида, 15 мл 96%-ного этанола, подогревают до растворения, добавляют 2 капли морфолина. Смесь перемешивают 3 минуты, добавляют 1,78 г (1,78 ммоль) цианотиоацетамида 2, 1,55 мл морфолина и еще 20 мл этанола. Смесь кипятят с интенсивным перемешиванием в течение 4 часов (контроль по результатам ТСХ на пластинах Сорбфил-А, элюент - ацетон: гексан=2:1). Смесь охлаждают до комнатной температуры, подкисляют 30% HCl до рН 3. Выпавший желто-оранжевый осадок отфильтровывают, промывают теплым этанолом и затем петролейным эфиром. Получают 4,57 г 6-амино-4-(4-бромфенил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила в виде желто-оранжевого порошка в аналитически чистом виде (ТСХ), выход 92%, т.пл. 280-285°С.ИК-спектр, ν, см-1: 3420-3330 (N-H); 2215 (2 C≡N). ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д.: 7.57 (уш. с, 2Н, NH2), 7.65 (д, 2Н, Ar, 3J=8.1 Гц), 7.79 (д, 2Н, Ar, 3J=8.1 Гц), 13.10 (уш.с, 1H, NH). Найдено, %: С 47.20; Н 2.20; N 16.90. C13H7BrN4S (М 331.19). Вычислено, %: С 47.15; Н 2.13; N 16.92.
Пример б. Получение 6-амино-4-(4-метилфенил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила.

В круглодонную колбу объемом 100 мл помещают 2,00 г (30 ммоль) малононитрила 4, 30 ммоль свежеперегнанного 4-толуальдегида, 10 мл 96%-ного этанола, подогревают до растворения, добавляют 2 капли морфолина. Смесь перемешивают 5 минут, добавляют 1,78 г (1,78 ммоль) цианотиоацетамида 2, 1,55 мл морфолина и еще 20 мл этанола. Смесь кипятят с интенсивным перемешиванием в течение 5 часов (контроль по результатам ТСХ на пластинах Сорбфил-А, элюент - ацетон: гексан=2: 1). Смесь охлаждают до комнатной температуры, подкисляют 30% HCl до рН 3. Выпавший желто-оранжевый осадок отфильтровывают, промывают теплым этанолом и затем петролейным эфиром. Получают 3,60 г 6-амино-4-(4-метилфенил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила в виде желто-оранжевого порошка в аналитически чистом виде (ТСХ), выход 90%, т.пл. 230-235°С.ИК-спектр, ν, см-1: 3330, 3250 (N-H); 2218 (2 C≡N). ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.: 7.40-7.45 (м, 4Н, Ar), 7.60 (уш. с, 2Н, NH2), 12.98 (уш.с, 1H, NH). Найдено, %: С 63.20; Н 3.84; N 21.00. C14H10N4S (М 266.32). Вычислено, %: С 63.14; Н 3.78; N 21.04.
Пример 7. Получение 6-амино-4-(4-гидрокси-3-метоксифенил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила.
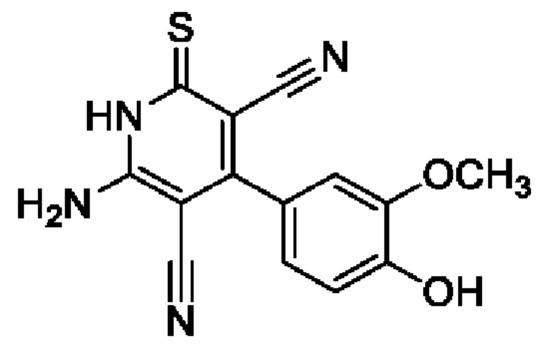
В круглодонную колбу объемом 100 мл помещают 2,00 г (0,03 моль) малононитрила 4, 4,55 г (0,03 моль) ванилина, 15 мл 96%-ного этанола и 2 капли морфолина, смесь перемешивают при нагревании (40-50°С) 5 минут, к полученному ярко-желтому раствору добавляют 1,51 г (0,015 моль) цианотиоацетамида 2, 1,4 мл морфолина и 25 мл этанола. Смесь кипятят с интенсивным перемешиванием в течение 5 часов (контроль по результатам тонкослойной хроматографии (ТСХ) на пластинах Сорбфил-А, элюент -этилацетат: гексан=2: 1). Смесь охлаждают до комнатной температуры, подкисляют 30% HCl до рН 3. Выпавший осадок отфильтровывают, промывают теплым этанолом и затем петролейным эфиром. Получают 3,90 г 6-амино-4-(4-гидрокси-3-метоксифенил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила в виде желтого порошка в аналитически чистом виде (ТСХ), выход 87%, т.пл. 230°С (разл.). ИК-спектр, ν, см-1: 3450-3200 (N-H, О-Н); 2218 (2 C≡N). ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д.: 3.86 (s, 3Н, ОСН3), 7.62-7.75 (м, 5Н, NH2 и Ar), 10.22 (уш.с, 1H, ОН), 12.85 (уш.с, 1H, NH). Найдено, %: С 56.46; Н 3.49; N 18.65. C14H10N4O2S (М 298.32). Вычислено, %: С 56.37; Н 3.38; N 18.78.
Пример 8. Получение 6-амино-2-тиоксо-4-фенил-1,2-дигидропиридин-3,5-дикарбонитрила.
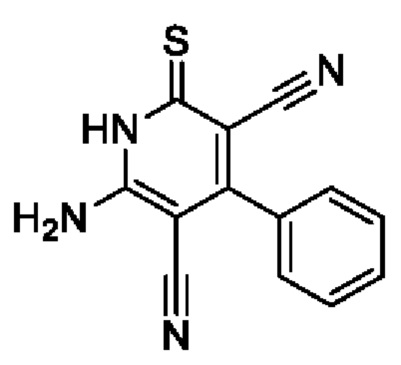
В круглодонную колбу объемом 100 мл помещают 2,00 г (0,03 моль) малононитрила 4, 3.1 мл (0,03 моль) бензальдегида, 10 мл 96%-ного этанола и 2 капли N-метилморфолина, смесь перемешивают 4 минуты, затем добавляют 1,51 г (0,015 моль) цианотиоацетамида 2, 1,7 мл N-метилморфолина и 20 мл этанола. Смесь кипятят с интенсивным перемешиванием в течение 3,5 часов (контроль по результатам тонкослойной хроматографии (ТСХ) на пластинах Сорбфил-А, элюент - этилацетат: гексан=2:1). Смесь охлаждают до комнатной температуры, подкисляют 30% HCl до рН 3. Выпавший осадок отфильтровывают, промывают теплым этанолом и затем петролейным эфиром. Получают 3,43 г 6-амино-2-тиоксо-4-фенил-1,2-дигидропиридин-3,5-дикарбонитрила в виде желтого порошка в аналитически чистом виде (ТСХ), выход 91%, т.пл. 235-240°С (разл.). ИК-спектр, ν, см-1: 3450, 3320 (N-H); 2220 (2 C≡N). ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д.: 7.40-7.48 (м, 5Н, Ph), 7.63 (уш. с, 2Н, NH2), 12.82 (уш.с, 1H, NH). Найдено, %: С 61.86; Н 3.29; N 22.20. C13H8N4S (М 252.29). Вычислено, %: С 61.89; Н 3.20; N 22.21.
Пример 9. Получение 6-амино-4-(2-тиенил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила.

В круглодонную колбу объемом 100 мл помещают 2,00 г (0,03 моль) малононитрила 4, 2.8 мл (0,03 моль) тиофен-2-карбальдегида, 10 мл 96%-ного этанола и 2 капли триэтиламина, смесь перемешивают 5 минут, затем добавляют 1.51 г (0,015 моль) цианотиоацетамида 2, 2.1 мл триэтиламина и 20 мл этанола. Смесь кипятят с интенсивным перемешиванием в течение 4 часов (контроль по результатам тонкослойной хроматографии (ТСХ) на пластинах Сорбфил-А, элюент - этилацетат: гексан=2:1). Смесь охлаждают до комнатной температуры, подкисляют 30% HCl до рН 3. Выпавший осадок отфильтровывают, промывают теплым этанолом и затем петролейным эфиром. Получают 3,40 г 6-амино-4-(2-тиенил)-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрила в виде ярко-желтого порошка в аналитически чистом виде (ТСХ), выход 88%, т.пл. 240-245°С (разд.). ИК-спектр, ν, см-1: 3420, 3330 (N-Н); 2220 (2 C≡N). ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д.: 7.20-7.21 (м, 1Н, Ar), 7.55 (уш. с, 2Н, NH2), 7.70-7.71 (м, 1H, Ar), 7.82-7.84 (м, 1H, Ar), 12.90 (уш.с, 1H, NH). Найдено, %: С 51.10; Н 2.46; N 21.57. C11H6N4S2 (М 258.32). Вычислено, %: С 51.14; Н 2.34; N 21.69.
Как видно из приведенных примеров конкретного выполнения, выходы 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов существенно возрастают вплоть до количественных при введении в реакцию дополнительно 1 экв. ароматического альдегида и 1 экв. малононитрила.
На основании изложенного следует вывод, что предлагаемое техническое решение является новым, обладает отличительными признаками и может быть масштабировано для использования в тонком органическом синтезе.
| название | год | авторы | номер документа |
|---|---|---|---|
| Применение 1,6-диамино-4-арил-2-оксо-1,2-дигидропиридин-3,5-дикарбонитрилов в качестве антидотов 2,4-Д на подсолнечнике | 2024 |
|
RU2826751C1 |
| Способ получения 5-арил-4-тиоксо-3,4,5,6-тетрагидро-2H-пиридо[3,2-e][1,3]тиазин-7(8H)-онов | 2024 |
|
RU2831154C1 |
| Способ получения 2-амино-4-арил-6-гексил-7-гидрокси-4H-хромен-3-карбонитрилов | 2022 |
|
RU2802631C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЗАМЕЩЕННЫХ 2-ОКСО-1,2-ДИГИДРОПИРИДИН-3,4-ДИКАРБОНИТРИЛОВ | 2015 |
|
RU2577526C1 |
| Способ получения замещенных 2-аминобута-1,3-диен-1,1,3-трикарбонитрилов | 2022 |
|
RU2792619C1 |
| Применение бензил 6-({ 2-[(3,4-диметилфенил)амино]-2-оксоэтил} тио)-2-метил-4-(4-хлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксилата в качестве гепатопротекторного средства | 2021 |
|
RU2755349C1 |
| Способ получения 6-стирил-4-трифторметил-2-тиоксо-1,2-дигидропиридин-3-карбонитрилов | 2023 |
|
RU2827934C1 |
| БИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА, ПОДАВЛЯЮЩИЕ ПАТОГЕННЫЕ БАКТЕРИИ | 2008 |
|
RU2402531C2 |
| Способ получения 5-амино-3-цианометил-1Н-пиразол-4-карбонитрила | 2023 |
|
RU2803146C1 |
| Способ получения 4-гетарил-3,6-диоксо-2,3,4,5,6,7-гексагидроизотиазоло[5,4-b]пиридин-5-карбонитрилов | 2023 |
|
RU2812610C1 |
Изобретение относится к способу получения 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов общей формулы 1, где R представляет собой незамещенный или замещенный ароматический или гетероциклический заместитель. Способ основан на взаимодействии ароматических альдегидов, малононитрила и цианотиоацетамида в качестве исходных соединений в среде растворителя с использованием в качестве катализаторов органических оснований. Способ характеризуется тем, что цианотиоацетамид вводят в реакцию с двукратным избытком альдегидов, отвечающих формуле RCHO, где R представляет собой незамещенный или замещенный ароматический или гетероциклический заместитель, и двукратным избытком малононитрила в среде кипящего этанола в присутствии органического основания - триэтиламина, морфолина, N-метилморфолина, в течение 3-5 ч. Предлагаемый способ позволяет увеличить выход целевых продуктов. 9 пр.
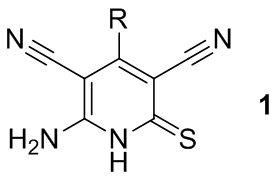
Способ получения 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов общей формулы 1
 ,
,
где R - незамещенный или замещенный ароматический или гетероциклический заместитель, основанный на взаимодействии ароматических альдегидов, малононитрила и цианотиоацетамида в качестве исходных соединений в среде растворителя с использованием в качестве катализаторов органических оснований, отличающийся тем, что цианотиоацетамид вводят в реакцию с двукратным избытком альдегидов, отвечающих формуле RCHO, где R представляет собой незамещенный или замещенный ароматический или гетероциклический заместитель, и двукратным избытком малононитрила в среде кипящего этанола в присутствии органического основания - триэтиламина, морфолина, N-метилморфолина, в течение 3-5 ч.
| Ю.А | |||
| ШАРАНИН И ДР | |||
| Реакции циклизации нитрилов | |||
| Синтез, структура и свойства 6-амино-4-арил(гетерил)-3,5-дициано-2(1Н)-пиридинтионов, ЖУРН | |||
| ОРГАН | |||
| ХИМИИ, 1989, Т | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| W | |||
| BRANDT ET AL | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| J | |||
| MED | |||
| CHEM., 2010, 45, 2919-2927 | |||
| S.I | |||
Авторы
Даты
2023-03-22—Публикация
2022-04-25—Подача