Область техники, к которой относится изобретение
Настоящее изобретение касается двухцепочечных олигонуклеотидов, способных весьма специфично ингибировать экспрессию амфирегулина с большой эффективностью, предпочтительно двухцепочечных олигонуклеотидов, содержащих гибридные последовательности типа РНК/РНК, ДНК/ДНК или ДНК/РНК; двухцепочечные олигонуклеотидные структуры, включающих двухцепочечные олигонуклеотиды; наночастиц, содержащих 3 двухцепочечные олигонуклеотидные структуры и; и их применения для профилактики или лечения фиброза либо респираторных заболеваний.
Уровень техники
В 1995 г. Guo and Kemphues сообщили, что не только смысловая РНК, но и антисмысловая РНК эффективно подавляет экспрессию генов у C.elegans, и с тех пор проводились исследования для определения причины этого. В 1998 году Fire et al. впервые описали феномен, при котором введение двухцепочечной РНК (дцРНК) подавляет экспрессию гена путем специфического разрушения соответствующей ему мРНК. Это явление получило название РНК-интерференция (РНКи). Процесс РНКи, который применяется для подавления экспрессии генов, может проявлять четкий эффект подавления экспрессии генов простым способом и с низкими затратами, поэтому сфера применения этой технологии становится все более разнообразной.
Поскольку эта технология подавления экспрессии генов может регулировать экспрессию определенных генов, она может удалять конкретные гены, связанные с раком, генетическими заболеваниями и т.п. на уровне мРНК, и может применяться в качестве важного инструмента при разработке терапевтических средств для лечения заболеваний и проверки мишеней. В качестве стандартных методов подавления экспрессии целевых генов приводились методы введения трансгена для целевого гена. Эти методы включают методы введения трансгена в антисмысловом направлении по отношению к промотору.
Такая прицельная РНК для РНК-терапии представляет собой метод устранения функции представляющего интерес гена с помощью олигонуклеотидов против целевой РНК и может рассматриваться как отличный от традиционных методов, в которых терапевтические средства типа антител и небольших молекул в основном нацелены на белки. Нацеленные на РНК подходы подразделяются примерно на два типа: РНКи, опосредованная двухцепочечной РНК, и методы с использованием антисмысловых олигонуклеотидов (ASO). В настоящее время предпринимаются клинические испытания по наведению РНК при различных заболеваниях.
Антисмысловые олигонуклеотиды (далее именуются “ASO”) представляют собой короткие синтетические ДНК, предназначенные для связывания с целевым геном в соответствии со спариванием оснований Уотсона-Крика, которые могут специфически подавлять экспрессию определенной нуклеотидной последовательности гена. Так, антисмысловые олигонуклеотиды применялись для изучения роли генов и разработки терапевтических средств, способных лечить заболевания типа рака на молекулярном уровне. Эти ASO обладают тем преимуществом, что их можно легко получить, устанавливая различные мишени для ингибирования экспрессии генов, причем проводились исследования по применению ASO для подавления экспрессии онкогенов и роста раковых клеток. Процесс подавления ASO экспрессии определенного гена происходит либо путем связывания ASO с комплементарной последовательностью мРНК и индукции активности РНКазы H для удаления этой мРНК, либо путем нарушения формирования и продвижения рибосомного комплекса для трансляции белка. Кроме того, сообщалось, что ASO связываются с геномной ДНК, образуя структуры типа тройной спирали, тем самым ингибируя транскрипцию генов. ASO обладают потенциалом, описанным выше, но для применения ASO в клинической практике требуется улучшить устойчивость ASO к нуклеазам и чтобы они эффективно попадали в целевые ткани или клетки и при этом специфически связывались с нуклеотидной последовательностью целевого гена. Кроме того, важными факторами для специфического связывания ASO являются вторичные и третичные структуры генетической мРНК, а участки, в которых уменьшается образование вторичной структуры мРНК, очень выгодны для доступа ASO. Так, предпринимались усилия для эффективного достижения геноспецифического ингибирования не только in vitro, но и in vivo путем систематического анализа участков, в которых уменьшается образование вторичной структуры мРНК, перед синтезом ASO. Эти ASO более стабильны, чем миРНК (siRNA), другая РНК, и обладают тем преимуществом, что они легко растворимы в воде и физиологическом растворе. На сегодняшний день три ASOs получили одобрение Управления по контролю за продуктами и лекарствами (FDA) (Jessica C., J Postdoc Res., 4:35-50, 2016).
С тех пор, как была обнаружена роль РНК-интерференции (которая в дальнейшем именуется “РНКи”), было установлено, что РНКи действует на специфичные по последовательности мРНК в различных типах клеток млекопитающих (Barik S., J Mol. Med. (2005) 83: 764-773). Когда длинная нить двухцепочечной РНК попадает в клетки, введенная двухцепочечная РНК преобразуется в короткую или малую интерферирующую РНК (которая в дальнейшем именуется “миРНК”) по 21-23 пары нуклеотидов (п.н.) при процессинге эндонуклеазой Dicer). миРНК связывается с комплексом РНК-индуцируемого сайленсинга (RISC) и ингибирует экспрессию целевого гена специфичным для последовательности способом посредством процесса, при котором направляющая (антисмысловая) нить распознает и разрушает целевую мРНК. Технология подавления экспрессии генов с помощью миРНК применяется для подавления экспрессии целевых генов в клетках-мишенях и отслеживания возникающих изменений, а также эффективно применяется в исследованиях для определения функции целевых генов в клетках-мишенях. В частности, подавление функции целевых генов в инфекционных вирусах или раковых клетках может эффективно применяться для разработки способов лечения представляющих интерес заболеваний. В результате проведения исследований in vitro и in vivo на экспериментальных животных было отмечено, что с помощью миРНК можно ингибировать экспрессию целевых генов.
Bertrand et al. отмечали, что миРНК оказывает лучшее ингибирующее действие на экспрессию мРНК in vitro и in vivo, чем антисмысловые олигонуклеотиды (ASO) в отношении одного и того же целевого гена, и что этот эффект более продолжительный. Кроме того, в отношении механизма действия: миРНК регулирует экспрессию целевого гена специфичным для последовательности образом путем комплементарного связывания с целевой мРНК. Таким образом, миРНК обладает преимуществом перед обычными препаратами на основе антител или химическими препаратами (низкомолекулярными) в том, что диапазон субъектов, к которым применима миРНК, может быть значительно расширен (M.A. Behlke, Molecular Therapy 2006, 13(4):664-670).
миРНК обладает превосходным действием и может применяться в широком диапазоне применений, но для разработки миРНК в качестве терапевтических средств необходимо повысить стабильность миРНК in vivo и эффективность её доставки в клетки с тем, чтобы миРНК могла эффективно попасть в клетки (FY Xie, Drug Discov. Today, 2006 Jan, 11(1-2):67-73). Для улучшения стабильности in vivo и решения проблем, связанных с неспецифической стимуляцией миРНК врожденного иммунитета, активно предпринимались исследования по этим вопросам путем модификации некоторых нуклеотидов миРНК или её остова, чтобы обеспечить устойчивость к нуклеазам, или же с помощью вирусных векторов, липосом или наночастиц.
Системы доставки, содержащие вирусные векторы типа аденовирусных или ретровирусных, обладают высокой эффективностью трансфекции, но и сильной иммуногенностью и онкогенностью. С другой стороны, невирусные системы доставки, содержащие наночастицы, обладают меньшей эффективностью доставки в клетки, чем вирусные системы доставки, но имеют преимущества, включающие высокую безопасность in vivo, целенаправленную доставку, эффективный захват и интернализацию олигонуклеотидов РНКи в клетках или тканях и слабую цитотоксичность и иммуностимуляцию. Поэтому невирусные системы доставки в настоящее время считаются более перспективным методом доставки, чем вирусные системы доставки (Akhtar S, J Clin Invest. 2007 December 3, 117(12): 3623-3632).
Среди невирусных систем доставки к методам с использованием наноносителей относятся методы, в которых формируются наночастицы с использованием различных полимеров типа комплексов липосом и катионных полимеров, и в такие наночастицы (то есть наноносители) загружается миРНК и доставляется в клетки. Среди методов с использованием наноносителей часто применяются методы, в которых используются полимерные наночастицы, полимерные мицеллы, липоплексы и т.п. Среди них липоплексы состоят из катионных липидов и функционируют, взаимодействуя с анионными липидами клеточных эндосом и вызывая дестабилизацию эндосом, тем самым обеспечивая внутриклеточную доставку экзосом.
Кроме того, известно, что эффективность миРНК in vivo можно повысить путем конъюгирования химических соединений и т.п. с концевым участком смысловой (попутной) нити миРНК с тем, чтобы придать ей лучшие фармакокинетические характеристики (J. Soutschek, Nature 11, 432(7014):173-8, 2004). При этом изменяется стабильность миРНК в зависимости от свойств химического соединения, конъюгированного с концом смысловой (попутной) или антисмысловой (направляющей) нити миРНК. Например, миРНК, конъюгированная с полимерным соединением типа полиэтиленгликоля (PEG), взаимодействует с анионной фосфатной группой миРНК в присутствии катионного соединения с образованием комплекса, тем самым обеспечивая носитель с улучшенной стабильностью миРНК (S.H. Kim, J. Control. Release 129(2):107-16, 2008). В частности, мицеллы, состоящие из полимерного комплекса, имеют очень маленькие размеры и очень однородное распределение по размерам в сравнении с другими системами доставки лекарств типа микросфер или наночастиц и образуются спонтанно. Поэтому такие мицеллы обладают преимуществами в том, что качество рецептуры мицелл легко регулируется и легко обеспечивается их воспроизводимость.
Для того, чтобы улучшить эффективность внутриклеточной доставки миРНК, была разработана технология обеспечения стабильности миРНК и повышения проницаемости клеточных мембран для миРНК с помощью конъюгатов миРНК, получаемых путем конъюгирования миРНК с гидрофильным соединением (напр., полиэтиленгликолем (PEG), который является биосовместимым полимером)), через простую ковалентную связь или ковалентную связь, опосредованную линкером (Korean Patent No. 883471). Однако, даже если миРНК химически модифицирована и конъюгирована с полиэтиленгликолем (PEG) (ПЭГилирована), она все еще обладает низкой стабильностью in vivo и имеет недостаток в том, что она с трудом попадает в целевой орган. Чтобы преодолеть эти недостатки, были разработаны структуры из двухцепочечной олиго-РНК, которые содержат гидрофильные и гидрофобные соединения, связанные с олигонуклеотидом, в частности, двухцепочечные олиго-РНК типа миРНК. Эти структуры образуют самосборочные наночастицы, названные SAMiRNA™ (самосборочные мицеллы с ингибирующей РНК), посредством гидрофобных взаимодействий с гидрофобным соединением (Korean Patent No. 1224828). Технология SAMiRNA™ имеет преимущества перед традиционными технологиями доставки в том, что можно получать однородные наночастицы очень маленьких размеров.
В частности, в технологии SAMiRNA™ в качестве гидрофильного соединения используется PEG (полиэтиленгликоль) или HEG (гексаэтиленгликоль). PEG, синтетический полимер, обычно применяется для повышения растворимости медицинских препаратов, в частности белков, и для регулирования фармакокинетики лекарств. ПЭГ является полидисперсным материалом, причем полимер из одной партии состоит из различного количества мономеров и поэтому проявляет молекулярные массы по гауссовой кривой. Кроме того, однородность материала выражается показателем полидисперсности (Mw/Mn). Иными словами, когда PEG имеет низкую молекулярную массу (от 3 до 5 кДа), он проявляет индекс полидисперсности около 1,01, а когда PEG имеет высокую молекулярную массу (20 кДа), он проявляет высокий показатель полидисперсности около 1,2, что означает, что однородность PEG снижается с увеличением его молекулярной массы. Так, когда PEG связан с медицинским препаратом, то существует недостаток в том, что полидисперсные свойства PEG отражаются на конъюгате, поэтому бывает трудно проверить отдельный материал. Из-за этого недостатка были усовершенствованы способы синтеза и очистки PEG с тем, чтобы получить материалы с низким показателем полидисперсности. Однако, когда PEG связывается с соединением, имеющим низкую молекулярную массу, возникают проблемы, связанные с полидисперсными свойствами соединения, в том числе проблема в том, что бывает трудно проверить, легко ли происходит связывание (Francesco M.V., Drug Discovery Today (2005) 10(21):1451-1458).
Соответственно, в последние годы технология SAMiRNA™ (то есть самоорганизующихся наночастиц) была усовершенствована путем формирования из гидрофильного соединения со структурой двухцепочечной РНК (составляющей SAMiRNA™) базовых стандартных блоков, содержащих от 1 до 15 мономеров с одинаковой молекулярной массой, а при необходимости и линкер с тем, чтобы использовать подходящее количество блоков в соответствии с потребностями. Таким образом, были разработаны технологии систем доставки нового типа, которые имеют небольшие размеры и значительно улучшенные полидисперсные свойства по сравнению с обычным SAMiRNA™. Хорошо известно, что при введении миРНК она быстро разрушается различными ферментами, присутствующими в крови, поэтому эффективность её доставки в целевые клетки или ткани является низкой. При этом и в усовершенствованной SAMiRNA™ проявлялись вариации стабильности и скорости ингибирования экспрессии в зависимости от целевых генов. Соответственно, для более стабильного и эффективного ингибирования экспрессии целевых генов с помощью SAMiRNA™, которая состоит из усовершенствованных самосборочных наночастиц, авторы настоящего изобретения попробовали усилить эффект ингибирования экспрессии целевых генов и стабильность SAMiRNA™ при помощи двухцепочечных олигонуклеотидов, содержащих последовательность ДНК ASO в качестве направляющей (смысловой) нити и последовательность РНК в качестве попутной (антисмысловой) последовательности.
Идиопатический фиброз легких (в дальнейшем именуется “IPF”), один из типов фиброза, это заболевание, при котором через стенку альвеол (легочных альвеол) проникают хронические воспалительные клетки, вызывая различные изменения, которые делают легкие жесткими, что приводит к различным серьезным структурным изменениям в легочной ткани и постепенному снижению функции легких, что ведет к смерти. На сегодняшний день не существует эффективного способа лечения IPF. После появления симптомов IPF у пациентов и постановки диагноза IPF средняя продолжительность жизни составляет всего 3-5 лет. Таким образом, IPF - заболевание с очень плохим прогнозом. В зарубежных странах заболеваемость IPF составляет от 3 до 5 на 100 000 человек, причем известно, что уровень заболеваемости IPF обычно повышается после 50 лет и вдвое выше у мужчин, чем у женщин.
Хотя причины IPF пока еще не были четко установлены, сообщалось, что частотность IPF высока у курильщиков, а антидепрессанты, хроническая аспирация легких из-за желудочно-пищеводного рефлюкса, вдыхание металлической пыли, древесной пыли, растворителей и т.п. являются факторами риска, связанными с возникновением IPF. Однако у большинства пациентов не было отмечено определенных причинных факторов. Что касается чаще всего упоминаемых факторов, то известно, что при активации реакций Th1/Th2, коагуляционного каскада и т.п. по какой-либо причине секретируются фиброзные цитокины, а активированные цитокины стимулируют фибробласты и утолщение ECM (внеклеточного матрикса), что приводит к фиброзу легких. Конечно, этот процесс сопровождается воспалением легких, которое может привести к фиброзу легких, но в последние годы преобладает мнение, что этот процесс может напрямую вызвать фиброз легких, независимо от воспаления легких. Недавняя гипотеза состоит в том, что патологический фиброз легких возникает при заживлении ран из-за нарушения сигнальной системы при эпителиально-мезенхимальном взаимодействии. При повреждении эпителиальных клеток усиливается апоптоз эпителиальных клеток, ограничивается миграция эпителиальных клеток, не регулируется специализация миграции эпителиальных клеток, подавляется пролиферация и секретируются растворимые факторы (TGF, HGF, KGF, ангиотензин II, ROS и др.). Кроме того, при этом подавляется апоптоз мезенхимальных клеток вместе с ECM. Подавление апоптоза мезенхимальных клеток ведет к усилению дифференцировки миофибробластов и вызывает фиброз легких вследствие утолщения ECM или же приводит к рестимуляции эпителиальных клеток. Иными словами, нельзя полагать, что воспаление легких напрямую вызывает фиброз легких, но это значит, что сначала возникает воспаление легких, а затем уже фиброз легких вследствие отличия в процессе заживления и восстановления нормальной ткани между больными IPF и нормальными людьми. Кроме того, вызывать IPF может дисбаланс цитокинов Th1/Th2. Ответ цитокинов Th1 связан с клеточным иммунитетом, который восстанавливает поврежденные участки ткани до нормального состояния, тогда как цитокины Th2 вызывают отложение ECM и фиброз через активацию и пролиферацию фибробластов. Были сообщения, что при введении IFN-γ на модели индуцированного блеомицином фиброза легких он может предотвращать фиброз легких за счет снижения мРНК TGF-β и проколлагена. Однако, поскольку этиология фиброза легких точно не известна, то необходимо идентифицировать исходный причинный фактор, вызывающий фиброз, и разработать вещества, которые могут ингибировать гены, связанные с IPF и сигнальной системой TGF-β.
Известно, что если IPF не лечится, то он постоянно ухудшается, вследствие чего более 50% пациентов умирают в пределах 3-5 лет. Кроме того, как только легкие полностью затвердеют из-за фиброза по мере прогрессирования заболевания, независимо от того, какое лечение проводится, состояние пациента не улучшается. Поэтому предполагается, что при лечении IPF на ранней стадии будет высокая вероятность того, что лечение будет эффективным. Известен способ лечения IPF с помощью комбинации стероидов с азатиоприном или циклофосфамидом, но, по-видимому, это не дает особого эффекта. Кроме того, опробовали различные ингибиторы фиброза в экспериментах на животных и на небольших группах больных, но их эффекты не были четко продемонстрированы. В частности, нет другого эффективного метода лечения, кроме трансплантации легких для пациентов с терминальной стадией IPF. Поэтому существует настоятельная потребность в разработке более эффективных средств для лечения IPF.
Фиброз означает такое заболевание, при котором ткань или орган по какой-то причине затвердевает из-за чрезмерного фиброза соединительной ткани. Все процессы, при которых возникает фиброз, следуют по тому же пути, что и процесс заживления ран, независимо от участка. На сегодняшний день существует несколько способов лечения фиброзных симптомов, которые разработаны и изучены. Эффективные терапевтические средства от фиброза могут применяться при циррозе, фиброзе печени, миелофиброзе, фиброзе миокарда, фиброзе почек и фиброзе легких, которые являются типичными формами фиброза, а также при различных заболеваниях, сопровождающихся фиброзом, поэтому существует настоятельная потребность в эффективных терапевтических средствах от фиброза.
Между тем известно, что амфирегулин активирует путь рецептора эпидермального фактора роста (EGFR) путем связывания с рецептором эпидермального фактора роста и участвует в пролиферации клеток. Кроме того, оказалось, что экспрессия амфирегулина может подавляться амфирегулин-специфичной миРНК, которая проявляет терапевтические эффекты против определенных типов рака молочной железы. Также оказалось, что применение кшРНК против амфирегулина может подавлять проникновение клеток при воспалительном раке молочной железы (Andrea Baillo, J. Cell Physiol. 2011, 226 (10): 2691-2701), а при подавлении экспрессия амфирегулина с помощью амфирегулин-специфичной кшРНК подавляется ремоделирование легочной артерии у мышей, подвергшихся воздействию табачного дыма. Оказалось, что амфирегулин связан с гиперплазией гладких мышц дыхательных путей (ASM) и ангиогенезе, а также участвует в чрезмерной секреции эпидермального фактора роста (EGF), особенно при усилении ремоделирования дыхательных путей у больных астмой и ремоделировании тканей после острой астмы.
Как изложено выше, предполагалась возможность применения амфирегулина в качестве терапевтической мишени при респираторных заболеваниях и фиброзе, в особенности COPD и IPF, но разработка терапевтических средств на основе РНКи для амфирегулина и технологии их доставки все еще недостаточны, а рыночный спрос на терапевтические средства типа двухцепочечных олигонуклеотидов, способных подавлять экспрессию амфирегулина с высокой эффективностью и специфичностью, и на технологии их доставки очень высок.
Соответственно, авторы настоящего изобретения выбрали амфирегулин в качестве гена, связанного с фиброзом, включая IPF, выбрали двухцепочечные олигонуклеотиды, нацеленные на амфирегулин, а также установили терапевтические средства на основе РНКи, способные ингибировать экспрессию амфирегулина, и носители для их доставки, и тем самым совершили настоящее изобретение.
Сущность изобретения
Целью настоящего изобретения является получение двухцепочечных олигонуклеотидов, предпочтительно двухцепочечных олигонуклеотидов, содержащих гибридные последовательности РНК/РНК, ДНК/ДНК или ДНК/РНК, которые способны весьма специфически ингибировать амфирегулин с большой эффективностью; двухцепочечные олигонуклеотидные структуры, включающие двухцепочечные олигонуклеотиды; и наночастиц, содержащих двухцепочечные олигонуклеотидные структуры.
Другой целью настоящего изобретения является получение фармацевтических композиций для профилактики или лечения фиброза либо респираторных заболеваний, содержащих в качестве активного ингредиента двухцепочечные олигонуклеотиды, двухцепочечные олигонуклеотидные структуры, включающие их самих, и/или наночастицы, содержащие двухцепочечные олигонуклеотидные структуры.
Следующей целью настоящего изобретения является обеспечение способа профилактики или лечения фиброза либо респираторных заболеваний, который включает стадию введения фармацевтической композиции для профилактики или лечения фиброза либо респираторных заболеваний субъектам, нуждающимся в профилактике или лечении фиброза или респираторных заболеваний.
Следующей целью настоящего изобретения является получение двухцепочечных олигонуклеотидов, двухцепочечных олигонуклеотидных структур, включающих их самих, и/или наночастиц, содержащих двухцепочечные олигонуклеотидные структуры, для применения в способе профилактики или лечения фиброза либо респираторных заболеваний.
Следующей целью настоящего изобретения является получение фармацевтических композиций для применения в способе профилактики или лечения фиброза либо респираторных заболеваний.
Следующей целью настоящего изобретения является обеспечение применения двухцепочечных олигонуклеотидов, двухцепочечных олигонуклеотидных структур, включающих их самих, и/или наночастиц, содержащих двухцепочечные олигонуклеотидные структуры, для изготовления лекарственных средств для предотвращения фиброза или респираторных заболеваний.
Для достижения вышеуказанных целей настоящим изобретением предусмотрены двухцепочечные олигонуклеотиды, включающие смысловую нить, содержащую какую-либо последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-14, более предпочтительно из группы, состоящей из SEQ ID NO: 10, 11 и 12, и антисмысловую нить, содержащую комплементарную ей последовательность.
Настоящим изобретением также предусмотрены двухцепочечные олигонуклеотидные структуры, включающие двухцепочечные олигонуклеотиды, и наночастицы, содержащие двухцепочечные олигонуклеотидные структуры.
Настоящим изобретением также предусмотрены фармацевтические композиции для профилактики или лечения фиброза либо респираторных заболеваний, включающие: двухцепочечные олигонуклеотиды, содержащие смысловую нить, содержащую какую-либо последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-14, более предпочтительно из группы, состоящей из SEQ ID NO: 10, 11 и 12, и антисмысловую нить, содержащую комплементарную ей последовательность; или двухцепочечные олигонуклеотидные структуры, включающие двухцепочечные олигонуклеотиды; или наночастицы, содержащие двухцепочечные олигонуклеотидные структуры.
Настоящим изобретением также предусмотрен способ профилактики или лечения фиброза либо респираторных заболеваний, который включает стадию введения фармацевтической композиции для профилактики или лечения фиброза либо респираторных заболеваний субъектам, нуждающимся в профилактике или лечении фиброза или респираторных заболеваний.
Двухцепочечные олигонуклеотиды, включающие смысловую нить по настоящему изобретению, которая содержит какую-либо последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-14, более предпочтительно из группы, состоящей
из SEQ ID NO: 10, 11 и 12, и антисмысловую нить, содержащую комплементарную ей последовательность; или двухцепочечные олигонуклеотидные структуры, включающие двухцепочечные олигонуклеотиды; или наночастицы, содержащие двухцепочечные олигонуклеотидные структуры; могут весьма эффективно ингибировать экспрессию амфирегулина, причем и двухцепочечные олигонуклеотиды по настоящему изобретению, и двухцепочечные олигонуклеотидные структуры, содержащие их самих, и наночастицы, содержащие двухцепочечные олигонуклеотидные структуры, могут эффективно применяться для профилактики или лечения фиброза либо респираторных заболеваний.
В предпочтительных двухцепочечных олигонуклеотидах, предназначенных для достижения вышеуказанных целей, содержатся следующие последовательности по SEQ ID NO: 10, 11 и 12:
5′-CACCTACTCTGGGAAGCGT-3′ (SEQ ID NO: 10)
5′-ACCTACTCTGGGAAGCGTG-3′ (SEQ ID NO: 11)
5′-CTGGGAAGCGTGAACCATT-3′ (SEQ ID NO: 12).
В настоящем изобретении термин “двухцепочечный олигонуклеотид” служит для обозначения всех материалов, обладающих активностью РНКи (РНК-интерференции) вообще, а специалистам в данной области должно быть ясно, что к двухцепочечным олигонуклеотидам, специфичным для мРНК, кодирующей белок амфирегулин, также относится амфирегулин-специфичная кшРНК и др. То есть олигонуклеотид может представлять собой миРНК, кшРНК или миРНК.
Кроме того, специалистам в данной области должно быть ясно, что амфирегулин-специфичная миРНК, содержащая смысловую нить и антисмысловую нить, либо антисмысловые олигонуклеотиды, содержащие последовательности, полученные в результате замены, делеции или вставки одного или нескольких нуклеотидов в смысловой нити, включающей какую-либо последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, 11 и 12, или в комплементарной ей антисмысловой нити, также входят в рамки настоящего изобретения, если только сохраняется специфичность для амфирегулина.
В настоящем изобретении смысловая или антисмысловая нить может быть независимо представлена ДНК или РНК. Кроме того, смысловая и антисмысловая нити могут иметь вид гибрида, в котором смысловая нить представлена ДНК, а антисмысловая нить представлена РНК, или же смысловая нить представлена РНК, а антисмысловая нить представлена ДНК.
В настоящем изобретении SEQ ID NO: 10, 11 и 12 представлены в виде ДНК, но при использовании их в виде РНК последовательности SEQ ID NO: 10, 11 и 12 могут быть представлены соответствующими им последовательностями РНК, то есть последовательностями, в которых T заменен на U.
Кроме того, двухцепочечные олигонуклеотиды по настоящему изобретению включают не только те, у которых смысловая нить последовательности полностью комплементарна (идеально соответствует) сайту связывания гена амфирегулина, но также и те, у которых смысловая нить частично комплементарна (не соответствует) сайту связывания, если только сохраняется специфичность к амфирегулину.
Двухцепочечные олигонуклеотиды по настоящему изобретению могут содержать на 3′-конце одной или обеих нитей выступ (overhang), содержащий один или несколько неспаренных нуклеотидов.
В настоящем изобретении смысловая нить или антисмысловая нить может предпочтительно состоять из 19-31 нуклеотидов, без ограничения.
В настоящем изобретении двухцепочечные олигонуклеотиды, содержащие смысловую нить, включающую какую-либо последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, 11 и 12, и антисмысловую нить, содержащую комплементарную ей последовательность, могут быть специфичными для амфирегулина, но не ограничиваются этим.
В настоящем изобретении смысловая нить или антисмысловая нить двухцепочечных олигонуклеотидов может включать различные химические модификации с тем, чтобы повысить их стабильность in vivo или придать устойчивость к нуклеазам и уменьшить неспецифические иммунные ответы. Химических модификаций может быть одна или несколько, выбранных, без ограничения, из группы, состоящей из следующих химических модификаций: модификации, в которых группа ОН в положении 2′-углерода в структуре сахарида у одного или нескольких нуклеотидов заменена на любую из числа -CH3 (метила), -OCH3 (метокси), амина (-NH2), фтора (-F), -O-2-метоксиэтила, -O-пропила, -O-2-метилтиоэтила, -O-3-аминопропила, -O-3-диметиламинопропила, -O-N-метилацетамидо и -O-диметиламидооксиэтила; модификации, в которых кислород в структуре сахарида у нуклеотидов заменен на серу; модификации связей между нуклеотидами на любые связи из числа фосфоротиоатной связи, боранофосфатной связи и метилфосфонатной связи; модификации типа PNA (пептидонуклеиновая кислота), LNA (блокированная нуклеиновая кислота) или UNA (разблокированная нуклеиновая кислота); и модификации типа гибридов ДНК-РНК (Ann. Rev. Med. 55, 61-65, 2004; US 5,660,985; US 5,958,691; US 6,531,584; US 5,808,023; US 6,326,358; US 6,175,001; Bioorg. Med. Chem. Lett. 14:1139-1143, 2003; RNA 9:1034-1048, 2003; Nucleic Acids Res. 31:589-595, 2003; Nucleic Acids Research, 38 (17): 5761-773, 2010; Nucleic Acids Research, 39(5):1823-1832, 2011).
В настоящем изобретении одна или несколько фосфатных групп, предпочтительно от одной до трех фосфатных групп, могут быть связаны с 5′-концом антисмысловой нити двухцепочечных олигонуклеотидов.
В другом аспекте настоящего изобретения предусмотрены двухцепочечные олигонуклеотидные структуры, имеющие структуру, представленную следующей формулой (1), где A означает гидрофильное соединение, B означает гидрофобное соединение, X и Y каждый независимо означает ковалентную связь или опосредованную линкером ковалентную связь, а R означает двухцепочечный олигонуклеотид.
В предпочтительном воплощении двухцепочечные олигонуклеотидные структуры, содержащие амфирегулин-специфичные последовательности по настоящему изобретению, предпочтительно имеют структуру, представленную следующей структурной формулой (1):
A-X-R-Y-B (структурная формула 1)
где A означает гидрофильное соединение, B означает гидрофобное соединение, каждый из X и Y независимо означает простую ковалентную связь или опосредованную линкером ковалентную связь, а R означает двухцепочечный олигонуклеотид.
Двухцепочечные олигонуклеотиды по настоящему изобретению предпочтительно находятся в виде гибридов ДНК-РНК, миРНК (короткая интерферирующая РНК), кшРНК (короткая шпилечная РНК) или микроРНК, но не ограничиваются этим и могут также включать ингибиторы одноцепочечной миРНК, которые могут действовать в качестве антагонистов против миРНК.
В дальнейшем двухцепочечные олигонуклеотиды по настоящему изобретению будут описаны с упором на РНК, но специалистам в данной области должно быть ясно, что настоящее изобретение также может применяться и к другим двухцепочечным олигонуклеотидам, имеющим такие же характеристики, как и двухцепочечные олигонуклеотиды по настоящему изобретению.
Более предпочтительно двухцепочечные олигонуклеотидные структуры, содержащие амфирегулин-специфичные двухцепочечные олигонуклеотиды по настоящему изобретению, имеют структуру, представленную следующей структурной формулой (2):

где A, B, X и Y уже определены выше в структурной формуле (1), S означает смысловую нить амфирегулин-специфичного двухцепочечного олигонуклеотида, а AS - антисмысловую нить амфирегулин-специфичного двухцепочечного олигонуклеотида.
Более предпочтительно двухцепочечные олигонуклеотидные структуры, содержащие амфирегулин-специфичные двухцепочечные олигонуклеотиды, имеют структуру, представленную следующей структурной формулой (3) или (4):

где A, B, S, AS, X и Y уже определены выше в структурной формуле (2), а 5′ и 3′ означают 5′-конец и 3′-конец, соответственно, смысловой нити амфирегулин-специфичного двухцепочечного олигонуклеотида.
Гидрофильное соединение может быть выбрано из группы, состоящей из полиэтиленгликоля (PEG), поливинилпирролидона и полиоксазолина, но не ограничивается этим.
Специалистам в той области техники, к которой относится настоящее изобретение, должно быть ясно, что в структурах из двухцепочечных олигонуклеотидов, содержащих амфирегулин-специфичную миРНК, с 5′-концом антисмысловой нити РНК могут быть связаны от одной до трех фосфатных групп, как показано в структурных формулах (1)-(4), причем вместо этой РНК может использоваться кшРНК.
Гидрофильное соединение в приведенных выше структурных формулах (1)-(4) предпочтительно представляет собой полимерное соединение с молекулярной массой от 200 до 10000, более предпочтительно полимерное соединение с молекулярной массой от 1000 до 2000. Например, в качестве гидрофильного полимерного соединения предпочтительней использовать такое неионное гидрофильное полимерное соединение, как полиэтиленгликоль, поливинилпирролидон или полиоксазолин, но изобретение этим не ограничивается.
В частности, гидрофильное соединение (A) в структурных формулах (1)-(4) может использоваться в виде гидрофильных блоков, как показано в следующей структурной формуле (5) или (6), и можно использовать подходящее количество (n в структурной формуле (5) или (6)) таких гидрофильных блоков, как потребуется, тем самым преодолевая проблемы, связанные с полидисперсными свойствами, которые могут возникнуть при использовании обычных синтетических полимерных соединений:
(A′m-J)n…(структурная формула 5)
(J-A′m)n…(структурная формула 6)
где A′ означает гидрофильный мономер, J означает линкер, соединяющий (m) гидрофильных мономеров вместе или соединяющий (m) гидрофильных мономеров с двухцепочечным олигонуклеотидом, m - целое число от 1 до 15, n - целое число от 1 до 10, а повторяющееся звено, представленное как (A′m-J) или (J-Am′), соответствует основному звену гидрофильного блока.
При использовании гидрофильных блоков, представленных в структурной формуле (5) или (6), двухцепочечные олигонуклеотидные структуры, содержащие амфирегулин-специфичные двухцепочечные олигонуклеотиды по настоящему изобретению, могут иметь структуру, представленную следующей структурной формулой (7) или (8):
(A′m-J)n-X-R-Y-B…(структурная формула 7)
(J-A′m)n-X-R-Y-B…(структурная формула 8)
где X, R, Y и B уже определены выше в структурной формуле (1), а A′, J, m и n уже определены выше в структурных формулах (5) и (6).
В качестве гидрофильного мономера (A′) в приведенных выше структурных формулах (5) и (6) можно использовать любые из числа неионных гидрофильных полимеров без ограничения, если только они совместимы с целями настоящего изобретения. Предпочтительно можно использовать мономер из числа соединений (1)-(3), приведенных ниже в таблице 1. Более предпочтительно можно использовать мономер соединения (1). У соединения (1) предпочтительно G можно выбрать из O, S и NH.
В частности, среди гидрофильных мономеров для получения структур по настоящему изобретению очень подходит мономер, представленный соединением (1), так как этот мономер обладает преимуществом в том, что в него можно вводить различные функциональные группы и он вызывает слабые иммунные реакции за счет хорошего сродства in vivo и отличной биосовместимости, он может повышать стабильность in vivo двухцепочечных олигонуклеотидов, входящих в структуры, представленные структурной формулой (7) или (8), и может повышать эффективность доставки двухцепочечных олигонуклеотидов.
Таблица 1. Структура гидрофильных мономеров, используемых в настоящем изобретении
 ,
,
где G означает O, S или NH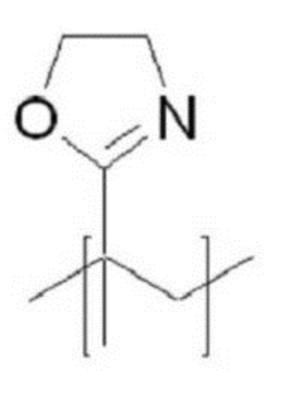

Общая молекулярная масса гидрофильного соединения в структурных формулах (5)-(8) предпочтительно составляет от 1000 до 2000. Так, например, когда соединение (1) в структурной формуле (7) и структурной формуле (8) представляет собой гексаэтиленгликоль, то есть соединение, в котором G означает O, а m равно 6, то число повторов (n) предпочтительно составляет от 3 до 5, так как гексаэтиленгликоль имеет молекулярную массу 344. В частности, настоящее изобретение отличается тем, что можно использовать подходящее количество (представленное n) повторяющихся звеньев гидрофильной группы (гидрофильных блоков), представленных (A′m-J) или (J-A′m)n в структурной формуле (5) и структурной формуле (6), как потребуется. Гидрофильный мономер A′ и линкер J, содержащиеся в каждом гидрофильном блоке, могут быть одинаковыми или разными среди гидрофильных блоков. Иными словами, при использовании 3 гидрофильных блоков (n = 3) в первом, втором и третьем блоке можно использовать гидрофильный мономер соединения (1), гидрофильный мономер соединения (2) и гидрофильный мономер соединения (3), соответственно, если предполагать, что во всех гидрофильных блоках можно использовать разные мономеры. С другой стороны, также можно использовать и какой-либо один гидрофильный мономер из числа соединений (1)-(3) во всех гидрофильных блоках. Точно так же в качестве линкера, опосредующего связывание гидрофильного мономера, можно использовать один и тот же линкер во всех гидрофильных блоках или же использовать различные линкеры в гидрофильных блоках. Кроме того, m, то есть количество гидрофильных мономеров, также может быть одинаковым или разным среди гидрофильных блоков. Другими словами, в первом гидрофильном блоке соединяются три гидрофильных мономера (m = 3), во втором гидрофильном блоке соединяются пять гидрофильных мономеров (m = 5), а в третьем гидрофильном блоке соединяются четыре гидрофильных мономера (m = 4), если предполагать, что в гидрофильных блоках можно использовать различное количество гидрофильных мономеров. С другой стороны, также можно использовать и одинаковое количество гидрофильных мономеров во всех гидрофильных блоках.
Кроме того, в настоящем изобретении линкер (J) предпочтительно выбирают из группы, состоящей из -PO3-, -SO3- и -CO2-, без ограничения. Специалистам в данной области должно быть ясно, что можно использовать любой линкер, выбранный с учетом используемого гидрофильного мономера, если только он совместим с целями настоящего изобретения.
Гидрофобное соединение (B) в структурных формулах (1)-(4), структурной формуле (7) и структурной формуле (8) действует, формируя наночастицы, состоящие из олигонуклеотидных структур, представленных в структурных формулах (1)-(4), структурной формуле (7) и структурной формуле (8), посредством гидрофобных взаимодействий. Гидрофобное соединение предпочтительно имеет молекулярную массу от 250 до 1000 и может быть выбрано из группы, состоящей из производных стероидов, производных глицеридов, простых эфиров глицерина, полипропиленгликоля, ненасыщенных или насыщенных C12-C50-углеводородов, диацилфосфатидилхолина, жирных кислот, фосфолипидов, липополиаминов, липидов, токоферола и токотриенола, без ограничения. Специалистам в данной области должно быть ясно, что можно использовать любое гидрофобное соединение, если только оно совместимо с целями настоящего изобретения.
Производные стероидов можно выбирать из группы, состоящей из холестерина, холестанола, холевой кислоты, холестерилформиата, холестанилформиата и холестериламина, а производные глицеридов можно выбирать из моно-, ди- и триглицеридов и т.п. При этом жирная кислота глицерида предпочтительно представлена ненасыщенной или насыщенной C12-C50-жирной кислотой.
В частности, среди гидрофобных соединений предпочтительно используются насыщенные или ненасыщенные углеводороды или холестерин, так как они могут легко связываться на стадии синтеза двухцепочечных олигонуклеотидных структур по настоящему изобретению. Наиболее предпочтительно используются C24-углеводороды, в особенности гидрофобные углеводороды, содержащие дисульфидную связь.
Гидрофобное соединение может связываться с дистальным концом гидрофильного соединения и может связываться с любым положением в смысловой или антисмысловой нити двухцепочечного олигонуклеотида.
Гидрофильное соединение или гидрофобное соединение в структурных формулах (1)-(4), (7) и (8) по настоящему изобретению связывается с амфирегулин-специфичным олигонуклеотидом простой ковалентной связью или опосредованной линкером ковалентной связью (X или Y). Линкер, который опосредует ковалентную связь и связывается ковалентно с гидрофильным или гидрофобным соединением на конце амфирегулин-специфичного олигонуклеотида, не имеет особых ограничений, если только он обеспечивает разлагаемую связь в определенной среде, при необходимости. Следовательно, линкер, который используется в настоящем изобретении, может представлять собой любое соединение, которое связывается для того, чтобы активировать амфирегулиновый олигонуклеотид и/или гидрофильное (или гидрофобное) соединение в процессе получения двухцепочечных олигонуклеотидных структур по настоящему изобретению. Ковалентная связь может быть либо нерасщепляемой, либо расщепляемой связью. При этом примеры нерасщепляемых связей включают, без ограничения, амидную связь и фосфатную связь, а примеры расщепляемых связей включают, без ограничения, дисульфидную связь, расщепляемые кислотами связи, сложноэфирные связи, ангидридные связи, биоразлагаемые связи и расщепляемые ферментами связи.
Кроме того, в качестве амфирегулин-специфичного двухцепочечного олигонуклеотида, представленного R (или S и AS) в структурных формулах (1)-(4), (7) и (8), можно использовать любой двухцепочечный олигонуклеотид, обладающий свойством специфического связывания с мРНК амфирегулина, без ограничения. Предпочтительно амфирегулин-специфичный двухцепочечный олигонуклеотид по настоящему изобретению включает смысловую нить, содержащую какую-либо последовательность из числа SEQ ID NO: 10, 11 и 12, и антисмысловую нить, содержащую последовательность, комплементарную последовательности смысловой нити.
Кроме того, в двухцепочечные олигонуклеотидные структуры, содержащие амфирегулин-специфичные двухцепочечные олигонуклеотиды по настоящему изобретению, можно дополнительно вводить аминогруппу или полигистидин на дистальный конец гидрофильного соединения, связанного с олигонуклеотидом в структурах.
Это способствует внутриклеточному захвату и выходу из эндосом носителя, содержащего двухцепочечные олигонуклеотидные структуры, содержащие специфичные для амфирегулина двухцепочечные олигонуклеотиды по настоящему изобретению, и уже сообщалось, что введение аминогруппы и полигистидина можно использовать для облегчения внутриклеточного поглощения и выхода из эндосом таких носителей, как квантовые точки, дендримеры или липосомы.
В частности, известно, что первичная аминогруппа, введенная на конец носителя или возле него, протонируется при биологическом pH, образуя конъюгат за счет взаимодействия с отрицательно заряженным геном, а выход из эндосом облегчается за счет внутреннего третичного амина, обладающего буферным действием при низком pH после внутриклеточного захвата, при этом носитель будет защищен от деградации в лизосомах (Gene delivery and expression inhibition using polymer-based hybrid material. Polymer Sci. Technol., Vol. 23, No. 3, pp 254-259).
Кроме того, известно, что заменимая аминокислота - гистидин содержит имидазольное кольцо (pKa = 6,04) в своем остатке (-R), поэтому он способен повышать буферную ёмкость в эндосомах и лизосомах, поэтому модификация гистидином может использоваться в невирусных носителях генов, включая липосомы, для повышения эффективности выхода из эндосом (Novel histidine-conjugated galactosylated cationic liposomes for efficient hepatocyte selective gene transfer in human hepatoma HepG2 cells. J. Controlled Release 118, pp 262-270).
Аминогруппа или полигистидин может связываться с гидрофильным соединением или гидрофильным блоком посредством одного или нескольких линкеров.
При введении аминогруппы или полигистидина в гидрофильное составляющее двухцепочечных олигонуклеотидных структур, представленных структурной формулой (1) по настоящему изобретению, структура РНК может иметь структуру, представленную следующей структурной формулой (9):
P-J1-J2-A-X-R-Y-B…(структурная формула 9)
где A, B, R, X и Y уже определены в структурной формуле (1) выше,
P означает аминогруппу или полигистидин, а J1 и J2 означают линкеры, каждый из которых может быть выбран независимо из простой ковалентной связи, PO3−, SO3, CO2, C2-12-алкила, алкенила и алкинила, без ограничения. Специалистам в данной области должно быть ясно, что в качестве J1 и J2 можно использовать любые линкеры, выбранные с учетом используемого при этом гидрофильного соединения, если только они совместимы с целями настоящего изобретения.
Предпочтительно при введении аминогруппы J2 означает простую ковалентную связь или PO3−, а J1 означает C6-алкил, но настоящее изобретение этим не ограничивается.
Кроме того, при введении полигистидина предпочтительно J2 в структурной формуле (9) означает простую ковалентную связь или PO3−, а J1 означает соединение (4), но настоящее изобретение этим не ограничивается.

Кроме того, когда гидрофильное составляющее в двухцепочечных олигонуклеотидных структурах из, представленных структурной формулой (9), представляет собой гидрофильный блок, представленный структурной формулой (5) или (6), и в него введена аминогруппа или полигистидин, то двухцепочечные олигонуклеотидные структуры могут иметь структуру, представленную следующей структурной формулой (10) или (11):
P-J1-J2-(A′m-J)n-X-R-Y-B…(структурная формула 10)
P-J1-J2-(J-A′m)n-X-R-Y-B…(структурная формула 11)
где X, R, Y, B, A′, J, m и n уже определены в структурной формуле (5) или (6) выше, а P, J1 и J2 уже определены в структурной формуле (9).
В частности, гидрофильное соединение в структурных формулах (10) и (11) предпочтительно связано с 3′-концом смысловой нити амфирегулин-специфичного двухцепочечного олигонуклеотида. В этом случае структурные формулы (9)-(11) могут соответствовать следующим структурным формулам (12)-(14):
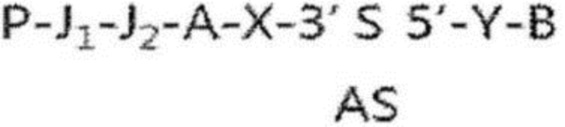 (структурная формула 12)
(структурная формула 12)
 (структурная формула 13)
(структурная формула 13)
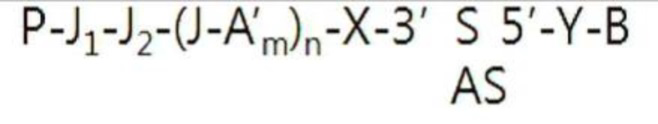 (14)
(14)
где X, R, Y, B, A, A′, J, m, n, P, J1 и J2 уже определены выше в структурных формулах (9)-(11), а 5′ и 3′ означают 5′-конец и 3′-конец смысловой нити амфирегулин-специфичного двухцепочечного олигонуклеотида.
Аминогруппа, которая может вводиться в настоящем изобретении, может быть первичной, вторичной или третичной аминогруппой. В частности, предпочтительно используется первичная аминогруппа. Введенная аминогруппа может находиться в виде соли амина. Например, соль первичной аминогруппы может находиться в виде NH3+.
Кроме того, полигистидиновая группа, которая может вводиться в настоящем изобретении, предпочтительно содержит от 3 до 10 гистидинов, более предпочтительно от 5 до 8 гистидинов и наиболее предпочтительно 6 гистидинов. В дополнение к гистидинам можно включить один или несколько цистеинов.
Между тем, когда в двухцепочечных олигонуклеотидных структурах, содержащих амфирегулин-специфичные олигонуклеотиды по настоящему изобретению и образовавшиеся из них наночастицы, предусмотрен наводящий фрагмент, то он может способствовать эффективной доставке РНК-структур к клеткам мишени с тем, чтобы РНК-структуры могли попасть в клетки мишени даже при относительно низкой концентрации, тем самым проявляя сильный эффект регуляции экспрессии целевого гена. Кроме того, наводящий фрагмент может предотвращать неспецифическую доставку амфирегулин-специфичных двухцепочечных олигонуклеотидов в другие органы и клетки.
Соответственно, настоящим изобретением предусмотрены структуры из двухцепочечной олиго-РНК, в которых со структурами, представленными какой-либо из структурных формул (1)-(4), (7) и (8), дополнительно связан лиганд (L), в частности лиганд, обладающий свойством специфически связываться с рецептором, усиливающим интернализацию в клетках мишени посредством опосредованного рецептором эндоцитоза (RME). Например, структуры, в которых лиганд связан со структурой из двухцепочечной олиго-РНК, представленной структурной формулой (1), имеют структуру, представленную следующей структурной формулой (15):
(Li-Z)-A-X-R-Y-B…(15)
где A, B, X и Y уже определены в структурной формуле (1) выше, L означает лиганд, обладающий свойством специфически связываться с рецептором, усиливающим интернализацию в клетках мишени посредством опосредованного рецептором эндоцитоза (RME), а “i” означает целое число от 1 до 5, предпочтительно от 1 до 3.
Лиганд в структурной формуле (15) предпочтительно может быть выбран из числа специфичных к данному рецептору антител, аптамеров и пептидов, обладающих свойством усиления RME-интернализации в клетках мишени; фолата (термин “фолат” обычно применяется взаимозаменяемо с фолиевой кислотой, а в настоящем изобретении термин “фолат” означает фолат, который находится в естественном виде или активируется в организме человека); и химических соединений, в том числе таких гексозаминов, как N-ацетилгалактозамин (NAG), и таких сахаров или углеводов, как глюкоза и манноза, без ограничения.
Кроме того, гидрофильное соединение (A) в приведенной выше структурной формуле (15) может использоваться в виде гидрофильного блока, представленного структурной формулой (5) или (6).
В следующем аспекте настоящего изобретения предусмотрен способ получения двухцепочечных олигонуклеотидных структур, содержащих амфирегулин-специфичные двухцепочечные олигонуклеотиды.
Например, способ получения двухцепочечных олигонуклеотидных структур, содержащих амфирегулин-специфичные двухцепочечные олигонуклеотиды по настоящему изобретению, может включать следующие стадии:
(1) связывание гидрофильного соединения с твердой подложкой;
(2) синтез первой нити олигонуклеотида на твердой подложке со связанным гидрофильным соединением;
(3) ковалентное связывание гидрофобного соединения с 5′-концом первой нити олигонуклеотида;
(4) синтез второй нити олигонуклеотида, последовательность которой комплементарна последовательности первой нити олигонуклеотида из стадии (2);
(5) отделение от твердой подложки и очистка структуры олигонуклеотид-полимер и второй нити олигонуклеотида по завершении синтеза; и
(6) отжиг полученной структуры олигонуклеотид-полимер со второй нитью олигонуклеотида, имеющей комплементарную последовательность, тем самым получая двухцепочечнную олигонуклеотидную структуру.
Твердая подложка, которая используется в настоящем изобретении, предпочтительно представляет собой стекло с контролируемым размером пор (CPG), но не ограничивается этим, также можно использовать полистирол (PS), полиметилметакрилат (PMMA), силикагель, целлюлозную бумагу и т.п. При использовании CPG шарики предпочтительно имеют диаметр от 40 до 180 мкм и размеры пор от 500 до 3000 Å. После стадии (5) можно измерить молекулярные массы полученной и очищенной структуры РНК-полимер и второй нити олигонуклеотида методом масс-спектрометрии MALDI-TOF с тем, чтобы подтвердить, что получена требуемая структура олигонуклеотид-полимер и вторая нить олигонуклеотида. В вышеописанном способе получения стадия (4) синтеза второй нити олигонуклеотида, последовательность которой комплементарна последовательности первой нити олигонуклеотида, синтезируемой на стадии (2), может выполняться перед стадией (1) или на любой из стадий (1)-(5).
Кроме того, вторая нить олигонуклеотида, последовательность которой комплементарна последовательности первой нити олигонуклеотида, синтезируемой на стадии (2), может использоваться в таком состоянии, в котором с 5′-концом данной нити олигонуклеотида связана фосфатная группа.
Между тем, настоящим изобретением предусмотрен способ получения двухцепочечных олигонуклеотидных структур, в котором со двухцепочечной олигонуклеотидной структурой, содержащей амфирегулин-специфичный двухцепочечный олигонуклеотид, дополнительно связан лиганд.
Например, способ получения двухцепочечных олигонуклеотидных структур со связанным лигандом, содержащих амфирегулин-специфичные двухцепочечные олигонуклеотиды, может включать следующие стадии:
(1) связывание гидрофильного соединения с твердой подложкой, содержащей связанную с ней функциональную группу;
(2) синтез первой нити олигонуклеотида на твердой подложке с функциональной группой и связанным с ней гидрофильным соединением;
(3) ковалентное связывание гидрофобного соединения с 5′-концом первой нити олигонуклеотида;
(4) синтез второй нити олигонуклеотида, последовательность которой комплементарна последовательности первой нити олигонуклеотида из стадии (2);
(5) отделение от твердой подложки структуры олигонуклеотид-полимер с функциональной группой и второй нити олигонуклеотида с комплементарной последовательностью по завершении синтеза;
(6) связывание лиганда с концом гидрофильного соединения по функциональной группе с получением одной нити структуры лиганд-олигонуклеотид-полимер; и
(6) отжиг полученной структуры лиганд-олигонуклеотид-полимер со второй нитью олигонуклеотида, имеющей комплементарную последовательность, тем самым получая структуру лиганд/двухцепочечный олигонуклеотид.
После стадии (6) можно отделить и очистить полученную структуру лиганд-олигонуклеотид-полимер и вторую нить олигонуклеотида с комплементарной последовательностью, а затем измерить их молекулярные массы методом масс-спектрометрии MALDI-TOF с тем, чтобы подтвердить, что получена требуемая структура лиганд-РНК-полимер и требуемая вторая нить РНК с комплементарной последовательностью. При отжиге полученной структуры лиганд/РНК-олигонуклеотид со второй нитью олигонуклеотида, имеющей комплементарную последовательность, образуется структура лиганд/двухцепочечный олигонуклеотид. В описанном выше способе получения стадия (4) синтеза второй нити олигонуклеотида, последовательность которой комплементарна последовательности первой нити олигонуклеотида, синтезируемой на стадии (3), может выполняться перед стадией (1) или на любой из стадий (1)-(6).
В следующем аспекте настоящего изобретения предусмотрены наночастицы, содержащие двухцепочечные олигонуклеотидные структуры по настоящему изобретению. Двухцепочечные олигонуклеотиды по настоящему изобретению образуют самосборочные наночастицы за счет гидрофобных взаимодействий гидрофобного соединения (патент Кореи No. 1224828). Эти наночастицы обладают превосходной эффективностью доставки in vivo и стабильностью in vivo. Кроме того, высокая однородность размеров наночастиц облегчает контроль качества (QC) и тем самым процесс получения этих наночастиц в качестве лекарственных средств.
В настоящем изобретении наночастицы также могут состоять из смеси двухцепочечных олигонуклеотидных структур, содержащих двухцепочечные структуры, имеющие разные последовательности. Например, наночастицы могут содержать один вид амфирегулин-специфичного двухцепочечного олигонуклеотида, содержащего смысловую нить, включающую какую-либо последовательность из числа SEQ ID NO: 10-12, и антисмысловую нить, включающую последовательность, комплементарную ей; однако в другом воплощении наночастицы могут содержать различные виды амфирегулин-специфичных двухцепочечных олигонуклеотидов, каждый из которых содержит смысловую нить, включающую какую-либо последовательность из числа SEQ ID NO: 10-12, и антисмысловую нить, включающую последовательность, комплементарную ей; а также могут содержать амфирегулин-специфичный двухцепочечный олигонуклеотид, который не приведен в настоящем изобретении.
В следующем аспекте настоящего изобретения предусмотрены фармацевтические композиции для профилактики или лечения фиброза либо респираторных заболеваний, которые содержат в качестве активного ингредиента двухцепочечные олигонуклеотиды по настоящему изобретению, двухцепочечные олигонуклеотидные структуры или наночастицы, содержащие двухцепочечные олигонуклеотидные структуры.
Фармацевтические композиции для профилактики или лечения фиброза или респираторных заболеваний по настоящему изобретению проявляют действие по профилактике или лечению фиброза либо респираторных заболеваний путем ингибирования ремоделирования соединительных тканей, в частности, ремоделирования легочной артерии и ремоделирования дыхательных путей.
В настоящем изобретении респираторное заболевание может представлять собой хроническую обструктивную болезнь легких (COPD), астму, острый и хронический бронхит, аллергический ринит, кашель, мокроту, бронхит, бронхиолит, боль в горле, тонзиллит или ларингит, а фиброз может представлять собой идиопатический фиброз легких (IPF), фиброз печени, цирроз, миелофиброз, фиброз миокарда, фиброз почек, фиброз легких, фиброз сердца или фиброз, вызванный облучением, но настоящее изобретение этим не ограничивается. В настоящем изобретении вызванный облучением фиброз означает побочный эффект, который часто возникает при радиотерапии, широко применяемой для лечения рака, опухолей и т.д., а термин “вызванный облучением фиброз” может применяться взаимозаменяемо с термином “синдром лучевого фиброза (RFS)”.
Для введения композиций настоящего изобретения они могут дополнительно содержать один или несколько фармацевтически приемлемых носителей, наряду с вышеописанным активным ингредиентом. Фармацевтически приемлемые носители должны быть совместимы с активным ингредиентом и могут быть выбраны из физиологического раствора, стерильной воды, раствора Рингера, забуференного солевого раствора, раствора декстрозы, раствора мальтодекстрина, глицерина, этанола и смеси из двух или нескольких из них. При необходимости композиции могут содержать другие стандартные добавки, как-то антиоксиданты, буферы или бактериостатические средства. Кроме того, в композиции также можно еще вводить разбавители, диспергирующие средства, поверхностно-активные вещества, связующие и смазывающие вещества для получения таких форм для инъекций, как водные растворы, суспензии и эмульсии. В частности, композиции предпочтительно получают в виде лиофилизованных форм. Для получения лиофилизованных композиций можно применять стандартные методы, известные в той области техники, к которой относится настоящее изобретение, а также можно еще добавить стабилизатор для лиофилизации. Кроме того, композиции предпочтительно составляют в соответствии с заболеванием или компонентами подходящим методом, известным в данной области, или же методом, изложенным в Remington’s Pharmaceutical Science, Mack Publishing Company, Easton, PA.
Дозы композиций по настоящему изобретению могут быть установлены специалистами в данной области, исходя из состояния пациента и тяжести заболевания. Кроме того, композиции могут быть составлены в виде различных дозовых форм, включая порошки, таблетки, капсулы, жидкости, растворы для инъекций, мази и сиропы, и могут находиться в контейнерах для однократной или многократной дозировки, к примеру, в запечатанных ампулах или флаконах.
Композиции по настоящему изобретению можно вводить перорально или парентерально. Композиции по настоящему изобретению можно вводить, к примеру, перорально, посредством ингаляции, внутривенно, внутримышечно, внутриартериально, интрамедуллярно, интрадурально, внутрисердечно, трансдермально, подкожно, внутрибрюшинно, интраректально, под язык или местно, без ограничения. В частности, композиции также можно вводить в легкие путем внутрибронхиальной инстилляции для лечения респираторных заболеваний. Дозы композиций по настоящему изобретению могут варьироваться в зависимости от веса, возраста, пола, состояния здоровья и диеты пациента, продолжительности введения, способа введения, скорости выведения, тяжести заболевания и т.п. и могут быть легко установлены специалистами в данной области. Кроме того, для клинического применения композиции настоящего изобретения могут быть приготовлена в виде подходящей лекарственной формы по известной методике.
В следующем аспекте настоящего изобретения предусмотрены лиофилизованные лекарственные формы, содержащие фармацевтические композиции по настоящему изобретению.
В следующем аспекте настоящего изобретения предусмотрен способ профилактики или лечения фиброза либо респираторных заболеваний, который включает стадию введения фармацевтической композиции для профилактики или лечения фиброза либо респираторных заболеваний по настоящему изобретению субъектам, нуждающимся в профилактике или лечении фиброза либо респираторных заболеваний.
В настоящем изобретении респираторное заболевание может представлять собой хроническую обструктивную болезнь легких (COPD), астму, острый и хронический бронхит, аллергический ринит, кашель, мокроту, бронхит, бронхиолит, боль в горле, тонзиллит или ларингит, а фиброз может представлять собой идиопатический фиброз легких (IPF), фиброз печени, цирроз, миелофиброз, фиброз миокарда, фиброз почек, фиброз легких, фиброз сердца или фиброз, вызванный облучением, но настоящее изобретение этим не ограничивается.
В следующем аспекте настоящего изобретения предусмотрены двухцепочечные олигонуклеотиды, содержащие их двухцепочечные олигонуклеотидные структуры и наночастицы, содержащие двухцепочечные олигонуклеотидные структуры, для применения в способе профилактики или лечения фиброза или респираторных заболеваний.
В следующем аспекте настоящего изобретения предусмотрены фармацевтические композиции для применения в способе профилактики или лечения фиброза или респираторных заболеваний.
В следующем аспекте настоящего изобретения предусмотрено применение двухцепочечных олигонуклеотидыов, содержащих их двухцепочечных олигонуклеотидных структур и наночастиц, содержащих двухцепочечные олигонуклеотидные структуры, для изготовления лекарственных средств для профилактики фиброза или респираторных заболеваний.
Краткое описание фигур
На фиг. 1 представлены результаты скрининга 1257 SAMiRNA, нацеленных на амфирегулин человека.
На фиг. 2 представлено распределение размеров наночастиц двухцепочечных гибридов ДНК/РНК, содержащих выбранные амфирегулин-специфичные двухцепочечные олигонуклеотиды. (a): SAMi-AREG #10, (b): SAMi-AREG #11 и (c): SAMi-AREG #12.
На фиг. 3 представлены результаты количественного анализа уровней экспрессии мРНК амфирегулина в примере 4 и приведены графики, показывающие относительные уровни экспрессии мРНК (%) амфирегулина в клетках линии A549 рака легких при различных концентрациях (200 и 600 нМ) SAMiRNA с последовательностями по SEQ ID NO: 1-14 настоящего изобретения в качестве смысловой нити.
На фиг. 4 представлены результаты количественного анализа уровня экспрессии мРНК амфирегулина в примере 5 и приведены графики, показывающие результаты анализа относительных уровней экспрессии мРНК (%) амфирегулина (фиг. 4(a)) и определения значений IC50 SAMiRNA (фиг. 4(b)) в клетках линии A549 рака легких после обработки при различных концентрациях (12,5 нМ, 25 нМ, 50 нМ, 100 нМ, 200 нМ, 600 нМ и 1200 нМ) SAMiRNA с последовательностью по SEQ ID NO: 10 настоящего изобретения в качестве смысловой нити.
На фиг. 5 представлены результаты количественного анализа уровня экспрессии мРНК амфирегулина в примере 5 и приведены графики, показывающие результаты анализа относительных уровней экспрессии мРНК (%) амфирегулина (фиг. 5(a)) и определения значений IC50 SAMiRNA (фиг. 5(b)) в клетках линии A549 рака легких после обработки при различных концентрациях (12,5 нМ, 25 нМ, 50 нМ, 100 нМ, 200 нМ, 600 нМ и 1200 нМ) SAMiRNA с последовательностью по SEQ ID NO: 11 настоящего изобретения в качестве смысловой нити.
На фиг. 6 представлены результаты количественного анализа уровня экспрессии мРНК амфирегулина в примере 5 и приведены графики, показывающие результаты анализа относительных уровней экспрессии мРНК (%) амфирегулина (фиг. 6(a)) и определения значений IC50 SAMiRNA (фиг. 6(b)) в клетках линии A549 рака легких после обработки при различных концентрациях (12,5 нМ, 25 нМ, 50 нМ, 100 нМ, 200 нМ, 600 нМ и 1200 нМ) SAMiRNA с последовательностью по SEQ ID NO: 12 настоящего изобретения в качестве смысловой нити.
На фиг. 7 представлены результаты теста на врожденный иммунитет для последовательностей-кандидатов по амфирегулину в Примере 6 и приведены результаты, полученные при обработке мононуклеарных клеток периферической крови (PBMC) человека 2,5 мкМ амфирегулин-специфичных SAMiRNA с последовательностями по SEQ ID NO: 10 (AR-1), 11 (AR-2) и 12 (AR-3) настоящего изобретения в качестве смысловой нити, анализа относительного повышения уровней экспрессии мРНК связанных с врожденным иммунитетом цитокинов под действием амфирегулин-специфичной SAMiRNA и оценки цитотоксичности in vitro на мононуклеарных клетках периферической крови человека. (a): гибридная SAMiRNA типа ДНК/РНК и (b): гибридная SAMiRNA типа РНК/РНК.
На фиг. 8 представлены результаты количественного анализа уровней экспрессии мРНК амфирегулина в примере 7 и приведены графики, показывающие относительные уровни экспрессии мРНК (%) амфирегулина под действием двухцепочечных олигонуклеотидов типа ДНК/РНК и типа РНК/РНК, содержащих выбранную амфирегулин-специфичную SAMiRNA. А именно, на фиг. 8 приведены графики, показывающие уровни экспрессии мРНК амфирегулина в клетках линии A549 рака легких после обработки при различных концентрациях (200 нМ, 600 нМ и 1200 нМ) SAMiRNA с последовательностями по SEQ ID NO: 10 (AR-1), 11 (AR-2) и 12 (AR-3) настоящего изобретения в качестве смысловой нити.
На фиг. 9 представлены результаты скрининга 237 SAMiRNA, нацеленных на амфирегулин мыши, и 9 последовательностей-кандидатов, выбранных из них.
На фиг. 10A представлены результаты количественного анализа уровня экспрессии мРНК амфирегулина мыши в примере 8 и приведены графики, показывающие относительные уровни экспрессии мРНК (%) амфирегулина в клетках линии MLg фибробластов легких мыши после обработки при различных концентрациях (200 и 500 нМ) SAMiRNA с последовательностями по SEQ ID NO: 19, 20 и 21 настоящего изобретения в качестве смысловой нити.
На фиг. 10B представлены результаты количественного анализа уровня экспрессии мРНК амфирегулина мыши в примере 8 и приведены графики, показывающие относительные уровни экспрессии мРНК (%) амфирегулина в эпителиальных клетках линии LA-4 легких мыши после обработки при различных концентрациях (200, 500 и 1000 нМ) SAMiRNA с последовательностями по SEQ ID NO: 19, 20 и 21 настоящего изобретения в качестве смысловой нити.
На фиг. 11 представлены графики, показывающие результаты окрашивания легочной ткани и относительные уровни экспрессии мРНК (%) целевого гена и маркерных генов фиброза после внутривенного введения 1 мг/кг и 5 мг/кг SAMiRNA-AREG #20 мышам с индуцированным диоксидом кремния фиброзом легких в примере 9.
На фиг. 12 представлены графики, показывающие результаты окрашивания легочной ткани и относительные уровни экспрессии мРНК (%) целевого гена и маркерных генов фиброза после внутривенного введения 5 мг/кг SAMiRNA-AREG #20 мышам с индуцированным блеомицином фиброзом легких в примере 10.
На фиг. 13 представлены графики, показывающие относительные уровни экспрессии мРНК (%) целевого гена, маркерных генов фиброза и маркерных генов воспаления в почечной ткани после внутривенного введения 1 мг/кг и 5 мг/кг SAMiRNA-AREG #20 мышам на модели UUO, подвергнутым операции UUO в примере 11.
Примеры
Далее настоящее изобретение будет описано более подробно на примерах. Специалистам в данной области должно быть ясно, что эти примеры предназначены только для более подробного объяснения настоящего изобретения, и объем настоящего изобретения не ограничивается этими примерами. Таким образом, объем настоящего изобретения будет определяться прилагаемой формулой изобретения и её эквивалентами.
В настоящем изобретении были идентифицированы три специфические последовательности, способные ингибировать экспрессию амфирегулина, и было подтверждено, что эти последовательности могут комплементарно связываться с мРНК, кодирующей амфирегулин, и эффективно ингибировать экспрессию амфирегулина, тем самым эффективно лечить фиброз и респираторные заболевания.
Пример 1. Алгоритм для скрининга SAMiRNA, нацеленных на амфирегулин, и отбора последовательностей-кандидатов
Высокопроизводительный скрининг препаратов на основе SAMiRNA - это метод, в котором создаются все возможные последовательности-кандидаты с применением алгоритма типа скользящего окна по 1 или 2 основаниям ко всей мРНК, ненужные последовательности-кандидаты удаляются путем фильтрования по гомологии и определяется степень, в которой подавляется экспрессия представляющего интерес гена, по всем окончательно выбранным SAMiRNA.
Сначала проводили разработку последовательностей-кандидатов SAMiRNA против амфирегулина. В частности, проводили отбор 1257 последовательностей-кандидатов SAMiRNA, состоящих из 19 нуклеотидов, с применением алгоритма типа скользящего окна по 1 основанию к мРНК амфирегулина человека NM_001657.3 (1290 п.н.), и проводили эксперимент по определению степени ингибирования амфирегулина.
Пример 2. Синтез структур из двухцепочечной олиго-РНК
Структуры из двухцепочечной олиго-РНК (SAMiRNA), полученные в настоящем изобретении, представлены следующей структурной формулой:
C24-5′ S 3′-(гексаэтиленгликоль-PO4−)3-гексаэтиленгликоль
AS 5′-PO4
Для синтеза смысловой нити моноSAMiRNA (n = 4) структуры из двухцепочечной олиго-РНК в качестве носителя использовали 3,4,6-триацетил-1-гекса(этиленгликоль)-N-ацетилгалактозамин-CPG, а в качестве гидрофильных мономеров три десметокситритил (DMT)-гексаэтиленгликоль-фосфорамидата непрерывно связывались с носителем посредством реакции. Затем проводили синтез РНК или ДНК, а затем с 5′-концевым участком связывали гидрофобный C24-(C6-S-S-C18), содержащий дисульфидную связь, тем самым синтезируя смысловую нить моноSAMiRNA (n = 4), в которой NAG-гексаэтиленгликоль-(PO4−-гексаэтиленгликоль)3 связан с 3′-концом, а C24-(C6-S-S-C18) связан с 5′-концом.
По завершении синтеза синтезированную первую нить РНК и структуры олиго(ДНК или РНК)-полимер отделяли от CPG путем обработки 28% (об/об) аммиаком на водяной бане при 60°C, а затем удаляли защитные остатки посредством реакции деблокирования. После удаления защитных остатков первую нить РНК и структуры типа олиго(ДНК или РНК)-полимер обрабатывали N-метилпирролидоном, триметиламином и триэтиламинотригидрофторидом в объемном соотношении 10:3:4 в печи при 70°C с тем, чтобы удалить 2′-TBDMS (трет-бутилдиметилсилил). Первую нить РНК, структуры типа олиго(ДНК или РНК)-полимер и связанные с лигандом структуры типа олиго(ДНК или РНК)-полимер отделяли от продуктов реакции методом высокоэффективной жидкостной хроматографии (HPLC) и измеряли их молекулярные массы методом масс-спектрометрии MALDI-TOF (MALDI TOF-MS, Shimadzu, Япония), чтобы проверить, будут ли они соответствовать требуемой нуклеотидной последовательности и структуре синтезируемого полимера. После этого, чтобы получить двухцепочечные олигонуклеотидные структуры, смешивали вместе смысловую нить и антисмысловую нить, вносили в 1×буфер для отжига (30 мМ HEPES, 100 мМ ацетат калия, 2 мМ ацетат магния, pH 7,0-7,5), оставляли для реакции на водяной бане при 90°C на 3 мин, а затем проводили реакцию при 37°C, получая при этом требуемую SAMiRNA. Отжиг полученных структур из двухцепочечной олиго-РНК проверяли методом электрофореза.
Пример 3. Высокопроизводительный скрининг (HTS) наночастиц SAMiRNA, нацеленных на амфирегулин человека и индуцирующих РНКи
3-1. Получение наночастиц SAMiRNA
1257 нацеленных на амфирегулин последовательностей SAMiRNA, синтезированных в примере 2, растворяли в 1×фосфатно-солевом буфере Дюльбекко (DPBS) (Welgene, KR) и лиофилизировали в сублимационной сушке (LGJ-100F, CN) в течение 5 дней. Лиофилизованные порошки наночастиц растворяли и гомогенизировали в 1,429 мл деионизированной дистиллированной воды (Bioneer, KR) и использовали в эксперименте для настоящего изобретения.
3-2. Обработка клеток наночастицами SAMiRNA
Для идентификации тех SAMiRNA, которые ингибируют экспрессию амфирегулина, использовали клетки линии A549 рака легких человека. Клетки линии A549 культивировали в среде Gibco™ Ham’s F-12K (Kaighn’s) (Thermo, США), содержащей 10% фетальной телячьей сыворотки (Hyclone, США) и 1% пенициллина-стрептомицина (Hyclone, США) при 37°C и 5% СО2. Используя ту же среду, что и выше, клетки линии A549 вносили в 96-луночный планшет (Costar, США) при плотности 2×104 клеток на лунку. На следующий день SAMiRNA, гомогенизированные в деионизированной дистиллированной воде в примере 3-1 выше, разбавляли 1×DPBS и обрабатывали клетки при разведении до концентрации SAMiRNA 500 или 1000 нМ. Обработку с помощью SAMiRNA проводили в целом 4 раза (каждые 12 часов) и культивировали клетки при 37°C и 5% CO2.
3-3. Скрининг SAMiRNA путем анализа ингибирования экспрессии мРНК амфирегулина человека
Экстрагировали тотальную РНК из клеток, обработанных SAMiRNA в примере 3-2, и синтезировали из неё кДНК, а затем определяли относительный уровень экспрессии мРНК гена амфирегулина методом ПЦР в реальном времени.
Для анализа уровня экспрессии мРНК гена амфирегулина в каждую лунку набора AccuPower® Dual-HotStart RT-qPCR (Bioneer, Корея) вносили 300 нМ прямого праймера для AREG, 300 нМ обратного праймера для AREG, 300 нМ зонда для AREG, 300 нМ прямого праймера для RPL13A, 300 нМ обратного праймера для RPL13A, 300 нМ зонда для RPL13A, 400 нМ прямого праймера для TBP, 400 нМ обратного праймера для TBP и 300 нМ зонда для TBP и высушивали (последовательности праймеров и гидролизуемых зондов, используемых в эксперименте по высокопроизводительному скринингу (HTS), приведены в таблице 2). Для оценки эффективности приготовленного набора строили калибровочную кривую, используя тотальную РНК из клеток A549, и определяли эффективность ПЦР-амплификации (таблица 3).
В 96-луночном планшете (Costar, США), обработанном SAMiRNA, проводили экстракцию тотальной РНК и одностадийную ОТ-кПЦР по автоматизированной программе на автоматизированной установке ExiStation HT™ Korea, используя приготовленный отдельно набор AccuPower® Dual-HotStart RT-qPCR (Bioneer, Корея), содержащий праймеры и зонды для анализа амфирегулина.
Исходя из значений Ct по двум генам, полученных после кПЦР в наборе, определяли относительный уровень экспрессии мРНК амфирегулина в опытной группе по сравнению с контрольной группой методом 2-Delta Delta C(T)) [Livak KJ, Schmittgen TD. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods Dec, 25(4):402-8].
Таблица 2. Последовательности праймеров и гидролизуемых зондов, используемых в эксперименте по высокопроизводительному скринингу (HTS)
Таблица 3. Эффективность амплификации при 3-плексной ОТ-кПЦР
При отборе высокоэффективных SAMiRNA были отобраны 14 SAMiRNA, которые имели последовательности по SEQ ID NO: 1-14 в качестве смысловой нити. При этом выбранные SAMiRNA проявляли наибольшую эффективность, причем уровень экспрессии мРНК амфирегулина снижался по сравнению с контролем при конечной концентрации 500 нМ или 1000 нМ.
Как видно из фиг. 1, из 1257 SAMiRNA, нацеленных на амфирегулин, были окончательно отобраны 14 SAMiRNA, которые наиболее эффективно ингибируют экспрессию гена амфирегулина. Информация о последовательностях выбранных SAMiRNA представлена в таблице 4 ниже.
Таблица 4. Последовательности амфирегулин-специфичных SAMiRNA, отобранных при скрининге кандидатов методом скользящего окна по 1 основанию и при высокопроизводительном скрининге (HTS)
Пример 4. Скрининг наночастиц SAMiRNA, нацеленных на амфирегулин человека и индуцирующих РНКи
Клетки линии A549 рака легких обрабатывали SAMiRNA (отобранными в примере 3) с последовательностями по SEQ ID NO: 1-14 в качестве смысловой нити и анализировали профиль экспрессии мРНК амфирегулина в клетках этой линии.
4-1. Обработка клеток наночастицами SAMiRNA
Для идентификации тех SAMiRNA, которые ингибируют экспрессию амфирегулина, использовали клетки линии A549 рака легких человека. Клетки линии A549 культивировали в среде Gibco™ Ham’s F-12K (Kaighn’s) (Thermo, США), содержащей 10% фетальной телячьей сыворотки (Hyclone, США) и 1% пенициллина-стрептомицина (Hyclone, США) при 37°C и 5% СО2. Используя ту же среду, что и выше, клетки линии A549 вносили в 12-луночный планшет (Costar, США) при плотности 8×104 клеток на лунку. На следующий день SAMiRNA, гомогенизированные в деионизированной дистиллированной воде в примере 3-1 выше, разбавляли 1×DPBS и обрабатывали клетки при разведении до концентрации SAMiRNA в 200 или 600 нМ. Обработку с помощью SAMiRNA проводили в целом 4 раза (каждые 12 часов) и культивировали клетки при 37°C и 5% CO2.
4-2. Скрининг SAMiRNA путем анализа ингибирования экспрессии мРНК амфирегулина человека
Экстрагировали тотальную РНК из клеток, обработанных SAMiRNA в примере 4-1, и синтезировали из неё кДНК, а затем определяли относительный уровень экспрессии мРНК гена амфирегулина методом ПЦР в реальном времени.
4-2-1. Выделение РНК из обработанных SAMiRNA клеток и синтез кДНК
С помощью набора для экстракции РНК (набор AccuPrep для экстракции тотальной РНК из клеток, Bioneer, Корея) экстрагировали тотальную РНК из клеток, обработанных SAMiRNA в примере 4-1 выше. Из экстрагированной РНК синтезировали кДНК с помощью обратной РНК-транскриптазы (AccuPower® RocketScript™ Cycle RT Premix с олиго(dT)20, Bioneer, Корея) следующим образом. А именно, в каждую пробирку Eppendorf на 0,25 мл с AccuPower® RocketScript™ Cycle RT Premix с олиго(dT)20, (Bioneer, Корея) вносили 1 мкг экстрагированной РНК и туда же добавляли обработанную DEPC (диэтилпирокарбонатом) дистиллированную воду до общего объема 20 мкл. На установке для амплификации генов (градиентный термоблок MyGenie™ 96, Bioneer, Корея) 12 раз повторяли процесс гибридизации РНК с праймерами по 30 сек при 37°C и процесс синтеза кДНК по 4 мин при 48°C.
4-2-2. Количественный анализ относительного уровня экспрессии мРНК амфирегулина человека
Используя в качестве матрицы кДНК, синтезированную в примере 4-2-1, проводили кПЦР SYBR Green в реальном времени и определяли относительный уровень экспрессии мРНК амфирегулина в сравнении с контрольным образцом SAMiRNA следующим образом. Синтезированную выше в примере 4-2-1 кДНК разводили в 5 раз дистиллированной водой, а для анализа уровня экспрессии мРНК амфирегулина в каждую лунку 96-луночного планшету добавляли 3 мкл разведенной кДНК, 25 мкл смеси AccuPower® 2X GreenStar™ qPCR MasterMix (Bioneer, Корея), 19 мкл дистиллированной воды и 3 мкл праймеров для кПЦР на амфирегулин (SEQ ID NO: 17 и 18 (таблица 5); по 10 пмоль/мкл для каждого праймера, Bioneer, Корея), получая смесь. При этом в качестве стандартного гена для нормализации уровня экспрессии мРНК амфирегулина использовали ген «домашнего хозяйства» (далее он именуется HK-геном) GAPDH (глицеральдегид-3-фосфатдегидрогеназы). 96-луночный планшет, содержащий смесь, подвергали следующей реакции на термоблоке Exicycler™ Real-Time Quantitative Thermal Block (Bioneer, Корея). А именно, смесь оставляли реагировать при 95°C в течение 15 мин для активации фермента и устранения вторичной структуры кДНК, а затем проводили 42 цикла, каждый из которых состоял из денатурации по 30 сек при 94°C, отжига по 30 сек при 58°C, наращивания по 30 сек при 72°C и сканирования SYBR Green и окончательного наращивания по 3 мин при 72°C. Затем выдерживали смесь 1 мин при температуре 55°C и анализировали кривую плавления от 55°C до 95°C.
По завершении ПЦР проводили коррекцию значений Ct (порогового цикла) целевого гена по гену GAPDH, а затем рассчитывали значения ΔCt, используя контроли, обработанные контрольной последовательностью SAMiRNA (SAMiCONT), не вызывающей ингибирования экспрессии генов. Относительный уровень экспрессии целевого гена в клетках, обработанных амфирегулин-специфичной SAMiRNA, определяли по значениям ΔCt и уравнению 2(-ΔCt)×100.
При отборе высокоэффективных SAMiRNA были отобраны 14 SAMiRNA, которые имели последовательности по SEQ ID NO: 10, 11 и 12 в качестве смысловой нити. При этом выбранные SAMiRNA проявляли наибольшую эффективность, причем уровень экспрессии мРНК амфирегулина снижался по сравнению с контролем при конечной концентрации 200 нМ или 600 нМ.
Как видно из фиг. 3, из 14 SAMiRNA, нацеленных на амфирегулин, были окончательно отобраны 3 SAMiRNA, которые наиболее эффективно ингибируют экспрессию гена амфирегулина. Информация о последовательностях выбранных SAMiRNA представлена в таблице 6 ниже.
Таблица 5. Информация о последовательностях праймеров для кПЦР
(F означает прямой праймер, а R означает обратный праймер)
Таблица 6. Последовательности тех SAMiRNA, которые эффективно ингибируют экспрессию амфирегулина
Пример 5. Ингибирование экспрессии амфирегулина человека в клетках линии рака легких (A549) выбранными SAMiRNA
Клетки линии A549 рака легких обрабатывали SAMiRNA (отобранными в примере 4) с последовательностями по SEQ ID NO: 10, 11 и 12 в качестве смысловой нити и анализировали профиль экспрессии мРНК амфирегулина в данных клетках для определения значений IC50 этих SAMiRNA.
5-1. Получение и анализ размеров наночастиц SAMiRNA
Каждую из трех SAMiRNA, нацеленных на последовательность амфирегулина, синтезированных в примере 2, растворяли в 1×фосфатно-солевом буфере Дюльбекко (DPBS) (Welgene, KR) и лиофилизировали в сублимационной сушке (LGJ-100F, CN) в течение 5 дней. Лиофилизованные порошки наночастиц растворяли и гомогенизировали в 2 мл деионизованной дистиллированной воды (Bioneer, KR) и использовали в эксперименте для настоящего изобретения. Для анализа размеров полученных наночастиц SAMiRNA измеряли размеры и индекс полидисперсности SAMiRNA на Zetasizer Nano ZS (Malvern, UK). Результаты измерения размеров и индекса полидисперсности наночастиц SAMiRNA представлены ниже в таблице 7 и графически на фиг. 2.
Таблица 7. Размеры и индекс полидисперсности амфирегулин-специфичных наночастиц SAMiRNA
5-2. Обработка клеток наночастицами SAMiRNA
Для оценки эффекта выбранных SAMiRNA, ингибирующих экспрессию амфирегулина, использовали клетки линии A549 рака легких человека. Клетки линии A549 культивировали в среде Gibco™ Ham’s F-12K (Kaighn’s) (Thermo, США), содержащей 10% фетальной телячьей сыворотки (Hyclone, США) и 1% пенициллина-стрептомицина (Hyclone, США) при 37°C и 5% СО2. Используя ту же среду, что и выше, клетки линии A549 вносили в 12-луночный планшет (Costar, США) при плотности 8×104 клеток на лунку. На следующий день SAMiRNA, гомогенизированные в деионизированной дистиллированной воде в примере 5-1 выше, разбавляли 1×DPBS и обрабатывали клетки при разведении до концентрации SAMiRNA в 12,5 нМ, 25 нМ, 50 нМ, 100 нМ, 200 нМ, 600 нМ или 1200 нМ. Обработку клеток SAMiRNA проводили в целом 4 раза (каждые 12 часов) и культивировали клетки при 37°C и 5% CO2.
5-3. Определение IC50 SAMiRNA путем анализа ингибирования экспрессии мРНК амфирегулина человека
Экстрагировали тотальную РНК из клеток, обработанных SAMiRNA в примере 5-2, и синтезировали из неё кДНК, а затем определяли относительный уровень экспрессии мРНК гена амфирегулина методом ПЦР в реальном времени.
5-3-1. Выделение РНК из обработанных SAMiRNA клеток и синтез кДНК
С помощью набора для экстракции РНК (набор для экстракции тотальной РНК из клеток AccuPrep, Bioneer, Корея) экстрагировали тотальную РНК из клеток, обработанных SAMiRNA в примере 5-2 выше. Из экстрагированной РНК синтезировали кДНК с помощью обратной РНК-транскриптазы (AccuPower® RocketScript™ Cycle RT Premix с олиго(dT)20, Bioneer, Корея) следующим образом. А именно, в каждую пробирку Eppendorf на 0,25 мл с AccuPower® RocketScript™ Cycle RT Premix с олиго(dT)20 (Bioneer, Корея) вносили 1 мкг экстрагированной РНК и туда же добавляли обработанную DEPC (диэтилпирокарбонатом) дистиллированную воду до общего объема 20 мкл. На установке для амплификации генов (градиентный термоблок MyGenie™ 96, Bioneer, Корея) 12 раз повторяли процесс гибридизации РНК с праймерами по 30 сек при 37°C и процесс синтеза кДНК по 4 мин при 48°C. Затем реакцию амплификации останавливали путем дезактивации фермента при 95°C в течение 5 мин.
5-3-2. Количественный анализ относительного уровня экспрессии мРНК амфирегулина человека
Используя в качестве матрицы кДНК, синтезированную в примере 5-3-1, проводили кПЦР SYBR Green в реальном времени и определяли относительный уровень экспрессии мРНК амфирегулина в сравнении с контрольным образцом SAMiRNA следующим образом. Синтезированную выше в примере 5-3-1 кДНК разводили в 5 раз дистиллированной водой, а для анализа уровня экспрессии мРНК амфирегулина в каждую лунку 96-луночного планшету добавляли 3 мкл разведенной кДНК, 25 мкл смеси AccuPower® 2X GreenStar™ qPCR MasterMix (Bioneer, Корея), 19 мкл дистиллированной воды и 3 мкл праймеров для кПЦР на амфирегулин (SEQ ID NO: 17 и 18 (таблица 5); по 10 пмоль/мкл для каждого праймера, Bioneer, Корея), получая смесь. При этом в качестве стандартного гена для нормализации уровня экспрессии мРНК амфирегулина использовали ген «домашнего хозяйства» (далее он именуется HK-геном) GAPDH (глицеральдегид-3-фосфатдегидрогеназы). 96-луночный планшет, содержащий смесь, подвергали следующей реакции на термоблоке Exicycler™ Real-Time Quantitative Thermal Block (Bioneer, Корея). А именно, смесь оставляли реагировать при 95°C в течение 15 мин для активации фермента и устранения вторичной структуры кДНК, а затем проводили 42 цикла, каждый из которых состоял из денатурации по 30 сек при 94°C, отжига по 30 сек при 58°C, наращивания по 30 сек при 72°C и сканирования SYBR Green и окончательного наращивания по 3 мин при 72°C. Затем выдерживали смесь 1 мин при температуре 55°C и анализировали кривую плавления от 55°C до 95°C.
По завершении ПЦР проводили коррекцию значений Ct (порогового цикла) целевого гена по гену GAPDH, а затем рассчитывали значения ΔCt, используя контроли, обработанные контрольной последовательностью SAMiRNA (SAMiCONT), не вызывающей ингибирования экспрессии генов. Относительный уровень экспрессии целевого гена в клетках, обработанных амфирегулин-специфичной SAMiRNA, определяли по значениям ΔCt и уравнению 2(-ΔCt)×100.
В результате было установлено, что все специфичные для амфирегулина SAMiRNA с последовательностями по SEQ ID NO: 10, 11 и 12 в качестве смысловой нити проявляют снижение уровня экспрессии мРНК амфирегулина на 50% и более даже при низкой концентрации 100 нМ, свидетельствуя о том, что специфичные для амфирегулина SAMiRNA проявляют эффект ингибирования экспрессии амфирегулина с высокой эффективностью. Было установлено, что значения IC50 составляют 28,75 нМ, как видно из фиг. 4 для амфирегулин-специфичной SAMiRNA с последовательностью по SEQ ID NO: 10 в качестве смысловой нити, 26,04 нМ, как видно из фиг. 5 для амфирегулин-специфичной SAMiRNA с последовательностью по SEQ ID NO: 11 в качестве смысловой нити, и 12,07 нМ, как видно из фиг. 6 для амфирегулин-специфичной SAMiRNA с последовательностью по SEQ ID NO: 12 в качестве смысловой нити. В частности, было установлено, что амфирегулин-специфичная SAMiRNA с последовательностью по SEQ ID NO: 12 в качестве смысловой нити проявляет снижение уровня экспрессии мРНК амфирегулина на 50% и более даже при низкой концентрации в 25 нМ, как видно из фиг. 6, свидетельствуя о том, что она проявляет эффект наиболее эффективного ингибирования экспрессии гена амфирегулина среди трех выбранных последовательностей.
Пример 6. Оценка цитотоксичности in vitro на мононуклеарных клетках периферической крови человека (PBMC)
Для того, чтобы проверить, повышают ли SAMi-hAREG уровни экспрессии мРНК связанных с врожденным иммунитетом цитокинов, криоконсервированные PBMC человека (мононуклеарные клетки периферической крови человека) ePBMC® (Cellular Technology Limited, США) вносили при плотности 5×105 клеток на лунку в 12-луночный планшет (Costar®, США) со средой RPMI 1640 (Hyclone™), содержащей 10% FBS (фетальной телячьей сыворотки; Hyclone™). Клетки культивировали в инкубаторе с 5% CO2 при 37°C в течение 1 часа для стабилизации, а затем внесенные PBMC обрабатывали 2,5 мкМ одного из SAMi-CON (ДНК/РНК), SAMi-hAREG#10 (ДНК/РНК), SAMi-hAREG#11 (ДНК/РНК), SAMi-hAREG#12 (РНК/РНК), SAMi-CON (РНК/РНК), SAMi-hAREG#10 (РНК/РНК), SAMi-hAREG#11 (РНК/РНК) или SAMi-hAREG#12 (РНК/РНК) и культивировали в инкубаторе с 5% CO2 при 37°C в течение 6 часов. В качестве положительного контроля использовали 20 мкг/мл конканавалина А (Sigma Aldrich, США).
После этого все клетки собирали и выделяли из них тотальную РНК с помощью наборов RNeasy Mini Kit (Qiagen, Германия) и RNase-Free DNase Set (Qiagen, Германия) в соответствии с протоколами производителя.
Смешивали 200 нг экстрагированной РНК с деионизированной стерильной дистиллированной водой (Bioneer, Korea) и обратной РНК-транскриптазой (AccuPower® RocketScript™ Cycle RT Premix с олиго(dT)20, Bioneer, Корея) и эту смесь подвергали реакции на установке для амплификации генов (градиентный термоблок MyGenie™ 96, Bioneer, Корея) в условиях 12 циклов, состоящих по 30 сек при 37°C, по 4 мин при 48°C и по 30 сек при 55°C, а затем 5 мин при 95°C, синтезируя при этом всего 20 мкл кДНК.
Синтезированную кДНК смешивали с праймерами кПЦР для каждого из генов RPL13A, IL1B, IL6, IFNG, TNF и IL12B, а затем проводили амплификацию в термоблоке Exicycler™ 96 в реальном времени (Bioneer, Корея) в следующих условиях: 5 мин при 95°C, а затем 45 циклов, состоящих по 5 сек при 95°C и по 15 сек при 58°C.
Исходя из значений Ct по двум генам, полученных после кПЦР в наборе, определяли относительный уровень экспрессии мРНК амфирегулина в опытной группе по сравнению с контрольной группой методом 2(-Delta Rocket Script C(T)) [Livak KJ, Schmittgen TD. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods Dec, 25(4):402-8].
В результате, как видно из фиг. 7, было установлено, что экспрессия связанных с врожденным иммунитетом цитокинов в мононуклеарных клетках периферической крови человека (PBMC человека) под действием амфирегулин-специфичных SAMiRNA #10, SAMiRNA #11 и SAMiRNA #12 не наблюдается.
Пример 7. Сравнительный анализ ингибирования экспрессии амфирегулина человека гибридными SAMiRNA типа ДНК/РНК и РНК/РНК, содержащими выбранные последовательности SEQ ID NO: 10, 11 или 12 в качестве смысловой нити
Клетки линии A549 рака легких обрабатывали каждым из двухцепочечных гибридов ДНК/РНК и гибридов РНК/РНК, содержащих специфичные для амфирегулина SAMiRNA (отобранные в примере 4) с последовательностями по SEQ ID NO: 10, 11 и 12 в качестве смысловой нити, и проводили сравнительный анализ относительных уровней экспрессии мРНК (%) амфирегулина в клетках этой линии.
7-1. Обработка клеток наночастицами SAMiRNA
Для идентификации тех SAMiRNA, которые ингибируют экспрессию амфирегулина, использовали клетки линии A549 рака легких человека. Клетки линии A549 культивировали в среде Gibco™ Ham’s F-12K (Kaighn’s) (Thermo, США), содержащей 10% фетальной телячьей сыворотки (Hyclone, США) и 1% пенициллина-стрептомицина (Hyclone, США) при 37°C и 5% СО2. Используя ту же среду, что и выше, клетки линии A549 вносили в 12-луночный планшет (Costar, США) при плотности 8×104 клеток на лунку. На следующий день SAMiRNA, гомогенизированные в деионизированной дистиллированной воде в примере 3-1 выше, разбавляли 1×DPBS и обрабатывали клетки при разведении до концентрации SAMiRNA в 200 нМ, 600 нМ или 1200 нМ. Обработку клеток SAMiRNA проводили в целом 4 раза (каждые 12 часов) и культивировали клетки при 37°C и 5% CO2.
7-2. Скрининг SAMiRNA путем анализа ингибирования экспрессии мРНК амфирегулина человека
Экстрагировали тотальную РНК из клеток, обработанных SAMiRNA в примере 7-1, и синтезировали из неё кДНК, а затем определяли относительный уровень экспрессии мРНК гена амфирегулина методом ПЦР в реальном времени.
7-2-1. Выделение РНК из обработанных SAMiRNA клеток и синтез кДНК
С помощью набора для экстракции РНК (набор AccuPrep для экстракции тотальной РНК из клеток, Bioneer, Корея) экстрагировали тотальную РНК из клеток, обработанных SAMiRNA в примере 7-1 выше. Из экстрагированной РНК синтезировали кДНК с помощью обратной РНК-транскриптазы (AccuPower® RocketScript™ Cycle RT Premix с олиго(dT)20, Bioneer, Корея) следующим образом. А именно, в каждую пробирку Eppendorf на 0,25 мл с AccuPower® RocketScript™ Cycle RT Premix с олиго(dT)20, (Bioneer, Корея) вносили 1 мкг экстрагированной РНК и туда же добавляли обработанную DEPC (диэтилпирокарбонатом) дистиллированную воду до общего объема 20 мкл. На установке для амплификации генов (градиентный термоблок MyGenie™ 96, Bioneer, Корея) 12 раз повторяли процесс гибридизации РНК с праймерами по 30 сек при 37°C и процесс синтеза кДНК по 4 мин при 48°C. Затем реакцию амплификации останавливали путем дезактивации фермента при 95°C в течение 5 мин.
7-2-2. Количественный анализ относительного уровня экспрессии мРНК амфирегулина человека
Используя в качестве матрицы кДНК, синтезированную в примере 7-2-1, проводили кПЦР SYBR Green в реальном времени и определяли относительный уровень экспрессии мРНК амфирегулина в сравнении с контрольным образцом SAMiRNA следующим образом. Синтезированную выше в примере 7-2-1 кДНК разводили в 5 раз дистиллированной водой, а для анализа уровня экспрессии мРНК амфирегулина в каждую лунку 96-луночного планшету добавляли 3 мкл разведенной кДНК, 25 мкл смеси AccuPower® 2X GreenStar™ qPCR MasterMix (Bioneer, Корея), 19 мкл дистиллированной воды и 3 мкл праймеров для кПЦР на амфирегулин (SEQ ID NO: 17 и 18 (таблица 5); по 10 пмоль/мкл для каждого праймера, Bioneer, Корея), получая смесь. При этом в качестве стандартного гена для нормализации уровня экспрессии мРНК амфирегулина использовали ген «домашнего хозяйства» (далее он именуется HK-геном) GAPDH (глицеральдегид-3-фосфатдегидрогеназы). 96-луночный планшет, содержащий смесь, подвергали следующей реакции на термоблоке Exicycler™ Real-Time Quantitative Thermal Block (Bioneer, Корея). А именно, смесь оставляли реагировать при 95°C в течение 15 мин для активации фермента и устранения вторичной структуры кДНК, а затем проводили 42 цикла, каждый из которых состоял из денатурации по 30 сек при 94°C, отжига по 30 сек при 58°C, наращивания по 30 сек при 72°C и сканирования SYBR Green и окончательного наращивания по 3 мин при 72°C. Затем выдерживали смесь 1 мин при температуре 55°C и анализировали кривую плавления от 55°C до 95°C.
По завершении ПЦР проводили коррекцию значений Ct (порогового цикла) целевого гена по гену GAPDH, а затем рассчитывали значения ΔCt, используя контроли, обработанные контрольной последовательностью SAMiRNA (SAMiCONT), не вызывающей ингибирования экспрессии генов. Относительный уровень экспрессии целевого гена определяли по значениям ΔCt и уравнению 2(-ΔCt)×100.
При отборе высокоэффективной SAMiRNA из двухцепочечных гибридов типа ДНК/РНК и РНК/РНК была окончательно выбрана SAMiRNA типа гибрида ДНК/РНК с последовательностью по SEQ ID NO: 12 в качестве смысловой нити. При этом выбранная последовательность SAMiRNA типа гибрида ДНК/РНК проявляла наибольшую эффективность (ингибирование экспрессии гена на 90% и более), причем уровень экспрессии мРНК амфирегулина снижался по сравнению с контролем при конечной концентрации 200 нМ, 600 нМ или 1200 нМ.
Как видно из фиг. 8, из гибридов типа ДНК/РНК и РНК/РНК, содержащих три выбранных амфирегулин-специфичных SAMiRNA, соответственно, была окончательно выбрана SAMiRNA-12 типа гибрида ДНК/РНК, которая наиболее эффективно ингибирует экспрессию гена амфирегулина.
Пример 8. Высокопроизводительный скрининг (HTS) наночастиц SAMiRNA, нацеленных на амфирегулин мыши и индуцирующих РНКи
В случае терапевтических средств типа миРНК трудно определить оптимальную последовательность, применимую к различным штаммам. В этом случае применяются руководящие принципы FDA США, в соответствии с которыми разрабатывается последовательность ДНК (суррогатная последовательность; специфичная для гена мыши миРНК), специфичная для животной модели для анализа терапевтических эффектов (теста на эффективность in vivo), с тем, чтобы проверить фармакологическую активность, возникающую при ингибировании экспрессии представляющего интерес гена, и токсичность при ингибировании экспрессии данного гена (презентация Robert T. Dorsam, Ph.D., Pharmacology/Toxicology Reviewer, FDA/CDER).
Описанный ранее скрининг модифицировали по программе миРНК на основе существующего алгоритма (Turbo-si-Designer, принадлежащий компании заявителя) и проводили высокопроизводительный скрининг последовательностей миРНК на основе SAMiRNA. Проводили сканирование со скользящим окном по 1 основанию (тем же методом, что и описанный выше скрининг амфирегулина человека в качестве мишени) 19-мерных миРНК по всему целевому гену и получили в общей сложности 1190 последовательностей-кандидатов миРНК против вероятной полной последовательности транскрипта гена амфирегулина мыши (NM_009704.4). Для удаления ненужных последовательностей-кандидатов, влияющих на экспрессию других генов, проводили бласт-фильтрование по гомологии последовательностей и синтезировали 237 окончательно выбранных SAMiRNA. Клетки линии NIH3T3 мыши обрабатывали каждой выбранной SAMiRNA в концентрации 1 мкМ в среде для культивирования клеток, содержащей 10% FBS, и сначала проверяли ингибирующие экспрессию эффекты SAMiRNA in vitro, используя праймеры, приведенные в таблице 8 (информация о последовательностях праймеров для кПЦР) (фиг.9).
После этого клетки линии MLg фибробластов легких мыши обрабатывали каждой из двух последовательностей (SEQ ID NO: 19 и 20), отобранных на клетках линии NIH3T3, и SAMiRNA против амфирегулина мыши по SEQ ID NO: 21, открытой на предыдущих стадиях исследований, при концентрациях 200 и 500 нМ в среде для культивирования клеток, содержащей 10% FBS, и проводили дополнительный скрининг. В результате было установлено, что SEQ ID NO: 20 проявляет наилучший эффект ингибирования экспрессии (фиг. 10A).
Кроме того, эпителиальные клетки линии LA-4 легких мыши обрабатывали каждой из двух выбранных последовательностей (SEQ ID NO: 19 и 20) и SAMiRNA против амфирегулина мыши по SEQ ID NO: 21, открытой на предыдущих стадиях исследований, при концентрациях 200, 500 и 1000 нМ в среде для культивирования клеток, содержащей 10% FBS, и проводили дополнительную оценку эффектов ингибирования экспрессии. В результате было опять установлено, что SEQ ID NO: 20 проявляет наилучший эффект ингибирования экспрессии (фиг. 10B).
Как видно из фиг. 10, из 237 SAMiRNA, нацеленных на амфирегулин мыши, были окончательно отобраны две SAMiRNA, которые наиболее эффективно ингибируют экспрессию гена амфирегулина, а информация о последовательностях данных SAMiRNA представлена в таблице 9 ниже.
Таблица 8. Информация о последовательностях праймеров для кПЦР
(F означает прямой праймер, а R означает обратный праймер)
Таблица 9. Последовательности тех SAMiRNA, которые эффективно ингибируют экспрессию амфирегулина мыши
Пример 9. Исследование эффективности SAMiRNA-mAREG при внутривенном введении на модели фиброза легких, индуцированного диоксидом кремния
Для анализа эффективности SAMi-mAREG на животной модели фиброза легких, индуцированного двуокисью кремния (диоксид кремния, Sigma, Корея), проводили эксперимент. Для эксперимента приобретали 7-недельных мышей и давали им акклиматизироваться в течение 1 недели. Для запуска модели растворяли диоксид кремния (3 мг) и вводили мышам интратрахеально. Через 3 дня после запуска отбирали мышей без аномальных симптомов и подразделяли на нормальную группу, опытную группу, которой вводили физиологический буферный раствор (PBS), опытную группу, которой вводили контрольную SAMiRNA, и опытные группы (SAMi-mAREG#20), которым вводили 1 мг/кг и 5 мг/кг SAMi-mAREG#20, соответственно, три раза с интервалом в 2 дня. Кроме того, через 14 дней после запуска модели мышей забивали.
9-1. Анализ экспрессии генов в отношении SAMiRNA на животной модели фиброза легких, индуцированного диоксидом кремния
Извлекали ткани легких у забитых мышей и измельчали их с помощью гомогенизатора. С помощью набора для экстракции РНК (набор AccuPrep для экстракции тотальной РНК из клеток, Bioneer, Корея) экстрагировали тотальную РНК из клеток, обработанных SAMiRNA в примере 7-1 выше. Из экстрагированной РНК синтезировали кДНК следующим образом, с помощью обратной РНК-транскриптазы (AccuPower® RocketScript ™ Cycle RT Premix с олиго(dT)20, Bioneer, Корея). Используя синтезированную кДНК в качестве матрицы, проводили кПЦР SYBR Green в реальном времени и определяли относительные уровни экспрессии из тотальной РНК в группах следующим образом. Синтезированную кДНК разводили в 5 раз дистиллированной водой, а для анализа уровня экспрессии мРНК амфирегулина в каждую лунку 96-луночного планшету добавляли 3 мкл разведенной кДНК, 25 мкл смеси AccuPower® 2X GreenStar™ qPCR MasterMix (Bioneer, Корея), 19 мкл дистиллированной воды и 3 мкл праймеров для кПЦР на амфирегулин (SEQ ID NO: 24 и 25 (таблица 8); по 10 пмоль/мкл для каждого праймера, Bioneer, Корея), получая смесь. При этом в качестве стандартного гена для нормализации уровней экспрессии мРНК амфирегулина, фибронектина и 3α1-коллагена использовали ген «домашнего хозяйства» (далее он именуется HK-геном) RPL13A.
По завершении ПЦР проводили коррекцию значений Ct (порогового цикла) каждого целевого гена по гену RPL13A, а затем рассчитывали значения ΔCt между группами. Относительные уровни экспрессии генов амфирегулина, фибронектина и 3α1-коллагена определяли по значениям ΔCt и уравнению 2(-ΔCt)×100.
В результате было установлено, что наблюдалось снижение экспрессии амфирегулина в группах, получавших 1 мг/кг SAMiRNA-AREG и 5 мг/кг SAMiRNA-AREG, соответственно, по сравнению с группой модели индуцированного диоксидом кремния фиброза легких, получавшей физиологический буферный раствор, и группой модели индуцированного диоксидом кремния фиброза легких, получавшей контрольную SAMiRNA. Кроме того, было установлено, что фибронектин и 3α1-коллаген снижались зависимым от концентрации образом в группах, получавших 1 мг/кг SAMiRNA-AREG и 5 мг/кг SAMiRNA-AREG, соответственно, по сравнению с группой модели индуцированного диоксидом кремния фиброза легких, получавшей физиологический буферный раствор, и группой модели индуцированного диоксидом кремния фиброза легких, получавшей контрольную SAMiRNA.
9-2. Гистопатологический анализ в отношении SAMiRNA на животной модели фиброза легких, индуцированного диоксидом кремния
Для того, чтобы проверить, влияет ли SAMiRNA-AREG против модели фиброза легких, индуцированного диоксидом кремния, на экспрессию компонентов внеклеточного матрикса, проводили иммуногистохимическое окрашивание. Животных из каждой группы забивали и готовили парафиновые срезы посредством фиксации, промывки, обезвоживания, очистки, пропитки, заливки и нарезания тканей. Делали тонкие парафиновые срезы с помощью микротома и монтировали их на предметные стекла. Для выявления патологии легочной ткани проводили окрашивание гематоксилином и эозином (H&E), а для проверки уровня экспрессии 3α1-коллагена проводили трихромное окрашивание по Массону. Кроме того, для анализа уровня экспрессии амфирегулина проводили иммуногистохимическое окрашивание.
По окрашиванию гематоксилином и эозином видно, что легочная ткань при индуцированном диоксидом кремния фиброзе повреждена сильнее, чем легочная ткань в нормальной группе. Однако легочная ткань у мышей, которым вводили SAMiRNA-AREG, имела слабые повреждения, как и легочная ткань в нормальной группе. Кроме того, для оценки степени фиброза проводили трихромное окрашивание по Массону. Было установлено, что степень фиброза в интерстиции легочной ткани в группе, которой вводили SAMiRNA-AREG, снижалась по сравнению с таковой в группе модели индуцированного диоксидом кремния фиброза легких, которой вводили физиологический буферный раствор (PBS), и в группе, которой вводили контрольную SAMiRNA. Кроме того, по иммуногистохимическому окрашиванию на амфирегулин видно, что амфирегулин в значительной степени экспрессируется в интерстиции между клетками в группе животных с индуцированным диоксидом кремния фиброзом легких. Однако оказалось, что в группе, которой вводили SAMiRNA-AREG, экспрессия AREG в интерстиции легочной ткани снижалась.
Итак, мышам на модели индуцированного диоксидом кремния фиброза легких внутривенно вводили 1 мг/кг и 5 мг/кг SAMiRNA-AREG по три раза (дни 10, 12 и 14) и проводили оценку ингибирующего действия SAMiRNA-AREG на экспрессию целевого гена амфирегулина и маркерных генов фиброза в легочной ткани, а также окрашивание легочной ткани H&E и трихромное окрашивание по Массону. В результате анализа экспрессии целевого гена амфирегулина и маркерных генов фиброза - 3α1-коллагена и фибронектина было установлено, что экспрессия повышается при индуцированном диоксидом кремния фиброзе легких, и был установлен эффект подавления экспрессии зависимым от концентрации образом при обработке SAMiRNA-AREG. Кроме того, по данным окрашивания тканей было установлено, что у мышей с индуцированным диоксидом кремния фиброзом легких, получавших PBS или контрольную SAMiRNA, повышалась инфильтрация клеток в ткань легких и экспрессия коллагена, но в опытной группе, получавшей SAMiRNA-AREG, инфильтрация клеток и коллаген значительно снижались до уровней, сравнимых с уровнем в контрольной группе, получавшей PBS (фиг. 11).
Кроме того, на модели индуцированного диоксидом кремния фиброза легких проводили иммуногистохимическое окрашивание на AREG. Как видно из фиг. 11, уровни экспрессии AREG в тканях мышей на модели индуцированного диоксидом кремния фиброза легких, которым вводили 1 мг/кг и 5 мг/кг SAMiRNA-AREG, анализировали по IHC-окрашиванию. Было установлено, что в легочной ткани модельных мышей, которым вводили диоксид кремния + PBS или диоксид кремния + контр. SAMi, экспрессия AREG в интерстициальном участке значительно повышалась по сравнению с таковой в нормальной ткани легких. Однако при анализе экспрессии AREG в тканях мышей, которым вводили 1 мг/кг и 5 мг/кг SAMiRNA-AREG, оказалось, что экспрессия AREG в тканях значительно снижалась по сравнению с таковой в легочной ткани при фиброзе, индуцированном диоксидом кремния (фиг. 11).
Пример 10. Исследование эффективности SAMiRNA-mAREG при внутривенном введении на модели фиброза легких, индуцированного блеомицином
Мышам на модели индуцированного блеомицином фиброза легких внутривенно вводили 5 мг/кг SAMiRNA-AREG (SAMi-mAREG#20) по три раза (дни 8, 10 и 12) и проводили анализ Sircol. В результате было установлено, что содержание белка коллагена в опытной группе, которой вводили SAMiRNA-AREG, снижалось на >40% по сравнению с таковым в контрольной группе SAMiRNA-Cont. Кроме того, экстрагировали РНК из легочной ткани той же опытной группы и анализировали эффект ингибирования экспрессии целевого гена амфирегулина и маркерного гена фиброза - 3α1-коллагена. При этом был обнаружен эффект ингибирования экспрессии по сравнению с контролем. Как оказалось, эффект вновь идентифицированного исследуемого вещества по SEQ ID NO: 20 был равен или выше, чем эффект существующей последовательности. Проводили окрашивание легочной ткани H&E и трихромное окрашивание легочной ткани по Массону, специфичное для 3α1-коллагена. По окрашиванию легочной ткани было установлено, что в группе мышей с индуцированным блеомицином фиброзом легких, получавших PBS или контрольную SAMiRNA, усиливалась инфильтрация клеток в ткани легких и усиливалось окрашивание вследствие накопления коллагена. Было установлено, что в опытной группе, получавшей SAMiRNA-AREG, значительно снижалась инфильтрация клеток и накопление коллагена (фиг. 12). Окрашивание тканей и анализ экспрессии целевого гена проводили так же, как в Примере 8.
Пример 11. Оценка действия SAMiRNA-AREG против почечного фиброза, вызванного UUO (односторонняя обструкция мочеточника) у мышей
Проводили анализ действия SAMiRNA-AREG (SAMi-mAREG#20) на животной модели почечного фиброза, вызванного операцией UUO. Для получения животной модели фиброза почек сначала проводили ингаляционную анестезию мышей раствором iFran (Hana Pharmaceutical, Корея). Рассекали кожу и брюшину и перевязывали мочеточник левой почки шелковой нитью 4-0 в двух положениях. Посередине между двумя положениями его разрезали, чтобы предотвратить инфекции мочевыводящих путей. Кроме того, проводили такую же операцию на правой почке, но без перевязки мочеточника. Точно так же вскрывали брюшную полость в нормальной группе и проверяли мочеточник левой почки, но не перевязывали. Кроме того, брюшину и кожу зашивали для предотвращения инфекций. Через 6 часов после запуска модели проводили первое введение 1 мг/кг или 5 мг/кг SAMiRNA-AREG. Через 24 часа проводили второе введение. После двух введений животных забивали через 24 часа после последнего введения. На животной модели было всего 4 группы: нормальная группа, группа модели UUO, которой вводили физиологический буферный раствор, и группы UUO, которым вводили 1 мг/кг и 5 мг/кг SAMiRNA-AREG, соответственно.
11-1. Анализ экспрессии генов в отношении SAMiRNA при почечном фиброзе, вызванном UUO (односторонняя обструкция мочеточника)
Извлекали ткани легких у забитых мышей и измельчали их с помощью гомогенизатора. С помощью набора для экстракции РНК (набор AccuPrep для экстракции тотальной РНК из клеток, Bioneer, Корея) экстрагировали тотальную РНК из клеток, обработанных SAMiRNA в примере 7-1 выше. Из экстрагированной РНК синтезировали кДНК следующим образом, с помощью обратной РНК-транскриптазы (AccuPower® RocketScript ™ Cycle RT Premix с олиго(dT)20, Bioneer, Корея). Используя синтезированную кДНК в качестве матрицы, проводили кПЦР SYBR Green в реальном времени и определяли относительные уровни экспрессии из тотальной РНК в группах следующим образом. Синтезированную кДНК разводили в 5 раз дистиллированной водой, а для анализа уровня экспрессии мРНК амфирегулина в каждую лунку 96-луночного планшету добавляли 3 мкл разведенной кДНК, 25 мкл смеси AccuPower® 2X GreenStar™ qPCR MasterMix (Bioneer, Корея), 19 мкл дистиллированной воды и 3 мкл праймеров для кПЦР (SEQ ID NO: 24 и 25 (таблица 8); по 10 пмоль/мкл для каждого праймера, Bioneer, Корея) на амфирегулин и маркеры фиброза, получая смесь. При этом в качестве стандартного гена для нормализации уровней экспрессии мРНК трансформирующего фактора роста-1, амфирегулина, фибронектина, коллагена-1, гладкомышечного актина и 3α1-коллагена использовали ген «домашнего хозяйства» (далее он именуется HK-геном) RPL13A. Кроме того, также проводили анализ гена CCR2 для проверки действия против воспалительных факторов.
По завершении ПЦР проводили коррекцию значений Ct (порогового цикла) целевых генов по гену RPL13A, а затем рассчитывали значения ΔCt между группами. Относительные уровни экспрессии генов трансформирующего фактора роста-1, амфирегулина, фибронектина, коллагена-1, гладкомышечного актина, 3α1-коллагена и CCR2 определяли по значениям ΔCt и уравнению 2(-ΔCt)×100.
В результате уровень экспрессии амфирегулина оказался в 60 раз выше в группе модели UUO, которой вводили физиологический буферный раствор, чем в нормальной группе. Было установлено, что экспрессия гена амфирегулина снижается в группах, которым вводили 1 мг/кг SAMiRNA-AREG и 5 мг/кг SAMiRNA-AREG, соответственно. Кроме того, оказалось, что фибронектин и трансформирующий фактор роста-1 снижались зависимым от концентрации образом в группах, которым вводили 1 мг/кг SAMiRNA-AREG и 5 мг/кг SAMiRNA-AREG, соответственно, по сравнению с группой модели UUO. Кроме того, 3α1-коллаген, коллаген-1 и гладкомышечный актин проявляли тенденцию к снижению в группе, которой вводили 1 мг/кг SAMiRNA-AREG, по сравнению с группой модели UUO. Однако оказалось, что эффект снижения экспрессии генов был сильнее в группе, которой вводили 5 мг/кг SAMiRNA-AREG, чем в группе, которой вводили 1 мг/кг SAMiRNA-AREG. Кроме того, оказалось, что CCR2 повышается примерно в 6 раз в группе модели UUO, но снижается в группах, которым вводили SAMiRNA-AREG.
Хотя настоящее изобретение было описано подробно в отношении конкретных особенностей, однако специалистам в данной области должно быть ясно, что это описание представляет собой только его предпочтительное воплощение и не ограничивает объем настоящего изобретения. Таким образом, объем настоящего изобретения должен определяться прилагаемой формулой изобретения и её эквивалентами.
Промышленная применимость
Двухцепочечные олигонуклеотидные структуры, содержащие амфирегулин-специфичные двухцепочечные олигонуклеотиды по настоящему изобретению, и фармацевтические композиции, содержащие их в качестве активного ингредиента, могут ингибировать амфирегулин с высокой эффективностью без побочных эффектов, поэтому они могут проявлять отличное действие на профилактику и лечение заболеваний, вызванных чрезмерным фиброзом, и респираторных заболеваний.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> BIONEER CORPORATION
<120> СПЕЦИФИЧНЫЕ ДЛЯ ГЕНА АМФИРЕГУЛИНА ДВУХЦЕПОЧЕЧНЫЕ ОЛИГОНУКЛЕОТИДЫ
И
СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ СВЯЗАННЫХ С
ФИБРОЗОМ
ЗАБОЛЕВАНИЙ И РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ
<130> PF-B2476
<140> PCT/KR2019/006144
<141> 2019-05-22
<150> 10-2018-0059783
<151> 2018-05-25
<160> 48
<170> PatentIn версия 3.5
<210> 1
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина
<400> 1
cctataaagc ggcaggtgc 19
<210> 2
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина
<400> 2
gagcggcgca cactcccgg 19
<210> 3
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина
<400> 3
gtcccagaga ccgagttgc 19
<210> 4
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина
<400> 4
gagacgccgc cgctgcgaa 19
<210> 5
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина
<400> 5
ccggcgccgg tggtgctgt 19
<210> 6
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина
<400> 6
ggtggtgctg tcgctcttg 19
<210> 7
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина
<400> 7
cgctcttgat actcggctc 19
<210> 8
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина
<400> 8
tcttgatact cggctcagg 19
<210> 9
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина
<400> 9
ggacctcaat gacacctac 19
<210> 10
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина
<400> 10
cacctactct gggaagcgt 19
<210> 11
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина
<400> 11
acctactctg ggaagcgtg 19
<210> 12
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина
<400> 12
ctgggaagcg tgaaccatt 19
<210> 13
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина
<400> 13
gaagcgtgaa ccattttct 19
<210> 14
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина
<400> 14
ttctggggac cacagtgct 19
<210> 15
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер hGAPDH-F
<400> 15
ggtgaaggtc ggagtcaacg 20
<210> 16
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер hGAPDH-R
<400> 16
accatgtagt tgaggtcaat gaagg 25
<210> 17
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер hAREG-F
<400> 17
acacctactc tgggaagcgt 20
<210> 18
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер hAREG-R
<400> 18
gccaggtatt tgtggttcgt 20
<210> 19
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина мыши
<400> 19
aacgggactg tgcatgcca 19
<210> 20
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина мыши
<400> 20
acgggactgt gcatgccat 19
<210> 21
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Смысловая нить миРНК для амфирегулина мыши (контроль)
<400> 21
cagttgtcac tttttatga 19
<210> 22
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер mGAPDH-F
<400> 22
aggtcggtgt gaacggattt g 21
<210> 23
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер mGAPDH-R
<400> 23
tgtagaccat gtagttgagg tca 23
<210> 24
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер mAREG-F
<400> 24
gaggcttcga caagaaaacg 20
<210> 25
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер mAREG-R
<400> 25
accaatgtca tttccggtgt 20
<210> 26
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для AREG
<400> 26
cagtgctgat ggatttgagg t 21
<210> 27
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для AREG
<400> 27
atagccaggt atttgtggtt cg 22
<210> 28
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Зонд для AREG
<400> 28
tgaaccgtcc tcgggagccg act 23
<210> 29
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для RPL13A
<400> 29
gtgtttgacg gcatcccacc 20
<210> 30
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для RPL13A
<400> 30
taggcttcag acgcacgacc 20
<210> 31
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Зонд для RPL13A
<400> 31
aagcggatgg tggttcctgc t 21
<210> 32
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для TBP
<400> 32
caccacagct cttccactc 19
<210> 33
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для TBP
<400> 33
atcccagaac tctccgaagc 20
<210> 34
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Зонд для TBP
<400> 34
acccttgccg ggcaccactc 20
<210> 35
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Антисмысловая нить миРНК для амфирегулина
<400> 35
gcaccugccg cuuuauagg 19
<210> 36
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Антисмысловая нить миРНК для амфирегулина
<400> 36
ccgggagugu gcgccgcuc 19
<210> 37
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Антисмысловая нить миРНК для амфирегулина
<400> 37
gcaacucggu cucugggac 19
<210> 38
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Антисмысловая нить миРНК для амфирегулина
<400> 38
uucgcagcgg cggcgucuc 19
<210> 39
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Антисмысловая нить миРНК для амфирегулина
<400> 39
acagcaccac cggcgccgg 19
<210> 40
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Антисмысловая нить миРНК для амфирегулина
<400> 40
caagagcgac agcaccacc 19
<210> 41
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Антисмысловая нить миРНК для амфирегулина
<400> 41
gagccgagua ucaagagcg 19
<210> 42
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Антисмысловая нить миРНК для амфирегулина
<400> 42
ccugagccga guaucaaga 19
<210> 43
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Антисмысловая нить миРНК для амфирегулина
<400> 43
guagguguca uugaggucc 19
<210> 44
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Антисмысловая нить миРНК для амфирегулина
<400> 44
acgcuuccca gaguaggug 19
<210> 45
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Антисмысловая нить миРНК для амфирегулина
<400> 45
cacgcuuccc agaguaggu 19
<210> 46
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Антисмысловая нить миРНК для амфирегулина
<400> 46
aaugguucac gcuucccag 19
<210> 47
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Антисмысловая нить миРНК для амфирегулина
<400> 47
agaaaauggu ucacgcuuc 19
<210> 48
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Антисмысловая нить миРНК для амфирегулина
<400> 48
agcacugugg uccccagaa 19
<---



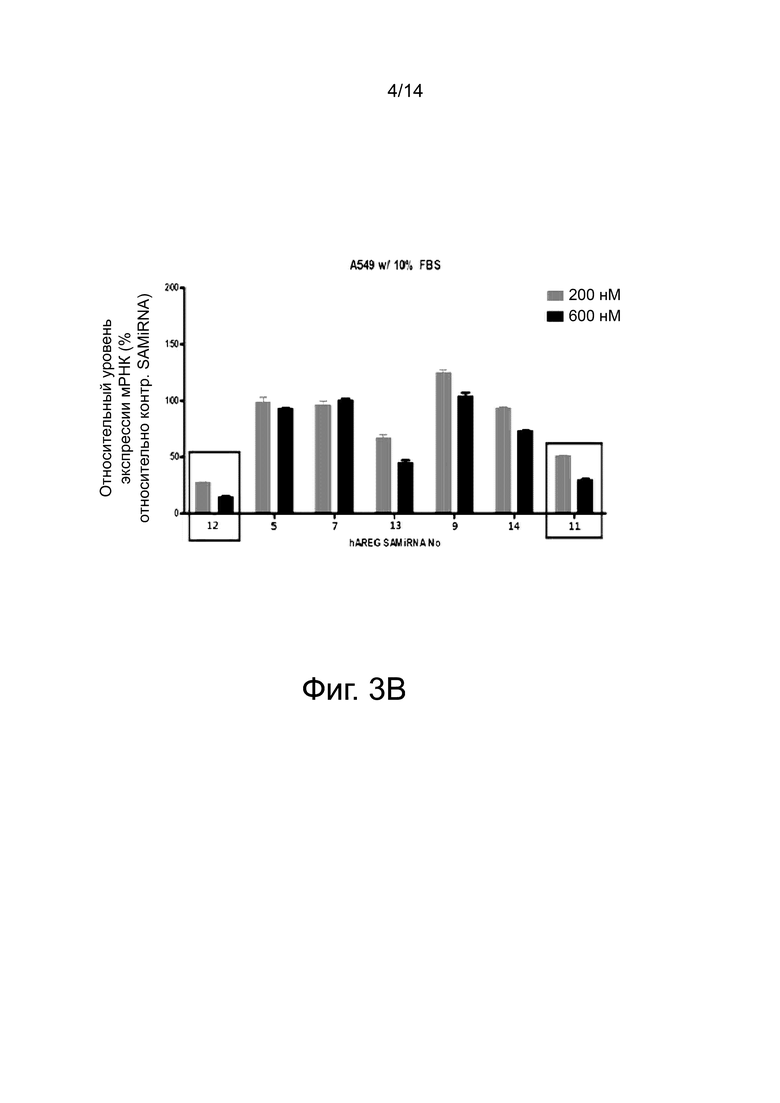

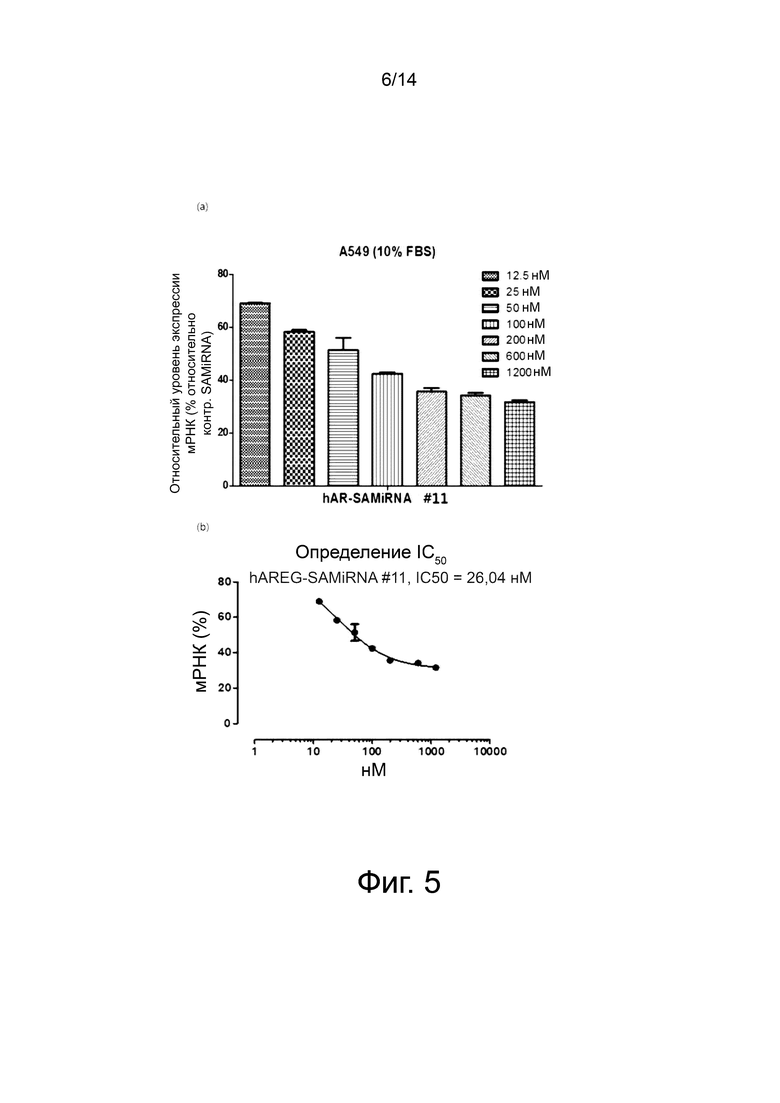



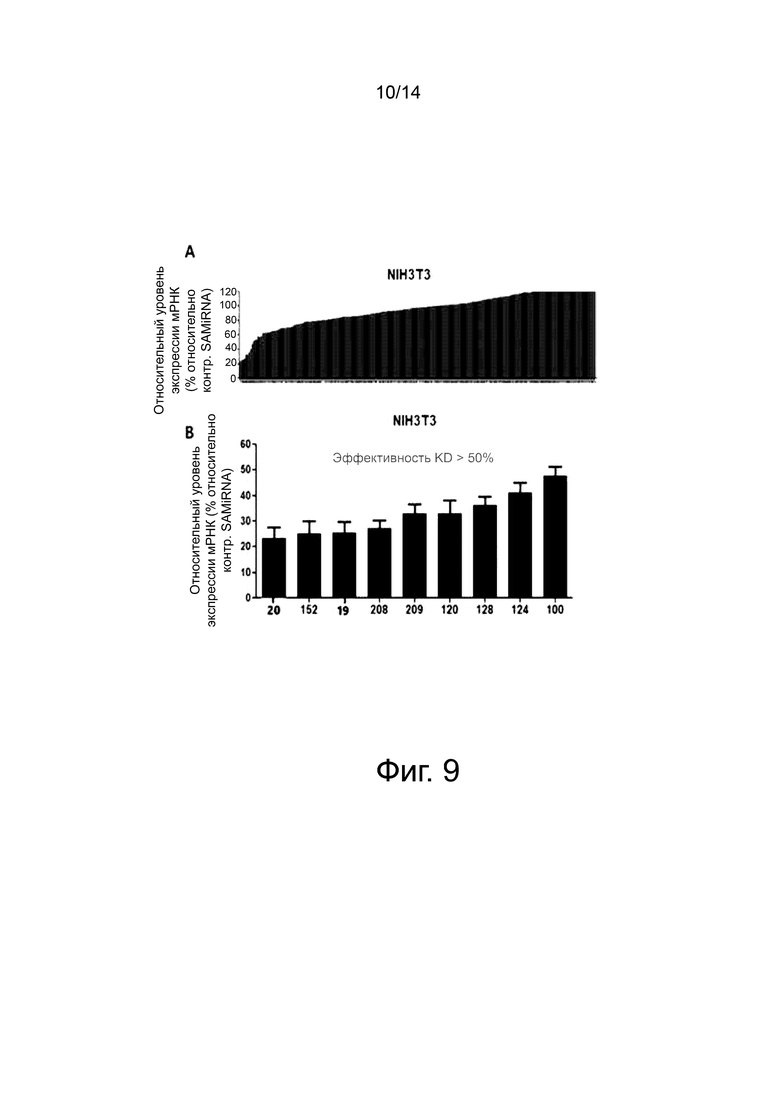
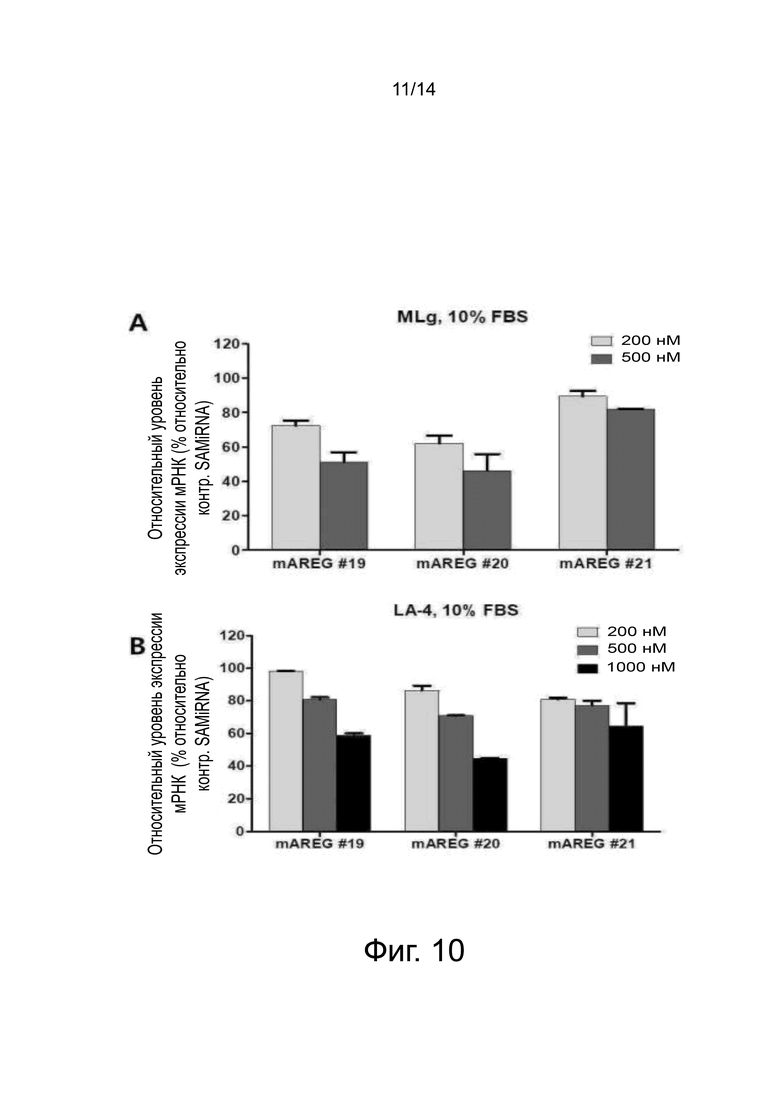
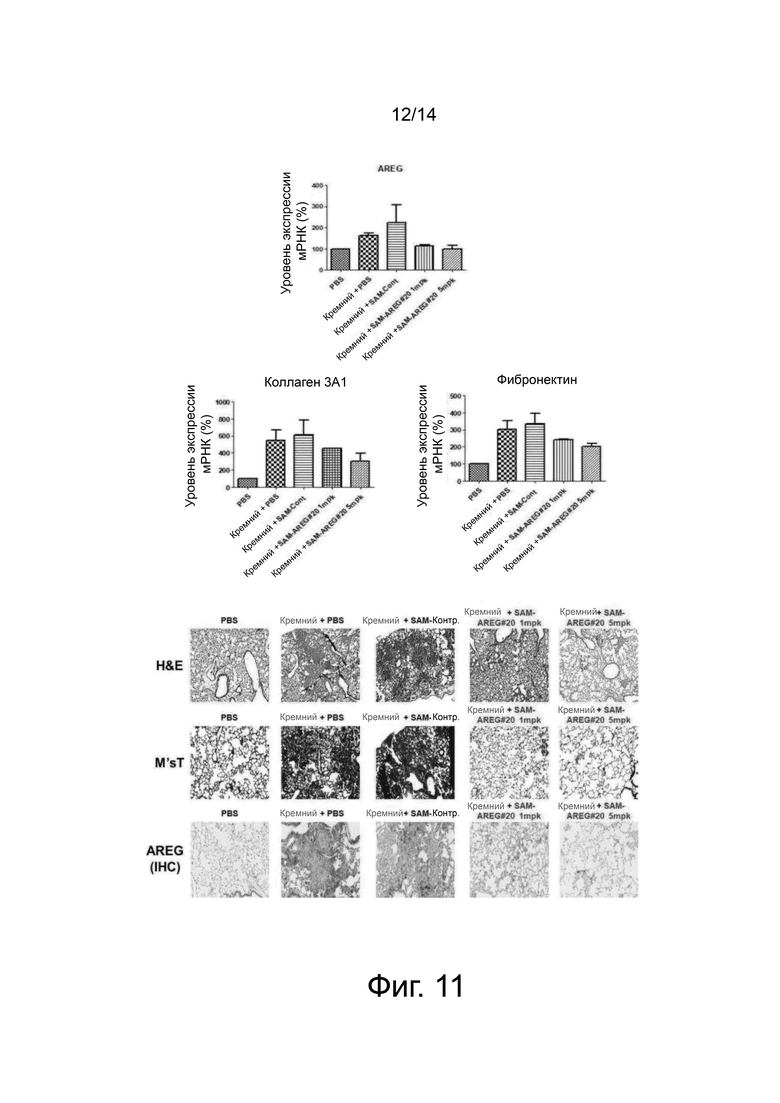


Настоящее изобретение относится к области биотехнологии, в частности к новым специфичным по отношению к амфирегулину олигонуклеотидным конструкциям, и может быть применимо в медицине. Изобретение раскрывает двухцепочечные олигонуклеотиды, способные весьма специфически и эффективно ингибировать экспрессию амфирегулина. Изобретение может быть применимо для профилактики или лечения патологического разрастания соединительной ткани, которым сопровождаются различные фиброзы, в том числе возникающие как осложнение при респираторных заболеваниях. 6 н. и 12 з.п. ф-лы, 11 пр., 13 ил., 9 табл.
1. Амфирегулин-специфичная двухцепочечная олигонуклеотидная структура, включающая структуру, представленную следующей структурной формулой (3) или (4):

где A представляет собой гексаэтиленгликоль-(PO4−-гексаэтиленгликоль), B представляет собой C24 (C6-S-S-C18), X и Y каждый независимо представляют собой простую ковалентную связь или опосредованную линкером ковалентную связь,
где S и AS соответственно представляют собой смысловую цепь SEQ ID NO: 12 и антисмысловую цепь, содержащую комплементарную ей последовательность, двухцепочечного олигонуклеотида.
2. Амфирегулин-специфичная двухцепочечная олигонуклеотидная структура по п. 1, при этом ковалентная связь, представленная X или Y, является нерасщепляемой связью или расщепляемой связью.
3. Амфирегулин-специфичная двухцепочечная олигонуклеотидная структура по п. 2, при этом нерасщепляемая связь представляет собой амидную связь или фосфатную связь.
4. Амфирегулин-специфичная двухцепочечная олигонуклеотидная структура по п. 2, при этом расщепляемая связь выбрана из группы, состоящей из дисульфидной связи, расщепляемой кислотами связи, сложноэфирной связи, ангидридной связи, биоразлагаемой связи и расщепляемой ферментами связи.
5. Амфирегулин-специфичная двухцепочечная олигонуклеотидная структура по п. 1, где смысловая и антисмысловая цепь независимо представляют собой ДНК или РНК.
6. Амфирегулин-специфичная двухцепочечная олигонуклеотидная структура по п. 1, где смысловая цепь или антисмысловая цепь двуцепочечного одлигонуклеотида содержат химическую модификацию.
7. Амфирегулин-специфичная двухцепочечная олигонуклеотидная структура по п. 6, где химическая модификация представляет собой одну или несколько модификаций, выбранных из группы, состоящей из:
модификации, в которой гидроксильная группа ОН в положении 2′-углерода в структуре сахарида у нуклеотидов заменена на любую из числа метила (CH3), метокси - (OCH3), амина (-NH2), фтора (-F), -O-2-метоксиэтила, -O-пропила, -O-2-метилтиоэтила, -O-3-аминопропила, -O-3-диметиламинопропила, -O-N-метилацетамидо и -O-диметиламидооксиэтила;
модификации, в которой кислород в структуре сахарида у нуклеотидов заменен на серу;
модификации связей между нуклеотидами на любые связи из числа фосфоротиоатной связи, боранофосфатной связи и метилфосфонатной связи;
и модификации типа PNA (пептидонуклеиновая кислота), LNA (закрытая нуклеиновая кислота) или UNA (раскрытая нуклеиновая кислота).
8. Амфирегулин-специфичная двухцепочечная олигонуклеотидная структура по п. 1, где одна или несколько фосфатных групп связаны с 5’ концом антисмысловой цепи двухцепочечного олигонуклеотида.
9. Наночастица, которая нацелена на амфирегулин и индуцирует РНКи, содержащая двухцепочечную олигонуклеотидную структуру по любому из пп. 1-8.
10. Наночастица по п. 9, при этом наночастица состоит из смеси двухцепочечных олигонуклеотидных структур, содержащей двухцепочечные олигонуклеотиды, имеющие разные последовательности.
11. Фармацевтическая композиция для ингибирования ремоделирования соединительной ткани, которая содержит в качестве активного ингредиента двухцепочечную олигонуклеотидую структуру по любому из пп. 1-8.
12. Фармацевтическая композиция по п. 11, где композиция предназначена для использования в профилактике или лечении фиброза, связанного с ремоделированием соединительной ткани.
13. Фармацевтическая композиция по п. 11, где композиция предназначена для использования в профилактике или лечении респираторных заболеваний, ассоциированных с ремоделированием соединительной ткани.
14. Фармацевтическая композиция для ингибирования ремоделирования соединительной ткани, которая содержит в качестве активного ингредиента наночастицу по п. 8.
15. Фармацевтическая композиция по п. 14, где композиция предназначена для использования в профилактике или лечении фиброза, связанного с ремоделированием соединительной ткани.
16. Фармацевтическая композиция по п. 14, где композиция предназначена для использования в профилактике или лечении респираторных заболеваний, ассоциированных с ремоделированием соединительной ткани.
17. Лиофилизованная препаративная форма, которая нацелена на амфирегулин и индуцирует РНКи, содержащая двухцепочечную олигонуклеотидную структуру по любому из пп. 1-8.
18. Лиофилизованная препаративная форма, которая нацелена на амфирегулин и индуцирует РНКи, содержащая наночастицу по п. 9.
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| US 20060246448 A1, 02.11.2006 | |||
| US 20130034565 A1, 07.02.2013 | |||
| Устройство для записи работы тракторов и т.п. машин | 1929 |
|
SU20335A1 |
Авторы
Даты
2023-05-02—Публикация
2019-05-22—Подача