ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам пролонгирования выживаемости примата, которому трансплантировали генетически модифицированное сердце, почку, легкое или печень из ксеногенного млекопитающего способом жизнеобеспечения, и к композициям для применения в способе пролонгирования выживаемости примата, которому трансплантировали генетически модифицированное сердце, почку, легкое или печень из ксеногенного млекопитающего способом жизнеобеспечения. Изобретение также относится к живому примату, сердце, почку, легкое или печень которого функционально заменяли трансплантируемым, генетически модифицированным сердцем, почкой, легким или печенью из ксеногенного млекопитающего. И наконец, изобретение относится к генетически модифицированному млекопитающему и организму-донору для ксеногенной трансплантации органов, а также способам их получения.
УРОВЕНЬ ТЕХНИКИ
Необходимы альтернативы донорству аллогенных органов. В прошлом были заданы некоторые экспериментальные предварительные условия высокого уровня для внедрения генетически модифицированных сердец свиней в клинику, которым никто не мог соответствовать за последние 25 лет. В настоящем описании авторы настоящего изобретения описывают способы и композиции для успешной жизнеобеспечивающей ксеногенной трансплантации сердца. Эти способы и композиции также можно использовать для жизнеобеспечивающей трансплантации ксеногенной почки, легкого и печени.
Замена сердца все еще является способом выбора для пациентов на терминальной стадии заболевания. Но потребность в органах значительно превосходит возможности их получения (см. ссылки 1, 2, 3). Вспомогательные механические устройства служат альтернативным вариантом при терапии перехода к трансплантации или конечной целевой терапии (см. ссылку 4); однако, тяжелые, связанные со способом явления, подобные кровотечению, тромбозу или инфицированию силового кабеля, ограничивают их долговременный успех. Недавно достигнутая медиана выживаемости 298 дней (наибольшая выживаемость - 945 дней) в модели гетеротопической трансплантации генетически модифицированного (gm) сокращающегося, но нерабочего сердца в брюшную полость от свиньи павиану (нежизнеобеспечивающей) демонстрирует возможность долговременного иммунологического приживления дискордантных органов при использовании безопасной иммуносупрессии (IS; см. ссылку 5). Однако до клинического использования в соответствии с руководствами Экспертного совета ISHLT требуется хорошее функционирование трансплантата в течение по меньшей мере 3 месяцев в жизнеобеспечивающем положении (предпочтительно, в ортотопическом, но также интраторакальном гетеротопическом способе) по меньшей мере в двух третях последовательных экспериментов (см. ссылку 6), что является результатом, которого не могли достичь последние 25 лет (см. ссылку 7). Фактически, существует мнение, что ортотопические ксеногенные способы невозможны для не являющихся человеком приматов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение удовлетворяет описанные выше потребности и позволяет решать указанные выше задачи в этой области посредством описанных ниже вариантов осуществления.
Авторы настоящего изобретения обнаружили, что, когда генетически модифицированное сердце из ксеногенного организма-донора, такого как свинья, трансплантируют примату-реципиенту, трансплантированное сердце разрастается, что в конечном итоге вызывает смерть примата-реципиента. Авторы настоящего изобретения неожиданно обнаружили, что выживаемость примата-реципиента можно значительно пролонгировать, используя новый способ трансплантации и/или посредством введения реципиенту композиций ингибитора mTOR/антигипертензивного средства. В частности, авторы настоящего изобретения неожиданно обнаружили, что, помимо прочего, следующими способами можно улучшать выживаемость реципиентов:
Консервация сердца из организма-донора посредством неишемической консервации до трансплантации.
Введение реципиенту одного или более антигипертензивних средств после трансплантации. Млекопитающие, такие как свиньи, имеют систолическое давление ±80 мм рт.ст., приматы, такие как павианы, имеют систолическое давление ±120 мм рт.ст. Авторы настоящего изобретения обнаружили, что антигипертензивное лечение снижает более высокие значения у приматов, которые в ином случае будут вызывать гипертрофию миокарда (разрастание). Учитывая эти результаты, авторы настоящего изобретения обнаружили, что введение одного или более антигипертензивных средств предотвращает разрастание донорского сердца у организма-реципиента.
Введение реципиенту ингибитора mTOR после трансплантации. Авторы настоящего изобретения неожиданно обнаружили, что ингибиторы mTOR не только являются иммуносупрессорами, но также и сильными ингибиторами гормонов роста у млекопитающих, таких как свиньи. Таким образом, введение ингибитора mTOR также предотвращает разрастание донорского сердца в организме-реципиенте.
Снижение дозы глюкокортикоида, вводимого реципиенту как часть иммуносупрессорной поддерживающей терапии, на ранней стадии после трансплантации. Авторы настоящего изобретения неожиданно обнаружили, что ранее прекращение введения глюкокортикоида также предотвращает разрастание донорского сердца в организме-реципиенте.
Явление разрастания донорского органа у реципиента после трансплантации также наблюдают после трансплантации почки и легкого (см. ссылку 15). Реципиенты при таких трансплантациях будут страдать соответствующими заболеваниями на терминальной стадии. Таким образом, способы, представленные в настоящем описании (в частности, введение реципиенту одного или более антигипертензивных средств после трансплантации, введение реципиенту ингибитора mTOR после трансплантации и снижение дозы глюкокортикоида, вводимого реципиенту как часть иммуносупрессорной поддерживающей терапии, на ранней стадии после трансплантации), можно использовать при любой трансплантации ксеногенных органов, включая трансплантацию почки, трансплантацию легкого и трансплантацию печени.
Таким образом, настоящее изобретение относится к способам пролонгирования выживаемости примата, которому трансплантировали сердце, почку, легкое или печень из ксеногенного млекопитающего, и композициям для применения в способах пролонгирования выживаемости примата, которому трансплантировали сердце, почку, легкое или печень из ксеногенного млекопитающего, посредством предпочтительных вариантов осуществления, описанных в следующих пунктах. Изобретение также относится к живому примату, сердце, почку, легкое или печень которого функционально заменяют трансплантируемым, генетически модифицированным сердцем, почкой, легким или печенью, соответственно, из ксеногенного млекопитающего, посредством предпочтительных вариантов осуществления, описанных в следующих пунктах.
1. Способ пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце, почку, легкое или печень из ксеногенного организма-донора, где способ включает все или некоторые из следующих стадий:
(i) введение иммуносупрессорного индукционного терапевтического средства организму-реципиенту в соответствии со схемой введения, где схема введения включает введение одного или более иммуносупрессорных средств перед трансплантацией;
(ii) хирургическое извлечение сердце, почки, легкого или печени из организма-донора и консервацию хирургически извлеченного сердца, почки, легкого или печени, соответственно, посредством неишемической консервации до трансплантации;
(iii) трансплантацию хирургически извлеченного, законсервированного сердца, почки, легкого или печени организма-донора организму-реципиенту таким образом, что им функционально заменяют сердце, почку, легкое или печень, соответственно, организма-реципиента;
(iv) введение иммуносупрессорного поддерживающего терапевтического средства организму-реципиенту в соответствии со схемой введения, где схема введения включает введение одного или более иммуносупрессорных средств после трансплантации, и где схема введения включает первое введение глюкокортикоида в пределах 1 дня после трансплантации;
(v) введение противовоспалительного терапевтического средства организму-реципиенту в соответствии со схемой введения, где схема введения включает введение одного или более противовоспалительных средств после трансплантации;
(vi) введение одного или более антигипертензивных средств организму-реципиенту в соответствии со схемой введения, где схема введения включает введение одного или более антигипертензивных средств после трансплантации;
(vii) введение ингибитора mTOR организму-реципиенту в соответствии со схемой введения, где схема введения включает введение ингибитора mTOR после трансплантации; и
(viii) снижение дозы (мг/кг/сутки) глюкокортикоида, вводимого организму-реципиенту в соответствии со схемой введения на стадии (iv), по меньшей мере в 5 раз, предпочтительно - по меньшей мере в 10 раз, в пределах 5 дней после трансплантации;
где организм-донор представляет собой млекопитающего; и
где организм-реципиент представляет собой примата.
Указанный выше способ по п.1 может включать только стадии (vi) и (vii), но, предпочтительно, включает стадии (ii), (iii), (iv), (vi), (vii) и (viii) и, наиболее предпочтительно, включает все из стадий (i)-(viii).
2. Способ по п.1, где способ предназначен для профилактики разрастания сердца, почки, легкого или печени.
3. Способ по п.1 или 2, где функциональная замена на стадии (iii) является ортотопической заменой.
4. Способ по любому из пп.1-3, где генетически модифицированное сердце, почка, легкое или печень имеет следующие генетические модификации:
a) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы;
b) инсерцию гена CD46 человека; и
c) инсерцию гена тромбомодулина человека.
5. Способ по любому из пп.1-3, где генетически модифицированное сердце, почка, легкое или печень имеет следующие генетические модификации:
a) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы, гена CMAH и гена B4GALNT2; и
b) инсерцию гена CD46 человека, гена CD55 человека, гена CD59 человека, гена гемоксигеназы 1 и гена A20.
6. Способ по п.5, где генетически модифицированное сердце, почка, легкое или печень дополнительно имеет следующую генетическую модификацию:
c) инсерцию гена LEA или гена PDL-1.
7. Способ по п.6, где ген LEA является LEA29Y, приведенным в SEQ ID NO: 1.
8. Способ по любому из пп.4-7, где генетически модифицированное сердце, почка, легкое или печень дополнительно имеет следующую генетическую модификацию:
d) инсерцию последовательность, кодирующую α1,2-фукозилтрансферазу человека.
9. Способ по любому из пп.1-8, где организм-донор принадлежит к семейству Suidae, предпочтительно - где организм-донор принадлежит к роду Sus, более предпочтительно - где организм-донор принадлежит к биологическому виду S. scrofa, наиболее предпочтительно - где организм-донор принадлежит к подвиду S. s. domesticus.
10. Способ по любому из пп.1-9, где организм-донор принадлежит к биологическому виду S. scrofa.
11. Способ по любому из пп.1-10, где организм-донор является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы, свиньей породы дюрок, свиньей швабской-галльской породы, черным минипигом или свиньей Оклендских островов; предпочтительно, где организм-донор является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы.
12. Способ по любому из пп.1-11, где организм-реципиент принадлежит к семейству Cercopithecidae, предпочтительно - где организм-реципиент принадлежит к роду Papio, более предпочтительно - где организм-реципиент принадлежит к биологическому виду Papio anubis или Papio hamadryas, наиболее предпочтительно - где организм-реципиент принадлежит к биологическому виду Papio anubis.
13. Способ по любому из пп.1-11, где организм-реципиент принадлежит к семейству Hominidae, предпочтительно - где организм-реципиент принадлежит к роду Homo, более предпочтительно - где организм-реципиент является человеком.
14. Способ по любому из пп.1-13, где выживаемость организма-реципиента пролонгируют до более чем 40 дней после трансплантации, до более чем 50 дней после трансплантации, до более чем 60 дней после трансплантации, до более чем 70 дней после трансплантации, до более чем 80 дней после трансплантации, или до более чем 90 дней после трансплантации; предпочтительно - где выживаемость организма-реципиента пролонгируют до более чем 50 дней после трансплантации, более предпочтительно - до более чем 70 дней после трансплантации, и наиболее предпочтительно - до более чем 90 дней после трансплантации.
15. Способ по любому из пп.1-14, где схема введения иммуносупрессорного индукционного терапевтического средства на стадии (i) включает введение одного или более иммуносупрессорных средств, выбранных из следующего списка: антитела против CD20, антитимоцитарного глобулина (ATG) и антитела против CD40/пасилированного Fab против CD40L; предпочтительно, где схема введения включает введение всех из указанных выше иммуносупрессорных средств.
16. Способ по любому из пп.1-15, где неишемическая консервация на стадии (ii) является неишемической перфузией сердца, почки, легкого или печени.
17. Способ по любому из пп.1-16, где схема введения иммуносупрессорного поддерживающего терапевтического средства на стадии (iv) включает введение глюкокортикоида в дозе от 9 мг/кг/сутки до 11 мг/кг/сутки в день первого введения глюкокортикоида.
18. Способ по любому из пп.1-17, где схема введения иммуносупрессорного поддерживающего терапевтического средства на стадии (iv) включает введение глюкокортикоида и одного или более иммуносупрессорных средств, выбранных из следующего списка: антитела против CD20, антитела против CD40/пасилированного Fab против CD40L и микофенолата мофетила (MMF); предпочтительно, где схема введения включает введение всех из указанных выше иммуносупрессорных средств.
19. Способ по любому из пп.1-18, где схема введения противовоспалительного терапевтического средства на стадии (v) включает введение одного или более противовоспалительных средств, выбранных из следующего списка: антитела против рецептора ИЛ-6, ингибитора ФНОα и антагониста рецептора ИЛ-1; предпочтительно, где схема введения включает введение всех из указанных выше противовоспалительных средств.
20. Способ по любому из пп.1-19, где дозу (мг/кг/сутки) глюкокортикоида, вводимого организму-реципиенту в соответствии со схемой введения на стадии (iv), снижают на стадии (viii) по меньшей мере в 10 раза, предпочтительно - по меньшей мере в 20 раз в пределах 10 дней после трансплантации.
21. Способ по любому из пп.1-20, где схема введения на стадии (vi) включает введение одного или более антигипертензивных средств, выбранных из следующего списка: диуретики, блокаторы кальциевых каналов, ингибиторы ангиотензинпревращающего фермента (АПФ), антагонисты рецептора ангиотензина II, антагонисты адренергических рецепторов, вазодилататоры, ингибиторы ренина, антагонисты рецепторов альдостерона, агонисты альфа-2-адренергических рецепторов и блокаторы рецепторов эндотелина, предпочтительно, где схема введения включает введение одного или более антигипертензивных средств, выбранных из ингибиторов ангиотензинпревращающего фермента (АПФ) и антагонистов адренергических рецепторов, более предпочтительно - где схема введения включает введение эналаприла и/или метопролола тартрата, наиболее предпочтительно - где схема введения включает введение эналаприла и метопролола тартрата.
22. Способ по любому из пп.1-21, где схема введения на стадии (vi) включает первое введение одного или более антигипертензивных средств в пределах 2 дней после трансплантации.
23. Способ по любому из пп.1-22, где антигипертензивные средства на стадии (vi) вводят таким образом, что среднее артериальное давление организма-реципиента поддерживают в диапазоне от 70 до 90 мм рт.ст., предпочтительно - в диапазоне от 75 до 85 мм рт.ст.
24. Способ по любому из пп.1-23, где схема введения на стадии (vii) включает введение ингибитора mTOR, выбранного из следующего списка: дактолисиб (BEZ235, NVP-BEZ235), рапамицин (сиролимус), эверолимус (RAD001), AZD8055, темсиролимус (CCI-779, NSC 683864), SF2523, 3BDO, PI-103, KU-0063794 I, торкиниб (PP242), ридафоролимус (дефоролимус, MK-8669), сапанисертиб (INK 128, MLN0128), аналог воксталисиба (SAR245409, XL765), торин 1, омипалисиб (GSK2126458, GSK458), OSI-027, PF-04691502, апитолисиб (GDC-0980, RG7422), GSK1059615, гедатолисиб (PF-05212384, PKI-587), WYE-354, вистусертиб (AZD2014), торин 2, WYE-125132 (WYE-132), BGT226 (NVP-BGT226), паломид 529 (P529), PP121, WYE-687, WAY-600, ETP-46464, GDC-0349, XL388, зотаролимус (ABT-578), CZ415, MHY1485, воксталисиб (XL765, SAR245409), хризофановая кислота и CC-223, LY3023414; предпочтительно, где схема введения включает введение темсиролимуса.
25. Способ по любому из пп.1-25, где схема введения на стадии (vii) включает первое введение ингибитора mTOR в пределах 10 дней после трансплантации, предпочтительно - от 2 дней до 9 дней после трансплантации, более предпочтительно - от 4 дней до 7 дней после трансплантации.
26. Способ по любому из пп.1-25, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированным сердцем.
27. Способ по любому из пп.1-25, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированной почкой.
28. Способ по любому из пп.1-25, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированным легким.
29. Способ по любому из пп.1-25, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированной печенью.
30. Живой примат, сердце, почку, легкое или печень которого функционально заменяют трансплантируемым, генетически модифицированным сердцем, почкой, легким или печенью, соответственно, из ксеногенного млекопитающего, где указанного живого примата можно получать (или получают) способом по любому из пп.1-29.
31. Живой примат, сердце, почку, легкое или печень которого функционально заменяют трансплантируемым, генетически модифицированным сердцем, почкой, легким или печенью, соответственно, из ксеногенного млекопитающего, где сердце, почку, легкое или печень указанному живому примату трансплантировали более 40 дней назад, более 50 дней назад, более 60 дней назад, более 70 дней назад, более 80 дней назад, или более 90 дней назад, предпочтительно - более 50 дней назад, более предпочтительно - более 70 дней назад, и наиболее предпочтительно - более 90 дней назад.
32. Живой примат по п.31, где указанный живой примат является не являющимся человеком живым приматом.
33. Живой примат по п.31 или 32, где указанный живой примат принадлежит к семейству Cercopithecidae, предпочтительно - где указанный живой примат принадлежит к роду Papio, более предпочтительно - где указанный живой примат принадлежит к биологическому виду Papio anubis или Papio hamadryas, наиболее предпочтительно - где указанный живой примат принадлежит к биологическому виду Papio anubis.
34. Живой примат по любому из пп.31-33, где ксеногенное млекопитающее принадлежит к семейству Suidae, предпочтительно - где ксеногенное млекопитающее принадлежит к роду Sus, более предпочтительно - где ксеногенное млекопитающее принадлежит к биологическому виду S. scrofa, наиболее предпочтительно - где ксеногенное млекопитающее принадлежит к подвиду S. s. domesticus.
35. Живой примат по любому из пп.31-34, где ксеногенное млекопитающее принадлежит к биологическому виду S. scrofa.
36. Живой примат по любому из пп.31-35, где ксеногенное млекопитающее является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы, свиньей породы дюрок, свиньей швабской-галльской породы, черным минипигом или свиньей Оклендских островов; предпочтительно, где ксеногенное млекопитающее является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы.
37. Живой примат по любому из пп.31-36, где генетически модифицированное сердце, почка, легкое или печень имеет следующие генетические модификации:
a) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы;
b) инсерцию гена CD46 человека; и
c) инсерцию гена тромбомодулина человека.
38. Живой примат по любому из пп.31-36, где генетически модифицированное сердце, почка, легкое или печень имеет следующие генетические модификации:
a) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы, гена CMAH и гена B4GALNT2; и
b) инсерцию гена CD46 человека, гена CD55 человека, гена CD59 человека, гена гемоксигеназы 1 и гена A20.
39. Живой примат по п.38, где генетически модифицированное сердце, почка, легкое или печень дополнительно имеет следующую генетическую модификацию:
c) инсерцию гена LEA или гена PDL-1.
40. Живой примат по п.39, где ген LEA является геном LEA29Y, приведенным в SEQ ID NO: 1.
41. Живой примат по любому из пп.37-40, где генетически модифицированное сердце, почка, легкое или печень дополнительно имеет следующую генетическую модификацию:
d) инсерцию последовательности, кодирующей α1,2-фукозилтрансферазу человека.
42. Живой примат по любому из пп.31-41, сердце которого функционально заменяют трансплантируемым, генетически модифицированным сердцем.
43. Живой примат по любому из пп.31-41, почку которого функционально заменяют трансплантируемой, генетически модифицированной почкой.
44. Живой примат по любому из пп.31-41, легкое которого функционально заменяют трансплантируемым, генетически модифицированным легким.
45. Живой примат по любому из пп.31-41, печень которого функционально заменяют трансплантируемой, генетически модифицированной печенью.
46. Живой примат по п.42, где трансплантированное сердце указанного живого примата имеет массу левого желудочка, составляющую 150% массы левого желудочка того же сердца на момент трансплантации или менее, предпочтительно - 140% массы левого желудочка того же сердца на момент трансплантации или менее, более предпочтительно - 130% массы левого желудочка того же сердца на момент трансплантации или менее, даже более предпочтительно - 120% массы левого желудочка того же сердца на момент трансплантации или менее, и наиболее предпочтительно - 110% массы левого желудочка того же сердца на момент трансплантации или менее.
47. Живой примат по любому из пп.31-46, где указанный живой примат имеет количество тромбоцитов от 150 до 300 г/л, предпочтительно - от 170 до 250 г/л, более предпочтительно - от 180 до 230 г/л.
48. Живой примат по любому из пп.31-47, где указанный живой примат имеет уровень билирубина 1,2 мг/дл или менее, предпочтительно - 1,0 мг/дл или менее, более предпочтительно - 0,8 мг/дл или менее, наиболее предпочтительно - 0,6 мг/дл или менее.
49. Живой примат по любому из пп.31-48, где указанный живой примат имеет уровень тропонина T (hs) 0,3 нг/мл или менее, предпочтительно - 0,2 нг/мл или менее, более предпочтительно - 0,1 нг/мл или менее, наиболее предпочтительно - 0,014 нг/мл или менее.
50. Живой примат по любому из пп.31-49, где указанный живой примат имеет уровень ЛДГ 1500 ед./л или менее, предпочтительно - 1000 ед./л или менее, более предпочтительно - 700 ед./л или менее, наиболее предпочтительно - 500 ед./л или менее.
51. Композиция, содержащая ингибитор mTOR, для применения в способе пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце, почку, легкое или печень из ксеногенного организма-донора, где организм-донор представляет собой млекопитающего, и где организм-реципиент представляет собой примата.
52. Композиция, содержащая ингибитор mTOR, для применения по п.51, где композиция предназначена для применения в способе профилактики разрастания сердца, почки, легкого или печени.
53. Композиция, содержащая ингибитор mTOR, для применения по п.51 или 52, где организму-реципиенту трансплантировали генетически модифицированное сердце, почку, легкое или печень из ксеногенного организма-донора таким образом, что им функционально заменяют сердце, почку, легкое или печень, соответственно, организма-реципиента.
54. Композиция, содержащая ингибитор mTOR, для применения по п.53, где функциональная замена является ортотопической заменой.
55. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-54, где организм-донор принадлежит к семейству Suidae, предпочтительно - где организм-донор принадлежит к роду Sus, более предпочтительно - где организм-донор принадлежит к биологическому виду S. scrofa, наиболее предпочтительно - где организм-донор принадлежит к подвиду S. s. domesticus.
56. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-55, где организм-донор принадлежит к биологическому виду S. scrofa.
57. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-56, где организм-донор является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы, свиньей породы дюрок, свиньей швабской-галльской породы, черным минипигом или свиньей Оклендских островов; предпочтительно, где организм-донор является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы.
58. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-57, где организм-реципиент принадлежит к семейству Cercopithecidae, предпочтительно - где организм-реципиент принадлежит к роду Papio, более предпочтительно - где организм-реципиент принадлежит к биологическому виду Papio anubis или Papio hamadryas, наиболее предпочтительно - где организм-реципиент принадлежит к биологическому виду Papio anubis.
59. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-57, где организм-реципиент принадлежит к семейству Hominidae, предпочтительно - где организм-реципиент принадлежит к роду Homo, более предпочтительно - где организм-реципиент является человеком.
60. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-59, где выживаемость организма-реципиента пролонгируют до более чем 40 дней после трансплантации, до более чем 50 дней после трансплантации, до более чем 60 дней после трансплантации, до более чем 70 дней после трансплантации, до более чем 80 дней после трансплантации или до более чем 90 дней после трансплантации; предпочтительно, где выживаемость организма-реципиента пролонгируют до более чем 50 дней после трансплантации, более предпочтительно - до более чем 70 дней после трансплантации, и наиболее предпочтительно - до более чем 90 дней после трансплантации.
61. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-60, где генетически модифицированное сердце, почка, легкое или печень имеет следующие генетические модификации:
a) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы;
b) инсерцию гена CD46 человека; и
c) инсерцию гена тромбомодулина человека.
62. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-60, где генетически модифицированное сердце, почка, легкое или печень имеет следующие генетические модификации:
a) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы, гена CMAH и гена B4GALNT2; и
b) инсерцию гена CD46 человека, гена CD55 человека, гена CD59 человека, гена гемоксигеназы 1 и гена A20.
63. Композиция, содержащая ингибитор mTOR, для применения по п.62, где генетически модифицированное сердце, почка, легкое или печень дополнительно имеет следующую генетическую модификацию:
c) инсерцию гена LEA или гена PDL-1.
64. Композиция, содержащая ингибитор mTOR, для применения по п.63, где ген LEA является геном LEA29Y, приведенным в SEQ ID NO: 1.
65. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.61-64, где генетически модифицированное сердце, почка, легкое или печень дополнительно имеет следующую генетическую модификацию:
d) инсерцию последовательности, кодирующей α1,2-фукозилтрансферазу человека.
66. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-65, где ингибитор mTOR выбран из следующего списка: дактолисиб (BEZ235, NVP-BEZ235), рапамицин (сиролимус), эверолимус (RAD001), AZD8055, темсиролимус (CCI-779, NSC 683864), SF2523, 3BDO, PI-103, KU-0063794 I, торкиниб (PP242), ридафоролимус (дефоролимус, MK-8669), сапанисертиб (INK 128, MLN0128), аналог воксталисиба (SAR245409, XL765), торин 1, омипалисиб (GSK2126458, GSK458), OSI-027, PF-04691502, апитолисиб (GDC-0980, RG7422), GSK1059615, гедатолисиб (PF-05212384, PKI-587), WYE-354, вистусертиб (AZD2014), торин 2, WYE-125132 (WYE-132), BGT226 (NVP-BGT226), паломид 529 (P529), PP121, WYE-687, WAY-600, ETP-46464, GDC-0349, XL388, зотаролимус (ABT-578), CZ415, MHY1485, воксталисиб (XL765, SAR245409), хризофановая кислота и CC-223, LY3023414; предпочтительно, где ингибитор mTOR является темсиролимусом.
67. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-66, где композицию вводят в соответствии со схемой введения, включающей первое введение композиции в пределах 10 дней после трансплантации, предпочтительно - от 2 дней до 9 дней после трансплантации, более предпочтительно - от 4 дней до 7 дней после трансплантации.
68. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-67, где композицию вводят в соответствии со схемой введения, включающей первое введение и последующие ежедневные введения.
69. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-68, где организм-реципиент подвергали иммуносупрессорной индукционной терапии в соответствии со схемой введения, где схема введения включала введение одного или более иммуносупрессорных средств перед трансплантацией.
70. Композиция, содержащая ингибитор mTOR, для применения по п.69, где схема введения иммуносупрессорного индукционного терапевтического средства включала введение одного или более иммуносупрессорных средств, выбранных из следующего списка: антитела против CD20, антитимоцитарного глобулина (ATG) и антитела против CD40/пасилированного Fab против CD40L; предпочтительно, где схема введения включала введение всех из указанных выше иммуносупрессорных средств.
71. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-70, где организм-реципиент подвергают иммуносупрессорной поддерживающей терапии в соответствии со схемой введения, где схема введения включает введение одного или более иммуносупрессорных средств после трансплантации, и где схема введения включает первое введение глюкокортикоида, осуществляемое в пределах 1 дня после трансплантации.
72. Композиция, содержащая ингибитор mTOR, для применения по п.71, где схема введения иммуносупрессорного поддерживающего терапевтического средства включает введение глюкокортикоида в дозе от 9 мг/кг/сутки до 11 мг/кг/сутки в день первого введения глюкокортикоида.
73. Композиция, содержащая ингибитор mTOR, для применения по п.71 или 72, где схема введения иммуносупрессорного поддерживающего терапевтического средства включает введение глюкокортикоида и одного или более иммуносупрессорных средств, выбранных из следующего списка: антитела против CD20, антитела против CD40/пасилированного Fab против CD40L и микофенолата мофетила (MMF); предпочтительно - где схема введения включает введение глюкокортикоида, антитела против CD40/пасилированного Fab против CD40L и микофенолата мофетила (MMF); наиболее предпочтительно - где схема введения включает введение глюкокортикоида, антитела против CD20, антитела против CD40/пасилированного Fab против CD40L и микофенолата мофетила (MMF).
74. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.71-73, где дозу (мг/кг/сутки) глюкокортикоида, вводимого организму-реципиенту в соответствии со схемой введения, снижают по меньшей мере в 5 раз, предпочтительно - по меньшей мере в 10 раз, в пределах 5 дней после трансплантации.
75. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-74, где организм-реципиент подвергают противовоспалительной терапии в соответствии со схемой введения.
76. Композиция, содержащая ингибитор mTOR, для применения по п.75, где схема введения противовоспалительного терапевтического средства включает введение одного или более противовоспалительных средств, выбранных из следующего списка: антитела против рецептора ИЛ-6, ингибитора ФНОα и антагониста рецептора ИЛ-1; предпочтительно, где схема введения включает введение всех из указанных выше противовоспалительных средств.
77. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-76, где организм-реципиент подвергают антигипертензивному лечению в соответствии со схемой введения.
78. Композиция, содержащая ингибитор mTOR, для применения по п.77, где схема введения антигипертензивного средства включает введение одного или более антигипертензивных средств, выбранных из следующего списка: диуретики, блокаторы кальциевых каналов, ингибиторы ангиотензинпревращающего фермента (АПФ), антагонисты рецептора ангиотензина II, антагонисты адренергических рецепторов, вазодилататоры, ингибиторы ренина, антагонисты рецепторов альдостерона, агонисты альфа-2-адренергических рецепторов и блокаторы рецепторов эндотелина, предпочтительно - где схема введения включает введение одного или более антигипертензивных средств, выбранных из ингибиторы ангиотензинпревращающего фермента (АПФ) и антагонисты адренергических рецепторов, более предпочтительно - где схема введения включает введение эналаприла и/или метопролола тартрата, наиболее предпочтительно - где схема введения включает введение эналаприла и метопролола тартрата.
79. Композиция, содержащая ингибитор mTOR, для применения по п.77 или 78, где схема введения антигипертензивного средства включает первое введение одного или более антигипертензивных средств, осуществляемое в пределах 2 дней после трансплантации.
80. Композиция, содержащая ингибитор, mTOR для применения по любому из пп.77-79, где антигипертензивные средства вводят таким образом, что среднее артериальное давление организма-реципиента поддерживают в диапазоне от 70 до 90 мм рт.ст., предпочтительно - в диапазоне от 75 до 85 мм рт.ст.
81. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-80, где перед трансплантацией сердце, почку, легкое или печень из ксеногенного организма-донора консервируют посредством неишемической консервации.
82. Композиция, содержащая ингибитор mTOR, для применения по п.81, где неишемическая консервация является неишемической перфузией сердца, почки, легкого или печени.
83. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-82, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированным сердцем.
84. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-82, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированной почкой.
85. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-82, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированным легким.
86. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-82, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированной печенью.
87. Композиция, содержащая одно или более антигипертензивных средств, для применения в способе пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце, почку, легкое или печень из ксеногенного организма-донора, где организм-донор представляет собой млекопитающего, и где организм-реципиент представляет собой примата.
88. Композиция, содержащая одно или более антигипертензивных средств, для применения по п.87, где композиция предназначена для применения в способе профилактики разрастания сердца, почки, легкого или печени.
89. Композиция, содержащая одно или более антигипертензивных средств, для применения по п.87 или 88, где организму-реципиенту трансплантировали генетически модифицированное сердце, почку, легкое или печень из ксеногенного организма-донора таким образом, что им функционально заменяют сердце, почку, легкое или печень, соответственно, организма-реципиента.
90. Композиция, содержащая одно или более антигипертензивных средств, для применения по п.89, где функциональная замена является ортотопической заменой.
91. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-90, где организм-донор принадлежит к семейству Suidae, предпочтительно - где организм-донор принадлежит к роду Sus, более предпочтительно - где организм-донор принадлежит к биологическому виду S. scrofa, наиболее предпочтительно - где организм-донор принадлежит к подвиду S. s. domesticus.
92. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-91, где организм-донор принадлежит к биологическому виду S. scrofa.
93. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-92, где организм-донор является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы, свиньей породы дюрок, свиньей швабской-галльской породы, черным минипигом или свиньей Оклендских островов; предпочтительно, где организм-донор является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы.
94. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-93, где организм-реципиент принадлежит к семейству Cercopithecidae, предпочтительно - где организм-реципиент принадлежит к роду Papio, более предпочтительно - где организм-реципиент принадлежит к биологическому виду Papio anubis или Papio hamadryas, наиболее предпочтительно - где организм-реципиент принадлежит к биологическому виду Papio anubis.
95. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-93, где организм-реципиент принадлежит к семейству Hominidae, предпочтительно - где организм-реципиент принадлежит к роду Homo, более предпочтительно - где организм-реципиент является человеком.
96. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-95, где выживаемость организма-реципиента пролонгируют до более чем 40 дней после трансплантации, до более чем 50 дней после трансплантации, до более чем 60 дней после трансплантации, до более чем 70 дней после трансплантации, до более чем 80 дней после трансплантации, или до более чем 90 дней после трансплантации; предпочтительно - где выживаемость организма-реципиента пролонгируют до более чем 50 дней после трансплантации, более предпочтительно - до более чем 70 дней после трансплантации, и наиболее предпочтительно - до более чем 90 дней после трансплантации.
97. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-96, где генетически модифицированное сердце, почка, легкое или печень имеет следующие генетические модификации:
a) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы;
b) инсерцию гена CD46 человека; и
c) инсерцию гена тромбомодулина человека.
98. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-96, где генетически модифицированное сердце, почка, легкое или печень имеет следующие генетические модификации:
a) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы, гена CMAH и гена B4GALNT2; и
b) инсерцию гена CD46 человека, гена CD55 человека, гена CD59 человека, гена гемоксигеназы 1 и гена A20.
99. Композиция, содержащая одно или более антигипертензивных средств, для применения по п.98, где генетически модифицированное сердце, почка, легкое или печень дополнительно имеет следующую генетическую модификацию:
c) инсерцию гена LEA или гена PDL-1.
100. Композиция, содержащая одно или более антигипертензивных средств, для применения по п.99, где ген LEA является геном LEA29Y, приведенным в SEQ ID NO: 1.
101. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.97-100, где генетически модифицированное сердце, почка, легкое или печень дополнительно имеет следующую генетическую модификацию:
d) инсерцию последовательности, кодирующей α1,2-фукозилтрансферазу человека.
102. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-101, где антигипертензивные средства представляют собой одно или более средств, выбранных из следующего списка: диуретики, блокаторы кальциевых каналов, ингибиторы ангиотензинпревращающего фермента (АПФ), антагонисты рецептора ангиотензина II, антагонисты адренергических рецепторов, вазодилататоры, ингибиторы ренина, антагонисты рецепторов альдостерона, агонисты альфа-2-адренергических рецепторов и блокаторы рецепторов эндотелина, предпочтительно, где антигипертензивние средства выбраны из ингибиторов ангиотензинпревращающего фермента (АПФ) и антагонистов адренергических рецепторов, более предпочтительно - где антигипертензивные средства являются эналаприлом и/или метопрололом тартрата, наиболее предпочтительно - где антигипертензивные средства являются эналаприлом и метопролола тартратом.
103. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-102, где композицию вводят в соответствии со схемой введения, включающей первое введение композиции в пределах 2 дней после трансплантации.
104. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-103, где композицию вводят таким образом, что среднее артериальное давление организма-реципиента поддерживают в диапазоне от 70 до 90 мм рт.ст., предпочтительно - в диапазоне от 75 до 85 мм рт.ст.
105. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-104, где организм-реципиент подвергали иммуносупрессорной индукционной терапии в соответствии со схемой введения, где схема введения включала введение одного или более иммуносупрессорных средств перед трансплантацией.
106. Композиция, содержащая одно или более антигипертензивных средств, для применения по п.105, где схема введения иммуносупрессорного индукционного терапевтического средства включала введение одного или более иммуносупрессорных средств, выбранных из следующего списка: антитела против CD20, антитимоцитарного глобулина (ATG) и антитела против CD40/пасилированного Fab против CD40L; предпочтительно, где схема введения включала введение всех из указанных выше иммуносупрессорных средств.
107. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-106, где организм-реципиент подвергают иммуносупрессорной поддерживающей терапии в соответствии со схемой введения, где схема введения включает введение одного или более иммуносупрессорных средств после трансплантации, и где схема введения включает первое введение глюкокортикоида, осуществляемое в пределах 1 дня после трансплантации.
108. Композиция, содержащая одно или более антигипертензивных средств, для применения по п.107, где схема введения иммуносупрессорного поддерживающего терапевтического средства включает введение глюкокортикоида в дозе от 9 мг/кг/сутки до 11 мг/кг/сутки в день первого введения глюкокортикоида.
109. Композиция, содержащая одно или более антигипертензивных средств, для применения по п.107 или 108, где схема введения иммуносупрессорного поддерживающего терапевтического средства включает введение глюкокортикоида и одного или более иммуносупрессорных средств, выбранных из следующего списка: антитела против CD20, антитела против CD40/пасилированного Fab против CD40L и микофенолата мофетила (MMF); предпочтительно - где схема введения включает введение глюкокортикоида, антитела против CD40/пасилированного Fab против CD40L и микофенолата мофетила (MMF); наиболее предпочтительно - где схема введения включает введение глюкокортикоида, антитела против CD20, антитела против CD40/пасилированного Fab против CD40L и микофенолата мофетила (MMF).
110. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.107-109, где дозу (мг/кг/сутки) глюкокортикоида, вводимого организму-реципиенту в соответствии со схемой введения, снижают по меньшей мере в 5 раз, предпочтительно - по меньшей мере в 10 раз, в пределах 5 дней после трансплантации.
111. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-110, где организм-реципиент подвергают противовоспалительной терапии в соответствии со схемой введения.
112. Композиция, содержащая одно или более антигипертензивных средств, для применения по п.111, где схема введения противовоспалительного терапевтического средства включает введение одного или более противовоспалительных средств, выбранных из следующего списка: антитела против рецептора ИЛ-6, ингибитора ФНОα и антагониста рецептора ИЛ-1; предпочтительно, где схема введения включает введение всех из указанных выше противовоспалительных средств.
113. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-112, где организму-реципиенту вводят ингибитор mTOR в соответствии со схемой введения.
114. Композиция, содержащая одно или более антигипертензивных средств, для применения по п.113, где ингибитор mTOR выбран из следующего списка: дактолисиб (BEZ235, NVP-BEZ235), рапамицин (сиролимус), эверолимус (RAD001), AZD8055, темсиролимус (CCI-779, NSC 683864), SF2523, 3BDO, PI-103, KU-0063794 I, торкиниб (PP242), ридафоролимус (дефоролимус, MK-8669), сапанисертиб (INK 128, MLN0128), аналог воксталисиба (SAR245409, XL765), торин 1, омипалисиб (GSK2126458, GSK458), OSI-027, PF-04691502, апитолисиб (GDC-0980, RG7422), GSK1059615, гедатолисиб (PF-05212384, PKI-587), WYE-354, вистусертиб (AZD2014), торин 2, WYE-125132 (WYE-132), BGT226 (NVP-BGT226), паломид 529 (P529), PP121, WYE-687, WAY-600, ETP-46464, GDC-0349, XL388, зотаролимус (ABT-578), CZ415, MHY1485, воксталисиб (XL765, SAR245409), хризофановая кислота и CC-223, LY3023414; предпочтительно, где ингибитор mTOR является темсиролимусом.
115. Композиция, содержащая одно или более антигипертензивных средств, для применения по п.113 или 114, где схема введения включает первое введение ингибитора mTOR, осуществляемое в пределах 10 дней после трансплантации, предпочтительно - от 2 дней до 9 дней после трансплантации, более предпочтительно - от 4 дней до 7 дней после трансплантации.
116. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.113-115, где ингибитор mTOR вводят в соответствии со схемой введения, включающей первое введение и последующие ежедневные введения.
117. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-116, где перед трансплантацией сердце, почку, легкое или печень из ксеногенного организма-донора консервировали посредством неишемической консервации.
118. Композиция, содержащая одно или более антигипертензивных средств, для применения по п.117, где неишемическая консервация является неишемической перфузией сердца, почки, легкого или печени.
119. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-118, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированным сердцем.
120. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-118, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированной почкой.
121. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-118, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированным легким.
122. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-118, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированной печенью.
Следует понимать, что признаки живого примата по пп.30-50 и/или признаки композиции по пп.51-122 также можно использовать в отношении способа или реципиента способа по пп.1-29.
Как указано выше, авторы настоящего изобретения неожиданно обнаружили, что, если осуществляют способ пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце и/или вводят композиции по настоящему изобретению, то значительно пролонгируют выживаемость реципиента сердца. Кроме того, если осуществляют способ и/или вводят композиции по настоящему изобретению, трансплантированное сердце не разрастается в организме реципиента, и не наблюдают или наблюдают лишь незначительные связанные с сердцем макроскопические (например, во внешнем виде стенок желудочков и полостей), микроскопические (например, в иммуногистохимических анализах сердца), функциональные (например, при электрокардиографии) или биохимические (например, в значениях показателей крови) отклонения (см. фигуру 1 и фигуру 6, в частности, в кратком описании чертежа 6 ниже).
В описанном выше способе пролонгирования выживаемости организма-реципиента указанному организму-реципиенту трансплантируют генетически модифицированное сердце, почку, легкое или печень из ксеногенного организма-донора. Аналогично, описанному выше живому примату трансплантировали генетически модифицированное сердце, почку, легкое или печень из ксеногенного млекопитающего, и описанные выше композиции, содержащие ингибитор mTOR/антигипертензивные средства, предназначены для применения в способе пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце, почку, легкое или печень из ксеногенного организма-донора. Таким образом, настоящее изобретение также относится к генетически модифицированному млекопитающему, которое в одном из вариантов осуществления может служить в качестве ксеногенного организма-донора такого генетически модифицированного сердца, почки, легкого или печени. Это генетически модифицированное млекопитающее имеет инсерцию последовательности, кодирующей регуляторный белок системы комплемента человека, а также инсерцию последовательности, кодирующей тромбомодулин человека. Обе эти последовательности встраивают в эндогенный локус N-ацетиллактозаминид-альфа-1,3-галактозилтрансферазы (далее также обозначаемый как локус GGTA1 или локус гена альфа-1,3-галактозилтрансферазы), таким образом, что локус GGTA1 прерывают, и GGTA1 больше не экспрессируется. Последовательность, кодирующую регуляторный белок системы комплемента человека, встраивают таким образом, что его экспрессия находится под контролем эндогенного промотора GGTA1. Этот дизайн, помимо прочего, обеспечивает следующие преимущества: встраивание последовательности, кодирующей регуляторный белок системы комплемента человека, а также последовательность, кодирующую тромбомодулин человека, в одном локусе (т.е. локусе GGTA1) предотвращает сегрегацию этих генов во время разведения генетически модифицированного млекопитающего. Кроме того, локус GGTA1 известен как транскрипционно активный центр, делающий возможной достаточную транскрипцию из "безопасной зоны". Таким образом, настоящее изобретение относится к генетически модифицированному млекопитающему и способам его получения посредством предпочтительных вариантов осуществления, описанных в следующих пунктах:
123. Генетически модифицированное млекопитающее, имеющее следующие генетические модификации:
a) инсерцию последовательности, кодирующей регуляторный белок системы комплемента человека, и
b) инсерцию последовательности, кодирующей тромбомодулин человека;
где последовательность, кодирующую регуляторный белок системы комплемента человека, и последовательность, кодирующую тромбомодулин человека, встраивают в локус гена альфа-1,3-галактозилтрансферазы, где по меньшей мере последовательность, кодирующая регуляторный белок системы комплемента человека, экспрессируется под контролем эндогенного промотора гена альфа-1,3-галактозилтрансферазы; и
где генетически модифицированное млекопитающее не является человеком.
124. Генетически модифицированное млекопитающее по п.123, где последовательность, кодирующая регуляторный белок системы комплемента человека, и последовательность, кодирующая тромбомодулин человека, экспрессируются под контролем эндогенного промотора гена альфа-1,3-галактозилтрансферазы.
125. Генетически модифицированное млекопитающее по п.123, где последовательность, кодирующая регуляторный белок системы комплемента человека, экспрессируется под контролем эндогенного промотора гена альфа-1,3-галактозилтрансферазы, и где последовательность, кодирующая тромбомодулин человека, экспрессируется под контролем экзогенного промотора.
126. Генетически модифицированное млекопитающее по п.125, где экзогенный промотор, контролирующий экспрессию последовательности, кодирующей тромбомодулин человека, является убиквитарно активным промотором.
127. Генетически модифицированное млекопитающее по любому из пп.123-126, где у генетически модифицированного млекопитающего отсутствует экспрессия альфа-1,3-галактозилтрансферазы.
128. Генетически модифицированное млекопитающее по любому из пп.123-127, где последовательность, кодирующая регуляторный белок системы комплемента человека, является последовательностью, кодирующей CD46 человека, CD55 человека или CD59 человека.
129. Генетически модифицированное млекопитающее по любому из пп.123-128, где последовательность, кодирующая регуляторный белок системы комплемента человека, является последовательностью, кодирующей CD46 человека.
130. Генетически модифицированное млекопитающее по любому из пп.123-129, где генетически модифицированное млекопитающее дополнительно имеет следующие генетические модификации:
c) гомозиготный нокаут гена CMAH, и
d) гомозиготный нокаут гена B4GALNT2.
131. Генетически модифицированное млекопитающее по любому из пп.123-130, где генетически модифицированное млекопитающее дополнительно имеет следующую генетическую модификацию:
e) инсерцию последовательности гена селективного маркера между последовательностью, кодирующей регуляторный белок системы комплемента человека, и последовательностью, кодирующей тромбомодулин человека.
132. Генетически модифицированное млекопитающее по п.131, где последовательность гена селективного маркера фланкируют участками loxP.
133. Генетически модифицированное млекопитающее по любому из пп.123-132, где генетически модифицированное млекопитающее дополнительно имеет следующую генетическую модификацию:
f) инсерцию последовательности, кодирующей α1,2-фукозилтрансферазу человека.
134. Генетически модифицированное млекопитающее по любому из пп.123-133, где генетически модифицированное млекопитающее имеет одну или более дополнительных генетических модификаций.
135. Генетически модифицированное млекопитающее по п.134, где одна или более дополнительных генетических модификаций представляют собой инсерции.
136. Генетически модифицированное млекопитающее по п.133 или 135, где одна или более инсерций находятся в локусе гена альфа-1,3-галактозилтрансферазы.
137. Генетически модифицированное млекопитающее по любому из пп.123-136, где генетически модифицированное млекопитающее принадлежит к семейству Suidae, предпочтительно - где генетически модифицированное млекопитающее принадлежит к роду Sus, более предпочтительно - где генетически модифицированное млекопитающее принадлежит к биологическому виду S. scrofa, наиболее предпочтительно - где генетически модифицированное млекопитающее принадлежит к подвиду S. s. domesticus.
138. Генетически модифицированное млекопитающее по любому из пп.123-137, где генетически модифицированное млекопитающее принадлежит к биологическому виду S. scrofa.
139. Генетически модифицированное млекопитающее по любому из пп.123-138, где генетически модифицированное млекопитающее является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы, свиньей породы дюрок, свиньей швабско-галльской породы, черным минипигом или свиньей Оклендских островов; предпочтительно, где млекопитающее-донор является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы.
140. Генетически модифицированное млекопитающее по любому из пп.123-139, где генетически модифицированное млекопитающее не содержит эндогенный ретровирус C свиней (PERV-C).
141. Генетически модифицированное млекопитающее по любому из пп.123-140, где генетически модифицированное млекопитающее подходит для использования в качестве организма-донора для трансплантации ксеногенных органов.
142. Орган, полученный из генетически модифицированного млекопитающего по любому из пп.123-141.
143. Сердце, полученное из генетически модифицированного млекопитающего по любому из пп.123-141.
144. Почка, полученная из генетически модифицированного млекопитающего по любому из пп.123-141.
145. Легкое, полученное из генетически модифицированного млекопитающего по любому из пп.123-141.
146. Печень, полученная из генетически модифицированного млекопитающего по любому из пп.123-141.
147. Клетка, полученная из генетически модифицированного млекопитающего по любому из пп.123-141.
148. Способ по любому из пп.1-29,где ксеногенный организм-донор является генетически модифицированным млекопитающим по любому из пп.123-141.
149. Живой примат по любому из пп.30-50, где ксеногенное млекопитающее является генетически модифицированным млекопитающим по любому из пп.123-141.
150. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-86, где ксеногенный организм-донор является генетически модифицированным млекопитающим по любому из пп.123-141.
151. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-122, где ксеногенный организм-донор является генетически модифицированным млекопитающим по любому из пп.123-141.
152. Способ получения генетически модифицированного млекопитающего, включающий следующие стадии:
(a) встраивание последовательности, кодирующей регуляторный белок системы комплемента человека, и последовательности, кодирующей тромбомодулин человека, в локус гена альфа-1,3-галактозилтрансферазы генома млекопитающего для получения генетически модифицированного генома;
(b) встраивание генетически модифицированного генома в клетку; и
(c) созревание клетки, содержащей генетически модифицированный геном, в генетически модифицированном млекопитающем;
где генетически модифицированное млекопитающее не является человеком.
153. Способ по п.152, где геном является геномом соматической клетки, и где генетически модифицированный геном встраивают в клетку посредством переноса ядра соматической клетки.
154. Способ по п.152 или 153, где последовательность, кодирующая регуляторный белок системы комплемента человека, является последовательностью, кодирующей CD46 человека, CD55 человека или CD59 человека.
155. Способ по любому из пп.152-154, где последовательность, кодирующая регуляторный белок системы комплемента человека, является последовательностью, кодирующей CD46 человека.
156. Способ по любому из пп.152-155, где последовательность, кодирующая регуляторный белок системы комплемента человека, и последовательность, кодирующая тромбомодулин человека, находятся на одном экспрессирующем векторе, встраиваемом в локус гена альфа-1,3-галактозилтрансферазы.
157. Способ по п.156, где экспрессирующий вектор, встраиваемый в локус гена альфа-1,3-галактозилтрансферазы, дополнительно содержит последовательность гена селективного маркера между последовательностью, кодирующей регуляторный белок системы комплемента человека, и последовательностью, кодирующей тромбомодулин человека.
158. Способ по п.157, где последовательность гена селективного маркера фланкируют участками loxP.
159. Способ по любому из пп.152-158, где последовательность, кодирующую регуляторный белок системы комплемента человека, и последовательность, кодирующую тромбомодулин человека, встраивают в локус гена альфа-1,3-галактозилтрансферазы таким образом, что у генетически модифицированного млекопитающего отсутствует экспрессия альфа-1,3-галактозилтрансферазы.
160. Способ по любому из пп.152-159, где последовательность, кодирующую регуляторный белок системы комплемента человека, и последовательность, кодирующую тромбомодулин человека, встраивают в локус гена альфа-1,3-галактозилтрансферазы таким образом, что по меньшей мере последовательность, кодирующая регуляторный белок системы комплемента человека, экспрессируется под контролем эндогенного промотора гена альфа-1,3-галактозилтрансферазы.
161. Способ по любому из пп.152-160, где последовательность, кодирующую регуляторный белок системы комплемента человека, и последовательность, кодирующую тромбомодулин человека, встраивают в локус гена альфа-1,3-галактозилтрансферазы таким образом, что последовательность, кодирующая регуляторный белок системы комплемента человека, и последовательность, кодирующая тромбомодулин человека, экспрессируются под контролем эндогенного промотора гена альфа-1,3-галактозилтрансферазы.
162. Способ по любому из пп.152-160, где последовательность, кодирующую регуляторный белок системы комплемента человека, и последовательность, кодирующую тромбомодулин человека, встраивают в локус гена альфа-1,3-галактозилтрансферазы таким образом, что последовательность, кодирующая регуляторный белок системы комплемента человека, экспрессируется под контролем эндогенного промотора гена альфа-1,3-галактозилтрансферазы, и последовательность, кодирующая тромбомодулин человека, экспрессируется под контролем экзогенного промотора.
163. Способ по п.162, где экзогенный промотор является убиквитарно активным промотором.
164. Способ по любому из пп.152-163, где способ дополнительно включает нокаут генов CMAH и B4GALNT2 из генома млекопитающего перед стадией (b).
165. Способ по любому из пп.152-164, где способ дополнительно включает встраивание последовательности, кодирующей α1,2-фукозилтрансферазу человека, в геном млекопитающего перед стадией (b).
166. Способ по п.165, где последовательность, кодирующая регуляторный белок системы комплемента человека, последовательность, кодирующая тромбомодулин человека, и последовательность, кодирующая α1,2-фукозилтрансферазу человека, находятся на одном экспрессирующем векторе, встраиваемом в локус гена альфа-1,3-галактозилтрансферазы.
167. Способ по любому из пп.152-166, где способ дополнительно включает встраивание одной или более дополнительных генетических модификаций в геном млекопитающего перед стадией (b).
168. Способ по п.167, где одна или более дополнительных генетических модификаций представляют собой инсерции.
169. Способ по п.168, где последовательность, кодирующая регуляторный белок системы комплемента человека, последовательность, кодирующая тромбомодулин человека, и одна или более дополнительных инсерций находятся на одном экспрессирующем векторе, встраиваемом в локус гена альфа-1,3-галактозилтрансферазы.
170. Способ по любому из пп.152-169, где генетические модификации встраивают с использованием CRISPR/Cas9, ZFN или TALEN.
171. Способ по любому из пп.152-170, где генетические модификации встраивают с использованием CRISPR/Cas9.
172. Способ по любому из пп.152-171, где млекопитающее принадлежит к семейству Suidae, предпочтительно - где млекопитающее принадлежит к роду Sus, более предпочтительно - где млекопитающее принадлежит к биологическому виду S. scrofa, наиболее предпочтительно - где млекопитающее принадлежит к подвиду S. s. domesticus.
173. Способ по любому из пп.152-172, где млекопитающее принадлежит к биологическому виду S. scrofa.
174. Способ по любому из пп.152-173, где млекопитающее является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы, свиньей породы дюрок, свиньей швабско-галльской породы, черным минипигом или свиньей Оклендских островов; предпочтительно, где млекопитающее является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы.
175. Способ по любому из пп.152-174, где млекопитающее не содержит эндогенный ретровирус C свиней (PERV-C).
176. Способ по любому из пп.152-175, где генетически модифицированное млекопитающее подходит для использования в качестве организма-донора для трансплантации ксеногенных органов.
177. Генетически модифицированное млекопитающее, которое можно получать (или получают) способом по любому из пп.152-176.
178. Способ по любому из пп.1-29,где ксеногенный организм-донор является генетически модифицированным млекопитающим по п.177.
179. Живой примат по любому из пп.30-50, где ксеногенное млекопитающее является генетически модифицированным млекопитающим по п.177.
180. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-86, где ксеногенный организм-донор является генетически модифицированным млекопитающим по п.177.
181. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-122, где ксеногенный организм-донор является генетически модифицированным млекопитающим по п.177.
Разрастание органа в организме-реципиенте является значительной проблемой, когда генетически модифицированный орган из ксеногенного организма-донора (например, свиньи) трансплантируют организму-реципиенту (например, павиану). В рамках изобретения разрастанию органов препятствуют с помощью комбинации способов лечения: (i) снижения артериального давления реципиента (например, павиана) для соответствия более низким уровням у донора (например, свиньи); (ii) снижения кортизона на ранней стадии; и/или (iii) использования пролекарства сиролимуса темсиролимуса для снижения гипертрофии миокарда (см. примеры 1-4). Однако авторы настоящего изобретения обнаружили, что росту свиней (и, таким образом, их органов) также можно противодействовать генетически посредством нокаута гена рецептора гормона роста (GHR). Авторы настоящего изобретения обнаружили, что масса тела свиней GHR-KO (с нокаутом GHR) снижали на 60% по сравнению с контролями, и масса большинства органов снижалась пропорционально (см. пример 7). Кроме того, у свиней GHR-KO значительно снижались уровни инсулиноподобного фактора роста 1 (IGF1) в сыворотке. Примечательно, что с помощью введения IGF1 свиньям GHR-KO можно будет способствовать их росту (см. ссылки 88, 108, 109 и 110 в случае пациентов с синдромом Ларона). Таким образом, посредством введения IGF1 свиньям GHR-KO можно по желанию корректировать размер свиней и их органов.
В свете изложенного выше, авторы настоящего изобретения осуществляли нокаут гена GHR у свиней GT-KO/hCD46/hTM, которых можно использовать в качестве организмов-доноров для ксенотрансплантации приматам (см. пример 7). Таким образом, настоящее изобретение относится к млекопитающим GHR-KO (например, свиньям), являющихся подходящими донорами для ксенотрансплантации, и размер которых/размер органов которых можно корректировать посредством введения им IGF1. Использование таких млекопитающих-доноров в ксенотрансплантации по изобретению можно комбинировать с указанными выше способами медикаментозного лечения по настоящему изобретению для противодействия разрастанию органов. Кроме того, при использовании млекопитающих GHR-KO в качестве доноров можно избегать длительного лечения реципиента ингибитором mTOR. И наконец, возможность корректировать размер органов донора для потребностей реципиента может особенно подходить для реципиентов относительно небольшого размера, которым необходимы относительно небольшие донорские органы.
Таким образом, настоящее изобретение относится к организму-донору для трансплантации ксеногенных органов и способам его получения посредством предпочтительных вариантов осуществления, описанных в следующих пунктах:
182. Организм-донор для трансплантации ксеногенных органов, где организм-донор имеет следующую генетическую модификацию:
a) гомозиготный нокаут гена рецептора гормонов роста;
и где организм-донор является не являющимся человеком млекопитающим.
183. Организм-донор по п.182, где организм-донор дополнительно имеет следующие генетические модификации:
b) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы;
c) инсерцию последовательности, кодирующей CD46 человека; и
d) инсерцию последовательности, кодирующей тромбомодулин человека.
184. Организм-донор по п.182, где организм-донор дополнительно имеет следующие генетические модификации:
b) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы, гена CMAH и гена B4GALNT2; и
c) инсерции последовательности, кодирующей CD46 человека, последовательности, кодирующей CD55 человека, последовательности, кодирующей CD59 человека, последовательности, кодирующей гемоксигеназы 1, и последовательности, кодирующей A20.
185. Организм-донор по п.184, где последовательность, кодирующая гемоксигеназу 1, кодирует гемоксигеназу 1 человека, и где последовательность, кодирующая A20, кодирует A20 человека.
186. Организм-донор по п.184 или 185, где организм-донор дополнительно имеет следующую генетическую модификацию:
d) инсерцию последовательности, кодирующей LEA29Y или PD-L1.
187. Организм-донор по п.186, где последовательность, кодирующая LEA29Y, является последовательностью, приведенной в SEQ ID NO: 1.
188. Организм-донор по п.186, где последовательность, кодирующая PD-L1, кодирует человек PD-L1.
189. Организм-донор по любому из пп.182-188, где организм-донор дополнительно имеет следующую генетическую модификацию:
e) инсерцию последовательности, кодирующей α1,2-фукозилтрансферазу человека.
190. Организм-донор по любому из пп.182-189, где организм-донор принадлежит к семейству Suidae, предпочтительно - где организм-донор принадлежит к роду Sus, более предпочтительно - где организм-донор принадлежит к биологическому виду S. scrofa, наиболее предпочтительно - где организм-донор принадлежит к подвиду S. s. domesticus.
191. Организм-донор по любому из пп.182-190, где организм-донор принадлежит к биологическому виду S. scrofa.
192. Организм-донор по любому из пп.182-191, где организм-донор является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы, свиньей породы дюрок, свиньей швабско-галльской породы, черным минипигом или свиньей Оклендских островов; предпочтительно, где организм-донор является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы.
193. Организм-донор по любому из пп.182-192, где организм-донор не содержит эндогенный ретровирус C свиней (PERV-C).
194. Организм-донор по любому из пп.182-193, где организм-донор является генетически модифицированным организмом по любому из пп.123-141.
195. Способ по любому из пп.1-29,где ксеногенный организм-донор является организмом-донором по любому из пп.182-194.
196. Живой примат по любому из пп.30-50, где ксеногенное млекопитающее является организмом-донором по любому из пп.182-194.
197. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-86, где ксеногенный организм-донор является организмом-донором по любому из пп.182-194.
198. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-122, где ксеногенный организм-донор является организмом-донором по любому из пп.182-194.
199. Способ получения организма-донора для трансплантации ксеногенных органов, включающий следующую стадию (i):
(i) коррекции размера организма-донора посредством введения организму-донору IGF1;
где организм-донор имеет следующую генетическую модификацию:
a) гомозиготный нокаут гена рецептора гормонов роста;
и где организм-донор является не являющимся человеком млекопитающим.
200. Способ по п.199, где введение IGF1 начинают после рождения организма-донора.
201. Способ по п.199 или 200, где организм-донор дополнительно имеет следующие генетические модификации:
b) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы;
c) инсерцию последовательности, кодирующей CD46 человека; и
d) инсерцию последовательности, кодирующей тромбомодулин человека.
202. Способ по п.199 или 200, где организм-донор дополнительно имеет следующие генетические модификации:
b) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы, гена CMAH и гена B4GALNT2; и
c) инсерции последовательности, кодирующей CD46 человека, последовательности, кодирующей CD55 человека, последовательности, кодирующей CD59 человека, последовательности, кодирующей гемоксигеназу 1, и последовательности, кодирующей A20.
203. Способ по п.202, где последовательность, кодирующая гемоксигеназу 1, кодирует гемоксигеназу 1 человека, и последовательность, кодирующая A20, кодирует A20 человека.
204. Способ по п.202 или 203, где организм-донор дополнительно имеет следующую генетическую модификацию:
d) инсерцию последовательности, кодирующей LEA29Y или PD-L1.
205. Способ по п.204, где последовательность, кодирующая LEA29Y, является последовательностью, приведенной в SEQ ID NO: 1.
206. Способ по п.204, где последовательность, кодирующая PD-L1, кодирует PD-L1 человека.
207. Способ по любому из пп.199-206, где организм-донор дополнительно имеет следующую генетическую модификацию:
e) инсерцию последовательности, кодирующей α1,2-фукозилтрансферазу человека.
208. Способ по любому из пп.199-207, где организм-донор принадлежит к семейству Suidae, предпочтительно - где организм-донор принадлежит к роду Sus, более предпочтительно - где организм-донор принадлежит к биологическому виду S. scrofa, наиболее предпочтительно - где организм-донор принадлежит к подвиду S. s. domesticus.
209. Способ по любому из пп.199-208, где организм-донор принадлежит к биологическому виду S. scrofa.
210. Способ по любому из пп.199-209, где организм-донор является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы, свиньей породы дюрок, свиньей швабско-галльской породы, черным минипигом или свиньей Оклендских островов; предпочтительно, где организм-донор является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы.
211. Способ по любому из пп.199-210, где организм-донор не содержит эндогенный ретровирус C свиней (PERV-C).
212. Способ по любому из пп.199- 210, где организм-донор является генетически модифицированным организмом по любому из пп.123-141.
213. Организм-донор для трансплантации ксеногенных органов, где организм-донор можно получать (или получают) способом по любому из пп.199-212.
214. Способ по любому из пп.1-29,где ксеногенный организм-донор является организмом-донором по п.213.
215. Живой примат по любому из пп.30-50, где ксеногенное млекопитающее является организмом-донором по п.213.
216. Композиция, содержащая ингибитор mTOR, для применения по любому из пп.51-86, где ксеногенный организм-донор является организмом-донором по п.213.
217. Композиция, содержащая одно или более антигипертензивных средств, для применения по любому из пп.87-122, где ксеногенный организм-донор является организмом-донором по п.213.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1A-L, иллюстрация результатов, описанных в примере 2:A, высокочувствительный сердечный тропонин T, и B, уровни билирубина в трех экспериментальных группах (I, светло-серые точки; II, темно-серый пунктир; III, черные линии). В отличие от животных в группе I (кристаллоидная кардиоплегия) и II (неишемическая перфузия сердца), животные в группе III (неишемическая перфузия сердца и лечение от гипертрофии сердца) имели низкие уровни тропонина T и билирубина на всем протяжении экспериментов, что свидетельствует о нормальном приживлении и функции печени. C, кривая Каплана-Мейера выживаемости после ортотопической ксенотрансплантации в группах I, II и III; наиболее длительный эксперимент избирательно прерывали после достижения конечной точки исследования 90 дней; логарифмический ранговый критерий, p=0,0236. D, повышение массы LV донорских сердец по результатам эхокардиографии. Масса LV эксперимента 64 группы II увеличивалась в четыре раза через 40 дней, в то время как масса LV эксперимента 67 (группа III) оставалась неизменной после 90 дней. Контрольное сердце (сиблинг донора из эксперимента 64, Co) увеличивалось в три раза через 33 дня. E, Изображение донорского сердца свиньи из эксперимента 57 (группа I) после эксплантации (слева) в POD 30 и собственное сердце животного (справа) для сравнения. К концу эксперимента трансплантат достигал 230% своей исходной массы; сердца донора и реципиента имели приблизительно одинаковый размер ко дню трансплантации. F, те же сердца, что и на E, после консервации в формалине и забор образцов ткани. Поперечные разрезы на приблизительно 1 см ниже митрального клапана; LV трансплантата имели обширную гипертрофию, и полость LV уменьшалась. G, изображение донорского сердца свиньи из эксперимента 67 (группа III) после эксплантации (слева) в POD 90 и собственное сердце животного (справа). Поперечные разрезы на приблизительно 1 см ниже митрального клапана. К концу эксперимента увеличение толщины стенки LV являлось лишь незначительным, полость LV не уменьшалась. H, окрашивание HE миокарда LV донорского сердца свиньи (слева) и печени реципиента (справа) из эксперимента 64 в POD 40. Миокарда: мультифокальный некроз с гиперэозинофилией, умеренной интерстициальной инфильтрацией лимфоцитами, нейтрофилами и макрофагами, спорадический тромбоз мелких сосудов; печень: мультифокальная центролобулярная вакуолизация клеток и некроз, мультифокальные геморрагии в очагах поражения. I, окрашивание HE миокарда LV донорского сердца свиньи и печени реципиента из эксперимента 67 в POD 90. Миокард: спорадическая инфильтрация лимфоцитов, мультифокальный минорный интерстициальный отек; печень: небольшая вакуолярная дегенерация гепатоцитов (липидного типа). J, размер миоцитов (окрашивание WGA, масштабная линейка=50 мкм) отражен на соответствующих срезах миокарда ложнооперированного сердца свиньи (контроль, слева), эксперименты 64 (группа II, в центре) и 67 (группа III, справа). K, по сравнению с ложнооперированным сердцем (Co), площадь поперечного среза миоцита повышалась в эксперименте 64 но не в эксперименте 67 (данные представлены в виде среднего ±SD; указаны значения p, односторонний ANOVA с критерием множественных сравнений Шидака-Холма). L, вестерн-блоттинг (миокард) фосфорилированного mTOR и PCNA, оба из которых подвергались отрицательной регуляции в эксперименте 67 после введения темсиролимуса по сравнению с контролем (Co). Co, контроль; HE, гематоксилин-эозин; LV, левый желудочек; mTOR, мишень рапамицина в клетках млекопитающих; POD, день после операции; PCNA, ядерный антиген пролиферирующих клеток; WGA, агглютинин из проростков пшеницы.
Фигура 2A-K: Иммунофлуоресцентное окрашивание тканей миокарда (A-D), их количественные измерения (E-I) и уровни антител против не-Gal-антигенов (J-K). Примеры окрашивания в трех разных группах: эксперименты №57 (группа I, верхний ряд), №64 (группа II, средний ряд) и №67 (группа III, нижний ряд). Накопление IgM (A, показано зеленым, слабое в группах I, II, отсутствует в группе III), накопление IgG (B, отсутствует во всех группах); ядра всегда окрашивали DAPI (голубой), все масштабные линейки соответствуют 25 мкм. Небольшое накопление C3b/c (красное), C4b/c (зеленое) (C) и фибрина (зеленое, D) в тканях миокарда свиньи из групп I, II, отсутствие таких результатов в группе III. E-I, интенсивности флуоресценции (n=5 каждое) измеряли с использованием ImageJ и строили графики соответствующих значений с использованием GraphPad Prism. Представлены три группы: группа I (№57); группа II (№№60, 63, 64) и группа III (№№66, 67). E, IgM. F, IgG. G, C3b/c. H, C4b/c. I, фибрин; значения C3b/c и C4b/c сравнивают с таковыми у контролей (Co), измеренными в сердце здоровой свиньи; столбики соответствуют среднему значению ± стандартные отклонения. J и K, уровни антител IgM и IgG против не-Gal-антигенов в плазме павиана; связывание антитела с GT-KO/hCD46/hTM PAEC; клетки инкубировали в термически инактивированной плазме павиана, окрашивали на IgG и IgM и анализировали посредством активируемой флуоресценцией сортировки клеток (FACS). Значения выражают как медиану интенсивности флуоресценции (MFI). У павиана №46 наблюдали гуморальное отторжение (гетеротопически трансплантированного интраторакального) донорского сердца, что служило в качестве положительного контроля (серый); POD=день после операции; Gal, α1,3-галактозил.
Фигура 3A-D: Гемодинамические данные, измеряемые посредством транспульмональной термодилюции, и послеоперационная поддержка катехоламинами. Гемодинамические измерения осуществляли после начала анестезии (до CPB) и через 60 минут после прекращения сердечно-легочного шунтирования (после CPB). Донорские сердца из группы I (светло-серый) подвергали кристаллоидной кардиоплегии, донорские сердца из групп II (темно-серый) и III (черный) консервировали посредством непрерывной холодовой гиперонкотической перфузии; данные представляли в виде диаграмм рассеяния с медианными планками и анализировали на значимость с помощью парного и непарного t-критерия. A, SVI и B, CI до и после CPB. Оба параметра снижались в группе I и были ниже в сердцах в группе I после CPB по сравнению с группами II и III. C, дозы катехоламинов через 60 минут после прекращения CPB и D, длительность послеоперационной вазопрессорной и инотропной поддержки. В группе I требовалось больше норадреналина (NOR) и эпинефрина (EPI) по сравнению в группы II и III. Животным из группы I требовалась инотропная поддержка эпинефрином в течение большего времени. CI, сердечный индекс; CPB, сердечно-легочное шунтирование; EPI, эпинефрин; SVI, индекс ударного объема; NOR, норадреналин.
Фигура 4A-C: Графики размеров LV во время диастолы (слева) и систолы (справа), полученных при трансторакальной эхокардиографии. A, эксперимент 64 (группа II, выживаемость 40 дней): масса LV повышалась на 303% к POD 38, диастолическая и систолическая функции значительно нарушались из-за гипертрофии миокарда, и внутрижелудочковая полость уменьшалась. FS LV составляли 32% и 14% в POD 1 и POD 38. У животного наблюдали признаки сердечной недостаточностью. Эти результаты были схожи с результатами в других экспериментах в группах I и II. B, эксперимент 67 (группа III, выживаемость 90 дней): в отличие от эксперимента 64, масса LV повышалась только на 22% в POD 82, диастолическая и систолическая функции сохранялись. FS LV составляли 27% и 34% в POD 1 и POD 82. У животного не наблюдали признаков сердечной недостаточности. C, свинья 5157 (контроль, сиблинг донора из эксперимента 64): масса LV повышалась на 187% к POD 33, однако, диастолическая и систолическая функции сохранялись. FS LV составляли 32% и 41% в POD 1 и POD 33. По сравнению с трансплантированным сердцем сиблинга (эксперимент 64), LV меньше увеличился в размере, и не наблюдали ни гипертрофии миокарда, ни сердечной недостаточности. FS, фракция укорочения; LV, левый желудочек; POD, день после операции.
Фигура 5A-B: Корреляция между массой LV (черные точки), количеством тромбоцитов (темно-серая линия) и значениями ЛДГ (светло-серый пунктир). A, приблизительно в POD 20 у реципиента 64 (группа II) масса LV повышалась более интенсивно, в то время как количество тромбоцитов снижалось, ЛДГ повышалась. B, эти результаты противоречили результатам, полученным в случае реципиента 67 (группа III), масса LV у которого оставалась стабильной. LV, левый желудочек; POD, день после операции.
Фигура 6A-B: Позиции по короткой оси на уровне папиллярных мышц при трансторакальной эхокардиографии трансплантатов свиней после ксенотрансплантации сердца (видеокадры). A, пример разрастания трансплантированного органа, эксперимент 64 (группа II, POD 30): мышечная стенка LV утолщалась, а сердечная функция ухудшалась; полость LV значительно уменьшалась; подвижность стенки снижалась; наблюдали признаки терминальной стадии сердечной недостаточности; последующая терминальная стадия печеночной недостаточности. Эти результаты были схожи с результатами других экспериментов в группе I и II. B, эксперимент 67 (группа III, POD 57): в отличие от эксперимента 64, мышечная стенка LV оставалась неизмененной, функции LV и RV сохранялись на хорошем уровне; полость LV являлась нормальной по размеру; наблюдали почти нормальную насосную функцию; не наблюдали признаков сердечной недостаточности или печеночной недостаточности. RV, правый желудочек; LV, левый желудочек.
Фигура 7: График примера схемы введения иммуносупрессорной индукционной и поддерживающей терапии, а также примера схемы введения ингибитора mTOR. Отметки на каждой линии времени соответствуют введениям. Числа под отметками линии времени метилпреднизолона соответствуют дозам (мг/кг/сутки). HTX, трансплантация сердца; ATG, антитимоцитарный глобулин; i.v., внутривенное введение.
Фигура 8: График примера схемы введения противовоспалительного терапевтического средства. HTX, трансплантация сердца; i.v., внутривенное введение; s.c., подкожное введение. Отметки на каждой линии времени соответствуют введениям.
Фигура 9: График примера схемы введения антигипертезивного терапевтического средства. HTX, трансплантация сердца; i.v., внутривенное введения. Отметки на каждой линии времени соответствуют введениям.
Фигура 10A-C: Примеры способов ксенотрансплантации сердца. A, ортотопическая трансплантация сердца. Сердце реципиента удаляют на уровне предсердия; восходящую дугу аорты и легочный ствол отрезают. Затем донорский орган соединяют таким образом. B, интраторакальная гетеротопическая трансплантация сердца. Донорский орган помещают справа от сердца реципиента в правую область грудной клетки. Здесь два общих предсердия, т.к. их анастомозируют одно за другим. Объем крови изгоняется обоими сердцами через два терминолатеральных соединения на уровне восходящих дуг аорты, стволов легочной артерии (для последних необходима интерпозиция трансплантата). Оба органа работают несинхронно. Их общий минутный объем кровообращения зависит от соответствующего конечно-диастолического давления, которое, в свою очередь, связано с частями циклов двух сердец. C, Гетеротопическая абдоминальная трансплантация. Перфузируют только коронарные артерии (через брюшную аорту), коронарная венозная кровь поступает в правое предсердие, а затем в желудочек. Она изгоняется через легочный ствол в нижнюю полую вену. Сердце сокращается, но не работает. Фигура взята из Mohiuddin, Reichart et al., 2015.
Фигура 11A-F: Выживаемость, лабораторные параметры, некропсия и гистологическое исследование после ортотопической ксенотрансплантации. A, кривая Каплана-Мейера выживаемости в группах I (светло-серые точки; n=5 животные), II (темно-серый пунктир; n=4 животные) и III (черные линии; n=5 животные). Двухсторонний логарифмический ранговый критерий, P=0,0007. B, C, концентрации сердечного тропонина T (B) и билирубина (C) в сыворотке. D, масса левого желудочка (LV) ксенотрансплантированных сердец из животных 9 (группа II), 11 и 13 (группа III); необходимо отметить повышенный рост трансплантата после прекращения введения темсиролимуса (стрелка). E, количественный анализ площадей поперечных срезов кардиомиоцитов. Данные представляют собой среднее значение ±s.d., указаны значения P, односторонний дисперсный анализ (ANOVA) с критерием множественных сравнений Шидака-Холма (n=3 биологически независимых образцов с 5-8 измерениями каждый). F, при анализе вестерн-блоттинга миокарда из трансплантированных сердец животных 11 и 12 наблюдали сниженное фосфорилирование mTOR (p-mTOR) по сравнению с образцами совпадающих по возрасту контролей. n=2, группа III; n=2, контроли.
Фигура 12A-G: Количественная оценка антител, комплемента и фибрина в ткани миокарда и уровни ксенореактивных антител против антигенов, несодержащих галактоза-α1,3-галактозу, в сыворотке. A-E, количественная оценка интенсивностей флуоресценции (n=9 биологически независимых образцов с 5-10 измерениями на эксперимент; соответствующие изображения см. на фиг. 2A-D). Необработанные интегральные плотности показаны для IgM (A), IgG (B), C3b/c (C), C4b/c (D) и фибрина (E). Группа I (животное 3); группа II (животные 6, 8, 9); группа III (животные 11-14). Значения C3b/c и C4b/c сравнивают с таковыми у контролей, измеряемыми в сердцах здоровых свиней. Данные представляют собой среднее значение ±s.d. F, G, Уровни ксенореактивных антител IgM и IgG против антигенов, несодержащих галактоза-α1,3-галактозу, в плазме павиана; связывание антител с эндотелиальными клетками аорты свиньи с нокаутом α-галактозилтрансферазы, экспрессирующими CD46 человека и тромбомодулин, анализировали посредством активируемой флуоресценцией сортировки клеток. Значения выражали как среднюю интенсивность флуоресценции. Животным 6, 9 и 10 вводили пасилированный Fab против CD40L, другим вводили моноклональное антитело против CD40. Плазма павиана, отторгавшего гетеротопически интраторакально трансплантированное сердце свиньи, служила в качестве положительного контроля.
Фигура 13A-D: Гемодинамические данные, получаемые при транспульмональной термодилюции, и послеоперационная поддержка катехоламинами. Измерения осуществляли после начала анестезии (до) и через 60 мин после прекращения CPB (после). Донорские сердца из группы I (светло-серый) подвергали кристаллоидной кардиоплегии, донорские сердца из групп II (темно-серый) и III (черный) консервировали посредством непрерывной холодовой гиперонкотической перфузии; данные представляли в виде диаграмм рассеяния со средним значением ±s.d., при этом индивидуумы показаны точками; n=14 животные, двухсторонний парный и непарный t-критерий, указаны значения P. A, индекс ударного объема. B, сердечный индекс до и после CPB. Оба параметра снижались в группе I и были ниже в группе I после CPB, чем в группах II и III. C, дозы катехоламинов 60 мин после прекращения CPB. D, длительность послеоперационной вазопрессорной и инотропной поддержки. Животным из группы I требовалось больше норадреналина и адреналина, чем в группах II и III. Животным в группе I требовалась инотропная поддержка адреналином в течение большего периода времени.
Фигура 14A-B: Дополнительные лабораторные параметры. A, B, Концентрации лактатдегидрогеназы в сыворотке (A) и количество тромбоцитов (B) у животных в группах I (светло-серые точки на черно-белой версии фигур; черная линия на цветной версии фигур), II (темно-серая пунктирная линия на черно-белой версии фигур; красная линия на цветной версии фигур) и III (черная линия на черно-белой версии фигур; линия цвета маджента на цветной версии фигур). К концу экспериментов в группах I и II количество тромбоцитов снижалось, в то время как ЛДГ повышалась. У животных в группе III не наблюдали такие изменения.
Фигура 15A-B: Иммуногистохимия посмертных образцов миокарда. A, B, экспрессия мембранного кофакторного белка человека (hCD46) (A) и тромбомодулина человека (hTM) (B) являлась сопоставимой во всех донорских органах (1-14). Масштабные линейки, 50 мкм. n=14 свиней GTKO/hCD46/hTM; n=1 свинья дикого типа (контроль). Показаны биологические образцы из всех животных.
Фигура 16: Посредством нанопорового секвенирования локуса трансгена hCD46 у трансгенных свиней GGTA1-KO/hCD46, предоставленных Revivicor, выявляли наличие по меньшей мере двух интегрантов кодирующей последовательности FUT1 человека в экспрессирующей кассете, регулируемой промотором MHC мыши. Два интегранта (помеченных как 1 и 2 справа) можно четко дифференцировать по ориентации фланкирующих копий трансгена hCD46.
Фигура 17: Среднее количество транскрипта GGTA1, CMAH и B4GALNT2 в разных тканях пяти 2-летних самок свиней дикого типа. Определение профиля экспрессии осуществляли посредством секвенирования РНК. TPM (транскрипты на миллион; см. ссылку 106) является мерой количества транскрипта, которую можно использовать для сравнения уровней экспрессии разных генов в образце. При использовании TPM учитывают глубину библиотеки посредством нормализации на миллион ридов, а также длину гена, разделяя каждую точку данных на длину транскрипта в количестве оснований.
Фигура 18: Стратегия для генной инженерии свиней-доноров. Гены GGTA1, CMAH и B4GALNT2 будут инактивировать посредством CRISPR/Cas9. Затем кассету с минигеном hCD46 без промотора, фланкированный участками loxP ген селективного маркера (SMG) и экспрессирующую кассету hTM встраивают в локус GGTA1 таким образом, что экспрессия hCD46 регулируется регуляторными последовательностями GGTA1. Дополнительные трансгены можно встраивать с помощью Cre-опосредованной замены кассет сконструированной BAC, содержащей один или несколько дополнительных трансгенов.
Фигура 19: Получение модели свиней с дефицитом GHR с использованием технологии CRISPR/Cas. Частичная последовательность ДНК экзона 3 GHR. Участок связывания sgRNA указан сплошной линией под последовательностью, и мотив, прилегающий к протоспейсеру, (PAM) указан пунктирной линией под последовательностью. Инсерции (двойная линия под последовательностью) 1 п.н. (основатель №2529) или 7 п.н. (основатель №2533) приводили к сдвигу рамки считывания. WT=дикий тип.
Фигура 20: Получение модели свиней с дефицитом GHR с использованием технологии CRISPR/Cas. При иммуногистохимии лигандов определяли отсутствие функционального GHR (темное окрашивание в контроле) у свиней GHR-KO. Хромоген: DAB; докрашивание: гематоксилин Майера; планка=10 мкм.
Фигура 21A-C: Концентрации IGF1, IGFBP и GH в сыворотке свиней GHR-KO по сравнению с контрольными свиньями. A, средние значения и стандартное отклонение значений IGF1 в сыворотке (GHR-KO: n=42; контроль: n=69). B, количественный анализ IGFBP3 и IGFBP2 в сыворотке свиней GHR-KO (n=10) и контрольных свиней (n=12). На фигуре показаны медианы, 25-ые и 75-ые процентили (рамка) и экстремумы (усы). C, площадь под кривой GH (AUC; средние значения и стандартное отклонение для 6 самок свиней GHR-KO и 5 самок/1 самца контрольных свиней). AU=произвольные единицы. *p<0,05; ***p<0,001.
Фигура 22A-B: Увеличение массы тела и рост свиней GHR-KO по сравнению с контрольными свиньями. A, свинья GHR-KO (спереди) и контрольный детеныши из одного опороса возрастом 6 месяцев. B, Увеличение массы тела. Параметры определяли у 12 свиней GHR-KO и 25 контрольных свиней. На панели B показаны среднеквадратичные средние значения (LSM) и стандартные ошибки LSM, определяемые для группы*возраста. *p<0,05; **p<0,01; ***p<0,001; ns=незначимый.
Фигура 23A-B: Непропорциональный рост органов у свиней GHR-KO по сравнению с контрольными свиньями. Дефицит GHR приводил к пропорциональному и непропорциональному уменьшению размеров органов. A, типичные органы у контролей (слева) и свиней GHR-KO (справа). B, относительные различия между свиньями GHR-KO и контрольными свиньями по абсолютной массе органов и соотношения массы органов и массы тела (относительная масса органов). Эти параметры определяли у 9 свиней GHR-KO и 25 контрольных свиней, и среднеквадратичные средние значения (LSM) и стандартные ошибки LSM определяли в 2 группах. *p<0,05; **p<0,01; ***p<0,001.
Фигура 24A-D: A, состав тела 6-месячных GHR-KO по сравнению с контрольными свиньями. С помощью анализа DXA определяли значимо более высокое количество общего жира тела у свиней GHR-KO (GHR-KO: n=12; контроль: n=25;***p<0,001). На панели A показаны среднеквадратичные средние значения (LSM) и стандартные ошибки LSM, определяемые для 2 групп. B-D, возрастные изменения параметров гомеостаза глюкозы и липидов у свиней GHR-KO и контрольных свиней. B, транзиторная ювенильная гипогликемия у свиней GHR-KO. Концентрации (C) триглицеридов и (D) холестерина в сыворотке была значимо ниже у молодых свиней GHR-KO, чем у совпадающих по возрасту контролей, но нормализованных по возрасту. Исследовали по меньшей мере 6 животных на группу и возрастной класс. На панелях B-D показаны среднеквадратичные средние значения (LSM) и стандартные ошибки LSM, определяемые для группы*возраста. *p<0,05; **p<0,01.
Фигура 25: Получение hCD46/hTBM-трансгенных свиней GGTA1-KO, с дефицитом GHR. Первичные клетки выделяли из hCD46/hTBM-трансгенной свиньи GGTA1-KO и котрансфицировали с использованием Cas9-экспрессирующей плазмиды и плазмиды, с которой транскрибируется гидовая РНК, специфическая для экзона 3 GHR свиньи. Биаллельный GHR-мутантный клон клетки использовали для переноса ядра соматической клетки, и клонированные эмбрионы переносили в синхронизированных по эстральному циклу молодых свиней-реципиентов, что приводило к рождению небольших hCD46/hTBM-трансгенных свиней GGTA1-KO с дефицитом GHR.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если ниже не указано иначе, термины, используемые в настоящем описание, следует понимать в соответствии с их с общепринятым значением, известным специалисту в этой области.
В рамках изобретения термины "содержит" и "состоит из" имеют значение, известное в этой области. Необязательно, каждое использование термина "содержит" в рамках изобретения можно заменять термином "состоит из".
Все публикации, патенты и патентные заявки, процитированные в настоящем описании, включены, таким образом, в него в качестве ссылки в полном объеме для всех целей.
Определения
Термин "ксеногенный" используют в соответствии с его общим значением, известным в этой области. Таким образом, в рамках изобретения "ксеногенный донор" является донором, принадлежащим к иному биологическому виду, чем организм-реципиент. "Ксеногенная трансплантация" является трансплантацией, где трансплантат получают из биологического вида, отличающегося от организма-реципиента.
В рамках изобретения термин "разрастание", как правило, относится к любому повышению массы или объема органа или ткани, являющемуся вредоносным для функции органа или ткани, в частности, из-за экзогенных факторов (например, компрессии или ограничения пространства) или эндогенных факторов (например, гипоксии по причине недостаточной микрососудистой циркуляции). Таким образом, если сердце, почку или печень трансплантируют при массе, находящейся в пределах физиологического диапазона соответствующего органа организма-реципиента, в одном из вариантов осуществления настоящего изобретения термин "разрастание" означает, что масса органа повышалась, достигая массы, на 50% более высокой, чем физиологическая масса. Если легкое трансплантируют при объеме, находящемся в пределах физиологического диапазона легкого организма-реципиента, в одном из вариантов осуществления термин "разрастание" означает, что объем легкого повышалась, достигая объема, на 50% более высокого, чем физиологический объем. В рамках изобретения "масса или объем в пределах физиологического диапазона" означает массу или объем, соответственно, не отклоняющуюся более чем на ±20%, предпочтительно - более чем ±10% от физиологической массы или объема соответствующего органа соответствующего организма-реципиента. Специалист в этой области может определять физиологическую массу или объем органа для любого указанного реципиента, используя общие знания. Примеры физиологических масс и объемов органов приведены в ссылках 116 и 117. В рамках изобретения в предпочтительном варианте осуществления термин "разрастание" означает, что трансплантированный орган (например, сердце) в 3-4 раза увеличивается в объеме и массе в пределах приблизительно одного месяца после трансплантации.
В рамках изобретения термин "генетически модифицированное сердце/почка/легкое/печень" относится к сердцу/почке/легкому/печени, клетки которого несут искусственно модифицированный геном. В качестве неограничивающих примеров, такая искусственная модификация может являться, например, искусственной инсерцией экзогенных нуклеиновых кислот и/или делецией эндогенных нуклеиновых кислот. Специалисту в этой области известны различные способы внесения таких генетических модификаций для получения генетически модифицированного сердца/почки/легкого/печени. Например, мутации можно искусственно вносить в зародышевую линию животных таким образом, что все клетки такого генетически модифицированного животного несут соответствующие мутации в своих геномах. Сердце/почка/легкое/печень такого генетически модифицированного животного в рамках изобретения будет являться генетически модифицированным сердцем/почкой/легким/печенью.
В рамках изобретения термин "иммуносупрессорная индукционная терапия" относится к любому иммуносупрессорному терапевтическому средству, вводимому организму-реципиенту до трансплантации указанному организму-реципиенту трансплантата. Таким образом, в настоящем изобретении термин "иммуносупрессорная индукционная терапия" относится к иммуносупрессорному терапевтическому средству, вводимому организму-реципиенту до трансплантации сердца/почки/легкого/печени.
В рамках изобретения термин "иммуносупрессорная поддерживающая терапия" относится к любому иммуносупрессорному терапевтическому средству, вводимому организму-реципиенту после трансплантации указанному организму-реципиенту трансплантата. Таким образом, в настоящем изобретении термин "иммуносупрессорная поддерживающая терапия" относится к иммуносупрессорному терапевтическому средству, вводимому организму-реципиенту после трансплантации сердца/почки/легкого/печени.
В рамках изобретения термин "неишемическая консервация" относится к консервации ex vivo органа, где во время указанной консервации обеспечивают достаточное снабжение клеток указанного органа кислородом, питательными веществами и гормонами. Например, в одном из вариантов осуществления изобретения "неишемическую консервацию" хирургически извлеченного сердца/почки/легкого/печени осуществляют посредством "неишемической перфузии сердца/почки/легкого/печени". В рамках изобретения термин "неишемическая перфузия сердца/почки/легкого/печени" относится к консервации ex vivo сердца/почки/легкого/печени, где несущую кислород кровь или несущую кислород кровеподобную жидкость, дополненную питательными веществами и гормонами, прокачивают через кровеносные сосуды указанного сердца/почки/легкого/печени для обеспечения достаточного снабжения кислородом и энергией и удовлетворения потребностей клеток указанного сердца/почки/легкого/печени в гормонах.
В рамках изобретения термин "функциональная замена" сердца/почки/легкого/печени трансплантируемым сердцем/почкой/легким/печенью, предпочтительно, относится к ортотопической замене, но также может относиться к гетеротопической поддержке и, в случае трансплантированного сердца, к интраторакальной гетеротопической поддержке. Если замена является ортотопической заменой, замена является замещением, где трансплантируемое сердце/почка/легкое/печень перенимает функции собственного сердца/почки/легкого/печени реципиента. Для такой функциональной замены необходимо удаление сердца/почки/легкого/печени организма-реципиента перед трансплантацией и помещение донорского сердца/почки/легкого/печени в ортотопическое (т.е. природное) положение в организме-реципиенте. В случае трансплантируемого сердца, если замена является интраторакальной гетеротопической поддержкой, замену осуществляют для поддержки сердца реципиента, например, пораженного заболеванием в случае человека (см. ссылку 24, фигуру 10 B). При гетеротопической интраторакальной замене собственное сердце реципиента остается на месте, в то время как донорское сердце гемодинамически подсоединяют параллельно и справа; другими словами, донорский орган поддерживает (как указано) сердце реципиента (которое, например, в клинических условиях будет поражено заболеванием на терминальной стадии). Как будет очевидно специалисту в этой области, функциональные параметры (например, частота сердечных сокращений, минутный объем кровообращения, фракция выброса, ударный объем и т.д.) трансплантированного сердца могут не являться идентичными функциональным параметрам собственного сердца реципиента. Несмотря на это, трансплантированное сердце считают функциональной заменой сердца реципиента, если функциональные параметры находятся в пределах диапазона, делающего возможной выживаемость реципиента.
В рамках изобретения термин "противовоспалительная терапия" известен в этой области и относится к введению противовоспалительных средство. Как известно специалисту в этой области, противовоспалительные свойства средств можно оценивать in silico, in vitro, и/или in vivo. Например, средство будут считать имеющим противовоспалительные свойства (и, таким образом, являющимся противовоспалительным средством), если указанное средство снижает или ингибирует, или ожидают, что оно будет снижать или ингибировать, провоспалительный сигнал, опосредованный ксеногенным белком, и/или если указанное средство снижает или ингибирует воспаление у индивидуума.
Временная точка трансплантации сердца/почки/легкого/печени по изобретению является временной точкой, в которой трансплантированное сердце/почка/легкое/печень начинает функционально замещать сердце/почку/легкое/печень организма-реципиента. Например, если глюкокортикоид вводят "в пределах 1 дня после трансплантации", такое введение глюкокортикоида осуществляют в пределах периода времени, начинающегося, когда трансплантированное сердце/почка/легкое/печень начинает функционально замещать сердце/почку/легкое/печень организма-реципиента, и заканчивающего к концу следующего дня. Таким образом, если трансплантацию осуществляют утром, период времени "в пределах 1 дня после трансплантации" заканчиваются к концу последующего дня, т.е. через более чем 24 часа. Аналогично, период времени, например, "от 2 дней до 9 дней после трансплантации" или "от 2 до 9 дней после трансплантации" начинается в начале 2-го дня после трансплантации и заканчивается в конце 9-го дня после трансплантации. Если указано, что введение осуществляют, например, "через 5 дней после трансплантации", это относится к введению в 5-ый день после трансплантации.
В рамках изобретения термин "доза (мг/кг/сутки)" относится к дозе вещества в миллиграммах (мг), вводимой индивидууму на килограмм (кг) массы тела индивидуума в сутки. Такую дозу можно вводить, например, за одно введение или за несколько введений, распределенных в течение дня, или ее можно вводить посредством непрерывного введения. При снижении дозы (мг/кг/сутки) в конкретное количество раз сниженную дозу вычисляют, разделяя дозу при первом введении на указанное количество раз. Например, если глюкокортикоид вводят как часть иммуносупрессорной поддерживающей терапии в начальной дозе 10 мг/кг/сутки, снижение этой дозы до 2 мг/кг/сутки будет являться снижением в 5 раз.
Термин "среднее артериальное давление" используют в соответствии с его общим значением, известным в этой области, и он относится к среднему артериальному давлению в артериях индивидуума в течение одного сердечного цикла. Специалисту в этой области будут известны различные способы определения среднего артериального давления.
В рамках изобретения термин "эндогенный промотор" относится к промотору, от природы присутствующему в геноме соответствующего млекопитающего. В отличие от этого, в рамках изобретения термин "экзогенный промотор" относится к промотору, в природе не присутствующему в геноме соответствующего млекопитающего.
В рамках изобретения термин "убиквитарно активный промотор" относится к промотору, регулирующему экспрессию гена во множестве типов тканей и клеток. Другими словами, если экспрессия гена контролируется убиквитарно активным промотором, экспрессия не является тканеспецифической.
В рамках изобретения термин "сердце/почка/легкое/печень" означает один или более органов, выбранных из группы, состоящей из сердца, почки, легкого и печени. В рамках изобретения в предпочтительном варианте осуществления термин "сердце/почка/легкое/печень" означает сердце, почку, легкое или печень.
Варианты осуществления
Способ пролонгирования выживаемости примата после трансплантации сердца/почки/легкого/печени
Настоящее изобретение относится к способу пролонгирования выживаемости организма-реципиента, которому трансплантируют генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора. Помимо прочего, каждый из следующих аспектов способа по настоящему изобретению вносит вклад в пролонгированную выживаемость организма-реципиента: (1) Введение иммуносупрессорного индукционного терапевтического средства реципиенту перед трансплантацией. (2) Консервация хирургически извлеченного сердца/почки/легкого/печени из организма-донора посредством неишемической консервации до трансплантации. (3) Введение иммуносупрессорного поддерживающего терапевтического средства организму-реципиенту, включающее первое введение глюкокортикоида в пределах 1 дня после трансплантации, и где дозу (мг/кг/сутки) указанного глюкокортикоида снижают по меньшей мере в 5 раз в пределах 5 дней после трансплантации. (4) Введение одного или более антигипертензивных средств организму-реципиенту после трансплантации. (5) Введение ингибитора mTOR организму-реципиенту после трансплантации. Указанные выше аспекты (в отдельности или в комбинации) способствуют пролонгированию выживаемости организма-реципиента, которому трансплантируют сердце/почку/легкое/печень из ксеногенного организма-донора, по сравнению с выживаемостью организма-реципиента, которому трансплантируют сердце/почку/легкое/печень из ксеногенного организма-донора, но которого не лечат по изобретению. В одном из вариантов осуществления изобретения способом по настоящему изобретению пролонгируют выживаемость организма-реципиента до более чем 40 дней после трансплантации, до более чем 50 дней после трансплантации, до более чем 60 дней после трансплантации, до более чем 70 дней после трансплантации, до более чем 80 дней после трансплантации или до более чем 90 дней после трансплантации. Предпочтительно, способом по настоящему изобретению пролонгируют выживаемость организма-реципиента до более чем 50 дней после трансплантации, более предпочтительно - до более чем 70 дней после трансплантации, и наиболее предпочтительно - до более чем 90 дней после трансплантации.
В настоящем изобретении организм-реципиент представляет собой примата, предпочтительно - организм-реципиент принадлежит к семейству Cercopithecidae, более предпочтительно - организм-реципиент принадлежит к роду Papio, даже более предпочтительно - организм-реципиент принадлежит к биологическому виду Papio anubis или Papio hamadryas, наиболее предпочтительно - организм-реципиент принадлежит к биологическому виду Papio anubis. Павиан (Papio) может служить в качестве модельного организма для трансплантации сердца/почки/легкого/печени у людей. Таким образом, в другом варианте осуществления настоящего изобретения организм-реципиент принадлежит к семейству Hominidae, предпочтительно - организм-реципиент принадлежит к роду Homo, более предпочтительно - организм-реципиент является человеком. В альтернативном варианте осуществления настоящего изобретения, организм-реципиент принадлежит к семейству Cercopithecidae, предпочтительно - к роду Macaca, наиболее предпочтительно - к биологическому виду M. mulatta.
В настоящем изобретении организм-донор представляет собой млекопитающего, предпочтительно - организм-донор принадлежит к семейству Suidae, более предпочтительно - организм-донор принадлежит к роду Sus, даже более предпочтительно - организм-донор принадлежит к биологическому виду S. scrofa, и наиболее предпочтительно - организм-донор принадлежит к подвиду S. s. domesticus. Предпочтительно, организм-донор является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы, свиньей породы дюрок, свиньей швабско-галльской породы, черным минипигом или свиньей Оклендских островов (имеющей меньше микроорганизмов-возбудителей инфекций, см. ссылку 26); более предпочтительно - организм-донор является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы. Во всех других аспектах этого варианта осуществления организм-донор является ювенильным.
Если в рамках изобретения трансплантируют сердце, почку или печень, предпочтительно выбирать организм-донор таким образом, чтобы масса органа, подлежащего трансплантации, находилась в пределах физиологического диапазона соответствующего органа организма-реципиента. В рамках изобретения термин "масса в пределах физиологического диапазона" означает, что масса органа не отклоняется более чем на ±20%, предпочтительно, более чем на ± 10% от физиологической массы органа соответствующего организма-реципиента. Если в рамках изобретения трансплантируют легкое, предпочтительно выбирать организм-донор таким образом, чтобы объем легкого находился в пределах физиологического диапазона легкого организма-реципиента. В рамках изобретения термин "объем в пределах физиологического диапазона" означает, что объем легкого не отклоняется более чем на ±20%, предпочтительно - более чем на ±10% от физиологического объема легкого соответствующего организма-реципиента. Специалист в этой области можно определять физиологическую массу или объем органа для любого указанного реципиента, используя общие знания. Примеры физиологических масс и объемов органов приведены в ссылках 116 и 117. Как будет очевидно специалисту в этой области, масса тела организма может служить в качестве показателя массы и объема его органов. Таким образом, в другом варианте осуществления настоящего изобретения масса тела организма-донора не отклоняется более чем на ±20%, предпочтительно - более чем на ±10% от массы тела организма-реципиента.
В рамках изобретения сердце/почку/легкое/печень генетически модифицируют во избежание отторжения трансплантата организмом-реципиентом. Специалисту в этой области будут известны подходящие генетические модификации в зависимости от соответствующего организма-донора и соответствующего организма-реципиента по настоящему изобретению. В одном из вариантов осуществления генетически модифицированное сердце/почка/легкое/печень по настоящему изобретению имеет следующие генетические модификации: (1) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы; (2) инсерцию гена CD46 человека; и (3) инсерцию гена тромбомодулина человека. Если организм-донор принадлежит к семейству Suidae, и организм-реципиент принадлежит к роду Papio, генетически модифицированное сердце/почка/легкое/печень, необязательно, может иметь только указанную выше генетическую модификацию (1), т.е. гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы. Если организм-донор принадлежит к семейству Suidae, и организм-реципиент является человеком, генетически модифицированное сердце/почка/легкое/печень предпочтительно имеет все из указанных выше генетических модификаций (1)-(3). В другом варианте осуществления генетически модифицированное сердце/почка/легкое/печень по настоящему изобретению имеет следующие генетические модификации: (1) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы, гена CMAH и гена B4GALNT2; (2) инсерцию гена CD46 человека, гена CD55 человека, гена CD59 человека, гена гемоксигеназы 1 и гена A20; и, необязательно, (3) инсерцию гена LEA или гена PDL-1 (PD-L1, PDL1, CD274). Подробности генетических модификаций по этому варианту осуществления можно найти в ссылке 23 (в полном объеме включенной в настоящее описание). В этом варианте осуществления ген гемоксигеназы 1, ген A20, ген LEA и ген PDL-1 можно получать из любого организм, но, предпочтительно, они являются геном гемоксигеназы 1 человека, геном A20 человека, геном LEA человека и геном PDL-1 человека, соответственно. В указанных выше вариантах осуществления при инсерции гена CD46 человека (huCD46), предпочтительно, экспрессируются транскрипты, соответствующие любому транскрипту, продуцирующемуся со следующего геномного локуса/кодирующей области: GRCH38p7, NC_000001, область 207752038-207795516. Более предпочтительно, при инсерции гена CD46 человека по меньшей мере один из следующих транскриптов экспрессируется с экспрессирующей кассеты трансгена: NM_002389, NM_172359, NM_172351, NM_153826, NM_172352, NM_172353, NM_172350 и NM_172361. В указанных выше вариантах осуществления при инсерции гена тромбомодулина человека (huTHBD, huTBM), предпочтительно, экспрессируются транскрипты, соответствующие любому транскрипту, продуцирующемуся со следующего геномного локуса/кодирующей области: GRCH38p7, NC_000020, область 23045633-23049664. Более предпочтительно, при инсерции гена тромбомодулина человека следующий транскрипт экспрессируется с экспрессирующей кассеты трансгена: NM_000361. В указанных выше вариантах осуществления при инсерции гена CD55 человека (huCD55), предпочтительно, экспрессируются транскрипты, соответствующие любому транскрипту, продуцирующемуся со следующего геномного локуса/кодирующей области: GRCH38p7, NC_000001, область 207321472-207360966. Более предпочтительно, при инсерции гена CD55 человека по меньшей мере один из следующих транскриптов экспрессируется с экспрессирующей кассеты трансгена: NM_001114752, NM_001300903, NM_001300904, NM_000574 и NM_001300902.В указанных выше вариантах осуществления при инсерции гена CD59 человека (huCD59), предпочтительно, экспрессируются транскрипты, соответствующие любому транскрипту, продуцирующемуся со следующего геномного локуса/кодирующей области: GRCH38p7, NC_000011, область 33703010-33736479. Более предпочтительно, при инсерции гена CD59 человека по меньшей мере один из следующих транскриптов экспрессируется с экспрессирующей кассеты трансгена: NM_000611, NM_203331, NM_203329, NM_203330, NM001127227, NM_001127226, NM_001127225 и NM_001127223.В указанных выше вариантах осуществления при инсерции гена гемоксигеназы 1 человека (huHMOX1, huHO1), предпочтительно, экспрессируются транскрипты, соответствующие любому транскрипту, продуцирующемуся со следующего геномного локуса/кодирующей области: GRCH38p7, NC_000022, область 35381067-35394214. Более предпочтительно, при инсерции гена гемоксигеназы 1 человека следующий транскрипт экспрессируется с экспрессирующей кассеты трансгена: NM_002133. В указанных выше вариантах осуществления при инсерции гена A20 человека (huA20, huTNFAIP3), предпочтительно, экспрессируются транскрипты, соответствующие любому транскрипту, продуцирующемуся со следующего геномного локуса/кодирующей области: GRCH38p7, NC_000006,12, область 137866317-137883314. Более предпочтительно, при инсерции гена A20 человека по меньшей мере один из следующих транскриптов экспрессируется с экспрессирующей кассеты трансгена: NM_001270508; NM_001270507; NM_006290. Как будет очевидно специалисту в этой области, в рамках изобретения термин "ген LEA" относится к синтетической последовательности, кодирующей искусственный белок CTLA4-Ig, оптимизированный для высокой аффинности к CD80/CD86. В указанных выше вариантах осуществления при инсерции гена LEA человек (т.е. последовательности), предпочтительно, экспрессируют следующий кодон-оптимизированный вариант LEA29Y, например, с экспрессирующей кассеты трансгена:
atgggggtactgctcacacagaggacgctgctcagtctggtccttgcactcctgtttccaagcatggcgagcatggcgatgcacgtggcccagcctgctgtggtactggccagcagccgaggcatcgccagctttgtgtgtgagtatgcatctccaggcaaatatactgaggtccgggtgacagtgcttcggcaggctgacagccaggtgactgaagtctgtgcggcaacctacatgatggggaatgagttgaccttcctagatgattccatctgcacgggcacctccagtggaaatcaagtgaacctcactatccaaggactgagggccatggacacgggactctacatctgcaaggtggagctcatgtacccaccgccatactacgagggcataggcaacggaacccagatttatgtaattgatccagaaccgtgcccagattctgatcaggagcccaaatcttctgacaaaactcacacatccccaccgtccccagcacctgaactcctggggggatcgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgggtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggatgagctgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatga (SEQ ID NO: 1).
В указанных выше вариантах осуществления при инсерции гена PDL-1 человека (huPD-L1, huPDL1, huCD274), предпочтительно, экспрессируются транскрипты, соответствующие любому транскрипту, продуцирующемуся со следующего геномного локуса/кодирующей области: GRCH38p7, NC_000009, область 5450503-5470567. Более предпочтительно, при инсерции гена PDL-1 человека по меньшей мере один из следующих транскриптов экспрессируется с экспрессирующей кассеты трансгена: NM_014143; NM_001267706; NM_00134029.
Как будет очевидно специалисту в этой области, и что напрямую следует из указанного выше, в рамках изобретения, когда ссылаются на "инсерцию гена", в предпочтительном варианте осуществления встраивают не весь ген. В этом варианте осуществления можно встраивать любую последовательность (например, в экспрессирующей кассете), делающую возможной транскрипцию соответствующего гена, подлежащего экспрессии.
В другом варианте осуществления, который можно комбинировать с любыми из описанных выше вариантов осуществления, генетически модифицированное сердце/почка/легкое/печень по настоящему изобретению дополнительно имеет инсерцию последовательности, кодирующей α1,2-фукозилтрансферазу человека. Предпочтительно, α1,2-фукозилтрансфераза человека является белком, экспрессирующимся со следующего гена: общепринятое обозначение: FUT1; общепринятое полное название: фукозилтрансфераза 1 (группа крови H); первичный источник: HGNC: HGNC:4012; см.: Ensembl: ENSG00000174951, MIM: 211100.
В настоящем изобретении, когда ссылаются на инсерцию гена/последовательности, эта инсерция может являться гетерозиготной или гомозиготной инсерцией. Как будет очевидно специалисту в этой области, если уровень экспрессии является недостаточно высоким при гетерозиготной инсерции, гомозиготная инсерция является предпочтительной.
Предпочтительно, в рамках изобретения генетически модифицированное сердце/почку/легкое/печень получают из генетически модифицированного организма-донора, т.е. из организма-донора, несущего соответствующие генетические модификации в своей зародышевой линии. Способы получения таких генетически модифицированных организмов-доноров (например, свиней) известны специалисту в этой области (см. ссылки 92, 103, 104 и 105, все из которых включены в настоящее описание в полном объеме). В качестве альтернативы общепринятым способам, генетически модифицированных свиней также можно получать новыми способами, такими как способы с использованием CRISPR/CAS 9, которые могут обеспечивать получение улучшенных локусов для инсерций.
Иммуносупрессорное индукционное терапевтическое средство, иммуносупрессорное поддерживающее терапевтическое средство, противовоспалительное терапевтическое средство, антигипертензивные средства и ингибитор mTOR по изобретению вводят в соответствии со схемами введения. Каждая схема введения может включать введение только одного фармацевтически активного средства или введение нескольких фармацевтически активных средств. Если схема введения включает введение нескольких фармацевтически активных средств, указанные средства можно смешивать в одной композиции перед введением или их можно вводить раздельно. При раздельном введении указанные фармацевтически активные средства можно вводить, по существу, одновременно (например, одновременно или последовательно) или их можно вводить в разные моменты времени. Кроме того, независимо от того, включает ли схема введения введение только одного фармацевтически активного средства или нескольких фармацевтически активных средств, каждая схема введения может включать одно введение каждого фармацевтически активного средства или несколько введений каждого фармацевтически активного средства. Если схема введения включает введение нескольких фармацевтически активных средств, и если несколько фармацевтически активных средств вводят несколько раз, временные интервалы между введениями разных фармацевтически активных средств могут отличаться. Например, если схема введения включает несколько введений фармацевтически активного средства A и фармацевтически активного средства B, фармацевтически активное средство A можно вводить каждый день (или после фиксированного интервала в один или несколько дней), в то время как фармацевтически активное средство B можно вводить через день. Любое первое введение фармацевтически активного средства в рамках схемы введения по изобретению обозначают как "первое введение". Разумеется, такое "первое введение" не исключает того, что индивидууму вводят то же фармацевтически активное средство до начала схемы введения в рамках изобретения.
Как будет очевидно специалисту в этой области, если настоящее изобретение относится к одному введению фармацевтически активного средства, осуществляемому в указанный день после трансплантации, такое одно введение также можно разделять на несколько введений, при условии, что эти несколько введений осуществляют в один и тот же день. Разумеется, если доза указана для такого одного введения, и одно введение разделяют на несколько введений, осуществляемых в один и тот же день, дозы для нескольких введений необходимо суммировать в дозу для одного введения, указанную в настоящем описании. Как будет очевидно специалисту в этой области, введение также может являться непрерывным введением, где фармацевтически активное средство вводят непрерывно на всем протяжении всего дня. Если дозу указывают для такого непрерывного введения, доза представляет собой суммарную дозу, вводимую на всем протяжении дня. Если непрерывные введения осуществляют в последовательные дни, фармацевтически активное средство вводят непрерывно в течение нескольких дней.
В рамках изобретения иммуносупрессорное индукционное терапевтическое средство вводят организму-реципиенту в соответствии со схемой введения. Указанная схема введения включает введение одного или более иммуносупрессорных средств перед трансплантацией. Примеры иммуносупрессорных средств, которые можно вводить в соответствии со схемой введения иммуносупрессорного индукционного терапевтического средства, включают антитело против CD20, антитимоцитарный глобулин и антитело против CD40/пасилированный Fab против CD40L (антигенсвязывающий фрагмент).
В одном из вариантов осуществления изобретения схема введения иммуносупрессорного индукционного терапевтического средства включает введение антитела против CD20. В предпочтительном варианте осуществления указанное антитело против CD20 является антителом против CD20 Mabthera, коммерчески доступным в Roche Pharma AG (Grenzach-Wyhlen, Germany). Схема введения иммуносупрессорного индукционного терапевтического средства может включать одно или несколько введений антитела против CD20. В предпочтительном варианте осуществления схема введения включает одно введение антитела против CD20. Более предпочтительно - указанное одно введение антитела против CD20 осуществляют за 5-9 дней до трансплантации сердца/почки/легкого/печени, наиболее предпочтительно - указанное одно введение осуществляют за 7 дней до трансплантации сердца/почки/легкого/печени. Предпочтительная доза при введении антитела против CD20 составляет 19 мг на кг массы тела. Во всех других аспектах этого варианта осуществления предпочтительным путем введения антитела против CD20 является короткая внутривенная (i.v.) инфузия.
В другом варианте осуществления изобретения схема введения иммуносупрессорного индукционного терапевтического средства включает введение антитимоцитарного глобулина (ATG). В предпочтительном варианте осуществления указанный антитимоцитарный глобулин является антитимоцитарным глобулином тимоглобулином, коммерчески доступным в Sanofi-Aventis Germany GmbH (Frankfurt, Germany). Схема введения иммуносупрессорного индукционного терапевтического средства может включать одно или несколько введений антитимоцитарного глобулина. В предпочтительном варианте осуществления схема введения включает несколько введений антитимоцитарного глобулина, в даже более предпочтительном варианте осуществления схема введения включает два введения антитимоцитарного глобулина. Предпочтительно, указанные два введения антитимоцитарного глобулина осуществляют в пределах 3 дней до трансплантации сердца/почки/легкого/печени, наиболее предпочтительно, их осуществляют за 1 и 2 дня до трансплантации сердца/почки/легкого/печени, соответственно. Предпочтительная доза при введении антитимоцитарного глобулина составляет 50 мг на кг массы тела. В другом варианте осуществления предпочтительная доза при введении антитимоцитарного глобулина составляет 5 мг на кг массы тела. Во всех других аспектах этого варианта осуществления предпочтительным путем введения антитимоцитарного глобулина является короткая внутривенная (i.v.) инфузия.
В другом варианте осуществления изобретения схема введения иммуносупрессорного индукционного терапевтического средства включает введение антитела против CD40 или пасилированного Fab против CD40L. В предпочтительном варианте осуществления указанное антитело против CD40 является клоном химерного IgG4 мыши/макака-резуса 2C10R4, доступным в NIH Nonhuman Primate Reagent Resource, Mass Biologicals, Boston, MA, USA; любезно предоставленным Keith Reimann. В другом предпочтительном варианте осуществления указанный пасилированный Fab против CD40L является гуманизированным пасилированным Fab против CD40L, производимым Wacker-Chemie (Burghausen, Germany) и очищенным XL-protein GmbH (Freising, Germany), как описано в Binder & Skerra (см. ссылку 9). Схема введения иммуносупрессорного индукционного терапевтического средства может включать одно или несколько введений антитела против CD40/пасилированного Fab против CD40L. В предпочтительном варианте осуществления схема введения включает одно введение антитела против CD40/пасилированного Fab против CD40L. Более предпочтительно - указанное одно введение антитела против CD40/пасилированного Fab против CD40L осуществляют в пределах 2 дней до трансплантации сердца/почки/легкого/печени, наиболее предпочтительно - указанное одно введение осуществляют за 1 день до трансплантации сердца/почки/легкого/печени. Предпочтительная доза введения составляет 50 мг на кг массы тела антитела против CD40 или 20 мг на кг массы тела пасилированного Fab против CD40L. Во всех других аспектах этого варианта осуществления предпочтительным путем введения антитела против CD40/пасилированного Fab против CD40L является короткая внутривенная (i.v.) инфузия.
В предпочтительном варианте осуществления изобретения схема введения иммуносупрессорного индукционного терапевтического средства включает введение антитела против CD20, антитимоцитарного глобулина и антитела против CD40/пасилированного Fab против CD40L. В этом предпочтительном варианте осуществления предпочтительное антитело против CD20, предпочтительный антитимоцитарный глобулин и предпочтительное антитело против CD40/пасилированный Fab против CD40L являются такими, как описано для соответствующих вариантов осуществления выше. Кроме того, в этом предпочтительном варианте осуществления предпочтительные частоты, предпочтительные моменты времени, предпочтительные дозы и предпочтительные пути введения также являются такими, как описано для соответствующих вариантов осуществления выше. В рамках изобретения особенно предпочтительная схема введения иммуносупрессорного индукционного терапевтического средства представлена на фигуре 7.
В рамках изобретения хирургическое извлечение сердца/почки/легкого/печени из организма-донора осуществляют как известно специалисту в этой области. Затем хирургически извлеченное сердце/почку/легкое/печень консервируют посредством неишемической консервации до трансплантации. Длительность неишемической консервации, предпочтительно, составляет менее 24 часов, более предпочтительно - менее 15 часов, даже более предпочтительно - менее 10 часов, даже более предпочтительно - менее 5 часов, и наиболее предпочтительно - менее 4 часов. Предпочтительно, указанная неишемическая консервация является неишемической перфузией сердца/почки/легкого/печени, например, как описано в случае неишемической перфузии сердца по Steen et al. в ссылке 10 (включенной в настоящее описание в полном объеме). Для такой неишемической перфузии сердца можно использовать 3,5 л оксигенированного альбумин-содержащего гиперонкотического кардиоплегического питательного раствора с гормонами и эритроцитами при температуре 8°C в портативной экстракорпоральной системе консервации сердца, состоящей из перистальтического насоса с контролируемым давлением и потоком, обменника O2/CO2, лейкоцитарного фильтра, артериального фильтра и холодильно-нагревательного модуля. После пережатия аорты сердце можно перфузировать 600 мл консервационной среды, затем иссекать и перемещать в систему консервации сердца. В восходящую дугу аорты можно вставлять большую канюлю и митральный клапан можно делать временно нефункционирующим для предотвращения дилатации левого желудка; верхнюю полую вену можно окклюдировать, однако, нижнюю полую вену, легочную артерию и легочные вены можно оставлять открытыми для свободного выхода перфузата. Сердце можно погружать в резервуар, наполненный холодной перфузионной средой, и можно начинать антеградную коронарную перфузию через уже помещенную аортальную канюлю. Перфузионное давление можно оставлять на уровне ровно 20 мм рт.ст. Во время имплантации сердце можно периодически перфузировать в течение 2 мин каждые 20 мин.
В рамках изобретения трансплантацию сердца/почки/легкого/печени организму-реципиенту также осуществляют как известно специалисту в этой области. Предпочтительно, организм-реципиент подвергают анестезии и анальгезии, которые могут включать введение кетамина гидрохлорида, мидазолама, пропофола, фентанила, севофлурана и/или метамизола, например, как описано в ссылке 11 (включенной в настоящее описание в полном объеме). В предпочтительном варианте осуществления трансплантацию сердца осуществляют способом Shumway и Lower, как описано в ссылке 8, включенной в настоящее описание в полном объеме.
В способах по настоящему изобретению хирургически извлеченное, консервированное сердце/почку/легкое/печень организма-донора трансплантируют организму-реципиенту таким образом, что им функционально заменяют сердце/почку/легкое/печень организма-реципиента. Такая функциональная замена, предпочтительно, является ортотопической заменой, но также может являться гетеротопической поддержкой и, в случае трансплантированного сердца, интраторакальной гетеротопической поддержкой. Ортотопическую замену сердца можно осуществлять, как описано в примере 1. Интраторакальная гетеротопическая трансплантация сердца также является жизнеобеспечивающей и будет являться альтернативой. В кратком изложении, при интраторакальной гетеротопической трансплантации сердца сердце реципиента оставляют на месте и в качестве резерва на случай, если трансплантированный ксеногенный орган откажет, что является важной стратегией, которую можно использовать по меньшей мере в самом начале клинического пилотного исследования (и будет возможной повторная трансплантация). Интраторакальную гетеротопическую ксеногенную трансплантацию сердца можно осуществлять способом (фигура 10B), основанным на способе, разработанном C.N. Barnard (см. ссылки 24, 25). Для этого способа необходима поддержка с помощью аппарата для сердечно-легочной реанимации. Донорское сердце (например, сердце свиньи) помещают справа от сердца реципиента (например, павиана), таким образом, сдавливая части правого легкого. Имплантацию начинают с анастомозов левого и правого предсердий. Затем обе аорты комбинируют терминолатерально. И наконец, обе легочные артерии соединяют с помощью трансплантата для интерпозиции (см. фигуру 10B). В отличие от абдоминально трансплантированных сердец, сокращающих, но не изгоняющих кровь (см. фигуру 10C, иммунологическая модель), интраторакально размещенные трансплантаты изгоняют кровь. Посредством послеоперационной эхокардиографии подтверждают систолические и диастолические движения аортального и митрального клапанов, и кривые аортального систолического давления коррелируют с ЭКГ донора. После интраторакальных гетеротопических процедур и донорское сердце, и сердце реципиента (которое в клинических условиях может иметь нарушенную функцию) вносят вклад в минутный объем кровообращения в соответствии со своими соответствующими сердечными циклами (их конечно-диастолическим давлением). Интраторакальную гетеротопическую трансплантацию ксеногенного сердца будут осуществлять, как описано в ссылке 25. Разумеется, интраторакальную гетеротопическую трансплантацию ксеногенного сердца, описанную в ссылке 25, предпочтительно, комбинируют с неишемической консервацией сердца по изобретению, введением иммуносупрессорного индукционного и поддерживающего терапевтического средства по изобретению, снижением дозы глюкокортикоида, вводимого как часть иммуносупрессорной поддерживающей терапии по изобретению, введением противовоспалительного терапевтического средства по изобретению, введением одного или более антигипертензивных средств в рамках изобретения по изобретению и/или введением ингибитора mTOR по изобретению.
Иммуносупрессорное поддерживающее терапевтическое средство по изобретению вводят организму-реципиенту в соответствии со схемой введения. Указанная схема введения включает введение одного или более иммуносупрессорных средств после трансплантации, где схема введения включает первое введение глюкокортикоида в пределах 1 дня после трансплантации, предпочтительно, в день трансплантации. В дополнение к глюкокортикоиду, примеры иммуносупрессорных средств, которые можно вводить в соответствии со схемой введения иммуносупрессорного поддерживающего терапевтического средства, включают антитело против CD20, микофенолата мофетил и антитело против CD40/пасилированный Fab против CD40L.
Схема введения иммуносупрессорного поддерживающего терапевтического средства в рамках изобретения, необязательно, включает введение глюкокортикоида. Первое введение глюкокортикоида осуществляют в пределах 1 дня после трансплантации, предпочтительно, в день трансплантации. Схема введения иммуносупрессорного поддерживающего терапевтического средства включает несколько введений глюкокортикоида, предпочтительно, одно введение в каждый день после первого введения. Предпочтительная доза глюкокортикоида в день первого введения составляет от 5 мг/кг/сутки до 15 мг/кг/сутки, предпочтительно - от 7 мг/кг/сутки до 13 мг/кг/сутки, более предпочтительно - от 9 мг/кг/сутки до 11 мг/кг/сутки, наиболее предпочтительно - 10 мг/кг/сутки. Схема введения иммуносупрессорного поддерживающего терапевтического средства включает снижение дозы (мг/кг/сутки) глюкокортикоида, вводимого организму-реципиенту по меньшей мере в 5 раз, предпочтительно - по меньшей мере в 10 раз, в пределах 5 дней после трансплантации. Например, если доза глюкокортикоида в день первого введения составляет 10 мг/кг/сутки, максимальная доза в 5-ый день после трансплантации составляет 2 мг/кг/сутки, предпочтительно - 1 мг/кг/сутки. В предпочтительном варианте осуществления в различных аспектах схема введения иммуносупрессорного поддерживающего терапевтического средства включает снижение дозы (мг/кг/сутки) глюкокортикоида, вводимого организму-реципиенту по меньшей мере в 10 раз, предпочтительно - по меньшей мере в 20 раз, в пределах 10 дней после трансплантации. В другом предпочтительном варианте осуществления схема введения иммуносупрессорного поддерживающего терапевтического средства включает снижение дозы (мг/кг/сутки) глюкокортикоида, вводимого организму-реципиенту по меньшей мере в 50 раз, предпочтительно по меньшей мере в 100 раз, в пределах 20 дней после трансплантации. В принципе, в настоящем изобретении можно использовать любой кортикостероид с глюкокортикоидной активностью. Однако в предпочтительном варианте осуществления глюкокортикоид является кортизолом, кортизоном, преднизоном, преднизолоном, метилпреднизолоном, дексаметазоном, бетаметазоном или триамцинолоном, предпочтительно - глюкокортикоид является преднизолоном или метилпреднизолоном, наиболее предпочтительно - глюкокортикоид является метилпреднизолоном. Метилпреднизолон коммерчески доступен, например, как урбазон солюбиле от Sanofi-Aventis Germany GmbH (Frankfurt, Germany). Во всех других аспектах этого варианта осуществления предпочтительным путем введения глюкокортикоида является внутривенная (i.v.) болюсная инъекция.
В одном из вариантов осуществления изобретения схема введения иммуносупрессорного поддерживающего терапевтического средства включает введение антитела против CD20. Если антитело против CD20 уже вводили как часть предшествующей иммуносупрессорной индукционной терапии, антитело против CD20, вводимое как часть иммуносупрессорной поддерживающей терапии, предпочтительно, является тем же антителом против CD20, которое вводили как часть иммуносупрессорной индукционной терапии. В предпочтительном варианте осуществления антитело против CD20 при иммуносупрессорной индукционной терапии и иммуносупрессорной поддерживающей терапии является антителом против CD20 Mabthera, коммерчески доступным в Roche Pharma AG (Grenzach-Wyhlen, Germany). Схема введения иммуносупрессорного поддерживающего терапевтического средства может включать одно или несколько введений антитела против CD20. В предпочтительном варианте осуществления схема введения включает несколько введений антитела против CD20. Более предпочтительно, схема введения включает от 2 до 4 введений антитела против CD20, наиболее предпочтительно, схема введения включает 3 введения антитела против CD20. В одном из вариантов осуществления схема введения иммуносупрессорного поддерживающего терапевтического средства включает введение антитела против CD20 в пределах 1 дня после трансплантации, предпочтительно, схема введения иммуносупрессорного поддерживающего терапевтического средства включает введение антитела против CD20 в день трансплантации. В другом варианте осуществления, если схема введения включает два или более введений антитела против CD20, схема введения включает введение антитела против CD20 в пределах 1 дня после трансплантации и введение антитела против CD20 через 6-8 дней после трансплантации, предпочтительно, введение антитела против CD20 в день трансплантации и введение антитела против CD20 через 7 дней после трансплантации. В другом варианте осуществления, если схема введения включает три или более введений антитела против CD20, схема введения включает введение антитела против CD20 в пределах 1 дня после трансплантации, введение антитела против CD20 через 6-8 дней после трансплантации и введение антитела против CD20 через 13-15 дней после трансплантации, предпочтительно, введение антитела против CD20 в день трансплантации, введение антитела против CD20 через 7 дней после трансплантации и введение антитела против CD20 через 14 дней после трансплантации. Предпочтительная доза при введении антитела против CD20 составляет 19 мг на кг массы тела. Во всех других аспектах этого варианта осуществления предпочтительным путем введения антитела против CD20 является короткая внутривенная (i.v.) инфузия.
В другом варианте осуществления изобретения схема введения иммуносупрессорного поддерживающего терапевтического средства включает введение микофенолата мофетила (MMF). В предпочтительном варианте осуществления микофенолата мофетил в рамках иммуносупрессорной поддерживающей терапии является микофенолата мофетилом CellCept, коммерчески доступным в Roche (Basle, Switzerland). Схема введения иммуносупрессорного поддерживающего терапевтического средства, предпочтительно, включает несколько введений микофенолата мофетила, где одно введение осуществляют в пределах 1 дня после трансплантации, предпочтительно, в день трансплантации. В предпочтительном варианте осуществления схема введения иммуносупрессорного поддерживающего терапевтического средства включает одно введение микофенолата мофетила каждый день после трансплантации. Предпочтительная доза при введении микофенолата мофетила составляет 40 мг на кг массы тела. Даже более предпочтительно, дозу корректируют до остаточного уровня 2-3 мкг/мл. Во всех других аспектах этого варианта осуществления предпочтительным путем введения микофенолата мофетила является непрерывная внутривенная (i.v.) инфузия. В предпочтительном варианте осуществления, если микофенолата мофетил вводят в соответствии со схемой введения иммуносупрессорного поддерживающего терапевтического средства, микофенолата мофетил дополнительно вводят перед трансплантацией для достижения уровней терапевтического лекарственного средства уже во время трансплантации. Например, микофенолата мофетил можно вводить один или несколько раз перед трансплантацией. Предпочтительно, микофенолата мофетил несколько раз вводят перед трансплантацией, и даже более предпочтительно - микофенолата мофетил дважды вводят перед трансплантацией. Предпочтительно, указанные два введения микофенолата мофетила осуществляют в пределах 3 дней до трансплантации, наиболее предпочтительно - за 1 и 2 дня до трансплантации сердца/почки/легкого/печени, соответственно. Предпочтительный микофенолата мофетил, предпочтительная доза при введении микофенолата мофетила и предпочтительный путь введения являются такими, как описано выше для введения микофенолата мофетила в соответствии со схемой введения иммуносупрессорного поддерживающего терапевтического средства.
В другом варианте осуществления изобретения схема введения иммуносупрессорного поддерживающего терапевтического средства включает введение антитела против CD40 или пасилированного Fab против CD40L. Если антитело против CD40 или пасилированный Fab против CD40L уже вводили как часть предшествующей иммуносупрессорной индукционной терапии, антитело против CD40 или пасилированный Fab против CD40L, вводимые как часть иммуносупрессорной поддерживающей терапии, предпочтительно, являются тем же антителом против CD40 или пасилированным Fab против CD40L, которые вводили как часть иммуносупрессорной индукционной терапии. В предпочтительном варианте осуществления указанное антитело против CD40 является клоном химерного IgG4 мыши/макака-резуса 2C10R4, доступным в NIH Nonhuman Primate Reagent Resource, Mass Biologicals, Boston, MA, USA; любезно предоставленным Keith Reimann. В другом предпочтительном варианте осуществления указанный пасилированный Fab против CD40L является гуманизированным пасилированным Fab против CD40L, производимым Wacker-Chemie (Burghausen, Germany) и очищенным XL-protein GmbH (Freising, Germany), как описано в Binder & Skerra (см. ссылку 9). Схема введения иммуносупрессорного поддерживающего терапевтического средства, предпочтительно, включает несколько введений антитела против CD40/пасилированного Fab против CD40L, где одно введение осуществляют в пределах 1 дня после трансплантации, предпочтительно, в день трансплантации. В предпочтительном варианте осуществления схема введения иммуносупрессорного поддерживающего терапевтического средства включает одно введение в пределах 1 дня после трансплантации, 4 введения в пределах 8 дней после трансплантации, 6 введений в пределах 15 дней после трансплантации, 7 введений в пределах 20 дней после трансплантации и последующие введения каждые 6-8 дней. Предпочтительная доза при введении составляет 50 мг на кг массы тела антитела против CD40 или 20 мг на кг массы тела пасилированного Fab против CD40L. Во всех других аспектах этого варианта осуществления предпочтительным путем введения антитела против CD40/пасилированного Fab против CD40L является короткая внутривенная (i.v.) инфузия.
В предпочтительном варианте осуществления изобретения схема введения иммуносупрессорного поддерживающего терапевтического средства включает введение глюкокортикоида, антитела против CD20, микофенолата мофетила и антитела против CD40/пассилированного Fab против CD40L. В этом предпочтительном варианте осуществления предпочтительный глюкокортикоид, предпочтительное антитело против CD20, предпочтительный микофенолата мофетил и предпочтительное антитело против CD40/пасилированный Fab против CD40L являются такими, как описано для соответствующих вариантов осуществления выше. Кроме того, в этом предпочтительном варианте осуществления предпочтительные частоты, предпочтительные временные точки, предпочтительные дозы и предпочтительные пути введения являются такими же, как описано для соответствующих вариантов осуществления выше. Особенно предпочтительная схема введения иммуносупрессорного поддерживающего терапевтического средства в рамках изобретения показана на фигуре 7.
Противовоспалительное терапевтическое средство по изобретению вводят организму-реципиенту в соответствии со схемой введения. Указанная схема введения включает введение одного или более противовоспалительных средств после трансплантации. Примеры противовоспалительных средств, которые можно вводить в соответствии со схемой введения противовоспалительного терапевтического средства включают антагонист рецептора ИЛ-1, ингибитор ФНОα и антитело против рецептора ИЛ-6. В настоящем изобретении противовоспалительное лечение должно противодействовать типичным неспецифическим ксеногенным воспалительным реакциям, подобным плевральному/перикардиальному выпоту.
В одном из вариантов осуществления изобретения схема введения противовоспалительного терапевтического средства включает введение антагониста рецептора ИЛ-1. В предпочтительном варианте осуществления указанный антагонист рецептора ИЛ-1 является антагонистом рецептора ИЛ-1 кинерет, коммерчески доступным в Swedish Orphan Biovitrum GmbH (Martinsried, Germany). В предпочтительном варианте осуществления схема введения противовоспалительного терапевтического средства включает несколько введений антагониста рецептора ИЛ-1, где одно введение осуществляют в пределах 1 дня после трансплантации, предпочтительно в день трансплантации. В более предпочтительном варианте осуществления схема введения противовоспалительного терапевтического средства включает несколько введений антагониста рецептора ИЛ-1, где одно введение осуществляют в пределах 1 дня после трансплантации, предпочтительно, в день трансплантации, и где одно введение осуществляют в каждый последующий день. Предпочтительная доза при введении антагониста рецептора ИЛ-1 составляет 1,3 мг на кг массы тела. Во всех других аспектах этого варианта осуществления предпочтительным путем введения антагониста рецептора ИЛ-1 является подкожная (s.c.) или внутривенная (i.v.) болюсная инъекция.
В другом варианте осуществления изобретения схема введения противовоспалительного терапевтического средства включает введение ингибитора ФНОα. В предпочтительном варианте осуществления указанный ингибитор ФНОα является ингибитором ФНОα энбрел, коммерчески доступным в Pfizer Pharma GmbH (Berlin, Germany). В предпочтительном варианте осуществления схема введения противовоспалительного терапевтического средства включает несколько введений ингибитора ФНОα, где одно введение осуществляют в пределах 1 дня после трансплантации, предпочтительно в день трансплантации. В более предпочтительном варианте осуществления схема введения противовоспалительного терапевтического средства включает несколько введений ингибитора ФНОα, где одно введение осуществляют в пределах 1 дня после трансплантации, а затем одно введение осуществляют каждые 6-8 дней, предпочтительно, где одно введение осуществляют в день трансплантации, а затем одно введение осуществляют каждые 7 дней. Предпочтительная доза при введении ингибитора ФНОα составляет 0,7 мг на кг массы тела. Во всех других аспектах этого варианта осуществления предпочтительным путем введения ингибитора ФНОα является подкожная (s.c.) болюсная инъекция.
В другом варианте осуществления изобретения схема введения противовоспалительного терапевтического средства включает введение антитела против рецептора ИЛ-6. В предпочтительном варианте осуществления указанное антитело против рецептора ИЛ-6 является антителом против рецептора ИЛ-6 RoActemra, коммерчески доступным в Roche Pharma AG (Grenzach-Wyhlen, Germany). Схема введения противовоспалительного терапевтического средства может включать одно или несколько введений антитела против рецептора ИЛ-6. В предпочтительном варианте осуществления схема введения противовоспалительного терапевтического средства включает несколько введений антитела против рецептора ИЛ-6, где одно введение осуществляют в пределах 1 дня после трансплантации, предпочтительно, в день трансплантации. В более предпочтительном варианте осуществления схема введения противовоспалительного терапевтического средства включает несколько введений антитела против рецептора ИЛ-6, где одно введение осуществляют в пределах 1 дня после трансплантации, а затем одно введение осуществляют каждые 20-40 дней, предпочтительно, где одно введение осуществляют в день трансплантации, а затем одно введение осуществляют каждые 25-35 дней. Предпочтительная доза при введении антитела против рецептора ИЛ-6 составляет 8 мг на кг массы тела. Во всех других аспектах этого варианта осуществления предпочтительным путем введения антитела против рецептора ИЛ-6 является короткая внутривенная (i.v.) инфузия.
В предпочтительном варианте осуществления изобретения схема введения противовоспалительного терапевтического средства включает введение антагониста рецептора ИЛ-1, ингибитора ФНОα и антитела против рецептора ИЛ-6. В этом предпочтительном варианте осуществления предпочтительный антагонист рецептора ИЛ-1, предпочтительный ингибитор ФНОα и предпочтительный антитело против рецептора ИЛ-6 являются такими, как описано для соответствующих вариантов осуществления выше. Кроме того, в этом предпочтительном варианте осуществления предпочтительные частоты, предпочтительные временные точки, предпочтительные дозы и предпочтительные пути введения также являются такими, как описано для соответствующих вариантов осуществления выше. Особенно предпочтительная схема введения противовоспалительного терапевтического средства в рамках изобретения показана на фигуре 8.
В рамках изобретения одно или более антигипертензивные средства вводят организму-реципиенту в соответствии со схемой введения. Указанная схема введения включает введение одного или более антигипертензивных средств после трансплантации. Примеры антигипертензивных средств, которые можно вводить в соответствии со схемой введения противовоспалительного терапевтического средства, включают диуретики, такие как петлевые диуретики фуросемид и этакриновая кислота, тиазидные/тиазид-подобные диуретики гидрохлоротиазид и индапамид, и калий-сберегающие диуретики триамтерен и амилорид; блокаторы кальциевых каналов, такие как дигидропиридины амлодипин и нифедипин и недигидропиридины верапамил и дилтиазем; ингибиторы ангиотензинпревращающего фермента (АПФ), такие как эналаприл и рамиприл; антагонисты рецептора ангиотензина II, такие как валсартан и кандесартан; антагонисты адренергических рецепторов, такие как бета-блокаторы бисопролол и метопролол, альфа-блокаторы доксазозин и феноксибензамин, и смешанные альфа/бета-блокаторы карведилол и лабеталол; вазодилататоры, такие как нитропруссид натрия и гидралазин; ингибиторы ренина, такие как алискирен; антагонисты рецепторов альдостерона, такие как спиронолактон и эплеренон; агонисты альфа-2-адренергических рецепторов, такие как клонидин и метилдопа; и блокаторы рецепторов эндотелина, такие как бозентан. В предпочтительном варианте осуществления схема введения включает введение одного или более антигипертензивных средств, выбранных из ингибиторов ангиотензинпревращающего фермента (АПФ) и антагонистов адренергических рецепторов. Предпочтительно, дозу одного или более антигипертензивных средств корректируют таким образом, что среднее артериальное давление организма-реципиента поддерживают в диапазоне от 70 до 90 мм рт.ст., предпочтительно - в диапазоне от 75 до 85 мм рт.ст. Даже более предпочтительно, дозу корректируют таким образом, что среднее артериальное давление организма-реципиента поддерживают в диапазоне от 70 до 90 мм рт.ст., предпочтительно - в диапазоне от 75 до 85 мм рт.ст., и таким образом, что частота сердечных сокращений поддерживают в диапазоне от 80 до 120 уд./мин, предпочтительно - в диапазоне от 90 до 110 уд./мин.
В одном из вариантов осуществления изобретения схема введения одного или более антигипертензивных средств включает введение ингибитора ангиотензинпревращающего фермента (АПФ). В предпочтительном варианте осуществления указанный ингибитор ангиотензинпревращающего фермента (АПФ) является эналаприлом. Эналаприл коммерчески доступен, например, как энагексал от Hexal AG (Holzkirchen, Germany). В предпочтительном варианте осуществления схема введения одного или более антигипертензивных средств включает несколько введений ингибитора ангиотензинпревращающего фермента (АПФ), где одно введение осуществляют в пределах 2 дней после трансплантации, предпочтительно - в пределах 1 дня после трансплантации. В более предпочтительном варианте осуществления схема введения одного или более антигипертензивных средств включает несколько введений ингибитора ангиотензинпревращающего фермента (АПФ), где одно введение осуществляют в пределах 2 дней после трансплантации, предпочтительно - в пределах 1 дня после трансплантации, и где одно введение осуществляют в каждый последующий день. Во всех других аспектах этого варианта осуществления предпочтительным путем введения ингибитора ангиотензинпревращающего фермента (АПФ) является внутривенное (i.v.) введение.
В другом варианте осуществления изобретения схема введения одного или более антигипертензивных средств включает введение антагониста адренергических рецепторов. В предпочтительном варианте осуществления указанный антагонист адренергических рецепторов является метопролола тартратом. Метопролола тартрат является коммерчески доступным, например, как Beloc i.v. от AstraZeneca GmbH (Wedel, Germany). В предпочтительном варианте осуществления схема введения одного или более антигипертензивных средств включает несколько введений антагониста адренергических рецепторов, где одно введение осуществляют в пределах 2 дней после трансплантации, предпочтительно - в пределах 1 дня после трансплантации. В более предпочтительном варианте осуществления схема введения одного или более антигипертензивных средств включает несколько введений антагониста адренергических рецепторов, где одно введение осуществляют в пределах 2 дней после трансплантации, предпочтительно - в пределах 1 дня после трансплантации, и где одно введение осуществляют в каждый последующий день. Во всех других аспектах этого варианта осуществления предпочтительным путем антагониста адренергических рецепторов введение является внутривенное (i.v.) введение.
В предпочтительном варианте осуществления изобретения схема введения одного или более антигипертензивных средств включает введение ингибитора ангиотензинпревращающего фермента (АПФ) и антагониста адренергических рецепторов. В этом предпочтительном варианте осуществления предпочтительный ингибитор ангиотензинпревращающего фермента (АПФ) и предпочтительный антагонист адренергических рецепторов являются такими, как описано для соответствующих вариантов осуществления выше. Кроме того, в этом предпочтительном варианте осуществления предпочтительные частоты, предпочтительные временные точки и предпочтительные пути введения также являются такими, как описано для соответствующих вариантов осуществления выше. Особенно предпочтительная схема введения одного или более антигипертензивных средств по изобретению показана на фигуре 9. Антигипертензивные средства в рамках изобретения вводят организму-реципиенту для снижения артериального давления до (более низкого) уровня организма-донора (например, свиньи).
В рамках изобретения ингибитор mTOR вводят организму-реципиенту в соответствии со схемой введения. Указанная схема введения включает введение ингибитора mTOR после трансплантации. Примеры ингибиторов mTOR, которые можно вводить в соответствии со схемой введения ингибитора mTOR, включают дактолисиб (BEZ235, NVP-BEZ235), рапамицин (сиролимус), эверолимус (RAD001), AZD8055, темсиролимус (CCI-779, NSC 683864), SF2523, 3BDO, PI-103, KU-0063794 I, торкиниб (PP242), ридафоролимус (дефоролимус, MK-8669), сапанисертиб (INK 128, MLN0128), аналог воксталисиба (SAR245409, XL765), торин 1, омипалисиб (GSK2126458, GSK458), OSI-027, PF-04691502, апитолисиб (GDC-0980, RG7422), GSK1059615, гедатолисиб (PF-05212384, PKI-587), WYE-354, вистусертиб (AZD2014), торин 2, WYE-125132 (WYE-132), BGT226 (NVP-BGT226), паломид 529 (P529), PP121, WYE-687, WAY-600, ETP-46464, GDC-0349, XL388, зотаролимус (ABT-578), CZ415, MHY1485, воксталисиб (XL765, SAR245409), хризофановую кислоту и CC-223, LY3023414. В предпочтительном варианте осуществления схема введения включает введение ингибитора mTOR темсиролимуса. Темсиролимус доступен для внутривенного использования, например, как торизел от Pfizer Pharma GmbH (Berlin, Germany). Темсиролимус может иметь длительное действие схожим образом с антителом против CD40/пасилированным Fab против CD40L. Это является преимуществом в экспериментах на не являющихся человеком приматах. В рамках изобретения ингибитор mTOR вводят организму-реципиенту для ингибирования гормонов роста для ингибирования разрастания трансплантированного сердца/почки/легкого/печени.
В предпочтительном варианте осуществления схема введения ингибитора mTOR включает несколько введений ингибитора mTOR, где первое введение осуществляют в пределах 10 дней после трансплантации, предпочтительно - через 2-9 дней после трансплантации, более предпочтительно - через 4-7 дней после трансплантации. В более предпочтительном варианте осуществления схема введения ингибитора mTOR включает несколько введений ингибитора mTOR, где первое введение осуществляют в пределах 10 дней после трансплантации, предпочтительно - через 2-9 дней после трансплантации, более предпочтительно - через 4-7 дней после трансплантации, и где одно введение осуществляют в каждый последующий день. Как будет очевидно специалисту в этой области, временная точка первого введения ингибитора mTOR зависит от общего состояния реципиента (например, есть ли перикардиальный/плевральный выпот). Предпочтительно, дозу при введения ингибитора mTOR корректируют до остаточного уровня 5-10 нг/мл рапамицина. Во всех других аспектах этого варианта осуществления предпочтительным путем введения ингибитора mTOR является короткая внутривенная (i.v.) инфузия. Особенно предпочтительная схема введения ингибитора mTOR в рамках изобретения показана на фигуре 7.
В одном из вариантов осуществления настоящего изобретения организм-реципиент, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора, подвергают вспомогательной терапии в соответствии со схемой введения. Указанная схема введения включает введение одного или более фармацевтически активных средств. Примеры фармацевтически активных средств, которые можно вводить в соответствии со схемой введения вспомогательного терапевтического средства, включают ацетилсалициловую кислоту, нефракционированный гепарин, ингибитор C1-эстеразы, ганцикловир, цефуроксим и эпоэтин бета.
В одном из вариантов осуществления изобретения схема введения вспомогательного терапевтического средства включает введение ацетилсалициловой кислоты. В предпочтительном варианте осуществления указанная ацетилсалициловая кислота является ацетилсалициловой кислотой аспирин, коммерчески доступной в Bayer Vital GmbH (Leverkusen, Germany). Схема введения вспомогательного терапевтического средства, предпочтительно, включает несколько введений ацетилсалициловой кислоты. В предпочтительном варианте осуществления схема введения включает введение ацетилсалициловой кислоты каждый день после трансплантации. Предпочтительная доза при введении ацетилсалициловой кислоты составляет 2 мг на кг массы тела. Во всех других аспектах этого варианта осуществления предпочтительным путем введения ацетилсалициловой кислоты является внутривенная (i.v.) болюсная инъекция. В настоящем изобретении ацетилсалициловую кислоту используют в качестве антикоагулянта.
В другом варианте осуществления изобретения схема введения вспомогательного терапевтического средства включает введение нефракционированного гепарина. В предпочтительном варианте осуществления указанный нефракционированный гепарин является нефракционированным гепарином натрия 25000 Ratiopharm, коммерчески доступным в Ratiopharm GmbH (Ulm, Germany). Схема введения вспомогательного терапевтического средства, предпочтительно, включает несколько введений нефракционированного гепарина, где первое введение нефракционированного гепарина осуществляют через 4-6 дней после трансплантации, предпочтительно, 5 дней после трансплантации. В более предпочтительном варианте осуществления схема введения вспомогательного терапевтического средства включает несколько введений нефракционированного гепарина, где первое введение нефракционированного гепарина осуществляют через 4-6 дней после трансплантации, предпочтительно - через 5 дней после трансплантации, и где одно введение осуществляют в каждый последующий день. Предпочтительная доза при введении нефракционированного гепарина составляет от 480 до 960 ед. на кг массы тела в сутки. Во всех других аспектах этого варианта осуществления предпочтительным путем введения нефракционированного гепарина является непрерывная внутривенная (i.v.) инфузия. Таким образом, нефракционированный гепарин, предпочтительно, вводят непрерывно в течение 24 часов в день в дозе от 20 до 40 ед. на кг массы тела в час. В настоящем изобретении нефракционированный гепарин используют в качестве антикоагулянта.
В другом варианте осуществления изобретения схема введения вспомогательного терапевтического средства включает введение ингибитора C1-эстеразы. В предпочтительном варианте осуществления указанный ингибитор C1-эстеразы является ингибитором C1-эстеразы беринерт, коммерчески доступным в CSL Behring GmbH (Hattersheim, Germany). Схема введения вспомогательного терапевтического средства, предпочтительно, включает несколько введений ингибитора C1-эстеразы, где первое введение осуществляют в пределах 1 дня после трансплантации, предпочтительно, в день трансплантации. В более предпочтительном варианте осуществления схема введения вспомогательного терапевтического средства включает несколько введений ингибитора C1-эстеразы, где первое введение осуществляют в пределах 1 дня после трансплантации, другое введение осуществляют через 6-8 дней после трансплантации, и другое введение осуществляют через 13-15 дней после трансплантации. В наиболее предпочтительном варианте осуществления схема введения вспомогательного терапевтического средства включает несколько введений ингибитора C1-эстеразы, где первое введение осуществляют в день трансплантации, другое введение осуществляют через 7 дней после трансплантации, и другое введение осуществляют через 14 дней после трансплантации. Предпочтительная доза при введении ингибитора C1-эстеразы составляет 17,5 ед. на кг массы тела. Во всех других аспектах этого варианта осуществления предпочтительным путем введения ингибитора C1-эстеразы является короткая внутривенная (i.v.) инфузия. В настоящем изобретении ингибитор C1-эстеразы используют в качестве ингибитора комплемента.
В другом варианте осуществления изобретения схема введения вспомогательного терапевтического средства включает введение ганцикловира. В предпочтительном варианте осуществления указанный ганцикловир является ганцикловиром цимевен, коммерчески доступным в Roche Pharma AG (Grenzach-Wyhlen, Germany). Схема введения вспомогательного терапевтического средства, предпочтительно, включает несколько введений ганцикловира. В предпочтительном варианте осуществления схема введения включает введение ганцикловира каждый день после трансплантации. Предпочтительная доза при введении ганцикловира составляет 5 мг на кг массы тела. Во всех других аспектах этого варианта осуществления предпочтительным путем введения ганцикловира является непрерывная внутривенная (i.v.) инфузия. В настоящем изобретении ганцикловир используют для блокирования инфекции цитомегаловируса примата.
В другом варианте осуществления изобретения схема введения вспомогательного терапевтического средства включает введение цефуроксима. В предпочтительном варианте осуществления указанный цефуроксим является цефуроксимом Hikma, коммерчески доступным в Hikma Pharma GmbH (Martinsried, Germany). Схема введения вспомогательного терапевтического средства, предпочтительно, включает несколько введений цефуроксима. В предпочтительном варианте осуществления схема введения включает введение цефуроксима в пределах 1 дня после трансплантации, предпочтительно, в день трансплантации. В более предпочтительном варианте осуществления схема введения включает введение цефуроксима в день трансплантации и введение цефуроксима в каждый последующий день до (и включая) дня 5 после трансплантации. Предпочтительная доза при введении цефуроксима составляет 50 мг на кг массы тела. Во всех других аспектах этого варианта осуществления предпочтительным путем введения цефуроксима является непрерывная внутривенная (i.v.) инфузия. В настоящем изобретении цефуроксим (цефалоспорин) используют в качестве профилактического антибиотика широкого спектра против бактериальных инфекций, заражение которыми может произойти во время хирургического вмешательства.
В другом варианте осуществления изобретения схема введения вспомогательного терапевтического средства включает введение эпоэтина бета. В предпочтительном варианте осуществления указанный эпоэтин бета является эпоэтином бета неорекормон 5000 МЕ, коммерчески доступным в Roche Pharma AG (Grenzach-Wyhlen, Germany). Схема введения вспомогательного терапевтического средства может включать одно введение или несколько введений эпоэтина бета. В предпочтительном варианте осуществления схема введения включает введение эпоэтина бета за 6-8 дней до трансплантации и введение эпоэтина бета между 1 днем до и 1 днем после трансплантации. В более предпочтительном варианте осуществления схема введения включает введение эпоэтина бета за 7 дней до трансплантации и введение эпоэтина бета в день трансплантации. Предпочтительная доза при введении эпоэтина бета составляет 2000 ед. Во всех других аспектах этого варианта осуществления предпочтительным путем введения эпоэтина бета является подкожная (s.c.) или внутривенная (i.v.) болюсная инъекция. В настоящем изобретении эритропоэтин используют в качестве гормона, стимулирующего продукцию гемоглобина (т.е. это может противодействовать потере крови).
В предпочтительном варианте осуществления изобретения схема введения вспомогательного терапевтического средства включает введение ацетилсалициловой кислоты, нефракционированного гепарина, ингибитора C1-эстеразы, ганцикловира, цефуроксима и эпоэтина бета. В этом предпочтительном варианте осуществления предпочтительная ацетилсалициловая кислота, предпочтительный нефракционированный гепарин, предпочтительный ингибитор C1-эстеразы, предпочтительный ганцикловир, предпочтительный цефуроксим и предпочтительный эпоэтин бета являются такими, как описано для соответствующих вариантов осуществления выше. Кроме того, в этом предпочтительном варианте осуществления предпочтительные частоты, предпочтительные временные точки, предпочтительные дозы и предпочтительные пути введения также являются такими, как описано для соответствующих вариантов осуществления выше.
Примат с трансплантированным сердцем/почкой/легким/печенью
Настоящее изобретение также относится к живому примату (например, не являющемуся человеком живому примату), сердце/почку/легкое/печень которого функционально заменяют трансплантируемым, генетически модифицированным сердцем/почкой/легким/печенью из ксеногенного млекопитающего, где указанного живого примата можно получать способом пролонгирования выживаемости примата после трансплантации сердца/почки/легкого/печени, как описано выше.
Кроме того, настоящее изобретение относится к живому примату, сердце/почку/легкое/печень которого функционально заменяют трансплантируемым, генетически модифицированным сердцем/почкой/легким/печенью из ксеногенного млекопитающего, где сердце/почку/легкое/печень указанного живого примата трансплантировали более 40 дней назад, более 50 дней назад, более 60 дней назад, более 70 дней назад, более 80 дней назад, или более 90 дней назад, предпочтительно более 50 дней назад, более предпочтительно более 70 дней назад и наиболее предпочтительно более 90 дней назад.
В одном из вариантов осуществления живой примат принадлежит к семейству Cercopithecidae, предпочтительно - к роду Papio, более предпочтительно - к биологическому виду Papio anubis или Papio hamadryas, наиболее предпочтительно - к биологическому виду Papio anubis. В альтернативном варианте осуществления живой примат принадлежит к семейству Cercopithecidae, предпочтительно - к роду Macaca, наиболее предпочтительно - к биологическому виду M. mulatta.
В другом варианте осуществления ксеногенное млекопитающее принадлежит к семейству Suidae, более предпочтительно - к роду Sus, даже более предпочтительно - к биологическому виду S. scrofa, и наиболее предпочтительно - к подвиду S. s. domesticus. Предпочтительно, ксеногенное млекопитающее является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы, свиньей породы дюрок, свиньей швабско-галльской породы, черным минипигом или свиньей Оклендских островов; более предпочтительно - ксеногенное млекопитающее является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы. Во всех других аспектах этого варианта осуществления ксеногенное млекопитающее являлось молодым на момент трансплантации.
В рамках изобретения сердце/почку/легкое/печень генетически модифицируют во избежание отторжения трансплантата живым приматом. Специалисту в этой области будут известны подходящие генетические модификации в зависимости от соответствующего организма-донора и соответствующего живого примата по настоящему изобретению. В одном из вариантов осуществления генетически модифицированное сердце/почка/легкое/печень живого примата имеет следующие генетические модификации: (1) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы; (2) инсерцию гена CD46 человека; и (3) инсерцию гена тромбомодулина человека. Если организм-донор принадлежит к семейству Suidae, и живой примат принадлежит к роду Papio, генетически модифицированное сердце/почка/легкое/печень, необязательно, может иметь только указанную выше генетическую модификацию (1), т.е. гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы. В другом варианте осуществления генетически модифицированное сердце/почка/легкое/печень живого примата имеет следующие генетические модификации: (1) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы, гена CMAH и гена B4GALNT2; (2) инсерцию гена CD46 человека, гена CD55 человека, гена CD59 человека, гена гемоксигеназы 1 и гена A20; и необязательно (3) инсерцию гена LEA или гена PDL-1 (PD-L1, PDL1, CD274). Подробности генетических модификаций по этому варианту осуществления можно найти в ссылке 23 (включенной в настоящее описание в полном объеме). В этом варианте осуществления ген гемоксигеназы 1, ген A20, ген LEA и ген PDL-1 можно получать из любого организма, но, предпочтительно, они представляют собой ген гемоксигеназы 1 человека, ген A20 человека, ген LEA человека и ген PDL-1 человека, соответственно. В указанных выше вариантах осуществления при инсерции гена CD46 человека (huCD46), предпочтительно, экспрессируются транскрипты, соответствующие любому транскрипту, продуцирующемуся со следующего геномного локуса/кодирующей области: GRCH38p7, NC_000001, область 207752038-207795516. Более предпочтительно, при инсерции гена CD46 человека по меньшей мере один из следующих транскриптов экспрессируется с экспрессирующей кассеты трансгена: NM_002389, NM_172359, NM_172351, NM_153826, NM_172352, NM_172353, NM_172350 и NM_172361. В указанных выше вариантах осуществления при инсерции гена тромбомодулина человека (huTHBD, huTBM), предпочтительно, экспрессируются транскрипты, соответствующие любому транскрипту, продуцирующемуся со следующего геномного локуса/кодирующей области: GRCH38p7, NC_000020, область 23045633-23049664. Более предпочтительно, при инсерции гена тромбомодулина человека следующий транскрипт экспрессируется с экспрессирующей кассеты трансгена: NM_000361. В указанных выше вариантах осуществления при инсерции гена CD55 человека (huCD55), предпочтительно, экспрессируются транскрипты, соответствующие любому транскрипту, продуцирующемуся со следующего геномного локуса/кодирующей области: GRCH38p7, NC_000001, область 207321472-207360966. Более предпочтительно, при инсерции гена CD55 человека по меньшей мере один из следующих транскриптов экспрессируется с экспрессирующей кассеты трансгена: NM_001114752, NM_001300903, NM_001300904, NM_000574 и NM_001300902. В указанных выше вариантах осуществления при инсерции гена CD59 человека (huCD59), предпочтительно, экспрессируются транскрипты, соответствующие любому транскрипту, продуцирующемуся со следующего геномного локуса/кодирующей области: GRCH38p7, NC_000011, область 33703010-33736479. Более предпочтительно, при инсерции гена CD59 человека по меньшей мере один из следующих транскриптов экспрессируется с экспрессирующей кассеты трансгена: NM_000611, NM_203331, NM_203329, NM_203330, NM001127227, NM_001127226, NM_001127225 и NM_001127223. В указанных выше вариантах осуществления при инсерции гена гемоксигеназы 1 человека (huHMOX1, huHO1), предпочтительно, экспрессируются транскрипты, соответствующие любому транскрипту, продуцирующемуся со следующего геномного локуса/кодирующей области: GRCH38p7, NC_000022, область 35381067-35394214. Более предпочтительно, при инсерции гена гемоксигеназы 1 человека следующий транскрипт экспрессируется с экспрессирующей кассеты трансгена: NM_002133. В указанных выше вариантах осуществления при инсерции гена A20 человека (huA20, huTNFAIP3), предпочтительно, экспрессируются транскрипты, соответствующие любому транскрипту, продуцирующемуся со следующего геномного локуса/кодирующей области: GRCH38p7, NC_000006,12, область 137866317-137883314. Более предпочтительно, при инсерции гена A20 человека по меньшей мере один из следующих транскриптов экспрессируется с экспрессирующей кассеты трансгена: NM_001270508; NM_001270507; NM_006290. Как будет очевидно специалисту в этой области, в рамках изобретения термин "ген LEA" относится к синтетической последовательности, кодирующей искусственный белок CTLA4-Ig, оптимизированный для высокой аффинности к CD80/CD86. В указанных выше вариантах осуществления при инсерции человек гена LEA, предпочтительно, экспрессируется следующий кодон-оптимизированный вариант LEA29Y, например, с экспрессирующей кассеты трансгена:
atgggggtactgctcacacagaggacgctgctcagtctggtccttgcactcctgtttccaagcatggcgagcatggcgatgcacgtggcccagcctgctgtggtactggccagcagccgaggcatcgccagctttgtgtgtgagtatgcatctccaggcaaatatactgaggtccgggtgacagtgcttcggcaggctgacagccaggtgactgaagtctgtgcggcaacctacatgatggggaatgagttgaccttcctagatgattccatctgcacgggcacctccagtggaaatcaagtgaacctcactatccaaggactgagggccatggacacgggactctacatctgcaaggtggagctcatgtacccaccgccatactacgagggcataggcaacggaacccagatttatgtaattgatccagaaccgtgcccagattctgatcaggagcccaaatcttctgacaaaactcacacatccccaccgtccccagcacctgaactcctggggggatcgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgggtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggatgagctgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatga (SEQ ID NO: 1).
В указанных выше вариантах осуществления при инсерции гена PDL-1 человека (huPD-L1, huPDL1, huCD274), предпочтительно, экспрессируются транскрипты, соответствующие любому транскрипту, продуцирующемуся со следующего геномного локуса/кодирующей области: GRCH38p7, NC_000009, область 5450503-5470567. Более предпочтительно, при инсерции гена PDL-1 человека по меньшей мере один из следующих транскриптов экспрессируется с экспрессирующей кассеты трансгена: NM_014143; NM_001267706; NM_00134029.
Как будет очевидно специалисту в этой области, и как напрямую следует из изложенного выше, когда в рамках изобретения ссылаются на "инсерцию гена", в предпочтительном варианте осуществления встраивают не весь ген. В этом варианте осуществления можно встраивать любую последовательность (например, в экспрессирующей кассете), делающую возможной экспрессию транскрипта соответствующего гена.
В другом варианте осуществления, который можно комбинировать с любыми из указанных выше вариантов осуществления, генетически модифицированное сердце/почка/легкое/печень по настоящему изобретению дополнительно имеет инсерцию последовательности, кодирующей α1,2-фукозилтрансферазу человека. Предпочтительно, α1,2-фукозилтрансфераза человека является белком, экспрессирующимся со следующего гена: общепринятый символ: FUT1; общепринятое полное название: фукозилтрансфераза 1 (группа крови H); первичный источник: HGNC:HGNC:4012; см.: Ensembl: ENSG00000174951, MIM:211100.
В настоящем изобретении, когда ссылаются на "вставку гена/последовательности", эта инсерция может являться гетерозиготной или гомозиготной инсерцией. Как будет очевидно специалисту в этой области, если уровень экспрессии не является достаточно высоким при гетерозиготной инсерции, гомозиготная инсерция является предпочтительной.
Предпочтительно, в рамках изобретения генетически модифицированное сердце/почку/легкое/печень получают из генетически модифицированного организма-донора, т.е. из организма-донора, несущего соответствующие генетические модификации в своей зародышевой линии. Специалисту в этой области известны способы получения таких генетически модифицированных организмов-доноров (например, свиней). В качестве альтернативы общепринятым способам, генетически модифицированных свиней также можно получать новыми способами, такими как способы с использованием CRISPR/CAS 9, с помощью которых можно получать улучшенные локусы для инсерции.
В одном из вариантов осуществления примата с трансплантированным сердцем трансплантированное сердце живого примата в рамках изобретения имеет массу левого желудочка 150% массы левого желудочка того же сердца на момент трансплантации или менее. Предпочтительно, трансплантированное сердце указанного живого примата имеет массу левого желудочка 140% массы левого желудочка того же сердца на момент трансплантации или менее, более предпочтительно - 130% массы левого желудочка того же сердца на момент трансплантации или менее, даже более предпочтительно - 120% массы левого желудочка того же сердца на момент трансплантации или менее, и наиболее предпочтительно - 110% массы левого желудочка того же сердца на момент трансплантации или менее. В этом варианте осуществления массу левого желудочка (LV), повышение массы LV и фракцию укорочения (FS) количественно анализировали следующим образом. Трансторакальную эхокардиографию осуществляли при аналгоседации через регулярные интервалы, например, с использованием HP Sonos 7500 (HP Inc., Palo Alto, CA, USA); регистрировали позиции по короткой оси на уровне папиллярных мышц. В конце диастолы и конце систолы измеряют диаметры LV (LVEDD, LVESD), конечно-диастолическую и конечно-систолическую толщину межжелудочковой перегородки (IVSd, IVSs), толщину задней стенки (PWd, PWs); для дальнейших вычислений и визуализации (Excel и PowerPoint, Microsoft, Redmond, Washington, USA) используют среднее значение для трех измерении. Массу LV вычисляют по приведенной ниже формуле 1, относительное повышение массы LV и FS LV - по приведенным ниже формулам 2 и 3 (см. ссылки 11,12).
(Формула 1) масса LV (г) = 0,8*(1,04([LVEDD+IVSd+PWd]3-[LVEDD]3))+0,6
(Формула 2) повышение массы LV (%) = ([масса LVконечная/масса LVначальная] - 1)*100
(Формула 3) FS (%) = ([LVEDD - LVESD]/LVEDD)*100
IVSd, конечно-диастолическая толщина межжелудочковой перегородки; IVSs, конечно-систолическая толщина межжелудочковой перегородки; LVEDD, конечно-диастолический диаметр левого желудочка; LVESD, конечно-систолический диаметр левого желудочка; PWd, диастолическая толщина задней стенки; PWs, систолическая толщина задней стенки.
В одном из вариантов осуществления в рамках изобретения живой примат с трансплантированным сердцем/почкой/легким/печенью имеет количество тромбоцитов от 150 до 300 г/л, предпочтительно - от 170 до 250 г/л, более предпочтительно - от 180 до 230 г/л. В этой области известны способы определения количества тромбоцитов.
В другом варианте осуществления в рамках изобретения живой примат имеет уровень билирубина 1,2 мг/дл или менее, предпочтительно - 1,0 мг/дл или менее, более предпочтительно - 0,8 мг/дл или менее, наиболее предпочтительно - 0,6 мг/дл или менее. В этой области известны способы определения уровня билирубина.
В другом варианте осуществления в рамках изобретения живой примат имеет уровень тропонина T (hs) 0,3 нг/мл или менее, предпочтительно - 0,2 нг/мл или менее, более предпочтительно - 0,1 нг/мл или менее, наиболее предпочтительно - 0,014 нг/мл или менее. В этой области известны способы определения уровня тропонина T (hs).
В другом варианте осуществления в рамках изобретения живой примат имеет уровень ЛДГ 1500 ед./л или менее, предпочтительно - 1000 ед./л или менее, более предпочтительно - 700 ед./л или менее, наиболее предпочтительно - 500 ед./л или менее. В этой области известны способы определения уровня ЛДГ.
Композиция ингибитора mTOR для применения в способе пролонгирования выживаемости примата после трансплантации сердца/почки/легкого/печени
Кроме того, настоящее изобретение относится к композиции, содержащей ингибитор mTOR для применения в способе пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора, где организм-донор представляет собой млекопитающего, и где организм-реципиент представляет собой примата. Предпочтительно, указанному организму-реципиенту трансплантировали генетически модифицированное сердце/почку/легкое/печень таким образом, что им функционально заменяют сердце/почку/легкое/печень организма-реципиента.
Способ, в котором используют композицию, содержащую ингибитор mTOR, похож на описанный выше способ пролонгирования выживаемости организма-реципиента, соответствующими вариантами осуществления описанного выше способа пролонгирования выживаемости организма-реципиента также являются варианты осуществления композиции, содержащей ингибитор mTOR, для применения в способе пролонгирования выживаемости организма-реципиента, и наоборот. В частности, организм-донор, организм-реципиент и генетически модифицированное сердце/почка/легкое/печень являются такими, как описано выше для соответствующих вариантов осуществления способа пролонгирования выживаемости организма-реципиента. В другом предпочтительном варианте осуществления способом, в котором используют ингибитор mTOR, пролонгируют выживаемость организма-реципиента до более чем 40 дней после трансплантации, до более чем 50 дней после трансплантации, до более чем 60 дней после трансплантации, до более чем 70 дней после трансплантации, до более чем 80 дней после трансплантации или до более чем 90 дней после трансплантации. Предпочтительно, способом, в котором используют ингибитор mTOR, пролонгируют выживаемость организма-реципиента до более чем 50 дней после трансплантации, более предпочтительно - до более чем 70 дней после трансплантации, и наиболее предпочтительно - до более чем 90 дней после трансплантации.
В одном из вариантов осуществления в рамках изобретения композиция, содержащая ингибитор mTOR, содержит ингибитор mTOR, выбранный из дактолисиба (BEZ235, NVP-BEZ235), рапамицина (сиролимуса), эверолимуса (RAD001), AZD8055, темсиролимуса (CCI-779, NSC 683864), SF2523, 3BDO, PI-103, KU-0063794 I, торкиниба (PP242), ридафоролимуса (дефоролимуса, MK-8669), сапанисертиба (INK 128, MLN0128), аналога воксталисиба (SAR245409, XL765), торина 1, омипалисиба (GSK2126458, GSK458), OSI-027, PF-04691502, апитолисиба (GDC-0980, RG7422), GSK1059615, гедатолисиба (PF-05212384, PKI-587), WYE-354, вистусертиба (AZD2014), торина 2, WYE-125132 (WYE-132), BGT226 (NVP-BGT226), паломида 529 (P529), PP121, WYE-687, WAY-600, ETP-46464, GDC-0349, XL388, зотаролимуса (ABT-578), CZ415, MHY1485, воксталисиба (XL765, SAR245409), хризофановой кислоты и CC-223, LY3023414. В предпочтительном варианте осуществления ингибитор mTOR является темсиролимусом. Темсиролимус является коммерчески доступным, например, как торизел от Pfizer Pharma GmbH(Berlin, Germany). Как будет очевидно специалисту в этой области, композиция, содержащая ингибитор mTOR по изобретению, может дополнительно содержать фармацевтически приемлемые носители и/или эксципиенты.
Предпочтительно, композицию, содержащую ингибитор mTOR по изобретению, вводят организму-реципиенту в соответствии со схемой введения. Более предпочтительно, указанная схема введения включает введение композиции после трансплантации.
В предпочтительном варианте осуществления схема введения композиции, содержащей ингибитор mTOR по изобретению, включает несколько введений композиции, где первое введение осуществляют в пределах 10 дней после трансплантации, предпочтительно - через 2-9 дней после трансплантации, более предпочтительно - через 4-7 дней после трансплантации. В более предпочтительном варианте осуществления схема введения композиции, содержащей ингибитор mTOR, включает несколько введений композиции, где первое введение осуществляют в пределах 10 дней после трансплантации, предпочтительно - через 2-9 дней после трансплантации, более предпочтительно - через 4-7 дней после трансплантации, и где одно введение осуществляют в каждый последующий день. Как будет очевидно специалисту в этой области, временная точка первого введения ингибитора mTOR зависит от общего состояния реципиента (например, есть ли перикардиальный/плевральный выпот). Предпочтительно, дозу композиции, содержащей ингибитор mTOR, при введении корректируют до остаточного уровня 5-10 нг/мл рапамицина. Во всех других аспектах этого варианта осуществления предпочтительным путем введения является короткая внутривенная (i.v.) инфузия. Особенно предпочтительная схема введения композиции, содержащей ингибитор mTOR по изобретению, показана на фигуре 7.
В одном из вариантов осуществления изобретения композицию, содержащую ингибитор mTOR, для применения в способе пролонгирования выживаемости организма-реципиента по изобретению вводят организму-реципиенту, которого подвергали иммуносупрессорной индукционной терапии в соответствии со схемой введения, и/или организму-реципиенту, которого подвергают иммуносупрессорной поддерживающей терапии, противовоспалительной терапии, антигипертензивной терапии и/или вспомогательной терапии в соответствии с соответствующими схемами введения. Учитывая, что авторы настоящего изобретения обнаружили, что введение одного или более антигипертензивных средств реципиенту после трансплантации, введение ингибитора mTOR реципиенту после трансплантации и снижение дозы глюкокортикоида, вводимого реципиенту как часть иммуносупрессорной поддерживающей терапии, на ранней стадии после трансплантации предотвращает разрастание донорского сердца в организме-реципиенте, композицию, содержащую ингибитор mTOR, для применения в способе пролонгирования выживаемости организма-реципиента по изобретению, предпочтительно, вводят организму-реципиенту, которого подвергают иммуносупрессорной поддерживающей терапии и антигипертензивной терапии в соответствии с соответствующими схемами введения. Соответствующие схемы введения для любого указанного выше лечения и их (предпочтительные) варианты осуществления являются такими, как описано выше для способа пролонгирования выживаемости организма-реципиента. Как будет очевидно специалисту в этой области, если организм-реципиент подвергают одному из указанных выше способов лечения в соответствии с соответствующей схемой введения, первое введение, включенное в указанную схему введения, уже осуществили. Предпочтительно, если организм-реципиент подвергают иммуносупрессорной поддерживающей терапии в соответствии со схемой введения, и если указанная схема введения включает снижение дозы (мг/кг/сутки) глюкокортикоида в конкретное количество раз в пределах некоторого периода времени, такое снижение уже осуществили.
В другом варианте осуществления изобретения композицию, содержащую ингибитор mTOR, для применения в способе пролонгирования выживаемости организма-реципиента вводят организму-реципиенту, генетически модифицированное сердце/почку/легкое/печень которого из ксеногенного организма-донора консервировали посредством неишемической консервации, предпочтительно - посредством неишемической перфузии сердца/почки/легкого/печени, перед трансплантацией, например, как описано выше для способа пролонгирования выживаемости организма-реципиента.
Композиция антигипертензивного средства для применения в способе пролонгирования выживаемости примата после трансплантации сердца/почки/легкого/печени
Кроме того, настоящее изобретение относится к композиции, содержащей одно или более антигипертензивных средств, для применения в способе пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора, где организм-донор представляет собой млекопитающего, и где организм-реципиент представляет собой примата. Предпочтительно, указанному организму-реципиенту трансплантировали генетически модифицированное сердце/почку/легкое/печень таким образом, что им функционально заменяют сердце/почку/легкое/печень организма-реципиента.
Способ, в котором используют композицию, содержащую одно или более антигипертензивных средств, похож на описанный выше способ пролонгирования выживаемости организма-реципиента, соответствующие варианты осуществления описанного выше способа пролонгирования выживаемости организма-реципиента также являются вариантами осуществления композиции, содержащей одно или более антигипертензивных средств, для применения в способе пролонгирования выживаемости организма-реципиента. В частности, организм-донор, организм-реципиент и генетически модифицированное сердце/почка/легкое/печень являются такими, как описано выше для соответствующих вариантов осуществления способа пролонгирования выживаемости организма-реципиента. В другом предпочтительном варианте осуществления способом, в котором используют одно или более антигипертензивных средств, пролонгируют выживаемость организма-реципиента до более чем 40 дней после трансплантации, до более чем 50 дней после трансплантации, до более чем 60 дней после трансплантации, до более чем 70 дней после трансплантации, до более чем 80 дней после трансплантации или до более чем 90 дней после трансплантации. Предпочтительно, способом, в котором используют одно или более антигипертензивных средств, пролонгируют выживаемость организма-реципиента до более чем 50 дней после трансплантации, более предпочтительно - до более чем 70 дней после трансплантации, и наиболее предпочтительно - до более чем 90 дней после трансплантации.
В одном из вариантов осуществления композиция, содержащая одно или более антигипертензивных средств по изобретению, содержит одно или более антигипертензивных средств, выбранных из диуретиков, таких как петлевые диуретики фуросемид и этакриновая кислота, тиазидные/тиазид-подобные диуретики гидрохлоротиазид и индапамид, и калий-сберегающие диуретики триамтерен и амилорид; блокаторов кальциевых каналов, таких как дигидропиридины амлодипин и нифедипин и недигидропиридины верапамил и дилтиазем; ингибиторов ангиотензинпревращающего фермента (АПФ), таких как эналаприл и рамиприл; антагонистов рецептора ангиотензина II, таких как валсартан и кандесартан; антагонистов адренергических рецепторов, таких как бета-блокаторы бисопролол и метопролол, альфа-блокаторы доксазосин и феноксибензамин, и смешанные альфа/бета-блокаторы карведилол и лабеталол; вазодилататоров, таких как нитропруссид натрия и гидралазин; ингибиторов ренина, таких как алискирен; антагонистов рецепторов альдостерона, таких как спиронолактон и эплеренон; агонистов альфа-2-адренергических рецепторов, таких как клонидин и метилдопа; и блокаторов рецепторов эндотелина, таких как бозентан. В предпочтительном варианте осуществления композиция, содержащая одно или более антигипертензивных средств, содержит одно или более антигипертензивных средств, выбранных из ингибиторов ангиотензинпревращающего фермента (АПФ) и антагонистов адренергических рецепторов.
В предпочтительном варианте осуществления изобретения композиция, содержащая одно или более антигипертензивных средств по изобретению, содержит ингибитор ангиотензинпревращающего фермента (АПФ), предпочтительно - эналаприл. Эналаприл является коммерчески доступным, например, как энагексал от Hexal AG (Holzkirchen, Germany). В другом предпочтительном варианте осуществления изобретения композиция, содержащая одно или более антигипертензивных средств по изобретению, содержит антагонист адренергических рецепторов, предпочтительно - метопролола тартрат. Метопролола тартрат является коммерчески доступным, например, как Beloc i.v. от AstraZeneca GmbH (Wedel, Germany). В другом предпочтительном варианте осуществления композиция, содержащая одно или более антигипертензивных средств по изобретению, содержит ингибитор ангиотензинпревращающего фермента (АПФ), предпочтительно - эналаприл, и антагонист адренергических рецепторов, предпочтительно - метопролола тартрат.
Как будет очевидно специалисту в этой области, композиция, содержащая одно или более антигипертензивных средств по изобретению, может дополнительно содержать фармацевтически приемлемые носители и/или эксципиенты.
Предпочтительно, композицию, содержащую одно или более антигипертензивных средств по изобретению, вводят организму-реципиенту в соответствии со схемой введения. Более предпочтительно, указанная схема введения включает введение композиции после трансплантации.
В предпочтительном варианте осуществления схема введения композиции, содержащей одно или более антигипертензивных средств, включает несколько введений композиции, где одно введение осуществляют в пределах 2 дней после трансплантации, предпочтительно - в пределах 1 дня после трансплантации. В более предпочтительном варианте осуществления схема введения композиции, содержащей одно или более антигипертензивных средств, включает несколько введений композиции, где одно введение осуществляют в пределах 2 дней после трансплантации, предпочтительно - в пределах 1 дня после трансплантации, и где одно введение осуществляют в каждый последующий день. Во всех других аспектах этого варианта осуществления предпочтительным путем введения композиции, содержащей одно или более антигипертензивных средств, является внутривенное (i.v.) введение.
Предпочтительно, дозу композиции, содержащей одно или более антигипертензивных средств, корректируют таким образом, что среднее артериальное давление организма-реципиента поддерживают в диапазоне от 70 до 90 мм рт.ст., предпочтительно - в диапазоне от 75 до 85 мм рт.ст. Даже более предпочтительно, дозу корректируют таким образом, что среднее артериальное давление организма-реципиента поддерживают в диапазоне от 70 до 90 мм рт.ст., предпочтительно - в диапазоне от 75 до 85 мм рт.ст., и таким образом, что частоту сердечных сокращений поддерживают в диапазоне от 80 до 120 уд./мин, предпочтительно - в диапазоне от 90 до 110 уд./мин. Особенно предпочтительная схема введения композиции, содержащей одно или более антигипертензивных средств по изобретению, показана на фигуре 9.
В одном из вариантов осуществления изобретения композицию, содержащую одно или более антигипертензивных средств, для применения в способе пролонгирования выживаемости организма-реципиента вводят организму-реципиенту, которого подвергали иммуносупрессорной индукционной терапии в соответствии со схемой введения, и/или организму-реципиенту, которого подвергают иммуносупрессорной поддерживающей терапии, противовоспалительной терапии, введению ингибитора mTOR и/или вспомогательной терапии в соответствии с соответствующими схемами введения. Учитывая, что авторы настоящего изобретения обнаружили, что введение одного или более антигипертензивных средств реципиенту после трансплантации, введение ингибитора mTOR реципиенту после трансплантации и снижение дозы глюкокортикоида, вводимого реципиенту как часть иммуносупрессорной поддерживающей терапии, на ранней стадии после трансплантации предотвращает разрастание донорского сердца в организме-реципиенте, композицию, содержащую одно или более антигипертензивных средств, для применения в способе пролонгирования выживаемости организма-реципиента по изобретению, предпочтительно, вводят организму-реципиенту, которого подвергают иммуносупрессорной поддерживающей терапии и введению ингибитора mTOR в соответствии с соответствующими схемами введения. Соответствующие схемы введения для любого из указанных выше способов лечения и их (предпочтительные) варианты осуществления являются такими, как описано выше для способа пролонгирования выживаемости организма-реципиента. Как будет очевидно специалисту в этой области, если организм-реципиент подвергают одному из указанных выше способов лечения в соответствии с соответствующей схемой введения, первое введение, включенное в указанную схему введения, уже осуществили. Предпочтительно, если организм-реципиент подвергают иммуносупрессорной поддерживающей терапии в соответствии со схемой введения, и если указанная схема введения включает снижение дозы (мг/кг/сутки) глюкокортикоида в конкретное количество раз в пределах некоторого периода времени, такое снижение уже осуществили.
В другом варианте осуществления изобретения композицию, содержащую одно или более антигипертензивных средств, для применения в способе пролонгирования выживаемости организма-реципиента вводят организму-реципиенту, генетически модифицированное сердце/почку/легкое/печень которого из ксеногенного организма-донора, консервировали посредством неишемической консервации, предпочтительно - посредством неишемической перфузии сердца/почки/легкого/печени, перед трансплантацией, например, как описано выше для способа пролонгирования выживаемости организма-реципиента.
Способ профилактики или лечения сердечной/почечной/легочной/печеночной недостаточности, примат, получаемый таким способом, и композиции для применения в таком способе
Настоящее изобретение также относится к способу профилактики или лечения сердечной/почечной/легочной/печеночной недостаточности в организме-реципиенте, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора, где указанный способ включает все из стадий и предпочтительных вариантов осуществления, описанных выше для способа пролонгирования выживаемости организма-реципиента, которому трансплантируют генетически модифицированное сердце/почка/легкое/печень из ксеногенного организма-донора.
Настоящее изобретение также относится к живому примату, сердце/почку/легкое/печень которого функционально заменяют трансплантируемым, генетически модифицированным сердцем/почкой/легким/печенью из ксеногенного млекопитающего, где указанного живого примата можно получать описанным выше способом профилактики или лечения сердечной/почечной/легочной/печеночной недостаточности в организме-реципиенте, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора. Указанный живой примат и его предпочтительные варианты осуществления являются такими, как описано выше для живого примата, которого можно получать способом пролонгирования выживаемости организма-реципиента, которому трансплантируют генетически модифицированное сердце/почка/легкое/печень из ксеногенного организма-донора.
Настоящее изобретение также относится к композиции, содержащей ингибитор mTOR, для применения в способе профилактики или лечения сердечной/почечной/легочной/печеночной недостаточности в организме-реципиенте, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора, где организм-донор представляет собой млекопитающего, и где организм-реципиент представляет собой примата. Указанная композиция, содержащая ингибитор mTOR, и его предпочтительные варианты осуществления являются такими, как описано выше для композиции, содержащей ингибитор mTOR, для применения в способе пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора.
Настоящее изобретение также относится к композиции, содержащей одно или более антигипертензивных средств, для применения в способ профилактики или лечения сердечной/почечной/легочной/печеночной недостаточности в организме-реципиенте, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора, где организм-донор представляет собой млекопитающего, и где организм-реципиент представляет собой примата. Указанная композиция, содержащая одно или более антигипертензивных средств, и ее предпочтительные варианты осуществления являются такими, как описано выше для композиции, содержащей одно или более антигипертензивных средств, для применения в способе пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора.
Способ лечения организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора, примат, получаемый таким способом, и композиции для применения в таком способе
Настоящее изобретение также относится к способу лечения организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора, где указанный способ включает все из стадий и предпочтительных вариантов осуществления, описанных выше для способа пролонгирования выживаемости организма-реципиента, которому трансплантируют генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора.
Настоящее изобретение также относится к живому примату, сердце/почку/легкое/печень которого функционально заменяют трансплантируемым, генетически модифицированным сердцем/почкой/легким/печенью из ксеногенного млекопитающего, где указанного живого примата можно получать описанным выше способом лечения организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора. Указанный живой примат и его предпочтительные варианты осуществления являются такими, как описано выше для живого примата, которого можно получать способом пролонгирования выживаемости организма-реципиента, которому трансплантируют генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора.
Настоящее изобретение также относится к композиции, содержащей ингибитор mTOR, для применения в способе лечения организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора, где организм-донор представляет собой млекопитающего, и где организм-реципиент представляет собой примата. Указанная композиция, содержащая ингибитор mTOR, и его предпочтительные варианты осуществления являются такими, как описано выше для композиции, содержащей ингибитор mTOR, для применения в способе пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора.
Настоящее изобретение также относится к композиции, содержащей одно или более антигипертензивных средств, для применения в способе лечения организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора, где организм-донор представляет собой млекопитающего, и где организм-реципиент представляет собой примата. Указанная композиция, содержащая одно или более антигипертензивных средств, и ее предпочтительные варианты осуществления являются такими, как описано выше для композиции, содержащей одно или более антигипертензивных средств, для применения в способе пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора.
Способ профилактики разрастания сердца/почки/легкого/печени у организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора, примат, получаемый таким способом, и композиции для применения в таком способе
Разрастание трансплантированного сердца/почки/легкого/печени в организме-реципиенте является значительной проблемой, когда генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора трансплантируют организму-реципиенту. Термин "разрастание" относится к любому повышению массы или объема органа или ткани, являющемуся вредоносным для функции органа или ткани, в частности, из-за экзогенных факторов (например, компрессии по причине ограничения пространства) или эндогенных факторов (например, гипоксии по причине недостаточной микрососудистой циркуляции). В одном из вариантов осуществления термин "разрастание сердца" означает, что трансплантированное сердце увеличивается в 3-4 раза в объеме и массы в пределах приблизительно одного месяца после трансплантации. Окружающие анатомические структуры и, наконец, грудная клетка реципиента ограничивает это расширение. В результате функция сердца сильно ограничена; кровоток ограничен, затруднен, замедлен, перекрыт. Т.к. печень является первым органом, гемодинамически расположенным ниже сердца, функция печени нарушается первой. Реципиент погибает от терминальной стадии дисфункции сердца и печени. Причиной разрастания является то, что сердце млекопитающего (например, сердце свиньи) быстро растет у донора (пропорционально быстро растущему всему организму, который на момент трансплантации может составлять приблизительно 20 кг). Группа из Гарвардского университета также наблюдали это явление после трансплантации почки и легкого и назвали его "внутренний рост" (сердце должно быстро расти во время развития организма; оно не прекращает расти даже при трансплантации в организм примата; см. ссылку 15).
Авторы настоящего изобретения обнаружили, что, в частности, введение одного или более антигипертензивных средств реципиенту после трансплантации, введение ингибитора mTOR реципиенту после трансплантации и быстрое снижение дозы глюкокортикоида, вводимого реципиенту как часть иммуносупрессорной поддерживающей терапии, на ранней стадии после трансплантации предотвращает разрастание донорского сердца в организме-реципиенте (см., например, фигуры 5 и 6). Таким образом, настоящее изобретение также относится к способу профилактики разрастания сердца/почки/легкого/печени в организме-реципиенте, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора, где указанный способ включает все из стадий и предпочтительных вариантов осуществления, описанных выше для способа пролонгирования выживаемости организма-реципиента, которому трансплантируют генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора.
Настоящее изобретение также относится к живому примату, сердце/почку/легкое/печень которого функционально заменяют трансплантируемым, генетически модифицированным сердцем/почкой/легким/печенью из ксеногенного млекопитающего, где указанного живого примата можно получать описанным выше способом профилактики разрастания сердца/почки/легкого/печени в организме-реципиенте, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора. Указанный живой примат и его предпочтительные варианты осуществления являются такими, как описано выше для живого примата, получаемого способом пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора.
Настоящее изобретение также относится к композиции, содержащей ингибитор mTOR, для применения в способе профилактики разрастания сердца/почки/легкого/печени в организме-реципиенте, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора, где организм-донор представляет собой млекопитающего, и где организм-реципиент представляет собой примата. Указанная композиция, содержащая ингибитор mTOR, и ее предпочтительные варианты осуществления являются такими, как описано выше для композиции, содержащей ингибитор mTOR, для применения в способе пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора.
Настоящее изобретение также относится к композиции, содержащей одно или более антигипертензивных средств, для применения в способе профилактики разрастания сердца/почки/легкого/печени в организме-реципиенте, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора, где организм-донор представляет собой млекопитающего, и где организм-реципиент представляет собой примата. Указанная композиция, содержащая одно или более антигипертензивных средств, и его предпочтительные варианты осуществления являются такими, как описано выше для композиции, содержащей одно или более антигипертензивных средств, для применения в способе пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце/почку/легкое/печень из ксеногенного организма-донора.
Применимость настоящего изобретения для ксеногенной трансплантации других органов
Как описано выше, группа из Гарвардского университета также наблюдала явление разрастания донорского органа у реципиента после трансплантации почки и легкого (см. ссылку 15). Реципиенты таких трансплантаций будут страдать соответствующими заболеваниями на терминальной стадии. Таким образом, способы, представленные в настоящем описании (в частности, введение одного или более антигипертензивных средств реципиенту после трансплантации, введение ингибитора mTOR реципиенту после трансплантации и снижение дозы глюкокортикоида, вводимого реципиенту как часть иммуносупрессорной поддерживающей терапии, на ранней стадии после трансплантации), можно использовать для трансплантации любого ксеногенного органа, включая трансплантацию почки, трансплантацию легкого и трансплантацию печени. Например, способы по настоящему изобретению также должны работать у макак-резусов после доклинической трансплантации почки, легкого (а также печени) (см. ссылку 15).
Генетически модифицированное млекопитающее и способ его получения
Значительный прогресс в генной инженерии и редактировании генома видов домашнего скота позволил расширить их использование до биомедицинской области, при этом наиболее примечательными являются: специальные модели на крупных животных для трансляционной медицины; клетки, ткани и органы свиней для ксенотрансплантации; и получение фармацевтических белков в трансгенных крупных животных. Переход новых открытых от фундаментальных исследований к клиническому использованию является длинным, зачастую неэффективным и затратным процессом. Соответствующие модели на животных являются ключевыми для успеха трансляционного исследования. Хотя широко используют модели на грызунах, они зачастую неточно соответствуют заболеванию человека. Таким образом, необходимы дополнительные модели на животных, в которых лучше имитируют аспекты анатомии и физиологии человека. Получено несколько генетически сконструированных моделей на свиньях, многие из которых представляют механизмы и фенотипы заболевания человека ближе, чем существующие модели на грызунах. Кроме того, свиньи являются наиболее перспективным биологическим видом-донором для ксенотрансплантации. Т.к. необходимо множество генетических модификаций для предотвращения иммунного отторжения, преодоления физиологической несовместимости ксеноорганов и устранения потенциальных факторов риска, таких как эндогенные ретровирусы свиней (PERV), редактирование генома ускоряет прогресс в этой области. Наконец, что не менее важно, генная инженерия крупных видов животных как биореакторов для производства фармацевтических белков все еще является интересным вариантом, хотя на рынке есть лишь несколько таких продуктов. В целом, генетически сконструированные крупные животные играют все более важную роль в биомедицине. Во всех областях использования устойчивая и надежная экспрессия трансгена является критической для ценности генетически сконструированных свиней. Настоящее изобретение относится к генетически модифицированному млекопитающему с устойчивой и надежной экспрессией трансгена.
В способе пролонгирования выживаемости организма-реципиента, представленном в настоящем описании, указанному организму-реципиенту трансплантируют генетически модифицированное сердце, почку, легкое или печень из ксеногенного организма-донора. Аналогично, описанному выше живому примату трансплантировали генетически модифицированное сердце, почку, легкое или печень из ксеногенного млекопитающего, и описанные выше композиции, содержащие ингибитор mTOR/антигипертензивные средства, предназначены для применения в способе пролонгирования выживаемости организма-реципиента, которому трансплантировали генетически модифицированное сердце, почку, легкое или печень из ксеногенного организма-донора. В одном из вариантов осуществления генетически модифицированное млекопитающее с устойчивой и надежной экспрессией трансгена, представленного в настоящем описании, может служить в качестве ксеногенного организма-донора для такого генетически модифицированного сердца, почки, легкого или печени.
Экспрессия трансгенов, случайным образом встроенных в геном, в значительной степени зависит от контекста соседнего хроматина. Эти так называемые позиционные эффекты приводят к вариабельной экспрессии трансгена среди разных трансгенных линий и зачастую к неустойчивой экспрессии в пределах одной линии. Стратегией, направленной на избежание этих недостатков случайной инсерции трансгенов, является направленное расположение экспрессирующих кассет в так называемых локусах "безопасной зоны", имеющих открытую конфигурацию и обеспечивающих стабильную экспрессию трансгена. Наиболее выраженным примером является локус Rosa26 у мышей, также обнаруженный и используемый у свиней (см. ссылку 27). Настоящее изобретение относится к локусу GGTA1 как благоприятной безопасной зоне для надежной экспрессии трансгена. Помимо прочего, это обеспечивает следующие преимущества:
i) GGTA1 высоко экспрессируется во многих типах тканей и клеток, что наиболее важно - в эндотелиальных клетках: в эндотелиальных клетках свиньи дикого типа уровень транскрипции CMAH схож с таковым у B4GALNT2, в то время как уровень транскрипции GGTA1 является в приблизительно 5 раз более высоким (см. также пример 6);
ii) GGTA1 является необязательным для нормального развития, что показано на людях и обезьянах Старого Света, у которых отсутствует GGTA1, и многочисленных линиях GGTA1-нокаутных свиней;
iii) мутация GGTA1, полученная с использованием направленных нуклеаз, является высокоэффективной даже после инъекции в ооциты (см. ссылку 28);
iv) для получения свиней-доноров для ксенотрансплантации предпочтительно инактивировать GGTA1 каким-либо образом во избежание сверхострого отторжения ксенотрансплантатов от свиньи примату; и
v) направленное встраивание ксенопротективных трансгенов в локус GGTA1 предотвращает их сегрегацию во время размножения.
В свете изложенного выше, настоящее изобретение относится к генетически модифицированному млекопитающему, где трансгены встраивают в локус гена альфа-1,3-галактозилтрансферазы (GGTA1), и где по меньшей мере один из трансгенов экспрессируется под контролем эндогенного промотора гена альфа-1,3-галактозилтрансферазы.
Для предотвращения иммунного отторжения ксенотрансплантатов, преодоления физиологической несовместимости и снижения риска передачи зоонозных патогенов свиньям вводили более 40 разных генетических модификаций (обзор по ссылке 29). Проблему комбинирования множества трансгенов, чтобы сделать возможной практическое разведение животное и избежать сегрегации независимых участков встраивания, можно преодолеть посредством "комбиниринга" и пирамидирования генов, т.е. случайного или направленного расположения множества экспрессирующих кассет в одном геномном локусе (см. ссылки 23, 30). Таким образом, настоящее изобретение относится к генетически модифицированному млекопитающему, где несколько трансгенов встраивают в один локус, т.е. в локус гена альфа-1,3-галактозилтрансферазы (GGTA1).
Встраивание трансгенов в локус GGTA1 повреждает ген GGTA1 и, таким образом, устраняет экспрессию альфа-1,3-галактозилтрансферазы. Повреждение GGTA1 является предпочтительным в генетически модифицированном сердце, почке, легком или печени, трансплантируемым по изобретению, т.е. оно помогает избегать сверхострого отторжения ксенотрансплантатов. Сверхострое отторжение ксенотрансплантатов от свиньи примату запускается связыванием уже образованных антител против специфических ксеноантигенов. Последующая активация системы комплемента не может контролироваться из-за видовой несовместимости между регуляторами на эффекторных молекулах ксенотрансплантата и реципиента (обзор по ссылке 31). Основным ксеноантигеном является галактоза-α1,3-галактоза (αGal), синтезирующаяся под действием N-ацетиллактозаминид-альфа-1,3-галактозилтрансферазы (GGTA1). Этот фермент является дефектным у людей и обезьян Старого Света, и, таким образом, αGal отсутствует. Иммуногенный контакт с бактериальными эпитопами αGal в желудочно-кишечном тракте вызывает повышение антител против αGal у людей и обезьян Старого Света на ранних стадиях жизни.
Трансгенами, встраиваемыми в локус GGTA1, являются трансген регуляторного белка системы комплемента человека (т.е. последовательность, кодирующая регуляторный белок системы комплемента человека) и трансген тромбомодулина человека (т.е. последовательность, кодирующая тромбомодулин человека). Экспрессия регуляторных белков системы комплемента человека в трансгенных млекопитающих-донорах (например, свиньях) является желаемой для преодоления сверхострого отторжения ксенотрансплантатов от млекопитающего (например, свиньи) примату. Регуляторные белки системы комплемента человека ослабляют активацию комплемента и значительно пролонгируют выживаемость ксенотрансплантатов от млекопитающего (например, свиньи) примату (обзор по ссылке 29). В рамках изобретения примерами регуляторных белком системы комплемента человека являются CD46 (мембранный кофакторный белок; MCP), CD55 (комплемент-зависимый фактор гемолиза, DAF) и CD59 (мембранный ингибитор реактивного лизиса, MIRL). В рамках изобретения особенно предпочтительным регуляторным белком системы комплемента человека является CD46. Однако генетически модифицированное млекопитающее по изобретению также может включать все из CD46, CD55 и CD59, встроенные в локус GGTA1.
Дисрегуляция свертывания и нарушенный гемостаз являются частыми осложнениями при доклинической ксенотрансплантации от млекопитающего (например, свиньи) не являющемуся человеком примату (обзор по ссылке 32). Их манифестация находится в диапазоне от острой опасной для жизни истощающей коагулопатии с тромбоцитопенией и кровотечением до тромботической микроангиопатии, приводящей к утрате ксенотрансплантата. Предполагаемые причины включают воспаление, сосудистое повреждение, врожденный, гуморальный и клеточный иммунные ответы и, в частности, молекулярную несовместимость между регуляторами свертывания млекопитающего (например, свиньи) и примата (см. ссылку 33). Тромбомодулин человека (hTM) является ключевым эндотелиальным антикоагулянтом/антитромботическим белком, который можно пополнять посредством генной инженерии млекопитающих-доноров (например, свиней). TM свиньи связывается с тромбином человека, но является плохим кофактором для активации протеина C человека (см. ссылку 34). Для преодоления этой проблемы можно получать линии трансгенных млекопитающих (например, свиней), экспрессирующих TM человека под контролем различных промоторов: CMV (см. ссылку 35), CAGGS (см. ссылку 36), человек ICAM (см. ссылку 5) и THBD свиньи (см. ссылку 37). Сердце hCD46-трансгенной свиньи с нокаутом GGTA1 с последним из hTM-экспрессирующих векторов выживало в течение более чем 900 дней после гетеротопической абдоминальной трансплантации павиану с использованием соответствующей иммуносупрессии (индукционная терапия антитимоцитарным глобулином и антителом против CD20, поддерживающая терапия с использованием микофенолата мофетила и интенсивно вводимого антитела против CD40 (2C10R4)) (см. ссылку 5).
В рамках изобретения генетически модифицированное млекопитающее может иметь дополнительные генетические модификации. В одном из вариантов осуществления генетически модифицированное млекопитающее в рамках изобретения дополнительно имеет гомозиготный нокаут генов CMAH и B4GALNT2. Гидроксилаза цитидин-монофосфат-N-ацетилнейраминовой кислоты (CMAH) синтезирует N-ацетилнейраминовую кислоту (Neu5Gc, также называемую антигеном Flanganutziu-Deicher), и β-1,4-N-ацетил-галактозаминилтрансфераза 2 свиньи (B4GALNT2) приводит к образованию Sd(a)-подобного гликана. Оба фермента являются другими важными ксеноантигенами (обзор по ссылке 38). Клетки свиней с дефицитом GGTA1/CMAH/B4GALNT2 демонстрируют сниженное связывание с IgM и IgG человека по сравнению с клетками, в которых отсутствуют только GGTA1 и CMAH.
В другом варианте осуществления генетически модифицированное млекопитающее по изобретению дополнительно имеют инсерции последовательности, кодирующей гемоксигеназу 1 (предпочтительно, гемоксигеназу 1 человека), и последовательности, кодирующей A20 (предпочтительно, A20 человека). Предпочтительно, эти инсерции также находятся в локусе GGTA1.
В другом варианте осуществления генетически модифицированное млекопитающее по изобретению дополнительно имеет инсерции последовательности, кодирующей LEA29Y или PD-L1 (предпочтительно, PD-L1 человека). Предпочтительно, эти инсерции также находятся в локусе GGTA1. В другом варианте осуществления генетически модифицированное млекопитающее по изобретению дополнительно имеет инсерцию последовательности, кодирующей α1,2-фукозилтрансферазу человека. Предпочтительно, эта инсерция также находится в локусе GGTA1.
В генетически модифицированном млекопитающем по изобретению последовательность, кодирующую регуляторный белок системы комплемента человека, и последовательность, кодирующую тромбомодулин человека, встраивают в локус гена альфа-1,3-галактозилтрансферазы, таким образом, что по меньшей мере последовательность, кодирующая регуляторный белок системы комплемента человека, экспрессируется под контролем эндогенного промотора гена альфа-1,3-галактозилтрансферазы. Как указано выше, GGTA1 высоко экспрессируется во многих типах тканей и клеток, что наиболее важно, в эндотелиальных клетках. Таким образом, встраивание последовательности, кодирующей регуляторный белок системы комплемента человека, в локус GGTA1 таким образом, что она экспрессируется под контролем эндогенного промотора гена альфа-1,3-галактозилтрансферазы, обеспечивает высокую экспрессию регуляторного белка системы комплемента человека.
В другом варианте осуществления генетически модифицированного млекопитающего по изобретению последовательность, кодирующую регуляторный белок системы комплемента человека, и последовательность, кодирующую тромбомодулин человека, встраивают таким образом, что они экспрессируются под контролем эндогенного промотора гена альфа-1,3-галактозилтрансферазы, таким образом, что оба гена высоко экспрессируются во множестве типов тканей и клеток. Экспрессия регуляторного белка системы комплемента человека и тромбомодулина человека во множестве типов тканей и клеток приводит к тому, что генетически модифицированное млекопитающее по изобретению может служить в качестве ксеногенного организма-донора различных органов, т.е. для каждого из генетически модифицированного сердца, почки, легкого или печени.
В альтернативном варианте осуществления генетически модифицированного млекопитающего по изобретению последовательность, кодирующая регуляторный белок системы комплемента человека, экспрессируется под контролем эндогенного промотора гена альфа-1,3-галактозилтрансферазы, и последовательность, кодирующая тромбомодулин человека, экспрессируется под контролем промотора THBD свиньи или экзогенного промотора. Например, экзогенный промотор может являться промотором CMV, промотором CAGGS или промотором ICAM человека. Предпочтительно, такой экзогенный промотор является убиквитарно активным промотором, т.е. промотором, экспрессирующимся во множестве типов тканей и клеток. И снова, экспрессия последовательности, кодирующей тромбомодулин человека, во множестве типов тканей и клеток приводит к тому, что генетически модифицированное млекопитающее по изобретению может служить в качестве ксеногенного организма-донора различных органов.
В другом варианте осуществления генетически модифицированного млекопитающего по изобретению генетически модифицированное млекопитающее дополнительно имеет инсерцию последовательности гена селективного маркера между последовательностью, кодирующей регуляторный белок системы комплемента человека, и последовательностью, кодирующей тромбомодулин человека. Предпочтительно, эту последовательность гена селективного маркера фланкируют участками loxP. Это приводит к тому, что клетки из генетически модифицированного млекопитающего можно выделять и использовать для направленного встраивания дополнительных экспрессирующих векторов. Дополнительные экспрессирующие векторы можно встраивать посредством Cre-опосредованной замены кассеты с использованием сконструированной бактериальной искусственной хромосомы (BAC), содержащей один или несколько дополнительных трансгенов (см. фигуру 18).
В другом варианте осуществления генетически модифицированного млекопитающего по изобретению генетически модифицированное млекопитающее принадлежит к семейству Suidae, предпочтительно - к роду Sus, более предпочтительно - к биологическому виду S. scrofa, и наиболее предпочтительно - к подвиду S. s. domesticus. В предпочтительном варианте осуществления генетически модифицированного млекопитающего по изобретению оно принадлежит к биологическому виду S. scrofa.
В другом варианте осуществления генетически модифицированного млекопитающего по изобретению оно является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы, свиньей породы дюрок, свиньей швабско-галльской породы, черным минипигом или свиньей Оклендских островов; предпочтительно, генетически модифицированное млекопитающее является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы.
В другом варианте осуществления генетически модифицированного млекопитающего по изобретению генетически модифицированное млекопитающее (например, свинья) не содержит эндогенный ретровирус C свиней (PERV-C). Эндогенные ретровирусы свиньи (PERV) не так просто удалить, т.к. они интегрированы в геном свиньи и, таким образом, представляют собой наиболее устойчивый источник риска (обзор по ссылке 39). PERV-A и PERV-B могут инфицировать некоторые опухолевые клетки человека и, в меньшей степени, первичные клетки человека. PERV-C инфицирует только клетки свиньи, но рекомбинанты с PERV-A могут инфицировать клетки человека и отличаются высокой скоростью репликации. Т.к. PERV-C присутствует не у всех свиней, в качестве потенциальных доноров можно идентифицировать и выбирать несодержащих PERV-C животных. Это является предпочтительным, в частности, если генетически модифицированное млекопитающее (например, свинья) по изобретению служит в качестве ксеногенного организма-донора для органов, подлежащих трансплантации приматам.
Настоящее изобретение также относится к способу получения генетически модифицированного млекопитающего, которое может служить в качестве ксеногенного организма-донора для органов, трансплантируемых приматам. Этот способ включает встраивание последовательности, кодирующей регуляторный белок системы комплемента человека, и последовательности, кодирующей тромбомодулин человека, в локус гена альфа-1,3-галактозилтрансферазы генома млекопитающего для получения генетически модифицированного генома, внесение генетически модифицированного генома в клетку и созревание клетки, содержащей генетически модифицированный геном, в генетически модифицированное млекопитающее. Предпочтительно, геном является геномом соматической клетки, и генетически модифицированный геном встраивают в клетку посредством переноса ядра соматической клетки (подробности получения такого генетически модифицированного млекопитающего см., например, по ссылке 92, включенной в настоящее описание в качестве ссылки в полном объеме).
В одном из вариантов осуществления способа получения генетически модифицированного млекопитающего по изобретению последовательность, кодирующая регуляторный белок системы комплемента человека, и последовательность, кодирующая тромбомодулин человека, находятся на одном экспрессирующем векторе, встроенном в локус гена альфа-1,3-галактозилтрансферазы. Предпочтительно, экспрессирующий вектор, встроенный в локус гена альфа-1,3-галактозилтрансферазы, дополнительно содержит последовательность гена селективного маркера между последовательностью, кодирующей регуляторный белок системы комплемента человека, и последовательностью, кодирующей тромбомодулин человека. Как известно специалисту в этой области, эта последовательность маркерного гена делает возможной селекцию клетки, содержащей генетически модифицированный геном.
В другом варианте осуществления способа получения генетически модифицированного млекопитающего по изобретению способ дополнительно включает встраивание последовательности, кодирующей α1,2-фукозилтрансферазу человека, и/или встраивание одной или более дополнительных генетических модификаций в геном млекопитающего. Если эти генетические модификации являются инсерциями, предпочтительно встраивать последовательности в локус GGTA1. Даже более предпочтительно, чтобы встраиваемые последовательности находились на одном экспрессирующем векторе вместе с последовательностью, кодирующей регуляторный белок системы комплемента человека, и последовательностью, кодирующей тромбомодулин человека, встраиваемый в локус гена альфа-1,3-галактозилтрансферазы по изобретению.
В предпочтительном варианте осуществления способа получения генетически модифицированного млекопитающего по изобретению генетические модификации вносят с использованием CRISPR/Cas9. CRISPR/Cas9 делает возможной направленную инсерцию и/или делецию генов в пределах генома. Альтернативно, генетические модификации можно вносить с использованием нуклеаз с цинковыми пальцами (ZFN) или эффекторной нуклеазы, подобной активаторам транскрипции (TALEN). Использование этих способов описано по ссылке 107, в полном объеме включенной в настоящее описание.
Варианты осуществления, описанные выше в случае генетически модифицированного млекопитающего по изобретению, также относятся к способу получения генетически модифицированного млекопитающего по изобретению с соответствующими изменениями. В частности, в предпочтительном варианте осуществления способа получения генетически модифицированного млекопитающего по изобретению млекопитающее принадлежит к биологическому виду S. scrofa.
И в случае генетически модифицированного млекопитающего по изобретению, и в случае способа получения генетически модифицированного млекопитающего по изобретению, подробности, касающиеся указанных выше последовательности, встраиваемых в генетически модифицированное млекопитающее, можно найти в разделе, касающемся способа пролонгирования выживаемости примата после трансплантации сердца/почки/легкого/печени по изобретению, и в разделе, касающемся примата с трансплантированным сердцем/почкой/легким/печенью в рамках изобретения. В частности, транскрипты, предпочтительно, экспрессирующиеся при инсерции генов, описанных в этих разделах, также являются транскриптами, предпочтительно, экспрессирующимися при инсерции соответствующих последовательностей в генетически модифицированное млекопитающее по изобретению.
В одном из вариантов осуществления генетически модифицированного млекопитающего по изобретению генетически модифицированное млекопитающее имеет одну или более дополнительных генетических модификаций. Аналогично, в одном из вариантов осуществления способа получения генетически модифицированного млекопитающего по изобретению способ дополнительно включает встраивание одной или более дополнительных генетических модификаций. Если генетически модифицированное млекопитающее должно служить ксеногенным организмом-донором генетически модифицированных органов для ксенотрансплантации, эти одна или более дополнительных генетических модификаций, предпочтительно, выбраны из (1) генетических модификаций для преодоления сверхострого сосудистого отторжения ксенотрансплантатов от млекопитающего (например, свиньи) примату; (2) генетических модификаций для преодоления клеточного отторжения ксенотрансплантатов от млекопитающего (например, свиньи) примату; (3) генетических модификаций для преодоления дисрегуляции свертывания и воспаления; и/или (4) генетических модификаций для снижения риска зоонозных инфекций. В предпочтительном варианте осуществления, если эти генетические модификации представляют собой генетические инсерции, они находятся в локусе GGTA1. Указанные выше группы потенциальных генетических модификаций по изобретению описаны далее, в частности, в отношении ксенотрансплантации от свиньи примату. Любые из этих генетических модификаций могут являться одной или более дополнительными генетическими модификациями по изобретению:
(1) Генетические модификации для преодоления сверхострого и острого сосудистого отторжения ксенотрансплантатов от свиньи примату.
Сверхострое отторжение ксенотрансплантатов от свиньи примату запускается связыванием уже образованных антител против специфических ксеноантигенов. Последующая активация системы комплемента не может контролироваться по причине видовой несовместимости между регуляторами на эффекторных молекулах ксенотрансплантата и реципиента (обзор по ссылке 31). Основным ксеноантигеном является галактоза-α1,3-галактоза (αGal), синтезируемая N-ацетиллактозаминид-альфа-1,3-галактозилтрансферазой (GGTA1). Этот фермент является дефектным у людей и обезьян Старого Света, и, таким образом, αGal отсутствует. Иммуногенный контакт с бактериальными эпитопами αGal в желудочно-кишечном тракте вызывает повышение антител против αGal у людей и обезьян Старого Света на ранних стадиях жизни. Другими важными ксеноантигенами являются N-ацетилнейраминовая кислота (Neu5Gc, также называемый антигеном Flanganutziu-Deicher), синтезируемая гидроксилазой цитидин-монофосфат-N-ацетилнейраминовой кислоты (CMAH), и Sd(a)-подобный гликан, образующийся под действием β-1,4-N-ацетил-галактозаминилтрансферазы 2 свиней (B4GALNT2) (обзор по ссылке 38). Первой стадией для преодоления сверхострого отторжения ксенотрансплантатов от свиньи примату являлось получение трансгенных свиней-доноров, экспрессирующих регуляторные белки системы комплемента человека, такие как CD46 (мембранный кофакторный белок; MCP), CD55 (комплемент-зависимый фактор гемолиза, DAF), CD59 (мембранный ингибитор реактивного лизиса, MIRL), в отдельности или в комбинации. CD46-трансгенная свинья описана по ссылке 113. Эти трансгенные свиньи-доноры имеют ослабленную активацию комплемента и значительно пролонгированную выживаемость ксенотрансплантатов от свиньи примату (обзор по ссылке 29). Значительным шагом к долговременной выживаемости васкуляризированных ксенотрансплантатов от свиньи примату являлась инактивация гена GGTA1 свиньи. После первой публикации о свиньях с дефицитом GGTA1 (и, таким образом, αGal) (см. ссылку 40) получено множество линий свиней с нокаутом GGTA1, исходно посредством таргетинга генов (обзор по ссылке 41), а затем посредством редактирования генома (например, ссылка 42). Для удаления ксеноантигена Neu5Gc получали свиней, у которых отсутствует CMAH (см. ссылку 43), что комбинировали с дефицитом GGTA1 (см. ссылки 44-46). Ген B4GALNT2 свиньи также инактивировали для устранения Sd(a)-подобного ксеноантигена (см. ссылку 47). Авторы показали, что клетки свиней с дефицитом GGTA1/CMAH/B4GALNT2 демонстрировали сниженное связывание IgM и IgG человека по равнению с клетками, в которых отсутствуют только GGTA1 и CMAH.
(2) Генетические модификации для преодоления клеточного отторжения ксенотрансплантатов от свиньи примату
Врожденные и адаптивные компоненты клеточной иммунной системы участвуют в отторжении ксенотрансплантата (обзор по ссылке 48). Инфильтрация ткани и ксенотрансплантатов солидных органов иммунными клетками начинается с нейтрофилов, а затем присоединяются макрофаги и T-клетки (обзор по ссылке 49). Кроме того, естественные киллеры (NK) могут индуцировать активацию эндотелиальных клеток в ксенотрансплантате (см. ссылку 50) и лизировать клетки свиньи напрямую и через антителозависимую цитотоксичность (обзор по ссылке 51).
Клеточные ксенотрансплантаты, такие как островки свиньи, у не являющихся человеком приматов, в основном, отторгаются CD4+ T-клетками. Их активация может индуцироваться прямым связыванием T-клеточными рецепторами примата с молекулами SLA класса 1 и класса 2 клеток свиньи или косвенно антигенпрезентирующими клетками (APC) реципиента, экспрессирующего MHC с процессированными ксеноантигенами (обзор по ссылке 49). В дополнение к этому опосредованному T-клеточными рецепторами сигналу, активация T-клеток регулируется костимуляторным сигналом, который может, в зависимости от своей природы, индуцировать и амплифицировать эффективный иммунный ответ, или проявлять ингибиторную толерогенную функцию. Что касается ксенотрансплантации, наиболее исследованными костимуляторными сигнальными комплексами T-клеток являются CD80/CD86-CD28 и CD40-CD154, при этом CD28 и CD154 (=CD40L) локализуются на T-клетках, а CD80/CD86 и CD40 - на APC. Путь костимуляции CD80/CD86-CD28 можно блокировать системным введением CTLA4-Ig (абатацепта) или LEA29Y (белатацепта), которые значительно улучшают долговременный исход трансплантации аллогенной и ксеногенной ткани (обзор по ссылке 52). Эти молекулы также могут экспрессироваться в генетически модифицированных свиньях-донорах, открывая перспективы локального ингибирования активации T-клеток в участке трансплантации, таким образом, позволяя избегать системной иммуносупрессии реципиента и риска последующей инфекции (комментарий по ссылке 53). LEA29Y-экспрессирующие кластеры клеток неонатальных островков (NICC) трансгенных свиней, трансплантированные мышам с иммунодефицитом и диабетом, нормализовали уровни глюкозы в крови и, в отличие от NICC дикого типа, не отторгались после преобразования мышей-реципиентов с использованием иммунных клеток человека (см. ссылку 54). Последующее исследование с использованием мышей с диабетом с долговременно "гуманизированной" иммунной системой в качестве реципиентов показало, что ксенотрансплантированные островки мышей, экспрессирующих LEA29Y, выживали в течение нескольких месяцев и нормализовали уровни глюкозы в крови реципиентов, в то время как островки дикого типа не приживлялись в этой модели (см. ссылку 55).
Для предотвращения клеточного отторжения также получали трансгенных свиней, экспрессирующих ФНО-связанный апоптоз-индуцирующий лиганд (TRAIL) человека (см. ссылки 56, 57), лиганд FAS человека (FASL) (см. ссылку 58) и HLA-E/микроглобулин бета-2. Клетки из свиней с HLA-E/микроглобулином бета-2 эффективно защищали от опосредованной NK-клетками человека цитотоксичности в зависимости от уровня экспрессии CD94/NKG2A на NK-клетках (см. ссылку 51). Для контроля активности макрофага CD47 человека экспрессировали на клетках свиней для активации рецептора "сигнала не ешь меня" SIRPα на моноцитах/макрофагах (человека) и для супрессии фагоцитарной активности (обзор по ссылке 29).
(3) Генетические модификации для преодоления дисрегуляции свертывания и воспаления
Дисрегуляция свертывания и нарушенный гемостаз являются частыми осложнениями при доклинической ксенотрансплантации от свиньи не являющемуся человеком примату (обзор по ссылке 32). Их манифестация находится в диапазоне от острой опасной для жизни истощающей коагулопатии с тромбоцитопенией и кровотечением до тромботическая микроангиопатия, приводящие к утрате ксенотрансплантате. Предполагаемые причины включают воспаление, сосудистое повреждение, врожденный, гуморальный и клеточный иммунные ответы и, в частности, молекулярную несовместимость между регуляторами свертывания свиньи и примата (см. ссылку 33).
Ключевые эндотелиальные антикоагулянтые/антитромботические белки модифицированные/дополненные посредством генной инженерии свиней-доноров, включают тромбомодулин человека (hTM), эндотелиальный рецептор протеина C (EPCR), ингибитор пути тканевого фактора (TFPI) и эктонуклеозидтрифосфат-дифосфогидролазу 1 (ENTPD1, CD39) (обзор по ссылке 33).
TM свиньи связывается с тромбином человека, но он является плохим кофактором для активации протеина C человека (см. ссылку 34). Для преодоления этой проблемы получали линии трансгенных свиней, экспрессирующих TM человека под контролем различных промоторов: CMV (см. ссылку 35), CAGGS (см. ссылку 36), ICAM человека (см. ссылку 5) и THBD свиньи (см. ссылку 37). Сердце hCD46-трансгенной свиньи с нокаутом GGTA1 с последним из hTM-экспрессирующих векторов выживало в течение более чем 900 дней после гетеротопической абдоминальной трансплантации павиану при соответствующей иммуносупрессии (индукционная терапия антитимоцитарным глобулином и антителом против CD20, поддерживающая терапия с использованием микофенолата мофетила и интенсивно вводимого антитела против CD40 (2C10R4)) (см. ссылку 5).
EPCR связывается с протеином C и презентирует его комплексу THBD/тромбин для активации, усиливая образование активированного протеина C (см. ссылку 59). Экспрессия EPCR человека в эндотелиальных клетках аорты свиньи снижала агрегацию тромбоцитов человека почти так же эффективно, как человек THBD (см. ссылку 60). Авторы сделали вывод о том, что трансгенная экспрессия EPCR человека может усиливать эффект THBD свиньи, но будет иметь даже больший эффект при коэкспрессии с THBD человека. TFPI свиньи является менее эффективным ингибитором TF/фактором VIIa человека, чем TFPI человека (обзор по ссылке 33). Недавнее исследование показало, что домен Куница 1 является критическим для видовой несовместимости между TFPI свиньи и тканевым фактором человека (TF), и что тромбообразование можно ингибировать с помощью трансфицированных с использованием TFPI человека мезенхимальных клеток костного мозга свиньи (см. ссылку 61). Для преодоления этой несовместимости получали трансгенных свиней, экспрессирующих TFPI человека (см. ссылки 62, 63).
CD39 быстро гидролизует АТФ и АДФ до АМФ. АМФ гидролизуется экто-5'-нуклеотидазой (CD73) до аденозина, антитромботического и сердечно-сосудистого протективного медиатора. У трансгенных свиней, экспрессирующих CD39 человека под контролем промотора H-2Kb мыши, наблюдали сниженный размер инфаркта после ишемии/реперфузии миокарда (см. ссылку 64). Затем почки (см. ссылки 65, 66) и островки (см. ссылку 67) генетически модифицированных свиней (включая экспрессию CD39 человека) тестировали в экспериментах по ксенотрансплантации на не являющихся человеком приматах. Однако специфические эффекты CD39 человека невозможно отличить от эффектов других генетических модификаций.
Сниженной экспрессии прокоагуляторного TF достигали с помощью миРНК-опосредованного нокдауна (см. ссылку 68). Аномальный фагоцитоз тромбоцитов человека во время перфузии печени свиньи можно частично преодолевать посредством делеции рецептора асиалогликопротеина свиньи (ASGR) (см. ссылку 69). В дополнение к модификациям, направленным на нарушения свертывания при ксенотрансплантации, получали трансгенных свиней, экспрессирующих антиапоптотические и противовоспалительные белки, такие как индуцируемый фактором некроза опухоли-альфа белок 3 (A20) человека (см. ссылку 70) и гемоксигеназа-1 человека (HO-1) (см. ссылку 71).
(4) Генетические модификации для снижения риска зоонозных инфекций.
Ксенотрансплантация клеток, тканей или органов свиньи несет риск передачи микроорганизмов-возбудителей инфекций свиньи реципиенту-человеку и индуцирования зоонозного заболевания (см. ссылки 72, 73). Аллотрансплантация в редких случаях ассоциирована с передачей патогенных микроорганизмов, таких как вирус иммунодефицита человека и вируса бешенства. Однако ксенотрансплантаты строго регулируются как лекарственные препараты для передовой терапии (ATMP), проверяются на соответствие требованием безопасности самого высокого уровня и, таким образом, фактически могут в будущем стать более безопасными, чем аллотрансплантаты (см. ссылку 74). Хотя широкий спектр бактерий, вирусов, паразитов и грибов несет теоретический риск, всеобъемлющие исследования различных колоний свиней показали, что, например, фактическое количество микроорганизмов, обнаруживаемых у свиней, ограничено (см. ссылки 26, 75). Полная картина микроорганизмов у отдельных свиней еще не доступна и будет сильно зависеть от используемых способов тестирования, но маловероятно, что будет идентифицировано много новых патогенов. Одной из причин являются тысячелетия сосуществования людей и свиней, а второй является то, что большинство свиней-доноров получают в условиях SPF или почти SPF, что позволяет предотвращать инфекции от третьих биологических видов. Несмотря на это, скрининг на предполагаемые зоонозные микроорганизмы и тестирование стерильности являются обязательными.
Эндогенные ретровирусы свиньи (PERV) не так просто удалить, т.к. они интегрированы в геном свиньи и, таким образом, представляют собой наиболее устойчивый источник риска (обзор по ссылке 39). PERV-A и PERV-B могут инфицировать некоторые опухолевые клетки человека и, в меньшей степени, первичные клетки человека. PERV-C инфицируют только клетки свиньи, но рекомбинанты с PERV-A могут инфицировать клетки человека и отличаются высокой скоростью репликации. Т.к. PERV-C присутствует не у всех свиней, можно идентифицировать и выбирать несодержащих PERV-C животных в качестве потенциальных доноров. До настоящего времени передача PERV in vivo незадокументирована, несмотря на множество исследований, включая первые клинические испытания островков свиньи с использованием более чем 200 пациентов. Передача PERV также незадокументирована в многочисленных доклинических испытаниях клеток и органов свиней, трансплантированных не являющимся человеком приматам (обзор по ссылке 39). Однако почти во всех клинических испытаниях ксенотрансплантации не использовали иммуносупрессию и трансплантировали лишь небольшое количество клеток. Эксперименты по ксенотрансплантации и инфицированию PERV на животных включали виды-реципиенты, не имеющие полностью функциональный рецептор PERV, например, не являющихся человеком приматов или крыс. Таким образом, данные об инфективности PERV in vivo не считают полными.
Стратегии предотвращения передачи PERV включают (i) селекцию несодержащих PERV-C животных (см. ссылку 23) с низкой экспрессией PERV-A и -B; (ii) вакцины на основе нейтрализующих антител (см. обзор по ссылке 76); и (iii) долговременное снижение экспрессии PERV с помощью PERV-специфической миРНК (например, ссылки 77, 78). В статье описана одновременная инактивация до 62 провирусов с линии иммортализованных клеток почки свиньи (PK15) с использованием системы CRISPR/Cas9 (см. ссылку 79). Этот подход можно воспроизводить с использованием первичных клеток свиньи, получая здоровых, несодержащих PERV животных (см. ссылку 80; комментарии по ссылкам 81, 82).
Организм-донор для трансплантации ксеногенных органов и способы его получения
Разрастание органа в организме-реципиенте является основной проблемой при трансплантации генетически модифицированного органа из ксеногенного организма-донора (например, свиньи) организму-реципиенту (например, павиану). В рамках изобретения разрастанию органа противодействуют посредством комбинации способов лечения: (i) снижения артериального давления реципиента (например, павиана) для соответствия более низким уровням у донора (например, свиньи); (ii) снижения кортизона на ранней стадии; и/или (iii) использования пролекарства сиролимуса темсиролимуса для снижения гипертрофии миокарда (см. примеры 1-4). Однако авторы настоящего изобретения обнаружили, что росту свиней (и, таким образом, их органов) также можно препятствовать генетически посредством нокаута гена рецептора гормона роста (GHR) (см. пример 7). Авторы настоящего изобретения обнаружили, что массу тела свиней GHR-KO (с нокаутом GHR) снижали на 60% по сравнению с контролями, и масса большинства органов снижалась пропорционально. Кроме того, свиньи GHR-KO имели значительно сниженные уровни инсулиноподобного фактора роста 1 в сыворотке (IGF1). Примечательно, что посредством введения IGF1 свиньям GHR-KO можно способствовать их росту (см. ссылки 88, 108, 109 и 110 в отношении пациентов с синдромом Ларона). Таким образом, вводя IGF1 свиньям GHR-KO, можно, при желании, уменьшать размер свиней и их органов.
В свете изложенного выше, авторы настоящего изобретения осуществляли нокаут гена GHR у свиней GT-KO/hCD46/hTM, которых можно использовать в качестве организмов-доноров для ксенотрансплантации приматам (см. пример 7). Таким образом, настоящее изобретение относится к млекопитающим GHR-KO (например, свиньям), являющихся подходящими донорами для ксенотрансплантации, и размер которых/размер органов которых можно корректировать, вводя им IGF1. Использование таких млекопитающих-доноров в ксенотрансплантации по изобретению можно сочетать с указанным выше медикаментозным лечением по настоящему изобретению для противодействия разрастанию органов. Кроме того, используя млекопитающих GHR-KO в качестве доноров, можно избегать длительного лечения реципиента ингибитором mTOR. И наконец, возможность коррекции размера донорских органов для нужд реципиента может являться особенно полезной для реципиентов относительно небольшого размера, которым необходимы относительно небольшие донорские органы.
Таким образом, настоящее изобретение относится к организму-донору для трансплантации ксеногенных органов, где организм-донор имеет гомозиготный нокаут гена рецептора гормонов роста, и где организм-донор представляет собой млекопитающего. Такого организма-донора можно получать, как описано в примере 7.
В одном из вариантов осуществления организма-донора для трансплантации ксеногенных органов по изобретению организм-донор дополнительно имеет гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы, инсерцию последовательности, кодирующей CD46 человека, и инсерцию последовательности, кодирующей тромбомодулин человека. В альтернативном варианте осуществления организм-донор дополнительно имеет гомозиготный нокаут генов альфа-1,3-галактозилтрансферазы, CMAH и B4GALNT2, и инсерции последовательности, кодирующей CD46 человека, последовательности, кодирующей CD55 человека, последовательности, кодирующей CD59 человека, последовательности, кодирующей гемоксигеназу 1 (предпочтительно, гемоксигеназу 1 человека), и последовательности, кодирующей A20 (предпочтительно, A20 человека). В последнем варианте осуществления организм-донор может дополнительно иметь инсерции последовательности, кодирующей LEA29Y или PD-L1, предпочтительно, PD-L1 человека. Подробности, касающиеся указанных выше последовательностей, которые можно встраивать в организм-донор для трансплантации ксеногенных органов по изобретению, можно найти в разделе, касающемся способа пролонгирования выживаемости примата после трансплантации сердца/почки/легкого/печени по изобретению, и в разделе, касающемся примата с трансплантированным сердцем/почкой/легким/печенью по изобретению. В частности, транскрипты, предпочтительно, экспрессирующиеся при инсерции генов, описанных в этих разделах, также являются транскриптами, предпочтительно, экспрессирующимися при инсерции соответствующих последовательностей в организме-доноре для трансплантации ксеногенных органов по изобретению.
В другом варианте осуществления организма-донора для трансплантации ксеногенных органов по изобретению организм-донор может иметь одну или более дополнительных генетических модификаций. Подробности, касающиеся этой одной или более дополнительных генетических модификаций, можно найти в разделе "Генетически модифицированное млекопитающее и способ его получения" выше. Одной из этих одной или более дополнительных генетических модификаций может являться инсерция последовательности, кодирующей α1,2-фукозилтрансферазу человека. Предпочтительно, α1,2-фукозилтрансфераза человека является белком, экспрессирующимся со следующего гена: общепринятый символ: FUT1; общепринятое полное название: фукозилтрансфераза 1 (группа крови H); первичный источник: HGNC:HGNC:4012; см.: Ensembl: ENSG00000174951, MIM: 211100.
В другом варианте осуществления организма-донора для трансплантации ксеногенных органов по изобретению организм-донор принадлежит к семейству Suidae, предпочтительно - к роду Sus, более предпочтительно - к биологическому виду S. scrofa, наиболее предпочтительно - к подвиду S. s. domesticus. В предпочтительном варианте осуществления организм-донор принадлежит к биологическому виду S. scrofa. В дополнительном варианте осуществления организм-донор является свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы, свиньей породы дюрок, свиньей швабско-галльской породы, черным минипигом или свиньей Оклендских островов; предпочтительно, свиньей с генетическим фоном гибрида немецкого ландраса/английской крупной белой породы.
Организм-донор для трансплантации ксеногенных органов по изобретению также может являться генетически модифицированным организмом по изобретению, как описано выше.
Настоящее изобретение также относится к способу получения организма-донора для трансплантации ксеногенных органов, включающему стадию коррекции размера организма-донора посредством введения организму-донору IGF1; где организм-донор имеет гомозиготный нокаут гена рецептора гормонов роста, и где организм-донор является не являющимся человеком млекопитающим. Предпочтительно, введение IGF1 начинают после рождения организма-донора. В случае людей рекомендована начальная доза rhIGF-1 0,04 мг/кг дважды в сутки SC. Дозу необходимо повышать с регулярными приращениями для достижения поддерживающей дозы 0,12 мг/кг дважды в сутки через ~2-3 месяца при ее переносимости. Длительное лечение дозами менее 0,12 мг/кг/сутки может приводить к субоптимальным ответам в отношении роста. В случае не принадлежащих человеку млекопитающих-доноров по изобретению подходящей может являться схожая схема введения.
Варианты осуществления, описанные для организма для трансплантации ксеногенных органов по изобретению, также можно использовать в отношении способа получения организма-донора для трансплантации ксеногенных органов по изобретению с соответствующими изменениями.
Как будет очевидно специалисту в этой области, во всех вариантах осуществления настоящего изобретения, когда ссылаются на инсерцию последовательности, кодирующей блок, такую последовательность, предпочтительно, встраивают таким образом, что белок экспрессируется, например, посредством встраивания последовательности как части экспрессирующей кассеты, дополнительно содержащей регуляторные последовательности. Инсерцию такой последовательности по изобретению также можно обозначать как инсерцию трансгена.
Как будет очевидно специалисту в этой области, когда в настоящем описании ссылаются на инсерции генов или последовательностей в донорском органе или организме-доноре по изобретению, необходимо убедиться, что белки, кодируемые этими генами или последовательностями, являются совместимыми с соответствующим организмом-реципиентом. Таким образом, в одном из вариантов осуществления, который можно комбинировать со всеми другими вариантами осуществления настоящего изобретения, встраиваемые гены или последовательности можно получать из того же биологического вида, что и организм-реципиент. Высокая гомология последовательности встраиваемого гена или последовательности в отношении соответствующего гена организма-реципиента будет обеспечивать совместимость. В рамках изобретения организм-донор представляет собой млекопитающего, и организм-реципиент представляет собой примата. Т.к. считают, что донорские органы с инсерциями генов или последовательностей человека совместимы даже с не являющимися человеком приматами-реципиентами (см. примеры 1-4), в одном из вариантов осуществления встраиваемые гены или последовательности по изобретению являются генами человека или последовательностями человека, соответственно. В этом варианте осуществления организм-реципиент также может являться человеком.
Далее настоящее изобретение будет проиллюстрировано с помощью неограничивающих примеро
ПРИМЕРЫ
Пример 1: Материалы и способы
Следующие материалы и способы использовали в последующих экспериментах по настоящему изобретению.
Животные
Семь молодых свиней с гибридным генетическим фоном (немецкий ландрас и английская крупная белая порода, группа крови 0) служили в качестве доноров для ксенотрансплантации сердца. Все органы являлись гомозиготными по нокауту альфа-1,3-галактозилтрансферазы (GT-KO) и трансгенными по hCD46/тромбомодулину (hTM) (Revivicor, Blacksburg, VA, USA и Institute for Molecular Animal Breeding and Biotechnology, Gene Center, Faculty of Veterinary Medicine, Ludwig-Maximilians-University, Munich, Germany). Локализацию и стабильность экспрессии hCD46/hTM проверяли посмертно посредством иммуногистохимии (фиг. 15). Функцию донорского сердца и отсутствие клапанных дефектов оценивали за 7 дней до трансплантации посредством эхокардиографии. Семь выращенных в неволе самцов павианов (Papio anubis, группы крови B и AB) использовали в качестве реципиентов.
Исследование было одобрено местными органами власти и правительством Верхней Баварии. Со всеми животными обращались в соответствии с Руководством по содержанию и использованию лабораторных животных (Национальные институты здравоохранения США и национальное право).
Анестезия и анальгезия
Премедикация павианов состояла из внутримышечной инъекции кетамина гидрохлорида 6-10 мг/кг (Ketavet® 100 мг/мл; Pfizer Deutschland GmbH, Berlin, Germany) и 0,3-0,5 мг/кг мидазолама (мидазолам Ratiopharm®; Ratiopharm GmbH, Ulm, Germany). Общую анестезию начинали с внутривенного болюса 2,0-2,5 мг/кг пропофола (Propofol®-Lipuro 2%; B. Braun Melsungen AG, Melsungen, Germany) и 0,05 мг фентанила (фентанил Janssen 0,5 мг; Janssen-Cilag GmbH, Neuss, Germany) и поддерживали с помощью пропофола (0,16±0,06 мг/кг/мин) или севофлурана (1-2% об. в конце выдоха; севоран, AbbVie Germany GmbH & Co. KG, Wiesbaden, Germany) и болюсных введений фентанила (5-10 мкг/кг, повторяли каждые 45 мин), как описано где-либо (см. ссылку 11). Для обеспечения анальгезии после операции использовали непрерывную инфузию фентанила, кетамина гидрохлорида и метамизола (новаминсульфон Ratiopharm® 1 г/2 мл; Ratiopharm GmbH, Ulm, Germany).
Эксплантация и консервация донорского сердца
После срединной стернотомии и гепаринизации (500 МЕ/кг) небольшую канюлю вводили в восходящую дугу аорты, которую затем поперечно зажимали дистально относительно канюли. В группе I сердце подвергали кардиоплегии с использованием одной дозы 20 мл/кг раствора для кристаллоидной кардиоплегии при 4°C: в экспериментах №№56, 58 и 59 вводили раствор Custodiol HTK (Dr. F. Köhler Chemie GmbH, Bernsheim, Germany), в экспериментах №№55 и 57 - раствор Белзера UW (Preservation Solutions Inc., Elkhorn, WI, USA). Ушки правого и левого предсердия открывали для декомпрессии. Затем сердце иссекали, погружали в кардиоплегический раствор и хранили на льду.
В группах II и III сердца консервировали, как описано в Steen at al. (см. ссылку 10), с использованием 3,5 л оксигенированного альбумин-содержащего гиперонкотического кардиоплегического питательного раствора с гормонами и эритроцитами при температуре 8°C в портативной экстракорпоральной системе консервации сердца, состоящей из перистальтического насоса с контролируемым давлением и потоком, обменника O2/CO2, лейкоцитарного фильтра, артериального фильтра и холодильно-нагревательного модуля.
После пережатия аорты сердце перфузировали 600 мл консервационной среды, затем иссекали и перемещали в систему консервации сердца. В восходящую дугу аорты вставляли большую канюлю и митральный клапан делали временно нефункционирующим для предотвращения дилатации левого желудка; окклюдировали верхнюю полую вену, однако, нижнюю полую вену, легочную артерию и легочные вены оставляли открытыми для свободного выхода перфузата. Сердце погружали в резервуар, наполненный холодной перфузионной средой, и начинали антеградную коронарную перфузию через уже введенную аортальную канюлю. Перфузионное давление оставляли на уровне ровно 20 мм рт.ст. Во время имплантации сердце периодически перфузировали в течение 2 мин каждые 20 мин.
Способ имплантации
Грудную клетку реципиента открывали по средней линии. Вводили нефракционированный гепарин (500 МЕ/кг; гепарин натрия 25000 Ratiopharm, Ratiopharm GmbH, Ulm, Germany) и подключали аппарат для сердечно-легочной реанимации с использованием обоих полых вен и восходящей дуги аорты. Начинали сердечно-легочное шунтирование и охлаждали реципиента (30°C в группе I, 34°C в группах II и III). После поперечного пережатия восходящей аорты, сердце реципиента иссекали на уровне предсердий, оба крупных сосуда перерезали. Донорское сердце свиньи трансплантировали способом Shumway и Lower (см. ссылку 8).
Беспроводной телеметрический передатчик (Data Sciences International, St. Paul, MN, USA) имплантировали в подкожный резервуар по правой среднеключичной линии между 5-ым и 6-ым ребром. В аорту и верхушку левого желудочка помещали датчики давления, датчик для ЭКГ помещали в стенку правого желудочка.
Иммуносупрессорная схема лечения, противовоспалительная и вспомогательная терапия
Иммуносупрессия основана на схеме лечения Mohiuddin (см. ссылку 5; были сделаны изменения, указанные далее) с использованием ингибитора C1-эстеразы вместо фактора из яда кобры для ингибирования комплемента. Индукционная терапия состояла из антитела против CD20 (Mabthera; Roche Pharma AG, Grenzach-Wyhlen, Germany), ATG (тимоглобулина, Sanofi-Aventis Germany GmbH, Frankfurt, Germany) и любого из антитела против CD40 (клона химерного IgG4 мыши/макака-резуса 2C10R4, NIH Nonhuman Primate Reagent Resource, Mass Biologicals, Boston, MA, USA; любезно предоставленного Keith Reimann) или гуманизированного пасилированного Fab против CD40L (производство: Wacker-Chemie, Burghausen, Germany; очистка: XL-protein GmbH, Freising, Germany; любезно предоставленного Arne Skerra, см. ссылку 9). Поддерживающая иммуносупрессорная терапия состояла из MMF (CellCept, Roche, Basle, Switzerland; остаточный уровень 2-3 мкг/мл), любого из антитела против CD40 или пасилированного Fab против CD40L, метилпреднизолона (урбазона солюбиле, Sanofi-Aventis Germany GmbH, Frankfurt, Germany). Противовоспалительная терапия включала антитело против рецептора ИЛ-6 (RoActemra, Roche Pharma AG, Grenzach-Wyhlen, Germany), ингибитор ФНОα (энбрел, Pfizer Pharma GmbH, Berlin, Germany) и антагонист рецептора ИЛ-1 (кинерет, Swedish Orphan Biovitrum GmbH, Martinsried, Germany). Вспомогательная терапия: ацетилсалициловая кислота (аспирин, Bayer Vital GmbH, Leverkusen, Germany), нефракционированный гепарин (гепарин натрия 25000 Ratiopharm, Ratiopharm GmbH, Ulm, Germany), ингибитор C1-эстеразы (беринерт, CSL Behring GmbH, Hattersheim, Germany), ганцикловир (цимевен, Roche Pharma AG, Grenzach-Wyhlen, Germany), цефуроксим (цефуроксим Hikma, Hikma Pharma GmbH, Martinsried, Germany) и эпоэтин бета (неорекормон 5000 МЕ, Roche Pharma AG, Grenzach-Wyhlen, Germany).
Начиная с 10 мг/кг/сутки, метилпреднизолон снижали на 1 мг/кг каждые 10 дней в группе I и II; в группе III метилпреднизолон снижали до 0,1 мг/кг за 19 дней. Кроме того, в группе III темсиролимус (торизел, Pfizer Pharma GmbH, Berlin, Germany) добавляли к поддерживающей иммуносупрессорной терапии, вводя в виде ежедневных коротких инфузий i.v. для достижения остаточных уровней рапамицина 5-10 нг/мл. Группу III также подвергали непрерывному i.v. введению антигипертензивных средств эналаприла (энагексала, Hexal AG, Holzkirchen, Germany) и метопролола тартрата (Beloc i.v., AstraZeneca GmbH, Wedel, Germany) для достижения среднего артериального давления 80 мм рт.ст. и частоты сердечных сокращений 100 уд./мин.
Гемодинамические измерения
После индуцирования общей анестезии центральный венозный катетер (Arrow International, Reading, PA, USA) вводили в левую яремную вену и артериальный катетер (Thermodilution Pulsiocath; Pulsion Medical Systems, Munich, Germany) вводили в правую бедренную артерию. Минутный объем кровообращения и ударный объем оценивали посредством транспульмональной термодилюции и индексировали по площади поверхности тела реципиента по формуле 0,083*кг.0,639. Измерения проводили после начала анестезии и через 60 минут после прекращения CPB в равновесном состоянии и регистрировали с помощью программного обеспечения PiCCOWin (Pulsion Medical Systems, Munich, Germany). Все данные обрабатывали с помощью Excel (Microsoft, Redmond, Washington, USA) и анализировали с помощью GraphPad Prism 7.0 (GraphPad Software Inc., San Diego, California, USA).
Количественный анализ массы LV, повышения массы LV и FS
Трансторакальную эхокардиографию проводили при аналгоседации через регулярные интервалы с использованием HP Sonos 7500 (HP Inc., Palo Alto, CA, USA); регистрировали позиции по короткой оси на уровне папиллярных мышц. В конце диастолы и конце систолы измеряли диаметры LV (LVEDD, LVESD), конечно-диастолическую и конечно-систолическую толщину межжелудочковой перегородки (IVSd, IVSs), толщину задней стенки (PWd, PWs); для дальнейших вычислений и визуализации (Excel и PowerPoint, Microsoft, Redmond, Washington, USA) использовали среднее значение трех измерений.
Массу LV вычисляли по формуле (1), относительное повышение массы LV и FS LV - по формулам (2) и (3) (см. ссылки 11,12).
(1) масса LV (г) = 0,8*(1,04([LVEDD+IVSd+PWd]3-[LVEDD]3))+0,6
(2)повышение массы LV (%) = ([масса LVконец/масса LVначало]-1)*100
(3) FS (%) = ([LVEDD - LVESD]/LVEDD)*100
Некропсия и гистологическое исследование
Некропию и гистологическое исследование проводили в Institute of Veterinary Pathology и Institute of Pathology, оба в LMU Munich. Образцы фиксировали в формалине, заключали в парафин и пластик, разрезали и окрашивали гематоксилином-эозином (HE).
Гистохимический анализ
Криосрезы (8 мкм) получали стандартными гистологическими способами. Размер миоцитов количественно анализировали как площадь поперечного среза. Срезы левого желудочка толщиной 8 мкм окрашивали с использованием конъюгированного с Alexa Fluor 647 агглютинина из проростков пшеницы (Life Technologies) и ядерного красителя DAPI (Life Technologies). Изображения получали с помощью 10-кратного и 63-кратного объективов с использованием конфокального микроскопа Leica TCS SP8; для определения средней площади поперечных срезов кардиомиоцитов на одном среде (200-300 клеток на срез и 5-7 срезов на сердце) использовали программное обеспечение ImageJ.
Иммунофлуоресцентное окрашивание
Биоптаты ткани миокарда заключали в Tissue-Tek (Sakura Finetek, Zoeterwoude, The Netherlands) и хранили замороженными при -80°C. Для иммунофлуоресцентного окрашивания нарезали криосрезы толщиной 5 мкм, сушили воздухом в течение от 30 до 60 мин и хранили при -20°C до дальнейшего анализа. Криосрезы фиксировали ледяным ацетоном, гидратировали и окрашивали с использованием одностадийного прямого или двухстадийного непрямого иммунофлуоресцентных способов. Использовали следующие антитела: антитело кролика против C3b/c человека (Dako, Glostrup, Denmark), FITC-конъюгированное антитело кролика против C4b/c человека (Dako), антитело козы против IgM свиньи (AbD Serotec, Hercules CA, USA), FITC-конъюгированное антитело козы против IgG свиньи (Southern Biotech, Birmingham, USA). Вторичными антителами являлись Alexa 488-конъюгированное антитело осла против IgG козы (Thermo Fischer Scientific, MA, USA), Cy3-конъюгированное антитело овцы против кролика (Sigma-Aldrich, St. Louis, MO, USA). Ядерное окрашивание осуществляли с использованием 4',6-диамидино-2-фенилиндола (DAPI; Boehringer, Roche Diagnostics, Indianapolis, IN, USA). Препараты анализировали с использованием флуоресцентного микроскопа (DM14000B; Leica, Wetzlar, Germany). Количественный анализ интенсивности флуоресценции осуществляли с использованием программного обеспечения Image J версии 1.50i (https://imagej.nih.gov/ij/) на необработанных изображениях TIFF (теговый формат файлов изображений). Все изображения получали в одних и тех же условиях, чтобы сделать возможным правильный количественный анализ и сравнение интенсивностей флуоресценции.
Оценка уровней антитела против не-Gal-антигенов
Уровни в плазме антитела IgM и IgG павиана против не-Gal-антигенов измеряли посредством проточной цитометрии способом, описанным Azimzadeh et al. (см. ссылку 14). В кратком изложении, эндотелиальные клетки аорты свиньи (PAEC) GT-KO/hCD46/hTM собирали и суспендировали в количестве 2×106 клеток/мл в буфере для окрашивания (PBS+1% BSA). Образцы плазмы термически инактивировали при 56°C в течение 30 мин и разводили 1/20 в буфере для окрашивания. PAEC инкубировали с разведенной плазмой павиана в течение 45 минут при 4°C. Затем клетки промывали холодным буфером для окрашивания и инкубировали с RPE-конъюгированным антителом козы против IgM человека (Southern Biotech) или FITC-конъюгированным антителом козы против IgG человека (Thermo Fischer) в течение 30 минут при 4°C. Затем клетки промывали холодным буфером для окрашивания, ресуспендировали в фосфатно-солевом буфере (PBS), анализировали с помощью FACS LSRII и с использованием аналитического программного обеспечения FlowJo для определения средней интенсивности флуоресценции (MFI) по каналу FITC. Затем строили график данных с использованием Prism 7 (Graphpad Software, Inc.). FITC, флуоресцеинизотиоцианат; RPE, рибулозо-фосфатэпимераза.
Анализ вестерн-блоттинга
Для выделения белков образцы сердца гомогенизировали в буфере Лэммли и оценивали содержание бела с помощью анализа белков с использованием бицинхониновой кислоты (BCA, Merck, Darmstadt, Germany). 20 мкг общего белка разделяли с помощью 10% ПААГ с SDS и переносили на мембраны из поливинилидендифторида (PDVF) (Millipore, Billerica, USA) посредством электроблоттинга. Мембраны промывали Трис-забуференным физиологическим раствором с 0,1% Tween-20 (Merck) (TBS-T) и блокировали в 5% масс./об. обезжиренном порошковом молоке (Roth, Karlsruhe, Germany) в течение 1 ч. при комнатной температуре. Затем мембраны снова промывали в TBS-T и инкубировали в 5% масс./об. BSA (Roth) соответствующего первичного антитела в течение ночи при 4°C. Использовали следующие антитела: антитело кролика против pmTOR человека (#5536; Cell Signaling, Frankfurt, Germany) и антитело мыши против PCNA человека (#2586; Cell Signaling). После промывки мембраны инкубировали в 5% масс./об. обезжиренном порошковом молоке с меченым пероксидазой хрена вторичным антителом в течение 1 ч. при комнатной температуре. Связанные антитела определяли с использованием реагента для детекции посредством усиленной хемилюминесценции (набор для детекции посредством вестерн-блоттинга ECL Advance, GE Healthcare, Munich, Germany) и подходящих рентгеновских пленок (GE Healthcare). После детекции мембраны стрипировали (элюирующий буфер: 2% SDS, 62,5 мМ Трис/HCl, pH 6,7, и 100 мМ β-меркаптоэтанол в течение 30 мин при 70°C) и инкубировали с подходящим вторичным антителом. ПААГ с SDS, электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия.
Статистический анализ
Для данных о выживаемости строили кривые Каплана-Мейера и использовали логарифмический ранговый критерий Кокса-Мантеля для определения значимых различий между группами. В случае гемодинамических данных статистическую значимость определяли с использованием непарного и парного t-критерия Стьюдента, как указано; данные представлены в виде отдельных измерений с планками для медиан на группу. В случае гистохимического анализа для определения статистической значимости использовали односторонний ANOVA с критерием множественных сравнений Шидака-Холма; данные представлены в виде среднего ±s.d. Значимым считали P<0,05. s.d., стандартное отклонение.
Пример 2: Результаты
Эксперименты по трансплантации сердца от генетически модифицированных свиней (GTKO/hCD46/hTM) павиану осуществляли, используя клинически одобренный ортотопический способ Shumway (см. ссылку 8). Всех реципиентов в исследовании подвергали IS, как в той или иной степени описано Mohiuddin (см. ссылку 5): индукционная терапия включала антитело против CD20, антитимоцитарный глобулин (ATG) и антитело против CD40 или собственный пасилированный Fab против CD40L авторов настоящего изобретения (см. ссылку 9). Поддерживающая терапия состояла из антитела против CD40 или пасилированного Fab против CD40L, MMF и метилпреднизолона (MP), дозу которого снижали (см. таблицу 1; также представлено вспомогательное лечение; ингибитором C1-эстеразы заменяли фактор из яда кобры).
11 экспериментов разделяли на 3 группы (см. таблицу 2); в группе I (n=5) консервировали донорские органы с использованием 2 клинически одобренных кристаллоидных растворов (4°C Custodial HTK, раствор Белзера UW, каждый из которых вводили однократно; затем сердца свиней (группа крови 0) хранили в пластиковых пакетах, наполненных раствором, а пакеты хранили в кубиках льда; статическая консервация); в группах II (n=4) и III (n=2) иссеченные сердца незамедлительно перфузировали при 8°C с помощью перистальтического насоса с контролируемым давлением через канюлю, зафиксированную в восходящей дуге аорты. Дезоксигенированную кровь, оставшуюся в донорском органе, собирали в резервуар, а затем пропускали через оксигенатор (неишемическая консервация). Во время анастомозирования левого и правого предсердий по линии шва легочной артерии перфузию продолжали непрерывно; ее прекращали только при соединении обеих культей аорты.
Одиннадцать выращенных в неволе павианов (Papio anubis, группы крови B и AB) служили в качестве реципиентов. Послеоперационное лечение реципиентов описано в другом месте (см. ссылку 11).
Результаты в группе I (статическая холодовая консервация кристаллоидными растворами) являлись следующими: хотя время ишемии делали настолько небольшим, насколько это возможно (123 ± 7 мин), выживаемость в трех случаях составляла один день и по одному случаю 3 дня и 28 дней. В последнем случае (консервация сердца раствором Белзера UW) при эхокардиографии наблюдали ограничение диастолической насосной функции (утолщенный миокарда LV, уменьшение полости LV и, таким образом, диастолическое наполнение; фигура 6A; фигура 3; фигура 1E, F) в комбинации с терминальной стадией печеночной недостаточности (таблица 3, фигура 1B, H); в отличие от этого, 4 выживших с небольшим временем выживания всегда находились в состоянии тяжелой левой систолической сердечной недостаточности после прекращения сердечно-легочного шунтирования (CPB), что делает необходимым внутривенное введение высоких доз катехоламинов (фигура 3, фигура 1A-C). Однако всех 4 отключали от CPB, 3 из них экстубировали.
В следующих группах II и III начинали перфузию органа (неишемическую консервацию сердца; время перфузии 196±44 и 224±45 мин, соответственно), как описано в примере 1. Затем всех павианов из двух групп легко отключали от CPB с использованием небольших количеств катехоламинов (фигура 3). Однако, все 3 животных с длительным выживанием из группы II (18, 27 и 40 дней, эксперимент с 4 днями являлся технической ошибкой) умерли от диастолической недостаточности насосной функции в комбинации с терминальной стадией печеночной недостаточности, схожие результаты описаны для единственного выжившего в течение 28 дней из группы I (фигура 6A; таблица 3; фигура 1A, B,H).
Данные большинства важных биохимических измерений в сыворотке у животных из группы II непосредственно перед прекращением каждого эксперимента приведены в таблице 3: Билирубин был повышен, как и печеночные ферменты, такие как АСТ; протромбиновый индекс и холинэстераза снижались; тропонин T превышал нормальный диапазон (на фигуре 1A, B показано резкое повышение уровней тропонина и билирубина непосредственно перед прекращением экспериментов). Уровни лактатдегидрогеназы были повышены, а количество тромбоцитов являлось низким. При аутопсии донорские сердца являлись увеличенными по сравнению с их массой на момент имплантации, разрастание в группах I и II в среднем составляло 259%. Фактически, трансплантаты выглядели сжатыми окружающими медиастинальными структурами. Диаметры стенок левого и правого желудочков были увеличены, полость левого желудочка являлась небольшой (фигура 4A; см. ссылки 12,13). Следует отметить фигуру 4C, на которой показан размер сердца сиблинга донора трансплантата 64: при умерщвлении в то же время внешние диаметры их сердец являлись практически идентичными.
При гистологическом исследовании миокарда трансплантатов в группе II выявляли гипертрофические клетки (фигура 1E, F,J, K). Наблюдали обширный некроз клеток печени вокруг центральных вен (фигура 1H).
В отличие от этого, все из описанных выше патологических результатов отсутствовали у реципиентов в группе III, которых подвергали антигипертензивному лечению (свиньи имеют более низкое систолическое давление по сравнению с павианами, в среднем 80 по сравнению с 120 мм рт.ст.), раннему прекращению введения глюкокортикоидов и дополнительному введению темсиролимуса. Необходимо отметить вид миокарда при аутопсии: к концу 90-дневного периода эхокардиография являлась нормальной (фигура 6B). При аутопсии стенки желудочков являлись практически нормальными, и размеры полостей не были нарушены; гистологические показатели донорского сердца и печени реципиента также являлись нормальными (таблица 3; фигура 1G, I,J, K,L; фигура 4B).
На фигуре 2 приведены иммунологические ответы у всех животных с длительным выживанием. В случае трансплантатов в группе II не наблюдали значительных признаков гуморального отторжения, и небольшие изменения скорее можно приписать описанным ограничением функции сердца перед смертью; не наблюдали патологических иммуногистохимических показателей в группе III. В обеих группах при измерении антител против не-Gal-антигенов в плазме (см. ссылку 14) не наблюдали повышения выше уже существующих низких уровней.
В дополнение к описанным выше экспериментам, другому павиану трансплантировали сердце, как описано для павианов из группы III и в соответствии с "Материалами и способами" из примера 1. Павиан выживал в течение 90 дней, и послеоперационные показатели и измерения являлись такими же, как и в описанном выше эксперименте № 67.
Пример 3: Выводы
В совокупности, представленные эксперименты (группа III) в конечном итоге показали, что жизнеобеспечивающая (ортотопическая) ксенотрансплантация сердца возможна при использовании (до-) клинических стандартов и частично удовлетворении требований руководства ISHLT (см. ссылку 6).
Успеху способствовало следующее:
Заимствование базовой схемы IS Mohiuddin (см. ссылку 5), позволяющее эффективно избегать клеточного и, что наиболее важно, гуморального отторжения; очевидные признаки тромботической микроангиопатии (снижение тромбоцитов, повышение ЛДГ), наблюдаемые в группе II, скорее можно объяснить чрезмерным ростом органов и повышенной потребностью в энергии при клеточной гипертрофии, которые, как очевидно, не соответствуют ее поступлению из-за недостаточного неогенеза сосудов (что ранее описано для других органов (см. ссылку 15), фигура 5). Однако было сделано несколько важных изменений: пасилированный Fab против CD40L, по-видимому, является таким же эффективным, как антитело против CD40 (фигура 2). Добавляли противовоспалительную терапию. Дозу глюкокортикоида снижали быстрее, добавляли темсиролимус и, наконец, осуществляли антигипертензивное лечение.
Добавление неишемической консервации сердца свиньи (см. ссылку 10). В отличие от групп II и III, донорские органы в группе I подвергали статической консервации миокарда, которую используют для клинических аллогенных способов. При статической консервации миокарда, минутный объем кровообращения в промежуточный момент после операции являлся низким (фигура 3A), что делает необходимым введение больших количеств катехоламинов (фигура 3B). Являющаяся результатом высокая ранняя смертность соответствует описанному в литературе за последние 25 лет, где описанные диапазоны составляют от 40 до 60% (см. ссылку 7). Это явление названо "периоперационной дисфункцией ксенотрансплантата сердца" (см. ссылку 16) и, как очевидно, схоже с оглушенностью миокарда, известной с ранних дней после операции на сердце; оно не похоже на сверхострое отторжение.
Способом неишемической консервации в группах II и III достигали даже клинически приемлемых результатов: всех 7 реципиентов легко отключали от CPB, т.к. минутный объем кровообращения оставался неизменным по сравнению с исходным уровнем.
Также описано ограничивающее разрастание трансплантата после ксеногенной трансплантации почки и легкого (см. ссылку 15). Авторы объяснили это явление внутренними факторами (что означает, что "разрастание" органов свиньи предопределено), а не внешними стимулами (различными гормонами роста реципиента). Это заявление подтверждается наблюдением авторами настоящего изобретения почти идентичного увеличения размера нетрансплантированного сердца сиблинга до конечной точки в эксперименте 64 (фигура 4C).
Впервые успешно противодействовали разрастанию посредством снижения артериального давления павиана для соответствия более низким уровням у свиней. Дозу глюкокортикоида снижали на ранней стадии, т.к. описано, что лекарственное средство вызывает гипертрофическую кардиомиопатию на ранних стадиях жизни (см. ссылку 17). И наконец, известно, что соединения сиролимуса контролируют комплексную сеть роста всех клеток посредством ингибирования двух киназ mTOR (см. ссылку 18). Существуют клинические доказательства того, что гипертрофия миокарда снижалась, а диастолическая насосная функция улучшалась (см. ссылки 19, 20); у людей редкие генетически гипертрофические синдромы подвергают лечению (см. ссылку 21). В этом случае, выбирали темсиролимус, снижали гипертрофию миокарда и избегали облитерации полости LV.
В совокупности, в настоящем описании впервые показано, что ортотопическая ксенотрансплантация сердца возможна в трудоемкой модели трансплантации от генетически модифицированной свиньи павиану. Реализация полного спектра требований руководства ISHLT (см. ссылку 6) кажется возможной. Проблемы безопасности (см. ссылку 22) могут быть решены.
Пример 4: Протокол расширенного исследования
Расширяли протокол исследования для группы III, чтобы достигнуть выживаемости трансплантата в течение шести месяцев (см. ссылку 115). Объединенные результаты показаны в следующей таблице 4, а также на фигурах 11-15. Результаты, приведенные в таблице 4, включают результаты экспериментов, описанных в примере 2 выше, где эксперименты №№ 57, 60, 63, 64, 66 и 67 из таблицы 3 соответствуют экспериментам 3, 6, 8, 9, 10 и 11 из таблицы 4, соответственно. Эксперимент 12 из таблицы 4 соответствуют дополнительному эксперименту, упомянутому в последнем абзаце примера 2 выше, и эксперименты 13 и 14 из таблицы 4 являются дополнительными экспериментами, для которых протокол исследования для группы III расширяли, чтобы достигнуть выживаемости трансплантата шесть месяцев. Данные, представленные на фигурах 11-15, основаны на результатах всех экспериментов, указанных в таблице 4.
Объединенные результаты расширенного исследования подтверждают результаты из примера 2: в совокупности, после перфузии сердца в течение 219±30 мин, все пять животных в группе III легко отключали от CPB, что сравнимо с группой II (фиг. 13). Ни у одного из реципиентов в группе III не наблюдали PCXD; все из них достигали равновесного состояния с хорошей функцией сердца через четыре недели. У одного реципиента (эксперимент 10) развивался неподдающийся лечению плевральный выпот, вызванный окклюзией лимфатического грудного протока, и, таким образом, его умерщвляли через 51 день. Два реципиента (эксперименты 11 и 12) находились в хорошем состоянии в течение трех месяцев до эвтаназии в соответствии с протоколом исследования (фиг. 11A). У этих трех реципиентов при эхокардиографии не наблюдали повышения массы левого желудочка (фиг. 11D); функция трансплантата оставалась нормальной без признаков диастолической дисфункции (фиг. 4B). Биохимические параметры функции сердца и печени, а также уровни ЛДГ и количество тромбоцитов являлись нормальными или лишь немного измененными на всем протяжении экспериментов (таблица 4, фиг. 11B, C и фиг. 14A, B), что соответствовало нормальной гистологии (фиг. 1I). При гистологическом исследовании миокарда левого желудочка не наблюдали признаков гипертрофии (фиг. 1J и фиг. 11E), а при анализе вестерн-блоттинга миокарда выявляли уровни фосфорилирования mTOR, более низкие, чем в нетрансплантированных совпадающих по возрасту контрольных сердцах (фиг. 11F). Аналогично группе II, в группе III не наблюдали признаков гуморального отторжения трансплантата (фиг. 12 и фиг. 2A-D).
Последним двум реципиентам в группе III (эксперименты 13 и 14) находились в хорошем состоянии в течение 195 и 182 дней, не наблюдая значительных изменений количества тромбоцитов или уровней ЛДГ и билирубина в сыворотке (фиг. 11A, C и фиг. 14A, B). Внутривенное введение темсиролимуса прекращали в день 175 и день 161. До этого момента систолическая и диастолическая функция сердца являлась нормальной. Затем наблюдали повышенный рост трансплантата сердца у обоих реципиентов (фиг. 11D), что подчеркивает важность ингибирования mTOR в модели ортотопической ксенотрансплантации ксеногенного сердца. Аналогично изменениям, наблюдаемым в группе II, у меньшего реципиента 13 развивались признаки диастолической дисфункции, ассоциированные с повышенными уровнями тропонина T в сыворотке и началом застойного повреждения печени (повышенные уровни АЛТ и АСТ в сыворотке, сниженный протромбиновый индекс и холинэстераза); количество тромбоцитов оставалось в нормальном диапазоне (таблица 4, фиг. 11B, C и фиг. 14A, B). При гистологическом исследовании подтверждали застойную гепатопатию и выявляли мультифокальный некроз миокарда без инфильтрации иммунными клетками или признаков тромботической микроангиопатии. У более крупного реципиента 14, которого пришлось подвергнуть эвтаназии одновременно с животным 13, последствия разрастания сердца являлись минимальными.
Указанные выше результаты подтверждают результаты из примера 2 и вводы, описанные в примере 3. Достигали сопоставимой выживаемости жизнеобеспечивающих сердец свиней у не являющихся человеком приматов в течение по меньшей мере трех месяцев, что соответствует доклиническим требованиям к эффективности для начала клинических испытаний ксенотрансплантации, что предложено в консультативном докладе Международного общества трансплантации легких и сердца (см. ссылку 6). Успеху способствовали два шага. Во-первых, обнаружили, что неишемическая консервация сердца свиньи важна для выживаемости ксенотрансплантированных сердец. Ксенотрансплантированные сердца из группы I, подвергнутые ишемической статической консервации миокарда с использованием кристаллоидных растворов (как в случае клинических аллогенных способов), демонстрировали PCXD в четырех из пяти случаев, что делает необходимым введение более высоких количеств катехолеаминов. Это явление очевидно схоже с "оглушенностью сердца", возникновение которой известно с ранних дней после операции на сердце и не является сверхострым отторжением (см. ссылку 7). В отличие от этого, в группах II и III (неишемическая консервация сердца свиньи посредством перфузии) (см. ссылку 10) все девять реципиентов легко отключали от CPB, т.к. их минутный объем кровообращения оставался неизменным по сравнению с исходным уровнем. Кратковременные результаты, достигнутые в этих группах, являлись исключительными даже по клиническим стандартам. Вторым шагом являлась профилактика неблагоприятного разрастания ксенотрансплантата. Предыдущие эксперименты по трансплантации почки и легкого от свиньи павиану позволили предполагать, что рост трансплантата больше зависит от внутренних факторов, чем от стимулов реципиента, таких как гормоны роста (см. ссылку 15). Массивная гипертрофия сердца у реципиентов в группе II свидетельствует о более комплексной ситуации. Примечательно, что трансплантированное сердце в этой группе имело на 62% большее увеличение массы, чем нетрансплантированное сердце сиблинга за тот же промежуток времени (фиг. 4C). В группе III разрастанию сердца успешно противодействовали с помощью комбинации способов лечения: (i) снижения артериального давления павианов для соответствия более низким уровням артериального давления у свиней; (ii) снижения кортизона на ранней стадии - кортизон может вызывать гипертрофическую кардиомиопатию на ранних стадиях жизни у людей (см. ссылку 83); и (iii) использование пролекарства сиролимуса темсиролимуса для снижения гипертрофии миокарда. Известно, что соединения сиролимуса контролируют комплексную сеть роста клеток посредством ингибирования обеих киназ mTOR (см. ссылку 84). Если клинически доказательства того, что лечение сиролимусом может снижать гипертрофию миокарда и улучшать диастолическую насосную функцию (см. ссылки 19, 20), а также облегчать редкие генетические гипертрофические синдромы у людей (см. ссылку 21). В дополнение к эффектам экспрессии тромбомодулина человека в трансплантате (см. ссылки 5, 37), лечение темсиролимусом может предотвращать образование тромботических микроангиопатических очагов еще больше посредством снижения индуцируемой коллагеном агрегации тромбоцитов и посредством дестабилизации агрегатов тромбоцитов, образующихся в условиях напряжения сдвига (см. ссылку 85). В совокупности, это исследование показало, что соответствующая долговременная жизнеобеспечивающиая ортотопическая ксеногенная трансплантация сердца в наиболее релевантной доклинической модели является возможной, что облегчает клинический переход к ксеногенной трансплантации сердца.
Совокупность материалов и способов (относительно примеров 2-4)
Животные
Эксперименты осуществляли с февраля 2015 года по август 2018 года. Четырнадцать молодых свиней с гибридным генетическим фоном (немецкий ландрас и английская крупная белая породы, группа крови 0) служили в качестве доноров для ксенотрансплантации сердца. Все органы являлись гомозиготными по нокауту альфа-1,3-галактозилтрансферазы (GTKO) и гетерозиготно трансгенными по CD46 человека (hCD46) и тромбомодулину человека (hTM) (см. ссылку 37) (Revivicor и Institute of Molecular Animal Breeding and Biotechnology). Локализацию и стабильность экспрессии hCD46 и hTM проверяли посмертно посредством иммуногистохимии (фиг. 15). Функцию донорского сердца и отсутствие клапанных дефектов оценивали за семь дней до трансплантации посредством эхокардиографии. Четырнадцать выращенных в неволе самцов павианов (P. anubis, группы крови B и AB) использовали в качестве реципиентов (German Primate Centre).
Исследование было одобрено местными органами власти и правительством Верхней Баварии. Со всеми животными обращались в соответствии с Руководством по содержанию и использованию лабораторных животных (Национальные институты здравоохранения США и законодательство Германии).
Анестезия и анальгезия
Павианов подвергали премедикации посредством внутримышечной инъекции кетамина гидрохлорида 6-8 мг кг−1 (Ketavet® 100 мг мл−1; Pfizer) и 0,3-0,5 мг кг−1 мидазолама (мидазолам Ratiopharm; Ratiopharm). Общую анестезию начинали с внутривенного болюса 2,0-2,5 мг кг−1 пропофола (пропофол Lipuro 2%; B. Braun Melsungen) и 0,05 мг фентанила (фентанил Janssen 0,5 мг; Janssen-Cilag) и поддерживали с помощью пропофола (0,16±0,06 мг кг−1 мин−1) или севофлурана (1-2% об. в конце выдоха; севоран, AbbVie) и болюсных введений фентанила (6-8 мкг кг−1, повторяли каждые 45 мин), как описано где-либо (см. ссылку 11). Для обеспечения анальгезии после операции использовали непрерывную инфузию фентанила, кетамина гидрохлорида и метамизола (новаминсульфон Ratiopharm® 1 г на 2 мл; Ratiopharm).
Эксплантация и консервация донорских сердец
Свиней подвергали премедикации посредством внутримышечной инъекции кетамина гидрохлорида 10-20 мг кг−1, азаперона 10 мг кг−1 (стреснила 40 мг мл−1; Lilly Deutschland) и атропина сульфата (атропина сульфата B. Braun 0,5 мг; B. Braun Melsungen). Общую анестезию начинали с внутривенного болюса 20 мг пропофола и 0,05 мг фентанила и поддерживали с помощью пропофола (0,12 мг кг−1 мин−1) и болюсных введений фентанила (2,5 мкг кг−1, повторяли каждые 30 мин).
После срединной стернотомии и гепаринизации (500 МЕ кг−1) небольшую канюлю вводили в восходящую дугу аорты, которую затем поперечно зажимали дистально относительно канюли. В группе I сердце перфузировали одной дозой 20 мл кг−1 раствора для кристаллоидной кардиоплегии при 4 C: для сердец животных 2, 4 и 5 использовали раствор Custodiol HTK (Dr. Franz Köhler Chemie), раствор Белзера UW (Preservation Solutions) использовали для сердец животных 1 и 3. Ушки правого и левого предсердия открывали для декомпрессии. Затем сердце иссекали, погружали в кардиоплегический раствор и хранили на льду.
В группах II и III сердца консервировали, как описано ранее (см. ссылку 10) с использованием 3,5 л оксигенированного альбумин-содержащего гиперонкотического кардиоплегического питательного раствора с гормонами и эритроцитами при температуре 8°C в портативной экстракорпоральной системе консервации сердца, состоящей из перистальтического насоса с контролируемым давлением и потоком, обменника O2/CO2, лейкоцитарного фильтра, артериального фильтра и холодильно-нагревательного модуля.
После пережатия аорты сердце перфузировали 600 мл консервационной среды, затем иссекали и перемещали в систему консервации сердца. В восходящую дугу аорты вставляли большую канюлю и митральный клапан делали временно нефункционирующим для предотвращения дилатации левого желудка; на верхнюю полую вену накладывали лигатуру; однако, нижнюю полую вену, легочную артерию и легочные вены оставляли открытыми для свободного выхода перфузата. Сердце погружали в резервуар, наполненный холодной перфузионной средой, и начинали антеградную коронарную перфузию через уже введенную аортальную канюлю. Перфузионное давление оставляли на уровне ровно 20 мм рт.ст. Во время имплантации сердце периодически перфузировали в течение 2 мин каждые 15 мин.
Способ имплантации
Грудную клетку реципиента открывали по средней линии. Вводили нефракционированный гепарин (500 МЕ кг−1; гепарин натрия 25000 Ratiopharm, Ratiopharm) и подключали аппарат для сердечно-легочной реанимации с использованием обоих полых вен и восходящей дуги аорты. Начинали CBP и охлаждали реципиента до 30°C в группе I и 34°C в группах II и III. После поперечного пережатия восходящей аорты, сердце реципиента иссекали на уровне предсердий, оба крупных сосуда перерезали. Донорское сердце свиньи трансплантировали способом Shumway и Lower (см. ссылку 8).
Беспроводной телеметрический передатчик (Data Sciences International) имплантировали в подкожный резервуар по правой среднеключичной линии между пятым и шестым ребром. В восходящую дугу аорты и верхушку левого желудочка помещали датчики давления, датчик для электрокардиографии помещали в стенку правого желудочка.
Иммуносупрессорная схема лечения, противовоспалительная и вспомогательная терапия.
Иммуносупрессия была основана на ранее опубликованной схеме лечения (см. ссылку 5) с использованием ингибитора C1-эстеразы вместо фактора из яда кобры для ингибирования комплемента (таблица 5). Индукционная терапия состояла из антитела против CD20 (Mabthera; Roche Pharma), ATG (тимоглобулина, Sanofi-Aventis) и любого из моноклонального антитела против CD40 (клона химерного IgG4 мыши/макака-резуса 2C10R4, NIH Nonhuman Primate Reagent Resource, Mass Biologicals; любезно предоставленного K. Reimann; животные 1-3, 5, 7, 8, 11-14) или гуманизированного пасилированного Fab против CD40L (XL-Protein и Wacker-Chemie; животные 4, 6, 9, 10). Поддерживающая иммуносупрессорная терапия состояла из микофенолата мофетила (CellCept, Roche; остаточный уровень 2-3 мкг мл−1), любого из моноклонального антитела против CD40 (животные 1-3, 5, 7, 8, 11-14) или пасилированного Fab против CD40L (животные 4, 6, 9, 10) и метилпреднизолона (урбазона солюбиле, Sanofi-Aventis). Противовоспалительная терапия включала антагониста рецептора ИЛ-6 (RoActemra, Roche), ингибитор ФНО (энбрел, Pfizer) и антагониста рецептора ИЛ-1 (кинерет, Swedish Orphan Biovitrum). Вспомогательная терапия состояла из ацетилсалициловой кислоты (аспирина, Bayer Vital), нефракционированного гепарина (гепарина натрия 25000 Ratiopharm, Ratiopharm), ингибитора C1-эстеразы (беринерта, CSL Behring), ганцикловира (цимевена, Roche), цефуроксима (цефуроксима, Hikma) и эпоэтина бета (неорекормона 5000 МЕ, Roche P).
Начиная с 10 мг кг−1 в сутки, метилпреднизолон медленно снижали на 1 мг кг−1 каждые 10 дней в группах I и II; в группе III метилпреднизолон снижали до 0,1 мг кг−1 за 19 дней. Кроме того, в группе III темсиролимус (торизел, Pfizer) добавляли к поддерживающей иммуносупрессорной терапии, вводя в виде ежедневных коротких внутривенных инфузий для достижения остаточных уровней рапамицина 5-10 нг мл−1. Группу III также подвергали непрерывному внутривенному введению антигипертензивных средств эналаприла (энагексала, Hexal AG, Holzkirchen, Germany) и метопролола тартрата (Beloc, AstraZeneca) для достижения среднего артериального давления 80 мм рт.ст. и частоты сердечных сокращений 100 уд./мин.
Гемодинамические измерения
После индуцирования общей анестезии центральный венозный катетер (Arrow International) вводили в левую яремную вену и артериальный катетер (Thermodilution Pulsiocath; Pulsion Medical Systems) вводили в правую бедренную артерию. Минутный объем кровообращения и ударный объем оценивали посредством транспульмональной термодилюции и индексировали по площади поверхности тела реципиента по формуле 0,083×B0,639, где B является массой тела в кг. Измерения проводили после начала анестезии и через 60 мин после прекращения CPB в равновесном состоянии и регистрировали с помощью программного обеспечения PiCCOWin (Pulsion Medical Systems). Все данные обрабатывали с помощью Excel (Microsoft) и анализировали с помощью GraphPad Prism 7.0 (GraphPad Software).
Количественный анализ массы левого желудочка, повышения массы левого желудочка и фракции укорочения
Трансторакальную эхокардиографию проводили при аналгоседации через регулярные интервалы с использованием HP Sonos 7500 (HP) и Siemens Acuson X300 (Siemens); регистрировали позиции по короткой оси на уровне папиллярных мышц. Измеряли конечно-диастолический диаметр левого желудочка (LVEDD) и конечно-систолический диаметр левого желудочка (LVESD), конечно-диастолическую толщину межжелудочковой перегородки (IVSd) и толщину задней стенки в конце диастолы (PWd); для дальнейших вычислений и визуализации (Excel и PowerPoint, Microsoft) использовали среднее значение трех измерений.
Массу левого желудочка вычисляли по уравнению (1), относительное повышение массы левого желудочка и фракцию укорочения (FS) левого желудочка (LV) вычисляли по уравнениям (2) и (3) опубликованными ранее способами (см. ссылки 13, 12).
Масса LV (г) = 0,8(1,04((LVEDD+IVSd+PWd)3−LVEDD))+0,6 (1)
Повышение массы LV (%) = ((масса LVконец/масса LVначало)−1)×100 (2)
FS (%) = ((LVEDD−LVESD)/LVEDD)×100 (3)
Некропсия и гистологическое исследование
Некропсию и гистологическое исследование проводили в Institute of Veterinary Pathology и Institute of Pathology. Образцы фиксировали формалином, заключали в парафин и пластик, разрезали и окрашивали гематоксилином и эозином.
Гистохимический анализ
Криосрезы (8 мкм) получали стандартными гистологическими способами. Размер кардиомиоцитов количественно анализировали как площадь поперечного среза. В кратком изложении, срезы левого желудочка толщиной 8 мкм окрашивали с использованием конъюгированного с Alexa Fluor 647 агглютинина из проростков пшеницы (Life Technologies) и ядерного красителя 4′,6-диамидино-2-фенилиндола (DAPI, Life Technologies). Изображения получали с помощью 63-кратного объектива с использованием конфокального микроскопа Leica TCS SP8; для определения средней площади поперечных срезов кардиомиоцитов на одном среде (200-300 клеток на срез и 5-8 срезов на сердце) использовали программное обеспечение SMASH (MATLAB, https://de.mathworks.com/products/matlab.html).
Иммунофлуоресцентное окрашивание
Биоптаты ткани миокарда заключали в Tissue-Tek (Sakura Finetek) и хранили замороженными при −80°C. Для иммунофлуоресцентного окрашивания нарезали криосрезы толщиной 5 мкм, сушили воздухом в течение от 30 до 60 мин и хранили при -20°C до дальнейшего анализа. Криосрезы фиксировали ледяным ацетоном, гидратировали и окрашивали с использованием одностадийного прямого или двухстадийного непрямого иммунофлуоресцентных способов. Использовали следующие антитела: антитело кролика против C3b/c человека (DAKO), FITC-конъюгированное антитело кролика против C4b/c человека (DAKO), антитело козы против IgM свиньи (AbDSerotec), FITC-конъюгированное антитело козы против IgG человека (Sigma-Aldrich) и FITC-конъюгированное антитело кролика против фибриногена человека (DAKO). Вторичными антителами являлись Alexa 488-конъюгированное антитело осла против IgG козы (Thermo Fisher Scientific), Cy3-конъюгированное антитело овцы против кролика (Sigma-Aldrich). Ядерное окрашивание осуществляли с использованием DAPI (Boehringer, Roche Diagnostics). Препараты анализировали с использованием флуоресцентного микроскопа (DM14000B; Leica). От пяти до десяти иммунофлуоресцентных изображений на маркер получали случайным образом и количественно анализировали интенсивность флуоресценции с использованием программного обеспечения ImageJ версии 1.50i (https://imagej.nih.gov/ij/) на необработанных изображениях TIFF. Все изображения получали одних и тех же условиях, чтобы сделать возможным правильный количественный анализ и сравнение интенсивностей флуоресценции.
Оценка уровней антитела против несодержащих галактоза-α1,3-галактозу антигенов
Уровни в плазме антител IgM и IgG павиана против несодержащих галактоза-α1,3-галактозу антигенов измеряли посредством проточной цитометрии, следуя опубликованному ранее консенсусному протоколу (см. ссылку 14). В кратком изложении, эндотелиальные клетки аорты свиньи GTKO/hCD46/hTM собирали и суспендировали в количестве 2×106 клеток на мл буфера для окрашивания (PBS, содержащего 1% BSA). Образцы плазмы термически инактивировали при 56°C в течение 30 мин и разводили 1:20 в буфере для окрашивания. Эндотелиальные клетки аорты свиньи инкубировали с разведенной плазмой павиана в течение 45 мин при 4°C. Затем клетки промывали холодным буфером для окрашивания и инкубировали с RPE-конъюгированным антителом козы против IgM человека (Southern Biotech) или FITC-конъюгированным антителом козы против IgG человека (Thermo Fisher) в течение 30 мин при 4°C. После повторной промывки холодным буфером для окрашивания клетки ресуспендировали в PBS, флуоресценцию считывали с помощью FACS LSRII (BD Biosciences) и данные анализировали с использованием аналитического программного обеспечения FlowJo для детекции средней интенсивности флуоресценции (MFI) по каналу FITC или каналу RPE. Затем строили график данных с использованием Prism 7 (GraphPad Software).
Анализ вестерн-блоттинга
Для выделения белков образцы сердца гомогенизировали в буфере Лэммли и оценивали содержание бела с помощью анализа белков с использованием бицинхониновой кислоты (BCA, Merck). Затем 20 мкг общего белка разделяли с помощью 10% ПААГ с SDS и переносили на мембраны из PDVF (Millipore) посредством электроблоттинга. Мембраны промывали Трис-забуференным физиологическим раствором с 0,1% Tween-20 (Merck) (TBS-T) и блокировали в 5% масс./об. обезжиренном порошковом молоке (Roth) в течение 1 ч. при комнатной температуре. Затем мембраны снова промывали в TBS-T и инкубировали в 5% масс./об. BSA (Roth) соответствующего первичного антитела в течение ночи при 4°C. Использовали следующие антитела: антитело кролика против pmTOR человека (5536; Cell Signaling), антитело кролика против mTOR человека (2983; Cell Signaling) и антитело кролика против GAPDH человека (2118; Cell Signaling). После промывки мембраны инкубировали в 5% масс./об. обезжиренном порошковом молоке с меченым пероксидазой хрена вторичным антителом (антителом козы против IgG кролика; 7074; Cell Signaling) в течение 1 ч. при комнатной температуре. Связанные антитела определяли с использованием реагента для детекции посредством усиленной хемилюминесценции (набор для детекции посредством вестерн-блоттинга ECL Advance, GE Healthcare) и подходящих рентгеновских пленок (GE Healthcare). После детекции мембраны стрипировали (2% SDS, 62,5 мМ Трис-HCl, pH 6,7, 100 мМ β-меркаптоэтанол) в течение 30 мин при 70°C и инкубировали с подходящим вторичным антителом.
Иммуногистохимическое окрашивание
Ткань миокарда фиксировали 4% формалином в течение ночи, погружали в парафин, нарезали срезы 3 мкм и сушили. Термически индуцируемое демаскирование антигена осуществляли в растворе Target Retrieval Solution (S1699, DAKO) на кипящей водяной бане в течение 20 мин в случае hCD46 и в цитратном буфере, pH 6,0, в паровой установке в течение 45 мин в случае hTM, соответственно. Иммуногистохимию осуществляли с использованием следующих первичных антител: моноклонального антитела мыши против CD46 человека (HM2103, Hycult Biotech) и моноклонального антитела мыши против тромбомодулина человека (sc-13164, Santa Cruz). Вторичным антителом являлось биотинилированное антитело козы против IgG мыши AffiniPure (115-065-146, Jackson ImmunoResearch). Иммунореактивность визуализировали с использованием 3,3-диаминобензидина тетрагидрохлорида дигидрата (DAB) (коричное окрашивание). Осуществляли ядерное докрашивание гематоксилином Майера (синее окрашивание).
Статистический анализ
Для данных о выживаемости строили кривые Каплана-Мейера и использовали логарифмический ранговый критерий Кокса-Мантеля для определения значимых различий между группами. В случае гемодинамических данных статистическую значимость определяли с использованием непарного и парного t-критерия Стьюдента, как указано; данные представлены в виде отдельных измерений с планками для средних значений в группе ±s.d. В случае гистохимического анализа для определения статистической значимости использовали односторонний ANOVA с критерием множественных сравнений Шидака-Холма; данные представлены в виде среднего ±s.d.; значимым считали P<0,05. Не использовали статистические способы для задания размера выборки. Эксперименты не являлись рандомизированными, и исследователи не использовали маскирование в отношении распределения во время экспериментов и при оценке исходов.
Совокупный обзор иммуносупрессорной схемы лечения, противовоспалительной и вспомогательной терапии с использованием соответствующих доз и временных интервалов
*моноклональное антитело против CD40: животные 1-3, 5, 7, 8, 11-14; пасилированный Fab против CD40L: животные 4, 6, 9, 10.
Пример 5: Идентификация гена α1,2-фукозилтрансферазы человека у генетически модифицированных свиней
Как указано выше, свиньи-доноры, используемые в примерах 1-4, являлись гомозиготными по нокауту альфа-1,3-галактозилтрансферазы (GT-KO) и трансгенными по hCD46/тромбомодулину (hTM) (Revivicor, Blacksburg, VA, USA и Institute for Molecular Animal Breeding and Biotechnology, Gene Center, Faculty of Veterinary Medicine, Ludwig-Maximilians-University, Munich, Germany). При нанопоровом секвенировании генома трансгенных свиней неожиданно обнаруживали, что геном содержит две копии дополнительного трансгена, т.е. гена α1,2-фукозилтрансферазы человека, в пределах массива множества копий минигена hCD46 (фигура 16). Экспрессия α1,2-фукозилтрансферазы человека в генетически модифицированном сердце/почке/легком/печени ксеногенного организма-донора по настоящему изобретению может способствовать избеганию отторжения ксенотрансплантата после трансплантации приматам (также см. ссылку 112).
Пример 6: Получение генетически модифицированных свиней для ксенотрансплантации сердца
Трансплантация сердца все еще является лечением по выбору для пациентов с терминальной стадией сердечной недостаточности, но потребности в донорстве органов человека значительно превосходит возможности их получения, и срочно необходимы альтернативы. Значительный прогресс достигнут в гетеротопической абдоминальной (см. ссылку 5) и жизнеобеспечивающей ортотопической ксенотрансплантации сердца (см. примеры 1-4) павианам с использованием трижды модифицированных донорских сердец (GTKO/hCD46/hTM). Животных с фоном GTKO/hCD46 получали в Revivicor Inc., Blacksburg, VA; добавляли трансген hTM, контролируемый промотором гена THBD свиньи (см. ссылку 37)). Однако этот генетический фон мог включать PERV-C, структура локуса трансгена hCD46 неясна, и трансген hTM находится в другом участке встраивания, что осложняет размножение животных при разведении. Таким образом, свиней GTKO/hCD46/hTM будут получать de novo с использованием фона без PERV-C и дополнительно будут достигать нокаута генов CMAH и B4GALNT2.
Для получения свиней GTKO/hCD46/hTM de novo использовали следующую стратегию: экспрессия трансгенов, случайным образом встроенных в геном, в значительной степени зависит от контекста соседнего хроматина. Эти так называемые позиционные эффекты приводят к вариабельной экспрессии трансгенов среди разных трансгенных линий и зачастую к неустойчивой экспрессии в пределах одной линии. Стратегией для избегания этих недостатков случайного встраивания трансгена является направленное размещение экспрессирующих кассет в так называемых локусах "безопасной зоны", имеющих открытую конфигурацию и обеспечивающих стабильную экспрессию трансгенов.
Таким образом, сначала идентифицируют благоприятную безопасную зону. Обнаружено, что в эндотелиальных клетках свиньи дикого типа уровень транскрипции CMAH схож с уровнем B4GALNT2, в то время как уровень транскрипции GGTA1 является приблизительно в 5 раз более высоким. Кроме того, обнаружено, что в сердце свиньи экспрессия GGTA1 является в 20-30 более высокой, чем экспрессия CMAH или B4GALNT2 (фигура 17). Также в случае печени и жировой ткани свиньи обнаружено, что экспрессия GGTA1 является более высокой, чем экспрессия CMAH или B4GALNT2 (фигура 17). Таким образом, обнаружено, что GGTA1 высоко экспрессируется во множестве типов тканей и клеток, что наиболее важно, в эндотелиальных клетках, что делает его благоприятной безопасной зоной для размещения трансгена. Направленная интеграция нескольких ксенопротективных трансгенов в эту безопасную зону также предотвращает их сегрегацию при разведении.
Таким образом, для получения свиней GTKO/hCD46/hTM de novo гены GGTA1, CMAH и B4GALNT2 будут инактивировать с использованием технологии CRISPR/Cas в клетках PERV-C-несодержащих поросят мужского и женского пола. Миниген hCD46 будут размещать под контролем эндогенного промотора GGTA1 свиньи с последующим геном селективного маркера, фланкированным участками loxP, и экспрессирующей кассетой hTM с промотором THBD свиньи. Первичные клетки почки самцов и самок будут получать с использованием этого базового набора генетических модификаций, и поросят будут получать посредством ядерного переноса и выращивать посредством разведения. В этот локус можно добавлять дополнительные модификации посредством Cre-регулируемой замены кассеты с использованием вектора на основе бактериальной искусственной хромосомы (BAC), сконструированного посредством рекомбиниринга таким образом, чтобы он нес одну или более дополнительных экспрессирующих кассет (фиг. 18). Наличие желаемых генетических модификаций будут оценивать посредством ПЦР. Исследования экспрессии на клонах отдельных клеток будут осуществлять посредством RT-ПЦР и иммунофлуоресцентных анализов.
Пример 7: Нокаут гена рецептора гормона роста (GHR) у свиней для коррекции размера органов для ксенотрансплантации
Разрастание органов в организме-реципиенте является основной проблемой, когда генетически модифицированный орган из ксеногенного организма-донора (например, свиньи) трансплантируют организму-реципиенту (например, павиану). Т.к. контроль роста ксенотрансплантированных органов свиньи важен не только для доклинических экспериментов по трансплантации от свиньи павиану, но также и для клинических исследований трансплантации, проводили поиск генетического подхода для уменьшения размера свиней за одну стадию. Это позволяет избегать длительного введения реципиенту ингибитора mTOR, например, рапамицина.
Мутации с утратой функции гена рецептора гормона роста (GHR) у людей вызывают синдром Ларона, отличающийся задержкой роста и ожирением, но сниженной частотой злокачественных новообразований и диабета и повышенной продолжительностью жизни (см. ссылку 89). Таким образом, сначала тестировали эффекты нокаута GHR на фоне свиней дикого типа (см. ссылку 86). Конструировали систему CRISPR/Cas9 и инъецировали в зиготы свиней для мутагенеза экзона 3 гена GHR. Двух гетерозиготных свиноматок-основателей (GHR+/-) с инсерцией 1 п.н. или 7 п.н. в экзоне 3 GHR (что вызывает сдвиг рамки считывания; фиг. 19) спаривали с хряками дикого типа (немецкого ландраса) для получения гетерозиготных свиней F1, которых скрещивали между собой для получения свиней GHR-/- (KO). У свиней GHR-KO отсутствовал GHR (фиг. 20) и были значительно снижены уровни инсулиноподобного фактора роста 1 (IGF1) в сыворотке (фиг. 21A) и снижена активность IGF-связывающего белка 3 (IGFBP3), но повышены уровни IGFBP2 (фиг. 21B). Концентрации GH в сыворотке значительно повышались по сравнению с контрольными свиньями (фиг. 21C). Свиньи GHR-KO имели нормальную массу тела при рождении. Задержка роста становилась значимой в возрасте пяти недель. В возрасте шести месяцев масса тела свиней GHR-KO была снижена на 60% по сравнению с контролями (фиг. 22A, B). Масса большинства органов свиней GHR-KO была снижена пропорционально массе тела (фиг. 23A, B). Однако, масса печени, почек и сердца снижалась непропорционально, в то время как относительная масса головного мозга являлась почти в два раза более высокой (фиг. 23A, B). Свиньи GHR-KO имели значительно повышенный процент общего жира тела относительно массы тела (фиг. 24A)и демонстрировали транзиторную ювенильную гипогликемию (фиг. 24B) вместе со сниженными уровнями триглицеридов и холестерина в сыворотке (фиг. 24C, D). При анализе связанной с рецептором инсулина передачи сигнала в печени взрослых свиней натощак выявляли повышенное фосфорилирование IRS1 и PI3K. В соответствии с утратой GHR, фосфорилирование STAT5 значительно снижалось (см. ссылку 86).
Спаривание хряка GHR-/- и свиноматки GHR-/- приводило к получению помета из шести здоровых поросят GHR-/-, имевших меньшую (p<0,001) массу при рождении (808±103 г), чем потомство GHR-/- гетерозиготных родителей (1331±298 г). Первые смогли сравняться по массе тела с последними к возрасту приблизительно 16 недель (8,2±1,6 кг по сравнению с 7,3±1,9 кг; p=0,36).
Т.к. дефицит GHR не имел неблагоприятных эффектов при использовании фона свиней дикого типа, мутацию GHR-KO также вносили в условия hCD46/hTBM-трансгенного фона GGTA1-KO, что приносило успех при ксенотрансплантации сердца (фигура 25). Первые поросята рождались и демонстрировали ту же степень задержки роста, которую наблюдали у свиней GHR-KO в условиях фона дикого типа. В частности, масса тела двух hCD46/hTBM-трансгенных свиней GHR-KO, GGTA1-KO в возрасте 9 месяцев составляла 70,3 и 73,4 кг. Свиньи дикого типа достигали этой массы тела на три месяца раньше. Уровни IGF1 в кровотоке составляли 23,5 ± 0,7 нг/мл по сравнению с 33,8 ± 1,5 нг/мл у свиней только с GHR-KO (среднее ± SD) и 215,5 ± 141,2 нг/мл у контролей дикого типа.
Вышесказанное может иметь важные последствия для клинической ксенотрансплантации, т.к.
i) органы сельскохозяйственных свиней являются слишком крупными для многих пациентов;
ii) минипиги, имеющие более подходящий размер органов, имеют высокую нагрузку эндогенных ретровирусов свиней (PERV) (см. ссылку 87);
iii) размер свиней GHR-KO и их органов можно корректировать посредством введения рекомбинантного инсулиноподобного фактора роста 1 (IGF1) (обзор по ссылке 88) для нужд реципиента; и
iv) показано, что дефицит GHR является благоприятным в терминах устойчивости клеток и тканей к стрессу (см. ссылку 89), что в конечном итоге приводит к увеличенной продолжительности жизни ксенотрансплантата.
Что касается указанного выше аспекта iii), указано, что, если размер свиней GHR-KO и их органов корректируют для нужд организма-реципиента, благоприятный эффект размера не будет нейтрализован при трансплантации органа с дефицитом GHR IGF1-интактному ксено-реципиенту. Это является результатом того, что свиней-доноров с дефицитом GHR можно использовать в более старшем возрасте (за пределами острой фазы кривой роста). Кроме того, локально продуцируемый IGF1 является более важным для роста органов, чем образующийся в печени, циркулирующий (см. ссылку 114). Таким образом, в рамках изобретения размер органов с дефицитом GHR можно корректировать для нужд реципиента посредством введения IGF1 свинье-донору.
Материалы и способы
Получение GHR-мутантных свиней на фоне дикого типа с использованием CRISPR/Cas
Все процедуры с использованием животных в настоящем исследовании были одобрены ответственным органом по защите прав животных (Правительством Верхней Баварии; разрешение 55.2-1-54-2532-70-12) и осуществлены в соответствии с Законом о защите прав животных Германии и директивой 2010/63/EU о защите животных, используемых в научных исследованиях.
Для повреждения гена GHR с помощью CRISPR/Cas с использованием одиночной гидовой РНК (sgRNA), специфичной для последовательности экзона 3 5′-TTCATGCCACTGGACAGATG-3′ (SEQ ID NO: 8), соответствующий олигонуклеотид клонировали в вектор pEX-A-U6-gRNA, как описано ранее (см. ссылку 90). мРНК Cas9 и sgRNA транскрибировали in vitro с использованием набора Ambion Maxiscript SP6 (Thermo Fisher Scientific).
Получали зиготы свиней (с фоном породы немецкий ландрас 91), и инъецировали мРНК Cas9 (50 нг/мкл) и sgRNA (100 нг/мкл) в их цитоплазму через 8,5-9,5 ч. после оплодотворения in vitro. Молодых свинок-реципиентов синхронизировали по эстральному циклу посредством перорального введения 4 мл альтреногеста (Regumate®; MSD Animal Health) в течение 15 дней с последующей внутримышечной инъекцией 750 МЕ ECG (Intergonan®; MSD Animal Health) и 750 МЕ HCG (Ovogest®; MSD Animal Health) еще через 24 и 104 ч., соответственно. Перенос эмбрионов осуществляли лапароскопически в одну маточную трубу (см. ссылки 92, 93). Беременность подтверждали посредством ультразвукового исследования сначала в день 21 и снова через 4-6 недель.
Геномную ДНК выделяли из кончиков хвостов поросят с использованием набора для выделения ДНК Wizard (Promega). Мутации GHR определяли посредством секвенирования продукта ПЦР экзона 3 GHR, полученного с использованием праймеров GHR_Fw 5′-acc gct ctg aag ctg tga cc-3′ (SEQ ID NO: 9) и GHR_Rv 5′-cac cct cag ata ctc tca tgc-3′ (SEQ ID NO: 10). Учитывая определенные мутации, проводили анализ полиморфизма длин рестрикционных фрагментов XcmI, получая фрагменты 203 п.н. и 441 п.н. в случае GHR дикого типа и один фрагмент 644 п.н. в случае мутантной последовательности GHR.
Двух самок-основателей с разными мутациями со сдвигом рамки считывания спаривали с хряками дикого типа для получения гетерозиготного потомства F1. Гетерозиготное потомство того же основателя скрещивали между собой для получения гомозиготных животных (GHR-KO) с соответствующими мутациями GHR.
Получение GHR-мутантных свиней в условиях hCD46/hTBM-трансгенного фона GGTA1-KO
Все процедуры с использованием животных в настоящем исследовании были одобрены ответственным органом по защите прав животных (Правительством Верхней Баварии; разрешение 55.2-1-54-2532-70-12) и осуществлены в соответствии с Законом о защите прав животных Германии и директивой 2010/63/EU о защите животных, используемых в научных исследованиях.
Первичные клетки выделяли из самки hCD46/hTBM-трансгенной свиньи GGTA1-KO. Клетки котрансфицировали с использованием экспрессирующей плазмиды Cas9 (CMV-Cas9; см. ссылку 111) и плазмиды, с которой транскрибируется gRNA ttcatgccactggacaGAtgGGG (SEQ ID NO: 11) (PAM подчеркнут), специфическая для экзона 3 GHR свиньи. Получали клоны отдельных клеток; продукты ПЦР гена GHR свиньи амплифицировали с использованием пары праймеров 5'-gcacacttcagatgctacctaa (SEQ ID NO: 12) и 5'-cacatgctcaccctcagatac (SEQ ID NO: 13); осуществляли секвенирование по Сэнгеру продукта ПЦР и анализировали на мутации со сдвигом рамки считывания посредством двухстороннего секвенирования по Сэнгеру с использованием праймеров 5'-accgctctgaagctgtgacc (SEQ ID NO: 14) и 5'-caggagaccagagaccttatct (SEQ ID NO: 15). Клон клетки, несущий биаллельное сочетание вредоносных мутаций (ctggacagatggggt (SEQ ID NO: 16)/ctggacagatggggt (SEQ ID NO: 16) → ctgTCC-Atggggt (SEQ ID NO: 17)/ctggacag---gggt (SEQ ID NO: 18)), использовали для переноса ядра соматической клетки.
Молодых свинок-реципиентов синхронизировали по эстральному циклу посредством перорального введения 4 мл альтреногеста (Regumate®; MSD Animal Health) в течение 15 дней с последующей внутримышечной инъекцией 750 МЕ ECG (Intergonan®; MSD Animal Health) и 750 МЕ HCG (Ovogest®; MSD Animal Health) еще через 24 и 104 ч., соответственно. Перенос эмбрионов осуществляли лапароскопически в одну маточную трубу (см. ссылки 92, 93). Беременность подтверждали посредством ультразвукового исследования сначала в день 21 и снова через 4-6 недель.
Геномную ДНК выделяли из кончиков хвостов поросят с использованием набора для выделения ДНК Wizard (Promega). Мутации GHR определяли посредством секвенирования продукта ПЦР экзона 3 GHR, полученного с использованием праймеров GHR_Fw 5′-acc gct ctg aag ctg tga cc-3′ (SEQ ID NO: 9) и GHR_Rv 5′-cac cct cag ata ctc tca tgc-3′ (SEQ ID NO: 10). С учетом определенных мутаций осуществляли анализ полиморфизма длин рестрикционных фрагментов XcmI, получая фрагменты 203 п.н. и 441 п.н. в случае GHR дикого типа и один фрагмент 644 п.н. в случае мутантной последовательности GHR.
Родились четыре самки GTKO.hCD46.hTBM.GHRKO, и посредством секвенирования по Сэнгеру подтверждали, что они несут соответствующее сочетание мутаций. Два из четырех поросят погибли через день после рождения, двух других свиней выращивали до взрослого состояния без клинических проблем.
Лигандное иммуноокрашивание GHR свиньи (только в условиях фона дикого типа)
Ткань печени и почки свиней GHR-KO и контрольных свиней фиксировали в течение ночи в 4% формальдегиде и общепринятым образом заключали в парафин. Парафиновые срезы депарафинизировали и эндогенную пероксидазу и биотин блокировали с помощью 1% H2O2 в Трис-забуференном физиологическом растворе (TBS) в течение 15 мин и с использованием набора для блокирования авидина/биотина (кат. № SP-2001; Vector Laboratories), соответственно. После блокирования с помощью 0,5% рыбьего желатина в течение 30 мин препараты инкубировали в 0,5 мкг/мл рекомбинантного GH крысы (№ 16343667, ImmunoTools) в 0,2% растворе рыбьего желатина в течение ночи при 4°C. Затем их промывали 3 раза в течение 5 мин в TBS и инкубировали в растворе поликлонального антитела козы против GH крысы (разведение 1:2,400, кат. № AF1566, R&D Systems) в течение 6 ч. при комнатной температуре. После 3 стадий промывки в TBS (10 мин каждая) препараты инкубировали в растворе биотинилированного антитела кролика против IgG козы (разведение 1:100, кат. № BA-5000, Vector Laboratories) в течение 1 ч. при комнатной температуре, промывали 3 раза в течение 10 мин в TBS и наконец инкубировали с меченым пероксидазой хрена комплексом авидин-биотин в течение 30 мин (кат. № PK-6100, набор VECTASTAIN Elite ABC-Peroxidase kit, Vector Laboratories). Иммунореактивность визуализировали с использованием 3,3′-диаминобензидина тетрагидрохлорида гидрата (DAB) (коричневое окрашивание). Докрашивание ядер осуществляли с использованием гематоксилина Майера (синее окрашивание). В качестве контролей специфичности для анализа лигандной иммуногистохимии, пренебрегали GH крысы, а также GH крысы с первичным антителом.
Сбор крови
Животные голодали в течение ночи (16 ч.) перед забором крови из яремной вены. После образования сгустка в течение 30 мин при комнатной температуре сыворотку отделяли посредством центрифугирования (1200×g) в течение 20 мин при 6°C и хранили при −80°C до анализа. Для повторного забора крови, необходимого для анализа профилей секреции GH, хирургически вводили центральные венозные катетеры (Argon Careflow™; Merit Medical) через вену наружного уха. Образцы крови собирали каждые 30 мин в течение 9 ч., начиная с 11 часов утра, и обрабатывали для получения сыворотки, как описано выше. Во время тестирования животных регулярно кормили, и они имели свободный доступ к воде.
Биохимический анализ, анализы гормонов, анализ блоттинга лиганда IGFBP (только в условиях фона дикого типа)
Параметры биохимического анализа в сыворотке определяли с использованием системы Cobas 311 (Hitachi) или автоанализатора AU480 (Beckman-Coulter) и адаптированных реагентов из Roche Diagnostics или Beckman-Coulter, соответственно. Концентрации GH в сыворотке измеряли с помощью ELISA на GH крысы/мыши (EZRMGH-45K; Merck), перекрестно реагирующего с GH свиньи. Для вычисления площади под кривой GH значения ниже предела количественного определения анализа (<0,07 нг/мл) произвольно устанавливали на 0,07 нг/мл. Уровни IGF1 в сыворотке определяли посредством RIA после диссоциации IGF1 от IGFBP посредством закисления и блокирования участков связывания IGF1 с помощью избытка IGF2 (см. ссылку 94). Анализ блоттинга лиганда IGFBP в образцах сыворотки осуществляли, как описано ранее (см. ссылку 95), с использованием серийных разведений рекомбинантных IGFBP3 (41/38 кДа), IGFBP2 (32 кДа), IGFBP5 (29 кДа) и IGFBP4 (24 кДа) человека для количественного анализа. Инсулин в плазме определяли с использованием видоспецифического RIA (Merck Millipore), как описано ранее (см. ссылку 96). Уровни глюкозы в крови определяли незамедлительно с использованием глюкометра Precision Xceed® и тест-полосок Precision XtraPlus® (Abbott) (см. ссылку 97). Уровни лептина в сыворотке измеряли с использованием многовидового радиоиммунологического анализа лептина (кат. № XL-85K; EMD Millipore Corporation), валидированного для образцов свиньи (см. ссылку 98).
Параметры роста и состав тела
Массу тела и длину тела (расстояние между кончиком морды и корнем хвоста у выпрямленных животных) свиней GHR-KO и контрольных свиней определяли с недельными интервалами. Относительную длину тела вычисляли, разделяя длину тела на кубический корень массы тела для сохранения той же размерности. Т.к. не всех животных можно взвесить/измерить точно в одном и том же возрасте, необработанные данные корректировали посредством линейной интерполяции к определенному возрасту/моменту времени.
Процент общего жира тела определяли у 6-месячных свиней GHR-KO и контрольных свиней с использованием двухэнергетической рентгеновской абсорбциометрии (DXA; Lunar iDXA, GE Healthcare), как описано ранее (см. ссылку 99). Кроме того, осуществляли магнитно-резонансную томографию (МРТ; Magnetom Open, Siemens) (см. ссылку 100) для визуализации и определения соотношения мышц и жира как площади длиннейшей мышцы спины, разделенной на площадь покрывающего ее жира на спине до последнего ребра.
Некропсия (только в условиях фона дикого типа)
Свиней GHR-KO и контрольных свиней подвергали эвтаназии в возрасте 6 месяцев под анестезией посредством внутривенной инъекции T61® (Intervet) и незамедлительно подвергали некропсии. Органы рассекали и взвешивали до ближайшего мг. Образцы ткани собирали, как описано ранее (см. ссылку 101), и общепринятым образом фиксировали в нейтральном забуференном растворе формалина (4%) в течение 24 ч. или незамедлительно замораживали на сухом льду и хранили при −80°C для молекулярного профилирования. Фиксированные формалином образцы ткани заключали в парафин. Срезы мышц окрашивали гематоксилином и эозином (H&E).
Анализ каскадов передачи сигнала с помощью иммуноблоттинга (только в условиях фона дикого типа)
Концентрации и статус фосфорилирования GHR-родственных сигнальных молекул в печени оценивали посредством вестерн-блоттинга, как описано ранее (см. ссылку 102). В кратком изложении, образцы ткани печени гомогенизировали в буфере Лэммли и определяли содержание белка с помощью анализа белков с использованием бицинхониновой кислоты. Сорок микрограммов общего белка разделяли посредством электрофореза в ПААГ в присутствии SDS и переносили на мембраны PVDF (Millipore) посредством электроблоттинга. Мембраны промывали в TBS с 0,1% Tween-20 и блокировали 5% масс./об. обезжиренного порошкового молока (Roth) в течение 1 ч. Затем мембраны снова промывали и инкубировали в 5% масс./об. растворе BSA (Roth) с соответствующими первичными антителами в течение ночи при 4°C. Используемые антитела и концентрации приведены в дополнительной таблице 1. После промывки мембраны инкубировали в 5% масс./об. растворе обезжиренного порошкового молока с вторичным антителом (антителом осла против кролика; 1:2000; GE Healthcare) в течение 1 ч. Связанные антитела определяли с использованием набора для детекции посредством вестерн-блоттинга ECL Advance (GE Healthcare) и подходящих пленок от того же поставщика. Интенсивности полос количественно анализировали с использованием пакета программ ImageQuant (GE Healthcare).
Статистический анализ (только для фона дикого типа)
Данные продольного исследования о массе тела и длине тела или относительной длине тела, соответственно, анализировали с использованием PROC MIXED (SAS 8,2), учитывая эффекты линии свиней (#2529; #2533), группы (GHR-KO; контроль), пола, возраста и группы взаимодействия*возраст. Среднеквадратичные средние значения (LSM) и стандартные ошибки (SE) LSM вычисляли для группы*возраста и сравнивали с использованием t-критерия Стьюдента. Данные о гомеостазе глюкозы и концентрациях липидов в сыворотке анализировали с использованием PROC GLM (SAS 8.2), учитывая эффекты группы, пола, возраста и группы взаимодействия*возраста. LSM и SE вычисляли для группы*возраста и сравнивали с использованием t-критерия Стьюдента. Состав тела, массу органов и данные биохимического анализа анализировали с использованием PROC GLM, учитывая эффекты группы и пола. LSM и SE вычисляли для групп и сравнивали с использованием t-критерия Стьюдента. Данные блоттинга лиганда IGFBP и вестерн-блоттинга оценивали на значимые различия между свиньями GHR-KO и контрольными свиньями с использованием U-критерия Манна-Уитни.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Способы и продукты по изобретению являются коммерчески применимыми. Например, композиции по настоящему изобретению можно продавать для пролонгирования выживаемости примата, которому трансплантировали сердце, почку, легкое или печень из ксеногенного млекопитающего. Живого примата по настоящему изобретению можно использовать для обнаружения новых композиций и/или схем лечения для дальнейшего пролонгирования выживаемости примата, которому трансплантировали ксеногенное сердце, почку, легкое или печень. Организмы-доноры для трансплантации ксеногенных органов можно использовать для получения органов для ксенотрансплантации. Таким образом, настоящее изобретение является промышленно применимым.
ССЫЛКИ
1. Eurotransplant. Annual Report 2016. 104 (Eurotransplant International Foundation, 2017).
2. Lund, L. H. et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-fourth Adult Heart Transplantation Report-2017; Focus Theme: Allograft ischemic time. J. Heart Lung Transplant. 36, 1037-1046 (2017).
3. Rossano, J. W. et al. The Registry of the International Society for Heart and Lung Transplantation: Twentieth Pediatric Heart Transplantation Report-2017; Focus Theme: Allograft ischemic time. J. Heart Lung Transplant. 36, 1060-1069 (2017).
4. Kirklin, J. K. et al. Eighth annual INTERMACS report: Special focus on framing the impact of adverse events. J. Heart Lung Transplant. 36, 1080-1086 (2017).
5. Mohiuddin, M. M. et al. Chimeric 2C10R4 anti-CD40 antibody therapy is critical for long-term survival of GTKO.hCD46.hTBM pig-to-primate cardiac xenograft. Nat Commun 7, 11138 (2016).
6. Cooper, D. K. et al. Report of the Xenotransplantation Advisory Committee of the International Society for Heart and Lung Transplantation: the present status of xenotransplantation and its potential role in the treatment of end-stage cardiac and pulmonary diseases. J. Heart Lung Transplant. 19, 1125-1165 (2000).
7. Mohiuddin, M. M., Reichart, B., Byrne, G. W. & McGregor, C. G. A. Current status of pig heart xenotransplantation. International Journal of Surgery 23, 234-239 (2015).
8. LOWER, R. R. & SHUMWAY, N. E. Studies on orthotopic homotransplantation of the canine heart. Surg Forum 11, 18-19 (1960).
9. Binder, U. & Skerra, A. PASylation®: A versatile technology to extend drug delivery. Current Opinion in Colloid & Interface Science 31, 10-17 (2017).
10. Steen, S., Paskevicius, A., Liao, Q. & Sjöberg, T. Safe orthotopic transplantation of hearts harvested 24 hours after brain death and preserved for 24 hours. Scand. Cardiovasc. J. 50, 193-200 (2016).
11. Mayr, T. et al. Hemodynamic and perioperative management in two different preclinical pig-to-baboon cardiac xenotransplantation models. Xenotransplantation 24, (2017).
12. Lang, R. M. et al. Recommendations for chamber quantification: a report from the American Society of Echocardiography's Guidelines and Standards Committee and the Chamber Quantification Writing Group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology. Journal of the American Society of Echocardiography : official publication of the American Society of Echocardiography 18, 1440-1463 (2005).
13. Devereux, R. B. et al. Echocardiographic assessment of left ventricular hypertrophy: comparison to necropsy findings. The American Journal of Cardiology 57, 450-458 (1986).
14. Azimzadeh, A. M. et al. Development of a consensus protocol to quantify primate anti-non-Gal xenoreactive antibodies using pig aortic endothelial cells. Xenotransplantation 21, 555-566 (2014).
15. Tanabe, T. et al. Role of Intrinsic (Graft) Versus Extrinsic (Host) Factors in the Growth of Transplanted Organs Following Allogeneic and Xenogeneic Transplantation. Am. J. Transplant. 17, 1778-1790 (2017).
16. Byrne, G. W. & McGregor, C. G. A. Cardiac xenotransplantation: progress and challenges. Curr Opin Organ Transplant 17, 148-154 (2012).
17. Kumar, R. S. & Vimala, J. Steroid-Induced Hypertrophic Cardiomyopathy. APJOC 1-5 (2010).
18. Saxton, R. A. & Sabatini, D. M. mTOR Signaling in Growth, Metabolism, and Disease. Cell 168, 960-976 (2017).
19. Imamura, T. et al. Everolimus Attenuates Myocardial Hypertrophy and Improves Diastolic Function in Heart Transplant Recipients. Int Heart J 57, 204-210 (2016).
20. Paoletti, E. mTOR Inhibition and Cardiovascular Diseases: Cardiac Hypertrophy. Transplantation (2017). doi:10.1097/TP.0000000000001691
21. Manning, B. D. Game of TOR - The Target of Rapamycin Rules Four Kingdoms. N. Engl. J. Med. 377, 1297-1299 (2017).
22. Schuurman, H.-J. Microbiological safety of clinical xenotransplantation products: monitoring strategies and regulatory aspects. A commentary. Xenotransplantation 23, 440-443 (2016).
23. Fischer, K. et al. Efficient production of multi-modified pigs for xenotransplantation by 'combineering', gene stacking and gene editing.Sci Rep 6:29081(2016). doi: 10.1038/srep29081
24. Cooper, D.K., Novitzky, D., Becerra, E., and Reichart, B.. Are there indications for heterotopic heart transplantation in 1986? A 2- to 11-year follow-up of 49 consecutive patients undergoing heterotopic heart transplantation. The Thoracic and Cardiovascular Surgeon 34, 300-304 (1986).
25. Abicht, J., Mayr, T., Reichart, B., Buchholz, S., Werner, F., Lutzmann, I., Schmoeckel, M., Bauer, A., Thormann, M., Langenmayer, M.C., et al. Preclinical heterotopic intrathoracic heart Xenotransplantation: a possibly useful clinical technique. Xenotransplantation, doi: 10.1111/xen.12213(2015). [Epub ahead of print].
26. Wynyard S., Nathu D., Garkavenko O., Denner J. Elliot R.. Microbiologic safety of the first clinical pig islet xenotransplantation trial in New Zealand. Xenotransplantation 21, 309-323 (2014)
27. Li S, et ol. (2014) Dual fluorescent reporter pig for Cre recombination: transgene placement at the ROSA26 locus. PLoS one 9(7):el02455.
28. Petersen B, et al. (2016) Efficient production of biallelic GGTA1 knockout pigs by cytoplasmic microinjection of CRISPR/Cas9 into zygotes. Xenotransplantation 23(5):338-346.
29. Cooper DK, Ekser B, Ramsoondar J, Phelps C, & Ayares D (2016) The role of genetically engineered pigs in xenotransplantation research. The Journal of pathology 238(2):288-299.
30. Rieblinger B, et al. (2018) Strong xenoprotective function by single-copy transgenes placed sequentially at a permissive locus. Xenotransplantation.
31. Kourtzelis I, Magnusson PU, Kotlabova K, Lambris JD, & Chavakis T (2015) Regulation of instant blood mediated inflammatory reaction (IBMIR) in pancreatic islet xenotransplantation: points for therapeutic inventions. Advances in experimental medicine and biology 865:171-188.
32. Bulato C, Radu C, & Simoni P (2012) Studies on coagulation incompatibilities for xenotransplantation. Methods of molecular biology (Clifton, N.J.) 885:71-89.
33. Cowan PJ & Robson SC (2015) Progress towards overcoming coagulopathy and hemostatic dysfunction associates with xenotransplantation. Int J Surg 23(Pt B):296-300.
34. Roussel JC, et al. (2008) Pig thrombomodulin binds human thrombin but is a poor cofactor for activation of human protein C and TAFI. American journal of transplantation: official journal of the American Society of Transplantation and the American Society of Transplant Surgeons 8(6):1101-1112.
35. Petersen B, et al. (2009) Pigs transgenic for human thrombomodulin have elevated production of activated protein C. Xenotransplantation 16(6):486-495.
36. Yazaki S, et al. (2012) Production of cloned pigs expressing human thrombomodulin in endothelial cells. Xenotransplantation 19(2):82-91,
37. Wuensch A, et al. (2014) Regulatory sequences of the porcine THBD gene facilitate endothelial-specific expression of bioactive human thrombomodulin in single- and multitransgenic pigs. Transplantation 97(2):138-147.
38. Byrne GW, McGregor CG, & Breimer ME (2015) Recent investigations into pig antigen and anti-pig antibody expression. Int J Surg 23(Pt B):223-228.
39. Denner J & Tonjes RR (2012) Infection barriers to successful xenotransplantation focusing on porcine endogenous retroviruses. Clin Microbiol Rev 25(2):318-343.
40. Phelps CJ, et al. (2003) Production of alpha 1,3-galactosyltransferase-deficient pigs. Sciene 299(5605):411-414.
41. Klymiuk N, Aigner B, Brem G, & Wolf E (2010) Genetic modification of pigs as organ donors for xenotransplantation. Molecular reproduction and development 77(3):209-221.
42. Hauschild J, et al. (2011) Efficient generation of a biallelic knockout in pigs using zinc-finger nucleases. Proceedings of the National Academy of Sciences of the United States of America 108(29):12013-12017.
43. Kwon DN, et al. (2013) Production of biallelic CMP-Neu5Ac hydroxylase knock-out pigs. Scientific reports 3:1981.
44. Lutz AJ, et al. (2013) Double knockout pigs deficient in N-glycolylneuraminic acid and galactose alpha-1,3-galactose reduce the humoral barrier to xenotransplantation. Xenotransplantation 20(1):27-35.
45. Burlak C, et al. (2014) Reduced binding of human antibodies to cells from GGTA1/CMAH KO pigs. American journal of transplantation: official journal of the American Society of Transplantation and the American Society of Transplant Surgeons 14(8):1895-1900.
46. Miyagawa S, et al. (2015) Generation of alpha1,3-galactosyltransferase and cytidine monophospho-N-acetylneuraminic acid hydroxylase gene double-knockout pigs. J Reprod Dev 61(5):449-457.
47. Estrada JL, et al. (2015) Evaluation of human and non-human primate antibody binding to pig cells lacking GGTA1/CMAH/beta4GalNT2 genes. Xenotransplantation 22(3):194-202.
48. Griesemer A, Yamada K, _& Sykes M (2014) Xenotransplantation: immunological hurdles and progress towards tolerance. Immunol Rev 258(1)241-258.
49. Vadori M & Cozzi E (2015) The immunological barriers to xenotransplantation. Tissue antigens 86(4):239-253.
50. Dawson JR, Vidal AC, & Malyguine AM (2000) Natural killer cell-endothelial cell interactions in xenotransplantation. Immunological research 22(2-3):165-176.
51. Weiss EH, et al. (2009) HLA-E/human beta2-microglobulin transgenic pigs: protein against xenogeneic human anti-pig natural killer cell cytotoxicity. Transplantation 87(1).35-43.
52. Bartlett ST, et al. (2016) Report from IPITA-TTS Opinion Leaders Meeting on the Future of beta-Cell Replacement. Transplantation 100 Suppl 2:S1-44.
53. Aikin RA (2012) How to kill two birds with one transgenic pig. Diabetes 61(6):1348-1349.
54. Klymiuk N, et al. (2012) Xenogafted islet cell cluster from INSLEA29Y transgenic pig rescue diabetes and prevent immune rejection in humanized mice. Diabetes 61(6):1527-1532.
55. Wolf-van Buerck L, et al. (2017) LEA29Y expression in transgenic neonatal porcine islet-like cluster promotes long-lasting xenograft survival in humanized mice without immunosuppressive therapy. Scientific reports 7(1):3572.
56. Klose R, et al. (2005) Expression of biologically active human TRAIL in transgenic pigs. Transplantation 80(2):222-230.
57. Kemter E, et al. (2012) Human TNF-related apoptosis-inducing ligand-expressing dendritic cells from transgenic pigs attenuate human xenogeneic T cell responses. Xenotransplantation 19(1):40-51.
58. Seol JG, et al. (2010) Production of transgenic cloned miniature pigs with membrane-bound human Fas ligand (FasL) by somatic call nuclear transfer. Nature Precedings <http://hdl.handle.net/10101/npre.2010.4539.1>
59. Taylor FB, Jr., Peer GT, Lockhart MS, Ferrell G, & Esmon CT (2001) Endothelial cell protein C receptor plays an important role in protein C activation in vivo. Blood 97(6):1685-1688.
60. Iwase H, et al. (2014) Regulation of human platelet aggregation by genetically modified pig endothelial cells and thrombin inhibition. Xenotransplantation 21(1):72-83.
61. Ji H, et al. (2015) Pig BMSCs Transfected with Human TFPI Combat Species Incompatibility and Regulate the Human TF Pathway in Vitro and in a Rodent Model. Cellular physiology and biochemistry: international journal of experimental cellular physiology, biochemistry, and pharmacology 36(1):233-249.
62. Lee HJ, Lee BC, Kim YH, Paik NW, & Rho HM (2011) Characterization of transgenic pigs that express human decay accelerating factor and cell membrane-tethered human tissue factor pathway inhibitor. Reproduction in domestic animals=Zuchthygiene 46(2):325-332.
63. Wijkstrom M, et al. (2015) Glucose metabolism in pigs expressing human genes under an insulin promoter. Xenotransplantation 22(1):70-79.
64. Wheeler DG, et al. (2012) Transgenic swine: expression of human CD39 protects against myocardial injury. Journal of molecular and cellular cardiology 52(2):958-961.
65. Le Bas-Bernardet S, et al. (2015) Bortezomib, C1-inhibitor and plasma exchange do not prolong the survival of multi-transgenic GalT-KO pig kidney xenografts in baboons. American journal of transplantation: official journal of the American Society of Transplantation and the American Society of Transplant Surgeons 15(2):358-370.
66. Pintore L, et al. (2013) Clinicopathological findings in non-human primate recipients of porcine renal xenografts: quantitative and qualitative evaluation of proteinuria. Xenotransplantation 20(6):449-457.
67. Bottino R, et al. (2014) Pig-to-monkey islet xenotransplantation using multi-transgenic pigs. American journal of transplantation: official journal of the American Society of Transplantation and the American Society of Transplant Surgeons 14(10):2275-2287.
68. Ahrens HE, et al. (2015) siRNA mediated knockdown of tissue factor expression in pigs for xenotransplantation. American journal of transplantation: official journal of the American Society of Transplantation and the American Society of Transplant Surgeons 15(5):1407-1414.
69. Paris LL, et al. (2015) Reduced human platelet uptake by pig livers deficient in the asialoglycoprotein receptor 1 protein. Xenotransplantation 2(3):203-210.
70. Oropeza M, et al. (2009) Transgenic expression of the human A20 gene in cloned pigs provides protection against apoptotic and inflammatory stimuli. Xenotransplantation 16(6):522-534.
71. Pertersen B, et al. (2011) Transgenic expression of human heme oxygenase-1 in pigs confers resistance against xenograft during ex vivo perfusion of porcine kidneys.Xenotransplantation 18(6) :355-368.
72. Fishman JA, Scobie L, & Takeuchi Y (2012) Xenotransplantation-associates infectious risk: a WHO consultation. Xenotransplantation 19(2):72-81.
73. Mueller NJ, Takeuchi Y, Mattiuzzo G, & Scobie L (2011) Microbial safety in xenotransplantation. Current opinion in organ transplantation 16(2):201-206.
74. Fishman JA (2014) Assessment of infectious risk in clinical xenotransplantation: the lesson for clinical allotransplantation. Xenotransplantation 21(4):307-308.
75. Morozov VA, et al. (2015) Extended microbiological characterization of Göttingen minipigs in the context of xenotransplantation: detection and vertical transmission of hepatitis E virus. PloS one 10(10):e0139893.
76. Denner J (2013) Immunising with the transmembrane envelope proteins of different retroviruses including HIV-1: a comparative study. Hum Vaccin Immunother 9(3):462-470.
77. Dieckhoff B, et al. (2008) Knockdown of porcine endogenous retrovirus (PERV) expression by PERV-specific shRNA in transgenic pigs. Xenotransplantation 15(1):36-45.
78. Ramsoondar J, et al. (2009) Production of transgenic pigs that express porcine endogenous retrovirus small interfering RNAs. Xenotransplantation 16(3):164-180.
79. Yang L, et al. (2015) Genome-wide inactivation of porcine endogenous retroviruses (PERVs). Science 350(6264):1101-1104.
80. Niu D, et al. (2017) Inactivation of porcine endogenous retroviruses in pigs using CRISPR-Cas9. Science 357(6357):1303-1307.
81. Denner J (2017) Paving the Path toward Porcine Organs for Transplantation. The New England journal of medicine 377(19):1891-1893.
82. Denner J (2017) Advances in organ transplant from pigs. Science 357(6357):1238-1239.
83. Lesnik, J.J., Singh, G. K., Balfour, I.C. & Wall, D.A. Steroid-induced hypertrophic cardiomyopathy following stem cell transplantation in a neonate: a case report. Bone Marrow Transplant. 27, 1105-1108 (2001).
84. Saxon, R. A. / Sabatini, D. M. mTOR signaling in growth, metabolism, and disease. Cell 168, 960-976 (2017).
85. Aslan, J.E., Tormoen, G.W., Loren, C.P., Pang, J. & McCarty, O.J. S6K1 and mTOR regulate Rac1-driven platelet activation and aggregation. Blood 118, 3129-3136 (2011).
86. Hinrichs, A., B. Kessler, M. Kurome, A. Blutke, E. Kemter, M. Bernau, A.M. Scholz, B. Rathkolb, S. Renner, S. Bultmann, H. Leonhardt, M.H. de Angelis, H. Nagashima, A. Hoeflich, W.F. Blum, M. Bidlingmaier, R. Wanke, M. Dahlhoff, and E. Wolf, Growth hormone receptor-deficient pigs resemble the pathophysiology of human Laron syndrome and reveal altered activation of signaling cascades in the liver. Mol Metab, 2018. 11: p. 113-128.87. Bittmann, I., D. Mihica, R. Plesker, and J. Denner, Expression of porcine endogenous retroviruses (PERV) in different organs of a pig. Virology, 2012. 433(2): p. 329-36.
88. Cohen, J., S. Blethen, J. Kuntze, S.L. Smith, K.G. Lomax, and P.M. Mathew, Managing the child with severe primary insulin-like growth factor-1 deficiency (IGFD): IGFD diagnosis and management. Drugs R D, 2014. 14(1): p. 25-9.
89. Guevara-Aguirre, J., P. Balasubramanian, M. Guevara-Aguirre, M. Wei, F. Madia, C.W. Cheng, D. Hwang, A. Martin-Montalvo, J. Saavedra, S. Ingles, R. de Cabo, P. Cohen, and V.D. Longo, Growth hormone receptor deficiency is associated with a major reduction in pro-aging signaling, cancer, and diabetes in humans. Sci Transl Med, 2011. 3(70): p. 70ra13.
90. Dahlhoff, M., Gaborit, N., Bultmann, S., Leonhardt, H., Yarden, Y.,Schneider, M.R., 2017. CRISPR-assisted receptor deletion reveals distinctroles for ERBB2 and ERBB3 in skin keratinocytes. FEBS Journal 284:3339-3349.
91. Umeyama, K., Honda, K., Matsunari, H., Nakano, K., Hidaka, T., Sekiguchi, K., et al., 2013. Production of diabetic offspring using cryopreserved epididymalsperm by in vitro fertilization and intrafallopian insemination techniques intransgenic pigs. Journal of Reproduction and Development 59:599-603.
92. Kurome, M., Kessler, B., Wuensch, A., Nagashima, H., Wolf, E., 2015. Nucleartransfer and transgenesis in the pig. Methods in Molecular Biology (Clifton, NJ)1222:37-59.
93. Besenfelder, U., Modl, J., Muller, M., Brem, G., 1997. Endoscopic embryocollection and embryo transfer into the oviduct and the uterus of pigs. Theriogenology47:1051-1060.
94. Blum, W.F., Breier, B.H., 1994. Radioimmunoassays for IGFs and IGFBPs.Growth Regulation 4(Suppl 1):11-19.
95. Wirthgen, E., Hoflich, C., Spitschak, M., Helmer, C., Brand, B., Langbein, J.,et al., 2016. Quantitative Western ligand blotting reveals common patterns anddifferential features of IGFBP-fingerprints in domestic ruminant breeds andspecies. Growth Hormone & IGF Research 26:42-49.
96. Renner, S., Fehlings, C., Herbach, N., Hofmann, A., von Waldthausen, D.C.,Kessler, B., et al., 2010. Glucose intolerance and reduced proliferation ofpancreatic beta-cells in transgenic pigs with impaired glucose-dependentinsulinotropic polypeptide function. Diabetes 59:1228-1238.
97. Blutke, A., Renner, S., Flenkenthaler, F., Backman, M., Haesner, S.,Kemter, E., et al., 2017. The Munich MIDY Pig Biobank - a unique resource forstudying organ crosstalk in diabetes. Molecular Metabolism 6:931-940.
98. Papadopoulos, G.A., Erkens, T., Maes, D.G., Peelman, L.J., van Kempen, T.A.,Buyse, J., et al., 2009. Peripartal feeding strategy with different n-6:n-3 ratiosin sows: effect on gene expression in backfat white adipose tissue postpartum.British Journal of Nutrition 101:197-205.
99. Kremer, P.V., Fernandez-Figares, I., Forster, M., Scholz, A.M., 2012. In vivobody composition in autochthonous and conventional pig breeding groups bydual-energy X-ray absorptiometry and magnetic resonance imaging underspecial consideration of Cerdo Iberico. Animal : An International Journal of Animal Bioscience 6:2041-2047.
100. Kremer, P.V., Forster, M., Scholz, A.M., 2013. Use of magnetic resonanceimaging to predict the body composition of pigs in vivo. Animal : An InternationalJournal of Animal Bioscience 7:879-884.
101. Albl, B., Haesner, S., Braun-Reichhart, C., Streckel, E., Renner, S., Seeliger, F., et al., 2016. Tissue sampling guides for porcine biomedical models. Toxicologic Pathology 44:414-420.
102. Streckel, E., Braun-Reichhart, C., Herbach, N., Dahlhoff, M., Kessler, B., Blutke, A., et al., 2015. Effects of the glucagon-like peptide-1 receptor agonistliraglutide in juvenile transgenic pigs modeling a pre-diabetic condition.Journal of Translational Medicine 13:73.
103. Yang H, Wu Z. Genome Editing of Pigs for Agriculture and Biomedicine. Front Genet. 2018 Sep 4;9:360. doi: 10.3389/fgene.2018.00360. eCollection 2018. Review. PubMed PMID: 30233645; PubMed Central PMCID: PMC6131568.
104. Fischer K, Kind A, Schnieke A. Assembling multiple xenoprotective transgenes in pigs. Xenotransplantation. 2018 Nov;25(6):e12431. doi: 10.1111/xen.12431. Epub 2018 Jul 28. Review. PubMed PMID: 30055014.
105. Ryu J, Prather RS, Lee K. Use of gene-editing technology to introduce targeted modifications in pigs. J Anim Sci Biotechnol. 2018 Jan 29;9:5. doi: 10.1186/s40104-017-0228-7. eCollection 2018. Review. PubMed PMID: 29423214; PubMed Central PMCID: PMC5787920.
106. Li, B., Ruotti, V., Stewart, R. M., Thomson, J. A. & Dewey, C. N. RNA-Seq gene expression estimation with read mapping uncertainty. Bioinformatics 26, 493-500, doi:10.1093/bioinformatics/btp692 (2010).
107. Klymiuk N, Seeliger F, Bohlooly-Y M, Blutke A, Rudmann DG, Wolf E. Tailored Pig Models for Preclinical Efficacy and Safety Testing of Targeted Therapies. Toxicol Pathol. 2016 Apr;44(3):346-57. doi: 10.1177/0192623315609688. Epub 2015 Oct 27. Review. PubMed PMID: 26511847.
108. Chatterjee S, Shapiro L, Rose SJ, Mushtaq T, Clayton PE, Ten SB, Bhangoo A, Kumbattae U, Dias R, Savage MO, Metherell LA, Storr HL. Phenotypic spectrum and responses to recombinant human IGF1 (rhIGF1) therapy in patients with homozygous intronic pseudoexon growth hormone receptor mutation. Eur J Endocrinol. 2018May;178(5):481-489. doi: 10.1530/EJE-18-0042. Epub 2018 Mar 2. PubMed PMID: 29500309.
109. Kemp SF. Insulin-like growth factor-I deficiency in children with growth hormone insensitivity: current and future treatment options. BioDrugs. 2009;23(3):155-63. doi: 10.2165/00063030-200923030-00002. Review. PubMed PMID: 19627167.
110. Carel JC, Chaussain JL, Chatelain P, Savage MO. Growth hormone insensitivity syndrome (Laron syndrome): main characteristics and effects of IGF1 treatment. Diabetes Metab. 1996 Jul;22(4):251-6. Review. PubMed PMID: 8767171.
111. Mali P, Yang L, Esvelt KM, Aach J, Guell M, DiCarlo JE, Norville JE, Church GM. RNA-guided human genome engineering via Cas9. Science. 2013 Feb 15;339(6121):823-6.
112. Osman N, McKenzie IF, Ostenried K, Ioannou YA, Desnick RJ, Sandrin MS.Combined transgenic expression of alpha-galactosidase and alpha1,2-fucosyltransferase leads to optimal reduction in the major xenoepitope Galalpha(1,3)Gal.Proc Natl Acad Sci U S A. 1997 Dec 23;94(26):14677-82.
113. Loveland BE, Milland J, Kyriakou P, Thorley BR, Christiansen D, Lanteri MB, van Regensburg M, Duffield M, French AJ, Williams L, Baker L, Brandon MR, Xing P-X, Kahn D, McKenzie IFC. Characterization of a CD46 transgenic pig and protection of transgenic kidneys against hyperacute rejection in non-immunosuppressed baboons. Xenotransplantation 2004; 11: 171-183
114. Yakar S, Liu JL, Stannard B, Butler A, Accili D, Sauer B, LeRoith D. Normal growth and development in the absence of hepatic insulin-like growth factor I.Proc Natl Acad Sci U S A. 1999 Jun 22;96(13):7324-9.
115.  M, Mayr T, Reichart B, Michel S, Buchholz S, Guethoff S, Dashkevich A, Baehr A, Egerer S, Bauer A, et al. Consistent success in life-supporting porcine cardiac xenotransplantation. Nature. 2018 Dec;564(7736):430-433. doi: 10.1038/s41586-018-0765-z. Epub 2018 Dec 5.
M, Mayr T, Reichart B, Michel S, Buchholz S, Guethoff S, Dashkevich A, Baehr A, Egerer S, Bauer A, et al. Consistent success in life-supporting porcine cardiac xenotransplantation. Nature. 2018 Dec;564(7736):430-433. doi: 10.1038/s41586-018-0765-z. Epub 2018 Dec 5.
116.  OL, Ozdemir A, Akkaya A,
OL, Ozdemir A, Akkaya A,  G, Celik H,
G, Celik H,  S. Normal liver, spleen, and kidney dimensions in neonates, infants, and children: evaluation with sonography. AJR Am J Roentgenol. 1998 Dec;171(6):1693-8. PubMed PMID: 9843315.
S. Normal liver, spleen, and kidney dimensions in neonates, infants, and children: evaluation with sonography. AJR Am J Roentgenol. 1998 Dec;171(6):1693-8. PubMed PMID: 9843315.
117. Rao UV, Wagner HN Jr. Normal weights of human organs. Radiology. 1972 Feb;102(2):337-9. PubMed PMID: 5009936.
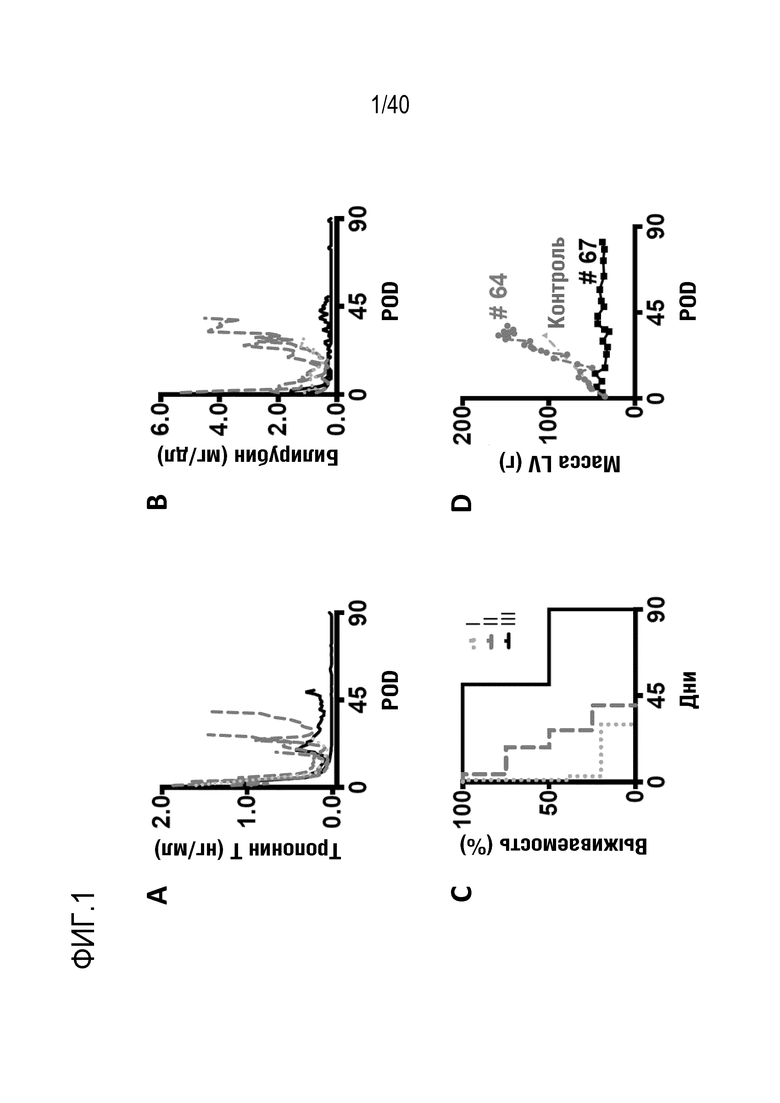
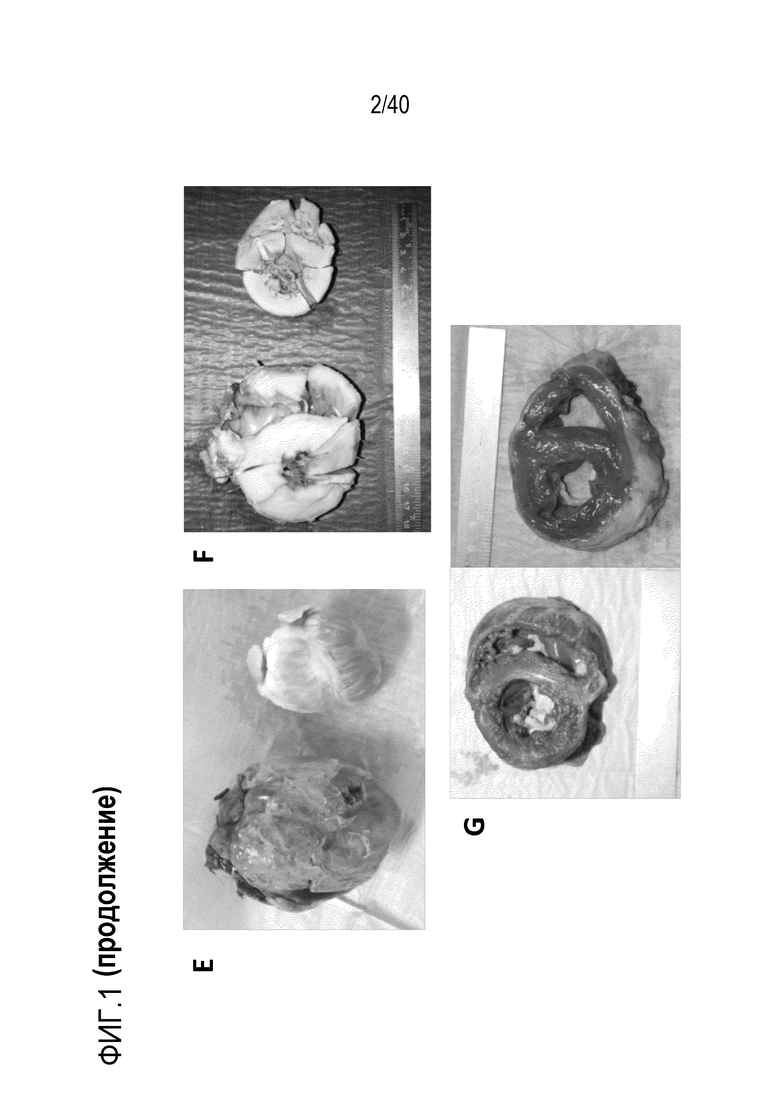

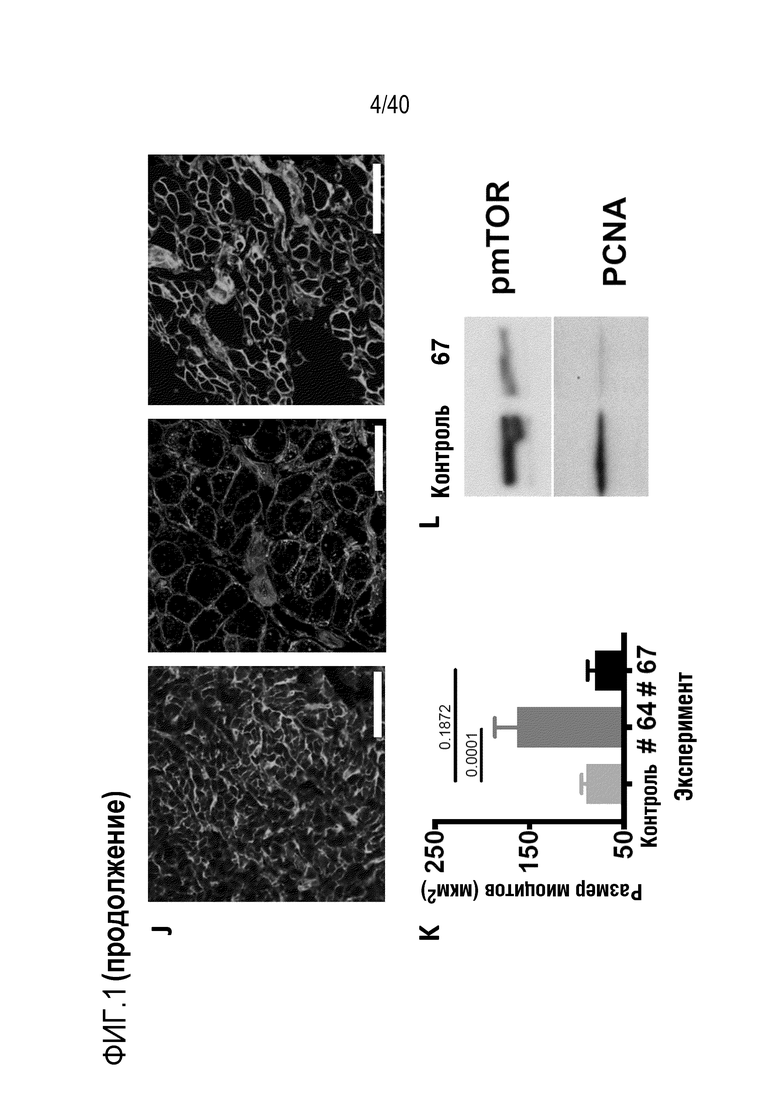
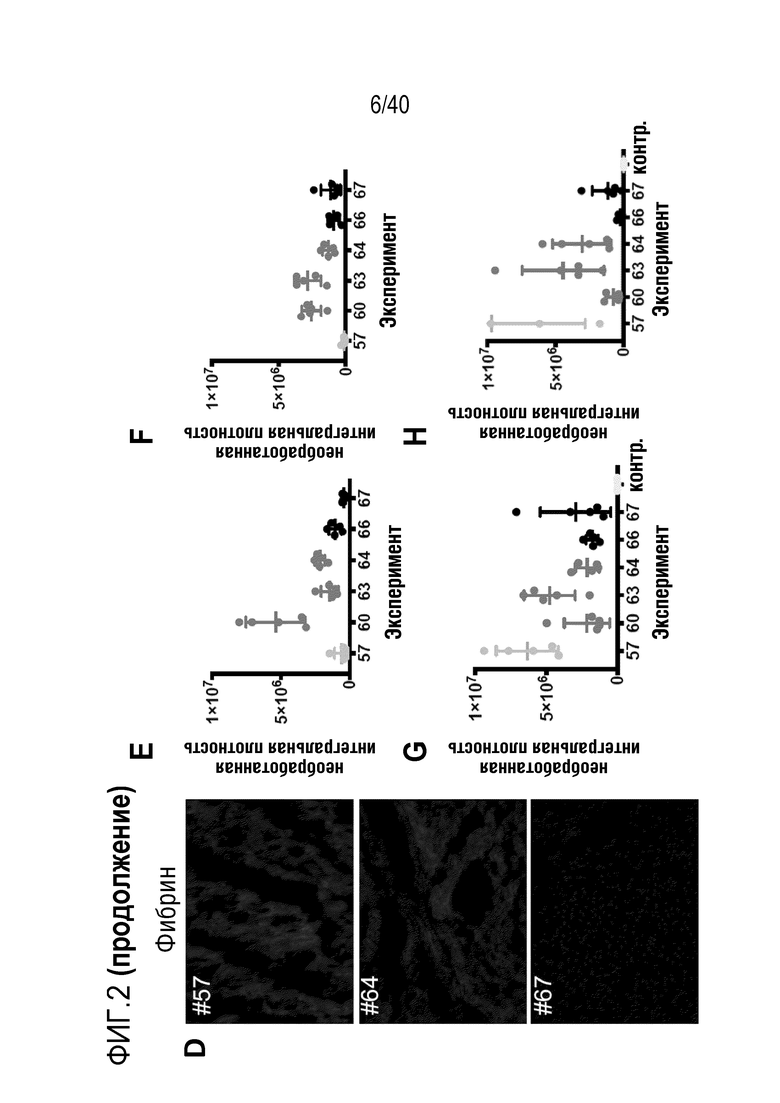
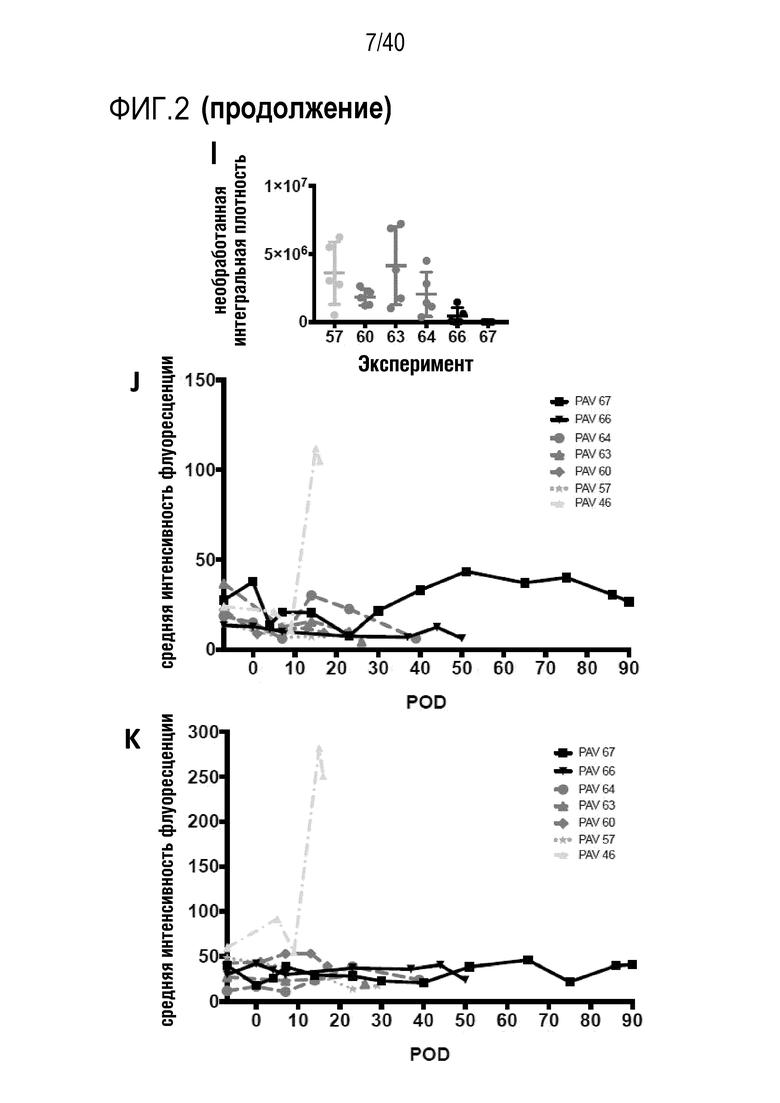
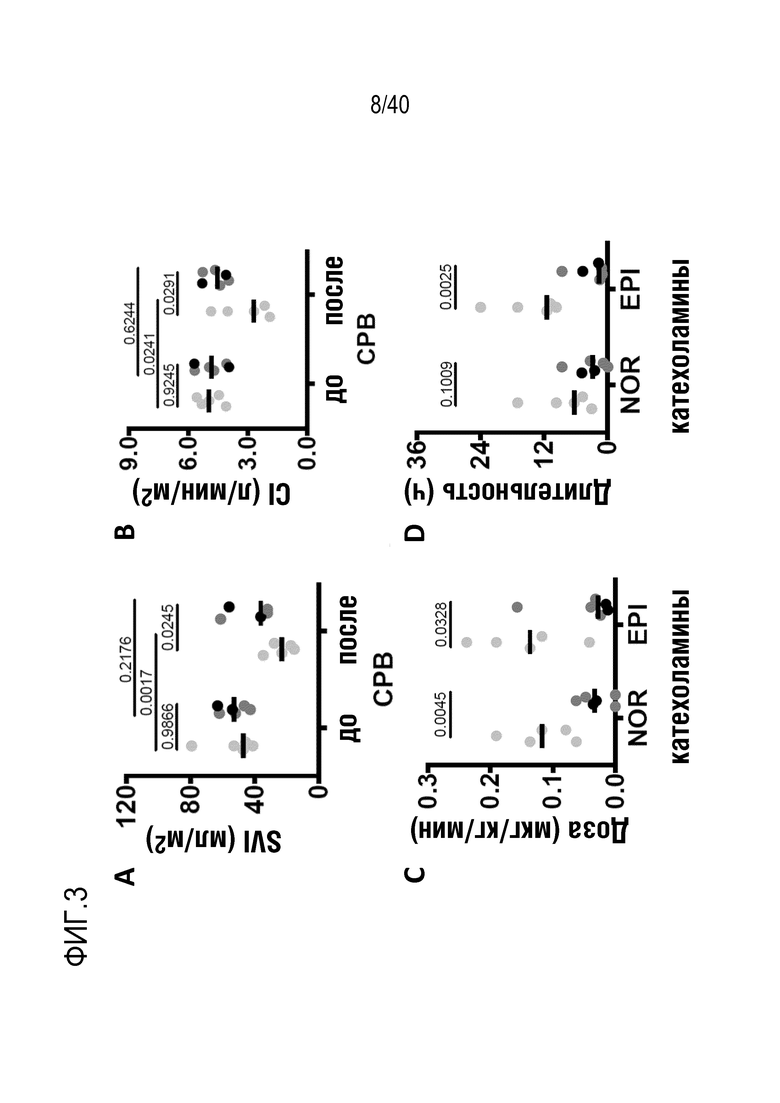
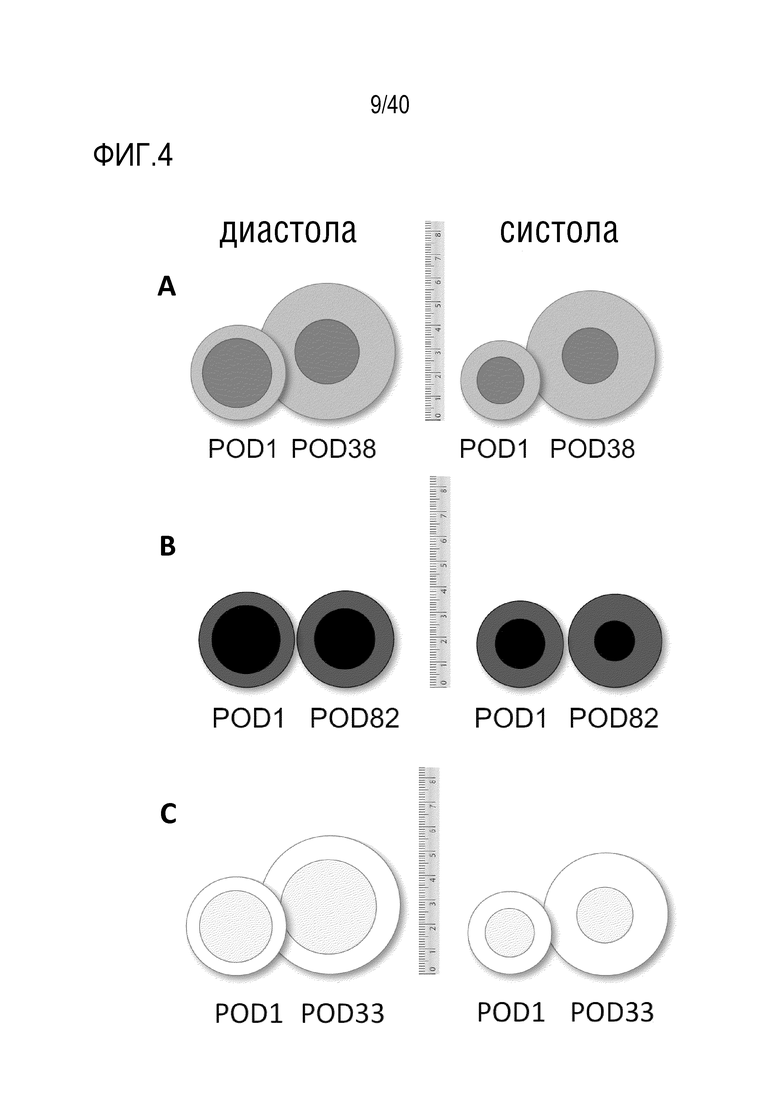

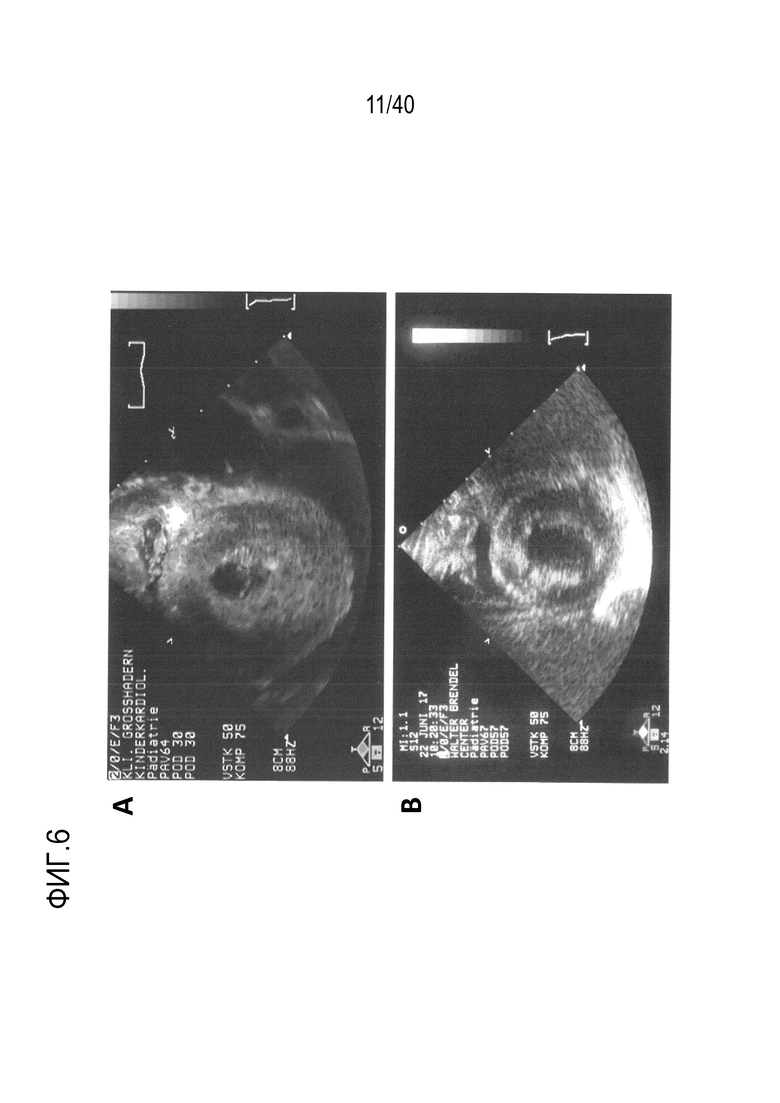
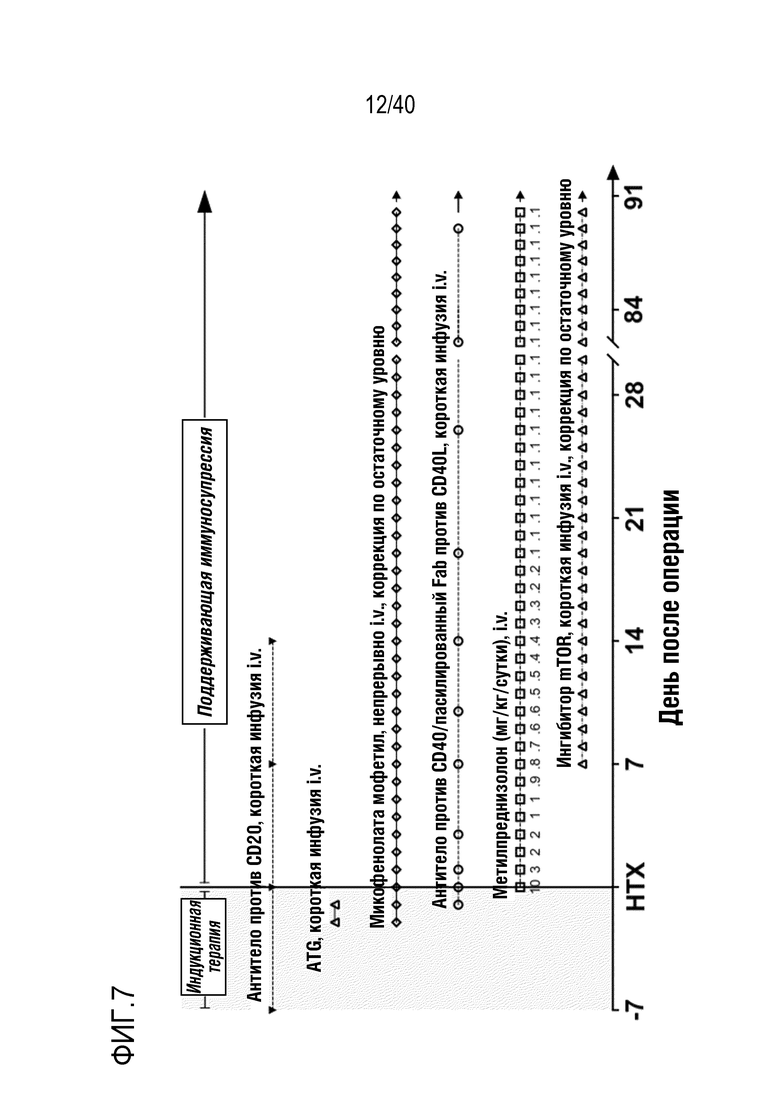
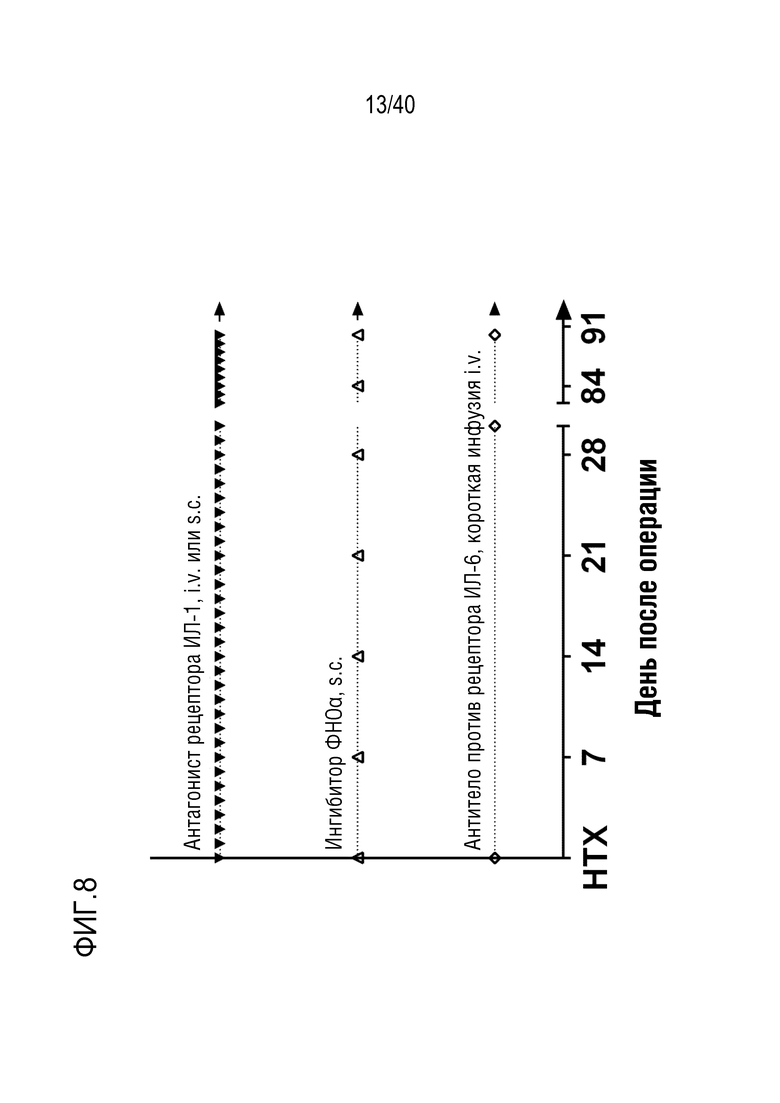
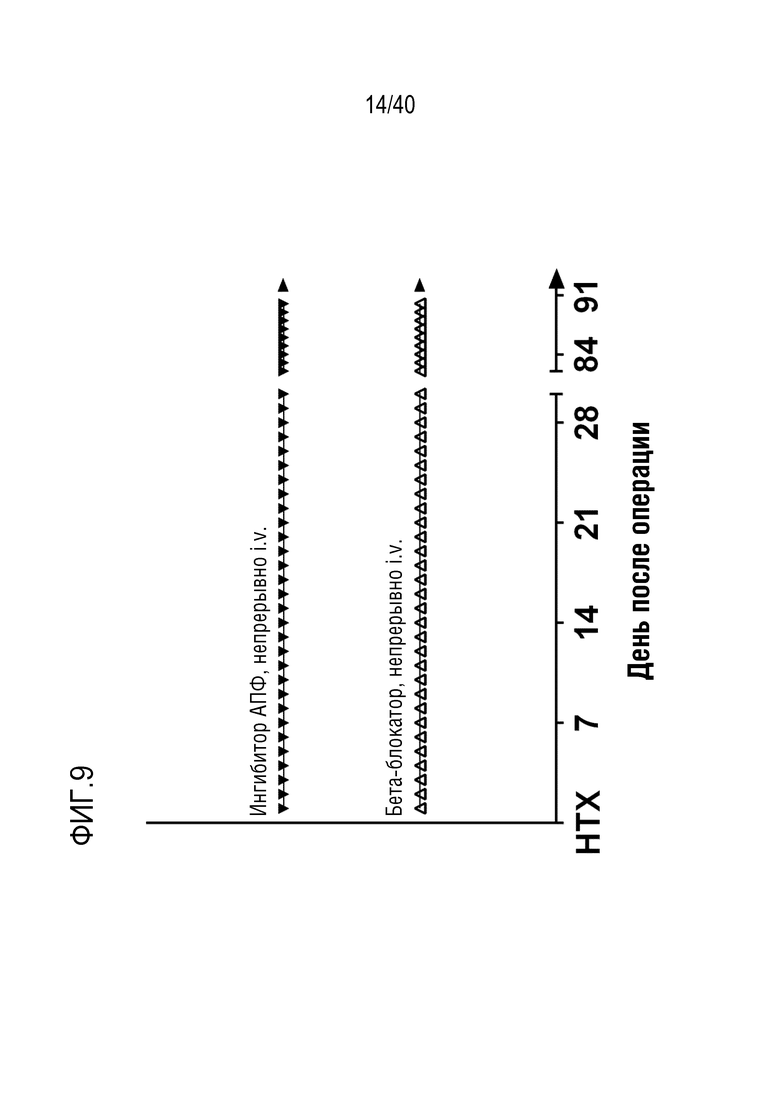
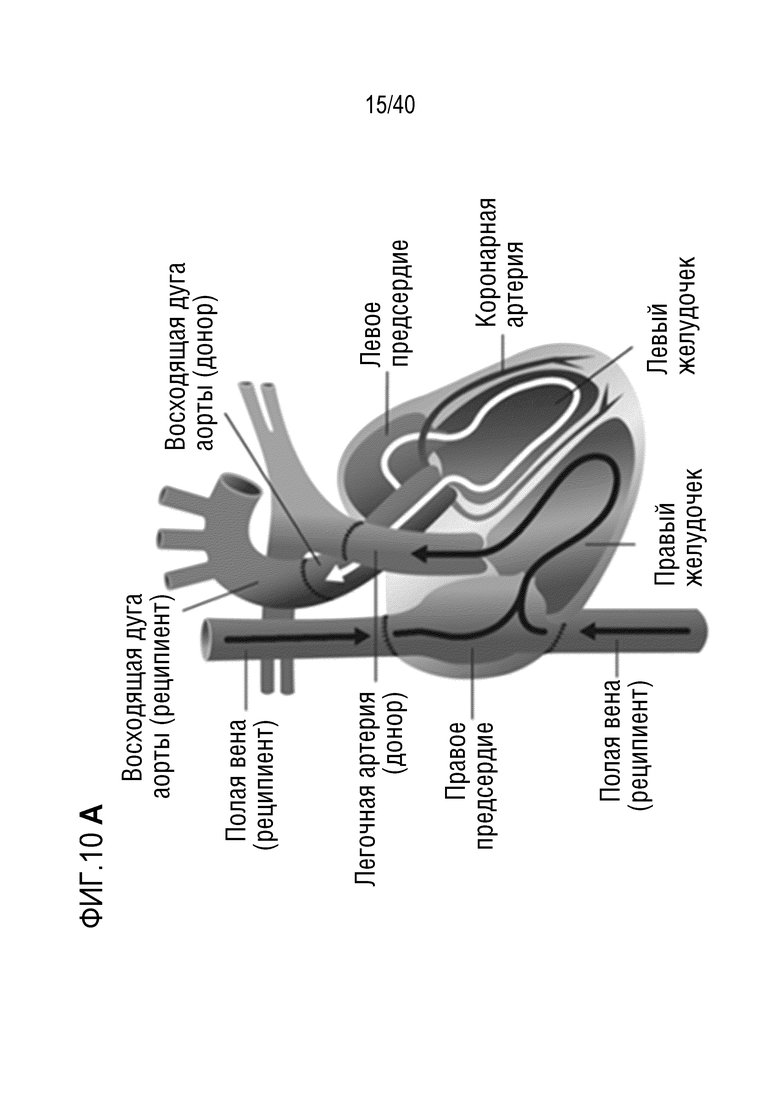
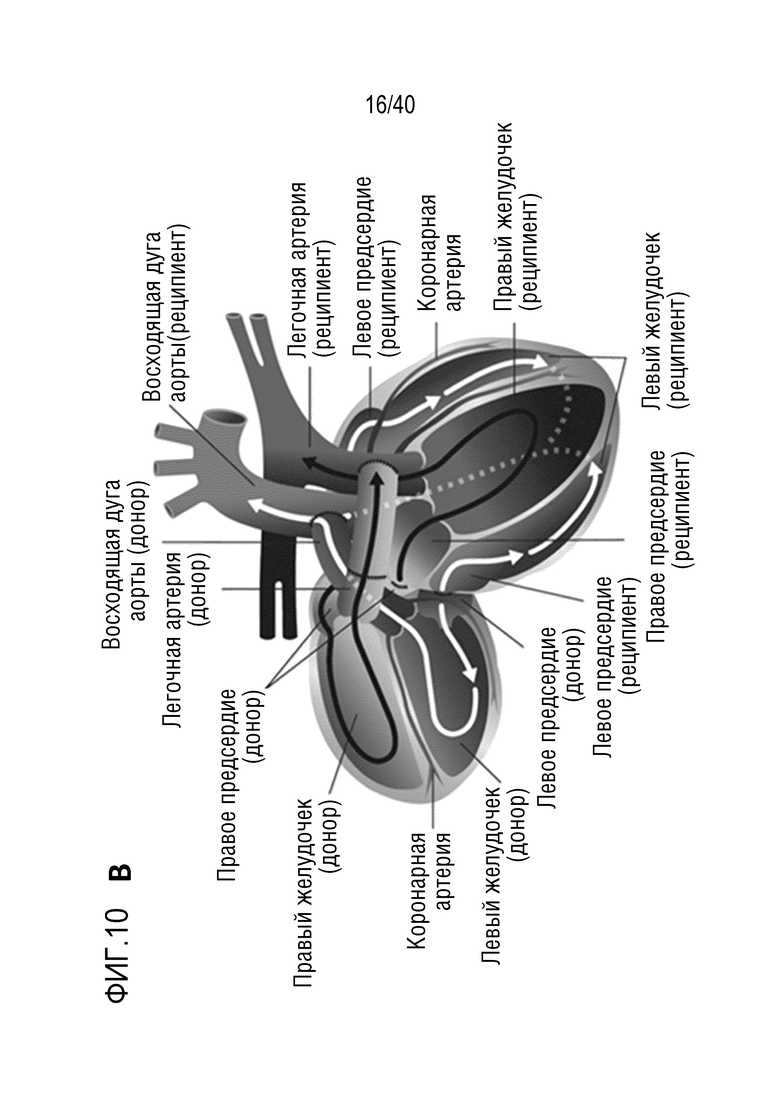
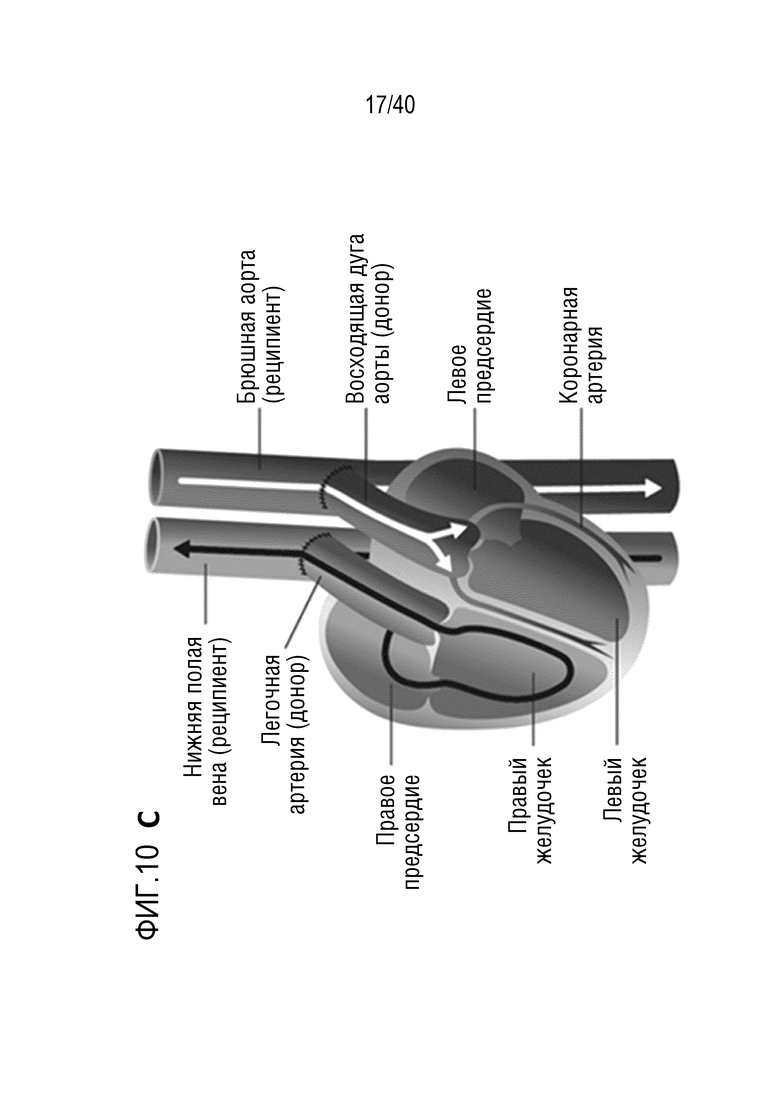

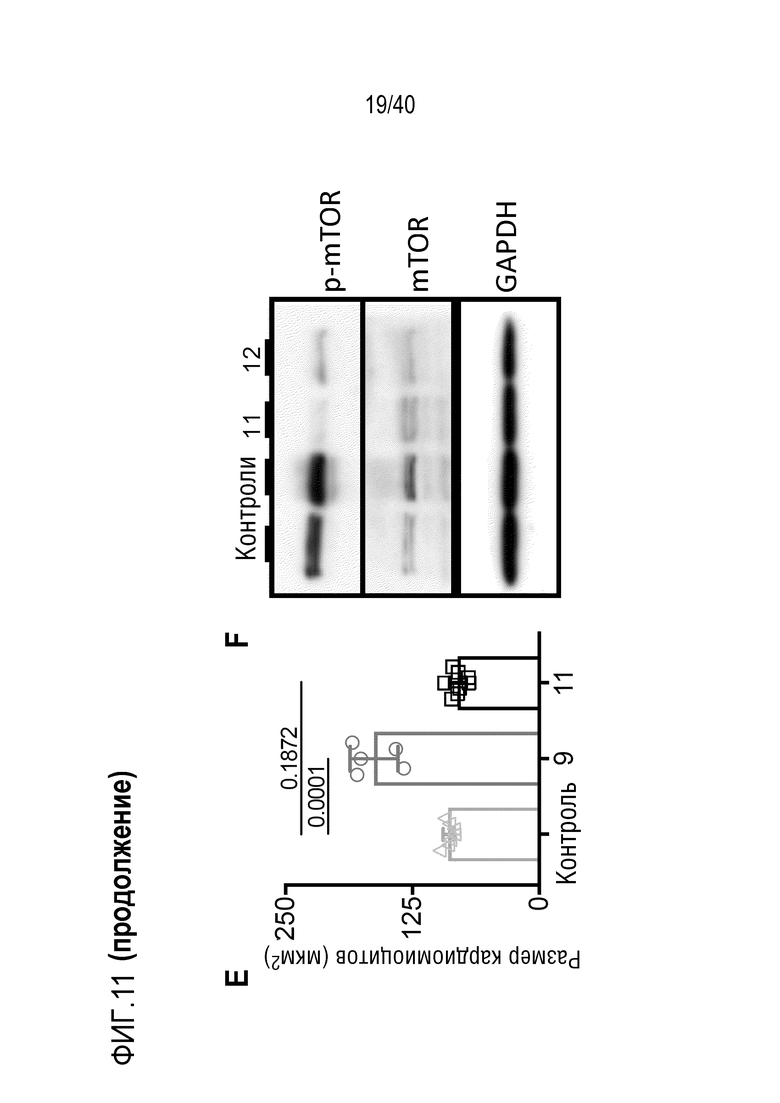
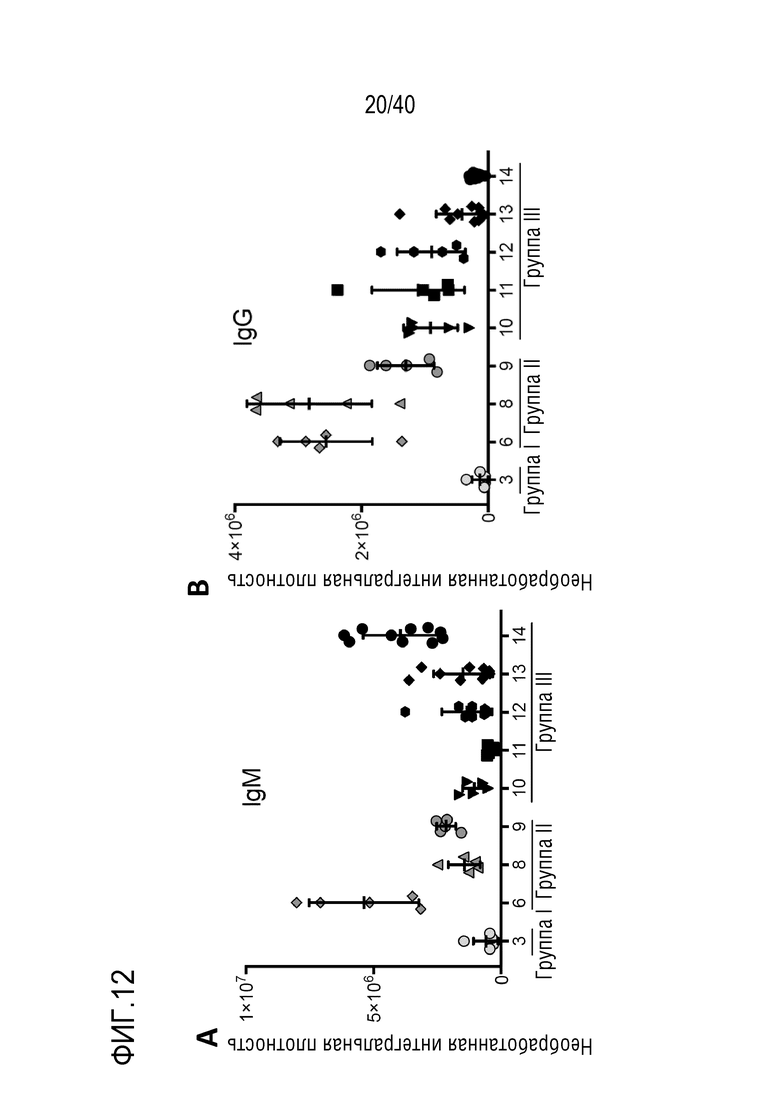
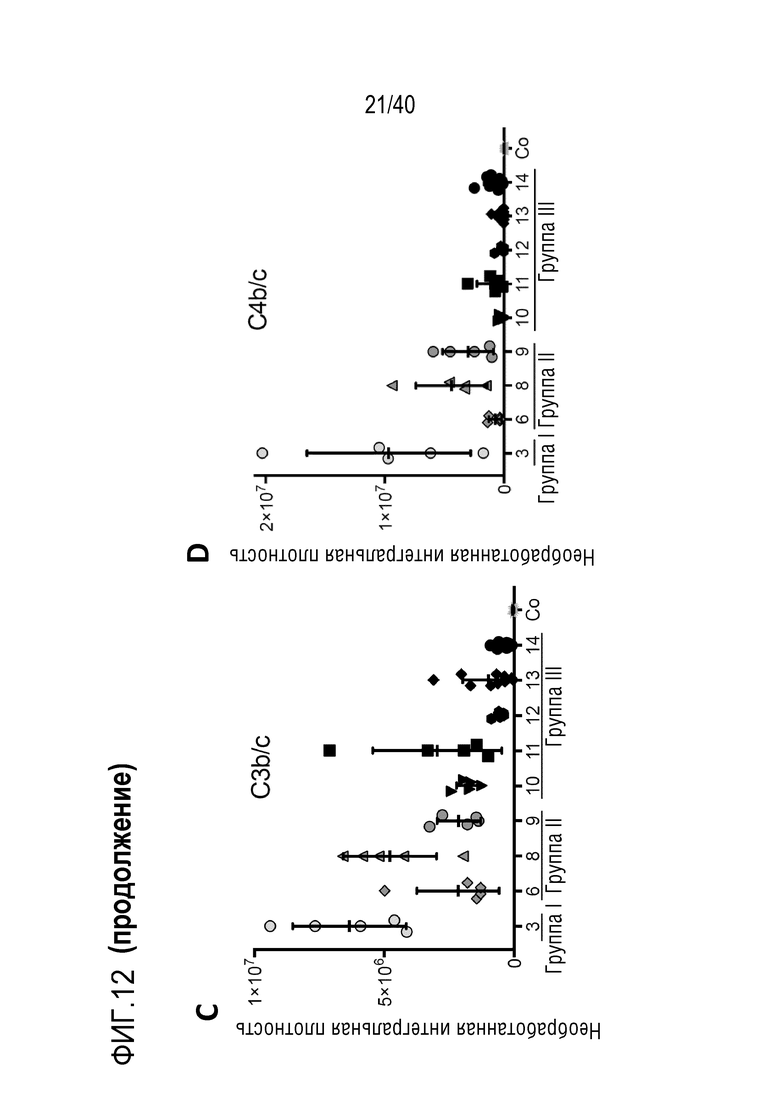


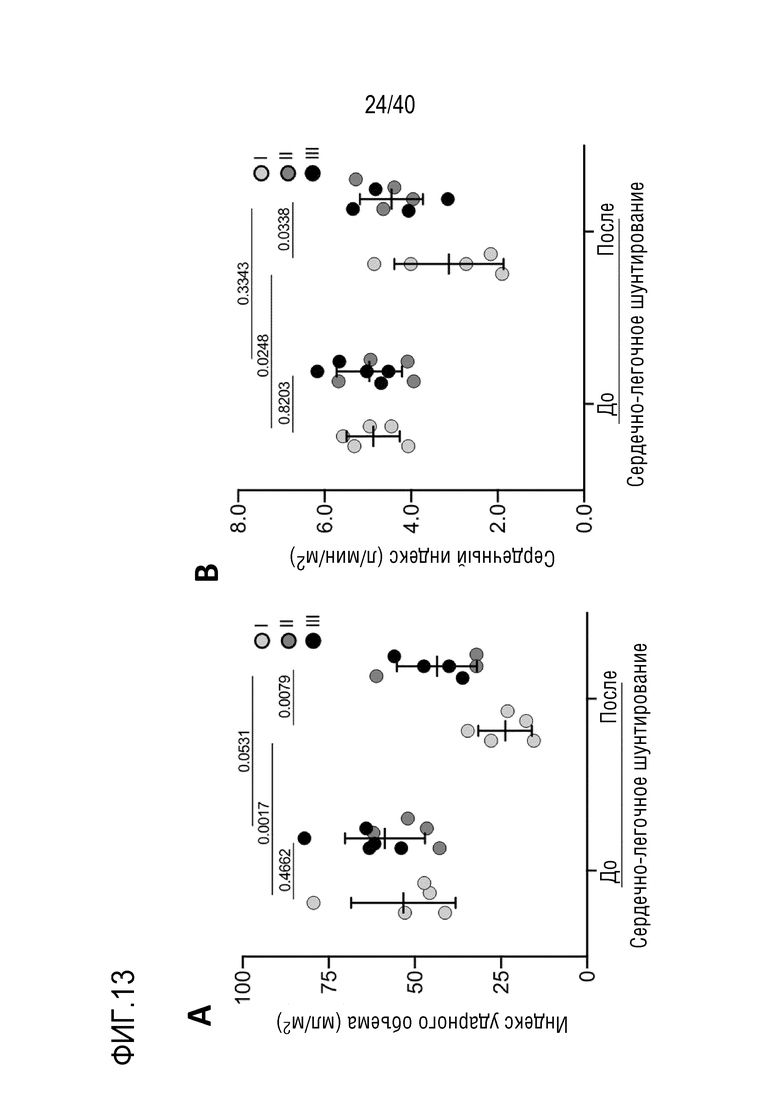
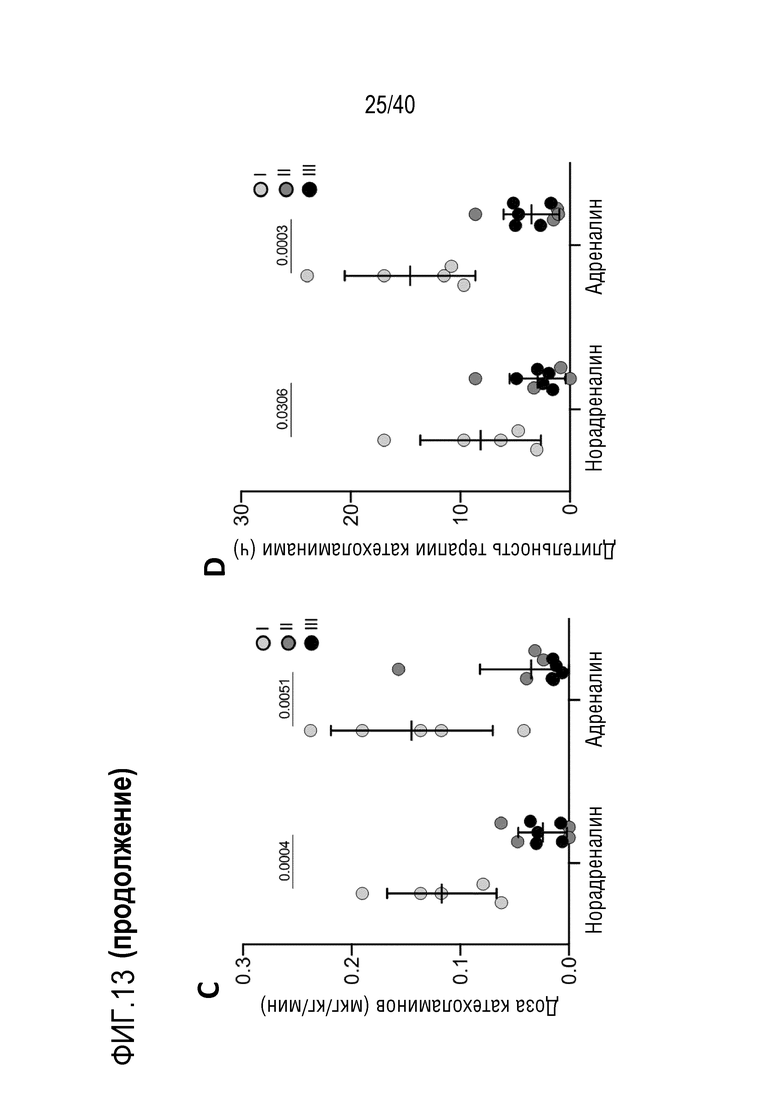
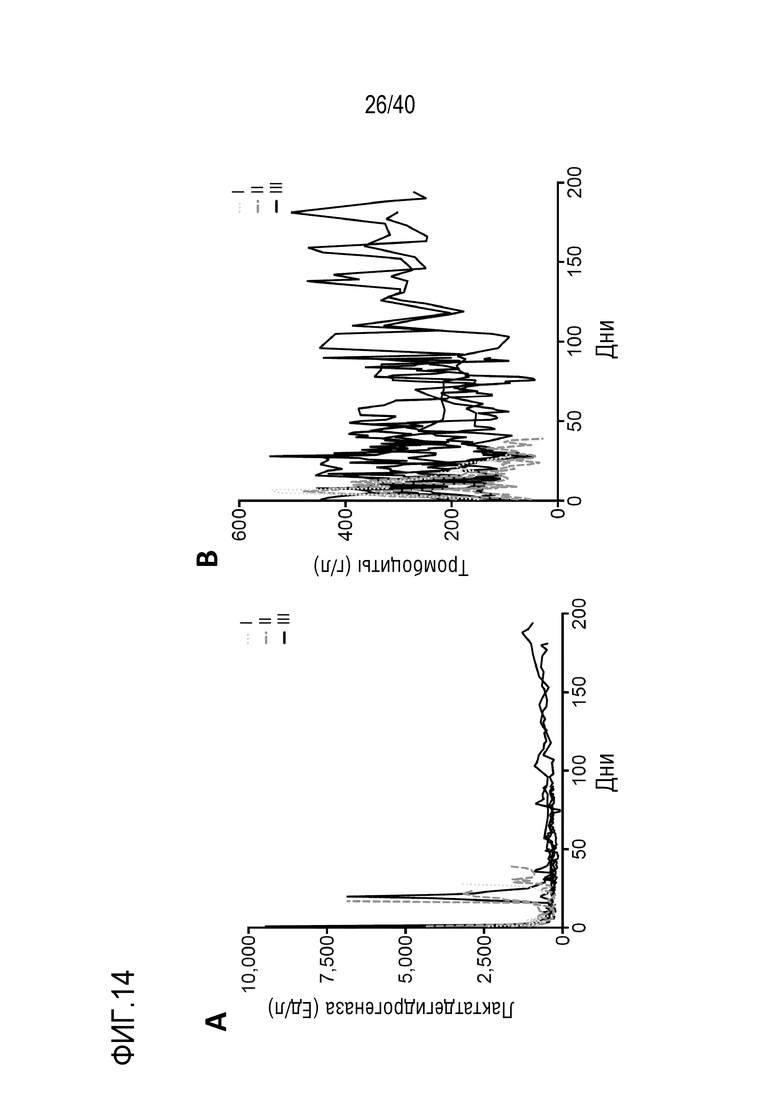
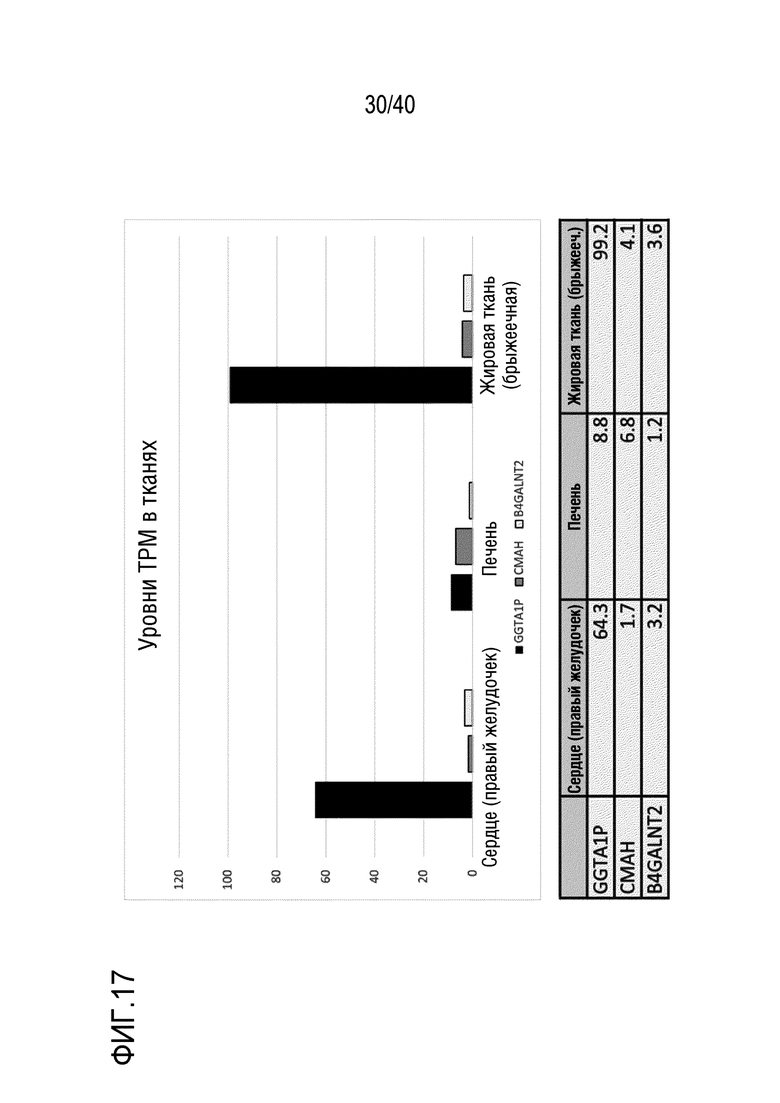
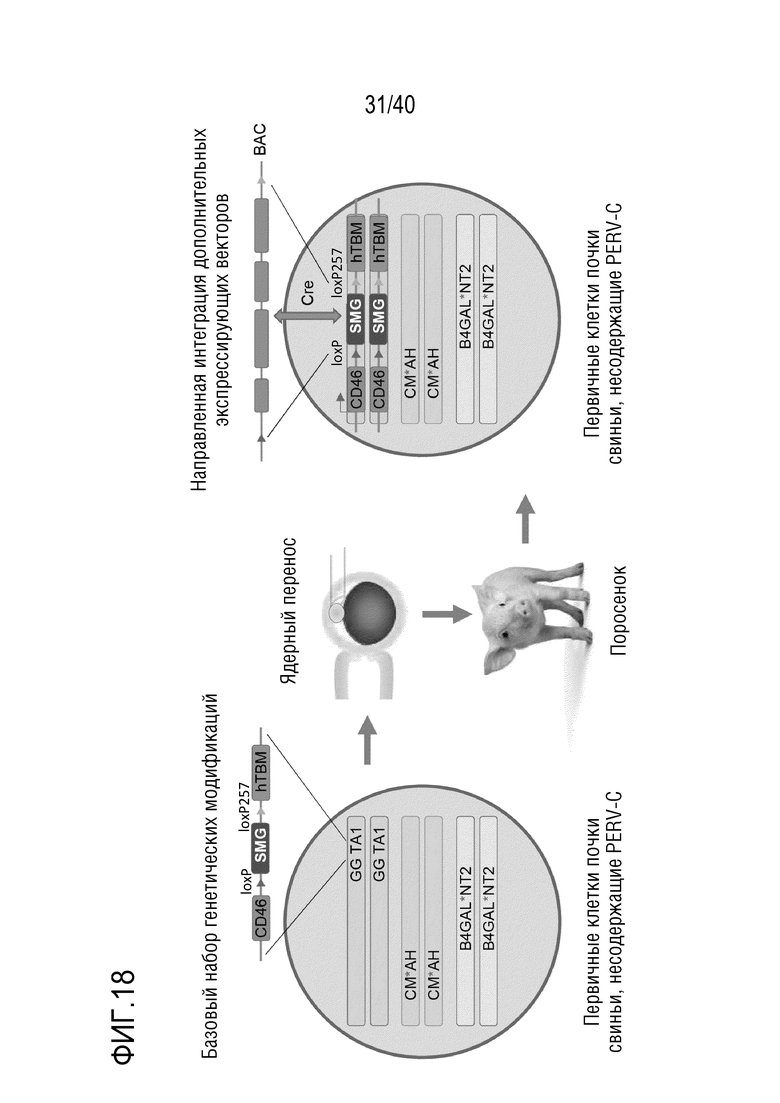
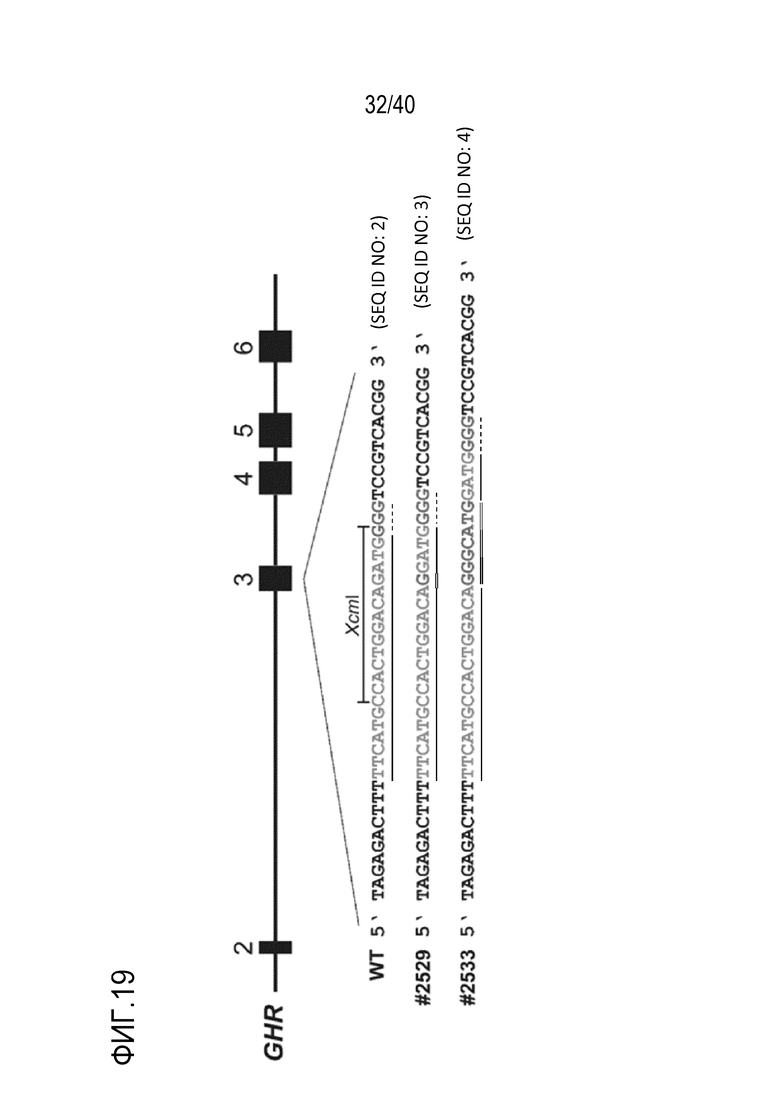
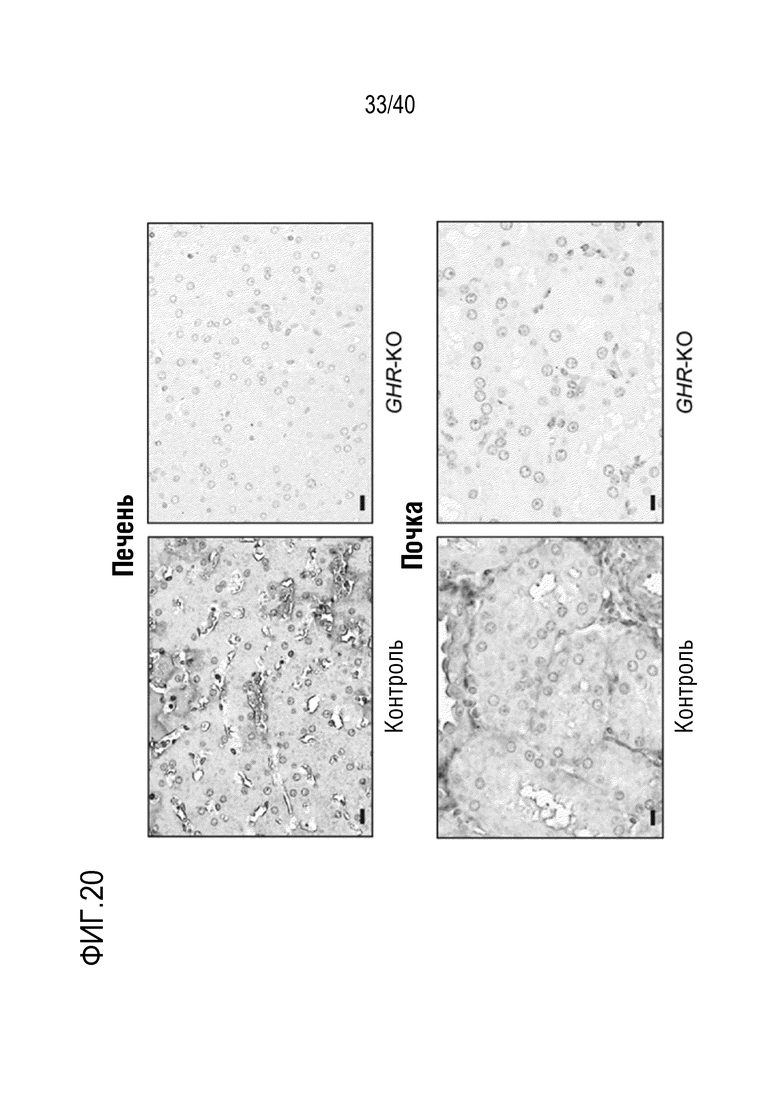
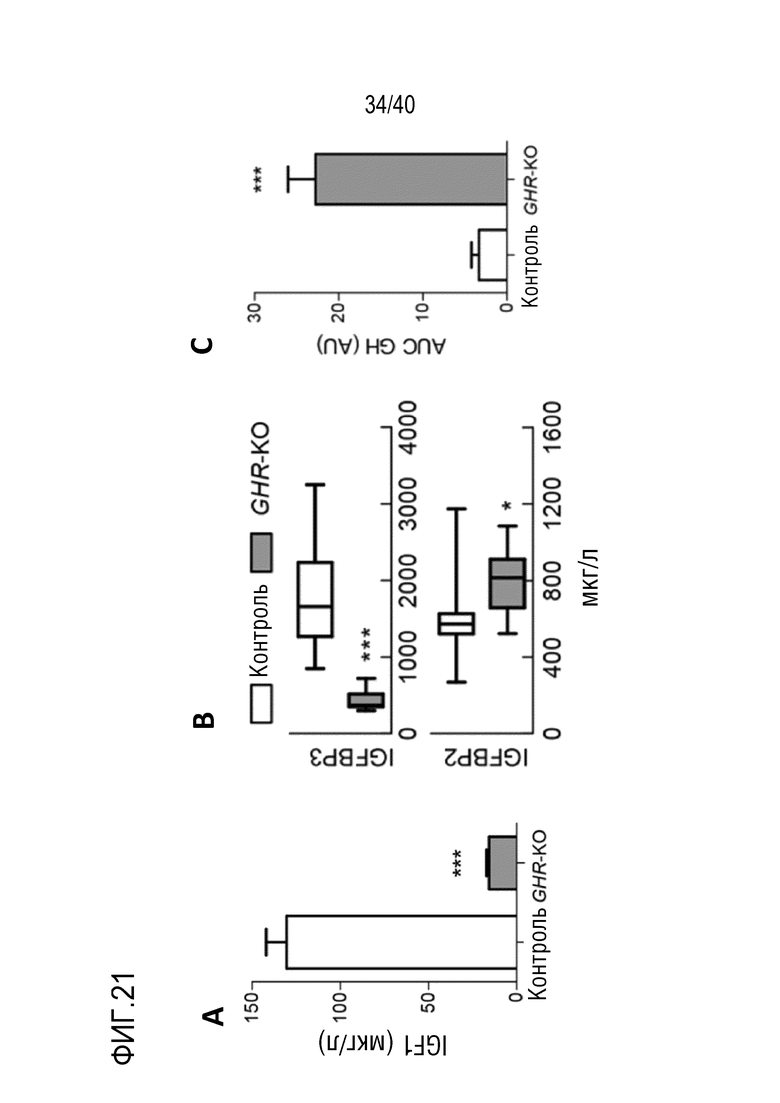
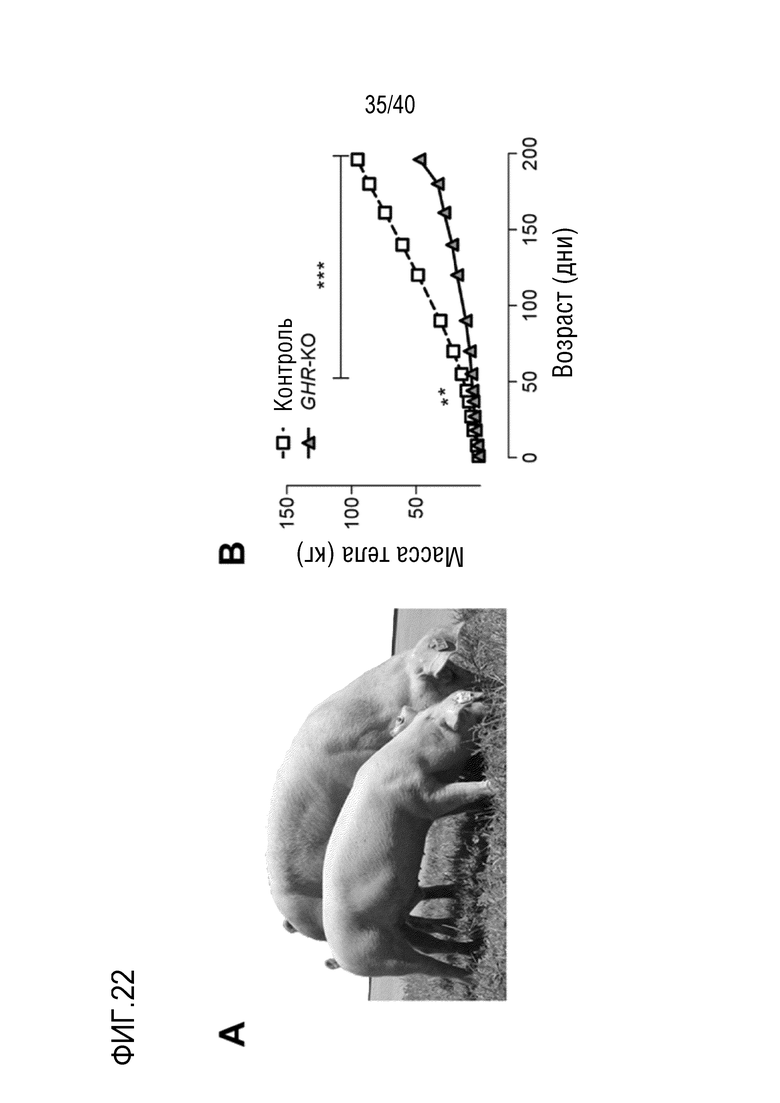
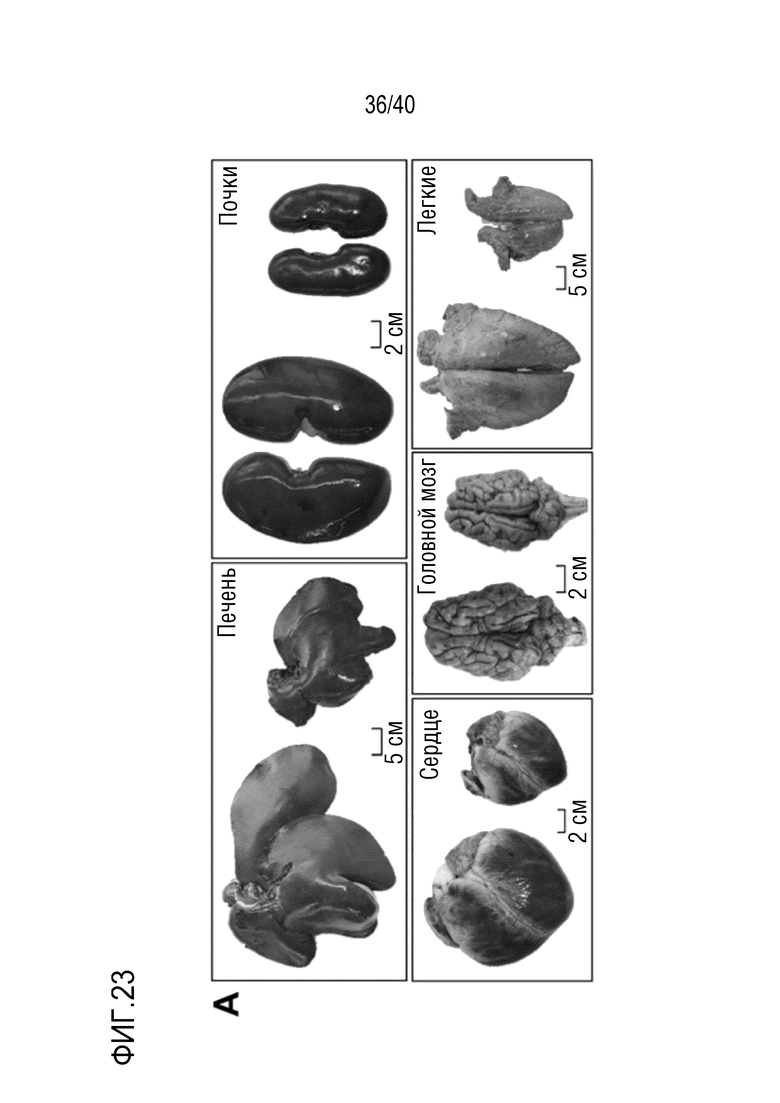
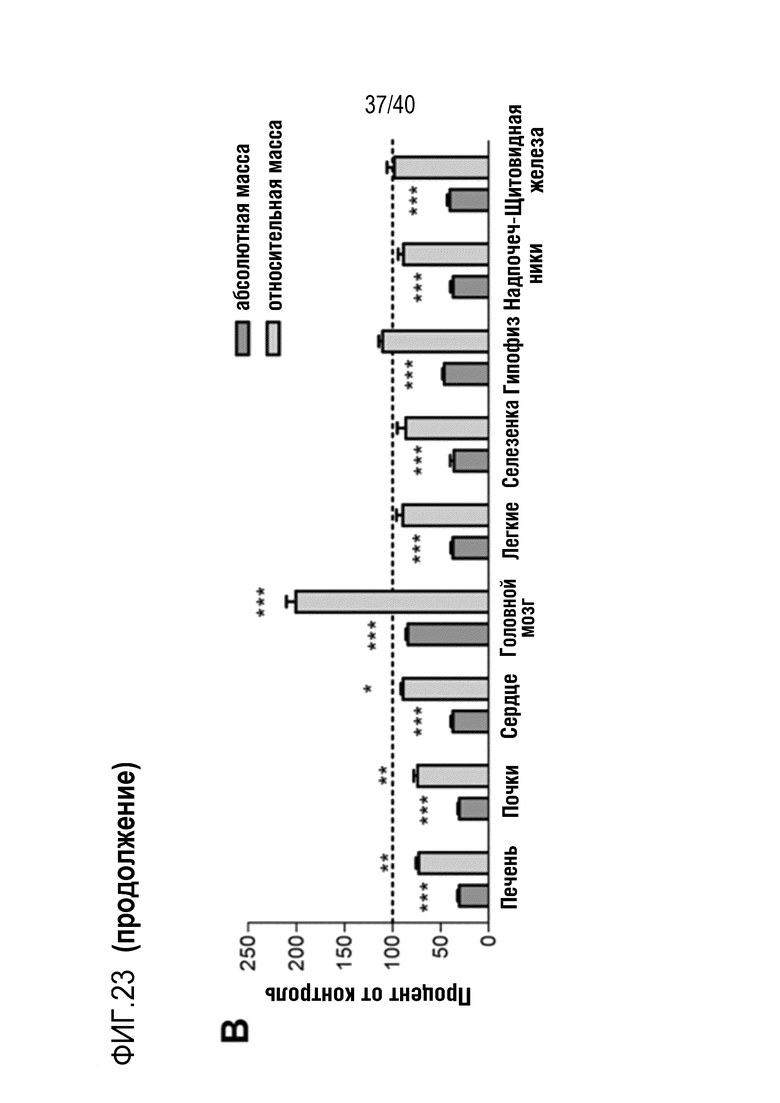
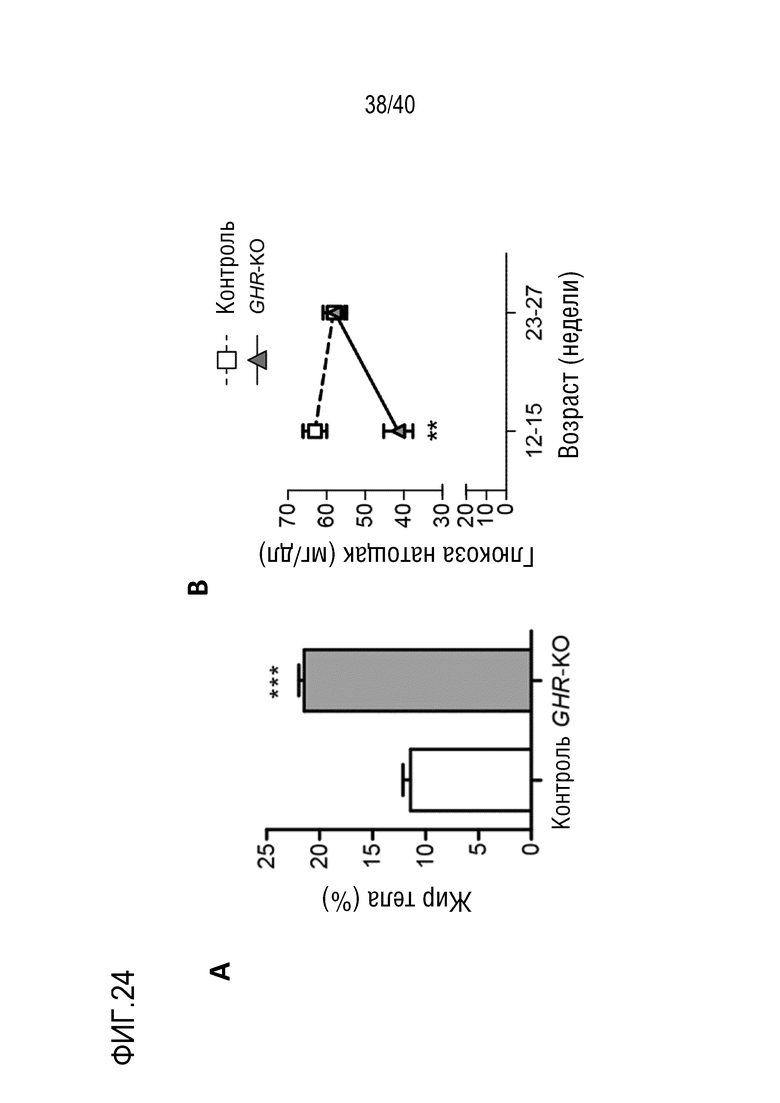
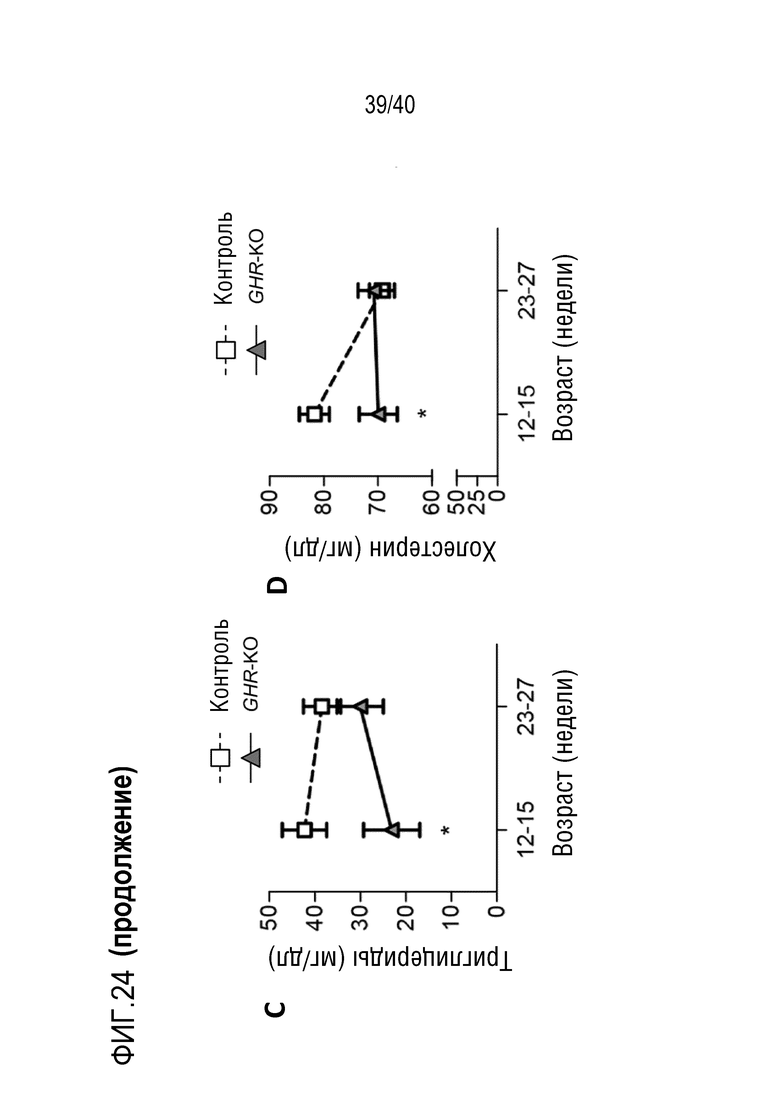

Группа изобретений относится к области медицины, а именно к трансплантологии и иммунологии, и предназначена для пролонгирования выживаемости организма-реципиента после трансплантации. Для пролонгирования выживаемости организма-реципиента, которому трансплантируют генетически модифицированное сердце, почку, легкое или печень из ксеногенного организма-донора, осуществляют введение иммуносупрессорного поддерживающего терапевтического средства организму-реципиенту в соответствии со схемой введения; введение одного или более антигипертензивных средств организму-реципиенту в соответствии со схемой введения; введение организму-реципиенту ингибитора mTOR в соответствии со схемой введения. Далее, снижают дозу глюкокортикоида, вводимого организму-реципиенту, по меньшей мере в 5 раз в пределах 5 дней после трансплантации. Организм-донор представляет собой примата. В других воплощениях представлено применение композиции, содержащей ингибитор mTOR, и применение композиции, содержащей одно или более антигипертензивных средств, в указанном способе. Использование группы изобретений обеспечивает пролонгирование выживаемости организма-реципиента после трансплантации вследствие предотвращения разрастания донорского органа в организме-реципиенте. 3 н. и 30 з.п. ф-лы, 25 ил., 5 табл., 7 пр.
1. Способ пролонгирования выживаемости организма-реципиента, которому трансплантируют генетически модифицированное сердце, почку, легкое или печень из ксеногенного организма-донора, где способ включает следующие стадии:
(iv) введение иммуносупрессорного поддерживающего терапевтического средства организму-реципиенту в соответствии со схемой введения, где схема введения включает введение одного или более иммуносупрессорных средств после трансплантации, где схема введения включает первое введение глюкокортикоида в пределах 1 дня после трансплантации;
(vi) введение одного или более антигипертензивных средств организму-реципиенту в соответствии со схемой введения, где схема введения включает введение одного или более антигипертензивных средств после трансплантации;
(vii) введение организму-реципиенту ингибитора mTOR в соответствии со схемой введения, где схема введения включает введение ингибитора mTOR после трансплантации; и
(viii) снижение дозы (мг/кг/сутки) глюкокортикоида, вводимого организму-реципиенту в соответствии со схемой введения на стадии (iv), по меньшей мере в 5 раз в пределах 5 дней после трансплантации;
где организм-донор представляет собой млекопитающего; и
где организм-реципиент представляет собой примата.
2. Способ по п.1, где способ дополнительно включает следующие стадии:
(ii) хирургическое извлечение сердца, почки, легкого или печени из организма-донора и консервация хирургически извлеченного сердца, почки, легкого или печени, соответственно, посредством неишемической консервации до трансплантации; и
(iii) трансплантацию хирургически извлеченного, законсервированного сердца, почки, легкого или печени организма-донора организму-реципиенту таким образом, что им функционально заменяют сердце, почку, легкое или печень, соответственно, организма-реципиента.
3. Способ по п.1 или 2, где способ дополнительно включает следующие стадии:
(i) введение иммуносупрессорного индукционного терапевтического средства организму-реципиенту в соответствии со схемой введения, где схема введения включает введение одного или более иммуносупрессорных средств перед трансплантацией; и
(v) введение противовоспалительного терапевтического средства организму-реципиенту в соответствии со схемой введения, где схема введения включает введение одного или более противовоспалительных средств после трансплантации.
4. Способ по любому из пп. 1-3,
где стадия (viii) включает снижение дозы (мг/кг/сутки) глюкокортикоида, вводимого организму-реципиенту в соответствии со схемой введения на стадии (iv), по меньшей мере в 10 раз в пределах 5 дней после трансплантации, и/или снижение дозы (мг/кг/сутки) глюкокортикоида, вводимого организму-реципиенту в соответствии со схемой введения на стадии (iv), по меньшей мере в 50 раз в пределах 20 дней после трансплантации.
5. Способ по любому из пп. 1-4, где способ предназначен для профилактики разрастания сердца, почки, легкого или печени.
6. Способ по любому из пп. 2-5, где функциональная замена на стадии (iii) является ортотопической заменой.
7. Способ по любому из пп. 1-6, где генетически модифицированное сердце, почка, легкое или печень имеет следующие генетические модификации:
a) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы;
b) инсерцию гена CD46 человека; и
c) инсерцию гена тромбомодулина человека.
8. Способ по любому из пп. 1-7, где организм-донор принадлежит к семейству Suidae, предпочтительно где организм-донор принадлежит к биологическому виду S. scrofa.
9. Способ по любому из пп.1-8, где организм-реципиент принадлежит семейству Cercopithecidae, предпочтительно, где организм-реципиент принадлежит роду Papio.
10. Способ по любому из пп.1-8, где организм-реципиент является человеком.
11. Способ по любому из пп. 2-10, где неишемическая консервация на стадии (ii) является неишемической перфузией сердца, почки, легкого или печени.
12. Способ по любому из пп.1-11, где схема введения на стадии (vi) включает введение одного или более антигипертензивных средств, выбранных из следующего списка: диуретики, блокаторы кальциевых каналов, ингибиторы ангиотензинпревращающего фермента (АПФ), антагонисты рецептора ангиотензина II, антагонисты адренергических рецепторов, вазодилататоры, ингибиторы ренина, антагонисты рецепторов альдостерона, агонисты альфа-2-адренергических рецепторов и блокаторы рецепторов эндотелина, предпочтительно, где схема введения включает введение одного или более антигипертензивных средств, выбранных из ингибиторов ангиотензинпревращающего фермента (АПФ) и антагонистов адренергических рецепторов, более предпочтительно - где схема введения включает введение эналаприла и/или метопролола тартрата, наиболее предпочтительно - где схема введения включает введение эналаприла и метопролола тартрата.
13. Способ по любому из пп.1-12, где схема введения на стадии (vii) включает введение ингибитора mTOR, выбранного из следующего списка: дактолисиб (BEZ235, NVP-BEZ235), рапамицин (сиролимус), эверолимус (RAD001), AZD8055, темсиролимус (CCI-779, NSC 683864), SF2523, 3BDO, PI-103, KU-0063794 I, торкиниб (PP242), ридафоролимус (дефоролимус, MK-8669), сапанисертиб (INK 128, MLN0128), аналог воксталисиба (SAR245409, XL765), торин 1, омипалисиб (GSK2126458, GSK458), OSI-027, PF-04691502, апитолисиб (GDC-0980, RG7422), GSK1059615, гедатолисиб (PF-05212384, PKI-587), WYE-354, вистусертиб (AZD2014), торин 2, WYE-125132 (WYE-132), BGT226 (NVP-BGT226), паломид 529 (P529), PP121, WYE-687, WAY-600, ETP-46464, GDC-0349, XL388, зотаролимус (ABT-578), CZ415, MHY1485, воксталисиб (XL765, SAR245409), хризофановая кислота и CC-223, LY3023414; предпочтительно, где схема введения включает введение темсиролимус.
14. Способ по любому из пп.1-13, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированным сердцем.
15. Способ по любому из пп.1-13, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированной почкой.
16. Способ по любому из пп.1-13, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированным легким.
17. Способ по любому из пп.1-13, где генетически модифицированное сердце, почка, легкое или печень является генетически модифицированной печенью.
18. Способ по любому из пп. 1-17, где ксеногенный организм-донор представляет собой генетически модифицированное млекопитающее, имеющее следующие генетические модификации:
a) инсерцию последовательности, кодирующей регуляторный белок системы комплемента человека, и
b) инсерцию последовательности, кодирующей тромбомодулин человека;
где последовательность, кодирующую регуляторный белок системы комплемента человека, и последовательность, кодирующую тромбомодулин человека, встраивают в локус гена альфа-1,3-галактозилтрансферазы, где по меньшей мере последовательность, кодирующая регуляторный белок системы комплемента человека, экспрессируется под контролем эндогенного промотора гена альфа-1,3-галактозилтрансферазы; и
где генетически модифицированное млекопитающее не является человеком.
19. Способ по п. 18, где у генетически модифицированного млекопитающего отсутствует экспрессия альфа-1,3-галактозилтрансферазы.
20. Способ по п. 18 или 19, где последовательность, кодирующая регуляторный белок системы комплемента человека, является последовательностью, кодирующей CD46 человека.
21. Способ по любому из пп. 18-20, где генетически модифицированное млекопитающее дополнительно имеет следующие генетические модификации:
c) гомозиготный нокаут гена CMAH, и
d) гомозиготный нокаут гена B4GALNT2.
22. Способ по любому из пп. 18-21, где генетически модифицированное млекопитающее имеет одну или более дополнительные генетические модификации.
23. Способ по п. 22, где одна или более дополнительных генетических модификаций представляют собой инсерции, и где одна или более инсерций находятся в локусе гена альфа-1,3-галактозилтрансферазы.
24. Способ по любому из пп. 18-23, где генетически модифицированное млекопитающее принадлежит биологическому виду S. scrofa.
25. Способ по любому из пп. 18-24, где генетически модифицированное млекопитающее не содержит эндогенный ретровирус C свиней (PERV-C).
26. Способ по любому из пп. 1-17, где ксеногенный организм-донор представляет собой организм-донор для трансплантации ксеногенных органов, и где организм-донор имеет следующую генетическую модификацию:
a) гомозиготный нокаут гена рецептора гормонов роста;
и где организм-донор является не являющимся человеком млекопитающим.
27. Способ по п. 26, где организм-донор дополнительно имеет следующие генетические модификации:
b) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы;
c) инсерцию последовательности, кодирующей CD46 человека; и
d) инсерцию последовательности, кодирующей тромбомодулин человека.
28. Способ по п. 26, где организм-донор дополнительно имеет следующие генетические модификации:
b) гомозиготный нокаут гена альфа-1,3-галактозилтрансферазы, гена CMAH и гена B4GALNT2; и
c) инсерции последовательности, кодирующей CD46 человека, последовательности, кодирующей CD55 человека, последовательности, кодирующей CD59 человека, последовательности, кодирующей гемоксигеназа 1, и последовательности, кодирующей A20.
29. Способ по п. 28, где организм-донор дополнительно имеет следующую генетическую модификацию:
d) инсерцию последовательности, кодирующей LEA29Y или PD-L1.
30. Способ по любому из пп. 26-29, где организм-донор принадлежит биологическому виду S. scrofa.
31. Способ по любому из пп. 26-30, где организм-донор не содержит эндогенный ретровирус C свиней (PERV-C).
32. Применение композиции, содержащей ингибитор mTOR, в способе по любому из пп. 1-31.
33. Применение композиции, содержащей одно или более антигипертензивных средств, в способе по любому из пп. 1-31.
| WO 2010083298 A1, 22.07.2010 | |||
| GORAN B | |||
| KLINTMALM et al | |||
| The Role of mTOR Inhibitors in Liver Transplantation: Reviewing the Evidence Journal of Transplantation, 2014, 45 pages - http://dx.doi.org/10.1155/2014/845438 | |||
| YAMADA K | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2023-05-03—Публикация
2019-03-29—Подача