ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к таблетке и к способу ее приготовления.
УРОВЕНЬ ТЕХНИКИ
При гипертонии важной задачей является предотвращение возникновения заболеваний коронарных артерий и сердечно-сосудистых осложнений, таких как представляющие опасность для жизни инсульт, сердечная недостаточность, инфаркт миокарда и другие подобные заболевания, путем поддержания артериального давления в диапазоне нормальных значений, а не проведение лечения самого артериального давления. Поэтому, больше внимания следует уделять величине артериального давления, которое должно быть ниже, чем наблюдаемое постоянно у пациента повышенное давление.
Как правило, гипертония у пациентов часто сопровождается другими типами сердечно-сосудистых заболеваний, включая гиперлипидемию, вследствие чего очень часто пациентам назначают комбинацию двух или более лекарственных средств. Кроме того, для этих пациентов необходимо принимать лекарственные средства в течение длительного периода времени. Поэтому, следует уделять больше внимания подбору терапевтических средств. В силу этого, возникает необходимость в снижении потенциальных побочных эффектов, возникающих в результате длительного применения лекарственных средств, путем одновременного применения лекарственных средств с различными механизмами и уменьшения количества одного применяемого лекарственного средства, а не просто путем выбора одного лекарственного средства.
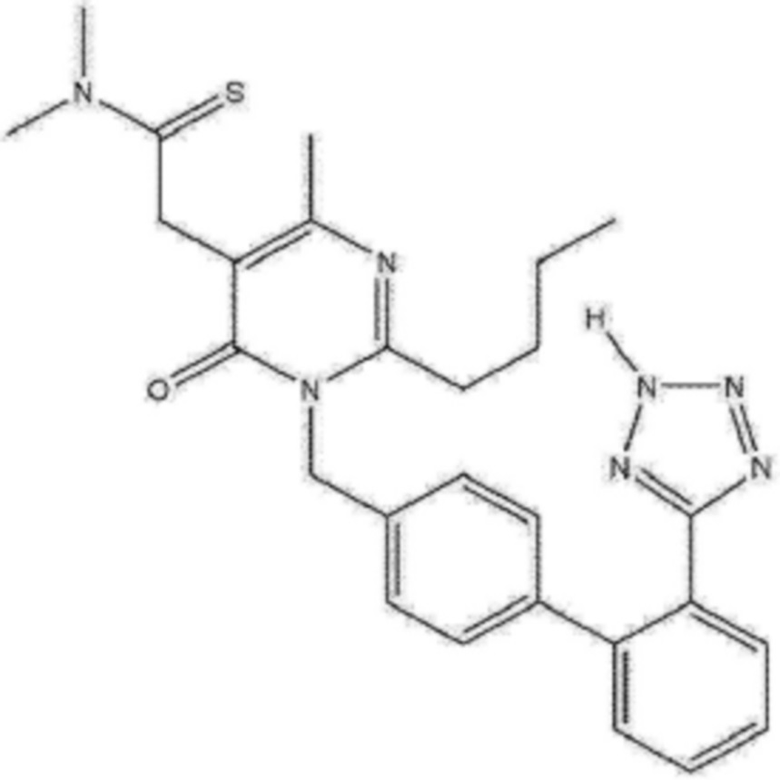
Фимасартан, представленный формулой 1 ниже, известен в качестве антагониста рецепторов ангиотензина II, созданного для лечения гипертензии и других медицинских проявлений (патентный документ Korean Registered Patent No. 10-1058284). Фимасартан представляет собой 2-н-бутил-5-диметиламинотио-карбонилметил-6-метил-3-[[2'-(1H-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3H)-он, который с точки зрения молекулярной химии относят к непептидному соединению. Фимасартан имеет эмпирическую формулу C27H30N7OS и молекулярную массу 501,65. Фимасартан производится промышленностью Южной Кореи и одобрен к применению в качестве лекарственного средства под названием фимасартана калия тригидрат.
[Формула 1]
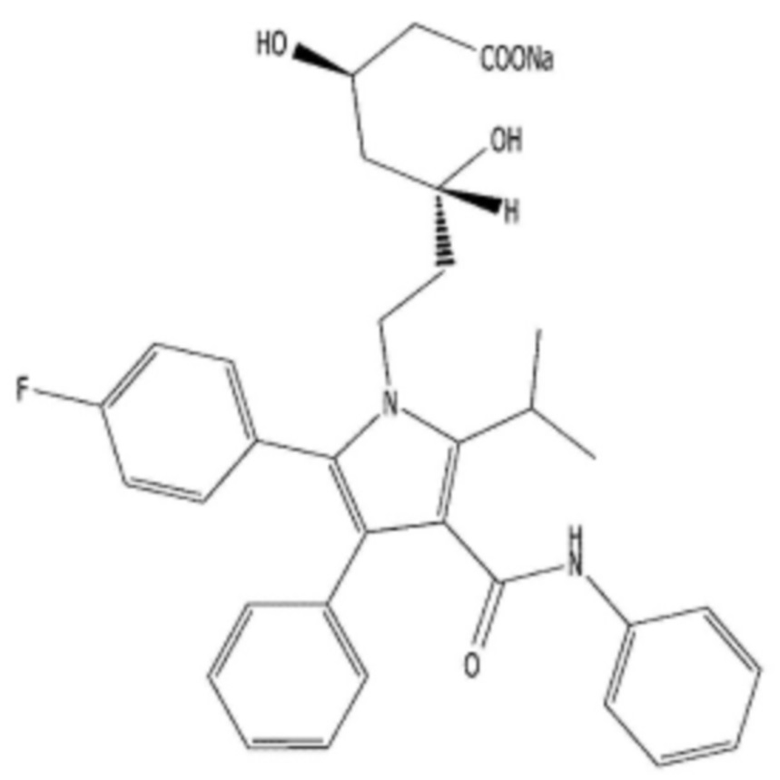
Что касается аторвастатина, представленного формулой 2 ниже, то он является селективным и конкурентным ингибитором HMG-CoA редуктазы. В форме типичной соли аторвастатина, кальциевой соли аторвастатина (химическое название: [R-(R*,R*)]-2-(4-фторфенил)-β,δ-дигидрокси-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1H-пиррол-1-гептановой кислоты кальциевая соль (2:1)), он известен в качестве гиполипидемического средства, которое понижает концентрацию холестерина липопротеинов низкой плотности, и применяется при лечении гиперлипидемии. Кроме того, известно, что аторвастатин кальция снижает смертность, обусловленную сердечно-сосудистыми заболеваниями, а также инсультом.
[Формула 2]
Для более эффективного лечения сердечно-сосудистых заболеваний, в том числе гипертензии и других подобных сердечно-сосудистых заболеваний, представляется перспективным применение таблеток, содержащих фимасартан и аторвастатин, имеющих различные описанные выше механизмы действия. Однако при осуществлении описанного выше процесса таблетирования возникают нарушение технологического режима, такое как прилипание аторвастатина.
В связи с этим, существует необходимость в разработке технологии приготовления таблетки, содержащей фимасартан и аторвастатин, позволяющей проводить более эффективно лечение сердечно-сосудистых заболеваний, в том числе гипертензии и других подобных сердечно-сосудистых заболеваний, которая исключала бы возникновение нарушения в процессе таблетирования аторвастатина.
[Материалы, использованные при экспертизе заявки]
[Непатентный документ]
(Непатентный документ 1) Compatibility study of Atorvastatin Calcium and Telmisartan with selected excipients and formulation of a bilayer tablet using box behnkein design, Bajracharya et. al., Am. J. PharmTech Res. 2015; 5(3) ISSN: 2249-3387
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая задача
Настоящее изобретение относится к таблетке со значительно улучшенными характеристиками таблетирования в процессе таблетирования с фимасартаном в результате корректировки распределения частиц по размеру гранул аторвастатина до конкретной величины или более и к способу приготовления такой таблетки.
Конкретно, в настоящем изобретении предлагается таблетка, которая включает: порцию гранул фимасартана, содержащих фимасартан, его фармацевтически приемлемую соль, гидрат или сольват и фармацевтически приемлемую добавку, и порцию гранул аторвастатина, содержащих аторвастатин, его фармацевтически приемлемую соль, гидрат или сольват и фармацевтически приемлемую добавку, где порция гранул фимасартана и порция гранул аторвастатина, присутствующие в таблетке, разделены друг от друга.
Кроме того, в настоящем изобретении предлагается таблетка, которая включает: первый слой, включающий гранулы, содержащие фимасартан, его фармацевтически приемлемую соль, гидрат или сольват и фармацевтически приемлемую добавку; и второй слой, включающий гранулы, содержащие аторвастатин, его фармацевтически приемлемую соль, гидрат или сольват и фармацевтически приемлемую добавку, где гранулы второго слоя характеризуются распределением частиц по размеру с величиной D50 80 мкм или более.
Кроме того, в настоящем изобретении предлагается способ приготовления таблетки, который включает: (S1) приготовление первого слоя, включающего гранулы, содержащие фимасартан, его фармацевтически приемлемую соль, гидрат или сольват и фармацевтически приемлемую добавку; (S2) приготовление второго слоя, включающего гранулы, содержащие аторвастатин, его фармацевтически приемлемую соль, гидрат или сольват и фармацевтически приемлемую добавку; и (S3) приготовление двухслойной таблетки путем таблетирования первого и второго слоев.
Кроме того, в настоящем изобретении предлагается фармацевтическая композиция для приготовления таблетки.
Кроме того, в настоящем изобретении предлагается способ предотвращения или лечения сердечно-сосудистых заболеваний, который включает введение терапевтически эффективного количества таблетки млекопитающим, в том числе человеку.
Кроме того, в настоящем изобретении предлагается применение таблетки в производстве препарата для лечения сердечно-сосудистых заболеваний.
Кроме того, в настоящем изобретении предлагается применение таблетки для лечения сердечно-сосудистых заболеваний.
Решение технической задачи
Для решения описанных выше задач, в настоящем изобретении была разработана технология приготовления таблетки, содержащей активный ингредиент фимасартан и активный ингредиент аторвастатин, путем решения проблемы нарушения процесса таблетирования аторвастатина в процессе таблетирования с фимасартаном с применением метода контроля размера частиц гранул аторвастатина, и поскольку отклонение массы аторвастатина находится в соответствующем диапазоне, таблетку можно приготовить в соответствии с заданной массой, и, таким образом, было подтверждено, что таблетка характеризуется высокой однородностью содержания.
Далее настоящее изобретение будет описано более подробно.
Таблетка
В настоящем изобретении предлагается таблетка, которая включает: порцию гранул фимасартана, содержащих фимасартан, его фармацевтически приемлемую соль, гидрат или сольват и фармацевтически приемлемую добавку, и порцию гранул аторвастатина, содержащих аторвастатин, его фармацевтически приемлемую соль, гидрат или сольват и фармацевтически приемлемую добавку, где порция гранул фимасартана и порция гранул аторвастатина, присутствующие в таблетке, разделены друг от друга.
В настоящем изобретении предлагается таблетка, которая включает: первый слой, включающий гранулы, содержащие фимасартан, его фармацевтически приемлемую соль, гидрат или сольват, и фармацевтически приемлемую добавку; и второй слой, включающий гранулы, содержащие аторвастатин, его фармацевтически приемлемую соль, гидрат или сольват, и фармацевтически приемлемую добавку, где гранулы второго слоя характеризуются распределением частиц по размеру с величиной D50 80 мкм или более.
При приготовлении комбинированного препарата с фимасартаном, аторвастатин очень сложно вводить в состав препарата. Поскольку аторвастатин имеет низкую стабильность, в качестве стабилизатора добавляют большое количество измельченного осажденного карбоната кальция. Это обуславливает нарушение технологии таблетировании в процессе таблетирования фимасартана и аторвастатина в двухслойную таблетку, что приводит к нарушению процесса формования из-за недостатка некоторого количества композиции. В случае приготовления таблеток в промышленном масштабе, также предполагается, что такое нарушение технологии таблетирования может быть причиной остановки оборудования, что обуславливает сложность осуществления производства как такового. Кроме того, когда на поверхности таблетки делают оттиск идентификационного кода, нанесение такого оттиска может быть пропущено в результате нарушения технологии таблетирования, что становится серьезной проблемой. Кроме того, когда такое прилипание к поверхности пуансона происходит в процессе реального производства, сразу после этого возникает необходимость в остановке производства и удалении материала, прилипшего к поверхности пуансона. Если в процессе производства эта проблема возникает часто, то она может перерасти в различные проблемы, такие как снижение эффективности производства и снижение качества из-за увеличения количества бракованных таблеток (снижение выхода). В некоторых случаях, для решения этой проблемы нарушения процесса таблетирования используют смазочные материалы, такие как тальк, но при добавлении большего количества смазочного материала может уменьшиться пластичность самой композиции, что приведет к снижению твердости или абразивному повреждению таблеток. Следовательно, этот метод не позволяет непосредственно решить данную проблему.
Кроме того, можно предотвратить нарушение технологии таблетирования путем полировки поверхности пуансона и матрицы, используемых в процессе таблетирования. Однако, поскольку эффект полировки действует не долго, может произойти нарушение технологии таблетирования в результате абразивного износа, и, следовательно, этот метод не позволяет непосредственно решить данную проблему.
Поэтому, для решения указанной выше проблемы, в настоящем изобретении предлагается корректировать распределение частиц по размеру гранул аторвастатина, содержащихся во втором слое, до определенной величины или более, что позволяет легко осуществлять процесс таблетирования для приготовления комбинированного лекарственного препарата с фимасартаном. Кроме того, это позволяет поддерживать высокую степень однородности содержания каждого компонента, содержащегося в каждой таблетке, и, следовательно, экономически эффективно осуществлять их производство в массовом масштабе.
В настоящем изобретении термин, "фимасартан", который представляет собой 2-н-бутил-5-диметиламинотиокарбонилметил-6-метил-3-[[2'-(1H-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4-(3H)-он, представленный ниже формулой 1, относится к антагонисту рецепторов ангиотензина II, разработанному для лечения гипертензии и других медицинских проявлений.
[Формула 1]

В настоящем изобретении, термин "аторвастатин", который представляет собой гиполипидемическое средство для снижения концентрации холестерина липопротеинов низкой плотности, представленного формулой 2 ниже, представляет собой селективный и конкурентный ингибитор HMG-CoA редуктазы, применяемый при лечении гиперлипидемии.
[Формула 2]

В настоящем изобретении, термин "фармацевтически приемлемое" относится к некоему веществу, которое является физиологически приемлемым и обычно не вызывает аллергической реакции, такой как желудочно-кишечные расстройства и головокружение, или другие подобные им реакции, при введении человеку, и термин "соль" обозначает соль присоединения кислоты, образованную фармацевтически приемлемой свободной кислотой.
В примерах настоящего изобретения, фармацевтически приемлемая соль фимасартана может быть выбрана из группы, состоящей из соли неорганического иона, соли неорганической кислоты, соли органической кислоты, соли сульфоновой кислоты, соли аминокислот и соли амина. В частности, фармацевтически приемлемая соль фимасартана может представлять собой соль неорганического иона, образованную с кальцием, калием, натрием, магнием или другими подобными ионами; соль неорганической кислоты, образованной с соляной кислотой, азотной кислотой, фосфорной кислотой, бромной кислотой, йодной кислотой, хлорной кислотой, серной кислотой или с другими подобными кислотами; соли органических кислот, образованные с уксусной кислотой, трифторуксусной кислотой, лимонной кислотой, малеиновой кислотой, янтарной кислотой, щавелевой кислотой, бензойной кислотой, винной кислотой, фумаровой кислотой, пропионовой кислотой, лимонной кислотой, молочной кислотой, гликолевой кислотой, глюконовой кислотой, галактуроновой кислотой, глутаминовой кислотой, глутаровой кислотой, глюкуроновой кислотой, аспарагиновой кислотой, аскорбиновой кислотой, угольной кислотой, ванилиновой кислотой, миндальной кислотой, слизевой кислотой, памовой кислотой, пантотеновой кислотой, янтарной кислотой или с другими подобными кислотами; соли сульфоновой кислотой, образованные с метансульфоновой кислотой, этансульфоновой кислотой, этандисульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой, камфорсульфоновой кислотой, нафталиндисульфоновой кислотой, нафталинсульфоновой кислотой или с другими подобными кислотами; соли аминокислот, образованные с глицином, аргинином, лизином и или с другими подобными аминокислотами; соли аминов, образованные с триметиламином, меглумином, триэтиламином, аммиаком, пиридином, пиколином, холином или с другими подобными аминами; или другие подобные соли, но подразумеваемые в настоящем изобретении типы солей не ограничиваются перечисленными солями. В частности, фармацевтически приемлемая соль фимасартана может представлять собой калиевую соль фимасартана, соль фимасартана и толуолсульфоновой кислоты или аммиачную соль фимасартана, более конкретно, калиевую соль фимасартана.
В одном варианте осуществления настоящего изобретения, фармацевтически приемлемая соль аторвастатина может представлять собой соль неорганического иона, образованную с кальцием, стронцием, натрием, калием, магнием, аммонием и с другими подобными ионами; соль неорганической кислоты, образованную с соляной кислотой, азотной кислотой, фосфорной кислотой, бромной кислотой, йодной кислотой, хлорной кислотой, серной кислотой или с другими подобными кислотами; и другие подобные соли, но подразумеваемые в настоящем изобретении типы солей не ограничиваются перечисленными солями. В частности, фармацевтически приемлемая соль аторвастатина может представлять собой кальциевую соль аторвастатина.
В настоящем изобретении термин "гидрат" относится к комбинации активных ингредиентов и воды за счет нековалентной межмолекулярной силы, содержащей стехиометрическое или нестехиометрическое количество воды. В частности, гидрат может содержать воду при соотношении от приблизительно 0,25 до приблизительно 10 моль на 1 моль активных ингредиентов, более конкретно, приблизительно 0,5, приблизительно 1, приблизительно 1,5, приблизительно 2, приблизительно 3, приблизительно 5 моль и так далее.
В одном варианте осуществления настоящего изобретения гидрат фимасартана может представлять собой любой гидрат, выбранный из группы, состоящей из тригидрата фимасартана калия, тригидрата гидрохлорида фимасартана, тригидрата фимасартана кальция, тригидрата сульфата фимасартана, тригидрата адипата фимасартана, тригидрата камзилата фимасартана и тригидрата безилата фимасартана, в частности, но этим не ограничивая, гидрат фимасартана может представлять собой тригидрат фимасартана калия.
В примерах настоящего изобретения, гидрат фимасартана или его фармацевтически приемлемой соли может представлять собой моногидрат или тригидрат, в частности, моногидрат или тригидрат фимасартана калия, и более конкретно, тригидрат фимасартана калия.
В одном варианте осуществления настоящего изобретения, гидрат аторвастатина или его фармацевтически приемлемой соли может представлять собой тригидрат, в частности, но этим не ограничивая, тригидрат аторвастатина кальция.
В настоящем изобретении термин "сольват" относится к комбинации активных ингредиентов и растворителя за счет нековалентной межмолекулярной силы, содержащей стехиометрическое или нестехиометрическое количество растворителя. Предпочтительный растворитель может быть летучим, нетоксичным и может быть введен людям в очень небольшом количестве. Например, он может представлять собой метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, 1-ацетат??, ацетон, уксусную кислоту, анизол, тетрагидрофуран, метилацетат, этилацетат, пропилацетат, изопропилацетат, изобутилацетат, н-бутилацетат, диметилсульфоксид, пентан, гептан и другие подобные растворители, но сольват по настоящему изобретению не ограничивается сольватами с этими растворителями. В частности, гидрат может содержать воду в соотношении от приблизительно 0,25 до приблизительно 10 моль на 1 моль активных ингредиентов, более конкретно, приблизительно 0,5, приблизительно 1, приблизительно 1,5, приблизительно 2, приблизительно 3, приблизительно 5 моль и другие подобные соотношения.
В настоящем изобретении, термин "приблизительно" относится к 10% отклонению от указанной величины (например, к 1 моль%, 2 моль%, 3 моль% и так далее) или к 10% отклонению как от нижнего, так и от верхнего пределов, диапазона числовых значений. Например, "приблизительно 1 моль" относится к диапазону от 0,9 до 1,1 моль.
В настоящем изобретении, термин "гранула" относится к более мелкой первичной частице или твердой частице, образованной из первичной частицы. Термин "гранула, содержащая фимасартан, его фармацевтически приемлемую соль, гидрат или сольват и фармацевтически приемлемую добавку" относится к первичной частице, образованной смесью фимасартана, его фармацевтически приемлемой соли, гидрата или сольвата и фармацевтически приемлемой добавки, или к твердой частице, образованной из первичной частицы. Термин "гранула, содержащая аторвастатин, его фармацевтически приемлемую соль, гидрат или сольват и фармацевтически приемлемую добавку" относится к первичной частице, образованной из смеси аторвастатина, его фармацевтически приемлемой соли, гидрата или сольвата и фармацевтически приемлемой добавки, или к твердой частице, образованной из первичной частицы.
В настоящем изобретении, "размер частицы" может быть представлен распределением частиц по размеру, таким как D (X) = Y (здесь X и Y представляют собой положительные числа). D (X) = Y может означать, что, когда распределение частиц лекарственного средства по размеру, полученное путем измерения диаметра частиц лекарственного средства в композиции, выражают кумулятивной кривой, размеры частиц аккумулируют в порядке их возрастания и они достигают X% (% рассчитывают от числа, объема или массы) в точке, в которой размер частицы относят к Y. Например, D(10) может относиться к диаметру частицы в точке, в которой размер частиц достигает 10%, когда размеры частиц лекарственного средства аккумулируют в порядке возрастания. D(50) может относиться к диаметру частицы в точке, в которой размер частицы достигает 50%, когда размеры частиц лекарственного средства аккумулируют в порядке возрастания. D(90) может относиться к диаметру частицы, в точке, в которой размер частицы достигает 90%, когда размеры частиц лекарственного средства аккумулируют в порядке возрастания.
В настоящем изобретении, D(X) может быть выражено иначе в виде D(0,X), и D(X) и D(0,X) могут использоваться взаимозаменяемо. Например, D(50) может быть также выражено в виде D(0,5), а D(10) и D(90) могут быть также выражены в виде D(0,1) и D(0,9), соответственно.
Представляет ли распределение частиц по размеру D(X) процент от общего кумулятивного количества частиц на основе числа, объема или массы, может зависеть от метода, используемого для измерения распределения частиц по размеру. Методы измерения распределения частиц по размеру и связанных с ними типов процентов известны специалистам в данной области техники. Например, при измерении распределения частиц по размеру известным методом лазерной дифракции значение X в D(X) может представлять собой процент, вычисленный по среднему объему. Специалистам в данной области техники известно, что результаты измерения распределения частиц по размеру конкретным методом могут быть сопоставлены с результатами, полученными с помощью других методов, основанных на проведении обычных экспериментов. Например, метод лазерной дифракции может давать среднеобъемный размер частиц в зависимости от объема частицы, который соответствует средневзвешенному размеру частицы при постоянной плотности.
В одном варианте осуществления настоящего изобретения, гранулы второго слоя могут иметь, но этим не ограничивая, распределение частиц по размеру с D50 80 мкм или более, и конкретно, от 80 до 260 мкм, от 90 до 240 мкм или от 100 до 235 мкм. Когда гранулы второго слоя имеют D50 в указанном выше диапазоне, может быть обеспечена эффективность процесса таблетирования с фимасартаном в двухслойную таблетку. Кроме того, может поддерживаться высокая степень однородности содержания каждого компонента, содержащегося в каждой таблетке, и, следовательно, может быть экономически эффективно осуществлено производство таблеток в массовом масштабе.
В одном варианте осуществления настоящего изобретения, гранулы второго слоя могут иметь, но этим не ограничивая, D10 от 14 до 70 мкм, , и, в частности, гранулы второго слоя могут иметь размер от 14 до 50 мкм. Когда гранулы второго слоя имеют D10 в указанном выше диапазоне, может быть обеспечена эффективность процесса таблетирования с фимасартаном в двухслойную таблетку. Кроме того, может поддерживаться высокая степень однородности содержания каждого компонента, содержащегося в каждой таблетке, и, следовательно, может быть экономически эффективно осуществлено производство таблеток в массовом масштабе.
В одном варианте осуществления настоящего изобретения, гранулы второго слоя могут иметь, но этим не ограничивая, D90 от 290 до 600 мкм, и, в частности, гранулы второго слоя могут иметь D90 от 300 до 550 мкм или от 300 до 500 мкм. Когда гранулы второго слоя имеют D90 в указанном выше диапазоне, может быть обеспечена эффективность процесса таблетирования с фимасартаном в двухслойную таблетку. Кроме того, может поддерживаться высокая степень однородности содержания каждого компонента, содержащегося в каждой таблетке, и, следовательно, может быть экономически эффективно осуществлено производство таблеток в массовом масштабе.
В одном варианте осуществления настоящего изобретения, таблетка может быть в форме двухслойной таблетки, включающей, но этим не ограничивая, первый слой, содержащий гранулы фимасартана, и второй слой, содержащий гранулы аторвастатина.
В настоящем изобретении, термин "таблетка" может относиться к таблетке, включающей прессованную фармацевтическую лекарственную форму всех форм и размеров, а термин "двухслойная таблетка" может относиться к комбинированному лекарственному средству, в котором два или более разных ингредиента объединены так, чтобы они не смешивались вместе, и каждый независимо присутствовал в отдельных частях таблетки. В настоящем изобретении, первый слой двухслойной таблетки может содержать гранулы фимасартана, а второй слой может содержать гранулы аторвастатина, в которых гранулы фимасартана и гранулы аторвастатина, независимо присутствующие в первом и втором слоях, не смешаны друг с другом, и независимо присутствуют в отдельных частях таблетки, что позволяет более эффективно проводить лечение сердечно-сосудистых заболеваний, в том числе гипертензии.
В настоящем изобретении, термин "гранула (гранулы) фимасартана" может относиться к грануле, содержащей фимасартан, его фармацевтически приемлемую соль, гидрат или сольват и фармацевтически приемлемую добавку. В настоящем изобретении, термин "гранула (гранулы) аторвастатина" может относиться к грануле, содержащей аторвастатин, его фармацевтически приемлемую соль, гидрат или сольват и фармацевтически приемлемую добавку.
В настоящем изобретении термин "первый и второй" может использоваться только для того, чтобы различать друг от друга разные слои, мембраны, стадии и так далее, но не предназначен для указания последовательности или степени их важности и отличительных признаков слоев, мембран, стадии и так далее, которые не ограничиваются указанными терминами, такими как первый, второй и так далее. Следовательно, указанные термины, такие как первый, второй и так далее, не могут использоваться одинаково во всех случаях в подробном описании изобретения, примерах, формуле изобретения и так далее, и их использование соответствует только тем случаям, когда эти слои, мембраны, стадии и так далее можно отличить друг от друга с помощью таких терминов, как первый, второй и так далее.
В одном варианте осуществления настоящего изобретения, фимасартан, его фармацевтически приемлемая соль, гидрат или сольват могут быть включены в стандартную лекарственную форму в количестве, но этим не ограничивая, от 0,5 до 240,0 мг, в частности, в количестве от 10 до 180 мг или от 20 до 120 мг.
В одном из вариантов осуществления настоящего изобретения, аторвастатин, его фармацевтически приемлемая соль и гидрат или сольват могут быть включены в стандартную лекарственную форму в количестве, но этим не ограничивая, от 1,0 до 100,0 мг, в частности, в количестве от 10 до 80 мг.
В одном варианте осуществления настоящего изобретения, добавки первого и второго слоев могут представлять, но этим не ограничивая, любые добавки, выбранные из группы, состоящей из наполнителя, солюбилизирующего агента, разрыхлителя, связующего, смазывающего вещества и их смеси.
В настоящем изобретении термин "вспомогательное вещество" может относиться к любому веществу, но не к терапевтическому средству, которое используется в качестве носителя или среды для доставки терапевтического средства или вводится в фармацевтическую композицию. Соответственно, вспомогательное вещество может улучшать характеристики лекарственного препарата при транспортировке и хранении или может способствовать приготовлению композиции, содержащей разовую дозу. Например, вспомогательное вещество может представлять собой, по меньшей мере, одно вспомогательное вещество, выбранное из группы, включающей, но этим не ограничивая, осажденный карбонат кальция, лактозу или ее гидрат, микрокристаллическую целлюлозу, маннит и коллоидный диоксид кремния, и, более конкретно, осажденный карбонат кальция, микрокристаллическую целлюлозу и лактозу.
В настоящем изобретении термин "солюбилизирующее средство" относится к веществу, легкорастворимому в растворителе (в основном в воде), которое добавляют с целью увеличения растворимости плохо растворимого лекарственного средства. Например, солюбилизирующее средство может представлять собой, но этим не ограничивая, изотонический раствор, в том числе физиологический раствор, глюкозу и другие вспомогательные вещества, такие как D-сорбит, D-манноза, D-маннит и хлорид натрия; спирты, такие как этанол; полиолы, такие как пропиленгликоль и полиэтиленгликоль; и неионные поверхностно-активные вещества, такие как полисорбат 80 и HCO-50; и другие подобные вещества.
В настоящем изобретении, термин "разрыхлитель" относится к веществу, которое добавляют с целью ускорения распада таблеток, капсул, гранул и других подобных лекарственных форм в желудочном соке. Например, разрыхлитель может быть выбран, но этим не ограничивая, из группы, состоящей из кросповидона (сшитого поливинилпирролидона), кроскармеллозы натрия (сшитой карбоксиметилцеллюлозы натрия), натрия крахмал гликолята, кукурузного крахмала, прежелатинизированного крахмала, низкозамещенной гидроксипропилцеллюлозы и микрокристаллической целлюлозы.
В настоящем изобретении, термин "связующее вещество" относится к веществу, которое добавляют для изготовления лекарственной формы, такой как таблетки или пилюли. Например, связующее вещество может быть выбрано, но этим не ограничивая, из группы, состоящей из поливинилпирролидона (повидона), сополимера винилпирролидона и других виниловых производных (коповидона), гидроксипропилметилцеллюлозы, метилцеллюлозы, гидроксипропил-целлюлозы и прежелатинизированного крахмала.
В настоящем изобретении, термин "смазывающее вещество" относится к добавке, которую используют для придания гранулам свойства текучести и облегчения высвобождения таблеток из формы при изготовлении таблеток. Например, смазывающее вещество может представлять собой, но этим не ограничивая, стеарат магния, стеарилфумарат натрия или коллоидный диоксид кремния.
В одном варианте осуществления настоящего изобретения, гранулы второго слоя могут включать, но этим не ограничивая, смесь гидрата лактозы и микрокристаллической целлюлозы, и эта смесь может быть введена в количестве от 40 до 50 масс.% от суммарной массы гранул второго слоя. В частности, смесь гидрата лактозы и микрокристаллической целлюлозы может оказывать влияние на способность гранул аторвастатина подвергаться таблетированию в процессе таблетирования при приготовлении комбинированного лекарственного средства, содержащего аторвастатин и фимасартан в качестве активных ингредиентов. Введение смеси гидрата лактозы и микрокристаллической целлюлозы в количестве от 40 до 50 масс.% от суммарной массы гранул второго слоя позволяет влиять на распределение частиц по размеру гранул аторвастатина второго слоя и предотвращать нарушение технологии таблетирования, например, прилипание в процессе таблетирования с фимасартаном, вследствие чего упрощается осуществление процесса таблетирования. Кроме того, это позволяет поддерживать высокую степень однородности содержания каждого компонента, содержащегося в каждой таблетке, и, следовательно, может быть экономически эффективно осуществлено производство таблеток в массовом масштабе.
В одном варианте осуществления настоящего изобретения, гранулы второго слоя могут дополнительно содержать, но этим не ограничивая, осажденный карбонат кальция. В частности, при приготовлении комбинированного лекарственного средства аторвастатина и фимасартана, для стабилизации аторвастатина в процессе таблетирования можно добавлять большое количество осажденного карбоната кальция.
В одном варианте осуществления настоящего изобретения, смесь гидрата лактозы и микрокристаллической целлюлозы может иметь, но этим не ограничивая, распределение частиц по размеру с D50 от 75 мкм или более, и, в частности, от 75 до 200 мкм, от 85 до 180 мкм, или от 95 до 170 мкм. При использовании смеси гидрата лактозы и микрокристаллической целлюлозы, имеющей распределение частиц по размеру в пределах указанного выше диапазона, может быть увеличен размер частиц гранул второго слоя, вследствие чего упрощается осуществление процесса таблетирования при приготовлении комбинированного препарата с фимасартаном. Кроме того, это позволяет поддерживать высокую степень однородности содержания каждого компонента, содержащегося в каждой таблетке, и, следовательно, может быть экономически эффективно осуществлено производство таблеток в массовом масштабе.
В одном варианте осуществления настоящего изобретения, смесь гидрата лактозы и микрокристаллической целлюлозы может иметь, но этим не ограничивая, распределение частиц по размеру с D10 от 15 до 50 мкм, и, в частности, от 20 до 40 мкм, или от 23 до 35 мкм. При использовании смеси гидрата лактозы и микрокристаллической целлюлозы, имеющей распределение частиц по размеру в пределах указанного выше диапазона, может быть увеличен размер частиц гранул второго слоя, вследствие чего упрощается осуществление процесса таблетирования при приготовлении комбинированного препарата с фимасартаном. Кроме того, это позволяет поддерживать высокую степень однородности содержания каждого компонента, содержащегося в каждой таблетке, и, следовательно, может быть экономически эффективно осуществлено производство таблеток в массовом масштабе.
В одном варианте осуществления настоящего изобретения, смесь гидрата лактозы и микрокристаллической целлюлозы может иметь, но этим не ограничивая, распределение частиц по размеру с D90 от 150 до 400 мкм, и, в частности, от 180 до 350 мкм или от 200 до 300 мкм. При использовании смеси гидрата лактозы и микрокристаллической целлюлозы, имеющей распределение частиц по размеру в пределах указанного выше диапазона, может быть увеличен размер частиц гранул второго слоя, вследствие чего упрощается осуществление процесса таблетирования при приготовлении комбинированного препарата с фимасартаном. Кроме того, это позволяет поддерживать высокую степень однородности содержания каждого компонента, содержащегося в каждой таблетке, и, следовательно, может быть экономически эффективно осуществлено производство таблеток в массовом масштабе.
В одном варианте осуществления настоящего изобретения, гранулы второго слоя могут включать, но этим не ограничивая, от 1 до 10 частей по массе аторвастатина, его фармацевтически приемлемой соли, гидрата или сольвата, от 50 до 99,9 частей по массе вспомогательного вещества, от 0,1 до 2 частей по массе солюбилизирующего средства, от 0,5 до 15 частей по массе разрыхлителя, от 0,1 до 10 частей по массе связующего вещества и от 0,1 до 5 частей по массе смазывающего вещества.
В настоящем изобретении, единица измерения "частей по массе" может относиться к массовому соотношению между соответствующими ингредиентами, если не указано иное. Например, выражение "гранулы слоя, включающие от 1 до 10 частей по массе аторвастатина, его фармацевтически приемлемой соли, гидрата или сольвата, от 50 до 99,9 частей по массе вспомогательных веществ, от 0,1 до 2 частей по массе солюбилизирующего средства, от 0,5 до 15 частей по массе разрыхлителя, от 0,1 до 10 частей по массе связующего вещества и от 0,1 до 5 частей по массе смазывающего вещества", может означать, что гранулы второго слоя сформированы путем смешивания аторвастатина, его фармацевтически приемлемой соли, гидрата или сольвата, вспомогательных веществ, солюбилизирующего средства, разрыхлителя, связующего вещества и смазывающего вещества в массовом соотношении 1 ~ 10 : 50 ~ 99,9 : 0,1 ~ 2 : 0,5 ~ 15 : 0,1 ~ 10 : 0,1 ~ 5. В частности, выражение "гранулы второго слоя" может означать, что часть гранул аторвастатина сформирована путем смешивания аторвастатина, его фармацевтически приемлемой соли, гидрата или сольвата, вспомогательных веществ, солюбилизирующего средства, разрыхлителя, связующего вещества и смазывающего вещества в массовом соотношении 3 ~ 7 : 70 ~ 85 : 0,1 ~ 0,5 : 1 ~ 10 : 0,5 ~ 2 : 0,1 ~ 0,5.
В другом аспекте, выражение "гранулы второго слоя" может означать, что гранулы второго слоя сформированы путем смешивания от 1 до 20 масс.% аторвастатина, его фармацевтически приемлемой соли, гидрата или сольвата, от 50 до 98,2 масс.% вспомогательного вещества, от 0,1 до 5 масс.% солюбилизирующего средства, от 0,5 до 15 масс.% разрыхлителя, от 0,1 до 10 масс.% связующего вещества и от 0,1 до 5 масс.% смазывающего вещества. В частности, выражение "гранулы второго слоя" может означать, что гранулы второго слоя сформированы путем смешивания от 5 до 15 масс.% аторвастатина, его фармацевтически приемлемой соли, гидрата или сольвата, от 70 до 85 масс.% вспомогательного вещества, от 0,1 до 1 масс.% солюбилизирующего средства, от 1 до 10 масс.% разрыхлителя, от 0,5 до 5 масс.% связующего вещества и от 0,1 до 3 масс.% смазывающего вещества.
В одном варианте осуществления настоящего изобретения, вспомогательное вещество может представлять собой, но этим не ограничивая, любое вспомогательное вещество из осажденного карбоната кальция, гидрата лактозы, микрокристаллической целлюлозы или их смеси.
В одном варианте осуществления настоящего изобретения, смесь вспомогательных веществ может включать, но этим не ограничивая, от 30 до 50 частей по массе осажденного карбоната кальция, от 20 до 40 частей по массе гидрата лактозы и от 15 до 35 частей по массе микрокристаллической целлюлозы. В частности, выражение "смесь" может означать, что смесь вспомогательных веществ сформирована путем смешивания осажденного карбоната кальция, гидрата лактозы и микрокристаллической целлюлозы в массовом соотношении 30 ~ 50 : 20 ~ 40 : 15 ~ 35.
В одном варианте осуществления настоящего изобретения, указанная таблетка может применяться для лечения сердечно-сосудистых заболеваний. В настоящем изобретении, термин "сердечно-сосудистое заболевание" может относиться к любому заболеванию, которое возникает в сердце и/или сосудистой системе (во всех кровеносных сосудах, таких как артерии, капилляры и вены).
В одном варианте осуществления настоящего изобретения, сердечно-сосудистое заболевание может представлять собой, но этим не ограничивая, любое сердечно-сосудистое заболевание, выбранное из гипертензии, диабета, ожирения, гиперлипидемии, ишемической болезни сердца, хронической стабильной стенокардии, вазоспастической стенокардии, инсульта, инфаркта миокарда, временной ишемической атаки, застойной сердечной недостаточности, резистентности к инсулину, нарушения толерантности к глюкозе, предиабета, сахарного диабета 2 типа, диабетической нефропатии, дислипидемии, снижения когнитивных функций, деменции и их комбинации.
В одном варианте осуществления настоящего изобретения, таблетка может представлять собой, но этим не ограничивая, форму таблетки с покрытием, которая дополнительно включает наружный слой покрытия. В частности, в качестве слоя покрытия может использоваться вещество Opadry (Colorcon; 415 Moyer Blvd., P.O. Box 4, West Point, PA 19486-0024, U.S.A.).
В одном варианте осуществления настоящего изобретения, таблетка, дополнительно включающая наружный слой покрытия, может дополнительно включать, но этим не ограничивая, наружное полирующее средство. В настоящем изобретении, термин "полирующее средство" может относиться к веществу, которое полирует поверхность лекарственного препарата для улучшения свойств лекарственной формы. Например, полирующее средство может представлять собой, но этим не ограничивая, пчелиный воск или карнаубский воск.
В одном варианте осуществления настоящего изобретения, гранулы первого и второго слоев могут представлять собой сухие гранулы или влажные гранулы, в частности, влажные гранулы.
Способ приготовления таблетки
В настоящем изобретении предлагается способ приготовления таблетки, который включает: (S1) приготовление первого слоя, включающего гранулы, содержащие фимасартан, его фармацевтически приемлемую соль, гидрат или сольват и фармацевтически приемлемую добавку; (S2) приготовление второго слоя, включающего гранулы, содержащие аторвастатин, его фармацевтически приемлемую соль, гидрат или сольват и фармацевтически приемлемую добавку; и (S3) приготовление двухслойной таблетки путем таблетирования первого и второго слоев.
В одном варианте осуществления настоящего изобретения, стадия таблетирования первого и второго слоев может выполняться путем приложения давления таблетирования от 5 до 15 кН, но этим не ограничивая.
Фармацевтическая композиция в форме таблетки
В настоящем изобретении предлагается фармацевтическая композиция в форме таблетки. Фармацевтическая композиция по настоящему изобретению характеризуется эффективным воздействием при предотвращении и лечении сердечно-сосудистых заболеваний.
Фармацевтическая композиция по настоящему изобретению может быть предназначена для перорального введения. В настоящем изобретении, термин "пероральное введение" означает, что вещество, приготовленное для обеспечения усвоения активного вещества, вводят в желудочно-кишечный тракт для всасывания. Неограничивающий пример лекарственной формы для перорального введения может включать таблетку, пастилку, леденец, водорастворимую суспензию, масляную суспензию, приготовленный порошок, гранулы, эмульсию, твердую капсулу, мягкую капсулу, сироп, эликсир или другие подобные формы. Для приготовления фармацевтической композиции по настоящему изобретению для перорального введения могут быть использованы следующие вещества: связующие вещества, такие как лактоза, сахароза, сорбит, маннит, крахмал, амилопектин, целлюлоза, желатин или другие подобные вещества; вспомогательные вещества, такие как дикальцийфосфат и другие подобные вещества; разрыхлители, такие как кукурузный крахмал, крахмал батата и другие подобные вещества; смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарилфумарат натрия, полиэтиленгликоль, воск или другие подобные вещества; и другие вещества, среди которых могут быть также использованы подсластители, ароматизаторы, сиропы и другие подобные вещества. Кроме того, в случае капсулы, помимо вышеупомянутых материалов, может быть также дополнительно использован жидкий носитель, такой как жирное масло и другой подобный жидкий носитель.
Способ предотвращения или лечения сердечно-сосудистых заболеваний
В настоящем изобретении предлагается способ предотвращения или лечения сердечно-сосудистых заболеваний, который включает введение терапевтически эффективного количества таблетки млекопитающим, включая человека.
В настоящем изобретении термин "предотвращение" относится к отсрочке возникновения заболевания, нарушения или состояния. Если возникновение заболевания, нарушения или состояния откладывается на ожидаемый период времени, предотвращение может считаться полным.
В настоящем изобретении термин "лечение" относится к лечению, которое частично или полностью уменьшает, улучшает состояние, облегчает, подавляет или задерживает возникновение конкретного заболевания, нарушения и/или состояния, снижает их тяжесть или уменьшает вероятность возникновения, по крайней мере, одного симптома или его характерного проявления.
В настоящем изобретении, термин "терапевтически эффективное количество" может представлять собой количество таблеток по настоящему изобретению, которое является эффективным для предотвращения или лечения сердечно-сосудистых заболеваний, при этом такое количество может включать все количества таблеток, которые предотвращают возникновение или рецидив сердечно-сосудистых заболеваний, облегчают симптом, подавляют прямой или косвенный обусловленный болезнью конечный результат, предотвращают распространение, снижают скорость прогрессирования, облегчают или временно облегчают состояние или улучшают прогноз. Другими словами, терапевтически эффективное количество можно интерпретировать как включающее все дозы, при которых проявление симптома сердечно-сосудистых заболеваний принимает благоприятный оборот или симптом полностью излечивается с помощью таблетки.
В одном варианте осуществления настоящего изобретения, сердечно-сосудистые заболевания включают гипертензию или все виды гипертензии, осложнений и других подобных заболеваний у пациентов, страдающих так называемым метаболическим синдромом, который сложным путем приводит к развитию диабета, ожирения, гиперлипидемии, ишемической болезни сердца и других подобных заболеваний, и могут также включать хроническую стабильную стенокардию, вазоспастическую стенокардию, инсульт, инфаркт миокарда, временную ишемическую атаку, застойную сердечную недостаточность, резистентность к инсулину, нарушение толерантности к глюкозе, сахарный диабет 2 типа, диабетическую нефропатию, дислипидемию, снижение когнитивных функций, деменцию и другие подобные заболевания.
Способ предотвращения или лечения по настоящему изобретению включает не только борьбу с самим заболеванием до проявления его симптомов, но также подавление или предотвращение таких симптомов путем введения таблетки. При проведении лечения заболевания, профилактическая или терапевтическая доза конкретного активного ингредиента может варьировать в зависимости от природы и тяжести заболевания или состояния и способа введения активного компонента. Доза и частота ее введения могут варьировать в зависимости от возраста, массы тела и ответных реакций конкретного пациента. Подходящая доза и ее введение могут быть легко подобраны специалистами в данной области, естественно, с учетом этих факторов. Кроме того, способ лечения по настоящему изобретению может дополнительно включать введение терапевтически эффективного количества дополнительного активного лекарственного средства, которое применяют при лечении заболевания вместе с таблеткой, где применение дополнительного активного лекарственного средства вместе с фармацевтической композицией позволяет достигать синергетического эффекта или аддитивного эффекта.
В настоящем изобретении, термин "млекопитающие" относится к каждому животному, принадлежащему к классу млекопитающих с точки зрения биосистематики. В частности, млекопитающие, в том числе человек, включают млекопитающих, таких как человек, обезьяна, корова, лошадь, собака, кошка, кролик, скорость, мышь и другие подобные млекопитающие.
Применение таблетки в производстве лекарственного препарата для лечение сердечно-сосудистого заболевания
В настоящем изобретении предлагается применение таблетки в производстве лекарственного препарата для лечения сердечно-сосудистого заболевания.
Таблетка по настоящему изобретению в производстве лекарственного средства может быть приготовлена путем смешивания вышеупомянутой приемлемой добавки и других подобных веществ, например, путем введения таких добавок, как фармацевтически приемлемый стабилизатор, связующее вещество, разрыхлитель, смазывающее вещество, разбавитель, вещество для нанесения слоя покрытия, регулятор величины pH, солюбилизирующее средство, поверхностно-активное вещество и другие подобные вещества, в пределах диапазона их количеств, которые не оказывают отрицательного влияния на осуществление настоящего изобретения.
В одном варианте осуществления настоящего изобретения, сердечно-сосудистые заболевания включают гипертензию или все виды гипертензии, осложнений и других подобных заболеваний у пациентов, страдающих так называемым метаболическим синдромом, который сложным путем приводит к развитию диабета, ожирения, гиперлипидемии, ишемической болезни сердца и других подобных заболеваний, и могут также включать хроническую стабильную стенокардию, вазоспастическую стенокардию, инсульт, инфаркт миокарда, временную ишемическую атаку, застойную сердечную недостаточность, резистентность к инсулину, нарушение толерантности к глюкозе, сахарный диабет 2 типа, диабетическую нефропатию, дислипидемию, снижение когнитивных функций, деменцию и другие подобные заболевания.
Применение таблетки для лечения сердечно-сосудистых заболеваний
В настоящем изобретении предлагается применение таблетки для лечения сердечно-сосудистых заболеваний.
В одном варианте осуществления настоящего изобретения, сердечно-сосудистые заболевания включают гипертензию или все виды гипертензии, осложнений и других подобных заболеваний у пациентов, страдающих так называемым метаболическим синдромом, который сложным путем приводит к развитию диабета, ожирения, гиперлипидемии, ишемической болезни сердца и других подобных заболеваний, и могут также включать хроническую стабильную стенокардию, вазоспастическую стенокардию, инсульт, инфаркт миокарда, временную ишемическую атаку, застойную сердечную недостаточность, резистентность к инсулину, нарушение толерантности к глюкозе, сахарный диабет 2 типа, диабетическую нефропатию, дислипидемию, снижение когнитивных функций, деменцию и другие подобные заболевания.
Объекты, упомянутые применительно к таблетке, композиции, способу лечения и применению согласно настоящему изобретению, используют в одном и том же значении, если эти значения не вступают в противоречие друг с другом.
Положительные эффекты изобретения
Настоящее изобретение относится к таблетке и к способу ее приготовления, который позволяет существенно улучшить свойства таблетирования в процессе таблетирования с фимасартаном путем регулирования распределения частиц по размеру гранул аторвастатина до определенной величины или более, что позволяет экономически эффективно осуществлять производство таблеток в массовом масштабе с высокую степенью однородности содержания.
Краткое описание чертежей
На фигуре 1 представлена блок-схема, иллюстрирующая способ приготовления таблетки по настоящему изобретению.
На фигуре 2 приведено изображение поверхности таблетки из сравнительного примера 1.
На фигуре 3 приведено изображение поверхности таблетки из примера 1.
На фигуре 4 приведено изображение поверхности таблетки из примера 2.
На фигуре 5 приведено изображение поверхности таблетки из примера 3.
Примеры вариантов осуществления изобретения
Далее настоящее изобретение будет описано более подробно с помощью примеров вариантов осуществления. Однако объем настоящего изобретения не ограничивается этими примерами. Примеры настоящего изобретения приведены для того, чтобы более подробно описать настоящего изобретения для специалистов в данной области техники.
Тригидрат фимасартана кальция, используемый в следующих далее примерах приготовления, приобретали у фирмы Boryung Pharmaceutical Co., Ltd., тригидрат аторвастатина кальция приобретали у фирмы Dr. Reddy's, осажденный карбонат кальция приобретали у фирмы Bihoku, гидрат лактозы приобретали у фирмы DFE Pharma, микрокристаллическую целлюлозу приобретали у фирмы Asahi kasei, полисорбат 80 приобретали у фирмы Croda, кроскармеллозу натрия приобретали у фирмы DPE Pharma, гидроксипропилцеллюлозу приобретали у фирмы Nippon soda, стеарат магния приобретали у фирмы FACI, Opadry приобретали у фирмы Colorcon, и другие реагенты приобретали у фирмы Sigma-Aldrich.
Пример приготовления 1. Приготовление порции гранул фимасартана
Порцию гранул, содержащую тригидрат фимасартана калия в качестве активного ингредиента, приготавливали приведенным далее методом так, чтобы ингредиенты и их содержание в стандартной лекарственной форме (350 мг) соответствовали данным, приведенным в таблице 1 ниже.
Тригидрат фимасартана калия, микрокристаллическую целлюлозу и кроскармеллозу натрия смешивали вместе в течение приблизительно 10 минут, после чего полученную смесь помещали в высокоскоростной миксер и дополнительно перемешивали в течение приблизительно трех минут, получая в результате смесь, содержащую фимасартан в качестве активного ингредиента.
Помимо этого, гидроксипропилцеллюлозу растворяли в 41,7 мл очищенной воды, получая в результате раствор связующего вещества.
Приготовленный раствор связующего помещали в высокоскоростной смеситель, затем подвергали влажной грануляции со смесью, содержащей фимасартан в качестве активного ингредиента, размер гранул регулировали с помощью сита 20 меш и затем сушили. После сушки, к гранулам добавляли кроскармеллозу натрия и перемешивали в двухконусном смесителе в течение приблизительно пяти минут, после чего добавляли стеарат магния и дополнительно перемешивали в течение приблизительно пяти минут, получая в результате порцию гранул фимасартана.
Пример приготовления 2-1. Приготовление порции гранул аторвастатина 1
Порцию гранул аторвастатина приготавливали так, чтобы ингредиенты и их содержание в стандартной лекарственной форме (350 мг) соответствовали данным, приведенным в таблице 2 ниже.
Тригидрат аторвастатина кальция (D50: 3 мкм), осажденный карбонат кальция (D50: менее 45 мкм), гидрат лактозы (D50: 40 мкм), микрокристаллическую целлюлозу (D50: 50 мкм) и полисорбат 80 смешивали вместе в течение приблизительно 10 минут, после чего полученную смесь помещали в высокоскоростной смеситель и дополнительно перемешивали в высокоскоростном смесителе в течение приблизительно трех минут, получая в результате смесь, содержащую тригидрат аторвастатина кальция в качестве активного ингредиента. В этот момент времени, при измерении распределения частиц по размеру смеси гидрата лактозы и микрокристаллической целлюлозы, величина D10 составляла 12,33 мкм, D50 составляла 53,56 мкм, и D90 составляла 128,86 мкм.
Помимо этого, гидроксипропилцеллюлозу растворяли в 60 мл очищенной воды, получая в результате раствор связующего вещества.
Приготовленный раствор связующего помещали в высокоскоростной смеситель, затем подвергали влажной грануляции со смесью, содержащей тригидрат аторвастатина кальция в качестве активного ингредиента, размер гранул которого регулировали с помощью сита 18 меш, и затем сушили, получая в результате гранулы, содержащие тригидрат аторвастатина кальция в виде активного ингредиента. В этот момент времени, при измерении распределения частиц по размеру гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента, величина D10 составляла 13,37 мкм, D50 составляла 71,66 мкм и D90 составляла 288,58 мкм.
После сушки гранул, к ним добавляли кроскармеллозу натрия и перемешивали в двухконусном смесителе в течение приблизительно пяти минут, после чего добавляли стеарат магния и дополнительно перемешивали в течение приблизительно пяти минут, получая в результате порцию гранул аторвастатина.
Пример приготовления 2-2. Приготовление порции гранул аторвастатина 2
Порцию гранул аторвастатина приготавливали так, чтобы ингредиенты и их содержание в стандартной лекарственной форме (350 мг) соответствовали данным, приведенным в таблице 3 ниже.
Тригидрат аторвастатина кальция (D50: 3 мкм), осажденный карбонат кальция (D50: менее 45 мкм), гидрат лактозы (D50: 150 мкм), микрокристаллическую целлюлозу (D50: 50 мкм) и полисорбат 80 смешивали вместе в течение приблизительно 10 минут, после чего полученную смесь помещали в высокоскоростной миксер и дополнительно перемешивали в течение приблизительно трех минут, получая в результате смесь, содержащую тригидрат аторвастатина кальция в качестве активного ингредиента. В данной момент времени, при измерении распределения частиц по размеру смеси гидрата лактозы и микрокристаллической целлюлозы, которое влияет на таблетирование гранул аторвастатина, величина D10 составляла 28,00 мкм, D50 составлял 97,70 мкм, и D90 составлял 229,38 мкм.
Помимо этого, гидроксипропилцеллюлозу растворяли в 60 мл очищенной воды, получая в результате раствор связующего вещества.
Приготовленный раствор связующего помещали в высокоскоростной смеситель, затем подвергали влажному гранулированию со смесью, содержащей тригидрат аторвастатина кальция в качестве активного ингредиента, размер гранул регулировали с помощью сита 18 меш, а затем сушили, получая в результате гранулы, содержащие тригидрат аторвастатина кальция в качестве активного ингредиента. В этот момент времени, при измерении распределения частиц по размеру гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента, величина D10 составляла 15,79 мкм, D50 составляла 111,06 мкм и D90 составляла 423,35 мкм.
После сушки, к гранулам добавляли кроскармеллозу натрия и перемешивали в двухконусном смесителе в течение приблизительно пяти минут, после чего добавляли стеарат магния и дополнительно перемешивали в течение приблизительно пяти минут, получая в результате порцию гранул аторвастатина.
Пример приготовления 2-3. Приготовление порции гранул аторвастатина 3
Порцию гранул аторвастатина приготавливали так, чтобы ингредиенты и их содержание в стандартной лекарственной форме (350 мг) соответствовали данным, приведенным в таблице 4 ниже.
Тригидрат аторвастатина кальция (D50: 3 мкм), осажденный карбонат кальция (D50: менее 45 мкм), гидрат лактозы (D50: 150 мкм), микрокристаллическую целлюлозу (D50: 90 мкм) и полисорбат 80 смешивали вместе в течение приблизительно 10 минут, после чего полученная смесь помещали в высокоскоростной смеситель и дополнительно перемешивали в течение приблизительно трех минут, приготавливая в результате смесь, содержащую тригидрат аторвастатина кальция в качестве активного ингредиента. В этот момент времени, при измерении распределения частиц по размеру смеси гидрата лактозы и микрокристаллической целлюлозы, которое влияет на таблетирование гранул аторвастатина, величина D10 составляла 25,88 мкм, D50 составляла 115,11 мкм, и D90 составляла 234,22 мкм.
Помимо этого, гидроксипропилцеллюлозу растворяли в 60 мл очищенной воды, получая в результате раствор связующего вещества.
Приготовленный раствор связующего вещества помещали в высокоскоростной смеситель, затем подвергали влажному гранулированию со смесью, содержащей тригидрат аторвастатина кальция в качестве активного ингредиента, размер гранул которого регулировали с помощью сита 18 меш, а затем сушили, получая в результате гранулы, содержащие тригидрат аторвастатина кальция в качестве активного ингредиента. В этот момент времени, при измерении распределения частиц по размеру гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента, величина D10 составляла 24,59 мкм, D50 составляла 160,02 мкм, и D90 составляла 494,80 мкм.
После сушки к гранулам добавляли кроскармеллозу натрия и перемешивали в двухконусном смесителе в течение приблизительно пяти минут, после чего добавляли стеарат магния и дополнительно перемешивали в течение приблизительно пяти минут, получая в результате порцию гранул аторвастатина.
Пример приготовления 2-4. Приготовление порции гранул аторвастатина 4
Порцию гранул аторвастатина приготавливали так, чтобы ингредиенты и их содержание в стандартной лекарственной форме (350 мг) соответствовали данным, приведенным в таблице 5 ниже.
Тригидрат аторвастатина кальция (D50: 3 мкм), осажденный карбонат кальция (D50: менее 45 мкм), гидрат лактозы (D50: 150 мкм), микрокристаллическую целлюлозу (D50: 170 мкм) и полисорбат 80 смешивали вместе в течение приблизительно 10 минут, после чего полученную смесь помещали в высокоскоростной миксер и дополнительно перемешивали в течение приблизительно трех минут, получая в результате смесь, содержащую тригидрат аторвастатина кальция в качестве активного ингредиента. В этот момент времени, при измерении распределения частиц по размеру смеси гидрата лактозы и микрокристаллической целлюлозы, которое влияет на таблетирование гранул аторвастатина, величина D10 составляла 52,99 мкм, D50 составляла 115,11 мкм, и D90 составляла 282,48 мкм.
Помимо этого, гидроксипропилцеллюлозу растворяли в 60 мл очищенной воды, получая в результате раствор связующего вещества.
Приготовленный раствор связующего помещали в высокоскоростной смеситель, затем подвергали влажному гранулированию со смесью, содержащей тригидрат аторвастатина кальция в качестве активного ингредиента, размер гранул которой регулировали с помощью сита 18 меш, и затем сушили, получая в результате гранулы, содержащие тригидрат аторвастатина кальция в качестве активного ингредиента. В этот момент времени, при измерении распределения частиц по размеру гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента, величина D10 составляла 47,40 мкм, D50 составляла 230,84 мкм и D90 составляла 460,13 мкм.
После сушки гранул, к ним добавляли кроскармеллозу натрия и перемешивали в двухконусном смесителе в течение приблизительно пяти минут, после чего добавляли стеарат магния и дополнительно перемешивали в течение приблизительно пяти минут, получая в результате порцию гранул аторвастатина.
Пример приготовления 2-5. Приготовление порции гранул аторвастатина 5
Порцию гранул аторвастатина приготавливали так, чтобы ингредиенты и их содержание в стандартной лекарственной форме (350 мг) соответствовали данным, приведенным в таблице 2.
Тригидрат аторвастатина кальция (D50: 3 мкм), осажденный карбонат кальция (D50: менее 45 мкм), гидрат лактозы (D50: 40 мкм), микрокристаллическую целлюлозу (D50: 50 мкм) и полисорбат 80 смешивали вместе в течение приблизительно 10 минут, после чего полученную смесь помещали в высокоскоростной миксер и дополнительно перемешивали в течение приблизительно трех минут, получая в результате смесь, содержащую тригидрат аторвастатина кальция в качестве активного ингредиента. В этот момент времени, при измерении распределения частиц по размеру смеси гидрата лактозы и микрокристаллической целлюлозы, величина D10 составляла 12,33 мкм, D50 составляла 53,56 мкм, и D90 составляла 128,86 мкм.
Помимо этого, гидроксипропилцеллюлозу растворяли в 70 мл очищенной воды, получая в результате раствор связующего вещества.
Приготовленный раствор связующего вещества помещали в высокоскоростной смеситель, затем подвергали влажному гранулированию со смесью, содержащей тригидрат аторвастатина кальция в качестве активного ингредиента, размер гранул которой регулировали с помощью сита 18 меш, а затем сушили, получая в результате гранулы, содержащие тригидрат аторвастатина кальция в качестве активного ингредиента. В этот момент времени, при измерении распределения частиц по размеру гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента, величина D10 составляла 24,35 мкм, D50 составляла 177,98 мкм и D90 составляла 507,06 мкм.
После сушки гранул к ним добавляли кроскармеллозу натрия и перемешивали в двухконусном смесителе в течение приблизительно пяти минут, после чего к ним добавляли стеарат магния и дополнительно перемешивали в течение приблизительно пяти минут, получая в результате порцию гранул аторвастатина.
Пример приготовления 2-6. Приготовление порции гранул аторвастатина 6
Порцию гранул аторвастатина приготавливали так, чтобы ингредиенты и их содержание в стандартной лекарственной форме (350 мг) соответствовали данным, приведенным в таблице 2.
Тригидрат аторвастатина кальция (D50: 3 мкм), осажденный карбонат кальция (D50: менее 45 мкм), гидрат лактозы (D50: 40 мкм), микрокристаллическую целлюлозу (D50: 50 мкм) и полисорбат 80 смешивали вместе в течение приблизительно 10 минут, после чего полученную смесь помещали в высокоскоростной миксер и дополнительно перемешивали в течение приблизительно трех минут, получая в результате смесь, содержащую тригидрат аторвастатина кальция в качестве активного ингредиента. В этот момент времени, при измерении распределения частиц по размеру смеси гидрата лактозы и микрокристаллической целлюлозы, величина D10 составляла 12,33 мкм, D50 составляла 53,56 мкм, и D90 составляла 128,86 мкм.
Помимо этого, гидроксипропилцеллюлозу растворяли в 60 мл очищенной воды, получая в результате раствор связующего вещества.
Приготовленный раствор связующего вещества помещали в высокоскоростной смеситель, затем подвергали влажному гранулированию со смесью, содержащей тригидрат аторвастатина кальция в качестве активного ингредиента, размер гранул которой регулировали с помощью сита 14 меш, и затем сушили, получая в результате гранулы, содержащие тригидрат аторвастатина кальция в виде активного ингредиента. В этот момент времени, при измерении распределения частиц по размеру гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента, величина D10 составляла 14,19 мкм, D50 составляла 118,77 мкм и D90 составляла 303,93 мкм.
После сушки гранул, к ним добавляли кроскармеллозу натрия и перемешивали в двухконусном смесителе в течение приблизительно пяти минут, после чего добавляли стеарат магния и дополнительно перемешивали в течение приблизительно пяти минут, получая в результате порцию гранул аторвастатина.
Пример 1. Двухслойная таблетка, содержащая фимасартан и аторвастатин
Гранулы, содержащие тригидрат фимасартана калия в качестве активного ингредиента в соответствии с примером приготовления 1, и гранулы, содержащие тригидрат аторвастатина кальция в качестве активного ингредиента в соответствии с примером приготовления 2-2, соответственно, помещали в пуансон и подвергали таблетированию при давлении таблетирования от 5 до 15 кН с целью получения двухслойной таблетки.
Двухслойную таблетку приготавливали с использованием пресса для изготовления многослойных таблеток (пресса для изготовления двухслойных таблеток Piccola), так что твердость одной двухслойной таблетки достигала 5 ~ 20 кПа.
После этого, приготавливали таблетку с покрытием, используя 10,5 мг Opadry (Colorcon; 415 Moyer Blvd., PO Box 4, West Point, PA 19486-0024, USA), и поверхность таблетки с покрытием полировали, используя 0,5 мг карнаубского воска, с получением двухслойной таблетки, содержащей фимасартан и аторвастатин.
Пример 2. Двухслойная таблетка, содержащая фимасартан и аторвастатин
Гранулы, содержащие тригидрат фимасартана калия в качестве активного ингредиента в соответствии с примером приготовления 1, и гранулы, содержащие тригидрат аторвастатина кальция в качестве активного ингредиента в соответствии с примером приготовления 2-3, соответственно, помещали в пуансон и подвергали таблетированию при давлении таблетирования от 5 до 15 кН с целью получения двухслойной таблетки.
Двухслойную таблетку приготавливали с использованием пресса для изготовления многослойных таблеток (пресса для изготовления двухслойных таблеток Piccola), так что твердость одной двухслойной таблетки достигала 5 ~ 20 кПа.
После этого, приготавливали таблетку с покрытием, используя 10,5 мг Opadry (Colorcon; 415 Moyer Blvd., PO Box 4, West Point, PA 19486-0024, USA), и поверхность таблетки с покрытием полировали, используя 0,5 мг карнаубского воска, с получением двухслойной таблетки, содержащей фимасартан и аторвастатин.
Пример 3. Двухслойная таблетка, содержащая фимасартан и аторвастатин
Гранулы, содержащие тригидрат фимасартана калия в качестве активного ингредиента в соответствии с примером приготовления 1, и гранулы, содержащие тригидрат аторвастатина кальция в качестве активного ингредиента в соответствии с примером приготовления 2-4, соответственно, помещали в пуансон и подвергали таблетированию при давлении таблетирования от 5 до 15 кН с целью получения двухслойной таблетки.
Двухслойную таблетку приготавливали с использованием пресса для изготовления многослойных таблеток (пресса для изготовления двухслойных таблеток Piccola), так что твердость одной двухслойной таблетки достигала 5 ~ 20 кПа.
После этого, приготавливали таблетку с покрытием, используя 10,5 мг Opadry (Colorcon; 415 Moyer Blvd., PO Box 4, West Point, PA 19486-0024, USA), и поверхность таблетки с покрытием полировали, используя 0,5 мг карнаубского воска, с получением двухслойной таблетки, содержащей фимасартан и аторвастатин.
Пример 4. Двухслойная таблетка, содержащая фимасартан и аторвастатин
Гранулы, содержащие тригидрат фимасартана калия в качестве активного ингредиента в соответствии с примером приготовления 1, и гранулы, содержащие тригидрат аторвастатина кальция в качестве активного ингредиента в соответствии с примером приготовления 2-5, соответственно, помещали в пуансон и подвергали таблетированию при давлении таблетирования от 5 до 15 кН с целью получения двухслойной таблетки.
Двухслойную таблетку приготавливали с использованием пресса для изготовления многослойных таблеток (пресса для изготовления двухслойных таблеток Piccola), так что твердость одной двухслойной таблетки достигала 5 ~ 20 кПа.
После этого, приготавливали таблетку с покрытием, используя 10,5 мг Opadry (Colorcon; 415 Moyer Blvd., PO Box 4, West Point, PA 19486-0024, USA), и поверхность таблетки с покрытием полировали, используя 0,5 мг карнаубского воска, с получением двухслойной таблетки, содержащей фимасартан и аторвастатин.
Пример 5. Двухслойная таблетка, содержащая фимасартан и аторвастатин
Гранулы, содержащие тригидрат фимасартана калия в качестве активного ингредиента в соответствии с примером приготовления 1, и гранулы, содержащие тригидрат аторвастатина кальция в качестве активного ингредиента в соответствии с примером приготовления 2-6, соответственно, помещали в пуансон и подвергали таблетированию при давлении таблетирования от 5 до 15 кН с целью получения двухслойной таблетки.
Двухслойную таблетку приготавливали с использованием пресса для изготовления многослойных таблеток (пресса для изготовления двухслойных таблеток Piccola), так что твердость одной двухслойной таблетки достигала 5 ~ 20 кПа.
После этого, приготавливали таблетку с покрытием, используя 10,5 мг Opadry (Colorcon; 415 Moyer Blvd., PO Box 4, West Point, PA 19486-0024, USA), и поверхность таблетки с покрытием полировали, используя 0,5 мг карнаубского воска, с получением двухслойной таблетки, содержащей фимасартан и аторвастатин.
Сравнительный пример 1. Двухслойная таблетка, содержащая фимасартан и аторвастатин
Гранулы, содержащие тригидрат фимасартана калия в качестве активного ингредиента в соответствии с примером приготовления 1, и гранулы, содержащие тригидрат аторвастатина кальция в качестве активного ингредиента в соответствии с примером приготовления 2-1, соответственно, помещали в пуансон и подвергали таблетированию при давлении таблетирования от 5 до 15 кН с целью получения двухслойной таблетки.
Двухслойную таблетку приготавливали с использованием пресса для изготовления многослойных таблеток (пресса для изготовления двухслойных таблеток Piccola), так что твердость одной двухслойной таблетки достигала 5 ~ 20 кПа.
После этого, приготавливали таблетку с покрытием, используя 10,5 мг Opadry (Colorcon; 415 Moyer Blvd., PO Box 4, West Point, PA 19486-0024, USA), и поверхность таблетки с покрытием полировали, используя 0,5 мг карнаубского воска, с получением двухслойной таблетки, содержащей фимасартан и аторвастатин.
Методы испытания
Метод 1. Метод измерения размера частиц
Размер частиц полученной гранулы, содержащей тригидрат аторвастатина кальция в качестве активного ингредиента, и смеси гидрата лактозы и микрокристаллической целлюлозы, которые влияют на таблетирование гранул аторвастатина, измеряли сухим методом с использованием анализатора размера частиц HELOS (лазерный анализатор размера частиц) фирмы Sumpatec Inc.
Метод 2. Метод оценки наличия нарушения процесса таблетирования
Наблюдали невооруженным глазом за наличием отпечатка на поверхности двухслойной таблетки, содержащей фимасартан и аторвастатин согласно примерам 1-3 и сравнительному примеру 1.
Метод 3. Метод оценки однородности содержания
Гранулы, содержащие тригидрат аторвастатина кальция в качестве активного ингредиента в соответствии с примером получения 2-1 - примером получения 2-4 (заданная масса: 200 мг), подвергали таблетированию и хранили при 60°C в течение 1 недели, и, соответственно, измеряли массу таблетки в зависимости от времени, для того чтобы рассчитать отклонение массы от среднего значения.
Далее настоящее изобретение будет описано более подробно с помощью примеров проведения экспериментов. Однако объем настоящего изобретения не ограничивается этими примерами проведения экспериментов. Примеры проведения экспериментов настоящего изобретения предоставлены для более полного описания настоящего изобретения специалистам в данной области техники.
Примеры проведения экспериментов
Пример проведения эксперимента 1. Оценка наличия нарушения процесса таблетирования
Оценивали, происходит или не происходит нарушение технологии таблетирования в процессе таблетирования двухслойных таблеток, содержащих фимасартан и аторвастатин, приготовленных в соответствии с примерами 1-3 и сравнительным примером 1, описанным выше методом 2.
В частности, как показано на фигуре 2, было подтверждено, что отпечаток на поверхности двухслойной таблетки, содержащей фимасартан и аторвастатин в соответствии со сравнительным примером 1, поврежден до такой степени, что его невозможно идентифицировать на поверхности таблетки невооруженным глазом.
Однако, как показано на фигурах 3-5, отпечаток на поверхности двухслойных таблеток, содержащих фимасартан и аторвастатин в соответствии с примерами 1-3, четко сохранялся в достаточной степени, для того чтобы его можно было идентифицировать на поверхности таблеток невооруженным глазом, подтверждая в результате хорошее качество таблеток.
Соответственно, при таблетировании гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента (заданная масса: 200 мг), в случае сравнительного примера 1, двухслойная таблетка может быть приготовлена путем таблетирования гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента, в соответствии с примером приготовления 2-1, где гранулы имеют распределение частиц по размеру с величиной D50, равной 71,66 мкм. Однако в примерах 1-3, двухслойная таблетка может быть получена путем таблетирования гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента, в соответствии с примером приготовления 2-2 - примером приготовления 2-4, где гранулы имеют распределение частиц по размеру с величиной D50, равной 80,00 мкм или более. Было подтверждено, что когда величина распределения частиц по размеру гранул равна определенному уровню или меньше его, эта величина распределения частиц по размеру приводит к нарушению технологии таблетирования, такому как прилипание в процессе таблетирования, и также было подтверждено, что качество таблеток (отпечаток на поверхности таблетки и другие подобные характеристики) не соответствуют фармацевтическим стандартам.
Другими словами, смесь гидрата лактозы и микрокристаллической целлюлозы, которая влияет на процесс таблетирования, может содержаться в количестве от 40 до 50 масс.% от суммарной массы гранул аторвастатина, содержащихся во втором слое, и, соответственно, было подтверждено, что величина распределения частиц по размеру (D50) гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента, может достигать определенного уровня или более за счет изменения величины распределения частиц по размеру (D50) смеси гидрата лактозы и микрокристаллической целлюлозы, вследствие чего не возникает нарушения технологии таблетирования при осуществлении процесса таблетирования фимасартана и аторвастатина в двухслойную таблетку.
Кроме того, было подтверждено, что даже в случае использования смеси гидрата лактозы и микрокристаллической целлюлозы в тех же условиях, но если при этом увеличивать количество раствора связующего вещества во время влажного гранулирования в соответствии с примером приготовления 2-5, или увеличивать регулируемый размер гранул в соответствии с примером приготовления 2-6, то полученная величина распределения частиц по размеру (D50) гранул может быть увеличена в большей степени, чем величина распределения частиц по размеру (D50) гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента, в соответствии с примером приготовления 2-1, и, в результате, не возникает нарушения технологии таблетирования, такого как прилипание, при осуществлении процесса таблетирования с фимасартаном.
Пример проведения эксперимента 2. Оценка однородности содержания
После таблетирования гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента в соответствии с примером приготовления 2-1 - примером приготовления 2-6, методом 3 (заданная масса: 200 мг), измеряли отклонение массы таблетки от среднего значения, и результаты приведены в таблице 6 ниже.
Согласно данным, приведенным выше в таблице 6, гранулы, содержащие тригидрат аторвастатина кальция в качестве активного ингредиента в соответствии с примером приготовления 2-1, приводили к нарушению технологии таблетирования, такому как прилипание в процессе таблетирования, и, в результате, было подтверждено, что даже если режимы работы оборудования устанавливали в соответствии с заданной массой (200 мг), масса таблетки не достигала заданной величины, и таблетку признавали непригодной с точки зрения однородности содержания из-за большого отклонения массы (пороговая величина для принятия решения: 15,4, коэффициент принятия решения: 2,4, референсная величина: 98,5. Однако было подтверждено, что в случае гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента в соответствии с примером приготовления 2-2 (пороговая величина для принятия решения: 1,9, коэффициент принятия решения: 2,4, референсная величина: 99,5), гранулы, содержащие тригидрат аторвастатина кальция в качестве активного ингредиента в соответствии с примером приготовления 2-3 (пороговая величина для принятия решения: 1,2, коэффициент принятия решения: 2,4, референсная величина: 99,8), и гранулы содержащие тригидрат аторвастатина кальция в качестве активного ингредиента в соответствии с примером приготовления 2-4 (пороговая величина для принятия решения: 3,5, коэффициент принятия решения: 2,4, референсная величина: 99,6), что не происходит нарушения технологии таблетирования в процессе таблетирования, таблетки характеризуются хорошими свойствами, пороговая величина для принятия решения об отклонении величины массы рассчитывается как равная или меньшая, чем референсная величина (референсная величина: 15), и на основании этого таблетки признавали соответствующими требованиям по однородности содержания.
Кроме того, было подтверждено в случае гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента в соответствии с примером приготовления 2-5 (пороговая величина для принятия решения: 2,2, коэффициент принятия решения: 2,4, референсная величина: 99,9), гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента в соответствии с примером приготовления 2-6 (пороговая величина для принятия решения: 2,0, коэффициент принятия решения: 2,4, референсная величина: 99,6), что не происходит нарушения технологии таблетирования в процессе таблетирования, таблетки характеризуются хорошими свойствами, пороговая величина для принятия решения об отклонении величины массы рассчитывается как равная или меньшая, чем референсная величина (референсная величина: 15), и на основании этого таблетки признавали соответствующими требованиям по однородности содержания.
В частности, при приготовлении гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента, необходимо добавлять в качестве стабилизатора большое количество осажденного карбоната кальция, который представляет собой мелкодисперсный порошок, что вызывает нарушение технологии таблетирования, такое как прилипание в процессе таблетирования гранул аторвастатина. Однако было подтверждено, что при тех же самых условиях таблетирования можно регулировать размер частиц (D50) смеси гидрата лактозы и микрокристаллической целлюлозы, в результате чего что распределение частиц по размеру (D50) гранул, содержащих тригидрат аторвастатина кальция в качестве активного ингредиента, может достигать определенной величины или более, что значительно улучшает свойства таблетирования при высокой степени однородности содержания.
Несмотря на то, что выше были подробно описаны конкретные разделы настоящего изобретения, тем не менее, для специалистов в данной области техники является очевидным, что такие подробные описания приведены только с целью иллюстрации примеров вариантов осуществления, и они никоим образом не ограничивают объем настоящего изобретения. Поэтому, следует иметь в виду, что фактический объем настоящего изобретения определяется прилагаемой формулой изобретения и ее эквивалентами.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТАБЛЕТКА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2016 |
|
RU2697660C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 2019 |
|
RU2756452C1 |
| ФАРМАЦЕВТИЧЕСКОЕ КОМБИНИРОВАННОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2014 |
|
RU2639818C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ФИМАСАРТАН И ГИДРОХЛОРТИАЗИД | 2013 |
|
RU2613900C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ | 2016 |
|
RU2702117C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПЛЕКСНАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ АМЛОДИПИН, ЛОЗАРТАН И РОЗУВАСТАТИН | 2016 |
|
RU2724338C2 |
| ФАРМАЦЕВТИЧЕСКИЙ КОМБИНИРОВАННЫЙ СОСТАВ, СОДЕРЖАЩИЙ АМЛОДИПИН, ЛОЗАРТАН И РОЗУВАСТАТИН | 2014 |
|
RU2660586C1 |
| Комбинированная композиция, содержащая метформин замедленного высвобождения и ингибитор HMG-CoA-редуктазы немедленного высвобождения | 2014 |
|
RU2651460C2 |
| КОМБИНИРОВАННАЯ КОМПОЗИЦИЯ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ, СОДЕРЖАЩАЯ ЭЗЕТИМИБ И РОЗУВАСТАТИН | 2014 |
|
RU2683937C2 |
| ФАРМАЦЕВТИЧЕСКАЯ ЛЕКАРСТВЕННАЯ ФОРМА АТОРВАСТАТИНА | 2005 |
|
RU2395280C2 |
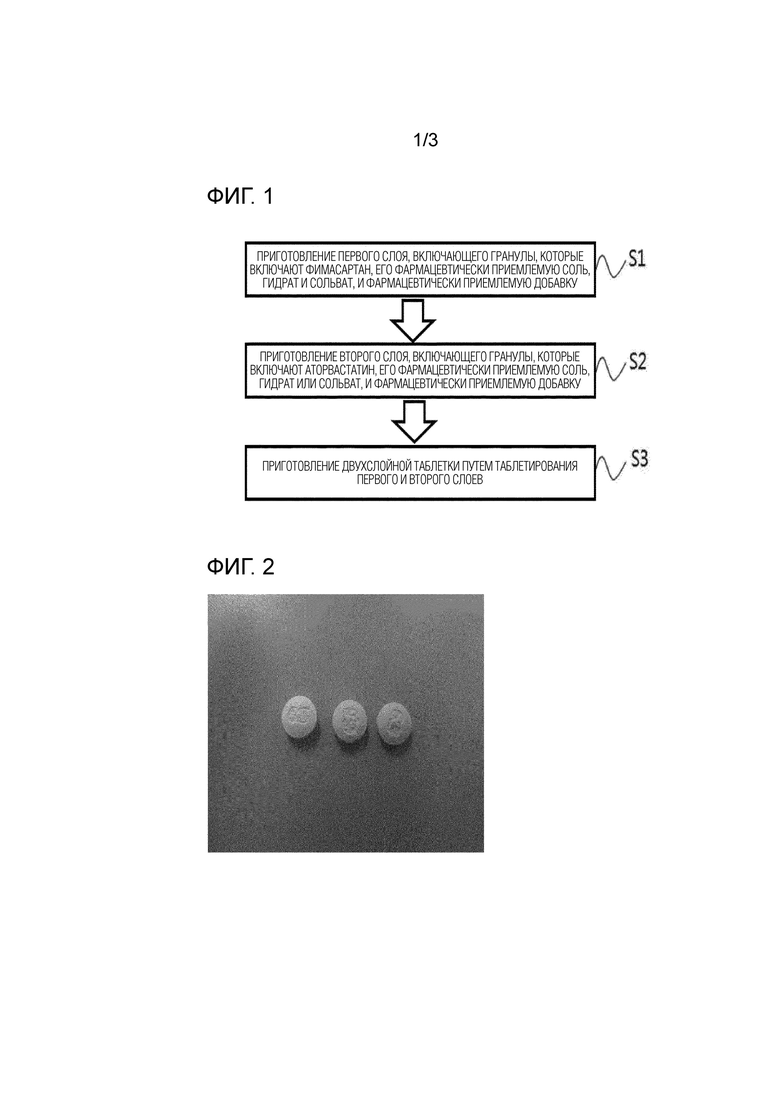
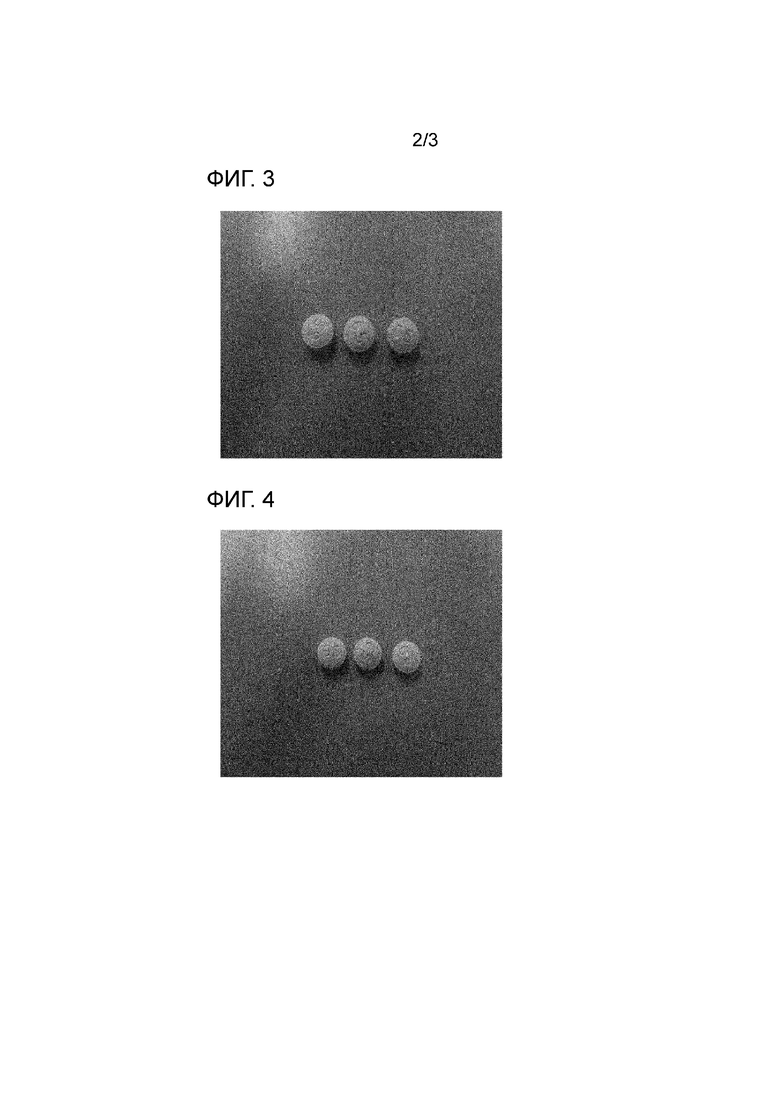
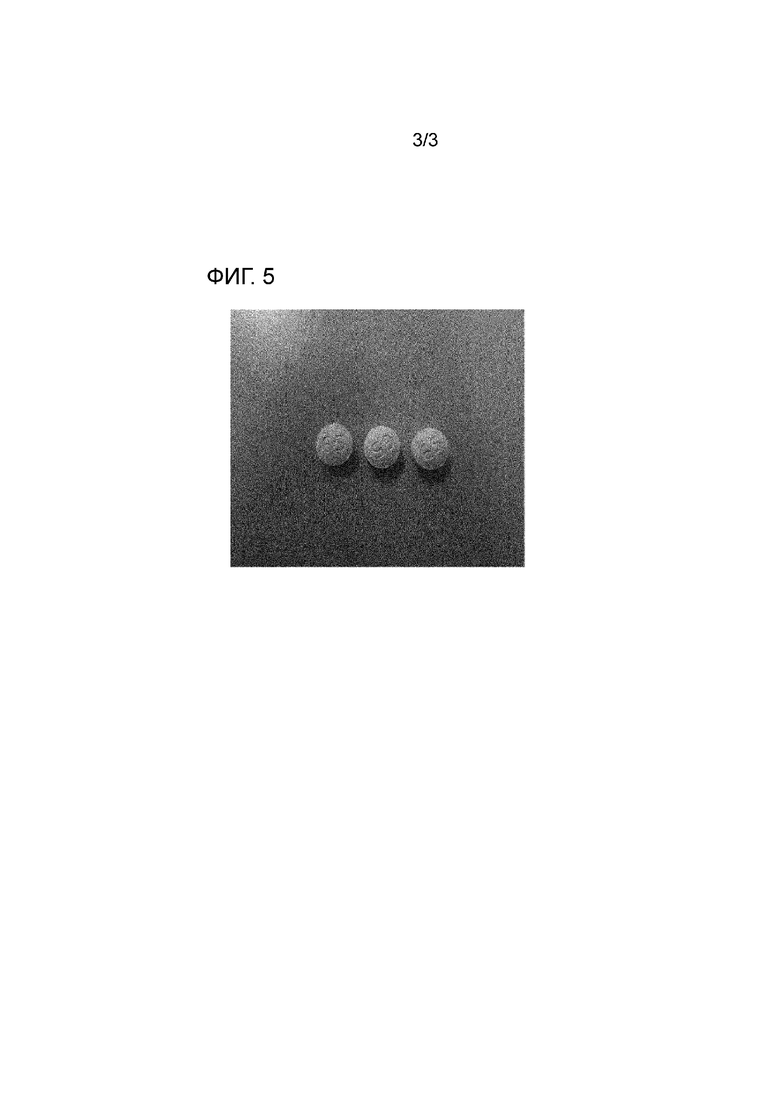
Настоящее изобретение относится к таблетке и к способу ее приготовления, где гранулы аторвастатина подвергают корректировке, для того чтобы они имели заданную величину распределения частиц по размеру или превышающую ее, в результате чего значительно улучшаются характеристики таблетирования в процессе таблетирования с фимасартаном, что позволяет достигать очень высокой однородности состава таблетки и делает возможным экономически эффективное и легко технологически осуществимое массовое производство этих таблеток. 3 н. и 13 з.п. ф-лы, 5 ил., 6 табл., 5 пр.
1. Таблетка для предотвращения или лечения гипертензии и гиперлипидемии, включающая:
первый слой, включающий гранулы, содержащие тригидрат фимасартана калия, микрокристаллическую целлюлозу, кроскармеллозу натрия, гидроксипропилцеллюлозу и стеарат магния; и
второй слой, включающий гранулы, содержащие тригидрат аторвастатина кальция, карбонат кальция, гидрат лактозы, микрокристаллическую целлюлозу, полисорбат 80, кроскармеллозу натрия, гидроксипропилцеллюлозу и стеарат магния,
где гранулы второго слоя характеризуются распределением частиц по размеру с величиной D50, равной от 80 мкм до 260 мкм.
2. Таблетка для предотвращения или лечения гипертензии и гиперлипидемии, включающая:
первый слой, включающий гранулы, включающие тригидрат фимасартана калия, микрокристаллическую целлюлозу, кроскармеллозу натрия, гидроксипропилцеллюлозу и стеарат магния; и
второй слой, включающий гранулы, включающие тригидрат аторвастатина кальция, карбонат кальция, гидрат лактозы, микрокристаллическую целлюлозу, полисорбат 80, кроскармеллозу натрия, гидроксипропилцеллюлозу и стеарат магния,
где смесь гидрата лактозы и микрокристаллической целлюлозы второго слоя характеризуются распределением частиц по размеру с величиной D50, равной от 75 мкм до 200 мкм; и
где гранулы второго слоя характеризуются распределением частиц по размеру с величиной D50, равной от 80 мкм до 260 мкм.
3. Таблетка по п. 1, где гранулы второго слоя характеризуются распределением частиц по размеру с величиной D10 от 14 до 70 мкм.
4. Таблетка по п. 1, где гранулы второго слоя характеризуются распределением частиц по размеру с величиной D90 от 290 до 600 мкм.
5. Таблетка по п. 1, где таблетка представляет собой двухслойную таблетку.
6. Таблетка по п. 1, где содержание тригидрата фимасартана калия в стандартной лекарственной форме составляет от 0,5 до 240,0 мг.
7. Таблетка по п. 1, где содержание тригидрата аторвастатина кальция в стандартной лекарственной форме составляет от 1,0 до 100,0 мг.
8. Таблетка по п. 1, где содержание смеси гидрата лактозы и микрокристаллической целлюлозы второго слоя составляет от 40 до 50 масс.% от суммарной массы гранул второго слоя.
9. Таблетка по п. 8, где кальция карбонат второго слоя представляет собой осажденный карбонат кальция.
10. Таблетка по п. 1, где гранулы второго слоя включают от 1 до 10 частей по массе тригидрата аторвастатина кальция, от 50 до 99,9 частей по массе смеси кальция карбоната, гидрата лактозы и микрокристаллической целлюлозы, от 0,1 до 2 частей по массе полисорбата 80, от 0,5 до 15 частей по массе кроскармеллозы натрия, от 0,1 до 10 частей по массе гидроксипропилцеллюлозы и от 0,1 до 5 частей по массе стеарата магния.
11. Таблетка по п. 1, где смесь карбоната кальция, гидрата лактозы и микрокристаллической целлюлозы включает от 30 до 50 частей по массе карбоната кальция, от 20 до 40 частей по массе гидрата лактозы и от 15 до 35 частей по массе микрокристаллической целлюлозы.
12. Таблетка по п. 1, где таблетка находится в форме двуслойной таблетки, состоящей из первого и второго слоев; и
таблетка дополнительно включает слой покрытия снаружи двухслойной таблетки, причем Opadry используется в качестве слоя покрытия.
13. Таблетка по п. 1, где гранулы первого и второго слоев представляют собой влажные гранулы.
14. Способ приготовления таблетки для предотвращения или лечения гипертензии и гиперлипидемии, где способ включает:
(S1) приготовление первого слоя, включающего гранулы, которые включают тригидрат фимасартана калия, микрокристаллическую целлюлозу, кроскармеллозу натрия, гидроксипропилцеллюлозу и стеарат магния;
(S2) приготовление второго слоя, включающего гранулы, которые включают тригидрат аторвастатина кальция, карбонат кальция, гидрат лактозы, микрокристаллическую целлюлозу, полисорбат 80, кроскармеллозу натрия, гидроксипропилцеллюлозу и стеарат магния; и
(S3) приготовление двухслойной таблетки путем таблетирования первого и второго слоев,
где гранулы второго слоя характеризуются распределением частиц по размеру с величиной D50, равной от 80 мкм до 260 мкм.
15. Способ по п. 14, где таблетирование первого слоя и второго слоя проводят путем приложения давления таблетирования от 5 до 15 кН.
16. Таблетка по п. 2, где содержание смеси гидрата лактозы и микрокристаллической целлюлозы составляет от 40 до 50 масс.% от суммарной массы второго слоя.
| KR 20110126020 A, 2011.11.22 | |||
| EP 3184103 A1, 2017.06.28 | |||
| Boryung Pharmaceutical Co., Ltd, A Study to Compare the Pharmacokinetics of Fimasartan/Atorvastatin Combination Tablet, Clinical Trials, February 25, 2016, найдено онлайн, найдено в Интернете: https://clinicaltrials.gov/ct2/history/NCT02566187 | |||
| BORYUNG PHARMACEUTICAL CO., LTD, A clinical |
Авторы
Даты
2023-05-22—Публикация
2019-12-30—Подача