Изобретение относится к области медицины и биохимии, в частности, к молекулярной диагностике, а именно к многопараметрической диагностической тест-системе, и может быть использовано в медицине при разработке, скрининге и проведении доклинических испытаний терапевтических препаратов, в частности, противовирусных.
Настоящее изобретение представляет собой диагностическую тест-систему для количественного определения уровней мРНК генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL мыши методом ПЦР в режиме реального времени в биологическом образце. Тест-система включает в себя две пробы-композиции, в которых одновременно проходят несколько ПЦР, а именно: в пробе I - определение уровней экспрессии генов мыши OAS1a/g, IL-6, IRF-7 и GAPDH (ген нормировки), в пробе II - определение уровня экспрессии генов мыши IFNA, IFNB, IFNL и GAPDH (ген нормировки).
Для изучения патогенеза вирусных инфекций in vivo требуются адекватные модели на животных. К часто используемым моделям гриппозной инфекции относятся модели на различных линиях мышей. В ответ на проникновение респираторной вирусной инфекции происходит индукция интерферонов (Interferons, IFN) и интерферон-стимулируемых генов (Interferon-stimulated genes, ISGs). Следовательно, уровень экспрессии IFN и ISGs является одним из ключевых параметров, определяющих иммунный ответ и тяжесть инфекционного заболевания. В силу этого оценка уровня мРНК IFN и ISGs является важнейшим критерием, определяющим специфические особенности патогенеза вирусной инфекции [1-4].
IFN I и III типов мыши (IFN-α, IFN-β и IFN-λ2/3) - это медиаторы врожденного иммунного ответа организма. В ответ на сигнал о проникновении вирусной инфекции IFN I и III типов подготавливают клетки к возможной вирусной инвазии [2, 3]. Способность клеток к экспрессии IFN зависит от уровня активации факторов транскрипции IRF (Interferon-regulatory factor). Считается, что в клетках с конститутивной экспрессией гена IRF-7 повышена продукция IFN [2]. Поэтому для оценки способности клеток к индукции IFN мы предлагаем оценивать уровень экспрессии гена IRF-7.
Действие IFN реализуется путем индукции экспрессии сотен ISGs, многие из которых обладают прямой противовирусной активностью. Ключевую роль для иммунного ответа к респираторным вирусам играет ген OAS1, обеспечивающий активацию РНКазы L, которая, в свою очередь, отвечает за деградацию как вирусной РНК, так и мРНК клетки хозяина. Таким образом, индукция OAS1 является одним из важнейших защитных противовирусных механизмов [2].
IL-6 является важнейшим провоспалительным цитокином, повышение уровня IL-6 коррелирует с наступлением наиболее тяжелой фазы гриппозной и коронавирусной инфекции и может служить маркером развития системного воспалительного процесса. Повышенная экспрессия гена IL-6 может быть ассоциирована с иммунопатологией и «цитокиновым штормом» [5]. Для комплексной оценки иммунной системы мышей при гриппозной инфекции мы предлагаем измерять уровень мРНК генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL мыши.
Таким образом, актуальность предлагаемого изобретения обусловлена необходимостью определения уровня экспрессии генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL мыши. Это может способствовать более глубокому пониманию патогенеза острых респираторных вирусных инфекций, оценки эффективности кандидатных противовирусных препаратов, в том числе и препаратов против вируса гриппа и коронавируса [6]. Отсутствие аналогичных коммерческих тест-систем делает данное изобретение уникальным продуктом интеллектуального творчества.
На сегодняшний день известны технические решения, в рамках которых описаны пептиды, представляющие собой антигенсвязывающий центр антитела [7, 8]. Причем в рамках данных технических решений могут быть определены следующие антигены: инсулин, инсулиноподобный фактор роста, hGH, tPA, цитокины, такие как интерлейкины (IL), например, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IFN-α, IFN-β, IFN-γ, IFN-ω или IFN-τ, фактор некроза опухоли (TNF), такой как TNF-α и TNF-β, TNF-γ, TRAIL, G-CSF, GM-CSF, M-CSF, MCP-1 и VEGF.
Также известны молекулы нуклеиновой кислоты, кодирующие полипептид, способный связываться с TFIIB и ингибировать экспрессию генов, выбранных из группы, в которую входят OAS1, IL-6, IL-7, IRF-7, IFNA и IFNB [9]. Однако отсутствует полноценная тест-система для количественной диагностики мРНК генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL.
Техническая проблема заключается в необходимости разработки эффективной тест-системы для количественной диагностики мРНК генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL мыши методом ПЦР в режиме реального времени.
Технический результат состоит в обеспечении возможности проведения быстрой и точной количественной оценки уровней мРНК генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL мыши.
Технический результат достигается тем, что тест-система для количественной диагностики мРНК генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL мыши на основе ПЦР включает две пробы-композиции, причем первая проба включает в себя следующие олигонуклеотидные праймеры и флуоресцентные зонды:
прямой праймер на ген OAS1a/g - GATGTGCCGACGGTGGT (SEQ NO. 1)
обратный праймер на ген OAS1a/g - TGGACAGGAGTCAAACATGGC (SEQ NO. 2)
флуоресцентный зонд на ген OAS1a/g - HEX-CACCTGGCATCAGACTCCGTGCTTCT-BHQ2 (SEQ NO. 3)
прямой праймер на ген IL-6 - TGATGGATGCTACCAAACTGGA (SEQ NO. 4)
обратный праймер на ген IL-6 - CTGAAGGACTCTGGCTTTGTCT (SEQ NO. 5)
флуоресцентный зонд на ген IL-6 - ROX-CTTCTGGAGTACCATAGCTACCTGGAGTA-BHQ2 (SEQ NO. 6)
прямой праймер на ген IRF-7 - CCTGGAAGCATTTCGGTCGT (SEQ NO. 7)
обратный праймер на ген IRF-7 - CTCTTCGCTCTCTTCGCTCA (SEQ NO. 8)
флуоресцентный зонд на ген IRF-7 - Cy5.5-CCACCTAGTGGAGTTAACCTGCCA-BHQ1 (SEQ NO. 9)
прямой праймер на ген GAPDH - AATGGTGAAGGTCGGTGTG (SEQ NO. 10)
обратный праймер на ген GAPDH - ACAAGCTTCCCATTCTCGG (SEQ NO. 11)
флуоресцентный зонд на ген GAPDH - FAM-TTGACTGTGCCGTTGAATTTGCCG-BHQ1 (SEQ NO. 12)
при этом вторая проба включает в себя следующие олигонуклеотидные праймеры и флуоресцентные зонды:
прямой праймер на ген IFNA - RGAHATAYTTCCACAGSATCACTGT (SEQ NO. 13)
обратный праймер на ген IFNA - YTTCTGCTCTGAYCACYTCC (SEQ NO. 14)
флуоресцентный зонд на ген IFNA - HEX-CCTGAGAGA(G/A)AAGAAACACAGCC(C/T)CTGT-BHQ1 (SEQ NO. 15)
прямой праймер на ген IFNB - ATGAGTGGTGGTTGCAGGC (SEQ NO. 16)
обратный праймер на ген IFNB - TGACCTTTCAAATGCAGTAGATTCAC (SEQ NO. 17)
флуоресцентный зонд на ген IFNB - Cy5-AAGCATCAGAGGCGGACTCTGGGAC-BHQ3 (SEQ NO. 18)
прямой праймер на ген IFNL2/3 - CAGTGCTGACAAGAACCCAAG (SEQ NO. 19)
обратный праймер на ген IFNL2/3 - TCAAGCAGCCTCTTCTCGATG (SEQ NO. 20)
флуоресцентный зонд на ген IFNL2/3 - ROX-CAGTGGAAGCAAAGGATTGCCACATTGCTC-BHQ2 (SEQ NO. 21)
прямой праймер на ген GAPDH - AATGGTGAAGGTCGGTGTG (SEQ NO. 22)
обратный праймер на ген GAPDH - ACAAGCTTCCCATTCTCGG (SEQ NO. 23)
флуоресцентный зонд на ген GAPDH - FAM-TTGACTGTGCCGTTGAATTTGCCG-BHQ1 (SEQ NO. 24)
Тест-система включает в себя две пробы-композиции, в которых одновременно проходят несколько ПЦР, а именно: в пробе I - определение уровней экспрессии генов мыши OAS1a/g, IL-6, IRF-7 и GAPDH (ген нормировки), в пробе II - определение уровня экспрессии генов мыши IFNA, IFNB, IFNL и GAPDH (ген нормировки).
С помощью указанной тест-системы осуществляют количественное определение уровня мРНК OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL мыши, в ходе которого проводят предварительную реакцию обратной транскрипции, а затем полимеразную цепную реакцию в реальном времени по следующим температурным профилям: первичная денатурация в течение 5 мин при температуре 95°С, далее 40 циклов двухступенчатой реакции, состоящей из этапа денатурации в течение 10 с при температуре 95°С и этапа отжига праймеров и элонгации цепи в течение 15 с при температуре 63°С для сета I (гены OAS1a/g, IL-6, IRF-7 и GAPDH); первичная денатурация в течение 5 мин при температуре 95°С, далее 40 циклов двухступенчатой реакции, состоящей из этапа денатурации в течение 10 с при температуре 95°С и этапа отжига праймеров и элонгации цепи в течение 40 с при температуре 60°С для сета II (IFNA, IFNB, IFNL и GAPDH).
Описание фигур
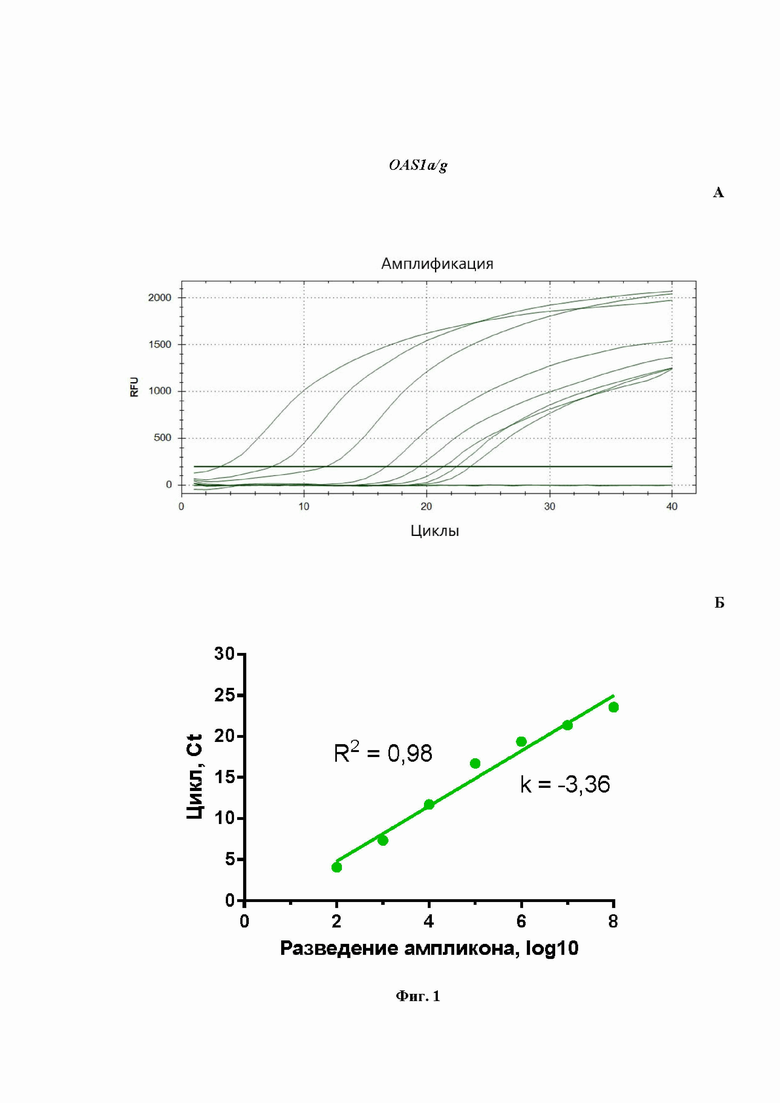
На Фиг.1 представлен расчет эффективности ПЦР для количественной оценки мРНК гена OAS1a/g, проведенной в моноплексном режиме: A - кривые роста флуоресценции, полученные для линейки разведений образцов (от -8 до -2) при анализе флуоресценции на канале HEX в режиме реального времени; Б - построенная по полученным значениям Cq кривая, используется для расчета эффективности реакции.
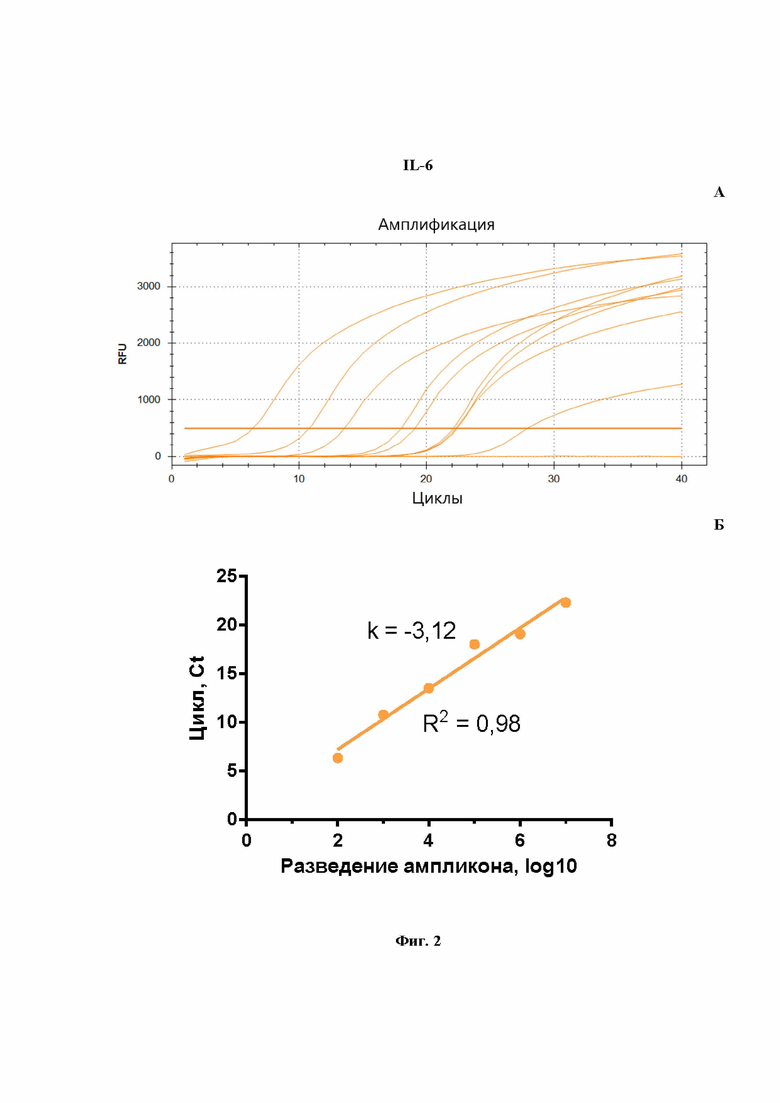
На Фиг.2 представлен расчет эффективности реакции ПЦР для количественной оценки мРНК гена IL-6, проведенной в моноплексном режиме: A - кривые роста флуоресценции, полученные для линейки разведений образцов (от -8 до -2) при анализе флуоресценции на канале ROX в режиме реального времени; Б - построенная по полученным значениям Cq кривая, используется для расчета эффективности реакции.
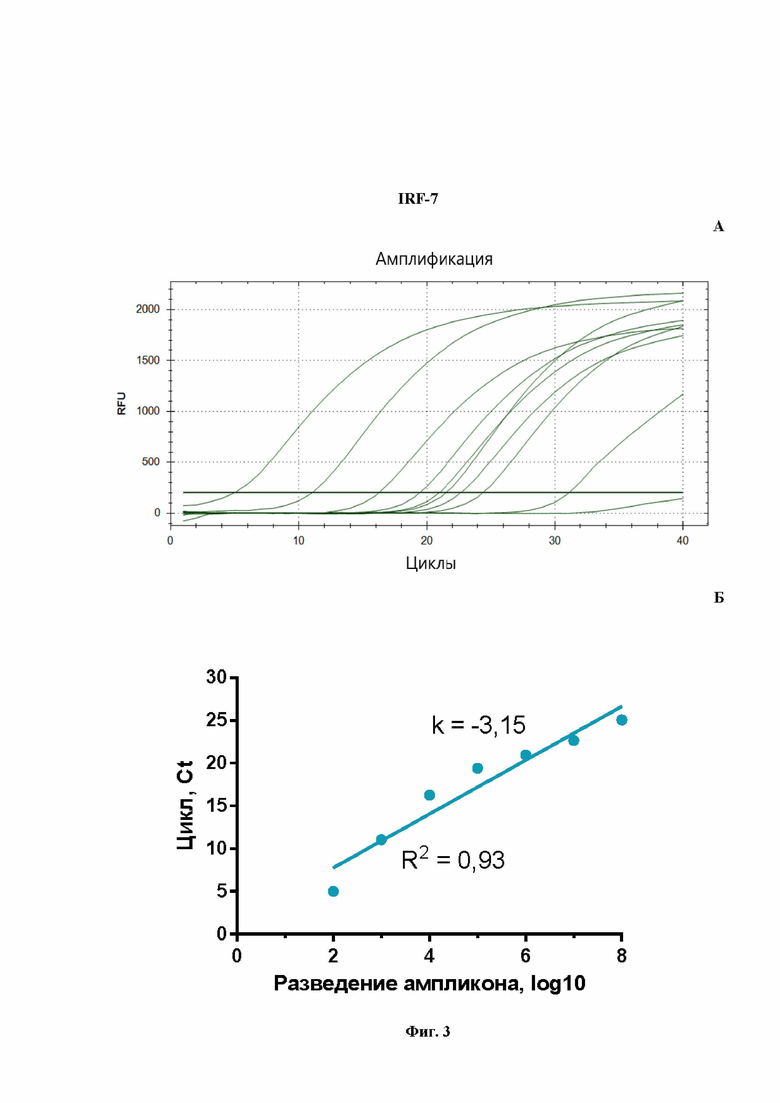
На Фиг.3 представлен расчет эффективности реакции ПЦР для количественной оценки мРНК гена IRF-7, проведенной в моноплексном режиме: A - кривые роста флуоресценции, полученные для линейки разведений образцов (от -8 до -2) при анализе флуоресценции на канале Cy5.5 в режиме реального времени; Б - построенная по полученным значениям Cq кривая, используется для расчета эффективности реакции.
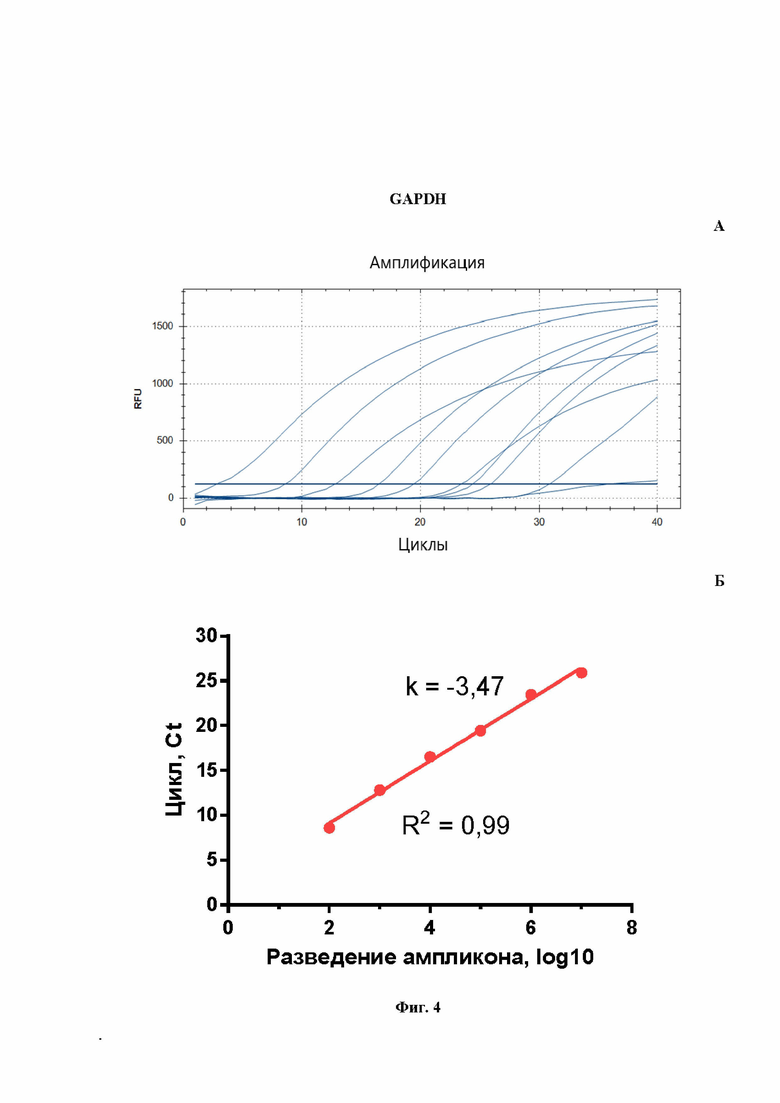
На Фиг.4 представлен расчет эффективности реакции ПЦР для количественной оценки мРНК гена GAPDH, проведенной в моноплексном режиме: A - кривые роста флуоресценции, полученные для линейки разведений образцов (от -7 до -2) при анализе флуоресценции на канале FAM в режиме реального времени; Б - построенная по полученным значениям Cq кривая, используется для расчета эффективности реакции.
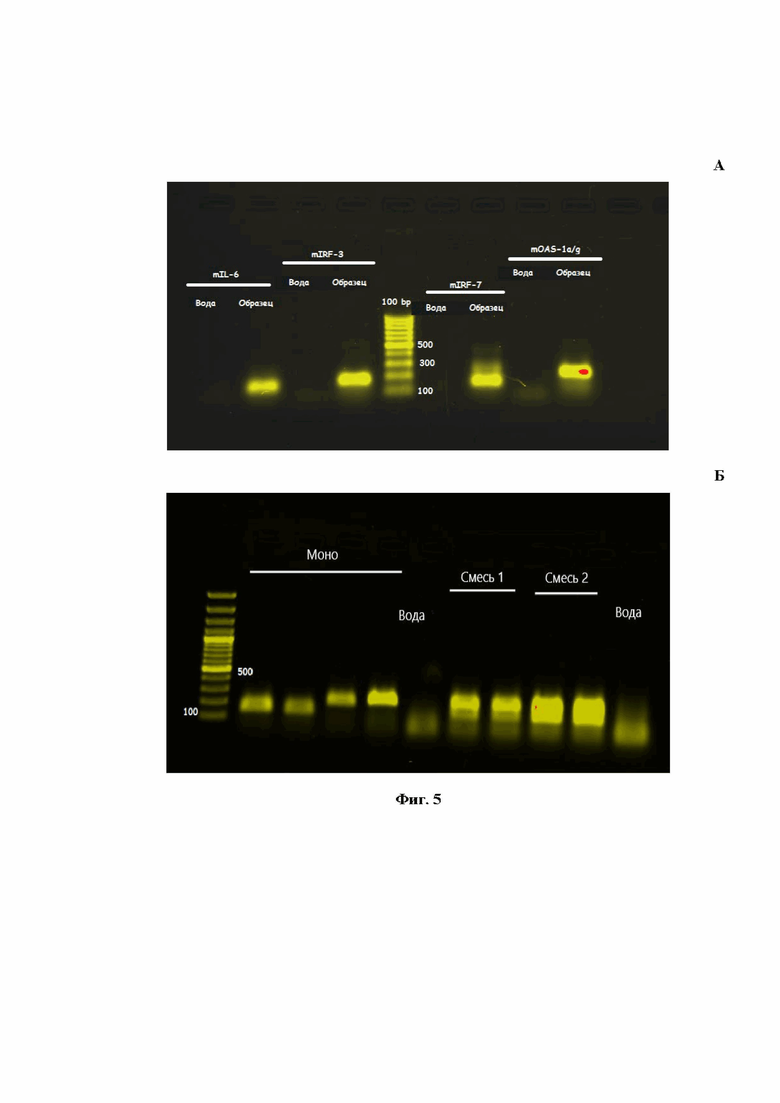
На Фиг.5 представлен результат электрофоретического разделения в агарозном геле продуктов, полученных в ходе проведения моноплексных (A) и мультиплексной (Б) ПЦР на гены OAS1a/g, IL-6, IRF-7 и GAPDH, для оценки возможности образования в ходе реакции нежелательных неспецифических продуктов.
На рисунке А показана электрофореграмма 2% агарозного геля, в котором проводили анализ ПЦР-продуктов после внесения в ПЦР-микс полученной в результате ревертирования тотальной РНК, выделенной из легочных тканей мышей (образец). Вода - негативный контроль, в ПЦР-смесь добавляли MilliQ-воду.
На рисунке Б показана электрофореграмма 2% агарозного геля, в котором проводили анализ ПЦР-продуктов моноплексной и мультиплексной (mix) ПЦР.
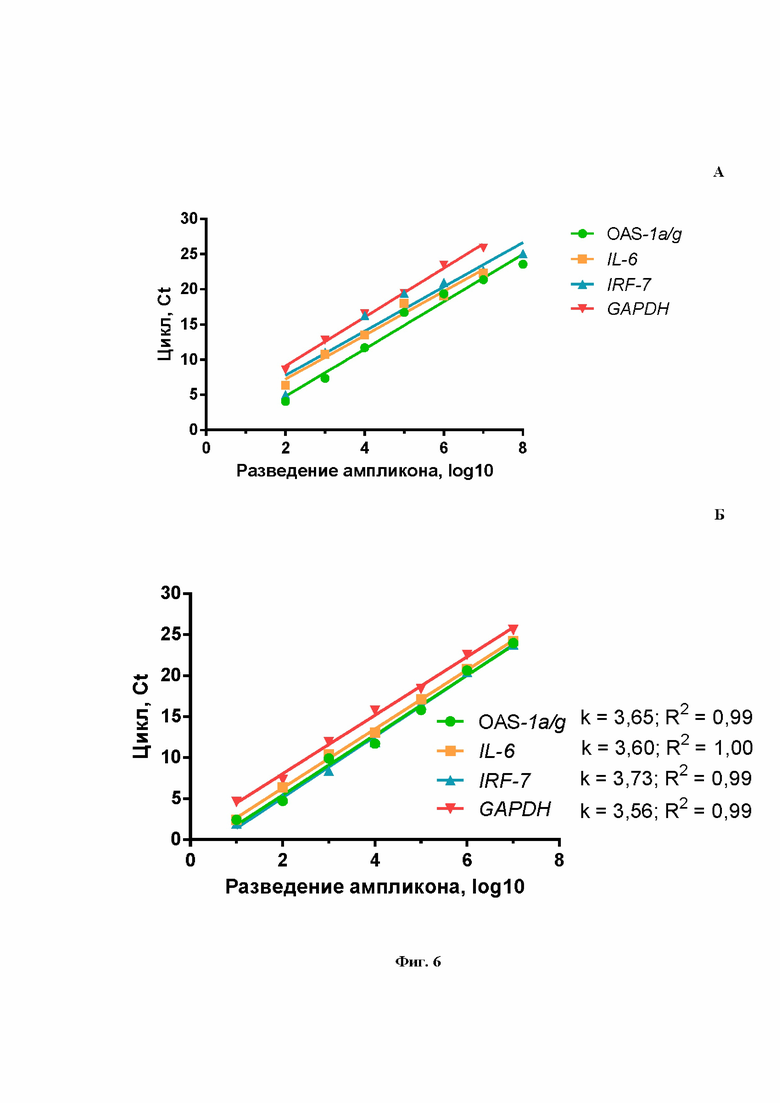
На Фиг.6 представлено сравнение эффективности амплификации генов OAS1a/g, IL-6, IRF-7 и GAPDH в моноплексном (А) и мультиплексном (Б) вариантах. На рисунке Б график зависимости цикла (Cq) от разведения ампликона аппроксимирован прямой линией, указан угловой коэффициент k и коэффициент аппроксимации R2.
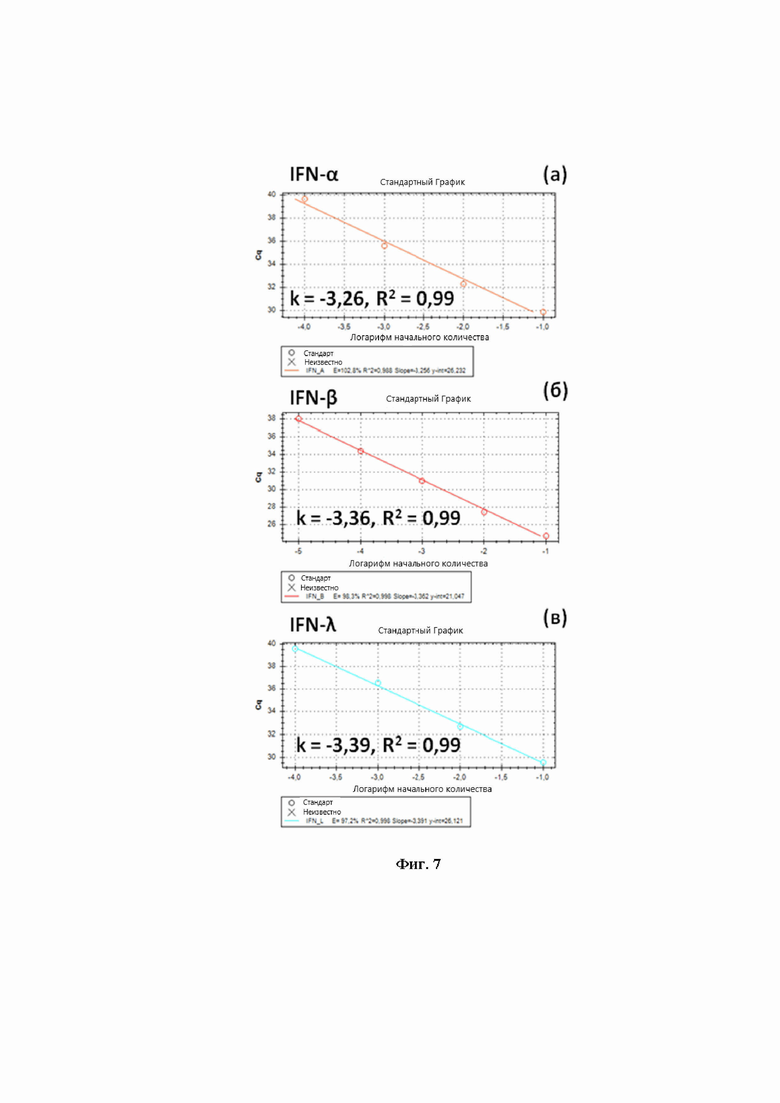
На Фиг.7 представлена зависимость значений Cq от разведений образцов, построенный график используется для расчета эффективности реакции на гены IFNA, IFNB, IFNL в моноплексном формате.
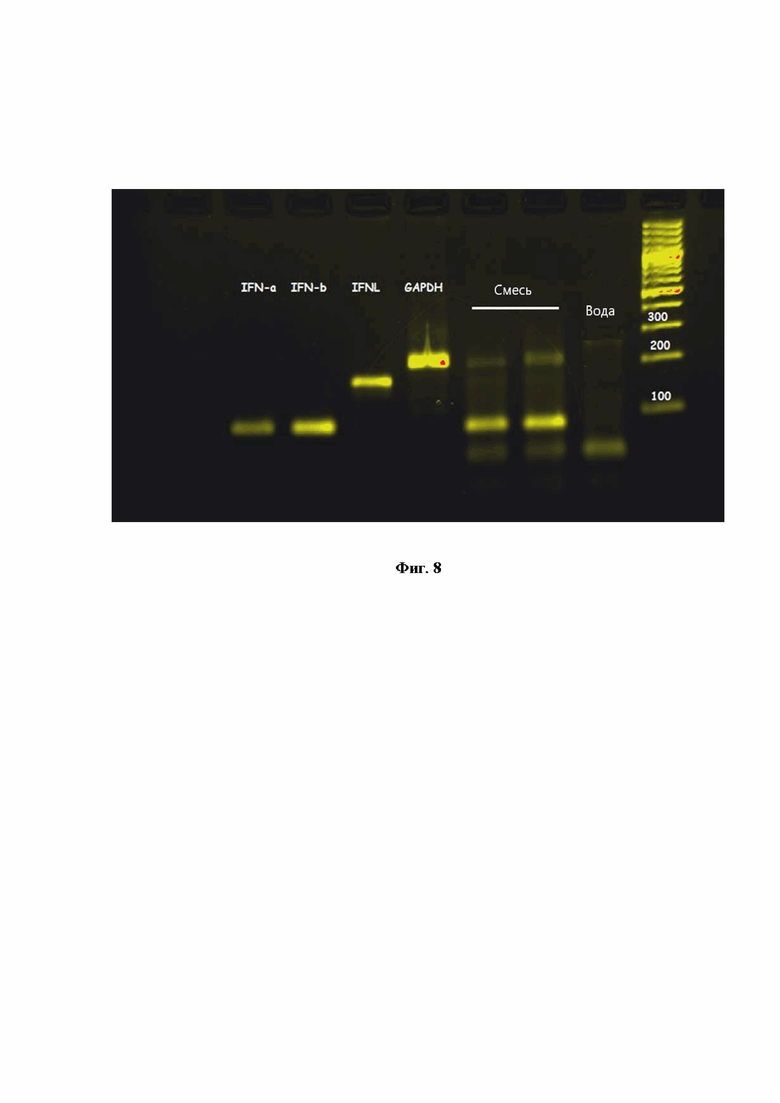
На Фиг.8 представлена электрофореграмма 2% агарозного геля, в котором проводили анализ ПЦР-продуктов моноплексной и мультиплексной (mix) ПЦР на гены IFNA, IFNB, IFNL и GAPDH. Вода - негативный контроль, в ПЦР-смесь добавляли MilliQ-воду.
На Фиг.9 представлена зависимость значений Cq от разведений образцов, построенный график используется для расчета эффективности реакции на гены IFNA, IFNB, IFNL в мультиплексном формате.
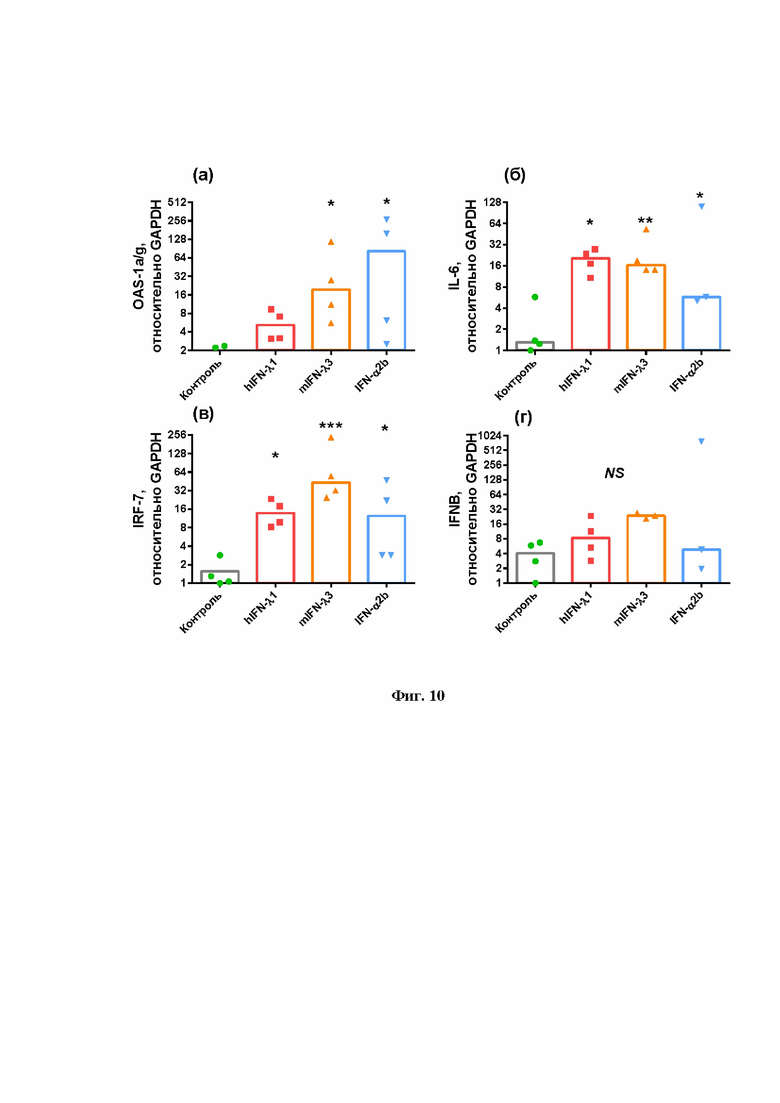
На Фиг.10 показано, что внесение экзогенных IFN (IFN-α2b, IFN-λ человека 1-го типа, IFN-λ мыши 3-го типа) стимулирует экспрессию OAS1a/g (а), IL-6 (б), IRF-7 (в). В то же время интраназальное введение рекомбинантных IFN не индуцирует экспрессию IFNB (г) и других IFN.
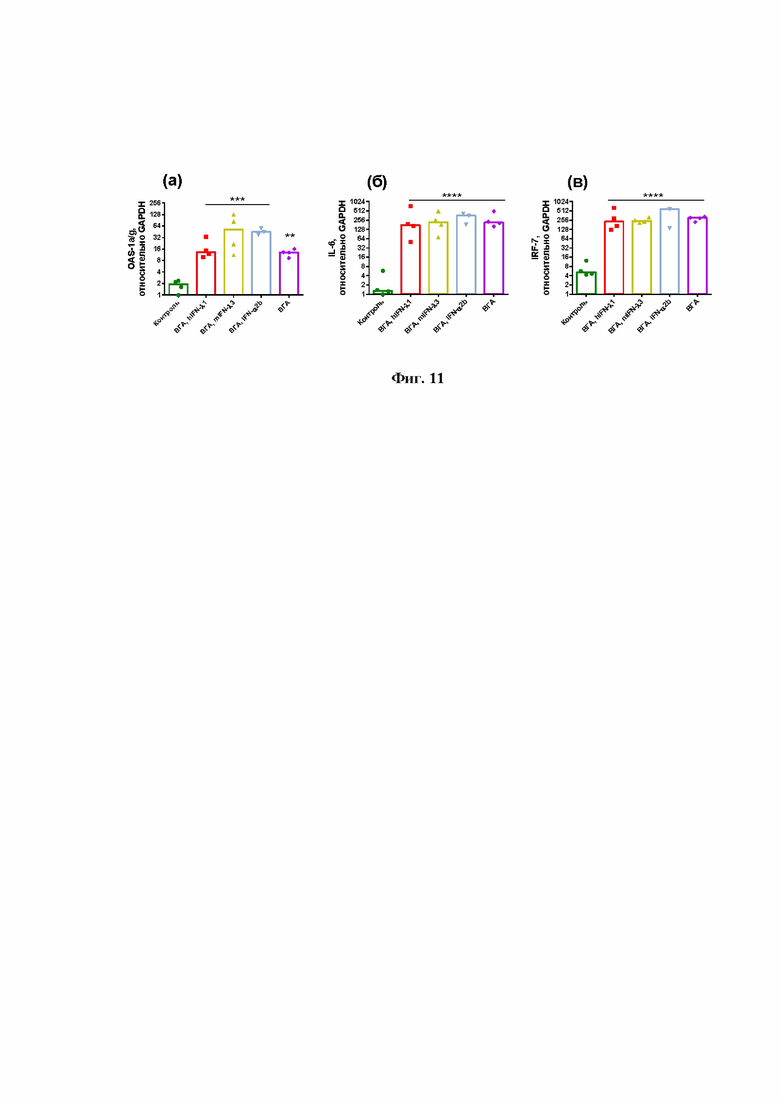
На Фиг.11 показано, что инфицирование мышей вирусом гриппа А в летальной дозе стимулирует экспрессию всех представленных в сете 1 генов (OAS1a/g, IL-6, IRF-7).
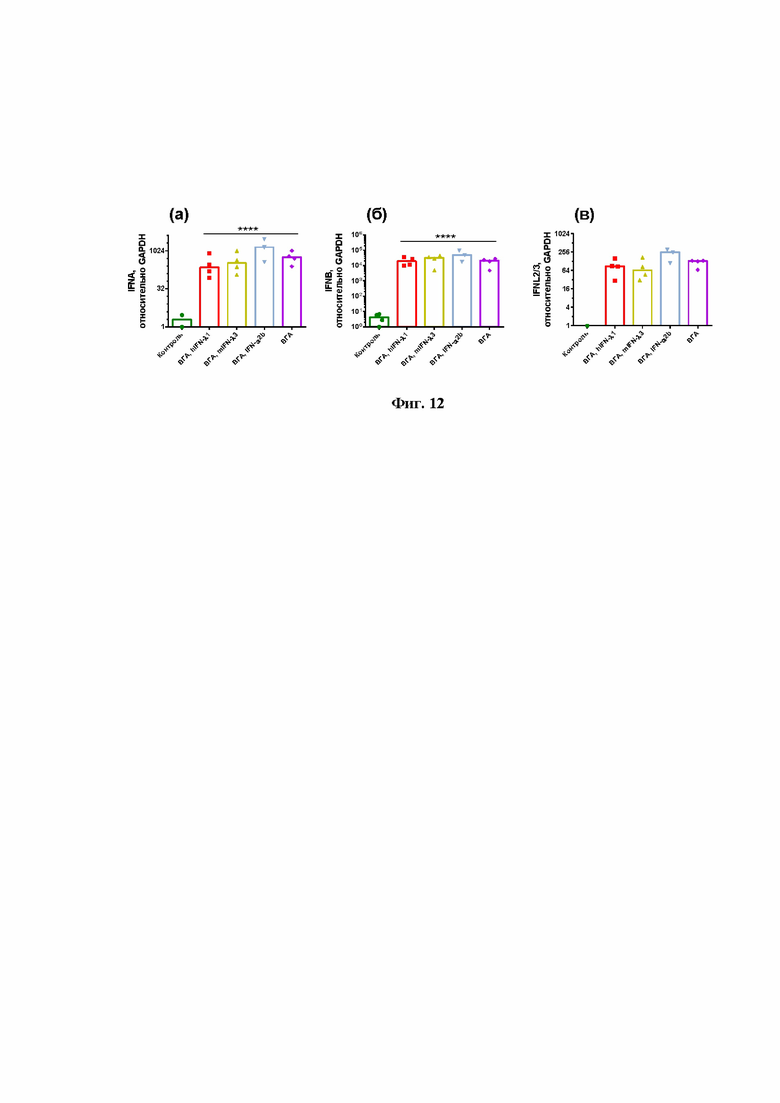
На Фиг.12 показано, что инфицирование мышей вирусом гриппа А в летальной дозе стимулирует экспрессию всех представленных в сете 2 генов (IFNA, IFNB, IFNL).
Заявляемое изобретение поясняется примерами.
Пример 1. Дизайн праймеров и олигонуклеотидных зондов
Для определения уровня экспрессии генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL мыши был проведен дизайн праймеров и олигонуклеотидных зондов. Оригинальные последовательности всех праймеров и зондов для количественной оценки мРНК генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL мыши были подобраны к белок-кодирующей области генов таким образом, чтобы праймеры были разделены областью интрона, температуры их плавления были схожи, а длины ампликонов, образующихся в процессе ПЦР, не превышали 300 п.н. В качестве эндогенного контроля, используемого для нормировки экспрессии генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL мыши, был предложен ген глицеральдегид-3-фосфатдегидрогеназы мыши (GAPDH) (табл.1).
Пример 2. Подбор и оптимизация условий ПЦР
На данном этапе работы была проведена оценка качества подобранных пар праймеров и зондов, а также возможность образования ими гетеро- и гомодимеров и неспецифических продуктов. В качестве матрицы для проведения данного исследования использовали образцы кДНК, полученные из препаратов тотальной РНК, выделенных из легких инфицированных вирусом гриппа A мышей линии BALB/c. Работа проводилась с использованием 2× реакционной смеси, содержащей Taq ДНК-полимеразу с «горячим» стартом, для проведения ПЦР с контролем по конечной точке (БиоМастер HS-Taq ПЦР (2×), Биолабмикс). Реакцию проводили в объеме 25 мкл, содержащем прямой и обратный праймер в концентрации 500 нМ и олигонуклеотидный зонд в концентрации 200 нМ. Для определения оптимального термального профиля реакций были проведены ПЦР с температурным градиентом отжига праймеров: 1) 95°С - 5 минут; 2) [95°С - 10 c; градиент температур 55°С - 65°С - 30 c] - 40 циклов.
Детекцию результатов осуществляли по росту флуоресценции, наличие неспецифических продуктов оценивали электрофоретическим разделением продуктов в агарозном геле.
С учетом полученных результатов в качестве оптимального температурного профиля проводимой мультиплексной ПЦР для сета I было предложено использовать следующий температурный режим:
1) первичная денатурация 95°С - 5 мин,
далее 40 двухступенчатых циклов:
2) денатурация 95°С - 10 с;
3) отжиг праймеров и элонгация цепи 63°С - 15 c.
Для сета II было предложено использовать следующий термический профиль:
1) первичная денатурация 95°С - 5 мин,
далее 40 двухступенчатых циклов:
2) денатурация 95°С - 10 с;
3) отжиг праймеров и элонгация цепи 60°С - 40 c.
Пример 3. Расчет эффективностей ПЦР
Для корректного проведения относительного количественного анализа экспрессии генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL мыши в мультиплексном формате значения эффективностей амплификации соответствующих мРНК должны быть идентичными или максимально приближенными друг к другу. Поэтому далее при подобранных оптимальных условиях были рассчитаны эффективности проводимых ПЦР.
Для определения эффективностей реакций использовали специфические очищенные ампликоны, полученные в неколичественных ПЦР (без использования TaqMan зонда). Расчет проводили по углу наклона кривой, полученной в результате постановки qПЦР с серией последовательных разбавлений подготовленных ампликонов.
На Фиг.1Б показаны результаты расчета эффективности ПЦР при амплификации гена OAS1a/g в формате моноплексной ПЦР. Рассчитанная эффективность ПЦР на ген OAS1a/g (Фиг.1Б) составила 98%, что является хорошим параметром амплификации. Аналогичным образом были получены эффективности амплификации ПЦР для IL-6 (Фиг.2Б), IRF-7 (Фиг.3Б) и GAPDH (Фиг.4Б). Таким образом, продемонстрировано, что в моноплексном формате эффективности амплификации продуктов этих трех генов составили: 109%, 108%, 94%, соответственно. Стандартные калибровочные кривые, представленные на Фиг.1-4Б, имеют похожие углы наклона, т.е. параллельны.
При постановке мультиплексной ПЦР амплификация всех включенных в сет генов проводилась одновременно в одной пробирке. При этом в пробу ПЦР, содержащую фермент ДНК-зависимую ДНК-полимеразу и прилагаемый к ней буфер, также добавлялись все подобранные пары праймеров и олигонуклеотидные зонды, специфически выявляющие заявленные гены. Конечные концентрации праймеров и зондов, содержащиеся в пробе при проведении мультиплексной ПЦР, представлены в таблице 2.
Ввиду того, что во время реакции пары праймеров могут давать неспецифические химерные продукты, был проведен анализ продуктов моноплексной (а) и мультиплексной (б) ПЦР методом электрофоретического разделения в агарозном геле (Фиг.5).
Результаты, представленные на Фиг.5, свидетельствуют о том, что при проведении моноплексной ПЦР в пробирках амплифицировались только целевые продукты, соответствующие заявленным генам OAS1a/g, IL-6, IRF-7, GAPDH. Продукты ПЦР представлены яркими бэндами с длинами, соответствующими расчетным: 211 п.н., 142 п.н., 147 п.н. и 198 п.н. для каждого анализируемого гена (OAS1a/g, IL-6, IRF-7, GAPDH мыши, соответственно). При проведении мультиплексной ПЦР в пробирке одновременно выявлялись все четыре гена, имеющие аналогичные длины. Таким образом, в ходе мультиплексной ПЦР не образовывались какие-либо нежелательные неспецифические продукты.
Далее были рассчитаны эффективности амплификации каждого из заявленных генов при проведении мультиплексной ПЦР. Как продемонстрировано на Фиг.6А, эффективности амплификации всех специфических продуктов OAS1a/g, IL-6, IRF-7, GAPDH при проведении ПЦР в одной пробирке составили около 90%.
Аналогично было показано, что эффективность ПЦР на гены IFNA, IFNB, IFNL составляла 103%, 98% и 97%, соответственно (Фиг.7). При электрофоретическом разделении продуктов ПЦР не было обнаружено бэндов, соответствующих неспецифическим продуктам амплификации (Фиг.8), расчет эффективности ПЦР в мультиплексном формате показал, что в этом случае эффективность амплификации генов была не ниже 85% (Фиг.9).
Пример 4. Верификация тест-системы на опытных образцах
Разработанная тест-система применялась для одновременного измерения экспрессии генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL в легких зараженных гриппом мышей, а также в легких контрольной группы мышей. Диагностика инфекции была проведена ПЦР-набором, сертифицированным для проведения подобных исследований.
В результате измерения было установлено, что в ответ на интраназальное введение рекомбинантных IFN в легких мышей возрастает уровень OAS1a/g, IL-6, IRF-7, в то время как уровень экспрессии эндогенных IFN I и III типов достоверно не меняется (Фиг.10).
Инфицирование мышей вирусом гриппа А в дозе 5 минимальных летальных доз на мышь приводит к достоверному возрастанию уровня экспрессии всех генов (OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL). Уровень мРНК генов IL-6 и IFNL возрастал более чем в 100 раз по сравнению с контролем, тогда как было отмечено повышение IFNA и IFNB не менее чем на 3 порядка (в 1000 раз) (Фиг.11 и Фиг.12).
Использование разработанной мультиплексной ПЦР тест-системы позволяет с высокой эффективностью проводить количественный анализ генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL мыши в биологических образцах. Гриппозная инфекция индуцирует экспрессию всех указанных генов.
Список литературы
1. Haller O. et al. Mx GTPases: dynamin-like antiviral machines of innate immunity //Trends in microbiology. - 2015. - Т. 23. - №. 3. - С.154-163.
2. Randall R. E., Goodbourn S. Interferons and viruses: an interplay between induction, signalling, antiviral responses and virus countermeasures //Journal of General Virology. - 2008. - Т. 89. - №. 1. - С.1-47.
3. Stanifer M. L., Pervolaraki K., Boulant S. Differential regulation of type I and type III interferon signaling //International journal of molecular sciences. - 2019. - Т. 20. - №. 6. - С.1445.
4. Stanifer M. L. et al. Critical role of type III interferon in controlling SARS-CoV-2 infection in human intestinal epithelial cells //Cell reports. - 2020. - Т. 32. - №. 1. - С.107863.
5. Xi-zhi J. G., Thomas P. G. New fronts emerge in the influenza cytokine storm //Seminars in immunopathology. - Springer Berlin Heidelberg, 2017. - Т. 39. - №. 5. - С.541-550.
6. Dinnon K. H. et al. A mouse-adapted model of SARS-CoV-2 to test COVID-19 countermeasures //Nature. - 2020. - С.1-9.
7. Модифицированные нуклеозиды, нуклеотиды и нуклеиновые кислоты и их применение: патент RU2648950, Российская Федерация, заявка RU2014117701, заявл. 03.10.2012, опубл. 02.04.2018.
8. Модифицированные нуклеозиды, нуклеотиды и нуклеиновые кислоты и их применение: патент RU2707251, Российская Федерация, заявка RU2018104839, заявл. 03.10.2012, опубл. 25.11.2019.
9. Средства и способы ингибирования экспрессии генов: заявка EP3205663, Европейская патентная организация, первичная заявка EP16155719, заявл. 15.02.2016, опубл. 16.08.2017.
| название | год | авторы | номер документа |
|---|---|---|---|
| Тест-система для количественной диагностики мРНК генов MxA, OAS1, EIF2AK2 человека на основе ПЦР | 2022 |
|
RU2811690C1 |
| Многопараметрическая диагностическая тест-система для количественного определения уровня мРНК генов RIG-1, IFIT-1, IFIH-1 человека | 2021 |
|
RU2782428C1 |
| Тест-система для количественной диагностики мРНК интерферонов I, II и III типов человека на основе ПЦР | 2020 |
|
RU2751791C1 |
| Количественный метод определения экспрессии аллелей GNAO1 здоровой формы и с мутацией c.607 G>A | 2021 |
|
RU2777663C1 |
| Аналитическая тест-система по определению чувствительности злокачественной опухоли конкретного пациента к онколитической биотерапии | 2017 |
|
RU2667648C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ РНК ИНТЕРФЕРОНА λ, ИНТЕРЛЕЙКИНА IL23 И ПРОТИВОВИРУСНОГО БЕЛКА MxA | 2016 |
|
RU2627179C1 |
| Экспресс-тест на основе ПЦР, позволяющий предсказывать чувствительность опухоли головного мозга конкретного пациента к онколитическим вирусам | 2016 |
|
RU2697412C2 |
| Набор для определения копийности гена АРР в геноме человека | 2021 |
|
RU2789799C1 |
| Набор для определения копийности вставки интересующей конструкции в AAVS1 локус генома человека | 2021 |
|
RU2786396C1 |
| Набор для определения CCR5delta32 мутации в геноме человека | 2020 |
|
RU2748998C1 |

Изобретение относится к области биотехнологии, в частности изобретение представляет собой диагностическую тест-систему для количественного определения уровней мРНК генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL мыши методом ПЦР в режиме реального времени в биологическом образце. Тест-система включает в себя две пробы-композиции, в которых одновременно проходят несколько ПЦР, а именно: в сете I - определение уровней экспрессии генов мыши OAS1a/g, IL-6, IRF-7 и GAPDH (ген нормировки), в сете II - определение уровня экспрессии генов мыши IFNA, IFNB, IFNL и GAPDH (ген нормировки). 1 з.п. ф-лы, 12 ил., 2 табл., 4 пр.
1. Тест-система для количественной диагностики мРНК генов OAS1a/g, IL-6, IRF-7, IFNA, IFNB, IFNL мыши на основе ПЦР, включающая две пробы-композиции, причем первая проба включает в себя следующие олигонуклеотидные праймеры и флуоресцентные зонды:
прямой праймер на ген OAS1a/g - GATGTGCCGACGGTGGT
обратный праймер на ген OAS1a/g - TGGACAGGAGTCAAACATGGC
флуоресцентный зонд на ген OAS1a/g - HEX-CACCTGGCATCAGACTCCGTGCTTCT-BHQ2
прямой праймер на ген IL-6 - TGATGGATGCTACCAAACTGGA
обратный праймер на ген IL-6 - CTGAAGGACTCTGGCTTTGTCT
флуоресцентный зонд на ген IL-6 - ROX-CTTCTGGAGTACCATAGCTACCTGGAGTA-BHQ2
прямой праймер на ген IRF-7 - CCTGGAAGCATTTCGGTCGT
обратный праймер на ген IRF-7 - CTCTTCGCTCTCTTCGCTCA
флуоресцентный зонд на ген IRF-7 - Cy5.5-CCACCTAGTGGAGTTAACCTGCCA-BHQ1
прямой праймер на ген GAPDH - AATGGTGAAGGTCGGTGTG
обратный праймер на ген GAPDH - ACAAGCTTCCCATTCTCGG
флуоресцентный зонд на ген GAPDH - FAM-TTGACTGTGCCGTTGAATTTGCCG-BHQ1,
при этом вторая проба включает в себя следующие олигонуклеотидные праймеры и флуоресцентные зонды:
прямой праймер на ген IFNA - RGAHATAYTTCCACAGSATCACTGT
обратный праймер на ген IFNA - YTTCTGCTCTGAYCACYTCC
флуоресцентный зонд на ген IFNA - HEX- CCTGAGAGA(G/A)AAGAAACACAGCC(C/T)CTGT -BHQ1
прямой праймер на ген IFNB - ATGAGTGGTGGTTGCAGGC
обратный праймер на ген IFNB - TGACCTTTCAAATGCAGTAGATTCAC
флуоресцентный зонд на ген IFNB - Cy5-AAGCATCAGAGGCGGACTCTGGGAC-BHQ3
прямой праймер на ген IFNL2/3 - CAGTGCTGACAAGAACCCAAG
обратный праймер на ген IFNL2/3 - TCAAGCAGCCTCTTCTCGATG
флуоресцентный зонд на ген IFNL2/3 - ROX-CAGTGGAAGCAAAGGATTGCCACATTGCTC-BHQ2
прямой праймер на ген GAPDH - AATGGTGAAGGTCGGTGTG
обратный праймер на ген GAPDH - ACAAGCTTCCCATTCTCGG
флуоресцентный зонд на ген GAPDH - FAM-TTGACTGTGCCGTTGAATTTGCCG-BHQ1.
2. Тест-система по п. 1, отличающаяся тем, что оптимальная концентрация праймеров и зонда к гену OAS1a/g составляет 200 нМ и 100 нМ, соответственно; для праймеров и зонда к гену IL-6 - 500 нМ и 200 нМ, соответственно; для праймеров и зонда к гену IRF-7 - 1000 нМ и 500 нМ, соответственно; для праймеров и зонда к гену IFNA - 500 нМ и 500 нМ, соответственно; для праймеров и зонда к гену IFNB - 200 нМ и 100 нМ, соответственно; для праймеров и зонда к гену IFNL - 500 нМ и 200 нМ, соответственно. Для эндогенного контроля, гена GAPDH, оптимальная концентрация праймеров и зонда в сете 1 составляет 200 нМ и 100 нМ, в сете 2 - 200 нМ и 100 нМ.
| Yao Y | |||
| et al | |||
| Use of type I interferon-inducible mRNAs as pharmacodynamic markers and potential diagnostic markers in trials with sifalimumab, an anti-IFNα antibody, in systemic lupus erythematosus //Arthritis research & therapy | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| - Т | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| - С | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Green J | |||
| C | |||
| et al | |||
| Measurement of interferon-tau (IFN-τ) stimulated gene expression in | |||
Авторы
Даты
2023-05-25—Публикация
2022-12-28—Подача