Изобретение относится к области медицины, биотехнологии, молекулярной биологии, может быть использовано для определения и подсчета количества копий гена АРР в исследуемом генетическим материале при генетическом скрининге. Актуальность изобретения связана с необходимостью скрининга для раннего обнаружения наследственных форм болезни Альцгеймера.
Болезнь Альцгеймера (БА) - наиболее распространенная форма деменции, впервые описанная в 1906 году немецким психиатром Алоисом Альцгеймером. В 2006 году общемировая заболеваемость оценивалась в 26,6 миллионов человек, а к 2050 году число больных может вырасти вчетверо [Bermejo-Pareja F. et al. Incidence and subtypes of dementia in three elderly populations of central Spain // J. Neurol. Sci. 2008. Vol. 264, №1-2. P. 63-72]. Существует две формы БА: наследственная форма (1% случаев заболеваемости БА) и ненаследственная форма БА. Клиническая картина развития заболевания идентична для обеих форм, однако, отличается возраст заболевших (от 35 лет для наследственной формы и от 55 лет для ненаследственной формы заболевания) [van Duijn С.М. et al. Amyloid precursor protein gene mutation in early-onset Alzheimer's disease. // Lancet. 1991. Vol. 337, №8747. P. 978-985]. В настоящее время механизм развития БА точно не установлен. Классическим маркером БА являются внеклеточные бета-амилоидные бляшки в тканях головного мозга, возникающие вследствие протеолитического расщепления мембранного белка-предшественника амилоида (АРР) [Shi Y. et al. A human stem cell model of early Alzheimer's disease pathology in Down syndrome. // Sci. Transl. Med. 2012. Vol. 4, №124. P. 124-129]. В пользу особой роли бета-амилоида говорит то, что наследственные формы БА связаны с мутациями в генах АРР или генах, кодирующих ферменты, участвующие в расщеплении АРР. Трипликация гена АРР является одним из важных часто-встречающихся факторов возникновения ранней формы БА. В пользу этой теории говорит факт о том, что люди с синдромом Дауна является крупнейшей когортой людей с предрасположенностью к БА в раннем возрасте [Antonarakis S.E. Down syndrome and the complexity of genome dosage imbalance // Nature Reviews Genetics. 2017. Vol. 18, №3. P. 147-163]. Скорее всего, это связано с тем, что ген АРР (и возможно некоторые другие гены, связанные с БА), расположены на 21 хромосоме, трипликация которой приводит к повышению экспрессии этих генов [Lemere С.А. et al. Sequence of deposition of heterogeneous amyloid beta-peptides and APO E in Down syndrome: implications for initial events in amyloid plaque formation. // Neurobiol. Dis. 1996. Vol. 3, №1. P. 16-32]. Также существуют наследственные формы БА, связанные с трипликацией только одного гена АРР в геноме, без трипликации всей 21-й хромосомы [Muratore C.R. et al. The familial Alzheimer's disease APPV717I mutation alters APP processing and Tau expression in iPSC-derived neurons. // Hum. Mol. Genet. 2014. Vol. 23, №13. P. 3523-3536]. Исследователи получили ИПСК с триплицированным геном АРР и дифференцировали их в нейральном направлении. Удалось показать, что трипликация АРР приводит к повышению экспрессии белка АРР в целом, а так же к увеличению доли фосфорилированного белка МАРТ, другого участника образования синильных бляшек. Добавление в культуральную среду на ранних этапах дифференцировки специфических антител против бета-амилоида позволяет снизить уровень фосфорилирования МАРТ и секреции Аβ42 до уровня, не отличимого от здорового контроля.
Существуют, как минимум, еще две научные работы, указывающие на копийность гена АРР, как на основную причину некоторых ранних форм болезни Альцгеймера [Lee МН, Siddoway В, Kaeser GE, Segota I, Rivera R, Romanow WJ, Liu CS, Park C, Kennedy G, Long T, Chun J. Somatic APP gene recombination in Alzheimer's disease and normal neurons. Nature. 2018 Nov;563(7733):639-645. doi: 10.1038/s41586-018-0718-6. Epub 2018 Nov 21. Erratum in: Nature. 2019 Feb;566(7743):E6. PMID: 30464338; PMCID: PMC6391999.] и [McNaughton D, Knight W, Guerreiro R, Ryan N, Lowe J, Poulter M, Nicholl DJ, Hardy J, Revesz T, Lowe J, Rossor M, Collinge J, Mead S. Duplication of amyloid precursor protein (APP), but not prion protein (PRNP) gene is a significant cause of early onset dementia in a large UK series. Neurobiol Aging. 2012 Feb;33(2):426.el3-21. doi: 10.1016/j.neurobiolaging.2010.10.010. Epub 2010 Dec 28. PMID: 21193246; PMCID: PMC3657692].
Также существует научная работа, в которой исследователи при помощи системы редактирования генома CRISPR/Cas9 инактивировали «лишнюю» копию гена АРР в клетках пациента с синдромом Дауна и показали возвращение уровня секреции Аβ42 до нормального уровня [Ovchinnikov DA, Korn О, Virshup I, Wells CA, Wolvetang EJ. The Impact of APP on Alzheimer-like Pathogenesis and Gene Expression in Down Syndrome iPSC-Derived Neurons. Stem Cell Reports. 2018 Jul 10; 11(1):32-42. doi: 10.1016/j.stemcr.2018.05.004. Epub 2018 May 31. PMID: 29861166; PMCID: PMC6066957].
Эти данные в совокупности указывают на важную роль копийности гена АРР в патологических процессах БА.
Таким образом становится актуальной разработка метода точного определения копийности гена АРР в исследуемом генетическом материале.
На момент подачи заявки из открытых источников было известно о следующих наиболее близких аналогах:
В патенте RU 2483108, С2 описан способ специфической детекции аллели полиморфизма rs908832 гена АВСА2, что указывает на наличие или повышенный риск развития болезни Альцгеймера у пациента. Однако данная известная тест-система позволяет обнаруживать только один конкретный полиморфизм гена АВСА2, и никоим образом не определяет копийность гена АРР.
В патенте RU 2600874, С2 описывается способ одновременной специфической детекции аллельных полиморфизмов в локусах ДНК АроЕ, ApoJ и GAB2, а также описывается необходимый для этого набор олигонуклеотидных праймеров и зондов. Изобретение обеспечивает возможность определения нуклеотидного состава в четырех полиморфных позициях: АроЕ (rs429358, rs7412), ApoJ (rs11136000) и GAB2 (rs2373115), что, в свою очередь, позволяет определить предрасположенность к спорадической форме болезни Альцгеймера у пациентов.
Однако, как и в вышеописанном случае, данная известная тест-система позволяет обнаруживать только четыре конкретных полиморфизма генов АроЕ, ApoJ и GAB2, и никоим образом не определяет копийность гена АРР.
В качестве прототипа нами выбран способ полуколичественной детекции копийности гена АРР при помощи двух пар праймеров (одна пара для амплификации локуса гена АРР, а другая пара для амплификации нормировочного гена GRN) и двух флуоресцентных зондов, один из которых написан на последовательность гена АРР, а другой написан на последовательность GRN [McNaughton D, Knight W, Guerreiro R, Ryan N, Lowe J, Poulter M, Nicholl DJ, Hardy J, Revesz T, Lowe J, Rossor M, Collinge J, Mead S. Duplication of amyloid precursor protein (APP), but not prion protein (PRNP) gene is a significant cause of early onset dementia in a large UK series. Neurobiol Aging. 2012 Feb;33(2):426.el3-21. doi: 10.1016/j.neurobiolaging.2010.10.010. Epub 2010 Dec 28. PMID: 21193246; PMCID: PMC3657692].
В способе-прототипе мультиплексная полимеразная цепная реакция (ПЦР) проходит в амплификаторе с функцией измерения флуоресценции в режиме реального времени (Real-Time PCR), при которой детектируются обе амплификационные кривые в обоих каналах, одна кривая отвечает за содержание гена АРР, а вторая отвечает на содержание нормировочного гена GRN. Далее методом ΔΔCt кривая АРР нормируется на кривую GRN и делается вывод о копийности гена АРР.
Данный способ предполагает только условно количественное определение копийности аллели АРР, поскольку точность данного метода ограничена возможностью разделения двух групп амплификационных кривых и составляет по теоретических выкладкам не более 33%. В практических случаях, увеличение копийности гена АРР на одну копию, увеличивает параметр ΔΔCt на 50% (на 0,66 цикла ПЦР), что находится вблизи теоретически различимого минимума. Учитывая ошибки, которые возникают при пробоподготовке (ошибки пипетирования и детекции сигнала амплификатором) предложенный метод нельзя назвать специфически достоверным, что обуславливает необходимость в дальнейшей модернизации метода.
Также к недостаткам описанного в прототипе метода следует отнести невозможность детекции увеличения копийности АРР в случае с мозаичными пациентами, когда в организме пациента только доля клеток (иногда небольшая, до 1%) несут триплицированный ген АРР.
Проблемой, на решение которой направлено данное изобретение, является создание набора, позволяющего проводить точное определение копийности гена АРР в представленном генетическом материале по отношению к копийности генома.
Технический результат, достигаемый при использовании предлагаемого набора, заключается в обеспечении высокоточного подсчета копийности гена АРР в представленном генетическом материале с разрешением до 0.5% (детекция 1 лишней копии АРР на 200 копий геномов) за счет высокой специфичности реагентов предлагаемого набора.
Предложены оригинальные олигонуклеотидные праймеры и флуоресцентные зонды, позволяющие точно подсчитать копии гена АРР с нормировкой на один геном, при проведении цифровой капельной ПЦР.
Сущность изобретения заключается в следующем:
Предложен набор для определения копийности гена АРР в геноме человека при проведении цифровой капельной мультиплексной ПЦР, включающий прямой праймер FW-APP, имеющий последовательность SEQ ID NO: 1; обратный праймер RV-APP, имеющий последовательность SEQ ID NO: 2; флуоресцентный зонд APP-FAM, имеющий последовательность SEQ ID NO: 3, с ковалентно пришитой к 5'- концу последовательности молекулой флуоресцентного красителя 5(6)-карбоксифлуоресцеина (FAM) и ковалентно пришитой к 3'- концу последовательности молекулой гасителя флуоресценции BHQ1; прямой праймер FW-CCR5, имеющий последовательность SEQ ID NO: 4; обратный праймер RV-CCR5, имеющий последовательность SEQ ID NO: 5; флуоресцентный зонд CCR5-R6G, имеющий последовательность SEQ ID NO: 6, с ковалентно пришитой к 5'-концу последовательности молекулой флуоресцентного красителя Rhodamine 6G (R6G) и ковалентно пришитой к 3'- концу последовательности молекулой гасителя флуоресценции BHQ2.
Таким образом, возможность точного подсчета копийности гена АРР достигается за счет использования двух праймеров, фланкирующих локус участка гена АРР:
FW-APP: 5'- TTGGTTGTCCTGCATACTTT - 3'
RV-APP: 5'- AGCACAGGATGAACCAGA - 3'
и флуоресцентного зонда, комплементарного последовательности ампликона АРР:
APP-FAM: [FAM]-5'-CTCTGAAGTGAAGATGGATGC-3'-[BHQ1]
а также двух праймеров, фланкирующих локус участка гена CCR5:
FW- CCR5: 5'- GCGTCTCTCCCAGGA - 3'
RV- CCR5: 5'- CAACCTGTTAGAGCTACTG - 3'
и флуоресцентного зонда, комплементарного последовательности ампликона CCR5:
CCR5-R6G: [FAM]-5'- CTGGGCTCCCTACAACAT-3'-[BHQ2]
При этом прямой праймер FW-APP для амплификации фрагмента гена АРР, имеет последовательность SEQ ID NO: 1.
Обратный праймер RV-APP для амплификации фрагмента гена АРР, имеет последовательность SEQ ID NO: 2.
Флуоресцентный зонд APP-FAM с флуоресцентным красителем FAM и гасителем BHQ1 для детекции участка гена АРР, имеет последовательность SEQ ID NO: 3.
Прямой праймер FW-CCR5 для амплификации фрагмента гена CCR5, имеет последовательность SEQ ID NO: 4.
Обратный праймер RV-CCR5 для амплификации фрагмента гена CCR5, имеет последовательность SEQ ID NO: 5.
Флуоресцентный зонд CCR5-R6G с флуоресцентным красителем R6G и гасителем BHQ2 детектирует участок гена CCR5 для нормировки и имеет последовательность SEQ ID NO: 6.
Для дизайна праймеров и зондов был проведен биоинформатический анализ, где в качестве исходной информации использовали последовательности генов АРР и CCR5 из базы данных National Center for Biotechnology Information U.S. National Library of Medicine (Gene ID: 1234, updated on 3-Dec-2017).
Далее, для реализации изобретения необходимо осуществить серию ПЦР-реакций с помощью системы (установки) для цифровой капельной ПЦР, например, Bio-Rad QX200 Droplet Digital PCR System, с использованием реагентов, предназначенных для конкретной системы (мастермикс, содержащий необходимые компоненты ПЦР, такие как Taq-полимераза, dNTP, растворы солей и т.д.). Приготовление смеси для цифровой ПЦР идет по следующему протоколу:
Состав смеси на одну лунку:
Общий объем должен быть 22 мкл, конечная концентрация праймеров 450 нМ, конечная концентрация зондов 250 нМ, раствор ДНК рекомендуется готовить так, чтобы в 4 мкл содержалось от 50 нг до 350 нг ДНК. Далее, с использованием прибора для генерации капель необходимо приготовить эмульсию капель. После завершения генерации капель планшет с каплями запаивается фольгой в течение 5 секунд при 180 градусах С.Запаянное плато помещается в любой амплификатор, поддерживающий формат 96-луночных планшетов «с юбкой» (например, С1000 Thermal Cycler, Bio-Rad). Протокол термоциклирования представлен в таблице.


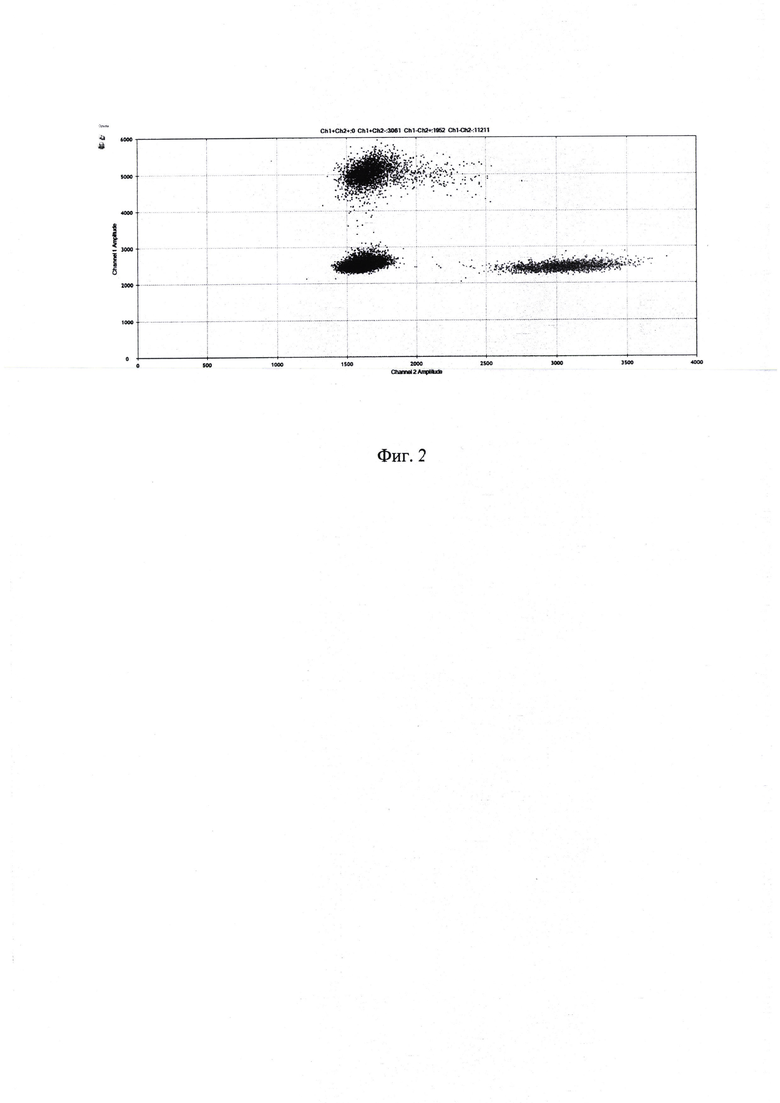
После амплификации плато переносится в прибор, детектирующий флуоресценцию в каплях, по каналах FAM и R6G(HEX). Анализ результатов проводится с помощью программы, поставляемой с прибором - QuantaSoft Software Bio-Rad. В качестве типового результата программа выдает два графика флуоресценции (FAM и R6G) в формате 1D и совмещенный мультиплексный плот в формате 2D.
На фиг. 1 представлен пример анализа результата цифровой капельной ПНР в виде графиков в формате 1D; верхний график - измерение флуоресценции в канале FAM; нижний график - измерение флуоресценции в канале R6G; каждая точка на графиках - проанализированная капля; по шкале ординат - интенсивность флуоресценции, по шкале абсцисс - порядковый номер проанализированной капли; нижний кластер капель (бесцветный) - капли без матрицы; верхние кластеры - положительные капли, где прошла ПЦР; в данном случае мы видим анализ матрицы с триплицированной копией гена АРР, поскольку отношение количества капель, положительных по FAM к количеству капель, положительных по R6G составляет примерно 1,5.
На фиг. 2 представлен пример анализа результата цифрового капельного ПЦР в виде 2D плота: по шкале ординат - интенсивность флуоресценции в канале FAM, по шкале абсцисс - интенсивность флуоресценции в канале R6G; негативный кластер капель (бесцветный) - слева внизу; кластер позитивных по FAM капель (синий) - слева вверху; кластер позитивных по R6G капель (зеленый) - справа внизу.
Таким образом, при анализе графиков в формате 1D (фиг. 1) видно два кластера капель, нижний - негативный, состоит из капель, в которые не попала матрица (ДНК) для амплификации, и верхний - позитивный, куда матрица (ДНК) попала, где успешно прошла ПЦР и появился сигнал флуоресценции. Программа автоматически разделяет оба кластера и подсчитывает количество положительных капель в каждом канале.
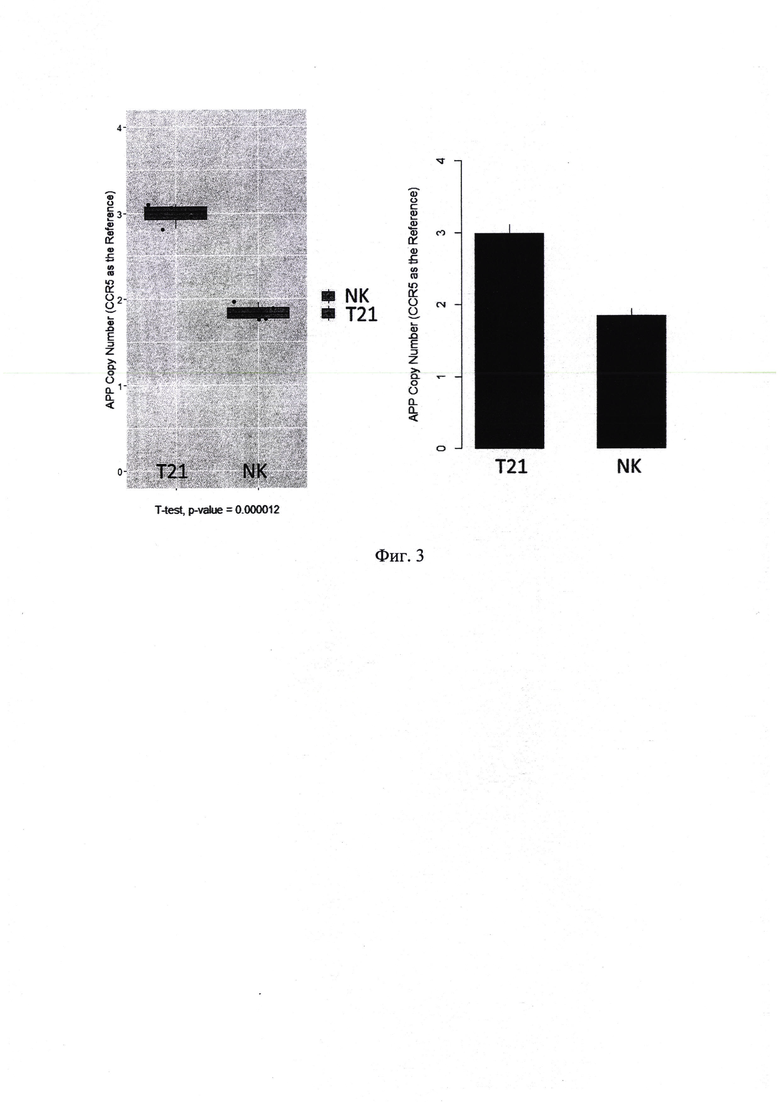
При анализе графиков в формате 2D (фиг. 2) кластеры капель, положительных по FAM и R6G, отчетливо различимы, и также автоматически разделяются. В случае трипликации гена АРР, отношение количества капель, положительных по FAM к количеству капель, положительных по R6G составляет примерно 1,5. В случае нормального кариотипа данное соотношение равно примерно 1. Для наглядности, полученное соотношение умножают на 2 для определения копийности гена АРР. На фиг. 3 показаны результаты анализа четырех образцов ДНК с триплицированным геном АРР (трисомия по 21-ой хромосоме, синдром Дауна) и четырех образцов ДНК с нормальным кариотипом.
Поскольку формат цифровой капельной ПЦР проводит количественный анализ содержания матрицы в изначальной смеси в штуках, это позволяет осуществлять высокоточное измерение соотношения аллелей CCR5 (хромосома 3) и АРР (хромосома 21), что позволяет в данном случае судить о копийности гена АРР.
Основу способа с предлагаемым набором для измерения копийности гена АРР составляют синтезированные короткие ДНК олигонуклеотиды и приборная база для проведения цифрового капельного ПЦР, Технология синтеза ДНК-олигонуклеотидов достаточно хорошо освоена биохимической промышленностью. Приборы для проведения цифрового капельного ПЦР широкодоступны, могут быть приобретены или могут быть использованы в Центрах коллективного пользования.
Описание настоящего изобретения является иллюстративным и не ограничивает сферы действия формулы изобретения. Для квалифицированных специалистов является очевидным, что возможны варианты и модификации изобретения, связанные с конкретной его реализацией, не выходящие за рамки формулы изобретения.
Фигуры в заявке представлены в виде, достаточном для понимания принципов изобретения специалистами в данной области, и ни в какой мере не ограничивают объема настоящего изобретения.
--->
Перечень последовательностей
<110> Федеральное государственное автономное
образовательное учреждение высшего образования
«Российский национальный исследовательский медицинский
университет имени Н.И. Пирогова» Министерства
здравоохранения Российской Федерации (Federalnoe
gosudarstvennoe autonomnoe obrazovatelnoe uchrezhdenie
vysshego obrazovaniya «Rossijskij natsionalnyj
issledovatelskij meditsinskij universitet imeni N.I.
Pirogova» Ministerstva zdravookhraneniya Rossijskoj Federatsii)
<120> Набор для определения копийности гена АРР в геноме
человека
<160> 6
<210> SEQ ID NO: 1
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> Прямой праймер FW-Primer-APP для амплификации фрагмента
гена АРР
<400> 1
ttggttgtcc tgcatacttt 20
<210> SEQ ID NO: 2
<211> 18
<212> ДНК
<213> Искусственная
<220>
<223> Обратный праймер RV-Primer-APP для амплификации фрагмента
гена АРР
<400> 2
agcacaggat gaaccaga 18
<210> SEQ ID NO:3
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> Флуоресцентный зонд APP-FAM с флуоресцентным
красителем FAM и гасителем BHQ1 для детекции участка гена
АРР
<400> 3
ctctgaagtg aagatggatg с 21
<210> SEQ ID NO: 4
<211> 15
<212> ДНК
<213> Искусственная
<220>
<223> Прямой праймер FW-Primer-CCR5 для амплификации фрагмента
гена CCR5
<400> 4
gcgtctctcc cagga 15
<210> SEQ ID NO: 5
<211> 19
<212> ДНК
<213> Искусственная
<220>
<223> Обратный праймер RV-Primer-CCR5 для амплификации
фрагмента гена CCR5
<400> 5
caacctgtta gagctactg 19
<210> SEQ ID NO: 6
<211> 18
<212> ДНК
<213> Искусственная
<220>
<223> Флуоресцентный зонд CCR5-R6G с флуоресцентным
красителем R6G и гасителем BHQ1 для детекции участка гена CCR5
<400> 6
ctgggctccc tacaacat 18
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Набор для определения копийности вставки интересующей конструкции в AAVS1 локус генома человека | 2021 |
|
RU2786396C1 |
| Набор для определения CCR5delta32 мутации в геноме человека | 2020 |
|
RU2748998C1 |
| Способ генотипирования гена TLR2 по полиморфизму rs5743708 и набор олигонуклеотидных праймеров и зондов для его реализации | 2023 |
|
RU2805861C1 |
| Способ генотипирования гена TLR2 по полиморфизму rs3804100 и набор олигонуклеотидных праймеров и зондов для его реализации | 2023 |
|
RU2805860C1 |
| Способ генотипирования гена TLR4 по полиморфизму rs4986790 и набор олигонуклеотидных праймеров и зондов для его реализации | 2023 |
|
RU2805862C1 |
| Способ генотипирования гена TLR1 по полиморфизму rs5743551 и набор олигонуклеотидных праймеров и зондов для его реализации | 2023 |
|
RU2805859C1 |
| НАБОР РЕАГЕНТОВ И СПОСОБ ДЛЯ ВЫЯВЛЕНИЯ ДНК ВОЗБУДИТЕЛЕЙ ЧУМЫ, СИБИРСКОЙ ЯЗВЫ И ТУЛЯРЕМИИ МЕТОДОМ ПЦР С ГИБРИДИЗАЦИОННО-ФЛУОРЕСЦЕНТНЫМ УЧЕТОМ РЕЗУЛЬТАТОВ | 2013 |
|
RU2542395C1 |
| Способ выявления наличия мутаций, приводящих к резистентности у Mycoplasma genitalium к макролидным и фторхинолоновым антибиотикам | 2019 |
|
RU2725477C1 |
| Способ генотипирования гена TLR8 по полиморфизму rs3764880 и набор олигонуклеотидных праймеров и зондов для его реализации | 2023 |
|
RU2805864C1 |
| Способ генотипирования гена TLR6 по полиморфизму rs5743810 и набор олигонуклеотидных праймеров и зондов для его реализации | 2023 |
|
RU2805863C1 |

Изобретение относится к биотехнологии, конкретно к набору для определения копийности гена АРР в геноме человека при проведении цифровой капельной мультиплексной ПЦР в режиме реального времени. Набор включает по два прямых и обратных праймера, флуоресцентный зонд APP-FAM с ковалентно пришитой к 5'-концу последовательности молекулой флуоресцентного красителя 5(6)-карбоксифлуоресцеина (FAM) и ковалентно пришитой к 3'-концу последовательности молекулой гасителя флуоресценции BHQ1, флуоресцентный зонд CCR5-R6G с ковалентно пришитой к 5'-концу последовательности молекулой флуоресцентного красителя Rhodamine 6G (R6G) и ковалентно пришитой к 3'-концу последовательности молекулой гасителя флуоресценции BHQ2. Изобретение обеспечивает высокоточный подсчет копийности гена АРР в исследуемом генетическом материале при генетическом скрининге с разрешением до 0.5% за счет высокой специфичности реагентов предлагаемого набора. 3 ил., 1 табл.
Набор для определения копийности гена АРР в геноме человека при проведении цифровой капельной мультиплексной полимеразной цепной реакции (ПЦР) в режиме реального времени, включающий прямой праймер, имеющий последовательность SEQ ID NO: 1; обратный праймер, имеющий последовательность SEQ ID NO: 2; флуоресцентный зонд APP-FAM, имеющий последовательность SEQ ID NO: 3, с ковалентно пришитой к 5'-концу последовательности молекулой флуоресцентного красителя 5(6)-карбоксифлуоресцеина (FAM) и ковалентно пришитой к 3'-концу последовательности молекулой гасителя флуоресценции BHQ1; прямой праймер, имеющий последовательность SEQ ID NO: 4; обратный праймер, имеющий последовательность SEQ ID NO: 5; флуоресцентный зонд CCR5-R6G, имеющий последовательность SEQ ID NO: 6, с ковалентно пришитой к 5'-концу последовательности молекулой флуоресцентного красителя Rhodamine 6G (R6G) и ковалентно пришитой к 3'-концу последовательности молекулой гасителя флуоресценции BHQ2.
| BUSHMAN D.M | |||
| et al., Genomic mosaicism with increased amyloid precursor protein (APP) gene copy number in single neurons from sporadic Alzheimer's disease brains, Elife, 2015, vol | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Набор для определения CCR5delta32 мутации в геноме человека | 2020 |
|
RU2748998C1 |
| ГАРБУЗ Д | |||
| Г | |||
| и др., Бета-амилоид, ТАУ-белок и нейровоспаление: попытка объединения различных гипотез патогенеза болезни | |||
Авторы
Даты
2023-02-10—Публикация
2021-12-22—Подача