Область техники
[0001] Настоящее изобретение относится к области тестирование наличия пищевых аллергий, в частности отсроченных реакций гиперчувствительности на пищевые антигены (антигены из пищи).
Уровень техники
[0002] Следующее описание содержит информацию, которая может быть полезной для понимания настоящего изобретения. Это не является признанием того, что какая-либо информация, приводимая в настоящей заявке, составляет известный уровень техники или связана с заявляемым в настоящей заявке изобретением, или что любая публикация, упоминаемая прямо или косвенно, является известным уровнем техники.
[0003] Аутоиммунные нарушения, включая нейроаутоиммунные заболевания, поражают 7-10% населения во всем мире. Все чаще такие нарушения становятся связанными с иммунной реактивностью в отношении часто потребляемых пищевых продуктов. Обычно иммунная система слизистой оболочки кишечника поддерживает иммунный гомеостаз, индуцируя толерантность к антигенам, обнаруживаемым в белках и пептидах, поступающих с пищей, и симбиотической микрофлоре, но в то же время запуская иммунный ответ на патогены. Однако нормальная толерантность организма в отношении «дружеских» антигенных веществ может нарушаться из-за ряда факторов. Дисфункция кишечного барьера и нарушение связанных с кишечником барьеров может создавать возможность для поступления непереваренных белков и пептидов в кровяное русло. При данных обстоятельствах поглощение указанных питательных веществ может приводить к выработке антител IgG и IgA, не только к разным пищевым антигенам, но также и к собственным тканям организма (явление, известное как пищевая аутоиммунная реактивность). Указанная реактивность возникает вследствие гомологии (которая имеет место в разной степени) между аминокислотными последовательностями многих часто потребляемых пищевых продуктов и последовательностями многих белков, которые присутствуют в норме в тканях человека, включая нервные клетки. Как следствие такого антигенного сходства или молекулярной мимикрии между указанными разными пищевыми белками и разными антигенами тканей-мишеней отсутствие возможности определить типы пищевой иммунной реактивности может изначально приводить к развитию аутоиммунной реактивности и потенциально приводить к аутоиммунным (например, нейроаутоиммунным) заболеваниям (Vojdani, 2014а; Vojdani, 2014b). В результате типам пищевой иммунной реактивности придается все большее внимание из-за их возрастающей распространенности и их нежелательного воздействия на здоровье и качество жизни (Johnson et al., 2014; Vojdani et al., 2014c).
[0004] Все указываемые в настоящей заявке публикации включены в нее посредством ссылки, как если бы было указано, что каждая отдельная публикация или заявка на патент были бы специфически и индивидуально включены посредством ссылки. В тех случаях, когда определение или применение термина во включенном источнике не согласуется или противоречит определению такого термина, приводимому в настоящей заявке, применимо определение такого термина, приводимое в настоящей заявке, а определение такого термина в источнике не применимо.
[0005] Механизм иммунной реактивности обычно двухфазный: острая реакция наступает сразу же после взаимодействия с аллергеном, а затем через несколько часов начинается реакция поздней фазы. Во время острой реакции симптомы возникают вследствие связывания IgE и/или IgG с разными клетками и выделения медиаторов, таких как гистамин и фактор активации тромбоцитов (ФАТ), тучными клетками, нейтрофилами и базофилами. Поздняя фаза предполагает поступление воспалительных цитокинов, таких как ИЛ-4, ИЛ-9, ИЛ-33 и ФНО-α, и таких клеток, как нейтрофилы и эозинофилы (Но et al., 2012). При классической отсроченной пищевой иммунной реактивности выработка высокого уровня IgG, IgM или IgA против разных пищевых антигенов приводит к связыванию C1q с антителом, с образованием иммунных комплексов и отложением иммунных комплексов в разных участках тканей. Продолжительность симптомов может составлять нескольких дней или даже недель после первичной иммунной реакции на такие пищевые антигены.
[0006] IgE, IgG, IgA или IgM играют разную роль при пищевой иммунной реактивности (Mijayima et al., 1997). IgE действует через высокоаффинный рецептор-, FcεRI - который в высокой степени экспрессируется на поверхности тучных клеток или базофилов. Для IgG есть несколько рецепторов, включая высокоаффинные рецепторы FcyRI и FcyRIV, и низкоаффинные рецепторы FcyRIIB и FeyRIII. Все указанные рецепторы экспрессируются на поверхности нескольких типов клеток, участвующих в анафилаксии, включая тучные клетки, базофилы, нейтрофилы и макрофаги.
[0007] В пищевой иммунной реактивности участвуют пять разных путей (Mancardi et al., 2013; Smit etal, 2011; Strait etal., 2002):
1. Классический путь - включающий IgE и его рецептор FceRI, тучные клетки и гистамин.
2. Альтернативный путь - опосредуемый IgG1, FcyRIII, макрофагами и путем ФАТ.
3. Путь IgG-базофилов-ФАТ.
4. Путь IgG-нейтрофилов-ФАТ через FcyRIV.
5. Путь IgG, IgM или IgA-иммунного комплекса - нейтрофилов.
Все указанные реакции на компоненты пищи могут возникать вследствие сбоя в пероральной переносимости (толерантности).
[0008] Как отмечалось выше, иммунная система слизистой оболочки кишечника в норме поддерживает иммунный гомеостаз, который состоит в поддержании переносимости (толерантности) безвредных или даже полезных молекул в кишечнике при создании эффективных и адекватных иммунных ответов на вредные патогены (Lim and Rowley, 1982). Отсутствие ответа на пищевые антигены с последующим угнетением системного иммунного ответа - это то, что характеризуется как пероральная переносимость. Нарушение пероральной переносимости может приводить к иммунной реактивности на потребляемую пищу, сопровождающейся потенциально угрожающими жизни последствиями, такие как аллергии и аутоиммунные состояния (Tsuji and Kosaka, 2008).
[0009] В случае, когда указанные разные механизмы действия становятся не способны контролировать потребляемые антигены, на ранней стадии результатом может быть нарушение переносимости растворимых антигенов, которые активируют секреторные и системные иммунные ответы на пищевые антигены. Индивидуумы, у которых не функционирует механизм иммунной эксклюзии, могут страдать хронической гиперабсорбцией макромолекул и склонностью к выработке аутоантител и даже аутоиммунными заболеваниями (Maul and Dichmann, 2008). По этой причине индукция антител IgG, IgM и IgA и образование иммунных комплексов на реальный пищевой антиген и даже примирование перекрестнореагирующими минорными антигенами может иметь клиническую значимость. Экспериментальные исследования in vitro и in vivo продемонстрировали, что антитела IgG, которые не уравновешены ответом IgA слизистой оболочки, могут усиливать проникновение через эпителий минорных белков (Brandtzaeg and Tolo, 1997). Поступление бактериальных токсинов и разных пищевых антигенов через эпителиальные клетки может приводить ко многим иммунным нарушениям, включая аутоиммунные состояния.
[0010] Тип системной иммунной реакции на пищевые белки и пептиды зависит от структуры антигена (например, антигены-белки, крупнодисперсные антигены, полисахариды, гликопротеины, гликолипиды или ферменты) и генетических особенностей индивидуумов. Например, у одного человека может вырабатываться IgG, а другого на компоненты пищи могут вырабатываться антитела IgA или IgM (Barnes, 1995). Если такие антитела IgG, IgM и IgA на пищевые антигены остаются не диагностированными, результатом может быть развитие аутоиммунного состояния, а затем аутоиммунного заболевания.
[0011] Как следствие, в последние десятилетия был достигнут значительный прогресс в идентификации пептидов-мишеней в пищевых антигенах, которые обладают сходством с аутоантигенами, которые вовлечены в аутоиммунные заболевания (Baboonian etal., 1989; Baboonian et al., 1991; Lunardi et al., 1992; Lunardi etal., 2000; Ostenstad et al., 1995; Schrander et al., 1997). Богатый глицином пептид белка клеточной стенки (GRP) является примером антигенной пептидной последовательности, которая способна примировать Т- и В-клеточный иммунный ответ при абсолютно разных и не связанных между собой заболеваниях. GRP является широко распространенным пищевым белком, обнаруживаемым в бобах, фруктах, овощах и в желатине. Он обладает очень высокой степенью антигенного сходства/гомологии с рибонуклеопротеином, фибриллярным коллагеном, цитокератином и ядерным антигеном вируса Эпштейна-Барр-1 (EBNA-1), которые являются антигенами, которые наиболее часто ассоциированы с аутоиммунными нарушениями.
[0012] Указанное антигенное сходство между богатым глицином пищевым антигеном и вирусом Эпштейна-Барр и разными тканевыми антигенами, вовлеченными в аутоиммунные заболевания, может приводить к выработке перекрестно-реагирующих антител. Обнаружение распространенного пептидного эпитопа, способного вызывать иммунный ответу пациентов с пищевой иммунной реактивностью и разными аутоиммунными нарушениями, ставит вопрос о возможной взаимосвязи между пищевыми антигенами, слизистой оболочкой кишечника и системным иммунным ответом (Lunardi et al., 1992; Schrander et al., 1997). Сывороточные антитела IgG, направленные на пептид GRP, были обнаружены у пациентов с несколькими аутоиммунными нарушениями и пищевой аллергией, и они были способны перекрестно реагировать с аутоантигенами, включая кератин, коллаген и EBNA-1 (Lunardi et al., 2000). Указанные данные свидетельствуют о том, что высоко филогенетически консервативные эпитопы в вирусах растений и у человека могут быть причиной аутоиммунного ответа у восприимчивых индивидуумов. Кроме того, это указывает на то, что антиген, конкретная последовательность которого является общей у вероятно дивергентных белков, может быть вовлечен в инициацию или усиление иммунного ответа, что приводит к аутоиммунному состоянию у восприимчивых индивидуумов.
[0013] В слизистой оболочке кишечника может возникать аутоиммунный ответ, опосредуемый клонами Т-лимфоцитов, специфичными к эпитопам конкретных пищевых антигенов. Такие Т-лимфоциты могут рекрутироваться в определенные очаги, такие как суставы, где они пролиферируют в ответ на гомологичные пептиды, получаемые из синовиальных белков. После возникновения местного воспаления и активации молекул ГКГС (главного комплекса гистосовместимости), выделение дополнительных аутоантигенов и/или распространение эпитопов может приводить к хроническому самовозобновляющемуся процессу воспаления и разрушения в органах, приводящего к аутоиммунному состоянию (Lunardi etal., 1992; Vojdani, 2014а).
[0014] В последние два десятилетия нарастает осознание проблемы пищевой иммунной реактивности и связанных с ней проблем со здоровьем, в частности применительно к пшенице и молоку (Bousquet et al., 1998; Lack, 2008; Zuidmeer et al., 2008). У пациентов с глютеновой болезнью (ГБ) был идентифицирован ряд глютеновых пептидов, способных стимулировать Т-хелперы в кишечнике (Arentz-Hansen et al., 2000; Arentz-Hansen et al., 2002; Camarca et al., 2009; Tollefsen et al., 2006). Недавнее исследование показало, что пациенты с чувствительностью к глютену, не связанной с глютеновой болезнью, (NCGS) и болезнью Крона реагируют на набор антигенов пшеницы, и у них вырабатываются IgG и IgA к ним. Указанный набор включает разные пептиды, α-, γ-, ω-глиадины, глютенины, глютеоморфины и агглютинин зародыша пшеницы (Vojdani, 2011). Постоянное воздействие факторов окружающей среды, таких как пшеница, не только вызывает NCGS и глютеновую болезнь, но, если оставить их без лечения, может приводить к воспалению и аутоиммунному состоянию (Counsell et al., 1994; De Freitas et al., 2002; Gillett et al., 2001). Действительно, была показана взаимосвязь глютеновой болезни с разными аутоиммунными нарушениями. Спектр аутоиммунно-ассоциированных антител, определяемых у пациентов с ГБ или NCGS, показывает, что между глиадином и разными тканевыми антигенами возникает перекрестная реактивность и молекулярная мимикрия (Alaedini et al., 2007; Collin et al., 2002; Frustaci et al., 2002; Hadjivassiliou et al., 2004; Jacob et al., 2005; Natter et al., 2001; Pratesi et al., 1998; Reinke et al., 2011; Vojdani etal., 2004).
[0015] Многие исследования были сосредоточены на взаимосвязи между распространенностью рассеянного склероза (PC) и потреблением молочных продуктов, и в них было показано, что частота PC коррелирует с потреблением молока (Agranoff and Goldberg, 1974; Butcher, 1976; Kahana etal., 1994; Knox, 1977; Malosse et al, 1992). Примечательно, что между основным белком жировых шариков молока, называемым бутирофилином (BTN) и миелиновым олигодендроцитарным гликопротеином (MOG) была показана высокая степень гомологии последовательностей (Gardinier et al., 1992; Henry etal., 1999; Jack and Mather, 1990).
[0016] MOG (миелиновый олигодендроцитарный гликопротеин) является основным антигеном при патогенном аутоиммунном ответе при PC и в его модели на животных -экспериментальном аутоиммунном энцефаломиелите (ЭАЭ) (Vojdani et al., 2002). MOG является единственным миелиновым аутоантигеном, о котором известно, что он вызывает ответ димиелинизирующих аутоантител и ответ энцефалитогенных CD4+-T-лимфоцитов у животных с ЭАЭ (Amoret al., 1994). Было показано, что энцефалитогенный ответ Т-лимфоцитов на MOG может либо вызываться, либо, в качестве альтернативы, подавляться в результате иммунологической перекрестной реактивности (или «молекулярной мимикрии») с внеклеточным IgV-подобным доменом молочного белка бутирофилина (BTN). У крыс активная иммунизация нативным BTN запускает воспалительный ответ в центральной нервной системе, который характеризуется образованием рассеянных менингиальных или периваскулярных инфильтратов Т-лимфоцитов и макрофагов (Vojdani et al., 2002). Было показано, что данная патология опосредуется ответом Т-лимфоцитов, ограниченным ГКГС II класса, на BTN, который перекрестно реагирует с последовательностью пептида MOG (Muthukumar М, et al., 2009).
[0017] Нейромиелит зрительного нерва (НЗН) является тяжелым нейроиммунным нарушением, которое поражает серое и белое вещество в головном и спинном мозге, что ведет к димиелинизации, повреждению аксонов и некрозу, и в итоге приводит к параличу и потере чувствительности у страдающих данным заболеванием индивидуумов (Jarius et al., 2008). В 75% случаев НЗН ассоциирован с присутствием антитела lgG1, которое селективно связывается с аквапорином-4 (AQP4), который представляет собой водный канал, принадлежащий к семейству аквапоринов (Jarius et al., 2010; Kimet al., 2012). AQP4 экспресс и руется в отростках ножек астроцитов на гематоэнцефалическом барьере, которые контактируют с микрососудами головного мозга или субарахноидальным пространством, влияя на концентрацию растворенных веществ, электрическую активность и модуляцию нейротрансмиссии и возбудимости (Kinoshita et al., 2010). После связывания АОР4-специфичное антитело lgG1 приобретает способность сначала поражать астроциты, а затем вызывать демиелинизацию спинного мозга и зрительного нерва (Bradl and Lassmann, 2008). Связывание lgG1 с AQP4 также вызывает активацию каскада комплемента и воспалительные инфильтраты, которые после индукции астроцитарной цитотоксичности вызывают демиелинизацию и разрушение ткани.
[0018] Недавно было выдвинуто предположение, что выработка патогенетических антител к AQP4 может запускаться воздействием белком из окружающей среды, которые обладают сходством или молекулярно имитируют специфический эпитоп AQP4 (Vaishnav et al., 2013). Интересно, что в листьях шпината экспрессируются два термостабильных аквапорина, которые составляют 20% от всех интегральных мембранных белков (Plasencia et al., 2011). Аналогично в сое экспрессируются аквапорины в проросших семенах, а также в корневых клубеньках (Fleurat-Lassard et al., 2005). Также было показано, что AQP4 человека может перекрестно реагировать с собственными белками тонопластов помидоров и кукурузы (Vaishnav et al., 2013).
[0019] Также было отмечено, что аминокислотная последовательность, имеющая значительную идентичность с первичным эпитопом Т-лимфоцитов при НЗН, встречается в потенциально иммуногенном белке оболочки вируса желтых пятен пастернака, который инфицирует пастернак, сельдерей, морковь, петрушку, кориандр, кервель и укроп. Данный эпитоп также обладает значительной идентичностью последовательности с последовательностью, представленной в ингибиторе сериновой протеазы в фасоли М. truncatula (Vaishnav et al., 2013).
[0020] Очевидно, что многие компоненты пищевых продуктов, которые еще не были охарактеризованы, также могут обладать способностью инициировать аутоиммунные состояния. До настоящего времени в большинстве исследований, связанных с пищевой иммунной реактивностью, была охарактеризована только водорастворимая совокупность белков и пептидов, присутствующих в исследуемых пищевых продуктах. Исключение составляет пшеница, поскольку глютен (спирторастворимый компонент пшеницы) применялся в исследованиях пищевой иммунной реактивности, перекрестной реактивности и аутоиммунных состояний. Кроме того, в настоящее время не ясна роль комплемента.
[0021] Как отмечалось выше, до настоящего времени исследования пищевых аллергий были сосредоточены главным образом на определении наличия иммуноглобулинов против специфических антигенов, но указанные исследования не были направлены на решение вопроса об активации комплемента. В заявке на патент США №2009/0010937 (автор Chauhan) обсуждается определение циркулирующих в крови иммунных комплексов, которые включают компоненты комплемента, такие как C1q, однако методология, которая обсуждается в указанном источнике, основана на применении клеточных рецепторов для иммунных комплексов, чтобы обеспечить иммобилизацию, необходимую для детекции с применением антител к комплементу. Сами по себе, они либо говорят мало, либо ничего не говорят об антигенной специфичности таких комплексов. В патенте США №8309318 (авторы Dorval and Dantini) обсуждается определение аллерген-специфичных иммунных комплексов, содержащих связанный C3b, при помощи иммобилизованных антигенов. Однако было продемонстрировано, что во время активации комплемента могут образовываться так называемые «молчаливые наблюдатели» - аддукты lgG-C3b (что сильно ограничивает применимость такого подхода при определении наличия антиген-специфичных комплексов (Fries et al,1984)).
[0022] Таким образом, остается потребность в системах, изделиях и способах описания свойств антитела (например, IgG, IgA, IgM и других классов антител), связывающегося с более широким спектром антигенных молекул, обнаруживаемых в пищевых продуктах, чем тот, что представлен водорастворимыми белками и пептидами в их естественном состоянии. Кроме того, остается потребность в системах, изделиях и способах, которые бы позволили охарактеризовать присутствие компонентов комплемента (например, C1q), ассоциированных с такими антителами.
Краткое описание изобретения
[0023] Объектом изобретения являются устройство, системы и способы, в которых разные группы антигенных молекул, включая щелочерастворимые белки, спирторастворимые белки, водорастворимые белки, полисахариды, гликолипиды и гликопротеины, экстрагируются из пищевых продуктов при помощи разнообразия особых химических/физических способов. Каждый из указанных экстрактов применяют в специфическом порядке на одной и той же поверхности для анализа, чтобы получить покрытую многими веществами поверхность для анализа, которая включает антигены из каждого из указанных разных экстрактов. IgG, IgA и C1q (в форме нативных комплексов иммуноглобулин-Clq), которые связываются с указанными антигенами, идентифицируют путем обработки поверхности для анализа образцом, отмывки с целью удаления избытка образца и приведения в контакт обработанной поверхности для анализа с видоспецифичными антителами против IgG и/или к IgA, и антителами на C1q, которые содержат в себе метку с возможностью детекции, например, фермент. Характеристика связанной метки показывает степень связывания IgG, IgA и/или C1q с по меньшей мере одним из большого разнообразия пищевых антигенов, присутствующих на поверхности для анализа.
[0024] Разные объекты, свойства, аспекты и преимущества настоящего изобретения станут более понятными из нижеследующего подробного описания предпочтительных вариантов реализации, вместе с сопровождающими чертежами, в которых однотипные числовые значения соответствуют однотипным компонентам.
Краткое описание чертежей
[0025] На ФИГ. 1 показана калибровочная кривая для иммунного ответа, генерируемого при помощи поверхности для анализа согласно идее настоящего изобретения.
[0026] На ФИГ. 2 показаны результаты исследований связывания IgG с поверхностью для анализа согласно идее настоящего изобретения. Связывание антитела IgG описывали при помощи поверхностей для анализа, которые включали разные антиген-содержащие экстракты из 180 исследуемых пищевых продуктов для первого индивидуума. Результаты, превышающие порог анализа 0,5 OD, показывают значимое повышение уровня IgG на банан, ананас, имбирь, ваниль, топинамбур, спаржу, капусту, кукурузу, баклажан, оливки, маринады, жареный картофель, водоросли, чечевицу, лектин, пекан, белок яйца и крабовые палочки. Иммунная реактивность IgG в отношении оставшихся 163 пищевых экстрактов была ниже 0,4 OD и была сочтена отрицательной.
[0027] На ФИГ. 3 показаны результаты количественного определения связывания C1q (с применением нативного комплекса иммуноглобулин-Clq) с поверхностью для анализа согласно идее настоящего изобретения. Связывание иммуноглобулин- C1q описывали при помощи поверхностей для анализа, которые включали разные антиген-содержащие экстракты из 180 исследуемых пищевых продуктов для первого индивидуума. В данном примере примечательно, что, когда измеряется связывание C1q (с применением нативного комплекса иммуноглобулин-Clq), уровень данного комплекса значительно повышен в отношении 12 разных новых пищевых экстрактов, которые не давали положительного результата, когда измерялся IgG. Указанные экстракты включают экстракты латексного хевина, чеснока, лука, лектина гороха, редиса, эндохитиназы риса, пищевого красителя, тунца, креветок, камедей и зеленого чая. Также примечательно, что, когда уровень IgG измерялся, как показано на ФИГ. 2, показатели оптической плотности для указанных тех же 12 пищевых продуктов были ниже 0,5 и были сочтены отрицательным результатом.
[0028] На ФИГ. 4 показаны результаты количественного определения связывания и IgG, и C1q (с применением нативного комплекса иммуноглобулин-Clq) на той же поверхности для анализа согласно идее настоящего изобретения. Связывание IgG и C1q описывали при помощи поверхностей для анализа, которые включали разные антиген-содержащие экстракты из 180 исследуемых пищевых продуктов для первого индивидуума. Все пищевые экстракты, которые были реактивны, когда измеряли IgG или C1Q (как показано на ФИГ. 2 и 3), становились высоко активны. Для оставшегося 151 пищевого продукта оптические плотности оставались ниже 0,5 и были сочтены отрицательным результатом.
[0029] На ФИГ. 5 показаны результаты исследований связывания IgG с поверхностью для анализа согласно идее настоящего изобретения. Связывание антитела IgG описывали при помощи поверхностей для анализа, которые включали разные антиген-содержащие экстракты из 180 исследуемых пищевых продуктов для второго индивидуума. Результаты, превышающие порог анализа 0,5 OD, показывают значимое повышение уровня IgG. Было идентифицировано значимое связывание IgG с 10 из 180 экстрактов пищевых антигенов.
[0030] На ФИГ. 6 показаны результаты количественного определения связывания C1q (с применением нативного комплекса иммуноглобулин- C1q) от второго индивидуума с поверхностью для анализа согласно идее настоящего изобретения. Связывание иммуноглобулин- C1q описывали при помощи поверхностей для анализа, которые включали разные антиген-содержащие экстракты из 180 исследуемых пищевых продуктов. Результаты, превышающие порог анализа 0,5 OD, указывают на значимое повышение уровня C1q. Значимое связывание C1q (с применением нативного комплекса иммуноглобулин-Clq) было идентифицировано для 14 экстрактов пищевых антигенов, 11 из которых были уникальны для C1q.
[0031] На ФИГ. 7 показаны результаты анализа связывания и IgG, и C1q (с применением нативного комплекса иммуноглобулин-Clq) от второго индивидуума с той же поверхностью для анализа согласно идее настоящего изобретения. Связывание IgG и C1q описывали при помощи поверхностей для анализа, которые включали разные антиген-содержащие экстракты из 180 исследуемых пищевых продуктов для второго индивидуума. В сочетании значимое связывание и IgG, и C1q было идентифицировано для 21 экстракта пищевых антигенов, которые представляли собой экстракты пищевых антигенов, идентифицированные в индивидуальных исследованиях для IgG и C1q, для данного индивидуума.
[0032] На ФИГ. 8 приведена таблица, демонстрирующая связывание IgG и IgA из сыворотки индивидуума с набором поверхностей для анализа, полученных из разных пищевых продуктов с применением имеющихся коммерческих препаратов пищевых антигенов, и поверхностей для анализа, полученных при помощи способов согласно идее настоящего изобретения. Показаны результаты для индивидуальных препаратов антигенов для каждого пищевого продукта, для поверхностей для анализа, покрытых последовательно всеми препаратами пищевых антигенов из пищевого продукта, и для поверхностей для анализа, покрытых последовательно всеми препаратами пищевых антигенов, полученными из того же продукта питания, например, после тепловой обработки.
[0033] На ФИГ. 9 приведена таблица, демонстрирующая продолжение набора пищевых антигенов, показанного на Фигуре 8.
[0034] На ФИГ.10 приведена таблица, демонстрирующая продолжение набора пищевых антигенов, показанного на Фигурах 8 и 9.
[0035] На ФИГ. 11 приведена таблица, демонстрирующая продолжение набора пищевых антигенов, показанного на Фигурах 8, 9 и 10.
Подробное описание
[0036] Предложены системы, изделия и способы для обнаружения (харакетризации) наличия антител на пищевые антигены и наличия комплексов C1q - антитела, которые связываются с пищевым антигеном. Экстракты пищевых антигенов готовят при помощи способов экстракции водорастворимых белков, спирторастворимых белков, гликолипидов, полисахаридов и гликопротеинов из разных пищевых продуктов и денатурированных под действием тепловой обработки версий указанных веществ. При последовательном нанесении на обычную поверхность для анализа получают поверхность для анализа, которая обеспечивает значительно большее разнообразие пищевых антигенов, чем в способах на известном уровне техники. Неожиданно было обнаружено, что необходимо применять последовательное добавление и порядок, в котором наносились экстракты антигенов, чтобы получить такие составные поверхности для анализа.
[0037] Кроме того, было обнаружено, что при обработке множества поверхностей для анализа, каждая из которых содержит экстракты пищевых антигенов из разных пищевых источников, IgG и нативный комплекс иммуноглобулин-Clq (т.е., комплекс иммуноглобулин-Clq, образующийся в организме индивидуума) демонстрировали разные профили связывания. Также было обнаружено, что описание связывания и IgG/lgA, и C1q (в форме нативного комплекса иммуноглобулин-Clq) одновременно с одной и той же поверхностью для анализа обеспечивало профиль, который коррелировал с результатами, полученными при исследовании связывания IgG/lgA и C1q по-отдельности, с тем преимуществом, что оно дает полный профиль иммунореактивности для пищевых антигенов при уменьшенном количестве поверхностей для анализа и этапов количественного определения.
[0038] Согласно некоторым вариантам реализации значения выражаемых количеств ингредиентов, свойства, такие как концентрация, условия реакции и так далее, применяемые для описания и заявления определенных вариантов реализации настоящего изобретения следует понимать как модифицированные в некоторых случаях посредством термина «приблизительно». Соответственно, согласно некоторым вариантам реализации численные параметры, излагаемые в письменном описании и прилагаемой формуле изобретения, являются приближением, которое может варьировать в зависимости от желаемых свойств, которые должны быть достигнуты посредством конкретного варианта реализации. Согласно некоторым вариантам реализации числовые параметры должны интерпретироваться в свете числа сообщаемых значащих разрядов и с применением общепринятых способов округления. Несмотря на то, что диапазоны числовых значений и параметры, устанавливающие широкую область некоторых вариантов реализации настоящего изобретения, являются приближением, численные значения, установленные в конкретных примерах, сообщаются точно, насколько это возможно. Численные значения, приводимые согласно некоторым вариантам реализации настоящего изобретения, могут содержать определенные погрешности, неизбежно возникающие из-за стандартного отклонения, обнаруживаемого в соответствующих им измерительных инструментах.
[0039] В настоящем описании и в формуле изобретения, которая следует за ним, значения определенных и неопределенных артиклей включают множественное число, если из контекста явно не следует другое. Также в настоящем описании значение «в» включает «в» и «на», если из контекста явно не следует другое.
[0040] Если из контекста не следует противоположное, все диапазоны, установленные в настоящей заявке, следует интерпретировать как включающие их конечные точки, а неограничивающие диапазоны должны интерпретироваться как включающие только практические с коммерческой точки зрения значения. Аналогично, все перечни значений должны рассматриваться как включающие промежуточные значения, если из контекста не следует противоположное.
[0041] Перечисление диапазонов значений исключительно должно служить способом условного обозначения для индивидуального указания каждого отдельного значения, попадающего в диапазон. Если в заявке не указано другое, каждое индивидуальное значение в пределах диапазона включено в описание, как если бы оно было индивидуально перечислено в настоящей заявке. Все способы, описываемые в настоящей заявке, можно реализовывать в любом подходящем порядке, если в настоящей заявке не указано другое, или это иным образом явно не противоречит контексту. Применение любого и всех примеров, или примерной формулировки (например, «такой как») в отношении определенных вариантов реализации в настоящей заявке предназначено исключительно для того, чтобы лучше проиллюстрировать изобретение, но не чтобы ограничить область изобретения, заявленного иным образом. Ни одна формулировка в настоящем описании не должна трактоваться как указывающая на любой незаявленный элемент, важный для осуществления на практике настоящего изобретения.
[0042] В настоящей заявке и если из контекста не следует другое, предполагается, что термин «соединенный с» включает прямое соединение (при котором два элемента, которые соединяются друг с другом, контактируют друг с другом) и непрямое соединение (при котором между двумя указанными элементами расположен по меньшей мере один дополнительный элемент). Следовательно, термины «соединен с» и «соединен при помощи» применяются как синонимы.
[0043] Группировки альтернативных элементов или вариантов реализации настоящего изобретения, раскрываемых в настоящей заявке, не предназначены служить ограничением. Каждый член группы может упоминаться и заявляться индивидуально или в любом сочетании с другими членами группы или другими элементами, обнаруживаемыми в настоящей заявке. Один или более членов группы могут быть включены, или исключены, в группу по причинам удобства и/или патентоспособности. Когда происходит любое такое включение или исключение, предполагается, что настоящее описание содержит группу, которая модифицирована таким образом и удовлетворяет письменному описанию всех групп Маркуша, применяемых в прилагаемой формуле изобретения.
[0044] В нижеследующем обсуждении приведено множество примеров вариантов реализации объекта изобретения. Хотя каждый вариант реализации представляет собой единственное сочетание элементов изобретения, считается, что объект изобретения включает все возможные сочетания раскрываемых элементов. Таким образом, если один вариант реализации содержит элементы А, В и С, а второй вариант реализации содержит элементы В и D, то считается также, что объект изобретения включает другие оставшиеся сочетания А, В, С или D, даже если это явным образом не раскрывается.
[0045] Согласно некоторым вариантам реализации идеи настоящего изобретения пищевые компоненты можно классифицировать на общие группы, включающие молочные продукты и яйца (модифицированные), злаки (сырые и модифицированные), бобы и фасоль (модифицированные), орехи и семена (модифицированные), овощи (сырые и модифицированные), фрукты (сырые и модифицированные), рыбу и морепродукты (сырые и модифицированные), мясо (сырое и модифицированное), травы (сырые и модифицированные), специи (сырые), камеди и заваренные напитки и добавки. Под модифицированными пищевыми продуктами могут пониматься этапы приготовления, обычно проводимые перед употреблением, например, варка, запекание и/или жарка.
[0046] «Молочные продукты и яйца» могут включать яичный белок, приготовленный (вареный); яичный желток, приготовленный (вареный); козье молоко; мягкий сыр и твердый сыр; и йогурт. «Злаки, сырые и модифицированные» могут включать рис, пшеницу и бурый рис, приготовленные (вареные); рисовые хлебцы; белок риса; эндохитиназу риса; дикий рис, приготовленный (вареный); и пшеницу+альфа-глиадины.
[0047] «Бобы и фасоль, модифицированные» могут включать черные бобы, приготовленные; агглютинины бобов; черный шоколад и какао; стручковую фасоль, приготовленную (вареную), нут, приготовленный (вареный); фасоль обыкновенную приготовленную (вареную); чечевицу приготовленную (вареную); лектин чечевицы (вареный), лимскую фасоль приготовленную (вареную); фасоль пинто приготовленную (вареную); агглютинин сои; олеозин сои+аквапорин; соевый соус, безглютеновый; и то фу.
[0048] «Орехи и семена, сырые и модифицированные» могут включать миндаль; миндаль, жаренный; бразильский орех, сырой и жаренный; кешью; кешью, жаренный; кешью, бициллин; семена чиа; семена льна; фундук, сырой и жаренный; макадамия, сырой и жаренный; горчичные зерна; пекан, сырой и жаренный; арахис, жаренный; арахисовое масло; агглютинин арахиса; олеозин арахиса; фисташку, сырую и жаренную; семена тыквы, жаренные; кунжутный альбумин; олеозин кунжута; семена подсолнечника, жаренные; и грецкий орех.
[0049] «Овощи, сырые и модифицированные» могут включать топинамбур, приготовленный (вареный); спаржу; спаржу, приготовленную (вареную); свеклу, приготовленную (вареную); болгарский перец; брокколи, брокколи, приготовленную (вареную); брюссельскую капусту, приготовленную (вареную); капусту, красную+зеленую; капусту, красную+зеленую (вареную); олеиозин канолы; морковь; морковь, приготовленную (вареную); цветную капусту, приготовленную (вареную); сельдерей; перец чили; кукурузу, приготовленную (вареную); аквапорин кукурузы; поп-корн; олеозин кукурузы; огурец, соленый; баклажан, приготовленный (вареный); чеснок; чеснок, приготовленный (вареный); зеленую фасоль, приготовленную (вареную); латук; грибы, сырые и приготовленные (вареные); окру, приготовленную (вареную); оливки, зеленые и черные, соленые; лук и/или зеленый лук; лук и/или зеленый лук, приготовленный (вареный); горох, приготовленный (вареный); белок гороха; лектин гороха; картофель, белый, приготовленный (печеный); картофель, белый, приготовленный (жареный); тыкву и/или тыкву крупноплодную, приготовленную (печеную); редис; олеозин сафлора и/или подсолнечника; водоросли; шпинат; аквапорин шпината; помидор; аквапорин помидора; томатную пасту; батат и/или сладкий картофель, приготовленный (печеный); и цуккини, приготовленный (вареный).
[0050] «Фрукты, сырые и модифицированные» могут включать яблоко; яблочный сидр; абрикос; авокадо; банан; банан, приготовленный (вареный); латексный хевеин; чернику; канталупу и/или белую мускатную дыню; вишню; кокос; мякоть и/или воду и/или молоко; клюкву; финик; фигу; виноград, красный+зеленый; красное вино; белое вино; грейпфрут; киви; лимон и/или лайм; манго; апельсин; апельсиновый сок; папайю; персик и/или нектарин; грушу, ананас; бромелайн ананаса; сливу; гранат; клубнику и арбуз.
[0051] «Рыба и морепродукты, сырые и модифицированные» могут включать треску, приготовленную (печеную), палтус, приготовленный (печеный), макрель, приготовленную (печеную); красный луциан, приготовленный (печеный); лосось, приготовленный (печеный); сардину+анчоус, приготовленные (вареные); морской окунь, приготовленный (печеный); тиляпию, приготовленную (печеную); радужную форель, приготовленную (печеную); тунец; тунец, приготовленный (печеный); белую рыбу, приготовленную (печную); краб+лобстер, приготовленные (вареные); крабовые палочки, приготовленные (вареные); моллюски, приготовленные (вареные); устрицу, приготовленную (вареную); гребешок, приготовленный (вареный), кальмар, приготовленный (вареный), креветку, приготовленную (вареную), тропомиозин креветки; и парвальбумин.
[0052] «Мясо, модифицированное» может включать говядину средней степени приготовления (вареную); курицу, приготовленную (вареную); ягненка, приготовленного (вареного); свинину, приготовленную (вареную); индейку, приготовленную (вареную), желатин и мясной клей (вареный).
[0053] «Травы, сырые» могут включать базилик, кориандр, кумин, укроп, мяту, орегано, петрушку, розмарин и тмин.
[0054] «Специи, сырые» могут включать корицу, гвоздику, имбирь, мускатный орех, паприку, куркуму (куркумин) и ваниль.
[0055] «Камеди» могут включать бета-глюкан, каррагенан, камедь; гуаровую камедь, мастиковую смолу+аравийскую камедь, и ксантановую камедь.
[0056] «Заваренные напитки и добавки» могут включать белок кофейных бобов, заваренный; черный чай, заваренный; зеленый чай, заваренный; мед, сырой и обработанный; и пищевой краситель, искусственный.
[0057] Перед экстракцией пищевые продукты можно обрабатывать, чтобы увеличить площадь поверхности, доступную для процесса экстракции. Например, пищевые вещества можно уменьшить до размера частиц путем вымачивания, резки, перемалывания, перетирания, обработки ультразвуком и/или экструзии. Согласно предпочтительным вариантам реализации идеи изобретения пищевой продукт, который требуется экстрагировать, сначала замораживают, например, при помощи жидкого азота. Замороженный пищевой продукт затем измельчают или размалывают, например, при помощи коммерческого блендера или мельницы.
[0058] Помимо пользы в уменьшении размера частиц пищевого продукта обработка ультразвуком может также применяться для лизиса клеток и улучшения выделения пищевых антигенов во время экстракции. Такую обработку ультразвуком можно проводить при помощи ультразвуковой ванны, путем введения ультразвукового облучателя или зонда в суспензию для экстракции, или путем прохождения через сквозной прибор для воздействия ультразвуком.
[0059] Для экстракции водорастворимых белков (например, альбумина) из пищевых продуктов подходят разнообразные способы. Перед экстракцией при помощи воды или по существу нейтральных (т.е. рН от 6,5 до 7,5) буферов пищевой продукт можно измельчить до состояния частиц, как отмечалось выше. Затем пищевой продукт можно суспендировать в воде иди в по существу нейтральном водном буфере при соответствующей температуре. Согласно некоторым вариантам реализации в раствор, применяемый для экстракции, можно включить соединения, которые ингибируют активность протеаз, такие как EDTA (этилен-диамин тетрауксусная кислота), PMSF (фенилметилсульфонилфторид) и/или пепстатин. Согласно другим вариантам реализации в раствор, применяемый для экстракции, можно включать поверхностно-активные вещества, такие как 4-(1,1,3,3-тетраметилбутил)фенил-полиэтиленгликоль, полиэтиленгликоль сорбитан монолаурат, n-додецил-β-D-мальтозид, алкилфенолэтоксилат и додецилсульфат натрия. Подходящая температура для экстракции может варьировать в диапазоне от 4° до 95°С, в зависимости от того, что подходит для конкретного пищевого продукта, который подвергают обработке. Аналогично, время, нужное для оптимальной экстракции, может зависеть от пищевого продукта, размера частиц и природы экстрагируемых водой белковых антигенов. Подходящее время экстракции может варьировать от 30 минут до 48 часов. После экстракции остаточные твердые частицы можно удалить путем осаждения и отстаивания, центрифугирования, фильтрации или сочетания указанных способов. После экстракции и удаления экстрагируемых твердых частиц, препарат водорастворимого белкового антигена можно перенести в соответствующий буфер для связывания, или, в качестве альтернативы, можно хранить перед применением. Препараты водорастворимых белковых антигенов можно лиофилизировать для хранения, хранить в жидкой форме при низких температурах, или хранить замороженными до применения. Согласно некоторым вариантам реализации в препарат водорастворимого белкового антигена можно добавлять вспомогательное вещество, такое как глицерин, чтобы было возможно хранение жидкой формы при температуре ниже 0°С.
[0060] Для экстракции щелочерастворимых белков из пищевых продуктов подходят разнообразные способы. Перед экстракцией при помощи щелочного раствора пищевой продукт можно измельчить до образования частиц, как указано выше. Затем пищевой продукт можно суспендировать в основном растворе (т.е. рН больше или равно приблизительно 8) при соответствующей температуре. Согласно предпочтительным вариантам реализации идеи изобретения такой щелочной раствор может иметь рН больше или равное приблизительно 10. Такие щелочные растворы можно получить путем добавления основных солей в воду. Подходящие основные соли включают NaOH, KOH, Са(ОН)2, Na2CO3, NaHCO3, Na2HPO4, K2CO3, KHCO3, Са(HCO3)2, СаСО3 и их сочетания. В качестве альтернативы подходящие щелочные буферы можно получить с применением таких буферов как CAPS, CAPSO, Tris и/или глицин. Согласно другим вариантам реализации идеи изобретения такой щелочной раствор может иметь рН больше или равное приблизительно 9. Согласно некоторым вариантам реализации идеи изобретения такой щелочной раствор может иметь рН больше или равный 8. Согласно некоторым вариантам реализации в раствор, применяемый для экстракции, можно включить соединения, которые ингибируют активность протеаз, такие как EDTA, PMSF и/или пепстатин. Согласно другим вариантам реализации в раствор, применяемый для экстракции, можно включать поверхностно-активные вещества, такие как 4-(1,1,3,3-тетраметилбутил)фенил-полиэтиленгликоль, полиэтиленгликоль сорбитан монолаурат, n-додецил-β-D-мальтозид, алкилфенолэтоксилат и додецилсульфат натрия. Подходящая температура для экстракции может варьировать в диапазоне от 4° до 95°С, в зависимости от того, что подходит для конкретного пищевого продукта, который подвергают обработке. Аналогично, время, нужное для оптимальной экстракции, может зависеть от пищевого продукта, размера частиц и природы экстрагируемых щелочью белковых антигенов. Подходящее время экстракции может варьировать от 30 минут до 48 часов. После экстракции остаточные твердые частицы можно удалить путем осаждения и отстаивания, центрифугирования, фильтрации или сочетания указанных способов. После экстракции и удаления экстрагируемых твердых частиц препарат щелочерастворимого белкового антигена можно перенести в соответствующий буфер для связывания, или, в качестве альтернативы, можно хранить перед применением. Препараты щелочерастворимых белковых антигенов можно лиофилизировать для хранения, хранить в жидкой форме при низких температурах, или хранить замороженными до применения. Согласно некоторым вариантам реализации в препарат водорастворимого белкового антигена можно добавлять вспомогательное вещество, такое как глицерин, чтобы было возможно хранение жидкой формы при температуре ниже 0°С.
[0061] Для экстракции белков, растворимых в спирте/органических растворителях, из пищевых продуктов подходят разнообразные способы. Перед экстракцией при помощи спирта или другого органического растворителя пищевой продукт можно измельчить до образования частиц, как указано выше. Затем пищевой продукт можно суспендировать в водном растворе спирта или другого подходящего органического растворителя. Подходящие спирты включают метанол, этанол, пропанол и их смеси. Другие подходящие органические растворители являются по меньшей мере смешиваемыми с водой, и включают DMSO (диметилсульфоксид), DMF (диметилформамид) и глицерин. Подходящая температура для экстракции может варьировать в диапазоне от 4° до 95°С, в зависимости от того, что подходит для конкретного пищевого продукта, который подвергают обработке. Аналогично, время, нужное для оптимальной экстракции, может зависеть от пищевого продукта, размера частиц и природы экстрагируемых водой белковых антигенов. Подходящее время экстракции может варьировать от 30 минут до 48 часов. После экстракции остаточные твердые частицы можно удалить путем осаждения и отстаивания, центрифугирования, фильтрации или сочетания указанных способов. После экстракции и удаления экстрагируемых твердых частиц препарат растворимого в спирте/органических растворителях белкового антигена можно перенести в соответствующий буфер для связывания, или, в качестве альтернативы, можно хранить до его применения. Препараты растворимых в спирте/органических растворителях белковых антигенов можно лиофилизировать для хранения, хранить в жидкой форме при низких температурах, или хранить замороженными до применения. Согласно некоторым вариантам реализации в препарат водорастворимого белкового антигена можно добавлять вспомогательное вещество, такое как глицерин, чтобы было возможно хранение жидкой формы при температуре ниже 0°С.
[0062] Для экстракции гликолипидов из пищевых продуктов подходят разнообразные способы. Перед экстракцией пищевой продукт можно измельчить до образования частиц, как указано выше. Липид-содержащую фракцию можно экстрагировать из пищевого продукта при помощи органического растворителя или смеси органических растворителей, таких как хлороформ, метанол, пиридин или их смесь. Гликолипиды можно отделить от смеси экстрагируемых липидов посредством ионообменной хроматографии, например, при помощи диэтиламинометил-замещенной среды хроматографирования, и десорбировать при помощи смеси органического растворителя/водного раствора соли (например, ацетат натрия, смешанный со смесью хлороформ/метанол). Согласно некоторым вариантам реализации во время экстракции можно применять обработку ультразвуком. Согласно некоторым вариантам реализации десорбированные гликолипиды можно гидролизовать при помощи основного раствора, а затем нейтрализовать. Получаемые соли можно удалять посредством соответствующего процесса обессоливания, такого как гель-фильтрация, хроматография с гидрофобным взаимодействием и/или хроматография с обращенной фазой. Подходящая температура для экстракции может варьировать в диапазоне от 4° до 95°С, в зависимости от того, что подходит для конкретного пищевого продукта, который подвергают обработке. Аналогично, время, нужное для оптимальной экстракции, может зависеть от пищевого продукта, размера частиц и природы экстрагируемых водой белковых антигенов. Подходящее время экстракции может варьировать от 30 минут до 48 часов. После экстракции остаточные твердые частицы можно удалить путем осаждения и отстаивания, центрифугирования, фильтрации или сочетания указанных способов. После экстракции и удаления экстрагируемых твердых частиц препарат гликолипидного антигена можно перенести в соответствующий буфер для связывания, или, в качестве альтернативы, можно хранить до его применения. Гликолипиды можно выпаривать до сухого состояния, лиофилизировать, хранить в жидкой форме при низких температурах, или хранить замороженными до применения. Согласно некоторым вариантам реализации в препарат гликолипида можно добавлять вспомогательное вещество, такое как глицерин, чтобы было возможно хранение жидкой формы при температуре ниже 0°С.
[0063] Для экстракции полисахаридов из пищевых продуктов подходят разнообразные способы. Перед экстракцией пищевой продукт можно измельчить до образования частиц, как указано выше. Полисахарид-содержащую фракцию можно экстрагировать из пищевого продукта путем ферментативного расщепления, например, при помощи целлюлазы. После подходящего периода времени ферментативную активность можно приостановить, например, путем кипячения смеси для экстракции. После этого белки (включая добавленные ферменты) можно удалить из препарата полисахаридного антигена путем осаждения. Белки можно с удобством осаждать при помощи летучего органического растворителя, такого как хлороформ, бутанол или их смесь. Подходящая температура для экстракции может варьировать в диапазоне от 4° до 100°С, в зависимости от того, что подходит для конкретного пищевого продукта, который подвергают обработке. Аналогично, время, нужное для оптимальной экстракции, может зависеть от пищевого продукта и размера частиц. Подходящее время экстракции может варьировать от 30 минут до 48 часов. После экстракции остаточные твердые частицы можно удалить путем осаждения и отстаивания, центрифугирования, фильтрации или сочетания указанных способов. После экстракции и удаления экстрагируемых твердых частиц препарат полисахаридного антигена можно перенести в соответствующий буфер для связывания, или, в качестве альтернативы, можно хранить до его применения. Полисахариды можно выпаривать до сухого состояния, лиофилизировать, хранить в жидкой форме при низких температурах, или хранить замороженными до применения. Согласно некоторым вариантам реализации в препарат полисахарида можно добавлять вспомогательное вещество, такое как глицерин, чтобы было возможно хранение жидкой формы при температуре ниже 0°С.
[0064] Гликопротеиновые антигены, под которыми в целях данной заявки понимают белки, которые обладают аффинностью к сахарам, можно экстрагировать из пищевых продуктов разнообразными способами. Перед экстракцией пищевой продукт можно измельчить до образования частиц, как указано выше. Гликопротеин-содержащую фракцию можно экстрагировать из пищевого продукта, например, посредством аффинной хроматографии или специфических осаждающих агентов. В способах аффинной хроматографии белковая фракция, получаемая из пищевого продукта, наносится на среду для хроматографирования, которая включает фиксированные группы сахаридов или полисахаридов, способные взаимодействовать с указанным гликопротеином. Связавшиеся гликопротеины можно впоследствии десорбировать из среды путем нанесения раствора соответствующего сахара, такого как глюкоза, галактоза, манноза или их производные. Специфические осаждающие агенты могут включать соединения, которые включают углеводный компонент и плохо растворимый органический компонент. Связывание таких соединений может способствовать осаждению гликопротеинов при правильно подобранных буферных условиях (например, в присутствии двухвалентных катионов). Такие осажденные гликопротеины можно извлечь, например, посредством расщепления плохо растворимого органического компонента после этапа обессоливания (несколько примеров которых приведено ниже). Подходящая температура для экстракции может варьировать в диапазоне от 4° до 95°С, в зависимости от того, что подходит для конкретного пищевого продукта, который подвергают обработке. Аналогично, время, нужное для оптимальной экстракции, может зависеть от пищевого продукта и размера частиц. Подходящее время экстракции может варьировать от 30 минут до 48 часов. После экстракции остаточные твердые частицы можно удалить путем осаждения и отстаивания, центрифугирования, фильтрации или сочетания указанных способов. После экстракции и удаления экстрагируемых твердых частиц препарат гликопротеинового антигена можно перенести в соответствующий буфер для связывания, или, в качестве альтернативы, можно хранить до его применения. Гликопротеины можно лиофилизировать, хранить в жидкой форме при низких температурах, или хранить замороженными до применения. Согласно некоторым вариантам реализации в препарат гликопротеина можно добавлять вспомогательное вещество, такое как глицерин, чтобы было возможно хранение жидкой формы при температуре ниже 0°С.
[0065] Как отмечалось выше, согласно некоторым вариантам реализации желательно переносить препарат экстрагируемого антигена из одного буфера в другой, например, из одного буфера для обработки в другой или из буфера для хранения в буфер, подходящий для прикрепления антигена к твердой фазе. Такого переноса между буферами можно добиться посредством диализа против нового буфера с применением диализной мембраны с эксклюзионным пределом, который позволяет сохранить экстрагируемый антиген. В качестве альтернативы, буферы можно менять посредством эксклюзионной хроматографии с соответствующей средой для хроматографирования. Согласно еще одному варианту реализации буферы можно заменять путем осаждения с применением летучего вспомогательного вещества, сбора и сушки осадка и повторного растворения в желаемом буфере.
[0066] Для применения при количественном определении связывания с антителом и/или C1q экстрагированные антигены соединяют с твердой фазой. В контексте настоящей заявки термин «твердая фаза» включает нерастворимые, суспендируемые фазы, такие как частицы и микрочастицы. Такие микрочастицы можно кодировать, например, по размеру частиц и/или путем включения красителей, чтобы можно было различать популяции частиц (например, частицы, связанные с антигенами, полученными из конкретного продукта питания). Такое кодирование может позволить одновременно проводить определение входе единого, мультиплексного анализа. Типичные твердые фазы включают без ограничений планшеты с микролунками, ленты с микролунками, микроматрицы, пористые или волокнистые материалы, наконечники пипеток, гранулы и микрочастицы. Такое соединение может быть ковалентным (т.е., применение ковалентных связей между молекулами экстрагированного антигена и твердой фазой) или нековалентными. Согласно одному предпочтительному варианту реализации идеи изобретения твердой фазой является по меньшей мере часть внутренней поверхности лунки планшета с микролунками или ленты с микролунками. Такие микролунки могут быть сконструированы из любого подходящего материала, включая полистирол, поликарбонат, полипропилен и полиэтилен. Согласно некоторым вариантам реализации идеи изобретения поверхность микролунки была физически или химически модифицирована (например, путем текстуризации), чтобы усилить связывание.
[0067] Анализ, применяемый для определения образования комплексов между антителом и/или C1q из образца и иммобилизованным пищевым антигеном может представлять собой иммуноанализ. Такой иммуноанализ может быть непрямым (т.е., конкурентным) или прямым (т.е., «сэндвич»-анализ), и может быть основан на применении любой подходящей метки с возможностью детекции (например, флуоресцентных компонентов, хромогенных компонентов, меток массы, радиоактивных компонентов и/или ферментов). Согласно одному предпочтительному варианту реализации идеи изобретения, анализ представляет собой иммуноанализ, основанный на применении такой метки, как щелочная фосфатаза или пероксидаза хрена. Следует понимать, что для одной поверхности для анализа можно применять более одного специфичного антитела (например, антивидовой IgG, антивидовой IgA и/или анти-Clq), что для всех можно применять общую метку.
[0068] Согласно некоторым вариантам реализации идеи изобретения антигены из популяции антигенов, которая была описана выше, фиксируют на твердой поверхности для анализа посредством адсорбции. Поверхность для анализа согласно настоящему изобретению включает антигены, полученные из по меньшей мере двух разных экстрактов антигенов, приготовленных из одного пищевого источника разными способами. Согласно некоторым вариантам реализации поверхность для анализа включает по меньшей мере три разных экстракта антигенов, приготовленные из одного пищевого источника разными способами. Согласно другим вариантам реализации поверхность для анализа включает по меньшей мере четыре разных экстракта антигенов, приготовленные из одного пищевого источника разными способами. Согласно еще некоторым другим вариантам реализации поверхность для анализа включает по меньшей мере пять разных экстрактов антигенов, приготовленных из одного пищевого источника разными способами. Согласно предпочтительным вариантам реализации поверхность для анализа включает по меньшей мере шесть разных экстрактов антигенов, приготовленных из одного пищевого источника разными способами.
[0069] Согласно предпочтительному варианту реализации настоящего изобретения препараты антигенов, полученные, как было описано выше, адсорбируют на поверхности для анализа последовательно поэтапно, и между этапами добавления несвязавшийся материал удаляют. Например, препарат антигена, полученный из пищевого продукта, можно нанести на поверхности для анализа на период времени, достаточный, чтобы произошла адсорбция. Например, препарат антигена, полученный из пищевого продукта, можно нанести на поверхности для анализа на период времени, достаточный, чтобы по меньшей мере часть первых пищевых антигенов из указанного препарата первого пищевого антигена образовала комплекс с указанной обычной поверхностью для анализа. Такие периоды времени могут варьировать от 0,5 до 48 часов, и температура во время них может устанавливаться в диапазоне от 4°С до 50°С. Затем несвязавшийся материал удаляют, например, путем пипетирования, перед адсорбцией второго, другого препарата антигена, полученного из того же пищевого продукта. Необязательно поверхность для анализа можно подвергать отмывке перед ее приведением в контакт со вторым и/или последующим препаратом антигена. Такую отмывку можно проводить при помощи отмывочного буфера, который может включать поверхностно-активное вещество. Подходящие поверхностно-активные вещества включают полиоксиэтилен сорбитан монолаурат (Tween 20), полиоксиэтилен сорбитан моноолеат (Tween 80), 4-(1,1,3,3-тетраметилбутил)фенил-полиэтиленгликоль (Triton X-100) и/или октилфеноксиполи(этиленокси)этанол (Nonidet Р40). Данный процесс можно повторять с дополнительными (например, третьим, четвертым, пятым и шестым) препаратами антигенов из того же пищевого продукта для получения последовательно покрытой поверхности для анализа.
В одном аспекте настоящего изобретения предложена поверхность для анализа, содержащая: первое покрытие на поверхности для анализа, содержащее первый пищевой антиген, экстрагированный из пищевого продукта в ходе первого процесса; второе покрытие на поверхности для анализа, содержащее второй пищевой антиген, экстрагированный из указанного пищевого продукта в ходе второго процесса; и третье покрытие на поверхности для анализа, содержащие третий пищевой антиген, экстрагированный из указанного пищевого продукта в ходе третьего процесса; при этом указанное второе покрытие было нанесено на указанную поверхность для анализа после нанесения указанного первого покрытия, а указанное третье покрытие было нанесено на указанную поверхность для анализа после нанесения указанного второго покрытия.
В одном аспекте настоящего изобретения также предложен способ получения поверхности для анализа для определения характеристики чувствительности к пищевым продуктам, включающий обеспечение поверхности для анализа; приведение в контакт препарата первого пищевого антигена с частью указанной поверхности для анализа в течение периода времени, достаточного, чтобы по меньшей мере часть первых пищевых антигенов из указанного препарата первого пищевого антигена адсорбировалась на указанной части указанной поверхности для анализа; после приведения в контакт с указанным препаратом первого пищевого антигена, приведение в контакт препарата второго пищевого антигена с частью указанной поверхности для анализа в течение периода времени, достаточного, чтобы по меньшей мере часть вторых пищевых антигенов из указанного препарата второго пищевого антигена адсорбировалась на указанной части указанной поверхности для анализа; и после приведения в контакт с препаратом второго пищевого антигена, приведение в контакт препарата третьего пищевого антигена с частью указанной поверхности для анализа в течение периода времени, достаточного, чтобы по меньшей мере часть третьего пищевого антигена из указанного препарата третьего пищевого антигена адсорбировалась на указанной части указанной поверхности для анализа, при этом указанный препарат первого пищевого антигена, указанный препарат второго пищевого антигена и указанный препарат третьего пищевого антигена получены из одного пищевого продукта.
В рамках настоящего изобретения также предложен набор для анализа для определения характеристики профилей связывания антитела и C1q, содержащий планшет для анализа, при этом указанный планшет для анализа содержит множество поверхностей для анализа согласно настоящему изобретению. В одном из вариантов реализации, указанный планшет для анализа включает первую поверхность для анализа, содержащую антигены из первого пищевого продукта, и вторую поверхность для анализа, содержащую антигены из второго пищевого продукта.
[0070] Неожиданно было обнаружено, что, несмотря на предшествующее воздействие препаратов антигенов и содержащие поверхностно-активное вещество буферы, многие распространенные поверхности для анализа (например, полистирольные микролунки) сохраняют способность адсорбировать дополнительный антигенный материал. После нанесения последнего препарата антигена оставшиеся центры адсорбции поверхности для анализа можно блокировать путем нанесения блокирующего буфера. Такие блокирующие буферы могут содержать один или более белков (например, блокирующих белков), которые занимают оставшиеся центры адсорбции или центры соединения поверхности для анализа, но не создают значимого взаимодействия с другими компонентами анализа. Примеры подходящих блокирующих белков включают сывороточный альбумин, яичные альбумины, желатин, молочные белки и неспецифические иммуноглобулины из соответствующих видов.
[0071] Неожиданно авторы изобретения обнаружили, что поверхности для анализа, включающие множество экстрактов антигенов, не удается эффективно получать путем смешивания таких экстрактов антигенов перед нанесением на поверхность для анализа. Было показано, что такие смеси нестабильны, что приводит к образованию осадков, из-за которых удалялись по меньшей мере некоторые антигенные соединения еще до нанесения на поверхность для анализа. Поскольку потеря таких антигенов может приводить к ложноотрицательному результату для данного конкретного пищевого продукта, это весьма нежелательно. Неожиданно авторы изобретения обнаружили, что нанесение препаратов пищевых антигенов на поверхность для анализа приводит к получению поверхности для анализа, на которой присутствует более широкий спектр пищевых антигенов. Согласно некоторым вариантам реализации идеи изобретения препараты пищевых антигенов добавляют в особом порядке. Например, множество препаратов пищевых антигенов можно с успехом наносить в следующем порядке: сначала щелочерастворимые белки, затем спирторастворимые белки, затем водорастворимые белки, затем полисахариды, затем гликолипиды и в конце гликопротеины. Согласно другим вариантам реализации идеи изобретения может быть подходящим другой порядок добавления, при условии, что разные препараты антигенов наносятся на поверхность для анализа по-отдельности, в различных этапах. Также следует понимать, что согласно некоторым вариантам реализации один или более препаратов антигенов, обсуждаемых выше, в процессе покрытия может быть пропущен.
Примеры
[0072] ПРИМЕР 1: Экстракция белков из разных пищевых продуктов
[0073] Подходящие способы экстракции водорастворимых, спирторастворимых и щелочерастворимых белков из разных пищевых источников следующие:
Этап 1 - для каждого препарата белкового антигена толкут или перемалывают 2 грамма сухих бобов, орехов, семян и специй или 20 грамм сырых фруктов или овощей в одном из трех разных растворителей/буферов (обозначены А, В и С):
A. 100 мл 0,1 М ФСБ (фосфатно-солевого буфера) (рН 7,2) для водорастворимых белков
B. 100 мл 70% этанола для спирторастворимых белков
C. 100 мл 0,1 М КОН (рН 10,0) для щелочерастворимых белков.
Этап 2 - проводят обработку ультразвуком в течение 2-5 минут с целью лизиса клеток. Добавляют 2 мл детергента (1,1,3,3-тетраметилбутил)фенил- полиэтиленгликоль или n-додецил-β-D-мальтозид) и повторяют обработку ультразвуком еще в течение 2-5 минут.
Этап 3 - Перемешивают смесь в течение 2 часов, а затем центрифугируют каждый препарат при 10000 g в течение 15 минут. Удаляют надосадочную жидкость.
Этап 4 - Переносят каждую надосадочную жидкость в отдельный диализный мешок (порог по молекулярной массе (ММ) 6000 Дальтон) и проводят диализ против конкретного растворителя. Например, для раствора белкового антигена, растворенного в ФСБ, диализ следует проводить против ФСБ. Аналогично, для белкового антигена, экстрагированного при помощи КОН, диализ следует проводить против 0,1 М КОН.
Этап 5 - после диализа в течение 48 часов отбирают диализированные растворы и центрифугируют при 14000 g в течение 15 минут. Для измерения концентрации белка можно отбирать образцы; оставшиеся препараты белковых антигенов можно хранить при -20°С, пока они не понадобятся для применения при иммуноанализе.
[0074] ПРИМЕР 2: Экстракция гликолипидов из разных пищевых продуктов
[0075] Подходящий способ экстракции гликолипидов из разных пищевых источников следующий:
Этап 1 - толкут или перемалывают 2 грамма сухих бобов, орехов, семян и специй или 20 грамм сырых фруктов или овощей в 100 мл воды.
Этап 2 - проводят обработку ультразвуком в течение 2-5 минут с целью лизиса клеток.
Этап 3 - Добавляют 120 мл хлороформа:метанола (2:1, об.:об.) и повторяют обработку ультразвуком.
Этап 4 - Добавляют 600 мкл пиридина и инкубируют смесь при 50°С в течение 24 часов, чтобы экстрагировать простые липиды, фосфолипиды и гликолипиды.
Этап 5 - Наносят экстракт в хлороформе:метаноле на ионообменный носитель на основе DEAE (диэтиламиноэтила); затем десорбируют гликолипиды из колонки при помощи хлороформа: метанола: ацетата натрия (1:2:1, объем:объем:объем).
Этап 6 - Гидролизуют десорбированные гликолипиды раствором 0,1 Н гидроксида натрия/метанола, нейтрализуют уксусной кислотой, затем обессоливают путем связывания с обращенной фазой С-18 в колонке и последующей десорбции с нее.
Этап 7 - Растворяют обессоленные гликолипиды в хлороформе:метаноле (2:1, объем:объем).
Этап 8 - Удаляют органические растворители из растворенного гликолипида при 55°С при помощи роторного испарителя. Такой высушенный материал можно хранить при -20°С.
Этап 9 - для применения, суспендируют гликолипиды в 70% метаноле и обрабатывают ультразвуком в течение 2 минут при комнатной температуре.
[0076] ПРИМЕР 3 - Получение полисахаридов из разных пищевых продуктов
[0077] Подходящий способ получения полисахаридов из фруктов, овощей или бобов следующий:
Этап 1 - толкут или перемалывают 2 грамма сухих бобов, орехов, семян и специй или 20 грамм сырых фруктов или овощей в 100 мл воды.
Этап 2 - проводят обработку ультразвуком в течение 2-5 минут с целью лизиса клеток.
Этап 3 - Добавляют 100 мг целлюлазы и инкубируют при 37°С в течение 4 часов.
Этап 4 - Увеличивают температуру до 100°С и инкубируют в течение 60 минут.
Этап 5 - Центрифугируют при 10000 g в течение 15 минут и сохраняют надосадочную жидкость.
Этап 6 - Добавляют хлороформ:бутиловый спирт (4:1, объем:объем), чтобы удалить свободные белки, включая целлюлазу.
Этап 7 - Осаждают полисахариды из депротеинированного раствора путем добавления 4 объемов 95% этанола, повторно растворяют осадок в 100 мл воды.
Этап 8 - Определяют содержание нейтральных Сахаров (например, при помощи колориметрического метода с фенолом-серной кислотой согласно Dubois etal, 1956) с применением глюкозы в качестве стандарта, и проводят дальнейшее описание моносахаридного состава (например, по методу Sheng et al 2007). Препараты полисахаридов можно хранить при -20°С, пока они не понадобятся для применения при иммунологическом анализе.
[0078] ПРИМЕР 4 - Экстракция гликопротеинов из разных пищевых продуктов
[0079] Подходящий способ получения гликопротеинов из разных пищевых продуктов следующий:
Этап 1 - толкут или перемалывают 100 граммов сухих фруктов, овощей, бобов, фасоли, орехов, семян, трав, молочных продуктов, яиц, мяса, морепродуктов, камедей или напитков в блендере.
Этап 2 - Добавляют 100 мл 2% (масса/объем) CaCl2 и гомогенизируют в течение 5 минут.
Этап 3 - Проводят обработку ультразвуком в течение 3 минут с целью лизиса клеток.
Этап 4 - Перемешивают смесь в течение 2 часов при комнатной температуре, а затем центрифугируют раствор при 10000 g в течение 30 минут. Сохраняют надосадочную жидкость.
Этап 5 - Добавляют 120 мл 2% (масса/объем) CaCl2, содержащего 120 мг, 3,5-Р-β-D-галактозил-оксигеназо) 2,4,6-тригидроксибензола и перемешивают в течение 1 часа, чтобы осадить гликопротеины.
Этап 6 - Отбирают осадок, содержащий гликопротеины, путем центрифугирования в течение 10 минут при 2000 g.
Этап 7 - Растворяют осадок в 15 мл дистиллированной воды.
Этап 8 - Добавляют 250 мг метабисульфита натрия в 5 мл дистиллированной воды, чтобы восстановить диазо-связь.
Этап 9 - Плотно закрывают пробкой пробирку, содержащую гликопротеины, и инкубируют при 50°С в течение 20 минут.
Этап 10 - Проводят диализ раствора восстановленного гликопротеина против 3 литров дистиллированной воды с применением диализной мембраны с порогом по молекулярной массе в течение 3 дней, воду заменяют ежедневно.
Этап 11 - Центрифугируют диализированный материал при 14000 g в течение 15 минут. Концентрацию гликопротеина можно измерить при помощи набора DIG GLYCAN DETECTION KIT® от компании «Roche Life Sciences» (Индианаполис, Индиана). Указанный препарат можно хранить при -20°С, пока он не понадобится для иммунологического анализа.
[0080] ПРИМЕР 5 - Связывание разных пищевых экстрактов с твердой матрицей для измерения антител
[0081] При успешном покрытии планшета с применением препаратов антигенов, экстрагированных, как было описано выше, на одной и той же поверхности для анализа, разные экстракты добавляют последовательно на одну и ту же поверхность для анализа, и между успешными этапами добавления проводят этапы отмывки, чтобы удалить несвязавшийся материал. Подходящий порядок добавления в лунки планшета с микролунками следующий.
Этап 1 - Добавляют в планшет щелочерастворимые белки, затем в течение 24 часов инкубируют при 4°С, а затем отмывают ФСБ/Tween 20.
Этап 2 - Добавляют в планшет спирторастворимые белки, затем в течение 24 часов инкубируют при 4°С, а затем отмывают ФСБ/Tween 20
Этап 3 - Добавляют в планшет водорастворимые белки, затем в течение 24 часов инкубируют при 4°С, а затем отмывают ФСБ/Tween 20
Этап 4 - Добавляют в планшет полисахариды, затем в течение 24 часов инкубируют при 4°С, а затем отмывают ФСБ/Tween 20
Этап 5 - Добавляют в планшет гликолипиды, затем в течение 24 часов инкубируют при 4С, а затем отмывают ФСБ/Tween 20
Этап 6 - Добавляют в планшет гликопротеины, затем в течение 24 часов инкубируют при 4°С, а затем отмывают ФСБ/Tween 20
Этап 7 - После того, как в планшет были добавлены все шесть препаратов антигенов, и антигенам, содержащимся в указанных препаратах дали связаться с твердой матрицей, оставшиеся неспецифические центры связывания насыщают путем добавления 2% (масса/объем) бычий сывороточный альбумин, 2% (масса/объем) яичный альбумин, 2% (масса/объем) сухое молоко, 2% (масса/объем) желатин или 2% (масса/объем) желатин из костистых рыб. После конечной отмывки ФСБ/Tween 20 планшет можно хранить при 4°С до его применения при измерении антител и/или C1q.
[0082] ПРИМЕР 6 - Процедура анализа для определения антител IgG, IgA и комплекса иммуноглобулин-Clq в крови относительно сочетания экстрактов разных пищевых продуктов
[0083] В нижеследующей процедуре описано применение планшетов с микролунками, покрытых сочетанием пищевых экстрактов в соответствии с Примером 5. Следует понимать, что можно применять пробирки, нитроцеллюлозную бумагу, суспензии микрочастиц и другие матрицы.
[0084] Образцы сыворотки отбирали у индивидуумов посредством венипункции и давали отстояться при комнатной температуре в течение 20 минут. Также подходят другие типы образцов, включая плазму крови, цельную кровь, слюну, слизь, синовиальную жидкость и/или спинномозговую жидкость. После центрифугирования в течение 10 минут при 800 g сыворотку отбирают и хранят при -40°С.
[0085] Буфер для отмывки готовили следующим образом: в мерный цилиндр на 500 мл добавляли 450 мл воды и 50 мл 10х буфера для отмывки (1,0 л 1хФСБ, разбавленный 3,0 л дистиллированной воды или деионизированной НЬО; 1,5 мл Tween 20; 400 мг азида натрия). Раствор смешивали и переносили в пластиковую бутыль и хранили при 2-8°С до применения.
[0086] Анти-иммуноглобулиновые и анти-C1q антитела получали следующим образом: 100 мкл меченного ферментом антитела на IgG человека, антитела на IgA человека, антитела к IgG человека плюс антитела на комплемент C1q, или антитела на IgA человека плюс антитела на комплемент C1q добавляли к 20-50 мл разбавителя конъюгата, содержащего 0,1 М ФСБ/ Tween 20 и 2% БСА, и применяли для детекции антител и/или конъюгатов антител C1q в сыворотке.
[0087] Раствор субстрата готовили непосредственно перед применением путем добавления 5 мл буфера для субстрата на таблетку субстрата 5 мг в пустой полипропиленовой пробирке. Пробирку закрывали пробкой. Перемешивали до растворения таблетки, а затем сразу же применяли данный раствор. На одну ленту с микролунками применяли приблизительно 1 мл раствора субстрата.
[0088] Для определения характеристики профиля антител и C1q сыворотку разводили в соотношении 1:100 (объем/объем) путем добавления 40 мкл сыворотки к 4 мл буфера-разбавителя, содержащего 0,1 М ФСБ/ Tween 20 плюс 2% БСА. Следует понимать, что данное разведение можно при необходимости скорректировать, и соотношение может варьировать от 1:20 (объем/объем) до 1:400 (объем/объем). Разведенную сыворотку добавляют в двух повторах в лунки для каждого пищевого продукта и инкубируют в течение 30-60 минут при 4°С - 25°С. Данную инкубацию можно сократить до 15 минут и увеличить до 24 часов. После инкубации планшеты отмывают 3-6 раз с применением буфера для отмывки, такого как 0,1 М ФСБ/ Tween 20, затем в исследуемые лунки добавляют 100 мкл разведенного соответствующим образом антитела к IgG человека, антитела к IgA человека или антитела к IgG человека плюс антитела на комплемент C1q, меченных ферментом, таким как щелочная фосфатаза. Подходящие разведения для таких антииммуноглобулинов и конъюгатов анти-Clq могут варьировать от приблизительно 1:200 до приблизительно 1:1000 (объем/объем).
[0089] Планшеты или ленты с микролунками затем накрывают и инкубируют в течение 60 минут при комнатной температуре (т.е., 22°С-25°С). Затем из всех лунок отбирают жидкость, и лунки отмывают четыре раза с применением приблизительно 200 мкл буфера. Затем в лунки добавляют 100 мкл раствора субстрата p-NPP с временными интервалами, которые соответствуют времени считывания прибора, требуемого на считывание реакции (например, если прибору требуется 30 секунд для захвата данных в одной лунке, субстрат добавляют в лунки с интервалами 30 секунд). Время инкубации субстрата в каждой лунке составляет от 45 минут до 60 минут, при температуре 22°С-25°С. Следует понимать, что данное время можно сократить, если этап инкубации субстрата проводится при более высоких температурах. Ферментативную реакцию останавливают, добавляя в лунки 50 мкл 3Н NaOH с теми же временными интервалами, с которыми добавляли p-NPP. Затем планшет с микролунками встряхивают в течение 1-2 минут. Дно планшета с микролунками перед считыванием промокают неабразивной бумагой, и выставляют нулевой уровень прибора по пустой лунке. Оптическую плотность (OD) считывают на длине волны 405 нм±5 нм не позднее 30 минут после остановки ферментативной реакции, и регистрируют значения.
[0090] Титр антител можно определить при помощи компьютерной программы по следующим формулам:
1) Показатель IgG, IgA или IgG+C1q=
(Поглощение исследуемого образца)/(Поглощение калибратора)
2) Уровень IgG, IgA или IgG+C1q=
((Значения калибраторов) X (Поглощение исследуемого образца))/(Поглощение калибраторов)
Для точного определения показатели поглощения можно переводить в значения концентраций при помощи способа поточечного сжатия данных. В качестве альтернативы можно применять наилучшую подгонку линейной регрессии, чтобы получить данные.
[0091] Значения получали при помощи автоматического ридера для ELISA (твердофазного иммуноферментного анализа). По оси X откладывали значение концентрации каждого калибратора. По оси Y откладывали соответствующее значение среднего поглощения, выражаемого как оптическая плотность (OD). Получали кривую наилучшей подгонки. Концентрацию в слюне или сыворотке каждого пациента получали путем локализации их значения поглощения на оси Y и нахождения соответствующего значения концентрации на оси X. Пример типичной калибровочной кривой показан на Фигуре 1. Концентрацию выражают в относительных единицах, которые на практике зависят от природы вида, применяемого для калибровки.
[0092] Результаты, полученные для сыворотки, отобранной у первого пациента, показаны на Фигуре 2. Фигура 2 демонстрирует повышение уровня антитела IgG на антигены, полученные из 180 исследуемых пищевых продуктов, которое описывали при помощи лунки планшета с микролунками, которая была последовательно покрыта, как было описано выше, и зондировали только с применением антитела на IgG человека. На основании распределения не повышенных значений было выбрано значение порога OD 0,5, и оптическая плотность выше указанного значения указывала на положительную реакцию. В данном примере с пороговым уровнем 0,5 следует отметить, что значимое повышение наблюдается в отношении банана, ананаса, имбиря, ванили, топинамбура, спаржи, капусты, кукурузы, баклажана, оливок, маринадов, жареного картофеля, водорослей, лектина чечевицы, пекана, яичного белка и крабовых палочек. Иммунная реактивность IgG в отношении еще 163 экстрактов пищевых продуктов была ниже OD 0,5 или отрицательной.
[0093] Результаты для того же образца, но когда лунки планшета с микролунками зондировали только анти-C1q антителом, показаны на Фигуре 3. Фигура 3 демонстрирует повышение уровня связывания C1q (в форме нативного комплекса иммуноглобулина-C1q) со смесью антигенов, полученных из 180 исследуемых пищевых продуктов. Примечательно, что C1q, измеренный таким образом, показывает, что концентрация данного комплекса значительно повышена в отношении 12 разных новых пищевых экстрактов, которые не давали положительного результата, когда измерялся только IgG. Указанные экстракты включали хевеин латекса, чеснок, лук, лектин гороха, редьку, эндохитиназу риса, пищевой краситель, тунец, креветку, камеди и зеленый чай. Кроме того, примечательно, что для указанных 12 пищевых продуктов концентрация IgG была ниже 0,5 или отрицательна, когда аналогичные лунки зондировали при помощи антитела на IgG человека (см. Фигуру 2).
[0094] Результаты для того же образца, но когда каждую из лунок планшета с микролунками зондировали и антителом на IgG человека, и анти-Clq антителом, показаны на Фигуре 4. Фигура 4 демонстрирует, что когда сочетание IgG и комплекса C1q-lgG измеряли путем одновременного нанесения и антитела к IgG человека, и антитела на C1q человека, все пищевые экстракты, которые были реактивны, когда измеряли либо IgG, либо C1q-IgG (как показано на Фигурах 2 и 3), приобретали высокую реактивность. Для другого 151 пищевого продукта показатели оптической плотности были ниже 0,5 или отрицательны.
[0095] Указанные наблюдения демонстрируют, что если для сыворотки данного индивидуума описывали только связывание антитела IgG, то могла определяться реактивность в отношении только 17 пищевых экстрактов. Аналогично, если измеряют только нативный комплекс иммуноглобулин-C1q, профиль C1q пациента демонстрирует реакцию на 12 пищевых экстрактов, которые не определялись при измерении только IgG. Однако, когда одновременно измеряют и IgG, и C1q-lgG, генерируется профиль, демонстрирующий реактивность на все 29 пищевых экстрактов (показан на Фигуре 4), которые сочетают в себе 17, определяемых по повышению IgG (показаны на Фигуре 2) и еще 12, определяемые по повышению C1q-IgG (показаны на Фигуре 3).
[0096] На Фигурах 5, 6 и 7 показаны результаты аналогичных исследований с другим индивидуумом (т.е., профили антител IgG, комплекса иммуноглобулина-C1q, и IgG+ нативный комплекс иммуноглобулин-C1q в отношении 180 пищевых экстрактов). Примечательно, что для измерения IgG реактивными были только 10 из 180 пищевых экстрактов (Фигура 5), а когда измеряли нативный комплекс иммуноглобулин-C1q, реактивными были 14 пищевых продуктов (11 из которых были уникальны для нативного комплекса иммуноглобулин-C1q, см. Фигуру 6). Когда были описаны и IgG, и нативный комплекс иммуноглобулин-C1q, совместный профиль показывает повышенную реактивность на 21 пищевой экстракт (как показано на Фигуре 7). Данный совместный профиль соответствует сочетанию 10 пищевых антигенов, определяемых по IgG (показано на Фигуре 5) и дополнительных 11, определяемых для нативного комплекса иммуноглобулин-С1 (показано на Фигуре 6).
[0097] Это демонстрирует, что для оптимального определения пищевой иммунной реактивности следует генерировать сочетание профиля IgG плюс нативного комплекса иммуноглобулин-C1q с применением поверхностей для анализа, покрытых сочетанием разных популяций антигенов, полученных из каждого исследуемого пищевого продукта.
[0098] На Фигурах 8, 9, 10 и 11 показаны в табличной форме результаты исследований связывания анти-IgG антител и анти-C1q антител в отношении обработанных сывороткой поверхностей для анализа, покрытых антигенами, полученными из четырех разных наборов пищевых продуктов, соответственно. Поверхности для анализа покрывали разными препаратами антигенов, которые содержали в основном водорастворимые компоненты, некоммерческие водорастворимые белки, экстрагированные, как было описано выше, некоммерческие спирторастворимые белки, экстрагированные, как было описано выше, некоммерческие щелочерастворимые белки, экстрагированные, как было описано выше, некоммерческие гликолипиды, экстрагированные, как было описано выше, некоммерческие полисахариды, экстрагированные, как было описано выше, и некоммерческие гликопротеины, экстрагированные, как было описано выше. Результаты показаны для поверхностей для анализа, покрытых индивидуальными препаратами антигенов, и для поверхностей для анализа, покрытых сочетанием всех шести некоммерческих препаратов антигенов. Кроме того, показан результат, полученный для поверхностей, обработанных сочетанием некоммерческих препаратов антигенов из подвергнутых тепловой обработке/приготовленных продуктов питания. Для данного набора результаты, демонстрирующие оптическую плотность более 0,5, считались положительными.
[0099] Хотя между определением антител на коммерческие препараты пищевых антигенов и водорастворимых компонентов пищевых продуктов существует хорошая корреляция, когда указанные измерения сравнивают с измерениями, полученными с применением спирторастворимых, щелочерастворимых, гликолипидных, полисахаридных и гликопротеиновых компонентов, обнаруживаются значимые различия в иммунной реактивности. Аналогичные различия наблюдаются при сравнении с поверхностями для анализа, покрываемыми последовательно такими из препаратов пищевых антигенов.
[00100] Например, когда связывание IgG и нативного комплекса IgG-Cq описывали относительно коммерческого экстракта банана (см. Фигуру 8), результатом является оптическая плотность (OD) 0,58, или очень слабо положительный результат. При применении водорастворимого экстракта, полученного, как было описано выше, OD стала 0,65, что является слабоположительным результатом (или «+»). Но при описании относительно полисахаридов банана OD возрастала до 0,98 или (++), а при применении смеси всех шести экстрактов OD возрастала до 1,73 (++++). Аналогично, при применении термоденатурированной смеси антигенов банана получаемая в результате OD составила 1,48 (+++). Указанные наблюдения демонстрируют, что сильная иммунная реактивность на банан могла остаться не выявленной, если бы были применены только коммерческие антигены.
[00101] Аналогичная картина наблюдалась для кукурузы (см. Фигуру 8). Когда измеряли концентрацию IgG плюс нативного комплекса иммуноглобулина-C1q, результатом была OD 0,48 или (±) относительно коммерческого экстракта кукурузы, 0,56 или (+) при применении водорастворимого экстракта, 1,4 или (+++) при применении спирторастворимого экстракта, 0,93 или (++) при применении щелочерастворимого экстракта, 0,72 или (+) при применении препарата гликолипидов и 0,86 или (++) при применении препарата полисахаридов. При измерении относительно поверхности для анализа, последовательно покрытой указанными шестью экстрактами, O.D. составила 2,84 или (+++++), что указывает на высокую степень иммунной реактивности.
[00102] Другим хорошим примером являются грибы (см. Фигуру 9), где иммунная реактивность возрастает от 0,45 или (±) при применении коммерческого экстракта до 3,11 (+++++) при применении водорастворимого экстракта, и даже до 3,52 (++++++) при применении поверхности для анализа, на которую последовательно нанесены все термоденатурированные препараты антигенов. Аналогично O.D. для гороха (Фигура 9), картофеля (Фигура 9), риса (Фигура 10), семян кунжута (Фигура 10), шпината (Фигура 10), помидора (Фигура 10), пшеницы (Фигура 10) и яичного желтка заслуживает оценки. Относительно яичного желтка, компоненты водорастворимого экстракта не позволяли определить практически никакого IgG или нативного комплекса иммуноглобулин-C1q (-), однако O.D. возрастала до 0,36 при применении спирторастворимых компонентов и до 3,31 (+++++), когда применяли поверхность для анализа, покрытую последовательно всеми препаратами антигенов. Что касается яичного белка (Фигура 10), который представляет собой водорастворимые белки, наблюдалась сходная реактивность (++++). Аналогичные результаты также определялись для креветок (Фигура 11), миндаля (Фигура 11), бразильского ореха (Фигура 11), арахиса (Фигура 11) и пшеницы.
[00103] Примечательно, что в случае с креветками и миндалем связывание IgG и нативного комплекса иммуноглобулин-C1q значимо изменялось, когда измерение проводили при помощи поверхностей для анализа, последовательно покрытых всеми препаратами антигенов. Также следует отметить, что хотя термоденатурация приводила к уменьшению O.D. с 2,76 (+++++) до 1,2 (++), когда смесь экстрактов применяли для креветок, для миндаля термоденатурация смеси приводила к увеличению иммунной реактивности с 0,5 до 1,6, а для бразильского ореха с 1,36 до 2,49. В качестве последнего примера O.D. для IgG плюс нативный комплекс иммуноглобулин-C1q в отношении арахиса возрастала с 1,51 при применении коммерческого экстракта до 2,18, когда применяли поверхность для анализа, последовательно покрытую всеми экстрактами, и возрастала далее до 3,98, когда смесь была термоденатурирована.
[00104] Это показывает, что для более точного описания (характеристики) IgG и/или C1q-содержащих иммунных комплексов, следует применять поверхности для анализа, последовательно покрытые экстрактами, полученными из водорастворимых компонентов, спирторастворимых компонентов, щелочерастворимых компонентов, гликолипидов, полисахаридов, гликопротеинов, полученных из пищевых продуктов в их необработанной форме и, когда применимо, в термоденатурированной или приготовленной форме, чтобы получить полный профиль связывания.
[00105] Следует понимать, что хотя выше приведены результаты для IgG из образцов, аналогично улучшенные результаты предполагается получить при исследовании связывания IgA с поверхностями для анализа согласно идее настоящего изобретения. Следует также понимать, что ожидается, что описание связывания IgE, IgM и/или IgD с поверхностями для анализа согласно идее настоящего изобретения обеспечит более полную, чувствительную и/или точную оценку опосредуемого антителами ответа на пищевые антигены, чем оценка, получаемая при помощи поверхностей для анализа, полученных с применением экстракции одного антигена или способа получения из каждого пищевого продукта. Согласно некоторым вариантам реализации идеи изобретения разные виды антител можно исследовать в сочетании с применением одной и той же поверхности для анализа. Например, определение связывания IgG и IgA с одной и той же поверхностью для анализа можно проводить одновременно. Аналогично определение IgG, IgA и IgE на одной и той же поверхности для анализа можно проводить одновременно. Согласно другим вариантам реализации идеи изобретения связывание IgG и IgE с одной и той же поверхностью для анализа можно проводить одновременно. Согласно еще некоторым другим вариантам реализации связывание IgA и IgE с одной и той же поверхностью для анализа можно проводить одновременно.
[00106] Следует также понимать, что, хотя выше специфически упоминается C1q, аналогично улучшенные результаты предполагается получить при исследовании других видов комплемента во взаимодействии с одним или более из IgG, IgA, IgM, IgE и/или IgD. Подходящие компоненты комплемента включают участников классического пути, включая C1r и/или C1s. Согласно некоторым вариантам реализации C1q, C1r и/или C1s описывают во взаимодействии (т.е. одновременно) с одним или более из IgG, IgA, IgM, IgE и/или IgD с применением одной и той же поверхности для анализа. Аналогично, можно описывать один или более из С4, С2, С4а, C4b, С2а, C2b С3, С3а и C3b, во взаимодействии с одним или более из C1q, C1r, C1s, IgG, IgA, IgE, IgM и/или IgD с применением одной и той же поверхности для анализа.
[00107] Ссылки:
1. Vojdani A. A potential link between environmental triggers and autoimmunity. Autoimmune Diseases. Volume 2014, Article ID 437231, 18 pages. http://dx.doi.org/10.115/2014/437231, 2014.
2. Vojdani A. Food immune reactivity and neuroautoimmunity. Fund Neurol Rehabil Ergon. 2014;4(2-3): 175-195.
3. Johnston LK, Chen KB, Bryce PJ. The immunology of food allergy. J. Immunol. 2014;192:2529-2534.
4. Vojdani A, Kharrazian D, Mukherjee PS. The prevalence of antibodies against wheat and milk proteins in blood donors and their contribution to neuroautoimmune reactivities. Nutrients. 2014;6:15-36.
5. Ho MH, Wong WH, Chang C. Clinical spectrum of food allergies: a comprehensive review. Clin. Rev. Allergy Immunol. 2012;DOI:10.1007/s12016-012-8339-6.
6. Miyajima I, Dombrowicz S, Martin TR, Ravetch JV, Kinet JP, Galli SJ. Systemic anaphylaxis in the mouse can be mediated largely through lgG1 and Fc gammaRIII. Assessment of the cardiopulmonary changes, mast cell degranulation, and death associated with active or IgE- or IgG1-dependent passive anaphylaxis. J. Clin. Invest. 1997;99:901-914.
7. Strait RT, Morris SC, Yang M, Qu XW, Finkelman FD. Pathways of anaphylaxis in the mouse. J. Allergy Clin. Immunol. 2002;109: 658-668.
8. Smit JJ, Willemsen K, Hassing I, Fiechter D, Storm G, van Bloois L, Leusen JH, Pennings M, Zaiss D, Pieters RH. Contribution of classic and alternative effector pathways in peanut-induced anaphylactic responses. PLoS ONE. 2011;6:e28917.
9. Mancardi DA, Albanesi M,  F, Iannascoli B, Van Rooijen N, Kang X, England P, Daeron M, Bruhns P. The high-affinity human IgG receptor FcgRI (CD64) promotes IgG-mediated inflammation, anaphylaxis, and antitumor immunotherapy. Blood. 2013;121:1563-1573.
F, Iannascoli B, Van Rooijen N, Kang X, England P, Daeron M, Bruhns P. The high-affinity human IgG receptor FcgRI (CD64) promotes IgG-mediated inflammation, anaphylaxis, and antitumor immunotherapy. Blood. 2013;121:1563-1573.
10. Lim PL, Rowley D. The effect of antibody on the intestinal absorption of macromolecules and on intestinal permeability in adult mice. Int Arch Allergy Appl Immunol 1982;68.41-46.
11. Tsuji NM, Kosaka A. Oral tolerance: intestinal homeostasis and antigen-specific regulatory T cells. Trends Immunol. 2008;29(11):532-540. Doi10.1016/j.it.2008.09.002.
12. Maul J, Dichmann R. Can loss of immune tolerance cause IBD? Inflamm Bowel Dis. 2008;14(2):S115-S116.
13. Brandtzaeg P, Tolo K. Mucosal penetrability enhanced by serum-derived antibodies. Nature. 1977;266.262-263.
14. Barnes RMR. IgG and IgA antibodies to dietary antigens in food allergy and intolerance. Clin Exp Allergy. 1995;25:7-9.
15. Schrander JJ, Mracelis C, de Vries MP, van Santen-Hoeufft HM. Does food intolerance play a role in juvenile chronic arthritis? Br J Rheumatol. 1997;36:905.
16. Lunardi C, Bambara LM, Biasi D, Zagni P, Caramaschi P, Pacor ML. Elimination diet in the treatment of selected patients with hypersensitivity vasculitis. Clin Exp Rheumatol. 1992; 10:131.
17. Lunardi C, Nanni L, Tiso M, et al. glycine-rich cell wall proteins act as specific antigen targets in autoimmune and food allergic disorders. Int Immunol. 2000;12:647-657.
18. Baboonian C, Halliday D, Venables PJW, Pawlowski T, Millman G, Maini RN. Antibodies in rheumatoid arthritis react specifically with the glycine alanine repeat sequence of Epstein-Bar nuclear antigen-1. Rheumatol Int. 1989;9:161.
19. Baboonian С, Venavles PJW, Williams DG, Williams RO, Maini RN. Cross reaction of antibodies to glycine/alanine repeat sequence of Epstein-Barr virus nuclear antigen-1 with collagen, cytokeratin, and actin. Ann Rheum Dis, 1991;50:772.
20. Ostenstad B, Dybwad A, Lea T, Forre O, Vinje O, Sioud M. Evidence for monoclonal expansion of synovial T cells bearing V alpha 2.1/V beta 5.5 gene segments and recognizing a synthetic peptide that shares homology with a number of putative autoantigens. Immunology, 1995;86:168.
21. Zuidmeer L, Goldhan K, Rona RJ, Gislason D, Madsen C, Summers C, Sodergreen E, Dahlstrom J, Lindner T, Sigurdardottir ST, et al. The prevalence of plant food allergies: A systemic review. J Allergy Clin Immunol. 2008; 121,1210-1218.
22. Lack G. Epidemiologic risks for food allergy. J Allergy Clin Immunol. 2008;121:1331-1336.
23. Bousquet J, 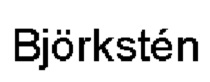 B, Bruijnzeel-Koomen CA, Huggett A, Ortolani C. Warner JO, Smith M. Scientific criteria and selection of allergenic foods for product labelling. Allergy. 1998;53,3-21.
B, Bruijnzeel-Koomen CA, Huggett A, Ortolani C. Warner JO, Smith M. Scientific criteria and selection of allergenic foods for product labelling. Allergy. 1998;53,3-21.
24. Arentz-Hansen H,  R, Molberg 0, et al. The intestinal T cell response to a-gliadin in adult celiac disease is focused on a single deamidated glutamine targeted by tissue transglutaminase. J Exp Med. 2000;191 (4)603-312.
R, Molberg 0, et al. The intestinal T cell response to a-gliadin in adult celiac disease is focused on a single deamidated glutamine targeted by tissue transglutaminase. J Exp Med. 2000;191 (4)603-312.
25. Arentz-Hansen H, Mcadam SN, Molberg O, et al. Celiac lesion T cells recognize epitopes that cluster in regions of gliadins rich in proline residues. Gastroenterology. 2002; 123(3)803-809.
26. Tollefsen S, Arentz-Hansen H, Flechenstein B, etal. HLA-DQ2 and -DQ8 signatures of gluten T cell epitopes in celiac disease. J Clin Invest. 2006; 116(8)2226-2236.
27. Camarca A, Anderson RP, Mamone G, et al. Intestinal T cell responses to gluten peptides are largely heterogeneous: implications for a peptide-based therapy in celiac disease. J Immunol. 2009:182(7)4158-4166.
28. Vojdani A. The characterization of repertoire of what antigen and peptide involved in the humoral immune response in patients with gluten sensitivity and Crohn's disease. ISRN Allergy. 2011;2011,950104.
29. De Freitas IN, Sipahi AM, Damiao AO, de Brito T, Cancado EL, Leser PG, Laudanna AA. Celiac disease in Brazilian adults. J Clin Gasroenterol. 2002;34:430-434.
30. Gillett PM, Gillett HR, Israel DM, Metzger DL, Stewart L, Chanoine JP, Freeman HJ. High prevalence of celiac disease in patients with type I diabetes detected by antibodies to endomysium and tissue transglutaminase. Can J Gastorenterol. 2001;15:297-301.
31. Counsell CE, Taha A, Ruddell WSJ. Coeliac disease and autoimmune thyroid disease. Gut. 1994;35:844-846.
32. Vojdani A, Tarash I. Cross-reaction between gliadin and different food and tissue antigens. Food Nutr Sci. 2013;44,20-32.
33. Hadjivassiliou M, Sanders DS, Woodroofe N, Williamson C, Grunewald RA. Gluten ataxia. Cerebellum. 2008;7:494-98.
34. Stamnaes J, Dorum S, Fleckenstein B, Aeschlimann D, Sollid LM. Gliadin T-cell epitope targeting by TG3 and TG6: implications for gluten ataxia and dermatitis hypertiformis. Proceedings of the 13th International Symposium on Coeliac Disease. Amsterdam. 2009; P-163:148.
35. Stagi S, Giani T, Simoni G, Falcini F. Thyroid function, autoimmune thyroiditis and coeliac disease in juvenile idiopathic arthritis. Rheumatology. 2005;44:517-520.
36. Vojdani A, O'Bryan T, Green JA, McCandless J, Woeller KN, Vojdani E, Nourian AA, Cooper EL. Immune response to dietary proteins, gliadin and cerebellar peptides in children with autism. Nutr. Neurosci. 2004;7,151-161.
37. Alaedini A, era/. Immune cross-reactivity in celiac disease: anti-gliadin antibodies bind to neuronal synapsin I. J. Immunol. 2007;178:6590-6595.
38. Jacob S, Zarei M, Kenton A, Allroggen H. Gluten sensitivity and neuromyelitis optica: two case reports. J Neurol Neurosurg Psychiatry. 2005;76:1028-1030.
39. Reinke Y, Behrendt M, Schmidt S, Zimmer KP, Nairn HY. Impairment of protein trafficking by direct interaction of gliadin peptide with actin. Exp Ceil Res. 2011;DOI:10.1016/J.YXCT.2011.05.022.
40. Hadjivassiliou M, Sanders DS,  RA, Akil M, Gluten sensitivity masquerading as systemic lupus erythematosus. Ann Rhem Dis. 2004;63:1501-1503.
RA, Akil M, Gluten sensitivity masquerading as systemic lupus erythematosus. Ann Rhem Dis. 2004;63:1501-1503.
41. Sugai E, Chernavsky A, Pedreira S, ef al. Bone-specific antibodies in sera from patients with celiac disease: characterization and implications in osteoporosis. J Clin Immunol. 2002;22:353-362.
42. Collin P, Kaukinen К,  M, Salmi J. Endocrinological disorders and celiac disease. Endoc Rev. 2002;23:464-483.
M, Salmi J. Endocrinological disorders and celiac disease. Endoc Rev. 2002;23:464-483.
43. Frustaci A, Cuoco L, Chimenti C, ef al. Celiac disease associated with autoimmune myocarditis circulation. 2002;2:2611-2618
44. Pratesi R, Gandolfi L, Friedman H, et al. Serum IgA antibodies from patients with coeliac disease react strongly with human brain blood-vessel structures. 1998;33:817-821.
45. Natter S, Granditsch G. Reichel GL, ef al. IgA cross-reactivity between a nuclear autoantigen and wheat protein suggests molecular mimicry as a possible pathomechanism in celiac disease. Eur J Immunol. 2001;31:918-928.
46. Kahana E, Zilber N, Abramson JH, Biton V, Leibowitz Y, Abramsky O. Multiple sclerosis: genetic versus environmental aetiology. Epidemiology in Israel updated. J Neurol. 1994;241:341-346.
47. Agranoff BWA, Goldberg D. Diet and the geographical distribution of multiple sclerosis. Lancet 1974;2:1061 -1066.
48. Knox EG. Foods and diseases. Br. J. Prev. Soc. Med. 1977;31:71-80.
49. Butcher J. The distribution of multiple sclerosis in relation to the dairy industry and milk consumption. N.Z. Med. J. 1976;83:427-430.
50. Malosse D, Perron H, Sasco A, Seigneurin JM. Correlatoin between milk and dairy product consumption and multiple sclerosis prevalence: a worldwide study. Neuroepidemiol. 1992; 11:304-312.
51. Henry J, Miller MM, Pontarotti PP. Structure and evolution of the extended B7 family. Immunol. Today. 1999;20:285.
52. Gardinier MV, Amiguet P, Limington C, Matthieu JM. Myelin/oligodendrocyte glycoprotein is a unique member of the immunoglobulin super-family. J. Neurosci. Res. 1992;33:177.
53. Jack LJ, Mather IH, Cloning and analysis of cDNA encoding bovine butyrophilin, and apical glycoprotein expressed in mammary tissue and secreted in association with the milk-fat globule membrane during lactation. J. Biol. Chem. 1990;265:14481.
54. Vojdani A, Campbell A, Anyanwu E, Kashanian A, Bock K, Vojdani E. Antibodies to neuron-specific antigens in children with autism: Possible cross reaction with encephalitogenic proteins from milk. Chlamydia pneumonia and Streptococcus Group A. J. Neuroimmunol. 2002;129:168-177.
55. Amor S, Groome N, Linington C, Morris MM, Dornmair K, Gardinier MV, Matthieu JM, Baker D. Identification of epitopes of myelin oligodendrocyte glycoprotein for the induction of experimental allergic encephalomyelitis in SJL and Biozzi AB/H mice. J. Immunol. 1994; 153:4349.
56. Jarius S, ef al. Mechanisms of disease: aquaporin-4 antibodies in neuromyelitis optica. Nat. Clin. Pract. Neurol. 2008;4:202-214.
57. Jarius S, Wildermann B. AQP4 antibodies in neuromyelitis optica: diagnostic and pathogenetic relevance. Nat. Rev. Neurol. 2010;6:383-392.
58. Kim SH, ef al. Clinical spectrum of CNS aquaporin-4 autoimmunity. Neurol. 2012;78:1179-1185.
59. Kinoshita M, ef al. Anti-aquaporin-4 antibody induces astrocytic cytotoxicity in the absence of CNS antigen-specific T cells. Biochem. Biophys. Re.s Commun. 2010;394:205-210.
60. Bradl M, Lassmann DH. Anti-aquaporin-4 antibodies in neuromyelitis optica: how to prove their pathogenetic relevance? Int. MS J. 2008;15:75-78.
61. Vaishnav R, et al. Aquaporin-4 molecular mimicry and implication for neuromyelitis optics. J. Neuroimmunol. 2013;26:92-98.
62. Plasencia I, et al. Structure and stability of the spinach aquaporin SoPIP2:1 in detergent micelles and lipid membranes. PLoS One. 2011;6:e14674.
63. Fleurat-Lassard P, ef al. The distribution of aquaporin subtypes (PIP1, PIP2 and gamma-TIP) is tissue dependent in soybean (Glycine Max) root nodules. Ann. Bot. 2005;96:457-460.
64. Fabian C, Ju Y-H; A review on rice bran protein: its properties and extraction methods. Crit Rev Food Sci Nutr. 2011;51:816-827.
65. Hamada JS. Characterization of protein fractions of rice bran to devise effective methods of protein solubilization. Cereal Chem. 1997;74:662-668.
66. Singh NK, Donovan GR, Batey IL, et al. Use of sonication and size-exclusion HPLC in the study of wheat flour protein. I. Dissolution of total protein in unreduced form. Cereal Chem. 1990;67:150-161.
67. Tang S, Hettiararchy NS, Shellhammer TH. Protein extraction from heat-stabilized defatted rice bran. I. Physical processing and enzyme treatments. J Agric Food Chem. 2002;50:7444-7448.
68. Novik Gl, Astapovich Nl, Grzegorzewicz A, et al. Isolation and comparative analysis of glycolipids from bifidobacteria. Mikrobiology. 2005;74(5):1-8.
69. Novik Gl, Gamian A, Francisco Jda C, Dey ES. A novel procedure for the isolation of glycolipids from Bifidobacterium adolescentis 94 BIM using supercritical carbon dioxide. J Biotechnol. 2006;121(4):555-62.
70. Ishikawa T, et al. Method of separating glycolipids. Pub. No: US2005/0119475 A1, June 2, 2005.
71. Chaiklahan R, et al. Polysaccharide extraction from Spirulina sp. and its antioxidant capacity. Int J Biol Macromol. 58: 73-78, 2013.
72. Dubois M, et al. Colorimetric method for determination of sugar and related substances. Anal Chem. 28(3): 350-356, 1956.
73. Sheng J, et al. Preparation, identification and their antitumor activities in vitro of polysaccharides from Chlorella pyrenoidosa. Food Chem. 105(2): 533-539, 2007.
74. Vojdani A. Lectins, agglutinins, and their role in autoimmune reactivities. Alternative Therapies in Health and Medicine, (In Press), 2015.
75. Lamport DT. Preparation of arabinogalactan glycoproteins from plant tissues. Bio-Protocol. 3(19): 10/5/2013, e918.
76. Muthukumar M, et al. Isolation, purification and biochemical characterization of lectin from oyster mushroom, Pleurotus sajor-caju. Plant Archives 2009;9:41-46.
[00108] Специалистам в данной области техники должно быть понятно, что возможно гораздо больше модификаций помимо тех, что уже описаны, которые не будут отклоняться от идеи изобретения, изложенной в настоящей заявке. Следовательно, объект изобретения не ограничивается ничем, кроме как духом прилагаемой формулы изобретения. Кроме того, при интерпретации как описания, так и формулы изобретения, все термины следует интерпретировать в самом широком из возможных смыслов, который согласуется с контекстом. В частности, термины «включает» и «включающий» следует интерпретировать как относящиеся к элементам, компонентам или этапам неисключающим образом, и как указывающие на то, что упоминаемые элементы, компоненты или этапы могут присутствовать, или применяться, или сочетаться с другими элементами, компонентами или этапами, которые явно не упоминаются. В тех случаях, когда в описании или формуле изобретения есть ссылка по меньшей мере на одно из чего-либо, выбираемого из группы, состоящей из А, В, С… и N, текст следует интерпретировать как потребность только в одном элементе из группы, а не А плюс N или В плюс N, и т.д.
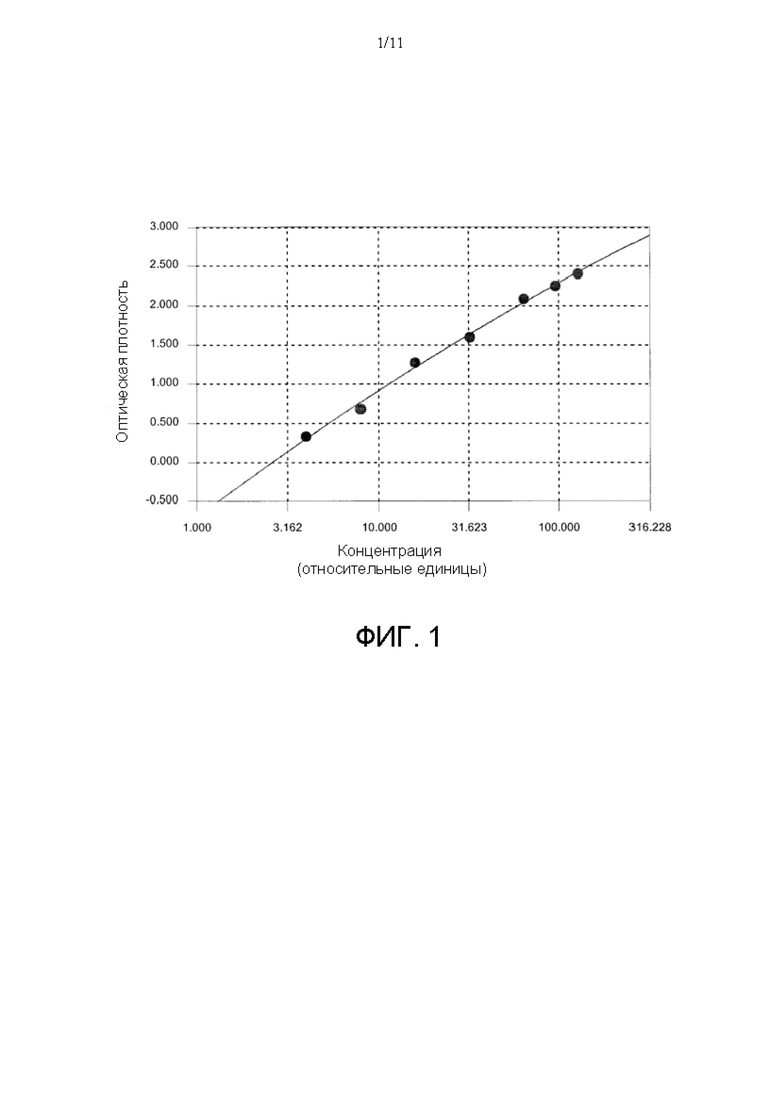
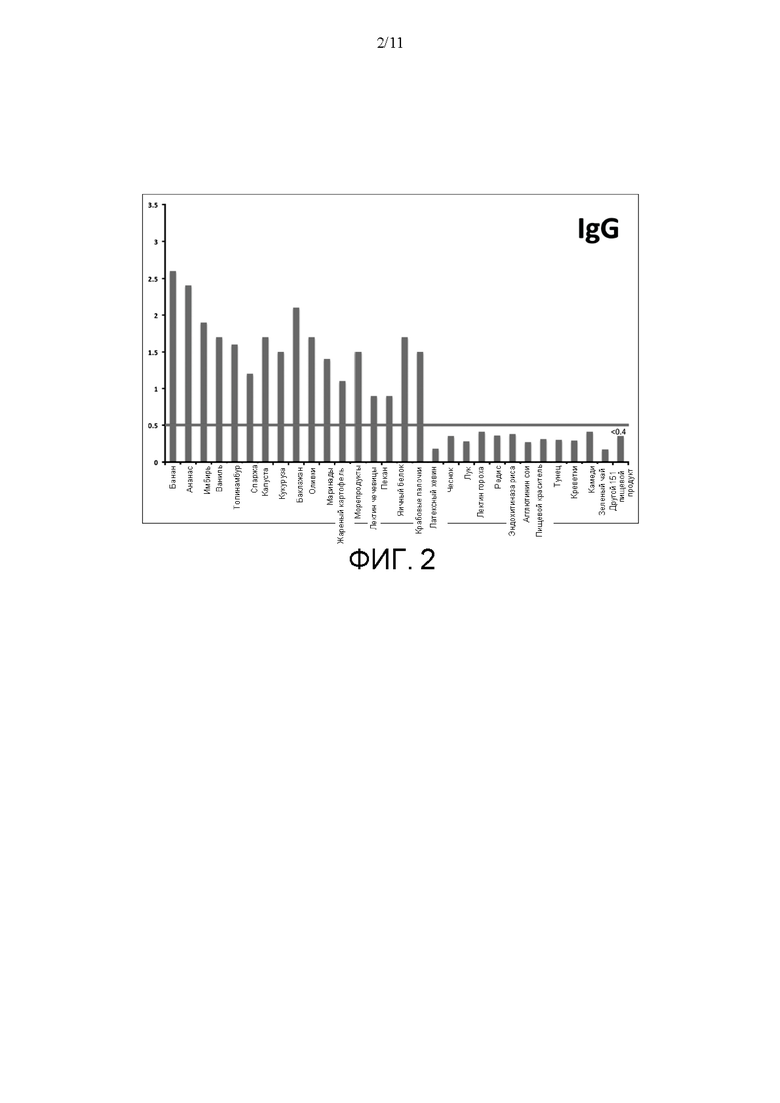
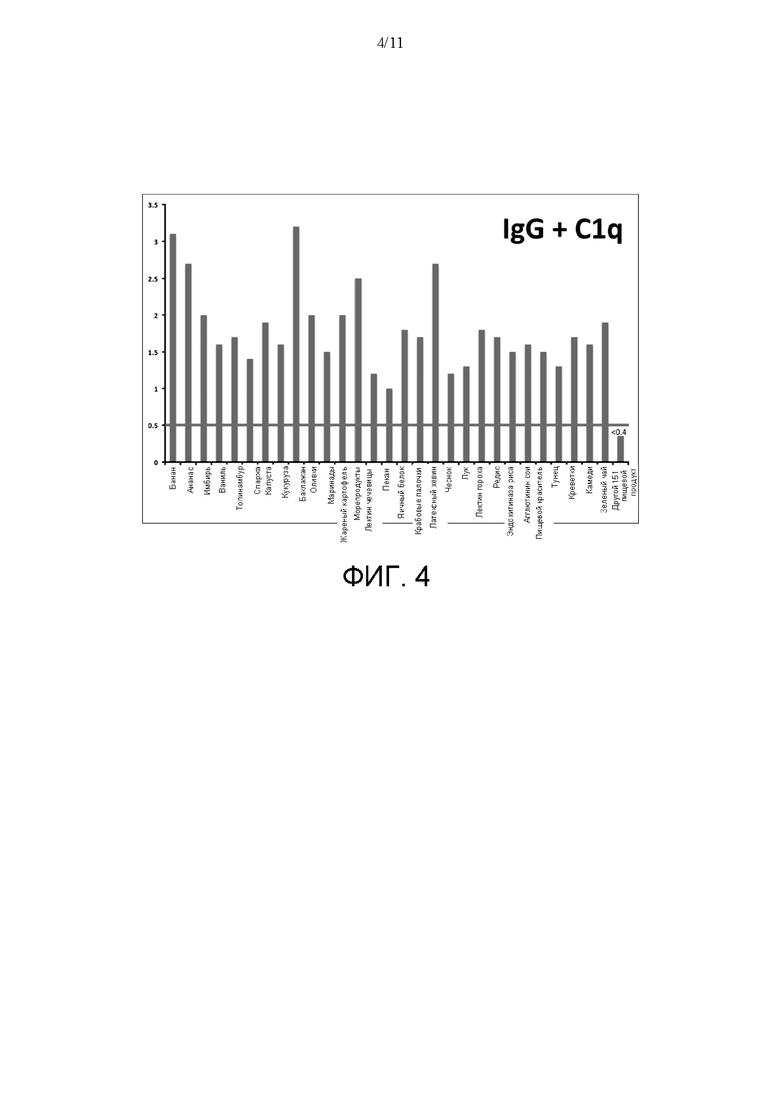
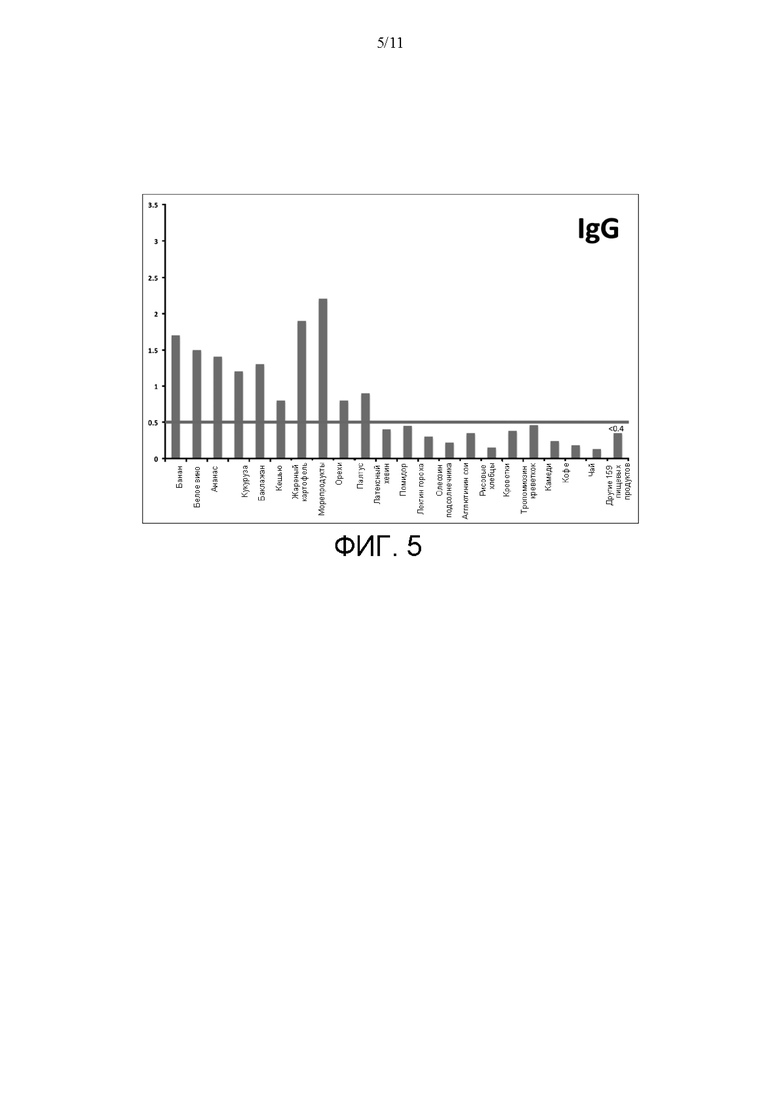
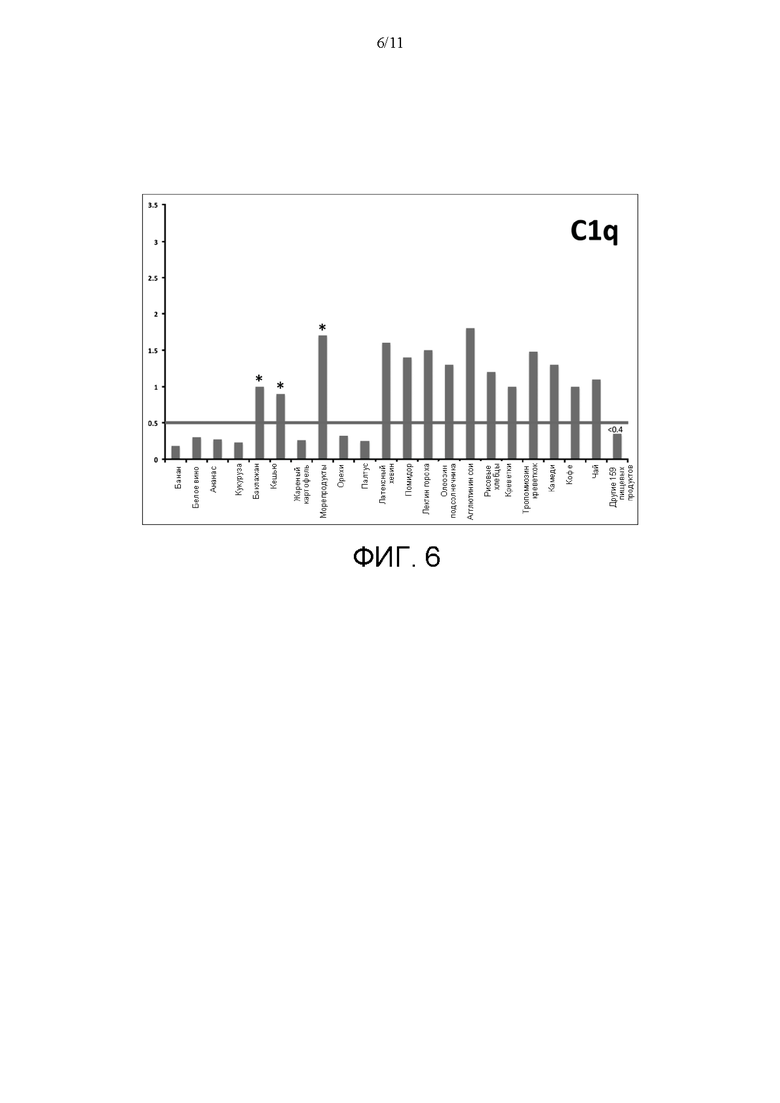
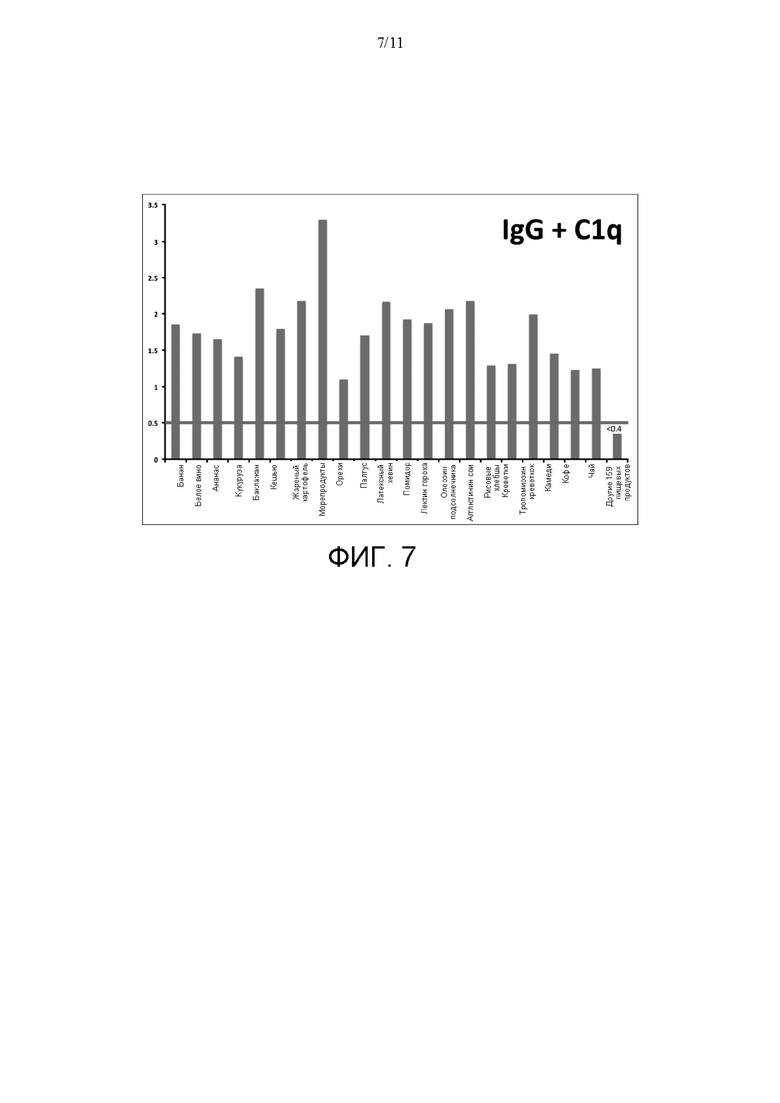
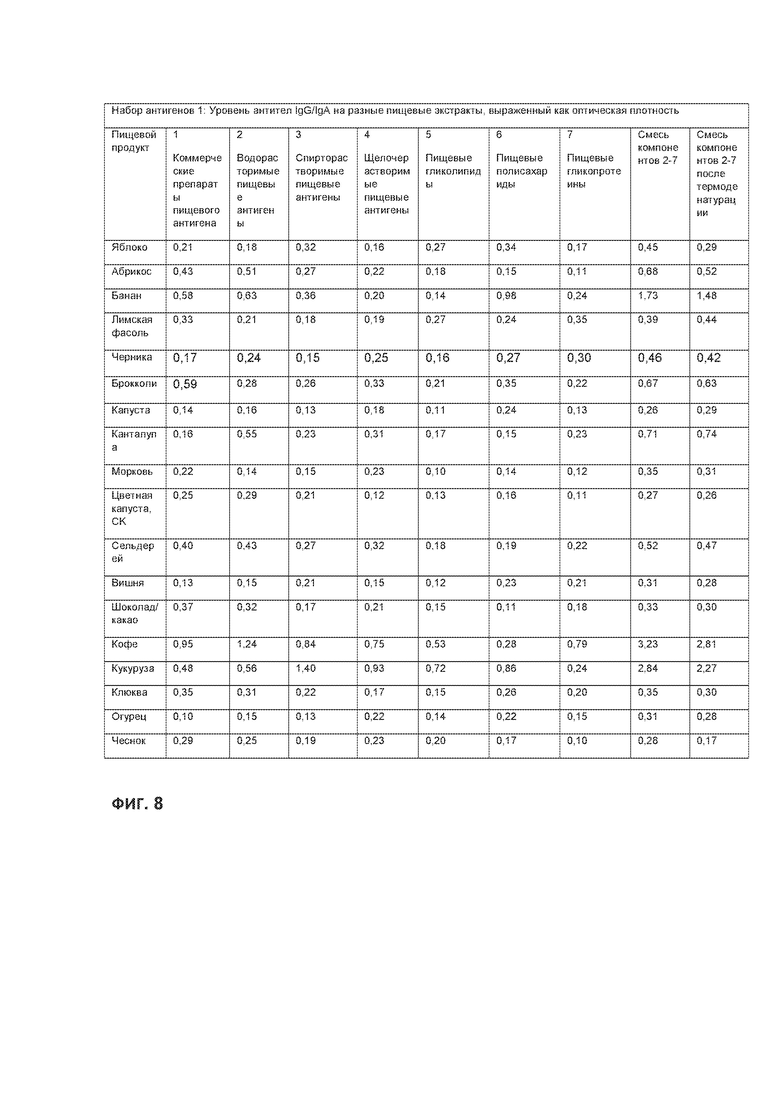
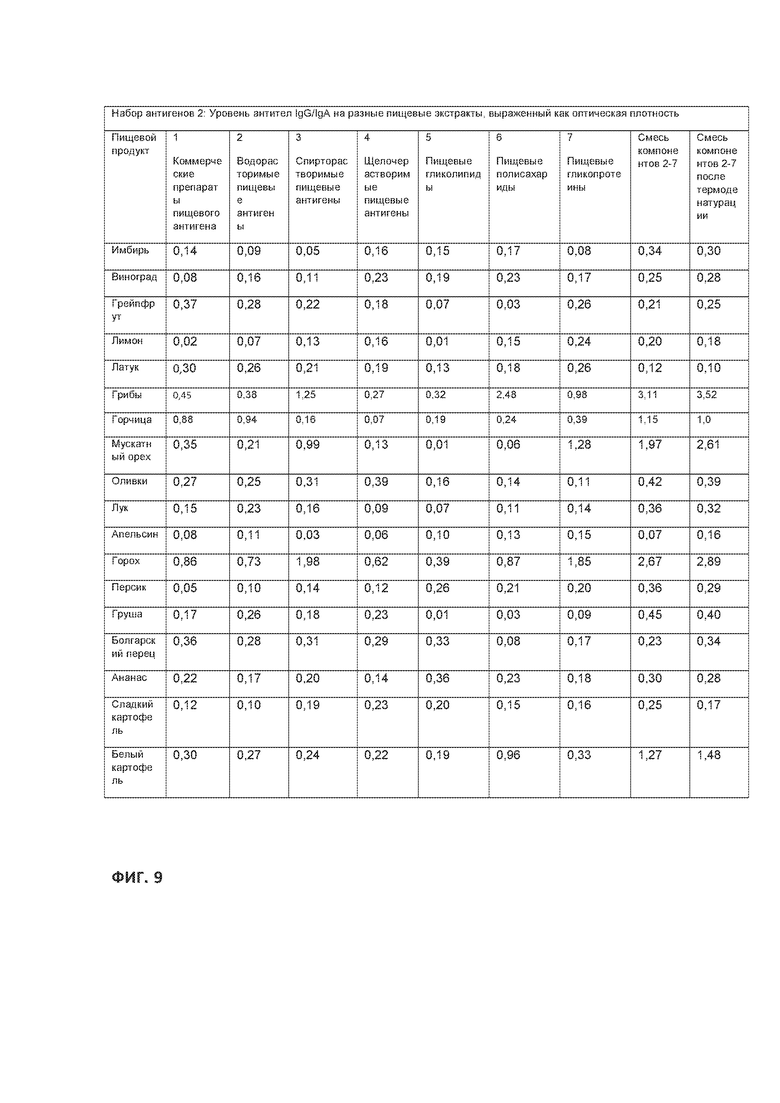
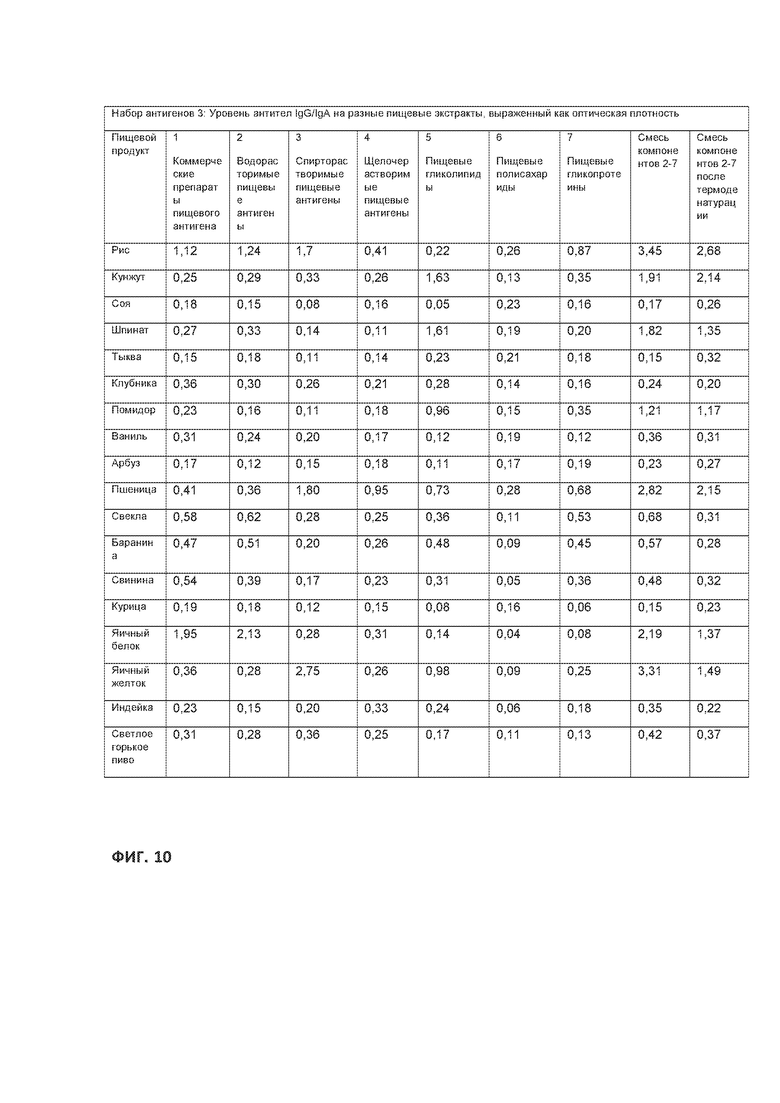
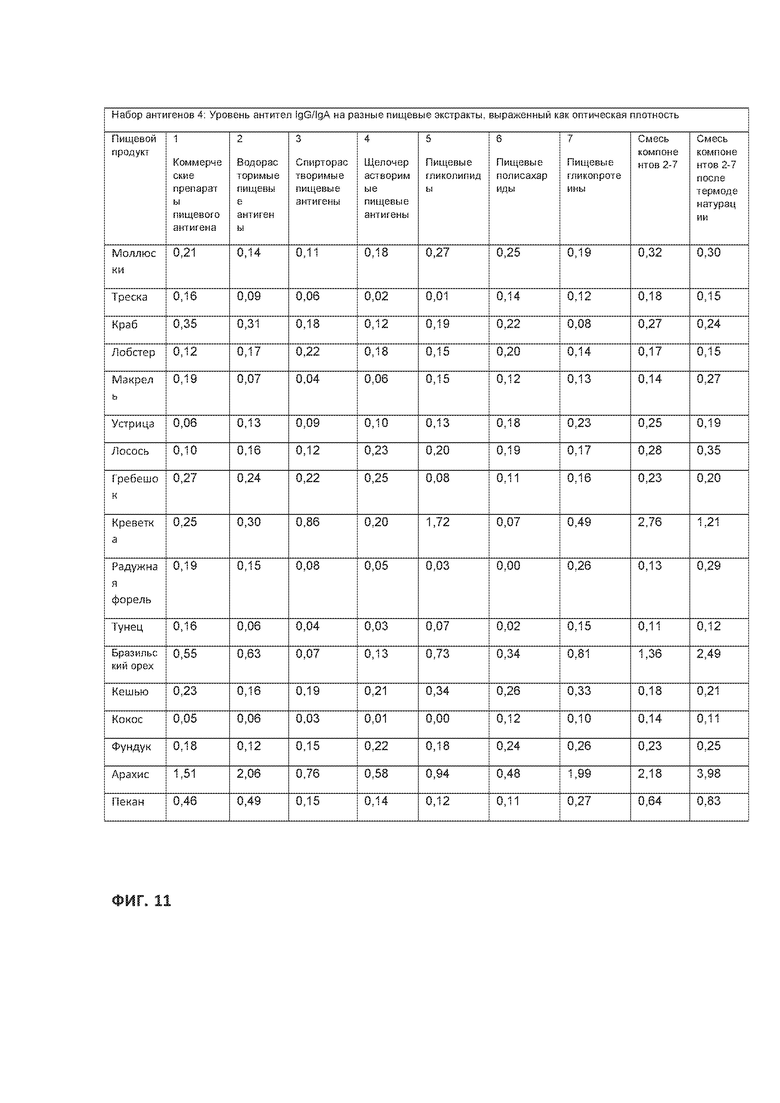
Группа изобретений относится к области медицины и может быть использована для определения иммунной реактивности на пищевые аллергены. Предложена поверхность для анализа для определения характеристики профиля антител и C1q, содержащая: первое покрытие на поверхности для анализа, содержащее первый пищевой антиген, экстрагированный из пищевого продукта в ходе первого процесса; второе покрытие на поверхности для анализа, содержащее второй пищевой антиген, экстрагированный из указанного пищевого продукта в ходе второго процесса; и третье покрытие на поверхности для анализа, содержащее третий пищевой антиген, экстрагированный из указанного пищевого продукта в ходе третьего процесса. При этом второе покрытие нанесено на поверхность для анализа после нанесения первого покрытия, а третье покрытие нанесено на поверхность для анализа после нанесения второго покрытия. Предложены также способ получения указанной поверхности для анализа и набор для анализа для определения характеристики профилей связывания антитела и C1q. Группа изобретений обеспечивает улучшенную чувствительность и точность при определении иммунной реактивности и ответа на специфические пищевые продукты. 3 н. и 9 з.п. ф-лы, 11 ил., 6 пр.
1. Поверхность для анализа для определения характеристики профиля антител и C1q, содержащая:
первое покрытие на поверхности для анализа, содержащее первый пищевой антиген, экстрагированный из пищевого продукта в ходе первого процесса;
второе покрытие на поверхности для анализа, содержащее второй пищевой антиген, экстрагированный из указанного пищевого продукта в ходе второго процесса; и
третье покрытие на поверхности для анализа, содержащее третий пищевой антиген, экстрагированный из указанного пищевого продукта в ходе третьего процесса;
при этом указанное второе покрытие было нанесено на указанную поверхность для анализа после нанесения указанного первого покрытия, а указанное третье покрытие было нанесено на указанную поверхность для анализа после нанесения указанного второго покрытия.
2. Поверхность для анализа по п. 1, отличающаяся тем, что указанный первый пищевой антиген выбран из группы, состоящей из водорастворимого белка, спирторастворимого белка, щелочерастворимого белка, гликолипида, полисахарида и гликопротеина.
3. Поверхность для анализа по п. 1 или 2, отличающаяся тем, что указанный второй пищевой антиген выбран из группы, состоящей из водорастворимого белка, спирторастворимого белка, щелочерастворимого белка, гликолипида, полисахарида и гликопротеина.
4. Поверхность для анализа по одному из пп. 1-3, отличающаяся тем, что указанный третий пищевой антиген выбран из группы, состоящей из водорастворимого белка, спирторастворимого белка, щелочерастворимого белка, гликолипида, полисахарида и гликопротеина.
5. Способ получения поверхности для анализа для определения характеристики чувствительности к пищевому продукту, включающий:
обеспечение поверхности для анализа;
приведение в контакт препарата первого пищевого антигена с частью указанной поверхности для анализа в течение периода времени, достаточного, чтобы по меньшей мере часть первых пищевых антигенов из указанного препарата первого пищевого антигена адсорбировалась на указанной части указанной поверхности для анализа;
после приведения в контакт с указанным препаратом первого пищевого антигена, приведение в контакт препарата второго пищевого антигена с частью указанной поверхности для анализа в течение периода времени, достаточного, чтобы по меньшей мере часть вторых пищевых антигенов из указанного препарата второго пищевого антигена адсорбировалась на указанной части указанной поверхности для анализа; и
после приведения в контакт с препаратом второго пищевого антигена, приведение в контакт препарата третьего пищевого антигена с частью указанной поверхности для анализа в течение периода времени, достаточного, чтобы по меньшей мере часть третьих пищевых антигенов из указанного препарата третьего пищевого антигена адсорбировалась на указанной части указанной поверхности для анализа,
при этом указанный препарат первого пищевого антигена, указанный препарат второго пищевого антигена и указанный препарат третьего пищевого антигена получены из одного пищевого продукта.
6. Способ по п. 5, дополнительно включающий этап удаления не адсорбированного материала из указанного препарата первого пищевого антигена перед приведением в контакт указанной поверхности для анализа с указанным препаратом второго пищевого антигена.
7. Способ по п. 6, отличающийся тем, что указанный этап удаления включает приведение в контакт указанной поверхности для анализа с раствором, содержащим поверхностно-активное вещество.
8. Способ по любому из пп. 5-7, дополнительно включающий этап удаления не адсорбированного материала из указанного препарата второго пищевого антигена перед приведением в контакт с указанной поверхностью для анализа указанного препарата третьего пищевого антигена.
9. Способ по п. 8, отличающийся тем, что указанный этап удаления включает приведение в контакт указанной поверхности для анализа с раствором, содержащим поверхностно-активное вещество.
10. Способ по любому из пп. 5-9, дополнительно включающий этап приведения в контакт части указанной поверхности для анализа с блокирующим раствором.
11. Набор для анализа для определения характеристики профилей связывания антитела и C1q, содержащий планшет для анализа, при этом указанный планшет для анализа содержит множество поверхностей для анализа по п. 1.
12. Набор для анализа по п. 11, отличающийся тем, что указанный планшет для анализа включает первую поверхность для анализа, содержащую антигены из первого пищевого продукта, и вторую поверхность для анализа, содержащую антигены из второго пищевого продукта.
| WO 1994029696 A1, 22.12.1994 | |||
| US 8309318 B2, 13.11.2012 | |||
| DE 3338759 C1, 18.10.1984 | |||
| VOJDANI ARISTO Detection of IgE, IgG, IgA and IgM antibodies against raw and processed food antigens | |||
| Nutrition & Metabolism, BioMed Central, 2009, 6:22.doi: 10.1186/1743-7075-6-22. |
Авторы
Даты
2023-05-31—Публикация
2015-01-30—Подача