Изобретение относится к медицине (более точно - травматологии, космической медицине, а также к физиологии) и может найти применение при устранении негативного последствия гипокинезии или гравитационной разгрузки.
Скелетная мышца чрезвычайно пластична. Снижение сократительной активности, или ее полное прекращение приводит к снижению веса мышц, площади поперечного сечения мышечных волокон, снижению максимальной силы и скорости мышечного сокращения, а также работоспособности (Baldwin K.М., Haddad F., 2002, Fitts R.H., et al., 2000; Flück M, Hoppeler H., 2003). Атрофия обусловлена снижением белкового синтеза и резким увеличением белкового распада (Jackman RW, Kandarian SC et al., 2004). С.Беловой и соавторами показано, что даже трехнедельное нахождение крыс в клетках ограниченного размера вызывает атрофию скелетных мышц, изменения клеточных сигнальных путей и ускоренный набор веса тела животных [Белова С. и др., 2020]. Сейчас, в пандемию, исследования причин этих изменений особенно актуальны, т.к. у большой популяции людей ограничена двигательная активность, что негативно влияет на качество жизни. Атрофия скелетных мышц при гипокинезии развивается очень быстро и вес мышцы снижается уже после 3 дней гипокинезии (Zaripova KA и др., 2021). В то же время ранние этапы развития атрофии изучены хуже всего. Негативные изменения в маркерах сигнальных путей мышц начинают проявляться уже через несколько часов воздействия функциональной разгрузки. Например, экспрессия основных мышечных Е3-лигаз, участвующих в процессе деградации белка, достоверно повышается через 24 часа разгрузки мышц и достигает пика к 3-м суткам (Shenkman B.S., 2020). Именно поэтому мы исследовали триггерные механизмы, запускающие белковую деградацию при 3-суточном воздействии на мышцу. Мы предположили, что одним из таких механизмов может быть накопление АТФ в мышце при разгрузке, обнаруженное ранее нами и другими авторами (Gupta R. Си др., 1989, Y. Ohira, и др., 1994, Zaripova KA и др., 2021). Стимул, активирующий работу АТФ-зависимых путей регуляции сигналлинга скелетных мышц при их разгрузке может быть следующий. Функциональная разгрузка мышц ведет к снижению электрической мышечной активности, открытию дигидропиридиновых (DHPR) L-тип Са- зависимых каналов, которые плотно соединены с паннексиновыми каналами (Panx1) [М. Casas и др., 2014]. Ранее показано, что паннексиновые каналы пропускают АТФ из цитоплазмы во внеклеточное пространство (G. Dahl и др., 2015). В 2021 г мы подтвердили предположение о том, что внеклеточный АТФ при функциональной разгрузке может являться одним из основных сигналов в скелетных мышцах для регулирования различных процессов, среди которых - экспрессия генов (Zaripova KA и др., 2021). Мы показали, что Panx1-опосредованный транспорт АТФ влияет на экспрессию мышечно-специфичных Е3 убиквитинлигаз MuRF1 и MAFbx, и регулирует сигнальные пути, контролирующие процессы трансляции и элонгации белка при функциональной разгрузке мышц (Zaripova KA и др., 2021). В представленной работе мы проверили предположение о возможном вовлечении пуринэргических рецепторов P2Y2 в эти процессы. В литературе имеются данные о том, что внеклеточный АТФ может восприниматься как P2Y2 так и P2Y1 рецепторами (May С et al.,2006; Juan Riquelme MA et al., 2013; Bin Liu и др., 2018; Casas M. et al., 2014; Arias-Calderón M et al., 2016). Для проверки нашей гипотезы об участии пуринэргических рецепторов P2Y2 в процессе атрофии мышц мы блокировали P2Y2 рецепторы (чувствительные к адениловым нуклеотидам) при 3-дневном вывешивании крыс специфическим ингибитором AR-C 118925ХХ. Такой подход раньше не применялся. Специфические ингибиторы пуринэргических рецепторов появились недавно и используются впервые при моделировании функциональной разгрузки крыс. Мы впервые показали, что при разгрузке мышц активация специфических транскрипционных программ запускается в том числе с помощью передачи АТФ-опосредованных сигналов и пуринэргические рецепторы принимают в этом участие. Ингибирование пуринэргических рецепторов P2Y2 при 3х-дневной разгрузке предотвращает атрофию мышц.
В результате проведенных исследований было обнаружено, что ингибирование P2Y2 рецепторов с помощью специфического ингибитора AR-С 118925ХХ (Химическое наименование: 5-[[5-(2,8-Dimethyl-5Н-dibenzo[a,d]cyclohepten-5-yl)-3,4-dihydro-2-oxo-4-thioxo-1(2Н)-pyrimidinyl]methyl]-N-2H-tetrazol-5-yl-2-furancarboxamide) при 3-дневной функциональной разгрузке крыс предотвращает атрофию m.soleus, предотвращает накопление АТФ в мышце soleus, замедляет экпрессию мРНК Е3-лигазы MAFbx, убиквитина и рецепторов IL6, способствует повышению уровня фосфорилирования АМРК, снижает уровень фосфорилирования GSK-3β, а также замедляет снижение интенсивности белкового синтеза.
Данный способ предотвращения атрофии при 3-х дневной функциональной разгрузке мышц основан на том, что при разгрузке ингибируются пуринэргические рецепторы P2Y2.
Таким образом, заявляемое изобретение основано на применении ингибитора пуринэргических рецепторов P2Y2 с помощью AR-C 118925ХХ для предотвращения атрофии скелетных мышц при их функциональной разгрузке.
Наиболее близким способом (прототипом), направленным на предотвращение атрофии скелетных мышц при их функциональной разгрузке можно считать способ Chen М, Chen Н, Gu Y, Sun Р, Sun J, Yu H, Zheng H, Chen D. P2Y2 promotes fibroblasts activation and skeletal muscle fibrosis through AKT, ERK, and PKC. BMC Musculoskelet Disord. 2021 Aug 11;22(1):680. doi: 10.1186/s12891-021-04569-y. PMID: 34380439; PMCID: PMC8359595. -согласно которому авторы исследовали первичные мышечные фибробласты, выделенные из мышей дикого типа и мышей с отсутствием гена P2Y2 после повреждения у них нерва sciatic в течении 2, 4 и 6 недель. Авторы обнаружили меньшую атрофию мышцы у мышей при денервации, у которых отсутствовал ген P2Y2. Было показано, что P2Y2 усиливают атрофию скелетных мышц и активацию фибробластов после мышечного повреждения.
Стоит отметить, что использование метода генных модификаций и воздействий на геном человека для предотвращения атрофии мышц у людей неприменимо.
Техническим результатом заявленного изобретения является повышение эффективности степени предотвращения атрофии путем ингибирования пуринэргических рецепторов P2Y2 и ключевых сигнальных путей, инициирующих атрофию.
Этот технический результат достигается тем, что в известном способе предотвращения атрофии скелетных мышц при их 3х-дневной функциональной разгрузке путем воздействия на организм ингибитора P2Y2 рецептора мы вводили AR-C 118925ХХ (Химическое наименование: 5-[[5-(2,8-Dimethyl-5H-dibenzo[a,d]cyclohepten-5-yl)-3,4-dihydro-2-oxo-4-thioxo-1(2H)-pyrimidinyl]methyl]-N-2H-tetrazol-5-yl-2-furancarboxamide), который приводит к предотвращению накопления АТФ в мышце, повышению уровня фосфорилирования в ней АМРК, замедлению экспрессию мРНК Е3-лигазы MAFbx, снижению уровня убиквитина и экспрессии рецепторов IL6, снижению в ней уровня фосфорилирования GSK-3β, предотвращению снижения уровня фосфорилирования p90RSK, а также замедлению снижения интенсивности белкового синтеза.
В отличие от предыдущих работ, мы использовали препарат, ингибирующий рецепторы P2Y2 в организме животного in vivo.
Гипотеза была проверена с помощью ингибирования пуринэргических рецепторов P2Y2 при вывешивании крыс.
Возможные механизмы действия метода
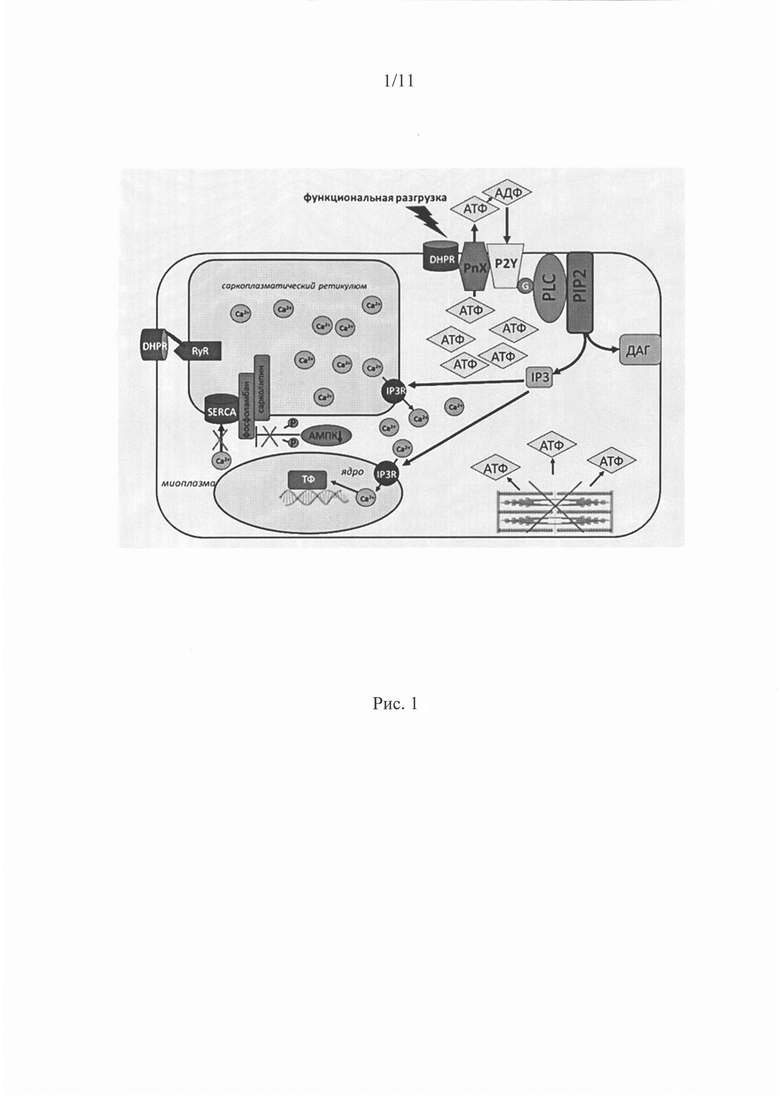
Схематическое описание АТФ-зависимого механизма передачи сигналов в скелетных мышцах представлено на рис. 1.
АТФ высвобождается через каналы паннексин-1 (PnX1) при функциональной разгрузке мышц; сенсором напряжения являются дигидропиридиновые рецепторы (DHPR). АТФ быстро распадается на аденозиндифосфат (АДФ), аденозинмонофосфат (АМФ) и аденозин под действием эктонуклеотидаз АТФ и АДФ могут взаимодействовать с P2Y2 рецепторами, связанные с G белоком Y, которые, в свою очередь, активируют PI3 киназу в мембране Т-трубочек. PI3 киназа катализирует фосфорилирование фосфатидилинозитолдифосфата (PIP2), давая PIP3 высоко заряженный остаток, который рекрутирует фосфолипазу С (PLC) в мембрану, запуская гидролиз PIP2 на диацилглицерин (DAG) и инозитол 1,4,5 трифосфат (IP3). IP3 затем связывается с рецепторами IP3 (IP3R), присутствующими как в ядерной оболочке, так и в саркоплазматической сети, вызывая слабый сигнал высвобождения кальция, как в цитозоле, так и нуклеоплазме, что способствует (возможно, с другими сигнальными каскадами) к активации факторов транскрипции (ФТ), приводящих к экспрессии или репрессии генов, вовлеченных в фенотип мышечных клеток.
Материалы, подтверждающие воспроизводимость способа
24 самца крыс линии Wistar случайным образом были распределены на 3 группы по 8 крыс в каждой группе: контроль (группа К) с введением плацебо (10% DMSO в физ. растворе, объем инъекции - 400 мкл), 3-суточное вывешивание (группа В) с введением плацебо, 3-суточное вывешивание с введением ингибитора P2Y2 рецепторов AR-C 118925ХХ (10 мг/кг в день в 10% DMSO в физ. растворе, внутрибрюшинно) (группа А). Вывешивание задних конечностей по широко применяемой во всем мире методике Ильина-Новикова в модификации Morey-Holton делалось так, что задние конечности крыс не касались пола, а передние свободно опирались на пол и животные свободно передвигались. Крысы были подвешены на специальных мягких шинках. Данные показывают, что при таком способе проведения вывешивания животные подвергаются стрессу, кровообращение хвоста не нарушается. Пищу и воду животные получали ad libitum. Через 3 дня эксперимента крыс наркотизировали сверхдозой авертина (5 мл/кг веса 10% раствора), m.soleus немедленно замораживали в жидком азоте и хранили при -85°С.
Эксперимент был одобрен комиссией по биомедицинской этике ГНЦ РФ ИМБП РАН (протокол №585) и соответствует современным нормам и стандартам работы с животными. Новизна работы заключается в том, что до сих пор не был использован подход ингибирования пуринэргических рецепторов P2Y2 с использованием его ингибирования препаратом in vivo при функциональной разгрузке мышц для предотвращения их атрофии.
Обработка биоматериала.
Электрофорез с последующим вестерн-блоттингом.
С каждого образца m.soleus были сделаны срезы толщиной 20 мкм (10-15 мг) на микротоме-криостате фирмы Leica и немедленно прогомогенизированы в течение 25 минут в 125 мкл лизирующего буфера RIPA (Santa-Cruz, USA), содержащего 50 mM Tris (рН 7.4), 150 mM NaCl, 0.1% Triton Х-100, 0.1% SDS, 5 mM EDTA (рН 8.0) 1 mM DTT, 1 mM PMSF, 1 мМ Na3VO4, 1 mM PMSF, апротинин (10 μg/ml), леупептин (10 μg/ml), пепстатин А (10 μg/ml), протеазный ингибиторный коктейль (Santa-Cruz, USA) и фосфотазный ингибиторный коктейль (Santa-Cruz, USA), либо 50 мМ NaF и 50 мМ бета-глицерофосфат. Затем образцы центрифугировали при 20000xg в течение 15 минут.
Цитоплазматическая фракция белков была выделена с помощью набора NE-PER Nuclear and Cytoplasmic Extraction Reagents (Thermo Scientific, США).
Часть супернатанта отбирали для определения концентрации общего белка с помощью реактива Бредфорда (Bio-Rad Laboratories, США). Определения проводились на современном планшетном фотометре Epoch при длине волны 595 нм. Остальная часть белковых образцов разаликвочивалась в пробирки для дальнейшего проведения электрофоретических анализов.
Образцы для нанесения разводились в 2х-кратном Laemmli буфере для образцов (5,4 мМ Tris-HCl (рН 6,8), 4%-ный Ds-Na, 20%-ный глицерин, 10%-ный (3 меркаптоэтанол, 0,02%-ный бромфеноловый синий).
Электрофорез проводили в 10%-ном разделяющем ПААГ (0,2%-ный метилбисакриламид, 0,1%-ный Ds-Na, 375 мМ Tris-HCl (рН 8,8), 0,05%-ный персульфат аммония, 0,1%-ный ТЕМЕД) и в 5%-ном концентрирующем ПААГ (0,2%-ный метилбисакриламид, 0,1%-ный Ds-Na, 125 мМ Tris-HCl (рН 6,8), 0,05%-ный аммоний персульфат, 0,1%-ный ТЕМЕД). Для проведения электрофореза был использован трис-глициновый буфер (192 мМ Tris-глицин (рН 8,6), 0,1%-ный Ds-Na). Образцы каждой группы загружались на один гель с контрольными образцами. Образцы загружались из расчета 25 мкг общего белка в каждой пробе на дорожку и нормировались относительно уровня GAPDH, содержащегося в той же пробе. При необходимости для некоторых белков объем нанесения мог подбираться индивидуально. Электрофорез проводился при 15 мА на гель в мини-системе («Bio-Rad Laboratories») при комнатной температуре.
Вестерн-блоттинг. Электроперенос белков проводился в буфере (25 мМ Tris (рН 8,3), 192 мМ глицин, 20%-ный метанол, 0,04%-ный Ds-Na) на нитроцеллюлозную мембрану при 100 V при температуре 4°С в системе mini Trans-Blot («Bio-Rad Laboratories») в течение 2 часов. После электропереноса НЦ-мембраны инкубировались в течение 5 минут в 0,3%-ом растворе Ponceau Red в 5%-ой уксусной кислоте, затем отмывались в PST (Биолот) с 0,1%-ный Tween20 (PBST) до появления четких белковых полос на мембране. Этот этап проводился для контроля эффективности переноса; а также для того, чтобы убедиться, что количества общего белка, внесенного в каждую дорожку, было одинаковым. Мембраны блокировались в растворе 5%-го сухого молока («Bio-Rad Laboratories») в PBST 1 час при комнатной температуре, затем помещались в раствор первичных антител на ночь на +4°С. Для выявления белковых полос были использованы первичные антитела против pGSK3b (1:1000, #9322), GSK3b (1:1000, #12456), рАМРК (1:500, #2535), AMPK (1:1000, #2532), рР90 (1:1000, #9344), Р90 (1:1000, #8408) фирмы «Cell Signaling Technology» (США), к GAPDH (1:10000) фирмы «АВМ».
Затем мембрана отмывалась от первичных антител в PBST 3 раза по 5 минут на шейкере и инкубировалась 1 час с вторичными антителами goat-anti-rabbit (1:30 000, «Jackson Immuno Research», США) или goat-anti-mouse (1:20 000 «Bio-Rad Laboratories», США). Потом мембрана отмывалась от вторичных антител в PBST 3 раза по 5 минут на шейкере. Выявление проводилось с помощью Clarity Western ECL Substrate (Bio-Rad Laboratories, США). Хемилюминисцентный сигнал детектировался с помощью сканера C-DiGit Blot Scanner (LI-COR, США). Затем полученные на сканере изображения обрабатывались с помощью прилагаемого программного обеспечения Image Studio Software (LI-COR) для получения количественных данных для анализа. Для каждого параметра электрофорез с последующим иммуноблоттингом был повторен не менее 3х раз. Хемилюминесцентный сигнал полосы контрольной группы на анализируемой мембране принимали за 100%, а сигнал полос других групп сравнивали с сигналом полос контрольной группы, расположенных на одной и той же мембране.
Содержания АТФ в мышце
Для определения содержания АТФ в мышце использовался набор АТР Colorimetric/Fluorometric Assay Kit (MAK 190; Sigma, St. Louis, МО, США). Образец ткани взвешивали, добавляли в пробирку 2Н хлорную кислоту - 10 мкл/мг ткани и гомогенизировали. Затем пробы выдерживались на льду 30-45 минут. После этого образцы центрифугировались на 13000g 2 минуты при 4°С, супернатант переносился в чистую пробирку. Объем супернатанта измеряли, доводили до 500 мкл с помощью ATP Assay Buffer. Хлорную кислоту нейтрализовали добавлением 2М KOH (KOH добавляли постепенно, перемешивая и проверяя рН с помощью индикаторной бумаги до тех пор, пока рН пробы не достигал 6,5-8. Далее пробы центрицугировали при 13000g 15 минут при 4°С. Супернатант использовали для дальнейшего определения АТФ.
В лунки планшета вносили по 50 мкл образца (и по 50 μl подготовленных стандартов в диапазоне 2-10 нмоль/лунка) и 50 мкл ATP Reaction Mix и инкубировали 30 минут в темноте. Оптическую плотность каждого образца измеряли с помощью планшетного спектрофотометра при 570 нм. Концентрация АТФ рассчитывалась по следующей формуле:
Концентрация АТФ=В*DDF / V, где
В - количество АТФ в лунке с образцом, рассчитанное по стандартной кривой;
V - объем пробы, добавленный в лунки (50 мкл в нашем случае);
DDF - deproteinization dilution factor - фактор разведения, считался по формуле:
DDF = (500 мкл + объем KOH (мкл))/начальный объем пробы.
Исследование интенсивности синтеза белка
Для определения общего синтеза белка применялась методика SUnSET (Goodman С.А., 2011). За полчаса до введения наркоза животным вводили внутрибрюшинно 500 мкл 0.8%-ного раствора пуромицина, который ингибирует рост полипептидной цепи на рибосоме. При этом содержание пуромицина в скелетной мышце коррелирует с интенсивностью синтеза белка. Включение пуромициновой метки оценивалось с помощью вестерн-блоттинга.
Исследование экспрессии генов.
Выделение мРНК из мышечной ткани. Для проведения ГТЦР в реальном времени и оценки количества мРНК в экспериментальных группах была выделена РНК из образцов мышечной ткани. Для выделения тотальной РНК из скелетных мышц была использована методика выделения РНК на микроколонках «RNeasy Micro» («Qiagen», Германия). Производилась нарезка m. soleus крысы на микротоме при толщине срезов 20 мкм. 4-6 мкг нарезанной ткани помещались в эппендорф с 300 мкл лизирующего буфера RLT, содержащего гуанидин тиоцианат, сильный белковый детергент, в который добавлялось 10 мкл β-меркаптоэтанола. Гомогенат был перемешен в течение 1 минуты на Microspin FV-2400 («Biosan», Латвия). Затем к гомогенату было добавлено 589 мкл воды, очищенной от РНКазы, и 11 мкл раствора протеиназы К (18,7 мг/мл) («Синтол», Россия). Далее раствор инкубировался в течение 15 минут при 55°С, а затем центрифугировался при комнатной температуре 3 минуты при 10 000g. Супернатант переносился в новую пробирку с 450 мкл 96%-100% этилового спирта, смесь перемешивалась пипетированием. Данный лизат был перенесен на колонку в пробирке и центрифугировался 15 секунд при ≥8000g. Смыв был отброшен. Колонка была промыта 350 мкл буфера RW1 центрифугированием 15 секунд при ≥8000g. На 20 минут на силикагелевую мембрану колонки было нанесено 80 мкл ДНКазы I. Затем колонка последовательно была промыта буферами RW1, RPE, 80%-ным этанолом. Для элюции колонка была перенесена в эппендорф, на мембрану нанесено 30 мкл воды, проведено центрифугирование 1 минуту при 10000g. Эппендорф с водным раствором РНК немедленно был помещен в лед, а затем на хранение в криостат (-85°С). При помощи данного метода выделяются в основном молекулы мРНК.
Концентрация мРНК определялась по поглощению раствора мРНК при помощи спектрофотометра NanoPhotometer IMPLEN, способного проводить измерения в объеме 2 мкл. Снимались показания в диапазоне от 200 до 320 нм. Измерение каждой пробы проводилось не менее 3 раз. Чистота образцов была оценена исходя из соотношений показателей поглощения при различных длинах волн. Соотношение А260/А230 экспериментальных образцов было >2,0, что указывает на то, что они являлись достаточно чистыми от углеводов, пептидов, фенолов или ароматических соединений.
Обратная транскрипция. Для проведения обратной транскрипции были использованы реагенты фирмы «Синтол», Россия. Для подготовки кДНК водный раствор, содержащий 1 мкг тотальной РНК, 30 мкМ случайных гексануклеотидов и 17,4 мкМ олиго-d(Т)15 инкубировался 3 мин при 70°С, и немедленно переносился на лед. Далее к смеси было добавлено 11,5 мкл мастер-микса (1,3 мМ дНТФ, 0,02 ед./мкл ингибитора РНКазы, 6 ед./мкл М-MLV-ревертазы, 4 мкл 5х-буфера для M-MLV-ревертазы, «Синтол»). После этого пробы были помещены в амплификатор (iQ5 Multicolor Real-Time PCR Detection System, «Bio-Rad Laboratories») для проведения обратной транскрипции: 10 мин при 25°С, 60 мин при 37°С, 5 мин при 95°С, 30 мин при 4°С. После проведения реакции образцы, содержащие кДНК, хранились при -25°С.
Проведения ПЦР в реальном времени. Для проведения ПЦР в реальном времени смешивалось 2 мкл кДНК, 2 мкл праймеров с концентрацией 10 мкМ и 21 мкл мастер-микса (0,3 мМ дНТФ, 3 мМ MgCl2, 2,5 мкл 10х ПЦР-буфера Б (рН 8,8), 0,06 ед./мкл Taq ДНК-полимеразы, «Синтол»). Затем пробы были помещены в амплификатор для проведения реакции: 1 цикл: 5 мин при 95°С; 2 цикл по 44 повтора: 15 сек при 93°С, 15 сек при Tm (табл. 2), 15 сек при 72°С; 3 цикл: 6 мин 45 сек при 72°С, 30 сек при 65°С; 4 цикл по 61 повтору: 15 сек при 65°С; 5 цикл: 10 мин 15°С.
Используемые в работе праймеры:
5'-ctacgatgttgcagccaaga-3' и 5'-ggcagtcgagaagtccagtc-3' для MAFbx/Atrogine-1;
5'-gccaatttggtgctttttgt-3' и 5'-aaattcagtcctctccccgt-3' для MuRF-1;
5'-catggctaagagcaggaagg-3' и 5'-cgaagtctgca-ggtctaggg-3' для кальпаина-1;
5'-caccaagaaggtcaaacagga-3' и 5'-gcaagaactttattcaaag-tgcaa-3' для убиквитина;
5'-ctgccaggcacccgtgctctactt-3' и 5'-ctgaggtcaagtgatcggaaggag-3' для P2Y2; 5'-cgatcgtggagcagtacttgaaga-3' и 5'-aggagaggctgaagtagtagct-3' для паннексина1;
5'- tca-cag-agc-aga-gaa-tgg-act -3' и 5'- gta-tgg-ctg-ata-cca-caa-ggt -3' для IL6R;
5' -tga-cgg-ctc-ttt-gga-aga-tga-cg-3' и 5'- ata-tcc-aca-gct-ggg-cct-tta-cca-3' для миостатина;
5'-act-ccc-tta-cgt-cca-tcg-tg-3' и 5'-cag-gac-agc-ccc-act-taa-aa-3' для миогенина
Все праймеры были синтезированы фирмой «Синтол» (Россия).
Для анализа полученных с помощью ПЦР в реальном времени данных применялось относительное количественное определение исследуемого гена, нормализованное к референсному, метод 2-ΔΔCt (метод Ливака). В качестве референсного гена был использован RPL19, экспрессия которого постоянна в m. soleus в условиях эксперимента.
Анализ полученных данных и статистическая обработка данных.
Статистическая обработка данных производилась с помощью программы REST 2009 v.2.0.12 и OpenOffice.org Calc, находящихся в свободном доступе. REST 2009 v.2.0.12 позволяет анализировать данные по нескольким референсным генам, что снижает вероятность ошибки. Достоверность отличий между группами определялась с помощью U-критерия Манна-Уитни. U-критерий был выбран в связи с тем, что количество повторов в выборках не превышало 10. В тексте и на гистограммах результаты анализа экспрессии представлены в виде медианы и интерквартильной широты, результаты анализа относительного содержания белков с помощью вестерн-блоттинга представлены в виде среднего значения и ошибки среднего.
Влияние введения ингибиторов на вес разгруженной m.soleus, экспрессию мРНК, P2Y2 рецепторов и энергетический гомеостаз.
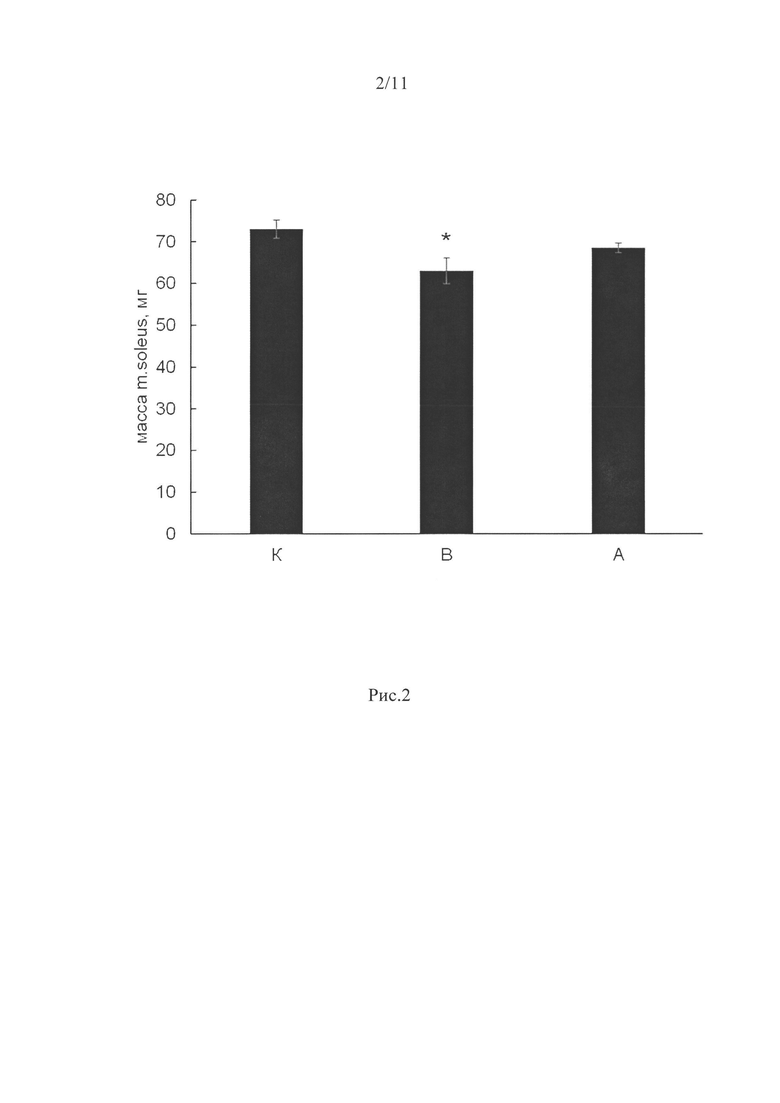
Для эксперимента были взяты 3-месячные самцы крыс Wistar весом 190±10 г. За время эксперимента изменения веса крыс ни в одной из групп не наблюдалось. В группе вывешенных без препарата крыс (В) вес m.soleus через 3 дня вывешивания был достоверно снижен на 14% по отношению к группе контроля (р<0,05, рис. 2), в то время, как между группой крыс, вывешенной с введением ингибитора P2Y2 рецепторов (А) и контролем различий не наблюдалось.
Мы обнаружили предотвращение атрофии m.soleus при 3-дневном введении ингибитора пуринэргических рецепторов P2Y2 во время вывешивания крыс (относительно группы интактного контроля.
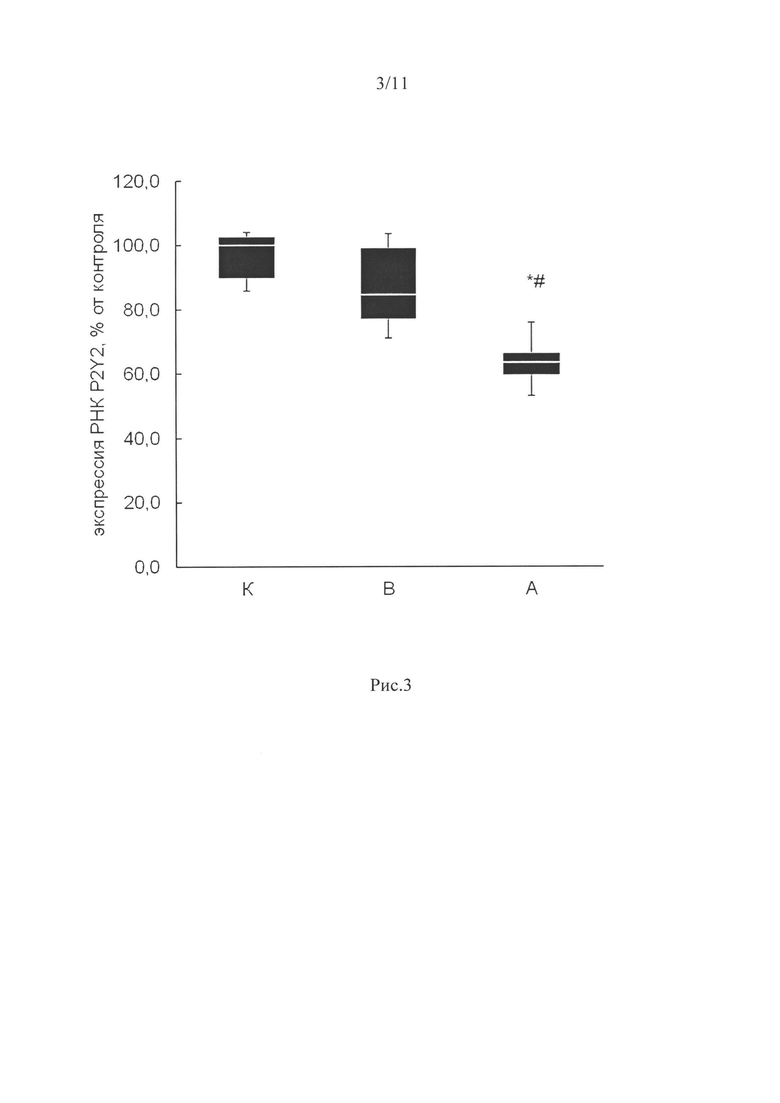
Мы обнаружили пониженную на 36% экспрессию мРНК P2Y2 (А) при применении специфических ингибиторов у вывешенных с препаратом животных (р<0,05) относительно контрольной группы (рис. 3). Результат свидетельствует о специфическом действии ингибиторов на белок-мишень и снижении его экспрессии в мышце.
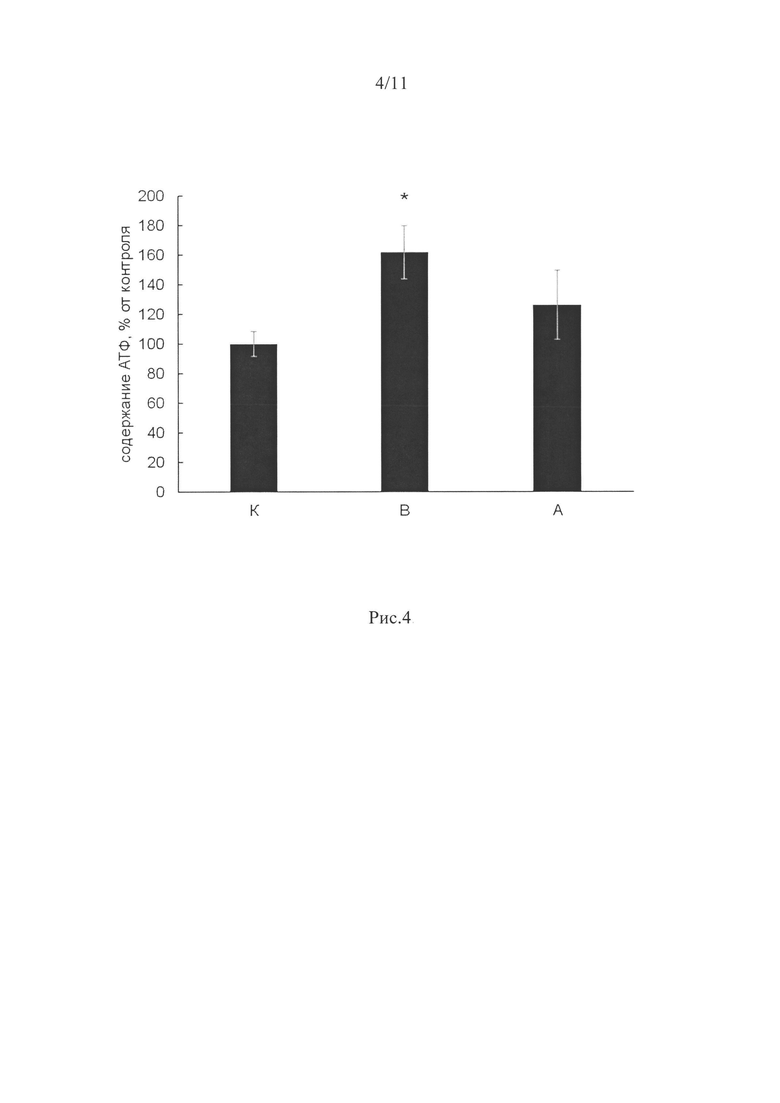
Уровень АТФ был существенно повышен только в группе вывешенных животных без введения препарата (В) на 62% по сравнению с группой контроля (р<0,05, рис. 4). В группе А (с ингибированием P2Y2 рецепторов) - этот параметр не отличался от группы контроля (рис. 4).
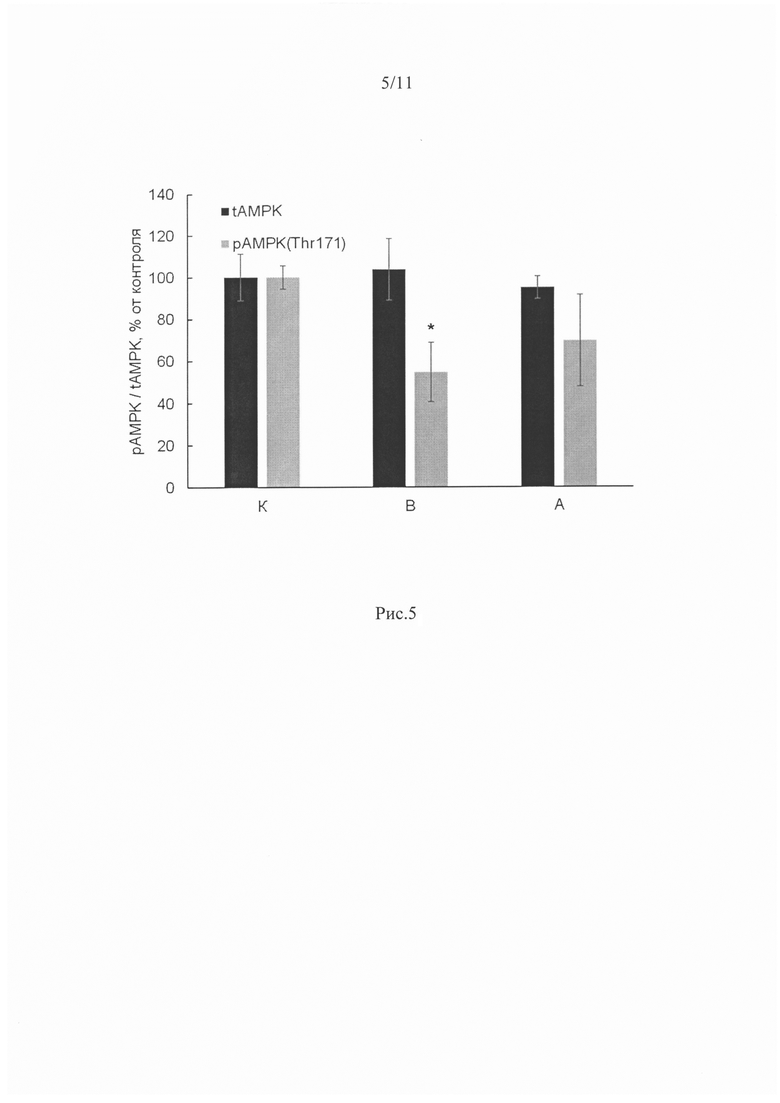
В нашем исследовании содержание рАМРК в группе В было существенно ниже, чем в группе контроля (рис. 5). Однако в группе с ингибирование P2Y2 рецепторов (группа А) ее уровень в m.soleus не отличался от группы интактного контроля.
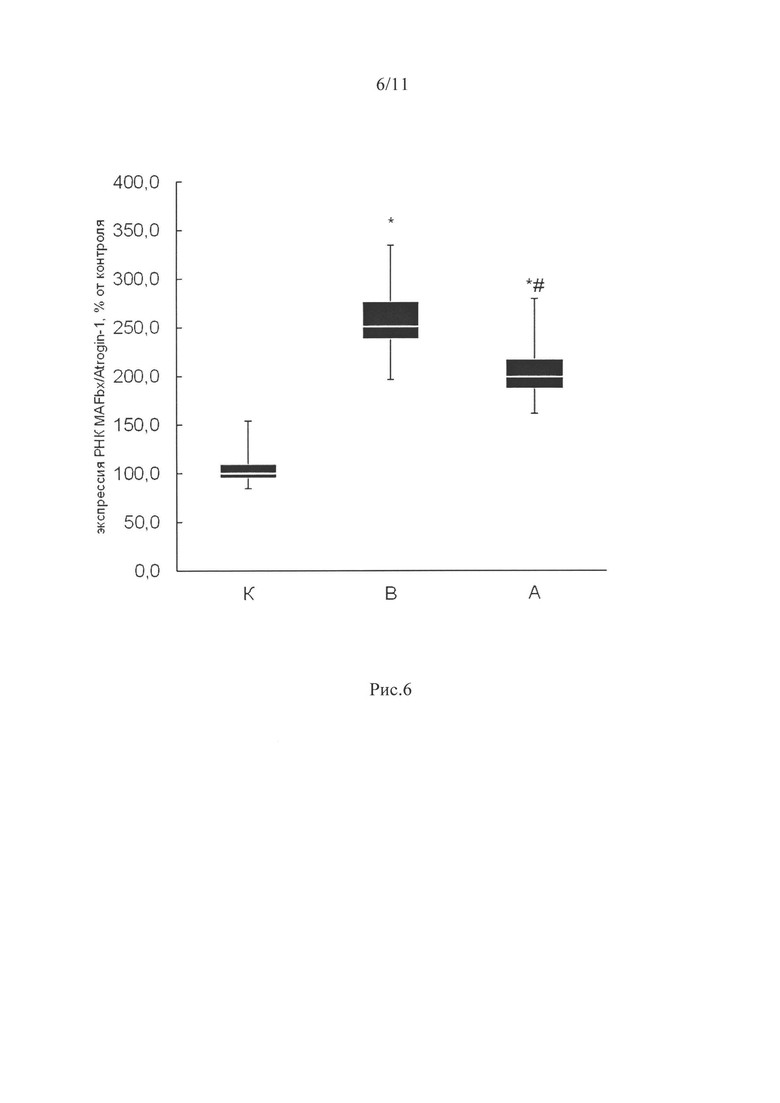
Мы определили уровень экспрессии мРНК Е3-убиквитинлигаз MuRF1 и MAFbx. Экспрессия MuRF1 у всех вывешенных животных была достоверно выше по сравнению с группой контроля (р<0,05, рис. 6). Экспрессия мРНК MAFbx была высокой в вывешенных группах относительно уровня группы контроля (р<0,05), однако в группе А (введение ингибитора P2Y2 рецепторов) экспрессия мРНК MAFbx была существенно ниже, чем в группе В (вывешивания без препарата (р<0,05, рис. 6)).
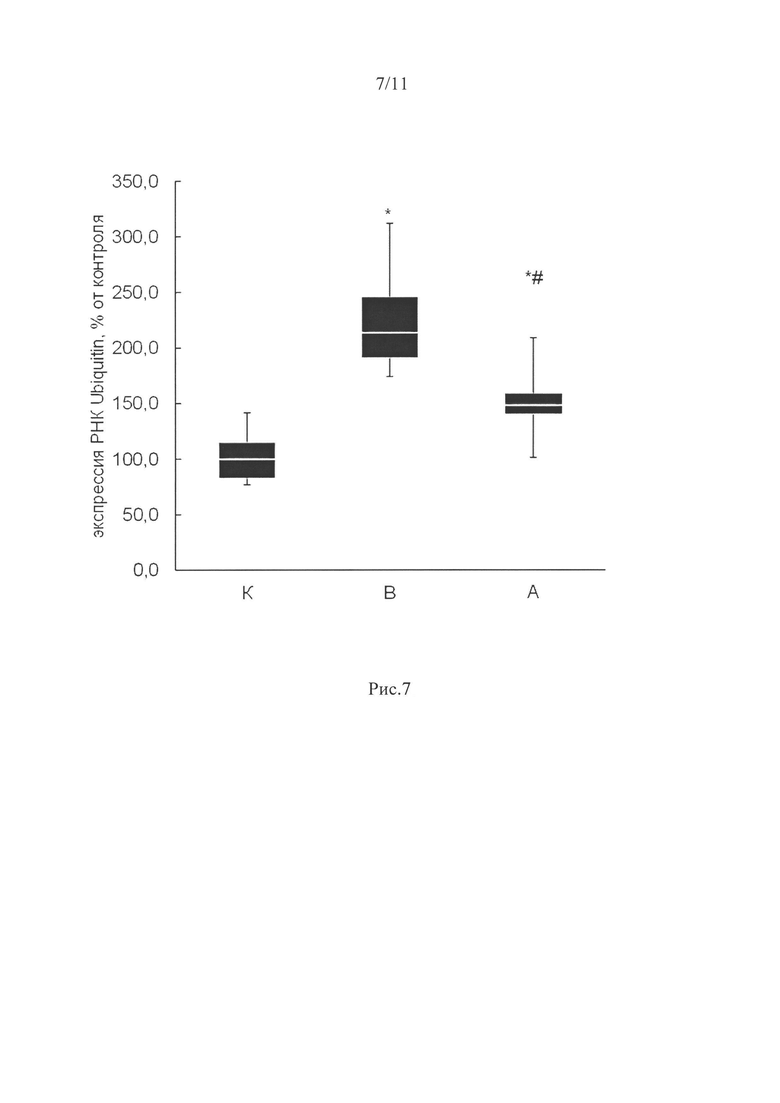
Увеличение экспрессии мРНК убиквитина частично было предотвращено в группе, вывешенной с ингибированием P2Y2 рецепторов относительно группы контроля. В то время, как в вывешенной без препарата группе (В) его уровень был на 114% выше, чем в группе контроля, в группе с ингибированием P2Y2 рецепторов (т.е. в той группе, где не было атрофии камбаловидной мышцы) экспрессия была повышена только на 48% (р<0,05; рис. 7)
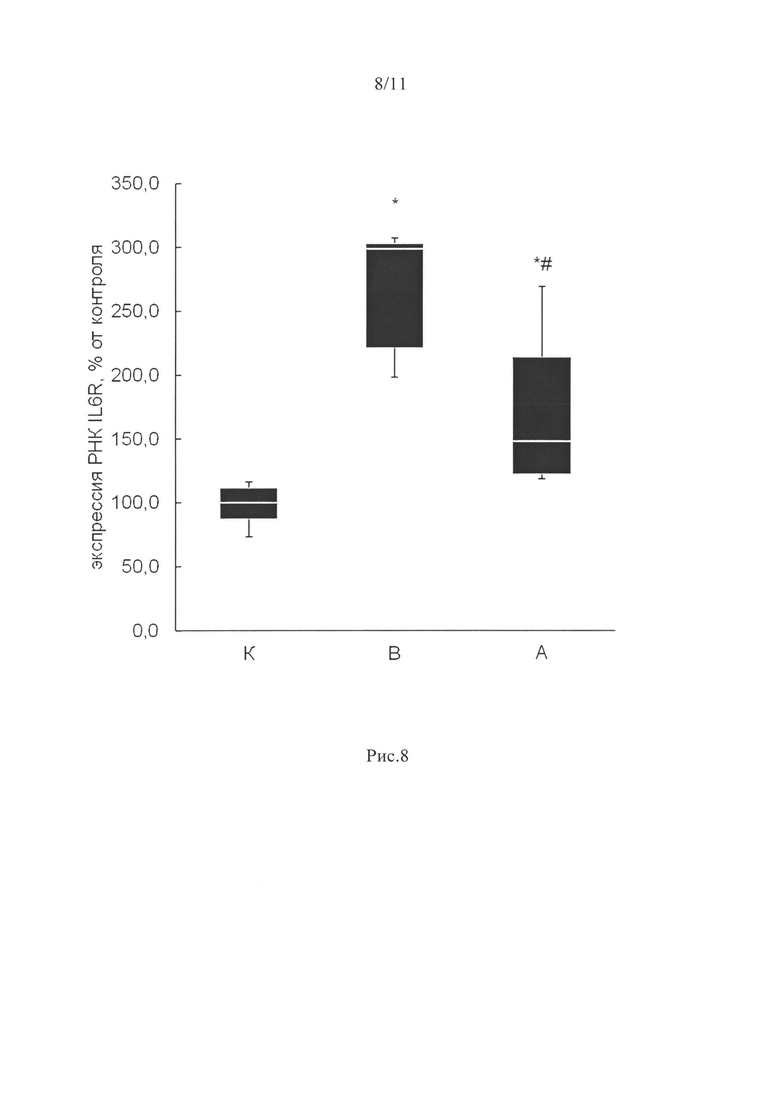
Мы обнаружили увеличение экспрессии рецептора интерлейкина 6 (IL-6R) во всех m.soleus вывешенных животных (гр. В и А) относительно группы контроля на 199 и 48% соответственно (рис. 8). Стоит отметить, что в группе А (где масса m.soleus не отличалась от группы контроля) экспрессия рецепторов IL-6 была значительно ниже, чем в группе вывешивания без препарата В (р<0,05).
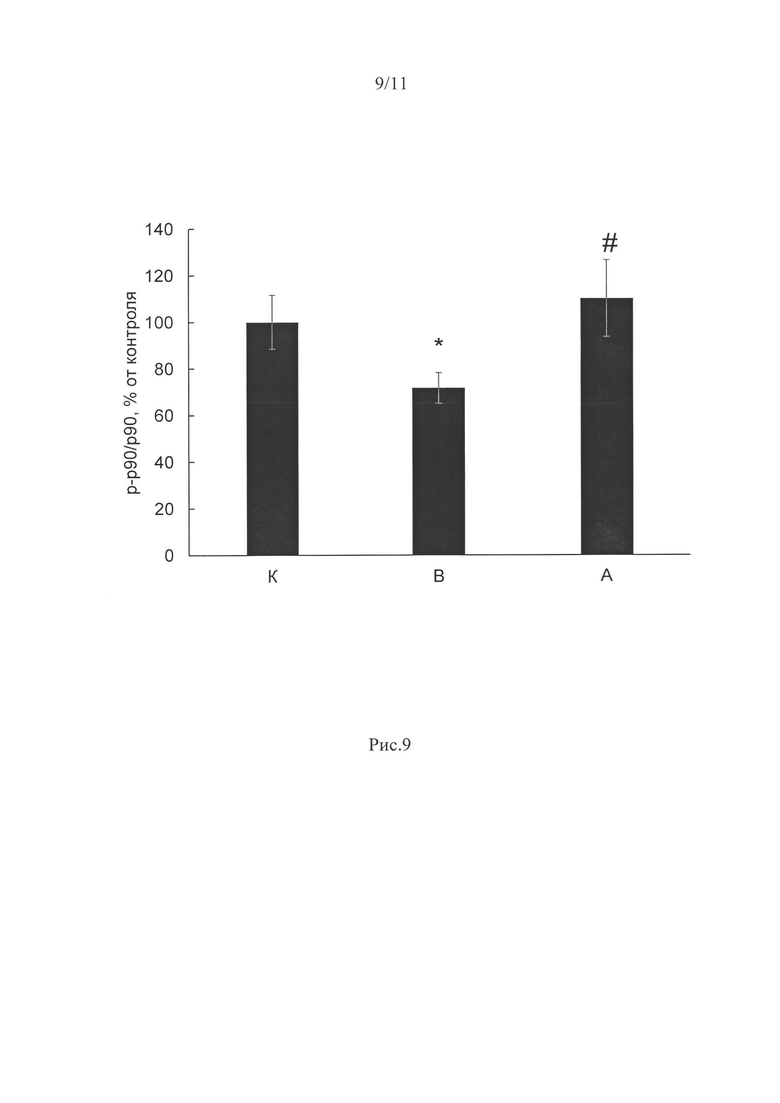
Уровень фосфорилирования p90RSK был значительно снижен в вывешенной группе HS на 28% (р<0,05) относительно группы контроля (рис. 9). Однако в группе А, вывешенной с ингибированием пуринэргических рецепторов, уровень фосфорилирования p90RSK в m.soleus не отличался от группы контроля.
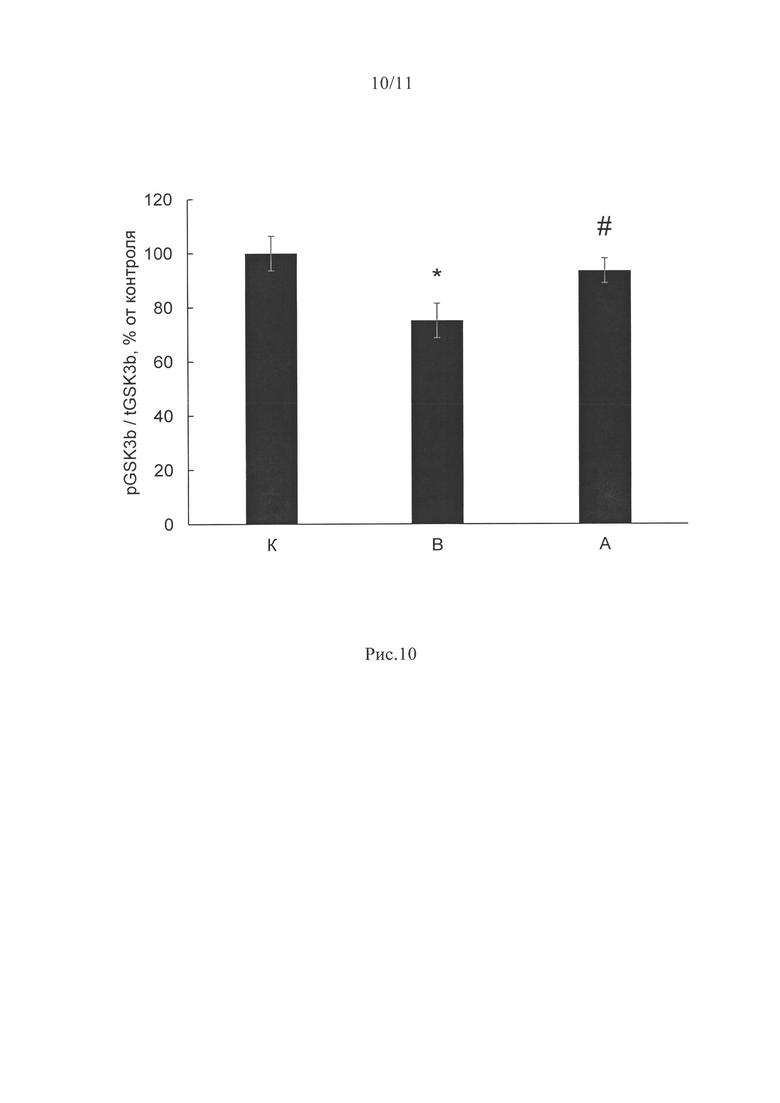
В нашем эксперименте фосфорилирование GSK3β в разных группах созвучно тем результатам, что мы наблюдали для p90RSK. В группе В оно было существенно снижено (на 25%, р<0,05), тогда как в группе с введением ингибитора P2Y2 оно не отличалось от группы контроля (рис. 10).
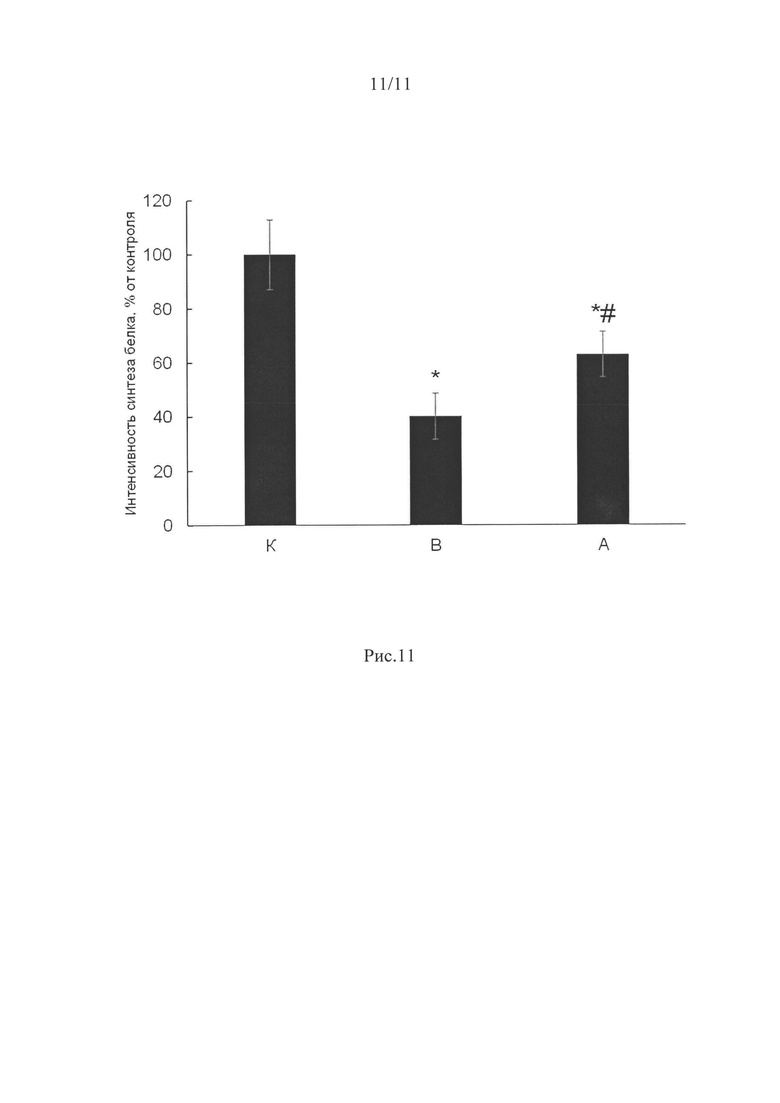
Интенсивность синтеза белка была достоверно снижена в группе вывешивания (В) (на 60%, р<0,05) относительно группы контроля, и только на 37% - в группе А (рис. 11).
Рецепторы P2Y (в том числе Y1 и Y2) (связаны с рецептором, сопряженным с G-белком (GPCR)), активируются как ди-, так и трифосфат-пуриновыми или пиримидиновыми нуклеотидами. Мы исследовали роль рецепторов P2Y2 в регуляции клеточного сигналинга при функциональной разгрузке мышц. Экспрессия мРНК P2Y2 рецепторов при применении ингибитора была снижена относительно уровня группы контроля (рис. 3). Результат свидетельствует о специфическом действии ингибитора на белок-мишень и снижении его экспрессии в мышце. Так как этот рецептор взаимодействует с нуклеотидами, мы определили содержание АТФ в m.soleus всех экспериментальных групп. Уровень АТФ был существенно повышен только в группе вывешенных животных без введения препарата (В) на 62% по сравнению с группой контроля (р<0,05, рис. 4). О таком же повышении уровня АТФ при 3-дневном вывешивании крыс сообщалось ранее (Zaripova et al., 2021). В группе с ингибированием P2Y2 рецепторов такого увеличения АТФ в m.soleus не было. Результат свидетельствует от том, что ингибирование пуринэргических P2Y2 рецепторов при разгрузке мышцы эффективно влияет на уровень АТФ в ней.
АМРК (аденозинмонофосфат протеинкиназа) является ключевым регулятором энергетического гомеостаза. Уровень фосфорилирования АМРК может меняться в зависимости от продолжительности мышечной разгрузки (Vilchinskaya et al., 2017; Tyganov et al., 2019; Stouth et al., 2018). В нашем исследовании содержание pAMPK в группе В было значительно снижено относительно группы контроля (рис. 5). Однако в группе с ингибирование P2Y2 рецепторов (группа А) уровень ее фосфорилирования в m.soleus не отличался от уровня группы контроля. Фосфорилирование AMPK может регулироваться несколькими механизмами, включая метилирование (Stouth et al., 2020) и содержание АМФ (аденозин монофосфата). Активация AMPK регулируется также кальцием (Mathew et al., 2014). Можно отметить, что в группе с ингибированием P2Y2 пуринэргических рецепторов снижение фосфорилирования AMPK при функциональной разгрузке m.soleus было полностью предотвращено. Можно предположит, что это произошло потому, что уровень АТФ, ингибирующий ее фосфорилирование, в этой группе не отличался от уровня группы интактного контроля (в отличие от группы В).
Ингибирование P2Y2 рецепторов в m.soleus при ее функциональной разгрузке препятствует накоплению АТФ в камбаловидной мышце при вывешивании. Ингибирование P2Y2 рецептора препятствует развитию в ней атрофии и препятствуют снижению фосфорилирования AMPK - ключевого регулятора энергетического гомеостаза.
Экспрессия мРНК MAFbx была высокой во всех вывешенных группах относительно уровня группы контроля (р<0,05), но в группе А (введение ингибитора P2Y2 рецепторов) экспрессия его мРНК была значительно ниже, чем в группе В (вывешивание без препарата (р<0,05, рис. 6)). MAFbx является убиквитин лигазой, участвующей в убиквитинировании белков, что ведет к атрофии мышц (Bodine S., 2001).
Увеличение экспрессии мРНК убиквитина частично также было предотвращено только в группе А, вывешенной с ингибированием P2Y2 рецепторов относительно группы контроля (рис. 7), т.е. в той группе, где не было атрофии камбаловидной мышцы. Самая высокая экспрессия убиквитина была в группе крыс, вывешенных без препарата. Убиквитинирование белков способствует их деградации (Bodine S., 2001).
Можно отметить, что пуринэргические рецепторы P2Y2 имеют отношение к регуляции экспрессии мРНК MAFbx и убиквитина при разгрузке m.soleus, что может способствовать снижению степени атрофии soleus при ее разгрузке.
Известно, что содержание интерлейкина-6 (IL-6), миокина, увеличивается при функциональной разгрузке мышц, что ассоциируется с экспрессией атрогенов (MuRF1 и MAFbx) и атрофией (Yakabe et al., 2018). Блокирование рецепторов IL-6 предотвращает развитие атрофии (Yakabe et al., 2018), а введение IL-6 в мышцу, напротив, ведет к ее атрофии (Sun et al., 2021). Интересно отметить, что в группе А (где масса m.soleus не отличалась от группы контроля) экспрессия рецепторов IL-6 была значительно ниже, чем в группе вывешивания без препарата В (р<0,05), рис. 8. IL-6 способен влиять на генную экспрессию через эпигеномную модификацию.
Ингибирование P2Y2 рецепторов при вывешивании крыс существенно замедляет экспрессию мРНК IL-6R в m.soleus, что может способствовать снижению степени атрофии мышцы при ее разгрузке.
Маркеры, принимающие участие в регуляции белкового синтеза.
P90RSK (рибосомальная серин/треонин киназы р90) является маркером Erk1/2-сигнального пути и также влияет на синтез белка (Mirzoev ТМ, Shenkman B.S., 2018). Erk1/2 может фосфорилировать и активировать p90RSK с последующим фосфорилированием множества клеточных субстратов (Mirzoev ТМ, Shenkman B.S., 2018; Yu et al., 2001). p90RSK регулирует активность mTOR и синтез белка посредством фосфорилирования TSC2 и Raptor (Roux et al, 2004; Kimball SR, Jefferson LS. 2006; Carriere A., et al., 2008). В нашем эксперименте уровень фосфорилирования p90RSK был значительно снижен в вывешенной группе В (на 28%, р<0,05) относительно группы контроля (рис. 9). Снижение содержания p-p90RSK при 3-дневном вывешивании было обнаружено ранее (Zaripova et al., 2021). Однако в группе А, вывешенной с ингибированием пуринэргических рецепторов, уровень фосфорилирования p90RSK в m.soleus не отличался от группы контроля. Различия в уровне фосфорилирования p90RSK между группами В и А также указывают на то, что предотвращение атрофии soleus в группе А могло быть связано лучшим регулированием процессов белкового синтеза в вывешенной с ингибированием P2Y2 рецепторов группе.
Киназа гликогенсинтазы 3β (GSK-3β) является субстратом для фосфорилирования p90RSK, что может также регулировать ее активность (Mirzoev ТМ, Shenkman BS., 2018). Предполагается, что GSK-3P может взаимодействовать с более чем сотней различных белков и может фосфорилировать многие из них. GSK-3β-зависимое фосфорилирование белков может приводить к их убиквитинированию через β-TrCP (Robertson et al., 2018). В нашем эксперименте фосфорилирование GSK3β в разных группах созвучно тем результатам, что мы наблюдали для p90RSK. В группе В оно было существенно снижено на 25% (р<0,05), тогда как в группе с введением ингибитора P2Y2 оно не отличалось от группы контроля (рис. 11). В нормальных мышцах этот фермент ингибируется посредством фосфорилирования с помощью передачи сигналов PI3K-Akt-FoxO сигнального пути. При разгрузке мышц, передача сигналов PI3K-Akt-FoxO снижается, a GSK-3β активируется и катализирует фосфорилирование белка. GSK-3β имеет первостепенное значение в регулировании массы мышц, потому что он фосфорилирует десминовые филаменты, способствует их потере и вызывает разрушение и атрофию миофибрилл (Aweida D., et al., 2018). Можно предположить, что P-p90RSK могла иметь отношение к фосфорилированию GSK-3β в ненагруженных мышцах крыс, которым вводили ингибиторы пуринэргических рецепторов.
Оценивая интегральный показатель интенсивности синтеза белка с помощью введения пуромицина (метод SUnSET), мы также обнаружили существенно более высокий уровень интенсивности синтеза белка в группе А (р<0,05) относительно группы вывешивания без препарата (В).
Ингибирование пуринэргических рецепторов P2Y2 предотвращает снижение фосфорилирования и активацию GSK-3β, что может препятствовать ее разрушительному действию на белки мышцы и развитию атрофии при 3-дневном вывешивании крыс, а также предотвращает снижение p-p90RSK, принимающей участие в регуляции белкового синтеза. Сама интенсивность белкового синтеза в группе с ингибированием P2Y2 рецепторов оказывается выше, чем в группе, где это ингибирование при функциональной разгрузке мышц не проводилось.
Мы впервые показали, что пуринэргические рецепторы P2Y2 принимают участие в регуляции атрофических процессов при функциональной разгрузке мышц.
Активация атрофических процессов запускается в том числе с помощью передачи АТФ-опосредованных сигналов, и пуринэргические рецепторы P2Y2 принимают участие в регуляции этого процесса. Атрофия предотвращается как за счет снижения протеолитических процессов в разгруженной мышце, так и за счет улучшения в ней процессов интенсивности белкового синтеза.
Краткое описание рисунков
Рис. 1. Схематическое описание АТФ-зависимого механизма передачи сигналов в скелетных мышцах, где PANX1 - паннексиновые каналы; P2Y-рецепторы; G - g-белок; PI3K - PI3-киназа, IP3R - IP3 рецепторы (IP3R - инозитол 1,4,5 - трифосфатные рецепторы), IP3 - инозитол 1,4,5 - трифосфат; PLC - фосфолипаза С
Рис. 2. Вес мышцы при 3-х дневном вывешивании крыс и введении ингибитора P2Y2 рецепторов.
К - контроль, В - 3-х суточное вывешивание с введением плацебо, А - 3-х суточное вывешивание с введением AR-C 118925ХХ. * - достоверные отличия от группы К (р<0,05).
Рис. 3. Экспрессия мРНК P2Y2 при 3-х дневном вывешивании крыс и введении ингибитора P2Y2 рецепторов.
К - контроль, В - 3-х суточное вывешивание с введением плацебо, А - 3-х суточное вывешивание с введением AR-C 118925ХХ. * - достоверные отличия от группы К (р<0,05); # - достоверные отличия от групп В (р<0,05).
Рис. 4. Уровень АТФ при 3-х дневном вывешивании крыс и введении ингибитора P2Y2 рецепторов.
К - контроль, В - 3-х суточное вывешивание с введением плацебо, А - 3-х суточное вывешивание с введением AR-C 118925ХХ. * - достоверные отличия от группы К (р<0,05).
Рис. 5. Уровень тотального АМРК и фосфорилированного рАМРК при 3-х дневном вывешивании крыс и введении ингибитора P2Y2 рецепторов.
Содержание рАМРК в m.soleus крыс после 3-дневного вывешивания. К - контроль, В - 3-х суточное вывешивание с введением плацебо, А - 3-х суточное вывешивание с введением AR-C 118925ХХ. * - достоверные отличия от группы К (р<0,05); # - достоверные отличия от групп В (р<0,05).
Рис. 6. Экспрессия мРНК MuRF-1 (А) и MAFbx (Б) при 3-х дневном вывешивании крыс и введении ингибитора P2Y2 рецепторов.
Экспрессия мРНК MAFbx/Atrogin в m.soleus крыс после 3-дневного вывешивания. К - контроль, В - 3-х суточное вывешивание с введением плацебо, А - 3-х суточное вывешивание с введением AR-C 118925ХХ. * - достоверные отличия от группы К (р<0,05); # - достоверные отличия от групп В (р<0,05).
Рис. 7. Экспрессия мРНК убиквитина при 3-х дневном вывешивании крыс и введении ингибитора P2Y2 рецепторов.
Экспрессия мРНК убиквитина в m.soleus крыс после 3-дневного вывешивания. К - контроль, В - 3-х суточное вывешивание с введением плацебо, А - 3-х суточное вывешивание с введением AR-C 118925ХХ. * - достоверные отличия от группы К (р<0,05); # - достоверные отличия от групп В (р<0,05).
Рис. 8. Экспрессия мРНК IL6R при 3-х дневном вывешивании крыс и введении ингибитора P2Y2 рецепторов.
Экспрессия мРНК IL6R в m.soleus крыс после 3-дневного вывешивания. К - контроль, В - 3-х суточное вывешивание с введением плацебо, А - 3-х суточное вывешивание с введением AR-C 118925ХХ. * - достоверные отличия от группы К (р<0,05); # - достоверные отличия от групп В (р<0,05).
Рис. 9. Содержание р-р90 в m.soleus при 3-х дневном вывешивании крыс и введении ингибитора P2Y2 рецепторов.
Содержание р-р90 в m.soleus крыс после 3-дневного вывешивания. К - контроль, В - 3-х суточное вывешивание с введением плацебо, А - 3-х суточное вывешивание с введением AR-C 118925ХХ. * - достоверные отличия от группы К (р<0,05); # - достоверные отличия от групп В (р<0,05).
Рис. 10. Уровень фосфорилирования GSK3P при 3-х дневном вывешивании крыс и введении ингибитора P2Y2 рецепторов. Содержание pGSK3β в m.soleus крыс после 3-дневного вывешивания.
К - контроль, В - 3-х суточное вывешивание с введением плацебо, А - 3-х суточное вывешивание с введением AR-C 118925ХХ. * - достоверные отличия от группы К (р<0,05); # - достоверные отличия от групп В (р<0,05).
Рис. 11. Интенсивность синтеза белка при 3-х дневном вывешивании крыс и введении ингибитора P2Y2 рецепторов.
К - группа контроля, В - группа вывешивания, А - группа крыс с введением ингибитора P2Y2 рецепторов. * - отличие от контроля достоверно при р<0,05, # - отличие от группы вывешивания (В) достоверны при р<0,05.
Литература:
Baldwin KM, Haddad F. Skeletal muscle plasticity: cellular and molecular responses to altered physical activity paradigms. Am J Phys Med Rehabil. 2002 Nov;81(11 Suppl):S40-51. doi: 10.1097/01.PHM.0000029723.36419.0D. PMID: 12409810.
Fitts RH, Riley DR, Widrick JJ. Physiology of a microgravity environment invited review: microgravity and skeletal muscle. J Appl Physiol (1985). 2000 Aug;89(2):823-39. doi: 10.1152/jappl.2000.89.2.823. PMID: 10926670.
Flück M, Hoppeler H. Molecular basis of skeletal muscle plasticity-from gene to form and function. Rev Physiol Biochem Pharmacol. 2003;146:159-216. doi: 10.1007/s10254-002-0004-7. Epub 2003 Jan 14. PMID: 12605307.
Jackman RW, Kandarian SC. The molecular basis of skeletal muscle atrophy. Am J Physiol Cell Physiol. 2004 Oct;287(4):C834-43. doi: 10.1152/ajpcell.00579.2003. PMID: 15355854.
Belova S. Tyganov, S; Mochalova,E; Shenkman,B. Restricted Activity and Protein Synthesis in Postural and Locomotor Muscles // Ross Fiziol Zh Im I M Sechenova. 2021. V.107. P.842-853.
Zaripova KA, Kalashnikova EP, Belova SP, Kostrominova TY, Shenkman BS, Nemirovskaya TL. Role of Pannexin 1 ATP-Permeable Channels in the Regulation of Signaling Pathways during Skeletal Muscle Unloading. Int J Mol Sci. 2021 Sep 28;22(19):10444. doi: 10.3390/ijms221910444. PMID: 34638792; PMCID: PMC8508840.
Shenkman BS. How Postural Muscle Senses Disuse? Early Signs and Signals. Int J Mol Sci. 2020 Jul 16;21(14):5037. doi: 10.3390/ijms21145037. PMID: 32708817; PMCID: PMC7404025.
Gupta RC, Misulis KE, Dettbarn WD. Activity dependent characteristics of fast and slow muscle: biochemical and histochemical considerations. Neurochem Res. 1989 Jul;14(7):647-55. doi: 10.1007/BF00964874. PMID: 2779725.
Ohira Y, Yasui W, Kariya F, Wakatsuki T, Nakamura K, Asakura T, Edgerton VR. Metabolic adaptation of skeletal muscles to gravitational unloading. Acta Astronaut. 1994 Jul;33:113-7. doi: 10.1016/0094-5765(94)90115-5. PMID: 11539510.
Casas M, Buvinic S, Jaimovich E. ATP signaling in skeletal muscle: from fiber plasticity to regulation of metabolism. Exerc Sport Sci Rev. 2014 Jul;42(3):110-6. doi: 10.1249/JES.0000000000000017. PMID: 24949845.
Dahl G. ATP release through pannexon channels. Philos Trans R Soc Lond В Biol Sci. 2015 Jul 5;370(1672):20140191. doi: 10.1098/rstb.2014.0191. PMID: 26009770; PMCID: PMC4455760.
May C, Weigl L, Karel A, Hohenegger M. Extracellular ATP activates ERK1/ERK2 via a metabotropic P2Y1 receptor in a Ca2+ independent manner in differentiated human skeletal muscle cells. Biochem Pharmacol. 2006 May 14;71(10):1497-509. doi: 10.1016/j.bcp.2006.02.003. Epub 2006 Mar 14. PMID: 16533496.
Riquelme MA, Cea LA, Vega JL, Boric MP, Monyer H, Bennett MV, Frank M, Willecke K, Sáez JC. The ATP required for potentiation of skeletal muscle contraction is released via pannexin hemichannels. Neuropharmacology. 2013 Dec;75:594-603. doi: 10.1016/j.neuropharm.2013.03.022. Epub 2013 Apr 11. PMID: 23583931.
Liu B, Cao W, Li J, Liu J. Lysosomal exocytosis of ATP is coupled to P2Y2 receptor in marginal cells in the stria vascular in neonatal rats. Cell Calcium. 2018 Dec;76:62-71. doi: 10.1016/j.ceca.2018.09.006. Epub 2018 Sep 21. PMID: 30273839.
Casas M, Buvinic S, Jaimovich E. ATP signaling in skeletal muscle: from fiber plasticity to regulation of metabolism. Exerc Sport Sci Rev. 2014 Jul;42(3):110-6. doi: 10.1249/JES.0000000000000017. PMID: 24949845.
Arias-Calderón M, Almarza G, Díaz-Vegas A, Contreras-Ferrat A, Valladares D, Casas M, Toledo H, Jaimovich E, Buvinic S. Characterization of a multiprotein complex involved in excitation-transcription coupling of skeletal muscle. Skelet Muscle. 2016 Apr 11;6:15. doi: 10.1186/sl3395-016-0087-5. PMID: 27069569; PMCID: PMC4827232.
Chen M, Chen H, Gu Y, Sun P, Sun J, Yu H, Zheng H, Chen D. P2Y2 promotes fibroblasts activation and skeletal muscle fibrosis through АКТ, ERK, and PKC. BMC Musculoskelet Disord. 2021 Aug 11;22(1):680. doi: 10.1186/s12891-021-04569-y. PMID: 34380439; PMCID: PMC8359595.
Morey-Holton, E., et al., The hindlimb unloading rat model: literature overview, technique update and comparison with space flight data. Adv Space Biol Med, 2005. 10: p.7-40.
Vilchinskaya NA, Mochalova EP, Nemirovskaya TL, Mirzoev TM, Turtikova OV, Shenkman BS. Rapid decline in MyHC I(β) mRNA expression in rat soleus during hindlimb unloading is associated with AMPK dephosphorylation. J Physiol. 2017 Dec 1;595(23):7123-7134. doi: 10.1113/JP275184. Epub 2017 Oct 25. PMID: 28975644; PMCID: PMC5709318.
Tyganov SA, Mochalova EP, Belova SP, Sharlo KA, Rozhkov SV, Vilchinskaya NA, Paramonova II, Mirzoev TM, Shenkman BS. Effects of Plantar Mechanical Stimulation on Anabolic and Catabolic Signaling in Rat Postural Muscle Under Short-Term Simulated Gravitational Unloading. Front Physiol. 2019 Sep 27;10:1252. doi: 10.3389/fphys.2019.01252. PMID: 31611819; PMCID: PMC6776874.
Stouth, D.W.; Manta, A.; Ljubicic, V. Protein arginine methyltransferase expression, localization, and activity during disuseinduced skeletal muscle plasticity. Am. J. Physiol. Physiol. 2018, 314, C177-C190.
Mathew, Т.; Ferris, R.; Downs, R.; Kinsey, S.; Baumgarner, B. Caffeine promotes autophagy in skeletal muscle cells by increasing the calcium-dependent activation of AMP-activated protein kinase. Biochem. Biophys. Res. Commun. 2014, 453, 411-418.
Bodine SC, Latres E, Baumhueter S, Lai VK, Nunez L, Clarke BA, Poueymirou WT, Panaro FJ, Na E, Dharmarajan K, Pan ZQ, Valenzuela DM, DeChiara TM, Stitt TN, Yancopoulos GD, Glass DJ. Identification of ubiquitin ligases required for skeletal muscle atrophy. Science. 2001 Nov 23;294(5547):1704-8. doi: 10.1126/science. 1065874. Epub 2001 Oct 25. PMID: 11679633.
Yakabe M, Ogawa S, Ota H, Iijima K, Eto M, Ouchi Y, Akishita M. Inhibition of interleukin-6 decreases atrogene expression and ameliorates tail suspension-induced skeletal muscle atrophy. PLoS One. 2018 Jan 19;13(1):e0191318. doi: 10.1371/journal.pone.0191318. PMID: 29351340; PMCID: PMC5774788.
Sun H, Sun J, Li M, Qian L, Zhang L, Huang Z, Shen Y, Law BY, Liu L, Gu X. Transcriptome Analysis of Immune Receptor Activation and Energy Metabolism Reduction as the Underlying Mechanisms in Interleukin-6-Induced Skeletal Muscle Atrophy. Front Immunol. 2021 Sep 6;12:730070. doi: 10.3389/fimmu.2021.730070. PMID: 34552592; PMCID: PMC8450567.
Mirzoev TM, Shenkman BS. Regulation of Protein Synthesis in Inactivated Skeletal Muscle: Signal Inputs, Protein Kinase Cascades, and Ribosome Biogenesis. Biochemistry (Mosc). 2018 Nov;83(11): 1299-1317. doi: 10.1134/S0006297918110020. PMID: 30482143.
Yu M, Blomstrand E, Chibalin AV, Krook A, Zierath JR. Marathon running increases ERK1/2 and p38 MAP kinase signalling to downstream targets in human skeletal muscle. J Physiol. 2001 Oct l;536(Pt 1):273-82. doi: 10.1111/j.1469-7793.2001.00273.x. PMID: 11579175; PMCID: PMC2278852.
Roux PP, Ballif BA, Anjum R, Gygi SP, Blenis J. Tumor-promoting phorbol esters and activated Ras inactivate the tuberous sclerosis tumor suppressor complex via p90 ribosomal S6 kinase. Proc Natl Acad Sci USA. 2004;101:13489-94
Kimball SR, Jefferson LS. Signaling pathways and molecular mechanisms through which branched-chain amino acids mediate translational control of protein synthesis. J Nutr. 2006 Jan;136(l Suppl):227S-31S. doi: 10.1093/jn/136.1.227S. PMID: 16365087.
Carrière A, Cargnello M, Julien LA, Gao H, Bonneil E, Thibault P, Roux PP. Oncogenic MARK signaling stimulates mTORC1 activity by promoting RSK-mediated raptor phosphorylation. Curr Biol. 2008 Sep 9; 18(17): 1269-77. doi: 10.1016/j.cub.2008.07.078. Epub 2008 Aug 21. PMID: 18722121.
Carriere A, Ray H, Blenis J, Roux PP. The RSK factors of activating the Ras/MAPK signaling cascade. Front Biosci. 2008 May 1;13:4258-75. doi: 10.2741/3003. PMID: 18508509.
Robertson H, Hayes JD, Sutherland C. A partnership with the proteasome; the destructive nature of GSK3. Biochem Pharmacol. 2018 Jan; 147:77-92. doi: 10.1016/j.bcp.2017.10.016. Epub 2017 Nov 1. PMID: 29102676; PMCID: PMC5954166.
Aweida D, Rudesky I, Volodin A, Shimko E, Cohen S. GSK3-β promotes calpain-1-mediated desmin filament depolymerization and myofibril loss in atrophy. J Cell Biol. 2018 Oct 1;217(10):3698-3714. doi: 10.1083/jcb.201802018. Epub 2018 Jul 30. PMID: 30061109; PMCID: PMC6168250.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ VX 745 ДЛЯ ПРЕДОТВРАЩЕНИЯ АТРОФИИ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ ФУНКЦИОНАЛЬНОЙ РАЗГРУЗКЕ | 2019 |
|
RU2714923C1 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И СНИЖЕНИЯ ДЕСТРУКЦИИ БЕЛКОВ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ АТРОФИИ, ВЫЗВАННОЙ ГИПОКИНЕЗИЕЙ И/ИЛИ ГРАВИТАЦИОННОЙ РАЗГРУЗКОЙ | 2013 |
|
RU2517576C1 |
| СПОСОБ ПРОФИЛАКТИКИ И СНИЖЕНИЯ ДЕСТРУКЦИИ БЕЛКОВ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ АТРОФИИ, ВЫЗВАННОЙ ГИПОКИНЕЗИЕЙ И/ИЛИ ГРАВИТАЦИОННОЙ РАЗГРУЗКОЙ | 2013 |
|
RU2517259C1 |
| СПОСОБ ПРЕДОТВРАЩЕНИЯ АТРОФИИ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ ФУНКЦИОНАЛЬНОЙ РАЗГРУЗКЕ | 2012 |
|
RU2481105C1 |
| Способ предотвращения атрофии, повышенной утомляемости медленных мышечных волокон и их трансформации в быстрые мышечные волокна в камбаловидной мышце | 2024 |
|
RU2834246C1 |
| Способ предотвращения развития утомления скелетной мышцы | 2023 |
|
RU2814077C1 |
| Способ поддержания силы и жесткости постуральных мышц млекопитающих при их функциональной разгрузке | 2022 |
|
RU2800317C1 |
| СПОСОБ УСКОРЕНИЯ ВОССТАНОВЛЕНИЯ СКЕЛЕТНЫХ МЫШЦ ОТ АТРОФИИ ПОСЛЕ ДЛИТЕЛЬНОЙ АЛКОГОЛЬНОЙ ИНТОКСИКАЦИИ | 2014 |
|
RU2578463C1 |
| СПОСОБ ПРОФИЛАКТИКИ И СНИЖЕНИЯ ДЕСТРУКЦИИ ЦИТОСКЕЛЕТНЫХ БЕЛКОВ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ АТРОФИИ, ВЫЗВАННОЙ ГИПОКИНЕЗИЕЙ И/ИЛИ ГРАВИТАЦИОННОЙ РАЗГРУЗКОЙ | 2010 |
|
RU2444354C2 |
| ИНГИБИТОР ПРОТЕОЛИЗА ЦИТОСКЕЛЕТНЫХ БЕЛКОВ СКЕЛЕТНЫХ МЫШЦ ПРИ ФИЗИЧЕСКОЙ НАГРУЗКЕ | 2008 |
|
RU2389486C1 |
Изобретение относится к медицине, а именно к травматологии, космической медицине, физиологии, и может быть использовано для предотвращения атрофии скелетных мышц при их функциональной разгрузке. Способ характеризуется тем, что в организм инъекционно вводят ингибитор пуринэргических рецепторов P2Y2 AR-C 118925ХХ в количестве 10 мг/кг в день. Способ обеспечивает повышение эффективности степени предотвращения атрофии путем ингибирования пуринэргических рецепторов P2Y2 и ключевых сигнальных путей, инициирующих атрофию. 11 ил.
Способ предотвращения атрофии скелетных мышц при их функциональной разгрузке, характеризующийся тем, что в организм инъекционно вводят ингибитор пуринэргических рецепторов P2Y2 AR-C 118925ХХ в количестве 10 мг/кг в день.
| СПОСОБ ПРЕДОТВРАЩЕНИЯ АТРОФИИ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ ФУНКЦИОНАЛЬНОЙ РАЗГРУЗКЕ | 2012 |
|
RU2481105C1 |
| ПРИМЕНЕНИЕ VX 745 ДЛЯ ПРЕДОТВРАЩЕНИЯ АТРОФИИ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ ФУНКЦИОНАЛЬНОЙ РАЗГРУЗКЕ | 2019 |
|
RU2714923C1 |
| СПОСОБ ПРОФИЛАКТИКИ И СНИЖЕНИЯ ДЕСТРУКЦИИ БЕЛКОВ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ АТРОФИИ, ВЫЗВАННОЙ ГИПОКИНЕЗИЕЙ И/ИЛИ ГРАВИТАЦИОННОЙ РАЗГРУЗКОЙ | 2013 |
|
RU2517259C1 |
| ЗАРИПОВА К.А | |||
| и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Клеточная сигнализация: итоги и перспективы | |||
| V Российский симпозиум с международным участием | |||
| Тезисы докладов | |||
| Казань, 14-17 сентября | |||
Авторы
Даты
2023-05-31—Публикация
2022-05-11—Подача