Изобретение относится к медицине, а именно к реабилитационной и космической медицине, и может применяться для предотвращения атрофии мышечных волокон и поддержания максимальной мышечной силы при гипокинезии и в условиях невесомости.
Уровень техники
Скелетные мышцы млекопитающих (особенно постуральные или «антигравитационные») претерпевают значительные морфофункциональные изменения в условиях вынужденной гипокинезии и микрогравитации. В научной литературе хорошо описаны изменения, происходящие в постуральных мышцах грызунов и человека в условиях функциональной разгрузки, вызванной пребыванием в условиях реальной или модулируемой невесомости. Так, в постуральной камбаловидной мышце были отмечены такие изменения, как уменьшение площади поперечного сечения (ППС) мышечных волокон (атрофия), значительное снижение силы и жесткости мышечных волокон (атония), а также увеличение доли волокон, содержащих «быстрые» изоформы тяжелых цепей миозина (Oganov et al., 1981, 1988; Ohira et al., 1992; Caiozzo et al., 1994; McDonald and Fitts, 1995; Widrick et al., 1999; Toursel et al., 2002; Fitts et al., 2010). Атрофию мышечных волокон и сопутствующее снижение мышечного тонуса (жесткости) и силы связывают с увеличением распада ключевых саркомерных белков (миозина, актина, титина), а также снижением интенсивности синтеза миофибриллярных белков (Bodine, 2013; Atherton et al., 2016; Peris-Moreno et al., 2021). Для количественной оценки мышечного тонуса принято использовать показатели мышечной жесткости. Под мышечной жесткостью понимают приращение растягивающей силы, отнесенной к площади поперечного сечения, в ответ на относительное удлинение мышечных волокон (Shenkman et al., 2021). Мышечная жесткость может служить индикатором структурно-функционального состояния мышцы. Хорошо известно, что нахождение человека в условиях функциональной разгрузки (невесомости) приводит к снижению мышечного тонуса (Grigoriev et al., 2004), связанного с инактивацией пула «медленных» двигательных единиц мышц-экстензоров. Такое снижение мышечного тонуса (жесткости) можно называют рефлекторным (Shenkman et al., 2021). Однако было установлено, что изолированная от нервной системы скелетная мышца обладает собственной жесткостью. Жесткостные свойства изолированной скелетной мышцы определяются как активным компонентом, представленным актомиозиновыми взаимодействиями, так и состоянием белков внеклеточного матрикса и внутриклеточного цитоскелета, представленного молекулами белков, проявляющими эластические свойства (титин) и способных к механическому сопротивлению в ответ на растяжение или сокращение мышцы (Shenkman et al., 2021). Ранее было продемонстрировано, что функциональная разгрузка задних конечностей грызунов методом антиортостатического вывешивания (2-3 недели) приводит к значительному снижению пассивных свойств как изолированных камбаловидных мышц крысы (Canon and Goubel, 1995), так и отдельных мышечных волокон (Toursel et al., 2002). При этом в условиях функциональной разгрузки было установлено достоверное снижение содержания ключевого эластичного белка титина в волокнах камбаловидной мышцы (Toursel et al., 2002; Udaka et al., 2008; Ulanova et al., 2019).
В настоящее время ведутся поиски фармакологической коррекции морфофункциональных изменений в скелетных мышцах млекопитающих после периода гипокинезии (функциональной разгрузки). Одним из перспективных и одобренных медицинскими организациями препаратов является литий - препарат, который широко используется в медицинской практике для лечения биполярного расстройства и является хорошо известным природным ингибитором киназы гликогензинаты-3 (GSK-3) (Beurel et al., 2015). Показано, что литий ингибирует GSK-3 двумя способами: (а) конкурируя с ионами Mg2+, которые необходимы для киназной активности GSK-3, (б) путем увеличения ингибирующего фосфорилирования Ser9/Ser21 GSK-3a/β (Davis et al., 2018). При биполярном расстройстве литий обычно назначают в узком диапазоне (концентрация лития в сыворотке крови 0,5-1,0 ммоль) из-за опасений нефротоксичности при хронически более высокой дозе (Davis et al., 2018). Недавно опубликованные результаты показывают, что кормление мышей низкой дозой хлорида лития (10 мг/кг) в течение 6 недель приводит к концентрации хлорида лития в сыворотке 0,02 ммоль (Hamstra et al., 2020; Kurgan et al., 2019). Несмотря на то, что данная доза лития значительно ниже терапевтического диапазона, она эффективно ингибировала GSK-3 в сердечной и костной ткани мышей, что приводило к улучшению регуляции Са2+ (Hamstra et al., 2020; Kurgan, Bott, et al., 2019). GSK-3 является ферментом, который негативно регулирует анаболические процессы (синтез белка) в мышечных волокнах и способствует активации протеолитических процессов (деградация белков) (Mirzoev et al., 2021).
Из уровня техники известно, что получение мышами низкой дозы хлорида лития (10 мг/кг, с питьевой водой) в течение 6 недель ингибирует GSK-3 и повышает устойчивость к утомляемости камбаловидной мышцы за счет активации NFAT и увеличения экспрессии PGC-1-alpha и белка МуНС I, а также увеличивает генерацию удельной силы скелетных мышц (Whitely et al., 2020). Также на мышиной модели поясно-конечностной мышечной дистрофии (ПКМД) было показано, что введение хлорида лития (250 мг/кг) в течение 1 месяца может увеличивать массу скелетных мышц и диаметр мышечных волокон (Findlay et al., 2019).
Наиболее близкими к заявляемому изобретению являются следующие изобретения: способ профилактики деструкции цитоскелетных белков скелетных мышц грызунов в условиях 14-суточной функциональной разгрузки с помощью аминокислоты L-аргинина (патент на изобретение RU 2444354, 10.03.2012), а также способ предотвращения атрофии скелетных мышц при 3-суточном антиортостатическом вывешивании грызунов путем перорального введения вещества VX 745 (патент на изобретение RU 2714923, 21.02.2020). Однако в данных изобретениях применялись другие препараты и не измерялось действие используемых препаратов на активные и пассивные механические свойства изолированных постуральных мышц. Кроме того, значительно отличаются сроки функциональной разгрузки задних конечностей: 7 суток в заявляемом изобретении против 14 и 3 суток в вышеуказанных изобретениях.
Раскрытие изобретения
Технической проблемой, решаемой настоящим изобретением, является отсутствие эффективных средств поддержания мышечной силы и пассивной жесткости (собственного тонуса) в условиях вынужденной гипокинезии (лежачие больные) и невесомости (космонавты на борту космической станции).
Техническим результатом заявленного изобретения является поддержание удельной силы и пассивной жесткости изолированных постуральных мышц (m. soleus) в условиях 7-суточной функциональной разгрузки путем ежедневного введения хлорида лития (LiCl). Преимуществом препарата LiCl перед известными является то, что в используемой дозе (40 мг/кг веса) он не вызывает побочных реакций и эффективно предотвращает вызванное 7-суточной функциональной разгрузкой снижение сократительных возможностей постуральной камбаловидной мышцы, если препарат вводится ежедневно, начиная с первых суток функциональной разгрузки.
Этот технический результат достигается за счет предотвращения уменьшения диаметра мышечных волокон и снижения силы и жесткости изолированных постуральных мышц при их функциональной разгрузке путем воздействия на организм фактора, ингибирующего киназу гликогнсинтазы-3 в мышечной ткани, в качестве которого используется хлорид лития (LiCl).
Из уровня техники неизвестно применение хлорида лития для профилактики негативных последствий функциональной разгрузки (антиортостатического вывешивания) для механических (сократительных) свойств изолированных постуральных мышц. Известно протективное действие LiCl для скелетных мышц в мышиной модели поясно-конечностной мышечной дистрофии (ПКМД), при этом доза вводимого хлорида лития (250 мг/кг) и длительность введения (1 месяц) были в несколько раз больше, чем заявляемом изобретении.
Краткое описание чертежей
Сущность изобретения и возможность его осуществления поясняются фиг. 1-6.
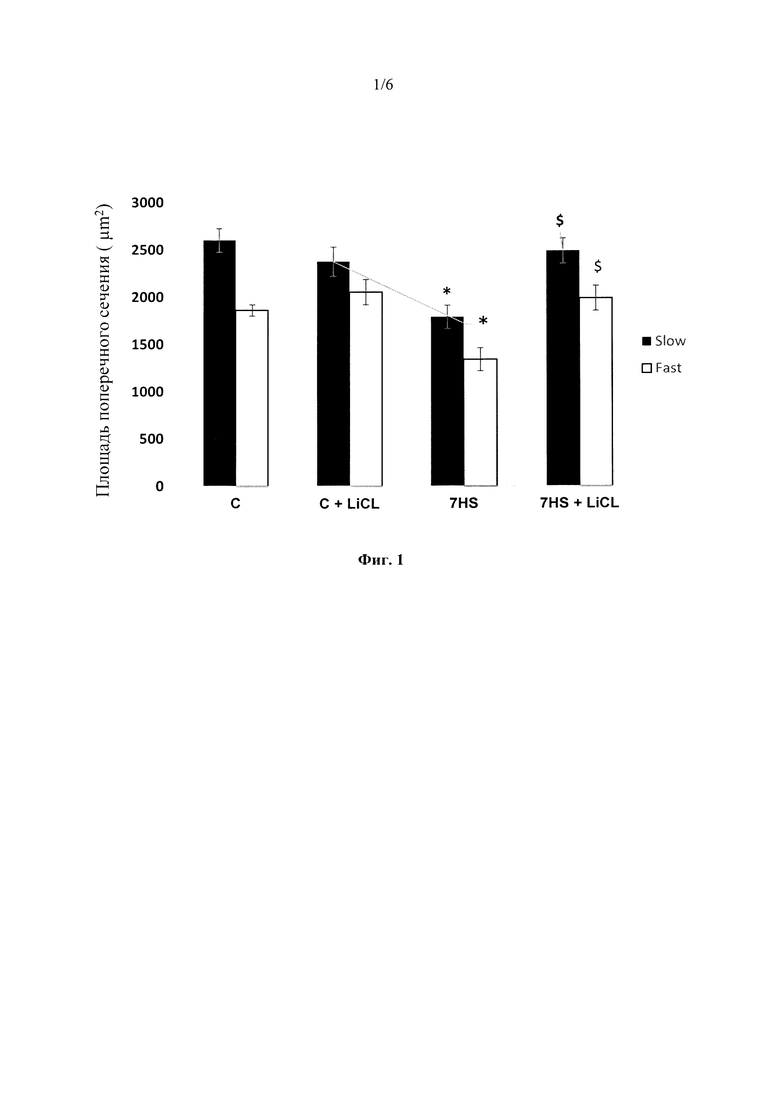
На фиг. 1 представлена площадь поперечного сечения (ППС) «медленных» (slow) и «быстрых» (fast) волокон камбаловидной мышцы (m.soleus). Данные представлены как среднее значение ± SEM. Различия между группами представлены в % от контрольной группы. С - контрольная группа животных, C+Li - контроль + ежедневные инъекции LiCl в течение 7 суток, 7HS - 7-суточное антиортостатическое вывешивание, 7HS+Li - 7-суточное антиортостатическое вывешивание + ежедневные инъекции LiCl, * - р<0.05 vs. С, $ - р<0.05 vs. 7HS.
На фиг. 2 представлено соотношение разных типов волокон в камбаловидной мышце (m. soleus). Данные представлены как среднее значение ± SEM. Различия между группами представлены в % от контрольной группы. С - контрольная группа животных, C+Li - контроль + ежедневные инъекции LiCl в течение 7 суток, 7HS - 7-суточное антиортостатическое вывешивание, 7HS+Li - 7-суточное антиортостатическое вывешивание + ежедневные инъекции LiCl, * - р<0.05 vs. С, $ - р<0.05 vs. 7HS.
На фиг. 3 представлена таблица, где приводятся параметры активных механических свойств изолированной камбаловидной мышцы (m. soleus) крысы при введении хлорида лития на фоне 7-суточной функциональной разгрузки. Данные представлены в виде «среднее значения ± стандартная ошибка среднего значения». Обозначения: С - контрольная группа, C+Li -контроль + ежедневные инъекции LiCl в течение 7 суток, 7HS - 7-суточное антиортостатическое вывешивание, 7HS+Li - 7-суточное антиортостатическое вывешивание + ежедневные инъекции LiCl. * -достоверное отличие от «С» (р<0,05); # - достоверное отличие от «7HS».
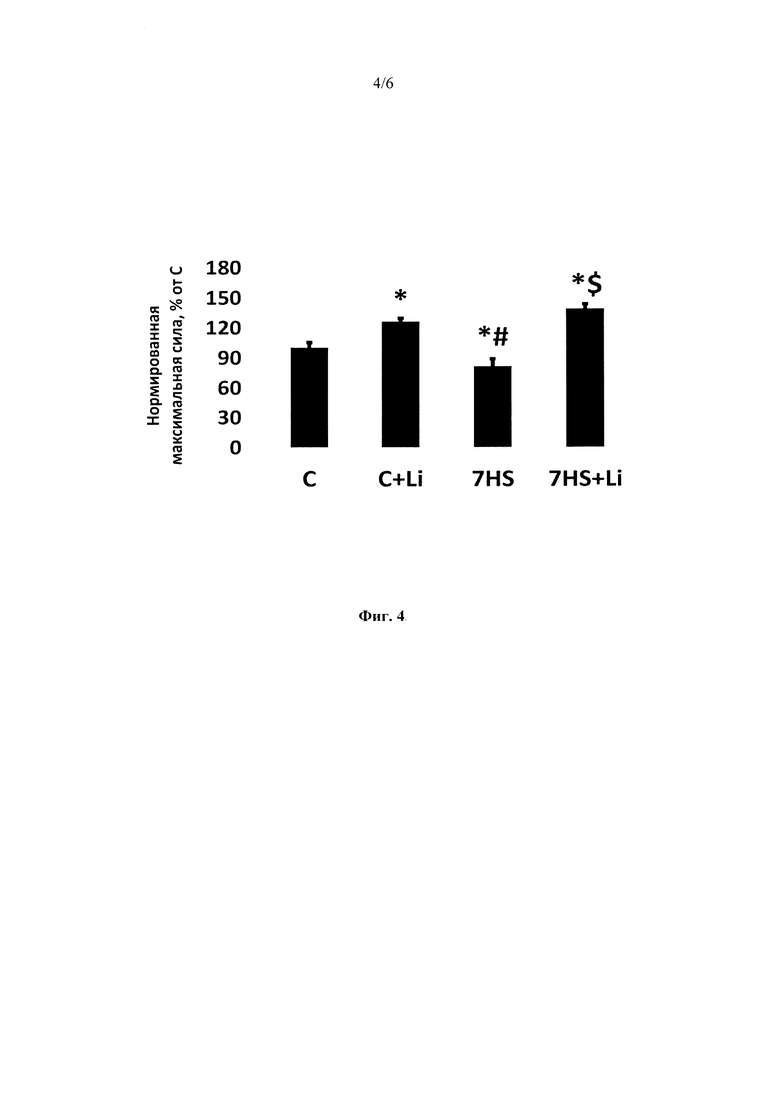
На фиг. 4 представлена удельная максимальная сила изолированной камбаловидной мышцы (m. soleus) крысы. Данные представлены как среднее значение ± SEM. Различия между группами представлены в % от контрольной группы. С - контрольная группа животных, C+Li - контроль + ежедневные инъекции LiCl в течение 7 суток, 7HS - 7-суточное антиортостатическое вывешивание, 7HS+Li - 7-суточное антиортостатическое вывешивание + ежедневные инъекции LiCl, * - р<0.05 vs. С, # - р<0.05 vs. C+Li, $ - р<0.05 vs. 7HS.
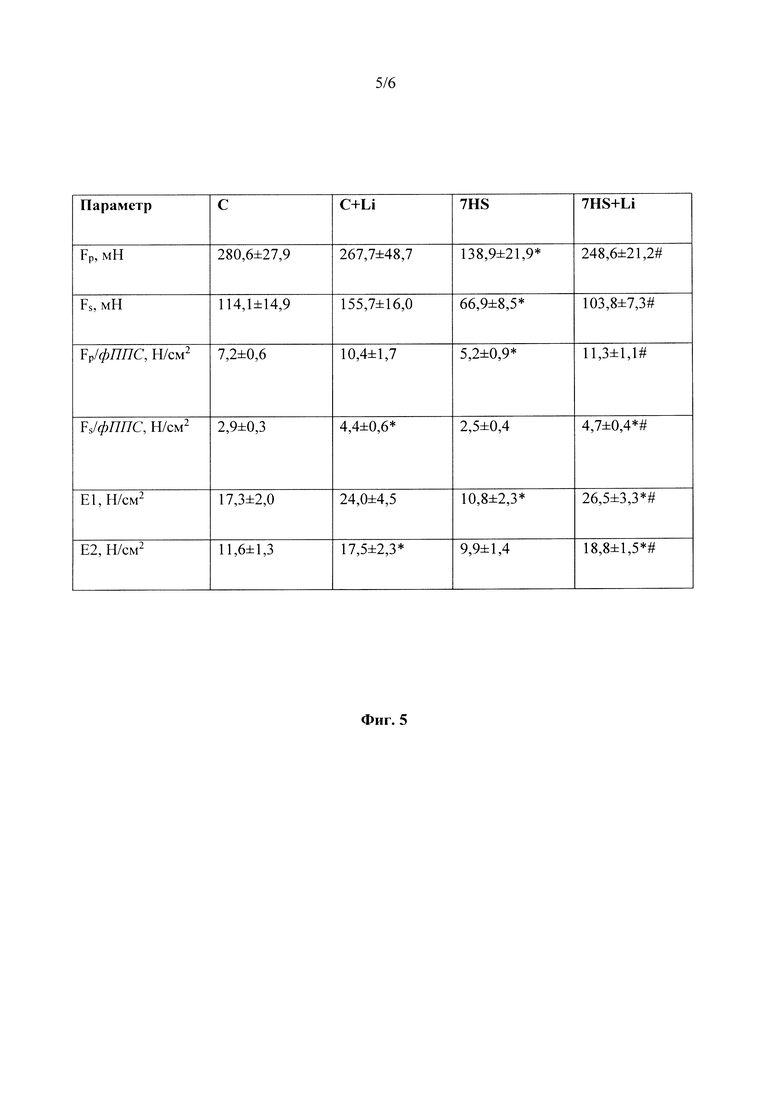
На фиг. 5 представлена таблица, где приводятся параметры пассивных механических свойств изолированной камбаловидной мышцы (m. soleus) крысы при введении хлорида лития на фоне 7-суточной функциональной разгрузки. Данные представлены в виде «среднее значения ± стандартная ошибка среднего значения». Обозначения: Fp - максимальная пиковая сила, Fs - максимальная сила в конце теста на растяжение, F/фППС - удельное напряжение, Е1/2 - модуль Юнга. С - контрольная группа, C+Li - контроль + ежедневные инъекции LiCl в течение 7 суток, 7HS - 7-суточное антиортостатическое вывешивание, 7HS+Li - 7-суточное антиортостатическое вывешивание + ежедневные инъекции LiCl. * - достоверное отличие от «С» (р<0,05); # - достоверное отличие от «7HS».
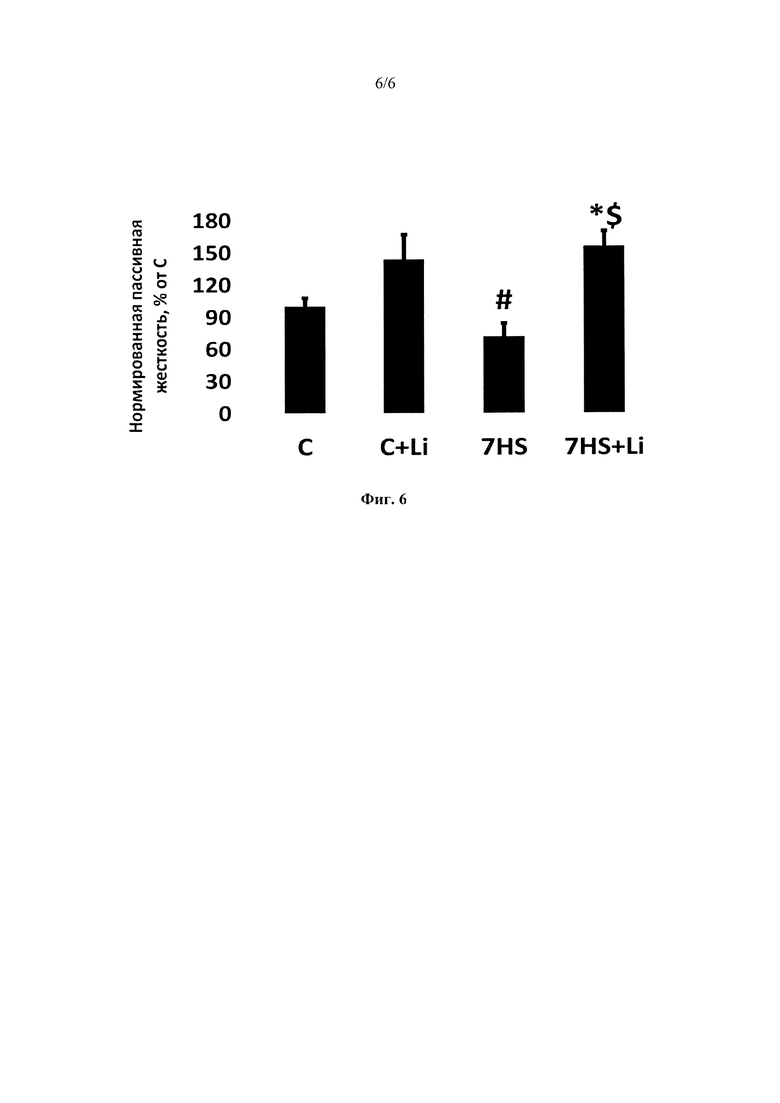
На фиг. 6 представлена удельная пассивная жесткость изолированной камбаловидной мышцы (m. soleus) крысы. Данные представлены как среднее значение ± SEM. Различия между группами представлены в % от контрольной группы. С - контрольная группа животных, C+Li - контроль + ежедневные инъекции LiCl в течение 7 суток, 7HS - 7-суточное антиортостатическое вывешивание, 7HS+Li - 7-суточное антиортостатическое вывешивание + ежедневные инъекции LiCl, * - р<0.05 vs. С, # - р<0.05 vs. C+Li, $ - р<0.05 vs. 7HS.
Осуществление изобретения
Самцы крыс Вистар возрастом 3 месяца (весом 207*+14 г) были разделены на четыре группы (по 8 крыс в каждой группе): виварный контроль (С); виварный контроль с введением хлорида лития (C+Li); 7-суточное антиортостатическое вывешивание (7HS); 7-суточное антиортостатическое вывешивание с введением хлорида лития (7HS+Li). Хлорид лития вводили в дозировке 40 мг\кг веса внутрибрюшинно один раз в сутки. Животных содержали в помещении с контролем температуры и светового дня. Все животные имели свободный доступ к пище и воде. Эвтаназия животных осуществлялась путем введения овердозы трибромэтанола. Все эксперименты с животными были одобрены Комиссией по биомедицинской этике ГНЦ РФ - ИМБП РАН (протокол №618 от 23 июня 2022 г.).
Функциональная разгрузка мышц задних конечностей осуществлялась стандартным методом антиортостатического вывешивания (англ. - hindlimb suspension, HS) грызунов (Novikov and Ilyin, 1981; Morey-Holton and Globus, 2002). В этой модели крысы подвешиваются за хвост под углом 35 градусов к полу клетки так, чтобы задние конечности не касались пола, а передние опирались на него. Эта экспериментальная модель позволяет грызуну свободно передвигаться по клетке на передних конечностях, вращаться на 360°, имея при этом доступ к корму и питьевой воде ad libitum. Данная модель одобрена институциональными комиссиями по биомедицинской этике большинства научных организаций мира, в том числе Физиологической секцией Российской Национальной комиссии по биологической этике. При правильном выполнении всех условий содержания животных, эксперименты с использованием этой модели, как правило, не сопровождаются гормональными проявлениями стресс-реакции (Ogneva et al., 2014; Tyganov et al., 2019). В исследовании крысы вывешивались в течение 7 суток. Объектом исследования являлась постуральная («антигравитационная») камбаловидная мышца (m. soleus).
Определение механических свойств изолированных мышц
Измерения силы изолированной камбаловидной мышцы (m. soleus) оценивали ex vivo. Перед извлечением камбаловидной мышцы измеряли оптимальную длину этой мышцы с помощью цифрового штангенциркуля in situ, располагая коленный и голеностопный суставы под прямым углом. Далее мышцу извлекали из животного и помещали в охлажденный раствор Рингера-Кребса (138 мМ NaCl, 5 мМ KCl, 1 мМ NaH2PO4, 2 мМ CaCl2, 2 мМ MgCl2, 24 мМ NaHCO3, 11 мМ глюкозы), с постоянной перфузией карбогеном (95% O2 + 5% CO2), и инкубировали в течение 45 минут. Двойные простые узлы завязывали вокруг дистального и проксимального концов мышцы вблизи мышечно-сухожильного соединения. После этого мышцу прикрепляли датчику силы с одного конца и к фиксированному крючку с другого конца в ванночке с регулируемой температурой (28°С) (Aurora Scientific Bath 809С). Оптимальную длину мышцы (L0) заново определяли с помощью серии одиночных сокращений (0,5 мс, 10 В). Максимальная сила одиночных сокращений измерялась при L0. Для каждого одиночного сокращения измеряли время до пика (время, необходимое для достижения максимальной силы) и время полурасслабления (время, необходимое для падения силы до половины максимальной). Тест на тетаническое изометрическое сокращение также выполняли при L0. Камбаловидную мышцу (m. soleus) стимулировали в течение 2 секунд при частоте импульсов 40 Гц двумя параллельными платиновыми электродами. Оптимальная частота и длительность стимуляции была определена в предварительных экспериментах. Регистрировали максимальную силу тетанического сокращения. На этой же мышце измерялись пассивные механические свойства. Мышца устанавливалась на расслабленную длину (slack length, Ls), то есть на длину, когда можно зафиксировать минимальное напряжение. Затем мышца растягивалась на 25% от Ls со скоростью 50 мм/с. Мышца находилась в растянутом состоянии в течении двух минут, после чего возвращалась на Ls. Фиксировалась максимальная сила в начале теста на растяжение (peak tension, Fp) и в конце (steady tension, Fs), так как пассивное напряжение постепенно снижалось (расслабление напряжения) и выходило на плато ко второй минуте теста. Поскольку считается, что моделью мышцы могут служить 2 эластичных элемента, соединенные параллельно через вязкостной элемент, то из полученных данных рассчитывался модуль Юнга для двух эластичных элементов (Е1 и Е2). Подробно методика измерения пассивных свойств описана в работе Anderson et al., 2001. Для всех расчетов использовалось измерения, полученные в результате 5 повторений для каждой мышцы. Для нормализации показателей рассчитывали физиологическое сечение мышцы (фППС): сырой вес мышцы, деленный на оптимальную длину, умноженную на плотность мышцы (1.07 г/см3). Измерения силы были выполнены с использованием датчика силы Aurora Scientific 305C-LR с частотой сбора данных 10 кГц. Обработку данных проводили с помощью Aurora Scientific 615А Analysis Software Suite.
Статистическая обработка полученных данных
Поскольку не во всех случаях было подтверждено нормальное распределение выборки, для сравнения экспериментальных групп между собой был использован непараметрический критерий Краскела-Уоллиса. Данные представлены как среднее (М)±стандартная ошибка среднего (SEM).
Результаты
Площадь поперечного сечения (ППС) «медленных» и «быстрых» волокон камбаловидной мышцы была достоверно ниже контрольных значений после периода антиортостатического вывешивания (Фиг. 1), однако применение хлорида лития (LiCl) на фоне функциональной разгрузки предотвратило уменьшение ППС мышечных волокон m. soleus как медленного, так и быстрого типов (Фиг. 1). Кроме того, инъекции LiCl на фоне антиортостатического вывешивания позволили предотвратить изменение соотношения «медленных» и «быстрых» волокон камбаловидной мышцы, а именно, трансформацию «медленных» мышечных волокон в «быстрые» волокна (Фиг. 2).
Максимальная сила одиночного сокращения достоверно снизилась в группах «7HS» и «7HS+Li» на 29% и 23% соответственно. Антиортостатическое вывешивание в течение 7 суток также привело к снижению времени сокращения и времени полурасслабления (Фиг 3). После 7 суток вывешивания также наблюдалось снижение максимальной тетанической силы изометрического сокращения на 38% по сравнению с контролем (Фиг. 3). Введение животным LiCl в течение 7 суток привело к достоверному увеличению удельной максимальной силы сокращения изолированной камбаловидной мышцы как в группе «С+Li», так и в группе антиортостатического вывешивания («7HS+Li») по сравнению с контрольной группой («группа С») (Фиг. 3, 4). Также введение крысам хлорида лития на фоне 7-суточной функциональной разгрузки предотвращало изменение модуля юнга первого и второго эластичных элементов камбаловидной мышцы (Фиг. 5). Схожие изменения наблюдались для таких параметров, как пиковая и устойчивая пассивная жесткость изолированной камбаловидной мышцы (Фиг. 5). Эти параметры достоверно снизились после 7-суточного вывешивания на 51% и 42% процента соответственно (Фиг. 5). Это снижение предотвращалось введением хлорида лития на фоне антиортостатического вывешивания. Гистограмма, иллюстрирующая предотвращение снижения удельной пассивной жесткости изолированной камбаловидной мышцы при введении хлорида лития показана на Фиг. 6.
Таким образом, впервые было показано, что ежедневное введение крысам хлорида лития (40 мг/кг) во время 7-суточного антиортостатического вывешивания предотвращает уменьшение диаметра мышечных волокон и трансформацию волокон в «быструю» сторону, а также поддерживает основные активные и пассивные механические свойства изолированной постуральной камбаловидной мышцы.
Краткое описание фигур
Фиг 1. Площадь поперечного сечения (ППС) «медленных» (slow) и «быстрых» (fast) волокон камбаловидной мышцы (m. soleus). Данные представлены как среднее значение ± SEM. Различия между группами представлены в % от контрольной группы. С - контрольная группа животных, C+Li - контроль + ежедневные инъекции LiCl в течение 7 суток, 7HS - 7-суточное антиортостатическое вывешивание, 7HS+Li - 7-суточное антиортостатическое вывешивание + ежедневные инъекции LiCl, * - р<0.05 vs. С, $ - р<0.05 vs. 7HS.
Фиг 2. Соотношение разных типов волокон в камбаловидной мышце (m. soleus). Данные представлены как среднее значение ± SEM. Различия между группами представлены в % от контрольной группы. С - контрольная группа животных, C+Li - контроль + ежедневные инъекции LiCl в течение 7 суток, 7HS - 7-суточное антиортостатическое вывешивание, 7HS+Li - 7-суточное антиортостатическое вывешивание + ежедневные инъекции LiCl, * - р<0.05 vs. С, $ - р<0.05 vs. 7HS.
Фиг 3. Активные механические свойства изолированной камбаловидной мышцы (m. soleus) крысы. С - контрольная группа, C+Li - контроль + ежедневные инъекции LiCl в течение 7 суток, 7HS - 7-суточное антиортостатическое вывешивание, 7HS+Li - 7-суточное антиортостатическое вывешивание + ежедневные инъекции LiCl. * - достоверное отличие от «С» (р<0,05); # - достоверное отличие от «7HS». Данные представлены в виде «среднее значения ± стандартная ошибка среднего значения».
Фиг 4. Удельная максимальная сила изолированной камбаловидной мышцы (m. soleus) крысы. Данные представлены как среднее значение ± SEM. Различия между группами представлены в % от контрольной группы. С - контрольная группа животных, C+Li - контроль + ежедневные инъекции LiCl в течение 7 суток, 7HS - 7-суточное антиортостатическое вывешивание, 7HS+Li - 7-суточное антиортостатическое вывешивание + ежедневные инъекции LiCl, * - р<0.05 vs. С, # - р<0.05 vs. C+Li, $ - р<0.05 vs. 7HS.
Фиг 5. Пассивные механические свойства изолированной камбаловидной мышцы (m. soleus) крысы. Fp - максимальная пиковая сила, Fs - максимальная сила в конце теста на растяжение, F/фППС - удельное пассивное напряжение, Е1/2 - модуль Юнга. С - контрольная группа, C+Li - контроль + ежедневные инъекции LiCl в течение 7 суток, 7HS - 7-суточное антиортостатическое вывешивание, 7HS+Li - 7-суточное антиортостатическое вывешивание + ежедневные инъекции LiCl. * - достоверное отличие от «С» (р<0,05); # - достоверное отличие от «7HS». Данные представлены в виде «среднее значения ± стандартная ошибка среднего значения».
Фиг 6. Удельная пассивная жесткость изолированной камбаловидной мышцы (m. soleus) крысы. Данные представлены как среднее значение ± SEM. Различия между группами представлены в % от контрольной группы. С - контрольная группа животных, C+Li - контроль + ежедневные инъекции LiCl в течение 7 суток, 7HS - 7-суточное антиортостатическое вывешивание, 7HS+Li - 7-суточное антиортостатическое вывешивание + ежедневные инъекции LiCl, * - р<0.05 vs. С, # - р<0.05 vs. C+Li, $ - р<0.05 vs. 7HS.
Список использованной литературы
1. Anderson J, Li Z, Goubel F. Passive stiffness is increased in soleus muscle of desmin knockout mouse. Muscle Nerve. 2001; 24(8): 1090-2. doi: 10.1002/mus.1115.
2. Atherton PJ, Greenhaff PL, Phillips SM, Bodine SC, Adams CM, Lang CH. Control of skeletal muscle atrophy in response to disuse: clinical/preclinical contentions and fallacies of evidence. Am J Physiol Endocrinol Metab. 2016 Sep 1; 311(3):E594-604. doi: 10.1152/ajpendo.00257.2016.
3. Beurel, E., Grieco, S., Jope, R. Glycogen synthase kinase-3 (GSK3): Regulation, actions, and diseases. Pharmacology & Therapeutics. 2015. 148, 114-131. doi: 10.1016/j.pharmthera.2014.11.016.
4. Bodine SC. Disuse-induced muscle wasting. Int J Biochem Cell Biol. 2013; 45(10):2200-8. doi: 10.1016/j.biocel.2013.06.011.
5. Caiozzo VJ, Baker MJ, Herrick RE, Tao M, Baldwin KM. Effect of spaceflight on skeletal muscle: mechanical properties and myosin isoform content of a slow muscle. J Appl Physiol (1985). 1994 Apr; 76(4): 1764-73. doi: 10.1152/jappl.1994.76.4.1764.
6. Canon F, Goubel F. Changes in stiffness induced by hindlimb suspension in rat soleus muscle. Pflugers Archiv: European journal of physiology. 1995; 429:332-337. doi:10.1007/bf00374147.
7. Davis J, Desmond M, Berk M. Lithium and nephrotoxicity: Unravelling the complex pathophysiological threads of the lightest metal. Nephrology (Carlton). 2018; 23(10):897-903. doi: 10.1111/nep.13263.
8. Findlay AR, Bengoechea R, Pittman SK, Chou TF, True HL, Weihl CC. Lithium chloride corrects weakness and myopathology in a preclinical model of LGMD1D. Neurol Genet. 2019; 5(2):e318. doi: 10.1212/NXG.0000000000000318.
9. Fitts RH, Trappe SW, Costill DL, Gallagher PM, Creer AC, Colloton PA, Peters JR, Romatowski JG, Bain JL, Riley DA. Prolonged space flight-induced alterations in the structure and function of human skeletal muscle fibres. J Physiol. 2010; 588(Pt 18):3567-92. doi: 10.1113/jphysiol.2010.188508.
10. Grigoriev AI, Kozlovskaia IB, Shenkman BS. [The role of support afferents in organisation of the tonic muscle system]. Ross Fiziol Zh Im I M Sechenova. 2004; 90(5):508-21.
11. Hamstra SI, Kurgan N, Baranowski RW, Qiu L, Watson CJF, Messner HN, MacPherson REK, MacNeil AJ, Roy BD, Fajardo VA. Low-dose lithium feeding increases the SERCA2a-to-phospholamban ratio, improving SERCA function in murine left ventricles. Exp Physiol. 2020; 105(4):666-675. doi: 10.1113/EP088061.
12. Kurgan N, Bott KN, Helmeczi WE, Roy BD, Brindle ID, Klentrou P, Fajardo VA. Low dose lithium supplementation activates Wnt/β-catenin signalling and increases bone OPG/RANKL ratio in mice. Biochem Biophys Res Commun. 2019; 511(2):394-397. doi: 10.1016/j.bbrc.2019.02.066.
13. McDonald KS, Fitts RH. Effect of hindlimb unloading on rat soleus fiber force, stiffness, and calcium sensitivity. J Appl Physiol (1985). 1995 Nov; 79(5): 1796-802. doi: 10.1152/jappl. 1995.79.5.1796.
14. Mirzoev TM, Sharlo KA, Shenkman BS. The Role of GSK-3p in the Regulation of Protein Turnover, Myosin Phenotype, and Oxidative Capacity in Skeletal Muscle under Disuse Conditions. Int J Mol Sci. 2021; 22(10):5081. doi: 10.3390/ijms22105081.
15. Morey-Holton ER, Globus RK. Hindlimb unloading rodent model: technical aspects. Journal of applied physiology. 2002; 92:1367-1377. doi: 10.1152/japplphysiol.00969.2001.
16. Novikov VE, Ilyin EA. Age-related reactions of rat bones to their unloading. Aviat Space Environ Med. 1981; 52(9):551-3.
17. Oganov VS, Skuratova SA, Murashko LM, Guba F, Takach O. [Effect of short-term space flights on physiological properties and composition of myofibrillar proteins of the skeletal muscles of rats]. Kosm Biol Aviakosm Med. 1988 Jul-Aug; 22(4):50-4.
18. Oganov VS, Skuratova SA, Shirvinskaia MA. [Effect of a flight on the Cosmos-936 biosatellite on the contractile properties of rat muscle fibers]. Kosm Biol Aviakosm Med. 1981 Jun-Jul; 15(4):58-61.
19. Ogneva IV, Biryukov NS, Leinsoo ТА, Larina IM. Possible role of non-muscle alpha-actinins in muscle cell mechanosensitivity. PLoS One. 2014; 9(4):e96395. doi: 10.1371/journal.pone.0096395.
20. Ohira Y, Jiang B, Roy RR, Oganov V, Ilyina-Kakueva E, Marini JF, Edgerton VR. Rat soleus muscle fiber responses to 14 days of spaceflight and hindlimb suspension. J Appl Physiol (1985). 1992 Aug; 73 (2 Suppl):51S-57S. doi: 10.1152/jappl.1992.73.2.S51.
21. Peris-Moreno D, Cussonneau L, Combaret L, Polge C, Taillandier D. Ubiquitin Ligases at the Heart of Skeletal Muscle Atrophy Control. Molecules. 2021 Jan 14; 26(2):407. doi: 10.3390/molecules26020407.
22. Shenkman BS, Tsaturyan AK, Vikhlyantsev IM, Kozlovskaya IB, Grigoriev AI. Molecular Mechanisms of Muscle Tone Impairment under Conditions of Real and Simulated Space Flight. Acta Naturae. 2021; 13(2):85-97. doi: 10.32607/actanaturae. 10953.
23. Toursel T, Stevens L, Granzier H, Mounier Y. Passive tension of rat skeletal soleus muscle fibers: effects of unloading conditions. J Appl Physiol (1985). 2002; 92(4): 1465-72. doi: 10.1152/japplphysiol.00621.2001.
24. Tyganov SA, Mochalova EP, Belova SP, Sharlo KA, Rozhkov SV, Vilchinskaya NA, Paramonova II, Mirzoev TM, Shenkman BS. Effects of Plantar Mechanical Stimulation on Anabolic and Catabolic Signaling in Rat Postural Muscle Under Short-Term Simulated Gravitational Unloading. Front Physiol. 2019; 10:1252. doi: 10.3389/fphys.2019.01252.
25. Udaka J, Ohmori S, Terui T, Ohtsuki I, Ishiwata S, Kurihara S, Fukuda N. Disuse-induced preferential loss of the giant protein titin depresses muscle performance via abnormal sarcomeric organization. The Journal of general physiology. 2008; 131:33-41. doi:10.1085/jgp.200709888.
26. Ulanova A, Gritsyna Y, Salmov N, Lomonosova Y, Belova S, Nemirovskaya T, Shenkman B, Vikhlyantsev I. Effect of L-Arginine on Titin Expression in Rat Soleus Muscle After Hindlimb Unloading. Frontiers in physiology. 2019; 10:1221. doi: 10.3389/fphys.2019.01221.
27. Whitley КС, Hamstra SI, Baranowski RW, Watson CJF, MacPherson REK, MacNeil AJ, Roy BD, Vandenboom R, Fajardo VA. GSK3 inhibition with low dose lithium supplementation augments murine muscle fatigue resistance and specific force production. Physiol Rep.2020; 8(14):e14517. doi: 10.14814/phy2.14517.
28. Widrick JJ, Knuth ST, Norenberg KM, Romatowski JG, Bain JL, Riley DA, Karhanek M, Trappe SW, Trappe ТА, Costill DL, Fitts RH. Effect of a 17 day spaceflight on contractile properties of human soleus muscle fibres. J Physiol. 1999; 516 (Pt 3):915-30. doi: 10.1111/j. 1469-7793.1999.0915u.x.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ предотвращения атрофии, повышенной утомляемости медленных мышечных волокон и их трансформации в быстрые мышечные волокна в камбаловидной мышце | 2024 |
|
RU2834246C1 |
| Способ предотвращения развития утомления скелетной мышцы | 2023 |
|
RU2814077C1 |
| Способ предотвращения атрофии скелетных мышц при их функциональной разгрузке | 2022 |
|
RU2797216C1 |
| СПОСОБ ПРОФИЛАКТИКИ И СНИЖЕНИЯ ДЕСТРУКЦИИ ЦИТОСКЕЛЕТНЫХ БЕЛКОВ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ АТРОФИИ, ВЫЗВАННОЙ ГИПОКИНЕЗИЕЙ И/ИЛИ ГРАВИТАЦИОННОЙ РАЗГРУЗКОЙ | 2010 |
|
RU2444354C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ МАССЫ ПОСТУРАЛЬНЫХ МЫШЦ ГОЛЕНИ ПОСЛЕ ВОЗДЕЙСТВИЯ ГИПОКИНЕЗИИ И/ИЛИ ГИПОГРАВИТАЦИИ | 2008 |
|
RU2368398C1 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И СНИЖЕНИЯ ДЕСТРУКЦИИ БЕЛКОВ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ АТРОФИИ, ВЫЗВАННОЙ ГИПОКИНЕЗИЕЙ И/ИЛИ ГРАВИТАЦИОННОЙ РАЗГРУЗКОЙ | 2013 |
|
RU2517576C1 |
| ПРИМЕНЕНИЕ VX 745 ДЛЯ ПРЕДОТВРАЩЕНИЯ АТРОФИИ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ ФУНКЦИОНАЛЬНОЙ РАЗГРУЗКЕ | 2019 |
|
RU2714923C1 |
| СПОСОБ ПРЕДОТВРАЩЕНИЯ АТРОФИИ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ ФУНКЦИОНАЛЬНОЙ РАЗГРУЗКЕ | 2012 |
|
RU2481105C1 |
| СПОСОБ ПРОФИЛАКТИКИ И СНИЖЕНИЯ ДЕСТРУКЦИИ БЕЛКОВ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ АТРОФИИ, ВЫЗВАННОЙ ГИПОКИНЕЗИЕЙ И/ИЛИ ГРАВИТАЦИОННОЙ РАЗГРУЗКОЙ | 2013 |
|
RU2517259C1 |
| СПОСОБ УСКОРЕНИЯ ВОССТАНОВЛЕНИЯ СКЕЛЕТНЫХ МЫШЦ ОТ АТРОФИИ ПОСЛЕ ДЛИТЕЛЬНОЙ АЛКОГОЛЬНОЙ ИНТОКСИКАЦИИ | 2014 |
|
RU2578463C1 |


Настоящее изобретение относится к медицине, а именно к реабилитационной и космической медицине, и касается предотвращения снижения силы и жесткости постуральных камбаловидных мышц крысы в условиях функциональной разгрузки задних конечностей методом антиортостатического вывешивания. Способ заключается в ежедневном внутрибрюшинном введении крысам хлорида лития в дозе 40 мг/кг на фоне 7-суточного антиортостатического вывешивания. Изобретение обеспечивает предотвращение атрофии мышечных волокон и поддерживание силы и жесткости изолированной камбаловидной мышцы. 6 ил.
Способ поддержания силы и жесткости постуральных камбаловидных мышц млекопитающих при их функциональной разгрузке, заключающийся в ежедневном внутрибрюшинном введении крысам хлорида лития в дозе 40 мг/кг на фоне 7-суточного антиортостатического вывешивания.
| СПОСОБ ПРОФИЛАКТИКИ И СНИЖЕНИЯ ДЕСТРУКЦИИ ЦИТОСКЕЛЕТНЫХ БЕЛКОВ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ АТРОФИИ, ВЫЗВАННОЙ ГИПОКИНЕЗИЕЙ И/ИЛИ ГРАВИТАЦИОННОЙ РАЗГРУЗКОЙ | 2010 |
|
RU2444354C2 |
| ПРИМЕНЕНИЕ VX 745 ДЛЯ ПРЕДОТВРАЩЕНИЯ АТРОФИИ СКЕЛЕТНЫХ МЫШЦ ПРИ ИХ ФУНКЦИОНАЛЬНОЙ РАЗГРУЗКЕ | 2019 |
|
RU2714923C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ФИЗИОЛОГИЧЕСКИХ ЭФФЕКТОВ ПРЕБЫВАНИЯ НА ПОВЕРХНОСТИ ПЛАНЕТ С ПОНИЖЕННЫМ УРОВНЕМ ГРАВИТАЦИИ | 2013 |
|
RU2529813C1 |
| Дёмина А.В., Коваленко А.А, Антонова И.В., Смоленский И.В., Захарова М.В | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Секция | |||
Авторы
Даты
2023-07-20—Публикация
2022-08-17—Подача