Изобретение касается трансдермальных терапевтических систем (ТТС), которые в качестве биологически активного вещества содержат антагонист NMDA-рецепторов (N-метил-D-аспартат-рецепторов) мемантин или его физиологически совместимую соль. Эти трансдермальные терапевтические системы могут получаться и использоваться для лечения заболеваний центральной нервной системы.
Согласно уровню техники заболевания центральной нервной системы, особенно заболевания, связанные со слабоумием, типа болезни Альцгеймера в ее формах от легких до средней тяжести, лечатся при помощи ингибиторов ацетилхолинэстеразы (например, донепезила). Для лечения болезни Альцгеймера в формах от средней до тяжелой используются антагонисты NMDA-рецепторов.
Возникновение болезни Альцгеймера основано на нейродегенеративных процессах с усыханием клеток в коре головного мозга или соответственно отделах мозга. При этом холинергетические нервные волокна, включая их области проекции, затрагиваются в большей степени. На ранней стадии заболевания повреждается глутаматергическая система. Вследствие избыточного поступления кальция в нейроны со временем может дойти до нейродегенерации. При этом NMDA комплекс играет центральную роль в качестве важнейшего глутаматергического синапса. Его подавление с помощью селективного антагониста может предохранить нейрональную область от нервных повреждений.
Симптомами болезни Альцгеймера являются сильно расширенные желудочки, микроскопически различимые атеросклеротические бляшки и нейрофибриллярные узелки. Клиническая картина по большей части выражается потерей памяти, а также постепенной деградацией личности и интеллекта. В этом отношении целью лечения болезни Альцгеймера является смягчить личные страдания и, таким образом, препятствовать социальной изоляции. Лечебная терапия на сегодняшний день является недоступной. Пока желательно соответственно отсрочить развитие слабоумия, которое в большинстве случаев протекает прогрессивно. Облегчающая терапия при этом имеет следующие цели: улучшение когнитивной дееспособности, минимизация бросающихся в глаза неврологических моделей поведения, отсрочивание прогресса заболевания и предотвращение приступов.
Согласно уровню техники известно, что антагонисты NMDA-рецепторов подходят в качестве нейропротекторов, путем того, что они предотвращают вредное воздействие глутамата на NMDA-рецепторы. К группе антагонистов NMDA-рецепторов относятся, например, такие вещества, как МК 801, декстрометорфан, кетамин, мемантин, амантадин, декстрофан, фелбамат, акампросат, MRZ 2/579, фенциклидин, аптиганель, причем эти вещества рассматриваются и как индивидуальные вещества, и как смеси или соответственно как их физиологически совместимые соли, например, гидрохлориды, цитраты, малеаты и т.д.
Известно, что применение антагонистов NMDA-рецепторов, особенно вследствие психомиметических побочных эффектов, ограничено, в этом отношении их широкое применение до сих пор не осуществляется. При этом особенное значение при лечении пациентов с болезнью Альцгеймера придается антагонисту NMDA-рецепторов мемантину (3,5-диметил-9-аминоадамантану) или соответственно его гидрохлориду. Мемантин назначается для лечения болезни Альцгеймера в формах от средней до тяжелой. Это медицинский препарат доступен в Германии под названием Axura®. Это лекарственное средство имеется в распоряжении в пероральной форме как капли для приема или в виде таблеток, покрытых оболочкой. Прием этого медицинского препарата может осуществляться только под контролем ухаживающего персонала, причем дозировка биологически активного вещества на протяжении промежутка времени в несколько недель должна повышаться постепенно, чтобы минимизировать побочные эффекты, описанные особенно в случае лечения болезни Альцгеймера в формах от средней до тяжелой, такие как, среди прочего, галлюцинации, спутанность сознания, головокружение, головные боли и усталость. После начальной фазы этот препарат также следует принимать соответственно строго один раз утром и один раз после обеда (капли) или соответственно при использовании таблеток, покрытых оболочкой, ежедневно в одно и то же время.
По причине этой строгой схемы лечения и связанной с ней обязанностью по надзору получается неблагоприятная ситуация с очень высокими затратами или соответственно высокой стоимостью лечения при уходе за этими пациентами.
На основании этих указанных недостатков проистекает потребность в новых терапевтических системах, которые преодолевают эти недостатки, особенно таких системах, в случае которых могут снижаться затраты на уход.
Из уровня техники известно, что антагонисты NMDA-рецепторов при необходимости в комбинации с анальгетиками могут применяться для лечения местных болей в лекарственных формах для наружного применения (международные заявки WO 00/03716; WO 03/015 699; патенты США US 2002/0016319, US 6,194,000). Также в патентах США US 2004/0102525, US 2003/0139698 и международной заявке WO 04/009062 предлагается введение антагонистов NMDA-рецепторов. Международная заявка WO 04/106275 предлагает определенные соли антагонистов NMDA-рецепторов.
Однако лекарственные формы из уровня техники не подходят или лишь условно подходят для того, чтобы после наружного применения создавать системные концентрации в плазме антагонистов NMDA-рецепторов, которые вызывают достаточный фармакологический эффект в течение периода достаточной продолжительности. В отношении чрескожной проницаемости в уровне техники не предлагается экспериментальных данных.
Однако при профилактике и лечении заболеваний центральной нервной системы особенно желательными были бы именно лекарственные формы, которые могут поддерживать фармакологически эффективные концентрации в плазме в течение сравнительно длинного промежутка времени (например, 12 ч, 24 ч или дольше), не в последнюю очередь, поскольку в таких случаях могли бы снизиться затраты пациентов на уход обслуживающим персоналом.
Следовательно, в основе изобретения лежит задача предоставить лекарственную форму для лечения или профилактики заболеваний центральной нервной системы, особенно заболеваний, связанных со слабоумием, предпочтительно болезни Альцгеймера (Morbus Alzheimer), которая обладает преимуществами по сравнению с лекарственными формами из уровня техники.
При этом преимущества могут проявляться в отношении применимости, дозировки и/или переносимости. По возможности эта лекарственная форма при однократном применении должна бы обеспечивать фармакологически эффективную концентрацию биологически активного вещества в плазме на протяжении более длительного периода времени, например, по меньшей мере в течение 12 ч, предпочтительно по меньшей мере в течение 24 ч или даже в течение нескольких дней, так что повторное использование, а, таким образом, и повторный контроль обслуживающим персоналом требуется менее часто (например, только один раз в день).
Эта задача решается с помощью предмета данной заявки на патент.
Неожиданно было обнаружено, что может быть получена трансдермальная терапевтическая система, которая подходит для того, чтобы вводить мемантин трансдермально, причем применение может осуществляться на срок, например, по меньшей мере 12 ч, или, к примеру, на более длительный промежуток времени, например, по меньшей мере на 24 ч, и в течение этого промежутка времени могут поддерживаться фармакологически эффективные концентрации мемантина в плазме.
Изобретение касается трансдермальной терапевтической системы (ТТС) для введения биологически активного вещества мемантина в форме свободного основания или физиологически совместимой соли, или пролекарства, причем эта ТТС имеет
- непроницаемый для биологически активного вещества слой носителя;
- по меньшей мере один слой, содержащий биологически активное вещество, который содержит удерживающий материал, в который помещено это биологически активное вещество;
- при необходимости защитную пленку;
- tmax по меньшей мере 24 ч;
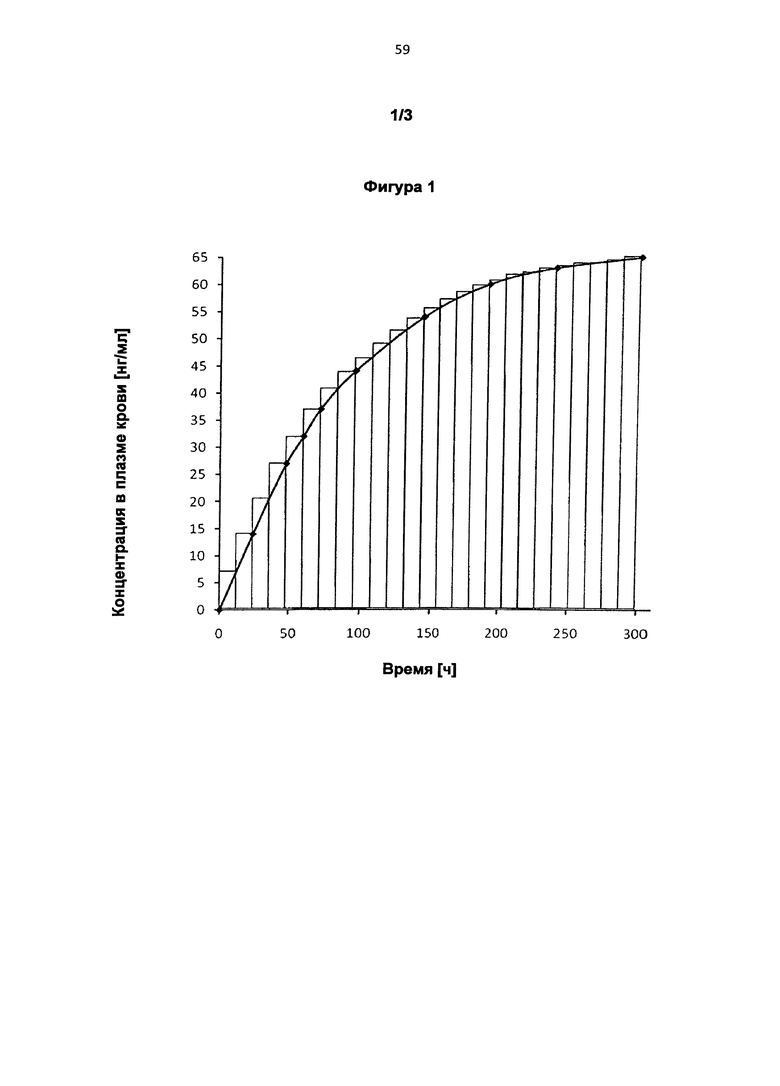
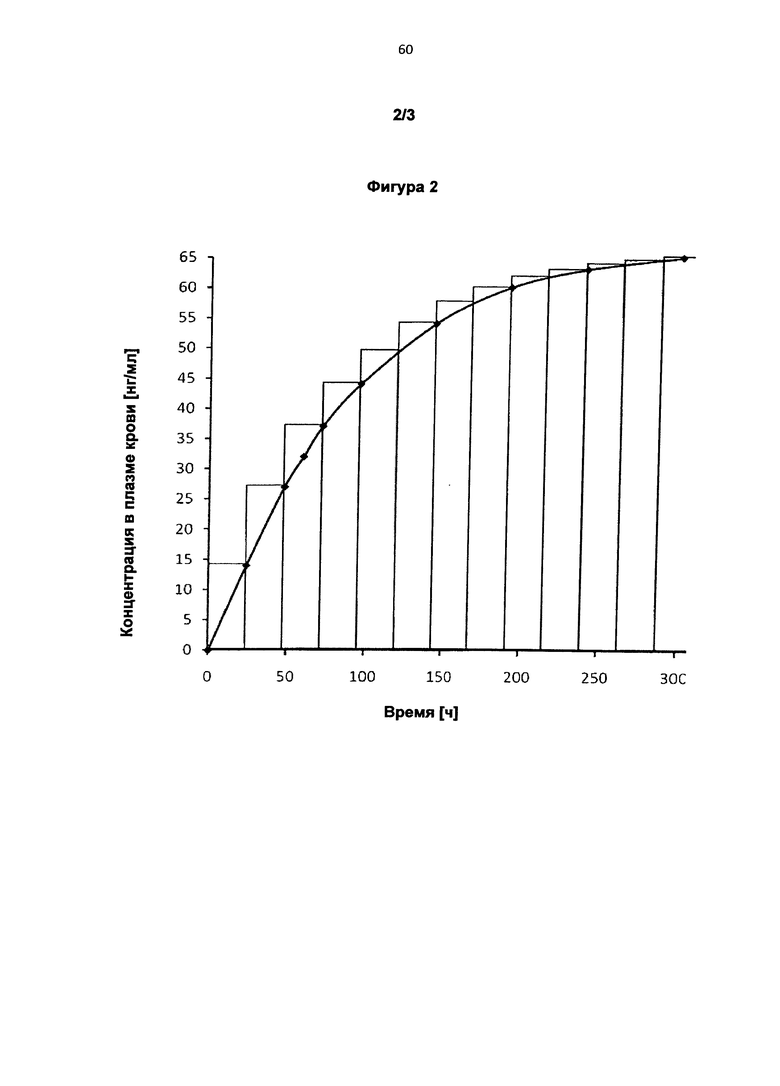
и причем при следующих друг за другом или смещенных во времени, предпочтительно повторяющихся применениях соответственно одной или нескольких трансдермальных терапевтических систем для интервалов между применениями, составляющих соответственно независимо друг от друга по меньшей мере 12 ч, предпочтительно на протяжении всего промежутка времени, составляющего по меньшей мере 300 ч, у нуждающегося в лечении индивида в его плазме крови соответственно от начала первого применения достигаются следующие концентрации биологически активного вещества:
спустя 24 ч по меньшей мере 14 нг/мл, предпочтительно по меньшей мере 16,2 нг/мл,
спустя 48 ч по меньшей мере 27 нг/мл, предпочтительно по меньшей мере 29,2 нг/мл,
спустя 60 ч по меньшей мере 32 нг/мл, предпочтительно по меньшей мере 34,5 нг/мл,
спустя 72 ч по меньшей мере 37 нг/мл, предпочтительно по меньшей мере 39,1 нг/мл,
спустя 96 ч по меньшей мере 44 нг/мл, предпочтительно по меньшей мере 46,6 нг/мл,
спустя 144 ч по меньшей мере 54 нг/мл, предпочтительно по меньшей мере 56,5 нг/мл,
спустя 192 ч по меньшей мере 60 нг/мл, предпочтительно по меньшей мере 62,3 нг/мл,
спустя 240 ч по меньшей мере 63 нг/мл, предпочтительно по меньшей мере 65,5 нг/мл, и
спустя 300 ч по меньшей мере 65 нг/мл, предпочтительно по меньшей мере 67,8 нг/мл.
Предпочтительно максимальная интенсивность высвобождения биологически активного вещества составляет не более 100 мкг/см3.
ТТС согласно изобретению содержит биологически активное вещество мемантин (3,5-диметиладамантан-1-амин) в форме свободного основания или физиологически совместимой соли, или пролекарства. Для целей описания термин «биологически активное вещество» включает мемантин и его физиологически совместимые сольваты. При этом мемантин может присутствовать в форме свободного основания, в форме физиологически совместимой соли и/или в форме сольвата, особенно гидрата или на выбор - в форме любых смесей вышеупомянутых соединений.
В одном предпочтительном варианте исполнения ТТС согласно изобретению содержит мемантин в виде свободного основания. Принципиальное получение свободного основания из гидрохлорида известно специалисту. Это может производиться, например, с применением ионообменных смол. Другим методом является экстракция из щелочной водной среды с использованием органических растворителей, которые обычно не смешиваются или незначительно смешиваются с водой. В результате удаления органического растворителя получается свободное основание (3,5-диметиладамантан-1-амин).
В другом предпочтительном варианте исполнения ТТС согласно изобретению содержит мемантин в форме физиологически совместимой соли. Предпочтительными физиологически совместимыми солями мемантина являются, например, его гидрохлорид, гидробромид, сульфат, гидросульфат, фосфат, гидрофосфат, дигидрофосфат, ацетат, пропионат, лактат, цитрат, аскорбат, формиат, фумарат, малеат, себацинат, мезилат и безилат. Особенно предпочтительным является гидрохлорид мемантина.
ТТС согласно изобретению может содержать пролекарство мемантина. В качестве пролекарства в этой связи обозначается неактивное или мало активное фармакологическое вещество, которое только при помощи метаболизирования в организме переводится в действующее биологически активное вещество (метаболит). Примерами пролекарств мемантина или его фармакологически совместимых солей являются производные, полученные по аминной функциональной группе, например, амидированные с помощью физиологически совместимых карбоновых кислот. В таком случае эти амиды расщепляются в физиологических условиях, при необходимости при ферментативном катализе. Другим примером пролекарства мемантина является его N-оксид.
ТТС согласно изобретению в качестве биологически активного вещества, помимо мемантина или соответственно его физиологически совместимых солей, или пролекарств, может содержать другие фармакологически активные вещества. Однако предпочтительно помимо мемантина или соответственно его физиологически совместимых солей не содержится других биологически активных веществ.
Предпочтительно ТТС согласно изобретению представляет собой пластырь, содержащий биологически активное вещество.
Обычно такая ТТС включает в себя по меньшей мере
a) непроницаемый для биологически активного вещества слой носителя (защитный слой, backing layer), предпочтительным является слой носителя, который непроницаем для воды в жидком виде и/или водяного пара;
b) по меньшей мере один слой, содержащий биологически активное вещество, который по меньшей мере частично покрывает слой носителя и предпочтительно сам имеет возможность приклеивания. При необходимости может быть нанесен дополнительный клеящий слой, чтобы обеспечить достаточную адгезию на коже;
с) при необходимости защитную пленку, которая покрывает слой, содержащий биологически активное вещество, и может сниматься с него (удаляемую подложку, release liner). Предпочтительной является защитная пленка, которая непроницаема для воды в жидком виде и/или водяного пара.
Обычно перед применением ТТС имеющаяся при необходимости защитная пленка удаляется, чтобы раскрыть способный приклеиваться слой. Эта защитная пленка может состоять, например, из полиэтилена, сложного полиэфира, полиэтилентерефталата, полипропилена, полисилоксана, поливинилхлорида или полиуретана, а при необходимости из обработанных бумажных волокон, таких как, например, целлофан, и при необходимости иметь силиконовое, фторсиликоновое или фторуглеродное покрытие.
ТТС согласно изобретению имеет непроницаемый для биологически активного вещества слой носителя и один слой, содержащий биологически активное вещество, или несколько слоев, содержащих биологически активное вещество, причем, разумеется, не все слои помимо слоя носителя должны содержать биологически активное вещество.
В одном предпочтительном варианте исполнения ТТС согласно изобретению в общей сложности имеет не более 3, 4, 5, 6, 7, 8 или 9 различных слоев. В другом предпочтительном варианте исполнения ТТС согласно изобретению имеет в общей сложности по меньшей мере 3, 4, 5, 6, 7, 8 или 9 различных слоев.
Слой носителя, непроницаемый для биологически активного вещества, (задний или соответственно наружный слой) ТТС согласно изобретению предпочтительно для веществ, содержащихся в слое, содержащем биологически активное вещество, и в клеящем слое, особенно для содержащегося при необходимости биологически активного вещества, является непроницаемым и инертным и может быть образован из полимеров, таких как сложные полиэфиры, например, полиэтилентерефталата, полиолефинов, таких как полиэтилены, полипропилены или полибутилены, поликарбонатов, полиэтиленоксидов, политерефталатов, таких как полиэтилентерефталаты, полиуретанов, полистиролов, полиамидов, полиимидов, поливинилацетатов, поливинилхлоридов и/или поливинилиденхлоридов, сополимеров, таких как сополимеры акрилонитрил/бутадиен/стирол, содержащих бумажные волокна, текстильные волокна, и/или их смесей, которые при необходимости могут быть металлизированы или пигментированы. Слой носителя также может быть образован из комбинации металлической пленки и полимерного слоя. Приведенные полимеры могут использоваться в виде пленки, ткани, валяного материала или пеноматериала.
Слой, непроницаемый для биологически активного вещества, предпочтительно имеет толщину слоя в диапазоне от 15 до 2000 мкм.
ТТС согласно изобретению имеет слой, содержащий биологически активное вещество, который содержит удерживающий материал, в который помещено биологически активное вещество. Этот слой, содержащий биологически активное вещество, одновременно может быть клеящимся слоем, в котором биологически активное вещество присутствует в растворенном виде и/или диспергированным в матрице вместе с клеящим веществом (drug in adhesive). Однако в случае ТТС согласно изобретению слой, содержащий биологически активное вещество, и клеящийся слой также могут присутствовать отдельно друг от друга.
Слой, содержащий биологически активное вещество, предпочтительно имеет толщину слоя в интервале от 10 до 9000 мкм.
ТТС согласно изобретению может быть оформлена, например, как мембранно-контролируемая система (ТТС резервуарного типа), или как диффузионно-контролируемая система (ТТС матричного типа) (сравните с К.Н. Bauer, с соавт., Pharmazeutische Technologie; R.H. Müller, с соавт., Pharmazeutische Technologie: ModerneArzneiformen).
ТТС резервуарного типа обычно включает самоприклеивающийся на кожу плоский пакет, который содержит биологически активное вещество в растворенном виде. Со стороны, обращенной к коже, пакет снабжен проницаемой для биологически активного вещества мембраной, которая регулирует высвобождение биологически активного вещества. Клеящийся слой и слой, содержащий биологически активное вещество (резервуар), обычно представляют собой отделенные друг от друга в пространстве субсоставляющие.
В случае ТТС матричного типа биологически активное вещество внедрено в матрицу, причем оно может присутствовать в диспергированном жидком, полутвердом или твердом состоянии или в растворенной форме. Если матрица одновременно обладает клеящимися свойствами, то клеящийся слой одновременно представляет собой также слой, содержащий биологически активное вещество (drug in adhesive). Но также возможно, чтобы клеящийся слой и слой, содержащий биологически активное вещество, так же как и в случае ТТС резервуарного типа, были отделены друг от друга. В этом случае клеящийся слой может быть нанесен на слой, содержащий биологически активное вещество, или соответственно мембрану резервуара по всей поверхности, частично или в форме кольца.
С помощью состава и структурирования матрицы и/или мембраны высвобождение биологически активного вещества может регулироваться. В отношении дополнительных подробностей можно сослаться, например, на Т.К. Gosh, Transdermal and Topical Drug Delivery Systems Es Into Practice, CRC Press, 1997; R.O. Potts с соавт., Mechanisms of Transdermal Drug Delivery (Drugs and the Pharmaceutical Sciences), Marcel Dekker, 1997; и R. Gurny с соавт., Dermal and Transdermal Drug Delivery. New Insights and Perspectives, Wissenschaftliche VG., Stuttgart, 1998.
В качестве клеящих веществ для изготовления клеящего слоя ТТС согласно изобретению могут использоваться клеящие вещества, чувствительные к давлению (самоклеящиеся материалы, pressure-sensitive adhesives, PSA). Клеящий слой может быть образован, например, как клейкая область или клейкая поверхность, которая ограничивает слой, содержащий биологически активное вещество, по бокам. Для изготовления клеящего слоя подходят, например, полимеры, такие как полиакрилаты, простые поливиниловые эфиры, полиизобутилены (ПИБ), сополимеры стирол/изопрен или бутадиен/стирол или полиизопреновые каучуки. Кроме того, подходят силиконовые клеящие вещества, такие как, например, при необходимости полимерно сшитые полидиметилсилоксаны. Помимо этого, подходящими являются смолы, такие как, например, сложные эфиры глицина, глицерина или пентаэритритола, или углеводородные смолы, такие как политерпены. Клеящие вещества на акрилатной основе получаются в результате полимеризации акрилатов, метакрилатов, алкилакрилатов и/или алкилметакрилатов, при необходимости с другими ненасыщенными мономерами, такими как акриламид, диметилакриламид, диметиламиноэтилакрилат, гидроксиэтилакрилат, гидроксипропилакрилат, метоксиэтилакрилат, метоксиэтилметакрилат, акрилонитрил и/или винилацетат. Примерами подходящих полимеров являются коммерчески доступные под наименованием Durotak®, например, продукты 2516, 2287, 900А или 9301. Другими подходящими коммерчески доступными полимерами являются полиизобутилены, полиакрилаты, такие как, например, GMS 3083, Plastoid В и Eudragit® E 100.
Клеящий слой может дополнительно содержать вспомогательные вещества, такие как пластификаторы, например, фталаты, такие как дибутилфталат, минеральные масла, сложные эфиры лимонной кислоты или сложные эфиры глицерина, средства, усиливающие проницаемость кожи, например, диметилсульфоксид, активатор склеивания (вещество, придающее клейкость, tackifier), наполнители (такие как оксид цинка или диоксид кремния), сшивающий агент, консервант и/или растворитель. Вспомогательные вещества такого типа известны специалисту. В отношении них можно сослаться, например, на публикации R. Niedner с соавт., Dermatika: therapeutischer Einsatz, Pharmakologie und Pharmazie, Wiss. Verl.-Ges. 1992; H.P. Fiedler, Lexikon der Hilfsstoffe für Pharmazie, Kosmetik und angrenzende Gebiete, Editio Cantor Aulendorff, 2002.
Биологически активное вещество в слое, содержащем это биологически активное вещество, присутствует в растворенной или твердой форме. Предпочтительно биологически активное вещество присутствует в полностью растворенном виде, то есть, предпочтительно практически нельзя обнаружить кристаллическую часть биологически активного вещества. В одном предпочтительном варианте исполнения концентрация биологически активного вещества в слое, содержащем биологически активное вещество, согласно изобретению составляет по меньшей мере 25%, более предпочтительно по меньшей мере 50%, еще более предпочтительно по меньшей мере 66%, наиболее предпочтительно по меньшей мере 75%, но и в особенности по меньшей мере 80% от его концентрации насыщения. Определение концентрации насыщения является известным специалисту. Например, концентрация насыщения еще не достигнута, если кристалл чистого биологически активного вещества приводится в контакт со слоем, содержащим это биологически активное вещество, и в течение 5 минут поглощается этим слоем, то есть, растворяется. Если биологически активное вещество присутствует по крайней мере частично в твердой форме, то речь предпочтительно идет о микродисперсии.
Слой, содержащий биологически активное вещество, ТТС согласно изобретению содержит удерживающий материал, в который помещено это биологически активное вещество.
В одном предпочтительном варианте исполнения этот удерживающий материал расположен между непроницаемым для биологически активного вещества слоем носителя и проницаемым для биологически активного вещества слоем мембранного материала, так что ТТС согласно изобретению предпочтительно представляет собой ТТС резервуарного типа.
В другом предпочтительном варианте исполнения удерживающий материал служит в качестве матрицы, так что ТТС согласно изобретению предпочтительно представляет собой ТТС матричного типа.
Подходящими удерживающими материалами являются природные или (полу)синтетические полимеры, образующие матрицу. В качестве полимеров, образующих матрицу, могут быть названы, например, полиэтилены, хлорированные полиэтилены, полипропилены, полиуретаны, поликарбонаты, сложные эфиры полиакриловой кислоты, полиакрилаты, полиметакрилаты, поливиниловые спирты, поливинилхлориды, поливинилиденхлориды, поливинилпирролидоны, полиэитлентерефталаты, политетрафторэтилены, сополимеры этилен/пропилен, сополимеры этилен/этилакрилат, сополимеры этилен/винилацетат, сополимеры этилен/виниловый спирт, сополимеры этилен/винилоксиэтанол, сополимеры винилхлорид/винилацетат, сополимеры винилпирролидон/этилен/винилацетат, каучуки, резиноподобные синтетические гомо-, со- или блоксополимеры, силиконы, производные силикона, такие как сополимеры полисилоксан/полиметакрилат, производные целлюлозы, такие как простые эфиры целлюлозы, особенно метилцеллюлоза, этилцеллюлоза, пропил целлюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза и/или их смеси. Особенно предпочтительными являются полиакрилаты или полисиликоны.
Удерживающий материал может включать в себя указанные выше полимеры, которые подходят для изготовления клеевого слоя (drug in adhesive).
Содержание удерживающего материала составляет предпочтительно от 10 до 99,9% масс. в пересчете на общую массу слоя, содержащего биологически активное вещество, более предпочтительно от 50 до 95% масс.
Что касается количественных соотношений удерживающий материал/содержание биологически активного вещества, предпочтительно выбираются соотношения от 99:1 до 50:50 (масса удерживающего материала : масса биологически активного вещества), предпочтительно от 95:5 до 60:40. В предпочтительных вариантах исполнения выбирают от 99,5:0,5 до 80:20 (масса матрицы : масса биологически активного вещества), предпочтительно от 99:1 до 85:15. Относительно высокая доля биологически активного вещества обосновывается пропорционально высокой потребностью в веществе для лечения болезни Альцгеймера в формах от средней тяжести до тяжелой.
Предпочтительно удерживающий материал включает в себя:
- жидкую или гелеобразную композицию, в которой частично или полностью растворено биологически активное вещество; и/или
- матрицу на основе полимерного материала, в которой биологически активное вещество присутствует в растворенном виде или распределенным как микродисперсия; и/или
- полимерный материал на основе полиакрилата или полисиликона; и/или
- липогель, который предпочтительно содержит от 10 до 50% масс. биологически активного вещества.
В одном предпочтительном варианте исполнения слой, содержащий биологически активное вещество, включает гидрогель или липогель. В рамках этого описания гидрогели представляют собой гели, которые содержат воду и/или другие гидрофильные или полностью или частично смешивающиеся с водой вещества, которые придают этому гелю гидрофильные свойства. В рамках этого описания липогели представляют собой гели, которые в основном содержат вещества, не смешивающиеся с водой, которые придают этому гелю липофильные свойства.
В одном предпочтительном варианте исполнения биологически активное вещество в слое, содержащем это биологически активное вещество, присутствует в виде физиологически совместимой соли, особенно как гидрохлорид мемантина. Предпочтительно слой, содержащий биологически активное вещество, дополнительно содержит по меньшей мере один основный материал, основность которого достаточна, чтобы вступать в реакцию с физиологически совместимой солью биологически активного вещества с высвобождением свободного основания биологически активного вещества. Подходящие основные материалы известны специалисту, а их пригодность может оцениваться на основании величины pKa основания мемантина. Предпочтительно основный материал выбирается из группы, состоящей из полимеров с основными боковыми группами, органических оснований и неорганических оснований. В одном предпочтительном варианте исполнения основный материал отбирается из группы, состоящей из полимеров на акрилатной основе, которые имеют аминоалкильные боковые группы; неорганических оксидов или гидроксидов, особенно оксидов щелочных или щелочноземельных металлов; органических аминов или их солей; алкоголятов или карбоксилатов щелочных или щелочноземельных металлов.
Предпочтительными примерами подходящих основных материалов являются оксид кальция (CaO), этилат натрия и основные сополимеры метакрилата, такие как, например, Eudragit® E100.
В одном предпочтительном варианте исполнения слой, содержащий биологически активное вещество, содержит от 20 до 90% масс. удерживающего материала, от 10 до 50% масс. биологически активного вещества, а также при необходимости от 5 до 40% масс. основного материала, в пересчете на общую массу слоя, содержащего биологически активное вещество.
Слой, содержащий биологически активное вещество, ТТС согласно изобретению, помимо биологически активного вещества и присутствующего при необходимости клеящего вещества, также может содержать усилитель клейкости, пластификатор, вещества, усилители проникающей способности, вещества, повышающие вязкость, усилители растворимости, сшивающие агенты, консерванты, эмульгаторы, загустители и/или другие обычные вспомогательные вещества. Добавки такого типа являются известными специалисту.
Примерами усилителей растворимости и/или усилителей проникающей способности являются ацетилацетон, ацетилтрибутилцитрат, ацетилтриэтилцитрат, бензиловый спирт, бутилстеарат, цетиллактат, цетилпальмитат, цетилстеарат, цетилстеариловый спирт/цетиловый спирт, хлорбутанол, цинеол, децилметилсульфоксид, децилолеат, дибутилфталат, простой моноэтиловый эфир диэтиленгликоля, диэтилфталат, диэтилсебацинат, диизопропиладипат, диметилфталат, диоктиладипат, дипропиленгликоль, глицерилмоноолеат, глицерилмоностеарат, стеариловый спирт, арахисовое масло, этиллактат, этиллинолеат, этил-(9,12,15)-линолеат, эвгенол, фарнезол, глицерин, сложный глицерилацетиловый эфир, глицерилстеарат, гликольдистеарат, глиоксаль, гексадеканол, гексиленгликоль, изобутилстеарат, изоцетилстеарат, изодецилолеат, изопропилланолат, изопропилмиристат/изопропилпальмитат, изопропилстеарат, изостеарилнеопентаноат, диэтаноламид лауриновой кислоты, лимонен, линоленовая кислота, диэтаноламид линоленовой кислоты, ментол, миристиллактат, миристилмиристат, миристилстеарат, м-толилацетат, октилдодеканол, октилпальмитат, октилстеарат, диэтаноламид олеиновой кислоты, олеиловый спирт, олеилолеат, фенилэтиловый спирт, пропиленгликоль, пропиленкарбонат, изостеариновая кислота, октановая кислота, гидрированное касторовое масло, 1,3-бутиленгликоль, сафлоровое масло, сквалан, сквален, триацетин, глицерилтриацетат, триэтилцитрат, ундециленовая кислота, (+)-фенхон, простой лаурилэфирсульфат аммония, холестерин, лецитин, глицерингидроксистеарат, моно- и диглицериды жирных кислот, каприлат натрия, простой лаурилэфирсульфат натрия, натриевые/калиевые соли жирных кислот, лаурилсульфат натрия, ПЭГ-(2)-сеарат, сульфосукцинат натрия, сложные полиглицериловые эфиры жирных кислот, простые полиоксиэтиленалкиловые эфиры, цетомакрогол, сложные эфиры сорбита и полиоксиэтиленовых жирных кислот, пропиленгликольстеарат, сложные эфиры сорбита и жирных кислот, диэтаноламид стеариновой кислоты, триглицериды со средней длиной цепи (предпочтительно 12-14 атомами углерода) (согласно Европейской фармакопее, Ph. Eur.).
В качестве веществ, способствующих растворению, могут применяться N-метил-2-пирролидон, лаурилпирролидон, триэтаноламин, триацетин, простой моноэтиловый эфир диэтиленгликоля, производные жирных кислот или жирных спиртов и/или низкомолекулярных многоатомных спиртов, таких как, например, пропиленгликоль или глицерин.
В случае веществ, повышающих вязкость, в рамках этого описания речь идет предпочтительно о гелеобразователе, то есть, о веществе, которое, с одной стороны, повышает вязкость композиции, а с другой стороны, способствует образованию геля. Примерами таких повышающих вязкость веществ являются желатины (например, Gelatin), камедь плодов рожкового дерева (например, Cesagum® LA-200, Cesagum® LID/150, Cesagum® LN-1), пектины, такие как цитрусовый пектин (например, Cesapectin® HM Medium Rapid Set), яблочный пектин, пектин из кожуры лимона, крахмал восковидной кукурузы (C*Gel® 04201), альгинат натрия (например, Frimulsion® ALG (E401)), гуаровая камедь (например, Frimulsion® ВМ, Polygum® 26/1-75), йота-каррагинан (например, Frimulsion® D021), камедь карайи, геллановая камедь (например, Kelcogel® F, Kelcogel® LT100), галактоманнан (например, Meyprogat® 150), камедь тары (например, Polygum® 43/1), пропиленгликольальгинат (например, Protanal®-Ester SD-LB), гиалуронат натрия, трагант, камедь тары (например, Vidogum® SP 200), ферментированная полисахаридная велановая камедь (например, К1А96), ксантановая камедь (например, Xantural® 180).
Если ТТС согласно изобретению образована по системе с резервуаром, мембрана резервуара может состоять из инертных полимеров, таких как, например, полиэтилены, полипропилены, поливинилацетаты, полиамиды, сополимеры этилен/винилацетат и/или силиконы. С помощью мембраны резервуара может достигаться контролируемое высвобождение биологически активного вещества из этого резервуара.
Матрица, содержащая биологически активное вещество, или соответственно резервуар, содержащий биологически активное вещество, также может содержать растворитель, такой как, например, вода, этанол, 1-пропанол, изопропанол, низкомолекулярный многоатомный спирт, например, пропиленгликоль или глицерин, или сложный эфир, такой как изопропилмиристат, или их смеси. Однако в предпочтительном варианте исполнения матрица, содержащая биологически активное вещество, или соответственно резервуар, содержащий биологически активное вещество, в основном не содержат этанола и/или изопропанола.
В качестве консервантов для слоя, содержащего биологически активное вещество, могут применяться антиокислители, такие как витамин Е, бутилгидрокситолуол, бутилгидроксианизол, парабены, аскорбиновая кислота, аскорбилпальмитат, и/или вещества, образующие хелаты, такие как динатриевая соль этилендиаминтетрауксусной кислоты, цитрат калия или натрия. Кроме того, в качестве консервантов подходят сложные эфиры полигидроксибутирата (ПГБ), такие как сложный метиловый эфир ПГБ и сложный пропиловый эфир ПГБ, хлорид бензалкония, хлоргексидин, сорбиновая кислота, бензойная кислота, пропионовая кислота, салициловая кислота и ее соли, формальдегид и параформальдегид, гексахлорофен, о-фенилфенол, цинкпиритион, неорганические сульфиты, йодат натрия, хлорбутол, дегидроуксусная кислота, муравьиная кислота, дибромгексамид, мертиолат, фенилртутные соли (соединения фенилртути), ундециленовая кислота, гексетидин, бронидокс, бронопол, 2,4-дихлорбензиловый спирт, триклокарбан, парахлорметакрезол, триклозан, парахлорметаксиленол, производные имидазолидинилмочевины, хлоргидрат полигексаметиленбигуанида, феноксиэтанол, метенамин, Dowicil 200, 1-имидазолил-(4-хлорфенокси)-3,3'-диметилбутан-2-он, диметилгидантоин, бензиловый спирт, 1-гидрокси-4-метил-6-(2,4,4-триметилпентил)-2-пиридон, 1,2-дибром-2,4-дицианобутан, 3,3'-дибром-5,5'-дихлор-2,2-дигидроксидифенилметан, изопропилметакрезол и катон.
ТТС согласно изобретению может в одном слое или в нескольких слоях содержать также по меньшей мере один пластификатор, выбираемый из группы, включающей длинноцепные спирты, такие как додеканол, ундеканол, октанол, сложные эфиры карбоновых кислот с полиэтоксилированными спиртами, сложные диэфиры алифатических дикарбоновых кислот, таких как адипиновая кислота, и триглицериды каприловой кислоты и/или каприновой кислоты со средней длиной цепи, кокосовое масло, многоатомные спирты, такие как 1,2-пропандиол, сложные эфиры многоатомных спиртов, таких как глицерин, с левулиновой кислотой или каприловой кислотой и превращенные в простые эфиры многоатомные спирты.
Получение ТТС согласно изобретению может осуществляться согласно известным способам получения, особенно для пластырей, содержащих активные вещества, с помощью таких стадий процесса, как ламинирование, перфорирование, расслаивание, раскатывание, нарезка, перематывание, сборка или дозирование (сравните с публикацией Verpackungs-Rundschau 4/2002, 83-84).
Высвобождение биологически активного вещества из ТТС согласно изобретению предпочтительно осуществляется контролируемо. При этом ТТС согласно изобретению предпочтительно имеет максимальную скорость высвобождения биологически активного вещества не более 100 мкг/см2 ч, предпочтительно не более 95 мкг/см2 ч, не более 90 мкг/см2 ч или не более 85 мкг/см2 ч; более предпочтительно не более 80 мкг/см2 ч, не более 75 мкг/см2 ч или не более 70 мкг/см2 ч; еще более предпочтительно не более 65 мкг/см2 h, не более 60 мкг/см2 ч или не более 55 мкг/см2 ч; наиболее предпочтительно не более 50 мкг/см2 ч, не более 45 мкг/см2 ч или не более 40 мкг/см2 ч; и в особенности не более 35 мкг/см2 ч или не более 32 мкг/см2 ч.
В одном предпочтительном варианте исполнения максимальная скорость высвобождения биологически активного вещества находится в диапазоне 20±15 мкг/см2 ч, более предпочтительно 20±12,5 мкг/см2 ч, еще более предпочтительно 20±10 мкг/см2 ч, наиболее предпочтительно 20±7,5 мкг/см2 ч и в особенности 20±5 мкг/см2 ч. В другом предпочтительном варианте исполнения максимальная скорость высвобождения биологически активного вещества находится в диапазоне 25±10 мкг/см2 ч, еще более предпочтительно 25±7,5 мкг/см2 ч, наиболее предпочтительно 25±5 мкг/см2 ч и в особенности 25±2,5 мкг/см2 ч. В другом предпочтительном варианте исполнения максимальная скорость высвобождения биологически активного вещества находится в диапазоне 30±5 мкг/см2 ч, еще более предпочтительно 30±2,5 мкг/см2 ч.
Обычно скорость высвобождения изменяется в течение интервала между применениями ТТС. Так, с одной стороны, количество биологически активного вещества в ТТС вследствие высвобождения непрерывно уменьшается, с другой стороны, кожа может проявлять определенную аккумулирующую способность. Оба эффекта могут влиять на скорость высвобождения.
Максимальная скорость высвобождения ТТС и ее определение известны специалисту. Максимальная скорость высвобождения может обозначаться как максимальная проникающая способность для человеческой кожи и в лабораторных условиях in vitro определяться, например, с помощью диффузионной ячейки Франца. Предпочтительно это определение осуществляется при условиях, приведенных в экспериментальной части.
ТТС согласно изобретению имеет tmax по меньшей мере 24 ч, более предпочтительно по меньшей мере 26 ч, еще более предпочтительно по меньшей мере 28 ч, наиболее предпочтительно по меньшей мере 30 ч и в особенности по меньшей мере 32 ч. В одном предпочтительном варианте исполнения ТТС согласно изобретению tmax лежит в диапазоне 36±12 ч, более предпочтительно 36±10 ч, еще более предпочтительно 36±8 ч, наиболее предпочтительно 36±6 ч, и в особенности 36±4 ч. В другом предпочтительном варианте исполнения ТТС согласно изобретению tmax лежит в диапазоне 32±8 ч, более предпочтительно 32±7 ч, еще более предпочтительно 32±6 ч, наиболее предпочтительно 32±5 ч, и в особенности 32±4 ч. В другом предпочтительном варианте исполнения ТТС согласно изобретению tmax лежит в диапазоне 28±4 ч, более предпочтительно 28±3 ч, наиболее предпочтительно 28±2 ч.
При этом tmax предпочтительно определяется как то время, после которого в процессе однократного и первого применения ТТС согласно изобретению достигается максимальная концентрация биологически активного вещества в плазме крови (Cmax), измеренная с момента нанесения этой ТТС на кожу. Подходящие методы определения tmax и Cmax известны специалисту.
ТТС согласно изобретению предпочтительно имеет Cmax von mindestens 4 нг/мл, по меньшей мере 4,5 нг/мл, по меньшей мере 5 нг/мл или по меньшей мере 5,5 нг/мл, более предпочтительно по меньшей мере 6 нг/мл, еще более предпочтительно по меньшей мере 8 нг/мл, наиболее предпочтительно по меньшей мере 10 нг/мл и в особенности по меньшей мере 12 нг/мл.
ТТС согласно изобретению предпочтительно имеет фармакокинетическое время запаздывания tlag не более 6 ч, более предпочтительно 1,33±1,00 ч, еще более предпочтительно 1,33±0,66 ч и в особенности 1,33±0,33 ч. Тем самым фармакокинетическое время запаздывания tlag ТТС согласно изобретению является неожиданно коротким, что влечет за собой преимущества. Так, эффективные концентрации биологически активного вещества в плазме крови достигаются за сравнительно короткое время после нанесения ТТС на кожу.
ТТС согласно изобретению предпочтительно имеет длительность биоаналитической обнаружимости tlast по меньшей мере 200 ч, более предпочтительно по меньшей мере 220 ч и в особенности предпочтительно по меньшей мере 240 ч.
ТТС согласно изобретению предпочтительно имеет фармакокинетический период полувыведения биологически активного вещества t1/2,z в диапазоне 60-100 ч, более предпочтительно в диапазоне 52±25 ч, более предпочтительно 52±15 ч, наиболее предпочтительно 52±10 ч и в особенности 52±5 ч.
Подходящие методы определения этих фармакокинетических параметров известны специалисту. Определение концентрации биологически активного вещества в плазме крови так же известно специалисту. Оно осуществляется предпочтительно с помощью жидкостной хроматографии (ЖХ), например, высокоэффективной жидкостной хроматографии (ВЭЖХ), предпочтительно в сочетании с масс-спектрометрией (МС) (ЖХ-МС или соответственно ВЭЖХ-МС).
ТТС согласно изобретению предпочтительно имеет незначительную межиндивидуальную изменчивость, предпочтительно не более 25%, более предпочтительно не более 20%. Низкая межиндивидуальная изменчивость такого типа обладает тем преимуществом, что достигаемый in vivo уровень в крови может хорошо предсказываться, что, среди прочего, сопровождается также повышенной терапевтической надежностью.
При максимальном значении межиндивидуальной изменчивости фармакокинетических параметров 25% ТТС согласно изобретению отличается от других ТТС, которые предусмотрены для введения других активных веществ. Например, сообщалось о ТТС для введения биологически активного вещества ривастигмина, у которой изменчивость параметров составляет >32% (сравните с G. Lefevre с соавт., Clinical Pharmacology & Therapeutics, 83 (1), 2008, 106-114).
В одном предпочтительном варианте исполнения ТТС согласно изобретению после применения согласно назначению имеет сравнительно низкое остаточное содержание биологически активного вещества. Предпочтительно это остаточное содержание после 24 ч применения составляет не более 75% масс., более предпочтительно не более 70% масс., еще более предпочтительно не более 65% масс. и в особенности не более 60% масс. от первоначально содержащегося в ТТС количества. Это является преимуществом из экономических соображений и также из соображений безопасности.
ТТС согласно изобретению разработана таким образом, что при следующих друг за другом или смещенных во времени, предпочтительно повторяющихся применениях соответственно одной или нескольких ТТС согласно изобретению для интервалов между применениями, составляющих соответственно независимо друг от друга по меньшей мере 12 ч, в течение всего промежутка времени, составляющего по меньшей мере 300 ч, у нуждающегося в лечении индивида в его плазме крови соответственно от начала первого применения достигаются следующие концентрации биологически активного вещества:
спустя 24 ч по меньшей мере 14 нг/мл, предпочтительно по меньшей мере 16,2 нг/мл,
спустя 48 ч по меньшей мере 27 нг/мл, предпочтительно по меньшей мере 29,2 нг/мл,
спустя 60 ч по меньшей мере 32 нг/мл, предпочтительно по меньшей мере 34,5 нг/мл,
спустя 72 ч по меньшей мере 37 нг/мл, предпочтительно по меньшей мере 39,1 нг/мл,
спустя 96 ч по меньшей мере 44 нг/мл, предпочтительно по меньшей мере 46,6 нг/мл,
спустя 144 ч по меньшей мере 54 нг/мл, предпочтительно по меньшей мере 56,5 нг/мл,
спустя 192 ч по меньшей мере 60 нг/мл, предпочтительно по меньшей мере 62,3 нг/мл,
спустя 240 ч по меньшей мере 63 нг/мл, предпочтительно по меньшей мере 65,5 нг/мл, и
спустя 300 ч по меньшей мере 65 нг/мл, предпочтительно по меньшей мере 67,8 нг/мл.
При этом повторные применения предпочтительно осуществляются непосредственно друг за другом, то есть, когда одна или несколько ТТС согласно изобретению в конце интервала между применениями удаляются, немедленно применяется одна или несколько ТТС согласно изобретению на следующий за этим интервал между применениями. При этом промежуток времени, на который на тело при необходимости не наносится никакая ТТС согласно изобретению, предпочтительно составляет не более 10 минут, более предпочтительно не более 5 минут.
В одном предпочтительном варианте исполнения применение всех ТТС согласно изобретению на протяжении всего промежутка времени осуществляется на том же самом участке кожи индивидуума, то есть, на данную часть кожи индивидуума повторно накладывается или соответственно наклеивается ТТС согласно изобретению.
В другом предпочтительном варианте исполнения применение всех ТТС согласно изобретению на протяжении всего промежутка времени осуществляется соответственно на других участках кожи индивидуума, то есть, на данную часть кожи индивидуума ТТС согласно изобретению повторно не накладывается или соответственно не наклеивается.
При этом ТТС согласно изобретению применяются на следующие друг за другом интервалы между применениями, составляющие соответственно независимо друг от друга по меньшей мере 12 ч, предпочтительно в течение всего промежутка времени, составляющего по меньшей мере 300 ч. Если каждый интервал между применениями длится, например, 12 ч, то требуются по меньшей мере 25 следующих друг за другом интервалов между применениями, чтобы охватить общий промежуток времени по меньшей мере в 300 ч. Например, если каждый интервал между применениями длится 18 ч, то требуются соответственно по меньшей мере 17 следующих друг за другом интервалов между применениями, чтобы охватить общий промежуток времени по меньшей мере в 300 ч.
Отдельные интервалы между применениями могут иметь такую же точно или отличающуюся продолжительность. Предпочтительно все интервалы между применениями имеют одну продолжительность, предпочтительно соответственно 12 ч, 14 ч, 16 ч, 18 ч, 20 ч, 22 ч, 24 ч, 26 ч, 28 ч, 30 ч, 32 ч, 34 ч, 36 ч, 38 ч, 40 ч, 42 ч, 44 ч, 46 ч, 48 ч, 50 ч, 52 ч, 54 ч, 56 ч, 58 ч, 60 ч, 62 ч, 64 ч, 66 ч, 68 ч, 70 или 72 ч. В одном предпочтительном варианте исполнения каждый интервал между применениями независимо от других составляет не более 168 ч или не более 144 ч, более предпочтительно не более 120 ч или не более 96 ч, еще более предпочтительно не более 72 ч или не более 48 ч, наиболее предпочтительно не более 36 ч или не более 24 ч и в особенности не более 12 ч.
Интервалы между применениями более подробно поясняются на Фигурах 1 и 2. Обе Фигуры схематично показывают процесс изменения минимальной концентрации биологически активного вещества в плазме крови с течением времени. На Фигуре 1 каждый столбик на диаграмме равен интервалу между применениями 12 ч, на Фигуре 2 интервалу между применениями 24 ч. Высота этих столбиков соответственно равняется минимальной достигнутой концентрации в плазме крови.
В процессе каждого интервала между применениями может применяться одна ТТС согласно изобретению, или могут соответственно одновременно применяться несколько ТТС согласно изобретению. Количество использованных ТТС может различаться от одного интервала между применениями к другому интервалу между применениями. Предпочтительно число использованных ТТС в каждом интервале между применениями является одинаковым.
В одном предпочтительном варианте исполнения указанные концентрации биологически активного вещества достигаются при применении в течение одного интервала между применениями соответственно одного или одновременно двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати или шестнадцати ТТС согласно изобретению.
В одном предпочтительном варианте исполнения для каждого интервала между применениями продолжительность в часах, деленная на количество соответственно одновременно используемых ТТС, независимо друг от друга лежит в диапазоне от 4 до 24, более предпочтительно от 5 до 20, еще более предпочтительно от 6 до 18. В одном предпочтительном варианте исполнения для каждого интервала между применениями продолжительность в часах, деленная на количество соответственно одновременно используемых ТТС, независимо друг от друга составляет величину в диапазоне от 3 до 8, более предпочтительно от 4 до 7 и в особенности примерно 6.
Предпочтительные варианты выполнения ТТС согласно изобретению, которые достигают описанных выше концентраций биологически активного вещества, перечисляются ниже: 122, 123, 124, 182, 183, 184, 185, 243, 244, 245, 246, 247, 365, 366, 367, 368, 369, 3610, 3611, 487, 488, 489, 4810, 4811, 4812, 4813, 4814, 4815, 4816, 609, 6010, 6011, 6012, 6013, 6014, 6015, 6016, 6017, 6018, 6019, 7212, 7213, 7214, 7215, 7216, 7217, 7218, 7219, 7220, 7221, 7222, 8414, 8415, 8416, 8417, 8418, 8419, 8420, 8421, 8422, 8423, 8424, 9619, 9620, 9621, 9622, 9623, 9624. В этом случае сначала указана продолжительность каждого интервала между применениями в часах (например, «12»), а затем в виде верхнего индекса количество соответственно при необходимости одновременно применяемых ТТС согласно изобретению (например, «3»). В соответствии с этим, например, «242» обозначает соответственно одновременное применение двух ТТС согласно изобретению в течение следующих друг за другом интервалов между применениями, составляющих соответственно 24 ч.
Предпочтительно ТТС согласно изобретению подготовлено для того, чтобы применяться в соответствии с указанными выше интервалами между применениями. Другой аспект изобретения касается способа лечения или профилактики заболеваний центральной нервной системы, включающего следующее друг за другом применение нескольких ТТС согласно изобретению с соблюдением определенных выше интервалов между применениями.
Специалист понимает, что определенное соотношение продолжительности применения и количества ТТС, которые при необходимости следует применять одновременно, при уменьшении этого количества ТТС, которые при необходимости следует применять одновременно, аналогично может достигаться путем соответствующего увеличения ТТС, и наоборот. Так, фармакологическая эффективность ТТС с поверхностью, выделяющей биологически активное вещество, составляющей, например, 5 см2, примерно вдвое выше, чем фармакологическая эффективность в остальном идентичной ТТС с поверхностью, выделяющей биологически активное вещество, составляющей 2,5 см2.
Поверхность ТТС согласно изобретению, выделяющая биологически активное вещество (контактная поверхность, содержащая биологически активное вещество), предпочтительно лежит в диапазоне от 0,1 до 400 см2. В одном предпочтительном варианте исполнения поверхность ТТС согласно изобретению, выделяющая биологически активное вещество, лежит в диапазоне 10±9 см2, более предпочтительно 10±7,5 см2, еще более предпочтительно 10±5 см2, наиболее предпочтительно 10±2,5 см2 и в особенности 10±1 см2. В другом предпочтительном варианте исполнения поверхность ТТС согласно изобретению, выделяющая биологически активное вещество, лежит в диапазоне 20±9 см2, более предпочтительно 20±7,5 см2, еще более предпочтительно 20±5 см2, наиболее предпочтительно 20±2,5 см2 и в особенности 20±1 см2. В другом предпочтительном варианте исполнения поверхность ТТС согласно изобретению, выделяющая биологически активное вещество, лежит в диапазоне 25±20 см2, более предпочтительно 25±15 см2, еще более предпочтительно 25±10 см2, наиболее предпочтительно 25±5 см2 и в особенности 25±2,5 см2. В другом предпочтительном варианте исполнения поверхность ТТС согласно изобретению, выделяющая биологически активное вещество, лежит в диапазоне 30±9 см2, более предпочтительно 30±7,5 см2, еще более предпочтительно 30±5 см2, наиболее предпочтительно 30±2,5 см2 и в особенности 30±1 см2. В другом предпочтительном варианте исполнения поверхность ТТС согласно изобретению, выделяющая биологически активное вещество, лежит в диапазоне 100±90 см2, более предпочтительно 100±75 см2, еще более предпочтительно 100±50 см2, наиболее предпочтительно 100±25 см2 и в особенности 100±10 см2. В другом предпочтительном варианте исполнения поверхность ТТС согласно изобретению, выделяющая биологически активное вещество, лежит в диапазоне 200±90 см2, более предпочтительно 200±75 см2, еще более предпочтительно 200±50 см2, наиболее предпочтительно 200±25 см2 и в особенности 200±10 см2.
Если поверхность, выделяющая биологически активное вещество, является достаточно большой, например, больше чем, к примеру, 10 см2, то в результате закрытия части поверхности, содержащей биологически активное вещество, с помощью защитного слоя, непроницаемого для биологически активного вещества, фактическая поверхность, выделяющая биологически активное вещество, может уменьшаться. Например, если ТТС согласно изобретению имеет содержащую биологически активное вещество квадратную поверхность 6×6 см, то можно 26 см2 этой поверхности покрыть слоем, непроницаемым для биологически активного вещества, чтобы обеспечить поверхность, выделяющую биологически активное вещество, площадью 10 см2. Специалист осознает, что при необходимости следует принимать во внимание имеющую место диффузию в поперечном направлении, особенно в случае веществ, которые хорошо проникают в содержащий клеящие вещества слой, так что величина защитного слоя при необходимости должна подбираться.
В одном предпочтительном варианте исполнения ТТС согласно изобретению от начала первого применения достигаются соответственно следующие концентрации биологически активного вещества:
спустя 24 ч максимально 50 нг/мл,
спустя 48 ч максимально 90 нг/мл,
спустя 60 ч максимально 110 нг/мл,
спустя 72 ч максимально 130 нг/мл,
спустя 96 ч максимально 150 нг/мл,
спустя 144 ч максимально 180 нг/мл,
спустя 192 ч максимально 195 нг/мл,
спустя 240 ч максимально 200 нг/мл, и
спустя 300 ч максимально 210 нг/мл.
Предпочтительные области концентраций биологически активного вещества от B1 до B4 обобщены в следующей Таблице 1:
В одном предпочтительном варианте исполнения при непрерывном применении в соответствии с назначением ТТС согласно изобретению достигаются стационарные (Steady-State) уровни фармакологических концентраций биологически активного вещества в плазме крови в диапазоне от 70 до 150 нг/мл.
В одном предпочтительном варианте исполнения ТТС согласно изобретению его усредненная по всему интервалу между применениями скорость высвобождения биологически активного вещества лежит в диапазоне от 0,2 до 2,0 мг/ч. В одном предпочтительном варианте исполнения эта усредненная скорость высвобождения лежит в диапазоне 0,7±0,5 мг/ч, более предпочтительно 0,7±0,4 мг/ч, еще более предпочтительно 0,7±0,3 мг/ч. В другом предпочтительном варианте исполнения эта усредненная скорость высвобождения лежит в диапазоне 1,0±0,5 мг/ч, более предпочтительно 1,0±0,4 мг/ч, еще более предпочтительно 1,0±0,3 мг/ч. В другом предпочтительном варианте исполнения эта усредненная скорость высвобождения лежит в диапазоне 1,3±0,5 мг/ч, более предпочтительно 1,3±0,4 мг/ч, еще более предпочтительно 1,3±0,3 мг/ч. В другом предпочтительном варианте исполнения эта усредненная скорость высвобождения лежит в диапазоне 1,5±0,5 мг/ч, более предпочтительно 1,5±0,4 мг/ч, еще более предпочтительно 1,5±0,3 мг/ч.
Предпочтительно содержащееся в ТТС согласно изобретению, трансдермально высвобождаемое количество биологически активного вещества соответствует по меньшей мере половине суточной дозы, предпочтительно по меньшей мере целой суточной дозе, которая необходима для лечения или профилактики соответствующего заболевания центральной нервной системы. Величина необходимой суточной дозы является известным специалисту.
В одном предпочтительном варианте исполнения ТТС согласно изобретению содержит соответствующую дозу по меньшей мере на
- 1 день (трансдермально высвобождаемая доза = однократной суточной дозе),
- 2 дня (трансдермально высвобождаемая доза = двукратной суточной дозе),
- 3 дня (трансдермально высвобождаемая доза = трехкратной суточной дозе),
- 4 дня (трансдермально высвобождаемая доза = четырехкратной суточной дозе),
- 5 дней (трансдермально высвобождаемая доза = пятикратной суточной дозе),
- 6 дней (трансдермально высвобождаемая доза = шестикратной суточной дозе) или
- 7 дней (трансдермально высвобождаемая доза = семикратной суточной дозе).
Если в случае заболевания центральной нервной системы речь идет о болезни Альцгеймера в формах от средней до тяжелой, то предпочтительная суточная, введенная трансдермально доза составляет примерно 20 мг (эквивалентное количество, пересчитанное на гидрохлорид мемантина). Однако в первые недели лечения может быть рекомендовано начинать с более низкой суточной вводимой трансдермально дозы и увеличивать эту дозу со временем, пока величина не достигнет примерно 20 мг. Предпочтительно, например, чтобы суточная вводимая трансдермально доза в первую неделю составляла примерно 5,0 мг, во вторую неделю примерно 10 мг, в третью неделю примерно 15 мг, а после этого постоянно примерно 20 мг (эквивалентное количество, соответственно пересчитанное на гидрохлорид мемантина).
Предпочтительно поверхностная концентрация мемантина или соответственно его физиологически совместимой соли составляет по меньшей мере 1,0 мг/см2, более предпочтительно по меньшей мере 5,0, 10 или 15 мг/см2, еще более предпочтительно по меньшей мере 20, 25 или 30 мг/см2, наиболее предпочтительно по меньшей мере 35, 40 или 50 мг/см2 и в особенности по меньшей мере 60 или 70 мг/см2.
В предпочтительном варианте исполнения ТТС согласно изобретению имеет общую толщину слоя в интервале от 50 до 4000 мкм, более предпочтительно от 100 до 2500 мкм, еще более предпочтительно от 200 до 2000 мкм, наиболее предпочтительно от 250 до 1500 мкм и в особенности от 300 до 1200 мкм.
ТТС согласно изобретению подходят для того, чтобы помимо слабоумия бороться и с другими заболеваниями центральной нервной системы. К таким относятся острые нейродегенеративные процессы, например, при травмах и инсультах, хронические процессы (помимо описанной выше болезни Альцгеймера, эти заболевания представляют собой, например, болезнь Паркинсона и болезнь Хантингтона [Chorea Huntington]), а также симптоматически протекающие заболевания разного типа, связанные с эпилепсией, наркотической зависимостью, депрессией и тревожностью.
Другой аспект изобретения касается единицы упаковки, включающей по меньшей мере два различных типа описанной выше ТТС согласно изобретению, которые предпочтительно различаются по содержащейся в них высвобождающейся за сутки дозе (мемантина или соответственно его физиологически совместимой соли). Предпочтительно наличествуют по меньшей мере 2, более предпочтительно по меньшей мере 3 и в особенности по меньшей мере 4 различных типа ТТС с различными высвобождающимися за сутки дозами, причем типы ТТС с одинаковой высвобождающейся за сутки дозой предпочтительно могут быть представлены многократно (несколькими типами одного и того же вида).
В предпочтительном варианте исполнения единица упаковки согласно изобретению включает в себя столько ТТС, сколько требуется, чтобы, исходя из высвобождающейся за сутки начальной дозы, путем постепенного повышения (титрования) достигнуть высвобождающейся за сутки максимальной дозы. Предпочтительно эта максимальная доза достигается в 2, 3 или 4 этапа, причем каждый этап может включать одинаковые или разные промежутки времени, один или несколько интервалов применения. В этой связи интервал применения представляет собой тот временной промежуток, за который при применении согласно назначению соответствующей ТТС может фактически высвобождаться заявленная суточная доза, которую следует вводить трансдермально. Например, если интервал применения охватывает 48 ч, то ТТС должна обеспечивать, чтобы в течение этого промежутка времени соответствующая суточная доза, которую следует вводить трансдермально, действительно могла высвобождаться из этой ТТС.
В предпочтительном варианте исполнения интервалы применения соответствуют интервалам между применениями, описанным выше в разделе, относящемся к концентрации биологически активного вещества.
Другой предмет изобретения относится к набору для лечения или соответственно профилактики заболеваний центральной нервной системы, включающему в себя
- по меньшей мере одну лекарственную форму для начального, не трансдермального, предпочтительно перорального или парентерального введения мемантина или его физиологически совместимой соли
- и по меньшей мере одну ТТС согласно изобретению.
Другой аспект изобретения касается применения мемантина или физиологически совместимой соли, или пролекарства для изготовления описанной выше ТТС для лечения или профилактики заболеваний центральной нервной системы. Предпочтительно заболевание центральной нервной системы выбирается среди слабоумия, особенно болезни Альцгеймера, травмы, инсульта, болезни Паркинсона, болезни Хантингтона, эпилепсии, наркотической зависимости, депрессии и тревожного состояния.
Нижеследующие примеры служат для более подробного пояснения изобретения, однако не должны расцениваться как ограничивающие:
Пример 1:
Получали ТТС в форме пластыря, содержащего биологически активное вещество, следующего состава:
Для этого получали дозировочный раствор из мемантина (свободного основания) и Miglyol 812 со следующим соотношением в смеси.
Соответствующий акрилат, например, Durotak 2516, наносится в виде покрытия на подходящую защитную пленку (например, полиэтилентерефталатную пленку, ПЭТ), высушивается и покрывается подходящим закрывающим слоем носителя (1-ый слой). Затем изготавливается 2-ой слой, например, из Durotak 2516, как описано выше, однако не покрывается подходящим закрывающим слоем носителя. Вместо этого на высушенный акрилатный слой накладывается подходящая ткань, например, из бумаги из длинных волокон LF26, определенного размера (например, 10 см2) и на эту подходящую ткань дозируется соответствующее количество дозировочного раствора. 1-ый слой накладывается на 2-ой слой, содержащий ткань, после удаления защитной пленки. После высекания штампом ТТС (в форме, чтобы ткань находилась в середине) эти ТТС упаковываются в подходящий материал, предпочтительно ПЭТ.
Пример 2:
По образцу Примера 1 получали восемь различных ТТС в форме пластырей, содержащих биологически активное вещество (drug in adhesive}, следующего состава:
Берут соответствующее количество гидрохлорида мемантина или соответственно его основания и суспендируют или, в случае основания, растворяют в количестве, составляющем примерно 1/3 от количества биологически активного вещества, органического растворителя (например, этилацетата). После добавления соответствующего количества подходящего акрилата перемешивают, чтобы обеспечить гомогенное распределение биологически активного вещества в полимере.
Затем в эту массу при перемешивании добавляют другие соответствующие исходные материалы (Plastoid® В для 2-1 и 2-2 или соответственно каприлат натрия и Eudragit® E100 для 2-3, или соответственно этилат натрия для 2-4, или соответственно CaO для систем с 2-5 по 2-8) и перемешивают дополнительно, пока не образуется гомогенная масса. После нанесения на подходящую защитную пленку (например, полиэтилентерефталатную пленку, ПЭТ) это слоистое изделие сушат и покрывают подходящим закрывающим слоем носителя. При этом, чтобы достичь необходимой толщины или содержания биологически активного вещества, для примера 2-1 совместно наносят три слоя (соответственно с подходящей тканью (например, нетканым материалом из ПЭТ) для укрепления между акрилатными слоями) или соответственно для 2-2 и 2-3 три слоя без ткани, или для 2-4 два слоя, или для примеров с 2-5 по 2-8 один слой. После высекания ТТС штампом они упаковываются в подходящий материал, предпочтительно ПЭТ.
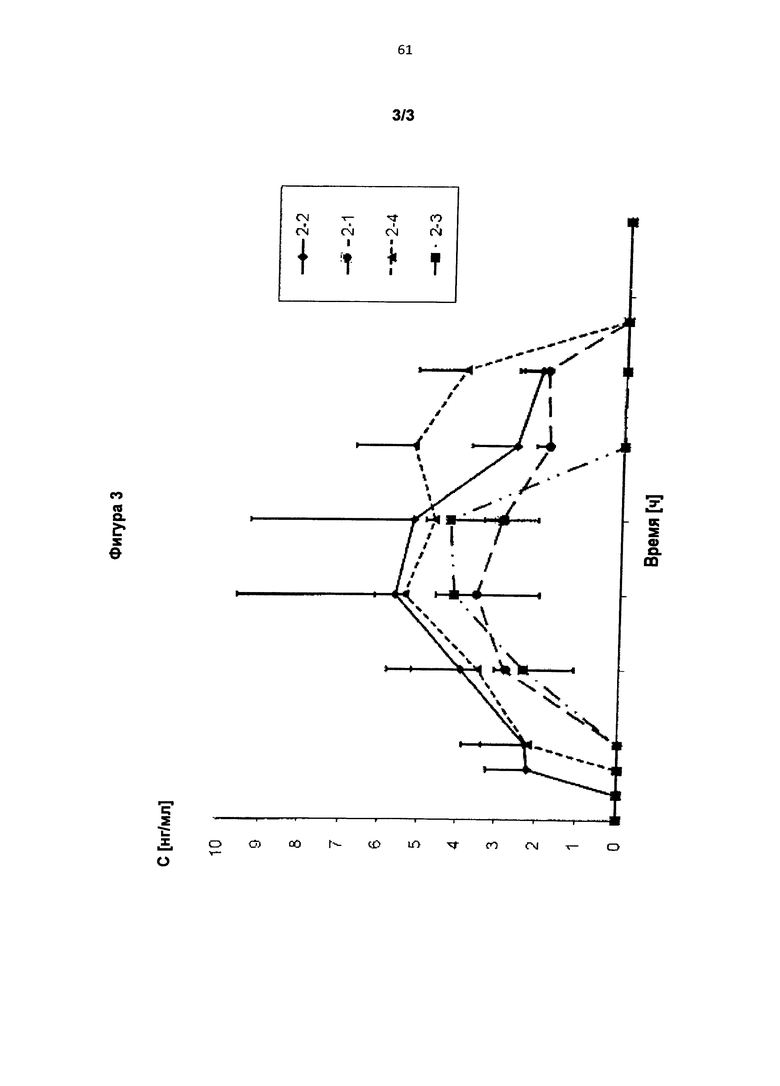
ТТС согласно изобретению, соответствующие примерам 2-1, 2-2, 2-3 и 2-4 были исследованы in vivo (на кроликах). Концентрации мемантина в плазме крови после трехдневного применения (удаление ТТС спустя 72 ч) представлены на Фигуре 3.
Пример 3:
ТТС, соответствующие Примеру 2-7 были исследованы в клинических испытаниях на человеке. Группа испытуемых (группа 1) получала 3 пластыря, содержащих биологически активное вещество, с содержанием биологически активного вещества соответственно 24,0 мг мемантина в пересчете на основание. Спустя 24 ч один из пластырей удаляли. Спустя еще 24 часа удаляли другой пластырь. Спустя следующие 24 часа удаляли последний пластырь. Другая группа испытуемых (группа 2) получала на 48 часов 2 пластыря, содержащих биологически активное вещество, с содержанием этого биологически активного вещества соответственно 24,0 мг мемантина в пересчете на основание.
Фармакокинетические параметры были определены из измеренных концентраций в плазме крови и обобщены в следующих таблицах 2 и 3:
Остаточные содержания биологически активного вещества в ТТС после применения так же были определены и обобщены для всех 6 испытуемых в следующей таблице 4:
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕРМОПЛАВКАЯ ТТС ДЛЯ ПРИМЕНЕНИЯ РОТИГОТИНА | 2003 |
|
RU2304434C2 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА | 2006 |
|
RU2450805C2 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА, СОДЕРЖАЩАЯ АЗЕНАПИН | 2019 |
|
RU2798017C2 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА ДЛЯ ВВЕДЕНИЯ АКТИВНОГО ВЕЩЕСТВА БУПРЕНОРФИНА | 2007 |
|
RU2484822C2 |
| РАЗРУШАЮЩАЯ УТИЛИЗАЦИЯ ЛЕКАРСТВЕННЫХ АКТИВНЫХ ИНГРЕДИЕНТОВ В ТРАНСДЕРМАЛЬНЫХ ТЕРАПЕВТИЧЕСКИХ СИСТЕМАХ | 2010 |
|
RU2563131C2 |
| ЗАМЕСТИТЕЛЬНОЕ ТРАНСДЕРМАЛЬНОЕ ВВЕДЕНИЕ ФЕНТАНИЛА ОДИН РАЗ В ДЕНЬ | 2008 |
|
RU2499583C2 |
| ТРАНСДЕРМАЛЬНЫЕ СИСТЕМЫ ДОСТАВКИ МЕМАНТИНА | 2017 |
|
RU2764764C2 |
| ОБЛАДАЮЩАЯ ВЫСОКОЙ ГИБКОСТЬЮ ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА С НИКОТИНОМ В КАЧЕСТВЕ АКТИВНОГО ВЕЩЕСТВА | 2002 |
|
RU2302856C2 |
| ТРАНСДЕРМАЛЬНЫЙ ПЛАСТЫРЬ ДЛЯ ВВЕДЕНИЯ ФЕНТАНИЛА | 2007 |
|
RU2351318C2 |
| Трансдермальный пластырь для введения фентанила | 2002 |
|
RU2708563C2 |
Группа изобретений относится к медицине. Описаны трансдермальные терапевтические системы (ТТС), которые в качестве биологически активного вещества содержат антагонист NMDA-рецепторов мемантин или его физиологически совместимую соль. Трансдермальные терапевтические системы могут изготавливаться и использоваться для лечения заболеваний центральной нервной системы и могут вводить мемантин на более длительный промежуток времени, например, по меньшей мере на 24 ч, и в течение этого промежутка времени могут поддерживаться фармакологически эффективные концентрации мемантина в плазме. 2 н. и 13 з.п. ф-лы, 4 табл., 3 ил., 3 пр.
1. Применение трансдермальной терапевтической системы, содержащей биологически активное вещество мемантин в форме свободного основания или физиологически совместимой соли для лечения или профилактики заболеваний центральной нервной системы, где указанная система включает
- непроницаемый для биологически активного вещества слой носителя;
- по меньшей мере один слой, содержащий биологически активное вещество, который содержит удерживающий материал, в который помещено это биологически активное вещество;
- при необходимости защитную пленку; и
при введении биологически активного вещества мемантина в форме свободного основания или физиологически совместимой соли имеет
- tmax по меньшей мере 24 ч,
и причем при следующих друг за другом или смещенных во времени применениях соответственно одной или нескольких трансдермальных терапевтических систем для интервалов между применениями, составляющих соответственно независимо друг от друга по меньшей мере 12 ч, у нуждающегося в лечении индивида в его плазме крови соответственно от начала первого применения достигаются следующие концентрации биологически активного вещества:
спустя 24 ч по меньшей мере 14 нг/мл,
спустя 48 ч по меньшей мере 27 нг/мл,
спустя 60 ч по меньшей мере 32 нг/мл,
спустя 72 ч по меньшей мере 37 нг/мл,
спустя 96 ч по меньшей мере 44 нг/мл,
спустя 144 ч по меньшей мере 54 нг/мл,
спустя 192 ч по меньшей мере 60 нг/мл,
спустя 240 ч по меньшей мере 63 нг/мл, и
спустя 300 ч по меньшей мере 65 нг/мл.
2. Применение трансдермальной терапевтической системы по п. 1, причем для каждого интервала между применениями продолжительность в часах, деленная на количество при необходимости одновременно используемых трансдермальных терапевтических систем, независимо друг от друга составляет величину в диапазоне от 3 до 8.
3. Применение трансдермальной терапевтической системы по п. 1, причем концентрации биологически активного вещества при применении соответственно одной или одновременно нескольких трансдермальных терапевтических систем достигаются в течение одного интервала между применениями.
4. Применение трансдермальной терапевтической системы по п. 1, причем соответственно от начала первого применения достигаются соответственно следующие концентрации биологически активного вещества:
спустя 24 ч максимально 50 нг/мл,
спустя 48 ч максимально 90 нг/мл,
спустя 60 ч максимально 110 нг/мл,
спустя 72 ч максимально 130 нг/мл,
спустя 96 ч максимально 150 нг/мл,
спустя 144 ч максимально 180 нг/мл,
спустя 192 ч максимально 195 нг/мл,
спустя 240 ч максимально 200 нг/мл, и
спустя 300 ч максимально 210 нг/мл.
5. Применение трансдермальной терапевтической системы по п. 1, причем концентрации биологически активного вещества достигаются, когда каждый интервал между применениями независимо друг от друга составляет максимально 72 ч.
6. Применение трансдермальной терапевтической системы по п. 1, причем
- его усредненная по интервалу между применениями скорость высвобождения биологически активного вещества лежит в диапазоне от 0,2 до 2,0 мг/ч; и/или
- его фармакокинетическое время запаздывания tlag составляет максимально 6 ч.
7. Применение трансдермальной терапевтической системы по п. 1, причем слой удерживающего материала расположен между непроницаемым для биологически активного вещества слоем носителя и проницаемым для биологически активного вещества мембранным материалом.
8. Применение трансдермальной терапевтической системы по п. 1, причем удерживающий материал:
- включает жидкую или гелеобразную композицию, в которой частично или полностью растворено биологически активное вещество; или
- включает матрицу на основе полимерного материала, в которой биологически активное вещество присутствует в растворенном виде или распределенным как микродисперсия; или
- включает полимерный материал на основе полиакрилата или полисиликона; или
- представляет собой липогель, который содержит от 10 до 50 мас. %, биологически активного вещества.
9. Применение трансдермальной терапевтической системы по одному из пп. 1 - 8, причем биологически активное вещество присутствует в виде физиологически совместимой соли.
10. Применение трансдермальной терапевтической системы по п. 9, причем слой, содержащий биологически активное вещество, дополнительно содержит по меньшей мере один основный материал, основность которого достаточна, чтобы вступать в реакцию с физиологически совместимой солью биологически активного вещества с высвобождением свободного основания биологически активного вещества.
11. Применение трансдермальной терапевтической системы по п. 10, причем этот основный материал выбирается из группы, состоящей из полимеров с основными боковыми группами, органических оснований и неорганических оснований.
12. Применение трансдермальной терапевтической системы по п. 11, причем этот основный материал отбирается из группы, состоящей из полимеров на акрилатной основе, которые имеют аминоалкильные боковые группы; неорганических оксидов или гидроксидов, органических аминов или их солей; алкоголятов или карбоксилатов щелочных или щелочноземельных металлов.
13. Применение трансдермальной терапевтической системы по одному из п.п. 10-12, причем слой, содержащий биологически активное вещество, содержит от 20 до 90 мас.% удерживающего материала, от 10 до 50 мас.% биологически активного вещества, а также при необходимости от 5 до 40 мас.% основного материала, в пересчете на общую массу слоя, содержащего биологически активное вещество.
14. Применение мемантина или физиологически совместимой соли для получения трансдермальной терапевтической системы, используемой
для лечения или профилактики заболеваний центральной нервной системы, где указанная система включает
- непроницаемый для биологически активного вещества слой носителя;
- по меньшей мере один слой, содержащий биологически активное вещество, который содержит удерживающий материал, в который помещено это биологически активное вещество;
- при необходимости защитную пленку; и
при введении биологически активного вещества мемантина в форме свободного основания или физиологически совместимой соли имеет
- tmax по меньшей мере 24 ч, и причем при следующих друг за другом или смещенных во времени применениях соответственно одной или нескольких трансдермальных терапевтических систем для интервалов между применениями, составляющих соответственно независимо друг от друга по меньшей мере 12 ч, у нуждающегося в лечении индивида в его плазме крови соответственно от начала первого применения достигаются следующие концентрации биологически активного вещества:
спустя 24 ч по меньшей мере 14 нг/мл,
спустя 48 ч по меньшей мере 27 нг/мл,
спустя 60 ч по меньшей мере 32 нг/мл,
спустя 72 ч по меньшей мере 37 нг/мл,
спустя 96 ч по меньшей мере 44 нг/мл,
спустя 144 ч по меньшей мере 54 нг/мл,
спустя 192 ч по меньшей мере 60 нг/мл,
спустя 240 ч по меньшей мере 63 нг/мл, и
спустя 300 ч по меньшей мере 65 нг/мл.
15. Применение по п. 14, причем заболевание центральной нервной системы выбирается среди слабоумия, травм, инсульта, болезни Паркинсона, болезни Хантингтона, эпилепсии, наркотической зависимости, депрессии и тревожного состояния.
| Колосоуборка | 1923 |
|
SU2009A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| RU 2008126459 A, 20.01.2010. | |||
Авторы
Даты
2016-03-27—Публикация
2011-06-15—Подача