ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к лечению острого инфаркта миокарда. Более конкретно, настоящее изобретение относится к применению конкретного низкотоксичного состава восстановленного липопротеина высокой плотности для лечения острого инфаркта миокарда. Также описано применение такого состава для лечения пациентов, которые ранее, или недавно, не перенесли острый инфаркт миокарда (ИМ), для уменьшения риска серьезного нежелательного сердечно-сосудистого явления (СНСЯ) у таких пациентов.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Несмотря на достижения в стратегиях лечения острого инфаркта миокарда (ИМ), для пациентов сохраняется высокий риск повторных ишемических явлений, особенно в ближайшие недели после события1. Повторные случаи чаще являются следствием дополнительного разрыва или эрозии бляшек, и связаны с серьезными осложнениями и смертью2,3. Хотя они могут происходить на участке сосуда, связанного с ИМ, они с равной вероятностью могут происходить и на другом участке в любом месте древа коронарных артерий2. Хотя низкий уровень холестерина липопротеинов высокой плотности (ЛПВП-Х) является фактором риска для серьезных нежелательных сердечно-сосудистых явлений (СНСЯ)4-12, остается неясным, приводит ли повышение уровня ЛПВП к уменьшению вероятности СНСЯ, поскольку несколько методов лечения, приводящих к повышению уровня ЛПВП-Х, не были связаны с улучшением клинических результатов13-17. Эти исследования могли быть ограничены вследствие неспособности обеспечивать для пациентов значительное уменьшение степени риска, нецелевой токсичности или неспособности вызывать повышение уровня функционального ЛПВП. Обратный транспорт холестерина (ОТХ), ex-vivo показатель функции ЛПВП, позволяет оценивать способность ЛПВП вызывать удаление избытка холестерина из атеросклеротических бляшек для переноса в печень. ОТХ является фактором, коррелирующим с СНСЯ, который не зависит от ЛПВП-Х, и, возможно, улучшение клинических результатов может быть более эффективным за счет идентификации фармакологических средств, действующих вскоре после острого ИМ, которые приводят к улучшению обратного транспорта холестерина и, тем самым, к уменьшению количества бляшек и стабилизации неустойчивых бляшек, чем за счет методов лечения, которые приводят лишь к повышению уровня ЛПВП18-20. Важно отметить, что в большинстве потерпевших неудачу исследований, направленных на повышение уровня ЛПВП-Х, была проведена оценка хронической фармакотерапии, и лечение не было начато сразу после инфаркта миокарда (ИМ), в период времени, когда обратный транспорт холестерина существенно нарушен21-23.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение, в целом, относится к применению составов восстановленного ЛПВП (вЛПВП) для лечения пациентов после острого инфаркта миокарда (ИМ). Конкретно, изобретение относится к лечению пациентов с ИМ периодическими инфузиями вЛПВП, которые приводят к увеличению обратного транспорта холестерина и не вызывают существенное изменение функции печени или почек. В некоторых вариантах осуществления пациент с ИМ имеет нормальную функцию почек. В некоторых вариантах осуществления пациент с ИМ имеет легкую почечную недостаточность. В некоторых вариантах осуществления пациент с ИМ имеет умеренную почечную недостаточность. Изобретение, в целом, также относится к применению составов вЛПВП для уменьшения риска серьезного нежелательного сердечно-сосудистого явления (СНСЯ) у пациентов, которые ранее не перенесли ИМ, или недавно не перенесли ИМ (то есть, которые не перенесли ИМ в пределах семи дней до начала лечения). В конкретном варианте осуществления такие пациенты имеют умеренную почечную недостаточность. В некоторых вариантах осуществления такие пациенты имеют легкую почечную недостаточность. В некоторых вариантах осуществления такие пациенты имеют нормальную функцию почек. Лечение пациентов, которые ранее, или недавно, не перенесли ИМ, может заключаться в периодических инфузиях вЛПВП, может приводить к увеличению обратного транспорта холестерина и, в предпочтительных вариантах осуществления, не вызывает существенное изменение функции печени или почек.
Один из аспектов изобретения относится к способу увеличения обратного транспорта холестерина (ОТХ) у пациента-человека после острого инфаркта миокарда (ИМ), включающему этапы:
в пределах приблизительно семи (7) дней после ИМ введения пациенту состава восстановленного липопротеина высокой плотности (вЛПВП), содержащего аполипопротеин, или его фрагмент, липид, стабилизатор и, необязательно, детергент, при этом соотношение между аполипопротеином и липидом составляет от приблизительно 1:20 до приблизительно 1:120 (моль:моль); и
последующего введения состава вЛПВП пациенту, предпочтительно, в течение по меньшей мере приблизительно четырех (4) недель;
что приводит к увеличению обратного транспорта холестерина (ОТХ) без вызывания существенного изменения функции печени или почек у человека.
Соответственно, доза, используемая в пределах семи (7) дней после острого ИМ, представляет собой начальную дозу состава восстановленного липопротеина высокой плотности (вЛПВП). Впоследствии пациенту вводят по меньшей мере три (3) дополнительные дозы состава вЛПВП, всего по меньшей мере четыре дозы (включая начальную дозу), предпочтительно, на протяжении по меньшей мере приблизительно четырех (4) недель от введения, включительно, начальной дозы. Период лечения может быть определен, как время от введения начальной дозы вЛПВП до одной недели после введения последней дозы.
Связанный аспект изобретения относится к составу восстановленного липопротеина высокой плотности (вЛПВП), содержащему аполипопротеин, или его фрагмент, липид, стабилизатор и, необязательно, детергент, при этом соотношение между аполипопротеином и липидом составляет от приблизительно 1:20 до приблизительно 1:120 (моль:моль), для применения с целью увеличения обратного транспорта холестерина (ОТХ) у пациента-человека после острого инфаркта миокарда (ИМ), при этом состав вЛПВП вводят пациенту-человеку в пределах приблизительно семи (7) дней после острого ИМ, с последующим введением пациенту, предпочтительно, в течение по меньшей мере приблизительно четырех (4) недель.
Другой аспект изобретения относится к способу лечения острого инфаркта миокарда (ИМ) у пациента-человека, включающему этапы:
в пределах приблизительно семи (7) дней после ИМ введения пациенту состава восстановленного липопротеина высокой плотности (вЛПВП), содержащего аполипопротеин, или его фрагмент, липид, стабилизатор и, необязательно, детергент, при этом соотношение между аполипопротеином и липидом составляет от приблизительно 1:20 до приблизительно 1:120 (моль:моль); и
последующего введения состава вЛПВП пациенту, предпочтительно, в течение по меньшей мере приблизительно четырех (4) недель;
что приводит к лечению острого инфаркта миокарда (ИМ) у пациента без вызывания существенного изменения функции печени или почек у пациента.
Соответственно, доза, используемая в пределах семи (7) дней после острого ИМ, представляет собой начальную дозу состава восстановленного липопротеина высокой плотности (вЛПВП). Впоследствии пациенту вводят по меньшей мере три (3) дополнительные дозы состава вЛПВП, всего по меньшей мере четыре дозы (включая начальную дозу), предпочтительно, на протяжении по меньшей мере приблизительно четырех (4) недель от введения, включительно, начальной дозы. Период лечения может быть определен, как время от введения начальной дозы вЛПВП до одной недели после введения последней дозы.
Связанный аспект изобретения относится к составу восстановленного липопротеина высокой плотности (вЛПВП), содержащему аполипопротеин, или его фрагмент, липид, стабилизатор и, необязательно, детергент, при этом соотношение между аполипопротеином и липидом составляет от приблизительно 1:20 до приблизительно 1:120 (моль:моль), для применения с целью лечения острого инфаркта миокарда (ИМ) у пациента-человека, при этом состав вЛПВП вводят пациенту-человеку в пределах приблизительно семи (7) дней после острого ИМ, с последующим введением пациенту, предпочтительно, в течение по меньшей мере приблизительно четырех (4) недель.
Другой аспект изобретения относится к способу уменьшения риска серьезного нежелательного сердечно-сосудистого явления (СНСЯ) у пациента-человека, который ранее не перенес ИМ, или который не перенес ИМ в пределах семи дней до начала лечения, включающему этапы:
введения пациенту состава восстановленного липопротеина высокой плотности (вЛПВП), содержащего аполипопротеин, или его фрагмент, липид, стабилизатор и, необязательно, детергент, при этом соотношение между аполипопротеином и липидом составляет от приблизительно 1:20 до приблизительно 1:120 (моль:моль),
что приводит к уменьшению риска СНСЯ у пациента, в некоторых вариантах осуществления, без вызывания существенного изменения функции печени или почек у человека.
Связанный аспект изобретения относится к составу восстановленного липопротеина высокой плотности (вЛПВП), содержащему аполипопротеин, или его фрагмент, липид, стабилизатор и, необязательно, детергент, при этом соотношение между аполипопротеином и липидом составляет от приблизительно 1:20 до приблизительно 1:120 (моль:моль), для применения в способе уменьшения риска СНСЯ у пациента-человека, который ранее не перенес ИМ, или не перенес ИМ в пределах семи дней до начала лечения, и, в некоторых вариантах осуществления, без вызывания существенного изменения функции печени или почек у человека.
Другой аспект изобретения относится к способу увеличения ОТХ у пациента-человека, который ранее не перенес ИМ, или не перенес ИМ в пределах семи дней до начала лечения, включающему этап:
введения пациенту состава восстановленного липопротеина высокой плотности (вЛПВП), содержащего аполипопротеин, или его фрагмент, липид, стабилизатор и, необязательно, детергент, при этом соотношение между аполипопротеином и липидом составляет от приблизительно 1:20 до приблизительно 1:120 (моль:моль),
что приводит к увеличению обратного транспорта холестерина (ОТХ) и, в некоторых вариантах осуществления, без вызывания существенного изменения функции печени или почек у человека.
Связанный аспект изобретения относится к составу восстановленного липопротеина высокой плотности (вЛПВП), содержащему аполипопротеин, или его фрагмент, липид, стабилизатор и, необязательно, детергент, при этом соотношение между аполипопротеином и липидом составляет от приблизительно 1:20 до приблизительно 1:120 (моль:моль), для применения в способе увеличения обратного транспорта холестерина (ОТХ) у пациента-человека, который ранее не перенес ИМ, или не перенес ИМ в пределах семи дней до начала лечения, и, в некоторых вариантах осуществления, без вызывания существенного изменения функции печени или почек у человека.
В вариантах осуществления, в которых пациент ранее не перенес ИМ, или не перенес ИМ в пределах семи дней до начала лечения, пациент может иметь нормальную функцию почек, умеренную почечную недостаточность, или может иметь легкую почечную недостаточность. В конкретных вариантах осуществления пациент имеет умеренную почечную недостаточность, как в примере 2.
Предпочтительно, способы, описанные в настоящем документе, приводят к увеличению обратного транспорта холестерина (ОТХ) у человека.
В некоторых вариантах осуществления вышеуказанных аспектов общий ОТХ увеличивается в диапазоне от 1,5 до 2 раз.
В некоторых вариантах осуществления вышеуказанных аспектов ABCA1-зависимый ОТХ увеличивается в диапазоне от 3 до приблизительно 5 раз.
Предпочтительно, в вышеуказанных аспектах, в которых пациент недавно перенес острый ИМ, пациенту первоначально вводят вЛПВП в пределах 5 дней после острого ИМ. В некоторых вариантах осуществления пациенту-человеку первоначально вводят состав вЛПВП не ранее, чем через 12 часов после острого ИМ или после введения контрастного вещества для ангиографии.
Предпочтительно, последующее введение состава вЛПВП производят еженедельно, предпочтительно, в течение по меньшей мере четырех (4) недель.
Если пациент ранее не перенес ИМ, или не перенес ИМ в пределах семи дней до начала лечения, начальное введение состава вЛПВП можно производить в любое время, и затем можно производить последующие введения в соответствующие моменты времени, например, в течение периода времени 1, 2, 3 или 4 недели, или дольше. Предпочтительно, последующее введение состава вЛПВП производят еженедельно, предпочтительно, в течение четырех (4) недель или дольше.
Предпочтительно, в соответствии с вышеуказанными аспектами состав вЛПВП вводят внутривенной (в/в) инфузией.
Предпочтительно, аполипопротеин представляет собой apoA-I. Предпочтительно, количество apoA-I в составе вЛПВП составляет по меньшей мере 2 г или по меньшей мере 4 г, или по меньшей мере 6 г. В конкретном варианте осуществления количество apoA-I в составе вЛПВП составляет от 2 г до 8 г. В одном из вариантов осуществления количество apoA-I в составе вЛПВП составляет 6 г.
Предпочтительно, стабилизатор представляет собой сахарозу. Предпочтительно, сахароза присутствует в составе вЛПВП в концентрации от приблизительно 1,0% до менее 6,0% по массе.
В конкретном варианте осуществления предложен способ увеличения обратного транспорта холестерина (ОТХ) у пациента-человека после острого инфаркта миокарда (ИМ), включающий этапы: в пределах приблизительно семи (7) дней после острого ИМ введения пациенту состава восстановленного липопротеина высокой плотности (вЛПВП), содержащего по меньшей мере 6 г apoA-I, фосфатидилхолин, стабилизатор и холат натрия на уровне, выбранном из группы, состоящей из приблизительно 0,5-1,5 г/л и/или приблизительно 0,010-0,030 г/г apoA-I, и от приблизительно 1,0% до менее 6,0% по массе сахарозы, при этом соотношение между apoA-I и фосфатидилхолином составляет от приблизительно 1:20 до приблизительно 1:120 (моль:моль); и последующего введения состава вЛПВП человеку в течение по меньшей мере четырех (4) недель; что приводит к увеличению обратного транспорта холестерина (ОТХ) у пациента-человека без вызывания существенного изменения функции печени и/или почек у человека, при этом признаком существенного изменения функции печени является значение АЛТ, более чем приблизительно в 2 или 3 раза превышающее верхний предел нормы (ВПН); или увеличение уровня общего билирубина до значения, по меньшей мере в 1,5-2 раза превышающего ВПН; и признаком существенного изменения функции почек является уровень сывороточного креатинина, превышающий более чем, или приблизительно, в 1,2-1,5 раза исходное значение, и/или показатель рСКФ, значительно меньший, чем 90 мл/мин/м2 (например, значительно меньший, чем 90 мл/мин/1,73 м2). Например, на существенное изменение функции почек может указывать показатель рСКФ, значительно меньший, чем 90 мл/мин/1,73 м2. Дополнительно или альтернативно, пациента можно считать не имеющим существенное изменение функции почек, если показатель рСКФ после лечения вЛПВП находится в пределах 30, 20 или 10 мл/мин/1,73 м2 от показателя рСКФ до лечения, как описано более подробно ниже.
В связанном конкретном варианте осуществления предложен состав восстановленного липопротеина высокой плотности (вЛПВП), содержащий по меньшей мере 6 г apoA-I, фосфатидилхолин, стабилизатор и холат натрия на уровне, выбранном из группы, состоящей из приблизительно 0,5-1,5 г/л и/или приблизительно 0,010-0,030 г/г apoA-I, и от приблизительно 1,0% до менее 6,0% по массе сахарозы, при этом соотношение между apoA-I и фосфатидилхолином составляет от приблизительно 1:20 до приблизительно 1:120 (моль:моль), для применения с целью увеличения обратного транспорта холестерина (ОТХ) у пациента-человека в пределах приблизительно семи (7) дней после острого ИМ, при этом состав вЛПВП впоследствии вводят пациенту-человеку в течение по меньшей мере приблизительно четырех (4) недель, что приводит к увеличению обратного транспорта холестерина (ОТХ) у пациента-человека без вызывания существенного изменения функции печени и/или почек у человека; при этом признаком существенного изменения функции печени является значение АЛТ, более чем приблизительно в 2 или 3 раза превышающее верхний предел нормы (ВПН); или увеличение уровня общего билирубина до значения, по меньшей мере в 1,5-2 раза превышающего ВПН; и признаком существенного изменения функции почек является уровень сывороточного креатинина, превышающий более чем, или приблизительно, в 1,2-1,5 раза исходное значение, и/или показатель рСКФ, существенно меньший, чем 90 мл/мин/м2 (например, существенно меньший, чем 90 мл/мин/1,73 м2). Например, на существенное изменение функции почек может указывать показатель рСКФ, существенно меньший, чем 90 мл/мин/1,73 м2. Дополнительно или альтернативно, пациента можно считать не имеющим существенное изменение функции почек, если показатель рСКФ после лечения вЛПВП находится в пределах 30, 20 или 10 мл/мин/1,73 м2 от показателя рСКФ до лечения, как описано более подробно ниже.
В следующем варианте осуществления предложен способ уменьшения риска СНСЯ и/или увеличения ОТХ у пациента-человека, который ранее не перенес ИМ, или не перенес ИМ в пределах семи дней до начала лечения, включающий этапы: введения пациенту состава восстановленного липопротеина высокой плотности (вЛПВП), содержащего по меньшей мере 6 г apoA-I, фосфатидилхолин, стабилизатор и холат натрия на уровне, выбранном из группы, состоящей из приблизительно 0,5-1,5 г/л и/или приблизительно 0,010-0,030 г/г apoA-I, и от приблизительно 1,0% до менее 6,0% по массе сахарозы, при этом соотношение между apoA-I и фосфатидилхолином составляет от приблизительно 1:20 до приблизительно 1:120 (моль:моль), что приводит к уменьшению риска СНСЯ и/или увеличению ОТХ у пациента. В некоторых вариантах осуществления это уменьшение риска СНСЯ и/или увеличение ОТХ у пациента происходит без вызывания существенного изменения функции печени и/или почек у человека.
В связанном конкретном варианте осуществления предложен состав восстановленного липопротеина высокой плотности (вЛПВП), содержащий по меньшей мере 6 г apoA-I, фосфатидилхолин, стабилизатор и холат натрия на уровне, выбранном из группы, состоящей из приблизительно 0,5-1,5 г/л и/или приблизительно 0,010-0,030 г/г apoA-I, и от приблизительно 1,0% до менее 6,0% по массе сахарозы, при этом соотношение между apoA-I и фосфатидилхолином составляет от приблизительно 1:20 до приблизительно 1:120 (моль:моль), для применения в способе уменьшения риска СНСЯ и/или увеличения ОТХ у пациента-человека, который ранее не перенес ИМ, или не перенес ИМ в пределах семи дней до начала лечения. В некоторых вариантах осуществления это уменьшение риска СНСЯ и/или увеличение ОТХ у пациента происходит без вызывания существенного изменения функции печени и/или почек у человека.
Следует понимать, что способ, раскрытый в настоящем документе, может включать введение одного или более дополнительных терапевтических средств. Аналогично, состав восстановленного липопротеина высокой плотности (вЛПВП), раскрытый в настоящем документе, для применения в конкретных способах, раскрытых в настоящем документе, может быть применен с одним или более дополнительными терапевтическими средствами. Предпочтительно, одно или более дополнительных терапевтических средств могут помогать или способствовать лечению, предотвращению или уменьшению риска острого инфаркта миокарда (ИМ) и/или СНСЯ, и/или увеличению обратного транспорта холестерина (ОТХ) у пациента-человека, но без ограничения.
Если состав восстановленного липопротеина высокой плотности (вЛПВП), раскрытый в настоящем документе, используется, или предназначен для применения, в конкретном способе, описанном в настоящем документе, с одним или более дополнительными терапевтическими средствами, это может быть описано, как состав вЛПВП по настоящему изобретению, предназначенный для применения в данном способе в сочетании с одним или более дополнительными терапевтическими средствами (например, одним или более липид-модифицирующими средствами; одним или более ингибиторами поглощения холестерина; одним или более антикоагулянтами; одним или более антигипертензивными средствами и одной или более связывающими желчные кислоты молекулами). Это также может быть описано, как одно или более терапевтических средств, выбранных из одного или более липид-модифицирующих средств; одного или более ингибиторов поглощения холестерина; одного или более антикоагулянтов; одного или более антигипертензивных средств и одной или более связывающих желчные кислоты молекул, для применения в данном способе в сочетании с составом вЛПВП по настоящему изобретению. Также предложен состав вЛПВП по настоящему изобретению и одно или более дополнительных терапевтических средств (например, одно или более липид-модифицирующих средств; один или более ингибиторов поглощения холестерина; один или более антикоагулянтов; одно или более антигипертензивных средств и одна или более связывающих желчные кислоты молекул) для применения в виде комбинированного состава в конкретном способе, описанном в настоящем документе. Средства в комбинированном составе могут быть предназначены для одновременного или последовательного введения.
Одно или более дополнительных терапевтических средств могут включать: одно или более липид-модифицирующих средств; один или более ингибиторов поглощения холестерина; один или более антикоагулянтов; одно или более антигипертензивных средств и одну или более связывающих желчные кислоты молекул.
В тексте настоящей заявки, если нет иных указаний, «включать», «включает» и «включая» используют в качестве включающих, а не исключающих терминов, так что указанное целое значение или группа целых значений может включать одно или более других не указанных целых значений или групп целых значений.
Следует также понимать, что термины в единственном числе не следует интерпретировать, как относящиеся только к одиночным объектам или иным образом исключающие большие, чем один, или единственный, количества объектов, к которым относятся эти термины. Например, термин «белок» включает один белок, один или более белков, или множество белков.
Используемое в настоящем документе применительно к пациенту-человеку выражение «который недавно не перенес ИМ» означает, что пациент не перенес ИМ в пределах семи дней до начала лечения. То есть, к моменту введения состава вЛПВП, описанного в настоящем документе, прошло восемь или более дней после того, как пациент перенес ИМ. В некоторых вариантах осуществления такой пациент не перенес ИМ в пределах 8, 9 или 10 дней, или более, например, 2, 3 или 4 недель, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев, или 1, 2, 3, 4, 5, 10, 15, 20, 30, 40, 50, 60, 70, 80 или 90 лет до начала лечения. Дополнительно или альтернативно, в некоторых вариантах осуществления у таких пациентов не был диагностирован ИМ, который произошел в один из периодов времени, описанных выше.
Как отмечено выше, используемое в настоящем документе выражение «существенное изменение функции печени» означает, что показатель АЛТ превышает приблизительно в 2 или 3 раза верхний предел нормы (ВПН); или уровень общего билирубина превышает по меньшей мере в 1,5-2 раза ВПН, и используется взаимозаменяемо с выражением «значительное изменение функции печени».
Как отмечено выше, используемое в настоящем документе выражение «существенное изменение функции почек» означает, что уровень сывороточного креатинина превышает более чем, или приблизительно, в 1,2-1,5 раза исходное значение, и/или показатель рСКФ значительно меньше, чем 90 мл/мин/м2 (например, значительно меньше, чем 90 мл/мин/1,73 м2). Например, на существенное изменение функции почек может указывать показатель рСКФ, значительно меньший, чем 90 мл/мин/1,73 м2. Дополнительно или альтернативно, пациента можно считать не имеющим существенное изменение функции почек, если показатель рСКФ после лечения вЛПВП находится в пределах 30, 20 или 10 мл/мин/1,73 м2 от показателя рСКФ до лечения, как описано более подробно ниже. В настоящем документе выражение «существенное изменение функции почек» используют взаимозаменяемо с выражением «значительное изменение функции почек».
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1: Схема распределения участников исследования.
Фигура 2: Время до возникновения первого СНСЯ. Совокупность случаев смерти от сердечно-сосудистого заболевания, случаев не фатального ИМ, ишемического инсульта и госпитализации по поводу нестабильной стенокардии. Пунктирная линия в день 112 обозначает завершающее посещение в конце исследования.
Фигура 3: Время до возникновения первого исследовательского СНСЯ. Совокупность случаев смерти от сердечно-сосудистого заболевания, случаев не фатального ИМ и инсульта. Пунктирная линия в день 112 обозначает завершающее посещение в конце исследования.
Фигура 4: Дни после рандомизации до смерти.
Фигура 5: Профили apoA-I после инфузии CSL112 у субъектов с умеренной почечной недостаточностью (Ум. ПН) или нормальной функцией почек (НФП). Величины представлены в виде средних значений (скорректированных на исходное значение) со стандартным отклонением.
Фигуры 6A-6B: Показатели обратного транспорта холестерина (ОТХ) и уровни пре-β1-ЛПВП после инфузии CSL112 у субъектов с умеренной почечной недостаточностью (Ум. ПН) или нормальной функцией почек (НФП). Величины представлены в виде средних значений (скорректированных на исходное значение) со стандартным отклонением.
Фигуры 7A-7B: Влияние увеличения дозы CSL112 на показатели обратного транспорта холестерина (ОТХ) и уровни пре-β1-ЛПВП у субъектов с умеренной почечной недостаточностью (Ум. ПН) или нормальной функцией почек (НФП). Показаны точки индивидуальных данных с кривыми регрессии.
Фигура 8: Превращение не этерифицированного холестерина (ЛПВП-НХ) в этерифицированный холестерин (ЛПВП-ЭХ) после инфузии CSL112 у субъектов с умеренной почечной недостаточностью (Ум. ПН) и нормальной функцией почек (НФП). Величины представлены в виде средних значений (скорректированных на исходное значение) со стандартным отклонением для дозы 6 г CSL112.
Фигура 9: Распределение участников клинического исследования. Субъектов считали завершившими исследование, если они выполняли все запланированные посещения во время исследования вплоть до, и включительно, периода последующего наблюдения для оценки безопасности/посещения 8.
Фигура 10: Коробчатые диаграммы изменения уровней сывороточного креатинина от исходных значений (центральная лаборатория) в AEGIS-I и 2001, сгруппированные по состоянию функции почек, посещениям и варианту лечения (популяция для оценки безопасности). рСКФ=расчетная скорость клубочковой фильтрации. Примечание: Концы каждой коробки соответствуют верхнему и нижнему квартилям, медиана отмечена горизонтальной линией внутри коробки, при этом кружки (CSL112) и квадраты (плацебо) соответствуют средним значениям. Два вертикальных уса отходят от нижнего и верхнего квартилей к наименьшему и наибольшему не выпадающим значениям, соответственно. Выпадающие значения представлены в виде точек индивидуальных данных за пределами концов каждого уса. Для лучшего определения тенденций ось Y была укорочена и, в результате, предельные значения не представлены. Исследование CSL112-2001, посещение 7, день 29 (7-10 дней после последней инфузии), включает данные для субъектов, которые прекратили лечение в исследовании или которые рано прекратили участие в исследовании. Субъекты с тяжелой почечной недостаточностью (рСКФ <30 мл/мин/1,73 м2) исключены из совокупных анализов. Запланированный день исследования [X]: AEGIS-I посещение/2001 посещение - день 2: 2a/3, день 8: 3/4, день 15: 4/5, день 22: 5/6, день 29: 6/7.
Фигура 11. Коробчатые диаграммы изменения уровней сывороточного креатинина от исходных значений (центральная лаборатория) в AEGIS-I и 2001, сгруппированные по времени между ангиографией и введением первой дозы, состоянию функции почек, посещениям и варианту лечения (популяция для оценки безопасности). A: подгруппа: 12 - <24 часов; B: подгруппа: 24 - <48 часов; C: подгруппа: ≥ 48 часов. рСКФ=расчетная скорость клубочковой фильтрации. Примечание: Концы каждой коробки соответствуют верхнему и нижнему квартилям, медиана отмечена горизонтальной линией внутри коробки, при этом кружки (CSL112) и квадраты (плацебо) соответствуют средним значениям. Два вертикальных уса отходят от нижнего и верхнего квартилей к наименьшему и наибольшему не выпадающим значениям, соответственно. Выпадающие значения представлены в виде точек индивидуальных данных за пределами концов каждого уса. Для лучшего определения тенденций ось Y была укорочена и, в результате, предельные значения не представлены. Исследование CSL112-2001, посещение 7, день 29 (7-10 дней после последней инфузии), включает данные для субъектов, которые прекратили лечение в исследовании, или которые рано прекратили участие в исследовании. Субъекты с тяжелой почечной недостаточностью (рСКФ <30 мл/мин/1,73 м²) исключены из совокупных анализов. Запланированный день исследования [X]: AEGIS-I посещение/2001 посещение - день 2: 2a/3, день 8: 3/4, день 15: 4/5, день 22: 5/6, день 29: 6/7.
Фигура 12. Коробчатые диаграммы изменения показателей рСКФ от исходных значений (центральная лаборатория) в AEGIS-I и 2001, сгруппированные по состоянию функции почек, посещениям и варианту лечения (популяция для оценки безопасности). рСКФ=расчетная скорость клубочковой фильтрации. Примечание: Концы каждой коробки соответствуют верхнему и нижнему квартилям, медиана отмечена горизонтальной линией внутри коробки, при этом кружки (CSL112) и квадраты (плацебо) соответствуют средним значениям. Два вертикальных уса отходят от нижнего и верхнего квартилей к наименьшему и наибольшему не выпадающим значениям, соответственно. Выпадающие значения представлены в виде точек индивидуальных данных за пределами концов каждого уса. Исследование CSL112-2001, посещение 7, день 29 (7-10 дней после последней инфузии), включает данные для субъектов, которые прекратили лечение в исследовании, или которые рано прекратили участие в исследовании. Субъекты с тяжелой почечной недостаточностью (рСКФ <30 мл/мин/1,73 м²) исключены из совокупных анализов. Запланированный день исследования [X]: AEGIS-I посещение/2001 посещение - день 2: 2a/3, день 8: 3/4, день 15: 4/5, день 22: 5/6, день 29: 6/7.
Фигура 13. Общий обратный транспорт холестерина, ОТХ (%), в популяции пациентов, получающих CSL112 (6 г) в исследовании CSL112_2001 (пример 3), относительно пациентов, получающих CSL112 в исследовании AEGIS-I (пример 1), в начале исследования, во время посещений 2, 3 и 6.
Фигура 14. Независимый от переносчика холестерина ABCA1 показатель ОТХ (%) в популяции пациентов, получающих CSL112 (6 г) в исследовании CSL112_2001 (пример 3), относительно пациентов, получающих CSL112 в исследовании AEGIS-I (пример 1), в начале исследования, во время посещений 2, 3 и 6.
Фигура 15. Зависимый от переносчика холестерина ABCA1 показатель ОТХ (%) в популяции пациентов, получающих CSL112 (6 г) в исследовании CSL112_2001 (пример 3), относительно пациентов, получающих CSL112 в исследовании AEGIS-I (пример 1), в начале исследования, во время посещений 2, 3 и 6.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В некоторых аспектах изобретение основано на том открытии, что введение составов восстановленного ЛПВП (вЛПВП) может быть полезным для лечения пациентов с острым ИМ. Более конкретно, четыре (4) еженедельные инфузии составов вЛПВП, таких как CSL112, являются эффективными, хорошо переносимыми и не связаны с какими-либо значительными изменениями функции печени или почек, либо с другими проблемами безопасности. Такие составы, как CSL112, приводят к увеличению обратного транспорта холестерина (ОТХ) после введения пациентам. Данный эффект был продемонстрирован для пациентов с острым ИМ, имеющих нормальную функцию почек и легкую почечную недостаточность (смотри пример 1).
В некоторых аспектах изобретение относится к тому открытию, что введение составов восстановленного ЛПВП (вЛПВП) пациентам с умеренной почечной недостаточностью (Ум. ПН) приводит к увеличению обратного транспорта холестерина (ОТХ). Аналогичные эффекты на ОТХ были обнаружены у здоровых людей и пациентов с умеренной почечной недостаточностью, результаты для которых приведены в примере 1, после введения составов вЛПВП. Кроме того, увеличение пре-β1-ЛПВП было более выраженным у пациентов с умеренной почечной недостаточностью (Ум. ПН), чем у тех, которые имели нормальную функцию почек (смотри пример 2). Эти результаты были получены для субъектов с Ум. ПН, которые не перенесли ИМ в пределах семи дней до начала лечения. Таким образом, в некоторых аспектах изобретение относится к тому открытию, что введение составов восстановленного ЛПВП (вЛПВП) пациентам, которые ранее не перенесли ИМ, или которые недавно не перенесли ИМ, приводит к увеличению обратного транспорта холестерина (ОТХ) и, следовательно, может быть полезным для уменьшения риска СНСЯ. Такие субъекты могут иметь умеренную почечную недостаточность, легкую почечную недостаточность или нормальную функцию почек. В следующих вариантах осуществления данные, представленные в примере 3, демонстрируют безопасность и эффективность введения вЛПВП субъектам с Ум. ПН; эти пациенты представляют важную, отличающуюся высокой степенью риска, подгруппу пациентов, перенесших ИМ, с высокой неудовлетворенной потребностью в медицинской помощи.
Без связи с конкретной теорией, клиническая значимость результатов, достигнутых для пациентов с Ум. ПН, является двоякой. Во-первых, они подтверждают, что эффект вЛПВП на ОТХ у пациентов с острым ИМ может быть воспроизведен у пациентов с Ум. ПН. Кроме того, тот факт, что увеличение ОТХ имело место после введения вЛПВП у пациентов, которые не являлись пациентами с острым ИМ, свидетельствует в пользу применения вЛПВП для уменьшения риска СНСЯ на основании его способности вызывать увеличение ОТХ.
Как описано в настоящем документе, в конкретных аспектах изобретение относится к лечению пациентов-людей после острого ИМ. ИМ, как правило, является результатом коронарной болезни сердца (КБС) или связанных заболеваний, нарушений или состояний, включая болезнь коронарных артерий, ишемическую болезнь сердца, атеросклероз, стенокардию, желудочковую аритмию и/или фибрилляцию желудочков. КБС является следствием постепенного накопления холестерина в коронарных артериях, что может приводить к инфаркту миокарда (ИМ), потенциально смертельному разрушению сердечной мышцы.
Термин «острый коронарный синдром (ОКС)» относится к спектру клинических проявлений, от тех, которые имеют место при инфаркте миокарда с подъемом сегмента ST (STEMI), до проявлений, имеющих место при инфаркте миокарда без подъема сегмента ST (NSTEMI) или при нестабильной стенокардии (НС). Он почти всегда связан с разрывом или эрозией атеросклеротической бляшки и частичным или полным тромбозом связанной с инфарктом артерии.
Используемый в настоящем документе термин «серьезное нежелательное сердечно-сосудистое явление», или «СНСЯ», включает смерть от сердечно-сосудистого заболевания, фатальный или не фатальный инфаркт миокарда, НС, фатальный или не фатальный инсульт, потребность в процедуре реваскуляризации, сердечную недостаточность, реанимацию при остановке сердца и/или новое объективное свидетельство ишемии, а также любые, и все, подкатегории явлений, попадающие в рамки каждого из этих явлений (например, STEMI и NSTEMI, документированная НС с необходимостью срочной госпитализации). В конкретных вариантах осуществления СНСЯ представляет собой смерть от сердечно-сосудистого заболевания, фатальный или не фатальный ИМ, НС (включая НС с необходимостью срочной госпитализации), фатальный или не фатальный инсульт и/или риск, или опасность, в связи с реваскуляризацией. В конкретных вариантах осуществления СНСЯ представляет собой смерть от сердечно-сосудистого заболевания, фатальный или не фатальный ИМ и ишемический инсульт. В конкретных вариантах осуществления СНСЯ представляет собой смерть от сердечно-сосудистого заболевания, фатальный или не фатальный ИМ, например, ИМ. В конкретных вариантах осуществления лечение или предотвращение коронарной болезни сердца (или уменьшение риска коронарной болезни сердца, или лечение пациентов, имеющих риск СНСЯ, включая пациентов, которые перенесли острый ИМ, или пациентов, которые не перенесли острый ИМ, или которые не перенесли ИМ в пределах семи дней до начала лечения) таким составом, как вЛПВП, приводит к уменьшению вероятности развития СНСЯ, отсрочке развития СНСЯ и/или уменьшению степени тяжести СНСЯ. В каждом из этих случаев эффект на СНСЯ может означать эффект на СНСЯ, в целом (например, снижение вероятности развития всех видов СНСЯ), эффект на один или более конкретных видов СНСЯ, например, снижение вероятности смерти, не фатального ИМ, НС с необходимостью срочной госпитализации, не фатального инсульта, либо необходимости в процедуре реваскуляризации или связанного с ней риска, или их сочетание.
В некоторых аспектах, описанных в настоящем документе, состав вЛПВП предназначен для применения с целью либо (i) уменьшения риска последующего СНСЯ у пациента, который недавно перенес ИМ (то есть, который перенес ИМ в пределах семи дней до начала лечения), либо (ii) уменьшения риска СНСЯ у пациента, который не перенес ИМ, или который недавно не перенес ИМ (то есть, который не перенес ИМ в пределах семи дней до начала лечения). В этих контекстах, уменьшение риска СНСЯ может означать уменьшение вероятности развития СНСЯ, отсрочку развития СНСЯ и/или уменьшение степени тяжести СНСЯ. Это может происходить за счет увеличения ОТХ; таким образом, в предпочтительных вариантах осуществления уменьшение риска СНСЯ (или риска последующего СНСЯ) сопровождается увеличением ОТХ, более предпочтительно, увеличением ABCA1-зависимого ОТХ.
Пациенты, имеющие риск СНСЯ, включают пациентов, которые перенесли ИМ, и пациентов с коронарной болезнью сердца или связанными заболеваниями, указанными выше. Такие пациенты особенно предусмотрены в качестве субъектов по настоящему изобретению.
Термин «инфаркт миокарда» (другие названия «острый инфаркт миокарда», «острый ИМ» или «ОИМ») хорошо известен в данной области и является синонимом более широко используемого термина «сердечный приступ». Острый ИМ развивается, когда останавливается приток крови к части сердца, что вызывает повреждение сердечной мышцы. Острый ИМ может вызывать сердечную недостаточность, нерегулярное сердцебиение (включая серьезные случаи), кардиогенный шок или остановку сердца.
Преобладающей причиной острого ИМ является болезнь коронарных артерий, и острый ИМ часто возникает в результате блокады коронарной артерии, вызванной разрывом атеросклеротической бляшки. Факторы риска включают высокое кровяное давление, курение, диабет, недостаток физической активности, ожирение, высокий уровень холестерина в крови, неправильное питание и избыточное потребление алкоголя.
Острый ИМ часто диагностируют на основании электрокардиограммы (ЭКГ, которая позволяет определять, является ли острый ИМ инфарктом миокарда с подъемом сегмента ST (STEMI) или инфарктом миокарда без подъема сегмента ST (NSTEMI)), анализов крови (например, для определения тропонина) и результатов коронарной ангиографии. Пациент с острым ИМ, таким образом, может иметь STEMI или NSTEMI. Признанные критерии для определения острого ИМ приведены, например, в публикации Thygesen et al.30
Без связи с конкретной теорией, считается, что увеличение ОТХ вследствие введения вЛПВП (как показано в примерах) связано с обратным транспортом холестерина из атеросклеротических бляшек и, как следствие, уменьшением вероятности СНСЯ.
Используемые в настоящем документе термины «лечение» или «лечить», или «терапия» означают терапевтическое вмешательство, которое, по меньшей мере частично, устраняет, или уменьшает, одну или более существующих, или ранее выявленных, патологий, или симптомов, заболевания или состояния. В некоторых вариантах осуществления лечение после острого ИМ может, по меньшей мере частично или временно, предотвращать или подавлять, либо уменьшать вероятность последующего ИМ.
Следует понимать, что лечение можно считать проведенным, даже если некоторые симптомы заболевания, или состояния, появляются или сохраняются, и полное или абсолютное устранение, уменьшение, предотвращение или подавление заболевания, состояния или симптома не является обязательным.
При применении в настоящем документе «уменьшение» или «увеличение» какого-либо параметра, как правило, происходит на любое количество, однако предпочтительно происходит на статистически значимое количество, и происходит относительно того же параметра в отсутствие указанного лечения. Например, уменьшение риска СНСЯ (например, уменьшение вероятности развития или уменьшение степени тяжести СНСЯ) представляет собой уменьшение риска СНСЯ в сравнении с риском СНСЯ (например, вероятностью развития или степенью тяжести СНСЯ) в отсутствие лечения, описанного в настоящем документе. Это уменьшение, или снижение, может происходить на любое количество (например, 5, 10, 15, 20, 25, 50% или более). Аналогично, если уменьшение риска проявляется в отсрочке развития СНСЯ, эта отсрочка имеет место относительно времени развития СНСЯ в отсутствие лечения, описанного в настоящем документе, и может происходить на любое количество времени (например, отсрочка на 1, 2, 3, 4, 5 или 6 месяцев, или более, либо 1, 2, 5 или 10 лет или более, например, от 1 месяца до 10 лет), однако предпочтительно имеет место статистически значимая отсрочка.
В конкретных аспектах изобретения пациент-человек получает лечение в пределах 7 дней после острого ИМ. В других аспектах пациент-человек не перенес ИМ, или недавно не перенес ИМ, то есть, не перенес ИМ в пределах семи дней до начала лечения (то есть, к моменту начала лечения прошло более семи дней с тех пор, как пациент перенес ИМ). Как описано выше, диагностирование ИМ является рутинной процедурой. В конкретных вариантах осуществления пациент-человек не перенес ИМ в пределах 8, 9 или 10 дней, или более, до начала лечения, либо 2, 3 или 4 недель до начала лечения, или более, либо в пределах 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев до начала лечения, или более, либо в пределах 1, 2, 5, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90 лет до начала лечения. Альтернативно, у пациента-человека не был диагностирован ИМ, произошедший в один из периодов времени, указанных выше.
Пациент может иметь риск развития СНСЯ по любой причине, например, из-за наличия коронарной болезни сердца, ишемической болезни сердца, атеросклероза, стенокардии, желудочковой аритмии и/или фибрилляции желудочков, или пациент мог перенести острый ИМ (в том числе перенести острый ИМ в пределах последних 7 дней). Альтернативно или дополнительно, пациент может иметь один или более других факторов риска для СНСЯ, например, он может:
- быть в возрасте 45 лет или старше (например, по меньшей мере 50, 55, 60, 65, 70, 75, 80 или 85 лет);
- курить;
- иметь высокое кровяное давление (140/90 мм рт.ст. или выше);
- иметь высокие уровни в крови холестерина или триглицеридов, например, высокие уровни холестерина липопротеинов низкой плотности (ЛПНП) (натощак уровни ЛПНП-холестерина 160-199 мг/дл или 4,1-4,9 ммоль/л) или высокие уровни триглицеридов;
- иметь диабет;
- иметь в семейном анамнезе ИМ;
- быть физически неактивным;
- быть тучным (например, ИМТ 30 или более).
Пациенты-люди, подлежащие лечению, могут иметь любое состояние их почечной функции. Предпочтительные примеры включают пациентов с нормальной функцией почек, легкой почечной недостаточностью и умеренной почечной недостаточностью. Почечная недостаточность является распространенным сопутствующим состоянием при остром коронарном синдроме, при этом приблизительно 30% субъектов имеют хроническую почечную недостаточность 3 стадии. Функцию почек обычно определяют с применением формулы, разработанной организацией «Сотрудничество в области эпидемиологии хронических заболеваний почек» (смотри, например, Levey, 2009 Ann Intern Med May 5; 150(9): 604-612), позволяющей определять значение расчетной скорости клубочковой фильтрации (рСКФ), которая коррелирует с состоянием функции почек (смотри, например, Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney inter., Suppl. 2013; 3: 1-150). Скорость клубочковой фильтрации (СКФ) считают наилучшим общим показателем функции почек в здоровом состоянии и при болезни. Нормальную функцию почек (стадия 1 функции почек), как правило, определяют на основании показателя рСКФ ≥90 мл/мин/1,73 м2. Пациенты с легкой почечной недостаточностью (стадия 2 функции почек) имеют рСКФ от ≥60 до <90 мл/мин/1,73 м2, и пациенты с умеренной почечной недостаточностью имеют рСКФ от ≥30 до <60 мл/мин/1,73 м2. Пациентов с умеренной почечной недостаточностью дополнительно можно подразделять на пациентов, имеющих рСКФ от ≥45 до <60 мл/мин/1,73 м2 (стадия 3a функции почек), и пациентов, имеющих рСКФ от ≥30 до <45 мл/мин/1,73 м2 (стадия 3b функции почек). Пациенты с тяжелой почечной недостаточностью имеют рСКФ от ≥15 до <30 мл/мин/1,73 м2 (стадия 4 функции почек), при этом считается, что пациенты, имеющие рСКФ <15 мл/мин/1,73 м2 (стадия 5 функции почек), страдают почечной недостаточностью.
Как отмечено в других разделах, в предпочтительных вариантах осуществления лечение вЛПВП не вызывает существенное изменение функции почек, однако пациенты, страдающие почечной недостаточностью, например, легкой или умеренной почечной недостаточностью, до начала лечения вЛПВП, могут получать лечение в соответствии с изобретением.
В некоторых вариантах осуществления пациент-человек, который получает лечение в пределах 7 дней после острого инфаркта миокарда, имеет нормальную функцию почек, легкую почечную недостаточность или умеренную почечную недостаточность.
В некоторых вариантах осуществления пациент-человек, который ранее не перенес ИМ, или недавно не перенес ИМ (то есть, не перенес ИМ в пределах семи дней до начала лечения), имеет умеренную почечную недостаточность. В других вариантах осуществления такой пациент имеет легкую почечную недостаточность. В других вариантах осуществления такие пациенты имеют нормальную функцию почек. В конкретных вариантах осуществления лечение получают пациенты с умеренной почечной недостаточностью, как проиллюстрировано в примере 2 и примере 3.
В контексте настоящего изобретения термин «состав восстановленного ЛПВП (вЛПВП)» означает состав или композицию любого искусственно полученного липопротеина, который является функционально сходным, аналогичным, соответствующим или имитирующим липопротеин высокой плотности (ЛПВП), как правило, присутствующий в плазме крови. Составы вЛПВП включают «миметики ЛПВП» и «синтетические ЛПВП частицы». Состав вЛПВП предпочтительно содержит аполипопротеин, липид, стабилизатор и, необязательно, детергент. Конкретные варианты осуществления составов вЛПВП будут описаны более подробно далее. Особенно предпочтительный вариант осуществления состава вЛПВП в настоящем документе называют «CSL112». Смотри международные патентные публикации WO2012/000048, WO2013/090978 и WO2014/066943, в которых приведены конкретные примеры составов CSL112.
Предпочтительно, способы лечения по вышеуказанным аспектам (например, в которых пациент получает лечение в пределах приблизительно 7 дней после острого инфаркта миокарда) включают введение начальной дозы состава вЛПВП пациенту-человеку в пределах приблизительно семи (7) дней после острого ИМ. Это может включать введение через несколько часов (например, 4, 6, 12 или 18 часов) после острого ИМ, или через 1, 2, 3, 4, 5, 6 или 7 дней (или с любыми часовыми интервалами между ними) после острого ИМ. Предпочтительно, лечение включает введение начальной дозы состава вЛПВП пациенту-человеку в пределах приблизительно пяти (5) дней после острого ИМ.
Если пациент не получает лечение в пределах 7 дней после острого ИМ (например, из-за того, что пациент не перенес ИМ, или недавно не перенес ИМ), начальную дозу можно вводить в любое подходящее время.
В конкретном варианте осуществления пациенту-человеку могло быть введено контрастное вещество для ангиографии. В таком варианте осуществления начальную дозу состава вЛПВП вводят не ранее чем через 12 часов после введения контрастного вещества.
Такую же, или другую, дозу состава вЛПВП можно впоследствии вводить пациенту-человеку один или более раз в неделю в течение приблизительно 2, 3, 4, 5, 6, 7, 8, 9 или 10 недель. Предпочтительно, такую же дозу состава вЛПВП впоследствии вводят пациенту-человеку один раз в неделю в течение приблизительно 4 недель. Период лечения может быть определен, как время от введения начальной дозы вЛПВП до одной недели после последней инфузии. Если пациент не получает лечение в пределах 7 дней после острого ИМ (например, из-за того, что пациент не перенес ИМ, или недавно не перенес ИМ), это может продолжаться, например, в течение вплоть до, или по меньшей мере, 1, 2, 3, 4, 5, 6 месяцев или вплоть до, или по меньшей мере, 1, 2, 3, 4, 5 лет.
Предпочтительно, состав вЛПВП вводят внутривенной (в/в) инфузией. В/в инфузию можно выполнять в течение периода времени приблизительно 0,5, 1, 1,5, 2, 2,5, 3, 3,5 или 4 часа. В конкретном варианте осуществления в/в инфузию выполняют в течение приблизительно 2 часов. В некоторых вариантах осуществления количество аполипопротеина, такого как apoA-I, в составе вЛПВП может составлять 2 г (такую дозу называют «низкой дозой») или 6 г (такую дозу называют «высокой дозой»). Таким образом, предпочтительные скорости инфузии в данных вариантах осуществления составляют приблизительно от 1 г до 3 г apoA-I в час.
Предпочтительно, состав вЛПВП вводят еженедельно в виде 2-часовой внутривенной инфузии в течение 4 последовательных недель. Период лечения может быть определен, как время от введения начальной дозы вЛПВП до одной недели после последней инфузии. Если пациент не получает лечение в пределах 7 дней после ОИМ (например, из-за того, что пациент не перенес ИМ, или недавно не перенес ИМ), это может продолжаться, например, в течение вплоть до, или по меньшей мере, 1, 2, 3, 4, 5, 6 месяцев или вплоть до, или по меньшей мере, 1, 2, 3, 4, 5 лет.
Характерной особенностью настоящего изобретения является тот факт, что способы по вышеуказанным аспектам приводят к увеличению обратного транспорта холестерина (ОТХ) у пациента-человека, например, после острого ИМ. Обратный транспорт холестерина (ОТХ), ex-vivo показатель функции ЛПВП, позволяет оценивать способность ЛПВП вызывать удаление избытка холестерина из атеросклеротических бляшек для переноса в печень. ОТХ является фактором, коррелирующим с СНСЯ, который не зависит от ЛПВП-Х, однако составы вЛПВП, которые приводят к увеличению или улучшению ОТХ, могут тем самым приводить к уменьшению количества бляшек и стабилизации неустойчивых бляшек, что может быть более ценным эффектом, чем просто увеличение уровня ЛПВП.
Предпочтительно, ОТХ представляет собой общий обратный транспорт холестерина, предпочтительно, измеряемый или выражаемый в виде %/4 часа. В одном из вариантов осуществления ОТХ измеряют со средним арифметическим по меньшей мере приблизительно 12. Предпочтительно, ОТХ включает ABCA1-зависимый обратный транспорт холестерина (предпочтительно, измеряемый или выражаемый в виде %/4 часа) со средним арифметическим по меньшей мере приблизительно 5. Анализы на обратный транспорт холестерина можно выполнять в истощенных по apoB образцах сыворотки с применением макрофагов J774, например, как описано в публикации de le Llera-Moya et al., Arterioscler. Thromb. Vasc. Biol. 2010; 30-796-801.
Предпочтительно, способы, раскрытые в настоящем документе, приводят к увеличению общего обратного транспорта холестерина по меньшей мере приблизительно в 1,5 раза, вплоть до приблизительно 2,5 раз. ABCA1-зависимый обратный транспорт холестерина может быть увеличен по меньшей мере приблизительно в 3 раза и вплоть до приблизительно 5 раз. Такое большое увеличение ABCA1-зависимого обратного транспорта холестерина (также в сравнении с циркулирующими уровнями apoA-I) свидетельствует о том, что CSL112 может приводить не только к увеличению количества циркулирующего apoA-I, но также и к увеличению ABCA1-зависимого обратного транспорта в расчете на количество apoA-I. «Удельную активность» циркулирующего пула apoA-I для ABCA1-зависимого обратного транспорта холестерина можно рассчитывать, как соотношение ABCA1-зависимый обратный транспорт холестерина/apoA-I по окончании инфузии. В качестве примера, инфузия CSL112 привела к 2,51-кратному увеличению соотношения в группе дозы 2 г (0,05) и к 1,78-кратному увеличению соотношения в группе дозы 6 г (0,035) в сравнении с группой плацебо (0,02). Возрастание ABCA1-зависимого обратного транспорта было больше, чем возрастание уровня apoA-I. Без связи с конкретной теорией, предполагают, что инфузия CSL112 приводит к возрастанию не только количества, но также и функциональности пула apoA-I. Соотношения ABCA1-зависимый обратный транспорт холестерина/apoA-I были повышены в случае обеих доз, 2 г и 6 г, CSL112 в сравнении с группой плацебо.
Предпочтительно, увеличение ОТХ не связано с, или не вызывает существенное изменение функции печени или почек у пациента-человека.
Неограничивающие примеры показателей функции(ий) печени включают активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) и/или уровни билирубина. Измерение этих показателей хорошо известно в данной области (смотри, например, Fischbach FT, Dunning MB III, eds. (2009). Manual of Laboratory and Diagnostic Tests, 8th ed. Philadelphia: Lippincott Williams and Wilkins) и является рутинным анализом в медицинских лабораториях. Наборы для измерения этих показателей коммерчески доступны. Как правило, функцию печени и/или почек измеряют после введения состава вЛПВП. Полученные показатели можно сравнивать с показателями функции печени и/или почек до введения состава вЛПВП, например, для определения того, произошло ли изменение функции. Избегание существенного изменения функции печени и/или почек является преимуществом. Предпочтительно поддерживать уровень функции печени и/или почек, который имел место до лечения, например, предпочтительно, если лечение с применением вЛПВП не вызывает какое-либо изменение функции печени и/или почек. В конкретных вариантах осуществления уровень функции печени и/или почек может улучшаться (то есть, будут получены показатели более сильной функции печени и/или почек, чем в отсутствие лечения), однако в любом случае предпочтительно избегать существенного снижения функции печени и/или почек.
В конкретных вариантах осуществления способы могут дополнительно включать этап оценки функции печени и/или почек (i) после введения состава вЛПВП и, необязательно, также (ii) до введения состава вЛПВП. Параметры функции почек и/или печени до и после введения состава вЛПВП можно сравнивать для определения того, произошло ли изменение функции печени и/или почек. В конкретных вариантах осуществления такие способы могут дополнительно включать этап получения соответствующего образца (например, крови, сыворотки, плазмы) от пациента-человека.
В некоторых вариантах осуществления признаком существенного изменения функции печени является значение АЛТ, более чем приблизительно в 2 или 3 раза превышающее верхний предел нормы (ВПН); или увеличение уровня общего билирубина до значения, по меньшей мере в 1,5-2 раза превышающего ВПН. Вследствие этого, предпочтительно, если пациент-человек не будет иметь показатель АЛТ, более чем приблизительно в 2 или 3 раза превышающий верхний предел нормы (ВПН), как до лечения вЛПВП, так и после лечения вЛПВП. Также предпочтительно, если пациент-человек не будет иметь показатель общего билирубина, превышающий по меньшей мере в 1,5-2 раза ВПН, как до лечения вЛПВП, так и после лечения вЛПВП. В конкретных предпочтительных вариантах осуществления показатель АЛТ остается практически постоянным до и после лечения (например, остается в пределах 10% или 20% от значения до лечения).
Почечную токсичность можно определять на основании уровней сывороточного креатинина. В некоторых вариантах осуществления признаком существенного изменения функции почек является уровень сывороточного креатинина, превышающий более чем, или приблизительно, в 1,2-1,5 раза исходное значение. Вследствие этого, предпочтительно, если пациент-человек не будет иметь показатель уровня сывороточного креатинина, превышающий более чем, или приблизительно, в 1,2-1,5 раза исходное значение, как до лечения вЛПВП, так и после лечения вЛПВП. В некоторых предпочтительных вариантах осуществления показатель уровня сывороточного креатинина остается практически постоянным до и после лечения (например, остается в пределах 10% или 20% от значения до лечения).
Дополнительно или альтернативно, почечную токсичность можно определять на основании уменьшения скорости клубочковой фильтрации (рСКФ). Нормальная скорость клубочковой фильтрации (рСКФ) у человека составляет по меньшей мере приблизительно 90 мл/мин/м2 (например, по меньшей мере приблизительно 90 мл/мин/1,73 м2). Ее можно рассчитывать по формуле CKD-EPI (смотри, например, Levey, 2009 Ann Intern Med May 5; 150(9): 604-612). Корреляция между рСКФ и заболеванием почек хорошо известна и стандартизирована в данной области (смотри, например, Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney inter., Suppl. 2013; 3: 1-150). Таким образом, признаком существенного изменения функции почек является показатель рСКФ, значительно меньший, чем 90 мл/мин/м2 (например, значительно меньший, чем 90 мл/мин/1,73 м2). Легкая почечная недостаточность, как правило, связана с показателем рСКФ, составляющим не менее, чем приблизительно 60 мл/мин/м2 (например, не менее, чем приблизительно 60 мл/мин/1,73 м2).
Как отмечено выше, изобретение имеет отношение к пациентам с нормальной функцией почек, легкой почечной недостаточностью и умеренной почечной недостаточностью. Таким образом, следует понимать, что пациенты, имеющие рСКФ менее чем 90 мл/мин/1,73 м2 до начала лечения вЛПВП (например, пациенты, имеющие легкую или умеренную почечную недостаточность), могут иметь рСКФ, составляющую менее чем 90 мл/мин/1,73 м2, после лечения вЛПВП, при этом данный уровень рСКФ не вызван лечением. Следовательно, в этих случаях лечение вЛПВП не считают вызывающим «изменение функции почек», как описано в настоящем документе, исключительно на основании того, что рСКФ составляет менее чем 90 мл/мин/1,73 м2. Таким образом, может быть полезно выяснять состояние функции почек у пациента до начала лечения, чтобы определять, вызывает ли лечение изменение функции почек.
Так, например, если пациент-человек не имеет показатель рСКФ, значительно меньший, чем 90 мл/мин/1,73 м2, до лечения вЛПВП, то указанный пациент предпочтительно не будет иметь показатель рСКФ, значительно меньший, чем 90 мл/мин/1,73 м2, после лечения вЛПВП. Кроме того, если пациент-человек не имеет показатель рСКФ, значительно меньший, чем 60 мл/мин/1,73 м2, до лечения вЛПВП, то указанный пациент предпочтительно не будет иметь показатель рСКФ, значительно меньший, чем 60 мл/мин/1,73 м2, после лечения вЛПВП. Аналогично, если пациент-человек не имеет показатель рСКФ, значительно меньший, чем 30 мл/мин/1,73 м2, до лечения вЛПВП, то указанный пациент предпочтительно не будет иметь показатель рСКФ, значительно меньший, чем 30 мл/мин/1,73 м2, после лечения вЛПВП. Иными словами, в предпочтительных вариантах осуществления лечение вЛПВП не вызывает изменение состояния почек пациента в соответствии со стандартными определениями, используемыми в публикации Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney inter., Suppl. 2013; 3: 1-150, и используемыми в других разделах настоящего документа.
Учитывая, что в соответствии с моделью заболевания почек вышеуказанные группы пациентов отнесены к определенным дискретным категориям, при том, что показатель рСКФ изменяется постепенно, может быть полезным определять существенное изменение функции почек на основании изменения (например, уменьшения) рСКФ после лечения вЛПВП на 10 или 20, или 30 мл/мин/1,73 м2, или более, в сравнении с рСКФ до лечения вЛПВП. В качестве примера, пациент предпочтительно имеет показатель рСКФ после лечения в пределах 10, 20 или 30 мл/мин/1,73 м2 от показателя рСКФ до лечения вЛПВП. Например, пациента считают не имеющим существенное изменение функции почек, если показатель рСКФ после лечения вЛПВП находится в пределах 30, 20 или 10 мл/мин/1,73 м2 от показателя рСКФ до лечения.
Альтернативно, почечную токсичность можно определять на основании необходимости в заместительной почечной терапии.
Предпочтительно, состав вЛПВП содержит аполипопротеин или его фрагмент. Аполипопротеин может представлять собой любой аполипопротеин, который является функциональным, биологически активным компонентом естественного ЛПВП или восстановленного липопротеина высокой плотности/вЛПВП. Как правило, аполипопротеин представляет собой либо полученный из плазмы, либо рекомбинантный аполипопротеин, такой как apoA-I, apoA-II, apoA-V, про-apoA-I, или вариант, такой как apoA-I Milano. Предпочтительно, аполипопротеин представляет собой apoA-I. Более предпочтительно, apoA-I представляет собой либо полученный рекомбинантными методами, содержащий последовательность дикого типа или последовательность Milano, либо, альтернативно, он был очищен из плазмы крови человека. Аполипопротеин может иметь форму биологически активного фрагмента аполипопротеина. Такие фрагменты могут быть естественными, химически синтезированными или рекомбинантными. Лишь в качестве примера, биологически активный фрагмент apoA-I предпочтительно имеет по меньшей мере 50%, 60%, 70%, 80%, 90% или от 95% до 100%, или более 100% стимулирующей лецитин-холестерин ацилтрансферазу (ЛХАТ) активности apoA-I.
В некоторых общих вариантах осуществления аполипопротеин присутствует в концентрации от приблизительно 5 до приблизительно 50 мг/мл. Сюда относятся концентрации 5, 8, 10, 15, 20, 25, 30, 35, 40, 45 и 50 мг/мл, а также любые диапазоны между этими количествами. Аполипопротеин, предпочтительно, присутствует в концентрации приблизительно 25-45 мг/мл. В конкретных вариантах осуществления аполипопротеин представляет собой apoA-I, предпочтительно, в концентрации приблизительно 25-45 мг/мл. В других вариантах осуществления аполипопротеин может присутствовать в концентрации приблизительно 5-20 мг/мл, например, приблизительно 8-12 мг/мл. В некоторых вариантах осуществления аполипопротеин представляет собой apoA-I, и его содержание в составе вЛПВП составляет приблизительно 25-45 мг/мл. В других вариантах осуществления вЛПВП является восстановленным после лиофилизации, так что содержание apoA-I в восстановленном составе вЛПВП составляет приблизительно 5-50 мг/мл. ApoA-I после восстановления лиофилизированного состава вЛПВП, предпочтительно, имеет концентрацию приблизительно 25-45 мг/мл. В конкретных вариантах осуществления apoA-I после восстановления лиофилизированного состава вЛПВП имеет концентрацию приблизительно 30-40 мг/мл. В одном из вариантов осуществления apoA-I после восстановления лиофилизированного состава вЛПВП имеет концентрацию приблизительно 30 мг/мл.
Как правило, вводимая доза состава вЛПВП может находиться в диапазоне от приблизительно 1 до приблизительно 120 мг/кг массы тела. Предпочтительно, доза находится в диапазоне от приблизительно 5 до приблизительно 80 мг/кг, включая дозы 8 мг/кг, 10 мг/кг, 12 мг/кг, 20 мг/кг, 30 мг/кг, 40 мг/кг, 50 мг/кг, 60 мг/кг и 70 мг/кг.
В альтернативных вариантах осуществления состав вЛПВП может иметь форму состава «с фиксированной дозой». Предпочтительно, состав с фиксированной дозой аполипопротеина находится в дозе, которая является терапевтически эффективной при введении пациентам-людям с любой массой тела, или с любой массой тела в определенном диапазоне массы тела. Соответственно, дозу состава вЛПВП не рассчитывают, не определяют или не выбирают на основании конкретной массы тела человека, что, как правило, имеет место в случае «скорректированной на массу тела дозы».
Скорее, состав с фиксированной дозой аполипопротеина определяют, как состав, доза которого при введении пациентам-людям с любой массой тела, или с любой массой тела в определенном диапазоне массы тела, будет приводить к относительно более низкой вариабельности между пациентами в отношении экспозиции аполипопротеиновых компонентов состава аполипопротеина. Вариабельность между пациентами является относительно более низкой в сравнении с той, которая наблюдается, или связана с введением популяции пациентов доз, скорректированных на массу тела.
Вариабельность экспозиции можно выражать или измерять в виде вариаций у пациентов экспозиции аполипопротеина после введения состава аполипопротеина с фиксированной дозой. Предпочтительно, вариабельность является такой, которая имела бы место, когда состав аполипопротеина с фиксированной дозой вводят пациентам-людям, имеющим массу тела в некотором диапазоне, в сравнении с вариабельностью, которая имела бы место в случае введения скорректированных на массу тела доз пациентам-людям, имеющим массу тела в том же диапазоне, что и пациенты, получающие фиксированную дозу. В некоторых вариантах осуществления экспозицию аполипопротеина можно измерять в виде усредненной экспозиции (например, средней или медианной экспозиции), общей экспозиции (например, суммарного количества за время экспозиции) или максимального уровня экспозиции (например, Cmax). Как правило, масса, или диапазон массы, тела составляет 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 кг, или любой диапазон между этими значениями. Предпочтительно, масса, или диапазон массы, тела составляет 20-200 кг, 20-60 кг, 40-160 кг, 50-80 кг, 60-140 кг, 70-80 кг, 80-120 кг, 100-180 кг или 120-200 кг.
Предпочтительно, вариабельность составляет менее 100% или, предпочтительно, 99%, 98%, 97%, 96% 95%, 94%, 93%, 92%, 91%, или менее 90%, 85% или 80% от вариабельности, имеющей место в случае введения скорректированных на массу тела доз. Вариабельность можно рассчитывать и выражать с помощью любых статистических показателей, известных в данной области, включая коэффициент вариации (например, % КВ), стандартное отклонение, стандартную ошибку или тому подобное, но без ограничения.
Несмотря на введение состава аполипопротеина с фиксированной дозой пациентам со значительными различиями в массе тела, экспозиция аполипопротеина у пациентов является на удивление однородной. Соответственно, предполагается, что терапевтическая эффективность состава аполипопротеина с фиксированной дозой не будет существенно нарушена или снижена в сравнении с составом в дозе, скорректированной на массу тела.
Лишь в качестве примера, показано, что отсутствует разница в общей экспозиции аполипопротеина при введении состава аполипопротеина с фиксированной дозой пациентам с массой тела в диапазоне 60-120 кг. Кроме того, значение Cmax для аполипопротеина уменьшалось в среднем на 16% при диапазоне массы тела 60-120 кг.
Для сравнения, в режимах с введением доз, скорректированных на массу тела, при применении того же состава аполипопротеина в случае удвоения массы тела с 60 кг до 120 кг необходимо удваивать дозу аполипопротеина и увеличивать экспозицию apoA-I.
Составы аполипопротеина с фиксированной дозой можно вводить несколькими дозами с любой подходящей частотой, в том числе, ежедневно, дважды в неделю, еженедельно, раз в две недели или ежемесячно. Составы аполипопротеина с фиксированной дозой можно вводить любым путем введения, известным в данной области, таким как внутривенный (например, в виде болюса или непрерывной инфузии в течение некоторого периода времени, например, 60, 90, 120 или 180 минут), внутримышечный, внутрибрюшинный, внутриартериальный, в том числе, непосредственно в коронарные артерии, в спинномозговую жидкость, подкожный, внутрисуставной, внутрисиновиальный, интратекальный, пероральный, топический или ингаляционный пути введения. Как правило, составы аполипопротеина с фиксированной дозой вводят парентерально, например, внутривенной инфузией или инъекцией.
Предпочтительные фиксированные дозы включают 0,1-15 г, 0,5-12 г, 1-10 г, 2-9 г, 3-8 г, 4-7 г или 5-6 г аполипопротеина. Особенно предпочтительные фиксированные дозы включают 1-2 г, 3-4 г, 5-6 г или 6-7 г аполипопротеина. Неограничивающие примеры конкретных фиксированных доз включают 0,25 г, 0,5 г, 1 г, 1,7 г, 2 г, 3,4 г, 4 г, 5,1 г, 6 г, 6,8 г и 8 г аполипопротеина. Соответственно, ампула состава вЛПВП с фиксированной дозой предпочтительно содержит лиофилизированный состав вЛПВП с содержанием аполипопротеина, составляющим 0,25 г, 0,5 г, 1, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 8 или 10 г на ампулу. Более предпочтительно, содержание аполипопротеина составляет или 2, 4, 6, 8, или 10 г на ампулу. Особенно предпочтительно, ампула содержит 6 г или более состава вЛПВП.
Неограничивающий пример составов CSL112 с фиксированной дозой вЛПВП можно найти в международной патентной публикации WO2013/090978.
Липид в составе вЛПВП может представлять собой любой липид, который является функциональным, биологически активным компонентом естественного ЛПВП или восстановленного липопротеина высокой плотности (вЛПВП). Такие липиды включают фосфолипиды, холестерин, сложные эфиры холестерина, жирные кислоты и/или триглицериды. Предпочтительно, липид представляет собой по меньшей мере один заряженный или незаряженный фосфолипид, или их смесь.
В предпочтительном варианте осуществления состав вЛПВП по настоящему изобретению содержит сочетание детергента и незаряженного фосфолипида. В альтернативном предпочтительном варианте осуществления состав вЛПВП содержит заряженный фосфолипид, но совсем не содержит детергент. В следующем предпочтительном варианте осуществления состав вЛПВП содержит заряженные и незаряженные липиды, а также детергент.
Описанные в настоящем документе «незаряженные фосфолипиды», также называемые нейтральными фосфолипидами, представляют собой фосфолипиды, имеющие суммарный заряд, равный приблизительно нулю, при физиологическом значении pH. Незаряженные фосфолипиды могут представлять собой цвиттер-ионы, хотя и другие виды суммарно нейтральных фосфолипидов известны и могут быть применены. «Заряженные фосфолипиды» представляют собой фосфолипиды, которые имеют суммарный заряд при физиологическом значении pH. Заряженный фосфолипид может включать заряженный фосфолипид одного вида, или смесь двух или более разных, как правило, одинаково заряженных, фосфолипидов. В некоторых примерах заряженные фосфолипиды представляют собой отрицательно заряженные гликофосфолипиды.
Состав вЛПВП также может содержать смесь разных липидов, например, смесь нескольких незаряженных липидов, или незаряженного липида и заряженного липида. Примеры фосфолипидов включают фосфатидилхолин (лецитин), фосфатидную кислоту, фосфатидилэтаноламин (кефалин), фосфатидилглицерин (PG), фосфатидилсерин (PS), фосфатидилинозитол (PI) и сфингомиэлин (SM), либо их естественные или синтетические производные. Естественные производные включают яичный фосфатидилхолин, яичный фосфатидилглицерин, соевый фосфатидилхолин, гидрогенизированный соевый фосфатидилхолин, соевый фосфатидилглицерин, мозговой фосфатидилсерин, сфинголипиды, мозговой сфингомиелин, яичный сфингомиелин, галактоцереброзид, ганглиозиды, цереброзиды, кефалин, кардиолипин и дицетилфосфат. Синтетические производные включают дипальмитоилфосфатидилхолин (DPPC), дидеканоилфосфатидилхолин (DDPC), диерукоилфосфатидилхолин (DEPC), димиристоилфосфатидилхолин (DLPC), пальмитоилолеоилфосфатидилхолин (PMPC), пальмитоилстеароилфосфатидилхолин (PSPC), диолеоилфосфатидилэтаноламин (DOPE), дилауроилфосфатидилглицерин (DLPG), дистеароилфосфатидилглицерин (DSPG), диолеоилфосфатидилглицерин (DOPG), пальмитоилолеоилфосфатидилглицерин (POPG), димиристоилфосфатидную кислоту (DMPA), дипальмитоилфосфатидную кислоту (DPPA), дистеароилфосфатидную кислоту (DSPA), дипальмитоилфосфатидилсерин (DPPS), дистеароилфосфатидилэтаноламин (DSPE), диолеоилфосфатидилэтаноламин (DOPE), диолеоилфосфатидилсерин (DOPS), дипальмитоилсфингомиелин (DPSM) и дистеароилсфингомиелин (DSSM).
Фосфолипид также может представлять собой производное или аналог любого из вышеуказанных фосфолипидов. Наилучшие результаты могут быть получены с фосфатидилхолином. В другом варианте осуществления липиды в составе по настоящему изобретению представляют собой сфингомиелин и отрицательно заряженный фосфолипид, такой как фосфатидилглицерин (например, DPPG).
Состав вЛПВП может содержать смесь сфингомиелина и фосфатидилглицерина (в частности, DPPG). В этих вариантах осуществления сфингомиелин и фосфатидилглицерин могут присутствовать в соответствующем соотношении, например, от 90:10 до 99:1 (по массе), как правило, от 95:5 до 98:2, и чаще всего, 97:3. В других вариантах осуществления состав вЛПВП не содержит смесь сфингомиелина и фосфатидилглицерина (в частности, DPPG).
Предпочтительно, молярное соотношение аполипопротеин:липид составляет, как правило, от приблизительно 1:20 до приблизительно 1:120, и предпочтительно от приблизительно 1:20 до приблизительно 1:100, более предпочтительно от приблизительно 1:20 до приблизительно 1:75 (моль:моль), и в частности, от 1:45 до 1:65. Этот диапазон включает такие молярные соотношения, как например, 1:25, 1:30, 1:35, 1:40, 1:45, 1:50, 1:55, 1:60, 1:65, 1:70, 1:75, 1:80, 1:85, 1:90, 1:95 и 1:100. Особенно предпочтительное соотношение аполипопротеин:липид составляет от 1:40 до 1:65 (моль:моль). Это гарантирует, что состав вЛПВП по настоящему изобретению содержит липид на уровне, который не вызывает печеночную токсичность.
В других вариантах осуществления молярное соотношение аполипопротеин:липид может находиться в диапазоне от приблизительно 1:80 до приблизительно 1:120. Например, соотношение может составлять от 1:100 до 1:115, или от 1:105 до 1:110. В таких вариантах осуществления молярное соотношение может составлять, например, от 1:80 до 1:90, от 1:90 до 1:100 или от 1:100 до 1:110. В альтернативных вариантах осуществления молярное соотношение аполипопротеин:липид не находится в диапазоне от приблизительно 1:80 до приблизительно 1:120.
Предпочтительно, состав вЛПВП содержит стабилизатор. Как правило, стабилизатор присутствует в концентрации от приблизительно 1,0% до приблизительно 6,0%, например, от 1,0, 1,1, 1,2 или 1,3% до 5,5, 5,6, 5,7, 5,8, 5,9, или 6,0%, предпочтительно, от приблизительно 1,0% до менее 6,0%, например, от приблизительно 1,0% до 5,9% (в расчете на массу состава вЛПВП). Предпочтительно от приблизительно 3,0% до менее 6,0%, например, от приблизительно 3,0% до 5,9%, предпочтительно от приблизительно 4,0% до 5,9%, предпочтительно от приблизительно 4,0% до 5,5%, предпочтительно от 4,3% до 5,3%, предпочтительно от 4,3% до 5,0%, и наиболее предпочтительно от 4,6% до 4,8% (по массе), и в указанном составе соотношение между аполипопротеином и липидом предпочтительно составляет от приблизительно 1:20 до приблизительно 1:75, более предпочтительно от приблизительно 1:45 до приблизительно 1:65 (моль:моль). Стабилизатор для лиофилизации предпочтительно представляет собой сахар (например, дисахарид, такой как сахароза).
Это относительно низкое количество стабилизатора может уменьшать риск почечной токсичности. Это также особенно подходит для пациентов, которым вводят контрастные вещества в процессе терапии острого коронарного синдрома (ОКС), поскольку эти средства могут конкурировать со стабилизатором за клиренс в почках.
Предпочтительно, стабилизатор представляет собой «стабилизатор для лиофилизации», который представляет собой вещество, стабилизирующее белок в процессе лиофилизации. Предпочтительный стабилизатор для лиофилизации представляет собой сахар. Например, дисахариды, такие как сахароза, являются особенно подходящими сахарами для применения в качестве стабилизатора для лиофилизации. Другие дисахариды, которые можно использовать, включают фруктозу, трегалозу, мальтозу и лактозу. В дополнение к дисахаридам можно использовать трисахариды, такие как рафиноза и мальтотриоза. Более крупные олигосахариды также могут быть подходящими, например, мальтопентоза, мальтогексоза и мальтогептоза. Альтернативно, можно использовать моносахариды, такие как глюкоза, манноза и галактоза. Эти моно-, ди-, три- и более крупные олигосахариды можно использовать либо отдельно, либо в сочетании друг с другом.
В некоторых других вариантах осуществления стабилизатор для лиофилизации представляет собой сахарный спирт, аминокислоту, или смесь сахара и сахарного спирта и/или аминокислоты.
Конкретным сахарным спиртом является маннит. Другие сахарные спирты, которые можно использовать, включают инозитол, ксилит, галактит и сорбит. Также могут быть подходящими полиолы, такие как глицерин.
Можно использовать смесь сахарозы и маннита. Сахар и сахарный спирт можно смешивать в любом подходящем соотношении, например, от приблизительно 1:1 (по массе) до приблизительно 3:1 (по массе) и, в частности, приблизительно 2:1 (по массе). Особенно предусмотрены соотношения менее 2:1, например, менее 3:2. Как правило, соотношение составляет более 1:5, например, более 1:2 (по массе). В некоторых вариантах осуществления состав содержит менее 4% сахарозы и 2% маннита (в расчете на массу состава вЛПВП), например, 3% сахарозы и 2% маннита. В некоторых вариантах осуществления состав содержит 4% сахарозы и менее 2% маннита. В некоторых вариантах осуществления состав содержит менее 4% сахарозы и менее 2% маннита, например, приблизительно от 1,0% до 3,9% сахарозы и приблизительно от 1,0% до 1,9% (по массе) маннита.
Аминокислоты, которые могут быть применены в качестве стабилизаторов для лиофилизации, включают пролин, глицин, серин, аланин и лизин. Также можно использовать модифицированные аминокислоты, например, 4-гидроксипролин, L-серин, глутамат натрия, саркозин и γ-аминомасляную кислоту. Пролин является особенно подходящей аминокислотой для применения в качестве стабилизатора для лиофилизации. В некоторых вариантах осуществления стабилизатор для лиофилизации представляет собой смесь сахара и аминокислоты. Например, можно использовать смесь сахарозы и пролина. Сахар и аминокислоту можно смешивать в любом подходящем соотношении, например, от приблизительно 1:1 до приблизительно 3:1 (по массе) и, в частности, приблизительно 2:1 (по массе). Особенно предусмотрены соотношения менее 2:1, например, менее 3:2 (по массе). Как правило, соотношение составляет более 1:5, например, более 1:2 (по массе). Предпочтительно, аминокислота присутствует в концентрации от приблизительно 1,0 до приблизительно 2,5%, например, 1,0, 1,2 или 1,3 до 2,0, 2,1, 2,2, 2,3, 2,4 или 2,5% (в расчете на массу состава вЛПВП). В некоторых вариантах осуществления состав содержит 1,0% сахарозы и 2,2% пролина или 3,0% сахарозы и 1,5% пролина, или 4% сахарозы и 1,2% пролина. Аминокислоту можно добавлять к сахару для поддержания изотоничности раствора. Растворы с осмоляльностью более 350 мосмоль/кг, как правило, являются гипертоническими, при этом растворы с осмоляльностью менее 250 мосмоль/кг, как правило, являются гипотоническими. Растворы с осмоляльностью от 250 мосмоль/кг до 350 мосмоль/кг как правило, являются изотоническими.
Соотношение между аполипопротеином и стабилизатором для лиофилизации, как правило, корректируют так, что соотношение составляет от приблизительно 1:1 до приблизительно 1:7 (по массе). Более предпочтительно, соотношение составляет от приблизительно 1:1 до приблизительно 1:3, в частности, от приблизительно 1:1,1 до приблизительно 1:2. Таким образом, в конкретных вариантах осуществления составы вЛПВП имеют соотношение 1:1,1, 1:1,2, 1:1,3, 1:1,4, 1:1,5, 1:1,6, 1:1,7, 1:1,8, 1:1,9 или 1:2 (по массе). Однако предусмотрено, что в конкретных вариантах осуществления, в которых количества белка являются низкими (например, <20 мг/мл), соотношение между аполипопротеином и стабилизатором для лиофилизации может быть расширено, например, приблизительно 1:7 (по массе), например, приблизительно 1:4,5 (по массе).
Смотри международную патентную публикацию WO2014/066943, в которой приведены неограничивающие конкретные примеры и описание стабилизаторов для лиофилизации в контексте состава вЛПВП CSL112.
В некоторых опциональных вариантах осуществления состав вЛПВП содержит детергент. Детергент может представлять собой любой ионный (например, катионный, анионный, цвиттер-ионный) детергент или неионный детергент, включая желчные кислоты и их соли, подходящие для применения в составах вЛПВП. Ионные детергенты могут включать желчные кислоты и их соли, полисорбаты (например, PS80), 3-[(3-холамидопропил)диметиламмонио]-1-пропансульфонат (CHAPS), 3-[(3-холамидопропил)диметиламмонио]-2-гидрокси-1-пропансульфонат (CHAPSO), цетилтриметиламмоний бромид, лауроилсаркозин, трет-октилфенилпропансульфоновую кислоту и 4'-амино-7-бензамидотаурохолевую кислоту.
Желчные кислоты, как правило, являются дигидроксилированными или тригидроксилтированными стероидами с 24 атомами углерода, включая холевую кислоту, дезоксихолевую кислоту, хенодезоксихолевую кислоту или урсодезоксихолевую кислоту. Предпочтительно, детергент представляет собой соль желчной кислоты, например, холат, дезоксихолат, хенодезоксихолат или урсодезоксихолат. Особенно предпочтительный детергент представляет собой холат натрия. Концентрация детергента, в частности, холата натрия, предпочтительно составляет 0,3-1,5 мг/мл. В некоторых вариантах осуществления изобретения состав вЛПВП содержит холат на уровнях приблизительно 0,015-0,030 г/г аполипопротеина. Концентрацию желчной кислоты можно определять разными методами, включая колориметрический анализ (например, смотри Lerch et. al., 1996, Vox Sang. 71:155-164; Sharma, 2012, Int. J. Pharm Biomed. 3(2), 28-34; и аналитический набор Gallsäuren и Gallsäuren-Stoppreagens (Trinity Biotech)). В некоторых вариантах осуществления изобретения состав вЛПВП содержит холат на уровнях 0,5-1,5 мг/мл, при определении в колориметрическом анализе.
В предпочтительном варианте осуществления состав вЛПВП, раскрытый в настоящем документе, имеет значение pH в диапазоне от 6 до 8, предпочтительно в диапазоне от 7 до 8. Даже более предпочтительно, значение pH находится в диапазоне от 7,3 до 7,7.
В предпочтительном варианте осуществления состав вЛПВП является лиофилизированным. Из-за присутствия описанного ранее в настоящем документе стабилизатора для лиофилизации, предпочтительно сахарозы, в сочетании с комбинацией аполипопротеин:липид при лиофилизации получают стабильный порошок, имеющий длительный срок хранения. Этот порошок можно хранить, использовать сразу или после хранения в виде порошка, или использовать после регидратации, используемой для получения состава восстановленного липопротеина высокой плотности.
Изобретение может быть применено с вЛПВП, изготовленным в процессе крупномасштабного производства с применением полученного из человеческой плазмы apoA-I. Лиофилизированный продукт может быть получен из нефасованных составов или, альтернативно, смешанный раствор белка/липида может быть распределен по небольшим контейнерам (например, однодозовым контейнерам) перед проведением лиофилизации, и такие небольшие контейнеры могут быть применены в качестве стерильных стандартных лекарственных форм. Лиофилизированный состав может быть восстановлен для получения раствора или суспензии белок-липидного комплекса, который представляет собой восстановленный липопротеин высокой плотности. Лиофилизированный порошок регидратируют водным раствором до соответствующего объема. Предпочтительными водными растворами являются вода для инъекций (WFI), фосфатно-солевой буферный раствор или физиологический солевой раствор. Смесь можно перемешивать для облегчения регидратации. Предпочтительно, этап восстановления проводят при комнатной температуре.
Специалисту в данной области хорошо известно, как может быть получен раствор, содержащий липид и аполипопротеин, такой, который описан в WO 2012/000048.
Лиофилизированный состав вЛПВП по настоящему изобретению может быть получен с применением любого способа лиофилизации, известного в данной области, включая, но без ограничения, сублимационную сушку, то есть раствор, содержащий смесь аполипопротеин/липид, подвергают замораживанию с последующим обезвоживанием при пониженном давлении.
Предложенные лиофилизированные составы вЛПВП могут сохранять в значительной степени их исходные характеристики стабильности в течение по меньшей мере 2, 4, 6, 8, 10, 12, 18, 24, 36 или более месяцев. Например, лиофилизированные составы вЛПВП, хранящиеся при 2-8°C или 25°C, как правило, могут сохранять практически без изменения показатель распределения по размеру молекул, измеряемый методом ВЭЖХ-ЭХ, после хранения в течение 6 месяцев или дольше. Конкретные варианты осуществления состава вЛПВП могут быть стабильными и подходящими для коммерческого фармацевтического применения в течение по меньшей мере 6 месяцев, 12 месяцев, 18 месяцев, 24 месяцев, 36 месяцев или даже дольше, в случае их хранения при температуре 2-8°C и/или при комнатной температуре.
Следует также понимать, что способ и/или состав вЛПВП, раскрытые в настоящем документе, могут включать одно или более дополнительных терапевтических средств. Аналогично, состав восстановленного липопротеина высокой плотности (вЛПВП), раскрытый в настоящем документе, используемый в конкретных способах, раскрытых в настоящем документе, может быть применен с одним или более дополнительными терапевтическими средствами. Предпочтительно, одно или более дополнительных терапевтических средств могут помогать или способствовать лечению, предотвращению или уменьшению риска развития острого инфаркта миокарда (ИМ) и/или СНСЯ, и/или увеличению обратного транспорта холестерина (ОТХ) у пациента-человека, но без ограничения.
Одно или более дополнительных терапевтических средств могут включать: одно или более липид-модифицирующих средств; один или более ингибиторов поглощения холестерина; один или более антикоагулянтов; одно или более антигипертензивных средств и одну или более связывающих желчные кислоты молекул.
Липид-модифицирующие средства могут вызывать уменьшение или снижение уровней ЛПНП и/или триглицеридов, и/или повышение уровней ЛПВП. Неограничивающие примеры включают ингибиторы HMG-CoA редуктазы, фибраты (например, фенофибрат, гемфиброзил), ингибиторы пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9) и ниацин.
Неограничивающие примеры ингибиторов HMG-CoA редуктазы включают «статины», такие как ловастатин, розувастатин, аторвастатин, питавастатин и симвастатин, но без ограничения.
Неограничивающим примером ингибитора поглощения холестерина является эзетимиб, который можно вводить отдельно или вместе со статином, как описано ранее в настоящем документе.
Неограничивающие примеры антикоагулянтов включают варфарин, антагонисты витамина K, гепарин или его производные, ингибиторы фактора Xa и ингибиторы тромбина, но без ограничения.
Неограничивающие примеры антигипертензивных средств включают ингибиторы ангиотензинпревращающего фермента (ACE) (например, эналаприл, рамиприл, каптоприл и так далее), антагонисты рецепторов ангиотензина II (например, ирбесартан), ингибиторы ренина, антагонисты адренергических рецепторов, блокаторы кальциевых каналов, сосудорасширяющие средства, бензодиазепины и диуретики (например, тиазиды), но без ограничения.
Неограничивающие примеры связывающих желчные кислоты молекул, или «секвестрантов», включают холестирамин, колестипол и колесевилам, но без ограничения.
Подходящие дозы одного или более дополнительных терапевтических средств можно с легкостью определять на основании информации о существующих, проверенных режимах безопасных доз для этих средств, которые могут быть без труда изменены или модифицированы практикующими специалистами в данной области.
Следует понимать, что одно или более дополнительных терапевтических средств можно включать в состав вЛПВП, раскрытый в настоящем документе, или можно вводить отдельно в соответствии со способом лечения, или терапевтического применения, раскрытым в настоящем документе. Сюда может относиться введение до или после введения состава вЛПВП, раскрытого в настоящем документе, по меньшей мере в пределах 24, 18, 12, 6, 3, 2 или 1 часов от введения состава вЛПВП.
Для более легкого понимания и практического применения конкретных вариантов осуществления изобретения далее приведены следующие неограничивающие примеры.
ПРИМЕРЫ
Сокращения
ОКС: Острый коронарный синдром
НЯ: Нежелательное явление
ОПП: Острое повреждение почек
ОИМ: Острый инфаркт миокарда
ApoA-I: Аполипопротеин A-I
АСТ: Аспартатаминотрансфераза
AUC: Площадь под кривой
BARC: Академический исследовательский консорциум по кровотечениям
БКА: Болезнь коронарных артерий
ОТХ: Обратный транспорт холестерина
CKD-EPI: Сотрудничество в области эпидемиологии хронических заболеваний почек
СК: Системный клиренс
Cmax: Максимальная концентрация в плазме
СС: Сердечно-сосудистое заболевание
DSMB: Независимый комитет по мониторингу данных
рСКФ: Расчетная скорость клубочковой фильтрации
HAV: Вирус гепатита A
HBV: Вирус гепатита B
HCV: Вирус гепатита C
ЛПВП: Липопротеин высокой плотности
HIV: Вирус иммунодефицита человека
ITT: Популяция всех пациентов, первоначально отобранных для исследования
ФВЛЖ: Фракция выброса левого желудочка
СНСЯ: Серьезные нежелательные сердечно-сосудистые явления
ИМ: Инфаркт миокарда
Ум. ПН: Умеренная почечная недостаточность
ТНК: Тестирование нуклеиновых кислот
НФП: Нормальная функция почек
NYHA: Нью-Йоркская ассоциация кардиологов
PC: Фосфатидилхолин
ЧКВ: Чрескожное коронарное вмешательство
ФК/ФД: Фармакокинетика/Фармакодинамика
ПН: почечная недостаточность
СНЯ: Серьезное нежелательное явление
t1/2: Время полувыведения
НЯВЛ: Нежелательное явление, возникшее в ходе лечения
Tmax: Время до достижения максимальной концентрации в плазме
ВПН: Верхний предел нормы
Vss: Объем распределения в равновесном состоянии
ПРИМЕР 1
CSL112 представляет собой полученный из плазмы apoA-I, основной функциональный компонент ЛПВП, восстановленный в дисковидные липопротеины с фосфатидилхолином и стабилизированный сахарозой24. Начальные исследования с введением CSL112 продемонстрировали значительное зависимое от дозы увеличение содержания в плазме apoA-I и зависимое от дозы увеличение общего и ABCA1-зависимого обратного транспорта холестерина25-27. К настоящему времени в клинических исследованиях был продемонстрирован благоприятный профиль безопасности, в том числе у пациентов со стабильной атеросклеротической болезнью сердца, хотя он не был охарактеризован у пациентов с острым ИМ27. Разработка прототипа состава CSL112 была прекращена из-за временного возрастания уровня печеночных ферментов, предположительно связанного с содержанием фосфатидилхолинового эксципиента28,29. При внутривенном введении высоких доз сахарозы был отмечен риск почечной токсичности. Вследствие этого, авторы изобретения оценивали как функцию печени, так и функцию почек, после инфузии данного состава CSL112, имеющего более низкое содержание фосфатидилхолина и низкое содержание сахарозы, у пациентов с ИМ.
Исследование «Apo-I Event reductinG in Ischemic Syndromes I (AEGIS-I)» представляло собой многоцентровое, рандомизированное, плацебо-контролируемое клиническое исследование фазы 2b с подбором дозы, основной целью которого являлась оценка безопасности и переносимости, а вторичные и исследовательские цели включали определение времени до первого СНСЯ, а также определение фармакокинетики и фармакодинамики в случае 4 еженедельных введений двух доз CSL112, в сравнении с введением плацебо, у пациентов с острым ИМ, имеющих или нормальную функцию почек, или легкую почечную недостаточность (ClinicalTrials.gov: NCT02108262).
Методы
Контроль за исследованием
Исследование AEGIS-I представляло собой рандомизированное, двойное-слепое, плацебо-контролируемое клиническое исследование фазы 2b с подбором дозы, совместно разработанное спонсором исследования (CSL Behring) и членами исполнительного и организационного комитета. Статистический анализ был выполнен независимо исследовательской группой PERFUSE с применением баз данных SDTM. Исполнительный комитет составлял все предварительные варианты рукописи и утвердил содержание окончательного варианта. Спонсор имел возможность ознакомиться и прокомментировать окончательный вариант рукописи, но не имел редакционных полномочий. Дизайн исследования соответствовал Хельсинкской декларации 1964 года и ее более поздним редакциям, и был утвержден соответствующими национальными и институциональными регулирующими органами и комитетами по этике. Независимый комитет по мониторингу данных (DSMB) контролировал проведение исследования и рассматривал данные после раскрытия рандомизационного кода.
Популяция, вошедшая в исследование
В исследование были включены мужчины и женщины в возрасте по меньшей мере 18 лет с клиническими проявлениями, согласующимися с ИМ I типа (спонтанным), в пределах последних 7 дней, которые имели или нормальную функцию почек, или легкую почечную недостаточность. Критерии для определения ИМ были основаны на третьем универсальном определении ИМ30. Нормальную функцию почек определяли на основании показателя рСКФ ≥90 мл/минуту/1,73 м2, и легкую почечную недостаточность определяли на основании показателя рСКФ <90 мл/минуту/1,73 м2 и ≥60 мл/минуту/1,73 м2.
Основные критерии исключения включали наличие признаков текущего гепатобилиарного заболевания, наличие исходной умеренной или тяжелой хронической почечной недостаточности, наличие в анамнезе острого повреждения почек, вызванного контрастным веществом, или наличие продолжающейся гемодинамической нестабильности. Среди субъектов, прошедших ангиографию, которым вводили контрастное вещество, стабильная функция почек по меньшей мере через 12 часов после введения контрастного вещества (то есть, отсутствие увеличения уровня сывороточного креатинина на ≥0,3 мг/дл от уровня до введения контрастного вещества) была необходимым условием для включения в исследование. Исследование было одобрено институциональным наблюдательным комитетом, и все субъекты предоставили письменное информированное согласие до включения в исследование.
Протокол исследования
Управление по контролю качества пищевых продуктов и медикаментов США поручило DSMB рассмотреть вопросы безопасности исследования для почек и печени после того, как первые 9 пациентов были включены в исследование, и после одобрения DSMB было начато включение пациентов в основное исследование. Отвечающие требованиям пациенты сначала были стратифицированы по состоянию функции почек (или нормальная функция почек, или легкая почечная недостаточность), а затем были рандомизированы в соотношении 1:1:1 в одну из трех групп лечения: группу низкой дозы CSL112 (2 г apoA-I/дозу), группу высокой дозы CSL112 (6 г apoA-I/дозу) или группу плацебо. Исследуемый состав вводили еженедельной 2-часовой внутривенной инфузией в течение 4 последовательных недель (в дни 1, 8, 15 и 22 исследования). Период активного лечения был определен, как время от введения первой дозы исследуемого состава (день 1 исследования) до одной недели после последней инфузии (день 29 исследования).
Оценку состояния здоровья пациентов проводили регулярно с заранее определенными интервалами времени с момента скрининга до последнего посещения в период последующего наблюдения. Оценка состояния здоровья включала медицинский осмотр, анализы на сывороточный креатинин, общий билирубин, щелочную фосфатазу, АЛТ, АСТ, АМК, Cr, глюкозу, метаболические, сердечно-сосудистые и липидные биомаркеры, маркеры иммуногенности, а также оценку зоны инфузии, кровотечений и нежелательных явлений. Возникновение серьезных нежелательных сердечно-сосудистых явлений (СНСЯ) также контролировали у всех субъектов в течение срока вплоть до одного года после рандомизации, или до того времени, когда последний рандомизированный субъект завершил посещение в день 112 исследования.
Концентрации в плазме apoA-I и ex vivo обратный транспорт холестерина измеряли в нескольких временных точках. Кроме того, для 63 пациентов проводили подисследование фармакокинетики/фармакодинамики (ФК/ФД). Субъекты, включенные в подисследование, были поровну стратифицированы по состоянию функции почек и были рандомизированы в соотношении 2:3:3 в группу плацебо, группу низкой дозы CSL112 (2 г apoA-I/дозу) или группу высокой дозы CSL112 (6 г apoA-I/дозу), соответственно. Способность плазмы опосредовать обратный транспорт холестерина от культивируемых клеток J774 определяли, как описано ранее26. В этих анализах измеряли как общий обратный транспорт холестерина, так и обратный транспорт, который мог быть связан с переносчиком ABCA1. Оба показателя обратного транспорта выражали в виде процентной доли от клеточного содержания холестерина. Дополнительные подробности дизайна исследования AEGIS-I были опубликованы ранее31.
Комбинированные первичные конечные точки для оценки безопасности
Комбинированными первичными конечными точками для оценки безопасности являлись показатели степени гепатотоксичности и почечной токсичности. Гепатотоксичность определяли на основании либо показателя АЛТ >3x значения верхнего предела нормы (ВПН), либо показателя общего билирубина >2x ВПН, подтвержденного при повторном измерении. Почечную токсичность определяли на основании либо показателя сывороточного креатинина ≥1,5x исходного значения, подтвержденного при повторном измерении, либо возникшей необходимости в заместительной почечной терапии. Конечные точки для оценки безопасности как для печени, так и для почек, оценивали с момента начала исследования (до первой инфузии) до окончания периода активного лечения (день 29 исследования). Все показатели комбинированных первичных конечных точек для оценки безопасности были основаны на результатах, полученных в центральной лаборатории.
Вторичные и исследовательские конечные точки
Вторичные и исследовательские конечные точки для оценки эффективности оценивали в популяции всех пациентов, первоначально отобранных для исследования (ITT) (всех пациентов, прошедших рандомизацию, включая тех, которые не получали исследуемый состав), и эти критерии включали время до возникновения первого СНСЯ, которое определяли, как совокупность случаев смерти от сердечно-сосудистого заболевания, случаев не фатального ИМ, ишемического инсульта или госпитализации по поводу нестабильной стенокардии, от момента рандомизации вплоть до момента, когда последний получающий лечение субъект завершил посещение в день 112 исследования. Все СНСЯ были рассмотрены независимым комитетом по контролю клинических событий, члены которого были не осведомлены о кодах рандомизации.
Кровотечение оценивали в качестве вторичной конечной точки для оценки безопасности, поскольку ожидалось, что большинство субъектов будут получать двойную антитромбоцитарную терапию после ИМ. Были оценены измеренные и скорректированные на исходный уровень концентрации в плазме apoA-I, проведен анализ фармакодинамических характеристик CSL112, включая изменение показателей общего и ABCA1-зависимого обратного транспорта холестерина (ex vivo), а также анализ липидных, метаболических и сердечно-сосудистых биомаркеров. Дополнительные предварительно установленные конечные точки описаны ранее31.
Статистический анализ
Статистический анализ выполняли с применением программы SAS® версии 9.4. Все конечные точки для оценки безопасности анализировали в популяции для оценки безопасности, которая состояла из рандомизированных субъектов, получивших по меньшей мере одну частичную дозу исследуемого состава. В популяции для оценки безопасности субъекты были классифицированы в соответствии с фактическим лечением, которое они получали, и их истинной типической группой по состоянию функции почек. Конечные точки для оценки эффективности анализировали в популяции ITT, которая состояла из всех рандомизированных субъектов. В популяции ITT субъекты были классифицированы в соответствии с лечением, для которого они были рандомизированы, и в соответствии с типической группой по состоянию функции почек, из которой они были рандомизированы, независимо от фактического лечения или истинной типической группы по состоянию функции почек. Дополнительные популяции, такие как популяция для анализа ФК, популяция для анализа ФК/ФД и популяция для анализа биомаркеров, были заранее определены в протоколе исследования.
Метод Ньюкомба-Уилсона использовали для расчета двусторонних 95% доверительных интервалов для разницы в показателях (CSL112 минус плацебо) в случае комбинированных первичных конечных точек для оценки безопасности. Верхняя граница двустороннего 95% доверительного интервала была установлена для комбинированных первичных конечных точек в сравнении с установленными порогами конечных точек для оценки безопасности для печени и почек с целью оценки не меньшей эффективности. Это дает одностороннюю 2,5% ошибку I типа для каждой из конечных точек для оценки безопасности для печени и почек, и было основано на применении метода Бонферрони для контроля общей ошибки I типа на уровне 5%. Было заранее установлено, что результаты будут соответствовать критериям отсутствия меньшей эффективности для разницы в показателях, если верхняя граница 95% доверительного интервала будет составлять ≤4% в результатах для функции печени и ≤5% в результатах для функции почек при попарном сравнении групп лечения. Результаты, относящиеся к кровотечениям, сравнивали для трех групп.
Хотя и не обладающие достаточной мощностью для выявления разницы в СНСЯ, вторичные и исследовательские результаты для СНСЯ оценивали путем расчета разницы во времени до первого возникновения СНСЯ между группами лечения с помощью модели пропорциональных рисков Кокса, используя распределение в группу лечения и типическую группу по исходному состоянию функции почек в качестве ковариатов. P-значение двустороннего логарифмического рангового критерия рассчитывали для каждой дозы CSL112 относительно плацебо со стратификацией по состоянию функции почек. Никакой формальной проверки гипотез для СНСЯ не предполагалось.
Результаты
С января 2015 г. до ноября 2015 г. в общей сложности 1258 пациентов в 16 странах были рандомизированы, из них 1244 (99,6%) получили по меньшей мере одну дозу исследуемого состава и 1147 (91,2%) получили все 4 инфузии. Всего 680 (54,1%) пациентов были стратифицированы в типическую группу нормальной функции почек и 578 (45,9%) были стратифицированы в типическую группу легкой почечной недостаточности (Фигура 1). В качестве индексного явления 61,6% пациентов перенесли STEMI и 38,4% перенесли NSTEMI. Средняя продолжительность периода времени от индексного явления до рандомизации составила 4 дня, и хотя для 24-34 пациентов на группу лечения период последующего наблюдения составил один год, средняя продолжительность периода последующего наблюдения составляла 7,5 (МКР 5,8, 9,7) месяцев. Исходные характеристики были хорошо сбалансированы между 3 группами лечения (Таблица 1).
Результаты для комбинированных первичных конечных точек
Во время периода активного лечения развитие печеночной недостаточности, в качестве комбинированной первичной конечной точки для оценки безопасности, имело место у 0 (0,0%) пациентов в группе плацебо, 4/415 (1,0%) пациентов в группе дозы 2 г (p=0,12 против плацебо), 2/416 (0,5%) пациентов в группе дозы 6 г (p=0,50 против плацебо). Результаты для групп обеих доз в сравнении с группой плацебо существенно не отличались и находились в пределах заранее установленных границ ≤4% (Таблица 2). В исследовании отсутствовали случаи, соответствующие закону Хая (то есть, одновременного повышения уровней АЛТ/АСТ и билирубина без какого-либо иного объяснения этого сочетания). Результаты двух заранее определенных анализов чувствительности, включающих пациентов с повышенными исходными уровнями билирубина и всеми повышенными значениями, независимо от подтвержденных значений, находились в соответствии с результатами первичного анализа на безопасность (Таблица 7).
Развитие почечной недостаточности, в качестве комбинированной первичной конечной точки для оценки безопасности, имело место у 1/413 (0,2%) пациента в группе плацебо, 0/415 (0,0%) пациентов в группе дозы 2 г (p=0,50 против плацебо) и 3/416 (0,7%) пациентов в группе дозы 6 г (p=0,62 против плацебо). Результаты для групп обеих доз в сравнении с группой плацебо существенно не отличались и находились в пределах заранее установленных границ ≤5% (Таблица 2). Результаты дополнительных заранее определенных исследовательских анализов на безопасность и апостериорных анализов приведены в Таблицах 8 и 9.
Результаты для вторичных и исследовательских конечных точек
В течение 12 месяцев последующего наблюдения риски развития комбинированного СНСЯ, в качестве вторичной конечной точки (смерть от СС заболевания, не фатальный ИМ, ишемический инсульт и госпитализация по поводу нестабильной стенокардии), при лечении CSL112 в сравнении с группой плацебо были одинаковыми (низкая доза [2 г] (27/419, 6,4%) против плацебо (23/418, 5,5%): относительный риск, 1,18; 95% ДИ, 0,67-2,05; p=0,72) и высокая доза [6 г]: (24/421, 5,7%, относительный риск, 1,02; 95% ДИ, 0,57-1,80; p=0,52) (Фигура 2). Наблюдали сходные риски для групп лечения в отношении комбинированного СНСЯ в качестве исследовательской конечной точки, включающего традиционную конечную точку фазы 3 в виде смерти от сердечно-сосудистого заболевания, не фатальный ИМ и инсульт (Фигура 3). Как и в случае комбинированного СНСЯ в качестве вторичной конечной точки, результаты для большинства СНСЯ в качестве дополнительных исследовательских конечных точек были аналогичными среди групп лечения. Имело место различие в количестве смертей, связанных с сердечно-сосудистыми заболеваниями, при сравнении CSL112 с 6 г apoA-I (n=4, 1,0%; p=0,0477) и плацебо (n=0, 0,0%), однако эта разница отсутствовала при сравнении CSL112 с 2 г apoA-I (n=2, 0,5%; p=0,32) и плацебо. Однако число пациентов, умерших от сердечно-сосудистого заболевания, было низким (Таблица 3). Аналогично, была отмечена разница в количестве случаев сердечной недостаточности при сравнении CSL112 с 6 г apoA-I (n=4, 1,0%; p=0,2525) и плацебо (n=1, 0,2%), и CSL112 с 2 г apoA-I (n=5, 1,2%; p=0,1205) и плацебо. Число пациентов, испытывающих сердечную недостаточность, было низким (Таблица 3).
Показатели для кровотечений всех категорий согласно BARC были низкими и были сопоставимыми для всех 3 групп (Таблица 4). Реакции гиперчувствительности к лекарственному средству и реакции в зоне инфузии были приблизительно одинаковыми для всех групп. В целом, количества серьезных и угрожающих жизни нежелательных явлений, а также серьезных нежелательных явлений, приводящих к прекращению применения лекарственного средства, были относительно низкими и сопоставимыми во всех группах (Таблицы 10 и 11).
Исходные показатели концентрации в плазме apoA-I, обратного транспорта холестерина, а также липидных и сердечно-сосудистых биомаркеров были сходными в трех группах лечения (Таблица 5). Инфузия CSL112 приводила к зависимому от дозы увеличению как уровня apoA-I, так и и обратного транспорта холестерина (Таблица 6). Доза 2 г приводила к увеличению уровня apoA-I в 1,29 раз и общего обратного транспорта холестерина в 1,87 раз, в то время как доза 6 г приводила к увеличению уровня apoA-I в 2,06 раз и общего обратного транспорта холестерина в 2,45 раз. В соответствии с полученными ранее результатами, увеличение ABCA1-зависимого обратного транспорта холестерина (в 3,67 раз в случае дозы 2 г, в 4,30 раз в случае дозы 6 г) было существенно большим, чем увеличение уровня apoA-I или общего обратного транспорта холестерина, свидетельствуя о том, что CSL112 может на только вызывать увеличение количества циркулирующего apoA-I, но также может вызывать увеличение активности для ABCA1-зависимого обратного транспорта в расчете на количество apoA-I26. Авторы изобретения оценивали эту «удельную активность» циркулирующего пула apoA-I для ABCA1-зависимого обратного транспорта холестерина путем расчета соотношения ABCA1-зависимый обратный транспорт холестерина/apoA-I по окончании инфузии. Инфузия CSL112 приводила к 2,51-кратному увеличению соотношения в группе дозы 2 г (0,05) и 1,78-кратному увеличению соотношения в группе дозы 6 г (0,035) в сравнении с группой плацебо (0,02)26. Увеличение ABCA1-зависимого обратного транспорта было больше, чем увеличение уровня apoA-I. Хотя данное соотношение не является признанным показателем, можно предположить, что инфузия приводит к увеличению не только количества, но и функциональности пула apoA-I. Действительно, соотношения ABCA1-зависимый обратный транспорт холестерина/apoA-I были повышены при введении обеих доз CSL112 в сравнении с введением плацебо (Таблица 9).
Обсуждение
Инфузии CSL112, восстановленного полученного из плазмы apoA-I, как в низкой [2 г], так и высокой [6 г], дозах, вводимого в виде 4 еженедельных инфузий, начиная с момента в пределах 7 дней после острого ИМ, не были связаны с изменением функций как печени, так и почек. Данное исследование было первым, в котором CSL112 вводили пациентам с острым ИМ, и впервые данная процедура была добавлена к стандарту оказания медицинской помощи при остром ИМ. Установление безопасности и целесообразности процедуры при остром ИМ было важным этапом перед началом крупномасштабного исследования фазы 3 по оценке результатов лечения. Результаты исследования AEGIS-I свидетельствуют о том, что настоящий состав CSL112 в сравнении с прототипом состава не является проблемным с точки зрения безопасности для печени. Кроме того, инфузия CSL112 вскоре после введения контрастного вещества пациентам с ИМ не была связана с токсичностью для почек, что указывает на целесообразность введения CSL112 пациенту с ИМ, имеющему нормальную функцию почек или легкую почечную недостаточность, вскоре после ангиографии. Исследование с участием пациентов с ИМ, имеющих умеренную почечную недостаточность, в настоящее время продолжается.
Число СНСЯ, в целом, было низким (n=74), как и число субъектов, для которых период последующего наблюдения был завершен в течение одного года (89/1258). Статистическая мощность исследования для оценки СНСЯ в качестве вторичной конечной точки была очень низкой, приблизительно 8,4% (Таблица 13). Показатели СНСЯ были, в целом, сопоставимы во всех группах, хотя смертность от сердечно-сосудистого заболевания была выше в группе дозы 6 г в сравнении с группой плацебо (4 против 0 смертей, p=0,0477). Рассчитанное значение р не было скорректировано для множественности 32 сравнений эффективности. Отсутствовала кластеризация событий смерти в непосредственной близости по времени с инфузией CSL112 (Таблица 12 и Фигура 4). Следует отметить, что случаи смерти по неопределенной причине считали смертью от сердечно-сосудистого заболевания. Отдельно взятая разница в смертности не согласовывалась с общими аналогичными показателями для СНСЯ.
В сравнении с плацебо состав CSL112 также приводил к улучшению показателей обратного транспорта холестерина. Было высказано предположение, что улучшение функции ЛПВП, а не концентрации ЛПВП, может быть более важным для стабилизации атеросклеротических бляшек и уменьшения числа СС осложнений. В проводимом в Далласе исследовании болезней сердца высокий обратный транспорт холестерина, показатель эффективности обратного транспорта холестерина, был связан со снижением на 67% риска СНСЯ в сравнении с низким обратным транспортом холестерина18, эта связь не зависела от концентрации ЛПВП. В настоящее время, при том что методы лечения, направленные на увеличение уровня ЛПВП, действительно приводят к увеличению концентрации ЛПВП, они оказывают умеренный, или вовсе не оказывают, эффект на обратный транспорт холестерина, наблюдение, которое может объяснить, по меньшей мере частично, почему методы лечения, направленные на увеличение уровня ЛПВП, не были способны приводить к уменьшению случаев СНСЯ в прошлом32-38. Напротив, обратный транспорт холестерина был заметно повышен сразу после инфузии CSL112. В частности, ABCA1-зависимый обратный транспорт, путь, особенно связанный с нагруженными холестерином клетками в бляшках, был увеличен более, чем в три раза после инфузии CSL112. Стоит отметить, что увеличение ABCA1-зависимого обратного транспорта происходило в большей степени, чем увеличение уровня apoA-I, тем самым свидетельствуя о том, что инфузия приводит к увеличению не только количества, но также и функциональности пула apoA-I. Действительно, соотношения ABCA1-зависимый обратный транспорт холестерина/apoA-I были увеличены в группах обеих доз CSL112 в сравнении с группой плацебо (Таблица 6). Предыдущие механистические исследования39 показали сопоставимые функциональные изменения и позволили определить, что CSL112 приводит к увеличению ABCA1-зависимого обратного транспорта путем реструктурирования эндогенного ЛПВП, с образованием более мелких, более функциональных видов ЛПВП с высокой способностью к взаимодействию с ABCA1.
Показано, что увеличение обратного транспорта холестерина, вызываемое CSL112, является временным и возвращается к исходному уровню после клиренса apoA-I26. Неизвестно, каким образом временное увеличение обратного транспорта холестерина сразу после острого ИМ будет влиять на клинические исходы в сравнении с постоянными или долгосрочными показателями обратного транспорта холестерина, оцененными в исследовании болезней сердца, проводимом в Далласе18. Хотя количество СНСЯ не было уменьшено в исследовании AEGIS-I, данное исследование фазы 2b было запланировано в качестве исследования для оценки безопасности и не обладало достаточной мощностью для оценки эффективности (Таблица 13). Как и в других исследованиях фазы 2 для оценки безопасности, серьезные нежелательные сердечно-сосудистые явления (СНСЯ) были изучены в AEGIS-I для оценки времени и частоты возникновения этих явлений и для идентификации подгрупп пациентов, имеющих высокий риск возникновения таких явлений, с тем, чтобы можно было спланировать исследование фазы 3 с адекватной мощностью для достоверной оценки эффективности. Несмотря на то, что эти анализы являются исследовательскими, они были заранее определены, чтобы сконцентрировать внимание на анализах при планировании исследования фазы 3.
Явления, выступающие в качестве комбинированных первичных конечных точек для оценки безопасности, были менее частыми, чем предполагалось для анализа отсутствия меньшей эффективности, однако очень низкая частота этих явлений свидетельствовала об отсутствии клинически значимых проблем, связанных с безопасностью для печени или почек. Хотя было выполнено несколько анализов липидов и липопротеинов, уровни Lp(a) и apoE не оценивали после инфузии.
Данное исследование было исследованием фазы 2 для оценки безопасности, которое не имело достаточную мощность для оценки эффективности и не было предназначено для получения одобрения регулирующих органов в отношении эффективности. Для количества СНСЯ в качестве вторичной конечной точки мощность исследования составляла 8,4% для определения клинически значимого снижения риска на 15%, исходя из показателя явлений в группе плацебо 5,5% (Таблица 13). Как и многие исследования фазы 2, данное исследование было предпринято, главным образом, для оценки безопасности, но также и для оценки частоты и времени возникновения СНСЯ и для идентификации пациентов, имеющих риск возникновения таких явлений, чтобы можно было осуществить кардинальное исследование фазы 3 с адекватной мощностью для оценки эффективности.
В завершение, 4 еженедельные инфузии CSL112, восстановленного полученного из плазмы apoA-I, как в низкой [2 г], так и высокой [6 г], дозах, проводимые, начиная с момента в пределах 7 дней после острого ИМ и близко по времени от введения контрастного вещества, были обоснованными, не были связаны с изменениями функции как печени, так и почек, или другими серьезными проблемами безопасности, и были связаны с резким улучшением обратного транспорта холестерина. Дальнейшая оценка клинической эффективности CSL112 для уменьшения числа ранних рецидивов сердечно-сосудистых явлений после острого ИМ должна быть произведена в обладающем достаточной мощностью, многоцентровом, рандомизированном исследовании фазы 3.
ПРИМЕР 2
Введение
В этом примере описаны данные клинического исследования CSL112 и его способности вызывать обратный транспорт холестерина из макрофагов у пациентов с умеренной почечной недостаточностью.
Предыдущие клинические исследования CSL112 продемонстрировали благоприятный профиль безопасности, благоприятные фармакокинетические (ФК) и фармакодинамические результаты у здоровых субъектов, пациентов со стабильной атеросклеротической болезнью и пациентов с острым ИМ, имеющих нормальную функцию почек (НФП) или легкую почечную недостаточность26,27. Почечная недостаточность является распространенным состоянием при остром коронарном синдроме, при этом приблизительно у 30% субъектов развивается хроническая почечная недостаточность (ХПН) 3 стадии. Целью данного исследования была оценка влияния инфузии CSL112 на ОТХ и липопротеиновые биомаркеры у субъектов с умеренной почечной недостаточностью (Ум. ПН).
Обратный транспорт холестерина
При обратном транспорте холестерина свободный холестерин (СХ) переносится из клеток в пре-β1-ЛПВП с помощью переносчика ABCA1, который в большом количестве экспрессируется на макрофагах в атеросклеротических бляшках. СХ в ЛПВП частице затем этерифицируется с помощью лецитин-холестерин ацилтрансферазы (ЛХАТ), образуя более крупные ЛПВП частицы (ЛПВП3 и ЛПВП2). СХ также переносится в ЛПВП3 с помощью переносчиков ABCG1 и SR-B1. Этерифицированный холестерин ЛПВП затем переносится в печень для экскреции или реутилизации.
Инфузия CSL112 приводит к увеличению образования пре-β1-ЛПВП, который, в свою очередь, вызывает увеличение ОТХ, главным образом, за счет переносчика ABCA1, и в итоге к увеличению активности ЛХАТ и этерификации СХ.
Методы
Дизайн исследования
Двойное слепое исследование фазы 1 по изучению действия однократных нарастающих доз (NCT02427035) проводили для оценки ФК, безопасности и биомаркеров CSL112 у взрослых людей с Ум. ПН. Почечную недостаточность классифицировали, как умеренную, если показатель рСКФ составлял ≥30 и <60 мл/мин/1,73 м2. Проводили сравнение с НФП, при которой показатель рСКФ составляет ≥90 мл/мин/1,73 м2.
Всего в исследовании участвовали 32 субъекта, в том числе 16 с НФП и 16 с Ум. ПН. Субъекты были рандомизированы по группам на основании состояния функции почек для получения 2 г (n=6 в группе) или 6 г (n=6 в группе) CSL112, или плацебо (n=4 [n=2 на каждую группу дозы CSL112]).
Исследование состояло из 28-дневного периода скрининга, с последующим 16-дневным периодом активного лечения, включающим обязательное пребывание в клинике, во время которого CSL112 вводили одной 2-часовой внутривенной (в/в) инфузией, нескольких амбулаторных посещений и 76-дневного периода последующего наблюдения для оценки безопасности.
Определение биомаркеров
Тринадцать разных исходных параметров обратного транспорта холестерина и липопротеинов измеряли в каждой группе, сформированной на основании состояния функции почек. Измеряли в плазме apoA-I, аполипопротеин B (apoB) и высокочувствительный C-реактивный белок (hsCRP) иммунотурбидиметрическим методом. ОТХ, общий и ABCA1-независимый, измеряли после инкубации сыворотки in vitro с макрофагами, предварительно нагруженными радиоактивно меченым холестерином, не экспрессирующими ABCA1, или с экспрессией ABCA1, индуцируемой циклическим АМФ (смотри, например, de le Llera-Moya et al., Arterioscler. Thromb. Vasc. Biol. 2010; 30-796-801). ABCA1-зависимый ОТХ рассчитывали путем вычитания ABCA1-независимого ОТХ из общего ОТХ. Пре-β1-ЛПВП измеряли методом ELISA в «сэндвич»-формате, используя специфическое в отношении конформации антитело против apoA-I в составе пре-β1-ЛПВП. Другие липидные параметры оценивали стандартными ферментативными методами.
Статистический анализ
Использовали параллельный критерий Стьюдента для сравнения исходных параметров обратного транспорта холестерина и липопротеинов у пациентов с Ум. ПН и НФП. Воздействие на биомаркеры дозы CSL112 сравнивали для групп, сформированных на основании состояния функции почек, с применением ANOVA.
Результаты
Исходные характеристики
Всего 32 субъекта (n=16 НФП и n=16 Ум. ПН) получали одну в/в инфузию CSL112 или плацебо. Исходные характеристики для каждой из этих групп пациентов приведены в Таблице 14.
В исходном состоянии показатели общего и ABCA1-зависимого ОТХ были в 1,3 раз и 1,8 раз выше, соответственно, у субъектов с Ум. ПН в сравнении с субъектами с НФП, но отсутствовала значимая разница в ABCA1-независимом ОТХ. В соответствии с данным результатом, имело место значительное 1,4-кратное увеличение исходного уровня пре-β1-ЛПВП в группе Ум. ПН в сравнении с группой НФП. Уровни всех других липидов и липопротеинов, а также hsCRP, в исходном состоянии были сходными в группах субъектов с разным состоянием функции почек (Таблица 15). (Meier et al., Life Sci 2015; 136:1-6, ранее наблюдаемый более высокий ОТХ при более низкой рСКФ у взрослых пациентов с ХПН).
Уровни всех других липидов и липопротеинов, а также hsCRP, в исходном состоянии были сходными в группах субъектов с разным состоянием функции почек (Таблица 15). Инфузия CSL112 не приводила к значительному изменению уровней проатерогенных липидов apoB, не-ЛПВП холестерина или триглицеридов, от исходных уровней в любой группе, сформированной на основании состояния функции почек (данные не представлены).
Параметры обратного транспорта холестерина и липопротеинов после инфузии CSL112
После инфузии CSL112 уровень apoA-I быстро возрастал зависимым от дозы образом, достигая пика в конце периода инфузии (2 ч), и оставался повышенным относительно исходных уровней через 72 ч после инфузии. Концентрации в плазме apoA-I с течением времени были сходными в группах пациентов с разной функцией почек, в каждой группе дозы CSL112 (Фигура 5).
Быстрое зависимое от дозы увеличение общего, ABCA1-зависимого и ABCA1-независимого ОТХ наблюдали после инфузии CSL112. Влияние инфузии CSL112 на общий и ABCA1-независимый ОТХ было аналогичным в группах пациентов с разной функцией почек. В обеих группах пациентов с разной функцией почек состав CSL112 приводил к зависимому от дозы увеличению уровней пре-β1-ЛПВП (Фигура 6A-B).
В обеих группах пациентов с разной функцией почек состав CSL112 приводил к зависимому от дозы увеличению общего ОТХ, ABCA1-независимого ОТХ, ABCA1-зависимого ОТХ и уровней пре-β1-ЛПВП. В случае пре-β1-ЛПВП это зависимое от дозы увеличение было более выражено у субъектов с Ум. ПН, чем у субъектов с НФП (Фигура 7 A-B).
Без связи с конкретной теорией, возможным объяснением этого результата является то, что понижающая регуляция экспрессии ABCA1 на периферических клетках у субъектов с Ум. ПН приводит к увеличению уровней пре-β1-ЛПВП вследствие уменьшения способности к метаболическому превращению пре-β1-ЛПВП в ЛПВП3. В этом случае инфузия CSL112 приводила бы к более сильному увеличению уровней пре-β1-ЛПВП у субъектов с Ум. ПН, чем у субъектов с НФП. Это согласуется с различием в исходных уровнях пре-β1-ЛПВП (Таблица 14).
После инфузии CSL112 имело место временное зависимое от дозы увеличение уровней ЛПВП-не этерифицированного холестерина (ЛПВП-НХ), которые достигали пика в конце периода инфузии (2 ч), а затем снижались (Фигура 8). За этим следовало увеличение уровней ЛПВП-этерифицированного холестерина (ЛПВП-ЭХ), достигающих пика через 24 ч после инфузии и превышающих уровень ЛПВП-НХ. Уровни как ЛПВП-НХ, так и ЛПВП-ЭХ, оставались выше исходных уровней через 144 ч после инфузии. Аналогичные результаты были получены для CSL112 в дозе 2 г. Этот результат согласуется с постоянным перемещением не этерифицированного холестерина в ЛПВП и быстрой этерификацией за счет ЛХАТ. Непосредственно активность ЛХАТ не измеряли в данном исследовании, однако сильное возрастание этерификации ранее наблюдали в плазме кроликов, которым вводили CSL112 инфузией. В группах дозирования CSL112 оказывал аналогичное влияние на уровни ЛПВП-НХ и ЛПВП-ЭХ в обеих группах пациентов с разной функцией почек (Фигура 8).
Инфузия CSL112 не приводила к значительному изменению уровней проатерогенных липидов apoB, не-ЛПВП холестерина или триглицеридов от исходных уровней в любой из групп пациентов с разной функцией почек.
Выводы
Инфузия CSL112 у субъектов с Ум. ПН и НФП приводила к сходному быстрому, сильному, зависимому от дозы увеличению уровней apoA-I и ОТХ. У субъектов с Ум. ПН наблюдалось большее увеличение уровней пре-β1-ЛПВП (p=0,003), что может отражать сниженную способность к метаболическому превращению пре-β1-ЛПВП в ЛПВП3. Активность ЛХАТ, проявляющаяся в виде изменения с течением времени соотношения свободного холестерина и этерифицированного холестерина, судя по всему, была сходной у субъектов с Ум. ПН и НФП. Ни в одной из групп не наблюдали каких-либо связанных с CSL112 изменений от исходных уровней в концентрациях apoB, не-ЛПВП холестерина или триглицеридов.
Результаты данного исследования показывают, что CSL112 приводит к увеличению уровней биомаркеров обратного транспорта холестерина аналогичным образом у субъектов с Ум. ПН и НФП. Это свидетельствует о том, что CSL112 может представлять собой новый терапевтический состав для быстрого снижения атеросклеротической нагрузки и для уменьшения риска повторных сердечно-сосудистых явлений у пациентов с Ум. ПН, или без нее, после острого инфаркта миокарда.
Эти результаты были получены для субъектов с Ум. ПН, не перенесших ИМ в пределах семи дней до начала лечения.
ПРИМЕР 3
Введение
Для пациентов с ОКС и ПН прогноз, как краткосрочный, так и долгосрочный, является менее благоприятным, чем для пациентов, имеющих нормальную функцию почек, поскольку риск СС явлений и смертность обратно пропорциональны расчетной скорости клубочковой фильтрации (рСКФ) [Nabais et al., 2008; Bhandari and Jain, 2012]. Поскольку субъекты с умеренной ПН составляют значительную часть (то есть, до 30% [Gibson et al., 2004; Fox et al., 2010]) популяции пациентов с ОКС, важно включить эту субпопуляцию в программу исследования CSL112 фазы 3.
Исследование CSL112_2001, многоцентровое, двойное слепое, рандомизированное, плацебо-контролируемое, с параллельными группами исследование фазы 2, было предпринято с целью оценки безопасности для почек и других видов безопасности при многократном введении дозы 6 г CSL112 субъектам с ОИМ и умеренной ПН.
Дизайн исследования
В исследование CSL112_2001 были включены субъекты с умеренной ПН, которые прошли скрининг в пределах 5-7 дней после ОИМ. Приблизительно 81 субъект был включен в исследование и рандомизирован для получения 4 еженедельных инфузий дозы 6 г CSL112 (~54 субъектов) в сравнении с плацебо (~27 субъектов) с целью оценки параметров безопасности для почек и других видов безопасности. Для гарантии того, что по меньшей мере одна треть популяции пациентов, включенных в исследование, имели рСКФ в диапазоне, характерном для хронической почечной недостаточности (ХПН) стадии 3b (рСКФ от 30 до <45 мл/мин/1,73 м2), не более двух третей популяции пациентов, включенных в исследование, (то есть, 54 субъекта) должны были иметь рСКФ в диапазоне, соответствующем ХПН стадии 3a (от 45 до <60 мл/мин/1,73 м2). При рандомизации проводили стратификацию по рСКФ (от 30 до <45 мл/мин/1,73 м2 или от 45 до <60 мл/мин/1,73 м2), выполняя расчеты в соответствии с формулой разработанной организацией «Сотрудничество в области эпидемиологии хронических заболеваний почек» (CKD-EPI) [Levey et al., 2009; Stevens et al., 2010], и по наличию в анамнезе диабета, контролируемого современными методами фармакотерапии. Субъекты должны были находиться под наблюдением в течение приблизительно 60 дней.
Цели исследования и конечные точки
Основной целью исследования CSL112_2001 была оценка безопасности для почек CSL112 у субъектов с умеренной ПН и ОИМ. Комбинированными первичными конечными точками были случаи почечных СНЯ и явления ОПП. Показатели частоты возникновения явлений были основаны на числе субъектов, у которых возникло по меньшей мере 1 представляющее интерес явление.
- Почечные СНЯ определяли в соответствии с предпочтительным термином (ПТ) Медицинского словаря нормативной деятельности (MedDRA), включенным в опросник Acute Renal Failure narrow Standard MedDRA Query (SMQ), или ПТ для почечного тубулярного некроза, почечного кортикального некроза, почечного некроза или почечного папиллярного некроза.
- Острое повреждение почек определяли на основании абсолютного увеличения уровня сывороточного креатинина от исходного значения на величину ≥0,3 мг/дл (26,5 мкмоль/л) во время периода активного лечения, которое сохранялось при повторном измерении в центральной лаборатории через не менее, чем 24 часа после измерения повышенного значения. Если значение не было получено повторно (из-за отсутствия последующего наблюдения или нарушения протокола, например), одного значения уровня сывороточного креатинина, которое было повышено в сравнении с исходным значением на ≥0,3 мг/дл (26,5 мкмоль/л) во время периода активного лечения, должно было быть достаточно для определения ОПП. Исходным значением для определения ОПП считали уровень сывороточного креатинина, определенный в центральной лаборатории до проведения инфузии в день 1 исследования.
Вторичными целями исследования были 1) дополнительное определение безопасности и переносимости CSL112 у субъектов с умеренной ПН и ОИМ и 2) определение ФК CSL112 после введения нескольких доз у субъектов с умеренной ПН и ОИМ.
Соответствующие конечные точки для этих целей включали:
- Частоту случаев НЯВЛ и неблагоприятных реакций на лекарственное средство (НРЛС) или предполагаемых НРЛС
- Частоту случаев возникших в ходе лечения кровотечений
- Изменение от исходного уровня функции почек (сывороточный креатинин, рСКФ) и печени (аланинаминотрансфераза [АЛТ], общий билирубин) по результатам анализа
- Клинически значимые изменения результатов клинических лабораторных анализов (биохимия сыворотки, анализ крови и анализ мочи), результатов физического осмотра, массы тела, электрокардиограммы (ЭКГ) и основных показателей состояния организма
- Наличие антител к CSL112 или apoA-I
- Концентрацию в плазме в начале исследования и после окончания инфузии apoA-I и PC
- Коэффициент накопления (R) для apoA-I и PC.
Исследовательскими целями исследования были 1) определение особенностей фармакодинамики CSL112 путем оценки обратного транспорта холестерина, а также других липидных и СС биомаркеров активности CSL112, и 2) оценка эффекта CSL112 на биомаркеры безопасности для почек.
Результаты
Распределение участников клинического исследования
Всего 102 субъекта предоставили письменное информированное согласие на участие в исследовании, и был проведен скрининг на соответствие критериям включения в исследование CSL112_2001 (Фигура 9). Из этих субъектов, 19 не прошли скрининг, и остальные 83 (81,4%) удовлетворяющие требованиям субъекта были рандомизированы в соотношении 2:1 в группы активного состава и плацебо для получения 6 г CSL112 (55 субъектов, 53,9%) или плацебо (28 субъектов, 27,5%), соответственно. Три субъекта, рандомизированные в группу CSL112, не получили состав. Шестьдесят девять (83,1%) рандомизированных субъектов завершили исследование, при этом 46 (83,6%) субъектов завершили исследование в группе CSL112 и 23 (82,1%) субъекта завершили исследование в группе плацебо.
Четырнадцать (16,9%) субъектов не завершили исследование, 9/55 (16,4%) и 5/28 (17,9%) в группах CSL112 и плацебо, соответственно. Причины, по которым субъекты не завершили исследование, включали НЯ (1,8% CSL112; 0 плацебо), смерть (3,6% CSL112; 7,1% плацебо), отклонение от протокола (1,8% CSL112; 0 плацебо), решение субъекта (9,1% CSL112; 7,1% плацебо) и другое (0 CSL112; 3,6% плацебо).
Исходные характеристики
Средний возраст субъектов составлял 71,1 лет, при этом 81,9% субъектов были в возрасте по меньшей мере 65 лет, и средний ИМТ составлял 29,5 кг/м2. Группы лечения были хорошо сбалансированы в отношении возраста и пола участников (Таблица 16).
Средний показатель рСКФ у субъектов при скрининге составлял 46,32 мл/мин/1,73 м2, определение было проведено в центральной лаборатории. Медианные лабораторные значения рСКФ приблизительно соответствовали крайнему значению для хронической почечной недостаточности (ХПН) стадии 3a/3b (то есть, 45 мл/мин/1,73 м2). При рандомизации 47,0% и 53,0% субъектов были классифицированы на основании оценки в местной лаборатории, как имеющие ХПН стадии 3b (от 30 до <45 мл/мин/1,73 м2) или стадии 3a (от 45 до <60 мл/мин/1,73 м2), соответственно, при этом данные, полученные в центральной лаборатории, позволили определить 39,8% субъектов, как имеющих ХПН стадии 3b, и 44,6% субъектов, как имеющих ХПН стадии 3a. Различия в результатах анализов, полученных в центральной и местной лабораториях, могли способствовать пересмотру категории субъектов на основании полученных в центральной лаборатории результатов, в сравнении с результатами, полученными в местной лаборатории, которые были применены для рандомизации.
Субъекты получали аспирин (95,2%), другие антитромбоцитарные терапевтические средства (91,6%), статины (89,2% всего; 59,0% высокой интенсивности), другие липид-модифицирующие средства (6,0%), бета-блокаторы (79,5%), ингибиторы ангиотензин I-превращающего фермента или блокаторы рецепторов ангиотензина (74,7%) и пероральные антитромботические средства (26,5%).
В целом, группы лечения были хорошо сбалансированы в отношении демографических и исходных характеристик.
Анализ безопасности
Экспозиция исследуемого состава
Все 80 (100%) субъектов в популяции для оценки безопасности получили по меньшей мере 1 инфузию исследуемого состава; большинство субъектов (81,3%) получили, и завершили, курс из 3 или 4 инфузий исследуемого состава.
Всего 55/80 (68,8%) субъектов в популяции для оценки безопасности получили все 4 инфузии. Причины, по которым субъекты не получили все 4 инфузии, включали НЯ (19,2% CSL112; 14,3% плацебо), решение субъекта (5,8% CSL112; 10,7% плацебо), смерть (1,9% CSL112; 3,6% плацебо), ключевые показатели функции почек (0 CSL112; 3,6% плацебо), решение врача (1,9% CSL112; 0 плацебо) и другое (1,9% CSL112; 0 плацебо).
Введение исследуемого состава было прекращено для 4 субъектов из-за связанных с почками нежелательных явлений, 3 (3,8%) и 1 (3,4%) субъектов в группе дозы 6 г CSL112 и группе плацебо, соответственно. В группе дозы 6 г CSL112 все явления были оценены исследователем, как не связанные с составом. Два явления у 2 субъектов были несерьезными, и каждый субъект получил 3 дозы CSL112. У третьего субъекта возникло СНЯ в виде токсической нефропатии в день 2 исследования после получения 1 дозы CSL112. В группе плацебо у 1 субъекта возникло СНЯ в виде почечной недостаточности в день 12 исследования, и он получил 2 дозы плацебо. Данное явление было оценено исследователем, как связанное с ИП. Для одного субъекта в группе CSL112 была пропущена инфузия вследствие «повышения уровня креатинина в крови» и у 2 субъектов в группе плацебо была пропущена инфузия, у 1 вследствие «острого повреждения почек» и у 1 вследствие величины ключевого лабораторного показателя функции почек, которая соответствовала критерию правил отсрочки и остановки воздействия для отдельного субъекта, это не было оценено как нежелательное явление.
У двух субъектов в группе CSL112 возникли печеночные НЯ (повышение уровня АЛТ, повышение уровня общего билирубина; оба легкие и временные), которые соответствовали критериям протокола для прекращения введения исследуемого состава; ни для одного из субъектов в группе плацебо исследование не было прекращено вследствие причин, связанных с печенью.
Время до первой инфузии исследуемого состава
Средний период времени, прошедший от ангиографии до первой инфузии исследуемого состава, составлял 65,2 часов (2,7 дней), с несколько более коротким промежутком времени для группы дозы 6 г CSL112 (61,83 ч [2,57 дней]) в сравнении с группой плацебо (71,79 ч [2,99 дней]). Средний период времени, прошедший от ангиографии до первой инфузии, составлял 59,47 часов (2,48 дней) для субъектов, у которых ИМ был классифицирован, как STEMI, в сравнении с периодом времени 67,2 часов (2,8 дней) для тех, у которых ИМ был классифицирован, как NSTEMI. Аналогичное количество, в процентах, субъектов с STEMI (40,0%) и NSTEMI (38,6%) получали исследуемый состав в пределах менее 48 часов после введения контрастного вещества. Небольшое количество, в процентах, субъектов (5/77, 6,5%) получили первую инфузию в пределах периода времени от 12 до <24 часов после ангиографии (Таблица 17).
Комбинированная первичная конечная точка
Сводные данные по возникшим в ходе лечения почечным СНЯ и ОПП приведены в Таблице 18.
Возникшие в ходе лечения почечные СНЯ были отмечены у 1/52 (1,9%) субъектов в группе дозы 6 г CSL112 в сравнении с 4/28 (14,3%) субъектов в группе плацебо. На основании первичного анализа различие в частоте случаев (95% доверительный интервал) между этими группами составляло -0,124 (-0,296, -0,005). У всех субъектов с почечными СНЯ возникло 1 явление, за исключением 1 субъекта в группе плацебо, у которого возникло 2 явления.
Возникшие в ходе лечения ОПП были отмечены у 2/50 (4,0%) субъектов в группе дозы 6 г CSL112 в сравнении с 4/28 (14,3%) субъектов в группе плацебо. На основании первичного анализа различие в частоте случаев (95% доверительный интервал) между этими группами составляло -0,103 (-0,277, 0,025). Ни у одного из субъектов не возникло более 1 ОПП. У 6 субъектов с ОПП эти явления продолжались во время завершения исследования. У субъектов в обеих группах на основании времени между введением контрастного вещества и определением уровня сывороточного креатинина, наблюдаемая частота ОПП была в численном выражении ниже в группе CSL112 в сравнении с группой плацебо (Таблица 18).
Анализ чувствительности комбинированных первичных конечных точек с применением независимо подтвержденных результатов для компонента возникших в ходе лечения почечных СНЯ и данных местной лаборатории для компонента возникших в ходе лечения ОПП подтвердил результаты первичного анализа.
Не было никаких свидетельств того, что частота случаев почечных СНЯ или ОПП была выше в группе CSL112, чем в группе плацебо, у субъектов в подгруппах с ХПН стадии 3a или 3b или у субъектов с диабетом. В этих подгруппах более высокая частота случаев почечных СНЯ и ОПП имела место в группе плацебо (Таблица 19). Более высокая частота случаев ОПП в группе CSL112 была у субъектов без диабета в анамнезе.
Подтвержденные почечные серьезные явления
Выявленные исследователем почечные серьезные явления были подтверждены комиссией по рассмотрению клинических явлений, и из 6 заявленных исследователем явлений, 5 были положительно подтверждены: 1/2 в группе CSL112 и 4/4 в группе плацебо. Одно явление в группе CSL112 не было утверждено в качестве явления, поскольку оно было несерьезным.
Все явления были классифицированы, как необструктивные (то есть, не вследствие физической обструкции в почке или мочеточнике, такой как почечный камень), и причинно-следственная связь была возможной для 1 явления в группе CSL112, и возможной или маловероятной для 3 и 2 явлений, соответственно, в группе плацебо. В момент диагностирования все явления находились в стадии 1. Прогрессирование до стадии 2 произошло для одного положительно подтвержденного явления в группе CSL112 в течение 7 дней после начала развития ОПП; в группе плацебо 2 явления прогрессировали в этих временных рамках, по 1 до стадии 2 (25%) и стадии 3 (25%).
Нежелательные явления
Если нет иных указаний, все НЯ, описанные в данном разделе, относятся к НЯВЛ.
Сводные данные
Сводные данные по НЯВЛ, описанным в настоящем документе, приведены в Таблице 20.
Возникшие в ходе лечения нежелательные явления
У сопоставимого количества, в процентном выражении, субъектов в группах CSL112 и плацебо были отмечены возникшие в ходе лечения НЯ (НЯВЛ): 38 (73,1%) субъектов в группе дозы 6 г CSL112 и 20 (71,4%) субъектов в группе плацебо. Явления в классах систем органов (КСО) с частыми (≥10%) НЯВЛ, имеющие большую частоту в группе CSL112 в сравнении с группой плацебо, включали: сердечные нарушения, исследуемые, дыхательные нарушения, нарушения в грудной клетке и средостении, желудочно-кишечные нарушения и нарушения в нервной системе.
В целом, сопоставимое количество, в процентах, НЯВЛ, соответствующих 3, 4 и 5 степени тяжести согласно CTCAE, было отмечено в группах CSL112 (17,3%, 7,7% и 3,8%, соответственно) и плацебо (35,7%, 3,6% и 7,1%, соответственно). У 15/52 (28,8%) субъектов в группе CSL112 имели место НЯВЛ 3, 4 или 5 степени в сравнении с 13/28 (46,4%) субъектов в группе плацебо. Явления 5 степени имели место с большей частотой в группе плацебо (2/28, 7,1%) в сравнении с группой CSL112 (2/52, 3,8%). Частые (≥10% или более субъектов) НЯВЛ, которые имели место только в группе CSL112, включали повышение уровня в крови креатинина, сердечную недостаточность и фибрилляцию предсердий.
Серьезные нежелательные явления
Всего у 22/80 (27,5%) субъектов имели место серьезные НЯВЛ, у 12/52 [23,1%] и 10/28 [35,7%] субъектов в группах дозы 6 г CSL112 и плацебо, соответственно (Таблица 21). Серьезные НЯВЛ были отмечены в следующих КСО: сердечные нарушения (12,5%), нарушения почек и мочевыводящих путей (6,3%), инфекции и паразитарные инвазии (3,8%), желудочно-кишечные нарушения, общие нарушения и осложнения в зоне введения, травмы, отравления и процедурные осложнения, нарушения в нервной системе, а также дыхательные нарушения, нарушения в грудной клетке и средостении (2,5% каждого вида), нарушения в кровеносной и лимфатической системах, нарушения в наружном ухе и лабиринте, нарушения в глазу и сосудистые нарушения (1,3% каждого вида).
Серьезные НЯВЛ, отмеченные у 2 или более субъектов в группе CSL112, включали (с применением предпочтительного термина) фибрилляцию предсердий (3/52, 5,8%) и сердечную недостаточность (3/52, 5,8%). Для субъектов в группе плацебо серьезные НЯВЛ, зарегистрированные у 2 или более субъектов, включали застойную сердечную недостаточность (2/28, 7,1%) и ОПП (2/28, 7,1%).
Сердечная недостаточность и все интересующие почечные явления
Нежелательные явления, которые были оценены более подробно, включают сердечную недостаточность и все почечные явления.
Возникшие в ходе лечения нежелательные явления в виде сердечной недостаточности, которые были зарегистрированы, включали, с применением предпочтительного термина: сердечную недостаточность, застойную сердечную недостаточность и острую сердечную недостаточность. Большее, в процентном выражении, число субъектов в группе CSL112 (7/52, 13,5%) в сравнении с группой плацебо (2/28, 7,1%) имели НЯВЛ в виде сердечной недостаточности. Возникшие в ходе лечения СНЯ в виде сердечной недостаточности имели место со сходной частотой в группах CSL112 (4/52, 7,6%) и плацебо (2/28, 7,1%). Один субъект в каждой из групп CSL112 и плацебо имел сердечную недостаточность, которая привела к смерти.
Возникшие в ходе лечения почечные явления включали, с применением предпочтительного термина: почечную недостаточность, токсическую нефропатию, ОПП, нарушение функции почек и повышение уровня в крови креатинина. Эти явления имели место со сходной частотой у субъектов в группах CSL112 (17,3%) и плацебо (14,3%). Как отмечено ранее (смотри раздел «Комбинированная первичная конечная точка»), возникшие в ходе лечения почечные СНЯ имели место с меньшей частотой у субъектов в группе CSL112 (1,9%), чем в группе плацебо (14,3%).
Возникшие в ходе лечения кровотечения
Возникшие в ходе лечения кровотечения были отмечены исследователями и подтверждены комиссией по рассмотрению клинических явлений на основании критериев, разработанных Академическим исследовательским консорциумом по кровотечениям (BARC). Аналогичную частоту и степень тяжести кровотечений наблюдали во всех группах лечения. У всех субъектов, перенесших кровотечение, кровотечения соответствовали 3 или меньшей степени по шкале BARC. Всего у 3/52 (5,8%) субъектов в группе дозы 6 г CSL112 имело место кровотечение 3 степени по шкале BARC, в сравнении с 1/28 (3,6%) субъектов в группе плацебо. Ни у одного из субъектов ни в одной из групп лечения не было кровотечения 4 или 5 степени по шкале BARC. Отсутствовали случаи смерти, связанной с кровотечением, и отсутствовали кровотечения в центральной нервной системе.
Неблагоприятные реакции на лекарственное средство или предполагаемые неблагоприятные реакции на лекарственное средство
Возникшие в ходе лечения НЯ, классифицированные как НРЛС или предполагаемые НРЛС на основании определения FDA1, возникали с большей частотой в группе CSL112 (57,7%), чем в группе плацебо (14,3%).
Классификация большой процентной доли НЯВЛ в группе CSL112, как предполагаемых НРЛС, являлась следствием применения определения в части 4 документа FDA к исследованию с малым размером выборки. В соответствии с четвертым критерием, если у 1 субъекта в группе лечения активным составом, и ни у одного из субъектов в группе плацебо, имеет место явление, то явление должно быть классифицировано как предполагаемое НРЛС. Учитывая малый размер выборки, полученные данные были недостаточными для определения того, являются ли все НЯВЛ, отмеченные в исследовании, НРЛС (то есть имеют причинно-следственную связь с CSL112).
Результаты клинических лабораторных анализов
Анализы на изменение функции почек
В дополнение к оценке стадий почечных СНЯ комиссией по рассмотрению клинических явлений анализировали лабораторные результаты на повышение уровней показателей, соответствующих определению ОПП согласно документу Kidney Disease: Improving Global Outcomes (KIDGO, 2012). Ни у одного из субъектов в группах CSL112 или плацебо не возникало ОПП 3 стадии (уровни сывороточного креатинина ≥3× исходного значения или ≥ 4,0 мг/дл [353,6 мкмоль/л]), исходя из значений сывороточного креатинина, полученных в центральной или местной лаборатории (Таблица 22). Для двух субъектов были потеряны данные центральной лаборатории по исходному уровню сывороточного креатинина. Большинство повышенных значений сывороточного креатинина (67,3% 6 г CSL112; 64,3% плацебо) находились в диапазоне от >0 до <0,3 мг/дл повышения в сравнении с исходными значениями. Для каждой из этих категорий с увеличением абсолютного значения от исходного уровня в диапазоне от ≥0,3 до ≤0,5 мг/дл и увеличением уровня сывороточного креатинина >0,5 мг/дл от исходного значения, меньшее, в процентном выражении, количество субъектов были в группе дозы 6 г CSL112 в сравнении с группой плацебо. У одного (1,9%) субъекта в группе CSL112 и 4 (14,3%) субъектов в группе плацебо увеличение уровня сывороточного креатинина от исходного уровня в диапазоне от ≥0,3 до ≤0,5 мг/дл имело место в течение ≥24 часов. У одного (1,9%) субъекта в группе дозы 6 г CSL112 увеличение уровня сывороточного креатинина >0,5 мг/дл имело место в течение ≥24 часов. Ни у одного из субъектов не было уровней сывороточного креатинина, ≥2 раза превышающих исходные уровни.
Анализы на изменение функции печени
Средние исходные уровни аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы (ЩФ), а также общего и прямого билирубина, были сходными в группах плацебо и дозы 6 г CSL112. Эти параметры не были увеличены после инфузии CSL112.
Количество, в процентном выражении, субъектов как в группе плацебо, так и в группе дозы 6 г CSL112, для которых отсутствовали данные по АЛТ или общему билирубину, было низким. За все посещения максимальное количество, в процентном выражении, субъектов с недостающими данными, составляло 7,5% совокупно для АЛТ и общего билирубина.
Ни у одного из субъектов, как в группе дозы 6 г CSL112, так и в группе плацебо, не было одновременного увеличения общего или прямого билирубина до уровня более 2× ВПН и АЛТ или АСТ до уровня более 3× ВПН во время периода активного лечения (Таблица 22). Не было субъектов с увеличением уровня АЛТ >3× ВПН во время периода активного лечения. У одного (1,9%) субъекта в группе CSL112 имел место отдельный эпизод увеличения уровня АСТ до >5× ВПН во время посещения 3, которое разрешилось ко времени посещения 4. Во время периода активного лечения у 3 (5,8%) субъектов в группе CSL112 имело место временное увеличение уровня общего билирубина (или прямого билирубина для субъектов с синдромом Жильбера) до уровня >1,5× ВПН во время посещения 3, через 24-48 часов после начала инфузии, которое больше не наблюдалось во время посещения 4, в сравнении с отсутствием таких субъектов в группе плацебо.
Другие биохимические показатели сыворотки
Никакие клинически значимые различия в других биохимических параметрах сыворотки не были обнаружены для групп лечения и, в целом, не были обнаружены никакие клинически значимые тенденции.
Гематология
Никакие клинически значимые различия в гематологических параметрах не были обнаружены для групп лечения и, в целом, не были обнаружены никакие клинически значимые тенденции.
Всего у 9/80 (11,3%) субъектов было обнаружено снижение уровня гемоглобина на ≥2 г/л от исходных значений на протяжении исследования, при этом количество субъектов, в процентном выражении, было больше в группе дозы 6 г CSL112 (7/52, 13,5%), чем в группе плацебо (2/28, 7,1%).
Анализ мочи
Никакие клинически значимые различия в параметрах мочи при анализе не были обнаружены для групп лечения и, в целом, не были обнаружены никакие клинически значимые тенденции. Случаи изменения уровней гемоглобина от исходных значений и качественного определения общего белка в моче были немногочисленными и, если такие изменения имели место, они происходили не более, чем на 1 категорию. Соотношения в разовой порции мочи белка/креатинина и цистатина C/креатинина демонстрировали легкое, временное увеличение средних значений через 24-48 часов после первой инфузии CSL112, с большой вариабельностью данных.
Аномалии лабораторных результатов
Ни у одного из субъектов не было аномалий лабораторных результатов 4 степени для гемоглобина, сывороточного креатинина, рСКФ, глюкозы (в сыворотке и моче), АЛТ, АСТ, ЩФ или билирубина (прямого, непрямого или общего). Аномалии лабораторных результатов 3 степени имели место у субъектов в обеих группах лечения для рСКФ (3,8% CSL112; 7,4% плацебо) и глюкозы (13,5% CSL112; 22,2% плацебо). Единственная аномалия лабораторных результатов 3 степени для АСТ была обнаружена в группе дозы 6 г CSL112 (смотри раздел: Анализы на изменение функции печени).
Иммуногенность
В начале исследования все субъекты имели реципрокные титры антител, которые были признаны отрицательными (10 или 11). Ни у одного из субъектов как в группе дозы 6 г CSL112, так и в группе плацебо, не было обнаружено изменение от исходного уровня реципрокных титров анти-CSL112 или анти-apoA-I антител в конце периода активного лечения (посещение 7) или после завершения исследования (посещение 8).
Анализ фармакокинетики
Относительно исходных уровней и относительно группы плацебо средние концентрации в плазме как apoA-I, так и PC, были повышены в группе CSL112, при этом максимальные средние значения имели место в момент завершения инфузии 1 (посещение 2) и 4 (посещение 6).
Аналогичное увеличение концентраций в плазме apoA-I и PC наблюдали у получавших CSL112 субъектов в каждой подгруппе, сформированной на основании функции почек, в момент завершения инфузии 1 (посещение 2) и 4 (посещение 6).
Средние значения скорректированных на исходный уровень максимальных наблюдаемых концентрацией в плазме (Cmax) для apoA-I и PC были повышены в группе дозы 6 г CSL112 относительно группы плацебо после первой и четвертой инфузий (Таблица 24). Значения коэффициента накопления для Cmax после 4-й инфузии относительно 1-ой инфузии для apoA-I и PC составляли 1,20 (20%) и 1,00 (0%), соответственно. Для обоих аналитов CSL112 накопление в плазме было низким.
Общий ОТХ был на 13% выше (P <0,001) в начале исследования у пациентов в исследовании 2001 в сравнении с популяцией пациентов исследования AEGIS-I (пример 1). В частности, общий ОТХ, в %, составлял 9,8 ± 2,7 (n=78) в исследовании CSL112_2001 в сравнении с 8,7 ± 2,7 (n=1204) в исследовании AEGIS-I. Аналогично, ABCA1-зависимый ОТХ исходно был на 35% выше (P <0,001) у пациентов в исследовании 2001 в сравнении с пациентами в исследовании AEGIS-I. ABCA1-зависимый ОТХ, в %, составлял 3,6 ± 2,0 (n=78) в исследовании CSL112_2001 против 2,6 ± 1,8 (n=1204) в исследовании AEGIS-I. Какая-либо разница отсутствовала в ABCA1-независимом ОТХ, при этом ABCA1-независимый ОТХ, в %, составлял 6,2 ± 1,7 (n=78) в исследовании CSL112_2001 против 6,0 ± 1,5 (n=1204) в исследовании AEGIS-I. Эти наблюдения соответствовали паттерну ОТХ, наблюдаемому у субъектов с умеренной ПН, в сравнении с субъектами, имеющими нормальную функцию почек, в исследовании CSL112_2001 (пример 2).
Совокупные данные параметров функции почек: AEGIS I и CSL112_2001
Совокупный анализ изменений от исходного уровня показателей сывороточного креатинина и рСКФ приведен в настоящем документе для исследований AEGIS-I (исследование CSLCT-HDL-12-77) и CSL112_2001. Целью этого анализа данных являлось определение общего воздействия, а также воздействия в зависимости от времени инфузии CSL112 относительно времени ангиографии, на функцию почек у субъектов с разной степенью почечной недостаточности. В исследовании AEGIS-I была проведена оценка CSL112 у субъектов с ИМ, имеющих либо нормальную функцию почек, либо легкую ПН. В исследовании CSL112_2001 была проведена оценка для субъектов с ОИМ, имеющих умеренную ПН. Совокупный анализ этих данных позволил провести оценку для спектра состояний функции почек, который ожидался у целевой популяции исследования фазы 3. В обоих исследованиях принимающие участие субъекты являются репрезентативными для целевой популяции исследования фазы 3 по возрасту, полу, сопутствующим медицинским состояниям (например, диабет, гипертензия) и постоянно принимаемым сопутствующим лекарственным составам (например, статины в двойной антитромбоцитарной терапии).
Сывороточный креатинин
Совокупный анализ (Фиг. 10) показал небольшое изменение от исходного значения средних уровней сывороточного креатинина у субъектов, получавших CSL112 или плацебо, с показателями рСКФ ≥60 мл/мин/1,73 м2, а также у субъектов с показателями рСКФ 45-60 мл/мин/1,73 м2, во время периодов активного лечения и до 7-10 дней после последней инфузии. У субъектов с показателями рСКФ 30-<45 мл/мин/1,73 м2 уменьшение от исходного значения средних уровней сывороточного креатинина наблюдали в обеих группах лечения, начиная со дня 15 исследования. Относительно сопоставимое уменьшение средних уровней сывороточного креатинина наблюдали у субъектов в группах CSL112 и плацебо.
Проведенный в зависимости от типической группы по состоянию функции почек и от времени между проведением ангиографии и введением первой дозы анализ изменений от исходных значений (центральная лаборатория) уровней сывороточного креатинина показал уменьшение от исходных уровней у субъектов с показателями рСКФ в диапазоне от 30 до <45 мл/мин/1,73 м2, как в окне от 24 до <48 часов, так и в окне ≥48 часов (Фигура 11). В случае субъектов с показателями рСКФ от 45 до <60 мл/мин/1,73 м2, получавших дозу в окне от 24 до <48 часов, у большинства субъектов изменение уровня креатинина представляло собой увеличение на менее 0,3 мг/дл относительно исходных значений. Количество данных является недостаточным, чтобы делать выводы для субъектов, получавших дозу через <24 часа после ангиографии.
Расчетная скорость клубочковой фильтрации
Совокупный анализ (Фиг. 12) показал небольшое изменение от исходного значения показателей рСКФ у субъектов с показателями рСКФ ≥60 мл/мин/1,73 м2, а также у субъектов с показателями рСКФ 45 - <60 мл/мин/1,73 м2 во время периодов активного лечения и до 7-10 дней после последней инфузии. У субъектов с показателями рСКФ 30-<45 мл/мин/1,73 м2 небольшое увеличение среднего изменения от исходных значений рСКФ наблюдали у субъектов, получавших как CSL112, так и плацебо, начиная в день 15 исследования. Сводные Таблицы совокупных данных по рСКФ приведены на Фигурах 10-12.
Результаты
Комбинированные первичные конечные точки
Частота связанных с почками серьезных и несерьезных нежелательных явлений была сходной в группах лечения (Таблица 19). Не было свидетельств в пользу более высокой частоты повышения уровня креатинина в группе CSL112 в сравнении с группой плацебо, по результатам анализа, проведенного как центральной, так и местной, лабораториями. В большинстве случаев повышение уровней креатинина от исходных значений было легким и временным.
Анализ нежелательных явлений
Возникшие в ходе лечения НЯ имели место у приблизительно одинакового, в процентном выражении, количества субъектов в группах CSL112 (73,1%) и плацебо (71,4%). Отсутствовал явный дисбаланс явлений в КСО между группами лечения, и наиболее частые НЯ были ожидаемы, исходя из популяции пациентов с острым ИМ и умеренной ПН. Частота связанных НЯВЛ была низкой, с 4 случаями в группе CSL112 (увеличение уровня АЛТ, увеличение уровня в крови билирубина, опухание зоны инфузии и гипервентиляция); была 1 предполагаемая НР в виде почечной недостаточности в группе плацебо. Случаи гемолиза отсутствовали, и наблюдали аналогичную частоту и степень тяжести кровотечений в обеих группах лечения. На протяжении исследования отсутствовали случаи фатального кровотечения или кровотечения в центральной нервной системе.
Показатели функции печени и другие лабораторные результаты
Что касается показателей функции печени, ни у одного из субъектов они не соответствовали критерию закона Хая для вызываемого лекарственным средством повреждения печени, поскольку отсутствовало одновременное повышение уровней АЛТ до >3× ВПН и уровня общего билирубина до >2× ВПН у субъектов во всех группах лечения. Легкое временное увеличение уровней билирубина, или прямого билирубина у субъектов с синдромом Жильбера, наблюдали через 24-48 часов после начала инфузии 1 CSL112 у небольшого количества (5,8%) субъектов, получавших CSL112. Это временное увеличение уровней билирубина ранее наблюдалось в программе, и его не считают клинически значимым или связанным с изменениями функции печени.
Что касается других лабораторных результатов, никакие клинически значимые различия не наблюдали между группами лечения в гематологических или биохимических параметрах. Не были обнаружены проблемы, связанные с безопасностью, в результатах анализа на общий белок в моче или клинически значимые изменения, или различия между группами лечения, в соотношениях белок/креатинин в разовой порции мочи. Не были обнаружены клинически значимые различия между группами лечения в уровнях сывороточного цистатина C. Не были обнаружены антитела к CSL112 или apoA-I.
Фармакокинетика
Изучение фармакокинетики показало, что отсутствовало накопление apoA-I или PC при введении CSL112 (4-я инфузия в сравнении с 1-й инфузией) у субъектов с острым ИМ и умеренной ПН, это указывало на приемлемость применения дозы 6 г CSL112 в данной популяции. Аналогичное повышение уровней apoA-I относительно исходных значений наблюдали у получавших CSL112 субъектов с ХПН стадии 3a (рСКФ=45 - <60 мл/мин/1,73 м2) и 3b (рСКФ=30 - <45 мл/мин/1,73 м2).
Исследование показало, что фармакокинетический профиль дозы 6 г является подходящим для пациентов с острым ИМ с умеренной ПН. Доза 6 г CSL112 приводила к увеличению ОТХ в аналогичной степени у субъектов в исследовании CSL112_2001 и субъектов в исследовании AEGIS-I (пример 1). Во временных точках завершения инфузии относительное увеличение ОТХ было аналогичным в обоих исследованиях (Фигуры 13-15). ABCA1-зависимый ОТХ был увеличен более длительное время у субъектов в исследовании CSL112_2001, это согласуется с тем, что наблюдали у пациентов с УПН, получавших CSL112 в исследовании CSL112-1001 (пример 2).
Совокупный анализ лабораторных данных
Совокупный анализ лабораторных данных из исследований AEGIS-I и CSL112_2001 проводили для изучения изменений от исходных значений показателей сывороточного креатинина и рСКФ, и он показал отсутствие отрицательного влияния инфузии CSL112 на эти параметры функции почек в подгруппах субъектов с умеренной ПН, в сравнении с субъектами, имеющими легкую ПН или нормальную функцию почек. Изменения от исходных значений уровней сывороточного креатинина были сходными в группах пациентов с разным состоянием функции почек, независимо от времени введения первой дозы CSL112 относительно введения контрастного вещества.
Заключение
Исследование CSL112_2001 с участием субъектов с острым ИМ и умеренной ПН подтвердило безопасность для почек при введении 4 еженедельных инфузий дозы 6 г CSL112 в сравнении с введением плацебо в данной популяции. Общий профиль безопасности был благоприятным, и отсутствовали какие-либо новые тревожные сигналы, свидетельствующие о необходимости специального контроля для субъектов с умеренной ПН, в сравнении с субъектами, имеющими нормальную функцию почек или легкую ПН.
Целью настоящей спецификации являлось описание предпочтительных вариантов осуществления изобретения, без ограничения изобретения каким-либо одним вариантом осуществления или конкретным набором признаков. Различные изменения и модификации описанных и проиллюстрированных вариантов осуществления могут быть произведены без отклонения от сущности настоящего изобретения.
Описание каждого патента и научного документа, компьютерной программы и алгоритма, на которые приводятся ссылки в настоящей спецификации, включены в настоящий документ посредством ссылки в полном объеме.
СПИСОК ЛИТЕРАТУРЫ
1. Fox KAA, Dabbous OH, Goldberg RJ, Pieper KS, Eagle KA, Van de Werf F, Avezum A, Goodman SG, Flather MD, Anderson FA, Granger CB. Prediction of risk of death and myocardial infarction in the six months after presentation with acute coronary syndrome: Prospective multinational observational study (grace). BMJ. 2006;333:1091-1091.
2. Stone GW, Maehara A, Lansky AJ, de Bruyne B, Cristea E, Mintz GS, Mehran R, McPherson J, Farhat N, Marso SP, Parise H, Templin B, White R, Zhang Z, Serruys PW, Investigators P. A prospective natural-history study of coronary atherosclerosis. N Engl J Med. 2011;364:226-235.
3. Shotan A, Blondheim DS, Gottlieb S, Kazatsker M, Frimerman A, Shochat M, Garty M, Boyko V, Behar S, Meisel SR, Working Group on Intensive Cardiac C, Israel Heart S, Acute Coronary Syndrome Israeli Survey I. Comparison of outcome of recurrent versus first st-segment elevation myocardial infarction (from national israel surveys 1998 to 2006). The American journal of cardiology. 2011;107:1730-1737.
4. Anderson KM, Odell PM, Wilson PW, Kannel WB. Cardiovascular disease risk profiles. Am Heart J. 1991;121:293-298.
5. Wallis EJ, Ramsay LE, Ul Haq I, Ghahramani P, Jackson PR, Rowland-Yeo K, Yeo WW. Coronary and cardiovascular risk estimation for primary prevention: Validation of a new sheffield table in the 1995 scottish health survey population. Bmj. 2000;320:671-676.
6. Anderson KM, Wilson PW, Odell PM, Kannel WB. An updated coronary risk profile. A statement for health professionals. Circulation. 1991;83:356-362.
7. Kannel WB, Dawber TR, Kagan A, Revotskie N, Stokes J, 3rd. Factors of risk in the development of coronary heart disease--six year follow-up experience. The framingham study. Ann Intern Med. 1961;55:33-50.
8. Assmann G, Cullen P, Schulte H. Simple scoring scheme for calculating the risk of acute coronary events based on the 10-year follow-up of the prospective cardiovascular munster (procam) study. Circulation. 2002;105:310-315.
9. Ferrario M, Chiodini P, Chambless LE, Cesana G, Vanuzzo D, Panico S, Sega R, Pilotto L, Palmieri L, Giampaoli S. Prediction of coronary events in a low incidence population. Assessing accuracy of the cuore cohort study prediction equation. International journal of epidemiology. 2005;34:413-421.
10. Conroy RM, Pyorala K, Fitzgerald AP, Sans S, Menotti A, De Backer G, De Bacquer D, Ducimetiere P, Jousilahti P, Keil U, Njolstad I, Oganov RG, Thomsen T, Tunstall-Pedoe H, Tverdal A, Wedel H, Whincup P, Wilhelmsen L, Graham IM. Estimation of ten-year risk of fatal cardiovascular disease in europe: The score project. Eur Heart J. 2003;24:987-1003.
11. Woodward M, Brindle P, Tunstall-Pedoe H. Adding social deprivation and family history to cardiovascular risk assessment: The assign score from the scottish heart health extended cohort (shhec). Heart. 2007;93:172-176.
12. Hippisley-Cox J, Coupland C, Vinogradova Y, Robson J, May M, Brindle P. Derivation and validation of qrisk, a new cardiovascular disease risk score for the united kingdom: Prospective open cohort study. Bmj. 2007;335:136.
13. Landray MJ, Haynes R, Hopewell JC, Parish S, Aung T, Tomson J, Wallendszus K, Craig M, Jiang L, Collins R, Armitage J. Effects of extended-release niacin with laropiprant in high-risk patients. N Engl J Med. 2014;371:203-212.
14. Barter PJ, Caulfield M, Eriksson M, Grundy SM, Kastelein JJP, Komajda M, Lopez-Sendon J, Mosca L, Tardif J-C, Waters DD, Shear CL, Revkin JH, Buhr KA, Fisher MR, Tall AR, Brewer B. Effects of torcetrapib in patients at high risk for coronary events. New England Journal of Medicine. 2007;357:2109-2122.
15. Boden WE, Probstfield JL, Anderson T, Chaitman BR, Desvignes-Nickens P, Koprowicz K, McBride R, Teo K, Weintraub W. Niacin in patients with low hdl cholesterol levels receiving intensive statin therapy. N Engl J Med. 2011;365:2255-2267.
16. Schwartz GG, Olsson AG, Abt M, Ballantyne CM, Barter PJ, Brumm J, Chaitman BR, Holme IM, Kallend D, Leiter LA, Leitersdorf E, McMurray JJ, Mundl H, Nicholls SJ, Shah PK, Tardif JC, Wright RS, dal OI. Effects of dalcetrapib in patients with a recent acute coronary syndrome. N Engl J Med. 2012;367:2089-2099.
17. Tardif JC, Ballantyne CM, Barter P, Dasseux JL, Fayad ZA, Guertin MC, Kastelein JJ, Keyserling C, Klepp H, Koenig W, L'Allier PL, Lesperance J, Luscher TF, Paolini JF, Tawakol A, Waters DD. Effects of the high-density lipoprotein mimetic agent cer-001 on coronary atherosclerosis in patients with acute coronary syndromes: A randomized trial. Eur Heart J. 2014;35:3277-3286.
18. Rohatgi A, Khera A, Berry JD, Givens EG, Ayers CR, Wedin KE, Neeland IJ, Yuhanna IS, Rader DR, de Lemos JA, Shaul PW. Hdl cholesterol efflux capacity and incident cardiovascular events. N Engl J Med. 2014;371:2383-2393.
19. Saleheen D, Scott R, Javad S, Zhao W, Rodrigues A, Picataggi A, Lukmanova D, Mucksavage ML, Luben R, Billheimer J, Kastelein JJ, Boekholdt SM, Khaw KT, Wareham N, Rader DJ. Association of hdl cholesterol efflux capacity with incident coronary heart disease events: A prospective case-control study. The lancet. Diabetes & endocrinology. 2015;3:507-513.
20. Siddiqi HK, Kiss D, Rader D. Hdl-cholesterol and cardiovascular disease: Rethinking our approach. Current opinion in cardiology. 2015;30:536-542.
21. Ray KK, Ditmarsch M, Kallend D, Niesor EJ, Suchankova G, Upmanyu R, Anzures-Cabrera J, Lehnert V, Pauly-Evers M, Holme I, Stasek J, van Hessen MW, Jones P, dal AI. The effect of cholesteryl ester transfer protein inhibition on lipids, lipoproteins, and markers of hdl function after an acute coronary syndrome: The dal-acute randomized trial. Eur Heart J. 2014;35:1792-1800.
22. Bounafaa A, Berrougui H, Ikhlef S, Essamadi A, Nasser B, Bennis A, Yamoul N, Ghalim N, Khalil A. Alteration of hdl functionality and pon1 activities in acute coronary syndrome patients. Clin Biochem. 2014;47:318-325.
23. Shao B, Tang C, Sinha A, Mayer PS, Davenport GD, Brot N, Oda MN, Zhao XQ, Heinecke JW. Humans with atherosclerosis have impaired abca1 cholesterol efflux and enhanced high-density lipoprotein oxidation by myeloperoxidase. Circ Res. 2014;114:1733-1742.
24. Diditchenko S, Gille A, Pragst I, Stadler D, Waelchli M, Hamilton R, Leis A, Wright SD. Novel formulation of a reconstituted high-density lipoprotein (csl112) dramatically enhances abca1-dependent cholesterol efflux. Arterioscler Thromb Vasc Biol. 2013;33:2202-2211.
25. Easton R, Gille A, D'Andrea D, Davis R, Wright SD, Shear C. A multiple ascending dose study of csl112, an infused formulation of apoa-i. Journal of clinical pharmacology. 2014;54:301-310.
26. Gille A, Easton R, D'Andrea D, Wright SD, Shear CL. Csl112 enhances biomarkers of reverse cholesterol transport after single and multiple infusions in healthy subjects. Arterioscler Thromb Vasc Biol. 2014;34:2106-2114.
27. Tricoci P, D'Andrea DM, Gurbel PA, Yao Z, Cuchel M, Winston B, Schott R, Weiss R, Blazing MA, Cannon L, Bailey A, Angiolillo DJ, Gille A, Shear CL, Wright SD, Alexander JH. Infusion of reconstituted high-density lipoprotein, csl112, in patients with atherosclerosis: Safety and pharmacokinetic results from a phase 2a randomized clinical trial. Journal of the American Heart Association. 2015;4:e002171.
28. Herzog E, Pragst I, Waelchli M, Gille A, Schenk S, Mueller-Cohrs J, Diditchenko S, Zanoni P, Cuchel M, Seubert A, Rader DJ, Wright SD. Reconstituted high-density lipoprotein can elevate plasma alanine aminotransferase by transient depletion of hepatic cholesterol: Role of the phospholipid component. J Appl Toxicol. 2016;36:1038-1047.
29. Tardif JC, Gregoire J, L'Allier PL, Ibrahim R, Lesperance J, Heinonen TM, Kouz S, Berry C, Basser R, Lavoie MA, Guertin MC, Rodes-Cabau J, Effect of r HDLoA-S, Efficacy I. Effects of reconstituted high-density lipoprotein infusions on coronary atherosclerosis: A randomized controlled trial. JAMA. 2007;297:1675-1682.
30. Thygesen K, Alpert JS, Jaffe AS, Simoons ML, Chaitman BR, White HD, Thygesen K, Alpert JS, White HD, Jaffe AS, Katus HA, Apple FS, Lindahl B, Morrow DA, Chaitman BR, Clemmensen PM, Johanson P, Hod H, Underwood R, Bax JJ, Bonow RO, Pinto F, Gibbons RJ, Fox KA, Atar D, Newby LK, Galvani M, Hamm CW, Uretsky BF, Steg PG, Wijns W, Bassand J-P, Menasche P, Ravkilde J, Ohman EM, Antman EM, Wallentin LC, Armstrong PW, Simoons ML, Januzzi JL, Nieminen MS, Gheorghiade M, Filippatos G, Luepker RV, Fortmann SP, Rosamond WD, Levy D, Wood D, Smith SC, Hu D, Lopez-Sendon J-L, Robertson RM, Weaver D, Tendera M, Bove AA, Parkhomenko AN, Vasilieva EJ, Mendis S. Third universal definition of myocardial infarction. Journal of the American College of Cardiology. 2012;60:1581-1598.
31. Gibson CM, Korjian S, Tricoci P, Daaboul Y, Alexander JH, Steg PG, Lincoff AM, Kastelein JJP, Mehran R, D'Andrea D, Merkely B, Zarebinski M, Ophius TO, Harrington RA. Rationale and design of apo-i event reduction in ischemic syndromes i (aegis-i): A phase 2b, randomized, placebo-controlled, dose-ranging trial to investigate the safety and tolerability of csl112, a reconstituted, infusible, human apoa-i, after acute myocardial infarction. American Heart Journal. 2016;180:22-28.
32. Nicholls SJ. Accelerate: Evacetrapib does not reduce major cv events in high-risk patients. 2016, http://www.thecardiologyadvisor.com/acc-meeting-highlights/evacetrapib-did-not-reduce-cv-events-in-high-risk-patients/article/487228.
33. Chapman MJ, Le Goff W, Guerin M, Kontush A. Cholesteryl ester transfer protein: At the heart of the action of lipid-modulating therapy with statins, fibrates, niacin, and cholesteryl ester transfer protein inhibitors. Eur Heart J. 2010;31:149-164.
34. Investigators TA-H. Niacin in patients with low hdl cholesterol levels receiving intensive statin therapy. New England Journal of Medicine. 2011;365:2255-2267.
35. Bays HE, Shah A, Lin J, Sisk CM, Dong Q, Maccubbin D. Consistency of extended-release niacin/laropiprant effects on lp(a), apob, non-hdl-c, apo a1, and apob/apoa1 ratio across patient subgroups. American journal of cardiovascular drugs: drugs, devices, and other interventions. 2012;12:197-206.
36. Maccubbin D, Bays HE, Olsson AG, Elinoff V, Elis A, Mitchel Y, Sirah W, Betteridge A, Reyes R, Yu Q, Kuznetsova O, Sisk CM, Pasternak RC, Paolini JF. Lipid-modifying efficacy and tolerability of extended-release niacin/laropiprant in patients with primary hypercholesterolaemia or mixed dyslipidaemia. International journal of clinical practice. 2008;62:1959-1970.
37. Fayad ZA, Mani V, Woodward M, Kallend D, Abt M, Burgess T, Fuster V, Ballantyne CM, Stein EA, Tardif JC, Rudd JH, Farkouh ME, Tawakol A. Safety and efficacy of dalcetrapib on atherosclerotic disease using novel non-invasive multimodality imaging (dal-plaque): A randomised clinical trial. Lancet. 2011;378:1547-1559.
38. Nicholls SJ, Ruotolo G, Brewer HB, Kane JP, Wang MD, Krueger KA, Adelman SJ, Nissen SE, Rader DJ. Cholesterol efflux capacity and pre-beta-1 hdl concentrations are increased in dyslipidemic patients treated with evacetrapib. Journal of the American College of Cardiology. 2015;66:2201-2210.
39. Didichenko SA, Navdaev AV, Cukier AM, Gille A, Schuetz P, Spycher MO, Therond P, Chapman MJ, Kontush A, Wright SD. Enhanced hdl functionality in small hdl species produced upon remodeling of hdl by reconstituted hdl, csl112: Effects on cholesterol efflux, anti-inflammatory and antioxidative activity. Circ Res. 2016;119:751-763.
40. Anderson WAD, Bethea WR. Renal lesions following administration of hypertonic solutions of sucrose. Report of six Cases. JAMA. 1940; 114(20):1983-7.
41. Bhandari S, Jain P. Management of acute coronary syndrome in chronic kidney disease. J Assoc Physicians India. 2012;60:48-51.
42. Epstein JS, Zoon KC. Important drug warning: Immune globulin intravenous (human) (IGIV) products. Neonatal Netw. 2000;19(2):60-2.
43. Fox KAA, Dabbous OH, Goldberg RJ et al. Prediction of risk of death and myocardial infarction in the six months after presentation with acute coronary syndrome: prospective multinational observational study (GRACE). BMJ. 2006;333: 1091-4.
44. Fox CS, Muntner P, Chen AY, et al. Use of evidence-based therapies in short-term outcomes of ST-segment elevation myocardial infarction and non-ST-segment elevation myocardial infarction in patients with chronic kidney disease: A report from the National Cardiovascular Data Acute Coronary Treatment and Intervention Outcomes Network Registry. Circulation. 2010;121:357-65.
45. Gibson CM, Dumaine RL, Gelfand EV, et al. Associated of glomerular filtration rate on presentation with subsequent mortality in non-ST-segment elevation acute coronary syndrome; observations in 13307 patients in five TIMI trials. Eur Heart J 2004; 25:1998-2005.
46. Guidance for Industry: Drug-Induced Liver Injury: Premarketing Clinical Evaluation. July 2009 http://www.fda.gov/downloads/Drugs/.../Guidances/UCM174090.pdf Kidney Disease: Improving Global Outcomes (KDIGO). Acute Kidney Injury Work Group. KDIGO clinical practice guidelines for acute kidney injury. Kidney Int Suppl 2012; 2:1.
47. Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009;150(9):604-12.
48. Mehran R, Rao SV, Bhatt DL, et al. Standardized bleeding definitions for cardiovascular clinical trials. A consensus report from the Bleeding Academic Research Consortium. Circulation. 2011;123:2736-47.
49. Nabais S, Rocha S, João C, et al. Prognostic impact of moderate renal dysfunction in acute coronary syndrome. Rev Port Cardiol. 2008;27(3):303-12.
50. Pierce LR, Jain N. Risks associated with the use of intravenous immunoglobulin. Transfus Med Rev 2003; 17 (4): 241-51.
51. Stevens LA, Schmid CH, Greene T, et al. Comparative performance of the CKD epidemiology collaboration (CKD-EPI) and the modification of diet in renal disease (MDRD) study equations for estimating GFR levels above 60 mL/minute/1.73 m2. American Journal of Kidney Diseases. 2010;56(3):486-95.
Таблица 1
Исходные характеристики
(N=419)
(N=421)
(N=418)
p-значение
Исходные характеристики были рассчитаны для пациентов при рандомизации.
Для категориальных переменных критерий хи-квадрат использовали для расчета p-значения, для параметрических непрерывных переменных использовали анализ ANOVA и критерий Крускала-Уоллиса.
рСКФ рассчитывали с применением формулы, разработанной организацией «Сотрудничество в области эпидемиологии хронических заболеваний почек» (2009). Обобщенные значения рСКФ представляют собой значения, полученные на основании показателей сывороточного креатинина, полученных в центральной лаборатории при скрининге. В случае отсутствия данных центральной лаборатории, были применены данные, полученные в местной лаборатории.
Для времени между первой инфузией и рандомизацией проводили множественные попарные сравнения: (6 г против плацебо=0,002) и (2 г против плацебо=0,1059) и (6 г против 2 г=0,3462).
† Эзетимиб или ингибиторы PCSK9
ACE означает ангиотензинпревращающий фермент, ARB - блокатор рецепторов ангиотензина, ИМТ - индекс массы тела, АКШ - аорто-коронарное шунтирование, рСКФ - расчетная скорость клубочковой фильтрации, ИМ - инфаркт миокарда, NSTEMI - инфаркт миокарда без подъема сегмента ST, ЧКВ - чрескожное вмешательство на коронарных сосудах, SD - стандартное отклонение и STEMI - инфаркт миокарда с подъемом сегмента ST.
Таблица 2
Комбинированные первичные конечные точки для оценки безопасности
ДИ=доверительный интервал.
a95% доверительные интервалы для различий в частоте случаев у субъекта рассчитывали с применением метода Ньюкомба-Уилсона.
bДа означает соответствие критерию не меньшей эффективности.
cP-значения рассчитывали с применением точного критерия Фишера.
Верхняя граница двустороннего 95% доверительного интервала была установлена для комбинированных первичных конечных точек в сравнении с установленными порогами конечных точек для оценки безопасности для печени и почек с целью оценки не меньшей эффективности. Это дает одностороннюю 2,5% ошибку I типа для каждой из конечных точек для оценки безопасности для печени и почек, и было основано на применении метода Бонферрони для контроля общей ошибки I типа на уровне 5%.
Результаты, в процентном выражении, основаны на количестве субъектов с данными.
Интересующую конечную точку для функции печени определяли, если у какого-либо субъекта имел место один из двух следующих результатов: АЛТ >3x ВПН, общий билирубин >2x ВПН, подтвержденный в последующем повторном тесте через по меньшей мере 24 часа, но в пределах 1 недели от оригинального теста.
Конечную точку для функции почек определяли в случае увеличения уровня сывороточного креатинина до уровня ≥1,5x исходного значения, подтвержденного в повторном тесте через по меньшей мере 24 часа, но в пределах 1 недели, или в случае возникновения необходимости в заместительной почечной терапии.
Таблица 3
Конечные точки СНСЯ в популяции ITT
(6 г против П)
Все значения основаны на анализе времени до первого СНСЯ в популяции ITT.
Результаты, в процентном выражении, основаны на количестве субъектов с данными.
Все явления были подтверждены ОТХ.
Показатели относительного риска основаны на модели пропорциональных рисков с факторами для группы лечения и функции почек.
Относительный риск <1 свидетельствует в пользу CSL112.
P-значение <0,05 для стратифицированного логарифмического рангового критерия указывает на то, что время до первого СНСЯ в группе CSL112 значимо отличается в сравнении с группой плацебо.
Комбинированная вторичная конечная точка в виде СНСЯ состоит из смерти от СС заболевания, не фатального ИМ, ишемического инсульта и госпитализации по поводу нестабильной стенокардии.
Исследовательская комбинированная конечная точка 1 в виде СНСЯ состоит из смерти от СС заболевания, не фатального ИМ и ишемического инсульта.
Исследовательская комбинированная конечная точка 2 в виде СНСЯ состоит из смерти от СС заболевания, не фатального ИМ и любых инсультов.
Исследовательская комбинированная конечная точка 3 в виде СНСЯ состоит из не фатального ИМ, смерти по любой причине и любых инсультов.
Исследовательская комбинированная конечная точка 4 в виде СНСЯ состоит из госпитализации по поводу нестабильной стенокардии, смерти по любой причине, любых инсультов, сердечной недостаточности и коронарной реваскуляризации.
Таблица 4
Категории оценки согласно BARC для самых тяжелых кровотечений в популяции для оценки безопасности
Тип 0 включает субъектов, у которых не было кровотечений для рассмотрения.
Если у пациента имело место более одного кровотечения, засчитывали наиболее тяжелое кровотечение.
Подсчет кровотечений вели со времени рандомизации.
Таблица 5
Исходные липидные и сердечно-сосудистые биомаркеры
Все анализы были выполнены для пациентов с имеющимися данными.
ОТХ=обратный транспорт холестерина, ДИ=доверительный интервал.
ABCA1 означает АТФ-связывающую кассету A1, ЛПВП - липопротеин высокой плотности, hsCRP - высокочувствительный C-реактивный белок, IL-6 - интерлейкин 6, ЛПНП - липопротеин низкой плотности, NT-proBNP - N-концевой фрагмент прогормона мозгового натрийуретического пептида и SD - стандартное отклонение.
aСравнение групп лечения с применением ANOVA с условиями для группы лечения.
Таблица 6
Значения обратного транспорта холестерина, ЛПВП-холестерина и apoA-I сразу после инфузии CSL112
Все анализы были выполнены для пациентов с имеющимися данными.
#Кратность увеличения относительно исходных значений, рассчитанная как среднее геометрическое соотношений для отдельных пациентов.
Таблица 7
Анализы чувствительности комбинированных первичных конечных точек для оценки безопасности
ДИ=доверительный интервал.
a95% доверительные интервалы для различий в частоте случаев у субъекта рассчитывали с применением метода Ньюкомба-Уилсона.
bДа означает соответствие критерию не меньшей эффективности.
c*P-значения рассчитывали с применением критерия хи-квадрат или точного критерия Фишера, когда ожидаемое количество клеток составляло <5.
*Результаты, в процентном выражении, основаны на количестве субъектов с данными.
*Для данного анализа чувствительности интересующую конечную точку для функции печени определяли, если у какого-либо субъекта имел место один из двух следующих результатов: АЛТ >3x ВПН, общий билирубин >2x ВПН, без подтверждения в последующем повторном тесте через по меньшей мере 24 часа, но в пределах 1 недели от оригинального теста.
*Для данного анализа чувствительности почечное явление определяли в случае увеличения уровня сывороточного креатинина до уровня ≥1,5x исходного значения или в случае возникновения необходимости в заместительной почечной терапии, без подтверждения в последующем повторном тесте через по меньшей мере 24 часа, но в пределах 1 недели от оригинального теста.
Таблица 8
Апостериорный анализ чувствительности комбинированных первичных конечных точек для оценки безопасности с поправкой Бонферрони для множественных сравнений вариантов лечения
ДИ=доверительный интервал.
aВерхняя граница двустороннего 95% доверительного интервала была установлена для тестирования комбинированных первичных конечных точек в сравнении с установленными порогами конечных точек для оценки безопасности для печени и почек с целью оценки не меньшей эффективности. Это дает одностороннюю 2,5% ошибку I типа для каждой из конечных точек для оценки безопасности для печени и почек, и было основано на применении метода Бонферрони для контроля общей ошибки I типа на уровне 5%. Поправку на множественность не применяли к попарному сравнению двух групп лечения в отношении каждой комбинированной первичной конечной точки. В данной таблице приведена более консервативная оценка с применением двустороннего 97,5% доверительного интервала, в которой дополнительно применена апостериорная поправка Бонферрони к сравнениям групп лечения для достижения индивидуальной односторонней 1,25% ошибки I типа для каждого из сравнений групп лечения.
bДа означает соответствие критерию не меньшей эффективности.
cP-значения рассчитывали с применением точного критерия Фишера.
Результаты, в процентном выражении, основаны на количестве субъектов с данными.
Интересующую конечную точку для функции печени определяли, если у какого-либо субъекта имел место один из двух следующих результатов: АЛТ >3x ВПН, общий билирубин >2x ВПН, подтвержденный в последующем повторном тесте через по меньшей мере 24 часа, но в пределах 1 недели от оригинального теста.
Конечную точку для функции почек определяли в случае увеличения уровня сывороточного креатинина до уровня ≥1,5x исходного значения, подтвержденного в повторном тесте через по меньшей мере 24 часа, но в пределах 1 недели, или в случае возникновения необходимости в заместительной почечной терапии.
Таблица 9
Соотношение обратного транспорта холестерина и apoA-I сразу после инфузии CSL112
Все анализы были выполнены для пациентов с имеющимися данными.
@Кратность изменения в сравнении с плацебо, рассчитанная как соотношение средних арифметических значений для групп лечения.
Таблица 10
Возникшие в ходе лечения нежелательные явления, частота явлений в популяции для оценки безопасности
N означает общее число нежелательных явлений в каждой группе лечения.
Таблица 11
Возникшие в ходе лечения нежелательные явления, количество, в процентном выражении, пациентов в популяции для оценки безопасности
N означает количество, в процентном выражении, пациентов, испытавших нежелательное явление, в каждой группе лечения.
*Если у пациента имело место более одного нежелательного явления, степень тяжести нежелательного явления определяли по наиболее тяжелому явлению.
Таблица 12
Сводные данные по фатальным исходам, по периодам исследования
Таблица 13
Расчет размера выборки и мощности конечных точек для СНСЯ, необходимых для установления ≥15% снижения риска с двусторонним уровнем значимости 0,05
СНСЯ
Размер выборки и мощность исследования рассчитывали на основании частоты явлений в группе плацебо с применением критерия хи-квадрат Пирсона.
Для данного расчета мощности исследования количество пациентов как в группе лечения, так и в группе плацебо, стандартизировали до 420.
Таблица 14: Исходные характеристики
Таблица 15: Исходные параметры обратного транспорта холестерина и параметры липопротеинов в группах по состоянию функции почек
Таблица 16: Характеристики популяции, вошедшей в исследование
ИМТ=индекс массы тела, эИРК=электронная индивидуальная регистрационная карта, рСКФ=расчетная скорость клубочковой фильтрации, ТИО=технология интерактивного ответа, ITT=популяция всех пациентов, первоначально отобранных для исследования, Макс=максимум, ИМ=инфаркт миокарда, Мин=минимум, NSTEMI=инфаркт миокарда без подъема сегмента ST, SD=стандартное отклонение, STEMI=инфаркт миокарда с подъемом сегмента ST
aТипическая группа, в которую был распределен субъект на основании первоначально рассчитанной системой ТИО рСКФ, исходя из возраста, пола, расы субъекта, и его показателя сывороточного креатинина, полученного во время посещения 2 (день 1 исследования).
bТипическая группа, к которой относится субъект на основании расчета рСКФ с применением формулы, разработанной организацией «Сотрудничество в области эпидемиологии хронических заболеваний почек», и определенного в центральной лаборатории показателя сывороточного креатинина, полученного во время посещения 2 (день 1 исследования).
cПоказатели рСКФ, зарегистрированные в системе ТИО
dОбобщенные показатели рСКФ были рассчитаны с применением формулы, разработанной организацией «Сотрудничество в области эпидемиологии хронических заболеваний почек», на основании показателей сывороточного креатинина, полученных в центральной лаборатории во время посещения 2 (день 1 исследования).
eДиабет в анамнезе, отмеченный в эИРК.
Примечание: Результаты, в процентном выражении, основаны на количестве субъектов, рандомизированных в каждую группу лечения. Возраст был автоматически рассчитан на основании даты рождения и даты информированного согласия. Исходные значения в случае отсутствующих лабораторных данных были определены на основании последнего перед инфузией не отсутствующего значения, полученного до, или на момент, даты введения первой дозы исследуемого состава.
Таблица 17: Сводные данные по периодам времени до первой инфузии (популяция ITT)
ITT=популяция всех пациентов, первоначально отобранных для исследования, ИМ=инфаркт миокарда, NSTEMI=инфаркт миокарда без подъема сегмента ST, SD=стандартное отклонение, STEMI=инфаркт миокарда с подъемом сегмента ST
aРезультаты, в процентном выражении, основаны на количестве субъектов в исходной категории.
Таблица 18: Сводные данные по комбинированным первичным конечным точкам для возникших в ходе лечения почечных серьезных нежелательных явлений и случаев острого повреждения почек (популяция для оценки безопасности)
ОПП=острое повреждение почек, ДИ=доверительный интервал, н/п=не применимо, n (%)=показывает число и процентную долю субъектов, у которых возникло явление, n'=показывает число случаев, СНЯ=серьезное нежелательное явление
a95% ДИ для различий в частоте случаев у субъектов рассчитывали с применением интервалов метода Ньюкомба-Уилсона, когда имело место по меньшей мере 1 явление, или в противном случае, с точными односторонними верхними 97,5% доверительными интервалами для частоты случаев в каждой из групп лечения.
Таблица 19: Сводные данные по комбинированным первичным исследовательским конечным точкам для оценки безопасности для почек по подгруппам (популяция для оценки безопасности
ОПП=острое повреждение почек, CKD-EPI=Сотрудничество в области эпидемиологии хронических заболеваний почек, рСКФ=расчетная скорость клубочковой фильтрации, MedDRA=Медицинский словарь нормативной деятельности, ПТ=предпочтительный термин, СНЯ=серьезное нежелательное явление, SMQ=стандартный опросник MedDRA.
Результаты, в процентном выражении, основаны на количестве субъектов с данными.
n (%) показывает число и процентную долю субъектов, испытавших явление, n' показывает число случаев.
aПочечная функция определена на основании рассчитанных с применением формулы CKD-EPI показателей рСКФ, исходя из данных, полученных в центральной лаборатории.
Примечание: Частота случаев рассчитана с применением в знаменателе числа субъектов с данными. «Возникшее в ходе лечения» определяли как возникшее в процессе или после начала первой инфузии.
Таблица 20: Общие сводные данные по нежелательным явлениям (популяция для оценки безопасности)
CTCAE=общие терминологические критерии для нежелательных явлений, НЯВЛ=возникшее в ходе лечения нежелательное явление.
aДля каждой группы лечения 1 смерть по невыясненной причине; 1 смерть вследствие сердечной недостаточности.
Примечание: Результаты, в процентном выражении, основаны на количестве субъектов в популяции для оценки безопасности для каждой группы лечения.
Таблица 21: Возникшие в ходе лечения связанные с исследуемым составом нежелательные явления, по предпочтительному термину (популяция для оценки безопасности)
MedDRA=Медицинский словарь нормативной деятельности, НЯВЛ=возникшее в ходе лечения нежелательное явление.
Примечание: Нежелательные явления кодировали по классу систем органов и предпочтительному термину с применением MedDRA версии 20.0. Для субъекта можно регистрировать явления, относящиеся к более, чем одному предпочтительному термину, но только один раз в пределах предпочтительного термина. Результаты, в процентном выражении, основаны на количестве субъектов в популяции для оценки безопасности для каждой группы лечения.
Таблица 22: Сводные данные по аномальным показателям сывороточного креатинина (центральная лаборатория) в период активного лечения (популяция для оценки безопасности)
ОПП=острое повреждение почек, рСКФ=расчетная скорость клубочковой фильтрации.
aОпределено на основании увеличения уровня сывороточного креатинина в период активного лечения до уровня ≥3× исходного значения или уровня сывороточного креатинина до уровня ≥4,0 мг/дл, что было подтверждено при повторном анализе с применением данных центральной лаборатории.
bОпределено на основании уменьшения на по меньшей мере 25%, начавшегося в период активного лечения.
Примечание: Период активного лечения продолжался со времени первой инфузии субъекту вплоть до завершения посещения 7. В случае отсутствия данных анализа во время посещения 7 завершением периода активного лечения считали дату последнего введения субъекту исследуемого состава+10 дней. Исходным значением считали последнее значение, полученное до даты/времени начала первой инфузии исследуемого состава.
Таблица 23: Сводные данные по аномальным значениям параметров функции печени (независимо от подтверждения) (центральная лаборатория) во время периода активного лечения (популяция для оценки безопасности)
Результаты, в процентном выражении, основаны на количестве субъектов с данными.
Все случаи увеличения уровней суммировали, независимо от подтверждения в повторном анализе.
aВ сводные данные включено одно самое неблагоприятное значение во время периода активного лечения, включая незапланированные анализы, для всех субъектов в указанной группе лечения.
bУвеличение уровней относительно диапазонов ВПН специфичны для половой принадлежности.
cДля субъектов с синдромом Жильбера в анамнезе использовали значения прямого билирубина вместо общего билирубина.
Примечание: Период активного лечения продолжался со времени первой инфузии субъекту вплоть до завершения посещения 7. В случае отсутствия данных анализа во время посещения 7 завершением периода активного лечения считали дату последнего введения субъекту исследуемого состава+10 дней. Посещение 7 (7-10 дней после последней инфузии) включает данные для субъектов, прекративших лечение исследуемым составом или прекративших участие в исследовании ранее (до посещения 7).
Таблица 24: Сводные данные по скорректированным на исходные значения фармакокинетическим параметрам (популяция для оценки ФК)
ApoA-I=аполипопротеин A-I, Cmax=максимальная концентрация, PC=фосфатидилхолин, ФК=фармакокинетика, Q1=1-й квартиль, Q3=3-й квартиль, SD=стандартное отклонение.
Примечание: Скорректированные на исходные значения показатели рассчитывали, как (значение во время посещения - исходное значение). Исходным значением считали результат последнего анализа, полученный до даты/времени начала первой инфузии исследуемого состава.
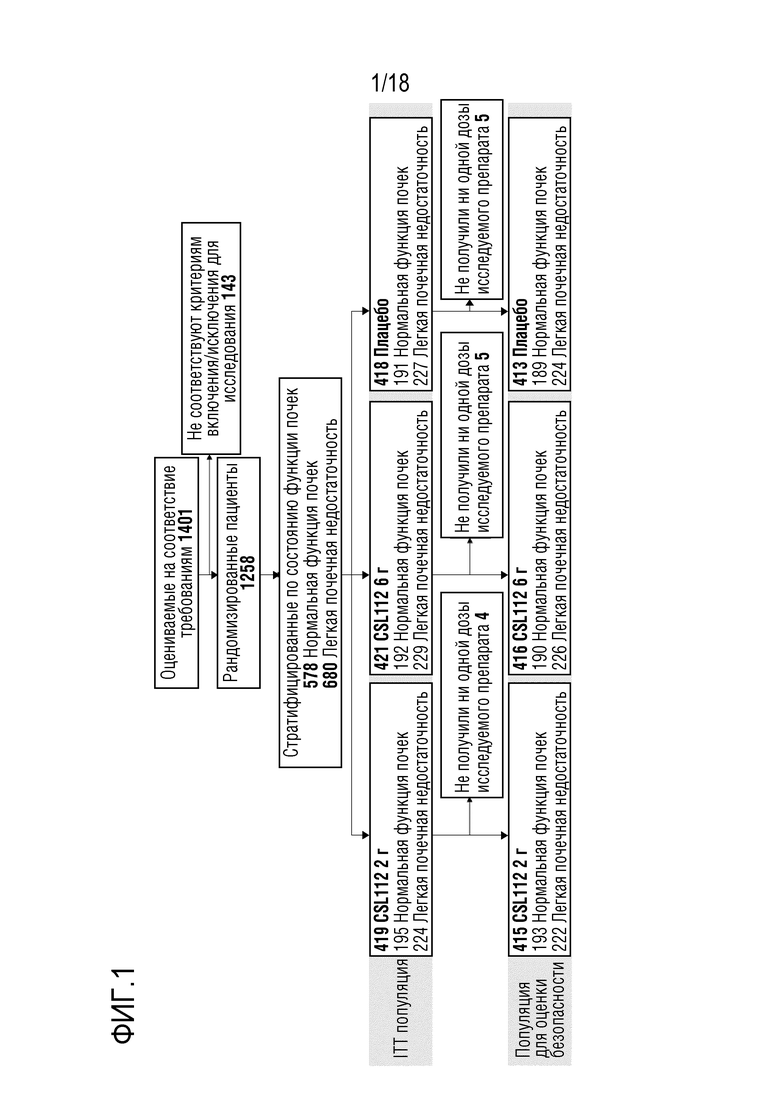
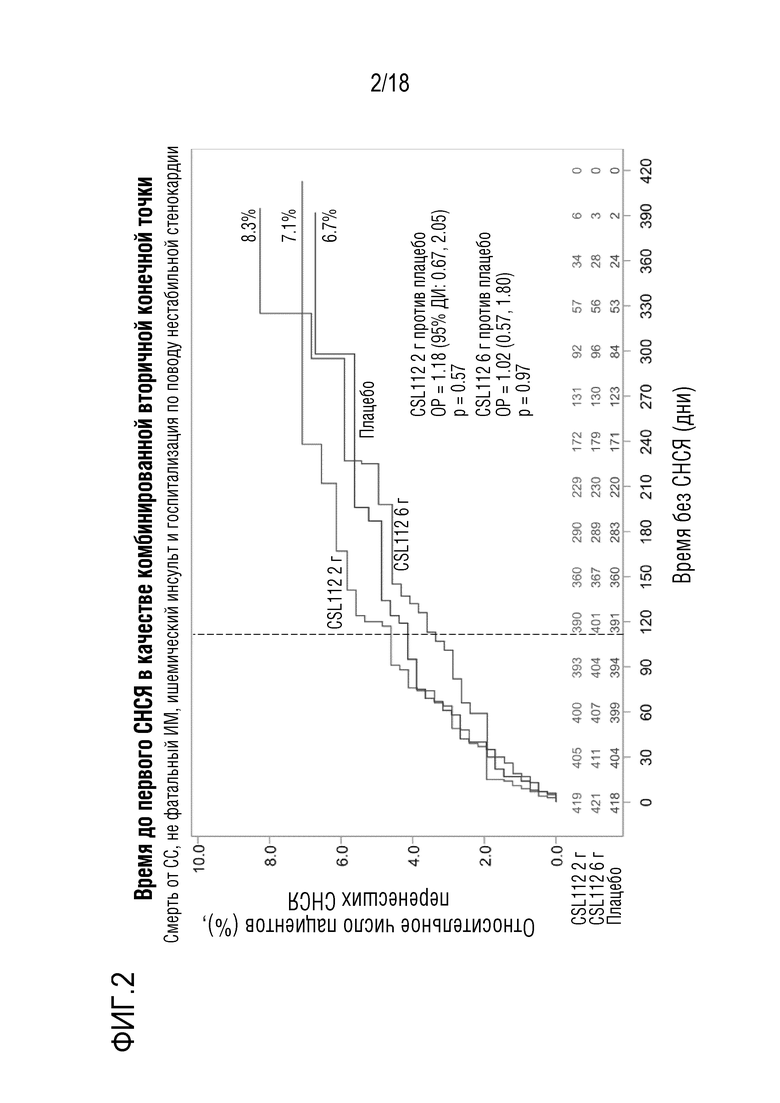
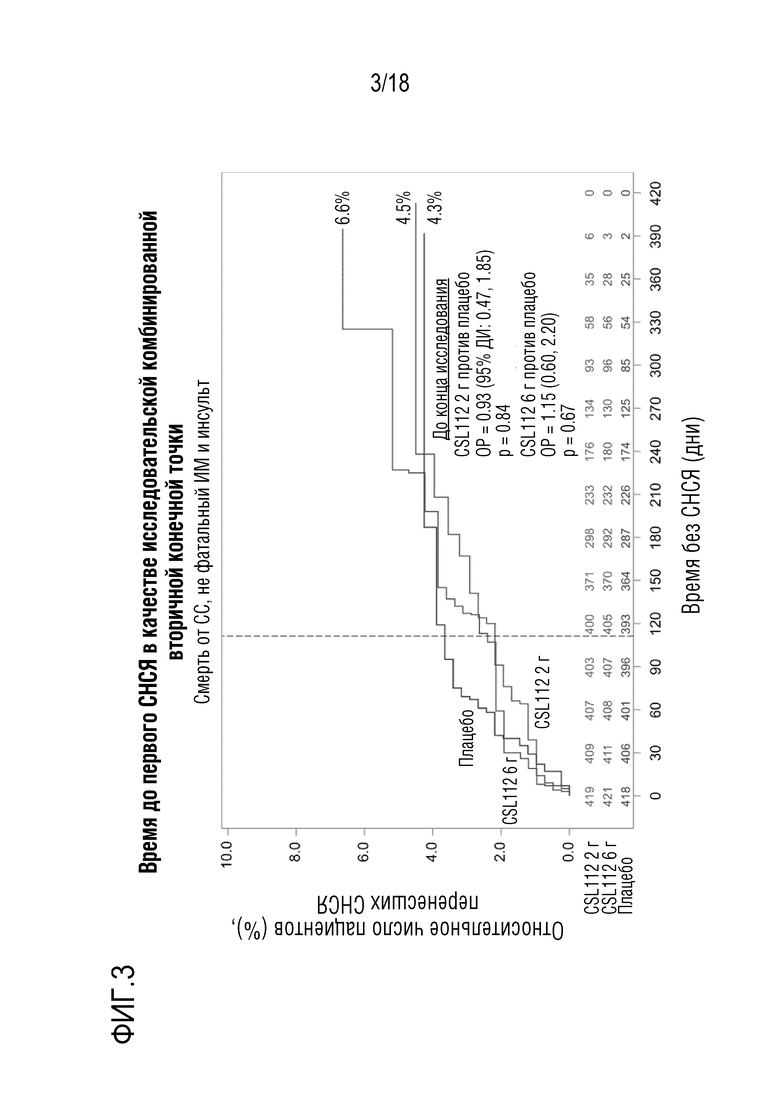
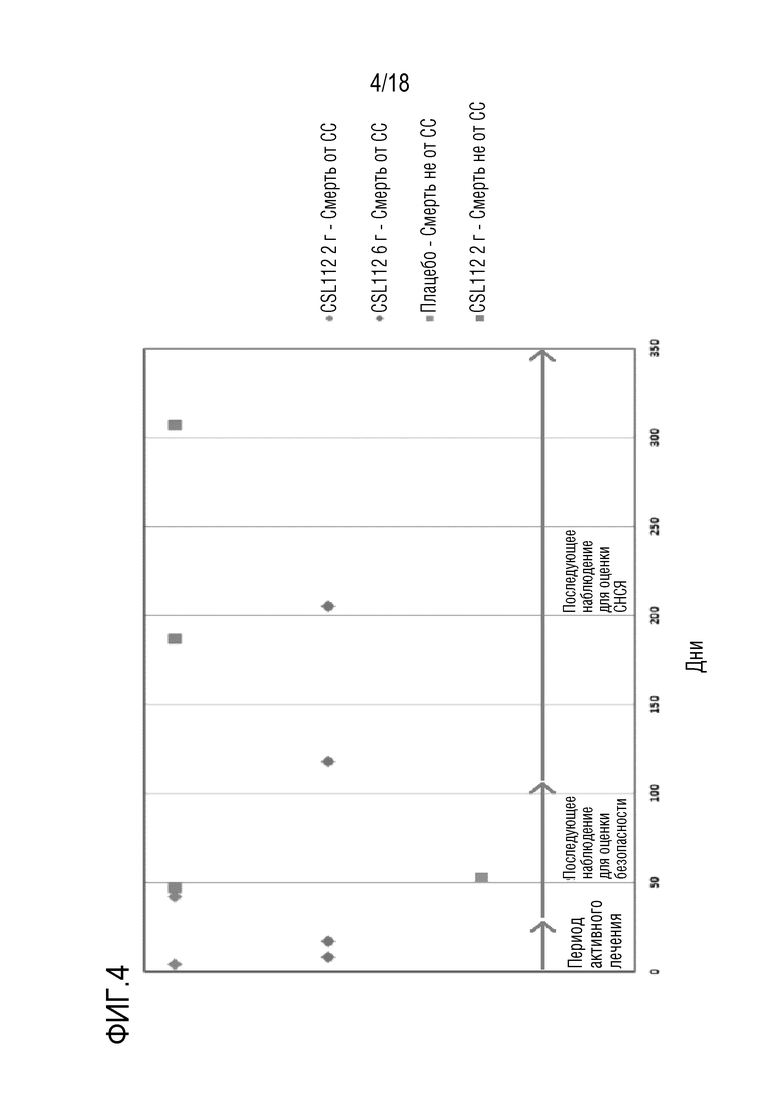
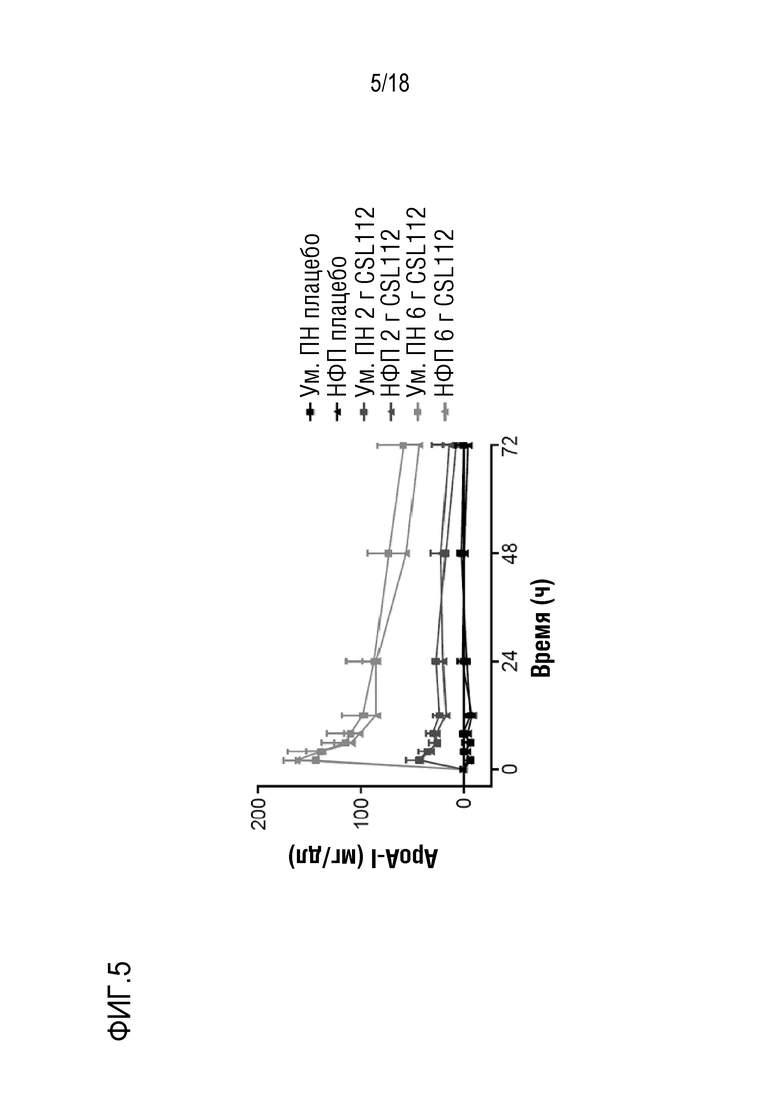
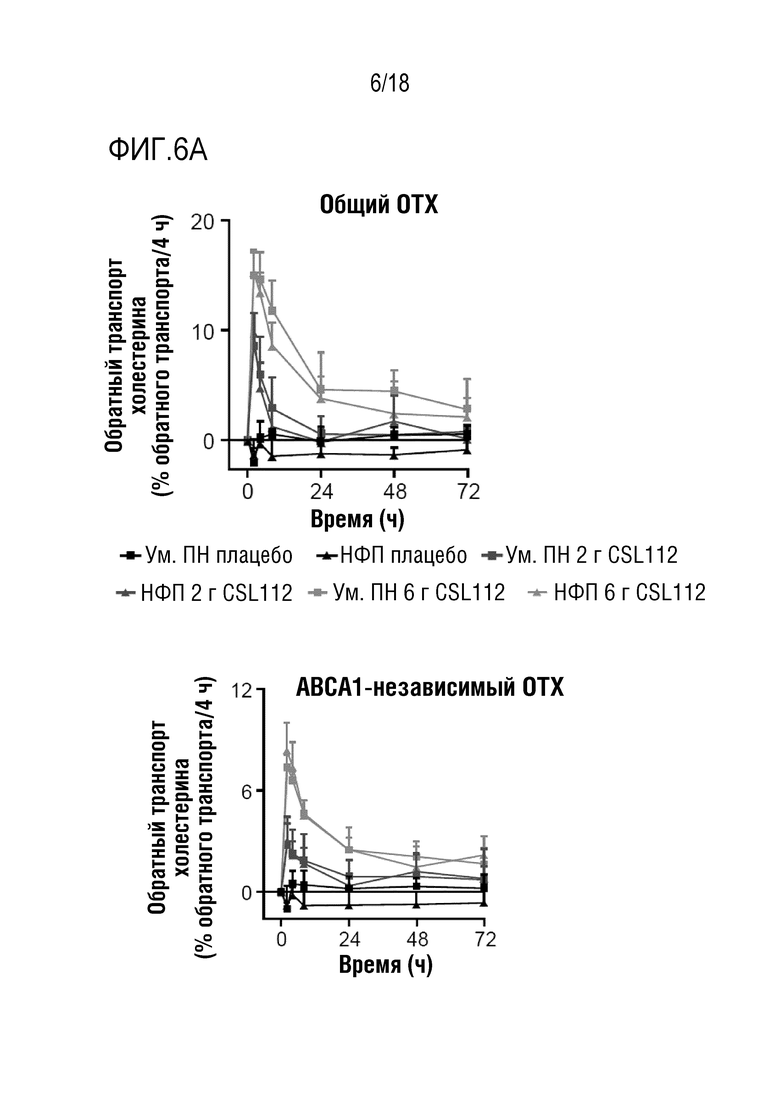
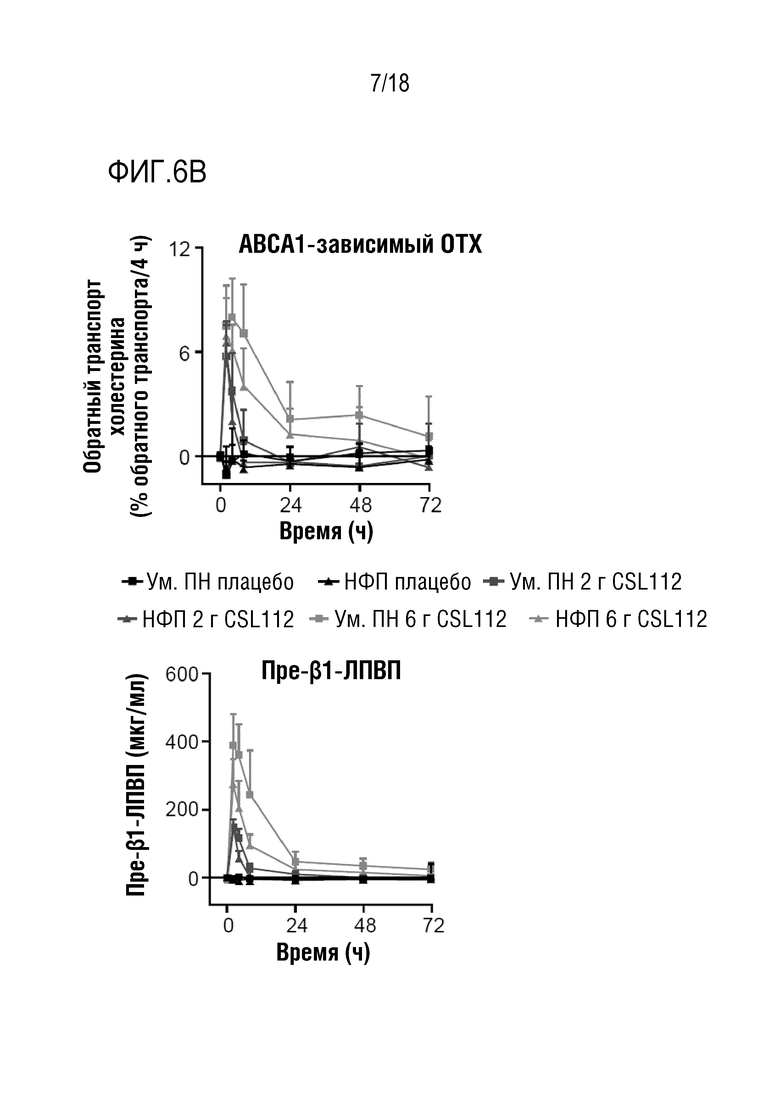
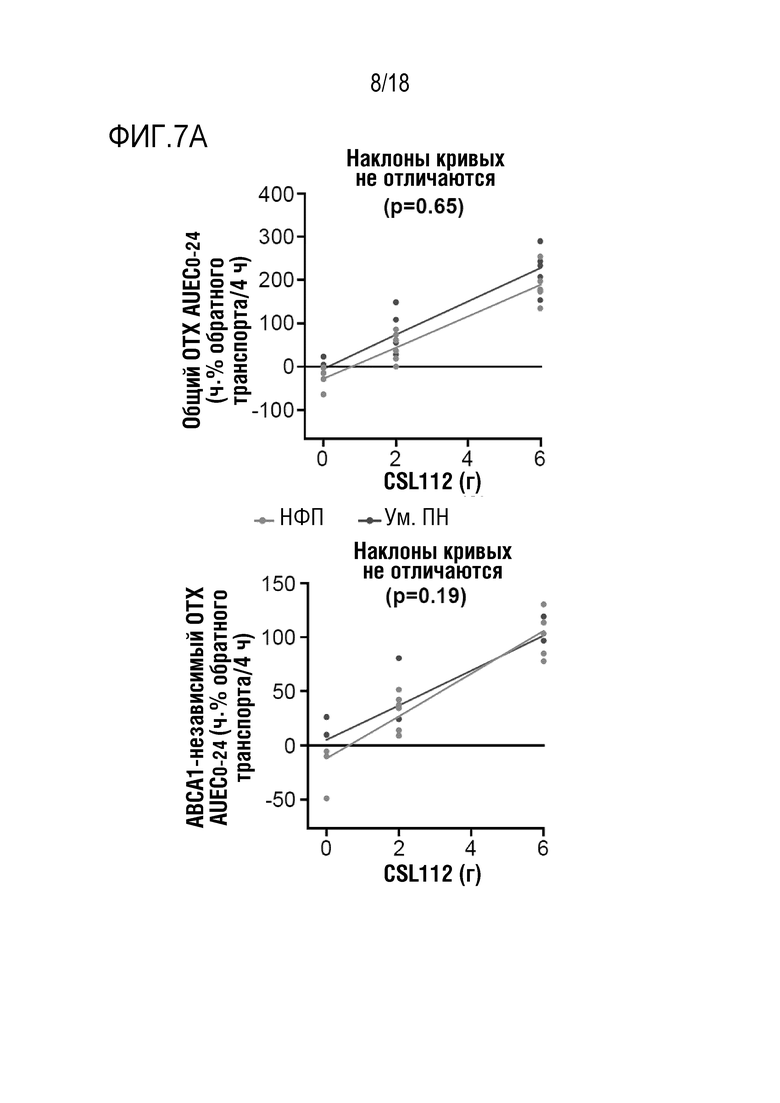
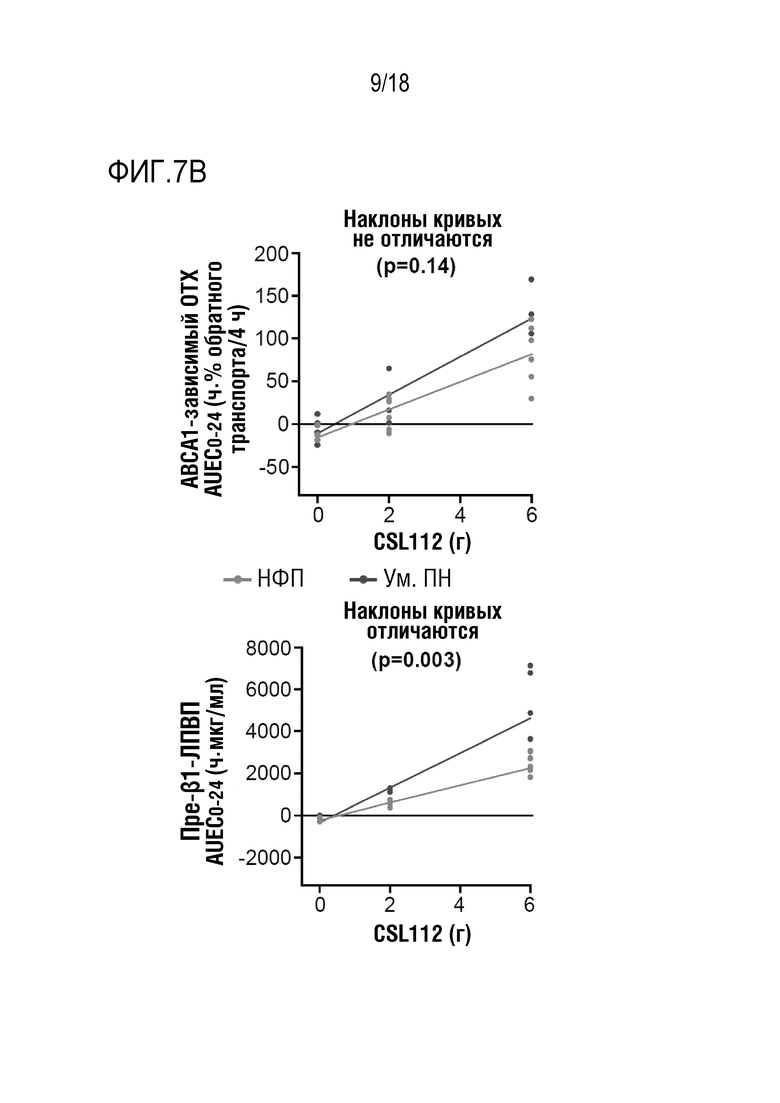
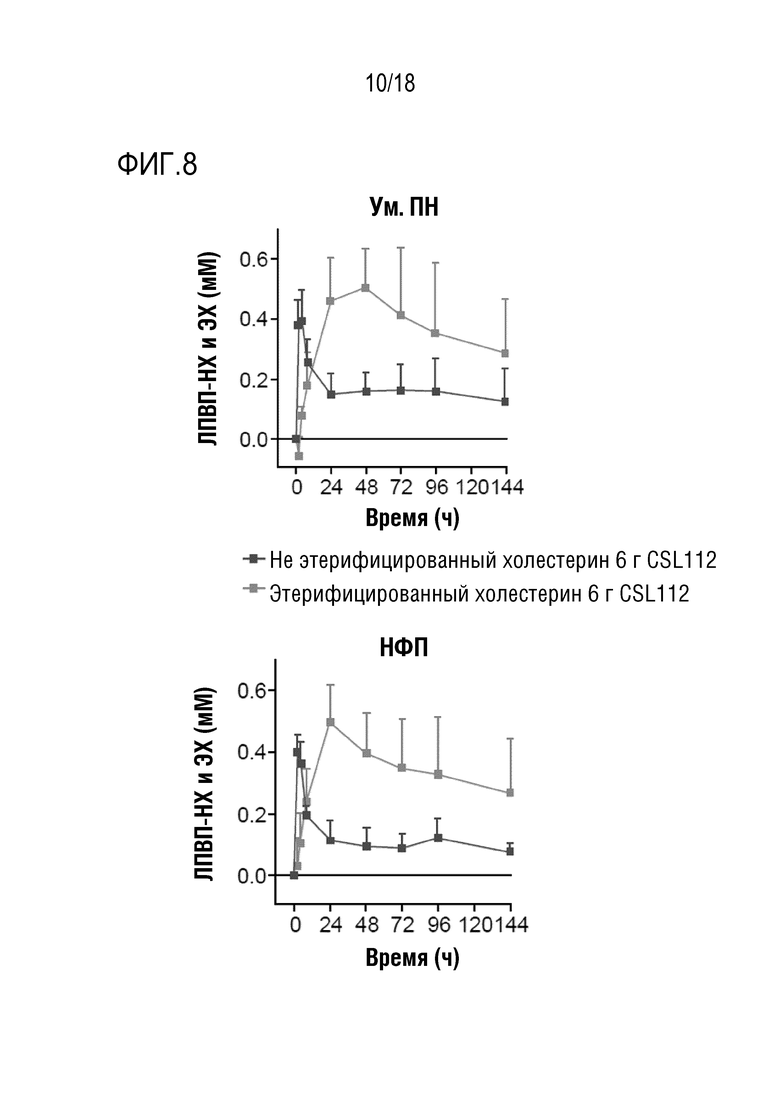
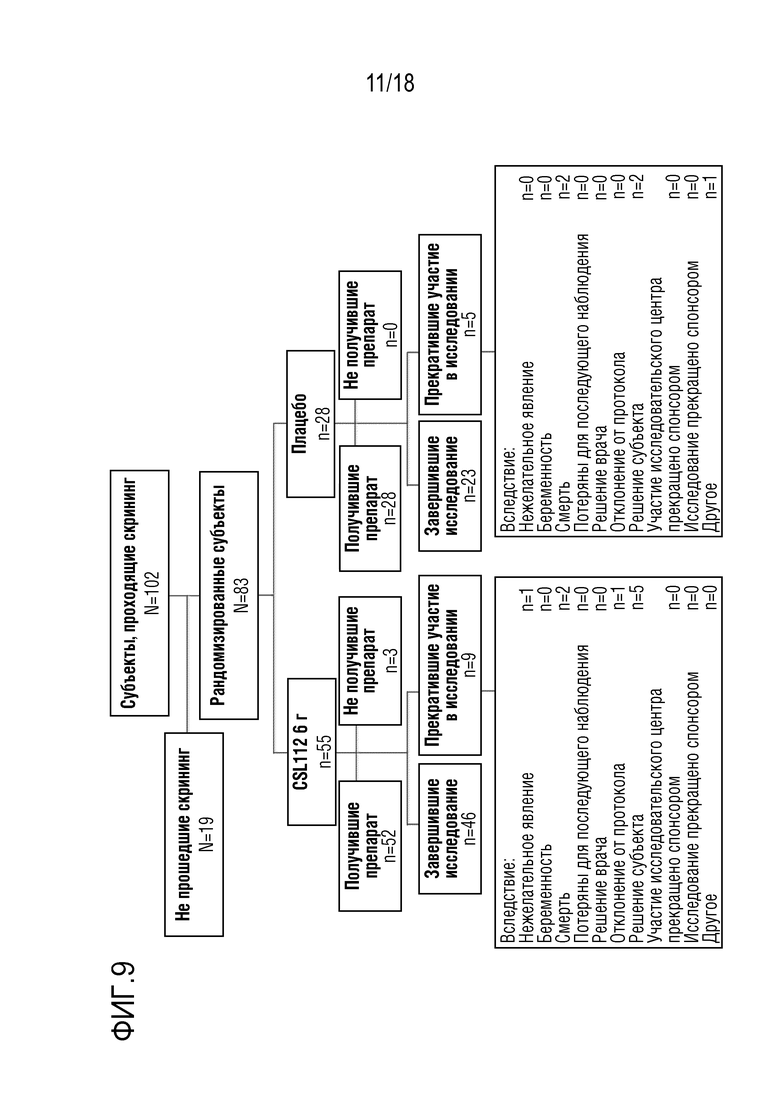
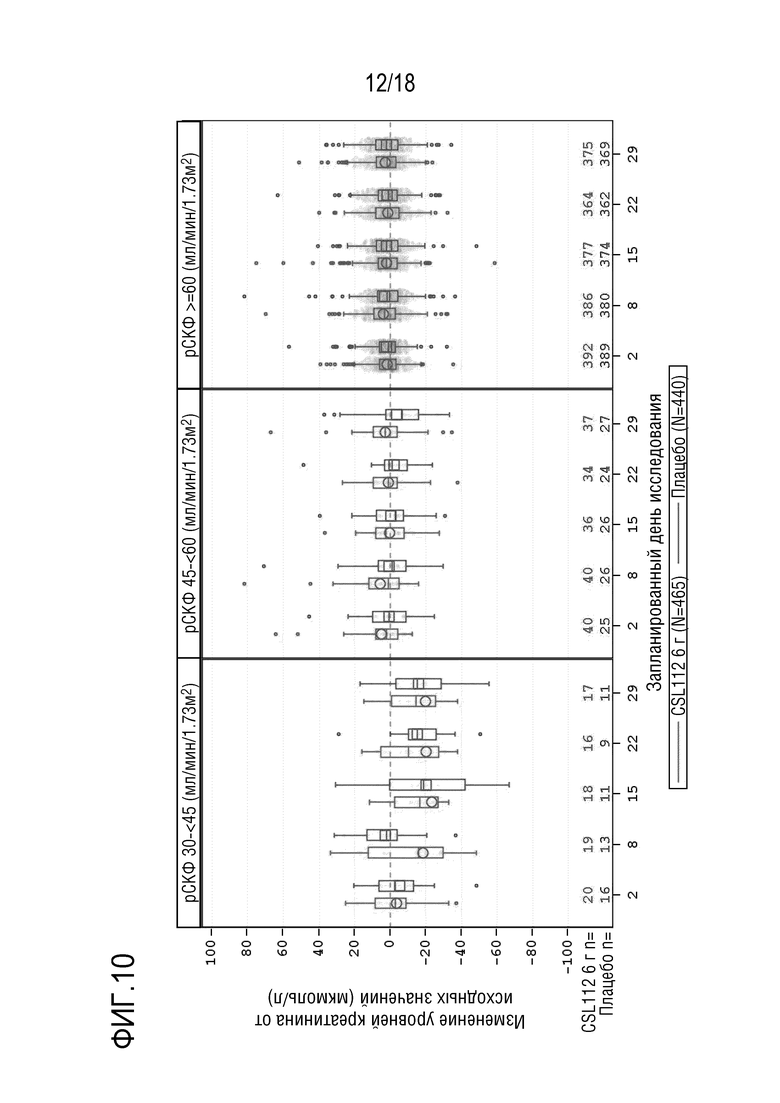
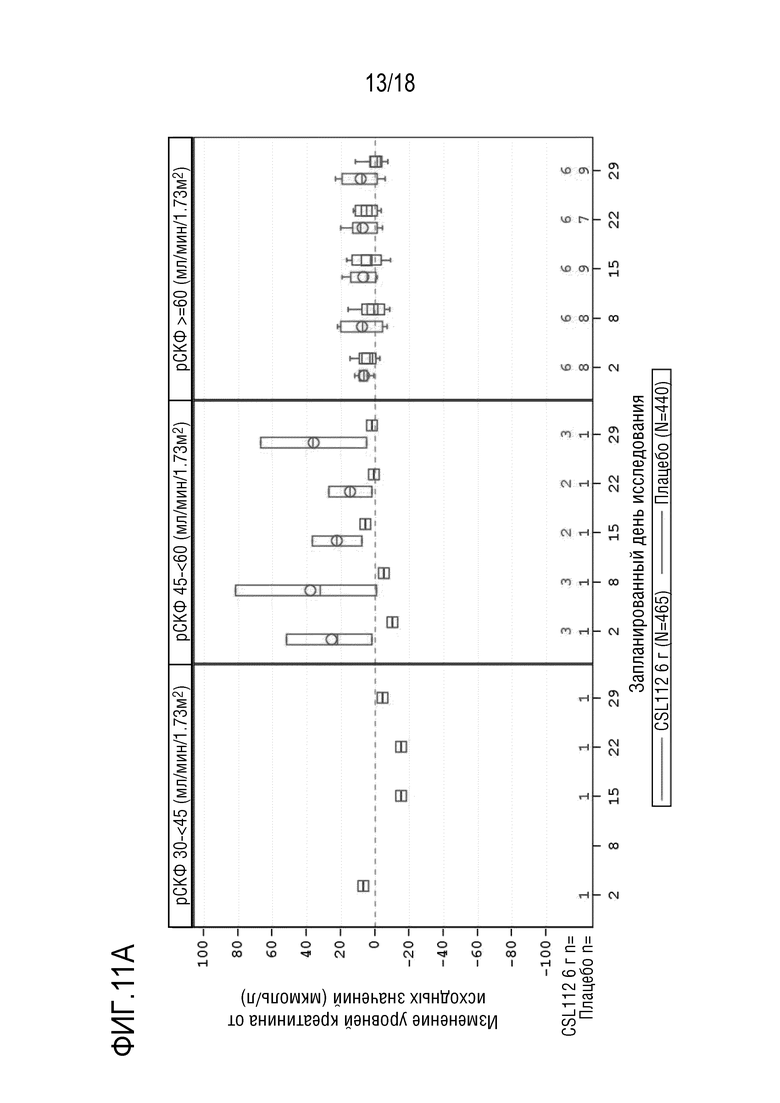
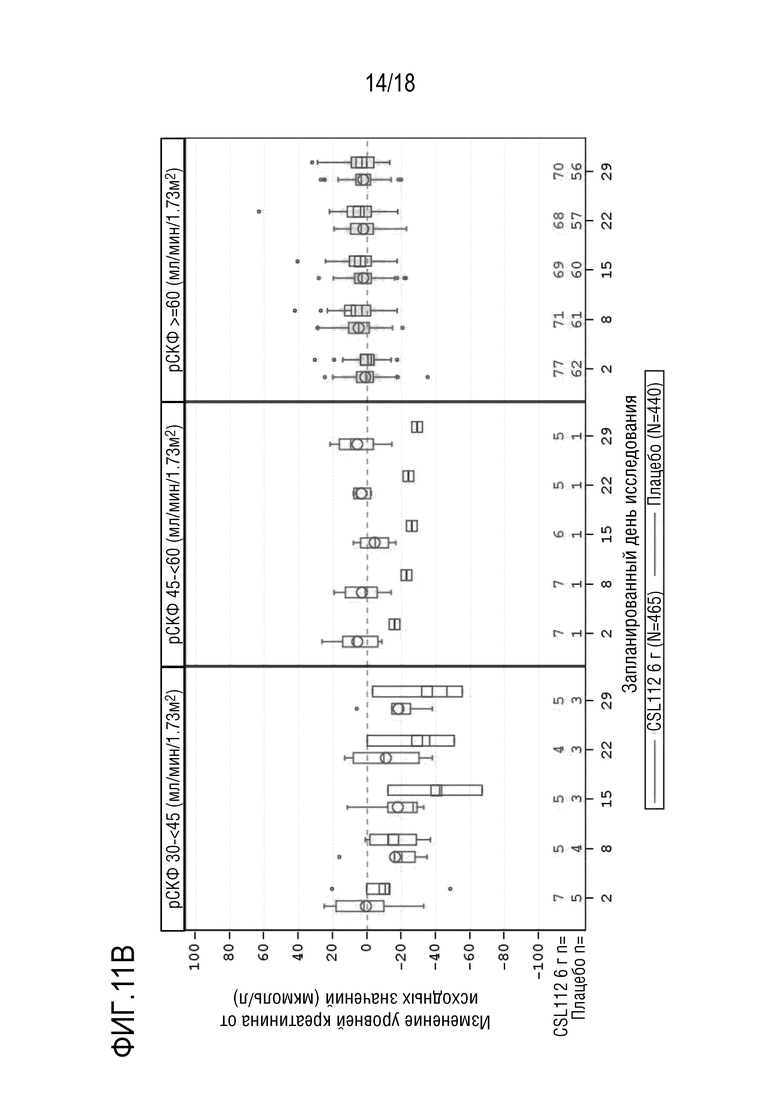
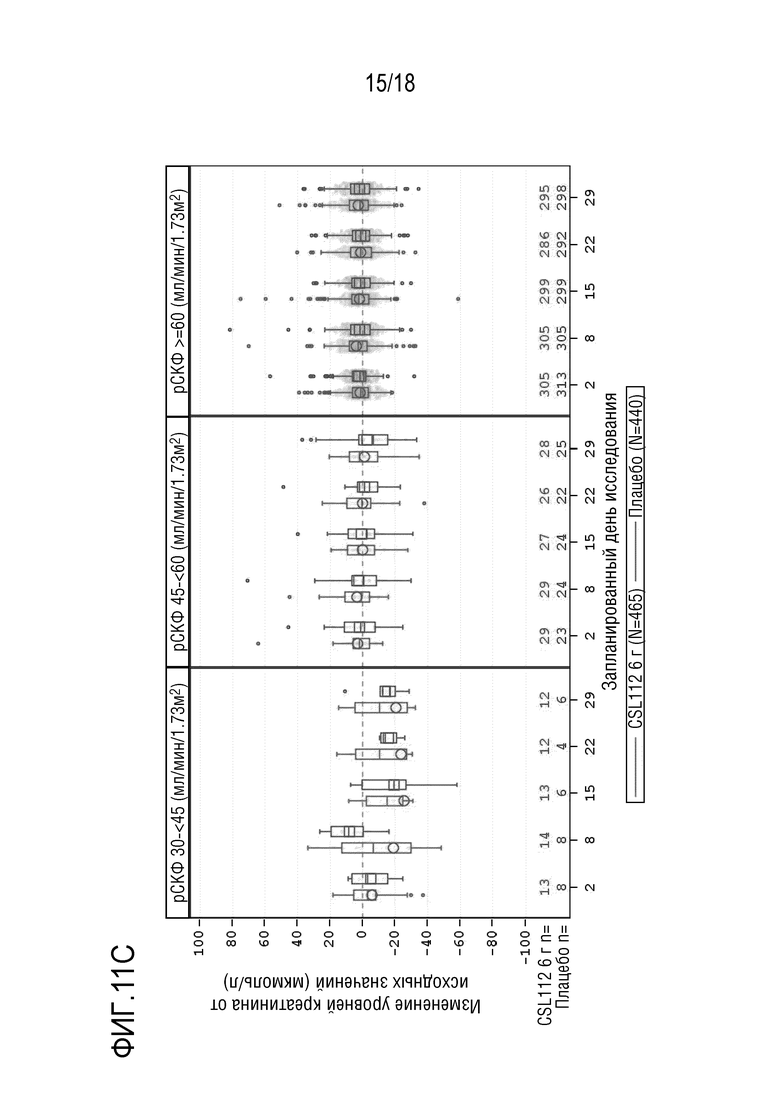
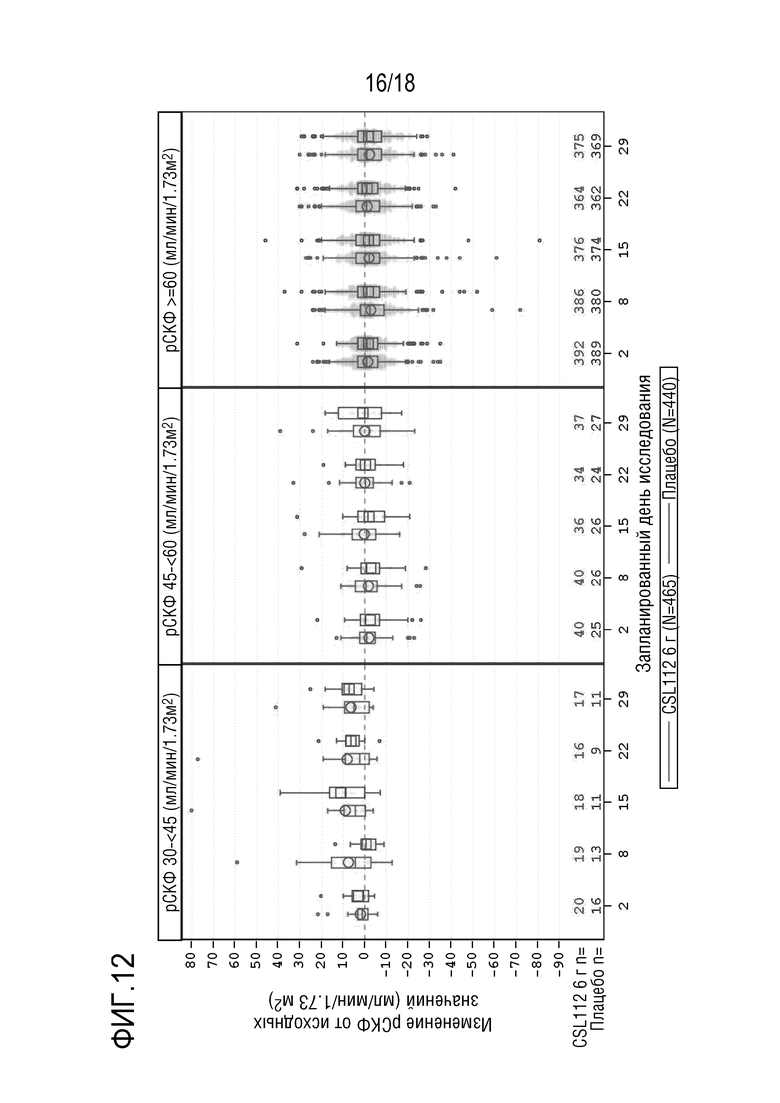
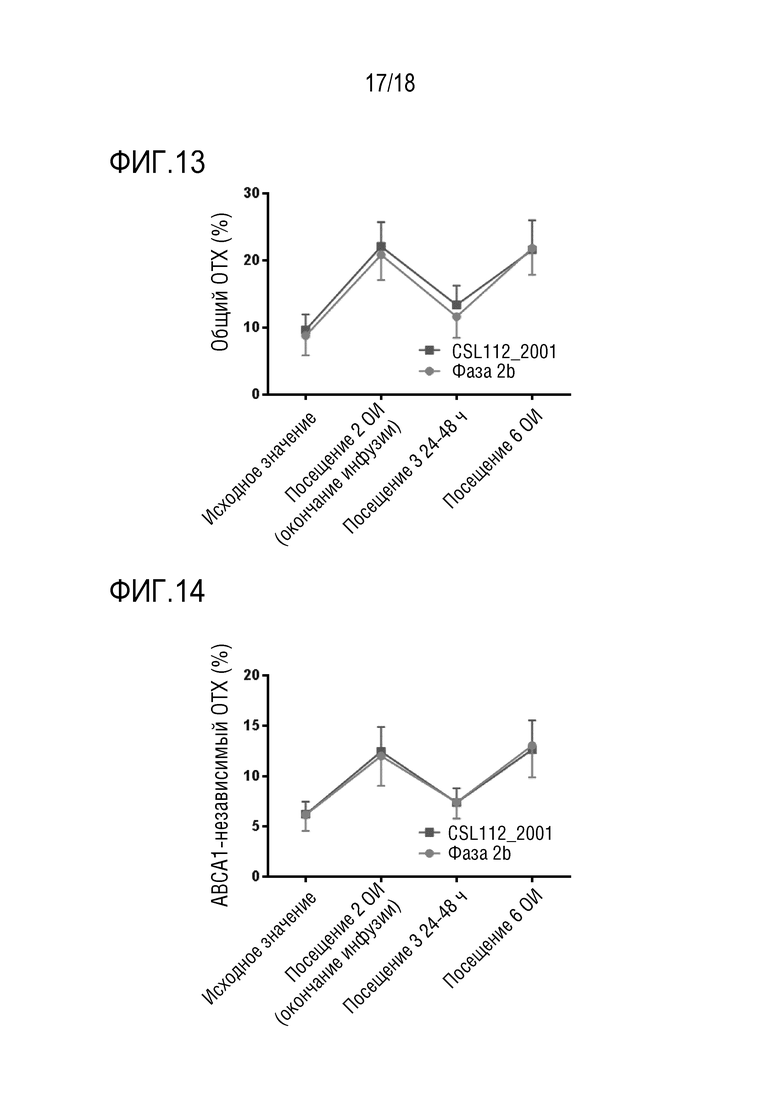
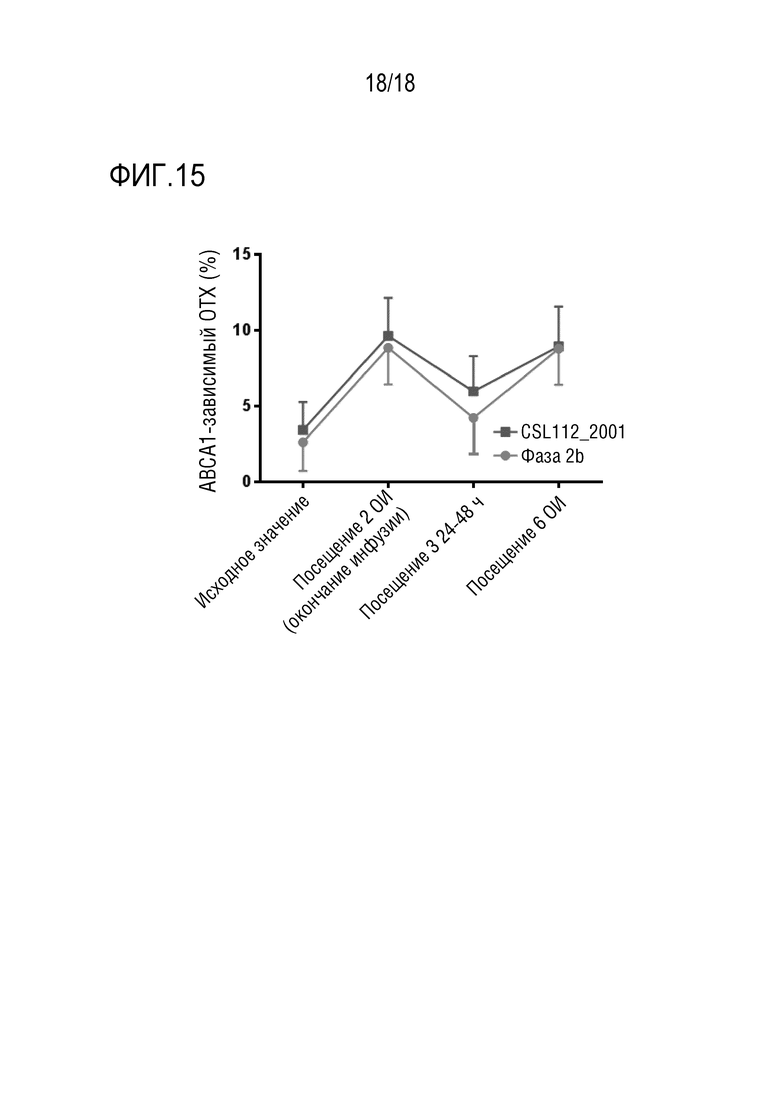
Группа изобретений относится к медицине, а именно к способам увеличения обратного транспорта холестерина (ОТХ) у человека после острого инфаркта миокарда (ИМ). Способ увеличения обратного транспорта холестерина (ОТХ) у человека после острого инфаркта миокарда (ИМ) включает внутривенное введение пациенту, в пределах семи (7) дней после острого ИМ, состава восстановленного липопротеина высокой плотности (вЛПВП), содержащего аполипопротеин или его фрагмент, липид, стабилизатор, где стабилизатор представляет собой сахарозу, и, необязательно, детергент, взятые в определенном количестве и соотношении; при этом пациенту вводят контрастное вещество для ангиографии после острого инфаркта миокарда и до первоначального введения состава вЛПВП; и последующее внутривенное введение состава вЛПВП человеку еженедельно в течение по меньшей мере четырех (4) недель; что приводит к увеличению обратного транспорта холестерина (ОТХ) у человека без вызывания существенных изменений функции печени и/или почек. Способ увеличения обратного транспорта холестерина (ОТХ) у пациента-человека после острого инфаркта миокарда (ИМ) включает внутривенное введение пациенту, в пределах семи (7) дней после острого ИМ, состава восстановленного липопротеина высокой плотности (вЛПВП), содержащего apoA-I, фосфатидилхолин, стабилизатор, где стабилизатор представляет собой сахарозу, и холат натрия, взятые в определенном количестве и соотношении; при этом пациенту вводят контрастное вещество для ангиографии после острого инфаркта миокарда и до первоначального введения состава вЛПВП; последующее внутривенное введение состава вЛПВП человеку еженедельно в течение по меньшей мере четырех (4) недель; что приводит к увеличению обратного транспорта холестерина (ОТХ) у пациента-человека без вызывания существенных изменений функции печени и/или почек, при этом существенное изменение функции печени определяют на основании показателя АЛТ, более чем в 2 или 3 раза превышающего верхний предел нормы (ВПН); или увеличения уровня общего билирубина до показателя, по меньшей мере в 1,5-2 раза превышающего ВПН; и существенное изменение функции почек определяют на основании показателя сывороточного креатинина, превышающего более чем или в 1,2-1,5 раза исходное значение, и/или показателя рСКФ, значительно меньшего чем 90 мл/мин/м2, включая меньшего чем 90 мл/мин/1,73 м2. Вышеописанный способ позволяет улучшить ОХТ в период, когда обратный транспорт холестерина значительно нарушен после острого ИМ или как усовершенствованный способ повышения ОТХ при лечении острого ИМ. 2 н. и 35 з.п. ф-лы, 15 ил., 24 табл., 3 пр.
1. Способ увеличения обратного транспорта холестерина (ОТХ) у человека после острого инфаркта миокарда (ИМ), включающий этапы:
в пределах семи (7) дней после острого ИМ внутривенное введение пациенту состава восстановленного липопротеина высокой плотности (вЛПВП), содержащего 2-6 г аполипопротеина или его фрагмента, липид, стабилизатор, где стабилизатор представляет собой сахарозу, и, необязательно, детергент, при этом соотношение между аполипопротеином и липидом составляет от 1:20 до 1:120 моль:моль; при этом пациенту вводят контрастное вещество для ангиографии после острого инфаркта миокарда и до первоначального введения состава вЛПВП; и
последующее внутривенное введение состава вЛПВП человеку еженедельно в течение по меньшей мере четырех (4) недель;
что приводит к увеличению обратного транспорта холестерина (ОТХ) у человека без вызывания существенных изменений функции печени и/или почек у человека.
2. Способ по п. 1, при этом увеличение общего ОТХ находится в диапазоне от 1,5-кратного до 2,5-кратного.
3. Способ по п. 1, при этом увеличение ABCA1-зависимого обратного транспорта холестерина находится в диапазоне от 3-кратного до 5-кратного.
4. Способ по любому из пп. 1-3, при этом пациенту-человеку первоначально вводят состав вЛПВП в пределах пяти (5) дней после острого ИМ.
5. Способ по любому из пп. 1-4, при этом пациенту-человеку первоначально вводят состав вЛПВП не ранее чем через 12 часов после острого ИМ или после введения контрастного вещества для ангиографии.
6. Способ по любому из пп. 1-5, при этом состав вЛПВП вводят внутривенной (в/в) инфузией.
7. Способ по п. 6, при этом скорость инфузии составляет 1-3 г аполипопротеина в час.
8. Способ по любому из пп. 1-7, при этом существенное изменение функции печени определяют на основании активности аланинаминотрансферазы (АЛТ), более чем в 3 раза превышающей верхний предел нормы (ВПН), и/или увеличения уровня общего билирубина до значения по меньшей мере двух ВПН.
9. Способ по любому из пп. 1-8, при этом существенное изменение функции почек определяют на основании показателя уровня сывороточного креатинина, по меньшей мере в 1,5 раза превышающего исходное значение, и/или необходимости в заместительной почечной терапии.
10. Способ по любому из пп. 1-9, при этом существенное изменение функции почек определяют на основании показателя расчетной скорости клубочковой фильтрации (рСКФ), составляющего менее 60 мл/мин/м2, включая менее 60 мл/мин/1,73 м2.
11. Способ по любому из пп. 1-10, при этом пациенту вводят первую дозу в пределах 5 дней после острого ИМ.
12. Способ по п. 11, при этом пациенту вводят первую дозу через по меньшей мере 12 часов после острого ИМ либо не ранее чем через 12 часов после острого ИМ или после введения контрастного вещества для ангиографии.
13. Способ по любому из пп. 1-12, при этом количество аполипопротеина в составе вЛПВП составляет по меньшей мере 2 г или по меньшей мере 6 г.
14. Способ по п. 13, при этом аполипопротеин представляет собой apo-AI или его фрагмент.
15. Способ по любому из пп. 1-14, при этом стабилизатор присутствует в составе вЛПВП в концентрации от 1,0% до менее 6,0% по массе; 1,0-5,9% по массе; 3,0-5,9% по массе; 4,0-5,5% по массе; 4,3-5,3% по массе или 4,6-4,8% по массе.
16. Способ по любому из пп. 1-15, при этом соотношение между аполипопротеином и стабилизатором составляет от 1:1 по массе до 1:7 по массе; от 1:1 по массе до 1:3 по массе; от 1:1 по массе до 1:2,4 по массе или от 1:1 по массе до менее 1:2 по массе.
17. Способ по любому из пп. 1-16, при этом соотношение между аполипопротеином и липидом составляет от 1:20 до 1:100 моль:моль; от 1:20 до 1:75 моль:моль или от 1:45 до 1:65 моль:моль.
18. Способ по любому из пп. 1-17, при этом состав вЛПВП содержит детергент.
19. Способ по п. 18, при этом уровень детергента составляет 0,5-1,5 г/л.
20. Способ по п. 18 или 19, при этом уровень детергента составляет 0,015-0,030 г/г аполипопротеина.
21. Способ по любому из пп. 18-20, при этом детергент представляет собой соль желчной кислоты или желчную кислоту.
22. Способ по п. 21, при этом детергент представляет собой холат натрия.
23. Способ по любому из пп. 1-22, при этом липид представляет собой фосфолипид.
24. Способ по п. 23, при этом фосфолипид представляет собой фосфатидилхолин.
25. Способ увеличения обратного транспорта холестерина (ОТХ) у пациента-человека после острого инфаркта миокарда (ИМ), включающий этапы:
в пределах семи (7) дней после острого ИМ внутривенное введение пациенту состава восстановленного липопротеина высокой плотности (вЛПВП), содержащего по меньшей мере 2-6 г apoA-I, фосфатидилхолин, стабилизатор, где стабилизатор представляет собой сахарозу, и холат натрия на уровне, выбранном из группы, состоящей из 0,5-1,5 г/л и/или 0,010-0,030 г/г apoA-I и от 1,0% до менее 6,0% по массе сахарозы, при этом соотношение между apoA-I и фосфатидилхолином составляет от 1:20 до 1:120 моль:моль; при этом пациенту вводят контрастное вещество для ангиографии после острого инфаркта миокарда и до первоначального введения состава вЛПВП;
последующее внутривенное введение состава вЛПВП человеку еженедельно в течение по меньшей мере четырех (4) недель;
что приводит к увеличению обратного транспорта холестерина (ОТХ) у пациента-человека без вызывания существенных изменений функции печени и/или почек у человека, при этом существенное изменение функции печени определяют на основании показателя АЛТ, более чем в 2 или 3 раза превышающего верхний предел нормы (ВПН); или увеличения уровня общего билирубина до показателя, по меньшей мере в 1,5-2 раза превышающего ВПН; и существенное изменение функции почек определяют на основании показателя сывороточного креатинина, превышающего более чем или в 1,2-1,5 раза исходное значение, и/или показателя рСКФ, значительно меньшего чем 90 мл/мин/м2, включая меньшего чем 90 мл/мин/1,73 м2.
26. Способ для применения по любому из пп. 1-25, при этом дополнительно вводят одно или более терапевтических средств, которые помогают или способствуют лечению, предотвращению или уменьшению риска острого инфаркта миокарда (ИМ) и/или СНСЯ и/или увеличению обратного транспорта холестерина (ОТХ) у пациента-человека.
27. Способ по п. 26, при этом одно или более терапевтических средств включают: одно или более липид-модифицирующих средств; один или более ингибиторов поглощения холестерина; один или более антикоагулянтов, одно или более антигипертензивных средств и одну или более связывающих желчные кислоты молекул.
28. Способ по п. 27, при этом одно или более липид-модифицирующих средств включают ингибиторы HMG-CoA редуктазы, фибраты, ингибиторы пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9) и ниацин.
29. Способ по п. 28, при этом один или более ингибиторов HMG-CoA редуктазы включают статин.
30. Способ по п. 29, при этом один или более статинов включают ловастатин, розувастатин, аторвастатин, питавастатин и симвастатин.
31. Способ по п. 28, при этом один или более фибратов включают фенофибрат и гемфиброзил.
32. Способ по п. 28, при этом одно или более липид-модифицирующих средств включают ингибиторы пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9).
33. Способ по п. 27, при этом один или более ингибиторов поглощения холестерина включают эзетимиб.
34. Способ по п. 27 или 33, при этом один или более ингибиторов поглощения холестерина вводят со статином.
35. Способ по п. 34, при этом один или более ингибиторов поглощения холестерина вводят с одним или более статинами, включая ловастатин, розувастатин, аторвастатин, питавастатин и симвастатин.
36. Способ по п. 27, при этом один или более антикоагулянтов включают варфарин, антагонисты витамина K, гепарин или его производные, ингибиторы фактора Xa и ингибиторы тромбина.
37. Способ по любому из пп. 1-36, где пациент-человек имеет умеренную почечную недостаточность (Ум. ПН).
| AU 2013205684 B, 22.05.2014 | |||
| WO 2015044459 А, 02.04.2015 | |||
| RICOCI, P et al | |||
| Infusion of reconstituted high-density lipo-protein, CSL112, in pateints with artherosclerosis: safety and pharmacokinetic results from a phase 2a randomized clinical trial // Journal of the American Heart association, (20150000), vol | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
Авторы
Даты
2023-06-28—Публикация
2017-11-10—Подача