Настоящее изобретение относится к очистке сиалилированных олигосахаридов. Более конкретно, настоящее изобретение относится к очистке сиалилированных олигосахаридов, в частности, сиалилированных олигосахаридов грудного молока (sHMO), из ферментационного бульона, осветленного клеточного лизата или реакционной смеси.
Предшествующий уровень техники
Грудное молоко человека представляет собой сложную смесь углеводов, жиров, белков, витаминов, минеральных веществ и микроэлементов. Наиболее преобладающая фракция представлена углеводами, которые в свою очередь могут подразделяться на лактозу и более сложные олигосахариды, так называемые олигосахариды грудного молока, НМО). В то время как лактоза используется в качестве источника энергии, сложные олигосахариды не метаболизируются в организме младенца. Фракция сложных олигосахаридов составляет до 10% включительно от всей углеводной фракции и вероятно состоит из более чем 150 различных олигосахаридов. Наличие и концентрация этих сложных олигосахаридов специфичны для людей, и поэтому они не могут быть обнаружены в больших количествах в молоке других млекопитающих, таких как дающие молоко домашние животные.
О наличии этих сложных олигосахаридов в грудном молоке человека известно давно, и физиологические функции этих олигосахаридов были предметом медицинских исследований в течение многих десятилетий (Gura, Т. (2014) Science, 345: 747-749; Kunz, С. & Egge, Н. (2017) в: Prebiotics and Probiotics in Human Milk. Eds. McGuire, M.K; McGuire, M.A. & Bode, L. Elsevier, London, pp. 3-16). Для некоторых наиболее распространенных НМО конкретные функции уже идентифицированы (Bode, L. (2012) Glycobiology, 22: 1147-1162.; Bode, L. and Jantscher-Krenn, E. (2012) Adv. Nutr., 3: 383S-391S; Morrow et al. (2004) J. Pediatr., 145: 297-303).
Ограниченные запасы отдельных HMO и невозможность получения этих молекул в достаточных количествах послужили толчком к разработке способов, основанных на химическом синтезе, с целью создания некоторых из этих сложных молекул. Однако химический синтез НМО, а также ферментативный синтез и основанное на ферментации получение оказались чрезвычайно сложными процессами. Крупномасштабное получение НМО, характеризующихся качеством, достаточным для применения в качестве пищевых добавок, до сих пор практически не освоено. В частности, для химического синтеза таких НМО, как 2'-фукозиллактоза (WO 2010/115935 А1), необходимо применение нескольких токсичных химических реагентов, которые могут загрязнять конечный продукт.
Недостатки химического синтеза НМО послужили толчком к разработке нескольких ферментативных и основанных на ферментации способов (Miyazaki et al., (2010) Methods in Enzymol., 480: 511-524; Murata et al., (1999) Glycoconj. J., 16: 189-195; Baumgartner et al., (2013) Microb. Cell Fact., 12: 40; Lee et al., (2012) Microb. Cell Fact., 11: 48; US 7521212 B1; Albermann et al., (2001) Carbohydr. Res., 334: 97-103; Fierfort, N. and Samain, E. (2008) J. Biotechnol., 134: 216-265). Однако, в случае применения этих способов наблюдается тенденция к получению сложных смесей олигосахаридов, вследствие чего желаемый продукт содержит примеси исходного вещества, такого как лактоза, а также промежуточных соединений, нежелательных побочных продуктов (например, побочных продуктов, образующихся в результате побочных активностей некоторых гликозилтрансфераз) и субстратов, таких как отдельные моносахариды и полипептиды.
Соответствующие современному уровню техники способы очистки индивидуальных олигосахаридов из смесей олигосахаридов являются технически сложными, непростыми с точки зрения масштабирования и неэкономичными в плане применения в пищевой промышленности. Для очистки таких дисахаридов, как лактоза и сахароза, из молочной сыворотки или мелассы, соответственно, разработаны способы промышленного масштаба, но эти способы включают многочисленные стадии кристаллизации, которые сложны и дают низкие выходы. Тем не менее, молочная сыворотка и меласса в качестве исходных веществ являются продуктами "пригодными для применения в пищевой промышленности" и далеко не такими сложными и проблемными в плане нормирования, как ферментационные бульоны, получаемые в результате процессов ферментации с участием рекомбинантных бактерий или рекомбинантных дрожжей.
Гель-фильтрационная хроматография является самым хорошим методом очистки сложных олигосахаридов, таких как НМО, полученных путем микробиологической ферментации, тем не менее, недостатки гель-фильтрационной хроматографии включают невозможность ее масштабирования и ее несочетаемость с непрерывным процессом обработки. Ввиду этого гель-фильтрационная хроматография неэкономична и не может быть использована для получения НМО, таких как 3'-сиалиллактоза или 6'-сиалиллактоза либо любой другой сиалилированный олигосахарид, достаточного качества и в достаточных количествах для применения в продуктах питания человека, в частности, в продуктах питания для детей грудного и ясельного возраста. Однако, получение сиалилированных НМО (таких как 3'-сиалиллактоза (3'-SL), 6'-сиалиллактоза (6'-SL), сиалиллакто-N-тетраоза a (LST-a), сиалиллакто-N-тетраоза b (LST-b), сиалиллакто-N-тетраоза с (LST-c), 3-фукозил-сиалиллактоза (F-SL), дисиалил-лакто-N-тетраоза (DS-LNT) и фукозил-LST b (F-LSTb)) представляет интерес, поскольку сиалилированные олигосахариды, например, ассоциированы с улучшением развития нейронов.
Применение рекомбинантных микроорганизмов (бактерий или дрожжей) для ферментативного получения НМО также является проблематичным, поскольку рекомбинантная ДНК или рекомбинантные белки могут вносить примеси в конечный продукт, и в настоящее время это неприемлемо для потребителей и органов надзора. Следует иметь в виду, что пределы обнаружения, в частности для рекомбинантных молекул ДНК, являются очень низкими (например, при обнаружении, основанном на использовании количественной полимеразной цепной реакции (кПЦР), которая в настоящее время рассматривается как общепринятый стандарт для обнаружения), и в олигосахаридном продукте можно обнаружить даже единственную молекулу ДНК. Кроме того, наличие белков связано с риском возникновения аллергических реакций, и поэтому их тоже следует эффективно удалять из желаемого олигосахаридного продукта.
Исходя из этого предшествующего уровня техники, задача заключалась в разработке способа очистки сиалилированных олигосахаридов, в частности, сиалилированных НМО, которые получены путем микробиологической ферментации, при этом указанный способ применим для производства сиалилированных олигосахаридов в коммерческих или промышленных масштабах и может приводить к получению продукта, имеющего чистоту, которая делает его пригодным для потребления человеком.
Краткое описание сущности изобретения
Согласно первому аспекту предложен способ очистки сиалилированных олигосахаридов, которые были получены путем микробиологической ферментации или биокатализа in vitro.
Согласно второму аспекту предложены препараты сиалилированных олигосахаридов, которые получены путем микробиологической ферментации или биокатализа in vitro.
Согласно третьему аспекту предложено применение сиалилированных олигосахаридов по второму аспекту.
Согласно четвертому аспекту предложены питательные композиции, содержащие по меньшей мере один сиалилированный олигосахарид, при этом указанный по меньшей мере один сиалилированный олигосахарид получен путем микробиологической ферментации или биокатализа in vitro.
Согласно пятому аспекту предложен высушенный распылением не содержащий генетически модифицированных организмов (GMO) порошок, который состоит по существу из сиалилированного олигосахарида.
Краткое описание графических материалов
На Фиг. 1 показаны химические структуры 3'-сиалиллактозы и 6'-сиалиллактозы.
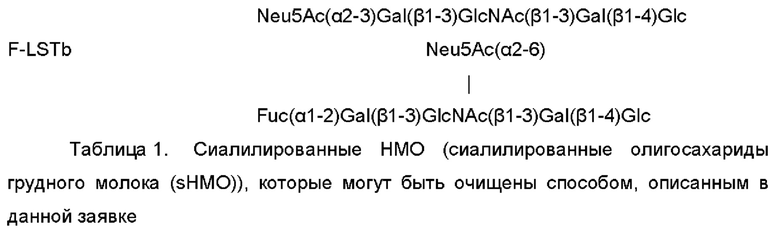
На Фиг. 2 показана диаграмма, иллюстрирующая воплощение способа очистки сиалилированного олигосахарида из ферментационного бульона.
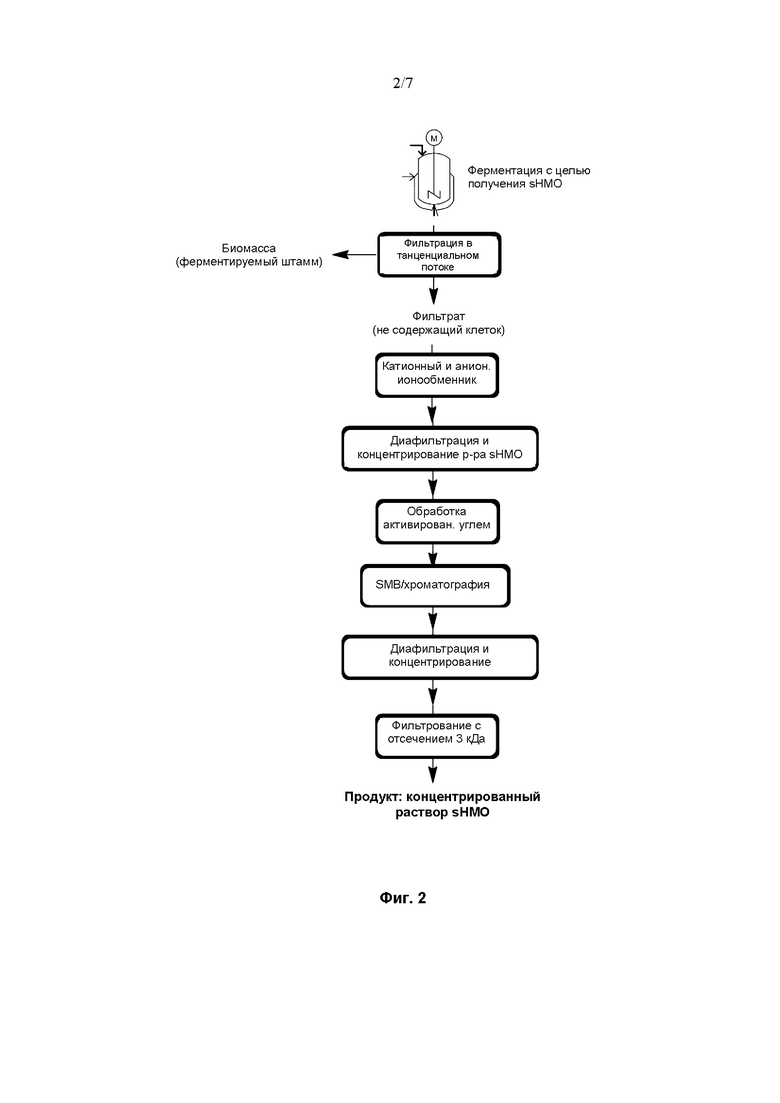
На Фиг. 3 показана диаграмма, иллюстрирующая воплощение способа очистки сиалилированного олигосахарида из ферментационного бульона.
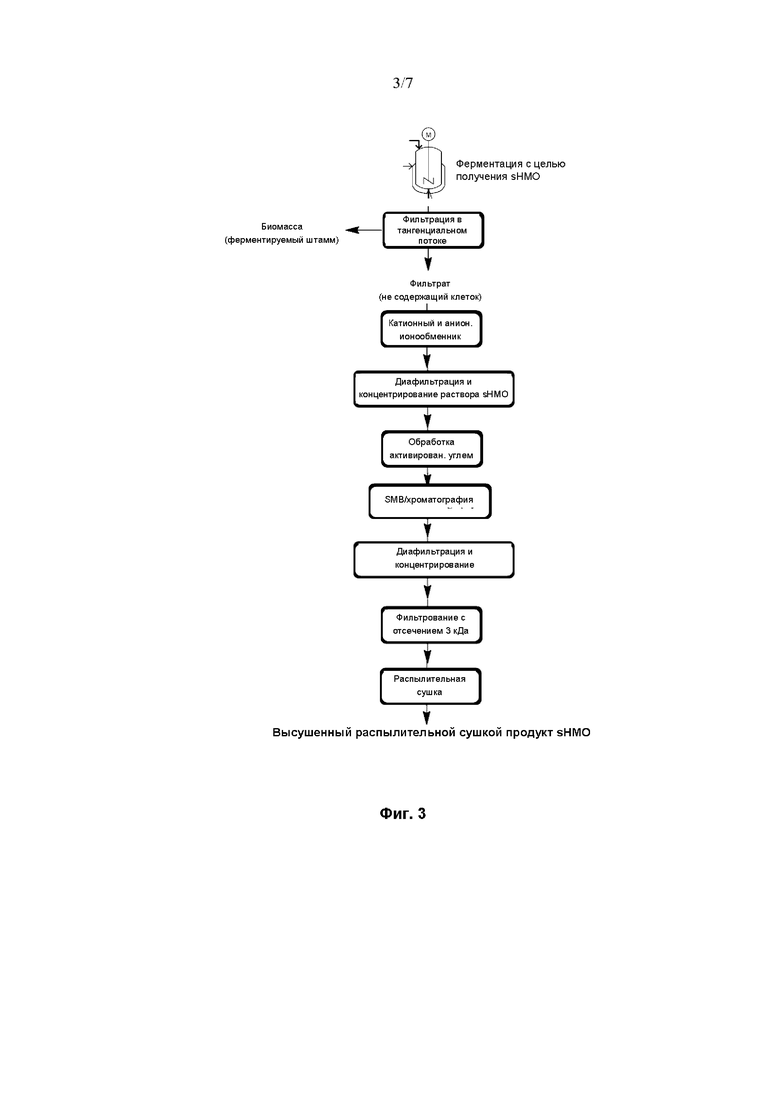
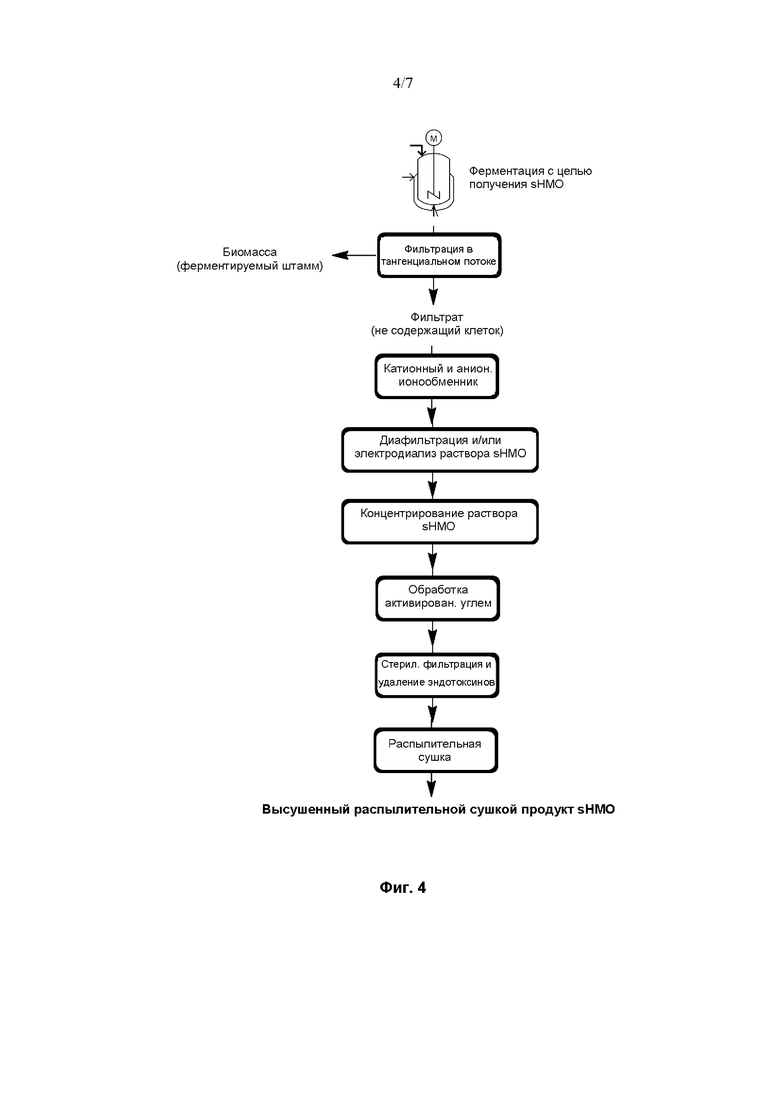
На Фиг. 4 показана диаграмма, иллюстрирующая воплощение способа очистки сиалилированного олигосахарида из ферментационного бульона.
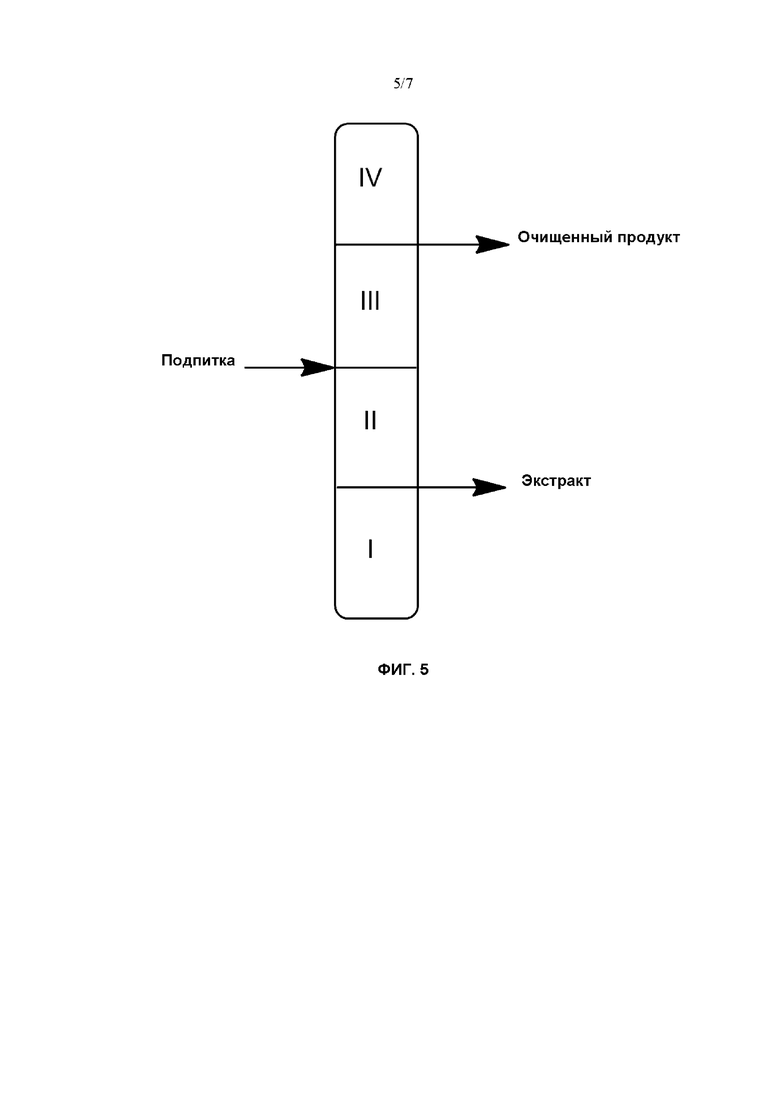
На Фиг. 5 проиллюстрирован принцип четырехзонной хроматографии с псевдодвижущимся слоем.
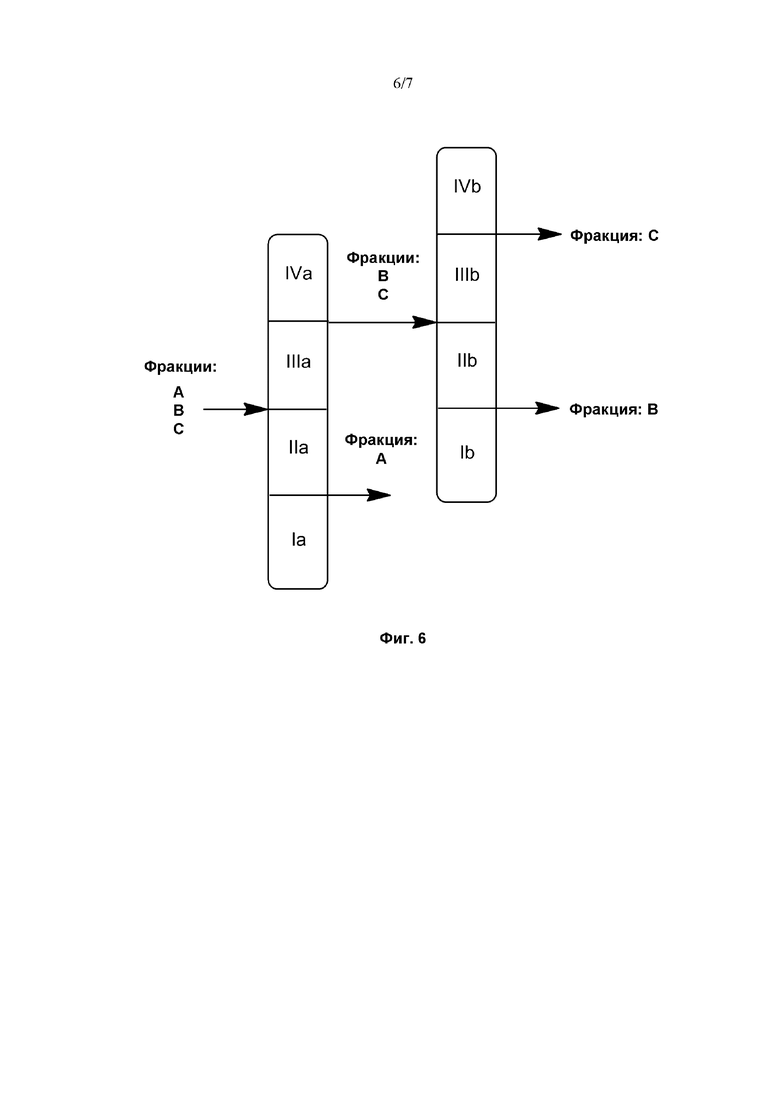
На Фиг. 6 проиллюстрирован принцип восьмизонной хроматографии с псевдодвижущимся слоем.
На Фиг. 7 показан график, иллюстрирующий результаты дифракции рентгеновских лучей на порошке для высушенной распылением 6'-SL.
На Фиг. 8 показан график, иллюстрирующий результаты дифракции рентгеновских лучей на порошке для высушенной распылением 3'-SL.
Подробное описание
Согласно первому аспекту предложен способ или процесс очистки сиалилированных олигосахаридов, которые получали путем микробиологической ферментации. Данный способ включает стадии:
1) отделения биомассы от ферментационного бульона;
2) удаления катионов из ферментационного бульона;
3) удаления анионных примесей из ферментационного бульона; и
4) удаления соединений, имеющих молекулярную массу ниже, чем у подлежащего очистке сиалилированного олигосахарида.
В одном из воплощений требуемые сиалилированные олигосахариды получают путем микробиологической ферментации. Соответственно, клетки, обладающие способностью продуцировать требуемый сиалилированный олигосахарид, культивируют в условиях, которые дают возможность клеткам продуцировать требуемый сиалилированный олигосахарид. Клетки, подходящие для продуцирования требуемого олигосахарида, включают бактерии, такие как Escherichia coli, Lactobacillus lactis, Corynebacterium glutamicum, Bacillus subtilis, Pseudomonas putita, или дрожжи, такие как Saccharomyces cerevisiae, Schizosaccharomyces pombe, Pichia pastoris.
Клетки могут быть генетически модифицированы с возможностью продуцирования требуемого сиалилированного олигосахарида, при этом генетически не модифицированная клетка-предшественник не способна к такому продуцированию, или с возможностью улучшения эффективности продуцирования желаемого олигосахарида. Бактерию Escherichia coli, которая является предпочтительным хозяином для конструирования метаболизма, уже использовали для ферментации с целью получения НМО (нейтральных НМО, а также сиалилированных НМО). Однако другие штаммы-хозяева, такие как штаммы дрожжей (типа Saccharomyces cerevisiae), молочнокислых бактерий, Corynebacterium glutamicum, видов Bacillus, которые обладают статусом GRAS (признаны безвредными), в равной степени могут быть использованы для конструирования с целью продуцирования олигосахаридов, в общем случае НМО, а также, в частности, сиалилированных НМО.
Для продуцирования требуемого сиалилированного олигосахарида бактериальный или дрожжевой штамм-хозяин обычно содержит одну или несколько гетерологичных гликозилтрансфераз, в типичном случае по меньшей мере одну гетерологичную сиалилтрансферазу, сверхэкспрессирует гены для синтеза СМР (цитидин-монофосфо)-сиаловой кислоты (как например, гены, кодирующие синтетазу СМР-сиаловых кислот, в дополнение к генам, вовлеченным в захват или синтез сиаловой кислоты de novo), гены, кодирующие импортер лактозы и/или экспортер, подходящий для желаемого sHMO. Экспрессия подходящего экспортера особенно выгодна при использовании дрожжей в качестве хозяев-продуцентов sHMO, поскольку известно, что S. cerevisiae не секретируют гетерологически продуцированный олигосахарид в экономически целесообразных количествах в среду ферментации, не имея подходящего экспортера.
Термин "требуемый" применительно к сиалилированному олигосахариду относится к сиалилированному олигосахариду, который будет продуцирован клеткой. Требуемый сиалилированный олигосахарид представляет собой олигосахарид, подлежащий очистке способами, описанными в данной заявке. Термин "требуемый", использованный в данном описании применительно к сиалилированному олигосахариду, также служит для того, чтобы провести различие между предназначенным для продуцирования сиалилированным олигосахаридом и другими сиалилированными олигосахаридами, которые могут случайным образом продуцироваться клетками.
Термин "олигосахарид", использованный в данном описании, относится к линейным или разветвленным сахаридам, содержащим от трех до 20 моносахаридных остатков.
В одном из воплощений сиалилированный олигосахарид представляет собой сиалилированный НМО. Термин "сиалилированный НМО", использованный в данном описании, относится к олигосахаридам грудного молока, содержащим один или более остатков сиаловой кислоты.
Способ включает стадию отделения биомассы от ферментационного бульона. Эта стадия представляет собой первую стадию способа очистки сиалилированных олигосахаридов.
Термин "биомасса", использованный в данном описании, относится ко всем клеткам, находящимся в ферментационном бульоне по окончании стадии ферментации. Клетки, находящиеся в ферментационном бульоне по окончании стадии ферментации, включают клетки, способные продуцировать требуемый сиалилированный олигосахарид, возможно вспомогательные клетки, находящиеся в ферментационном бульоне и способствующие продуцированию сиалилированного олигосахарида, например, такие клетки, которые разлагают нежелательные побочные продукты. Поэтому клетки, находящиеся в ферментационном бульоне по окончании стадии ферментации, отделяют от ферментационного бульона, в результате чего полученный ферментационный бульон по существу не содержит клеток.
Подходящие способы отделения биомассы от ферментационного бульона включают центрифугирование, при этом биомассу получают в виде осадка после центрифугирования, а ферментационный бульон в виде супернатанта. В дополнительном и/или альтернативном воплощении биомассу отделяют от ферментационного бульона посредством фильтрования. Подходящие методы фильтрации для отделения клеток от среды ферментации включают микрофильтрацию и ультрафильтрацию.
Микрофильтрация как таковая представляет собой способ фильтрации методом осаждения, при котором содержащую частицы жидкость пропускают через мембрану со специальным размером пор для отделения частиц от жидкости. Термин "микрофильтрация", использованный в данном описании, относится к способу фильтрации методом осаждения, при котором клетки отделяют от ферментационного бульона.
Ультрафильтрация представляет собой разновидность мембранной фильтрации и не имеет принципиальных отличий. При проведении ультрафильтрации такие силы, как градиенты давления или концентрации, приводят к разделению путем прохождения через полупроницаемую мембрану. Клетки, суспендированные твердые вещества и растворенные вещества с высокой молекулярной массой удерживаются в так называемом ретентате, в то время как вода и низко молекулярные растворенные вещества, такие как желаемый сиалилированный олигосахарид, проходят через мембрану в пермеат (фильтрат).
Ультрафильтрационные мембраны характеризуются значением отсечения по молекулярной массе (MWCO) используемой мембраны. Ультрафильтрацию применяют в режиме с тангенциальным потоком или в тупиковом режиме.
Подходящими фильтрами для микрофильтрации или ультрафильтрации являются SPIRA-CEL® DS МР005 4333 и волокна FS10-FC FUS1582 (Microdyn-Nadir GmbH, Wiesbaden, DE).
Обычно требуемый сиалилированный олигосахарид синтезируется внутри клетки и секретируется в ферментационный бульон. Полученный таким образом сиалилированный олигосахарид попадает в ферментационный бульон, который затем подвергают дальнейшим стадиям способа очистки требуемого сиалилированного олигосахарида, изложенного в данном описании далее.
В тех воплощениях, когда требуемый сиалилированный олигосахарид остается после своего биосинтеза внутри клетки, биомассу отделяют от ферментационного бульона и для очистки требуемого сиалилированного олигосахарида используют указанную биомассу. С этой целью осуществляют лизис клеток биомассы и полученный лизат осветляют, в результате чего нерастворимые компоненты, нуклеиновые кислоты, липиды и белки удаляются из лизата. Методы лизиса клеток и удаления нерастворимых компонентов, нуклеиновых кислот, липидов и/или белков из клеточного лизата известны. Полученный таким образом осветленный лизат, который содержит требуемый сиалилированный олигосахарид, затем подвергают тем же стадиям способа, что и в случае использования не содержащего клеток ферментационного бульона, содержащего требуемый сиалилированный олигосахарид, с целью очистки требуемого сиалилированного олигосахарида.
Несмотря на то, что данный способ очистки сиалилированных олигосахаридов используется для очистки сиалилированных олигосахаридов, которые были получены путем микробиологической ферментации, указанный способ также может быть применен для очистки сиалилированных олигосахаридов, которые были получены с использованием ферментативной реакции in vitro, так называемой биокаталитической реакции in vitro. Требуемый сиалилированный олигосахарид получают с использованием одной или более чем одной ферментативной реакции in vitro, и он может быть очищен из реакционной смеси по окончании биокаталитической реакции, при этом указанную реакционную смесь подвергают, вместо не содержащего клеток ферментационного бульона или осветленного лизата, способу очистки, описанному в данной заявке. Очевидно, что для очистки сиалилированных олигосахаридов из реакционной смеси в случае биокатализа in vitro нет необходимости в удалении биомассы из реакционной смеси.
Не содержащий клеток ферментационный бульон, осветленный лизат или реакционная смесь содержит желаемый сиалилированный олигосахарид, а также значительное количество примесей и нежелательных компонентов, включая другие олигосахариды, помимо требуемого сиалилированного олигосахарида, одновалентные соли, двухвалентные соли, аминокислоты, полипептиды, белки, органические кислоты, нуклеиновые кислоты и моносахариды.
Способ очистки сиалилированных олигосахаридов включает стадию катионообменной хроматографии для удаления положительно заряженных соединений из не содержащего клеток ферментационного бульона, осветленного лизата или реакционной смеси.
Подходящие катионообменные смолы для удаления положительно заряженных соединений включают Lewatit S2568 (Н+) (Lanxess AG, Cologne, DE).
Способ очистки сиалилированных олигосахаридов включает стадию анионнобменной хроматографии для удаления нежелательных отрицательно заряженных соединений из не содержащего клеток ферментационного бульона, осветленного лизата или реакционной смеси.
Подходящие анионообменные смолы включают Lewatit S6368 A, Lewatit S4268, Lewatit S5528, Lewatit S6368A (Lanxess AG. Cologne, DE), Dowex AG 1x2 (меш 200-400), Dowex 1x8 (меш 100-200), Purolite Chromalite CGA100x4 (Purolite GmbH, Ratingen, DE), Dow Amberlite FPA51 (Dow Chemicals, MI, USA).
Способ очистки сиалилированных олигосахаридов включает стадию удаления соединений, имеющих молекулярную массу ниже, чем у подлежащего очистке сиалилированного олигосахарида. Способы, подходящие для удаления соединений, имеющих молекулярную массу ниже, чем у подлежащего очистке сиалилированного олигосахарида, включают нанофильтрацию и диафильтрацию.
Диафильтрация включает добавление свежей воды к раствору с целью удаления (вымывания) проходящих через мембрану компонентов. Диафильтрацию можно использовать для разделения компонентов на основании их молекулярного размера и заряда, применяя соответствующие мембраны, при этом одна или несколько разновидностей компонентов эффективно удерживаются, а для других разновидностей компонентов мембрана является проницаемой. В частности, для отделения низкомолекулярных соединений от солей эффективна диафильтрация с использованием нанофильтрационной мембраны. Мембраны для нанофильтрации обычно имеют значение отсечения по молекулярной массе в диапазоне 150-300 дальтон. Нанофильтрация широко используется в молочной промышленности для концентрирования и деминерализации молочной сыворотки.
Мембраны, подходящие для нанофильтрации и/или диафильтрации, включают Dow Filmtec NF270-4040, Trisep 4040-XN45-TSF (Microdyn-Nadir GmbH, Wiesbaden, DE), GE4040F30 и GH4040F50 (GE Water & Process Technologies, Ratingen, DE).
Было обнаружено, что диафильтрация с использованием нанофильтрационных мембран эффективна в качестве стадии предварительной обработки для удаления значительных количеств примесей перед обработкой раствора, содержащего конкретный НМО, электродиализом. Тем не менее, в случае нанофильтрации было обнаружено, что она эффективна для удаления низкомолекулярных примесей после стадии ультрафильтрации, при этом указанное удаление оказывается полезным для концентрирования и деминерализации раствора НМО перед обработкой с использованием ионообменника. Применение нанофильтрационных мембран для концентрирования и диафильтрации в ходе очистки НМО приводит к снижению энергетических затрат и затрат на переработку, а также к улучшению качества продукта благодаря уменьшению теплового воздействия, обуславливающему ослабление реакций Майяра и альдольных реакций.
Способ очистки предусматривает получение требуемого сиалилированного олигосахарида, при этом чистота указанного требуемого сиалилированного олигосахарида составляет ≥80%, ≥85%, ≥90%, ≥95%. Данный способ предусматривает получение препарата сиалилированного олигосахарида, при этом чистота сиалилированного олигосахарида делает его подходящим для применения в пищевых продуктах и кормах.
Кроме того, данный способ является экономически выгодным и легко масштабируемым, что делает его пригодным в качестве основы для многотоннажного способа производства.
Способ очистки сиалилированного олигосахарида также имеет преимущество в том, что требуемые сиалилированные олигосахариды получают не содержащими рекомбинантной ДНК и рекомбинантных белков, происходящих из используемых для микробиологической ферментации рекомбинантных штаммов, которые могут использоваться в качестве вспомогательных средств для технологического процесса.
В дополнительном и/или альтернативном воплощении способ дополнительно включает стадию нанофильтрации для повышения концентрации сахаридов в растворе.
В дополнительном и/или альтернативном воплощении способ включает стадию электродиализа.
Электродиализ сочетает в себе диализ и электролиз, и его можно использовать для разделения или концентрирования ионов в растворах на основании их селективной электромиграции через полупроницаемую мембрану.
Электродиализ (ED) сочетает в себе диализ и электролиз, и его можно использовать для разделения или концентрирования ионов в растворах на основании их селективной электромиграции через полупроницаемые мембраны. Первые применения электродиализа в промышленности датируются началом 1960-х годов, когда этот метод использовали для деминерализации сырной сыворотки с целью включения в детскую смесь. Другие применения электродиализа включают его использование для регулирования рН таких напитков, как вина, виноградное сусло, яблочный сок и апельсиновый сок.
Опреснение слабоминерализованной воды с целью получения питьевой воды и деминерализация молочной сыворотки для производства детского питания являются наиболее распространенными видами применения электродиализа в настоящее время (Tanaka, Y. (2010), Ion Exchange Membrane Electrodialysis. Nova Science Publishers, Inc. New York).
Основной принцип электродиализа заключается в использовании электролитической ячейки, содержащей пару электродов, погруженных для обеспечения ионной проводимости в электролит и подключенных к источнику постоянного тока. Электрод, соединенный с положительным полюсом источника постоянного тока, представляет собой анод, а электрод, соединенный с отрицательным полюсом, представляет собой катод. Таким образом, раствор электролита поддерживает электрический ток, который обусловлен движением отрицательных и положительных ионов по направлению к аноду и катоду, соответственно. Мембраны, используемые для электродиализа, по существу представляют собой листы из пористых ионообменных смол с отрицательно или положительно заряженными группами и поэтому описываются как катионные или анионные мембраны, соответственно. Ионообменные мембраны обычно изготовлены из полистирола, несущего подходящую функциональную группу (такую как группа сульфоновой кислоты для катионных мембран или группа четвертичного аммония для анионных мембран), поперечно сшитого с использованием дивинилбензола. Электролитом может быть, например, хлорид натрия, ацетат натрия, пропионат натрия или сульфаминовая кислота. Затем собирают электродиализный пакет таким образом, чтобы анионные и катионные мембраны располагались параллельно как в фильтр-прессе между двумя электродными блоками, с тем, чтобы поток, подвергающийся обеднению ионами, хорошо отделялся от потока, подвергающегося обогащению ионами (эти два раствора также называются разбавленным раствором (раствором, подвергающимся обеднению ионами) и концентратом (раствором, подвергающимся обогащению ионами). Основой процесса электродиализа является использование пакета мембран, который состоит из нескольких разделенных прокладками анионообменных мембран и катионообменных мембран, установленных между двумя электродами. При подключении источника постоянного электрического тока анионы и катионы будут мигрировать сквозь мембраны по направлению к электродам, образуя (обессоленный) поток разбавленного раствора и поток концентрата.
При проведении электродиализа в кислотных условиях sHMO могут протонироваться таким образом, что они становятся незаряженными (в результате протонирования карбонильной группы остатка сиаловой кислоты олигосахарида). В качестве альтернативы электродиализ может быть проведен в условиях нейтральных значений рН с использованием биполярных мембран. В этом случае сиалилированные олигосахариды даже могут концентрироваться в отдельном участке получаемого при электродиализе концентрата. Таким образом, в процессе электродиализа даже может осуществляться обогащение сиалилированным олигосахаридом.
Размер пор ионообменных мембран достаточно мал, чтобы предотвратить диффузию продукта из потока разбавленного раствора в поток концентрата, обусловленную большой разницей в концентрациях между этими двумя потоками. После отделения биомассы должно произойти количественное удаление белков и в особенности молекул рекомбинантной ДНК (изменяющихся в размере от фрагментов до целых геномов) из желаемого продукта. Если это вообще возможно, электродиализ таких больших молекул (по сравнению с молекулярным размером НМО) будет занимать много времени, что несомненно будет сопровождаться значительными потерями желаемого продукта, связанными с переходом из разбавленного раствора в концентрат.
В дополнительном и/или альтернативном воплощении способ очистки сиалилированных олигосахаридов дополнительно включает стадию хроматографии с псевдодвижущимся слоем (SMB).
Хроматография с псевдодвижущимся слоем (SMB) возникла в нефтехимической и горнодобывающей отраслях промышленности. В настоящее время хроматографию с SMB применяют в фармацевтической промышленности для выделения энантиомеров из рацемических смесей. Уже описано крупномасштабное применение хроматографии с SMB для выделения моносахарида фруктозы из фруктозо-глюкозных растворов и для выделения дисахарида сахарозы из сиропов, полученных из сахарной свеклы или сахарного тростника. Тем не менее, хроматографию с SMB для очистки сиалилированных олигосахаридов грудного молока человека, таких как сиалилированная лакто-N-тетраоза, 3'-сиалиллактоза или 6'-сиалиллактоза, в ходе химического, ферментативного или основанного на ферментации синтеза еще не применяли. SMB использовали для очистки сиалиллактозы из коровьего молока, однако коровье молоко представляет собой совершенно другой материал по сравнению со средой для микробиологической ферментации, которая используется в данной заявке в качестве источника НМО.
Хроматографию с SMB используют в виде непрерывно протекающего процесса разделения, аналогичного таким процессам непрерывного химического разделения, как ректификация. При ректификации между жидкой и газовой фазами создается противоток, позволяющий осуществлять непрерывную подачу сырья и непрерывное отведение продукта. Теоретически противоточная хроматография должна обеспечивать лучшее разделение по сравнению с традиционными системами с тангенциальным потоком, но подвижная и неподвижная фазы в противоточных системах должны двигаться в противоположных направлениях. Хроматография с SMB была разработана для разрешения практических трудностей, возникающих при попытке осуществления движения твердого хроматографического материала в ходе непрерывного процесса хроматографического разделения.
Классическая концепция SMB включает в себя использование четырех разных зон с четырьмя внешними потоками: потоком сырья, содержащим компоненты, подлежащие разделению, потоком десорбирующей или подвижной фазы, потоком экстракта и потоком очищенного продукта (причем последний представляет собой наименее эффективно удерживаемые компоненты). Эти потоки жидкости разделяют систему с SMB на четыре разные зоны (при этом каждая зона или секция может содержать одну или несколько колонок), выполняющие следующие задачи: зона I необходима для регенерации твердой фазы, целью зоны II является десорбция десорбируемого с меньшими усилиями вещества, задачей зоны III является адсорбция более сильно адсорбируемого вещества и, наконец, задачей зоны IV является адсорбция наименее сильно адсорбируемого вещества (Фиг. 5). Таким образом, более сильно адсорбируемые компоненты создают "волну" концентрации в зоне II и перемещаются к отверстию для экстракта, в то время как менее сильно адсорбируемые компоненты мигрируют по направлению к отверстию для очищенного продукта.
В принципе, зоны I и IV служат для регенерации твердой фазы (зоны регенерации), в то время как зоны II и III могут рассматриваться как зоны фактического разделения в данной системе (как зоны разделения). Помимо таких четырех потоков жидкости и образующихся при этом зон система содержит (для работы с замкнутым контуром) циркуляционный насос для подвижной фазы (десорбента), способствующий прохождению подвижной фазы через эти неподвижные зоны в одном направлении. Тогда противоток в данной системе обеспечивается посредством периодического перемещения и непрерывной подачи или непрерывного отвода сырья, десорбента и продуктов последовательно из одной колонки в следующую.
Помимо классической четырехзонной системы с 4 SMB с замкнутым контуром имеются трехзонные системы с разомкнутым контуром, и они могут быть более экономичными с точки зрения затрат в случае использования недорогостоящего свежего растворителя, например, когда в качестве подвижной фазы используют воду или смеси вода/этанол. В случае конфигурации контура с тремя зонами больше нет необходимости в регенерации жидкой фазы, что делает использование зоны IV неактуальным.
Помимо классических систем с SMB, используемых для разделения двухкомпонентных смесей, для разделения более 2-х компонентов разработаны восьмизонные системы с замкнутым контуром (Фиг. 6) и пятизонные системы с разомкнутым контуром.
Учитывая непрерывный режим работы, рециркуляцию подвижной фазы, а также возможность применения колонок больших размеров, системы с SMB в принципе можно масштабировать для достижения объемов производства в сотни тонн.
Стадия способа с применением хроматографии с псевдодвижущимся слоем имеет преимущество в том, что эта стадия способа позволяет осуществлять дополнительное удаление олигосахаридов, близких по структуре требуемому сиалилированному олигосахариду.
В дополнительном и/или альтернативном воплощении способ дополнительно включает стадию удаления красителей.
Стадии способа, подходящие для удаления красителей, включают обработку не содержащего клеток ферментационного бульона или осветленного лизата активированным углем, таким как активированный древесный уголь.
Обработка данной среды активированным углем позволяет удалить любые нежелательные красители и предусматривает получение препарата требуемого олигосахарида, который имеет приемлемый внешний вид.
В дополнительном и/или альтернативном воплощении способ очистки сиалилированных олигосахаридов включает по меньшей мере одну стадию повышения концентрации требуемого сиалилированного олигосахарида.
В дополнительном и/или альтернативном воплощении данного способа раствор, содержащий требуемый сиалилированный олигосахарид, концентрируют после по меньшей мере одной из стадий очистки от 1) до 4), предпочтительно после стадии очистки 4), используя упаривание в вакууме (например, с применением испарителя с падающей пленкой или пластинчатого испарителя), или обратный осмос, или нанофильтрацию (например, нанофильтрацию с нанофильтрационной мембраной, имеющей предел размера исключения ≤20 
а) до концентрации ≥100 г/л, предпочтительно ≥200 г/л, более предпочтительно ≥300 г/л; и/или
b) при температуре ниже 80°С, предпочтительно ниже 50°С, более предпочтительно от 20°С до 50°С, еще более предпочтительно от 30°С до 45°С, наиболее предпочтительно от 35°С до 45°С (особенно релевантно для упаривания в вакууме или обратного осмоса); и/или
c) при температуре ниже 80°С, предпочтительно ниже 50°С, более предпочтительно от 4°С до 40°С (особенно релевантно для нанофильтрации).
Подходящие способы повышения концентрации требуемого сиалилированного олигосахарида включают нанофильтрацию и выпаривание растворителя.
В дополнительном и/или альтернативном воплощении способа по изобретению очищенный раствор подвергают стерилизующей фильтрации и/или подвергают удалению эндотоксинов, предпочтительно путем фильтрования очищенного раствора через фильтр с отсечением 3 кДа или фильтр с отсечением 6 кДа.
Способ очистки требуемого олигосахарида из ферментационного бульона, клеточного лизата или реакционной смеси, в которой протекала биокаталитическая реакция, предусматривает получение водного раствора требуемого олигосахарида. В дополнительном и/или альтернативном воплощении способ дополнительно включает стадию удаления растворителя из раствора сиалилированного олигосахарида, в результате чего или получают раствор требуемого олигосахарида, который включает требуемый олигосахарид в высокой концентрации, или в результате чего получают препарат требуемого олигосахарида в твердой форме.
Методы, подходящие для удаления растворителя из препарата сиалилированного олигосахарида в жидкой форме для получения препарата желаемого олигосахарида в твердой форме, включают кристаллизацию и лиофилизацию (сублимационную сушку - способ, при котором содержащий sHMO водный раствор замораживают и затем в результате уменьшения окружающего давления дают возможность замороженной в веществе воде сублимироваться непосредственно из твердой фазы в газовую фазу, это обычно приводит к получению гигроскопичного порошка sHMO).
В альтернативном воплощении растворитель может быть удален из препарата сиалилированного олигосахарида в жидкой форме путем распылительной сушки. Авторы изобретения неожиданным образом обнаружили, что препарат в жидкой форме, содержащий требуемый сиалилированный олигосахарид, может быть высушен распылением с получением порошка, по существу состоящего из требуемого сиалилированного олигосахарида, хотя хорошо известно, что обычно углеводы не поддаются распылительной сушке, это также относится к лактозе, сиаловой кислоте, фукозе и так далее.
Отделение биомассы от ферментационного бульона обычно представляет собой первую стадию способа очистки. При условии, что способ включает стадию удаления растворителя из препарата, эта стадия обычно представляет собой конечную стадию очистки желаемого олигосахарида. Особых ограничений в порядке проведения дополнительных стадий способа нет.
На ФИГ. 2 схематично показано воплощение способа очистки сиалилированного олигосахарида, где сиалилированный олигосахарид представляет собой sHMO, полученный путем микробиологической ферментации. По окончании ферментации биомассу отделяют от ферментационного бульона, применяя фильтрацию в тангенциальном потоке. Фильтрат (не содержащий клеток ферментационный бульон) подвергают катионообменной хроматографии и анионообменной хроматографии. После этого элюат концентрируют и обрабатывают активированным углем. Полученный раствор подвергают хроматографии с SMB, и концентрация сиалилированного олигосахарида в полученном растворе повышается. Окончательно, после фильтрования через фильтр с отсечением 3 кДа осуществляют стерилизующую фильтрацию, получая раствор, содержащий требуемый sHMO в высокой концентрации.
На Фиг. 3 проиллюстрировано другое воплощение способа, которое отличается от показанного на Фиг. 2 воплощения тем, что раствор, содержащий требуемый sHMO в высокой концентрации, подвергают сушке распылением, получая требуемый sHMO в виде порошка. Неожиданно авторы изобретения смогли определить условия, при которых 3'-сиалиллактоза и 6'-сиалиллактоза могут быть высушены распылением. В отличие от лактозы или сиаловой кислоты, которые невозможно высушить распылением, могут быть определены условия, позволяющие получить эти sHMO в виде высушенного распылением порошка. Высушенный распылением порошок также оказался лишь незначительно гигроскопичным. Применение распылительной сушки имеет ряд преимуществ по сравнению с другими способами, такими как кристаллизация или сублимационная сушка, например, характеризуется высокой экономичностью, совместимостью с крупномасштабным производством sHMO, недопущением использования органических растворителей, как в случае кристаллизации.
Воплощение способа, схематично проиллюстрированного на Фиг. 4, отличается от показанного на Фиг. 3 воплощения тем, что данный способ не включает хроматографию с SMB для получения препарата sHMO высокой чистоты.
Согласно второму аспекту предложены препараты сиалилированных олигосахаридов, при этом сиалилированные олигосахариды получали путем микробиологической ферментации или биокатализа in vitro.
Сиалилированный олигосахарид в таком препарате очищен от ферментационного бульона, клеток или реакционной смеси способом, изложенным в данном описании.
В дополнительном и/или альтернативном воплощении сиалилированный олигосахарид представляет собой сиалилированный НМО. В дополнительном и/или альтернативном воплощении сиалилированный НМО выбран из группы, состоящей из 3'-SL, 6'-SL, LST-a, LST-b, LST-c, F-SL, F-LST-b и DS-LNT.
Препарат сиалилированного олигосахарида может быть представлен в жидкой форме в виде раствора сиалилированного олигосахарида в растворителе, предпочтительно в воде. В альтернативном воплощении препарат сиалилированного олигосахарида представлен в твердой форме, предпочтительно в форме порошка. Порошок содержит сиалилированный олигосахарид в форме частиц, при этом сиалилированный олигосахарид представлен в форме аморфных частиц или представлен в форме кристаллических частиц. Наиболее предпочтительно сиалилированный олигосахарид получали в виде высушенного распылением порошка с содержанием воды меньше 10%.

Препарат сиалилированных олигосахаридов, полученных способом, описанным в данной заявке, содержит требуемый сиалилированный олигосахарид с чистотой ≥80% по массе.
Согласно третьему аспекту предложено применение сиалилированного олигосахарида, описанного в данной заявке ранее, в частности, сиалилированного НМО, для приготовления питательной композиции, предпочтительно детской смеси.
Способ очистки сиалилированных олигосахаридов предусматривает получение сиалилированных олигосахаридов, при этом получаемый олигосахарид имеет чистоту, достаточную для потребления человеком.
Указанная питательная композиция содержит по меньшей мере один сиалилированный олигосахарид, который получен способом, описанным в данной заявке ранее.
Таким образом, согласно четвертому аспекту предложены питательные композиции, содержащие по меньшей мере один сиалилированный олигосахарид, предпочтительно по меньшей мере один sHMO, который получен способом, описанным в данной заявке ранее. По меньшей мере один sHMO в такой питательной композиции выбран из группы, состоящей из 3'-SL, 6'-SL, LST-a, LST-b, LST-c, F-SL, DS-LNT и F-LSTb. Указанный по меньшей мере один сиалилированный олигосахарид получен путем микробиологической ферментации или биокатализа in vitro.
В дополнительном воплощении питательная композиция выбрана из группы, состоящей из лекарственных составов, детских смесей, молочных напитков и пищевых добавок. Такая питательная композиция дополнительно содержит микро- и/или макронутриенты, такие как белки, углеводы, жиры, жирные кислоты, предпочтительно полиненасыщенные жирные кислоты (PUFA), витамины, минеральные вещества.
Питательную композицию можно использовать в качестве лекарственной композиции для облегчения симптомов диабета, поскольку сиалиллактозы усиливают секрецию инсулина и таким образом повышают уровень глюкозы в крови, предотвращая или частично снимая симптомы сахарного диабета. Кроме того, питательная композиция, содержащая 3'-SL, может оказывать эффективное действие в отношении остеоартрита.
Питательная композиция в качестве детской смеси соответствует требованиям к композиции, изложенным в Делегированном регламенте Комиссии Европейского союза (ЕС) 2016/127. Типичные составы детских смесей указаны в Таблице 2 и Таблице 3.




В дополнительном и/или альтернативном воплощении питательная композиция дополнительно содержит микроорганизмы, предпочтительно пробиотические микроорганизмы. В случае использования в качестве пищевых добавок для грудных детей предпочтительные микроорганизмы происходят из микробиома, или их можно обнаружить в микробиоме здорового человека. Предпочтительно, но не ограничиваясь этим, микроорганизмы выбраны из родов Bifidobacterium, Lactobacillus, Enterococcus, Streptococcus, Staphylococcus, Peptostreptococcus, Leuconostoc, Clostridium, Eubacterium, Veilonella, Fusobacterium, Bacteroides, Prevotella, Escherichia, Proprionibacterium и Saccharomyces. В дополнительном и/или альтернативном воплощении микроорганизм выбран из группы, состоящей из Bifidobacterium breve, Bifidobacterium longum, Bifidobacterium lactis, Bifidobacterium animalis, Bifidobacterium bifidum, Bifidobacterium infantis, Bifidobacterium aldolescentis, Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus salivarius, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus reuteri, Lactobacillus rhamnosus, Lactobacillus plantarum, Lactobacillus salivarius, Lactococcus lactis, Lactobacillus paracasei, Lactobacillus bulgaricus, Lactobacillus helveticus, Lactobacillus fermentum, Leuconostoc mesenteroides; Escherichia coli, Enterococcus faecium и Streptococcus thermophilus (VSL №3).
Помимо комбинирования sHMO с живыми микроорганизмами, эти олигосахариды также могут быть использованы в комбинации с мертвыми культурами. В области пробиотиков иногда используют убитые культуры (например, подвергнутые тиндализации бактерии). Считается, что такие убитые культуры обеспечивают наличие белков, пептидов, олигосахаридов, фрагментов внешних клеточных стенок, природных продуктов, которые могут вызывать кратковременную стимуляцию иммунной системы.
Комбинирование по меньшей мере одного сиалилированного олигосахарида, в частности по меньшей мере одного sHMO, и пробиотических микроорганизмов в питательной композиции имеет особое преимущество в том, что облегчается формирование или восстановление соответствующего микробиома кишечника и обеспечивается связанная с этим польза для здоровья.
Еще более предпочтительной является комбинация по меньшей мере одного сиалилированного олигосахарида, в частности одного sHMO, с традиционными пребиотиками, такими как GOS (галактоолигосахариды) и/или FOS (фруктоолигосахариды, инулин).
Питательная композиция может быть представлена в жидкой форме или в твердой форме, включая, но не ограничиваясь этим, порошки, гранулы, хлопья и пеллеты.
Таким образом, также предложена питательная композиция, содержащая по меньшей мере 5 НМО, при этом указанные по меньшей мере 5 НМО выбраны из группы, состоящей из 2'-фукозиллактозы, 3-фукозиллактозы, лакто-N-тетраозы, лакто-N-неотетраозы, лакто-N-фукопентаозы I, 3'-сиалиллактозы и 6'-сиалиллактозы.
В дополнительном и/или альтернативном воплощении питательная композиция, описанная в данной заявке ранее, содержит по меньшей мере один сиалилированный НМО и по меньшей мере один нейтральный НМО и пробиотический микроорганизм.
Согласно пятому аспекту предложен высушенный распылением не содержащий GMO порошок, состоящий по существу из сиалилированного олигосахарида с чистотой выше 80% по сухой массе и имеющий содержание воды меньше 10% по массе.
В одном из воплощений высушенный распылением порошок представляет собой порошок, состоящий по существу из сиалилированного олигосахарида, выбранного из группы, состоящей из 3'-сиалиллактозы, 6'-сиалиллактозы и смеси 3'-сиалиллактозы и 6'-сиалиллактозы.
В дополнительном и/или альтернативном воплощении высушенный распылением порошок состоит по существу из смеси 3'-сиалиллактозы, 6'-сиалиллактозы и одного или более чем одного нейтрального НМО, при этом указанный один или более чем один нейтральный НМО выбран из группы, состоящей из 2'-фукозиллактозы, 3-фукозиллактозы, лакто-N-тетраозы, лакто-N-неотетраозы, лакто-N-фукопентаозы I.
Настоящее изобретение будет описано применительно к конкретным воплощениям и со ссылкой на графические материалы, однако данное изобретение не ограничивается ими, а только формулой изобретения. Кроме того, термины "первый", "второй" и тому подобные в описании и в формуле изобретения используются для различения схожих элементов и необязательно для описания последовательности либо во времени, либо в пространстве, либо при ранжировании, либо для описания любым другим образом. Следует понимать, что используемые таким образом термины являются взаимозаменяемыми при соответствующих обстоятельствах, и что воплощения изобретения, описанные в данной заявке, могут работать в других последовательностях, чем изложено или проиллюстрировано в данном описании.
Нужно отметить, что термин "содержащий", использованный в формуле изобретения, не следует интерпретировать как термин, ограниченный перечисленными ниже средствами; он не исключает другие элементы или стадии. Таким образом, его следует интерпретировать как термин, конкретизирующий наличие указанных признаков, целых чисел, стадий или компонентов, которые упомянуты, но не исключающий наличия или добавления одного или нескольких других признаков, целых чисел, стадий или компонентов либо их групп. Таким образом, объем выражения "устройство, содержащее средства А и В", не следует ограничивать устройствами, состоящими только из компонентов А и В. Применительно к настоящему изобретению это означает, что единственными релевантными компонентами данного устройства являются А и В.
Упоминание по всему этому описанию "одного из воплощений" или "какого-либо воплощения" означает, что по меньшей мере в одно воплощение настоящего изобретения включены конкретный признак, конкретная структура или конкретное характерное свойство, описанные вместе с данным воплощением. Таким образом, случаи появления в различных местах по всему данному описанию фраз "в одном из воплощений" или "в воплощении" не обязательно все относятся, но могут относиться, к одному и тому же воплощению. Кроме того, конкретные признаки, структуры или характеристики могут быть объединены любым подходящим образом в одном или нескольких воплощениях, как будет очевидно специалисту средней квалификации в данной области техники из этого описания.
Аналогичным образом, должно быть очевидно, что в описании типичных воплощений изобретения различные признаки изобретения иногда сгруппированы вместе в одном воплощении, на одном чертеже или его описании с целью оптимизации описания и помощи в понимании одного или более чем одного из различных аспектов изобретения. Этот способ описания, однако, не следует интерпретировать как отражение намерения, что заявляемое изобретение требует большего количества признаков, чем явно указанные в каждом пункте формулы изобретения. Скорее, как отражено следующей далее формулой изобретения, аспекты изобретения заключаются не во всех признаках одного описанного выше воплощения. Таким образом, формула изобретения, приведенная после подробного описания, тем самым явно включена в это подробное описание, причем каждый пункт формулы изобретения существует сам по себе.
Кроме того, хотя некоторые воплощения, описанные в данной заявке, включают в себя некоторые, но не другие признаки, включенные в другие воплощения, подразумевается, что комбинации признаков различных воплощений находятся в пределах объема изобретения и образуют различные воплощения, как будет понятно специалистам в данной области техники. Например, в приведенной далее формуле изобретения любое из заявляемых воплощений можно использовать в любой комбинации.
Кроме того, некоторые из воплощений описаны в данной заявке как способ или комбинация элементов способа, который может быть реализован с использованием процессора компьютерной системы или другого средства выполнения функции. Таким образом, процессор с необходимыми инструкциями для выполнения такого способа или элемента способа образует средство для осуществления способа или элемента способа. Кроме того, описанный в данной заявке элемент воплощения устройства представляет собой пример средства для осуществления функции, выполняемой элементом с целью осуществления изобретения.
В описании и графических материалах, представленных в данной заявке, приведены многочисленные конкретные подробности. Однако очевидно, что воплощения изобретения могут быть осуществлены на практике без этих конкретных подробностей. В других случаях общеизвестные способы, структуры и методы не показаны подробно, чтобы не затруднять понимания этого изобретения.
Теперь данное изобретение будет описано посредством подробного описания нескольких воплощений изобретения. Очевидно, что в соответствии со знаниями специалистов в данной области техники могут быть созданы другие воплощения изобретения без отклонения от истинной сущности или технического учения изобретения, при этом изобретение ограничено только условиями прилагаемой формулы изобретения.
Пример 1. Ферментация с использованием рекомбинантного микроорганизма с целью получения 3'-сиалиллактозы
Для ферментации с подпиткой с целью получения 3'-сиалиллактозы использовали рекомбинантный 3'-сиалиллактоза-синтезирующий штамм Е. coli (Е. coli BL21(DE3) ΔlacZ), несущий интеграцию в геном гена 3'-сиалилтрансферазы из Vibrio sp. JT-FAJ-16. Чтобы усилить биосинтез СМР-сиаловых кислот, гены, кодирующие глюкозамин-6-фосфат-синтазу GlmS из Е. coli, N-ацетилглюкозамин-2-эпимеразу Slr1975 из Synechocystis sp., глюкозамин-6-фосфат-N-ацетилтрансферазу Gna1 из Saccharomyces cerevisiae, фосфоенолпируват-синтазу PpsA из Е. coli, N-ацетилнейраминат-синтазу NeuB и синтетазу СМР-сиаловых кислот NeuA, обе последние из Campylobacter jejuni, были интегрированы в хромосому хозяина Е. coli BL21(DE3). Кроме того, в геном BL21 интегрировали ген, кодирующий пермеазу лактозы LacY из Е. coli, и гены cscB (пермеазы сахарозы), cscK (фруктокиназы), cscA (гидролазы сахарозы) и cscR (регулятора транскрипции) из Е. coli W. Транскрипцию интегрированных генов инициировали под контролем конститутивных промоторов, либо тетрациклинового промотора Ptet, либо промотора РТ5. Функциональный gal-оперон, состоящий из генов galE (УДФ(уридиндифосфат)-глюкозо-4-эпимеразы), galT (галактозо-1-фосфат-уридилилтрансферазы), galK (галактокиназы) и galM (галактозо-1-эпимеразы), переносили из Е. coli K12 в геном штамма BL21. Чтобы предотвратить расщепление N-ацетилглюкозамин-6-фосфата, гены, кодирующие N-ацетилглюкозамин-6-фосфат-деацетилазу (NagA), глюкозамин-6-фосфат-дезаминазу (NagB) и N-ацетилглюкозамин-специфичный белок IIABC фосфотрансферазной системы (PTS) (NagE), были делетированы из хромосомы. Кроме того, был делетирован оперон manXYZ, кодирующий переносчик Сахаров из PTS системы Е. coli для маннозы, глюкозы, глюкозамина и N-ацетилглюкозамина, а также гены nanA, nanK, nanE и nanT, кодирующие N-ацетилнейраминат-лиазу, N-ацетилманнозамин-киназу, N-ацетилманнозамин-6-фосфат-эпимеразу и переносчик сиаловых кислот, соответственно. Также был делетирован ген, кодирующий N-ацетилгалактозамин-6-фосфат-деацетилазу (AgaA).
3'-Сиалиллактоза-продуцирующий штамм растили на определенной среде с минеральными солями, содержащей: NH4H2PO4 - 7 г⋅л-1; K2HPO4 - 7 г⋅л-1; KOH - 2 г⋅л-1; лимонную кислоту - 0,3 г⋅л-1; NH4Cl - 5 г⋅л-1; противовспенивающий агент (Struktol J673, Schill + Seilacher) - 1 мл⋅л-1; 0,1 мМ CaCl2; 8 мМ MgSO4, микроэлементы и 2% сахарозы в качестве источника углерода.
В состав микроэлементов входили: нитрилотриуксусная кислота - 0,101 г⋅л-1, рН 6,5; лимоннокислое аммиачное трехвалентное железо - 0,056 г⋅л-1; MnCl2×4H2O - 0,01 г⋅л-1; CoCl2×6H2O - 0,002 г⋅л-1; CuCl2×2H2O - 0,001 г⋅л-1; борная кислота - 0,002 г⋅л-1; ZnSO4×7H2O - 0,009 г⋅л-1; Na2MoO4×2H2O - 0,001 г⋅л-1; Na2SeO3 - 0,002 г⋅л-1; NiSO4×6H2O - 0,002 г⋅л-1.
Подпитку сахарозой (500 г⋅л-1) дополняли 8 мМ MgSO4, 0,1 мМ CaCl2, микроэлементами и NH4Cl (5 г⋅л-1). Для образования 3'-сиалиллактозы применяли подпитку лактозой в концентрации 216 г⋅л-1. Значение рН регулировали путем использования раствора аммиака (25%-ного, об./об.). Ферментацию с подпиткой проводили при 30°С при постоянном аэрировании и перемешивании в течение 72 часов при скорости подпитки сахарозой 5,5-7 мл⋅л-1⋅ч-1, с учетом начального объема. Через 72 часа после начала ферментации большая часть добавленной лактозы превращалась в 3'-сиалиллактозу. Чтобы удалить оставшуюся лактозу в супернатанте после проведения ферментации, в сосуд для ферментации добавляли β-галактозидазу. Полученные моносахариды подвергали метаболизму штаммом-продуцентом.
Пример 2. Ферментация с использованием рекомбинантного микроорганизма с целью получения sHMO - 6'-сиалиллактозы
Штамм, синтезирующий 6'-сиалиллактозу, характеризуется теми же генетическими признаками, что и 3'-сиалиллактоза-продуцирующий штамм, за исключением сиалилтрансферазы. Чтобы получить 6'-сиалиллактозу, в геном Е. coli BL21(DE3) интегрировали ген plsT6 из Photobacterium leiognathi JT-SHIZ-119, кодирующий альфа-2,6-сиалилтрансферазу.
Для получения 6'-сиалиллактозы ферментативным путем штамм растили на определенной среде с минеральными солями, содержащей: NH4H2PO4 - 7 г⋅л-1; K2HPO4 - 7 г⋅л-1; KOH - 2 г⋅л-1; лимонную кислоту - 0,3 г⋅л-1; NH4Cl - 5 г⋅л-1; противовспенивающий агент (Struktol J673, Schill + Seilacher) - 1 мл⋅л-1; 0,1 мМ CaCl2; 8 мМ MgSO4, микроэлементы (нитрилотриуксусную кислоту - 0,101 г⋅л-1, рН 6,5; лимоннокислое аммиачное трехвалентное железо - 0,056 г⋅л-1; MnCl2×4H2O - 0,01 г⋅л-1; CoCl2×6H2O - 0,002 г⋅л-1; CuCl2×2H2O - 0,001 г⋅л-1; борную кислоту - 0,002 г⋅л-1; ZnSO4×7H2O - 0,009 г⋅л-1; Na2MoO4×2H2O - 0,001 г⋅л-1; Na2SeO3 - 0,002 г⋅л-1; NiSO4×6H2O - 0,002 г⋅л-1) и 2% сахарозы в качестве источника углерода.
Подпитку сахарозой (500 г⋅л-1) дополняли 8 мМ MgSO4, 0,1 мМ CaCl2, микроэлементами и NH4Cl (5 г⋅л-1). Для образования 6'-сиалиллактозы применяли подпитку лактозой в концентрации 216 г⋅л-1. Значение рН регулировали путем использования раствора аммиака (25%-ного, об./об.). Ферментацию с подпиткой проводили при 30°С при постоянном аэрировании и перемешивании в течение 72 часов при скорости подпитки сахарозой 5,5-7 мл⋅л-1⋅ч-1, с учетом начального объема. Лактозу, которая не превратилась в 6'-сиалиллактозу в конце процесса продуцирования, расщепляли путем добавления β-алактозидазы, и моносахариды, полученные в результате гидролиза лактозы, подвергали метаболизму штаммом-продуцентом.
Пример 3. Очистка 6'-сиалиллактозы и 3'-сиалиллактозы из ферментационного бульона
Биомассу отделяли от ферментационного бульона путем ультрафильтрации, после чего использовали фильтр на основе намотанных волокон (с отсечением, соответствующим порам с размером 0,05 мкм) (CUT membrane technology, Erkrath, Germany) и тангециальный фильтр (с отсечением 150 кДа) (Microdyn-Nadir, Wiesbaden, Germany). Получали приблизительно 1 м3 не содержащего клеток ферментационного бульона, содержащего сиалилированные олигосахариды в концентрации более 20 г⋅л-1.
Не содержащую клеток жидкость затем деионизовали, применяя ионообменную хроматографию. Сначала на сильном катионообменнике Lewatit S 2568 (Lanxess, Cologne, Germany) в Н+-форме объемом 200 л удаляли катионные примеси. Используя NaOH, рН полученного раствора устанавливали на значении 7,0. На второй стадии, используя сильный анионообменник Lewatit S 6368 S (Lanxess, Cologne, Germany) в хлоридной форме, из раствора удаляли анионы и нежелательные красители. Ионообменник имел объем слоя 200 л. Применяя вторую стадию фильтрации с использованием тангециального фильтра (с отсечением 150 кДа) (Microdyn-Nadir, Wiesbaden, Germany), удаляли осадки, образующиеся в результате подкисления раствора. Для концентрирования раствора сахара проводили нанофильтрацию раствора на Dow Filmtec NF270-4040 (Inaqua,  Germany) или, альтернативно, на мембране Trisep 4040-XN45-TSF (с отсечением 0,5 кДа) (Microdyn-Nadir, Wiesbaden, Germany). С использованием последней от продукта отделяли моносахарид N-ацетилглюкозамин, образующийся в ходе процесса ферментации и загрязняющий раствор сиалиллактозы. Затем концентрированный раствор сиалиллактозы обрабатывали активированным углем (CAS (Химическая реферативная служба): 7440-44-0, Carl Roth, Karlsruhe, Germany) для удаления красителей, таких как продукты реакций Майяра и альдольных реакций. Для отделения сиалиллактозы от побочных продуктов, которые образуются в ходе процесса ферментации, подобных сиаловой кислоте и N-ацетилглюкозамину, раствор фильтровали с использованием мембраны GE4040F30 с отсечением 1 кДа (GE water & process technologies, Ratingen, Germany) и подвергали диафильтрации до достижения электропроводности 0,6-0,8 мСм. Разбавленный раствор концентрировали на роторном испарителе до концентрации примерно 300 г⋅л-1. При проведении конечного хроматографического разделения удаляли другие примесные сахара, такие как ди-сиалиллактоза. Для этого концентрированный раствор наносили на слабую анионообменную смолу в ацетатной форме (Amberlite FPA51, Dow Chemical, Michigan, USA). Хотя сиалиллактоза плохо связывается со смолой, ди-сиалиллактоза адсорбируется. Так, сиалиллактоза элюируется 10 мМ раствором ацетата аммония, в то время как ди-сиалиллактоза элюируется 1 мМ раствором ацетата аммония. Для удаления ацетата аммония сиалиллактозу осаждали 10-кратным избытком этанола. Твердую фракцию фильтровали и сушили.
Germany) или, альтернативно, на мембране Trisep 4040-XN45-TSF (с отсечением 0,5 кДа) (Microdyn-Nadir, Wiesbaden, Germany). С использованием последней от продукта отделяли моносахарид N-ацетилглюкозамин, образующийся в ходе процесса ферментации и загрязняющий раствор сиалиллактозы. Затем концентрированный раствор сиалиллактозы обрабатывали активированным углем (CAS (Химическая реферативная служба): 7440-44-0, Carl Roth, Karlsruhe, Germany) для удаления красителей, таких как продукты реакций Майяра и альдольных реакций. Для отделения сиалиллактозы от побочных продуктов, которые образуются в ходе процесса ферментации, подобных сиаловой кислоте и N-ацетилглюкозамину, раствор фильтровали с использованием мембраны GE4040F30 с отсечением 1 кДа (GE water & process technologies, Ratingen, Germany) и подвергали диафильтрации до достижения электропроводности 0,6-0,8 мСм. Разбавленный раствор концентрировали на роторном испарителе до концентрации примерно 300 г⋅л-1. При проведении конечного хроматографического разделения удаляли другие примесные сахара, такие как ди-сиалиллактоза. Для этого концентрированный раствор наносили на слабую анионообменную смолу в ацетатной форме (Amberlite FPA51, Dow Chemical, Michigan, USA). Хотя сиалиллактоза плохо связывается со смолой, ди-сиалиллактоза адсорбируется. Так, сиалиллактоза элюируется 10 мМ раствором ацетата аммония, в то время как ди-сиалиллактоза элюируется 1 мМ раствором ацетата аммония. Для удаления ацетата аммония сиалиллактозу осаждали 10-кратным избытком этанола. Твердую фракцию фильтровали и сушили.
Продукт окончательно получали путем последовательного пропускания 20%-ного раствора сиалиллактозы через фильтр с отсечением 6 кДа (ультрафильтрационный модуль SIP-2013 Pall Microza, Pall Corporation, Dreieich, Germany) и стерилизующий фильтр с диаметром пор 0,2 мкм.
Часть раствора сушили распылением, используя распылительную сушилку от  (распылительную минисушилку В-290 от
(распылительную минисушилку В-290 от  ) (
) ( , Essen, Germany), применяя следующие параметры: температура на входе: 130°С, температура на выходе 67°С-71°С, скорость потока газа 670 л/ч, вытяжной вентилятор 100%.
, Essen, Germany), применяя следующие параметры: температура на входе: 130°С, температура на выходе 67°С-71°С, скорость потока газа 670 л/ч, вытяжной вентилятор 100%.
Высушенная распылением 6'-сиалиллактоза имела чистоту 91%, в то время как соединение 3'-сиалиллактоза имело чистоту 93%.
Пример 4. Анализ высушенных распылением сиалиллактоз с использованием метода широкоугольной дифракции рентгеновских лучей на порошке (XRPD)
Для изучения морфологии лиофилизированных продуктов использовали широкоугольную дифракцию рентгеновских лучей на порошке (XRPD). Применяли рентгеновский дифрактометр Empyrean (Panalytical, Almelo, Netherlands), оснащенный медным анодом (45 кВ, 40 мА, Kα1-излучение на длине волны 0,154 нм) и детектором PIXcel3D. Приблизительно по 100 мг высушенных распылением образцов анализировали в режиме отражения в диапазоне углов 5-45° 2θ, с размером шага 0,04° 2θ и временем счета 100 секунд за один шаг.
Было обнаружено, что высушенная распылением 6'-сиалиллактоза имеет полностью аморфную структуру (Фиг. 7), в то время как образец 3'-сиалиллактозы демонстрирует два дифракционных пика при 7° и 31°, что указывает на частично кристаллическую структуру, тем не менее, образец 3'-сиалиллактозы в основном также дает сигнал, соответствующий аморфной структуре (Фиг. 8).
Пример 5. Анализ высушенных распылением сиалиллактоз с использованием метода дифференциальной сканирующей калориметрии (DSC)
Чтобы определить термические события для высушенных распылением продуктов (температуру стеклования (Tg), другие экзо- и эндотермические события), использовали дифференциальную сканирующую калориметрию (DSC) на приборе 821е от Mettler Toledo (Mettler Toledo, Giessen, Germany).
Приблизительно no 25 мг высушенного распылением продукта анализировали в гофрированных алюминиевых тиглях (Mettler Toledo, Giessen, Germany). Образцы охлаждали до 0°С со скоростью 10 К/мин и повторно нагревали до 100°С со скоростью сканирования 10 K/мин. После охлаждения образцов до 0°С во втором цикле нагревания образцы нагревали до 150°С. Среднюю точку эндотермического сдвига базовой линии на сканограмме нагревания принимали за Tg. Экзотермические и эндотермические пики приведены с использованием значения соответствующей пикам температуры и нормированной энергии события.
Образец высушенной распылением 6'-сиалиллактозы демонстрировал значение Tg 48°С на первой сканограмме нагревания и Tg 50°С на второй сканограмме нагревания с эндотермическим релаксационным пиком после первой Tg. По сравнению с 6'-сиалиллактозой показанные для 3'-сиалиллактозы значения Tg 22°С на обеих сканограммах нагревания, указывают на более высокую стабильность 6'-сиалиллактозы при более высоких температурах.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЫСУШЕННАЯ РАСПЫЛЕНИЕМ СМЕСЬ ОЛИГОСАХАРИДОВ ГРУДНОГО МОЛОКА | 2018 |
|
RU2803849C2 |
| ВЫСУШЕННАЯ РАСПЫЛЕНИЕМ 3-ФУКОЗИЛЛАКТОЗА | 2018 |
|
RU2810298C2 |
| СПОСОБ СУШКИ ОЛИГОСАХАРИДОВ ГРУДНОГО МОЛОКА | 2020 |
|
RU2805178C1 |
| ОЧИСТКА ОЛИГОСАХАРИДОВ ОТ ФЕРМЕНТАЦИОННОГО БУЛЬОНА ПОСРЕДСТВОМ ИСПОЛЬЗОВАНИЯ ФИЛЬТРАЦИИ | 2020 |
|
RU2808729C2 |
| ВЫСУШЕННАЯ РАСПЫЛЕНИЕМ СИАЛИЛЛАКТОЗА | 2018 |
|
RU2802680C2 |
| ВЫСУШЕННЫЕ РАСПЫЛЕНИЕМ ТЕТРАСАХАРИДЫ | 2018 |
|
RU2812853C2 |
| ВЫСУШЕННАЯ РАСПЫЛЕНИЕМ ЛАКТО-N-ФУКОПЕНТАОЗА | 2018 |
|
RU2812864C2 |
| СПОСОБ ОЧИСТКИ L-ФУКОЗЫ ОТ ФЕРМЕНТАЦИОННОГО БУЛЬОНА | 2018 |
|
RU2789351C2 |
| СПОСОБ ОЧИСТКИ СИАЛОВОЙ КИСЛОТЫ ИЗ ФЕРМЕНТАЦИОННОГО БУЛЬОНА | 2018 |
|
RU2780437C1 |
| ПРОСТОЙ СПОСОБ ОЧИСТКИ СИАЛИЛЛАКТОЗЫ | 2019 |
|
RU2793469C2 |


Изобретение относится к способу очистки сиалилированных олигосахаридов, которые были получены путем микробиологической ферментации, включающему следующие стадии: 1) отделение биомассы от ферментационного бульона; 2) удаление катионов из ферментационного бульона; 3) удаление анионных примесей из ферментационного бульона; и 4) удаление соединений, имеющих молекулярную массу ниже, чем молекулярная масса подлежащего очистке сиалилированного олигосахарида, из ферментационного бульона, где способ дополнительно включает стадию электродиализа, где (i) для проведения электродиализа используют кислотные условия или (ii) электродиализ проводят в нейтральных условиях с использованием биполярных мембран, и где сиалилированный олигосахарид представляет собой сиалилированный олигосахарид грудного молока, выбранный из группы, состоящей из 3'-SL, 6'-SL, LST-a, LST-b, LST-c, 3-F-SL, DS-LNT и FLST-b. Техническим результатом заявленного изобретения является повышение чистоты сиалилированных олигосахаридов, полученных путем микробиологической ферментации. 12 з.п. ф-лы, 8 ил., 3 табл., 5 пр.
1. Способ очистки сиалилированных олигосахаридов, которые были получены путем микробиологической ферментации, включающий следующие стадии:
1) отделение биомассы от ферментационного бульона;
2) удаление катионов из ферментационного бульона;
3) удаление анионных примесей из ферментационного бульона; и
4) удаление соединений, имеющих молекулярную массу ниже, чем молекулярная масса подлежащего очистке сиалилированного олигосахарида, из ферментационного бульона, где способ дополнительно включает стадию электродиализа, где (i) для проведения электродиализа используют кислотные условия или (ii) электродиализ проводят в нейтральных условиях с использованием биполярных мембран, и где сиалилированный олигосахарид представляет собой сиалилированный олигосахарид грудного молока, выбранный из группы, состоящей из 3'-SL, 6'-SL, LST-a, LST-b, LST-c, 3-F-SL, DS-LNT и FLST-b.
2. Способ по п. 1, дополнительно включающий одну или более стадий, выбранных из группы, состоящей из следующего:
5) повышение концентрации сиалилированного олигосахарида;
6) удаление нежелательных олигосахаридов;
7) удаление красителей;
8) удаление эндотоксинов;
9) стерилизация; и
10) распылительная сушка или кристаллизация сиалилированного олигосахарида.
3. Способ по любому из пп. 1, 2, где удаление биомассы из ферментационного бульона осуществляют путем подвергания ферментационного бульона ультрафильтрационному удалению биомассы и соединений, имеющих молекулярную массу, большую или равную 500 кДа, из ферментационного бульона.
4. Способ по любому из пп. 1, 2, где удаление биомассы из ферментационного бульона осуществляют путем подвергания ферментационного бульона ультрафильтрационному удалению биомассы и соединений, имеющих молекулярную массу, большую или равную 150 кДа, из ферментационного бульона.
5. Способ по любому из пп. 1, 2, где удаление биомассы из ферментационного бульона осуществляют путем подвергания ферментационного бульона ультрафильтрационному удалению биомассы и соединений, имеющих молекулярную массу, большую или равную 100 кДа, из ферментационного бульона.
6. Способ по любому из пп. 1-5, где удаление катионов из ферментационного бульона осуществляют посредством катионообменной хроматографии.
7. Способ по любому из пп. 1-6, где удаление анионных примесей из ферментационного бульона осуществляют посредством анионообменной хроматографии.
8. Способ по любому из пп. 1-7, где удаление соединений, имеющих молекулярную массу ниже, чем молекулярная масса подлежащего очистке сиалилированного олигосахарида, осуществляют посредством фильтрации в тангенциальном потоке.
9. Способ по любому из пп. 1-8, где концентрацию подлежащего очистке сиалилированного олигосахарида повышают посредством нанофильтрации или выпаривания растворителя.
10. Способ по любому из пп. 1-9, где удаление красителей осуществляют путем обработки ферментационного бульона/раствора, содержащего требуемый сиалилированный олигосахарид, активированным углем.
11. Способ по любому из пп. 1-10, где удаление эндотоксинов осуществляют путем фильтрования раствора, содержащего требуемый олигосахарид, через фильтр с отсечением 6 кДа или фильтр с отсечением 3 кДа.
12. Способ по любому из пп. 1-11, где стерилизацию раствора осуществляют путем фильтрования раствора через фильтр с диаметром пор 0,2 мкм.
13. Способ по любому из пп. 1-12, дополнительно включающий стадию хроматографии с псевдодвижущимся слоем (SMB).
| US 20100038313 A1, 18.02.2010 | |||
| WO 2015106943 A1, 23.07.2015 | |||
| WO 2012092160 A2, 05.07.2012 | |||
| WO 1998015581 A1, 16.04.1998 | |||
| US 20040185146 A1, 23.09.2004 | |||
| СПОСОБ ВЫДЕЛЕНИЯ ОЛИГОСАХАРИДОВ, СОДЕРЖАЩИХ СИАЛОВУЮ КИСЛОТУ, И ПОЛУЧАЕМЫЕ В СВЯЗИ С ЭТИМ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ОЛИГОСАХАРИДЫ, СОДЕРЖАЩИЕ СИАЛОВУЮ КИСЛОТУ | 2009 |
|
RU2496342C2 |
| CN 102154163 A, 17.08.2011 | |||
| WO 2015049331 A1, 09.04.2015. | |||
Авторы
Даты
2023-07-04—Публикация
2018-08-29—Подача